Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Mercure (7439-97-6)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
7439-97-6
Nom scientifique (FR)
Mercure
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-106-7
Code SANDRE
1387
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Hg }\)
Code InChlKey
Code SMILES
[Hg]
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP01
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H330 |
|---|---|
| Mention du danger - Texte | Mortel par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H360D |
|---|---|
| Mention du danger - Texte | Peut nuire au fœtus. |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Mention du danger - Code | H372 |
|---|---|
| Mention du danger - Texte | Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
200.59 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 30/06/2025
Matrices
Atmosphère
Le mercure élémentaire et les composés organiques du mercure sont très volatils. Les composés inorganiques le sont très peu.
Milieu eau douce
Le mercure élémentaire est très faiblement soluble dans l’eau. La solubilité des composés du mercure inorganique est très variable. Des composés comme le chlorure mercurique sont solubles, alors que le sulfure mercurique est complètement insoluble. Les composés organiques sont plus ou moins solubles.
Sous sa forme élémentaire
Oxydé, il forme deux séries de composés : les composés mercuriques
Les ions mercuriques forment des composés stables avec le carbone, l'azote, le chlore, le brome, l'iode et surtout le soufre. A la différence des autres métaux, le mercure a une forte tendance à former des liaisons covalentes plutôt que ioniques. Les composés alkylés ou arylés, et notamment le méthylmercure, sont très stables. Les composés dialkylés comme le diméthylmercure sont quant à eux volatils. L'ion mercurique a une forte tendance à former des complexes, les plus stables étant ceux formés avec les halogènes, l'azote, le soufre et le carbone (Casas, 2005).
Le méthylmercure peut se former dans l’environnement par métabolisation microbienne
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Du fait de leur très fortes capacités de complexation, le mercure s’adsorbe facilement sur les particules en suspension et les ligands organiques
Milieu terrestre
Le mercure est faiblement mobile dans le sol (ATSDR, 1999). Son adsorption diminue avec l’augmentation du pH et la concentration en ions Cl- du sol (ATSDR, 1999 ; Rossaro et al., 1986). Dans les sols, on peut observer certaines réactions microbiennes ou chimiques de méthylation (formation de méthylmercure), favorisant ainsi sa bioaccumulation. Ces processus dépendent des conditions du milieu et notamment de la concentration en ions sulfures, du potentiel d’oxydoréduction et de la quantité de matière organique. Ils se produisent principalement dans les sols hydromorphes sub-oxiques à pH faible avec une forte teneur en matière organique (Rossaro et al., 1986).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
Dans les sols,
A l’état naturel, le mercure se trouve principalement sous forme de cinabre
Dans l’atmosphère,
La plus grande partie du mercure est sous forme élémentaire. Le diméthylmercure, qui lui aussi est volatil, serait rapidement dégradé en Hg0 dans l’atmosphère
Milieu sédiment eau douce
Méthylation du mercure inorganique dans les sédiments et les poissons.
La méthylation du mercure inorganique peut se faire de façon abiotique
L'acidification du milieu augmente le taux de méthylation, en particulier dans les poissons.
Milieu terrestre
Volatilisation
Une partie du mercure présent dans les sols est éliminée par volatilisation, notamment après réduction microbienne de Hg2+ en HgLloyd, 2003), qui serait le processus biologique dominant de la chimie du mercure dans les sols (ATSDR, 1999), ou après photo-réduction. L’émission à partir du sol serait conditionnée par la température et l’intensité lumineuse (Ericksen et al., 2003).
Méthylation du mercure dans les sols et sédiments
Le méthyl et le diméthylmercure
La déméthylation
De nombreux paramètres influencent la méthylation et la déméthylation, par exemple la concentration en ions sulfures
Bioaccumulation
Organismes aquatiques
Mercure Inorganique
|
|
Espèce |
Substance testée |
Durée de test |
Concentration testées (µg Hg.L-1) |
BCF (L.kg-1 ) |
Référence |
|---|---|---|---|---|---|---|
|
Algues |
Chroomonas salina* |
HgCl2 |
2j |
8537 |
8537 |
Parrish et Carr, 1976 |
|
|
Oedogonium sp. |
HgCl2 |
54j |
0,05 |
871 |
Hannerz, 1968 |
|
Plantes aquatiques |
Egeria densa |
HgCl2 |
30 |
0,3 |
1000 |
Simon et Boudou, 2001 |
|
|
Eichhornia crassipes |
HgCl2 |
16j |
1000 |
580 |
Muramota et Oki, 1983 |
|
|
Iris pseudacorus |
HgCl2 |
49j |
0,05 |
18 |
Hannerz, 1968 |
|
|
Iris pseudacorus |
HgCl2 |
49j |
0,05 |
23 |
Hannerz, 1968 |
|
|
Lemna minor |
HgCl2 |
41j |
0,05 |
70 |
Hannerz, 1968 |
|
|
Phragmites australis |
HgCl2 |
41j |
0,05 |
56 |
Hannerz, 1968 |
|
|
Phragmites australis |
HgCl2 |
14j |
0,05 |
149 |
Hannerz, 1968 |
|
|
Schoenoplectus lacustris |
HgCl2 |
21j |
0,05 |
77 |
Hannerz, 1968 |
|
|
Schoenoplectus lacustris |
HgCl2 |
41j |
0,05 |
70 |
Hannerz, 1968 |
|
Annélides |
Erpobdella octoculata |
HgCl2 |
65j |
0,05 |
534 |
Hannerz, 1968 |
|
|
Glossiphonia complanata |
HgCl2 |
65j |
0,05 |
670 |
Hannerz, 1968 |
|
|
Oligochaeta |
HgCl2 |
65j |
0,05 |
517 |
Hannerz, 1968 |
|
Mollusques |
Lymnaea stagnalis |
HgCl2 |
14j |
0,05 |
297 |
Hannerz, 1968 |
|
|
Mytilus edulis*
|
HgNO3 |
28j |
10 |
2 200 |
Zsürger et Breittmayer, 1987 |
|
|
28j |
10 |
1 000 |
|||
|
|
28j |
1 |
800 |
|||
|
|
|
|
|
1208 |
Moyenne géométrique |
|
|
|
Mytilus edulis*
|
HgCl2 |
50j |
30 |
5 333 |
Pelletier, 1988 |
|
|
|
|
|
2540 |
Moyenne géométrique |
|
|
|
Mytilus edulis* |
HgCl2 |
4j |
50 |
664 |
Tsuruga, 1963 |
|
|
Mytilus edulis* |
HgCl2 |
4j |
0,06 |
236 |
Hannerz, 1968 |
|
|
Planorbis sp. |
HgCl2 |
49j |
0,05 |
795 |
Hannerz, 1968 |
|
|
Venerupis philippinarum* |
HgCl2 |
8j |
50 |
190 |
Tsuruga, 1963 |
|
Crustacés |
Acartia clausi* |
HgCl2 |
1j |
0,1 |
760 |
Hirota et al., 1983 |
|
|
Daphnia magna |
HgCl2 |
21j |
0,36 |
2386 |
Biesinger et al., 1982 |
|
|
Daphnia magna |
HgCl2 |
21j |
0,72 |
2120 |
|
|
|
Daphnia magna |
HgCl2 |
21j |
1,28 |
1818 |
|
|
|
Daphnia magna |
HgCl2 |
3j |
1,5 |
333 |
Ray et Tripp, 1976 |
|
Organismes benthiques |
Chironomus riparius (larves) |
HgCl2 |
30j |
5,5 |
12600 |
Rossaro et al., 1986 |
|
|
Chironomus riparius (juveniles) |
HgCl2 |
30j |
5,5 |
10470 |
Rossaro et al. 1986 |
|
|
Chironomus riparius (adultes) |
HgCl2 |
30j |
5,5 |
3623 |
Rossaro et al. 1986 |
|
Insectes |
Corixa sp. |
HgCl2 |
65j |
0,05 |
414 |
|
|
|
Dytiscus marginalis (larve) |
HgCl2 |
65j |
0,05 |
603 |
|
|
|
Dytiscus marginalis (adulte) |
HgCl2 |
65j |
0,05 |
862 |
|
|
|
Ephemeridae |
HgCl2 |
65j |
0,05 |
138 |
|
|
|
Gerris najas |
HgCl2 |
65j |
0,05 |
431 |
|
|
|
Notonecta glauca |
HgCl2 |
65j |
0,05 |
483 |
|
|
|
Odonata sp. |
HgCl2 |
65j |
0,05 |
655 |
|
|
|
Tilupa sp. |
HgCl2 |
65j |
0,05 |
840 |
|
|
|
Trichoptera sp. |
HgCl2 |
65j |
0,05 |
513 |
|
|
Poissons |
Raja clavata |
HgCl2 |
64j |
0,02 |
3655 |
Pentreath, 1976 |
|
|
Pimephales promelas |
HgCl2 |
287j |
0,26 |
4984 |
Snarski et Olson, 1982 |
|
|
Oncorhynchus mykiss |
HgCl2 |
60j |
1 |
1800 |
Boudou et Ribeyre, 1984 |
|
|
Oncorhynchus mykiss
|
HgCl2 |
30j |
0,1 |
5670 |
Ribeyre et Boudou, 1984 |
|
|
|
|
|
3195 |
Moyenne géométrique |
|
|
|
Oncorhynchus mykiss |
HgNO3 |
4j |
50 |
26 |
MacLeod et Pessah, 1973 |
Les valeurs de BCF pour les invertébrés sont comprises entre 190 et 12 600.
En ce qui concerne les mollusques une moyenne géométrique du BCF a été calculée par Slooff et al. (1995) pour les moules
Pour les végétaux, les concentrations varient en fonction des niveaux d'exposition et des végétaux étudiés ; les végétaux flottants présentent des niveaux d'accumulation inférieurs à ceux des organismes immergés tels que Elodea sp. (Simon et Boudou, 2001). Toutefois, l'accumulation dans les feuilles d'Elodea densa est élevée ; les facteurs de concentration sont de l'ordre de 1 000 pour le mercure inorganique.
Pour les poissons, des valeurs de BCF
L’OSPAR a estimé un BCF
Mercure organique
|
|
Espèce |
Substance testée |
Durée de test |
Concentration testées (µg Hg.L-1) |
BCF (L.kg-1 ) |
Référence |
|---|---|---|---|---|---|---|
|
Plantes aq. |
Elodea densa |
CH3Hg+ |
30 |
0,03 |
13000 |
Simon et Boudou, 2001 |
|
|
Iris pseudacorus |
MeHgOH |
32 |
3 |
18 |
Hannerz, 1968 |
|
|
Asterias rubens* |
MeHgOH |
32 |
3 |
34 |
|
|
|
Lemna minor |
MeHgOH |
32 |
3 |
2950 |
|
|
|
Phragmites australis |
MeHgOH |
32 |
3 |
25 |
|
|
|
Schoenoplectus lacustris |
MeHgOH |
32 |
3 |
8 |
|
|
Mollusques |
Lymnaea stagnalis |
MeHgOH |
32 |
3 |
3480 |
|
|
|
Mytilus edulis* |
CH3HgCl |
32 |
0,3 |
Moyenne 13333 |
Pelletier, 1988 |
|
|
Planorbis sp. |
MeHgOH |
32 |
3 |
3570 |
Hannerz, 1968 |
|
Crustacés |
Acartia clausi* |
CH3HgCl |
1 |
0,1 |
24900 |
Hirota et al., 1983 |
|
|
Daphnia magna |
CH3HgCl |
21 |
0,04 |
41000 |
Biesinger et al., 1982 |
|
|
Daphnia magna |
CH3HgCl |
21 |
0,07 |
66700 |
|
|
|
Daphnia magna |
CH3HgCl |
21 |
0,13 |
58200 |
|
|
|
Daphnia magna |
CH3HgCl |
21 |
0,26 |
70700 |
|
|
Organismes benthiques |
Chironomus riparius |
MeHgOH |
32 |
3 |
3070 |
Hannerz, 1968 |
|
Insectes |
Coixa sp. |
MeHgOH |
32 |
3 |
8470 |
|
|
|
Ephemeridae |
MeHgOH |
32 |
3 |
3290 |
|
|
|
Notonecta glauca |
MeHgOH |
32 |
3 |
2460 |
|
|
Poissons |
Lepomis macrochirus |
CH3HgCl |
29 |
0,2 |
524 |
Cember et al., 1978 |
|
|
Lepomis macrochirus |
CH3HgCl |
29 |
0,5 |
1138 |
|
|
|
Lepomis macrochirus |
CH3HgCl |
29 |
0,2 |
1138 |
|
|
|
Poecilia reticulata |
CH3HgCl |
10 |
0,1 |
1850 |
Kramer et Neidhart, 1975 |
|
|
Gambusia affinis |
CH3HgCl |
30 |
1 |
4300 |
Boudou et Ribeyre, 1984 |
|
|
Salmo gairdneri |
CH3HgCl |
84 |
0,263 |
4532 |
Reinert et al., 1974 |
|
|
Salmo gairdneri |
CH3HgCl |
84 |
0,258 |
6622 |
|
|
|
Salmo gairdneri |
CH3HgCl |
84 |
0,234 |
8049 |
|
|
|
Salmo gairdneri |
CH3HgCl |
30 |
1 |
7500 |
Boudou et Ribeyre, 1984 |
|
|
Salmo gairdneri
|
CH3HgCl |
30 |
0,1 |
35000 |
Ribeyre et Boudou, 1984 |
|
|
|
|
|
9129 |
moy. geo. |
|
|
|
Salvelinus s fontinalis |
CH3HgCl |
273 |
0,93 |
10110 |
McKim et al., 1976 |
|
|
CH3HgCl |
273 |
0,29 |
11720 |
||
|
|
CH3HgCl |
273 |
0,09 |
12220 |
||
|
|
CH3HgCl |
273 |
0,03 |
23330 |
||
|
|
|
|
|
13557 |
moy. geo |
Les valeurs de BCF pour les invertébrés varient de 2460 à 70 700.
En ce qui concerne les mollusques, deux valeurs de moyenne géométrique du BCF ont été calculées pour les moules
Pour les végétaux, Simon et al, (2001) observent que l'accumulation dans les feuilles d'Elodea densa est plus élevée pour le méthylmercure que pour le mercure inorganique (de l'ordre de 13 000 pour le méthylmercure et de 1 000 pour le mercure inorganique).
Pour les poissons, des valeurs de BCF
L’OSPAR a estimé un BCF
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Mercure organique
Le mercure est rapidement accumulé dans les plantes via les racines (Cavallini et al., 1999). En effet, chez les plantes supérieures, la translocation du mercure est rare (ATSDR, 1999 ; Boening, 2000) bien qu’elle semble favorisée par des concentrations élevées (Cavallini et al., 1999). Le mercure atmosphérique est à l’origine de a contamination du feuillage (Ericksen et al., 2003), principalement par dépôt sec. L’accumulation ensuite par les feuilles est relativement lente (Cavallini et al., 1999).
Le mercure des composés organiques est beaucoup plus facilement absorbé et transféré vers les parties aériennes que le mercure inorganique.
Le facteur de bioconcentration
|
Végétaux |
BCFmercure organique |
Références |
|---|---|---|
|
carottes |
0,083 |
Cappon |
|
radis |
0,079 |
Cappon |
|
navets |
0,013 |
Cappon |
|
courgettes |
0,009 |
Cappon |
|
tomates |
0,088 |
Cappon |
|
salades |
0,852 |
Cappon |
|
choux |
0,364 |
Cappon |
|
haricots verts |
0,020 |
Cappon |
|
pommes de terre |
0,2 |
US EPA |
Remarques :
Seules les deux publications de Cappon (1981, 1987) ont été utilisées pour le choix des facteurs de bioconcentration des composés du mercure dans les plantes, car ce sont les rares études
Facteur de bioconcentration du mercure inorganique depuis les sols
L'INERIS recommande de consulter la Base de données sur les teneurs en éléments traces métalliques de plantes potagères - BAPPET V1.2[1] (ADEME, INERIS, CNAM, INP, ENSAT, ISA, INRA, 2014). La base indique des concentrations en plomb dans les végétaux et dans des sols, permettant de calculer un BCF ; pour certaines données, les concentrations dans d’autres milieux environnementaux (eau, air) sont également renseignées. Pour le plomb, 2 050 couples de données végétaux-sol sont actuellement disponibles.
Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante, au sol, au contexte environnemental, à l’origine de la pollution, au type expérimental, etc.) afin de se rapprocher des conditions propres à la situation étudiée.
Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des ETM pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
[1] Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les éléments traces métalliques (ETM)[1], dont le plomb, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site http://www.developpement-durable.gouv.fr/BAPPET-BAse-de-donnees-sur-les.html et fonctionne sur ACCESS 2003 et 2007.
Bibliographie
Toxicologie
Dernière vérification le 30/06/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1999, 2001 ; IARC, 1993 ; OMS IPCS, 1990, 1991, CICAD, 2003 ; US EPA (IRIS), 1995, US EPA (IRIS), 2001). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Le mercure élémentaire ou métallique, qui correspond à la valence 0 du mercure, Hg0 est un liquide sous la forme métal, pouvant former des vapeurs, dont l'inhalation est essentiellement à l’origine des effets toxiques observés du mercure élémentaire.Les sources de mercure élémentaire sont principalement anthropiques, lors de son utilisation, ce mercure peut subir des modifications chimiques, biochimiques et/ou environnementales, et être transformé en mercure inorganique ou organique, dont la toxicité et les modes de contamination sont différents (cycle du mercure).
Le mercure inorganique (sels de mercure) est principalement représenté par le chlorure mercurique. Dans les formes inorganiques, le mercure possède une valence de 1 ou 2 (la valence 2 étant la forme la plus courante et la plus toxique). La voie de contamination principale est la voie orale.
Le mercure organique forme des sels avec des dérivés alkyles ou phényles. Il s’agit principalement du méthylmercure et du phénylmercure. La voie de contamination principale est la voie orale.
Toxicocinétique
Chez l'homme
Absorption
Mercure élémentaire et mercure inorganique
Chez l'homme, le mercure élémentaire sous forme de vapeur est essentiellement absorbé par voie pulmonaire. L’absorption rapide du mercure élémentaire par voie respiratoire a été mise en évidence de façon indirecte par la présence d'un taux élevé de mercure dans les hématies, dans le plasma et dans les excréments chez 5 volontaires sains ayant inhalé du mercure élémentaire radiomarqué pendant 14 à 24 minutes (Cherian et al., 1978). Le taux d’absorption pulmonaire est compris entre 75 et 85 %.
L'étude de Sandborgh-Englund et al., (1998) a permis d’étudier la persistance chez 9 volontaires sains (2 hommes et 7 femmes) exposés par voie respiratoire à 400 µg.m-3 de vapeur de mercure élémentaire (médiane 399 µg.m-3 et concentrations comprises entre 365 et 430 µg.m-3) pendant 15 minutes (5,5 nmol de mercure par kg de poids du corps). Des échantillons d’air expiré, de sang et d’urines ont été collectés pendant 30 jours après exposition. La rétention moyenne du mercure élémentaire après 30 jours était de 69 % de la dose inhalée. Cela correspond approximativement à une demi-vie de 60 jours pour le mercure élémentaire.
Pour les composés inorganiques du mercure, l’absorption via les poumons est faible, probablement en raison du dépôt des particules au niveau des voies aériennes supérieures qui ne subissent pas par conséquent l’action de l’escalator mucociliaire (Friberg et Nordberg, 1973).
Peu d'études traitent de l'absorption par voie orale du mercure élémentaire et du mercure inorganique. Toutefois, l’absorption par voie orale de ces deux types de mercure semble faible. L'ingestion d'une faible quantité de mercure élémentaire (0,1 mL ou 1 g) n'induit pas de symptômes (Wright et al., 1980) et des études concernant l'ingestion du mercure élémentaire ont indiqué que son absorption par voie orale était négligeable (Sue, 1994 ; Wright et al., 1980). Seulement 15 % de la dose de nitrate de mercure administrée par voie orale chez l'homme dans une solution aqueuse ou couplée à des protéines de foie de veau sont absorbés par le tractus gastro-intestinal (Rahola et al., 1973). Aucune information n'est disponible concernant le pourcentage d'absorption par voie orale du chlorure mercurique et du sulfure de mercure.
Le taux d’absorption cutanée des vapeurs de mercure élémentaire a été mesuré chez 5 volontaires sains. Ce taux d'absorption est de 0,024 ng.cm-2 de peau par minute pour 1 ng de mercure par cm3 d’air, soit un taux d’absorption de 2,6 % (Hursch et al., 1989). Aucune information sur l'absorption cutanée du mercure métallique sous forme liquide n’est disponible. Par contre, des preuves indirectes de l'absorption cutanée du mercure inorganique ont été fournies par des cas cliniques dans lesquels une intoxication au mercure a été rapportée après une application cutanée de crème contenant des sels de mercure inorganiques (Bourgeois et al., 1986; Debont et al., 1986). En effet, des échantillons urinaires, prélevés chez de jeunes femmes utilisant régulièrement des crèmes éclaircissantes contenant de 5 à 10 % de chlorure mercurique et d’ammonium, présentaient des concentrations moyennes de 109 µg.L-1 ; celles utilisant ces crèmes de manière discontinue ont présenté des concentrations urinaires de 6 µg.L-1 et celles n’en utilisant pas des concentrations de 2 µg.L-1 (Barr et al., 1973).
Il a également été montré une absorption du mercure élémentaire sous forme vapeur via les nerfs olfactifs. Cependant, Maas et al., 1996 ont démontré qu’il n’y a pas de relation entre les concentrations en mercure au niveau des parties basses du cerveau et la quantité d’amalgames mercuriques présents dans la bouche.
L’importance du transport du mercure inorganique à travers la barrière intestinale dépend de la solubilité du composé (Friberg et Nordberg, 1973) et/ou de la facilité du composé à se dissocier dans le lumen intestinal pour devenir biodisponible (Endo et al., 1990). L’absorption des composés mercureux est moins importante que celle des composés mercuriques à cause des différences de solubilités (Friberg et Nordberg, 1973).
Mercure organique
Aucune donnée concernant l’absorption du mercure organique par inhalation n’est disponible. Cependant, des preuves indirectes indiquent que ce mercure peut être absorbé à travers les poumons : 6 heures après l’inhalation de diméthylmercure radioactif, de la radioactivité a été retrouvée dans les urines (Ostlund, 1969).
Par voie orale, l’absorption du mercure organique est plus importante que celle du mercure inorganique ou du mercure élémentaire. Environ 95 % d’une dose de nitrate de méthylmercure (quantité non indiquée) sont absorbés par voie orale (Aberg et al., 1969). Aucune donnée quantitative n’est disponible concernant l’absorption cutanée du mercure organique. Cependant, il a été montré que la concentration de mercure dans les urines était plus importante chez les enfants ayant porté des couches traitées par des fongicides contenant du phénylmercure (Gotelli et al., 1985).
Distribution
Mercure élémentaire et mercure inorganique
Chez l’homme, le mercure élémentaire absorbé se retrouve dans le sang après inhalation (Magos, 1967) et est distribué dans tout le corps (Cherian et al., 1978). En effet, du fait de ces propriétés lipophiles, il traverse facilement la barrière sang/cerveau et la barrière placentaire (Clarkson, 1989).
Le cation divalent (Hg2+) existe sous deux formes : une forme diffusible et une forme non-diffusible. La forme non-diffusible existe comme ion mercurique qui se lie aux protéines et qui est impliquée dans la formation de complexes à haut poids moléculaire.. Dans le plasma, l’ion mercurique est sous forme non diffusible de façon prédominante et est lié à l’albumine et aux globulines (Clarkson et Cross, 1961 ; Berlin, 1963 ;Cember et al., 1968).
Après exposition à des concentrations comprises entre 0,1 et 0,2 mg.m-3 de mercure élémentaire sous forme de vapeur, 74 à 80 % de ce mercure sont retenus dans les tissus humains (Hursch et al., 1976 ; Teisinger et Fiserosa-Bergerova, 1965).
Chez des volontaires sains, ayant inhalé une de mercure élémentaire radiomarqué pendant 20 minutes, approximativement 2 %, de la dose absorbée, sont retrouvées par litre de sang. La fixation dans les hématies est maximale en 2 h, mais elle n’est pas complète dans le plasma même après 24h. Les concentrations en mercure dans les hématies sont le double de celles mesurées dans le plasma. Ce ratio persiste pendant au moins 6 jours après l’exposition (Cherian et al., 1978).
La plus longue rétention de mercure après inhalation est observée dans le cerveau. En effet, il a été montré que des travailleurs japonais, morts 10 ans après la dernière exposition à des vapeurs de mercure élémentaire, présentaient des taux élevés de mercure dans leurs cerveaux (Takahata et al., 1970).
Le mercure élémentaire se retrouve prioritairement dans les reins (Rothstein et Hayes, 1964) alors que le mercure inorganique divalent, atteint de façon similaire tous les organes. L’accumulation du mercure inorganique divalent au niveau des reins et dans le fœtus est moins importante que celle du mercure élémentaire puisqu’il est moins lipophile.
Après une exposition par voie orale, chez l’homme, au chlorure de mercure, du mercure a été retrouvé dans les cheveux des individus exposés (Suzuki et al., 1992).
Mercure organique
Chez l’homme, la distribution du mercure organique absorbé par voie pulmonaire ou cutanée n’a pas fait l’objet d’étude. Par contre, le mercure organique absorbé par voie orale est distribué dans tout le corps et s’accumule principalement dans les reins et le cerveau.
Métabolisme
Mercure élémentaire et mercure inorganique
Le métabolisme du mercure est identique chez l’homme et chez l’animal quel que soit le type de mercure (élémentaire ou inorganique) et quel que soit le mode d’absorption. Chez l’homme, le mercure élémentaire inhalé sous forme de vapeurs se retrouve rapidement dans le sang et le mercure est dans un premier temps oxydé dans les hématies en mercure inorganique par l’hydrogène peroxydase (Clarkson, 1989 ; Halbach et Clarkson, 1978). Nielsen-Kudsk (1973) a montré que la stimulation de la production de peroxyde d’hydrogène dans les hématies augmente le captage du mercure par ces hématies (Nielsen-Kudsk, 1973). De même, la voie d’oxydation du mercure élémentaire (hydrogène peroxyde-catalase) peut être inhibée par l’éthanol (substrat compétitif pour la catalase bloquant ainsi la recapture du mercure par les hématies). Le taux d’oxydation dépend de la concentration de la catalase dans les tissus, de la production endogène de peroxyde d’hydrogène et de la disponibilité du mercure au niveau des sites d’oxydation. Cependant, deux variants de l’acatalasémie/hypocatalasémie existent conduisant à une activité déficiente de cette enzyme, qui peut engendrer une sous-population humaine particulièrement sensible (Aebi, 1967 ; Paul et Engstedt, 1958) L’oxydation du mercure élémentaire a lieu également dans le cerveau, le foie (Magos et al., 1978), les poumons et probablement dans les autres tissus (Clarkson, 1989). Chez l’homme, le mercure inorganique est également oxydé puis réduit en mercure élémentaire par la glutathion réductase.
Mercure organique
Le méthylmercure est métabolisé en mercure inorganique dans les tissus (Dunn et Clarkson, 1980). En effet, de nombreuses études ont montré un taux élevé de mercure inorganique dans les tissus et dans les excréments après une exposition des individus au méthylmercure (OMS IPCS, 1990). Une faible dose de chlorure de méthylmercure, absorbée par voie orale, peut être également transformée en mercure inorganique par la flore intestinale (Nakamura et al., 1977 ; Rowland et al., 1980). Le phénylmercure est aussi rapidement métabolisé en mercure inorganique (Nordberg, 1976) et son métabolisme implique l’hydroxylation du noyau benzène en un métabolite instable puis une transformation en mercure inorganique (Gage, 1973 ; Nordberg, 1976).
Élimination
Mercure élémentaire et mercure inorganique
En ce qui concerne l’élimination, le mercure inorganique et le mercure élémentaire, quelles que soient leurs niveaux d’absorption, sont principalement excrétés dans les urines et dans les fèces, leur demi-vie étant de 1 à 2 mois (Clarkson, 1989). Ainsi une demi-vie de 25,9 jours a été estimée suite à une exposition unique à une concentration élevée (13,8 mg.kg-1) de chlorure mercurique (Suzuki et al., 1992).
Après une courte exposition à de fortes concentrations de mercure élémentaire et inorganique, l’excrétion urinaire compte pour 13% de la charge corporelle totale. Après une exposition de longue durée, l’excrétion urinaire augmente jusqu’à 58%. La partie éliminée par les poumons via la respiration et la quantité excrétée par les sécrétions (salive, bile, sueur) constitue une petite partie de l’excrétion du mercure (Joselow et al., 1968 ; Lovejoy et al., 1974).
Chez l’homme, le mercure élémentaire inhalé, au cours d’expositions inférieures à une heure, montre que 7% du mercure absorbé est excrété dans l’air expiré (Cherian et al., 1978 ; Hursch et al., 1976). Le mercure inorganique est également excrété dans lait maternel (Yoshida et al., 1992).
Il a été montré que le taux d’élimination total du mercure inorganique est du même ordre que le taux d’élimination rénale. Dans une cohorte de 1107 individus répartis dans 15 pays, Goldwater (1972) rapporte les concentrations en mercure urinaire pour des sujets (en pourcentages cumulés) non exposés au mercure : <0,5 µg.L-1 – 78 % ; <5 µg.L-1 – 86 % ; <10 µg.L-1 – 89 % ; <15 µg.L-1 – 94 % ; <20 µg.L-1 – 95 % (Goldwater, 1972).
Après une administration unique par voie orale de mercure divalent chez 10 volontaires, 85 % du mercure (203Hg) a été excrété en 4 à 5 jours, par les fèces, ce qui est en accord avec la faible absorption intestinale du cation divalent (Rahola et al., 1973).
Toutefois, lorsque les individus sont exposés à de fortes concentrations de mercure inorganique divalent, l’excrétion du mercure se fait majoritairement dans les urines. L’étude de Barregard et al. (1992) a montré que 25,9 jours après une exposition aiguë à 13,8 mg.kg-1 de chlorure de mercure, la moitié du mercure absorbé était éliminée dans les urines. Il a également été montré que l’élimination du mercure se faisait en deux phases (Takahata et al., 1970). En effet, dans cette étude, après une exposition de travailleurs à du mercure élémentaire (concentration supérieure à 0,1 mg.m-3) pendant 20 à 45 heures, une analyse par un modèle à double compartiment a permis de mettre en évidence qu’une partie du mercure inhalé était éliminée 28 jours après l’exposition (phase rapide), alors qu’une autre partie était éliminée 41 jours après l’exposition (phase longue)(Barregard et al., 1992). Ainsi, le mercure en excès est éliminé rapidement, alors que le mercure retenu dans les tissus est éliminé dans un second temps. Le mercure inorganique et le mercure élémentaire peuvent être également excrétés dans l’air exhalé, dans la salive et dans la bile (Lovejoy et al., 1974). L'étude de Sandborgh-Englund et al. (1998) a montré chez 9 volontaires sains (2 hommes et 7 femmes) exposés par voie respiratoire à 400 µg.m-3 (médiane 399 µg.m-3 et concentrations comprises entre 365 et 430 µg.m-3) de vapeur de mercure élémentaire pendant 15 minutes (5,5 nmol de mercure.kg poids du corps) que durant les 3 premiers jours qui suivent l'exposition, 7,5 à 12 % de la dose absorbée étaient rejetés dans l'air exhalé alors que seulement 1 % du mercure inhalé a été mesuré dans les urines.
Dans une étude chez des travailleurs exposés à des vapeurs de mercure élémentaire pendant 2 à 18 ans (en moyenne 5 ans), il a été montré que l’élimination du mercure dans l’urine est caractérisable par un modèle à un compartiment, avec une demi-vie estimée de 55 jours (Sallsten et al., 1993). Pour de fortes expositions à du mercure inorganique divalent, la voie urinaire est la voie majoritaire d’élimination (Inouye et Kajiwara, 1990), avec une demi-vie similaire au mercure élémentaire (Clarkson, 1989).
Mercure organique
Chez l’homme, le mercure organique est principalement excrété dans les fèces sous forme de mercure inorganique. Moins d’un tiers du mercure organique inhalé ou ingéré est excrété dans les urines (Norseth et Clarkson, 1970).
Chez l'animal
Absorption
Mercure élémentaire et mercure inorganique
Chez l’animal, le mercure élémentaire et le mercure inorganique sont principalement absorbés par voie pulmonaire. Chez des cobayes en gestation ou pendant la lactation, des taux élevés de mercure ont été détectés dans le sang et dans les tissus après des expositions de courtes durées (2 à 2h30) à 6 et à 10 mg.m-3 de mercure élémentaire (Yoshida et al., 1990 ; Yoshida et al., 1992). Chez le rat, des taux élevés de mercure dans le sang et dans le cerveau ont été détectés après une exposition répétée pendant 5 semaines à 1 mg.m-3 de vapeurs de mercure. Enfin, l’étude de Morrow et al. (1964) a montré, chez le chien, que le taux d’absorption par voie pulmonaire de mercure inorganique divalent était approximativement de 40 % (Morrow et al., 1964).
Le taux d’absorption par voie orale du mercure élémentaire et du mercure inorganique est faible. Seulement 1 à 2 % du chlorure mercurique administré aux souris par voie orale sont absorbés (Clarkson, 1971). Chez le rat, le taux d’absorption du chlorure mercurique est de 3 à 4 %, de 8,5 % et de 6,5 % après des administrations respectives de 0,2 à 12,5 mg.kg-1, de 17,5 mg.kg-1 et de 20 mg.kg-1 (Piotrowski et al., 1992). Cependant, si on considère la rétention dans l’organisme entier comme un indicateur d’absorption, une valeur d’absorption de 20 % à 25 % a été calculée suite à l’administration unique par voie orale de 0,2 à
20 mg(Hg).kg-1 (chlorure mercurique) chez la souris (Nielsen et Andersen, 1990). L’absorption du mercure élémentaire et du mercure inorganique par voie orale dépend de l’âge des animaux étudiés, de leur alimentation et du pH intestinal (Endo et al., 1990). Après administration de chlorure de mercure, le taux d’absorption est de 38 % chez les souris d’une semaine et de 1 % chez les souris adultes. Lorsque les rats adultes sont nourris avec du lait et non avec une nourriture standard, le taux d’absorption du chlorure mercurique est de 7 % au lieu de 1 % (Kostial et al., 1978).
L’examen de biopsies de peau, 2 à 96 heures après l’application cutanée d’une solution de 0,1 % de chlorure de mercure a montré que le mercure inorganique pouvait être absorbé par voie cutanée (Silberberg et al., 1969). Mais le taux d’absorption du mercure n’a pas été mesuré.
Mercure organique
Chez l’animal, aucune donnée concernant l’absorption du mercure organique par voie pulmonaire n’est disponible.
La voie orale est la voie d’absorption principale du mercure organique et le taux d’absorption de ce mercure est de 95 % (Aberg et al., 1969).
L’absorption par voie orale du mercure organique est importante et est plus élevée que celle du mercure élémentaire et du mercure inorganique. Il a été montré que les sels de phénylmercure présents dans la nourriture des souris étaient complètement absorbés (Clarkson, 1972). De même, chez les singes femelles, l’absorption de chlorure de méthylmercure est presque complète après exposition, par gavage, à 0,5 mg.kg-1 de chlorure de méthylmercure (Rice, 1989).
L’absorption cutanée du mercure organique est de 75 %, chez le rat, 8 heures après l’application du mercure (Laug et Kunze, 1949).
Distribution
Mercure élémentaire et mercure inorganique
Chez l’animal, le mercure élémentaire absorbé par voie pulmonaire est dissous dans le sang et est ensuite distribué dans tout l’organisme. Le mercure élémentaire se distribue préférentiellement dans le cerveau mais également au niveau du foie et des reins. Après une exposition répétée pendant 5 semaines à 1 mg.m-3 de vapeurs de mercure, des taux élevés de mercure ont été détectés dans le sang et dans le cerveau des rats exposés. Une étude réalisée chez des rats exposés à 1 mg.m-3 de vapeur de mercure élémentaire, soit 24 heures par jour pendant 6 semaines, soit 6 heures par jour, 3 jours par semaine pendant 5 semaines, a montré que les concentrations en mercure dans le cerveau de ces rats étaient respectivement de 5,03 et de 0,71 µg.g-1 de cerveau (Warfvinge et al., 1992). L’étude de Schionning et al., (1991) a montré que le mercure élémentaire se retrouvait essentiellement au niveau du néocortex et des cellules du Purkinje du cervelet mais également dans d’autres tissus (foie, rein, poumon et intestin) et dans certains types cellulaires (fibroblastes et macrophages). Du mercure a également été retrouvé au niveau des neurones de la racine dorsale et dans les cellules satellites de primates exposés pendant un an à du mercure présent dans des amalgames dentaires (Danscher et al., 1990). L’âge des animaux étudiés a une influence sur la distribution du mercure élémentaire. Ainsi, après une exposition de cobayes à 8 ou à 10 mg.m-3 de vapeurs de mercure élémentaire pendant 120 minutes, la concentration de mercure retrouvée dans le cerveau, les poumons et le cœur est plus importante chez les nouveaux nés que chez les mères (Yoshida et al., 1989). Cette expérience, confortée par d’autres études, a indiqué que l’accumulation du mercure se faisait plus facilement chez le jeune que chez l’adulte expliquant un effet neurotoxique plus important des vapeurs de mercure chez les jeunes que chez les adultes.
Alors que les premiers organes cibles du mercure après inhalation de vapeurs de mercure élémentaire sont le cerveau et les reins, la distribution dans les autres parties de l’organisme dépend de la durée d’exposition et surtout de la concentration d’exposition. Chez des rats exposés à des concentrations en mercure de l’ordre de 10 à 100 µg.m-3, 6 h.j-1, 5 jours par semaine, de la 4ème à la 11ème semaine, des quantités mesurables de mercure ont été détectées dans le sang, les poils, les dents, les reins, le cerveau, les poumons, le foie, la rate et la langue, avec la plus grande quantité dans le cortex rénal (Eide et Wesenberg, 1993). L’exposition au mercure stimule la production de métallothionine par les reins, laquelle augmente la quantité d’ions mercuriques liés (Cherian et Clarkson, 1976 ; Piotrowski et al., 1992).
Bien que certaines études montrent que l’organe cible majoritaire après exposition de vapeurs de mercure est le rein (Rothstein et Hayes, 1964), d’autres études ont montré que le cerveau est l’organe principal de rétention du mercure. En effet, les cerveaux de souris exposées pendant 4h à des vapeurs de mercure présentent de grandes quantités de mercure par rapport aux autres organes (Berlin et al., 1966).
Chez des souris exposées à des vapeurs de mercure (8 mg.m-3, 6 h.j-1, pendant 10 jours), la quantité de mercure est plus importante dans la substance grise que dans la substance blanche (Cassano et al., 1966 ; Cassano et al., 1969).
Après absorption par voie orale, les distributions du mercure élémentaire et du mercure inorganique sont similaires. Chez les souris, après une exposition unique à des doses comprises entre 0,2 et 20 mg.kg-1 de chlorure de mercurique, les concentrations de mercure les plus élevées ont été retrouvées dans le foie et dans les reins (Nielsen et Andersen, 1990). Il a également été montré une accumulation de mercure au niveau du corps cellulaire des neurones des noyaux supra-optiques et paraventriculaires, ainsi qu’au niveau des neurones sécréteurs et des axones terminaux de la neurohypophyse chez des rats traités avec du chlorure mercurique dans l’eau de boisson (Villegas et al., 1999).
Le mercure élémentaire étant rapidement oxydé en ions mercuriques, sa distribution reflète plus les mouvements des ions mercuriques que celui du mercure élémentaire lui même. En revanche, le mercure inorganique étant moins lipophile que le mercure élémentaire, la quantité de mercure divalent inorganique traversant la barrière sang-cerveau et la barrière du placenta est plus faible que la quantité de mercure élémentaire (Clarkson, 1989). Ainsi, les niveaux de mercure chez le fœtus de souris sont approximativement 4 fois plus élevés après exposition à des vapeurs de mercure élémentaire par rapport à une exposition à du chlorure mercurique, et 10 à 40 fois plus élevé chez les rats (Clarkson, 1989). Le transport des ions mercuriques est limité à la barrière placentaire par la présence de sites de liaison à haute affinité (Dencker et al., 1983). De plus, chez la souris, l’absorption du mercure à travers le placenta semble augmenter à mesure que la gestation progresse (Dencker et al., 1983).
Après exposition de souris à de fortes doses de sulfure de mercure (8 à 200 mg(Hg).kg-1.j-1) pendant 7 jours, le taux de mercure présent dans le foie et dans les reins est significativement plus élevé que celui retrouvé dans le foie et les reins des souris témoins (Sin et al., 1983). Ce résultat n’est pas observé pour des doses faibles de sulfure de mercure (4-5 mg de mercure par kg) pour une exposition de 2 à 8 semaines.
Aucune étude sur la distribution du mercure élémentaire et du mercure inorganique absorbés par voie cutanée n’est disponible.
Mercure organique
Chez l’animal, aucune donnée concernant la distribution du mercure absorbé par inhalation n’est disponible.
Le méthylmercure, après son absorption par voie orale se distribue dans l’ensemble de l’organisme (Aberg et al., 1969 ; Miettinen, 1973). De fortes doses de méthylmercure ont été mesurées dans les reins et le foie, après une administration unique chez les souris de 0,04, 0,1, 1 ou 5 mg de chlorure de méthylmercure, 14 jours après l’exposition (Nielsen et Andersen, 1991). Il est noté que le méthylmercure traverse la barrière placentaire (Ask et al., 2002).
La distribution du mercure organique absorbé par voie cutanée n’a pas été étudiée chez l’animal.
Métabolisme
Mercure élémentaire et mercure inorganique
Comme précisé auparavant, en ce qui concerne le métabolisme, de nombreuses études ont montré que le mercure inorganique divalent absorbé par voie respiratoire était oxydé puis réduit partiellement en mercure élémentaire. Ainsi, les rats et les souris prétraités avec du chlorure de mercure exhalent des vapeurs de mercure élémentaire (Clarkson et Rothstein, 1964 ; Dunn et al., 1981). Le mercure élémentaire entre rapidement dans le flux sanguin au niveau des poumons. Il subit ainsi rapidement une oxydation, au niveau des hématies, qui le transforme en une forme inorganique divalente par la voie de l’hydrogène peroxyde-catalase (Clarkson, 1989 ; Halbach et Clarkson, 1978). Le taux d’oxydation est dépendant de la concentration en catalase dans le tissu, de la production endogène de peroxyde d’hydrogène et de la biodisponibilité des vapeurs de mercure sur le site d’oxydation (Magos et al., 1978). La gluthation réductase serait responsable de la réduction des ions mercure (Williams et al., 1982).
La voie d’oxydation par l’hydrogène peroxyde-catalase est saturée lorsque les doses sont élevées (Magos et al., 1989). En effet, la quantité de mercure contenue dans le sang est proportionnellement plus élevée après exposition à une faible dose qu’après exposition à une forte dose, indiquant qu’une grande partie de la faible dose est oxydée (Magos et al., 1989).
L’oxydation du mercure élémentaire, lorsque celui-ci est distribué sous cette forme, s’effectue principalement dans le cerveau, le foie (adulte et fœtal) (Magos et al., 1978), les poumons (Hursh et al., 1980) et probablement dans d’autres tissus dans une moindre mesure (Clarkson, 1989). Dans le cerveau, la forme élémentaire inoxydée du mercure peut être oxydée et être piégée, car la forme divalente du mercure passe plus difficilement la barrière hémato-encéphalique. Des études autoradiographiques montrent que l’oxydation du mercure survient aussi au niveau du placenta et du fœtus (Dencker et al., 1983).
Mercure organique
Chez l’animal, après inhalation, le mercure organique est transformé en mercure inorganique (Dunn et Clarkson, 1980). Chez le rat, les microsomes du foie sont capables de dégrader le méthylmercure en mercure inorganique, libérant ainsi des radicaux hydroxylés. La NADH-cytochrome P-450 réductase est responsable de la formation de radicaux hydroxylés capables d’induire la dégradation du mercure alkylé. Une faible dose de chlorure de méthylmercure ingéré peut être également transformée en mercure inorganique par la flore intestinale (Nakamura et al., 1977 ; Rowland et al., 1980). Chez le rat et le singe, le méthylmercure est sécrété dans la bile et ne peut être réabsorbé dans l’intestin (Berlin et al., 1975 ; Norseth et Clarkson, 1971 ; Urano et al., 1990). Il semblerait que le méthylmercure puisse se complexer avec un composé sulfhydrique non protéique, présent dans la bile et qu’il puisse être réabsorbé sous cette forme grâce un transporteur (Ballatori et Clarkson, 1982 ; Urano et al., 1990).
Élimination
Mercure élémentaire et mercure inorganique
Les données concernant l’élimination du mercure élémentaire et du mercure inorganique sont limitées chez l’animal. Après inhalation, 10 à 20 % du mercure élémentaire excrété est exhalé (Rothstein et Hayes, 1964). Le mercure inorganique inhalé est également excrété dans le lait maternel (Yoshida et al., 1992).
L’âge est un facteur important dans le processus d’élimination du mercure inorganique : en effet, la rétention chez les jeunes rats est plus importante que chez les rats plus âgés. Cette différence âge-dépendant pour le taux d’élimination du mercure peut refléter des différences de sites de rétention du mercure comme les poils, les hématies ou la peau (Yoshida et al., 1992).
Le mercure inorganique absorbé par voie orale est éliminé dans les urines. Ainsi, après administration de 8 à 200 mg.kg-1 de sulfure de mercure chez les souris, le mercure est éliminé dans les urines (Yeoh et al., 1986 ; Yeoh et Lee, 1989). Le taux d’excrétion du mercure est de 1,6 à 2,2 ng.h-1.
Aucune donnée n’est disponible concernant l’élimination du mercure élémentaire et du mercure inorganique absorbés par voie cutanée.
Mercure organique
Le méthylmercure peut être également transformé en mercure inorganique dans le lumen gastro-intestinal par la flore intestinale (Nakamura et al., 1977 ; Rowland et al., 1980) ce qui diminue son absorption et augmente le quantité de mercure excrétée dans les matières fécales. L’excrétion du méthylmercure est plus longue chez les rats nouveau-nés que chez les rats adultes car le foie des rats nouveau-nés est incapable de sécréter le méthylmercure dans la bile. Le méthylmercure est également excrété dans le lait maternel des rats et des cobayes (Sundberg et Oskarsson, 1992 ; Yoshida et al., 1992).
Autre
Mécanisme d’action :
Le mercure exerce sa toxicité par plusieurs mécanismes, mais la plupart sont en relation avec la haute affinité de l’ion mercurique pour les groupements sulfhydryls. Par liaison à ces groupements sulfhydryls de molécules comme le glutathion et l’N-acétylcystéine, le mercure altère le statut des thiols intracellualires, ce qui a pour conséquence d’augmenter le stress oxydatif et la peroxydation des lipides. Au niveau de la mitochondrie, le mercure interagit avec la chaîne de transport des électrons, augmentant ainsi la quantité de peroxyde d’hydrogène. Ceci est concommittant avec la déplétion de glutathion mitochondrial, la dépolarisation de la membrane mitochondriale interne, et l’augmentation de la sensibilité de la membrane mitochondriale à la peroxydation. Ainsi, la fonction mitochondriale est affectée et le stress oxydatif augmenté (Lund et al., 1993 ; OEHHA, 2008). En plus de ces effets pro-oxydatifs, la liaison du mercure avec les groupements sulfhydryls altère certaines fonctions cellulaires comme la polymérisation des microtubules (Yole et al., 2007), la transcritption de l’ADN (Rodgers et al., 2001), la synthèse de glutamine (Allen et al., 2001) et l’homéostasie du calcium (Yole et al., 2007). Ces effets conduisent à de nombreux dysfonctionnement cellulaires et même à la mort cellulaire, ces effets étant eux-mêmes exacerbés par la capacité du mercure à induire des réponses auto-immunes (Rowley et Monestier, 2005).
Synthèse
Chez l’homme, comme chez l’animal, le mercure métallique (Hg0) est essentiellement absorbé par voie pulmonaire. Le mercure inorganique est très peu absorbé par voie pulmonaire. De manière générale, chez l’homme, le mercure métallique et le mercure inorganique présentent un faible taux d’absorption par voie orale et encore plus faible par voie cutanée. Enfin, les sels mercuriques (Hg2+) sont plus facilement absorbés que les sels mercureux (Hg+). Le mercure organique, est absorbé plus facilement par voie orale. Quelle que soit la forme de mercure considérée, il est distribué dans tout l’organisme, mais se retrouve préférentiellement au niveau des reins, du foie et du cerveau. Le métabolisme du mercure a lieu au niveau des poumons, des hématies, du foie et du cerveau. Le mercure de manière générale subit au sein des organes où il se situe un cycle d’oxydo-réduction. Le mercure élémentaire et le mercure inorganique sont éliminés principalement par les urines et les fécès, et une plus faible quantité par la respiration et par les sécrétions.
La toxicocinétique des composés organiques du mercure, en particulier le méthylmercure, montre que leur absorption est plus importante que pour les composés inorganiques. La distribution se fait dans tous les tissus, avec toutefois une présence plus élevée au niveau des reins et du cerveau. Les sels organiques de mercure sont transformés en ions mercuriques divalents et sont par conséquent largement excrétés au niveau des fécès.
Le mécanisme d’action toxique du mercure est fortement lié à sa capacité à se fixer sur les groupements sulfhydryls et consécutivement à l’induction de nombreux dysfonctionnements cellulaires.
Toxicité aiguë
Chez l'homme
Inhalation
Mercure élémentaire
Des expositions aiguës à de fortes concentrations de vapeurs de mercure élémentaire (dose non précisée) peuvent entraîner la mort chez l’homme (Matthes et al., 1958 ; Taueg et al., 1992). Par inhalation, on observe de manière générale une irritation des voies respiratoires (pneumopathie diffuse avec œdème interstitiel), une encéphalopathie parfois sévère des troubles digestifs (nausée, vomissements, diarhhée), une stomatite et une atteinte tubulaire rénale modérée (INRS, 2014). Friberg et Vostal, (1972) ont également montré qu’une exposition par voie pulmonaire à du mercure élémentaire aux concentrations comprises entre 1 et 3 mg.m-3 pouvait provoquer chez l’homme des pneumonies mercurielles aiguës suivies de trachéo-bronchites, de pneumonies diffuses et parfois un pneumothorax bilatéral ainsi qu’un arrêt respiratoire (Friberg et Vostal, 1972). Des cas de réactions allergiques ont été également notés chez certains individus, 24 à 48 h après la pose d’un amalgame dentaire contenant du mercure.
L’inhalation de vapeurs de mercure issues d’un chauffage de mercure élémentaire (liquide, en quantité inconnue) a provoqué une intoxication aiguë chez un jeune enfant, avec notamment des effets hépatiques (Jaffe et al., 1983). Il a également été montré une hépatomégalie et des vacuoles lobulaires centrales chez un homme exposé pendant un court temps à une forte concentration de vapeurs de mercure élémentaire (Kanluen et Gottlieb, 1991 ; Rowens et al., 1991).
Mercure inorganique
Aucune donnée concernant l’effet du mercure inorganique par voie pulmonaire n’est disponible.
Mercure organique
Des cas de décès ont été rapportés chez des salariés ayant inhalé des vapeurs d'alkylmercure à la suite d'accidents de travail. La cause des décès n'a pas été identifiée mais dans tous les cas, la mort est survenue avant le développement de troubles neurotoxiques sévères (Hill, 1943 ; Hook et al., 1954).
Voie orale
Mercure inorganique
La dose létale de chlorure mercurique a été estimée entre 10 et 42 mg Hg.kg-1 pour un homme de 70 kg (Gleason et al., 1957). La mort survenant après une exposition orale au mercure inorganique, est la plupart du temps provoquée par un choc hémodynamique, une défaillance cardiovasculaire, une insuffisance rénale ou par des dommages gastrointestinaux sévères (Gleason et al., 1957 ; Murphy et al., 1979 ; Troens et al., 1951). Neuf personnes sont décédées après avoir ingéré de façon volontaire une dose unique de chlorure mercurique (entre 29 et 50 mg.kg-1). Ces personnes présentaient toutes des lésions gastrointestinales ainsi que troubles rénaux (urémie, anurie, albuminurie) (Troens et al., 1951). Une femme de 50 ans, traitée par la médecine chinoise, décéda également après avoir ingéré une dose non connue de chlorure mercureux. La cause du décès a été attribuée à une insuffisance rénale (Kang-Yum et Oransky, 1992). Enfin, il a été diagnostiqué des troubles gastriques, une insuffisance rénale ainsi qu’une hyperamylasémie chez une femme âgée ayant ingéré volontairement 25 g de poudre de chlorure de mercure mélangée dans 50 mL de lait. A la sortie de l’hôpital, seule une concentration élevée en amylase et en protéase dans le sérum est observée (Kamijo et al., 2001).
D’autre part, l’ingestion de mercure inorganique provoque des troubles respiratoires. Un homme de 35 ans ayant avalé une quantité indéterminée de chlorure mercurique a présenté un œdème pulmonaire sévère, nécessitant une ventilation artificielle (Murphy et al., 1979). Cette étude a également mis en évidence des effets hépatiques (ictère, élévation du taux d’enzymes hépatiques) et l’autopsie a révélé une hépatomégalie (Murphy et al., 1979). Une hépatomégalie a également été observée chez un jeune enfant de 19 mois, ayant ingéré une quantité inconnue de poudre de chlorure de mercure (Samuels et al., 1982).
Mercure organique
Des études ont pu montrer que des individus exposés par voie orale à des composés d’alkylmercure (aucune forme spécifiée) ont présenté des diarrhées, des irritations et des brûlures au niveau de la partie suérieure du tractus gastro-intestinal (Lundgren et Swensson, 1949). Il a également été rapporté le cas de personnes intoxiquées par de la viande de porcs, qui avaient été nourris avec des graines traitées avec du chlorure d’éthylmercure. Il a été observé des vomissements (Cinca et al., 1979).
Voie cutanée
Mercure élémentaire
Aucune donnée concernant l’effet aigu du mercure élémentaire par voie cutanée n’est disponible.
Peu d’études traitent de l’effet toxique induit par une exposition cutanée au mercure inorganique.
Mercure inorganique
Un cas d’absoprtion par les muqueuses a été décrit où une jeune femme de 27 ans décéda, 4 jours après l’insertion d’une tablette de perchlorure de mercure de 8,75 g (93 mg Hg.kg-1 pour un homme de 70 kg) dans le vagin (Miller, 1916).
Mercure organique
Chez l'homme, aucune étude ne traite des effets induits par une exposition aiguë par voie cutanée au mercure organique.
Synthèse
Chez l’homme, l’exposition unique à de fortes concentrations en mercure élémentaire peut provoquer des céphalées, des convulsions, un électroencéphalogramme anormal, et des troubles respiratoires, pouvant conduire à la mort. L’intoxication aiguë par les sels de mercure inorganique se traduit surtout par des troubles gastro-intestinaux, par un choc hémodynamique, des effets respiratoires (œdème pulmonaire). Le mercure sous forme de sels organiques peut également provoquer la mort. Les mêmes organes cibles sont observés chez l’animal.
Chez l'animal
Inhalation
Mercure élémentaire
Chez les rats, l’exposition à 27 mg.m-3 de vapeurs de mercure élémentaire pendant 2 heures induit dans les 15 jours suivant l’exposition, la mort de 20 rats sur les 32 traités (Livardjani et al., 1991). Les lapins apparaissent moins sensibles aux vapeurs de mercure élémentaire que les rats. En effet, l'exposition de 2 lapins à 28,8 mg.m-3 de mercure élémentaire pendant 30 heures induit la mort d'un des lapins alors que l'exposition à la même concentration de vapeurs de mercure élémentaire pendant 20 heures ou moins, n'induit pas la mort des lapins, avec un temp d’observation de 6 jours (Ashe et al., 1953). L’exposition à 28,8 mg.m-3 de vapeurs de mercure élémentaire pendant 1 à 20 heures provoque chez les animaux des troubles pulmonaires, cardiaques, gastro-intestinaux, hépatiques et rénaux. Des dégénérescences cellulaires marquées avec des nécroses du tissu cardiaque, sont observées chez les lapins exposés longtemps de façon intermittente, tandis que des modifications pathologiques mineures sont observées chez les lapins exposés 1 à 4 h. Pour des expositions de 4 à 30h, les effets gastro-intestinaux sont des dégénérescences cellulaires marquées, avec parfois des nécroses du colon. Après 6h à 30h d’exposition, les effets hépatiques s’échelonnent de modifications pathologiques (sans précision) à des nécroses hépatiques sévères. Après 1h d’exposition, les effets rénaux sont limités à des modifications pathologiques modérées du tissu rénal ; ces effets rénaux s’amplifient jusqu’à 30h d’exposition, jusqu’à l’apparition de nécrose étendue des reins (Ashe et al., 1953).
Mercure organique
Chez le rat, l'exposition par voie respiratoire pendant 22 jours à une concentration non connue d'iodure de méthylmercure a entrainé la mort de 4 rats. La mort de ces animaux fut précédée par le développement d'une ataxie sévère (Hunter et al., 1940).
Voie orale
Mercure élémentaire
Par voie orale (administration unique, 8 jours d’observation) et chez le rat, la DL50 pour le chlorure mercurique est comprise entre 25,9 mg et 77 mg.kg-1 de mercure (Kostial et al., 1978). L’organe cible du chlorure mercurique est le rein. Chez le rat, une nécrose du tubule proximal 24 heures après une exposition unique à 1, 1,5 ou à 1,75 µmol.kg-1 de chlorure mercurique a été observée (Zalups, 1997). Chez les souris, la toxicité rénale varie en fonction de la souche de souris utilisée dans les expériences. Ainsi, cette toxicité est plus importante chez les souris C3H/He que chez les souris C57BL/6. Cette différence de sensibilité au chlorure mercurique s’explique par une plus grande accumulation du mercure dans les tissus des souris C3H/He que chez les souris C57BL/6 (Tanaka-Kagawa et al., 1998).
Un lot de 10 femelles Sprague-Dawley exposées par voie orale à 7,4 ou 9,2 mg Hg.kg-1 a présenté une diminution du taux d’hémoglobine, du nombre d’érythrocytes et par voie de conséquence de l’hématocrite à l’autopsie. Des diminutions significatives des protéines sériques et du calcium ont également été rapportées chez le lot exposé à la plus faible dose (Lecavalier et al., 1994).
Mercure organique
Par voie orale, la toxicité du méthylmercure chez la souris varie en fonction du sexe. L’administration unique de 16 mg.kg-1 de chlorure de méthylmercure induit la mort de 4 souris mâles sur les 6 traitées, alors qu'aucune des souris femelles n'est morte (Yasutake et al., 1991). Aucune mortalité n’a été notée chez les souris femelles pour des doses allant jusqu'à 40 mg.kg-1 de mercure organique.
Voie cutanée
Mercure élémentaire
Par voie cutanée, l’étude de Schamberg et al., (1918) a montré que l’application de sels de mercure (crème contenant 50 % de mercure) sur la peau des lapins pendant 5 minutes entraînait la mort de ces derniers.
Mercure organique
Aucune étude concernant l'effet induit par une exposition aiguë par voie cutanée au mercure organique n'est disponible chez l'animal.
Injection
Mercure élémentaire
L’injection sous-cutanée de chlorure de mercure chez des rats, 5 mg.kg-1, induit une inhibition de l’activité de l’enzyme rénale, d-aminolevulinate déshydratase, une augmentation de la peroxydation des lipides (génération d’espèces réactives, augmentation du stress oxydatif) ainsi que des niveaux plasmatiques de créatine (jusqu’à 123 %), démontrant ainsi une insuffisance rénale (Augusti et al., 2007 ; Augusti et al., 2008). Les auteurs ont également montré que le lycopène est capable de protéger les tissus du stress oxydatif par piégeage des espèces réactives issues de l’action du mercure, sans pour autant atténuer l’insuffisance rénale (Augusti et al., 2007).
Chez la souris, l’injection intrapéritonéale de chlorure mercurique (5 µg.g-1 de poids corporel) pendant 2 jours consécutifs, induit une réduction partielle de l’assimilation de l’iode 131 par la thyroïde, 4 heures et 24 heures après l’injection (Kawada et al., 1980).
Mercure organique
Après injection, le mercure organique entraîne chez les animaux des troubles du système nerveux et un dysfonctionnement de la thyroïde. L’injection de méthylmercure chez les souris pendant 7 jours consécutifs a induit une atrophie du thymus cortical, le développement de follicules lymphoïdes au niveau de la rate ainsi qu’une diminution de la formation d’anticorps anti-hématies de mouton. L'injection péritonéale chez les souris de 5 µg de méthylmercure par gramme de poids corporel pendant 2 jours consécutifs induit une diminution partielle de l’assimilation de l’iode 131 au bout de 4 heures et de 24 heures (Kawada et al., 1980).
Synthèse
Les mêmes organes cibles chez l'homme sont observés chez l’animal.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Mercure élémentaire
La plupart des données proviennent d’enquêtes épidémiologiques réalisées chez des salariés d’usines fabriquant du chlore (OMS IPCS, 1991).
Chez l’homme exposé au mercure élémentaire, les organes cibles sont le système nerveux central et le rein.
Une exposition à long terme au mercure élémentaire provoque des effets de même nature qu’une exposition à court terme mais plus l’exposition est importante et longue, plus les effets sont sévères et peu réversibles. Les études épidémiologiques ont montré que les individus exposés à 100 µg.m-3 de mercure élémentaire (ou 100 µg.g-1 créatinine) présentaient des tremblements de la main, des paupières, des lèvres et de la langue dus à des lésions du cervelet, mais présentaient également des gingivites, une salivation et une modification de la personnalité (insomnie, irritabilité). Des expositions à plus long terme et à plus faibles concentrations en mercure (25-80 µg.m-3 correspondant à 30 –100 µg de mercure par gramme de créatinine) provoquent des tremblements, une irritabilité, une diminution de la concentration intellectuelle et des troubles de la mémoire (Albers et al., 1988; Bidstrup et al., 1951; Chapman et al., 1990; Smith et al., 1970). La majorité de ces études suggère que les troubles du système moteur sont réversibles alors que la diminution cognitive ainsi que les pertes de mémoire peuvent être permanentes (Chaffin et al., 1973; Hannien, 1982). On observe également une diminution de la capacité psychomotrice et de la neurotransmission ainsi qu’une modification de la personnalité (Fawer et al., 1983; Piikivi et Hannien, 1989). Par exemple, l’étude de Fawer et al. (1983), réalisée chez 26 salariés masculins (âge moyen 44 ans) et dont le temps d’exposition moyen au mercure était de 15,3 ans, a mis en évidence une augmentation des tremblements de la main chez les salariés exposés par rapport aux salariés non exposés au mercure. Ces tremblements sont la conséquence de dommages neurophysiologiques résultant d’une accumulation de mercure élémentaire dans le cervelet. Des mesures d’échantillons d’air ont permis de déterminer la concentration moyenne d’exposition soit 0,026 mg.m-3 de mercure élémentaire. Une valeur moyenne d’exposition de 0,026 mg.m-3 fut retenue comme LOAEC. Dans l’étude de Piikivi et Tolonen (1989), les travailleurs exposés à des vapeurs de mercure sur leur lieu de travail, ont présenté des concentrations moyennes en mercure dans le sang de 0,12 µg.L-1, correspondant environ à une exposition à 0,025 mg.m-3. Après une exposition moyenne de 15,6 ans, une augmentation du nombre d’anomalies de l’EEG a été observée par rapport aux témoins. L’activité cérébrale de ces employés est modifiée par rapport à celle des témoins non exposés, l'analyse montre une diminution de l'amplitude et des fréquences recueillies ; cet effet est plus important chez les sujets travaillant en 3x8 que chez ceux travaillant uniquement de jour. Un LOAEC de 0,025 mg.m-3 a été déterminé. L’étude de l’influence des vapeurs de mercure sur le comportement et une évaluation neuropsychologique des travailleurs, exposés en moyenne pendant 15,8 ans, a été menée par Ngim et al., 1992. Les niveaux d’exposition étaient compris entre 8 et 85 µg Hg.m-3, avec un niveau moyen estimé à 33 µg Hg.m-3. Les travailleurs exposés ont moins bien réussi une série de tests proposés, soit l’épreuve du pianotage (évaluant la motricité fine), le calcul mental, le maintien de l’attention ou le temps de réaction à des stimuli visuels, que les témoins. Ces effets perdurent une fois la prise en compte de l’âge, qui est considéré comme un facteur confondant dans le type de réponse observée, pouvant. La concentration moyenne à laquelle sont observés ces effets est de 0,033 mg.m-3.
Le rein est également un organe cible du mercure élémentaire pour des concentrations supérieures à 50 µg.g-1 de créatinine. Le mercure élémentaire induit généralement une protéinurie accompagnée de lésions du tubule proximal puis du tubule terminal. A des concentrations supérieures, le mercure élémentaire peut induire des lésions glomérulaires (Danziger et Possick, 1973 ; Tubbs et al., 1982). Une étude réalisée chez un groupe de 63 salariés, travaillant dans une usine de chlore, a montré la présence d'une concentration élevée dans le sang et dans les urines de b galactosidase, associée à une albuminurie. Ces effets sont observés pour des concentrations de mercure supérieures à 30 µg.L-1 dans le sang et supérieures à 50 µg.g-1 de créatinine dans les urines (Buchet et al., 1980).
L'exposition par voie respiratoire au mercure élémentaire induit chez les enfants la maladie rose ou "Pink disease". Cette maladie est caractérisée par une tuméfaction froide, humide et cyanotique des mains et des pieds accompagnée de prurit et de crises sudorales, parfois de troubles nerveux ou de troubles cardiaques et un syndrome des ganglions lymphatiques muco-cutanés ("Kawasaki disease"). L’étiologie de ce syndrome aigu est peut être d’origine immunitaire (Fuortes et al., 1995). De nombreuses études montrent qu’une exposition à long terme de mercure élémentaire chez les enfants induit aussi de l’hypertension artérielle, de l’acrodynie[1], de la tachycardie, de l’anxiété, de l’irritabilité et un malaise général (Sexton et al., 1978 ; Torres et al., 2000).
Une toux chronique est rapportée chez les sujets exposés au mercure élémentaire pendant plusieurs semaines (ATSDR, 1999).
L'effet des vapeurs du mercure élémentaire a été évoqué chez les dentistes et leurs patients. Les vapeurs de mercure élémentaire relarguées par les amalgames dentaires pourraient être la cause de troubles neurologiques mais les preuves de ces effets manquent (Siblerud, 1992). Berdouses et al., 1995 ont étudié le mercure relargué par un amalgame dentaire en utilisant une bouche artificielle. La dose quotidienne et moyenne de mercure relarguée par 1 seul amalgame dentaire est d’environ de 0,03 µg. Dans cette étude, aucune relation n’a été mise en évidence entre le mercure relargué par un amalgame dentaire et les excrétions d’albumine. De même, aucune modification des facteurs immunitaires tels que le nombre de lymphocytes B et de lymphocytes T4 et T8 n’a été observée. Enfin, l’étude de Ritchie et al., 2002 a mis en évidence que la quantité de mercure présente dans les urines était 4 fois plus élevée chez les dentistes que chez les individus contrôles. Des atteintes rénales ainsi que des troubles de mémoire ont été observés chez les dentistes, mais sans corrélation avec la concentration de mercure présent dans les urines.
Une étude épidémiologique, réalisée chez 68 patients atteints de la maladie d’Alzheimer, n’a pas montré de relation entre la maladie et l’exposition au mercure contenu dans les amalgames dentaires, ni avec la concentration en mercure présente dans le cerveau (Saxe et al., 1999).
Mercure inorganique
Chez l’homme, aucune donnée concernant l’effet chronique du mercure inorganique après une exposition par voie pulmonaire n’est disponible.
Mercure organique
L’exposition chronique par voie pulmonaire au mercure organique entraîne des troubles respiratoires, gastro-intestinaux, musculaires, hépatiques et neurologiques. Une dyspnée par sécrétion de mucus ainsi qu’une nécrose d’une partie du foie furent observées chez un fermier de 39 ans ayant traité pendant plusieurs saisons ses graines avec de l’acétate de phénylmercure (Brown, 1954). Ce fermier présentait également une bouche enflée et infectée, des gencives rouges et douloureuses à la pression et des dents cariées. Dans cette étude, il n'est pas aisé de conclure pour savoir si les troubles respiratoires (dépression respiratoire, hypersécretion bronchique et bronchopneumonie purulente) sont les conséquences directes de l'intoxication au phénylmercure ou s’ils sont la conséquence d'une neurotoxicité sévère induite par le phénylmercure. Aucun effet respiratoire ou cardiovasculaire néfaste n'a été constaté chez 4 hommes ayant inhalé une concentration non connue de méthylmercure sous forme de poussières pendant plusieurs mois (Hunter et al., 1940). Par contre, ces personnes présentaient des troubles neurologiques tels que de l'engourdissement, des troubles de la marche et une irritabilité ainsi que des troubles musculo-squelettiques comme des fasciculations musculaires (contraction pathologique simultanée de fibres musculaires appartenant à la même unité motrice) et une absence de réflexe profond du bras. Ces troubles musculo-squelettiques sont secondaires aux atteintes neurologiques. Deux ans après l'exposition, certains de ces symptômes étaient encore observés chez ces individus.
[1] Aussi appelée « Pink disease » en anglais, maladie infantile dont la cause peut être l’intoxication au mercure et dont les symtômes sont des tuméfactions, une sudation, des démangeaisons, une desquamation ainsi que des troubles nerveux, digestifs et cardio-vasculaires
Voie orale
Mercure élémentaire
L’exposition par voie orale au mercure élémentaire induit des troubles cardiovasculaires, gastro-intestinaux mais surtout neurologiques et rénaux.
Mercure inorganique
Le rein est l’organe cible après une exposition chronique par voie orale au mercure inorganique et le taux d’absorption digestive est de 7-15 %. Un dysfonctionnement rénal a été observé chez deux patientes ayant ingéré de façon chronique une dose inconnue de chlorure mercureux (Davis et al., 1974). En milieu industriel, l’exposition au mercure inorganique est associée à une protéinurie, et parfois à une néphropathie d’ordre glomérulaire qui pourrait être d’origine immunitaire.
Plusieurs observations ont mis en évidence l’effet neurotoxique du mercure inorganique par voie orale. Un garçon de 4 ans ayant été traité par la médecine chinoise avec un produit contenant du chlorure mercureux pendant 3 mois développa une dysphagie (sensation de gêne ou d'arrêt survenant au cours de la déglutition), un déséquilibre dans la démarche et une incapacité à contrôler le mouvement de ses bras (Kang-Yum et Oransky, 1992). Deux femmes furent atteintes de démence et d'irritabilité après avoir ingéré de façon chronique des tablettes laxatives contenant chacune 120 mg de chlorure mercureux (0,72 mg Hg.kg-1.j-1 pour un poids moyen de 70 kg). Une de ces deux femmes avait pris 2 tablettes par jour pendant 25 ans alors que l’autre avait ingéré 2 tablettes par jour pendant 6 ans. Ces 2 patientes décédèrent à la suite d’une intoxication au mercure inorganique. Dans cette étude, l’autopsie a montré un poids et un volume du cerveau faible ainsi qu’une réduction du nombre de cellules nerveuses dans le cervelet. Les microscopies optique et électronique ont révélé la présence de granules de mercure dans le cytoplasme des neurones et dans certains neurones (Davis et al., 1974).
Enfin, de nombreux troubles cardiovasculaires (tachycardie et augmentation de la pression sanguine) ont été observés chez des enfants ayant été traités pour des maux de dents ou pour la constipation avec des tablettes contenant du chlorure mercureux (Warkany et Hubbard, 1953). Plusieurs de ces enfants présentaient des démangeaisons de la peau et de la muqueuse ainsi qu'une desquamation des cellules de la paume de la main, de la plante des pieds et une conjonctivite ainsi que des douleurs abdominales, des diarrhées, des crampes au niveau des jambes et des mains, des troubles neurologiques tels qu’une irritabilité, des insomnies, une anorexie, une photophobie et une confusion.
Mercure organique
L’exposition chronique par voie orale au mercure organique peut entrainer la mort des individus. Le décès survient, le plus souvent, après une consommation importante de nourriture contaminée par du méthylmercure, comme la contamination du poisson, au Japon (Tsubaki et Takahashi, 1986) ou la contamination des graines en Irak (Bakir et al., 1973). Un temps relativement important s'écoule entre l’apparition des premiers symptômes et la consommation de nourriture et c'est pour cette raison que la dose létale du mercure organique est difficile à estimer. Des doses létales de mercure organique ont pu toutefois être estimées à partir des concentrations de mercure présent dans les tissus des personnes contaminées. Ces doses sont comprises entre 10 et 60 mg.kg-1 de mercure organique (US EPA, 1985). Deux garçons décédèrent également après avoir mangé de la viande issue de troupeaux élevés avec des graines traitées par du chlorure d'éthylmercure (Cinca et al., 1979).
Par voie orale, le cerveau est le principal organe cible du mercure organique. Les fonctions sensorielles telles que la vue et l’ouïe ainsi que les zones du cerveau impliquées dans la coordination motrice sont généralement affectées. Les premiers symptômes induits par une exposition par voie orale au mercure organique, tels que la paresthésie (troubles de la sensibilité), un malaise général ou une vision brouillée, sont non spécifiques. Ces premiers symptômes sont suivis d'une restriction du champ visuel, d'une surdité, d'un défaut d’élocution et de troubles de la coordination musculaire (Bakir et al., 1973; Kutsuma, 1968; Jalili et Abbasi, 1961). Dans certains cas, une réversibilité des symptômes peut survenir. A plusieurs reprises, des populations ont été l’objet d’empoisonnements par des composés du méthyl- et de l’éthylmercure : au Japon, à Minamata en 1953 (Kutsuma, 1968), à Niigata, en Irak en 1971-1972 (Al-Mufti et al., 1976) et au Canada. Au Japon, une partie de la population fut empoisonnée par du poisson contaminé par du méthylmercure. 700 cas ont été rapportés à Minamata et 500 à Niigata. Sur les 1 422 personnes intoxiquées et présentant la maladie de "Minamata", 378 personnes décédèrent. Les symptômes observés sont le plus souvent d'ordre neurologique et sont des sensations de fourmillements au niveau des extrémités des membres (paresthésie), une réduction du champs de vision, une perte de goût, de l'odorat, de l'ouïe, une irritabilité, une perte de mémoire, des difficultés à s'endormir et une dépression. D’autres troubles sévères du système nerveux ont également été rapportés. La concentration moyenne en mercure total dans les poissons consommés a été estimée à environ 10 mg.kg-1 de poisson frais (Kutsuma, 1968). La dose journalière de mercure absorbée pendant plusieurs mois, voire des années, est de 5-100 µg.kg-1 avec une médiane de 30 µg.kg-1. Les concentrations sanguines mesurées chez les patients variaient entre 200 et 400 µg.L-1 et la concentration moyenne dans les cheveux était de 52 mg.kg-1 de cheveux. Une situation similaire en Irak a été constatée entre les années 1956 et 1960 (Bakir et al., 1973; Jalili et Abbasi, 1961) provoquée par la consommation de farine fabriquée à partir de graines traitées au p-toluène sulfonanilide éthylmercure. Entre l'hiver 1971 et 1972, plus de 6 530 personnes ont été hospitalisées en Irak et environ de 460 sont décédées à la suite de détériorations sévères du système nerveux central. Les personnes contaminées présentaient des difficultés à marcher et à parler, une ataxie cérébelleuse, une paraplégie, des réflexes anormaux, une restriction du champ visuel, des tremblements, des énervements, de la confusion, des hallucinations et une perte de connaissance (Bakir et al., 1973). Les effets neurologiques observés au Japon et en Irak ont été associés à une dégénérescence neuronale et à une prolifération gliale dans la substance grise corticale et cérébelleuse (Al-Saleem et Clinical Committe on Mercury Posoning, 1976).
Voie cutanée
Mercure élémentaire
Par voie cutanée, il a été montré que certaines personnes sensibles au mercure pouvaient développer des stomatites (inflammation buccales, des muqueuses et des gencives) aux endroits ayant été en contact avec les amalgames dentaires (Veien, 1990).
En 1991, l’OMS IPCS a conclu que pour des concentrations urinaires en mercure de 30 à 50 µg.g-1 de créatinine, aucun effet imputable au mercure n’était observé. De plus, selon l’OMS IPCS (1991) la toxicité du mercure élémentaire n’est pas prouvée à l’exception des cas d’allergie. Ceci a été repris par un groupe d’experts suédois et dans un rapport américain (DHHS, 1993).
Mercure inorganique
L’exposition par voie cutanée au mercure inorganique pendant de longues durées induit des troubles cardiovasculaires, gastro-intestinaux, rénaux, neurologiques et immunologiques. L’application pendant environ 18 ans d’une crème contenant 17,5 % de chlorure de mercuriammonium a induit chez une femme de 42 ans, une détérioration de la fonction rénale (Dyall-Smith et Scurry, 1990). Cette personne présenta également une pigmentation « bleu noir » au niveau du menton et de la bosse frontale moyenne ainsi que des tremblements, une anxiété et une dépression (Dyall-Smith et Scurry, 1990).
Mercure organique
Très peu de données concernant l’effet d’une exposition à long terme par voie cutanée au mercure organique sont disponibles. Un seul cas a été rapporté où un salarié de 33 ans fut exposé à de la poussière de nitrate de méthyl mercure pendant 2 ans. Ce salarié présenta des brûlures et des vésicules sur les avant bras (Hunter et al., 1940).
Synthèse
Chez l’homme, les deux principaux organes cibles du mercure élémentaire et du mercure inorganique sont le système nerveux central et le rein. Ainsi, les principaux symptômes d’hydrargyrisme chronique (intoxication par le mercure) sont d’ordre neurologique comme des troubles de la psychomotricité, des troubles cognitifs et des modifications de la personnalité (comme de l’irritabilité, de l’anxiété). Le mercure atteint également les reins (lésions glomérulaires et tubulaires). Enfin, il est également observé des troubles cardiovasculaires (tachycardie, hypertension artérielle), respiratoires, hépatiques et immunologiques.
Le mercure organique atteint essentiellement le cerveau, avec des paresthésies, un malaise général, des troubles sensoriels. Le méthylmercure induit la maladie de Minamata avec l’appartition de troubles neurologiques sévères. Le mercure organique provoque également des atteintes rénales. Les mêmes observations sont faites chez l’animal, et les organes cibles sont les mêmes.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
Substance Chimique |
Voies d’exposition |
Taux d’absorption |
Organe cible Principal |
Organe cible Secondaire |
|---|---|---|---|---|
|
Mercure élémentaire |
Inhalation |
75 – 85 % |
SNC, rein, cardio-vasculaire |
foetus |
|
Ingestion |
15 % |
SNC, rein |
coeur, intestin |
|
|
Cutanée |
2,6 % (vapeurs) |
ND |
bouche |
|
|
Mercure inorganique |
Inhalation |
ND |
SNC |
ND |
|
Ingestion |
7 - 15 % |
SNC, reins |
Cœur, système immunitaire |
|
|
Cutanée |
ND |
Cœur, rein, SNC |
Intestin, système immunitaire. |
|
|
Mercure organique et méthylmercure |
Inhalation |
ND |
SNC, rein |
Fœtus, systèmes respiratoire et gastro-intestinal, muscles |
|
Ingestion |
95 % (méthylmercure) |
SNC |
ND |
|
|
Cutanée |
ND |
ND |
ND |
Chez l'animal
Inhalation
De nombreuses études ont mis en évidence que l’exposition chronique par voie pulmonaire au mercure élémentaire et au mercure inorganique induisait principalement des troubles neurologiques mais également des troubles respiratoires, cardiovasculaires, hépatiques et immunologiques (Gage, 1961).
Mercure élémentaire
Chez 6 lapins exposés à 4 mg.m-3 de vapeurs de mercure élémentaire pendant 13 semaines, 2 présentaient des légers tremblements et un clonus (série de contractions rythmiques suite au maintien d'un étirement). La concentration de mercure retrouvée dans le cerveau de ces lapins était comprise entre 0,8 et 3,7 µg.g-1 de tissu humide (Fukuda, 1971). Après une exposition intermittente à 3 mg.m-3 de vapeurs de mercure élémentaire pendant 12 à 39 semaines, les rats présentaient une augmentation de l’agressivité. Cependant, aucun changement histopathologique n’a été décelé (Kishi et al., 1978). Les symptômes observés chez les rats étaient réversibles, 12 semaines après l’arrêt de l’exposition (Kishi et al., 1978).
Une congestion pulmonaire a été observée chez les rats après une exposition à 1 mg.m-3 de vapeurs de mercure élémentaire, 100 heures consécutives par semaine pendant 6 semaines (Gage, 1961). Chez les rats exposés à 3 mg.m-3 de vapeurs de mercure, seulement 3 jours par semaines pendant 12 à 42 semaines, l’examen pathologique n’a révélé aucune modification significative de l’arbre respiratoire (Kishi et al., 1978).
Les études rapportant un effet cardiovasculaire induit par l’exposition au mercure sont limitées. Une étude a montré des changements pathologiques (intermédiaires à modérés) du cœur chez les lapins exposés à de faibles concentrations de vapeurs de mercure (0,86 à 6 mg.m-3) pendant 2 à 12 semaines (Ashe et al., 1953).
Des effets hépatiques importants tels que des nécroses ont été observés chez des animaux exposés à de fortes doses de mercure élémentaire (28,8 mg.m-3) et plutôt pour des expositions de durées intermédiaires. Pour une exposition à 6 mg.m-3 de vapeurs de mercure, 7 heures par jour, 5 jours par semaine pendant 1 à 5 semaines chez les lapins, les effets sur le foie sont moins sévères, et sont principalement des effets intermédiaires et des dégénérescences cellulaires (Ashe et al., 1953). Des changements pathologiques "modérés" du foie, des dégénérescences cellulaires marquées et quelques nécroses ont été constatés chez les lapins exposés à 6 mg.m-3 de vapeurs de mercure élémentaire, 7 heures par jour, 5 jours par semaine pendant 6 à 11 semaines (Ashe et al., 1953). Aucun changement hépatique n’a été constaté chez les rats exposés de façon intermittente à 3 mg.m-3 de vapeurs de mercure, 3 heures par jour, 5 jours par semaine pendant 12 à 42 semaines (Kishi et al., 1978).
Les troubles rénaux induits pour une exposition par voie respiratoire à 3 mg.m-3 de mercure élémentaire 3 h.j-1, 5 jours par semaine pendant 12 à 42 semaines sont des dégénérescences légères de l’épithélium tubulaire chez le rat, le lapin et le chien (Kishi et al., 1978).
En ce qui concerne les troubles immunologiques, l’exposition à des vapeurs de mercure de souris rendues génétiquement susceptibles au mercure, pendant 10 semaines, a induit une réponse auto-immune chez ces souris, se manifestant par une stimulation du système immunitaire, une hypergammaglobulinémie IgE et par la synthèse d’auto-anticorps. Les souris ont été exposées à des concentrations de mercure comprises entre 0,3 et 1 mg.m-3 pendant un temps d’exposition allant de 0,5 à 19 heures par jour, 5 jours par semaine, pendant 10 semaines. Les doses d’exposition pour chaque groupe ont été exprimées en µg.kg-1 par semaine. Un LOAEL a été établi pour la synthèse d’auto-anticorps, il équivaut à une dose absorbée de 0,170 mg Hg.kg-1 par semaine pour une exposition de 1h30 par jour à 0,5 mg.m-3 de mercure élémentaire. Le NOAEL calculé équivaut à une dose absorbée de 0,075 mg Hg.kg-1.j-1 pour une exposition de 0,5 heure par jour à 0,5 µg.m-3 de mercure (Warfvinge, 1995).
Mercure organique
Aucune étude concernant l’effet induit par une exposition chronique par voie pulmonaire au mercure organique n’est disponible chez l’animal.
Voie orale
Mercure inorganique
Il a été montré une augmentation du poids relatif de l’adrénosurrénale chez des rats mâles traités avec du chlorure mercurique par gavage, à une dose équivalent à 20 mg.kg-1 de mercure pendant 4 semaines. Chez les femelles, il a été observé une diminution du poids absolu des adrénosurrénales pour la dose de 22 mg.kg-1 (Jonker et al., 1993). D’autres études ont montré un effet sur la glande thyroïde après une exposition à des sels divalents du mercure (Goldman et Blackburn, 1979 ;Sin et al., 1990).
Un grand nombre d’études ont montré que le rein était l’organe cible privilégié d’une exposition chronique par voie orale au mercure inorganique. Le NTP, 1993, a mené plusieurs études chez le rat et la souris, exposés par gavage, au chlorure mercurique pendant 14 jours, pendant 6 mois et pendant 2 ans.
Pour l’étude de 14 jours, une augmentation du poids relatif et absolu des reins chez les mâles à partir de 1,9 mg.kg-1.j-1 et chez les femelles de 3,7 mg.kg-1.j-1 est observé ainsi qu’une nécrose tubulaire rénale dose-dépendante à partir de 3,7 mg.kg-1.j-1 avec une sensibilité plus marquée chez les mâles ainsi qu’une nécrose d’intensité moyenne à modérée à la plus forte dose. Un NOEL de 1,25 mg.kg-1 de chlorure mercurique (correspondant à 0,95 mg Hg.kg-1) a été déterminé.
Pour l’étude de 6 mois, les rats Fischer 344 (10 rats par sexe et par lot) ont été exposés par gavage à du chlorure mercurique aux concentrations de 0 - 0,23 - 0,46 - 0,93 - 1,9 ou 3,7 mg Hg.kg-1.j-1 dans de l’eau déionisée. Les poids totaux des animaux, ainsi que de différents organes (cœur, cerveau, foie, rein, testicules et thymus) sont mesurés et des examens histopathologiques sont réalisés. Une augmentation significative du poids des reins chez les mâles et les femelles exposés aux doses supérieures ou égales à 0,46 mg.kg-1.j-1 est observée. Chez les mâles, une néphropathie minime apparaît pour les animaux exposés aux deux plus faibles doses ainsi que chez les témoins. Toutefois, cette atteinte devient plus sévère dès 0,93 mg.kg-1.j-1. Chez les femelles, l’atteinte des reins reste minime et n’est significative qu’à la plus forte dose. La néphropathie observée se caractérise par des foyers de régénération tubulaire, un amincissement de la membrane tubulaire et la présence d’inclusions hyalines. Ces changements sont associés au niveau macroscopique à une apparence granuleuse des reins. Aucun effet rénal (NOAEL) n’a été observé chez les animaux exposés à 0,23 mg Hg.kg-1.j-1.
Dans l’étude couplée traitant de toxicité systémique et de cancérogénicité (exposition des animaux pendant 2 ans), tous les animaux, rats et souris, ont développé une néphropathie. Divers effets secondaires ont été mis en évidence dans cette étude chez le rat mâle, tels qu’une dystrophie de tissus osseux, une déminéralisation des tissus et une hyperplasie des glandes parathyroïdiennes. De plus, une inflammation de la muqueuse nasale imputable, soit à l’administration par gavage, soit à une affinité du chlorure mercurique pour la muqueuse, a été observée. La mortalité chez des rats Fischer-344 exposés du chlorure mercurique par gavage pendant 2 ans est augmentée chez les mâles à la dose de 1,9 mg Hg.kg-1.j-1, mais il n’y pas d’augmentation de la mortalité chez les femelles à la dose de 3,7 mg Hg.kg-1.j-1. Il n’y a pas d’augmentation de la mortalité chez les souris mâles et femelles B6C3F1 jusqu’à la dose de 7,4 mg Hg.kg-1.j-1 (NTP, 1993).
Une augmentation de la peroxydation lipidique hépatique, et une diminution de la glutathion peroxydase ont été observées chez des rats exposés par voie orale à une dose non spécifiée pendant 30 jours (Rana et Boora, 1992). Une diminution du poids du foie a également été observée chez des rats recevant une dose de 10 mg.kg-1 par jour pendant 4 semaines (Jonker et al., 1993).
Des effets cardiovasculaires ont aussi été observés après une exposition par voie orale au mercure inorganique. Chez le rat, l’exposition pendant 180 jours à 28 mg.kg-1 de chlorure mercurique présent dans l’eau de boisson induit une diminution de la contractilité cardiaque, une augmentation de la pression sanguine mais aucun effet sur la fréquence cardiaque (Carmignani et al., 1992). L’augmentation de la pression sanguine a été attribuée à un effet vasoconstricteur du mercure et l’augmentation de la contractilité cardiaque a été attribuée à un effet toxique direct du mercure sur le muscle cardiaque. Des résultats légèrement différents ont été observés après une exposition de 350 jours à 7 mg de chlorure mercurique par kg et par jour présent dans l’eau de boisson chez les rats d’une souche différente (Boscolo et al., 1989 ; Carmignani et al., 1989). Une réponse inotrope positive, une augmentation de la pression sanguine et de la contractilité cardiaque ainsi qu’une diminution de la sensibilité des barorécepteurs ont été observées lors de cette étude. Ce résultat a permis de montrer que les mécanismes conduisant à une cardiotoxicité, dans le cadre d’une exposition chronique au mercure inorganique, impliquaient un relargage de noradrénaline par les terminaisons présynaptiques.
De nombreuses études ont été menées sur les effets immunitaires pouvant être induits par une exposition par voie orale au mercure inorganique. Cet impact sur le système immunitaire dépend de l’espèce et de la souche animale étudiée. La plupart des rats développent une protéinurie et une néphropathie. A la dose de 0,04 mg.kg-1 de mercure inorganique, des anticorps liés à la membrane rénale sont observés, tandis qu’à plus fortes concentrations (0,07-1,48 mg.kg-1) apparaît une protéinurie. L’étude de Druet et al., 1978 dans laquelle des rats "Brown Norway" furent exposés par injection sous-cutanée à 0, 100, 250, 500, 1 000 et 2 000 µg.kg-1 de chlorure mercurique, 3 fois par semaine pendant 8 semaines et à 50 µg.kg-1 pendant 12 semaines, a mis évidence la présence d’anticorps IgG dans les reins chez tous les rats exposés, accompagnée de protéinurie chez les rats exposés à 100 µg.kg-1 de chlorure mercurique ou à des doses supérieures. Des lésions tubulaires sont apparues à la plus forte dose de mercure soit 2 000 µg.kg-1. Cette étude a permis de déterminer un LOAEL de 0,317 mg.kg-1.j-1 pour une réaction auto-immune mesurée par la présence d’IgG dans les reins. Dans l’étude de Bernaudin et al., 1981 où des rats "Brown Norway" furent exposés par l’intermédaire de la nourriture à 0 ou à 3 000 µg.kg-1 par semaine de chlorure mercurique pendant 60 jours, un dépôt d’IgG dans les glomérules fut observé chez 80 % des rats après 15 jours d’exposition et chez 100 % des rats après 60 jours d’exposition. Une légère protéinurie est observée chez 60 % des rats exposés. Un LOAEL de 0,226 mg.kg-1.j-1 a été établi à partir de cette étude. Enfin, l’étude de Andres (1984) menée chez des rats "Brown Norway" et chez des rats "Lewis" exposés, par gavage, à 3 mg.kg-1 de chlorure mercurique présent dans 1 L d’eau de boisson, 2 fois par semaine pendant 60 jours, a mis en évidence la présence d’un dépôt d’IgG au niveau du glomérule chez les rats "Brown Norway" ainsi que des lésions au niveau du colon et de l’iléon et un dépôt anormal d’IgA au niveau de la lame basale des glandes intestinales. Aucun effet néfaste n’a été observé chez les rats "Lewis".
Mercure organique
Le mercure organique induit, par voie orale, des troubles respiratoires, cardiovasculaires, gastro-intestinaux, hématologiques, rénaux, immunologiques, neurologiques et une perte de poids. L’effet critique est l’atteinte neurologique.
Charleston et al., 1996 ont étudié l’effet à long terme de l’exposition du méthylmercure sur le nombre de neurones, d’oligodendrocytes, d’astrocytes, de microglies, de cellules épithéliales et de péricytes présents dans le thalamus chez le singe "Macaca fasciculus". Quatre lots de guenons, 4-5 individus par lot, ont été exposés pendant 6, 12 ou 18 mois à 50 µg de méthylmercure par kg et par jour. Le méthylmercure était présent dans du jus de pomme. Dans un des lots, les singes ont été exposés pendant 12 mois suivis de 6 mois sans exposition. Un lot témoin fut établi pour chaque temps d’exposition. Le comportement des singes ne semblait pas différent après l’exposition au mercure, les fonctions hématologiques ne sont pas touchées et les constantes sanguines ont été normales. Les singes exposés pendant 6 mois présentaient une réduction de 44,6 % du nombre d’astrocytes. Cette réduction a été également observée chez le lot des singes exposés au méthylmercure pendant 12 mois suivis de 6 mois sans exposition (réduction du nombre d’astrocytes de 37,2 %). Une augmentation de 228 % du nombre de microglies fut observée chez les singes exposés pendant 18 mois. Cette augmentation est de 162 % chez les singes ayant été exposés pendant 12 mois, puis non exposés pendant 6 mois. L’étude de la spéciation du mercure présent dans le thalamus des singes a montré que la concentration de méthylmercure atteint un plateau chez les singes exposés pendant 12 mois.
Par voie orale, une seule étude traite de l’effet respiratoire du mercure organique chez l’animal : l’exposition pendant 2 ans à du chlorure de méthylmercure présent dans la nourriture des rats n’induit aucune lésion pulmonaire pour une dose de 0,1 mg Hg.kg-1.j-1 (Verschuuren et al., 1976). Dans cette même étude, aucune modification histopathologique du cœur ne fut observée. D’autres études ont par contre mis en avant l’effet du mercure organique sur le cœur. Une diminution de la pression systolique du sang a été constatée chez les rats mâles exposés, par gavage, à 0,4 mg.kg-1.j-1 de chlorure de méthylmercure pendant 3 à 4 semaines (Wakita, 1987). Cet effet fut observé environ 60 jours après le début de l’exposition et persiste au moins pendant 9 mois.
Le mercure organique ingéré est également toxique pour le système gastro-intestinal et hématologique. L’exposition de rats pendant 2 ans à de l’acétate de phénylmercure présent dans l’eau de boisson, induit une nécrose et une ulcération du caecum à partir de 4,2 mg Hg.kg-1.j-1. Aucun effet n’est observé lorsque les rats sont exposés pendant 2 ans à
1,7 mg.kg-1.j-1 d’acétate de phénylmercure (Fitzhugh et al., 1950 ; Solecki et al., 1991). Cependant, les femelles présentent des altérations légères à modérées des reins (dilatation tubulaire, atrophie, fibrose) à partir de 0,5 ppm d’acétate de phénylmercure soit 0,042 mg.kg-1.j-1. A la dose de 0,1 ppm soit 0,0084 mg.kg-1.j-1, aucune anomalie n’a été observée (Fitzhugh et al, 1950). Un NOEL de 0,1 ppm soit 0,0084 mg.kg-1.j-1a été retenu.
Après avoir été exposées pendant 2 ans, par la nourriture, à 0,60 mg.kg-1.j-1 de chlorure de méthylmercure, les souris présentaient une ulcération de l’estomac glandulaire (Mitsumori et al., 1990).
L’effet principalement observé chez les rongeurs après une exposition par voie orale au mercure organique est une toxicité rénale. Des modifications histopathologiques à ce niveau ont été observées chez les rats femelles exposés, par gavage, 5 jours par semaine, pendant 3 à 12 semaines à 0,86, 1,68 ou à 3,36 mg.kg-1.j-1 de diacyanidiamide de méthylmercure. Le lot exposé à la plus faible dose présente de larges foyers de cellules basophiles au niveau des tubules, une desquamation cellulaire, une fibrose et une inflammation du cortex rénal (Magos et Butler, 1972). Mais aucun lot témoin n’a été réalisé dans cette étude. Dans l’étude de Fitzhugh et al., 1950, les rats exposés pendant 2 ans, par la nourriture, à l’acétate de phénylmercure présentaient des altérations légères à modérées des reins (dilatation tubulaire, atrophie, fibrose). Ces effets ont été observés chez les rats femelles à partir de 0,5 ppm d’acétate de phénylmercure (0,042 mg Hg.kg-1.j-1). A la dose de 0,1 ppm (0,0084 mg.kg-1.j-1), aucune anomalie n'a été observée. Une dégénérescence des cellules épithéliales ainsi qu’une fibrose interstitielle furent observées chez les souris exposées pendant 2 ans à 0,13 mg de chlorure de méthylmercure par kg et par jour. Aucun effet ne fut constaté à la dose de 0,03 mg Hg.kg-1.j-1 (Mitsumori et al., 1990).
Le mercure organique induit également une diminution du poids des rongeurs. Chez les rats, l’exposition à 0,4 mg d’acétate de phénylmercure, présent dans la nourriture, pendant 2 ans, induit une perte du gain de poids de 10 % (Solecki et al., 1991).
Le mercure organique induit aussi chez les animaux des troubles hématologiques et immunologiques. L’étude de Solecki et al., 1991 a montré que des rats ayant été exposés par l’eau de boisson à 4,2 mg.kg-1.j-1 d’acétate de phénylmercure présentaient une diminution du taux d’hémoglobine et du taux d’hématocrite ainsi qu’une réduction du nombre d’hématies. Des souris BALB/c exposées, par voie orale, pendant 12 semaines à 0,5 mg de méthylmercure dans la nourriture présentent des troubles immunologiques caractérisés par une diminution du poids du thymus d’environ 22 % et une diminution du nombre de cellules dans le thymus d’environ 50 %. L’activité des cellules NK «Natural Killer» fut réduite de 44 % dans la rate et de 75 % dans le sang. Un LOAEL de 0,5 mg.kg-1.j-1 a été établi chez les souris femelles pour une réduction de l’activité des cellules « Natural Killer » et pour une diminution de poids du thymus.
La déméthylation du méthylmercure conduisant à l’ion mercurique, il existe une certaine similarité de mécanismes toxiques des formes de mercure. De plus, il a été montré que chez des rats exposés in utero à du mercure élémentaire, à du méthylmercure, ou les deux, les effets neurotoxiques sont similaires aux effets du méthymercure potentialisant les effets du mercure élémentaire (Fredriksson et al., 1996).
Voie cutanée
Mercure inorganique
Aucune étude ne traite des effets induits par une exposition par voie cutanée au mercure élémentaire et au mercure inorganique chez l’animal.
Synthèse
Chez l'animal les observations et les organes cibles sont les mêmes que chez l'homme.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
Substance Chimique |
Voies d’exposition |
Taux d’absorption |
Organe cible Principal |
Organe cible Secondaire |
|---|---|---|---|---|
|
Mercure élémentaire |
Inhalation |
ND |
SNC, rein, cardio-vasculaire |
foetus |
|
Ingestion |
1 à 8,5 % |
SNC, rein |
coeur, intestin |
|
|
Cutanée |
ND |
ND |
bouche |
|
|
Mercure inorganique |
Inhalation |
40 % (chien) |
SNC |
ND |
|
Ingestion |
1 à 8,5 % |
SNC, reins |
Cœur, système immunitaire |
|
|
Cutanée |
ND |
Cœur, rein, SNC |
Intestin, système immunitaire. |
|
|
Mercure organique et méthylmercure |
Inhalation |
ND |
SNC, rein |
Fœtus, systèmes respiratoire et gastro-intestinal, muscles |
|
Ingestion |
Quasi-totale (phénylmercure) |
SNC |
ND |
|
|
Cutanée |
75 % |
ND |
ND |
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| IARC | Mercure et composés inorganiques : groupe 3 « l’agent (ou le mélange) ne peut être classé pour sa cancérogénicité pour l’homme » Méthylmercure : groupe 2B « l’agent ou le mélange pourrait être cancérogène pour l’homme » . | 1993 |
| US EPA | Mercure élémentaire : « ne peut pas être classé comme cancérogène pour l’homme » Chlorure mercurique : classe C –« cancérigène possible pour l’homme ». Méthylmercure : classe C – « cancérigène possible pour l’homme » | 1995 |
Chez l'homme
Toutes voies
Mercure élémentaire
Un certain nombre d’études épidémiologiques ont été conduites pour examiner la mortalité par cancer chez des salariés exposés aux vapeurs de mercure élémentaire.
Les résultats sont variés :
- Une étude de cohorte menée dans une usine de fabrication d’armes chimiques n’a pas mis en évidence de différence significative concernant le risque de cancer du poumon entre les salariés exposés et les salariés non exposés (Cragle et al., 1984).
- L’étude de Barregard et al., 1990 réalisée dans une usine de fabrication de chlore à montré l’existence d’un excès de risque significatif de cancer du poumon ainsi qu’un excès de risque non significatif des cancers du cerveau et du rein chez les salariés exposés par rapport aux salariés non exposés.
- Des risques significatifs de cancer du cerveau ont été montrés dans une usine de fabrication de chlore en Norvège (Ellingsen et al., 1992).
Les résultats obtenus lors de ces études sont contradictoires.
Mercure inorganique - Chlorure mercurique
Aucune étude épidémiologique n’a été réalisée sur l’effet cancérigène du mercure inorganique.
Mercure organique - Méthylmercure
Chez l’homme, trois études menées au Japon, en Pologne et en Suède (Tamashiro et al., 1984 ; Janicki et al., 1987; Erikson, 1981-1990) ont été sélectionnées pour examiner la relation entre l’exposition au méthylmercure et l’effet cancérogène éventuel. Cette relation n’a pu être clairement mise en évidence.
Synthèse
Les résultats contradictoires, concernant la cancérogénèse du mercure et de ses composés, ne permettent pas de statuer sur son caractère cancérigène, ce qui explique l’absence de classification européenne.
Chez l'animal
Voie orale
Il n’existe pas d’études expérimentales concernant la cancérogénicité du mercure élémentaire.
Mercure inorganique - chlorure mercurique
Les résultats de l’étude du NTP (1993) menée chez le rat et la souris exposés pendant 2 ans, par gavage, au chlorure mercurique ont montré :
- chez la souris mâle, la présence de quelques adénomes et adénocarcinomes rénaux,
- chez le rat femelle, la présence de quelques adénocarcinomes rénaux
De plus, chez le rat une relation dose-effet a été observée :
- chez les femelles, pour l’apparition de papillomes de l’estomac,
- chez le mâle et la femelle, pour l’apparition de l’hyperplasie de l’estomac.
Deux autres études ne mettent pas clairement en évidence la cancérogénicité du chlorure mercurique (Fitzhugh et al., 1950 ; Schroeder et Mitchener, 1975).
Mercure organique- Méthylmercure
Les études réalisées chez des souris de deux souches différentes exposées au méthylmercure, par leur alimentation, ont montré une augmentation de l’incidence des tumeurs rénales uniquement chez les souris mâles (Hirano et al., 1986 ; Mitsumori et al., 1981 ; Mitsumori et al., 1990).
Chez le rat, les études sont plus limitées et les résultats n’ont pas permis de mettre en évidence un effet cancérogène du mercure organique (Mitsumori et al., 1983 ; Mitsumori et al., 1984; Verschuure et al., 1976 ; Verschuuren et al., 1976).
Synthèse
Les résultats contradictoires, concernant la cancérogénèse du mercure et de ses composés, ne permettent pas de statuer sur son caractère cancérigène, ce qui explique l’absence de classification européenne.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le chlorure mercurique est classé en catégorie 2 | 2009 |
Chez l'homme
Toutes voies
Il existe peu d’études sur le potentiel génotoxique du mercure chez l’homme. Les études épidémiologiques chez des ouvriers exposés à du mercure élémentaire (Anwar et Gabal, 1991 ; Barregard et al., 1991 ; Mabille et al., 1984 ; Popescu et al., 1979 ; Verschaeve et al., 1976 ; Verschaeve et al., 1979 ) ou accidentelles par ingestion (Wulf et al., 1986) n’apportent pas de preuves convaincantes de l’altération du nombre et de la structure des chromosomes dans les cellules somatiques humaines.
Chez l'animal
Toutes voies
Chez l’animal, des études ont pu montrer le caractère potentiellement génotoxique du mercure. Le chlorure mercurique est capable de se fixer à la chromatine de fibroblastes de rats (Rozalski et Wierzbicki, 1983) et aux cellules ovariennes de hamster chinois (Cantoni et al., 1984). Il a également été noté des dommages sur l’ADN de fibroblastes embryonnaires de souris et de rats (Zasukhina et al., 1983) et d’autres études ont montré que le chlorure mercurique est capable d’engendrer des cassures monobrin de l’ADN (Cantoni et al., 1984 ; Christie et al., 1984).
Synthèse
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le mercure élémentaire est classé Repr. Cat. 1B et le chlorure mercurique est classé Repr. Cat. 2. | 2009 |
Chez l'homme
Inhalation
Mercure élémentaire
Dans une étude épidémiologique, réalisée chez des assistantes dentaires, les auteurs ont montré que la fécondabilité des femmes exposées à de fortes concentrations en mercure (via les amalgames dentaires) n’est que de 63% par rapport aux femmes non exposées aux amalgames contenant du mercure (Rowland et al., 1994). De même, une étude récente a pu montrer que les femmes exposées à des vapeurs de mercure au travail (0,001-0,200 mg.m-3) présentent plus de douleurs abdominales et des dysménorrhées comparativement aux femmes non exposées (Yang et al., 2002).
Mercure inorganique
Au cours d’une étude épidémiologique chez des femmes régulièrement exposées à du mercure (80 µg.m-3), aucun effet néfaste sur le taux de fertilité n’a été observé (Goncharuk, 1977).
Synthèse
Il a clairement été montré un effet reprotoxique du mercure et du méthylmercure. En effet chez l’homme une exposition au mercure peut provoquer des avortements spontanés et des malformations (tératogénicité). Des troubles neurocomportementaux peuvent apparaître lorsque les mères sont exposées au méthylmercure. Ces effets sont confirmés par les données expérimentales.
Chez l'animal
Inhalation
Mercure élémentaire
Une étude réalisée chez la ratte a montré l’allongement des cycles menstruels à la concentration de 2,5 mg.m-3 de mercure élémentaire pour une exposition de 6 heures par jour, 5 jours par semaine pendant 21 jours.*
Intraveineuse
Mercure inorganique
Une seule injection, chez le rat mâle, de chlorure méthylmercurique à 1 mg de mercure par kg, provoque une diminution de la fertilité qui est réversible après deux mois (Lee et Han, 1995).
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | le chlorure mercurique est classé Mut. Cat. 2 | 2009 |
Chez l'homme
Inhalation
Mercure élémentaire
Des études menées, sur des femmes enceintes, chez les dentistes et leur personnel, au Danemark, aux USA, en Pologne, en Suède, en Union Soviétique, décrivent une augmentation des malformations congénitales et des avortements. De même, une diminution du poids des enfants à la naissance a été notée. L’étude de Cordier et al., 1991 a mis en évidence un risque d’avortement spontané doublé chez les femmes de salariés exposés au mercure élémentaire, si la concentration de mercure dans les urines des salariés est supérieure à 50 µg.L-1. Cependant, il semble que la relation entre l’exposition au mercure élémentaire et les effets sur la reproduction ne soit pas aussi évidente.
Mercure inorganique
Une étude menée chez les femmes travaillant dans une fonderie, exposées à 80 µg.m-3 de mercure, a montré une augmentation des avortements spontanés (Goncharuk, 1977).
Etant donné la sensibilité des enfants au méthylmercure et les similarités de mécanismes toxiques avec le mercure élémentaire, les enfants peuvent être considérés comme plus sensibles à la toxicité du mercure inorganique. De nombreuses études ont pu montrer que l’exposition au mercure in utero et post-natal induit une neurotoxicité et une toxicité sur le développement (Grandjean et al., 1994 ; Harada, 1995 ; McKeown-Eyssen et Ruedy, 1983 ; McKeown-Eyssen et al., 1983).
Voie orale
Mercure organique
Plusieurs études menées dans des endroits différents (les îles Seychelles, les îles Féroé, la Nouvelle Zélande) ont étudié l’effet du méthylmercure sur le développement des enfants dont les mères furent exposées pendant toute la grossesse à du méthylmercure par voie orale. Ces publications ont principalement étudié les paramètres neurospychologiques et les effets sur le neurocomportement des enfants.
Les études longitudinales sur le développement réalisées dans les îles Seychelles (Myers et al., 1995b ; Myers et al., 1995c ; Myers et al., 1995a ; Myers et al., 1997; Myers et Davidson, 1998; Davidson et al., 1995a, 1995b, 1998) ont été menées chez 779 enfants issus de mères contaminées par le méthylmercure, présent dans les poissons consommés. Les enfants ont été suivis de la naissance jusqu'à l’âge de 5,5 ans et certains paramètres neuropsychologiques ont été étudiés. La quantité de mercure présent dans les cheveux des mères exposées fut mesurée comme biomarqueur d’exposition. La concentration moyenne de mercure présent dans les cheveux des femmes enceintes était de 6,8 ppm et la concentration moyenne la plus élevée était de 15,3 ppm. Aucun trouble du comportement n’a été mis en évidence chez les enfants et ce, quelle que soit la concentration de mercure présent dans les cheveux des mères.
Dans l’étude menée dans les îles Féroé, 900 enfants, dont les mères furent contaminées par voie orale par le méthylmercure, ont été examinés (Grandjean et al., 1997). La quantité de mercure présent dans le sang et dans les cheveux des mères exposées a été mesurée. A l’âge de 7 ans les enfants ont subi une série de tests comportementaux. Dans leur étude, Grandjean et al., 1994 ont montré que des risques de troubles neurocomportementaux pouvaient apparaître chez l’enfant si la concentration de méthylmercure présent dans les cheveux de la mère était supérieure à 6 µg de mercure par g de cheveux soit 2,4 µg de mercure pour 100 mL de sang. Une étude récente publiée par la même équipe (Grandjean et al., 2003) a été réalisée chez 1 022 enfants nés dans les îles Féroé de mars 1986 à décembre 1987. La performance neurocomportementale de 917 enfants fut analysée à l’âge de 7 ans. L’exposition intra-utérine au méthylmercure fut déduite pour 614 enfants à partir des concentrations de mercure mesurées dans le sang et dans les cheveux des mères exposées. Chez ces 614 enfants, la diminution de la performance à 8 tests neuropsychologiques sur 16 est significative et est directement corrélée à la concentration de mercure dans le sang des mères exposées. Les tests neurophysiologiques présentent des résultats normaux alors que les tests neuropsychologiques réalisés révèlent des dysfonctionnements plus prononcés au niveau du langage, de la mémoire et de l’attention, et dans une moindre mesure, au niveau des fonctions motrices et visuelles. Plusieurs zones du cerveau semblent donc être atteintes suite à une exposition prénatale au méthylmercure, et ce même pour des concentrations en dessous de 10 µg.g-1 de mercure, retrouvées dans les cheveux des mères. Les auteurs suggèrent donc qu’un doublement de l’exposition au mercure est à l’origine d’un retard du développement de 2 mois, pour certaines fonctions (Grandjean et al., 1997). Cette étude confirme que l’exposition des mères au méthylmercure pendant la grossesse induit un déficit neuropsychologique chez les enfants détectable à partir de 7 ans.
L’étude de Cordier et al., 2002 menée en Guyane Française a également mis en évidence de faibles troubles neurologiques chez des enfants âgés de 5 à 7 ans dont les mères furent exposées à du méthylmercure. Une relation dose effet a été observée entre le taux de mercure présent dans les cheveux des mères, une augmentation des réflexes et une diminution dans la réussite de tests analysant l’organisation visiospatiale chez les enfants. Cette association dépend du sexe de l’enfant et est plus importante chez les garçons que chez les filles.
Les études épidémiologiques menées à la suite des accidents qui ont eu lieu au Japon, en Irak, au Canada et en Nouvelle-Zélande, ont montré que le méthyl et l’éthylmercure pouvaient provoquer des altérations du cerveau chez les enfants exposés in utero (Al-Mufti et al., 1976; Kutsuma, 1968). Les malformations les plus sévères (paralysie, retard de croissance, cécité) sont observées chez les enfants exposés pendant le second trimestre de la grossesse (Harada, 1978 ; Pierce et al., 1972; Snyder, 1971), ce qui souligne la vulnérabilité des enfants au mercure et ce qui justifie leur appartenance à une sous-population sensible.
Chez l'animal
Inhalation
Mercure élémentaire
Chez les rats, le mercure élémentaire (exposition par inhalation des mères) traverse la barrière placentaire et s’accumule chez le fœtus (Morgan et al., 2002). L’inhalation de mercure métallique (1,8 mg.m-3, 1h ou 3h par jour) pendant la gestation, et plus particulièrement entre le 11ème et le 14ème jour et entre le 17ème et le 20ème jour de gestation, a provoqué des déficits comportementaux par comparaison aux rats non exposés (Danielsson et al., 1993). Un LOAEC de 1,8 mg.m-3 dose est observé sur l’abscence de toxicité maternelle.
Des auteurs ont montré une augmentation des résorptions fœtales, une diminution de la taille des portées, ainsi qu’une modification du poids des nouveau-nés chez des rattes exposées pendant 2h par jour à 8 mg.m-3 de vapeurs métalliques de mercure entre le 6ème et le 15ème de gestation (Morgan et al., 2002).
Une exposition de rats nouveau-nés à des vapeurs de mercure élémentaire à 0,05 mg.m-3 pendant 1h ou 4h, pendant 1 semaine correspondante à une forte croissance du cerveau (du 11ème au 17ème jour post-parturition) a montré des modifications comportementales chez les rats testés à 4 et 6 mois chez le groupe exposé pendant 4 h. La sévérité des effets est directement liée à l’exposition (Fredriksson et al., 1992).
Voie orale
Mercure organique
Des études réalisées chez le singe et le rat ont montré que le mercure organique était tératogène à des doses qui ne sont pas toxiques chez la mère. Ces effets se manifestent par une hydrocéphalie, un bec de lièvre, un retard d’ossification. L’exposition prénatale peut être associée à des troubles du comportement mais aussi à des modifications fonctionnelles du rein, du foie et du système immunitaire.
Une étude chez le rat exposé au méthylmercure du 6ème au 9ème jour de gestation a permis de déterminer un NOEL de 4 µg de mercure organique par kg. Chez la souris exposée au 8ème jour de gestation, le NOEL est de 2 mg de mercure organique par kg.
Intraveineuse
Mercure inorganique
Une administration par voie intraveineuse de chlorure mercurique (0,8 mg.kg-1) au milieu de la gestation des rats provoque une augmentation de l’incidence des malformations fœtales, particulièrement au niveau du cerveau. Toutefois, ces effets semblent être liés à la toxicité maternelle (Holt et Webb, 1986).
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance dangereuse et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes dont la notoriété internationale est variable.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Aucune valeur toxicologique de référence pour des effets sans seuil n’est actuellement disponible
Valeurs de l'ANSES et/ou de l'INERIS
Description
Mercure métallique - Mercure élémentaire
Effets à seuil - Exposition chronique par inhalation
L'OEHHA propose un REL de 3.10-2 µg.m-3 pour une exposition chronique par inhalation au mercure élémentaire et composés inorganiques (2008).
Comme ce qui a été fait par l'US EPA en 1995 et rapporté ci-dessous, cette valeur a été établie à partir d’études épidémiologiques menées chez des ouvriers exposés à des vapeurs métalliques (Fawer et al., 1983 ; Piikivi et Tolonen, 1989; Piikivi et Hannien, 1989; Ngim et al., 1992 ; Liang et al., 1993). Dans ces études, les salariés exposés au mercure élémentaire présentaient des troubles de la mémoire, un manque d’autonomie ainsi que des tremblements de la main.
L'ensemble de ces études tend à déterminer une LOAEC d'environ 0,025 mg.m-3 pour une exposition sur le lieu de travail (8 h.j-1, 5 jours par semaine, environ 14 ans et pour un volume respiratoire de 10 m3 par jour), ce qui correspond, après ajustement, à une LOAEC de 0,009 mg.m-3 pour une exposition continue au sein de la population générale.
Facteur d’incertitude : Un facteur 10 est appliqué pour l'utilisation d'une LOAEC, un facteur 10 pour la variabilité au sein de l'espèce humaine (plus grande susceptibilité des enfants, notamment dans le développement du système nerveux) et un facteur 3 pour la variabilité inter-individuelle. Par rapport à la VTR de 2003, qui était de 9.10-5 mg.m-3, le facteur intra-espèce à été réévalué à 3 et un facteur supplémentaire de 10 a été ajouté pour tenir compte de la plus grande sensibilité des enfants.
Calcul = 0,009 mg.m-3 x 1/(100 x 3) = 3.10-5 mg.m-3 soit 3.10-2 µg.m-3
Mercure inorganique
Effets à seuil - Exposition aiguë par voie orale
L’ATSDR a défini un MRL de 7.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale au chlorure mercurique (2001).
Cette valeur a été évaluée à partir de l’étude NTP, 1993 menée chez des rats Fischer 344 exposés, par gavage, à 0, 0,93, 1,9, 3,7, 7,4 et 14,8 mg de chlorure mercurique par kg par jour présent dans de l’eau déionisée, 1 fois par jour pendant 14 jours. Un NOAEL de 0,93 mg.kg-1.j-1 a été établi pour des atteintes rénales chez le rat.
Facteur d’incertitude : Un facteur de 100 a été appliqué. Un facteur 10 pour l’extrapolation des données animales à l’homme et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul = 0,93 mg.kg-1.j-1 x (5 j / 7 j) x 1/100 = 6,6.10-3 mg.kg-1.j-1 (arrondi à 7.10-3 mg.kg-1.j-1)
En 2022, l’ATSDR propose un projet de nouvelle valeur de 2.10-3 mg.kg-1.j-1 en retenant comme effet critique des effets rénaux chez le chien dans une étude par gavage de 2 semaines (Dieter et al., 1992 ; NTP, 1993).
Effets à seuil - Exposition sub-chronique par voie orale
L’ATSDR a défini un MRL de 2.10-3 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale au chlorure mercurique (2001).
Cette valeur est fondée sur l’étude du NTP (1993) menée chez des rats Fischer 344. Ces rats ont été exposés, par gavage, à 0, 0,23, 0,46, 0,93, 1,9 et 3,7 mg.kg-1.j-1 de chlorure mercurique présent dans de l’eau déionisée, 1 fois par jour, 5 jours par semaine pendant 26 semaines. L’effet critique retenu est l’atteinte rénale. Un NOAEL de 0,23 mg.kg-1.j-1 a été défini.
Facteur d’incertitude : Un facteur de 100 a été appliqué. Un facteur 10 pour l’extrapolation des données animales à l’homme et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul = 0,23 mg.kg-1.j-1 x (5 j / 7 j) x 1/100 = 1,6.10-3 mg.kg-1.j-1 (arrondi à 2.10-3 mg.kg-1.j-1)
En 2022, l’ATSDR propose un projet de nouvelle valeur de 1.10-5 mg.kg-1.j-1 en retenant comme effet critique des effets rénaux chez le rat dans une étude de 28 jours (Apaydin et al., 2016).
Effets à seuil - Exposition chronique par voie orale
L’Efsa a établi une TWI de 4.10-3 mg.kg-1.sem-1 (soit 0,57.10-3 mg.kg-1.j-1) pour une exposition chronique par voie orale au mercure inorganique (Efsa, 2012).
Comme la valeur proposée par l’OMS et présentée ci-dessus, cette valeur est fondée sur l’étude du NTP (1993) menée chez des rats Fischer 344. Ces rats ont été exposés, par gavage, à 0, 0,23, 0,46, 0,93, 1,9 et 3,7 mg de chlorure mercurique par kg par jour, présent dans de l’eau déionisée, 1 fois par jour, 5 jours par semaine pendant 26 semaines. L’effet critique retenu est l’atteinte rénale. Une BMDL10 de 0,112 mg de chlorure mercurique par kg par jour a été calculée soit 0,06 mg Hg .kg-1.j-1.
Un NOAEL de 0,23 mg.kg-1.j-1 a été défini.
Facteur d’incertitude : Un facteur 100 a été appliqué. Un facteur 10 pour la variabilité inter-espèce et un facteur 10 pour la variabilité intra-espèce.
Calcul : 0,06 mg.kg-1.j-1 x 1/100 = 0,6.10-3 mg.kg-1.j-1
Mercure organique - Méthylmercure
Effets à seuil - Exposition chronique par voie orale
L’US EPA (IRIS) propose une valeur de RfD de 10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au méthylmercure (2001).
Plusieurs études épidémiologiques menées dans trois zones géographiques différentes (les îles Seychelles, les îles Féroé et la Nouvelle Zélande) ont permis d’établir une RfD de
10-4 mg.kg-1.j-1. Les études longitudinales sur le développement réalisées dans les îles Seychelles (Myers et al., 1997 ; Myers et Davidson, 1998, Davidson et al., 1995a, 1995b) ont été menées chez 779 enfants issus de mères contaminées par le méthylmercure présent dans les poissons consommés. Les enfants ont été suivis de la naissance jusqu'à l’âge de 5,5 ans et divers paramètres neurospychologiques étudiés. La quantité de mercure présent dans les cheveux des mères exposées fut mesurée.
Dans l’étude menée dans les îles Féroé, 900 enfants issus de mères contaminées par le méthylmercure furent examinés (Grandjean et al., 1997). La quantité de mercure présent dans le sang et dans les cheveux des mères exposées fut mesurée. A l’âge de 7 ans, les enfants ont subi des tests de comportements.
Les études menées en Nouvelle Zélande sont des études prospectives dans lesquelles 38 enfants dont les mères avaient une concentration de mercure dans les cheveux supérieure à 6 ppm pendant la grossesse, ont été étudiés. Des tests neuropsycologiques ont été menés chez ces enfants et comparés aux tests réalisés chez des enfants dont les mères avaient une plus faible concentration de mercure dans les cheveux. Les tests ont été réalisés chez les enfants à l’âge de 6 ans.
Afin de quantifier les relations dose-effet à partir des trois études citées ci-dessus, l’US EPA utilise l’analyse en BMD (benchmarck dose). Une BMDL05 (limite inférieure de la BMD) a été calculée pour chaque point critique retenu dans les 3 articles précédents.
Les études réalisées dans les îles Féroé prennent en compte la concentration (exprimée en ppb) de mercure dans le sang des mères. Pour le calcul de la dose de méthylmercure ingérée, l’US EPA choisi le modèle à un compartiment. Ce modèle semble approprié pour évaluer la quantité de méthylmercure ingérée en fonction de la concentration de mercure présent dans le sang. L’équation est la suivante :
d (µg.kg-1.j-1) = (c x b x V) / (A x f x bw) =
(BMDL05 µg.L-1 x 0,014 j-1 x 5 L) / (0,95 x 0,059 x 67 kg)
d = dose de méthylmercure ingéré par la nourriture, par jour
c = concentration dans le sang (µg.L-1) : (BMDL05)
b = constante d’élimination : 0,014 j-1
V = volume de sang dans le corps (L) : 5 L
A = facteur d’absorption : 0,95
F = fraction de la dose absorbée prise par le sang : 0,059
bw = poids du corps (Kg) : 67 Kg
Une dose de méthylmercure ingérée par jour a été ainsi calculée pour chaque paramètre étudié : la présence de doigts collés, le temps de réaction mesuré pendant les tests de performance continue, les résultats au test de reconnaisance par le nom de Boston et les résultats au test d’apprentissage verbal de Californie. Une BMDL05 comprise entre 0,857 et 1,472 µg.kg-1.j-1 a été ainisi calculée. Soit une moyenne de 1,16 µg.kg-1.j-1.
Pour les études réalisées en Nouvelle-Zélande, la valeur médiane ainsi que les résultats des tests de perceptibilité fournissent une RfD de 0,05 µg.kg-1.j-1.
Basée sur une analyse intégrative des 3 études, une RfD de 0,1 µg.kg-1.j-1 a été proposée.
Facteurs d’incertitude : un facteur de 10 a été appliqué. Un facteur 3 pour la variabilité et l’incertitude des modèles pharmacocinétiques dans l’estimation d’une dose ingérée à partir de la concentration de mercure présent dans le sang. Un facteur 3 pour la variabilité et l’incertitude globale apportée par l’utilisation d’un modèle pharmacocinétique.
Calcul = 1,16 µg.kg-1.j-1 x 1/10 = 10-4 mg.kg-1.j-1
Mercure organique - Acétate de phénylmercure
Effets à seuil - Exposition chronique par voie orale
L’US EPA (IRIS) propose une RfD de 8.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’acétate de phénylmercure (1996).
Cette valeur a été établie à partir de l’étude de Fitzhugh et al. (1950). Dans cette étude, des rats ont été exposés, par la nourriture, à 0, 0,1, 0,5, 2,5, 10 40 et 160 ppm d’acétate de phénylmercure pendant 2 ans. Cette étude a permis de déterminer un NOEL de 0,1 ppm (0,0084 mg.kg-1.j-1) pour des atteintes rénales chez le rat et un LOAEL de 0,5 ppm (0,042 mg.kg-1.j-1).
Facteur d’incertitude : Un facteur de 100 est appliqué. Un facteur 10 pour l’extrapolation de données animales à l’homme et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul : 0,0084 x 1/100 = 8.10-5 mg.kg-1.j-1.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Mercure métallique - Mercure élémentaire
Effets à seuil - Exposition aiguë par inhalation
L’INERIS ne retient aucune de ces deux valeurs aiguës pour le mercure élémentaire.
De manière générale, les valeurs 1h et 8h sont proposées pour des durées d'exposition caractéristiques d'une exposition accidentelle, c'est à dire une exposition unique pendant une courte durée. Ces valeurs accidentelles sont différentes des valeurs pour des expositions répétées (de plusieurs jours à la vie entière) pour lesquelles des Valeurs Toxicologiques de Référence (VTR) sont établies.
Par ailleurs, ces valeurs pour le mercure sont discutables pour une utilisation dans le cas d'une exposition accidentelle :
- valeur 1h : elle est fondée sur une étude dans laquelle l’exposition est répétée (chez le rat, pendant la période de gestation, 6 jours). De façon générale, les effets observés pendant 6 jours ne peuvent être extrapolés à ceux attendus après seulement 1 heure, dans le contexte d'un "accident". Les résultats pour 6 jours d'exposition d’une population sensible sont néanmoins pertinents pour une exposition équivalente, mais la transposition chez l'homme est accompagnée de beaucoup d'incertitudes. L'utilisation d'un facteur élevé témoigne de cette incertitude.
L'OEHHA a appliqué un facteur de 3 000 pour prendre en compte cette incertitude (extrapolation de l'animal à l'homme, un premier facteur générique, ainsi qu'un second facteur spécifique du méthylmercure (mercure organique), qui a également été appliqué au mercure inorganique, par précaution: cela correspond à un facteur de 300, assez élevé). La variabilité individuelle est également prise en compte.
Il est à noter par ailleurs que 6 jours d'organogénèse chez le rat ne sont pas équivalents à 6 jours d’organogénèse chez la femme.
- valeur 8h : la valeur est basée sur une dose critique calculée à partir d'études épidémiologiques chez des travailleurs exposés 8h.j-1, 5j.sem-1, pendant environ 14 ans. Ainsi, la valeur correspond à une exposition chronique et il est peu pertinent de réduire l'exposition de 14 ans à 8 heures. En effet, sur la même base, avec un calcul légèrement différent (ajustement par les volumes respiratoires pour une exposition continue sur la journée), l'OEHHA calcule une VTR chronique, VTR retenue par l'INERIS.
Ces valeurs ne sont donc pas retenues.
Effets à seuil - Exposition chronique par inhalation
L’INERIS propose de retenir la valeur de 0,03 µg.m-3 pour une exposition chronique par inhalation au mercure élémentaire (OEHHA, 2008).
Cinq organismes proposent des VTR : l’US EPA (1995), l’ATSDR (2001), l’OMS (CICAD, 2003), le RIVM (2001) et l’OEHHA (2008). Les VTR élaborées par ces différents organismes, se basent toutes sur les mêmes études épidémiologiques dont celle de Fawer et al., 1983, les mêmes effets critiques et les mêmes LOAEC de départ. Cette étude est jugée de bonne qualité scientifique et les effets critiques : effets neurologiques (troubles de la mémoire, un manque d’autonomie ainsi que des tremblements de la main) sont pertinents au regard du profil toxicologique de la substance.
Tous les organismes retiennent la même LOAEC de 26 µg.m-3, l’OMS quant à lui considère une valeur moyenne de 20 µg.m-3, qui reste très proche de celle retenue par les autres organismes. Tous les organismes calculent une valeur ajustée pour une exposition continue sur la base des durées d’exposition ou des volumes respiratoires, le choix de l’une ou l’autre méthode induisant une différence pour le résultat final facteur de ½ lors de l’utilisation des volumes respiratoires (10 m3/20 m3) versus 1/3 lors de l’utilisation des durées d’exposition (8 h/24 h). L’US EPA et l’OEHHA tiennent compte du volume d’air inhalé ce qui est la méthode la plus pertinente alors que les autres organismes préfèrent les durées d’exposition.
Enfin, les différences se situent également au niveau des facteurs d’incertitude choisis : tous les organismes retiennent un facteur global de 30 sauf l’OEHHA qui applique un facteur de 300. Le facteur global de 30 correspond à un facteur de 10 pour la variabilité intra-espèce, à ce niveau l’OEHHA retient un facteur de 30 au lieu de 10, et d’un facteur de 3 pour l’utilisation d’un LOAEC, seul l’US EPA ne retient pas ce dernier alors que l’OEHHA prend un facteur de 10 au lieu de 3. Toutefois, il existe donc de légères différences selon les organismes. Ainsi, l’US EPA a ajouté un facteur 3 pour le manque de données. Comme précisé ci-dessus, l’OEHHA applique un facteur 10 pour l’extrapolation d’une LOAEC à une NOAEC, ce qui est pénalisant, par rapport au facteur 3 utilisé par l’US EPA. L’OEHHA applique un facteur 10 pour la plus grande sensibilité des enfants et un facteur de 3 pour la variabilité inter-individuelle. Même si l’OEHHA propose une VTR très pénalisante (ceci dû au facteur 10 pour la LOAEC), elle semble plus pertinente que celle de l’US EPA parce qu’elle tient compte de la sous-population sensible que sont les enfants.
De plus, le mercure n’étant pas un élément constitutif normal chez l’homme, et devant être le moins possible présent dans l’environnement, la valeur la plus faible est retenue.
Cette valeur est retenue par l’INERIS.
La construction de la VTR est scientifiquement valide. De plus, l’ensemble des facteurs d’incertitudes, en particulier pour la prise en compte de la susceptibilité accrue des enfants, est justifié.
Indice de confiance : moyen (les données sont principalement professionnelles, et les expositions multiples).
Mercure inorganique
Effets à seuil - Exposition sub-chronique par inhalation
L’INERIS ne recommande pas de VTR pour une exposition sub-chronique par inhalation au mercure inorganique.
Il ne nous semble pas opportun de retenir une valeur pour l’exposition sub-chronique aux vapeurs de mercure inorganique, car il ne s’agit pas d’une voie majoritaire d’exposition pour cette forme de mercure. De plus, un seul organisme a nommément établi une valeur pour les vapeurs de mercure inorganique (OMS) alors que les autres organismes de référence ont déterminé une valeur pour la voie respiratoire pour le mercure métallique (ou élémentaire), ce qui semble plus judicieux, cette forme de mercure étant la plus représentée dans le cas de l’inhalation.
Aucune VTR sub-chronique pour l’exposition à du mercure inorganique par voie respiratoire n’est donc à retenir.
Effets à seuil - Exposition aiguë par voie orale
L’INERIS propose de retenir la valeur de 7.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale au mercure inorganique (ATSDR, 2001).
La valeur de l’ATSDR est la seule VTR proposée pour une exposition aiguë. Elle s’appuie sur une étude expérimentale de bonne qualité scientifique (NTP, 1993), concernant les effets rénaux du mercure inorganique. La construction de cette VTR est correcte, la durée de l’étude utilisée correspondant à une exposition aiguë. Le point de départ est un NOAEL de 0,93 mg Hg.kg-1.j-1, auquel est appliqué un facteur de sécurité de 100 (facteur intra-espèce de 10 et facteur inter-espèces de 10). De plus un ajustement au temps pour la population générale est réalisé (5j/7j).
Cette valeur est retenue par l’INERIS.
La construction de la VTR est bien décrite et scientifiquement correcte.
Indice de confiance : élevé.
Effets à seuil - Exposition sub-chronique par voie orale
L’INERIS propose de retenir la valeur de 2.10-3 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale au mercure inorganique (ATSDR, 2001).
La valeur de l’ATSDR est la seule VTR proposée pour une durée d’exposition sub-chronique. Elle s’appuie sur une étude expérimentale de bonne qualité scientifique (NTP, 1993), concernant les effets rénaux du mercure inorganique. La construction de cette VTR est correcte, la durée de l’étude qui est utilisée correspondant bien à une exposition sub-chronique. Le point de départ est un NOAEL de 0,23 mg Hg.kg-1.j-1, auquel est appliqué un facteur de sécurité de 100 (facteur intra-espèce de 10 et facteur inter-espèces de 10). De plus un ajustement au temps pour la population générale est réalisé (5j/7j).
Cette valeur est retenue par l’INERIS.
La construction de la VTR est bien décrite et scientifiquement correcte.
Indice de confiance : élevé.
Effets à seuil - Exposition chronique par voie orale
Pour une exposition chronique, l’INERIS recommande la valeur de 6,6.10-4 mg.kg-1.j-1 comme VTR pour une exposition chronique au mercure inorganique (Efsa, 2012).
Cinq organismes proposent des valeurs US EPA (1995), OMS (2011), RIVM (2001), Santé Canda (2021) et l’Efsa (2012). L’Anses (2016) propose de retenir la valeur construite par l’Efsa, ce choix a été reconduit en 2018.
Une étude de bonne qualité scientifique (NTP, 1993), est disponible concernant les effets rénaux du mercure inorganique et sert de base à l’élaboration des VTR de l’OMS, du RIVM et de l’Efsa. La VTR de l’US EPA et de Santé Canada semble moins pertinente, car elle est basée sur des études expérimentales plus anciennes et de moins bonne qualité.
Les VTR élaborées par l’OMS et le RIVM se basent sur les mêmes effets critiques et la même étude. Ces organismes prennent comme point de départ un NOAEL de 0,23 mg Hg.kg-1.j-1, auquel est appliqué un facteur de sécurité de 100. La VTR en résultant est de 2 µg Hg.kg-1.j-1. Aucun facteur n’est appliqué pour l’extrapolation sub-chronique à chronique par l’OMS et le RIVM.
L’Efsa retient la même étude et le même effet critique que l’OMS et le RIVM mais réalise un calcul de BMDL et applique un facteur d’incertitude identique à celui retenu par l’OMS et le RIVM. Cette construction de l’Efsa est plus pertinente que l’approche de l’OMS ou du RIVM.
La valeur de l’Efsa est retenue par l’Anses et l’Ineris.
Indice de confiance : moyen, du fait de l’absence de prise en compte de l’extrapolation sub-chronique vers chronique.
Mercure organique - Méthyl mercure
Effets à seuil - Exposition chronique par voie orale
L’INERIS propose de retenir la valeur RfD de 10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au méthylmercure (US EPA, 2001).
Cinq organismes proposent des VTR l’ATSDR (2001), l’US EPA (2001), l’OMS (2003), Santé Canada (2021), le RIVM (2001) et l’Efsa (2012). L’Anses a réalisé un choix de VTR et retient la valeur de l’Efsa (Anses, 2018). Les VTR élaborées par les différents organismes se basent toutes sur les mêmes études épidémiologiques (RIVM, ATSDR : Davidson et al. (1998), OMS : Myers et al., 2003 et Grandjean et al., 2003, US EPA : Myers et al., 1997 ; Myers et Davidson, 1998, Davidson et al., 1995a, 1995b et Grandjean, 1997) les mêmes effets et les mêmes LOAEL de départ. Toutefois, l’US EPA et l’EFSA tient compte des résultats des 3 études afin de déterminer une BML05 intégrant donc l’ensemble des résultats. Cette approche est jugée plus pertinente. Enfin, les facteurs d’incertitude appliqués par l’Efsa ne sont pas ceux habituellement recommandés pour la construction d’une VTR ce qui limite la confiance dans cette valeur.
C’est pourquoi nous préconisons de la retenir comme VTR, d’autant plus qu’elle s’avère la plus sécuritaire des VTR disponibles.
Indice de confiance : élevé
Mercure organique - Acétate de phénylmercure
Effets à seuil - Exposition chronique par voie orale
L’INERIS propose de retenir la valeur RfD de 8.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’acétate de phénylmercure
Seul l’US EPA (1996) a fourni une VTR pour l’acétate de phénylmercure à partir d’une étude expérimentale Fitzhugh et al. (1950), de bonne qualité. Cette valeur sera retenue en cas d’exposition spécifique à cette substance.
Cette valeur est celle proposée par l’US EPA qui considère que la confiance dans la valeur est faible.
Indice de confiance : Faible
Autres valeurs des organismes reconnus
Description
Mercure métallique - Mercure élémentaire
Effets à seuil - Exposition aiguë par inhalation
Seul l’OEHHA propose des VTR aiguës pour le mercure élémentaire.
L'OEHHA propose un REL de 0,6 µg.m-3 pour une exposition aiguë (1 heure) par inhalation au mercure élémentaire et composés inorganiques (2008).
Cette VTR est établie à partir des résultats de l’étude de Danielsson et al., 1993 chez des rates gestantes (12 rates par lot). Les animaux ont été exposés par inhalation à des vapeurs de mercure élémentaire pendant une heure par jour. L’effet critique observé consiste en des troubles au niveau du système nerveux central de la descendance. Une LOAEC de 1,8 mg.m-3 a été déterminée.
Facteur d’incertitude : Un facteur d’incertitude de 10 est appliqué pour l’utilisation d’un LOAEL, un facteur 3 pour l’extrapolation des données animales, un facteur 10 pour la plus grande sensibilité de l’homme par rapport à l’animal et un facteur intra-espèce de 10, soit un facteur d’incertitude total de 3 000.
Calcul = 1,8 mg.m-3 x (1/3 000) = 6.10-4 mg.m-3
L'OEHHA propose un REL de 6.10-2 µg.m-3 pour une exposition aiguë (8 heures) par inhalation au mercure élémentaire et composés inorganiques (2008).
Cette valeur a été établie à partir d’études épidémiologiques menées chez des ouvriers exposés à des vapeurs métalliques (Fawer et al., 1983 ; Piikivi et Tolonen, 1989; Piikivi et Hannien, 1989; Ngim et al., 1992 ; Liang et al., 1993). Dans ces études, les salariés exposés au mercure élémentaire présentaient des troubles de la mémoire, un manque d’autonomie ainsi que des tremblements de la main.
L'ensemble de ces études a permis de déterminer une LOAEC d'environ 0,025 mg.m-3 pour une exposition sur le lieu de travail (8 h.j-1, 5 jours par semaine, environ 14 ans), ce qui correspond, après ajustement, à une LOAEC de 0,018 mg.m-3 pour une exposition continue au sein de la population générale.
Facteur d’incertitude : Un facteur 10 est appliqué pour l'utilisation d'une LOAEC, un facteur 10 pour la variabilité au sein de l'espèce humaine (plus grande susceptibilité des enfants, notamment dans le développement du système nerveux) et un facteur 3 pour la variabilité inter-individuelle.
Calcul = 0,018 mg.m-3 x 1/(100 x 3) = 6.10-5 mg.m-3
Effets à seuil - Exposition chronique par inhalation
L’US EPA (IRIS) propose une RfC de 0,3 µg.m-3 pour une exposition chronique par voie pulmonaire au mercure élémentaire (1995).
Cette valeur a été établie à partir d’études épidémiologiques menées chez des ouvriers exposés à des vapeurs métalliques (Fawer et al., 1983 ; Piikivi et Tolonen, 1989; Piikivi et Hannien, 1989 ; Ngim et al., 1992 ; Liang et al., 1993). Dans ces études, les salariés exposés au mercure élémentaire présentaient des troubles de la mémoire, un manque d’autonomie ainsi que des tremblements de la main.
L’étude principale retenue est celle de Fawer et al. (1983). Dans cette étude, des salariés exposés à une moyenne de 0,026 mg.m-3 de mercure élémentaire souffraient de tremblements de la main. La TWA de 0,026 mg.m-3 a été retenue comme LOAEC ce qui a permis, après ajustement, de déterminer une LOAEC de 9 µg.m-3 (en tenant compte du temps de travail par semaine et du volume d’air inhalé : 0,026 x (8 h / 24 h) x (5 j / 7 j) x (10 m3 / 6,7 m3)[1]).
Deux études plus récentes (Liang et al., 1993 ; Ngim et al., 1992) ont permis d’établir des LOAEC similaires, respectivement 12 µg.m-3 et 6 µg.m-3. La LOAEC proposé par Fawer et al. (1983) a été retenue car elle correspond à une valeur médiane.
Facteurs d’incertitude : Un facteur de 30 est appliqué : un facteur 10 pour protéger l’ensemble de la population et un facteur 3 pour combler le manque de données (notamment les effets sur le développement et la reproduction).
Calcul = 9.10-3 mg.m-3 x 1/30 = 3.10-4 mg.m-3 soit 0,3 µg.m-3
L’ATSDR a établi un MRL de 0,2 µg.m-3 pour une exposition chronique par inhalation au mercure élémentaire (2001).
Cette valeur a été déterminée à partir de l’étude de Fawer et al. (1983) également retenue par l’US EPA. Vingt six salariés ont été exposés en moyenne à 0,026 +/- 0,004 mg.m-3 de mercure élémentaire et 3 salariés ont été exposés à plus de 0,05 mg.m-3 de mercure. Une LOAEC de 0,026 mg.m-3 a été retenu. Contrairement à l’US EPA, lors de l’ajustement de la LOAEC, l’ATSDR ne tient pas compte du volume d’air inhalé.
LOAELADJ = 0,026 x (8 h/ 24 h) x (5 j / 7 j) = 0,0062 mg.m-3
Facteurs d’incertitude : Un facteur de 30 fut appliqué. Un facteur de 3 pour l’utilisation de la LOAEC et un facteur de 10 pour la variabilité au sein de la population humaine.
L’ATSDR juge ce MRL suffisant pour protéger des effets affectant le développement neurologique du fœtus humain et des enfants qui représentent le sous-groupe le plus sensible à la toxicité du mercure élémentaire.
Calcul = 6,2 10-3 mg.m-3 x 1 / 30 = 2.10-4 mg.m-3 soit 0,2 µg.m-3
En 2022, l’ATSDR propose un projet de valeur pour une exposition chronique 0,3 µg.m-3. Cette valeur est basée sur une série de 7 études épidémiologiques en milieu professionnel dont celle de Fawer et al. (1983). Si cette valeur était confirmée, elle pourrait conduire à une évolution du choix de VTR.
L’OMS, 2003 (CICAD) établit une TCI de 0,2 µg.m-3 pour une exposition chronique par inhalation au mercure élémentaire (OMS CICAD, 2003).
Cette valeur se base aussi sur l’étude (Fawer et al., 1983) qui précise qu’une exposition moyenne à 20 µg.m-3 induit des effets au niveau du système nerveux central mais non cliniquement observables chez les travailleurs exposés. L’extrapolation de cette valeur pour une exposition de 8 h par jour, 40 h par semaine, 5 jours par semaine, à une valeur d’exposition pour 24 h par jour et 7 jours sur 7 conduit à un équivalent de 4,8 µg.m-3.
Facteurs d’incertitude : Un facteur d’incertitude total de 30 a été appliqué, se décomposant ainsi : 10 pour la variabilité inter-individuelle et 3 pour l’utilisation d’une LOAEC plutôt qu’une NOAEC, ce qui conduit à la valeur de 2.10-4 µg.m-3.
Calcul = 0,020 mg.m-3 x 8/24 x 5/7 x 1/30 = 2.10-4 mg.m-3 soit 0,2 µg.m-3
Le RIVM, 2001 a établi une TCA de 0,2 µg.m-3 pour une exposition chronique par inhalation au mercure élémentaire (Baars et al., 2001).
Cette valeur est issue d'une étude épidémiologique chez des individus exposés chroniquement aux vapeurs de mercure (Fawer et al., 1983). Une LOAEC de 0,026 mg.m-3 a été déterminé pour des effets sur le système nerveux (tremblements modérés), qui étaient associés à une augmentation des teneurs sanguines en mercure et en créatinine. Pour une exposition continue, cette LOAEC équivaut à une concentration de 0,006 mg.m-3 (la méthode de calcul n'est pas précisée).
Facteur d’incertitude : Un facteur de 30 est appliqué. Un facteur 3 pour l'utilisation d'une LOAEC au lieu d'une NOAEC et un facteur 10 pour les différences de sensibilité au sein de la population humaine.
Calcul = 0,006 mg/m3 x 1/30 = 2.10-4 mg.m-3 soit 0,2 µg.m-3
Mercure inorganique
Effets à seuil - Exposition sub-chronique par inhalation
L’OMS propose une valeur guide de 1 µg.m-3 pour une exposition d’un an par inhalation au mercure inorganique sous forme de vapeurs (OMS, 2000).
A partir d’une LOAEC comprise entre 15 et 30 µg.m-3 (moyenne 22,5 µg.m-3) établie pour des atteintes rénales (publications de référence non indiquées), l’OMS propose une valeur guide de 1 µg.m-3 pour une exposition d’un an.
Facteur d’incertitude : Un facteur de 20 est appliqué. Un facteur 10 pour l’incertitude liée à la population très sensible et un facteur de 2 pour l’utilisation d’une LOAEC.
Calcul = 22,5 µg.m-3 x 1/20 = 1,12.10-3 mg.m-3 (arrondi à 1.10-3 mg.m-3 soit 1 µg.m-3)
Effets à seuil - Exposition chronique par voie orale
L’US EPA (IRIS) propose une RfD de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au chlorure mercurique (1995).
Cette valeur a été établie à partir de 3 études expérimentales réalisées chez les rats (Andres, 1984 ; Bernaudin et al., 1981 ; Druet et al., 1978). Des LOAEL peu différents ont été définis dans ces 3 études et ont permis de calculer la RfD. L’étude de Druet et al. (1978) dans laquelle les rats ‘Brown Norway’ furent exposés par injection sous-cutanée à 0, 100, 250, 500, 1 000 et 2 000 µg.kg-1 de chlorure mercurique, 3 fois par semaine pendant 8 semaines et à 50 µg.kg-1 pendant 12 semaines, a permis de déterminer un LOAEL de 0,317 mg.kg-1.j-1 pour une réaction auto-immune mesurée par la présence d’IgG dans les reins. Dans l’étude de Bernaudin et al. (1981) où des rats ‘Brown Norway’ furent exposés par l’intermédiaire de la nourriture à 0 ou à 3 000 µg.kg-1 par semaine de chlorure mercurique pendant 60 jours, un dépot d’IgG dans les glomérules fut observé chez 80 % des rats après 15 jours d’exposition et chez 100 % des rats après 60 jours d’exposition. Un LOAEL de 0,226 mg.kg-1.j-1 a été établi à partir de cettte étude. Enfin, l’étude de Andres (1984) a été menée chez des rats ‘Brown Norway’ et chez des rats ‘Lewis’ exposés, par gavage, à 3 mg.kg-1 de chlorure mercurique présent dans 1 L d’eau de boisson, 2 fois par semaine pendant 60 jours. Un dépôt d’IgG fut observé au niveau du glomérule chez les rats ‘Brown Norway’ ainsi que des lésions au niveau du colon et de l’iléon et un dépôt anormal d’IgA au niveau de la lame basale des glandes intestinales. Aucun effet néfaste n’a été observé chez les rats ‘Lewis’.
Facteurs d’incertitude : Un facteur de 1 000 fut appliqué. Un facteur 10 pour l’utilisation d’un LOAEL, un facteur 10 pour l’extrapolation de données sous-chroniques à des données chroniques et un facteur 10 pour l’extrapolation de données animales à l’homme, en tenant compte des populations sensibles.
Calcul = 0,226 mg.kg-1.j-1 x 1/1 000 = 2,26 10-4 mg.kg-1.j-1 = 2.10-4 mg.kg-1.j-1
arrondi à 3. 10-4 mg.kg-1.j-1
L’OMS établit une valeur TDI de 2.10-3 mg.kg-1.j-1 pour une exposition par voie orale au mercure inorganique (OMS, 2022)
Cette valeur est fondée sur l’étude du NTP (1993) menée chez des rats Fischer 344. Ces rats ont été exposés, par gavage, à 0, 0,23, 0,46, 0,93, 1,9 et 3,7 mg de chlorure mercurique par kg par jour, présent dans de l’eau déionisée, 1 fois par jour, 5 jours par semaine pendant 26 semaines. L’effet critique retenu est l’atteinte rénale. Un NOAEL de 0,23 mg.kg-1.j-1 a été défini.
Facteur d’incertitude : Un facteur de 100 a été appliqué. Un facteur 10 pour la variabilité inter-espèces et un facteur 10 pour la variabilité intra-espèce.
Calcul = 0,23 mg.kg-1.j-1 x (5 j / 7 j) x 1/100 = 1,6.10-3 mg.kg-1.j-1 (arrondi à
2.10-3 mg.kg-1.j-1)
Le groupe de travail OMS FAO a établi une PTWI de 1 µg.kg-1.sem-1 pour les adultes et de 4 µg.kg-1.sem-1 pour les enfants pour des expositions au mercure par la nourriture à l’exception des poissons et produits dérivés (OMS FAO, 2011).
Cette valeur repose sur la même étude expérimentale que celle décrite cite ci-dessus pour l’OMS mais utilise une apporche par calcul de la BMDL10 de 0,11 mg.kg-1.j-1 chlorure mercurique ce qui correspond à 0,06 mg.kg-1.j-1 de mercure. Cette valeur a été ajustée pour une exposition 5 jours par semaine et tenir de la contribution du chlorure mercurique.
Facteur d’incertitude : Un facteur de 100 a été appliqué. Un facteur 10 pour la variabilité inter-espèces et un facteur 10 pour la variabilité intra-espèce.
Calcul = 0,06 mg.kg-1.j-1 x (5 j) x 1/100 = 3.10-3 mg.kg-1.sem-1 (arrondi à
4.10-3 mg.kg-1.sem-1)
Le RIVM a établi une TDI de 2.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au mercure inorganique (Baars et al., 2001).
Cette valeur est issue d'une étude expérimentale chez le rat exposé chroniquement au chlorure mercurique, au cours de laquelle un LOAEL de 1,9 mg.kg-1.j-1 et un NOAEL de 0,23 mg.kg-1.j-1 ont été établis pour des effets sur le rein (NTP, 1993).
Facteur d’incertitude : Un facteur de 100 est appliqué pour les variations inter- et intra-espèce.
Calcul = 0,23 mg.kg-1.j-1 x 1/100 = 2,3.10-3 mg.kg-1.j-1 (arrondi à 2.10-3 mg.kg-1.j-1)
Indice de confiance : Le RIVM accorde une confiance élevée dans sa valeur.
Santé Canada a établi une DJA de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au mercure inorganique (Santé Canada, 2021).
Cette valeur est calculée de la même manière que la VTR RfD de l’US EPA. Cette valeur a été établie à partir de 3 études expérimentales réalisées chez les rats (Andres, 1984 ; Bernaudin et al., 1981 ; Druet et al., 1978). Des LOAEL peu différents ont été définis dans ces 3 études et ont permis de calculer la DJA.
Facteurs d’incertitude : Un facteur de 1 000 a été appliqué. Un facteur 10 pour l’utilisation d’un LOAEL, un facteur 10 pour l’extrapolation de données sub-chroniques à des données chroniques et un facteur 10 pour l’extrapolation de données animales à l’homme, en tenant compte des populations sensibles.
Calcul = 0,226 mg.kg-1.j-1 x 1/1 000 = 2,26 10-4 mg.kg-1.j-1 = 2.10-4 mg.kg-1.j-1
arrondi à 3. 10-4 mg.kg-1.j-1
Mercure organique - Méthylmercure
Effets à seuil - Exposition chronique par voie orale
L’ATSDR, a établi un MRL de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au méthylmercure (2001).
Cette valeur a été estimée à partir de l’étude de Davidson et al. (1998) réalisée aux Seychelles. Les effets sur le développement neurologique des enfants nés de mères exposées, par ingestion d’une grande quantité de poissons contenant du méthylmercure, ont été évalués dans une série de tests comportementaux. Les doses ingérées par ces femmes ont été évaluées à partir des concentrations de mercure présent dans les cheveux. Les tests comportementaux ont été réalisés chez les enfants jusqu'à l’âge de 66 mois. La concentration moyenne de mercure présent dans les cheveux des mères pendant la grossesse est de 6,8 ppm. Les différents tests menés chez les enfants n’ont montré aucune anomalie du comportement. La concentration moyenne la plus élevée de mercure trouvée dans les cheveux des femmes enceintes est de 15,3 ppm. Cette valeur a été prise en compte par l’ATSDR comme NOAEL.
La concentration de mercure présent dans les cheveux est considérée comme étant 250 fois plus élevée que la concentration de mercure dans le sang. En utilisant la valeur de 15,3 ppm comme concentration de méthylmercure dans les cheveux, la concentration correspondante de méthylmercure dans le sang est :
C = 1/250 x 15,3 µg.g-1 x 1 mg / 1 000 µg x 1 000 g.L-1 = 0,061 mg.L-1
La dose ingérée est alors calculée à partir des concentrations de mercure présent dans le sang des mères exposées. L’équation proposée par l’OMS a été utilisée :
C = (f x d) / (b x V) x (AD x AB x d) / (b x V)
C = concentration dans le sang : 0,061 mg.L-1
f = fraction de la dose ingérée par jour allant dans le sang :
d = dose ngérée par jour : 0,075 mg.j-1
b = constante d’élimination
AD = pourcentage de mercure absorbé après une ingestion de mercure présent dans le nourriture
AB = Pourcentage de ce qui est absorbé parmi ce qui rentre dans le sang
V = volume de sang dans le corps
Poids moyen des femmes = 60 kg.
Un NOAEL de 0,0013 mg.kg-1.j-1 a ainsi été calculé.
Facteur d’incertitude : Un facteur de 4,5 est appliqué. Un facteur 3 pour la variabilité induite par des modèles pharmacocinétiques et pharmacodynamiques et un facteur 1,5 pour tenir compte de l’étude menée dans les îles Faroé.
Calcul = 1,3.10-3 mg.kg-1.j-1 x 1 / 4,5 = 2,8 10-4 mg.kg-1.j-1 = 3.10-4 mg.kg-1.j-1
L’OMS a établi une DHPT de 1,6 10-3 mg.kg-1.semaine-1 pour un adulte de 70 kg, pour une exposition chronique par voie orale au méthylmercure (2003).
L’OMS a révisé lors du 61e meeting conjoint de l’OMS et du FAO relatif aux additifs alimentaires la valeur provisoire de la dose hebdomadaire du méthylmercure. Cette valeur a été fixée à 1,6.10 –3 mg.kg-1.semaine-1. Cette réévalution prend en compte les résultats d’une étude épidémiologique, dont le principal résultat est qu’il n’existe pas d’association négative entre l’exposition maternelle au méthylmercure via une consommation de poisson élevée (12 repas par semaine) et le développement neurologique des enfants (Myers et al., 2003). La seconde étude prise en compte est celle des Iles Féroé. De nouvelles analyses statistiques ont été réalisées sur cette cohorte, faisant intervenir d’autres facteurs que l’exposition au méthylmercure dans la survenue d’effets néfastes sur le développement neurologique des nouveau-nés, notamment ceux d’une exposition concomittante aux PCB. Il a été montré l’absence de rôle propre des PCB présents dans la chair des mammifères marins dans les effets observés sur le développement cognitifs des enfants (Grandjean et al., 2003)
Les experts de l’OMS ont estimé que l’ingestion de 1,5 µg.kg-1.j-1 de méthylmercure
(soit 10,5 µg de MeHg.kg-1.semaine-1) ne présente pas de danger pour l’enfant. Le calcul de la DHTP se base donc sur cette valeur.
Considérant que la grossesse (surtout aux 2ème et 3ème trimestres) était la période la plus vulnérable pour le développement de l’enfant vis-à-vis d’une exposition au méthylmercure, il a été calculé qu’un apport de manière récursive de 1,5 µg.kg-1.j-1 (soit 10,5 µg.kg-1 par semaine) n’avait pas d’effet néfaste. En état d’équilibre, cet apport correspond à une concentration dans le sang maternel de 56 µg.L-1, cette valeur dérivant elle-même d’une dose de 14 mg.kg-1 dans les cheveux.
Facteur d’incertitude : Un facteur d’incertitude de 2 est appliqué pour tenir compte de la variabilité inter-individuelle de la relation entre la concentration de MeHg mesurée dans les cheveux et celles mesurées dans le sang (analyse de la concentration en mercure chez les sujets exposés) et un facteur de 3,2 (100,5) pour tenir compte de la variabilité inter-individuelle (composante pharmacocinétique) de la relation d’incertitude entre l’apport alimentaire en méthylmercure et la concentration mesurée dans le sang. Le facteur total est donc de 6,4.
L’Efsa a établi une dose tolérable hebdomadaire (DHT) de 1,3 10-3 mg.kg-1.sem-1 (soit 1,8 10-4 mg.kg-1.j-1) pour une exposition chronique par voie orale au méthylmercure (2012).
Cette valeur est basée sur la même approche que des autres organismes à savoir une réévaluation des deux cohortes principales (des îles Féroé et des Seychelles) en tenant compte des dernières analyses rapportées ci-dessus pour la construction de la valeur de l’OMS (2003) et de la précédente valeur de l’Efsa (2004). L’OMS avait alors révisé lors de la 61e réunion conjointe de l’OMS et du FAO relatif aux additifs alimentaires la valeur provisoire de la dose hebdomadaire du méthylmercure. Cette valeur a été fixée à 1,6.10-3 mg.kg-1.sem-1. Les nouvelles études n’ont pas modifié les conclusions existantes mais ont permis d’affiner la valeur de la dose retenue comme NOEL 11,5 mg.kg-1 sur la base de la dose mesurée dans les cheveux des mères des enfants exposés. Un modèle toxicocinétique à un compartiment a permis de calculer la dose interne associée soit 46 µg.L-1 dans le sang maternel et de la convertir en dose journalière soit 1,2 µg.kg-1 de poids corporel.
Facteur d’incertitude : Un facteur d’incertitude 2 est appliqué pour tenir compte de la variabilité inter-individuelle de la relation entre la concentration de MeHg mesurée dans les cheveux et celles mesurées dans le sang (analyse de la concentration en mercure chez les sujets exposés) et un facteur 3,2 (100,5) pour tenir compte de la variabilité inter-individuelle (composante pharmacocinétique) de la relation d’incertitude entre l’apport alimentaire en méthylmercure et la concentration mesurée dans le sang. Le facteur total est donc 6,4.
Calcul : 1,2.10-3 mg.kg-1.j-1 x 1 / 6,4 = 1,86.10-4 mg.kg-1.j-1 soit 1,3.10-3 mg.kg-1.sem-1
Santé Canada propose deux valeurs provisoire l’une de 4,7.10-4 mg.kg-1.j-1 pour la population adulte générale et l’autre de 2.10-4 mg.kg-1.j-1 pour les femmes en âge de procréer et les enfants de moins de 12 ans pour des expositions chroniques par voie orale au méthyl mercure.
Ces valeurs reposent sur les valeurs de 0,20 µg.kg-1 pc.j-1 établie plus tôt (en 1997) par le Bureau d'innocuité des produits chimiques du Canada pour le méthylmercure pour les femmes en âge de procréer et les jeunes enfants afin de tenir compte de la susceptibilité accrue du foetus en développement et des enfants aux effets du méthylmercure. Cette valeur a été établie en fonction du seuil approximatif pour les dysfonctions neuropsychologiques de 10 ppm de méthylmercure dans les cheveux de la mère (Grandjean et al., 1997). Cette valeur a tout d'abord été convertie en une concentration de méthylmercure dans le sang, puis en un taux d'apport alimentaire en méthylmercure au moyen d'une équation utilisée par l’US EPA (1995). Pour obtenir une DJAP en méthylmercure de 0,20 µg.kg-1 pc.j-1 pour les femmes en âge de procréer et les jeunes enfants, on a appliqué à ce taux d'apport alimentaire un facteur d'incertitude de 5 (Feeley et Lo, 1998).
Le RIVM a établi une TDI de 1.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au mercure organique (Baars et al., 2001).
Cette valeur est issue de l'étude épidémiologique de Davidson et al. (1998) qui s'est intéressée au développement sur 66 mois d'enfants exposés in utero au méthylmercure. A partir de cette étude, l'ATSDR (1999) a calculé un NOAEL de 1,3 µg.kg-1.j-1 pour les effets sur le développement, d'après les concentrations en mercure total dans les cheveux et le sang des mères (voir construction de la VTR par l’ATSDR pour le détail du calcul de l'exposition des mères).
Facteur d’incertitude : Un facteur de 10 est appliqué pour la variabilité au sein de l'espèce humaine.
Calcul = 1,3 µg.kg-1.j-1 x 1/10 = 0,13 µg.kg-1.j-1 (arrondi à 0,1 µg.kg-1.j-1)
Indice de confiance : Le RIVM accorde une confiance élevée à sa valeur.
[1] volume d’air inhalé pour les travailleurs : 10 m3 .jour-1 ; volume d’air inhalé pour la population générale : 6,7 m3 .jour-1.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 30/06/2025
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis.
Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis par Klimisch et al., 1997. Ces auteurs ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après :
- Score 1 : valide (sans restriction)
- Score 2 : valide avec restriction
- Score 3 : non valide
- Score 4 : pas suffisamment d'information pour valider le test
On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2).
Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC.
Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Description
Lorsque plusieurs valeurs du paramètre d’exposition (ex : CL50 96h) existent pour une même espèce, la moyenne géométrique de ces valeurs a été calculée et est indiquée dans les tableaux de données.
Abréviations:
|
m: espèces marines |
mol: mollusques |
|
bac: bactéries |
coe: coelentérés |
|
cya: cyanophycées |
ann: annélides |
|
mac: macrophytes |
pla: planaires |
|
pro: protozoaires |
|
Ecotoxicité aquatique
Paramètre d'écotoxicité aiguë
Au total, 10 données concernant les poissons, 12 données concernant les invertébrés, et 4 données concernant les algues ont été évaluées et considérées comme valides. Celles-ci-sont reportées dans le tableau ci- dessous
|
|
Espèce |
Substance testée |
Paramètre d’écotoxicté |
Valeur |
Référence |
Validité |
|---|---|---|---|---|---|---|
|
Algues |
P. subcapitata |
HgCl2 |
96 h-CE50 |
9 (statique) |
Chen et al., 1997 |
2 |
|
P. subcapitata |
HgCl2 |
96 h-CE50 |
27 (dynamique) |
Chen et al., 1997 |
2 |
|
|
Lingulodinium polyedra |
HgCl2 |
48 h-CL50 |
5,5 |
Okamoto et al., 1999 |
2 |
|
|
Ditylum brightwellii (m) |
HgCl2 |
120h-CE50 |
10 |
Canterford et Canterford, 1980 |
2 |
|
|
Invertébrés |
Ceriodaphnia reticulata |
HgCl2 |
48 h-CL50 |
2,9 |
Elnabarawy et al., 1986 |
2 |
|
Asellus aquaticus |
HgCl2 |
96 h-CL50 |
199 |
Martin et Holdich, 1986 |
2 |
|
|
Crangonyx pseudogracilis |
HgCl2 |
96 h-CL50 |
1 |
Martin et Holdich, 1986 |
2 |
|
|
Daphnia magna |
HgCl2 |
48 h-CL50 |
5,2 |
Khangarot et Ray, 1987 |
2 |
|
|
Daphnia pulex |
HgCl2 |
48 h-CL50 |
3,8 |
Elnabarawy et al., 1986 |
2 |
|
|
Paratelphusa hydrodromous |
HgCl2 |
96 h-CL50 |
365* |
Ananthalakshmikumari et al., 1990 |
2 |
|
|
Fenneropenaeus indicus |
HgCl2 |
96 h-CL50 |
15,3 |
McClurgh, 1984 |
1 |
|
|
Penaeus merguiensis merguiensis |
HgCl2 |
96 h-CL50 |
30 |
Denton et Burdon-Jones, 1982 |
2 |
|
|
Scylla serrata |
HgCl2 |
96 h-CL50 |
680 |
Krishnaja et al., 1987 |
2 |
|
|
Carcinus maenas |
HgCl2 |
96 h-CL50 |
235 |
Elumalai et al., 2007 |
2 |
|
|
Daphnia pulex |
CH3HgCl |
48 h-CL50 |
5,7 |
Tian-yi et McNaught, 1992 |
2 |
|
|
Gammarus duebeni |
CH3HgCl |
96 h-CL50 |
150 |
Lockwood et Inman, 1975 |
2 |
|
|
Poissons |
Cyprinus carpio |
HgCl2 |
96 h-CL50 |
160 |
Alam et Maughan, 1992 |
2 |
|
Oncorhynchus mykiss |
HgCl2 |
96 h-CL50 |
193 |
Buhl et Hamilton, 1991 |
2 |
|
|
Pimephales promelas |
HgCl2 |
96 h-CL50 |
168 |
Snarski et Olson, 1982 Khangarot et Ray, 1987 |
1 |
|
|
Poecilia reticulata |
HgCl2 |
96 h-CL50 |
26 |
Pandey et al., 2005 |
2 |
|
|
Channa punctata |
HgCl2 |
96 h-CL50 |
1210 |
Vieira et al., 2009 |
2 |
|
|
Fundulus heteroclitus |
HgCl2 |
96 h-CL50 |
61.9 |
Sharp et Neff, 1980 |
2 |
|
|
Pomatoschistus microps |
HgCl2 |
96 h-CL50 |
67.5** |
Matida et al., 1971 |
1 |
|
|
Oncorhynchus mykiss |
CH3HgCl |
96 h-CL50 |
31 |
Wobeser, 1975 |
2 |
|
|
Oncorhynchus mykiss |
CH3HgCl |
96 h-CL50 |
24 |
Roales et Perlmutter, 1974 |
2 |
|
|
Trichopodus trichopterus |
CH3HgCl |
96 h-CL50 |
89,5 |
Sharp et Neff, 1982 |
2 |
|
|
Fundulus heteroclitus |
CH3HgCl |
96 h-CL50 |
51 |
Buhl et Hamilton, 1991 |
2 |
|
|
Autres données |
Tetrahymena pyriformis (pro) |
CH3HgCl |
2-6 h CL50 |
168 |
Thrasher et Adams, 1972 |
3 |
|
Perna perna |
CH3HgCl |
1h-CE50 |
50 |
Watling et Watling, 1982 |
3 |
|
|
Villosa iris |
HgCl2 |
96 h-CL50 |
99 |
Valenti et al., 2005 |
2 |
Les essais sur algues réalisés dans des conditions normalisées
*Moyenne géométrique sur 3 valeurs
**Moyenne géométrique sur 4 valeurs
Algues
Un essai standard de toxicité aiguë été réalisé par Chen et al.
Pour les algues marines, deux valeurs de CE50 de 10 et 5,5 ug.L-1 ont été obtenues pour une diatomée, Ditylum brightwellii, par Canterford et al.(1980) et une dinoflagellé Gonyaulax polyedra par Okamoto et al.
Invertébrés
Neuf études présentant des CE50 96h/48h sont disponibles pour six espèces d’invertébrés d’eau douce et 3 espèces d’invertébrés marins. Les 48h-CE50 obtenues par Khangarot
Pour les invertébrés marins, quatre études sont disponibles présentant trois 96 h–CL50 et une 96 h-CE50. La CL50 la plus basse (15,3 pg.L-1) est obtenue pour Penaeus indicus (recevabilité 1, renouvellement du milieu en continu, concentrations mesurées) par McClurgh et al.
Poissons
Des données sont disponibles pour cinq espèces d’eau douce et deux espèces d’eau marine.
Parmi les 8 données sur les espèces d’eau douce, sept présentent une recevabilité de 2 (essai statique court terme, concentrations nominales), alors que seulement une étude (Snarski et Olson, 1982) obtenue sur Pimephales promelas se caractérise par une recevabilité de 1 (renouvellement du milieu en continu et concentrations mesurées). La valeur obtenue pour cette espèce est une 96h-CL50 de 168 µg.L-1.
Les deux espèces marines testées
Paramètres d'écotoxicité chronique
Les données présentées dans le tableau ci-dessous ont été sélectionnées et validées par RIVM (1999) et Slooff et al. (1995) sur la base des paramètres écotoxicologiques, du milieu et des conditions d’essai. La validité de ces données ayant fait l’objet d’une validation d’experts, elle ne sera pas rediscutée ici. Toutefois, des travaux ultérieurs ont permis de déterminer des valeurs d’écotoxicité complémentaires. Ces dernières sont donc présentées ci-dessous et ont fait l’objet d’une étude de validité.
Lorsque plusieurs valeurs existent pour une même espèce et lorsque les conditions de test le permettent (même paramètre étudié, …), nous indiquons la moyenne géométrique de ces valeurs.
Abréviations:
|
m: espèces marines |
mol: mollusques |
|
bac: bactéries |
coe: coelentérés |
|
cya: cyanophycées |
ann: annélides |
|
mac: macrophytes |
pla: planaires |
|
pro: protozoaires |
|
Mercure inorganique
|
|
Espèce |
Substance testée |
Paramètre d’écotoxicité |
Valeur (µg.L-1) |
Référence |
|---|---|---|---|---|---|
|
Algues |
Chlorella vulgaris |
HgCl2 |
33 j-NOEC |
100 |
Rosko et Rachlin, 1977 |
|
|
Cladophora glomerata |
|
3 j-NOEC |
100 |
Whitton, 1967 |
|
|
Microcystis aeruginosa |
HgCl2 |
8 j-NOEC |
2,5 |
Bringmann et Kühn, 1978 |
|
|
Scenedesmus obliquus |
HgCl2 |
10 j-NOEC |
20 |
Huisman et al., 1980 |
|
|
Scenedesmus quadricauda |
HgCl2 |
8 j-NOEC |
35 |
Bringmann et Kühn, 1978 |
|
|
Lingulodinium polyedra |
HgCl2 |
4 j-NOEC |
0,25 |
Okamoto et al., 1999 |
|
Crustacés |
Hyalella azteca |
- |
6-10s NOEC |
0,62 |
Borgmann et al., 1993 |
|
|
Brachionus patulus |
HgCl2 |
14 j-NOEC |
1,4 |
Sarma et al., 2008 |
|
|
Cyclops sp. |
HgCl2 |
14 j-NOEC |
18 |
Borgmann, 1980 |
|
|
Ceriodaphnia dubia |
Hg |
7 j-NOEC |
8,5 |
Spehar et Fiandt, 1986 |
|
|
Daphnia similis |
HgCl2 |
28 j-NOEC |
10 |
Soundrapandian et Venkataraman, 1990 |
|
|
Daphnia magna |
HgCl2 |
28 j-NOEC |
1,2 |
Tsui et Wang, 2005 |
|
|
Daphnia magna |
Hg |
21 j-NOEC |
2,2 |
Enserink et al., 1991 |
|
|
Daphnia magna |
|
1,6 |
moyenne géométrique |
|
|
|
Artemia franciscana |
HgCl2 |
3 j-NOEC |
2 |
Go et al., 1990 |
|
|
Callinectes sapidus (m) |
HgCl2 |
10-35 j-NOEC |
4,9 |
McKenne et Costlow, 1982 |
|
|
Americamysis bahia |
|
44 j-NOEC |
0,8 |
Gentile et al., 1982 |
|
|
Americamysis bahia |
HgCl2 |
35 j-NOEC |
0,8 |
Lussier et Gentile, 1985 |
|
|
Americamysis bahia |
|
35-44 j-NOEC |
0,8 |
moyenne géométrique |
|
|
Fenneropenaeus indicus (m) |
HgCl2 |
28 j-NOEC |
6 |
McClurgh, 1984 |
|
Poissons |
Pomatoschistus microps |
HgCl2 |
4 j-NOEC |
3,1 |
Vieira et al., 2009 |
|
|
Acipenser baerii |
HgCl2 |
30 j-NOEC |
3 |
Lapirova et al., 2000 |
|
|
Danio rerio |
HgCl2 |
14 j-NOEC |
1 |
Dave et Xiu, 1991 |
|
|
Pimephales promelas |
Hg |
32 j-NOEC |
0,63 |
Spehar et Fiandt, 1986 |
|
|
Pimephales promelas |
HgCl2 |
60 j-NOEC |
0,31 |
Snarski et Olson, 1982 |
|
|
Pimephales promelas |
HgCl2 |
30 j-NOEC |
0,26* |
Snarski et Olson, 1982 |
|
|
Pimephales promelas |
HgCl2 |
30 j-NOEC |
0,09 |
Snarski et Olson, 1982 |
|
|
Pimephales promelas |
|
|
0,3 |
moyenne géométrique |
|
|
Fundulus heteroclitus |
HgCl2 |
32 j-NOEC |
10 |
Sharp et Neff, 1980 |
|
Organismes benthiques |
Chironomus riparius |
|
28 j-NOEC |
930 mg.kg-1** |
Thompson et al., 1998 |
|
Macrophytes |
Fucus serratus |
HgCl2 |
10 j-NOEC |
0,9 |
Strömgren, 1980 |
|
|
Ascophyllum nodosum |
HgCl2 |
10 j-NOEC |
0,9 |
Strömgren, 1980 |
|
|
Lamina saccharina |
HgCl2 |
14 j-NOEC |
1 |
Thompson et Burrows, 1984 |
|
|
Pelvetia canaliculata |
HgCl2 |
10 j-NOEC |
5 |
Strömgren, 1980 |
|
|
Fucus spiralis |
HgCl2 |
10 j-NOEC |
9 |
Strömgren, 1980 |
|
|
Fucus vesiculosus |
HgCl2 |
10 j-NOEC |
9 |
Strömgren, 1980 |
|
|
Chara vulgaris |
HgCl2 |
14 j-NOEC |
20 |
Heumann, 1987 |
|
Autres |
Pseudomonas putida |
HgCl2 |
16 h-NOEC |
5 |
Bringmann et Kühn, 1979 |
|
|
Pseudomonas putida |
HgCl2 |
6 h-NOEC |
25 |
Slabbert, 1986 |
|
|
Pseudomonas putida |
HgCl2 |
|
11 |
moyenne géométrique |
|
|
Bacteria |
HgCl2 |
18 h-NOEC |
1 |
Liebert et al., 1991 |
|
|
Microcystis aeruginosa |
HgCl2 |
8 j-NOEC |
2,5 |
Bringmann et Kühn, 1978 |
|
|
Chilomonas paramecium |
HgCl2 |
48 h-NOEC |
8 |
Bringmann et Kühn, 1981 |
|
|
Entosiphon sulcatum |
HgCl2 |
72 h-NOEC |
9 |
Bringmann et Kühn, 1981 |
|
|
Poteriochromonas malhamensis |
HgCl2 |
3 j-NOEC |
500 |
Röderer, 1983 |
|
|
Tetrahymena pyriformis |
HgCl2 |
2-6 h-NOEC |
775 |
Thrasher et Adams, 1972 |
|
|
Uronema parduczi |
HgCl2 |
20 h-NOEC |
34 |
Bringmann et Kühn, 1981 |
|
|
Crassostrea gigas (mol-m) |
HgCl2 |
21 j-NOEC |
20 |
Géret et al., 2002 |
|
|
Crassostrea gigas (mol-m) |
HgCl2 |
7 j-NOEC |
25 |
Sharma et al., 2006 |
|
|
Crassostrea virginica |
HgCl2 |
42-48 h-NOEC |
1 |
Calabrese et al., 1973 |
|
|
Crassostrea gigas |
|
|
7,9 |
moyenne géométrique |
|
|
Crepidula fornicata |
HgCl2 |
112 j-NOEC |
0,25 |
Thain, 1984 |
|
|
Ilyanassa obsoleta |
HgCl2 |
2,5 h-NOEC |
2 |
Conrad, 1988 |
|
|
Mercenaria mercenaria |
HgCl2 |
8-10 j-NOEC |
4 |
Calabrese et al., 1977 |
|
|
Villosa iris |
HgCl2 |
21 j-NOEC |
4 |
Valenti et al., 2005 |
|
|
Villosa iris |
HgCl2 |
21 j-NOEC |
114 |
Valenti et al., 2005 |
|
|
Villosa iris |
|
|
21 |
moyenne géométrique |
|
|
Viviparus bengalensis |
HgCl2 |
7 j-NOEC |
20*** |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
HgCl2 |
7 j-NOEC |
40 |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
HgCl2 |
7 j-NOEC |
100 |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
HgSO4 |
7 j-NOEC |
20 |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
HgSO4 |
7 j-NOEC |
60 |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
HgSO4 |
7 j-NOEC |
90 |
Muley et Mane, 1988 |
|
|
Viviparus bengalensis |
|
|
45 |
moyenne géométrique |
|
|
Cristigera sp. (pro - m) |
HgCl2 |
4-9 h-NOEC |
2,5 |
Gray et Ventilla, 1973 |
|
|
Pachycordyle michaeli |
Hg |
8 j-NOEC |
0,1 |
Piraino, 1991 |
|
|
Ctenodrilus serratus |
HgCl2 |
21 j-NOEC |
10 |
Reish et Carr, 1978 |
|
|
Ctenodrilus serratus |
HgCl2 |
28-31 j-NOEC |
10 |
Reish, 1978 |
|
|
Ctenodrilus serratus |
|
|
10 |
moyenne géométrique |
|
|
Ophryotrocha diadema |
HgCl2 |
28 j-NOEC |
50 |
Reish et Carr, 1978 |
|
|
Ophryotrocha diadema |
HgCl2 |
28 j-NOEC |
100 |
Reish, 1978 |
|
|
Ophryotrocha diadema |
|
28 j-NOEC |
70 |
moyenne géométrique |
*les deux essais sur Pimephales promelas (Snarski et Olson, 1982) ont été effectués sur deux générations de poissons
**poids sec de sédiments
***Les essais de Muley et Mane ont été effectués dans des conditions de pH, de température et de duretés variables.
Algues et macrophytes
Les NOEC disponibles pour les algues varient entre 0,25 et 100 µg.L-1 pour le mercure inorganique (HgCl2).
Pour les algues d’eau douce, cinq données variant entre 20 et 100 µg.L-1 sont disponibles. Une plus forte sensibilité des algues et marcophytes marins est observée, les valeurs des six NOEC disponibles variant de 0,25 à 9 µg.L-1. La plus faible donnée a été établie par Okamoto et al. (1999) pour l’algue marine Lingulodinium polyedra (anciennement dénommée Gonyaulax polyedra).
Crustacés
Au total 12 données chroniques sont disponibles pour les crustacés variant entre 0,62 µg.L-1 et 18 µg.L-1.
Parmi les crustacés d’eau douce, les données chroniques sont disponibles pour six espèces différentes. Parmi ces données, l’espèce Hyalella azteca est la plus sensible avec une valeur de 0.62 µg.L-1.
Parmi les crustacés d’eau marine des données chroniques sont disponibles pour quatre espèces différentes. Parmi ces espèces marines, Americamysis bahia est la plus sensible (moyenne géométrique sur 2 NOEC : 0,8 µg.L-1).
Poissons
Pour les poissons, huit données chroniques sont disponibles pour cinq espèces de poissons, variant entre 0,09 µg/L et 10 µg.L-1.
Parmi ces huit données, six ont été établies pour trois espèces d’eau douce. L’espèce Pimephales promelas est la plus sensible (moyenne géométrique des 4 valeurs de NOEC disponibles : 0,3 µg.L-1).
Pour les deux espèces d’eau marine, les NOEC varient entre 3,1 µg.L-1 et 10 µg.L-1.
Organismes benthiques
Une donnée chronique est disponible pour les organismes benthiques. Cette étude, réalisée par Thompson et al. (1998) a été conduite en exposant des chironomes (Chironomus riparius) pendant 28 jours avec un renouvellement du milieu.
Mercure Organique
|
Espèce |
Substance testée |
Critère d’effet |
Valeur (µg.L-1 ) |
Référence |
|
|---|---|---|---|---|---|
|
Micro-crustacés |
Daphnia pulex |
CH3HgCl |
30 j-NOEC |
0,09 |
Tian-yi et McNaught, 1992 |
|
Poissons |
Jordanella floridae |
CH3Hg+ |
30 j-NOEC |
0,17 |
Smith (cité par Slooff et al., 1995) |
|
Oncorhynchus kisutch |
CH3HgOH |
48 j-NOEC |
19 |
Devlin et Mottet 1992 |
|
|
Pimephales promelas |
CH3Hg+ |
60 j-NOEC |
0,07 |
Mount et Olson (cité par Slooff et al., 1995) |
|
|
Poecilia reticulata |
CH3HgCl |
90 j-NOEC |
0,8 |
Wester et Canton, 1992 |
|
|
Salvelinus fontinalis |
CH3HgCl |
1 008 j-NOEC |
0,29 |
McKim et al., 1976 |
|
|
Salvelinus fontinalis |
CH3HgCl |
248 j-NOEC |
0,08 |
Christensen, 1975 |
|
|
Salvelinus fontinalis |
0,15 |
moyenne géométrique |
|||
|
Hoplias malabaricus |
CH3HgCl |
70 j-NOEC |
75 |
Ribeiro et al., 2006 |
|
|
Autres |
Bacteria |
CH3HgCl |
18 h-NOEC |
0,2 |
Liebert et al., 1991 |
|
Poterriochromonas malhamensis (pro) |
CH3HgCl |
3 j-NOEC |
0,2 |
Röderer, 1983 |
|
|
Tetrahymena pyriformis (pro) |
CH3HgCl |
2-6 h-NOEC |
14 |
Thrasher et Adams, 1972 |
|
|
Dugesia dorotocephala (pla) |
CH3HgCl |
14 j-NOEC |
0,03 |
Best et al., 1981 |
|
|
Mytilus edulis (mol-m) |
CH3HgOH |
32 j-NOEC |
0,3 |
Pelletier, 1988 |
A l’exception de l’étude réalisée par Ribeiro et al. (2006), l’ensemble des données disponibles ont été sélectionnées et validées par RIVM, 1999 et Slooff et al., 1995 sur la base des paramètres écotoxicologiques, du milieu et des conditions d’essai.
L’étude de Ribeiro et al. (2006) vient compléter cette liste de données sur la base des mêmes critères de sélection du RIVM. Cette étude a été réalisée sur des poissons tropicaux (Hoplias malabaricus) exposés pendant 70 jours (avec renouvellement du milieu) à des doses subchroniques de méthylmercure. Les concentrations indiquées correspondent à des concentrations mesurées dans le milieu d’exposition.
Ecotoxicité terrestre
L’ensemble des données disponibles pour organismes terrestres a été sélectionné et validé par RIVM, 1999 et Slooff et al. (1995) sur la base des paramètres écotoxicologiques, du milieu et des conditions d’essai.
Paramètre d'écotoxicité aiguë
|
|
Espèce |
Substance traitée |
Paramètre d'écotoxicité |
Valeur (en mg.kg-1 de sol standard poids sec) |
Référence |
|---|---|---|---|---|---|
|
Arthropodes |
Oxythyera funesta (larve d'insecte) |
|
CL50 |
26.6 |
Pandard et Martinet, 1998 |
Paramètre d'écotoxicité chronique
Mercure inorganique
|
|
Espèce |
Substance traitée |
Paramètre d’écotoxicité |
Valeur |
Référence |
|---|---|---|---|---|---|
|
Microorganismes |
Microorganismes |
HgCl2 |
3 j-NOEC |
79 |
Tu, 1988 |
|
|
|
HgCl2 |
28 j-NOEC |
9 |
Landa et Fang, 1978 |
|
|
|
HgCl2 |
28 j-NOEC |
110* |
Landa et Fang, 1978 |
|
|
|
|
28 j-NOEC |
12 |
Spalding, 1979 |
|
|
|
|
1 j-NOEC |
31 |
Pancholi et al., 1975 |
|
|
|
|
6 h-NOEC |
784 |
Landa et Fang, 1978 |
|
|
Microorganismes |
|
42 j-NOEC |
84 |
Van Faassen, 1973 |
|
|
Microorganismes |
|
42 j-NOEC |
84 |
Van Faassen, 1973 |
|
|
Microorganismes |
|
3 j-NOEC |
79 |
Tu, 1988 |
|
|
Microorganismes |
|
3 h-NOEC |
2406 |
Tyler, 1981 |
|
|
Microorganismes |
|
48 j-NOEC |
1,4 |
Zelles et al., 1985 |
|
Autres |
Etourneaux |
HgCl2 |
56 j-NOEC |
1 mg.kg-1 de nourriture |
Nicholson et Osborn, 1984 |
|
|
Cailles |
HgCl2 |
365 j-NOEC |
4 mg/kg de nourriture |
Hill et Schafner, 1975 |
|
|
Poules |
HgCl2 |
21 j-NOEC |
10 mg/kg de nourriture |
Scott, 1977 |
|
|
Visons |
HgCl2 |
135 j-NOEC |
7 mg/kg de nourriture |
Aulerich et al., 1974 |
*Moyenne géométrique
Différentes données d’écotoxicité sur micro-organismes mettant en œuvres différents processus du sol (ammonification, nitrification, etc) sont disponibles pour le mercure inorganique. Au total onze valeurs de NOEC variant de 1,4 mg.kg-1 sol sec (synthèse ATP) à 2 406 mg.kg-1 sol sec (phosphatase) ont été recensées.
Diverses études sur volatiles et mammifères sont également disponibles, présentant des NOEC allant de 1 mg.kg-1 de nourriture (étourneaux) à 10 mg.kg-1 de nourriture (poules).
Mercure organique
|
|
Espèce |
Substance testée |
Paramètre d’écotoxicité |
Valeur (mg CH3Hg |
Référence |
|---|---|---|---|---|---|
|
Annélides |
Eisenia foetida |
CH3HgCl |
84 j-NOEC |
3,7 mg.kg-1poids sec |
Beyer et al., 1985 |
|
Autres |
canards |
CH3Hg+ |
3 générations NOEC |
0,25 |
Heinz, 1979 |
|
faisans |
CH3Hg+ |
20j-NOEC |
0,36 |
Gardiner, 1972 |
|
|
poules |
CH3Hg+ |
20j-NOEC |
0,36 |
Gardiner, 1972 |
|
|
poules |
CH3Hg+ |
21j-NOEC |
0,86 |
Fimreite, 1970 |
|
|
poules |
|
|
0,56 |
moyenne géométrique |
|
|
cailles |
CH3Hg+ |
63j-NOEC |
1,7 |
Hill et Soares, 1984 |
|
|
Poephila guttata |
CH3Hg+ |
67j-NOEC |
2,7 |
Scheuhammer, 1988 |
|
|
Buteo jamai-censis |
CH3Hg+ |
84j-NOEC |
2,8 |
Fimreite et Karstad, 1971 |
|
|
cailles |
CH3Hg+ |
54j-NOEC |
4,3 |
Spann et al., 1986 |
|
|
singes |
CH3Hg+ |
365j-NOEC |
0,22 |
Kawasaki, 1986 |
|
|
visons |
CH3Hg+ |
60j-NOEC |
0,5 |
Wren et al., 1987 |
|
|
visons |
CH3Hg+ |
93j-NOEC |
1,2 |
Wobeser et al., 1976 |
|
|
visons |
CH3Hg+ |
100j-NOEC |
2,5 |
Jernelov et al., 1975 |
|
|
visons |
|
|
1,1 |
moyenne géométrique |
Une seule étude sur organismes du sol est disponible. Il s’agit de l’étude de Beyer et al., 1985 sur le vers de terre Eisenia foetida ayant permis de déterminer une NOEC de 3,7 mg.kg-1 poids sec.
Par ailleurs, différentes données d’écotoxicité sur volatiles et mammifères sont également disponibles. La plus faible donnée recensée est l’étude de Kawasaki (1986) sur le singe, donnant une NOEC de 0,22 mg.kg-1 de nourriture. Les autres études montrent des NOEC variant de 0,25 (canards) à 4,3 (cailles) mg.kg-1 de nourriture.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
- Ecotoxicité Aiguë
Mercure inorganique :
Pour les algues, les CE50 (2 à 5 jours) pour le HgCl2 sont comprises entre 9 et 25 µg.L-1.
Pour les micro-crustacés, les CL50 pour le HgCl2
Enfin pour les poissons, les CL50 pour le HgCl2
Pour les mollusques, une CL50
Mercure organique :
Aucune valeur n’est disponible pour les algues.
Pour les micro-crustacés, les CL50
Pour les poissons, les CL50
Pour les protozoaires et les mollusques, les CL50 (1 h à 6 h) pour le CH3HgCl se situent entre 50 µg.L-1 et 168 µg.L-1.
Aucune valeur n’est disponible pour les organismes benthiques.
- Ecotoxicité chronique
Un grand nombre d’espèces ont été exposées à du mercure sous les deux formes :
Mercure inorganique :
Pour les algues, les NOEC
Pour les crustacés, les NOEC (3 jours à 44 jours) pour le HgCl2 et le Hg(NO3)2 se situent entre 0,62 µg.L-1 et 18 µg.L-1.
Enfin pour les poissons, les NOEC
Une donnée chronique est disponible pour les organismes benthiques, une NOEC (28 j) de 930 mg.kg-1 poids sec sur Chironomus riparius.
Pour les bactéries, cyanophycées, macrophytes, protozoaires, mollusques, coelenterés, les NOEC
Mercure organique :
Aucune valeur n’est disponible pour les algues.
Pour les micro-crustacés,
Pour les poissons, les NOEC pour le CH3HgCl et le CH3HgOH sont comprises entre 0,07 µg.L-1 et 75 µg.L-1.
Pour les bactéries, les protozoaires, les plannaires et les mollusques, les NOEC pour le CH3HgCl et le CH3HgOH sont comprises entre 0,03 µg.L-1 et 14 µg.L-1.
Sol
- Ecotoxicité aiguë
Pour un arthropode (Oxythyrea funesta), la CL50 est de 26,6 mg.kg-1.
- Ecotoxicité chronique
Mercure inorganique
Il n’existe pas de valeurs pour les végétaux et les annélides.
Pour les micro-organismes, les NOEC pour le HgCl2 sont comprises entre 1,4 et 2 406 mg.kg-1 de sol standard, poids sec.
Pour les étourneaux, cailles, poules et visons, les NOEC
Mercure organique
Il n’existe pas de valeurs pour les végétaux.
Pour les annélides,
Pour les canards, la NOEC évaluée sur 3 générations
Chez les faisans, poules, cailles, diamant mandarin (Poephila guttata), buse (Buteo jamaicensis), singes et visons, les NOEC
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Compartiment aquatique
|
Substances chimiques (n°CAS) |
Pays |
Compartiment |
Valeur de PNEC |
Unité |
Source (Année) |
|---|---|---|---|---|---|
|
7439-97-6 |
Canada |
Eau douce |
GL (I) = 0,1 |
µg.L-1 |
CCREM, 1999* |
|
Suisse |
Eau douce |
QZ = 0.01 |
µg.L-1 |
Behra et al., 1994 |
|
|
Allemagne |
Eau douce |
QN-V = 0,04 |
µg.L-1 |
Ohlenbusch, 2001 |
|
|
Danemark |
Sols |
SQC = 0,1 |
µg.kg-1 |
Scott-Fordsmand et Pedersen, 1995 |
|
|
Union Européenne (UE) |
Eaux de surface intérieure** |
NQE-MA*** = 0,05 |
µg.L-1 |
CE, 2008 |
|
|
NQE-CMA = 0,07 |
µg.L-1 |
||||
|
Autres eaux de surface |
NQE-MA*** = 0,05 |
µg.L-1 |
|||
|
NQE-CMA= 0,07 |
µg.L-1 |
||||
|
|
Biote |
EQS-AA = 0,02 |
µg.L-1 |
||
|
Grande-Bretagne |
Eau Marine |
EQS = 0,3 – 0,5 |
µg.L-1 |
Matthiessen, 1993 |
|
|
Japon |
Eau Marine |
EQS = 0,5 |
µg.L-1 |
Environment Agency, 1993 |
|
|
Pays-Bas |
Eau douce (concentration dissoute) |
MPC = 0,2 |
µg.L-1 |
VROM, 1999b
|
|
|
Eau douce (concentration totale) |
MPC = 1,2 |
µg.L-1 |
|||
|
Eau douce (concentration dissoute) |
TV = 0,01 |
µg.L-1 |
|||
|
Eau douce (concentration totale) |
TV = 0,07 |
µg.L-1 |
|||
|
Sols |
TV = 0,3 |
µg.kg-1 |
VROM, 1999a |
||
|
Sols |
IV = 10 |
µg.kg-1 |
|||
|
Suisse |
Eau douce |
Class 2 = 0,003-0,006 |
µg.L-1 |
Bingman, 1991 |
|
|
Etats-Unis |
Eau douce |
CCC = 0.77 |
µg.L-1 |
EPA, 1999 |
|
|
CMC = 1.4 |
µg.L-1 |
||||
|
Eau marine |
CCC = 0.94 |
µg.L-1 |
|||
|
CMC = 1.8 |
µg.L-1 |
||||
|
Empoisonnement IIR (poissons) |
WQC = 0,051 |
µg.L-1 |
*CCREM : Canadian Council of Resource and Environment Ministers
*Eaux de surface intérieures : rivières, lacs et masses d'eau artificielles ou sérieusement modifiées qui y sont reliées
***NQE-MA : Ce paramètre est
Attention, il convient de noter que ces valeurs seuils sont fournies pour le mercure élémentaire (N°CAS : 7439-97-6). Par conséquent aucune distinction n’est faite entre les différentes formes du mercure (i.e. organique ou inorganique). Ces valeurs seuils ne sont donc pas directement comparables à celles retenues par l’INERIS (qui font une distinction entre ces différentes formes).
PNEC retenue par l’INERIS
|
Substances chimiques |
Compartiment |
Facteur d’extrapolation |
Valeur de PNEC |
Unité |
Source |
|---|---|---|---|---|---|
|
Mercure inorganique |
PNECEAU-DOUCE |
4 (SSD) |
0,08 |
µg.L-1 |
INERIS, 2011 |
|
|
PNECEAU-MARINE |
5 (SSD) |
0,03 |
µg.L-1 |
INERIS, 2011 |
|
Mercure organique |
PNECEAU-DOUCE |
10 |
0.003 |
µg.L-1 |
Best et al., 1981 |
|
|
PNECEAU-MARINE |
50 |
0,0006 |
µg.L-1 |
Pelletier, 1988 |
|
|
PNECorale |
10 |
22 |
µg.kg-1 de nourriture/j |
US EPA, 1997 |
Mercure inorganique
- Compartiment aquatique eau douce :
Etant donné qu’un nombre suffisant de NOEC existet pour le compartiment aquatique d’eau douce, la PNEC peut être évaluée par la méthode statistique. Les valeurs suivantes ont été calculées à l’aide des données aquatiques d’eaux douces présentées dans le tableau section 4.1.2, et d'après Aldenberg et Jaworska (2000) :
HC5 = 0,32 µg.L-1 (IC_95 %= [0,09 ; 0,81])
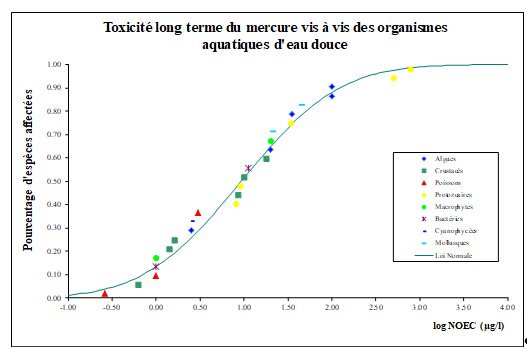
Compte tenu du nombre de données disponibles (26 espèces différentes pour 8 groupes taxonomiques différents) et de l’intervalle de confiance autour de l’HC5, nous suggérons d'utiliser un facteur d'extrapolation de 4 pour dériver la PNEC.
PNECEAU-DOUCE = 0,08 μg.L-1
- Compartiment aquatique eau marine :
Un nombre important de NOEC long terme étant disponible pour le compartiment aquatique marin,
HC5 = 0,15 µg.L-1 (IC_95 %= [0,03 ; 0,38])
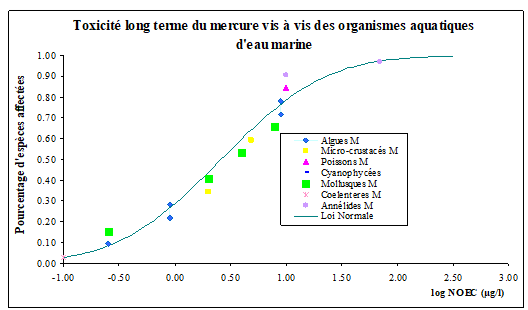
Compte tenu du nombre de données disponibles (16 espèces différentes pour 7 groupes taxonomiques différents) et de l’intervalle de confiance autour de l’HC5, nous proposons d'utiliser un facteur d'extrapolation de 5 pour dériver la PNEC.
PNECEAU-MARINE = 0,03 μg.L-1
Mercure organique
- Compartiment aquatique d’eau douce :
Le nombre de données chroniques disponibles pour le mercure organique étant limité, nous ne pouvons utiliser l’approche statistique en considérant l’ensemble des données d’écotoxicité d’eau douce et marine. Compte tenu du nombre important de données d’écotoxicité aiguë et chronique disponibles, nous appliquons un facteur d’extrapolation de 10 à la NOEC la plus faible obtenue sur le planaire Dugesia dorotocephala Best et al., 1981:
PNECEAU-DOUCE = 0,03 μg.L-1 / 10 soit PNECEAU-DOUCE = 3 ng.L-1
- Compartiment aquatique marin :
Compte tenu du faible nombre de données d’écotoxicité chronique disponibles pour les organismes marins, les données d’écotoxicité d’eau douce et marine seront considérées ensemble pour la dérivation de la PNECEAU-MARINE, comme recommandé par le guide de l’ECHA (Chapitre R10). Ainsi, disposant de plus de deux données long terme sur organismes d’eau douce et d’une donnée chronique supplémentaire sur espèce marine appartenant à un groupe taxonomique différents (Mytilus edulis, Pelletier, 1988, nous appliquons un facteur d’extrapolation de 50 à la plus faible NOEC disponible, soit celle sur l’organisme d’eau douce Dugesia dorotocephala, Best et al., 1981:
PNECEAU-MARINE = 0,03 μg.L-1/ 50 soit PNECEAU- MARINE = 0,6 ng.L-1
- Empoisonnement secondaire
L’empoisonnement secondaire se réfère aux prédateurs tels que les mammifères et les oiseaux qui se nourrissent de proies (poissons, moules) contaminées au mercure. Or, de nombreuses études EQS, 2005 ; ONU, 2005 ; OSPAR, 1996 indiquent que 70 - 99% du mercure est sous forme organique, considéré comme bien plus toxique que le mercure inorganique. Par conséquent, il est plus pertinent d’évaluer l'empoisonnement secondaire des prédateurs sur la base des données relatives au mercure organique.
Des données de toxicité orale sont disponibles pour les mammifères et les oiseaux, la plus faible donnée étant une NOEC à 0.22 mg.kg-1de nourriture sur le singe. Compte tenu de la quantité de données disponibles sur volatiles et mammifères pour le mercure organique, un facteur d’extrapolation de 10 est proposé.
La PNECorale pour les prédateurs aquatiques est donc de
PNECorale = 22 µg.kg-1 de nouriture
Remarque : à titre d’information, dans son rapport au Congrès sur le mercure, l'US-EPA a calculé les doses de référence (RfD) suivantes pour la faune aquatique US EPA, 1997 :
Rfd prédateurs aquatiques : 18 µg.kg-1 de nourriture / jour
Rfd espèces aviaires aquatique: 21 µg.kg-1 de nourriture / jour
Compartiment sédimentaire
PNEC retenue par l’INERIS
|
Substances chimiques (n°CAS) |
Espèce |
Facteur d’extrapolation |
Valeur de PNEC |
Unité |
Source (Année) |
|---|---|---|---|---|---|
|
Mercure inorganique |
Chironomius riparius |
100 |
9,3 |
mg.kg-1 poids sec |
Thompson et al., 1998 |
|
Mercure organique |
|
Méthode equilibre de partage |
0,509 |
mg.kg-1 poids sec |
INERIS, 2014 |
Mercure inorganique
Il existe une donnée d’ecotoxicité chronique obtenue pour les organismes benthiques. D’après le guide de l’ECHA (Chapitre R10), nous pouvons utiliser un facteur d’extrapolation de 100 sur le résultat sur Chironomius riparius Thompson et al., 1998.
PNEC sed = 9,3 mg.kg-1 poids sec
Pour comparaison, la méthode de l’équilibre de partage est utilisée :
PNECSED = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
D'où : PNECSED = 2,95 mg.kg-1 poids humide= 13,6 mg.kg-1 poids sec
Le détail des paramètres ayant servi au calcul sont fournis ci-après :
PNECSED = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1 150 kg.m-3)
Kmes-eau : Coefficient de partage entre les MES et l’eau (42 457 m3.m-3)
=Feaumes + (Fsolidmes x Kpmes / 1 000) x RHOsolid
Feaumes : Fraction d’eau dans les MES (défaut :
Fsolidmes : Fraction solide dans les MES (défaut :
Kpmes : Coefficient de partage eau-MES (16 9824 L.kg-1)
RHOsolid : densité de la phase solide (défaut 2 500 kg.m-3)
Compte tenu des valeurs obtenues par les deux méthodes, la valeur issue de la méthode des facteurs d’extrapolation sera retenue car plus protectrice, soit :
PNEC SED = 9,3 mg.kg-1 poids sec
Mercure organique
Aucune donnée n’est disponible pour les organismes benthiques. Par conséquent,
PNECSED = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
D'où : PNECSED = 110,8 µg.kg-1 poids humide = 509,5 µg.kg-1 poids sec
Le détail des paramètres ayant servi au calcul sont fournis ci-après :
PNECsed = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1 150 kg.m-3)
Kmes-eau : Coefficient de partage entre les MES et l’eau (42 457 m3.m-3)
=Feaumes + Fsolidmes x Kpmes / 1 000) x RHOsolid
Feaumes : Fraction d’eau dans les MES (défaut :
Fsolidmes : Fraction solide dans les MES (défaut :
Kpmes : Coefficient de partage eau-MES (169 824 L.kg-1)
RHOsolid : densité de la phase solide (défaut 2 500 kg.m-3)
Compartiment sol
PNEC retenue par l’INERIS
|
Substances chimiques (n°CAS) |
Espèce |
Facteur d’extrapolation |
Valeur de PNEC |
Unité |
Source (Année) |
|---|---|---|---|---|---|
|
Mercure inorganique |
Micro-organismes du sol |
100 |
14 |
µg.kg-1 poids sec |
Zelles et al., 1985 |
|
Mercure organique |
Eisenia foetida |
100 |
37 |
µg.kg-1 poids sec |
Beyer et al., 1985 |
Mercure inorganique
Une seule donnée d’écotoxicité aiguë est disponible (pas d’information sur l’espèce chimique testée) et plusieurs données d’écotoxicité chronique sont disponibles pour divers micro-oganismes du sol. Nous proposons un facteur d’extrapolation de 100 sur le plus faible résultat obtenu par Zelles et al. (1985).
PNEC sol = 1,4 /100 mg.kg-1 poids sec
Soit
PNEC sol = 14 µg.kg-1 poids sec
Mercure organique
Une seule donnée d’écotoxicité aiguë est disponible (pas d’information sur l’espèce chimique testée) et une donnée d’écotoxicité chronique est disponible pour des annélides. Nous proposons d’utiliser un facteur d’extrapolation de 100 sur cette donnée obtenue par Beyer et al., 1985.
PNEC sol = 37 µg.kg-1 poids sec
Le mercure est une substance naturellement présente dans l’environnement et lors d’une évaluation des risques, il est nécessaire de tenir compte de la concentration « naturelle » du milieu. L’approche des risques ajoutés proposée par Struijs et al., 1997 permet de tenir compte de cette concentration. Cette approche est encore en discussion au niveau français.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Concentrations sans effet prévisible pour l'environnement
Mercure inorganique
|
Compartiment |
Facteur d’extrapolation |
Valeur de PNEC |
Unité |
Source (Année) |
|
|---|---|---|---|---|---|
|
Mercure inorganique |
PNECEAU-DOUCE |
4 (SSD) |
0,08 |
µg.L-1 |
INERIS, 2014 |
|
PNECEAU-MARINE |
5 (SSD) |
0,03 |
µg.L-1 |
INERIS, 2014 |
|
|
PNECSED |
100 |
9,3 |
mg.kg-1 poids sec |
Thompson et al., 1998 |
|
|
PNECSOL |
100 |
14 |
µg.kg-1 poids sec |
Zelles et al., 1985 |
Mercure organique
|
|
Compartiment |
Facteur d’extrapolation |
Valeur de PNEC |
Unité |
Source (Année) |
|---|---|---|---|---|---|
|
Mercure organique |
PNECEAU-DOUCE |
10 |
0,03 |
µg.L-1 |
Best et al., 1981 |
|
PNECEAU-MARINE |
50 |
0,0006 |
µg.L-1 |
Pelletier, 1988 |
|
|
PNECSED |
Méthode equilibre de partage |
509,5 |
µg.kg-1 poids sec |
INERIS, 2014 |
|
|
PNECSOL |
100 |
37 |
µg.kg-1 poids sec |
Beyer et al., 1985 |
|
|
PNECorale |
10 |
22 |
µg.kg-1 de nourriture |
INERIS, 2014 |
Le mercure est une substance naturellement présente dans l’environnement et lors d’une évaluation des risques, il est nécessaire de tenir compte de la concentration « naturelle » du milieu. L’approche des risques ajoutés proposés par Struijs et al. (1997) permet de tenir compte de cette concentration. Cette approche est encore en discussion au niveau français.
Valeurs réglementaires
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
L’empoisonnement secondaire se réfère aux prédateurs tels que les mammifères et les oiseaux qui se nourrissent de proies (poissons, moules) contaminées au mercure. Or, de nombreuses études EQS, 2005 ; ONU, 2005 ; OSPAR, 1996 indiquent que 70 - 99% du mercure est sous forme organique, considéré comme bien plus toxique que le mercure inorganique. Par conséquent, il est plus pertinent d’évaluer l'empoisonnement secondaire des prédateurs sur la base des données relatives au mercure organique.
Des données de toxicité orale sont disponibles pour les mammifères et les oiseaux, la plus faible donnée étant une NOEC à 0.22 mg.kg-1de nourriture sur le singe. Compte tenu de la quantité de données disponibles sur volatiles et mammifères pour le mercure organique, un facteur d’extrapolation de 10 est proposé.
La PNECorale pour les prédateurs aquatiques est donc de
PNECorale = 22 µg.kg-1 de nouriture
Remarque : à titre d’information, dans son rapport au Congrès sur le mercure, l'US-EPA a calculé les doses de référence (RfD) suivantes pour la faune aquatique US EPA, 1997 :
Rfd prédateurs aquatiques : 18 µg.kg-1 de nourriture / jour
Rfd espèces aviaires aquatique: 21 µg.kg-1 de nourriture / jour
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 7439-97-6 |
|---|---|
| SANDRE | 1387 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. D'après Marlière (2003) modifié, le tableau 1.2 regroupe les principales réglementations européennes touchant le mercure. Tableau 1.2. Principales réglementations européennes visant le mercure (d'après Marlière, 2003 mis à jour ; les cellules grisées repèrent les textes réglementaires repris ci-après).  
De plus, le mercure est inscrit dans la circulaire du 13 juillet 2004 relative aux Installations classées « Stratégie de maîtrise et de réduction des émissions atmosphériques toxiques pour la santé » (disponible par internet sur le site Aida). Cette circulaire fixe des objectifs globaux nationaux déterminés à partir d'estimations quantitatives qui se basent sur les connaissances actuelles et sur la mise en œuvre des dispositions réglementaires en vigueur. Néanmoins, les actions de réduction des émissions dans l'eau ne relèvent pas de cette stratégie mais des dispositions de la directive 2000/60/CE du 23 octobre 2000 établissant un cadre pour une politique communautaire dans le domaine de l'eau. Dans ce cadre, des objectifs de réduction ou d'élimination sont fixés afin d'obtenir un bon état des eaux d'ici 2015. D'une manière plus générale, sur le mercure, la Commission européenne a publié, le 28 janvier 2005, une communication expliquant sa stratégie (Commission européenne, 2005a). Les buts de la Commission sont de :
Les paragraphes suivants présenteront les principaux textes (français et européens) ayant trait au mercure ainsi qu'à ses composés minéraux. Textes législatifs de référenceÉtiquetageEn France les substances chimiques contenant du mercure ou des composés de mercure sont régies par l'arrêté du 9 novembre 2004, modifié par l'arrêté du 7 février 2007 définissant les critères de classification et les conditions d'étiquetage et d'emballage des préparations dangereuses. Ce texte transpose en droit français la directive 1999/45/CE du Parlement européen et du Conseil du 31 mai 1999, modifié par la directive 2006/8/CE de la commission du 23 janvier 2006. D'autre part, le décret 99 374 du 12 mai 1999 relatif à la « mise sur le marché des piles et accumulateurs et à leur élimination » impose que la présence de mercure dans des piles soit indiquée par l'apposition du symbole chimique : Hg. Nomenclature Installations Classées (IC)France : Décret n°53 578 du 20 mai 1953 modifié relatif à la nomenclature des installations classées pour la protection de l'environnement mise à jour par le Ministère de l'écologie et du développement durable « Nomenclature des installations classées pour la protection de l'environnement ».
[6] La liste des rubriques mentionnées est indicative et ne se veut pas exhaustive. Piles et accumulateursDécret n° 99 374 du 12 mai 1999 relatif à la mise sur le marché des piles et accumulateurs et à leur élimination : « Est interdite la mise sur le marché des piles et accumulateurs contenant plus de 5 ppm en masse de mercure, à l'exception des piles de type bouton ou des piles composées d'éléments de type bouton ne contenant pas plus de 2% en masse de mercure, ainsi que la mise sur le marché des appareils dans lesquels ces piles et accumulateurs sont incorporés. ». Ne sont toutefois pas soumises à cette prescription certaines catégories d'appareils (les appareils en vue d'assurer une alimentation électrique continue à des fins industrielles intensives ou pour préserver la mémoire et les données d'équipements informatiques, les appareils scientifiques et professionnels équipés de piles de référence, les appareils médicaux équipés de piles ou d'accumulateurs destinés à maintenir les fonctions vitales ainsi que les stimulateurs cardiaques, •). Une directive de l'Union européenne (2006/66/CE du 6 septembre 2006) relative aux piles et accumulateurs ainsi qu'aux déchets de piles et accumulateurs reprend ces principes en imposant en plus l'obligation de collecte séparée (en vue d'un recyclage) de ces batteries. De plus, ces directives incitent les états membres à construire des programmes d'action visant à réduire les quantités de mercure présentes dans les piles et accumulateurs. Cet objectif pouvant passer par la promotion de substituts moins polluants et/ou par l'encouragement du recyclage. Équipements électriques et électroniquesLa directive 2002/95/EC du 27 janvier 2003 « restriction of the use of certain hazardous substances in electrical and electronic equipment » impose la substitution de certains métaux lourds (y compris mercure) par d'autres substances pour les équipements électriques et électroniques neufs (date de mise en application : 1er juillet 2006). Certains usages du mercure sont exemptés pour une durée de quatre ans renouvelable (usage du mercure dans les lampes compactes, les tubes fluorescents et d'autres lampes). Ces exceptions doivent néanmoins respecter certaines limitations dans les quantités de mercure utilisées (ces limitations étant définies en annexe du texte). L'arrêté du 25 novembre 2005 (JORF n°277 du 29 novembre 2005, page 18451, texte n° 31) transpose ces recommandations en droit français. La directive 2002/96/EC du 27 janvier 2003 « waste electrical and electronic equipment » impose, à partir du 13 août 2004, que les industriels mettent en œuvre « les meilleures techniques de traitement/recyclage disponibles » pour les déchet électriques et électroniques. Ce texte impose également une obligation de collecte avec une collecte séparée pour les déchets contenant du mercure7 . [7] Sont considérés comme non soumis à cette directive les matériaux homogènes contenant moins de 0,1% en masse de mercure. EmballagesDécret n° 98 638 du 20 juillet 1998 relatif à la prise en compte des exigences liées à l'environnement dans la conception et la fabrication des emballages (transcription de la directive 94/62/CE du Parlement européen et du Conseil du 20 décembre 1994 relative aux emballages et aux déchets d'emballages) : « La somme des niveaux de concentration en plomb, cadmium, mercure et chrome hexavalent présents dans l'emballage ou dans ses éléments ne devra pas dépasser 600 parties par million (ppm) en masse s'ils sont fabriqués après le 30 juin 1998, 250 ppm en masse s'ils sont fabriqués après le 30 juin 1999 et, enfin, 100 ppm en masse s'ils sont fabriqués après le 30 juin 20018. » Des dérogations permettant le dépassement de ces seuils existent pour certains types de produits (par exemple directive 2001/171/CE du 19 février 2001 concernant les emballages en verre et directive 1999/177/CE du 8 février 1999 concernant les caisses en plastique). Néanmoins la législation précise qu'aucune quantité de mercure ne doit être introduite intentionnellement au cours du processus de fabrication : le matériau d'emballage ne peut dépasser les limites de concentration que de façon accidentelle ou du fait de l'adjonction de matières recyclées. [8] Ces niveaux de concentration ne s'appliquent pas aux emballages composés entièrement de verre cristal. Vente de substances dangereusesDécret n° 92 1074 du 2 octobre 1992 (transposition dans le droit français de la directive européenne 89/677/CEE du 21 décembre 1989) relatif à la mise sur le marché, à l'utilisation et à l'élimination de certaines substances et préparations dangereuses : « Il est interdit de mettre sur le marché, détenir en vue de la vente, céder à titre onéreux ou gratuit, acquérir ou utiliser des produits antisalissures contenant des composés du mercure (…) ». Ce texte vise les applications suivantes :
Vente de produits phytosanitairesLa directive européenne 79/117/CEE du 21 décembre 1978 prohibe la vente et l'utilisation de produits phytosanitaires contenant certaines substances actives. Cette directive est amendée par la directive 91/188/CEE du 19 mars 1991 (interdiction des produits échappant préalablement à cette réglementation). Ces directives visent tout particulièrement :
Vente de biocidesDécret n° 92 1074 du 2 octobre 1992 relatif à la mise sur le marché, à l'utilisation et à l'élimination de certaines substances et préparations dangereuses : « Il est interdit de mettre sur le marché, détenir en vue de la vente, céder à titre onéreux ou gratuit, acquérir ou utiliser des produits de protection du bois contenant des composés du mercure (…). » « Il est interdit d'utiliser (…) des composés du mercure (…) pour le traitement des eaux industrielles, indépendamment de leur usage. » Cette réglementation est reprise dans la directive européenne 98/8/EC du 16 février 1998. Exportation et importation de substances chimiques dangereusesEntré en vigueur en mars 2003, le règlement n° 304/2003/CE du Parlement européen et du Conseil du 28 janvier 2003, modifié par le règlement n° 1376/2007/CE du 23 novembre 2007 concernant les exportations et importations de produits chimiques dangereux précise que le mercure et ses composés sont sujets à déclaration préalablement à toute exportation (y compris les composés du mercure utilisés en tant que pesticides). Ce règlement interdit également certains articles : les savons cosmétiques contenant du mercure en font partie. Sûreté des jouetsLa directive européenne 88/378/CEE du 3 mai 1988 (entrée en vigueur en 1990) autorise la mise sur le marché de jouets dans la limite ou la biodisponibilité de certaines substances chimiques ne dépasse pas des niveaux définis : pour le mercure, ce niveau équivaut à 0,5 µg par jour. CosmétiquesLa directive européenne 76/768/CEE du 27 juillet 1976 (entrée en vigueur en 1978) sur les produits cosmétiques indique que le mercure et ses composés ne doivent pas être présents en tant qu'ingrédient dans les cosmétiques (savons, lotions, shampoings, crèmes, etc... Ce texte attribue une dérogation aux sels phenyl mercuriques en tant que conservateurs pour le maquillage des yeux ainsi que les produits démaquillants dédiés à ce type de maquillage (si les concentrations n'excèdent pas 0,007% en masse de mercure). Dispositifs de mesuresLa directive européenne 2007/51/CE du 25 septembre 2007 sur la limitation de la mise sur le marché de certains dispositifs de mesure contenant du mercure établit que ne peut être mis sur le marché :
La restriction du point 2) ne s'applique pas :
Pour le 3 octobre 2009, la commission va passer en revue les solutions fiables, plus sûres et étant techniquement et économiquement réalisables afin de remplacer ces dispositifs pour les applications médicales et industrielles. Sur la base de cet examen, la Commission présentera, le cas échéant, une proposition législative visant à étendre les restrictions aux sphygmomanomètres (ou tensiomètres) et aux autres dispositifs de mesure à usage médical ainsi que dans ceux destinés à d'autres usages professionnels et industriels, de manière à éliminer le mercure des dispositifs de mesure chaque fois que cela est techniquement et économiquement réalisable. Législation française vis à vis des émissions et de la présence dans l'environnementGrandes installations de combustion (GIC)L'arrêté du 20 juin 2002, modifié par les arrêtés du 24 décembre 2002 et du 13 juillet 2004, relatif aux chaudières présentes dans une installation nouvelle ou modifiée d'une puissance supérieure à 20 MWth9 fixe des VLE10 dans l'air pour le Cadmium (Cd), le mercure (Hg) et le thallium (TI) et ses composés : 0,05 mg.Nm-3 par métal et 0,1 mg.Nm-3 (mg.m 3 dans des conditions dites normales11) pour la somme exprimée en (Cd + Hg + TI) et dans l'eau (0,05 mg.L-1 pour le mercure) L'arrêté du 30 juillet 2003, modifié par les arrêtés du 13 juillet 2004 et du 31 octobre 2007, relatif aux chaudières présentes dans des installations existantes de combustion d'une puissance supérieure à 20 MWth renvoie aux mêmes VLE. [9] MWth : Mega Watt thermique unité de mesure de la puissance thermique (chaleur) d'une centrale, transformée en électricité. Le rapport entre la puissance électrique et la puissance thermique de la centrale (<1) est son rendement. 10VLE signifie : valeur limite d'émission, c'est à dire la valeur maximum de rejet autorisé pour l'installation dans l'environnement. [11] La lettre « N » est une abréviation du terme « normal ». Ce qui est synonyme d'une température moyenne de 0°C et une pression de 1,013 bar (conditions dans lesquels une mole de gaz parfait à un volume de 22,413837 litres). Installations effectuant de l'électrolyse des chlorures alcalinsLa directive européenne 82/176/CEE du 22 mars 1982, concernant les valeurs limites et les objectifs de qualité pour les rejets de mercure du secteur de l'électrolyse des chlorures alcalins a été transcrite en droit français par l'arrêté du 2 février 1998 modifié par celui du 6 août 2007 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation fixe les valeurs limites de rejets à 0,3 g.t 1 de capacité de production de chlore, à la sortie de l'atelier et à 0,6 g.t 1 de capacité de production de chlore, à la sortie du site industriel. (les valeurs limites en moyenne journalière sont égales au double des valeurs limites mensuelles). Les ateliers existants doivent respecter les valeurs limites suivantes pour les rejets de mercure dans l'air : 1,5 g.t-1 de capacité de production de chlore dans l'installation et 1,2 g.t-1 à partir de 2010. Incinération de déchetsLes arrêtés du 10 octobre 1996 et du 20 septembre 2002, modifiés par l'arrêté du 10 février 2005, relatifs aux installations spécialisées d'incinération et aux installations de co incinération de certains déchets industriels spéciaux, dangereux ou non dangereux fixent :
Pour les cimenteries, la teneur des déchets industriels spéciaux à l'entrée du four ne doit pas dépasser 10 mg.kg-1 de mercure (Hg). Ces valeurs sont reprises par la directive européenne 2000/76/CE du 4 décembre 2000 qui impose de surcroît la surveillance des effluents gazeux et aqueux (au minimum deux mesures par jour de concentration en mercure des gaz de combustion et une mesure par mois de concentration des eaux de lavage des gaz de combustion). Autres installations classées pour la protection de l'environnement (ICPE)L'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation est repris ci dessous : Rejets de cadmium, mercure et thallium, et de leurs composés : si le flux horaire total de cadmium, mercure et thallium, et de leurs composés dépasse 1 g.h-1, la valeur limite de concentration est de 0,05 mg.m-3 par métal, de 0,1 mg.m-3 pour la somme des métaux (exprimée en Cd + Hg + Tl) et de 0,05 mg.L-1 dans l'eau. L'arrêté du 3 mai 1993 relatif aux cimenteries indique que : « les teneurs en métaux des émissions gazeuses en provenance du four, mesurées sur un échantillon représentatif d'une période de deux heures minimum, respectent les valeurs limites suivantes : 0,2 mg.m-3 pour la somme Cd + Tl + Hg (gaz et particules). » L'arrêté du 3 avril 2000 relatif à l'industrie papetière réglemente les rejets de cadmium, mercure et thallium, et de leurs composés : si le flux horaire total de cadmium, mercure et thallium, et de leurs composés dépasse 1 g.h-1, la valeur limite de concentration est de 0,2 mg.m-3 (exprimée en Cd + Hg + Tl). L'arrêté du 12 mars 2003 relatif à l'industrie du verre et de la fibre minérale indique que si le flux horaire total de cadmium, mercure, thallium et leurs composés, sous forme gazeuse et particulaire, dépasse 1 g.h-1, la valeur limite de concentration des rejets de cadmium, mercure et thallium et de leurs composés est de 0,05 mg.Nm-3 par métal et de 0,1 mg.Nm-3 pour la somme des métaux (exprimée en Cd + Hg + Tl), en ce qui concerne à la fois les rejets des unités de fusion et des autres activités annexes. Pour le verre d'emballage dont le taux de recyclage de calcin externe est supérieur à 40% et dont les poussières de filtres sont recyclées dans le four, la valeur limite de concentration des rejets de cadmium, mercure et thallium et de leurs composés de 0,05 mg.Nm-3 par métal est portée à 0,1 mg.Nm-3 et à 0,15 mg.Nm-3 pour la somme des métaux en ce qui concerne à la fois les rejets des unités de fusion et des autres activités annexes. Pour les verres sodocalciques la valeur limite peut s'appliquer uniquement au cadmium si l'exploitant démontre que les matières premières utilisées contiennent des quantités négligeables de mercure et de thallium. Législation communautaire vis à vis des émissions et de la présence dans l'environnementIntegrated Pollution Prevention and Control (IPPC)L'Union européenne a une série de règles communes sur l'octroi d'autorisations aux installations industrielles. Ces règles sont exposées dans la directive IPPC de 1996 (directive 96/61/EC du 24 septembre 1996) modifiée par le règlement CE n°166/2006. Toutes les installations industrielles couvertes par l'Annexe I de la directive12 doivent obtenir une autorisation (permis) des autorités dans les pays de l'Union européenne. Son entrée en vigueur à eu lieu en 1999 pour les nouvelles installations (ou les installations anciennes subissant des modifications substantielles). Les installations existantes avant 1996 bénéficient d'un délai pour ce conformer à ce texte (dead-line le 30 octobre 2007). Les autorisations doivent être fondées sur les Meilleures Techniques Disponibles (MTD). A certaines MTD sont associées des Valeurs Limites d'Emission (VLE) de Mercure. Des VLE associées aux MTD sont à prendre en compte dans un grand nombre de secteurs industriels, parmi lesquels notamment :
[12] Entre autres, les installations industrielles visant à produire de l'énergie, des métaux, des minéraux, des produits chimiques, les installations industrielles gérant les déchets ainsi que d'autres activités telles que les fermes industrielles, les papeteries et les tanneries. Les documents de référence qui décrivent les MTD et donnent les VLE qui y sont associées sont appelés des BREFs. Ils peuvent être consultés, ainsi que des résumés en français sur le site AIDA de l'INERIS : http://aida.ineris.fr Rejets dans les eauxLes rejets de mercure dans l'environnement aquatique sont réglementés par différents textes européens :
Protection des eauxLa Directive 2000/60/CE du Parlement européen et du Conseil du 23 octobre 2000 établit un cadre pour une politique communautaire dans le domaine de l'eau (eau de surface, eaux transitoire, eau côtière et eau souterraine). La décision 2001/2455/CE classe le mercure comme « substance dangereuse prioritaire » (“priority hazardous substance”). Pour ces substances, la directive impose la cessation ou l'élimination progressive des émissions, rejets et pertes dans un délai de 20 ans après l'adoption de la Directive. Notons qu'à l'échelle européenne, une directive établissant des normes de qualité environnementale dans le domaine de l'eau et modifiant les directives 82/176/CEE, 83/513/CEE, 84/156/CEE, 84/491/CEE, 86/280/CEE et 2000/60/CE a été adoptée le 17 juin 2008. L'application de cette directive « fille » adoptée en juin 2008 par le parlement devrait permettre d'éliminer progressivement d'ici à 2018 les 13 substances déjà identifiées comme « substances dangereuses prioritaires » dont le mercure. Protection des eaux souterrainesLa directive européenne 80/68/CEE est relative à la protection des eaux souterraines contre la pollution causée par certaines substances dangereuses. Dans le cas du mercure, ce texte interdit les rejets directs (introduction sans percolation à travers le sol ou le sous sol) et les rejets indirects sont sujets à des investigations préalables et à la mise en place des techniques de précaution nécessaires. Ce texte est entré en vigueur en 1981 et sera abrogé au 22 décembre 2013. La directive 2000/60/EC reprend et élargit ces principes à toutes les activités pouvant entraîner des pollutions par le mercure ou ses composés. La directive européenne 2006/118 sur la protection des eaux souterraines contre la pollution et la détérioration demande aux pays membres de fixer les valeurs limites de rejets de différents polluants. Protection de la santé et protection des travailleursLa directive européenne 98/24/EC du 7 avril 1998 propose des valeurs limites d'exposition des travailleurs : 0,02 mg.m 3 d'air pour une moyenne de huit heures de mise en contact ; 0,01 mg.L 1 dans le sang et 0,03 mg.g 1 de créatinine dans les urines. Air ambiantLes directives européennes 96/62/EC du 27 septembre 1996 et 2004/107/CE du 15 décembre 2004 concernent l'arsenic, le cadmium, le mercure, le nickel et les hydrocarbures aromatiques polycycliques dans l'air ambiant. Ces directives invitent les états membres à définir des objectifs environnementaux (valeurs limites, valeurs cibles, valeurs d'alertes). Néanmoins, à ce jour, de telles valeurs n'existent pas pour le mercure. Parmi les différentes actions demandées par ces directives, citons l'obligation d'installer pour chaque état membre un point de prélèvement ou au moins un point de prélèvement tous les 100 000 km2 pour assurer une mesure indicative, dans l'air ambiant du mercure gazeux total15 et du dépôt total de mercure. La mesure du mercure bivalent particulaire et gazeux est recommandée. [15] Cette appellation correspond à la vapeur de mercure élémentaire (Hg0) et le mercure gazeux réactif, c'est-à-dire les espèces de mercure hydrosoluble qui ont une pression de vapeur suffisamment élevée pour exister en phase gazeuse. Mesure et contrôleL'arrêté du 24 décembre 2002 de la République Française relatif à la déclaration annuelle des émissions polluantes des installations classées soumises à autorisation et le règlement 574/2004 de la Commission du 23 février 2004 modifiant les annexes I et III du règlement 2150/2002 relatif aux statistiques sur les déchets, définissent le suivi réglementaire s'imposant pour toute utilisation du mercure et/ou de ses composés. Plus en détails, la décision européenne 2000/479/EC du 17 juillet 2000 relative au registre EPER (European Pollutant Emission Register) impose aux états membres de soumettre à la Commission des rapports rendant compte des émissions vers l'air et l'eau de toutes les installations responsables de rejets de mercure en direction de l'air supérieures à 10 kg.an 1 et/ou vers l'eau de 1 kg.an 1. Le premier rapport traite des émissions de l'année 2001 et le second de celles de l'année 2004. Déchets et recyclagePiles et batteriesLa circulaire du 7 janvier 1997 de la République Française régit l'organisation de la collecte, du recyclage et de l'élimination des piles et accumulateurs. Véhicules en fin de vieLa directive européenne 2000/53/EC du 18 septembre 2000 tend à définir de bonnes pratiques afin d'encourager et de faciliter la valorisation et le recyclage des véhicules en fin de vie. Ainsi, les états membres se sont engagés à ce que les équipements automobiles mis sur le marché après le 1er juillet 2003 ne contiennent plus de mercure (à l'exception des ampoules et de certains instruments d'affichage). De plus, les états membres doivent assurer que les véhicules en fin de vie soient stockés et traités en respect des règles techniques en vigueur (y compris le démontage, dans la mesure du possible, de l'ensemble des équipements identifiés comme contenant du mercure) Ce texte est entré en vigueur en 2002. Déchets spéciauxLa décision de la commission du Parlement européen 2000/532/EC du 3 mai 2000 (en remplacement de la décision 94/3/EC) établit une liste des déchets dits « spéciaux » (Hazardous Waste). Pour chacun, elle précise les seuils de concentrations admissibles, la classification, l'étiquetage... Cette décision fait directement référence au mercure à travers les déchets portant les codes :
ainsi que d'autres codes spécifiques qui incluent l'expression “containing dangerous” qui peut faire référence au mercure. Amalgames dentairesSelon le site internet de la SDF (Société Dentaire Française), le mercure utilisé en odontologie peut contaminer l'environnement par le biais de l'évacuation des déchets provenant des cabinets dentaires. Il existe dans ce domaine un matériel moderne qui permet de récupérer, avec une efficacité supérieure à 95% pour le mercure, les déchets métalliques produits à la suite de l'insertion ou de l'élimination de l'amalgame. Les dispositions réglementaires sont précisées par l'arrêté du 30 mars 1998 relatif à l'élimination des déchets d'amalgame issus des cabinets dentaires (texte entré en vigueur en 2001) : « Les déchets secs et liquides d'amalgames dentaires sont, dès leur production, séparés des autres déchets. Les déchets secs d'amalgames dentaires, les déchets d'amalgame contenus dans le préfiltre et les capsules de prédose sont conditionnés dans des emballages identifiés à usage unique, étanches à l'eau en toutes positions, résistant à la perforation, stables et présentant une fermeture provisoire et une inviolabilité complète lors du transport. Les effluents liquides contenant des résidus d'amalgames dentaires sont évacués vers le réseau d'eaux usées après passage dans un séparateur d'amalgame. Le séparateur d'amalgame retient, quelles que soient les conditions de débit, 95% au moins, en poids, de l'amalgame contenu dans les eaux usées. » Les conditions de transport de l'ensemble des déchets d'amalgame sont également spécifiées dans le texte. Mise en déchargeLa directive européenne 1999/31/EC du 26 avril 1999 complétée par la décision 2003/33/EC du 19 décembre 2002 établit des procédures et critères d'acceptabilité des déchets en décharge (afin de réduire les effets sur l'environnement et sur la santé humaine de la mise en décharge de déchets). Les états membres doivent s'assurer que certains déchets ne soient pas acceptés en décharge et en particulier les déchets pouvant entraîner la lixiviation de mercure (selon des critères précisés en annexe de la directive). Ce texte se penche également sur le cas des décharges souterraines où des techniques particulières d'entreposage ainsi qu'un suivi environnemental sont imposés. Les états membres disposent d'un délai s'étendant jusqu'en juillet 2009 pour mettre aux normes leurs décharges. Épandage de bouesL'arrêté du 8 janvier 1998 de la République Française fixe les prescriptions techniques applicables aux épandages de boues sur les sols agricoles issues du traitement des eaux usées. Il fixe des teneurs limites en éléments traces (y compris le mercure ) dans les boues, des valeurs limites de concentration en éléments traces dans les sols et des flux cumulés maximaux en éléments traces apportés par les boues pour les pâturages ou les sols de pH inférieurs à 6. La directive européenne 86/278/CEE du 12 juin 1986 traite de la même question. Par exemple, dans le cas du mercure, les valeurs limites sont comprises entre 1 à 1,5 mg.kg 1 (matière sèche) pour les sols à pH supérieur à 6 et inférieur à 7. Cette directive indique que les états membres doivent réguler l'épandage de boues issues de stations d'épuration afin que l'accumulation des métaux lourds dans les sols n'entraîne pas de dépassement des valeurs limites. Pour cela ils disposent de deux moyens :
Consommation humaineContamination des poissons destinés à l'alimentationLes régulations de la Commission européenne 466/2001 du 8 mars 2001 et 221/2002 du 6 février 2002 réglementent les niveaux maximums de certains contaminants dans les poissons destinés à l'alimentation. Pour le mercure la limite équivaut à 0,5 mg.kg 1 de matière humide pour le poisson (à l'exception des espèces suivantes soumises à un maximum de 1 mg.kg 1 : Lophius spp. ; Anarhichas lupus ; Dicentrarchus labrax ; Molva dipterygia ; Sarda spp. ; Anguilla spp. ; Hoplostethus atlanticus ; Coryphenoides rupestris ; Hippoglossus hippoglossus ; Makaira spp. ; Esox lucius ; Orcynopsis unicolor ;Centroscymnes coelolepis ; Raja spp. ; Sebastes marinus ; Sebastes mentella ; Sebastes viviparus ; Istiophorus platypterus ; Lepidopus caudatus ; Aphanopus carbo ; toutes espèces de requin ; Lepidocybium flavobrunneum ; Ruvettus pretiosus ; Gempylus serpens ; Acipenser spp. ; Xiphias gladius ;Thunnus et Euthynnus spp. Qualité des eaux en zone conchylicolesD'après la directive européenne 79/923/CEE du 30 octobre 1979, les états membres doivent s'assurer que la concentration de mercure dans les eaux en zone conchylicoles ne dépasse pas un niveau entraînant des effets négatifs sur les coquillages, mollusques. |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Valeurs sanitaires et environnementalesUn exemple de compilation de ces valeurs est disponible sur Internet sur le site de l'INERIS (http://www.ineris.fr ; rubrique Etudes et Recherches / Fiches toxicologiques ).
Notes documentaires INRS ED 984 (2006) "Valeurs limites d'exposition professionnelle aux agents chimiques en France" et ND 2190 191 03 "Indices biologiques d'exposition". Air (Circulaire du Ministère chargé du Travail du 19 juillet 1982) : Mercure (vapeur) : VME5 : 0,05 mg.m-3 ; Mercure (composés alkylés),en Hg : VME :0,01 mg.m-3 ; Mercure (composés arylés et inorganiques en Hg) : VME : 0,1 mg.m-3 . Indices biologiques d'exposition : Mercure : 15 µg.L-1 (sang).
Qualité des eaux de consommation : France, Décret n° 2001 – 1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine (à l'exclusion des eaux minérales naturelles) et directive européenne 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine : Mercure 1,0 µg.L-1 ; Cette valeur est reprise par l'OMS au sein de ses « directives de qualité pour l'eau de boisson » (2004). Qualité de l'air : Valeur « à ne pas dépasser » recommandée par l'OMS (2000) : 1 µg.m-3 (moyenne annuelle pour les vapeurs de mercure inorganique). [5] VME : valeurs moyennes d'exposition. |
| Informations complémentaires |
Le mercure (Hg) est le seul métal liquide à température ordinaire. Cet élément se présente généralement sous forme d’un liquide blanc argenté, brillant et très dense (INRS, 1997). Il existe de nombreux composés mercureux mais le suivi réglementaire des rejets de mercure dans l’environnement n’inclut pas d’obligation quant à des mesures des espèces rejetées. Ainsi, extrêmement peu de données sont disponibles sur le sujet. Le mercure élémentaire est quasiment insoluble dans l’eau. Cependant, la solubilité des composés organiques est variable, tous sont plus ou moins solubles. La solubilité des composés du mercure inorganique est très variable : des composés comme le chlorure mercurique sont solubles, le sulfure mercurique est complètement insoluble (INERIS, 2005). Le sulfure mercurique (ou cinabre) est le principal constituant des minerais du métal (INRS, 1997). Les minerais exploités contiennent de 0,5 à 5% de Hg selon Vignes et al. (1997) et de 0,1 à 3% d’après le BREF sur les métaux non ferreux3. [2] Mercuriel est un terme générique signifiant « qui contient du mercure ». Plus précisement, un ion mercureux correspond aux dimère du mercure (ion mercure (I)) comme Hg22+, Hg2SO4, … L’ion mercurique correspond à la forme ionique 2+ (ion mercure (II)) comme dans Hg2+, HgO, HgSO3, HgI+, HgI2, HgI3-, HgI42-, … [3] BREF Industrie des métaux non ferreux, 2001 (http://aida.ineris.fr/bref/bref_cadres.htm). |
Production et utilisation
Production et ventes
Données économiques
En France, les chiffres du commerce extérieur concernant le mercure sont fournis sur le site internet de la Direction générale des douanes (tableau 2.1).
Tableau 2.1. Chiffres du commerce extérieur français concernant le mercure (d'après Direction générale des douanes)
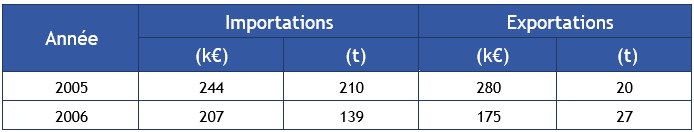
En France, le prix du mercure est estimé à ~ 6 €.kg-1. De même, le marché français du mercure est estimé à ~ 60 k€ en 2005 (importations et exportations). Au niveau européen, le prix du mercure est estimé à 5 €.kg-1 (Commission européenne, 2005a).
Ce chiffre est a comparer avec le chiffre total du marché français « de la métallurgie et de la transformation de métaux » équivalent à ~ 65 milliards d'euros (site internet du Sessi). Le marché du mercure ne représente donc qu'un millionième du marché français de la métallurgie et de la transformation de métaux.
Néanmoins, le mercure entre dans de nombreux procédés de fabrication et dans de nombreux produits. Mis à part quelques rares exemples, une évaluation exhaustive de la place de cette substance dans l'économie française est donc impossible à mener dans le cadre de cette fiche.
Procédés de production
FTE 2005 Importer
Production primaire à partir de cinabre
L'écorce terrestre contient en moyenne environ 0,02 ppm de mercure. Le cinabre (HgS) est le minéral mercuriel le plus largement répandu et exploité. Il provient de gisements souterrains ou a ciel ouvert. Le minerai exploité se localise à des profondeurs comprises entre quelques mètres et 700 mètres. Celui-ci est extrait par des techniques minières classiques, puis broyé et grillé dans un four. Le mercure, libéré sous forme vapeur, est recueilli par condensation.
En France, on ne recense aucune activité minière ni métallurgique concernant le mercure. La production mondiale est en constante diminution depuis une vingtaine d'année : 10000 t en 1970 ; 6500 t en 1986 ; 3260 t en 1996, 1600 t en 2003 et 1100 t en 2005 (cf. figure 2.1. ci après d'après Vignes et al., 1997 ; Quid 2006, 2008).

Figure 2.1. Production mondiale de mercure ; en tonnes (d'après Vignes et al., 1997 ; Quid 2006, 2008).
La production primaire européenne (estimée à 500 t en 2003) est uniquement réalisée en Espagne[16]. A ce chiffre s'additionne la production secondaire (incluant le recyclage et la régénération industrielle) : en 1991, Maxson et al. estimaient cette production secondaire en Europe à près de 70% de la production primaire. Ainsi, des quantités importantes de mercure ont été mises sur le marché à la suite du remplacement continu de cet élément et de la fermeture d'installations de chlore soude à base de mercure en Europe. Une analyse du marché montre qu'entre 700 et 900 tonnes de mercure recyclé (correspondant à environ 30% de la production primaire recensée) ont été mises sur le marché dans le monde depuis le milieu des années 90, dont la majorité avait comme origine les installations chlore soude. (UNEP, 2002)
[16] Production primaire européenne de mercure assurée par la société Minas de Almaden (Espagne).
Production primaire à partir de minerais d'autres métaux
Les procédés de récupération du mercure exposés ci dessous sont tirés de Vignes et al. (1997). Néanmoins, aucun chiffre français n'a été identifié au cours de cette étude.
Le mercure est parfois associé à divers minerais sulfurés, par exemple la blende (les concentrés de zinc contiennent de 5 à 350 ppm de Hg). De même, le mercure est souvent présent dans les gisements d'or et d'argent.
- Métallurgie de l'or et de l'argent : lors du traitement du minerai par cyanuration, le mercure se comporte comme l'or et l'argent et se retrouve, après électrolyse, avec ces éléments, sur la cathode. Avant fusion de la cathode et obtention du "doré", le mercure est éliminé et récupéré par distillation puis condensation dans des retortes maintenues sous vide. Par exemple, aux Etats Unis, 75 t de Hg.an-1 sont ainsi récupérées.
- Métallurgie du zinc : lors du grillage de la blende, le mercure se retrouve à l'état de vapeur avec le dioxyde de soufre. Afin d'éliminer le mercure, le procédé Norzink est le plus employé. Il consiste à fixer le mercure dans une solution de chlorure mercurique selon la réaction :
Une partie du chlorure mercureux est oxydé par le dichlore afin de régénérer, en solution, le chlorure mercurique, selon la réaction :
Après traitement, le gaz contient moins de 0,05 mg de Hg.m-3 . Le mercure peut être récupéré par électrolyse de la solution de chlorure mercurique. Le mercure ainsi récupéré représente 360 t.an-1 dans le monde.
Production secondaire et recyclage
Les exemples de recyclage du mercure exposés ci dessous sont tirés de Vignes et al., 1997.
- Déchets industriels et domestiques :
En France, la Société Duclos Environnement (13) recycle le mercure des déchets industriels et domestiques (thermomètres, amalgames dentaires, …). Les déchets sont traités dans un four sous vide (0,01 bar) entre 350 et 700°C. Dans ces conditions, le mercure distillé est récupéré par condensation. En 1992, cette société a ainsi récupéré 150 tonnes de mercure.
- Traitement des piles :
Euro Dieuze Industrie, à Dieuze (57), a démarré, en 1996, une usine de traitement de piles prévue pour traiter 3 500 t.an-1. Elle fonctionne par hydrométallurgie à l'acide sulfurique.
La société MBM (49) a une capacité de traitement de piles, par distillation, de 10 t.an-1 .
Sarp Industrie (Groupe Veolia) a un projet de traitement de 5 000 t.an-1 à Limay (78) et Tulle (19).
Les principales usines européennes de traitement de piles, exploitées par Batrec et Recymet, sont situées en Suisse. La société Batrec a un projet d'implantation au Havre (76) avec une capacité de 200 000 t.an-1 .
- Traitement des lampes fluorescentes :
En France, en 1997, le traitement est effectué par deux camions usines de la société Provalor qui avait comme prévision de traitement, en 1997, 1 million de tubes (chiffre à rapprocher des 50 millions d'unités vendues annuellement en France). Précisons que la directive 2002/96/CE impose à partir du 13 août 2005, la collecte et le recyclage de ces lampes (avec prise en charge des coûts de traitement par les producteurs).
Selon le site internet de l'Agence Poitou Charentes Energie Déchets Eau, SARP Industries et Philips ont également développé un procédé qui consiste à couper les extrémités des tubes par choc thermique et souffler la poudre fluorescente qu'ils contiennent. Les différentes parties collectées séparément sont ensuite orientées vers des unités de traitement qui assureront, entre autre, leur démercurisation.
Citons par exemple, la société Lumiver Optim (http://www.lumiver.fr/) qui assure, en France, la collecte et le recyclage des lampes fluorescentes avec une valorisation atteignant 98% du tube. Selon cette source, la valorisation conduit à la réutilisation du verre dans l'industrie du tube, les métaux ferreux et non ferreux dans l'affinage des métaux alors que les poudres de mercure sont distillées et retournées à l'industrie.
Utilisations
Introduction (varitétés d'utilisations)
FTE 2005 Importer
Le mercure est utilisé dans diverses activités industrielles (cf. Tableau 2.2). Le rapport publié par Floyd et al. (2002) propose une estimation des quantités de mercure annuellement dédiées à chacun de ces usages en Europe.
Les paragraphes ci-après apporteront plus de détails pour les activités représentant les plus fortes consommations de mercure : l'industrie du chlore et l'usage du mercure dans les amalgames dentaires.
Tableau 2.2. Utilisation de mercure en France en 1990-1992 (d'après EOCD, 1995).

[1] Batteries : la consommation annuelle française de piles et batteries est estimée à 600 millions de piles, soit ~22 000 t.
-
Piles salines : contenaient 0,6% de Hg qui formait un amalgame avec le zinc et permettait ainsi d'éviter l'oxydation du zinc par l'eau avec dégagement de dihydrogène. En France, chaque année, de 10 à 20 t de mercure contenu dans les piles usées étaient rejetées. Actuellement les piles salines ne contiennent plus de mercure, il est substitué par un produit fluoré polyéthoxylé placé dans le séparateur.
-
Piles alcalines : la teneur en Hg est de 0,025%.
-
Piles bouton : 10% de ces piles ont une cathode constituée d'un mélange HgO C (par exemple utilisées pour les appareils auditifs). Elles contiennent 30% de Hg. Les piles à oxyde d'argent et zinc air contiennent 0,5% de Hg. Tous types de piles bouton confondus, la France, consomme annuellement 40 t de piles bouton.
[2] Thermomètres : en 1998, la vente de thermomètres à mercure a été interdite. Néanmoins, il en existe un important stock en circulation. A titre d'exemple, un thermomètre médical représente ~ 2 g de mercure, en France, avant 1998 il s'en cassait 5 millions par an, soit une dispersion de 10 tonnes de mercure par an.
[3] Amalgames dentaires : ils contiennent environ 50% de Hg (0,6 g de Hg par amalgame) et sont obtenus par trituration (mélange) à froid d'une poudre (par exemple : Ag : 70%, Sn : 25%, Cu : 4%, Zn : 1%) avec le mercure. On estime, en France, que les dentistes seraient responsables des 3/4 de la pollution des particuliers. Il convient également de prendre en compte la pollution atmosphérique en mercure provenant des amalgames dentaires depuis les crématoriums.
[4] Pesticides : secteur d'activité où l'usage du mercure est prohibé.
[5] Lampes fluorescentes : un total de près de 50 millions de lampes et de tubes fluorescents est vendu annuellement en France (site internet de l'Agence Poitou Charentes Energie Déchets Eau). Elles contiennent, en moyenne, 15 mg de Hg. Plus en détail, selon Vignes et al. ; 1997), en 1996 , en France, on estimait la consommation de lampes fluorescentes à 40 millions d'unités, de lampes fluocompactes (3 à 10 mg de Hg par lampe) à 5 millions, de lampes luminescentes (30 mg de Hg par lampe) à 3,6 millions, soit, au total, 1 t de Hg.an-1 .
[6] Industrie du chlore : Un ordre d'idée peut être obtenu à partir de l'exemple des cellules à cathode de mercure pour la production de Cl2 – NaOH. 3 à 4 t de Hg sont nécessaires par cellule. Les rejets de Hg dans l'air sont traités ci après.
[7] Divers : Il existe de nombreuses utilisations industrielles minoritaires du mercure17 : fabrication de matières plastiques, chlorure de vinyl, en tant que catalyseurs, fabrication de médicaments (vaccins18 et antiseptiques19), fabrication automobile de commutateurs électriques, de phares et des systèmes ABS, industrie pyrotechnique20, peintures pour bateaux, pigments21 , extraction des métaux précieux, lentilles des phares (sémaphores), …
[17] Des estimations de teneurs en mercure de certains de ces usages du mercure sont synthétisées dans les rapports rédigés par Floyd et al. (2002) et Environnement Canada (site internet d'environnement Canada).
[18] L'Agence européenne d'évaluation des médicaments a recommandé le 04/07/2000 que les vaccins contenant des composés de mercure (thiomersal) ne soient plus utilisés chez les nourrissons et les jeunes enfants. D'après le site internet du Vidal et une communication personnelle de Mosqueron, en 2005, des vaccins contenant du thiomersal étaient encore disponibles sur le marché français.
[19] Une note (disponible sur internet sur le site Pharmacorama) fait état, sauf erreur ou omission, de la situation actuelle en France en matière de commercialisation d'antiseptiques mercuriels.
[20] Usage abandonné en France depuis une vingtaine d'années (R. Branka, communication personnelle).
[21] Floyd et al. (2002) estiment que l'usage commercial du mercure dans les pigments (vermilon) a pratiquement disparu.
Industrie du chlore
FTE 2005 Importer
Utilisation du mercure par l'industrie du chlore
Cette industrie produit du chlore (Cl2) par électrolyse d'une solution de sel. En 2002, la production française atteignait 1,7 Mt (SHD, 2004). Les principales techniques utilisées pour produire du chlore sont l'électrolyse dans des cellules à cathode de mercure (figure 2.2) pour 51% de la production Française en 2002, l'électrolyse à diaphragme pour 33% ou à membrane pour 14% (SHD, 2004 ; Commission Européenne, 2001b).

Figure 2.2. Electrolyseur à cathode de mercure (d'après le site internet de l'IUPAC ; schéma modifié).
Le tableau 2.3 présente, selon Euro Chlor (2005), les sites industriels français ayant recours (au moins en partie) à la technologie « mercure » pour fabriquer du chlore.
Tableau 2.3. Sites industriels français ayant recours (au moins en partie) à la technologie « mercure » pour fabriquer du chlore (d'après Euro Chlor, 2008).
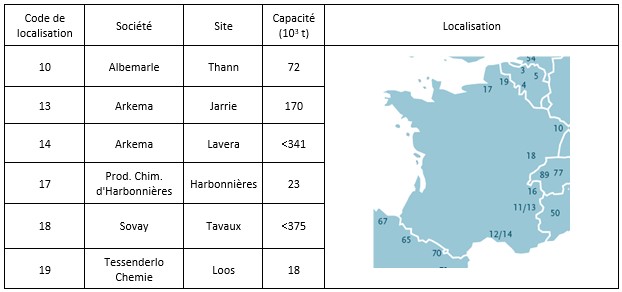
Amalgames dentaires
FTE 2005 Importer
Utilisation du mercure par les chirurgiens dentistes
Concernant le mercure des amalgames dentaires, la Commission européenne (2005a) écrit : « Dans la mesure où l'industrie du chlore et de la soude abandonne progressivement l'usage du mercure, les amalgames dentaires sont appelés à devenir la principale utilisation du mercure dans l'Union européenne. Il convient, dès lors, de réexaminer la question des substituts possibles. La question est d'autant plus importante que les États membres peuvent encourager les
substituts, mais que les dispositions relatives aux amalgames dentaires dans la directive concernant les dispositifs médicaux limitent la possibilité d'adopter des mesures restrictives à l'échelon national. »
En France, jusqu'à très récemment, la réglementation sur l'usage du mercure ne portait pas sur l'amalgame dentaire. L'arrêté du 30 mars 1998 ne réglemente pas l'usage de l'amalgame, mais seulement les déchets d'amalgame en imposant aux cabinets dentaires de se doter d'un séparateur destiné à collecter de tels déchets. La première réglementation spécifique a été adoptée par décision de l'Afssaps du 14 décembre 2000 (2001) qui impose l'utilisation des amalgames conditionnés en capsules prédosées.
Selon le site internet de l'AFSSAPS les amalgames dentaires sont disponibles et employés dans tous les pays du monde. Leur utilisation ne fait l'objet d'aucune interdiction formelle. Cependant, l'Allemagne, le Danemark, la Norvège et la Suède ont pris des dispositions qui limitent leur utilisation. Ces encouragements à la réduction de l'utilisation des amalgames en Norvège et leur déremboursement en Suède sont surtout motivés par la protection de l'environnement.
Appareils scientifiques
FTE 2005 Importer
La place des équipements de mesure et de contrôle contenant du mercure et/ou des composés mercuriels est difficilement quantifiable. Néanmoins, Floyd et al. (2002) estiment que la durée moyenne de vie de tels instruments est de 10 ans. Cette donnée est à prendre en compte pour évaluer les futurs flux de mercure dans l'environnement suite à l'élimination de ces déchets23 .
Rejets dans l’environnement
Sources naturelles
FTE 2005 Importer
Selon l'INERIS (2005), l'importante volatilité du mercure fait que sa principale source naturelle dans l'environnement atmosphérique reste le dégazage de l'écorce terrestre, qui en rejette annuellement plusieurs milliers de tonnes. Les émissions de mercure par volatilisation à partir des sols sont très difficilement estimables et les estimations expérimentales sont souvent complexes à mettre en œuvre et d'un coût prohibitif (Böhme et al., 2005). C'est pourquoi peu de données sont disponibles. Néanmoins, de nouvelles méthodes de mesure in-situ sont en cours de développement (Böhme et al., 2005) et devraient apparaître sur le marché prochainement.
L'activité volcanique constitue aussi une source naturelle de mercure importante. A ces deux sources naturelles importantes il convient d'ajouter les feux de forets, les réactions chimiques naturelles (photoréduction, formation biologique) ainsi que les sources hydrothermales (OECD, 1995).
De nos jours, à l'échelle mondiale, les rejets naturels sont inférieurs aux rejets anthropiques : Lindquist (1991) évalue au début des années 90 les émissions naturelles moyennes à 3 000 t.an-1 et les émissions anthropogéniques à 4 500 t.an-1 .
Sources non-intentionelles
FTE 2005 Importer
Grande Installation de Combustion (GIC)
Lors d'une évaluation de l'impact sur la santé des rejets atmosphériques des tranches à charbon d'une grande installation de combustion (Bonnard, 2003) une modélisation du transfert du mercure dans les différents compartiments environnementaux a été réalisée. D'après ce document, seule une partie du mercure émis dans l'atmosphère se dépose à courte distance des installations (fraction estimée à 48% de la quantité émise). Une fois déposée, une faible proportion de mercure passe sous forme organique dans le sol (estimation : 2%) et dans les compartiments végétaux et animaux (estimation : 22%).
[23] Des estimations de teneurs en mercure de ces différents appareils sont synthétisées dans le rapport rédigé par Floyd et al. en 2002.
Industrie du ciment
Les composés volatils présents dans le charbon et/ou les déchets utilisés pour chauffer le four des cimenteries peuvent se vaporiser (absence de décomposition ou d'intégration chimique au clinker[24]). L'incinération de déchets contenant des métaux volatils tels que le mercure peut donc entraîner une augmentation des émissions de ces substances (Commission Européenne, 2001a).
Les poussières résultant de la fabrication du ciment contiennent de faibles quantités de composés métalliques comme l'arsenic (As), le cadmium (Cd), le mercure (Hg), le plomb (Pb), le thallium (Tl) et le zinc (Zn). La principale source de poussières chargées en métaux est le four, y compris les préchauffeurs, les précalcinateurs, les fours rotatifs et les refroidisseurs à clinker. Leur concentration en métaux dépend de la matière à cuire et des éléments recyclés dans le four (Commission Européenne, 2001a). Comme les métaux qui entrent dans le four n'ont pas tous le même degré de volatilité et du fait des températures élevées, les gaz chauds du four contiennent aussi des composés métalliques en phase gazeuse. L'étude du bilan matière montre que le clinker contient peu d'éléments fortement volatils, ce qui veut dire que ces substances s'accumulent dans le four (Karlsruhe II, 1996).
Production de chaux
Vis à vis de la production de chaux peu de données sont disponibles sur les émissions métalliques. La grande pureté de la plupart des calcaires utilisés pour la production de chaux calcique et dolomitique se traduit normalement par de faibles émissions de métaux. Des mesures effectuées sur différents types de fours à chaux démontrent des niveaux de cadmium, de mercure et de thallium nettement inférieurs à 0,1 mg.Nm-3 (Commission Européenne, 2001a).
Production de métaux non ferreux
De nombreux minerais contiennent des traces de mercure, ainsi, lors de leur traitement (généralement par « grillage ») des vapeurs de mercure sont générées. Même si ces traces de mercure sont présentes en quantités très faibles dans les minerais, les quantités de mercure générées peuvent être significatives du fait des quantités importantes de minerais traités (Floyd et al., 2002).
Du fait de la grande variabilité des teneurs en mercure au sein des minerais ainsi que des différents procédés de traitement des vapeurs mis en œuvre, cette production accidentelle de mercure est difficilement chiffrable. Néanmoins, les rejets environnementaux de mercure issus de la production française de métaux non ferreux (zinc et plomb notamment) ont été estimés pour l'année 1993 à 18 tonnes (Thornthon, 2001).
Selon le CITEPA (2007) les émissions de mercure liée à la production de métaux non-ferreux en France sont nulles depuis 2003, suite à la fermeture du site de METALEUROP à Noyelles Godault.
[24] Constituant du ciment, qui est commun à tous les ciments courants, et qui prend la forme de granules dures résultant de la cuisson d'un mélange composé d'environ 80% de calcaire et de 20% d'argile.
Rejets liés à l’utilisation de produits
Depuis le bannissement des pesticides contenant des composés mercuriels et des thermomètres médicaux à mercure, les principaux produits contenant du mercure sont les batteries, les amalgames dentaires, les lampes fluorescentes, et plus anecdotiquement les instruments scientifiques (type baromètre de Torricelli) ainsi que des appareillages électriques.
Au sein de ces produits une ségrégation en trois catégories peut être faite en fonction de la possibilité de rejet de mercure en usage normal :
- Rejets peu probables si le produit est utilisé, recyclé selon la législation en vigueur (batteries, catalyseurs chimiques, appareillages électriques ; amalgames dentaires) ;
- Rejets possibles en cas de bris de matériel mais peu probable en cas d'usage normal et si le produit est recyclé selon les textes en vigueur (lampes fluorescentes et instruments scientifiques) ;
- Rejets attestés[37] (produits médicaux et cosmétiques, peintures, pigments et extractions de métaux précieux).
Selon un rapport de l'union européenne (Research EU, 2007), le traitement par incinération des déchets électriques et électroniques, en particulier les produits gris issus de la bureautique et de l'informatique (écrans, unités centrales, imprimantes, etc.) diffuse dans l'atmosphère près de 36 tonnes de mercure. Cet article signale également que ce type de déchets est insuffisamment collecté ou recyclé.
[37] En France métropolitaine, la plupart de ces utilisations du mercure sont très minoritaires. Ces utilisations sont également fortement encadrées par la législation.
Cas du méthylmercure
À l'heure actuelle, on ne connaît pas d'importantes sources anthropiques directes de méthylmercure. Cependant, les rejets anthropiques contribuent indirectement à la présence de méthylmercure dans l'environnement via la transformation d'autres formes de mercure en méthylmercure. Selon l'UNEP (2005), le méthylmercure peut être formé dans l'environnement par métabolisation microbienne (processus biotiques) ou par des processus chimiques où n'intervient aucun organisme vivant (processus abiotiques). Toutefois, on pense généralement que le méthylmercure est essentiellement formé dans la nature par des processus biotiques[25].
Néanmoins, des recherches récentes ont montré que du méthylmercure peut être libéré directement par les décharges municipales (Lindberg et al., 2001) et par les stations d'épuration (Sommar et al., 1999), mais l'importance globale de ces sources demeure encore incertaine.
[25] La formation de méthylmercure en milieu aquatique varie en fonction d'un grand nombre de facteurs environnementaux : activité microbienne, concentration de mercure biodisponible, •, facteurs dépendant eux-mêmes de paramètres tels que la température, le pH, le potentiel redox et la présence d'agents complexants inorganiques et organiques (Ullrich et al., 2001).
Émissions anthropiques totales
Le site internet de la Commission Mixte Internationale USA/Canada reprend des informations de l’EPA qui estime approximativement que 20% des émissions de mercure proviennent de sources naturelles, 40% proviennent des retombées à l’échelle mondiale des émissions produites par les activités anthropiques passées et 40% proviennent des activités anthropiques actuelles. Le schéma (Figure 3.1) suivant, issu d’un rapport UNEP (2005), illustre les principales interactions entre les compartiments de l’environnement.
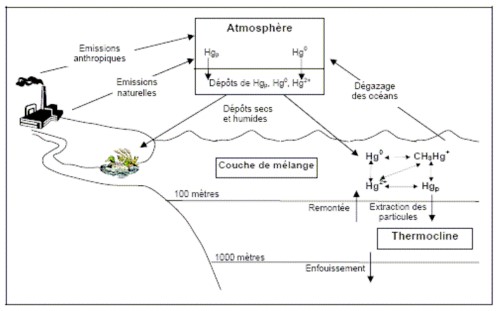
En moyenne, au niveau mondial, les émissions de mercure d’origine anthropique ont entraîné des taux de déposition qui sont aujourd’hui 1,5 à 3 fois supérieurs à ceux de l’ère préindustrielle (PNUE, 2002). Dans et autour des zones industrielles, les taux de déposition ont crû de 2 à 10 fois au cours des deux derniers siècles (PNUE, 2002). Quoi qu’il en soit, la problématique « rejet de mercure et présence dans l’environnement » a été intensément étudiée. Dans ce paragraphe, nous ne nous appuierons que sur les références les plus récentes et les plus proches géographiquement de notre zone d’étude.
Selon SHD (2004), le principal secteur d'émission de mercure est lié à l'industrie manufacturière (tableau 3.3). Ce constat est d'ailleurs confirmé par Algros et al. (2005) qui indiquent que le mercure et ses composés sont retrouvés dans les effluents urbains avec une fréquence comprise entre >0% à 30% et dans la gamme >30% à 60% pour les effluents industriels.
Tableau 3.3. Principaux secteurs d'émission de mercure en France en 2002 (selon SHD, 2004 modifié) ; émissions dirigées vers l'eau, l'air et les produits.
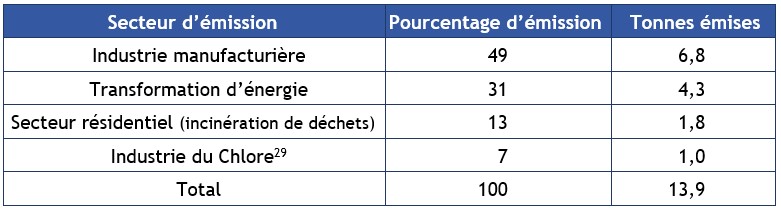
[29] cf. paragraphe dédié aux émissions de l'industrie du chlore ci-dessous
Au niveau américain (site internet de l'EPA) on identifie les mêmes sources d'émission : installations d'incinération des déchets urbains, installations d'incinération des déchets médicaux, installations d'incinération des déchets dangereux spéciaux et les chaudières industrielles. En outre, certains procédés industriels, et plus particulièrement les installations de chlore et les cimenteries, sont également cités bien que leurs émissions soient considérablement inférieures à celles des installations d'incinération (Commission Européenne, 2001b).
D'autres sources d'émission de mercure de moindre importance peuvent être listées : industries du fer et de l'acier ; extraction et raffinage de l'or ; fabrication de thermomètres et autres instruments de précision ; amalgames dentaires ; traitement des déchets, …
Le tableau 3.4 (issu de SOCOPSE, 2008) est une estimation des contributions relatives des différentes sources de mercure aux émissions globales, pour les compartiments Air, Eau, et Sols.
Tableau 3.4. Estimation des contributions relatives des différentes sources de mercure aux émissions globales, pour les compartiments Air, Eau, et Sols (issus de SOCOPSE, 2008).
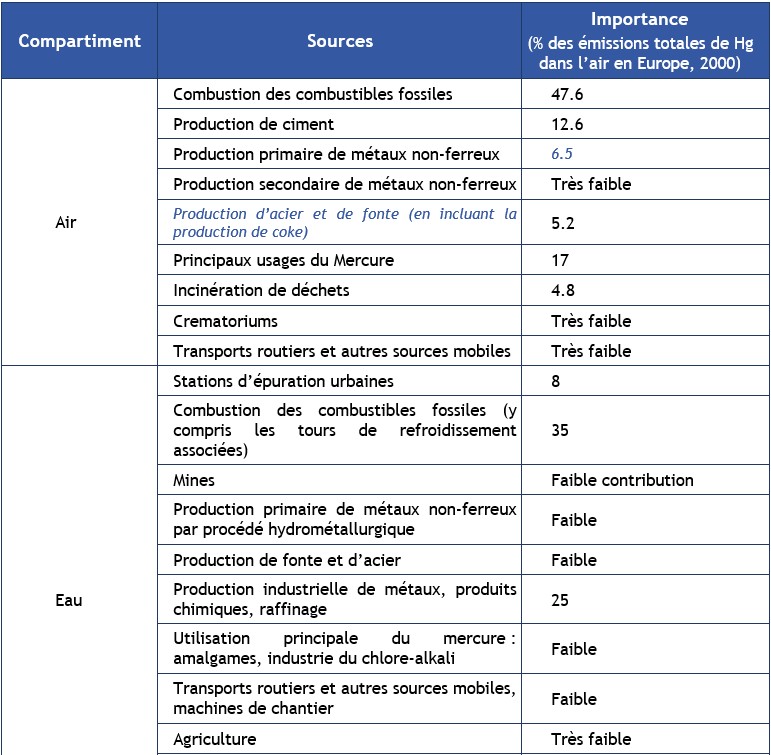
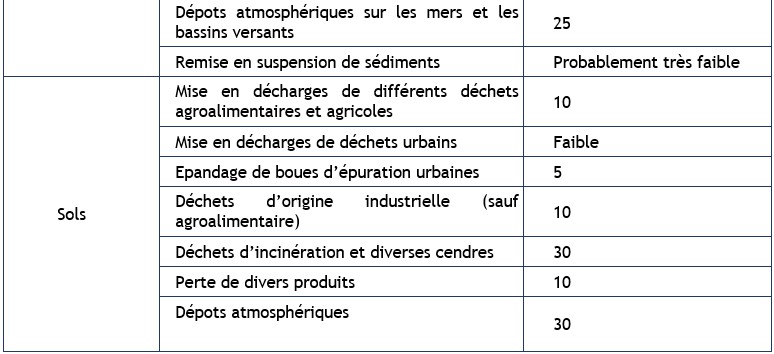
EMISSIONS DE MERCURE PAR LES INDUSTRIELS DU CHLORE
La pollution par le mercure de l'industrie du chlore est spécifique de la technique de l'électrolyseur à mercure (Commission Européenne, 2001b). Le mercure utilisé à la cathode n’est pas une matière consommable et n’a qu’une fonction de support (SHD, 2004). Néanmoins, compte tenu des caractéristiques du procédé, ce mercure peut être émis par le procédé via l'air, l'eau, les déchets et dans les produits. En 2002, les émissions totales de mercure dans l'air, l'eau et les produits provenant des installations de chlore en Europe de l'Ouest ont été estimées à 13,9 tonnes, selon un taux d’émission de 1,05 g de mercure par tonne de chlore produite (SHD, 2004). Ces émissions sont majoritairement dirigées vers le compartiment air. De nos jours, le site internet d’Euro Chlor estime l’émission de mercure par les industriels du chlore inférieure à 1% de l’émission totale anthropogénique. De 1977 à 2003, en Europe de l’Ouest, les émissions de mercure rapportées à la tonne de chlore produite ont été divisées par 25 (figure 8.1). Plus récemment de 1995 à 2003, en Europe de l’Ouest, les émissions de mercure rapportées à la tonne de chlore produite ont été divisées par 2,5 (SHD, 2004). L’industrie du chlore a annoncé un objectif d’émission de mercure inférieur à 1 g par tonne de capacité de chlore à l’horizon 2007 (SHD, 2004) pour l’ensemble des producteurs d’Europe de l’Ouest (y compris la Hongrie, les Républiques Tchèque et Slovaque ainsi que la Pologne). En France, cet objectif a été atteint en 2004 (Euro Chlor, 2005).
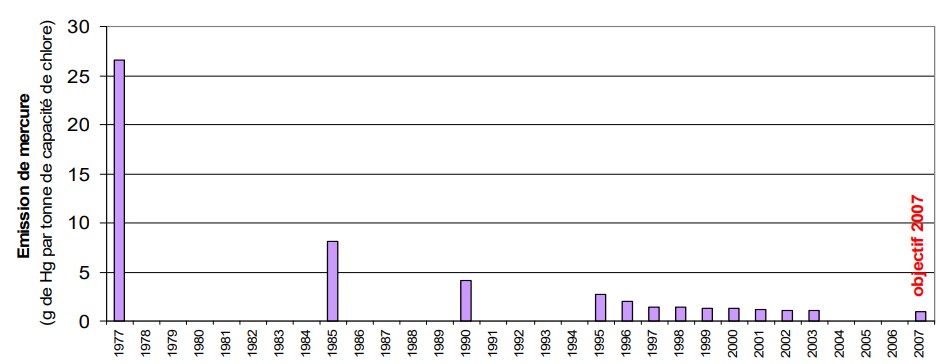
Figure 8.1. Emissions européennes de mercure pour l’industrie du chlore ; exprimées en gramme de mercure émis par tonne de capacité de chlore (données issues de Euro Chlor, 1998 ; SHD, 2004 ; BelgoChlore, 2004).
Plus en détails, sur les vingt dernières années, Euro Chlor (2005) rapporte les émissions de mercure (figure 8.2) ayant pour origine les industries de synthèse du chlore et en fonction de trois types de rejets : les émissions atmosphériques, aquatiques ainsi que les émissions vers les produits.
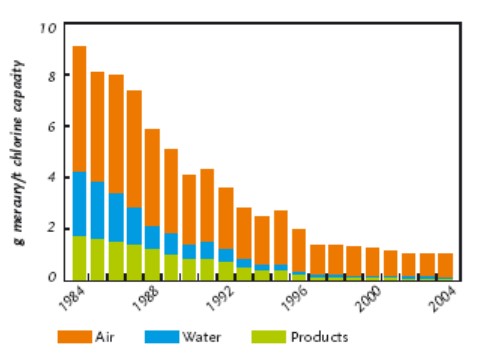
Figure 8.2. Emissions européennes de mercure pour l’industrie du chlore vers l’air, l’eau et les produits ; exprimées en gramme de mercure émis par tonne de capacité de chlore (graphique extrait de Euro Chlor, 2005).
La figure 8.3 représente un focus sur les émissions européennes de mercure pour l’industrie du chlore sur la période 1995-2006.
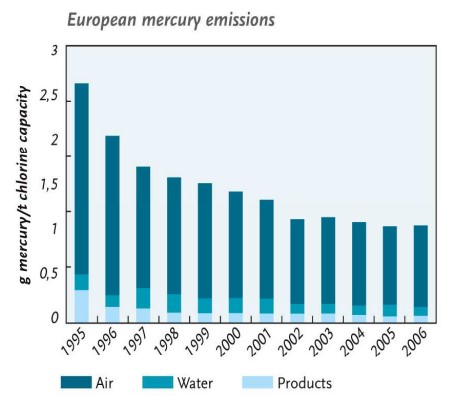
Figure 8.3. Emissions de mercure de l’industrie du Chlore vers l’air, l’eau et les produits (Euro Chlor, 2008)
La figure 3.4 montre que depuis 2002, les émissions de mercure sont proches de 1 g.t-1 de chlore produit (objectifs des industriels pour 2007). Selon la Commission européenne (2001b), les installations à cellules à mercure les plus performantes atteignent des pertes totales de mercure dans l'air, dans l'eau et avec les produits, de l'ordre de 0,2 à 0,5 g de mercure par tonne de capacité de chlore, en moyenne annuelle (Tableau 8.1).
Tableau 8.1. Rejets de mercure dans les installations de fabrication de chlore par cellule à mercure (d’après la Commission européenne, 2001b).
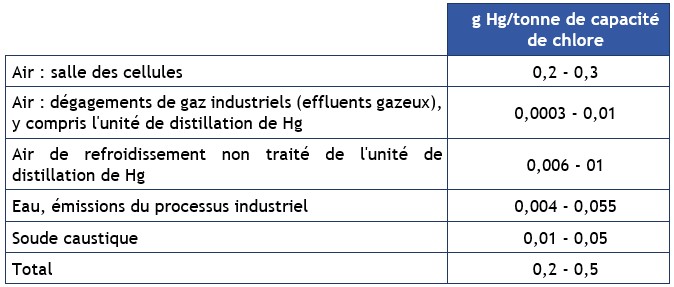
Actuellement, les cellules à mercure utilisées pour la production de chlore dans l'Union européenne contiennent quelques 12 000 tonnes de mercure (BelgoChlore, 2004 ; Commission Européenne, 2001b). Lors de la conversion ou de la mise à l'arrêt de ces installations, le mercure peut, potentiellement, être rejeté dans l'environnement. Actuellement, il n'existe aucune politique ou législation à l'échelle de l'Union européenne sur la façon de traiter cette énorme quantité de mercure pur (Commission Européenne, 2001b). Néanmoins, les producteurs de chlore ont conclu un accord avec le seul producteur européen de mercure, Minas de Almaden en Espagne, en vue de lui retourner cette quantité de mercure. Minas de Almaden adaptera sa capacité de production afin de prévenir toute distorsion du marché22 (BelgoChlore, 2004).
Le document européen de référence sur les Meilleures Techniques Disponibles pour la production de chlore (IPPC, 2001b) indique que l'électrolyse à mercure n'est pas une MTD, ce qui explique l'annonce de son abandon par l'industrie.
Ainsi, aucune nouvelle installation utilisant le procédé d'électrolyse à mercure ne sera plus construite : des technologies alternatives seront appliquées pour chaque nouvelle unité d'électrolyse à construire (BelgoChlore, 2004).
Les installations européennes de fabrication de chlore par électrolyse à mercure existantes seront démantelées à l'expiration de leur durée de vie (BelgoChlore, 2004). Ainsi, on considère que la technologie « mercure » sera totalement abandonnée en 2020 (BelgoChlore, 2004 ; SHD, 2004 ; communication personnelle de Moulet).
A titre d'exemple, la figure 2.3 illustre l'évolution des procédés de fabrication de chlore depuis 1997.
[22] A ce jour, plus de 1.000 tonnes de mercure ont déjà été expédiées vers l'Espagne.

Figure 2.3. Evolution des procédés de fabrication du chlore en Europe de l'ouest (graphique extrait de Euro Chlor, 2005).
Émissions atmosphériques
FTE 2005 Importer
Rejets dans l'air en France
Le mercure élémentaire et ses composés organiques sont volatils. Les composés inorganiques le sont très peu (INERIS, 2005). En 2002, le CITEPA (2005) estime que les émissions de mercure vers l'air représentent 70% des émissions totales de ce métal. Plus en détail, la figure 3.9 illustre les évolutions des émissions et de leurs répartitions par secteur au cours des 15 dernières années. Notons qu'un récent rapport du CITEPA (2008) indique que les émissions atmosphériques de mercure en 2006 ont été de 7,9 t.

Figure 3.9. Emissions de mercure vers l'air en France métropolitaine (d'après CITEPA, 2007).
Le rapport CITEPA (2007) sur les émissions atmosphériques de métaux lourds commente les données précédemment illustrées :
« En 2005, les émissions de mercure représentent 8,6 tonnes. Deux secteurs contribuent principalement aux émissions : la transformation d'énergie et l'industrie manufacturière avec respectivement 56% et 42% des émissions en France métropolitaine pour l'année 2005.
Les autres secteurs ont une contribution nulle ou très faible.
Dans le secteur de l'industrie manufacturière, les principaux sous secteurs émetteurs sont en 2005 :
- le secteur de la chimie (39% des émissions), en particulier la production de chlore (environ 22% des émissions du secteur de l'industrie manufacturière).
- le secteur du traitement des déchets (incinération) avec 25% des émissions,
Ces émissions sont en baisse depuis 1990, date à laquelle les émissions de ce polluant étaient de 27 t, soit une diminution de 68% entre ces deux années. Cette baisse s'explique en grande partie par l'amélioration des performances de l'incinération des déchets mais aussi du fait :
- de la limitation ou de l'interdiction de l'emploi de ce métal dans les piles et les thermomètres médicaux,
- du tri sélectif des déchets ;
- de meilleures optimisations des procédés de la production de chlore. »
Rejets de l'industrie dans l'air en Europe
Au niveau européen, le site internet EPER (Figure 3.10) synthétise les émissions de mercure et de ses composés (en tonne et en pourcentage) vers l'air (année 2004) pour plus de 600 installations industrielles.

Figure 3.10. Emissions 2004 de mercure vers l'air en Europe (d'après le site internet EPER).
Ainsi, au niveau européen des émissions industrielles à l'atmosphère de plus de 32 t de mercure et de ses composés ont été mises en évidence. Près de 13% de ces émissions étaient réalisés par 82 sites industriels français (soit 4,16 t)[30] .
Bien que les secteurs d'activités ne soient pas directement comparables entre les données françaises et européennes, on note que ce sont les deux même secteurs qui contribuent majoritairement aux émissions : le secteur de la transformation d'énergie et de l'industrie manufacturière.
[30] D'après les informations que nous avons regroupées, les 111 sites industriels français considérés par EPER équivalent à près de 50% des industries françaises émettrices de mercure (par rapport aux données CITEPA pour 2004).
Rejets de l'industrie dans l'air en France
Au niveau français, les rejets de mercure dans les différents milieux, et en particulier l'air, pour les industries soumises à déclaration sont collectés sur le site de l'IREP.
La carte 3.11 extraite de ce site (http://www.irep.ecologie.gouv.fr/IREP/index.php) permet de localiser les différents sites émetteurs de mercure dans l'air en France.

Figure 3.11. Carte des industries soumises à déclaration émettant du mercure dans l'air (site internet IREP).
Une information plus importante sur les entreprises concernées est disponible sur le site de l'IREP et permettrait d'approfondir les connaissances sur l'activité et les rejets de ces entreprises.
Dans le tableau 3.5 ci dessous figurent les émissions de mercure dans l'air pour les industries soumises à déclaration. L'obligation de déclaration par les exploitants des installations industrielles et des élevages est fixée (polluants concernés et seuils de déclaration) par l'arrêté du 24 décembre 2002 relatif à la déclaration annuelle des émissions polluantes des installations classées soumises à autorisation (JO du 07 mars 2003).
Tableau 3.5. Emissions atmosphériques de mercure des installations soumises à déclaration de 2003 à 2006 (données BDREP).
La comparaison de ces chiffres d'émissions des installations classées à ceux du CITEPA (estimation de 8.6 t.an-1) concernant la totalité des émissions atmosphériques françaises montre que, pour l'année 2006, plus de 50% de la totalité des rejets atmosphériques de mercure sont originaires des installations classées.
Sur la période 2004 2006, les émissions de mercure dans l'atmosphère des installations soumises à déclaration sont demeurées stables et voisines de 4600 kg.an-1. Selon les données du registre des émissions polluantes, cinq grands secteurs émetteurs se dégagent et représentent plus de 99% des émissions totales :
- Les déchets et leur traitement (environ 32%)
- La chimie, parachimie, pétrole (25%)
- La sidérurgie, métallurgie, coke (20%)
- Les industries minérales (10%)
- L'énergie (5%)
Le graphique ci après (figure 3.12) montre l'évolution des émissions atmosphériques de mercure pour ces cinq secteurs.

Figure 3.12. Evolution des émissions atmosphériques de mercure pour les cinq principaux secteurs pour la période 2004-2006.
Les émissions de certains secteurs sont particulièrement variables, principalement le secteur de l'énergie (environ 4% en 2004 et 2006 et 15% en 2005) et celui de la sidérurgie, métallurgie, coke (environ 20% en 2004 et 2006 et 15% en 2005).
Ces chiffres ne correspondent pas avec les valeurs du CITEPA sur la ventilation des émissions de mercure dans les différentes catégories. La définition des différents secteurs est à l'origine de ces différences.
Une description plus fine des secteurs émettant du mercure dans l'air est présentée dans le tableau 3.6.
Tableau 3.6. Répartition par sous secteurs d'activité des émissions atmosphériques de mercure pour les industries soumises à déclaration (données BDREP).
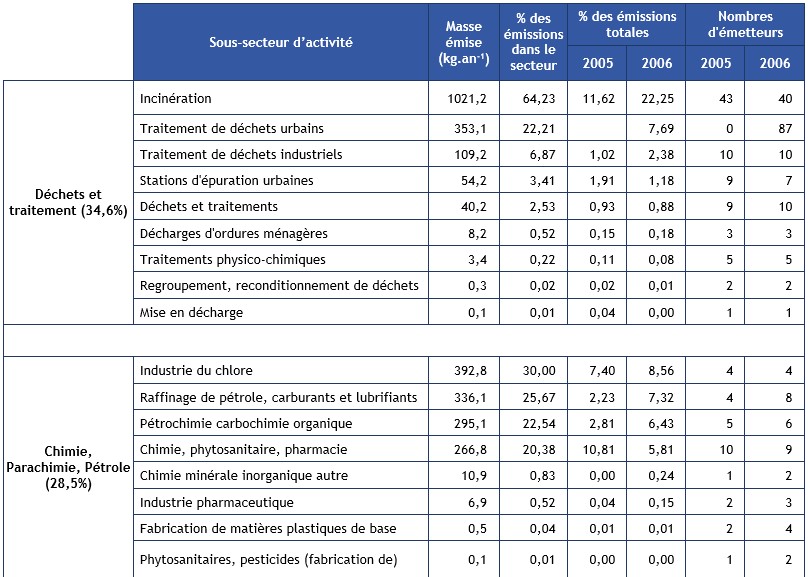
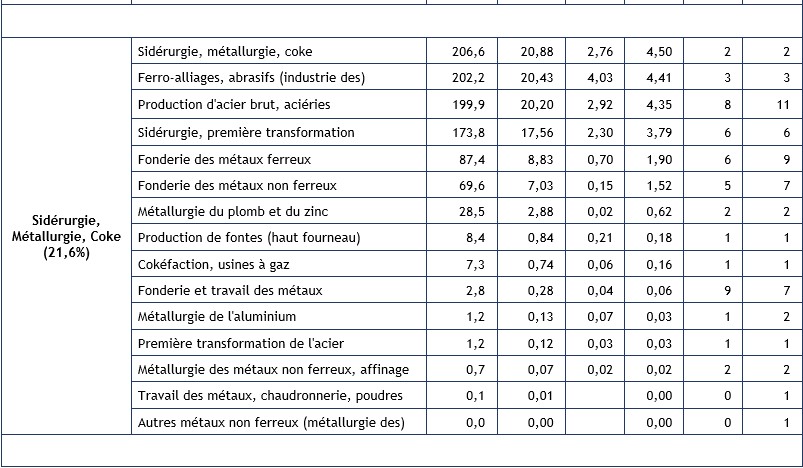
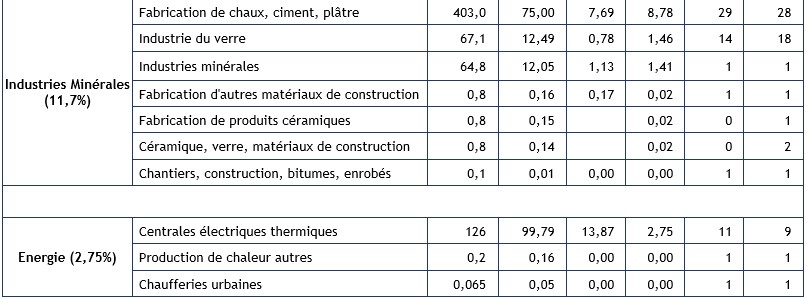
Au travers de ces résultats ; il apparaît que 11 sous secteurs regroupent près de 84% des émissions totales de mercure en 2006.
Plus de 30% des rejets atmosphériques de mercure en 2006 ont été produits par les 40 incinérateurs et les 87 centres de traitement des déchets urbains. Comme le montre Research EU (2007), une collecte spécifique ou un recyclage de certains déchets (par exemple les déchets d'équipements électriques et électroniques) permettrait de réduire les émissions atmosphériques.
Pris de façon conjointe, les secteurs de l'industrie du chlore, du raffinage de pétrole – carburants lubrifiants, de la pétrochimie – carbochimie – organique et de la chimie – phytosanitaire – pharmacie ont produit plus de 28% des émissions.
Le secteur de la sidérurgie – métallurgie – coke a représenté près de 22% des rejets de mercure dans l'air en 2006 avec en particulier les industries des ferro-alliages – abrasifs et les aciéries.
Evolution des rejets dans l’atmosphère d’origine naturelle et humaine
En Amérique du Nord (Wyoming), les dépôts atmosphériques de mercure des 270 dernières années peuvent être estimés à partir de l'analyse d'une carotte de glace prélevée sur un glacier. Ces analyses (figure 3.15) donnent un ordre d'idée des quantités de mercure rejetées dans l'atmosphère d'origine naturelle et humaine et ce, à partir des sources régionales et globales (Schuster et al., 2002).

Figure 3.15. Dépôts atmosphériques de mercure sur les 270 dernières années (d'après Schuster et al., 2002).
En plus des variations exceptionnelles liées à des événements naturels (éruptions volcaniques), cette figure illustre la tendance historique du recours au mercure :
- tendance générale à l'augmentation depuis 1900 (liée aux utilisations humaines de ce métal) ;
- décroissance significative des rejets anthropiques de mercure depuis 25 ans.
Sur certains sites en Europe, on rencontre un grave problème environnemental lié à la pollution historique du sol et des cours d'eau par le mercure (Commission européenne ; 2001b). Cette pollution est en partie due aux retombées de mercure et au rejet traditionnel des boues de graphite, corollaire de l'emploi des anodes en graphite pour la fabrication de chlore, et d'autres déchets sur le site même de l'installation ou à proximité.
Coût de l'impact sur la santé humaine des émissions atmosphériques
Une première estimation des coûts globaux de l'impact sur la santé des émissions atmosphériques de mercure a été effectuée par Rabl et Spadaro (non publié) : 4 900$ (~4 100€) par kg de mercure émis[48]. Néanmoins, précisons que l'écart type géométrique sur cette estimation est de 6,5.
[48] Les modalités de calcul de cette estimation sont abordées dans Rabl (2005).
Émissions vers les eaux
FTE 2005 Importer
Flux vers les eaux superficielles
Les chiffres présentés par le tableau 3.2 sont repris d'un rapport de l'Agence de l'eau Seine Normandie (2004). Ils indiquent l'origine et l'importance des différents flux de mercure vers les eaux superficielles du bassin Seine Normandie (le flux total moyen de mercure sur ce bassin est estimé à 730 kg.an-1).
Tableau 3.2. Origine des flux de métaux vers les eaux superficielles du bassin Seine-Normandie (pourcentages calculés ; d'après AESN, 2004).

La Commission Internationale pour la Protection du Rhin (2000) présente un inventaire des émissions vers l'eau de substances dangereuse. Dans le cas du mercure, les émissions d'origine diffuse sont plus importantes que les émissions d'origine ponctuelle (cf. figure 3.8).
[28] Pour le mercure, environ la moitié de toutes les émissions d'origine diffuse proviennent des eaux d'épisodes pluviaux (Commission Internationale pour la Protection du Rhin, 2000).


Figure 3.8. Présentation synoptique des émissions de mercure d'origine ponctuelle et diffuse dans les eaux de surface du bassin du Rhin (d'après la Commission Internationale pour la Protection du Rhin ; 2000).
Rejets industriels dans l'eau en Europe
Au niveau européen, le site internet EPER présente les émissions directes (figure 3.13a) et indirectes[31] (figure 3.13b) de mercure et de ses composés (en tonne et en pourcentage) vers l'eau (année 2004) pour plus de 600 installations industrielles.

Figure 3.13. Emissions 2004 de mercure vers l'eau en Europe (d'après le site internet EPER) ; a : émissions directes ; b :émissions indirectes.
Ainsi, au niveau européen des émissions industrielles vers l'eau de près de 5,25 t de mercure et de ses composés ont été mises en évidence (avec 4,72 t émises de façon directe et 0,53 de façon indirecte). Près de 4,5% et 30% des émissions vers l'eau étaient dues à 111 sites industriels français (soit respectivement 0,21 t[32] de façon directe et 0,16 t[15] de façon indirecte).
On note que ce sont les deux même secteurs qui contribuent majoritairement aux émissions, vers l'air, comme vers l'eau : la transformation d'énergie et l'industrie manufacturière.
[31] Après station d'épuration.
[32] D'après les informations que nous avons regroupées, les 111 sites industriels français considérés par EPER équivalent à plus de 30% des industries françaises émettrices de mercure.
Rejets industriels en France
Le mercure et ses composés ont de multiples applications dans l'industrie (cf. Utilisations). La figure 3.14 extraite du site internet IREP permet de localiser les différents sites émetteurs de mercure dans l'eau en France métropolitaine.

Figure 3.14.Carte des installations soumises à déclaration émettant du mercure dans l'air (site internet IREP).
Sur cette carte se dégagent quatre régions dans lesquelles ont retrouvent un nombre important d'industries émettrices de mercure dans l'eau (Ile–de France, Nord–Pas de Calais, Alsace et Rhône-Alpes). Les sites industriels du pourtour de l'étang de Berre sont également des émetteurs de mercure dans l'eau.
Dans le tableau 3.7. figurent les émissions de mercure dans l'eau pour les industries soumises à déclaration.
Tableau 3.7. Emissions de mercure dans l'eau des installations soumises à déclaration de 2003 à 2006 (données BDREP)[33] .
Sur la période 2004 2006, les émissions totales de mercure dans l'eau sont restées relativement stables.
Les secteurs qui rejettent le plus sont la chimie – parachimie – pétrole, les industries extractives, le secteur de l'agroalimentaire et des boissons, la sidérurgie – métallurgie – coke, les déchets et traitement ainsi que le secteur textile. Des émissions de mercure moins importantes sont également le fait de l'industrie du bois – papier – carton, des industries minérales (céramique), du traitement de surface et du secteur de l'énergie.
Le graphique ci après (figure 3.14) montre l'évolution des émissions de mercure vers les eaux pour les six plus importants secteurs.
[33] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.

Figure 3.14. Evolution des émissions de mercure dans les eaux par les six principaux secteurs émetteurs (données BDREP).
Sur ce graphique sont représentées les variations des émissions de mercure dans l'eau par les six plus importants secteurs industriels concernés pour la période 2004 2006. Pour la période 2004 2006, les rejets de mercure par le secteur de la chimie – parachimie pétrole ont diminué de 33% avec un pic en 2005, ceux du secteur des déchets ont été divisés par 3. Par contre, les émissions de mercure dans l'industrie agro alimentaire et des boissons ont augmenté de 25% (passant de 62 à 80 kg.an-1)[34]. De même, les rejets de mercure dans le secteur de la sidérurgie – métallurgie – coke ont été multipliés par 2 sur cette période.
[34] A ce jour, nous n'avons pas d'explication pour la présence de mercure dans ce secteur industriel.
Le tableau 3.8. présente la ventilation des rejets dans les différents sous secteurs d'activité.
Tableau 3.8. Répartition des rejets de mercure dans les eaux par sous secteurs d'activité pour les industries soumises à déclaration (données BDREP).
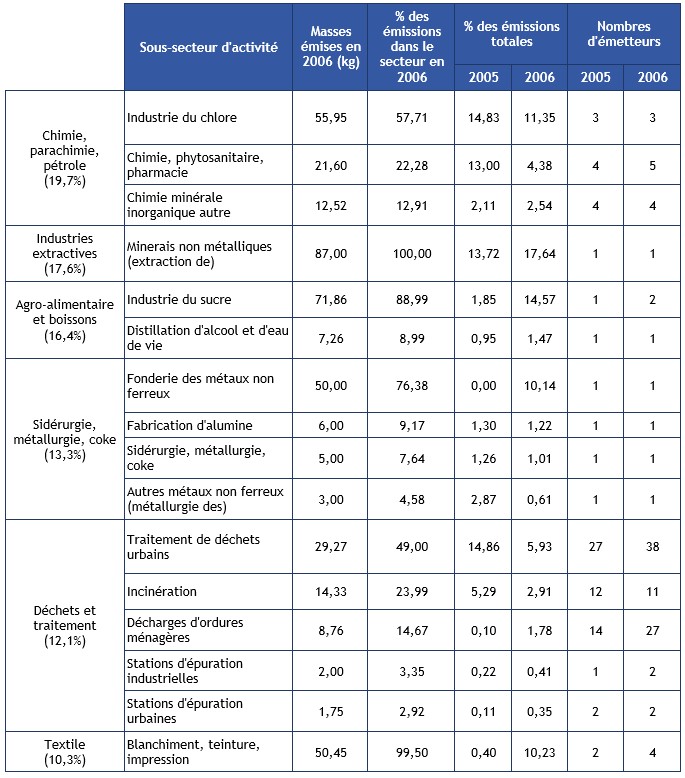
Dans le tableau 3.8. sont regroupés plus de 85% des émissions de mercure vers les eaux pour l'année 2006. Pour 2006, près de 64% des rejets de mercure vers les eaux sont produits par et onze sites d'installations soumises à déclaration, appartenant à cinq sous secteurs d'activité :
- l'industrie du chlore (3 sites)
- l'extraction de minerais non métalliques (1 site)
- l'industrie du sucre (2 sites)
- le secteur du blanchiment, teinture, imprimerie (4 sites)
- la fonderie de métaux non-ferreux (1 site)
Les émissions de mercure provenant de l'industrie du chlore sont amenées à fortement diminuer voir disparaître avec le changement de technologie prévu.
Émissions vers les sols
FTE 2005 Importer
Selon l'UNEP (2005), les conditions dans les sols sont habituellement favorables à la formation de composés mercuriels inorganiques et organiques se complexant avec des anions organiques. Ce mécanisme de complexation gouverne en grande partie la mobilité du mercure dans les sols. Une partie importante du mercure présent dans les sols est liée à des matières organiques brutes. Il est donc susceptible d'être entraîné par les eaux de ruissellement lorsqu'il est lié à des particules de sol ou de l'humus en suspension.
Néanmoins, rappelons que certains micro organismes présents dans les sols peuvent faire passer le mercure présent dans l'environnement d'une forme chimique à une autre[35] .
Cet état de fait explique pourquoi le temps de rétention du mercure dans les sols est long. Il s'ensuit que le mercure accumulé dans les sols peut continuer d'être libéré dans les eaux de surface et d'autres compartiments de l'environnement pendant de longues périodes, peut être des centaines d'années (Pirrone et al., 2001).
[35] De nombreux paramètres influencent la méthylation et la déméthylation, par exemple la concentration en ions sulfures (S2-) et le potentiel d’oxydoréduction.
Pollutions historiques et accidentelles
FTE 2005 Importer
Pollutions historiques liées à l'exploitation de la filière « mercure »
Selon Euro Chlor (1998) la production de chlore par electrolyseur à cathode de mercure s'est développée au milieu des années 70 (la durée de vie d'une telle installation se situant entre 40 et 60 ans).
Il est admis que la plus grande partie de pertes de mercure se trouvent dans les différents déchets provenant du procédé (Commission Européenne, 2001b). Selon Euro Chlor (1998) De façon optimisée, le mercure est récupéré et réutilisé par une variété de techniques (recyclage, lavage, …). Néanmoins, d'importantes émissions de mercure peuvent également se produire au niveau des eaux d'écoulement.
En de nombreux endroits, le sol des sites est contaminé par du mercure résultant du dépôt d'émissions diffuses et/ou de décharges anciennes de déchets contaminés par du mercure (Commission Européenne, 2001b). De nos jours, les déchets solides résiduels souillés sont entreposés de façon non émissive par encapsulation et stockage souterrain profond (Euro Chlor, 1998).
Sites industriels pollués en France
En France, le site internet BASOL[38] du Ministère de l'Ecologie et du Développement Durable recense 156 sites industriels pollués au mercure : parmi eux, certains sont liés à l'industrie du chlore (par exemple : Arkema Saint Auban ; Arkema Villers Saint Paul ; …).
[38] Base de données BASOL sur les sites et sols pollués (ou potentiellement pollués) appelant une action des pouvoirs publics, à titre préventif ou curatif.
Présence environnementale
Atmosphère
FTE 2005 Importer
Au niveau européen, des moyennes de concentrations atmosphériques annuelles de mercure peuvent être calculées à l'aide d'un modèle (EMEP[26]). La figure 3.2. présente une représentation cartographique de ces calculs (carte extraite du site internet de l'Office Fédéral de la Statistique, Suisse). De la sorte, les zones fortement impactées par la présence de mercure atmosphérique peuvent être identifiées.

Figure 3.2. Moyennes de concentrations atmosphériques annuelles de mercure en 2001 ; exprimées en ng.m-3 par le modèle EMEP (extrait du site internet de l'Office Fédéral de la Statistique, Suisse).
Selon Pirrone (2006), les émissions de mercure dans l'atmosphère sont de l'ordre de 6000 à 6600 tonnes par an avec une part des émissions naturelles estimées entre 800 et 3000 tonnes par an. La ré émission du mercure préalablement déposé et provenant de sources naturelles et anthropiques est difficilement quantifiable.
[26] EMEP : Modèle géoréférencé sur le continent européen décrit par un maillage de 150 km par 150 km. Il simule 5 compartiments atmosphériques et 5 compartiments dans le sol (Shatalov et al., 2001).
Devenir des rejets dans l'air
Selon l'UNEP (2005), la chimie atmosphérique du mercure fait intervenir plusieurs interactions :
- réactions en phase gazeuse ;
- réactions en phase aqueuse (dans les gouttelettes de nuage et de brouillard et les particules d'aérosol en déliquescence) ;
- partage du mercure élémentaire et des espèces de mercure oxydé entre la phase gazeuse et la phase solide ;
- partage entre la phase gazeuse et la phase aqueuse ;
- partage entre la phase solide et la phase aqueuse dans le cas des matières particulaires insolubles piégées par les gouttelettes de brouillard et de nuage.
Rappelons que la spéciation du mercure dans l'atmosphère joue un rôle important dans le transport du mercure à grande distance ainsi que dans les mécanismes de dépôt de cette substance.
Selon l'UNEP (2005), le changement de forme chimique du mercure (ou spéciation) a un effet sur le transport du mercure dans et entre les compartiments de l'environnement, notamment l'atmosphère et les océans. Par exemple, l'espèce est un facteur déterminant en ce qui concerne la distance que le mercure peut parcourir à partir de sa source d'émission dans l'air. Selon le Programme des Nations Unies pour l'environnement traitant du mercure (PNU, 2005), le mercure adsorbé sur des particules et les composés ioniques du mercure seront déposés sur le sol et dans l'eau à proximité de leur source (transport d'échelle locale ou régionale), tandis que le mercure élémentaire en phase vapeur sera transporté à l'échelle de l'hémisphère ou de la planète.
D'autres formes de mercure, telles que le mercure inorganique, se redéposent dans un rayon approximatif de 100 à 1 000 kilomètres autour de leur point d'émission. Cependant, la distance de transport atmosphérique du mercure dépend également des conversions chimiques que cet élément subit au cours de son transport. A titre d'exemple, il a été estimé par modélisation que 20% du mercure anthropogénique déposé en Europe est originaire d'un autre continent.
La figure 3.3. extraite de AMAP (2005) présente la distribution mensuelle des dépôts de mercure sur une partie de l'hémisphère Nord au début des années 2000.
Figure 3.3. Distribution des dépôts de mercure sur une partie de l'hémisphère Nord (AMAP ; 2005).

Cette carte permet de situer les sites où sont présents les plus importants dépôts de mercure (généralement proches de régions émettrices) mais également la présence de dépôts non négligeables dans les régions arctiques. Ceci illustre le transport du mercure sur toute la surface du globe et le fait qu'il s'agisse d'un problème global à envisager au niveau mondial.
La figure 3.4. extraite du site internet Msc e présente plus précisément la distribution des dépôts de mercure sur l'Europe. Cette modélisation a été réalisée par les groupes de travail EMEP de la Convention sur la pollution atmosphérique transfrontière.

Figure 3.4. Distribution des dépôts annuels totaux de mercure (secs et humide) sur l'Europe en 2005 (site internet Msc-e).
Galsomiès et al. (1999) et Gombert et al. (2005) ont dressé des inventaires (non exhaustifs) des études réalisées en France sur les dépôts métalliques de 1990 à 2003. Certains des études reprises dans ces publication concernent le mercure. Dans ce cas, la nature du dépôt considéré est précisée.
Aquatique
Selon INERIS (2003), le mercure peut se retrouver sous différentes formes physico chimiques dans le milieu aquatique, le Hg élémentaire, le Hg divalent Hg(II) libre ou complexé à des ligands inorganiques ou organiques et le mercure méthylé (MeHg).
Selon Chery (2006), « la concentration en mercure dans les eaux souterraines ne dépasse généralement pas 1 µg.L-1. Les valeurs se situent le plus souvent autour de 0,1 µg.L-1 ».
D'après INERIS (2003), « Le pourcentage de MeHg dans les eaux douces et marines est généralement peu élevé (<1%). Cependant, des concentrations élevées sont rencontrées dans les eaux anoxiques de l'hypolimnion[27] de lacs. Le pourcentage de MeHg peut aussi être plus élevé dans des systèmes contaminés par le mercure (Hg), comme par exemple dans le réservoir de Petit Saut en Guyane française où le MeHg atteint 25% du mercure total dans les eaux profondes et dans le fleuve Synnamary en aval du réservoir). »
Comme le montre le tableau 3.1 extrait d'une publication de l'INERIS (2003), la pollution des eaux dans les fleuves et les eaux côtières est relativement bien documentée.
Tableau 3.1. Concentration en mercure total (dissous et particulaire) dans les eaux fluviales et côtières
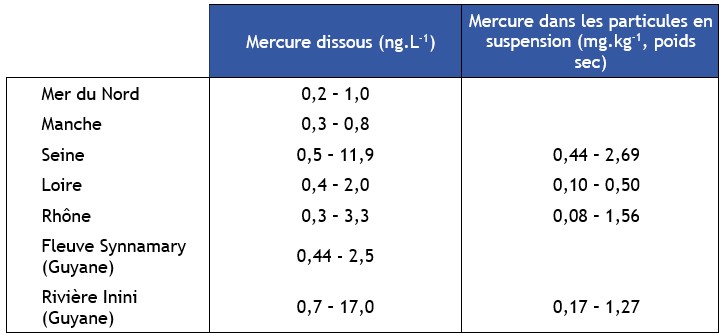
D'après le projet FOREGS, les teneurs en Mercure dans les sédiments de cours d'eau en Europe vont de 0.00074 mg Hg.kg-1 à 13.6 mg Hg.kg-1 avec une valeur moyenne de 0.081 mg Hg.kg-1 (données rapportées par SOCOPSE, 2008).
[27] L'hypolimnion est la couche thermique la plus profonde d'un lac, toujours froide et à température peu variable; elle est située selon la saison en dessous de 15 à 30m de profondeur.
Evolution temporelle des concentrations dans les eaux de surface européennes
La figure 3.5. présente l'évolution dans le temps des rejets de mercure (et de cadmium) en direction des eaux de surface européenne (d'après EEA, 2003). Ces données représentent les moyennes des concentrations nationales annuelles moyennes (originaires de Belgique, de France, d'Allemagne, d'Irlande, des Pays Bas et du Royaume-Uni pour la courbe du mercure).

Figure 3.5. Concentration de cadmium et de mercure dans les stations fluviales (d'après EEA, 2003).
Présence dans les sédiments marins
Les seules informations disponibles quant aux concentrations de mercure des sédiments marins ont été obtenues en Mer du Nord (Helgoland ; figure 3.6). Elles démontrent, qu'au sein des sédiments fins locaux, les teneurs en mercure diminuent graduellement depuis les années 70.
Figure 3.6. a : évolution des teneurs sédimentaires en mercure (mg.kg-1) ;

Figure 3.6. b : localisation du point de prélèvement.

Terrestre
FTE 2005 Importer
D'après la base de données FOREGS (rapportée dans SOCOPSE, 2008), les teneurs en mercure dans les sols européens sont dans les gammes suivantes :
- pour le topsoil, elles sont comprises entre 0,005 et 1,35 mg Hg.kg-1 avec une moyenne à 0.061 mg Hg.kg-1 .
- Pour la couche de sub-surface, les niveaux vont de 0.002 à 0.93 mg Hg.kg-1 avec une moyenne de 0,035 mg Hg.kg-1 .
La figure 3.7 ci après est une représentation cartographique des teneurs dans le topsoil en Europe de l'Ouest.
Figure 3.7. Représentation cartographique des teneurs de mercure dans le topsoil en Europe de l'Ouest.

Présence dans les roches
Chery (2006) indique, qu'en France, le mercure est présent sous forme de sulfure de mercure, le cinabre, qui est un minéral abondant dans le massif armoricain.
Observations dans la végétation
L'UNECE ICP Vegetation a dédié un rapport à la mesure des teneurs en métaux lourds présentes dans les mousses terrestres (UNECE ICP, 2003)[36]. Pour l'année 2001, en France, les plus fortes teneurs en mercure ont été observées en Picardie et à proximité d'un site industriel de production de chlore en région Rhône Alpes.
[36] En effet, les concentrations des mousses en métaux lourds reflètent approximativement le dépôt de ces métaux depuis l’atmosphère sur les sols et la végétation. Ces mesures se révèlent donc être une alternative bon marché à méthodes conventionnelles de précipitation
Synthèse
FTE 2005 Importer
Forme chimique dans l'environnement
Le mercure, pour une part naturellement présent dans l'environnement, existe sous de nombreuses formes. Sous sa forme pure, on l'appelle soit « mercure élémentaire », soit « mercure métallique » (symbolisé par Hg(0) ou Hg0). Le mercure se trouve rarement dans la nature sous forme de métal liquide pur ; il y est plutôt présent sous forme de composés ou de sels inorganiques. On trouve des composés du mercure monovalent et divalent (symbolisés par Hg(I) et Hg(II) ou Hg2+, respectivement). Le Hg(II) forme de nombreux composés organiques et inorganiques.
Perspectives de réduction
Réduction des rejets
Possibilité de réduction des rejets
FTE 2005 Importer
Selon le PNUE (2002), les méthodes de réduction des rejets de mercure d’origine anthropique varient considérablement, en fonction du contexte local mais peuvent se regrouper en quatre catégories :
- La réduction des activités d’extraction et de consommation des matières premières et des produits générateurs de rejets de mercure ;
- La substitution (ou l’élimination), par des alternatives sans mercure, des produits des procédés et des pratiques qui contiennent ou qui utilisent du mercure ;
- La réduction des émissions de mercure par la mise en œuvre de technologies de traitement des rejets ;
- La gestion des déchets de mercure.
Réduction de consommation de matières premières et de produits
FTE 2005 Importer
Selon le PNUE (2005), cette mesure préventive vise le plus souvent les produits et procédés à base de mercure mais peut également résulter d'une meilleure efficacité de la consommation des matières premières ou de la consommation des combustibles aux fins de production d'électricité.
Choix, utilisation et traitement des matières premières
Selon le PNUE (2005), le choix d'une matière première alternative, comme par exemple, le passage au gaz naturel pour produire de l'électricité (en remplacement du charbon) peut permettre la réduction des émissions de mercure[39]. Une autre solution pourrait consister à utiliser du charbon ayant une plus faible teneur en mercure à l'état de trace[40]. Selon le PNUE (2002), ces mesures préventives ont généralement un bon rapport coût efficacité.
Le problème des émissions de mercure provenant des chaudières (surtout celles fonctionnant au charbon), peut être traité efficacement au moyen de différentes approches :
- épuration préalable du charbon ;
- réduction des quantités de charbon consommées par une augmentation de l'efficacité énergétique ;
- utilisation de combustibles autres que le charbon.
[39] Le mercure est typiquement présent dans le charbon et le pétrole selon des concentrations s'étalant respectivement de 0,1 à 1 et de 0,01 à 1 ppm (Floyd et al., 2002).
[40] Cependant, il est probable que certains producteurs d'électricité soient prêts à payer plus cher pour du charbon à faible teneur en mercure, ce qui pourrait, à son tour, conduire à une consommation plus importantes de charbon à forte teneur en mercure dans des régions où les contrôles d'émissions sont moins rigoureux.
Exploitations artisanales de métaux précieux
Hormis certains territoires d'Outre mer, l'exploitation artisanale (autorisée ou non) de métaux précieux (minerais aurifères) ne concerne pas de façon sensible la France métropolitaine, selon le PNUE (2005), il est possible de réduire les émissions de mercure associées à ces exploitations :
- faisant appel à des programmes de formation des mineurs et de leurs familles sur les dangers auxquels ils s'exposent ;
- en favorisant des techniques qui sont plus sûres et qui n'utilisent pas ou qui utilisent peu de mercure ;
- en créant des ateliers où les mineurs peuvent apporter leurs minerais concentrés pour les soumettre à un procédé final de raffinage.
Certains pays ont essayé d'interdire l'utilisation du mercure par des mineurs artisanaux. Cette interdiction pourrait favoriser l'utilisation d'installations de traitement centralisées, mais son application pourrait se révéler difficile.
Réduction de la Production d'électricité
En France la production d'électricité à partir des énergies fossiles (gaz, pétrole et charbon combinés) n'atteint que 3% de la production totale (site internet d'EDF). Les mesures visant à réduire la consommation d'électricité au niveau national n'auront donc que peu d'impact sur les rejets français de mercure.
Gestion des déchets
FTE 2005 Importer
Selon l'UNEP (2005), la gestion des déchets contenant du mercure gagne en complexité à mesure qu'augmentent les quantités de mercure récupérées et que se diversifient les sources de mercure, notamment : les équipements de filtration d'effluents industriels atmosphériques usagés , les boues provenant des fabriques de chlore, les cendres, les scories et les résidus minéraux inertes ainsi que les tubes fluorescents usagés, les piles et d'autres produits qui sont rarement recyclés.
La gestion des déchets contenant du mercure, telle que pratiquée le plus couramment aujourd'hui, c'est à dire en respectant la réglementation nationale et locale, demande de plus en plus une vision et des investissements à long terme. Une gestion adéquate des déchets contenant du mercure est importante si l'on veut limiter les rejets provenant notamment de thermomètres et de manomètres cassés ou, encore, les rejets graduels dus à certaines applications (par exemple les autocommutateurs et amalgames dentaires). En outre, comme il existe une demande du marché pour le mercure, la collecte de produits contenant du mercure en vue de leur recyclage limite le besoin de nouvelles exploitations minières de mercure.
Campagnes de collectes exceptionnelles
Selon le PNUE (2002), les émissions des installations d'incinération des ordures ménagères et des déchets des activités de soins peuvent être réduites en séparant la petite fraction des déchets qui contient du mercure avant incinération, par exemple par la mise ne place d'un tri sélectif en milieu hospitalier. Néanmoins, la généralisation à l'ensemble de la population d'un tel dispositif aurait un coût prohibitif. Pour contourner ce problème, le PNUE (2002) suggère la mise en place d'une période limitée de collecte volontaire de l'ensemble des produits contenant du mercure ou des dérivés mercuriques.
Accroissement du recyclage des piles et batteries
En 2003, on estime que seuls 27% des piles et batteries mises sur le marché français (775 millions de piles et accumulateurs, soit plus de 7 000 tonnes) étaient recyclés (ADEME, 2004). De plus, l'ADEME (2004) affiche des objectifs de collecte compris entre 40 et 50% des piles et accumulateurs portables mis sur le marché en 2006.
De même, la capacité française de recyclage couvre largement l'ensemble des piles mises sur le marché (ADEME, 2004). Quantitativement, une entreprise du secteur du recyclage estime que le recyclage des piles pourrait générer une « économie » pouvant atteindre 10 tonnes de mercure par an (Onyx, 2003).
Un accroissement de la collecte des piles et batteries est donc nécessaire : un système de consigne pourrait être imaginé afin d'accroître la participation des particuliers à cet effort.
Stockage et destruction des véhicules en fin de vie
Selon l'UNEP (2002), les émissions de mercure dues aux procédés de traitement de la ferraille ou celles provenant de parcs à ferrailles, de déchiqueteurs et d'aciéries secondaires, résultent surtout de la présence de commutateurs électriques, des phares et des systèmes ABS (systèmes de freinage anti blocage) dans les véhicules automobiles. Une solution pourrait consister en la mise en place de programmes efficaces de démontage et de collecte des matériels contenant du mercure.
Application en dentisterie du mercure
Selon l'UNEP (2005), il est possible de réduire les rejets de mercure provenant des cabinets dentaires en préparant les amalgames au mercure d'une manière plus efficace, en remplaçant ces amalgames par d'autres produits (composites) et en installant des siphons/mode de récupération des déchets appropriés dans les systèmes d'évacuation des eaux. Néanmoins, il faut préciser que mis à part la généralisation des composites non mercuriels, les autres préconisations sont déjà mises en œuvre en France.
Selon l'UNEP(2005), la meilleure manière de réduire les émissions de mercure produites par les amalgames dentaires pendant la crémation consiste à filtrer les émissions. Comme les systèmes d'épuration des fumées coûtent cher, l'approche à privilégier consiste en une politique dynamique de prévention, c'est à dire l'utilisation de matériaux autres que des amalgames de mercure pour les traitements dentaires courants.
Dans un article récent, Vandeven et McGinnis (2005) estiment le coût des installations à mettre en place pour traiter les rejets de mercure issus de l'activité professionnelle des dentistes à 700 1 400 € + 500 à 750 €.an 1 d'entretien (soit environ 730 €.an 1 en considérant une durée de vie moyenne de 10 ans pour ces matériels).
A l'échelle de la France (soit 42 194 dentistes en 1997 selon le site internet de la santé bucco dentaire), la systématisation de ces équipements représente environ 44 M€ d'investissement et 26 M€ d'entretien annuel (soit environ 31 M€.an 1 en considérant une durée de vie moyenne de 10 ans pour ces matériels).
Mise en décharge « sauvage »
Selon l'UNEP (2005), afin de contrer l'élimination « sauvage » de produits ou de déchets contenant du mercure, il convient de combiner une stricte application de la loi à une facilitation de l'accès aux installations de traitement de déchets toxiques. A plus long terme, la réduction/disparition des quantités de mercure utilisées dans les produits de grande consommation est une piste à suivre.
Réduction des émissions par la mise en œuvre de technologies de traitement des rejets
FTE 2005 Importer
Selon le PNUE (2002) et l'IPPC (2005), la réduction des émissions de mercure par la mise en œuvre de technologies de traitement des rejets (telles que la dépollution des gaz de combustion) peut être adaptée aux matières premières génératrices de contamination de mercure à l'état de trace, y compris les centrales de production d'électricité thermiques classiques (à combustibles fossiles), la fabrication du ciment (filière où la chaux contient souvent du mercure), l'extraction et la transformation des matières premières (fer, acier, ferromanganèse, zinc, ou et d'autres métaux non ferreux),la transformation des matières premières secondaires (ferraille) ainsi que l'incinération des déchets (ménagers, industriels ou hospitaliers).
Par exemple, pour les rejets atmosphériques des chaudières à charbon, le niveau de réduction varie de 0 à 96%, en fonction du type de charbon utilisé, de la conception de la chaudière et du dispositif de traitement des émissions. Des techniques de réduction supplémentaires du mercure sont en cours de développement : à long terme, les technologies de réduction multi polluants (SO2, NOx, PM, Mercure, …) pourraient constituer une approche ayant un bon rapport coût efficacité. Cependant, si les techniques de traitement des rejets réduisent les émissions atmosphériques du mercure, elles produisent toujours des déchets contenant du mercure qui sont des sources potentielles d'émissions futures. Par conséquent, ces déchets doivent être éliminés ou valorisés de manière respectueuse de l'environnement (PNUE, 2002).
Comparatif des techniques pour les effluents aqueux
Le tableau 4.2 présente un récapitulatif des différentes techniques de traitement des effluents contenant du mercure et/ou des composés à base de mercure. Ces techniques sont dédiées au traitement des effluents liquides.
Tableau 4.2. Récapitulatif des techniques et de leur efficacité vis à vis de la démercurisation des effluents aqueux ; * : peu d'effet ; ** : effet suffisant pour répondre aux normes en vigueur ; *** : excellent (d'après Degrémont, 1991).
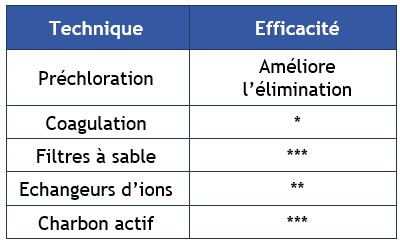
Degrémont (2005) indique que le meilleur procédé d'élimination de mercure des effluents aqueux est la combinaison clarification (coagulation, floculation et décantation) associée à un affinage par filtres à charbon actif granulaire.
Préchloration
D'après le site internet de la société Lenntech, la préchloration permet au chlore de décomposer les complexes organiques qui maintiennent les métaux lourds en solution en les portant à un degré d'oxydation maximum. Une préchloration est souvent recommandable avant la décantation, afin d'obtenir une meilleure qualité.
Degrémont (2005) précise que cette technique ne s'utilise pas seule mais associée à la coagulation décantation et filtration.
Coagulation, floculation, décantation
Le coagulant ajouté à l'eau a pour rôle de transformer les métaux lourds dissous dans l'eau en composés insolubles qui précipiteront. On utilisera alors un procédé de décantation ou de filtration pour finir le traitement.
Les taux de mercure peuvent être réduits de 50 à 90% (Degrémont, 2005). Néanmoins, ce procédé à des limites :
- la présence d'un trop grand nombre d'espèces métalliques peut nuire à l'efficacité ;
- l'efficacité du procédé repose sur l'utilisation des bonnes techniques de séparation (floculation et/ou filtration) ;
- le procédé peut aboutir à la formation de boues toxiques, qu'il faudra traiter par la suite ;
- les eaux traitées nécessitent souvent un réajustement de pH.
D'après US EPA (2007), ce procédé est le plus fréquemment utilisé. De plus, il peut supporter différentes caractéristiques d'effluents ainsi que des débits très importants. In fine, après plusieurs cycles de traitement éventuellement associés à une étape d'adsorption sur charbon actif, ce procédé permet d'atteindre des concentration de l'ordre de 2 µg.L-1.
Echangeur d'ions
Les échangeurs d'ions (également appelées résines) sont des substances granuleuses insolubles dont la structure possède un radical acide ou basique. Ces substances sont capables de fixer les cations ou anions minéraux et organiques. Des sociétés proposent des résines spécialement conçues pour la rétention des métaux lourds.
L'usage de ce type de matériel permet une bonne capacité d'adsorption (même en présence d'huiles, solvants et oxydants), une adsorption de tous les métaux lourds, une utilisation dans tout type de matériel et une utilisation immédiate. Ce type de matériel peut être utilisé pour limiter les rejets des incinérateurs (IPPC, 2005). Néanmoins, cette technique semble peu utilisée du fait de son coût économique important.
Filtres à charbon actif
Le phénomène physique à l'œuvre au sein des filtres à charbon actif[41] est l'adsorption, c'est à dire l'adhésion des matières à filtrer sur la surface d'un solide, sans réaction chimique. Le charbon actif est le composé le plus adsorbant actuellement connu. Les origines du charbon actif peuvent être minérales ou végétales. L'utilisation de la filtration par charbon actif en poudre permet une adsorption totale du mercure (Degrémont, 2005 ; IPPC, 2005). Cette technologie peut être mise en place en milieu industriel.
D'après US EPA (2007),cette technique de traitement est plus sensible aux caractéristiques de l'effluent à traiter (débit de liquide, nombres de polluant dans la matrice à traiter). Cette source, précise également que cette technique est adaptée pour un petit système ou en complément, pour la finalisation d'un traitement sur un système de grande ampleur.
[41] On dénomme également « filtres CAG » les filtres à charbon actif granulaire.
Filtration par membrane
Le principe de la filtration par membrane est de concentrer les polluants dans un petit volume d'eau (US EPA, 2007). Pour cela, l'effluent à traiter passe au travers d'une membrane semi perméable et microporeuse qui le sépare en deux parties :
- Le perméat, c'est à dire le fluide qui est passé de l'autre coté de la membrane avec un niveau de contamination plus faible ;
- Le concentrat, c'est à dire l'eau et les polluants retenus par la membrane.
In fine, cette technique permet d'atteindre des concentrations de l'ordre de 2 µg.L-1 dans le perméat.
Selon le site internet de Lenntech, les procédés de filtration par membrane couvrent les domaines de la microfiltration jusqu'à l'hyperfiltration (osmose inverse). De tels procédés ont fait leurs preuves dans le traitement d'effluent spécifiques contenant des métaux lourds
Autres techniques innovantes
Traitement biologique
Cette technique qui permet la décontamination par voie biologique est en développement. Deux types de procédés sont actuellement testés ; le premier transforme les ions mercure en mercure élémentaire par des bactéries puis l'effluent passe sur du charbon actif pour éliminer le mercure résiduel. Le second procédé est une succession d'étapes de traitement biologiques aérobies et anaérobies (US EPA, 2007).
Purification par chélation
Soutenu par l'Union européenne, le projet de recherche « mercury » s'intéresse à la chélation[42] du mercure par les calixarènes[43] en milieu aqueux. Ainsi, un nouveau matériau, de la silice dopée aux calixarènes, a été développé et testé et pourrait permettre de constituer des membranes extractrices filtrant les effluents industriels à faible coût (RDT info, 2005). Néanmoins, à ce jour, aucune application commerciale de cette technologie n'est encore disponible.
[42] Formation ou présence de liaisons ou autres forces attractives entre un atome central unique (ici le mercure) et deux ou plusieurs sites liants distincts d'un même ligand.
[43] Les calixarènes sont des composés cycliques utilisés comme complexants en chimie supra moléculaire. Leur nom vient de leur ressemblance dans leur forme avec les vases grecs nommés en anglais "calix crater".
Nanotechnologie
Le développement d'un nouvel adsorbant spécifique au mercure (substrat de céramique nanoporeuse présentant une importante surface fonctionnalisée par une couche de groupements thiols) semble présenter des perspectives intéressantes pour l'avenir. A l'échelle du laboratoire, cet adsorbant présente une capacité d'adsorption de 635 mg.g 1. De plus, cette capacité ne semble pas être affecté par la présence d'autres cations ou anions complexants dans l'effluent à traiter (US EPA, 2007).
Phytoremédiation
Des essais en laboratoire sont effectués pour évaluer l'efficacité de traitement d'effluents liquides par des plantes (riz génétiquement modifié, peupliers,•). Les résultats de ces essais ne sont pas disponibles.
Air stripping
Cette technique expérimentale, consiste à utiliser du chlorure d'étain pour réduire Hg2+ en Hg0 qui est volatil. Ce mercure élémentaire présent dans l'air au dessus de l'eau est ensuite collecté afin de l'éliminer (US EPA, 2007). Cependant, avant toute recommandation d'utilisation de ce procédé, il sera nécessaire d'évaluer les effets sur l'environnement de l'étain introduit dans l'eau.
Techniques spécifiques aux effluents gazeux
De façon préliminaire, il est utile de préciser que selon l'UNEP (2005), la spéciation revêt une grande importance en ce qui concerne la possibilité de réduire les émissions de mercure dans l'atmosphère. Par exemple, les émissions de composés inorganiques du mercure (tels que le chlorure de mercure) sont capturées avec une relativement bonne efficacité par certains dispositifs anti pollution (comme les dépoussiéreurs par voie humide), tandis que la plupart des dispositifs anti pollution parviennent mal à piéger le mercure élémentaire.
Techniques de traitement des effluents gazeux des grandes installations de combustion
Le document de référence BAT (Best Available Techniques) pour les GIC (Commission Européenne, 2005b) souligne qu'une des particularités du mercure réside dans la forte pression de vapeur que ce métal possède. Contrairement aux autres métaux lourds (mis à part le sélénium) cette caractéristique physico chimique entraîne une forte présence de mercure dans la phase vapeur se dégageant des GIC. Pour cette phase gazeuse, les réductions des émissions ne peuvent être réalisées que par la mise en œuvre de mesures primaires : substitution de combustibles, utilisation de certains minerais ou brûlage de combustibles moins riches en mercure. En effet, le traitement des effluents gazeux de ces installations par des appareillages destinés au contrôle des particules est donc d'une efficacité extrêmement variable.
Les BREF concernant les grandes installations de combustion ou GIC et les incinérateurs (Commission européenne, 2005b ; IPPC, 2005) préconisent différents appareillages pour minimiser les émissions atmosphèriques de mercure (ESPs : Electrostatic Precipitators ; FFs : Fabrix Filters ; FGD : Flue Gas Desulphurisation ; SCR : Selective Catalytic Reduction ; scrubbers[44] ; dry sorbent injection, …). Un synthèse de l'efficacité de capture de ces procédés vis à vis du mercure est présentée dans le tableau 4.3 (ci après).
[44] Afin de maintenir l'efficacité du système, une partie du liquide contenu dans le circuit doit être remplacée et évacuée en tant que déchet (IPPC, 2005). Ce liquide doit être traité vis à vis de son contenu en métaux lourds (dans certains incinérateurs, ce liquide est incinéré).
Tableau 4.3. Coût et efficacité des mesures de control des émissions atmosphériques de mercure pour les centrales électriques, les incinérateurs municipaux et médicaux (d'après Commission européenne, 2001c).
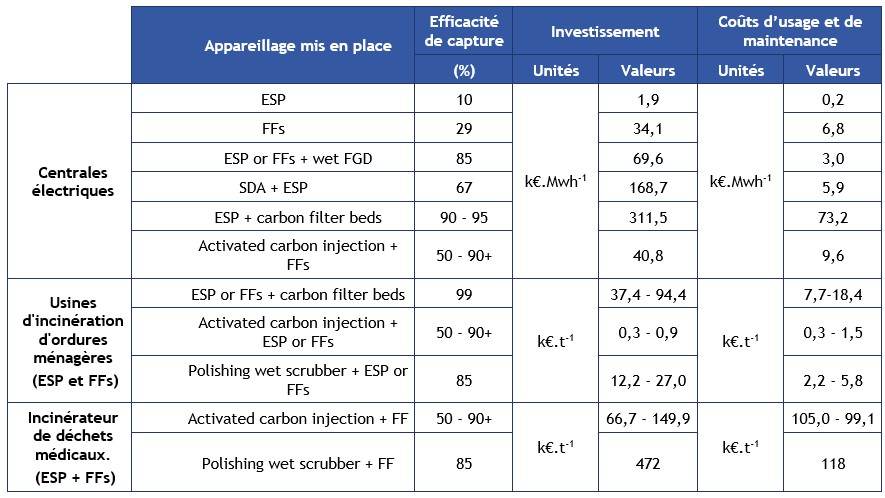
Les chiffres retraçant l'efficacité de capture du mercure selon les systèmes de traitement mis en place sont confirmés par un rapport de l'IPPC (2005). De plus ce document détaille les mesures à mettre en œuvre afin de garantir une efficacité maximale (injection d'un agent fortement oxydant, …).
Selon l'UNEP (2005) et l'IPPC (2005), on peut réduire les émissions de mercure provenant des incinérateurs de déchets urbains et de déchets médicaux en ajoutant du charbon actif à l'équipement de réduction des particules et du SO2 déjà en place. Cependant, cette technique n'est pas totalement efficace.
Techniques de traitement des effluents gazeux dans l'industrie du chlore
Il existe un BREF concernant l'industrie du chlore[45] dont la principale recommandation est de passer de la technique utilisant des cellules d'électrolyse à mercure à la technologie des cellules à membrane. Pour la durée de vie restante des installations fonctionnant avec des cellules à mercure (leur arrêt total est prévu pour 2020), il est possible de trouver dans le BREF des recommandations pour réduire au minimum les rejets de mercure dans l'environnement.
[45] BREF Industrie du chlore et de la soude, 2001 (http://aida.ineris.fr/bref/bref_cadres.htm).
Techniques de traitement des effluents gazeux dans l'industrie des métaux non-ferreux
Les techniques reprises ci dessous sont issues du BREF dédié aux métaux non ferreux[46]. Le mercure est volatil aux températures rencontrées dans la plupart des procédés de dépollution, des techniques additionnelles spécifiques au traitement du mercure gazeux peuvent être nécessaires (OSPARCOM, 1996 ; Finland Zn, 1999 ; VDI 3460, 1997). La production de métaux non ferreux entraîne le dégagement d'acide sulfurique. Les différentes techniques déclarées comme meilleures techniques disponibles pour la réduction des émissions de mercure dans l'industrie des métaux non ferreux sont donc adaptées à ces conditions acides.
- Procédé Boliden/Norzink. Ce procédé est basé sur un laveur humide employant la réaction entre le chlorure mercurique et le mercure pour former du chlorure mercureux (calomel), qui précipite. Le calomel est extrait de la solution de lavage en circulation et partiellement régénéré en HgCl2 par ajout de chlore gazeux. Le mercure métallique issu de cette réaction est récupéré. Le chlorure mercurique est très toxique ; ce procédé est à réaliser avec la plus grande précaution mais il permet d'atteindre des niveaux d'émissions compris entre 0,05 et 0,1 mg/Nm3 de mercure dans l'air.
- Procédé Bolchem. L'acide sulfurique à 99% oxyde le mercure à température ambiante. Le mercure est précipité comme sulfure avec du thiosulfate. L'acide utilisé est régénéré, par conséquent, aucun acide n'est consommé par le procédé.
- Procédé Outokumpu. Le gaz (à environ à 350°C) est dirigé vers une tour à lit à garnissage où il est lavé à contre courant avec de l'acide sulfurique à 90% à près de 190°C. Le mercure est précipité. La boue de mercure est retirée de l'acide refroidi, filtrée et lavée.
- Procédé au thiocyanate de sodium. Ce procédé est utilisé sur un four de grillage de zinc. Le gaz est lavé avec une solution de thiocyanate de sodium et le mercure est extrait comme sulfure. Le thiocyanate de sodium est régénéré.
- Filtre à charbon actif. Les filtres d'adsorption à charbon actif servent à éliminer les vapeurs de mercure des effluents gazeux. La fraction de mercure qui passe dans le filtrat est difficile à prévoir ; c'est pourquoi on utilise un système de filtration double, le second filtre servant à récupérer cette fraction résiduelle. Lorsque le premier filtre est usé, il est chargé de charbon frais et le second filtre est utilisé en tête du système. Le charbon peut être régénéré dans un four Herreschoff, tandis que le mercure peut être récupéré. Dans les meilleurs conditions d'emploi, les filtres à charbon actif pourraient permettre d'atteindre des concentrations de mercure comprises entre 0,002 et 0,007 mg.m-3, à condition que l'on opte pour le système à deux filtres.
- Procédé d'échange d'ions Superlig. Ce procédé utilise l'échange d'ions pour retirer le mercure du produit acide et obtient une concentration en mercure < 0,5 ppm.
- Procédé d'ajout de iodure de potassium. Du iodure de potassium est ajouté à l'acide qui doit au moins avoir une puissance de 93% (puissance déterminée à une température d'environ 0°C). L'iodure de mercure, l'HgI2, est alors précipité.
Parmi ces procédés, celui de Boliden/Norzink est le plus couramment utilisé. Néanmoins, d'autres procédés sont disponibles (OSPARCOM 1996) :
- Laveur au sélénium. Ce procédé est basé sur un laveur humide et emploie la réaction entre le sélénium amorphe dans l'acide sulfurique et le mercure. Ceci aboutit à l'élimination des concentrations élevées de vapeur de mercure.
- Filtre à sélénium. Procédé de lavage sec qui emploie du sélénium amorphe pour réagir avec la vapeur de mercure et ainsi former du séléniure de mercure.
- Procédé par sulfure de plomb. Procédé de lavage sec utilisant des nodules de sulfure de plomb afin d'éliminer le mercure du courant des gaz.
A partir de ces éléments, il nous est impossible de prévoir l'évolution des émissions de mercure car nous ne connaissons pas les équipements déjà existants dans les industries du secteur.
[46] BREF Industrie des métaux non ferreux, 2001 (http://aida.ineris.fr/bref/bref_cadres.htm).
Techniques spécifiques aux effluents gazeux des centres d'incinération des déchets
Le tableau 4.4 ci dessous présente des techniques de traitement d'effluents gazeux contenant du mercure. Ces techniques ont été extraites du BREF dédié à l'incinération des déchets[47] .
Tableau 4.4. Techniques de traitement d'effluents gazeux contenant du mercure (centre d'incinération des déchets (d'après le BREF dédié à l'incinération des déchets, 2006).
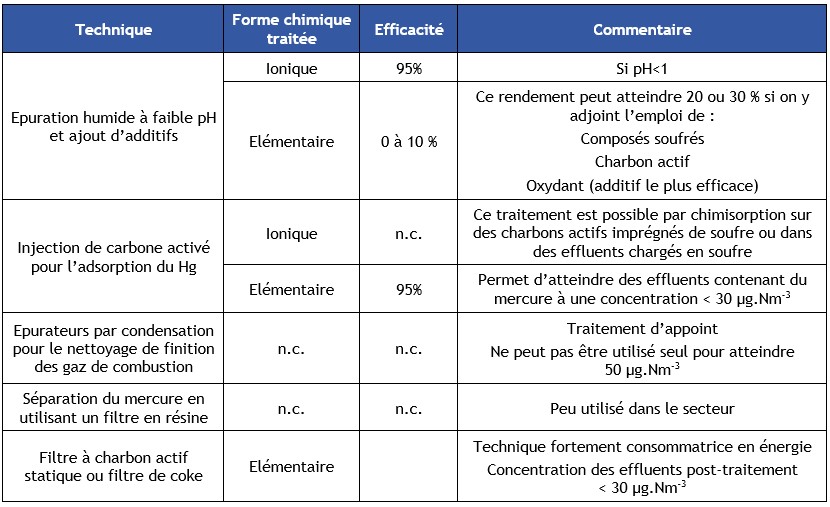
[47] BREF Incinération des déchets, 2006 (http://aida.ineris.fr/bref/bref_cadres.htm).
Techniques spécifiques aux effluents gazeux des centrales à charbon
Techniques actuelles
Une étude du traitement des émissions gazeuses de mercure provenant de centrales électriques alimentées au charbon (Environnement Canada ; 2004) révèle que certaines techniques de traitement des polluants acides servent aussi à capter le mercure, à divers degrés. En général, le taux d'élimination du mercure est le plus élevé dans les centrales alimentées au charbon bitumineux, suivies des centrales alimentées au charbon subbitumineux. Le taux d'élimination le plus faible se retrouve dans les centrales alimentées par de la lignite. De plus, Environnement Cananda (2004) propose également quelques exemples de mesures de lutte contre la pollution qui captent une partie du mercure :
- Le lavage du charbon : On utilise beaucoup le lavage du charbon pour retirer le soufre et la cendre du charbon avant la combustion. On rapporte que les méthodes de lavage employées aux États Unis permettent d'éliminer le mercure dans une proportion qui va de zéro à environ 60%.
- Les précipitateurs électrostatiques (PES) : Les précipitateurs électrostatiques sont conçus pour capter les particules. Le taux d'élimination du mercure des PES varie entre 4 et 27%.
- Les séparateurs à couche filtrante : Les séparateurs à couche filtrante sont aussi destinés à capter les particules. Leur taux d'élimination du mercure est supérieur à celui des précipitateurs électrostatiques, puisqu'il atteint en moyenne 58%.
- La désulfuration des gaz de combustion : La désulfuration des gaz de combustion est destinée à éliminer le dioxyde de soufre, un gaz responsable des précipitations acides. Les systèmes de désulfuration des gaz de combustion secs et humides permettent de retirer de 80 à 90% du mercure gazeux, mais n'affectent aucunement le mercure élémentaire.
- Les chambres de combustion en lit fluidisé équipées de séparateurs à couche filtrante : Destinés à réduire les émissions de soufre, ces systèmes atteignent un niveau moyen d'élimination du mercure de 86%.
- La réduction sélective catalytique (SCR) et la réduction sélective non catalytique (SNCR) : Les procédés de SCR et de SNCR servent à réduire les émissions d'oxydes d'azote. Les résultats des essais d'élimination du mercure par la SCR et la SNCR ne sont pas concluants. De nouveaux essais exhaustifs sont en cours.
Technologies émergentes
Selon Environnement Canada (2004), le Department of Energy (DOE, USA) finance des recherches sur des techniques émergentes de réduction des émissions de mercure provenant des centrales électriques alimentées au charbon. De plus, l'Office of Fossil Energy du DOE annonce des réductions de 90% des émissions de mercure pour cet usage du charbon d'ici 2010 (US DOE OFE, 2001). À cette fin, plusieurs techniques ont fait l'objet d'essais :
- L'injection d'adsorbants : Actuellement, l'injection d'adsorbants est la technologie de réduction du mercure la plus susceptible d'être commercialisée pour les centrales électriques. Elle consiste à injecter du charbon activé ou un autre adsorbant directement dans le flux des gaz de combustion. Le mercure que contiennent les gaz de combustion est adsorbé par l'adsorbant, lequel est recueilli en aval par des dispositifs d'interception des particules. L'élimination du mercure dépend de plusieurs facteurs; les résultats préliminaires indiquent un taux d'élimination supérieur à 90% pour les chaudières alimentées au charbon bitumineux.
- Les lits filtrants au charbon activé : Les lits filtrants au charbon activé peuvent retirer de fortes concentrations de mercure des incinérateurs de déchets. À l'usine de gazéification du charbon de la société Eastman Chemical, à Kingsport (Tennessee), on obtient un taux d'élimination du mercure égal ou supérieur à 90% grâce à cette technique. Toutefois, aucun essai d'élimination du mercure par les lits filtrants au charbon activé n'a été réalisé dans les centrales électriques alimentées au charbon pulvérisé.
- La technique in-situ : La technique in situ consiste à capter le mercure dans les gaz de combustion à l'aide d'un adsorbant thermoactif produit sur place. L'adsorbant se compose de charbon partiellement brûlé, extrait de la chaudière, injecté dans les gaz de combustion en aval du réchauffeur d'air, puis capté dans un dispositif d'interception des particules. Des essais indiquent qu'on peut ainsi atteindre une efficacité d'élimination du mercure de 90%.
On ignore toujours le coût de ces techniques émergentes de réduction du mercure à l'échelle commerciale, néanmoins, l'expérience américaine a démontré que les coûts réels du respect des règlements de lutte contre la pollution atmosphérique s'avèrent souvent inférieurs aux prévisions (Environnement Canada ; 2004).
Autres traitements envisageables
FTE 2005 Importer
Bien que les techniques exposées dans ce paragraphe ne soient pas spécifiques à un compartiment particulier de l'environnement, elles sont principalement dédiées au traitement des sols pollués par des rejets de mercure.
Bioremédiation
Le laboratoire de biologie végétale de l'université de Barcelone teste la capacité de certaines plantes à fixer le mercure dans leur tissus (et par conséquent de dépolluer leur environnement). Un crucifère donne actuellement les meilleurs résultats (RDT info, 2005). Néanmoins, à ce jour, aucune application commerciale de cette technologie n'est encore disponible. Plus récemment, des réseaux et projets de recherche ont été lancés par l'Union Européenne sur ce thème.
Désorption et lixiviation
Selon le site internet du ministère de l'économie des finances et de l'industrie, les sols et les déchets solides pollués peuvent être l'objet d'une élimination totale avec récupération du mercure soit par désorption thermique (250 à 900°C), soit par lixiviation (Hg solubilisé et récupéré par électrolyse ou par cémentation). II existe également des traitements de concentration et d'immobilisation temporaire à moyen terme du polluant.
Exemple du traitement du site METALEUROP
En 2004, la société INERTEC a été chargée du traitement des déchets dangereux : sur le site 240 tonnes de catalyseurs souillés au mercure (~250 mg de mercure par kg de catalyseur) étaient à stabiliser/neutraliser avant leur stockage définitif.
Le principe fait appel à une homogénéisation des déchets/réactifs sur un mélangeur. La cadence moyenne de traitement atteint 50 t.j-1. Au final, les déchets sont conformes à la norme NF X30402-2.
Selon INERTEC, le coût d'un tel traitement équivaut à la moitié du coût de l'incinération de déchets mercuriels.
Impact économique des mesures de réduction
Industrie du chlore
La société Euro Chlore indique que le marché mondial du chlore est actuellement stable dans le temps. De plus, tous les producteurs de chlore de l'Europe de l'Ouest utilisant la filière « mercure » se sont engagés à fermer ou modifier leurs installations au plus vite, soit avant 2020 (Euro Chlor, 2005). Néanmoins ces industriels insistent sur la nécessité de conserver ce délai afin que les 3 000 M€ nécessaires à la conversion puissent être financés (site internet d'Euro Chlor)[49] .
Selon le nombre d'usines présentes sur le territoire français, à l'échelle de la nation, cette modification de mode de production coûterait environ 400 M€.
L'amélioration de la filière « mercure » est difficilement chiffrable du fait de la multiplicité des techniques à mettre en œuvre (utilisation de rayons ultraviolets pour détecter la présence de fuites de mercure ; contrôle et filtration de la qualité de l'atmosphère dans la salle des cellule, refroidissement des cellules avant leur ouverture, …).
[49] En Europe, de 1999 à 2004, huit installations utilisant la technologie « mercure « ont été converties à des technologies non mercuriques et quatre installations ont été définitivement fermées. Ces 12 usines représentaient une capacité annuelle de 1 145 000 tonnes de chlore.
Grandes installations de combustion
Le paragraphe "Techniques de traitement des effluents gazeux des grandes installations de combustion" présente des données concernant les techniques de réduction des émissions de mercure issues des grandes installations de combustion (GIC). Pour chacune de ces techniques, des estimations de l'investissement nécessaire ainsi que du coût de fonctionnement sont également présentées.
Néanmoins, dans un contexte de multi pollution, du fait d'un manque de données fiables à la fois sur la teneur en mercure des rejets des GIC (avant traitement) et sur les techniques déjà mises en œuvre dans ces installations, nous ne pouvons pousser plus avant l'estimation économique du coûts de la mise en place des meilleurs techniques disponible de traitement des rejets atmosphériques de mercure.
Coût du traitement des déchets et des boues contenant du mercure
Selon INERTEC, le coût d'incinération des déchets contaminés par du mercure ou des composés mercuriques est estimé à 1 000 €.t-1.
Le prix d'enfouissement en centre technique est estimé entre 150 et 250 €.t-1 (en fonction des teneurs de mercure contenues dans les déchets). Néanmoins, à ce prix doit être ajouté celui de la « neutralisation des déchets » estimée à environ 500 €.t-1.
Les deux estimations citées ci dessus ne concernent que le coût de traitement/stockage, le transport des déchets (considérés comme dangereux) doit être considéré en supplément.
L'épandage des boues contenant du mercure reste une solution infiniment moins coûteuse que toutes les autres solutions (incinération, séchage ou mise en décharge) mais cette solution entraîne un transfert de pollution (Miquel, 2001).
Alternatives aux usages
Produits et procédés de substitution
FTE 2005 Importer
Selon l'UNEP (2005), la substitution de produits et de procédés contenant ou utilisant du mercure par des produits ou procédés exempts de mercure pourrait être l'une des mesures préventives susceptibles d'avoir la plus grande incidence sur tous les flux de mercure dans l'économie et l'environnement. Elle pourrait limiter sensiblement les quantités de mercure présentes dans les maisons, dans l'environnement, dans le flux des déchets, dans les émissions des incinérateurs et
dans les décharges. La substitution présente généralement un bon rapport coût efficacité, d'autant plus qu'elle est de plus en plus exigée par le marché.
Industrie du chlore – Minimisation des rejets des installations à cellule à mercure
Selon la Commission européenne (2001b), les installations à cellules à mercure les plus performantes atteignent des pertes totales de mercure dans l'air, dans l'eau et avec les produits, de l'ordre de 0,2 à 0,5 g de mercure par tonne de capacité de chlore, en moyenne annuelle (tableau 4.1) :
Tableau 4.1. Rejet de mercure dans les installations de fabrication de chlore par cellule à mercure (d'après la Commission européenne, 2001b).
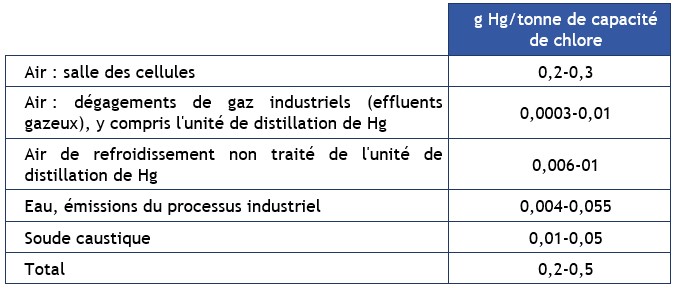
Selon la Commission européenne (2001b), la meilleure technique disponible spécifique à la fabrication de chlore consiste au remplacement des installations à cellules à mercure par la technique de la cellule à membrane.
Néanmoins, pendant la durée de vie restante des installations fonctionnant avec des cellules à mercure, il convient de prendre toutes les mesures qui s'imposent pour protéger l'environnement dans son ensemble, notamment des mesures propres à minimiser les pertes de mercure dans l'air, l'eau et les produits, à savoir :
- utilisation d'équipements et de matériels adéquats et, si possible, un aménagement de l'installation (aménagement par exemple des zones consacrées à certaines activités) qui minimisent les pertes de mercure dues à l'évaporation et/ou à du liquide répandu ;
- des méthodes d'entretien adaptées et un personnel motivé pour travailler selon ces bonnes pratiques ;
- des programmes de maintenance adaptés, avec notamment, une planification des travaux périodiques de maintenance et de réparation ;
- collecte et traitement de tous les effluents gazeux contenant du mercure provenant de toutes les sources possibles, y compris l'hydrogène gazeux ;
- mesures pour minimiser la quantité d'eaux usées (effluents liquides) et traitement de tous les effluents liquides contenant du mercure ;
- réduction des teneurs en mercure dans la soude caustique.
De plus, la majorité des pertes de mercure s'observant via les divers déchets provenant du procédé, il convient de prendre des mesures propres à minimiser les émissions de mercure actuelles et futures provenant de la manutention, du stockage, du traitement et de l'évacuation de ces déchets contenant du mercure :
- mise en œuvre d'un plan de gestion des déchets élaboré après consultation avec les autorités compétentes ;
- mesures propres à minimiser la quantité de déchets mercuriels ;
- recyclage du mercure contenu dans les déchets lorsque cela est possible ;
- traitement des déchets pollués par le mercure pour réduire la teneur en mercure dans ces déchets ;
- stabilisation des déchets résiduels contenant du mercure avant leur évacuation définitive.
Enfin, il convient de prendre des mesures lors de la mise à l'arrêt définitive des installations industrielles de manière à éviter les impacts sur l'environnement avant et après la procédure de fermeture. Ainsi, avant de procéder à la fermeture les questions à aborder sont les suivantes :
- le nettoyage et la démolition des bâtiments ;
- la récupération du mercure ; le traitement et l'évacuation des matériaux provenant du nettoyage général ; les travaux de démolition de l'installation ; la démolition des bâtiments, des tuyaux, etc... ;
- la planification des activités de transport et de démolition ;
- surveillance des émissions de mercure dans l'air et dans l'eau de même que des contrôles sanitaires pour le personnel concerné ;
- le suivi après l'arrêt de l'installation (étude du risque de contamination de l'ensemble du site et de ses environs, y compris le sol, les anciennes décharges de déchets et les sédiments dans les cours d'eau voisins).
Industrie du chlore – remplacement des installations à cellules à mercure
La Commission européenne (2001b) considère que la meilleure technique disponible spécifique aux installations à cellules à mercure consiste à passer à la technique de la cellule à membrane. De même, la décision 90/3 du 14 juin 1990 de la Commission pour la protection de l'environnement marin de l'atlantique du nord est (PARCOM2) recommande la fermeture progressive des installations existantes de production de chlore par le procédé mercure dès que cela est faisable.
Depuis 1987, la quasi totalité des nouvelles installations de chlore alcali dans le monde utilise ce procédé des cellules à membrane. Le remplacement de la capacité actuelle des procédés au mercure et à diaphragme par les cellules à membrane se fait à un rythme lent qui s'explique par la longue durée de vie des installations et aux investissements en équipement élevés que nécessite ce remplacement. Néanmoins, malgré l'investissement important que représente ce changement de process (Commission Européenne, 2001b), les industriels du chlore se sont engagés à bannir la technologie « mercure » du territoire européen au plus tard en 2020 (SHD, 2004 ; Euro Chlor, 2005).
Substitution des combustibles
Plus extrême que les mesures proposées précédemment (choix de combustibles fossiles moins riches en mercure ou traitement de ce combustible) la substitution des combustibles non fossiles (bois, biogaz, biomasse, …) aux combustibles fossiles est également envisageable pour les centrales électriques, les GIC, les chaudières collectives, ...
De façon plus générale, cette réflexion est également valable pour tous types d'utilisations d'énergies renouvelables (biomasse, énergie éolienne, solaire, hydraulique, …) ou non renouvelable (nucléaire) permettant de diminuer le recours aux énergies fossiles libératrices de mercure.
Alternatives à l'utilisation de tubes fluorescents
Selon l'UNEP (2005), les lampes fluorescentes présentent un haut rendement énergétique. Il est donc généralement préférable d'utiliser ce type de lampe au mercure plutôt qu'une lampe à incandescence sans mercure mais à moins bon rendement énergétique.
Néanmoins, pour remplacer ces lampes fluorescentes au mercure, Asari et al. (2008) suggèrent d'encourager le développement de lampes de haute efficacité exempte de mercure en particulier les LED (diodes électroluminescentes).
Coûts de la substitution
Lampes fluorescentes
Comme précisé précédemment, la substitution des lampes fluorescentes à haut rendement énergétique contenant du mercure par des lampes à incandescence sans mercure (et à moins bon rendement énergétique) n'est pas pertinent du point de vue environnemental dans le contexte des pratiques actuelles de production de l'électricité.
Interrupteurs électriques
Le marché européen des interrupteurs électriques contenant du mercure (0,1 g. par interrupteur) est estimé à plus de 1% du marché total des interrupteurs, soit 1% d'un milliard d'euros (Floyd et al., 2002). Néanmoins, ce marché diminue depuis l'apparition d'alternatives technologiques aux interrupteurs à mercure.
De plus, Floyd et al. (2002) estiment que la durée moyenne de vie de tels biens est comprise entre 5 et 10 ans. Cette donnée est à prendre en compte pour évaluer les futurs flux de mercure dans l'environnement suite à l'élimination de ces déchets.
Conclusion
FTE 2005 Importer
Selon l'UNEP (2005), bien que le mercure soit l'un des produits toxiques environnementaux les plus étudiés, il subsiste quelques lacunes dans la compréhension d'un certain nombre de questions globales. Ainsi, un surcroît d'informations pourrait aider à assurer une gestion efficace du mercure (données de base sur les utilisations, les rejets, les concentrations dans les environnements locaux, sur les risques, …).
De plus, d'après Marlière (2003), en l'absence de nouvelles mesures de prévention ou de limitation, les émissions devraient continuer à se réduire mais à un rythme plus modéré que celui observé ces dernières années.
Dans l'hypothèse d'une diminution drastique des rejets à l'horizon 2015 (sans pour autant accroître la quantité de déchets « ultimes » issus du traitement des effluents), il semblerait raisonnable d'encourager, dans un premier temps, les mesures de substitution et dans un second temps pour les produits où la substitution est difficile ou non rentable (lampes fluorescentes, les produits pharmaceutiques, les pièces détachées d'automobiles, …), d'accroître l'efficacité des filières de collecte et de valorisation des déchets contenant du mercure. Il conviendrait en premier lieu d'organiser et/ou renforcer les systèmes de collecte pour les produits contenant du mercure et dont l'utilisation est croissante (en particulier les pièces détachées automobiles).
Le tableau 6.1 présente les différentes options apparaissant les plus favorables à la diminution des rejets environnementaux de mercure. Néanmoins, il faut noter que certaines des mesures proposées sont déjà partiellement (voire totalement dans le cas des pesticides) mises en œuvre.
Tableau 6.1. Préconisations des mesures à adopter vis à vis des différents produits contenant du mercure
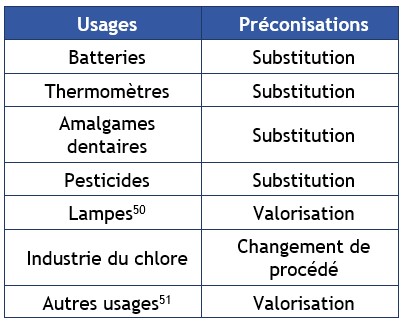
Rappelons qu'à ce jour, la quasi totalité des secteurs responsables d'émissions de mercure dans l'environnement ont déjà appliqué des mesures de traitement des rejets. Cette affirmation souffre d'une exception, les crématoriums, qui rejettent le mercure présent dans les amalgames dentaires. Les quantités de mercure annuellement rejetées par ce processus sont estimées à 3,4 t à l'échelle européenne (Floyd et al., 2002).
[50] Un système de consigne pourrait par exemple être envisagé pour les produits tels que les tubes fluorescents.
[51] Le développement d'une filière spécifique à chaque type de déchet serait à encourager (par exemple, une filière « automobile » dédiée à la récupération des équipements contenant du mercure avant le recyclage des véhicules en fin de vie.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










