Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Chlorpyriphos (2921-88-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
2921-88-2
Nom scientifique (FR)
Chlorpyrifos
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
220-864-4
Code SANDRE
1083
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C9H11Cl3NO3PS }\)
Code InChlKey
Code SMILES
CCOP(=S)(OCC)Oc1nc(Cl)c(Cl)cc1Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H301 |
|---|---|
| Mention du danger - Texte | Toxique en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M |
M=10000 |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M |
M=10000 |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
350.58 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Toxicité à doses répétées
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Le chlorpyrifos est inscrit à l’Annexe VI du règlement (CE) No 1272/2008 mais ne fait pas l’objet d’un classement pour la cancérogenèse | 2022 |
| IARC | FDTE/VTR Importer Le chlorpyrifos n’a pas encore été évalué par le programme IARC Monographs | 2019 |
| US EPA | FDTE/VTR Importer Classe E : Preuve de non-carcinogénicité pour les Humains | 2006 |
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Le chlorpyrifos est inscrit à l’Annexe VI du règlement (CE) No 1272/2008 mais ne fait pas l’objet d’un classement pour la mutagenèse. | 2022 |
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Le chlorpyrifos est inscrit à l’Annexe VI du règlement (CE) No 1272/2008 mais ne fait pas l’objet d’un classement pour la reproduction. | 2022 |
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Effets à seuil - Exposition par voie orale
Etudes chez l'homme - Toxicité sub-aiguë:
Coulston, 1972 (Cité dans le rapport NHRMC, 2016, ATSDR, 1997 et JMPR, 1999)
Type de test:
Hommes volontaires sains (4/dose)
Durée exposition : 20 jours réduite à 9 jours pour la plus forte dose
Administration orale via une capsule de 0 – 0,014 – 0,03 – 0,10 mg.kg-1.j-1
Effets : Inhibition de la cholinestérase (ChE) plasmatique à 0,10 mg.kg-1.j-1 , absence d’observation d’effets cliniques excepté un volontaire à 0,10 mg.kg-1.j-1 (traité pour un rhume)
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de l’activité ChE plasmatique : LOAEL = 0,10 / NOAEL = 0,03
Inhibition de l’activité ChE érythrocytaire : NOAEL = 0,10
Etudes expérimentales - Toxicité aiguë
Marty, 2012
Type de test:
Etude CCA (comparative cholinesterase activity)
Rats juvéniles (8/sexe/dose ; PND11)
Durée : Dose unique
Administration par gavage de 0 – 0,05 – 0,1 – 0,5 – 2 – 5 mg.kg-1.j-1
Pureté : 99,8 %
Effets : Inhibition de la ChE plasmatique et érythrocytaire à partir de 2 mg.kg-1.j-1 ; dans le cerveau à partir de 5 mg.kg-1.j-1
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE érythrocytaire et plasmatique : LOAEL = 2 / NOAEL = 0,05
Inhibition de la ChE dans le cerveau : LOAEL = 5 / NOEL = 2
Etudes expérimentales - Toxicité sub-aiguë
Maurissen, 2000
Type de test:
Etude cognitive (DMTP – Delayed Matching to Position)
Rates (10/dose et groupe satellite 6/dose : ChE)
Durée : 4 semaines
Administration par gavage de 0 – 1 – 3 – 10 mg.kg-1.j-1
Pureté : 98,1 %
Effets : Inhibition (réversible après 4 sem) de la ChE plasmatique et érythrocytaire à partir d’1 mg.kg-1.j-1 ; dans le cerveau à partir de 3 mg.kg-1.j-1
A 10 mg.kg-1.j-1 (pas d’analyse statistique) : salivation, myosis, ↓ de l’activité motrice, signes cliniques non cognitifs (sem 1 et 2)
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE érythrocytaire et plasmatique : LOAEL = 1
Inhibition de la ChE dans le cerveau : LOAEL = 3 / NOEL = 1
Etudes expérimentales - Toxicité sub-chronique
Szabo, 1988 (Cité dans Yano, 2000)
Type de test:
Rat (10/sexe/dose)
Durée : 13 semaines
Administration orale via l’alimentation de 0 – 0,1 – 1 – 5 – 15 mg.kg-1.j-1
Pureté : 95,7 %
Effets : Inhibition de la ChE : plasmatique et érythrocytaire à partir d’1 mg.kg-1.j-1 ; dans le cerveau à partir de 5 mg.kg-1.j-1
A partir de 15 mg.kg-1.j-1 : vacuolisation de la zone fasciculé des glandes surrénales, ↑ du poids corporel et du gain de poids (♂), ↑ poids des reins (♀), du cerveau et du cœur (♂)
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE érythrocytaire : LOAEL = 1 / NOAEL = 0,1
Inhibition de la ChE dans le cerveau : LOAEL = 5 / NOAEL = 1
Etudes expérimentales - Toxicité chronique
McCollister, 1974
Type de test:
Rat (25/sexe/dose)
Durée : 2 ans
Administration orale via l’alimentation de 0 – 0,01 – 0,03 – 0,1 – 1 – 3 mg.kg-1.j-1
Pureté : 97,2 %
Effets : ↓ de l’activité de la Cholinestérase (ChE) érythrocytaire et plasmatique à partir de 1 mg.kg-1.j-1, et dans le cerveau à partir de 3 mg.kg-1.j-1
Pas d’observation d’effets cliniques liés à la variation d’activité ChE
Après 1 an d’exposition et 5-7 sem. de récupération : rétablissement de l’activité ChE
Impossibilité d’évaluer les signes cliniques et la cancérogénicité (manque de données)
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de l’activité ChE érythrocytaire et plasmatique : LOAEL = 1 / NOAEL = 0,1
Inhibition de l’activité ChE (cerveau) : LOAEL = 3 / NOAEL = 1
McCollister, 1974
Type de test:
Chien (4/sexe/dose)
Durée : 2 ans
Administration orale via l’alimentation de 0 – 0,01 – 0,03 – 0,1 – 1 – 3 mg.kg-1.j-1
Pureté : 97,2 %
Effets : Diminution de l’activité ChE dans le plasma, les érythrocytes et dans le cerveau respectivement à partir de 0,03 – 0,1 et 3 mg.kg-1.j-1
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE érythrocytaire : LOAEL = 0,1 / NOAEL = 0,03
Inhibition de la ChE dans le cerveau : LOAEL = 3 / NOAEL = 1
Young, 1988 (Cité dans Yano, 2000)
Type de test:
Rat (60/sexe/dose)
Durée : 2 ans
Administration orale via l’alimentation de 0 – 0,05 – 0,1 – 1 – 10 mg.kg-1.j-1
Pureté : 98,5 %
Effets : Inhibition de l’activité ChE plasmatique et érythrocytaire (♂) à partir de 1 mg.kg-1.j-1 ; érythrocytaire (♀) et dans le cerveau à partir de 10 mg.kg-1.j-1
↓ du poids corporel à 1 mg.kg-1.j-1 chez les mâles et à 10 mg.kg-1.j-1 chez les femelles (sem. 8-53)
↑ du poids des glandes surrénales (vacuolisation de la zone fasciculée) chez les mâles à 10 mg.kg-1.j-1
Absence d’incidence sur les tumeurs
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de l’activité ChE plasmatique et érythrocytaire (♂) : LOAEL = 1 / NOAEL = 0,1
Inhibition de l’activité ChE dans le cerveau et érythrocytaire (♀) : LOAEL = 10 / NOAEL = 1
Crown, 1988 (Cité dans le rapportSanté Canada, 2003)
Type de test:
Rat (60/sexe/dose)
Durée : 2 ans
Administration orale via l’alimentation de 0 – véhicule - 0,2 – 5,0 – 100 ppm (soit, 0 – 0,012 – 0,3 – 6 mg.kg-1.j-1)
Pureté : 96,1 %
Effets : inhibition de la ChE plasmatique (à partir de 0,3 mg.kg-1.j-1), dans le cerveau (à partir de 6 mg.kg-1.j-1) ; inhibition non significative et relation dose mitigé dans les érythrocytes
A 6 mg.kg-1.j-1 : ↓ du poids corporel et ↑ de l’incidence de la cataracte et de l’atrophie diffuse de la rétine.
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE plasmatique : LOAEL = 0,3 / NOAEL = 0,012
Inhibition de la ChE dans le cerveau : LOAEL = 6 / NOAEL = 0,3
Gur, 1991 (Cité dans le rapport US EPA, 1999)
Type de test:
Souris
Durée : 78 semaines
Administration orale via l’alimentation de 0 – 5 – 50 – 250 ppm (soit respectivement pour les mâles et femelles 0 – 0,89 – 8,84 – 45.2 et 0 – 0,93 – 9,79 – 48,1 mg.kg-1.j-1
Pureté : 95,9 %
Effets :
A partir de 0,9 mg.kg-1.j-1 : inhibition de la ChE plasmatique
A 45 et 48 mg.kg-1.j-1 : inhibition de la ChE érythrocytaire et dans le cerveau, lésions non néoplasiques (foie et yeux : péricholangite, vacuolisation hépatique centro-lobulaire et kératite), ↓ du poids corporel (chez les mâles les premières semaines), ↓ du poids corporel (♀) et de la consommation
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE plasmatique : LOAEL = 0,9
Inhibition de la ChE érythrocytaire et dans le cerveau LOAEL = 45 (♂) ou 48 (♀) / NOAEL = 9
Etudes expérimentales - Toxicité sur la reproduction
Breslin, 1996 (Cité dans le rapport JMPR, 1999 ; Santé Canada, 2003)
Type de test:
Sur deux générations ( étude BPL – OCDE 416)
Rat (30/sexe/dose)
Durée : respectivement 10 et 12 semaines avant l’accouplement, pour P et F1,
Administration orale via l’alimentation de 0 – 0,1 – 1 – 5 mg.kg-1.j-1
Pureté : 97,8-98,5 %
Effets chez la descendance (D) :
Inhibition de l’activité ChE érythrocytaire (à partir de 0,1 chez les ♂ et d’1 mg.kg-1.j-1 chez les ♀) plasmatique (à partir d’1 mg.kg-1.j-1) et dans le cerveau (à 5 mg.kg-1.j-1)
A 5 mg.kg-1.j-1 : ↓ du gain de poids durant la lactation (F1),de la survie (F1 et F2), et effets sur les glandes surrénales (vacuolisation)
Effets chez les parents (P) :
Inhibition de l’activité ChE érythrocytaire et plasmatique (à partir d’1 mg.kg-1.j-1) et dans le cerveau (à 2 mg.kg-1.j-1)
Glandes surrénales : vacuolisation à 5 mg.kg-1.j-1
Effets sur la reproduction (R) : absence d’effets
NOAEL/LOAEL en mg.kg-1 pc.j-1
LOAELD = 5 Inhibition ChE érythrocytaire
NOAELD = 1 Inhibition ChE (cerveau)
NOAELP = 0,1 Inhibition ChE érythrocytaire
NOAELP = 1 Inhibition ChE (cerveau)
NOAELR = 5 Absence d’effet sur la reproduction
Etudes expérimentales - Toxicité développementale
Hoberman, 1998 (Cité dans le rapport Santé Canada, 2003)
Type de test:
Sur la neurotoxicité développementale
Rates gestantes (25 /dose ; groupe satellite : 5/dose)
Durée : JG6 -JL11 (satellite : dosage ChE à JG20)
Administration par gavage de 0 – 0,3 – 1 – 5 mg.kg-1.j-1
Pureté : 99,8 %
Effets chez la mère (M) :
Inhibition de l’activité de la ChE non évalué statistiquement : plasmatique et érythrocytaire(à partir de 0,3 mg.kg-1.j-1), dans le cerveau (à partir de 1 mg.kg-1.j-1)
A 5 mg.kg-1.j-1 : signes de toxicité ( altération du système nerveux autonome : fasciculation, hyperactivité, hyperpnée),
Effets sur le développement (D) :
A 5 mg.kg-1.j-1 : ↓ du poids corporel, de la viabilité de la portée, maturation sexuelle retardé
Pas d’effets significatifs sur la mémoire, l’apprentissage ou d’anormalité morphologique
Présentation statistique inadéquate pour une évaluation des effets toxiques
NOAEL/LOAEL en mg.kg-1 pc.j-1
Effets sur le neurodéveloppement : LOAELD provisoire= 5 / NOAELD provisoire= 1
Inhibition de l’activité de la ChE plasmatique et érythrocytaire : LOAEL M = 0,3
Deacon, 1980 (Cité dans le rapport JMPR, 1999)
Type de test:
Sur le développement
Souris (40-47souris gestante/dose)
Durée : JG6-JG15
Administration par gavage de 0 – 1 – 10 – 25 mg.kg-1.j-1
Pureté : 96,8 %
Effets sur le développement (D) :
A 1 mg.kg-1.j-1 : ↑ des malformations (↓ de la fusion des sternèbres, ↑ exencéphalie)
A partir de 10 mg.kg-1.j-1 : inhibition de la ChE fœtale
A 25 mg.kg-1.j-1 ↓ du poids corporel, de la longueur cranio-caudale, ↑ de variantes squelettiques mineures (retard ossification os du crâne, des sternèbres, et augmentation de sternèbres non fusionnées)
Effets chez la mère (M) :
↓ du niveau de ChE plasmatique (à partir de 1 mg.kg-1.j-1), érythrocytaire (réversible à 1 mais pas à 10 mg.kg-1.j-1)
Signes cholinergiques à 10 mg.kg-1.j-1 (salivation excessive) et à 25 mg.kg-1.j-1 (tremblement, ataxie, léthargie, pelage imbibé d’urine)
A 25 mg.kg-1.j-1 : ↑ de la mortalité, ↓ du gain de poids, de la consommation alimentaire et d’eau
NOAEL/LOAEL en mg.kg-1 pc.j-1
Malformations : LOAELD = 10 / NOAELD = 1
Inhibition de l’activité ChE érythrocytaire : LOAEL M = 10 Et NOAELM = 1
Deacon, 1980 (Cité dans le rapport JMPR, 1999)
Type de test:
Sur le développement
Souris (35-41 souris gestante/dose)
Durée : JG6-JG15
Administration par gavage de 0 - 0,1 – 1 - 10 mg.kg-1.j-1
Pureté : 96,8 %
Effets sur le développement (D)
↓ Retard d’ossification des os du crâne à partir d’1 mg.kg-1.j-1 et ↓ Retard d’ossification des sternèbres à 10 mg.kg- 1.j-1
Pas de malformations significatives
Effets chez la mère (M) : inhibition de la ChE érythrocytaire et plasmatique à partir d’1 mg.kg-1.j-1
NOAEL/LOAEL en mg.kg-1 pc.j-1
Absence de malformations : NOAELD = 10
Inhibition de l’activité ChE érythrocytaire : LOAEL M = 1 Et NOAELM = 0,1
Etude de neurotoxicité
Zheng, 2000
Type de test:
Etude de neurotoxicité
Rat (5-7 rats mâles âgés de 7 jours/dose et 5-7 rats ou rates âgés de 90 jours/dose)
Durée : 14 jours
Administration par gavage de 0 – véhicule – 0,15 – 0,45 – 0,75 -1,5 – 4,5 – 7,5 -15 mg.kg-1.j-1
Pureté : >98 %
Effets chez les adultes (A) : ↓ de l’activité ChE érythrocytaire (à partir de 0,45 mg.kg-1.j-1), plasmatique (à partir de 0,75 mg.kg-1.j-1), et dans le cerveau (à partir de 4,5 mg.kg-1.j-1), signes de contractions involontaires (à partir de 15 mg.kg-1.j-1)
Effets chez les nouveaux nés (NN) : Inhibition de la ChE érythrocytaire, plasmatique et dans le cerveau à partir d’1,5 mg.kg-1.j-1, ↓ du poids corporel à partir de 4,5 mg.kg-1.j-1, signes de contractions involontaires à partir de 7,5 mg.kg-1.j-1
NOAEL/LOAEL en mg.kg-1 pc.j-1
Inhibition de la ChE érythrocytaire LOELA = 0,45 / NOAELA= 0,15
Inhibition de la ChE érythrocytaire, plasmatique et dans le cerveau LOELNN = 1,5 / NOAELNN= 0,75
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 3 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos (ATSDR, 1997).
La valeur repose sur une étude 20 jours menée chez le volontaire sain au cours de laquelle les volontaires (4/dose) ont été exposés aux doses de 0 – 0,014 – 0,03 – 0,10 mg.kg pc-1. j-1 ({Coulston, 1972}). La durée d’exposition a été limitée à 9 jours pour les volontaires exposés à la plus forte dose. L’effet critique retenu est une inhibition de la cholinestérase plasmatique survenant à 0,10 mg.kg pc-1.j-1. La dose critique retenue est le NOAEL de 0,03 mg.kg pc-1.j-1.
Facteurs d’incertitude : un facteur d’incertitude de 10 a été appliqué pour tenir compte de la variabilité intra-espèce.
Calcul : 0,03 mg.kg pc-1.j-1 X 1/10 = 0,003 mg.kg pc-1.j-1 soit 3 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 3 µg.kg pc-1. j-1 pour une exposition sub-chronique par voie orale au chlorpyrifos (ATSDR, 1997).
La valeur repose sur une étude 20 jours menée chez le volontaire sain au cours de laquelle les volontaires (4/dose) ont été exposés aux doses de 0 – 0,014 – 0,03 – 0,10 mg.kg pc-1. j-1 ({Coulston, 1972}). La durée d’exposition a été limitée à 9 jours pour les volontaires exposés à la plus forte dose. L’effet critique retenu est une inhibition de la cholinestérase plasmatique survenant à 0,10 mg.kg pc-1.j-1. La dose critique retenue est le NOAEL de 0,03 mg.kg pc-1.j-1.
Facteurs d’incertitude : un facteur d’incertitude de 10 a été appliqué pour tenir compte de la variabilité intra-espèce.
Calcul : 0,03 mg.kg pc-1.j-1 X 1/10 = 0,003 mg.kg pc-1.j-1 soit 3 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose une MRL de 1 µg.kg pc-1.j-1 pour une exposition chronique par voie orale au chlorpyrifos (1997).
Cette valeur se base sur une étude expérimentale menées chez le rat pour une exposition par voie orale aux doses de 0 – 0,01 – 0,03 – 0,1 – 1 - 3,0 mg.kg pc-1.j-1 pendant 2 ans ({McCollister, 1974}). L’effet critique retenu est une inhibition de l’activité cholinestérasique sanguine (plasmatique et érythrocytaire) observée à partir d’1 mg.kg pc-1.j-1 (NOAEL = 0,1 mg.kg pc-1.j-1).
Facteurs d’incertitude : Un facteur de 100 a été appliqué qui correspond à un facteur de 10 pour tenir compte de la variabilité inter-espèce et un facteur de 10 pour tenir compte de la variabilité intra-espèce.
Calcul : 0,1 mg.kg pc-1.j-1 x 1/100 = 0,001 mg.m-3 soit 1 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale :
L’Ineris propose de retenir pour une exposition aiguë au chlorpyrifos la valeur de 3 µg.kg pc-1.j-1 proposé par l’ATSDR (1997)
Cinq organismes proposent des valeurs, l’ATSDR (1997), OMS (JMPR - 1999), Santé Canada (2003), EFSA (2014) et NHMRC (2022). Si la majorité d’entre elles sont proposées pour la population générale, d’autres concernant des sous populations spécifiques de femmes en âge de procréer ou d’enfants sont élaborées par Santé Canada.
L’ensemble des études sélectionnées par ces organismes regroupent des études chez le volontaire sain et des études expérimentales.
Trois des études utilisées ont été réalisées chez l’humain (Coulston et al.,1972 et 2 autres études dont les auteurs ne sont pas précisés). La durée d’exposition de ces études de l’ordre de quelques jours est en adéquation avec la durée d’exposition pour laquelle la VTR est construite. L’étude de Coulston n’a pas été publiée mais elle a été évaluée par plusieurs organismes reconnus et a été considérée comme de qualité recevable. A contrario, l’absence de précision pour deux d’entre elles (OMS et NHMRC) ainsi que des doses critiques élevées (NOAEL de 1 mg.kg pc-1.j-1) ne permet pas de les retenir.
Quatre études expérimentales sont utilisées (Dittenber et al.,1997 ; Hoberman et al.,1988, Zheng et al., 2000 et Marty et al.,2010). Les données disponibles relatives à l’étude de Dittenber retenue par Santé Canada sont insuffisantes pour mener une analyse et la dose critique est élevée (Dittenber et al.,1997). Cette valeur n’est pas retenue. La durée d’exposition de l’étude d’Hoberman est un peu longue couvrant une partie de la gestation et de la lactation soit une période > 1 mois (Hoberman et al.,1988) cette valeur également développée par Santé Canada n’est pas retenue. Les deux autres études menées avec une dose unique d’exposition sont compatibles avec la durée d’exposition d’une VTR aiguë (Zheng et al., 2000 ; Marty et al., 2010). Ces deux études sont de bonne qualité.
L’effet critique retenu pour chacune des valeurs est l’inhibition de la cholinestérase plasmatique et/ou érythrocytaire. Cet effet qui est mesuré chez l’adulte volontaire sains ou chez le jeune rat pour les deux études expérimentales est pertinent puisqu’il est spécifique du mécanisme d’action neurotoxique de la substance.
Concernant les facteurs d’incertitudes utilisés par l’ATSDR, Santé Canada et l’EFSA, les 3 organismes appliquent un facteur prenant en compte la variabilité intra-individuelle (UFH =10). L’EFSA et Santé Canada utilisent également un facteur prenant en compte la variabilité inter-espèces ce qui est indispensable lors de l’utilisation d’études expérimentales. Enfin, Santé Canada applique un facteur supplémentaire pour la sensibilité des nouveau-nés dans le cadre de la construction d’une valeur spécifique pour les enfants de < 12 ans ce qui est cohérent bien que protecteur.
Au total, un facteur de 1 000 est appliqué à la valeur proposée par Santé Canada ce qui est assez élevé, la valeur proposée par Santé Canada n’est pas retenue.
Enfin, la valeur proposée par l’ATSDR est basée sur une étude menée chez le volontaire sain et la dose critique retenue est un NOAEL = 0,03 mg.kg pc-1.j-1 alors que la valeur proposée par l’EFSA est construite sur une étude chez l’animal à partir d’un NOAEL de 0,5 mg.kg pc-1.j-1. la valeur proposée par l’ATSDR apparait plus pertinente que celle de l’EFSA et est retenue.
Indice de confiance : Moyen en raison de la qualité, de la pertinence de l’étude ainsi que de l’ensemble des données disponibles présentant quelques limites par rapport au scénario d’exposition
Effets à seuil - Exposition sub-chronique par voie orale :
L’Ineris propose de retenir pour une exposition sub-chronique au chlorpyrifos par voie orale la VTR de 3 µg.kg pc-1.j-1 de l’ATSDR (1997).
Seul l’ATSDR propose une valeur pour une exposition sub-chronique par voie orale au chlorpyrifos celle-ci est fondée sur une étude de 20 jours réalisée chez 16 volontaires sains (Coulston,1972).
Cette étude n’a pas été publiée mais elle est suffisamment détaillée par l’ATSDR dans son rapport et par l’US EPA (1984) et l’on considéré comme étant de bonne qualité. De plus celle-ci est réalisée chez l’homme exposé par voie orale ce qui pertinent. Cependant, la durée d’exposition à la plus forte dose (9 jours) est assez courte pour construire une VTR spécifique d’une exposition sub-chronique. L’effet critique correspondant à l’inhibition de la cholinestérase plasmatique est représentatif des effets de la substance. La dose critique associée est le NOAEL de 0,03 mg.kg pc-1.j-1. Le facteur d’incertitude 10 appliqué est pertinent puisqu’il prend en compte la variabilité intra-individuelle chez l’Homme. Néanmoins, l’organisme aurait pu aussi appliquer un facteur d’incertitude pour la prise en compte de la différence entre la durée d’exposition de l’étude et celle de la VTR.
La qualité de l’étude et le modèle expérimental utilisé conduisent à retenir cette valeur proposée par l’ATSDR.
Indice de confiance : Moyen. Il s’agit d’une valeur de bonne qualité mais présentant quelques limites par rapport au scénario d’exposition.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique au chlorpyrifos par voie orale la VTR construite par l’ATSDR de 1 µg.kg pc-1.j-1 (2010)
Six organismes ont élaboré des valeurs pour une exposition chronique au chlorpyrifos (ATSDR, 1997 ; JMPR, 1999 ; Santé Canada, 2003 ; OEHHA, 2010 ; EFSA, 2014 et NHMRC,2022). Si la majorité d’entre elles sont proposées pour la population générale, d’autres concernant des sous populations spécifiques de femmes en âge de procréer ou d’enfants sont élaborées par Santé Canada.
L’ensemble des études sélectionnées par ces organismes regroupent des études chez le volontaire sain et des études expérimentales.
Le NHMRC base sa valeur sur l’étude de Coulston menée pendant 20 jours chez le volontaire sain ; cette durée est trop courte pour l’élaboration d’une valeur pour une exposition chronique {Coulston,1972}. Cette valeur n’est pas retenue.
Douze études expérimentales ont été utilisées par les différents organismes. Les études chroniques chez le rat {McCollister, 1974 ; Young, 1988 ; Crown,1988}, le chien {McCollister, 1974} et la souris (Gur,1991) sont compatibles avec la construction d’une valeur pour une exposition chronique. Les études d’exposition aigue (Zheng, 2000) et sub aigue (Maurissen, 2000), sont trop courtes pour la construction d’une valeur d’exposition chronique. Les études de développement {Deacon, 1980} ou de neurodéveloppement Hoberman et al., 1998} sont également trop courtes mais elles concernent une population spécifique et leur pertinence est à vérifier. Dans ces conditions la valeur de Santé Canada spécifique aux enfants n’est pas retenue.
Les études de McCollister (1974), Deacon (1980) sont de bonne qualité (catégorie 1 ou 2 cotation de Klimisch). Les études de Gur (1991), Young (1988), Breslin (1991), Crown (1988) et Hoberman, (1998) n’ont pas pu être évaluées.
L’effet critique retenu par l’ensemble des organismes est l’inhibition de l’activité de la cholinestérase (plasmatique, érythrocytaire et/ou cérébrale selon les études choisies). Cet effet est pertinent et spécifique du mécanisme d’action de la substance même s’il est réversible. Toutefois l’activité mesurée dans les érythrocytes semble apparaitre aux plus faibles niveaux de doses dès (0,1 µg.kg pc-1.j-1) tandis que celle cérébrale apparaît aux plus forts niveaux de dose. Le chien serait une espèce plus sensible que le rat. Par conséquent, les valeurs de Santé Canada et de JMPR ne sont pas retenues.
La valeur du JMPR repose à la fois sur l’étude chez le volontaire de courte durée d’exposition et sur plusieurs études expérimentales mais la transparence de cette construction reste limitée. Cette valeur n’est pas retenue. La valeur proposée par Santé Canada pour la population générale avec un NOAEL de 1 mg.kg pc-1.j-1 n’est pas suffisamment protectrice, elle n’est pas retenue.
L’ATSDR, l’OEHHA et l’EFSA retiennent tous les trois la même étude chronique, le même effet critique mais des doses critiques légèrement différentes. Concernant l’application de facteurs d’incertitude l’ATSDR et l’EFSA ont choisi d’appliquer un facteur de 10 pour la prise en compte de la variabilité inter-espèce et de 10 pour la variabilité intra-espèce. Si l’OEHHA retient le même facteur pour la variabilité intra espèce et un facteur équivalent pour la variation inter espèce, il applique un facteur supplémentaire de 10 en raison de l’absence de données sur les juvéniles.
La valeur proposée par l’OEHHA est basée sur des NOEL (0,1 et 0,3 mg.kg pc-1.j-1) et la valeur proposée par l’ATSDR est basée sur un NOAEL (0,1 mg.kg pc-1.j-1). Le choix de la VTR est plus protecteur s’il est basé sur un NOAEL. Enfin, l’OEHHA est le seul organisme ayant intégré au sein de son calcul un facteur d’incertitude pour prendre en compte l’absence d’études sur les animaux juvéniles (facteur d’incertitude de 10) et ainsi construire une VTR plus protectrice pour les enfants. Cette démarche conduit à un facteur d’incertitude total appliqué élevé (UF= 1 000) aboutissant certes à une VTR plus faible que celle de l’ATSDR mais moins sûre.
Au final, si les deux valeurs de l’ATSDR et de l’EFSA sont équivalentes, la construction de l’ATSDR est plus transparente ce qui conduit à préférer cette valeur. Par conséquent, au vu des données existantes, l’Ineris retient la valeur construite par l’ATSDR pour une exposition chronique par voie orale au chlorpyrifos.
Indice de confiance : Moyen. Compte tenu des études récentes des effets critiques neurodéveloppementaux pourraient survenir à des doses plus faibles. Une réévaluation de ces données jusqu’à la proposition d’une nouvelle VTR serait à considérer.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale :
Le JMPR de l’OMS propose une ARfD de 100 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos (JMPR, 1999)
L’organisme ne précise pas l’étude utilisée pour construire cette valeur. Les rares informations fournies indiquent qu’elle a été réalisée chez des volontaires sains auxquels une seule dose de chlorpyrifos a été administrée par voie orale L’effet critique retenu est l’inhibition de l’activité de la cholinestérase érythrocytaire et la dose critique retenue est le NOAEL de 1 mg.kg pc-1. j-1.
Facteurs d’incertitude : Un facteur d’incertitude de 10 a été appliqué sans précision mais il est probable qu’il s’agisse d’un facteur prenant en compte la variabilité intra-individuelle.
Calcul : 1 mg.kg pc-1. j-1 X 1/10 = 0,1 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Santé Canada propose 3 valeurs l’une pour la population générale, les deux autres pour deux populations sensibles spécifiques l’une pour les femmes en âge de procréer et l’autre pour les enfants de moins de 12 ans.
Santé Canada propose une ARfD de 10 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos chez la population générale à l’exception des femmes en âge de procréer (Santé Canada, 2003)
La valeur repose sur deux études de neurotoxicité chez le rat, non publiée ({Dittenber, 1997}). La dose critique choisie est le NOAEL de 1 mg.kg pc-1 sans précision de l’effet critique associé.
Facteurs d’incertitude : un facteur d’incertitude de 100 a été appliqué pour la variabilité inter-espèces (facteur de 10) et pour la variabilité intra-individuelle (facteur de 10).
Calcul : 1 mg.kg pc-1. j-1 X 1/100 = 0,01 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Santé Canada propose une ARfD de 1 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos pour les femmes en âge de procréer (Santé Canada, 2003)
Cette valeur se base sur une étude de toxicité neurodéveloppementale chez le rat exposé aux doses de 0 – 0,3 – 1 – 5 mg.kg-1.j-1 du 6ème jour de gestation au 11ème jour de lactation ({Hoberman, 1998 }). L’effet retenu est une inhibition de l’activité de la cholinestérase plasmatique et érythrocytaire. La dose critique retenue est un LOAEL de 0,3 mg.kg-1. j-1.
Facteurs d’incertitude : un facteur d’incertitude de 300 a été appliqué pour la variabilité inter-espèces (facteur de 10), pour la variabilité intra-individuelle (facteur de 10) et pour l’utilisation d’un LOAEL (facteur de 3)
Calcul : 0,3 mg.kg pc-1. j-1 X 1/300 = 0,001 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Santé Canada propose une ARfD de 0,75 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos chez les enfants (jusqu’à 12 ans)(Santé Canada, 2003)
Cette valeur repose sur une étude chez le rat (nouveau-né et adultes) ayant été exposé aux doses de 0 - 0,15 – 0,45 – 0,75 – 1,5 – 4,5 – 7,5 ou 15 mg.kg pc-1. j-1. Certains animaux (nouveau-nés et adultes) ont été tués 4h après la première dose ({Zheng, 2000}).
L’effet critique retenu est l’inhibition de la cholinestérase érythrocytaire. La dose critique retenue est le NOAEL de 0,75 mg.kg pc-1. j-1 spécifique au nouveau-né.
Facteurs d’incertitude : un facteur d’incertitude de 1 000 a été appliqué pour la variabilité inter et intra-espèces (facteur de 100) ainsi que pour la prise en compte de la sensibilité des nouveau-nés (facteur de 10)
Calcul : 0,75 mg.kg pc-1. j-1 X 1/1 000 = 0,00075 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’EFSA propose une ARfD de 5 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos (EFSA, 2014)
Cette valeur est établie à partir d’une étude comparative sur la cholinestérase menée chez le rat mâles et femelles juvéniles (PND 11) et rat femelle adulte. Les rats ont été exposés à une unique dose de chlorpyrifos qui diffère selon les groupes (0,05 ; 0,1 ; 0,5 ; 2,0 et 10 mg/kg) (Marty et al, 2010. L’effet critique retenu est l’inhibition de la cholinestérase érythrocytaire survenant chez les nouveau nés. La dose critique retenue est le NOAEL de 0,5 mg.kg pc-1. j-1.
Facteurs d’incertitude : un facteur d’incertitude de 100 a été appliqué sans que le détail soit précisé mais il est probable que cela corresponde à des facteurs prenant en compte la variabilité inter et intra-individuelle.
Calcul : 0,5 mg.kg pc-1. j-1 X 1/100 = 0,005 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Le NHMRC propose une ARfD de 100 µg.kg pc-1.j-1 pour une exposition aiguë par voie orale au chlorpyrifos (NHMRC, 2022)
Cette valeur est basée sur une étude par voie orale chez le volontaire sain d’une durée de 3 jours (étude non précisée). L’effet critique retenu est l’inhibition de la cholinestérase érythrocytaire. La dose critique retenue est le NOAEL de 1 mg.kg pc-1. j-1.
Facteurs d’incertitude : un facteur d’incertitude de 10 a été appliqué sans que celui-ci soit précisé mais il semblerait qu’il s’agisse d’un facteur prenant en compte la variabilité intra-individuelle.
Calcul : 1 mg.kg pc-1. j-1 X 1/10 = 0,1 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Effets à seuil - Exposition chronique par voie orale :
Le JMPR propose une ADI de 0-10 µg.kg pc-1.j-1 pour une exposition chronique par voie orale au chlorpyrifos (JMPR, 1999 ; OMS, 2022).
Cette valeur repose sur 4 études expérimentales et 1 étude chez le volontaire sain. L’organisme ne précise pas les études retenues, seulement les types d’étude retenus. Au vu des études et des données rapportées dans son rapport, il est possible qu’il s’agisse des études suivantes : volontaires sains (Coulston, 1972), 2 ans chez le rat (Young, 1988), 2 ans chien (McCollister, 1974),sur la reproduction chez le rat (Breslin, 1991), et sur le développement chez la souris (Deacon, 1979 ; Deacon, 1980).
Pour les études expérimentales chez une espèce animale (rat, souris, et chien), l’effet critique retenu est une inhibition de l’activité cholinestérasique dans le cerveau (NOAEL = 1 mg.kg pc-1.j-1). En revanche, pour l’étude chez l’homme, l’effet critique retenu est une inhibition de l’activité cholinestérasique dans les érythrocytes observée à partir de (NOAEL = 0,1 mg.kg pc-1.j-1).
Facteurs d'incertitude : Pour l’étude chez l’homme, un facteur de 10 a été appliqué, l’organisme n’a ni détaillé, ni justifié ce facteur. Toutefois, il est donc raisonnable de penser que ce facteur équivaut à un facteur de 10 pour la prise en compte de la variabilité intra-espèce.
Pour les études expérimentales menées chez différentes espèces (rat, souris, et chien) un facteur de 100 a été appliqué, l’organisme n’a ni détaillé, ni justifié ce facteur. Toutefois, il est donc raisonnable de penser que ce facteur équivaut à un facteur de 10 pour la prise en compte de la variabilité inter-espèce et un facteur de 10 pour la prise en compte de la variabilité intra-espèce.
Calcul : Etude chez l’homme : 0,1 mg.kg pc-1.j-1 X 1/10 = 0,01 mg.kg pc-1.j-1
Etudes expérimentales : 1 mg.kg pc-1.j-1 X 1/100 = 0,01 mg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
L’OEHHA propose une chRD de 0,1 µg.kg pc-1.j-1 pour une exposition chronique des enfants par voie orale au chlorpyrifos (2010).
Cette valeur repose sur 3 études expérimentales de 2 ans : une étude chez le chien et deux études chez le rat. McCollister et al. (1974) ont exposés des chiens par voie orale aux doses de 0 – 0,01 – 0,03 – 0,1 – 1 – 3 mg.kg-1.j-1. L’effet critique retenu est la diminution de l’activité cholinestérasique dans le plasma et les érythrocytes (NOEL = 0,03 mg.kg pc-1.j-1). Young et al,. (1988) et McCollister et al. (1974) ont exposés des rats par voie orale, respectivement aux doses de 0 – 0,05 – 0,1 – 1 – 10 mg.kg pc-1.j-1 et 0 – 0,01 – 0,03 – 0,1 – 1 – 3 mg.kg-1.j-1. L’effet critique retenu pour ces deux études est également la diminution de l’activité cholinestérasique dans le plasma et les érythrocytes (NOEL = 0,1 mg.kg pc-1.j-1).
Facteurs d'incertitude : Pour l’étude chez le chien, un facteur de 300 a été appliqué qui correspond à un facteur de 3 pour tenir compte de la variabilité inter-espèce (l’organisme considère que le chien est plus sensible que le rat et est possiblement aussi sensible que l’homme), un facteur de 10 pour la variabilité intra-espèce, et un facteur additionnel de 10 pour les enfants afin de considérer l’absence d’études sur des animaux juvéniles.
Pour les études chez le rat, un facteur de 1 000 a été appliqué qui correspond à un facteur de 10 pour tenir compte de la variabilité inter-espèce, un facteur de 10 pour la variabilité intra-espèce, et un facteur additionnel de 10 pour les enfants afin de considérer l’absence d’études sur des animaux juvéniles.
Calcul : Etude chez le chien : 0,03 mg.kg pc-1.j-1 X 1/300 = 0,000 1 mg.kg pc-1.j-1 soit 0,1 µg.kg pc-1.j-1
Etudes chez le rat : 0,1 mg.kg pc-1.j-1 X 1/1 000 = 0,0001 mg.kg pc-1.j-1 soit 0,1 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Santé Canada propose 3 valeurs l’une pour la population générale, les deux autres pour deux populations sensibles spécifiques l’une pour les femmes en âge de procréer et l’autre pour les enfants de moins de 12 ans.
Santé Canada propose une ADI de 10 µg.kg pc-1.j-1 pour une exposition chronique de la population générale (excepté les femmes en âge de procréer) par voie orale au chlorpyrifos (2003).
Cette valeur repose sur 7 études expérimentales menées sur 3 espèces différentes (rat, souris et chien) : une étude chronique de 78 semaine chez la souris ({Gur, 1991}), trois études chroniques de 2 ans chez le rat ({Crown, 1988; McCollister, 1974; Yano, 2000 }), une étude de 2 ans chez le chien ({McCollister, 1974 }), une étude de toxicité sur la reproduction ({Breslin, 1996) et une étude cognitive de 4 semaines chez le rat ({Maurissen, 2000}). L’effet retenu est une inhibition de la cholinestérase avec un NOAEL d’1 mg.kg pc-1.j-1.
Facteurs d'incertitude : Un facteur de 100 a été appliqué qui correspond à un facteur de 10 pour tenir compte de la variabilité inter-espèce et un facteur de 10 pour tenir compte de la variabilité intra-espèce.
Calcul : 1 mg.kg pc-1.j-1 X 1/100 = 0,01 mg.kg pc-1.j-1 soit 10 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Santé Canada propose une ADI de 1 µg.kg pc-1.j-1 pour une exposition chronique des femmes en âge de procréer par voie orale au chlorpyrifos (2003).
Cette valeur se base sur une étude de toxicité neuro-développementale chez le rat exposé aux doses de 0 – 0,3 – 1 – 5 mg.kg-1.j-1 du 6ème jour de gestation au 11ème jour de lactation ({Hoberman, 1998 }). Le mesure de la cholinestérase effectué au 20ème jour de gestation n’aurait pas fait l’objet d’une analyse statistique. L’effet retenu est une inhibition de l’activité de la cholinestérase. Un LOAEL de 0,3 est retenu, ce qui correspond à une diminution de l’activité cholinestérasique dans le plasma et les érythrocytes (diminution supérieure à 40%).
Facteurs d'incertitude : Un facteur de 300 a été appliqué qui correspond à un facteur de 10 pour tenir compte de la variabilité inter-espèce et un facteur de 10 pour tenir compte de la variabilité intra-espèce et un facteur de 3 pour tenir compte de l’utilisation d’un LOAEL.
Calcul : 0,3 mg.kg pc-1.j-1 X 1/300 = 0,001 mg.kg pc-1.j-1 soit 1 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Santé Canada propose une ADI de 0,75 µg.kg pc-1. j-1 pour une exposition chronique des enfants par voie orale au chlorpyrifos (2003).
La valeur repose sur une étude de 14 jours chez des rats exposés aux doses de 0 – 0,15 – 0,45 – 0,75 -1,5 – 4,5 – 7,5 ou 15 mg.kg-1.j-1 ({Zheng, 2000}). L’effet critique retenu est la diminution de l’activité cholinestérasique érythrocytaire. L’étude étant menée chez des nouveau-nés (7 jours) et des adultes (90 jours), cela a abouti à deux NOAEL spécifiques, respectivement 0,75 et 0,15 mg.kg-1.j-1. Pour élaborer une VTR aiguë spécifique pour les enfants, Santé Canada a choisi la valeur de 0,75 mg.kg-1.j-1 (LOAEL = 1,5 mg.kg-1.j-1).
Facteurs d’incertitude : Un facteur de 1 000 a été appliqué qui correspond à un facteur de 10 pour tenir compte de la variabilité inter-espèce, un facteur de 10 pour tenir compte de la variabilité intra-espèce, et un facteur de 10 pour tenir compte de la sensibilité des enfants.
Calcul : 0,75 mg.kg pc-1.j-1 X 1/1 000 = 0,00075 mg.kg pc-1.j-1 soit 0,75 µg.kg pc-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 2921-88-2 |
|---|---|
| SANDRE | 1083 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Classification
R50/53 : Très toxique pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l'environnement aquatique.
S1/2 -S45 -S60 -S61 (Décision de la CEE le 29/04/04 ;http://www.inra.fr/agritox/php/fiches.php). S1/2 : Conserver sous clé et hors de portée des enfants.
Classification et étiquetage : existence de limites de concentration, se référer à la publication correspondante du JOCEE (http://europa.eu.int/eur-lex/lex/fr/index.htm). Textes législatifs de référencePour la réglementation européenne, cette substance active a été révisée positivement en vue de l'inscription à l'annexe I de la directive 91/414/CEE (liste des substances actives dont l'incorporation est autorisée dans les produits phytosanitaires). La décision d'inscription est transcrite dans la directive européenne 2005/72/CE du 21 octobre 2005. Les états membres bénéficient d'un délai s'étalant jusqu'au 31 décembre 2006 pour mettre en conformité leur réglementation nationale Pour la réglementation française, cette substance active est autorisée dans la composition de préparations bénéficiant d'une autorisation de mise sur le marché. En revanche, le traitement des cultures pendant leur floraison est interdit du fait de la dangerosité supposée de cette substance pour les abeilles. |
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Aucun chiffre de production de chlorpyriphos n'a été obtenu (ni à l'échelle mondiale, ni à des échelles plus réduites). Néanmoins, on peut déduire de la consommation en Amérique du Nord, estimée entre 9 000 et 10 000 tonnes par an (HS-SC, 1989 ; EPA, 2000), une estimation grossière des quantités produites mondialement, soit< 100 000 t.an-1.
Selon nos informations, en 2005, aucun site de fabrication européen n'a été recensé.
Place de la substance dans l'économie française
En France, la place du chlorpyriphos dans l'économie est principalement liée à l'usage de cette substance en tant que produit phytosanitaire. Ainsi, en croisant les quantités utilisées (§ 2.2.2) et le prix moyen de vente en 2006 (Bayer CropScience, 2006), il est possible de calculer le coût de l'usage du chlorpyriphos à l'échelle nationale : soit ~ 11 000 k€.an-1 .
Impact économique des mesures de réduction
En France, F. Marlière (2001) a sélectionné certaines cultures représentatives quant à l'usage du chlorpyriphos : le maïs, la vigne et les pêchers.
Sur cette liste restreinte de cultures, une évaluation du coût économique du remplacement du chlorpyriphos par un autre pesticide à même spectre d'action peut être menée (Tableau 5.1 ; ci-après). Les substances de remplacement ainsi que les doses d'application recommandées sont issues de l'index phytosanitaire (ACTA, 2004).
Néanmoins, il faut rappeler que le remplacement d'une substance phytosanitaire par une autre n'est pas sans impact sur l'environnement. Pour cela, le tableau 5.1 synthétise également les informations disponibles sur l'impact potentiel de ces substitutions de substances actives sur l'environnement. Ces évaluations s'effectuent selon trois composantes de l'environnement :
- l'air grâce à une estimation d'impact des substances sur la santé suite à une exposition par voie atmosphèrique (Gouzy et Farret, 2005) ;
- l'eau de surface grâce à une estimation de la potentialité que les substances atteignent l'eau de surface ;
- l'eau souterraine grâce à cette même méthode déclinée au cas des eaux souterraines.
Le tableau 5.1 montre que, sur l'ensemble des usages rapportés, la substitution du chlorpyriphos par un autre produit phytosanitaire pourrait s'effectuer sans augmentation d'impact global sur l'environnement (air, eau de surface et eau souterraine) ainsi que sans surcoût pour le producteur. Dans la très grande majorité des cas, ce remplacement peut même se traduire par un gain qu'on peut estimer en première approche à ~4 €/ha.
Néanmoins, il faut préciser que cette évaluation de l'impact économique des mesures de réduction est purement indicative et dépend en grande partie des informations disponibles sur le prix des substances.
Tab. 5.1. Evaluation du coût économique du remplacement du chlorpyriphos par une autre substance.
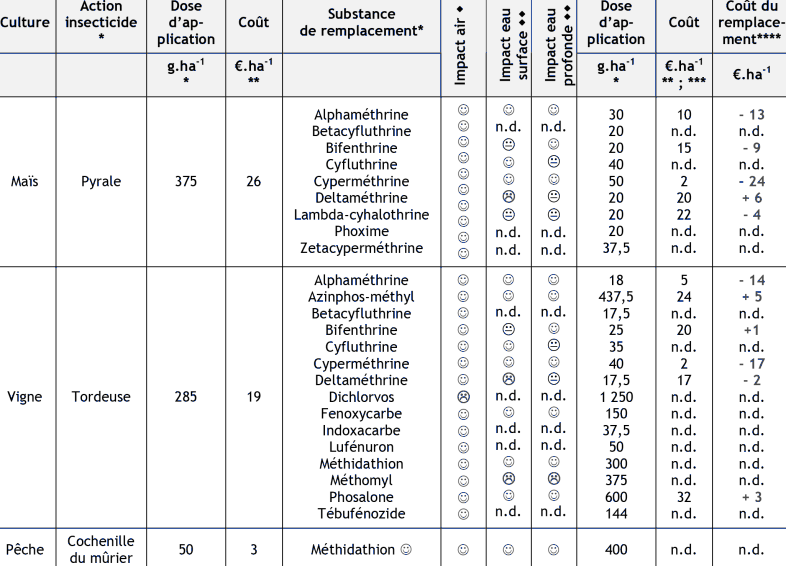
n.c. aucune action autorisée en France sur cette culture ;
n.d. donnée non disponible ;
[*] d'après ACTA (2004) ;
[**] valeur moyenne selon Bayer CropScience Suisse (2006) ; BNIC (com. pers.) et OMS-RBM-UNICEF-PSI-MSH (2004) ;
[***] d'après le Groupe Lorca (prix moyen de la substance ; tarif au 20 octobre 2005) ;
[****] le coût de remplacement ne prend en compte que le prix d'achat des substances.
☺ pour un milieu donné ces substances peuvent être recommandées pour remplacer le chlorpyriphos ;
pour un milieu donné ces substances de remplacement sont équivalentes au chlorpyriphos ;
pour un milieu donné ces substance ne saurait être recommandées pour remplacer le chlorpyriphos.
d'après une estimation d'impact sur la santé humaine par voie atmosphérique (Gouzy et Farret, 2005) ;
d'après le classement « SIRIS » en vue de la surveillance de la qualité des eaux (GT Listes prioritaires, 1995).
Utilisations
Introduction
FTE 2005 Importer
Les seuls usages rapportés pour le chlorpyriphos sont liés à son action de pesticide (EPA, 2000) soit pour un usage agricole2 , soit pour un usage domestique (par exemple les boîtes appât contre les fourmis de la société Baygon) et/ou industriel.
De nos jour, le recours au chlorpyriphos lors de la formulation de nouveaux insecticides est encore d'actualité (sites internet de France-industrie et de Dowagro).
Spécialités commerciales disponibles en France
FTE 2005 Importer
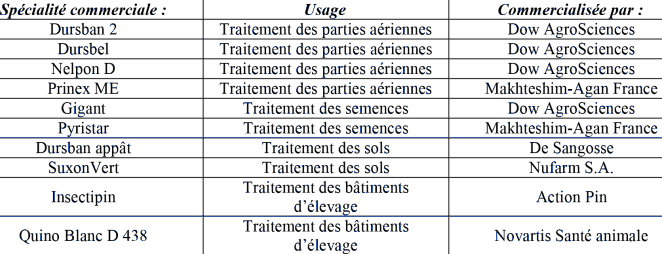
- Chlorpyriphos seul
Les noms d'usage des substances contenant uniquement du chlorpyriphos-éthyl comme substance active sont présentés ci-après au sein du tableau 2.1. Les usages rapportés pour cette substance sont présentés au paragraphe 2.2.
[2] Cet usage regroupe l'usage agricole extérieur (en plein champ) et intérieur (traitement des grains après récolte)c.
Tab. 2.1. Noms d'usage des spécialités et firmes de commercialisation du chlorpyriphos ; d'après (ACTA, 2004).
Usage en mélange
En France, le chlorpyriphos est également utilisé en mélange :
- avec de la cyperméthrine, le pesticide ainsi formulé est préconisé en tant qu'insecticide des parties aériennes des pomme de terre et des vignes (ACTA, 2004). Le tableau 2.2 présente le nom des spécialités commerciales et leurs firmes d'origine.
Tab. 2.2. Noms d'usage des spécialités et firmes de commercialisation du mélange chlorpyriphos et cyperméthrine ; d'après (ACTA, 2004).

- avec du diméthoate, le pesticide ainsi formulé est préconisé en tant qu'insecticide des parties aériennes des vignes, des poiriers-cognassier-nashi et des pommiers (ACTA, 2004). Le tableau 2.3 présente le nom des spécialités commerciales et leurs firmes d'origine.
Tab. 2.3. Noms d'usage des spécialités et firmes de commercialisation du mélange chlorpyriphos et diméthoate ; d'après (ACTA, 2004).

- avec du zetacyperméthrine, le pesticide ainsi formulé est préconisé en tant qu'insecticide des bâtiments d'élevage (ACTA, 2004). Le tableau 2.4 présente le nom des spécialités commerciales et leurs firmes d'origine.
Tab. 2.4. Noms d'usage des spécialités et firmes de commercialisation du mélange chlorpyriphos et zetacyperméthrine ; d'après (ACTA, 2004).

Usage de la substance
FTE 2005 Importer
Le chlorpyriphos est un insecticide utilisé pour le traitement des :
- parties aériennes ;
- des semences ;
- des sols (formulation sous forme de granulés) ;
- des locaux de stockage, des bâtiments d'élevage.
En France, cette substance est utilisée sur divers végétaux :
- les arbres fruitiers (DAR3 : 30 j. ; pêcher, pommier, poirier-cognassier-nashi) ;
- les légumes (DAR : 45 j.) ;
- les vignes (DAR : 21 j.) ;
-…
[3] DAR : Délai d'emploi avant récolte (d'après ACTA, 2004).
Usage quantitatif de la substance
FTE 2005 Importer
Aucun chiffre de consommation à l'échelle européenne et/ou nationale n'a été obtenu. Néanmoins, selon nos informations, la consommation française peut être estimée à environ une centaine de tonnes par an.
Rejets dans l’environnement
Rejets dans l'environnement
FTE 2005 Importer
Pour cette substance aucune source naturelle n'a été identifiée.
Les principales contaminations sont donc limitées aux zones d'utilisation du chlorpyriphos et, dans une moindre mesure, à ses zones de fabrication et/ou de stockage.
Aucun rejet dans l'environnement n'a été rapporté lors de la fabrication du chlorpyriphos ce qui est cohérent avec le fait qu'aucun site de production n'existe en France. Néanmoins, il pourrait s'avérer nécessaire de surveiller les sites de stockage ainsi que les locaux traités par cette substance.
Le chlorpyriphos est rejeté dans l'environnement suite à son usage en tant que pesticide. La principale source de rejets de cette substance dans l'environnement est liée à son application en plein champ. Les rejets générés sont donc multiples et répartis sur l'ensemble du territoire national (notons que cette substance est plus utilisée pour les régions possédant une forte densité de vergers).
Après son application, cette substance se retrouve à la fois dans le compartiment atmosphérique, dans le sol et dans l'eau (la présence de chlorpyriphos dans les sédiments n'a pas été documentée).
Présence environnementale
Synthèse
FTE 2005 Importer
- Chlorpyriphos dans les sols
Suite à l'usage agricole du chlorpyriphos, l'essentiel des quantités de la substance non dirigée vers les plantes atteint, directement ou indirectement, le sol. De plus, une partie des traitements réalisés au chlorpyriphos est réalisée sous forme d'incorporation de granulés (ACTA, 2004).
Sur la base des données disponibles (EPA, 2000), le chlorpyriphos semble se dégrader lentement dans les sols (conditions anaérobiques et/ou aérobiques). Son temps de demi-vie dans le sol est estimé à 35 jours (Gouzy et al., 2005).
A cause de la faible solubilité de cette substance et de sa forte capacité d'adsorption particulaire, un retour potentiel du chlorpyriphos aux eaux de surface ne semble possible que via l'érosion (EPA, 2000).
- Chlorpyriphos dans le compartiment aérien
Le temps de demi-vie dans l'air est faible : < 2 jours (Gouzy et al., 2005). De plus, la volatilisation ne semble pas être une source de dissipation majeure pour le chlorpyriphos : en laboratoire moins de 10% de volatilisation en un mois (EPA, 2000).
La pollution atmosphérique semble donc être une voie d'exposition mineure.
- Chlorpyriphos dans l'eau
Ce produit n'est pas entraîné par lessivage dans le sol. Il est donc peu probable qu'il contamine les eaux souterraines (EDIALUX, 2002).
D'autre part, en France, cette substance n'est pas présente en quantité suffisante pour être identifiée dans les eaux de boisson d'Ile de France (Ministère de la santé et de la protection sociale, 2004).
De même, malgré la rareté des informations françaises sur la présence de chlorpyriphos dans les eaux de surface et les eaux souterraines, on peut estimer que cette substance n'est présente dans ces milieux que de façon exceptionnelle (IFEN, 2002).
Perspectives de réduction
Réduction des rejets
Réduction des émissions industrielles
FTE 2005 Importer
L'usage principalement agricole du chlorpyriphos (d'où de multiples sources de rejets à l'échelle nationale) limite les possibilités de réduction des rejets. En effet, en plein champ, les eaux de ruissellement ne sont récupérées que dans une très faible mesure (aucun traitement n'est donc envisageable).
L'essentiel des possibilités de réduction des rejets passe donc par la réduction ou de meilleures conditions pour l'utilisation de la substance et/ou sa substitution.
Notons néanmoins l'existence de récentes recherches fondamentales visant à identifier des acteurs potentiels de dégradation de cette substance, par exemple, Agdi et al. (2000) rapportent que les diatomées ont la capacité de capturer 95% du chlorpyriphos pour des eaux prises dans différentes conditions physico-chimiques.
A ce jour, aucune application opérationnelle de ces recherches n'est disponible à notre connaissance.
Bien que constituant une voie de rejet très minoritaire (cf. §3.1), les eaux usées ou pluviales polluées par le chlorpyriphos peuvent être traitées en station d'épuration. Selon le site internet de l'agence de l'Eau Seine-Normandie, quand on vise de forts rendements d'élimination, on utilise la technique d'adsorption sur charbon actif. Cependant, ces techniques ont un coût comparativement très élevé et ne sont pas adaptées aux stations non-industrielles de traitement des eaux.
Alternatives aux usages
Produits de substitution
FTE 2005 Importer
Il semble difficile de trouver un unique produit de substitution pour remplacer tous les usages du chlorpyriphos et ce sur l'ensemble des cultures concernées. En revanche, pratique par pratique, des traitements équivalents peuvent être proposés : les correspondances sont listées, par exemple, dans l'index phytosanitaire (publication ACTA remise à jour annuellement).
Ainsi, une éventuelle disparition du chlorpyriphos ne semblerait poser un problème technique que pour la lutte contre les cochenilles (pour contrer ces insectes, à ce jour, seule cette substance est recommandée). Pour les autres types de cultures le chlorpyriphos est un pesticide fréquemment employé (voir 5.1 pour les possibilités détaillées de remplacement).
Conclusion
FTE 2005 Importer
A l'horizon 2015, la suppression des rejets exigée par la DCE semble techniquement possible, en raison du nombre réduit d'usages liés à cette substance et de la disponibilité d'alternatives sans surcoût ni difficulté technique de mise en œuvre. Seules quelques rares difficultés résiduelles pourraient subsister telles que l'usage des stocks anciens de substance, ou certains usages particuliers (contre les cochenilles)…
Au-delà de la question du chlorpyriphos, la substitution d'une substance par d'autres produits phytosanitaires pourrait continuer d'engendrer des problèmes environnementaux. Il conviendrait donc d'inscrire la réduction des rejets de chlorpyrifos dans une démarche générale de réduction de l'emploi des pesticides, et d'évolution vers des molécules moins écotoxiques.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










