Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Chrysène (218-01-9)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
218-01-9
Nom scientifique (FR)
Chrysène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
205-923-4
Code SANDRE
1476
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C18H12 }\)
Code InChlKey
Code SMILES
c1ccc2ccc3c4ccccc4ccc3c2c1
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H341 |
|---|---|
| Mention du danger - Texte | Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Prélèvement
Analyse
Sol
Prélèvement
Analyse
Autres milieux
Prélèvement
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
228.30 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
Dans l'air, le chrysène est principalement présent dans la phase particulaire (HSDB, 2018).
Milieu eau douce
Dans le milieu aquatique, le chrysène est associé à la phase particulaire de la colonne d'eau ou du sédiment. Sa volatilisation à partir des eaux superficielles est faible (HSDB, 2018).
Milieu terrestre
La mobilité du chrysène est très limitée dans les sols (HSDB, 2018). La volatilisation à partir de sols humides ou secs n’est pas un processus significatif (HSDB, 2018).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Le chrysène, comme les autres HAP contenant moins de 5 noyaux aromatiques, est dégradé par les microorganismes, et est facilement métabolisé par les organismes pluricellulaires possédant un système enzymatique à monooxygéases à fonction mixte (Callahan et al., 1979). La biodégradation est probablement plus lente dans les systèmes aquatiques que dans le sol où la densité microbienne est généralement plus élevée. Les eaux contaminées de façon chronique par la présence de chrysène sont généralement plus enclines à biodégrader cette substance (Callahan et al., 1979). Les demi-vies varient de quelques mois à quelques années selon les conditions du milieu récepteur, la concentration à laquelle se trouve la substance à biodégrader et l'acclimatation de la flore bactérienne présente dans la matrice. Ainsi, des demi-vies de l'ordre de 380 jours ont été observées dans des sols sablo-limoneux. Des expériences de biodégradation, menées sur des sables contaminés par des extraits de sols contenant du chrysène et inoculés avec un mélange de microorganismes capables de biodégrader les HAP, ont permis de voir les concentrations de chrysène passer de 50 à 19 mg.kg -1 (Weissenfels et al., 1992). La biodégradation aérobie semble beaucoup plus efficace que la biodégradation anaérobie.
Dégradabilité abiotique
L’hydrolyse du chrysène est négligeable compte tenu de sa structure chimique (HSDB, 2018).
Bioaccumulation
Organismes aquatiques
La bioaccumulation des HAP, et du chrysène en particulier, dépend en grande partie de la capacité des organismes à métaboliser les substances organiques par le biais de leurs systèmes enzymatiques, après leur entrée dans l’organisme. Ainsi, les organismes tels que le phytoplancton, ou encore les mollusques ont plutôt tendance à accumuler les HAP, quand les poissons, qui ont des capacités de métabolisation supérieures présenteront des facteurs de bioconcentration et de bioaccumulation inférieurs (HWC, 1979). Les facteurs de bioconcentration (BCF), de bioaccumulation (BAF) et de bioamplification (BMF) mesurés chez les organismes aquatiques sont variables. La revue la plus récente disponible est celle qui a été réalisée par le RIVM (Verbruggen et van Herwijnen, 2011) et qui résume ainsi les principaux facteurs disponibles après une analyse critique de la fiabilité des études qui leur ont donné naissance.
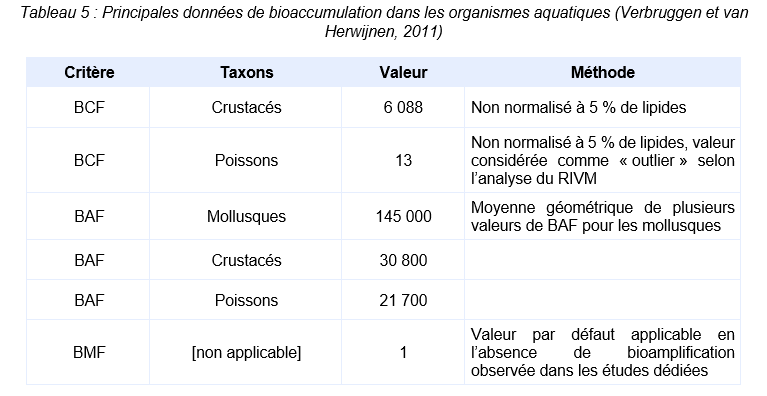
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Des publications rapportent des expérimentations conduites sur la bioaccumulation dans les végétaux du chrysène, mais elles ne sont pas suffisamment satisfaisantes ou détaillées pour permettre d’estimer des facteurs de bioconcentration ou présenter ceux proposés. La Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP 2015 [1] (ADEME, INERIS, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015) ne comporte pas le chrysène dans sa liste des HAP. Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les molécules Organiques Polluantes, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site https://www.ademe.fr/bappop-base-donnees-contamination-plantes-potageres-molecules-organiques-polluantes et fonctionne sur ACCESS.
Bibliographie
Toxicologie
Dernière vérification le 06/11/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1995 ; IARC 1983 ; IARC, 1987, 2010 ; OMS IPCS, 1998 ; US EPA, 1990, 2001). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Seule la substance chrysène est considérée, excluant autant que possible les données relatives à la co-exposition de plusieurs HAP. La plupart des HAP disposent également d’une fiche de données toxicologiques.
Le chrysène se situe dans la classe des HAP de haut poids moléculaire (4 cycles), avec une exposition théorique majoritaire sous forme particulaire.
Toxicocinétique
Chez l'homme
Absorption
Chez l’homme, très peu de données sont disponibles concernant le devenir dans l’organisme du chrysène seul.
Des preuves indirectes de l’absorption du chrysène après inhalation ou contact cutané avec des mélanges de HAP ont été fournies par la détection de HAP, dont le chrysène et ses métabolites, dans des urines de fumeurs (Becher, 1986 ; Yang et al., 2017), d’ouvriers dont l’environnement atmosphérique est contaminé par de fortes concentrations de HAP (Becher et Bjorseth, 1983) ou encore de personnes utilisant des crèmes au goudron de houille (Clonfero et al., 1986).
Distribution
Une étude menée chez 24 femmes a recherché la présence de chrysène, benzo(a)pyrène (B(a)P) et dibenz(a,c)anthracène dans des échantillons de placenta, de lait maternel, de sang maternel et de cordon ombilical (Madhavan et Naidu, 1995). Les concentrations les plus élevées de chrysène ont été détectées dans le lait et le sang de cordon ombilical (de 0,002 à 2,8 ppm). Il a également été détecté dans le lait, le placenta et le cordon ombilical (moyennes respectives de 7,4 – 25,1 – 116 ng.g1 lipides) chez des femmes vivant à Pékin depuis au moins 6 ans et non fumeuses (Yu et al., 2011) ou encore dans le lait de mères italiennes, 0,84 µg.kg-1 de lait (Santonicola et al., 2017).
Métabolisme
Le métabolisme du chrysène n’a pas été spécifiquement étudié chez l’homme.
Néanmoins, l’un de ses métabolites, le 6-hydroxy-chrysène a été dosé dans les urines de sujets sains fumeurs et non-fumeurs (Yang et al., 2017).
Des études in vitro réalisées à partir d’enzymes microsomales hépatiques et pulmonaires d’origine humaine ont montré que les principaux métabolites formés étaient le 3,4-dihydroxy-3,4-dihydrochrysène (ou chrysène-3,4-diol), le chrysène-1,2-diol, ainsi qu’à un moindre degré des phénols, le chrysène -5-6-diol n’étant présent qu’à l’état de traces (Koehl et al., 1996 ; Shimada et Fujii‐Kuriyama, 2004). Les auteurs ont également montré que dans le cas du chrysène l’activation métabolique faisait intervenir les cytochromes P450 de la famille 1 (1A1 et 1B1) par la voie du récepteur Ah (AhR) aussi bien au niveau du foie que des poumons.
D’autres travaux antérieurs in vitro réalisés sur des préparations de peau humaine ont montré que la transformation métabolique du chrysène donnait naissance aux 1,2-, 3,4- et 5,6-dihydrodiol ainsi qu’aux dérivés 1-, 3-, et 4-phénol (Weston et al., 1985). D’autres travaux réalisés sur une lignée de kératinocytes humains (HaCAT) ont confirmé l’activation des cytochromes 1A1 et 1B1 en présence de chrysène. A partir des techniques d’approche métabolomique, une augmentation de 23 métabolites différents a été observée, seule la glutamine étant régulée négativement (Potratz et al., 2016).
Élimination
Aucune donnée spécifique n’a été identifiée. Le chrysène a pu être dosé dans les urines de personnes exposées à des mélanges de HAP par inhalation ou contact cutané.
Des concentrations urinaires de chrysène de 62,6 - 6,9 et < 0,6 ng.L-1 ont respectivement été dosées chez des salariés travaillant dans des raffineries (n=12), au collage de l’asphalte (n=10) ou non professionnellement exposé (n=10) (Campo et al., 2011).
Chez l'animal
Absorption
Les études animales montrent que l’absorption du chrysène est effective après exposition par voie orale, cutanée ou par inhalation. Après administration par voie orale de chrysène (à 1 % dans la nourriture) à des rats, 64 à 87 % de la dose a été éliminée dans les fèces (Chang, 1943).
Distribution
Le chrysène absorbé par voie orale chez le rat est rapidement et largement distribué (Bartosek et al., 1984). Une heure après administration de 22,8 ou 11,4 mg de chrysène dans de l’huile d’olive/animal, des pics de concentration ont été mesurés dans le sang et le foie, la concentration hépatique étant 4 à 10 fois supérieure à la concentration sanguine (Bartosek et al., 1984 ; Modica et al., 1983). La distribution s’est effectuée préférentiellement dans le tissu adipeux, suivie du tissu mammaire, du cerveau, du foie et du sang.
Métabolisme
Des études in vitro réalisées sur des préparations de foie de rats, de peau de souris ont montré que la transformation métabolique du chrysène générait du 1,2-, 3,4- et 5,6-dihydrodiol ainsi que des dérivés 1-, 3-, et 4-phénol (Hodgson et al., 1983 ; Jacob et al., 1982 ; Jacob et al., 1987 ; Jacob et al., 1990 ; Jacob et al., 1996 ; Nordquist et al., 1981 ; Shappell et al., 2003 ; Sims, 1970 ; Weston et al., 1985).
Des transformations métaboliques ultérieures entraînent la formation du dérivé 1,2-dihydrodiol-3,4-époxyde ainsi que du 9-hydroxychrysène 1,2-dihydrodiol-3,4-oxyde qui sont des agents alkylants (Hodgson et al., 1985).
La stimulation de l’activité hépatique des CYP450 de la famille 1 a été observée à partir de l’injection de 3 mg.kg-1 de chrysène par voie intrapéritonéale chez la souris (Peden-Adams et al., 2007).
Élimination
Chez des rats Wistar mâles exposés à une dose unique de 0,22 mg.kg-1 de chrysène, 74 % de la dose administrée a été éliminée en quatre jours dans les fèces et les urines (Grimmer et al., 1988).
Plusieurs métabolites hydroxylés du chrysène (les 1, 2, 3, 4 ou 6 OH-chrysènes) ont été dosés dans les urines de rats exposés 90 jours à une dose de 0,8 mg.kg-1, 3 fois par semaine pendant 90 jours (Grova et al., 2017).
Autre
Relation avec le récepteur AhR :
Sur les modèles in vitro humains ou animaux, le chrysène présente une affinité moyenne pour l’AhR, environ 2 fois plus faible que celle du B(a)P (Barron et al., 2004 ; Jones et Anderson, 1999 ; Misaki et al., 2016 ; Vondráček et al., 2017).
Synthèse
Chez l’homme, très peu de données sont disponibles concernant le devenir dans l’organisme du chrysène seul. L’exposition de sujets à des mélanges de HAP par inhalation ou contact cutané a fourni des preuves indirectes de son absorption. Plusieurs métabolites ont été identifiés à partir de cellules humaines exposées in vitro au chrysène suite à l’induction des cytochromes P450 par la voie de l’AhR. Le chrysène est mesuré notamment au niveau du placenta et du cordon ombilical ainsi que dans le lait maternel et le sang maternel.
Les études chez l’animal montrent que son absorption est effective après exposition par voie orale, cutanée ou par inhalation mais sans quantification disponible. Il est ensuite rapidement et largement distribué préférentiellement dans le tissu adipeux, le tissu mammaire, le cerveau, le foie et le sang. Le chrysène est métabolisé en dérivés dihydrodiols et phénols, avant une élimination par les fèces ou l’urine. Son affinité pour l’AhR (récepteurs aux HAP capables d’induire l’activation des cytochromes P450) est environ deux fois plus faible que celle du B(a)P.
Toxicité aiguë
Chez l'homme
Toutes voies
Chez l’homme, aucune donnée concernant l’effet induit par une exposition aiguë au chrysène n’est disponible.
Synthèse
Aucune donnée sur la toxicité aiguë du chrysène seul chez l’homme n’a été identifiée
Chez l'animal
Inhalation
Aucune donnée n’a été identifiée.
Voie orale
L’administration par voie orale de 100 mg.kg-1.j-1 de chrysène (dans de l’huile d’olive) à des rats Wistar pendant 4 jours a entraîné une induction de l’activité aldéhyde déshydrogénase (Torronen et al., 1981).
Dans le cadre d’une étude d’immunotoxicité aiguë rapportée uniquement sous forme de résumé, des souris BALB/c ont été exposées à une dose unique de 30 – 60 ou 120 µmol.kg-1 de chrysène administré per os. Le traitement n’a pas eu d’effet sur la croissance pondérale ou le poids des organes lymphoïdes (rate et thymus), et seule une hépatomégalie isolée a été observée (augmentation significative (p<0,05) du poids absolu et relatif du foie) chez les souris exposées aux deux plus fortes doses de 60 et 120 µmol.kg-1 (Lee D et al., 2004). Les effets immunosuppresseurs du chrysène ont pu être observés chez des souris exposées par gavage à une dose unique de 0,1 à 100 mg.kg-1 de chrysène 12 heures avant d’être immunisées par une injection intraveineuse de globules rouges de moutons (Silkworth et al., 1995). La diminution, dose-dépendante de la production d’anticorps est indépendante de la voie de l’AhR.
Voie cutanée
Aucune donnée n’a été identifiée.
Autres voies d'exposition
Des effets immunosuppresseurs dans la réponse splénique et la production d’anticorps ont été rapportés suite à l’injection intrapéritonéale d’un mélange HAP de plus de 4 cycles contenant du chrysène chez la souris (Harper et al., 1996).
Ces résultats ont été confirmés sur des souris (Sylvestre) exposées uniquement au chrysène par des injections intrapéritonéales (11 jours) à des doses de 0,3 à 30 mg.kg-1 (Peden-Adams et al., 2007). Les auteurs rapportent en particulier une suppression des plages de lyses (production d’Ac) avec le test PFC dès 0.3 mg.kg-1, mais aussi une réponse positive au test de lymphoprolifération des splénocytes par la Concanavaline A chez les souris exposées à la plus forte dose de 30 mg.kg-1 par comparaison aux souris témoins. Enfin les auteurs rapportent également une altération de la réponse macrophagique dès 3 mg/kg, pouvant contribuer en partie à l’effet immunosuppresseur.
Synthèse
Chez l’animal, l’exposition aiguë au chrysène entraîne des effets hépato- et immuno-toxiques par voie orale, seule voie d’administration usuelle étudiée. L’impact clinique des altérations de la réponse immunitaire chez la souris, indépendantes de la voie de l’AhR, n’a pas été objectivé.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Chez des salariés travaillant dans une fonderie de fer en Pologne (Szczeklik et al., 1994) exposés pendant une durée moyenne de 15 ans à un mélange de HAP comprenant du chrysène, du fluoranthène, du pérylène, du pyrène, du B(a)P, du benz(a)anthracène, du dibenz(a,h)anthracène et du benzo(g,h,i)perylène, des variations des taux d’immunoglobulines sériques ont été observées. La signification biologique de ces effets n’est pas claire et aucune conclusion concernant l’effet spécifique du chrysène n’a pu être établie.
Synthèse
Aucune étude spécifique concernant les effets systémiques du chrysène n’est disponible. Seules des variations des taux d’immunoglobulines sériques ont été observés chez des travailleurs exposés à un mélange d’HAP, dont le chrysène.
Chez l'animal
Toutes voies
Aucune étude relative aux effets d’une exposition répétée au chrysène seul n’est disponible chez l’animal.
Synthèse
Aucune étude relative aux effets d’une exposition répétée au chrysène seul n’est disponible chez l’animal.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1B | 2008 |
| IARC | Groupe 2B: L’agent (ou le mélange) pourrait être cancérogène pour l’homme. | 2010 |
| US EPA | Classe B2: Substance cancérogène possible pour l'homme. Il existe des preuves suffisantes chez l'animal et des preuves non adéquates ou pas de preuve chez l'homme. | 1990 |
Chez l'homme
Inhalation
Aucune étude de cancérogenèse spécifique au chrysène n’est disponible chez l’homme. Cependant, des études épidémiologiques ont montré une augmentation de la mortalité due au cancer du poumon chez les individus exposés aux émissions des fours à coke (Lloyd, 1971 ; Mazumdar et al., 1975) ou aux émissions de goudrons (Hammond et al., 1976). Tous ces mélanges contiennent notamment du B(a)P, du chrysène, du benzo(a)anthracène, du benzo(b)fluoranthène et du dibenzo(a,h)anthracène.
Synthèse
Aucune étude de cancérogenèse spécifique au chrysène n’est disponible chez l’homme.
Chez l'animal
Toutes voies
Chez l’animal, l’effet potentiellement cancérigène du chrysène a été étudié par voie intrapéritonéale ou cutanée.
Inhalation
Aucune étude par inhalation n’a été identifiée chez l’animal.
Voie orale
Aucune étude cancérogénèse par voie orale n’a été identifiée.
Voie cutanée
Plusieurs études rapportent que le chrysène produit des tumeurs de la peau chez des souris après une exposition chronique par voie cutanée (68 à 82 semaines) (IARC 1983).
L’application de solution de chrysène (0,15 %) dans du dodécane ou un mélange (50 :50) de dodécane et de décaline a entraîné une augmentation significative des papillomes et carcinomes par rapport à l’utilisation de décaline seule (Horton et Christian, 1974).
Autres voies d'exposition
Des souris CD-1 ont reçu aux jours 1, 8 et 15 après leur naissance des injections intra-péritonéales de chrysène (dose totale 0, 160 ou 640 µg) et l’incidence des tumeurs a été déterminée chez les souris mortes naturellement ou sacrifiées au terme de l’étude (1 an). Il a été observé chez les souris mâles une augmentation de l’incidence des adénomes et carcinomes du foie dans les deux lots traités (160 ou 640 µg de chrysène), ainsi qu’une augmentation de l’incidence des adénomes pulmonaires à la plus forte dose (Wislocki et al., 1986). Une augmentation de l’incidence des tumeurs hépatiques a également été observée chez des souris Swiss Webster BLU/Ha(ICR) mâles traitées aux jours 1, 8 et 15 après leur naissance par des injections intra-péritonéales de chrysène (dose totale 320 µg dans du diméthyl sulfoxyde) et sacrifiés à 38 ou 42 semaines (Buening et al., 1979). Des effets cancérigènes modérés sur le foie sont également rapportés dans une autre étude pratiquée chez des souris Swiss Webster BLU/Ha(ICR) mâles traitées aux jours 1, 8 et 15 après leur naissance par des injections intra-péritonéales de chrysène (dose totale 320 µg dans du diméthyl sulfoxyde) et sacrifiées à 37 ou 41 semaines. Ces effets ne sont pas retrouvés chez les femelles. Dans cette étude, d’autres lots d’animaux traités avec des métabolites du chrysène, 1,2-dihydrodiol et 1,2-dihydrodiol-3,4-epoxide présentent une augmentation plus importante de l’incidence des tumeurs pulmonaires et/ou hépatiques (Chang et al., 1983). Il semble donc que l’effet cancérigène du chrysène soit principalement lié à la présence de ses métabolites.
Synthèse
Plusieurs études rapportent des tumeurs de la peau chez des souris après une exposition chronique par voie cutanée. Chez la souris, une augmentation de l’incidence des adénomes et carcinomes du foie et des adénomes pulmonaires a été mise en évidence après des injections intra-péritonéales de chrysène.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : Substances préoccupantes du fait qu’elles pourraient induire des mutations héréditaires dans les cellules germinales des êtres humains. |
Chez l'homme
Toutes voies
Aucune étude n’a été identifiée chez l’homme.
Chez l'animal
Toutes voies
Des effets chromosomiques (aberrations et échanges de chromatides sœurs) ont été observés sur les ovocytes de souris et les spermatogonies de hamster après gavage à des doses de 450 et 900 mg.kg-1.j-1 de chrysène (Basler et al., 1977 ; Roszinsky-Köcher et al., 1979) ou encore au niveau du foie, de la rate, des poumons, des reins, de la moelle et du colon (tous les organes examinés) de souris exposées (Yamada et al., 2005).
In vitro
Organismes procaryotes
Le chrysène a donné des résultats positifs sur différentes souches de Salmonella typhimurium dans le test de mutation reverse (Cheung et al., 1993 ; Dunkel et Simmon, 1980 ; LaVoie et al., 1979 ; McCann et al., 1975 ; Sakai et al., 1985 ; Tokiwa, 1981 ; Wood et al., 1977).
Organismes eucaryotes
Un accroissement dose-dépendant des micronoyaux a été observé sur des kératinocytes en culture 4 jours après l’exposition pendant 24 heures à des doses de 0,128 à 50 µg (He et al., 1991). La présence d’ultra-violets (UV) B augmente la fréquence des lésions de l’ADN mises en évidence par le test des comètes dans les kératinocytes humains exposés in vitro au chrysène (Ali et al., 2011).
Les tests sur peau chez la souris sont positifs aussi bien comme initiateur tumoral que comme carcinogène complet (Wynder et Hoffmann, 1959). Dans les tests de transformation, des résultats positifs ont été obtenus à 10 µg.ml-1 sur cellules embryonnaires de hamster alors que sur cellules prostatiques G3HG23 de souris, les résultats sont négatifs (Marquardt et Heidelberger, 1972 ; Pienta et al., 1977). Plus récemment un effet promoteur tumoral a clairement été observé dans le modèle de transformation cellulaire Bhas 42, lignée cellulaire murine transgénique transfectée avec l’oncogène v-Ha-ras, rendant la lignée particulièrement sensible aux agents promoteurs de tumeurs (Asada et al., 2005 ; Misaki et al., 2016).
L’un des métabolites du chrysène, le 1,2-dihydrodiol, possède des propriétés mutagènes in vitro sur des systèmes bactériens ou cellulaires (Cheung et al., 1993 ; Hodgson et al., 1983 ; Levin et al., 1978 ; Wood et al., 1977 ; Wood et al., 1979).
Synthèse
Le potentiel génotoxique du chrysène a été démontré à partir d’études in vivo et in vitro. Des tests in vitro ont également montré une activité photogénotoxique.
Effets sur la reproduction
Chez l'homme
Synthèse
Chez l’homme, aucune donnée n’est disponible concernant les effets sur la reproduction de cette substance.
Chez l'animal
Synthèse
Aucune donnée concernant l’effet du chrysène sur la reproduction n’est disponible chez l’animal.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classée |
Chez l'homme
Synthèse
Aucune donnée concernant l’effet du chrysène sur le développement n’est disponible chez l’homme.
Chez l'animal
Voie orale
L’administration de 60 mg.kg-1 de chrysène par voie orale à des rats au jour 19 de la gestation a provoqué une induction des enzymes à cytochrome P-450 au niveau du foie des fœtus (Welch et al., 1972).
Synthèse
Chez l’animal, par voie orale, l’induction des enzymes à cytochrome P450 a été observée au niveau du foie des fœtus.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets sans seuils
Selon le rapport INERIS (2003), une méthode de calcul est proposée par l’OMS IPCS, sur la base d’une valeur de référence multipliée par un FET (facteur d’équivalence toxique). Le principe du FET est fondé sur les hypothèses selon lesquelles l’organe cible et l’activité toxique sont identiques pour chaque molécule apparentée et qu’il n’y a pas d’interaction toxicocinétique ni toxicodynamique. Une telle approche autorise l’addition des risques cancérigènes liés à une co-exposition et permet de quantifier le pouvoir cancérigène d’un mélange de substances en fonction du pouvoir cancérigène d’une substance dite de référence, appartenant à la même famille chimique (OMS IPCS, 1998).
Néanmoins, comme le rappelle l’AFSSA, 2006, cette approche n’est possible que sous 3 conditions :
- les doses et les effets de chacun des composés du mélange sont additifs,
- il n'existe pas d'interactions antagonistes ou synergiques entre les composés du mélange et
- ils agissent selon le même mécanisme d'action toxique.
Or de nombreuses études expérimentales montrent que ces 3 conditions ne sont pas toujours réunies et peuvent conduire à une surestimation ou à une sous-estimation du risque.
Dans le cas des HAP, la molécule de référence est le B(a)P car c’est le HAP le plus étudié et donc le mieux connu. Le potentiel toxique relatif de chaque HAP dont le chrysène est ensuite évalué par rapport à la toxicité du B(a)P. Un facteur d’équivalence toxique par rapport au B(a)P est alors évalué pour le chrysène. Les FET retenus dans cette approche sont ceux proposés par Nisbet et LaGoy (1992) et sélectionnés dans le document INERIS (2003) .
Un FET de 0,01 a été attribué au chrysène par Nisbet et LaGoy, 1992.
Effets sans seuil - Inhalation
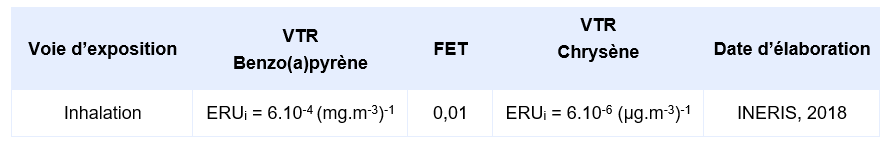
L’OEHHA propose un excès de risque unitaire de 1,1.10-5 (µg.m-3)-1 pour une exposition continue par voie respiratoire au chrysène (OEHHA, 2011).
Le potentiel cancérigène des différents HAP a été établi en référence au B(a)P qui possède une valeur de 1, la valeur du chrysène étant de 0,01 (OEHHA, 1993). L’ERUi du chrysène a donc été obtenu en appliquant ce facteur à l’ERUi de 1,1.10-3 (µg.m-3)-1 déterminé pour le B(a)P par l’OEHHA à partir d’une étude de deux ans réalisée chez des hamsters (Thyssen et al., 1981). Dans cette étude, les hamsters ont été exposés à 0 - 2,2 - 9,5 - 46,5 mg.m-3 de B(a)P, durant 2 ans. Une augmentation dose-dépendante de l'incidence de tumeurs au niveau du tractus respiratoire a été mise en évidence (0/27 - 0/27 – 9/26- 13/25) chez les mâles. A partir de ces données, un modèle multi-étapes linéarisé a été utilisé pour déterminer un excès de risque pour la voie respiratoire du B(a)P de 1,1.10-3 (µg.m-3)-1, en écartant de la modélisation l’incidence de tumeurs observées pour le dernier groupe pour cause de mortalité trop importante au bout d’un an d’expérimentation.
Cet ERUi correspond à une concentration de 0,9 µg.m3 pour un risque de 10-5 ou à une concentration de 0,09 µg.m3 pour un risque de 10-6.
L'INERIS propose un ERUi de 6.10-6 (mg.m-3)-1 pour une exposition chronique par inhalation au chrysène (2018).
Pour une exposition par inhalation à un HAP et en l’absence de valeur spécifique, l’INERIS recommande de prendre en compte l’Excès de Risque Unitaire (ERUi) du B(a)P proposé par l’US EPA, 2017 à savoir 6.10-4 (µg.m-3)-1, et de lui appliquer le FET correspondant à cet HAP. Pour le chrysène, l’INERIS a retenu en 2003 (INERIS, 2003) un FET de 0,01 dérivant de la classification de Nisbet et LaGoy, 1992.
Effets sans seuil - voie orale
Le RIVM propose un CRoral de 5.10-3 mg.kg-1.j-1 pour une exposition par voie orale au chrysène (Baars et al., 2001).
Cette concentration correspond à un excès de risque cancérogène de 1.10-4 pour une exposition continue durant toute la vie. Elle est issue des données d'une étude expérimentale par gavage au B(a)P chez le rat (0, 3, 10 et 30 mg.kg-1.j-1 durant 2 ans, 5 j.sem-1) (Kroese et al., 1999). Une augmentation dose-dépendante de l'incidence de tumeurs a été observée dans de nombreux organes et tissus, notamment le foie et l'estomac, et également l'œsophage, la peau, la glande mammaire, le canal auditif, la cavité orale, l'intestin grêle et les reins.
A l’aide des deux valeurs, la VTR du B(a)P de 0,5 µg.kg-1.j-1 pour un excès de risque cancérigène de 1.10-4 et le FET de 0,01 attribué au chrysène, un CRoral de 50 µg.kg-1.j-1 pour un excès de risque cancérigène de 1.10-4 a été calculé pour le chrysène.
Selon le RIVM, la fiabilité de cette valeur est élevée.
L’OEHHA propose un ERUo de 2,0 (mg.kg-1.j-1)-1 pour une exposition au chrysène par voie orale (OEHHA, 2011).
Cette valeur a été obtenue à partir des études de Buening et al., 1979 et Chang et al., 1983 dans lesquelles l’incidence des tumeurs hépatiques a été augmentée après administration par voie intrapéritonéale de chrysène à des souris mâles nouveau-nés. Une extrapolation par un modèle multi-étapes linéarisé a permis de déterminer un potentiel cancérigène pour la voie intrapéritonéale de 150 (mg.kg-1.j-1)-1. La conversion de la voie intrapéritonéale à la voie orale a été basée sur les données
L’ANSES propose de retenir une valeur de 0,005 µg TEQ.kg-1.j-1(Un excès de risque de cancer de 10-6 calculé sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1) pour une exposition à 11 HAP (ANSES, 2016).
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le B(a)P. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM.
Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
Pour les autres HAP, l’AFSSA recommande l’utilisation de FET basés sur le pouvoir cancérigène relatif des HAP. Dans le cadre de l’étude sur l’alimentation totale infantile, l’ANSES (2016) a considéré 11 HAP (benzo(a)anthracène, B(a)P, benzo(b)fluoranthène, chrysène, benzo(g,h,i)perylène, benzo(k)fluoranthène, dibenzo(a,h)anthracène, indeno(1,2,3-c,d)pyrène, anthracène, benzo(j)fluoranthène et fluoranthène) les plus toxiques et les plus représentatifs de la contamination alimentaire. L’ANSES (2016) a alors considéré qu’il était possible de calculer un excès de risque de cancer de 10-6 sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1 (RIVM 2001). Cette DVS a été établie sur la base d’apparition de tumeurs dans de nombreux organes (dont principalement le foie et le pré-estomac) observée au cours d’une étude réalisée chez le rat exposé par gavage pendant 2 ans au B(a)P.
L’INERIS propose un ERUO de 10-2 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au chrysène (INERIS, 2018).
Comme précisé ci-dessus, l'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le
29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le B(a)P. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
En 2003, l’INERIS retenait la proposition de l’AFSSA (2003) et proposait donc pour le B(a)P l’utilisation de la valeur établie par le RIVM, soit une DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, ce qui correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
En 2018, suite à la réévaluation de la valeur de l’US EPA pour le B(a)P décrite dans la fiche de données toxicologique et environnementale du B(a)P, l’INERIS propose de modifier sa valeur. Cette valeur est basée sur celle proposée par l’US EPA (2017) et retenue par l’INERIS pour le B(a)P à savoir
1 (mg.kg-1.j-1)-1. A partir de cette valeur une approche par l’application de FET a été réalisée.

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets sans seuil - Inhalation
L’Ineris propose de retenir pour une exposition chronique au chrysène par inhalation la VTR chronique de 6.10-6 (µg.m-3)-1 de Ineris (2018).
En ce qui concerne les effets sans seuil du chrysène, il n’existe pas de VTR propre au composé.
L’OEHHA et l’INERIS proposent deux valeurs, toutes deux construites, à partir d’une même approche basée sur l’utilisation du FET du chrysène de valeur 0,01 appliqué à la VTR du B(a)P retenue pour chacun des organismes.
La VTR de l’US EPA ayant été retenue pour le B(a)P par l’INERIS en 2018, l’ERUi construit à partir de cette valeur est retenu, à savoir l’ERUi chronique de 6.10-6 (µg.m-3)-1 de l’INERIS.
Pour l’exposition par inhalation la valeur retenue est celle proposée par l’INERIS en 2018.
Indice de confiance : Faible en raison du peu de données disponibles.
Effets sans seuil - Voie orale
L’INERIS propose de retenir pour une exposition chronique au chrysène par voie orale la VTR chronique de 10-2 (mg.kg-1.j-1)-1 de INERIS (2018).
Quatre valeurs sont disponibles pour l’exposition chronique par voie orale au chrysène, celle du RIVM (2001), de l’OEHHA (2011), de l’Anses (2016) et de l’INERIS (2018).
La valeur construite par l’OEHHA est spécifique du chrysène. Elle est construite sur une étude par voie intrapéritonéale (Buening et al., 1979 ; Chang et al., 1983), voie d’exposition non usuelle qui en limite fortement la portée. Puis, une transposition voie à voie a été réalisée à partir des données sur le B(a)P. Bien que basées sur une étude spécifique au chrysène, la voie d’exposition et la méthode d’extrapolation ne permettent pas de retenir cette valeur.
Les valeurs du RIVM, l’ANSES et l’INERIS sont construites à partir d’une même approche basée sur l’utilisation du FET du chrysène de valeur 0,01 appliqué à l’ERUo du B(a)P. Du fait de la révision en 2017 de la valeur développée pour le B(a)P par l’US EPA, l’INERIS propose une mise à jour de la valeur du chrysène. La valeur de l’ANSES étant plus ancienne, cette mise à jour n’a pas été évaluée.
Pour l’exposition par voie orale la valeur retenue est celle proposée par l’INERIS en 2018.
Indice de confiance : Moyen car les éléments en faveur d’effets cancérogènes sont en cohérence avec TEF.
Informations relatives à l’utilisation des VTR
Seul le chrysène est considéré, la toxicité du chrysène en mélange avec d’autres HAP est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP.
Rappelons que dans le concept de FET permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le B(a)P est la substance de référence à laquelle un potentiel toxique de valeur 1 est arbitrairement donné.
Même si à ce jour il n’existe pas de VTR pour des expositions cutanées, cette voie d’exposition peut ne pas être négligeable.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. De nombreux hydrocarbures aromatiques polycycliques (HAP), parmi lesquels le chrysène, ont fait l’objet d’une évaluation des risques dans le cadre de l’ancien règlement 793/93/EC relatif à la mise sur le marché des « substances existantes ». Cette évaluation est disponible dans un document portant sur les « brais de goudron de houille produits à haute température » (Coal-Tar Pitch, High Temperature, E.C., 2008). Les informations en lien avec l’écotoxicité du chrysène présentées ci-dessous en sont extraites. Il existe également un document plus récent produit par le RIVM (Verbruggen et van Herwijnen, 2011), mais qui reprend les données d’écotoxicité déjà analysées dans l’évaluation des risques européennes. Plus récemment encore, le chrysène a été identifié comme « substance extrêmement préoccupante » (SVHC) dans le cadre du règlement REACH. Il a fait l’objet d’une évaluation réglementaire récente dans ce contexte (ECHA, 2009).
Dangers
Description
Ecotoxicité aquatique
L’hydrosolubilité du chrysène est située aux alentours de 1,6 µg.L-1 (entre 1 et 3,3 µg.L-1, d’après Mackay et al., 2004).
Paramètres d’écotoxicité aiguë

(9) Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
A une concentration proche et en-deçà de l’hydrosolubilité du chrysène, aucun effet significatif n’est observé pour les algues. Lors d’un test aigu réalisé sur Daphnia magna, l’exposition au chrysène (une seule concentration d’exposition testée de 0,7 µg.L-1) a provoqué une mortalité significative des nouveaux-nés (Newsted et Giesy, 1987). Ce taux de mortalité était de 50 % à l’unique concentration testée et mesurée de 0,7 µg.L-1, portant de fait la CE50 à cette concentration (test réalisé sous radiations UV de 24h à 48h).
Paramètres d’écotoxicité chronique
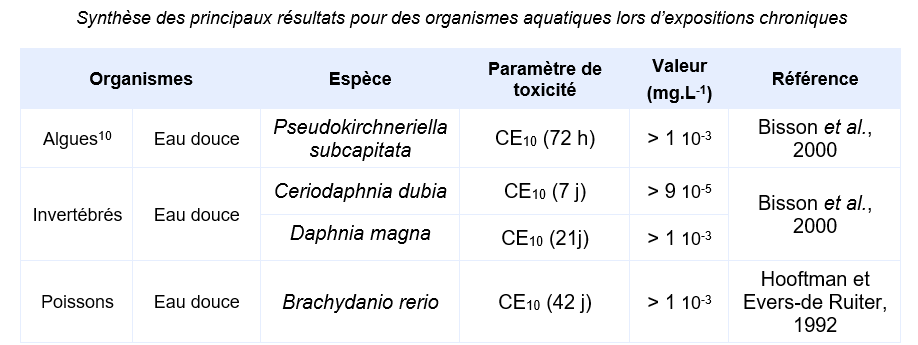
(10) Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
Les tests disponibles réalisés en exposition chronique ne démontrent pas d’effets significatifs aux plus fortes concentrations testées et/ou au-delà de la limite de solubilité de la substance.
Synthèse
Eau marine
Aucune donnée d’écotoxicité sur organismes marins
Sédiments d'eau douce
Aucune donnée expérimentale d’écotoxicité sur organismes sédimentaires n’est disponible pour le chrysène.
Sol
Paramètres d’écotoxicité aiguë
D’après l’évaluation européenne des risques environnementaux, des tests ont été réalisés sur l’arthropode Folsomia candida (Sverdrup et al., 2002 ; Bowmer et al., 1993) et sur l’annélide Eisenia fetida (Bowmer et al., 1993). Aucun effet significatif n’a été observé dans ces études.
Paramètres d’écotoxicité chronique
Aucune donnée valide n'a pu être identifiée dans la littérature consultée.
Biote
Organismes prédateurs (par empoisonnement secondaire)
L’application de faibles concentrations de chrysène (environ 0,1 %) dans 10 µL d’un mélange d’hydrocarbures de pétrole sur des coquilles d’œufs de canard Malard a entraîné des effets embryotoxiques et tératogènes chez les jeunes canards (Hoffmann et Gay, 1981). De nombreuses études sont disponibles dans la section dédiée aux données toxicologiques. Pour autant, aucune NOAEL exploitable pour l’établissement d’une valeur seuil pour l’empoisonnement des prédateurs supérieurs n’est disponible pour le chrysène lui-même.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Organismes aquatiques (colonne d’eau)
Le chrysène est jugé « substance extrêmement préoccupante » (SVHC) dans le cadre du règlement REACH. Il a fait l’objet d’une évaluation réglementaire récente dans ce contexte (ECHA, 2009), qui a conclu à l’impossibilité de déterminer une relation dose effet (et donc une PNEC) pour la protection des organismes aquatiques. La raison invoquée est qu’il existe des données valides pour les 3 taxons, mais pour la plupart sans effet à la limite de solubilité, ce qui ne permet pas de déterminer une dose réponse et donc une valeur seuil. La seule donnée pour laquelle des effets ont été démontrés est celle obtenue au cours d’un essai d’écotoxicité aiguë de Daphnia magna avec exposition à une seule concentration de chrysène. A cette concentration d’exposition de 0,7 µg.L-1, 50 % de l’effectif de daphnies est mort, ce qui permet d’assimiler cette concentration à une CL50. Cet essai ne permet donc pas non plus de montrer une relation dose-réponse. Pour autant, utiliser cette CL50 comme une valeur pire cas permettrait de proposer une PNEC dont l’utilisation à des fins d’évaluation des risques pourrait tout au plus surestimer le risque.
Compte-tenu des informations disponibles, l’INERIS propose donc de déterminer une PNEC en utilisant la plus faible valeur de CL50 disponible à laquelle un facteur d’extrapolation de 10 est appliqué, compte tenu des éléments cités ci-dessus (50 % d’effets sur Daphnia magna à 0,7 µg.L-1 en exposition aiguë, mais pas d’effets sur Ceriodaphnia dubia à 0,09 µg.L-1 en exposition chronique). L’INERIS propose donc d’utiliser la valeur suivante :
PNEC eau douce = 0,7 / 10 = 0,07 µg.L-1
Pour les eaux marines, compte tenu de l’absence de données d’écotoxicité marine par ailleurs, l’INERIS propose d’appliquer le facteur additionnel de 10 à la même donnée d’effet, pour tenir compte des incertitudes additionnelles liées à l’extrapolation en raison de la sous-représentation de taxons clefs et d’une diversité d'espèces plus complexe en milieu marin. L’INERIS propose donc d’utiliser la valeur suivante :
PNEC eau marine = 0,7 / 100 = 0,007 µg.L-1
Ces valeurs, finalement non retenues dans le dossier plus récent de l’ECHA de 2009, sont celles qui avaient été proposées par les Pays-Bas dans leur évaluation des risques européenne dans le cadre de la réglementation 793/93/CE (E.C., 2008).
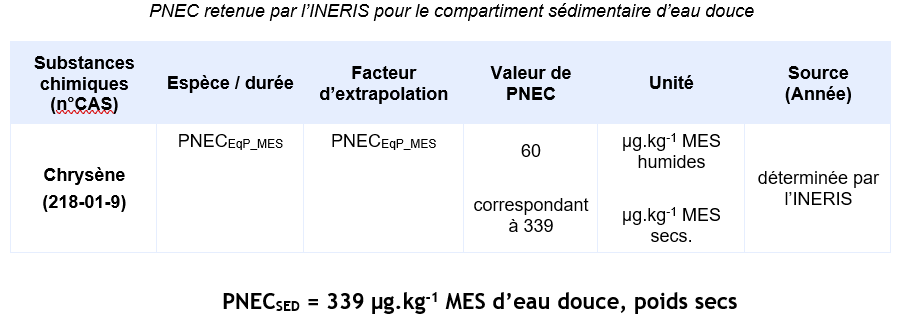
Organismes benthiques
Aucune donnée expérimentale d’écotoxicité sur organismes sédimentaires n’est disponible pour le chrysène. Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (ECHA, 2008). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
PNECmes = (Kmes-eau/RHOmes) x (PNECeau/10) x 1000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1150 kg.m-3)
Kmes-eau : Coefficient de partage entre les MES et l’eau (9 954 m3.m-3) (considérant un log Koc de 5,6)
=Feaumes + Fsolidmes x Kpmes / 1000) x RHOsolid
Feaumes : Fraction d’eau dans le sol (défaut : 0,9 m3.m-3)
Fsolidmes : Fraction solide dans les MES (défaut : 0,1 m3.m-3)
10 : Facteur permettant la prise en compte d’une autre voie d’exposition pour des substances ayant un log Kow > 5, ce qui est le cas du chrysène
D'où : PNECmes = 60,6 µg.kg-1 MES humides correspondant à 339,3 µg.kg-1 MES secs.
PNEC existantes : Il existe une PNEC pour le chrysène dans l’évaluation des risques européenne des HAP, mais qui n’est pas cohérente avec la valeur calculée par l’INERIS ci-dessus selon la méthodologie adéquate. Elle n’est donc pas retenue.
PNEC retenue par l’INERIS :

Organismes terrestres
Aucun effet significatif n’a été observé sur les espèces terrestres testées (Folsomia candida et Eisenia fetida) et seules les informations concernant l’étude de Sverdrup et al. (2002) sont disponibles, indiquant qu’après 21 jours d'exposition, aucun effet n’a été observé sur la reproduction de ces organismes à la plus forte concentration testée, parmi trois, de 1 030 mg.kg-1 de sol en poids sec, portant l’EC50 et l’EC10 au-dessus de cette valeur. Cet essai ne permet donc pas de montrer une relation dose-réponse. Pour autant, utiliser cette valeur comme un pire cas permettrait de proposer une PNEC dont l’utilisation à des fins d’évaluation des risques pourrait tout au plus surestimer le risque.
Compte-tenu des informations disponibles, l’INERIS propose donc de déterminer une PNEC en utilisant la plus forte concentration testée à laquelle aucun effet n’a été observé en exposition chronique, à laquelle un facteur d’extrapolation de 10 est appliqué, compte tenu des éléments cités ci-dessus (plusieurs données sans effets observés en exposition chronique). L’INERIS propose donc d’utiliser la valeur suivante :
PNEC sols = 1030 / 10 = 103 mg.kg-1 poids sec
Organismes prédateurs (par empoisonnement secondaire)
Aucune PNEC pour l’évaluation de l’empoisonnement secondaire n’est disponible dans les évaluations existantes et les données de toxicité disponibles pour les oiseaux et mammifères ne permettent pas de déterminer une valeur.
Synthèse
PNEC eau douce = 0,7 / 10 = 0,07 µg.L-1
PNEC eau marine = 0,7 / 100 = 0,007 µg.L-1
PNEC EqP mes, eau douce = 60,6 µg.kg-1 MES humides correspondant à 339,3 µg.kg-1 MES secs.
PNEC EqP mes, eau marine = 6 µg.kg-1 MES humides correspondant à 33,9 µg.kg-1 MES secs.
PNEC sols = 1030 / 10 = 103 mg.kg-1 poids sec
Valeurs réglementaires
Synthèse
Le chrysène ne figure dans aucune des listes de substances sujettes à la surveillance des écosystèmes dans le contexte de la Directive Cadre sur l’Eau (Directive 2000/60/CE, Directive n° 2013/39/UE, ou arrêtés transposés en droit français (arrêté du 25 janvier 2010 et arrêté du 27 juillet 2018 modifiant l’arrêté du 25 janvier 2010). Aucune valeur de référence réglementaire pour la surveillance des écosystèmes applicable en France n’est donc disponible.
Bibliographie
Archives
Dernière vérification le 06/11/2024
Documents
Exporter la substance
Choisissez le format de l'export :










