Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Tétrachloroéthylène (127-18-4)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
127-18-4
Nom scientifique (FR)
Tétrachloroéthylène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
204-825-9
Code SANDRE
1272
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C2Cl4 }\)
Code InChlKey
Code SMILES
C(=C(CL)CL)(CL)CL
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H411 |
|---|---|
| Mention du danger - Texte | Toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Eau
Analyse
Sol
Analyse
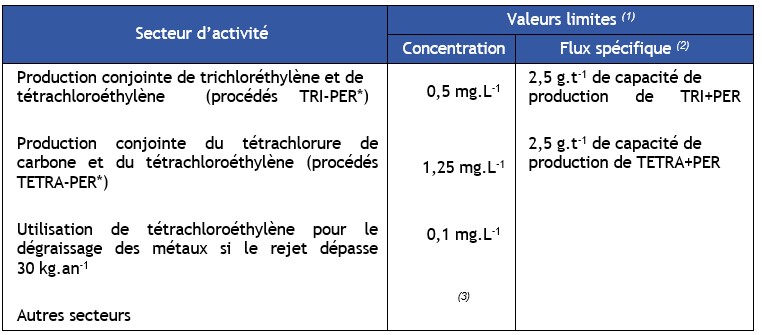
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
165.85 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 30/06/2025
Matrices
Atmosphère
Le tétrachloroéthylène contenu dans les eaux de surface se volatilise rapidement dans l’atmosphère. La volatilisation est d’autant plus rapide que le taux de mélange des eaux est fort, ce qui entraîne de fortes variations dans les taux d’évaporation mesurés. Les demi-vies par évaporation ont été estimées à 5 - 12 jours en étangs, 3 heures à 7 jours en rivières et 3 - 14 jours en lacs (Lyman et al., 1981). En mésocosmes de 13 m3 d’eau douce, les demi-vies ont varié de 11 à 25 jours suivant la saison (Wakeham et al., 1983).
Milieu eau douce
Le tétrachloroéthylène a une solubilité relativement faible dans l’eau. Plus fluide que l’eau, il migre plus rapidement que l’eau en sous-sol. Plus dense que l’eau il peut s’accumuler au fond de l’aquifère. Inversement, en cas de pollution du sous-sol, une grande partie du polluant peut se volatiliser ou se retrouver dans l’air du sol.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Le tétrachloroéthylène s’adsorbe en quantité négligeable dans les sols, il est donc assez mobile dans les sols, et il gagne facilement les eaux souterraines.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Il n’y a pas de biodégradation du tétrachloroéthylène en aérobie. Certaines études montrent une biodégradation en anaérobie mais celle-ci est très dépendante des conditions d’essai.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Dans l’atmosphère, le tétrachloroéthylène est soumis à une photooxydation, sa persistance peut varier entre une demi-vie de deux mois et une dégradation complète en une heure. Les produits de dégradation du tétrachloroéthylène sont le trichloroéthylène, le dichloroéthylène (principalement le cis-1,2) et le chlorure de vinyle.
En milieu aquatique, la dégradation abiotique du tétrachloroéthylène est assez lente. La volatilisation est son principal processus de perte.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Plusieurs essais ont été réalisés sur des poissons. Un BCF de l’ordre de 40 - 50 peut être retenu suite aux essais suivants :
- sur Lepomis macrochirus, BCF = 49 (Barrows et al., 1980)
- sur Oncorhynchus mykiss, BCF = 40 (Neely et al., 1974)
L’accumulation du tetrachloroéthylène dans les poissons est en conséquence peu probable.
Un BCF sur les algues marines de 312 pour Heterosigma akashiwo et de 101 pour Skeletonema costatum a été rapporté par Wang et al., 1996.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucun résultat d’essai valide n’a pu être trouvé dans la littérature.
Bibliographie
Toxicologie
Dernière vérification le 30/06/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1997, 2014, 2019 ; IARC, 1995, 2014 ; OEHHA, 2016 ; US EPA, 2012). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l'information scientifique mais n'ont généralement pas fait l'objet d'un nouvel examen critique par les rédacteurs de cette rubrique.
Toxicocinétique
Chez l'homme
Absorption
La principale voie de pénétration du tétrachloroéthylène dans l'organisme est la voie pulmonaire et, dans une moindre mesure, les voies orale et cutanée (OMS CICAD, 2006).
Inhalation
L'absorption pulmonaire du tétrachloroéthylène est rapide et le passage au niveau sanguin se fait facilement. Chez six volontaires masculins, l'absorption du tétrachloroéthylène, après une exposition de 72 ppm (488 mg.m-3) durant 4 h au repos, a été estimée à 455 mg (intervalle : 370 - 530). Pour une exposition de 144 ppm (976 mg.m-3) durant 4 h, l'absorption a été de 945 mg (intervalle : 670 - 1 210) au repos, et de 1 318 mg (intervalle : 1 060 - 1 510) après la réalisation d'exercices intermittents (100 W, deux fois 30 minutes sur 4 h). La rétention alvéolaire après exposition au repos a été estimée à environ 60 % (Monster et Houtkooper, 1979). L’absorption est de 78 à 93 % chez des volontaires exposés à des concentrations de 340 à 630 mg.m-3 (Benoit et al., 1985).
Voie orale
Par voie orale, aucune donnée spécifique n'est disponible chez l'homme mais, compte tenu des propriétés physico-chimiques du composé et des observations issues des études lors ingestions accidentelles ou volontaires, l'absorption est possible.
Voie cutanée
La pénétration cutanée du tétrachloroéthylène a été étudiée chez l'homme. Cinq volontaires, protégés des vapeurs de tétrachloroéthylène, ont immergé un de leurs pouces dans du tétrachloroéthylène liquide (99 % pureté) durant 40 minutes (Stewart et Dodd, 1964). La concentration moyenne maximale de tétrachloroéthylène dans les alvéoles pulmonaires à la fin de l'exposition a été de 0,31 ppm, tombant à 0,23 ppm deux heures après. Dans une autre étude, six volontaires ont immergé leur avant-bras dans du tétrachloroéthylène liquide. La contribution cutanée est estimée à 0,3 % (exposition à 164 ppm pendant 20 minutes ; coefficient de perméabilité, Kp = 0,054 cm.h-1)(Kezic et al., 2000).
Après une période d'exposition de 3,5 heures à 600 ppm, la pénétration percutanée de vapeurs de tétrachloroéthylène a été estimée à seulement 1 % de ce qui serait absorbé par le tractus respiratoire (Riihimaki et Pfaffl, 1978).
Enfin, les travaux de Poet et al. (Poet et al., 2002) en exposition contrôlée chez l’homme (exposition d’une main dans une terre contaminée à 30 g.L-1) concluent à un flux de 10,1 mg.h‑1 soit 0,021 mg.cm-2.h-1 ce qui permet d’évaluer la contribution de la voie cutanée à 6,1 %.
Distribution
Bien que la distribution du tétrachloroéthylène n'ait pas fait l'objet d'une investigation chez l'homme, il est raisonnable de postuler que, comme chez l'animal, ce composé se répartit dans l'ensemble de l'organisme, avec une préférence pour le SNC et le tissu adipeux, puis le foie, les reins et les poumons. Des cas de décès après exposition au tétrachloroéthylène, ont permis d'obtenir des données sur les concentrations de ce composé au niveau de divers tissus. Le tétrachloroéthylène a été détecté dans le foie (240 mg.kg-1), les reins (71 mg.kg-1), le cerveau (69 mg.kg-1) et les poumons (30 mg.kg-1) d'un travailleur décédé après avoir inhalé de fortes concentrations de ce composé (Levine et al., 1981). Le coefficient de partage sang : air du tétrachloroéthylène chez l'homme est compris entre 10,3 et 14,0 (Hattis et al., 1990 ; Gearhart et al., 1993). Le coefficient de partition graisse : sang est compris entre 125 et 159 chez l'homme (Gearhart et al., 1993 ; Byczkowski et Fisher, 1994). Chez l'homme, la demi-vie du tétrachloroéthylène est estimée à 12 - 16 heures dans les tissus vascularisés, 30 - 40 heures dans les muscles et 55 heures au niveau des tissus adipeux (ATSDR, 1997 ; OMS CICAD, 2006).
Le tétrachloroéthylène a été mesuré dans le lait maternel (Schreiber et al., 2002).
Métabolisme
Chez l'homme, la majeure partie du tétrachloroéthylène inhalé est exhalée telle quelle (OMS CICAD, 2006). La voie principale de dégradation du tétrachloroéthylène fait intervenir une oxydation par les cytochromes P450 et conduit à l'acide trichloroacétique (TCA)(Ikeda et al., 1972 ; Fernandez et al., 1976 ; Ikeda, 1977 ; Monster et al., 1979, Monster et al., 1983 ; Ziglio et al., 1985 ; Skender et al., 1991 ; Popp et al., 1992). A partir d’un certain niveau de dose, encore mal défini, une seconde voie de métabolisation implique la conjugaison du tétrachloroéthylène au glutathion et conduit à la production de métabolites réactifs génotoxiques (acide dichloroacétique, S-(1,2,2-trichlorovinyl-cystéine, S-(1,2,2-trichlorovinyl glutathion (TCVG), N-acétyl trichlorovinyl-cystéine (TCVC)) détectés chez l’homme (Birner et al., 1996). Cette seconde voie peut elle-même être divisée en 2 types de réactions enzymatiques, l’une dépendante de la β-liase, l’autre non. Cependant, le taux de métabolisation reste faible. Quelle que soit la voie d'exposition, seul 1 - 3 % du tétrachloroéthylène absorbé est métabolisé en TCA chez l'homme. Un taux de métabolisation moyen de 13 nmol.min-1.kg-1 a été rapporté (ATSDR, 1997).
Élimination
Le TCA est éliminé par voie urinaire alors que le tétrachloroéthylène non métabolisé est exhalé (Fernandez et al., 1976 ; Monster et Houtkooper, 1979 ; Monster et al., 1979). Son excrétion dans l’air exhalé estimée à partir de modèles pharmacocinétiques serait chez l’homme de 90 à 99 % après une exposition par inhalation et de 81–99 % pour une exposition par voie orale (Chiu et Ginsberg, 2011).
L’excrétion du TCA et du métabolite, N-acétyl-S-(1,2,2-trichlorovinyl)-L-cystéine, est dose dépendante chez 6 volontaires exposés pendant 6 heures à des concentrations de 69 – 140 – 280 mg.m-3 (Volkel et al., 1998). Le N-acétyl-S-(1,2,2-trichlorovinyl)-L-cystéine est rapidement éliminé dans les urines (demi-vie de 14,1 h).
Chez l'animal
Absorption
Les données obtenues chez l'animal confirment le taux d'absorption élevé du tétrachloroéthylène par voie respiratoire ou orale.
Inhalation
Chez le rat, le taux d'absorption pulmonaire est d'environ 40 % à 500 ppm (3,45 g.m-3) et 50 % à 50 ppm (345 mg.m-3) (Dallas et al., 1994a). L'absorption totale de tétrachloroéthylène au bout de 3 h d'exposition était de 79,9 mg.kg-1 à 500 ppm et 11,2 mg.kg-1 à 50 ppm, indiquant une absence de relation avec la concentration inhalée. Les auteurs ont suggéré que l'absorption relative plus importante à 50 ppm qu'à 500 ppm était le reflet d'une saturation du métabolisme du tétrachloroéthylène (Dallas et al., 1994a).
Voie orale
Par voie orale, le tétrachloroéthylène est rapidement et massivement absorbé au niveau du tractus gastro-intestinal (taux d'absorption : 82 – 100 %) chez diverses espèces (rat, chien) (CE, 2001).
Voie cutanée
Par voie cutanée, le taux de pénétration du tétrachloroéthylène liquide a été estimé à 24 nmol.min-1.cm-2 chez la souris (Tsuruta, 1975). Les essais réalisés à partir d’un modèle in vitro de pénétration cutanée ont montré une perméabilité similaire du tétrachloroéthylène sur la peau humaine ou de hamster (Frasch et Barbero, 2009).
Distribution
Une fois absorbé, le tétrachloroéthylène, lipophile, se retrouve préférentiellement dans les graisses et le lait. Des rats exposés à 200 ppm (1 380 mg.m-3) de vapeurs de tétrachloroéthylène durant 5 jours, présentaient un niveau élevé en tétrachloroéthylène au niveau des tissus adipeux, notamment la graisse périrénale. Au niveau de cette dernière, les niveaux étaient 145 fois plus élevés que dans le sang (Savolainen et al., 1977). Après exposition de rats à du tétrachloroéthylène radioactif par gavage (500 mg.kg-1), ce composé a été détecté dans le foie, les reins, la graisse mais pas dans le cerveau (Pegg et al., 1979). Le tétrachloroéthylène traverse la barrière placentaire et se répartit au niveau du fœtus et du liquide amniotique (Ghantous et al., 1986 ; Szakmary et al., 1997). La demi vie plasmatique et la persistance du tétrachloroéthylène dans les tissus est supérieure chez les chiens par rapport au rat, en raison vraisemblablement d’une métabolisation et d’un taux d’élimination plus efficace chez le rat (Dallas et al., 1994b).
Métabolisme
Comme chez l'homme, la voie oxydative conduit à la formation d’un métabolite principal, l'acide trichloroacétique (TCA). La vitesse de métabolisation est plus rapide que chez l'homme, en moyenne de 144 et 710 nmol.min-1.kg-1 respectivement chez le rat et la souris (ATSDR, 1997). Outre le TCA, le métabolisme oxydatif conduit à la formation de monoxyde et dioxyde de carbone et, surtout chez le rat d'acide oxalique (Pegg et al., 1979).
Comme chez l’homme, la seconde voie métabolique, débute par une conjugaison du tétrachloroéthylène au glutathion par la glutathion-S-transférase qui a lieu surtout dans le foie (Dekant et al., 1986). Les métabolites formés, le S-(trichlorovinyl)-glutathion (TCVG), puis le S-(trichlorovinyl)-cystéine (TCVC), sont ultérieurement transportés vers les reins où se poursuit la métabolisation avec in fine la formation d’acide dichloroacétique (Volkel et al., 1998), de N-acétyl-TCVC présents dans les urines (Bartels, 1994). Cette voie est minoritaire à faible dose mais augmenterait après saturation de la voie des cytochromes P450 conduisant au TCA (Green et al., 1990). Cependant, il n’est pas exclu que cette voie soit active avant saturation de la voie oxydative (Chiu et Ginsberg, 2011).
La saturation de la voie oxydative est atteinte entre 6,9 et 69 mg.m-3 chez la souris, alors qu’elle s’observe chez le rat entre 69 et 690 mg.m-3 (OEHHA, 2016).
Élimination
Comme chez l'homme, le tétrachloroéthylène est majoritairement éliminé dans l'air exhalé, sans subir de métabolisation, quelle que soit la voie d'administration. A partir d’un modèle prédictif PBPK, le pourcentage de tétrachloroéthylène exhalé sous forme inchangé serait d’environ 90 à 95 % chez le rat et de 40 à 80 % chez la souris, selon la voie d’exposition et dans des conditions non saturantes (Chiu et Ginsberg, 2011).
Chez le rat, après 6 h d'exposition à 10 ppm (69 mg.m-3) de tétrachloroéthylène radiomarqué, 68 % de la dose absorbée ont été exhalés sous forme de tétrachloroéthylène en 72 heures, 24 % ont été excrétés sous forme de métabolites non volatils dans l'urine, 3,6 % ont été éliminés sous forme de CO2 et 3-4 % sont restés au niveau de la carcasse (Pegg et al., 1979). Un résultat similaire a été observé chez le rat (Pegg et al., 1979 ; Frantz et Watanabe, 1983) et la souris (Schumann et al., 1980) exposés par voie orale. L'étude de l'élimination du tétrachloroéthylène inhalé chez la souris a donné des résultats plus variables, l'élimination se faisant soit majoritairement par les métabolites urinaires (Schumann et al., 1980), soit par exhalation du composé parent (Yllner, 1961). Dans le premier cas, les souris étaient exposées à une faible dose (10 ppm soit 69 mg.m-3 durant 6 h), ce qui suggère que le métabolisme du tétrachloroéthylène et l'élimination urinaire des métabolites sont limités et dose-dépendants (ATSDR, 1997). L’excrétion du TCA, de l’acide dichloroacétique et du N-acétyl-S-(1,2,2-trichlorovinyl)-L-cystéine est dose dépendante chez des rats Wistar exposés jusqu’à 2 800 mg.m-3 pendant 6 heures (Volkel et al., 1998). Le N-acétyl-S-(1,2,2-trichlorovinyl)-L-cystéine est rapidement éliminé dans les urines (demi-vie de 7,5 h). Ces données suggèrent que la formation de glutathion conjugué et l’activation de la S-(1,2,2-trichlorovinyl)-L-cystéine bêta lyase dépendante lors du métabolisme du tétrachloroéthylène sont significativement supérieures chez le rat par rapport à l’homme.
Autre
Mécanisme d'action :
Plusieurs éléments permettent d’affirmer que les métabolites issus aussi bien de la voie oxydative que de la voie du glutathion sont à la fois impliqués dans les mécanismes de toxicité génotoxique et non génotoxique (Cichocki et al., 2016).
L’acide trichloroacétique, métabolite de la voie oxydative du tétrachloroéthylène, est un cancérigène hépatique chez la souris qui pourrait, au moins en partie, expliquer l’incidence d’adénomes et de carcinomes observés au niveau du foie chez la souris exposée au tétrachloroéthylène (Sweeney et al., 2009). La prolifération des peroxysomes (liaison au récepteur nucléaire PPARα) reste l’un des mécanismes envisagés, car très actif chez la souris, mais pas nécessairement transposable à l’homme. Cependant, aux concentrations mesurées, l’acide trichloroacétique ne peut être la seule cause des effets cancérigènes hépatiques. Il semblerait que les effets du tétrachloroéthylène soient également médiés via les métabolites minoritaires avec une action essentiellement locale.
L’IARC considère que deux métabolites issus de la voie du glutathion, le trichlorovinyl glutathion (TCVG) et le N-acétyl-trichlorovinyl-cystéine (Nac-TCVC) sont génotoxiques et que l’acide dichloroacétique issus de la voie d’oxydation par les cytochromes P450 présente une activité qualifiée de faible à modérée. Les autres métabolites du tétrachloroéthylène, de même que le tétrachloroéthylène lui-même ne présente pas (comme l’acide trichloracétique) ou peu d’activité génotoxique (IARC, 2014).
Il a également été mis en évidence la formation d’adduits aux protéines, induits par les métabolites des différentes voies de métabolisme du tétrachloroéthylène : il s’agit de protéines dichloroacétylées dans les mitochondries rénales ou trichloroacétylées dans les mitochondries hépatiques (Pahler et al., 1998). Ces adduits hépatiques ont été détectés par des techniques immunohistochimiques dans la zone centrolobulaire (Green et al., 2001).
Au niveau des reins, l’un des organes cibles de la toxicité du tétrachloroéthylène, la S-(1,2,2-trichlorovinyl)-L-cystéine serait clivée par la bêta lyase en métabolites cytotoxiques et génotoxiques potentiellement à l’origine des tumeurs rénales chez le rat mâle (Green, 1990 ; Green et al., 1990 ; Dekant et al., 1998). En revanche, l’accumulation d’α2-microglobuline ne serait pas déterminante dans le mécanisme d’action conduisant à une cytotoxicité évoluant vers une toxicité rénale chronique de type non cancéreuse. Dans les deux cas, ces mécanismes sont toutefois difficilement transposable à l’homme ; l’activité de la bêta lyase est 10 fois plus faible chez l’homme que chez le rat (Lash et al., 1998; Lash et al., 2001) et la néphropathie induite par l’α2-microglobuline est exclusivement observée chez le rat mâle (Hildebrand et al., 1997).
Concernant les effets neurotoxiques, l’analyse menée par l’ANSES en 2018, considère que le tétrachloroéthylène passe la barrière hémato-encéphalique et placentaire et qu’il est capable d’altérer la structure des phospholipides et des acides aminés au niveau cérébral. Cette substance peut également s’incorporer au niveau des membranes du SNC et ainsi altérer la vitesse de conduction neurale. Ces phénomènes pourraient être à l’origine de la neurotoxicité induite par le PCE. Cependant, le mécanisme d’action n’est pas complètement élucidé. Le tétrachloroéthylène pourrait avoir une activité sur la dopamine qui conduirait à altérer la discrimination des couleurs et la sensibilité aux contrastes. De plus, le tétrachloroéthylène accroît l’activation et diminue l’inactivation des canaux calciques sensibles à la tension ce qui entraine des décalages dans le sens de l’hyperpolarisation. Il provoque également une inhibition proportionnelle à la concentration des récepteurs neuronaux nicotiniques de l’acétylcholine. Enfin, une incidence sur la cognition pourrait être induite par une démyélinisation de l’hippocampe.
Synthèse
Chez l’homme, le tétrachloroéthylène est absorbé par inhalation (78 à 93 %). Une pénétration par voie cutanée est possible par contact avec le tétrachloroéthylène liquide. La distribution est mal connue, la demi-vie est courte et varie en fonction des organes entre 12 et 55 h. Le tétrachloroéthylène est faiblement métabolisé (1 à 3 %) au niveau hépatique en acide trichloroacétique. Le tétrachloroéthylène absorbé est exhalé sous la forme inchangée et les métabolites étant éliminés par voie urinaire.
Chez l’animal, le tétrachloroéthylène est bien absorbé par inhalation (40 à 50 %) et par voie orale (80 à 100 %). Le tétrachloroéthylène se distribue préférentiellement vers les graisses et le lait et est aussi retrouvé dans d’autres organes (foie, rein). Le taux de métabolisation varie en fonction de l’espèce. Le tétrachloroéthylène est métabolisé majoritairement en acide trichloroacétique. Comme chez l’homme, une forte proportion de tétrachloroéthylène est éliminée sous forme inchangée par voie pulmonaire alors que les métabolites sont éliminés par voie urinaire.
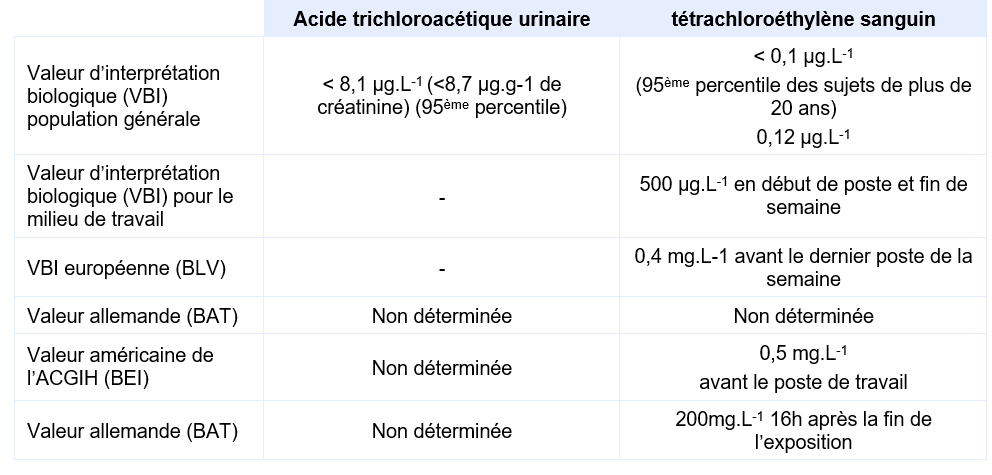
Equivalents biosurveillance
Description
Synthèse des principaux indices biologiques d’exposition (INRS, 2021)
Toxicité aiguë
Chez l'homme
Inhalation
A des concentrations élevées, le tétrachloroéthylène inhalé a des propriétés anesthésiques pouvant s'accompagner de troubles du rythme cardiaque. L'inhalation de fortes quantités peut entraîner un coma (Ferrau et al., 1980 ; Palecek, 1970 ; Stewart, 1969), s'accompagnant parfois d’une dyspnée (Einhorn, 1972 ; Metz et al., 1982 ; Meyer, 1973). Des effets transitoires hépatiques ont parfois été notés (Hake et Stewart, 1977 ; Saland, 1967). Des cas de décès ont été rapportés chez l'homme après inhalation de vapeurs de tétrachloroéthylène (Garnier et al., 1996 ; Levine et al., 1981 ; Lukaszewski, 1979). La mort est attribuée à une dépression du système nerveux central. Dans tous ces cas, les teneurs inhalées n'étaient pas assez précisément connues pour définir une concentration létale chez l'homme (ATSDR, 1997).
Des volontaires, exposés à une dose unique de tétrachloroéthylène (1 060 ppm durant 1 – 2 min, 600 ppm pendant 10 min, 216 - 280 ppm jusqu'à 2 h et 106 ppm durant 1 h), ont présenté une irritation nasale et oculaire, des vertiges et une somnolence au-dessus de 216 ppm, et une altération de la coordination motrice à 280 - 600 ppm. Aucun effet n'a été noté à 106 ppm pendant 1 h, excepté une légère irritation oculaire (Rowe et al., 1952). Cette dose est considérée comme un NOAEL pour l'irritation pulmonaire et comme un LOAEL pour l'irritation oculaire (ATSDR, 1997).
Chez des volontaires exposés à 50 ppm de tétrachloroéthylène durant 4 jours (4 heures par jour), des effets neurologiques oculaires (altération des potentiels évoqués, altération de la coordination motrice et oculaire) ont été observés. Aucun effet n'a été noté à 10 ppm (Altmann et al., 1992).
Chez 10 hommes volontaires, exposés à 0, 20, 100 ou 150 ppm de tétrachloroéthylène durant 5 jours consécutifs pour chaque concentration (1 à 7,5 h/j), aucun symptôme tel que céphalées, nausées, vertiges, irritation des yeux, du nez, de la gorge n'a été noté. Par ailleurs, aucun effet n'a été observé sur les fonctions cardiaque, pulmonaire, hépatique et rénale et au niveau des paramètres sanguins. Une altération de l'électroencéphalogramme, mimant un sommeil léger, a été notée chez trois volontaires sur quatre durant l'exposition à 100 ppm (Stewart et al., 1981). Chez l'homme adulte, la dose de 150 ppm durant 5 jours (7,5 h par jour) est considérée comme une NOAC pour les systèmes respiratoire, cardiaque, sanguin, hépatique et rénal (ATSDR, 1997).
Voie orale
Le tétrachloroéthylène a été très utilisé par voie orale (doses 1 - 13 g) pour lutter contre les vers intestinaux. Ceci suggère une absence de toxicité marquée aux faibles doses. Quelques cas de perte de conscience suite à ce type de traitement ont toutefois été rapportés (Kendrick, 1929 ; Sandground, 1941 ; Wright et al., 1937). Chez certains patients très infestés, des chocs anaphylactiques sévères (Rabbini et al., 1985) et une réaction psychotique aiguë avec hallucinations (Haerer et Udelman, 1964) ont été observés mais semblent plutôt dus aux produits libérés par les parasites morts qu'au traitement en lui-même.
Une ingestion accidentelle chez 19 enfants (entre 1,6 et 4,8 g.kg-1) a provoqué des vomissements (8/19), des saignements gastro-intestinaux (5/19), une arythmie cardiaque (1/19), une narcose (3/19), une anémie modérée (10/19), une augmentation de l'activité des amino-transférases sériques (8/19), une élévation de température (7/19) et un décès (Lemburg et al., 1971).
L’ingestion, toujours accidentelle, de 75 grammes de tétrachloroéthylène a provoqué une sévère nécrose tubulaire rénale, la biopsie 19 jours après l’ingestion ayant révélé l’accumulation de cristaux composés majoritairement de calcium dans la lumière des tubules chez un homme de 32 ans admis dans un état semi-comateux (Choi et al., 2003). Des hémodialyses et traitements adaptés ont permis le retour progressif à une fonction rénale normale.
Voie cutanée
Le contact cutané avec le tétrachloroéthylène peut provoquer des érythèmes voire des œdèmes qui régressent spontanément (Metz et al., 1982 ; Meyer, 1973 ; Morgan, 1969).
Synthèse
Chez l’homme, à forte concentration, le tétrachloroéthylène provoque une dépression du SNC pouvant s’accompagner de difficultés respiratoires ou d’altérations hépatiques transitoires et de troubles cardiaques. En cas d’ingestion accidentelle, des effets digestifs (vomissements et saignements), une nécrose rénale, une anémie modérée et une augmentation des activités enzymatiques hépatiques sont les principaux effets observés.
Chez l'animal
Toutes voies
Le tétrachloroéthylène présente une faible toxicité aiguë quelle que soit la voie d'administration
Inhalation
Chez le rat et la souris, des CL50 comprises entre 3 000 et 5 200 ppm ont été établies pour des expositions entre 4 et 8 h (Bonnet et al., 1980 ; Friberg et al., 1953 ; Gradiski et al., 1978 ; Pozzani et al., 1959). Les symptômes majeurs observés sont une hypotonie musculaire, une somnolence, des tremblements et, pour les cas les plus graves, une perte de conscience et un arrêt respiratoire indiquant une dépression du système nerveux central. Une toxicité hépatique est également observée pour des expositions de l'ordre de 500 à 2 000 ppm durant 4 h, se traduisant chez la souris par une augmentation des teneurs en lipides au niveau du foie (Ikeda et al., 1969 ; Kylin et al., 1963 ; Ogata et al., 1968) et chez le rat par une augmentation de l'activité de diverses enzymes telles que l'alanine et l'aspartate aminotransférase, témoignant d'un effet hépatotoxique (Drew et al., 1978).
Voie orale
Par voie orale, une DL50 de 7,8 g.kg-1 a été rapportée chez la souris mâle (Dybing et Dybing, 1946). Chez le rat, les DL50 observées sont comprises entre 2,6 et 4,5 g.kg-1 (Hayes et al., 1986 ; Pozzani et al., 1959 ; Whitey et Hall, 1975). Pour des ingestions sur 5 à 14 jours, le NOAEL chez le rat se situe entre 500-1 500 mg.kg-1.j-1 (Berman et al., 1995 ; Goldsworthy et Popp, 1987 ; Hanioka et al., 1995 ; Schumann et al., 1980).
De fortes doses de tétrachloroéthylène administrées par gavage pendant 10 jours (jusqu'à 1 000 mg.kg-1.j-1) induisent une augmentation du poids relatif du foie, plus prononcée chez la souris que chez le rat (Goldsworthy et Popp, 1987).
Des souris mâles, âgées de 10 jours, ont été gavées pendant 7 jours avec du tétrachloroéthylène aux doses de 0 – 5 – 320 mg.kg-1.j-1 (Fredriksson et al., 1993). Des altérations de comportement comprenant une augmentation de l’activité et un ralentissement de la vitesse d’apprentissage sont observées dès la dose de 5 mg.kg-1.j-1.
Voie cutanée
Une étude chez le lapin suggère que la DL50 par voie cutanée est supérieure à 10 g.kg-1 (Wolf, 1956). Les données recueillies chez l'animal, et quelques observations effectuées chez l'homme, indiquent que le tétrachloroéthylène est un irritant cutané mais n'est pas corrosif (Van Beek, 1990).
Dans le cadre d’un essai de stimulation locale des ganglions lymphatiques (LLNA) réalisé chez la souris, la sensibilité cutanée du tétrachloroéthylène s’est révélée positive uniquement à la plus forte concentration testée de 100 % conduisant à la considérer comme un faible sensibilisant cutané (étude BPL non publiée de l’ECHA, 2010).
Le tétrachloroéthylène ne provoque qu’une irritation minime de la muqueuse oculaire du lapin (Duprat et al., 1976).
Synthèse
Chez l’animal, le tétrachloroéthylène présente une faible toxicité aiguë quelle que soit la voie d'administration. Les symptômes principalement observés sont une hypotonie musculaire, une somnolence, des tremblements et des altérations hépatiques voire une dépression du SNC dans les cas les plus graves. Le tétrachloroéthylène est un irritant cutané.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
La majorité des données disponibles sont issues d’études en milieu professionnel, seules deux études menées sur des populations exposées via l’environnement sont rapportées.
Etudes chez les travailleurs :
Effets neurologiques :
De nombreuses études épidémiologiques ont été menées sur des travailleurs exposés de façon répétée aux vapeurs de tétrachloroéthylène et ont étudié plus spécifiquement les effets neurotoxiques (Seeber, 1989 ; Ferroni et al., 1992 ; Cavalleri et al., 1994; Gobba et al., 1998, Spinatonda et al., 1997 ;Echeverria et al., 1995). L'interprétation des données recueillies est cependant difficile en raison de l'absence ou de l'inadéquation de groupes témoin, d'une connaissance insuffisante de l'exposition au tétrachloroéthylène ou de la possibilité d'exposition antérieure ou simultanée à d'autres produits chimiques (CE, 2001). Deux études, une belge (Lauwerys et al., 1983) et une chinoise (Cai et al., 1991), portant sur des travailleurs exposés durant 3 à 6 ans à une moyenne de 20 - 21 ppm de tétrachloroéthylène sur 8 h, ont montré une absence d'effet au niveau neurologique (tests psychomoteurs), hépatique et rénal. Seule une augmentation de symptômes tels que vertiges ou irritation nasale a été notée dans l'étude chinoise. Chez des travailleurs exposés durant 2 à 8 h par semaine à des concentrations très élevées de tétrachloroéthylène (230 - 385 ppm), des maux de tête, nausées, vertiges, sensations d'ébriété et fatigue ont été relevés (Coler et Rossmiller, 1953).
Des effets neurologiques (augmentation des temps de réaction au cours de plusieurs tests) ont été rapportés chez 60 femmes exposées dans le cadre de leur travail à des concentrations moyennes de 15 ppm sur environ 10 ans (Ferroni et al., 1992). Les niveaux d'exposition ont été déterminés en mesurant les concentrations en tétrachloroéthylène dans le sang et l'air des locaux de travail. Aucune corrélation n'a été notée entre les mesures d'exposition et les tests neurologiques. Il est possible que des pics d’exposition puissent être à l’origine des effets observés.
Peu d’études ont spécifiquement recherché un effet du tétrachloroéthylène sur la vision des couleurs. Une revue détaillée de ces études a été réalisée (CE, 2001) ; parmi celle-ci, les études de Nakatsuka et al. (1992) et Cavalleri et al. (1994) sont pertinentes. Une autre étude récente, Chiesi et al., 2016 apporte des éléments également intéressants.
L’étude de Nakatsuka et al., 1992 a porté sur un groupe de 64 personnes employées dans le nettoyage à sec et exposés à 13 ppm (90 mg/m3 ; moyenne géométrique) comparés à un groupe de témoins non exposés aux solvants. Aucune information sur la durée d’emploi ou sur la méthode de recrutement (contrairement à Cavalleri et al., 1994). Les auteurs, utilisant le test Lanthony (Lanthony’s New Color test) et le test Ishihara, n’ont pu montrer un effet entre le tétrachloroéthylène et un effet sur la discrimination des couleurs.
Cavalleri et al., 1994 ont sélectionné 35 sujets (33 femmes et 2 hommes) travaillant dans des entreprises de nettoyage à sec ainsi qu’un groupe de 35 sujets témoins non exposés à des solvants ou à des neurotoxiques. Le test utilisé était le Lanthony D15 de discrimination des couleurs. La moyenne d’exposition globale était de 6 ppm (0,4-31 ppm) : 7 ppm (0,4-31 ppm) pour les 22 opérateurs et 5 ppm (0,5-11 ppm) pour les 13 personnes affectées au repassage. La durée d’exposition moyenne était de 8,8 années. Les résultats sur les 35 personnes montrent une augmentation significative de l’Index de Confusion des Couleurs (ICC). Cette augmentation n’est pas significative pour le sous-groupe des personnes affectées au repassage. Les auteurs ont aussi réalisé une analyse de régression multiple qui a montré une corrélation significative entre l’ICC et l’exposition moyenne du jour (TWA) reflétant donc les effets d’une exposition récente. En revanche, cette analyse n’a pas montré de corrélation entre l’ICC et le nombre d’années sous exposition au tétrachloroéthylène d’où une faible probabilité que ces effets sur la vision des couleurs soient cumulatifs. Les experts de l’EU ont estimé que l’ICC moyen du groupe exposé (1,14) se situait dans l’intervalle de référence normal en fonction de l’âge (CE, 2001). Ainsi, si ce faible score d’ICC était relié à l’exposition au tétrachloroéthylène alors l’effet sur la discrimination des couleurs serait très modéré. Au total, ces experts estiment que cette étude ne fournit pas de preuve convaincante d’un effet du tétrachloroéthylène à faible concentration sur la vision des couleurs. Elle a malgré tout été considérée comme recevable par plusieurs organismes et a été retenue pour la construction de leur valeur toxicologique de référence (VTR).
Chiesi et al., 2016 ont, sur un schéma proche de celui de l’étude précédente, réalisés des tests sur la vision des couleurs (Ishihara, Lanthony) et la réduction des contrastes chez 38 employés de 21 pressings et un groupe témoin de 60 sujets non exposés. L’exposition moyenne des employés, mesurée par badges individuels était de 16,9 mg.m-3 de tétrachloroéthylène. Une différence significative (p<0,01) de l’ICC a été observé entre les sujets exposés (moyenne de 1,28, sd 0,22) et non exposés (moyenne de 1,15, sd 0,21). L’analyse stratifiée (sous-groupes selon les postes occupés) a permis d’isoler le groupe le plus fortement exposé (17 personnes exposées en moyenne à 26,8 mg.m-3 sur des postes de nettoyage à sec) présentant un ICC moyen de 1,32 versus l’ICC moyen de 1,15 des sujets témoins. Les autres postes (repassage, tâches diverses) n’ont pas été significativement reliés aux changements d’ICC par rapport au groupe témoin. Les résultats du test sur la réduction des contrastes n’a montré aucune différence significative entre sujets exposés et sujets témoins.
Une étude allemande a été réalisée auprès de 101 employés de pressing exposés pendant au moins 10 ans (Seeber, 1989). Dans cette étude deux niveaux d’exposition ont été identifiés : niveau d’exposition faible à 12 ppm (83 mg.m-3) 57 employés exposés, niveau d’exposition élevé à 54 ppm (373 mg.m-3) 44 individus exposés. Une série de tests psychologiques a été menée, l’analyse des résultats a pris en compte les facteurs confondants tels que le sexe, l’âge et les habitudes de consommation d’alcool notamment. De cette étude, une LOAEC de 83 mg.m-3 a été déterminée pour des effets neurologiques (vitesse de perception retardée, détérioration de l’attention et de détection visuelle). Un ajustement de l’exposition discontinue à une exposition continue a été réalisé 8 heures par 24 heures x 5 jours sur 7 soit une LOAEC ajustée de 20 mg.m-3.
Effets rénaux :
Plusieurs études ont examiné les effets du tétrachloroéthylène sur la fonction rénale (Trevisan et al., 2000 ; Verplanke et al., 1999 ; Mutti et al., 1992 ; Solet et Robins, 1991 ; Lauwerys et al., 1983). Les niveaux urinaires élevés en retinol binding protein (RBP) rapportés par deux études (Mutti et al., 1992 ; Verplanke et al., 1999) mettent en évidence les effets du tétrachloroéthylène sur le tubule proximal.
Une étude européenne (Mutti et al., 1992) a porté sur 50 travailleurs exposés au tétrachloroéthylène, en moyenne 10 ans (exposition moyenne : 15 ppm sur une période de référence de 4 heures – intervalle : approximativement 0,2 - 85 ppm). Un groupe témoin apparié a été sélectionné. De nombreux marqueurs de lésions rénales ont été étudiés. Les niveaux sériques en créatinine et en 2-microglobuline n'ont pas été altérés par l'exposition au tétrachloroéthylène, indiquant que la fonction rénale n'avait pas été gravement altérée. Une augmentation significative des niveaux urinaires en albumine, transferrine, glycosaminoglycanes, phosphatase alcaline non spécifique et une diminution des teneurs en fibronectine ont été observées. Par contre, les niveaux urinaires en protéines totales, retinol binding protein (RBP), α2-microglobuline, immunoglobulines, eicosanoïdes, phosphatase alcaline intestinale et N-acétylglucosaminidase sont restés inchangés.
Les études de Solet et Robins, 1991, de Vyskocil et al., 1990 et de Franchini et al., 1983 sur les paramètres urinaires n’ont pas non plus révélé d’effet sur les reins ou ne permettent pas de conclure compte tenu de la faible taille de la population pour la seconde étude.
Effets hépatiques :
Des études transversales ont évalué les effets du tétrachloroéthylène sur le foie chez des teinturiers (Lauwerys et al., 1983 ; Cai et al., 1991 ; Gennari et al., 1992, Brodkin et al., 1995). Une élévation de la concentration sérique en gammaglutamyl transpeptidase (Gennari et al., 1992) et des altérations modérées du parenchyme hépatique (Brodkin et al., 1995) sont les seules observations notables pour des niveaux d’exposition de 13 à 16 ppm pendant 12 à 20 ans. Pour des durées d’expositions plus courtes (3 ou 6 ans), ces effets ne sont pas retrouvés (Cai et al., 1991 Lauwerys et al., 1983 ; Cai et al., 1991).
Principales études pour des effets chroniques par inhalation :
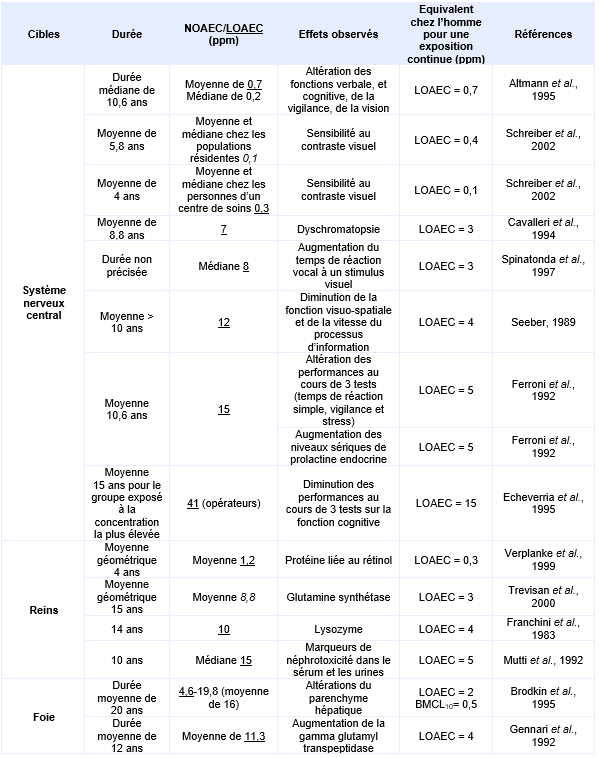
Expositions environnementales :
A Paris, entre 2010 et 2014, 89 personnes, occupant 43 logements, situés à proximité de 27 pressings différents ont été vus en consultation. La concentration de PCE mesurée dans leurs logements était comprise entre 180 et 59 000 μg.m-3 (médiane 2 100 μg.m-3). Aucune relation entre l’exposition au PCE et les anomalies neurologiques ou rénales observées n’a été mise en évidence. La concentration sanguine de PCE, mesurable chez 66 personnes, était comprise entre 0,1 et 38,7 μg.L-1 (Garnier et al., 2015 ; Piétin et al., 2014 ; Roda et al., 2013).
Une étude épidémiologique environnementale menée en 1992 dans une ville de la Rhur (Allemagne) a pris en compte les expositions des populations riveraines d’établissements de nettoyage à sec (Altmann et al., 1995). Quatorze individus vivants à proximité d’une blanchisserie et présentant un niveau de tétrachloroéthylène sanguin moyen supérieur à 2 µg.L-1 constituent le groupe exposé. Chacun de ces individus réside à proximité d’une blanchisserie depuis au minium 1 an et n’est pas exposé à d’autres solvants. L’âge moyen des sujets est de 39,2 ans (27-58 ans) et la durée moyenne d’exposition de 10,6 ans (1-30 ans). Un groupe de 23 individus témoins appariés en âge, âge moyen 37,2 ans (24-63 ans), en sexe et en habitudes (consommation de boisson alcoolisée, traitement médicamenteux, habitude tabagique et indice de masse corporel) et dont le niveau de tétrachloroéthylène sanguin moyen est inférieur à 0,5 µg.L-1 a également été constitué. Aucun sujet témoin n’a d’exposition connue aux solvants. Néanmoins, les auteurs considèrent que, compte tenu des différences sociales entre les sujets témoins et exposés, un biais est possible et est pris en compte dans le modèle de régression linéaire.
Les mesures d’air intérieur réalisées dans les appartements correspondent à des valeurs moyennes de 0,7 ppm (4,9 mg.m-3) pour le groupe exposé et de 0,0005 ppm (0,003 mg.m-3) pour le groupe témoin pour une durée d’exposition moyenne de 10,6 ans. Le niveau sanguin de tétrachloroéthylène a également été mesuré in situ et à l’hôpital, juste avant la réalisation des tests. Une bonne corrélation entre les mesures d’air intérieur et les concentrations sanguines en tétrachloroéthylène est mise en évidence lors de mesures concomitantes mais cette corrélation est moins bonne lorsque les deux mesures sont différées. Une série de tests neurologiques et neurophysiologiques ont été pratiqués pour les deux groupes témoins et exposés. Aucune différence existe entre sujets exposés et témoins pour l’épreuve du pianotage «finger tapping test» et pour la coordination main-yeux et la différence de temps moyen de réponse au test de vision des potentiels évoqués n’est pas statistiquement significative. Les différences significatives observées correspondent à un allongement du délai moyen de réponse, qui est augmenté (p<0,05) pour le test performance continue, à un temps de réaction prolongé au test de temps de réaction simple et une diminution du nombre de stimuli visuels correctement identifiés dans le test de mémoire visuelle (p<0,05). De cette étude, une LOAEC de 0,7 ppm est proposée, les effets critiques sont une diminution de la mémoire visuelle associée à un allongement du délai de réaction.
Une autre étude a été menée sur deux populations distinctes : la première en milieu résidentiel (16 appartements dans 8 immeubles) de la ville de New York (Etats Unis), la seconde en milieu professionnel dans un centre de jour mitoyen d’un service de nettoyage à sec (Schreiber et al., 2002). Dix-sept sujets appartenant à 6 familles ont été sélectionnés (9 femmes et 8 hommes soit 4 enfants, 11 adultes et 2 personnes de plus de 60 ans). Un groupe témoin apparié a été constitué pour les deux types d’exposition. Les niveaux d’exposition rapportés dans la population en milieu résidentiel sont compris entre 650 et 6 100 µg.m-3 entre mi-octobre et fin janvier soit une exposition moyenne de 778 µg.m-3 dans l’air intérieur pendant 5,8 ans. Les sujets retenus pour l’étude ont été exposés pour une durée d’au moins un an. Une diminution statistiquement significative de la sensibilité aux contrastes visuels est mesurée entre témoins et exposés en milieu résidentiel.
En milieu professionnel, les sujets ont été exposés à une concentration de 2 150 µg.m-3 de tétrachloroéthylène pendant 4 ans. Une diminution statistiquement significative de sensibilité aux contrastes visuels est également mesurée entre témoins et exposés. De cette étude, deux LOAEC peuvent être retenus pour chacune des deux populations étudiées : un LOAEC de 0,4 ppm pour la population résidentielle et un LOAEC de 0,1 ppm pour les travailleurs à partir de la sensibilité aux contrastes visuels observée. Les résultats de cette étude étayent ceux de celle d’Altmann et al., 1995.
La ré-analyse des études de Altmann et al., 1995 et de Schreiber et al., 2002 par un groupe de travail (NRC, 2010) met en évidence les faiblesses de la méthodologie et ne recommande pas leur utilisation comme base de l’élaboration de valeur de référence.
La sensibilité aux contrastes visuels a également été explorée à la fois chez des adultes et des enfants exposés via l’air intérieur d’appartements situés à proximité de pressings (Storm et al., 2011 initialement rapportée dans NYSDOH, 2010). Si les auteurs ont pu observer une diminution de la sensibilité aux contrastes associée à une exposition au tétrachloroéthylène > à 0,015 ppm (> 100 µg.m-3), exacerbée chez les enfants, Santé Canada considère que les caractéristiques socio-économiques ainsi que l’âge moyen entre les sujets témoins ou exposés sont trop éloignés et remet en cause la fiabilité de l’analyse (Santé Canada, 2015).
Voie orale
Parmi le nombre limité d’études réalisées sur des populations exposées non professionnellement par l’eau contaminée au tétrachloroéthylène, pas ou peu de données relatives aux effets touchant les fonctions rénales ou hépatiques sont retrouvées (Santé Canada, 2015).
Les données les plus intéressantes en termes de résultats sont issues d’une étude rétrospective ayant examiné les effets neurocomportementaux et neuropsychiques à long terme d’adultes exposés avant la naissance (via l’allaitement) et jusqu’à l’âge de cinq ans au tétrachloroéthylène présent dans l’eau potable (Aschengrau et al., 2016 ; Getz et al., 2012). La moyenne et médiane cumulées ont été respectivement estimées à 142 et 32 g, soit une concentration variable dans l’eau de boisson comprise entre 1 et 5197 µg.L-1. Les analyses regroupant 831 sujets exposés et 547 sujets non exposés ont montré dans le tertile le plus élevé une augmentation significative du risque de trouble bipolaire et du trouble de stress post-traumatique (avec des risques relatifs respectifs de 2,7 [IC95% :1,3 - 5,6] et 1,7 [IC95% :0,9 – 3,2]. Les comportements à risque (usage régulier du tabac, de l’alcool ou de drogues pendant l’adolescence ou chez les adultes) sont également plus fréquents parmi les sujets les plus exposés (tertile supérieur). Les autres analyses portant sur l’acuité visuelle (uniquement), les performances cognitives ou la structure cérébrale (imagerie par résonance magnétique) sont restées négatives.
Dans cette même cohorte, les auteurs ont procédé à un examen détaillé de la fonction visuelle sur un petit nombre de sujets exposés (29) et non exposés (25) (Getz et al., 2012). Si les auteurs ont observé chez les sujets exposés une plus grande confusion des couleurs, ainsi qu’une baisse de la sensibilité aux contrastes par comparaison aux sujets non exposés, la significativité de ces résultats a le plus souvent été compromise par le faible effectif de l’étude.
Dans le cadre d’une exposition au tétrachloroéthylène via le lait maternel (1 mg.dL-1), la seule information disponible est le cas d'un bébé de 6 semaines qui a développé un ictère et une hépatomégalie. Après arrêt de l'allaitement, une amélioration rapide a été constatée et aucune séquelle n'a été notée dans les 2 ans qui ont suivi (Bagnell et Ennenberger, 1977).
Suite à la contamination de l'eau d'un puits par divers solvants chlorés (principalement le trichloroéthylène : 267 ppb et le tétrachloroéthylène : 21 ppb), des lésions cutanées (éruptions maculopapulaires) et des effets immunologiques (augmentation du nombre de lymphocytes T, diminution du ratio lymphocytes T helper / lymphocytes T suppresseurs, présence d'autoanticorps chez 11 adultes sur 23) ont été observés chez les populations exposées par l'eau de boisson Byers et al., 1988. Toutefois, en raison de la multi exposition, le lien avec le tétrachloroéthylène ne peut être établi.
Synthèse
Chez l’homme, les effets neurologiques, et en particulier des altérations de la vision des couleurs, constituent les effets les plus sensibles des expositions par inhalation et par voie orale au tétrachloroéthylène. Des altérations rénales, au niveau du tubule proximal, sont également décrites de même que des altérations hépatiques mais uniquement pour des expositions prolongées (supérieures à une dizaine d’années) par inhalation.
Chez l'animal
Toutes voies
Il existe une quantité importante de données concernant la toxicité (par inhalation ou par voie orale) du tétrachloroéthylène en administration réitérée chez l'animal.
Inhalation
Plusieurs études ont évalué les effets du tétrachloroéthylène pour des expositions subchroniques (Kjellstrand et al., 1984; Kyrklund et al., 1990 ; Odum et al., 1988 ; Kylin et al., 1965 ; Goldsworthy et Popp, 1987 ; Bergamaschi et al., 1992 ; Mattsson et al., 1998). Les résultats indiquent que le foie, le rein et le système nerveux central sont les organes cibles majeurs du tétrachloroéthylène, malgré quelques différences interespèces. La souris apparaît comme particulièrement sensible à l'action hépatotoxique du tétrachloroéthylène (NTP, 1986 ; Lash et Parker, 2001).
Exposition sub-chronique :
Une étude, par inhalation, menée sur deux semaines (5 jour par semaine, 6 heures par jour) chez le rat F344 et la souris B6C3F1 exposés aux concentrations de 0 – 690 – 1 400 – 2 900 mg.m-3 a conduit à une NOAEC de 875 ppm chez le rat et 425 ppm chez la souris (NTP, 1986). A 825 ppm, les souris présentent une vacuolisation hépatique. Dans la même étude, l’exposition de souris B6C3F et de rats F344/N au tétrachloroéthylène pendant 13 semaines à raison de 5 jours par semaine et 6 heures par jour à une concentration 0 – 690 – 1 400 – 2 800 – 5 500 – 11 000 mg.m-3 a été réalisée.
A partir de 400 ppm (2 712 mg.m-3), les souris présentent des atteintes hépatiques (nécrose tubulaire, stase biliaire, infiltration leucocytaire) et une atteinte rénale (caryomégalie) est observée à 1 600 ppm (10 848 mg.m-3). Chez les rats, une exposition à 200 ppm (1 356 mg.m-3) entraîne une congestion du foie et une congestion des poumons à 1600 ppm (10 848 mg.m-3). De cette étude une NOAEC chez la souris a été estimée à 100 ppm (678 mg.m-3).
Chez le rat, une étude plus récente indique clairement une NOAEC de 1 000 ppm pour 14 – 17 semaines d'exposition (5 jours par semaine, 6 heures par jour) concernant les effets sur le foie. La NOAEC pour le rein se situe à 300 ppm (avec seulement un effet faible à 1 000 ppm) (Tinston, 1995).
Plusieurs auteurs ont cherché à identifier des effets neurologiques lors d’une exposition au tétrachloroéthylène. Les rats F344 ont été exposés à des concentrations de tétrachloroéthylène de 0 – 50 – 200 – 800 ppm 6 heures par jour, 5 jours par semaine, pendant 13 semaines (Mattsson et al., 1998). Une altération des potentiels évoqués instantanés est mesurée à 50 ppm mais pas aux concentrations plus élevées. Une altération des potentiels évoqués instantanés et somatosensoriels est rapportée à 800 ppm. Une LOAEC de 800 ppm et une NOAEC de 200 ppm ont été établies chez le rat, pour la survenue de ces effets neurologiques.
Des résultats similaires sont observés chez la gerbille exposée aux concentrations de 60 ou 300 ppm pendant 3 mois (Rosengren et al., 1986). Des études menées chez le rat ont montré des altérations de la composition des acides gras du cortex cérébral pour des expositions à 320 ppm de tétrachloroéthylène pendant 90 jours (Kyrklund et al., 1990) ou 30 jours (Kyrklund et al., 1988).
Expositions chroniques:
Pour des inhalations de plus longue durée (expositions chroniques) des rats F344 et des souris B6C3F1 ont été exposés respectivement aux concentrations de 0 - 1 400 - 2 800 mg.m-3 et 0 – 700 – 1 400 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 103 semaines (Mennear et al., 1986 ; NTP, 1986). Une diminution du taux de survie a été observée à 400 ppm chez le rat et à 100 ppm chez la souris. Ces dernières apparaissent plus sensibles que les rats : à la dose de 100 ppm durant 103 semaines, les souris ont présenté des effets au niveau respiratoire (congestion pulmonaire aiguë), hépatique (dégénérescence hépatocellulaire) et rénal (néphrose). A la dose de 400 ppm durant 103 semaines, les rats ont développé des ulcères gastriques (200 ppm est un NOAEL pour cet effet) et dès 200 ppm, des effets au niveau respiratoire (thrombose, métaplasie squameuse des cavités nasales), rénal (caryomégalie des tubules rénaux) et endocrinien (hyperplasie des médullo-surrénales) ont été observés.
Une autre étude a également été menée sur deux espèces de rongeurs : le rat F344 exposé aux concentrations de 0 – 340 – 1 400 – 4 100 mg.m-3 6 heures par jour, 5 jours par semaine pendant 104 semaines et la souris exposée aux concentrations de 0 – 69 – 340 – 1 700 mg.m-3 selon une protocole similaire (JISA, 1993 ; Nagano et al., 1998). Chez le rat, une hépatotoxicité limitée à une spongiose (œdème du corps muqueux de l'épiderme provoquant des aspects lacunaires) à 1 400 mg.m-3, à une hyperplasie à 4 100 mg.m-3 et des altérations rénales correspondant à une hypertrophie nucléaire et une dilatation des cellules apicales tubulaires proximales ont été observées. Chez la souris, des tumeurs bénignes de la glande de Harder à la dose la plus élevée et des altérations rénales identiques à celles rapportées chez le rat sont rapportées dès 340 mg.m-3 ainsi que des effets hépatiques (angiectasie, dégénérescence centrale, nécrose centrale et focale et hyperplasie) dès 340 mg.m-3.
Voie orale
Expositions sub-chroniques:
Chez la souris Swiss Cox mâle, les effets d’une exposition subchronique ont été étudiés suite à l’administration par voie orale de tétrachloroéthylène en solution dans de l’huile de maïs de 0 – 20 – 100 – 1 000 – 1 4000 mg.kg-1, 5 jours par semaine, pendant 6 semaines, équivalent à 0 – 14 – 70 – 700 – 1 400 mg.kg-1.j-1 (Buben et O'Flaherty, 1985). Les souris exposées à la dose de 70 mg.kg-1.j-1 présentent une augmentation significative des niveaux de triglycérides hépatiques et du poids relatif du foie. A la dose la plus élevée, des effets hépatiques incluant une diminution du contenu en ADN, une augmentation des concentrations sériques en alanine aminotransférase et une diminution de la concentration sérique en glucose 6-phosphate déshydrogénase, une nécrose, une dégénérescence et une polyploïdie hépatocellulaire sont observés.
Chez le rat (en particulier les mâles), l'ingestion répétée de fortes doses de tétrachloroéthylène (500 mg.kg-1 durant 4 semaines) induit des lésions des tubules rénaux proximaux, via un mécanisme impliquant la formation de gouttelettes hyalines (Bergamaschi et al., 1992).
Une étude subchronique de 90 jours a été menée chez le rat Sprague Dawley pour des expositions à 14 – 400 – 1 400 mg.kg-1.j-1 (Hayes et al., 1986). Pour les mâles exposés à la dose la plus élevée et pour les femelles aux doses de 400 et 1 400 mg.kg-1.j-1 une diminution du poids corporel est observée. Une augmentation des poids des reins et du foie est également rapportée aux deux doses les plus élevées avec une hépatotoxicité potentielle.
Des rats Sprague Dawley âgés de 3 à 4 semaines ont été exposés au tétrachloroéthylène par gavage aux doses de 0 – 5 – 50 mg.kg-1.j-1, 5 jours par semaine pendant 8 semaines (Chen et al., 2002). Un ralentissement statistiquement significatif de la réponse à 3 tests de nociception est rapporté. Les activités d’apprentissage et de locomotion sont réduites mais la différence n’est statistiquement significative qu’à la dose la plus élevée.
Synthèse
Chez l’animal, des expositions par inhalation au tétrachloroéthylène, induisent des effets hépatiques et rénaux, des troubles neurologiques et respiratoires. Pour des expositions par voie orale, il s’agit essentiellement d’altérations hépatiques et rénales. Un ralentissement de la réponse à des tests de nociception est observé chez les rats.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : Substance préoccupante pour l'homme en raison d'effets cancérogènes possibles | 1996 |
| IARC | Groupe 2A : Le tétrachloroéthylène est probablement cancérigène pour l’homme | 2012 |
| US EPA | Classe B1 : cancérigène possible pour l’homme | 2012 |
Chez l'homme
Inhalation
De nombreuses études épidémiologiques ont exploré les effets potentiellement cancérogènes du tétrachloroéthylène par inhalation en milieu professionnel, en particulier dans le secteur industriel du nettoyage à sec. Si certaines d’entre-elles ont révélé un lien possible avec certains types de cancers, d’autres sont négatives, l’inconstance des résultats étant vraisemblablement liée au manque de précision sur l’exposition elle-même (absence d’analyse, co-exposition à d’autres solvants potentiellement cancérogènes comme le trichloréthylène, erreur de classification par rapport à l’utilisation des matrices emplois-expositions, etc.). Prises dans leur ensemble, il existe néanmoins un faisceau de preuves permettant de retenir le cancer de la vessie comme étant vraisemblablement associé à l’exposition au tétrachloroéthylène. Pour les autres types de cancers, les données actuelles sont trop discordantes pour conclure.
Cancer de la vessie:
L’analyse des études ayant spécifiquement évalué l’exposition au tétrachloroéthylène, ou celles examinant exclusivement les emplois dans le secteur du nettoyage à sec, en écartant notamment les études combinant nettoyage à sec et blanchisserie, ainsi que celles se référant à des expositions combinées de plusieurs solvants a permis d’identifier la vessie comme étant l’organe cible de l’effet cancérogène induit par le tétrachloroéthylène chez l’homme (IARC, 2014).
Cette conclusion émane de l’analyse de plusieurs études de cohortes américaines et européennes (Blair et al., 2003 ; Boice et al., 1999 ; Bond et al., 1990 ; Calvert et al., 2011 ; Lynge et al., 2006 ; Selden et Ahlborg, 2011), ainsi que 10 études cas-témoins (Burns et Swanson, 1991 ; Christensen et al., 2013 ; Colt et al., 2011b ; Colt et al., 2011a ; Gaertner et al., 2004 ; Pesch et al., 2000a ; Schoenberg et al., 1984 ; Siemiatycki et al., 1994 ; Steineck et al., 1990 ; Swanson et Burns, 1995). Les 3 études de cohortes réalisées dans le secteur du nettoyage à sec ont mis en évidence une augmentation du risque de cancer de la vessie avec un RR de 1,3 (95 %, IC = 0,7-2,4) dans l’étude réalisée dans le Missouri de 1948 à 1993, (Blair et al., 2003), un RR de 1,8 (95 %, IC = 0,9-3,3) dans la seconde étude californienne réalisée entre 1940 et 2004 (Calvert et al., 2011) et enfin un RR 1,44 (95 %, IC = 1,07-1,93) statistiquement significatif dans la cohorte d’Europe du Nord ayant regroupé les données danoises, finlandaises, suédoises et norvégiennes de 1970 à 2001 (Lynge et al., 2006). Ces études n’ont toutefois pas permis d’établir de relation dose-réponse, en dehors de l’étude de Calvert qui a montré une augmentation du risque relatif RR de 4,1 (95 %, IC = 2,1-7,1) chez les travailleurs exposés plus de 5 ans avec un délai d’apparition de la tumeur vésicale après plus de 20 ans. Dans les deux autres études, aucune augmentation du risque de cancer de la vessie n’a été observée en fonction de la durée d’exposition (Lynge et al., 2006), l’effet inverse ayant même été décrit dans celle de Blair.
Concernant les études cas-témoins examinées par l’IARC, toutes ont bénéficié d’ajustements sur le tabac et autres facteurs confondants, mais seules deux d’entre-elles ont spécifiquement évalué l’exposition professionnelle au tétrachloroéthylène. La première, étude allemande de Pesch, dans laquelle le statut de l’exposition au tétrachloroéthylène a été réalisé par matrice emplois-expositions ou matrice emplois-tâches-exposition, des RR significatifs de cancer de la vessie chez les femmes moyennement exposées (RR 1,8 (95 %, IC = 1,0-3,0), ou chez les hommes les plus fortement exposés (forte RR 1,2 (95 %, IC = 1,0-1,5), substantielle RR 1,4 (95 %, IC = 1,0-1,9) vis-à-vis de l’emploi et substantielle RR 1,8 (95 %, IC = 1,1-3,1) vis-à-vis de la tâche) ont pu être déterminés. La seconde, étude canadienne, a montré une association négative, mais basée sur un très petit nombre de cas (RR 0,9 (95 %, IC = 0,1-7,3) pour une exposition substantielle) (Christensen et al., 2013). Les 8 autres études cas-témoin ayant porté sur les employés du nettoyage à sec ont toutes montré une association positive avec le cancer de la vessie, significative dans une seule d’entre-elles (Pesch et al., 2000a) (IARC, 2014).
Une méta-analyse regroupant les résultats de 7 études (Blair et al., 2003 ; Burns et Swanson, 1991 ; Calvert et al., 2011 ; Colt et al., 2011b ; Gaertner et al., 2004 ; Lynge et al., 2006 ; Steineck et al., 1990) (139 sujets exposés) confirme le lien entre le risque de cancer de la vessie et l’exposition au tétrachloroéthylène chez les employés du secteur du nettoyage à sec avec un RR global de 1,5 (95 %, IC = 1,16-1,85) (Vlaanderen et al., 2014).
Cancer rénal:
Plusieurs études cas-témoins réalisées dans le secteur professionnel impliquant les opérations de nettoyage à sec ou de blanchisserie rapportent des associations positives chez les hommes et/ou les femmes, bien que le seuil de signification statistique n’ait été atteint que dans 3 d’entre elles avec notamment un odds ratio de 1,4 (95 %, IC = 1,1-1,7) sur 245 sujets exposés (Mandel et al., 1995), de 2,7 (95 %, IC = 1,1-6,7 sur 16 cas (McCredie et Stewart, 1993), ou de 2,5 (95 %, IC = 1,2-5,2) sur 27 cas (Schlehofer et al., 1995). A contrario, d’autres études mentionnent une absence ou un faible lien entre l’exposition potentielle au tétrachloroéthylène (établi le plus souvent à partir des matrices emplois-expositions) et le cancer des reins, avec des nombres de cas le plus souvent inférieurs à 15 (Asal et al., 1988 ; Christensen et al., 2013 ; Dosemeci et al., 1999 ; Karami et al., 2012 ; Pesch et al., 2000a, 2000b).
Les études de cohortes n’ont généralement pas d’avantage permis d’observer d’association entre l’exposition au tétrachloroéthylène et le cancer des reins, la plupart n’ayant pas évalué ou montré de relation positive entre l’intensité de l’exposition (ou la durée) et la réponse (cancer des reins) (Anttila et al., 1995 ; Blair et al., 2003 ; Calvert et al., 2011).
Par ailleurs, dans un contexte d’exposition non professionnelle , un lien entre la survenue d’un cancer rénal et le lieu de résidence à proximité d’entreprises de nettoyage à sec utilisant du tétrachloroéthylène est rapporté chez des résidents New Yorkais sur la période de 1993-2004 (Ma et al., 2009). Malgré une augmentation de 10 à 27 % du taux de cancer rénal chez les sujets exposés par rapport au groupe témoin, la qualité de l’estimation des niveaux d’exposition en absence de mesure ne permet pas de conclure.
De plus, l’IARC souligne que la co-exposition possible au trichloroéthylène, associé au développement de tumeurs rénales dans de nombreuses autres études, n’a pas été prise en compte dans ces analyses et constitue un biais supplémentaire limitant encore davantage la portée de ces études (IARC, 2014).
Cancer de l’œsophage, poumons et langue :
Toujours dans le secteur d’activité du nettoyage à sec, des augmentations significatives de mortalité par cancer de l’œsophage ont été montrées dans les deux cohortes américaines de Blair (2003) et Calvert (2011), en particulier chez les travailleurs les plus longuement exposés n’excluant pas le tabac comme facteur de confusion possible. Dans l’étude de Calvert, 1 704 ouvriers employés dans le nettoyage à sec de 4 villes ont été exposés au moins 1 an avant 1960 dans des magasins utilisant du tétrachloroéthylène comme solvant principal (Calvert et al., 2011). Un excès significatif de mortalité par cancer a été déterminé avec un SMR* de 1,22 [1,09-1,36]. Les cancers de l’œsophage, des poumons et de la langue entrainent un excès de mortalité significatif. Le risque de cancer de l’œsophage est particulièrement élevé chez les employés ayant utilisé pendant au moins 5 ans du tétrachloroéthylène dans leur magasin et le délai d’apparition des tumeurs par rapport aux premières expositions est supérieur ou égal à 20 ans (SMR de 4,8 [2,7-8]. Ces résultats sont confortés par un excès de mortalité par pathologies non malignes de l’estomac et du duodénum. Une augmentation statistiquement significative d’hypertension est observée sur l’ensemble de la cohorte avec un SIR de 1,98 [1,11 – 3,27] et chez les employés utilisant du tétrachloroéthylène depuis au moins 5 ans.
Par ailleurs, dans un autre secteur industriel, deux études de cohortes américaines ne rapportent pas d’excès de mortalité par cancer de l’œsophage chez les travailleurs de l’aéronautique régulièrement exposés au tétrachloroéthylène (maintenance des avions), mais aussi au trichloréthylène (Boice et al., 1999 ; Radican et al., 2008). Enfin, une élévation du risque de mortalité par cancer pulmonaire est observée avec un RR = 1,4 (95 %, IC = 1,1-1,6) (Blair et al., 2003), SMR = 1,2 (95 %, IC = 0,7-1,8) (Ruder et al., 2001) et RR = 1,2 (95 %, IC = 0,9-1,6) (Lynge et Thyegesen, 1990).
*: SMR : ratio standardisé de mortalité
Leucémies et lymphomes:
Le risque de lymphomes non hodgkinien** a fait l’objet de plusieurs recherches aussi bien dans des études de cohortes que des études cas-témoins.
Dans le secteur du pressing, des études menées dans des pays scandinaves semblent montrer la possibilité d’augmentation du risque de lymphomes non hodgkiniens, toutefois ces études sont souvent basées sur un petit nombre de cas, la sensibilité des hommes par rapport aux femmes étant rapportés dans le tableau suivant (Andersen et al., 1999 ; Selden et Ahlborg, 2011).
Différence de sensibilité en fonction du sexe pour la survenue de lymphomes non hodgkiniens :
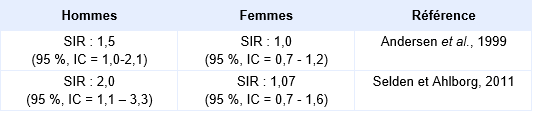
Dans d’autres cohortes, comme celle d’Anttila, concernant 849 travailleurs finlandais dont l'exposition au tétrachloroéthylène a été contrôlée, un excès de risque non significatif de lymphomes non-Hodgkiniens a été observée [SIR = 3,8 (95 %, IC = 0,8-11,0)] (Anttila et al., 1995). Le niveau moyen de tétrachloroéthylène dans le sang était de 116 µg.L-1 chez les hommes et de 66 µg.L-1 chez les femmes, avec un niveau moyen d'exposition sur 8 heures inférieur à 50 ppm (345 mg.m-3). Au total, 31 cas de cancers ont été observés sur cette cohorte, ce qui était comparable au taux national en Finlande.
Des résultats similaires sont obtenus à partir de la cohorte de Boice et al., 1999 dans laquelle le risque de lymphomes non-Hodgkiniens est augmenté mais non statistiquement significatif avec un SIR de 1,7 (95 %, IC = 0,7-3,3). Cependant, des études similaires ont également indiqué l’absence de risque excédentaire en ce qui concerne les lymphomes non hodgkiniens (Cano et Pollan, 2001 ; Lynge et Thyegesen, 1990 ; Travier et al., 2002b).
Les études cas-témoins n’ont quant à elles pas mise en évidence d’excès de risque de lymphomes non-Hodgkiniens (Kato et al., 2005 ; Lynge et al., 2006 ; Miligi et al., 1999)
D’autres études réalisées notamment dans le secteur de l’aéronautique ont également évoqué un risque élevé de syndromes non hodgkiniens, mais l’exposition concomitante à d’autres composés tels que le trichloréthylène ne peut être écartée (Boice et al., 1999 ; Lipworth et al., 2011 ; Radican et al., 2008).
Concernant les leucémies, les résultats varient également d’une étude à l’autre. Une augmentation statistiquement significative du risque de leucémies lymphoïdes chroniques a été mise en évidence chez les femmes mais pas chez les hommes à partir de données regroupant les activités de blanchisserie, nettoyage à sec, repassage, ou la teinture (Travier et al., 2002a ; Ji et Hemminki, 2005), avec un SIR de 1,5 (95 %, IC = 1,1-2,1) chez les femmes et un de SIR 0,9 (95 %, IC = 0,5-1,3) chez les hommes (Ji et Hemminki, 2005). A l’inverse, dans une autre cohorte composée uniquement de sujets employés dans le nettoyage à sec, le risque de leucémie est resté faible (Risque Relatif : 0,8 [IC 95%, 0,4 -1,4]) (Blair et al., 2003).
Si le lien entre l’exposition au tétrachloroéthylène et le cancer de la vessie semble être établi aussi bien par l’IARC que par l’US EPA, pour les autres types de cancers (reins, col de l’utérus, lymphomes non hodgkiniens), ces deux instances considèrent toujours que le niveau de preuve est limité chez l’Homme.
** : Affection maligne caractérisée par des adénopathies superficielles et profondes, une splénomégalie, de la fièvre, des lésions cutanées prurigineuses et une éosinophilie sanguine.
Voie orale
Aucune relation n'a été clairement établie entre l'exposition au tétrachloroéthylène par voie orale et l'augmentation de l'incidence de cancer.
Une étude cas - témoin a examiné la relation entre les cas de leucémies, de cancer de la vessie et des reins et l'exposition au tétrachloroéthylène via l'eau de boisson (Aschengrau et al., 1993). Une augmentation significative des cas de leucémies a été notée chez les personnes les plus exposées mais ce résultat ne repose que sur deux cas. En raison du faible nombre de personnes considérées et de la possibilité d'exposition multiple, le lien entre exposition au tétrachloroéthylène et les leucémies reste très hypothétique. Concernant le cancer de la vessie, l’analyse a inclus 61 cas pour 852 témoins. Le RR de 1,39 (95 %, IC = 0,67-2,91) obtenu à partir de tous les cas exposés est 4,03 (95 %, IC = 0,65-25,10) pour les fortes expositions (analyse semi-quantitative correspondant au 90èmepercentile de l’intervalle) ne concernant que 4 personnes, effectif trop faible limitant l’interprétation de ce résultat.
Quatre études de cohortes ont examiné l'incidence de divers types de cancer chez des populations ayant consommé de l'eau contaminée par du tétrachloroéthylène (et d'autres solvants chlorés dont le trichloroéthylène). Une étude a montré une augmentation de lymphomes non-hodgkiniens chez les femmes exposées jusqu'à 14 µg.L-1 (Cohn et al., 1994), une autre, un taux significativement plus élevé de leucémies chez les enfants exposés à 21 µg.L-1 de tétrachloroéthylène (Lagakos et al., 1986), tandis que les deux dernières n'ont pas permis de mettre en évidence de relation entre cancers (lymphomes, leucémies, myélomes, cancers du foie, de la vessie…) et exposition au tétrachloroéthylène (Isacson et al., 1985 ; Vartiainen et al., 1993).
Dans un contexte similaire, une augmentation tout juste significative du risque de cancer du sein (odds ratio compris entre 1,0 et 1,5) a été mise en évidence chez des femmes fortement exposées (90ème percentile) au tétrachloroéthylène présent dans l’eau de boisson avec un délai d’apparition de 0 et 19 ans (Gallagher et al., 2011), mais des biais de sélection notamment du groupe témoin ne sont, selon l’IARC, pas exclus (IARC, 2014).
D’autres cancers parmi ceux étudiés étaient sans lien avec l’exposition au tétrachloroéthylène, dont les cancers de la vessie, du rein et colorectal (Aschengrau et al., 1993 ; Paulu et al., 1999).
Synthèse
Chez l’homme, de nombreuses études constatent une association possible entre cancers (système hématopoïétique, foie, vessie, poumon, œsophage) et l’exposition par inhalation au tétrachloroéthylène mais les excès de risques restent faibles, les populations sont de faible effectif. Des biais sont possibles et la causalité n’est pas établie. Seule l’association avec la survenue de cancer de la vessie semble faire consensus. Les observations pour des expositions par voie orale sont nombreuses, mais l’interprétation est limitée en raison de la co-exposition fréquente à d’autres substances.
Chez l'animal
Inhalation
Par inhalation, le tétrachloroéthylène induit des carcinomes et des adénomes hépatocellulaires chez la souris et des leucémies chez le rat.
L'effet cancérigène du tétrachloroéthylène inhalé a été étudié chez le rat et la souris (NTP, 1986). Les animaux, par lots de 50, ont été exposés à 100 ou 200 ppm (souris) et 200 ou 400 ppm (rats) de tétrachloroéthylène durant 103 semaines (5 jours par semaine, 6 heures par jour).
Chez les rats mâles, une augmentation de l'incidence des adénocarcinomes des cellules des tubules rénaux a été observée à la plus forte dose. Bien que cette augmentation ne soit pas statistiquement significative (2/50 cas), elle est considérée comme significative d'un point de vue toxicologique, car ce type de tumeur n'avait jamais été observé chez 2 000 témoins historiques. Les hypothèses mécanistiques ne sont pas en faveur d’une néphropathie liée à l’accumulation d’α-2 macroglobuline, ou encore de la prolifération des peroxysomes* ; les métabolites issus de la voie de la glutathion S-transférase, à savoir le trichlorovinyl glutathion (TCVG) sous forme libre ou conjuguée et le N-acétyl-trichlorovinyl-cystéine (Nac-TCVC), seraient prépondérants dans la formation des tumeurs rénales par l’intermédiaire d’une activité mutagène démontrée notamment à partir de tests sur bactéries (Guyton et al., 2014).
Une augmentation des cas de leucémie a également été observée chez les mâles et les femelles mais le rôle du tétrachloroéthylène est ici sujet à caution en raison de l'absence d'une relation dose-effet et d'un niveau basal élevé de ce type de cancer chez les rongeurs (NTP, 1986).
Chez la souris, une augmentation dose-dépendante de l'incidence des carcinomes hépatocellulaires a été clairement mise en évidence chez les mâles comme chez les femelles, dès 100 ppm (NTP, 1986).
Une autre étude de cancérogenèse a été menée chez les rats et les souris (JISA, 1993). Les rats F344/DuCrj (mâle et femelle) ont été exposés aux concentrations de 0, 50, 200 et 600 ppm 6 heures par jour, 5 jours par semaine, pendant 104 semaines. Une augmentation des leucémies mononucléaires (respectivement 11/50, 14/50, 22/50, 27/50) a été clairement mise en évidence chez les mâles alors que l’augmentation est plus limitée chez les femelles (respectivement 10/50, 17/50, 16/50, 19/50). De même, la présence d’adénomes et de carcinomes hépatocellulaires est plus importante chez les mâles (respectivement 13/46, 21/49, 19/48, 40/49) que chez les femelles (respectivement 3/50, 3/47, 7/48, 33/49). Enfin, chez les mâles, des hémangiosarcomes malins hépatiques ou rénaux sont rapportés aux concentrations les plus élevées (respectivement 2/46, 1/49, 6/48, 9/49) alors que l’incidence des adénomes et adénocarcinomes des cellules tubulaires rénales est très limitée et qu’il n’y a pas de mise en évidence de gliomes du cerveau.
Les souris Crj:BDF1 ont été exposées à des concentrations de 0, 10, 50 ou 250 ppm, pendant 104 semaines (JISA, 1993). Une augmentation de l’incidence d’adénomes (non détaillé) ou de carcinomes hépatocellulaires (respectivement 7/50 (témoins), 8/50, 12/50 et 25/50 chez les mâles et 0/50 (témoins), 0/47, 0/49 et 14 :49 chez les femelles) a été mesurée, ainsi que d’adénomes/carcinomes combinés (13/50 (témoins), 21/50, 19/50 et 40/50 chez les mâles et 3/50 (témoins), 3/47, 7/49 et 33/49 chez les femelles), significatives à la plus forte dose. De plus, une augmentation non significative pour ce qui est de l’incidence des hémangiomes et hémangiosarcomes (combinés) chez les mâles et les femelles, incidence des hémangiosarcomes localisés dans le foie ou la rate chez les mâles, et enfin incidence d’adénomes dans les glandes de Harder (glandes lacrymales) chez les souris mâles, a été rapportée.
* : Par l’intermédiaire des récepteurs activés par les proliférateurs de peroxysomes α (PPARα), ce dernier étant susceptible de s’exprimer aussi bien chez les mâles que chez les femelles, chez le rat comme chez la souris
Voie orale
Par voie orale, le tétrachloroéthylène est également cancérigène chez la souris exposée par gavage 5 jours par semaine (NCI, 1977 ; Weisburger, 1977). Les doses de 450 et 900 mg.kg-1 pendant 11 semaines suivies des doses de 550 ou 1 100 mg.kg-1 pendant 67 semaines (soit 536 ou 1 072 mg.kg-1 pendant 78 semaines) sont données pour les mâles. Les doses de 300 et 600 mg.kg-1.j-1 pendant 11 semaines et suivies des doses de 400 ou 800 mg.kg-1 pendant 67 semaines (soit 386 ou 772 mg.kg-1 pendant 78 semaines) sont administrées pour les femelles. Ces expositions provoquent une augmentation de l'incidence des carcinomes hépatocellulaires chez les mâles comme chez les femelles aux doses moyennes de 536 ou 1 072 mg.kg-1.j-1 (mâles) et 386 ou 772 mg.kg-1.j-1 (femelles). Chez les mâles l’incidence est de 2/17 pour le lot témoin non traités, 2/20 pour le lot témoin solvant, 32/49 pour la plus faible dose et 27/48 pour la dose la plus élevée. Chez les femelles, l’incidence est de 2/20 pour le lot témoin, de 2/20 pour le lot témoin solvant, de 19/48 à la dose la plus faible et de 19/48 à la dose la plus élevée. Par contre, en raison d'une forte mortalité dans l’étude réalisée chez le rat, le potentiel cancérigène du tétrachloroéthylène n'a pu être correctement évalué.
Voie cutanée
Les études menées par voie cutanée n'ont pas permis de mettre en évidence de potentiel cancérigène du tétrachloroéthylène, qu'il soit appliqué en tant qu'initiateur ou promoteur (Van Duuren et al., 1979 ; Van Duuren et al., 1983). Toutefois, aucune conclusion définitive ne peut en être tirée en raison des limitations de ces études.
Synthèse
Le tétrachloroéthylène est cancérigène chez l’animal. Pour des expositions par inhalation des carcinomes et des adénomes hépatocellulaires sont observés chez la souris et des leucémies chez le rat. Pour des expositions par voie orale, des carcinomes hépatocellulaires sont rapportés chez la souris.
Effets génotoxiques
Généralités
Le tétrachloroéthylène n’est pas classé génotoxique par l’Union Européenne du fait de résultats négatifs obtenus au moyen de tests non classiquement utilisés.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 1996 |
Chez l'homme
Toutes voies
En ce qui concerne les études humaines, la plupart se sont révélées négatives : échanges de chromatides sœurs dans les lymphocytes périphériques de travailleurs de nettoyage à sec (27 cas) par comparaison aux témoins (26 sujets) (Seiji et al., 1990) ; échanges de chromatides sœur ou aberrations chromosomiques dans les lymphocytes de 10 travailleurs employés dans le dégraissage au tétrachloroéthylène et 11 témoins non exposés (Ikeda et al., 1980) ; baisse significative des dommages oxydatif à l’ADN (dosages de 8-OH-dG) dans le sang des salariées exposées (nettoyage à sec) par comparaison aux salariées non exposées (blanchisserie), mais l’effet ne peut clairement pas être attribué au tétrachloroéthylène. Les autres marqueurs du stress oxydatif (peroxydation des lipides) n’ont pas été modifiés (Toraason et al., 2003).
L’analyse cytogénétique comparée sur lymphocytes de 18 employées du nettoyage à sec et de 18 employées dans des blanchisseries (témoins non exposés au tétrachloroéthylène) a montré une corrélation significative de l’induction de micronoyaux (fragments de chromosomes acentriques) (R2=0,488, p<0,026) avec l’exposition au tétrachloroéthylène alors que l’augmentation de la fréquence des translocations chromosomiques est restée en dessous du seuil de significativité (Tucker et al., 2011).
In vitro
Organismes eucaryotes
Le tétrachloroéthylène n’est pas mutagène à la fois sur tests bactériens (Ames) et sur tests de mutation génique de lymphome de souris. En revanche, les métabolites du tétrachloroéthylène issus des deux voies métaboliques (cytochromes P450 et conjugaison par la glutathion S-transférase) sont génotoxiques dans le test d’Ames (Dekant et al., 1986 ; Dreeßen et al., 2003).
De plus, des résultats positifs sont rapportés pour le tétrachloroéthylène dans le test du micronoyau réalisé in vitro sur lignées cellulaires MCL-5 et h2E1 exprimant des cytochromes P450 (Doherty et al., 1996). Dans la lignée cellulaire AHH-1, la production de micronoyaux issus d’activités aneugéniques et clastogéniques est observée. Dans la mesure où ces lignées expriment des cytochromes P450, les auteurs pensent que ces effets sont induits par les métabolites du tétrachloroéthylène.
L’induction de micronoyaux a également été observée sur des cellules ovariennes de hamster (CHO K1) exposées en vase clos à des vapeurs de tétrachloroéthylène (Wang et al., 2001).
La plupart des autres tests pratiqués aussi bien in vivo qu’in vitro se sont révélés négatifs.
Concernant le mécanisme de cancérogenèse, aucune étude n’a été publiée qui puisse permettre d’apporter des éléments en faveur d’un mécanisme plutôt qu’un autre pour le cancer de la vessie, des reins ou hépatique (IARC, 2014 ; OEHHA, 2016).
Compte tenu de l’incertitude autour des mécanismes d’action de promotion tumorale (à seuil), l’approche retenue par défaut est un mécanisme sans seuil (ANSES, 2013 ; US EPA, 2012).
Synthèse
Le tétrachloroéthylène n’est pas classé génotoxique par l’Union Européenne du fait de résultats positifs uniquement dans des tests non utilisés habituellement.
Effets sur la reproduction
Chez l'homme
Toutes voies
Quelques études ont rapporté l'existence de troubles menstruels et d'avortements spontanés chez des femmes exposées au tétrachloroéthylène sur leur lieu de travail (Kyyronen et al., 1989 ; Windham et al., 1991 ; Zielhuis et al., 1989). Toutefois, aucune conclusion définitive ne peut en être tirée en raison d’insuffisances dans ces études (connaissance des expositions limitée, petits groupes d'étude, peu de grossesses, non prise en compte de facteurs confondants). Chez 20 femmes exposées au tétrachloroéthylène (doses non spécifiées), il n'a pas été relevé d'augmentation significative du délai (en nombre de cycles menstruels) nécessaire pour concevoir (Sallmen et al., 1995).
Chez des travailleurs exposés, il n'a pas été noté de différence significative dans la qualité du sperme (concentration, nombre de spermatozoïdes, mobilité, vélocité, pourcentage de formes anormales). Toutefois, les spermatozoïdes tendent à prendre une forme plus ronde et moins effilée et effectuent plus de mouvements latéraux (Eskenazi et al., 1991a). Les taux d'avortements spontanés n'apparaissaient pas plus élevés chez les femmes de ces travailleurs bien que la durée pour concevoir soit légèrement plus longue (Eskenazi et al., 1991b). Les différences observées, bien que significatives, sont cependant faibles et leur signification toxicologique douteuse.
De nombreuses études ont étudiés les avortements spontanés, en particulier chez le personnel d'entreprises de nettoyage à sec (Doyle et al., 1997b ; Windham et al., 1991 ; Olsen et al., 1990 ; Lindbohm et al., 1990 ; Kyyronen et al., 1989 ; Bosco et al., 1987). Un risque élevé d’avortement spontané est rapporté mais les résultats observés ne permettent pas de tirer des conclusions définitives, en particulier à cause de la méconnaissance de la fréquence habituelle des avortements spontanés.
Dans le cadre d’une étude sur l’exposition aux solvants organiques regroupant 8 112 cas de cancer des cellules germinales du testicule (14 à 49 ans) sélectionnés à partir de registres en Finlande, Norvège et Suède, ainsi que 26 264 témoins, seule une association positive avec l’exposition paternelle au tétrachloroéthylène a été observée en Finlande (OR = 1,67, 95 %, IC = 1,32-4,41)(Le Cornet et al., 2017).
Synthèse
Chez l’homme, les rares données disponibles ne mettent pas en évidence d’effet sur la reproduction.
Chez l'animal
Toutes voies
Les effets du tétrachloroéthylène sur la fertilité ont été étudiés chez le rat, au cours d'une étude sur deux générations (Tinston, 1995). Les animaux ont été exposés à 100, 300 ou 1 000 ppm de tétrachloroéthylène durant 11 semaines avant l'accouplement, puis jusqu'au 20ème jour de gestation pour les femelles et ensuite pendant la lactation (total 19 semaines). Il n'a pas été clairement mis en évidence d'effet du tétrachloroéthylène sur la fertilité et l'accouplement.
Synthèse
Chez l’animal, il n’a pas été identifié d’effet sur la fertilité.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 1996 |
Chez l'homme
Inhalation
Si des augmentations du nombre d’avortements spontanés, de mortinatalité ou de malformations congénitales ont été décrites dans plusieurs études où l’exposition au tétrachloroéthylène par inhalation est abordée dans un contexte professionnel (blanchisseries, pressing) (Doyle et al., 1997a ; Kyyronen et al., 1989 ; McDonald et al., 1986 ; McDonald et al., 1987 ; Olsen et al., 1990 ; Windham et al., 1991), aucune association significative ne peut être déduite de ces études en raison le plus souvent du faible nombre de cas ou de l’exposition concomitantes à d’autres substances potentiellement nocives pour le développement.
Une étude ayant permis d’observer une augmentation significative du nombre de cas de schizophrénie (RR = 3,4 ; 95 %, IC = 1,3-9,2) parmi une cohorte de 88 829 enfants dont les parents (père ou mère) ont été employés dans le secteur du nettoyage à sec, l’exposition au tétrachloroéthylène n’ayant pas été spécifiquement analysée (Perrin et al., 2007).
Voie orale
Parmi les études citées précédemment faisant référence à une contamination au tétrachloroéthylène par l’intermédiaire de l’eau de boisson, certaines évoquent des associations entre l’exposition au cours de la grossesse et un petit poids de naissance (inférieur à 1,5 kg) (Bove et al., 1995 ; Lagakos et al., 1986), des anomalies au niveau des yeux et des oreilles (Lagakos et al., 1986) ou encore de fentes labio-palatines (Bove et al., 1995) et autres anomalies congénitales (musculo-squelettiques, cardiovasculaires, etc.) (Aschengrau et al., 2009 ; Lagakos et al., 1986). Les nombres de cas sont généralement trop faibles pour aboutir à des associations significatives et l’exposition à d’autres substances ne peut pas toujours être écartée.
Des effets neuro-développementaux ciblés autour du comportement et des troubles de la vision ont également été décrits en particulier chez des enfants exposés in utero et jusqu’à l‘âge de 5 ans via l’eau potable (Aschengrau et al., 2011, 2012 ; Aschengrau et al., 2016 ; Getz et al., 2012), les résultats étant plus détaillés dans le paragraphe se rapportant aux effets sur le système nerveux.
Synthèse
Chez l’homme, les rares données disponibles ne mettent pas en évidence d’effet sur le développement.
Chez l'animal
Inhalation
Les effets du tétrachloroéthylène sur les performances de reproduction ont été étudiés chez le rat, au cours d'une étude sur deux générations (Tinston, 1995). Les animaux ont été exposés à 100, 300 ou 1 000 ppm de tétrachloroéthylène durant 11 semaines avant l'accouplement, puis jusqu'au 20ème jour de gestation pour les femelles et ensuite pendant la lactation (total 19 semaines). Aux doses de 300 et 1 000 ppm, qui ont induit une légère toxicité générale chez les générations parentes, une diminution de la taille des portées et de la survie des jeunes a été observée. Une NOAEC de 100 ppm a été clairement établie pour ces effets.
Concernant les effets du tétrachloroéthylène inhalé sur le développement, des études chez le rat et le lapin n'ont pas permis de mettre en évidence d'effets tératogènes à des concentrations de 300-500 ppm durant la gestation (Beliles et al., 1980 ; Hardin et al., 1981).
A 1 000 ppm, une diminution du poids des fœtus et un retard dans l'ossification ont été observés. Ces effets étaient réversibles après la naissance (Tepe et al., 1980).
Une étude a été menée chez les rats CFY exposés du 1er au 8ème jour de la gestation, 8 heures par jour, aux concentrations de 1 500 – 4 500- 8 500 mg.m-3 et chez les souris C57B1 du 7ème au 15ème jour de la gestation, à 1 500 mg.m-3 et chez le lapin du 7ème au 20ème jour à la concentration de 4 500 mg.m-3 (Szakmary et al., 1997). Pour les concentrations de 4 500 et 8 500 mg.m-3, une toxicité maternelle est rapportée chez le rat. A ces concentrations, une diminution du poids des fœtus, un retard d’ossification et une augmentation des malformations sont observées, chacune de ces altérations étant statistiquement significative. Chez les souris et les lapins, une augmentation du poids du foie et une diminution de la croissance pondérale de la mère sont rapportées. Chez les jeunes souris, une augmentation du nombre de fœtus présentant des malformations viscérales est rapportée. Chez les lapins, une augmentation des pertes post-implantations et une augmentation des malformations des fœtus sont décrites.
Une étude, par exposition corps entier, menée chez le rat Sprague Dawley aux concentrations de 0 – 75 – 250 – 600 ppm de tétrachloroéthylène, 6 heures par jour, 7 jours par semaine, du 6ème au 19ème jour de la gestation selon les protocoles de l’OCDE, montre une toxicité légère mais statistiquement significative avec une diminution du poids corporel au cours de 3 jours d’exposition à 600 ppm chez les parents (Carney et al., 2006). Une diminution du poids du fœtus et du placenta ainsi qu’une ossification incomplète de la cage thoracique sont observées pour des concentrations supérieures ou égales à 250 ppm.
Voie orale
Par voie orale, peu d'études sont disponibles. Une diminution du nombre d'animaux par portée, une augmentation de la mortalité post-natale et des malformations ont été observées chez des rats exposés à forte dose (900 mg.kg-1.j-1) entre le 6ème et le 19ème jour de gestation. A cette dose, la toxicité maternelle était également conséquente (perte de poids, ataxie) (Narotsky et Kavlock, 1995).
Synthèse
Chez l’animal, les effets sur le développement surviennent pour des expositions par inhalation. Il s’agit essentiellement de retard de croissance et d’ossification. Toutefois, ces résultats ne sont pas assez robustes pour permettre un classement du tétrachloroéthylène par l’Union Européenne.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent. Comme précisé précédemment, les résultats des études de génotoxicité semblent mettre en évidence une activité plus liée aux métabolites du tétrachloroéthylène qu’au tétrachloroéthylène lui-même. En l’absence de données montrant clairement un mécanisme d’action à seuil d’effet, pour l’ensemble des cancers observés, il est souhaitable de proposer des valeurs pour des effets sans seuil.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L'ATSDR propose un MRL de 0,041 mg.m-3 (soit 0,006 ppm) pour une exposition aiguë au tétrachloroéthylène par inhalation (2019).
Cette valeur est établie à partir d’une étude chez les travailleurs exposés professionnellement au tétrachloroéthylène (Cavalleri et al., 1994 ; Echeverria et al., 1995). Cette étude a mis en évidence des effets neurotoxiques se traduisant notamment par une confusion des couleurs à une LOAEC de 7,3 ppm pour des expositions chroniques. Une concentration ajustée pour une exposition continue a été calculée : LOAECadj = 7,3 ppm x 8/24 h x 5/7 j = 1,7 ppm.
Cette LOAECadj de 1,7 ppm est considérée par l’ATSDR comme très proche et constituant une meilleure base pour le calcul de la MRL aiguë que la NOAEL de 2 ppm déterminée dans l’étude chez le volontaire d’Altmann et al., (1990) pour une exposition de 4 heures par jour. Par ailleurs, l’utilisation du modèle PBPK (Chiu et Ginsberg, 2011) a montré, qu’à la concentration de 1,7 ppm les concentrations sanguines de tétrachloroéthylène variaient peu selon la durée d’exposition (14 jours, 90 jours ou 365 jours)(Chiu et Ginsberg, 2011), ainsi la valeur calculée pour une exposition chronique, et présentée plus loin, est retenue pour une exposition aiguë.
Facteurs d'incertitude : Un facteur d’incertitude de 100 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de l’utilisation d’une LOAEC, ainsi qu’un facteur supplémentaire de 3 en raison de l’absence de données adéquates dans la base de données (manque d’informations relatives aux effets sur le système immunitaire de l’exposition aux faibles doses).
Calcul : 1,7 ppm x 1/300 = 0,0057 ppm arrondi à 0,006 ppm (soit 4,1 10-2 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L'OEHHA propose un REL de 20 mg.m-3 (2,9 ppm) pour une exposition aiguë au tétrachloroéthylène par inhalation (OEHHA, 2015).
Cette valeur, élaborée en 1999 (OEHHA, 1999), est issue d'une étude réalisée chez 3 sujets sains exposés pendant 7 heures par inhalation à une concentration de 700 mg.m-3 (100 ppm) (Stewart, 1969). Les effets se sont traduits par une atteinte du système nerveux central mis en évidence à partir des résultats anormaux au test de Romberg modifié (sensibilité proprioceptive), ainsi que par des symptômes tels des maux de tête, une légère irritation oculaire, nasale et de la gorge et de légers étourdissements. A noter que les effets ont été observés à partir de la 3ème heure d’exposition. Aucun NOAEL n'a pu être déterminé.
Facteur d'incertitude : un facteur 6 est appliqué pour l'utilisation d'une LOAEC et un facteur 10 pour la variabilité au sein de la population (variabilité intra-espèce).
Calcul : extrapolation de la concentration pour une exposition d’1 heure = 1200 mg.m-3 (à partir de la formule 7002 mg.m-3 x 3 h. = C2 x 1h).
REL = 1200 mg.m-3 x 1/60 = 20 mg.m-3
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L’ANSES propose une VTR de 1,38 mg.m-3 (0,2 ppm) pour une exposition court terme au tétrachloréthylène par inhalation (ANSES, 2018).
Cette valeur est construite à partir de l’étude d’Altmann et al., 1992. Une batterie de tests neurocomportementaux réalisée sur des volontaires avant et après exposition au PCE (10 et 50 ppm pendant 4 j, 4 h / jour) afin d’estimer les performances et la coordination motrices, la concentration, la reconnaissance des formes, l’apprentissage, l’humeur a permis de déterminer une NOAEC de 69 mg.m-3 (10 ppm). Cette NOAEC a été ajustée à une exposition continue : NOAECADJ = 10 ppm x 4 h /24 h = 1,7 ppm valeur arrondie à 2 ppm soit 13,8 mg.m-3)
Facteurs d'incertitude : un facteur 10 est appliqué pour la variabilité au sein de la population.
Calcul : 13,8 x 1/10 = 1,38 mg.m-3 soit 0,2 ppm.
Indice de confiance : L’ANSES accorde un indice fort dans la nature et la qualité des données, dans le choix de l’effet critique et mode d’action et dans le choix de l’étude clé, un indice moyen dans le choix de la dose critique. Finalement, l’ANSES accorde un indice fort au niveau de qualité global de la valeur élaborée.
Effets à seuil - Exposition sub-chronique par inhalation :
L'ATSDR propose un MRL de 0,041 mg.m-3 (soit 0,006 ppm) pour une exposition sub-chronique au tétrachloroéthylène par inhalation (ATSDR, 2019).
Cette valeur est basée sur la valeur développée pour des expositions chroniques. Elle est identique en tous points à celle proposée pour des expositions aiguës et présentée ci-dessus.
L’ANSES propose une VTR de 0,4 mg.m-3 (soit 0,06 ppm) pour une exposition sub-chronique au tétrachloroéthylène par inhalation (ANSES, 2018).
L’ANSES n’a pas développé de valeur spécifique pour des expositions sub-chroniques mais retient comme VTR subchronique, la VTR développée pour des expositions chroniques (et présentée plus loin) sur la base de l’étude de Cavalleri et al., 1994 avec comme effet critique, la diminution de vision des couleurs. En effet, les résultats de la modélisation toxicocinétique ont montré que la concentration sanguine en tétrachloroéthylène atteint un état d’équilibre dès deux semaines d’exposition.
Indice de confiance : L’Anses accorde un indice de confiance fort dans la nature et la qualité des données, dans le choix de l’effet critique et le mode d’action, dans le choix de l’étude clé, indice moyen dans le choix de la dose critique. Finalement l’ANSES accorde un indice de confiance fort au niveau global de la valeur élaborée.
Effets à seuil - Exposition chronique par inhalation :
L’ANSES propose une VTR de 0,4 mg.m-3 (soit 0,06 ppm) pour une exposition chronique au tétrachloréthylène par inhalation (ANSES, 2018).
Cette valeur est établie à partir de l’étude de Cavalleri et al., 1994 qui a recherché les effets du tétrachloroéthylène sur la vision des couleurs chez 35 employés d’entreprises de nettoyage à sec et sur un groupe de 35 sujets témoins non exposés. Une LOAEC de 50 mg.m-3 (7,3 ppm) a été retenu pour l’augmentation significative de l’index de Confusion des Couleurs (ICC) chez les sujets exposés. Une concentration équivalente d’exposition continue a été calculée :
LOAECADJ = 50 x [(8/24 h) x (5/7 j)] = 11,90 mg.m-3 arrondi à 12 mg.m-3 (1,8 ppm).
Facteurs d'incertitude : Un facteur d’incertitude de 30 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 3 pour tenir compte de l’utilisation d’une LOAEC.
Calcul : 12 x 1/30 = 0,4 mg.m-3 soit 0,06 ppm.
Indice de confiance : L’Anses accorde un indice de confiance fort dans la nature et la qualité des données, dans le choix de l’effet critique et le mode d’action, dans le choix de l’étude clé, indice moyen dans le choix de la dose critique. Finalement l’ANSES accorde un indice de confiance fort au niveau global de la valeur élaborée.
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 0,008 mg.kg-1.j-1 pour une exposition aiguë par voie orale au tétrachloroéthylène (ATSDR, 2019).
Cette valeur est établie par extrapolation voie à voie à partir de celle établie pour une exposition chronique par inhalation et présentée ci-dessus. Un LOAEL équivalent de 2,3 mg.kg-1.j-1 a été calculé à partir de la LOAEC de 1,7 ppm.
Facteurs d'incertitude : Un facteur d’incertitude de 100 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de l’utilisation d’une LOAEC, ainsi qu’un facteur supplémentaire de 3 en raison de l’absence de données adéquates sur la base de données (manque d’information des effets potentiels sur le système immunitaire à faible dose).
Calcul : 2,3 mg.kg-1.j-1 x 1/300 = 0,0077 mg.kg-1.j-1 arrondi à 0,008 mg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 0,008 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale au tétrachloroéthylène (ATSDR, 2019).
Cette valeur est identique en tous points à celle proposée pour des expositions aiguës et présentée ci-dessus
Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose un MRL de 0,041 mg.m-3 (soit 0,006 ppm) pour une exposition chronique au tétrachloroéthylène par inhalation.
Cette valeur est établie à partir d’une étude chez les travailleurs (22 employés dans le nettoyage à sec et 13 dans le repassage) exposés chroniquement en milieu professionnel au tétrachloroéthylène (Cavalleri et al., 1994 ; Echeverria et al., 1995). Cette étude a mis en évidence des effets neurotoxiques se traduisant notamment par une confusion des couleurs (score de 1,192 ± 0,133 dans le groupe exposé versus 1,089 ± 0,117 dans le groupe témoin, p=0,007) et a permis d’établir une LOAEC de 7,3 ppm. Une concentration équivalente d’exposition continue a été calculée : LOAECadj = 7,3 ppm x 8/24 h.x 5/7 j = 1,7 ppm.
Cette LOAELadj de 1,7 ppm est considérée par l’ATSDR comme très proche et constituant une meilleure base pour le calcul de la MRL aiguë que la NOAEL de 2 ppm déterminée dans l’étude chez le volontaire d’Altmann et al., (1990) pour une exposition de 4 heures par jour. Par ailleurs, l’utilisation du modèle PBPK (Chiu et Ginsberg, 2011) a montré, qu’à la concentration de 1,7 ppm les concentrations sanguines de tétrachloroéthylène variaient peu selon la durée d’exposition (14 jours, 90 jours ou 365 jours) (Chiu et Ginsberg, 2011), ainsi la valeur calculée pour une exposition chronique, est aussi retenue pour une exposition aiguë.
Facteurs d'incertitude : Un facteur d’incertitude 100 a été retenu correspondant à un facteur 10 pour la variabilité au sein de la population humaine, un facteur 10 pour tenir compte de l’utilisation d’une LOAEC, ainsi qu’un facteur supplémentaire de 3 en raison de l’absence de données adéquates dans la base de données (manque d’informations relatives aux effets sur le système immunitaire de l’exposition aux faibles doses).
Calcul : 1,7 ppm x 1/300 = 0,0057 ppm arrondi à 0,006 ppm (soit 4,1 10-2 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L'US EPA (IRIS) propose une RfC de 0,04 mg.m-3 (0,006 ppm) pour une exposition chronique par inhalation (US EPA, 2012).
Cette valeur est établie à partir de deux études chez les travailleurs exposés professionnellement au tétrachloroéthylène (Echeverria et al., 1995 ; Cavalleri et al., 1994). Ces deux études mettent en évidence la survenue d’effets neurotoxiques : augmentation du temps de réaction et altération des performances au cours de 3 tests cognitifs (Echeverria et al., 1995) et confusion des couleurs (Cavalleri et al., 1994). Ces deux études ont permis de déterminer des LOAEC pour ces effets : une LOAEC de 56 mg.m-3 (8 ppm) pour les effets cognitifs et une LOAEC de 15 mg.m-3 (2 ppm) pour la dyschromatopsie. A partir de ces études, il n’a pas été possible d’établir une relation dose effet du fait de l’absence de groupe témoin ou du manque d’une covariance suffisante. De ce fait, la valeur retenue est 35,5 mg.m-3 soit la moyenne arithmétique des deux LOAEC issues des deux études qui sert alors de point de départ pour le calcul de la VTR.
Facteurs d'incertitude : Un facteur d’incertitude de 1 000 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de l’utilisation d’une LOAEC, un facteur de 10 en raison de l’absence de données adéquates pour caractériser le danger et la relation dose effet dans la population humaine.
Calcul : 35,5 mg.m-3 x 1/1 000 = 0,035 mg.m-3 arrondi à 0,04 mg.m-3 (0,006 ppm)
Indice de confiance : indice moyen dans l’étude, la base de données et la valeur élaborée.
L’OMS CICAD propose une CT de 0,2 mg.m-3 pour une exposition chronique par inhalation (OMS CICAD, 2006).
Cette valeur est basée sur l’étude de Seeber, 1989, réalisée auprès de 101 employés de pressing exposés pendant au moins 10 ans. Dans cette étude, deux niveaux d’exposition ont été identifiés : niveau d’exposition faible à 12 ppm (83 mg.m-3) avec 57 employés exposés, niveau d’exposition élevé à 54 ppm (373 mg.m-3) avec 44 individus exposés. Une LOAEC de 83 mg.m-3 a été déterminée pour des effets neurologiques (vitesse de perception retardée, détérioration de l’attention et de la détection visuelle). Un ajustement de l’exposition discontinue à une exposition continue a été réalisé 8 h/24 h x 5 j/7 j soit un LOAEC ajusté de 20 mg.m-3.
Facteurs d'incertitude : Un facteur d’incertitude global de 100 est proposé : un facteur de 10 pour l’utilisation d’une LOAEC, un facteur de 10 pour les variations au sein de la population humaine.
Calcul : 83 x 8 h/24 h x 5 j/7 j x 1/100 = 0,198 mg.m-3 (arrondi à 0,2 mg.m-3 ou 0,03 ppm)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L’OMS propose une valeur guide de 0,25 mg.m-3 pour une exposition chronique par inhalation (OMS, 2000)
Cette valeur est établie à partir de l’étude épidémiologique de Mutti et al., 1992, sur des travailleurs exposés pendant 10 ans. De cette étude, une LOAEC de 102 mg.m-3 pour des effets rénaux est retenue. Un ajustement par rapport à la durée d’exposition des travailleurs avec un facteur de 4,2 est appliqué.
Facteurs d'incertitude : Un facteur d’incertitude de 100 correspondant à un facteur de 10 pour la variabilité intra espèce et un facteur de 10 pour l’utilisation d’un LOAEC.
Calcul : 102 mg.m-3 x1/4,2 x 1/100 = 0,243 mg.m-3 arrondi à 0,25 mg.m-3
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Santé Canada propose une CT de 0,04 mg.m-3 pour une exposition chronique par inhalation (Santé Canada, 2021).
Cette valeur est établie à partir de deux mêmes études chez les travailleurs exposés professionnellement au tétrachloroéthylène que celles retenues par l’US EPA en 2012 dans l’élaboration de sa valeur (Echeverria et al., 1995 ; Cavalleri et al., 1994). Ces deux études mettent en évidence la survenue d’effets neurotoxiques : augmentation du temps de réaction et de la fonction cognitive (Echeverria et al., 1995) et confusion des couleurs (Cavalleri et al., 1994). Ces deux études ont permis de déterminer des LOAEC pour ces effets : une LOAEC de 56 mg.m-3 (8 ppm) pour les effets cognitifs et une LOAEC de 15 mg.m-3 (2 ppm) pour la dyschromatopsie. A partir de ces études, deux valeurs ont été calculées pour chacune des deux. Un ajustement pour une durée d’exposition continue a été pratiqué en tenant compte des taux d’inhalation, le détail n’a pas été précisé. Le point médian de la fourchette des deux valeurs LOAEC/facteur d’incertitude a été retenu soit la valeur de 0,04 mg.m-3.
Facteur d'incertitude : un facteur 1 000 est appliqué (10 pour la variabilité intraspécifique, 10 pour l'utilisation d'une LOAEC et 10 les lacunes de la base de données).
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Le RIVM propose une TCA de 0,25 mg.m-3 pour une exposition chronique par inhalation (Baars et al., 2001).
Cette valeur est celle proposée par l'OMS comme valeur guide pour la qualité de l'air, il s’agit d’une valeur établie en 1995 qui est encore retenue en 2000 (voir paragraphe 5.3) (OMS, 2000).
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est moyenne.
L’ANSES propose une VTR de 0,4 mg.m-3 (soit 0,06 ppm) pour une exposition chronique au tétrachloréthylène par inhalation (ANSES, 2018).
Cette valeur est établie à partir de l’étude de Cavalleri et al., 1994 qui a recherché les effets du tétrachloroéthylène sur la vision des couleurs chez 35 employés d’entreprises de nettoyage à sec et sur un groupe de 35 sujets témoins non exposés. Une LOAEC de 50 mg.m-3 (7,3 ppm) a été retenu pour l’augmentation significative de l’index de Confusion des Couleurs (ICC) chez les sujets exposés. Une concentration équivalente d’exposition continue a été calculée :
LOAECADJ = 50 x [(8/24 h) x (5/7 j)] = 11,90 mg.m-3 arrondi à 12 mg.m-3 (1,8 ppm).
Facteurs d'incertitude : Un facteur d’incertitude de 30 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 3 pour tenir compte de l’utilisation d’une LOAEC.
Calcul : 12 x 1/30 = 0,4 mg.m-3 soit 0,06 ppm.
Indice de confiance : L’Anses accorde un indice de confiance fort dans la nature et la qualité des données, dans le choix de l’effet critique et le mode d’action, dans le choix de l’étude clé, indice moyen dans le choix de la dose critique. Finalement l’ANSES accorde un indice de confiance fort au niveau global de la valeur élaborée.
L’OEHHA propose un REL 0,035 mg.m-3 pour une exposition long terme au tétrachloroéthylène par inhalation (OEHHA, 1991)
Cette valeur est construite sur l’ancienne valeur de l’US EPA. La méthode de construction n’est pas explicitée et la valeur de l’US EPA a été revue.
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L'US EPA (IRIS) propose une RfD de 6.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (US EPA, 2012).
Cette valeur est basée sur les deux mêmes études chez les travailleurs que celles retenues pour l’élaboration de la RfC. Une dérivation voie à voie a été pratiquée à partir des LOAEC en utilisant le modèle PBPK humain de Chiu et Ginsberg, 2011). Les LOAEL obtenus sont de 9,7 mg.kg-1.j-1 pour les effets cognitifs et de 2,6 mg.kg-1.j-1 pour la dyschromatopsie. Le LOAEL retenu correspond à la valeur moyenne des deux LOAEL issus des deux études épidémiologiques : 6,15 mg.kg-1.j-1.
Facteurs d'incertitude : Un facteur d’incertitude de 1 000 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de l’utilisation d’un LOAEC, un facteur de 10 en raison de l’absence de données adéquates pour caractériser le danger et de relation dose effet dans la population humaine.
Calcul : 6,15 mg.kg-1.j-1 x 1/1 000 = 0,00615 mg.kg-1.j-1 arrondi à 0,006 mg.kg-1.j-1
Indice de confiance : indice moyen dans l’étude, la base de données et la valeur élaborée.
L’OMS CICAD propose une valeur TDI de 50.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (OMS CICAD, 2006).
Considérant que les données disponibles pour des expositions par voie orale ne sont pas suffisantes, cette valeur est basée sur la Concentration Tolérable (CT) de 0,2 mg.m-3. Elle prend en compte le fait que le tétrachloroéthylène est bien résorbé par inhalation ou par ingestion et qu’il n’y a pas d’effet de premier passage hépatique du fait d’une exposition par inhalation. Un modèle pharmacocinétique à base pharmacodynamique (PBPK) est utilisé avec une ingestion de tétrachloroéthylène dans l’eau de boisson de 0,047 mg.kg-1 de poids corporel par jour, ce qui équivaudrait en cas d’exposition en continue au tétrachloroéthylène de 0,2 mg.m-3 à une valeur arrondie de 50.10-3 mg.kg-1.j-1.
L'OMS propose une TDI de 16.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (OMS, 2022).
Cette valeur est construite par extrapolation voie à voie à partir d’une étude chez le travailleur (Cavalleri et al., 1994). De cette étude un NOAEL 4,8 ppm pour la confusion des couleurs a été déterminé et une BMDL10 de 6,6 ppm (45,2 mg.m-3) a été calculée (Santé Canada, 2015). Par modélisation PBPK, une dose équivalente pour la voie orale a été calculée conduisant à la détermination d’une dose externe pour une exposition par voie orale BMDL10 de 4,7 mg.kg-1 pc.j-1.
Facteur d’incertitude : un facteur de 300 est retenu qui correspond à un facteur de 10 pour les variations intra-espèces, un facteur de 10 pour les variations inter-espèces et un facteur de 3 pour l’extrapolation d’une exposition intermittente à continue.
Calcul : 4,7 mg.kg-1.j-1 x 1/300 = 16.10-3 mg.kg-1.j-1
Santé Canada propose une DJT de 4,7.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (Santé Canada, 2021).
Cette valeur est basée sur l’étude épidémiologique pour des expositions par inhalation chez le travailleur (Cavalleri et al., 1994). La valeur retenue pour la population des repasseuses, population exposée à des niveaux modérés entre 3,5 et 77 mg.m-3 correspondant à une valeur moyenne pondéré sur 8 heures de 33 mg.m-3. Le NOAEL retenu est 33 mg.m-3 pour des effets neurotoxiques (confusion des couleurs). Une modélisation a conduit à BMDL10 45 mg.m-3. Une modélisation PBPK a permis d’extrapoler ces valeurs pour des expositions par inhalation à des expositions par voie orale : BMDL10 4,7 mg.kg-1.j-1
Facteur d'incertitude : un facteur 1 000 est appliqué (10 pour la variabilité intraspécifique, 10 pour les lacunes de la base de données et 10 l'extrapolation à partir d’une exposition inférieure à la durée de vie).
Calcul : 4,7 mg.kg-1.j-1 x 1/1 000 = 0,0047 mg.kg-1.j-1
Le RIVM propose une TDI de 1,6.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
Cette valeur se base sur une étude expérimentale de 4 semaines par gavage chez le rat (Vries et al., 1982). Une hépatotoxicité a été observée (augmentation du poids du foie et augmentation de l'activité de l'aniline transférase) aux doses de 81 et 405 mg.kg-1.j-1. Pour cette étude, un NOAEL de 16 mg.kg-1.j-1 a été observé.
Une étude de gavage chez la souris durant 6 semaines, où un NOAEL de 14 mg.kg-1.j-1 a été établi pour les effets hépatiques (Buben et O'Flaherty, 1985), vient appuyer les résultats précédents.
Selon le RIVM, la fiabilité de cette valeur est élevée.
Facteur d'incertitude : un facteur 1 000 est appliqué (100 pour la variabilité inter et intraspécifique et 10 pour l'utilisation d'une étude subchronique).
Calcul : 16 x 1/ 1 000 = 1,6.10-2 mg.kg-1.j-1
L’ATSDR propose un MRL de 8.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (ATSDR, 2019).
Cette valeur est établie par extrapolation voie à voie à partir de celle établie pour une exposition chronique par inhalation et présentée ci-dessus. Un LOAEL équivalent de 2,3 mg.kg-1.j-1 a été calculé à partir de la LOAEC de 1,7 ppm.
Facteurs d'incertitude : Un facteur d’incertitude de 100 a été retenu correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de l’utilisation d’une LOAEC, ainsi qu’un facteur supplémentaire de 3 en raison de l’absence de données adéquates sur la base de données (manque d’information des effets potentiels sur le système immunitaire à faible dose).
Calcul : 2,3 mg.kg-1.j-1 x 1/300 = 0,0077 ppm arrondi à 0,008 mg.kg-1.j-1
Indice de confiance : indice moyen dans l’étude, la base de données et la valeur élaborée.
L’ANSES propose de retenir la VTR de 14.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (ANSES, 2016).
Dans le cadre de l’évaluation des risques sanitaires liés au dépassement de la limite de qualité du tétrachloroéthylène dans les eaux destinées à la consommation humaine, en 2006 l’AFSSA a analysé la qualité des VTR disponibles à cette date et retient la valeur de 14.10-3 mg.kg-1.j-1 de l’OMS pour une exposition chronique par voie orale (AFFSA, 2007). Depuis, cette valeur de l’OMS a été réévaluée en 2022. Suite à une actualisation de l’avis de l’AFSSA de 2006, l’ANSES recommande en 2016, toujours dans le cadre de la caractérisation des risques sanitaires, de s’appuyer sur la valeur de l’OMS établie en 2003 (ANSES, 2016).
Effets sans seuil - Exposition chronique par inhalation :
L'US EPA propose un ERUi de 2,6.10-7 (µg.m-3)-1 (ou 1,8.10-3 ppm-1) pour une exposition chronique par inhalation (US EPA, 2012).
Cette valeur est obtenue à partir des résultats d’une étude de cancérogenèse chez la souris (JISA, 1993). Dans cette étude, des souris (BDF1) mâles et femelles ont été exposées à des concentrations de 0 - 10 - 50 - 250 ppm (0 - 7 - 345 – 1 725 mg.m-3) de tétrachloroéthylène, 6 heures par jour, 5 jours par semaine, pendant 104 semaines. Les souris mâles et femelles ont développé des adénomes ou carcinomes hépatiques. Seuls les résultats chez les mâles sont retenus ici car ceux chez les femelles montrent une incidence un peu plus faible que chez les mâles. L’incidence du métabolisme oxydatif hépatique total a été considérée comme le meilleur indicateur de la toxicité hépatique chez les mâles survivants. Les résultats sont présentés dans le tableau ci-dessous.
Incidence des adénomes et carcinomes hépatocellulaires chez les souris mâles dans l’étude de JISA 1993 :

Une extrapolation des données à l’homme a été pratiquée, elle est basée sur la dose interne calculée sur le métabolisme oxydatif hépatique total. La pente de la courbe, en termes de dose interne (métabolisme oxydatif hépatique total) est convertie en unité de risque, équivalent pour l’homme pour une exposition par inhalation via l’environnement, au moyen du modèle PBPK de Chiu et Ginsberg, 2011).
Un modèle d’extrapolation linéaire multi-étapes a été utilisé en prenant comme point de départ la BMCL10 (limite inférieure de l’intervalle de confiance à 95 % de la dose pour un niveau de réponse de 10 %) de 3,9.105 µg.m-3 ou la BMC10 (estimation centrale) de 5,4.105 µg.m-3.
La pente de la courbe de l’extrapolation linéaire est 0,1/5,4.105 µg.m-3 = 1,9.10-7 (µg.m-3)-1. Comme le point de départ est la limite inférieure de l’intervalle de confiance à 10 %, le calcul de l’ERUi est : 0,1/ BMCL10 = 0,1/3,9.105 µg.m-3 = 2,6.10-7 (µg.m-3)-1.
L’excès de risque ne peut pas être utilisé pour des expositions dépassant le point de départ de (BMCL10), 4 × 104 µg.m-3 ou 60 ppm en raison d’une meilleure corrélation entre la relation dose-réponse et le modèle mathématique.
La valeur calculée est donc de 2,6.10-7 (µg.m-3)-1. Les concentrations associées à plusieurs niveaux de risque sont de 400 µg.m-3 pour un risque de 10-4, 40 µg.m-3 pour un risque de 10-5 et 4 µg.m-3 pour un risque de 10-6.
L'OEHHA propose un ERUi de 6,1.10-6 (µg.m-3)-1 pour une exposition par inhalation (OEHHA, 2016).
Dans sa dernière analyse, l’OEHHA s’est appuyé sur les résultats des deux études de cancérogénèse chez le rat et la souris du NTP, 1986 et du JISA, 1993. Dans ces études, des rats et des souris (mâles et femelles) ont été exposés 6 heures par jour, 5 jours par semaine, à des concentrations 0, 100 et 200 ppm (NTP) ou 0 - 10 - 50 - 250 ppm chez la souris (JISA) et 0 - 50 - 200 – 600 ppm chez le rat (JISA) de tétrachloroéthylène pendant respectivement 103 et 104 semaines. Pour les mêmes raisons que l’US EPA, l’OEHHA n’a retenu que les effets cancérogènes observés chez les mâles (plus forte sensibilité que les femelles). Seuls, les effets sur lesquels s’est appuyé l’OEHHA sont rapportés dans le tableau suivant :
Incidence des tumeurs observées chez les mâles rats et souris de l’étude de JISA, 1993 :
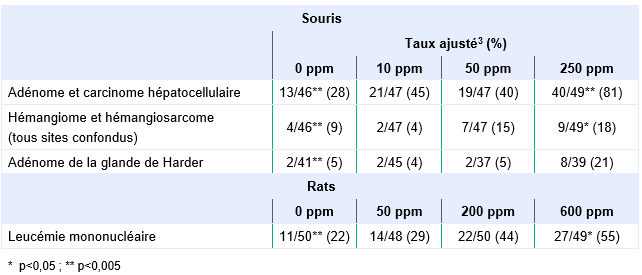
Incidence des tumeurs observées chez les mâles rats et souris de l’étude du NTP, 1986 :
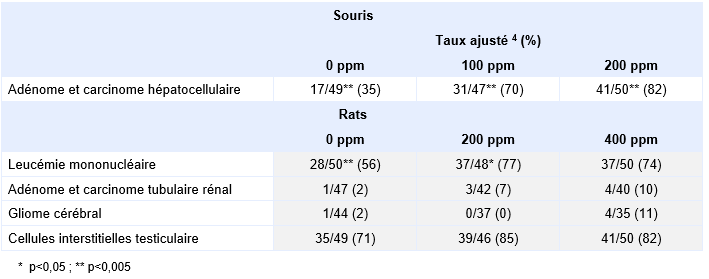
L’extrapolation des données à l’homme a été pratiquée, elle est basée sur la dose interne calculée sur le métabolisme total (oxydation hépatique, rénale et pulmonaire et conjugaison au GSH au niveau hépatique et rénal). La pente de la courbe, en termes de dose interne est convertie en unité de risque équivalent pour l’homme pour une exposition par inhalation via l’environnement, au moyen du modèle PBPK de Chiu et Ginsberg, 2011).
Des BMDL ont été calculés à 95 % pour un excès de risque de 5 % pour chaque type tumoral considéré, ainsi que des BMDL combinant les différents types de tumeurs à partir d’un modèle multi-étapes.
La valeur de l’ERU de 6,06 .10-6 (µg.m-3)-1 a été obtenue en faisant la moyenne géométrique de quatre valeurs d’ERU retenues par l’OEHHA pour certaines types de tumeurs à partir d’un argumentaire consultable sur le document d’origine :
ERU retenus pour le calcul de moyenne géométrique (OEHHA, 2016)
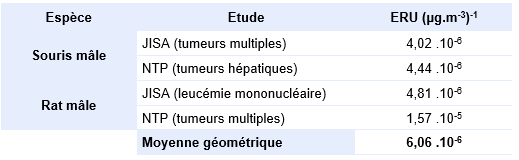
Les concentrations associées à plusieurs niveaux de risque sont de 16,5 µg.m-3 pour un risque de 10-4, 1,7 µg.m-3 pour un risque de 10-5, et 0,2 µg.m-3 pour un risque de 10-6.
L'ANSES retient l’ERUi de 2,6.10-7 (µg.m-3)-1 (ou 1,8.10-3 ppm-1) pour une exposition chronique par inhalation (ANSES, 2018).
Cette valeur est établie à partir d’une analyse critique de l’ERUi élaboré par l’US EPA (2012) et qui a été jugée pertinente. Les effets critiques sont les adénomes et les carcinomes hépatocellulaires chez les souris mâles observés dans l’étude JISA, (1993). Cependant des incertitudes subsistent, notamment concernant le mode d’action cancérogène du tétrachloroéthylène au niveau hépatique, l’extrapolation à l’homme des tumeurs du foie observées chez la souris, la part chez l’homme de la voie métabolique de conjugaison au GSH.
L’Anses ne rejette pas l’étude de JISA (1993) comme étude clé. Toutefois, il est indiqué que cette étude n’est pas publiée et que l’ensemble des données de cette étude n’est pas disponible.
La méthode de construction est basée sur le calcul d’une BMC10L95 au moyen du modèle PBPK de Chiu et Ginsberg, 2011. L’Anses considère donc que d'un strict point de vue calculatoire la BMCL fournie par l'US EPA est de bonne qualité, et remplit les conditions d'application de cette théorie. Elle a été critiquée par le NRC et les réponses de l'US EPA sont acceptables. L’ANSES considère que le modèle de Chiu et Ginsberg (2011) peut être utilisé pour les extrapolations voie à voie et pour extrapoler de l’animal à l’Homme.
La valeur calculée est donc de 2,6.10-7 (µg.m-3)-1. Les concentrations associées à plusieurs niveaux de risque sont de 400 µg.m-3 pour un risque de 10-4, 40 µg.m-3 pour un risque de 10-5 et 4 µg.m-3 pour un risque de 10-6.
Cette valeur a été retenue par l’Anses en 2013. La réévaluation des données a été menée par l’Anses en 2018 qui a conduit à la conclusion selon laquelle aucune nouvelle VTR ou nouvelle étude ne remet en cause le choix fait par l’Anses en 2013.
Indice de confiance : global moyen/faible dans la VTR élaboré ce qui correspond à indice de confiance moyen/faible pour le choix de l’effet critique et l’hypothèse de construction sans seuil, pour le choix de l’étude clé et de moyen/fort pour le choix de la dose critique et la construction de la VTR.
Effets sans seuil - Exposition chronique par voie orale :
L'US EPA propose un ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 pour une exposition par voie orale (US EPA, 2012).
Cette valeur est extrapolée à partir des données par inhalation du fait du manque de données pour des expositions par voie orale. Une BMDL10 a été calculée à 95 % pour un excès de risque de 10 % : 47 mg.kg-1.j-1 et une BMD10 centrale a été estimée pour un excès de risque de 10 % : 67 mg.kg-1.j-1. L’extrapolation linéaire a ensuite été menée à partir de la dose centrale : 0,1/67 mg.kg-1.j-1 = 0,0015 (mg.kg-1.j-1)-1.
La pente de la droite ne peut pas être utilisée pour des doses supérieures à 50 mg.kg-1.j-1.
L’ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 correspond à une dose de 4,8.10-3 mg.kg-1.j-1 pour un risque de 10-5 et de 4,8.10-4 mg.kg-1.j-1 pour un risque de 10-6.
Un excès de risque pour une exposition par l’eau de boisson a également été calculé et est de 6,1.10-8 (µg.L-1)-1.
L’OEHHA propose un ERUo de 0,54 (mg.kg-1.j-1)-1 pour une exposition au tétrachloroéthylène par voie orale (OEHHA, 2001).
Cette valeur est établie à partir d’une étude par gavage chez la souris (NCI, 1977). Les animaux ont été exposés au tétrachloroéthylène 5 jours par semaine pendant 78 semaines. Une augmentation de l’incidence des carcinomes hépatocellulaires a été observée dans les deux sexes.
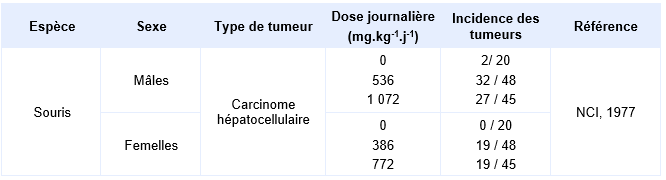
L’ERUo de 0,54 (mg.kg-1.j-1)-1 correspond à une dose de 1,85.10-5 mg.kg-1.j-1 pour un risque de 10-5 et de 1,85.10-6 mg.kg-1.j-1 pour un risque de 10-6.
L’ANSES propose un ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 pour une exposition par voie orale (ANSES, 2016)
Dans le cadre de l’évaluation des risques sanitaires liés au dépassement de la limite de qualité du tétrachloroéthylène dans les eaux destinées à la consommation humaine, en 2006 l’AFSSA a analysé la qualité des VTR disponibles à cette date (AFFSA, 2007). Suite à une actualisation de l’avis de l’AFSSA de 2006, l’ANSES recommande en 2016, toujours dans le cadre de la caractérisation des risques sanitaires, de s’appuyer sur la valeur de l’US EPA (ANSES, 2016).
L’ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 correspond à une dose de 4,8.10-3 mg.kg-1.j-1 pour un risque de 10-5 et de 4,8.10-4 mg.kg-1.j-1 pour un risque de 10-6.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’ANSES propose de retenir pour une exposition aiguë au tétrachloroéthylène par inhalation la VTR de 1,38 mg.m-3 (2018).
L’ATSDR (2019), l’OEHHA (1999) et l’ANSES (2018) proposent une valeur pour une exposition aiguë par inhalation. L’ATSDR propose une valeur basée sur une étude professionnelle (Cavalleri et al., 1994) en considérant que la valeur calculée pour des expositions chroniques est applicable dès 14 jours d’exposition. Cette approche ne parait pas adaptée.
La valeur proposée par l’OEHHA fait référence à une étude réalisée sur des volontaires sains (Stewart, 1969), mais qui ne comporte qu’une seule concentration d’exposition et pas de sujets témoins. Par ailleurs le calcul d’extrapolation sur la durée d’exposition est discutable et le choix des facteurs d’incertitude excessifs.
La valeur de l’ANSES est établie à partir d’une étude chez le volontaire sain sur la base d’effets sur le système nerveux (Altmann et al., 1992). Dans cette étude de bonne qualité, le protocole expérimental a permis d’établir une NOAEC.
La valeur de l’ANSES est retenue.
Indice de confiance : L’indice de confiance accordé par l’Anses dans sa valeur est fort.
Effets à seuil - Exposition sub-chronique par inhalation :
L’ANSES propose de retenir pour une exposition sub-chronique au tétrachloroéthylène par inhalation en la VTR 0,4 mg.m-3 (0,06 ppm) (2018).
Deux organismes proposent des valeurs pour une exposition sub-chronique par inhalation l’ANSES (2018) et l’ATSDR (2019). Ces valeurs sont établies par extrapolation de la valeur établie pour des expositions chroniques à partir de l’étude de Cavalleri et al., 1994 avec comme effet critique, la diminution de la vision des couleurs. Sur la base des résultats de modélisation toxicocinétique du tétrachloroéthylène indiquant que la concentration de tétrachloroéthylène sanguin atteint un état d’équilibre quasiment constant après 2 semaines d’exposition continue. Les deux organismes ont adopté leur VTR chronique en tant que VTR sub-chronique.
Indice de confiance : L’ANSES accorde un indice de confiance fort dans sa valeur.
L’ANSES propose de retenir pour une exposition chronique au tétrachloroéthylène par inhalation la VTR de 0,4 mg.m-3 (2018).
Huit organismes différents proposent des valeurs (ATSDR, 2019, US EPA, 2012, OMS CICAD, 2006, OMS, 2000, Santé Canada, 2021, RIVM, 2001, ANSES, 2018, OEHHA, 1991).
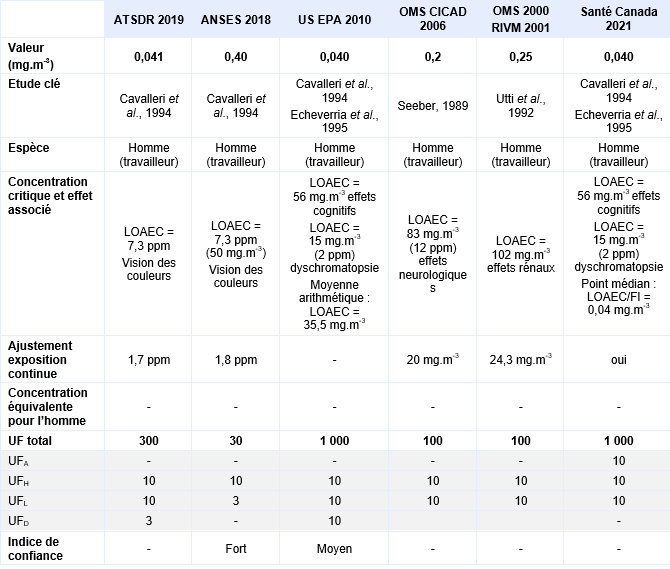
L’OEHHA retient une ancienne valeur de l’US EPA qui a été révisée depuis. Cette valeur n’est pas retenue.
L’OMS et le RIVM retiennent un effet critique correspondant à des effets rénaux chez l’homme avec une LOAEC de 102 ppm soit 725 mg.m-3 (Mutti et al., 1992). Cet effet n’est pas celui apparaissant aux plus faibles niveaux d’exposition.
L’ATSDR, l’OMS CICAD, l’US EPA, Santé Canada et l’ANSES retiennent comme effet critique des effets neurologiques. L’OMS CICAD retient une LOAEC de 12 ppm pour des effets neurologiques (vitesse de perception visuelle retardée, détérioration de l’attention et de détection visuelle), chez des individus résidant à proximité de pressing (Seeber, 1989). L’US EPA propose une valeur basée sur deux études épidémiologiques menées chez des travailleurs : l’une sur les troubles de la vision pour une LOAEC de 2,6 ppm soit 18 mg.m-3 (Cavalleri et al., 1994) et l’autre sur des troubles comportementaux pour une LOAEC de 9,7 ppm soit 70 mg.m-3 (Echeverria et al., 1995). Santé Canada retient la même approche que l’US EPA. Enfin, l’ANSES et l’ATSDR à partir d’une de ces deux études (Cavalleri et al., 1994) retient la LOAEC de 50 mg.m-3(7,3 ppm).
De manière générale, les effets neurologiques, et plus particulièrement les troubles de la vision des couleurs, sont décrits comme survenant pour les plus faibles niveaux d’exposition au tétrachloroéthylène. Ces derniers sont retenus comme effets critiques pour les valeurs proposées par l’OMS CICAD, l’US EPA, l’ANSES et l’ATSDR. De plus, une analyse de la robustesse méthodologique des différentes études rapportées dans la littérature sur ces effets neurologiques menée par le NRC ne retient pas les études de Ferroni et al., 1992 et de Seeber, 1989 parmi celles recevables alors qu’elle conseille l’utilisation notamment des études de Cavalleri et al., 1994 et de Echeverria et al., 1995. Cette analyse nous paraît justifiée.
Outre le choix de l’étude clé, les cinq valeurs proposées par l’ATSDR, l’OMS CICAD, l’US EPA, Santé Canada et l’ANSES différent par les facteurs d’incertitude appliqués. L’ATSDR, l’OMS CICAD et l’US EPA retiennent deux facteurs d’incertitude identiques : un facteur de 10 pour l’utilisation d’une LOAEC et un deuxième facteur de 10 pour la différence de sensibilité au sein de l’espèce humaine. L’US EPA retient un facteur supplémentaire de 10 pour prendre en compte en compte l’absence de données adéquates pour caractériser la relation dose effet dans la population humaine. En effet, les seules études permettant l’établissement d’une relation dose-effet sont celles chez le travailleur. Or, les études menées chez les populations résidentes à proximité des pressings révèlent des effets visuels qui surviennent pour des niveaux d’expositions plus bas que chez les travailleurs. Il y a donc des effets non pris en compte dans l’étude source qui ont été observés chez l’homme. Santé Canada suit l’approche de l’US EPA et retient un facteur 10 pour les lacunes de la base de données. L’ATSDR retient également un facteur supplémentaire de 3 en considérant qu’il y a un manque de données concernant les effets sur le système immunitaire pour des expositions à de faibles concentrations. L’ANSES retient ces deux mêmes facteurs d’incertitude avec une valeur 10 pour la différence de sensibilité au sein de l’espèce humaine mais prend un facteur uniquement de 3 pour l’utilisation d’une LOAEC.
Bien que l’effet critique retenu par l’OMS CICAD soit recevable (effets neurocomportementaux), l’étude clé de Seeber, 1998 pour l’OMS CICAD n’a pas été retenue par le NRC qui a mené une analyse de la robustesse méthodologique des différentes études rapportées dans la littérature portant sur les effets neurologiques du tétrachloroéthylène.
La valeur développée par l’US EPA se base sur deux études recevables, pour l’effet critique le plus sensible et prend en compte les résultats des études environnementales récentes. Toutefois, le calcul de la LOAEC, moyenne des LOAEC des deux études clés, n’est pas une démarche acceptable. De plus, le choix de certains facteurs d’incertitude n’est pas justifié par les données utilisées. La valeur de Santé Canada basée sur un raisonnement proche n’est pas retenue pour les mêmes raisons.
Les valeurs de l’ATSDR et de l’ANSES sont construites sur une seule de ces études (Cavalleri et al., 1994). Ces deux valeurs sont construites de la même façon à l’exception des facteurs d’incertitude : si les deux organismes retiennent un facteur 10 pour prendre en compte la variation intra-espèce et un facteur pour l’utilisation d’un LOAEC, la valeur de ce dernier est 3 pour l’ANSES et 10 pour l’ATSDR. De plus, l’ATSDR prend un facteur également un facteur supplémentaire de 3 en considérant qu’il y a un manque de données concernant les effets sur le système immunitaire pour des expositions à de faibles concentrations. Ces facteurs supplémentaires pris par l’ATSDR n’ont pas été jugés nécessaires par l’ANSES à partir du même jeu de données.
La valeur de l’ANSES est retenue
Indice de confiance : L’ANSES accorde un indice de confiance fort.
Effets à seuil - Exposition aiguë par voie orale :
L’INERIS propose de retenir pour une exposition aiguë au tétrachloroéthylène par voie orale le MRL de 0,008 mg.kg-1.j-1 de l’ATSDR (2019).
Seul l’ATSDR (2019) propose une valeur pour une exposition aiguë par voie orale. Cette valeur est établie à partir d’une étude épidémiologique chez le travailleur pour des expositions chroniques (Cavalleri et al., 1994). La voie d’exposition est l’inhalation, l’exposition est répétée et l’effet critique est pertinent. L’étude est de bonne qualité, la construction de la VTR et le choix du facteur d’incertitude sont justifiés. Cette valeur de l’ATSDR est retenue par l’INERIS .
Indice de confiance : moyen compte tenu des limites de l’étude source (durée et voie d’exposition).
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de retenir pour une exposition sub-chronique au tétrachloroéthylène par voie orale le MRL de 0,008 mg.kg-1.j-1 de l’ATSDR (2019).
Seul l’ATSDR (2019) propose une valeur pour une exposition sub-chronique par voie orale. Cette valeur est établie à partir d’une étude épidémiologique chez le travailleur pour des expositions chroniques (Cavalleri et al., 1994). La voie d’exposition est l’inhalation, l’exposition est répétée et l’effet critique est pertinent. L’étude est de bonne qualité, la construction de la VTR et le choix du facteur d’incertitude sont justifiés. Cette valeur de l’ATSDR est retenue par l’INERIS.
Indice de confiance : moyen compte tenu des limites de l’étude source (durée et voie d’exposition).
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique au tétrachloroéthylène par voie orale le MRL de 8.10-3 mg.kg-1.j-1 de l’ATSDR (2019).
Six valeurs de VTR sont proposées par l’OMS CICAD (2006), l’OMS (2022), Santé Canada (2021), le RIVM (2001), l’US EPA (2012), ATSDR (2019) et l’ANSES a réalisé un choix de VTR.
Le RIVM retient une étude chez le rat (Vries et al., 1982) pour une exposition de 4 semaines et un effet critique hépatique pour un NOAEL de 16 mg.kg-1.j-1. Il prend un facteur d’incertitude de 1 000 soit un facteur de 100 pour prendre en compte les différences intra- et inter-espèces et un facteur de 10 pour l’extrapolation subchronique à chronique. Compte tenu de la durée d’exposition de l’étude source, cette valeur n’est pas adaptée pour protéger des expositions chroniques : elle n’est pas retenue.
L’OMS CICAD propose, compte tenu de l’absence d’étude chronique chez l’animal et de données humaines pour une exposition voie orale, une dérivation de la VTR établie pour une exposition par inhalation à partir d’une étude humaine basée sur les effets neurologiques. Cette démarche apparaît justifiée car il s’agit d’effets neurologiques qui sont également observés pour des expositions voie orale. L’US EPA reprend la même démarche sur la base de la valeur RfC établie pour une exposition par inhalation. Afin d’assurer une extrapolation de bonne qualité, il base son extrapolation sur un modèle PBPK développé spécifiquement (Chiu et Ginsberg, 2011). La valeur chiffrée de l’US EPA ne peut pas être retenue pour une extrapolation voie à voie puisqu’elle n’a pas été jugée pertinente. Santé Canada et l’OMS retiennent une approche également basée sur une extrapolation voie à voie par modélisation PBPK qui ne peut être retenue pour les mêmes raisons. Enfin, en 2019, l’ATSDR propose également une approche similaire. Même si le mécanisme de genèse des lésions neurologiques n’est pas élucidé il semble lié aux effets du tétrachloroéthylène, ce qui rend possible ces effets par les deux voies d’exposition.
La valeur de l’ATSDR quoique protectrice présente la construction la plus adaptée, elle est retenue.
Indice de confiance : moyen en raison d’une extrapolation voie à voie.
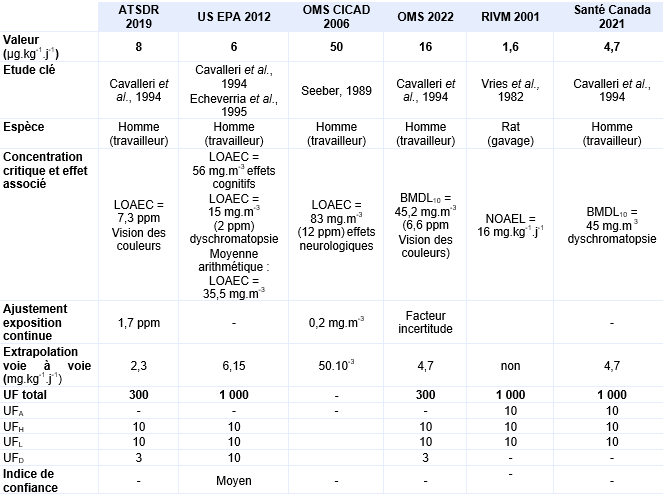
Effets sans seuil - Exposition chronique par inhalation :
L’ANSES propose de retenir pour une exposition chronique au tétrachloroéthylène par inhalation l’ERUi de 2,6.10-7 (µg.m-3)-1 (2018).
Trois organismes proposent des valeurs l’US EPA (2012), l’ANSES (2018) et l’OEHHA (2005). La valeur de l’ANSES retient celle proposée par l’US EPA (2012). Deux organismes, l’US EPA et l’ANSES utilisent une étude expérimentale de cancérogenèse chez la souris : l’étude de JISA (1993), alors que l’OEHHA a intégré dans son analyse les deux études de cancérogènes à la fois chez le rat et la souris (JISA, 1993 et NTP, 1986). La qualité de l’étude de JISA (1993) ne peut pas être évaluée car il s’agit d’une étude non publiée mais elle est décrite par l’US EPA, qui a eu accès au dossier, comme étant de bonne qualité. L’étude du NTP (1986) est de bonne qualité.
Les écarts observés entre les organismes US EPA, ANSES d’une part et OEHHA d’autre part, sont liés principalement à deux points particuliers :
- L’US EPA a fait le choix de considérer uniquement la voie d’oxydation dans son calcul de dose interne, alors que l’OEHHA a pris en compte à la fois une métabolisation du tétrachloroéthylène par la voie oxydative et la voie du glutathion. Les calculs de conversions de Benchmark dose en doses internes chez l’homme réalisés à partir du modèle PBPK aboutissent à un écart important : la dose interne selon l’hypothèse d’un métabolisme exclusivement oxydatif est 11 fois supérieure à celle obtenue si l’on fait l’hypothèse d’un métabolisme par les deux voies.
- L’US EPA a centré le calcul de risque uniquement par rapport aux tumeurs hépatiques chez la souris, l’ensemble des données relatives aux tumeurs n’a pas été prise en compte par l’US EPA dans le calcul de sa valeur. A l’inverse, l’OEHHA a fait le choix de balayer l’ensemble des pathologies tumorales observées dans les deux études, sur deux espèces rat et souris, la valeur finale étant la moyenne géométrique de quatre ERU sélectionnés pour leur pertinence. Ce choix a entraîné un facteur 1,7 dans le calcul des ERU.
Les trois organismes retiennent le même effet critique : la survenue d’hépatocarcinomes chez les souris. L’étude de JISA est plus complète et permet de déterminer une relation dose-effet plus fiable dans la mesure où trois concentrations ont été testées pour chacune des deux espèces alors que seules deux concentrations ont été testées par le NTP.
L’ANSES conseille de retenir la valeur de l’US EPA ERUi de 2,6 10-7 (µg.m-3)-1, mais fait observer que des incertitudes subsistent, notamment concernant le mode d’action cancérogène du tétrachloroéthylène au niveau hépatique, l’extrapolation à l’homme des tumeurs du foie observées chez la souris, la part chez l’homme de la voie métabolique de conjugaison au GSH.
Indice de confiance : Le niveau de confiance global de la VTR est de moyen à faible.
Effets sans seuil - Exposition chronique par voie orale :
L’ANSES retient pour une exposition chronique au tétrachloroéthylène par voie orale l’ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 de l’US EPA (2012).
Deux organismes proposent des valeurs l’OEHHA en 2001 et l’US EPA en 2012.
La valeur de l’OEHHA est basée sur une étude expérimentale pour une exposition par gavage (NCI, 1977) alors que celle de l’US EPA utilise une extrapolation voie à voie à partir de l’ERUi décrit ci-dessus. L’étude du NCI a été évaluée et jugée de mauvaise qualité pour l’évaluation des effets cancérogène en raison notamment de la mortalité prématurée des souris ayant potentiellement conduit à une sous-estimation du risque cancérogène, de l’augmentation séquentielle de la plus faible dose après 11 semaines de traitement (100 à 200 mg.kg-1,j-1) et un lot témoin non neutre. Il a été jugé que l’extrapolation voie à voie présentait moins d’incertitude.
L’ANSES préconise de retenir la valeur de l’US EPA. L’ERUo de 2,1.10-3 (mg.kg-1.j-1)-1 correspond à une dose de 4,8.10-3 mg.kg-1.j-1 pour un risque de 10-5 et de 4,8.10-4 mg.kg-1.j-1 pour un risque de 10-6.
Cette valeur est retenue par défaut.
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 30/06/2025
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Pour le tétrachloroéthylène, les informations de ce chapitre proviennent du rapport Européen d’évaluation des risques (CE, 2005), rapport ayant fait l’objet d’une expertise collective au niveau européen, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la rubrique. En raison des propriétés physico-chimiques du tétrachloroéthylène, en particulier sa volatilité, une attention particulière a été portée au contrôle des concentrations d’exposition lors de la validation des études.
Dangers
Description
Ecotoxicité aquatique
Paramètres d’écotoxicité aiguë :
L’essai sur Chlamydomonas reinhardtii rapporté par Brack et Rottler (1994) est valide et les conditions de l’essai sont bien décrites.
L’ensemble des essais sur poissons a été validé, les concentrations reportées sont des concentrations mesurées dans le milieu d’essai. Aucune différence significative entre organismes d’eau douce et organismes marins n’a pu être observée.
Les essais sur microcrustacés sont valides, les concentrations dans les milieux d’essai ont été mesurées.
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions aiguës :
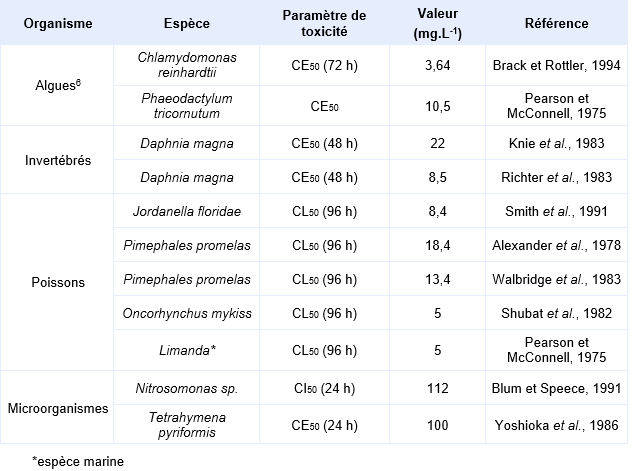
Paramètres d’écotoxicité chronique :
Dans l’étude de Brack et Rottler (1994) sur Chlamydomonas reinhardii les conditions de l’essai sont bien décrites et l’essai est considéré valide.
Les essais sur poissons effectués par Smith et al. (1991) sont considérés comme valides, les concentrations ont été mesurées dans le milieu d’essai. L’essai effectué par l’US EPA (1980), bien que de validité moindre, confirme les résultats de Smith et al. (1991).
Les essais sur microcrustacés sont valides, les concentrations ont été mesurées dans les milieux d’essai.
Des essais de terrain ont été rapportés par Lay et al. (1984) qui suggèrent que des effets toxiques sont observés à des concentrations plus faibles dans l’environnement qu’en laboratoire. Les auteurs ont contaminé un étang naturel avec du tétrachloroéthylène à 25 et 250 mg.L-1. Les concentrations initiales étaient de 0,44 et 1,2 mg.L-1 et, après 7 semaines, les concentrations étaient en dessous de la limite de détection de 0,1 mg.L-1. Des effets ont été observés sur les communautés de phyto et zooplancton dans les conditions de l’expérience. Les daphnies ont disparu en 1 jour à la plus forte concentration et en 3,5 jours à la plus faible concentration.
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions chroniques :
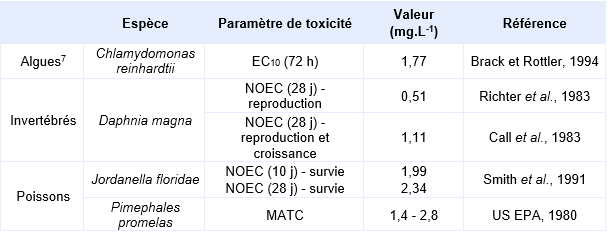
Ecotoxicité benthique
Aucun résultat avec des organismes benthiques n’est disponible.
Ecotoxicité terrestre
Paramètres d’écotoxicité aiguë :
Il est très difficile de tester la toxicité du tétrachloroéthylène vis-à-vis des organismes terrestres en raison de la forte volatilité de celui-ci.
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës :

Paramètres d’écotoxicité chronique :
Les données sur les organismes terrestres ne peuvent pas être validées compte tenu de la volatilité du tétrachloroéthylène, les concentrations n’ayant pas été mesurées dans les milieux d’essai. L’essai réalisé sur Eisenia foetida par Vonk et al. (1986) a cependant été effectué en milieu fermé, avec suffisamment d’oxygène pour les organismes et le sol et le substrat a été remplacé toutes les semaines. Cependant ces données, bien que non validées, donnent une idée de la toxicité du tétrachloroéthylène vis-à-vis des organismes terrestres.
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions chroniques :
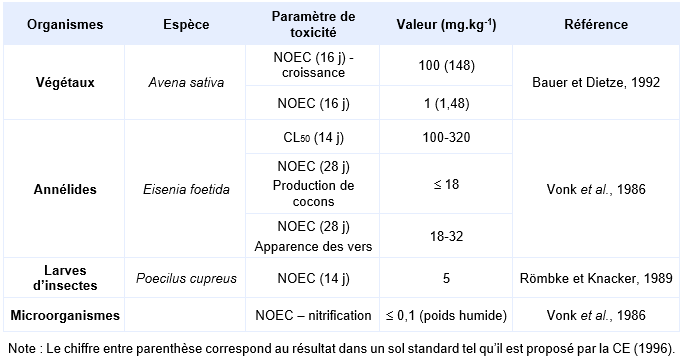
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Le tétrachloroéthylène n'est pas une substance prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE) (CE, 2013), transposée par l’arrêté du 27 juillet 2015 mais un des autres polluants pour lesquels les NQE sont identiques à celles définies dans la législation qui s'appliquait avant le 13 janvier 2009. Elle est réglementée au niveau européen (substance de l’état chimique) par une Norme de Qualité Environnementale, ou NQE, définie comme la « concentration d’un polluant ou d'un groupe de polluants dans l'eau, les sédiments ou le biote qui ne doit pas être dépassée, afin de protéger la santé humaine et l'environnement ». En pratique, la NQE est la norme de qualité la plus basse parmi 5 objectifs de protection couvrant la protection des organismes aquatique de la colonne d’eau, les organismes sédimentaires, les prédateurs se nourrissant dans les milieux aquatiques, et l’homme via la consommation de produit de la pêche ou d’eau de boisson. La détermination de ces normes suit une méthodologie spécifique qui a été élaborée au niveau européen (Technical Guidance For Deriving Environmental Quality Standards) (EC, 2018).
Valeurs guides
Description
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau) :
Eau Douce :
PNEC disponibles pour le compartiment aquatique (eau douce) :
Trois résultats d’essais long terme sont disponibles sur des espèces de niveaux trophiques différents : algues, invertébrés et poissons. Par conséquent, un facteur de sécurité de 10 peut être appliqué à la plus faible des 3 valeurs (CE, 2005).
D’où :
PNECEAU = 51 µg.L-1
Eau marine :
PNEC disponibles pour le compartiment sédiments (eau marine) :
Une PNECeau marine à 5 µg.L-1 est mentionnée dans le dossier d’enregistrement disponible pour cette substance sur le site de l’Agence Européen des substances chimiques (ECHA) . Cette valeur, issue du dossier d’enregistrement soumis par l’industrie n’a pas été revue par l’ECHA ou les Etats-Membres. Elle est cohérente avec l’ajout d’un facteur de 10 pour la prise en compte de la biodiversité marine sur la PNECeau douce présentée ci-avant.
D’où la proposition de l’Ineris :
PNECEau marine = 5 µg.L-1
Valeurs seuil pour la protection des organismes benthiques :
Eau Douce :
PNEC disponibles pour le compartiment sédiments (eau douce) :
Compte tenu de l’absence de résultats sur organismes benthiques, la PNEC sédiment peut être dérivée à l’aide de la méthode du coefficient de partage.
PNECSED = KSED-EAU/RHOSED x PNECEAU douce x 1 000
KSED-EAU : coefficient de partage entre l'eau et les sédiments = 7,08 m3.m-3 (CE, 2001)
RHOSED : densité des sédiments (humides) (valeur par défaut : 1 300 kg.m-3)
D’où :
PNECSED = 277 µg.kg-1 sédiment humide = 722 µg.kg-1 sédiment sec
Eau marine:
PNECSED = KSED-EAU/RHOSED ´ PNECeau marine ´ 1 000
KSED-EAU : coefficient de partage entre l'eau et les sédiments = 7,08 m3.m-3
RHOSED : densité des sédiments (humides) (valeur par défaut : 1 300 kg.m-3)
D’où :
PNEC SED = 27,7 µg.kg-1 sédiment humide = 72,2 µg.kg-1 sédiment sec
Valeurs seuil pour la protection des organismes terrestres :
PNEC existantes (CE, 2005)
Des valeurs de PNEC pour le sol ont été estimées dans (CE, 2005).
Une PNECsol a été dérivée en appliquant un facteur de 10 au résultat sur les microorganismes.
PNECSOL=10 µg.kg-1 sol humide = 11,3 µg.kg-1 sol sec
Une PNEC pour les plantes exposées au tétrachloroéthylène via l’air de 8,2 µg.m-3 est également proposée selon (CE, 2005).
Toutefois, les données sur les organismes terrestres ne peuvent pas être validées compte tenu de la volatilité du tétrachloroéthylène, les concentrations n’ayant pas été mesurées dans les milieux d’essai.
Ces valeurs doivent donc être utilisées avec prudence.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 127-18-4 |
|---|---|
| SANDRE | 1272 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Réglementation européenneLa Directive 1999/13/CE impose des réductions d'émissions de COV, dont le tétrachioloréthylène fait partie. Les deux principaux emplois des COV (nettoyage à sec et dégraissage) sont visés par la Directive. Les machines de lavage à sec doivent respecter un facteur d'émission de 20 g de tétrachloroéthylène par kilogramme de linge nettoyé et séché. Réglementation nationale visant à quantifier les rejets de la substanceLes exploitants d'installations classées soumises à autorisation, ayant des installations produisant ou utilisant la substance en quantité supérieure à 10 tonnes par an doivent déclarer les émissions dans l'air, l'eau, les sols ou les déchets (Arrêté du 24 Décembre 2002 relatif à la déclaration annuelle des émissions polluantes des installations classées soumises à autorisation). Réglementation nationale visant à limiter les rejets de la substanceD'après la circulaire n°90 55 du 18 Mai 1990 relative aux rejets toxiques dans les eaux, la France s'était engagée à réduire la pollution par le tétrachloroéthylène : cette substance est listée en annexe II (substances toxiques dont les rejets doivent être réduits entre 1985 et 1995 d'au moins 50 %). Cette substance est considérée comme un composé organique volatile (COV). Ainsi, au sein des installations classées pour la protection de l'environnement où le flux horaire total de cette molécule dépasse 0,1 kg.h 1, la valeur limite d'émission de la concentration globale en COV est fixée à 20 mg.m 3 (Arrêté du 2 Février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation). Ce même arrêté indique des valeurs limites de rejets en concentration et en flux spécifique pour les installations classées pour la protection de l'environnement soumises à autorisation appartenant à certains secteurs d'activité (tableau 2). Tableau 2 : Valeurs limites de rejets en concentration et en flux spécifique (selon l'arrêté du 2 Février 1998)
[1] Les valeurs limites indiquées sont des moyennes mensuelles pondérées selon le débit de l'effluent; les valeurs limites des moyennes journalières sont égales au double des valeurs limites des moyennes mensuelles. Les valeurs limites en concentration s'appliquent soit au rejet final, soit en sortie d'atelier. Les valeurs limites en flux spécifique s'appliquent au rejet final. [2] La capacité de production ou de transformation de référence correspond ici à la capacité autorisée par l'arrêté préfectoral. [3] Il convient que l'arrêté préfectoral autorisant une installation non visée (rubriques dénommées "autres secteurs") soumette les rejets de la substance visée ci dessus à des valeurs limites en concentration et en flux. Les valeurs limites du tableau ci dessus servent de référence. [*] Procédés repris et détaillés dans le paragraphe 2.1 Textes réglementaires visant à protéger l'environnementLe tableau 3 ci après précise les normes de qualité du tétrachloroéthylène dans les eaux (d'après l'Arrêté du 20 Avril 2005 pris en application du décret du 20 avril 2005 relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses). Tableau 3 : Normes de qualité (concentration totale dans les eaux >g.L 1), d'après l'Arrêté du 20 Avril 2005.
Autres textesLe Tétrachloroéthylène figure dans la liste 1998 des substances candidates, dans le cadre de la stratégie de l'OSPAR visant les substances dangereuses (OSPAR, 1998). |
| Classification CLP | Voir la classification CLP |
| Informations complémentaires |
Le tétrachloroéthylène est un liquide incolore, volatil, d’odeur caractéristique rappelant celle du trichlorométhane. Il est miscible dans la plupart des solvants organiques. En outre, le tétrachloroéthylène dissout un grand nombre de substances telles que graisses, huiles, résines… (INRS, 2004) |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Quantités produites
D'après le site Internet de la Société Française de Chimie, le tétrachloroéthylène était produit par six entreprises dans l'Union Européenne. Aujourd'hui en France, Solvay est l'entreprise principale et probablement la seule qui produit du tétrachloroéthylène.
D'après (ECB, 2005), en 1990, la production de tétrachloroéthylène en Europe occidentale était de 280 000 tonnes.
En 1994, la production de l'Union Européenne de tétrachloroéthylène s'élevait à 164 000 tonnes, les ventes à 78 000 tonnes et les exportations à 20 000 tonnes, le reste étant utilisé par l'industrie chimique comme intermédiaire. Le tétrachloroéthylène était également importé en 1994 en Union Européenne pour 10 000 tonnes par an (European Chemical Bureau, 2005).
En 2004, la production aurait été d'environ 150 000 t. Des données historiques rapportées dans (DEFRA, 2005) montrent une certaine stabilité de la production depuis une dizaine d'années en Europe. Par contre, ce même rapport fournit des données montrant une réelle tendance à la baisse des ventes en Europe sur cette même période. Par conséquent, les exportations hors de l'UE ont probablement progressé (puisque d'autres sources affirment que l'emploi comme intermédiaire, non comptabilisé dans les ventes, a lui aussi baissé).
Selon un expert interrogé, la principale entreprise du secteur produirait actuellement 130 tonnes par jour (soit environ 50 000 tonnes par an).
Place de la substance dans l'économie française
D'après le site Internet de la Société Française de Chimie, en France la consommation de solvants chlorés est de 42 000 t en 2004. La consommation de tétrachloroéthylène a fortement diminué les vingt dernières années : elle est passée de 38 000 t en 1980 à 9 400 t en 2004.
D'après le site Internet de la Société Française de Chimie, en 30 ans (1974 2004), la consommation européenne de solvants chlorés est passée de 920 000 à 220 000 t.an-1
D'après le site Internet du Ministère de l'Economie des Finances et de l'Industrie, les importations et les exportations mondiales de la substance ont augmenté de 2004 à 2005.
Le tableau 13 ci après présentent les données de collecte brutes (importations et exportations mondiales) du tétrachloroéthylène.
Tableau 13: Données de collecte brutes du tétrachloroéthylène d'après le site Internet du Ministère de l'Economie des Finances et de l'Industrie.
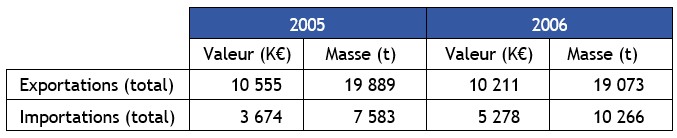
L'analyse de ces données montre que le prix à la tonne du tétrachloroéthylène a légèrement augmenté de 2005 à 2006 en ce qui concerne les exportations mais aussi les importations.
Afin de situer l'importance du tétrachloroéthylène au sein du marché mondial, le tableau 14 ci après présente le pourcentage des exportations et des importations cumulées de tétrachloroéthylène parmi les dérivés halogénés des hydrocarbures à l'échelle mondiale de février 2006 à janvier 2007.
Tableau 14 : Pourcentage des exportations et des importations de tétrachloroéthylène parmi les dérivés halogénés des hydrocarbures à l'échelle mondiale au cours des 12 derniers mois cumulés (février 2006 janvier 2007) d'après le site Internet du Ministère de l'Economie des Finances et de l'Industrie.
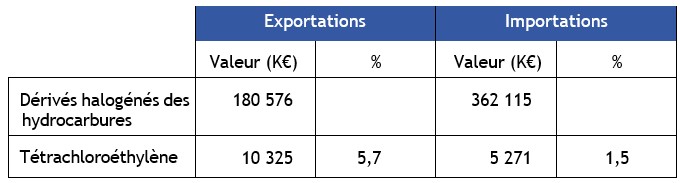
Nous pouvons constater que le tétrachloroéthylène représente une faible proportion dans échanges internationaux.
Procédés de production
Plusieurs procédés sont utilisés pour la production du tétrachloroéthylène.
Le tétrachloroéthylène est obtenu par chloration ou oxychloration de plusieurs matériaux bruts comme le propylène, le dichloroéthylène, le chloropropène et le chloropropane (EUROCHLOR, 1997).
D'après le site Internet de la Société Française de Chimie (SFC), le tétrachloroéthylène peut être obtenu à partir d'éthylène et de dichloroéthane : ce procédé produit principalement du trichloroéthylène et du tétrachloroéthylène. Des sous produits lourds tels que l'hexachloroéthane, l'hexachlorobutadiène ou des benzènes chlorés peuvent également être formés. La chloration ou l'oxychloration du 1,2 dichloroéthane peut produire du tétrachloroéthylène selon les réactions suivantes :
![]()
![]()
Le craquage d'un mélange de tétrachloroéthane et de pentachloroéthane donne également du tétrachloroéthylène ainsi que du trichloréthylène.
Habituellement, le tétrachloroéthylène est produit conjointement avec du tétrachlorure de carbone ou du trichloroéthylène.
D'après le site Internet de la Société Française de Chimie, la chloration de résidus chlorés (ou non) contenant de 1 à 3 atomes de carbone produit du tétrachloroéthylène. Ces résidus proviennent de diverses fabrications : solvants chlorés, oxyde de propylène (époxypropane), chlorure de vinyle (chloroéthylène). Ils donnent simultanément du tétrachloréthylène, du tétrachlorure de carbone (séparés ensuite par distillation) et du chlorure d'hydrogène. La réaction est amorcée par combustion de propylène dans le dichlore et est maintenue à haute température (environ 550°C). Ce procédé est par exemple utilisé par la firme Solvay, principal producteur français de tétrachloroéthylène
Le tétrachloroéthylène peut également être obtenu industriellement à partir d'acétylène via le trichloroéthylène : la durée des réactions utilisées dans les différentes étapes de ce procédé et le coût élevé de l'acétylène employé ont conduit à une utilisation de moins en moins importante de cette méthode (INERIS, 2006a).
Utilisations
FTE 2005 Importer
Le tétrachloroéthylène est utilisé principalement dans le secteur de l'ennoblissement textile et le nettoyage à sec avec une consommation annuelle de 12 000 tonnes en 2005 (INRS, 2006). En effet, la plupart des composés organiques se dissolvent dans le tétrachloroéthylène.
Le tableau 4 ci après rassemble les chiffres de la consommation annuelle de tétrachloroéthylène en Europe occidentale et en France, et montre les tendances à la baisse.
Tableau 4 : Consommation annuelle de tétrachloroéthylène en Europe occidentale et en France, d'après le site Internet de la Société Française de Chimie.
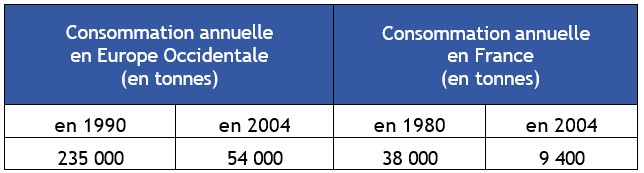
Ces chiffres sont cohérents avec l'estimation de l'ADEME qui indique qu'au début des années 2000, la mise sur le marché français du tétrachloroéthylène était de 10 000 tonnes (ADEME, 2003). Ils sont plus faibles, pour 2004, que ceux du rapport 2005 du DEFRA.
D'autre part, ces chiffres laissent également supposer que près de 4/5 des quantités de cette substances produites en France sont exportées ou utilisées comme intermédiaire réactionnel.
Le tableau 5 ci dessous regroupe les différentes utilisations rapportées au niveau mondial et européen du tétrachloroéthylène. Il fait également apparaître une tendance à la baisse, entre 1994 et 2004, mais surtout pour le nettoyage à sec.
Tableau 5 : Utilisations du tétrachloroéthylène.
Rejets dans l’environnement
Rejets dans l'environnement
FTE 2005 Importer
Le tétrachloroéthylène est principalement utilisé pour servir de solvant, pour le nettoyage à sec ou le nettoyage des métaux. Comme l'emploi qu'on en fait entraîne sa dispersion sans qu'il ne soit ni transformé, ni détruit, on s'attend à ce que la majorité du tétrachloroéthylène se retrouve dans l'environnement, en particulier dans l'atmosphère (d'après le site Internet d'Environnement Canada C).
La figure 1 reproduit un historique des rejets européens de tétrachloroéthylène disponibles sur le site internet eurochlor. On constate que les rejets atmosphériques sont supérieurs d'un facteurs 10 aux rejets dans l'eau, et qu'il y a eu une baisse importante des rejets, avec cependant un pic récent inexpliqué pour les rejets dans l'eau.
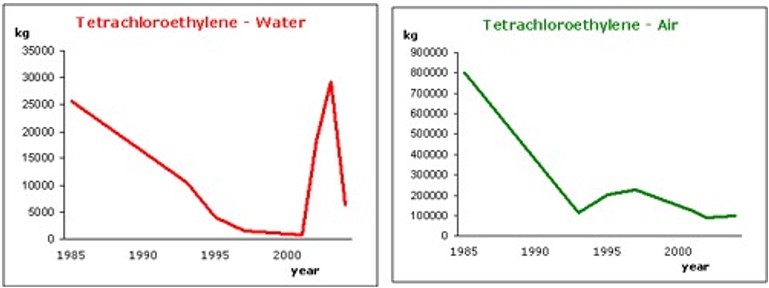
Figure 1 : Historique des rejets européens de tétrachloroéthylène.
La figure 2 ci après, présente les émissions atmosphériques de tétrachloroéthylène par activité industrielle à l'échelle européenne.
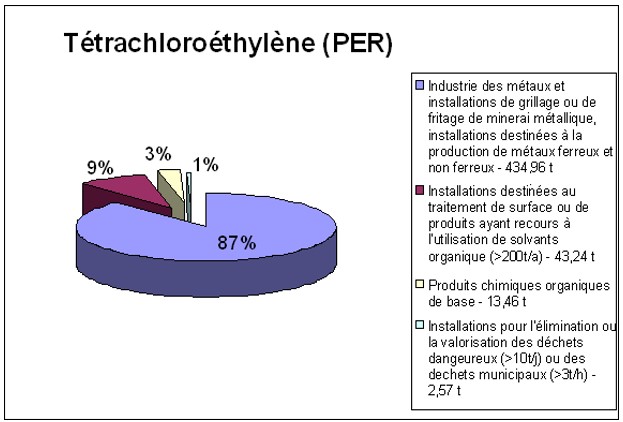
Figure 2 : Émissions atmosphériques par activité industrielle, d'après le site Internet de l'EPER, données de 2004.
Il n'y a pas de données EPER pour les émissions dans l'eau à l'échelle européenne.
D'après le site Internet de l'IREP (registre français des émissions polluantes), en France, pour l'année 2003 2004 plus de 65 établissements industriels étaient répertoriés en tant qu'émetteurs de tétrachloroéthylène dans l'environnement (air et eau). Les rejets industriels, dans l'air et dans l'eau, de tétrachloroéthylène sont donc disséminés à l'échelle du territoire national. Ces données ont été rassemblées dans le tableau 8 ci après.
Tableau 8 : Estimations des émissions globales de tétrachloroéthylène dans l'environnement, d'après le site Internet de l'IREP, données de 2004.
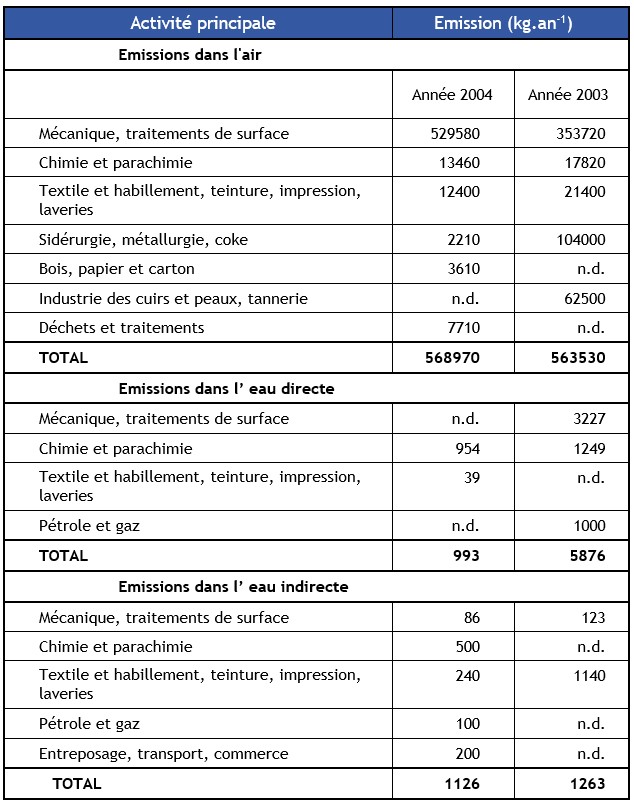
(n.d. : donnée non disponible)
L'analyse des données de l'IREP pour l'année 2004 montre qu'en France, les rejets du tétrachloroéthylène se font majoritairement dans l'air par les industriels ayant pour activité la mécanique et le traitement des surfaces. Il vient ensuite les industries de la chimie et de la parachimie ainsi que les industries du textile.
Les rejets dans l'eau de manière directe se font principalement par les industries de chimie et parachimie.
Les rejets dans l'eau de manière indirecte se font par les industries du textile.
Pollutions historiques et accidentelles
FTE 2005 Importer
Peu d'informations sont disponibles quant à la production accidentelle ou non intentionnelle de tétrachloroéthylène, néanmoins, selon le site Internet d'Environnement Canada A, de très faibles concentrations de cette substance peuvent se former lors de la chloration de l'eau potable ainsi que dans des procédés industriels, comme le blanchiment des pâtes et papiers.
D'après le site Internet de l'IREP, les régions parisienne, Rhin Meuse et celles traversées par le Rhône correspondent aux territoires les plus atteints par l'altération du tétrachloroéthylène dans les eaux souterraines. Cet état de fait s'explique par le passé industriel de ces régions.
Présence environnementale
Aquatique
FTE 2005 Importer
Présence dans les eaux de surface et souterraines
D'après le site Internet d'Environnement Canada, le tétrachloroéthylène présent dans les eaux de surface et les eaux souterraines provient principalement des rejets émis par les industries telles que les installations de production, les établissements de nettoyage à sec ainsi que les usines de textiles, et également des égouts. Le composé peut s'infiltrer dans les eaux souterraines par lessivage des décharges où des matériaux contaminés ont été déversés. Les concentrations les plus élevées se trouvent généralement dans les eaux de surface et les eaux souterraines situées près des sources de contamination.
D'après le site Internet d'Eurochlor, la concentration en tétrachloroéthylène dans les eaux de surface a progressivement diminué depuis 1983. Le tétrachloroéthylène se trouve majoritairement dans les zones côtières et dans les estuaires.
Le tableau 7 ci après, présente les concentrations en tétrachloroéthylène dans les eaux de surface.
Tableau 7 : Concentration en tétrachloroéthylène dans les eaux de surface des zones côtières et estuaires en France, d'après Eurochlor (1997).
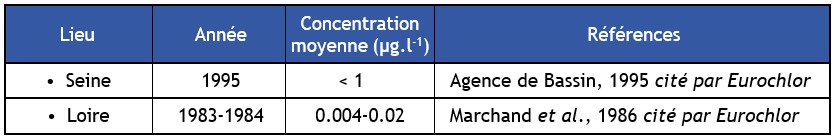
Présence dans le milieu marin et dans les précipitations
D'après le site Internet d'Environnement Canada, le tétrachloroéthylène a été décelé dans les précipitations et l'eau de mer, dans les sédiments et les tissus d'animaux, comme les poissons, les phoques et les oiseaux.
Synthèse
FTE 2005 Importer
Le tétrachloroéthylène n'est pas présent naturellement dans l'environnement, les concentrations relevées sont anthropiques. On estime qu'à terme, environ 85 % de la production sont émis dans l'atmosphère par évaporation. Le tableau suivant présente les taux de concentration ubiquitaires de tétrachloroéthylène présent dans l'environnement. (INERIS, 2006a).
Le tableau 6 ci après présente les taux de concentrations ubiquitaires de tétrachloroéthylène présent dans l'environnement.
Tableau 6 : Concentrations ubiquitaires, données IUCLID 1996 citées par l'INERIS (2006).
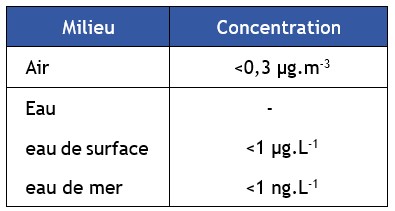
Les rejets atmosphériques de tétrachloroéthylène sont très supérieurs aux rejets dans les milieux aquatiques. La contribution des émissions atmosphériques aux concentrations dans les milieu aquatiques n'est pas négligeable et les mesures de réduction des émissions atmosphériques seront donc également prises en compte dans cette fiche qui s'attache aux milieux aquatiques.
En effet, le rapport (ECB,2005) indique qu'un modèle de fugacité de MacKay de niveau III a estimé que 20% des émissions atmosphériques retournaient en moyenne au compartiment aquatique.
Perspectives de réduction
Réduction des rejets
FTE 2005 Importer
Les informations de ce chapitre sont notamment tirées d’un document du CETIM, pour ce qui est du nettoyage des métaux. Ce document contient des informations techniques détaillées et des études de cas que nous n’avons pas reproduites ici, et le lecteur est invité à s’y reporter pour plus de détails (cf. lien Internet dans la section Références).
Amélioration des machines de nettoyage à sec
FTE 2005 Importer
Les analyses présentées dans les rapports ECB et DEFRA de 2005 montrent que les machines présentes en France sont, sur une échelle de 1 à 4 qui irait des machines les plus émettrices aux moins émettrices de tétrachloroéthylène, très majoritairement de type3. Il y a donc une marge de progression dans ce domaine, puisque, par comparaison, toutes les machines sont de type 4 en Allemagne.
Amélioration des machines de dégraissage
FTE 2005 Importer
Les analyses présentées dans les rapports ECB et DEFRA de 2005 montrent que les machines présentes en France sont, sur une échelle de 1 à 4 qui irait des machines les plus émettrices aux moins émettrices de tétrachloroéthylène, presque exclusivement de type1. Il y a donc une marge de progression très forte dans ce domaine, puisque, par comparaison, toutes les machines sont de type 4 en Allemagne et en Autriche, avec des situations intermédiaires dans beaucoup d'autres pays de l'UE. De plus seules les machines de Type 4 permettraient de respecter la réglementation liée à la Directive COV.
Traitement des rejets
FTE 2005 Importer
Traitement du tétrachloroéthylène dans l'eau
- Le stripping
On peut éliminer le tétrachloroéthylène de l'eau par stripping (ce qui consiste à provoquer l'entraînement de gaz ou de matières volatiles dissoutes dans l'eau, au moyen d'un courant de vapeur, de gaz ou d'air traversant le liquide à contre courant d'après la définition donnée par le Mémento technique de l'eau de Degrémont). Cependant, cette technique nécessite un traitement de l'air, sinon le tétrachloroéthylène est rejeté à l'atmosphère.
D'après une entreprise du domaine de la production de produits issus de l'électrolyse du sel, le principe consiste à injecter de la vapeur sous pression afin de mettre en vapeur des composés volatils. Les vapeurs toxiques récupérées sont traitées par un filtre à air au charbon actif ou par un autre procédé. Cette dernière méthode est jugée la plus rentable, elle est facile à mettre en œuvre et s'avère très efficace.
- Le charbon actif
D'après le site Internet de Santé Canada, le traitement avec du charbon actif en grains constitue également un moyen efficace d'éliminer le tétrachloroéthylène de l'eau.
D'après un spécialiste du traitement de l'eau et de l'air, le tétrachloroéthylène a une grande probabilité d'être absorbé par le charbon actif7 .
[7] L'adsorption est un processus où un solide est employé pour enlever le tétrachloroéthylène soluble de l'eau. Dans ce procédé, le charbon actif est le solide. Le charbon actif est produit spécifiquement pour couvrir une surface interne très grande (entre 500 et 1500 m2.g 1). Il existe deux formes de charbons actifs: le charbon actif en poudre (PAC) et le charbon actif granulaire (GAC). Suite à son utilisation, le charbon actif est régénéré et réutilisé. Il n'engendre pas de sous produits.
Traitement du tétrachloroéthylène dans l'air
- L'oxydation thermique
D'après un producteur de tétrachloroéthylène, l'oxydation thermique est un traitement efficace mais qui nécessite des installations coûteuses. Les installations sont des incinérateurs qui fonctionnent à très haute température 1200°C/2 secondes. Ces installations sont utilisables pour traiter tous les organochlorés gazeux produits en parallèle.
- Le charbon actif
D'après une entreprise du domaine de l'automobile, usager du tétrachloroéthylène, le traitement au charbon actif est également une solution pour éliminer le tétrachloroéthylène des rejets atmosphériques, il est efficace mais coûteux.
- Panorama du traitement des COV
Le tableau 12 des deux pages suivantes présente un panorama des techniques de traitement des COV, extrait de (IPPC, 2001).
Le tableau 12 ci dessous présente les différents procédés applicables aux traitements des COV (IPPC, 2001)
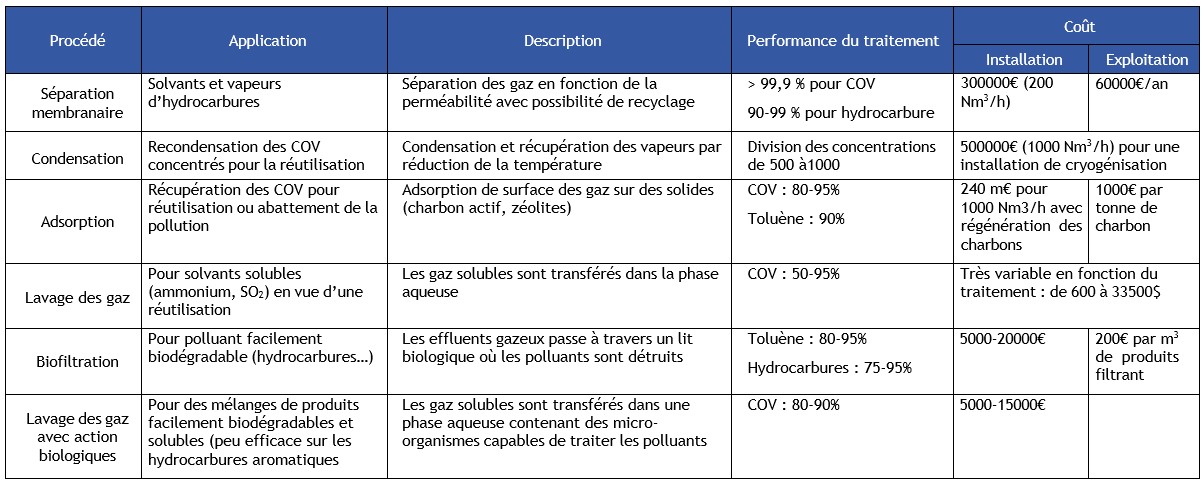
Alternatives aux usages
Techniques alternatives pour le nettoyage à sec
FTE 2005 Importer
Nettoyage au mouillé
Cette méthode est utilisée lors du nettoyage dans la fabrication et la finition des textiles. Il s'agit d'une nouvelle méthode d'immersion des textiles à nettoyer dans l'eau qui permet de contrôler la détérioration et le rétrécissement des tissus. En effet, l'eau a tendance à déstructurer les fibres naturelles et hydrophiles. Par ailleurs, l'étape de séchage est également délicate, les tissus exigent différents temps de séchage selon leur nature. Le temps de finition avec ce procédé est donc beaucoup plus long que celui du nettoyage à sec traditionnel.
Ce procédé fait intervenir des détergents qui représentent quelques pourcents du volume total de l'eau et des additifs : environ 1 % d'après des industriels interrogés par l'US EPA (1998), cité par l'INERIS (2005). De nombreuses formulations de détergents sont disponibles sur le marché mais il est difficile d'en connaître la composition. L'US EPA (1998), cité par l'INERIS (2005), présente quelques exemples de produits chimiques (surfactants et aide surfactants comprenant des suspenseurs de taches, des ajusteurs de pH et des solubilisant) utilisés dans la formulation des détergents : acide acétique, gomme de cellulose, acide citrique, cocamidopropyl bétaine, sorbitane éthoxylé monodécanoate, acide laurique diethnolamide, sel de sodium, méthyl 2 sulfoaurate, carbonate de sodium, citrate de sodium, sulfate de sodium laureth, iséthionate de lauryl sodium.
Le tableau 9 ci après présente les avantages et les inconvénients du nettoyage au mouillé par rapport au nettoyage traditionnel au tétrachloroéthylène.
Tableau 9 : Avantages et inconvénients du procédé de nettoyage au mouillé d'après NIOSH (1997a), cité par l'INERIS (2005).
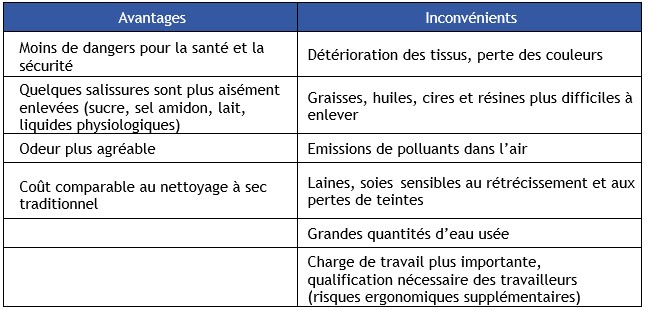
Nettoyage au dioxyde de carbone liquide (CO2)
C'est une technologie de nettoyage récente pour son application aux vêtements mais elle est utilisée depuis plusieurs années pour d'autres procédés. Les vêtements sont immergés dans le CO2 liquide contenu dans un récipient sous pression puis agités par des jets à grande vitesse ou une action mécanique qui enlève les tâches. Une fois le nettoyage terminé, les vêtements n'ont pas besoin de sécher. Du fait de la faible viscosité du produit, les taches sont plus faciles à enlever de la surface des articles à nettoyer. Les salissures comme les huiles et les graisses sont mieux nettoyées. Pour retirer les salissures comme le sel ou le glucose, des additifs doivent être utilisés ou les tâches enlevées préalablement (INERIS, 2005).
Le tableau 10 ci après, présente les avantages et les inconvénients du nettoyage au CO2 par rapport au nettoyage traditionnel au Tétrachloroéthylène.
Tableau 10 : Avantages et inconvénients du procédé utilisant le CO2 liquide d'après NIOSH (1997a), cité par l'INERIS (2005).
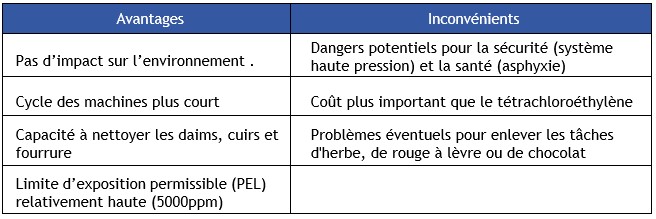
Techniques alternatives pour le dégraissage des métaux
FTE 2005 Importer
Procédés lessiviels
Des lessives peuvent être utilisées en substitution au tétrachloroéthylène. Il s'agit d'un mélange complexe contenant des phosphates, des silicates, des agents tensioactifs, des hydroxydes en solution dans l'eau. Les deux principaux procédés sont l'immersion ou le « traitement au trempé » et l'aspersion. Cette technique présente toutefois également certains risques pour la santé et met en jeu un grand volume d'eau à traiter par la suite (INRS, 2001), CETIM.
Dégraissage au laser
D'après une entreprise spécialisée dans le nettoyage technique, la désoxydation et le décapage au laser sont utilisés pour dégraisser les métaux. Ce procédé est basé sur l'interaction entre un laser de forte puissance instantanée et le polluant.
Les avantages sont variés (ARIST, 1995) :
- facilité d'utilisation ;
- peu d'effluents à traiter, seule une poudre est récupérée puis traitée par des filtres ;
- sans altération du métal de base, aucune action abrasive ;
- ne fait intervenir aucun produit chimique ;
- opérations économiques ;
- le laser atteint toute la surface du substrat : les géométries les plus compliquées peuvent être traitées respectivement couvertes d'une couche ;
- respect de l'environnement.
Il serait réservé aux petites surfaces et encore peu appliqué pour les métaux d'après le CETIM.
Nettoyage au CO2 supercritique
Les pièces sont nettoyées dans une chambre similaire à une machine fermée pour solvants. Le procédé est adapté au nettoyage des pièces vrac (CETIM).
Nettoyage par billes de glace ou neige carbonique
Les pièces sont nettoyées une par une ou en ligne par projection de billes de glace ou de neige carbonique (CETIM). Le CO2 employé peut provenir d'un recyclage de CO2 émis sur le site industriel.
Traitement au plasma
D'après l'IFAM (Institut Fertigungstechnik Materialforschung), cité par le site Internet Eurobonding, on substitue le nettoyage à base d'un solvant par le nettoyage à base d'eau et fait suivre ceci par un traitement au plasma afin de réaliser l'épuration fine et l'activation de la surface. Dans ce procédé, la pièce à traiter est exposée à un plasma froid à l'oxygène à des basses pressions pendant un temps très court. Le plasma exerce un nettoyage en volatisant des polluants organiques de surface par une "combustion froide" contrôlée. Par ce procédé, des épurations grossières comme des couches épaisses ou de grandes particules ne peuvent pas être enlevées d'une façon rentable. Avant qu'on ait recours à cette technique, il faut éliminer de grosses contaminations par d'autres moyens (mécaniquement, à air comprimé, par des épurateurs à base d'eau). Après, l'épuration fine peut être effectuée par le plasma en volatisant par exemple des fines couches d'huile. Le CETIM confirme ces limites du procédé plasma et indique qu'il est adapté au nettoyage de pièces en vrac.
Le plasma a cependant de nombreux avantages :
- il réduit la consommation de matières ;
- il est capable d'enlever des substances chimiquement stables ;
- le plasma atteint toute la surface du substrat : les géométries les plus compliquées peuvent être traitées, il est même possible d'infiltrer des substrats poreux ;
- aucune sollicitation thermique ou mécanique n'est exercée sur le substrat ;
- protection de l'utilisateur et de l'environnement.
Produits de substitution
FTE 2005 Importer
Substitution en tant qu'intermédiaire de synthèses chimiques
D'après (DEFRA, 2005), il n'y a pas d'alternative au tetrachloroethylene pour la production du HCFC 123 (2,2 dichloro 1,1,1 trifluoroethane) ou du HFC 125 (pentafluoroethane). Cependant, il existerait un procédé utilisant le trichloroethylene pour la production du HFC 134a (1,1,1,2 tetrafluoroethane) Les PNEC et valeurs sanitaires de référence, dans les fiches toxicologiques INERIS citées en référence, du tétrachloroéthylène sont supérieures à celles du trichloroéthylène, donc cette substitution pourrait être justifiée.
Substitution pour le dégraissage des métaux
D'après (DEFRA, 2005), d'autres solvants halogénés pour le dégraissage des métaux au tetrachloroéthylène sont le trichloroéthylène (cf 4.4.1 pour un commentaire), et le dichloromethane ou le 1 bromopropane. Bien que moins dangereux pour les milieux aquatiques (sur la base de son classement), le dichloromethane est une substance prioritaire de la Directive Cadre Eau dont les rejets doivent être également réduits, et cette substitution n'est pas vraiment satisfaisante. Le 1 bromopropane présente des risques plus importants pour la santé humaine, et est hautement inflammable, et cette seconde substitution est également potentiellement problématique.
Les solvants fluorés sont utilisés en machines sur réfrigérées et sont des substituts des CFC et HCFC.
Selon le CETIM, les principaux solvants organiques alternatifs non-halogénés sont les hydrocarbures et les solvants oxygénés (alcools, cétones, éthers, terpènes). Généralement moins dangereux pour l'environnement, leur efficacité doit cependant être évaluée au cas par cas.
D'après une entreprise du domaine automobile, utilisatrice de tétrachloroéthylène, des sociétés commercialisent des solvants inorganiques non chlorés. Ils ne remplacent cependant pas l'efficacité du tétrachloroéthylène.
Substitution pour le nettoyage des textiles
On peut mentionner les produits suivants :
- hydrocarbures (sans aromatiques)
- décaméthylcylcopentasiloxane
- éthers de propylène glycol, dipropylène glycol tertio butyl éther
Les hydrocarbures sont issus de la distillation fractionnée du pétrole brut. Les propriétés intrinsèques des hydrocarbures utilisés pour le nettoyage à sec sont nombreuses :
- l'inflammabilité ;
- le pouvoir solvant ;
- la volatilité ;
- l'odeur ;
- la toxicité.
Contrairement au tétrachloroéthylène, les hydrocarbures sont inflammables. Néanmoins, des machines sécurisées contre le risque d'incendie sont maintenant disponibles sur le marché. Il n'en demeure pas moins qu'en cas d'incendie les produits de combustion tels que le monoxyde de carbone et le cyanure d'hydrogène possèdent de nombreux effets dangereux pour la santé humaine (NIOSH, 1997b cité par l'INERIS, 2005).
Les hydrocarbures linéaires et ramifiés génèrent relativement peu d'odeurs tandis que le naphtalène et les hydrocarbures aromatiques ont des odeurs fortes et souvent gênantes pour les personnes exposées (INERIS, 2005).
Le tableau 11 ci après présente les avantages et les inconvénients du nettoyage avec des hydrocarbures par rapport au nettoyage traditionnel au tétrachloroéthylène.
Tableau 11 : Avantages et inconvénients du procédé utilisant des hydrocarbures d'après NIOSH (1997a), cité par l'INERIS (2005).
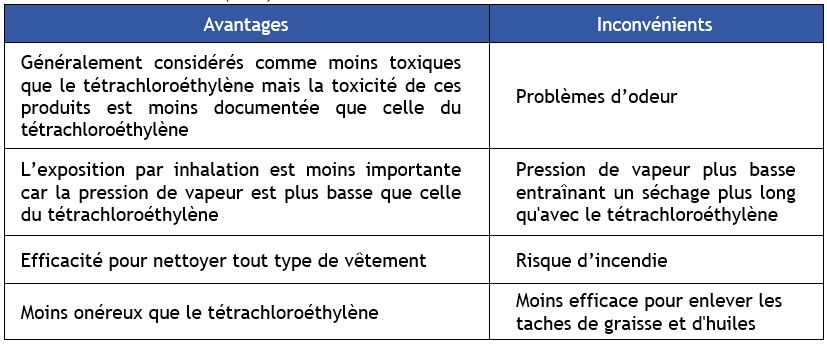
Coûts de la substitution
Les coûts des techniques alternatives sont variés : le nettoyage au mouillé a un coût comparable au nettoyage à sec traditionnel, le nettoyage à base d'hydrocarbure est plutôt moins onéreux. En revanche, le dioxyde de carbone liquide revient beaucoup plus cher (NIOSH, 1997a cité par l'INERIS, 2005).
Les coûts de traitements des Composés Organiques Volatils sont très variables en fonction des techniques (cf. « Panorama des traitements des COV » au § 4.6.2).
D'après l'INERIS (2006b), pour l'adsorption sur charbon actif le coût d'installation s'élève environ à 240 € pour 1000 Nm3.h 1 avec régénération des charbons. Il faut compter 1000 € par tonne de charbon. Le prix de l'installation d'un traitement par oxydation thermique varie entre 10 000 et 50 000 € selon les technologies. Au niveau de l'exploitation, le coût est de 25 000 € pour les combustions simples sans récupération de chaleur.
Une unité de stripping traitant un flux de 30 m3.h 1 coûte de 4 à 5 M€.
D'après le CETIM, pour les produits et techniques et solvants alternatifs dans le domaine du dégraissage :
- les solvants fluorés en machines sur réfrigérées sont plus chers, mais leur consommation est inférieure, et de plus l'investissement est plis modéré que pour les machines fermées utilisées avec les solvants chlorés.
- Les procédés lessiviels présentent des coûts d'investissement variables en fonction du type précis de machine, mais ils ne sont pas forcément plus chers. Le coût du traitement des rejets aqueux doit être pris en compte.
- Les machines de nettoyage au CO2 supercritique présentent un surcoût d'environ 50% par rapport aux machines à solvants hermétiques.
- Le nettoyage au plasma présente de faibles coûts de fonctionnement
Le rapport (DEFRA, 2005) mentionne le cas d'un site qui produit environ 30 000 t.an-1 de tétrachloroéthylène, et qui a déjà mis en place un traitement des COV sur l'évent du principal réacteur, et émet 80 tonnes/an de tétrachloroéthylène (soit 2.5 kg/t). Traiter les émissions résiduelles, qui ne sont pas collectées et traitées pour des raisons de sécurité (prévention du risque d'explosion), rendrait nécessaire l'installation d'un incinérateur supplémentaire, et le coût d'investissement serait de 56 millions d'euros, et le coût d'exploitation serait de 1.4 millions d'euros par an. Ce coût est élevé, dans la mesure où le montant de l'investissement représente un montant sensiblement supérieur aux ventes annuelles du site.
Les quelques éléments disponibles laissent à penser que des solutions (produit ou procédé) de substitution existent pour les utilisateurs de tétrachloroéthylène, et qu'elles peuvent être financièrement praticables, mais que la recherche d'une solution se fait au cas par cas. Des marges de progression importantes existent pour l'amélioration des performances des machines de lavage par solvants chlorés, comme le montre la comparaison entre la situation française et celle d'autres pays européens.
Par contre, le traitement des rejets (chez les producteurs, transformateurs ou utilisateurs) semble plus difficile et financièrement plus lourd à mettre en place.
Conclusion
FTE 2005 Importer
Le tétrachloroéthylène est un composé organique volatil, miscible dans la plupart des solvants organiques.
Le tétrachloroéthylène est principalement utilisé dans le secteur de l'ennoblissement textile et le nettoyage à sec, le dégraissage des métaux, et comme intermédiaire de synthèses chimiques, avec une consommation annuelle de 12 000 tonnes en 2005. Cet usage est en décroissance sensible. On constate que la consommation française de tétrachloroéthylène a fortement diminué ces vingt dernières années : elle est passée de 38 000 t en 1980 à 9 400 t en 2004. Le prix à la tonne du tétrachloroéthylène, quant à lui, a augmenté de 2004 à 2005 en ce qui concerne les exportations mais aussi les importations.
Aujourd'hui en France, Solvay est l'entreprise principale qui produit du tétrachloroéthylène, actuellement la production serait de l'ordre de 130 tonnes par jour.
Le tétrachloroéthylène n'est pas présent naturellement dans l'environnement, les concentrations relevées sont anthropiques. La solubilité du tétrachloroéthylène étant relativement faible dans l'eau il se retrouve donc en quantité négligeable dans l'eau ainsi qu'en quantité négligeable dans les sols. On le retrouve majoritairement dans les zones côtières et dans les estuaires. Les rejets du tétrachloroéthylène dans l'environnement se font majoritairement dans l'air par les industriels ayant pour activité la mécanique et le traitement des surfaces.
Un important effort de recherche et de développement concernant la réduction des rejets a conduit à mettre au point des alternatives à l'utilisation du tétrachloroéthylène en matière de nettoyage. Le nettoyage au mouillé, le nettoyage à sec à base de produits pétroliers, et des technologies plus récentes basées sur l'utilisation du dioxyde de carbone liquide sont déjà commercialisés.
Des produits de substitution sont utilisés pour le dégraissage des métaux : des solvants inorganiques non chlorés, des lessives, ainsi que des procédés alternatifs (plasma, dioxyde de carbone supercritique,…).
Les quelques éléments disponibles laissent à penser que des solutions (produit ou procédé) de substitution existent pour les utilisateurs de tétrachloroéthylène, et qu'elles peuvent être financièrement praticables, mais que la recherche d'une solution se fait au cas par cas. Des marges de progression importantes existent pour l'amélioration des performances des machines de lavage par solvants chlorés, comme le montre la comparaison entre la situation française et celle d'autres pays européens.
Par contre, le traitement des rejets (chez les producteurs, transformateurs ou utilisateurs) semble plus difficile et financièrement plus lourd à mettre en place.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :