Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Fluorène (86-73-7)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
86-73-7
Nom scientifique (FR)
Fluorène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
201-695-5
Code SANDRE
1623
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C13H10 }\)
Code InChlKey
Code SMILES
c(c(c(c1ccc2)c2)ccc3)(c3)C1
Familles
Familles chimiques
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Prélèvement
Analyse
Sol
Analyse
Autres milieux
Prélèvement
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
166.20 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Le processus d'adsorption sur les sédiments est très important.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Le fluorène est extrêmement peu mobile dans les sols. Sa volatilisation à partir du sol n'est pas un phénomène significatif.
Le fluorène ne se dégrade pas facilement dans les sols : des demi-vies allant de 32 jours à 60 jours ont été mesurées (Howard et al., 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
L'hydrolyse du fluorène n'est pas un processus significatif.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Atmosphère
Dans l'atmosphère, le fluorène est dégradé en réagissant avec des radicaux hydroxyles formés par réactions photochimiques, sa demi-vie due aux réactions hydroxyles a été estimée à 29 h.
Milieu eau douce
Le fluorène ne se dégrade pas facilement dans les eaux de surface : 0 % de dégradation a été observé après 28 jours lors d’un essai MITI II (méthode OCDE 301C)(CITI, 1992). Dans les eaux souterraines, considérées comme anoxiques, des demi-vies de 128 à 240 jours ont été estimées (Howard et al., 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Le fluorène ne se dégrade pas facilement dans les sols : des demi-vies allant de 32 jours à 60 jours ont été mesurées (Howard et al., 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Microcrustacés
Le taux d’accumulation du fluorène a été étudié chez la daphnie. Au bout de 24 heures, l’équilibre entre les concentrations dans l’eau et les organismes a été atteint. Un BCF (24 h) de 505 a ainsi pu être calculé (Newsted et Giesy, 1987).
Poissons
Poecilia reticulata : BCF (7 jours) : 2 230
Le test a été effectué en semi-statique pendant 7 jours. Au début de l’essai, la concentration en fluorène était de 883 µg.L-1, correspondant à la limite de solubilité de la substance. Les mesures de concentration dans le milieu aquatique, ainsi que dans les tissus des poissons ont été effectuées par la méthode HPLC avec détection UV (De Voogt et al., 1991).
Oryzias latipes : BCF (28 jours) : 396-830
Deux tests ont été effectués : l’un exposant les individus pendant 28 jours à une concentration en fluorène de 2 µg.L-1 et l’autre à une concentration de 20 µg.L-1. Les concentrations en fluorène ont été mesurées dans le milieu (CITI, 1992).
La bioamplification des HAP ne semble pas être possible dans les écosystèmes aquatiques et terrestres. Les raisons avancées sont de fortes capacités des organismes vertébrés (et quelques invertébrés) à métaboliser ces substances et à les excréter. Toutefois, les espèces des premiers niveaux trophiques n’en sont pas capables et peuvent présenter des cas de bioaccumulation (ECHA, 2008).

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
La Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP 2015 [1]( ) (ADEME, INERIS, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015) ne comporte pas le Fluorène dans sa liste des HAP. Une recherche exhaustive dans la bibliographie scientifique internationale de données suffisamment satisfaisantes ou détaillées pour permettre d’estimer des facteurs de transfert ou présenter ceux proposés, n’a pas été réalisée dans le cadre de la présente fiche en date de la présente mise à jour. La base BAPPOP regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les molécules Organiques Polluantes, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site https://www.ademe.fr/bappop-base-donnees-contamination-plantes-potageres-molecules-organiques-polluantes et fonctionne sur ACCESS.
Organismes sédimentaires
Organismes benthiques
Dans les sédiments, le taux d’accumulation du fluorène dans les organismes benthiques dépend de plusieurs facteurs dont :
- les propriétés physico-chimiques de la substance,
- le temps d’exposition,
- la nature du sédiment,
- les taux d’absorption et de désorption par les organismes (varie d’un individu à l’autre),
- le comportement de l’organisme durant la période d’exposition (alimentation, évitement, reproduction).
De plus, la disponibilité des HAP aux organismes benthiques détritivores est très inférieure à celle d’autres substances possédant des propriétés physico-chimiques similaires (Landrum et Faust, 1991 ; Tracey et Hansen, 1996). La séquestration des HAP dans la matière organique sédimentaire serait à l’origine de cette faible biodisponibilité (Kraaij et al., 2001 ; Van Hoof et al., 2001).
Les résultats des essais disponibles dans la littérature correspondent à une exposition des organismes benthiques à un mélange de HAP. Aucune conclusion ne peut donc être tirée sur la biodisponibilité et l’accumulation du fluorène.
Bibliographie
Toxicologie
Dernière vérification le 17/02/2025
Introduction
L'ensemble des informations citées ci-dessous s’appuie notamment sur diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1995 ; IARC 1983 ; IARC, 1987, 2010 ; US EPA, 1990). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Dans cette fiche, seule la substance fluorène est considérée, excluant autant que possible les données relatives à la co-exposition de plusieurs HAP. La plupart des HAP disposent également d’une fiche de données toxicologiques cependant il nous est apparu nécessaire de proposer une fiche « choix de VTR » regroupant les valeurs disponibles pour chacun d’eux, ainsi que les autres éléments de comparaison entre ces différents HAP (Ineris, 2020).
Le fluorène se trouve être parmi les HAP de plus bas poids moléculaire (PM) (2 à 3 cycles), ce qui lui confère une plus forte volatilité que les autres HAP de haut PM. Pour cette classe de HAP (bas PM), l’inhalation constitue la voie prépondérante d’exposition.
Toxicocinétique
Chez l'homme
Absorption
Aucune étude ne traite du devenir du fluorène seul dans l’organisme humain.
Néanmoins, des travaux ont permis d’identifier la présence de fluorène dans l’organisme d’individus exposés à des mélanges de polluants contenant du fluorène.
L’absorption de fluorène (différentes sources d’exposition confondues) a indirectement été démontrée par la présence de l’un de ses métabolites, le 2-hydroxyfluorène dans les urines d’hommes témoins ou consultant pour des problèmes de fertilité (Xia et al., 2009).
Distribution
Le fluorène a pu être dosé dans le lait de mères italiennes, 7,32 µg.kg-1 de lait (Santonicola et al., 2017).
Métabolisme
Les principaux métabolites identifiés chez l’homme sont les 2-, 3,- et 9-hydroxyfluorènes (Nikolova-Pavageau et Pillière, 2018).
Élimination
Des concentrations urinaires de 2-hydroxyfluorène de 2,80 µg.g-1 de créatinine ont été rapportées chez des sujets masculins exposés à des mélanges HAP dont du fluorène (Xia et al., 2009).
Chez l'animal
Absorption
Chez l’animal, très peu d’études sont disponibles sur le devenir du fluorène seul dans l’organisme.
L’absorption de fluorène par inhalation et par voie orale a indirectement été montrée chez le rat, mais non quantifiée (Peiffer et al., 2013 ; Peiffer et al., 2016).
Distribution
Après une exposition subaiguë par inhalation (1,5 ou 150 ppb, soit 0,01 ou 1 mg.m-3, 6 h.j-1 pendant
11 jours consécutifs), le fluorène et l’un de ses métabolites, le 9-hydroxy-fluorène ont pu être dosés dans le sang et le cerveau des animaux exposés, mais aussi chez les animaux du groupe témoin (non liée à la contamination de l’air ambiant), mais selon les auteurs résultant d’une imprégnation naturelle liée à la volatilité du fluorène (Peiffer et al., 2013).
Métabolisme
Plusieurs métabolites, le 9-, le 3- et 2-hydroxy-fluorène ont été identifiés dans le sang et/ou le cerveau de rats exposés à des concentrations de 150 ppb, soit 1 mg.m-3, de fluorène par inhalation (11 jours consécutifs, 6 h.j-1) (Peiffer et al., 2013). Seul le 9-hydroxyfluorène a été dosé aussi bien dans le sang que dans le cerveau des animaux du lot témoin.
Dans une étude réalisée sur des préparations de foie de rats, le 1-hydroxyfluorène, le 9-hydroxyfluorène et le 9-cétofluorène ont été identifiés comme étant les principaux métabolites du fluorène (LaVoie et al., 1981).
Élimination
Aucune donnée n’a été identifiée suite à des expositions par les voies physiologiques. Cependant, l’élimination par les urines et les fèces a été montrée chez plusieurs espèces exposées par voie intrapéritonéale.
Autre
Relation avec le récepteur AhR
A partir de tests réalisés in vitro sur cellules humaines ou sur poissons, le fluorène semble être un faible ligan de l’AhR, récepteur spécifique des HAP (affinité non quantifiable) et des cytochromes P450 (Barron et al., 2004).
Synthèse
Aucune donnée n’est disponible sur la toxicocinétique du fluorène seul chez l’homme. En mélange, son élimination par voie urinaire sous forme de métabolite a été observée, de même que sa présence dans le lait maternel.
Chez l’animal, l’absorption par voie orale et par inhalation est importante, la voie cutanée n’a pas été étudiée. Plusieurs de ses métabolites, les 9-, 3- et 2-hydroxy-fluorènes ont pu être dosés dans le sang et le cerveau. C’est un très faible ligand de l’AhR, récepteur spécifique des HAP (affinité non quantifiable) et des cytochromes P450.
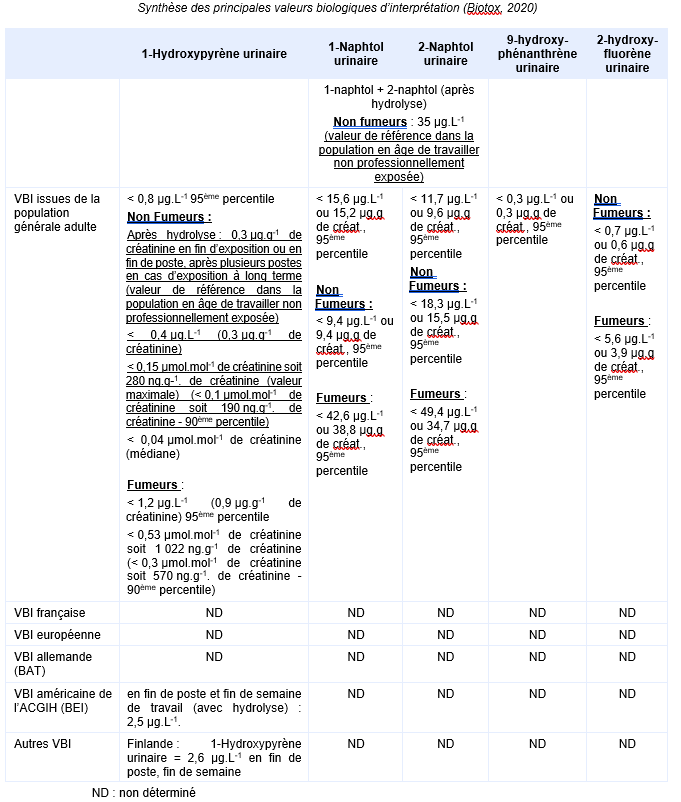
Equivalents biosurveillance
Description
Toxicité aiguë
Chez l'homme
Synthèse
Aucune étude concernant l’effet d’une exposition aiguë au fluorène n’est disponible chez l’homme.
Chez l'animal
Inhalation
Les effets du fluorène sur le comportement ont été étudiés dans le cadre d’une étude de toxicité subaiguë par inhalation (1,5 ou 150 ppm, soit 0,01 ou 1 mg.m-3, exposition oro-nasale 6 heures par jour pendant 14 jours consécutifs) chez les rats mâles (Peiffer et al., 2013). Si le traitement n’a pas eu d’incidence sur l’activité locomotrice ou les performances d’apprentissage, les auteurs ont en revanche observé un niveau d’anxiété plus faible chez les animaux traités par comparaison au lot témoin dans l’un des deux tests mesurant l’activité de type anxiolytique. Dans ces conditions expérimentales, le fluorène entraîne des troubles comportementaux en lien avec l’anxiété chez le rat mâle.
Voie orale
Des rats partiellement hépatectomisés et exposés par voie orale pendant 10 jours à 180 mg.kg-1.j-1 de fluorène (présent dans la nourriture) présentaient par rapport aux rats témoins une augmentation du poids du foie (Gershbein, 1975).
Dans l’étude de Danz et al., 1991, le poids du foie et l’index mitotique des cellules hépatiques ont été étudiés chez des rats exposés, par gavage, à une seule dose de fluorène dans du diméthyl sulfoxide. Le poids du foie des rats a augmenté de façon dose dépendante et jusqu'à 20 % par rapport au lot témoin, alors que l’indice mitotique des hépatocytes augmente chez les rats traités et est, 48 h après l’exposition, 6 fois plus important que chez les rats témoins.
Une seule exposition, par gavage, de rats mâles Sprague-Dawley à 150 mg.kg-1 de fluorène n’induit pas chez les animaux de modification du poids du thymus et de la rate (Danz et Brauer, 1988).
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Chez l’animal, l’exposition aiguë au fluorène induit une toxicité hépatique et des troubles du comportement.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Aucune étude épidémiologique ne traite de l’effet du fluorène seul chez l’homme.
Synthèse
Aucune donnée sur les effets de l’exposition chronique au fluorène seul n’est disponible chez l’homme.
Chez l'animal
Voie orale
Des souris CD-1 ont été exposées, par gavage, à 0, 125, 250 ou à 500 mg.kg-1.j-1 de fluorène en suspension dans de l’huile de maïs pendant 13 semaines (US EPA, 1989). Une augmentation de la salivation et une hypoactivité ont été observées chez toutes les souris mâles quelle que soit la dose de fluorène. A la dose de 500 mg.kg-1.j-1, une dyspnée, un ptosis (abaissement de la paupière supérieure, d'origine congénitale), une diminution du poids absolu du foie, une diminution du poids relatif du foie et de la rate, accompagnées par des changements histopathologiques, une diminution de la concentration d’hémoglobine et une augmentation du taux de bilirubine dans le sérum ont été observées chez les souris mâles et femelles. Une diminution significative du nombre de globules rouges a également été rapportée chez les souris femelles exposées à 250 mg.kg-1.j-1 de fluorène et chez les souris mâles et femelles exposées à 500 mg.kg-1.j-1. A la dose de 125 mg.kg-1.j-1 la diminution du nombre d’érythrocytes et de la concentration en hémoglobine chez les mâles et les femelles ne sont pas significativement plus faibles que les valeurs des animaux du lot témoin. En revanche, une diminution significative du poids absolu du foie et de la rate a été décrite chez les mâles de ce même lot (US EPA,1989).
Cette étude a permis d’établir un LOAEL de 250 mg.kg-1.j-1 et un NOAEL de 125 mg.kg-1.j-1 pour des atteintes hématologiques (US EPA, 1989).
Dans l’étude de Morris et al., 1960, 18 rats femelles buffalo ont été exposés par voie orale à 12,3 mg.kg-1.j-1 de fluorène pendant 6 mois ou à 13,1 mg.kg-1.j-1 de fluorène pendant 18 mois. Lors de l’étude de 6 mois, la nourriture a été préparée avec 3 % de propylène glycol et contenait une faible teneur en protéine et en graisses. Lors de l’étude de longue durée (18 mois) la nourriture a été préparée avec 3 % d’huile de maïs. Les symptômes observés chez les animaux lors de l’exposition de 6 mois au fluorène n’ont pas été retrouvés après 18 mois d’exposition. Le seul effet observé a été l’apparition d’hyperplasies de la muqueuse nasale chez 2 rats. Les effets observés lors de l’étude de 6 mois semblent avoir été induits par la composition de la nourriture, ou par la présence de propylène glycol ce qui est plus vraisemblable.
Les effets de l’exposition subchronique au fluorène sur le comportement ont été explorés dans le cadre d’une étude par voie orale où les rats ont été exposés pendant 60 jours consécutifs à des doses de 1, 10 ou 100 mg.kg-1.j-1 de fluorène dans l’alimentation (Peiffer et al., 2016). Une baisse de l’activité de type anxiolytique évaluée à partir du test du labyrinthe en croix surélevé (« Elevated Plus Maze ») et réalisé après 28 jours de traitement a été décrite dans les lots d’animaux exposés aux deux plus faibles doses de 1 et 10 mg.kg-1.j-1. Le traitement n’a pas eu d’effet sur les autres tests ayant examinés la fonction locomotrice et les capacités d’apprentissage. Les auteurs rapportent également une baisse de croissance pondérale chez les animaux du lot le plus exposé (100 mg.kg-1.j-1 de fluorène) à partir du 28ème jour et jusqu’à la fin de l’étude, de même qu’une augmentation dose-dépendante du poids relatif du foie.
Synthèse
Chez l’animal, le fluorène administré par voie orale entraîne une toxicité hépatique et hématologique, ainsi qu’une sensible diminution de l’état anxiogène chez le rat.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non déterminé | |
| IARC | Groupe 3 : l’agent ne peut être classé pour sa cancérogénicité pour l’homme | 2010 |
| US EPA | Classe D : substance non classifiable quant à sa cancérogénicité pour l'homme | 1990 |
Chez l'homme
Toutes voies
Aucune étude spécifique du fluorène seul n’est disponible chez l’homme.
Synthèse
Aucune étude épidémiologique n’a recherché les éventuels effets cancérogènes de l’exposition au fluorène seul.
Chez l'animal
Toutes voies
Chez l’animal, l’effet cancérigène du fluorène a été testé sur la peau des souris, chez les rats après une exposition par voie orale au fluorène (Morris et al., 1960 ; US EPA, 1989 ; Wilson et al., 1947) et après administration subcutanée (Iwata et al., 1981 ; Shear et Luter, 1941). Mais toutes ces données ne permettent pas de conclure quant au caractère cancérigène du fluorène.
Voie orale
Vingt rats Buffalo femelles ont été exposés à 0,05 % de fluorène (dose moyenne de 2 553 mg par rat). Le fluorène a été administré dans la nourriture contenant 3 % d’huile de maïs (dose moyenne de fluorène 796 mg par rat). L’étude a été arrêtée au bout de 10,7 mois et un examen histologique a été pratiqué chez 11 rats. Un carcinome à cellules squameuses au niveau du bassinet rénal et de l’uretère ont été rapportés (Morris et al., 1960).
Une étude subchronique a montré que les souris CD-1 mâles et femelles exposées, par gavage, à 0, 125, 250 ou à 500 mg.kg-1.j-1 de fluorène pendant 13 semaines ne présentaient pas de tumeur à l’autopsie (US EPA, 1989). Dans l’étude de Wilson et al. (1947), des rats albinos ont été exposés par voie orale à des concentrations de fluorène comprises entre 0,062 et 1 % pendant 104 jours ou à des concentrations de 0,125 - 0,25 - 0,5 % de fluorène pendant 453 jours. Dans la première expérience, une perte de poids des rats a été observée, mais les rats ne présentaient aucune anomalie. Dans la seconde expérience, les rats exposés à 0,125 % de fluorène ont développé un adénome tubulaire rénal bénin.
Voie cutanée
L’application de fluorène 1 ou 2 jours consécutifs sur la peau des souris C57BL/6 n’induit pas d’augmentation du nombre des mélanocytes, même pour des doses de 200 µg par souris (0,05 mg.m-3) (Iwata et al., 1981).
Enfin, l’injection subcutanée de 10 mg de fluorène dans du glycérol pendant 18 mois chez les souris n’induit pas de tumeur localisée (Shear et Luter, 1941).
Synthèse
Les seules études disponibles par voie orale et cutanée chez l’animal ne sont pas en faveur d’un effet cancérogène.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé |
Chez l'homme
Toutes voies
Aucune donnée n’a été identifiée chez l’homme.
Chez l'animal
Toutes voies
Aucune donnée n’a été identifiée chez l’animal.
In vitro
Organismes procaryotes
Le fluorène est négatif dans le test d’Ames sur les cinq souches de Salmonella typhimurium à des concentrations allant jusqu’à 1 000 µg par boîte. Il est également négatif sur la souche TM677 à 50 µg.ml-1 (Bos et al., 1988 ; Kaden et al., 1979 ; LaVoie et al., 1979 ; LaVoie et al., 1981 ; McCann et al., 1975 ; Sakai et al., 1985).
Organismes eucaryotes
Il semblerait que le fluorène ne soit pas génotoxique (AFSSA, 2006 ; LaVoie et al., 1979 ; Probst et al., 1981).
Les tests d’altération de l’ADN sont également négatifs sur bactéries et cultures primaires d’hépatocytes (Mamber et al., 1984 ; McQueen et al., 1983 ; Nakamura et al., 1987 ; Sina et al., 1983), mais positifs sur cellules de lymphomes de souris (cassures simple brin) (Garberg et al., 1988).
Synthèse
La plupart des tests réalisés in vitro n’ont pas mis en évidence de potentiel génotoxique du fluorène.
Effets sur la reproduction
Chez l'homme
Toutes voies
Il n’existe pas d’étude disponible chez l’homme concernant les effets du fluorène seul sur la reproduction.
Néanmoins, dans une étude regroupant 513 hommes ayant consulté pour des problèmes de fertilité et 273 sujets témoins, une augmentation de la concentration de 2-hydroxy-fluorène (2e et 3e tertile) (métabolite du fluorène) a été associée avec le risque d’infertilité idiopathique masculine (odds ratio de 1,46 ; IC95% [1,02 – 2,10] et 1,52 ; IC95% [1,06 – 2,17] pour respectivement le 2e et 3e tertile, p<0,05) (Xia et al., 2009).
Synthèse
La seule étude rapportée ici ne permet pas de conclure quant à un effet du fluorène seul sur la reproduction chez l’homme.
Chez l'animal
Toutes voies
Chez l’animal, la seule étude traitant de l’effet du fluorène sur la reproduction est celle de l’US EPA (1989). Dans cette étude, l’exposition des souris CD-1 à 125, 250 ou à 500 mg.kg-1.j-1 de fluorène n’induit aucun effet néfaste sur les organes reproducteurs.
Synthèse
Le fluorène ne semble pas altérer les organes de la reproduction (mâle et femelle) chez la souris, mais la capacité de reproduction n’a pas été examinée.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé |
Chez l'homme
Toutes voies
Il n'existe pas d'étude chez l'homme concernant les effets du fluorène seul sur le développement.
Synthèse
Aucune étude spécifique du fluorène seul sur le développement n’a été identifiée chez l’homme.
Chez l'animal
Synthèse
Il n'existe pas d'étude chez l'animal concernant les effets du fluorène seul sur le développement.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Informations relatives à l’utilisation des VTR Seul le fluorène est considéré, la toxicité du fluorène en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Certains HAP disposent d’une fiche de données toxicologiques( ) cependant il nous est apparu nécessaire de proposer également une fiche « choix de VTR » regroupant les valeurs disponibles pour chacun d’eux. Rappelons que dans le concept de facteur d’équivalence toxique (FET) permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le BaP est la substance de référence à laquelle un potentiel toxique de valeur 1 est arbitrairement donné.
Même si à ce jour il n’existe pas de VTR pour des expositions cutanées, cette voie d’exposition peut ne pas être négligeable.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition sub-chronique par voie orale
L’ATSDR propose un MRL de 0,4 mg.kg-1.j-1 pour une exposition subchronique par voie orale au fluorène (1995).
Cette valeur a été établie à partir d’une étude réalisée chez des souris CD-1 (25 souris/sexe/lot) exposées, par gavage, à 0, 125, 250 ou à 500 mg.kg-1.j-1 de fluorène, pendant 13 semaines (US EPA, 1989). Un LOAEL de 125 mg.kg-1.j-1 a été déterminé par l’ATSDR à partir de l’augmentation dose-dépendante du poids du foie.
Facteur d’incertitude : un facteur de 300 a été appliqué. Un facteur 10 pour l’extrapolation de données animales vers l’homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l’absence de NOAEL.
Calcul : 125 mg.kg-1.j-1 x 1/300 = 0,41 mg.kg-1.j-1 (arrondi à 0,4 mg.kg-1.j-1)
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale
L’US EPA propose une RfD de 4.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au fluorène (1990).
Cette valeur a été établie à partir de la même étude que celle retenue par l’ATSDR pour l’élaboration de sa VTR subchronique à savoir d’une étude réalisée chez des souris CD-1 (25/sexe/lot) exposées, par gavage, à 0, 125, 250 ou à 500 mg.kg-1.j-1 de fluorène, pendant 13 semaines. Un NOAEL de
125 mg.kg-1.j-1 a été établi pour des effets hématologiques et pour une diminution du poids du foie et de la rate (US EPA, 1989).
Facteur d’incertitude : Un facteur d’incertitude de 3 000 est appliqué. Un facteur 10 pour l’extrapolation de données subchroniques à des données chroniques, un facteur 10 pour l’extrapolation de données animales vers l’homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l’absence de données chez plusieurs espèces animales.
Calcul : 125 mg.kg-1.j-1 x 1/3 000 = 0,041 mg.kg-1.j-1 (arrondi à 4.10-2 mg.kg-1.j-1)
Indice de confiance : l’indice de confiance de l’US-EPA pour sa valeur est moyen pour l’étude retenue, et faible pour la valeur établie et l’utilisation des données disponibles.
Le RIVM propose un TDI de 4.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au fluorène (2001)
Cette valeur a été élaborée pour les hydrocarbures aromatiques comportant de 10 à 16 carbones et qui ne sont pas considérés comme cancérigènes (Baars et al., 2001).
La méthodologie ayant conduit à cette valeur de risque (et aussi à celles correspondant à d'autres fractions du pétrole) est issue des travaux réalisés en 1997 par le TPHCWG (Total Petroleum Hydrocarbons Criteria Working Group) (Edwards et al., 1997 ; Gustafson et al., 1997). Brièvement, afin d’évaluer le risque induit par le pétrole, 7 fractions indépendantes ont été distinguées, 4 fractions aliphatiques et 3 aromatiques. Dans la fraction aromatique comportant des HAP constitués de
10 à 16 carbones, 77 substances ont été identifiées. Des RfD ont été établies pour 8 de ces substances. Ces RfD sont comprises entre 0,03 et 0,3 mg.kg-1.j-1. Quatre substances présentent une RfD de
0,04 mg.kg-1.j-1 et seules 2 substances (fluorène et le mélange naphtalène/méthylnaphtalènes) ont une RfD de 0,03 mg.kg-1.j-1. Une RfD de 0,04 mg.kg-1.j-1 a été considérée par le TPHCWG comme appropriée en tant que valeur seuil pour les effets non cancérogènes induits par la fraction aromatique comportant des HAP constitués de 10 à 16 carbones. Cette valeur a été retenue par le RIVM pour chaque HAP non cancérogène comportant entre 10 et 16 carbones.
Indice de confiance : Selon le RIVM la fiabilité de cette valeur est élevée.
Effets sans seuil
Selon le rapport Ineris (2003), une méthode de calcul est proposée par l’OMS IPCS, sur la base d’une valeur de référence multipliée par un FET (facteur d’équivalence toxique) (Doornaert et Pichard, 2003). Le principe de FET est fondé sur les hypothèses selon lesquelles l’organe cible et l’activité toxique sont identiques pour chaque molécule apparentée et qu’il n’y a pas d’interaction toxicocinétique ni toxicodynamique. Une telle approche autorise l’addition des risques cancérigènes liés à une co-exposition et permet de quantifier le pouvoir cancérigène d’un mélange de substances en fonction du pouvoir cancérigène d’une substance dite de référence, appartenant à la même famille chimique (OMS IPCS, 1998).
Néanmoins, comme le précise l’AFSSA, 2006, cette approche n’est possible que sous 3 conditions :
- les doses et les effets de chacun des composés du mélange sont additifs,
- il n'existe pas d'interactions antagonistes ou synergiques entre les composés du mélange et
- ils agissent selon le même mécanisme d'action toxique. Or de nombreuses études expérimentales montrent que ces 3 conditions ne sont pas toujours réunies et peuvent conduire à une surestimation ou à une sous-estimation du risque.
Dans le cas des HAP, la molécule de référence est le benzo(a)pyrène car c’est le HAP le plus étudié et donc le mieux connu. Le potentiel toxique relatif de chaque HAP dont le fluorène est ensuite évalué par rapport à la toxicité du benzo(a)pyrène. Un facteur d’équivalence toxique par rapport au benzo(a)pyrène est alors évalué pour le fluorène. Les FET retenus dans cette approche sont ceux proposés par Nisbet et LaGoy (1992) et repris dans le document Ineris (2003). Cette étape est basée sur l’hypothèse selon laquelle le potentiel toxique relatif entre deux HAP estimé chez l’animal est identique ou similaire chez l’homme.
Un FET de 0,001 a été attribué au fluorène par Nisbet et LaGoy, 1992.
Effets sans seuil - Exposition chronique par inhalation
L'Ineris propose un ERUi de 6.10-7 (µg.m-3)-1 pour une exposition chronique par inhalation au fluorène (2018).
Pour une exposition par inhalation à un HAP et en l’absence de valeur spécifique, l’Ineris recommande de prendre en compte l’Excès de Risque Unitaire (ERUi) du benzo(a)pyrène proposée par l’US EPA, 2017 et retenue par l’Ineris pour cette substance à savoir 6.10-4 (µg.m-3)-1 et de lui appliquer le FET correspondant à cet HAP.
Pour le fluorène, l’Ineris a retenu en 2003, un FET de 0,001 provenant de de la classification de Nisbet et LaGoy (1992).
Dans ces conditions, le calcul pour l’obtention de VTR pour des effets sans seuil pour le fluorène retenu par l’Ineris est :
Cet ERUi correspond à une concentration de 16,7 µg.m-3 pour un risque de 10-5 ou à une concentration de 1,67 µg.m-3 pour un risque de 10-6.

Effets sans seuil - Exposition chronique par voie orale
L’Ineris propose un ERUO de 10-3 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au fluorène (Ineris, 2003).
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît au moment de l’évaluation comme la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
En 2003, l’Ineris retenait la proposition de l’AFSSA (2003) et proposait donc pour le benzo(a)pyrène l’utilisation de la valeur établie par le RIVM. Le RIVM détermine une dose virtuellement sûre (DVS) de 5 ng.kg-1.j-1, par un modèle d'extrapolation linéaire à l'origine, en retenant la dose critique de
10 mg.kg-1.j-1 de B(a)P administrée à l'animal induisant l'apparition significative de tumeurs, et après ajustement de la durée d’administration et d’observation. Cette DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
En 2018, suite à la réévaluation de la valeur de l’US EPA pour le benzo(a)pyrène décrite dans la fiche de données toxicologique et environnementale du benzo(a)pyrène, l’Ineris propose de modifier sa valeur. Cette valeur est basée sur celle proposée par l’US EPA (2017) et retenue par l’Ineris pour le benzo(a)pyrène à savoir 1 (mg.kg-1.j-1)-1. A partir de cette valeur une approche par l’application de FET a été réalisé.
calcul de VTR par inhalation à partir du Facteur Equivalent Toxique (FET) du fluorène
|
Voie d’exposition |
VTR benzo(a)pyrène |
FET |
VTR Fluorène |
|---|---|---|---|
|
Orale |
ERU0 = 1. (mg.kg-1.j-1)-1 |
0,001 |
ERU0 = 10-3 (mg.kg-1.j-1)-1 |
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition sub-chronique par voie orale
L’Ineris propose de retenir pour une exposition sub-chronique au fluorène par voie orale la VTR sub-chronique de 4.10-1 mg.kg-1.j-1 de l’ATSDR (1995).
L’ATSDR (1995) propose une VTR pour une exposition subchronique par voie orale à partir d’une étude de 23 semaines. Cette valeur est la seule disponible, et sa construction étant bien établie, elle est retenue pour des expositions subchroniques.
Toutefois, le LOAEL de 125 mg.kg-1.j-1 choisi par l’ATSDR à partir de l’augmentation dose-dépendante du poids du foie n’a pas été retenu par l’US-EPA pour la détermination de sa VTR Chronique (voir ci-dessous). Dans l’étude, des effets hématologiques (diminution des globules rouges et de l’hémoglobine, augmentation de la bilirubine sérique) ont également été constatés. Toutefois, à la dose de 125 mg.kg-1.j-1 de fluorène, ces effets n’étaient pas significatifs. Si, sur la base des effets hématologiques, l’US EPA a établi un NOAEL à la dose de 125 mg.kg-1.j-1 de fluorène, l’ATSDR a choisi de ne pas construire de valeur à partir de cet effet.
Indice de confiance : faible en raison des limites des effets critiques retenus
Effets à seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique au fluorène par voie orale la VTR chronique de 4.10-2 mg.kg-1.j-1 de l’US EPA.
Deux organismes proposent une valeur, l’US EPA (1990) et le RIVM (2001).
Pour l’exposition par voie orale, la valeur du RIVM est extraite du document des TPHCWG proposant une TDI pour les hydrocarbures aromatiques C8-C10, C10-C12 et C12-C16. Cette valeur bien qu’identique à celle de l’US EPA, est moins spécifique dans sa construction que celle de l’US EPA, elle n’a donc pas été retenue.
La valeur de l’US EPA est spécifique au fluorène. Elle a été construite à partir d’une étude chez le rat exposé uniquement au fluorène. L’US EPA retient la valeur de 125 mg.kg-1.j-1 comme un NOAEL et ajoute un facteur supplémentaire d’incertitude sur le manque de données. Cette valeur est retenue pour l’exposition par voie orale.
Indice de confiance : faible en raison de l’incertitude de la valeur du NOAEL.
Effets sans seuil - Exposition chronique par inhalation
L’Ineris propose de retenir pour une exposition chronique au fluorène par inhalation la VTR chronique de 6.10-7 (µg.m-3)-1 de Ineris (2018).
La seule valeur disponible est celle proposée par l’Ineris. Elle est construite par application du FET du fluorène sur la valeur du benzo(a)pyrène. Cette valeur est retenue.
Indice de confiance : Faible en raison du manque de données pour cette voie
Effets sans seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique au fluorène par voie orale la VTR chronique de 10-3 (mg.kg-1.j-1)-1 de 2018.
La seule valeur disponible est celle proposée par l’Ineris. Elle est construite par application du FET à partir de la valeur révisée du benzo(a)pyrène. Cette valeur est retenue.
Indice de confiance : Faible en raison du manque de données pour cette voie.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés.
Dangers
Description
Organismes aquatiques
La sensibilité des organismes aquatiques d’eau douce et marins sont comparables, les données obtenues avec les essais réalisés sur des espèces de ces deux groupes peuvent être utilisées conjointement.
Il n’existe pas de données valides issues de test réalisé sur organismes benthiques.
Paramètres d’écotoxicité aiguë
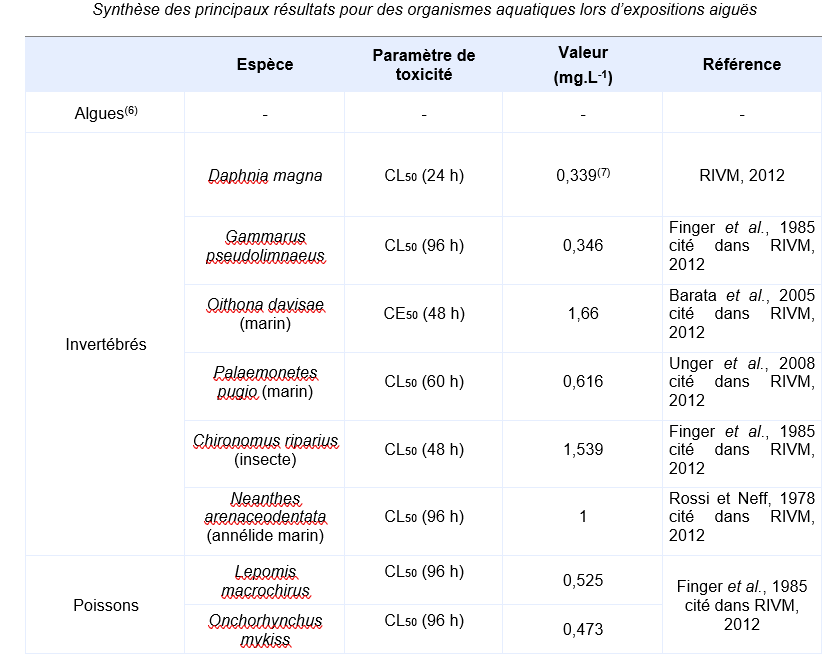
(6) Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
(7) Moyenne géométrique de 408 µg.L-1 (Vindimian, 2000) et 282 µg.L-1 (Finger et al., 1985 cité dans RIVM, 2012).
La toxicité des HAP envers les organismes aquatiques (pélagiques et benthiques) peut être accrue en présence de rayonnement UV et plus particulièrement les UV-A (Ankley et al., 1994 ; Hatch et Burton Jr., 1999 ; Krylov et al., 1997 ; Landrum et al., 1987 ; Newsted et Giesy, 1987 ; Sinha et Chignell, 1983 ; US EPA, 1993). Deux types de réactions photochimiques peuvent expliquer l’apparition de ce phénomène : Mécanisme « externe » La structure des molécules de HAP présents dans le milieu aqueux peut être modifiée sous l’influence de rayonnement UV et en présence d’oxygène. Ces formes modifiées, une fois accumulées dans les organismes, provoquent des destructions cellulaires. Mécanisme « interne » Sous l’influence de rayonnement UV, un transfert d’énergie a lieu entre les HAP et la molécule d’oxygène provoquant la formation d’espèces réactives de l’oxygène. Ces formes réactives de l’oxygène sont à l’origine de la destruction des membranes biologiques. La toxicité induite par la lumière serait régie par un mécanisme « interne » avec en premier lieu une accumulation de HAP dans les tissus puis une formation d’espèces réactives après une exposition aux UV. Ces deux mécanismes agissent de manière simultanée. Quelques facteurs régissant l’apparition et l’amplitude de cette toxicité sont : - la quantité et la nature des HAP, - l’intensité et la durée du rayonnement UV, - la nature des espèces présentes, - la nature du milieu considéré. Des modèles de type QSAR basés sur les propriétés toxiques, photo et physico-chimiques des HAP, montrent que la toxicité du fluorène n’augmente pas en présence de rayonnement UV (Mekenyan et al., 1994 ; Newsted et Giesy, 1987). Il faut tout de même noter que ces modèles intègrent seulement les réactions photochimiques du mécanisme « interne ». Un autre modèle QSAR développé par Krylov et al. (1997), a été construit en se basant également sur les propriétés photo et physico-chimiques et sur un test d’inhibition de la croissance de la lentille d’eau, Lemna gibba (Huang et al., 1997). Par ailleurs, les résultats de cet essai ne sont pas retenus dans le Tableau, il manquait des informations sur les conditions de l’essai pour pouvoir les valider. Les lentilles d’eau ont été exposées pendant 8 jours à un rayonnement UV ainsi qu’à deux « types » de fluorène : des molécules de fluorène dites « intactes » et des molécules de fluorène préalablement photomodifiées. Les réactions photochimiques du mécanisme « interne » et « externe » ont ainsi pu être distinguées. En présence de fluorène photomodifié, l’inhibition de la croissance de la lentille d’eau est plus importante, impliquant que les réactions photochimiques du mécanisme « externe » pourraient être à l’origine d’une éventuelle augmentation de la toxicité du fluorène.
Paramètres d’écotoxicité chronique
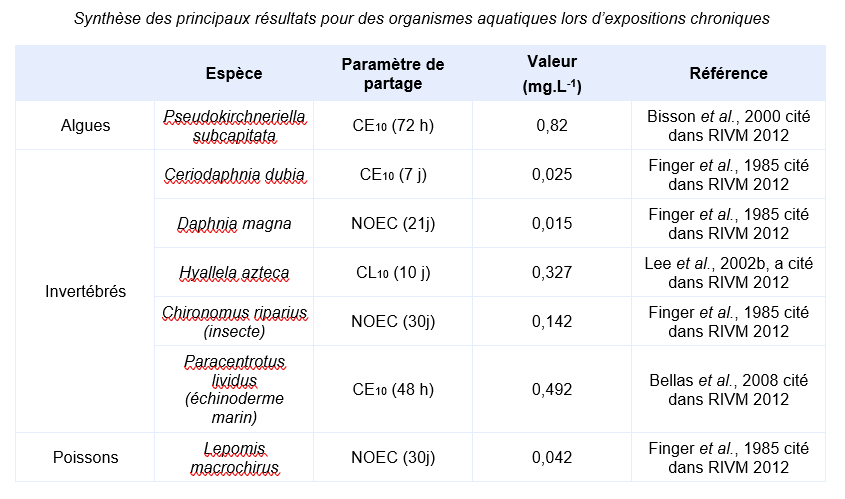
Algues
L’essai sur Pseudokirchneriella subcapitata a été effectué en utilisant un système statique. Les résultats sont basés sur des concentrations mesurées en tenant compte de leur décroissance au cours du temps dans le milieu d’essai.
Invertébrés
L’essai sur Ceriodaphnia dubia a été effectué en utilisant un système semi-statique. Les résultats sont basés sur des concentrations mesurées.
L’espèce testée la plus sensible est Daphnia magna : une NOEC de 15 µg.L-1 est obtenue sur le critère du succès de la reproduction, les daphnies étaient maintenues dans un cycle jour/nuit de 16/8 heures.
Le test réalisé sur les chironomes a permis d’obtenir une NOEC de 142 µg.L-1 sur le critère d’effet d’inhibition de l’émergence des larves. Le test réalisé sur l’échinoderme marin Paracentrotus lividus s’est fait sous des conditions lumière/obscurité pour prendre en compte la phototoxicité.
Poissons
La croissance est le critère d’effet le plus sensible lors du test réalisé sur Lepomis macrochirus. Une NOEC de 42 µg.L-1 est enregistrée.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
La toxicité des HAP envers les organismes aquatiques (pélagiques et benthiques) peut être accrue en présence de rayonnement UV et plus particulièrement les UV-A, c’est le cas du fluorène.
Le jeu de données court terme valides comprend des valeurs sur deux des trois groupes taxonomiques principaux : les invertébrés et les poissons. De plus, des groupes supplémentaires sont également documentés (insecte + annélide). Les organismes marins sont représentés dans le jeu de données puisqu’il comprend des résultats d’essai réalisés sur invertébrés marins. L’espèce la plus sensible à une exposition à court terme est Daphnia magna, la moyenne géométrique des résultats d’essais valides est de 339 µg.L-1.
Le jeu de données long terme valides comprend des valeurs sur les trois groupes taxonomiques principaux (algues/invertébrés/poissons). De plus, des groupes supplémentaires sont également documentés (insecte + échinoderme). Les organismes marins sont représentés dans le jeu de données puisqu’il comprend un résultat d’essai réalisé sur un échinoderme marin. L’espèce la plus sensible à une exposition de longue durée est l’invertébré Daphnia magna. Exposées au fluorène 21 jours avec un cycle d’éclairement de 16/8h, elles présentent une NOEC de 15 µg.L-1 sur le critère du succès de la reproduction.
Sédiments d'eau douce
Il n’a pas été rapporté de données valides sur le sédiment d’eau douce ou marin.
Sédiments marins
Il n’a pas été rapporté de données valides sur le sédiment d’eau douce ou marin.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité chronique
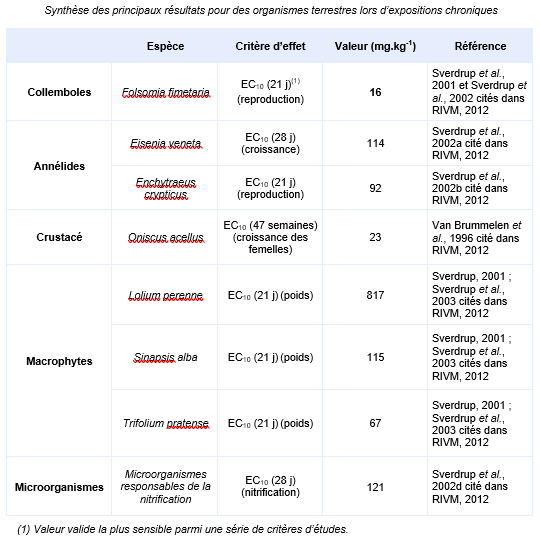
Il a été observé lors des essais sur organismes terrestres que le fluorène disparait rapidement dans le système d’essai. C’est la raison pour laquelle les concentrations moyennes pondérées par le temps sont des valeurs plus pertinentes pour discuter de la courbe dose-réponse pour cette substance. Seul le détail de l’essai réalisé sur l’espèce la plus sensible a été expertisé lors de l’élaboration de cette fiche. Collemboles Folsomia fimetaria a été exposé à deux concentrations de fluorène dans un sol prélevé dans le milieu naturel contenant 1,6 % de matières organiques avec un cycle jour/nuit de 12h/12h. Les valeurs des concentrations sont recalculées en concentrations moyennes pondérées dans le temps pour prendre en compte la rapide disparition de la substance dans le milieu. La mortalité des adultes ainsi que le nombre de jeunes en bonne santé ont été pris comme critère d’effet. La valeur de 16 mg.kg-1 correspond à la CE10 sur le critère d’efficacité de la reproduction (le nombre de jeunes). Les concentrations de la substance ont été suivies dans le milieu. Les résultats sont basés sur les concentrations mesurées.
Le jeu de données long terme valides comprend des valeurs sur les trois groupes taxonomiques principaux (invertébrés/plantes/microorganismes). Il couvre des essais sur
7 espèces du compartiment terrestre et sur la nitrification. Il a été remarqué que le fluorène disparaissait rapidement du système d’essai. En conséquence, les valeurs moyenne de concentration pondérées par rapport au temps sont estimées plus pertinentes pour discuter la relation dose/réponse du fluorène et les essais qui ne renseignent que la concentration initiale ne sont pas retenus. L’espèce la plus sensible est le collembole Folsomia fimetaria pour lequel une CE10 de 1,6 mg.kg-1 a été obtenue.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau)
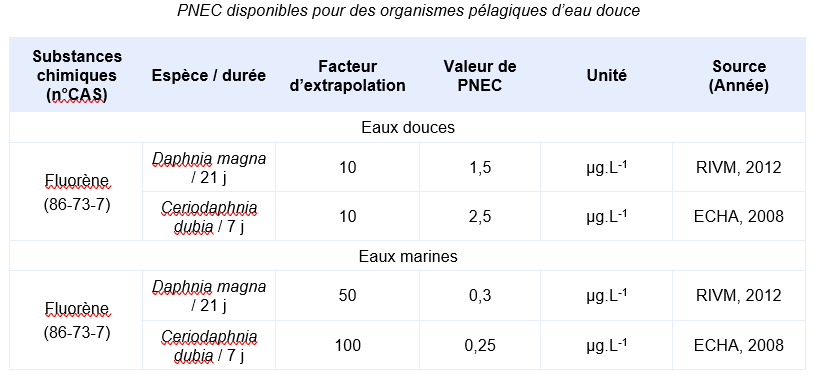
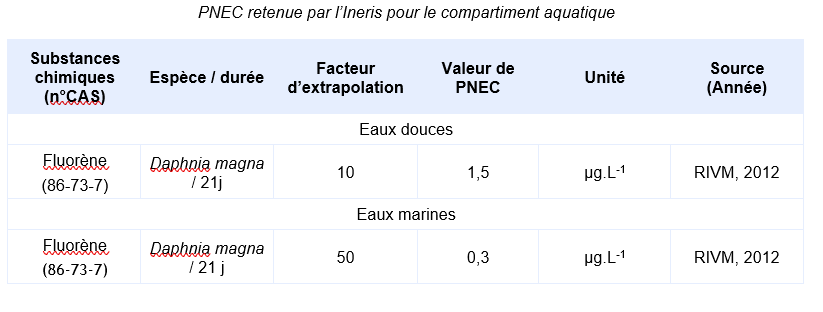
En l’absence valeur réglementaire, l’INERIS propose de déterminer une valeur de PNEC :
Les PNEC suivantes, élaborées par d’autres organismes internationaux, ont été identifiées :
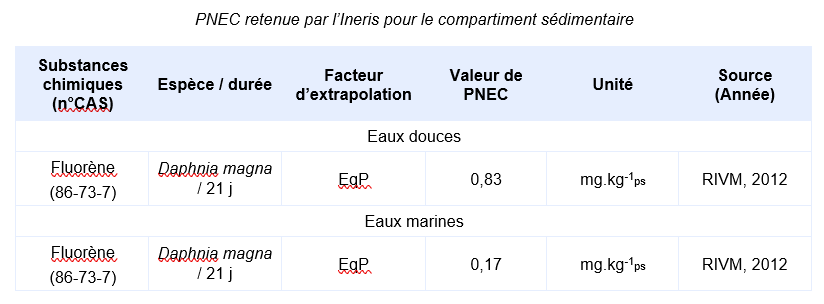
Valeurs seuil pour la protection des organismes benthiques
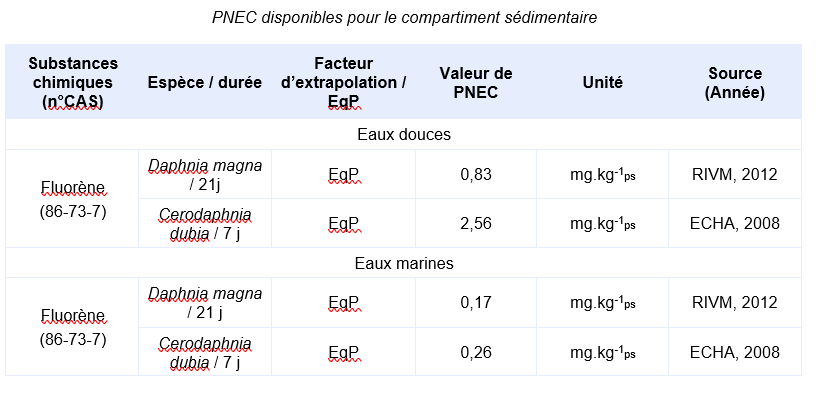
En l’absence valeur réglementaire, l’INERIS propose de déterminer une valeur de PNEC :
Il n’existe pas de données valides issues de test réalisé sur organismes benthiques. Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
Les PNEC suivantes, élaborées par d’autres organismes internationaux, ont été identifiées :
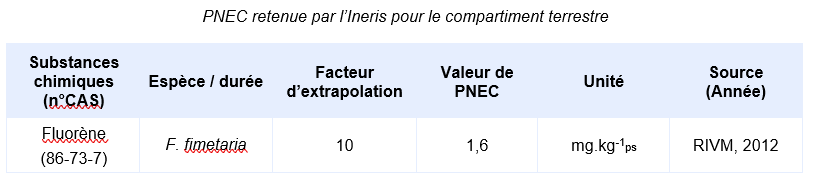
Valeurs seuil pour la protection des organismes terrestres
En l’absence valeur réglementaire, l’INERIS propose de déterminer une valeur de PNEC:
Les PNEC suivantes, élaborées par d’autres organismes internationaux, ont été identifiées :
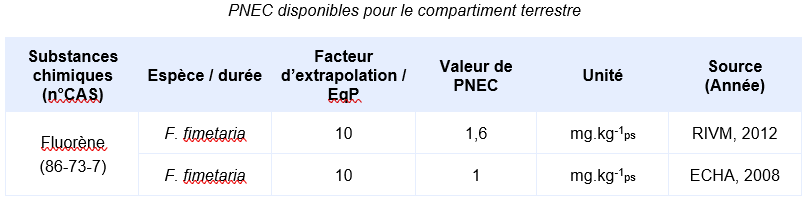
Il n’a pas été possible de consulter le détail du calcul de la PNEC proposée dans ECHA (2018). Il y est juste indiqué qu’elle est calculée depuis une valeur long terme de 10 mg.kg-1 obtenue sur des collemboles. Cette valeur n’a pas été retrouvée dans les bases de données consultées.
Empoisonnement secondaire (prédateurs)
La bioamplification des HAP n’est pas un phénomène attendu dans les écosystèmes aquatiques comme terrestres. Il n’a pas été calculé de valeur pour l’empoisonnement secondaire. Il n’a pas été trouvé de PNECoral dans la littérature scientifique.
Synthèse
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau)
Justification scientifique des valeurs écotoxicologiques de référence
Des résultats à long terme sur algues, invertébrés et poissons sont disponibles. Un facteur d’extrapolation de 10 est appliqué sur la valeur la plus faible du jeu de données. C’est la NOEC de Daphnia magna (15 µg.L-1). Une donnée long terme sur un échinoderme marin permet de calculer une PNEC = 0,3 µg.L-1 pour le milieu marin en appliquant un facteur d’extrapolation de 50 sur la valeur la plus faible du jeu de données (15 µg.L-1).
Valeurs seuil pour la protection des organismes benthiques
Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante
Justification scientifique des valeurs écotoxicologiques de référence :
: Il n’existe pas de données valides obtenues sur organismes benthiques. Les PNEC pour les sédiments d’eau douce et marins sont calculées depuis les PNEC aquatiques d’eaux douces et marines en utilisant la méthode du coefficient de partage à l’équilibre.
Valeurs seuil pour la protection des organismes terrestres
Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante
Justification scientifique des valeurs écotoxicologiques de référence :
La valeur obtenue sur l’espèce la plus sensible (Folsomia fimetaria) est une CE10 moyenne pondérée par le temps de 16 mg.kg-1. Le jeu de donnée comprend des données d’écotoxicité chronique sur des invertébrés, des plantes et sur la nitrification. En conséquence, la PNEC pour le compartiment terrestre est calculée en appliquant un facteur de 10 sur la valeur de 16 mg.kg-1.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

