Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Chlorure de vinyle (75-01-4)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
75-01-4
Nom scientifique (FR)
Chlorure de vinyle
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-831-0
Code SANDRE
1753
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C2H3Cl }\)
Code InChlKey
Code SMILES
C(=C)Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H220 |
|---|---|
| Mention du danger - Texte | Gaz extrêmement inflammable |
| Classe(s) de dangers | Gaz inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
62.50 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Dangers physiques
Dernière vérification le 29/03/2024
Explosivité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Inflammabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 21/07/2025
Matrices
Milieu eau douce
Volatilisation :
Au vu de la valeur de sa constante de Henry (2816.8 Pa.m 3/mol), le chlorure de vinyle est très volatil en solution aqueuse. (UNEP, 2004)
Milieu sédiment eau douce
Adsorption :
D'après le Koc (56 L.kg-1), la substance semble être peu adsorbable. (UNEP, 2004)
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Biodégradabilité :
Le chlorure de vinyle est stable dans l'eau (temps de demi-vie supérieur à 1 an). La substance peut être considérée comme non biodégradable. (UNEP, 2004)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse :
Aucune réaction d'hydrolyse n'est attendue en conditions environnementales. (INERIS, 2000)
Photolyse :
Le chlorure de vinyle n'absorbe pas la lumière à des longueurs d'ondes supérieures à 218 nm.
La photolyse dans l'eau ne semble pas constituer une voie de dégradation significative pour cette substance. (UNEP, 2004)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Bioaccumulation :
Une valeur de BCF égale à 5.1 (estimée à partir du log Kow et de l'hydrosolubilité), suggère que la bioconcentration du chlorure de vinyle chez les organismes aquatiques est faible. (UNEP, 2004)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Conclusion sur la bioaccumulation
Bioaccumulation :
Une valeur de BCF égale à 5.1 (estimée à partir du log Kow et de l'hydrosolubilité), suggère que la bioconcentration du chlorure de vinyle chez les organismes aquatiques est faible. (UNEP, 2004)
Bibliographie
Toxicologie
Dernière vérification le 21/07/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 1999 ; IARC, 2008, 2012 ; US EPA, 2000 ; ATSDR, 2006, 2016). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
La principale voie d'exposition au chlorure de vinyle chez l’homme est la voie respiratoire, avec une absorption ne dépassant généralement pas 30-40 %.
Les études réalisées sur cinq jeunes adultes volontaires sains exposés par inhalation au chlorure de vinyle à des concentrations comprises entre 7,5 et 60 mg.m-3 montrent que le chlorure de vinyle est rapidement absorbé, avec un taux en moyenne de 42 % (Bolt et al., 1977 ; Krajewski et al., 1980). La rétention maximale survient en 15 minutes, et le pourcentage de rétention est indépendant de la concentration en chlorure de vinyle de l’air inspiré. Après arrêt de l’exposition, la concentration en chlorure de vinyle dans l’air expiré diminue rapidement pour atteindre 4 % en 30 minutes (Krajewski et al., 1980).
Voie orale
Malgré l’absence de données humaines, l’absorption du chlorure de vinyle par voie orale est considérée comme étant proche de 100 % (US EPA, 2000). Une fraction non métabolisée lors du passage hépatique est expirée. Aussi la dose interne effective nette peut être inférieure à ce qui est absorbé, notamment à fortes concentrations lorsque le métabolisme du chlorure de vinyle est saturé.
Voie cutanée
L’absorption par voie cutanée n’est pas documentée chez l’homme.
Distribution
Aucune donnée humaine n’est disponible.
Métabolisme
Les voies métaboliques du chlorure de vinyle sont vraisemblablement similaires à celles mises en évidence chez l’animal et détaillées ultérieurement dans la partie concernée. Le chlorure de vinyle est principalement et rapidement métabolisé dans le foie par un processus dit saturable (Bolt, 2005). La première étape d’oxydation du chlorure de vinyle ferait intervenir chez l’homme principalement les cytochromes P450 (CYP) 2E1 (démontré in vitro), conduisant à la formation d’oxyde de chloroéthylène, très réactif, capable de former spontanément du chloroacétaldéhyde (IARC, 2008).
Élimination
L’acide thiodiglycolique est le principal métabolite identifié dans les urines de travailleurs exposés au chlorure de vinyle (Cheng et al., 2001).
L’élimination sous forme inchangée dans l’air exhalé est très faible chez l’homme.
Chez l'animal
Absorption
Inhalation
Chez le rat, le chlorure de vinyle est facilement absorbé par inhalation (environ 40 % pour une exposition initiale de 260 mg.m-3) (IARC, 2012).
Voie orale
Par voie orale, son absorption intestinale chez le rat est quasi complète 10 minutes après une dose unique de 44 à 92 mg.kg-1 (Withey, 1976 ; Feron et al., 1981). Une absorption de 98,7 % à partir du tractus gastro-intestinal a également été rapportée chez le rat après l’administration d’une dose unique de 450 mg.kg-1 (Green et Hathway, 1977).
Voie cutanée
Pour la voie cutanée, des études chez le singe ont montré que le chlorure de vinyle était très peu absorbé. En effet, après une exposition de 2-2,5 heures au chlorure de vinyle gazeux à des doses de 800 ppm et 7 000 ppm, respectivement 0,031 % et 0,023 % du chlorure de vinyle total ont été absorbés (Hefner Jr et al., 1975a).
Distribution
La distribution du chlorure de vinyle est rapide et étendue mais son accumulation dans l’organisme est limitée par un métabolisme et une excrétion rapide (Bolt et al., 1977). Des métabolites du chlorure de vinyle ont été retrouvés dans le foie, les reins, la rate, la peau et le cerveau, sans que les concentrations tissulaires augmentent au cours d’expositions à doses répétées (ATSDR, 2006).
Sa présence dans le sang fœtal et le liquide amniotique indique que le chlorure de vinyle peut traverser la barrière placentaire (IARC, 2012)
Métabolisme
Après absorption, la principale voie métabolique du chlorure de vinyle est le système des mono-oxygénases notamment le cytochrome P-450 2E1, majoritairement au niveau du foie. A faibles concentrations, le CYP2E1 est responsable de l’essentiel de la métabolisation du chlorure de vinyle (Guengerich et al., 1991 ; Sherman et al., 2009). A fortes concentrations, la métabolisation du chlorure de vinyle provoque une destruction des cytochromes P450 par les métabolites formés (Reynolds et al., 1975a ; Reynolds et al., 1975b, Guengerich et Strickland, 1977). Ce phénomène suggère l’apparition d’intermédiaires métaboliques très réactifs lors de la métabolisation du chlorure de vinyle (Guengerich et Strickland, 1977) qui sont pris en charge par le glutathion (Ivanetich et al., 1977). Les différents intermédiaires de métabolisation sont résumés dans la Figure ci dessous.
Métabolisme du chlorure de vinyle (IARC, 2012).
Les deux principaux métabolites du chlorure de vinyle formés dans le foie sont d’une part l’oxyde de chloroéthylène, très réactif et capable de réagir sur l’ADN pour y former des adduits (Sabadie et al., 1980, Zielinski et Hergenhahn, 2001) et d’autre part, le chloroacétaldéhyde, formé spontanément à partir de ce dernier et également capable de former des adduits.
Ces deux composés sont principalement détoxifiés par conjugaison au glutathion via les glutathion-S transférases (Gwinner et al., 1983 ; Laib et al., 1981 ; Tarkowski et al., 1980).
La toxicité de ces deux substances sur le foie est liée à leur capacité à créer des liaisons covalentes avec les protéines hépatiques (le chloroacétaldéhyde) et avec l’ADN ou à l’ARN (oxyde de chloroéthylène) (Bolt, 1986 ; Guengerich et Watanabe, 1979 ; Guengerich et al., 1979, Guengerich et al., 1981 ; Kappus et al., 1976 ; Watanabe et al., 1978a ; Watanabe et al., 1978b). Les animaux les plus jeunes sont plus sujets à la formation de ces adduits que l’adulte. Ce résultat a été montré dans l’étude de Morinello et al. (2002a) chez le rat adulte exposé à 0, 10, 100 et 1 100 ppm, pendant 6 heures par jour, 5 jours par semaine pendant 1 ou 4 semaines. Ces mêmes doses ont été testées chez de jeunes rats traités seulement 5 jours.
Des travaux ont également permis de constater que lors d’exposition par voie orale le foie conserve à toutes les doses testées (de 0,05 à 100 mg.kg-1) une activité métabolique des CYP2E1 3 à 5 fois supérieure à celle notée dans les muscles, les poumons ou les tissus graisseux (Watanabe et al., 1976a).
Élimination
A faible concentration, les métabolites du chlorure de vinyle sont éliminés majoritairement dans les urines sous forme conjuguée avec le GSH (Hefner et al., 1975b). Lorsque la voie métabolique arrive à saturation, aussi bien par voie orale (entre 1 et 100 mg.kg-1.j-1) que par inhalation (environ 100 ppm ou 260 mg.m-3), la proportion de chlorure de vinyle inchangé dans l'air exhalé augmente et l'acide chloracétique peut directement être excrété dans les urines (Hefner et al., 1975b ; Watanabe et al., 1976a, 1976b).
Chez le rat, les deux principaux métabolites urinaires identifiés sont la N-acétyl-S-(2-hydroxyethyl) cystéine et l’acide thioglycolique (Watanabe et al., 1976a).
Synthèse
Chez l’homme, le chlorure de vinyle est rapidement absorbé par inhalation (30 à 40 %). En l’absence de données, l’absorption par voie orale est estimée à 100 %. L’acide thioglycolique est le principal métabolite urinaire identifié chez des salariés exposés au chlorure de vinyle.
Chez l’animal, le chlorure de vinyle est efficacement et rapidement absorbé par inhalation (environ 40 %) et par voie orale (proche de 100 %). Il n’est quasiment pas absorbé par voie cutanée. Le chlorure de vinyle se distribue essentiellement dans le foie et passe la barrière placentaire. Il est métabolisé au niveau hépatique (cytochrome P450) en composés très réactifs (époxyde et acétaldéhyde) qui peuvent former des adduits à l’ADN et créer des liaisons covalentes avec les protéines hépatiques. Ces métabolites sont excrétés dans les urines, jusqu’à saturation du mécanisme de conjugaison. Au-delà de ce niveau, l’élimination du chlorure de vinyle inchangé se fait via l’air expiré. Le chlorure de vinyle et ses métabolites ne s’accumulent pas dans l’organisme.
Toxicité aiguë
Chez l'homme
Inhalation
Expositions accidentelles
Par inhalation, les intoxications aiguës à des niveaux élevés au chlorure de vinyle induisent une dépression du système nerveux central (SNC) qui s’accompagne de symptômes tels que des vertiges, des troubles de la coordination des mouvements, des nausées, des maux de tête, un état de fatigue, des troubles visuels et de la mémoire ainsi que des picotements et des tremblements au niveau des extrémités (Ho et al., 1991 ; Langauer-Lewowicka et al., 1983 ; Marsteller et al., 1975 ; INERIS, 2002 ; Suciu et al., 1963). Des symptômes respiratoires ont également été rapportés chez des sujets exposés accidentellement (déraillement d’un train transportant du chlorure de vinyle) et ne portant pas de protections respiratoires, sans toutefois que le niveau d’exposition soit connu (Brinker et al., 2015).
Expositions contrôlées chez le volontaire
Des étourdissements, une perte de l'orientation et une sensation de brûlure au niveau des pieds ont été observés lors de l'exposition d’hommes volontaires à 65 g.m-3 (25 000 ppm) de chlorure de vinyle pendant 3 minutes (Patty et al., 1930). La disparition rapide de ces symptômes après l’arrêt de l’exposition a néanmoins été suivie de forts maux de tête.
Dans une étude similaire réalisée chez des volontaires sains exposés 5 minutes deux fois par jour (avec un intervalle de 6 heures) pendant 3 jours consécutifs à différentes concentrations de chlorure de vinyle, les auteurs ont pu observer l’absence d’effet à 4 000 ppm (10,4 g.m-3), l’apparition de vertiges à 8 000 ppm (20,8 g.m-3) (1 homme sur 6) et de fortes nausées accompagnées de troubles visuels à la plus forte concentration de 20 000 ppm (52 g.m-3) (Lester et al., 1963).
Baretta et al., (1969) ont exposé au chlorure de vinyle 13 hommes volontaires à des concentrations plus modérées de 130 mg.m-3 (50 ppm), 650 mg.m-3 (250 ppm) et 1 300 mg.m-3 (500 ppm) pendant 7,5 heures (pose de 30 minutes entre deux phases de 3,5 heures d’exposition). Des réponses subjectives et neurologiques sont mesurées avant l’exposition puis à une heure d’intervalle. Vingt-quatre heures après l’arrêt de l’exposition, des échantillons de sang et d’urines sont prélevés. Aucun effet n’est observé à l’exception d’une certaine sécheresse des yeux et du nez, ainsi que des maux de tête, à la concentration de 1 300 mg.m-3 (chez 2 des 7 personnes exposées pendant 3,5 heures et 2 des 4 personnes exposées pendant 7,5 heures). L’exposition ne provoque aucun effet notable lors de l’examen neurologique, de même que sur les résultats des tests mentaux, de coordination ou de dextérité manuelle. Les analyses biochimiques se sont révélées normales. Aucune donnée statistique n’est mentionnée par les auteurs, vraissemblablement en raison des faibles effectifs des sujets de l’étude (4 à 7 par dose d’exposition). A noter, également que 5 des 6 sujets exposés à la plus faible dose, ont été également exposés à la plus forte dose dans un délai de 48 heures.
Voie orale
Aucune donnée n’a été identifiée.
Voie cutanée
Un homme dont les mains avaient été aspergées de chlorure de vinyle a développé un érythème et quelques brûlures du second degré (Harris, 1953).
Une irritation des yeux a été rapportée dans le cadre d’une exposition accidentelle au chlorure de vinyle suite au déraillement d’un train (Brinker et al., 2015).
Synthèse
Les intoxications aiguës par inhalation chez l’homme provoquent des dépressions du système nerveux central (SNC), des vertiges, des troubles de la coordination des mouvements, des nausées, des céphalées, une asthénie, des troubles visuels et de la mémoire et des picotements, des tremblements des extrémités et des troubles respiratoires. Les effets par voie cutanée sont marqués par un érythème et des brûlures.
Chez l'animal
Inhalation
De courtes expositions par inhalation à des concentrations de 100 000 à 400 000 ppm (260 à 1 040.103 mg.m-3) entraînent la mort, en 30 à 60 minutes, chez le rat, le cobaye et la souris (Lester et al., 1963 ; Mastromatteo et al., 1960). La CL50 – 2 heures chez le rat, la souris, le cobaye et le lapin a été calculée respectivement égale à 390.103 mg.m-3 (150 000 ppm), 293.103 mg.m-3 (112 800 ppm), 595.103 mg.m-3 (230 000 ppm) et 295.103 mg.m-3 (115 000 ppm).
L'inhalation brutale de chlorure de vinyle entraîne une dépression du SNC et la mort est précédée d'un accroissement de l'activité motrice, d’ataxie et de convulsions suivies d'une défaillance respiratoire.
Chez le chien exposé à des concentrations anesthésiantes de chlorure de vinyle (entre 100 000 et 400 000 ppm), plusieurs auteurs ont observé de graves arythmies cardiaques, caractérisées par une tachycardie intermittente, des extrasystoles ventriculaires et une fibrillation ventriculaire ; ces effets sont habituels chez le chien lors d'intoxications aiguës par des dérivés halogénés (Carr et al., 1949 ; Oster et al., 1947).
Par ailleurs, les analyses histologiques ont révélé chez la souris et le rat la présence de tissus congestionnés principalement localisés au niveau des poumons, du foie et des reins (exposition de 30 minutes entre 200 000 ppm (520.103 mg.m-3) et 300 000 ppm (780.103 mg.m-3) (Mastromatteo et al., 1960).
Voie orale
La DL50 par voie orale chez le rat est supérieure à 4 000 mg.kg-1 (ECHA, 2011). Les éventuels effets ne sont pas documentés.
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Chez l’animal, seules les expositions aiguës à des concentrations élevées par inhalation au chlorure de vinyle provoquent de graves arythmies cardiaques chez le chien, une augmentation de l’activité précédant des convulsions, une défaillance respiratoire et la mort chez les rongeurs. L’étude histologique montre des congestions au niveau des poumons, du foie et des reins. Les expositions par voies orale et cutanée ne sont pas documentées.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
En milieu industriel, l’exposition discontinue à des concentrations de l’ordre de 2 600 mg.m 3 (1 000 ppm) qui n’était pas rare avant 1974 pendant des périodes d’un mois à plusieurs années était à l’origine d’un syndrome particulier observé chez des décrouteurs de réacteurs travaillant avec le chlorure de vinyle et appelé « maladie du chlorure de vinyle ».
Les symptômes évoqués consistaient en douleurs articulaires et céphalées, étourdissements, troubles visuels, fatigue et perte d’appétit, nausées, insomnies, essoufflements, douleurs abdominales, douleurs et picotements dans les membres, diminution de la libido, perte de poids et syndrome de Raynaud (anomalie de la circulation sanguine au niveau des extrémités)(Laplanche et al., 1987 ; Laplanche et al., 1992 ; Thiess et P., 1974). Les anomalies de la microcirculation continuent de s’aggraver 15 ans après l’arrêt de 30 années d’exposition chez 21 salariés versus 35 salariés témoins appariés (p<0,01) (Lopez et al., 2013).
Ce syndrome de Raynaud a parfois été associé à des lésions osseuses de type acro-ostéolyses chez des personnes qui étaient chargées du nettoyage à la main des autoclaves de polymérisation du chlorure de vinyle (les « décrouteurs ») (Lauwerys, 1982). Les scléroses cutanées principalement localisées au niveau des doigts de la main ont également pu être observées, chez ces travailleurs fortement exposés, au niveau des bras, du cou et la face du visage (Jayson et al., 1976).
En plus des modifications de la circulation périphérique semblables à la maladie de Raynaud, une hypertrophie du foie et de la rate (splénomégalie avec une hypertension portale) et des troubles respiratoires sont notés (dyspnée, emphysème, insuffisance respiratoire, fibrose pulmonaire) (Lange et al., 1974 ; Lelbach et Marsteller, 1981 ; Marsteller et al., 1975 ; Suciu et al., 1975 ; Veltman et al., 1975 ;Walker, 1976).
Le foie demeure le principal organe cible. Plusieurs auteurs rapportent dans le cadre d’expositions en milieu professionnel à de fortes concentrations de chlorure de vinyle la présence d’une stéatose hépatique (Cave et al., 2010 ; Wahlang et al., 2013), de granulations anormales visibles à la surface du foie, la formation fréquente de noyaux de fibrose périsinusoïdale (Marsteller et al., 1975 ; Tamburro et al., 1984 ; Zhu et al., 2005), et l’apparition de fibrose périportale (Maroni et al., 2003). Dans une étude particulièrement bien documentée, une hypertension portale associée à un aspect histologique de fibrose d’origine non alcoolique non cirrhotique a été diagnostiquée chez 17 des 180 salariés affectés à la polymérisation du chlorure de vinyle (Lelbach et Marsteller, 1981). Une méta-analyse incluant 7 études et plus de 40 000 salariés exposés au chlorure de vinyle (cohortes américaines (Chiazze et Ference, 1981), européennes (Ward et al., 2001), françaises (Laplanche et al., 1987, italiennes (Pirastu et al., 2003), allemandes (Greiser et al., 1982) et taiwanaises (Wong et al., 2002) n’a pas mis en évidence d’augmentation de la mortalité par cirrhose du foie (Frullanti et al., 2012), bien que des controverses subsistent néanmoins sur ce point (Lotti, 2017 ; Fedeli et al., 2019).
Des associations positives entre la présence de lésions hépatiques, dont la fibrose, observées chez les salariés exposés au chlorure de vinyle et certains génotypes (c1c2/c2c2 ou c2c2 homozygote) du CYP2E1 ont été décrites (Zhu et al., 2005 ; Hsieh et al., 2007).
Les principales anomalies immunologiques rapportées chez les patients atteints de la maladie du chlorure de vinyle sont une hyperglobulinémie, une cryoglobulinémie, une cryofibrinogénémie, une thrombocytopénie, et une activation in vivo du complément (Ward et al., 1976). Il existe en effet une corrélation étroite entre la sévérité de « la maladie du chlorure de vinyle » et les anomalies immunologiques détectées (Grainger et al., 1980 ; Langauer-Lewowicka et al., 1976 ; Ward et al., 1976).
La sévérité et la probabilité d’apparition de la maladie du chlorure de vinyle sont également liées à la présence de certaines allèles codant pour le système HLA (Serratrice et al., 2001). En revanche, le polymorphisme génétique des glutathion transférases M1 et T1 n’a pas été significativement associé avec la maladie de Raynaud chez des salariés français exposés au chlorure de vinyle (Fontana et al., 2006).
Des troubles neurologiques de type polyneuropathie sensorielle et motrice (Perticoni et al., 1986 ; Podoll et al., 1990), et des troubles psychiatriques (syndromes neurasthéniques et dépressifs) (Penin et al., 1975) sont fréquemment observés. Des altérations de l’électroencéphalogramme sont également notées chez les patients (Penin et al., 1975 ; Styblova et al., 1981).
Concernant de plus faibles expositions au chlorure de vinyle, Bencko et al. (1988) ont observé une augmentation significative des niveaux des IgA, IgG, IgM dans le sérum des salariés exposés à des faibles concentrations de chlorure de vinyle (< 10 mg.m-3); il a été aussi constaté une diminution significative du niveau des IgG pour des expositions plus fortes (> 10 mg.m-3).
Une augmentation significative des irritations pharyngées (p<0,01) a été rapportée chez 138 des 238 travailleurs exposés en Chine au chlorure de vinyle, par comparaison à 63 sur 212 salariés non exposés (RR = 1,97, IC95% : [1,56–2,48] (Zhu et al., 2005). Les concentrations de chlorure de vinyle dans l’atmosphère de travail étaient comprises entre 0,85 et 48,41 mg.m-3 (moyenne géométrique de 7,11 mg.m-3. Les symptômes étaient significativement augmentés chez les travailleurs avec une exposition cumulée > à 15 000 mg (soit environ 6 000 ppm), par comparaison à ceux avec une exposition cumulée <à 15 000 mg.
Voie orale
Pas de données disponibles
Voie cutanée
Pas de données disponibles
Synthèse
Des expositions chroniques à des concentrations élevées (1 000 ppm, 2 600 mg.m-3) peuvent provoquer la « maladie du chlorure de vinyle » : douleurs articulaires, céphalées, troubles visuels, asthénie, douleurs abdominales et douleurs et picotement des membres, diminution de la libido et un syndrome de Raynaud. Les effets systémiques observés sont généralement hépatiques, spléniques, respiratoires, immunologiques, cardiovasculaires, neurologiques. Des modifications significatives de l’électroencéphalogramme peuvent également être notées.
Chez l'animal
Inhalation
Une hypertrophie centro-lobulaire et une augmentation du poids du foie ont été observées aux deux concentrations les plus élevées chez le rat (Sprague-Dawley) exposé 6 h/j, 7 j/sem pendant 13 semaines à 10, 100 et 1 100 ppm (soit 0, 26, 260 et 2 860 mg.m-3) (Thornton et al., 2002) au cours d’une étude sur deux générations aussi bien sur les générations F0 que F1, avec une intensité généralement plus marquée chez les femelles que chez les mâles . Chez la souris, la stéatose hépatique induite par des doses de 58, 287 et 1 434 ppm (soit 151, 746 et 3 730 mg.m-3) administrées 2 h/j, 5 j/sem pendant 16 semaines a été associée au stress oxydant caractérisé par l’augmentation du MDA (malondialdéhyde) et les baisses de GSH (glutathion réduit) et SOD (superoxyde dismutase) hépatiques, significatives dans tous les cas uniquement à la plus forte dose (p<0,05) (Wang et al., 2019).
A une plus faible dose d’environ 1 ppm (soit 2,6 mg.m-3) administrée 6 h/j, 7 j/sem pendant 12 semaines, une alimentation riche en graisse peut potentialiser les effets hépatiques chez la souris (augmentation des transaminases plasmatiques, poids du foie) (Lang et al., 2019), en particulier chez les mâles plus sensibles que les femelles (Wahlang et al., 2020).
Une atteinte rénale et une dégénérescence du myocarde sont observées chez le rat à 5 000 ppm (soit 13 000 mg.m-3) après une exposition chronique de 1 an (Feron et Kroes, 1979).
Chez le rat exposé par inhalation à des concentrations de 0 – 10 – 100 – 3 000 ppm soit 0 – 26 - -260 – 7 800 mg.m-3, 6 h/j, 6 j/semaine pendant 3, 6, 9 ou 12 mois (Bi et al., 1985), des NOAEC de 260 mg.m-3 (100 ppm) et 2,6 mg.m-3 (1 ppm) respectivement basées sur l’absence d’effet toxique au niveau du foie et des reins ont été déterminé pour une exposition de 12 mois.
Voie orale
Des études de toxicité chronique (108 semaines, 5 jours par semaine dans l’alimentation et 149 semaines dans l’alimentation) chez le rat montrent une augmentation de la mortalité chez le mâle à des doses supérieures ou égales à 5 mg.kg-1.j-1 et chez la femelle à des doses supérieures ou égales à 1,3 mg.kg-1.j-1 (Feron et al., 1981 ; Til et al., 1983 ; Til et al., 1991).
A moyen et à long terme, le foie est l'organe cible principal lors d’expositions par voie orale.
Feron et al. (1981) ont étudié chez le rat Wistar (60-80 animaux.sexe-1.lot-1) l’exposition au chlorure de vinyle par ingestion dans l’alimentation pendant 144 semaines. Les doses administrées sont 0 – 1,7 – 5,0 – 14,1 mg.kg-1.j-1. Concernant les effets non tumoraux, les auteurs ont rapporté des modifications histomorphologiques du foie y compris une nécrose hépatocellulaire à des doses supérieures ou égales à 5 mg.kg-1.j-1 chez les femelles et 14,1 mg.kg-1.j-1 chez les mâles, ainsi que des modifications de la forme, de la taille des hépatocytes et de leurs noyaux à partir de 1,4 mg.kg-1.j-1. Une augmentation relative du poids du foie est observée après 6 à 12 mois d'une exposition à 14,1 mg.kg-1.j-1. A 14,1 mg.kg-1.j-1, le temps de coagulation est diminué, cet effet n’est pas retrouvé à 5 mg.kg-1.j-1 (Feron et al., 1981).
Til et al, 1983, 1991 ont étudié la toxicité du chlorure de vinyle par voie orale chez le rat Wistar (100 animaux /sexe/lot pour le témoin et les deux doses les plus faibles, 50 animaux /sexe pour la dose la plus élevée) pendant 149 semaines. Les doses d’exposition étaient de 0 - 0,46 - 4,6 – 46 ppm (soit 0 – 1,2 – 12 et 120 mg.m-3) dans l’alimentation. La volatilité du chlorure de vinyle a contraint les auteurs à administrer le chlorure de vinyle en mélange avec des granules de PVC (pour encapsuler le chlorure de vinyle dans le PVC). La dose moyenne administrée pour les deux sexes a été évaluée, pendant les 4 heures quotidiennes de prise alimentaire, à 0 – 0,018 – 0,17 - 1,7 mg.kg-1.j-1. Après prise en compte du chlorure de vinyle excrété donc non absorbé, les doses calculées réellement absorbées sont 0 – 0,014 – 0,13 - 1,3 mg.kg-1.j-1. Des analyses macroscopiques ont été réalisées ainsi qu’une analyse histopathologique systématique du foie et de toutes les tumeurs. Concernant les lésions hépatiques une augmentation significative du polymorphisme des hépatocytes a été observée à 1,7 mg.kg-1.j-1 chez le male et la femelle. Une augmentation de l’incidence des kystes hépatiques chez la femelle a également été notée à la dose la plus élevée (1,7 mg.kg-1.j-1). La description des lésions néoplasiques est détaillée dans les effets cancérogènes.
Chez le rat, l’administration quotidienne par voie orale de 30 mg.kg-1.j-1 de chlorure de vinyle pendant 2 ans entraîne l’apparition de fibrose cutanée. Le collagène nouvellement synthétisé présente une structure modifiée par l’augmentation de liaisons croisées intra et intermoléculaires (Knight et al., 1987).
Voie cutanée
Pas de données disponibles
Synthèse
Chez l’animal, les effets pour des expositions par inhalation et par voie orale correspondent principalement à des atteintes hépatiques (poids et altérations histologiques pouvant conduire à une nécrose).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1A : le potentiel cancérogène du chlorure de vinyle est avéré pour l’homme | 2008 |
| IARC | Groupe 1 : le chlorure de vinyle est cancérigène pour l’homme. Il existe des données chez l’animal et chez l’homme démontrant le potentiel cancérigène du chlorure de vinyle. | 2012 |
| US EPA | Groupe A : le chlorure de vinyle est cancérigène pour l’homme. | 2000 |
Chez l'homme
Toutes voies
Le chlorure de vinyle est classé cancérogène avéré induisant des angiosarcomes hépatiques et des carcinomes hépatocellulaires chez l’homme (IARC, 2012).
Les trois premiers cas d’angiosarcomes chez des travailleurs exposés au chlorure de vinyle ont été signalés en 1974 (Creech et Johnson, 1974). Depuis, un grand nombre d’études épidémiologiques ont conforté la relation entre l’exposition au chlorure de vinyle et l’apparition d’angiosarcomes du foie qui est un type de cancer extrêmement rare dans la population générale (25 à 30 cas par an aux Etats-Unis, Heath Jr et al., 1975) et dont le temps de latence est très long.
Deux cohortes ont été étudiées afin de mieux comprendre la relation entre l’exposition au chlorure de vinyle et l’apparition de cancers.
La cohorte américaine a regroupé 10 173 travailleurs de 37 usines. Parmi ces usines, 11 usines (1 214 travailleurs) produisant seulement du chlorure de vinyle monomère, 18 usines (6 848 travailleurs) produisant seulement du PVC, 3 usines (935 travailleurs) produisant du PVC et du chlorure de vinyle monomère et 5 usines (1 176 travailleurs) produisant des homopolymères (Polymère issu d’une seule espèce de monomère) et des copolymères (Polymère issu de plusieurs espèces de monomères). Seuls les travailleurs hommes ont été retenus dans cette cohorte à condition qu’ils aient au moins été exposés pendant 1 an avant le 31/12/72 et qu’ils aient été employés à partir de 1942. Cette cohorte a été étudiée plusieurs fois par Barnes et al. (1976), par Cooper (1981), par Wong et al. (1991) (mise à jour des données au 31/12/89), par Mundt et al. (2000) (mise à jour des données au 31/12/95 et légère modification des critères d’entrée), et par Mundt et al. (2017) (mise à jour au 31/12/2017). Le tableau suivant récapitule les résultats de l’étude de Mundt et al. (2000) pour tout cancer.
Principaux effets cancéreux Mundt et al. (2001) :
|
Description de la cohorte |
Type de cancer |
Risque relatif (SMR) [IC95%] |
Nombre de décès |
|---|---|---|---|
|
10 109 travailleurs mâles caucasiens employés plus d’un an entre 1942 et 1972 |
Toute cause |
0,83 [0,8-0,86] |
- |
|
Néoplasmes malins |
0,96 [0,90-1,03] |
- |
|
|
Cancers du foie et des voies digestives |
3,59 [2,84-4,46] |
80 |
|
|
Cerveau et SNC |
1,42 [1,0-1,97] |
36 |
|
|
Poumons |
0,82 [0,73-0,92] |
303 |
|
|
Tissus lymphatiques et hématopoiétiques |
0,86 [0,67-1,08] |
71 |
|
|
Lymphosarcomes et réticulosarcomes |
1,20 [0,62-2,09] |
12 |
|
|
Cancer de la peau (néoplasmes malins) |
0,64 [0,33-1,12] |
12 |
Les dernières analyses de cette cohorte confirment l’augmentation de la mortalité par cancer du foie (SMR = 2,87, IC95% [2,40-3,40], avec une forte association pour les angiosarcomes (HR = 36,3, IC95%[13,1-100,5]), mais aussi après analyse des données jusqu’à 2013, pour les carcinomes hépatocellulaires (HR=5,3, IC95% [1,6-17,7] pour une dose cumulée > 865 ppm-années (2 250 mg.m-3-années) (HR : « Hasard Ratio », proche du RR (risque relatif) avec une dimension temporelle. Le HR se définit à un temps t comme le rapport entre la fonction de risque instantané au temps t chez les exposés et la fonction de risque instantané au temps t chez les non exposés). (Mundt et al., 2017). Un excès de mortalité par cancer des tumeurs conjonctives et des tissus mous (SMR=2,43, IC95% [1,48-3,75]) ainsi que par mésothéliomes (SMR=2,29, IC95%[1,18-4,00] a également été rapporté dans cette dernière analyse. En revanche, aucun excès de mortalité lié au mélanome, aux cancers du cerveau, des poumons ou aux lymphomes non Hodgkinien n’a été associé à l’exposition au chlorure de vinyle.
Une analyse complémentaire a été réalisée pour une usine de Louisville (USA), qui était incluse dans l’étude multi-cohortes publiée par Lewis et al. (2003). Historiquement, ce site est le premier où une augmentation significative des angiosarcomes hépatiques a été notée chez les travailleurs exposés au chlorure de vinyle. Cette cohorte comptait 2 200 personnes employées pendant au moins 1 an sur le site entre 1942 et 1972. Comme il est habituel dans les études de cohorte professionnelle, la mortalité (toute cause) de cette population s’est avérée inférieure à celle de la population générale du fait d’un effet de travailleur sain (903 décès contre 1 008,8 attendus, soit un SMR = 0,88 (IC non précisé)). Cependant, les décès liés au cancer sont légèrement supérieurs aux prévisions (264 décès contre 248,2 attendus soit un SMR =1,06 (IC non précisé)) et la mortalité par cancers du foie et des voies biliaires est très significativement plus élevée dans cette population que dans la population générale (24 décès contre 6 attendus SMR = 4 (IC non précisé)).
Une autre cohorte de 1 874 travailleurs employés entre 1946 et 2006 dans une usine chimique de l’Etat de New-York a permis de mettre en évidence une augmentation du nombre de décès par cancer du canal hépatobiliaire (SMR = 3,80, IC95%[1,89-6,80] parmi ceux exposés au chlorure de vinyle, en lien direct avec une durée d’exposition supérieure à 16 ans (Carreon et al., 2014). De même que dans l’étude de Mundt et al. (2017), aucun excés de mortalité par lymphomes non Hodgkinien n’a été observé chez les salariés exposés au chlorure de vinyle.
Les études réalisées sur ces cohortes ont montré que l’apparition de l’angiosarcome était étroitement liée à l’exposition au chlorure de vinyle mais pas aux autres substances. Le risque d’apparition d’un cancer du cerveau est plus important parmi les travailleurs engagés avant 1950 mais n’est pas lié à l’exposition au chlorure de vinyle.
Une cohorte multicentrique européenne, conduite dans 4 pays (Italie, Norvège, Suède et Royaume Uni) a également été étudiée. Le premier rapport de Simonato et al. (1991) l'évaluait jusqu’au 31 décembre 1986. Une mise à jour a été publiée par Ward et al. (2001) pour tenir compte des nouvelles données (jusqu’en 1997). L’étude regroupe 19 usines, dont 11 produisent du chlorure de vinyle monomère et du PVC, 2 produisent uniquement du chlorure de vinyle, 5 produisent uniquement du PVC, et une est une usine utilisant le PVC dans ses procédés. Des travailleurs (hommes) ayant été employés au moins une année entre 1942 et 1972 et exposés au chlorure de vinyle ont été inclus dans l’étude. La période d’observation a commencé en 1955. Le rapport le plus récent propose une mise à jour des informations sur la survie des travailleurs de 17 des 19 sites et des incidences de cancers de 13 sites de 3 pays. En complément de ces informations, les résultats pour la plupart des cohortes nationales ont été publiées séparément (Byrén et al., 1976 ; Fox et Collier, 1977 ; Molina et al., 1981 ; Heldaas et al., 1984 ; Heldaas et al., 1987 ; Jones et al., 1988 ; Hagmar et al., 1990 ; Pirastu et al., 1990 ; Pirastu et al., 1998 ; Langard et al., 2000).
Parmi les 12 700 hommes inclus dans la cohorte entière (Ward et al., 2001), 2 665 personnes sont décédées (21 % de l’effectif, valeur variant entre 10 et 33 % selon les pays), au moment de la mise à jour des données entre 1993 et 1997 selon les pays.
En général, l’exposition au chlorure de vinyle dans les usines étudiées était plus importante dans les premières années de l’étude (années 1950-1965) que vers les années 1976-1988.
Sur la base des données de diagnostics, 71 cas de cancers du foie ont été identifiés et utilisés dans l’analyse pour définir la latence, la durée du travail, l’exposition cumulée et l’éventuel emploi en tant que nettoyeur d’autoclaves. Sur cette même base, 37 cas d’angiosarcomes et 10 cas de carcinomes hépatocellulaires ont été confirmés. Des analyses détaillées de la latence, de la durée de l’exposition, de l’exposition cumulée ont également été réalisées. Le tableau suivant récapitule les principaux résultats de l’étude de Ward et al. (2001).
Principaux cancers d’après Ward et al. (2001) :
|
Description de la cohorte |
Type de cancer |
Risque relatif (SMR) |
Intervalle de confiance à 95% |
Nombre de décès |
|---|---|---|---|---|
|
12700 travailleurs européens sur 19 usines dans 3 pays produisant ou utilisant du PVC ou du VCM |
Mortalité Toute cause |
0,85 |
[0,82-0,88] |
- |
|
Tout cancer |
0,99 |
[0,93-1,06] |
- |
|
|
Cancers primitifs du foie |
2,40 |
[1,8-3,14] |
53 |
|
|
Cancer du cerveau |
0,93 |
[0,60-1,39] |
24 |
|
|
Cancer du poumon |
0,95 |
[0,84-1,07] |
272 |
|
|
Cancers lymphatiques et hématopoiétiques |
0,94 |
[0,72-1,21] |
62 |
|
|
Lymphomes et leucémies |
ns |
- |
- |
|
|
Mélanomes malins |
1,06 (ns) |
[0,63-1,68] |
18 |
ns : non significatif
Pirastu et al. (1990, 1998) ont rapporté, dans une étude portant sur une population de 5 946 travailleurs employés dans des usines de fabrication du chlorure de vinyle en Italie, un excès de mortalité par cancer du foie (majoritairement des angiosarcomes et quelques hépatocarcinomes). L’analyse des données n’a pas confirmé l’action cancérigène du chlorure de vinyle sur les autres organes cibles suggérés (poumons, cerveau et tissus lymphopoiëtiques). En France, une étude prospective réalisée sur une cohorte composée de 1 100 sujets exposés et 1 100 sujets non exposés, a également confirmé l’action cancérigène du chlorure de vinyle sur le foie (3 cas d’angiosarcomes) (Laplanche et al., 1992).
Ainsi l’actualisation des données épidémiologiques réalisées en milieu industriel en Europe et aux Etats-Unis depuis les 25 dernières années, présentée dans deux revues, a confirmé l’excès de risque de mortalité par cancer du foie (angiosarcomes) associé à l’exposition au chlorure de vinyle (Mundt et al., 2000 ; Ward et al., 2001).
Des méta-analyses menées aux Etats-Unis (37 usines), en Europe (19 usines), ainsi qu’à Taiwan (6 usines) ont examiné la relation dose-réponse entre le cancer du foie et l’exposition au chlorure de vinyle (Boffetta et al., 2003 ; Wong et al., 1991 ; Wong et al., 2002a ; Simonato et al., 1991). Dans ces études, l’excédent de cas d’angiosarcomes était de toute évidence lié à la durée de l’emploi et à l’intensité de l’exposition évaluée quantitativement dans l’étude de Simonato.
L’étude de Wong et al. (1991) a également rapporté un excès de cancers du cerveau qui ont été majoritairement observés dans deux usines ne fabriquant que du PVC. L’exposition au chlorure de vinyle augmente également le risque de développer des cirrhoses du foie qui est un facteur de risque connu pour le développement de carcinomes hépatocellulaires. Ainsi, le chlorure de vinyle apparait comme un facteur favorisant l’apparition d’angiosarcomes hépatiques et de carcinomes hépatocellulaires (Du et Wang, 1998 ; IARC, 2008 ; Ward et al., 2001 ; Fedeli et al., 2019 ; Fedeli et al., 2019b).
D’autres études ont montré que le chlorure de vinyle pouvait également induire des hémangiopéricytomes au niveau du foie (tumeur vasculaire proche de l’angiosarcome) (Hozo et al., 1997 ; Hozo et al., 2000), des carcinomes hépatocellulaires et des carcinomes cholangiocellulaires (Boffetta et al., 2003 ; Cheng et al., 1999 ; Du et Wang, 1998 ; Lelbach, 1996 ; Saurin et al., 1997 ; Ward et al., 2001 ; Weihrauch et al., 2000 ; Wong et al., 2002a ; Wong et al., 2003a ; Guido et al., 2016).
En conclusion, de nombreuses études épidémiologiques ont permis d’établir le lien entre l’apparition de cancers du foie (angiosarcomes et carcinomes hépatocellulaires) et une exposition prolongée au chlorure de vinyle. La relation existante entre les autres types de cancer (cancers respiratoires, du cerveau, des tissus lymphatiques ou hématopoïétiques, des mélanomes cutanés) et l’exposition au chlorure de vinyle n’est pas démontrée (Doll, 1988 ; ECETOC, 1988 ; Blair et Kazerouni, 1997 ; Storm et Rozman, 1997 ; IARC, 2012).
Synthèse
Chez l’homme, une augmentation du risque relatif des angiosarcomes hépatiques et des carcinomes hépatocellulaires est rapportée, la survenue de cancer sur d’autres sites étant incertaine.
Chez l'animal
Toutes voies
Le chlorure de vinyle administré par voie orale ou par inhalation chez le rat, la souris ou le hamster induit des angiosarcomes du foie, des néphroblastomes, des tumeurs des glandes mammaires, des poumons, des glandes de Zymbal (glandes salivaires) et des papillomes du préestomac.
Inhalation
Maltoni et al., (1981) ont étudié l’apparition de tumeurs associées à l’exposition à 1 - 5 - 10 - 25 – 50 – 100 – 150 – 200 – 250 – 500 – 2 500 – 6 000 – 10 000 – 30 000 ppm (2,6 – 13 – 26 – 65 -130 – 260 – 390 – 520 – 650 - 1 300 - 6 500 - 15 600 - 26 000 - 78 300 mg.m-3) de chlorure de vinyle, par inhalation 4 h/j, 5 j/sem. pendant 52 semaines chez le rat. Plusieurs concentrations ont été testées aux cours de plusieurs expérimentations rapportées dans la même publication. Au cours de cette étude, des souris et des hamsters ont également été exposés à 50 – 250 – 500 – 2 500 – 6 000 – 10 000 ppm (130 – 650 - 1 300 - 6 500 - 15 600 - 26 000 mg.m-3)de chlorure de vinyle, par inhalation 4 heures par jour, 5 jours par semaine pendant 30 semaines. L’apparition de tumeurs de type angiosarcomes hépatiques survient à 5 ppm (13 mg.m-3) chez le rat, à 50 ppm (130 mg.m-3) chez la souris et à 500 ppm (1 300 mg.m-3) chez le hamster.
Les travaux de Drew et al. (1983) ont montré que l'incidence tumorale consécutive à l'inhalation de chlorure de vinyle à des doses de 100 ppm (260 mg.m-3) chez le rat, 50 ppm (130 mg.m-3) chez la souris et 200 ppm (520 mg.m-3) chez le hamster) sur une période de 6 à 12 mois selon les espèces, était supérieure lorsque l'exposition débutait chez les animaux jeunes par comparaison à l'exposition des animaux à l'âge adulte. Cette observation avait auparavant été mentionnée par les travaux de Laib qui a par la suite démontré que le chlorure de vinyle radiomarqué s’incorporait 8 fois plus rapidement sur les bases puriques de l’ADN de rats âgés de 11 jours que chez les adultes (Laib et al., 1979, Laib et al., 1989).
Incidence tumorales chez les souris CD-1 exposées à 50 ppm par inhalation au chlorure de vinyle en fonction de l’âge (Drew et al., 1983) :
|
Espèce (âge en début d’exposition) |
Durée d’exposition à 130 mg.m-3 |
Incidence des hémangiosarcomes (tous les organes) |
Incidence des carcinomes pulmonaires |
Incidence des carcinomes des glandes mamaires |
|---|---|---|---|---|
|
Souris, CD-1 8 à 9 semaines |
témoin 6 mois 12 mois 18 mois |
1/71 29/67** 30/47** 20/45** |
9/71 18/67** 15/47** 11/45** |
2/71 33/67** 22/47** 22/45** |
|
Souris, CD-1 de 8 mois |
témoin 6 mois 12 mois |
1/71 11/49** 17/46** |
9/71 13/49* 9/46* |
2/71 13/49** 8/45** |
|
Souris, CD-1 de 14 mois |
témoin 6 mois 12 mois |
1/71 5/53 3/50 |
9/71 7/53 3/50 |
2/71 2/53 0/50 |
Effets significatifs : * (p<0,05) ; ** (p<0,01)
L’étude de Hong et al. (1981) a été conduite chez des rats et des souris exposés à 50, 250, ou 1 000 ppm (130, 650 ou 2 600 mg.m-3) de chlorure de vinyle 6 h/j, 5 j/sem par inhalation pendant 45 semaines maximum pour le rat et 28 semaines maximum pour la souris, suivies d’une période de surveillance post-exposition de 52 semaines. Cette étude montre une augmentation de l’incidence de certaines tumeurs (angiosarcomes hépatiques, carcinomes hépatocellulaires et nodules néoplasiques hépatiques chez le rat ; angiosarcomes hépatiques, tumeurs bronchioalvéolaires et tumeurs des glandes mammaires chez la souris) en lien avec la concentration d’exposition, cette incidence étant généralement plus élevé chez les femelles que chez les mâles.
Incidence cumulée (1, 3 et 6 mois d’exposition) des tumeurs cancéreuses observées chez la souris après une période sans exposition de 12 mois (Hong et al., 1981) :
|
Espèce
|
Dose d’exposition mg.m-3 |
Incidence des hémangiosarcomes hépatiques (M/F) |
Incidence des tumeurs broncho-alvéolaires (M/F) |
Incidence des carcinomes et adénocarcinomes des glandes mammaires |
|---|---|---|---|---|
|
Souris, CD-1
|
témoin 130 650 2 600 |
0/60 (M)/ 1/60 (F) 1/40 (M)/ 1/40 (F) 8/44* (M)/ 5/40*(F) 6/38* (M)/ 12/38* (F) |
8/60 (M)/ 8/60 (F) 12/40 (M)/ 6/40 (F) 29/44* (M)/ 23/40*(F) 27/38* (M)/ 23/38* (F) |
4/60 (F) 10/40 (F) 13/40* (F) 6/38* (F) |
* p<0,05
La sensibilité plus importante au chlorure de vinyle chez les animaux les plus jeunes, déjà décrite par l’équipe de Drew, serait liée à la formation accrue d’adduits à l’ADN (Morinello et al., 2002a).
Voie orale
Certaines des études de cancérogenèse par voie orale ont été réalisées en incorporant du chlorure de vinyle monomère à de la poudre de PVC, elle-même mélangée à l'alimentation des rats. Une étude déjà rapportée au §3.3.1 pour les effets non néoplasiques montre sur une période de deux ans, les principales lésions cancéreuses (tableau X). Une augmentation significative d’angiosarcomes hépatiques a été observée à partir d’une dose de 5 mg.kg-1.j-1 (6/56*, p<0,05) chez les mâles et 14,1 mg.kg-1.j-1 (9/57*, p<0,05) chez les femelles (Feron et al., 1981).
Principales lésions cancéreuses observées après une exposition par voie orale au chlorure de vinyle chez le rat (Feron et al., 1981) :
|
|
Incidence – dose de Chlorure de vinyle (mg.kg-1.j-1) |
|||
|---|---|---|---|---|
|
Tumeur type/sexe |
0 |
1,7 |
5,0 |
14,1 |
|
Angiosarcome du foie Male Femelle |
0/55 0/57 |
0/58 0/58 |
6/56 2/59 |
27/59 9/57 |
|
Carcinome hépatocellulaire Male Femelle |
0/55 0/57 |
1/58 4/58 |
2/56 19/59 |
8/59 29/57 |
|
Nodules néoplasiques hépatiques Male Femelle |
0/55 2/57 |
1/58 26/58 |
7/56 29/59 |
23/59 44/57 |
|
Angiosarcome pulmonaire Male Femelle |
0/55 0/57 |
0/58 0/58 |
4/56 1/59 |
19/59 5/57 |
|
Mesotheliome abdominal Male Femelle |
3/55 1/57 |
1/58 6/58 |
7/56 3/59 |
8/59 3/57 |
|
Tumeurs mammaires (adénomes, adénocarcinomes, carcinomes anaplasiques) femelle |
3/57 |
2/58 |
5/59 |
9/57 |
Sur la base d'un protocole expérimental similaire, d'autres auteurs ont administré des doses plus faibles de 0, 0,014, 0,13 et 1,3 mg.kg-1.j-1 pendant 149 semaines (valeurs tenant compte de la perte par évaporation de 20 % du produit par rapport aux doses initiales de 0,018, 0,17 et 1,7 mg.kg-1.j-1) (Til et al., 1983 ; Til et al., 1991). A la plus forte dose, des carcinomes hépatocellulaires (3/49*, p<0,05 mâles, 3/49, non significatif (NS) femelles) et des angiosarcomes hépatiques (1/49 mâles, 2/49 femelles NS) ont pu être observés. Les auteurs indiquent une NOAEL à 0,13 mg.kg-1.j-1 (0,05 ppm) pour les tumeurs hépatiques (bénignes et malignes).
D'autres auteurs ont étudié les effets cancérigènes en administrant par gavage chez le rat différentes concentrations : 0, 3,33, 16,65, ou 60 mg.kg-1.j-1 de chlorure de vinyle dissous dans l'huile d'olive, 5 jours par semaine, pendant 52 semaines (Maltoni et al., 1981). Après 136 semaines, 17/80 (p<0,05) animaux exposés à la plus forte dose (8 mâles et 9 femelles) ont développé des angiosarcomes du foie, ainsi que 10/80 (p<0,05) animaux (4 mâles et 6 femelles) exposés à la dose de 16,65 mg.kg-1.j-1, et aucun à la plus faible dose et chez les témoins. Les auteurs ont également relevé aux deux plus fortes doses des néphroblastomes, des tumeurs de la glande de Zymbal ainsi qu'un angiosarcome thymique, mais n'ont pu établir pour ces tumeurs aucune relation dose-réponse. Dans une seconde expérience similaire, destinée à mettre en évidence les effets cancérigènes du chlorure de vinyle à de faibles doses (0,003, 0,3 et 1 mg.kg-1.j-1), 1 mâle et 2 femelles ont développé un angiosarcome du foie à la plus forte dose, et 1 femelle à la dose de 0,3 mg.kg-1.j-1, statistiquement non significatif (Maltoni et al., 1984).
Synthèse
Chez l’animal, c’est un cancérigène hépatique.
Effets génotoxiques
Généralités
Les caractères mutagène et clastogène du chlorure de vinyle ont été montrés, dans les tests réalisés in vitro et in vivo chez l’homme et chez l’animal.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le chlorure a été examiné par l'Union Européenne (JOCE, 1993). Il est probable que du fait de sa classification comme cancérigène de catégorie 1 pour l’homme, il n’a pas fait l’objet d’une classification comme génotoxique. Remarque de l’INERIS : Il faut souligner que cette absence de classification ne doit pas être interprétée comme une absence d’effet. | 1993 |
Chez l'homme
Toutes voies
L’étude des lymphocytes prélevés sur des salariés exposés professionnellement au chlorure de vinyle ont montré l’augmentation significative des aberrations chromosomiques pour des expositions pouvant varier sur 8 heures de 1 à 300 ppm (2,6 à 780 mg.m-3) dans les études de Fucic et al. (1990) ; Fucic et al. (1992) ; Fucic et al. (1995), Kucerova et al. (1979) ; Sinues et al. (1991) ; Zhao et al. (1996) ; Kumar et al. (2013) ; Feng et al. (2017a) ; Anderson et Richardson (1981) ; Anderson (1999) ; Anderson (2000) ; Fleig et Thiess, (1978) ; Heath et al. (1977).
Ces observations concernent aussi bien les expositions accidentelles au chlorure de vinyle (Becker et al., 2001 ; Huttner et Nikolova, 1998 ; Huttner et al., 1998, Huttner et al., 1999) que les expositions chroniques. En effet, Garajvrhovac et al. (1990) ont constaté pour une exposition chronique (environ 15 ans), un taux élevé de micronoyaux et d’aberrations chromosomiques chez les personnes exposées par rapport aux personnes du groupe témoin. Ces modifications ont pu être corrélées à la concentration en chlorure de vinyle dans l’air et à la concentration d’acide thioglycolique excrétée dans les urines (Vaglenov et al., 1999 ; Awara et al., 1998 ; Lei et al., 2004). Il a été également montré qu’il existait une corrélation entre la sévérité des dommages causés sur l’ADN (fréquence des micronoyaux) et la durée de l’exposition au chlorure de vinyle (dose cumulée) (Ji et al., 2010 ; Jiao et al., 2012 ; Wang et al., 2010 ; Wu et al., 2013).
Cependant, il apparait que les dommages causés à l’ADN sont réparables après arrêt ou diminution de l’exposition (Hansteen et al., 1978 ; Fucic et al., 1996a ; Fucic et al., 1996b).
La mutation Ki-ras-2 a été retrouvée dans des angiosarcomes hépatiques et des carcinomes hépatocellulaires chez les travailleurs exposés à de fortes concentrations en chlorure de vinyle (Brandt-Rauf et al., 1996, Marion et al., 1991, Weihrauch et al., 2002, Weihrauch et al., 2001a ; Weihrauch et al., 2001b).
Le polymorphisme de plusieurs gènes impliqués dans le métabolisme (CYP2E1, glutathion S-transférase, aldéhyde désydrogénase), dans la réparation de l’ADN (8-oxoguanine glycosylase, 6-O-méthylguanine-ADN méthyltransférase, XRCC1 (lésions des rayonnements ionisants et UV), endonucléase APE1) et dans le contrôle du cycle cellulaire (p53, p21) ont été associés avec l’augmentation de la fréquence des micronoyaux chez les travailleurs exposés au chlorure de vinyle (ATSDR, 2016 ; Bolognesi et al., 2017).
Une corrélation entre la fréquence des micronoyaux et l’expression de micro-ARN (miR-22-3p) a été observé à partir de lymphocytes de 94 salariés exposés au chlorure de vinyle versus 53 sujets non exposés (Feng et al., 2017).
Chez l'animal
Toutes voies
Chez l’animal, plusieurs auteurs ont caractérisé le profil de mutations associées aux adduits à l’ADN formés par le chlorure de vinyle (Akasaka et al., 1997 Dosanjh et al., 1994 ; Guichard et al., 1996 ; Swenberg et al., 2000).
La caractérisation de couples éthène-nucléosides a été faite au cours de plusieurs études par inhalation chez l’animal (Bolt, 1986 ; Ciroussel et al., 1990 ; Eberle et al., 1989 ; Fedtke et al., 1990 ; Morinello et al., 2002a ; Morinello et al., 2002b ; Swenberg et al., 1992). Il existe une corrélation entre la formation d’adduits et l’âge des sujets exposés ; plus le sujet est jeune plus il tend à former des adduits, notamment dans le foie (Fedtke et al., 1990, Morinello et al., 2002a) mais pas dans le cerveau (Morinello et al., 2002b).
Parmi l’apparition de mutations propres au chlorure de vinyle, les éthénoadduits sont les plus persistants, mais aussi les moins nombreux (environ 2 %). Leur formation joue un rôle dans la cancérogénicité du chlorure de vinyle, mise en évidence dans le cadre d’études expérimentales (Albertini et al., 2003 ; Barbin, 1998 ; Barbin, 1999 ; Barbin, 2000 ; Kielhorn et al., 2000 ; Laib, 1986 ; Nivard et Vogel, 1998 ; Whysner et al., 1996) : les éthéno-adduits induisent des substitutions-mutations sur des gènes spécifiques tels que les oncogènes ras, et le gène suppresseur de tumeurs p53 (Li et al. 2006 ; 2009 ; Staib et al., 2003 ; Trivers et al., 1995 ; Guido et al., 2016).
Cette sensibilité peut conduire à des anomalies de la fonction hépatique, à des « maladies du chlorure de vinyle » et à l’apparition d’angiosarcomes hépatiques chez les travailleurs exposés au chlorure de vinyle (Antonino-Green et al., 2000 ; El Ghissassi et al., 1995, ; Huang et al., 1997).
In vitro
Organismes procaryotes
Les tests sur S.Typhimurium , E. Coli et B. Subtilis ont montré que le caractère mutagène du chlorure de vinyle est lié à l’apparition d’intermédiaires réactifs (oxyde de 2-chloroéthylène et 2-chloroacétaldéhyde) (Bartsch et al., 1976 ; Bartsch et al., 1979 ; Hussain et Ostermangolkar, 1976 ; Jacobsen et al., 1989 ; Laumbach et al., 1977 ; McCann et al., 1975 ; Rannug et al., 1976).
Le profil de mutations associées aux adduits à l’ADN formés par les métabolites réactifs du chlorure de vinyle a été étudié sur différentes lignées de cellules animales (Pandya et Moriya, 1996 ; Zhang et al., 1995 ; Zielinski et Hergenhahn, 2001).
Métabolites :
L’époxyde de chloréthylène constitue un métabolite très réactif capable de réagir sur l’ADN pour y former des adduits (Sabadie et al., 1980, Zielinski et Hergenhahn, 2001). Cet époxyde peut également, spontanément ou sous l’action d’une époxyde hydrolase, se transformer en chloroacétaldéhyde, composé réactif pouvant lui aussi former des adduits. La formation d’éthéno-adduits a en particulier été observée in vitro à partir de ces deux métabolites (Guengerich, 1992).
La toxicité de ces deux substances sur le foie est liée à leur capacité à créer des liaisons covalentes avec les protéines hépatiques (le chloroacétaldéhyde) et avec l’ADN ou l’ARN (oxyde de chloroéthylène) (Bolt, 1986 ; Guengerich et Watanabe, 1979 ; Guengerich et al.1979, 1981 ; Kappus et al., 1976 ; Watanabe et al., 1978a, 1978b).
Mécanisme d’action :
L’action toxique du chlorure de vinyle se manifeste par l’apparition d’adduits à l’ADN et/ou de liaisons covalentes avec les protéines hépatiques, formés à partir des deux substances très réactives que sont l’oxyde de chloroéthylène et le chloroacétaldéhyde (Bolt, 1986 ; Guengerich et Watanabe, 1979 ; Guengerich et al., 1979, Guengerich et al., 1981 ; Kappus et al., 1976 ; Watanabe et al., 1978a, 1978b).
Quatre-vint dix-huit pour cent des adduits formés par le chlorure de vinyle sont liés au 7-(2-oxoéthyl)guanine (OEG) qui ne semble pas avoir d’effet cancérigène (Laib, 1986 ; Swenberg et al., 1992). En revanche, la cancérogénicité du chlorure de vinyle est attribuée à la formation de 4 éthéno ADN-adduits dont les concentrations sont généralement beaucoup plus faibles que celle de l’OEG mais qui sont plus persistants. Ces substances peuvent conduire à des mutations.
Synthèse
Les caractères mutagène et clastogène du chlorure de vinyle ont été montrés, dans les tests réalisés in vitro et in vivo chez l’homme et chez l’animal. Ces propriétés conduisent à retenir une approche sans seuil pour les effets cancérogènes.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2008 |
Chez l'homme
Inhalation
Une augmentation de la fréquence et de la sévérité des cas d’hypertension ou d’œdèmes ont été mentionnées chez des femmes enceintes exposées professionnellement à des concentrations de chlorure de vinyle comprises entre 3,9 et 89,3 ppm (soit 10 et 232 mg.m-3) (Bao et al., 1988).
Les effets du chlorure de vinyle sur la fertilité de l’homme sont insuffisamment documentés (quelques études de cas) pour permettre une analyse des éventuels effets.
Synthèse
Des expositions prolongées au chlorure de vinyle peuvent provoquer des hypertensions et des œdèmes chez la femme enceinte. Les éventuels effets sur la fertilité ne sont documentés ni chez la femme, ni chez l’homme.
Chez l'animal
Inhalation
Chez la souris mâle exposée pendant 5 jours, 6 heures par jour à 30 000 ppm (78.103 g.m-3), aucune diminution de la fertilité n'a été observée (Anderson et al., 1976).
A l’inverse, plusieurs études par inhalation chez le rat suggèrent une réduction de la fertilité pour une exposition de 250 ppm (650 mg.m-3), 6 heures par jour, 5 jours par semaine pendant 11 semaines (NOAEC de 50 ppm) (Short et al., 1977) et une nécrose de l’épithélium testiculaire pour des expositions de 6 mois à 500 ppm (1 300 mg.m-3) ou 12 mois à 100 ppm (260 mg.m-3) (Sokal et al., 1980 ; Bi et al., 1985).
L’étude de Bi et al, (1985) a été menée chez le rat Wistar mâle exposé par inhalation à des concentrations de 0 – 10 – 100 – 3 000 ppm soit 0 – 26 - -260 – 7 800 mg.m-3, 6 h/j, 6 j/semaine pendant 3, 6, 9 ou 12 mois (Bi et al., 1985). Une diminution statistiquement significative du poids des testicules est observée à 6 mois à 260 mg.m-3 (NOAEC de 26 mg.m-3). Cette diminution de poids est associée à une augmentation statistiquement significative des altérations des tubules séminifères à 260 – 7 800 mg.m-3. Une relation dose-effet est déterminée pour cet effet. Il s’agit essentiellement d’une vacuolisation irrégulière des cytoplasmes avec condensation des noyaux. La fusion de plusieurs spermatides et une nécrose de l’épithélium testiculaire sont également observées.
Une étude a été menée par Shah (1998) sur deux générations de rats femelles exposées à 0, 26, 260 et 2 860 mg.m-3, 6 heures par jour, 5 jours par semaine pendant au moins 10 semaines avant l'accouplement jusqu'au 4ème jour de lactation. Aucun trouble de la fertilité n'a été détecté quelle que soit la concentration testée. Toutefois, une hypertrophie centro-lobulaire du foie et une augmentation relative du poids du foie sont notées à toutes les concentrations d'exposition et une relation concentration d'exposition-effet est observée.
Thornton et al. (2002) ont étudié la toxicité de l’exposition au chlorure de vinyle sur le développement et sur la reproduction (étude 2 générations selon la ligne OCDE 416) chez des rats Sprague-Dawley (30 par sexe et par lot) au moyen d’une exposition 10 semaines avant l’accouplement et jusqu’à 3 semaines après (pour l’étude sur la reproduction). Les concentrations d’exposition sont 0, 10, 100, 1 100 ppm (soit 0, 260 et 2 860 mg.m-3). Les paramètres du sperme des mâles des générations F0 et F1 ont également été étudiés. Aucun effet sur le nombre, la motilité et la morphologie des spermatozoïdes n’a été décrit. Les effets observés sont une augmentation du poids moyen relatif et absolu du foie pour tous les niveaux d’exposition chez les animaux des F0 et F1. Ces études ont montré que des concentrations pouvant atteindre 1 100 ppm de chlorure de vinyle n’avaient pas d’effets néfastes sur le développement embryo-fœtal et sur la reproduction. Une NOAEC de 1 100 ppm (2 860 mg.m-3) a donc été établie pour des effets sur la reproduction.
Synthèse
Chez le rat, il n’a pas été mis en évidence d’effet du chlorure de vinyle sur la reproduction. Le chlorure de vinyle altère néanmoins le poids et l’histologie des testicules et perturbe la spermatogénèse.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2008 |
Chez l'homme
Inhalation
Infante et al. (1976a,b) ont été les premiers à suggérer l’existence d’un lien entre l’exposition des parents au chlorure de vinyle et les avortements spontanés (Infante et al., 1976a ; Infante et al., 1976b). L’écart le plus important a été observé dans les couples dont le mari avait moins de 30 ans et était exposé professionnellement ; le nombre d’avortements spontanés est de 5,3 % chez les témoins et de 20 % lorsque le mari est exposé. Les résultats de cette étude ont été par la suite fortement contestés par Hatch et al. (1981) et Stallones (1987).
D’autres auteurs ont étudié l’incidence des malformations à la naissance dans le cas d’enfants nés de parents résidents à proximité d’une usine de polymérisation du chlorure de vinyle (Theriault et al., 1983). L’augmentation de l’incidence des malformations des muscles squelettiques, de l’appareil urogénital et du SNC, semble avoir été observées en même temps que les fluctuations saisonnières des émissions. Cependant, la proximité d’autres sites industriels n’a pas permis d’éliminer l’incidence d’autres substances chimiques sur les taux de malformations observées.
Les autres études menées ne permettent pas de confirmer ces éventuels effets (Bao et al., 1988 ; Huang, 1994 ; Jiangl, 1990 ; Mur et al., 1992).
Synthèse
Chez l’homme, les effets du chlorure de vinyle sur le risque d’avortements spontanés voire de malformations chez le nouveau-né de couples exposés ou de couples où le mari est exposé professionnellement demandent à être confirmés.
Chez l'animal
Inhalation
Une étude menée chez les rongeurs (rats, souris, lapin) a permis de vérifier l’impact d’une exposition par inhalation chez la femelle gestante (John et al., 1977 ; John et al., 1981). Les animaux ont été exposés 7 heures par jour du 6ème au 15ème jour de gestation à des doses de 0 - 50 - 500 ppm. Des femelles rats Sprague-Dawley, des souris CF-1 et des lapins de Nouvelle Zélande, ont été exposés à 500 ppm de chlorure de vinyle pendant 7 heures par jour lors de la période d’organogénèse (entre le 6ème et le 15ème jour de gestation). Les animaux ont été sacrifiés au 18ème jour de gestation. Le poids du foie maternel et des cornes utérines a été contrôlé. Les fœtus ont été mesurés et pesés. Leur sexe a été noté et un examen général et histopathologique a été réalisé(John et al., 1981). Dans l’étude de John et al. (1977), le même protocole a été suivi avec une exposition complémentaire des souris à une concentration de 50 ppm (130 mg.m-3). Une forte toxicité maternelle entrainant de la mortalité est observée chez les souris exposées à 500 ppm. A cette même concentration, la toxicité maternelle est également rapportée chez les rats et les lapins mais elle est plus modérée. Aucun effet maternel ni fœtal n’a été relevé pour les animaux exposés à 50 ppm en dehors d’une faible augmentation de la taille des fœtus (cet effet n’a pas été confirmé pour des expositions de 500 ppm). Ainsi, la valeur de 50 ppm a été considérée comme un NOAEC pour les effets sur le développement et sur la toxicité maternelle. La concentration de 500 ppm a été retenue comme LOAEC pour des retards d’ossification (p>0,05).
D'autres études permettent de conclure que le chlorure de vinyle est, pour des niveaux d'expositions toxiques pour la mère, embryotoxique, ou foetotoxique entraînant une augmentation du nombre d'avortements, une diminution du nombre de fœtus vivants ou un retard du développement (Mirkova et al., 1978 ; Sal'nikova et Kotsovskaya, 1980 ; Ungvary et al., 1978).
Par ailleurs, aucun effet sur le développement n’a été observé à partir de l’étude de reproduction sur deux générations chez le rat, jusqu’à la plus forte concentration testée de 1 100 ppm (2 860 mg.m-3) (NOAEC) Thornton et al., (2002).
Synthèse
Chez l’animal, des effets fœtotoxiques et/ou des retards sur le développement sont visibles uniquement en présence de toxicité maternelle.
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance dangereuse et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes dont la notoriété internationale est variable.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation
L'ATSDR propose un MRL de 1,3 mg.m-3 (0,5 ppm) pour une exposition aiguë au chlorure de vinyle par inhalation (2006).
Cette valeur a été établie à partir de deux études sur le développement chez la souris exposée par inhalation à 0 - 50 - 500 ppm (0 – 130 – 1 300 mg.m-3) de chlorure de vinyle, 7 heures par jour du 6ème au 15ème jour de gestation (John et al., 1977 ; John et al., 1981). Les effets critiques retenus portent sur le développement et la toxicité maternelle. En l’absence d’effet, la concentration de 50 ppm (130 mg.m-3) a été considérée comme une NOAEC.
Du fait d’une exposition discontinue des animaux (7 heures par jour), un ajustement de la NOAEC, de 50 ppm (130 mg.m-3), a été réalisé :
NOAECadj = NOAEC x 7 h/24 h = 50 ppm x 7 h /24 h = 15 ppm (39 mg.m-3).
Puis la concentration équivalente chez l’homme a été calculée. A défaut de valeur mesurée pour le ratio des coefficients de partage sang –air pour la souris et pour l’homme, la valeur de 1 a été utilisée : NOAECHEC = NOAECADJ
Facteurs d'incertitude : un facteur d'incertitude de 30 a été retenu (3 pour l'extrapolation de l'animal à l'homme et 10 pour la variabilité au sein de la population).
MRLaiguë = NOAECHEC / facteurs d’incertitude
Calcul : MRLaiguë = 15 ppm / 30 = 0,5 ppm soit 1,3 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice.
L'OEHHA propose un REL de 180 mg.m-3 (72 ppm) pour une exposition aiguë de 1 heure au chlorure de vinyle par inhalation (2008).
Cette valeur a été établie à partir de l’étude de Baretta et al. (1969), chez des volontaires sains. Les concentrations testées étaient 59, 261, 491 ou 493 ppm (150, 680, 1 280 mg.m-3) de chlorure de vinyle pendant 7,5 heures (à l’exclusion de la ½ heure de repas). L’effet critique retenu est la sécheresse des yeux et du nez ainsi que des céphalées. A partir des effets observés sur les sujets exposés, l’OEHHA a retenu une NOAEC de 261 ppm (680 mg.m-3) pour 7,5 heures d’exposition et une LOAEC de 491 ppm ou 493 ppm (1 280 mg.m-3) pour une exposition variant de 3,5 à 7,5 heures.
Une extrapolation de cette valeur pour une exposition de 1 heure a été réalisée à partir de la loi de Haber en considérant que n = 2 :
Cn x T = dose où C = la concentration, n = la constante de Haber et T = la durée d’exposition
[NOAECadj]² x 1 heure = [261 ppm]² x 7,5 heures
NOAECadj = 715 ppm.
Facteurs d'incertitude : un facteur d'incertitude de 10 est retenu (pour la variabilité au sein de la population).
REL = NOAECADJ / facteurs d’incertitude
Calcul : RfCaiguë = 715 ppm / 10 = 72 ppm
Indice de confiance : cet organisme n’accorde pas d’indice
Le TCEQ propose un ReV de 68 mg.m-3 (26 ppm) pour une exposition aiguë de 1 heure au chlorure de vinyle par inhalation (2009).
Cette valeur a été établie à partir de l’étude de Baretta et al. (1969), également retenue par l’OEHHA. Le TCEQ a retenu le même effet critique, sécheresse des yeux et du nez ainsi que des céphalées, et la même valeur de 261 ppm pour 7,5 heures d’exposition, comme POD (point de départ) au calcul de la VTR.
Aucun ajustement sur la durée d’exposition n’a été réalisé en raison de l’absence d’éléments permettant de considérer que l’effet critique observé était dépendant de la concentration et de la durée d’exposition. La valeur étant issue de données humaines, aucun ajustement n’a été utilisé. Le TCEQ a construit sa valeur à partir :
PODHEC = 261 ppm
Facteurs d'incertitude : un facteur d'incertitude de 10 est retenu (pour la variabilité au sein de la population).
ReV = PODHEC / facteurs d’incertitude
Calcul : ReVaiguë = 261 ppm / 10 = 26 ppm (68 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par inhalation:
L'ATSDR propose un MRL de 7,8.10-2 mg.m-3 (0,03 ppm) pour une exposition subchronique au chlorure de vinyle par inhalation (2006)
Cette valeur a été établie à partir d’une étude sur deux générations (Thornton et al., 2002). chez des rats mâles et femelles exposés par inhalation au chlorure de vinyle à des concentrations de 0, 10, 100 et 1100 ppm (0, 26, 260, 2 860 mg.m-3), 6 h/j pendant 10 semaines avant l’accouplement, puis 3 semaines pendant la période d’accouplement. Les femelles sont ensuite exposées au cours des périodes de gestation et de lactation. L’effet critique retenu est l’effet hépatique (apparition d’altérations hépatocellulaires pré-néoplasiques). Le MRL est dérivé d'une LEC10 (LEC10 : « low exposure concentration » induisant 10 % d’effet)(modélisation de Weibull à partir d’une Benchmark concentration) de 5 ppm.
Du fait d’une exposition discontinue des animaux (6 heures par jour), un ajustement de la valeur de LEC10 de 5 ppm a été nécessaire :
LEC10 adj = LEC10 x 6 h/24 h = 5 ppm x 6 h /24 h = 1,25 ppm (arrondi à 1 ppm).
Puis le calcul d’une concentration équivalente pour l’homme a été réalisé. A défaut de valeur mesurée pour le ratio des coefficients de partage sang–air pour le rat et pour l’homme, la valeur de 1 a été utilisée : LEC10 HEC = LEC10 ADJ
Facteurs d'incertitude : un facteur de 30 est appliqué (3 pour l'extrapolation de l'animal à l'homme et 10 pour la variabilité au sein de la population).
MRLsubchronique = LEC10 HEC / facteurs d’incertitude
Calcul : MRLsubchronique = 1 ppm / 30 = 0,03 ppm soit 7,8.10-2 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par inhalation:
L’US EPA (IRIS) propose une RfC de 0,1 mg.m-3 (0,038 ppm) pour une exposition chronique au chlorure de vinyle par inhalation (2000).
Cette valeur a été établie à partir des données obtenues pour une exposition chronique à 0 – 0,014 – 0,13 - 1,3 mg.kg-1.j-1 de chlorure de vinyle par voie orale chez le rat (Til et al., 1983 ; Til et al., 1991). Le NOAEL (0,13 mg.kg-1.j-1) obtenu dans cette étude sur la base d’un dysfonctionnement hépatique (augmentation significative du polymorphisme des hépatocytes et kystes observée à la dose juste supérieure chez les mâles et/ou les femelles) a été converti en une concentration sans effet observable équivalente chez l’homme NOAECHEC de 2,5 mg.m-3 grâce à l’utilisation du modèle PBPK de Clewell (1995).
Facteurs d'incertitude : un facteur de 30 est appliqué (3 pour l'extrapolation de l'animal à l'homme et 10 pour la variabilité de sensibilité au sein de la population).
Calcul : RfCchronique = 2,5 mg.m-3 / 30 = 0,0833 mg.m-3 arrondi à 0,1 mg.m-3
Indice de confiance : L’indice de confiance dans l’étude source est élevé, il est moyen à élevé pour l’ensemble de la base de données et est moyen pour la VTR élaborée.
Le TCEQ propose un ReV de 6.10-2 mg.m-3 (0,023 ppm) pour une exposition chronique au chlorure de vinyle par inhalation (2023)
Cette valeur a été établie à partir de l’étude sur deux générations (Thornton et al., 2002) retenue par l’ATSDR pour la construction de la MRL subchronique. L’effet critique retenu est l’effet hépatique (hypertrophie centro-lobulaire des femelles F1). La valeur est dérivée d'une BMCL10 (modélisation multi-étapes à partir d’une Benchmark concentration) de 2,72 ppm.
Du fait d’une exposition discontinue des animaux (6 h/j), un ajustement de la valeur de BMCL10 de 2,72 ppm a été nécessaire :
BMCL10 adj = BMCL10 x 6 h/24 h x 7j/7j= 2,72 ppm x 6 h /24 h = 0,680 ppm.
Le calcul d’une concentration équivalente pour l’homme a ensuite été réalisé. Dans la mesure où le ratio animal/homme du coefficient de partage sang–air est supérieur à 1 (2,4/1,16 = 2,1), la valeur de 1 a été retenue par défaut d’après les recommandations du guide TCEQ-ESL (Effects Screening Level) de 2006 : BMCL 10 HEC = BMCL10 ADJ (TECQ, 2006).
Facteurs d'incertitude : un facteur de 30 est appliqué (3 pour la variabilité entre les espèces et 10 pour la variabilité au sein de la population).
Calcul : ReVchronique = ReVchronique = BMLC10 HEC / facteurs d’incertitude = 0,680 ppm / 30 = 22,7 ppb arrondi à 23 ppb soit 60 µg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition chronique par voie orale:
L'ATSDR propose un MRL de 3.10-3 mg.kg-1.j-1 pour une exposition chronique au chlorure de vinyle par voie orale (2006).
Cette valeur a été établie à partir d’études de toxicité chronique et de cancérogenèse (Til et al., 1983 ; Til et al., 1991) chez des rats mâles et femelles exposés à 0 – 0,018 – 0,17 – 1,7 mg.kg-1.j-1 de chlorure de vinyle par voie orale via la nourriture selon que l’on tienne compte ou pas des résidus retrouvés dans les féces. L’effet critique retenu a été l’effet hépatique (l'augmentation de l'incidence du polymorphisme des cellules du foie chez le rat mâle et femelle) à 1,7 mg.kg-1.j-1. Un NOAEL de 0,17 mg.kg-1.j-1 correspondant à la dose moyenne ingérée a été retenu pour cet effet.
Un ajustement du NOAEL établi chez le rat a été réalisé grâce au modèle PBPK décrit par Clewell et al. (2001) afin de déterminer une dose équivalente chez l’homme (HED). La valeur NOAELHED obtenue est égale à 0,09 mg.kg-1.j-1.
Facteurs d'incertitude : un facteur d'incertitude de 30 est appliqué (3 pour l'extrapolation de l'animal à l'homme, 10 pour la variabilité au sein de la population).
Calcul : NOAELHED / 30 = 0,09 mg.kg-1.j-1 / 30 = 0,003 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
L’US EPA (IRIS) (2000) propose une RfD de 3.10-3 mg.kg-1.j-1 pour une exposition chronique au chlorure de vinyle par voie orale.
Cette valeur est définie à partir des mêmes études (2 ans) chez le rat que celles utilisées par l’ATSDR ce qui correspond à une dose moyenne ingérée de 0 – 0,014 – 0,13 – 1,3 mg.kg-1.j-1 pour tenir compte de l’absorption réelle (Til et al., 1983 ; Til et al., 1991). Dans ces études, le chlorure de vinyle a été incorporé dans la nourriture à raison de 1 % de poudre de PVC et d’une quantité variable de chlorure de vinyle monomère pour une administration par voie orale. Un NOAEL de 0,13 mg.kg-1.j-1 a été estimé pour la formation de nodules hépatiques (effet non cancérigène).
Un ajustement de cette valeur a été réalisé grâce au modèle PBPK décrit par Clewell et al. (1995). Ce calcul a permis d’extrapoler la valeur mesurée, à l’homme (HED). La valeur NOAELHED obtenue est égale à 0,09 mg.kg-1.j-1
Facteurs d'incertitude : un facteur de 30 a été appliqué (3 pour l’extrapolation de l’animal à l’homme, 10 pour la variabilité au sein de la population)
RfDchronique = NOAELHED / facteurs d’incertitude
Soit RfDchronique = 0,09 mg.kg-1.j-1 / 30 = 0,003 mg.kg-1.j-1
Indice de confiance : L’indice de confiance, donnée par l’US EPA, dans l’étude source est élevé, il est moyen à élevé dans la base de données et est moyen pour la VTR élaborée.
Effets sans seuil - Exposition chronique par inhalation:
L’Anses propose une valeur de 0,0038 (mg.m-3)-1 soit 3,8.10-6 (µg.m-3)-1 pour une exposition chronique au chlorure de vinyle par inhalation (Anses, 2012).
Il a été jugé plus opportun de retenir comme étude source une étude expérimentale du fait de la mauvaise caractérisation des expositions dans les études épidémiologiques.
Cette valeur a donc été établie à partir d’une étude expérimentale chez des rats et des souris exposés respectivement pendant 45 et 28 semaines maximum (Hong et al., 1981). Chez le rat, cette étude montre une augmentation du taux d’incidence de certaines tumeurs (angiosarcomes hépatiques, carcinomes hépatocellulaires et nodules néoplasiques) en lien avec la dose d’exposition. Chez la souris, cette étude montre une augmentation du taux d’incidence des angiosarcomes hépatiques, des tumeurs hépatocellulaires et des tumeurs bronchioalvéolaires en lien avec la dose d’exposition.
Relation dose réponse étude de Hong et al., (1981) sur la base des tumeurs hépatiques chez les souris mâles (exposition de 6 mois suivi d’une période sans exposition de 12 mois)
|
Tumeurs hépatiques |
Concentration d’exposition ppm (mg.m-3) |
|||
|---|---|---|---|---|
|
|
0 |
50 (130) |
250 (650) |
1 000 (2 600) |
|
Angiosarcomes |
0/28 |
0/8 |
7/12 |
5/12 |
|
Carcinomes hépatocellulaires |
4/28 |
1/8 |
0/12 |
1/12 |
|
Cumul des angiosarcomes, carcinomes hépatocellulaires |
4/28 |
1/8 |
7/12 |
6/12 |
Une relation dose-réponse statistiquement significative entre l’augmentation des angiosarcomes, et des carcinomes hépatocellulaires et la concentration journalière d’exposition au chlorure de vinyle a été établie. Cette étude a été retenue car les résultats étaient les mieux adaptés pour l’établissement d’une benchmark concentration. Les BMC les plus faibles sont déterminées à partir des résultats obtenus chez les souris mâles ; ces dernières ont donc été retenues.
Le modèle logistic a été retenu pour l’estimation de la limite inférieure de l’intervalle de confiance à 95 % d’une dose correspondant à une augmentation de 10 % de la réponse par rapport au groupe non exposé.
Un niveau de réponse de 10 % a été retenu, car le seuil de 10 % (augmentation de l’incidence des angiosarcomes et des carcinomes hépatocellulaires) est généralement retenu dans les études de cancérogénèse. La BMC10% est égale à 78,8 ppm, la BMC10%L95% à 33 ppm.
Un facteur de conversion de 2,6 a été pris en compte pour passer d’une concentration en ppm à une concentration en mg.m-3. Un ajustement temporel a été réalisé afin d’extrapoler à une exposition continue des animaux au chlorure de vinyle à partir de l’étude conduite chez des animaux exposés 5j/semaine pendant 6h/j, et sur 6 mois au lieu de 24 mois, ce qui correspond à l’application d’un facteur de pondération égal à (6/24)*(5/7)*(6/24).
De même que précédemment, la dose externe d’exposition chez l’animal est convertie en une dose interne à l’aide d’un modèle PBPK développé par l’US EPA. La dose d’exposition externe chez l’Homme requise pour produire une quantité équivalente de métabolites au niveau du foie est alors calculée.
Ainsi, pour une concentration critique calculée chez le rat (BMC10%L95% = 33 ppm), la dose interne associée serait de 28 mg.L-1 chez l’homme, ce qui correspond à une concentration d’exposition journalière de l’homme de 10 ppm, soit 26 mg.m-3.
La pente ou l’excès de risque unitaire se calcule suivant la formule :
Pente = BMR/BMC10%L95% HED
Pour un BMR de 10%, cela revient à un excès de risque unitaire de 0,1/26 soit 0,0038 (mg.m-3)-1 soit 3,8 (µg.m-3)-1.
L’US EPA (IRIS) propose deux valeurs d’excès de risque unitaire par inhalation (ERUi) de 4,4.10-6 (µg.m-3)-1 pour une exposition durant la vie d’un adulte et 8,8.10-6 (µg.m-3)-1 pour une exposition vie entière au chlorure de vinyle par inhalation (US EPA, 2000).
La valeur correspondant à une exposition au cours de la vie d’un adulte a été calculée à partir de l’étude de cancérogenèse chez le rat exposé à 1 - 5 - 10 - 25 – 50 – 100 – 150 – 200 – 250 – 500 – 2 500 – 6 000 – 10 000 – 30 000 ppm soit (2,6 – 13 – 26 – 65 -130 – 260 – 390 – 520 – 650 - 1 300 - 6 500 - 15 600 - 26 000 - 78 300 mg.m-3) de chlorure de vinyle par inhalation pendant 52 semaines (Maltoni et al., 1981 ; Maltoni et al., 1984). Une augmentation de l’incidence de tumeurs hépatocellulaires (angiosarcomes, hépatocarcinomes, hémangiomes, nodules néoplasiques) a été identifiée chez des rats femelles.
Incidence de tumeurs hépatocellulaires (Maltoni et al., 1981 ; Maltoni et al., 1984)
|
Administrée (ppm) |
Equivalent chez l’homme (ppm) |
|
|---|---|---|
|
Concentration |
Incidence des tumeurs |
|
|
0 1 5 10 25 50 100 150 200 250 500 2 500 6 000 |
0 0,59 2,96 5,90 14,61 31,27 55,95 76,67 90,00 103,45 116,94 134,37 143,72 |
0/141 0/55 0/47 1/46 5/40 1/29 1/43 5/46 10/44 3/26 11/28 10/24 13/25 |
La modélisation des données a utilisé un modèle multiétape linéarisé. La concentration équivalente chez homme a été dérivée avec un modèle PBPK (Clewell et al., 1995), utilisant la quantité de métabolites générés par jour et divisée par le volume des tissus dans lesquels ces métabolites ont été produits. Le facteur équivalent chez l’homme a été calculé pour une exposition continue chez l’homme dont l’exposition a commencé à l’âge adulte.
Un excès de risque de 4,4.10-6 (µg.m-3)-1 a été calculé pour tenir compte d’une exposition continue, en considérant que l’exposition a débuté à l’âge adulte.
Afin de tenir compte de l’hypersensibilité au chlorure de vinyle des jeunes populations, l’US EPA a recommandé un ajustement de sa valeur d’excès de risque unitaire pour des expositions précoces (US-EPA, 2000 ; Ginsberg, 2003). L’US-EPA différencie un excès de risque de cancer pour une exposition lors de la vie adulte, d’un excès de risque de cancer vie entière (durée d’exposition plus longue et plus grande sensibilité des enfants). En effet, malgré l’absence de données humaines, l’US EPA considère que les facteurs responsables de cette sensibilité chez les jeunes animaux (augmentation de la division cellulaire, de la respiration, du flux sanguin hépatique) sont parfaitement transposables chez les jeunes enfants. Il convient donc pour la vie entière de doubler la valeur et de proposer un ERUi de 8,8 10-6 (µg.m-3)-1.
Dans tous les cas, selon les recommandations de l’US EPA, les risques unitaires ne devraient pas être utilisés si la concentration dans l’air dépasse 104 µg.m-3 soit 3,85 ppm (non approprié).
Santé Canada propose deux valeurs d’excès de risque unitaire par inhalation (ERUi) de 4,4.10-6 (µg.m-3)-1 pour une exposition durant la vie d’un adulte et 8,8.10-6 (µg.m-3)-1 pour une exposition vie entière au chlorure de vinyle par inhalation (Santé Canada, 2021).
Ces valeurs sont établies à partir de l’étude de Maltoni et al., (1981) ; Maltoni et al., (1984) selon le même raisonnement et les mêmes calculs que ceux rapportés par US EPA (2000).
Santé Canada suit également les recommandations de l’US EPA, qui précise que les risques unitaires ne devraient pas être utilisés si la concentration dans l’air dépasse 104 µg.m-3 soit 3,85 ppm (non approprié).
Le RIVM propose un CRinhal de 3,6.10-3 mg.m-3 pour une exposition chronique au chlorure de vinyle par inhalation (Baars et al., 2001).
Cette valeur a été calculée à partir de l’étude de Maltoni et al. (1981) ; Maltoni et al. (1984), qui a observé une augmentation de l’incidence de tumeurs hépatocellulaires (angiosarcomes, hépatocarcinomes, hémangiomes, nodules néoplasiques) chez des rats femelles exposées par inhalation durant 52 semaines au chlorure de vinyle. Elle correspond à un excès de risque cancérigène de 1.10-4 pour une exposition vie entière par inhalation soit un ERUi de 0,28 (mg.m-3)-1 soit 0,28.10-3 (µg.m-3)-1.
L'OEHHA propose un ERUi de 7,8.10-5 (µg.m-3)-1 exposition chronique au chlorure de vinyle par inhalation (2002).
Cette valeur a été calculée à partir des résultats d'une étude épidémiologique chez des travailleurs exposés au chlorure de vinyle (Waxweiler et al., 1976) et de trois études de cancérogénèse expérimentale chez l'animal (Bi et al., 1985 ; Drew et al., 1983 ; Maltoni et al., 1984 ).
Le TCEQ propose deux valeurs d’excès de risque unitaire par inhalation (ERUi) de 4,2.10-6 (µg.m-3)-1 pour une exposition durant la vie d’un adulte et 8,4.10-6 (µg.m-3)-1 pour une exposition vie entière au chlorure de vinyle par inhalation (TCEQ, 2023).
La démarche du TECQ, très proche de celle suivie par l’US EPA (2000), a été calculée à partir de l’étude de cancérogenèse chez le rat exposé au chlorure de vinyle par inhalation pendant 52 semaines (Maltoni et al., 1981 ; Maltoni et al., 1984). Une augmentation de l’incidence de tumeurs hépatocellulaires (angiosarcomes, hépatocarcinomes, hémangiomes, nodules néoplasiques) a été identifiée chez des rats femelles (voir tableau d’incidence de tumeurs hépatocellulaires mentionné ci-dessus).
Le TCEQ a appliqué une extrapolation linéaire à partir de la LED10 (borne inférieure à l’IC à 95 % associé à une dose relative à un excès de risque de cancer de 10 %).
Un excès de risque de 4,2.10-6 (µg.m-3)-1 a été calculé pour tenir compte d’une exposition continue, en considérant que l’exposition a débuté à l’âge adulte. Tout comme l’US EPA, le TCEQ tient compte de sensibilité particulière au chlorure de vinyle des jeunes populations en doublant la valeur calculée à l’âge adulte et de proposer un ERUi de 8,4.10-6 (µg.m-3)-1.
Effets sans seuil - Exposition chronique par voie orale:
L’US EPA (IRIS) propose un excès de risque unitaire par voie orale (ERUo) de 7,2.10-1 (mg.kg-1.j-1)-1 pour une exposition au chlorure de vinyle durant la vie adulte et ERUo de 1,4 (mg.kg-1.j-1)-1 pour une exposition durant la vie entière (2000).
Ces valeurs ont été calculées à partir de l’étude de Feron et al. (1981) au cours de la quelle des rats ont été exposés à 0 – 1,7 – 5,0 - 14,1 mg.kg-1.j-1 de chlorure de vinyle pendant 2 ans. Cette étude a mis en évidence l’augmentation de l’incidence des tumeurs hépatiques (angiosarcomes, hépatocarcinomes, nodules néoplasiques) chez des rats Wistar femelles, exposés par voie orale au chlorure de vinyle monomère incorporé à de la poudre de PVC.
Incidence des tumeurs hépatiques chez les femelles (Feron et al., 1981)
|
Dose |
Incidence des tumeurs |
|
|---|---|---|
|
Administrée (mg.kg-1.j-1) |
Equivalent chez l’homme (mg.kg-1.j-1) |
|
|
0 1,7 5,0 14,1 |
0 1,07 3,13 8,77 |
2/57 28/58 49/59 56/57 |
La méthode d’élaboration des valeurs pour les expositions par voie orale est la même que pour des expositions par inhalation. Une modélisation des données a été menée par un modèle multiétape linéarisé. Puis, une dose équivalente chez l’homme a été calculée avec un modèle PBPK pour une exposition continue en prenant en compte les ajustements nécessaires.
Pour des raisons identiques à celles évoquées pour l’ERU par inhalation, l’US EPA a différencié le risque d’excès de cancer par voie orale pour une personne exposée sa vie durant à partir de l’âge adulte, de celui d’une personne exposée sa vie durant dès son enfance.
Selon les recommandations de l’US EPA, le risque unitaire ne devrait pas être utilisé si la concentration dans l’eau dépasse 105 µg.L-1 (non approprié).
Pour des expositions uniquement par l’eau, l’US EPA (IRIS) propose un ERUeau de 2,1.10-5 (µg.L-1)-1 pour une exposition durant la vie d’un adulte et de 4,2.10-5 (µg.L)-1 pour une exposition vie entière (2000).
Santé Canada propose un excès de risque unitaire par voie orale (ERUo) de 2,4.10-1 (mg.kg-1.j-1)-1 pour une exposition au chlorure de vinyle durant la vie adulte et ERUo de 4,8 (mg.kg-1.j-1)-1 pour une exposition durant la vie entière (Santé Canada, 2021).
Ces valeurs ont été calculées à partir de l’étude de Feron et al. (1981) au cours de laquelle des rats ont été exposés à 0 – 1,7 – 5,0 - 14,1 mg.kg-1.j-1 de chlorure de vinyle pendant 2 ans. Cette étude a mis en évidence l’augmentation de l’incidence des tumeurs hépatiques (angiosarcomes, hépatocarcinomes, nodules néoplasiques) chez des rats Wistar femelles, exposés par voie orale au chlorure de vinyle monomère incorporé à de la poudre de PVC.
Les doses externes ont été converties en doses internes en utilisant un modèle PBPK pour le rat. Ces doses internes correspondant aux cancers combinés (angiosarcomes du foie, hépatocarcinomes, et nodules néoplasiques) ont ensuite été analysées à l’aide du modèle multiétapes du cancer du logicil BMDS (US EPA, 2010), dans le but d’établir le point de départ, puis converti en dose externe à partir d’un modèle PBPK pour l’humain. Un facteur de pente correspondant à un ERUo de 2,4.10-1 (mg.kg-1.j-1)-1 a été retenue par Santé Canada.
Etant donné les preuves de sensibilité au chlorure de vinyle chez les animaux au début de leur vie, un facteur de 2 a été appliqué à l’ERUo de 2,4 10-1 (mg.kg-1.j-1)-1 pour l’exposition à l’âge adulte, pour tenir compte de l’exposition continue vie entière depuis la naissance, ce qui correspond à un ERUo de 4,8.10-1 (mg.kg-1.j-1)-1. Santé Canada précise que sa démarche adoptée pour protéger les jeunes enfants susceptibles d’être exposés au chlorure de vinyle dès la naissance concorde avec celle de l’US EPA (2000).
Aucunes des données quantitatives relatives aux différentes étapes dans la contsruction de l’ERUo ne sont détaillées par Santé Canada.
Le RIVM propose un CRoral de 6.10-4 mg.kg-1.j-1 pour une exposition chronique au chlorure de vinyle par voie orale (Baars et al., 2001).
Cette valeur est issue de l’étude de cancérogénèse chez le rat exposé par voie orale au chlorure de vinyle durant 149 semaines (Til et al., 1991). Un modèle d’extrapolation non linéaire a été appliqué qui conduit à un excès de risque de 1 :10-6 pour une exposition par voie orale à 0,4 µg par personne et par jour sur la base de l’augmentation de l’incidence des carcinomes hépatocellulaires, des angiosarcomes et des nodules néoplasiques. Ceci est équivalent à 6.10-4 mg.kg-1.j-1 pour un excès de risque cancérigène de 1:10-4 pour une exposition vie entière par voie orale ce qui correspond à un ERUo de 0,17 (mg.kg-1.j-1)-1.
Incidence des tumeurs dans l’étude de Til et al., 1971
|
Espèce, exposition |
Dose (mg.kg-1.j-1) |
Incidence des tumeurs |
Référence |
|---|---|---|---|
|
Rat, oral (149/149 sem) |
0 1,3* |
1/197 22/98 |
Til et al., 1991 |
* Dose tumorigène la plus faible
L’OEHHA propose un ERUo de 2,7.10 -1 (mg.kg-1.j-1)-1 pour une exposition au chlorure de vinyle par voie orale (OEHHA, 2011).
Cette valeur est dérivée par une extrapolation voie à voie non décrite à partir de l’ERUi.
L’Anses propose une valeur de 0,625 (mg.kg-1j-1)-1 pour des expositions chroniques au chlorure de vinyle par voie orale (Anses, 2012).
Cette valeur est basée sur une étude expérimentale qui a été jugée plus pertinente que les études épidémiologiques du fait de difficultés de caractérisation des niveaux d’exposition dans les études épidémiologiques et par conséquence de l’établissement d’une relation dose-effet. L’étude expérimentale retenue est celle de Feron et al. (1981) chez le rat Wistar exposé au chlorure de vinyle sous forme de poudre de PVC par voie orale via l’alimentation pendant 135 et 144 semaines respectivement pour les mâles et les femelles. Aux doses d’exposition de 1,7 - 5,0 - 14,1 mg.kg-1.j-1, des relations dose-réponse sont observées pour les tumeurs hépatiques : angiosarcomes, carcinomes hépatocellulaires et nodules néoplasiques, et pour les angiosarcomes pulmonaires. Le tableau ci-dessous présente les tumeurs hépatiques chez les femelles.
Relation dose réponse étude de Feron et al. (1981) sur la base des tumeurs hépatiques chez les rats femelles
|
Effets : Tumeurs hépatiques |
Doses journalières d’exposition (mg.kg-1.j-1) |
|||
|---|---|---|---|---|
|
|
0 |
1,7 |
5 |
14,1 |
|
Angiosarcomes |
0/57 |
0/58 |
2/59 |
9/57 |
|
Carcinomes hépatocellulaires |
0/57 |
4/58 |
19/59 |
29/57 |
|
Nodules néoplasiques |
2/57 |
26/58 |
39/59 |
44/57 |
|
Cumul des angiosarcomes, carcinomes hépatocellulaires et nodules néoplasiques |
2/57 |
28/58 |
49/59 |
56/57 |
Cette étude classée 2 (valide avec restriction selon Klimisch, 1997) dans le document de l’OCDE (OCDE SIDS, 2001) est également retenue comme étude critique par l’US EPA et l’OMS (OCDE SIDS, 2001) et est également retenue comme étude critique par l’US EPA, le RIVM et l’OMS pour construction de la VTR par ingestion.
Les données disponibles ont été modélisées pour l’établissement d’une benchmark dose.
Le modèle gamma a été retenu pour l’estimation de la limite inférieure de l’intervalle de confiance à 95 % d’une dose correspondant à une augmentation de 10 % de la réponse (augmentation de l’incidence des angiosarcomes, des carcinomes hépatocellulaires et des nodules néoplasiques) par rapport au groupe non exposé chez les femelles. Un niveau de réponse à 10 % a été retenu, car le seuil de 10 % est généralement retenu dans les études de cancérogénèse.
Plusieurs modélisations ont été réalisées, la plus faible BMD déterminée à partir des tumeurs hépatiques observées chez les rats femelles est retenue comme POD pour la construction de la VTR.
La BMD10% est égale à 0,31 mg.kg-1.j-1, la BMD10%L95% à 0,26 mg.kg-1.j-1.
La dose externe d’exposition chez l’animal a été convertie en une dose interne à l’aide d’un modèle PBPK humain développé par l’US EPA. La dose d’exposition externe chez l’Homme requise pour produire une quantité équivalente de métabolites au niveau du foie a été calculée. Ainsi pour une dose critique calculée chez l’animal (BMD10%L95% = 0,26 mg.kg-1.j-1), la dose interne associée serait de 5,9 mg.L-1 (quantité équivalente de métabolites au niveau du foie) chez l’homme, ce qui correspondrait chez l’homme à une exposition journalière de 0,16 mg.kg-1.j-1 chez l’homme.
La pente a été calculée Pente = BMR/BMD10%L95%
Le BMR étant de 10 %, cela conduit à un excès de risque unitaire de 0,1/0,16 soit 0,625 (mg.kg-1.j-1)-1.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’INERIS propose de retenir la valeur de 1,3 mg.m-3 pour une exposition aiguë par inhalation au chlorure de vinyle (ATSDR, 2006).
Trois valeurs sont proposées pour des expositions aiguës par inhalation (ATSDR, 2006 ; OEHHA, 2008 ; TCEQ, 2009).
La valeur de l’ATSDR a été établie à partir de l’étude de développement (John et al., 1977) et John et al., 1981) chez la souris exposée par inhalation au chlorure de vinyle. Cette étude est de bonne qualité. La valeur de l’OEHHA et celle du TCEQ ont été établies à partir d’une étude réalisée sur des volontaires sains (Baretta et al., 1969). Cette publication, de 1969 présente un certain nombre de limites : faible échantillon (13 hommes), l’effet critique est basé sur des symptômes subjectifs (maux de tête, sécheresse oculaire et nasale), des incertitudes métrologiques (mesures intermittentes de l’air expiré), et une absence de données statistiques.
Les effets sur la toxicité maternelle et sur le développement retenus comme effet critique par l’ATSDR, avec une NOAEC de 50 ppm (130 mg.m-3) en l’absence d’effet, ciblant notamment une période sensible de l’exposition du fœtus et de la femmelle gestante, parraissent plus pertinents que les symptômes subjectifs retenus par l’OEHHA et le TCEQ.
L’ATSDR a pratiqué un ajustement au temps ainsi que le calcul d’une concentration équivalente. La démarche est claire et argumentée. L’OEHHA a pratiqué un ajustement pour calculer une valeur pour 1 heure d’exposition.
L’ATSDR, l’OEHHA et le TCEQ retiennent un facteur d’incertitude de 10 en raison de la variabilité au sein de la population humaine. L’ATSDR utilise un facteur 3 pour l’extrapolation à partir des données animales. Ces différents facteurs sont justifiés.
Les limites de l’étude réalisée sur des volontaires sains entraînent une faible fiabilité des résultats de cette étude. L’INERIS n’a pas retenu cette étude et donc les VTR de l’OEHHA et du TCEQ construites à partir de celle-ci.
L’INERIS retient la valeur de l’ATSDR établie à partir d’une étude expérimentale de bonne qualité et qui s’avère plus protectrice.
Indice de confiance : faible en raison du choix de l’étude (en raison du procotole expérimental choisi et de l’effet critique retenu.
Effets à seuil - Exposition sub-chronique par inhalation:
L’INERIS propose de retenir la valeur de 7,8.10-2 mg.m-3 pour des expositions sub-chroniques au chlorure de vinyle par inhalation (ATSDR, 2006).
Une seule valeur est disponible pour des expositions sub-chroniques par inhalation celle de l’ATSDR (2006) établie à partir de l’étude par inhalation pour une exposition sub-chronique de Thornton et al., 2002. L’étude est jugée de bonne qualité. L’effet critique hépatique est pertinent au regard du profil toxicologique de la substance. La dose critique retenue (LED10) et les facteurs d’incertitude sont cohérents au regard des données utilisées.
Indice de confiance : élevé en raison de la qualité de l’étude et la transparence de la construction.
Effets à seuil - Exposition chronique par inhalation:
L’INERIS propose de retenir la valeur du TCEQ de 6.10-2 mg.m-3 pour des expositions chroniques au chlorure de vinyle par inhalation.
Deux VTR sont proposées celle de l’US-EPA (2000) et celle du TCEQ (2023).
|
|
US EPA (2000) |
TCEQ (2023) |
|---|---|---|
|
Etude clé, Durée et voie d’exposition |
Til et al., 1983 ; Til et al., 1991 Chronique chez le rat par voie orale |
l’étude sur deux générations (Thornton et al., 2002) par inhalation |
|
Effet critique/dose |
Hépatique NOAEL : 0,13 mg.kg-1.j-1 |
hépatique (hypertrophie centro-lobulaire des femelles F1 BMCL10 = 2,72 ppm (7,1 mg.m-3) |
|
Calcul |
Modélisation PBPK : NOAECHEC de 2,5 mg.m-3 |
Ajustement temporel Et concentration équivalente pour l’homme 0,680 ppm (1,8 mg.m-3) |
|
UF total |
30 |
30 |
|
UFA |
3 |
3 |
|
UFH |
10 |
10 |
|
0,1 mg.m-3 |
6.10-2 mg.m-3 |
La valeur de l’US-EPA a été extrapolée à partir de l’étude chronique par ingestion de Til et al., (1983, 1991). La valeur du TCEQ est basée sur une étude de reproduction sur 2 générations (Thornton et al., 2002). L’étude de Thornton n’est pas une étude chronique mais une étude par inhalation alors que l’étude de Til est une étude chronique par voie orale. L’US-EPA a estimé que la substance présentait un mode d’action commun pour les deux voies d’exposition (ingestion et inhalation) à savoir une toxicité hépatique. L’extrapolation voie à voie a donc été réalisée en utilisant les modèles PBPK. L’INERIS préfère retenir la valeur du TCEQ basée sur des études de bonne qualité par inhalation.
La valeur du TCEQ est basée sur une atteinte hépatique des femelles F1. L’effet hépatique apparait pertinent. Le TCEQ utilise ensuite une modélisation multi-étapes pour le calcul d’une Benchmark concentration. Une démarche similaire à partir de la même étude a également été retenue par l’ATSDR dans l’élaboration d’une VTR sub-chronique.
Concernant l’utilisation des facteurs d’incertitude, les deux organismes retiennent un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l’extrapolation de l’animal à l’homme en raison de l’utilisation d’un ajustement. L’utilisation de ces facteurs est justifiée et cohérente.
La valeur du TCEQ apparait donc plus pertinente pour les effets à seuil par inhalation.
Indice de confiance : Moyen en raison de la qualité de l’étude et la transparence de la construction mais limité par de la durée de l’étude.
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir la VTR de 3.10-3 mg.kg-1.j-1 pour des expositions chroniques au chlorure de vinyle par voie orale (US EPA, 2000 ; ATSDR, 2006).
Deux VTR sont proposées par les 6 bases internationales : la VTR de l’US-EPA (2000) et celle de l’ATSDR (2006) établies toutes deux à partir des études de Til et al. (1983) ; Til et al. (1991). Ces études sont de bonne qualité.
L’ATSDR (2006) et l’US-EPA (2000) se basent sur la même étude pour élaborer leur valeur toxicologique de référence. Pour les deux organismes, l’effet retenu est un effet hépatique différent selon les deux organismes (nodules hépatiques pour l’US EPA et polymorphisme des cellules du foie pour l’ATSDR), mais ce qui est cohérent avec le profil toxicologique de la substance. La dose critique retenue est le NOAEL. Dans les deux cas, une modélisation des données est pratiquée. Cependant, contrairement à l’US-EPA qui utilise la dose absorbée estimée (0,13 mg.kg-1.j-1) et le modèle PBPK de Clewell et al. (1995), l’ATSDR se base sur la valeur 0,17 mg.kg-1.j-1 correspondant à la dose moyenne ingérée. Un ajustement du NOAEL établi chez le rat a été réalisé par l’ATSDR grâce au modèle PBPK décrit par Clewell et al. (2001) et par l’US-EPA (2000) afin d’extrapoler la valeur mesurée à l’homme. La valeur HED obtenue est dans les deux cas égale à 0,09 mg.kg-1.j-1. Des facteurs d’incertitude ont été utilisés : 3 pour la variation inter-espèce et 10 pour la variation intra-espèce, soit un facteur global de 30. In fine, les deux valeurs de l’US EPA et l’ATSDR sont les même 3.10-3 mg.kg-1.j-1.
Les deux valeurs de l’ATSDR et de l’US EPA sont identiques et leurs méthodes de construction basées sur la même étude sont proches et satisfaisantes.
Indice de confiance : élevé en raison de de la qualité des données et de la cohérence de la démarche entre les deux organismes.
Effets sans seuil - Exposition chronique par inhalation :
L’Anses retient la valeur de 0,0038 (mg.m-3)-1 soit 3,8.10-6 (µg.m-3)-1 pour des expositions chroniques au chlorure de vinyle par inhalation (Anses, 2012)
Six VTR sont proposées : la VTR de l’US-EPA (2000) également retenue par Santé Canada (2021), celle du RIVM (2001), celle de l’OEHHA (2011), celle de l’Anses (2012) et celle du TCEQ (2023).
Le RIVM, l’US-EPA, Santé Canada et le TCEQ se basent sur les mêmes études pour élaborer leur valeur toxicologique de référence : Maltoni et al., 1981 ; Maltoni et al., 1984. L’OEHHA s’appuie sur des études expérimentales complémentaires (Bi et al., 1985, Drew et al., 1983) et sur une étude épidémiologique : Waxweiler et al., 1976. Enfin, en 2012, l’Anses propose une nouvelle valeur basée sur l’étude de Hong et al. (1981), cette étude n’avait pas été retenue par les autres organismes mais il s’agit d’une étude de bonne qualité et dont les résultats sont utilisables pour une modélisation et un calcul de benchmark dose. Selon l’Anses, les autres études retenues jusqu’à présent par les différents organismes se sont révélées moins bien adaptées à ce type de modélisation. La démarche de calcul est claire et détaillée, les arguments sont recevables. Cette valeur est retenue.
Cette valeur de 0,0038 (mg.m-3)-1 correspond à une concentration de 2,63 µg.m-3 pour un excès de risque de 10-5 et une concentration de 0,26 µg.m-3 pour un excès de risque de 10-6.
Indice de confiance de l’ANSES : L’Anses n’a pas donné d’indice de confiance pour cette valeur.
Effets sans seuil - Exposition chronique par voie orale :
L’Anses retient la valeur de 0,625 (mg.kg-1j-1)-1 pour des expositions chroniques au chlorure de vinyle par voie orale (Anses, 2012)
Cinq valeurs sont disponibles pour réaliser le choix de VTR : celle de l’US-EPA (2000), du RIVM (2001), de l’OEHHA (2011), de l’Anses (2012) et de Santé Canada (2021).
La valeur proposée par l’OEHHA est établie à partir d’une étude par inhalation (Drew et al., 1983). Une extrapolation voie à voie a été réalisée. Cette VTR n’a donc pas été retenue.
Le RIVM et l’US EPA se basent sur la même étude pour établir leur VTR (Feron et al., 1981). Le RIVM s’appuie sur une étude complémentaire (Til et al., 1991). L’effet retenu dans toutes ces études est le développement de tumeurs hépatiques. A la différence du RIVM, l’US EPA a extrapolé sa VTR à la vie entière en utilisant le modèle PBPK de Clewell et al. (1995). Cette valeur semble plus pertinente
L’Anses et Santé Canada proposent respectivement en 2012 et 2021 (construction en 2013) deux nouvelles valeurs basées sur la même étude de Feron et al. (1981), et le même effet critique de tumeurs hépatiques. L’Anses utilise ensuite une modélisation des données avec un calcul de benchmark dose et calcule la dose interne au moyen du modèle PBPK établi par l’US EPA, alors que Santé Canada modélise également les données par le même calcul de benchmark dose mais à partir des doses internes chez le rat déterminées à partir d’un modèle PBPK chez le rat. La dose externe humaine est, comme pour l’Anses convertie à partir d’un modèle PBPK humain. Il s’agit donc dans les deux cas d’une démarche semblable à celle de l’US EPA utilisant les outils plus récents (Modélisation PBPK, BMD…). Les valeurs retenues par l’Anses et Santé Canada sont proches. De plus, contrairement à Santé Canada, l’Anses donne davantage de détails dans le choix des différentes étapes.
Cette valeur de 0,625 (mg.kg-1j-1)-1 correspond à une dose de 1,6.10-5 mg.kg-1.j-1 pour un excès de risque de 10-5 et à 1,6.10-6 mg.kg-1.j-1 pour un excès de risque de 10-6.
Autres valeurs des organismes reconnus
Description
Effets sans seuil - Exposition chronique par voie orale:
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 21/07/2025
Introduction
Evaluation existante :
Dans le cadre des travaux de l'OCDE réalisés pour les substances produites à fort tonnage (programme HPVC OECD High Production Volume Chemicals Program, Screening Information Dataset for Vinyl Chloride / CAS n°75-01-4. (UNEP, 2004)), le chlorure de vinyle a été évalué et le dossier SIDS* de la substance est disponible sur le site du Programme des Nations Unies pour l'Environnement (UNEP, 2004). La plupart des données présentées dans cette fiche sont issues de cette évaluation et n'ont donc pas fait l'objet d'une évaluation supplémentaire.
*SIDS : Screening Information Data Set. Les dossiers SIDS regroupent le minimum d’informations nécessaires à une évaluation initiale des dangers des substances chimiques existantes. Ces évaluations des dangers sont gérées par l’OCDE
(Organisation de Coopération et de Développement Economiques) et font l’objet d’une évaluation collective par les états membres de l’OCDE au sein du SIAM (SIDS Initial Assessment Meeting).
Critères PBT /POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH, C.E., 2006).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Normes de qualité existantes :
UE (Directive 98/83/CE) :
- 0.5 µg.L-1 (C.E., 1998)
France :
- L'arrêté du 20/04/05, pris en application du décret du 20 avril 2005 relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses, indique pour le chlorure de vinyle une norme de qualité de 0.5 µg.L-1 pour les eaux de surface, les eaux de transition ainsi que les eaux marines intérieures et territoriales (ETOX, 2007), 3
Canada :
- critère de qualité pour l'eau potable = 2 µg.L-1 (concentration maximale admissible) (ETOX, 2007), 3
Allemagne :
- critère de qualité pour l'eau potable = 2 µg.L-1 (ETOX, 2007), 3
- norme de qualité pour les eaux prélevées destinées à la consommation = 2 µg.L-1 (ETOX, 2007), 3
Pays-Bas : objectif de qualité pour les eaux prélevées destinées à la consommation = 8 µg.L-1 (valeur cible sur la fraction totale), 820 µg.L-1 (concentration maximale admissible sur la fraction totale) (ETOX, 2007), 3
USA :
- critère de qualité pour l'eau potable et la consommation de poisson = 2 µg.L-1 (ETOX, 2007), 3
- critère de qualité pour la consommation de poisson et la protection de la santé = 525 µg.L-1 (ETOX, 2007). 3
[3] Les données issues de cette source ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS. http://webetox.uba.de/webETOX/index.do
Substance(s) associée(s) :
-
Dangers
Description
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées ont été validées par l'INERIS.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE AQUATIQUE AIGUË
|
Organisme |
Espèce |
Critère d’effet |
Référence |
|---|---|---|---|
|
Algues |
QSAR estimation |
CE50 (72 h) = 118 mg.L-1* |
ECOSAR, 2001 |
|
Algues |
Scenedesmus quadricauda |
Seuil de toxicité (192 h) = 710 mg.L-1 |
Bringmann et Kuehn, 1977 |
|
Protozoaire |
Tetrahymena pyriformis |
IC50 (9h) = 540 mg.L-1 |
Sauvant et al., 1995 |
|
Algues |
Chlamydomonas reinhardtii |
IC50 (2 h) = 580 mg.L-1* |
Brack et al., 1998 |
|
Invertébrés |
QSAR estimation |
CE50 (48 h) = 196 mg.L-1* |
ECOSAR, 2001 |
|
Invertébrés |
QSAR estimation |
CE50 (48h) = 103 mg.L-1* |
CEDRE, 2004 |
|
Poissons |
QSAR estimation |
CE50 (96 h) = 191 mg.L-1* |
ECOSAR, 2001 |
|
Poissons |
Danio rerio |
CE50 (96 h) = 210 mg.L-1 |
Groeneveld et al., 1993 |
|
Poissons |
Esox lucius |
CL100 (10 j) = 388 mg.L-1 |
Brown et al., 1977 |
|
Poissons |
Lepomis macrochirus |
CE50 (96 h) = 1 220 mg.L-1 |
Hann et Jensen, 1974 |
|
Poissons |
Micropterus salmoides |
CE50 (96 h) = 1 060 mg.L-1 |
Hann et Jensen, 1974 |
|
Poissons |
Leuciscus idus |
CE50 (48 h) = 356 – 406 mg.L-1 |
Juhnke et Ludemann, 1978 |
La toxicité du chlorure de vinyle a été étudiée chez les algues et les poissons. Aucune étude expérimentale n’est disponible chez les invertébrés. Des données estimées par relation structure-activité (ECOSAR) sont également disponibles pour les trois niveaux trophiques. Ces données ont été générées en supposant que le chlorure de vinyle a un comportement métabolique et biologique plus proche d’un alkan que d’un halogénure de vinyle ou d’allyl, dans le milieu aquatique.
Concernant les essais expérimentaux, seuls les résultats obtenus chez les poissons par Groeneveld et al. (1993) peuvent être considérés comme valides.
Ces auteurs mettent en évidence chez le Brachydanio rerio des valeurs de LC50 96h = 210 mg.L-1 et NOEC 96 h = 128 mg.L-1 (concentrations mesurées, système clos).
Ces valeurs sont relativement proches de celle obtenue par QSAR : LC50 = 191 mg.L-1.
L’évolution des concentrations en chlorure de vinyle n’ayant pas été suivie, les résultats obtenus lors des autres essais ne peuvent être considérés comme valides.
En conclusion : compte tenu de de son importante volatilité, de son faible potentiel de bioaccumulation et des résultats obtenus par les essais valides et les estimations QSAR, la toxicité du chlorure de vinyle pour le compartiment aquatique sera relativement faible.
ECOTOXICITE AQUATIQUE CHRONIQUE

ECOTOXICITE POUR LES VERTEBRES TERRESTRES
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été jugées valides.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biota n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen (Tableau 22, page 129, E.C., 2003) et le projet de guide technique européen pour la détermination de normes de qualité (E.C., 2009). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (tableau 23, page 130, E.C., 2003). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
TOXICITE ORALE POUR LES MAMMIFERES
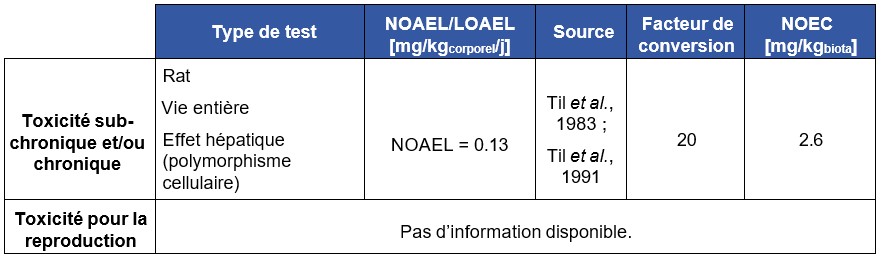
TOXICITE ORALE POUR LES OISEAUX

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Pour les organismes aquatiques, la toxicité du chlorure de vinyle a été étudiée chez les algues et les poissons. Aucune étude expérimentale n’est disponible chez les invertébrés. Les résultats obtenus chez Brachydanio rerio présentent des valeurs de LC50 96h = 210 mg.L-1 et NOEC 96 h = 128 mg.L-1 (concentrations mesurées, système clos).
Des données estimées par relation structure-activité (ECOSAR) sont également disponibles pour les trois niveaux trophiques.
Sol
FDTE (version 2020
Pour les organismes terrestres, il n’existe pas de données court terme valides pour les organismes terrestres.
Biote
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VALEUR GUIDE DE QUALITE POUR LES ORGANISMES AQUATIQUES DE LA COLONNE D'EAU
Devant l’absence de suffisamment données écotoxicologiques valides, il n’est pas possible de proposer pour le chlorure de vinyle une concentration prévisible sans effets dans l’environnement (PNEC).
Toutefois, il peut être signalé que :
- L’Arrêté du 20/04/05, pris en application du décret du 20 avril 2005 relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses, indique pour le chlorure de vinyle une norme de qualité de 0,5 mg.L-1 pour les eaux de surface, les eaux de transition ainsi que les eaux marines intérieures et territoriales,
- L’IPPC, 2006 indique une PNECeau de 8,2 mg.L-1 , (QSAR)
- EuroChlor, 1999 propose une PNEC de 0,210 mg/L en appliquant un facteur de 1000 sur la plus faible CL50 mesurée disponible est en estimant que les poissons sont les organismes les plus sensibles,
- CEDRE, 2004 propose une PNEC de 0,103 mg.L-1 en appliquant un facteur 1000 sur la CL50 estimée vis-à-vis des micro-crustacés d’eau douce. (QSAR)
VALEUR GUIDE DE QUALITE POUR LE SEDIMENT (QSSED)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Avec un log Koc inférieur à 3, le chlorure de vinyle n'est pas considéré comme une substance susceptible de s'accumuler de façon importante sur les sédiments. Un suivi dans ce compartiment n'apparaît donc pas pertinent. De plus, l'absence de norme de qualité pour les organismes de la colonne d'eau pour cette substance ne permet pas de déterminer un seuil de qualité pour les sédiments à partir de la méthode de l'équilibre de partage.
NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2003). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés dans le tableau 23 page 130 du guide (E.C., 2003).
Pour le chlorure de vinyle, un facteur de 30 est appliqué car la durée du test retenu (NOEC à 2.6 mg.kg-1biota sur rat) correspond à la durée de vie d'un rat. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée à une concentration dans l'eau selon la formule suivante :
![]()
Avec :
BCF : facteur de bioconcentration,
BMF : facteur de biomagnification.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biota. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biota.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le tableau 29, page 160, du guide technique européen (E.C., 2003).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le chlorure de vinyle, un BCF de 5.1 (UNEP, 2004) et un BMF de 1 (cf. E.C., 2003) ont été retenus. On a donc :
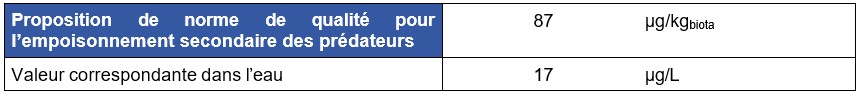
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE
La norme de qualité pour la santé humaine est calculée de la façon suivante (Lepper, 2005) :
![]()
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 0.0007 µg/kgcorporel/j (cf. tableau ci-dessus),
- une consommation moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2009).
Pour le chlorure de vinyle, le calcul aboutit à:
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
![]()
Pour le chlorure de vinyle, on obtient donc :

![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON
En principe, lorsque des normes de qualité réglementaires dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1).
Pour le chlorure de vinyle, la Directive 98/83/CE mentionne une valeur de 0.5 µg.L-1.
A titre de comparain, la norme de qualité pour l'eau de boisson est calculée de la façon suivante (Lepper, 2005) :
![]()
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR) ; pour cette substance elle est considérée égale à 0.0007 µg/kgcorporel/j,
- une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le chlorure de vinyle, on obtient :
![]()
La valeur la plus protectrice, calculée ci-dessus est proposée comme norme de qualité pour l'eau destinée à la production d'eau potable.

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
PROPOSITION DE NORME DE QUALITE ENVIRONNEMENTALE (NQE)
La NQE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
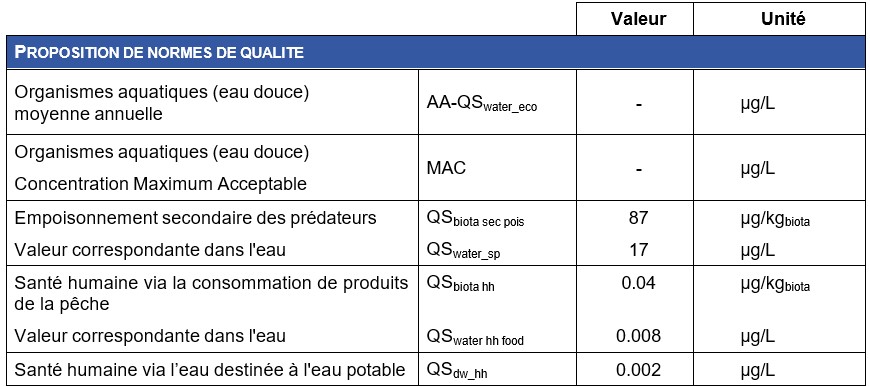
Pour le chlorure de vinyle, la norme de qualité pour l'eau destinée à l'eau potable est la valeur la plus faible pour l'ensemble des approches considérées.
Il faut rappeler que la valeur de la norme de qualité pour l'eau destinée à l'eau potable a été dérivée en l'absence d'information sur la fraction éliminée. Par défaut, la fraction éliminée pour le traitement de l'eau a donc été fixée à zéro. Ce qui implique que l'eau brute du milieu doit respecter le critère pour l'eau de boisson et que l'on néglige donc la possibilité d'éliminer une certaine fraction lors du traitement.
Selon le projet de document guide pour la détermination des norme de qualité environnementale (E.C., 2009), la norme pour l'eau de boisson ne doit être adoptée comme norme de qualité environnementale que pour les eaux destinées au captage des eaux de boissons. Pour les autres eaux, la valeur de 0.008 µg.L-1 dans l'eau correspondant à la valeur de norme de qualité pour la protection de la santé humaine via la consommation des produits de la pêche de 0.04 µg.kg-1biota peut être considérée.
La proposition de NQE pour le chlorure de vinyle est donc la suivante :
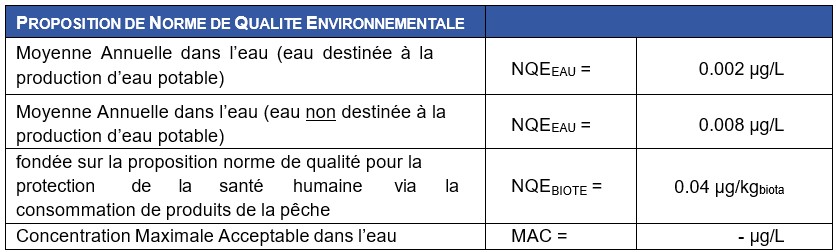
VALEURS GUIDES POUR LE SEDIMENT
Avec un Koc de 56 L.kg-1 et un Log Kow = 1.58, la mise en œuvre d'un seuil pour le sédiment n'est pas recommandée par le projet de document guide européen (E.C., 2009).
Bibliographie
Activité endocrine
Dernière vérification le 21/07/2025
Généralités sur les activités endocrines
Le chlorure de vinyle n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Bibliographie
Données technico-économiques
Dernière vérification le 11/04/2025
Tableaux de synthèse
Généralités
| CAS | 75-01-4 |
|---|---|
| SANDRE | 1753 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Le chlorure de vinyle fait l'objet de multiples réglementations au niveau national et international. On distingue des réglementations relatives :
Il s'y ajoute l'engagement volontaire de l'industrie européenne du PVC. Limitation de la mise sur le marché et de l'emploi du CVMConsidérée comme dangereuse pour la santé de l'homme, l'utilisation du chloro 1 éthylène (chlorure de vinyle monomère) comme agent propulseur d'aérosols a été interdite par la Directive 76/769/CEE du Conseil du 27 juillet 1976 (modifiée). Il est également important de constater que l'utilisation du PVC, débouché ultra majoritaire du CVM, fait débat au sein des différents pays européens. Ainsi, les avis sur les effets du PVC sur la santé humaine et sur l'environnement sont divergents, tout comme le sont les mesures prises par certains États membres sur le sujet. La Commission européenne juge donc qu'une approche intégrée est nécessaire. Elle a adopté le 26 juillet 2000, le livre vert sur les problèmes environnementaux du PVC. Ce livre aborde en particulier deux questions principales :
Le livre vert présente également un éventail d'options politiques visant à réduire les effets éventuels sur la santé humaine et l'environnement et des mesures envisageables dans le cadre d'une future stratégie communautaire sur le PVC. (Commission Européenne, 2000) Matériaux et objets contenant du CVM et destinés à être mis au contact des denrées, produits et boissons alimentairesLa directive de base (89/109/CEE) pour les matériaux et objets en contact avec les aliments date du 21 décembre 1988. Elle décrit en termes généraux les conditions auxquelles les matériaux et les objets doivent répondre pour pouvoir entrer en contact avec les aliments. Une législation spécifique (directive 2002/72/CE) a été élaborée pour les plastiques et mise en vigueur au niveau européen. Cette directive comprend une liste des monomères et additifs, déterminant les molécules/substances pouvant être utilisées pour fabriquer du plastique, lequel entrera plus tard en contact direct avec les denrées alimentaires. Le CVM figure sur la liste des monomères et autres substances de départ autorisées. Des directives séparées ont été élaborées pour le chlorure de vinyle:
Tableau 1.2.4 : Valeurs limites selon Directive 78/142/CEE
Ces trois directives ont été transposées en loi française par l'arrêté du 30 janvier 1984. Engagement volontaire de l'industrie européenne du PVCL'ECVM (European Council of Vinyl Manufacturers), rassemblant les producteurs européens de PVC, a développé deux chartes. L'une d'elles s'applique à la production de CVM et du PVC en suspension, et l'autre à la production du PVC en émulsion. 'Vinyl 2010', un programme sur 10 ans avec révision des objectifs à mi parcours en 2005 et définition de nouveaux objectifs en 2010, vise la conformité avec les chartes du ECVM. Les objectifs des chartes sont, en grande partie, identiques aux plafonds définis par l'OSPAR et les Directives européennes présentées ci dessus. Le tableau 1.2.5 ne comprend que les objectifs des chartes ECVM qui se démarquent des objectifs d'OSPAR et des Directives. Les tableaux en annexe récapitulent la totalité des valeurs limites des chartes. Tableau 1.2.5 : Objectifs des Chartes ECVM différant des objectifs d'OSPAR et des Directives européennes
Contrôle des mouvements transfrontaliers de déchets dangereux et de leur éliminationLes déchets issus de la production du chlorure de vinyle figurent dans la liste A de la convention de Bâle du 22 mars 1989 sur le contrôle des mouvements transfrontaliers de déchets dangereux et de leur élimination. Ils sont considérés comme des déchets dangereux en vertu de l'article 1er de la Convention. |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Au niveau international, deux décisions et une recommandation de l'OSPAR définissent des plafonds d'émissions et de rejets applicables à la fabrication du CVM, ainsi que la fabrication du 1,2 dichloroéthane (DCE), et du PVC. Leur but est de protéger la zone maritime des effets préjudiciables des activités humaines dans ces domaines (libération de quantités significatives d'organohalogénés et d'émissions d'hydrocarbures). La Décision OSPAR 98/44, sur les plafonds d'émissions et de rejets applicables à la fabrication du chlorure de vinyle monomère (CVM) incluant la fabrication du 1,2 dichloroéthane (DCE), fixe les plafonds d'émissions atmosphériques pour le CVM comme décrit dans le tableau 1.2.3.a. Ces mesures sont applicables aux nouvelles installations à partir du 9 février 1999 et aux installations existantes à partir du 1er janvier 2006. Tableau 1.2.3.a : Plafonds d'émissions selon la Décision OSPAR 98/4
(1) Plafonds d'émissions atmosphériques s'appliquant à toutes les installations de fabrication de CVM implantées sur les territoires des parties contractantes -(2) Normalisés aux conditions suivantes : température de 273°K, pression 101,3 kPa et 11% d'oxygène sec. – (3) Plafonds de rejets dans les eaux (effluents aqueux entiers) ne s'appliquant qu'aux installations de fabrication de CVM, dont les rejets peuvent atteindre la zone maritime de la Convention OSPAR par voie d'eau. – (4) Après désessenciement, avant traitement secondaire. La décision OSPAR 98/55 fixe des plafonds d'émissions et de rejets dans l'eau de certaines substances dangereuses émanant du procédé de fabrication du PVC en suspension à partir du CVM dans les eaux. Les plafonds d'émissions dans l'eau par rapport au CVM, s'appliquant à toutes les installations à vocation unique ou à vocation combinée, sont présentés dans le tableau 1.2.3.b. Ils sont en vigueur pour les nouvelles installations à partir du 9 février 1999 et pour les installations existantes, à partir du1er janvier 2003. Tableau 1.2.3.b : Plafonds d'émissions selon la Décision OSPAR 98/5
(1) Plafonds d'émission s'appliquant à toutes les installations à vocation unique ou à vocation combinée des Parties contractantes – (2) Les moyennes annuelles d'émission des installations produisant du PVC par polymérisation en suspension ne pourront dépasser les plafonds d'émission. – (3) Plafonds de rejet ne s'appliquant qu'aux installations à vocation unique ou à vocation combinée dont les rejets peuvent atteindre la zone maritime de la Convention OSPAR par voie d'eau – (4) Rejets au-delà de l'équipement de déssenciement de l'effluent et avant le traitement secondaire. – (5) Les moyennes annuelles de rejet dans l'eau des installations produisant du PVC par polymérisation en suspension ne pourront dépasser ces plafonds. Ces deux décisions sont complétées par la recommandation OSPAR 2000/3, fixant des plafonds d'émissions et de rejets dans le secteur du chlorure de vinyle qui sont applicables à la fabrication du PVC en émulsion (tableau 3). Les échéances, pour se mettre en conformité avec ces plafonds d'émissions sont le 1er janvier 2001 pour les nouvelles installations et le 1er janvier 2004 pour les installations existantes. Tableau 1.2.3.c : Plafonds d'émissions selon la Recommandation OSPAR 2000/3
(1) Plafonds d'émissions atmosphériques s'appliquant à toutes les installations implantées sur les territoires des Parties contractantes. – (2) Plafonds de rejet dans les eaux ne s'appliquant qu'aux installations de fabrication dont les rejets peuvent aboutir à la zone maritime de la Convention OSPAR par voie d'eau. – (3) Rejets au-delà de l'équipement de déssenciement de l'effluent et avant le traitement secondaire. Ces trois textes OSPAR requièrent également que les émissions fugitives6 de la production du CVM et du PVC soient minimisées autant que possible. En France, les dispositions des documents d'OSPAR ont été reprises par la circulaire du 2 août 2001 relative aux installations classées mettant en œuvre le chlorure de vinyle monomère. En France, d'autres dispositions proviennent de l'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature émanant des installations classées et soumises à autorisation :
Tableau 1.2.3.d : Dispositions de l'arrêté du 2 février 1998
La réduction des émissions atmosphériques du chlorure de vinyle monomère fait également partie des actions du Plan National Santé Environnement (cf. aussi la circulaire du 13 juillet 2004). Il fixe des objectifs globaux nationaux7 présentés dans le tableau 1.2.3.e. Tableau 1.2.3.e : Objectifs du Plan National Santé Environnement
Source : Annexe 1 de la circulaire du 13 juillet 2004 Selon l'annexe 2 de la circulaire du 13 juillet 2004, la mise en œuvre de l'ensemble des dispositions réglementaires actuelles, principalement des mesures de réduction des émissions diffuses, de traitement des rejets et d'optimisation des réacteurs, devrait permettre d'atteindre cette réduction d'émissions de CVM issues de la production de CVM et de PVC. [4] Publiée par le décret no 2001-1052 du 5 novembre 2001. [5] Publiée par le décret no 2001-868 du 17 septembre 2001. [6] La circulaire du 2 août 2001 définit les émissions fugitives comme émissions émises en un point de façon intermittente et peu prévisible (exemple : défaut d'étanchéité d'un joint, levé d'une soupape). [7] Ces objectifs globaux ne constituent pas des objectifs à imposer indifféremment à chacune des installations. De même, les niveaux d'émission estimés à l'horizon 2010 ne sont pas à considérer comme des plafonds nationaux d'émission pour les secteurs industriels concernés ou pour les substances visées. Il s'agit d'objectifs relatifs de réduction qui visent l'ensemble des émissions canalisées et diffuses. Ils pourront être consolidés sur la base de la mise en œuvre de cette stratégie nationale et de l'acquisition de nouvelles données, notamment sur le niveau des émissions diffuses (circulaire du 13 juillet 2004). |
| Informations complémentaires |
Le Chlorure de Vinyle Monomère (CVM) est un gaz dans les conditions normales. A température et pression ambiantes, il est inodore et sans couleur. Il est facilement liquéfié sous pression et habituellement stocké, transporté et utilisé comme liquide. En l’absence de lumière naturelle ou d’oxygène, le CVM est stable. Il est extrêmement inflammable. Le CVM à l'état non polymérisé est un produit toxique à long terme (INERIS, 2005). |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Sites de production et quantités produites
La production de CVM mobilise 35% de la production de chlore européen, et 50% de la production de chlore français. Cette production est d'ailleurs en forte augmentation depuis ces dernières décennies. En 1991, la capacité de production mondiale de CVM était, de 21 millions de tonnes (Vignes, J,L, 1997). En 1997, la production mondiale de CVM a été de 24 millions de tonnes. Et en se basant sur les capacités de production de PVC, les capacités de production de CVM devaient être, en 2002, supérieures à 32 millions de tonnes.
L'ECVM, qui représente 90 % de la production européenne de CVM et de dichlorure d'éthylène, compte 14 entreprises et 25 usines de production de chlorure de vinyle en Europe de l'ouest : Belgique (3), France (3), Allemagne (8), Italie (4), Pays Bas (1), Norvège (1), Espagne (2), Suède (1), RU (2) (Euro Chlor, 1999, citant ECVM, 1998). Les capacités de production des sites français sont présentées dans le tableau 2.1.2.a.
Tableau 2.1.2.a : Sites français produisant du CVM et leur capacité
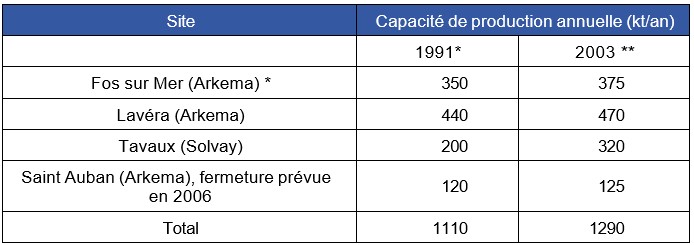
[*] Selon http://www.106.us/f/polychlorure_vinyle/index.htm#SITUATION.** selon chemical economics handbook, 2003
La production française de CVM est donc relativement stable depuis une vingtaine d'année. Elle va même diminuer en 2006 avec la fermeture du site de St Auban. Toutefois, cette situation est uniquement caractéristique de la France, et s'inscrit dans la stabilisation française de la production de chlore (SHD, 2005). En revanche, en Allemagne, la production de chlore a augmenté de près de 35% en vingt ans.
Pour le PVC, en 2002, les capacités de production annuelle étaient de 32 400 kt au niveau mondial, et 6 544 kt au niveau de l'Union Européenne (Vignes, J.L., 2005). Ces capacités sont aussi en forte augmentation, puisqu'en 1994, elles étaient au niveau mondial de 21 500 kt.
L'évolution des capacités de productions françaises est représentée dans le tableau 2.1.2.b (EC, 2005, Vignes, J.L., 2005):
Tableau 2.1.2.b :Sites français produisant du PVC et leur capacité
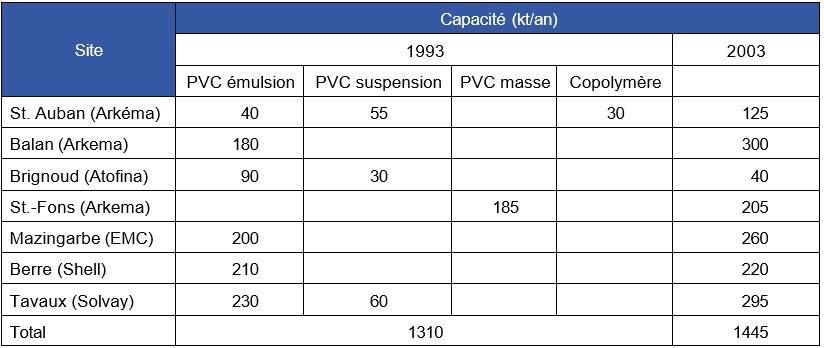
Source : EC, 2005. – Appartenance aux différents sociétés du secteur chimique selon http://www.106.us/f/polychlorure_vinyle/index.htm#SITUATION, décrivant la situation en 1993. Chemical economics handbok, 2003.
Grâce à ces capacités de production, la production française de PVC était de 1 185 kt en 1996, et de 1 213 kt en 2003. La production française de PVC suit donc la production française de CVM et se stabilise depuis plus de dix ans. Une grande partie de cette production est exportée et l'on constate finalement une diminution de la consommation française de PVC. Ainsi, en 1996, la consommation française de PVC a été de 833 kt, et en 2003, de seulement 707 kt (Vignes, J.L., 2005 ; SPMP, 2003).
Place de la substance dans l'économie française
Le CVM représente la moitié des débouchés de l'industrie du chlore en France et est quasiment exclusivement utilisé pour fabriquer du PVC. La place du CVM dans l'économie française dépend donc avant tout du marché du PVC. En 1999, les capacités de production française de CVM étaient de 1 260 kt, réparties sur 4 sites de production de deux groupes pétro chimiques (Arkema et Solvay). Toutefois, face à des difficultés internes rencontrées sur le marché des produits vinyliques (surcapacité, érosion des marges), le groupe Arkema prévoit une concentration de ses activités de production de CVM et la fermeture des unités de production de CVM du site de St Auban, principal site de rejet de CVM dans l'environnement, en France.
La production de CVM sert ensuite à fabriquer du PVC et la France en a ainsi produit en 2003, 1 213 kt, réparties sur 7 sites de production (restructuration des sites du groupe Arkema). Cette production n'est toutefois pas entièrement consommée en France (seulement 707 kt consommées en 2003), le reste étant exporté. Cette exportation pourrait d'ailleurs augmenter car il semble y avoir une baisse des consommations de PVC en France ( 2,5% entre 2002 et 2003), mais nous n'avons pas suffisamment de données pour savoir si cette baisse se poursuivra dans les années à venir.
Selon les données fournies par le ministère du commerce extérieur, on peut considérer que le prix du CVM s'est établi entre 350 et 450 €/t entre 2003 et 2005. De même, le prix du PVC sous forme primaire non mélangé s'est établi entre 600 et 750 €/t entre 2003 et 2005. Ces chiffres représentent donc un chiffre d'affaires moyen de 812 millions € pour les producteurs français de PVC.
Le PVC représente 13% des matériaux plastiques consommés en France. Il sert dans de nombreuses applications, en particulier dans le secteur du bâtiment. Ainsi, à titre d'exemple, en France, en 2004, quelques unes des productions d'éléments en matières plastiques contenant du PVC ont été les suivantes (SESSI, 2004):
Tableau 5.1.1 : Exemples de productions d'éléments en France
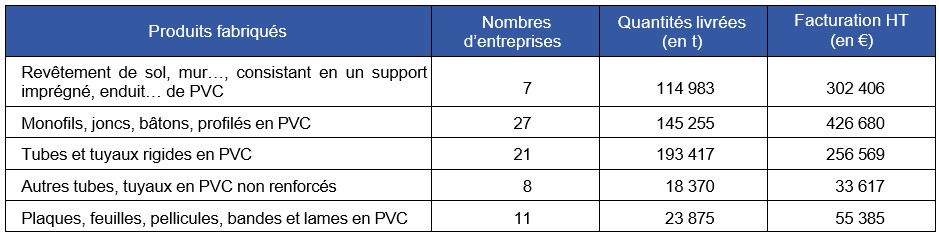
Procédés de production
Le chlorure de vinyle monomère (CVM) est produit industriellement à partir d'éthylène et de chlore ou de chlorure d'hydrogène (gaz chlorhydrique) en deux étapes successives :
- La première étape consiste à fabriquer du 1,2 dichloroéthane, soit par chloration directe d'éthylène avec du chlore, soit par chloration d'éthylène avec l'acide chlorhydrique (HCL) et l'oxygène (oxychloration).
- La seconde étape consiste en la pyrolyse du 1,2 dichloroéthane en phase gazeuse (Euro Chlor, 2001 ; EC, 2002 ; INERIS, 2001) :
![]()
La polymérisation du CVM peut ensuite être réalisée selon trois procédés (Vignes, J.L, 2005) :
- En suspension dans l'eau (80% de la production mondiale)
- En émulsion dans l'eau (10% de la production mondiale)
- En masse (10% de la production mondiale)
Utilisations
Chlorure de vinyle (CVM)
FTE 2005 Importer
Selon Euro Chlor (2001), 99 % du chlorure de vinyle est utilisé comme monomère pour la production de polychlorure de vinyle (PVC) et des copolymères associés. Un exemple de copolymère est la production de chlorure de polyvinylidene, un plastique utilisé pour les emballages (Tickner, 1998).
L'OMS (1999) estime, quant à lui, le pourcentage du CVM utilisé dans la fabrication de PVC à 95 %. Selon la même source, les autres 5 % seraient utilisés comme intermédiaire dans la production de solvants chlorés (cf. aussi EC, 2002), en particulier du 1,1,1 trichloroéthane. Toutefois, la production comme solvant de ce dernier produit n'est plus autorisée, en France, depuis 1996 (Vignes, J.L, 2005). L'entreprise Arkema de St Auban continue, ainsi, à le produire comme matière première mais en utilisant un réactif autre que le CVM. Enfin, le CVM est utilisé comme matière première pour la synthèse organique (INERIS, 2003). On estime à 300 000 tonnes les applications du chlorure de vinyle hors PVC.
Ayant un effet narcotique, le CVM a auparavant été utilisé comme anesthésiant. Il a également été utilisé comme réfrigérant et comme propulseur dans des sprays d'aérosols pour des produits variés comme des pesticides, médicaments et cosmétiques. Ces utilisations ont été bannies (WHO, 1999). L'utilisation du CVM comme réfrigérant et anesthésiant semble avoir également disparu.
Polychlorure de vinyle (PVC)
FTE 2005 Importer
Le PVC, premier consommateur du CVM, est le 3ème polymère utilisé dans le monde après les polyéthylènes et les polypropylènes (EC, 2005). Grâce à ses caractéristiques (résistance, isolation, légèreté, imperméabilité, durabilité, résistance mécanique, etc.), il est utilisé dans de nombreux secteurs industriels :
Tableau 2.2.2 : Utilisation du PVC par secteur en France et en Europe de l'ouest, en %
Source : (*) http://www.106.us/f/polychlorure_vinyle/index.htm#Utilisations ; (**) SPMP, 2003
Rejets dans l’environnement
Sources naturelles
Il n'y a pas de sources naturelles de CVM.
Sources non-intentionelles
FTE 2005 Importer
Décharges
La formation non intentionnelle de chlorure de vinyle survient dans des décharges, comme produit de dégradation des hydrocarbures chlorés (par exemple tetrachloroéthylène et trichloroéthène) utilisés comme solvants industriels. Ceci induit la présence de CVM dans des gaz émis, dans les eaux d'infiltration de la décharge (lixiviat), dans les nappes phréatiques, dans des aquifères, dans des puits et des sols (WHO, 1999).
Tabac
Le chlorure de vinyle se forme également dans la fumée des cigarettes et cigares, le niveau de CVM étant fonction du contenu en chlorure du tabac.
Utilisation de produits
Le CVM est utilisé pratiquement exclusivement en tant qu’intermédiaire réactionnel pour la fabrication de PVC. Les seuls rejets de CVM liés à l’utilisation de produits ne peuvent donc provenir que d’objets en PVC dans lesquels le CVM peut-être présent sous forme libre. Toutefois, des études de mesures de la qualité de l’air intérieur montrent que le CVM n’est jamais détecté (INERIS, 2005). De même, l’étude de la dégradation de canalisations en PVC, semble indiquer qu’il n’y a pas de rejet de CVM dans les eaux traversant des canalisations en PVC (STRPVC, 2001). Les rejets de CVM liés à l’utilisation de produits en PVC ne sont donc pas une source importante, même si elle reste toujours possible.
Émissions atmosphériques
Les émissions de CVM sont avant tout dues aux rejets industriels des sites de fabrication de CVM et de PVC dans l'air en proximité des sites de production. D'autres sources d'émissions sont les rejets accidentels pendant le transport du CVM, ainsi que les résidus du chlorure de vinyle monomère dans des produits de PVC. Tous ces rejets ont principalement lieu vers l'atmosphère. Eurochlor (site internet) donne l'évolution des rejets industriels de CVM dans l'air et dans l'eau depuis 1985.
Graphique 3.4 : évolution des émissions de CVM dans l'air et dans l'eau en Europe

Source : http://www.eurochlor.org/COCEM
Ces graphiques montrent que les émissions de CVM sont en forte diminution depuis 1985 en Europe. En outre, ils montrent également que les rejets dans l'air sont pratiquement 100 fois plus importante que les rejets dans l'eau. Ainsi, en 1995, les émissions de CVM dans l'air étaient de l'ordre de 3 millions kg.an-1 et de 30 000 kg.an-1 dans l'eau.
Emissions dans l'air d'une installation générique pour la France
Les valeurs d'émissions, pour une installation générique en France (cf. tableau 3.4.1.a), sont basées sur des valeurs d'émissions pour des installations utilisant les MTD (Meilleures Technologies Disponibles ou BAT : Best Available Techniques) ainsi que sur des résultats de mesures sur des installations en fonctionnement.
Tableau 3.4.1.a : Bilan d'émissions dans l'air de l'installation générique pour la France
Source : circulaire du 2 août 2001
La circulaire du 2 août 2001 présente également les résultats d'une modélisation des valeurs moyennes de la concentration autour de l'ensemble des sources (cf. tableau 3.4.1.b).9
Tableau 3.4.1.b : Valeurs moyennes de concentration à 500 mètres des sources de l'installation générique' pour la France
Source : circulaire du 2 août 2001
[9] Cf. l'annexe II de la circulaire du 2 août 2001 pour les hypothèses sous-jacentes au modèle.
Emissions dans l'air d'un nombre d'établissements français
Le Registre français des émissions polluantes comporte des données d'émissions de CVM dans l'air en France (cf. tableau 3.4.2), mais non des émissions dans l'eau.
Tableau 3.4.2 : Emissions de CVM en 2004 dans l'air, en kg.an
Source :Registre français des émissions polluantes (http://www.pollutionsindustrielles.ecologie.gouv.fr/IREP/index.php).
Émissions vers les eaux
Il est possible d'estimer de façon grossière, à partir des données d'émissions dans l'air, les émissions de CVM dans l'eau en France si on connaît la répartition des émissions de CVM dans l'air et dans l'eau. Ainsi en se basant sur des évolutions d'émissions de CVM (graphique 3.4) ainsi que sur les émissions dans l'air recensées dans le Registre Français des Emissions Polluantes (cf. tableau 3.4.2) nous pouvons estimer le flux total de rejet de CVM dans l'eau, des industriels Français, en 2004, à 500 kg.an-1, avec des émissions par installation variant entre 30 et 250 kg.an-1 pour l'industrie chimique.
Le Document de Référence sur les Meilleures Techniques Disponibles pour la production de polymères (EC, 2005) donne également les estimations des émissions dans l'eau des installations de PVC. Ainsi, on constate que le procédé de fabrication du PVC par émulsion rejette en moyenne 3 fois plus de CVM dans l'eau que le procédé par suspension. Ainsi, après le traitement des effluents aqueux, le procédé par émulsion rejette en moyenne 10 g de CVM par tonne de PVC produite alors que le procédé par suspension n'en rejette que 3,5 g/t.
Le CVM est utilisé pratiquement exclusivement en tant qu'intermédiaire réactionnel pour la fabrication de PVC. Les seuls rejets de CVM liés à l'utilisation de produits ne peuvent donc provenir que d'objets en PVC dans lesquels le CVM peut être présent sous forme libre. Toutefois, des études de mesures de la qualité de l'air intérieur montrent que le CVM n'est jamais détecté (INERIS, 2005). De même, l'étude de la dégradation de canalisations en PVC, semble indiquer qu'il n'y a pas de rejet de CVM dans les eaux traversant des canalisations en PVC (STRPVC, 2001). Les rejets de CVM liés à l'utilisation de produits en PVC ne sont donc pas une source importante, même si elle reste toujours possible.
Rejets dans l'environnement
Les sources sont entièrement anthropiques et ont majoritairement lieu vers l'atmosphère.
Selon l'INERIS (2005) les principales sources d'émission de CVM sont par ordre d'importance :
- les usines de fabrication du chlorure de vinyle,
- les usines de polymérisation du CVM pour fabriquer le PVC, et
- les usines de fabrication des produits en PVC.
Sont considérées comme sources mineures :
- les moyens de stockage et de gestion pour CVM et PVC,
- les usines produisant la diamine d'éthylène ou le dichlorure d'éthylène, et
Les décharges constituent une autre source d'émissions de CVM (formation non intentionnelle).
Sources de rejets dans la production du CVM
Selon IPPC (2002, cité dans la circulaire du 2 août 2001) les principales sources d'émission d'une installation générique8 lors de la production du CVM sont :
- les évents des réacteurs de chloration et d'oxychloration, des colonnes de distillation et autres équipements de purification ;
- les brides sur tuyauteries et appareils, les garnitures d'étanchéité des pompes et compresseurs ;
- les ouvertures des équipements, particulièrement des réacteurs pour les opérations d'entretien, les re largages des stations d'épuration ;
- les émissions lors des opérations de chargement/déchargement de véhicules de transport de CVM.
[8] L'installation générique, considérée dans le circulaire du 2 août 2001, est une installation représentative par sa capacité et ses niveaux d'émissions des sites de production les plus importants en France . Elle est composée de trois unités de production constituées d'une unité de fabrication de CVM d'une capacité de 300 000 t.an-1, d'une unité de PVC en suspension d'une capacité de 200 000 t.an-1 et d'une unité de PVC en émulsion d'une capacité de 80 000 t.an-1, représentatives des sites de production les plus importants en France. Elles sont supposées être regroupées sur un même site, et disposées de sorte que les expositions alentour soient maximisées, compte tenu de la rose des vents.
Sources de rejets dans la production du PVC
La circulaire du 2 août 2001 liste également des sources d'émissions de CVM issues de la fabrication du PVC dans une installation générique.
Premièrement, lorsque le PVC est produit en suspension, le CVM :
- se retrouve dans les eaux résiduaires
- il est également émis dans l'air par des sources canalisées et diffuses.
- Les sources canalisées convergent vers une cheminée avec une contribution majeure de l'unité de séchage.
- Les sources diffuses sont celles déjà citées ci dessus (production du CVM). Les opérations d'ouverture des réacteurs, lorsque ceux ci sont du type ouvert, sont importantes. En effet, il est nécessaire de procéder à cette ouverture après quelques opérations seulement, alors qu'en réacteur fermé on peut aller jusqu'à une centaine de cycles de fabrication.
Deuxièmement, lorsque le PVC est produit en émulsion, le CVM est émis :
- Dans les eaux résiduaires, en quantité trois fois plus importante que dans le procédé en suspension (EC, 2005)
- est émis par voie canalisée venant de la tour d'atomisation et de la sortie du filtre à manche, et
- par voies diffuses analogues à celles citées ci dessus (production du CVM).
Présence environnementale
Aquatique
FTE 2005 Importer
Des données relatives aux concentrations dans l'eau publiées par Euro Chlor (1999) indiquent que dans les eaux côtières et les estuaires, les concentrations observées sont inférieures à 0,15 µg.l-1. Le même organisme considère les niveaux de référence pour une rivière localisée dans une zone non industrielle comme étant probablement inférieurs au niveau de détection (0,008 µg.l-1). Euro chlor indique également que dans l'eau du Rhin et des autres rivières adjacentes, le niveau mesuré récemment près du point d'émission s'élève jusqu'à 0,4 µg.l-1.
Perspectives de réduction
Réduction des rejets
Recyclage
FTE 2005 Importer
Un autre moyen pour réduire la production de PVC par le CVM est de recycler les déchets de PVC en fin de vie afin de faire de la valorisation matière. Les industriels du secteur se sont, pour cela, organisés en association et ont lancé le programme d'action Vinyl 2010, qui vise en autre, à recycler, en Europe, 200 000 tonne de déchets de PVC post consommation par an d'ici fin 2010 (Vinyl2010, 2004). Ainsi, en 2004, les groupes sectoriels ont recyclé 18 077 tonnes de PVC, en augmentation de 30% par rapport à 2003.
Réduction des émissions industrielles
FTE 2005 Importer
Production de CVM
La synthèse de CVM, produit peu de déchets ou d'effluents aqueux comme gazeux. Le plus souvent, cette synthèse s'accompagne de la purification du CVM et du recyclage de l'acide chlorhydrique ou du chlorure d'éthylène qui sont ensuite réintroduits dans la chaîne de production. Les rejets gazeux proviennent donc majoritairement des opérations de stockage et de chargement/déchargement de CVM. C'est donc sur ces installations qu'il faut contrôler le mieux possible les rejets. Pour cela, plusieurs solutions existent (IPPC, 2002):
- Le stockage du CVM doit se faire, soit dans des conteneurs pressurisés mais à température ambiante, soit dans des conteneurs réfrigérés et à pression atmosphérique. On évite ainsi la formation trop importante de vapeur de CVM.
- Les vapeurs, provenant soit du dégazage des installations de stockage, soit des installations de production de CVM, doivent être traitées. Pour cela, on peut soit les brûler, soit les traiter par oxydation catalytique ou les adsorber sur du charbon actif.
- Pour les phases de chargement et déchargement, il est préférable de travailler en milieu fermé, ce qui est possible lorsque les sites de production sont proches des sites de transformation comme c'est le cas pour les usines de Tavaux ou de l'étang de Berre. En revanche les productions de CVM et de PVC du groupe Arkema sont dissociées (Akerman, F., Massey, R., 2005). Ainsi, le CVM est produit autour de Lavéra et le PVC dans la région lyonnaise (St Fos et Balan). Arkema achemine en fait le CVM en péniche jusqu'à Lyon puis dans un pipeline de 45 km reliant St Fons à Balan. Ce transport pose de nombreux problèmes, car les péniches transportent en moyenne 2 500 tonnes de CVM (toxique et inflammable) sur le Rhône, et le pipeline peut contenir jusqu'à 720 tonnes de CVM. Pour ces transports, il faut capter les vapeurs avec par exemple des systèmes de retour vapeur.
Toutes ces solutions doivent bien sûr s'accompagner de moyens de surveillance et de détection des fuites. Ainsi que d'un entretien régulier des installations (surveillance des joints…).
Le CVM est un composé très volatil. On peut en général lui appliquer les techniques de traitement des COV, en particulier le procédé de lavage des gaz sur lit bactérien pour lequel il est possible d'obtenir des rendements épuratoires de 99%. Le tableau suivant résume ces différentes techniques de traitement des COV (EC, 2001) :
Tableau 4.3.1 : Procédés de traitement des COV, source (EC, 2001)
Lorsqu'il est présent dans les effluents aqueux, on peut récupérer le CVM par des opérations de stripping avec de l'air. Selon le Document de Référence sur les Meilleures Techniques Disponibles pour le traitement des effluents dans la chimie (EC, 2001), un tel procédé permet d'atteindre un taux d'abattement de près de 90% dans le cas molécule chlorées (trichloroéthène, dichlorométhane…). Le coûts d'une telle installation est de 4 à 5 millions d'€ (exemple d'une raffinerie avec un traitement par stripping d'eau de 30 m3/h).
Production de PVC
Recyclage des effluents contenant du CVM
La fabrication de PVC se fait selon des procédés de fabrication utilisant de l'eau (procédé par suspension ou par émulsion). Au cours de ces synthèses, le CVM n'est pas entièrement consommé, et on cherche à le réutiliser. Il est donc nécessaire de mettre en place des procédés permettant de récupérer ce CVM résiduel à chaque étape de production et ainsi d'en limiter les émissions vers l'environnement. (EC, 2005).
Ainsi, à la suite des étapes de polymérisation (en émulsion et en suspension), on effectue des étapes de stripping (re vaporisation), de concentration et de séchage qui vont permettre de récupérer le CVM résiduel et de purifier le PVC produit en éliminant en particulier l'eau de process. Le CVM ainsi récupéré peut ensuite être reconcentré et réutilisé lors d'une production ultérieure.
Les effluents gazeux contenant du CVM qui ne peuvent pas être valorisés seront ensuite traités, soit par absorption ou adsorption chimique, soit par incinération, ou soit par traitement catalytique.
Traitement des effluents aqueux
En plus des effluents concentrés en CVM, la synthèse de PVC produit d'autres effluents aqueux qu'il faut traiter (eaux de lavage). Ces eaux subissent des opérations d'extraction permettant de récupérer le CVM (EC, 2005), comme par exemple des opérations de stripping. Le CVM ainsi récupéré peut être réintroduit dans la chaîne de production et les eaux sont envoyées vers une station de traitement des effluents. Elles subissent alors des opérations physico chimiques (floculation/coagulation, filtration membranaire) permettant de récupérer en particulier le PVC et d'abaisser la DCO.
Impact économique des mesures de réduction
Les émissions de CVM proviennent en très grande majorité des rejets des usines de fabrication de CVM ou de PVC. Pour réduire ces émissions, on peut soit agir à la source, en réduisant par exemple la production de CVM, soit agir directement en sortie des installations en réduisant leurs émissions polluantes.
Réduction à la source
La réduction à la source des émissions de CVM, passe par la réduction de la production de CVM. Pour cela, deux solutions peuvent être envisagées. Soit on réduit la consommation de PVC, en réduisant par exemple son utilisation, soit on recycle le PVC en fin de vie pour en faire du PVC secondaire.
Pour réduire les usages du PVC, il faut utiliser des produits de substitution. Comme on l'a vu, il en existe un grand nombre, pour des usages très différents. Certaines alternatives ne coûtent pas plus cher que le PVC, voire même un peu moins. D'autres coûtent légèrement plus. Ainsi, en considérant les coûts annualisés, le bois, utilisé pour les revêtements extérieurs, est moins cher que le PVC pour les constructions de hautes gammes. De même, la fibre ciment (mélange de sable et de fibres cellulosiques) est moins chère pour les bâtiments bon marché (Akerman, F., Massey, R., 2005).
Les revêtements de sols en PVC nécessitent un entretien important, ils sont donc plus chers pour des utilisations où les coûts d'entretien sont élevés (bâtiments publics…). Dans ce cas, il sera préférable de les remplacer par des produits alternatifs.
De façon générale, même si les produits en PVC sont moins chers à l'achat, ils ont une durée de vie plus courte, comme c'est le cas pour les fenêtres, les revêtements de façades, les canalisations… Pour voir si les alternatives sont économiquement acceptables, il faut comparer les différents produits, sur la totalité de leur cycle de vie. Enfin, tout comme le PVC, les alternatives créent des emplois dans l'industrie. En outre, les producteurs de PVC sont également producteurs de produits alternatifs. Ainsi, le groupe Arkema, principal producteur de PVC français est aussi un grand producteur de PE et de nombreux autres plastiques. Arkema présente même ses résines Lotryl comme le produit idéal parmi les produits « sans halogènes » (Akerman, F., Massey, R., 2005).
Le recyclage du PVC est aussi une solution pour réduire les émissions de CVM. Cette voie est défendue par les professionnels du PVC, qui dans le cadre du programme Vinyl2010 ont mis en place des filières de récupération et de retraitement du PVC. Les déchets de PVC sont alors valorisés ; le PVC recyclé est principalement utilisé dans la partie centrale de tubes coextrudés, dans les inserts de contreforts de chaussures, dans les sous couches de dalles de sol, en articles thermoformés et en fibres textiles. Le PVC recyclé coûte en moyenne 30% moins cher que le PVC vierge (Vignes, J.L., 2005).
Réduction des rejets industriels
En France, plus de la moitié des émissions de CVM, proviennent de l'usine de St Auban qui ne produit pourtant que 10% du CVM français (cf. tableau 2.1.2.a). Cette usine fait d'ailleurs l'objet d'une surveillance importante de la part de la DRIRE de la région Provence Alpes Côte d'Azur qui a limité, par arrêt préfectoral du 10 juin 2003, les rejets atmosphériques de CVM à 119 tonnes par an à compter du 1er janvier 2005 (DRIRE PACA, 2003). Le groupe Arkema a décidé de fermer les unités de fabrication du CVM dans l'usine de St Auban, en recentrant l'activité de l'usine sur la production de résines de PVC. Ces changements laissent donc présager d'une réduction des émissions de CVM pour le principal émetteur français.
Le coût des installations de traitement des effluents aqueux, comme des rejets gazeux est difficile à déterminer car il dépend de la composition des effluents de production (quantité, qualité, nature des produits…) ainsi que du milieu récepteur. Toutefois, selon (EC,2002), l'installation d'une unité de stripping traitant un flux de 40 m3 par heure, coûte 3 M€. De même, on peut citer à titre indicatif les coûts de quelques installations de traitement des COV (EC, 2001) :
Alternatives aux usages
FTE 2005 Importer
Chlorure de vinyle
Synthèse du trichloro 1,1,1 éthane
La production, comme solvant, de trichloro 1,1,1 éthane est interdite depuis 1996, mais la production, comme matière première est encore autorisée. Pour synthétiser ce composé, on peut utiliser deux procédés à partir du 1,2 dichloroéthane (CH2Cl CH2Cl) :
- Procédé par pyrolyse et obtention du chlorure de vinyle (CH2=CHCl) puis par hydrochloration (par HCl) et obtention du 1,1 dichloroéthane (CH3 CHCl2), puis chloration.
- Procédé par chloration et obtention du 1,1,2 trichloroéthane (CH2Cl CHCl2), qui décomposé par la chaleur ou traité par NaOH donne le 1,1 dichloroéthylène (ou chlorure de vinylidène, CH2=CCl2). Le 1,1 dichloroéthylène, en phase liquide, réagit avec du chlorure d'hydrogène gazeux, en absence d'eau et en présence de chlorure ferrique.
![]()
En France, Arkema à Saint Auban (04) utilise le procédé par chloration avec une capacité de production de 50 000 t.an-1, les produits formés n'étant employés, depuis début 1996, que comme matières premières, principalement dans la fabrication de HCFC 141 et 142b.
Pour plus de détails cf. la fiche sur le 1,1,1 trichloro éthane.
Synthèse du PVC
Il n'y a pas de produit de substitution au CVM pour synthétiser le PVC.
Polychlorure de vinyle
Le polychlorure de vinyle, même si il ne provoque pas d'émissions importantes de CVM, est source de nombreuses polémiques car certaines substances chimiques qu'il renferme (phtalates, organoétains) sont toxiques et peuvent être à l'origine de pollution de l'air. De plus, comme le PVC est le principal débouché du CVM, sa fabrication est la cause directe ou indirecte de la quasi totalité des rejets de CVM dans l'environnement. Pour toutes ces raisons, de nouvelles réglementations limitent la mise sur le marché d'objets en PVC (Allemagne, Suède). Confrontés à ces restrictions et surtout à la pression des sociétés de consommateurs, les industriels sont donc amenés à développer de nouveaux produits ne contenant plus de PVC. Mais, en raison de sa polyvalence et du large éventail d'applications, il n'y a pas un seul matériau individuel qui pourrait servir de substitut dans toutes les applications, mais toute une série, en fonction du produit concerné. Pour réaliser des substitutions il est nécessaire de réaliser des analyse de cycles de vie (ACV), permettant de comparer l'impact environnemental de plusieurs produits. Des études sur ce sujet sont actuellement menées par la commission européenne (http://europa.eu.int/comm/ environment/waste/studies/pvc/lca_study.htm.). Elles montrent notamment que, sur l'ensemble du cycle de vie, la fabrication du CVM est une étape ayant un impact environnemental significatif.
Déjà de très nombreux industriels ont supprimé ou réduit leur usage du PVC dans leurs produits (Greenpeace, 2003) :
- Les constructeurs automobiles remplacent par exemple le PVC contenu dans les intérieurs des véhicules, par des produits à base d'oléfines.
- Certaines bouteilles d'emballage en PVC peuvent être remplacées par du Polyethylène terephtalate (PET) (cosmétique, alimentaire)
- Les cartes de crédits en PVC peuvent être remplacées par des cartes en PET ou avec des matériaux à base de polyoléfines.
- Les plastiques en PVC des appareils électroniques peuvent être remplacés par du Polyethylène (PE), du PET et du Polystyrène (PS) en fonction des utilisations.
- Les emballages en PVC de produits pharmaceutiques sont remplacés par des produits à base de polypropylène (PP).
- Les jouets en PVC peuvent être remplacés par des matériaux à base de PP, d'acétate de vinyle éthylène ou d'ABS (Acrylonitrile Butadiene Styrene).
- Les tubes et flexibles de gaz et les canalisations d'eau peuvent être remplacés par du polyéthylène moyenne densité.
- Les canalisation en PVC, peuvent être remplacées par des tuyauteries en cuivre, fer, béton ou grès vitrifiés qui restent très utilisés pour les tuyaux de gros diamètre. L'ABS et le PE sont également très utilisés pour les tuyauteries (gouttières…).
- Les revêtements extérieurs en PVC peuvent être bien sûr remplacés par le bois, ainsi que la fibre ciment (Akerman, F., Massey, R., 2005).
- Les fenêtres en bois, aluminium, ou en fibres de verres sont des alternatives aux fenêtres en PVC.
- Les sols en liège, le linoléum, le stratica®, sont des matériaux pouvant remplacer les sols en PVC.
Conclusion
FTE 2005 Importer
Le chlorure de vinyle est un composé organique, gazeux dans les conditions ambiantes, cancérigène et extrêmement inflammable. Il est utilisé à plus de 95% pour la fabrication du polychlorure de vinyle (PVC), 3ème polymère utilisé dans le monde. En France, en 2003, la capacité de production de CVM était de 1290 kt.an-1, répartie sur 4 sites (les unités du site de St Auban devraient fermer en 2006). Cette production sert à la synthèse de PVC dont les capacités de production étaient en 2003 de 1445 kt.an-1, répartie sur 7 sites.
Les rejets de CVM proviennent, quasi exclusivement, des émissions industrielles des producteurs de CVM et de PVC. Les rejets de CVM vers l'atmosphère sont 100 fois plus importants que les rejets dans les milieux aqueux. Dans ces conditions les effluents gazeux pourraient représenter, par l'intermédiaire des eaux de ruissellement, la première source de rejet indirect de CVM dans les milieux aqueux. En outre, depuis 1985, les émissions de CVM sont en fortes diminutions, que se soit dans l'eau ou dans l'air.
Dans un contexte d'augmentation régulière des capacités de production, ces réductions des émissions de CVM s'expliquent avant tout par l'amélioration des procédés de production de PVC et de CVM et des procédés de traitement des effluents. Néanmoins, on constate aujourd'hui que de nombreux industriels développent des alternatives, moins nocives et plus économiques, à leurs usages du PVC. On peut donc s'attendre, dans ces prochaines années, soit à une stabilisation, soit à une diminution de la consommation de PVC comme on a déjà pu le constater entre 2002 et 2003. Cette stabilisation de la consommation, qui s'ajoute aux objectifs de valorisation matière du PVC en fin de vie, pourrait ainsi accélérer la réduction des émissions de CVM à l'horizon 2015.
De plus, selon le programme Vinyl2010, les industriels se sont engagés à recycler une grande partie du PVC en fin de vie. Les objectifs de cette démarche sont de valoriser chaque année 200 000 t de PVC en Europe, d'ici à 2010, ce qui représente, pour une capacité de production européenne de 6 500 t, 3% du PVC produit chaque année. Ce programme pourrait donc aussi avoir pour conséquence de réduire d'autant la production de CVM.
On peut également améliorer les procédés de production et de traitement des effluents chargés en CVM.
Par ailleurs, ce site Arkema de St Auban, responsable de la moitié des rejets de CVM en France va fermer.
Compte tenu de tous ces éléments, et en prenant comme référence l'année 1995, il semble possible de réduire significativement les émissions françaises de CVM à l'horizon 2015.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :