Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Cadmium (7440-43-9)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
7440-43-9
Nom scientifique (FR)
Cadmium
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-152-8
Code SANDRE
1388
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Cd }\)
Code InChlKey
Code SMILES
[Cd]
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H330 |
|---|---|
| Mention du danger - Texte | Mortel par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H341 |
|---|---|
| Mention du danger - Texte | Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Mention du danger - Code | H361fd |
|---|---|
| Mention du danger - Texte | Susceptible de nuire à la Fertilité. Susceptible de nuire au fœtus. |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Mention du danger - Code | H372 |
|---|---|
| Mention du danger - Texte | Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
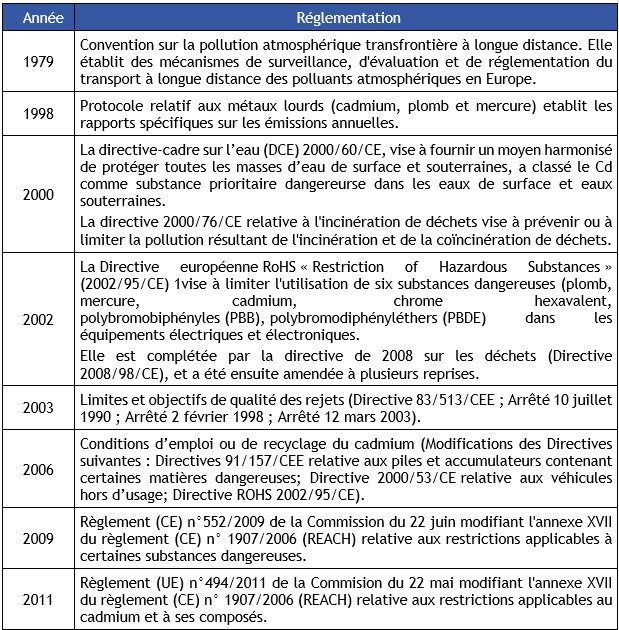
Règlementations
Physico-Chimie
Dernière vérification le 11/08/2025
Généralités
Poids moléculaire
112.41 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 04/08/2025
Matrices
Atmosphère
Le cadmium et ses composés ne sont pas ou sont très peu volatils. Dans l’air, le cadmium est présent sous forme particulaire, la principale forme étant l’oxyde de cadmium (les autres formes étant des sels de cadmium).
Milieu eau douce
Le cadmium à l’état métallique n’est pas soluble dans l’eau, ses sels le sont plus ou moins (la solubilité dépendant du contre-ion et du pH). En milieu aquatique, le cadmium est relativement mobile et peut être transporté sous forme de cations hydratés ou de complexes organiques ou inorganiques (HSDB, 2001).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Le cadmium est assez mobile dans les sols, néanmoins il a tendance à s’accumuler dans les horizons supérieurs du sol, riches en matière organique. La mobilité du cadmium est essentiellement fonction du pH du sol, son adsorption par la phase solide du sol pouvant être multipliée par un facteur de 3 lorsque le pH augmente d’une unité dans la plage 4-8 (Adriano, 1986).
Dans le sol, il existe sous forme soluble dans l’eau du sol : CdCl2, CdSO4 ou sous forme de complexes insolubles inorganiques ou organiques avec les constituants du sol.
Les principaux minerais contenant du cadmium sont le greenockite et l’hawleyite (avec comme contre ion l’ion sulfure), l'octavite (associé au carbonate), et le monteponite (associé à l'oxygène).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Le cadmium peut se concentrer dans les organismes par les chaînes alimentaires (Bottin et al. 2014b). Les facteurs de bioconcentration (BCF) pour le cadmium sont plus élevés pour les producteurs primaires que pour les poissons. Le BCF diminue lorsque la concentration d'exposition augmente. Il diminue également lorsque la dureté de l'eau croit.
Des BCF (poids frais) ont été calculés compris entre
- 1 636 et 23 143 (moyenne 7 535) pour les algues,
- 396 et 17 560 (moyenne 994) pour les invertébrés
- 0,5 et 6 484 (moyenne 229) pour les poissons.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
L'INERIS recommande de consulter la Base de données sur les teneurs en éléments traces métalliques de plantes potagères - BAPPET (ADEME, INERIS, ISA, INPT – ENSAT, Cnam – IHIE Ouest (2007), une base gratuite et téléchargeable, dont les sources documentaires sont les suivantes pour la recherche de facteurs de transfert - BCF dans les végétaux (cf. également le document « Présentation et Notice d’utilisation » de BAPPET (ADEME, INERIS, ISA, INPT – ENSAT, Cnam – IHIE Ouest (2007)). Cette base concerne les substances suivantes : As, Cd, Co, Cr, Cu, Hg, Mo, Ni, Pb, Se, Tl, Zn et les types de plante : légume feuille, légume tige, légume racine, légume tubercule, légume bulbe, légume sec, légume fleur, légume fruit, fruit, fines herbes. Les données ont été extraites des sources documentaires suivantes : des articles scientifiques publiés dans des revues à comité de lecture, des rapports expérimentaux d’organismes de recherches et de chambres d’agriculture, des diagnostics environnementaux liés notamment aux sites industriels en activité ou non, les données en provenance d’articles scientifiques sont à ce jour majoritaires. Les articles et rapports correspondent à des sites soumis à des contaminations uniques ou multiples d’origines industrielles, urbaines et/ou agricoles dans des contextes industriels, urbains ou ruraux. Les données issues de plantes cultivées dans des jardins potagers, n’étant pas suffisantes dans la littérature, ont été complétées par des données correspondant à des cultures sur parcelles agricoles. Les cultures de plantes en milieu contrôlé avec des apports artificiels en éléments traces ont été prises en compte si celles-ci n’étaient pas trop éloignées des conditions potentiellement rencontrées sur le terrain. Les données obtenues hors du territoire métropolitain ont été retenues dans la mesure où la situation environnementale pouvait s’apparenter aux conditions métropolitaines (exemple : type de sol). Des documents présentant des concentrations d’ETM dans les plantes couplées avec des teneurs en ETM du ou des milieu(x) environnementaux (sol, eau, air) ont été considérés. Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres indiqués en gras dans la liste ci-dessous) afin de se rapprocher des conditions propres à la situation étudiée. La base de données regroupe sur un même support des données relatives à la contamination de plantes potagères sélectionnées dans la littérature scientifique et technique. Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude . Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des ETM pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
Bibliographie
Toxicologie
Dernière vérification le 04/08/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1994, 1999, 2012 ; CE, 2007 ; EFSA, 2009 ; IARC, 1993, OMS/FAO, 2011). Les références bibliographiques sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas toujours fait l’objet d’un nouvel examen critique systématique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
Lors d’une exposition par inhalation, une fraction du cadmium se dépose le long du tractus respiratoire en fonction de la taille des particules. Soixante quatre pour cent du cadmium déposé dans les poumons sont absorbés (CE, 2007). Les composés les plus hydro-solubles, chlorure et oxyde sont absorbés à environ 90-100 % et le sulfure est absorbé à hauteur de 10 %. Cette absorption après une inhalation unique peut se faire sur une période de plusieurs semaines (Nordberg et al., 1985 ;(CE, 2007).
Voie orale
Par voie digestive, l’absorption est d’environ 5 % (Vahter et al., 1996) ; (Berglund et al., 1994). Le taux d’absorption du cadmium est directement lié à la forme chimique en fonction de la solubilité. Ce taux d’absorption peut être augmenté lors de carences alimentaires en calcium, en fer, en zinc, en cuivre ou en protéines (Nordberg et al., 1985) ; (CE, 2007) ; (Reeves et Chaney, 2008) ; (EFSA, 2009) ; (Kippler et al., 2007) ; (Barregard et al., 2010).
Voie cutanée
L’absorption par voie cutanée est faible, aucune donnée disponible ne permet de la quantifier (Wester et al., 1992).
Distribution
Le cadmium est transporté dans le sang fixé à l’hémoglobine ou aux métallothionéines*. Le cadmium se concentre principalement dans le foie et les reins : entre 50 % et 70 % de la charge totale (Christoffersen et al., 1988) ; (EFSA, 2009) ; (Nordberg et al., 2007). Il est également retrouvé dans les os, le pancréas, la glande thyroïde, les testicules et les glandes salivaires. Les concentrations de cadmium dans les reins sont proches de zéro à la naissance et augmentent linéairement avec l’âge jusqu’à un pic d’environ 40 à 50 mg.kg-1 de poids corporel vers l’âge de 50 à 60 ans, puis diminuent (EFSA, 2009). Les concentrations hépatiques de cadmium sont également proches de zéro à la naissance, augmentent jusqu’à 1 à 2 mg.kg-1 à l’âge de 20 à 25 ans, puis augmentent lentement tout au long de la vie (Sumino et al., 1975) ; (Lauwerys et al., 1984) ; (Chung et al., 1986). Des études chez les femmes, fumeuses ou non, rapportent que la concentration de cadmium est environ deux fois plus faible dans le cordon ombilical que dans le sang maternel (Lauwerys et al., 1978) ; (Kuhnert et al., 1982) ; (Truska et al., 1989). Le cadmium s'accumule au niveau du placenta pour atteindre des concentrations jusqu’à 10 fois supérieures à celles du sang maternel (Kuhnert et al., 1982) ; (Roels et al., 1978). Dans l’organisme, le cadmium se fixe sélectivement sur les métallothionéines, protéines dont la synthèse est directement stimulée par l’exposition au cadmium. Le cadmium peut également se fixer à d’autres peptides ou acides aminés de faible poids moléculaire tel que le gluthation ou la cystéine respectivement (Zalups et Ahmad, 2003). Le cadmium hépatique est ensuite excrété dans la bile essentiellement sous la forme liée au gluthation ou gagne le plasma sous la forme liée aux métallothionéines. Le cadmium libre est à l’origine des effets toxiques observés. Le cadmium possède une demi-vie de l’ordre de 6 à 38 ans dans le rein, de 4 à 19 ans dans le foie et de 30 jours dans le sang (EFSA, 2009) ; (Nordberg et al., 1985). Les concentrations de cadmium dans le lait maternel correspondent à 5 à 10 % des concentrations sanguines maternelles probablement (Radisch et al., 1987).
*Protéines soufrées de faible poids moléculaire qui réalisent des liaisons fortes avec le cadmium au niveau de ces cystéines.
Métabolisme
Le cadmium n’est pas métabolisé.
Élimination
Le cadmium est excrété dans les fécès, les urines et les phanères. En l’absence de lésions rénales, l’excrétion urinaire du cadmium est proportionnelle à la charge rénale et hépatique mais ne représente qu’une petite fraction de la charge corporelle du cadmium (Roels et al., 1981a). Le complexe cadmium-métallothionéines est filtré à travers le glomérule rénal, où il est dissocié puis réabsorbé par les cellules du tubule proximal jusqu’à une dose critique. Cette concentration critique correspond à la charge en cadmium à partir de laquelle les cellules tubulaires ne sont plus en mesure de synthétiser suffisamment de métallothionéines pour fixer le cadmium libre produit par la dégradation lysosomale du complexe cadmium-métallothionéine. Lorsque la concentration critique est dépassée, des atteintes tubulaires surviennent correspondant à une enzymurie, protéinurie de bas poids moléculaire, une augmentation de l’excrétion urinaire de cadmium sous la forme complexée aux métallothionéines ou libre (EFSA, 2009). La demi-vie rénale apparente a été estimée à 11,6 ans (+/- 3 ans) en moyenne [IC à 95 % : 10,1 – 14,7] pour le cadmium chez 680 suédoises âgées de 56 à 70 ans n’ayant jamais fumé (Amzal et al., 2009). La demi-vie rénale a été calculée en utilisant des modèles toxicocinétiques à partir d’un modèle à un compartiment. En tenant compte du fait que la concentration urinaire en cadmium est proportionnelle à la concentration de cadmium dans le cortex rénal, que l’absorption gastrointestinale chez les femmes est comprise entre 1 et 10 % et qu’environ un tiers de la quantité absorbée est transportée dans les reins, le modèle permet de prédire le niveau de cadmium dans les urines, sauf aux concentrations très faibles (<0,1 µg.g-1 créatinine) : le niveau moyen de cadmium urinaire est de 0,34 µg.g-1 créatinine (0,09 – 1,23 µg.g-1 créatinine)(OMS FAO, 2011).
Chez l'animal
Absorption
Inhalation
Des rats exposés à 20 mg.m-3 de fumées d’oxyde de cadmium pendant 30 minutes présentent un taux d’absorption de 30 % et de 60 % pour une exposition de 280 minutes (Boisset et al., 1978a), (Boisset et al., 1978b). Comme décrit chez l’homme, il existe des différences d’absorption des sels de cadmium en lien avec leur solubilité dans l’eau : le chlorure de cadmium est mieux absorbé que l’oxyde ou le sulfure de cadmium (Glaser et al., 1986), ou la taille des particules : fumées (50 %) ou poussières (30 %) d’oxyde de cadmium (Oberdörster et Cox, 1989).
Voie orale
L’absorption du cadmium interviendrait essentiellement au niveau du duodénum du fait du faible pH. Le cadmium libre, apporté par l’alimentation, serait rapidement fixé par des métallothionéines ou des composants alimentaires. Ce complexe serait plus ou moins absorbé en fonction de sa stabilité à faible pH. Le cadmium ingéré serait alors retenu sous forme liée aux métalloprotéines dans les cellules de la muqueuse intestinale, puis éliminé dans les fécès lors de la desquamation des cellules (Nordberg et al., 1985). L’absorption de cadmium est saturable (Weigel et al., 1984) et dépend de l’hydro-solubilité des sels (CE, 2007). L’absorption digestive est plus importante chez les animaux de grande taille (jusqu’à 12 % chez les singes) que chez les rongeurs (1 à 2 %) (Nordberg et al., 1985).
Voie cutanée
Une faible absorption cutanée (< 1 %) a été mise en évidence lors d’une exposition à une solution à 1 % de CdCl2 appliquée sur la peau de lapin rasée, pendant 5 semaines, ou chez la souris « hairless » pendant 2 semaines (Kimura et Otaki, 1972).
Distribution
Voie orale
De nombreuses études montrent que les organes cibles du cadmium sont le foie et les reins ; ces organes concentrent 50 à 75 % de la charge corporelle totale en cadmium (Weigel et al., 1984) ; (CE, 2007). Dans un premier temps, il s’agit d’une augmentation des concentrations hépatiques puis d’une redistribution vers les autres organes essentiellement les reins.
Métabolisme
Le cadmium n’est pas métabolisé.
Élimination
L’excrétion rénale de cadmium n’est observée que suite à la survenue de dysfonctionnements tubulaires rénaux (CE, 2007). Le passage du cadmium dans le lait maternel reste limité (Bhattacharyya et al., 1981), (Bhattacharyya et al., 1982) ; (Pietrzak-Flis et al., 1978) ; (Lucis et al., 1972).
Autre
Mécanisme d’action
Génotoxicité Le cadmium n’est pas directement génotoxique : il n’est pas mutagène chez les bactéries et faiblement mutagène sur les cellules de mammifères (EFSA, 2009). Au moins trois mécanismes d’action jouent un rôle prédominant dans la génotoxicité du cadmium : 1) L’induction indirecte d’espèces réactives de l’oxygène, 2) L’inhibition de la réparation de l’ADN, 3) La rupture de brins d’ADN par action directe sur la chromatine. A des concentrations cytotoxiques, le cadmium induit des cassures simples brins de l’ADN et une instabilité génomique sur plusieurs types de cellules de mammifères essentiellement liées au stress oxydant. A des concentrations de cadmium sub-cytotoxiques, il peut inhiber les processus de réparation de l’ADN rendant les cellules plus vulnérables à d'autres éléments délétères. Par ce mécanisme, le cadmium peut augmenter la mutagénicité induite par d’autres agents agissant sur l’ADN. Le mécanisme moléculaire précis impliqué dans l’inhibition de la réparation de l’ADN induite par le cadmium n’est pas clairement identifié. Il semblerait que le cadmium puisse agir au niveau de la réparation ou de l’accumulation de 8-hydroxyguanine par inactivation d’une série de protéines impliquées dans les premières étapes de la réparation de base par excision. Les protéines concernées sont XPA et TFIIH. Le cadmium pourrait également agir au niveau de la réparation des appariements (MMR) en agissant spécifiquement sur les liaisons avec l’ATP et l’hydrolyse des activités des enzymes MMR réduisant leur liaison à l’ADN et la reconnaissance des appariements (Giaginis et al., 2006). Au niveau des cellules rénales, la production d’espèces réactives de l’oxygène est clairement suspectée au niveau mitochondrial sans pour autant que les mécanismes soient totalement identifiés (Gobe et Crane, 2010) ; (Joseph, 2009).
Effets sur l’expression de gènes
Le cadmium affecte à la fois la transcription et la translation. Le cadmium interfère avec la concentration interne en calcium et joue un rôle sur les voies alternatives de la traduction des différents signaux de régulation cellulaire (Chang et Shoback, 2004). Le cadmium peut donc altérer l’homéostasie calcique du fait de ses capacités à moduler les récepteurs de détection du calcium extracellulaire (CaSR). Une étude chez la souris montre que le cadmium pourrait alors agir sur la fonction de production lactée au niveau de la glande mammaire et, par là, altérer le développement des jeunes (Ohrvik et al., 2006). Le cadmium n’agit pas directement sur la réaction de Fenton, mais induit la production d’espèces réactives de l’oxygène, perturbe l’homéostasie rédox et donc agit sur de nombreux facteurs de transcription dont le MTF1 qui est un inducteur des métallothionéines (Zhang et al., 2003). En modulant l’expression des gènes et le signal de transduction, le cadmium peut altérer la prolifération cellulaire, la différentiation, l’apoptose et les autres fonctions cellulaires (Waisberg et al., 2003), (Thevenod, 2009). La perturbation de ces mécanismes peut, in fine, contribuer à la cancérogenèse (EFSA, 2009). Le cadmium inhibe l’expression du suppresseur de tumeur p53 (Meplan et al., 1999), (Chatterjee et al., 2008) ce qui a été mis en cause dans les cancers du sein (Antila et al., 1996) ; (McElroy et al., 2006) et de l’ovaire (Philipp et Hughes, 1982).
Fonctions endocrines
Comme le rapporte l’expertise collective de (INSERM, 2008), l’effet œstrogène est corrélé à la constante d’affinité pour les récepteurs oestrogèniques (Stoica et al., 2000) ; (Johnson et al., 2003) ; (Nesatyy et al., 2006) ; (Brama et al., 2007). Le cadmium possède un fort effet inhibiteur de l’expression d’Epo aussi bien in vivo que in vitro (Horiguchi et al., 2006). Par ailleurs, de fortes concentrations de cadmium (1 mg.kg-1) 5 jours par semaine, pendant 6 semaines par voie intra-péritonéale, altèrent la synthèse stéroïdienne dans les organes reproducteurs femelles chez les rats (Zhang et al., 2008). A faible dose, le cadmium possède des activités œstrogènes et androgènes-like in vitro et in vivo par liaison directe sur les récepteurs androgènes et œstrogènes (Takiguchi et Yoshihara, 2006).
Synthèse
Chez l’homme, l’absorption pulmonaire du cadmium est proche de 100 % pour les composés les plus solubles (chlorure et oxyde de cadmium) et 10 % pour les moins solubles (sulfure de cadmium) pour les expositions par inhalation. Par voie orale, le taux d’absorption est d’environ 5 % et de l’ordre de 1 % par voie cutanée. Le cadmium est transporté dans le sang sous forme liée à l’hémoglobine ou aux métallothionéines. C’est un toxique cumulatif. Il se concentre surtout dans le foie et les reins où il est stocké. Le cadmium libre est à l’origine des effets toxiques observés. Le cadmium n’est pas métabolisé. Il est excrété principalement les fécès et un peu dans les urines. L’excrétion urinaire est proportionnelle à la charge corporelle en cadmium au niveau rénal et hépatique.
Chez l’animal, les résultats sont similaires à ceux observés chez l’homme.
Toxicité aiguë
Chez l'homme
Inhalation
Par inhalation, lors d’intoxications aiguës sévères par les fumées de cadmium, la mortalité est estimée comme pouvant atteindre 15 à 20 % de ceux qui développent une pneumonie chimique. La mort survient souvent 1 à 3 jours après l’exposition, les effets observés pendant cette période sont une irritation pulmonaire sévère accompagnée de dyspnée, de cyanose et de toux (Lauwerys, 1990). La mort est généralement due à un œdème pulmonaire. La charge pulmonaire mesurée lors de ces décès est de 1,5 à 4,7 µg.g-1 (Patwardhan et Finckh, 1976) ; (Lucas et al., 1980) ; (Seidal et al., 1993).
Les sujets qui survivent à ce type d’intoxication aiguë ne gardent généralement pas de séquelle. Cependant, certains auteurs rapportent des atteintes pulmonaires différées (Barnhart et Rosenstock, 1984) ; (Townshend, 1982).
Sur la base des données obtenues lors d’expositions professionnelles, il a été estimé qu’une exposition de 8 heures à 5 mg.m-3 pourrait être mortelle et qu’une exposition de 8 heures à 1 mg.m-3 pourrait être dangereuse pour la santé humaine (CRC, 1986).
Voie orale
Par voie orale, les symptômes observés sont une gastro-entérite avec crampes épigastriques, des vomissements, des diarrhées et des myalgies.
Une intoxication mortelle a été observée lors de l’ingestion volontaire de 5 g d’iodure de cadmium (Wisniewska-Knypl et al., 1971).
Un autre cas est décrit suite à l’ingestion de 150 g de chlorure de cadmium (Buckler et al., 1986). La mort est survenue en quelques heures par développement d’un œdème pulmonaire, d’épanchements pleuraux et d’une ascite. Il a été observé une nécrose focale hépatique, un aspect un peu hémorragique du pancréas et l’absence d’atteinte rénale.
Voie cutanée
Les rares études disponibles ont montré qu’un petit nombre de patients soumis à un patch-test (25 cas sur 1 502 exposés) à une dose de 2 % de chlorure de cadmium développait une irritation (Wahlberg, 1977). Ces résultats ne sont pas suffisants pour classer le cadmium comme irritant cutané. Le cadmium n’est ni corrosif ni sensibilisant (CE, 2007).
Synthèse
Chez l’homme, l’intoxication aiguë sévère par inhalation conduit à une pneumonie chimique pouvant être mortelle dans 15-20 % des cas. Les effets observés pendant cette période sont une irritation pulmonaire sévère, accompagnée de dyspnée, cyanose et toux.
Chez l'animal
Inhalation
Une CL50 de 30 mg Cd.m-3 est déterminée pour 15 minutes d’exposition à de l’oxyde de cadmium chez le rat (Barrett et Card, 1947) et une CL50 de 28,4 mg Cd.m-3 pour 4 heures d’exposition aux poussières de cadmium métallique chez le lapin (Friberg, 1950).
Aucune valeur fiable de CL50 n’est déterminée pour des expositions de 15 minutes aux fumées d’oxyde de cadmium chez le singe, chez la souris, chez le cobaye et chez le chien (Barrett et Card, 1947). En effet, le faible nombre d’animaux utilisés limite la qualité de l’étude.Des expositions à l’oxyde de cadmium à des concentrations supérieures à 5 mg.kg-1 induisent une destruction des cellules de l’épithélium pulmonaire, une trachéo-bronchite et une pneumonie.
Une étude a été menée chez les rats et les souris pour des concentrations de 0,1 à 10 mg.m-3 d’oxyde de cadmium sous forme d’aérosol 6 heures par jour, 5 jours par semaine, pendant 2 semaines (NTP, 1995). Les animaux exposés à la plus forte concentration, qui meurent au bout de 6 jours et présentent une inflammation, une nécrose et une fibrose pulmonaires. Une inflammation au niveau de la cavité nasale et des ganglions lymphatiques trachéobronchiques est également observée à 10 mg.m-3. A toutes les autres concentrations, une diminution du poids corporel est rapportée.
Voie orale
Les DL50 des différentes formes solubles de cadmium sont comprises entre 50 et 400 mg.kg-1 de poids corporel chez les rongeurs (Baer et Benson, 1987) ; (Basinger et al., 1988) ; (Kostial et al., 1978) ; (Kotsonis et Klaassen, 1978) ; (Shimizu et Morita, 1990) ; (ATSDR, 2008) ; (CE, 2007).
Lors de l’exposition par la voie orale, les souris sont plus sensibles que les rats. La toxicité aiguë varie en fonction de la forme chimique des composés du cadmium étudiés. Les composés peuvent être classés par ordre croissant de toxicité : CdS, Cd élémentaire, CdO, CdSO4 et CdCl2.
Des souris exposées à des doses de 0 – 0,6 – 3,9 – 7,9 – 15,9 – 30,7 – 60,2 – 89,9 mg Cd. kg-1 sous la forme de chlorure de cadmium à une dose unique par gavage ont présenté des atteintes digestives (Andersen et al., 1988) : gastroentérite, hyperémie, gastroentérite hémorragique, desquamation épithéliale ou nécrose avec hémorragie sévère de l’ensemble de l’épithélium de l’estomac et du duodénum et dans une moindre mesure de l’intestin grêle. Les atteintes hépatiques et rénales restent légères alors qu’une nécrose testiculaire extensive est observée à la plus forte dose.
Voie cutanée
Il n’existe pas de donnée pertinente (EFSA, 2009).
Synthèse
Chez l’animal les effets sont similaires à ceux observés chez l’homme.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Chez l’homme, il est indispensable de prendre également en compte l’apport de cadmium par inhalation via la fumée de cigarette (CE, 2007).
Le principal organe cible est le rein. L’exposition chronique au cadmium entraîne l’apparition d’une néphropathie irréversible pouvant évoluer vers une insuffisance rénale. Une dégénérescence des cellules tubulaires rénales se manifeste précocement, elle est suivie par une réaction inflammatoire interstitielle puis une fibrose (SFSP, 1999). Classiquement, une élimination accrue des protéines de faible poids moléculaire est observée : β2-microglobuline (β2M), protéine de liaison du rétinol (RBP), protéine de liaison de la vitamine D, lysosyme, ribonucléase, alpha1-microglobuline (EFSA, 2009). Cette protéinurie peut s’accompagner de glycosurie et d’aminoacidurie et d’une fuite de calcium (Lauwerys, 1990) ; (Mason et al., 1988) ; (Jarup et al., 1988a) ; (Thun et al., 1989) ; (Chia et al., 1989) ; (Bernard et al., 1990) ; (Roels et al., 1991) ; (Jakubowski et al., 1992).
Lors d’expositions professionnelles, l’atteinte fonctionnelle tubulaire rénale apparaît lorsque la concentration en cadmium dans le cortex rénal atteint environ 200 µg.g-1 de tissu rénal.
Les effets rénaux sont observés pour des concentrations urinaires de cadmium de 1,1 à 15 µg.g-1 de créatinine (Elinder et al., 1985) ; (Jakubowski et al., 1987) ; (Shaikh et al., 1987) ; (Verschoor et al., 1987) ; (Kawada et al., 1989) ; (Bernard et al., 1990) ; (Roels et al., 1991) ; (Chiba et Masironi, 1992) ; (Toffoletto et al., 1992) ; (Roels et al., 1993) ; (Jarup et Elinder, 1994) ; (Chen et al., 2006a) ; (Chen et al., 2006b).
La capacité de synthèse de la métallothionéine ne suffit plus pour maintenir le cadmium rénal sous forme liée et le cadmium non fixé à la métallothionéine peut exercer son action toxique (Lauwerys, 1990).
Inhalation
Effets rénaux
Le rein est donc l’organe cible pour des expositions par inhalation et les premiers effets lors d’expositions professionnelles correspondent à un dysfonctionnement tubulaire associé à une augmentation de l’excrétion urinaire des protéines de faible poids moléculaire telles que la β2M ou la RPB (Lauwerys, 1979) ; (Elinder et al., 1985) ; (Smith et al., 1986) ; (Jakubowski et al., 1987) ; (Shaikh et al., 1987) ; (Verschoor et al., 1987) ; (Mason et al., 1988) ; (Jarup et al., 1988a) ; (Thun et al., 1989) ; (Chia et al., 1989) ; (Bernard et al., 1990) ; (Roels et al., 1991) ; (Jakubowski et al., 1992) ; (Roels et al., 1993). La concentration critique en cadmium dans le cortex rénal associée à une augmentation de l’incidence des dysfonctionnements rénaux au cours d’expositions professionnelles est estimée à environ 200 ppm ce qui correspond une excrétion urinaire de environ 5-10 µg Cd.g-1 créatinine (Friberg et al., 1974) ; (Kjellstrom et al., 1977) ; (Roels et al., 1983).
Plusieurs études ont été conduites chez des travailleurs exposés à des niveaux élevés de cadmium (Cd-U> 10 µg.g-1 créatinine) et pour lesquels des dysfonctionnements tubulaires sont rapportés. Dans ces circonstances, il a été montré que la protéinurie tubulaire est toujours irréversible (Roels et al., 1983) ; (Piscator M., 1984) ; (Elinder et al., 1985) ; (Roels et al., 1989) ; (Jarup L. et al., 1993) ; (Jarup et al., 1998) ; (Mason H.J. et al., 1999).
Une étude a été réalisée en milieu professionnel, sur une cohorte d'une usine de production d'alliage cuivre-cadmium (Mason et al., 1988). Les concentrations mesurées ont diminué au cours du temps : elles étaient supérieures à 480 µg.m-3 avant 1935, comprises entre 150 et 360 µg.m-3 de 1936 à 1972 et comprises entre 34 et 85 µg.m-3 de 1973 à 1983. Les expositions cumulées seraient comprises entre 30 et 13 277 µg.m-3 an. Une augmentation significative des atteintes rénales est observée dans la population exposée. De cette étude, il est possible de définir un NOAEL de 719 µg.m-3 par an et un LOAEL de 1 301 µg.m-3 par an.
Une autre étude a cherché à évaluer les effets de l’exposition par inhalation au cadmium sur la fonction rénale de 82 salariés de sexe masculin (Ellis et al., 1985). Les niveaux d’expositions cumulées sont estimés à 7,5 – 54 - 315 - 684 µg.m-3 par an.
Aucun effet n’est observé pour le plus faible niveau d’exposition, en revanche une augmentation des atteintes rénales est identifiée dès 54 µg.m-3. De cette étude, sont déterminés un NOAEL de 7,5 µg.m-3 et un LOAEL de 54 µg.m-3.
Effets respiratoires
Des troubles respiratoires sont rapportés pour des expositions cumulées par inhalation ; les niveaux d’exposition étaient compris entre 30 et 13 277 µg.m-3 an (Davison et al., 1988) ; (Mason et al., 1988). Ces troubles sont essentiellement liés aux effets irritants des particules de cadmium. Ils comprennent une rhinite, une bronchite, de l’emphysème ainsi qu’une altération de l’odorat (Davison et al., 1988) ; (Smith et al., 1976) ; (Cortona et al., 1992) ; (Leduc et al., 1993). Dans les conditions d’exposition professionnelle au cadmium, l’altération de la fonction pulmonaire ne survient qu’après 20 ans environ d’exposition (Lauwerys, 1990).
L’évaluation de la fonction pulmonaire chez des salariés exposés au cadmium pendant au moins 6 ans à des concentrations souvent supérieures à 200 µg.m-3 montre une altération des paramètres ventilatoires pour le groupe le plus exposé. Les expositions cumulées ont été estimées entre 20 et 700 µg.m-3 et entre 800 et 20 000 µg.m-3 an. Par ailleurs, il a été montré que certaines atteintes pulmonaires peuvent être réversibles (Chan et al., 1988). Une augmentation modérée du volume résiduel a été observée chez les travailleurs exposés à des fumées d’oxyde de cadmium pour une exposition cumulée < 500 µg.m-3 (Cortona et al., 1992). Cette augmentation est considérée comme un effet critique et une LOAEC peut être dérivée à partir des concentrations de cadmium urinaire associées de 3,1 µg.L-1.
Voie orale
Effets rénaux
De nombreuses études ont mis en évidence une augmentation de mortalité en lien avec une augmentation de dysfonctionnements rénaux chez les populations résidant dans des zones polluées au cadmium. Une augmentation statistiquement significative des SMR est observée chez les résidants d’une zone polluée au cadmium au Japon en lien avec une augmentation des biomarqueurs de dysfonctionnements rénaux (Arisawa et al., 2001 ; Arisawa et al., 2007a, 2007b) ; (Iwata et al., 1991a ; Iwata et al., 1991b) ; (Matsuda et al., 2002) ; (Nakagawa et al., 1993) ; (Nishijo et al., 1995), (Nishijo et al., 2004a), (Nishijo et al., 2006).
Une augmentation de la mortalité en lien avec des dysfonctionnements rénaux est également observée dans des zones polluées au cadmium chez des populations en Belgique (Lauwerys et De Wals, 1981) et en Angleterre (Inskip et al., 1982).
Des niveaux élevés de plusieurs biomarqueurs de dysfonctionnements rénaux et/ou une association entre charge corporelle en cadmium et ces biomarqueurs a été rapportée chez des populations résidant dans des zones polluées en cadmium, mais à des niveaux qui restent peu élevés, au Japon (Ezaki et al., 2003) ; (Ikeda et al., 1999) ; (Suwazono et al., 2000) ;(Oo et al., 2000) ; (Uno et al., 2005) ; (Yamanaka et al., 1998), en Belgique (Buchet et al., 1990) ; (Roels et al., 1981a), aux Etats Unis (Noonan et al., 2002). Ces mêmes observations ont également été réalisées sur des populations résidant dans des zones polluées au cadmium en Chine (Cai et al., 1990 ; Cai et al., 1992 ; Cai et al., 1998) ; (Jin et al., 2002 ; Jin et al., 2004a ; Jin et al., 2004c) ; (Nordberg et al., 1997) ; (Wu et al., 2001a), au Japon (Cai et al., 2001) ; (Hayano et al., 1996) ; (Ishizaki et al., 1989) ; (Izuno et al., 2000) ; (Kawada et al., 1992) ; (Kido et Nogawa, 1993) ; (Kobayashi et al., 2002b) ; (Monzawa et al., 1998) ; (Nakadaira et Nishi, 2003) ; (Nakashima et al., 1997) ; (Nogawa et al., 1989) ; (Osawa et al., 2001) ; (Watanabe et al., 2002), en Thaïlande (Teeyakasem et al., 2007), en Suède (Järup et al., 2000 ; Olsson et al., 2002), en Pologne (Trzcinka-Ochocka et al., 2004). Ces données sont synthétisées dans le tableau ci-dessous.
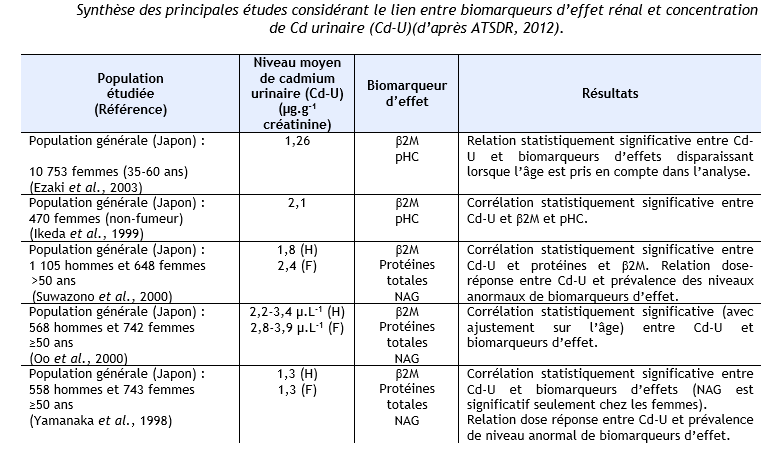
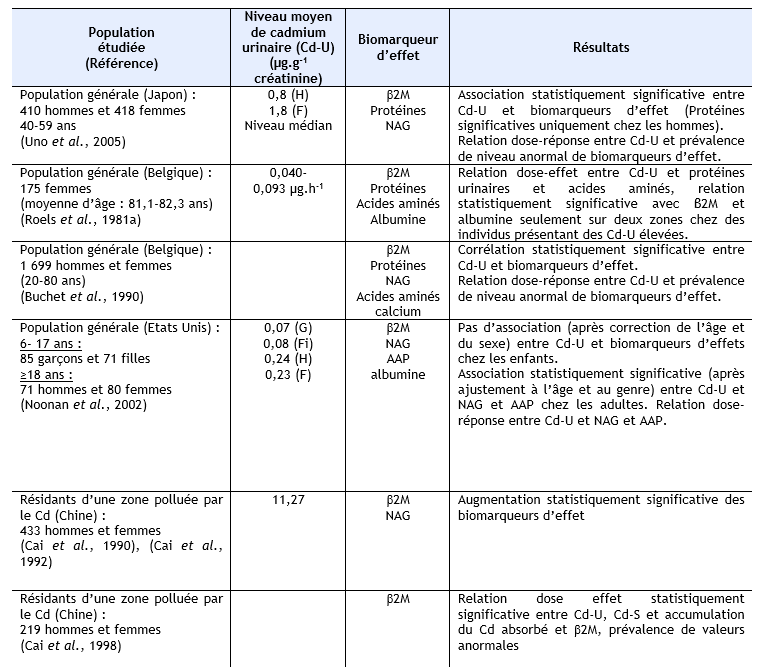
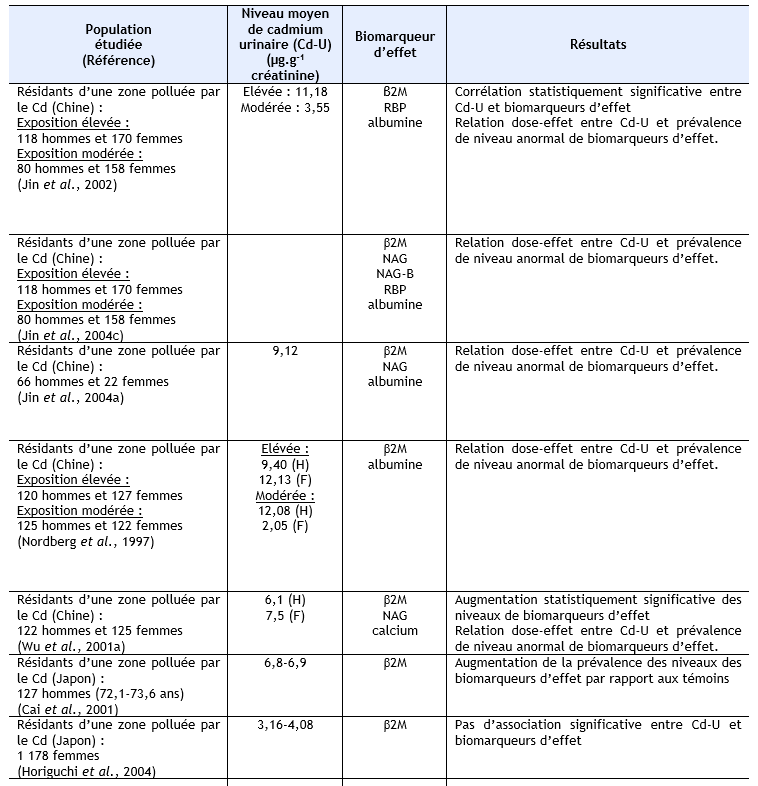
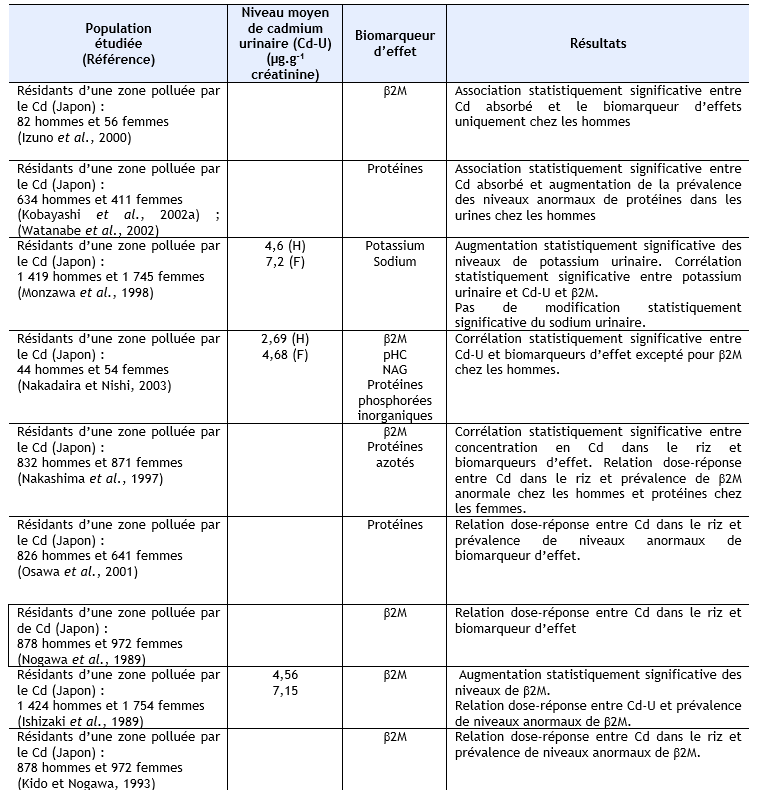
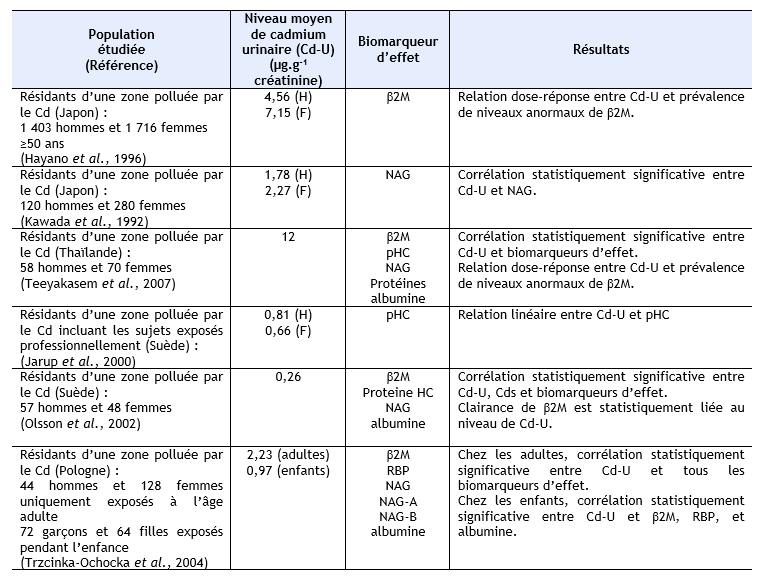
AAP : alanine-aminopeptidase, β2M : β2-µglobuline, Cd-U : cadmium urinaire, Cd-S : cadmium sanguin, F : femmes, H : hommes, G : garçons, Fi : Filles, NAG : N-acétyl-β-glucosaminidase, pHC : glycoprotéine humaine formant complexe, RBP : rétinol binding protéine
Les LOAEL induisant un dysfonctionnement rénal correspondent à une consommation quotidienne de 140 à 260 µg de cadmium pendant toute une vie (soit environ 14 à 26 µg Cd.kg-1 par semaine). Ces valeurs ont été établies pour une population de japonais exposée au cadmium lors de la consommation de riz contaminé (Nordberg et al., 1997) ; (Chaney et al., 1996).
Une dose cumulée de cadmium ingérée d’environ 2 g et au-delà soit une dose de 140 à 260 µg de cadmium ingéré quotidiennement sur la vie entière induit des altérations rénales (CE, 2007). De ce fait, il a été défini un NOAEL de 2,1 µg.kg-1.j-1 (Nogawa et al., 1989). Des études épidémiologiques ont également été menées en Europe (Roels et al., 1981a ; Roels et al., 1981b) ; (Buchet et al., 1990) ; (Hotz et al., 1999) ; (Jarup et al., 2000).
Une étude transversale en Belgique réalisée chez 1 699 individus de la population générale (urbaine et rurale) exposée à des doses élevées de cadmium, a cherché à identifier les effets du cadmium sur des paramètres de l’excrétion urinaire (protéine de liaison du rétinol, N-acétyl bêta-D-glucosaminidase, bêta 2 microglobuline, acides aminés et calcium) de la population générale exposée à des doses élevées de cadmium en milieu urbain et rural (Buchet et al., 1990) ; (Lauwerys et al., 1991). Une bonne corrélation a été mise en évidence entre les niveaux d’exposition au cadmium et l’élévation de ces paramètres. Ces résultats sont confortés par ceux d’une étude suédoise portant sur 1 021 individus exposés professionnellement ou via l’environnement (Jarup et al., 2000). De ces études, il apparaît que les effets rénaux liés à l’exposition au cadmium par ingestion sont observés pour une charge corporelle de cadmium correspondant à l'élimination urinaire de 1 à 2 µg de cadmium par gramme de créatinine.
Des calculs de benchmark dose à partir des données de population résidant dans des zones non polluées au cadmium en Suède (Suwazono et al., 2006) ou au Japon (Kobayashi et al., 2006) ; (Uno et al., 2005) ou dans les zones polluées au cadmium au Japon (Shimizu et al., 2006) ou en Chine (Jin et al., 2004c) ont été menée. L’analyse utilise les niveaux de cadmium urinaire (Cd-U) comme biomarqueur d’exposition au cadmium et la prévalence de niveau anormaux de biomarqueurs de dysfonctionnements rénaux (Bêta-2-microglobuline, pHC, protéines, NAG, rétinol binding protein (RBP), albumine ou filtration glomérulaire). Les différents résultats sont rapportés par ATSDR en 2008. Une benchmark dose (BMDL) a été calculée pour l’exposition chronique au cadmium sur la base des niveaux de cadmium urinaire (0,3 – 11,31 ou 0,6 – 11,4 µg.g-1 créatinine) associés à une augmentation de 5 à 10 % du risque de dysfonctionnement rénal (ATSDR, 2008), (Jarup et Akesson, 2009).
Une approche par méta-analyse a été menée afin d’estimer un seuil d’effet (Gamo et al., 2006). Dans cette approche, le cadmium urinaire est pris comme biomarqueur d’exposition et la prévalence des valeurs de β-2 µglobuline comme indicateur de dysfonctionnement rénal. Les auteurs déterminent que la moyenne géométrique des concentrations urinaires de cadmium pour une population dans une zone géographique limitée ne doit pas excéder 3 µg.g-1 de créatinine et pour une large zone géographique une valeur de 2 µg.g-1 (ATSDR, 2008) ce qui correspond à une consommation de cadmium de 0,9 – 1,4 g pour la vie entière (Suwazono et al., 2010).
Il est envisagé de développer des niveaux de cadmium urinaire pour les différentes tranches d’âge à partir de 55 ans pour tenir compte des effets cumulatifs et de l’excrétion variable en fonction de l’âge (Kobayashi et al., 2008).
Enfin, certains auteurs suggèrent que l’exposition au cadmium puisse induire une élévation de glucose sanguin et un diabète, par altération des cellules des îlots de Langerhans, à l’origine des altérations rénales (Edwards et Prozialeck, 2009).
Effets osseux
Des atteintes du squelette liées à une interférence avec le métabolisme du calcium sont également observées pour les expositions au cadmium aux concentrations les plus élevées (Jarup L. et al., 1988b) ; (Nordberg et al., 1997). Une excrétion excessive du calcium induit de l’ostéomalacie, de l’ostéoporose, avec des douleurs osseuses intenses. Ces troubles constituent une partie des signes de la maladie de « Itaï-Itaï » observée au Japon chez les populations exposées au cadmium (lors de la consommation de riz contaminé)(Shigematsu, 1984).
Si la toxicité osseuse du cadmium lors d’une exposition est clairement établie chez les populations souffrant de troubles du métabolisme du calcium, les études les plus récentes montrent que des atteintes osseuses ont également été mises en évidence pour des concentrations n’induisant pas de lésions rénales (Akesson et al., 2005). Les mécanismes osseux affectés par l’exposition au cadmium ne sont pas clairement identifiés. Le rôle du cadmium dans la genèse de l’ostéoporose et de l’ostéomalacie est probable (CE, 2007) ; (Nawrot et al., 2010).
Les résultats de l’étude transversale menée par (Alfven et al., 2000) sur une population de 1 064 personnes (hommes et femmes) exposés professionnellement et via l’environnement permet de proposer un LOAEL de 3,63.µg.g-1 de créatinine (3 nmol de Cd.mmol-1) de créatinine. D’autres études confirment la survenue d’effets sur la densité osseuse à de faibles doses de cadmium. Ces effets sont rapportés pour des concentrations en cadmium urinaire de 0,67 µg.g-1 créatinine et pour des concentrations sanguines de cadmium de 0,38 µg.L-1 (Akesson et al., 2006) et pour des concentrations sanguines de cadmium de 0,90 µg.L-1 (Schutte et al., 2008a). Les femmes sont plus sensibles que les hommes. Les femmes enceintes ou allaitantes sont atteintes plus précocement en raison des besoins accrus en calcium (Kjellstrom, 1992 ; Kjellstrôm, 1986) ; (Jarup et al., 1998) ; (Hayano et al., 1996) ; (Tsuritani et al., 1992) ; (Staessen et al., 1999) ; (Buchet et al., 1990).
Une augmentation de 18 % de l’incidence des fractures a été mise en évidence chez les personnes de plus de 50 ans par unité de cadmium urinaire (1,21.µg.g-1 de créatinine 1 nmol.mmol-1 de créatinine) (Alfven et al., 2004). Ce ratio est de 3,5 chez des sujets présentant des concentrations urinaires de cadmium de 2,42 à 4,84.µg.g-1 de créatinine (2 à 4 nmol.mmol-1 de créatinine) et de 8,8 chez des sujets présentant des concentrations urinaires de cadmium supérieure à 4,84.µg.g-1 de créatinine (4 nmol.mmol-1 de créatinine).
La diminution de l’exposition au cadmium via l’alimentation au niveau de la population ne se traduit pas par une diminution du cadmium osseux au niveau individuel (Chen et al., 2009) sauf cas particulier.
Certaines études n’ont pas montré de lien entre exposition au cadmium et effet osseux (Wallin et al., 2005) ; (Trzcinka-Ochocka et al., 2010) ; (Rignell-Hydbom et al., 2009).
Effets neurologiques
Il est possible que le cadmium soit également à l’origine de neuropathies périphériques. Cette observation a été réalisée chez une population de retraités ayant été exposés au cadmium au cours de leur activité professionnelle (Viaene et al., 1999)
Effets cardiovasculaires
Etudiées notamment en raison de l’atteinte rénale, différentes études épidémiologiques n'ont pas mis en évidence d’augmentation de la pression artérielle ou une fréquence accrue d’affection cardiovasculaire lors de l’exposition au cadmium (Lauwerys et al., 1991) ; (Staessen et al., 1990).
Plus récemment, plusieurs études avec une analyse transversale à partir des données du National Health and Nutrition Examination Surveys (NHANES) ont mis en évidence une association entre les niveaux sanguins et urinaires de cadmium et les effets cardiovasculaires (Everett et Frithsen, 2008) ; (Navas-Acien et al., 2009) ; (Tellez-Plaza et al., 2008). Les résultats portant sur 728 participants (1999-2000), ont mis en évidence un lien entre les niveaux de cadmium urinaires et la survenue d’une athérosclérose (Navas-Acien et al., 2009).
Une autre étude a montré une légère augmentation des pressions sanguines systolique et diastolique en lien uniquement avec les concentrations sanguines de cadmium (Tellez-Plaza et al., 2008). Une troisième étude portant sur 4 912 participants a mis en évidence une association significative entre niveau de cadmium urinaire (≥ 0,88 µg.g-1 de créatinine) et la survenue d’infarctus du myocarde chez les femmes mais pas chez les hommes (Schutte et al., 2008b).
Des sujets exposés au cadmium via l’environnement en Belgique avaient une excrétion urinaire de cadmium corrélée avec des modifications d’indicateurs physiologiques de la fonction cardiovasculaire tel que propagation de l’onde pulsatile, pression artérielle pulsée, compliance et élasticité artérielle (Schutte et al., 2008b).
Enfin, une étude menée en République de Corée a montré qu’une augmentation de la concentration sanguine en cadmium entrainait une augmentation du risque d’hypertension (Eum et al., 2008).
Voie cutanée
Il n’existe pas de donnée rapportant un effet toxique du cadmium lors de l’exposition par la voie cutanée.
Synthèse
Chez l’homme, le rein est la principale cible : néphropathie irréversible, pouvant conduire à une insuffisance rénale. L’atteinte fonctionnelle tubulaire rénale apparaît lorsque la concentration en cadmium dans le cortex rénal atteint environ 200 μg.g-1 de tissu rénal. L’exposition par inhalation induit des troubles respiratoires. Des atteintes du squelette, liées à une interférence avec le métabolisme du calcium sont observées surtout par voie orale. Des effets cardiovasculaires inconstants sont décrits.
Chez l'animal
Inhalation
Effets respiratoires
Les lésions du tractus respiratoire sont observées lors d’expositions subchroniques chez le rat et la souris (NTP, 1995) .
Des rats (F 344) et des souris (B6C3F1) mâles et femelles ont été exposés à 0 – 25 – 50 – 100 – 250 - 1 000 µg.m-3 d’oxyde de cadmium sous forme d’aérosol (0 – 22 – 44 – 88 – 219 - 875 µg Cd.m-3) pendant 6 heures par jour, 5 jours par semaine durant 13 semaines (NTP, 1995). Chez les rats comme les souris l’effet principal concerne le système respiratoire. Chez les rats, les lésions pulmonaires correspondent à un infiltrat alvéolaire d’histiocytes et à une hyperplasie de l’épithélium alvéolaire dans les deux sexes dès 50 µg.m-3. Une dégénérescence de l’épithélium du larynx apparaît dès l’exposition à 25 µg.m-3 alors que l’inflammation de l’épithélium respiratoire nasal ne survient qu’à 100 µg.m-3 chez les femelles et à 250 µg.m-3 chez les mâles.
Chez la souris, les résultats sont concordants pour des niveaux d’exposition analogues.
Ces effets ne sont pas retrouvés dans une autre étude menée chez la femelle exposée à des concentrations de 25 – 50 – 100 µg Cd.m-3 sous forme d’oxyde de cadmium en continu pendant 90 jours aux deux concentrations les plus basses et pendant 63 jours à la concentration la plus élevée (Prigge, 1978). Dans cette étude aucun signe clinique n’est observé.
Chez le hamster syrien doré exposé à 10 – 90 – 270 µg Cd.m-3 d’un aérosol d’oxyde de cadmium (taille des particules inconnue) 8 heures par jour, 5 jours par semaine, pendant 16 mois, une hyperplasie de la région péribronchiolaire est observée aux deux plus fortes concentrations (Aufderheide et al., 1989). Les effets chez le hamster sont plus marqués que chez le rat probablement du fait de différences des mécanismes impliqués (Thiedemann et al., 1989).
Une adaptation de la réponse inflammatoire induite par une exposition à de faibles concentrations pour de courtes durées d’exposition (2 semaines) est observée pour des durées d’exposition plus longues (6 semaines) avec une augmentation des niveaux de métallothionéine, glutathion et gamma glutamylcystéine (Hart et al., 2001).
Voie orale
Effets rénaux
Chez l’animal, il a été montré que les effets toxiques du cadmium, administré par voie orale, sont observés au niveau des reins à des concentrations inférieures à celles induisant des effets pulmonaires en raison d’une plus faible capacité de liaison du cadmium aux métallothionéines rénales (Goyer et al., 1989) ; (Kotsonis et Klaassen, 1978) ; (NTP, 1995) ; (Squibb et Fowler, 1984).
Effets osseux
Le cadmium affecte le métabolisme osseux ce qui se manifeste par de l’ostéopétrose, de l’ostéomalacie, de l’ostéosclérose et/ou de l’ostéoporose à des doses de 2 à 10 mg.kg-1.j-1 soit des concentrations en cadmium dans les reins de 200 à 300 µg.g-1 (OMS FAO, 2011). Ces effets seraient secondaires aux atteintes rénales.
Plusieurs études ont été menées par Brzoska et collaborateurs pour des expositions quotidiennes au chlorure de cadmium pendant 12 mois chez le rat. Une diminution de la minéralisation des os et de la densité osseuse de la colonne vertébrale, du fémur et du tibia ont été observées chez des femelles exposées à des doses ≥ 0,2 mg Cd.kg-1.j-1 (Brzoska et al., 2005a) ; (Brzoska et al., 2005b) ; (Brzoska et al., 2005c-a) et chez les mâles exposés à 0,2 mg Cd.kg-1.j-1 (Brzoska et Moniuszko-Jakoniuk, 2004a, 2004b) pour des expositions sub-chroniques et chez les femelles exposées de manière chronique à 0,08 mg Cd.kg-1.j-1 (Brzoska et Moniuszko-Jakoniuk, 2004a, 2004b).
Les résultats de l'exposition à long terme chez le rat, à des niveaux correspondant à des expositions environnementales chez l'homme, montrent que ces expositions conduisent à une fragilité du squelette accrue et une diminution de la densité minérale (Bhattacharyya et Sen Gupta, 2009). Le cadmium induit une déminéralisation qui commence dans les 24 heures après l'exposition par voie orale, chez des souris. Dans des systèmes de culture osseuse, l’exposition au cadmium à des concentrations faibles agit directement sur ces cellules et provoque une diminution de la formation osseuse et une augmentation de la résorption osseuse.
Autres effets
Si certaines études semblent montrer un effet de l’exposition sur la pression sanguine, ces effets restent faibles (ATSDR, 2008).
Plusieurs études ont recherché d’éventuels effets sur la fonction endocrine par examen histopathologique des organes concernés. Aucun effet n’a été observé (Kawamura et al., 1978) ; (Kotsonis et Klaassen, 1978) ; (Loeser et Lorke, 1977a).
Synthèse
Chez l’animal, les résultats sont similaires à ceux observés chez l’homme. Les effets toxiques du cadmium administré par voie orale au niveau des reins sont observés à des concentrations inférieures à celles induisant des effets pulmonaires en raison d’une plus faible capacité de liaison du cadmium aux métallothionéines rénales.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1B : cadmium, chlorure de cadmium, oxyde de cadmium, sulfate de cadmium, sulfure de cadmium | 2008 |
| IARC | Groupe 1 (l’agent (ou le mélange) est cancérigène pour l’homme) | 1993 |
| US EPA | Classe B1 (substance probablement cancérigène pour l’homme) | 1987 |
Chez l'homme
Inhalation
De nombreuses études épidémiologiques, notamment lors d’expositions professionnelles par inhalation, ont permis d’établir un lien entre exposition au cadmium et développement de cancers pulmonaires et, de manière plus limitée, pour les cancers rénaux, hépatiques et prostatiques (IARC, 1993). L’évaluation a été réalisée à partir de 7 cohortes indépendantes, relatives à la fabrication de piles nickel cadmium (Royaume Uni, Suède), l’industrie de la métallurgie en particulier les alliages cuivre-cadmium (Royaume Uni, Suède), l’industrie de la récupération du cadmium (Etats Unis), des usines de fabrication de produits contenant du cadmium (Royaume Uni) et des fonderies (Chine). Compte tenu des biais existants, tels que le tabac et des co-expositions notamment aux autres métaux tel que l’arsenic, le lien de causalité est parfois difficile à mettre en évidence.
Cancers pulmonaires
En milieu professionnel, les résultats obtenus sur différentes cohortes ont clairement établi un lien entre l’exposition au cadmium et la survenue de cancers pulmonaires malgré la taille souvent réduite des cohortes étudiées.
Les salariés de l’industrie de fabrication des batteries nickel-cadmium d’Angleterre présentent un excès de cancers pulmonaires et aussi prostatiques pour des expositions à l’oxyde de cadmium. Dans cette cohorte, les expositions sont estimées entre 0,6 et 2,8mg.m-3 en 1949, inférieures ou égales à 0,5 mg.m-3 entre 1950 et 1967, inférieures à 0,2 mg.m-3 entre 1968 et 1975 et inférieures à 0,05 mg.m-3 depuis 1975 (Potts, 1965) ; (Kipling et Waterhouse, 1967) ; (Sorahan et Waterhouse, 1983) ; (Sorahan, 1987). Le suivi de 926 hommes exposés au moins un an entre 1947 et 1975 montre un SMR[1] de 111 [IC à 95 %, 81-148] ce qui correspond à une diminution de l’excès, par rapport aux publications antérieures, liée notamment à une diminution des niveaux d’exposition d’un facteur 100 entre 1950 et 1975 (Sorahan et Esmen, 2004).
Une autre cohorte de salariés de l’industrie de fabrication des batteries nickel-cadmium d’origine suédoise a été analysée. Là encore, une augmentation de l’incidence des cancers pulmonaires et prostatiques est rapportée. Les niveaux d’exposition étaient de 1 mg.m-3 avant 1947, de 0,3 mg.m-3 entre 1947 et 1962, de 0,05 mg.m-3 entre 1962 et 1974 et de 0,02 mg.m-3 après 1975 (Kjellstrom et al., 1979) ; (Andersson et al., 1984) ; (Elinder et al., 1985). Les données actualisées ont mis en évidence un risque avec un SMR de 176 [IC 95 %, 101-287] sur 900 sujets exposés durant au moins 1 an entre 1931 et 1982 et suivis jusqu’en 1992 (Jarup et al., 1998).
Une cohorte de salariés de l’industrie de l’alliage cuivre-cadmium en Angleterre a fait l’objet d’investigations. Les résultats obtenus correspondent essentiellement à une augmentation de la mortalité par cancer pulmonaire pour des expositions supérieures à 1 mg.m-3 avant 1953, inférieures à 0,15 mg.m-3 entre 1953 et 1967, et inférieures à 0,05 mg.m-3 après 1957 (Holden, 1980a, 1980b) ; (Kazantzis et al., 1989). Il est également signalé une diminution des niveaux d’exposition au cadmium d’environ 0,6 mg.m-3 avant 1930, de l’ordre de 0,2-0,3 mg.m-3 entre 1943 et 1962 et inférieurs à 0,21 mg.m-3 après 1972 (Sorahan et al., 1995).
Aux Etats Unis, une première étude a été menée chez 292 ouvriers de la récupération du cadmium exposés au moins 6 mois Une augmentation de la mortalité a été observée (27 morts observées /17,57 attendues), par cancer respiratoire et de la prostate ainsi qu’à des pathologies pulmonaires non malignes (Lemen et al., 1976). Quatre morts sont attribuées à des carcinomes de la prostate et 12 à des cancers pulmonaires. Une extension de la cohorte de cette étude a pris en compte 602 travailleurs de type caucasien exposés pendant au moins 6 mois entre 1940 et 1969. Une relation dose-effet statistiquement significative a été déterminée entre mortalité par cancer pulmonaire et exposition cumulée au cadmium pour des expositions au-delà de 2 ans. Une augmentation de 50 % de la mortalité par cancer pulmonaire non statistiquement significative est observée pour des expositions cumulées comprises entre 41 et 200 µg.m-3. Une réévaluation de la cohorte d’ouvriers de la récupération du cadmium aux Etats Unis a conduit à une nouvelle estimation de la relation dose-effet pour le risque des cancers broncho-pulmonaires (Sorahan et Lancashire, 1997). A partir d’historiques professionnels détaillés sur la période 1926-1976 permettant le calcul d’index d’exposition cumulée, une relation dose–effet significative a été mise en évidence dans le sous-groupe des sujets ayant eu une exposition mixte arsenic-cadmium. Le RR[2] est de 0,81, IC 95 %, [0,17-3,82] pour une exposition cumulée de 200-499 mg.m-3 et de 1,83 IC 95 %, [0,36-9,39] pour une exposition cumulée de 500-999 mg.m-3 et de 4,02, IC 95 %, [1,34-12,03] pour une exposition cumulée de > 1 000 mg.m-3. Dans le sous-groupe des ouvriers ayant été exposés au cadmium sans exposition concomitante à l’arsenic, l’excès de risque de cancers bronchopulmonaires dans les groupes d’expositions cumulées les plus élevées n’est pas statistiquement significatif.
|
Type d’industrie, Pays (Référence) |
Population (durée d’exposition) |
Tumeurs pulmonaires (observées / exposées) |
Niveaux d’exposition /durée |
Niveaux de cadmium |
Risque relatif [IC 95 %] |
|||
|
Années |
Niveaux estimés (mg.m-3) |
|
||||||
|
Batterie (Cd-Ni) (CdO) |
||||||||
|
Royaume Uni |
||||||||
|
(Potts, 1965) |
74 hommes (≥10 ans) |
1/NR1 |
Continue |
|
|
Ne peut être calculé |
||
|
(Kipling et Waterhouse, 1967) |
248 hommes (≥ 1 an) |
5/4,40 |
Continue |
1949 |
0,6–2,8 |
1,14 [0,37-2,65] |
||
|
(Sorahan, 1987) |
3 025 hommes et femmes (≥ 1 mois) |
110/84,5 |
Continue Non exposé < 2 ans 2 ans 5 ans ≥ 15 ans |
1950-67 1968-75 >1975 |
< 0,5 < 0,2 < 0,05 |
1,30 [1,07-1,57] 1,0 1,4 1,3 1,3 1,5 |
||
|
Suède |
||||||||
|
(Kjellstrom et al., 1979) |
228 hommes (≥ 5 ans) |
2/1,35 |
Continue
|
< 1947 |
1 |
1,48 [0,17-5,35] |
||
|
(Elinder et al., 1985) |
522 hommes (> 1an) |
8/6,01 |
Continue >5ans > 20 ans de latence |
1947-1962 1962-74 >1975 |
0,3 0,05 0,02 |
1,33 [0,57-2,62] 1,75 [0,70-3,61]
|
||
|
Alliage cuivre-cadmium |
||||||||
|
Royaume Uni |
||||||||
|
(Holden, 1980a) |
Ville ≥ 1 an Rural ≥ 1 an 624 au voisinage de l’usine ≥ 1 an |
8/4,50
2/7,85
36/26,08 |
Continue
Continue
Continue |
<1953
1953-57
>1957 |
1
<0,15
<0,05 |
1,78 [0,77-3,50]
0,26 [0,03-0,92]
1,38 [0,97-1,91] |
||
|
Récupération du cadmium |
||||||||
|
USA |
||||||||
|
(Lemen et al., 1976) |
292 hommes ≥ 2 ans |
12/5,11 |
|
<1950 1950-59 |
1,16 0,50 |
2,35 [1,21-4,10] |
||
|
(Stayner et al., 1992) |
579 hommes ≥ 6 mois |
24/16,07 |
Continue ≤584 585-1460 1461-2920 >2920 |
1960-64 1965_76 |
0,34 0,26 |
1,49 [0,95-2,21] 0,34 1,63 2,17 2,72 |
||
|
(Stayner et al., 1993) |
Sous groupe de la cohorte de Stayner et al. (1992) après 1940 |
|
<584 584-1460 1461-2920 >2920 |
|
|
0,32 (NMA) 2,81 (NMA) 4,70 (NMA) 0 (NMA) |
||
|
Fabrication de produits contenant du cadmium |
||||||||
|
Royaume Uni |
||||||||
|
(Kazantzis et al., 1992) (Kazantzis et Blanks, 1992) |
6910 hommes >1 an |
339/304,1 270 55 14 |
Continue Bas Moyen Elevé |
|
|
1,12 [1,00-1,24] 1,08 [0,96-1,27] 1,21 [0,91-1,57] 1,62 [0,89-2,73] |
||
Cancer prostatique
Un excès de mortalité par cancer prostatique (RR : 1,48, IC 95 % 0,17-5,35) est rapporté dans une cohorte de salariés d’une usine de l’industrie de l’alliage cuivre-cadmium suédoise. Dans cette cohorte, les expositions aux fumées d’oxyde de cadmium étaient comprises entre 0,1 et 0,4 mg.m-3 dans les années 60 et de l’ordre de 0,05 mg.m-3 dans les années 70 (Kjellstrom et al., 1979).
Une cohorte américaine a été largement étudiée, il s’agit de salariés d’une usine de fabrication d’oxyde de cadmium, de sulfure de cadmium et de cadmium métal. Les niveaux d’exposition estimés sont de 1,16 mg.m-3 avant 1950, de 0,50 mg.m-3 entre 1950 et 1959, de 0,34 mg.m-3 entre 1960 et 1964 et de 0,26 mg.m-3 entre 1965 et 1976 (Smith et al., 1980). D’autres métaux tels que le plomb, l’arsenic, l’indium ou le thallium ont également été produits par intermittence dans cette usine, cependant (Lemen et al., 1976) estiment que les traces de ces métaux sont insignifiantes par rapport aux niveaux d’exposition au cadmium. Au cours des différentes analyses, plusieurs facteurs de confusion ont été retenus notamment la consommation de cigarettes et l’exposition à l’arsenic.
Le lien entre les expositions au cadmium et la survenue de cancer pulmonaire et prostatique est à nouveau rapportée (Stayner et al., 1992 ; Stayner et al., 1993) ; (Lemen et al., 1976) ; (Thun et al., 1985), (Thun et Clarkson, 1986) ; (Savitz, 1986) ; (Axelson, 1978) ; (Siemiatycki et al., 1988) ; (Lamm et al., 1992) ; (Doll, 1992) ; (Sorahan et Lancashire, 1997).
Une étude cas-témoin menée aux États Unis a permis de mettre en évidence une corrélation non statistiquement significative entre l’exposition au cadmium et la survenue de cancer prostatique, odd ratio 0,9 (IC : 0,7-1,2) et de 1 (IC : 0,7 – 1,3) pour des expositions les plus élevées au cadmium (Elghany et al., 1990).
Les études plus récentes ne confirment pas ce lien (Verougstraete et al., 2003) ; (Sahmoun et al., 2005) la puissance statistique de ces études est cependant limitée du fait du nombre restreint de cas (Huff et al., 2007). Une étude cas-témoin réalisée en Italie a montré une apparente relation entre la quantité de cadmium dans les ongles des pieds et les cancers de la prostate (Vinceti et al., 2007). Bien qu’il s’agisse d’un indice biologique non conventionnel, un excès de risque de cancer prostatique est calculé chez les sujets des troisième ou quatrième quartiles les plus élevés de concentration de cadmium au niveau des ongles des pieds avec un odd ratio respectif de 1,3 et 4,7 par comparaison aux sujets du quartile bas.
|
Type d’industrie, Pays (Référence) |
Population (durée d’exposition) |
Tumeurs pulmonaires (observées / exposées) |
Niveau d’exposition /durée |
Risque relatif [IC 95 %] |
|
Batterie (Cd-Ni) (CdO) |
||||
|
Royaume Uni |
||||
|
(Potts, 1965) |
74 hommes (≥10 ans) |
3/NR1 |
Continue |
Ne peut être calculé |
|
(Kipling et Waterhouse, 1967) |
248 hommes (≥ 1 an) |
4/0,58 |
Continue |
6,90 [1,86-17,66] |
|
(Sorahan et Waterhouse, 1983) |
2 559 hommes (≥ 1 mois) |
8/6,6 |
Continue
|
1,21 [0,52-2,39]
|
|
(Sorahan et al., 1985) |
2 559 hommes (≥ 1 mois) |
15/11,02 |
Continue >1 an et élevé |
1,36 [0,76-2,25] 4,02 [1,73-7,92] |
|
Suède |
||||
|
(Kjellstrom et al., 1979) |
228 hommes (≥ 5 ans) |
2/1,2 |
Continue
|
1,67 [0,19-6,02] |
|
(Elinder et al., 1985) |
522 hommes (> 1an) |
4/3,70 |
Continue >5ans > 20 ans de latence |
1,08 [0,29-2,77] 1,48 [0,40-3,79] |
|
Alliage Cu-Cd |
||||
|
Royaume Uni |
||||
|
(Holden, 1980a) |
347 hommes ≥ 1 an 624 travailleurs ≥ 1 an |
8/4,50
36/26,08 |
Exposé
Moins exposé |
0,63 [0,01-3,52]
2,67 [1,15-5,26]
|
|
Suède |
||||
|
(Kjellstrom et al., 1979) |
94 hommes (≥ 5ans) 328 témoins |
4/2,69 |
Exposé
Non exposé |
1,49 [0,40-3,81]
0,62 [0,17-1,60] |
|
Industrie de récupération du cadmium |
||||
|
USA |
||||
|
(Lemen et al., 1976) |
292 hommes ≥ 2 ans |
4/1,15 |
Continue ≥20 ans de latence |
3,48 [0,94-8,91] 4,55 [1,22-11,64] |
|
(Thun et al., 1985) |
602 hommes ≥ 6 mois |
3/1,41 |
≥ 2 ans de travail et ≥20 ans de latence |
2,13 [0,44-6,22]
|
|
Procédé de fabrication utilisant du cadmium |
||||
|
Royaume Uni |
||||
|
(Kazantzis et al., 1992) (Kazantzis et Blanks, 1992) |
6910 hommes >1 an |
37/49,3 36 0 1 |
Continue Bas Moyen Elevé |
0,75 [0,53-1,03] 0,85 [0,60-1,18] 0 [0,0-0,59] 0,97 [0,01-5,40] |
Cancer de l’estomac
Comme décrit précédemment, une cohorte de salariés de l’industrie de la transformation du cadmium en Angleterre a également fait l’objet d’analyses. Un excès de mortalité par cancer de l’estomac (RR : 1,24, IC 95 %1,02-1,50) est rapporté mais il n’est pas lié à l’intensité de l’exposition au cadmium car le RR est de 1,28, IC 95 % 1,03-1,57, pour le groupe faiblement exposé (Armstrong et Kazantzis, 1983) ; (Kazantzis et al., 1988 ; Kazantzis et al., 1992) ; (Kazantzis et Blanks, 1992) ; (Ades et Kazantzis, 1988).
Une cohorte chinoise de l’industrie des hauts fourneaux a été étudiée. Les niveaux d’exposition étaient de l’ordre de 0,186 et 0,014 mg.m-3 en fonction des zones d’activité pour des expositions postérieures à 1980, et avant 1980, ces niveaux étaient de 0,535 mg.m-3. Des expositions à l’arsenic sous forme d’As2O3 sont également mentionnées dans certaines zones (0,196 mg.m-3). Des excès de mortalité par cancer pulmonaire (SMR : 6,65), cancer du foie (SMR : 17,0) ou de l’estomac (SMR : 3,18) sont rapportés dans cette étude (Ding et al., 1987).
Cancers de la prostate et des testicules
Enfin, le lien entre exposition au cadmium et cancer de la prostate n’est pas clairement établi. Les résultats combinés de plusieurs cohortes ont montré une association entre l’exposition professionnelle au cadmium et cancer de la prostate, mais ne permettent pas de conclure (Elinder et al., 1985). Il ne semble pas qu’il puisse y avoir de relation avec des cancers du testicule (Waalkes, 2000).
Cancers prostatiques dans les cohortes de travailleurs exposés au Cd (d’après IARC, 1993)
|
Type d’industrie, Pays (Référence) |
Population (durée d’exposition) |
Tumeurs pulmonaires (observées / exposées) |
Niveau d’exposition /durée |
Risque relatif [IC 95 %] |
|
Batterie (Cd-Ni) (CdO) |
||||
|
Royaume Uni |
||||
|
(Potts, 1965) |
74 hommes (≥10 ans) |
3/NR1 |
Continue |
Ne peut être calculé |
|
(Kipling et Waterhouse, 1967) |
248 hommes (≥ 1 an) |
4/0,58 |
Continue |
6,90 [1,86-17,66] |
|
(Sorahan et Waterhouse, 1983) |
2 559 hommes (≥ 1 mois) |
8/6,6 |
Continue
|
1,21 [0,52-2,39]
|
|
(Sorahan et al., 1985) |
2 559 hommes (≥ 1 mois) |
15/11,02 |
Continue >1 an et élevé |
1,36 [0,76-2,25] 4,02 [1,73-7,92] |
|
Suède |
||||
|
(Kjellstrom et al., 1979) |
228 hommes (≥ 5 ans) |
2/1,2 |
Continue
|
1,67 [0,19-6,02] |
|
(Elinder et al., 1985) |
522 hommes (> 1an) |
4/3,70 |
Continue >5ans > 20 ans de latence |
1,08 [0,29-2,77] 1,48 [0,40-3,79] |
|
Alliage Cu-Cd |
||||
|
Royaume Uni |
||||
|
(Holden, 1980a) |
347 hommes ≥ 1 an 624 travailleurs ≥ 1 an |
8/4,50
36/26,08 |
Exposé
Moins exposé |
0,63 [0,01-3,52]
2,67 [1,15-5,26]
|
|
Suède |
||||
|
(Kjellstrom et al., 1979) |
94 hommes (≥ 5ans) 328 témoins |
4/2,69 |
Exposé
Non exposé |
1,49 [0,40-3,81]
0,62 [0,17-1,60] |
|
Industrie de récupération du cadmium |
||||
|
USA |
||||
|
(Lemen et al., 1976) |
292 hommes ≥ 2 ans |
4/1,15 |
Continue ≥20 ans de latence |
3,48 [0,94-8,91] 4,55 [1,22-11,64] |
|
(Thun et al., 1985) |
602 hommes ≥ 6 mois |
3/1,41 |
≥ 2 ans de travail et ≥20 ans de latence |
2,13 [0,44-6,22]
|
|
Procédé de fabrication utilisant du cadmium |
||||
|
Royaume Uni |
||||
|
(Kazantzis et al., 1992) (Kazantzis et Blanks, 1992) |
6910 hommes >1 an |
37/49,3 36 0 1 |
Continue Bas Moyen Elevé |
0,75 [0,53-1,03] 0,85 [0,60-1,18] 0 [0,0-0,59] 0,97 [0,01-5,40] |
NR : non rapporté, NMA : -Américains Non Mexicains
Voie orale
Une étude de mortalité réalisée chez une population japonaise exposée au cadmium via l’alimentation (riz contaminé) a mis en évidence l’absence d’augmentation de mortalité par cancer tous sites confondus et par cancer du foie ou de l’estomac en particulier.
Deux études rapportent des cas de cancers de la prostate (Shigematsu et al., 1982) ; (Bako et al., 1982). La première étude a montré l’augmentation de mortalité par cancer prostatique. Les niveaux de cadmium dans l’alimentation étaient de 0,2 à 0,7 ppm dans les zones polluées et de 0,02 à 0,1 ppm dans les zones non-polluées (Shigematsu et al., 1982). Les résultats d’une autre étude, réalisée au Canada, semblent confirmer la corrélation entre l’augmentation de la mortalité par cancer prostatique (53,6 cas sur 100 000) et les niveaux d’exposition au cadmium via l’environnement. Les niveaux mesurés étaient de 0,006 ppm dans les eaux usées, 0,27 ppm dans les sols et de 0,004 ppm dans l’eau courante (Bako et al., 1982). A l’inverse, une revue systématique des études épidémiologiques récentes chez des populations exposées via l’environnement n’a pas trouvé d’augmentation relative de cancer (Verougstraete et al., 2003).
Cancer pulmonaire
Une étude prospective menée en Belgique a évalué le lien entre exposition au cadmium via l’environnement et l’incidence de cancer. Cette étude s’inscrit dans le prolongement de celle de Flemmish dans l’étude Cadmibel. Elle a inclus 6 districts avec des forts niveaux d’exposition au cadmium, proches de ceux des travailleurs de la sidérurgie, et 4 districts avec de faibles niveaux d’exposition au cadmium. Au total 994 sujets ont été inclus. Les travailleurs exposés professionnellement n’ont pas été exclus mais la sensibilité de l’analyse a pris en compte uniquement l’exposition environnementale (Nawrot et al., 2006). L’association de cancer pulmonaire est de 67 % (IC 95 % : 33 – 101) pour les zones à fort niveau d’exposition et de 73 % (IC 95 % : 38-108) chez les fumeurs. Pour les cancers pulmonaires, le risque relatif ajusté est de 1,70 (IC 95 % : 1,13 – 2,57 , P = 0,011) pour un doublement de l’excrétion urinaire en cadmium sur 24 h, 4,17 (IC 95 % : 1,21 – 14,4 , P = 0,024) pour les résidants de zone à fort niveau d’exposition par comparaison avec ceux des zones à faible niveau d’exposition et de 1,57 (IC 95 % : 1,11 – 2,24 , P = 0,012) pour un doublement des concentrations de cadmium dans les sols. Dans cette étude, le niveau médian d’excrétion de cadmium dans les urines est de 0,8 µg.g-1 de créatinine avec une étendue du 25éme au 75ème percentile d’environ 0,5 à 1,4 µg.g-1 de créatinine (EFSA, 2009).
Cancer de la vessie
Une étude cas-témoin menée en Belgique relative à la survenue de cancers de la vessie rapporte un odds ratio de 5,7 (IC 95 % : 3,3 – 9,9) en comparant le tertile le plus élevé de concentration sanguine de cadmium avec le plus bas ajusté au sexe, âge, habitudes tabagiques, nombre de cigarettes par jour, nombre d’années de consommation de tabac, exposition professionnelle aux hydrocarbures aromatiques polycycliques ou aux amines aromatiques (Kellen et al., 2007).
Cancer du sein
Une autre étude cas-témoin menée aux Etats-Unis, sur une population de 246 femmes âgées de 20 à 69 ans, présentant des niveaux de cadmium urinaire ajustés à la créatinine dans le quartile le plus élevé (≥ 0,58 µg.g-1), a montré que ces dernières présentaient un risque de développer un cancer du sein deux fois supérieur (Odds Ratio = 2,29, IC 95 % : 1,3-4,2) à celles présentant des niveaux de cadmium urinaires dans le quartile le plus bas (< 0,26 µg.g-1) après ajustement avec les facteurs de risque (McElroy et al., 2006). Il y a une augmentation statistiquement significative en lien avec l’augmentation des niveaux de cadmium : la différence de risque absolu est 45, IC 95 % : 0-77.
Cancer de l’endomètre
Une étude prospective sur une large population de femmes suédoises ménopausées (n = 32 210) a mis en évidence une association entre exposition au cadmium via l’alimentation et incidence sur le développement de cancer de l’endomètre (Akesson et al., 2008).
Le risque relatif entre le tertile le plus élevé et le plus bas en exposition au cadmium est associé avec un risque de cancer de l’endomètre de 1,39 (IC 95 % : 1,04 – 1,85, P = 0,02). Une analyse permettant de réduire l’influence de l’exposition aux oestrogènes endogènes permet de calculer un risque relatif de 1,86 (IC 95 % : 1,13 – 3,08, P = 0,009) (Terry et al., 2002). L’augmentation du risque est de 2,9 (IC 95 % : 1,05 – 7,79) pour des expositions long terme au cadmium sur la période de 1987 à 1997 chez des femmes non fumeuses avec un faible taux d’oestrogènes.
Mortalité par cancer
L’association entre mortalité par cancer et cadmium d’origine alimentaire a été évaluée sur plusieurs cohortes japonaises (OMS FAO, 2011). La mortalité par cancer est augmentée d’un facteur 2,5 chez les femmes présentant une altération tubulaire acquise pour des niveaux médians d’exposition correspondant à une concentration urinaire de 12,1 µg.g-1 de créatinine (Nishijo et al., 2006). Dans une autre étude, une augmentation d’un facteur 2,58 du taux de mortalité par cancer est rapportée chez les sujets présentant une altération tubulaire (Arisawa et al., 2007a).
Synthèse
Chez l’homme, plusieurs études de cohorte ou des études cas-témoin ont été menées afin de déterminer le risque de cancers lié à une exposition au cadmium en milieu professionnel. La plupart rapportent des cancers pulmonaires et de la prostate. Une seule étude a identifié un cancer du sein ou de l’endomètre lors d’exposition par voie orale.
Chez l'animal
Inhalation
Les études par inhalation pratiquées chez le rat confirment les données rapportées chez l’homme. Elles indiquent une relation entre l’exposition à certains dérivés du cadmium et la survenue de cancers pulmonaires (Glaser et al., 1990) ; (Oldiges et al., 1989) ; (Takenaka et al., 1983).
Chez le rat, l’inhalation de chlorure de cadmium, d’un mélange de sulfure et de sulfates de cadmium, de fumée ou de poussières d’oxyde de cadmium induit une augmentation des tumeurs pulmonaires malignes pour de faibles niveaux d’exposition et de courtes durées d’exposition (IARC, 1993).
Des rats mâles ont été exposés au chlorure de cadmium en aérosol aux concentrations de 0 - 13,4 - 25,7, - 50,8 µg.m-3 (diamètre aérodynamique moyen de 0,55 µm) pendant 23 heures par jour, 7 jours par semaine, pendant 18 mois (Takenaka et al., 1983).Les animaux ont été observés 13 mois après l’arrêt de l’exposition. La relation entre l’exposition au cadmium et la survenue d’adénocarcinomes (0 chez les témoins, 6/39 à 13,4 µg.m-3, 20/38 à 25,7 µg.m-3 et 25/35 à 50 µg.m-3), de carcinomes épidermoïdes et mucoépidermoïdes est nettement établie dès la plus faible concentration étudiée. La présence de métastases est rapportée.
Une autre étude, pratiquée avec le même protocole expérimental, a été réalisée sur des lots de rats mâles et femelles exposés à 30 ou 90 µg Cd.m-3 de chlorure de cadmium ou à 90 µg Cd.m-3 de sulfate de cadmium ou à 90 µg Cd.m-3 de sulfure de cadmium ou à 30 ou 90 µg Cd.m-3 de poussières d’oxyde de cadmium ou à 30 ou 90 µg Cd.m-3 de fumées d’oxyde de cadmium (Glaser et al., 1990). Pour l’ensemble des composés étudiés, le diamètre aérodynamique moyen était compris entre 0,2 et 0,5 µm. Là encore, une augmentation de la survenue d’adénomes bronchio-alvéolaires, d’adénocarcinomes et de cancers épidermoïdes a été montrée. Il semblerait que le lot exposé aux fumées d’oxyde de cadmium présente des effets moindres que lors de l’exposition aux poussières et autres dérivés du cadmium (IARC, 1993).
Il existe cependant des différences de réponse en fonction de l’espèce étudiée : aucune relation entre exposition au cadmium par inhalation et cancer pulmonaire n’est retrouvée chez le hamster (Aufderheide et al., 1989) ; (Heinrich et al., 1989 ; Heinrich, 1992) et la relation chez la souris n’est pas clairement établie (Heinrich et al., 1989 ; Heinrich, 1992).
Chez le rat, l’administration intra-trachéale de sulfure de cadmium et de chlorure de cadmium induit une augmentation des tumeurs pulmonaires malignes mais cet effet n’est pas retrouvé avec l’oxyde de cadmium (Pott et al., 1987).
Chez le rat, il a été montré que des expositions à 700 µg.m-3 de chlorure de cadmium, 5 heures par jour, 5 jours par semaine pendant 1 mois ne sont pas initiatrices de tumeur pulmonaire même en présence d’injection intramusculaire de 5,6-bêtanaphtoflavone (Maximilien et al., 1992).
Voie orale
Plusieurs études ont cherché à identifier les effets du cadmium sur la cancérogenèse lors d’exposition par ingestion. La majorité d’entre elles se sont révélées inadéquates du fait de protocoles expérimentaux non adaptés (IARC, 1993).
Chez le rat, l’exposition au chlorure de cadmium dans la nourriture aux doses de 1 – 3 - 10 - 50 mg.kg-1 de nourriture pendant 104 semaines n’induit pas d’augmentation de l’incidence de tumeurs chez les lots exposés par rapport aux lots témoins (Löser, 1980a).
Du chlorure de cadmium à des doses de 0 – 25 - 100 - 200 mg.kg-1 dans la nourriture a été administré pendant 77 semaines chez le rat, soumis à un régime contrôlé en zinc (Waalkes et Rehm, 1992). Cette exposition induit une augmentation de l’incidence des leucémies, des tumeurs des cellules interstitielles des testicules et des lésions prolifératives de la prostate aux doses les plus élevées. L’exposition concomitante au cadmium et au zinc diminue les effets cancérigènes du cadmium quelles que soient les voies d’administration retenues pour chacun des deux composés.
Synthèse
Les études par inhalation chez le rat confirment que les poumons constituent l’organe cible. L’ingestion de chlorure de cadmium induit une augmentation de l’incidence des leucémies, des tumeurs des cellules interstitielles des testicules et des lésions prolifératives de la prostate chez le rat. Sur la base de ces résultats, l’UE classe le cadmium et ses dérivés chloré, oxygéné, sulfuré et sulfaté dans la catégorie 1B, l’IARC classe le cadmium dans le groupe 1, et l’US EPA classe le cadmium en catégorie B1.
Effets génotoxiques
Généralités
Les résultats sont variables en fonction des composés étudiés ainsi qu’en témoignent les différentes classifications (IARC, 2009, 2011).
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1B sulfate de cadmium, chlorure de cadmium, Catégorie 2 : cadmium élémentaire, oxyde de cadmium, sulfure de cadmium | 2008 |
Chez l'homme
Toutes voies
Une augmentation de la fréquence des aberrations chromosomiques dans les lymphocytes sanguins périphériques a été mise en évidence chez des travailleurs au cours de trois études sur cinq (IARC, 1993) ; (Bauchinger et al., 1976) ; (Deknudt et Leonard, 1975) ; (Dziekanowska, 1981) ; (Forni et al., 1990). Toutefois, ces travailleurs de l’industrie du métal sont également exposés à d’autres métaux. Aucun effet n’est retrouvé chez des travailleurs suédois dans une cohorte restreinte ou dans deux études portant sur des travailleurs de production à base de pigment de cadmium, aucune augmentation de la fréquence des aberrations chromosomiques n’est observée (Bui et al., 1975) ; (O'Riordan et al., 1978) ; (Fleig et al., 1983) ; (IARC, 1993). Aucune augmentation de la fréquence des échanges des chromatides sœurs n’est identifiée sur une seule étude de travailleurs exposés au cadmium (Dziekanowska, 1981).
Une augmentation de la fréquence et de la sévérité des aberrations chromosomiques a été observée chez des patients atteints de la maladie d’itaï-itaï (Shiraishi Y., 1975).
Chez des sujets exposés au cadmium via l’environnement, il n’a pas été observé d’altération lors du test d’échange de chromatides sœurs sur lymphocytes sanguins périphériques (Nogawa et al., 1986). En revanche, une augmentation du nombre d’aberrations chromosomiques est rapportée dans une autre étude (Tang et al., 1990).
Chez l'animal
Toutes voies
Des aberrations chromosomiques et des aneuploïdies sont observées chez les animaux exposés au chlorure de cadmium in vivo. Des mutations dominantes létales ne sont généralement pas observées chez les souris (IARC, 1993) ; (Mukherjee et al., 1988a ; Mukherjee et al., 1988b) ; (Nayak et al., 1989) ; (Bruce et Heddle, 1979) ; (Watanabe et al., 1977, 1979 ; Watanabe et al., 1982) ; (Kozachenko et al., 1987) ; (Volkova N.A. et Karplyuk I.A., 1990) ; (Adler et al., 1991) ; (Han et al., 1992) ; (Deknudt et Gerber, 1979) ; (Chopikashviti et al., 1989) ; (Gilliavod N. et Leonard A., 1975) ; (Epstein S.S. et al., 1972) ; (Suter, 1975) ; (Ramaiya et Pomerantseva, 1977) ; (Pomerantseva et al., 1980) ; (Bleyl et Lewerenz, 1980) ; (Sutou et al., 1980) ; (Shimada et al., 1976) ; (Mailhes et al., 1988) ; (Miller et Adler, 1992).
Un test du micronoyau a été mené chez le rat exposé à 15 mg.kg-1 du chlorure de cadmium en solution dans l’eau distillée par gavage pendant 1 ou 60 jours (Celik et al., 2009). Une augmentation statistiquement significative des micronoyaux est observée dans les érythrocytes du sang périphérique pour des expositions de 60 jours. Une augmentation similaire est également observée dans les cellules de la moelle osseuse pour une exposition unique associée à une cytotoxicité.
Synthèse
Le chlorure et le sulfate de cadmium induisent des effets génotoxiques probablement secondaires à un mécanisme de stress oxydatif. Les résultats pour l’oxyde et le sulfure de cadmium sont moins clairs. Le cadmium élémentaire, l’oxyde de cadmium et le sulfure de cadmium ont été classés par l’UE en catégorie 2 pour le caractère génotoxique. Le sulfate de cadmium et le chlorure de cadmium ont été classés en catégorie 1B (2004).
In vitro
Organismes procaryotes
De faibles taux de mutations ou une absence de mutation sont généralement rapportées par les nombreuses études qui ont été menées sur bactérie ou levures (IARC, 1993) ; (Mandel et Ryser, 1984) ; (Bruce et Heddle, 1979); (Tso et Fung, 1981) ; (Mortelmans et al., 1986) ; (De Flora et al., 1984a ; De Flora et al., 1984b) ; (Pagano et Zeiger, 1992) ; (Fukunaga et al., 1982) ; (Schiestl et al., 1989), (Marzin et Phi, 1985) ; (Arlauskas et al., 1985) ; (Mitra et Bernstein, 1978) ; (Kanematsu et al., 1980). -
Un faible niveau de réponse est observé dans certaines études, mais il a été montré que le cadmium induit des altérations de l’ADN chez les bactéries.
Organismes eucaryotes
Les études menées sur culture de cellules animales ont montré que les composés du cadmium altèrent le matériel génétique. Des cassures d’ADN, des mutations, des aberrations chromosomiques et des transformations cellulaires sont rapportées in vitro.
Les composés du cadmium inhibent la réparation de l’ADN endommagé par l’action d’autres composés et de ce fait augmentent leur génotoxicité.
Le chlorure de cadmium induit des altérations de l’ADN sur cultures cellulaires in vitro. Des aberrations chromosomiques sont observées lors d’exposition au sulfure de cadmium mais cet effet n’est pas retrouvé lors d’exposition au chlorure de cadmium. Le chlorure de cadmium induit des aneuploïdies dans les fibroblastes humains (IARC, 1993) ; (Casto et al., 1979 ; Casto, 1983) ; (Ohno et al., 1982) ; (DiPaolo et Casto, 1979) ; (Rivedal et Sanner, 1981) ; (Gasiorek et Bauchinger, 1981) ; (Robison et al., 1982) ; (Hamilton-Koch et al., 1986) ; (Ochi et Ohsawa, 1983, 1985) ; (Coogan et al., 1992) ; (Koizumi et al., 1992) ; (Hartwig et Beyersmann, 1989) ; (Kanematsu et al., 1990) ; (Amacher et Paillet, 1980) ; (McGregor et al., 1988) ; (Deaven et Campbell, 1980) ; (Howard et al., 1991) ; (Antoccia et al., 1991) ; (Lakkad et al., 1986) ; (Umeda et Nishimura, 1979) ; (Saffiotti et Bertolero, 1989) ; (Terracio et Nachtigal, 1986) ; (Chibber et Ord, 1990) ; (Zasukhina et Sinelschikova, 1976) ; (McLean et al., 1982) ; (Snyder, 1988) ; (Bonatti et al., 1992) ; (Han et al., 1992) ; (Deknudt et Deminatti, 1978) ; (Sina et al., 1983) ; (Oberly et al., 1982) ; (Rohr et Bauchinger, 1976) ; (Armstrong et al., 1992) ; (Bean et al., 1992) ; (Bassendowska-Karska et Zawadzka-Kos, 1987).
Plusieurs mécanismes ont été identifiés comme pouvant contribuer à la genèse des cancers lors d’exposition au cadmium. Les effets directs du cadmium sur l’ADN apparaissent comme mineurs et les effets mutagènes faibles. Les altérations chromosomiques et une instabilité génomique semblent plus induites par des perturbations des mécanismes de réparation de l’ADN et des protéines suppresseurs de tumeurs (IARC, 2011). A ce stade, il semble donc que les mécanismes de cancérogenèse seraient liés à des mécanismes génotoxiques indirects ou secondaires. Ce sont ces conclusions récentes : « le cadmium et ses composés n’entrainent pas de dommages à l’ADN, la génotoxicité du cadmium s’explique par des mécanismes indirects » qui ont poussé l’Anses à proposer des VTR à seuil d’effet pour les effets cancérogènes du cadmium pour des expositions par inhalation (Anses, 2012).
Précédemment, les résultats des études n’étaient pas suffisamment clairs pour affirmer que le mécanisme d’action pour les effets cancérogènes du cadmium était indirect. Ainsi, l’analyse de l’US EPA est basée sur les données existantes en 1992. Elle rapporte des mutations géniques in vitro sur cellules de mammifères et des aneuploïdies sur cellules germinales. Ces effets sont jugés suffisants pour l’élaboration de VTR pour des effets sans seuil.
En 2007, les conclusions du risk assement report montraient que, s’il était raisonnable de penser qu’un mécanisme d’action à seuil d’effet était envisageable, les données quantitatives n’étaient pas encore suffisamment robustes pour utiliser ces conclusions en évaluation des risques (CE, 2007).
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| EU | 1b : chlorure de cadmium, sulfacte de cadmium, 2 : cadmium élémentaire, oxyde de cadmium et sulfure de cadmium | 2008 |
Chez l'homme
Toutes voies
Les rares études ayant cherché à identifier un effet du cadmium sur la fonction de reproduction chez l’homme n’ont pas montré de diminution de la fertilité (Gennart et al., 1992), ni d’effet sur la fonction endocrine (testostérone, hormone lutéinisante (LH), hormone de stimulation des follicules (FSH) (Mason, 1990). Ces études confirment les conclusions du (Conseil Superieur d'Hygiène Publique de France, 1996) basées sur des études plus anciennes et qui considéraient que « prises dans leur ensemble, les données laissent penser que le retentissement de l’exposition modérée à long terme au cadmium sur la fertilité de l’homme est faible ». Toutefois, les récentes études semblent mettre en évidence une action du cadmium sur les cellules testiculaires mais des données complémentaires sont nécessaires pour conclure (Siu et al., 2009).
Synthèse
Chez l’homme, des atteintes de la fertilité ou de la fonction endocrinienne sont suspectées mais ne sont pas clairement démontrées.
Chez l'animal
Inhalation
Une étude menée chez le rat exposé à des concentrations de 0 – 0,025 – 0,05 – 0,1 – 0,25 – 1 mg CdO.m-3 sous forme d’aérosol 6 h/j 5 j par semaine pendant 13 semaines a montré une diminution du nombre de spermatozoïdes dans les testicules chez les mâles et un allongement du cycle oestral chez les femelles à la concentration la plus élevée (NTP, 1995).
Voie orale
Chez les rats et les souris mâles, une exposition aiguë aux dérivés du cadmium à des doses supérieures à 50 mg.kg-1 peut induire une atrophie et une nécrose testiculaire conduisant à une diminution de la fertilité (Bomhard et al., 1987) ; (Borzelleca et al., 1989) ; (Cha, 1987) ; (Saygi et al., 1991).
A des doses plus faibles et pour des expositions sub-chroniques certaines études n’ont pas identifié d’effet chez les mâles (Bomhard et al., 1987) ; (Dixon et al., 1976) ; (Groten et al., 1990) ; (Kotsonis et Klaassen, 1978) ; (Loeser et Lorke, 1977a),b ; (Zenick et al., 1982), alors que d’autres rapportent des effets sur la reproduction. Des rats mâles exposés à 8,58 mg.kg-1.j-1 via l’eau de boisson pendant 10 semaines ont développé une nécrose et une atrophie de l’épithélium des canalicules séminifères (Cha, 1987). Une augmentation du poids des testicules est observée pour des expositions à 5,8 mg.kg-1.j-1 ou 11,6 mg.kg-1.j-1 via l’eau de boisson pendant 14 semaines (Pleasants et al., 1993) ; (Pleasants et al., 1992). Une diminution du poids relatif des testicules, du nombre et de la mobilité des spermatozoïdes, du diamètre des tubules séminifères et des altérations de ces tubules sont observées chez des rats exposés à 12,9 mg.kg-1.j-1 via l’eau de boisson pendant 120 jours (Saxena et al., 1986).
Chez les femelles, des effets sur la durée du cycle oestral sont rapportés lors d’exposition aux dérivés du cadmium, par gavage à raison de 5 jours par semaine pendant 14 semaines, pour des doses de 40 mg.kg-1.j-1 (Baranski et Sitarek, 1987). La fertilité est affectée dès la dose de 10 mg.kg-1.j-1. Une diminution statistiquement significative du nombre de copulation et du nombre de femelles gestantes, du nombre d’implants et du nombre de fétus vivants est observée chez des femelles exposées à la dose de 10 mg.kg-1.j-1 par gavage pendant 9 semaines, 6 semaines avant la gestation et 3 semaines de gestation (Sutou et al., 1980). Par ailleurs, une induction des gènes oestrogéno-sensibles de l’utérus chez la rate est observée pour des expositions à de fortes doses de cadmium par voie orale (Hofer et al., 2009).
Synthèse
Chez le rat mâle, une atrophie et une nécrose testiculaire ainsi qu’une diminution du nombre de spermatozoïdes sont rapportées. Chez les femelles, un allongement du cycle ovarien et une induction de gènes oestrogéno-sensibles de l’utérus ont été identifiés.
Effets sur le développement
Généralités
FDTE/VTR Importer Le chlorure de cadmium et sulfate de cadmium ont été classés par l’Union Européenne en catégorie 2 « Substance devant-être assimilée à des substances altérant la fertilité dans l’espèce humaine ou causant des effets toxiques sur le développement dans l’espèce humaine » (JOCE, 2004), ce qui a été converti en catégorie 1B de la réglementation CLP (2008). Le cadmium élémentaire, l’oxyde de cadmium et le sulfure de cadmium ont été classés par l’Union Européenne en catégorie 3 « Substances préoccupantes pour la fertilité dans l’espèce humaine ou pour l’homme en raison d’effets toxiques possible sur le développement » (JOCE, 2004), ce qui a été converti en catégorie 2 de la réglementation CLP (2008).
Chez l'homme
Toutes voies
Les études chez l’homme révèlent une association faible entre l’exposition au cadmium et la survenue d’une atteinte néonatale telle que la diminution du poids de naissance (Galicia-Garcia et al., 1997) ; (Nishijo et al., 2002) ; (Salpietro et al., 2002) ou la diminution de la durée de la gestation (Nishijo et al., 2002).
Synthèse
Les données chez l’homme sont insuffisantes pour conclure.
Chez l'animal
Toutes voies
Le cadmium passe la barrière placentaire (OMS IPCS, 1992).
De nombreuses études ont montré que les sels de cadmium s’accumulent dans le placenta au cours de la gestation sans transfert ou accumulation significatifs vers le fœtus (Webb et Samarawickrama, 1981) ; (Christley et Webster, 1983) ; (Pietrzak-Flis et al., 1978) ; (Bhattacharyya et al., 1982) ; (Sorell et Graziano, 1990) ; (Bhattacharyya, 1983) ; (Whelton et al., 1993) ; (Saltzman et al., 1989) ; (Goyer, 1991) ; (Goyer et Cherian, 1992). Les concentrations sanguines chez les foetus de rats ou souris correspondent à 1 % de celles mesurées dans le placenta. Il est probable que le cadmium soit piégé au niveau du placenta par liaison aux métallothionéines (CE, 2007).
Les expositions au cadmium par voie orale ou par inhalation, ont montré que le cadmium est un toxique du développement qui induit des effets tels qu’une diminution du poids des fœtus, pour les expositions aux concentrations les plus élevées (Ali et al., 1986) ; (Baranski et Sitarek, 1987) ; (Gupta et al., 1993) ; (Kelman et al., 1978) ; (Kostial et al., 1993) ; (Petering et al., 1979) ; (Pond et Walker, 1975) ; (Sorell et Graziano, 1990) ; (Sutou et al., 1980) ; (Webster, 1978) ; (Whelton et al., 1988), des malformations du squelette (Baranski, 1984) ; (Machemer et Lorke, 1981) ; (Schroeder et Mitchener, 1971), des effets neuro-développementaux ou des effets tératogènes. Ces derniers sont retrouvés à des niveaux d’exposition correspondant à une toxicité maternelle sévère.
Inhalation
Une étude a été pratiquée chez les rats Sprague-Dawley et les souris Swiss (CD-1). Les animaux ont été exposés à de l’oxyde de cadmium aux concentrations de 0 – 44 - 438 - 1750 µg Cd.m-3 6 heures par jour, 7 jours par semaine et du 4ème au 19ème jour de la gestation pour les rats et du 4ème au 17ème jour pour les souris (NTP, 1995). De nombreux paramètres ont été évalués concernant les mères (toxicité et fertilité) et les fœtus (développement et neuro-développement).
Une toxicité maternelle est observée chez les rats exposés à la concentration la plus élevée dès 16 jours et correspond à une diminution de la prise de poids, des dyspnées et une hypoactivité. Il n’a pas été identifié de létalité chez l’embryon quelle que soit la concentration. En revanche, chez les rats exposés à la concentration la plus élevée, une diminution du poids des foetus et une augmentation statistiquement significative des réductions d’ossification sont rapportés.
Chez les souris, une toxicité maternelle est également observée à la concentration la plus élevée : dyspnée, hypoactivité, diminution du poids corporel. Il a été noté une diminution du nombre de gestations, la mort des mères au cours de la gestation, ainsi qu’une diminution du poids de naissance des fœtus pour une exposition par inhalation aux concentrations supérieures ou égales à 438 µg Cd.m-3. Une augmentation du nombre de résorptions par portée et une diminution de l’ossification du sternum sont observées à la concentration de 1 750 µg Cd.m-3.
L’impact sur le développement neurologique a été évalué chez les fœtus de mères exposées pendant l’accouplement et la gestation à un aérosol de chlorure de cadmium aux concentrations de 20 ou 160 µg de Cd.m-3 5 heures par jour, 5 jours par semaine pendant 5 semaines (Baranski, 1984b). Des effets sur le comportement ont été observés chez les jeunes rats nés de mères exposées à des concentrations supérieures ou égales à 0,02 mg.m-3.
Voie orale
Des rates ont été exposées à 0 ou 10 mg.L-1 de chlorure de cadmium introduit dans l’eau de boisson du premier au 21ème jour de la gestation (Benitez et al., 2009). Une diminution statistiquement significative du poids des foetus (20 % exposés versus témoins), ainsi qu’une diminution du poids des jeunes et du nombre de jeunes par portée est mesurée. Une augmentation statistiquement significative des concentrations en cadmium dans le sang des jeunes, le sang des fœtus, dans le placenta et dans le cerveau des foetus est identifiée. Une augmentation statistiquement significative de la concentration des métallothionéines dans le plasma est observée, ce résultat n’est pas retrouvé au niveau du cerveau des fœtus. Enfin, une corrélation entre concentration en cadmium dans le placenta et niveau de métallothionéine est clairement établie.
Il a été noté un retard à l’apprentissage chez les jeunes rats nés de mères qui ont été exposées à du chlorure de cadmium, introduit dans de l’eau de boisson à des doses de 0,36 mg.kg-1.j-1, pendant la gestation (Popieluch et al., 1995). Des effets neurotoxicologiques ont été mesurés pour des expositions de 0,4 mg.kg-1.j-1 et parfois pour la dose de 0,04 mg.kg-1.j-1. Ces effets neuro-comportementaux ne sont pas retrouvés chez des rats âgés de 12 semaines et qui ont été exposés in utéro et/ou pendant la lactation à des doses supérieures à 3,5 mg.kg-1.j-1. De cette étude un NOAEL de 3,5 mg.kg-1 est défini pour les effets nerveux périphériques (Desi et al., 1998) ; (Nagymajtenyi et al., 1997).
Synthèse
Chez l’animal, le cadmium traverse la barrière placentaire et peut même s’y accumuler, c’est un toxique pour le développement. Il induit une diminution du poids des fœtus, ainsi que des effets tératogènes et neurocomportementaux. Le cadmium élémentaire, l’oxyde de cadmium et le sulfure de cadmium ont été classés par l’UE en catégorie 2 pour leurs effets sur la fertilité ou la reproduction. Le sulfate de cadmium et le chlorure de cadmium ont été classés en catégorie 1B (2004).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Description de la construction des VTR et choix de VTR
Le fondement scientifique de ces VTR, c'est-à-dire les études, les effets critiques ainsi que le raisonnement qui ont conduit à la fixation de ces valeurs toxicologiques de référence, sont analysés en se basant sur la méthodologie de réalisation du choix approfondi de VTR de l’Ineris. Un choix parmi les différentes valeurs disponibles est proposé pour chacune des voies d’exposition, des durées d’exposition chronique, sub-chronique et aiguë pour des effets non cancérogènes et cancérogènes. Une qualification de la confiance en la VTR retenue est proposée par l’Ineris pour chaque VTR retenue à l’issue de la sélection.
Description des études sources pour des VTR
Dans cette section, les études ayant servi de base aux VTR élaborées par les différents organismes sont détaillées.
Pour la voie orale
Pour les expositions par voie orale une VTR sub-chronique (ATSDR) et des VTR chroniques à seuil (ATSDR, OMS, US EPA, OEHHA, RIVM, Santé Canada et Efsa) et ont été proposées.
La VTR sub-chronique a été élaboré à partir d’une série d’études menées par le même groupe d’auteurs (Brzoska et Moniuszko-Jakoniuk, 2005 ; Brzoska et al., 2005a, 2005c). Elles seront décrites de manière groupée.
La VTR chronique de l’ATSDR repose sur plusieurs études épidémiologiques (Buchet et al., 1990 ; Jarup et al., 2000 ; Jin et al., 2004c ; Kobayashi et al., 2006 ; Shimizu et al., 2006; Suwazono et al., 2006 ; Wu et al., 2001b) rapportées sous forme de synthèse. La valeur de l’Anses repose sur deux études Enström et al. (2011 et 2012) menée chez des femmes suédoises. Les autres VTR sont issues des conclusions de plusieurs rapports de synthèse.
Brzoska et Moniuszko-Jakoniuk (2005) ; Brzoska et al. (2005a, 2005c)
Plusieurs études ont été menées par Brzoska et collaborateurs pour des expositions quotidiennes au chlorure de cadmium pendant 12 mois chez le rat.
Espèce étudiée : rat
Voie d’exposition : orale via l’eau de boisson
Substance – forme chimique : chlorure de cadmium
Temps et fréquence d’exposition : expositions quotidiennes pendant 12 mois
Doses d’exposition : 0 - 1 - 5 – 50 mg Cd.L-1 dans l’eau de boisson. L’ingestion de cadmium estimée est respectivement de 0,2 - 0,5 - 4 mg Cd.kg-1.j-1 pour les lots exposés à 1 - 5 - 50 mg.L-1. La densité d’ossification, la concentration minérale des os ont été évaluées dès 3, 6, 9 ou 12 mois d’exposition.
Lot témoin : oui
Résultats / effets observés : Une diminution de la minéralisation des os et de la densité osseuse de la colonne vertébrale, du fémur et du tibia a été observée chez des femelles exposées à des doses ≥ 0,2 mg Cd.kg-1.j-1 et chez les mâles exposés à 0,2 mg Cd.kg-1.j-1 pour des expositions sub-chroniques (effets observés avant 12 mois d’exposition) et chez les femelles exposées de manière chronique à 0,08 mg Cd.kg-1.j-1.
Qualité de l’étude : 2 (étude de bonne qualité)
Buchet et al. (1990) ; Jarup et al. (2000) ; Jin et al. (2004c) ; Kobayashi et al. (2006) ; Shimizu et al. (2006); Suwazono et al. (2006) ; Wu et al. (2001b)
Une étude transversale en Belgique réalisée chez 1 699 individus de la population générale (urbaine et rurale) exposée à des doses élevées de cadmium, a cherché à identifier les effets du cadmium sur des paramètres de l’excrétion urinaire (protéine de liaison du rétinol, N-acétyl bêta-D-glucosaminidase, bêta 2 microglobuline, acides aminés et calcium) de la population générale exposée à des doses élevées de cadmium en milieu urbain et rural (Buchet et al., 1990 ; Lauwerys et al., 1991). Une bonne corrélation a été mise en évidence entre les niveaux d’exposition au cadmium et l’élévation de ces paramètres. Ces résultats sont confortés par ceux d’une étude suédoise portant sur 1 021 individus exposés professionnellement ou via l’environnement (Jarup et al., 2000). De ces études, il apparaît que les effets rénaux liés à l’exposition au cadmium par ingestion sont observés pour une charge corporelle de cadmium correspondant à l'élimination urinaire de 1 à 2 µg de cadmium par gramme de créatinine.
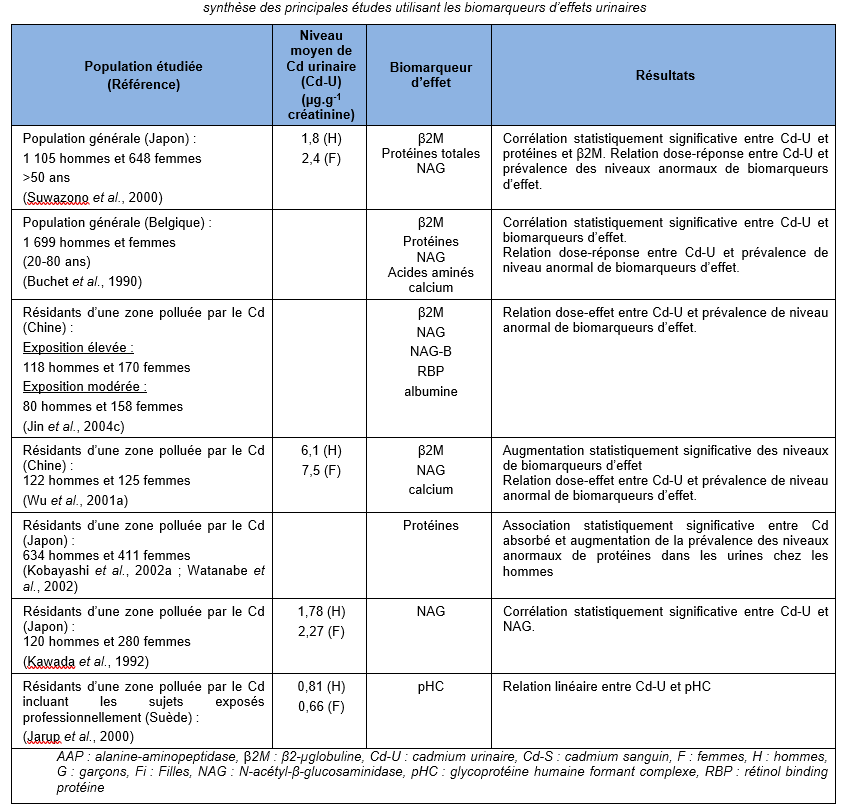
Des calculs de benchmark dose à partir des données de population résidant dans des zones non polluées au cadmium en Suède (Suwazono et al., 2006) ou au Japon (Kobayashi et al., 2006 ; Uno et al., 2005) ou dans les zones polluées au cadmium au Japon (Shimizu et al., 2006) ou en Chine (Jin et al., 2004c) ont été menée. L’analyse utilise les niveaux de cadmium urinaire (Cd-U) comme biomarqueur d’exposition au cadmium et la prévalence de niveau anormaux de biomarqueurs de dysfonctionnements rénaux (Bêta-2-microglobuline, pHC, protéines, NAG, rétinol binding protein (RBP), albumine ou filtration glomérulaire). Les différents résultats sont rapportés par ATSDR en 2008. Une benchmark dose (BMDL) a été calculée pour l’exposition chronique au cadmium sur la base des niveaux de cadmium urinaire (0,3 – 11,31 ou 0,6 – 11,4 µg.g-1 créatinine) associés à une augmentation de 5 à 10 % du risque de dysfonctionnement rénal (ATSDR, 2008, Jarup et Akesson, 2009).
Engström et al. (2011, 2012)
Cette étude transversale a pour objectif d’évaluer l’association entre le cadmium urinaire et la densité de masse osseuse chez des femmes non exposées.
L’étude de 2011 a porté sur l’ensemble des femmes de la ville d’Upsala (Suède). Les femmes retenues étaient âgées de moins de 70 ans et n’étaient pas diabétiques. Au final 2688 femmes ont été retenues. La concentration médiane en cadmium était de 0,34 *g.g-1 de créatinine chez les sujets âgés de 56 à 69 ans.
Des régression montrent que le cadmium urinaire est inversement associé à la densité osseuse et qu’une exposition au cadmium de faible niveau est associée de façon modeste mais significative à la fois à la baisse de densité de masse osseuse et à la survenue de fractures, spécialement chez les non-fumeuses.
En 2012, les travaux ont été poursuivis sur la même population et ont montré qu’un faible apport de cadmium via l’alimentation est associé à une fragilité osseuse chez des femmes ménopausées.
Par Inalation
Des VTR ont été développées pour des effets à seuil et pour les effets cancérogènes.
Seul l’ATSDR propose une VTR pour une exposition aiguë qui est basée sur l’étude du NTP, 1995.
Pour les expositions chroniques, les effets critiques sont soit non cancérogènes soit cancérogènes. Pour les effets non cancérogènes plusieurs organismes ont proposé une valeur basée sur les conclusions d’une ou plusieurs études épidémiologiques (ATSDR, OEHHA), de méta-analyses (Anses) ou de rapports de synthèse (OMS).
*Pour les effets cancérogènes, les connaissances relatives au mécanisme d’action cancérogène ont évolué récemment : celui-ci était considéré comme génotoxique jusqu’à peu et des VTR sans seuil étaient proposées par plusieurs organismes (US EPA, OEHHA et Santé Canada). En 2012, l’Anses a considéré que les preuves d’un mécanisme d’action cancérogène indirecte étaient suffisantes pour proposer une VTR à effet à seuil pour les effets cancérogènes.
L’US EPA et l’OEHHA ont retenu la même étude source Thun et al., 1985 alors que Santé Canada retient Takenaka et al., 1983 et Oldiges et al., 1984. La valeur de l’Anses est basée sur l’étude de Takenaka et al., 1983.
NTP (1995)
Espèce étudiée : rats (F 344) et des souris (B6C3F1)
Sexe et nombre d’animaux par lot : 10 mâles et 10 femelles
Voie d’exposition : inhalation
Substance – forme chimique : oxyde de cadmium sous forme d’aérosol
Temps et fréquence d’exposition : pendant 6 heures par jour, 5 jours par semaine durant 13 semaines
Doses d’exposition :. 0 – 25 – 50 – 100 – 250 - 1 000 µg.m-3 d’oxyde de cadmium sous forme d’aérosol (0 – 22 – 44 – 88 – 219 - 875 µg Cd.m-3)
Lot témoin : oui
Résultats / effets observés : Chez les rats comme chez les souris l’effet principal concerne le système respiratoire. Chez les rats, les lésions pulmonaires correspondent à un infiltrat alvéolaire d’histiocytes et à une hyperplasie de l’épithélium alvéolaire dans les deux sexes dès 50 µg.m-3.
Une dégénérescence de l’épithélium du larynx apparaît dès l’exposition à 25 µg.m-3 alors que l’inflammation de l’épithélium respiratoire nasal ne survient qu’à 100 µg.m-3 chez les femelles et à 250 µg.m-3 chez les mâles.
Dose critique : LOAEC = 0,088 mg Cd.m3 pour des atteintes niveau du système respiratoire (infiltration histiocytaire, inflammation, nécroses de l’épithélium alvéolaire...).
Qualité de l’étude : 2. L’étude est de bonne qualité, elle a été réalisée sous BPL toutefois, la ligne directrice (méthode OCDE) suivi n’est pas précisée.
Lauwerys et al., 1974
Type d’étude : Etude cas-témoin.
Lieu : 3 usines différentes (localisation non précisée).
Nombre de personnes étudiées : 31 femmes salariées dans le groupe noté E1, 27 hommes salariés dans le groupe E2 et 22 hommes salariés dans le groupe E3.
Voie d’exposition : exposition professionnelle (inhalation).
Niveaux d’exposition / formes chimiques : groupe E1 : en moyenne 4,08 ans à 31 µg.m-3 en cadmium total (1,4 µg.m-3 en cadmium inhalable), groupe E2 : en moyenne 8,6 ans à 134 µg.m-3 en cadmium total (88 µg.m-3 en cadmium inhalable) et groupe E3 : en moyenne 27,8 ans à 66 µg.m-3 en cadmium total (21 µg.m-3 en cadmium inhalable).
Groupe témoin : oui.
Symptômes observés : examen des fonctions pulmonaires et rénales
Méthode développée dans l’étude : le rôle du cadmium sur la fonction rénale et pulmonaire, chez des sujets exposés professionnellement, est étudié en comparaison à des populations témoins appariées en âge, stature et habitudes tabagiques.
Résultat de l’étude : Les concentrations urinaires en cadmium sont élevées chez les travailleurs du groupe E1 en l’absence d’atteinte pulmonaire ou rénale. Chez le groupe E2, les concentrations de cadmium sanguines et urinaires sont élevées par rapport au témoin. Une protéinurie glomérulaire est observée chez 15 % des ouvriers du groupe E2 et chez 68 % des ouvriers du groupe E3. Chez le groupe E3, une augmentation des concentrations de cadmium sanguin et urinaire est observée ainsi qu’une diminution statistiquement significative de certains paramètres de la fonction pulmonaire (capacité vitale forcée, volume expiratoire maximal par seconde et débit expiratoire de pointe). Cette étude montre que le rein est un organe cible de l’exposition chronique au cadmium. Pour le cadmium inhalable, un LOAEC de 21 µg.m-3 pour les ouvriers exposés 28 ans est déterminé et un NOAEC de 1,4 µg.m-3 est fixé pour une exposition de 4 ans.
Qualité de l’étude : 1.
Thun et al. (1985)
Type d’étude : étude de cohorte complétant l’étude initiale de Lemen et al. (1976).
Lieu : industrie de hauts fourneaux en cadmium aux Etats Unis.
Nombre de personnes étudiées : 602 ouvriers de sexe masculin.
Voie d’exposition : professionnelle (inhalation et/ou cutanée).
Niveaux d’exposition / formes chimiques : Les concentrations varient en fonction de la période d’exposition et du type d’activité, les niveaux d’exposition cumulés sont pris en fonction de la durée d’exposition.
Groupe témoin : population américaine.
Symptômes observés : excès de cancer de l’appareil respiratoire.
Méthode développée dans l’étude : mesures de cadmium urinaire.
Résultat de l’étude : doublement de l’excès de risque de cancer de l’appareil urinaire.
Qualité de l’étude : 1.
Takenaka et al., 1983 et Oldiges et al., 1989
Espèce étudiée : Rats mâles
Sexe et nombre d’animaux par lot :
Voie d’exposition : inhalation
*Substance – forme chimique : chlorure de cadmium en aérosol
Temps et fréquence d’exposition : 0 - 13,4 - 25,7 - 50,8 µg.m-3 (diamètre aérodynamique moyen de 0,55 µm)
Concentrations d’exposition : 23 heures par jour, 7 jours par semaine, pendant 18 mois
Protocole : Les animaux ont été observés 13 mois après l’arrêt de l’exposition.
Lot témoin : oui
Résultats / effets observés : La relation entre l’exposition au cadmium et la survenue d’adénocarcinomes (0 chez les témoins, 6/39 à 13,4 µg.m-3, 20/38 à 25,7 µg.m-3 et 25/35 à 50 µg.m-3), de carcinomes épidermoïdes et mucoépidermoïdes est nettement établie dès la plus faible concentration étudiée. La présence de métastases est rapportée.
Concentration critique : survenue d’adénocarcinomes, de carcinomes épidermoïdes et mucoépidermoïdes dès 13,4 µg.m-3
Qualité de l’étude : 2. La durée de l’exposition est un peu courte, exposition de 18 mois au lieu de 2 ans, chez le rat mais est suffisamment longue pour le développement de tumeurs.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition sub-chronique par voie orale:
L’ATSDR propose un MRL de 5.10-4 mg Cd.kg-1.j-1 pour une exposition sub-chronique par voie orale (ATSDR, 2012)
Cette valeur est établie à partir d’une étude expérimentale chez le rat Wistar (Brzoska et Moniuszko-Jakoniuk, 2005 ; Brzoska et al., 2005a, 2005c). Les lots ont été exposés à des doses **de 0 - 1 - 5 – 50 mg Cd.L-1 dans l’eau de boisson, pendant 12 mois. L’ingestion de cadmium estimée est respectivement de 0,2 - 0,5 - 4 mg Cd.kg-1.j-1 pour les lots exposés à 1 - 5 – 50 mg.L-1. L’effet critique retenu est l’altération de la densité minérale des os, effets apparaissant à des doses plus faibles que les altérations rénales. Une BMDsd1 de 0,05 mg Cd.kg-1.j-1 est retenue, pour la construction du MRL. Cette BMDsd1 est calculée avec le modèle de Hill.
Facteur d’incertitude : Un facteur global 100 est retenu, il correspond à un facteur d’incertitude
10 pour l’extrapolation des données animales chez l’homme, et à un facteur d’incertitude 10 pour la variabilité humaine.
Calcul : 0,05 mg Cd.kg-1.j-1 / 100 = 0,5 µg Cd.kg-1.j-1
Effets à seuil - Exposition chronique par voie orale:
L’ATSDR propose un MRL de 1.10-4 mg.kg-1.j-1 pour une exposition chronique au cadmium par voie orale (ATSDR, 2012)
Cette valeur est établie à partir d’une méta-analyse conduite par l’ATSDR en 2008, sur un ensemble d’études épidémiologiques lors d’expositions environnementales au cadmium et ayant évaluées la relation entre le cadmium urinaire et la prévalence de niveau élevé de biomarqueurs de la fonction urinaire (Buchet et al., 1990) ; (Jarup et al., 2000) ; (Jin et al., 2004c) ; (Kobayashi et al., 2006) ; (Shimizu et al., 2006); (Suwazono et al., 2006) ; (Wu et al., 2001b).
L’augmentation de l’élimination des protéines de faible poids moléculaire a été retenue comme effet critique. Un niveau de cadmium urinaire (UCD) de 1,34 μg.g-1 de créatinine a été calculé, et la limite de l’intervalle de confiance à 95 % (UCDL10) de 0,5 μg.g-1 de créatinine a été retenue comme point de départ pour l’élaboration du MRL.
L’utilisation d’un modèle pharmacocinétique (PBPK) a établi que les doses de cadmium à ingérer pour l’obtention d’un UCD et UCDL10 de 1,34 et 0,5 μg.g-1 sont respectivement chez l’homme de 2,24 et 0,70 µg.kg-1.j-1, et chez la femme de 0,97 et 0,33 µg.kg-1.j-1.
Facteur d’incertitude : un facteur global de 3 est retenu, pour la variabilité humaine.
Calcul : 0,33 µg.kg-1.j-1 / 3 = 0,1 µg.kg-1.j-1
L’OMS JEFCA propose une valeur de dose tolérable mensuelle provisoire (PTMI) de 25.10-3 mg.kg-1 pour une exposition par voie orale au cadmium. L’OMS (lignes directrice pour l’eau) propose une valeur de dose tolérable mensuelle provisoire (PTMI) de 25.10-3 mg.kg-1 pour une exposition par voie orale au cadmium (OMS JEFCA, 2010 ; OMS, 2022).
L’OMS en 2022 préconise dans ses lignes directrices pour l’eau potable, une valeur établie par le JECFA (Comité mixte FAO/OMS d’experts sur les additifs alimentaires) (JEFCA, 1988). Cette valeur est basée sur la relation entre l’excrétion de β2microglobuline et de cadmium dans les urines chez des individus âgés de 50 ans et plus, considérée comme la plus appropriée pour déterminer la concentration critique. Le calcul est ensuite basé sur le niveau d’exposition au moyen d’un modèle toxicocinétique et l’estimation de la valeur associée à 5 % de la population exposée au cadmium via l’alimentation. La valeur estimée est de 0,8 µg.kg-1.j-1 soit 25 µg.kg-1 par mois.
L’US EPA (IRIS) a établi une RfD de 5.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale dans l’eau de boisson et une RfD de 0,001 mg.kg-1.j-1 pour une exposition chronique par voie orale dans la nourriture (US EPA (IRIS), 1989).
Selon les résultats de plusieurs études, la concentration rénale en cadmium la plus élevée sans effet observé sur le rein a été établie à 200 μg.mg-1 de cortex rénal humain frais (US EPA, 1985). Un modèle toxicocinétique a permis d'évaluer la dose d'exposition chronique par voie orale aboutissant à cette teneur au niveau du rein, soit 0,005 mg Cd.kg-1.j-1 dans l’eau de boisson (absorption présumée de 5 %) et 0,01 mg Cd.kg-1.j -1 par l'alimentation (absorption présumée de 2,5 %). A partir de ces deux NOAEL, une valeur de RfD de 0,0005 mg Cd.kg-1.j-1 dans l'eau de boisson et une valeur de RfD de 0,001 mg Cd.kg-1.j-1 dans la nourriture ont été calculées.
Facteurs d’incertitude : Un facteur 10 est appliqué pour tenir compte des populations sensibles.
Calcul : 0,005 mg Cd.kg-1.j-1 x 1/10 = 0,0005 mg Cd.kg-1.j-1 pour une exposition via l’eau de boisson et 0,01 mg Cd.kg-1.j -1 x 1/10 = 0,001 mg Cd.kg-1.j -1 pour une exposition via l’alimentation
Indice de confiance : Un indice de confiance élevé pour la base de données et la valeur proposée est donné par l’US-EPA.
L'OEHHA propose un REL de 5.10-4 mg.kg-1.j-1 pour une exposition chronique au cadmium et ses dérivés par voie orale (OEHHA, 2000).
L’OEHHA reprend entièrement les calculs de l’US EPA, la démarche est la même, ainsi la REL correspond à la RfD proposée par l'US EPA. Selon les résultats de plusieurs études, la concentration rénale en cadmium la plus élevée sans effet observé sur le rein a été établie à 200 μg.mg-1 de cortex rénal humain frais (US EPA, 1985). Un modèle toxicocinétique a permis d'évaluer la dose d'exposition chronique par voie orale aboutissant à cette teneur au niveau du rein, soit 0,005 mg Cd.kg-1.j-1 dans l’eau de boisson (absorption présumée de 5 %). A partir de ce NOAEL, une valeur de RfD de 0,0005 mg Cd.kg-1.j-1 dans l'eau de boisson a été calculée.
Facteurs d’incertitude : Un facteur 10 est appliqué pour tenir compte des populations sensibles.
Calcul : 0,005 mg Cd.kg-1.j-1 x 1/10 = 5.10-4 mg.kg-1.j-1 mg Cd.kg-1.j-1
Le RIVM propose une TDI de 5.10-4 mg.kg-1.j-1 pour une exposition chronique au cadmium par voie orale (Baars et al., 2001).
Les résultats de nombreuses études chez l'homme et l'animal montrent que l'effet principal lié à l'exposition chronique au cadmium est une atteinte irréversible de la fonction rénale (Baars et al., 2001b). Des données récentes chez l'homme montrent que, pour une concentration corticale de 50 mg.kg-1, des effets délétères sur la fonction rénale peuvent être détectés chez 4 % de la population (Baars et al., 2001b). Ce niveau est susceptible d'être atteint au bout de 40-50 ans, si la dose de 50 μg Cd par jour (soit environ 1.10-3 mg.kg-1.j-1) est absorbée.
Facteurs d’incertitude : Un facteur d’incertitude 2 est retenu pour la variabilité inter-espèces.
Calcul : 1 μg.kg-1.j-1 x 1/2 = 0,5 μg.kg-1.j-1 = 5.10-4 mg.kg-1.j-1
Indice de confiance : un indice de confiance élevé est donné par le RIVM.
Santé Canada propose une DJT de 8.10-4 mg.kg-1.j-1 pour une exposition chronique au cadmium par voie orale (Sante Canada, 2021)
La construction de la VTR est basée sur une étude épidémiologique (méta-analyse) menée sur des expositions environnementales principalement via l’alimentation (OMS, 2011). L’effet critique retenu est un dysfonctionnement des cellules tubulaires rénales qui se manifeste par une protéinurie de faible poids moléculaire. Un NOAEL de 5,24 µg Cd.g-1 créatinine associé à l’ingestion orale chronique de 1,2 µg.kg-1 pc.j-1 (5ème à 95ème percentile 0,8-1,8 µg.kg-1 pc.j-1). La limite inférieure 0,8 µg.kg-1 pc.j-1 est retenue comme DJT pour tenir compte des personnes les plus sensibles. Cette DJT est rapportée par l’OMS comme un apport mensuel tolérable provisoire de 25 µg.kg-1 pc.
L’Efsa propose une dose hebdomadaire tolérable de 2,5 µg.kg-1 de poids corporel soit 3,6.10-4 mg.kg-1.j-1 pour le cadmium pour une exposition voie orale (Efsa, 2011).
En 2011, l’Efsa a reconduit la valeur établie en 2009 (Efsa, 2009). Cette valeur est basée sur une méta-analyse menée par un groupe de travail (CONTAM Panel) qui a repris toutes les études existantes dont notamment les méta-analyses les plus récentes comme celle de l’ATSDR de 2008. Cette analyse a permis de retenir la β2-microglobuline comme marqueur d’effets tubulaires avec un BMDL5 de 4 µg Cd.g-1 de créatinine ce qui, après ajustement (avec un facteur 3,9 pour tenir compte de la variabilité des concentrations urinaires en cadmium au sein de la population humaine), correspond à une valeur de 1 µg Cd.g-1 de créatinine. Les mêmes valeurs ont été obtenues à partir des données d’exposition professionnelle.
En prenant en compte un large panel de femmes suédoises non fumeuses d’âge moyen de 50 ans et présentant des niveaux de cadmium urinaire inférieurs à 1 µg Cd.g-1 de créatinine (Amzal et al., 2009), les expositions quotidiennes au cadmium via l’alimentation ne devraient pas excéder une dose hebdomadaire de 2,5 µg.kg-1 soit la dose de 0,36 µg.kg-1.j-1.
L’Anses propose une VTR de 0,35.10-3 mg.kg-1.j-1 pour une exposition chronique au cadmium par voie orale (Anses, 2017)
Cette valeur est établie à partir des études d’Engström et al., (2011 et 2012). Ces études mettent en évidence une corrélation entre une exposition au cadmium et une baisse de la densité osseuse (pouvant entrainer une augmentation du risque d’ostéoporose ou de fracture) chez les femmes suédoises de 56 à 69 ans. Cette relation a également été démontrée chez les hommes âgés de plus de 69 ans (Wallin et al., 2016). L’effet critique retenu est l’ostéoporose ou la fracture osseuse. La concentration en cadmium urinaire de 0,5 µg.g-1 de créatinine à 60 ans correspond à un NOAEL et a été retenue comme dose critique. Le calcul de la VTR a été réalisé au moyen du modèle cinétique de Kjellström et Nordberg, (1978) et a conduit à déterminer une dose journalière tolérable de 0,35 µg Cd.kg-1 pc.j-1 ou une dose hebdomadaire tolérable de 2,45 µg Cd .kg-1 pc.sem-1
Indice de confiance : Un indice de confiance moyen est donné par l’Anses.
Effets à seuil - Exposition aiguë par inhalation:
L’ATSDR propose un MRL de 0,03 µg Cd.m-3 pour une exposition aiguë au cadmium par inhalation (ATSDR, 2008, 2012)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat F344, réalisée par le NTP (1995). Les lots ont été exposés à des doses de 0 - 0,088 - 0,26 - 0,88 - 2,6 - 8,8 mg Cd.m-3, 6,2 h/j, pendant 2 semaines. La concentration de 0,088 mg Cd.m3 est retenue comme LOAEC. Les effets critiques sont focalisés au niveau du système respiratoire (infiltration histiocytaire, inflammation, nécroses de l’épithélium alvéolaire...).
Le LOAEC a été ajusté pour simuler une exposition continue :
LOAECADJ = 0,088 mg Cd.m-3 x 6,2 h/24 h x 5 j/7 j = 0,016 mg Cd.m-3
A partir du LOAECADJ, le LOAEC pour l’équivalence humaine a été calculé :
LOAECHEC = LOAECADJ x RDDR,
LOAECHEC = 0,01 mg Cd.m-3
avec RDDR (Regional deposited dose ratio) pour la région pulmonaire = 0,617
Facteur d’incertitude : Un facteur global 300 est retenu, il correspond à un facteur d’incertitude 3 pour la variabilité individuelle, un facteur d’incertitude 10 pour l’extrapolation des données animales chez l’homme, et à un facteur d’incertitude 10 pour l’utilisation d’une LOAEC.
Calcul : 0,01 mg Cd.m-3 / 300 = 0,03 µg Cd.m-3
Effets à seuil - Exposition chronique par inhalation:
L’ATSDR propose un MRL de 0,01 µg Cd.m-3 pour une exposition chronique au cadmium par inhalation (ATSDR, 2012)
Cette valeur est établie à partir d’une méta-analyse conduite par l’ATSDR en 2008, sur un ensemble d’études épidémiologiques lors d’expositions environnementales au cadmium et ayant évalué la relation entre le cadmium urinaire et la prévalence élevée des biomarqueurs de la fonction rénale (Buchet et al., 1990 ; Jarup et al., 2000 ; Suwazono et al., 2006). Cette méta-analyse s’appuie également sur trois études en milieu professionnel (Chen et al., 2006a ; Chen et al., 2006b ; Jarup et Elinder, 1994 ; Roels et al., 1993). L’effet critique retenu est la concentration de cadmium dans les urines qui résulterait d’une augmentation de 10 % de la prévalence de la β2-microglobuline dans l’urine. Une concentration de cadmium urinaire (UCD) de 1,34 μg.g-1 de créatinine a été calculée, et la limite de confiance à 95 % (UCDL10) de 0,5 μg.g-1 de créatinine a été retenue comme point de départ pour l’élaboration du MRL.
Un modèle de l’ICRP (Human Respiratory Tract Model, 1994) a été utilisé pour calculer la quantité de cadmium inhalé nécessaire afin d’atteindre une valeur de 0,5 µg Cd.g-1 de créatinine. La déposition et la clairance des particules d’oxyde de cadmium et de sulfure de cadmium inhalées ont été modélisées avec ce modèle. Il est à noter que l’alimentation introduit également une quantité non négligeable de cadmium dans l’organisme. Avec ce modèle, et sur la base de la relation entre l’inhalation chronique de cadmium, et l’ingestion orale, une exposition à une concentration de 0,1 µg Cd.m-3 et une ingestion de 0,3 µg.kg-1.j-1 sont susceptibles d'induire un niveau urinaire de cadmium de 0,5 µg.g-1 de créatinine.
Facteur d’incertitude : Un facteur global 9 arrondi à 10 est retenu, il correspond à un facteur 3 pour la variabilité au sein de l’espèce humaine et à un facteur modificatif 3 pour tenir compte de l’absence de données chez l’homme qui pourraient être utilisées pour comparer les sensibilités relatives du tractus respiratoire et des reins.
Calcul : 0,1 µg Cd.m-3 / 10 = 0,01 µg Cd.m-3
L'OMS propose une valeur guide de 5.10-3 μg.m-3 pour une exposition chronique au cadmium par inhalation (OMS, 2000).
La plus faible exposition au cadmium entraînant chez les travailleurs une augmentation des dysfonctionnements rénaux et des cancers du poumon est 100 µg.m-3 par an pour une exposition de 8 heures consécutives. Cette valeur, ajustée pour une exposition continue, est de 0,3 µg.m-3. Les concentrations atmosphériques en milieux urbains et industriels sont environ égales à 1/15ème de cette valeur. Toutefois, l’observation des effets rénaux dans des régions d’Europe, où les sols ont été anciennement contaminés par des émissions de cadmium, indique que le taux de cadmium corporel ne peut pas augmenter sans mettre en danger les fonctions rénales (OMS, 2000). C’est sur ces observations et pour éviter que les concentrations n’augmentent dans les sols agricoles et donc dans les régimes alimentaires qu’une valeur guide de 5.10-3 μg.m-3 a été développée et est considérée par l’OMS (2000) comme une VTR en moyenne annuelle dans l’air.
L'OEHHA propose un REL de 2.10-2 μg.m-3 pour une exposition chronique au cadmium par inhalation (OEHHA, 2000)
Cette valeur a été établie à partir d’une étude épidémiologique chez des travailleurs exposés au cadmium pour des durées de 1 à 20 ans (Lauwerys et al., 1974). Une LOAEC de 21 μg Cd.m-3 a été établie pour des effets rénaux et respiratoires. La concentration sans effet (NOAEC) a été établie à 1,4 μg.m-3 pour une exposition moyenne de 4,1 ans, ce qui équivaut à 0,5 μg.m-3 pour une exposition continue (1,4 x 10 m3/20 m3 x 5 j/7 j).
Facteurs d’incertitude : Un facteur 10 est appliqué pour tenir compte des différences de sensibilité au sein de l’espèce humaine et un facteur 3 pour la faible durée d'exposition.
Calcul : 0,5 μg.m-3 x 1 / 30 = 0,017 μg.m-3 (arrondi à 0,02 μg.m-3)
L’Anses propose une valeur toxicologique de référence de 0,45 µg.m-3 pour le cadmium, pour une exposition chronique par inhalation et des effets autres que cancérogènes (ANSES, 2012).
Cette valeur retient comme effet critique des effets rénaux et se base sur la valeur retenue par l’Efsa dans sa méta-analyse de 2009 avec une concentration de cadmium urinaire de 1,0 µg.g-1 de créatinine.
A partir de cette concentration urinaire, les concentrations atmosphériques en cadmium ont été estimées au moyen d’un modèle PBPK (modèle pharmacocinétique à base physiologique) au moyen des mêmes équations et paramètres que ceux utilisés par l’ATSDR en 2008 et repris en 2012. Cette modélisation comprend la modélisation du transfert de cadmium du tractus respiratoire vers le sang et les organes cibles (Kjellstrom et Nordberg, 1978). Ainsi, une exposition journalière à une concentration d’oxyde de cadmium atmosphérique de 0,45 μg.m-3 entraînerait une concentration urinaire de cadmium de 1 μg.g-1 de créatinine, en supposant que l’air soit la seule source de cadmium. Cette valeur a été établie en prenant un volume d’air expiré de 20 m3 et une concentration urinaire de créatinine de 1,5 g.j-1.
Facteurs d’incertitude : Aucun facteur d’incertitude n’a été retenu car il a été considéré que d’une part, la valeur est basée sur un effet précurseur [marqueur précoce], et d’autre part, elle est basée sur des valeurs moyennes de 165 groupes tirés de 35 études (soit plus de 30 000 cas).
Effets sans seuil - Exposition chronique par inhalation
L’US EPA (IRIS) a établi un ERUi de 1,8.10-3 (µg.m-3)-1 pour une exposition chronique au cadmium par inhalation (US EPA (IRIS), 1987).
Cette valeur a été établie à partir d’une étude réalisée sur une cohorte de 602 salariés de sexe masculin, employés dans l’industrie des hauts fourneaux et chez lesquels un doublement de l’excès de risque de cancers de l'appareil respiratoire a été observé (Thun et al., 1985). Au sein de cette population, des mesures de cadmium urinaire pratiquées chez 261 de ces salariés montrent qu’il s’agit d’individus fortement exposés. Dans ce travail, il a été montré que l’arsenic et le tabac ne sont probablement pas à l’origine des effets observés. Les données ont été modélisées par un modèle à deux étapes.
L'OEHHA propose un ERUi de 4,2.10-3 (µg.m-3)-1 pour une exposition chronique au cadmium par inhalation (OEHHA, 2011).
Cette valeur a été calculée à partir de l'étude épidémiologique de Thun et al., 1985 (voir ERUi de l'US EPA). Une régression de Poisson a été utilisée pour calculer le risque cancérogène.
Santé Canada propose une CERUi de 4,2.10-3 (µg.m-3)-1 pour une exposition chronique au cadmium par inhalation (2021)
Cette valeur a été calculée à partir de de l'étude épidémiologique de Thun et al., 1985 en suivant la même démarche que l’OEHHA.
L’Anses propose une valeur toxicologique de référence de 0,30 µg.m-3 pour le cadmium, pour une exposition chronique par inhalation et des effets cancérogènes (Anses, 2012)
Cette valeur retient comme effet critique la survenue de cancers pulmonaires chez les rats mâles Wistar exposés au chlorure de cadmium en aérosol aux concentrations de 12,5 – 25,0 – 50,0 µg.m-3 23 h/j, 7 j/7 pendant 18 mois (Takenaka et al., 1983). Les données de cette étude ont été modélisées avec le modèle logProbit par le logiciel BMDS 2.1.1. de l’US EPA pour déterminer une BMD10% de 8,9 µg.m-3 et une BMD10%L95 % de 6,37 µg.m-3.
Cette BMD10%L95 % a été ajustée
- au temps pour tenir compte du caractère discontinu de l’exposition dans l’étude : 6,37 µg.m-3 x 23 h/24 h x 18 mois/24 mois 4,58 µg.m-3 et
- à la dose pour tenir compte des propriétés physico-chimiques de la substance inhalée et du site où sont observés les effets critiques. Le calcul de la concentration équivalente humaine a été réalisé au moyen du logiciel MPPD2 (Multiple-Path- Particle Dosimetry Model) en utilisant la formule :
FAD = [(Ve/SPU)animal/(Ve/SPU)homme] x DFanimal/DFhomme
où SPU : surface pulmonaire (cm2)
Ve : volume d’air exhalé par minute (cm3/minute),
DF : fraction déposée au niveau de la région pulmonaire (ratio entre le nombre ou la masse de particules déposées au niveau pulmonaire par rapport au nombre ou à la masse de particules inhalées)Avec Ve homme = 13 800 mL.min-1 et Ve animal = 214 mL.min-1
SPU homme = 54 m2 et SPU animal = 0,34 m2
DFanimal = 0,107 et DFhomme = 0,169
Soit un FAD de 1,7.
Ce qui conduit à une concentration équivalente pour l’homme : 4,58 µg.m-3 x 1,7 = 7,8 μg.m-3.
Facteurs d’incertitude : Un facteur d’incertitude 25 a été appliqué. Il correspond à un facteur 2,5 pour tenir compte des différences non prises en compte lors des ajustements précédents pour la variabilité inter espèces. Un facteur 10 a également été retenu pour la variabilité intra-espèce.
Calcul : 7,8 μg.m-3 x 1/25 = 0,312 μg.m-3 (arrondi à 0,3 μg.m-3)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition sub-chronique par voie orale:
L’Ineris propose de retenir pour une exposition sub-chronique au cadmium par voie orale le MRL de 5.10-4 mg Cd.kg-1.j-1 de l’ATSDR
Une seule valeur est disponible (ATSDR, 2012). Cette valeur est établie à partir d’une étude expérimentale de bonne qualité. L’effet critique retenu, l’altération de la densité minérale des os, est plus sensible que les effets rénaux. Les détails de la construction de la benchmark dose sont clairement rapportés. Le facteur d’incertitude de 100 est justifié. La VTR de l’ATSDR est de bonne qualité et est retenue par l’Ineris.
Cette valeur est retenue par l’Ineris.
Cette valeur est établie à partir d’une étude chez l’animal pour une exposition sub-chronique, elle est de bonne qualité.
*Indice de confiance : élevé.
Effets à seuil - Exposition chronique par voie orale:
L’Anses propose de retenir pour une exposition chronique par voie orale au cadmium la valeur de 3,5.10-4 mg.kg-1.j-1.
Plusieurs organismes proposent des valeurs : l’Anses (2017), l’ATSDR (2012), l’OMS (2010, 2022), l’OEHHA (2000), l’US EPA (1989), le RIVM (2001), Santé Canada (2021) ainsi que l’Efsa (2011).
Toutes les valeurs s’appuient sur des données humaines et sont toutes établies à partir des concentrations rénales pouvant entrainer des altérations rénales, sauf celle de l’Anses. L’US EPA, le RIVM, l’OEHHA et l’OMS JECFA proposent une VTR basée sur le même critère d’effet : un niveau maximum d’apport journalier de cadmium estimé à 1.10-3 mg Cd.kg-1.j-1. Les informations prises en compte dans la littérature sont de bonne qualité et le même raisonnement a été tenu pour établir les facteurs de sécurité. Par ailleurs, la valeur établie par l’OMS JEFCA est une valeur guide provisoire. Les valeurs de l’US EPA et de l’OEHHA sont calculées sur la base de l’apport via l’eau de boisson. Le RIVM reprend également ses valeurs. L’Ineris conseille de ne retenir ni les valeurs guide ni les valeurs provisoires.
La VTR de l’ATSDR (2012) est basée sur une méta-analyse de 2008 permettant d’établir un lien entre le cadmium urinaire et la prévalence de niveaux élevés de biomarqueurs de la fonction urinaire. L’augmentation de l’élimination des protéines de faible poids moléculaire a été retenue comme effet critique. Enfin, l’utilisation d’un modèle PBPK a permis de déterminer les doses de cadmium ingérées en fonction du sexe. Cette valeur a été proposée en 2008 et validée en 2012.
Enfin, la valeur de l’Efsa (2011) est basée sur la β2-microglobinurie et prend en compte les méta-analyses et les données récentes en termes d’apports journaliers. Cette valeur tient compte de l’ensemble des données disponibles.
En 2017, l’Anses a réévalué les données et propose une valeur basée sur les effets osseux qui surviennent pour des concentrations en cadmium urinaires légèrement plus basses que celles induisant les effets rénaux. La corrélation des concentrations en cadmium urinaire et la survenue des effets est bien documentée en lien avec l’exposition au cadmium.
Cette nouvelle valeur de l’Anses construite à partir d’une étude épidémiologique est retenue par l’Ineris.
Cette valeur s’appuie sur des études épidémiologiques récentes et est soutenue par des méta-analyses récentes, elle est de bonne qualité.
Indice de confiance : L’Anses accorde un indice de confiance moyen dans sa valeur
Effets à seuil - Exposition aiguë par inhalation:
L’Ineris propose de retenir pour une exposition aiguë au cadmium par inhalation la VTR chronique de 0,45 µg Cd.m-3 de l’Anses.
Une seule valeur est disponible (ATSDR, 2012). Il s’agit d’une valeur établie à partir d’une étude expérimentale (NTP, 1995) de bonne qualité et dont la durée d’exposition (2 semaines) est adaptée à celle d’une VTR aiguë. L’ajustement de la concentration est clairement décrit et correspond aux pratiques usuelles, le choix des facteurs d’incertitude est en cohérence avec les données disponibles : facteur d’incertitude 300. La valeur de 0,03 µg Cd.m-3 de l’ATSDR établie pour une exposition aiguë étant plus faible que la valeur chronique retenue ci-dessous, la valeur retenue par l’Ineris est donc la VTR pour une exposition chronique de 0,45 µg Cd.m-3. Ces différences s’expliquent notamment par l’application sur l’étude aiguë chez l’animal de plusieurs facteurs d’extrapolation et d’incertitude.
Cette valeur est retenue par l’Ineris.
Cette valeur est construite à partir de la VTR pour une exposition chronique au cadmium ce qui limite la qualité de la valeur retenue. Il est à noter qu’elle est moins protectrice que celle développée pour une exposition aiguë.
Indice de confiance : L’Anses accorde un indice de confiance moyen dans sa valeur
Effets à seuil - Exposition chronique non cancérogène par inhalation:
L’Anses propose pour une exposition chronique par inhalation au cadmium la valeur de 0,45 µg.m-3.
Quatre organismes proposent des valeurs l’OMS (2000), l’OEHHA (2000), l’ATSDR (2012) et l’Anses (2012), toutes fondées sur des données humaines.
Dans la mesure où l’Anses a élaborée une valeur en juillet 2012, celle-ci est retenue. Depuis, l’ATSDR a proposé une nouvelle valeur en septembre 2012, cette dernière correspond à la validation de la valeur qui avait été proposée en 2008 par l’ATSDR.
La valeur établie par l’OMS (2000) est une valeur guide. De manière générale, l’Ineris ne conseille pas de retenir de valeur guide sauf quand il est clairement spécifié qu’il s’agit d’une VTR, ce qui est le cas ici. Par ailleurs, l’OEHHA (2000) propose également une VTR. Ces deux valeurs sont établies pour les mêmes effets (augmentation des dysfonctionnements rénaux et des cancers du poumon chez les travailleurs) et pour des niveaux d’effet proches.
La valeur de l’ATSDR (2012) est établie à partir d’une méta-analyse et retient comme effet critique les effets rénaux. A partir de la concentration de cadmium urinaire, la quantité de cadmium inhalé nécessaire afin d’atteindre une valeur de 0,5 µg Cd.g-1 de créatinine est approchée au moyen d’une modélisation. Un facteur d’incertitude 10 prenant en compte la variabilité au sein de l’espèce humaine et de l’absence de données relatives aux sensibilités du tractus respiratoire et des reins. La méta-analyse réalisée par l’ATSDR (2008) a été reprise par les travaux de l’Anses.
La valeur développée par l’Anses retient également les effets rénaux comme effet critique, sur la base des travaux de l’Efsa développés ci-dessous pour des expositions par voie orale et propose une extrapolation voie à voie à partir des mesures de dose interne. La démarche retenue suit celle proposée par l’ATSDR dans son projet de 2008, validé en 2012, mais en utilisant les valeurs de l’Efsa. Aucun facteur d’incertitude n’est appliqué du fait d’une démarche initiale protectrice en termes de sélection d’effet critique, de l’utilisation d’une population suffisamment représentative et de données issues d’une population sensible. Cette valeur, comme celle de l’ATSDR, semble plus adaptée que celles de l’OMS ou de l’OEHHA car elle n’est basée que sur les effets rénaux qui sont les premiers effets systémiques non cancérogènes. Si la construction des valeurs de l’ATSDR (2012) et l’Anses (2012) présentent une démarche analogue, celle de l’Anses intègre les travaux de l’ATSDR (2008) et ceux de l’Efsa (2009) ce qui la rende plus pertinente.
Dans ces conditions, la nouvelle valeur de l’ATSDR (2012) ne remet pas en cause la valeur de l’Anses (2012) qui est donc retenue pour les effets non cancérogènes.
Indice de confiance : élevé
Effets cancérogènes - Exposition chronique par inhalation
L’Anses propose pour une exposition chronique par inhalation au cadmium la valeur de 0,3 µg.m-3.
Quatre organismes proposent une valeur, l’US EPA (1987), l’OEHHA (2011), Santé Canada (2021) et Anses (2012). Les trois premiers proposent des valeurs pour des effets cancérogènes sans seuil, seul l’ANSES propose une valeur pour des effets cancérogènes à seuil d’effet. La valeur de l’Anses est retenue.
L’US EPA, l’OEHHA et Santé Canada proposent des valeurs basées sur la même étude épidémiologique, (Thun et al., 1985), et retiennent le même effet critique, à savoir l’excès de risque de cancer de l’appareil respiratoire. Des modèles mathématiques différents ont été utilisés par l’US EPA et l’OEHHA. Les récentes analyses ne permettent plus de retenir avec certitude le cadmium comme étant la seule source à l’origine des effets induits au cours des études épidémiologiques, les effets liés au tabagisme ou aux autres polluants tels que l’arsenic ou le nickel sont difficiles à estimer.
Compte tenu des conclusions des études relatives au mécanisme d’action du cadmium dans la genèse des cancers, en 2012, l’Anses propose une valeur pour des effets cancérogènes à seuil basée sur une étude expérimentale (Takenaka et al., 1983). L’utilisation d’étude expérimentale permet de s’affranchir des co-expositions, le lien de causalité est plus clair. L’étude de cancérogenèse chez le rat qui a été retenue est de bonne qualité. Le lien statistique entre l’exposition au cadmium et la survenue d’adénocarcinomes épidermoïdes et mucoépidermoïdes pulmonaires est significative et nettement établie dès la plus faible concentration. Une modélisation des données et un ajustement de la dose ont été pratiqués. Enfin, un facteur d’incertitude a été appliqué. La démarche est claire, cohérente et argumentée.
L’Ineris retient cette valeur de l’Anses.
Cette valeur est construite à partir d’une étude de bonne qualité chez le rat et repose sur l’analyse des données épidémiologiques existantes. La démarche est claire, cohérente et argumentée.
Indice de confiance : élevé
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 04/08/2025
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Malgré un déclin des utilisations intentionnelles, lié à une règlementation toujours plus contraignante, les apports de cadmium dans l'environnement, dans l'air, les milieux aquatiques et les sols vont perdurer longtemps, en raison de la difficulté de supprimer le cadmium dans certaines applications particulières et, surtout, en raison de la présence d'apports diffus très importants qui ne pourront pas être supprimés à court terme. Après une période de forte baisse dans les milieux aquatiques et les sédiments depuis plusieurs dizaines d'années, les concentrations semblent stagner ou ne décliner que lentement désormais.
Les rejets dans l'air restent associés aux activités de sidérurgie et métallurgie, de l'énergie et plus généralement de l'utilisation des ressources et combustibles fossiles. Dans les sols, la principale source est l'utilisation des engrais minéraux. Dans les milieux aquatiques les stations de traitements de déchets et des eaux usées restent les principales sources ponctuelles. L'industrie de bois, papier et carton ainsi que l'industrie chimique présentent également des rejets dans l'ensemble des compartiments environnementaux. Du fait d'une baisse continue des émissions ponctuelles directes, ce sont les sources diffuses et indirectes (engrais, apports atmosphériques, …) qui dominent les apports vers les eaux de surface.
Plusieurs voies d'interventions règlementaires ont été utilisées ces dernières années en France et en Europe pour tenter de réduire l'utilisation et les rejets de Cadmium dans l'environnement, notamment dans le cadre de REACH (interdiction dans les peintures).
Les usages plus importants présentent une réduction significative (fabrication de batteries, peintures, pigments, laques, plastiques, matériaux de construction) mais certains usages demeurent difficiles à réduire :
- L'utilisation non-intentionnelle dans les engrais semble se heurter à des difficultés plus économiques que techniques pour retirer le Cadmium des engrais phosphatés avant leur mise sur le marché,
- Certaines applications spéciales dans les batteries industrielles perdurent, pour des raisons d'exigences de performances que ne peuvent remplir les alternatives au Nickel et au Lithium,
- L'industrie du traitement de surface semble encore réclamer le cadmium pour des traitements anticorrosion dans les domaines de l'aérospatiale et militaire. Toutefois les alternatives (Zn/Ni, Aluminium sous divers procédés, …) semblent se développer de façon continue aux USA, avec une volonté des autorités du Department of Defence.
Quelques usages seraient même en croissance, comme pour les équipements électriques et électroniques ainsi que les panneaux photovoltaïques, ces derniers pouvant être des sources significatives à terme. La récupération du cadmium lors du recyclage est également un enjeu actuel et futur à maîtriser pour obtenir une réduction supplémentaire de la contamination des milieux aquatiques.
Abstract
Despite a decline in intentional uses due to increasingly stringent regulations, cadmium emissions to the atmospheric and aquatic environments and to soils will persist for a long time, due to the difficulty of removing cadmium in some of its applications, and because of the presence of very significant diffuse emissions which can not be eliminated in the short term. After a period of sharp decline in aquatic environments and sediments over several decades, concentrations appear to be stagnating or declining only slowly.
Releases to air remain associated with steel and metallurgical activities, energy and more generally the use of fossil fuels and resources. In soils, the main source is the use of mineral fertilizers. In aquatic environments waste and wastewater treatment plants remain the main point sources. The wood, paper and paperboard industry as well as the chemical industry also cause releases in all environmental compartments. Due to a continuous decline in direct point emissions, diffuse and indirect sources (fertilizers, atmospheric inputs, etc.) dominate emissions to surface water.
Several avenues of regulatory intervention have been used in recent years in France and Europe to try to reduce the use and releases of cadmium in the environment, in particular within the framework of REACH (ban in paints).
The most important uses show a significant reduction (manufacture of batteries, paints, pigments, lacquers, plastics, building materials) but some uses remain difficult to reduce:
- Removing nintended cadmium from phosphate fertilizers before they are placed on the market appears to face more economic than technical difficulties,
- Some special applications in industrial batteries persist, for reasons of performance requirements that can not be met by Nickel and Lithium alternatives,
- The surface treatment industry still seems to be demanding cadmium for anti-corrosion treatments in the aerospace and military fields. However, the alternatives (ZnNi, Aluminum under various processes, ...) seem to develop continuously in the USA, with the will of the authorities of the Department of Defense.
Some uses are even growing, as for electrical and electronic equipment as well as photovoltaic panels, and the latter may be a significant sources in the long term. The recovery of cadmium during recycling is also a current and future challenge to be mastered in order to obtain an additional reduction in the contamination of aquatic environments.
Tableaux de synthèse
Généralités
| CAS | 7440-43-9 |
|---|---|
| SANDRE | 1388 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | oui |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Le cadmium est une substance de la DCE classée dangereuse prioritaire, et qui fait également partie de la liste des mesures prioritaires OSPAR. TEXTES GENERAUXLes principaux textes réglementaires concernant le cadmium et ses composés sont présentés dans le Tableau 2. Tableau 2. Reglementation européenne sur les usages du cadmium et ses composés
Source: INRS 2013; Agence de l'eau Seine Normandie 2008; USGS 2016, site ECHA.
RESTRICTIONS D'USAGEL'usage du cadmium est limité par la réglementation européenne notamment dans les applications suivantes : Équipements électriques et électroniquesLa directive 2002/95/CE relative à la limitation de l'utilisation de certaines substances dangereuses dans les équipements électriques et électroniques1 prescrit que les États membres veillent à ce qu'à compter du 1er juillet 2006, les nouveaux équipements électriques et électroniques mis sur le marché ne contiennent pas de cadmium. En mai 2015, le Parlement Européen a rejeté la proposition de la Commission visant à prolonger la période pendant laquelle le cadmium (sous forme nanométrique de « quantum dots ») peut être utilisé dans l'éclairage d'appareils tels que des téléviseurs et des écrans d'ordinateur. (USGS 2016). [1] Directive 2002/95/CE du Parlement européen et du Conseil, du 27 janvier 2003, relative à la limitation de l'utilisation de certaines substances dangereuses dans les équipements électriques et électroniques. Piles et accumulateursLa directive 2006/66/CE du septembre 2006 relative aux piles et aux accumulateurs interdit la mise sur le marché de la plupart des piles et accumulateurs contenant plus de 0,002% de cadmium en poids. En 2013 une dérogation est votée pour les piles et accumulateurs portables destinés à être utilisés dans des outils électriques sans fil jusqu'au 31 décembre 2016, afin de permettre à l'industrie du recyclage et aux consommateurs, tout au long de la chaîne de valeur, de s'adapter davantage aux technologies de remplacement pertinentes. Une exception subsiste pour les piles et accumulateurs destinés à être utilisées dans les systèmes d'urgence et d'alarme ou les équipements médicaux. Trois textes réglementaires ont été transposées à la réglementation française, le décret 2015-849 du 10 juillet 2015, l'arrêté du 6 août 2015 et l'arrêté du 6 août 2015. Le dernier est relatif au registre national où les éco-organismes agrées déclarent les quantités mises sur le marché. Coloration et stabilisation de certains produits et traitement de surfaceLes interdictions d'usage et de mise sur le marché sont détaillées dans la directive 91/338/CEE2 . De multiples applications du PVC et des polymères sont touchées par ces interdictions. Une dérogation à la restriction de l'usage du Cadmium pour les pigments de cadmium (cadmium sulphide, cadmium sulphoselenide Orange 20, cadmium sulphoselenide Red 108 and cadmium zinc sulphide Yellow 35) utilisés dans des articles colorés pour des raisons de sécurité a été accordée en 2012 (European Chemicals Agency 2012e). Cette dérogation porte en général à des situations où les conditions environnementales ou de fonctionnement sont extrêmes (par exemple, des températures élevées, temps en plein air), où la solidité des couleurs est importante pour des raisons de sécurité (par exemple pour identifier les équipements de sécurité ou pour éviter les erreurs de maintenance « safety critical »), et où la durée de vie prévue des articles en question est relativement longue. Par dérogation l'utilisation du cadmium et de ses composés reste possible dans les secteurs où leur emploi demeure techniquement indispensable par sécurité : secteurs de l'aéronautique, l'aérospatiale, l'exploitation minière, secteurs « off-shore », du nucléaire, de la défense et fabrication des contacts électriques (INRS 2013). [2] Directive 91/338/CEE du Conseil du 18 juin 1991 portant dixième modification de la directive 76/769/CEE (directive concernant le rapprochement des dispositions législatives, réglementaires et administratives des États membres relatives à la limitation de la mise sur le marché et de l'emploi de certaines substances et préparations dangereuses). EngraisLes engrais phosphatés sont identifiés comme une source importante de Cd dans le sol. Le cadmium naturel présente dans les roches phosphatées et son contenu final dans l'engrais dépend à la fois des matières premières et de la méthode de fabrication. La régulation (EC) N°2003/2003 relatif aux fertilisants couvre les engrais minéraux mais elle n'impose pas de seuil pour la teneur en Cd. Ces limites peuvent être imposées à la discrétion des États membres (Cichy et al. 2014). La Commission européenne3 a pour projet de fixer des teneurs maximales en cadmium dans les engrais. Le projet actuel de la Commission4 vise à limiter les teneurs en cadmium, exprimées en mg Cd/ kg P2O5 aux valeurs suivantes : 60 mg 5 ans après l'entrée en vigueur, pour arriver progressivement à 20 mg 15 ans après l'entrée en vigueur. [3] Commission Risk Reduction Strategy for cadmium (2008). [4] Draft proposal relating to Cadmium in fertilizers, téléchargeable depuis : http://europa.eu.int/comm/enterprise/chemicals/legislation/fertilizers/cadmium/draft_proposal.pdf. PeinturesLe Cadmium est interdit dans les peintures dans l'UE5 (limite de 0,01% en poids sauf pour les peintures comportant au moins 10% de Zinc, pour lesquelles la limite est de 0,1%, et sauf pour les peintures d'artiste pour lesquelles il reste autorisé6). [5] Décision du 12 Février 2016 modifiant l’Annexe XVII du Règlement REACH. [6] Décision 2015/C 356/01de la CE ACTION DE RECHERCHE RSDEL'action nationale de recherche et de réduction des rejets de substances dangereuses dans l'eau (RSDE) par les installations classées registre les émissions de cadmium dans l'environnement (circulaire du 4 février 2002, circulaire du 5 janvier 2009)8 [8] http://www.ineris.fr/rsde/ . AUTRES TEXTESEn relation à la prévention du risque en milieu professionnel le Tableau 6 rapporte les textes cités dans le Code du travail et le Code de la sécurité sociale. Tableau 6. Réglementation sécurité et santé au travail sur les usages du cadmium et ses composés
Source: INRS 2013 |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. SEUILS DE REJETS POUR LES INSTALLATIONS CLASSEESPar l'arrêté du 26 décembre 2012, les installations classées pour la protection de l'environnement et exploitants de station d'épuration d'eaux urbaines dont les capacités sont supérieurs aux seuils de rejets de cadmium (voir Tableau 3) sont soumisses au registre et à la déclaration annuelle des émissions polluants et des déchets (Ministère de l'écologie du développement durable et de l'énergie 2012). Tableau 3. Seuil de rejets de cadmium et composés pour les installations classées [*] Pour les installations d'incinération de déchets non dangereux et les installations d'incinération de déchets dangereux, ce seuil est fixé à 0. Source: Ministère de l'écologie du développement durable et de l'énergie 2012 L'arrêté du 2 février 1998, dit 'arrêté intégré'7 , et l'arrêté du 12 mars 2003 imposent des valeurs limites de concentration et de flux pour certains rejets industriels : Tableau 4. Valeurs limites de rejets pour le cadmium
[7] Arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation. VALEURS LIMITES D'EXPOSITION PROFESSIONNELLELe Tableau 5 présente les valeurs limites d'exposition professionnelle (VLEP) établies en France dans les lieux de travail (circulaire du 13 mai 1987 modifiant la circulaire du ministère du travail du 19 juillet 1982). Tableau 5. Valeurs limites d'exposition professionnelle du cadmium
[*] L'absence de mention, elles se rapportent à la fraction inhalable. Source: INRS 2013 Le comité scientifique sur les limites d'exposition professionnelle (SCOEL, 2009) a recommandé un équivalent de 4 µg Cd/m3 (fraction respirable) pour le cadmium et ses composés inorganiques comme protection contre les effets à long terme (y compris les effets respiratoires et le cancer du poumon) ; ainsi qu'une valeur limite biologique (BLV) de 2 µg Cd/g de créatinine. L'EFSA (2009) a utilisé une valeur inférieure, 1 µg.g-1 de créatinine, comme point de référence pour l'évaluation du risque de cadmium dans les aliments. La liste HSE (2007) inclut une limite d'exposition professionnelle de 0,025 mg.m-3 pour le cadmium et ses composés, à l'exclusion du sulfure de cadmium CdS de 0,03 mg.m-3 (European Chemicals Agency, 2012b). |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
PRODUCTION MONDIALE
La plupart de la production primaire de cadmium se fait en Asie. Les principaux producteurs sont la Chine, la Corée et le Japon. La production secondaire représente environ 20% de la production mondiale (voir Tableau 9). La consommation est surtout localisée en Belgique9 , Chine, Inde et Japon.
La production de batteries NiCd représente plus de 80% de la consommation mondiale du cadmium. Les autres usages, par ordre décroissant de consommation au niveau mondial, sont les pigments, les revêtements et le placage, des stabilisants pour les matières plastiques et des alliages non ferreux (USGS 2016).
Tableau 9. Production mondiale par les raffineries de cadmium (tonnes de Cd)
Source: USGS (2016, 2008)
Le prix annuel moyen du cadmium a diminué pour la quatrième année consécutive, diminuant de 46% en 2015 par rapport à celui de 2014 à environ 1,05 US$ le kilogramme. La baisse des prix a été attribuée à une offre excédentaire de cadmium sur le marché (voir Figure 3), à une demande réduite en Inde et à un recul de la production de piles au nickel-cadmium en Chine, car une augmentation des réglementations environnementales nationales a entraîné plusieurs fermetures d'installations (USGS 2016).
Figure 3. Production mondiale et prix du cadmium
Source: USGS 2016
[9] La seconde place de la Belgique est liée à la présence de l'usine du groupe Floridienne, qui importe du cadmium dont celui recyclé par la société SNAM en France, pour le transformer en différents sels ou poudres qui sont ensuite, en grande partie, exportés.
PRODUCTION EN FRANCE
La production de Cd en Europe (2000-2002) est estimée à environ 1114t.an-1 et le commerce (import/export) est d'environ 2850 t.an-1 disponible pour les diverses utilisations (Joint Research Centre 2007).
En 2015, la France n'a plus de production minière de cadmium depuis la fermeture du gisement de Saint-Salvy (81). Le cadmium français est obtenu par recyclage principalement des accumulateurs nickel-cadmium (voir section sur le recyclage).
Les exportations sont estimées à 7t vers l'Allemagne et le Portugal, et les importations sont estimés à 62t en provenance de Chine, des Etats Unis et de Russie (Societe Chimique de France n.d.).
METALLURGIE DU ZINC
La métallurgie du zinc est réalisée en France par la société Umicore (ex Union minière) à l'usine d'Auby. La production de cadmium liée à la métallurgie du zinc était de 664 tonnes en 1981. En 2011, suite à l'interdiction de Cd dans les alliages (Europen Commission 2011) Umicore a cessé la production d'alliages contenant du cadmium en Europe et vise pour 2016 la vente de ses installations en France (La Voix du Nord 2015).
RECYCLAGE
En 2015, le taux de recyclage de cadmium est estimé, à l'échelle mondiale, à 20%, principalement à partir de accumulateurs de nickel-cadmium (Societe Chimique de France n.d.).
Le recyclage des accumulateurs nickel-cadmium est notamment assuré en France par la Société Nouvelle d'Affinage de Métaux (SNAM), filiale du groupe belge Floridienne. Celle-ci emploie 100 personnes à temps plein. Les sources de cadmium traitées par la SNAM sont, outre les accumulateurs et piles, des poudres provenant de systèmes d'assainissement de l'air des usines de la métallurgie et divers déchets de production industrielle. Le procédé de recyclage est divisé sur deux sites : Saint Quentin Fallavier (38) où est réalisée la collecte et le tri des sources ; et à Viviez (12) où un procédé thermique permet la séparation du cadmium dans un environnement confiné.
La SNAM a connu une baisse importante de sa production les huit dernières années, passant de 1000 tonnes à 100 tonnes aujourd'hui. Pur à 99,99 %, ce cadmium est vendu majoritairement à des producteurs d'accumulateurs nickel-cadmium.
La société SAFT, premier producteur européen d'accumulateurs nickel-cadmium à usage industriel, ne recycle pas ces derniers sur le territoire français mais confie cette tâche à une filiale suédoise.
SNAM et la filiale suédoise de SAFT-AB représentent ensemble près de 80 % de la capacité européenne de recyclage. Les 20 % restant sont constitués par l'opérateur ACCUREC en Allemagne (Commission européenne 2003c ; Joint Research Centre 2007).
Procédés de production
Le cadmium est principalement associé au minerai de zinc, avec une teneur en Cd comprise entre 0,01 et 0,05% et donc il est un coproduit de la métallurgie du Zn, avec un rendement de1,8 à 6 kg de cadmium par tonne de zinc. Le cadmium est également présent dans des minerais de plomb et de cuivre, ainsi que dans des phosphates naturels (Societe Chimique de France n.d.).
La production de cadmium est une activité industrielle connexe à celle du zinc. Le cadmium est récupéré par filtration du gaz provenant de la pyrométallurgie ou récupéré des effluents de l'hydrométallurgie du zinc.
Utilisations
Introduction (varitétés d'utilisations)
FTE 2015 Importer
Les utilisations du cadmium métal dans les secteurs autorisés sont les suivantes (INRS 2013) :
- fabrication de poudre d'oxyde de cadmium à partir de cadmium métallique, utilisée comme catalyseur de réactions de polymérisation ;
- électrode négative dans les accumulateurs électriques rechargeables au nickel-cadmium ; (au cours de ces dernières années, les deux utilisations mentionnées ci-dessus ont consommé la majorité de la production mondiale de cadmium alors que les autres utilisations sont en forte diminution) ;
- revêtement anticorrosion des métaux (acier, fonte, alliages de cuivre, aluminium...) ; le cadmiage est généralement réalisé par électrolyse, mais le trempage et la pulvérisation sont possibles ;
- constituants de nombreux alliages : à bas point de fusion (alliage d'étain-plomb-bismuth-cadmium) ; cependant l'utilisation de cadmium comme composant d'alliages tend à diminuer au profit d'alliages exempts de cadmium.
- matières premières pour la préparation d'autres composés du cadmium, notamment des sels d'acides organiques utilisés comme stabilisants pour plastiques (oxyde, chlorure, nitrate) ;
- pigments pour peintures, plastiques, encres, émaux (sulfure, sulfoséléniure), utilisations en nette diminution ;
- constituants de nombreux matériels électriques : batteries (CdO), cellules solaires ou photoélectriques, redresseurs, contacteurs, semi-conducteurs (oxyde, hydroxyde, sulfate, sulfure, séléniure).
- utilisation des composés minéraux du cadmium dans les secteurs autorisés où leur emploi demeure techniquement indispensable : secteurs de l'aéronautique, l'aérospatiale, l'exploitation minière, secteurs « off-shore », du nucléaire, de la défense et la fabrication des contacts électriques.
En France, la consommation de cadmium est estimée à 1 800 t.an-1 (National Resources Canada), mais il s'agit d'un chiffre ancien (1994) qui est probablement nettement surestimé à l'heure actuelle. 50 % de cette consommation serait consacrée à des applications industrielles et 50 % à des applications domestiques.
L'utilisation du cadmium est globalement en déclin. L'utilisation pour les accumulateurs et piles est très largement aujourd'hui la principale application du cadmium (ADEME 2015; HELCOM 2002) et elle est elle-même en déclin. En Europe, l'utilisation de Cd atteint 2638 tonnes réparties : 75,2% pour les batteries NiCd, 14,9% pour les pigments, 5% pour les stabilisateurs et 5% pour les alliages et les plaques (Joint Research Centre 2007).
PILES ET ACCUMULATEURS (PA)
Le couple électrochimique nickel-cadmium est employé dans la fabrication des accumulateurs et piles. Dans cette application, c'est la forme hydroxyde Cd(OH)2 du cadmium, obtenue à partir de l'oxyde CdO, qui est utilisée. Cet usage représentait environ trois quarts des usages totaux de Cd dans l'UE en 1996 (Commission européenne 2003a). En 2002 il est estimé à 83,5% (Joint Research Centre 2007) ; cette proportion n'était que de 55 % en 1990.
Du fait de la règlementation européenne les applications grand public sont en décroissance rapide, alors que les applications industrielles (ferroviaire, aviation, véhicules électriques) se maintiennent. Les accumulateurs Ni-Cd ne représentent cependant que 2 % des accumulateurs industriels, leur immense majorité étant au plomb (Commission européenne 2003a).
La société française SAFT (groupe Total) est un acteur majeur de ce marché. Seul fabricant français, elle emploie 4 140 personnes dans le monde (Google Finance 2016). Son chiffre d'affaires global est d'environ 45 millions d'euros ; la moitié environ est réalisée en France. La production d'accumulateurs Ni-Cd pour l'industrie représente 50 % à 60 % de son activité (premier rang en Europe). En France, l'activité de production de SAFT qui concerne les batteries Ni-Cd est répartie sur deux sites industriels : Bordeaux et Poitiers.
Le cadmium consommé par SAFT est principalement issu du recyclage : de France (SNAM) ou d'Europe (filiale suédoise de SAFT, société allemande de recyclage).
L'emploi du couple Ni-Cd subsiste pour des piles et batteries rechargeables dans les secteurs encore variés (même si des technologies alternatives tendent à le supplanter) :
- Industrie : systèmes de secours par batteries pour raffineries, centrales électriques, installations pétrolières et gazières off-shore ou on-shore, postes de transformation, d'infrastructures d'aéroports ou de bâtiments
- Aviation (démarrages en direct des moteurs et des groupes auxiliaires de puissance (Auxiliary Power Unit), stabilisation du réseau et secours énergie)
- Transports ferroviaires : alimentations d'urgence et de secours, démarrage de moteurs, traction par récupération de l'énergie au freinage et signalisation
- Véhicules électriques et hybrides
- Equipement des réseaux de télécommunications et d'énergie : stockage de l'énergie renouvelable,
- Applications militaires et spatiales.
En France, Le nombre d'accumulateurs Ni-Cd industriels mis sur le marché a diminué de 10 %. Ces accumulateurs représentent 27 % des PA industriels mis sur le marché en 2014. Une évolution à la baisse au profit d'autres natures est prévue pour les prochaines années, en réponse à la limitation réglementaire de l'utilisation du cadmium imposée par la directive européenne 2013/56/UE (ADEME 2014).
L'utilisation pour le grand public est désormais marginale pour des batteries de téléphones mobiles et d'ordinateurs portables. En revanche, leur emploi reste important pour les outils portables (Noréus, 2000). Aucune usine de fabrication de PA portables n'est installée en France. Environ la moitié des PA portables proviennent de l'Union européenne (Belgique, Allemagne, Europe de l'Est) et la moitié d'Asie et des États-Unis (ADEME 2014). On estime que les piles et accumulateurs NiCd portables contiennent en moyenne 13 % de cadmium en poids et les industriels 8 % (Commission européenne 2003a).
PIGMENTS ET STABILISANTS
Les pigments de cadmium sont des colorants inorganiques stables qui peuvent être produits dans une gamme de nuances brillantes de jaune, orange, rouge et marron. Leur plus grande utilisation est dans les plastiques, mais ils ont également une application significative dans la céramique, les verres et les peintures spécialisées (peintures d'artistes). Ces usages sont limités par la directive 91/338/EEC « directive Cadmium » ainsi que par la réglementation REACH, plusieurs pigments étant des substances soumises à autorisation (European Chemicals Agency 2012b; European Chemicals Agency 2012c; ECHA 2013; ECHA 2015; European Chemicals Agency 2012a).
La consommation mondiale de pigments de cadmium a suivi le développement de l'industrie des plastiques et a atteint environ 6000 tonnes en 1975 (European Chemicals Agency 2012e). Les pigments à base d'oxyde de cadmium CdO, représentaient environ 20 % des usages totaux de Cd dans l'UE en 1996 (15 % pour les pigments et 5 % pour les stabilisants) (Commission européenne 2003a). Ces deux pourcentages sont en forte baisse depuis 1990. Depuis lors, leur utilisation a été réduite en raison de leurs propriétés dangereuses, et de l'apparition de produits de substitution de haute qualité, en particulier, les pigments organiques thermostables jaunes et rouges. En 2003, l'EU-16 estimait une consommation de 499 tonnes métriques de Cd dans les pigments (Joint Research Centre 2007).
Les pigments de cadmium sont également utilisés pour colorer les glaçures, céramiques et émaux. Dans les deux cas, des températures de cuisson élevées sont nécessaires. Ceci exclut les pigments organiques et réduit le nombre de pigments inorganiques appropriés. Pour les teintes jaunes, il y a différentes alternatives, mais le sulfoséléniure de cadmium est le seul pigment rouge brillant utilisable selon l'industrie concernée. Les pigments de cadmium sont appropriés pour toutes les finitions de surface des céramiques.
Les pigments de cadmium ont aussi un certain nombre d'autres utilisations mineures dans le caoutchouc, le papier et les encres, bien que ceux-ci faibles en termes de consommation de cadmium (European Chemicals Agency 2012e). Il y a une seule société fabricant des pigments de cadmium en France (Eurometaux, 2004) (Micron Couleurs à Narbonne).
Le cadmium (CdO) est ou a été utilisé pour fabriquer des stabilisants incorporés notamment dans les plastiques. Cet usage est en déclin compte tenu des dispositions de la directive 91/338/CEE. L'usage de composés au cadmium comme stabilisant du PVC a cessé dans les pays de l'Union européenne en mars 2001, conformément à l'engagement volontaire de l'industrie du PVC.
CHARGES DE BRASAGE[10]
L'Annexe XVII de REACH sur le Cd restreint son utilisation dans les charges de brasage, celles-ci ne devant pas être mises sur le marché si la concentration de cadmium (exprimée en Cd métal) est égale ou supérieure à 0,01% en poids (European Chemicals Agency 2012d).
L'incorporation de cadmium dans les charges de brasage présente trois avantages essentiels : (i) elle réduit la température de brasage, (ii) elle raccourcit la durée du processus de brasage et (iii) elle réduit le coût de brasage. La charge la plus répandue utilise 25% de cadmium et 42% d'argent avec le cuivre à environ 17% et le zinc 16%, car cela offre la meilleure combinaison des caractéristiques de température de fusion, la vitesse et le coût (European Chemicals Agency 2012d).
La consommation européenne d'alliages de brasage contenant du cadmium (pour l'utilisation professionnelle et grand public) était de 90 à140 tonnes en 2010, représentant une quantité de cadmium d'environ 22,5 à 35 tonnes. Les principaux usages des alliages de soudure étaient l'outillage, les échangeurs de chaleur, la réfrigération, la plomberie et les composants électriques. Ces utilisations sont plus répandues dans les pays d'Europe du Sud comme la France, l'Espagne, l'Italie et le Portugal (European Chemicals Agency 2012d). La restriction REACH Annexe XVII devrait inciter la réduction de ces applications.
Une dérogation concerne les applications des charges de brasage utilisées dans la défense et l'aérospatiale pour des raisons de sécurité.
A demande de British Compressed Gases Association (BCGA) l'usage de charges contenant du cadmium a été accordée pour la production de systèmes d'acétylène à haute pression, du fait que l'absence de cadmium se traduirait par des joints de qualité inférieure, ce qui augmenterait le risque d'explosion (European Chemicals Agency 2012d).
[10] Le brasage est une opération d'assemblage de pièces métalliques au moyen d'un métal d'apport à l'état liquide, dont la température de fusion est inférieure à celle des pièces à assembler Le brasage de métal d'apport peut se présenter sous forme de fil, poudre, pâtes,…
TRAITEMENT DE SURFACE DES METAUX
Cet usage représentait environ 4 % des usages du Cd dans l'UE en 1996 et cette proportion a régressé de moitié entre 1990 et 1996 (Commission européenne 2003c). Le cadmium métal (Cd) est utilisé dans ce cas pour plusieurs raisons :
- conférer des propriétés particulières de résistance à la corrosion, supérieures à celles obtenues par des bains au zinc ;
- conférer des propriétés de faible coefficient de friction au métal, notamment pour des applications exigeantes de type aéronautique et militaires, comme pour les freins (automobile, aéronautique), les fixations (de trains d'atterrissage, des différents composants de munitions et d'armes,…) ;
- conférer des propriétés de résistance à l'oxydation et la corrosion et assurer une bonne conductivité électrique (pour des connecteurs électriques notamment).
La profession estime que les secteurs qui utilisent le cadmium sont à 90 % l'aéronautique et à 10 % le spatial, les autres applications étant très marginales.
PRODUCTION DE CELLULES PHOTOVOLTAÏQUES
Le tellure de cadmium (CdTe) est utilisé dans les panneaux photovoltaïques à couche mince pour absorber et convertir la lumière du soleil en électricité. Le CdTe est maintenant le deuxième matériau de cellule solaire le plus utilisé après le silicium. L'efficacité des panneaux du module de couche mince est évaluée à 6,3% pour le silicium amorphe (a-Si) ; 10,9% pour le CdTe et 11 ;5% pour le diselénure de cuivre indium gallium (CIGS) (NREL 2012).
Le parc solaire photovoltaïque de l'UE atteignait en 2015 une puissance totale de 94,6 GW, pour une puissance mondiale qui dépassait les 227GW. Le marché européen reste toutefois peu diversifié. En 2015, il s'appuie essentiellement sur trois pays, le Royaume-Uni, l'Allemagne et la France.(Observ'ER 2016).
En France, en 2015-2016 plusieurs appels d'offres portant sur le développement des installations photovoltaïques de moyenne puissance (100 à 250 kWc) pour des bâtiments et des ombrières de parking, ont été lancé par le gouvernement (MEEM). Fin 2015,le grand parc photovoltaïque de Cestes (33) a été mis en service (Observ'ER 2016).
Le développement de cette filière suscite des incertitudes sur l'utilisation des substances dangereuses (plomb, mercure, cadmium...) dans les équipements électriques ou électroniques des panneaux, notamment pour ce qui concerne la fin de vie des installations (Grasland 2010).
L'analyse de cycle de vie de l'IEA (Frischknecht et al. 2015) sur les systèmes photovoltaïques présente quelques données sur l'utilisation de cadmium dans la production de laminés photovoltaïques de CdTe et sur les émissions associées (voir Tableau 10).
Tableau 10. Données d'utilisation et d'émission de composés du Cd pour la production de laminés photovoltaïques de CdTe (exprimées par m2 de laminé produit)
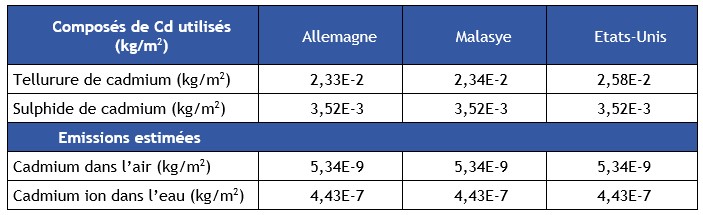
Source: NREL 2012
COMPOSANT D'ALLIAGES
Le cadmium métal (Cd) entre dans une assez grande variété d'alliages, dans des quantités en général faibles, comme par exemple dans le cuivre pour augmenter sa résistance sans baisser sa conductivité électrique. Cet usage est en forte chute dans l'UE : l'utilisation du cadmium dans des alliages a été, en quantité, divisée par 10 entre 1985 et 1996 (Commission européenne 2003b).
ENGRAIS
Les activités agricoles introduisent du cadmium dans les sols par usage des engrais phosphatés (Roberts 2014). Le cycle de l'eau et le labourage conduisent ensuite à une libération de ce polluant dans les hydrosystèmes. Le cadmium est un contaminant naturel des roches phosphatées et son contenu final dans l'engrais dépend à la fois du type de matière première et de la méthode de fabrication (Cichy et al. 2014).
Le règlement (CE) N°2003/2003 portait sur les engrais minéraux, mais n'a pas imposé de limite pour la teneur en Cd. La Commission européenne a proposé des valeurs limites plus strictes de transition de 60 à 20 mg Cd/kg P2O5 sur une période de 15 ans (Europen Commission 2004). Ces limites sont basées sur les conclusions d'une étude d'évaluation d'impact indiquant que les engrais contenant moins de 20 mg Cd/kg P2O5 ne devraient pas entraîner une accumulation de Cd à long terme dans le sol, ce qui par contre serait le cas avec des engrais contenant 60 mg Cd/kg P2O5.(Roberts 2014).
La teneur moyenne en Cd dans les engrais commercialisés dans l'UE est estimée à 45 mg Cd/kg P2O5. La valeur limite de 60 mg Cd/kg P2O5 (opinion de CSTEE11 dans la Commission Européenne) exclurait du marché environ 21% des engrais actuellement vendus, alors que l'introduction d'une valeur limite plus stricte de 20 mg Cd/kg P2O5 pourrait causer des changements importants sur le marché européen des engrais. Actuellement en Europe, une seule entreprise, Yara12 , commercialise des engrais à faible teneur en cadmium (Cichy et al. 2014).
[11] Scientific Committee on Toxicity, Ecotoxicity and the Environment (CSTEE)
[12] http://yara.com/
USAGES DIVERS
D'après les sources consultées (Joint Research Centre 2007; Commission européenne 2003b; OECD 1995), d'autres usages du cadmium sont:
- le traitement de surface du nickel ;
- les lampes à vapeur de cadmium ;
- le catalyseur (CdO) ;
- les composants électroniques. Cet usage était cependant normalement voué à disparaître après 2006 en raison de directives européennes (directives « EEE »). Cependant HELCOM (2002) estime qu'il peut progresser en raison de l'emploi dans les cellules photovoltaïques.
Synthèse des utilisations
Historiquement, le cadmium a été utilisé pour les traitements de surface, la fabrication de batteries ou de matières plastiques. Un assez grand nombre de produits (peintures, laques, vernis, matériaux de construction, réactifs de laboratoire, électronique…) peuvent ou ont pu contenir du cadmium en faible quantité. Les toitures en zinc, notamment pour les plus anciennes, sont dans ce cas. (Commission européenne 2003b). Les plus importantes d'entre elles seraient les piles et accumulateurs, suivis par les engrais (HELCOM 2002). Ses usages ont été restreints depuis une vingtaine d'années.
Il est maintenant interdit dans les plastiques alimentaires. Il a été remplacé dans les piles et est prohibé dans les équipements électriques et électroniques.
Le cadmium est fortement règlementé dans son utilisation ainsi que dans la manipulation au milieu professionnel. Cependant, il reste présent dans un très grand nombre d'applications industrielles, mais à de très faibles quantités. Cet usage diffus deviendrait donc de plus en plus significatif (électroniques, engrais) par rapport aux usages établis (batteries, pigments), qui sont en général en perte de vitesse.
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Le cadmium est un métal relativement rare présent dans l'environnement principalement en association avec le zinc, le plomb et le cuivre (The World Bank 1999).
Figure 2. Principaux pays producteurs de cadmium
Source: Maps of World 2011
Sources non-intentionelles
FTE 2015 Importer
Liées à la production de phosphate, les activités d'extraction de phosphore occasionnent encore des rejets de cadmium. C'est ainsi notamment le cas en France dans les mines de potasse d'Alsace, même après la cessation de leur activité (environ 70 tonnes de cadmium par an, source DRIRE Alsace Bilan 2003).
Le cadmium intervient, souvent de façon diffuse et à de faibles quantités dans un grand nombre de procédés et de produits industriels :
- la sidérurgie (émissions dans l'eau, dans l'air) ;
- la production de métaux non-ferreux ;
- la combustion de sources d'énergie fossiles (centrales thermiques, combustion industrielle, transport routier), du fait de sa présence dans les combustibles fossiles;
- l'incinération de déchets ménagers, les cimenteries.
Émissions anthropiques totales
FTE 2015 Importer
Le bilan de rejets industriels en France montre une réduction significative entre 2007 et 2014 du nombre d'établissements industriels ayant rejeté du cadmium dans le milieu naturel, voir Figure . Cet effet est également identifié par la diminution les rejets de cadmium (en kg) dans l'air, l'eau et le sol, voir Figure .
Figure 4. Nombre d'établissements industriels en France ayant rejetés du cadmium dans le milieu naturel en 2007 et 2014.
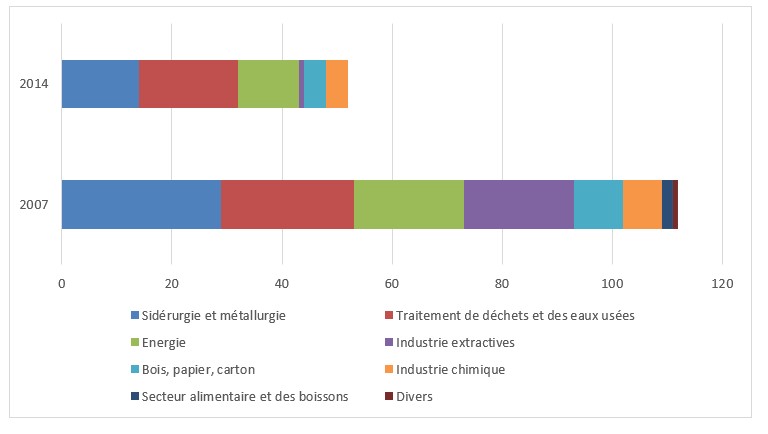
Source: European Environment Agency (2014)
Figure 5. Rejets du cadmium par activité industrielle en France dans l'air, l'eau et le sol en 2007 et 2014 en kg.
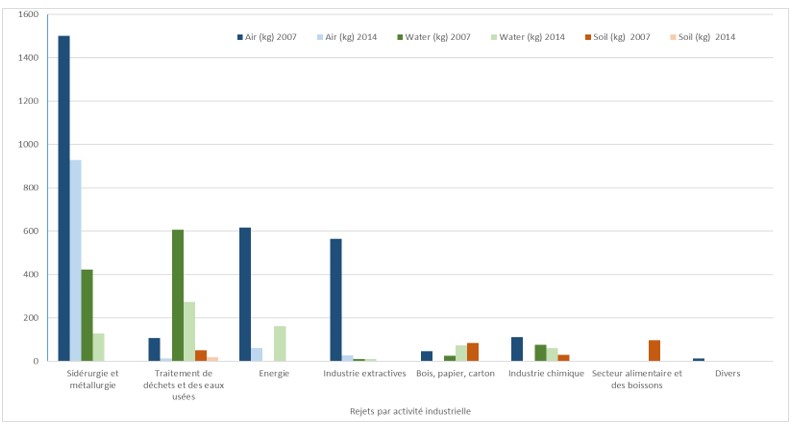
Source : European Environment Agency (2014)
Les rejets du cadmium dans l'environnement mettent en évidence une contribution importante du secteur de la sidérurgie et de la métallurgie. Notons qu'une des entreprises les plus polluantes de ce secteur est aujourd'hui fermée et que son site fera l'objet d'une dépollution.
Remarque : Selon les informations communiquées par un professionnel du secteur, la production de ciment n'engendrerait pas de rejets de cadmium comme il apparaît dans le bilan détaillé. En effet l'eau consommée n'entre jamais au contact de la matière.
La base de données européenne EPRTR13 a répertorié en 2014 un total des émissions française de cadmium des installations IPPC dans l'eau de 1140 kg, dans l'air de 1030 kg et 19,6 kg dans les sols.
[13] EPRTR (http://prtr.ec.europa.eu/) est alimenté en France par la BDREP, base de données gérée par l'INERIS.
Émissions atmosphériques
FTE 2015 Importer
D'après le CITEPA, les émissions atmosphériques en France ont été environ divisées par 10 entre 1990 et 2015 (pour s'établir à environ 2,5 kt.an-1), période sur laquelle une forte baisse continue a donc été observée, avec toutefois une stabilisation depuis quelques années. La principale source d'émissions atmosphériques demeure l'énergie manufacturière, suivie par le transport routier (voir Figure 6).
Figure 6. Emissions atmosphériques de Cadmium en France
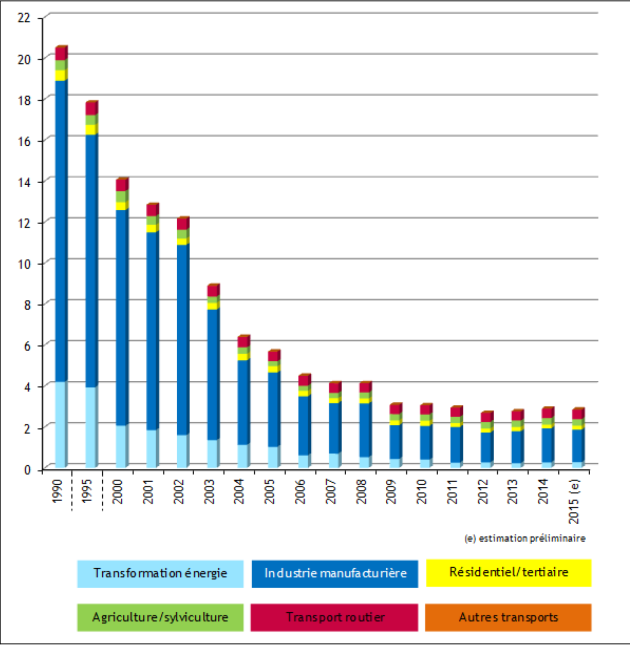
Source : CITEPA
Selon l'Agence Européenne de l'Environnement, les principales installations émettrices de Cd ont été en 2007 et 2014 les suivantes :
Tableau 11. Principales installations industrielles émettrices de cadmium en France dans l'air en 2014
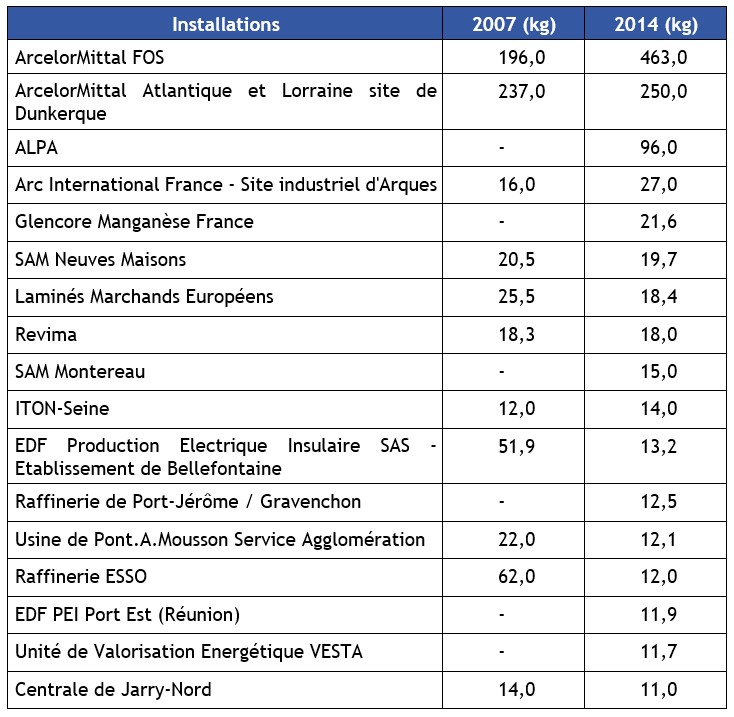
Source: European Environment Agency 2014
Émissions vers les eaux
FTE 2015 Importer
Le cadmium étant une substance prioritaire dangereuse de la DCE, il est suivi dans les eaux superficielles et les sédiments de cours d'eau en France. Quelques éléments quantitatifs sont donnés dans le Tableau 12.
Par rapport à l'ensemble des sources émettrices, la plupart des activités industrielles consommatrices de cadmium sont les sources majeures, ou du moins significatives, de ce polluant dans les eaux de surface : fabrication de batteries, d'alliages, de pigments, de stabilisants, d'engrais phosphatés, sidérurgie, traitement de surface (Royal Haskoning 2003b). La papeterie et la verrerie constituent des sources de moindre importance.
Les rejets de cadmium liés au traitement du zinc sont considérés comme une source majeure de cadmium dans les eaux de surface (Royal Haskoning 2003a).
Le Tableau 11, issu des travaux de la Commission internationale pour la protection du Rhin, montre que les apports diffus sur le bassin du Rhin seraient en fait sensiblement supérieurs aux sources ponctuelles (confirmant ainsi les constatations faites pour le bassin de la Seine ci-dessus). Les principales sources de pollution diffuses sont les eaux de drainage et les réseaux d'eaux usées. L'origine du cadmium dans les eaux de drainage est le cadmium accumulé dans les sols en raison de l'utilisation de fertilisants phosphatés contenant du cadmium, ou de la présence de déchets contaminés. Pour les rejets d'eaux usées, il peut s'agir d'origines diverses, dont notamment des eaux pluviales contenant du cadmium suite aux dépôts atmosphériques, à des micropollutions ponctuelles par des hydrocarbures, etc.
Tableau 12. Importance des différentes voies d'apport de cadmium dans le Rhin
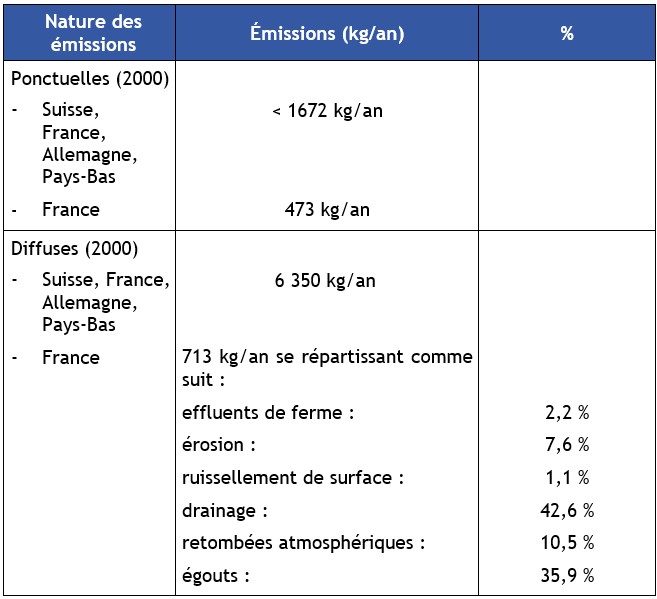
Source : Braun et al. 2003
Tableau 13. Emissions de cadmium dans les bassins hydrographiques en France métropolitaine en 2014 (référence en 2007)
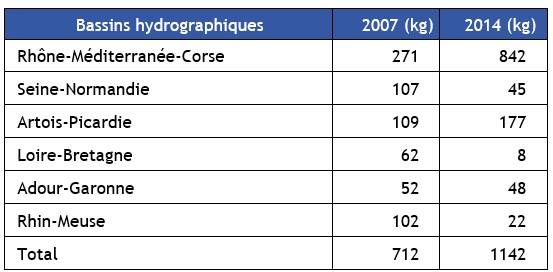
Source: European Environment Agency 2014
La CIPR a réalisé en 2016 un nouvel inventaire des émissions de Cadmium en 2010 (CIPR, 2016), et il en ressort que les émissions ont fortement baissé (total de 3,3t contre 8t en 2000). Les apports dans le Rhin restent principalement dus aux eaux souterraines et au drainage, et aux stations d'épuration, comme en témoigne le schéma de répartition des sources de la Figure 7.
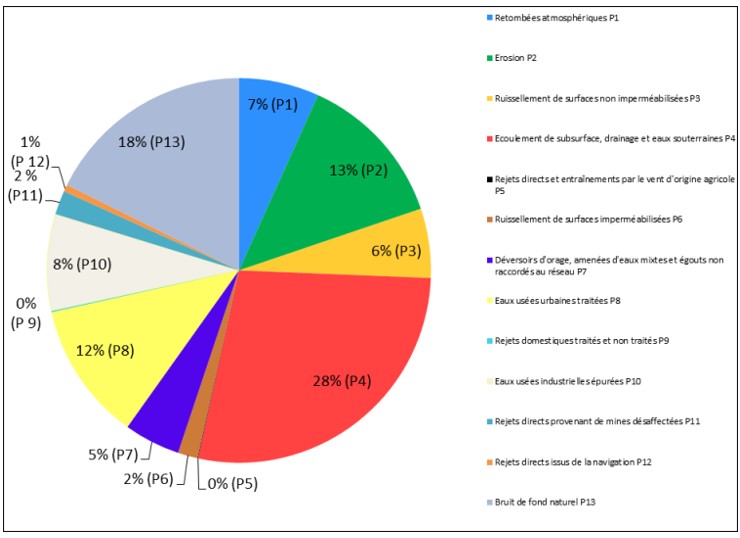
Figure 7 : Répartition des voies d'apport du Cadmium sur le Rhin, selon (CIPR, 2016)
L'action RSDE14 (INERIS, 2016) a suivi les substances dangereuses pour le milieu aquatique dans les rejets des stations de traitement des eaux usées industrielles et urbaines. Il répertorie divers secteurs à l'origine de ces émissions, qui sont recensés sur le Figure 8.
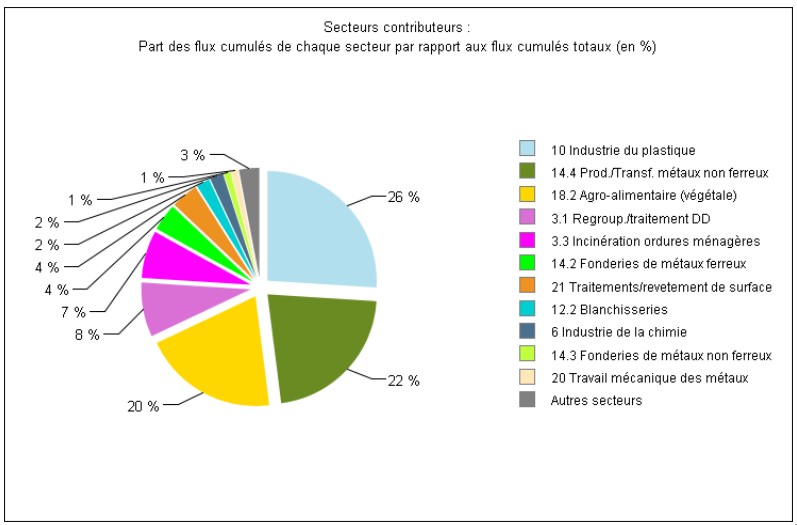
Figure 8. Secteurs émetteurs de cadmium dans l'action RSDE
Source : (INERIS 2016)
Émissions vers les sols
FTE 2015 Importer
Les teneurs en cadmium dans le sol français (voir Figure 9) résultent de l'altération des roches et de l'évolution des sols, comme ceux issus des craies et des calcaires jurassiques (Champagne, Charente, Causses, Jura) et aussi de contaminations diffuses d'origine industrielle (Nord) ou agricoles (usage d'engrais minéraux dans les régions céréalières dans le Nord et Sud-Ouest de la France et en Alsace) (Bottin et al. 2014a).
Figure 9. Teneurs en cadmium dans les sols
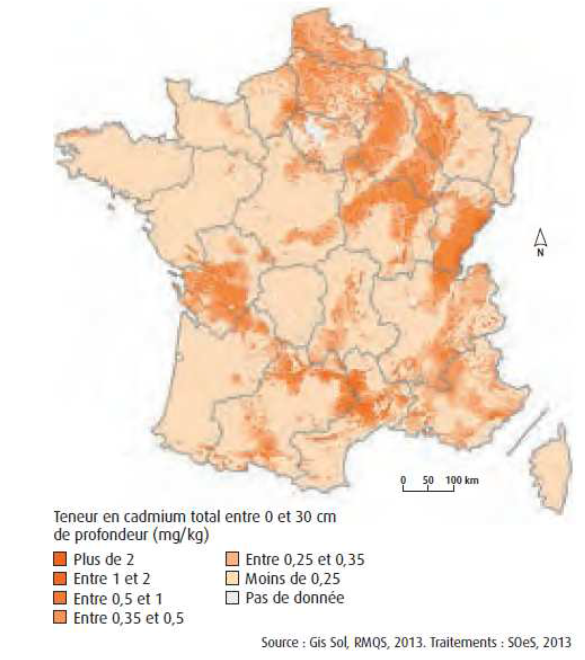
Source : Bottin et al. 2014a
La part la plus importante des apports anthropiques en Cd sur les sols agricoles provient des engrais minéraux suivis des effluents d'élevages et des retombées atmosphériques, voir 3 (Bottin et al. 2014a).
Tableau 13. Part de différentes sources de contamination dans l'estimation des apports de
cadmium sur les sols agricoles
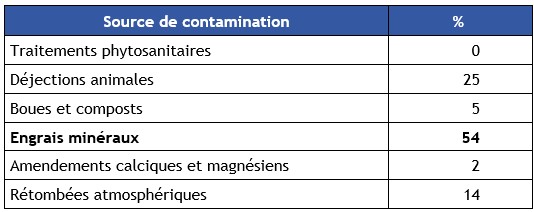
Source: Ademe-Sogreah 2007 dans Bottin et al. 2014a
En 2007, les émissions ponctuelles de Cd vers les sols en France ont atteint 261 kg et étaient liées notamment aux diverses activités industrielles : abattoirs, production de papier, traitement des eaux usées et industrie chimique (voir Tableau 14).
Tableau 14. Principaux établissements émetteurs de cadmium en 2007 en France
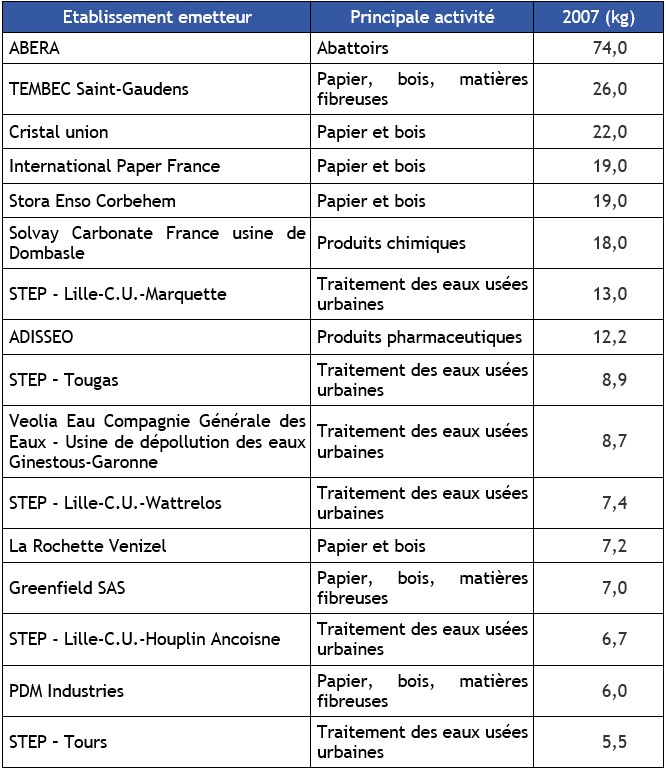
Source: European Environment Agency 2014
Rejets dans l'environnement
FTE 2015 Importer
Les utilisations et sources potentielles d'émission ponctuelle liées à l'usage intentionnel de cadmium dans l'environnement répertoriés sont principalement : l'industrie chimique et électrique, le raffinage des métaux non ferreux, les accumulateurs nickel-cadmium, le traitement des surfaces métalliques (revêtement anticorrosion), la métallurgie de l'acier, les). D'autres sources sont liées à une présence non-intentionnelle de cadmium : engrais phosphatés, la combustion du charbon et des produits pétroliers, l'incinération des ordures.
En raison de la très forte chute des émissions ponctuelles liées à la fabrication et la récupération du cadmium depuis plusieurs années, les sources indirectes ou diffuses sont aujourd'hui nettement plus importantes pour les rejets dans l'eau et dans les sols, que les sources associées à la production ou à l'usage direct et intentionnel de cadmium (OECD 1995; HELCOM 2002).
Globalement, à l'échelle d'un bassin versant comme celui de la Seine, les apports principaux ne semblent pas liés aux apports industriels directs, mais
- Pour les apports directs dans les milieux aquatiques, aux stations d'épuration, et au dragage,
- Pour les apports indirects aux décharges, aux engrais, et aux dépôts atmosphériques
Pollutions historiques et accidentelles
FTE 2015 Importer
Les études de l'INERIS sur les inégalités environnementales dans le cadre du projet PLAINE15 soulignent que la région Nord-Pas-de-Calais (Caudeville et al. 2009) est une zone de surexposition potentielle au cadmium n raison du passé minier de la région, avec les installations de Metaleurop et Umicore ; et à l'est Mortagne-du-Nord, voir Figure 10.
Figure 10. Concentration de cadmium dans les sols de surface dans la région Nord-Pas-de-Calais
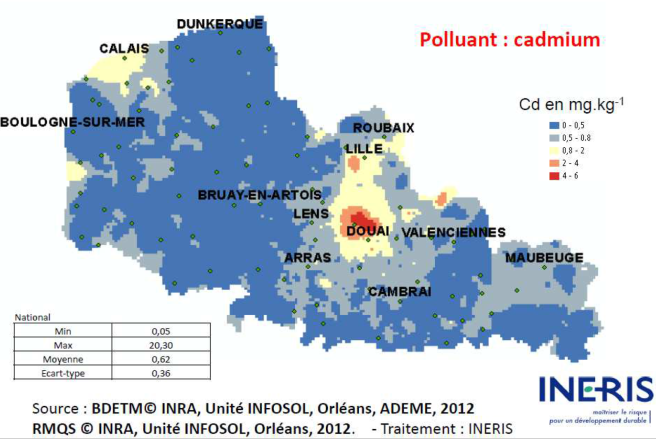
Source : INERIS 2012
D'après la base de données BASOL, le cadmium est rencontré dans 5,7 % des cas de sites pollués en France. Cette base de données répertorie environ une centaine de sites « actifs », c'est à dire en cours d'évaluation ou de travaux de réhabilitation. Une grande partie des cas provient de l'industrie métallurgique (ancienne industrie sidérurgique), d'activités de traitement de surface et d'anciens sites de stockages de divers déchets.
[15] PLAINE : Plate-forme d'analyse des inégalités environnementales.
Présence environnementale
Atmosphère
FTE 2015 Importer
Le cadmium est encadré par deux directives européennes (2008/50/CE et 2004/107/CE) sur l'évaluation et la gestion de la qualité de l'air en fixant des concentrations maximales dans l'air. En 2012, la plupart des points de mesures respectent la réglementation pour les teneurs en cadmium, hormis sur un site en Midi-Pyrénées (Bottin et al. 2014a).
Aquatique
FTE 2015 Importer
MILIEU MARIN
La concentration du cadmium dans le milieu marin a diminué, l'Observatoire national de la mer et du littoral a constaté par les travaux de l'Ifremer, RNO et ROCCH une réduction de la concentration de cadmium dans les huîtres à partir des années 1990, plus lentement depuis (voir Figure 11).
Figure 11. Evolution de la concentration de cadmium dans les coquillages
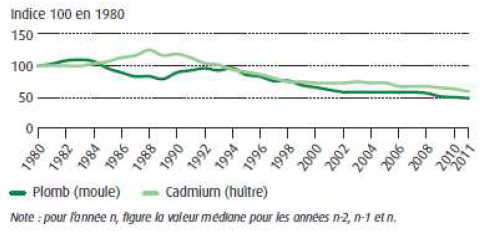
Source: Bottin et al. 2014
Le cadmium a tendance à s'accumuler le long des chaînes trophiques, notamment dans le golfe de Gascogne, une part non négligeable de dépassements des limites réglementaires dans les poissons piscivores et les anguilles est détectée (Bottin et al. 2014a).
En ce qui concerne les eaux littorales, mise en évidence dès les années 1980 par le RNO, la contamination de la Gironde par le cadmium reste le constat majeur (de 6 à 15 fois la médiane et jusqu'à 60 fois les niveaux les plus faibles rencontrés en France dans les huîtres). La diminution constante des concentrations observées depuis la fin des années 1980 a réduit l'amplitude de ce phénomène (figure 1). La contamination de la Seine, bien que moins spectaculaire qu'il y a dix ans, reste très perceptible. L'étang de Bages, près de Narbonne, se singularise encore par des niveaux forts, bien que diminuant également. (MEEM, 2011)
MILIEU CONTINENTAL
Une étude publiée en 2013 (Lemarchand et al. 2013) sur le bassin de la Loire montre que les loutres analysées étaient contaminées par des métaux (plomb, cuivre, cadmium, mercure).
Les deux tableaux (15 et 16) suivants résument les données sur la contamination des cours d'eau et de leurs sédiments.
Tableau 15. Contamination des sédiments de cours d'eau
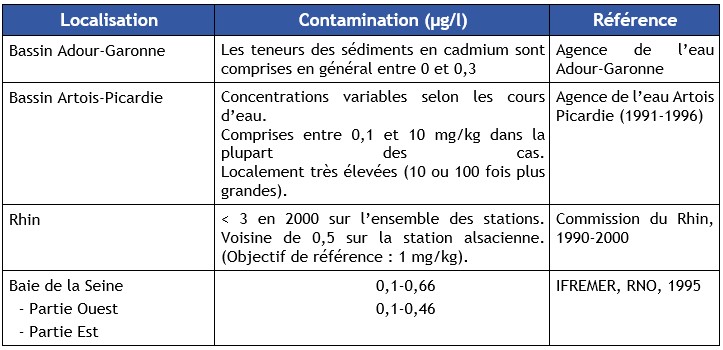
Tableau 16. Contamination des eaux superficielles

En outre, un suivi à long terme est réalisé sur le Rhin dans le cadre de la Commission Internationale pour la Protection du Rhin, qui met en évidence une décroissance continue des concentrations observées dans les matières en suspension (Figure 12)
Figure 12 : Evolution des concentrations de Cadmium dans les Matières en Suspension du Rhin (Source : CIPR)
Perspectives de réduction
Réduction des rejets
FTE 2015 Importer
Les mesures les plus significatives prises pour limiter la pollution et l’exposition au cadmium sont les suivantes :
- obligation de collecte des piles et accumulateurs contenant plus de 250 mg/kg de cadmium
- obligation de suppression et/ou substitution du cadmium, (ainsi que mercure, plomb et chrome hexavalent) dans les matériaux et équipements de fabrication des véhicules
- recyclage des matériaux contenant du cadmium
TECHNIQUES DE TRAITEMENT DANS LES EFFLUENTS INDUSTRIELS
FTE 2015 Importer
Dans les eaux usées issues de l'industrie chimique, le taux d'élimination du cadmium et de ses composés sous influence de la coagulation est de 98 % (BREF Traitement des eaux).
Pour la production de cadmium recyclé, la société SNAM a mis un œuvre des installations de filtration d'air, par filtres à manches (entretien avec la société).
STATIONS D'EPURATION
FTE 2015 Importer
Le taux d'élimination du cadmium à une station d'épuration urbaine est supérieur à 60 % et, la majorité du cadmium arrivant via les effluents, le cadmium est donc transféré dans les boues de la station (Commission européenne 2003b).
Une étude d'évaluation des rendements des stations d'épuration (Choubert et al. 2011) montre un rendement compris entre 30% et 70% comme résultats de traitement de la filière « boues activées en aération prolongée » qui est la plus répandue en France.
Alternatives aux usages
FTE 2015 Importer
Accumulateurs et piles nickel-cadmium
Dans le domaine grand public (secteur des « portables »), le couple nickel-cadmium a déjà en grande partie été remplacé par différentes technologies adaptées aux petits appareils légers (technologies autour du lithium et du nickel, par exemple le Ni-MH, nickel métal hydrure utilisé pour les téléphones, ordinateurs portables, les outils portables).
La substitution devrait se poursuivre, également par des batteries au lithium, ce qui devrait conduire à une baisse des consommations globales de cadmium en France.
Pour les appareils plus lourds d'application industrielle, le remplacement des batteries NiCd par NiMH est prévisible. Hormis quelques applications particulières, il semble possible selon certaines sources (Noreus Drag 2000) d'achever la substitution des batteries Ni-Cd et de proposer leur interdiction.
Une façon d'éviter les rejets associés aux batteries est leur recyclage. Cette solution est en place en France. Les systèmes de recyclage ont cependant des limites : sur la base de diverses expériences en Europe, HELCOM (2002) estime qu'un taux maximal de recyclage est 60 % pour les petites piles et accumulateurs. La société SNAM entre 2014-2016 déclare un taux de réutilisation supérieur à 50%.
Pigments
Il n'existe pas de substitut du cadmium et de ses composés en monopigmentaire (selon la FIPEC). L'interdiction de ces substances induirait la disparition de certaines teintes qui seraient remplacées par des imitations moins bonnes pour les artistes (selon la FIPEC). En effet, l'ECHA puis la Commission Européenne ont estimé (décision (2015/C 356/01) qu'il n'y avait pas lieu d'interdire ce type de peintures. Par contre, pour les autres peintures, l'ECHA et la Commission ont considéré que des alternatives étaient disponibles et le Cd y est interdit (limite de 0,01% en poids sauf pour les peintures comportant au moins 10% de Zinc, pour lesquelles la limite est de 0,1%)16 .
De même, il semble que le cadmium soit aisément substituable dans les plastiques de grande consommation et que cette substitution a déjà été effectuée en Europe (OCDE), sauf cas particulier. Dans les plastiques, le sulfure de cérium est l'alternative au cadmium la plus utilisée.
[16] Décision du 12 Février 2016 modifiant l'Annexe XVII du Règlement REACH.
Brasage des métaux
L'analyse socio-économique sur l'usage de cadmium réalisé par RPA (2010) résume les types de charges de brasage sans cadmium qui peuvent être utilisées pour remplacer les alliages porteurs de cadmium pour diverses applications. Ils sont basés sur l'argent, le cuivre et les alliages de zinc. Pour des applications spécifiques, des additions de nickel et de manganèse ou de l'étain et/ou de silicium peuvent être utilisées. La plupart des fabricants d'alliages offrent actuellement des alternatives (parfois exclusivement) sans cadmium (European Chemicals Agency 2012d).
Les sociétés Umicore BrazeTec17 et ICdA ont déclaré que le brasage des métaux contenant du cadmium peut être remplacé par des alternatives sans cadmium dans plus de 99% des cas. Les alliages de brasage sans cadmium sont disponibles pour une température de brasage supérieure ou égale à 650 °C, mais pour le brasage à des températures dans l'intervalle 610-650 °C, on ne dispose pas d'alternative sans cadmium (European Chemicals Agency 2012d).
Pour la préparation des pièces, il est possible dans certains cas de remplacer les solutions de cadmium par le zinc ou des procédés mécaniques utilisant le zinc pour certains aciers (Commission européenne 2004a).
[17] Umicore BrazeTec est le leader du marché en l'UE pour les alliages de brasage à l'argent, avec des installations de production en Chine, aux États-Unis et au Brésil. (European Chemicals Agency 2012d).
Traitement de surface des métaux
D'après les sources et les organismes que nous avons consultés, il ressort que le cadmium semble ne plus être utilisé que dans les domaines de l'aéronautique et du militaire. Des solutions alternatives au cadmium (pour ces secteurs aéronautique et militaire) ont été recherchées dans les directions suivantes :
- Alliages de zinc dans des bains aqueux (avec du nickel, du cobalt, du fer, de l'étain). La solution ZnNi serait, après des difficultés passées de mise au point, maintenant qualifiée et mise en œuvre par Boeing, Airbus et d'autres constructeurs aéronautiques, pour plusieurs composants (Legg, 2016).).
- Différentes technologies utilisant l'Aluminium ont été développées :
- Aluminium dans des bains organiques. La nécessité de recourir à un bain organique (solution de toluène pour le procédé AlumiplateTM) peut être un inconvénient environnemental.
- Aluminium sous forme de vapeur ionisée (développé par Mc-Donell Douglas, utilisé dans l'industrie aérospatiale). Le dépôt d'une couche de chrome serait encore nécessaire pour améliorer les caractéristiques anticorrosion (Legg & et al. 2002, 2016).
- Aluminium ou zinc dans des céramiques ou des polymères.
- Alliages au TItanium : ils remplaceraient le traitement au Cadmium de façon croissante dans l'industrie aéronautique (Legg, 2016).
En revanche, ces produits ne rempliraient pas toujours les cahiers des charges associés aux utilisations industrielles. Dans de multiples applications particulièrement exigeantes sur la durée de vie du produit et sur sa résistance aux hautes températures (aviation, métro, chemin de fer), le couple électrochimique nickel-cadmium serait aujourd'hui le seul viable d'un point de vue technique et économique.
Il semble donc que des substituts aux cadmium sont disponibles, sauf pour les applications les plus exigeantes dans lesquelles toutes les performances des systèmes au cadmium sont nécessaires. Il est également clair qu'il n'y a pas une alternative unique qui puisse remplacer les traitements au cadmium.
Il apparaît également que les alternatives au Cadmium soient plus avancées et utilisées aux USA qu'en Europe, en raison de programmes initiés de longue date par le DoD (Department of Defence) pour les applications militaires, et toujours en cours. On trouvera des informations détaillées sur les alternatives en cours de validation et développement (notamment les compte-rendus de workshops), ainsi que sur les difficultés persistantes aux USA, dans les documents du programme américain ASSETSDEFENSE sur le site www.asetsdefense.org.
Engrais
Les alternatives aux fertilisants de cadmium sont encore peu disponibles (Hoxha 2016) et les recherches dans ce domaine proposent les solutions suivantes : (i) les fertilisants à faible teneur de Cd, (ii) les fertilisants biologiques et (iii) les traitement d'élimination du Cadmium des engrais.
Selon Fertilizers Europe il existe plusieurs technologies d'élimination du Cadmium des engrais, donc le coût est estimé à environ 12-50€/tP2O5 suivant les sources, ce qui représenterait entre 5 à 20% d'augmentation du prix des fertilisants (Hoxha 2016).
Des recherches en Allemagne auraient conclu à l'impossibilité de séparer le cadmium des nitrophosphates. Pour les autres types de phosphates, des essais de procédés alternatifs avec extraction du cadmium par solvants amine-kérosène ont été menés et le surcoût associé à ce procédé a été évalué (OCDE).
Le BREF « Chimie inorganique » (Commission européenne 2004b) mentionne la possibilité d'isoler des impuretés comme le cadmium lors de la production d'acide phosphorique par voie humide, avec une extraction liquide-liquide, mais il ne s'agit pour l'instant que d'une technique « émergente ».
Une autre possibilité est de privilégier des matières premières minérales peu riches en cadmium, solution déjà mise en œuvre par l'industrie (HELCOM 2002).
Dix pays européens ont mis en place des valeurs limites pour la teneur des engrais en cadmium (Roberts 2014) et la réglementation européenne est la plus stricte.
Conclusion
FTE 2015 Importer
Malgré un déclin des utilisations intentionnelles, les apports de cadmium dans l'environnement, dans l'air, les milieux aquatiques et les sols vont perdurer longtemps, en raison de la difficulté de supprimer le cadmium dans certaines applications particulières et, surtout, en raison de la présence d'apports diffus très importants qui ne pourront pas être supprimés à court terme. Après une période de forte baisse dans les milieux aquatiques et les sédiments depuis plusieurs dizaines d'années, les concentrations semblent stagner ou ne décliner que lentement désormais.
Les rejets dans l'air restent associés aux activités de sidérurgie et métallurgie, de l'énergie et plus généralement de l'utilisation des ressources et combustibles fossiles. Dans les sols, la principale source est l'utilisation des engrais minéraux. Dans les milieux aquatiques les stations de traitements de déchets et des eaux usées restent les principales sources ponctuelles. L'industrie de bois, papier et carton ainsi que l'industrie chimique présentent également des rejets dans l'ensemble des compartiments environnementaux. Mais e sont les sources diffuses (engrais, apports atmosphériques, …) qui dominent les apports vers les eaux de surface.
Plusieurs voies d'interventions règlementaires ont été utilisées ces dernières années en France et en Europe pour tenter de réduire l'utilisation et les rejets de Cadmium dans l'environnement.
Les usages plus importants présentent une réduction significative (fabrication de batteries, peintures, pigments, laques, plastiques, matériaux de construction) mais certains usages demeurent difficiles à réduire :
- L'utilisation non-intentionnelle dans les engrais semble se heurter à des difficultés plus économiques que techniques pour retirer le Cadmium des engrais phosphatés avant leur mise sur le marché,
- Certaines applications spéciales dans les batteries industrielles perdurent,
- L'industrie du traitement de surface semble encore réclamer le cadmium pour des traitements anticorrosion dans les domaines de l'aérospatiale et militaire. Toutefois les alternatives semblent se développer de façon continue aux USA, avec une volonté des autorités du Department of Defense.
Quelques usages seraient même en croissance, comme pour les équipements électriques et électroniques ainsi que les panneaux photovoltaïques, ces derniers pouvant être des sources significatives à terme.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :