Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Arsenic (7440-38-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
7440-38-2
Nom scientifique (FR)
Arsenic
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-148-6
Code SANDRE
1369
Numéro CIPAC
-
Formule chimique brute
\(\ce{ As }\)
Code InChlKey
Code SMILES
[As]
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H301 |
|---|---|
| Mention du danger - Texte | Toxique en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H331 |
|---|---|
| Mention du danger - Texte | Toxique par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Prélèvement
Analyse
Autres milieux
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 22/10/2025
Généralités
Couleur
argenté
Aspect
cristallin
Poids moléculaire
74.92 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 22/10/2025
Matrices
Atmosphère
L'arsenic existe sous différents degrés d'oxydoréduction : -3, 0, + 3, + 5. Mis à part les sulfures, les composés minéraux les plus courants sont les combinaisons avec l'oxygène : arsénites (As III) et arséniates (As V). Certains des composés de l'arsenic sont volatils (arsines, composés organiques de l'arsenic). Bien que fréquemment suspectées, les pertes d'arsenic (sous forme d'arsine, de composés organométalliques ou d'arsenic élémentaire) par volatilisation depuis le sol n'ont pas vraiment été démontrées, contrairement au cas des sédiments aquatiques (Juste, Chassin et al., 1995). Sur des sols particulièrement humides, certaines études suggèrent la présence de forme arsine volatiles (Alloway, 1995). Une perte d'arsenic des sédiments par volatilisation microbiologique est également possible, mais son occurrence dans l'environnement naturel ne semble pas confirmée (Molénat, Holeman et al., 2000). Dans l'air, l'arsenic existe principalement sous la forme de particules. Il est présent sous forme d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers pentavalent. La photolyse n'est pas un processus important pour les composés de l'arsenic (ATSDR, 2007).
Milieu eau douce
La solubilité des composés de l'arsenic est assez variable, certains étant très solubles, d'autres quasiment insolubles. Globalement, la solubilité des dérivés pentavalents de l'arsenic serait supérieure à celle des dérivés trivalents.
Dans le milieu aquatique, les facteurs physico-chimiques (pH, potentiel d'oxydo-réduction (Eh), taux de phosphate, fer, sulfure, température…) affectent la capacité d'adsorption de l'arsenic sur les sédiments. De plus, l'activité microbiologique est responsable de la dissolution de certains hydroxydes, l'arsenic des sédiments est ainsi relargué dans l'eau. Dans les eaux naturelles, l'iAs est prédominant. Dans les eaux bien aérées (eaux de surface notamment), les arséniates sont largement majoritaires (H2AsO4 et HAsO42-). En conditions réductrices, H3AsO3 (As III) est en théorie la forme la plus stable. Dans les eaux souterraines, l'arséniate serait la forme prédominante, mais l'arsénite peut être un composé important. Les composés arséniés organiques (MMA - acide monométhylarsonique CH3AsO(OH)2, DMA - acide diméthylarsinique (CH3)2AsO(OH), TMAO - oxyde de triméthylarsine (CH3)3AsO) sont présents dans les eaux naturelles (douces ou salines) et dans les sédiments. Ils peuvent provenir de la méthylation de l'arsenic minéral par les algues ou par la dégradation microbienne des composés organiques complexés.
Volatilisation :
La plupart des dérivés organiques et inorganiques de l'arsenic sont des composés blancs ou incolores sous forme de poudre qui ne se volatilise pas.
Dans l'air, l'arsenic existe principalement sous la forme de particules d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers l'état V. (ATSDR, 2007)
Milieu sédiment eau douce
Adsorption :
Le coefficient d'adsorption (Kd) de l'arsenic est dépendant du pH, de la spéciation de l'arsenic et de la température. Ainsi, en milieu acide et neutre, la forme pentavalente est très adsorbée alors que la forme trivalente est peu adsorbée.
L'arsenic présent dans l'eau peut être issu d'une remobilisation de la fraction stockée dans le sédiment.
Le lessivage ne tend pas à être un phénomène important étant donné qu'une majorité des composés arsenic s'adsorbe au sol.
Plusieurs coefficient de partage sol-eau ont été proposés.
Pour l'Arsenic V,
- Kd = 1,9 à 18
- Kd = 8,5 à 1500
Une étude bibliographique portant sur les références dans la littérature aux Kd de certains métaux rapporte une valeur moyenne pour l'arsenic de 2,4 pour l'interface sédiment/eau. C'est cette valeur qui sera retenue pour l'évaluation dans les sédiments en l'absence de donnée sur les organismes benthiques. (US-EPA, 1979; US-EPA, 1982; Welch et al., 1982 Baes et Sharp, 1983 Buchter et al., 1989 Lepper et al., 2007)
Milieu terrestre
La mobilité de l'arsenic dans les sols est assez limitée (adsorption sur l'argile, sur les hydroxydes et sur la matière organique) (Adriano, 1986, Kabata-Pendias and Pendias, 1992). Néanmoins, l’arsenic III est reconnu comme étant plus mobile que l’arsenic V (Molénat, Holeman et al., 2000).
Dans les sols, selon le niveau du potentiel d'oxydoréduction et du pH, l'arsenic sera préférentiellement au degré d'oxydation III ou V, l'activité microbiologique pouvant conduire à une méthylation ou déméthylation des composés de l'arsenic ou même à des réactions d'oxydoréduction dans certains cas. La présence de minéraux d'argile, d'oxydes de fer et d'aluminium et la matière organique du sol peuvent également influencer la solubilité des composés et le niveau d'oxydoréduction (Alloway, 1995).
Dans les sols, l'arsenic existe principalement sous forme oxydée : arséniate AsO43- ou arsénite AsO33-. La forme arséniate est majoritaire dans des conditions d'aération normale (Alloway, 1995). Quand les conditions du sol deviennent réductrices (sol inondé), l'arséniate peut être transformé en arsénite. En situation d'anoxie maximale, la réduction peut aller jusqu'à la formation d'arsine (AsH3). Principalement en conditions réductrices, des bactéries méthanogènes peuvent conduire à la formation de composés organo-arséniés. Ces bactéries peuvent aussi conduire à la formation de composés méthylés (MMA, DMA, TMAO et TMA : triméthylarsine ((CH3)3As)) qui ont été détectés dans les sols. Ces composés peuvent également provenir de l'utilisation de pesticides et fertilisants. Dans les sols oxydants, l’arsenic V est retenu par sorption ou précipitation avec l'argile, l'humus, les hydroxydes de fer, de manganèse et d'aluminium. Dans les zones réductrices, l’arsenic III peut être précipité, par exemple, sous forme de As2S3, en présence de sulfures.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Biodégradabilité :
Non pertinent (ATSDR, 2007)
Dégradabilité abiotique
Hydrolyse :
L'arsenic dans l'eau est susceptible de subir de complexes transformations sujettes aux conditions du milieu, notamment le pH et les conditions oxydo-réductrices. Pour des pH situés dans les normales naturelles, les formes dissoutes prédominantes sont les ions arséniates (H2AsO4 -et HAsO42-) pour les As(V) et As(OH)3 pour les As(III). Les formes As(V) dominent généralement dans les eaux bien oxygénées alors que les formes As(III) dominent en conditions réductrices. (ATSDR, 2007)
Photolyse :
Dans l'air, l'arsenic existe principalement sous la forme de particules d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers l'état V. La photolyse n'est pas un processus important pour les composés inorganiques de l'arsenic (ATSDR, 2007)
Conclusion sur la persistance
L’arsenic est persistant dans l’environnement.
Bioaccumulation
Organismes aquatiques
L’arsenic se fixe majoritairement à l’exosquelette des invertébrés et dans le foie des poissons. Le transfert le plus important s’opère depuis l’eau vers les algues, celles-ci présentent les concentrations en arsenic les plus importantes. Le BCF le plus élevé a été mesuré sur des bryophytes (BCF=8700) (ATSDR, 2007).
L’arsenic est faiblement bioaccumulable. Ainsi, Spehar, Fiandt et al., 1980 ont trouvé que l’accumulation de l’arsenic V était légèrement supérieure à celle de l’Arsenic III chez l’invertébré Pteronarcys dorsata, les mollusques Helisoma campanulata et Stagnicola emarginata et chez le crustacé Daphnia magna (BCF en poids sec de 131, 99, 92 et 219 pour l’arsenic V respectivement). Une étude bibliographique couvrant 12 études sur 37 espèces de poissons d’eau douce (du poisson détritivore benthique au poisson carnivore pélagique) rapporte un BCF/BAF minimum de 0.1 obtenu sur Oncorynchus mykiss dans une eau à 16 300 µg/L d’arsenic et un BCF/BAF maximum de 1 600 obtenu sur Lepomis macrochirus dans une eau à 0,085 µg/L d’arsenic (Williams, Schoof et al., 2006). Barrows, Petrocelli et al., 1980 mettent en évidence un BCF de 4 pour Lepomis macrochirus.
Les BCF observés sur organismes marins sont généralement plus importants que ceux mesurés sur des organismes d’eau douce. Des données sont disponibles pour plusieurs espèces de mollusques : Crassostrea virginica (BCF = 114), Rangia cuneata (BCF = 478), de crustacés : Balanus aburneus (BCF = 400), Callinectes sapidus (BCF = 14) et de polychètes : Nereis sp. (BCF = 224) (Guthrie, Davis et al., 1979), Capitella capitata et Neanthes grubei (BCF = 1000) (Reish and LeMay, 1991). Si la bioaccumulation de l’arsenic a été observée, ce composé ne se bioamplifie pas le long de la chaîne trophique.
Les BCF mesurés dans les organismes aquatiques ne suivent pas une relation linéaire avec les concentrations mesurées dans l’eau. Les BCF les plus importants sont mesurés dans les cas où les concentrations d’arsenic dans l’eau étaient comparables avec les concentrations environnementales et semblent décroître lorsque les concentrations en arsenic augmentent dans le milieu, indiquant une saturation de l’accumulation.
Le BCF retenu doit être représentatif des concentrations pour lesquelles le phénomène de bioaccumulation est maximal, c'est-à-dire qu’il doit être obtenu pour des concentrations d’arsenic de l’ordre des concentrations naturelles environnementales. Un BCF de 100 a été calculé en réalisant la moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006) pour des concentrations d’arsenic dans l’eau comprises entre 0,5 µg.L-1 qui correspond à la PNEC proposée par Lepper, Sorokin et al. (2007) et la valeur correspondant au 90% centile des concentrations naturelles dans l’eau de la base de données FOREGS (2,45 µg/L). Cette valeur devrait être suffisamment protectrice étant donné que les BCF diminuent si les concentrations dans l’eau augmentent.
Principales données de bio-accumulation dans les organismes aquatiques :
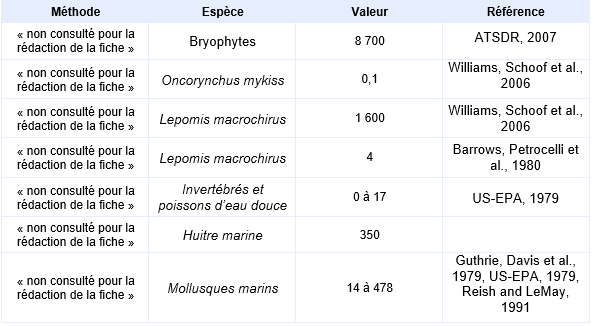
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Principales données de bio-accumulation dans les organismes terrestres :
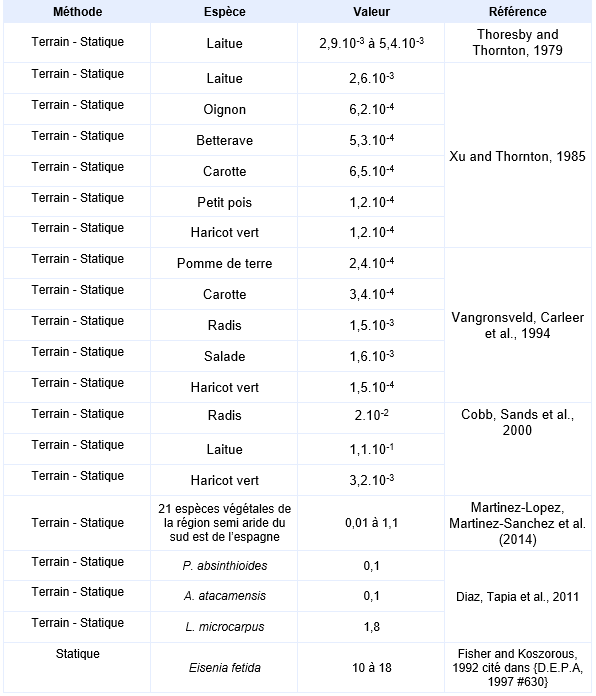
L'absorption des composés de l'arsenic par les plantes, depuis le sol, se fait principalement sous forme passive depuis le flux hydrique (Juste, Chassin et al., 1995). Plusieurs études expérimentales montrent l’augmentation des concentrations en arsenic dans les végétaux avec celles des sols. Toutefois, comme pour les organismes aquatiques, les facteurs de bioconcentration restent très faibles.
L’arsenic est un élément phytotoxique. La phytotoxicité de l’ion arsénite est plus importante que celle de l’ion arséniate, elle-même plus importante que celle des composés organo-métalliques.
La biodisponibilité et l'absorption de l’arsenic par les plantes dépendent de nombreux facteurs. Ils sont liés à la source et à la forme de l’élément, au pH du sol, au potentiel d'oxydoréduction, aux conditions de drainage, au type et à la quantité de matière organique présente. Ainsi, la valence de l’arsenic influence le taux d’absorption. L’absorption des ions arséniates est trois fois plus importante que celle des ions arsénites (Mitchell and Barr, 1995, Pitten, Muller et al., 1999). La disponibilité apparente de l’arsenic dans le sol n’est donc pas nécessairement reliée au taux d’absorption de l’arsenic par les végétaux. Le pH du sol joue aussi un rôle dans l’absorption d’arsenic par les végétaux : les pH acides (inférieurs à 5) favorisent l’absorption, de même que les pH très élevés (supérieurs à 8) tels que ceux rencontrés dans les sols calcaires (Juste, Chassin et al., 1995). Par ailleurs, les ions phosphate et sulfate, dont le comportement chimique est similaire à celui de l’arséniate, se présentent comme des compétiteurs efficaces susceptibles de réduire l’absorption et le transfert de ce dernier dans la plante (Mitchell and Barr, 1995, Pitten, Muller et al., 1999).
Lorsqu'elles sont dans un milieu déficient en phosphate et en présence d'arsenic V, les plantes (maïs, tomates, melons) sont capables de réduire l'arsenic V et de le méthyler en MMA et DMA (Molénat, Holeman et al., 2000).
Enfin, le taux d’absorption varie largement en fonction des espèces cultivées et les teneurs dans les racines apparaissent plus importantes que dans les feuilles et dans les tiges.
L’étude réalisée par Thoresby and Thornton, 1979 porte sur une région minière du sud-ouest de l’Angleterre, la vallée du Tamar où des mesures d'arsenic dans le ray-grass, les salades, les grains d’orge et les fraises ont été mises en relation avec les concentrations dans le sol. La région du Tamar a été exploitée pour son minerai d’arsénopyrite et fut aussi contaminée par les dépôts de fumée d’oxyde d’arsenic (As2O3). Bien qu’il s’agisse de formes trivalentes de l’arsenic, d’autres travaux ont montré dans des sols de terrils du sud-ouest de l’Angleterre que la forme soluble prédominante était l’arséniate, l’arsénite n’étant présent qu’en petite quantité. Les concentrations en arsenic dans les sols étudiés allaient jusqu’à 1 200 mg.kg-1. Les diagrammes mettant en relation la teneur dans les plantes avec la concentration dans les sols, montrent des valeurs expérimentales de coefficient de bioconcentration dispersées, mais la teneur en arsenic dans les plantes (laitues, ray-grass et fraises lavées à l’eau déminéralisée) augmente avec la concentration dans les sols. Le ray-grass est la plante présentant le taux d’accumulation le plus fort.
Parmi les plantes entrant dans l’alimentation humaine, les laitues présentent la plus forte capacité d’accumulation de l’arsenic avec une teneur maximale relevée de 1,4 mg.kg-1 de matière sèche pour une concentration dans le sol de 290 mg.kg-1. A partir de ces 12 points expérimentaux sur les laitues, plusieurs droites peuvent être extrapolées dont les pentes représentent des coefficients de bioaccumulation allant de 2,9.10-3 à 5,4.10-3.
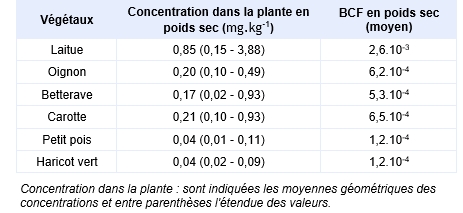
Une autre étude menée par Xu and Thornton, 1985 a été faite sur 32 jardins potagers situés dans la région de Hayle et Camborne au sud-ouest de l’Angleterre. Ces jardins présentaient des sols avec des teneurs en arsenic comprises entre 144 et 892 mg.kg-1 (moyenne géométrique : 322 mg.kg-1). Les teneurs en arsenic ont été mesurées dans les parties consommables de 6 types de cultures (laitues, oignons, betteraves, carottes, pois et haricots). Il existe une relation significative entre la teneur en arsenic dans le sol et la teneur dans les plantes. Les concentrations maximales ont été relevées pour la laitue. Dans cette analyse, la teneur en arsenic dans la laitue est reliée positivement à la teneur totale en phosphore du sol et négativement à la teneur en fer. Les facteurs de bioconcentration de l'arsenic dans les divers végétaux (partie comestible) calculés à partir de la moyenne géométrique des concentrations relevées dans les végétaux et la moyenne géométrique des concentrations mesurées dans les sols sont présentés dans le tableau ci-après.
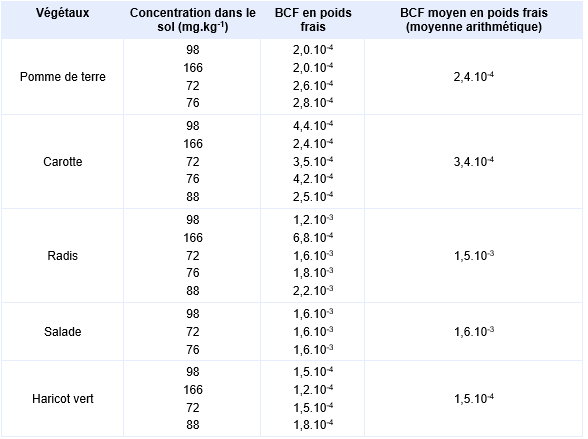
Une autre étude a été réalisée par Vangronsveld, Carleer et al., 1994 sur 5 jardins situés près d’une ancienne usine traitant l’arsenic. Les sols des jardins contenaient des teneurs en arsenic allant de 40 à 200 mg.kg-1. Ils étaient de type sableux avec des pH allant de 6 à 7. Des mesures d’arsenic ont été effectuées dans les parties comestibles de légumes (laitue, haricots, épinard, pommes de terre, carottes, radis) cultivés dans ces jardins après un nettoyage et un lavage soigneux. La laitue et le radis présentent les plus fortes capacités d’accumulation. Les facteurs de bioconcentration (BCF) dans les parties comestibles des végétaux en poids frais déterminés d'après cette étude sont présentés dans le tableau suivant.
Une autre étude rapportée dans la littérature porte sur une région minière des États-Unis (Bingham Creek), où l'activité a démarré dans les années 1860 et sur la problématique de l'accumulation de l'arsenic depuis le sol dans les radis, tomates, laitues et haricots verts (Cobb, Sands et al., 2000). Ces divers végétaux ont été cultivés, en serre, dans des pots, sur des sols aux teneurs en arsenic différentes. Les sols utilisés correspondent à des mélanges en différentes proportions de sol témoin (issu de la région) et de déchets issus de la mine (sols superficiels). Les végétaux ont été cultivés jusqu'à maturité sur les sols. Les sols ont globalement un contenu en matière organique de 1,1 % et un pH de 6,5. Les facteurs de bioconcentration de l'arsenic dans les divers végétaux (partie comestible) en poids sec calculés à partir de la moyenne géométrique des concentrations relevées dans les végétaux et la moyenne géométrique des concentrations mesurées dans les sols sont présentés dans le tableau suivant (Concentration dans le sol : sont indiquées les moyennes géométriques des concentrations et entre parenthèse l'étendue des valeurs).
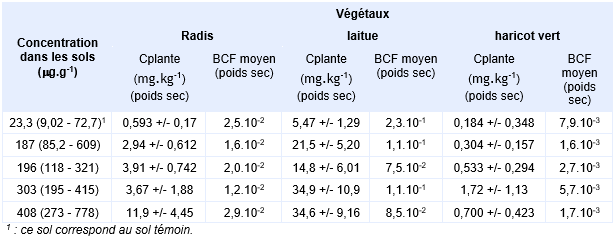
Des mesures de BCF sur des plantes non destinées à la consommation de l’homme ont également été menée. Martinez-Lopez, Martinez-Sanchez et al. (2014) ont mesuré les BCF de 21 plantes poussant naturellement dans la région d’une vieille mine au sud-est de l’Espagne. Les valeurs obtenues dépendent de la plante, de la concentration dans le sol et de ses propriétés, elles restent faibles et sont généralement en dessous de 0,1. La remarque qui a été faite dans l’eau semble applicable ici aussi puisque les BCF sont supérieur lorsque la concentration dans le sol est faible : dans les sols faiblement contaminés (7 à 35 mg.kg-1), le BCF calculé avec Arthrocnemum macrostachyum atteint une valeur maximum de 1,1, il est presque nul (0,08) dans les sols fortement contaminés (327 à 1800 mg.kg-1). Diaz, Tapia et al. (2011) ont rapporté des BCF mesurés dans 3 espèces de plantes de la région nord du Chili. Les trois sols concernés par les mesures présentent des concentrations en arsenic de 53 mg.kg-1 (sol1), 54 mg.kg-1 (sol 2) et 6 mg.kg-1(sol 3). Les espèces végétales sélectionnées sont P. absinthioides (sur le sol 1), A. atacamensis (sur le sol 2) et L. microcarpus (sur le sol 3). Les BCF mesurés restent peu élevés : ils sont de 0,1 sur les sols 1 et 2 et de 1,8 sur le sol 3.
Il est possible de mesurer de l’arsenic dans les tissus de vers de terre vivants dans des sols contaminés, mais les BCF restent inférieur à 1. Un BCF de 10 à 18 a été mesuré sur des Eisenia fetida exposés en laboratoire 8 semaines à un substrat présentant des concentration allant de 23 à 87 mg.kg-1 (As) ({D.E.P.A, 1997 #630}).
Remarque : aucune publication rapportant une quantification séparée du transfert des arséniates (As V) de celui des arsénites (As III) depuis le sol vers les végétaux n'a été trouvée dans la littérature, c'est pourquoi tous les facteurs de bioconcentration cités précédemment se rapportent à l'arsenic total.
Conclusion sur la bioaccumulation
Bibliographie
Toxicologie
Dernière vérification le 22/10/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 2001, IARC, 2004, OEHHA, 2004, INRS, 2006, ATSDR, 2007, IARC, 2012, ATSDR, 2016, HAS, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont généralement pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. L’arsine est un composé inorganique de l’arsenic qui n’est pas traité dans cette fiche mais a fait l’objet fiche de seuil de toxicité aiguë (Ineris, 2008).
Toxicocinétique
Chez l'homme
Absorption
La toxicocinétique de l’arsenic inorganique (iAs) et son métabolisme dépendent de sa valence et de l’hydrosolubilité du dérivé impliqué. En général, les composés présents en milieu environnemental ou professionnel sont très majoritairement des dérivés trivalents et pentavalents hydrosolubles : arsénites (AsIII) oxydés en arséniates (AsV) et arséniates réduits en arsénites selon le milieu dans lequel ils se trouvent.
Dans de nombreux secteurs d’activité, l’inhalation n’est ni la seule, ni la principale voie de pénétration dans l’organisme, l’absorption par ingestation (déglutition des particules déposées dans l’arbre respiratoire) et par voie cutanée pouvant survenir dans des situations particulières (HAS, 2020 ; Xu, 2010).
Inhalation:
Par voie respiratoire, le taux d’absorption est généralement compris entre 30 et 34 % (ATSDR, 2007). Chez les salariés exposés à des poussières fines de trioxyde d’arsenic dans les fonderies, l’absorption respiratoire a été estimée à 40-60 % de la quantité inhalée (Pinto, Varner et al., 1976, Vahter and Lind, 1986, Huang, Chen et al., 2014).
Voie orale:
Les arséniates et les arsénites sont bien absorbés par voie orale chez l'homme, avec un taux d'absorption de l'arsenic estimé à 95 % par voie orale (Zheng, Wu et al., 2002) ; ce taux d’absorption est plus faible si la solubilité du composé arsénié est plus faible et il dépend également du substrat (aliments, sols, eaux de boisson) avec lequel il est ingéré. Une étude sur volontaires sains (6 hommes et 7 femmes) a permis d’observer un taux d’absorption de 91 %, à partir de l’exposition d’iAs présent dans l’alimentation (Stanek III, Calabrese et al., 2010, El-Masri, Hong et al., 2018) .
Voie cutanée:
La voie cutanée, peu étudiée, est une voie mineure d'absorption. Son absorption n’a pas été quantifiée chez l’homme.
Distribution
Une fois absorbé, l'arsenic se retrouve fortement lié aux protéines plasmatiques et à l’hémoglobine, du fait de sa forte affinité avec les groupes sulfhydryles. Sa demi-vie sanguine est d’une heure environ (NRC, 2001). L'arsenic se distribue dans tous les organes, principalement au niveau du foie, des reins, des poumons, des muscles, de la peau, des phanères et des os. La rétention d’As est maximale dans les cheveux et les ongles (0,02 à 1 mg.kg-1 poids sec) ou dans la peau et le poumon (0,01 à 1 mg.kg-1 poids sec) (NRC, 2001). Des études suggèrent que l’As inorganique s’accumule avec l’âge (OMS IPCS, 2001). L’As est présent dans les tissus principalement sous forme inorganique et, dans une moindre mesure, sous forme d’acide diméthylarsinique (DMA). L’acide monométhylarsonique (MMA) n’a quant à lui été retrouvé que dans le foie et les reins (NRC, 2001, OMS IPCS, 2001).
L’iAs passe facilement la barrière placentaire (Lugo, Cassady et al., 1969) et est aussi retrouvé dans le lait maternel (ATSDR, 2007).
Métabolisme
Le métabolisme de l’arsenic a été largement étudié et se compose de réactions d’oxydation/réduction, pour convertir l’arsenic (III) et (V), et de réactions de méthylation, qui transforme l’arsénite en MMA et DMA (cf. figure 1, schéma métabolique d’après Styblo, Del Razo et al., 2000, Schuhmacher-Wolz, Dieter et al., 2009, Hughes, Beck et al., 2011, Khairul, Wang et al., 2017.
Si l’arsenic est sous forme pentavalente, il doit d’abord être réduit en arsenic trivalent (Uthe and Reinke, 1975). Ce processus tend à rendre l’arsenic moins réactif et faciliter son élimination (Buchet, Lauwerys et al., 1981, Vahter, 1983). Cette réaction peut suivre une voie non enzymatique, dans laquelle le glutathion joue le rôle d’un donneur d’électron, et une voie enzymatique catalysée par la glutathion-S-transférase oméga de classes 1-1 (GSTO1-1). Ce mécanisme enzymatique est saturable et de fait, lorsque le seuil est atteint, la toxicité de l’arsenic est augmentée (Benramdane, Accominotti et al., 1999). Les réactions de réduction, diminuant la toxicité aiguë, ne semblent pas impliquées dans la toxicité chronique et les mécanismes de cancérogénèse (Mc Kinney, 1992, Thomas, Styblo et al., 2001). Les variations des capacités de méthylation entre individus sont partiellement responsables de la variation de susceptibilité des individus à la toxicité de l’arsenic (Tseng, 2009, Faita, Cori et al., 2013). En revanche, chez un individu donné, les capacités de méthylation sont très stables (HAS, 2020).
Les facteurs environnementaux jouent aussi un rôle important comme tabac, alcool, habitudes alimentaires, l’âge peuvent réduire la méthylation de l’arsenic. De plus, la méthylation de l’arsenic est plus efficace chez la femme que chez l’homme (Shen, Niu et al., 2016). Par ailleurs, une voie de biotransformation alternative a été proposée, impliquant la formation non enzymatique de complexes entre le glutathion et l’arsénite, aboutissant à la synthèse d’arsenic triglutathion (Hayakawa, Kobayashi et al., 2005).
Des variations du métabolisme ont été observées notamment dans certaines populations des Andes qui excrètent moins de MMA (quelques pourcents), tandis que l’inverse est observé dans certaines régions de Taïwan (348).
Schéma métabolique d’après Styblo, Del Razo et al., 2000, Schuhmacher-Wolz, Dieter et al., 2009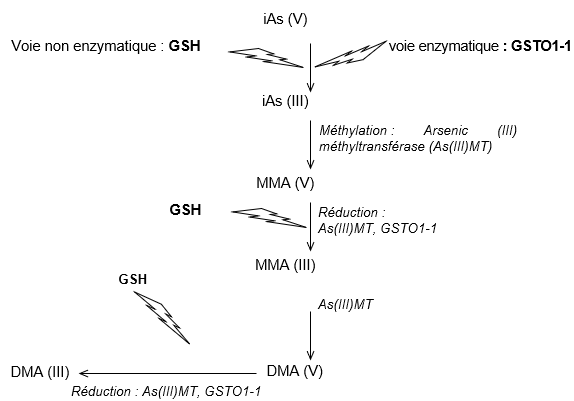
Élimination
Par voie orale ou voie respiratoire, l’arsenic absorbé est principalement éliminé dans les urines, sous forme inchangée et sous forme de métabolites méthylés, après filtration glomérulaire, sécrétion tubulaire et réabsorption active (Vahter and Gustafsson, 1980, Tsukamoto, Parker et al., 1983, Offergelt, Roels et al., 1992). Ainsi, suite à l’ingestion d’arsenic, 45 à 85 % sont excrétés dans les urines, dans les 3 jours qui suivent l’absorption (Apostoli, Bartoli et al., 1999). Pour des faibles doses d’exposition, les niveaux d’arsenic urinaires augmentent généralement de manière linéaire avec la quantité d’arsenic absorbée (Calderon, Hudgens et al., 1999). Des études chez des volontaires montrent que 46 à 63 % de la dose d’arsenic sont éliminés dans les 4 à 5 jours après l’ingestion (Vahter, 1983, Buchet and Lauwerys, 1988), 30 % sont éliminés avec une demi-vie de plus d’une semaine et le reste avec une demi-vie supérieure à un mois (Pomroy, Charbonneau et al., 1980). Les matières fécales peuvent éliminer jusqu’à 5 % de la dose absorbée par voie orale (Cikrt, Bencko et al., 1980). Il existe une excrétion biliaire, sous forme de complexes arsenic-glutathion (Kala, Neely et al., 2000).
Après une exposition par inhalation, 30 à 60 % de l’arsenic absorbé est rapidement éliminé dans les urines.
Les proportions relatives d’arsenic (III), As (V), MMA et DMA retrouvées dans les urines dépendent de la forme chimique administrée, de la voie d’exposition et de la dose. En général, le DMA est le principal métabolite (40-75 %) puis suivent l’iAs (20-25 %) et le MMA (15-25 %) (Christian, Hopenhayn et al., 2006 ; Mandal, Ogra et al., 2001, Hopenhayn, Huang et al., 2003, Loffredo, Aposhian et al., 2003). La forme pentavalente, la voie orale et les faibles doses sont associées à une élimination plus rapide (Vahter, 1981). La déplétion en glutathion nécessaire au processus de méthylation diminue l’élimination de l’arsenic (Buchet and Lauwerys, 1988, Hirata, Tanaka et al., 1990).
L’élimination varie aussi en fonction du sexe, de l’âge, du statut nutritionnel et du polymorphisme génétique.
L’arsenic est faiblement excrété dans le lait maternel, y compris chez les femmes présentant une forte contamination avec une concentration urinaire en moyenne de 154,8 µg.L-1(Islam, Attia et al., 2014).
Chez l'animal
Absorption
Inhalation:
Chez l’animal, l’absorption de l’iAs déposé dans les voies aériennes est fortement corrélée à son hydrosolubilité, le passage systémique des dérivés très hydrosolubles comme l’arsénite et l’arséniate étant à peu près complet et rapide, alors que celui des dérivés insolubles, tels que l’arséniate de plomb ou sulfure d’arsenic est beaucoup plus lent (ATSDR, 2007). Aucun de ces éléments n’a été quantifié.
Voie orale:
Seule l’absorption par voie orale des dérivés insolubles (arséniate de cadmium ou de plomb) semble être réduite de 30 à 40 % par rapport aux dérivés trivalents et pentavalents hydrosolubles (Diacomanolis, Noller et al., 2013, Diacomanolis, Noller et al., 2014).
Voie cutanée:
L’absorption par voie cutanée d’arsenic (V) est estimée entre 1 et 33 µg.cm-2.h-1 (Dutkiewicz, 1977) suite à l’immersion de la queue de rats femelles dans une solution d’arséniate de sodium pendant 1 heure.
Chez le singe, le passage transcutané de l’arsenic des sols est toujours inférieur à 1 % (ATSDR, 2016).
Distribution
Lors de l’exposition par inhalation chez la souris, il a été montré que l’arsenic n’a pas de tropisme spécifique : il est retrouvé dans tous les organes internes (Burchiel, Mitchell et al., 2009). Les plus fortes concentrations ont été observées dans le foie, suivi par la vessie et les reins. Chez les rongeurs, l’iAs passe facilement la barrière placentaire (Hood, Vedel et al., 1988, Murko, Elek et al., 2018).
Métabolisme
Le métabolisme de l’arsenic est quantitativement variable d’une espèce à l’autre ; les niveaux de méthylation des métabolites de l’arsenic et leurs proportions respectives varient d’une espèce animale à l’autre (nuls chez le cobaye, le ouistiti, le chimpanzé, proches de ceux de l’homme chez la souris et le lapin) ; elles ne sont pas directement transposables à l’homme (ATSDR, 2007).
Élimination
L’excrétion de l’iAs est principalement urinaire chez l’animal, avec un profil qui peut varier en fonction du profil métabolique de l’espèce considérée (ATSDR, 2007).
Autre
Mécanisme d’action et spécificité en fonction de la spéciation :
La toxicité de l’arsenic est intimement liée à son processus de métabolisation (Harrington, Middaugh et al., 1978, Hughes, Beck et al., 2011, Khairul, Wang et al., 2017). L’arsenic pentavalent absorbé est rapidement réduit en arsenic trivalent, qui va alors se distribuer dans les différents tissus et entrer dans les cellules (surtout les hépatocytes). L’As(III) étant considéré comme plus toxique que l’As(V) (NAS, 1977), cette étape est considérée comme une bio-activation plutôt qu’une détoxication. Ferguson et Gavis ont ainsi montré que la valence (III) était 60 fois plus toxique la valence (V) (Ferguson and Gavis, 1972).
L’As(III) et l’As(V) interagissent différemment avec les composants cellulaires et tissulaires. Il en résulte une distribution tissulaire et des mécanismes de toxicité différents pour ces deux composés.
La toxicité différentielle entre l’As(III) et l’As(V) n’apparaît néanmoins que pour une exposition à de fortes concentrations du composé. Après une exposition à de faibles concentrations d’As(III) ou d’As(V), la distribution dans les tissus, la rétention et la toxicité des deux composés sont similaires. En revanche, en cas d’exposition à de fortes concentrations, la rétention d’As est beaucoup plus importante s’il s’agit d’As(III).
Jusque récemment, les formes inorganiques étaient considérées comme 100 fois plus toxiques que les formes organiques de l’arsenic (NRC, 1999). Toutefois, des données récentes semblent indiquer que la conversion de l’arsenic de sa forme inorganique vers sa forme organique n’est pas nécessairement une détoxication (Mass, Tennant et al., 2001). De plus, très peu de données sont disponibles concernant la toxicité des métabolites méthylés trivalents de l’arsenic, soit le MMA(III) et le DMA(III).
En considérant la forte réactivité de l’arsenic trivalent, et plus spécifiquement sa forte affinité avec les sulfhydryles, les formes méthylées trivalentes pourraient donc être potentiellement aussi actives biologiquement que l’As(III) (Styblo, Del Razo et al., 2000). Plusieurs études ont ainsi montré que le MMA(III) est en fait plus toxique pour les hépatocytes que le MMA(V) et l’arsénite (Aposhian, Gurzau et al., 2000, Petrick, Ayala-Fierro et al., 2000, Styblo, Del Razo et al., 2000, NRC, 2001). Les formes trivalentes de l’arsenic MMA(III) et DMA(III) induisent ainsi un risque accru en ce qui concerne la cytotoxicité (Styblo, Del Razo et al., 2000), la génotoxicité (Mass, Tennant et al., 2001, Nesnow, Roop et al., 2002) et l’inhibition des enzymes anti-oxydantes (Styblo, Serves et al., 1997, Lin, Del Razo et al., 2001). Le MMA(III) et le DMA(III) présentent la même affinité que l’iAs(III) pour des protéines cellulaires spécifiques (Styblo, Hughes et al., 1996, Styblo and Thomas, 1997). Ainsi, comme l’As(III), le MMA(III) a la capacité d’inhiber la glutathion réductase, enzyme clé du métabolisme du GSH.
Ils tendent à montrer que la voie de méthylation de l’arsenic dans l’organisme jouerait un rôle important dans l’induction et la survenue d’effets toxiques associés à une exposition à l’iAs (Valenzuela, Borja-Aburto et al., 2005). Différents mécanismes de toxicité sont envisagés et étudiés pour tenter d’élucider le lien existant entre les métabolites méthylés trivalents de l'arsenic et l’apparition de lésions cutanées typiques à l’arsenic : une accumulation accrue de l’arsenic sous cette forme dans les cellules (Hirano, Kobayashi et al., 2004), une stimulation de l’expression de cytokines pro-inflammatoires et de facteurs de croissance au niveau des kératinocytes de l’épiderme par le MMA(III), à l’origine de difficultés pour la cellule à maintenir son homéostase et l’intégrité de la barrière cutanée (Vega, Styblo et al., 2001), de même qu’une affinité supérieure des formes trivalentes pour les thiols (Shiobara, Ogra et al., 2001).
L’ordre relatif de toxicité pouvant résulter de ces études serait donc le suivant :
MMA(III) et DMA(III) > arsénite (III) > arséniate (V) > MMA(V) et DMA(V)
Synthèse
Chez l'homme
L’iAs est facilement absorbé par voie orale et, dans une moindre mesure par voie respiratoire ; l’absorption cutanée est négligeable. Une fois absorbé, il est distribué rapidement dans tous les organes (principalement le foie et les reins) et a la capacité de traverser la barrière placentaire. La métabolisation de l’arsenic passe par des réactions d’oxydation et de méthylation, jusqu’à obtention de métabolites méthylés, majoritairement éliminés via l’urine.
Chez l'animal
L’absorption et la distribution de l’iAs chez l’animal sont similaires à celles décrites chez l’homme, pour toutes les voies considérées. En revanche, le profil métabolique, variable selon les espèces, peut conduire à la formation de métabolites qui peuvent varier selon l’espèce considérée. La toxicité de l’arsenic est intimement liée à son processus de métabolisation, avec une toxicité différentielle entre l’As(III) et l’As(V). L’ordre relatif de toxicité estimé à partir d’études récentes serait le suivant : MMA(III) et DMA(III) > arsénite (III) > arséniate (V) > MMA(V) et DMA(V)
Equivalents biosurveillance
Description
Synthèse des principales valeurs biologiques d’interprétation (Biotox, 2021)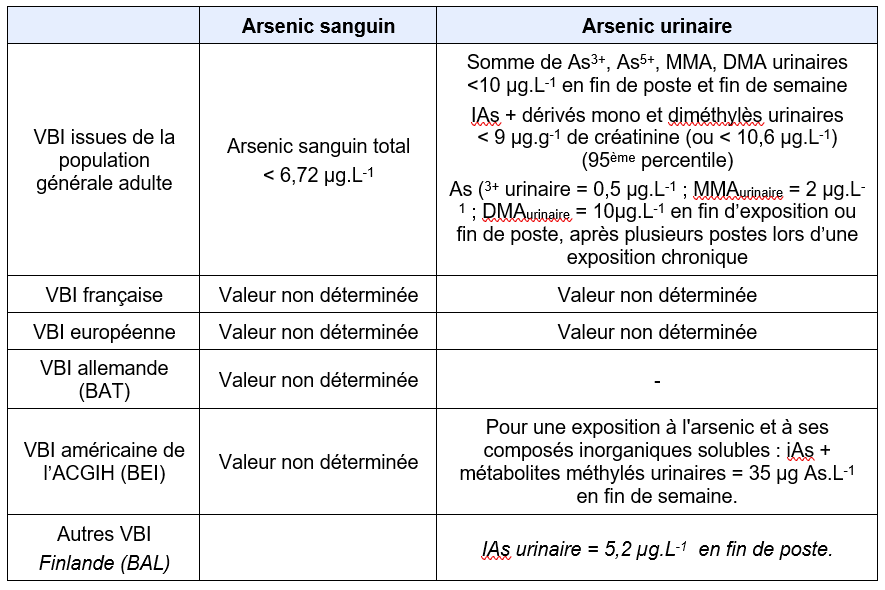
Toxicité aiguë
Chez l'homme
Inhalation
Aucune donnée n’a été identifiée.
Voie orale
Les effets aigus, suite à l’ingestion d’iAs, sont typiquement gastro-intestinaux associant nausées, vomissements, hémorragies gastro-intestinales, douleurs abdominales et diarrhées qui prennent parfois l’aspect « eau de riz », décrite sous le nom de « choléra arsenical », pouvant conduire au décès. Ces symptômes surviennent rapidement, dans les heures suivant l’ingestion (Kersjes, Maurer et al., 1987, Marsha and Ford, 1998).
Ils s’accompagnent souvent d’une instabilité hémodynamique se traduisant par une tachycardie sinusale et une hypotension artérielle orthostatique (Uede and Furukawa, 2003). Parfois, une franche diminution de la pression artérielle oriente faussement vers un choc septique ou un infarctus du myocarde. Une fièvre peut également exister perturbant le diagnostic (Bolliger, Van Zijt et al., 1992, Cullen, Woltf et al., 1995).
Les intoxications aiguës sévères s’accompagnent également d’une encéphalopathie aiguë avec confusion (Beckett, Moore et al., 1986, Uede and Furukawa, 2003, Vantroyen, Heilier et al., 2004), convulsions, coma associé à une atteinte polyviscérale : détresse respiratoire, œdème pulmonaire, syndrome de détresse respiratoire aiguë de l'adulte (SDRA), hépatite, rhabdomyolyse, anémie hémolytique (Chan and Matthews, 1990), insuffisance rénale (Hutton and Christians, 1983, Bolliger, Van Zijt et al., 1992). Les convulsions peuvent être en rapport avec des troubles du rythme cardiaque, en particulier des torsades de pointes (Goldsmith and From, 1980).
A des doses moins sévères, estimées à 3 mg.j-1 soit 0,05 mg.kg-1.j-1 pour une exposition journalière et comprise entre 2 et 3 semaines, Mizuta, Mizuta et al., 1956 rapportent les effets d’une intoxication massive de 220 japonais, ayant consommé de la sauce de soja contaminée par 100 mg.L-1 d’arsenic sous forme d’arséniate de calcium. A noter que sont rapportés dans cette étude, 220 des 417 cas de contamination identifiés au préalable, sur la base de symptômes différents de ceux généralement décrits dans la littérature. Les premiers symptômes sont un œdème de la face (50 à 60 %), ainsi que des symptômes gastro-intestinaux (40 à 50 %) et des voies respiratoires supérieures (20 à 30 %) suivis chez quelques patients de lésions cutanées et d’une neuropathie. Les autres effets observés sont une anémie modérée, avec leucopénie (32 patients), une dégénérescence modérée hépatique avec dysfonctionnement hépatique (biopsies de 5 patients), des lésions oculaires (7 patients) et des électrocardiogrammes anormaux (16 sur 20 sujets examinés). Ces symptômes gastro-intestinaux diminuent rapidement après l'arrêt de l'exposition. Un LOAEL de 0,05 mg.kg-1.j-1 en a été déduit pour l’œdème facial et les symptômes gastro-intestinaux (nausées, vomissements et diarrhée) par les auteurs.
D’autres signes se manifestent dans les jours ou semaines qui suivent. Une neuropathie périphérique, due à une dégénérescence axonale, peut se développer en une à trois semaines après l’ingestion d’arsenic. Chez neuf patients, la neuropathie (Chhuttani, Chawla et al., 1967, Le Quesne and McLeod, 1977) s’est développée en 24 heures. Les troubles sensitifs prédominent au début au niveau des extrémités, puis l’atteinte progresse vers la racine avec hypoesthésie, diminution de la sensation du toucher, diminution des réflexes ostéo-tendineux. L’atteinte motrice suit cette évolution. Parfois, le tableau réalise un syndrome de type Guillain-Barré* (Donofrio, Wilbourn et al., 1987).
De nombreux troubles neuropsychiques ont été décrits dans la période sub-aiguë : céphalées, confusion, perte de mémoire, irritabilité, modification de la personnalité, hallucinations, délires et convulsions (Freeman and Crouch, 1978, Danan, Dally et al., 1984, Marsha and Ford, 1998).
Les lésions de la peau et des phanères (Park and Currier, 1991, Valentine, Shan-Yuan et al., 1992) observées après une intoxication aiguë incluent un rash maculeux diffus et prurigineux, une alopécie en plaques, une desquamation non prurigineuse et brunâtre, une dermite exfoliative. Les lignes blanches au niveau des ongles (ou lignes de Mees) s’observent dans moins de 5 % des cas (Abernathy and Ohanian, 1992) et surviennent 30 à 40 jours après l’ingestion ; suivant la croissance des ongles (environ 1 mm par semaine), elles permettent ainsi une datation approximative de l’exposition (Heyman, Pfeiffer et al., 1956).
La dose létale pour l’homme adulte est estimée entre 1 et 3 mg.kg-1.j-1 d’arsenic (Vallée, Ulmer et al., 1960, Schoolmeester and White, 1980, Zaloga, Deal et al., 1985, Levin-Scherz, Patrick et al., 1987, Civantos, Lopez Rodriguez et al., 1995, Kamijo, Soma et al., 1998, Benramdane, Accominotti et al., 1999).
*Syndrome de type Guillain-Barré : Polyradiculonévrite aiguë inflammatoire aiguë avec démyélinisation segmentaire multifocale d’origine auto-immune qui se traduit par une paralysie généralisée avec une évolution en général favorable.
Voie cutanée
Les dérivés trivalents de l’arsenic sont généralement assez fortement irritants. Ils peuvent provoquer des brûlures des tissus avec lesquels ils ont un contact prolongé (HAS, 2020).
Synthèse
Les principaux effets aigus, observés suite à l’ingestion d’iAs, sont typiquement gastro-intestinaux associant nausées, vomissements, hémorragies gastro-intestinales, douleurs abdominales et diarrhées. Des effets sur le système nerveux et la peau peuvent aussi apparaître dans les jours ou les semaines suivant l’exposition.
Chez l'animal
Inhalation
Aucune donnée spécifique n’a été identifiée.
Voie orale
Pour les dérivés inorganiques de l’arsenic, la DL50 par voie orale est comprise entre 15 et 293 mg.kg-1 de poids corporel chez le rat et entre 11 et 150 mg.kg-1 pour les autres animaux de laboratoire. Dans la majorité des cas, la mort survient le jour suivant l’exposition (Schwartze, 1922, Dieke and Richter, 1946, Harrison, Packman et al., 1958, Gaines, 1960, Done and Peart, 1971, Kaise, Watanabe et al., 1985).
Lors d’expositions répétées par voie orale, il a été montré que les chiens et les singes mouraient pour des expositions à 3 mg As.kg-1.j-1 d’arséniate (As V) et d’arsénite (As III) (Byron, Bierbower et al., 1967, Heywood and Sortwell, 1979).
Voie cutanée
Lors de l’exposition par voie cutanée aux dérivés inorganiques de l’arsenic, des irritations ont été rapportées chez la souris pour des expositions à 2,5 mg As.kg-1 d’arsénite de sodium (Boutwell, 1963). En revanche, aucun effet n’est retrouvé chez le cobaye exposé à des solutions aqueuses contenant 4 000 mg As.L-1 sous forme d’arséniate ou 580 mg As.L-1 sous forme d’arsénite (Wahlberg and Boman,1986). L’application cutanée de MMA chez le lapin induit une irritation modérée (Jaghabir, Abdelghani et al., 1989).
Synthèse
Les effets aigus, observés suite à l’exposition d’iAs par voie orale chez l’animal, sont comparables à ceux décrits chez l’homme. Par voie cutanée, des irritations sont rapportées au niveau de la peau mais varient selon l’espèce chimique et animale considérée.
Toxicité à doses répétées
Effets généraux
Généralités
Effets sur la peau et les muqueuses
Dans les cas d’intoxications chroniques à l’arsenic, les lésions cutanées prédominent : hyperkératose de la paume des mains et de la plante des pieds, concomitante à une hyperpigmentation parsemée de petites zones hypo-pigmentées, également appelée une mélanose (Tseng, Chu et al., 1968, Chakraborty and Saha, 1987, Mazumder, Chakraborty et al., 1988, Haupert, Wiersma et al., 1996, Ahmad, Bandaranayake et al., 1997, Guha Mazumder, Ghoshal et al., 1998, Mazumder, Santra et al., 1998, Mazumder, Haque et al., 1998, Ahsan, Perrin et al., 2000, Ahmad, Sayed et al., 2001, Guo, Yu et al., 2001, Liu, Zheng et al., 2002, Chakraborti, Mukherjee et al., 2003, Chakraborti, Mukherjee et al., 2003, Milton, Hasan et al., 2004, Guo, Liu et al., 2006).
Effets sur le système cardiovasculaire
Les effets sur le système cardiovasculaire se manifestent au niveau du cœur et du système vasculaire lui-même (maladie de Raynaud). Ainsi, des troubles de la conduction avec modification de la repolarisation incluant un allongement de l'intervalle Q T, des modifications non spécifiques du segment S T, des troubles du rythme ventriculaire (Heyman, Pfeiffer et al., 1956, Mizuta, Mizuta et al., 1956, Glazener, Ellis et al., 1968, Goldsmith and From, 1980, Little, Kay et al., 1990, Moore, O'Callaghan et al., 1994, Cullen, Woltf et al., 1995, Joye, Marion et al., 1999, Mumford, Wu et al., 2007) et de l’hypertension sont observés (Zierold, Knobeloch et al., 2004).
Chez l'homme
Inhalation
Effets sur la peau et les muqueuses
En présence de poussières d’arsenic dans l’air ambiant, il est très difficile de différencier les effets sur la peau liés à un contact cutané de ceux liés à l’exposition par inhalation. Toutefois, des dermites sont fréquemment observées chez les travailleurs exposés (Col, Col et al., 1999), avec un taux d’apparition élevé lors d’expositions à de fortes concentrations. De même, en présence de fortes concentrations en arsenic (entre 0,384 et 1,034 mg As.m-3), l’incidence des hyperkératoses et des hyperpigmentations augmente (Perry, Bowler et al., 1948).
Effets sur le système cardiovasculaire
Plusieurs études réalisées chez des salariés, exposés par inhalation aux vapeurs de trioxyde d'arsenic, ont mis en évidence une augmentation du risque de mortalité par accident cardiovasculaire (Axelson, Dahlgren et al., 1978, Wall, 1980, Lee-Feldstein, 1983). Certaines études ne confirment pas ces résultats (Jarup, Pershagen et al., 1989). Les niveaux d'exposition ne sont pas connus. Il est probable que les effets observés soient également liés à d'autres facteurs de risques tels que le plomb ou la fumée de cigarette.
Par inhalation, les effets cardiovasculaires sont multiples. Lagerkvist et al. (1986) ont mis en évidence une augmentation de l’incidence du syndrome de Raynaud, chez des travailleurs exposés à 0,36 mg As.m-3 pendant 23 ans (Lagerkvist, Linderholm et al., 1986). La diminution des niveaux d’exposition des travailleurs à l’arsenic, dans les années qui ont suivi l’arrêt de l’exposition, a permis un retour à la normale du calibre des vaisseaux sanguins (Lagerkvist, Linderholm et al., 1988). A partir de ces études, une LOAEC pour le syndrome de Raynaud peut être fixée à 0,36 mg As.m-3.
Plusieurs études de cohortes menées chez des mineurs (Wall, 1980, Welch, Higgins et al., 1982, Lee-Feldstein, 1983, Xuan, Lubin et al., 1993, Enterline, Day et al., 1995, Qiao, Tockman et al., 1997) rapportent une augmentation du risque de mortalité liée à des maladies cardiovasculaires, notamment par cardiopathie ischémique (diminution de l’irrigation sanguine) et par maladies cérébrovasculaires. Toutefois, les relations dose-effet ne sont pas claires et ne permettent pas de conclure quant au lien entre l’exposition à l’arsenic et la mortalité par maladies cardiovasculaires, d’autant plus que les ouvriers concernés ont été exposés à d’autres métaux.
Effets hématologiques
L'exposition aux dérivés inorganiques de l'arsenic, par inhalation n'induit pas d'effets hématologiques (Watrous and McCaughey, 1945, Beckett, Moore et al., 1986, Bolla-Wilson and Bleecker, 1987, Ide and Bullough, 1988, Morton and Caron, 1989).
Effets neurologiques
Des neuropathies périphériques sensorielles et motrices (Landau, Thompson et al., 1977, Feldman, Niles et al., 1979) et des encéphalopathies franches (Beckett et al., 1986 ; Morton et Caron, 1989) sont rapportées lors d'expositions par inhalation aux dérivés inorganiques de l'arsenic. Ces effets sont partiellement réversibles à l'arrêt de l'exposition (Beckett, Moore et al., 1986). Gerr, Letz et al., 2000 rapportent une augmentation de l’incidence des neuropathies périphériques, observée chez les riverains d’une usine de pesticides utilisant l’arsenic. Une diminution de la vitesse de conduction nerveuse a aussi été mise en évidence par plusieurs auteurs, chez des mineurs (Feldman, Niles et al., 1979, Blom, Lagerkvist et al., 1985, Lagerkvist and Zetterlund, 1994), permettant de fixer une LOAEC pour cet effet à 0,31 mg As.m-3.
Effets digestifs
Des nausées, des vomissements et des diarrhées sont également rapportées chez des salariés, exposés par inhalation à des niveaux élevés de poussières et de vapeurs d'iAs (Beckett, Moore et al., 1986, Bolla-Wilson and Bleecker, 1987, Morton and Caron, 1989). La seule donnée disponible, concernant les niveaux d'exposition, correspond à ceux mesurés chez un salarié exposé à 0,11 mg As.m-3 de trioxyde d'arsenic et présentant des nausées et une anorexie. Ces effets sont réversibles et ne sont pas retrouvés lors d'expositions professionnelles à de faibles concentrations (Dunlap, 1921, Pinto and McGill, 1953).
Effets pancréatiques - Implication de l’arsenic dans le diabète
Dans le monde du travail, l’association entre une exposition à l’arsenic et le diabète est très peu décrite et présente des résultats variables, probablement dus à des biais importants (mesures d’exposition erronées, nombre trop faible de sujets, existence de facteurs confondants) (Lubin, Pottern et al., 2000; Chen et al., 2007). Rahman, Wingren et al., 1996 trouvent un risque à peine significatif de diabète chez des employés d’une usine de verre considérés comme exposés à l’arsenic. Dans une toute petite population (12 cas exposés) de la cohorte de Rönnskär, Rahman and Axelson, 1995 ont noté aussi une élévation très faible du risque de diabète. Ces résultats sont également retrouvés par Jensen and Hansen, 1998 dans une cohorte de 40 employés exposés à l’arsenic.
Autres effets
Plusieurs études épidémiologiques (Lee-Feldstein, 1983, Xuan, Lubin et al., 1993, Enterline, Day et al., 1995, Lubin, Pottern et al., 2000, Liu, Zheng et al., 2002) rapportent une augmentation de la mortalité, à la suite de maladies respiratoires telles que l’emphysème ou la pneumoconiose, chez les travailleurs exposés aux poussières de trioxyde d’arsenic. Toutefois, ces études ne tiennent pas compte de l’exposition à d’autres substances ou du tabagisme éventuel des travailleurs, et les relations dose-effet établies ne sont pas concluantes.
Voie orale
Effets sur la peau et les muqueuses
Dans les cas d’intoxication par l’eau de boisson, les manifestations cutanées, et en particulier les kératoses, sont les signes les plus sensibles et les plus précoces des effets de l’arsenic (Ahsan, Chen et al., 2006, Guo, Liu et al., 2006).
Plus de 10 000 personnes de la région d’Araihazar (Bangladesh) ont participé à l’étude transversale d’Ahsan et al. (2006) : des données individuelles sur l’exposition via l’eau de boisson (concentrations comprises entre 1,8 et 864 µg.L-1) et les lésions cutanées observées (mélanose et hyperkératose) ont été recueillies. La prévalence des lésions cutanées non cancéreuses augmentait du plus faible (0-8 µg. L-1; médiane : 1,8 µg. L-1) au plus fort quintile de la distribution de la concentration de l’arsenic dans l’eau consommée. Les odd ratio pour les lésions cutanés sont de 1,91 (IC 95 % : 1,26-2,89), 3,03 (IC 95 % : 2,05-4,50), 3,71 (IC 95 % : 2,53 – 5,44) respectivement pour des expositions à 8,1-40,0 ; 40,1-91,0 ; 91,1-175,0 ; 175,1-864,0 µg.L-1 d’arsenic dans l’eau de boisson par comparaison avec le groupe exposé à moins de 8,1 µg.L-1 (groupe témoin). L’influence du sexe (les hommes étant les plus sensibles) et du statut nutritionnel sur les lésions cutanées a été prise en compte. D’après ces études, lors d’expositions chroniques, les lésions cutanées apparaissent à partir de 10 µg.L-1. En dessous de 1 µg.L-1, aucun effet toxique n’est mis en évidence (Rahman, Mandal et al., 2003). Ces auteurs ont fixé un NOAEL pour les lésions cutanées, dans l’eau de boisson, à 10 µg.L-1 soit 0,8 µg.kg-1.j-1.
En 2006, dans le cadre d’une étude cas-témoins réalisée sur une population de 166 934 individus (dont 1 groupe témoin de 1 830 individus) âgées de plus de 4 ans, ayant vécu et bu de l’eau dans la région de Matlab, au Bangladesh, 504 personnes ont été identifiées comme présentant des lésions cutanées liées à l’arsenic (après entretien, détermination de la consommation en eau, examen des lésions par des médecins puis par des dermatologues) (Rahman et al., 2006). Pour chaque sexe, une relation dose-réponse significative (Tableau XXX) entre l’exposition moyenne ou cumulée en arsenic et le risque de développer des lésions cutanées a été mise en évidence, la catégorie la plus faible d’exposition étant utilisée comme témoin.
Odds ratios pour les lésions cutanées, chez les hommes et les femmes, en fonction des concentrations moyennes en arsenic (µg.L-1) dans l’eau de boisson (Rahman et al., 2006) :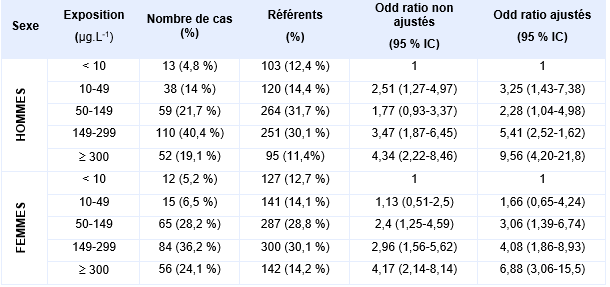
Ces relations dose-réponse ont été mises en évidence entre l’exposition à l’arsenic dans l’eau de boisson (concentrations supérieures à 50 µg.L-1) et l’apparition de lésions cutanées (dont les désordres pigmentaires), les hommes étant plus susceptibles de développer ces lésions que les femmes (LOAEL de 10 µg.L-1) (Guo, Liu et al., 2006, Rahman, Vahter et al., 2006). L’exposition à l’arsenic avant l’âge d’un an n’augmente pas le risque pour ces enfants de développer des lésions cutanées à l’âge adulte (Rahman, Vahter et al., 2006).
Une autre étude, Xia, Wade et al., 2009 a été conduite en Mongolie intérieure, 12 000 personnes ont été inclues. Celles qui consommaient une eau dont la concentration en arsenic était inférieure ou égale à 5 µg. L-1 constituaient la population témoin. La prévalence des lésions d’hyperkératose et de mélanodermie était significativement augmentée aux concentrations supérieures et le risque augmentait avec la concentration : OR de 2,52 (IC 95 % : 1,47-4,30) pour une concentration d’arsenic dans l’eau de 5,1-10 µg. L-1, de 2,83 (IC 95 % : 1,77-4,53) pour 10,1-20 µg. L-1, de 3,94 (IC 95 % : 2,78-5,59) pour 20,1-50 µg. L-1, de 6,03 (IC 95 % : 4,05-9,97) pour 50,1-100 µg. L-1, de 8,83 (IC 95 % : 5,77-13,51) pour 100,1-300 µg. L-1 et de 7,94 (IC 95 % : 2,73-23,12) au-delà de 300 µg. L-1.
Effets sur le système cardiovasculaire
L'ingestion par une population chilienne de 0,6 à 0,8 ppm d'arsenic dans l'eau de boisson (correspondant à des doses de 0,02 à 0,06 mg As.kg-1.j-1, fonction de l'âge) augmente l'incidence de la maladie de Raynaud et la cyanose des doigts et des orteils (Borgono and Greiber, 1972, Zaldivar and Guillier, 1977, ATSDR, 2007). L'autopsie de 5 enfants de cette région a mis en évidence l'épaississement des petites et moyennes artères dans tout le corps et plus particulièrement au niveau cardiaque (Rosenberg, 1974). Ces épaississements ont également été rapportés chez des négociants allemands en vin exposés à l'arsenic (Roth, 1957).
L’étude menée par Lewis, Southwick et al., 1999, sur la cohorte du comté de Millard exposée à l’arsenic présent dans l’eau potable, indique un excès significatif de mortalité cardiovasculaire chez les hommes (SMR = 2,20 ; 95 % IC = 1,36-3,36) et les femmes (SMR = 1,73 ; 95 % IC = 1,13-2,50). Un excès non significatif de décès par athérosclérose est aussi noté.
L’exposition à l’arsenic est aussi associée à une augmentation de l’incidence des maladies cérébrovasculaires (Chiou, Huang et al., 1997, Wang, Chiou et al., 2003) et microvasculaires (Chen, Chiou et al., 1996, Tseng, Chong et al., 2003, Chang, Ho et al., 2004). Une récente méta-analyse, regroupant 12 études de toxicité chronique à l’arsenic dans l’eau de boisson a montré une relation entre l’augmentation des risques relatifs poolés des maladies cardiovasculaires (toutes confondues) et maladies coronariennes et les concentrations log-transformées d’arsenic dans l’eau de boisson (Moon, Oberoi et al., 2017).
Maladie des pieds noirs
L’atteinte la plus caractéristique de cette intoxication est « la maladie des pieds noirs » (ou ‘Blackfoot disease’), endémique de la région de Taïwan, suite à l'ingestion d'eau de boisson contenant de l'arsenic à des niveaux de l'ordre de 0,17 à 0,80 ppm (Tseng, Chu et al., 1968, Tseng, 1977), correspondant à des doses de 0,014 à 0,065 mg As.kg-1.j-1 (Abernathy, Marcus et al., 1989). Cette maladie est caractérisée par une diminution progressive de la circulation sanguine périphérique (consécutive à une athérosclérose sous-jacente) au niveau des pieds, se manifestant par l’installation insidieuse d’une sensation de froid et d’engourdissement, suivie d’ulcérations et d’une coloration noire des téguments. Elle évolue en une gangrène sèche (Ch'i and Blackwell, 1968, Tseng, Chu et al., 1968, Tseng, 1977, Chen, Wu et al., 1988, Tseng, 1989). Si les études à Taïwan démontrent clairement l’association entre la maladie des pieds noirs et des apports excessifs d’arsenic par l’eau de boisson (0,9 à 1,2 % des hommes et 0,7 % des femmes développent la maladie des ‘pieds noirs’), cette observation n’est pas retrouvée dans d’autres régions. Il est probable que la malnutrition, des co-expositions ou des capacités de méthylation différentes selon les individus, jouent un rôle dans la physiopathologie de cette maladie (Yu, Sheu et al., 1984, Ko, 1986, Lu, Shih et al., 1990, Tseng, Huang et al., 2005, Tseng, 2008). Néanmoins, dans d’autres pays, les études confirment les effets de l’arsenic sur le système vasculaire périphérique.
Les études concernant la maladie des pieds noirs ont également mis en évidence une association entre l’exposition à l’arsenic par l’eau de boisson des puits et la mortalité par cause cardiaque (Chen, Wu et al., 1988, Wu, Kuo et al., 1989, Chen, Chiou et al., 1996, Tsai, Wang et al., 1999). Les mêmes recherches dans des régions où la contamination est moins importante ne sont pas aussi tranchées dans leurs résultats. Engel and Smith, 1994, dans une étude de la mortalité d’étiologie cardiovasculaire dans 30 villes américaines, comparée au nombre attendu de décès, retrouvent un excès de mortalité par atteinte du système vasculaire. Les rapports standardisés de mortalité (SMR) sont élevés lorsque les taux d’arsenic sont supérieurs à 20 µg.L-1.
Hypertension
Les études sur les liens entre une exposition chronique à l’arsenic et l’hypertension sont peu nombreuses, se résumant à deux études « environnementales » (Chen, Hsueh et al., 1995, Rahman, Tondel et al., 1999) et une lors d’une exposition professionnelle (Jensen and Hansen, 1998). Les trois études constatent une élévation de la pression artérielle sanguine avec l’exposition à l’arsenic. La prévalence de l’hypertension artérielle est augmentée de 1,56 pour les populations examinées par Chen, Hsueh et al., 1995 dans les régions d’endémie de la maladie des pieds noirs par comparaison à des populations non-exposées. Au Bangladesh, Rahman, Tondel et al., 1999 concluent à une relation dose-réponse entre l’exposition à l’arsenic et l’augmentation de la pression artérielle. Cependant, des analyses d’eau complètes ne sont pas disponibles et il existe des incertitudes dans l’identification de la population et leur niveau d’exposition. Dans un groupe de travailleurs danois, dont l’excrétion urinaire d’arsenic était de 22,3 µmol.L-1 soit deux fois la valeur de référence, l’augmentation de la pression artérielle systolique était statistiquement significative par comparaison aux témoins (Jensen and Hansen, 1998).
Effets hématologiques
De nombreuses études rapportent l'apparition d'effets hématologiques, tels une anémie et une leucopénie suite à l'ingestion de dérivés inorganiques de l'arsenic (Nagai, Usui et al., 1956, Kyle and Pease, 1965, Glazener, Ellis et al., 1968, Tay and Seah, 1975, Guha Mazumder, Das Gupta et al., 1992). L’anémie est habituellement normochromique et normocytaire (Kyle and Pease, 1965, Chakraborti, Mukherjee et al., 2003). Ces effets s’observent pour des doses supérieures ou équivalentes à 0,05 mg As.kg-1.j-1 (Chakraborti, Mukherjee et al., 2003).
Toutefois, cette association entre exposition chronique dans l’eau de boisson et troubles hématologiques n’a pas été mise en évidence en Alaska, Arizona, Utah ou au Michigan (NRC, 1999).
Effets neurologiques
Lors de l'exposition par ingestion aux dérivés inorganiques de l'arsenic, de nombreuses études épidémiologiques ont révélé la survenue d'atteintes du système nerveux. Les expositions chroniques à de faibles doses, comprises entre 0,03 et 0,1 mg As.kg-1.j-1, induisent des neuropathies périphériques symétriques (Lewis, Southwick et al., 1999, Muzi, Dell'omo et al., 2001, Chakraborti, Hussam et al., 2003, Chakraborti, Mukherjee et al., 2003). Elles se manifestent initialement par des paresthésies des extrémités des pieds et des mains, parfois accompagnées d’engourdissement et progressent vers la racine du membre en quelques jours. Les paresthésies peuvent être douloureuses, décrites comme une brûlure en chaussette ou en gant. Des douleurs musculaires intenses et une fatigabilité importante peuvent conduire à une incapacité motrice (Heyman, Pfeiffer et al., 1956, Le Quesne and McLeod, 1977, Kelafant, Kasarskis et al., 1993).
Les nerfs moteurs et sensoriels sont atteints (Heyman, Pfeiffer et al., 1956, Chhuttani, Chawla et al., 1967). L’atteinte porte sur la vitesse de conduction nerveuse motrice et sur des altérations des potentiels d’action sensitifs (Le Quesne and McLeod, 1977). L'analyse histologique révèle des altérations axonales avec ou sans démyélinisation (Le Quesne and McLeod, 1977, Hindmarsh and McCurdy, 1986, Goebel, Schmidt et al., 1990). Certains de ces effets sont partiellement réversibles après l'arrêt de l'exposition. Cependant, ce phénomène de récupération est souvent long et n’est jamais complet (Le Quesne and McLeod, 1977, Murphy, Lyon et al., 1981, Fincher and Koerker, 1987). Lors d’expositions chroniques par l’eau de boisson, l’exposition à des doses élevées, pouvant dépasser les 0,064 mg.kg-1.j-1 (équivalent à 800 µg.L-1), induit des neuropathies cliniques (neuropathies sensorielles et sensorimotrices) chez 35 % des patients présentant des lésions cutanées (Rahman, Mandal et al., 2003). D’une manière générale, aucun effet neurologique n’est visible pour des concentrations inférieures à 6 µg As.kg-1.j-1.
Effets hépatiques
Plusieurs études ont mis en évidence des effets hépatiques induits par les dérivés inorganiques de l'arsenic, lors de leur administration par voie orale. Ils se manifestent par une hépatomégalie, des douleurs abdominales, une perte d’appétit, une indigestion chronique associée à une hypertension portale (Franklin, Bean et al., 1950, Silver and Wainman, 1952, Wade and Frazer, 1953, Mizuta, Mizuta et al., 1956, Chakraborty and Saha, 1987, Mazumder, Chakraborty et al., 1988) pouvant être associées, dans certains cas, à une élévation du niveau sanguin des enzymes hépatiques (Armstrong, Stroube et al., 1984, Chakraborty and Saha, 1987, Franzblau and Lilis, 1989, Hernández-Zavala, Del Razo et al., 1998, Liu, Zheng et al., 2002, Mazumder, 2005). Ces effets sont plus souvent observés dès 6 µg As.kg-1.j-1 (Hernández-Zavala, Del Razo et al., 1998). Les conséquences les plus sérieuses de ces atteintes hépatiques sont des cirrhoses avec ou sans ascite (Tsai, Wang et al., 1999), les patients mourant généralement entre 6 et 12 mois après l’apparition d’ascite (Liu, Zheng et al., 2002). Plusieurs auteurs suggèrent que les lésions hépatiques observées sont secondaires à une atteinte des endothéliums des vaisseaux hépatiques (Morris, Schmid et al., 1974, Rosenberg, 1974, Labadie, Stoessel et al., 1990).
Effets digestifs
Lors d'expositions prolongées à de faibles doses par ingestion de dérivés inorganiques de l'arsenic, des nausées, des vomissements, des diarrhées et des douleurs abdominales sont observés (Holland, 1904, Silver and Wainman, 1952, Mizuta, Mizuta et al., 1956, Nagai, Usui et al., 1956, Borgono and Greiber, 1972, Wagner, Maliner et al., 1979, Cebrian, Albores et al., 1983, Huang, Qian et al., 1985, Mazumder, Chakraborty et al., 1988, Franzblau and Lilis, 1989, Muzi, Dell'omo et al., 2001, Uede and Furukawa, 2003, Vantroyen, Heilier et al., 2004). Ces effets ne sont pas visibles pour des niveaux d'exposition de l'ordre de 0,01 mg As.kg-1.j-1 (Harrington, Middaugh et al., 1978, Valentine, Reisbord et al., 1985). Dans une étude transversale indienne, le risque de diarrhée a augmenté seulement pour des concentrations d’arsenic dans l’eau supérieures à 800 µg.L-1 (Majumdar, Mazumder et al., 2009).
Effets pancréatiques - Implication de l’arsenic dans le diabète
La recherche d’une corrélation entre l’exposition à l’arsenic et le diabète de type 2 (non-insulino-dépendant) est fondée au plan physiopathologique, et donne lieu à des publications depuis les années 1990 et particulièrement nombreuses à partir de 2010 (ATSDR, 2016). Les travaux portent majoritairement sur des expositions par ingestion d’arsenic. Lai, Hsueh et al., 1994 ont montré une relation entre l’ingestion d’iAs et la prévalence de ce diabète dans une population de 891 adultes taïwanais. Après ajustement pour l’âge et le sexe, dans cette population qui vit en zone d’endémie de la maladie des pieds noirs, la prévalence du diabète est double de celle observée dans la population de Taipei et de Taiwan. Il est relevé, par les mêmes auteurs, une relation dose-réponse entre le taux d’arsenic dans l’eau et la prévalence de l’affection après prise en compte de l’âge, du sexe, de l’indice de masse corporelle et du niveau d’activité physique. Les risques relatifs sont de 6,61 et 10,05 pour des expositions cumulées de 0,1 – 15 ppm par an et plus de 15 ppm par an respectivement. Tsai, Wang et al., 1999 ont rapporté un excès de mortalité par diabète des populations exposées à l’arsenic dans quatre quartiers par rapport à la mortalité locale et nationale. L’étude de Tseng, Chu et al., 1968, dans une étude de cohorte d’habitants des régions endémiques de la maladie des pieds noirs, est en accord avec ces données. Il existe une association entre l’exposition cumulée à l’arsenic de l’eau de boisson et le diabète non insulino-dépendant (Tseng, Chong et al., 2000, Tseng, Tai et al., 2000, Tseng, Tseng et al., 2002 ; Wang, Chiou et al., 2003). Une telle association est notée au Bangladesh par Rahman, Tondel et al., 1998 qui utilise la kératose comme indicateur de l’exposition à l’arsenic. Ces auteurs ont mis en évidence une augmentation du nombre de diabètes liée à l’augmentation de l’exposition à l’arsenic, au Bangladesh, et ce dès une exposition comprise entre 1 et 5 µg.L-1 par an (Rahman, Tondel et al., 1998). A l’inverse, Lewis, Southwick et al., 1999 n’ont pas retrouvé de lien entre l’arsenic de l’eau de boisson et le diabète dans l’étude de la mortalité en Utah. Cependant, le diabète est une affection de faible mortalité aux USA et des études complémentaires seraient nécessaires pour conclure au rejet de l’hypothèse. Une revue exhaustive des études expérimentales (19 études in vitro, 10 études in vivo) et épidémiologiques (6 dans des régions de Taiwan et du Bangladesh présentant de fortes concentrations en arsenic, 9 en milieu professionnel et 4 autres) a été réalisée récemment abordant cette problématique (Navas-Acien, Silbergeld et al., 2006). Parmi les résidents des régions de Taiwan et du Bangladesh exposés à de fortes concentrations en arsenic dans l’eau de boisson, une augmentation de la prévalence du diabète est observée dans tous les cas, avec une relation dose-effet significative. Ainsi, Tseng, Tai et al., 2000 ont déterminé un odd ratio de 2,1 (95 % IC : 1,1-4,2) chez les habitants d’une région de Taiwan exposés à plus de 17 µg.L-1 par an et Wang, Chiou et al., 2003 ont calculé un odd ratio de 2,69 (95 % IC : 1,65-2,73) chez les taïwanais exposés.
De même, Meliker, Wahl et al., 2007 montrent une augmentation des taux de mortalité due au diabète, pour des concentrations en arsenic dans l’eau potable comprises entre 10 et 100 µg.L-1 (soit environ 0,8 à 80 µg.kg-1.j-1) sur une population de plus de 700 000 personnes regroupant six régions du Michigan.
Plusieurs études montrent qu’à exposition égale à l’arsenic, le risque de développer une maladie diabétique est plus élevé chez les personnes qui ont de bonnes capacités de méthylation se traduisant par une proportion élevée de DMA (acide diméthylarsinique) dans les urines et/ou une proportion faible de MMA (acide monométhylarsonique) et/ou un rapport DMA/MMA élevé (Del Razo, García-Vargas et al., 2011, Nizam, Kato et al., 2013, Mendez, González-Horta et al., 2016, Grau-Perez, Kuo et al., 2017, Kuo, Moon et al., 2017).
Autres effets
D’une manière générale, l’ingestion répétée de faibles doses d’arsenic n’a pas d’impact sur les voies respiratoires mais quelques études ont tout de même noté l’apparition de toux, rhinorrhées ou laryngites, pour des doses d’arsenic comprises entre 0,03 et 0,05 mg As.kg-1.j-1 (Mizuta, Mizuta et al., 1956, Ahmad, Bandaranayake et al., 1997). Quelques patients ont présenté des bronchites, avec leurs séquelles, suite à des intoxications chroniques (Milton and Rahman, 2002, Mazumder, Steinmaus et al., 2005).
Voie cutanée
Au niveau oculaire, la présence de poussières d’arsenic dans l’air est à l’origine de conjonctivites (Liu, Zheng et al., 2002), souvent associées à des dermites faciales.
Synthèse
L’exposition professionnelle par inhalation à l’arsenic à des niveaux élevés, induit des effets principalement au niveau de la peau (hyperkératose et hyperpigmentation), du système cardiovasculaire (maladie de Raynaud), du système nerveux (neuropathies périphériques) et des voies respiratoires (emphysème, pneumoconiose). Par voie orale, les effets chroniques de l’arsenic sont des effets sur la peau (hyperkératose et hyperpigmentation (mélanose)), le système cardiovasculaire (arythmies, péricardites, maladie de Raynaud, « Blackfoot disease » gangrène), le système respiratoire (toux, rhinorhées, laryngites), neurologique (neuropathies périphériques) et au niveau gastro-intestinal ou sanguin (anémie, leucopénie) et, un possible impact sur le développement de certains types de diabètes. Les effets sur la peau sont les signes les plus précoces traduisant une intoxication par l’arsenic.
L’ensemble des effets de l’iAs, observés après inhalation ou ingestion, est repris dans le tableau de synthèse ci-après. Les doses à partir desquelles ces effets se manifestent ont été recensées autant que possible dans les études les plus récentes.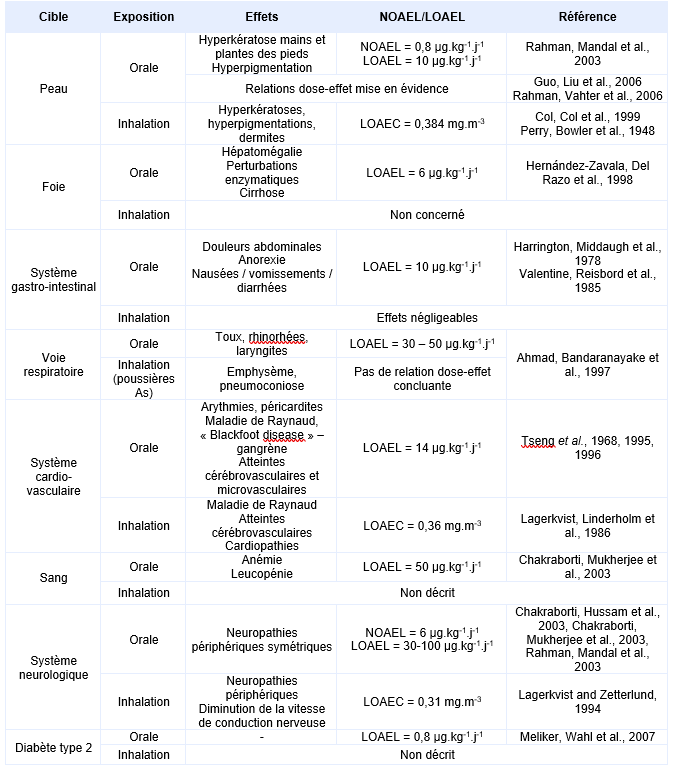
Chez l'animal
Inhalation
Etant donné la qualité des données épidémiologiques, il n’a pas été jugé opportun de détailler les résultats des études par inhalation chez l’animal, par ailleurs assez peu nombreuses et décrivant principalement des effets sur l’appareil respiratoire.
Voie orale
Lors de l’exposition à des dérivés inorganiques de l’arsenic par ingestion, les rats présentent des effets similaires à ceux observés chez l’homme. Des expositions répétées à des doses de trioxyde d’arsenic (11 mg As.kg-1.j-1) pendant plusieurs semaines induisent des altérations vasculaires (Bekemeier and Hirschelmann, 1989). Cependant, aucun effet histopathologique n’est rapporté au niveau cardiaque chez le rat ou le chien lors de l’exposition à l’arséniate ou l’arsénite pendant 2 ans (Byron, Bierbower et al., 1967).
Une diminution de la réponse humorale aux antigènes et des différents compléments est rapportée chez la souris, exposée à 5,7 mg As.kg-1 d’arsénite de sodium (Sikorski, McCay et al., 1989). Par voie orale, l’arséniate n’induit pas d’effets immunosuppresseurs chez la souris jusqu’à 100 ppm (20 mg As.kg-1.j-1) (Kerkvliet, Steppan et al., 1980). Au cours de cette étude les animaux ont été exposés aux doses de 2,5 – 25 et 100 ppm d’As dans l’eau de boisson pendant 10 à 12 semaines.
Voie cutanée
Aucune étude de toxicité chronique par voie cutanée ayant rapporté des effets systémiques n’a été identifiée chez l’animal (ATSDR, 2007).
Synthèse
Les données chez l’animal par inhalation et/ou voie cutanée sont relativement limitées et décrivent le plus souvent des effets comparables à ceux observés chez l’humain. Les effets par voie orale, détaillés chez l’humain et comparables chez l’animal, ne sont pas détaillés.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :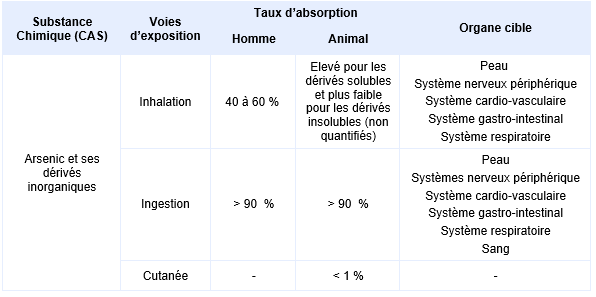
Effets cancérigènes
Généralités
Les principales études disponibles ont été recensées par l’IARC (2012) et ont conduit à la classification de l’arsenic. Les travaux plus récents complétant ces données sont rapportés par Zhou et Xi, 2018.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1A : le potentiel cancérogène est avéré pour l’homme pour le pentoxyde d’arsenic (CLP00, 2008), trioxyde d’arsenic (CLP, 2008), arséniate de plomb (CLP, 2008), l’acide arsénique et ses sels (JOCE, 2009 : première catégorie : « substances que l’on sait être cancérigènes pour l’homme ». | 2008 |
| IARC | Groupe 1 : l’agent (ou le mélange) est cancérogène pour l’homme pour l'arsenic et ses composés inorganiques | 2012 |
| US EPA | Classe A : substance cancérogène pour l'homme pour l'arsenic et ses composés inorganiques | 1998 |
Chez l'homme
Inhalation
Cancer des poumons et des voies respiratoires
Plusieurs études de populations exposées professionnellement à l’iAs (travailleurs de fonderies, travailleurs d’usines de fabrication de certains pesticides, travailleurs des vergers, négociants en vin) établissent une relation entre l'inhalation d'iAs et le cancer des voies respiratoires.
Quelques-unes, portant sur trois cohortes de travailleurs de fonderies, présentent suffisamment d'informations concernant l'exposition pour une estimation quantitative de l'augmentation du risque d'apparition de cancers respiratoires : ce sont les études des travailleurs de la fonderie de Tacoma (plomb, puis cuivre, or et argent ; Pinto, Henderson et al., 1978, Enterline and Marsh, 1982, Enterline, Henderson et al., 1987a, Enterline, Marsh et al., 1987b, Enterline, Day et al., 1995), de la fonderie d’Anaconda (cuivre ; Lee-Feldstein, 1983, Higgins, Oh et al., 1986, Lee-Feldstein, 1986, Lee-Feldstein, 1989, Lubin, Pottern et al., 2000), et de la fonderie de Ronnskar, en Suède (cuivre ; Axelson, Dahlgren et al., 1978, Jarup, Pershagen et al., 1989, Jarup and Pershagen, 1991, Sandstrom and Wall, 1993).
Dans la cohorte de 2 802 employés de la fonderie de Tacoma, les rapports standardisés de mortalité (SMR) pour le cancer respiratoire augmentent en même temps que l'exposition cumulée à l'arsenic. La consommation de tabac de ces sujets n’est pas connue. Le lien éventuel avec l'exposition à l'anhydride sulfureux est discuté du fait d’une étude antérieure, réalisée par les mêmes auteurs. Dans cette étude, une comparaison de la mortalité par cancer respiratoire dans deux départements présentant des concentrations élevées d'arsenic, mais des concentrations différentes d'anhydride sulfureux, avaient montré que l’excès de mortalité était lié à l’arsenic. Les résultats les plus récents (Enterline, Day et al., 1995) confirment, pour une exposition d’au moins un an entre 1940 et 1964, un SMR statistiquement significatif (p<0,05) de 316 pour la catégorie fortement exposée (≥ 45 mg.m-3).
Chez les 8 044 travailleurs de la fonderie d’Anaconda, Higgins, Oh et al., 1986 retrouvent une augmentation de la mortalité par cancer respiratoire rapportée à l’exposition à l’arsenic similaire à l'augmentation observée dans la cohorte de Tacoma. Cependant, la consommation de tabac de ces employés ou l’exposition à l'anhydride sulfureux ne sont pas bien documentées. Dans le groupe fortement exposé, la concentration est estimée à 11,3 mg.m-3, 0,6 et 0,3 mg.m-3 pour les groupes moyennement et faiblement exposés respectivement. Sur un total de 1 930 décès répertoriés, 446 sont dus à un cancer pulmonaire (SMR = 1,55 ; IC 95% : 1,41-1,70). Le risque augmente linéairement avec la durée d’emploi dans chaque catégorie (Lubin, Pottern et al., 2000), l’excès de risque apparaît à partir de 0,21 (mg.m-3)-1 par an (IC 95% : 0,10-0,46).
Welch, Higgins et al., 1982 notent une faible différence dans les valeurs des SMR pour le cancer respiratoire entre fumeurs et non-fumeurs sur 1 800 employés de la fonderie d’Anaconda (mais le pourcentage de non-fumeurs est faible 18,4 %).
Pour les 3 916 employés de la fonderie de Ronnskär, ayant travaillé au moins 3 mois dans la fonderie entre 1928 et 1967, l'excès de mortalité dû au cancer du poumon n’est pas en relation avec l'exposition à l'anhydride sulfureux. De plus, il existe une augmentation de la mortalité en fonction de l’intensité de l’exposition. Une augmentation statistiquement significative du risque est observée même pour les expositions < 0,25 mg.m-3 par an.
Cependant, il n’y a pas de relation nette et tranchée entre les variations de mortalité et la durée de l’exposition. Prenant en compte le tabagisme, Jarup and Pershagen, 1991 notent une faible augmentation du risque chez les fumeurs et les non-fumeurs pour des niveaux d’exposition inférieurs à 15 mg.m-3 par an. Ils suggèrent que l'interaction entre l'exposition à l'arsenic et la consommation de tabac est intermédiaire entre celle prévue par un modèle additif et multiplicatif.
Prises collectivement, les trois études démontrent une augmentation statistiquement significative du risque de cancer du poumon, pour des niveaux d’exposition à l’arsenic supérieurs à 75 mg.m-3 par an. Le risque semble augmenter plus rapidement avec la dose pour de faibles expositions cumulées qu’avec les fortes expositions (OMS IPCS, 2001, Lubin, Moore et al., 2008).
Sur la cohorte des travailleurs de la fonderie de Magna, Rencher, Carter et al., 1977 constatent que 7 % des décès sont dus au cancer du poumon par rapport à 0 - 2,2 % pour les autres employés et 2,7 % pour l’état (Utah) (10,1 / 10 000 pour la fonderie, 2,1 pour les mineurs et 3,3 pour les employés de l’Utah).
Etudiant les décès dus au cancer du poumon dans la ville de Saganoseki au Japon, à partir des certificats de décès validés par des analyses anatomo-pathologiques, Kuratsune, Tokudome et al., 1974 constatent que 58 % des cas de cancer du poumon sont observés chez les anciens employés de la fonderie par rapport à 15,8 % chez le groupe témoin.
Les travailleurs des usines d’anti-parasitaires ont aussi été étudiés. Hill and Faning, 1948 ont publié une étude ancienne sur la mortalité des travailleurs d’une usine de bains parasiticides à base d’arsenic : 29,3 % des décès sont dus aux cancers (cancer du poumon et cancer de la peau) contre 12,9 % pour les employés de la même zone géographique non exposés à l’arsenic (p < 0,05).
La cohorte de Ott, Holder et al., 1974 retrouve 20 décès par cancer respiratoire et 5 par cancer des tissus lymphatiques pour 5,8 et 1,3 décès attendus respectivement (p <0,01). De même Mabuchi, Lilienfeld et al., 1979, ayant suivi de 1946 à 1977 une cohorte de retraités d’une usine de produits anti-parasitaires à base d’arsenic de Baltimore, constatent 12 décès par cancer du poumon contre 3,6 attendus (p < 0,05).
Sobel, Bond et al., 1988 observent chez les travailleurs d’une usine de produits anti-parasitaires arsenicaux une augmentation significative des décès par cancers due à une augmentation de la localisation respiratoire. Mais aucune donnée n’a pu être fournie sur les niveaux d’exposition et sur l’exposition cumulative.
En 1991, Kusiak et al. ont publié les résultats du suivi d’une cohorte de travailleurs d’une mine d’or de l’Ontario et concluent que les effets de l’exposition à l’arsenic sont indépendants de ceux de l’exposition au radon (Kusiak, Springer et al., 1991). Une étude de cohorte menée sur des travailleurs d’une mine de cuivre, exposés pendant 50 ans, a mis en évidence une augmentation linéaire significative de l’excès de risque de cancer respiratoire lors de l’augmentation de la durée d’exposition à des poussières d’arsenic dans l’air ambiant et l’augmentation des niveaux d’exposition (Lubin, Pottern et al., 2000).
Un excès d'incidence du cancer du poumon ou de la mortalité due à cette forme, est rapporté dans un petit nombre d'études écologiques et dans une étude de mortalité de populations résidant près de sources ponctuelles d'émissions arsenicales (Blot and Fraumeni, 1975, Matanoski, Landau et al., 1976, Newman, Archer et al., 1976, Pershagen, Elinder et al., 1977, Matanoski, Landau et al., 1981, Cordier, Theriault et al., 1983, Arizona Departement of Health Services, 1990).
Toutefois, trois études cas-témoin ne retrouvent aucune association entre le taux de cancer et la proximité d'une source d'émission (Lyon, 1977, Rom, Varley et al., 1982, Frost, Harter et al., 1987).
Dans les mines, l’arsenic est inhalé sous forme particulaire : de grandes quantités de particules d’arsenic sont en effet retrouvées dans les poumons des mineurs ayant un cancer (Liu and Chen, 1996). La durée de l’exposition semble alors être le facteur prépondérant dans l’étiologie de ces cancers, par rapport à son intensité (Taylor, Qiao et al., 1989). Le développement de cancer des poumons chez les mineurs exposés aux poussières serait lié à la fois à l’irritation mécanique induite par ces poussières et à la toxicité intrinsèque de l’arsenic (Tapio and Grosche, 2006). Dans les fonderies de cuivre, l’arsenic n’est pas lié aux poussières et se trouve principalement sous forme de trioxyde d’arsenic. Les adénocarcinomes sont alors rencontrés en proportion plus importante que les carcinomes squameux : l’arsenic semble donc être à l’origine de différents mécanismes dans le développement des cancers du poumon, selon la voie l’exposition (Guo, Wang et al., 2004).
Toutefois, une étude très récente semble mettre en évidence que le risque de développer un cancer des poumons dépende plus de la dose absorbée que de sa voie d’absorption (Smith, Ercumen et al., 2009).
Autres cancers
Quelques études rapportent la survenue d’autres types de cancer (non respiratoire), potentiellement associés à l’inhalation d’iAs. Ainsi, Enterline, Day et al., 1995 ont mis en évidence une augmentation de la mortalité due aux cancers du gros intestin ou des os mais sans lien avec l’exposition cumulée en arsenic et sur un nombrer réduit de personnes. De même, des cancers de la peau sans présence de mélanome (Pesch, Ranft et al., 2002, Bencko, Franěk et al., 2005) ont été décrits mais sans association avec les niveaux d’exposition rencontrés. Il en est de même avec les cancers de l’estomac (Bulbulyan, Jourenkova et al., 1996), du colon (Wingren and Axelson, 1993), des sinus (Battista, Bartoli et al., 1996), du foie (Tsai, Chien et al., 1998) ou de la peau (Tsuruta, Hamada et al., 1998, Col, Col et al., 1999), mais sans aucune preuve de l’implication de l’arsenic inhalé dans l’étiologie de ces cancers.
Voie orale
Cancer de la peau
Des cancers de la peau associés à l’exposition à l’arsenic au cours de son usage médicinal, par ingestion d’eau contaminée, ou au cours d’expositions professionnelles sont signalés depuis plus de 50 ans (Hill and Faning, 1948, Zaldivar, 1974, Guo, Fujino et al., 2001, Beane Freeman, Dennis et al., 2004, Mitra, Mazumder et al., 2004). Les cancers cutanés induits par l’arsenic sont habituellement de type histologique épidermoïde ou basal, et surviennent dans des zones non exposées, y compris les paumes de mains et les pieds (Scotto, Fears et al., 1996).
L’hyperkératose de la paume des mains et de la plante des pieds, ainsi que la perturbation de la pigmentation du tronc, sont utilisées comme critères d’exposition à l’arsenic par l’eau de boisson. Les lésions cutanées induites par l’arsenic persistent et quelques-unes d’entre elles peuvent dégénérer en ulcérations et cancers cutanés (Liu, Zheng et al., 2002). Ainsi, la maladie de Bowen* est à l’origine de lésions cutanées précancéreuses qui évoluent, après 5 à 10 ans, en épithéliomas typiques, spinocellulaires et basocellulaires (Yu, Liao et al., 2006). Cette maladie est également rapportée dans l’étude de Rahman, Mandal et al., 2003.
L’exposition par l’eau de boisson est principalement associée à l’augmentation du risque de cancer cutané. Une relation a été bien établie entre la prévalence du cancer de la peau chez 40 421 individus vivant dans 37 villages à Taiwan et la concentration d'arsenic dans l'eau potable (jusqu'à 1 820 µg.L-1) (Tseng, Chu et al., 1968, Tseng, 1977). Pour une période de 10 ans, 528 individus sont décédés (47,7 %) dont 244 par cancers cutanés (Tseng, 1977). Parmi les 40 421 individus examinés, 428 ont été atteints de cancers cutanés et 370 de maladies des ‘pieds noirs’. Soixante et un patients présentaient à la fois des cancers cutanés et la maladie des ‘pieds noirs’ soit 1,5/1 000. Dans l’étude de 1977, il a été observé que la sévérité de la maladie des ‘pieds noirs' était directement liée à la durée d'exposition. Aucun cas de cancer de la peau ne s'est déclaré dans une autre population similaire (7 500 « témoins ») dont l'eau potable contenait 17 µg.L-1 d'arsenic (3 cas de cancer attendus) (Tseng, Chu et al., 1968, Tseng, 1977).
Une étude réalisée dans le Wisconsin a mis en évidence que les résidents exposés à de l’eau de boisson contenant des concentrations en arsenic supérieures à 1 µg.L-1 présentaient presque deux fois plus de risque de développer un cancer de la peau que ceux exposés à moins de 1 µg.L-1 (Knobeloch, Zierold et al., 2006). Les adultes exposés à plus de 10 µg.L-1 montrent les taux de cancer cutané les plus élevés.
*Maladie de Bowen : carcinome épidermique, favorisé par le soleil et l'arsenic. Elle peut toucher la peau mais aussi les muqueuses et se présente sous la forme d'une lésion brun rougeâtre arrondie ou arciforme bien limitée dont la surface est un peu surélevée et squameuse.
Principaux résultats de l’étude Knobeloch et al., 2006:
Hsueh, Cheng et al., 1995 ont étudié les relations entre l’exposition à l’arsenic dans trois villages taiwanais et le cancer de la peau. Sur 1 081 sujets examinés, 66 sont porteurs d’un cancer de la peau. La prévalence des cancers est après ajustement pour l’âge et le sexe, associée à tous les indicateurs retenus d’exposition à l’arsenic.
Cette augmentation de prévalence du cancer de la peau ou de la mortalité, associée à ce type de cancer, est notée dans la majorité des études épidémiologiques, portant sur des populations exposées à des concentrations élevées d'arsenic dans l'eau potable en Argentine (Bergoglio, 1964, Hopenhayn-Rich, Biggs et al., 1998), au Mexique (Cebrian, Albores et al., 1983), au Chili (Zaldivar, 1974, Zaldivar, 1977, Ferreccio, Psych et al., 1998, Smith, Goycolea et al., 1998, Ferreccio, Gonzalez et al., 2000) et en Angleterre (Philipp, Hughes et al., 1983). Dans un travail récent, Smith, Lingas et al., 2000 examinent une petite population de 44 sujets qui consomment une eau de puits contenant jusqu’à 800 µg.L-1 d’arsenic. Six cas de cancer cutané sont dénombrés. L’exposition à l’arsenic de ce village étant excessive depuis des centaines d’années, cette observation suggère l’absence d’adaptation de la population à ce risque. L’exposition prolongée à l’arsenic dans l’eau de boisson est généralement associée à l’augmentation du risque de cancer de la peau (épithéliomas spinocellulaires et basocellulaires) et non à celle des mélanomes malins (Guo, Yu et al., 2001). Mais une étude plus récente a mis en évidence le lien existant entre arsenic et mélanomes cutanés (Beane Freeman, Dennis et al., 2004). En effet, une relation linéaire a pu être mise en évidence entre les concentrations en arsenic retrouvées dans les ongles des personnes exposées (par l’eau de boisson et/ou sur leur lieu de travail) et l’augmentation du nombre de personnes atteintes de mélanomes cutanés.
Principaux résultats de l’étude de Beane Freeman et al., 2004 :
De tels résultats n’ont pas été observés chez des populations moins nombreuses exposées à l'arsenic dans l'eau potable aux États-Unis (Morton, Starr et al., 1976, Southwick, Western et al., 1983, Bates, Smith et al., 1995). L’exposition à de plus faibles doses d’arsenic et des effectifs de population plus petits expliquent probablement ces divergences et ne remettent pas en cause les corrélations observées dans les autres pays. De même, une étude belge a cherché à établir le lien entre la mortalité par cancer et par d’autres pathologies et l’exposition à l’arsenic sur une population du nord de la Belgique sur la période de 1981 à 1991 (Buchet and Lison, 1998). Dans cette zone, les concentrations en arsenic les plus élevées dans l’eau potable sont comprises entre 20 et 50 µg.L-1. Le niveau intermédiaire est inférieur à 20 µg.L-1 et les populations de référence sont exposées à des concentrations inférieures à 5 µg.L-1. Aucun lien entre les niveaux d’exposition et la mortalité par cancer du poumon, des reins et de la vessie n’a pu être établi.
Cancer de la vessie
L’exposition à de fortes concentrations en arsenic dans l’eau de boisson (> 600 µg.L-1) est à l’origine de l’augmentation de l’incidence de cancers de la vessie (Guo, Chiang et al., 1997, Kurttio, Pukkala et al., 1999, Chiou, Chiou et al., 2001, Chen, Su et al., 2003, Steinmaus, Yuan et al., 2003, Bates, Rey et al., 2004, Karagas, Tosteson et al., 2004, Lamm, Engel et al., 2004). Concernant les effets de faibles doses, les études disponibles présentent des résultats divergents. Steinmaus, Yuan et al., 2003 ne mettent en évidence aucune élévation du risque de cancer de la vessie pour les habitants de 7 états américains exposés à des concentrations en arsenic dans l’eau de boisson proches de 200 µg.j-1, excepté pour les fumeurs. Au contraire, Kurttio, Pukkala et al., 1999, Chiou, Chiou et al., 2001 et plus récemment Karagas, Tosteson et al., 2004 ont montré un lien entre l’exposition à de faibles doses d’arsenic (respectivement 0,5 et 10 µg.L-1) et l’augmentation de l’incidence des cancers de la vessie. Dans Chiou, Chiou et al., 2001, une relation linéaire significative est mise en évidence entre l’incidence des carcinomes transitionnels et les concentrations en arsenic comprises entre 10 et plus de 100 µg.L-1. Ces études mettent aussi en avant le rôle co-cancérigène de la fumée de cigarettes dans le développement de ces tumeurs.
Chen, Su et al., 2003 ont montré qu’une exposition cumulée à l’arsenic supérieure à 12 mg.L-1 par an est associée à une augmentation du risque de cancer de la vessie (odd ratio 4,23 ; 95 % IC 1,12-16,01), en présence d’une importante quantité de MMA détectée dans les urines. De plus, il apparaît que, en comparaison aux femmes, les hommes fumeurs et non-fumeurs présentent des risques accrus de ce type de cancer.
Les cancers de la vessie liés à l’arsenic sont des carcinomes transitionnels ou urothéliaux (Chiou et al., 2001) et des adénocarcinomes (Guo, Chiang et al., 1997).
Cancer des poumons
Dans les études épidémiologiques réalisées chez la population chilienne, exposée entre 1950 et 1996, le principal excès de mortalité due au cancer concerne les cancers de la vessie, suivis des cancers du poumon, le risque pouvant persister dans la région 20 à 30 ans après l’exposition (Ferreccio et Sancha, 2006). Ferreccio et al. (2000) ont mis en évidence une relation dose-effet entre l’exposition à l’arsenic dans l’eau de boisson et le risque de survenue de cancer des poumons (multiplication par 9 du risque lors de fortes expositions), tout en soulignant l’influence de la cigarette dans cette relation.
Principaux résultats de l’étude de Ferreccio et al. (2000) :
Une étude réalisée dans 138 villages de Taiwan, a permis de mettre en évidence une relation dose-effet entre l’exposition à l’arsenic par l’eau de boisson et les cas mortels de cancer des poumons (Guo, Wang et al., 2004). Ainsi, des niveaux supérieurs à 0,64 mg.L-1 sont associés à une augmentation significative de la mortalité due à ces cancers, non retrouvée à des doses plus faibles. De même, Lamm, Engel et al., 2006 mettent en évidence une relation dose-réponse positive entre l’exposition à l’arsenic dans l’eau de boisson et la mortalité par cancers des poumons et de la vessie, pour les villages présentant des niveaux moyens > 250 µg As.L-1.
Smith et al. (2006) ont mis en évidence une augmentation de la mortalité due au cancer des poumons chez les personnes exposées à des fortes concentrations en arsenic en Argentine (880 µg.L-1), dans l’eau de boisson, in utero ou pendant la petite enfance. Nakadaira, Endoh et al., 2002 suggèrent que même une exposition courte (< 5 ans) peut être suffisante pour être à l’origine du développement de cancers des poumons.
Les cancers des poumons observés présentent des types cellulaires spécifiques en fonction de la voie d’exposition impliquée (Guo, Wang et al., 2004). Ainsi, les carcinomes squameuxet les carcinomes à petites cellules apparaissent liés à l’ingestion d’arsenic, contrairement aux adénocarcinomes rencontrés plus souvent suite à son inhalation.
Arsenic et autres cancers
L’implication de l’arsenic dans les cancers des organes internes est avérée : l’exposition prolongée à l’arsenic augmente le risque de développer des cancers du foie, des reins, de l’estomac, de la prostate et du colon (Hopenhayn-Rich, Biggs et al., 1998, Lewis, Southwick et al., 1999, Tchounwou, Patlolla et al., 2003).
Une étude menée en Argentine dans la région de Cordoba (Hopenhayn-Rich, Biggs et al., 1998) met en évidence une relation dose-effet significative entre l’exposition à l’arsenic via l’eau de boisson et la mortalité par cancer des reins : les ratios de mortalité standardisés sont de 0,87-1,33-1,57 et 1-1,36-1,81 respectivement pour les hommes et les femmes exposés à de faibles, moyennes ou fortes (moyenne : 148 µg.L-1) concentrations en arsenic dans l’eau.
Dans le cas des cancers hépatiques, dont les angiosarcomes et les cancers primitifs, leur apparition est associée à l’exposition prolongée à l’arsenic par ingestion (Liu and Waalkes, 2008). Un angiosarcome hépatique a été observé chez des patients qui ingéraient des composés arsenicaux (arsénite contenu dans la liqueur de Fowler) pour des raisons médicales (Regelson, Kim et al., 1968, Lander, Stanley et al., 1975, Popper, Thomas et al., 1978, Falk, Caldwell et al., 1981, Roat, Wald et al., 1982). Dans une étude au Chili, Smith, Goycolea et al., 1998 constatent une association positive entre le cancer du foie et l’exposition à l’arsenic par l’eau de boisson, ce que Hopenhayn-Rich, Biggs et al., 1998 ne retrouve pas en Argentine.
Une augmentation modérée de mortalité par cancer de la prostate semble possible (Chen, Chuang et al., 1985, Lewis, Southwick et al., 1999). Les données disponibles les plus récentes indiquent que la prostate est une cible de la cancérogénicité de l’arsenic (Benbrahim-Tallaa and Waalkes, 2008). Ainsi, ces auteurs ont recensé plusieurs études épidémiologiques observant un lien entre les expositions environnementales à l’iAs et l’augmentation de l’incidence des cancers de la prostate, ainsi que des essais in vitro sur modèles cellulaires mettant en évidence la transformation maligne de cellules épithéliales de la prostate.
L’exposition à l’arsenic est associée statistiquement au cancer de la cavité buccale et du pharynx dans la cohorte de Tacoma (Enterline et al., 1995), mais pas dans celle d’Anaconda (Lubin et al., 1981) ou celle des travailleurs de l’industrie des pesticides (Sobel et al., 1988).
Synthèse
Par inhalation, les principaux cancers sont pulmonaires. Par voie orale, les cancers peuvent se développer au niveau de la peau, de la vessie et des poumons, mais aussi dans le foie, les reins, l’estomac, le colon ou la prostate.
Les principaux effets cancérigènes de l’iAs par voie orale et/ou inhalation sont synthétisés dans le tableau suivant :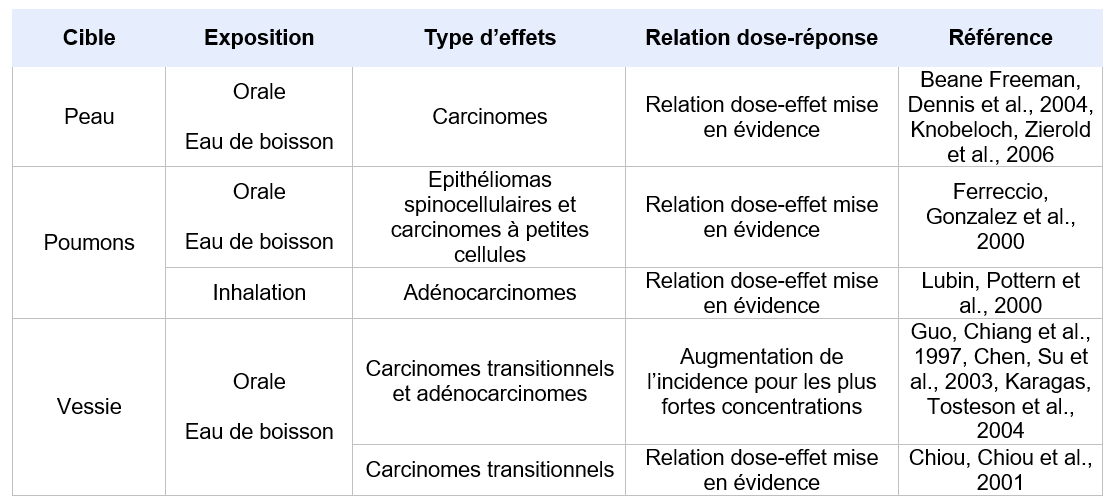
Mécanisme d’action cancérigène
Chez l’homme, la période de latence de la cancérogenèse liée à l’arsenic est comprise entre 30 et 50 ans.
Neuf modes d’actions différents de la cancérogenèse de l’arsenic ont pu être listés (Kitchin, 2001, Khairul, Wang et al., 2017) : induction d’aberrations chromosomiques, stress oxydatif, altération de la réparation de l’ADN, altération de la méthylation de l’ADN, altération des facteurs de croissance, stimulation de la prolifération cellulaire, promotion/progression, suppression p53 et amplification génique. Seuls 3 modes d’action (aberrations chromosomiques, stress oxydatif et altération des facteurs de croissance) ont été clairement reliés à la cancérogenèse de l’arsenic, à la fois dans les systèmes expérimentaux et les tissus humains (Yu, Liao et al., 2006). L’arsenic semble donc agir comme un co-cancérigène, un promoteur ou un agent de progression de la cancérogenèse.
Stress oxydatif
L’implication du stress oxydatif dans l’initiation d’atteintes hépatiques et dans le développement des cancers de la peau, par l’arsenic, est envisagée (De Vizcaya-Ruiz, Barbier et al., 2009).
La principale voie de métabolisation de l’arsenic, après ingestion, est sa méthylation en MMA et DMA, avant excrétion via l’urine (Tchounwou, Patlolla et al., 2003). Alors que dans le passé, les auteurs pensaient que cette voie métabolique détoxifiait l’arsenic, la communauté scientifique considère désormais que la méthylation de l’arsenic aggrave sa toxicité. Au cours des différentes étapes de méthylation, des espèces réactives de l’oxygène peuvent être générées. De par sa forte affinité pour le groupe sulfydryles des protéines, l’arsenic peut réagir avec le GSH, principal agent complexant des espèces réactives et radicalaires. Les cellules n’étant plus capables d’éliminer les radicaux libres formés, des dommages cellulaires, associés à la cancérogenèse de l’arsenic, apparaissent (Yu, Liao et al., 2006, McCarty, Chen et al., 2007). L’implication des formes méthylées trivalentes dans la cancérogénicité de l’arsenic est aussi envisagée depuis peu par Bredfeldt, Jagadish et al., 2006 : ces auteurs ont en effet mis en évidence la transformation maligne de cellules urothéliales humaines in vitro par ces formes méthylées.
La capacité des individus à méthyler l’arsenic est très variable et les études suggèrent que les personnes excrétant des proportions importantes d’arsenic sous sa forme MMA sont plus susceptibles que les autres de développer des cancers induits par l’arsenic (Steinmaus, Carrigan et al., 2005). Plusieurs facteurs comme la forme chimique de l’arsenic, les doses, la voie d’exposition ou le régime alimentaire semblent influencer la capacité de méthylation des individus (Abernathy, Marcus et al., 1989).
Chez l'animal
Inhalation
Aucune étude n’a été réalisée chez l’animal par voie respiratoire.
Voie orale
Par voie orale, la plupart des études n’ont mis en évidence aucune augmentation claire des cancers de la peau ou d’autres cancers, que cela soit chez le hamster, la souris ou le rat (Ishinishi, Yamamoto et al., 1983, Pershagen, Nordberg et al., 1984, Yamamoto, Hisanaga et al., 1987). Des macaques, exposés pendant 15 ans à de la nourriture contaminée par 0,1 mg.kg-1 d’arséniate de sodium, n’ont développé aucune tumeur (Thorgeirsson, Dalgard et al., 1994). Ng et al. (1998a, 1999 ) ont exposé deux souches différentes de souris à 500 µg As.L-1, pendant 26 mois. Chez les 2 souches, 41 et 26 % des souris ont développé des tumeurs principalement au niveau du tractus gastro-intestinal, des poumons et du foie. L’utilisation de modèle transgéniques ou transplacentaire montre la survenue de tumeurs (Hughes, Beck et al., 2011).
Synthèse
La plupart des études chez l’animal n’ont pas mis en évidence l’augmentation de l’incidence de tumeurs cancéreuses dans les modèles d’étude classiques.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé : Le pentoxyde d’arsenic, trioxyde d’arsenic, arsenic, l’arséniate de plomb, l’acide arsénique et ses sels | 2008 |
Chez l'homme
Toutes voies
Les données humaines disponibles indiquent que l’arsenic est clastogène par inhalation. Des travailleurs exposés dans une mine de cuivre en Suède présentent une augmentation significative de la fréquence d’aberrations chromosomiques dans les lymphocytes périphériques (Beckman, Beckman et al., 1977, Nordenson, Beckman et al., 1978). Plusieurs études humaines d’exposition à l’arsenic en milieu professionnel ou environnemental ont mis en évidence une association avec des lésions oxydatives non spécifiques à l’ADN (Basu, Som et al., 2005, Vuyyuri, Ishaq et al., 2006, Méndez‐Gómez, García‐Vargas et al., 2008, Pei, Ma et al., 2013), des lésions chromosomiques (échanges de chromatides sœurs dans les lymphocytes) (Paiva, Martínez et al., 2006) ou encore avec l’augmentation de la fréquence des micronoyaux (cellules exfoliées de l’épithélium buccal ou de cellules de l’épithélium des voies urinaires)(Martinez, Creus et al., 2005, Paiva, Martínez et al., 2008, Bartolotta, Pacskowski et al., 2011, Banerjee, Banerjee et al., 2013, Gamiño-Gutiérrez, González-Pérez et al., 2013) et la diminution de la réparation de l’ADN (Méndez‐Gómez, García‐Vargas et al., 2008).
Chez l'animal
Toutes voies
Les données animales disponibles confirment le caractère clastogène de l’arsenic par inhalation (IARC, 2012). Par voie orale, l’arsenic induit des aberrations chromosomiques, des échanges de chromatides sœurs et des micronoyaux dans des nombreux systèmes (lymphocytes ou cellules épithéliales, cellules de la moelle osseuse de souris et de rats) (Poddar, Mukherjee et al., 2000, Tian, Ma et al., 2001, McDorman, Collins et al., 2002, Mahata, Basu et al., 2003, Basu, Ghosh et al., 2004, Martinez, Creus et al., 2004).
In vitro
Organismes procaryotes
Concernant les organismes procaryotes, les études disponibles datent des années 1970 et 1980 et ne mettent en évidence aucune activité mutagène in vitro chez ces organismes, sans activation métabolique.
Organismes eucaryotes
Par contre, la plupart des systèmes eucaryotes testés in vitro montrent des effets sur les chromosomes (aberrations chromosomiques, échanges de chromatides sœurs, micronoyaux) dans les fibroblastes, les leucocytes ou les lymphocytes humains, les cellules de lymphomes de souris, les cellules ovariennes de hamster chinois (CHO cells) ou encore les cellules embryonnaires de hamster syrien (SHE cells) (Helleday, Nilsson et al., 2000, Kessel, Liu et al., 2002, Mure, Uddin et al., 2003).
L’étude de Klein met en évidence sur une lignée transgénique l’apparition d’effets clastogènes de l’arsenic (III) ou de MMA à des niveaux de concentrations hautement cytotoxiques (Klein, Leszczynska et al., 2007). Aucun effet mutagène n’est observé avec le DMA.
Le mécanisme génotoxique impliqué n’est pas connu mais semble non direct, lié à la capacité de l’arsenic à perturber l’apoptose (Pi, He et al., 2005), à inhiber la réplication de l’ADN ou les enzymes de réparation, ou à sa capacité à se comporter comme un analogue du phosphore (Tchounwou, Patlolla et al., 2003).
C’est dans ce contexte que l’US EPA initie actuellement de nouvelles recherches concernant le mécanisme cancérigène de l’arsenic ; le mécanisme d’action génotoxique indirect laissant penser à l’existence d’un seuil pour les effets cancérigènes induits par l’arsenic (Cohen, Chowdhury et al., 2016, Zhou and Xi, 2018). De fait, les modèles classiquement utilisés par l’US EPA pour évaluer le risque cancérigène ne seraient pas adaptés au cas de l’arsenic. Cet organisme réfléchit donc à la mise au point d’un nouveau modèle intégrant le mode d’action cancérigène spécifique de l’arsenic. En effet, dans leur optique, l’approche linéaire habituellement utilisée pour déterminer les excès de risques unitaires ne serait plus pertinente pour les faibles doses (Zhao, Kenyon et al., 2007).
Dans l'état actuel des connaissances, l’HAS recommande pour l’évaluation des dangers de l’iAs et des risques associés à l’exposition à ses dérivés par voie orale, de considérer que ses effets cancérogènes sont sans seuil (HAS, 2020). En l’absence de données suffisantes et par prudence, l’Ineris retient une approche sans seuil concernant les effets cancérogènes de l’iAs.
Synthèse
Les effets clastogènes de l’arsenic ont été observés dans les études réalisées chez l’homme, chez l’animal ou à partir de tests in vitro. Le mécanisme d’action cancérigène de l’arsenic étant controversé, il est conseillé pour l’instant de retenir par précaution une approche sans seuil pour les effets cancérigènes induits par l’arsenic.
Effets sur la reproduction
Chez l'homme
Toutes voies
Aucune donnée sur la fertilité féminine n’a été identifiée.
Concernant la fertilité des hommes, une étude transversale chinoise a montré une augmentation du risque d’oligospermie chez les hommes dont la concentration urinaire de DMA était supérieure à 20,9 µg.g-1 créatinine (OR : 7,2 ; IC 95 % : 1,4-37,1) (Xu, Bao et al., 2012).
Dans une étude cas-témoin indienne, les concentrations d’arsenic dans l’eau consommée et dans le sperme étaient significativement plus élevées chez les 68 individus oligo- ou azoospermiques que chez les 32 témoins (Sengupta, Deb et al., 2013).
Dans une étude cas-témoins (101/61) chinoise, les concentrations urinaires d’iAs, de MMA et de DMA, ainsi que le rapport As pentavavalent/As trivalent étaient significativement plus élevés et le rapport MMA/As significativement plus faible chez les hommes infertiles que chez les témoins ; dans cette étude, la moyenne géométrique de la concentration urinaire de la somme (As + MMA + DMA) était de 9,5 ± 102,1 µg.g-1 créatinine chez les témoins et 50,7 ± 294,5 µg.g-1 créatinine, chez les cas (Wang, Zhang et al., 2016).
Une étude japonaise n’a pas montré de corrélation entre les différents paramètres de la qualité du sperme (volume des éjaculats, compte des spermatozoïdes, mobilité des spermatozoïdes) et les concentrations urinaires d’iAs (III, V) de MMA, de DMA ou l’index de méthylation primaire (MMA/As) ; dans cette étude, les moyennes géométriques de la concentration urinaire de la somme (As + MMA) et de celle de DMA étaient respectivement de 2,5 ± 1,30 mg.g-1 créatinine et 20,6 ± 14,1 mg.g-1créatinine (Oguri, Yoshinaga et al., 2016).
Synthèse
Chez l’homme, l’altération spermatique en lien avec la consommation d’arsenic dans l’eau de boisson et/ou de métabolites urinaires est évoquée dans plusieurs études, et demande à être confirmée. Aucune donnée sur la fertilité féminine n’a été identifiée.
Chez l'animal
Inhalation
Chez le rat, par inhalation, à des concentrations comprises entre 0,08 et 20 mg As2O3.m-3 de 6 heures par jour pendant les 14 jours précédant l’accouplement jusqu’au 19e jour de la gestation, aucune modification de la période de l’accouplement, de l’indice d’accouplement ou de l’indice de fertilité n'est retrouvée. Ce qui permet de définir une concentration n’induisant pas d’effet à 20 mg As.m-3 pour la reproduction chez la femelle. Holson, Stump et al., 1999 ont étudié ces effets chez des rates et n’ont mis en évidence aucune modification des indices d’accouplement ou de fertilité, pour des doses supérieures à 0,08 mg As.m-3.
Voie orale
Une étude sur trois générations de souris, exposées à l’arsénite de sodium dans l’eau de boisson à la dose moyenne de 1 mg As.kg-1.j-1, ne montre pas d’effet significatif sur les paramètres de la reproduction. Seules une légère diminution du nombre de nouveau-nés et une légère modification du sex-ratio sont rapportées (Schroeder and Mitchener, 1971).
L’administration orale d’arsénite (AsIII) à des souris ou des rats mâles a entraîné une diminution du poids des testicules, de la concentration des spermatozoïdes dans le sperme et de leur motilité, ainsi que de la concentration plasmatique de testostérone (Zubair, Ahmad et al., 2017).
Dans plusieurs études, une diminution des concentrations plasmatiques de FSH et de LH a également été observée, ce qui indique une origine au moins partiellement centrale de l’atteinte testiculaire (HAS, 2020).
Synthèse
Chez l’animal, l’atteinte testiculaire (poids) et spermatique chez les mâles (rat/souris), associée à une altération des concentrations hormonales de testostérone, de FSH et de LH, est sans conséquence sur leur capacité de reproduction et ne peut donc pas être considéré comme un effet critique. Par ailleurs, l’iAs ne semble pas avoir d’effet sur la fertilité des femelles.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Arséniate de plomb : Catégorie 1A : substances dont la capacité d’induire des mutations héréditaires dans les cellules germinales des êtres humains est avérée.Arséniate de plomb : Catégorie 2 : substances préoccupantes du fait qu’elles pourraient induire des mutations héréditaires dans les cellules germinales des êtres humains.Pentaoxyde de diarsenic : Non classée : substances dont les données ne conduisent pas à une classificationtrioxyde d’arsenic : Non classéel’acide arsénique et ses sels :Non classéeArsenic : Non classée | 1998 |
Chez l'homme
Inhalation
Par inhalation, des études épidémiologiques ont été réalisées chez des salariées suédoises, exposées professionnellement, à l’arsenic sous forme inorganique, et notamment pendant leur grossesse. Il a été montré que les enfants nés de ces femmes présentaient un taux de malformations supérieur à celui attendu (Nordstrom et al., 1979b) et un poids de naissance légèrement diminué (Nordstrom, Beckman et al., 1979a). De plus, les poids de naissance mesurés chez les nouveaux-nés defemmes vivant à proximité de l’industrie étaient également diminués. Cependant, ces résultats ne sont pas corrélés avec ceux de l’exposition à l’arsenic.
Une étude cas-témoin réalisée chez les populations voisines d’une industrie de pesticides au Texas et exposées par inhalation à l’arsenic a montré une augmentation statistiquement significative du nombre de mort-nés lors de l’exposition aux concentrations les plus fortes, supérieures à 100 ng As.m-3 (Ihrig, Shalat et al., 1998), ce qui permet de définir une NOAEC de 5,5.10-5 mg.m-3. Malheureusement, cette étude présente des biais qui la rendent difficilement exploitable. Les résultats de ces études sont le plus souvent le fruit d’une co-exposition et aucune conclusion ne peut être retenue.
Voie orale
L’exposition chronique à l’arsenic dans l’eau de boisson a été associée à une augmentation de l’incidence des avortement spontanés, de morts fœtales tardives, de prématurité et de faible poids des nouveaux nés au Bangladesh, en Inde, et à Taiwan (Ahmad, Sayed et al., 2001, Chakraborti, Mukherjee et al., 2003, Yang, Chang et al., 2003, Chakraborti, Sengupta et al., 2004, Von Ehrenstein, Guha Mazumder et al., 2006), bien qu’aucune relation dose-effet n’ait été observée dans ces études. Toutefois, une méta-analyse de six études (Aschengrau, Zierler et al., 1989, Ahmad, Sayed et al., 2001, Guo, Fujino et al., 2003, Milton, Smith et al., 2005, Von Ehrenstein, Guha Mazumder et al., 2006, Rahman, Persson et al., 2010) montre un excès de risque significatif d’avortements et de morts in utero en cas de consommation d’une eau contenant au moins 50 µg.L-1 d’arsenic avec des OR respectifs de 2,02 ; IC 95 % (1,40-2,91) et 1,84 ; IC 95 % : (1,38-2,45) (Quansah, Armah et al., 2015).
Une autre étude met en évidence la forte relation existant entre l’exposition à des fortes doses d’arsenic dans l’eau de boisson et l’augmentation des mortalités fœtales tardives, néonatales et post-néonatales (Hopenhayn, Bush et al., 2006), confirmant les précédentes observations faites au Chili (Hopenhayn-Rich, Browning et al., 2000) et au Bangladesh (Ahamed, Sengupta et al., 2006 ; Milton, Smith et al., 2005). L’étude épidémiologique, réalisée sur la population d’une région du Chili depuis 50 ans (Hopenhayn, Bush et al., 2006), a montré que les plus fortes mortalités surviennent lorsque que les concentrations en arsenic dans l’eau sont les plus fortes, comprises entre 110 et 860 µg.L-1. La diminution de ces teneurs a conduit à une régression de la mortalité « infantile ».
Une diminution significative du poids moyen des nouveaux nés, dont les mères avaient été exposées à de l’eau de boisson contenant 40 µg.L-1 d’arsenic, a été mise en évidence au Chili (Hopenhayn-Rich, Ferreccio et al., 2003) et à Taïwan (Yang, Chang et al., 2003). De même, une étude de cohorte menée au Bangladesh (Rahman, Vahter et al., 2007) met en évidence une relation dose-effet entre l’exposition à des concentrations en arsenic supérieures à 50 µg.L-1 dans l’eau de boisson et le risque accru de mortalité infantile. Néanmoins, cette relation n’a pas été mise en évidence par Von Ehrenstein, Guha Mazumder et al., 2006 chez des femmes indiennes exposées à plus de 100 µg.L-1. Dans une méta-analyse incluant la plupart de ces études (Chili, Taïwan et Bangladesh), il existait une corrélation inverse entre le poids de naissance et la concentration d’arsenic dans l’eau consommée pendant la grossesse, avec une perte de poids des bébés de 53,2 g par µg.L-1 d’arsenic d’eau consommée par les mères (Quansah, Armah et al., 2015). Les données disponibles ne permettent ni de démontrer un effet sans seuil, ni d’identifier un seuil en-deçà duquel l’effet de l’exposition prénatale à l’arsenic sur le poids de naissance ne serait plus détectable (Bloom, Surdu et al., 2014). Des observations similaires ont été menées aux Etats Unis (Davis, Higgins et al., 2015, Gilbert-Diamond, Emond et al., 2016). Ces effets pouvant être associés à une diminution du périmètre crânien (Henn, Ettinger et al., 2016).
Aucune augmentation du risque de défaut de fermeture du tube neural n’a été identifiée pour des concentrations dans l’eau supérieures à 10 µg.L-1 au Mexique (Brender, Suarez et al., 2006) ou encore dans le cadre d’une étude cas-témoin chinoise, en lien avec une concentration placentaire élevée (> médiane) d’arsenic (Jin, Zhang et al., 2013). En revanche, une autre étude cas-témoin hongroise (9 734 cas vs 5 880 témoins) a montré un excès de risque statistiquement significatif de malformation cardiaque, associé à la consommation d’une eau contenant plus de 10 µg.L-1 pendant la grossesse (OR : 1,41 ; IC 95 % : 1,28-1,56) ; les malformations spécifiques pour lesquelles il existait un excès de risque statistiquement significatif était le défaut de fermeture du canal artériel (OR : 1,81 ; IC 95 % : 1,54-2,11) et les communications interauriculaires (OR : 1,75 ; IC 95 % : 1,54-2,11) (Rudnai, Sándor et al., 2014).
D’autres études semblent mettre en évidence une association entre l’exposition à l’arsenic et le déficit intellectuel des enfants. Ainsi, Wasserman, Liu et al., 2004 ont évalué les fonctions intellectuelles de 201 enfants de 10 ans, dont les parents faisaient partie d’une large cohorte étudiée au Bangladesh (12 000 individus). Une relation-dose réponse inverse a été mise en évidence entre l’exposition à l’arsenic dans l’eau de boisson et les performances intellectuelles évaluées par les auteurs, et ce dès 50 µg.L-1 d’arsenic. von Ehrenstein, Poddar et al., 2007 ont observé une diminution entre 12 et 21 % de ces performances (vocabulaire, associations d’images).
Des difficultés à maintenir l’attention, une altération de la mémoire et une diminution du QI ont aussi été observées chez des enfants exposés via l’eau de boisson (étude transversale de Tsai réalisée à partir de quatre tests neurocomportementaux sur 49 jeunes scolarisés exposés et 60 témoins appariés) (Tsai, Chou et al., 2003, Wang, Wang et al., 2007). La mémoire et l’attention sont altérées lors d’expositions chroniques cumulées à l’arsenic après ajustement en fonction de l’âge et du sexe pour des niveau d’exposition de 250 à 629 ppm. Néanmoins, d’autres études également réalisées au Bangladesh se sont révélées négatives (Tofail, Vahter et al., 2009, Hamadani, Grantham-McGregor et al., 2010). Une revue des effets sur le neurodéveloppement lors d’exposition à de faibles niveaux d’exposition montre que l’étude d’Hamadani, Tofail et al., 2011 qui met en évidence une possible association inverse entre les fonctions cognitives, sur la base du score brut au test verbal à l’âge de 5-11 ans, et l’exposition à l’arsenic urinaire et sanguin est celle qui apporte la meilleure relation quantitative parmi les études menées au Bangladesh (Tsuji, Van Kerkhove et al., 2005). Dans cette analyse, il est précisé que la mise au regard de ces éléments avec les données des Etats Unis conduirait à proposer une dose de référence entre 0,4 et 1 µg.kg-1.j-1.
Une étude semble montrer une immunosuppression chez des enfants exposés in utero, à l’origine d’un développement incomplet du thymus (Raqib, Ahmed et al., 2009).
Plusieurs études de cohorte ont montré un excès de risque d’infections respiratoires et/ou digestives pendant la première année de vie, associé à l’exposition prénatale à l’arsenic, du fait de la consommation par la mère d’une eau contenant une concentration élevée d’arsenic. Dans l’étude de Rahman, Vahter et al., 2011 incluant 1 522 paires mère-enfant, le risque relatif d’infections respiratoires était significativement augmenté dès que la concentration urinaire maternelle d’arsenic dépassait 39 µg.L-1 (Rahman, Vahter et al., 2011). Dans la même étude, le risque de diarrhée pendant la première année de vie n’était significativement augmenté que lorsque la concentration urinaire d’arsenic dépassait 133 µg.L-1 (HAS, 2020).
Synthèse
Des avortements spontanés, de la mortalité fœtale et infantile tardive et des faibles poids de naissance ont été mis en évidence, pour des doses très faibles. De même, des effets sur le développement intellectuel sont observés, ou encore sur le risque d’infections respiratoires chez le très jeune enfant.
Chez l'animal
Inhalation
Dans le cadre d’une étude par inhalation chez la souris (expositions aux dérivés inorganiques de l’arsenic du 9e au 12e jour de la gestation à 0 - 0,2 - 2,2 et 21,6 mg As.m-3 (sous la forme d’As2O3) une augmentation des malformations du squelette et des morts fœtales a été observée à partir de 2,2 mg As.m-3, bien que statistiquement significative qu’à la concentration la plus élevée (Nagymajtenyi, Selypes et al., 1985). La toxicité maternelle n’a pas été examinée. La diminution moyenne du poids des fœtus est de 9,9 % pour les souris exposées à 2,2 mg.m-3 d’arsenic et de 3,7 % pour les souris exposées à 0,26 mg.m-3. Cette diminution du poids des fœtus est statistiquement significative.
Chez le rat, aucune augmentation de la résorption fœtale, de la mortalité fœtale, des malformations ni de diminution du poids de naissance ne sont rapportées pour des expositions pendant 14 jours avant la période d’accouplement puis la gestation (19e jour) à des concentrations comprises entre 0,2 et 8 mg As.m-3. La toxicité maternelle n’a pas été examinée. Cette étude a permis de définir une NOAEC de 7,6 mg As.m-3 pour le développement et une LOAEC de 20 mg As.m-3 (Holson, Stump et al., 1999).
Voie orale
Les études, pratiquées chez l’animal, ont montré des effets fœtotoxiques ou faiblement tératogènes des dérivés inorganiques de l’arsenic, lors d’expositions réalisées par ingestion. Des souris exposées pendant la gestation, à des doses de 23-68 mg As.kg-1.j-1 d’arséniate de sodium, présentent une légère augmentation de l’incidence des malformations fœtales, principalement des malformations du squelette (Hood, Thacker et al., 1978, Baxley, Hood et al., 1981). Il n’y a pas d’effet tératogène observé chez les hamsters exposés, par voie orale, aux dérivés inorganiques de l’arsenic à la dose de 14 mg As.kg-1.j-1 sous la forme d’arsénite de sodium (Hood and Harrison, 1982). En revanche, il y a une augmentation de l’incidence de la mortalité fœtale, certainement secondaire à la forte toxicité maternelle (Baxley, Hood et al., 1981, Hood and Harrison, 1982). Plusieurs études, réalisées chez le rat, la souris ou le lapin, par ingestion d’iAs, montrent que l’iAs n’induit pas d’effets toxiques altérant le développement du fœtus, pour des expositions de l’ordre de 4 à 12 mg As.kg-1.j-1. Cependant, des atteintes sont observées aux doses pour lesquelles une toxicité maternelle est rapportée (Nemec, Holson et al., 1998, Stump, Holson et al., 1999, Holson, Stump et al., 2000t).
Il a été clairement montré que les arsénites et les arséniates passent la barrière placentaire et s’avèrent cancérigènes pour la descendance (Waalkes, Ward et al., 2003, Waalkes, Liu et al., 2004, Waalkes, Liu et al., 2004, Waalkes, Ward et al., 2004, Ahlborn, Nelson et al., 2009, Tokar, Diwan et al., 2011, Waalkes, Qu et al., 2014), probablement en liaison avec une perturbation des signaux œstrogéniques (Waalkes, Liu et al., 2006, Waalkes, Liu et al., 2006). L’arséniate de sodium et l’arsénite ont des effets embryo-létaux et un potentiel tératogène chez certaines espèces animales. Plusieurs études montrent différents effets tératogènes sur le neurodéveloppement (Martinez, Kolb et al., 2008, Goggin, Labrecque et al., 2012, Allan, Hafez et al., 2015, Tyler, Hafez et al., 2015), le métabolime (Ditzel, Li et al., 2016), la fontion pulmonaire (Ramsey, Bosco et al., 2013, Ramsey, Foong et al., 2013, Ramsey, Larcombe et al., 2013), ou de reproduction (Rodriguez, Ungewitter et al., 2016).
Synthèse
Chez l’animal, des effets sur le développement sont principalement mis évidence par inhalation, avec des pertes post-implantatoires et une diminution du nombre de fœtus viables.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Etudes sources pour les VTR
Voie orale - effets à seuil
Pour une exposition aiguë par voie orale, l’ATSDR (2007) propose une VTR à partir de l’étude de Mizuta et al. (1956).
Pour des expositions chroniques, plusieurs études sont retenues selon les organismes :
l’ATSDR : Tseng et al. (1968) ; Tseng (1977),
l’US EPA : Grau-Perez et al. (2017) ; James et al. (2013) ; Pan et al. (2013b) ; Coronado-González et al. (2007) ; Wu et al. (2010) ; Moon et al. (2013) ; James et al. (2015) ; Chen et al. (2013) ; Wade et al. (2015),
l’OEHHA : Tsai et al. (2003a) ; Wasserman et al. (2004),
le RIVM : FAO / OMS (1983 ; 1988),
le FoBiG : Ahsan et al. (2006),
l’Ineris : Rahman et al. (2006),
l’Efsa :Gilbert-Diamond et al. (2013),
l’HAS : Xia et al. (2009).
Ahsan et al. (2006)
Type d’étude : épidémiologique transversale basée sur les données de base (i.e à l’inclusion) d’une cohorte constituée entre 2000 et 2002
Lieu : région Araihazar, Bangladesh
Nombre de personnes étudiées : 11 746 individus adultes (18 à 75 ans)
Voie d’exposition : voie orale via l’eau de boisson provenant de puits.
Niveaux d’exposition / formes chimiques : Trois mesures de l’As dans l’eau sont calculées pour chaque participant : la concentration en As (pondérée sur le temps d’utilisation de chaque puit), l’index cumulatif des puits et l’arsenic urinaire ajusté sur la créatinine.
Pour la première mesure, 5 groupes sont retenus : < 8,1 ;8,1-40,0 ; 40,1-91,0 ; 91,1-175,0 ; 175,1-864,0 µg.L-1 d’As dans l’eau de boisson
Groupe témoin : individus exposés à de l’eau de boisson contenant < 8,1 µg.L-1
Symptômes observés : existence de lésions cutanées précancéreuses
Méthode développée dans l’étude : Le recrutement des participants a été mené sur une même région et chacun a suivi une visite médicale. Plusieurs modèles dont le modèle de régression logistique inconditionnelle sont utilisés pour estimer les odds ratios (OR) associés à l’existence des lésions de la peau.
Résultats de l’étude : Les OR pour les lésions cutanées sont de 1,91 (IC 95 % : 1,26-2,89), 3,03 (IC 95 % : 2,05-4,50), 3,71 (IC 95 % : 2,53 – 5,44) et 5,39 (IC 95 % : 3,69-7,86), respectivement pour des niveaux d’exposition compris entre 8,1-40,0 ; 40,1-91,0 ; 91,1-175,0 et 175,1-864,0 µg.L-1 d’As dans l’eau de boisson par comparaison avec le groupe exposé à < 8,1 µg.L-1. Les effets semblent influencés par le genre, l’âge et l’indice de masse corporel.
Qualité de l’étude : 2
FAO/OMS (1983, 1988)
Type d’étude : Les deux rapports du comité FAO / OMS de 1983 et 1988 font une revue de la littérature en mettant en avant les effets induits par l’As et les concentrations qui sont à l’origine des symptômes chez l’homme. Cet état de l’art a permis ensuite à ce comité d’établir une dose journalière tolérable (DJT). Le rapport de 1988 est moins détaillé et fait souvent référence à celui de 1983.
Résumé du rapport de 1983 : Le rapport du comité FAO / OMS de 1983 présente rapidement les études épidémiologiques montrant chez l’homme un lien entre l’ingestion d’As dans l’eau de boisson et des troubles toxicologiques.
Le rapport cite les études de Tseng (Tseng et al., 1968 ; Tseng, 1977), mais également les études de Grantham et Jones, 1977, Cebrian et al., 1983, Bergoglio, 1964, Zaldivar et al., 1981, Zaldivar et Guillier, 1977 et de Borgono et al., 1977. Ces études traitent aussi bien des cancers de la peau (Tseng et al., 1968 ; Tseng, 1977), du tube digestif, du tractus respiratoire (Arguello et al., 1938 ; Bergoglio, 1964), que des effets non cancérogènes (hyperkératose, toux, syndrome de Raynaud, diarrhée, pigmentation anormale de la peau) (Bergoglio, 1964 ; Borgono et al., 1977 ; Tseng et al., 1968 ; Tseng, 1977).
Après un examen des différentes doses d’As pouvant induire des symptômes, le comité FAO / OMS a admis, sans indiquer si des études particulières ont été retenues parmi celles décrites ci-dessus, que des symptômes spécifiquement liés à l’As apparaissaient généralement pour une concentration supérieure à 1 mg d’As présent dans 1 L d’eau. De plus, il précise qu’à une concentration de 0,1 mg.L-1, une toxicité liée à la présence d’As pouvait être soupçonnée. La spéciation de l’As présent dans l’eau n’est pas toujours bien identifiée dans les études, mais il semblerait que cet As soit majoritairement inorganique.
En admettant que la consommation d’eau moyenne soit de 1,5 L.j-1 chez l’homme, le comité FAO / OMS a admis que l’As pouvait être toxique à partir de 0,15 mg par jour, valeur calculée à partir de la concentration toxique d’As dans l’eau de boisson de 0,1 mg.L-1. Le comité FAO / OMS ne prend pas en compte le taux d’As apporté par la nourriture car selon lui la teneur d’As apportée par la nourriture est négligeable par rapport à celle apportée par l’eau de boisson. En admettant que le poids moyen d’un homme est de 70 kg, une DJT provisoire de 2,1.10-3 mg.kg-1.j-1 est alors proposée pour l'As. Enfin, le comité FAO / OMS a indiqué que l’exposition à des concentrations inférieures à celles induisant des effets non cancérogènes, n’induisait pas de risque cancérogène.
Mizuta et al. (1956)
Type d’étude : étude épidémiologique descriptive
Lieu : Japon
Nombre de personnes étudiées : 220 cas d’empoisonnement (intoxication aiguë)
Voie d’exposition : alimentaire via une sauce de soja contaminée à 100 mg As.L-1
Niveaux d’exposition / formes chimiques : concentration d’exposition estimée de 3 mg.j-1 pendant 2-3 semaines soit 0,05 mg.kg-1.j-1 pour un individu asiatique moyen de 55 kg, sous forme d’arséniate de calcium
Groupe témoin : Pas de groupe témoin.
Symptômes observés : symptômes d’intoxication, 70 patients avec examens ophtalmologiques ; examens sanguins, urinaires et fécaux, électrocardiogramme et biopsies hépatiques pour certains.
Résultat de l’étude : Les premiers symptômes sont un œdème de la face, ainsi que des symptômes gastro-intestinaux et des voies respiratoires supérieures suivis chez quelques patients de lésions cutanées et d’une neuropathie. Les autres effets observés sont une anémie modérée, avec leucopénie, une dégénérescence modérée hépatique avec dysfonctionnement hépatique, des lésions oculaires et des électrocardiogrammes anormaux.
Dose critique : LOAEL de 0,05 mg As.kg-1.j-1. Les effets critiques retenus pour une exposition aiguë sont l’œdème facial et les symptômes gastro-intestinaux (nausées, vomissements et diarrhée).
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l'évaluation.
Rahman et al. (2006)
Type d’étude : étude cas-témoins.
Lieu : Matlab, Bangladesh (18386 ha).
Nombre de personnes étudiées : Toutes les personnes âgées de plus de 4 ans, ayant vécu et bu de l’eau dans la région depuis au moins 6 mois sont incluses dans l’étude, soit 166 934 individus. Cinq cent quatre personnes ont été identifiées comme présentant des lésions cutanées liées à l’As (après entretien, détermination de la consommation en eau, examen des lésions par des médecins puis par des dermatologues). L’âge, le sexe, l’éducation et le niveau d’habitation ont été pris en compte comme facteurs pouvant influencer l’exposition à l’As.
Voie d’exposition : eau de boisson.
Durée d’exposition : au moins 6 mois, depuis 1970.
Niveau d’exposition : < 10, 10-49, 50-149, 150-299, >299 µg.L-1 ; pour chaque individu, l’exposition historique cumulée et l’exposition moyenne en As ont été calculées.
Groupe témoin : 1 830 individus (individus âgés de plus de 4 ans, résidents de la région concernée, sélectionnés aléatoirement au sein de la base de données du Système de Surveillance de la Démographie et de la Santé)
Symptômes observés : lésions cutanées liées à l’As (hyperpigmentation, hypopigmentation, kératose).
Méthode développée dans l’étude : Une régression logistique multivariée a été utilisée afin d’estimer les OR pour les lésions cutanées en fonction des différentes concentrations d’exposition en As. Les facteurs pouvant influencer la régression multivariée de plus de 5 % ont été inclus dans le modèle (âge, sexe, éducation et niveau d’habitation).
Résultats : Pour chaque sexe, une relation dose-réponse significative entre l’exposition moyenne ou cumulée en As et le risque de développer des lésions cutanées a été mise en évidence, la catégorie la plus faible d’exposition étant utilisée comme témoin. Les hommes présentent un risque accru en comparaison aux femmes.
Odds ratios pour les lésions cutanées, chez les hommes et les femmes, en fonction des concentrations moyennes en As (µg.L-1) dans l’eau de boisson (Rahman et al., 2006).
Sexe | Exposition (µg.L-1) | Nombre de cas (%) | Référents (%) | Odd ratio non ajustés (95 % IC) | Odd ratio ajustés (95 % IC) |
HOMMES | < 10 | 13 (4,8 %) | 103 (12,4 %) | 1 | 1 |
HOMMES | 10-49 | 38 (14 %) | 120 (14,4 %) | 2,51 (1,27-4,97) | 3,25 (1,43-7,38) |
HOMMES | 50-149 | 59 (21,7 %) | 264 (31,7 %) | 1,77 (0,93-3,37) | 2,28 (1,04-4,98) |
HOMMES | 149-299 | 110 (40,4 %) | 251 (30,1 %) | 3,47 (1,87-6,45) | 5,41 (2,52-1,62) |
HOMMES | ³ 300 | 52 (19,1 %) | 95 (11,4%) | 4,34 (2,22-8,46) | 9,56 (4,20-21,8) |
FEMMES | < 10 | 12 (5,2 %) | 127 (12,7 %) | 1 | 1 |
FEMMES | 10-49 | 15 (6,5 %) | 141 (14,1 %) | 1,13 (0,51-2,5) | 1,66 (0,65-4,24) |
FEMMES | 50-149 | 65 (28,2 %) | 287 (28,8 %) | 2,4 (1,25-4,59) | 3,06 (1,39-6,74) |
FEMMES | 149-299 | 84 (36,2 %) | 300 (30,1 %) | 2,96 (1,56-5,62) | 4,08 (1,86-8,93) |
FEMMES | ³ 300 | 56 (24,1 %) | 142 (14,2 %) | 4,17 (2,14-8,14) | 6,88 (3,06-15,5) |
Aussi bien pour les hommes que pour les femmes, les odds ratios ajustés montrent une augmentation significative du risque pour des concentrations en As dans l’eau comprises entre 10 et 49 µg.L-1. Le LOAEL, déterminé à partir de ces résultats, est donc de 10 µg.L-1. Par extrapolation, le NOAEL étant strictement inférieur à 10 µg.L-1, pourrait être fixé à 9 µg.L-1, puisque le groupe exposé à une concentration inférieure à 10 µg.L-1 ne présente pas d’augmentation significative des symptômes.
NOAEL lésions cutanées = 9 µg.L-1 soit 0,7 µg.kg-1.j-1*
* hypothèses de calcul : poids moyen des habitants 50 kg, consommation moyenne d’eau 4 L.j-1 (Rahman et al., 2003)
Qualité de l’étude : 2, bonne qualité scientifique même si la population étudiée est jeune. Le tabagisme éventuel n’a pas été pris en compte.
Tsai et al. (2003a)
Type d’étude : étude transversale
Lieu : région nord de Taïwan
Nombre de personnes étudiées : 49 jeunes scolarisés
Voie d’exposition : orale via l’eau de boisson
Niveaux d’exposition / formes chimiques : niveau d’exposition élevé (250 629 ppm) et faible (13 782 ppm)
Groupe témoin : 60 jeunes appariés sur l’âge, le sexe, le niveau d’éducation, le poids, la taille, l’ indice de masse corporel et le statut socio-économique
Symptômes observés : effets neurocomportementaux
Méthode développée dans l’étude : Quatre tests neurocomportementaux comprenant un test de performance continue, un test du doigt, des tests de mémoire et un test d’attention ont été pratiqués et comparés selon le groupe d’exposition au moyen d’une régression linéaire multiple.
Résultats de l’étude : La mémoire et l’attention sont altérées lors d’expositions chroniques cumulées à l’As après ajustement en fonction de l’âge et du sexe.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Tseng et al. (1968) ; Tseng (1977)
Ces 2 études sont similaires. L’étude de 1977 apporte quelques informations supplémentaires, par rapport à celle de 1968, qui seront détaillées ci-après.
Type des 2 études : cas-témoins.
Lieu : côte sud-ouest de Taiwan.
Nombre de personnes exposées : 40 421 paysans (19 269 hommes et 21 152 femmes) provenant de 37 villages différents. La pyramide d’âge de la population examinée dans cette étude est en faveur des jeunes.
Pyramide de population pour la population de l’étude de Tseng et al. (1968) et Tseng (1977)
Population | Homme (%) | Femme (%) |
moins de 10 ans | 38 | 32 |
entre 10 et 20 ans | 22 | 22 |
entre 20 et 30 ans | 11 | 15 |
entre 30 et 40 ans | 12 | 12 |
entre 40 et 50 ans | 10 | 9 |
entre 50 et 60 ans | 8 | 7 |
entre 60 et 70 ans | 5 | 5 |
Voie d’exposition : ingestion par l’eau de boisson. L’eau provient de puits artisanaux souvent contaminés par de l’As ou de bas-fonds contenant des concentrations faibles voire très faibles d’As.
Durée d’exposition : exposition des individus toute leur vie ou depuis leur arrivée dans les villages.
Niveaux d’exposition : analyse de l’eau de 114 puits (110 puits artisanaux et 4 bas-fonds). La concentration d’As dans les puits artisanaux varie de 0,4 à 1,82 ppm et la concentration d’As dans les bas-fonds est comprise entre 0,001 et 0,017 ppm. Quatre catégories d’exposition ont été définies, une exposition à des concentrations faibles d’As (< 0,3 ppm), une exposition à des concentrations moyennes (0,3 - 0,6 ppm), une exposition à des concentrations fortes (> 0,6 ppm) et une exposition à des concentrations fluctuantes d’As.
Groupe témoin : villageois ayant bu de l’eau provenant des bas-fonds ne contenant que très peu d’As (0,001 - 0,017 ppm) et ne développant pas de symptômes.
Symptômes observés : cancers cutanés, hyperpigmentation, kératose et maladie des 'pieds noirs’.
Résultats obtenus dans l’étude de Tseng et al. (1968) :
Cancer cutané : Parmi les 40 421 personnes étudiées, 428 présentent un cancer cutané lié à l’ingestion d’As. L’incidence de ces cancers s’accroit lorsque la concentration en As dans l’eau de boisson augmente. Le développement de cancers cutanés est lié à l’âge et aucun individu de moins de 20 ans ne présente ce type de symptômes. Le taux de prévalence des cancers cutanés augmente avec l’âge, sauf chez les femmes âgées de plus de 69 ans, et est supérieur chez les hommes.
Hyperpigmentation : 18,4 à 19,2 % des hommes présentent une hyperpigmentation, alors que 17,6 % des femmes sont atteintes. Une augmentation de l’incidence des hyperpigmentations est observée lorsque la concentration en As dans l’eau de boisson augmente. Cette incidence augmente également avec l’âge de la population.
Kératose : 7,1 à 7,5 % des hommes et 6,8 % des femmes sont atteints de kératoses. Le développement de kératoses est plus important quand la concentration en As dans l’eau de boisson augmente.
Maladie des ‘pieds noirs’ : 0,9 à 1,2 % des hommes et 0,7 % des femmes développent la maladie des ‘pieds noirs’. La prévalence de cette maladie augmente avec des taux croissants d’As. Après 39 ans, le taux de prévalence de cette maladie est supérieur chez les hommes. Enfin, ce taux augmente jusqu'à l’âge de 70 ans chez les hommes et jusqu'à 60 ans chez les femmes, puis diminue.
Différence entre l’étude de Tseng et al., (1968) et celle de Tseng, (1977) : La même population a été étudiée, l’étude de Tseng, 1977 se concentre sur l’analyse des cancers cutanés et la maladie des ‘pieds noirs’ de façon plus minutieuse. Des études histopathologiques ont été réalisées chez 184 patients sur 303 ayant développé un cancer de la peau lié à l’As. Mille cent huit patients atteints de la maladie des ‘pieds noirs’ furent examinés de 1958 à 1975. Contrairement à l’étude de 1968, le taux de mortalité a été recensé et la gravité de la maladie des ‘pieds noirs’ a été classée en fonction de la diminution des facultés physiques des patients (amputations).
Résultats obtenus dans l’étude de Tseng, (1977) : Pour une période de 10 ans, 528 individus sont décédés (47,7 %) dont 244 par cancers cutanés. Parmi les 40 421 individus examinés, 428 ont été atteints de cancers cutanés et 370 de maladies des ‘pieds noirs’. Soixante et un patients présentaient à la fois des cancers cutanés et la maladie des ‘pieds noirs’ soit 1,5/1 000. Dans l’étude de 1977, il a été observé que la sévérité de la maladie des ‘pieds noirs' était directement liée à la durée d'exposition. En 1956, dans certains villages, une nouvelle installation d’eau potable a été mise en place, une diminution du taux de prévalence des cancers cutanés et de la maladie des ‘pieds noirs’ a alors été observée dans ces villages.
Qualité des 2 études : Il manque des renseignements concernant la population étudiée (consommation de tabac, consommation d’eau et de nourriture, poids…). Dans cette étude, les biais de confusion ne sont donc pas pris en compte.
Le temps d’exposition est incertain et est extrêmement variable en fonction de la date d’arrivée de chaque individu dans le village. Peu de personnes ont été exposées toute leur vie.
Les concentrations d’As, auxquelles ont été exposés les individus, sont classées : concentrations d’As inférieures à 0,3 ppm, concentrations comprises entre 0,3 et 0,6 ppm, concentrations supérieures à 0,6 ppm et concentrations d’As fluctuantes. Il n’est donc pas facile d’établir une relation dose-réponse.
Une grande part de la population étudiée est jeune et les études ont montré que l’incidence des symptômes observés augmente avec l’âge de la population.
Les informations renseignent sur l’ensemble de la population témoin et non sur chaque individu pris séparément. De plus, le nombre d’individus témoins pris en compte n’est pas indiqué.
Wasserman et al. (2004)
Type d’étude : étude transversale au sein d’une étude de cohorte : enfants de 10 ans, dont les parents faisaient partie d’une large cohorte (12 000 individus) étudiée au Bangladesh
Lieu : Bangladesh
Nombre de personnes étudiées : 201 enfants âgés de 10 ans
Voie d’exposition : As dans l’eau de boisson
Niveaux d’exposition / formes chimiques : de 0,1 à 790 µg As.L-1 (moyenne de 117,8 µg As.L-1) dans l’eau de boisson.
Groupe témoin : non
Méthode développée dans l’étude : Des mesures d’As et du manganèse dans l’eau de boisson ont été pratiquées. Des tests sur la fonction intellectuelle ont été réalisés sur la base de l’échelle d’intelligence de Wechsler pour les enfants (version 3). Les niveaux d’exposition à l’As ont été évalués par dosage de l’As urinaire et des taux de créatinine. Des mesures du plomb sanguin et dans l’hémoglobine ont également été pratiquées.
Symptômes observés : diminution dose dépendant de la performance aux tests d’intelligence.
Résultats de l’étude : Une relation-dose réponse inverse a été mise en évidence entre l’exposition à l’As dans l’eau de boisson et les performances intellectuelles évaluées par les auteurs, et ce dès 50 µg.L-1 d’As.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Gilbert-Diamond et al. (2013)
Type d’étude : cas-témoins
Lieu : Etats-Unis (New Hampshire)
Nombre de personnes étudiées : 470 cas atteints de carcinomes épidermoïdes (25-74 ans)
Voie d’exposition : As dans l’eau de boisson et alimentation
Niveaux d’exposition / formes chimiques : concentration d’As total dans l’eau : 0,33 (0,14 – 1,11) µg.L-1 et 0,31 (0,12 – 0,94) µg.L-1 total respectivement chez les cas et les témoins (collecte individuelle eau du robinet) ; dosages urinaires 5,27 µg.L-1 (3,38 - 8,52) et 4,76 µg.L-1 (2,94 - 8,10) d’As total respectivement chez les cas et les témoins.
Groupe témoin : 447 témoins appariés aux cas sur le sexe et l’âge.
Méthode développée dans l’étude : des dosages urinaires de l’As total correspondant à l’As inorganique et ses deux principaux métabolites (l’acide monométhylarsonique (MMA) et l’acide diméthylarsonique (DMA)), ainsi que de la créatinine ont été réalisés chez tous les participants (exclusion dans l’analyse des sujets ayant consommé des fruits de mer dans les 2 jours précédant la collecte d’urine).
Les cas de carcinomes épidermoïdes ont été identifiés entre juillet 2003 et juin 2009 à partir des registres de pathologies et des dossiers médicaux.
Les données sur le sexe, l’âge, l’indice de masse corporelle (IMC), le statut tabagique, la réactivité aux UV de la peau (très, modérément, légèrement ou pas pigmentée) et la consommation de fruits de mer ont été recueillies.
Symptômes observés : carcinome épidermoïde invasif de la peau (confirmé histologiquement).
Résultats de l’étude : Des associations significatives entre les concentrations logarithmiques totales d'As (∑As), de MMA, DMA et le risque accru de carcinomes épidermoïdes ont été décrits après ajustements des différentes variables (âge, sexe, statut tabagique, etc.), y compris la créatinine (variable continue) :
OR de 1,37 (1,04 – 1,80) ln (∑As)
OR de 1,34 (1,04 – 1,71) ln (MMA)
OR de 1,34 (1,03 – 1,74) ln (DMA)
A noter que l’analyse a porté uniquement sur les sujets n’ayant pas consommé de fruits de mer au cours des 2 jours précédant les analyses d’urine (soit 323 cas et 319 témoins).
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Xia et al. (2009)
Type d’étude : étude épidémiologique descriptive
Lieu : Mongolie intérieure
Nombre de personnes étudiées : 12 334 individus
Voie d’exposition : As dans l’eau de boisson
Groupe témoin : population consommant une eau de boisson dont la concentration en As est inférieure ou égale à 5 µg. L-1
Méthode développée dans l’étude : réalisation d’une interview et examen des lésions cutanées. Des mesures d’As dans l’eau de boisson ont été pratiquées en 2004.
Symptômes observés : lésions cutanées en lien avec les concentrations en As dans l’eau de boisson. La présence des lésions cutanées est corrélée avec des pathologies cardiaques auto-rapportées (mais sans confirmation par le personnel médical).
Résultats de l’étude : La prévalence des lésions d’hyperkératose et de mélanodermie était significativement augmentée aux concentrations supérieures et le risque augmentait avec la concentration : OR de 2,52 (IC 95 % : 1,47-4,30) pour une concentration d’As dans l’eau
de 5,1-10 µg. L-1, de 2,83 (IC 95 % : 1,77-4,53) pour 10,1-20 µg. L-1, de 3,94 (IC 95 % : 2,78-5,59) pour 20,1-50 µg. L-1, de 6,03 (IC 95 % : 4,05-8,97) pour 50,1-100 µg. L-1, de 8,83 (IC 95 % :
5,77-13,51) pour 100,1-300 µg. L-1 et de 7,94 (IC 95 % : 2,73-23,12) au-delà de 300 µg. L-1.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Grau-Pérez et al. (2017) (même cohorte que l’étude Moon et al., 2017 pour les cardiopathies)
Type d’étude : étude cas-témoins nichée au sein d’une cohorte.
Lieu : Arizona, Oklahoma, Dakota du Nord et du Sud (Etats-Unis).
Nombre de personnes étudiées : 1 838 femmes et hommes amérindiens appartenant à la cohorte Strong Heart Family Study (SHFS), moyenne d’âge de 36 ans, répartis dans 13 communes de 4 états américains (Etats-Unis) recrutés soit entre 1998-1999 ou 2001-2004 et suivis jusqu’en 2001-2004 ou 2006-2009.
Voie d’exposition : eau de boisson
Niveau d’exposition : La concentration médiane As totale, As inorganique%, MMA%, et DMA% étaient respectivement de 4,4 µg.g-1 de créatinine, 9,5 %, 14,4 % et 75,6 % dans les urines.
Groupe témoin : 1 586 témoins
Méthode développée dans l’étude : l’As inorganique et ses deux métabolites, MMA et DMA, rapportés à la créatinine ont été dosés dans les urines. La somme de ces différentes espèces d’As a été utilisée pour évaluer l’exposition totale à l’As, de même que le métabolisme de l’As à partir du pourcentage des différentes espèces (As inorganique %, MMA%, DMA%).
L’âge, le sexe, l’origine ethnique, l’éducation des parents (≤ 12 ans , > 12 ans), et l’IMC ont été pris en compte dans l’analyse des résultats. L’estimation de la concentration sanguine de certains nutriments susceptibles d’interférer sur le métabolisme de l’As (folate, vitamines B) a été réalisée à partir d’un questionnaire sur la fréquence de consommation alimentaire. Des ajustements supplémentaires ont été réalisés pour ces facteurs nutritionnels.
Les HR (Hazard ratio) de l’incidence du diabète en fonction des niveaux d'exposition à l'As ont été réalisés à partir d’un modèle de Cox, en utilisant l’âge comme échelle de temps. Le modèle de Cox a également été utilisé à de multi-niveaux pour l’analyse des valeurs de HOMA2-IR (résistance à l’insuline) à la fois au niveau basal et au cours du suivi.
Symptômes observés : 2 types d’informations ont été évaluées ; l’apparition de diabète déterminée au cours de la visite annuelle de suivi par une glycémie à jeun ≥ 126 mg.dL-1, un diagnostic médical ou un traitement en cours à l’insuline ou par voie orale contre le diabète, de même que l’indice de résistance à l’insuline déterminé à partir du logiciel HOMA2-IR (ce modèle utilise les concentrations de glucose et d'insuline à jeun). Un score élevé de HOMA2-IR suggère une plus grande résistance à l'insuline, et correspond à un risque accru de développer des maladies métaboliques comme le diabète de type 2. Les scores HOMAR2-IR ont été enregistrés au cours de la première visite (inclusion = niveau de base) et des visites de suivi.
Résultats :
Au cours de 10 327 années-personnes de suivi, 252 participants ont développé un diabète. La médiane HOMA2-IR au début de l’étude (niveau de base) était de 1,5. Le HR pour l’incidence du diabète selon l’augmentation interquartile de l’As total était de 1,57 (IC95 % : 1,18 - 2,08) chez les sujets sans prédiabète au début de l’étude (ajustement sur tous les paramètres mesurés).
Le métabolisme de l’As n’était pas associé à l’incidence du diabète. Toutefois, des variations du métabolisme de l’As avec les résultats de HOMA2-IR différaient selon les participants en fonction de l’apport en vitamine B et de la variante génétique AS3MT, indiquant un rôle de la nutrition comme facteur de risque.
Enfin, l’As total était positivement associé aux valeurs HOMA2-IR au début de l’étude (niveau de base), mais négativement au cours du suivi (7 à 10 ans). Une diminution des indices d’HOMA2-IR a été associée à une augmentation du MMA%, mais à une diminution de l’As inorganique % et du DMA%.
Qualité de l’étude : 2, bonne qualité scientifique. Néanmoins les doses d’expositions ne sont basées que sur un dosage urinaire et le suivi de la cohorte reste relativement court (moins de 10 ans).
James et al. (2013) (même cohorte que l’étude James et al., 2015 pour les cardiopathies)
Type d’étude : étude cas-témoins nichée au sein d’une cohorte San Luis Valley Diabetes Study.
Lieu : comtés d’Alamosa et Conejos, Sud du Colorado (Etats-Unis)
Nombre de personnes étudiées : sous-cohorte de 488 sujets sélectionnés au hasard parmi une cohorte de 936 sujets non diabétiques au début de l’étude (entre 1984 et 1988). Parmi eux, 81 sujets ont développé un diabète de type 2. Les cas, au nombre de 141 sont constitués de ces 81 sujets auxquels ont été ajoutés 60 cas de diabètes, non sélectionnés initialement. Finalement l’étude porte sur 548 sujets. Tous les sujets, hommes et femmes étaient âgés de 20 à 74 ans, d’origine hispanique ou non hispanique (caucasiens), et résidants dans le sud du Colorado au début de l’étude.
Voie d’exposition : As dans l’eau de boisson
Niveaux d’exposition / formes chimiques : L’exposition à l’As a été déterminée à partir des données relatives au lieu de résidence, d’emploi et de collecte d’eau sur le lieu de résidence (n=334 sujets). Ces données ont été complétées par une modélisation géo-spatiale des concentrations d’As dans l’eau potable, validée par des dosages urinaires qualifiés d’historiques collectés dans les années de 1984 à 1991. Quatre groupes d’expositions à l’As ont été déterminés : ≤ 4 µg.L-1-année (120 sujets) ; > 4 à ≤ 8 µg.L-1-année (148 sujets) ; >8 à ≤ 20 µg.L-1-année (139 sujets) et > 20 µg.L-1-année (141 sujets).
Groupe témoin : 407 témoins
Méthode développée dans l’étude : Des facteurs de risque liés au diabète, tels que l’IMC, l‘activité physique, la consommation d’alcool ont été pris en compte dans les analyses statistiques. Un modèle de Cox à risque proportionnel a permis d’examiner l’association entre l’exposition cumulée à l’As et le risque de diabète de type 2. L’estimation du HR a permis de quantifier l’effet de l’exposition à l’As sur le diabète et de l’appliquer à des sous-groupes comme l’IMC, la sédentarité…
Symptômes observés : Les cas de diabète ont été soit auto-rapportés au cours du suivi annuel réalisé par appel téléphonique (confirmé par un médecin) ou diagnostiqués au cours du suivi clinique (2 à 5 visites par sujet au cours de l’étude) à partir d’un test d’hyperglycémie provoquée.
Résultats de l’étude : Une association significative a été observée entre l’exposition à l’As et le diabète. Une augmentation de 15 µg.L-1 d’As dans l’eau potable correspond à un HR de 1,27 (1,02 – 1,64, p=0,04), soit une augmentation de risque de 27 %. Le risque de diabète augmente progressivement avec les niveaux croissants d’As dans l’eau potable.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Coronado-Gonzalez et al. (2007)
Type d’étude : étude transversale.
Lieu : 9 localités de la région de Cohuila au Mexique où l’eau potable présente des concentrations élevées d’As (20-400 µg.L-1).
Nombre de personnes étudiées : 200 cas de diabète de type 2 sélectionnés au hasard dans un groupe de 302 sujets diabétiques identifiés à partir d’une étude transversale regroupant 1 314 participants, femmes et hommes de plus de 30 ans (mars à juillet 2003).
Voie d’exposition : eau de boisson.
Durée d’exposition : non précisée
Niveau d’exposition : dosages urinaires d’As total chez tous les sujets ajustés sur la créatinine. Sujets classés en 3 classes d’exposition : < 63,5 µg.g-1 créatinine ; 63,5 - 104 µg.g-1 créatinine ; > 104 µg.g-1. créatinine.
Groupe témoin : 200 témoins non diabétiques recrutés à partir de l’étude transversale immédiatement après l’identification des cas, et non appariés sur l’âge et le sexe.
Symptômes observés : diabète de type 2
Méthode développée dans l’étude : Les caractéristiques de la population comprennent l’âge, le sexe, l’IMC, l’hypertension, les antécédents familiaux de diabète et le tabagisme. Des dosages de glucose, du cholestérol et des triglycérides sanguins à jeun ont été réalisés chez tous les sujets. Le diagnostic du diabète reposait sur un taux de glucose ≥ à 126 mg.mL-1 (2 prélèvements) ou sur une auto-déclaration par questionnaire (prise d’insuline ou de médicaments hypoglycémiques).
Une analyse bivariée a été utilisée afin d’estimer les OR entre les cas et les témoins en fonction de la concentration urinaire totale d’As. A partir de modèles de régressions logistiques, des analyses multivariées ont permis un ajustement des résultats en tenant compte de facteurs confondants (âge, sexe, hypertension).
Résultats : Les sujets avec une concentration urinaire d’As de 63,5 - 104 µg.g-1 créatinine ont 2 fois plus de risque de déclarer un diabète (OR = 2,16, IC95% (1,23 – 3,79)) et presque 3 fois plus lorsque la concentration est > 104 µg.g-1 créatinine(OR = 2,84 IC95% (1,64 – 4,92)) après ajustement de facteurs (non clairement mentionnés).
L’hypertension et les antécédents familiaux de diabète constituent également des facteurs de risque (OR respectifs de 1,91 (1,21 - 3,01) et 2,67 (1,67 - 4,26)).
Qualité de l’étude : 2, bonne qualité scientifique, avec toutefois une incertitude sur le manque de temporalité (exposition à l’As précédant ou non l’apparition du diabète) et l’ajustement lié notamment au tabac.
Pan et al. (2013)
Type d’étude : étude cas-témoins (2009-2011) réutilisant les données d’une précédente étude cas-témoins (2001-2003) comprenant 900 cas de sujets porteurs de lésions cutanées et 900 témoins indemnes de ces lésions.
Lieu : Bangladesh (2009-2011).
Nombre de personnes étudiées : Sur les 1 542 personnes retrouvées, 933 participants ont été recrutés pour la nouvelle étude. Sur les 933 participants, 84 cas de diabète de type 2 ont été diagnostiqués à partir de dosages sanguins d’hémoglobine A1c (taux supérieur à 6,5 %).
Voie d’exposition : eau de boisson.
Durée d’exposition : non précisée
Niveau d’exposition : Les concentrations d’As étaient en moyenne de 142 µg.L-1 et 202 µg.L-1 dans l’eau de boisson (p<0,001), ou de 4,8 µg.g-1 et 5,4 µg.g-1 dans les ongles (p=0,007), respectivement dans le groupe témoin et les cas de diabète.
Symptômes observés : diabète de type 2
Groupe témoin : 849 témoins sur les 933 sujets recrutés pour l’étude (taux d’A1c < à 6,5 %).
Méthode développée dans l’étude : Les niveaux d’exposition à l’As total (espèces non précisées) ont été déterminés à partir de dosages réalisés dans des échantillons individuels d’eau de boisson et d’ongles.
Les caractéristiques de la population comprennent l’âge, le sexe, le statut marital, l’IMC, le tabagisme (jamais, passé, actuel).
La comparaison simple des caractéristiques des 2 groupes (cas et témoins) a été réalisée à partir du test exact de Fisher et du test U de Mann-Whitney. Les facteurs suivants, différents entre les participants de la nouvelle étude et les non participants ont été pris en compte dans les analyses : âge, niveau d’étude, et existence de lésions cutanées.
Les concentrations d’As dans l’eau de boisson et les ongles ont été catégorisées en quartiles. Une régression logistique multivariée a été utilisée afin d’estimer les OR pour le diabète en fonction des différentes concentrations d’exposition en As (quartiles eau de boisson et ongles). L’âge, le sexe, l’IMC, le tabagisme et les lésions cutanées (présentes/absentes) ont été inclus dans le modèle.
Une modélisation de la relation dose-réponse entre l’exposition à l’As (transformation logarithmique) et le risque de diabète de type 2 a été réalisée à partir d’une fonction de lissage des données (penalized splines régression).
Résultats : L’exposition à des niveaux modérés d’As dans l’eau de boisson augmente significativement le risque de diabète de type 2 avec des OR ajustés de 3,07 IC95% (1,38 – 6,85) pour le 3e quartile et de 4,51 IC95% (2,01 – 10,09) pour le 4e quartile par rapport au 1er quartile. Des résultats comparables ont été obtenus à partir de la concentration d’As dans les ongles.
Des relations dose-réponse significatives ont été obtenues entre l’augmentation de la concentration d’As (eau de boisson ou ongles) et le risque de diabète (p entre 0,001 et 0,043).
Qualité de l’étude : 2, bonne qualité scientifique, malgré l’absence de données sur l’apport en nutriments susceptibles d’interférer avec le diabète et/ou le métabolisme de l’As.
Chen et al. (2013)
Type d’étude : étude de type cas-témoins nichée dans une cohorte.
Lieu : Araihazar, Bangladesh.
Nombre de personnes étudiées à partir de la cohorte Health Effects of As Longitudinal Study (HEALS) regroupant 11 224 sujets, 369 cas de maladies cardiovasculaires ont été identifiés, parmi lesquels 211 cas de maladies cardiaques et 148 cas d’accidents cardio-vasculaires (AVC).
Voie d’exposition : eau de boisson
Niveau d’exposition : Les concentrations d’As total dans l’eau des puits ont été réparties en 3 catégories de 0,1 à 25 µg.L-1 – 25,1 à 107 µg.L-1 – 108 à 864 µg.L-1 avec des moyennes respectives de 7,2 ; 59,9 et 222,8 µg.L-1.
Groupe témoin : une sous cohorte de 1 109 sujets sélectionnés de manière aléatoire pour constituer le groupe témoin
Méthode développée dans l’étude : L’exposition a été évaluée à partir de prélèvements réalisés dans l’eau de puits (5 966 puits répartis dans une zone de 25 km2 d’Araihazar), avec une utilisation du puits de référence de 7,4 ans en moyenne avant le début de l’étude, ce qui correspond à environ 20 % de leur durée de vie. En parallèle, des dosages urinaires individuels ont été réalisés au cours de l’étude respectivement chez 95,6 % des participants au début de l’étude, 94,5 % des sujets au premier suivi de la cohorte (2 ans) et 91,2 % au cours du second suivi (2 ans). L’As total a été dosé, de même que les différentes espèces As inorganique, et les métabolites MMA et DMA. Les auteurs ont réalisé un calcul d’indices de méthylation : primaire (noté IMP = MMA/As inorganique) et secondaire (noté IMS = DMA/MMA).
Des données démographiques et cliniques ont été recueillies auprès de chaque participant par questionnaire et examens médicaux (âge, IMC, niveau d’éducation, tabagisme, hypertension (pression artérielle systolique ≥ 140 mmHg ou diastolique ≥ 90 mmHg), diabète).
Les HR de l’incidence des maladies cardiovasculaires en fonction des niveaux d'exposition à l'As ont été réalisés à partir d’un modèle de Cox. Des ajustements pour plusieurs variables (sexe, âge, IMC, tabagisme, hypertension, diabète, changement de concentrations en As selon les visites) ont été testés.
Symptômes observés : maladies cardiovasculaires fatales (classification de l’OMS) et non fatales (AVC et maladies cardiaques ischémiques établies à partir de critères de diagnostiques précis).
Résultats : Une augmentation de 112 µg.L-1 d’As dans l’eau des puits a été associée à une augmentation significative du risque de maladies cardiovasculaires (HR de 1,15 (1,01 - 1,30)), avec plus particulièrement un risque de maladies cardiaques (HR de 1,20 (1,04 – 1,38)) pour des ajustements sur le sexe et l’âge.
Concernant les associations entre les biomarqueurs urinaires et les maladies cardiovasculaires, des associations positives significatives ont été décrites pour le %MMA (correspond à une méthylation incomplète de l’As dans les urines) et le risque de maladies cardiovasculaires (HR de 1,55 (1,08 – 2,23), 3e tertile par rapport au 1er tertile), ainsi que plus particulièrement le risque de maladies cardiaques (HR de 1,61 (1,04 – 2,49)), avec des ajustements sur le sexe et l’âge.
A l’inverse, l’IMS, correspondant au degré de méthylation le plus complet de l’As, a été associé à une réduction significative à la fois du risque global de maladies cardiovasculaires et du risque de maladies cardiaques avec des HR respectifs de 0,54 (0,34 - 0,85) et 0,54 (0,33 – 0,88), également ajustés sur le sexe et l’âge.
Dans l’étude, le risque d’AVC n’a pas été associé à l’exposition d’As (eau de boisson et marqueurs urinaires).
Enfin des interactions entre la méthylation incomplète de l’As (% MMA) et l’âge ou le tabagisme ont été décrites, avec un risque de maladies cardiaques presque 4 fois plus élevé chez les sujets de plus de 36 ans (HR de 3,88 (2,12 – 7,09)) et chez les fumeurs (HR de 3,82 (2,04 – 7,14)).
Qualité de l’étude : 2, bonne qualité scientifique. Néanmoins, les sujets de l’étude sont globalement exposés à de fortes concentrations d’As dans l’eau des puits (1 seule campagne de mesures).
James et al. (2015) (même cohorte que l’étude James et al., 2013 pour le diabète))
Type d’étude : étude cas-témoins nichée au sein d’une cohorte San Luis Valley Diabetes Study.
Lieu : comtés d’Alamosa et Conejos, Sud du Colorado (Etats-Unis)
Nombre de personnes étudiées : sous-cohorte de 533 sujets sélectionnés au hasard parmi une cohorte initiale de 936 sujets non atteints de maladies cardiaques ou de diabète au début de l’étude (entre 1984 et 1988), dont 74 sujets ayant développé une maladie coronarienne. La cohorte initiale est suivie tous les 4 ans jusqu’en 1998. Un nombre supplémentaire de 22 cas de maladies coronariennes, non sélectionnés initialement, a été inclus dans l’étude pour porter le nombre de cas à 96 et le nombre total de sujets de la cohorte à 555. Tous les sujets, hommes et femmes étaient âgés de 20 à 74 ans, d’origine hispanique ou pas (caucasiens), et résidants dans le sud du Colorado au début de l’étude.
Voie d’exposition : As dans l’eau de boisson
Niveaux d’exposition / formes chimiques : L’exposition à l’As a été déterminée à partir des données relatives au lieu de résidence, d’emploi et de collecte d’eau sur le lieu de résidence (n=334 sujets). Ces données ont été complétées par une modélisation géo-spatiale des concentrations d’As dans l’eau potable, validée par des dosages urinaires qualifiés d’historiques collectés dans les années de 1984 à 1991. Une matrice d’exposition a été développée afin d’estimer pour chaque sujet la moyenne d’exposition par an. Quatre classes d’expositions à l’As ont été déterminées : 1-20, 20-30, 30-45 et 45-88 µg.L-1.année correspondant respectivement à une répartition de 77 %, 15 %, 6 % et 1 % des sujets de la cohorte totale.
Groupe témoin : 459 témoins
Méthode développée dans l’étude : Des facteurs de risque liés aux maladies coronariennes, tels que l’IMC, l‘activité physique sédentaire, les antécédents familiaux de maladies coronariennes, la consommation d’alcool et d’eau ont été pris en compte dans les analyses statistiques, de même que les lipides sanguins (triglycérides, cholestérol (LDL, HDL)) et micro-nutriments (folate, sélénium).
Un modèle de Cox à risques proportionnels a permis d’examiner les associations entre l’exposition cumulée à l’As (variable continue) ou par classes d’expositions et le risque de maladies coronariennes. L’estimation du HR a permis de quantifier l’effet de l’exposition à l’As sur les maladies coronariennes et de l’appliquer à des sous-groupes comme l’IMC, la sédentarité, la consommation d’alcool…
Symptômes observés : Les cas de maladies coronariennes ont été identifiés entre 1984 et 1998 en raison d’un infarctus du myocarde, d’une angioplastie (dilatation des artères coronaires) ou de décès dû à une maladie cardiaque ischémique aiguë, sub-aiguë ou chronique). Les cas ont été soit auto-rapportés au cours des entretiens annuels téléphoniques, dossiers médicaux ou surveillance des certificats de décès.
Résultats de l’étude : Une association significative positive a été observée entre de faibles expositions à l’As et le risque de maladie coronarienne. L’augmentation de 15 µg.L-1 d’As dans l’eau potable correspond à un HR de 1,38 (1,09 – 1,78) après ajustement sur le sexe, l’âge, les antécédents familiaux de maladies coronariennes et le taux de LDL (53 µg.dL-1).
Le risque augmente progressivement en fonction des différentes catégories d’exposition (p = 0,0007):
< 20 µg.L-1 année HR : 1 (référence)
20 – 30 µg.L-1 année HR : 1,2 (0,6 – 2,2)
30 – 45 µg.L-1 année HR : 2,2 (1,2 – 4,0)
45 - 88 µg.L-1 année HR : 3,0 (1,1 – 9,1)
Les sujets exposés aux 2 plus fortes catégories ont environ 2 à 3 fois plus de risque de développer une maladie coronarienne par comparaison aux sujets faiblement exposés.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Moon et al. (2013) (même cohorte que l’étude Grau-Pérez et al., 2017 pour le diabète)
Type d’étude : étude de cohorte.
Lieu : Arizona, Oklahoma, Dakota du Nord et du Sud (Etats-Unis).
Nombre de personnes étudiées : cohorte de 3 575 femmes et hommes amérindiens (âgés de 45 à 74 ans) issus de la cohorte Strong Heart Study (4 549 participants), répartis dans 13 communes de 4 états américains et recrutés entre 1989 et 1991, avec un suivi jusqu’en 2008.
Voie d’exposition : eau de boisson
Durée d’exposition : environ 15 ans
Niveau d’exposition :
La concentration d’As totale (As inorganique, DMA, MMA) a été répartie en 4 quartiles : <5,8 ; 5,8 – 9,7 ; 9,8 – 15,7 ; > 15,7 µg.g-1 de créatinine avec des médianes respectives de 4,2 ; 7,5 ; 12,4 et 21,8 µg.g-1 de créatinine pour chaque quartile.
Groupe témoin : non
Méthode développée dans l’étude : l’As inorganique et les métabolites MMA et DMA, rapportés à la créatinine ont été dosés dans les urines. La somme de ces différentes espèces de l’As a été utilisée pour évaluer l’exposition totale à l’As, de même que le métabolisme de l’As à partir du pourcentage des différentes espèces (As inorganique %, MMA%, DMA%). L’As inorganique de type arsenobétaïne présent dans les fruits de mer a également été dosé (considéré comme étant non toxique). La reproductibilité des dosages urinaires d’As a été déterminée à partir de 3 prélèvements urinaires réalisés successivement sur une période de 10 ans.
Le suivi de la cohorte (environ sur 20 ans) a été réalisé à partir de 2 visites (entre 1993-1995, puis 1998-1999) après l’examen initial, puis un suivi actif jusqu’en 2008. Les données collectées comprenaient des mesures de la taille, du poids, de l’IMC, de la pression artérielle, du tabagisme, des habitudes alimentaires. Des prélèvements de sang (dosages de cholestérol et de lipides (LDL), glycémie, hémoglobine A1c) et d’urine (dosages d’albumine, créatinine) ont permis de déterminer la filtration glomérulaire et la présence ou non de diabète (glycémie à jeun ≥ 126 mg.dL-1, hémoglobine A1c ≥6,5 % ou traitement par insuline/médicament hypoglycémiant auto-rapporté).
Les HR de l’incidence des maladies cardiovasculaires (MCV) en fonction des niveaux d'exposition à l'As ont été réalisés à partir d’un modèle de Cox, en utilisant l’âge comme échelle de temps. Le modèle de Cox a progressivement été ajusté pour tenir compte de facteurs de risques des maladies cardiovasculaires tels que le tabagisme, l’IMC, LDL, ou d’autres cofacteurs potentiels tels que la fonction rénale, l’hypertension ou le diabète.
Symptômes observés : incidence des maladies cardiovasculaires (suivi 99,2 %) et mortalité (suivi à 99,8 %). Le suivi a été réalisé à partir des contacts téléphoniques annuels, des 2 visites cliniques, de l’examen des dossiers médicaux et registres d’hospitalisations, ou encore à partir de la consultation des certificats de décès. Les pathologies cardiovasculaires recherchées étaient : les maladies coronariennes (infarctus du myocarde, angine de poitrine instable, décès d’origine coronarienne) ; les AVC (ischémique ou hémorragique confirmé par imagerie ou autopsie), les insuffisances cardiaques congestives et autres maladies cardiovasculaires fatales.
Résultats : 1 184 sujets ont développé une MCV fatale ou non fatale et 439 sujets ont développé une MCV fatale.
Des associations significatives positives du risque de mortalité par MCV (HR : 1,65 (1,20 – 2,27), p<0,001), maladie coronarienne (HR : 1,71 (1,19 – 2,44), p<0,001), ACV (HR : 3,03 (1,08 – 8,50), p<0,001) et l’exposition à l’As (comparaison entre le quartile le plus élevé (> 15,7 µg.g-1 créatinine) et le moins élevé (<5,8 µg.g-1 créatinine)) ont été rapportées après ajustement en fonction du sexe, du tabagisme, de l’IMC et des lipides sanguins (LDL).
Les incidences de ces mêmes pathologies pour un risque non fatal étaient également significatives avec des HR de 1,32 (1,09 – 1,59), p=0,002) pour les MCV ; 1,30 (1,04 – 1,62), p=0,006) pour les maladies coronariennes et 1,47 (0,97 – 2,21), p=0,032) pour les AVC.
Après des ajustements en fonction du diabète, de l’hypertension et de la fonction rénale, des atténuations du risque ont été décrites, suggérant un lien entre ces pathologies et les MCV.
Qualité de l’étude : 2, bonne qualité scientifique. Néanmoins, les doses d’exposition ne sont basées que sur un dosage urinaire et aucun dosage individuel dans l’eau de boisson n’a été réalisé. Toutefois, la variation temporelle des dosages urinaires d’As réalisée sur un petit nombre de sujets est modérée, ce qui suggère une exposition stable à l’As au cours de l’étude (environ 10 ans).
Wade et al. (2015)
Type d’étude : étude cas-témoins réalisée en milieu hospitalier (recrutement entre 2006 et 2011)
Lieu : Ba Men, région agricole de Mongolie intérieure (Chine).
Nombre de personnes étudiées : 298 cas correspondant à des patients atteints de maladies cardiovasculaires, âgés de 18 à 70 ans et recrutés dans l’hôpital régional de Hangjin Hou (Chine).
Voie d’exposition : eau de boisson.
Durée d’exposition : non précisée
Niveau d’exposition : dosages d’As total (espèces non précisées) dans des échantillons d’ongles des pieds (ou des mains pour moins de 5 % des sujets) et échantillons d’eau prélevés à partir de la source principale d’eau potable de chaque sujet au cours d’une visite à domicile. La concentration moyenne d’As était de 13,1 µg.L-1 dans l’eau de boisson et de 0,87 µg.g-1 dans les ongles. Les concentrations d’As dans l’eau de boisson ont été réparties en 4 catégories : < à 10 ; 11 – 39 ; 40 – 99 ; ≥ 100 µg.L-1, et celles des ongles en 3 catégories : 0,11 – 0,28 (<10e percentile); 0,29 -1,37 (10e au 90e percentiles); 1,38 – 34,21 (>90e percentile).
Groupe témoin : 275 témoins correspondant à des patients du même hôpital non atteints de maladies cardiovasculaires (infections, blessures, examens de routine….) et appariés aux cas en fréquence selon l’âge (± 5 ans) et le sexe.
Méthode développée dans l’étude : Les données médicales (pathologies cardiaques, IMC) et des informations personnelles (habitudes alimentaires, profession, niveau d’éducation, consommation d’alcool/tabac, antécédents familiaux d’hypertension, diabète ou maladies cardiaques) ont été recueillies par questionnaires.
Les associations entre l’exposition à l’As (eau de boisson et ongles) et les MCV ont été évaluées à partir de modèles de régression logistique, afin de déterminer des OR. L’IMC, la profession, le niveau d’éducation, et l’historique familial ont été inclus dans le modèle comme facteurs de confusion possibles.
Symptômes observés : infarctus du myocarde, cardiomyopathie, ou angine de poitrine (avec douleurs thoraciques et anomalies ECG).
Résultats : Une augmentation de 10 µg.L-1 d’As dans l’eau est associée à une augmentation significative du risque de MCV avec un OR ajusté de 1,19 (1,03 – 1,38) (p = 0,021). Chez les sujets exposés à plus de 40 µg.L-1, le risque de MCV était 4 fois plus élevé que chez les sujets exposés à moins de 10 µg.L-1 (OR de 4,05 (1,10 -14,99)).
L’association entre l’As des ongles et le risque de MCV a significativement augmentée uniquement dans le groupe exposé aux plus fortes concentrations (> 90e percentile) par comparaison aux sujets exposés aux 2 plus faibles concentrations (< 90e percentile) (OR ajusté de 2,48 (1,18 – 5,20)).
Qualité de l’étude : 2, bonne qualité scientifique. Seuls les éléments non fatals des MCV ont été étudiés.
Wu et al. (2010)
Type d’étude : étude cas-témoins nichée au sein d’une cohorte. L’objectif est d’étudier la relation entre le polymorphisme
génétique HO-1 et le risque d’athérosclérose relié à l’As.
Lieu : 2 régions historiquement exposées à l’As ; Bassin de Lanyang (Nord-Est) (cohorte Lanyang) et la région de la maladie du pied noir (Sud-Ouest) (cohorte LMN) à Taiwan. Il convient de préciser que les résultats de la cohorte LMN n’étant pas pris en compte dans l’élaboration de la RfD par l’US EPA (trop fortes contaminations à l’As), les données relatives à cette cohorte n’ont pas été mentionnées ci-après.
Nombre de personnes étudiées : 687 participants pris au hasard dans la cohorte Lanyang ont été soumis à un examen échographique des artères carotidiennes (1998-1999). Parmi eux, 530 sujets ont consenti à fournir des échantillons d’ADN. L’extraction d’ADN n’a pas été possible pour 26 échantillons, ramenant la cohorte à 506 participants.
Voie d’exposition : eau de boisson.
Durée d’exposition : environ 8 ans
Niveau d’exposition : Des concentrations d’As comprises entre moins de 15 µg.L-1 à plus de 3 000 µg.L-1, avec une valeur médiane de 140 µg.L-1 ont été déterminées dans l’eau des puits. Les résidents ont utilisé l’eau de ces puits depuis la fin des années 1940 jusqu’au début des années 1990, période à laquelle un nouveau système d’approvisionnement en eau publique a été mis en place. L’exposition à l’As dans l’eau a été répartie en 5 catégories : ≤ 10 ; 10,1 – 50 ; 50,1 – 100 ; 100,1 -300 ; > 300 µg.L-1.
Groupe témoin : 256 témoins issus de la cohorte Lanyang sans athérosclérose.
Méthode développée dans l’étude : En plus des données démographiques (âge, sexe), des données personnelles et médicales (tabagisme, IMC, historique familiale de l’hypertension, diabète) et des données biologiques (triglycéride, cholestérol total), des analyses génétiques du polymorphisme du gène HO-1 (hème oxygénase-1 de défense antioxydante et vasculo-relaxante) ont été réalisées à partir de l’extraction d’ADN. La région de répétition (GT)n correspond au promoteur du gène HO-1 : le polymorphisme du gène, allèle court (S) (< 27 répétitions GT) ou allèle long (L) (> 27 répétitions) a été déterminé pour chacun des sujets de l’étude, soit L/L, L/S et S/S.
Les concentrations d’As dans l’eau des puits ont été réparties en 5 catégories.
L’association entre l’exposition à l’As dans l’eau (par catégories) et l’athérosclérose a été évaluée à partir de modèles de régression logistique, afin de déterminer des OR, avec des ajustements sur l’âge, le sexe, les triglycérides, le cholestérol et l’historique familial de l’hypertension.
Symptômes observés : athérosclérose carotidienne évaluée à partir de 2 paramètres : l’épaisseur intima-média maximale (IMT) de la carotide extra-crânienne (IMT ≥ 1 considéré comme un indicateur d’athérosclérose) et présence de plaques carotidiennes (épaississement pariétal doit représenter au moins 50 % de l’IMT adjacente). 250 cas d’athérosclérose identifiés dans la cohorte Lanyang.
Résultats : Une augmentation significative dose-dépendante de l’exposition à l’As avec le risque d’athérosclérose a été observée dans la cohorte Lanyang avec des OR respectifs ajustés de :
≤ 10 µg.L-1 OR : 1 (référence)
101 – 50 µg.L-1 OR : 2,58 (0,70 – 9,56)
50,1 – 100 µg.L-1 OR : 2,98 (1,21 – 7,34) (p<0,05)
100,1 - 300 µg.L-1 OR : 3,07 (1,23 – 7,65) (p<0,05)
> 300 µg.L-1 OR : 2,62 (1,04 – 6,60) (p<0,05)
En revanche, aucun effet du polymorphisme (GT)n du gène OH-1 (allèle court (S) par rapport à allèle long (L)) sur le risque d’athérosclérose n’a été observé dans la cohorte Lanyang. Il semblerait que l’effet protecteur du polymorphisme OH-1 (S/S) sur le risque d’athérosclérose, observé uniquement dans la cohorte LMN, se manifeste uniquement en cas d’exposition à de fortes concentrations d’exposition à l’As.
Qualité de l’étude : 2, bonne qualité et en accord avec les principes scientifiques, acceptable pour l’évaluation.
Voie orale - effets sans seuil
Pour des expositions chroniques, les études de Tseng et al. (1968) ; Tseng (1977) ont été retenues par l’OEHHA, alors que Santé Canada construit sa valeur à partir de l’étude de Morales et al. (2000) qui reprend les données des études de Chen et al. (1985) et Wu et al. (1989).
L’US EPA retient 17 études pour construire sa valeur à partir d’une méta-analyse. Les références sont précisées ci-après avec le descriptif sommaire de ces études.
Morales et al. (2000)
Cette étude reprend les données des études de Chen et al. (1985) ; Wu et al., (1989) réalisées sur la même population au Sud-Ouest de Taïwan.
Type d’étude : étude environnementale.
Lieu : côte sud-ouest de Taiwan.
Nombre de personnes exposées : environ 40 000 paysans provenant de 42 villages différents.
Voie d’exposition : Ingestion par l’eau de boisson. L’eau provient de puits artisanaux souvent contaminés par de l’As ou de bas-fonds contenant des concentrations faibles voire très faibles d’As. Ces puits ont progressivement été fermés jusqu’au milieu des années 70.
Durée d’exposition : Exposition des individus toute leur vie ou depuis leur arrivée dans les villages.
Niveaux d’exposition : de moins de 10 à plus de 600 µg.L-1. répartis en 4 niveaux : < 100 µg.L-1 ; 100 – 299 µg.L-1 ; 300 – 599 µg.L-1 ; ≥ 600 µg.L-1
Groupe témoin : non
Méthode développée dans l’étude : Les certificats de décès ont été collectés entre 1973 et 1986. L’analyse commence par le calcul de Standardized Mortality Ratio (SMR) (ce qui correspond au nombre de cas observés / nombre de cas attendus x 100) en prenant comme population de référence soit la population globale taiwanaise soit la population rurale du sud-ouest (en dehors des villages contaminés). Puis plusieurs modèles mathématiques (modèle de Poisson, modèle linéaire généralisé, modèle de Weibull à plusieurs degrés) ont été utilisés pour exprimer le risque de décès vie entière en fonction de la dose d’As et de l’âge. Le critère AIC (critère d’information d’Akaike) permet de déterminer les modèles qui sont les plus adaptés aux données.
Symptômes observés : cancers de la vessie, du foie et des poumons.
Résultats : Parmi les sujets des 42 villages exposés, 614 décès (versus 254 attendus) pour les 3 types de cancers confondus (175 pour la vessie, 266 pour les poumons et 173 pour le foie) ont été observés et comparés à la population générale de Taïwan.
Les SMR augmentent nettement dans les catégories d’expositions les plus élevées, en particulier pour le cancer de la vessie et le cancer des poumons.
A noter que les résultats de leurs estimations variaient en fonction du modèle choisi.
Qualité des 2 études : Il manque des renseignements concernant la population étudiée (consommation de tabac, consommation d’eau et de nourriture, poids…). Dans cette étude, les biais de confusion ne sont donc pas pris en compte.
L’US EPA (2025) construit une valeur pour des expositions sans seuil à partir d’une méta-analyse regroupant 6 études pour le cancer du poumon (Argos et al., 2014 ; Garcia-Esquinas et al., 2013 ; Chen et al., 2010a ; Dauphiné et al., 2013 ; Ferreccio et al., 2000 ; Steinmaus et al., 2013) et 11 études pour le cancer de la vessie (Baris et al., 2016 ; Bates et al., 1995 ; Bates et al., 2004 ; Chang et al., 2016 ; Chen et al., 2010b ; Meliker et al., 2010 ; Steinmaus et al., 2003 ; Steimaus et al., 2013 ; Wu et al., 2013 ; Karagas et al., 2004 ; Michaud et al., 2004). En raison du nombre important d’études, seules les données principales sont rapportées dans 2 tableaux récapitulatifs, l’un pour le cancer du poumon et l’autre pour le cancer de la vessie.
Synthèse des principales études relatives à l’incidence du cancer du poumon lors de l’exposition à l’As utilisées pour l’élaboration de la VTR sans seuil l’US EPA (2025)
Etude (type)- Localisation | Mesure de l’exposition | Description de l’étude | Principaux Résultats : HR (Hasard Ratio) /RR (Relative Risk) /OR (Odds Ratio) (IC95%) |
(cohorte prospective) Bangladedsh | As urinaire ajusté à la créatinine (µg.g-1) <132,5 ; 132,5 - 531,9 - ; ≥332 | Large étude de cohorte (26 043 adultes) exposés à de fortes concentrations d’As via l’eau de boisson ; 90 décès par cancer du poumon ; concentration urinaire d’As mesurée à partir d’un échantillon unique ; contrôle des principaux facteurs de confusion dont le tabac. | Cancer du poumon : 5,69 (3,06 – 10,58) (ajustement par sexe (femme=1) HR : 1,61 (0,93 – 2,76) (ajustement As urinaire 1er /3e tertile) HR : 4,53 (2,82 – 7,29) (ajustement aux lésions cutanées (sans lésions = 1) |
Garcia-Esquinas et al. (2013) (cohorte prospective) Etats-Unis (Arizona, Oklahoma, Dakota nord et sud) | As urinaire ajusté à la créatinine (µg.g-1) <132,5 ; 132,5 - 531,9 ; ≥332 | Large étude de cohorte (4 549 adultes) exposés à de faibles concentrations d’As via l’eau de boisson et l’alimentation; 78 décès par cancer du poumon ; concentration urinaire d’As mesuré à partir d’un échantillon unique ; contrôle des principaux facteurs de confusion dont le tabac. | Cancer de la trachée, des bronches et des poumons HR : 1,56 (1,02 – 2 ,39) (entre 80e et 20e percentiles de concentration urinaire As inorganique + MMA et DMA) |
Chen et al. (2010a) (cohorte) Taiwan (Nord-Est) | Concentration cumulée dans l’eau de boisson (µg.L-1- année) <400 ; 400 - <1 000 ; 1 000 - < 5 000 ; 5 000 - < 10 000 ; ≥ 10 000 | Large étude de cohorte (6 888 sujets) avec un niveau d’exposition bien caractérisé pour 85 % des sujets. Large plage d’exposition, identification des cas bien documentés, bon suivi de la cohorte (12 ans), contrôle des principales co-variables | Cancer du poumon : RR : 1 RR : 0,83 (0,50 – 1,39) RR : 1,06 (0,73 – 1,56) RR : 1,87 (1,15 – 3,04) RR : 2,08 (1,33 - 3,27) selon les catégories croissantes de concentration cumulée d’eau de boisson (p =0,001) |
Dauphiné et al. (2013) (cas-témoins) Etats-Unis (Californie, Nevada) | Concentration As cumulée dans l’eau de boisson (µg.L-1- année) <0,1 ; 0,11 - 2 399 ; ≥ 2 400 | Etude cas-témoin de taille modérée (196 cas et 359 témoins) réalisée sur des sujets américains exposés majoritairement à de faibles concentrations d’As. Historique des antécédents résidentiels, consommation d’eau par questionnaire, estimation de l’exposition cumulative à l’As par des mesures d’eau potable et d’eau des puits ; principaux facteurs de confusion ajustés dans les analyses finales. | Cancer du poumon : OR : 1 OR : 0,75 (0,48 – 1,15) p=0,18 OR : 1,20 (0,45 – 3,22) p=0,71 selon les catégories croissantes de concentration cumulée d’eau de boisson (décalage de 10 ans) |
Ferreccio et al. (2000) (cas-témoins) Chili (Nord) | Concentration moy d’As dans l’eau de boisson (µg.L-1) 0 -10 (réf); 10 - 29 ; 30 – 49 ; 50 – 199 ; 200 – 400 | Etude cas-témoin de taille modérée (151 cas et 419 témoins) réalisée sur des sujets chiliens exposés à l’As via la consommation d’eau de ville; concentrations historiques bien documentées dans l’eau avec une bonne résolution dans la gamme des doses faibles à moyennes ; la cohorte a fait l’objet d’un certain nombre d’études sur les cancers liés à l’As et sur les interactions des covariables | Cancer du poumon (en fonction de la concentration As dans l’eau de boisson (par catégories croissantes): OR : 1 OR : 1,5 (0,4 – 4,6 OR : 4,0 (1,4 – 12,1) OR : 4,6 (2,2 – 10,0) OR : 8,0 (3,8 – 17,0) (ajustements sur l’âge et le sexe) |
Steinmaus et al. (2013) (cas-témoins) Chili (Nord) | Exposition. moy d’As par jour (µg.L-1) 0 -59 (réf); 60 - 199 ; 200 – 799 ; ≥ 800 | Etude cas-témoin de grande taille (306 cas et 640 témoins), exposition historique de la concentration d’As dans l’eau bien documentée, bonne résolution dans la gamme des doses faibles à moyennes. L’exposition à l’As a été déterminée à partir de l’historique du lieu de résidence et de l’eau de boisson. La cohorte a fait l’objet d’un certain nombre d’études sur les cancers liés à l’As et sur les interactions des covariables | Cancer du poumon (en fonction de la concentration As dans l’eau de boisson (par catégories croissantes): OR : 1 OR : 0,77 (0,49 – 1,21 OR : 1,38 (0,89 – 2,13) OR : 2,39 (1,61 – 3,54) (témoins appariés sur l’âge et le sexe, pas d’ajustements) |
Synthèse des principales études relatives à l’incidence du cancer de la vessie lors de l’exposition à l’As utilisées pour l’élaboration de la VTR sans seuil par l’US EPA (2025)
Etude (type) Localisation | Mesure de l’exposition | Description de l’étude | Principaux Résultats : HR (Hasard Ratio) /RR (Relative Risk) /OR (Odds Ratio) (IC95%) |
Baris et al. (2016) (cas-témoins) Etats-Unis (Nouvelle Angleterre) | Exposition cumulée à l’As (mg) (quantité totale As absorbé par voie orale dans l’eau de boisson) ≤15,7 ; >15,7 - 34,5 ; >34,5 – 77,0 ; >77,0 – 291 ; >291 – 483,6 ; >483,6 | Très large étude cas-témoin (1 213 cas et 1 418 témoins) sur la population étasunienne exposée à de faibles concentrations d’As dans l’eau de boisson. L’historique du lieu de résidence, emplois, données démographiques et personnelles sont bien détaillées. Les concentrations journalières et cumulées d’expositions à l’As sont estimées à partir de l’historique du lieu de résidence et consommation d’eau ; contrôle des covariables. | Carcinome des voies urinaires : OR : 1 (réf) OR : 1,18 (0,92 – 1,52) OR : 1,13 (0,88 – 1,46) OR : 1,32 (1,00 – 1,73) OR : 1,30 (0,74 – 2,28) OR : 1,60 (0,90 – 2,87) par catégories croissantes de concentration cumulée (p =0,12) |
Bates et al.(1995) (cas-témoins) Etats-Unis (Utah) | Exposition cumulée à l’As (mg) (quantité totale As absorbé par voie orale dans l’eau de boisson) ≤19 ; 19 - <33; 33 –<53 ; ≥53 | Etude cas-témoin de taille modérée (117 cas, 266 témoins adultes) sur la population étasunienne exposée à des concentrations de faibles à modérées d’As dans l’eau de boisson. La concentration cumulée d’exposition à l’As est dérivée à partir de l’historique du lieu de résidence et consommation d’eau ; une analyse spécifique est conduite pour les fumeurs. | Cancer de la vessie : chez les fumeurs. OR : 1 (réf) OR : 3,33 (1,0 – 10,8) OR : 1,93 (0,6 – 6,2) OR : 3,32 (1,1 – 10,3) par catégories croissantes de l’exposition. cumulée Pas de lien significatif sur le cancer de la vessie chez les non-fumeurs et sujets (fumeurs et non-fumeurs regroupés) |
Bates et al. (2004) (cas-témoins) Argentine | Concentration d’As dans l’eau de boisson (µg.L-1) 0 - 50 ; 51 - 100 ; 101 - 200 ; >200 | Etude cas-témoin de taille modérée (114 cas et témoins appariés sur l’âge, le sexe et lieu de résidence) sur une large gamme d’exposition ; mesures de la concentration d’As dans l’eau passées et récentes, principales covariables contrôlées, suivi de la durée et de la consommation d’eau de boisson ; risque examiné à partir de fenêtres d’expositions. | Cancer de la vessie : OR : 1 OR : 1,11 (0,3 – 3,7) OR : 0,81 (0,3 – 2,0) OR : 0,28 (0,1 – 1,4) selon les catégories croissantes d’As dans l’eau de boisson (pas d’associations significatives). OR : 1 (réf : non-fumeurs) OR : 2,75 (1,1 – 6,9) (fumeurs) OR : 3,82 (1,6 – 9,3) (anciens fumeurs) |
Chang et al. (2016) (cas-témoins) Taiwan (Ouest) | Concentration urinaire d’As (µg.L-1) <46 ; 46 – 86,8 ; ≥ 86,8 | Etude cas-témoin de taille modérée (205 cas et 406 témoins) recrutés dans un hôpital d’une université chinoise à Taiwan entre juin 2011 et décembre 2013 ; dosages urinaires d’As. De nombreuses études ont recherché les effets de la nutrition, le profil de méthylation, les variations génétiques entre l’As et le risque de cancer de la vessie dans cette même cohorte. | Carcinome urothélial : OR : 1,00 (1,00 – 1,05) (p<0,05) (As variable continue)
OR : 1 (réf.) OR : 0,94 (0,59 – 1,50) OR : 1,52 (0,98 – 2,37) (0,05<p<0,01) selon les catégories croissantes de concentration urinaire d’As. Associations significatives également pour Pb, Cd, Cr, Ni. |
Chen et al. (2010b) (cohorte prospective) Taiwan (Nord-Est) | Exposition As cumulée (eau de boisson) (µg.L-1-années) <400 ; 400 – <1 000 ; 1 000 - <5 000 ; 5 000 - <10 000 ; ≥ 10 000 | Très large étude de cohorte (6 888 sujets) avec mesures individuelles d’exposition de 85 % des sujets. Large éventail d’expositions, identification des cas bien documentée, suivi de la cohorte sur 12 ans. Poursuite du suivi de la cohorte (autre étude) | Cancer des voies urinaires : RR : 1 RR : 1,11 (0,27 – 4,54) RR : 2,33 (0,86 – 6,36) RR : 3,77 (1,13 – 12,6) RR : 7,49 (2,70 – 20,8) selon les catégories croissantes de concentration cumulée d’As dans l’eau (p<0,001). |
Meliker et al. (2010) (cas-témoins) Etats-Unis (Michigan) | Exposition. moy d’As dans l’eau de boisson (µg.L-1) <1 (réf.); 1 – 10 ; >10 | Etude cas-témoin de grande taille (411 cas et 566 témoins) de sujets exposés majoritairement à de faibles concentrations d’As dans l’eau de boisson (2002 à 2006). La dose journalière d’exposition est calculée à partir de l’historique de résidence, la consommation d’eau, l’emploi et style de vie. Les covariables sont contrôlées. Analyse séparée pour les fumeurs et non-fumeurs. | Cancer de la vessie : OR : 1,05 (0,92 – 1,20) (As variable continue)
OR : 1 (réf.) OR : 0,84 (0,63 – 1,12) OR : 1,10 (0,65 – 1,86) selon les catégories croissantes de concentration d’As dans l’eau. (ajustements sur l’historique de la consommation de tabac, l’éducation, l’emploi (risque d’exposition professionnelle), historique familiale du cancer de la vessie, l’âge, l’ethnie et le sexe) |
Steinmaus et al. (2003) (cas-témoins) Etats-Unis (Californie, Névada | Dose cumulée d’As (eau de boisson) (mg <6,4 (réf.); 6,4 – 82,8 ; >82,8 | Etude cas-témoin de grande taille (232 cas et 640 témoins), historique de l’As dans l’eau de boisson bien documentée, bonne résolution dans la plage d’exposition de légère à modérée. La dose journalière d’exposition est calculée à partir de l’historique de résidence et de la consommation d’eau. Les sujets de l’étude ont fait l’objet de plusieurs études sur le cancer et les interactions de plusieurs variables. | Cancer de la vessie : Latence de 5 ans OR : 1 (réf.) OR : 0,77 (0,48 – 1,24) OR : 0,73 (0,45 – 1,17) A partir des catégories croissantes de doses cumulées dans l’eau (ajustements sur l’âge, le sexe, l’emploi, l’historique de la consommation de tabac, l’éducation et l’ethnie. |
Steinmaus et al. (2013) (cas-témoins) Chili (Nord) | Exposition. moy d’As par jour (eau de boisson) (µg.L-1) 0 -59 (réf); 60 - 199 ; 200 – 799 ; ≥ 800 | Etude cas-témoin de grande taille (232 cas et 640 témoins), exposition historique de la concentration d’As dans l’eau bien documentée, bonne résolution dans la gamme des doses faibles à moyennes. L’exposition à l’As a été déterminée à partir de l’historique du lieu de résidence et de l’eau de boisson. La cohorte a fait l’objet d’un certain nombre d’études sur les cancers liés à l’As et sur les interactions des covariables | Cancer de la vessie (en fonction de la concentration As dans l’eau de boisson (par catégories croissantes): OR : 1 OR : 0,84 (0,46 – 1,52) OR : 2,50 (1,48 – 4,22) OR : 4,44 (2,75 – 7,15) (témoins appariés sur l’âge et le sexe, pas d’ajustements) |
Wu et al. (2013) (cas-témoins) Taiwan (Nord-Est) | Concentration urinaire d’As (µg.g-1. créatinie) <11,74 (réf.) ; 11,74 – 20,94 ; ≥ 20,94 | Etude cas-témoin de grande taille (300 cas et 594 témoins) recrutés dans un hôpital d’une université chinoise à Taiwan entre septembre 2002 et mai 2009 ; dosages urinaires d’As. De nombreuses études ont recherché les effets de la nutrition, le profil de méthylation, les variations génétiques entre l’As et le risque de cancer de la vessie dans cette même cohorte. | Carcinome urothélial : OR : 1 (réf.) OR : 1,42 (0,90 – 2,25) OR : 4,13 (2,69 – 6,35) p<0,0001 selon les catégories croissantes de concentration urinaire d’As (ajustements multi-variables). |
Karagas et al. (2004) (cas-témoins) Etats-Unis (New Hampshire) | Concentration d’As dans les ongles (µg.g-1) <25 (réf.) ; 25,1 – 50 ; 50,1 – 75 ; 75,1 – 90 ; 90,1 – 95 ; 95,1 – 97 ; 97,1 – 100 | Etude cas-témoin de grande taille (383 cas et 641 témoins) identifié dans le registre des cancers du NH entre juillet 1994 et juin 1998. As mesuré dans les ongles des pieds. Importants facteurs de confusion (âge, sexe, tabagisme) contrôlés. | Cancer de la vessie (carcinome) : OR : 1 (réf.) OR : 1,37 (0,96 – 1,96) OR : 1,08 (0,74 – 1,58) OR : 1,04 (0,66 – 1,63) OR : 1,33 (0,71 – 2,49) OR : 0,41 (0,11 – 1,50) OR : 1,36 (0,63 – 2,90) selon les catégories croissantes de concentration d’As dans les ongles (ajustements sur l’âge, le sexe, le tabagisme). |
Michaud et al. (2004) (cas-témoins) Finlande (Sud-Ouest) | Concentration d’As dans les ongles (µg.g-1) <0,050 (réf.) ; 0,050 – 1,105 ; 0,106 – 0,161 ; >0,161 | Etude cas-témoin de taille modérée (280 cas et 293 témoins) réalisée à partir des données provenant d’un essai randomisé sur une population d’hommes fumeurs (initié entre 1985 et 1988, suivi jusqu’en 1998) et complétée par la suite par des données de 2 registres nationaux finlandais de certificats de décès. Mesures réalisées dans les ongles des pieds. Importants facteurs de confusion (éducation, tabagisme) contrôlés. | Cancer de la vessie : OR : 1 (réf.) OR : 1,09 (0,68 – 1,74) OR : 1,13 (0,71 – 1,80) OR : 1,13 (0,70 – 1,81) p =0,65 selon les catégories croissantes de concentration d’As dans les ongles (ajustements sur l’âge, la date du prélèvement d’ongle, nbre de cigarettes et années d’années de fumeurs). |
Inhalation - effets à seuil
L’OEHHA propose une VTR aiguë à partir de l’étude expérimentale chez la souris de Nagymajtényi et al. (1985).
Pour les expositions chroniques à seuil, l’OEHHA et le RIVM proposent des VTR, toutefois, les études à partir desquelles ont été construites ces VTR ne sont pas précisées.
Nagymajtenyi et al. (1985)
Espèce étudiée : souris femelles CFLP.
Sexe et nombre d’animaux par lot : 8 à 10.
Voie d’exposition : exposition par inhalation d’aérosol de trioxyde d’arsenic As2O3 (spray d’une solution aqueuse d’As2O3 dans des chambres d’inhalation).
Temps et fréquence d’exposition : 4 heures par jour pendant 4 jours du 9ème au 12ème jour de gestation
Doses ou concentrations d’expositions : 0 - 0,26 - 2,9 et 28,5 mg.m-3 de As2O3 soit 0 - 0,2 - 2,2 et 21,6 mg.m-3 d’As. La mesure d’As dans les chambres d’inhalation a été réalisée une fois par jour.
Groupe témoin : eau distillée vaporisée.
Détail du protocole expérimental : Au 18ème jour de gestation, les souris ont été sacrifiées par une dose létale d’éther et les fœtus ont été récupérés. Les fœtus vivants et morts ont été dénombrés, tous les fœtus ont été pesés et examinés : observation du squelette (15 fœtus pour chaque groupe d’exposition), analyse des chromosomes du foie des fœtus (10 fœtus pour chaque groupe d’exposition). Toutes les données ont été analysées statistiquement avec le test de Fisher, à l’exception du poids des fœtus qui a été analysé statistiquement par le test-t afin de comparer les différents lots exposés au lot témoin.
Effet(s) observé(s) : Pour les souris exposées à la plus forte concentration d’As (21,6 mg.m-3), le nombre de fœtus vivants a significativement diminué et une détérioration du développement fœtal a été notée principalement par l’observation d’un retard de croissance in-utero chez un grand nombre de fœtus et par la présence de malformations osseuses. A cette concentration, une augmentation statistiquement significative de la fréquence des anomalies squelettiques a été constatée contrairement à ce qui a été observé aux autres concentrations (0,26 et à 2,2 mg.m-3).
Le pourcentage de fœtus morts dans les groupes exposés à 0,26 et à 2,2 mg.m-3 d’As est respectivement de 4 et de 5 % comparé aux souris du lot témoin. La diminution moyenne du poids des fœtus est de 9,9 % pour les souris exposées à 2,2 mg.m-3 d’As et de 3,7 % pour les souris exposées à 0,26 mg.m-3. Cette diminution du poids des fœtus est statistiquement significative, contrairement au nombre de fœtus présentant un retard de croissance in-utero. La fréquence des malformations osseuses chez les fœtus est également augmentée pour le lot exposé à 2,2 mg.m-3 d’As, mais cette augmentation n’est pas statistiquement significative.
L’As augmente également de façon significative la fréquence des aberrations chromosomiques (échanges des chromatides sœurs et fragmentations chromosomiques), mais uniquement chez les fœtus issus des souris exposées à la plus forte concentration (21,6 mg.m-3). Cette augmentation est non significative chez les fœtus issus des souris exposées aux deux autres concentrations (0,26 et à 2,2 mg.m-3).
Conclusion : A 21,6 mg.m-3, l’As induit une réduction du nombre de fœtus vivants, une diminution du poids de ces fœtus, une augmentation des fœtus présentant un retard dans l’ostéogenèse ainsi qu’une augmentation de la fragmentation chromosomique et de la fréquence des échanges des chromatides sœurs. Ces effets sont statistiquement significatifs. Pour les autres concentrations testées (0,26 et à 2,2 mg.m-3), seule la diminution moyenne du poids des fœtus est significative (diminution toutefois légère).
Dose critique : NOAEL = 2,2 mg.m-3 si on ne prend pas en compte la diminution du poids des fœtus comme effet critique. En effet, cette diminution est statistiquement significative pour le groupe exposé à 2,2 mg.m-3 d’As (diminution de 9,9 % par rapport au témoin) et également pour la concentration inférieure testée (0,26 mg.m-3) (diminution de 3,7 % par rapport au témoin). Seule la diminution du poids des fœtus est significative à ces deux concentrations.
Aucun NOAEL ne peut être déterminé pour la diminution du poids du fœtus car cet effet est observé dès la plus faible concentration testée.
LOAEL = 21,6 mg.m-3 pour les effets sur la mort des fœtus, l’augmentation de la fréquence des malformations osseuses et pour les aberrations chromosomiques.
LOAEL = 0,2 mg.m-3 uniquement pour les effets sur la diminution du poids des fœtus.
Qualité de l’étude : 2, étude bien documentée et en accord avec les principes scientifiques, acceptable pour l’évaluation avec toutefois une limite concernant l’absence de donnée concernant la toxicité maternelle. . Il n’est donc pas possible de savoir si les effets observés chez le fœtus sont secondaires à une souffrance maternelle ou directement imputables à l’action de l’As.
Inhalation - effets sans seuil
Les études qui ont été utilisées pour la construction des VTR chroniques sont des études épidémiologiques chez des travailleurs :
- Enterline et Marsh (1982) ; Higgins et al. (1986) ; Lee-Feldstein (1983) pour l’US EPA,
- Higgins et al. (1986) pour Santé Canada,
- Enterline et al. (1987) ; Higgins et al. (1986) ; Lee-Feldstein (1986) pour l’OEHHA et
- Enterline et al. (1987 et 1995) ; Lubin et al. (2000 et 2008) ; Jarup et al. (1989) pour le TCEQ
Enterline et al. (1987).
Type d’étude : étude de cohorte et étude cas-témoins nichée dans l’étude de cohorte.
Lieu : 8 fonderies de cuivre aux Etats-Unis.
Nombre de personnes étudiées : 6 078 salariés de sexe masculin et de type caucasien qui ont travaillé au moins 3 ans entre le 1er janvier 1946 et le 31 décembre 1976 dans une ou plusieurs fonderies parmi 8 fonderies de cuivre aux Etats Unis.
Voie d’exposition : inhalation.
Durée d’exposition : au minimum 3 ans.
Niveau d’exposition : moyenne de la concentration d’As pour chacune des fonderies (6 sur 8) en mg.m-3 : 12,9 - 68,6 - 12 - 8,1 ; 7 et 7,5 ; catégorie de concentrations d’As exprimée en fonction de la durée d’exposition (µg.m-3 année) pour l’ensemble de 6 fonderies : inférieur à 100 ; entre 100 et 249 ; entre 250 et 999 et 1 000 d’exposition ou plus.
Groupe témoin : 4 types de populations témoins ont été utilisés. L’ensemble de la population masculine de type caucasien aux Etats-Unis, la population masculine de type caucasien vivant dans les états où se trouvent les fonderies, la population masculine de type caucasien des pays ou des groupes de pays où sont localisées les fonderies, et un groupe témoin interne.
Symptômes observés : Le taux de mortalité est observé ainsi que la cause de cette mortalité : taux de mortalité pour tous les effets, pour l’ensemble des cancers et pour les cancers du poumon.
Méthode développée dans l’étude : L’exposition à l’As, mais également celle au dioxyde de soufre, aux poussières, au nickel, au cadmium et au plomb ont été estimées à partir d’une enquête rétrospective d’hygiène industrielle.
La mortalité chez les salariés a été regardée du 1er janvier 1949 au 31 décembre 1980. Les SMR ont été calculés pour le taux de mortalité liée à tous les effets (de 1960 à 1980), pour le taux de mortalité par cancers (de 1949 à 1980) et pour le taux de mortalité par cancers du poumon (de 1949 à 1980) en prenant les 4 types de population témoin cités ci-dessus.
Une analyse de la mortalité due aux cancers du poumon en relation avec l’exposition individuelle à l’As, exprimée en µg.m-3.année, a été également réalisée pour 6 des 8 fonderies.
Une étude cas-témoin incluse dans l’étude de cohorte a été réalisée afin d’analyser l’effet de la consommation du tabac sur la relation entre l’exposition à l’As ou au dioxyde de soufre et le taux de mortalité pour cancers du poumon.
Résultat de l’étude : Pour presque toutes les fonderies, les SMR calculés pour toutes causes de décès, pour tous les cancers et pour les cancers du poumon, en prenant comme population de référence successivement la population témoin masculine de type caucasien vivant aux Etats-Unis et la population masculine de type caucasien vivant dans les pays où se trouvent des fonderies, sont identiques ou très proches, à l’exception de certaines fonderies se trouvant dans des états particuliers, par exemple dans un état où la population Mormon est très importante.
L’ensemble des données montre une légère relation entre l’exposition à l’As et le taux de mortalité due aux cancers du poumon (ajustement sur l’âge, l’année calendaire et la période de latence).
Cette relation est plus importante pour une des fonderies où l’apport de l’As par la nourriture est élevé. Dans une des fonderies, le taux de mortalité par cancers est extrêmement faible, mais aucune explication n’a été trouvée par les auteurs.
De plus, en comparant au groupe témoin interne, une relation dose-réponse a été observée entre les cancers du poumon et l’exposition à l’As et au dioxyde de soufre.
L’étude cas-témoins incluse dans l’étude de cohorte, dans laquelle les données sur la consommation de tabac ont été intégrées avec les données concernant l’exposition à l’As et au dioxyde de soufre, montre que seuls l’As et la consommation de tabac sont des facteurs statistiquement significatifs. L’As apparaît comme étant la 1ère cause de cancer du poumon chez les salariés des fonderies après ajustement pour la consommation de tabac et l’exposition au dioxyde de soufre. Par contre, il n’est pas possible de rejeter l’hypothèse selon laquelle l’As, le dioxyde de soufre et la consommation de tabac puissent avoir un effet multiplicatif.
L’analyse de la mortalité due aux cancers du poumon en relation avec l’exposition individuelle à l’As pour 6 fonderies montre que le risque de mortalité par cancer du poumon augmente en fonction de la concentration d’As exprimée en µg.m-3 année. Les concentrations d’As ont été moyennées pour l’ensemble des fonderies.
Cette étude met en avant la difficulté de trouver une population témoin pour le calcul du taux de mortalité attendu, le type de population témoin à prendre varie en fonction de la fonderie considérée et surtout du lieu où elle se trouve.
Cette étude montre que le manque de dossiers pour certains salariés peut modifier les résultats concernant la relation ente le taux de mortalité et l’exposition à l’As, même si le nombre de dossiers manquants est faible.
Qualité de l’étude : Cette étude s’est intéressée aux salariés provenant de 8 fonderies différentes se trouvant aux Etats-Unis. Pour ces raisons, de grandes différences ont été trouvées en fonction des fonderies. Par exemple, dans une des fonderies, le niveau d’exposition à l’As était trop faible pour estimer l’exposition individuelle des salariés. L’exposition à l’As ainsi que celle au dioxyde de soufre peut également varier beaucoup en fonction des fonderies et de la date de construction de ces fonderies. Ceci montre qu’il y a des spécificités en fonction des fonderies et également en fonction du lieu où elles se situent. Par contre, cette étude a pris en compte l’exposition des salariés au dioxyde de soufre, la consommation de tabac et l’âge des salariés. De plus, cette étude analyse de façon identique les données issues de 8 fonderies différentes.
Enterline et Marsh (1982) et Enterline et al. (1995)
Type d’étude : cas-témoins chez des salariés travaillant dans une fonderie de cuivre.
Lieu : Tacoma, état de Washington.
Nombre de personnes étudiées : 2 802 salariés de type caucasien et de sexe masculin.
Voie d’exposition : inhalation.
Durée d’exposition : un an ou plus, pendant la période de 1940 à 1964.
Niveau d’exposition : La concentration de trioxyde d’As dans l’air autour et dans la fonderie a été mesurée ainsi que la concentration d’As dans les urines des salariés. La concentration en As dans les urines est divisée en 5 groupes : inférieure à 500 µg.L-1, entre 500 et 1 500 µg.L-1, entre 1 500 et 3 000 µg.L-1, entre 3 000 et 7 000 µg.L-1 et supérieure ou égale à 7 000 µg.L-1 d’As.
Groupe témoin : hommes de type caucasien de sexe masculin vivant dans l’état de Washington ou aux Etats-Unis.
Symptômes observés : mortalité induite par différentes maladies (cancers respiratoires, cancers digestifs, leucémies, tuberculoses, maladies cardiaques...).
Méthode développée dans l’étude : Cette étude reprend les données d’une étude précédente (Enterline et Marsh, 1980), mais des données nouvelles ont été ajoutées : il est rapporté que les salariés qui se trouvaient dans des zones où la concentration en As était importante portaient des protections individuelles (vêtements et masques).
La mesure de l’As dans les urines des salariés a été réalisée, ainsi que des calculs du SMR en fonction de la concentration en As et de la durée d’exposition (durée de l’embauche et temps écoulé depuis la 1ere exposition). Le SMR est évalué en divisant le nombre de morts par cancers respiratoires observé dans la fonderie par le nombre attendu de morts par cancers respiratoires dans la population générale. Le nombre attendu de morts par cancers respiratoires dans la population générale est calculé à partir des données obtenues chez les hommes de type caucasien de sexe masculin vivant dans l’état de Washington ou aux Etats-Unis.
Résultat de l’étude : Une relation faiblement positive entre le degré d’exposition à l’As et le nombre de cancers respiratoires a été observée. L’étude de 1995 a intégré 522 cas de mortalité supplémentaires portant le total à 1 061. Les résultats de cette étude montrent, pour une exposition d’au moins un an entre 1940 et 1964, un SMR statistiquement significatif (p<0,05) de 316 pour la catégorie fortement exposée (≥ 45 mg.m-3).
Qualité de l’étude : D’après les auteurs, les salariés ont été exposés à d’autres polluants tels que le dioxyde de soufre. Dans ce cas, selon eux, il est difficile de prouver que l’As soit le seul agent cancérogène. De plus, il est probable que le port de masque de protection ait limité les niveaux d’exposition. Toutefois, certaines études ont montré l’effet de l’As sur les cancers respiratoires en absence de dioxyde de soufre (Mabuchi et al., 1979 ; Ott et al., 1974). De plus, le dioxyde de soufre n’est pas classé par l’Union européenne, ni par l’US EPA, pour son caractère cancérogène et a été classé en groupe 3 par l’IARC en 1987 (l’agent ne peut être classé pour sa cancérogénicité pour l’homme).
Jarup et al. (1989).
Type d’étude : étude de cohorte.
Lieu : fonderie située en Suède.
Nombre de personnes étudiées : 3 916 salariés de sexe masculin incluant les salariés employés au moins 3 mois à partir de 1928 jusqu'à 1967. Ces sujets sont suivis jusqu’en 1981.
Voie d’exposition : inhalation.
Durée d’exposition : en fonction de la date à laquelle les employés ont été embauchés ; au minimum, 3 mois d’exposition à l’As.
Niveau d’exposition : Une matrice emploi x exposition à l’As a été réalisée pour chaque période d’exposition selon le type de travail, utilisant des mesures de l’air ambiant (les premières mesures datent de 1945) et prenant en compte les changements dans les méthodes de production. Sept catégories d’expositions à l’As ont été définies en mg.année.m-3 : < 0,25 ; 0,25 à <1 ; 1 à < 5 ; 5 à < 15 ; 15 à < 50 ; 50 à < 100 et de 100 à plus. Une matrice du même ordre a été effectuée pour le dioxyde de soufre.
Groupe témoin : population vivant en Suède.
Symptômes observés : taux de mortalité lié aux cancers du poumon et à d’autres maladies (cardiopathie ischémique et maladies cérébrovasculaires).
Méthode développée dans l’étude : La relation entre l’exposition à l’As et le taux de mortalité dû aux cancers du poumon et à d’autres maladies (cardiopathie ischémique et maladies cérébrovasculaires) a été recherchée pour les salariés en calculant le SMR . Le nombre de cas attendu a été calculé à partir des données issues de la population témoin.
Résultat de l’étude : La relation entre l’exposition cumulative à l’As et la mortalité liée aux cancers du poumon a été recherchée chez les salariés. Aucune relation dose-réponse n’est observée pour la plus faible dose d’As (< 0,25 mg.m-3.année).
La cohorte a été divisée en 3 sous-cohortes : les salariés embauchés avant 1940, ceux embauchés entre 1940 et 1950 et ceux embauchés après 1950. Une relation dose-réponse positive entre la mortalité liée aux cancers du poumon et l’exposition à l’As a été retrouvée dans les 3 catégories. Mais cette relation n’est statistiquement significative que pour les salariés embauchés avant 1940.
Le niveau de l’exposition à l’As joue un rôle plus important dans l’augmentation de la mortalité liée aux cancers du poumon que la durée de l’exposition.
Aucune relation n’a été constatée entre la survenue de cardiopathies ischémiques ou de maladies cérébrovasculaires et l’exposition à l’As.
Cette étude a également montré que la consommation de tabac n’explique pas l’association trouvée entre l’exposition à l’As et les cancers du poumon chez les salariés travaillant dans la fonderie. De plus, aucune association apparente entre l’exposition au dioxyde de soufre et la mortalité due aux cancers du poumon n’a été trouvée.
Qualité de l’étude : L’étude est de bonne qualité. Cependant, seules des fourchettes de concentrations d’exposition à l’As sont rapportées, issues d’une matrice emploi x exposition. Une relation dose-réponse pour les cancers du poumon a toutefois pu être établie.
Lee-Feldstein (1983)
Type d’étude : cohorte chez des salariés travaillant dans une fonderie de cuivre. Cette étude reprend l'étude de Lee et Fraumeni (1969) dans laquelle la mortalité des salariés a été étudiée de 1938 à 1963 et celle de Lubin (1981) dans laquelle la mortalité étudiée était élargie à la période 1938-1977.
Lieu : fonderie de cuivre située dans le Montana.
Nombre de personnes étudiées : 8 045 salariés de type caucasien de sexe masculin ayant été employés dans la fonderie de cuivre, 12 mois au moins, avant le 31 décembre 1956 (cohorte d’origine).
Voie d’exposition : inhalation.
Durée d’exposition : en fonction de la date à laquelle les employés ont été embauchés. L’histoire professionnelle de tous les salariés a été reconstituée, depuis la date d’embauche jusqu’au 30 septembre 1977 permettant une meilleure évaluation de l’exposition que l’étude initiale.
Niveau d’exposition : Un indice de 1 à 10, établi au sein de l’entreprise avant l’étude d’origine de Lee et Fraumeni, (1969) indique la quantité de trioxyde d’As et de dioxyde de souffre dans l’atmosphère de chaque local de la fonderie. La concentration de trioxyde d'As présente dans les différents locaux a été classée par catégorie (concentration élevée, moyenne ou faible).
Groupe témoin : population générale vivant dans le Montana.
Symptômes observés : mort des salariés induite par différentes maladies : la tuberculose, les cancers respiratoires, les maladies cardiaques et l'emphysème.
Méthode développée dans l’étude : La présente étude reprend les données de mortalité fournies du 1er janvier 1938 au 30 septembre 1963 par l'étude de Lee et Fraumeni (1969) et la complète par les données de mortalité obtenues de 1964 au 30 septembre 1977. De plus, des efforts ont été faits pour retrouver le devenir des « perdus de vue » de l’étude initiale (773 hommes en décembre 1963). Les salariés n’ayant pas été pris en compte lors de l’étude d’origine ont été inclus dans la nouvelle étude.
Les salariés ont été divisés en 3 cohortes selon la date de première embauche : cohorte I, avant 1925 ; cohorte II, de 1925 à 1947 et cohorte III, de 1948 à 1955. Dans chaque cohorte, les salariés ont été classés en fonction de la durée de travail dans la fonderie.
Résultats de l’étude : La mortalité observée chez les salariés de la fonderie est 3 fois plus élevée que celle attendue dans la population générale de Montana (population témoin). La mortalité est plus souvent induite par des cancers respiratoires et des maladies cardiaques, mais également, dans une plus faible proportion, par des emphysèmes et des cirrhoses du foie. Dans la cohorte I, la mortalité induite par les cancers respiratoires est 5 fois plus élevée que celle attendue dans la population générale du Montana. Elle est de 1,5 à 2 fois plus élevée dans les cohortes II et III. En présence de trioxyde d'As, la mortalité induite par des cancers respiratoires dans la cohorte I est très élevée (8 x plus élevée que celle attendue dans la population générale) et est proportionnelle au niveau d'As. Il en est de même pour l'exposition conjointe à l'As et au dioxyde de soufre.
Par contre, les poussières de ferromanganèse n'augmentent pas significativement la mortalité induite par des cancers respiratoires.
La mortalité liée aux cancers respiratoires dans les cohortes II et III est également proportionnelle à la concentration d'As et à l'association arsenic-dioxyde de soufre.
Qualité de l'étude : Dans cette étude, les salariés ont été également exposés à du dioxyde de soufre, composé cité par les auteurs comme pouvant induire des cancers respiratoires. Les auteurs ont pris en compte cette exposition au dioxyde de soufre pour examiner la relation entre l’exposition à l’As et le taux de mortalité due aux cancers du poumon. Toutefois, il est important de préciser que ni l’US EPA, ni l’Union européenne, n’a classé le dioxyde de soufre pour son caractère cancérogène. De plus, en 1992, l’IARC a classé cette substance en groupe 3 (l’agent ne peut être classé pour sa cancérogénicité pour l’homme). Une potentialisation des effets doit également être prise en compte.
Les concentrations exactes de trioxyde d’As auxquelles ont été exposés les salariés ne sont pas connues, seuls des niveaux de concentrations ont été donnés.
En effet, dans l'étude d’origine, celle de Lee et Fraumeni, (1969), les auteurs indiquent que les concentrations en As dans les locaux ont été classées en fonction d'une échelle : faibles concentrations : 1 à 3 ; concentrations moyennes : 4 à 7 et concentrations élevées : 8 à 10 et donne comme référence des données non publiées. Ce type de classification a été également réalisé pour les niveaux d’exposition au dioxyde de soufre.
La consommation de tabac des salariés n’a pas été prise en compte.
Lubin et al. (2000 et 2008).
L’étude de 2000 a analysé les données et celles de 2008 ont complété cette analyse.
Type d’étude : cohorte de salariés travaillant dans une fonderie de cuivre. Cette étude reprend l'étude de Lee et Fraumeni (1969) dans laquelle la mortalité des salariés a été étudiée de 1938 à 1963 et la prolonge jusqu’à fin1989.
Lieu : fonderie de cuivre située dans le Montana.
Nombre de personnes étudiées : 8 014 salariés de type caucasien de sexe masculin ayant été employés dans la fonderie de cuivre, 12 mois, au moins, avant le 31 décembre 1956. Le suivi de cette cohorte commence un an après l’embauche ou le 1/01/1938 et continue jusqu’au 31 décembre 1989. Des mesures des concentrations de l’As dans l’air réalisées entre 1943 et 1958 ont été utilisées pour calculer une moyenne pondérée par le temps de passage dans les 3 niveaux de concentrations (Low, Medium et Heavy) des travailleurs et a abouti aux valeurs moyennes de 0,29, 0,58 et 11,3 mg.m-3 pour ces 3 niveaux. Enfin une mesure d’exposition cumulée a été construite notée d = 0,29 L + 0,58 M + 11,3 H x c où c est une constante traduisant l’utilisation de masques protecteurs.
Voie d’exposition : inhalation.
Durée d’exposition : en fonction de la date à laquelle les employés ont été embauchés. Maximum : 52 ans.
Niveau d’exposition : La concentration de trioxyde d'As présente dans les différents locaux a été classée par catégorie (concentration élevée, moyenne ou faible). Cette classification a été réalisée dans l'étude d’origine de Lee et Fraumeni, (1969).
Groupe témoin : population générale vivant dans le Montana.
Symptômes observés : mort des salariés induite par différentes maladies : la tuberculose, les cancers respiratoires, les maladies cardiaques et l'emphysème.
Méthode développée dans l’étude : L’étude reprend les données des précédentes études notamment celle de Lee-Feldstein, (1983) et les complète jusqu’au 31 décembre 1989. Le statut vital est déterminé à partir de la base des enregistrements des décès et la cause de la mortalité est issue des certificats de décès. Les personnes dont le statut vital n’est pas connu sont considérées comme vivantes à l’exception de 81 personnes nées avant 1900 et qui ont dépassés les 90 ans et sont considérées comme décédées d’une cause inconnue. L’étude procède par le calcul de SMR, une analyse interne par modélisation de l’excès de risque relatif.
Résultats de l’étude : Il a été montré que 4 930 des 8 014 travailleurs sont décédés (62 %), 1 909 (24 %) sont en vie et 1 175 (15 %) ont un statut vital inconnu. Il y est déterminé une augmentation significative des SMR, toutes causes de mortalité confondues (SMR =1,14 ; IC 95% : 1,10-1,18), toutes causes de cancers (SMR =1,13 ; IC 95% : 1,07-1,21), de cancers pulmonaires (SMR = 1,55 ; IC 95% : 1,41-1,70), de pathologies du système nerveux et des organes des sens (SMR =1,31 ; IC 95% :
1,01-1,70), de pathologies du système respiratoire non malignes (SMR = 1,56 ; IC 95% : 1,42-2,12), et d’emphysème (SMR = 1,73 ; IC 95% : 1,41-2,12).
Le risque relatif de cancers respiratoires (régression de Poisson) augmente linéairement avec la durée d’emploi dans chaque catégorie, l’excès de risque apparaît à partir de 0,21 (mg.m-3)-1 par an (IC 95% : 0,10-0,46). Lors de la réanalyse de 2008, une relation dose-effet a été mise en évidence avec les concentrations en As.
Qualité de l'étude : Comme précisé précédemment, dans cette étude, les salariés ont été également exposés à du dioxyde de soufre, composé cité par les auteurs comme pouvant induire des cancers respiratoires. Les auteurs ont pris en compte cette exposition au dioxyde de soufre pour examiner la relation entre l’exposition à l’As et le taux de mortalité due aux cancers du poumon.
Les concentrations exactes de trioxyde d’As auxquelles ont été exposés les salariés ne sont pas connues, seuls des niveaux de concentrations sont donnés. En effet, dans l'étude d’origine, celle de Lee et Fraumeni, (1969), les auteurs indiquent que les concentrations en As dans les locaux ont été classées en fonction d'une échelle : faibles concentrations : 1 à 3 ; concentrations moyennes : 4 à 7 et concentrations élevées : 8 à 10 et donne comme référence des données non publiées. Ce type de classification a été également réalisé pour les niveaux d’exposition au dioxyde de soufre.
La consommation de tabac des salariés n’a pas été prise en compte.
VTR existantes
Effets à seuil - Exposition aigu par inhalation :
L'OEHHA propose un REL de 0,2 µg.m-3 pour une exposition d’une heure par inhalation (OEHHA, 2015).
Les éléments relatifs à cette valeur sont précisés dans le document de l’OEHHA 2008, révisé en 2014 et repris de manière synthétique en 2015. Cette valeur est issue d'une étude expérimentale chez des souris gestantes exposées à l'arsenic (As2O3) entre les jours 9 et 12 de gestation (4 h par jour), à des concentrations de 0 - 0,26 - 2,9 - 28,5 mg As2O3.m-3 (0 - 0,2 - 2,2 - 21,6 mg As.m-3) (Nagymajtenyi, Selypes et al., 1985). Une LOAEC de 0,2 mg As.m-3 a été établie pour les effets tératogènes : diminution du poids fœtal, retards de croissance intra-utérine et malformations osseuses.
Facteur d'incertitude : un facteur 10 est appliqué pour l'utilisation d'une LOAEC, un facteur 10 pour l'extrapolation des données animales à l'homme (variabilité interspécifique) et un facteur 10 pour la variabilité au sein de la population (variabilité intraspécifique).
Calcul : 0,2 mg.m-3 x 1/1000 = 2.10-4 mg.m-3
Indice de confiance : L’OEHHA ne propose pas d’indice de confiance
Effets à seuil - Exposition chronique par inhalation :
Le RIVM propose une TCA de 1 µg.m-3 pour une exposition chronique par inhalation (Baars et al., 2001).
Les composés inorganiques de l'arsenic trivalent présentent un potentiel cancérigène chez l'homme après inhalation (ATSDR, 2000). Cependant, le RIVM indique que le mécanisme d'induction des tumeurs n'est pas génotoxique et qu'il existe donc un seuil pour cet effet (Baars et al., 2001). Le RIVM a donc établi une TCA et non une valeur de risque pour le cancer. La LOAEC pour le cancer du poumon est de 10 µg.m-3 (ATSDR, 2000) et a servi à calculer la valeur de TCA.
Cette valeur est aussi protectrice pour les effets cancérigènes.
Facteur d'incertitude : un facteur 10 est appliqué pour tenir compte de la variabilité au sein de la population humaine.
Calcul : 10 µg.m-3 x 1/10 = 1 µg.m-3
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
L'OEHHA propose un REL de 1,5.10-2 µg.m-3 pour une exposition chronique par inhalation (OEHHA, 2015).
Les éléments relatifs à cette valeur sont précisés dans le document de l’OEHHA 2008, révisé en 2014 et repris de manière synthétique en 2015. Cette valeur est le résultat d’une extrapolation voie à voie, réalisée à partir de la REL déterminée pour la voie orale, décrite ci-après. Pour ce faire, l’OEHHA a pris en compte une absorption de l’arsenic deux fois plus importante par voie respiratoire que par voie orale, un volume inhalé de 9,9 m3 par jour et un poids moyen des enfants de 21,9 kg.
Calcul : (3,5.10-6 mg.kg-1.j-1 x 21,9 kg / 9,9 m3) x 2 = 1,5.10-5 mg.m-3
La REL proposée pour une exposition de 8 heures est définie par l’OEHHA comme la concentration pour laquelle, ou en dessous de laquelle, des effets non cancérigènes ne sont pas attendus, suite à des expositions répétées de 8 heures. Compte tenu de la forte probabilité d’expositions répétées à l’arsenic et de la lente clairance de ce composé, cette REL 8 heures est assimilée à la REL chronique.
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 5.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale à l’arsenic (ATSDR, 2007).
Cette valeur est établie à partir d’une intoxication massive de 220 personnes, ayant consommé de la sauce de soja contaminée par 100 mg.L-1d’arsenic sous forme d’arséniate de calcium (Mizuta, Mizuta et al., 1956). Les doses journalières estimées sont de 3 mg.j-1 soit 0,05 mg.kg-1.j-1, pour une exposition comprise entre 2 et 3 semaines. Les signes cliniques retenus sont l’œdème de la face et les symptômes gastro-intestinaux (nausées, vomissements et diarrhées). De cette étude, un LOAEL de 0,05 mg.kg-1.j-1 est déduit.
Facteurs d’incertitude : un facteur 10 est appliqué pour l’extrapolation à partir d’un LOAEL.
Calcul : 0,05 mg.kg-1.j-1 x 1/10 = 5 10-3 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 6.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’As inorganique (US EPA (IRIS), 2025).
Cette valeur a été établie à partir de 2 méta-analyses prenant en compte d’une part la survenue du diabète de type 2, avec 4 études épidémiologiques retenues (Grau-Perez et al., 2017 ; James et al., 2013 ; Pan et al., 2013b ; Coronado-González et al., 2007), et d’autre part les maladies cardiaques ischémiques avec 5 études épidémiologiques retenues (Wu et al., 2010 ; Moon et al., 2013 ; James et al., 2015 ; Chen et al., 2013 ; Wade et al., 2015).
Les données relatives aux effets de l’exposition à l’As sur le diabète de type 2 sont issues de 2 études de cohortes réalisées aux Etats-Unis (Grau-Perez et al., 2017 ; James et al., 2013) et de 2 études cas-témoins, la première nichée dans une cohorte mexicaine (Coronado-González et al., 2007), la seconde étant réalisée au Bangladesh.
Concernant les effets cardiaques, l’incidence et la mortalité des maladies cardiovasculaires (regroupant notamment l’athérosclérose, les accidents vasculaires cérébraux) et des maladies cardiaques ischémiques (angines de poitrine, infarctus du myocarde) ont été examinées dans 4 cohortes, dont 2 réalisées aux Etats-Unis (James et al., 2015 ; Moon et al., 2013), l’une au Bangladesh (Chen et al., 2013) et la dernière à Taiwan (Wu et al., 2010). Seule une étude cas-témoin réalisée en Chine a retenu uniquement l’incidence non fatale de MCV (Wade et al., 2015).
Les données des différentes études ont été utilisées pour modéliser la relation dose-réponse entre l’exposition à l’As et le risque de diabète de type 2 ou de maladies cardio-vasculaires en appliquant une approche bayésienne. Les données d’exposition individuelles exprimées en concentration d’As dans l’urine (µg.g-1 de créatine) ou dans l’eau (µg.L-1) ont été converties par l’US EPA en dose journalière (µg.kg-1.j-1) en utilisant des modèles physiologiques PBPK basés sur l’excrétion d’As et sur la consommation d’eau. Une synthèse des études et des calculs de l’US EPA est présentée dans le tableau ci-dessous.
Synthèse des principaux résultats des études relatives à l’incidence du diabète et des maladies cardiaques lors de l’exposition à l’As utilisés pour l’élaboration de la VTR chronique à seuil de l’US EPA (2025)
Etude (type) Localisation | Mesure de l’exposition | Estimation de l’exposition moyenne µg.kg-1.j-1 (équivalent eau potable µg.L-1) (calcul de l’US EPA) | Description de l’étude | Principaux Résultats |
|---|---|---|---|---|
Grau-Perez et al. (2017) (cas-témoins nichée dans une cohorte) Etats-Unis (Arizona, Oklahoma, Dakota du Nord et du Sud) | Concentration urinaire d’As (µg.g-1 créatinine) ≤3,3 ; 3,3 – 5,8 ; >5,8 | 0,066 – 0,276 (4,18 – 23,3) | Cohorte de taille moyenne (1 838 sujets) dont 125 cas de diabète chez des adultes exposés par l’eau contaminée. Contrôle dans l’analyse des principaux facteurs de confusion dont le tabac. | Incidence du diabète de type 2 HR : 1,63 (1,23 – 2,15) entre le premier quartile vs troisième quartile. |
James et al. (2013) (cas-témoins nichée dans une cohorte) Etats-Unis (Colorado) | Exposition dans l’eau de boisson (µg.L-1-année) ≤ 4 ; > 4 à ≤ 8 ; >8 à ≤ 20 ; > 20 | 0,135 – 0,61 (10,05 – 53,6) | Sous-cohorte de la San Luis Valley Diabetes Study regroupant 141 cas de diabète sur un total de 548 sujets. Ajustement des principales covariables (ethnie, genre, statut socio-économique, éducation, IMC, statut de fumeur, âge, consommation d’alcool et activité physique). | Incidence du diabète de type 2 HR : 1,27 (1,02 – 1,64) (p=0,04) entre le 1er et le 3e quartile. |
Coronado-Gonzalez et al. (2007) (transversale) Mexique (région de Cohuila) | Concentration urinaire d’As (µg.g-1 créatinine) < 63,5 (réf); 63,5 - 104 ; > 104 | 1,37– 4,81 (122,7 – 435,5) | Etude cas-témoin (200 cas et 200 témoins) nichée dans une étude de cohorte. Contrôle dans l’analyse des principaux facteurs de confusion incluant l’âge, l’hypertension, l’historique familiale du diabète, l’obésité (non prise en compte du tabac). | Incidence du diabète de type 2 : OR : 1 OR : 2,16 (1,23 – 3,79) OR : 2,84 (1,64 – 4,92)) selon les catégories croissantes d’As urinaire |
Pan et al. (2013) (cas-témoins) Bangladesh | Exposition As (eau de boisson) (µg.L-1) ≤1,7 (réf); 1,8 – 15,5; 15,6 - 170 ; ≥ 170,1 | 1,5– 23,20 (134,5 – 2 107) | Etude cas-témoin de grande taille (84 cas et 827 témoins) Ajustement du modèle pour les principales covariables (âge, sexe, IMC, statut de fumeur et lésions de la peau) | Incidence du diabète de type 2 : OR : 1 (réf) OR : 1,92 (0,84 – 4,35) OR : 3,07 (1,38 – 6,85) OR : 4,51 (2,01 – 10,09) Significatif dans les 3e et 4e quartiles par rapport au 1er quartile. |
Chen et al. (2013) (cas-témoins nichée dans une cohorte) Bangladesh | Exposition. moy d’As dans l’eau (µg.L-1) 0,1 – 25 ; 25,1 – 107 ; 108 - 864 | 1,8 – 12,8 (161,8 – 1 161) | Sous cohorte de 1 109 sujets sélectionnés à partir de la cohorte Health Effects of As Longitudinal Study (HEALS) avec 369 cas de maladies cardiovasculaires (211 cas de maladies cardiaques et 148 cas d’AVC). Contrôle dans l’analyse des principaux facteurs de confusion incluant l’âge, le sexe, l’IMC, l’hypertension, le diabète du diabète et les écarts de As entre les différentes visites. | Maladies cardio-vasculaires (MCV) (maladies cardiaques (MC) / AVC) (fatales et non fatales) HR : 1,15 (1,01 – 1,30) MCV HR : 1,20 (1,04 – 1,38) MC HR : 1,08 (0,9 – 1,30) AVC pour une augmentation de 112 µg.L-1 |
James et al. (2015) (cas-témoins nichée dans une cohorte) Etats-Unis (Colorado) | Concentration As eau de boisson (µg.L-1. année) 1 - 20 (réf) ; 20 – 30 ; 30 - 45 ; 45 - 88 | 0,2 – 0,8 (16,4 – 70,9) | Sous-cohorte de la San Luis Valley Diabetes Study regroupant 96 cas de maladies coronariennes et 459 témoins. Ajustement des principales covariables (ethnie, genre, statut socio-économique, éducation, IMC, statut de fumeur, âge, consommation d’alcool et activité physique, lipides sériques et consommation de micronutriments). | Maladies coronariennes (MCor.) (fatales et non fatales) HR : 1 (réf) HR : 1,23 (0,56 – 2,18) HR : 2,18 (1,23 – 4,02) HR : 3,10 (1,10 – 9,11) selon les catégories croissantes de concentration d’As eau de boisson (ajustements multi-variables). |
Moon et al. (2013) (cohorte prospective) Etats-Unis (Arizona, Oklahoma, Dakota du Nord et du Sud) | Concentration urinaire d’As (µg.g-1 créatinine) < 5,8 ; 5,8 – 9,7 ; 9,8 – 15,7 ; >15,7 | 0,18 – 0,64 (14,5 – 56,4) | Large cohorte de 3 575 Amérindiens exposés à de faibles concentrations d’As avec un taux de diabète et MCV relativement élevé. Ajustement du modèle pour les principales covariables (âge, sexe, IMC, statut de fumeur, LDL et cholestérol) | Maladies cardiovasculaires (MCV / Maladies coronarienne (MCor.) /AVC (mortalité) HR : 1,65 (1,20 – 2,27) MCV HR : 1,71 (1,19 – 2,44) MCor. HR : 3,03 (1,08 – 8,50) AVC entre le 1er et 4e quartile |
Wade et al. (2015) (cas-témoins) Chine (Mongolie) | Concentration As eau de boisson (µg.L-1) <10 (réf) ; 10 – 39 ; >40 | 0,8 – 3,0 (70,9 – 270,9) | Etude cas-témoin de taille modérée (298 cas MCV et 275 témoins) dont les sujets ont été recrutés dans l’hôpital de Hong-Hou. Ajustement du modèle pour les principales covariables (âge, sexe, éducation, IMC, statut de fumeur, emploi, consommation d’alcool, historique familiale de l’hypertension, diabète, maladies cardiaques) | Maladies cardiaques ischémiques (MCI) (non fatales) : OR : 1 (réf.) OR : 1,23 (0,78 – 1,93) OR : 4,05 (1,10 – 14,99) selon les catégories croissantes d’As (eau de boisson) |
Wu et al. (2010) (cas-témoins) Taiwan (bassin de Lanyang) | Concentration As eau de boisson (µg.L-1) ≤ 10 ; 10,1 – 50 ; 50,1 – 100 ; 100,1 -300 ; > 300 | 0,9 – 21,27 (80 – 1 926) | Etude cas-témoin de taille modérée (250 cas et 256 témoins) réalisée dans une région fortement contaminée via l’eau de boisson. Ajustement du modèle pour les principales covariables (âge, sexe, triglycérides, cholestérol, historique familial de l’hypertension) | Athéroscélrose OR : 1 (réf) OR : 2,58 (0,70 – 9,56) OR : 2,98 (1,21 – 7,34) p<0,05 OR : 3,07 (1,23 – 7,65 p<0,05 OR : 2,62 (1,04 -6,60) p<0,05) Selon les catégories croissantes d’As (eau de boisson). |
En ce qui concerne le diabète de type 2, l’ajustement du modèle a été considéré comme adéquat pour toutes les études retenues, sauf pour celle de Pan et al. (2013), où la dose la plus élevée a été exclue pour améliorer l’ajustement.
Ces 2 méta-analyses ont permis de déterminer des BMD et BMDL (limite inférieure à 95 % de l’intervalle de confiance de la BMD) associées à un niveau de réponse critique (BMR). Pour le diabète, une BMR de 5 % a été retenue par l’US EPA, alors que pour les maladies cardiaques ischémiques, une BMR de 3,9 % a été retenue pour tenir compte d’une BMR de 5 % pour les cas incidents (déclaration de diabète de type 2) et 1 % pour les cas mortels.
BMDL05 = 0,174 µg.kg-1.j-1 pour le diabète
BMDL03,9 = 0,171 µg.kg-1.j-1 pour les maladies cardiovasculaires
Facteurs d’incertitude : un facteur 3 pour la variabilité au sein de la population humaine.
Calcul : 0,174 µg.kg-1.j-1 x 1/3 = 0,058 µg.kg-1.j-1 arrondi à 0,06 µg.kg-1.j-1
: 0,171 µg.kg-1.j-1 x 1/3 = 0,057 µg.kg-1.j-1 arrondi à 0,06 µg.kg-1.j-1
Indice de confiance : moyen/fort comme indice global (fort pour le diabète et moyen/fort pour les maladies cardiaques.
L’ATSDR propose un MRL de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale (ATSDR, 2007).
Cette valeur a été établie à partir de deux études épidémiologiques réalisées à partir d’une cohorte de paysans exposés à l’As par l’eau de boisson contaminée dans le Sud-Ouest de Taiwan (Tseng et al., 1968, Tseng, 1977). La survenue de la « maladie des pieds noirs », d’une hyper-pigmentation et d’une kératose sont les effets critiques identifiés dès la plus faible dose d’exposition rapportée par Tseng (1977) soit 0,17 mg.L-1, qui correspond donc à un LOAEL. La population témoin de l’étude de Tseng et al. (1968) ne présente aucune lésion cutanée, suite à une exposition à 0,009 mg.L-1 d’arsenic dans l’eau de boisson : cette valeur est donc considérée comme un NOAEL. L’estimation des LOAEL et NOAEL est basée sur les moyennes arithmétiques des concentrations mesurées en As. Toutefois, pour tenir compte de l’apport en arsenic via la nourriture supplémentaire, ces dosesont été ajustées avec la prise en compte de la consommation moyenne d’eau journalière (4,5 L), de l’apport en arsenic via la nourriture (2 µg.j-1) et du poids moyen des habitants de cette région (55 kg). Les valeurs de ces paramètres ont été déterminées par Abernathy et al. (1989). Les doses ajustées sont donc de :
NOAELaj = 0,009 mg.L-1 x 4,5 L.j-1 + 2 µg.j-1 x 1/55 kg = 0,0008 mg.kg-1.j-1
LOAELaj = 0,17 mg.L-1 x 4,5 L.j-1 + 2 µg.j-1 x 1/55 kg = 0,014 mg.kg-1.j-1
Facteurs d’incertitude : un facteur de 3 tient compte de la variabilité intra-espèce.
Calcul : 0,0008 mg.kg-1.j-1 x 1/3 = 3.10-4 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Le RIVM propose une TDI de 10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
D’après le RIVM, l’As inorganique altère l’ADN par un mécanisme non génotoxique qui peut être un effet clastogène. Selon cet organisme, il existerait donc un consensus général admettant que l’action cancérigène de l’As inorganique serait basée sur un mécanisme non génotoxique. Une VTR à seuil devrait donc être proposée pour les effets cancérigènes de l’arsenic.
La TDI proposée par le RIVM a été établie à partir de la TDI provisoire de 2,1.10-3 mg.kg-1.j-1 proposée par l’OMS en 1996. Cette valeur a été évaluée initialement construite par le comité JECFA (Joint FAO/OMS Expert Committee on Food additives) en 1983 et confirmée par le même comité en 1988. Une première analyse de la littérature avait permis de conclure à de nombreux effets tels que l’hyperkératose, la toux chronique, le syndrome de Raynaud et la diarrhée chronique chez des patients présentant une pigmentation anormale de la peau, et la maladie des Pieds-Noirs dans des populations exposées à de fortes concentrations d’As dans l’eau (≥ 1 000 µg.L-1) en Argentine (Arguello et al., 1938 ; Bergoglio, 1964), au Chili (Zaldívar et al., 1981 ; Zaldívar et Guiller, 1977 ; Borgoño et al., 1977) et à Taïwan (Tseng et al., 1968 ; Tseng, 1977).
Le JECFA a en outre conclu qu’une concentration de 100 μg.L-1 pouvait donner lieu à des signes présumés de toxicité (non précisés) à partir d’une étude menée en Nouvelle-Écosse (Grantham et Jones, 1977). Sur les 33 sujets consommant de l’eau de puits contaminée à plus de 100 µg.L-1 d’As, 23 sujets (70 %) présentaient des signes attribuables à un empoisonnement à l’As, alors que de tels effets n’étaient plus visibles que sur 25 des 89 personnes (29 %) exposées à concentration d’As 50 et 100 µg.L-1.
En supposant une consommation quotidienne d’eau de 1,5 L, le JECFA a conclu que des apports de 1,5 mg.j-1 d’As inorganique étaient susceptibles d’entraîner une toxicité chronique de l’As et que des apports quotidiens de 0,15 mg.j-1 pouvaient également être toxiques à long terme pour certaines personnes. Sur cette base, et en tenant compte d’un poids moyen de 70 kg, une TDI provisoire de 2,1.10-3 mg.kg-1.j-1 a été estimée pour l’As inorganique.
Facteur d'incertitude : un facteur 2 est appliqué pour tenir compte des incertitudes liées aux études épidémiologiques.
Calcul : 2,1 µg.kg-1.j-1 x 1/2 = 1 µg.kg-1.j-1
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
L'OEHHA propose un REL de 3,5.10-6 mg.kg-1.j-1 pour une exposition chronique par voie orale (OEHHA, 2015) .
Les éléments relatifs à cette valeur sont précisés dans le document de l’OEHHA (2008), révisé en 2014 et repris de manière synthétique en 2015. Cette valeur est construite à partir des études épidémiologiques de Wasserman et al. (2004) et Tsai et al. (2003) réalisées respectivement au Bangladesh et dans la région nord de Taiwan. Les auteurs rapportent une diminution des capacités intellectuelles et des effets néfastes sur le comportement chez 200 enfants âgés de 10 ans, exposés depuis leur naissance via l’eau de boisson à 2,3 µg As.L-1, équivalent à l’ingestion de 2,3 µg As par jour.
Facteur d'incertitude : un facteur 3 est appliqué pour l'utilisation d'un LOAEL et un facteur 10 pour la variabilité au sein de la population (variabilité intra-spécifique).
Calcul : 2,3 µg.j-1 x 1/30 = 0,076 µg.j-1
Partant de l’hypothèse que les enfants de 10 ans pèsent en moyenne 21,9 kg, le REL pour la voie orale est déterminé selon le calcul suivant :
REL = 0,076 µg.j-1 / 21,9 kg = 3,5.10-3 µg.kg-1.j-1 soit 3,5.10-6 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Le Forschungs- und Beratungsinstitut Gefahrstoffe (FoBiG) propose une TDI de 45.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (FoBiG, 2009).
Cette valeur a été construite à partir des lésions cutanées observées par Ahsan et al. (2006), lors d'une étude transversale réalisée sur plus de 10 000 personnes au Bangladesh. Les hommes ont été considérés comme le sous-groupe le plus sensible car ils présentaient la prévalence de lésions cutanées la plus importante. Une BMDL05 de 109,2 µg par jour a été déterminée, en utilisant un modèle log-probit, par Schuhmacher-Wolz, Dieter et al. (2009) équivalent à une dose journalière de 2,18 µg.kg-1.j-1.
Facteur d'incertitude : un facteur 5 est utilisé pour établir la TDI de l’As inorganique à partir de l’ensemble des sources de contamination (eau de boisson et alimentation) car la BMDL a été déterminée pour un effet de 5 % (qui ne correspond pas à un niveau acceptable d’effet). Aucun facteur d’extrapolation intra-espèce n’est pris en compte car l’étude inclut plus de 10 000 personnes et, l’évaluation est basée sur la population la plus sensible (les hommes).
Calcul : 2,18 µg.kg-1.j-1 x 1/5 = 0,44 µg.kg-1.j-1 arrondi à 0,45 µg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
A noter que le FoBiG est un organisme non consulté habituellement. Toutefois, la qualité de la VTR proposée par cet organisme a conduit l’Ineris à la juger pertinente et à l’inclure dans la démarche de choix approfondi.
Ineris propose une TDI de 7.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (Ineris, 2007).
L’étude retenue pour la construction de la VTR est celle de Rahman et al. (2006), au cours de laquelle des lésions cutanées (hyper et hypopigmentations, kératoses) apparaissent pour des doses supérieures à 0,7 µg.kg-1.j-1.
Pour chaque sexe, une relation dose-réponse significative entre l’exposition moyenne ou cumulée en arsenic et le risque de développer des lésions cutanées a été mise en évidence, la catégorie d’exposition la plus faible étant utilisée comme témoin. Les hommes présentent un risque accru ; à la plus forte d’exposition, les odd ratio sont de 9,56 (IC 95 % : 4,20-21,8) pour les hommes et de 6,88 (IC 95 % : 3,06-15,5) pour les femmes.
Le LOAEL, déterminé à partir de ces résultats, est de 10 µg.L-1. Par extrapolation, le NOAEL étant strictement inférieur à 10 µg.L-1, pourrait être fixé à 9 µg.L-1, puisque le groupe exposé à une concentration inférieure à 10 µg.L-1 ne présente pas d’augmentation significative des symptômes. Il faut noter que l’apport en arsenic via la nourriture n’a pas été pris en compte par les auteurs de cette étude.
NOAEL lésions cutanées= 9 µg.L-1 soit 0,7 µg.kg-1.j-1 (hypothèses de calcul : poids moyen des habitants 50 kg, consommation moyenne d’eau 4 L par jour (Rahman et al., 2003)
Facteur d’incertitude : un facteur de 10 a été appliqué pour couvrir la variabilité au sein de la population humaine, des plus jeunes aux personnes âgées.
Calcul : 0,7 µg.kg-1.j-1 x 1/10 = 0,07 µg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
L’EFSA ne construit pas de VTR mais propose le calcul de marges d’exposition à partir d'une BMDL05 (EFSA, 2024).
Dans sa démarche, l’Efsa a procédé à une analyse comparative des BMDL déterminés dans plusieurs études (prise en compte des facteurs de confusion) à partir d’une augmentation relative de 5 % (BMR5%) de l’incidence de plusieurs effets, après ajustement sur les co-variables, à savoir le cancer de la peau (Leonardi et al., 2012 ; Gilbert-Diamond et al., 2013), le cancer de la vessie et le cancer des poumons (Chen et al., 2010a, 2010b ; Steinmaus et al., 2013), les lésions cutanés (Ahsan et al., 2006 ; Xia et al., 2009 ; Pierce et al., 2011), les avortements spontanés et la mortinatalité (Milton et al., 2005 ; Cherry et al., 2008), la mortalité infantile (Rahman et al., 2007), les effets sur le neuro-développement (Vahter et al., 2020), les cardiopathies ischémiques (Wade et al., 2015 ; James et al., 2015 ; Wu et al., 2015 ; Moon et al., 2013), les atteintes de la fonction pulmonaire (Powers et al., 2019) et les pathologies chroniques rénales (Hsueh et al., 2009 ; Zheng et al., 2015). L’intégralité de ces études, trop nombreuses, n’est pas détaillée, en dehors de celles examinées par d’autres organismes.
Les plus faibles BMDL (<0,1 µg.kg-1.j-1) ont été calculées pour le cancer de la peau, les lésions cutanées, les atteintes de la fonction pulmonaire et les pathologies rénales chroniques. L’Efsa a finalement retenu la BMDL05 de 0,06 μg.kg-1.j-1 déterminée à partir de l’étude cas-témoins sur le cancer de la peau réalisée aux Etats-Unis (Hampshire) (Gilbert-Diamond et al., 2013). Cette étude regroupant 470 cas de carcinome épidermoïde et 447 témoins, met en évidence une augmentation significative du risque de cancer de la peau en fonction de l’augmentation de l’exposition log transformée à l’As avec un OR de 1,43 IC 95% (1,04 – 1,80) (ajustement sur le sexe, âge, IMC, statut de fumeur, réaction de la peau au soleil et la concentration urinaire de créatinine). L’étude a été considérée comme présentant un faible risque de biais. De plus, l’Efsa considère que cette valeur couvre tous les autres effets examinés et que la population américaine est comparable à la population européenne en termes de nutrition et de facteurs socio-économiques.
L’Efsa n’a pas dérivé de VTR à partir de cette BMDL, indiquant qu’il lui semble plus approprié de calculer, pour les individus ou les populations exposées, une marge d’exposition, dans la mesure où il n’est pas fait de distinction entre les effets cancérogènes et non cancérogènes.
L’Efsa précise qu’une Marge d’exposition (ME) de 1 correspond au niveau d’exposition associé à une augmentation de 5% de l’incidence du cancer de la peau. Le point de référence retenu par l’Efsa de 0,06 µg.kg-1.j-1 se situe dans la fourchette de la moyenne d’exposition de la population européenne (0,03 à 0,15 µg.kg-1.j-1) et légèrement en dessous de la fourchette haute du 95e (0,07 à 0,33 µg.kg-1.j-1). L’Efsa recommande des ME de 2 et 0,4 pour les consommateurs moyens, de même que de 0,9 et 0,2 pour le 95e percentile de l’exposition.
La HAS propose une VTR de 0,3 µg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (HAS, 2020).
La HAS propose une valeur construite à partir de l’étude épidémiologique de Xia et al. (2009), également utilisée par l’Efsa (2009), et conduite en Mongolie intérieure sur une population de poids corporel moyen de 70 kg et des apports alimentaires d’As (10-20 µg.j-1), proches de ceux constatés en France. Sur la base de la prévalence des lésions cutanées (mélanodermie et hyperkératose), l’Efsa (2009) a calculé une BMC01 et une BMCL01 respectivement de 0,56 et 0,31 µg.L-1, et en a déduit une BMDL01 de 0,9 µg.kg pc.-1.j-1 en tenant compte des caractéristiques de la population étudiée (consommation d’eau de 1 à 2 L par jour). L’Efsa n’a pas dérivé de VTR à partir de ces BMC et BMD, indiquant qu’il lui semble plus approprié de calculer, pour les individus ou les populations exposées, une marge d’exposition, dans la mesure où il est incertain que les effets considérés comme à seuil de dose (en particulier, certains des effets cutanés dont l’hyperkératose disséminée) le soient réellement. La HAS a néanmoins retenu cette BMDL01 de 0,9 µg.kg pc.-1.j-1 pour la construction de sa valeur.
Facteur d'incertitude : un facteur de 3 a été appliqué pour prendre en compte la variabilité interindividuelle de la sensibilité aux effets toxiques de l’arsenic, en effet, bien que plusieurs études sur la relation dose-réponse entre l’exposition à l’arsenic dans l’eau et le risque de développer des lésions cutanées non cancéreuses soient disponibles, aucune d’entre elles n’a été conduite en Europe.
Calcul : 0,9 µg.kg-1.j-1 x 1/3 = 0,3 µg.kg-1.j-1
Indice de confiance : Pas d’indice de confiance
Effets sans seuil - Exposition chronique par inhalation :
L’US EPA (IRIS) propose une ERUi de 4,3.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (US EPA (IRIS), 1995)
Cette valeur a été établie en prenant en compte l’apparition des cancers pulmonaires dans des études réalisées en milieu professionnel et portant sur deux cohortes d’employés de fonderies de cuivre (Enterline and Marsh, 1982, Lee-Feldstein, 1983, Higgins, Oh et al., 1986). Il s’agit d’une moyenne géométrique calculée de 4,3.10-3 (µg.m-3)-1 à partir de deux moyennes géométriques de 2,6.10-3 (µg.m-3)-1 dans la première cohorte (trois séries de données) et 7,2.10-3 (µg.m-3)-1 dans la seconde cohorte (à partir de deux séries de données). L’US EPA précise que cet ERUi n’est applicable que pour des concentrations atmosphériques inférieures à 2 µg.m3 ; cet avertissement n’est pas justifié dans les documents accessibles.
L’OMS propose une ERUi (valeur guide) de 1,5.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (OMS, 2000)
A partir des mêmes cohortes que celles retenues par l’US EPA, l’OMS a calculé un excès de risque unitaire de cancer broncho-pulmonaire de 1,43.10-3 (µg.m-3)-1. La méthode de calcul n’est pas clairement décrite.
Santé Canada propose un ERUi de 6,4.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (Santé Canada, 2021).
Cette valeur a été établie à partir d’une étude réalisée chez des travailleurs exposés à des concentrations atmosphériques d'arsenic inorganique dans des fonderies de cuivre (Higgins et al., 1986). Cette étude, qui a montré une association entre l'exposition aux vapeurs d'arsenic et les cancers pulmonaires, a fourni des données suffisantes sur l'exposition des travailleurs pour établir une relation dose-effet servant à estimer la concentration induisant une augmentation de l'incidence des cancers de l'ordre de 5 % (CT0,05 = 7,83 µg.m-3). L’excès de risque unitaire en est alors déduit.
L'OEHHA propose un ERUi de 3,3.10-3 (µg.m-3)-1 pour une exposition par inhalation (OEHHA, 2011).
Cette valeur a été estimée à partir de trois études épidémiologiques portant sur la mortalité par cancer des poumons chez des travailleurs exposés à l'arsenic (Higgins, Oh et al., 1986, Lee-Feldstein, 1986, Enterline, Marsh et al., 1987). Les données de ces trois études ont été, dans un premier temps, intégrées dans un modèle linéaire. Dans ce modèle, les doses d’arsenic sont considérées comme cumulatives et il est émis l’hypothèse que le mécanisme d’action est sans seuil.
Afin de calculer l’excès de risque unitaire, l’intervalle de confiance à 95 % de la pente établie à partir des 4 groupes d’exposition à l’arsenic les plus faibles provenant de l’étude d’Enterline et al. (1987) a été choisi par l’OEHHA. Cette estimation a été considérée comme étant la plus vraisemblable. Dans ce présent rapport, seule l’étude d’Enterline et al. (1987) a été détaillée car la VTR proposée par l’OEHHA a été uniquement établie à partir des données de cette étude.
L’excès de risque final a été proposé après avoir réalisé un ajustement en fonction de la consommation de tabac en raison de la forte interaction entre l'exposition à l'arsenic et la consommation de tabac dans certaines cohortes. L’excès de risque unitaire de 3,3.10-3 (µg.m-3)-1 a été ainsi recommandé par l’OEHHA.
Le TCEQ propose un ERUi de 1,5.10-4 (µg.m-3)-1 pour une exposition chronique par inhalation (TCEQ, 2012).
Cette valeur a été élaborée sur la base de l’examen du suivi de trois cohortes d’employés de fonderies de cuivre exposés à l’arsenic, à savoir celle de Tacoma (Enterline, Marsh et al., 1987, Enterline, Day et al., 1995), de Montana (Lubin, Pottern et al., 2000, Lubin, Moore et al., 2008), ainsi que celle de Ronnskar en Suède (Jarup, Pershagen et al., 1989). Dans l’analyse de la TCEQ, plusieurs modélisations ont été testées et la plus adaptée aux données de l’étude a été retenue. Un excès de risque unitaire de cancers pulmonaires et respiratoires de 1,5.10-4 (µg.m-3)-1 a été calculé à partir de chacun des risques unitaires des trois cohortes compris entre 1,11 et 2,18 10-4 (µg.m-3)-1, pondérés par l’inverse de la variance pour chacune des valeurs. Ainsi, l’ERU,calculé au moyen d’une analyse combinée basée sur le taux de mortalité par cancer pulmonaire au Texas et la probabilité de survie, est celui qui a été retenu in fine 1,5.10-4 (µg.m-3)-1.
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose un ERUo de 3,17 (µg.kg-1.j-1)-1 pour une exposition chronique par voie orale (US EPA (IRIS), 2025).
Cette valeur a été établie à partir de 2 méta-analyses regroupant 6 études pour le cancer du poumon (Argos et al., 2014 ; Garcia-Esquinas et al., 2013 ; Chen et al., 2010 ; Dauphiné et al., 2013 ; Ferreccio et al., 2000 ; Steinmaus et al., 2013) et 11 études pour le cancer de la vessie (Baris et al., 2016 ; Bates et al., 1995 ; Bates et al., 2004 ; Chang et al., 2016 ; Chen et al., 2010b ; Meliker et al., 2010 ; Steinmaus et al., 2003 ; Steimaus et al., 2013 ; Wu et al., 2013 ; Karagas et al., 2004 ; Michad et al., 2004). Seules des études cas-témoins et des études de cohorte ont été retenues, la relation de causalité semblant trop incertaine dans les études transversales et les études écologiques. Dans les études sélectionnées, l’exposition à l’As a été mesurée via la dose externe dans l’eau potable ou la dose interne dans l’urine ou les ongles. Ces données ont été converties par l’US EPA en dose orale journalière (µg.kg-1.j-1) en utilisant des modèles physiologiques El-Masri-Kenyon-PBPK (El-Masri et al., 2018a,b) basés sur l’excrétion d’As et sur la consommation d’eau. Les 2 effets critiques retenus sont donc, le cancer du poumon et le cancer de la vessie. Le tabagisme étant un facteur de risque essentiel dans la survenue de ces 2 types de cancers, seules les études qui ont correctement évalué le tabagisme ont été retenues. De même, l’analyse a porté sur des études présentant des niveaux d’expositions pertinents au regard de celles des Etats-Unis, en écartant le plus souvent celles pour des expositions très élevées comme cela a pu être le cas dans le Sud-Ouest de Taiwan.
Synthèse des études relatives à l’incidence des cancers du poumon et de la vessie lors de l’exposition à l’As utilisées pour l’élaboration de la VTR chronique sans seuil de l’US EPA (2025)
Etude (type) | Localisation géographique | Estimation de l’exposition moyenne µg.kg-1.j-1 (équivalent eau potable µg.L-1) (calcul de l’US EPA) | Effet critique retenu |
Argos et al., 2014 (cohorte prospective) | Bangladesh | 1,86 – 18,9 (167 - 1 716) | Cancer du poumon : |
Garcia-Esquinas et al., 2013 (cohorte prospective) | Etats-Unis (Arizona, Oklahoma, Dakota nord et sud) | 0,139 – 0,584 (10,8 – 51,3) | Cancer de la trachée, des bronches et des poumons |
Chen et al., 2010a (cohorte) | Taiwan (Nord-Est) | 0,77 – 18,97 (68,2 – 1 722) | Cancer du poumon |
Dauphiné et al., 2013 (cas-témoin) | Etats-Unis (Californie, Nevada) | 0,11 – 1,99 (8,2 – 179) | Cancer du poumon |
Ferreccio et al., 2000 (cas-témoin) | Chili (Nord) | 1,1 – 3,1 (98,2 – 280) | Cancer du poumon |
Steinmaus et al., 2013 (cas-témoin) | Chili (Nord) | 1,3 – 10,8 (180 – 980) | Cancer du poumon |
Baris et al., 2016 (cas-témoin) | Etats-Unis (Nouvelle Angleterre) | 0,1 – 0,44 (7,3 - 38) | Carcinome des voies urinaires |
Bates et al.,1995 (cas-témoin) | Etats-Unis (Utah) | 0,12 – 0,15 (9,09 – 11,8) | Cancer de la vessie chez les fumeurs. |
Bates et al., 2004 (cas-témoin) | Argentine | 0,56 – 8,2 (49,1 – 744) | Cancer de la vessie |
Chang et al., 2016 (cas-témoin) | Taiwan (Ouest) | 1,1 – 5,3 (98,2 – 480) | Carcinome urothélial |
Chen et al., 2010b (cohorte prospective) | Taiwan (Nord-Est) | 0,83 – 16,44 (73,6 – 1 492) | Cancer des voies urinaires |
Meliker et al., 2010 (cas-témoin) | Etats-Unis (Michigan) | 0,1 – 0,45 (7,3 – 39,1) | Cancer de la vessie |
Steinmaus et al., 2003 (cas-témoin) | Etats-Unis (Californie, Névada | 0,1 – 0,23 (7,3 – 19,1) | Cancer de la vessie |
Steinmaus et al., 2013 (cas-témoin) | Chili (Nord) | 1,26 – 10,76 (112,7 – 976) | Cancer de la vessie |
Wu et al., 2013 (cas-témoin) | Taiwan (Nord-Est) | 0,127 – 0,566 (9,7 – 49,6) | Carcinome urothélial |
Karagas et al., 2004 (cas-témoin) | Etats-Unis (New Hampshire) | 0,116 – 0,154 (8,72 – 12,2) | Cancer de la vessie |
Michaud et al., 2004 (cas-témoin) | Finlande (Sud-Ouest) | 0,108 – 0,165 (8 – 13,2) | Cancer de la vessie |
L’approche bayésienne des méta-analyses réalisée pour estimer la relation dose-réponse entre l’exposition orale à l’As et le risque de cancer du poumon et de la vessie a suivi 2 types de modèles. Un modèle logistique – non linéaire a été appliqué pour les doses les plus élevées, alors qu’un modèle linéaire (slope factor) a été utilisé pour les doses inférieures à 0,2 µg.kg-1.j-1.
Ainsi, des slope factor de 1,76.10-2 (µg.kg-1.j-1)-1 pour le cancer de la vessie et de 2,13.10-2 (µg.kg-1.j-1)-1 pour le cancer des poumons ont été calculés. Un slope facteur combiné (cancers de la vessie et du poumon) de 3,17.10-2 (µg.kg-1.j-1)-1 a été retenu, en supposant que les risques individuels des cancers de la vessie et du poumon sont distribués normalement.
Santé Canada propose une CERUo de 1,8.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (Santé Canada, 2021).
Cette valeur a été établie à partir de l’étude épidémiologique de Morales et al. (2000), elle-même basée sur celles de Chen et al. (1985) et de Wu et al. (1989). Les populations sont exposées par voie orale via l’eau potable. L’effet critique retenu est le cancer de la vessie, des poumons et du foie. Sur la base d’une augmentation de 1 % du risque, l’étendue des CERU associées à l’ingestion de 1 µg.L-1 d’arsenic dans l’eau de boisson est 3,06.10-6 à 3,85.10-5 (µg.L-1)-1 pour le cancer des poumons.
La VTR est basée sur l’estimation de la limite supérieure des CERU dans l’eau potable CERUeau = 3,85.10-5 (µg.L-1)-1 :
CERUo = CERUeau x pcadulte x FC/TIeau = 1,8 (mg.kg-1.j-1)-1
Ou : pcadulte =70kg, TIeau = 1,5 L.j-1 et FC = 1 000 µg.mg-1
L'OEHHA propose un ERUo de 1,5 (mg.kg-1.j-1)-1 pour une exposition chronique par ingestion (OEHHA, 2025).
Les éléments relatifs à cette valeur sont précisés dans le document de l’OEHHA (2009), mis à jour en 2011 et repris de manière synthétique en 2025. Cette valeur est construite comme l'ERUo anciennement proposé par l'US EPA. Elle est basée sur les études de Tseng et al. (1968) et Tseng (1977). L’effet critique retenu est le cancer cutané. Le risque a été calculé séparément pour les hommes et les femmes en prenant comme hypothèse une exposition dans la population taïwanaise dès la naissance avec une consommation d’eau boisson de 3,5 L.j-1 pour les hommes et de 2 L.j-1 pour les femmes. Un modèle multi-étapes de type linéaire et quadratique basé sur la prédiction de l’apparition des cancers cutanés en fonction de la dose et de l’âge a été utilisé. L’excès de risque unitaire, anciennement proposé par l’US EPA, a été estimé entre 1 et 2.10-3, soit par approximation
1,5.10-3 (µg.kg-1.j-1)-1 soit 1,5 (mg.kg-1.j-1)-1.
Choix de VTR
Effets à seuil - Exposition aiguë par inhalation :
L'Ineris propose de ne pas retenir de VTR pour une exposition aiguë à l'arsenic par inhalation
Seul l’OEHHA (2015) propose une valeur. Le REL aiguë est basé sur une étude sur le développement de qualité moyenne en raison de l’absence de précisions sur la toxicité maternelle.
Les études sur le développement ne sont pas vraiment adaptées à la construction d’une VTR aigüe. De plus, il n’a pas été pratiqué d’ajustement pour une exposition continue.
Effets à seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par inhalation la VTR chronique de 1,5.10-2 µg.m-3 .
Deux valeurs élaborées par le RIVM (2001) et l’OEHHA (2008) sont disponibles. La Haute Autorité de Santé (HAS) propose une analyse des valeurs existantes (HAS, 2020). La HAS a proposé des recommandations de bonnes pratiques concernant le dépistage, la prise en charge et le suivi des personnes potentiellement surexposées à l’As inorganique du fait de leur lieu de résidence qui repose, en autre, sur l’analyse des VTR disponibles.
Le RIVM a construit sa VTR à partir d’une LOAEC de 10 µg.m-3 pour des cancers du poumon induits par une exposition par voie pulmonaire à l’arsenic trivalent. Cette valeur est issue d’un document de l’ATSDR (1999), cité par le RIVM, mais sans aucune mention de l’étude source ayant permis d’établir cette valeur. De plus, cette LOAEC de 10 µg.m-3 n’est pas retrouvée dans le rapport de l’ATSDR (2007). Cette valeur n’est donc pas préconisée par l’INERIS.
La valeur proposée par l’OEHHA est une extrapolation à partir de la VTR établie pour la voie orale. La HAS émet des réserves sur l’effet critique retenu (perte de points de QI) par l’OEHHA, qui n’est pas jugé pertinent.
Indice de confiance : Par défaut, la valeur retenue est construite à partir d’une extrapolation voie à voie et en raison des limites sur la qualité de l’effet critique retenu (évaluation du QI peut être soumise à de nombreux biais) rapportées par la HAS.
Effets à seuil - Exposition aiguë par voie orale :
L’ineris propose de retenir pour une exposition aiguë à l’arsenic par voie orale la VTR aiguë de 5.10-3 mg.kg-1.j-1 de l’ATSDR (2007).
Seul l’ATSDR (2007) propose une VTR pour une exposition aiguë par voie orale. La Haute Autorité de Santé (HAS) a évalué cette VTR (HAS, 2020).
Cette valeur est établie à partir d’une étude chez l’homme (Mizuta et al., 1956) exposé à l’arsenic via de la sauce soja et pour des effets tels que les symptômes gastro-intestinaux ou l’œdème de la face. Cette étude est de qualité recevable au regard de la date à laquelle elle a été menée. Toutefois, la qualité de la caractérisation des expositions et de la relation dose-effet reste limitée en l’absence de lot témoin.
La construction de la VTR est détaillée et les arguments sont recevables, l’utilisation des facteurs d’incertitude est appropriée compte tenu des données de l’étude clé.
La HAS a considéré cette valeur comme étant peu fiable en raison du choix des effets jugés trop sévères pour être retenus pour caractériser un LOAEL, la qualité plutôt médiocre de la caractérisation des expositions et des relations doses-effets, ainsi que l’absence de facteur d’incertitude supplémentaire pour la variabilité interindividuelle de la sensibilité à l’arsenic.
Cette valeur est retenue par défaut l’Ineris
Indice de confiance : par défaut au regard des limitations de l’étude clé.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic inorganique par voie orale la VTR chronique de 6.10-5 mg As.kg-1.j-1 (US EPA, 2025).
Six VTR sont disponibles, celles de l’ATSDR (2007), l’US EPA (2025), l’OEHHA, (2015), le RIVM (2001), l’Ineris (2007), le FoBiG (2009) et la HAS (2020) pour les expositions chroniques par voie orale à l’As. Les principales données relatives à la construction de ces valeurs sont résumées dans le tableau ci-dessous.
VTR élaborées par les différents organismes pour une exposition chronique par voie orale à l’As inorganique pour des effets à seuil
| ATSDR (2007) | US EPA (2025) | OEHHA (2015) | RIVM (2001) | Ineris (2007) | FoBiG (2009) | Efsa (2024) | HAS (2020) |
(mg.kg-1.j-1) | 3.10-4 | 6.10-5 | 3,5.10-6 | 1.10-3 | 7.10-5 | 4,5.10-4 | Marge d’exposition | 3.10-4 |
Etudes sources | Tseng (1968 ; 1977) | Méta-analyse 9 études de 2007 à 2017 | Wasserman (2004) ; Tsai (2003) | Grantham et Jones (1977) | Rahman (2006) | Ahsan (2006) | Gilbert-Diamond (2013) | Xia (2009) |
Population (taille) | Population paysanne : adultes et enfants (40 421 individus) | Adultes (environ 5 600 cas) | Enfants (12 000 individus) | Adultes Environ 100 individus | Enfants (>4ans) et adultes (166 934 individus) | Adultes (11 746 individus) | Adultes (470 cas atteints de carcinomes épidermoïdes) | Adultes (12 000 individus) |
Zone géographique | Taiwan | Etats-Unis ; Mexique ; Bangladesh ; Taiwan ; Chine | Bangladesh ; Taiwan | Canada (Nouvelle-Ecosse) | Bangladesh | Bangladesh | Etats-Unis (New Hampshire) | Chine (Mongolie) |
Niveau d’exposition (eau de boisson) | <0,3 à >0,6 ppm soit <300 à >600 µg.L-1 | Doses faibles à modérées (le plus souvent) : environ 4 à 2 000 µg.L-1 | Moy : 117,8 µg.L-1 | 50 à 100 µg.L-1 | < 10 à > 299 µg.L-1 | 8,1 à 864 µg.L-1 | 0,33 µg.L-1 (0,14 – 1,11) | ≤ 5 µg.L-1
|
Effets critiques | Lésions cutanées (maladie pieds noirs) | Diabète / maladies cardiovasculaires (MCV) | Neuro-développement (tests d’intelligence) | Non précisé | Lésions cutanées (hyper-/hypo-pigmentation ; kératose) | Lésions cutanées précancéreuses | Cancer cutané | Lésions cutanées (mélanodermie et hyperkératose) |
Dose critique (unité) | NOAELadj = 8.10-4 mg.kg-1.j-1 | BMDL05 = 1,74.10-4 mg.kg-1.j-1 pour le diabète BMDL03,9 = 1,71.10-4 mg.kg-1.j-1 pour MCV | LOAEL = 2,3.10-3 mg.j-1 soit soit 1,1.10-4 mg.kg-1.j-1 (enfant de 21,9 kg) | LOAEL : 2,1.10-3 mg.kg-1.j-1 | NOAEL = 9.10-3 mg.kg-1.j-1 | BMDL05 = 2,18.10-3 mg.kg-1.j-1 | BMDL05 = 6.10-5 mg.kg-1.j-1 | BMDL01 = 9.10-4 mg.kg pc.-1.j-1 |
Méthode de calcul | Ajustements consommation d’eau (4,5 L.j-1), apport nourriture (2 µg.j-1) et surpoids (55 kg) | Modèles PBPK et consommation d’eau | Poids des enfants de 21,9 kg | Ajustements consommation d’eau (1,5 L),) et sur poids (70 kg) | Ajustements consommation d’eau (4 L.j-1), et sur poids (50 kg) | Ajustement sur poids des individus (50 kg) | - | Ajustement au poids des individus (50 kg) |
UF total | 3 | 3 | 30 | 2 | 10 | 5 | Marge d’exposition | 3 |
UFH | 3 | 3 | 10 | 2 | 10 | - | - | 3 |
UFL | - | - | 3 | - | - | 5 | - | - |
UFH : facteur d’incertitude de variabilité intra-espèce, UFL facteur d’incertitude pour l’utilisation d’un LOAEL.
Les VTR ont toutes été construites à partir d’études épidémiologiques, réalisées le plus souvent dans des zones géographiques ciblées (Taiwan, Bangladesh, Chine) où la population est fortement exposée principalement à partir d’une contamination de l’eau de boisson, mais également via l’alimentation à l’As (ATSDR, OEHHA, Ineris, FoBig, HAS). Certaines de ces études sont relativement anciennes (Tseng et al., 1968 ; 1977) et, outre les niveaux d’exposition élevés, présentent des limites notamment en ce qui concerne les biais de confusion qui ne sont pas toujours pris en compte (consommation de tabac, consommation d’eau et de nourriture, poids…) ou encore la non prise en compte de l’apport en As via la nourriture (Rahman et al., 2006). Ces limites influencent de manière négative la qualité de ces études. D’autres organismes (RIVM, Efsa et US EPA) se réfèrent à des études menées sur des populations exposées à de plus faibles doses et réalisées aux Etats-Unis ou encore au Canada. L’US EPA réalise une méta-analyse basée sur plusieurs études américaines et plus généralement les populations exposées à de faibles doses pour construire une valeur représentative des expositions de la population américaine. Les études retenues par l’US EPA sont les plus récentes, bien documentées, en particulier pour la caractérisation de l’exposition déterminée le plus souvent à partir de marqueurs biologiques et/ou de dosages individuels dans l’eau de boisson. De plus, la qualité de ces études réside dans la prise en compte de biais potentiels tels que le statut tabagique.
La plupart des organismes, en dehors de l’US EPA et l’OEHHA, retiennent comme effet critique les lésions cutanées (cancéreuses ou non cancéreuses), avec en particulier les kératoses, qui sont les signes les plus sensibles et précoces des effets de l’As dans les populations généralement fortement exposées à l’As dans l’eau de boisson. Dans sa construction, l’OEHHA retient les effets sur le développement du système nerveux chez l’enfant, évalués à partir d’une déficience des capacités intellectuelles et du comportement d’enfants de 10 ans, exposés depuis leur naissance via l’eau de boisson à de faibles concentrations d’As dans l’eau de boisson (2,3 µg As.L-1). D’une manière générale, ces effets apparaissent pour des doses très faibles, inférieures à celles entrainant des effets cutanés. L’US EPA construit sa valeur pour des effets sur le diabète et les maladies cardiovasculaires, établis pour de faibles niveaux d’exposition et à partir de données médicales individuelles et de marqueurs biologiques, ce qui les rend particulièrement sensibles.
La valeur établie par le RIVM est basée sur la TDI provisoire proposée par l’OMS en 1996 et sans précision de l’effet critique retenu. Or, dans son rapport de 2017, l’OMS ne propose plus de TDI pour l’As compte tenu des difficultés d’extrapolation d’une valeur à partir des données épidémiologiques disponibles. Dans ces conditions, la valeur du RIVM n’est pas retenue.
La valeur élaborée par l’Ineris en 2007 repose sur l’étude épidémiologique de Rahman et al., 2006, qui présente des limites concernant notamment l’apport en As via la nourriture qui n’a pas été pris en compte. Cette valeur n’est pas retenue.
La VTR proposée par l’ATSDR est construite à partir de 2 études clés (Tseng et al., 1968 ; Tseng, 1977). Ces études présentent des limites notamment en ce qui concerne les durées et niveaux d’exposition et les biais de confusion ne sont donc pas pris en compte (consommation de tabac, consommation d’eau et de nourriture, poids…). Le choix de l’effet critique « maladie des pieds noirs », d’une hyper-pigmentation et d’une kératose conduit à un NOAEL dans l’eau de boisson de 9 µg.L-1 qui résulte de la moyenne arithmétique des concentrations d’As présent dans les bas-fonds. Cette concentration est selon les auteurs comprise entre 1 et 17 µg.L-1. En toute rigueur, si aucun effet (hyperpigmentation, kératose et « maladie des pieds noirs ») n’a été observé à ces concentrations, un NOAEL de 17 µg.L-1 aurait dû être retenu. Toutefois, ceci n’influence que très peu la valeur finale de la VTR, une valeur de 4,6.10-4 mg.kg-1.j-1 aurait été calculée au lieu de 3.10-4 mg.kg-1.j-1. De plus, dans les études retenues (Tseng et al., 1968 et Tseng, 1977), la population est jeune alors que l’incidence des lésions cutanées augmente avec l’âge des individus. Enfin, des incertitudes relatives au choix des facteurs à prendre en compte, pour extrapoler l’apport en As à partir de la concentration dans l’eau de boisson (consommation journalière, poids moyen et apport en As par la nourriture), existent. Cette valeur n’est pas retenue.
L’OEHHA (2015) a élaboré une valeur, à partir des études épidémiologiques de Wasserman, Liu et al. (2004) et Tsai et al. (2003). Ces auteurs rapportent une altération des résultats aux tests cognitifs chez 200 enfants âgés de 10 ans, exposés depuis leur naissance via l’eau de boisson à 2,3 µg As.L-1, équivalent à l’ingestion de 2,3 µg As par jour et retenu comme LOAEL. Le LOAEL ajusté au poids des enfants est divisé par un facteur d’incertitude de 30 pour tenir compte de l’utilisation d’un LOAEL (3) et de la variabilité intra-individuelle (10). Cette dernière peut être jugée non adéquate puisque la population de l’étude source est constituée d’enfants. La valeur n’est pas retenue.
Les chercheurs du FoBiG ont quant à eux dérivé leur TDI à partir d’une étude transversale de plus de 10 000 personnes (Ahsan et al., 2006), dans laquelle les différences de lésions cutanées observées, en fonction du sexe et du statut nutritionnel, ont été prises en compte dans l’élaboration de la relation dose/réponse. Une BMDL05 a été calculée et prise comme point de départ à l’élaboration de la VTR. Le choix de cette BMDL05 (et non de BMDL01) a nécessité un facteur d’ajustement supplémentaire de 5. Cette valeur n’est pas retenue.
La HAS a construit une valeur sur un schéma proche de celui du FoBig en retenant les effets cutanés non cancéreux comme effets critiques de l’étude de Xia et al., 2009. Cette étude conduite sur une population de 12 000 personnes en Mongolie est de qualité recevable. La HAS a retenu dans sa construction la BMDL01 sur la base des calculs établis par l’Efsa (2009) à laquelle elle a appliqué un facteur d’ajustement pour prendre en compte la variabilité interindividuelle. L’Efsa a établi en 2024 une nouvelle BMDL05 (0,06 µg.kg-1.j-1) plus faible que la BMDL01 initialement retenue en 2009 (0,93 µg.kg-1.j-1) et construite sur la base d’une autre étude sur les cancers cutanés. Du fait de cette nouvelle valeur, la démarche de la HAS perd en pertinence et n’est pas retenue.
Plus récemment, l’US EPA construit une RfD élaborée à partir de 2 méta-analyses regroupant 9 études clés. Les effets les plus sensibles retenus comme effets critiques dans ces études sont d’une part l’incidence du diabète de type 2 (Grau-Perez et al., 2017 ; James et al., 2013 ; Pan et al., 2013b ; Coronado-González et al., 2007) et l’incidence des maladies cardiaques ischémiques d’autre part (Wu et al., 2010 ; Moon et al., 2013 ; James et al., 2015 ; Chen et al., 2013 ; Wade et al., 2015). Les méta-analyses bayésiennes, utilisées pour combiner les résultats de ces études, ont permis d’établir des relations dose-réponse robustes. La RfD est construite à partir d’une BMDL05 pour le diabète et BMDL03,9 pour les maladies cardiaques ischémiques. Ce dernier ajustement de BMR n’est pas courant, mais impacte peu sur la valeur finale. Un facteur d’incertitude de 3 a été appliqué à ces 2 valeurs pour tenir compte de la variabilité interindividuelle. L’US EPA construit sa valeur à partir de méta-analyses prenant en compte des études récentes, réalisées sur plusieurs populations, notamment américaines, représentatives de différentes conditions d’exposition avec des niveaux de doses assez variés de faible à élevés. Par ailleurs, cette valeur est celle qui prend en compte, bien que non exclusivement, des données issues de la population américaine, comparable à la population européenne en termes de nutrition et de facteurs socio-économiques. Sa valeur est construite à partir de BMDL plus robustes, du fait des méta-analyses, que les BMDL/NOAEL/LOAEL retenus par les autres organismes. Le choix du facteur d’incertitude de 3 est parfaitement cohérent.
L’Ineris propose de retenir la valeur de l’US EPA pour des expositions chroniques par voie orale.
Indice de confiance : fort compte tenu du choix des effets critiques et du traitement des données issues de méta-analyses .
Effets sans seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par inhalation la VTR chronique de 1,5.10-4 (µg.m-3)-1 .
Quatre valeurs sont disponibles, celles de US EPA (1995), Santé Canada (2004), OEHHA (2009) et TCEQ (2012). Dans leur choix de VTR, l’Anses recommande d’utiliser la valeur développée par le TCEQ (Anses, 2018).
Dans le cas de la voie respiratoire, la méthode de construction utilisée par Santé Canada pour l’établissement de sa VTR n’est pas décrite en détail. Il est donc préférable de ne pas la retenir.
L’ensemble des données épidémiologiques montre une relation entre la mortalité due aux cancers du poumon et/ou des voies respiratoires et l’exposition à l’arsenic. L’US EPA retient six études réalisées dans des fonderies situées aux Etats-Unis et l’OEHHA retient une étude menée sur 8 fonderies différentes, également localisées aux Etats-Unis. Les fonderies étudiées sont souvent les mêmes.
La valeur d’excès de risque unitaire recommandée par l’US EPA est déterminée à partir d'études où les niveaux de concentrations d'arsenic sont estimés (élevés, moyens ou faibles). Une moyenne géométrique a ensuite été réalisée pour déterminer l’excès de risque final. La valeur du TCEQ est construite à partir des mêmes cohortes (américaines) que celle de l’US EPA mais prend en compte les résultats de réévaluations et ceux d’une méta-analyse. Cependant, la population de référence (concernant le taux de mortalité par cancer pulmonaire et la probabilité de survie) dans ce calcul est la population du Texas du fait de l’établissement d’une valeur pour cet état.
La VTR proposée par l’OEHHA est fondée sur une étude qui analyse de la même façon les données des 8 fonderies, mais ne prend en compte que les résultats d’une seule fonderie parmi ceux-ci. L’OEHHA a ajusté sa valeur sur le tabagisme.
La HAS a retenu la valeur de l’OEHHA qui correspond à une des propositions les plus récentes et qui selon elle, est la seule ajustée sur le tabagisme, cependant les valeurs construites par Santé Canada, l’OEHHA et le TCEQ sont basées sur les mêmes cohortes.
Les trois méthodes sont acceptables et l’Ineris préconise de retenir la VTR du TCEQ retenue par l’Anses qui est également la plus récente sur ces cohortes.
Il est toutefois intéressant d’indiquer que les VTR élaborées par l’OEHHA et par l’US EPA sont très proches, du fait de la prise en compte des mêmes cohortes initiales.
Indice de confiance : moyen en l’absence d’ajustement de la prise en compte du tabagisme dans toutes les études
Cette valeur ERUi correspond à une concentration de 6,6.10-2 µg.m-3 pour un excès de risque de 10-5 et de 6,6.10-3 µg.m-3 pour 10-6.
Effets sans seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par voie orale la VTR chronique de 31,7 (mg.kg-1.j-1)-1(US EPA, 2025).
Trois organismes proposent des valeurs, l’US EPA (2025), Santé Canada (2021) et l’OEHHA (2025). En 2020, la HAS a réalisé une analyse des données existantes (HAS, 2020) et a proposé de retenir l’ERUo de 1,5 (mg.kg-1.j-1), issus des relations dose-réponse des études de Tseng (1968, 1977) et conduites dans la population taïwanaise.
Les 2 valeurs construites par l’OEHHA et Santé Canada se réfèrent à une même population taiwanaise exposée à une large gamme de concentration d’As via l’eau de puits contaminée à l’As. Les études auxquelles se réfèrent ces 2 organismes sont anciennes et présentent plusieurs biais (consommation d’eau, poids, statut de fumeur…). L’US EPA a réalisé 2 méta-analyses qui regroupent plusieurs études plus récentes et menées sur différentes populations souvent faiblement exposées à l’As et géographiquement variées, plus représentatives de nos conditions d’exposition. Par ailleurs, les études retenues par l’US EPA font l’objet d’une analyse rigoureuse en particulier avec la prise en compte du statut de fumeur, essentiel vis-à-vis l’incidence des cancers examinés (poumons et vessie).
L’OEHHA propose un ERUo de 1,5 (mg.kg-1.j-1)-1 construit à partir d’une cohorte Taiwanaise fortement exposée à l’As, avec comme effet critique retenu, un cancer cutané qui survient plusieurs années après l'exposition, avec une incidence plus marquée en fonction de l’âge et du sexe (hommes plus atteints que les femmes). Par ailleurs, la consommation d’eau journalière chez la population taïwanaise prise en compte n’est pas la même pour l’élaboration de la VTR pour les effets à seuil et pour les effets sans seuil (3,5 L.j-1 pour les hommes et 2 L.j-1 pour les femmes pour les effets sans seuil et 4,5 L.j-1 dans le calcul des effets à seuil ).
La valeur établie par Santé Canada propose également une valeur construite à partir de la même cohorte Taiwanaise, d’après les données de l’étude de Morales et al. (2000). L’analyse cible les cancers de la vessie, du foie et des poumons. Le choix des effets critiques est cohérent avec le profil toxicologique de l’As qui a pu établir des relations dose-effet notamment pour le cancer de la vessie et des poumons. Outre le fait que le tabac n’ait pas été contrôlé dans cette étude, bien que directement impactant le cancer de la vessie et du poumon, le calcul de dose n’est pas cohérent avec les caractéristiques de la population taiwanaise (poids de 70 kg et consommation de 1,5 L.j-1). Par conséquent, cette valeur n’est pas retenue.
L’US EPA propose en 2025 un slope factor combiné, équivalent à un ERUo, de 31,7 (mg.kg-1.j-1)-1 pour 2 types de cancers (poumon et vessie). Cette valeur est issue de 2 méta-analyses, menées par l’US EPA, regroupant une vingtaine d’études récentes réalisées dans plusieurs zones géographiques. L’US EPA a concentré son analyse sur les études où les sujets ont été exposés à des plages qualifiées de faibles à modérées, rendant l’analyse plus pertinente en termes de sensibilité. Les populations étudiées, notamment aux Etats-Unis, présentent également plus de similitudes avec les populations européennes en termes de nutrition et de facteurs socio-économiques que la population taïwanaise. Les cancers du poumon et de la vessie, retenus comme effets critiques, étant des cancers du fumeur, l’US EPA s’est appuyé uniquement sur des études où le tabagisme était une variable bien contrôlée. La robustesse de la qualité des valeurs construites est quant à elle liée à l’analyse des données à partir des 2 méta-analyses directement élaborées par l’US EPA. Les étapes de la construction de la valeur sont clairement identifiées. De plus, la valeur construite par l’US EPA est la plus protectrice des valeurs élaborées par les différents organismes.
En raison du choix des populations étudiées, du plus faible niveau d’exposition et de l’analyse des données à partir de 2 méta-analyses avec la prise en compte du tabac comme facteur confondant, l’Ineris préconise donc de retenir la valeur de l’US EPA.
Cette valeur d’ERUo correspond à une dose de 3.10-7 mg.kg-1.j-1 pour un excès de risque de 10-5 et 3.10-8 mg.kg-1.j-1 pour un excès de risque de 10-6.
Indice de confiance : fort en raison du choix des études et de l’analyse des données (méta-analyses).
Valeurs de l'ANSES et/ou de l'INERIS
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 22/10/2025
Introduction
Evaluations existantes :
Ambient water quality criteria for arsenic (US-EPA, 1984b) Health Assessment Document for Inorganic Arsenic (US-EPA, 1984a) Preconsultation report: Proposed EQS for Water Framework Directive Annex
VIII substances: arsenic (total dissolved) (Lepper et al., 2007)
Maximum Permissible Concentrations and Negligible Concentrations for metals, taking background concentrations into account (RIVM, 1997) Integrated criteria document arsenicum effects (RIVM, 1990)
Critères PBT / POP :
La substance n’est pas concernée par les critères PBT/vPvB[1] (C.E., 2006) ou POP[2] (PNUE, 2001).
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Normes de qualité existantes (ETOX,2013[3]) :
Arsenic
Canada :
Critère de qualité organismes aquatiques (arsenic total), Eau douce = 5 μg.L-1
Eau de mer = 12,5 μg.L-1
Critère de qualité pour l’eau de boisson (IMAC) (arsenic total) = 25 μg.L-1
Suisse :
Norme de qualité pour les hydrosystèmes, (projet) (arsenic dissous) = 10 μg.L-1
Allemagne :
Norme de protection, matière en suspension, 40 mg/kg de poids sec
Angleterre :
Norme de qualité des eaux douces (arsenic dissous) : 50 μg.L-1
Proposition d’EQS eau douce (arsenic dissous, en concentration ajoutée à la concentration de fond[4]) : 0,5 μg.L-1
Norme de qualité des eaux marines (arsenic dissous) : 25 μg.L-1
Proposition d’EQS eau marine (arsenic dissous, en concentration ajoutée à la concentration de fond) : 0,6 μg.L-1
Hollande :
EQS eau de surface (arsenic dissous) : 1 µg.L-1
EQS eau de surface (arsenic total) : 0,8 µg.L-1
OSPAR :
Pour la mer du Nord et l’Atlantique NE (arsenic dissous) : 1-10 μg/L1 µg.L-1
Etats Unis :
Critère qualité pour la consommation humaine des poissons et de l’eau de boisson : 0,018 µg.L-1
Protection de la Santé, consommation des poissons : 0,14 µg.L-1
Substances associées :
-
Etats-Unis : Critère de qualité pour les organismes aquatiques, eau douce = 190 μg.L-1, pour les organismes aquatiques marins = 36 μg.L-1
Etats-Unis : Critère de qualité pour les organismes aquatiques, eau douce = 48 μg.L-1, eau marine = 13 μg.L-1.
[3] Les données issues de cette source (http://webetox.uba.de/webETOX/index.do) ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS.
[4] La concentration de fond correspond à la concentration en substance non reliée aux émissions d'un site. Elle est décrite comme d'origine environnementale et/ou anthropique.
Dangers
Description
ORGANISMES AQUATIQUES
Sauf mention contraire, toutes les données issues des documents référencés sous «(Lepper et al., 2007) » « RIVM, 1997« et « US-EPA, 1984b » ont fait l'objet d'un examen collectif, elles n'ont donc pas fait l'objet de validation supplémentaire.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
Les tableaux ci-dessous répertorient les données d'écotoxicité jugées pertinentes pour notre étude. Les concentrations sont indiquées en concentration d'arsenic, la spéciation est précisée à chaque fois que l'information est disponible.
ECOTOXICITE AQUATIQUE AIGUË
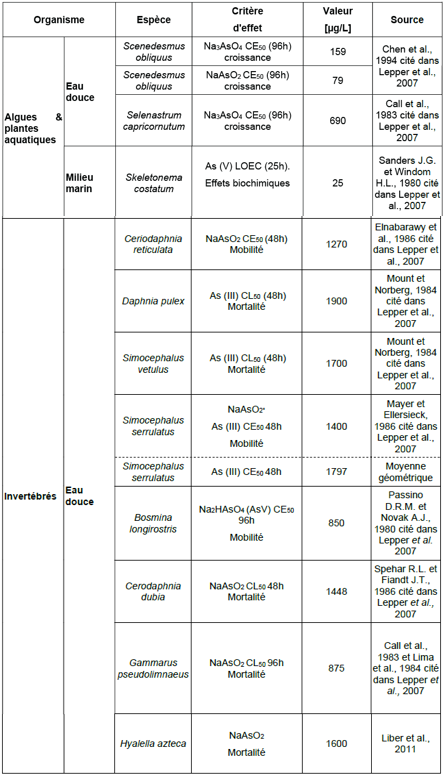
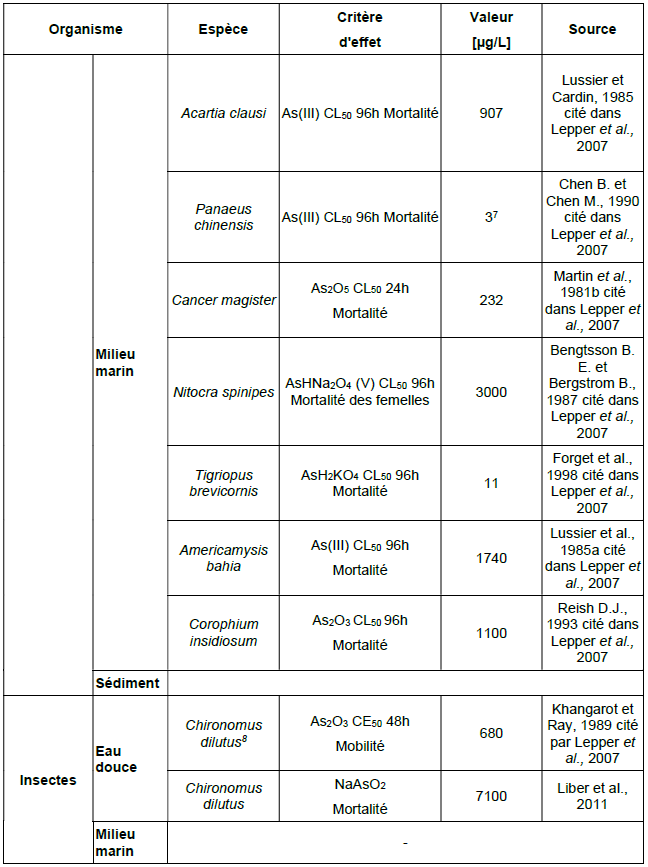
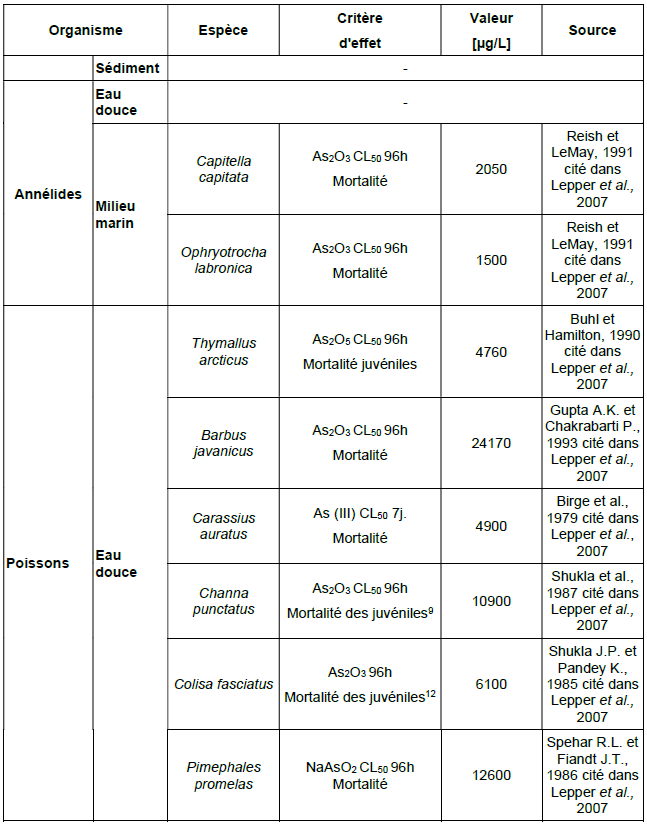
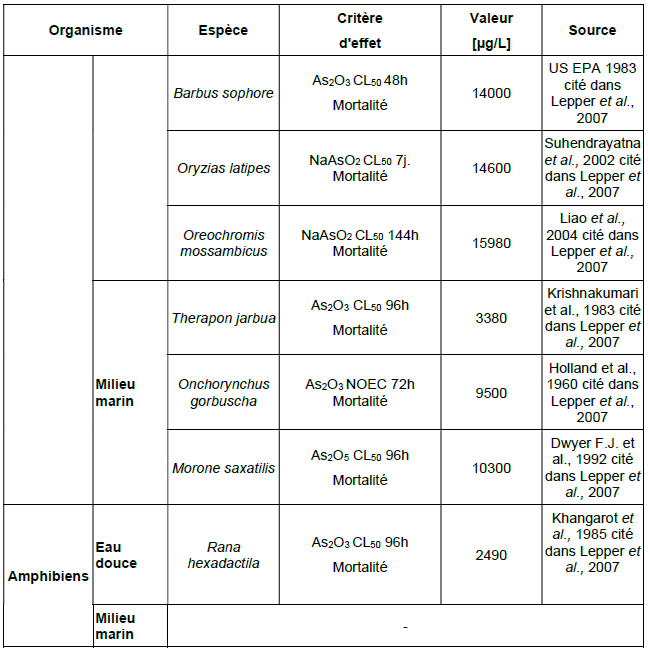
[7] Il n'a pas été possible de vérifier cette donnée issue du résumé d'une publication rédigée en chinois. Elle ne sera pas utilisée dans les calculs mais est citée à titre d'information en tant que donnée la plus basse reportée.
[8] Nouveau nom de Chironomus tentans
[9] Plus précisément les poissons utilisés pour l'essai sont au stade « fingerling ». C'est-à-dire qu'ils ont développé récemment des écailles et des branchies fonctionnelles. Cela correspond généralement à un poisson de 9 à 12 mois ayant la taille d'un doigt.
ECOTOXICITE AQUATIQUE CHRONIQUE
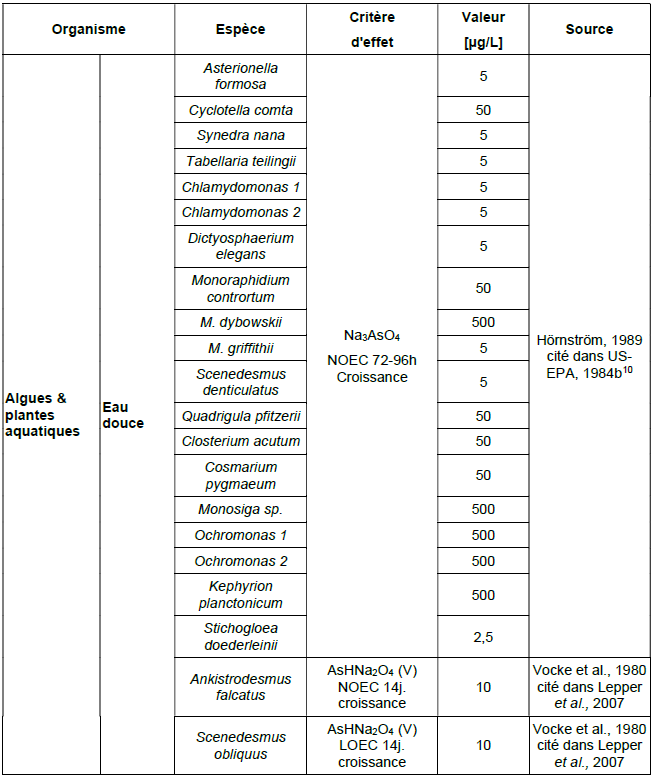
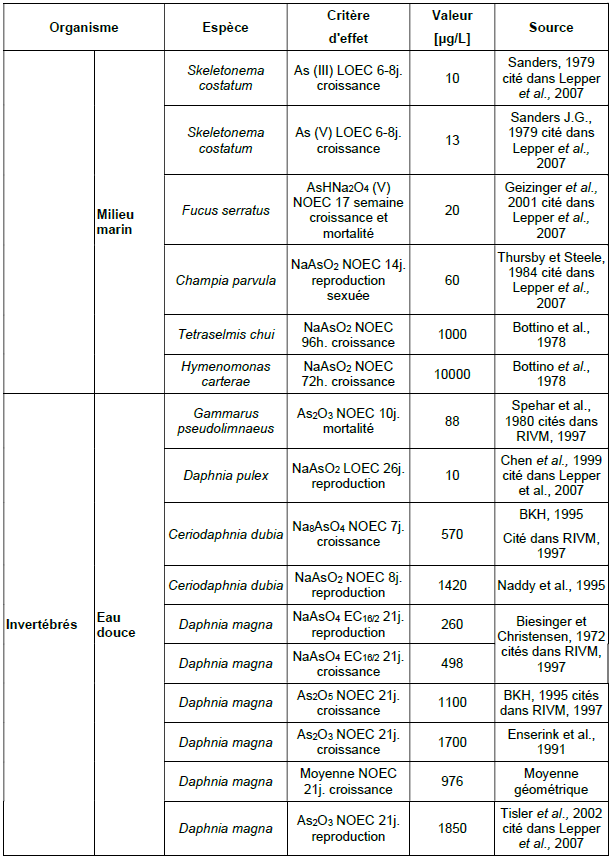
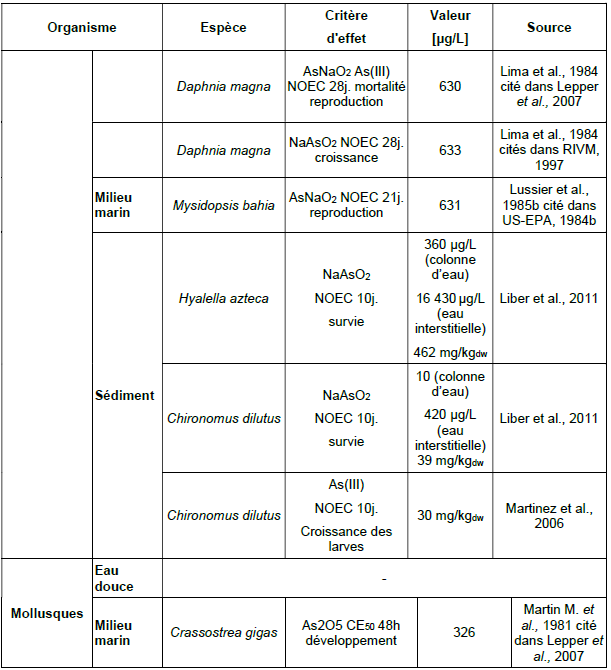
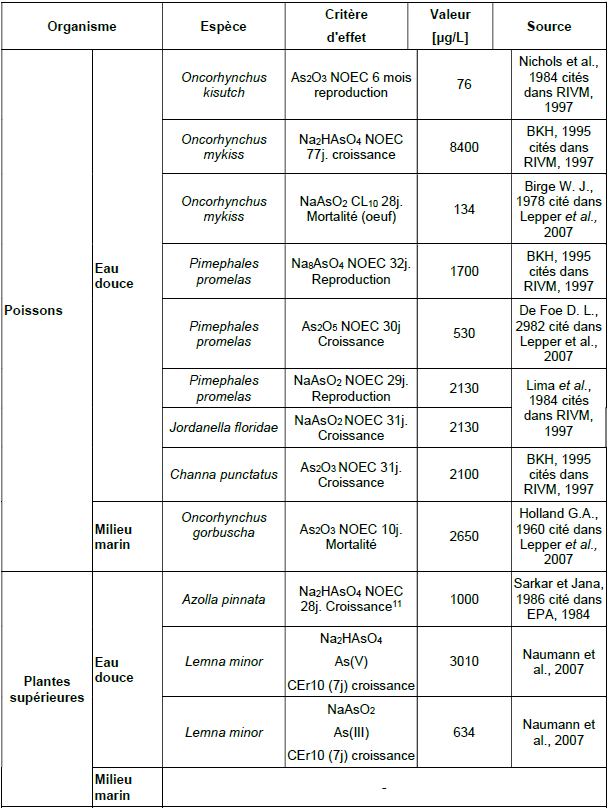
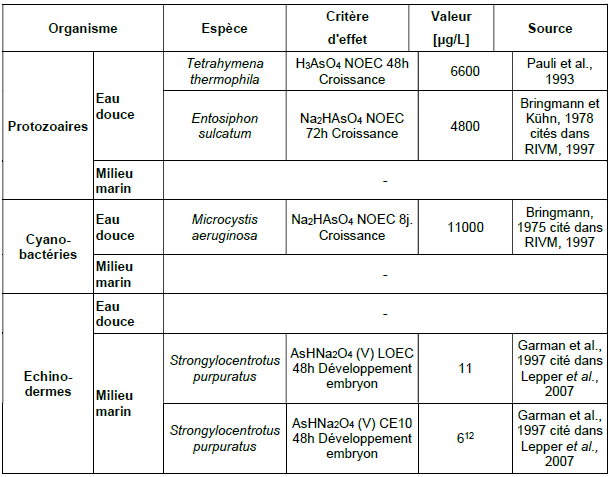
[10] Les concentrations utilisées lors des essais ne sont pas toutes présentées dans le document. Le pas entre les NOEC et les LOEC est donc inconnu. Ces valeurs ne sont pas utilisées pour les calculs mais sont présentées dans ce tableau à titre d'information.
[11] Il n'a pas été possible de vérifier si la NOEC est liée à un essai ayant enregistré un résultat positif ou si elle correspond à la plus haute concentration testée.
ECOTOXICITE POUR LES VERTÉBRÉS TERRESTRES
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
TOXICITE ORALE POUR LES MAMMIFERES
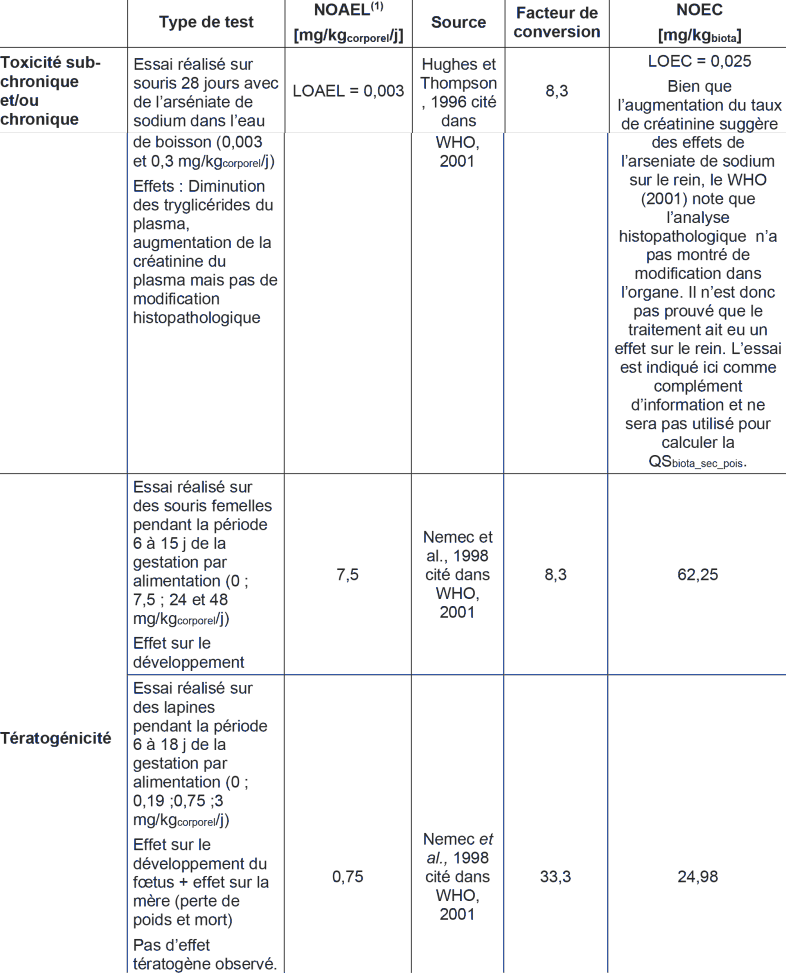
(1) NOAEL : No Observed Adverse Effect Level
TOXICITE ORALE POUR LES OISEAUX
Un essai présentant une LOEC et une NOEC est présenté mais la publication porte sur une exposition conjointe à l'arsenic et au sélénium. Il est résumé dans le tableau suivant.
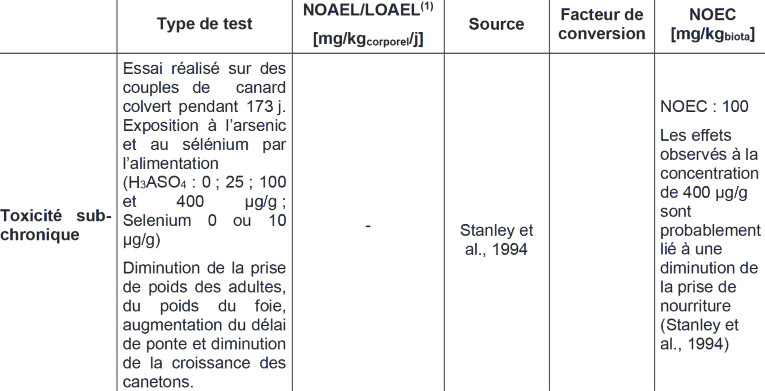
(1) NOAEL : No Observed Adverse Effect Level; LOAEL : Lowest Observed Adverse Effect Level
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Description
NORMES DE QUALITÉ POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011).
L'examen du jeu de donnée n'a pas permis de dégager une sensibilité particulière des organismes à un état d'oxydation ou à un paramètre environnemental. Conformément aux recommandations pour prendre en compte la biodisponibilité des métaux du guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), l'évaluation prend en compte la fraction dissoute du composé et considèrera les approches par facteur d'extrapolation, statistiques ou par coefficient de partition pour calculer les normes de qualité.
La valeur du facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), pour les métaux, les données de toxicité en eau douce et eau de mer doivent être séparées a priori. Ceci est expliqué par la différence de toxicité attendue sur les espèces dulçaquicoles ou marines en raison de la différence dans la spéciation des métaux et leur biodisponibilité ainsi que des capacités d'(osmo)régulation des espèces. Les données ne peuvent être combinées que si l'absence de différences est démontrée ou si la biodisponibilité est prise en compte par ailleurs.
Le facteur d'extrapolation appliqué pour déterminer la AA-QSmarine_eco doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons spécifiques marins et une diversité d'espèces plus complexe en milieu marin.
- Moyenne annuelle (AA-QSwater_eco et AA-QSmarine_eco) :
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
L'examen des données disponibles n'a pas permis de déterminer une différence entre les résultats des essais long terme réalisés avec des formes trivalentes et pentavalentes de l'arsenic. Il n'est donc pas justifié de les différentier selon le critère de la spéciation. Un test de Mann-Whitney sur XLStat 2007 a été réalisé sur les jeux de données long terme retenus en eau douce et en eau marine. Ce test a permis de vérifier qu'il n'y avait pas de différence significative entre les résultats d'essai en eau douce et en eau de mer, en conséquence, un jeu de données unique peut être considéré pour le calcul de la AA-QSwater_eco et AA-QSmarine_eco.
Le guide technique européen pour la détermination des normes de qualité environnementale permet d'évaluer l'AA-QSwater_eco et l' AA-QSmarine_eco selon une approche d'extrapolation statistique si le jeu de données remplit certains critères. En ce qui concerne l'arsenic, le jeu de donnée n'est pas optimal pour utiliser la méthode d'extrapolation statistique, une valeur long terme « insecte » et une valeur long terme sur - par exemple - des amphibiens sont manquantes. Toutefois, pour les insectes, les détails d'un essai d'écotoxicité réalisé sur la larve de moustique (Liber et al., 2011) exposée à du sédiment contaminé fournissent les concentrations en arsenic mesurées dans l'eau interstitielle et dans la colonne d'eau. Ces concentrations sont très différentes et il est difficile de déterminer la contribution de l'eau interstitielle (NOEC correspond à 420 µg.L-1) et de la colonne d'eau (NOEC correspond à 10 µg.L-1) pour ces organismes benthiques. Afin d'adopter une démarche protectrice, la concentration équivalente dans l'eau qui sera utilisée pour le taxon des insectes sera la concentration de 10 µg.L-1 . Bien qu'il manque encore une donnée sur un taxon supplémentaire (les amphibiens par exemple), la distribution des espèces (SSWD, Species Sensitivity Weighted Distribution) (Duboudin et al., 2004) est réalisée pour obtenir l'HC5, la concentration supposée sans effet néfaste sur 95% des espèces aquatiques.
La valeur suivante a été calculée à l'aide des données aquatiques d'eau douce et d'eau marine
HC5 = 6,85 μg/L (IC_90% = [3 ; 18.7]).
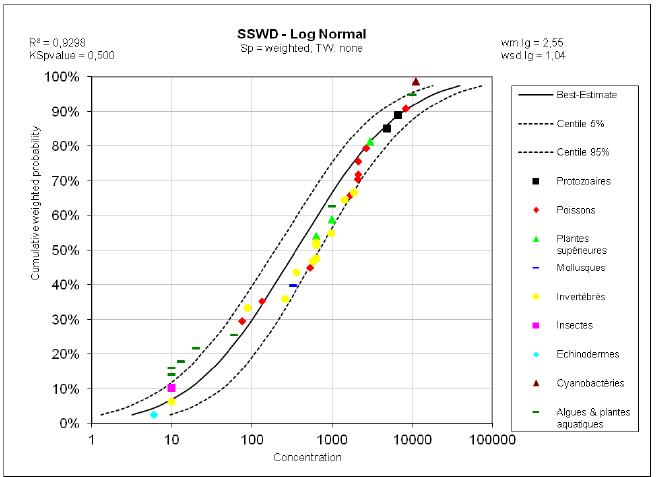
Figure 1 : Arsenic et ses dérivés inorganiques, distribution des résultats des essais de type chroniques
Cette courbe permet de visualiser une certaine sensibilité à l'arsenic et ses dérivés inorganiques des insectes, des échinodermes, des algues et des invertébrés par rapport aux poissons.
Pour l'arsenic et ses dérivés inorganiques, il a été décidé d'utiliser le résultat de la dérivation statistique des données d'écotoxicologie pour calculer l'AA-QSwater_eco et l' AA-QSmarine_eco. Afin de tenir compte de l'absence de donnée sur un taxon supplémentaire (par exemple les amphibiens), le facteur d'extrapolation maximum de 5 recommandé par le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) sera appliqué à la HC5 obtenue. Pour l'AA-QSwater_eco l'INERIS propose donc la valeur suivante :
AA-QSwater_eco = 6,85/5 μg.L-1, soit
AA-QSwater_eco = 1,37 μg.L-1
L'AA-QSwater_eco calculée est inférieure au 90% centile dans l'eau de la base de données FOREGS (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
Pour l'AA-QSmarine_eco l'INERIS propose la valeur suivante :
AA-QSmarine_eco = 6,85/5 μg.L-1, soit
AA-QSmarine_eco = 1,37 μg.L-1
Bien que la valeur de concentration naturelle ne soit pas disponible pour l'eau marine, les mêmes précautions au moment de la mise en œuvre de cette valeur seuil sont recommandées pour l'eau de mer.
- Concentration Maximum Acceptable (MAC)
L'examen des données disponibles n'a pas permis de déterminer une différence entre les résultats des essais court terme réalisés avec des formes trivalentes et pentavalentes de l'arsenic. Il n'est donc pas justifié de les différentier selon le critère de la spéciation.
Un test de Mann-Whitney sur XLStat 2007 a été réalisé sur les jeux de données court terme retenus en eau douce et en eau marine. Ce test montre qu'il n'y avait pas de différence significative entre les résultats d'essai d'écotoxicité aigüe en eau douce et en eau de mer. En conséquence, un jeu de données unique peut être considéré pour le calcul de la MAC et de la MACmarine.
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
L'invertébré marin Tigriopus brevicornis apparait comme l'espèce la plus sensible parmi les essais validés en exposition aigue avec une CL50 de 11 µg.L-1 (Forget et al., 1998). Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 peut être appliqué sur cette valeur puisque des données sont disponibles pour chaque niveau trophique (poissons, microcrustacés et algues), et que les espèces représentatives des taxons jugés le plus sensibles (ici les algues et les invertébrés) sont représentés.
L'INERIS propose donc la valeur suivante :
MAC = 11/10 μg.L-1, soit
MAC = 1,1 μg.L-1
La valeur obtenue pour la MAC est légèrement inférieure à la valeur obtenue pour l'AA-QSwater_eco. La MAC sera donc considérée comme égale à l'AA-QSwater_eco c'est-à-dire :
MAC = 1,37 μg.L-1
La MAC calculée est du même ordre de grandeur que le 90% centile dans l'eau de la base de donnée FOREGS* (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
En ce qui concerne les organismes marins, le jeu de donnée comprend des informations disponibles pour les taxons plantes, invertébrés et poissons en plus de données court terme pour deux taxons marins additionnels : deux CL50 obtenus sur des annélides (Reish et LeMay, 1991) et des données sur le mollusque Crassostrea gigas (Martin et al., 1981a)* . Les espèces représentatives des taxons jugés le plus sensibles (ici les algues et les invertébrés) étant représentés, conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 peut être appliqué à la donnée issue de l'essai validé le plus sensible disponible : une CL50 de 11 µg.L-1 sur l'invertébré marin Tigriopus brevicornis (Forget et al., 1998).
* Bien que le paramètre mesuré, le développement, soit plutôt du domaine des effets recherchés pour l'exposition chronique, la durée du test et le critère mesuré (une CE50 à 48h) justifie d'utiliser également cet essai parmi les informations du jeu de données aigues.
L'INERIS propose donc la valeur suivante :
MACmarine = 11/10 μg.L-1, soit
MACmarine = 1,1 μg.L-1
La valeur obtenue pour la MACmarine est légèrement inférieure à la valeur obtenue pour l'AA-QSmarine_eco. La MACmarine sera donc considérée comme égale à l'AA-QSmarine_eco c'est-à-dire :
MACmarine = 1,37 μg.L-1
Bien que le 90% centile dans l'eau marine ne soit pas disponible dans la base de donnée FOREGS, le 90ème centile en eau de surface est utilisé (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
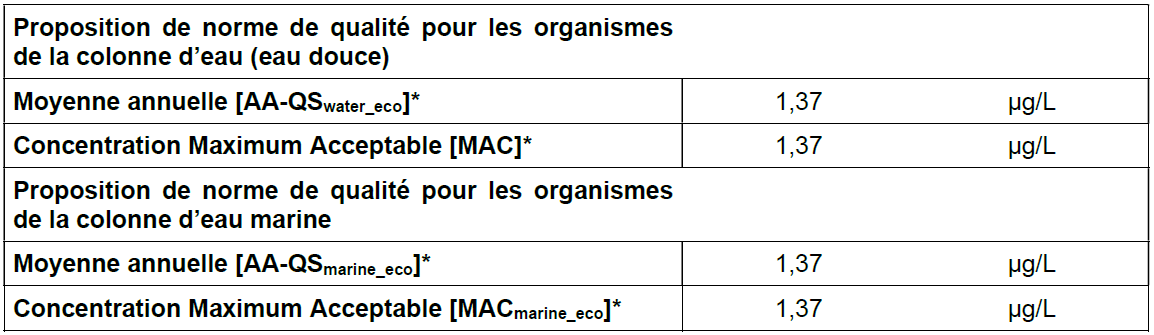
*Ces valeurs sont du même ordre de grandeur que les concentrations naturelles environnementales. Ceci implique de prendre en compte les concentrations bruit de fond au moment de la mise en œuvre de cette valeur seuil.
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus faible a été obtenue lors d'un essai réalisé sur la larve de Chironomus dilutus (NOEC = 30 mg.kg-1 de sédiment sec avec un As(III) (Martinez et al., 2006). Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSsed poids sec peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 50 puisque le jeu de donnée comprend également le résultat d'un essai long terme sur Hyallela azteca, un autre organisme benthique au mode de vie différent (Liber et al., 2011). L'INERIS propose donc la valeur suivante :
QSsed poids sec [mg/kg] = 30/50 mg/kg, soit 0,6 mg/kg
La QSsed poids sec calculée est inférieure au 90ème percentile dans le sédiment de la base de donnée FOREGS (22 mg/kg) aussi, conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), celles ci peuvent être prises en compte pour évaluer l'état d'un milieu. La QSsed poids sec ne tient pas compte des concentrations naturelles.
La concentration correspondante en poids frais peut être estimée en tenant compte du facteur de conversion suivant :
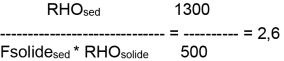
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0,2 m3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour l'arsenic et ses dérivés inorganiques, la concentration correspondante en poids humide est :
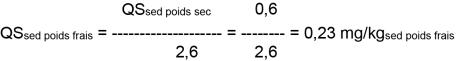
En ce qui concerne les organismes benthiques marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), l'hypothèse selon laquelle les données écotoxicologiques d'origine marine peuvent être rassemblées avec celles d'origine d'eau douce doit être vérifiée. La sensibilité des espèces benthiques marines à la toxicité des substances peut être considérée comme équivalente à celle des espèces d'eau douce si aucune différence entre les jeux de données n'a été démontrée ou si les données d'un des deux jeux sont insuffisantes pour permettre une analyse statistique (et en l'absence d'informations d'autres origines*).
Néanmoins, le facteur d'extrapolation appliqué pour déterminer la QSsed marin doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons spécifiques marins et une diversité d'espèces plus importante en milieu marin.
Il n'y a pas de données benthiques marines disponibles, la QSsed marin sera estimée à partir des données issues d'essais d'écotoxicité obtenus sur des espèces benthiques d'eau douce.
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus faible a été obtenue lors d'un essai réalisé sur la larve de Chironomus dilutus (NOEC =30 mg/kg de sédiment sec avec un As(III) (Martinez et al., 2006). Le guide technique européen précise que les données obtenues lors d'essais sédiment où la disponibilité de la substance est la plus importante sont préférées aux autres (E.C., 2011). Lors de cet essai, le sédiment utilisé est constitué de sable (pauvre en carbone organique) et le pH est maintenu entre 7 et 8. L'arsenic y est donc biodisponible. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSsed marin poids sec peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 500 puisque le jeu de donnée comprend également le résultat d'un essai long terme sur Hyallela azteca, un autre organisme benthique au mode de vie différent (Liber et al., 2011). L'INERIS propose donc la valeur suivante :
* Ces informations peuvent provenir de composés très proches par « read across » ou d'un jugement d'expert.
QSsed marin poids sec [mg/kg]= 30/500 mg/kg, soit 0,06 mg/kg
Bien que le 90ème percentile dans le sédiment marin ne soit pas disponible dans la base de donnée FOREGS, la même démarche que pour l'eau douce est suivie. La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
La concentration correspondante en poids frais peut être estimée en tenant compte du facteur de conversion suivant :
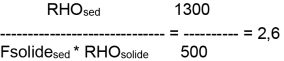
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0,2 m3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour l'arsenic et ses dérivés inorganiques, la concentration correspondante en poids humide est :

Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de remise en suspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
|
Proposition de valeur guide pour les organismes benthiques (eau douce) |
230 |
µg/kgsed poids frais |
|
|
600 |
µg/kgsed poids sec |
||
|
Proposition de valeur guide pour les organismes benthiques (eau marine) |
23 |
µg/kgsed poids frais |
|
|
60 |
µg/kgsed poids sec |
||
|
Conditions particulières |
Les critères décrits par le document guide technique européen (E.C., 2011) pour déterminer si la mise en œuvre d’un seuil pour le sédiment impliquent d’utiliser les valeurs de Koc et de Kow. Pour l’arsenic, comme pour les autres métaux, il n’est pas possible de s’appuyer sur ces valeurs qui varient avec le pH et la composition du sédiment. Etant donné que la substance a tendance à s’accumuler dans le sédiment (et est donc susceptible de se remettre en suspension à la moindre perturbation) et que la toxicité de l’arsenic pour les organismes benthiques a été démontrée dans la littérature scientifique, il est recommandé de mettre en œuvre un seuil pour le sédiment. |
||
NORME DE QUALITÉ EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
L'analyse en première approche des essais rapportés ne permet pas de mettre en évidence une sensibilité particulière des mammifères ou des oiseaux par rapport au poisson.
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus sensible est une NOEC de 24,98 mg.kg-1biota dérivée depuis une NOAEL obtenue lors d'un essai réalisé sur des lapines exposées par voie orale pendant la période de gestation. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSbiota_sec_pois peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 300 puisque l'exposition prévue dans le test est de courte durée. L'INERIS propose donc la valeur suivante :
QSbiota_sec_pois [mg/kg]= 24,98/300 mg/kg, soit 0,083 mg/kg
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
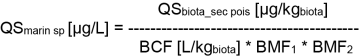
Avec :
BCF : facteur de bioconcentration,
BMF1 : facteur de biomagnification,
BMF2 : facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées. Il convient de rappeler que la bioaccumulation de l'arsenic dans les organismes n'est pas corrélée avec la concentration dans l'eau. De plus il a été rapporté que bien que la bioaccumulation de l'arsenic ait été observée, la bioamplification de ce composé n'a pas été observée (Farag et al., 1998; Williams et al., 2006).
Le BCF retenu pour réaliser les calculs concernant l'empoisonnement secondaire correspond à une moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006)** pour des concentrations d'arsenic dans l'eau comprises entre l' AA-QSwater_eco calculée dans ce rapport (0.5 µg.L-1) et la valeur correspondant au 90% centile des concentrations naturelles dans l'eau de la base de donnée FOREGS (2.45 µg.L-1) afin de correspondre à une gamme de concentration cohérente avec des conditions environnementales. Cette valeur est égale à 100 et devrait être suffisamment protectrice dans des conditions environnementales étant noté par ailleurs que les BCF diminuent si les concentrations dans l'eau augmentent.
Pour l'arsenic et ses dérivés inorganiques, un BCF de 100 et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc :
QSwater_sp = 0,083 / (100 * 1) = 0,83.10-3 mg/L = 0,83 μg/L
QSmarine_sp = 0,083 / (100 * 1 * 1) = 0,83.10-3 mg/L = 0,83 μg/L
QSwater_sp = 0,83 μg/L
QSmarine_sp = 0,83 μg/L
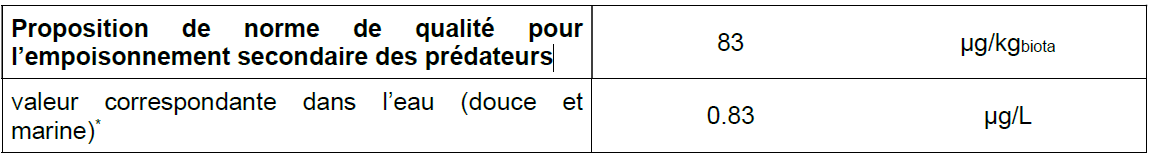
*Ces valeurs sont du même ordre de grandeur que les concentrations naturelles environnementales. Ceci implique de prendre en compte les concentrations bruit de fond au moment de la mise en œuvre de cette valeur seuil.
**Les BCF et les BAF de cette source n'ont pas été vérifiées.
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011) :

Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 6,66.10-4 µg/kgcorporel/j
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte de l'effet cancérogène de la substance, la VTR prend déjà en compte ce facteur donc il sera réduit ici à 1
- Cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journaliers contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
Pour l'arsenic et ses dérivés inorganiques, le calcul aboutit à :
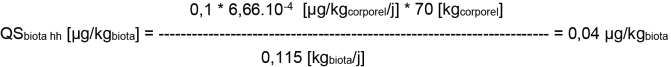
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
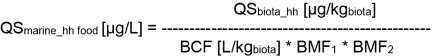
Le BCF retenu pour réaliser les calculs concernant l'empoisonnement secondaire correspond à une moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006)* pour des concentrations d'arsenic dans l'eau comprises entre l' AA-QSwater_eco calculée dans ce rapport (0,5 µg.L-1) et la valeur correspondant au 90% centile des concentrations naturelles dans l'eau de la base de donnée FOREGS (2,45 µg.L-1) afin de correspondre à une gamme de concentration cohérente avec des conditions environnementales. Cette valeur est égale à 100 et correspond à un pire cas réaliste étant donné que les BCF diminuent si les concentrations dans l'eau augmentent.
* Les BCF et les BAF de cette source n'ont pas été vérifiées.
Pour l'arsenic et ses dérivés inorganiques, on obtient donc :
![]()
![]()

NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0,1 µg.L-1). Pour l'arsenic et ses dérivés inorganiques, la Directive 98/83/CE fixe une valeur de 10 µg.L-1.
A titre de comparaison, la valeur seuil provisoire pour l'eau de boisson est calculée de la façon suivante (E.C., 2011):
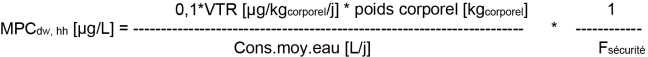
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 6,66.10-4 µg/kgcorporel/j
- Cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte de l'effet cancérogène de la substance. La VTR sélectionnée prend déjà en compte cet aspect, le facteur est donc abaissé à 1.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
Ainsi, la norme de qualité correspondante dans l'eau brute se calcule de la manière suivante :
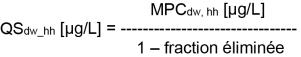
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour l'arsenic et ses dérivés inorganiques, on obtient :
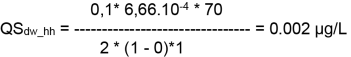
La valeur fixée par la directive 98/83/CE (10 µg.L-1) est plus élevée que la valeur calculée ici mais possède une portée réglementaire et s'applique.

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
SELECTION DE LA VALEUR GUIDE ENVIRONNEMENTALE
Elle est définie à partir de la valeur la plus protectrice parmi tous les compartiments étudiés.
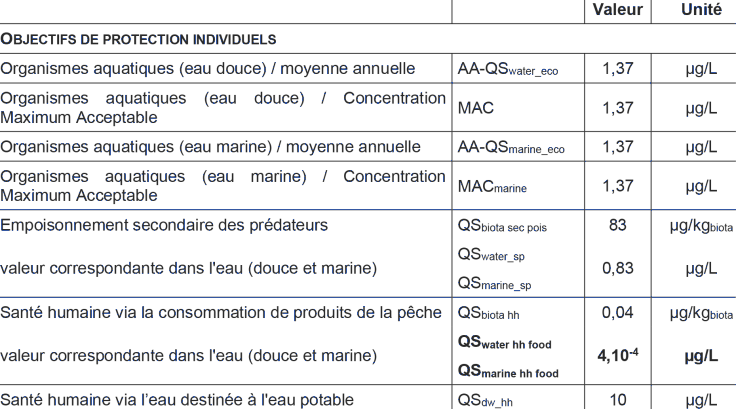
Pour l'arsenic et ses dérivés inorganiques, la valeur guide pour la santé humaine via la consommation de produits de la pêche est la valeur la plus faible pour l'ensemble des approches considérées.

Bibliographie
Activité endocrine
Dernière vérification le 22/10/2025
Généralités sur les activités endocrines
L'arsenic et ses dérivés ne sont pas cités dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Données technico-économiques
Dernière vérification le 21/10/2025
Tableaux de synthèse
Généralités
| CAS | 7440-38-2 |
|---|---|
| SANDRE | 1369 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. La majorité des secteurs industriels responsables de l'émission d'arsenic à l'environnement est concernée par un ou plusieurs textes spécifiques. Dans le paragraphe ci-dessous, nous ne citons que des extraits des exemples nous ayant paru être significatifs. Nous citons également des extraits de textes concernant les rejets de poussières car dans certains secteurs industriels, l'arsenic est majoritairement rejeté sous forme particulaire, toute mesure conduisant à l'abattement des teneurs de poussières émises constitue donc indirectement une mesure affectant les rejets atmosphériques d'arsenic. [26] Moyenne calculée sur l'année civile du contenu total de la fraction PM10. Divers emplois de l'arsenic La Directive n° 2006/139/CE de la Commission du 20 décembre 2006 modifiant la directive 76/769/CEE du Conseil, en ce qui concerne la limitation de la mise sur le marché et de l'emploi des composés de l'arsenic, en vue d'adapter son annexe I aux progrès techniques (JOUE n° L384 du 29 décembre 2006) indique que les composés de l'arsenic.
[26] DEROGATIONS A LA DIRECTIVE N° 2006/139/CE DE LA COMMISSION DU 20 DECEMBRE 2006 MODIFIANT LA DIRECTIVE 76/769/CEE DU CONSEIL, EN CE QUI CONCERNE LA LIMITATION DE LA MISE SUR LE MARCHE ET DE EMPLOI DES COMPOSES DE L'ARSENIC, EN VUE D'ADAPTER SON ANNEXE I AU PROGRES TECHNIQUE (JOUE N° L384 DU 29 DECEMBRE 2006) [27] CCA de type C : 47,5% de CrO3 18,5% de CuO et 34% d'As2O5. CCA qui était utilisé dans la Communauté avant le 30 septembre 2007:
Emplois d'arsenic dans le secteur de la fusion de verre L'Arrêté du 12 mars 2003 relatif à l'industrie du verre et de la fibre minérale publié au JO du 6 juillet 2003 fixe les prescriptions applicables aux établissements dans lesquels sont exercées à la date de publication des activités de fabrication et de travail du verre ou de fabrication de fibres de verre ou laine de roche.
Selon l'extrait considéré, le délai de mise en application s'étale de 2006 à 2010. Emplois phytosanitaires de l'arsenic29 En France, l'avis du 23 novembre 2001 relatif aux détenteurs d'autorisation de mise sur le marché, aux distributeurs et aux utilisateurs de produits phytopharmaceutiques contenant de l'arsénite de soude (arsenic de l'arsénite de sodium) publié au JO du 23 novembre 2001 impose le retrait des autorisations de mise sur le marché des produits phytopharmaceutiques contenant de l'arsénite de soude (arsenic de l'arsénite de sodium) sans délai d'écoulement des stocks aussi bien au stade de la distribution qu'à celui de l'utilisation. Cette mesure est entrée en vigueur à la date du 8 novembre 2001, date de notification des décisions de retraits d'autorisation de mise sur le marché des préparations concernées. Pour collecter et éliminer les stocks détenus par les distributeurs et les agriculteurs (essentiellement viticulteurs) un accord cadre entre les ministères en charge de l'Ecologie, de l'Agriculture, les Agences de l'eau et Adivalor30 a été mis en place. [29] A ce jour, la seule substance active contenant de l’arsenic autorisée en France en tant que produit phytosanitaire est l’arsenic du dimethylarsinate de sodium essentiellement utilisé pour formuler des formicides (site internet e-phy) [30] Société en charge d'organiser et gérer l'élimination des déchets de l'agro-fourniture |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux informations en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Les valeurs ci-dessous reprises sont tirées de notes documentaires rédigées par l'INRS 2003 ; 2006c).
[25] Valeur limite moyenne d'exposition : ces valeurs sont destinées à protéger le travailleur des effets à terme, mesurés ou estimés, sur la durée d'un poste de travail de 8 heures (INRS, 2006c). Qualité de l'eau La Directive 2000/60/CE du Parlement européen et du Conseil du 23 octobre 2000 établit un cadre pour une politique communautaire dans le domaine de l'eau (eau de surface, eaux transitoire, eau côtière et eau souterraine). Dans ce texte l'arsenic est placé en Annexe VIII : « Liste indicative des principaux polluants ». Qualité des eaux de consommation En France, le Décret n° 2001 – 1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation fixe la teneur maximale en arsenic à 10 µg.L-1 . En Europe, la Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine fixe la teneur maximale en arsenic à 10 µg.L-1 . Qualité de l'air En Europe, la Directive fille 2004/107/CE du Conseil du 15 décembre 2004 (directive cadre de 1999) concernant l'arsenic, le mercure, le nickel et les hydrocarbures aromatiques polycycliques dans l'air ambiant (JOUE du 26 janvier 2005) fixe une valeur cible26 en arsenic de 6 ng.m-3 . Cette valeur ne devra pas être dépassée à partir du 31 décembre 2012. Pour ce faire, les états membres doivent, au plus tard le 15 février 2007, prendre toutes les mesures nécessaires (n'entraînant pas des coûts disproportionnés) pour s'y conformer. |
| Informations complémentaires |
L’arsenic (As) est un élément chimique métalloïde1. Cet élément se présente généralement sous forme de cristaux gris, brillants, d’aspect métallique et existe sous deux autres formes allotropiques : l’arsenic jaune et l’arsenic noir (INRS, 2006). [1] Un métalloïde est un élément chimique semi-métallique, c'est-à-dire dont les propriétés physiques et chimiques sont intermédiaires entre celles d'un métal et d'un non-métal. |
Production et utilisation
Production et ventes
Procédés de production
FTE 2005 Importer
Ces quelques notions sur les principes de production de l'arsenic et de son principal composé (trioxyde d'arsenic) sont issues d'un document INERIS datant de 2006 : fiche de données toxicologiques et environnementales des substances chimiques.
L'élément arsenic est produit par l'une ou l'autre des méthodes suivantes (HSDB, 2000) :
- pyrolyse de Fe S As (arsénopyrite) ;
- grillage de sulfure puis réduction de l'oxyde formé avec du carbone.
Il peut également être obtenu par réduction du trioxyde d'arsenic par le carbone (ATSDR, 1993).
Le trioxyde d'arsenic (As2O3) est le composé d'arsenic le plus important commercialement. Lors de la fusion du plomb ou du cuivre, l'arsenic combiné avec ces métaux s'évapore et s'oxyde dans l'air en donnant naissance à des particules de trioxyde d'arsenic. Celles-ci sont recueillies et purifiées par grillage en présence de pyrite ou de galène (ATSDR, 1993).
Pour les autres composés, les principes de productions peuvent être, par exemple, obtenus en consultant le site internet toxnet (rubrique HSDB : Hazardous Substances Data Bank).
En 1980, la production mondiale d'arsenic était de l'ordre de 75 000 à 100 000 tonnes (Proust et al., 2000).
Utilisations
Introduction (varitétés d'utilisations)
FTE 2005 Importer
Ces quelques notions sur les secteurs d'utilisation de l'arsenic et de ses composés sont issues du document INERIS (2006).
L'arsenic et ses composés minéraux ont de très nombreuses applications industrielles ou agricoles (Molénat et al., 2000) :
- complexe « chromate copper arsenate» (CCA) utilisé pour le traitement du bois ;
- alliage plomb-antimoine-arsenic utilisé dans les batteries électriques (l'arsenic améliore la résistance à la corrosion électrique) ;
- semi-conducteurs (arséniure de gallium AsGa) ;
- divers équipements électriques et électroniques[5] (toner, DEL, éléments de cellules photovoltaïques, cartes électroniques, …) ;
- agent décolorant dans l'industrie du verre[6] ;
- pigments de peinture en association avec le cuivre: CuAsO4 H ;
- fabrication de plombs de chasse, en association avec le plomb dont il augmente la dureté ;
- alliages avec le cuivre, le plomb, l'or, pour augmenter leur dureté.
[5] De tels équipements sont soumis à une obligation de recyclage depuis la mise en application des directives 2002/95/CE et 2002/96/CE. Ces directives limitent l'utilisation de certaines substances dans ce type d'équipements et imposent des objectifs précis en matière de valorisation et d'élimination lorsqu'ils sont mis au rebut. L'arsenic n'étant qu'indirectement visé par ces directives, celles-ci n'apparaîtront pas dans la partie réglementation.
[6] Selon Eisler (1994), l'arsenic est employé dans l'industrie du verre comme agent décolorant à hauteur de 0,2 à 1%.
De façon plus détaillée (composé par composé), différentes sources bibliographiques mettent en avant des applications spécifiques. Néanmoins, celles-ci (ci-après détaillées) ne s'appliquent pas forcément à la France :
- l'arséniate de plomb est utilisé comme pesticide (Ullmann, 1985) ;
- l'arséniate de sodium sert à produire d'autres arséniates tels que les arséniates de calcium et les arséniates de plomb (Ullmann, 1985) ;
- le trioxyde d'arsenic est un produit de base pour la fabrication de nombreux composés d'arsenic. Il est également utilisé comme intermédiaire chimique pour la fabrication d'herbicides, de raticides, de fongicides et d'insecticides, de produits pharmaceutiques ou vétérinaires[7] (HSDB, 2000) ;
- le trioxyde d'arsenic est utilisé pour la production d'arsenic élémentaire (HSDB, 2000) ;
- le trioxyde d'arsenic est utilisé en tannerie pour la conservation des peaux (HSDB, 2000) ;
- le trioxyde d'arsenic est un agent de décoloration et d’affinage du verre et des émaux, de traitement du bois
- le pentoxyde d'arsenic sert d'intermédiaire chimique pour la fabrication d'arséniates (HSDB, 2000) ;
- le pentoxyde d'arsenic est utilisé pour la fabrication d'herbicides (HSDB, 2000) ;
- le trihydrure d’arsenic est employé pour le dopage des semi-conducteurs (INRS, 2000)
- …
En l'absence de chiffre concernant ces différentes applications, il nous a été impossible de les organiser selon des critères d'importance.
Pour plus de détails ; les principaux secteurs d'utilisation de l'arsenic et de ses composés peuvent être, par exemple, obtenus en consultant le site internet toxnet (rubrique HSDB : Hazardous Substances Data Bank)[8] .
D'autre part, le site internet VIDAL (site d'information sur les produits de santé : (www.vidal.fr) indique deux usages thérapeutiques pour des composés à base d'arsenic :
- produit dentaire dévitalisant avec anhydride arsénieux ;
- produit antinéoplasique[9] à perfuser avec anhydride arsénieux[10] .
[7] Cette dernière application semble avoir diminué au profit des pesticides organochlorés et organophosphatés (HSDB, 2000).
[8] Précisons que, selon le site internet IREP, l'arsenic est également un sous-produit de l'exploitation de certains minerais de métaux (pyrites de fer, minerais sulfureux de cuivre, argent, or, plomb, ...).
[9] Médicament utilisé pour détruire les cellules cancéreuses ou empêcher leur prolifération.
[10] Usage réservé aux hôpitaux.
Néanmoins, on estime que les quantités d'arsenic concernées par un usage thérapeutique sont anecdotiques en comparaison des principaux secteurs d'utilisation précédemment listés.
Dans la suite de cette fiche, nous focaliserons notre propos sur les principaux émetteurs et/ou utilisateurs d'arsenic.
Rejets dans l’environnement
Sources naturelles
FTE 2005 Importer
Synthèse des sources naturelles
Ces quelques notions sur les sources naturelles d'arsenic dans l'environnement sont issues du document INERIS (2006).
L'arsenic est présent dans la nature, en particulier dans les roches qui renferment plus de 99% de l'arsenic présent dans la croûte terrestre sous forme de minerais : principalement FeSAs (arsénopyrite ou mispickel), secondairement les sulfures As4S4 (réalgar) et As4S6 (orpiment).
Dans la partie superficielle de l'écorce terrestre, la concentration moyenne en arsenic est évaluée à 2 mg.kg-1 . Localement, la concentration naturelle peut atteindre 100 mg.kg-1 voire 200 mg.kg-1 dans des dépôts calcaires ou phosphatés ou dans des schistes.
L'érosion des roches, le lessivage des sols, les réactions d'oxydo-réduction et les précipitations entraînent une redistribution de l'arsenic vers les compartiments aquatiques et atmosphériques.
D'autres sources naturelles d'émission d'arsenic dans l'atmosphère sont l'activité volcanique et les feux de forêts.
Emissions atmosphériques non-anthropiques
Selon le programme IPCS (2001) environ un tiers des émissions atmosphériques mondiales d'arsenic est d'origine naturelle. Néanmoins, cette source précise également que c'est essentiellement au volcanisme et à la volatilisation à basse température que ces émissions sont attribuables. La France métropolitaine prise dans sa globalité ne se caractérisant ni par la présence d'un volcanisme dynamique, ni par une forte représentation de minéraux arséniés à la surface du sol, la source non-anthropique devrait se révéler de faible importance.
Cette conclusion est confortée par les estimations du CITEPA qui affiche, pour l'année 2006, une participation des sources « hors total », (catégorie regroupant les émissions maritimes et aériennes internationales, ainsi que les émissions des sources biotiques, des forêts et les émissions des sources non-anthropique) équivalentes à moins de 5% du total des autres émissions anthropiques.
Présence d'origine non anthropique : le fond géochimique
Même si aucun rejet d'arsenic n'est effectué vers une masse d'eau donnée (de surface ou souterraine), cette masse d'eau peut néanmoins contenir de l'arsenic de façon naturelle. Cette teneur est liée aux caractéristiques physico-chimiques des eaux ainsi qu'à la géologie régionale : on appelle cette teneur le « fond géochimique ».
Par exemple, selon le BRGM (2006), dans le Puy-de-Dôme, sur les 1200 sources et forages recensés, quelques points d'eau présentent des traces d'arsenic, d'origine naturelle et attribuable au fond géochimique, à un taux parfois nettement supérieur à 10 μg.L-1 , la norme de potabilité (Figure 3.4).
Figure 3.4. Carte des concentrations en arsenic dans les eaux souterraines en région Auvergne (document repris du BRGM, 2006).
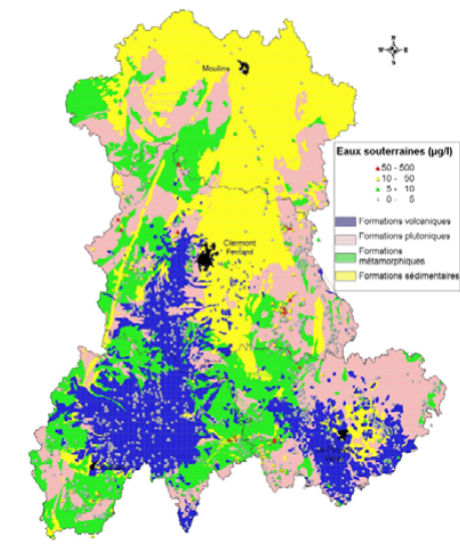
Des informations concernant la méthode préconisée pour caractériser le fond géochimique sont présentées dans un guide technique publié par le BRGM (2006b).
Sources non-intentionelles
Utilisation de combustibles fossiles
L'utilisation de combustibles fossiles peut expliquer la présence d'arsenic dans l'environnement du fait de dépôts atmosphériques dispersés.
Emissions atmosphériques par combustion de bois traité
Avant septembre 2007, le bois destiné à être utilisé en extérieur était fréquemment (et est en encore sous certaines conditions : cf. rubrique Réglementation) traité avec du CCA (chromate copper arsenate). Ce traitement conférait au bois une résistance supérieure à celle des bois non traités.
Bien que la réglementation encadre dorénavant cette pratique, il est apparu de la destruction des bois traités est problématique vis à vis des émissions d'arsenic. Ainsi, Lundholm et al. (2007) estiment que, lors de la combustion de bois traité au CCA dans un dispositif de 15 kW :
- de 30 à 45% de l'arsenic utilisé durant le traitement demeurent dans les cendres (résultats mesurés) ;
- de 35 à 60% de l'arsenic sont émis sous forme de particules submicroniques (résultats mesurés) ;
- de 30 à 60% de l'arsenic sont émis sous forme gazeuse (résultats calculés).
Bien que ces résultats demanderaient à être confirmés par d'autres expérimentations, il semble que plus des 2/3 de l'arsenic contenu dans un bois traité au CCA soit émis à l'atmosphère durant la combustion[21] .
[21] Des alternatives au traitement des bois par CCA semblent être en voie de développement, citons par exemple l'ASAM (anhydride succinite d'alkéonoate de méthyle), substance d'origine végétale, développée par l'Unité de chimie agro-industrielle de l'INRA.
Émissions anthropiques totales
La majeure partie de l'arsenic anthropique atmosphérique provient des fumées émanant des industries de production d'As2O3 [11] et de la combustion de produits fossiles (charbons, pétroles, huiles) qui contiennent un pourcentage important d'arsenic.
[11] Selon Molénat et al. (2000), la production d'arsenic se fait à 97% sous forme d'As2O3.
Émissions atmosphériques
FTE 2005 Importer
Emissions atmosphériques totales
Le CITEPA (2007b ; 2008) dresse le bilan[12] suivant quant aux principaux émetteurs français (métropole) d'arsenic dans l'air (période d'étude 1990-2006) :
Emissions en 2006 : 10,5 t
Emissions en 2005 : 10,4 t
Maximum observé : 17,5 t en 1991
Minimum observé : 10,4 t en 2005
Evolution 2005 / 1990 : -37 %
Il est notable que la valeur la plus récente disponible (2005) corresponde au minimum des émissions d'arsenic dans l'air.
Sous-secteurs prépondérants en 2005 (cinq premiers des émissions totales) :
- Minéraux non métalliques, matériaux de construction 32 % ; dont :
- verre 31 % ;
- ciment 1,0 % ;
- Résidentiel 20 % ;
- Métallurgie des métaux ferreux 13 % ;
- Métallurgie des métaux non ferreux 9,4 % ;
- Production d'électricité 9,0 %.
Selon cette même source, les émissions de ce polluant dans l'atmosphère proviennent :
- d'une part, de la présence de traces de ce métal dans les combustibles minéraux solides ainsi que dans le fioul lourd
- d'autre part, de la présence de ce composé dans certaines matières premières comme par exemple dans certaines installations de production de verre, de métaux ferreux ou non ferreux.
[12] Selon le CITEPA (2007b), les émissions sont déterminées au moyen du système national des inventaires d'émissions de polluants dans l'atmosphère (SNIEPA).
Les principaux secteurs émetteurs sont synthétisés dans le tableau 3.1 ci-dessous.
Tableau 3.1. Principaux secteurs émetteurs d'arsenic dans l'atmosphère en France, en 2005 (d'après CITEPA, 2007)[13],[14] .
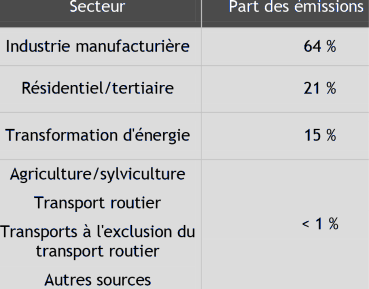
Les données annuelles (de 1990 à 2005) pour chacun de ces secteurs sont disponibles sur le document CITEPA (2007). Le graphique 3.1 ci-dessous synthétise les principaux résultats quantitatifs.
[13] Les émissions maritimes et aériennes internationales, ainsi que les émissions des sources biotiques, des forêts et les émissions des sources non-anthropiques ne sont pas répertoriées dans ce tableau.
[14] Le découpage des secteurs émetteurs est différent entre le CITEPA et la base de données IREP. La comparaison des données n'est donc pas directement possible.
Figure 3.1. Evolution des quantités d'arsenic émises dans l'atmosphère (en tonne ; d'après CITEPA, 2007)[15] .
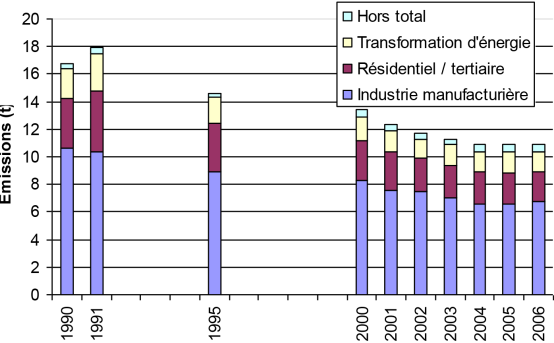
Il convient de noter que les bilans du CITEPA sont établis, pour la plupart des secteurs industriels, par le biais de facteurs d'émission estimés à partir d'hypothèses non communiquées.
[15] Les valeurs considérées pour l'année 2006 correspondent à des estimations.
Emissions atmosphériques industrielles
Selon L'INRS (2000), de très nombreuses opérations industrielles sont susceptibles de dégager du trihydrure d'arsenic. Les principales circonstances de dégagement accidentel se rencontrent dans la métallurgie : traitement de minerais arsenicaux ou de minerais ayant de l'arsenic comme impureté, décapage à l'acide de zinc, cuivre, étain ou plomb, fonderies de métaux ferreux, fonderies d'étain et de zinc.
Le paragraphe suivant présente les enseignements de l'étude des déclarations des installations industrielles classées soumises à autorisation préfectorales (données BDREP, correspondantes aux années 2003 à 2006, extraites le 10/01/2008). Bien que ces données ne soient pas exhaustives pour diverses raisons (elles ne concernent notamment pas les installations non classées ; en cas d'usage d'arsenic, il existe un seuil d'émission en deçà duquel la déclaration n'est pas nécessaire ; …), les informations ci-dessous compilées sont intéressantes pour dresser un état des lieux le plus proche de la réalité possible.
La carte ci-dessous (Figure 3.2) extraite du site internet IREP (site internet exploitant les données issues de la base BDREP) permet de localiser les différents sites émetteurs d'arsenic dans l'air en France.
Figure 3.2. Localisation des différents sites émetteurs d'arsenic dans l'air en France (extrait du site internet IREP en date du 04/et correspondant aux données de 2005)./
Ce document présente bien l'inhomogénéité des installations rejetant de l'arsenic dans l'atmosphère à l'échelle de la France métropolitaine. On note par exemple la sur-représentation du quart nord-est de la France et la sous-représentation du quart nord-ouest.
Quoiqu'il en soit, une information plus importante sur les entreprises concernées est disponible sur le site internet IREP et permettrait d'approfondir les connaissances sur l'activité et les rejets de ces entreprises.
Dans le tableau 3.2 ci-dessous figurent les émissions d'arsenic dans l'air pour les industries soumises à déclaration. L'obligation de déclaration par les exploitants des installations industrielles et des élevages est fixée (polluants concernés et seuils de déclaration) par l'arrêté du 24 décembre 2002 relatif à la déclaration annuelle des émissions polluantes des installations classées soumises à autorisation (JO du 07 mars 2003).
Tableau 3.2. Emissions atmosphériques d'arsenic des installations soumises à déclarations de 2003 à 2006 (données BDREP)[16] .
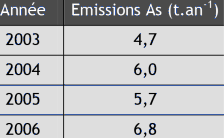
La comparaison de ces chiffres d'émissions des installations classées à ceux du CITEPA concernant la totalité des émissions atmosphériques françaises montre que, pour l'année 2006, plus de 65 % de la totalité des rejets atmosphériques d'arsenic sont originaires des installations classées.
On peut également interpréter plus en détails ce tableau 3.2. Sur la période 2004-2006[17] , une augmentation des rejets d'arsenic dans l'air est à souligner (+12%). Ces émissions représentent 6,8 t. en 2006. Nous n'avons pas pu mettre en évidence la raison de cette augmentation lors de la présente synthèse.
Les industries qui rejettent de l'arsenic dans l'air sont les industries minérales, la chimie – parachimie – pétrole, la sidérurgie – métallurgie -coke, les déchets et leur traitement, l'énergie, la mécanique et le traitement des surfaces, l'industrie du bois, l'industrie extractive, l'industrie agroalimentaire et celle des cuirs et peaux.
Les rejets sont, principalement, le fait de cinq grands secteurs industriels[18] (qui représentent, en 2006, 99,4 % des émissions atmosphériques) :
- industries minérales (40,6 % en 2006) ;
- chimie – parachimie-pétrole (31,8 % en 2006) ;
- sidérurgie – métallurgie-coke (14,8 % en 2006) ;
- déchets – traitement (7,6 % en 2006) ;
- énergie (4,6 % en 2006).
[16] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement..
[17] On ne retient pas l'année 2003 car les données associées à cette année sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
[18] Le découpage des secteurs émetteurs est différent entre le CITEPA et la base de données de l'IREP. La comparaison des données n'est donc pas directement possible.
Le graphique ci-après (Figure 3.3) montre l'évolution des émissions atmosphériques d'arsenic pour ces cinq secteurs.
Figure 3.3. Evolution des émissions atmosphérique d'arsenic pour les cinq principaux secteurs émetteurs (données BDREP).
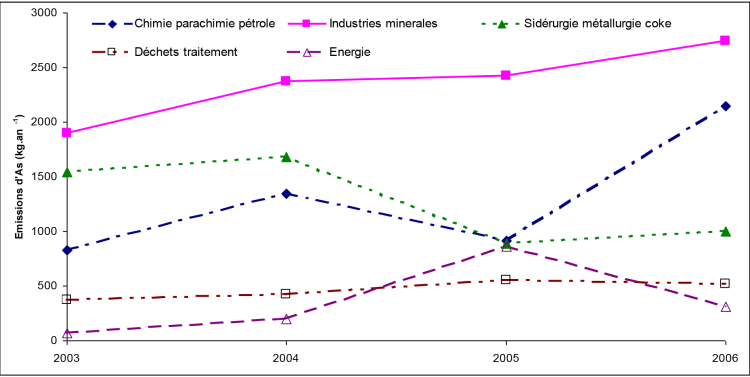
Les rejets pour l'industrie minérale et pour celle des déchets et de leur traitement sont relativement stables sur la période 2004-2006.
En ce qui concerne le secteur de la sidérurgie et de la métallurgie, il apparaît que les émissions ont été réduites d'un tiers entre 2004 et 2006.
A contrario, celles du secteur de la chimie-parachimie-pétrole ont augmenté de 30 à 50% pour cette même période.
Le tableau 3.3 donne la part de chaque secteur dans les émissions totales d'arsenic en 2006 ainsi que la répartition des rejets à l'intérieur de chaque secteur. On retrouve également la valeur minimale et maximale des rejets pour l'année 2006 ainsi que la valeur médiane qui permet de savoir si la distribution des émissions est homogène pour chaque type d'industrie ou si un site concentre la majorité des rejets. Enfin, le nombre de sites émetteurs pour 2005 et 2006 est également présenté dans ce tableau.
Tableau 3.3. Panorama des émissions atmosphériques d'arsenic des installations soumises à déclarations en 2006 (données BDREP)[19] .
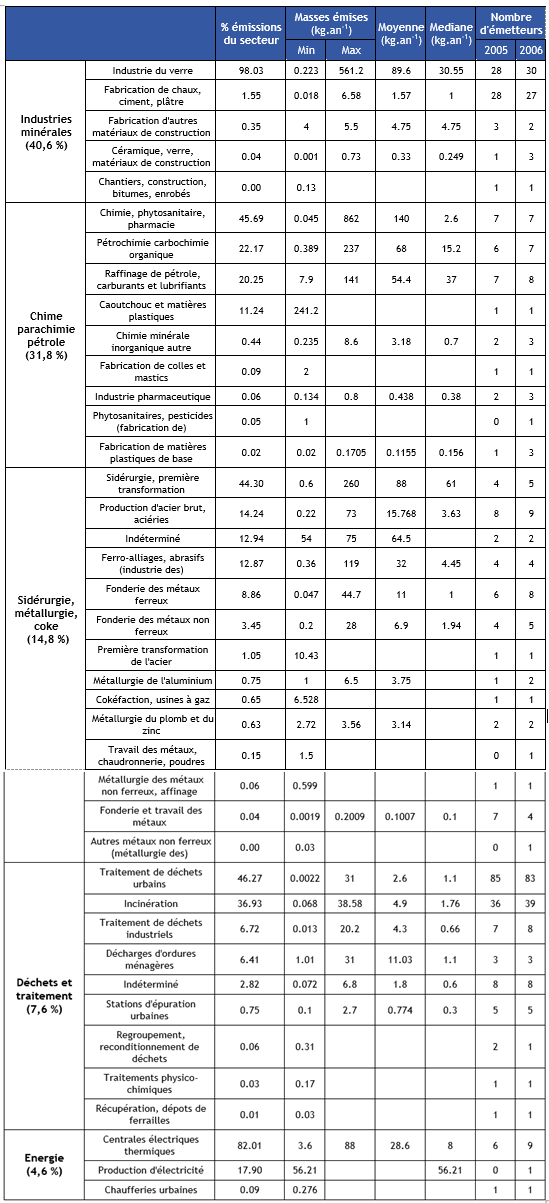
[19] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
L'industrie du verre représente près de 40 % des rejets annuels totaux des industries soumises à déclaration (98 % des émissions de la catégorie). Le tableau 3.5 fait apparaître qu'une seule usine de production de verre émettrait 0,5 tonne d'arsenic par an, soit plus de 8 % des rejets atmosphériques annuels d'arsenic en France (rejets des installations classées).
Dans le secteur de la chimie-parachimie-pétrole, les émissions atmosphériques d'arsenic[20] représentent 31,8 % des émissions totales d'arsenic des installations classées en France pour 2006. Les contributeurs les plus importants à ces rejets sont présents dans l'industrie chimique, phytosanitaire et pharmaceutique (près de 13 % de l'arsenic total rejetés par les installations classées en 2006 sont effectuées par une seule usine), ainsi que dans le domaine de la pétrochimie et du raffinage de pétrole.
Pour ce secteur, la combustion du charbon, utilisé comme source d'énergie, est à l'origine des rejets d'arsenic dans l'air.
Environ 15 % des émissions d'arsenic des installations classées proviennent du secteur de la sidérurgie et de la métallurgie. Ces rejets sont présents en majorité dans la sidérurgie, dans les aciéries et les fonderies de métaux ferreux et non ferreux.
L'industrie des déchets et de leur traitement représente 7,6 % des quantités d'arsenic émises par la totalité des installations classées. Les trois catégories d'industries dont les rejets sont les plus importants sont le traitement des
déchets, les incinérateurs et le traitement des déchets industriels. Il est important de noter le grand nombre de sites (près de 300) concernés par ce secteur d'activité, contrairement aux autres secteurs industriels émetteurs d'arsenic.
[20] Généralement la mesure des émissions d'arsenic est effectuée une fois par année et ramenée au débit des effluents gazeux. Cette façon de procéder entraîne donc une grande incertitude sur les données, en particulier pour les sites ayant une activité fluctuante sur l'année.
Enfin, le dernier contributeur important (4,6 % des rejets d'arsenic des installations classées) concerne le domaine de l'énergie avec en particulier les centrales électriques thermiques (82% des émissions du secteur).
Par conséquent, la réduction des émissions d'arsenic sur certains sites industriels précis (ou plus généralement sur certains secteurs industriels bien identifiés) pourrait avoir un impact significatif sur les rejets totaux annuels.
Émissions vers les eaux
FTE 2005 Importer
Au cours de cette synthèse, aucune information globale d'émissions d'arsenic dans les eaux n'a été recueillie.
L'arsenic et ses composés minéraux ont de très nombreuses applications industrielles (cf. rubrique Emissions atmosphériques non-anthropiques). Il semble donc probable que le secteur industriel soit prépondérant quant aux rejets vers les eaux.
La figure 3.5 extraite du site internet IREP permet de localiser les différents sites émetteurs d'arsenic dans l'eau en France métropolitaine.
Figure 3.5. Localisation des différents sites émetteurs d'arsenic dans les eaux en France (extrait du site internet IREP en date du 04/02/2008 et correspondant aux données de 2005).
A l'image des émissions industrielles atmosphériques d'arsenic, les émissions vers les eaux présentent une certaine inhomogénéité. On note par exemple la sur-représentation du quart nord-est de la France et la sous-représentation du quart nord-ouest.
Quoiqu'il en soit, une information plus importante sur les entreprises concernées est disponible sur le site internet IREP et permettrait d'approfondir les connaissances sur l'activité et les rejets de ces entreprises.
Dans le tableau 3.4 ci-dessous figurent les émissions d'arsenic dans l'eau pour les industries soumises à déclaration.
Tableau 3.4. Emissions d'arsenic dans les eaux par les installations soumises à déclarations de 2003 à 2006 (données BDREP)[22] .
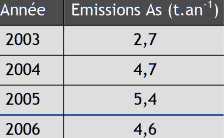
Sur la période 2004-2006, les émissions totales d'arsenic dans l'eau sont restées relativement stables.
Les secteurs qui rejettent le plus sont les industries extractives, la sidérurgie -métallurgie – coke, la chimie – parachimie – pétrole, les déchets et traitements et les industries du bois, papiers et cartons. Des émissions d'arsenic, moins importantes, sont également le fait des industries de traitement de surface, de l'énergie, de l'agroalimentaire et du textile
Le graphique ci-après (Figure 3.6) montre l'évolution des émissions d'arsenic vers les eaux pour ces cinq secteurs.
[22] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues ans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
Figure 3.6. Evolution des émissions d'arsenic dans les eaux d'arsenic par les cinq principaux secteurs émetteurs (données BDREP).
Sur ce graphique sont représentées les variations des émissions d'arsenic dans l'eau par les cinq plus importants secteurs industriels concernés pour la période 2003-2006.
Les valeurs pour l'année 2003 sont purement indicatives. Pour la période 2004-2006, les rejets d'arsenic par les industries extractives ont diminués d'environ 10 % ; ceux du secteur de la chimie et du pétrole ont été divisés par un facteur 2,5. Sur la même période, les émissions d'arsenic par les secteurs sidérurgique, des déchets et du bois et papiers ont été multipliées par 2. De nombreuses variations d'émissions d'une année sur l'autre sont à observer, particulièrement dans le secteur de la chimie.
Le tableau suivant donne, pour 2006, la part de chaque secteur dans les émissions totales d'arsenic ainsi que la répartition des rejets à l'intérieur de chaque secteur. On retrouve également la valeur minimale et maximale des rejets ainsi que la valeur médiane qui permet de savoir si la distribution des émissions est homogène pour chaque type d'industrie ou si un site concentre la majorité des rejets. Le nombre de sites émetteurs pour 2005 et 2006 sont également présentés dans ce tableau.
Tableau 3.5. Panorama des émissions d'arsenic des installations soumises à déclarations en 2006 (données BDREP)[23] .
[23] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues ans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
D'après ce tableau, les principaux émetteurs industriels (sites soumis à déclaration) d'arsenic dans l'eau en 2006 sont les industries excavatrices (environ 50 % des rejets totaux). En 2006, seuls deux sites étaient responsables de ces émissions.
Le secteur de la sidérurgie rejette 19 % de l'arsenic pour cette même année : ce sont en particulier les entreprises de fabrication d'alumine et l'industrie des ferro-alliages et abrasifs.
Le secteur chimique, parachimique et pétrolier regroupe 11,6 % des émissions dans l'eau en 2006. Dans cette catégorie les principaux émetteurs sont les secteurs chimie – phytosanitaire – pharmacie, caoutchouc et fabrication des engrais.
Près de 10% des émissions d'arsenic dans l'eau sont dues au secteur des déchets et de leur traitement. La plus grande part est celle de l'incinération, puis les stations d'épuration urbaines et les décharges d'ordures ménagères. Il faut remarquer également une forte augmentation du nombre d'émissions déclarées dans ce secteur (environ +30 entre 2005 et 2006).
Finalement, le dernier secteur important des émissions d'arsenic dans l'eau en 2006 est celui de l'industrie du bois et papier (environ 7% des rejets annuels)
Par conséquent, la réduction des émissions d'arsenic sur certains sites industriels précis (ou plus généralement sur certains secteurs industriels bien identifiés) pourrait avoir un impact significatif sur les rejets totaux annuels.
Émissions vers les sols
FTE 2005 Importer
Emissions totales vers les sols
Au cours de cette synthèse, aucune information n'a été recueillie nous permettant de renseigner cette rubrique. Néanmoins, il semble probable que la source industrielle d'arsenic pour les sols soit la source la plus importante.
Emissions industrielles vers les sols
La base de données BDREP ne contient pas de donnée correspondant aux émissions industrielles vers les sols.
Néanmoins, le site internet BASOL[24] (Base de données BASOL sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif) contient plusieurs centaines d'occurrences correspondant à une contamination par l'arsenic.
L'exploitation de cette base de données pourrait permettre d'approfondir les connaissances sur les activités industrielles historiques ou présentes utilisant de l'arsenic. De même, cette base de données s'avère également être une source d'information sur les actions engagées pour faire face à la contamination des sols par l'arsenic.
[24] http://basol.environnement.gouv.fr/recherche.php
Emissions agricoles vers les sols
Suite à l'interdiction en 2001 (cf. rubrique Réglementation) de l'arsénite de soude en tant que produit phytosanitaire (utilisé en viticulture pour la lutte contre les maladies du bois), une collecte nationale des produits contenant cette substance est organisée. En effet, un accord est intervenu entre les pouvoirs publics (Ministère de l'Agriculture et de la pêche, Ministère de l'Ecologie et du Développement Durable) et la profession agricole pour organiser une collecte unique et gratuite afin d'éliminer les stocks détenus par les distributeurs et les viticulteurs, actifs ou retraités.
A l'issue de cette action, on peut estimer que les émissions agricoles d'arsenic vers les sols (et indirectement vers les eaux) seront proches de zéro. En effet, le seul produit phytosanitaire encore autorisé contenant de l'arsenic est un formicide (cf. rubrique Réglementation) et n'est donc :
- ni utilisé en grandes quantités ;
- ni employé sous une forme susceptible de contaminer facilement les sols et eaux.
Rejets dans l'environnement
Charge critique
La charge critique est définie comme une valeur d'exposition à un ou plusieurs polluants en dessous de laquelle des effets significatifs indésirables sur des éléments sensibles de l'environnement n'apparaissent pas en l'état actuel des connaissances (Nilsson et Grennfelt,, 1988).
En pratique, la charge critique « rend compte » de la sensibilité d'un milieu aux retombées atmosphériques d'un polluant.
Ce concept a été adopté vers les années 90 par la Commission Economique pour l'Europe des Nations Unies dans le cadre de la convention de Genève sur la pollution atmosphérique transfrontière à longue distance (pour les oxydes de soufre et d'azote). Le concept a été développé et validé pour les métaux lourds (plomb, mercure et cadmium).
Alterra (2006) a montré que les calculs de la charge critique pour l'arsenic sont possibles. Les graphiques suivants (figure 6.1) illustrent les résultats obtenus pour l'arsenic sur les écosystèmes agricoles et forestiers (ou non-agricoles) et sur la santé humaine (à travers la consommation d'eau douce de surface dans les deux types d'écosystèmes).
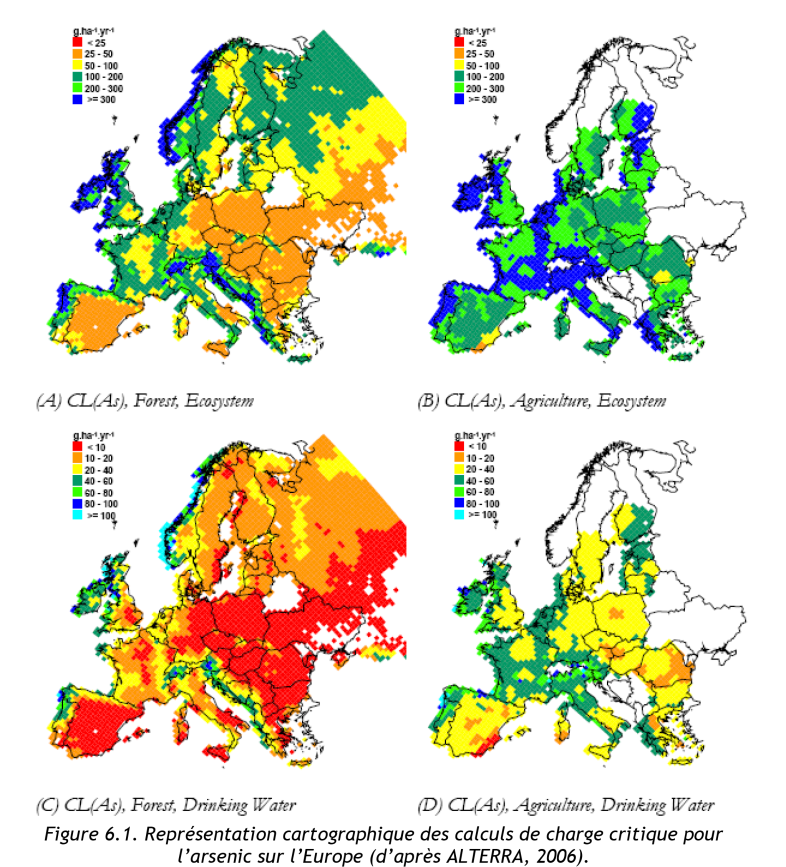
Cette approche pourrait être utilisée pour évaluer l'impact à l'échelle locale et à l'échelle nationale (voire internationale) des émissions. Elle peut également être utilisée en modélisation intégrée pour évaluer l'impact des mesures réglementaires.
Présence environnementale
Synthèse
FTE 2005 Importer
Selon l’International Programme on Chemical Safety (IPCS, 2001), l’arsenic est naturellement présent dans la croûte terrestre (à une concentration moyenne de 2 mg.kg-1). Cet élément et ses composés sont donc présents à l’état de traces dans de nombreux sols et roches (verres volcaniques, minéraux silicatés, roches ignées ou sédimentaires) ou bien dans certaines eaux et même dans le compartiment atmosphérique.
Selon l'OMS (2001), l'arsenic est largement répandu dans toute la croûte terrestre. Dans certaines régions, les eaux souterraines en contiennent parfois des quantités importantes en raison de l'érosion.
On peut trouver de l'arsenic inorganique dans l'environnement sous plusieurs formes mais, dans les eaux naturelles et donc dans l'eau de boisson, il se présente la plupart du temps sous forme d'arsénite trivalent (AsIII) ou d'arséniate pentavalent (ASV). Les formes d'arsenic organique, abondantes dans les poissons et les coquillages, sont beaucoup moins dangereuses pour la santé et facilement éliminées par l'organisme.
Concentrations ubiquitaires
Le tableau synthétique 6.1 est issu du document INERIS (2006).
Tableau 6.1. Concentration ubiquitaire de l'arsenic dans les différents compartiments de l'environnement.
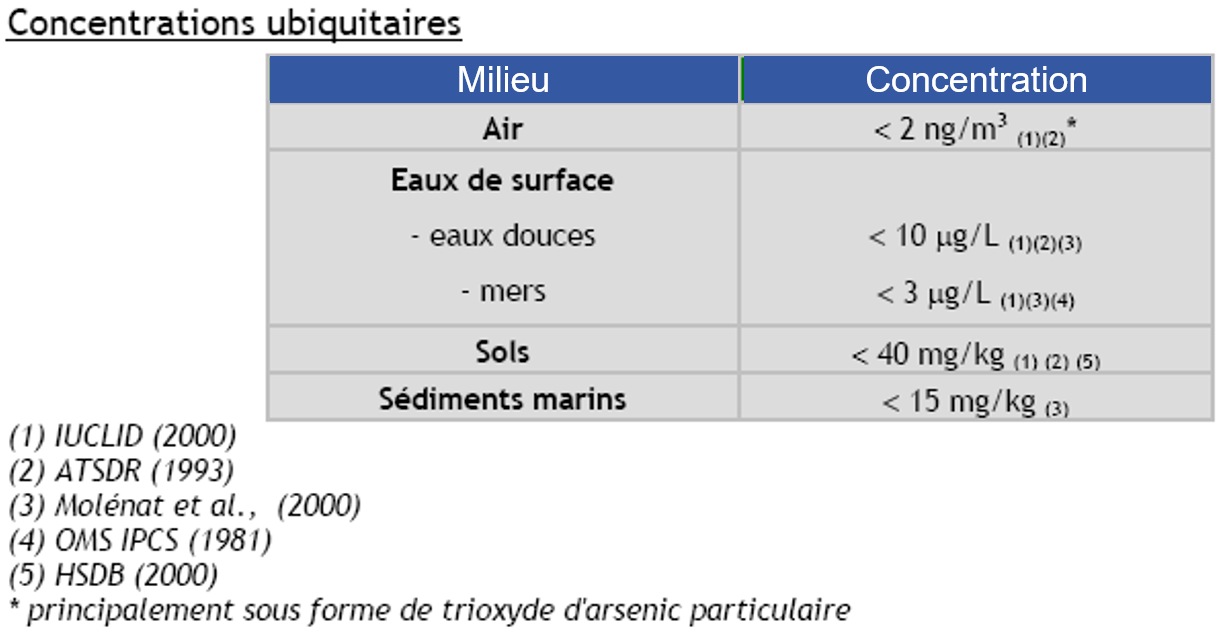
Au vu des concentrations d'arsenic observées dans le compartiment « eau » de l'environnement (< 10 µg.L-1), les données sur les émissions industrielles dans l'eau et urbaines[30] de l'ordre du μg.L-1 (INERIS, 2008) sont difficilement exploitables. En effet, de telles valeurs peuvent indifféremment être attribuées au « bruit de fond géochimique » (concentration des eaux en arsenic « naturellement » présent) ou à des rejets industriels suite à l'utilisation de cet élément.
[30] Données obtenues lors de l'action nationale de recherche et de réduction des rejets de substances dangereuses dans l'eau par les installations classées et autres installations (INERIS, 2008)
Exemples d'aquifères français contaminés par l'arsenic
Le BRGM (2006b), donne quelques exemples d'aquifères français contaminés par l'arsenic (tableau 6.2).
Tableau 6.2. Exemple d'aquifères français contaminés par l'arsenic (d'après le BRGM, 2006b).
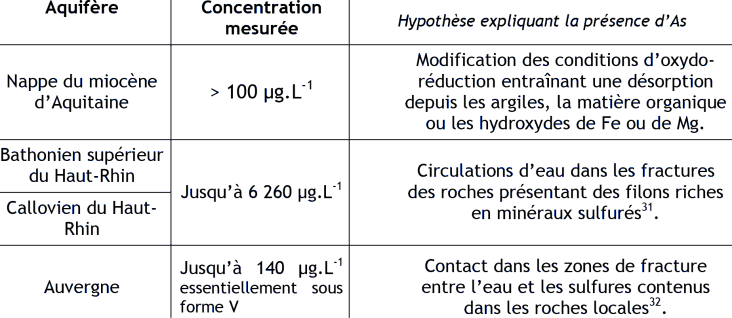
[31] La mise en solution de l'arsenic se fait par oxydation des sulfures.
[32] Cf. rubrique Emissions vers les eaux
Perspectives de réduction
Réduction des rejets
Réduction des émissions industrielles atmosphériques
FTE 2005 Importer
Pour rédiger ce paragraphe, nous nous sommes appuyés sur les « Meilleures Techniques Disponibles » rassemblées dans les « BREF ». Ces documents sont disponibles sur le site internet de l'European IPPC Bureau : http://eippcb.jrc.es/pages/FActivities.htm. Pour certains de ces documents, des résumés en français sont disponibles sur le site AIDA de l'INERIS (http://aida.ineris.fr/bref/bref_cadres.htm).
Les BREF proposent les solutions de réduction des émissions de polluants les plus adaptées en fonction des secteurs d'activité. Les principales émissions d'arsenic dans l'air sont regroupées dans quelques secteurs d'activité bien précis (cf rubrique Emissions atmosphériques non-anthropiques). Nous ne présenterons donc que les recommandations pour ces industries.
Industrie du verre
Dans l'industrie du verre, en particulier pour la fabrication du cristal et des verres spéciaux, des précautions sont prises pour limiter les rejets d'arsenic dans l'atmosphère. Pour la fabrication du cristal au plomb 24%, les émissions d'arsenic peuvent atteindre 20mg.Nm-3 . Pour traiter les émissions de métaux lourds, et plus particulièrement d'arsenic, le BREF recommande d'effectuer une meilleure sélection des matières premières combinée si nécessaire à une épuration des gaz acides.
Cependant, une grande partie des émissions d'arsenic se font sous forme de poussières, la réduction de ces rejets passe par une élimination des poussières (électrofiltres, filtres à manches[33]). Le traitement des gaz acides (lavage) permet également un abattement de la quantité de poussières émises.
[33] Selon des avis d'experts, l'adoption de cette technique dans le secteur de la verrerie s'accompagnerait d'une diminution de la température des rejets ainsi que de la création d'un « gâteau » de filtration. Ceci pourrait concourir à la diminution de la concentration en arsenic gazeux dans les rejets dans une proportion indéterminée.
Industrie chimie inorganique, engrais, acides
Il n'existe pas de données spécifiques à l'arsenic ; mais il est possible de réduire ses émissions en piégeant les poussières.
Le BREF propose l'utilisation d'une ou d'une combinaison des techniques suivantes :
- Cyclone ;
- filtre en tissu ou en céramique ;
- dépoussiéreur par voie humide ;
- dépoussiéreur électrostatique.
Le tableau présenté ci-dessous illustre les différentes techniques de traitement des effluents gazeux dans ce secteur d'activité.
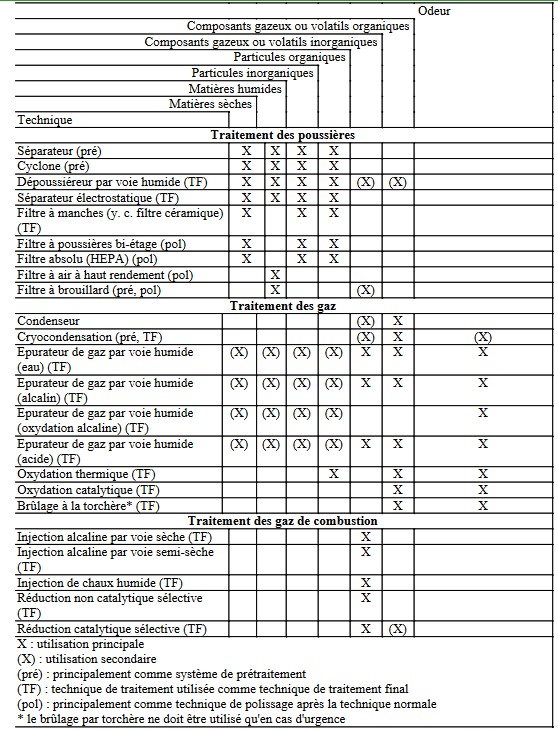
Sidérurgie, aciérie
Aucune donnée spécifique à l'arsenic ne figure dans le BREF correspondant. Cependant, il donne des informations sur les techniques de traitement des rejets de métaux lourds.
La technique de traitement préconisée dans les installations d'agglomération est l'utilisation de systèmes d'épuration fine par voie humide pour éliminer les métaux lourds hydrosolubles ou l'utilisation d'un filtre à manches avec addition de chaux suivi par la mise en décharge contrôlée (enrobage hermétique, collecte et traitement des lixiviats) des poussières provenant du dernier champ de l'électrofiltre au lieu de les recycler vers la bande d'agglomération, éventuellement après extraction de l'eau et précipitation des métaux lourds afin de limiter la quantité à mettre en décharge.
Cimenterie
Dans les cimenteries comme pour les autres secteurs industriels, les émissions de métaux lourds non volatils sont réduites en diminuant les rejets de poussières de ces industries.
Les mesures primaires générales suivantes figurent parmi les meilleures techniques disponibles pour fabriquer le ciment. La sélection et le suivi rigoureux des matières introduites dans le four permettant de réduire les émissions : il est conseillé de choisir chaque fois que possible des matières premières et des
combustibles à faible teneur en soufre, azote, chlore, métaux et composés organiques volatils.
Les meilleures techniques disponibles pour réduire les émissions de poussières combinent les mesures primaires générales et les mesures suivantes :
- Minimisation/prévention des émissions de poussières des sources fugitives dans certaines conditions[34] .
- Élimination efficace des matières particulaires des points sources au moyen de :
- filtres électrostatiques munis d'équipements de mesure et de contrôle à réaction rapide pour minimiser les pics,
- filtres à manches à plusieurs compartiments avec « détecteurs » de manches percées.
Le niveau d'émission moyen journalier associé aux MTD[35] lors de l'utilisation de ces techniques est de 20 à 30 mg de poussières par m 3 . Il peut être atteint en équipant de filtres électrostatiques ou de filtres à manches, ou des deux systèmes.
[34] Exemples de techniques de réduction des émissions fugitives de poussières (émissions dues à une perte progressive d'étanchéité d'un équipement conçu pour contenir un fluide (liquide ou gazeux) et dans lequel une différence de pression provoque une fuite) :
-Protection contre le vent des matériaux stockés à ciel ouvert.
-Pulvérisation d'eau et d'agents chimiques permettant d'éviter la formation de poussières.
-Pavage, humidification des chaussées, propreté.
-Nettoyage par des systèmes d'aspiration fixes et mobiles.
-Ventilation et récupération dans des filtres à manches.
-Stockage en milieu clos avec système de manutention automatique.
[35] Meilleurs Techniques Disponibles.
Déchets – Traitement
Il n'existe pas de données pour le traitement des émissions d'arsenic dans l'air.
Il convient, comme pour les autres secteurs d'activité de limiter les rejets de poussières afin de diminuer les émissions d'arsenic dans l'air.
Conclusion de l'étude des BREF
Excepté pour l'industrie du verre, ces documents ne fournissent aucune recommandation concernant spécifiquement les émissions d'arsenic dans l'air. Seul le BREF sur l'industrie du verre recommande de sélectionner des matières premières dont le niveau de contamination en arsenic est très faible et d'utiliser le lavage des gaz acides pour diminuer les émissions.
L'arsenic étant majoritairement rejeté sous forme particulaire, les techniques de réduction des particules sont à recommander à l'ensemble des secteurs industriels émetteurs (cf. liste ci-dessous, cette dernière fait correspondre des quantités de particules émises aux différentes techniques envisageables. Néanmoins, ne connaissant pas les émissions industrielles, les taux de réduction que l'on peut attendre de l'installation de ces équipements demeurent non estimables) Néanmoins, en ce qui concerne l'arsenic, le taux de réduction des rejets ne peut être estimé qu'au cas par cas en fonction des rejets initiaux en particules d'une part et des teneurs en arsenic de ces particules d'autre part.
Le site internet du CITEPA (http://www.citepa.org/techniques/poussieres.htm), quant aux principales techniques de réduction des émissions industrielles atmosphériques de poussières. N’ayant pas pu confirmer (ou infirmer) ces informations au cours de la rédaction de cette synthèse, nous citons intégralement et sans modification le paragraphe suivant.
Quatre grandes familles de matériels permettent de limiter les émissions de particules en sortie de cheminée :
- Cyclones
Ils sont efficaces sur les grosses particules (>15μm). Ce type de matériel met en jeu une force mécanique (pesanteur, inertie ou force centrifuge) pour faire migrer les poussières hors du courant du gaz porteur et assurer leur séparation. En effet la masse volumique des poussières est environ 1000 fois supérieure à celle des gaz. Ce matériel peut garantir des rejets de 250 à 120 mg.m-3 et il est souvent utilisé en pré-dépoussièrage.
- Filtres à manches
Le flux gazeux à traiter traverse un média filtrant qui retient les poussières. Celles-ci obstruent progressivement les pores du filtre et celui-ci doit être régulièrement régénéré par évacuation des poussières accumulées. Ce type de filtre permet de garantir des rejets de 10 à 5 mg.m-3 et présente une excellente efficacité pour toutes les poussières mêmes très fines. Le coût
d'exploitation de ce matériel est lié au renouvellement nécessaire et périodique des médias filtrants. De plus sa forte sensibilité aux hautes températures (>250°C) nécessite parfois un système de refroidissement des gaz en entrée.
- Electrofiltres
Les poussières présentes dans l'effluent gazeux sont ionisées puis piégées par l'action d'un champ électrique élevé créé entre une électrode collectrice et une électrode émissive. L'électrode collectrice est régulièrement mise en vibration pour récolter les poussières accumulées. Cette technologie présente une très bonne efficacité pour toutes les particules et permet de respecter 50mg.m-3 de poussières en rejet, voire 30 mg.m-3 en adaptant le nombre de champs.
- Laveurs
Les laveurs s'avèrent parfois indispensables pour le dépoussiérage lorsque les gaz à traiter sont proches de la saturation en eau, ou lorsque les problèmes de sécurité rendent très difficile leur épuration par voie sèche. Les laveurs ont l'inconvénient de transférer la pollution gazeuse vers une phase liquide. Un dépoussiéreur humide produit une boue qu'il faut traiter et au moins décanter. L'efficacité des laveurs est dépendante des niveaux d'énergie mis en jeu.
- Ordres de grandeur des coûts et des émissions liés à ces procédés

Certaines études de l'INERIS démontrent que de l'arsenic peut être également rejeté sous forme gazeuse depuis un site industriel. A ce jour, les BREFs ne contiennent aucune information spécifique à la réduction des émissions d'arsenic gazeux.
Retour d'expérience des industriels de la chimie
Le paragraphe suivant reprend des informations qui nous ont été communiquées par certains industriels ayant une activité rejetant de l'arsenic dans l'atmosphère. Celles-ci ne doivent pas être prises comme un état des lieux des sites industriels français mais plutôt comme des indications concernant les mesures envisageables dans le secteur donné (ici, celui de la chimie).
A ce jour, il n'existe pas de système de traitement propre aux rejets atmosphériques d'arsenic d'origine industriel, mais les efforts se portent sur l'abattement de la pollution par les particules.
Par exemple, l'usine NOVACARB de la Madeleine (production de carbonate de calcium à destination des verreries) met en place des électro-filtres et espère atteindre des rejets de poussières voisins de 30 à 40 mg.m -3 dès 2008 (actuellement les rejets avoisinent 200 mg.m -3) pour se mettre en conformité avec la réglementation. Le coût de cette opération est estimé à 6 M€.
Une autre entreprise du secteur va ajouter un module de lavage des effluents à son système de dépollution originel (multi-cyclone et électrofiltre) afin d'atteindre des concentrations de poussières inférieures à 50 mg.m -3 (actuellement les rejets avoisinent 100 à 120 mg.m -3) Cette opération lui coûtera 1,5 M€.
Pour un autre acteur du secteur, les rejets d'arsenic proviennent des impuretés présentes dans l'acide fluorhydrique qu'il utilise. L'arsenic est présent dans les effluents liquides. Son élimination est obtenue par précipitation.
Réduction des émissions industrielles vers l'eau
FTE 2005 Importer
Traitement des rejets industriels d'arsenic dans les eaux
Selon le site internet de l'inspection des installations classées[37] , la première technique de réduction des émissions de polluants dans l'eau est la réduction « à la source » qui passe par une meilleure maîtrise des procédés et se traduit par une moindre production d'effluents.
Quant à eux, les procédés de traitement avant émission consistent à piéger, concentrer ou transformer les substances polluantes afin de réduire les caractères polluants des effluents industriels avant rejet. Néanmoins, ces techniques aboutissent dans la majorité des cas à la production de déchets qu'il faut éliminer par ailleurs (boues, sels, concentrats, filtres usagés…).
Cette même source cite les techniques suivantes dans le cas du traitement avant émission de l'arsenic dans les eaux :
- précipitation ;
- adsorption ;
- résines échangeuses d'ions ;
- filtration sur membrane.
En se reportant aux documents BREF, les exemples suivants de traitements physico-chimiques avant rejet des eaux contenant de l'arsenic peuvent être retenus :.
Dans l'industrie extractive, la technique employée pour limiter les émissions d'arsenic dans les eaux est la précipitation par addition de sels ferriques pour atteindre des niveaux d'arsenic inférieurs à 0,5 mg.L-1 . A titre d'exemple, dans une mine de talc-magnésite en Finlande, les rendements des réactions de précipitation sont les suivants :
- si le pH est inférieur à 6 la précipitation de l'arsenic à la suite de l'ajout de sulfate ferrique est totale ;
- si le pH est supérieur à 6, la précipitation (en présence d'une quantité plus importante de sulfate que celle employée dans le cas précédent) aboutit à une teneur résiduelle en arsenic dans les eaux de 0,4 mg.L-1 .
[37] http://installationsclassees.ecologie.gouv.fr/5-Traitements-des-rejets.html
Dans l'industrie de production du plomb, l'arsenic est éliminé par oxydation par la réaction de l'arsenic avec une solution de nitrate de sodium et de soude caustique suivie d'un écrémage mécanique.
Dans le secteur de la chimie minérale, lors de la production d'acide phosphorique, l'arsenic est séparé de l'acide par précipitation à l'aide d'une solution de Na2S. Le précipité est éliminé par filtration. Le filtrat est traité avec les déchets chimiques dangereux.
Potabilisation des eaux contenant de l'arsenic
Différentes techniques tirées d'un guide « United Nations Synthesis Report on Arsenic in Drinking Water » (WHO, 2001) sont regroupées dans le tableau 8.1. Elles sont principalement adaptées à la potabilisation des eaux. Leur application à des rejets industriels pourrait s'avérer délicate et/ou non économiquement viable.
Tableau 8.1. Résumé des technologies de potabilisation des eaux contenant de l'arsenic (WHO, 2001).
Réduction des émissions industrielles vers les sols
FTE 2005 Importer
Différents tests de dépollution des sols contaminés par l'arsenic ont été effectués en France. Une synthèse de tels travaux a été rédigée par le BRGM (2004). Nous présentons ci-dessous les méthodes présentées comme les plus prometteuses.
Méthodes physico-chimiques
- Lavage basique pour éliminer la plus grande part de la contamination, suivi d'un lavage aux phosphates (Clozel et al., 2002).
- Le lavage acide peut également être utilisé (Matera et al., 2002).
Extraction de métaux et métalloïde par bio-réduction
- Utilisation de bactéries sulfato-réductrices.
Battaglia-Brunet et al.(2002) recensent les différents essais qui ont été effectués avec cette méthode.
- Bio-lixiviation en présence de microorganismes autotrophes ferro-oxydants et thio-oxydants et de soufre natif, en condition aérobie (Bayard et al. 2002).
Cependant cette méthode ne permet pas une réutilisation du sol de part son acidification importante et l'altération de la phase solide.
Phytoréhabilitation
Cette technique (toujours en cours de développement) est basée sur l'emploi de végétaux supérieurs capables de piéger des quantités importantes de métal, en particulier d'arsenic, du sol et de les transférer dans les parties supérieures est une alternative aux traitements physico-chimiques.
L'efficacité à long terme de cette technique demande à être validée par des essais en grandeur réelle même si les premiers résultats sont encourageants (Boisson et al., 1999, Mench et al.,. 2002, Mench et al., 2003).
Depuis l'achèvement des travaux du BRGM, d'autres techniques ont été testées, citons par exemple le couplage de techniques de bioréduction et de physico-chimie (Vaxevanidou et al., 2008). Néanmoins, ces travaux semblent toujours être à l'état de tests.
Selon le BRGM (2004), la méthode utilisée le plus fréquemment pour les sols pollués à l'arsenic reste le confinement avec ou sans étape de stabilisation/solidification préalable.
Réduction dans les déchets
FTE 2005 Importer
Le BREF consacré au traitement des déchets propose l'élimination des déchets arséniés par immobilisation c'est à dire une oxydation de As(III) suivi d'une étape de stabilisation / solidification.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :











avec sublimation