Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Pentaoxyde de diarsenic (1303-28-2)
Introduction
Dernière vérification le 29/03/2024
Dans la période transitoire de mise en cohérence des données du portail, les informations présentées pour cette substance peuvent ne pas être totalement à jour. Nous vous invitons à consulter la substance mère de cette famille : Arsenic
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
1303-28-2
Nom scientifique (FR)
Pentoxyde d'arsenic
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
215-116-9
Code SANDRE
5274
Numéro CIPAC
-
Formule chimique brute
\(\ce{ As2O5 }\)
Code InChlKey
Code SMILES
O=[As](=O)O[As](=O)=O
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H301 |
|---|---|
| Mention du danger - Texte | Toxique en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H331 |
|---|---|
| Mention du danger - Texte | Toxique par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Prélèvement
Analyse
Autres milieux
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
229.84 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer L'arsenic existe sous différents degrés d'oxydoréduction : -3, 0, + 3, + 5. Mis à part les sulfures, les composés minéraux les plus courants sont les combinaisons avec l'oxygène : arsénites (As III) et arséniates (As V). Certains des composés de l'arsenic sont volatils (arsines, composés organiques de l'arsenic). Bien que fréquemment suspectées, les pertes d'arsenic (sous forme d'arsine, de composés organométalliques ou d'arsenic élémentaire) par volatilisation depuis le sol n'ont pas vraiment été démontrées, contrairement au cas des sédiments aquatiques (Juste, Chassin et al., 1995). Sur des sols particulièrement humides, certaines études suggèrent la présence de forme arsine volatiles (Alloway, 1995). Une perte d'arsenic des sédiments par volatilisation microbiologique est également possible, mais son occurrence dans l'environnement naturel ne semble pas confirmée (Molénat, Holeman et al., 2000). Dans l'air, l'arsenic existe principalement sous la forme de particules. Il est présent sous forme d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers pentavalent. La photolyse n'est pas un processus important pour les composés de l'arsenic (ATSDR, 2007).
Milieu eau douce
VGE/NQE Importer
Volatilisation :
La plupart des dérivés organiques et inorganiques de l'arsenic sont des composés blancs ou incolores sous forme de poudre qui ne se volatilise pas.
Dans l'air, l'arsenic existe principalement sous la forme de particules d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers l'état V. (ATSDR, 2007)
FDTE/VTR Importer La solubilité des composés de l'arsenic est assez variable, certains étant très solubles, d'autres quasiment insolubles. Globalement, la solubilité des dérivés pentavalents de l'arsenic serait supérieure à celle des dérivés trivalents.
Dans le milieu aquatique, les facteurs physico-chimiques (pH, potentiel d'oxydo-réduction (Eh), taux de phosphate, fer, sulfure, température…) affectent la capacité d'adsorption de l'arsenic sur les sédiments. De plus, l'activité microbiologique est responsable de la dissolution de certains hydroxydes, l'arsenic des sédiments est ainsi relargué dans l'eau. Dans les eaux naturelles, l'iAs est prédominant. Dans les eaux bien aérées (eaux de surface notamment), les arséniates sont largement majoritaires (H2AsO4 et HAsO42-). En conditions réductrices, H3AsO3 (As III) est en théorie la forme la plus stable. Dans les eaux souterraines, l'arséniate serait la forme prédominante, mais l'arsénite peut être un composé important. Les composés arséniés organiques (MMA - acide monométhylarsonique CH3AsO(OH)2, DMA - acide diméthylarsinique (CH3)2AsO(OH), TMAO - oxyde de triméthylarsine (CH3)3AsO) sont présents dans les eaux naturelles (douces ou salines) et dans les sédiments. Ils peuvent provenir de la méthylation de l'arsenic minéral par les algues ou par la dégradation microbienne des composés organiques complexés.
Milieu sédiment eau douce
VGE/NQE Importer
Adsorption :
Le coefficient d'adsorption (Kd) de l'arsenic est dépendant du pH, de la spéciation de l'arsenic et de la température. Ainsi, en milieu acide et neutre, la forme pentavalente est très adsorbée alors que la forme trivalente est peu adsorbée.
L'arsenic présent dans l'eau peut être issu d'une remobilisation de la fraction stockée dans le sédiment.
Le lessivage ne tend pas à être un phénomène important étant donné qu'une majorité des composés arsenic s'adsorbe au sol.
Plusieurs coefficient de partage sol-eau ont été proposés.
Pour l'Arsenic V,
- Kd = 1,9 à 18
- Kd = 8,5 à 1500
Une étude bibliographique portant sur les références dans la littérature aux Kd de certains métaux rapporte une valeur moyenne pour l'arsenic de 2,4 pour l'interface sédiment/eau. C'est cette valeur qui sera retenue pour l'évaluation dans les sédiments en l'absence de donnée sur les organismes benthiques. (US-EPA, 1979; US-EPA, 1982; Welch et al., 1982 Baes et Sharp, 1983 Buchter et al., 1989 Lepper et al., 2007)
Milieu terrestre
FDTE/VTR Importer La mobilité de l'arsenic dans les sols est assez limitée (adsorption sur l'argile, sur les hydroxydes et sur la matière organique) (Adriano, 1986, Kabata-Pendias and Pendias, 1992). Néanmoins, l’arsenic III est reconnu comme étant plus mobile que l’arsenic V (Molénat, Holeman et al., 2000).
Dans les sols, selon le niveau du potentiel d'oxydoréduction et du pH, l'arsenic sera préférentiellement au degré d'oxydation III ou V, l'activité microbiologique pouvant conduire à une méthylation ou déméthylation des composés de l'arsenic ou même à des réactions d'oxydoréduction dans certains cas. La présence de minéraux d'argile, d'oxydes de fer et d'aluminium et la matière organique du sol peuvent également influencer la solubilité des composés et le niveau d'oxydoréduction (Alloway, 1995).
Dans les sols, l'arsenic existe principalement sous forme oxydée : arséniate AsO43- ou arsénite AsO33-. La forme arséniate est majoritaire dans des conditions d'aération normale (Alloway, 1995). Quand les conditions du sol deviennent réductrices (sol inondé), l'arséniate peut être transformé en arsénite. En situation d'anoxie maximale, la réduction peut aller jusqu'à la formation d'arsine (AsH3). Principalement en conditions réductrices, des bactéries méthanogènes peuvent conduire à la formation de composés organo-arséniés. Ces bactéries peuvent aussi conduire à la formation de composés méthylés (MMA, DMA, TMAO et TMA : triméthylarsine ((CH3)3As)) qui ont été détectés dans les sols. Ces composés peuvent également provenir de l'utilisation de pesticides et fertilisants. Dans les sols oxydants, l’arsenic V est retenu par sorption ou précipitation avec l'argile, l'humus, les hydroxydes de fer, de manganèse et d'aluminium. Dans les zones réductrices, l’arsenic III peut être précipité, par exemple, sous forme de As2S3, en présence de sulfures.
Persistance
Biodégradabilité
Dégradabilité abiotique
VGE/NQE Importer
Hydrolyse :
L'arsenic dans l'eau est susceptible de subir de complexes transformations sujettes aux conditions du milieu, notamment le pH et les conditions oxydo-réductrices. Pour des pH situés dans les normales naturelles, les formes dissoutes prédominantes sont les ions arséniates (H2AsO4 -et HAsO4 2-) pour les As(V) et As(OH)3 pour les As(III). Les formes As(V) dominent généralement dans les eaux bien oxygénées alors que les formes As(III) dominent en conditions réductrices. (ATSDR, 2007)
Photolyse :
Dans l'air, l'arsenic existe principalement sous la forme de particules d'arsenic trioxyde et d'arsines (formes organiques volatiles). L'arsenic trivalent et les arsines méthylées peuvent subir, dans l'atmosphère, une oxydation vers l'état V. La photolyse n'est pas un processus important pour les composés inorganiques de l'arsenic (ATSDR, 2007)
Conclusion sur la persistance
FDTE/VTR Importer L’arsenic est persistant dans l’environnement.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer L’arsenic se fixe majoritairement à l’exosquelette des invertébrés et dans le foie des poissons. Le transfert le plus important s’opère depuis l’eau vers les algues, celles-ci présentent les concentrations en arsenic les plus importantes. Le BCF le plus élevé a été mesuré sur des bryophytes (BCF=8700) (ATSDR, 2007).
L’arsenic est faiblement bioaccumulable. Ainsi, Spehar, Fiandt et al., 1980 ont trouvé que l’accumulation de l’arsenic V était légèrement supérieure à celle de l’Arsenic III chez l’invertébré Pteronarcys dorsata, les mollusques Helisoma campanulata et Stagnicola emarginata et chez le crustacé Daphnia magna (BCF en poids sec de 131, 99, 92 et 219 pour l’arsenic V respectivement). Une étude bibliographique couvrant 12 études sur 37 espèces de poissons d’eau douce (du poisson détritivore benthique au poisson carnivore pélagique) rapporte un BCF/BAF minimum de 0.1 obtenu sur Oncorynchus mykiss dans une eau à 16 300 µg/L d’arsenic et un BCF/BAF maximum de 1 600 obtenu sur Lepomis macrochirus dans une eau à 0,085 µg/L d’arsenic (Williams, Schoof et al., 2006). Barrows, Petrocelli et al., 1980 mettent en évidence un BCF de 4 pour Lepomis macrochirus.
Les BCF observés sur organismes marins sont généralement plus importants que ceux mesurés sur des organismes d’eau douce. Des données sont disponibles pour plusieurs espèces de mollusques : Crassostrea virginica (BCF = 114), Rangia cuneata (BCF = 478), de crustacés : Balanus aburneus (BCF = 400), Callinectes sapidus (BCF = 14) et de polychètes : Nereis sp. (BCF = 224) (Guthrie, Davis et al., 1979), Capitella capitata et Neanthes grubei (BCF = 1000) (Reish and LeMay, 1991). Si la bioaccumulation de l’arsenic a été observée, ce composé ne se bioamplifie pas le long de la chaîne trophique.
Les BCF mesurés dans les organismes aquatiques ne suivent pas une relation linéaire avec les concentrations mesurées dans l’eau. Les BCF les plus importants sont mesurés dans les cas où les concentrations d’arsenic dans l’eau étaient comparables avec les concentrations environnementales et semblent décroître lorsque les concentrations en arsenic augmentent dans le milieu, indiquant une saturation de l’accumulation.
Le BCF retenu doit être représentatif des concentrations pour lesquelles le phénomène de bioaccumulation est maximal, c'est-à-dire qu’il doit être obtenu pour des concentrations d’arsenic de l’ordre des concentrations naturelles environnementales. Un BCF de 100 a été calculé en réalisant la moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006) pour des concentrations d’arsenic dans l’eau comprises entre 0,5 µg.L-1 qui correspond à la PNEC proposée par Lepper, Sorokin et al. (2007) et la valeur correspondant au 90% centile des concentrations naturelles dans l’eau de la base de données FOREGS (2,45 µg/L). Cette valeur devrait être suffisamment protectrice étant donné que les BCF diminuent si les concentrations dans l’eau augmentent.
Principales données de bio-accumulation dans les organismes aquatiques :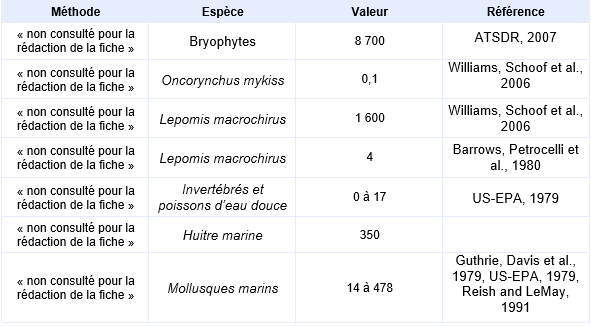
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Principales données de bio-accumulation dans les organismes terrestres :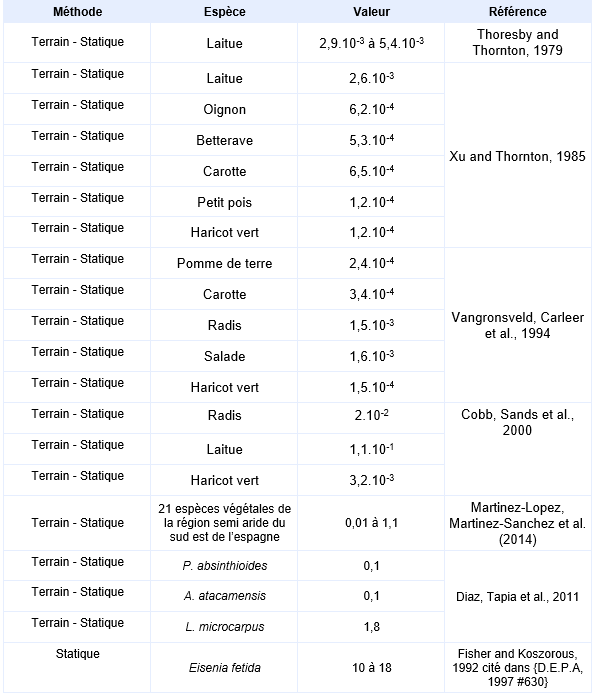
L'absorption des composés de l'arsenic par les plantes, depuis le sol, se fait principalement sous forme passive depuis le flux hydrique (Juste, Chassin et al., 1995). Plusieurs études expérimentales montrent l’augmentation des concentrations en arsenic dans les végétaux avec celles des sols. Toutefois, comme pour les organismes aquatiques, les facteurs de bioconcentration restent très faibles.
L’arsenic est un élément phytotoxique. La phytotoxicité de l’ion arsénite est plus importante que celle de l’ion arséniate, elle-même plus importante que celle des composés organo-métalliques.
La biodisponibilité et l'absorption de l’arsenic par les plantes dépendent de nombreux facteurs. Ils sont liés à la source et à la forme de l’élément, au pH du sol, au potentiel d'oxydoréduction, aux conditions de drainage, au type et à la quantité de matière organique présente. Ainsi, la valence de l’arsenic influence le taux d’absorption. L’absorption des ions arséniates est trois fois plus importante que celle des ions arsénites (Mitchell and Barr, 1995, Pitten, Muller et al., 1999). La disponibilité apparente de l’arsenic dans le sol n’est donc pas nécessairement reliée au taux d’absorption de l’arsenic par les végétaux. Le pH du sol joue aussi un rôle dans l’absorption d’arsenic par les végétaux : les pH acides (inférieurs à 5) favorisent l’absorption, de même que les pH très élevés (supérieurs à 8) tels que ceux rencontrés dans les sols calcaires (Juste, Chassin et al., 1995). Par ailleurs, les ions phosphate et sulfate, dont le comportement chimique est similaire à celui de l’arséniate, se présentent comme des compétiteurs efficaces susceptibles de réduire l’absorption et le transfert de ce dernier dans la plante (Mitchell and Barr, 1995, Pitten, Muller et al., 1999).
Lorsqu'elles sont dans un milieu déficient en phosphate et en présence d'arsenic V, les plantes (maïs, tomates, melons) sont capables de réduire l'arsenic V et de le méthyler en MMA et DMA (Molénat, Holeman et al., 2000).
Enfin, le taux d’absorption varie largement en fonction des espèces cultivées et les teneurs dans les racines apparaissent plus importantes que dans les feuilles et dans les tiges.
L’étude réalisée par Thoresby and Thornton, 1979 porte sur une région minière du sud-ouest de l’Angleterre, la vallée du Tamar où des mesures d'arsenic dans le ray-grass, les salades, les grains d’orge et les fraises ont été mises en relation avec les concentrations dans le sol. La région du Tamar a été exploitée pour son minerai d’arsénopyrite et fut aussi contaminée par les dépôts de fumée d’oxyde d’arsenic (As2O3). Bien qu’il s’agisse de formes trivalentes de l’arsenic, d’autres travaux ont montré dans des sols de terrils du sud-ouest de l’Angleterre que la forme soluble prédominante était l’arséniate, l’arsénite n’étant présent qu’en petite quantité. Les concentrations en arsenic dans les sols étudiés allaient jusqu’à 1 200 mg.kg-1. Les diagrammes mettant en relation la teneur dans les plantes avec la concentration dans les sols, montrent des valeurs expérimentales de coefficient de bioconcentration dispersées, mais la teneur en arsenic dans les plantes (laitues, ray-grass et fraises lavées à l’eau déminéralisée) augmente avec la concentration dans les sols. Le ray-grass est la plante présentant le taux d’accumulation le plus fort.
Parmi les plantes entrant dans l’alimentation humaine, les laitues présentent la plus forte capacité d’accumulation de l’arsenic avec une teneur maximale relevée de 1,4 mg.kg-1 de matière sèche pour une concentration dans le sol de 290 mg.kg-1. A partir de ces 12 points expérimentaux sur les laitues, plusieurs droites peuvent être extrapolées dont les pentes représentent des coefficients de bioaccumulation allant de 2,9.10-3 à 5,4.10-3.
Une autre étude menée par Xu and Thornton, 1985 a été faite sur 32 jardins potagers situés dans la région de Hayle et Camborne au sud-ouest de l’Angleterre. Ces jardins présentaient des sols avec des teneurs en arsenic comprises entre 144 et 892 mg.kg-1 (moyenne géométrique : 322 mg.kg-1). Les teneurs en arsenic ont été mesurées dans les parties consommables de 6 types de cultures (laitues, oignons, betteraves, carottes, pois et haricots). Il existe une relation significative entre la teneur en arsenic dans le sol et la teneur dans les plantes. Les concentrations maximales ont été relevées pour la laitue. Dans cette analyse, la teneur en arsenic dans la laitue est reliée positivement à la teneur totale en phosphore du sol et négativement à la teneur en fer. Les facteurs de bioconcentration de l'arsenic dans les divers végétaux (partie comestible) calculés à partir de la moyenne géométrique des concentrations relevées dans les végétaux et la moyenne géométrique des concentrations mesurées dans les sols sont présentés dans le tableau ci-après.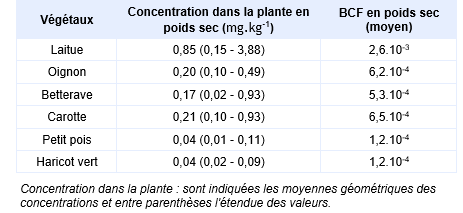
Une autre étude a été réalisée par Vangronsveld, Carleer et al., 1994 sur 5 jardins situés près d’une ancienne usine traitant l’arsenic. Les sols des jardins contenaient des teneurs en arsenic allant de 40 à 200 mg.kg-1. Ils étaient de type sableux avec des pH allant de 6 à 7. Des mesures d’arsenic ont été effectuées dans les parties comestibles de légumes (laitue, haricots, épinard, pommes de terre, carottes, radis) cultivés dans ces jardins après un nettoyage et un lavage soigneux. La laitue et le radis présentent les plus fortes capacités d’accumulation. Les facteurs de bioconcentration (BCF) dans les parties comestibles des végétaux en poids frais déterminés d'après cette étude sont présentés dans le tableau suivant.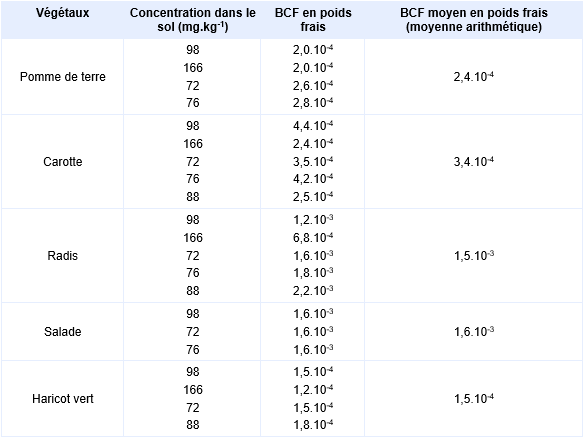
Une autre étude rapportée dans la littérature porte sur une région minière des États-Unis (Bingham Creek), où l'activité a démarré dans les années 1860 et sur la problématique de l'accumulation de l'arsenic depuis le sol dans les radis, tomates, laitues et haricots verts (Cobb, Sands et al., 2000). Ces divers végétaux ont été cultivés, en serre, dans des pots, sur des sols aux teneurs en arsenic différentes. Les sols utilisés correspondent à des mélanges en différentes proportions de sol témoin (issu de la région) et de déchets issus de la mine (sols superficiels). Les végétaux ont été cultivés jusqu'à maturité sur les sols. Les sols ont globalement un contenu en matière organique de 1,1 % et un pH de 6,5. Les facteurs de bioconcentration de l'arsenic dans les divers végétaux (partie comestible) en poids sec calculés à partir de la moyenne géométrique des concentrations relevées dans les végétaux et la moyenne géométrique des concentrations mesurées dans les sols sont présentés dans le tableau suivant (Concentration dans le sol : sont indiquées les moyennes géométriques des concentrations et entre parenthèse l'étendue des valeurs).
Des mesures de BCF sur des plantes non destinées à la consommation de l’homme ont également été menée. Martinez-Lopez, Martinez-Sanchez et al. (2014) ont mesuré les BCF de 21 plantes poussant naturellement dans la région d’une vieille mine au sud-est de l’Espagne. Les valeurs obtenues dépendent de la plante, de la concentration dans le sol et de ses propriétés, elles restent faibles et sont généralement en dessous de 0,1. La remarque qui a été faite dans l’eau semble applicable ici aussi puisque les BCF sont supérieur lorsque la concentration dans le sol est faible : dans les sols faiblement contaminés (7 à 35 mg.kg-1), le BCF calculé avec Arthrocnemum macrostachyum atteint une valeur maximum de 1,1, il est presque nul (0,08) dans les sols fortement contaminés (327 à 1800 mg.kg-1). Diaz, Tapia et al. (2011) ont rapporté des BCF mesurés dans 3 espèces de plantes de la région nord du Chili. Les trois sols concernés par les mesures présentent des concentrations en arsenic de 53 mg.kg-1 (sol1), 54 mg.kg-1 (sol 2) et 6 mg.kg-1(sol 3). Les espèces végétales sélectionnées sont P. absinthioides (sur le sol 1), A. atacamensis (sur le sol 2) et L. microcarpus (sur le sol 3). Les BCF mesurés restent peu élevés : ils sont de 0,1 sur les sols 1 et 2 et de 1,8 sur le sol 3.
Il est possible de mesurer de l’arsenic dans les tissus de vers de terre vivants dans des sols contaminés, mais les BCF restent inférieur à 1. Un BCF de 10 à 18 a été mesuré sur des Eisenia fetida exposés en laboratoire 8 semaines à un substrat présentant des concentration allant de 23 à 87 mg.kg-1 (As) ({D.E.P.A, 1997 #630}).
Remarque : aucune publication rapportant une quantification séparée du transfert des arséniates (As V) de celui des arsénites (As III) depuis le sol vers les végétaux n'a été trouvée dans la littérature, c'est pourquoi tous les facteurs de bioconcentration cités précédemment se rapportent à l'arsenic total.
Conclusion sur la bioaccumulation
VGE/NQE Importer
Bioaccumulation :
L'arsenic se fixe majoritairement à l'exosquelette des invertébrés et dans le foie des poissons. Le transfert le plus important s'opère depuis l'eau vers les algues, celles-ci présentent les concentrations en arsenic les plus importantes.
Des valeurs de BCF de 0 à 17 ont été mesurées pour des invertébrés et poissons d'eau douce, un BCF de 350 a été obtenu pour l'huître marine.
Des BCF de 8 700, 1 900-2 200 et 200-800 ont été respectivement mesurés sur les bryophytes, les invertébrés et les poissons (foies) capturés dans des (ATSDR, 2007 US-EPA, 1980 ATSDR, 2007)
Bibliographie
Toxicologie
Dernière vérification le 03/07/2025
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 2001, IARC, 2004, OEHHA, 2004, INRS, 2006, ATSDR, 2007, IARC, 2012, ATSDR, 2016, HAS, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont généralement pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. L’arsine est un composé inorganique de l’arsenic qui n’est pas traité dans cette fiche mais a fait l’objet fiche de seuil de toxicité aiguë (Ineris, 2008).
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation:
Par voie respiratoire, le taux d’absorption est généralement compris entre 30 et 34 % (ATSDR, 2007). Chez les salariés exposés à des poussières fines de trioxyde d’arsenic dans les fonderies, l’absorption respiratoire a été estimée à 40-60 % de la quantité inhalée (Pinto, Varner et al., 1976, Vahter and Lind, 1986, Huang, Chen et al., 2014).
Voie orale:
Les arséniates et les arsénites sont bien absorbés par voie orale chez l'homme, avec un taux d'absorption de l'arsenic estimé à 95 % par voie orale (Zheng, Wu et al., 2002) ; ce taux d’absorption est plus faible si la solubilité du composé arsénié est plus faible et il dépend également du substrat (aliments, sols, eaux de boisson) avec lequel il est ingéré. Une étude sur volontaires sains (6 hommes et 7 femmes) a permis d’observer un taux d’absorption de 91 %, à partir de l’exposition d’iAs présent dans l’alimentation (Stanek III, Calabrese et al., 2010, El-Masri, Hong et al., 2018) .
Voie cutanée:
La voie cutanée, peu étudiée, est une voie mineure d'absorption. Son absorption n’a pas été quantifiée chez l’homme.
Distribution
FDTE/VTR Importer Une fois absorbé, l'arsenic se retrouve fortement lié aux protéines plasmatiques et à l’hémoglobine, du fait de sa forte affinité avec les groupes sulfhydryles. Sa demi-vie sanguine est d’une heure environ (NRC, 2001). L'arsenic se distribue dans tous les organes, principalement au niveau du foie, des reins, des poumons, des muscles, de la peau, des phanères et des os. La rétention d’As est maximale dans les cheveux et les ongles (0,02 à 1 mg.kg-1 poids sec) ou dans la peau et le poumon (0,01 à 1 mg.kg-1 poids sec) (NRC, 2001). Des études suggèrent que l’As inorganique s’accumule avec l’âge (OMS IPCS, 2001). L’As est présent dans les tissus principalement sous forme inorganique et, dans une moindre mesure, sous forme d’acide diméthylarsinique (DMA). L’acide monométhylarsonique (MMA) n’a quant à lui été retrouvé que dans le foie et les reins (NRC, 2001, OMS IPCS, 2001).
L’iAs passe facilement la barrière placentaire (Lugo, Cassady et al., 1969) et est aussi retrouvé dans le lait maternel (ATSDR, 2007).
Métabolisme
FDTE/VTR Importer Le métabolisme de l’arsenic a été largement étudié et se compose de réactions d’oxydation/réduction, pour convertir l’arsenic (III) et (V), et de réactions de méthylation, qui transforme l’arsénite en MMA et DMA (cf. figure 1, schéma métabolique d’après Styblo, Del Razo et al., 2000, Schuhmacher-Wolz, Dieter et al., 2009, Hughes, Beck et al., 2011, Khairul, Wang et al., 2017.
Si l’arsenic est sous forme pentavalente, il doit d’abord être réduit en arsenic trivalent (Uthe and Reinke, 1975). Ce processus tend à rendre l’arsenic moins réactif et faciliter son élimination (Buchet, Lauwerys et al., 1981, Vahter, 1983). Cette réaction peut suivre une voie non enzymatique, dans laquelle le glutathion joue le rôle d’un donneur d’électron, et une voie enzymatique catalysée par la glutathion-S-transférase oméga de classes 1-1 (GSTO1-1). Ce mécanisme enzymatique est saturable et de fait, lorsque le seuil est atteint, la toxicité de l’arsenic est augmentée (Benramdane, Accominotti et al., 1999). Les réactions de réduction, diminuant la toxicité aiguë, ne semblent pas impliquées dans la toxicité chronique et les mécanismes de cancérogénèse (Mc Kinney, 1992, Thomas, Styblo et al., 2001). Les variations des capacités de méthylation entre individus sont partiellement responsables de la variation de susceptibilité des individus à la toxicité de l’arsenic (Tseng, 2009, Faita, Cori et al., 2013). En revanche, chez un individu donné, les capacités de méthylation sont très stables (HAS, 2020).
Les facteurs environnementaux jouent aussi un rôle important comme tabac, alcool, habitudes alimentaires, l’âge peuvent réduire la méthylation de l’arsenic. De plus, la méthylation de l’arsenic est plus efficace chez la femme que chez l’homme (Shen, Niu et al., 2016). Par ailleurs, une voie de biotransformation alternative a été proposée, impliquant la formation non enzymatique de complexes entre le glutathion et l’arsénite, aboutissant à la synthèse d’arsenic triglutathion (Hayakawa, Kobayashi et al., 2005).
Schéma métabolique d’après Styblo, Del Razo et al., 2000, Schuhmacher-Wolz, Dieter et al., 2009
Des variations du métabolisme ont été observées notamment dans certaines populations des Andes qui excrètent moins de MMA (quelques pourcents), tandis que l’inverse est observé dans certaines régions de Taïwan (348).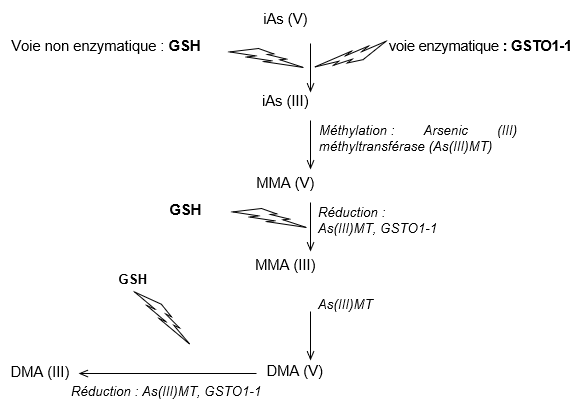
Élimination
FDTE/VTR Importer Par voie orale ou voie respiratoire, l’arsenic absorbé est principalement éliminé dans les urines, sous forme inchangée et sous forme de métabolites méthylés, après filtration glomérulaire, sécrétion tubulaire et réabsorption active (Vahter and Gustafsson, 1980, Tsukamoto, Parker et al., 1983, Offergelt, Roels et al., 1992). Ainsi, suite à l’ingestion d’arsenic, 45 à 85 % sont excrétés dans les urines, dans les 3 jours qui suivent l’absorption (Apostoli, Bartoli et al., 1999). Pour des faibles doses d’exposition, les niveaux d’arsenic urinaires augmentent généralement de manière linéaire avec la quantité d’arsenic absorbée (Calderon, Hudgens et al., 1999). Des études chez des volontaires montrent que 46 à 63 % de la dose d’arsenic sont éliminés dans les 4 à 5 jours après l’ingestion (Vahter, 1983, Buchet and Lauwerys, 1988), 30 % sont éliminés avec une demi-vie de plus d’une semaine et le reste avec une demi-vie supérieure à un mois (Pomroy, Charbonneau et al., 1980). Les matières fécales peuvent éliminer jusqu’à 5 % de la dose absorbée par voie orale (Cikrt, Bencko et al., 1980). Il existe une excrétion biliaire, sous forme de complexes arsenic-glutathion (Kala, Neely et al., 2000).
Après une exposition par inhalation, 30 à 60 % de l’arsenic absorbé est rapidement éliminé dans les urines.
Les proportions relatives d’arsenic (III), As (V), MMA et DMA retrouvées dans les urines dépendent de la forme chimique administrée, de la voie d’exposition et de la dose. En général, le DMA est le principal métabolite (40-75 %) puis suivent l’iAs (20-25 %) et le MMA (15-25 %) (Christian, Hopenhayn et al., 2006 ; Mandal, Ogra et al., 2001, Hopenhayn, Huang et al., 2003, Loffredo, Aposhian et al., 2003). La forme pentavalente, la voie orale et les faibles doses sont associées à une élimination plus rapide (Vahter, 1981). La déplétion en glutathion nécessaire au processus de méthylation diminue l’élimination de l’arsenic (Buchet and Lauwerys, 1988, Hirata, Tanaka et al., 1990).
L’élimination varie aussi en fonction du sexe, de l’âge, du statut nutritionnel et du polymorphisme génétique.
L’arsenic est faiblement excrété dans le lait maternel, y compris chez les femmes présentant une forte contamination avec une concentration urinaire en moyenne de 154,8 µg.L-1(Islam, Attia et al., 2014).
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation:
Chez l’animal, l’absorption de l’iAs déposé dans les voies aériennes est fortement corrélée à son hydrosolubilité, le passage systémique des dérivés très hydrosolubles comme l’arsénite et l’arséniate étant à peu près complet et rapide, alors que celui des dérivés insolubles, tels que l’arséniate de plomb ou sulfure d’arsenic est beaucoup plus lent (ATSDR, 2007). Aucun de ces éléments n’a été quantifié.
Voie orale:
Seule l’absorption par voie orale des dérivés insolubles (arséniate de cadmium ou de plomb) semble être réduite de 30 à 40 % par rapport aux dérivés trivalents et pentavalents hydrosolubles (Diacomanolis, Noller et al., 2013, Diacomanolis, Noller et al., 2014).
Voie cutanée:
L’absorption par voie cutanée d’arsenic (V) est estimée entre 1 et 33 µg.cm-2.h-1 (Dutkiewicz, 1977) suite à l’immersion de la queue de rats femelles dans une solution d’arséniate de sodium pendant 1 heure.
Chez le singe, le passage transcutané de l’arsenic des sols est toujours inférieur à 1 % (ATSDR, 2016).
Distribution
FDTE/VTR Importer Lors de l’exposition par inhalation chez la souris, il a été montré que l’arsenic n’a pas de tropisme spécifique : il est retrouvé dans tous les organes internes (Burchiel, Mitchell et al., 2009). Les plus fortes concentrations ont été observées dans le foie, suivi par la vessie et les reins. Chez les rongeurs, l’iAs passe facilement la barrière placentaire (Hood, Vedel et al., 1988, Murko, Elek et al., 2018).
Métabolisme
FDTE/VTR Importer Le métabolisme de l’arsenic est quantitativement variable d’une espèce à l’autre ; les niveaux de méthylation des métabolites de l’arsenic et leurs proportions respectives varient d’une espèce animale à l’autre (nuls chez le cobaye, le ouistiti, le chimpanzé, proches de ceux de l’homme chez la souris et le lapin) ; elles ne sont pas directement transposables à l’homme (ATSDR, 2007).
Élimination
FDTE/VTR Importer L’excrétion de l’iAs est principalement urinaire chez l’animal, avec un profil qui peut varier en fonction du profil métabolique de l’espèce considérée (ATSDR, 2007).
Autre
FDTE/VTR Importer Mécanisme d’action et spécificité en fonction de la spéciation :
La toxicité de l’arsenic est intimement liée à son processus de métabolisation (Harrington, Middaugh et al., 1978, Hughes, Beck et al., 2011, Khairul, Wang et al., 2017). L’arsenic pentavalent absorbé est rapidement réduit en arsenic trivalent, qui va alors se distribuer dans les différents tissus et entrer dans les cellules (surtout les hépatocytes). L’As(III) étant considéré comme plus toxique que l’As(V) (NAS, 1977), cette étape est considérée comme une bio-activation plutôt qu’une détoxication. Ferguson et Gavis ont ainsi montré que la valence (III) était 60 fois plus toxique la valence (V) (Ferguson and Gavis, 1972).
L’As(III) et l’As(V) interagissent différemment avec les composants cellulaires et tissulaires. Il en résulte une distribution tissulaire et des mécanismes de toxicité différents pour ces deux composés.
La toxicité différentielle entre l’As(III) et l’As(V) n’apparaît néanmoins que pour une exposition à de fortes concentrations du composé. Après une exposition à de faibles concentrations d’As(III) ou d’As(V), la distribution dans les tissus, la rétention et la toxicité des deux composés sont similaires. En revanche, en cas d’exposition à de fortes concentrations, la rétention d’As est beaucoup plus importante s’il s’agit d’As(III).
Jusque récemment, les formes inorganiques étaient considérées comme 100 fois plus toxiques que les formes organiques de l’arsenic (NRC, 1999). Toutefois, des données récentes semblent indiquer que la conversion de l’arsenic de sa forme inorganique vers sa forme organique n’est pas nécessairement une détoxication (Mass, Tennant et al., 2001). De plus, très peu de données sont disponibles concernant la toxicité des métabolites méthylés trivalents de l’arsenic, soit le MMA(III) et le DMA(III).
En considérant la forte réactivité de l’arsenic trivalent, et plus spécifiquement sa forte affinité avec les sulfhydryles, les formes méthylées trivalentes pourraient donc être potentiellement aussi actives biologiquement que l’As(III) (Styblo, Del Razo et al., 2000). Plusieurs études ont ainsi montré que le MMA(III) est en fait plus toxique pour les hépatocytes que le MMA(V) et l’arsénite (Aposhian, Gurzau et al., 2000, Petrick, Ayala-Fierro et al., 2000, Styblo, Del Razo et al., 2000, NRC, 2001). Les formes trivalentes de l’arsenic MMA(III) et DMA(III) induisent ainsi un risque accru en ce qui concerne la cytotoxicité (Styblo, Del Razo et al., 2000), la génotoxicité (Mass, Tennant et al., 2001, Nesnow, Roop et al., 2002) et l’inhibition des enzymes anti-oxydantes (Styblo, Serves et al., 1997, Lin, Del Razo et al., 2001). Le MMA(III) et le DMA(III) présentent la même affinité que l’iAs(III) pour des protéines cellulaires spécifiques (Styblo, Hughes et al., 1996, Styblo and Thomas, 1997). Ainsi, comme l’As(III), le MMA(III) a la capacité d’inhiber la glutathion réductase, enzyme clé du métabolisme du GSH.
Ils tendent à montrer que la voie de méthylation de l’arsenic dans l’organisme jouerait un rôle important dans l’induction et la survenue d’effets toxiques associés à une exposition à l’iAs (Valenzuela, Borja-Aburto et al., 2005). Différents mécanismes de toxicité sont envisagés et étudiés pour tenter d’élucider le lien existant entre les métabolites méthylés trivalents de l'arsenic et l’apparition de lésions cutanées typiques à l’arsenic : une accumulation accrue de l’arsenic sous cette forme dans les cellules (Hirano, Kobayashi et al., 2004), une stimulation de l’expression de cytokines pro-inflammatoires et de facteurs de croissance au niveau des kératinocytes de l’épiderme par le MMA(III), à l’origine de difficultés pour la cellule à maintenir son homéostase et l’intégrité de la barrière cutanée (Vega, Styblo et al., 2001), de même qu’une affinité supérieure des formes trivalentes pour les thiols (Shiobara, Ogra et al., 2001).
L’ordre relatif de toxicité pouvant résulter de ces études serait donc le suivant :
MMA(III) et DMA(III) > arsénite (III) > arséniate (V) > MMA(V) et DMA(V)
Synthèse
FDTE/VTR Importer Chez l'homme
La toxicocinétique de l’arsenic inorganique (iAs) et son métabolisme dépendent de sa valence et de l’hydrosolubilité du dérivé impliqué. En général, les composés présents en milieu environnemental ou professionnel sont très majoritairement des dérivés trivalents et pentavalents hydrosolubles : arsénites (AsIII) oxydés en arséniates (AsV) et arséniates réduits en arsénites selon le milieu dans lequel ils se trouvent.
Dans de nombreux secteurs d’activité, l’inhalation n’est ni la seule, ni la principale voie de pénétration dans l’organisme, l’absorption par ingestation (déglutition des particules déposées dans l’arbre respiratoire) et par voie cutanée pouvant survenir dans des situations particulières (Xue, Zartarian et al., 2010, HAS, 2020).
l’iAs est facilement absorbé par voie orale et, dans une moindre mesure par voie respiratoire ; l’absorption cutanée est négligeable. Une fois absorbé, il est distribué rapidement dans tous les organes (principalement le foie et les reins) et a la capacité de traverser la barrière placentaire. La métabolisation de l’arsenic passe par des réactions d’oxydation et de méthylation, jusqu’à obtention de métabolites méthylés, majoritairement éliminés via l’urine.
Chez l'animal
Les études réalisées chez l’animal permettent de compléter les données humaines.
l’absorption et la distribution de l’iAs chez l’animal sont similaires à celles décrites chez l’homme, pour toutes les voies considérées. En revanche, le profil métabolique, variable selon les espèces, peut conduire à la formation de métabolites qui peuvent varier selon l’espèce considérée.
La toxicité de l’arsenic est intimement liée à son processus de métabolisation, avec une toxicité différentielle entre l’As(III) et l’As(V). L’ordre relatif de toxicité estimé à partir d’études récentes serait le suivant : MMA(III) et DMA(III) > arsénite (III) > arséniate (V) > MMA(V) et DMA(V)
Equivalents biosurveillance
Description
FDTE/VTR Importer 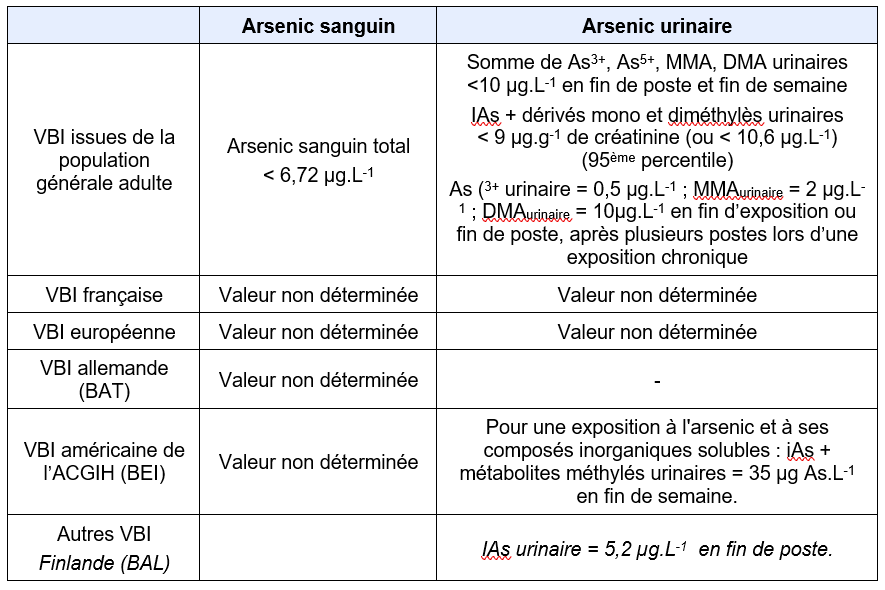
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Aucune donnée n’a été identifiée.
Voie orale
FDTE/VTR Importer Les effets aigus, suite à l’ingestion d’iAs, sont typiquement gastro-intestinaux associant nausées, vomissements, hémorragies gastro-intestinales, douleurs abdominales et diarrhées qui prennent parfois l’aspect « eau de riz », décrite sous le nom de « choléra arsenical », pouvant conduire au décès. Ces symptômes surviennent rapidement, dans les heures suivant l’ingestion (Kersjes, Maurer et al., 1987, Marsha and Ford, 1998).
Ils s’accompagnent souvent d’une instabilité hémodynamique se traduisant par une tachycardie sinusale et une hypotension artérielle orthostatique (Uede and Furukawa, 2003). Parfois, une franche diminution de la pression artérielle oriente faussement vers un choc septique ou un infarctus du myocarde. Une fièvre peut également exister perturbant le diagnostic (Bolliger, Van Zijt et al., 1992, Cullen, Woltf et al., 1995).
Les intoxications aiguës sévères s’accompagnent également d’une encéphalopathie aiguë avec confusion (Beckett, Moore et al., 1986, Uede and Furukawa, 2003, Vantroyen, Heilier et al., 2004), convulsions, coma associé à une atteinte polyviscérale : détresse respiratoire, œdème pulmonaire, syndrome de détresse respiratoire aiguë de l'adulte (SDRA), hépatite, rhabdomyolyse, anémie hémolytique (Chan and Matthews, 1990), insuffisance rénale (Hutton and Christians, 1983, Bolliger, Van Zijt et al., 1992). Les convulsions peuvent être en rapport avec des troubles du rythme cardiaque, en particulier des torsades de pointes (Goldsmith and From, 1980).
A des doses moins sévères, estimées à 3 mg.j-1 soit 0,05 mg.kg-1.j-1 pour une exposition journalière et comprise entre 2 et 3 semaines, Mizuta, Mizuta et al., 1956 rapportent les effets d’une intoxication massive de 220 japonais, ayant consommé de la sauce de soja contaminée par 100 mg.L-1 d’arsenic sous forme d’arséniate de calcium. A noter que sont rapportés dans cette étude, 220 des 417 cas de contamination identifiés au préalable, sur la base de symptômes différents de ceux généralement décrits dans la littérature. Les premiers symptômes sont un œdème de la face (50 à 60 %), ainsi que des symptômes gastro-intestinaux (40 à 50 %) et des voies respiratoires supérieures (20 à 30 %) suivis chez quelques patients de lésions cutanées et d’une neuropathie. Les autres effets observés sont une anémie modérée, avec leucopénie (32 patients), une dégénérescence modérée hépatique avec dysfonctionnement hépatique (biopsies de 5 patients), des lésions oculaires (7 patients) et des électrocardiogrammes anormaux (16 sur 20 sujets examinés). Ces symptômes gastro-intestinaux diminuent rapidement après l'arrêt de l'exposition. Un LOAEL de 0,05 mg.kg-1.j-1 en a été déduit pour l’œdème facial et les symptômes gastro-intestinaux (nausées, vomissements et diarrhée) par les auteurs.
D’autres signes se manifestent dans les jours ou semaines qui suivent. Une neuropathie périphérique, due à une dégénérescence axonale, peut se développer en une à trois semaines après l’ingestion d’arsenic. Chez neuf patients, la neuropathie (Chhuttani, Chawla et al., 1967, Le Quesne and McLeod, 1977) s’est développée en 24 heures. Les troubles sensitifs prédominent au début au niveau des extrémités, puis l’atteinte progresse vers la racine avec hypoesthésie, diminution de la sensation du toucher, diminution des réflexes ostéo-tendineux. L’atteinte motrice suit cette évolution. Parfois, le tableau réalise un syndrome de type Guillain-Barré* (Donofrio, Wilbourn et al., 1987).
De nombreux troubles neuropsychiques ont été décrits dans la période sub-aiguë : céphalées, confusion, perte de mémoire, irritabilité, modification de la personnalité, hallucinations, délires et convulsions (Freeman and Crouch, 1978, Danan, Dally et al., 1984, Marsha and Ford, 1998).
Les lésions de la peau et des phanères (Park and Currier, 1991, Valentine, Shan-Yuan et al., 1992) observées après une intoxication aiguë incluent un rash maculeux diffus et prurigineux, une alopécie en plaques, une desquamation non prurigineuse et brunâtre, une dermite exfoliative. Les lignes blanches au niveau des ongles (ou lignes de Mees) s’observent dans moins de 5 % des cas (Abernathy and Ohanian, 1992) et surviennent 30 à 40 jours après l’ingestion ; suivant la croissance des ongles (environ 1 mm par semaine), elles permettent ainsi une datation approximative de l’exposition (Heyman, Pfeiffer et al., 1956).
La dose létale pour l’homme adulte est estimée entre 1 et 3 mg.kg-1.j-1 d’arsenic (Vallée, Ulmer et al., 1960, Schoolmeester and White, 1980, Zaloga, Deal et al., 1985, Levin-Scherz, Patrick et al., 1987, Civantos, Lopez Rodriguez et al., 1995, Kamijo, Soma et al., 1998, Benramdane, Accominotti et al., 1999).
*Syndrome de type Guillain-Barré : Polyradiculonévrite aiguë inflammatoire aiguë avec démyélinisation segmentaire multifocale d’origine auto-immune qui se traduit par une paralysie généralisée avec une évolution en général favorable.
Voie cutanée
FDTE/VTR Importer Les dérivés trivalents de l’arsenic sont généralement assez fortement irritants. Ils peuvent provoquer des brûlures des tissus avec lesquels ils ont un contact prolongé (HAS, 2020).
Synthèse
FDTE/VTR Importer Les principaux effets aigus, observés suite à l’ingestion d’iAs, sont typiquement gastro-intestinaux associant nausées, vomissements, hémorragies gastro-intestinales, douleurs abdominales et diarrhées. Des effets sur le système nerveux et la peau peuvent aussi apparaître dans les jours ou les semaines suivant l’exposition.
Chez l'animal
Inhalation
FDTE/VTR Importer Aucune donnée spécifique n’a été identifiée.
Voie orale
FDTE/VTR Importer Pour les dérivés inorganiques de l’arsenic, la DL50 par voie orale est comprise entre 15 et 293 mg.kg-1 de poids corporel chez le rat et entre 11 et 150 mg.kg-1 pour les autres animaux de laboratoire. Dans la majorité des cas, la mort survient le jour suivant l’exposition (Schwartze, 1922, Dieke and Richter, 1946, Harrison, Packman et al., 1958, Gaines, 1960, Done and Peart, 1971, Kaise, Watanabe et al., 1985).
Lors d’expositions répétées par voie orale, il a été montré que les chiens et les singes mouraient pour des expositions à 3 mg As.kg-1.j-1 d’arséniate (As V) et d’arsénite (As III) (Byron, Bierbower et al., 1967, Heywood and Sortwell, 1979).
Voie cutanée
FDTE/VTR Importer Lors de l’exposition par voie cutanée aux dérivés inorganiques de l’arsenic, des irritations ont été rapportées chez la souris pour des expositions à 2,5 mg As.kg-1 d’arsénite de sodium (Boutwell, 1963). En revanche, aucun effet n’est retrouvé chez le cobaye exposé à des solutions aqueuses contenant 4 000 mg As.L-1 sous forme d’arséniate ou 580 mg As.L-1 sous forme d’arsénite (Wahlberg and Boman,1986). L’application cutanée de MMA chez le lapin induit une irritation modérée (Jaghabir, Abdelghani et al., 1989).
Synthèse
FDTE/VTR Importer Les effets aigus, observés suite à l’exposition d’iAs par voie orale chez l’animal, sont comparables à ceux décrits chez l’homme. Par voie cutanée, des irritations sont rapportées au niveau de la peau mais varient selon l’espèce chimique et animale considérée.
Toxicité à doses répétées
Effets généraux
Généralités
FDTE/VTR Importer Effets sur la peau et les muqueuses
Dans les cas d’intoxications chroniques à l’arsenic, les lésions cutanées prédominent : hyperkératose de la paume des mains et de la plante des pieds, concomitante à une hyperpigmentation parsemée de petites zones hypo-pigmentées, également appelée une mélanose (Tseng, Chu et al., 1968, Chakraborty and Saha, 1987, Mazumder, Chakraborty et al., 1988, Haupert, Wiersma et al., 1996, Ahmad, Bandaranayake et al., 1997, Guha Mazumder, Ghoshal et al., 1998, Mazumder, Santra et al., 1998, Mazumder, Haque et al., 1998, Ahsan, Perrin et al., 2000, Ahmad, Sayed et al., 2001, Guo, Yu et al., 2001, Liu, Zheng et al., 2002, Chakraborti, Mukherjee et al., 2003, Chakraborti, Mukherjee et al., 2003, Milton, Hasan et al., 2004, Guo, Liu et al., 2006).
Effets sur le système cardiovasculaire
Les effets sur le système cardiovasculaire se manifestent au niveau du cœur et du système vasculaire lui-même (maladie de Raynaud). Ainsi, des troubles de la conduction avec modification de la repolarisation incluant un allongement de l'intervalle Q T, des modifications non spécifiques du segment S T, des troubles du rythme ventriculaire (Heyman, Pfeiffer et al., 1956, Mizuta, Mizuta et al., 1956, Glazener, Ellis et al., 1968, Goldsmith and From, 1980, Little, Kay et al., 1990, Moore, O'Callaghan et al., 1994, Cullen, Woltf et al., 1995, Joye, Marion et al., 1999, Mumford, Wu et al., 2007) et de l’hypertension sont observés (Zierold, Knobeloch et al., 2004).
Chez l'homme
Inhalation
FDTE/VTR Importer Effets sur la peau et les muqueuses
En présence de poussières d’arsenic dans l’air ambiant, il est très difficile de différencier les effets sur la peau liés à un contact cutané de ceux liés à l’exposition par inhalation. Toutefois, des dermites sont fréquemment observées chez les travailleurs exposés (Col, Col et al., 1999), avec un taux d’apparition élevé lors d’expositions à de fortes concentrations. De même, en présence de fortes concentrations en arsenic (entre 0,384 et 1,034 mg As.m-3), l’incidence des hyperkératoses et des hyperpigmentations augmente (Perry, Bowler et al., 1948).
Effets sur le système cardiovasculaire
Plusieurs études réalisées chez des salariés, exposés par inhalation aux vapeurs de trioxyde d'arsenic, ont mis en évidence une augmentation du risque de mortalité par accident cardiovasculaire (Axelson, Dahlgren et al., 1978, Wall, 1980, Lee-Feldstein, 1983). Certaines études ne confirment pas ces résultats (Jarup, Pershagen et al., 1989). Les niveaux d'exposition ne sont pas connus. Il est probable que les effets observés soient également liés à d'autres facteurs de risques tels que le plomb ou la fumée de cigarette.
Par inhalation, les effets cardiovasculaires sont multiples. Lagerkvist et al. (1986) ont mis en évidence une augmentation de l’incidence du syndrome de Raynaud, chez des travailleurs exposés à 0,36 mg As.m-3 pendant 23 ans (Lagerkvist, Linderholm et al., 1986). La diminution des niveaux d’exposition des travailleurs à l’arsenic, dans les années qui ont suivi l’arrêt de l’exposition, a permis un retour à la normale du calibre des vaisseaux sanguins (Lagerkvist, Linderholm et al., 1988). A partir de ces études, une LOAEC pour le syndrome de Raynaud peut être fixée à 0,36 mg As.m-3.
Plusieurs études de cohortes menées chez des mineurs (Wall, 1980, Welch, Higgins et al., 1982, Lee-Feldstein, 1983, Xuan, Lubin et al., 1993, Enterline, Day et al., 1995, Qiao, Tockman et al., 1997) rapportent une augmentation du risque de mortalité liée à des maladies cardiovasculaires, notamment par cardiopathie ischémique (diminution de l’irrigation sanguine) et par maladies cérébrovasculaires. Toutefois, les relations dose-effet ne sont pas claires et ne permettent pas de conclure quant au lien entre l’exposition à l’arsenic et la mortalité par maladies cardiovasculaires, d’autant plus que les ouvriers concernés ont été exposés à d’autres métaux.
Effets hématologiques
L'exposition aux dérivés inorganiques de l'arsenic, par inhalation n'induit pas d'effets hématologiques (Watrous and McCaughey, 1945, Beckett, Moore et al., 1986, Bolla-Wilson and Bleecker, 1987, Ide and Bullough, 1988, Morton and Caron, 1989).
Effets neurologiques
Des neuropathies périphériques sensorielles et motrices (Landau, Thompson et al., 1977, Feldman, Niles et al., 1979) et des encéphalopathies franches (Beckett et al., 1986 ; Morton et Caron, 1989) sont rapportées lors d'expositions par inhalation aux dérivés inorganiques de l'arsenic. Ces effets sont partiellement réversibles à l'arrêt de l'exposition (Beckett, Moore et al., 1986). Gerr, Letz et al., 2000 rapportent une augmentation de l’incidence des neuropathies périphériques, observée chez les riverains d’une usine de pesticides utilisant l’arsenic. Une diminution de la vitesse de conduction nerveuse a aussi été mise en évidence par plusieurs auteurs, chez des mineurs (Feldman, Niles et al., 1979, Blom, Lagerkvist et al., 1985, Lagerkvist and Zetterlund, 1994), permettant de fixer une LOAEC pour cet effet à 0,31 mg As.m-3.
Effets digestifs
Des nausées, des vomissements et des diarrhées sont également rapportées chez des salariés, exposés par inhalation à des niveaux élevés de poussières et de vapeurs d'iAs (Beckett, Moore et al., 1986, Bolla-Wilson and Bleecker, 1987, Morton and Caron, 1989). La seule donnée disponible, concernant les niveaux d'exposition, correspond à ceux mesurés chez un salarié exposé à 0,11 mg As.m-3 de trioxyde d'arsenic et présentant des nausées et une anorexie. Ces effets sont réversibles et ne sont pas retrouvés lors d'expositions professionnelles à de faibles concentrations (Dunlap, 1921, Pinto and McGill, 1953).
Effets pancréatiques - Implication de l’arsenic dans le diabète
Dans le monde du travail, l’association entre une exposition à l’arsenic et le diabète est très peu décrite et présente des résultats variables, probablement dus à des biais importants (mesures d’exposition erronées, nombre trop faible de sujets, existence de facteurs confondants) (Lubin, Pottern et al., 2000; Chen et al., 2007). Rahman, Wingren et al., 1996 trouvent un risque à peine significatif de diabète chez des employés d’une usine de verre considérés comme exposés à l’arsenic. Dans une toute petite population (12 cas exposés) de la cohorte de Rönnskär, Rahman and Axelson, 1995 ont noté aussi une élévation très faible du risque de diabète. Ces résultats sont également retrouvés par Jensen and Hansen, 1998 dans une cohorte de 40 employés exposés à l’arsenic.
Autres effets
Plusieurs études épidémiologiques (Lee-Feldstein, 1983, Xuan, Lubin et al., 1993, Enterline, Day et al., 1995, Lubin, Pottern et al., 2000, Liu, Zheng et al., 2002) rapportent une augmentation de la mortalité, à la suite de maladies respiratoires telles que l’emphysème ou la pneumoconiose, chez les travailleurs exposés aux poussières de trioxyde d’arsenic. Toutefois, ces études ne tiennent pas compte de l’exposition à d’autres substances ou du tabagisme éventuel des travailleurs, et les relations dose-effet établies ne sont pas concluantes.
Voie orale
FDTE/VTR Importer Effets sur la peau et les muqueuses
Dans les cas d’intoxication par l’eau de boisson, les manifestations cutanées, et en particulier les kératoses, sont les signes les plus sensibles et les plus précoces des effets de l’arsenic (Ahsan, Chen et al., 2006, Guo, Liu et al., 2006).
Plus de 10 000 personnes de la région d’Araihazar (Bangladesh) ont participé à l’étude transversale d’Ahsan et al. (2006) : des données individuelles sur l’exposition via l’eau de boisson (concentrations comprises entre 1,8 et 864 µg.L-1) et les lésions cutanées observées (mélanose et hyperkératose) ont été recueillies. La prévalence des lésions cutanées non cancéreuses augmentait du plus faible (0-8 µg. L-1; médiane : 1,8 µg. L-1) au plus fort quintile de la distribution de la concentration de l’arsenic dans l’eau consommée. Les odd ratio pour les lésions cutanés sont de 1,91 (IC 95 % : 1,26-2,89), 3,03 (IC 95 % : 2,05-4,50), 3,71 (IC 95 % : 2,53 – 5,44) respectivement pour des expositions à 8,1-40,0 ; 40,1-91,0 ; 91,1-175,0 ; 175,1-864,0 µg.L-1 d’arsenic dans l’eau de boisson par comparaison avec le groupe exposé à moins de 8,1 µg.L-1 (groupe témoin). L’influence du sexe (les hommes étant les plus sensibles) et du statut nutritionnel sur les lésions cutanées a été prise en compte. D’après ces études, lors d’expositions chroniques, les lésions cutanées apparaissent à partir de 10 µg.L-1. En dessous de 1 µg.L-1, aucun effet toxique n’est mis en évidence (Rahman, Mandal et al., 2003). Ces auteurs ont fixé un NOAEL pour les lésions cutanées, dans l’eau de boisson, à 10 µg.L-1 soit 0,8 µg.kg-1.j-1.
En 2006, dans le cadre d’une étude cas-témoins réalisée sur une population de 166 934 individus (dont 1 groupe témoin de 1 830 individus) âgées de plus de 4 ans, ayant vécu et bu de l’eau dans la région de Matlab, au Bangladesh, 504 personnes ont été identifiées comme présentant des lésions cutanées liées à l’arsenic (après entretien, détermination de la consommation en eau, examen des lésions par des médecins puis par des dermatologues) (Rahman et al., 2006). Pour chaque sexe, une relation dose-réponse significative (Tableau XXX) entre l’exposition moyenne ou cumulée en arsenic et le risque de développer des lésions cutanées a été mise en évidence, la catégorie la plus faible d’exposition étant utilisée comme témoin.
Odds ratios pour les lésions cutanées, chez les hommes et les femmes, en fonction des concentrations moyennes en arsenic (µg.L-1) dans l’eau de boisson (Rahman et al., 2006) :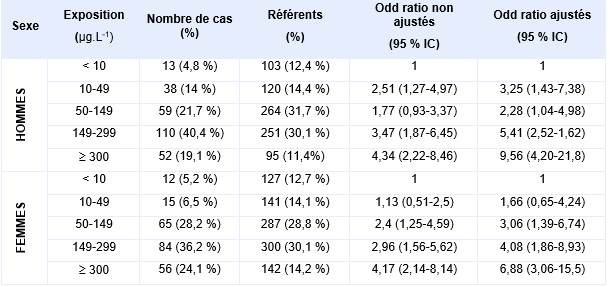
Ces relations dose-réponse ont été mises en évidence entre l’exposition à l’arsenic dans l’eau de boisson (concentrations supérieures à 50 µg.L-1) et l’apparition de lésions cutanées (dont les désordres pigmentaires), les hommes étant plus susceptibles de développer ces lésions que les femmes (LOAEL de 10 µg.L-1) (Guo, Liu et al., 2006, Rahman, Vahter et al., 2006). L’exposition à l’arsenic avant l’âge d’un an n’augmente pas le risque pour ces enfants de développer des lésions cutanées à l’âge adulte (Rahman, Vahter et al., 2006).
Une autre étude, Xia, Wade et al., 2009 a été conduite en Mongolie intérieure, 12 000 personnes ont été inclues. Celles qui consommaient une eau dont la concentration en arsenic était inférieure ou égale à 5 µg. L-1 constituaient la population témoin. La prévalence des lésions d’hyperkératose et de mélanodermie était significativement augmentée aux concentrations supérieures et le risque augmentait avec la concentration : OR de 2,52 (IC 95 % : 1,47-4,30) pour une concentration d’arsenic dans l’eau de 5,1-10 µg. L-1, de 2,83 (IC 95 % : 1,77-4,53) pour 10,1-20 µg. L-1, de 3,94 (IC 95 % : 2,78-5,59) pour 20,1-50 µg. L-1, de 6,03 (IC 95 % : 4,05-9,97) pour 50,1-100 µg. L-1, de 8,83 (IC 95 % : 5,77-13,51) pour 100,1-300 µg. L-1 et de 7,94 (IC 95 % : 2,73-23,12) au-delà de 300 µg. L-1.
Effets sur le système cardiovasculaire
L'ingestion par une population chilienne de 0,6 à 0,8 ppm d'arsenic dans l'eau de boisson (correspondant à des doses de 0,02 à 0,06 mg As.kg-1.j-1, fonction de l'âge) augmente l'incidence de la maladie de Raynaud et la cyanose des doigts et des orteils (Borgono and Greiber, 1972, Zaldivar and Guillier, 1977, ATSDR, 2007). L'autopsie de 5 enfants de cette région a mis en évidence l'épaississement des petites et moyennes artères dans tout le corps et plus particulièrement au niveau cardiaque (Rosenberg, 1974). Ces épaississements ont également été rapportés chez des négociants allemands en vin exposés à l'arsenic (Roth, 1957).
L’étude menée par Lewis, Southwick et al., 1999, sur la cohorte du comté de Millard exposée à l’arsenic présent dans l’eau potable, indique un excès significatif de mortalité cardiovasculaire chez les hommes (SMR = 2,20 ; 95 % IC = 1,36-3,36) et les femmes (SMR = 1,73 ; 95 % IC = 1,13-2,50). Un excès non significatif de décès par athérosclérose est aussi noté.
L’exposition à l’arsenic est aussi associée à une augmentation de l’incidence des maladies cérébrovasculaires (Chiou, Huang et al., 1997, Wang, Chiou et al., 2003) et microvasculaires (Chen, Chiou et al., 1996, Tseng, Chong et al., 2003, Chang, Ho et al., 2004). Une récente méta-analyse, regroupant 12 études de toxicité chronique à l’arsenic dans l’eau de boisson a montré une relation entre l’augmentation des risques relatifs poolés des maladies cardiovasculaires (toutes confondues) et maladies coronariennes et les concentrations log-transformées d’arsenic dans l’eau de boisson (Moon, Oberoi et al., 2017).
Maladie des pieds noirs
L’atteinte la plus caractéristique de cette intoxication est « la maladie des pieds noirs » (ou ‘Blackfoot disease’), endémique de la région de Taïwan, suite à l'ingestion d'eau de boisson contenant de l'arsenic à des niveaux de l'ordre de 0,17 à 0,80 ppm (Tseng, Chu et al., 1968, Tseng, 1977), correspondant à des doses de 0,014 à 0,065 mg As.kg-1.j-1 (Abernathy, Marcus et al., 1989). Cette maladie est caractérisée par une diminution progressive de la circulation sanguine périphérique (consécutive à une athérosclérose sous-jacente) au niveau des pieds, se manifestant par l’installation insidieuse d’une sensation de froid et d’engourdissement, suivie d’ulcérations et d’une coloration noire des téguments. Elle évolue en une gangrène sèche (Ch'i and Blackwell, 1968, Tseng, Chu et al., 1968, Tseng, 1977, Chen, Wu et al., 1988, Tseng, 1989). Si les études à Taïwan démontrent clairement l’association entre la maladie des pieds noirs et des apports excessifs d’arsenic par l’eau de boisson (0,9 à 1,2 % des hommes et 0,7 % des femmes développent la maladie des ‘pieds noirs’), cette observation n’est pas retrouvée dans d’autres régions. Il est probable que la malnutrition, des co-expositions ou des capacités de méthylation différentes selon les individus, jouent un rôle dans la physiopathologie de cette maladie (Yu, Sheu et al., 1984, Ko, 1986, Lu, Shih et al., 1990, Tseng, Huang et al., 2005, Tseng, 2008). Néanmoins, dans d’autres pays, les études confirment les effets de l’arsenic sur le système vasculaire périphérique.
Les études concernant la maladie des pieds noirs ont également mis en évidence une association entre l’exposition à l’arsenic par l’eau de boisson des puits et la mortalité par cause cardiaque (Chen, Wu et al., 1988, Wu, Kuo et al., 1989, Chen, Chiou et al., 1996, Tsai, Wang et al., 1999). Les mêmes recherches dans des régions où la contamination est moins importante ne sont pas aussi tranchées dans leurs résultats. Engel and Smith, 1994, dans une étude de la mortalité d’étiologie cardiovasculaire dans 30 villes américaines, comparée au nombre attendu de décès, retrouvent un excès de mortalité par atteinte du système vasculaire. Les rapports standardisés de mortalité (SMR) sont élevés lorsque les taux d’arsenic sont supérieurs à 20 µg.L-1.
Hypertension
Les études sur les liens entre une exposition chronique à l’arsenic et l’hypertension sont peu nombreuses, se résumant à deux études « environnementales » (Chen, Hsueh et al., 1995, Rahman, Tondel et al., 1999) et une lors d’une exposition professionnelle (Jensen and Hansen, 1998). Les trois études constatent une élévation de la pression artérielle sanguine avec l’exposition à l’arsenic. La prévalence de l’hypertension artérielle est augmentée de 1,56 pour les populations examinées par Chen, Hsueh et al., 1995 dans les régions d’endémie de la maladie des pieds noirs par comparaison à des populations non-exposées. Au Bangladesh, Rahman, Tondel et al., 1999 concluent à une relation dose-réponse entre l’exposition à l’arsenic et l’augmentation de la pression artérielle. Cependant, des analyses d’eau complètes ne sont pas disponibles et il existe des incertitudes dans l’identification de la population et leur niveau d’exposition. Dans un groupe de travailleurs danois, dont l’excrétion urinaire d’arsenic était de 22,3 µmol.L-1 soit deux fois la valeur de référence, l’augmentation de la pression artérielle systolique était statistiquement significative par comparaison aux témoins (Jensen and Hansen, 1998).
Effets hématologiques
De nombreuses études rapportent l'apparition d'effets hématologiques, tels une anémie et une leucopénie suite à l'ingestion de dérivés inorganiques de l'arsenic (Nagai, Usui et al., 1956, Kyle and Pease, 1965, Glazener, Ellis et al., 1968, Tay and Seah, 1975, Guha Mazumder, Das Gupta et al., 1992). L’anémie est habituellement normochromique et normocytaire (Kyle and Pease, 1965, Chakraborti, Mukherjee et al., 2003). Ces effets s’observent pour des doses supérieures ou équivalentes à 0,05 mg As.kg-1.j-1 (Chakraborti, Mukherjee et al., 2003).
Toutefois, cette association entre exposition chronique dans l’eau de boisson et troubles hématologiques n’a pas été mise en évidence en Alaska, Arizona, Utah ou au Michigan (NRC, 1999).
Effets neurologiques
Lors de l'exposition par ingestion aux dérivés inorganiques de l'arsenic, de nombreuses études épidémiologiques ont révélé la survenue d'atteintes du système nerveux. Les expositions chroniques à de faibles doses, comprises entre 0,03 et 0,1 mg As.kg-1.j-1, induisent des neuropathies périphériques symétriques (Lewis, Southwick et al., 1999, Muzi, Dell'omo et al., 2001, Chakraborti, Hussam et al., 2003, Chakraborti, Mukherjee et al., 2003). Elles se manifestent initialement par des paresthésies des extrémités des pieds et des mains, parfois accompagnées d’engourdissement et progressent vers la racine du membre en quelques jours. Les paresthésies peuvent être douloureuses, décrites comme une brûlure en chaussette ou en gant. Des douleurs musculaires intenses et une fatigabilité importante peuvent conduire à une incapacité motrice (Heyman, Pfeiffer et al., 1956, Le Quesne and McLeod, 1977, Kelafant, Kasarskis et al., 1993).
Les nerfs moteurs et sensoriels sont atteints (Heyman, Pfeiffer et al., 1956, Chhuttani, Chawla et al., 1967). L’atteinte porte sur la vitesse de conduction nerveuse motrice et sur des altérations des potentiels d’action sensitifs (Le Quesne and McLeod, 1977). L'analyse histologique révèle des altérations axonales avec ou sans démyélinisation (Le Quesne and McLeod, 1977, Hindmarsh and McCurdy, 1986, Goebel, Schmidt et al., 1990). Certains de ces effets sont partiellement réversibles après l'arrêt de l'exposition. Cependant, ce phénomène de récupération est souvent long et n’est jamais complet (Le Quesne and McLeod, 1977, Murphy, Lyon et al., 1981, Fincher and Koerker, 1987). Lors d’expositions chroniques par l’eau de boisson, l’exposition à des doses élevées, pouvant dépasser les 0,064 mg.kg-1.j-1 (équivalent à 800 µg.L-1), induit des neuropathies cliniques (neuropathies sensorielles et sensorimotrices) chez 35 % des patients présentant des lésions cutanées (Rahman, Mandal et al., 2003). D’une manière générale, aucun effet neurologique n’est visible pour des concentrations inférieures à 6 µg As.kg-1.j-1.
Effets hépatiques
Plusieurs études ont mis en évidence des effets hépatiques induits par les dérivés inorganiques de l'arsenic, lors de leur administration par voie orale. Ils se manifestent par une hépatomégalie, des douleurs abdominales, une perte d’appétit, une indigestion chronique associée à une hypertension portale (Franklin, Bean et al., 1950, Silver and Wainman, 1952, Wade and Frazer, 1953, Mizuta, Mizuta et al., 1956, Chakraborty and Saha, 1987, Mazumder, Chakraborty et al., 1988) pouvant être associées, dans certains cas, à une élévation du niveau sanguin des enzymes hépatiques (Armstrong, Stroube et al., 1984, Chakraborty and Saha, 1987, Franzblau and Lilis, 1989, Hernández-Zavala, Del Razo et al., 1998, Liu, Zheng et al., 2002, Mazumder, 2005). Ces effets sont plus souvent observés dès 6 µg As.kg-1.j-1 (Hernández-Zavala, Del Razo et al., 1998). Les conséquences les plus sérieuses de ces atteintes hépatiques sont des cirrhoses avec ou sans ascite (Tsai, Wang et al., 1999), les patients mourant généralement entre 6 et 12 mois après l’apparition d’ascite (Liu, Zheng et al., 2002). Plusieurs auteurs suggèrent que les lésions hépatiques observées sont secondaires à une atteinte des endothéliums des vaisseaux hépatiques (Morris, Schmid et al., 1974, Rosenberg, 1974, Labadie, Stoessel et al., 1990).
Effets digestifs
Lors d'expositions prolongées à de faibles doses par ingestion de dérivés inorganiques de l'arsenic, des nausées, des vomissements, des diarrhées et des douleurs abdominales sont observés (Holland, 1904, Silver and Wainman, 1952, Mizuta, Mizuta et al., 1956, Nagai, Usui et al., 1956, Borgono and Greiber, 1972, Wagner, Maliner et al., 1979, Cebrian, Albores et al., 1983, Huang, Qian et al., 1985, Mazumder, Chakraborty et al., 1988, Franzblau and Lilis, 1989, Muzi, Dell'omo et al., 2001, Uede and Furukawa, 2003, Vantroyen, Heilier et al., 2004). Ces effets ne sont pas visibles pour des niveaux d'exposition de l'ordre de 0,01 mg As.kg-1.j-1 (Harrington, Middaugh et al., 1978, Valentine, Reisbord et al., 1985). Dans une étude transversale indienne, le risque de diarrhée a augmenté seulement pour des concentrations d’arsenic dans l’eau supérieures à 800 µg.L-1 (Majumdar, Mazumder et al., 2009).
Effets pancréatiques - Implication de l’arsenic dans le diabète
La recherche d’une corrélation entre l’exposition à l’arsenic et le diabète de type 2 (non-insulino-dépendant) est fondée au plan physiopathologique, et donne lieu à des publications depuis les années 1990 et particulièrement nombreuses à partir de 2010 (ATSDR, 2016). Les travaux portent majoritairement sur des expositions par ingestion d’arsenic. Lai, Hsueh et al., 1994 ont montré une relation entre l’ingestion d’iAs et la prévalence de ce diabète dans une population de 891 adultes taïwanais. Après ajustement pour l’âge et le sexe, dans cette population qui vit en zone d’endémie de la maladie des pieds noirs, la prévalence du diabète est double de celle observée dans la population de Taipei et de Taiwan. Il est relevé, par les mêmes auteurs, une relation dose-réponse entre le taux d’arsenic dans l’eau et la prévalence de l’affection après prise en compte de l’âge, du sexe, de l’indice de masse corporelle et du niveau d’activité physique. Les risques relatifs sont de 6,61 et 10,05 pour des expositions cumulées de 0,1 – 15 ppm par an et plus de 15 ppm par an respectivement. Tsai, Wang et al., 1999 ont rapporté un excès de mortalité par diabète des populations exposées à l’arsenic dans quatre quartiers par rapport à la mortalité locale et nationale. L’étude de Tseng, Chu et al., 1968, dans une étude de cohorte d’habitants des régions endémiques de la maladie des pieds noirs, est en accord avec ces données. Il existe une association entre l’exposition cumulée à l’arsenic de l’eau de boisson et le diabète non insulino-dépendant (Tseng, Chong et al., 2000, Tseng, Tai et al., 2000, Tseng, Tseng et al., 2002 ; Wang, Chiou et al., 2003). Une telle association est notée au Bangladesh par Rahman, Tondel et al., 1998 qui utilise la kératose comme indicateur de l’exposition à l’arsenic. Ces auteurs ont mis en évidence une augmentation du nombre de diabètes liée à l’augmentation de l’exposition à l’arsenic, au Bangladesh, et ce dès une exposition comprise entre 1 et 5 µg.L-1 par an (Rahman, Tondel et al., 1998). A l’inverse, Lewis, Southwick et al., 1999 n’ont pas retrouvé de lien entre l’arsenic de l’eau de boisson et le diabète dans l’étude de la mortalité en Utah. Cependant, le diabète est une affection de faible mortalité aux USA et des études complémentaires seraient nécessaires pour conclure au rejet de l’hypothèse. Une revue exhaustive des études expérimentales (19 études in vitro, 10 études in vivo) et épidémiologiques (6 dans des régions de Taiwan et du Bangladesh présentant de fortes concentrations en arsenic, 9 en milieu professionnel et 4 autres) a été réalisée récemment abordant cette problématique (Navas-Acien, Silbergeld et al., 2006). Parmi les résidents des régions de Taiwan et du Bangladesh exposés à de fortes concentrations en arsenic dans l’eau de boisson, une augmentation de la prévalence du diabète est observée dans tous les cas, avec une relation dose-effet significative. Ainsi, Tseng, Tai et al., 2000 ont déterminé un odd ratio de 2,1 (95 % IC : 1,1-4,2) chez les habitants d’une région de Taiwan exposés à plus de 17 µg.L-1 par an et Wang, Chiou et al., 2003 ont calculé un odd ratio de 2,69 (95 % IC : 1,65-2,73) chez les taïwanais exposés.
De même, Meliker, Wahl et al., 2007 montrent une augmentation des taux de mortalité due au diabète, pour des concentrations en arsenic dans l’eau potable comprises entre 10 et 100 µg.L-1 (soit environ 0,8 à 80 µg.kg-1.j-1) sur une population de plus de 700 000 personnes regroupant six régions du Michigan.
Plusieurs études montrent qu’à exposition égale à l’arsenic, le risque de développer une maladie diabétique est plus élevé chez les personnes qui ont de bonnes capacités de méthylation se traduisant par une proportion élevée de DMA (acide diméthylarsinique) dans les urines et/ou une proportion faible de MMA (acide monométhylarsonique) et/ou un rapport DMA/MMA élevé (Del Razo, García-Vargas et al., 2011, Nizam, Kato et al., 2013, Mendez, González-Horta et al., 2016, Grau-Perez, Kuo et al., 2017, Kuo, Moon et al., 2017).
Autres effets
D’une manière générale, l’ingestion répétée de faibles doses d’arsenic n’a pas d’impact sur les voies respiratoires mais quelques études ont tout de même noté l’apparition de toux, rhinorrhées ou laryngites, pour des doses d’arsenic comprises entre 0,03 et 0,05 mg As.kg-1.j-1 (Mizuta, Mizuta et al., 1956, Ahmad, Bandaranayake et al., 1997). Quelques patients ont présenté des bronchites, avec leurs séquelles, suite à des intoxications chroniques (Milton and Rahman, 2002, Mazumder, Steinmaus et al., 2005).
Effets pancréatiques - Implication de l’arsenic dans le diabète
Voie cutanée
FDTE/VTR Importer Au niveau oculaire, la présence de poussières d’arsenic dans l’air est à l’origine de conjonctivites (Liu, Zheng et al., 2002), souvent associées à des dermites faciales.
Synthèse
FDTE/VTR Importer L’exposition professionnelle par inhalation à l’arsenic à des niveaux élevés, induit des effets principalement au niveau de la peau (hyperkératose et hyperpigmentation), du système cardiovasculaire (maladie de Raynaud), du système nerveux (neuropathies périphériques) et des voies respiratoires (emphysème, pneumoconiose).
Par voie orale, les effets chroniques de l’arsenic sont des effets sur la peau (hyperkératose et hyperpigmentation (mélanose)), le système cardiovasculaire (arythmies, péricardites, maladie de Raynaud, « Blackfoot disease » gangrène), le système respiratoire (toux, rhinorhées, laryngites), neurologique (neuropathies périphériques) et au niveau gastro-intestinal ou sanguin (anémie, leucopénie) et, un possible impact sur le développement de certains types de diabètes. Les effets sur la peau sont les signes les plus précoces traduisant une intoxication par l’arsenic.
L’ensemble des effets de l’iAs, observés après inhalation ou ingestion, est repris dans le tableau de synthèse ci-après. Les doses à partir desquelles ces effets se manifestent ont été recensées autant que possible dans les études les plus récentes.
Chez l'animal
Inhalation
FDTE/VTR Importer Etant donné la qualité des données épidémiologiques, il n’a pas été jugé opportun de détailler les résultats des études par inhalation chez l’animal, par ailleurs assez peu nombreuses et décrivant principalement des effets sur l’appareil respiratoire.
Voie orale
FDTE/VTR Importer Lors de l’exposition à des dérivés inorganiques de l’arsenic par ingestion, les rats présentent des effets similaires à ceux observés chez l’homme. Des expositions répétées à des doses de trioxyde d’arsenic (11 mg As.kg-1.j-1) pendant plusieurs semaines induisent des altérations vasculaires (Bekemeier and Hirschelmann, 1989). Cependant, aucun effet histopathologique n’est rapporté au niveau cardiaque chez le rat ou le chien lors de l’exposition à l’arséniate ou l’arsénite pendant 2 ans (Byron, Bierbower et al., 1967).
Une diminution de la réponse humorale aux antigènes et des différents compléments est rapportée chez la souris, exposée à 5,7 mg As.kg-1 d’arsénite de sodium (Sikorski, McCay et al., 1989). Par voie orale, l’arséniate n’induit pas d’effets immunosuppresseurs chez la souris jusqu’à 100 ppm (20 mg As.kg-1.j-1) (Kerkvliet, Steppan et al., 1980). Au cours de cette étude les animaux ont été exposés aux doses de 2,5 – 25 et 100 ppm d’As dans l’eau de boisson pendant 10 à 12 semaines.
Voie cutanée
FDTE/VTR Importer Aucune étude de toxicité chronique par voie cutanée ayant rapporté des effets systémiques n’a été identifiée chez l’animal (ATSDR, 2007).
Synthèse
FDTE/VTR Importer Les données chez l’animal par inhalation et/ou voie cutanée sont relativement limitées et décrivent le plus souvent des effets comparables à ceux observés chez l’humain. Les effets par voie orale, détaillés chez l’humain et comparables chez l’animal, ne sont pas détaillés.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 1A |
2008 |
| IARC | FDTE/VTR Importer Groupe 1 : l’agent (ou le mélange) est cancérogène pour l’homme | 2012 |
| US EPA | FDTE/VTR Importer Classe A : substance cancérogène pour l'homme | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Les principales études disponibles ont été recensées par l’IARC, 2012 et ont conduit à la classification de l’arsenic. Les travaux plus récents complétant ces données sont rapportés par Zhou and Xi, 2018.
Inhalation
FDTE/VTR Importer Cancer des poumons et des voies respiratoires
Plusieurs études de populations exposées professionnellement à l’iAs (travailleurs de fonderies, travailleurs d’usines de fabrication de certains pesticides, travailleurs des vergers, négociants en vin) établissent une relation entre l'inhalation d'iAs et le cancer des voies respiratoires.
Quelques-unes, portant sur trois cohortes de travailleurs de fonderies, présentent suffisamment d'informations concernant l'exposition pour une estimation quantitative de l'augmentation du risque d'apparition de cancers respiratoires : ce sont les études des travailleurs de la fonderie de Tacoma (plomb, puis cuivre, or et argent ; Pinto, Henderson et al., 1978, Enterline and Marsh, 1982, Enterline, Henderson et al., 1987a, Enterline, Marsh et al., 1987b, Enterline, Day et al., 1995), de la fonderie d’Anaconda (cuivre ; Lee-Feldstein, 1983, Higgins, Oh et al., 1986, Lee-Feldstein, 1986, Lee-Feldstein, 1989, Lubin, Pottern et al., 2000), et de la fonderie de Ronnskar, en Suède (cuivre ; Axelson, Dahlgren et al., 1978, Jarup, Pershagen et al., 1989, Jarup and Pershagen, 1991, Sandstrom and Wall, 1993).
Dans la cohorte de 2 802 employés de la fonderie de Tacoma, les rapports standardisés de mortalité (SMR) pour le cancer respiratoire augmentent en même temps que l'exposition cumulée à l'arsenic. La consommation de tabac de ces sujets n’est pas connue. Le lien éventuel avec l'exposition à l'anhydride sulfureux est discuté du fait d’une étude antérieure, réalisée par les mêmes auteurs. Dans cette étude, une comparaison de la mortalité par cancer respiratoire dans deux départements présentant des concentrations élevées d'arsenic, mais des concentrations différentes d'anhydride sulfureux, avaient montré que l’excès de mortalité était lié à l’arsenic. Les résultats les plus récents (Enterline, Day et al., 1995) confirment, pour une exposition d’au moins un an entre 1940 et 1964, un SMR statistiquement significatif (p<0,05) de 316 pour la catégorie fortement exposée (≥ 45 mg.m-3).
Chez les 8 044 travailleurs de la fonderie d’Anaconda, Higgins, Oh et al., 1986 retrouvent une augmentation de la mortalité par cancer respiratoire rapportée à l’exposition à l’arsenic similaire à l'augmentation observée dans la cohorte de Tacoma. Cependant, la consommation de tabac de ces employés ou l’exposition à l'anhydride sulfureux ne sont pas bien documentées. Dans le groupe fortement exposé, la concentration est estimée à 11,3 mg.m-3, 0,6 et 0,3 mg.m-3 pour les groupes moyennement et faiblement exposés respectivement. Sur un total de 1 930 décès répertoriés, 446 sont dus à un cancer pulmonaire (SMR = 1,55 ; IC 95% : 1,41-1,70). Le risque augmente linéairement avec la durée d’emploi dans chaque catégorie (Lubin, Pottern et al., 2000), l’excès de risque apparaît à partir de 0,21 (mg.m-3)-1 par an (IC 95% : 0,10-0,46).
Welch, Higgins et al., 1982 notent une faible différence dans les valeurs des SMR pour le cancer respiratoire entre fumeurs et non-fumeurs sur 1 800 employés de la fonderie d’Anaconda (mais le pourcentage de non-fumeurs est faible 18,4 %).
Pour les 3 916 employés de la fonderie de Ronnskär, ayant travaillé au moins 3 mois dans la fonderie entre 1928 et 1967, l'excès de mortalité dû au cancer du poumon n’est pas en relation avec l'exposition à l'anhydride sulfureux. De plus, il existe une augmentation de la mortalité en fonction de l’intensité de l’exposition. Une augmentation statistiquement significative du risque est observée même pour les expositions < 0,25 mg.m-3 par an.
Cependant, il n’y a pas de relation nette et tranchée entre les variations de mortalité et la durée de l’exposition. Prenant en compte le tabagisme, Jarup and Pershagen, 1991 notent une faible augmentation du risque chez les fumeurs et les non-fumeurs pour des niveaux d’exposition inférieurs à 15 mg.m-3 par an. Ils suggèrent que l'interaction entre l'exposition à l'arsenic et la consommation de tabac est intermédiaire entre celle prévue par un modèle additif et multiplicatif.
Prises collectivement, les trois études démontrent une augmentation statistiquement significative du risque de cancer du poumon, pour des niveaux d’exposition à l’arsenic supérieurs à 75 mg.m-3 par an. Le risque semble augmenter plus rapidement avec la dose pour de faibles expositions cumulées qu’avec les fortes expositions (OMS IPCS, 2001, Lubin, Moore et al., 2008).
Sur la cohorte des travailleurs de la fonderie de Magna, Rencher, Carter et al., 1977 constatent que 7 % des décès sont dus au cancer du poumon par rapport à 0 - 2,2 % pour les autres employés et 2,7 % pour l’état (Utah) (10,1 / 10 000 pour la fonderie, 2,1 pour les mineurs et 3,3 pour les employés de l’Utah).
Etudiant les décès dus au cancer du poumon dans la ville de Saganoseki au Japon, à partir des certificats de décès validés par des analyses anatomo-pathologiques, Kuratsune, Tokudome et al., 1974 constatent que 58 % des cas de cancer du poumon sont observés chez les anciens employés de la fonderie par rapport à 15,8 % chez le groupe témoin.
Les travailleurs des usines d’anti-parasitaires ont aussi été étudiés. Hill and Faning, 1948 ont publié une étude ancienne sur la mortalité des travailleurs d’une usine de bains parasiticides à base d’arsenic : 29,3 % des décès sont dus aux cancers (cancer du poumon et cancer de la peau) contre 12,9 % pour les employés de la même zone géographique non exposés à l’arsenic (p < 0,05).
La cohorte de Ott, Holder et al., 1974 retrouve 20 décès par cancer respiratoire et 5 par cancer des tissus lymphatiques pour 5,8 et 1,3 décès attendus respectivement (p <0,01). De même Mabuchi, Lilienfeld et al., 1979, ayant suivi de 1946 à 1977 une cohorte de retraités d’une usine de produits anti-parasitaires à base d’arsenic de Baltimore, constatent 12 décès par cancer du poumon contre 3,6 attendus (p < 0,05).
Sobel, Bond et al., 1988 observent chez les travailleurs d’une usine de produits anti-parasitaires arsenicaux une augmentation significative des décès par cancers due à une augmentation de la localisation respiratoire. Mais aucune donnée n’a pu être fournie sur les niveaux d’exposition et sur l’exposition cumulative.
En 1991, Kusiak et al. ont publié les résultats du suivi d’une cohorte de travailleurs d’une mine d’or de l’Ontario et concluent que les effets de l’exposition à l’arsenic sont indépendants de ceux de l’exposition au radon (Kusiak, Springer et al., 1991). Une étude de cohorte menée sur des travailleurs d’une mine de cuivre, exposés pendant 50 ans, a mis en évidence une augmentation linéaire significative de l’excès de risque de cancer respiratoire lors de l’augmentation de la durée d’exposition à des poussières d’arsenic dans l’air ambiant et l’augmentation des niveaux d’exposition (Lubin, Pottern et al., 2000).
Un excès d'incidence du cancer du poumon ou de la mortalité due à cette forme, est rapporté dans un petit nombre d'études écologiques et dans une étude de mortalité de populations résidant près de sources ponctuelles d'émissions arsenicales (Blot and Fraumeni, 1975, Matanoski, Landau et al., 1976, Newman, Archer et al., 1976, Pershagen, Elinder et al., 1977, Matanoski, Landau et al., 1981, Cordier, Theriault et al., 1983, Arizona Departement of Health Services, 1990).
Toutefois, trois études cas-témoin ne retrouvent aucune association entre le taux de cancer et la proximité d'une source d'émission (Lyon, 1977, Rom, Varley et al., 1982, Frost, Harter et al., 1987).
Dans les mines, l’arsenic est inhalé sous forme particulaire : de grandes quantités de particules d’arsenic sont en effet retrouvées dans les poumons des mineurs ayant un cancer (Liu and Chen, 1996). La durée de l’exposition semble alors être le facteur prépondérant dans l’étiologie de ces cancers, par rapport à son intensité (Taylor, Qiao et al., 1989). Le développement de cancer des poumons chez les mineurs exposés aux poussières serait lié à la fois à l’irritation mécanique induite par ces poussières et à la toxicité intrinsèque de l’arsenic (Tapio and Grosche, 2006). Dans les fonderies de cuivre, l’arsenic n’est pas lié aux poussières et se trouve principalement sous forme de trioxyde d’arsenic. Les adénocarcinomes sont alors rencontrés en proportion plus importante que les carcinomes squameux : l’arsenic semble donc être à l’origine de différents mécanismes dans le développement des cancers du poumon, selon la voie l’exposition (Guo, Wang et al., 2004).
Toutefois, une étude très récente semble mettre en évidence que le risque de développer un cancer des poumons dépende plus de la dose absorbée que de sa voie d’absorption (Smith, Ercumen et al., 2009).
Autres cancers
Quelques études rapportent la survenue d’autres types de cancer (non respiratoire), potentiellement associés à l’inhalation d’iAs. Ainsi, Enterline, Day et al., 1995 ont mis en évidence une augmentation de la mortalité due aux cancers du gros intestin ou des os mais sans lien avec l’exposition cumulée en arsenic et sur un nombrer réduit de personnes. De même, des cancers de la peau sans présence de mélanome (Pesch, Ranft et al., 2002, Bencko, Franěk et al., 2005) ont été décrits mais sans association avec les niveaux d’exposition rencontrés. Il en est de même avec les cancers de l’estomac (Bulbulyan, Jourenkova et al., 1996), du colon (Wingren and Axelson, 1993), des sinus (Battista, Bartoli et al., 1996), du foie (Tsai, Chien et al., 1998) ou de la peau (Tsuruta, Hamada et al., 1998, Col, Col et al., 1999), mais sans aucune preuve de l’implication de l’arsenic inhalé dans l’étiologie de ces cancers.
Voie orale
FDTE/VTR Importer Cancer de la peau
Des cancers de la peau associés à l’exposition à l’arsenic au cours de son usage médicinal, par ingestion d’eau contaminée, ou au cours d’expositions professionnelles sont signalés depuis plus de 50 ans (Hill and Faning, 1948, Zaldivar, 1974, Guo, Fujino et al., 2001, Beane Freeman, Dennis et al., 2004, Mitra, Mazumder et al., 2004). Les cancers cutanés induits par l’arsenic sont habituellement de type histologique épidermoïde ou basal, et surviennent dans des zones non exposées, y compris les paumes de mains et les pieds (Scotto, Fears et al., 1996).
L’hyperkératose de la paume des mains et de la plante des pieds, ainsi que la perturbation de la pigmentation du tronc, sont utilisées comme critères d’exposition à l’arsenic par l’eau de boisson. Les lésions cutanées induites par l’arsenic persistent et quelques-unes d’entre elles peuvent dégénérer en ulcérations et cancers cutanés (Liu, Zheng et al., 2002). Ainsi, la maladie de Bowen* est à l’origine de lésions cutanées précancéreuses qui évoluent, après 5 à 10 ans, en épithéliomas typiques, spinocellulaires et basocellulaires (Yu, Liao et al., 2006). Cette maladie est également rapportée dans l’étude de Rahman, Mandal et al., 2003.
L’exposition par l’eau de boisson est principalement associée à l’augmentation du risque de cancer cutané. Une relation a été bien établie entre la prévalence du cancer de la peau chez 40 421 individus vivant dans 37 villages à Taiwan et la concentration d'arsenic dans l'eau potable (jusqu'à 1 820 µg.L-1) (Tseng, Chu et al., 1968, Tseng, 1977). Pour une période de 10 ans, 528 individus sont décédés (47,7 %) dont 244 par cancers cutanés (Tseng, 1977). Parmi les 40 421 individus examinés, 428 ont été atteints de cancers cutanés et 370 de maladies des ‘pieds noirs’. Soixante et un patients présentaient à la fois des cancers cutanés et la maladie des ‘pieds noirs’ soit 1,5/1 000. Dans l’étude de 1977, il a été observé que la sévérité de la maladie des ‘pieds noirs' était directement liée à la durée d'exposition. Aucun cas de cancer de la peau ne s'est déclaré dans une autre population similaire (7 500 « témoins ») dont l'eau potable contenait 17 µg.L-1 d'arsenic (3 cas de cancer attendus) (Tseng, Chu et al., 1968, Tseng, 1977).
Une étude réalisée dans le Wisconsin a mis en évidence que les résidents exposés à de l’eau de boisson contenant des concentrations en arsenic supérieures à 1 µg.L-1 présentaient presque deux fois plus de risque de développer un cancer de la peau que ceux exposés à moins de 1 µg.L-1 (Knobeloch, Zierold et al., 2006). Les adultes exposés à plus de 10 µg.L-1 montrent les taux de cancer cutané les plus élevés 
Hsueh, Cheng et al., 1995 ont étudié les relations entre l’exposition à l’arsenic dans trois villages taiwanais et le cancer de la peau. Sur 1 081 sujets examinés, 66 sont porteurs d’un cancer de la peau. La prévalence des cancers est après ajustement pour l’âge et le sexe, associée à tous les indicateurs retenus d’exposition à l’arsenic.
Cette augmentation de prévalence du cancer de la peau ou de la mortalité, associée à ce type de cancer, est notée dans la majorité des études épidémiologiques, portant sur des populations exposées à des concentrations élevées d'arsenic dans l'eau potable en Argentine (Bergoglio, 1964, Hopenhayn-Rich, Biggs et al., 1998), au Mexique (Cebrian, Albores et al., 1983), au Chili (Zaldivar, 1974, Zaldivar, 1977, Ferreccio, Psych et al., 1998, Smith, Goycolea et al., 1998, Ferreccio, Gonzalez et al., 2000) et en Angleterre (Philipp, Hughes et al., 1983). Dans un travail récent, Smith, Lingas et al., 2000 examinent une petite population de 44 sujets qui consomment une eau de puits contenant jusqu’à 800 µg.L-1 d’arsenic. Six cas de cancer cutané sont dénombrés. L’exposition à l’arsenic de ce village étant excessive depuis des centaines d’années, cette observation suggère l’absence d’adaptation de la population à ce risque. L’exposition prolongée à l’arsenic dans l’eau de boisson est généralement associée à l’augmentation du risque de cancer de la peau (épithéliomas spinocellulaires et basocellulaires) et non à celle des mélanomes malins (Guo, Yu et al., 2001). Mais une étude plus récente a mis en évidence le lien existant entre arsenic et mélanomes cutanés (Beane Freeman, Dennis et al., 2004). En effet, une relation linéaire a pu être mise en évidence entre les concentrations en arsenic retrouvées dans les ongles des personnes exposées (par l’eau de boisson et/ou sur leur lieu de travail) et l’augmentation du nombre de personnes atteintes de mélanomes cutanés
De tels résultats n’ont pas été observés chez des populations moins nombreuses exposées à l'arsenic dans l'eau potable aux États-Unis (Morton, Starr et al., 1976, Southwick, Western et al., 1983, Bates, Smith et al., 1995). L’exposition à de plus faibles doses d’arsenic et des effectifs de population plus petits expliquent probablement ces divergences et ne remettent pas en cause les corrélations observées dans les autres pays. De même, une étude belge a cherché à établir le lien entre la mortalité par cancer et par d’autres pathologies et l’exposition à l’arsenic sur une population du nord de la Belgique sur la période de 1981 à 1991 (Buchet and Lison, 1998). Dans cette zone, les concentrations en arsenic les plus élevées dans l’eau potable sont comprises entre 20 et 50 µg.L-1. Le niveau intermédiaire est inférieur à 20 µg.L-1 et les populations de référence sont exposées à des concentrations inférieures à 5 µg.L-1. Aucun lien entre les niveaux d’exposition et la mortalité par cancer du poumon, des reins et de la vessie n’a pu être établi.
*Maladie de Bowen : carcinome épidermique, favorisé par le soleil et l'arsenic. Elle peut toucher la peau mais aussi les muqueuses et se présente sous la forme d'une lésion brun rougeâtre arrondie ou arciforme bien limitée dont la surface est un peu surélevée et squameuse.
Cancer de la vessie
L’exposition à de fortes concentrations en arsenic dans l’eau de boisson (> 600 µg.L-1) est à l’origine de l’augmentation de l’incidence de cancers de la vessie (Guo, Chiang et al., 1997, Kurttio, Pukkala et al., 1999, Chiou, Chiou et al., 2001, Chen, Su et al., 2003, Steinmaus, Yuan et al., 2003, Bates, Rey et al., 2004, Karagas, Tosteson et al., 2004, Lamm, Engel et al., 2004). Concernant les effets de faibles doses, les études disponibles présentent des résultats divergents. Steinmaus, Yuan et al., 2003 ne mettent en évidence aucune élévation du risque de cancer de la vessie pour les habitants de 7 états américains exposés à des concentrations en arsenic dans l’eau de boisson proches de 200 µg.j-1, excepté pour les fumeurs. Au contraire, Kurttio, Pukkala et al., 1999, Chiou, Chiou et al., 2001 et plus récemment Karagas, Tosteson et al., 2004 ont montré un lien entre l’exposition à de faibles doses d’arsenic (respectivement 0,5 et 10 µg.L-1) et l’augmentation de l’incidence des cancers de la vessie. Dans Chiou, Chiou et al., 2001, une relation linéaire significative est mise en évidence entre l’incidence des carcinomes transitionnels et les concentrations en arsenic comprises entre 10 et plus de 100 µg.L-1. Ces études mettent aussi en avant le rôle co-cancérigène de la fumée de cigarettes dans le développement de ces tumeurs.
Chen, Su et al., 2003 ont montré qu’une exposition cumulée à l’arsenic supérieure à 12 mg.L-1 par an est associée à une augmentation du risque de cancer de la vessie (odd ratio 4,23 ; 95 % IC 1,12-16,01), en présence d’une importante quantité de MMA détectée dans les urines. De plus, il apparaît que, en comparaison aux femmes, les hommes fumeurs et non-fumeurs présentent des risques accrus de ce type de cancer.
Les cancers de la vessie liés à l’arsenic sont des carcinomes transitionnels ou urothéliaux (Chiou et al., 2001) et des adénocarcinomes (Guo, Chiang et al., 1997). 
Une étude réalisée dans 138 villages de Taiwan, a permis de mettre en évidence une relation dose-effet entre l’exposition à l’arsenic par l’eau de boisson et les cas mortels de cancer des poumons (Guo, Wang et al., 2004). Ainsi, des niveaux supérieurs à 0,64 mg.L-1 sont associés à une augmentation significative de la mortalité due à ces cancers, non retrouvée à des doses plus faibles. De même, Lamm, Engel et al., 2006 mettent en évidence une relation dose-réponse positive entre l’exposition à l’arsenic dans l’eau de boisson et la mortalité par cancers des poumons et de la vessie, pour les villages présentant des niveaux moyens > 250 µg As.L-1.
Smith et al. (2006) ont mis en évidence une augmentation de la mortalité due au cancer des poumons chez les personnes exposées à des fortes concentrations en arsenic en Argentine (880 µg.L-1), dans l’eau de boisson, in utero ou pendant la petite enfance. Nakadaira, Endoh et al., 2002 suggèrent que même une exposition courte (< 5 ans) peut être suffisante pour être à l’origine du développement de cancers des poumons.
Les cancers des poumons observés présentent des types cellulaires spécifiques en fonction de la voie d’exposition impliquée (Guo, Wang et al., 2004). Ainsi, les carcinomes squameuxet les carcinomes à petites cellules apparaissent liés à l’ingestion d’arsenic, contrairement aux adénocarcinomes rencontrés plus souvent suite à son inhalation.
Arsenic et autres cancers
L’implication de l’arsenic dans les cancers des organes internes est avérée : l’exposition prolongée à l’arsenic augmente le risque de développer des cancers du foie, des reins, de l’estomac, de la prostate et du colon (Hopenhayn-Rich, Biggs et al., 1998, Lewis, Southwick et al., 1999, Tchounwou, Patlolla et al., 2003).
Une étude menée en Argentine dans la région de Cordoba (Hopenhayn-Rich, Biggs et al., 1998) met en évidence une relation dose-effet significative entre l’exposition à l’arsenic via l’eau de boisson et la mortalité par cancer des reins : les ratios de mortalité standardisés sont de 0,87-1,33-1,57 et 1-1,36-1,81 respectivement pour les hommes et les femmes exposés à de faibles, moyennes ou fortes (moyenne : 148 µg.L-1) concentrations en arsenic dans l’eau.
Dans le cas des cancers hépatiques, dont les angiosarcomes et les cancers primitifs, leur apparition est associée à l’exposition prolongée à l’arsenic par ingestion (Liu and Waalkes, 2008). Un angiosarcome hépatique a été observé chez des patients qui ingéraient des composés arsenicaux (arsénite contenu dans la liqueur de Fowler) pour des raisons médicales (Regelson, Kim et al., 1968, Lander, Stanley et al., 1975, Popper, Thomas et al., 1978, Falk, Caldwell et al., 1981, Roat, Wald et al., 1982). Dans une étude au Chili, Smith, Goycolea et al., 1998 constatent une association positive entre le cancer du foie et l’exposition à l’arsenic par l’eau de boisson, ce que Hopenhayn-Rich, Biggs et al., 1998 ne retrouve pas en Argentine.
Une augmentation modérée de mortalité par cancer de la prostate semble possible (Chen, Chuang et al., 1985, Lewis, Southwick et al., 1999). Les données disponibles les plus récentes indiquent que la prostate est une cible de la cancérogénicité de l’arsenic (Benbrahim-Tallaa and Waalkes, 2008). Ainsi, ces auteurs ont recensé plusieurs études épidémiologiques observant un lien entre les expositions environnementales à l’iAs et l’augmentation de l’incidence des cancers de la prostate, ainsi que des essais in vitro sur modèles cellulaires mettant en évidence la transformation maligne de cellules épithéliales de la prostate.
Synthèse
FDTE/VTR Importer Par inhalation, les principaux cancers sont pulmonaires. Par voie orale, les cancers peuvent se développer au niveau de la peau, de la vessie et des poumons, mais aussi dans le foie, les reins, l’estomac, le colon ou la prostate.
Les principaux effets cancérigènes de l’iAs par voie orale et/ou inhalation sont synthétisés dans le tableau suivant : 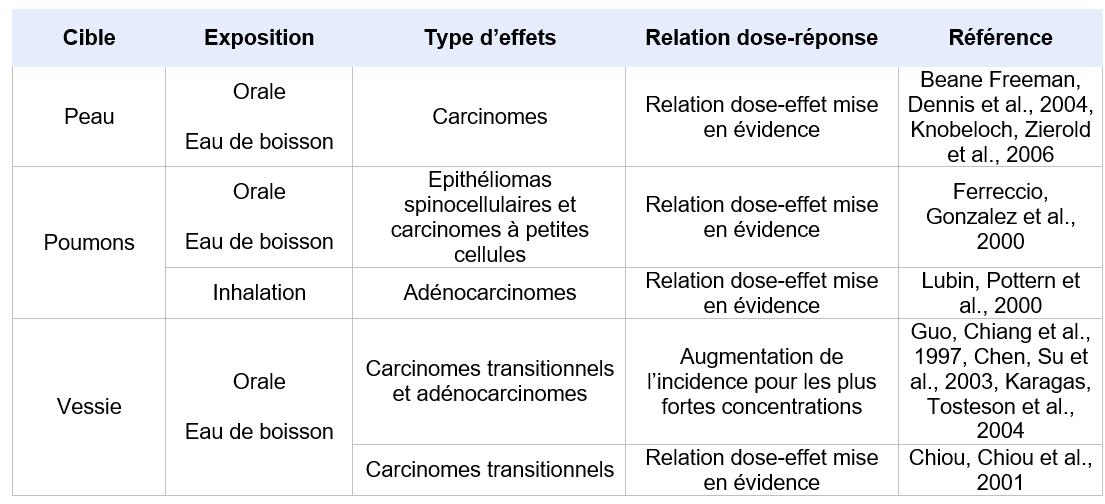
Mécanisme d’action cancérigène
Chez l’homme, la période de latence de la cancérogenèse liée à l’arsenic est comprise entre 30 et 50 ans.
Neuf modes d’actions différents de la cancérogenèse de l’arsenic ont pu être listés (Kitchin, 2001, Khairul, Wang et al., 2017) : induction d’aberrations chromosomiques, stress oxydatif, altération de la réparation de l’ADN, altération de la méthylation de l’ADN, altération des facteurs de croissance, stimulation de la prolifération cellulaire, promotion/progression, suppression p53 et amplification génique. Seuls 3 modes d’action (aberrations chromosomiques, stress oxydatif et altération des facteurs de croissance) ont été clairement reliés à la cancérogenèse de l’arsenic, à la fois dans les systèmes expérimentaux et les tissus humains (Yu, Liao et al., 2006). L’arsenic semble donc agir comme un co-cancérigène, un promoteur ou un agent de progression de la cancérogenèse.
Stress oxydatif
L’implication du stress oxydatif dans l’initiation d’atteintes hépatiques et dans le développement des cancers de la peau, par l’arsenic, est envisagée (De Vizcaya-Ruiz, Barbier et al., 2009).
La principale voie de métabolisation de l’arsenic, après ingestion, est sa méthylation en MMA et DMA, avant excrétion via l’urine (Tchounwou, Patlolla et al., 2003). Alors que dans le passé, les auteurs pensaient que cette voie métabolique détoxifiait l’arsenic, la communauté scientifique considère désormais que la méthylation de l’arsenic aggrave sa toxicité. Au cours des différentes étapes de méthylation, des espèces réactives de l’oxygène peuvent être générées. De par sa forte affinité pour le groupe sulfydryles des protéines, l’arsenic peut réagir avec le GSH, principal agent complexant des espèces réactives et radicalaires. Les cellules n’étant plus capables d’éliminer les radicaux libres formés, des dommages cellulaires, associés à la cancérogenèse de l’arsenic, apparaissent (Yu, Liao et al., 2006, McCarty, Chen et al., 2007). L’implication des formes méthylées trivalentes dans la cancérogénicité de l’arsenic est aussi envisagée depuis peu par Bredfeldt, Jagadish et al., 2006 : ces auteurs ont en effet mis en évidence la transformation maligne de cellules urothéliales humaines in vitro par ces formes méthylées.
La capacité des individus à méthyler l’arsenic est très variable et les études suggèrent que les personnes excrétant des proportions importantes d’arsenic sous sa forme MMA sont plus susceptibles que les autres de développer des cancers induits par l’arsenic (Steinmaus, Carrigan et al., 2005). Plusieurs facteurs comme la forme chimique de l’arsenic, les doses, la voie d’exposition ou le régime alimentaire semblent influencer la capacité de méthylation des individus (Abernathy, Marcus et al., 1989).
Chez l'animal
Inhalation
FDTE/VTR Importer Aucune étude n’a été réalisée chez l’animal par voie respiratoire.
Voie orale
FDTE/VTR Importer Par voie orale, la plupart des études n’ont mis en évidence aucune augmentation claire des cancers de la peau ou d’autres cancers, que cela soit chez le hamster, la souris ou le rat (Ishinishi, Yamamoto et al., 1983, Pershagen, Nordberg et al., 1984, Yamamoto, Hisanaga et al., 1987). Des macaques, exposés pendant 15 ans à de la nourriture contaminée par 0,1 mg.kg-1 d’arséniate de sodium, n’ont développé aucune tumeur (Thorgeirsson, Dalgard et al., 1994). Ng et al. (1998a, 1999 ) ont exposé deux souches différentes de souris à 500 µg As.L-1, pendant 26 mois. Chez les 2 souches, 41 et 26 % des souris ont développé des tumeurs principalement au niveau du tractus gastro-intestinal, des poumons et du foie. L’utilisation de modèle transgéniques ou transplacentaire montre la survenue de tumeurs (Hughes, Beck et al., 2011).
Synthèse
FDTE/VTR Importer La plupart des études chez l’animal n’ont pas mis en évidence l’augmentation de l’incidence de tumeurs cancéreuses dans les modèles d’étude classiques.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classée |
2008 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Les données humaines disponibles indiquent que l’arsenic est clastogène par inhalation. Des travailleurs exposés dans une mine de cuivre en Suède présentent une augmentation significative de la fréquence d’aberrations chromosomiques dans les lymphocytes périphériques (Beckman, Beckman et al., 1977, Nordenson, Beckman et al., 1978). Plusieurs études humaines d’exposition à l’arsenic en milieu professionnel ou environnemental ont mis en évidence une association avec des lésions oxydatives non spécifiques à l’ADN (Basu, Som et al., 2005, Vuyyuri, Ishaq et al., 2006, Méndez‐Gómez, García‐Vargas et al., 2008, Pei, Ma et al., 2013), des lésions chromosomiques (échanges de chromatides sœurs dans les lymphocytes) (Paiva, Martínez et al., 2006) ou encore avec l’augmentation de la fréquence des micronoyaux (cellules exfoliées de l’épithélium buccal ou de cellules de l’épithélium des voies urinaires)(Martinez, Creus et al., 2005, Paiva, Martínez et al., 2008, Bartolotta, Pacskowski et al., 2011, Banerjee, Banerjee et al., 2013, Gamiño-Gutiérrez, González-Pérez et al., 2013) et la diminution de la réparation de l’ADN (Méndez‐Gómez, García‐Vargas et al., 2008).
Chez l'animal
Toutes voies
FDTE/VTR Importer Les données animales disponibles confirment le caractère clastogène de l’arsenic par inhalation (IARC, 2012) Par voie orale, l’arsenic induit des aberrations chromosomiques, des échanges de chromatides sœurs et des micronoyaux dans des nombreux systèmes (lymphocytes ou cellules épithéliales, cellules de la moelle osseuse de souris et de rats) (Poddar, Mukherjee et al., 2000, Tian, Ma et al., 2001, McDorman, Collins et al., 2002, Mahata, Basu et al., 2003, Basu, Ghosh et al., 2004, Martinez, Creus et al., 2004).
In vitro
Organismes procaryotes
FDTE/VTR Importer Concernant les organismes procaryotes, les études disponibles datent des années 1970 et 1980 et ne mettent en évidence aucune activité mutagène in vitro chez ces organismes, sans activation métabolique.
Organismes eucaryotes
FDTE/VTR Importer Par contre, la plupart des systèmes eucaryotes testés in vitro montrent des effets sur les chromosomes (aberrations chromosomiques, échanges de chromatides sœurs, micronoyaux) dans les fibroblastes, les leucocytes ou les lymphocytes humains, les cellules de lymphomes de souris, les cellules ovariennes de hamster chinois (CHO cells) ou encore les cellules embryonnaires de hamster syrien (SHE cells) (Helleday, Nilsson et al., 2000, Kessel, Liu et al., 2002, Mure, Uddin et al., 2003).
L’étude de Klein met en évidence sur une lignée transgénique l’apparition d’effets clastogènes de l’arsenic (III) ou de MMA à des niveaux de concentrations hautement cytotoxiques (Klein, Leszczynska et al., 2007). Aucun effet mutagène n’est observé avec le DMA.
Le mécanisme génotoxique impliqué n’est pas connu mais semble non direct, lié à la capacité de l’arsenic à perturber l’apoptose (Pi, He et al., 2005), à inhiber la réplication de l’ADN ou les enzymes de réparation, ou à sa capacité à se comporter comme un analogue du phosphore (Tchounwou, Patlolla et al., 2003).
C’est dans ce contexte que l’US EPA initie actuellement de nouvelles recherches concernant le mécanisme cancérigène de l’arsenic ; le mécanisme d’action génotoxique indirect laissant penser à l’existence d’un seuil pour les effets cancérigènes induits par l’arsenic (Cohen, Chowdhury et al., 2016, Zhou and Xi, 2018). De fait, les modèles classiquement utilisés par l’US EPA pour évaluer le risque cancérigène ne seraient pas adaptés au cas de l’arsenic. Cet organisme réfléchit donc à la mise au point d’un nouveau modèle intégrant le mode d’action cancérigène spécifique de l’arsenic. En effet, dans leur optique, l’approche linéaire habituellement utilisée pour déterminer les excès de risques unitaires ne serait plus pertinente pour les faibles doses (Zhao, Kenyon et al., 2007).
Dans l'état actuel des connaissances, l’HAS recommande pour l’évaluation des dangers de l’iAs et des risques associés à l’exposition à ses dérivés par voie orale, de considérer que ses effets cancérogènes sont sans seuil (HAS, 2020). En l’absence de données suffisantes et par prudence, l’Ineris retient une approche sans seuil concernant les effets cancérogènes de l’iAs.
Synthèse
FDTE/VTR Importer Les effets clastogènes de l’arsenic ont été observés dans les études réalisées chez l’homme, chez l’animal ou à partir de tests in vitro. Le mécanisme d’action cancérigène de l’arsenic étant controversé, il est conseillé pour l’instant de retenir par précaution une approche sans seuil pour les effets cancérigènes induits par l’arsenic.
Effets sur la reproduction
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune donnée sur la fertilité féminine n’a été identifiée.
Concernant la fertilité des hommes, une étude transversale chinoise a montré une augmentation du risque d’oligospermie chez les hommes dont la concentration urinaire de DMA était supérieure à 20,9 µg.g-1 créatinine (OR : 7,2 ; IC 95 % : 1,4-37,1) (Xu, Bao et al., 2012).
Dans une étude cas-témoin indienne, les concentrations d’arsenic dans l’eau consommée et dans le sperme étaient significativement plus élevées chez les 68 individus oligo- ou azoospermiques que chez les 32 témoins (Sengupta, Deb et al., 2013).
Dans une étude cas-témoins (101/61) chinoise, les concentrations urinaires d’iAs, de MMA et de DMA, ainsi que le rapport As pentavavalent/As trivalent étaient significativement plus élevés et le rapport MMA/As significativement plus faible chez les hommes infertiles que chez les témoins ; dans cette étude, la moyenne géométrique de la concentration urinaire de la somme (As + MMA + DMA) était de 9,5 ± 102,1 µg.g-1 créatinine chez les témoins et 50,7 ± 294,5 µg.g-1 créatinine, chez les cas (Wang, Zhang et al., 2016).
Une étude japonaise n’a pas montré de corrélation entre les différents paramètres de la qualité du sperme (volume des éjaculats, compte des spermatozoïdes, mobilité des spermatozoïdes) et les concentrations urinaires d’iAs (III, V) de MMA, de DMA ou l’index de méthylation primaire (MMA/As) ; dans cette étude, les moyennes géométriques de la concentration urinaire de la somme (As + MMA) et de celle de DMA étaient respectivement de 2,5 ± 1,30 mg.g-1 créatinine et 20,6 ± 14,1 mg.g-1créatinine (Oguri, Yoshinaga et al., 2016)
Synthèse
FDTE/VTR Importer Chez l’homme, l’altération spermatique en lien avec la consommation d’arsenic dans l’eau de boisson et/ou de métabolites urinaires est évoquée dans plusieurs études, et demande à être confirmée. Aucune donnée sur la fertilité féminine n’a été identifiée.
Chez l'animal
Inhalation
FDTE/VTR Importer Chez le rat, par inhalation, à des concentrations comprises entre 0,08 et 20 mg As2O3.m-3 de 6 heures par jour pendant les 14 jours précédant l’accouplement jusqu’au 19e jour de la gestation, aucune modification de la période de l’accouplement, de l’indice d’accouplement ou de l’indice de fertilité n'est retrouvée. Ce qui permet de définir une concentration n’induisant pas d’effet à 20 mg As.m-3 pour la reproduction chez la femelle. Holson, Stump et al., 1999 ont étudié ces effets chez des rates et n’ont mis en évidence aucune modification des indices d’accouplement ou de fertilité, pour des doses supérieures à 0,08 mg As.m-3.
Voie orale
FDTE/VTR Importer Une étude sur trois générations de souris, exposées à l’arsénite de sodium dans l’eau de boisson à la dose moyenne de 1 mg As.kg-1.j-1, ne montre pas d’effet significatif sur les paramètres de la reproduction. Seules une légère diminution du nombre de nouveau-nés et une légère modification du sex-ratio sont rapportées (Schroeder and Mitchener, 1971).
L’administration orale d’arsénite (AsIII) à des souris ou des rats mâles a entraîné une diminution du poids des testicules, de la concentration des spermatozoïdes dans le sperme et de leur motilité, ainsi que de la concentration plasmatique de testostérone (Zubair, Ahmad et al., 2017).
Dans plusieurs études, une diminution des concentrations plasmatiques de FSH et de LH a également été observée, ce qui indique une origine au moins partiellement centrale de l’atteinte testiculaire (HAS, 2020).
Synthèse
FDTE/VTR Importer Chez l’animal, l’atteinte testiculaire (poids) et spermatique chez les mâles (rat/souris), associée à une altération des concentrations hormonales de testostérone, de FSH et de LH, est sans conséquence sur leur capacité de reproduction et ne peut donc pas être considéré comme un effet critique. Par ailleurs, l’iAs ne semble pas avoir d’effet sur la fertilité des femelles.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classée | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Chez l’homme, des avortements spontanés, de la mortalité fœtale et infantile tardive et des faibles poids de naissance ont été mis en évidence, pour des doses très faibles. De même, des effets sur le développement intellectuel sont observés, ou encore sur le risque d’infections respiratoires chez le très jeune enfant.
Inhalation
FDTE/VTR Importer Par inhalation, des études épidémiologiques ont été réalisées chez des salariées suédoises, exposées professionnellement, à l’arsenic sous forme inorganique, et notamment pendant leur grossesse. Il a été montré que les enfants nés de ces femmes présentaient un taux de malformations supérieur à celui attendu (Nordstrom et al., 1979b) et un poids de naissance légèrement diminué (Nordstrom, Beckman et al., 1979a). De plus, les poids de naissance mesurés chez les nouveaux-nés defemmes vivant à proximité de l’industrie étaient également diminués. Cependant, ces résultats ne sont pas corrélés avec ceux de l’exposition à l’arsenic.
Une étude cas-témoin réalisée chez les populations voisines d’une industrie de pesticides au Texas et exposées par inhalation à l’arsenic a montré une augmentation statistiquement significative du nombre de mort-nés lors de l’exposition aux concentrations les plus fortes, supérieures à 100 ng As.m-3 (Ihrig, Shalat et al., 1998), ce qui permet de définir une NOAEC de 5,5.10-5 mg.m-3. Malheureusement, cette étude présente des biais qui la rendent difficilement exploitable. Les résultats de ces études sont le plus souvent le fruit d’une co-exposition et aucune conclusion ne peut être retenue.
Voie orale
FDTE/VTR Importer L’exposition chronique à l’arsenic dans l’eau de boisson a été associée à une augmentation de l’incidence des avortement spontanés, de morts fœtales tardives, de prématurité et de faible poids des nouveaux nés au Bangladesh, en Inde, et à Taiwan (Ahmad, Sayed et al., 2001, Chakraborti, Mukherjee et al., 2003, Yang, Chang et al., 2003, Chakraborti, Sengupta et al., 2004, Von Ehrenstein, Guha Mazumder et al., 2006), bien qu’aucune relation dose-effet n’ait été observée dans ces études. Toutefois, une méta-analyse de six études (Aschengrau, Zierler et al., 1989, Ahmad, Sayed et al., 2001, Guo, Fujino et al., 2003, Milton, Smith et al., 2005, Von Ehrenstein, Guha Mazumder et al., 2006, Rahman, Persson et al., 2010) montre un excès de risque significatif d’avortements et de morts in utero en cas de consommation d’une eau contenant au moins 50 µg.L-1 d’arsenic avec des OR respectifs de 2,02 ; IC 95 % (1,40-2,91) et 1,84 ; IC 95 % : (1,38-2,45) (Quansah, Armah et al., 2015).
Une autre étude met en évidence la forte relation existant entre l’exposition à des fortes doses d’arsenic dans l’eau de boisson et l’augmentation des mortalités fœtales tardives, néonatales et post-néonatales (Hopenhayn, Bush et al., 2006), confirmant les précédentes observations faites au Chili (Hopenhayn-Rich, Browning et al., 2000) et au Bangladesh (Ahamed, Sengupta et al., 2006 ; Milton, Smith et al., 2005). L’étude épidémiologique, réalisée sur la population d’une région du Chili depuis 50 ans (Hopenhayn, Bush et al., 2006), a montré que les plus fortes mortalités surviennent lorsque que les concentrations en arsenic dans l’eau sont les plus fortes, comprises entre 110 et 860 µg.L-1. La diminution de ces teneurs a conduit à une régression de la mortalité « infantile ».
Une diminution significative du poids moyen des nouveaux nés, dont les mères avaient été exposées à de l’eau de boisson contenant 40 µg.L-1 d’arsenic, a été mise en évidence au Chili (Hopenhayn-Rich, Ferreccio et al., 2003) et à Taïwan (Yang, Chang et al., 2003). De même, une étude de cohorte menée au Bangladesh (Rahman, Vahter et al., 2007) met en évidence une relation dose-effet entre l’exposition à des concentrations en arsenic supérieures à 50 µg.L-1 dans l’eau de boisson et le risque accru de mortalité infantile. Néanmoins, cette relation n’a pas été mise en évidence par Von Ehrenstein, Guha Mazumder et al., 2006 chez des femmes indiennes exposées à plus de 100 µg.L-1. Dans une méta-analyse incluant la plupart de ces études (Chili, Taïwan et Bangladesh), il existait une corrélation inverse entre le poids de naissance et la concentration d’arsenic dans l’eau consommée pendant la grossesse, avec une perte de poids des bébés de 53,2 g par µg.L-1 d’arsenic d’eau consommée par les mères (Quansah, Armah et al., 2015). Les données disponibles ne permettent ni de démontrer un effet sans seuil, ni d’identifier un seuil en-deçà duquel l’effet de l’exposition prénatale à l’arsenic sur le poids de naissance ne serait plus détectable (Bloom, Surdu et al., 2014). Des observations similaires ont été menées aux Etats Unis (Davis, Higgins et al., 2015, Gilbert-Diamond, Emond et al., 2016). Ces effets pouvant être associés à une diminution du périmètre crânien (Henn, Ettinger et al., 2016).
Aucune augmentation du risque de défaut de fermeture du tube neural n’a été identifiée pour des concentrations dans l’eau supérieures à 10 µg.L-1 au Mexique (Brender, Suarez et al., 2006) ou encore dans le cadre d’une étude cas-témoin chinoise, en lien avec une concentration placentaire élevée (> médiane) d’arsenic (Jin, Zhang et al., 2013). En revanche, une autre étude cas-témoin hongroise (9 734 cas vs 5 880 témoins) a montré un excès de risque statistiquement significatif de malformation cardiaque, associé à la consommation d’une eau contenant plus de 10 µg.L-1 pendant la grossesse (OR : 1,41 ; IC 95 % : 1,28-1,56) ; les malformations spécifiques pour lesquelles il existait un excès de risque statistiquement significatif était le défaut de fermeture du canal artériel (OR : 1,81 ; IC 95 % : 1,54-2,11) et les communications interauriculaires (OR : 1,75 ; IC 95 % : 1,54-2,11) (Rudnai, Sándor et al., 2014).
D’autres études semblent mettre en évidence une association entre l’exposition à l’arsenic et le déficit intellectuel des enfants. Ainsi, Wasserman, Liu et al., 2004 ont évalué les fonctions intellectuelles de 201 enfants de 10 ans, dont les parents faisaient partie d’une large cohorte étudiée au Bangladesh (12 000 individus). Une relation-dose réponse inverse a été mise en évidence entre l’exposition à l’arsenic dans l’eau de boisson et les performances intellectuelles évaluées par les auteurs, et ce dès 50 µg.L-1 d’arsenic. von Ehrenstein, Poddar et al., 2007 ont observé une diminution entre 12 et 21 % de ces performances (vocabulaire, associations d’images).
Des difficultés à maintenir l’attention, une altération de la mémoire et une diminution du QI ont aussi été observées chez des enfants exposés via l’eau de boisson (étude transversale de Tsai réalisée à partir de quatre tests neurocomportementaux sur 49 jeunes scolarisés exposés et 60 témoins appariés) (Tsai, Chou et al., 2003, Wang, Wang et al., 2007). La mémoire et l’attention sont altérées lors d’expositions chroniques cumulées à l’arsenic après ajustement en fonction de l’âge et du sexe pour des niveau d’exposition de 250 à 629 ppm. Néanmoins, d’autres études également réalisées au Bangladesh se sont révélées négatives (Tofail, Vahter et al., 2009, Hamadani, Grantham-McGregor et al., 2010). Une revue des effets sur le neurodéveloppement lors d’exposition à de faibles niveaux d’exposition montre que l’étude d’Hamadani, Tofail et al., 2011 qui met en évidence une possible association inverse entre les fonctions cognitives, sur la base du score brut au test verbal à l’âge de 5-11 ans, et l’exposition à l’arsenic urinaire et sanguin est celle qui apporte la meilleure relation quantitative parmi les études menées au Bangladesh (Tsuji, Van Kerkhove et al., 2005). Dans cette analyse, il est précisé que la mise au regard de ces éléments avec les données des Etats Unis conduirait à proposer une dose de référence entre 0,4 et 1 µg.kg-1.j-1.
Une étude semble montrer une immunosuppression chez des enfants exposés in utero, à l’origine d’un développement incomplet du thymus (Raqib, Ahmed et al., 2009).
Plusieurs études de cohorte ont montré un excès de risque d’infections respiratoires et/ou digestives pendant la première année de vie, associé à l’exposition prénatale à l’arsenic, du fait de la consommation par la mère d’une eau contenant une concentration élevée d’arsenic. Dans l’étude de Rahman, Vahter et al., 2011 incluant 1 522 paires mère-enfant, le risque relatif d’infections respiratoires était significativement augmenté dès que la concentration urinaire maternelle d’arsenic dépassait 39 µg.L-1 (Rahman, Vahter et al., 2011). Dans la même étude, le risque de diarrhée pendant la première année de vie n’était significativement augmenté que lorsque la concentration urinaire d’arsenic dépassait 133 µg.L-1 (HAS, 2020).
e
Chez l'animal
Toutes voies
FDTE/VTR Importer Chez l’animal, des effets sur le développement sont principalement mis évidence par inhalation, avec des pertes post-implantatoires et une diminution du nombre de fœtus viables.
Inhalation
FDTE/VTR Importer Dans le cadre d’une étude par inhalation chez la souris (expositions aux dérivés inorganiques de l’arsenic du 9e au 12e jour de la gestation à 0 - 0,2 - 2,2 et 21,6 mg As.m-3 (sous la forme d’As2O3) une augmentation des malformations du squelette et des morts fœtales a été observée à partir de 2,2 mg As.m-3, bien que statistiquement significative qu’à la concentration la plus élevée (Nagymajtenyi, Selypes et al., 1985). La toxicité maternelle n’a pas été examinée. La diminution moyenne du poids des fœtus est de 9,9 % pour les souris exposées à 2,2 mg.m-3 d’arsenic et de 3,7 % pour les souris exposées à 0,26 mg.m-3. Cette diminution du poids des fœtus est statistiquement significative.
Chez le rat, aucune augmentation de la résorption fœtale, de la mortalité fœtale, des malformations ni de diminution du poids de naissance ne sont rapportées pour des expositions pendant 14 jours avant la période d’accouplement puis la gestation (19e jour) à des concentrations comprises entre 0,2 et 8 mg As.m-3. La toxicité maternelle n’a pas été examinée. Cette étude a permis de définir une NOAEC de 7,6 mg As.m-3 pour le développement et une LOAEC de 20 mg As.m-3 (Holson, Stump et al., 1999).
Voie orale
FDTE/VTR Importer Les études, pratiquées chez l’animal, ont montré des effets fœtotoxiques ou faiblement tératogènes des dérivés inorganiques de l’arsenic, lors d’expositions réalisées par ingestion. Des souris exposées pendant la gestation, à des doses de 23-68 mg As.kg-1.j-1 d’arséniate de sodium, présentent une légère augmentation de l’incidence des malformations fœtales, principalement des malformations du squelette (Hood, Thacker et al., 1978, Baxley, Hood et al., 1981). Il n’y a pas d’effet tératogène observé chez les hamsters exposés, par voie orale, aux dérivés inorganiques de l’arsenic à la dose de 14 mg As.kg-1.j-1 sous la forme d’arsénite de sodium (Hood and Harrison, 1982). En revanche, il y a une augmentation de l’incidence de la mortalité fœtale, certainement secondaire à la forte toxicité maternelle (Baxley, Hood et al., 1981, Hood and Harrison, 1982). Plusieurs études, réalisées chez le rat, la souris ou le lapin, par ingestion d’iAs, montrent que l’iAs n’induit pas d’effets toxiques altérant le développement du fœtus, pour des expositions de l’ordre de 4 à 12 mg As.kg-1.j-1. Cependant, des atteintes sont observées aux doses pour lesquelles une toxicité maternelle est rapportée (Nemec, Holson et al., 1998, Stump, Holson et al., 1999, Holson, Stump et al., 2000t).
Il a été clairement montré que les arsénites et les arséniates passent la barrière placentaire et s’avèrent cancérigènes pour la descendance (Waalkes, Ward et al., 2003, Waalkes, Liu et al., 2004, Waalkes, Liu et al., 2004, Waalkes, Ward et al., 2004, Ahlborn, Nelson et al., 2009, Tokar, Diwan et al., 2011, Waalkes, Qu et al., 2014), probablement en liaison avec une perturbation des signaux œstrogéniques (Waalkes, Liu et al., 2006, Waalkes, Liu et al., 2006). L’arséniate de sodium et l’arsénite ont des effets embryo-létaux et un potentiel tératogène chez certaines espèces animales. Plusieurs études montrent différents effets tératogènes sur le neurodéveloppement (Martinez, Kolb et al., 2008, Goggin, Labrecque et al., 2012, Allan, Hafez et al., 2015, Tyler, Hafez et al., 2015), le métabolime (Ditzel, Li et al., 2016), la fontion pulmonaire (Ramsey, Bosco et al., 2013, Ramsey, Foong et al., 2013, Ramsey, Larcombe et al., 2013), ou de reproduction (Rodriguez, Ungewitter et al., 2016).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
VGE/NQE Importer
SANTE HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.

TOXICITE

Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. Contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte. Sauf mention contraire, toutes les données issues des documents référencés dans le tableau ci-dessous ont fait l'objet d'un examen collectif, elles n'ont donc pas fait l'objet de validation supplémentaire.

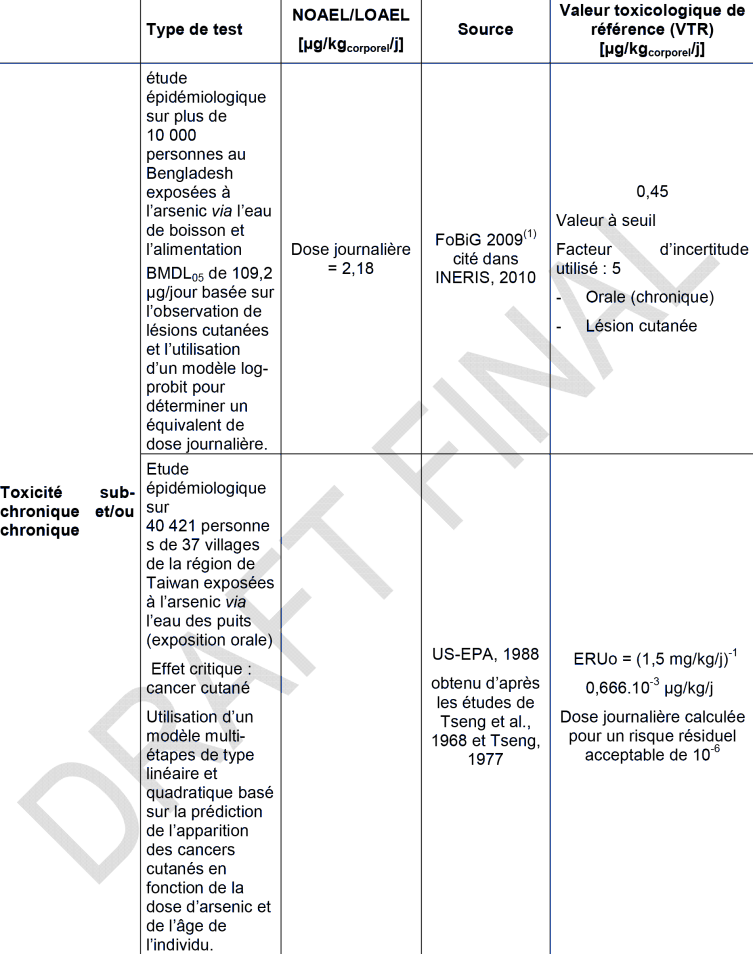
(1) FoBiG : institut de recherche et de conseil pour les substances dangereuses, Allemagne.
La dose provisoire tolérable hebdomadaire (PTWI) de 0,015 mg/kgcorporel d'arsenic inorganique (équivalente à environ 2,1 µg/kgcorporel/j) proposée suite au 33eme meeting des experts de l'OMS sur les contaminants alimentaires qui eu lieu en 1988 a été réévaluée et abandonnée dans le 72eme rapport, des experts de l'OMS sur les contaminants alimentaires (WHO/FAO, 2011).

FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par inhalation :
L'OEHHA propose un REL de 1,5.10-2 µg.m-3 pour une exposition chronique par inhalation (OEHHA, 2008).
Cette valeur est le résultat d’une extrapolation voie à voie, réalisée à partir de la REL déterminée pour la voie orale, décrite ci-après. Pour ce faire, l’OEHHA a pris en compte une absorption de l’arsenic deux fois plus importante par voie respiratoire que par voie orale, un volume inhalé de 9,9 m3 par jour et un poids moyen des enfants de 21,9 kg.
Calcul : (3,5.10-6 mg.kg-1.j-1 x 21,9 kg / 9,9 m3) x 2 = 1,5.10-5 mg.m-3
La REL proposée pour une exposition de 8 heures est définie par l’OEHHA comme la concentration pour laquelle, ou en dessous de laquelle, des effets non cancérigènes ne sont pas attendus, suite à des expositions répétées de 8 heures. Compte tenu de la forte probabilité d’expositions répétées à l’arsenic et de la lente clairance de ce composé, cette REL 8 heures est assimilée à la REL chronique.
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 5.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale à l’arsenic (ATSDR, 2007).
Cette valeur est établie à partir d’une intoxication massive de 220 personnes, ayant consommé de la sauce de soja contaminée par 100 mg.L-1d’arsenic sous forme d’arséniate de calcium (Mizuta, Mizuta et al., 1956). Les doses journalières estimées sont de 3 mg.j-1 soit 0,05 mg.kg-1.j-1, pour une exposition comprise entre 2 et 3 semaines. Les signes cliniques retenus sont l’œdème de la face et les symptômes gastro-intestinaux (nausées, vomissements et diarrhées). De cette étude, un LOAEL de 0,05 mg.kg-1.j-1 est déduit.
Facteurs d’incertitude : un facteur 10 est appliqué pour l’extrapolation à partir d’un LOAEL.
Calcul : 0,05 mg.kg-1.j-1 x 1/10 = 5 10-3 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
La HAS propose une VTR de 0,3 µg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (HAS, 2020).
La HAS propose une valeur construite à partir de l’étude épidémiologique de Xia, Wade et al., 2009, également utilisée par l’EFSA, et conduite en Mogolie intérieure sur une population poids corporel de 70 kg et des apports alimentaires d’arsenic (10-20 µg.j-1), proches de ceux constatés en France. Une BMCL01 (0,3 µg.L-1) et de BMDL01 (0,9 µg.kg pc.-1.j-1) pour la prévalence des lésions cutanées (mélanodermie et hyperkératose).
Facteur d'incertitude : un facteur de 3 a été appliqué pour prendre en compte la variabilité interindividuelle de la sensibilité aux effets toxiques de l’arsenic, bien que plusieurs études sur la relation dose-réponse entre l’exposition à l’arsenic dans l’eau et le risque de développer des lésions cutanées non cancéreuses soient disponibles, aucune d’entre elles n’a été conduite en Europe.
Calcul : 0,9 µg.kg-1.j-1 x 1/3 = 0,3 µg.kg-1.j-1
Indice de confiance : Pas d’indice de confiance
Effets sans seuil - Exposition chronique par inhalation :
Le TCEQ propose un ERUi de 1,5.10-4 (µg.m-3)-1 pour une exposition chronique par inhalation (TECQ, 2012).
Cette valeur a été élaborée sur la base de l’examen du suivi de trois cohortes d’employés de fonderies de cuivre exposés à l’arsenic, à savoir celle de Tacoma (Enterline, Marsh et al., 1987, Enterline, Day et al., 1995), de Montana (Lubin, Pottern et al., 2000, Lubin, Moore et al., 2008), ainsi que celle de Ronnskar en Suède (Jarup, Pershagen et al., 1989). Dans l’analyse de la TCEQ, plusieurs modélisations ont été testées et la plus adaptée aux données de l’étude a été retenue. Un excès de risque unitaire de cancers pulmonaires et respiratoires de 1,5.10-4 (µg.m-3)-1 a été calculé à partir de chacun des risques unitaires des trois cohortes compris entre 1,11 et 2,18 10-4 (µg.m-3)-1, pondérés par l’inverse de la variance pour chacune des valeurs. Ainsi, l’ERU,calculé au moyen d’une analyse combinée basée sur le taux de mortalité par cancer pulmonaire au Texas et la probabilité de survie, est celui qui a été retenu in fine 1,5.10-4 (µg.m-3)-1.
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose un ERUo de 1,5 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale (US EPA (IRIS), 1995).
Cette valeur a été établie à partir du rapport de synthèse réalisé par l’US EPA en 1988. Les études ayant fourni les valeurs pour l’établissement d’une relation dose-effet sont celles de Tseng et al. (1968) et Tseng (1977). L’effet critique retenu est le cancer cutané. Le calcul de risque a été calculé séparément pour les hommes et les femmes en prenant comme hypothèse une exposition dans la population taïwanaise dès la naissance avec une consommation d’eau boisson de 3,5 L.j-1 pour un poids de 55 kg chez les hommes et de 2 L.j-1 pour un poids de 50 kg chez les femmes, puis converti pour la population américaine pour un poids moyen de 70 kg et une consommation de 2 L d’eau par jour. Un modèle multi-étapes de type linéaire et quadratique basé sur la prédiction de l’apparition des cancers cutanés en fonction de la dose et de l’âge a été utilisé.
L’excès de risque unitaire a été estimé entre 1 et 2 10-3, par l’US EPA, qui a proposé une approximation de 1,5.10-3(µg.kg-1.j-1)-1soit 1,5 (mg.kg-1.j-1)-1
L'OEHHA propose un ERUo de 1,5 (mg.kg-1.j-1)-1 pour une exposition chronique par ingestion (OEHHA, 2011).
Cette valeur est similaire à l'ERUo proposé par l'US EPA.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
Seul l’OEHHA (2008) propose une valeur. La REL aiguë est basée sur une étude sur le développement de qualité moyenne en raison de l’absence de précisions sur la toxicité maternelle.
Les études sur le développement ne sont pas vraiment adaptées à la construction d’une VTR aigüe. De plus, il n’a pas été pratiqué d’ajustement pour une exposition continue.
Malgré les effets toxiques aigus (diminution du poids fœtal, retards de croissance intra-utérine et malformations osseuses) démontrés, l’Ineris choisit de ne pas recommander de VTR.
Effets à seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par inhalation la VTR chronique de 1,5.10-2 µg.m-3 de l’OEHHA (2008).
Deux valeurs élaborées par le RIVM (2001) et l’OEHHA (2008) sont disponibles. La Haute Autorité de Santé (HAS) propose une analyse des valeurs existantes (HAS, 2020).
Le RIVM a construit sa VTR à partir d’une LOAEC de 10 µg.m-3 pour des cancers du poumon induits par une exposition par voie pulmonaire à l’arsenic trivalent. Cette valeur est issue d’un document de l’ATSDR (1999), cité par le RIVM, mais sans aucune mention de l’étude source ayant permis d’établir cette valeur. De plus, cette LOAEC de 10 µg.m-3 n’est pas retrouvée dans le rapport de l’ATSDR (2007). Cette valeur n’est donc pas préconisée par l’INERIS.
La valeur proposée par l’OEHHA est une extrapolation à partir de la VTR établie pour la voie orale. La HAS émet des réserves sur l’effet critique retenu (perte de points de QI) par l’OEHHA, qui n’est pas jugé pertinent.
Indice de confiance : Par défaut, la valeur retenue est construite à partir d’une extrapolation voie à voie et en raison des limites sur la qualité de l’effet critique retenu (évaluation du QI peut être soumis à de nombreux biais) rapportés par la HAS.
Effets à seuil - Exposition aiguë par voie orale :
L’ineris propose de retenir pour une exposition aiguë à l’arsenic par voie orale la VTR aiguë de 5.10-3 mg.kg-1.j-1 de l’ATSDR (2007).
Seul l’ATSDR (2007) propose une VTR pour une exposition aiguë par voie orale. Le HAS a évalué cette VTR (HAS, 2020)*.
Cette valeur est établie à partir d’une étude chez l’homme (Mizuta, Mizuta et al., 1956) exposé à l’arsenic via de la sauce soja. Cette étude est de qualité recevable au regard de la date à laquelle elle a été menée. Toutefois, la qualité de la caractérisation des expositions et de la relation dose-effet reste limitée en l’absence de lot témoin.
La construction de la VTR est détaillée et les arguments sont recevables, l’utilisation des facteurs d’incertitude est appropriée compte tenu des données de l’étude clé.
La HAS a considéré cette valeur comme étant peu fiable en raison du choix des effets jugés trop sévères pour être retenus pour caractériser un LOAEL, la qualité plutôt médiocre de la caractérisation des expositions et des relations doses-effets, ainsi que l’absence de facteur d’incertitude supplémentaire pour la variabilité interindividuelle de la sensibilité à l’arsenic.
Cette valeur est retenue par défaut l’Ineris
Indice de confiance : par défaut au regard des limitations de l’étude clé.
*La Haute Autorité de Santé a proposé des recommandations de bonne pratique concernant le dépistage, prise en charge et le suivi des personnes potentiellement surexposées à l’arsenic inorganique du fait de leur lieu de résidence en 2020. Cette proposition repose, en autre, sur l’analyse des VTR disponibles.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic inorganique par voie orale la VTR chronique de 0,3 µg.kg-1.j-1 (HAS, 2020).
Six VTR sont disponibles US EPA (1991), ATSDR (2007), OEHHA, (2008), RIVM (2001), INERIS (2007), FoBiG (2009) et HAS (2020) pour les expositions à l’arsenic.
Les VTR chroniques proposées par l’US EPA et l’ATSDR pour la voie orale sont identiques. Les mêmes études clés (Tseng et al., 1968 ; Tseng, 1977) ont été retenues et le même raisonnement a été suivi. Les études clés présentent des limites notamment en ce qui concerne les durées et niveaux d’exposition et les biais de confusion ne sont donc pas pris en compte (consommation de tabac, consommation d’eau et de nourriture, poids…). Le choix de l’effet critique « maladie des pieds noirs », d’une hyper-pigmentation et d’une kératose est cohérent au regard du profil toxicologique. Le NOAEL dans l’eau de boisson de 9 µg.L-1 retenu par ces organismes résulte de la moyenne arithmétique des concentrations d’arsenic présent dans les bas-fonds. Cette concentration est en réalité comprise entre 1 et 17 µg.L-1. En toute rigueur, si aucun effet (hyperpigmentation, kératose et « maladie des pieds noirs ») n’a été observé à ces concentrations, un NOAEL de 17 µg.L-1 aurait dû être retenu. Toutefois, ceci n’influence que très peu la valeur finale de la VTR, une valeur de 4,6.10-4 mg.kg-1.j-1 aurait été calculée au lieu de 3.10-4 mg.kg-1.j-1. De plus, dans les études retenues (Tseng et al., 1968 et Tseng, 1977), la population est jeune alors que l’incidence des lésions cutanées augmente avec l’âge des individus. Enfin, des incertitudes relatives au choix des facteurs à prendre en compte, pour extrapoler l’apport en arsenic à partir de la concentration dans l’eau de boisson (consommation journalière, poids moyen et apport en arsenic par la nourriture), existent.
La valeur établie par le RIVM est basée sur la TDI provisoire proposée par l’OMS en 1996, sans aucune mention des études sources. Or, dans son rapport de 2017, l’OMS ne propose plus de TDI pour l’arsenic compte tenu des difficultés d’extrapolation d’une valeur à partir des données épidémiologiques disponibles. Dans ces conditions la valeur du RIVM n’est pas retenue.
L’OEHHA a élaboré (2008) une nouvelle valeur, à partir des études épidémiologiques de Wasserman, Liu et al., 2004 et Tsai, Chou et al., 2003. Ces auteurs rapportent une diminution des capacités intellectuelles et des effets néfastes sur le comportement chez 200 enfants âgés de 10 ans, exposés depuis leur naissance via l’eau de boisson à 2,3 µg As.L-1, équivalent à l’ingestion de 2,3 µg As par jour. D’une manière générale, ces effets apparaissent pour des doses très faibles, inférieures à celles entrainant des effets cutanés. Ces deux études sont de bonne qualité. Les effets retenus sont pertinents au regard du profil toxicologique de la substance.
L’INERIS a, pour sa part, élaboré une VTR en 2007, à partir d’une étude épidémiologique plus récente, celle de Rahman, Vahter et al., 2006, dans laquelle les lésions cutanées (hyper et hypopigmentations, kératoses) sont observées pour des doses supérieures à 0,7 µg.kg-1.j-1. Cependant, l’apport en arsenic via la nourriture n’ayant pas été pris en compte par les auteurs, la VTR construite à partir de cette étude ne sera pas retenue.
Les chercheurs du FoBiG ont quant à eux dérivés leur TDI à partir d’une étude transversale de plus de 10 000 personnes (Ahsan, Chen et al., 2006), dans laquelle les différences de lésions cutanées observées, en fonction du sexe et du statut nutritionnel, ont été prises en compte dans l’élaboration de la relation dose/réponse. Une BMDL05 a été calculée et prise comme point de départ à l’élaboration de la VTR. Le choix de cette BMDL05 (et non de BMDL01) a nécessité un facteur d’ajustement supplémentaire de 5.
La HAS a construit une valeur sur un schéma proche de celui du FoBig en retenant les effets cutanés non cancéreux comme effets critiques de l’étude de Xia, Wade et al., 2009. Cette étude conduite sur une population de 12 000 personnes en Mongolie est de qualité recevable. La HAS a retenu dans sa construction la BMDL01 sur la base des calculs établis par l’EFSA (2009) à laquelle elle a appliqué un facteur d’ajustement pour prendre en compte la variabilité interindividuelle. Cette démarche apparait pertinente.
Les démarches du FoBig et de la HAS sont relativement similaires et aboutissent à des valeurs proches qui semblent les plus solides et robustes de toutes les VTR disponibles. De plus, la valeur proposée par la HAS est identique à celles calculées par l’US EPA et l’ATSDR avec une construction différente.
L’INERIS propose de retenir la valeur de la HAS pour des expositions chroniques par voie orale.
Indice de confiance : moyen compte tenu des limites de la construction et notamment la qualification des lésions observées.
Effets sans seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par inhalation la VTR chronique de 1,5.10-4 (µg.m-3)-1 du TCEQ (2012).
Quatre valeurs sont disponibles US EPA (1995), Santé Canada (2010), OEHHA (2011) et TCEQ (2012). Dans leur choix de VTR, l’ANSES recommande d’utiliser la valeur développée par le TCEQ (Anses, 2015) et le HAS celle de l’OEHHA (HAS, 2020).
Dans le cas de la voie respiratoire, la méthode de construction utilisée par Santé Canada pour l’établissement de sa VTR n’est pas décrite en détail. Il est donc préférable de ne pas la retenir.
L’ensemble des données épidémiologiques montre une relation entre la mortalité due aux cancers du poumon et/ou des voies respiratoires et l’exposition à l’arsenic. L’US EPA retient six études réalisées dans des fonderies situées aux Etats-Unis et l’OEHHA retient une étude menée sur 8 fonderies différentes, également localisées aux Etats-Unis. Les fonderies étudiées aux Etats-Unis sont souvent les mêmes.
L’excès de risque unitaire recommandée par l’US EPA est déterminée à partir d'études où les niveaux de concentrations d'arsenic sont estimés (élevés, moyens ou faibles). Une moyenne géométrique a ensuite été réalisée pour déterminer l’excès de risque final. La valeur du TCEQ est construite à partir des mêmes cohortes (américaines) que celle de l’US EPA mais prend en compte les résultats de réévaluations et ceux d’une méta-analyse. Cependant, la population de référence (concernant le taux de mortalité par cancer pulmonaire et la probabilité de survie) dans ce calcul est la population du Texas du fait de l’établissement d’une valeur pour cet état.
La VTR proposée par l’OEHHA est fondée sur une étude qui analyse de la même façon les données des 8 fonderies, mais ne prend en compte que les résultats d’une seule fonderie parmi ceux-ci. L’OEHHA a ajusté sa valeur sur le tabagisme.
La HAS a retenu la valeur de l’OEHHA qui correspond à une des propositions les plus récentes et qui selon lui est la seule ajustée sur le tabagisme, cependant les valeurs construites par Santé Canada, l’OEHHA et le TCEQ sont basées sur les mêmes cohortes.
Les trois méthodes sont acceptables et l’INERIS préconise de retenir la VTR du TCEQ retenue par l’Anses qui est issue des données épidémiologiques les plus récentes sur ces cohortes.
Il est toutefois intéressant d’indiquer que les VTR élaborées par l’OEHHA et par l’US EPA sont très proches, du fait de la prise en compte des mêmes cohortes initiales.
Indice de confiance : moyen en l’absence d’ajustement de la prise en compte du tabagisme dans toutes les études
Cette valeur ERUi correspond à une concentration de 6,6.10-2 µg.m-3 pour un excès de risque de 10-5 et de 6,6.10-3 µg.m-3 pour 10-6.
Effets sans seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique à l’arsenic par voie orale la VTR chronique de 1,5 (mg.kg-1.j-1)-1de l’US EPA (1995).
Trois organismes proposent des valeurs, l’US EPA (1995), l’OEHHA (2011) et Santé Canada (2010). Le HAS a réalisé une analyse des données existantes (HAS, 2020).
L’US EPA et l’OEHHA et proposent le même ERUo de 1,5 (mg.kg-1.j-1)-1.
La valeur établie par Santé Canada présente des contradictions entre le texte explicatif et le tableau de valeurs utilisé. Ainsi, Santé Canada précise que le potentiel cancérigène de l’arsenic est 10 fois supérieur chez l’homme par rapport à la femme, mais que l’impact de l’âge sur ce potentiel est plus grand chez la femme. Ainsi, les TD0,05 sont similaires chez la femme et chez l’homme car les deux éléments se compenseraient. Mais, lorsque l’on regarde le tableau des valeurs, il apparaît que la femme est plus sensible que l’homme.
L’INERIS préconise donc de retenir les valeurs de l’OEHHA et de l’US EPA, même si la consommation d’eau journalière chez la population taïwanaise prise en compte n’est pas la même pour l’élaboration de la VTR pour les effets à seuil et pour les effets sans seuil.
Cette valeur de 1,5 (mg.kg-1.j-1)-1 a également été retenue par la HAS dans son rapport de 2020. Cette valeur d’ERUo correspond à une dose de 6,66.10-6 mg.kg-1.j-1 pour un excès de risque de 10-5 et 6,66.10-7 mg.kg-1.j-1 pour un excès de risque de 10-6.
Indice de confiance : moyen en raison du choix des études qui présentent des limites.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L'OEHHA propose un REL de 0,2 µg.m-3 pour une exposition d’une heure par inhalation (OEHHA, 2008).
Cette valeur est issue d'une étude expérimentale chez des souris gestantes exposées à l'arsenic (As2O3) entre les jours 9 et 12 de gestation (4 h par jour), à des concentrations de 0 - 0,26 - 2,9 - 28,5 mg As2O3.m-3 (0 - 0,2 - 2,2 - 21,6 mg As.m-3) (Nagymajtenyi, Selypes et al., 1985). Une LOAEC de 0,2 mg As.m-3 a été établie pour les effets tératogènes : diminution du poids fœtal, retards de croissance intra-utérine et malformations osseuses.
Facteur d'incertitude : un facteur 10 est appliqué pour l'utilisation d'une LOAEC, un facteur 10 pour l'extrapolation des données animales à l'homme (variabilité interspécifique) et un facteur 10 pour la variabilité au sein de la population (variabilité intraspécifique).
Calcul : 0,2 mg.m-3 x 1/1000 = 2.10-4 mg.m-3
Indice de confiance : L’OEHHA ne propose pas d’indice de confiance
Effets à seuil - Exposition chronique par inhalation :
Le RIVM propose une TCA de 1 µg.m-3 pour une exposition chronique par inhalation (Baars, Theelen et al., 2001).
Les composés inorganiques de l'arsenic trivalent présentent un potentiel cancérigène chez l'homme après inhalation (ATSDR, 2000). Cependant, le RIVM indique que le mécanisme d'induction des tumeurs n'est pas génotoxique et qu'il existe donc un seuil pour cet effet (Baars et al., 2001). Le RIVM a donc établi une TCA et non une valeur de risque pour le cancer. La LOAEC pour le cancer du poumon est de 10 µg.m-3 (ATSDR, 2000) et a servi à calculer la valeur de TCA.
Note : cette valeur est aussi protectrice pour les effets cancérigènes.
Facteur d'incertitude : un facteur 10 est appliqué pour tenir compte de la variabilité au sein de la population humaine.
Calcul : 10 µg.m-3 x 1/10 = 1 µg.m-3
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
Effets à seuil - Exposition chronique par voie orale :
INERIS propose une TDI de 7.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (2007).
L’étude retenue pour la construction de la VTR est celle de Rahman, Vahter et al., 2006, au cours de laquelle des lésions cutanées (hyper et hypopigmentations, kératoses) apparaissent pour des doses supérieures à 0,7 µg.kg-1.j-1.
Pour chaque sexe, une relation dose-réponse significative entre l’exposition moyenne ou cumulée en arsenic et le risque de développer des lésions cutanées a été mise en évidence, la catégorie d’exposition la plus faible étant utilisée comme témoin. Les hommes présentent un risque accru ; à la plus forte d’exposition, les odd ratio sont de 9,56 (IC 95 % : 4,20-21,8) pour les hommes et de 6,88 (IC 95 % : 3,06-15,5) pour les femmes.
Le LOAEL, déterminé à partir de ces résultats, est de 10 µg.L-1. Par extrapolation, le NOAEL étant strictement inférieur à 10 µg.L-1, pourrait être fixé à 9 µg/L, puisque le groupe exposé à une concentration inférieure à 10 µg.L-1 ne présente pas d’augmentation significative des symptômes. Il faut noter que l’apport en arsenic via la nourriture n’a pas été pris en compte par les auteurs de cette étude.
NOAEL lésions cutanées= 9 µg.L-1 soit 0,7 µg.kg-1.j-1*
* hypothèses de calcul : poids moyen des habitants 50 kg, consommation moyenne d’eau 4 L par jour (Rahman et al., 2003 )
Facteur d’incertitude : un facteur de 10 a été appliqué pour couvrir la variabilité au sein de la population humaine, des plus jeunes aux personnes âgées.
Calcul : 0,7 µg.kg-1.j-1 x 1/10 = 0,07 µg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
L’US EPA (IRIS) propose une RfD de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’iAs (US EPA (IRIS), 1991).
Cette valeur a été établie à partir de deux études épidémiologiques (Tseng, Chu et al., 1968, Tseng, 1977) prenant en compte la survenue de la « maladie des pieds noirs », d’une hyper-pigmentation et d’une kératose, dès la plus faible dose d’exposition rapportée par Tseng, 1977 soit 0,17 mg.L-1, qui correspond donc à un LOAEL. La population témoin de l’étude de Tseng, Chu et al., 1968 ne présente aucune lésion cutanée, suite à une exposition à 0,009 mg.L-1 d’arsenic dans l’eau de boisson : cette valeur est donc considérée comme un NOAEL. Toutefois, pour tenir compte de l’apport en arsenic via la nourriture supplémentaire, ces doses vont être ajustées avec la prise en compte de la consommation moyenne d’eau journalière (4,5 L), de l’apport en arsenic via la nourriture (2 µg/jour) et du poids moyen des habitants de cette région (55 kg). Les valeurs de ces paramètres ont été déterminées par Abernathy, Marcus et al., 1989. Les doses ajustées sont donc de :
NOAELaj = 0,009 mg.L-1 x 4,5 L.j-1 + 2 µg.j-1 x 1/55 kg = 0,0008 mg.kg-1.j-1
LOAELaj = 0,17 mg.L-1 x 4,5 L.j-1 + 2 µg.j-1 x 1/55 kg = 0,014 mg.kg-1.j-1
Facteurs d’incertitude : un facteur de 3 prend en compte à la fois l’absence de données concernant la reproduction et les variations intra-espèces.
Calcul : 0,0008 mg.kg-1.j-1 x 1/3 = 3.10-4 mg.kg-1.j-1
Indice de confiance : moyen par rapport à l’étude source, la base de données et l’élaboration de la valeur.
L’ATSDR propose un MRL de 3.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale (ATSDR, 2007).
Cette valeur est établie à partir des mêmes études que la RfD de l’US EPA (IRIS) (Tseng, Chu et al., 1968, Tseng, 1977) et pour les mêmes effets critiques.
Facteurs d’incertitude : un facteur de 3 tient compte de la variabilité intra-espèce.
Calcul : 0,0008 mg.kg-1.j-1 x 1/3 = 3.10-4 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Le RIVM propose une TDI de 10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
D’après le RIVM, l’iAs altère l’ADN par un mécanisme non génotoxique qui peut être un effet clastogène. Selon cet organisme, il existerait donc un consensus général admettant que l’action cancérigène de l’iAs serait basée sur un mécanisme non génotoxique. Une VTR à seuil devrait donc être proposée pour les effets cancérigènes de l’arsenic.
La TDI proposée par le RIVM a été établie à partir de la TDI provisoire de 2,1.10-3 mg.kg-1.j-1 proposée par l’OMS en 1996. Cette valeur a été évaluée par le comité JECFA (Joint FAO/WHO Expert Committe on Food additives) en 1983 et confirmée par le même comité en 1988.
Facteur d'incertitude : un facteur 2 est appliqué pour tenir compte des incertitudes liées aux études épidémiologiques.
Calcul : 2,1 µg.kg-1.j-1 x 1/2 = 1 µg.kg-1.j-1
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
L'OEHHA propose un REL de 3,5.10-6 mg.kg-1.j-1 pour une exposition chronique par voie orale (OEHHA, 2008) .
Cette valeur est construite à partir des études épidémiologiques de Wasserman, Liu et al., 2004 et Tsai, Chou et al., 2003. Les auteurs rapportent une diminution des capacités intellectuelles et des effets néfastes sur le comportement chez 200 enfants âgés de 10 ans, exposés depuis leur naissance via l’eau de boisson à 2,3 µg As.L-1, équivalent à l’ingestion de 2,3 µg As par jour.
Facteur d'incertitude : un facteur 3 est appliqué pour l'utilisation d'un LOAEL et un facteur 10 pour la variabilité au sein de la population (variabilité intra-spécifique).
Calcul : 2,3 µg.j-1 x 1/30 = 0,076 µg.j-1
Partant de l’hypothèse que les enfants de 10 ans pèsent en moyenne 21,9 kg, le REL pour la voie orale est déterminé selon le calcul suivant :
REL = 0,076 µg.j-1 / 21,9 kg = 3,5.10-3 µg.kg-1.j-1 soit 3,5.10-6 mg.kg-1.j-1
FoBiG propose une TDI de 45.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’arsenic (2009).
Cette valeur a été construite à partir des lésions cutanées observées dans une étude transversale réalisée sur plus de 10 000 personnes au Bangladesh (Ahsan, Chen et al., 2006). Les hommes ont été considérés comme le sous-groupe le plus sensible car ils présentaient la prévalence de lésions cutanées la plus importante. Une BMDL05 de 109,2 µg par jour a été déterminée, en utilisant un modèle log-probit, par Schuhmacher-Wolz, Dieter et al., 2009, équivalent à une dose journalière de 2,18 µg.kg-1.j-1.
Facteur d'incertitude : un facteur 5 est utilisé pour établir la TDI de l’iAs à partir de l’ensemble des sources de contamination (eau de boisson et alimentation) été appliqué car la BMDL a été déterminée pour un effet de 5 %. Aucun facteur d’extrapolation intra-espèce n’est pris en compte car l’étude inclut plus de 10 000 personnes et, l’évaluation est basée sur la population la plus sensible (les hommes).
Calcul : 2,18 µg.kg-1.j-1 x 1/5 = 0,44 µg.kg-1.j-1 arrondi à 0,45 µg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
L’EFSA ne construit pas de VTR mais propose le calcul de marges d’exposition à partir des BMCL01 et BMDL01 (EFSA, 2009).
Dans son analyse, l’EFSA a élaboré des BMCL01 et BMDL01 à partir des données de deux études ciblant la prévalence des effets cutanés.
La première étude est celle d’Ahsan, 2006 #652}, impliquant plus de 10 000 personnes, et également retenue par le FoBig. L’odds ratio était statistiquement augmenté dès le 2ème quintile (8,1-40 µg. L-1), même après ajustement sur les principaux facteurs de confusion (OR : 1,91 ; IC 95 % : 1,26-2,89) ; les OR des 3 ème (40,1-91 µg.L-1), 4 ème (91,1-175 µg.L-1) et 5 ème quintiles (> 175 µg.L-1) étaient respectivement de 3,03 (2,05-4,50), 3,71 (2,53-5,44) et 5,39 (3,69-7,86). La concentration dans l’eau correspondant à un excès de risque de 1 % de lésions cutanées non cancéreuses (BMC01) était de 26,47 µg. L-1 et la limite inférieure de son intervalle de confiance (BMCL01) de 22,92 µg. L-1. De cette BMCL01, l’EFSA a déduit une BMDL01, de 2,2 à 5,7 µg.kg-1 pc-1.j-1, compte tenu d’une consommation d’eau de 3 à 5 L.j-1 et d’un apport alimentaire d’iAs de 50 à 200 µg.j-1, chez des individus adultes d’un poids moyen de 55 kg.
La seconde étude, Xia, Wade et al., 2009, conduite en Mongolie intérieure, la prévalence des lésions d’hyperkératose et de mélanodermie était significativement augmentée aux concentrations supérieures et le risque augmentait avec la concentration. À partir de ces données, l’EFSA a calculé une BMC01 et une BMCL01 de respectivement 0,56 et 0,31 µg.L-1, dont une BMDL01 de 0,93 à 3,7 µg.kg pc-1.j-1 a été déduite, compte tenu d’une consommation d’eau de 1 à 2 L par jour et d’un apport alimentaire d’iAs de 10 à 20 µg.j-1, chez des individus adultes d’un poids moyen de 70 kg.
L’EFSA n’a pas dérivé de VTR à partir de ces BMC et BMD, indiquant qu’il lui semble plus approprié de calculer, pour les individus ou les populations exposées, une marge d’exposition, dans la mesure où il est incertain que les effets considérés comme à seuil de dose (en particulier, certains des effets cutanés dont l’hyperkératose disséminée) le soient réellement. Dans cette optique, l’Efsa :
ne distingue pas les effets cancérogènes des autres effets et propose également des BMC et BMD pour ce type d’effet ;
recommande pour l’évaluation de cette marge d’exposition d’utiliser les évaluations les plus faibles de BMCL01 et BMDL01, ainsi que les estimations d’exposition les plus fortes.
Effets sans seuil - Exposition chronique par inhalation :
L’US EPA (IRIS) propose une ERUi de 4,3.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (US EPA (IRIS), 1995)
Cette valeur a été établie en prenant en compte l’apparition des cancers pulmonaires dans des études réalisées en milieu professionnel et portant sur deux cohortes d’employés de fonderies de cuivre (Enterline and Marsh, 1982, Lee-Feldstein, 1983, Higgins, Oh et al., 1986). Il s’agit d’une moyenne géométrique calculée de 4,3.10-3 (µg.m-3)-1 à partir de deux moyennes géométriques de 2,6.10-3 (µg.m-3)-1 dans la première cohorte (trois séries de données) et 7,2.10-3 (µg.m-3)-1 dans la seconde cohorte (à partir de deux séries de données). L’US EPA précise que cet ERUi n’est applicable que pour des concentrations atmosphériques inférieures à 2 µg.m3 ; cet avertissement n’est pas justifié dans les documents accessibles.
L’OMS propose une ERUi (valeur guide) de 1,5.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (OMS, 2000)
A partir des mêmes cohortes que celles retenues par l’US EPA, l’OMS a calculé un excès de risque unitaire de cancer broncho-pulmonaire de 1,43.10-3 (µg.m-3)-1. La méthode de calcul n’est pas clairement décrite.
Santé Canada propose un ERUi de 6,4.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation (Santé Canada, 2021).
Cette valeur a été établie à partir d’une étude réalisée chez des travailleurs exposés à des concentrations atmosphériques d'arsenic inorganique dans des fonderies de cuivre (Higgins et al., 1986). Cette étude, qui a montré une association entre l'exposition aux vapeurs d'arsenic et les cancers pulmonaires, a fourni des données suffisantes sur l'exposition des travailleurs pour établir une relation dose-effet servant à estimer la concentration induisant une augmentation de l'incidence des cancers de l'ordre de 5 % (CT0,05 = 7,83 µg.m-3). L’excès de risque unitaire en est alors déduit.
L'OEHHA propose un ERUi de 3,3.10-3 (µg.m-3)-1 pour une exposition par inhalation (OEHHA, 2011).
Cette valeur a été estimée à partir de trois études épidémiologiques portant sur la mortalité par cancer des poumons chez des travailleurs exposés à l'arsenic (Higgins, Oh et al., 1986, Lee-Feldstein, 1986, Enterline, Marsh et al., 1987). Les données de ces trois études ont été, dans un premier temps, intégrées dans un modèle linéaire. Dans ce modèle, les doses d’arsenic sont considérées comme cumulatives et il est émis l’hypothèse que le mécanisme d’action est sans seuil.
Afin de calculer l’excès de risque unitaire, l’intervalle de confiance à 95 % de la pente établie à partir des 4 groupes d’exposition à l’arsenic les plus faibles provenant de l’étude d’Enterline et al. (1987) a été choisi par l’OEHHA. Cette estimation a été considérée comme étant la plus vraisemblable. Dans ce présent rapport, seule l’étude d’Enterline et al. (1987) a été détaillée car la VTR proposée par l’OEHHA a été uniquement établie à partir des données de cette étude.
L’excès de risque final a été proposé après avoir réalisé un ajustement en fonction de la consommation de tabac en raison de la forte interaction entre l'exposition à l'arsenic et la consommation de tabac dans certaines cohortes. L’excès de risque unitaire de 3,3.10-3 (µg.m-3)-1 a été ainsi recommandé par l’OEHHA.
Effets sans seuil - Exposition chronique par voie orale :
Santé Canada propose une CERUo de 1,8.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (Santé Canada, 2021).
Cette valeur a été établie à partir de l’étude épidémiologique de Morales et al. (2000), elle-même basée sur celles de Chen et al., 1985 et de Wu et al., 1989. Les populations sont exposées par voie orale via l’eau potable. L’effet critique retenu est le cancer de la vessie, des poumons et du foie. Sur la base d’une augmentation de 1 % du risque, l’étendue des CERU associées à l’ingestion de 1 µg.L-1 d’arsenic dans l’eau de boisson est 3,06.10-6 à 3,85.10-5 (µg.L-1)-1.
La VTR est basée sur l’estimation de la limite supérieure des CERU dans l’eau potable CERUeau = 3,85.10-5 (µg.L-1)-1 :
CERUo = CERUeau x pcadulte x FC/TIeau = 1,8 (mg.kg-1.j-1)-1
Ou : pcadulte =70kg, TIeau = 1,5 L.j-1 et FC = 1 000 µg.mg-1
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
Ambient water quality criteria for arsenic (US-EPA, 1984b) Health Assessment Document for Inorganic Arsenic (US-EPA, 1984a) Preconsultation report: Proposed EQS for Water Framework Directive Annex
VIII substances: arsenic (total dissolved) (Lepper et al., 2007)
Maximum Permissible Concentrations and Negligible Concentrations for metals, taking background concentrations into account (RIVM, 1997) Integrated criteria document arsenicum effects (RIVM, 1990)
Effets endocriniens :
L'arsenic et ses dérivés ne sont pas cités dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Critères PBT / POP :
La substance n’est pas concernée par les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
Normes de qualité existantes (ETOX,20133) :
Etats-Unis : Critère de qualité pour les organismes aquatiques, eau douce = 48 μg.L-1, eau marine = 13 μg.L-1.
Substances associées :
Canada : Critère de qualité organismes aquatiques (arsenic total), eau douce = 5 μg.L-1
Eau de mer = 12,5 μg.L-1
Critère de qualité pour l’eau de boisson (IMAC) (arsenic total) = 25 μg.L-1
Suisse : Norme de qualité pour les hydrosystèmes, (projet) (arsenic dissous) = 10 μg.L-1
Allemagne : Norme de protection, matière en suspension, 40 mg/kg de poids sec
Angleterre : Norme de qualité des eaux douces (arsenic dissous) : 50 μg.L-1
Proposition d’EQS eau douce (arsenic dissous, en concentration ajoutée à la concentration de fond4) : 0,5 μg.L-1
Norme de qualité des eaux marines (arsenic dissous) : 25 μg.L-1
-
Etats-Unis : Critère de qualité pour les organismes aquatiques, eau douce = 190 μg.L-1, pour les organismes aquatiques marins = 36 μg.L-1
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[3] Les données issues de cette source (http://webetox.uba.de/webETOX/index.do) ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS.
[4] La concentration de fond correspond à la concentration en substance non reliée aux émissions d'un site. Elle est décrite comme d'origine environnementale et/ou anthropique.
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
Sauf mention contraire, toutes les données issues des documents référencés sous «(Lepper et al., 2007) » « RIVM, 1997« et « US-EPA, 1984b » ont fait l'objet d'un examen collectif, elles n'ont donc pas fait l'objet de validation supplémentaire.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
Les tableaux ci-dessous répertorient les données d'écotoxicité jugées pertinentes pour notre étude. Les concentrations sont indiquées en concentration d'arsenic, la spéciation est précisée à chaque fois que l'information est disponible.
ECOTOXICITE AQUATIQUE AIGUË
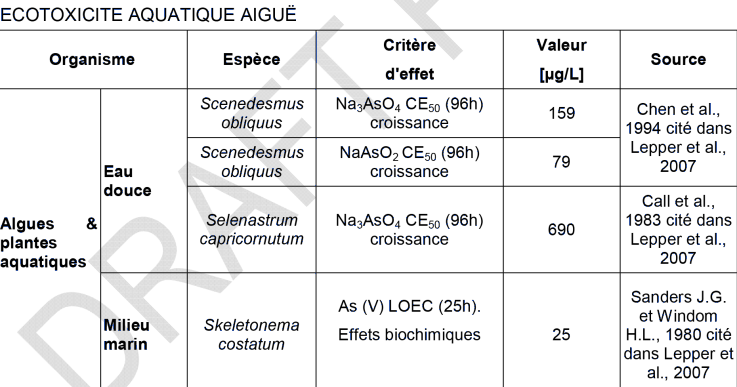
![]()

[7] Il n'a pas été possible de vérifier cette donnée issue du résumé d'une publication rédigée en chinois. Elle ne sera pas utilisée dans les calculs mais est citée à titre d'information en tant que donnée la plus basse reportée.
[8] Nouveau nom de Chironomus tentans
[9] Plus précisément les poissons utilisés pour l'essai sont au stade « fingerling ». C'est-à-dire qu'ils ont développé récemment des écailles et des branchies fonctionnelles. Cela correspond généralement à un poisson de 9 à 12 mois ayant la taille d'un doigt.
ECOTOXICITE AQUATIQUE CHRONIQUE

[10] Les concentrations utilisées lors des essais ne sont pas toutes présentées dans le document. Le pas entre les NOEC et les LOEC est donc inconnu. Ces valeurs ne sont pas utilisées pour les calculs mais sont présentées dans ce tableau à titre d'information.
[11] Il n'a pas été possible de vérifier si la NOEC est liée à un essai ayant enregistré un résultat positif ou si elle correspond à la plus haute concentration testée.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
ECOTOXICITE POUR LES VERTÉBRÉS TERRESTRES

(1) NOAEL : No Observed Adverse Effect Level
TOXICITE ORALE POUR LES OISEAUX
Un essai présentant une LOEC et une NOEC est présenté mais la publication porte sur une exposition conjointe à l'arsenic et au sélénium. Il est résumé dans le tableau suivant.

(1) NOAEL : No Observed Adverse Effect Level; LOAEL : Lowest Observed Adverse Effect Level


Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITÉ POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011).
L'examen du jeu de donnée n'a pas permis de dégager une sensibilité particulière des organismes à un état d'oxydation ou à un paramètre environnemental. Conformément aux recommandations pour prendre en compte la biodisponibilité des métaux du guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), l'évaluation prend en compte la fraction dissoute du composé et considèrera les approches par facteur d'extrapolation, statistiques ou par coefficient de partition pour calculer les normes de qualité.
La valeur du facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), pour les métaux, les données de toxicité en eau douce et eau de mer doivent être séparées a priori. Ceci est expliqué par la différence de toxicité attendue sur
les espèces dulçaquicoles ou marines en raison de la différence dans la spéciation des métaux et leur biodisponibilité ainsi que des capacités d'(osmo)régulation des espèces. Les données ne peuvent être combinées que si l'absence de différences est démontrée ou si la biodisponibilité est prise en compte par ailleurs.
[12] Valeur calculée. Dans le document de proposition d'EQS de Lepper et al. (2007), cette CE10 de 6 µg.L-1 est calculée depuis les concentrations présentées dans la figure 2A de l'étude de Garman et al. (1997) en utilisant le logiciel ToxRat®. Cette valeur est ensuite utilisée pour calculer l'AA-QSmarine_eco de 0,6 µg.L-1
Le facteur d'extrapolation appliqué pour déterminer la AA-QSmarine_eco doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons spécifiques marins et une diversité d'espèces plus complexe en milieu marin.
Moyenne annuelle (AA-QSwater_eco et AA-QSmarine_eco) :
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
L'examen des données disponibles n'a pas permis de déterminer une différence entre les résultats des essais long terme réalisés avec des formes trivalentes et pentavalentes de l'arsenic. Il n'est donc pas justifié de les différentier selon le critère de la spéciation. Un test de Mann-Whitney sur XLStat 2007 a été réalisé sur les jeux de données long terme retenus en eau douce et en eau marine. Ce test a permis de vérifier qu'il n'y avait pas de différence significative entre les résultats d'essai en eau douce et en eau de mer, en conséquence, un jeu de données unique peut être considéré pour le calcul de la AA-QSwater_eco et AA-QSmarine_eco.
Le guide technique européen pour la détermination des normes de qualité environnementale permet d'évaluer l'AA-QSwater_eco et l' AA-QSmarine_eco selon une approche d'extrapolation statistique si le jeu de données remplit certains critères. En ce qui concerne l'arsenic, le jeu de donnée n'est pas optimal pour utiliser la méthode d'extrapolation statistique, une valeur long terme « insecte » et une valeur long terme sur -par exemple -des amphibiens sont manquantes. Toutefois, pour les insectes, les détails d'un essai d'écotoxicité réalisé sur la larve de moustique (Liber et al., 2011) exposée à du sédiment contaminé fournissent les concentrations en arsenic mesurées dans l'eau interstitielle et dans la colonne d'eau. Ces concentrations sont très différentes et il est difficile de déterminer la contribution de l'eau interstitielle (NOEC correspond à 420 µg.L-1) et de la colonne d'eau (NOEC correspond à 10 µg.L-1) pour ces organismes benthiques. Afin d'adopter une démarche protectrice, la concentration équivalente dans l'eau qui sera utilisée pour le taxon des insectes sera la concentration de 10 µg.L-1 . Bien qu'il manque encore une donnée sur un taxon supplémentaire (les amphibiens par exemple), la distribution des espèces (SSWD, Species Sensitivity Weighted Distribution) (Duboudin et al., 2004) est réalisée pour obtenir l'HC5, la concentration supposée sans effet néfaste sur 95% des espèces aquatiques.
La valeur suivante a été calculée à l'aide des données aquatiques d'eau douce et d'eau marine présentées dans le chapitre « ECOTOXICITE AQUATIQUE CHRONIQUE ».
![]()
![]()
Cette courbe permet de visualiser une certaine sensibilité à l'arsenic et ses dérivés inorganiques des insectes, des échinodermes, des algues et des invertébrés par rapport aux poissons.
Pour l'arsenic et ses dérivés inorganiques, il a été décidé d'utiliser le résultat de la dérivation statistique des données d'écotoxicologie pour calculer l'AA-QSwater_eco et l' AA-QSmarine_eco. Afin de tenir compte de l'absence de donnée sur un taxon supplémentaire (par exemple les amphibiens), le facteur d'extrapolation maximum de 5 recommandé par le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) sera appliqué à la HC5 obtenue. Pour l'AA-QSwater_eco l'INERIS propose donc la valeur suivante :
![]()
L'AA-QSwater_eco calculée est inférieure au 90% centile dans l'eau de la base de données FOREGS13 (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
[13] Disponible à cette adresse : http://weppi.gtk.fi/publ/foregsatlas/article.php?id=15
Pour l'AA-QSmarine_eco l'INERIS propose la valeur suivante :
![]()
Bien que la valeur de concentration naturelle ne soit pas disponible pour l'eau marine, les mêmes précautions au moment de la mise en œuvre de cette valeur seuil sont recommandées pour l'eau de mer.
Concentration Maximum Acceptable (MAC)
L'examen des données disponibles n'a pas permis de déterminer une différence entre les résultats des essais court terme réalisés avec des formes trivalentes et pentavalentes de l'arsenic. Il n'est donc pas justifié de les différentier selon le critère de la spéciation.
Un test de Mann-Whitney sur XLStat 2007 a été réalisé sur les jeux de données court terme retenus en eau douce et en eau marine. Ce test montre qu'il n'y avait pas de différence significative entre les résultats d'essai d'écotoxicité aigüe en eau douce et en eau de mer. En conséquence, un jeu de données unique peut être considéré pour le calcul de la MAC et de la MACmarine.
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
L'invertébré marin Tigriopus brevicornis apparait comme l'espèce la plus sensible parmi les essais validés en exposition aigue avec une CL50 de 11 µg.L-1 (Forget et al., 1998). Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 peut être appliqué sur cette valeur puisque des données sont disponibles pour chaque niveau trophique (poissons, microcrustacés et algues), et que les espèces représentatives des taxons jugés le plus sensibles (ici les algues et les invertébrés) sont représentés.
L'INERIS propose donc la valeur suivante :
![]()
La valeur obtenue pour la MAC est légèrement inférieure à la valeur obtenue pour l'AA-QSwater_eco. La MAC sera donc considérée comme égale à l'AA-QSwater_eco c'est-à-dire :
![]()
![]()
La MAC calculée est du même ordre de grandeur que le 90% centile dans l'eau de la base de donnée FOREGS14 (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
En ce qui concerne les organismes marins, le jeu de donnée comprend des informations disponibles pour les taxons plantes, invertébrés et poissons en plus de données court terme pour deux taxons marins additionnels : deux CL50 obtenus sur des annélides (Reish et LeMay, 1991) et des données sur le mollusque Crassostrea gigas (Martin et al., 1981a)15 . Les espèces représentatives des taxons jugés le plus sensibles (ici les algues et les invertébrés) étant représentés, conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 peut être appliqué à la donnée issue de l'essai validé le plus sensible disponible : une CL50 de 11 µg.L-1 sur l'invertébré marin Tigriopus brevicornis (Forget et al., 1998).
[14] Disponible à cette adresse : http://weppi.gtk.fi/publ/foregsatlas/article.php?id=15
[15] Bien que le paramètre mesuré, le développement, soit plutôt du domaine des effets recherchés pour l'exposition chronique, la durée du test et le critère mesuré (une CE50 à 48h) justifie d'utiliser également cet essai parmi les informations du jeu de données aigues.
L'INERIS propose donc la valeur suivante :
![]()
La valeur obtenue pour la MACmarine est légèrement inférieure à la valeur obtenue pour l'AA-QSmarine_eco. La MACmarine sera donc considérée comme égale à l'AA-QSmarine_eco c'est-à-dire :
MACmarine = 1,37 µg.L-1
Bien que le 90% centile dans l'eau marine ne soit pas disponible dans la base de donnée FOREGS, le 90ème centile en eau de surface est utilisé (2,45 µg.L-1). La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
![]()
*= Ces valeurs sont du même ordre de grandeur que les concentrations naturelles environnementales. Ceci implique de prendre en compte les concentrations bruit de fond au moment de la mise en œuvre de cette valeur seuil.
![]()
NORME DE QUALITÉ EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
L'analyse en première approche des essais rapportés ne permet pas de mettre en évidence une sensibilité particulière des mammifères ou des oiseaux par rapport au poisson.
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus sensible est une NOEC de 24,98 mg.kg-1biota dérivée depuis une NOAEL obtenue lors d'un essai réalisé sur des lapines exposées par voie orale pendant la période de gestation. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSbiota_sec_pois peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 300 puisque l'exposition prévue dans le test est de courte durée. L'INERIS propose donc la valeur suivante :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées. Il convient de rappeler que la bioaccumulation de l'arsenic dans les organismes n'est pas corrélée avec la concentration dans l'eau. De plus il a été rapporté que bien que la bioaccumulation de l'arsenic ait été observée, la bioamplification de ce composé n'a pas été observée (Farag et al., 1998; Williams et al., 2006).
Le BCF retenu pour réaliser les calculs concernant l'empoisonnement secondaire correspond à une moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006)17 pour des concentrations d'arsenic dans l'eau comprises entre l' AA-QSwater_eco calculée dans ce rapport (0.5 µg.L-1) et la valeur correspondant au 90% centile des concentrations naturelles dans l'eau de la base de donnée FOREGS18 (2.45 µg.L-1) afin de correspondre à une gamme de concentration cohérente avec des conditions environnementales. Cette valeur est égale à 100 et devrait être suffisamment protectrice dans des conditions environnementales étant noté par ailleurs que les BCF diminuent si les concentrations dans l'eau augmentent.
Pour l'arsenic et ses dérivés inorganiques, un BCF de 100 et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc
![]()
QSmarine_sp = 0,83 µg.L-1
![]()
*= Ces valeurs sont du même ordre de grandeur que les concentrations naturelles environnementales. Ceci implique de prendre en compte les concentrations bruit de fond au moment de la mise en œuvre de cette valeur seuil.
![]()
![]()
[17] Les BCF et les BAF de cette source n'ont pas été vérifiées.
[18] Disponible à cette adresse : http://weppi.gtk.fi/publ/foregsatlas/article.php?id=15
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011) :
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 6,66.10-4 µg/kgcorporel/j (cf. tableau ci-dessus),
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte de l'effet cancérogène de la substance, la VTR prend déjà en compte ce facteur donc il sera réduit ici à 1
- Cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journaliers contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
Le BCF retenu pour réaliser les calculs concernant l'empoisonnement secondaire correspond à une moyenne géométrique des BCF/BAF rapportés par Williams et al. (2006)19 pour des concentrations d'arsenic dans l'eau comprises entre l' AA-QSwater_eco calculée dans ce rapport (0,5 µg.L-1) et la valeur correspondant au 90% centile des concentrations naturelles dans l'eau de la base de donnée FOREGS20 (2,45 µg.L-1) afin de correspondre à une gamme de concentration cohérente avec des conditions environnementales. Cette valeur est égale à 100 et correspond à un pire cas réaliste étant donné que les BCF diminuent si les concentrations dans l'eau augmentent.
[19] Les BCF et les BAF de cette source n'ont pas été vérifiées.
[20] Disponible à cette adresse : http://weppi.gtk.fi/publ/foregsatlas/article.php?id=15
Pour l'arsenic et ses dérivés inorganiques, on obtient donc :
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0,1 µg.L-1). Pour l'arsenic et ses dérivés inorganiques, la Directive 98/83/CE fixe une valeur de 10 µg.L-1.
A titre de comparaison, la valeur seuil provisoire pour l'eau de boisson est calculée de la façon suivante (E.C., 2011):
![]()
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 6,66.10-4 µg/kgcorporel/j (cf. tableau ci-dessus),
- Cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte de l'effet cancérogène de la substance. La VTR sélectionnée prend déjà en compte cet aspect, le facteur est donc abaissé à 1.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
Ainsi, la norme de qualité correspondante dans l'eau brute se calcule de la manière suivante :
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour l'arsenic et ses dérivés inorganiques, on obtient :
![]()
La valeur fixée par la directive 98/83/CE (10 µg.L-1) est plus élevée que la valeur calculée ici mais possède une portée réglementaire et s'applique.
![]()
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
VGE/NQE Importer
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus faible a été obtenue lors d'un essai réalisé sur la larve de Chironomus dilutus (NOEC = 30 mg.kg-1 de sédiment sec avec un As(III) (Martinez et al., 2006). Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSsed poids sec peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 50 puisque le jeu de donnée comprend également le résultat d'un essai long terme sur Hyallela azteca, un autre organisme benthique au mode de vie différent (Liber et al., 2011). L'INERIS propose donc la valeur suivante :
QSsed poids sec [mg/kg] = 30/50 mg/kg, soit 0,6 mg/kg
La QSsed poids sec calculée est inférieure au 90ème percentile dans le sédiment de la base de donnée FOREGS (22 mg/kg) aussi, conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), celles ci peuvent être prises en compte pour évaluer l'état d'un milieu. La QSsed poids sec ne tient pas compte des concentrations naturelles.
La concentration correspondante en poids frais peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0,2 m3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour l'arsenic et ses dérivés inorganiques, la concentration correspondante en poids humide est :
![]()
En ce qui concerne les organismes benthiques marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), l'hypothèse selon laquelle les données écotoxicologiques d'origine marine peuvent être rassemblées avec celles d'origine d'eau douce doit être vérifiée. La sensibilité des espèces benthiques marines à la toxicité des substances peut être considérée comme équivalente à celle des espèces d'eau douce si aucune différence entre les jeux de données n'a été démontrée ou si les données d'un des deux jeux sont insuffisantes pour permettre une analyse statistique (et en l'absence d'informations d'autres origines16).
Néanmoins, le facteur d'extrapolation appliqué pour déterminer la QSsed marin doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons spécifiques marins et une diversité d'espèces plus importante en milieu marin.
Il n'y a pas de données benthiques marines disponibles, la QSsed marin sera estimée à partir des données issues d'essais d'écotoxicité obtenus sur des espèces benthiques d'eau douce.
Pour l'arsenic et ses dérivés inorganiques, la donnée la plus faible a été obtenue lors d'un essai réalisé sur la larve de Chironomus dilutus (NOEC =30 mg/kg de sédiment sec avec un As(III) (Martinez et al., 2006). Le guide technique européen précise que les données obtenues lors d'essais sédiment où la disponibilité de la substance est la plus importante sont préférées aux autres (E.C., 2011). Lors de cet essai, le sédiment utilisé est constitué de sable (pauvre en carbone organique) et le pH est maintenu entre 7 et 8. L'arsenic y est donc biodisponible. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la QSsed marin poids sec peut être calculée à partir de cette valeur en appliquant un facteur d'extrapolation de 500 puisque le jeu de donnée comprend également le résultat d'un essai long terme sur Hyallela azteca, un autre organisme benthique au mode de vie différent (Liber et al., 2011). L'INERIS propose donc la valeur suivante :
[16] Ces informations peuvent provenir de composés très proches par « read across » ou d'un jugement d'expert.
QSsed marin poids sec [mg/kg]= 30/500 mg/kg, soit 0,06 mg/kg
Bien que le 90ème percentile dans le sédiment marin ne soit pas disponible dans la base de donnée FOREGS, la même démarche que pour l'eau douce est suivie. La valeur calculée est donc de l'ordre de grandeur des concentrations naturelles ce qui implique de prendre en compte ces dernières au moment de la mise en œuvre de cette valeur seuil.
La concentration correspondante en poids frais peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une (E.C., 2011) est utilisée : 0,2 m3/m3 . valeur exacte, la valeur générique proposée par le document guide technique européen
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour l'arsenic et ses dérivés inorganiques, la concentration correspondante en poids humide est :
![]()
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de remise en suspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
![]()
![]()
![]()
![]()
![]()
SELECTION DE LA VALEUR GUIDE ENVIRONNEMENTALE
Elle est définie à partir de la valeur la plus protectrice parmi tous les compartiments étudiés.
![]()
Pour l'arsenic et ses dérivés inorganiques, la valeur guide pour la santé humaine via la consommation de produits de la pêche est la valeur la plus faible pour l'ensemble des approches considérées.
![]()
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 03/07/2025
Tableaux de synthèse
Généralités
| CAS | 1303-28-2 |
|---|---|
| SANDRE | 5274 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | oui |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | oui |
| Réglementations |
FTE 2005 Importer La majorité des secteurs industriels responsables de l'émission d'arsenic à l'environnement est concernée par un ou plusieurs textes spécifiques. Dans le paragraphe ci-dessous, nous ne citons que des extraits des exemples nous ayant paru être significatifs. Nous citons également des extraits de textes concernant les rejets de poussières car dans certains secteurs industriels, l'arsenic est majoritairement rejeté sous forme particulaire, toute mesure conduisant à l'abattement des teneurs de poussières émises constitue donc indirectement une mesure affectant les rejets atmosphériques d'arsenic. [26] Moyenne calculée sur l'année civile du contenu total de la fraction PM10. Divers emplois de l'arsenic La Directive n° 2006/139/CE de la Commission du 20 décembre 2006 modifiant la directive 76/769/CEE du Conseil, en ce qui concerne la limitation de la mise sur le marché et de l'emploi des composés de l'arsenic, en vue d'adapter son annexe I aux progrès techniques (JOUE n° L384 du 29 décembre 2006) indique que les composés de l'arsenic.
[27] CCA de type C : 47,5% de CrO3 18,5% de CuO et 34% d'As2O5. CCA qui était utilisé dans la Communauté avant le 30 septembre 2007:
Emplois d'arsenic dans le secteur de la fusion de verre L'Arrêté du 12 mars 2003 relatif à l'industrie du verre et de la fibre minérale publié au JO du 6 juillet 2003 fixe les prescriptions applicables aux établissements dans lesquels sont exercées à la date de publication des activités de fabrication et de travail du verre ou de fabrication de fibres de verre ou laine de roche.
Selon l'extrait considéré, le délai de mise en application s'étale de 2006 à 2010. Emplois phytosanitaires de l'arsenic28 En France, l'avis du 23 novembre 2001 relatif aux détenteurs d'autorisation de mise sur le marché, aux distributeurs et aux utilisateurs de produits phytopharmaceutiques contenant de l'arsénite de soude (arsenic de l'arsénite de sodium) publié au JO du 23 novembre 2001 impose le retrait des autorisations de mise sur le marché des produits phytopharmaceutiques contenant de l'arsénite de soude (arsenic de l'arsénite de sodium) sans délai d'écoulement des stocks aussi bien au stade de la distribution qu'à celui de l'utilisation. Cette mesure est entrée en vigueur à la date du 8 novembre 2001, date de notification des décisions de retraits d'autorisation de mise sur le marché des préparations concernées. Pour collecter et éliminer les stocks détenus par les distributeurs et les agriculteurs (essentiellement viticulteurs) un accord cadre entre les ministères en charge de l'Ecologie, de l'Agriculture, les Agences de l'eau et Adivalor29 a été mis en place. |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2005 Importer Les valeurs ci-dessous reprises sont tirées de notes documentaires rédigées par l'INRS 2003 ; 2006c).
[25] Valeur limite moyenne d'exposition : ces valeurs sont destinées à protéger le travailleur des effets à terme, mesurés ou estimés, sur la durée d'un poste de travail de 8 heures (INRS, 2006c). Qualité de l'eau La Directive 2000/60/CE du Parlement européen et du Conseil du 23 octobre 2000 établit un cadre pour une politique communautaire dans le domaine de l'eau (eau de surface, eaux transitoire, eau côtière et eau souterraine). Dans ce texte l'arsenic est placé en Annexe VIII : « Liste indicative des principaux polluants ». Qualité des eaux de consommation En France, le Décret n° 2001 – 1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation fixe la teneur maximale en arsenic à 10 µg.L-1 . En Europe, la Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine fixe la teneur maximale en arsenic à 10 µg.L-1 . Qualité de l'air En Europe, la Directive fille 2004/107/CE du Conseil du 15 décembre 2004 (directive cadre de 1999) concernant l'arsenic, le mercure, le nickel et les hydrocarbures aromatiques polycycliques dans l'air ambiant (JOUE du 26 janvier 2005) fixe une valeur cible26 en arsenic de 6 ng.m-3 . Cette valeur ne devra pas être dépassée à partir du 31 décembre 2012. Pour ce faire, les états membres doivent, au plus tard le 15 février 2007, prendre toutes les mesures nécessaires (n'entraînant pas des coûts disproportionnés) pour s'y conformer. |
Production et utilisation
Production et ventes
Procédés de production
FTE 2005 Importer
Ces quelques notions sur les principes de production de l'arsenic et de son principal composé (trioxyde d'arsenic) sont issues d'un document INERIS datant de 2006 : fiche de données toxicologiques et environnementales des substances chimiques.
L'élément arsenic est produit par l'une ou l'autre des méthodes suivantes (HSDB, 2000) :
- pyrolyse de Fe S As (arsénopyrite) ;
- grillage de sulfure puis réduction de l'oxyde formé avec du carbone.
Il peut également être obtenu par réduction du trioxyde d'arsenic par le carbone (ATSDR, 1993).
Le trioxyde d'arsenic (As2O3) est le composé d'arsenic le plus important commercialement. Lors de la fusion du plomb ou du cuivre, l'arsenic combiné avec ces
métaux s'évapore et s'oxyde dans l'air en donnant naissance à des particules de trioxyde d'arsenic. Celles-ci sont recueillies et purifiées par grillage en présence de pyrite ou de galène (ATSDR, 1993).
Pour les autres composés, les principes de productions peuvent être, par exemple, obtenus en consultant le site internet toxnet (rubrique HSDB : Hazardous Substances Data Bank).
En 1980, la production mondiale d'arsenic était de l'ordre de 75 000 à 100 000 tonnes (Proust et al., 2000).
Utilisations
Secteurs d'utilisation
FTE 2005 Importer
Ces quelques notions sur les secteurs d'utilisation de l'arsenic et de ses composés sont issues du document INERIS (2006).
L'arsenic et ses composés minéraux ont de très nombreuses applications industrielles ou agricoles (Molénat et al., 2000) :
- complexe « chromate copper arsenate» (CCA) utilisé pour le traitement du bois ;
- alliage plomb-antimoine-arsenic utilisé dans les batteries électriques (l'arsenic améliore la résistance à la corrosion électrique) ;
- semi-conducteurs (arséniure de gallium AsGa) ;
- divers équipements électriques et électroniques5 (toner, DEL, éléments de cellules photovoltaïques, cartes électroniques, …) ;
- agent décolorant dans l'industrie du verre 6 ;
- pigments de peinture en association avec le cuivre: CuAsO4 H ;
- fabrication de plombs de chasse, en association avec le plomb dont il augmente la dureté ;
- alliages avec le cuivre, le plomb, l'or, pour augmenter leur dureté.
[5] De tels équipements sont soumis à une obligation de recyclage depuis la mise en application des directives 2002/95/CE et 2002/96/CE. Ces directives limitent l'utilisation de certaines substances dans ce type d'équipements et imposent des objectifs précis en matière de valorisation et d'élimination lorsqu'ils sont mis au rebut. L'arsenic n'étant qu'indirectement visé par ces directives, celles-ci n'apparaîtront pas dans la partie réglementation (§4).
[6] Selon Eisler (1994), l'arsenic est employé dans l'industrie du verre comme agent décolorant à hauteur de 0,2 à 1%.
De façon plus détaillée (composé par composé), différentes sources bibliographiques mettent en avant des applications spécifiques. Néanmoins, celles-ci (ci-après détaillées) ne s'appliquent pas forcément à la France :
- l'arséniate de plomb est utilisé comme pesticide (Ullmann, 1985) ;
- l'arséniate de sodium sert à produire d'autres arséniates tels que les arséniates de calcium et les arséniates de plomb (Ullmann, 1985) ;
- le trioxyde d'arsenic est un produit de base pour la fabrication de nombreux composés d'arsenic. Il est également utilisé comme intermédiaire chimique pour la fabrication d'herbicides, de raticides, de fongicides et d'insecticides7 (HSDB, 2000) ;
- le trioxide d'arsenic est utilisé pour la production d'arsenic élémentaire (HSDB, 2000) ;
- le trioxide d'arsenic est utilisé en tannerie pour la conservation des peaux (HSDB, 2000) ;
- le pentoxyde d'arsenic sert d'intermédiaire chimique pour la fabrication d'arséniates (HSDB, 2000) ;
- le pentoxyde d'arsenic est utilisé pour la fabrication d'herbicides (HSDB, 2000).
- …
En l'absence de chiffre concernant ces différentes applications, il nous a été impossible de les organiser selon des critères d'importance.
Pour plus de détails ; les principaux secteurs d'utilisation de l'arsenic et de ses composés peuvent être, par exemple, obtenus en consultant le site internet toxnet (rubrique HSDB : Hazardous Substances Data Bank)8 .
www.vidal.fr D'autre part, le site internet VIDAL (site d'information sur les produits de santé : () indique deux usages thérapeutiques pour des composés à base d'arsenic :
- produit dentaire dévitalisant avec anhydride arsénieux ;
- produit antinéoplasique9 à perfuser avec anhydride arsénieux10 .
[7] Cette dernière application semble avoir diminué au profit des pesticides organochlorés et organophosphatés (HSDB, 2000).
[8] Précisons que, selon le site internet IREP, l'arsenic est également un sous-produit de l'exploitation de certains minerais de métaux (pyrites de fer, minerais sulfureux de cuivre, argent, or, plomb, ...).
[9] Médicament utilisé pour détruire les cellules cancéreuses ou empêcher leur prolifération.
[10] Usage réservé aux hôpitaux.
Néanmoins, on estime que les quantités d'arsenic concernées par un usage thérapeutique sont anecdotiques en comparaison des principaux secteurs d'utilisation précédemment listés.
Dans la suite de cette fiche, nous focaliserons notre propos sur les principaux émetteurs et/ou utilisateurs d'arsenic.
Rejets dans l’environnement
Sources naturelles
FTE 2005 Importer
Ces quelques notions sur les principaux émetteurs d'arsenic dans l'environnement sont issues du document INERIS (2006).
L'arsenic est présent dans la nature, en particulier dans les roches qui renferment plus de 99% de l'arsenic présent dans la croûte terrestre sous forme de minerais : principalement FeSAs (arsénopyrite ou mispickel), secondairement les sulfures As4S4 (réalgar) et As4S6 (orpiment).
Dans la partie superficielle de l'écorce terrestre, la concentration moyenne en arsenic est évaluée à 2 mg.kg-1 . Localement, la concentration naturelle peut atteindre 100 mg.kg-1 voire 200 mg.kg-1 dans des dépôts calcaires ou phosphatés ou dans des schistes.
L'érosion des roches, le lessivage des sols, les réactions d'oxydo-réduction et les précipitations entraînent une redistribution de l'arsenic vers les compartiments aquatiques et atmosphériques.
D'autres sources naturelles d'émission d'arsenic dans l'atmosphère sont l'activité volcanique et les feux de forêts.
La majeure partie de l'arsenic anthropique atmosphérique provient des fumées émanant des industries de production d'As2O3 11 et de la combustion de produits fossiles (charbons, pétroles, huiles) qui contiennent un pourcentage important d'arsenic.
[11] Selon Molénat et al. (2000), la production d'arsenic se fait à 97% sous forme d'As2O3.
Émissions atmosphériques
FTE 2005 Importer
Emissions atmosphériques totales
Le CITEPA (2007b ; 2008) dresse le bilan12 suivant quant aux principaux émetteurs français (métropole) d'arsenic dans l'air (période d'étude 1990-2006) :
Emissions en 2006 : 10,5 t
Emissions en 2005 : 10,4 t
Maximum observé : 17,5 t en 1991
Minimum observé : 10,4 t en 2005
Evolution 2005 / 1990 : -37 %
Il est notable que la valeur la plus récente disponible (2005) corresponde au minimum des émissions d'arsenic dans l'air.
Sous-secteurs prépondérants en 2005 (cinq premiers des émissions totales) :
- Minéraux non métalliques, matériaux de construction 32 % ; dont :
- verre 31 % ;
- ciment 1,0 % ;
- Résidentiel 20 % ;
- Métallurgie des métaux ferreux 13 % ;
- Métallurgie des métaux non ferreux 9,4 % ;
- Production d'électricité 9,0 %.
Selon cette même source, les émissions de ce polluant dans l'atmosphère proviennent :
- d'une part, de la présence de traces de ce métal dans les combustibles minéraux solides ainsi que dans le fioul lourd
- d'autre part, de la présence de ce composé dans certaines matières premières comme par exemple dans certaines installations de production de verre, de métaux ferreux ou non ferreux.
[12] Selon le CITEPA (2007b), les émissions sont déterminées au moyen du système national des inventaires d'émissions de polluants dans l'atmosphère (SNIEPA).
Les principaux secteurs émetteurs sont synthétisés dans le tableau 3.1 ci-dessous.
Tableau 3.1. Principaux secteurs émetteurs d'arsenic dans l'atmosphère en France, en 2005 (d'après CITEPA, 2007)13,14 .
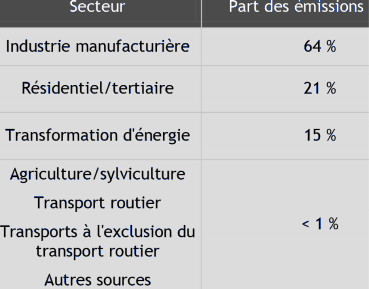
Les données annuelles (de 1990 à 2005) pour chacun de ces secteurs sont disponibles sur le document CITEPA (2007). Le graphique 3.1 ci-dessous synthétise les principaux résultats quantitatifs.
[13] Les émissions maritimes et aériennes internationales, ainsi que les émissions des sources biotiques, des forêts et les émissions des sources non-anthropiques ne sont pas répertoriées dans ce tableau.
[14] Le découpage des secteurs émetteurs est différent entre le CITEPA et la base de données IREP. La comparaison des données n'est donc pas directement possible.
Figure 3.1. Evolution des quantités d'arsenic émises dans l'atmosphère (en tonne ; d'après CITEPA, 2007)15 .
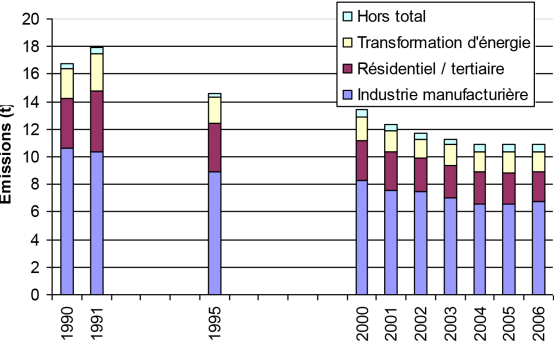
Il convient de noter que les bilans du CITEPA sont établis, pour la plupart des secteurs industriels, par le biais de facteurs d'émission estimés à partir d'hypothèses non communiquées.
Emissions atmosphériques non-anthropiques
Selon le programme IPCS (2001) environ un tiers des émissions atmosphériques mondiales d'arsenic est d'origine naturelle. Néanmoins, cette source précise également que c'est essentiellement au volcanisme et à la volatilisation à basse température que ces émissions sont attribuables. La France métropolitaine prise dans sa globalité ne se caractérisant ni par la présence d'un volcanisme dynamique, ni par une forte représentation de minéraux arséniés à la surface du sol, la source non-anthropique devrait se révéler de faible importance.
Cette conclusion est confortée par les estimations du CITEPA qui affiche, pour l'année 2006, une participation des sources « hors total », (catégorie regroupant les émissions maritimes et aériennes internationales, ainsi que les émissions des sources biotiques, des forêts et les émissions des sources non-anthropique) équivalentes à moins de 5% du total des autres émissions anthropiques
[15] Les valeurs considérées pour l'année 2006 correspondent à des estimations.
Emissions atmosphériques industrielles
Selon L'INRS (2000), de très nombreuses opérations industrielles sont susceptibles de dégager du trihydrure d'arsenic. Les principales circonstances de dégagement accidentel se rencontrent dans la métallurgie : traitement de minerais arsenicaux ou de minerais ayant de l'arsenic comme impureté, décapage à l'acide de zinc, cuivre, étain ou plomb, fonderies de métaux ferreux, fonderies d'étain et de zinc.
Le paragraphe suivant présente les enseignements de l'étude des déclarations des installations industrielles classées soumises à autorisation préfectorales (données BDREP, correspondantes aux années 2003 à 2006, extraites le 10/01/2008). Bien que ces données ne soient pas exhaustives pour diverses raisons (elles ne concernent notamment pas les installations non classées ; en cas d'usage d'arsenic, il existe un seuil d'émission en deçà duquel la déclaration n'est pas nécessaire ; …), les informations ci-dessous compilées sont intéressantes pour dresser un état des lieux le plus proche de la réalité possible.
La carte ci-dessous (Figure 3.2) extraite du site internet IREP (site internet exploitant les données issues de la base BDREP) permet de localiser les différents sites émetteurs d'arsenic dans l'air en France.
Figure 3.2. Localisation des différents sites émetteurs d'arsenic dans l'air en France (extrait du site internet IREP en date du 04/et correspondant aux données de 2005)./

Ce document présente bien l'inhomogénéité des installations rejetant de l'arsenic dans l'atmosphère à l'échelle de la France métropolitaine. On note par exemple la sur-représentation du quart nord-est de la France et la sous-représentation du quart nord-ouest.
Quoiqu'il en soit, une information plus importante sur les entreprises concernées est disponible sur le site internet IREP et permettrait d'approfondir les connaissances sur l'activité et les rejets de ces entreprises.
Dans le tableau 3.2 ci-dessous figurent les émissions d'arsenic dans l'air pour les industries soumises à déclaration. L'obligation de déclaration par les exploitants des installations industrielles et des élevages est fixée (polluants concernés et seuils de déclaration) par l'arrêté du 24 décembre 2002 relatif à la déclaration annuelle des émissions polluantes des installations classées soumises à autorisation (JO du 07 mars 2003).
Tableau 3.2. Emissions atmosphériques d'arsenic des installations soumises à déclarations de 2003 à 2006 (données BDREP)16 .
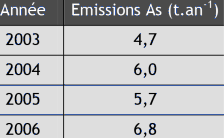
La comparaison de ces chiffres d'émissions des installations classées à ceux du CITEPA concernant la totalité des émissions atmosphériques françaises montre que, pour l'année 2006, plus de 65 % de la totalité des rejets atmosphériques d'arsenic sont originaires des installations classées.
On peut également interpréter plus en détails ce tableau 3.2. Sur la période 2004-200617 , une augmentation des rejets d'arsenic dans l'air est à souligner (+12%). Ces émissions représentent 6,8 t. en 2006. Nous n'avons pas pu mettre en évidence la raison de cette augmentation lors de la présente synthèse.
Les industries qui rejettent de l'arsenic dans l'air sont les industries minérales, la chimie – parachimie – pétrole, la sidérurgie – métallurgie -coke, les déchets et leur traitement, l'énergie, la mécanique et le traitement des surfaces, l'industrie du bois, l'industrie extractive, l'industrie agroalimentaire et celle des cuirs et peaux.
Les rejets sont, principalement, le fait de cinq grands secteurs industriels18 (qui représentent, en 2006, 99,4 % des émissions atmosphériques) :
- industries minérales (40,6 % en 2006) ;
- chimie – parachimie-pétrole (31,8 % en 2006) ;
- sidérurgie – métallurgie-coke (14,8 % en 2006) ;
- déchets – traitement (7,6 % en 2006) ;
- énergie (4,6 % en 2006).
[16] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement..
[17] On ne retient pas l'année 2003 car les données associées à cette année sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
[18] Le découpage des secteurs émetteurs est différent entre le CITEPA et la base de données de l'IREP. La comparaison des données n'est donc pas directement possible.
Le graphique ci-après (Figure 3.3) montre l'évolution des émissions atmosphériques d'arsenic pour ces cinq secteurs.
Figure 3.3. Evolution des émissions atmosphérique d'arsenic pour les cinq principaux secteurs émetteurs (données BDREP).
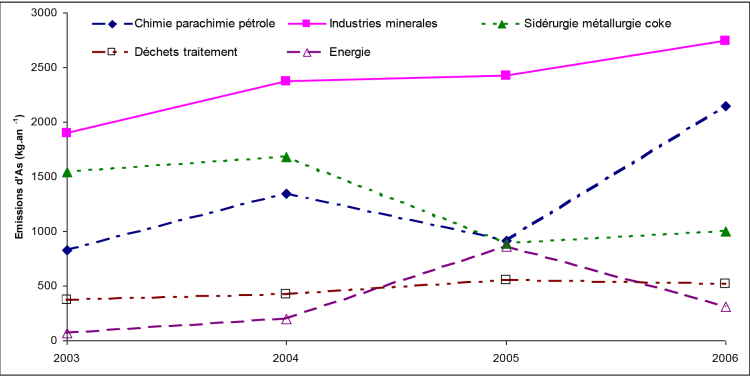
Les rejets pour l'industrie minérale et pour celle des déchets et de leur traitement sont relativement stables sur la période 2004-2006.
En ce qui concerne le secteur de la sidérurgie et de la métallurgie, il apparaît que les émissions ont été réduites d'un tiers entre 2004 et 2006.
A contrario, celles du secteur de la chimie-parachimie-pétrole ont augmenté de 30 à 50% pour cette même période.
Le tableau 3.3 donne la part de chaque secteur dans les émissions totales d'arsenic en 2006 ainsi que la répartition des rejets à l'intérieur de chaque secteur. On retrouve également la valeur minimale et maximale des rejets pour l'année 2006 ainsi que la valeur médiane qui permet de savoir si la distribution des émissions est homogène pour chaque type d'industrie ou si un site concentre la majorité des rejets. Enfin, le nombre de sites émetteurs pour 2005 et 2006 est également présenté dans ce tableau.
Tableau 3.3. Panorama des émissions atmosphériques d'arsenic des installations soumises à déclarations en 2006 (données BDREP)19 .

[19] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues dans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement.
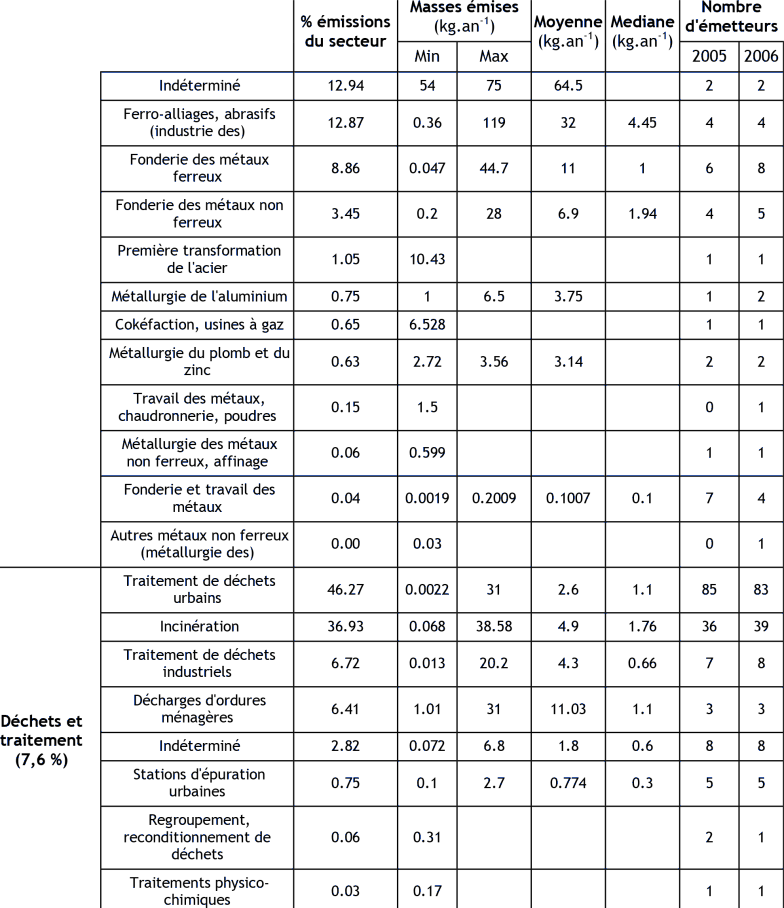
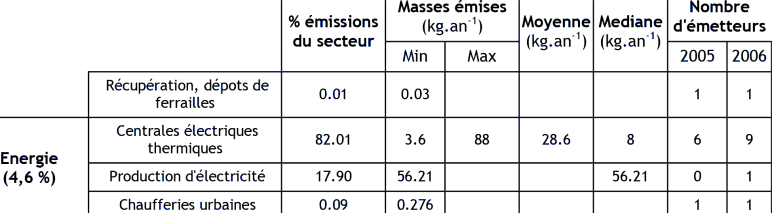
L'industrie du verre représente près de 40 % des rejets annuels totaux des industries soumises à déclaration (98 % des émissions de la catégorie). Le tableau 3.5 fait apparaître qu'une seule usine de production de verre émettrait 0,5 tonne d'arsenic par an, soit plus de 8 % des rejets atmosphériques annuels d'arsenic en France (rejets des installations classées).
Dans le secteur de la chimie-parachimie-pétrole, les émissions atmosphériques d'arsenic20 représentent 31,8 % des émissions totales d'arsenic des installations classées en France pour 2006. Les contributeurs les plus importants à ces rejets sont présents dans l'industrie chimique, phytosanitaire et pharmaceutique (près de 13 % de l'arsenic total rejetés par les installations classées en 2006 sont effectuées par une seule usine), ainsi que dans le domaine de la pétrochimie et du raffinage de pétrole.
Pour ce secteur, la combustion du charbon, utilisé comme source d'énergie, est à l'origine des rejets d'arsenic dans l'air.
Environ 15 % des émissions d'arsenic des installations classées proviennent du secteur de la sidérurgie et de la métallurgie. Ces rejets sont présents en majorité dans la sidérurgie, dans les aciéries et les fonderies de métaux ferreux et non ferreux.
L'industrie des déchets et de leur traitement représente 7,6 % des quantités d'arsenic émises par la totalité des installations classées. Les trois catégories d'industries dont les rejets sont les plus importants sont le traitement des
déchets, les incinérateurs et le traitement des déchets industriels. Il est important de noter le grand nombre de sites (près de 300) concernés par ce secteur d'activité, contrairement aux autres secteurs industriels émetteurs d'arsenic.
[20] Généralement la mesure des émissions d'arsenic est effectuée une fois par année et ramenée au débit des effluents gazeux. Cette façon de procéder entraîne donc une grande incertitude sur les données, en particulier pour les sites ayant une activité fluctuante sur l'année.
Enfin, le dernier contributeur important (4,6 % des rejets d'arsenic des installations classées) concerne le domaine de l'énergie avec en particulier les centrales électriques thermiques (82% des émissions du secteur).
Par conséquent, la réduction des émissions d'arsenic sur certains sites industriels précis (ou plus généralement sur certains secteurs industriels bien identifiés) pourrait avoir un impact significatif sur les rejets totaux annuels.
Emissions atmosphériques par combustion de bois traité
Avant septembre 2007, le bois destiné à être utilisé en extérieur était fréquemment (et est en encore sous certaines conditions : cf. §4.3) traité avec du CCA (chromate copper arsenate). Ce traitement conférait au bois une résistance supérieure à celle des bois non traités.
Bien que la réglementation encadre dorénavant cette pratique, il est apparu de la destruction des bois traités est problématique vis à vis des émissions d'arsenic. Ainsi, Lundholm et al. (2007) estiment que, lors de la combustion de bois traité au CCA dans un dispositif de 15 kW :
- de 30 à 45% de l'arsenic utilisé durant le traitement demeurent dans les cendres (résultats mesurés) ;
- de 35 à 60% de l'arsenic sont émis sous forme de particules submicroniques (résultats mesurés) ;
- de 30 à 60% de l'arsenic sont émis sous forme gazeuse (résultats calculés).
Bien que ces résultats demanderaient à être confirmés par d'autres expérimentations, il semble que plus des 2/3 de l'arsenic contenu dans un bois traité au CCA soit émis à l'atmosphère durant la combustion21 .
[21] Des alternatives au traitement des bois par CCA semblent être en voie de développement, citons par exemple l'ASAM (anhydride succinite d'alkéonoate de méthyle), substance d'origine végétale, développée par l'Unité de chimie agro-industrielle de l'INRA.
Emissions vers les eaux
Présence d'origine non anthropique : le fond géochimique
Même si aucun rejet d'arsenic n'est effectué vers une masse d'eau donnée (de surface ou souterraine), cette masse d'eau peut néanmoins contenir de l'arsenic de façon naturelle. Cette teneur est liée aux caractéristiques physico-chimiques des eaux ainsi qu'à la géologie régionale : on appelle cette teneur le « fond géochimique ».
Par exemple, selon le BRGM (2006), dans le Puy-de-Dôme, sur les 1200 sources et forages recensés, quelques points d'eau présentent des traces d'arsenic, d'origine naturelle et attribuable au fond géochimique, à un taux parfois nettement supérieur à 10 μg.L-1 , la norme de potabilité (Figure 3.4).
Figure 3.4. Carte des concentrations en arsenic dans les eaux souterraines en région Auvergne (document repris du BRGM, 2006).

Des informations concernant la méthode préconisée pour caractériser le fond géochimique sont présentées dans un guide technique publié par le BRGM (2006b).
Emissions anthropiques
Au cours de cette synthèse, aucune information globale d'émissions d'arsenic dans les eaux n'a été recueillie.
L'arsenic et ses composés minéraux ont de très nombreuses applications industrielles (cf. §3.2). Il semble donc probable que le secteur industriel soit prépondérant quant aux rejets vers les eaux.
La figure 3.5 extraite du site internet IREP permet de localiser les différents sites émetteurs d'arsenic dans l'eau en France métropolitaine.
Figure 3.5. Localisation des différents sites émetteurs d'arsenic dans les eaux en France (extrait du site internet IREP en date du 04/02/2008 et correspondant aux données de 2005).
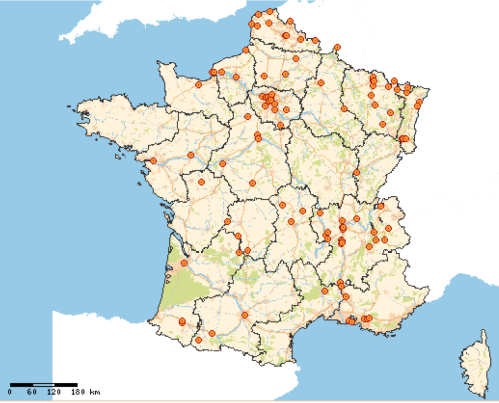
A l'image des émissions industrielles atmosphériques d'arsenic, les émissions vers les eaux présentent une certaine inhomogénéité. On note par exemple la sur-représentation du quart nord-est de la France et la sous-représentation du quart nord-ouest.
Quoiqu'il en soit, une information plus importante sur les entreprises concernées est disponible sur le site internet IREP et permettrait d'approfondir les connaissances sur l'activité et les rejets de ces entreprises.
Dans le tableau 3.4 ci-dessous figurent les émissions d'arsenic dans l'eau pour les industries soumises à déclaration.
Tableau 3.4. Emissions d'arsenic dans les eaux par les installations soumises à déclarations de 2003 à 2006 (données BDREP)22 .
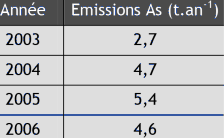
Sur la période 2004-2006, les émissions totales d'arsenic dans l'eau sont restées relativement stables.
Les secteurs qui rejettent le plus sont les industries extractives, la sidérurgie -métallurgie – coke, la chimie – parachimie – pétrole, les déchets et traitements et les industries du bois, papiers et cartons. Des émissions d'arsenic, moins importantes, sont également le fait des industries de traitement de surface, de l'énergie, de l'agroalimentaire et du textile
Le graphique ci-après (Figure 3.6) montre l'évolution des émissions d'arsenic vers les eaux pour ces cinq secteurs.
[22] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues ans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement..
Figure 3.6. Evolution des émissions d'arsenic dans les eaux d'arsenic par les cinq principaux secteurs émetteurs (données BDREP).
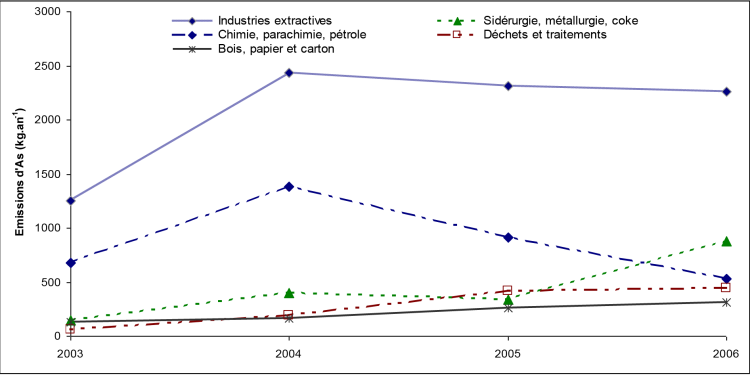
Sur ce graphique sont représentées les variations des émissions d'arsenic dans l'eau par les cinq plus importants secteurs industriels concernés pour la période 2003-2006.
Les valeurs pour l'année 2003 sont purement indicatives. Pour la période 2004-2006, les rejets d'arsenic par les industries extractives ont diminués d'environ 10 % ; ceux du secteur de la chimie et du pétrole ont été divisés par un facteur 2,5. Sur la même période, les émissions d'arsenic par les secteurs sidérurgique, des déchets et du bois et papiers ont été multipliées par 2. De nombreuses variations d'émissions d'une année sur l'autre sont à observer, particulièrement dans le secteur de la chimie.
Le tableau suivant donne, pour 2006, la part de chaque secteur dans les émissions totales d'arsenic ainsi que la répartition des rejets à l'intérieur de chaque secteur. On retrouve également la valeur minimale et maximale des rejets ainsi que la valeur médiane qui permet de savoir si la distribution des émissions est homogène pour chaque type d'industrie ou si un site concentre la majorité des rejets. Le nombre de sites émetteurs pour 2005 et 2006 sont également présentés dans ce tableau.
Tableau 3.5. Panorama des émissions d'arsenic des installations soumises à déclarations en 2006 (données BDREP)23 .
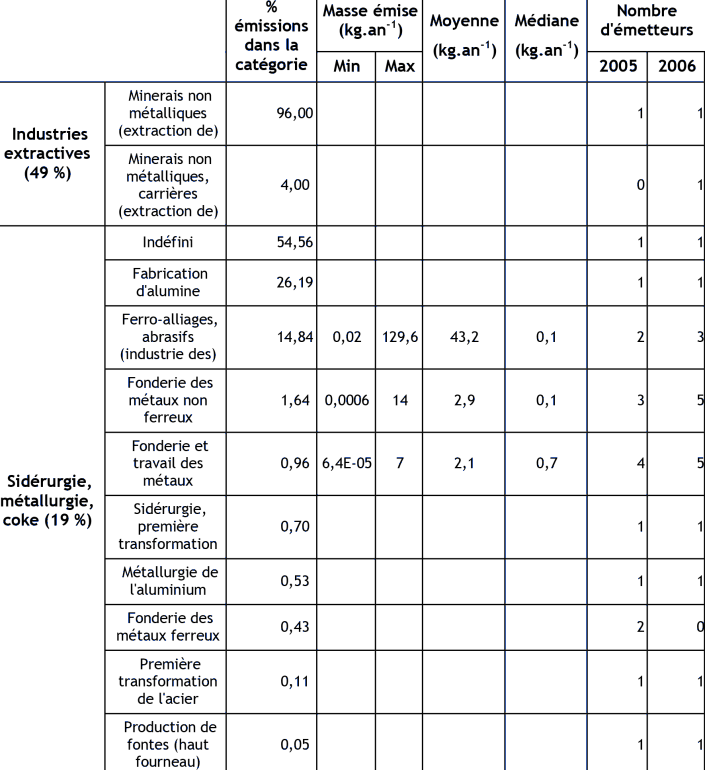
[23] Les données pour 2003 sont présumées incomplètes et sont données à titre indicatif. D'autre part, au jour de l'extraction des informations contenues ans BDREP, pour l'exercice 2006, environ 15% des données sont en attente de renseignement..
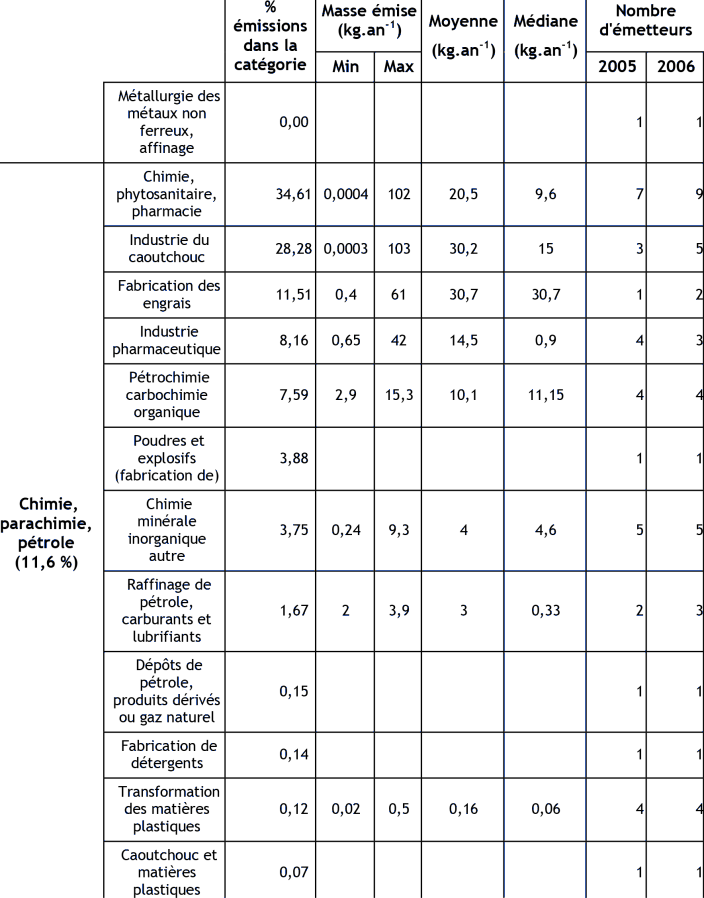

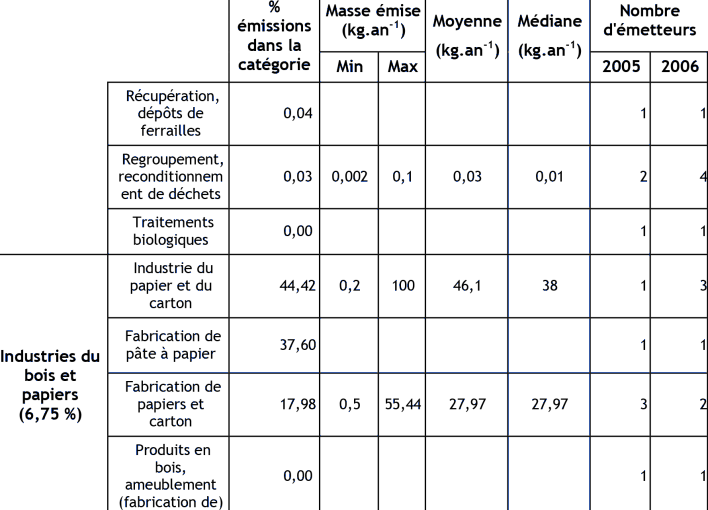
D'après ce tableau, les principaux émetteurs industriels (sites soumis à déclaration) d'arsenic dans l'eau en 2006 sont les industries excavatrices (environ 50 % des rejets totaux). En 2006, seuls deux sites étaient responsables de ces émissions.
Le secteur de la sidérurgie rejette 19 % de l'arsenic pour cette même année : ce sont en particulier les entreprises de fabrication d'alumine et l'industrie des ferro-alliages et abrasifs.
Le secteur chimique, parachimique et pétrolier regroupe 11,6 % des émissions dans l'eau en 2006. Dans cette catégorie les principaux émetteurs sont les secteurs chimie – phytosanitaire – pharmacie, caoutchouc et fabrication des engrais.
Près de 10% des émissions d'arsenic dans l'eau sont dues au secteur des déchets et de leur traitement. La plus grande part est celle de l'incinération, puis les stations d'épuration urbaines et les décharges d'ordures ménagères. Il faut remarquer également une forte augmentation du nombre d'émissions déclarées dans ce secteur (environ +30 entre 2005 et 2006).
Finalement, le dernier secteur important des émissions d'arsenic dans l'eau en 2006 est celui de l'industrie du bois et papier (environ 7% des rejets annuels)
Par conséquent, la réduction des émissions d'arsenic sur certains sites industriels précis (ou plus généralement sur certains secteurs industriels bien identifiés) pourrait avoir un impact significatif sur les rejets totaux annuels.
Émissions vers les sols
FTE 2005 Importer
Emissions totales vers les sols
Au cours de cette synthèse, aucune information n'a été recueillie nous permettant de renseigner cette rubrique. Néanmoins, il semble probable que la source industrielle d'arsenic pour les sols soit la source la plus importante.
Emissions industrielles vers les sols
La base de données BDREP ne contient pas de donnée correspondant aux émissions industrielles vers les sols.
Néanmoins, le site internet BASOL24 (Base de données BASOL sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif) contient plusieurs centaines d'occurrences correspondant à une contamination par l'arsenic.
L'exploitation de cette base de données pourrait permettre d'approfondir les connaissances sur les activités industrielles historiques ou présentes utilisant de l'arsenic. De même, cette base de données s'avère également être une source d'information sur les actions engagées pour faire face à la contamination des sols par l'arsenic.
[24] http://basol.environnement.gouv.fr/recherche.php
Emissions agricoles vers les sols
Suite à l'interdiction en 2001 (cf. §4.3) de l'arsénite de soude en tant que produit phytosanitaire (utilisé en viticulture pour la lutte contre les maladies du bois), une collecte nationale des produits contenant cette substance est organisée. En effet, un accord est intervenu entre les pouvoirs publics (Ministère de l'Agriculture et de la pêche, Ministère de l'Ecologie et du Développement Durable) et la profession agricole pour organiser une collecte unique et gratuite afin d'éliminer les stocks détenus par les distributeurs et les viticulteurs, actifs ou retraités.
A l'issue de cette action, on peut estimer que les émissions agricoles d'arsenic vers les sols (et indirectement vers les eaux) seront proches de zéro. En effet, le seul produit phytosanitaire encore autorisé contenant de l'arsenic est un formicide (cf. §4.3) et n'est donc :
- ni utilisé en grandes quantités ;
- ni employé sous une forme susceptible de contaminer facilement les sols et eaux.
Présence environnementale
Synthèse
FTE 2005 Importer
Selon l'OMS (2001), l'arsenic est largement répandu dans toute la croûte terrestre. Dans certaines régions, les eaux souterraines en contiennent parfois des quantités importantes en raison de l'érosion.
Les effluents industriels contribuent également à la présence d'arsenic dans l'eau dans certaines régions. L'arsenic est d'autre part utilisé à des fins commerciales, principalement dans les alliages et les conservateurs du bois. L'utilisation de combustibles fossiles explique aussi la présence d'arsenic dans l'environnement du fait de dépôts atmosphériques dispersés.
On peut trouver de l'arsenic inorganique dans l'environnement sous plusieurs formes mais, dans les eaux naturelles et donc dans l'eau de boisson, il se présente la plupart du temps sous forme d'arsénite trivalent (AsIII) ou d'arséniate pentavalent (ASV). Les formes d'arsenic organique, abondantes dans les poissons et les coquillages, sont beaucoup moins dangereuses pour la santé et facilement éliminées par l'organisme.
Concentrations ubiquitaires
Le tableau synthétique 6.1 est issu du document INERIS (2006).
Tableau 6.1. Concentration ubiquitaire de l'arsenic dans les différents compartiments de l'environnement.
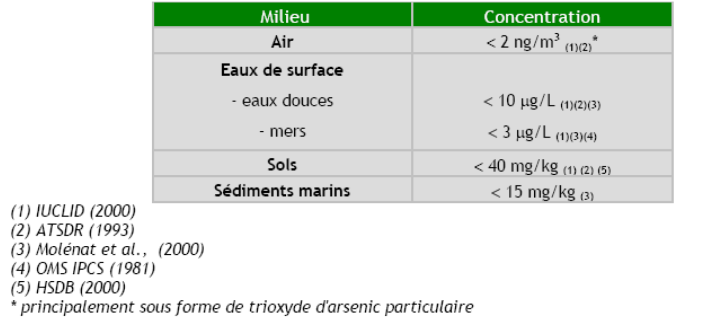
Au vu des concentrations d'arsenic observées dans le compartiment « eau » de l'environnement (< 10 µg.L-1), les données sur les émissions industrielles dans l'eau et urbaines30 de l'ordre du μg.L-1 (INERIS, 2008) sont difficilement exploitables. En effet, de telles valeurs peuvent indifféremment être attribuées au « bruit de fond géochimique » (concentration des eaux en arsenic « naturellement » présent) ou à des rejets industriels suite à l'utilisation de cet élément.
Exemples d'aquifères français contaminés par l'arsenic
Le BRGM (2006b), donne quelques exemples d'aquifères français contaminés par l'arsenic (tableau 6.2).
[30] Données obtenues lors de l'action nationale de recherche et de réduction des rejets de substances dangereuses dans l'eau par les installations classées et autres installations (INERIS, 2008)
Tableau 6.2. Exemple d'aquifères français contaminés par l'arsenic (d'après le BRGM, 2006b).

Charge critique
La charge critique est définie comme une valeur d'exposition à un ou plusieurs polluants en dessous de laquelle des effets significatifs indésirables sur des éléments sensibles de l'environnement n'apparaissent pas en l'état actuel des connaissances (Nilsson et Grennfelt,, 1988).
En pratique, la charge critique « rend compte » de la sensibilité d'un milieu aux retombées atmosphériques d'un polluant.
[31] La mise en solution de l'arsenic se fait par oxydation des sulfures.
[32] Cf. §3.5.
Ce concept a été adopté vers les années 90 par la Commission Economique pour l'Europe des Nations Unies dans le cadre de la convention de Genève sur la pollution atmosphérique transfrontière à longue distance (pour les oxydes de soufre et d'azote). Le concept a été développé et validé pour les métaux lourds (plomb, mercure et cadmium).
Alterra (2006) a montré que les calculs de la charge critique pour l'arsenic sont possibles. Les graphiques suivants (figure 6.1) illustrent les résultats obtenus pour l'arsenic sur les écosystèmes agricoles et forestiers (ou non-agricoles) et sur la santé humaine (à travers la consommation d'eau douce de surface dans les deux types d'écosystèmes).
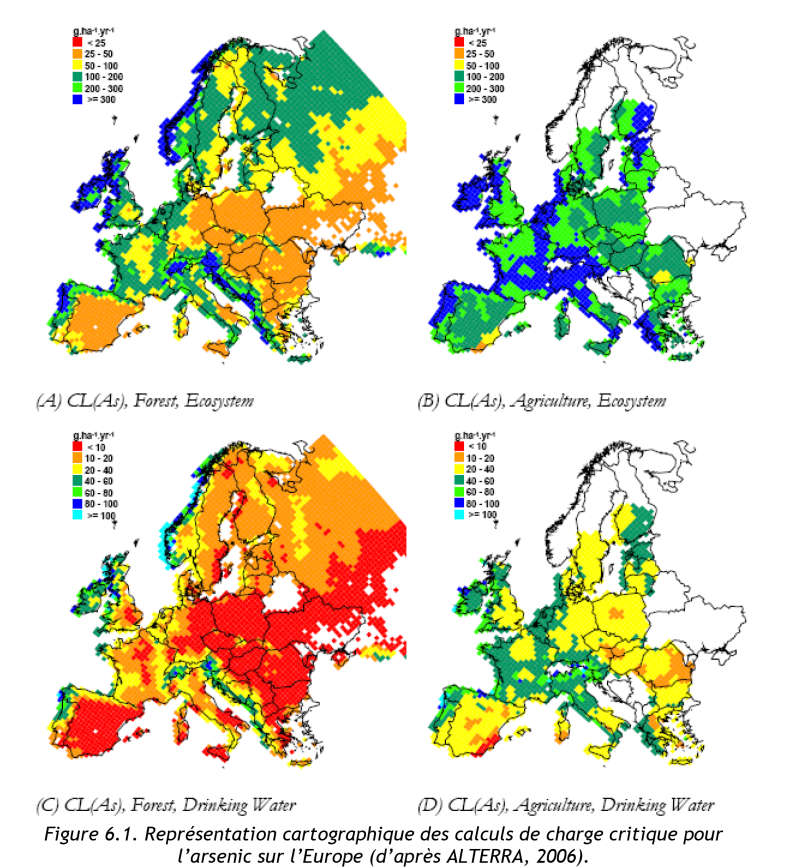
Cette approche pourrait être utilisée pour évaluer l'impact à l'échelle locale et à l'échelle nationale (voire internationale) des émissions. Elle peut également être utilisée en modélisation intégrée pour évaluer l'impact des mesures réglementaires.
Perspectives de réduction
Réduction des rejets
Réduction des émissions industrielles atmosphériques
FTE 2005 Importer
Pour rédiger ce paragraphe, nous nous sommes appuyés sur les « Meilleures Techniques Disponibles » rassemblées dans les « BREF ». Ces documents sont disponibles sur le site internet de l'European IPPC Bureau : http://eippcb.jrc.es/pages/FActivities.htm. Pour certains de ces documents, des résumés en français sont disponibles sur le site AIDA de l'INERIS (http://aida.ineris.fr/bref/bref_cadres.htm).
Les BREF proposent les solutions de réduction des émissions de polluants les plus adaptées en fonction des secteurs d'activité. Les principales émissions d'arsenic dans l'air sont regroupées dans quelques secteurs d'activité bien précis (cf § 3.2). Nous ne présenterons donc que les recommandations pour ces industries.
Industrie du verre
Dans l'industrie du verre, en particulier pour la fabrication du cristal et des verres spéciaux, des précautions sont prises pour limiter les rejets d'arsenic dans l'atmosphère. Pour la fabrication du cristal au plomb 24%, les émissions d'arsenic peuvent atteindre 20mg.Nm-3 . Pour traiter les émissions de métaux lourds, et plus particulièrement d'arsenic, le BREF recommande d'effectuer une meilleure sélection des matières premières combinée si nécessaire à une épuration des gaz acides.
Cependant, une grande partie des émissions d'arsenic se font sous forme de poussières, la réduction de ces rejets passe par une élimination des poussières (électrofiltres, filtres à manches33). Le traitement des gaz acides (lavage) permet également un abattement de la quantité de poussières émises.
[33] Selon des avis d'experts, l'adoption de cette technique dans le secteur de la verrerie s'accompagnerait d'une diminution de la température des rejets ainsi que de la création d'un « gâteau » de filtration. Ceci pourrait concourir à la diminution de la concentration en arsenic gazeux dans les rejets dans une proportion indéterminée.
Industrie chimie inorganique, engrais, acides
Il n'existe pas de données spécifiques à l'arsenic ; mais il est possible de réduire ses émissions en piégeant les poussières.
Le BREF propose l'utilisation d'une ou d'une combinaison des techniques suivantes :
- Cyclone ;
- filtre en tissu ou en céramique ;
- dépoussiéreur par voie humide ;
- dépoussiéreur électrostatique.
Le tableau présenté en annexe 2 illustre les différentes techniques de traitement des effluents gazeux dans ce secteur d'activité.
Sidérurgie, aciérie
Aucune donnée spécifique à l'arsenic ne figure dans le BREF correspondant. Cependant, il donne des informations sur les techniques de traitement des rejets de métaux lourds.
La technique de traitement préconisée dans les installations d'agglomération est l'utilisation de systèmes d'épuration fine par voie humide pour éliminer les métaux lourds hydrosolubles ou l'utilisation d'un filtre à manches avec addition de chaux suivi par la mise en décharge contrôlée (enrobage hermétique, collecte et traitement des lixiviats) des poussières provenant du dernier champ de l'électrofiltre au lieu de les recycler vers la bande d'agglomération, éventuellement après extraction de l'eau et précipitation des métaux lourds afin de limiter la quantité à mettre en décharge.
Cimenterie
Dans les cimenteries comme pour les autres secteurs industriels, les émissions de métaux lourds non volatils sont réduites en diminuant les rejets de poussières de ces industries.
Les mesures primaires générales suivantes figurent parmi les meilleures techniques disponibles pour fabriquer le ciment. La sélection et le suivi rigoureux des matières introduites dans le four permettant de réduire les émissions : il est conseillé de choisir chaque fois que possible des matières premières et des
combustibles à faible teneur en soufre, azote, chlore, métaux et composés organiques volatils.
Les meilleures techniques disponibles pour réduire les émissions de poussières combinent les mesures primaires générales et les mesures suivantes :
- Minimisation/prévention des émissions de poussières des sources fugitives dans certaines conditions34 .
- Élimination efficace des matières particulaires des points sources au moyen de :
- filtres électrostatiques munis d'équipements de mesure et de contrôle à réaction rapide pour minimiser les pics,
- filtres à manches à plusieurs compartiments avec « détecteurs » de manches percées.
Le niveau d'émission moyen journalier associé aux MTD35 lors de l'utilisation de ces techniques est de 20 à 30 mg de poussières par m 3 . Il peut être atteint en équipant de filtres électrostatiques ou de filtres à manches, ou des deux systèmes.
Déchets – Traitement
Il n'existe pas de données pour le traitement des émissions d'arsenic dans l'air.
Il convient, comme pour les autres secteurs d'activité de limiter les rejets de poussières afin de diminuer les émissions d'arsenic dans l'air.
Conclusion de l'étude des BREF
Excepté pour l'industrie du verre, ces documents ne fournissent aucune recommandation concernant spécifiquement les émissions d'arsenic dans l'air. Seul le BREF sur l'industrie du verre recommande de sélectionner des matières premières dont
[34] Exemples de techniques de réduction des émissions fugitives de poussières (émissions dues à une perte progressive d'étanchéité d'un équipement conçu pour contenir un fluide (liquide ou gazeux) et dans lequel une différence de pression provoque une fuite):
-Protection contre le vent des matériaux stockés à ciel ouvert.
-Pulvérisation d'eau et d'agents chimiques permettant d'éviter la formation de poussières.
-Pavage, humidification des chaussées, propreté.
-Nettoyage par des systèmes d'aspiration fixes et mobiles.
-Ventilation et récupération dans des filtres à manches.
-Stockage en milieu clos avec système de manutention automatique.
[35] Meilleurs Techniques Disponibles.
le niveau de contamination en arsenic est très faible et d'utiliser le lavage des gaz acides pour diminuer les émissions.
L'arsenic étant majoritairement rejeté sous forme particulaire, les techniques de réduction des particules sont à recommander à l'ensemble des secteurs industriels émetteurs (cf. annexe 3 : techniques de réduction des émissions industrielles atmosphériques de poussières36) Néanmoins, en ce qui concerne l'arsenic, le taux de réduction des rejets ne peut être estimé qu'au cas par cas en fonction des rejets initiaux en particules d'une part et des teneurs en arsenic de ces particules d'autre part.
Cependant certaines études de l'INERIS démontrent que de l'arsenic peut être également rejeté sous forme gazeuse depuis un site industriel. A ce jour, les BREFs ne contiennent aucune information spécifique à la réduction des émissions d'arsenic gazeux.
Retour d'expérience des industriels de la chimie
Le paragraphe suivant reprend des informations qui nous ont été communiquées par certains industriels ayant une activité rejetant de l'arsenic dans l'atmosphère. Celles-ci ne doivent pas être prises comme un état des lieux des sites industriels français mais plutôt comme des indications concernant les mesures envisageables dans le secteur donné (ici, celui de la chimie).
A ce jour, il n'existe pas de système de traitement propre aux rejets atmosphériques d'arsenic d'origine industriel, mais les efforts se portent sur l'abattement de la pollution par les particules.
Par exemple, l'usine NOVACARB de la Madeleine (production de carbonate de calcium à destination des verreries) met en place des électro-filtres et espère atteindre des rejets de poussières voisins de 30 à 40 mg.m -3 dès 2008 (actuellement les rejets avoisinent 200 mg.m -3) pour se mettre en conformité avec la réglementation. Le coût de cette opération est estimé à 6 M€.
Une autre entreprise du secteur va ajouter un module de lavage des effluents à son système de dépollution originel (multi-cyclone et électrofiltre) afin d'atteindre des concentrations de poussières inférieures à 50 mg.m -3 (actuellement les rejets avoisinent 100 à 120 mg.m -3) Cette opération lui coûtera 1,5 M€.
[36] Cette annexe fait correspondre des quantités de particules émises aux différentes techniques envisageables. Néanmoins, ne connaissant pas les émissions industrielles, les taux de réduction que l'on peut attendre de l'installation de ces équipements demeurent non estimables.
Pour un autre acteur du secteur, les rejets d'arsenic proviennent des impuretés présentes dans l'acide fluorhydrique qu'il utilise. L'arsenic est présent dans les effluents liquides. Son élimination est obtenue par précipitation.
Réduction des émissions industrielles vers l'eau
FTE 2005 Importer
Traitement des rejets industriels d'arsenic dans les eaux
Selon le site internet de l'inspection des installations classées37 , la première technique de réduction des émissions de polluants dans l'eau est la réduction « à la source » qui passe par une meilleure maîtrise des procédés et se traduit par une moindre production d'effluents.
Quant à eux, les procédés de traitement avant émission consistent à piéger, concentrer ou transformer les substances polluantes afin de réduire les caractères polluants des effluents industriels avant rejet. Néanmoins, ces techniques aboutissent dans la majorité des cas à la production de déchets qu'il faut éliminer par ailleurs (boues, sels, concentrats, filtres usagés…).
Cette même source cite les techniques suivantes dans le cas du traitement avant émission de l'arsenic dans les eaux :
- précipitation ;
- adsorption ;
- résines échangeuses d'ions ;
- filtration sur membrane.
En se reportant aux documents BREF, les exemples suivants de traitements physico-chimiques avant rejet des eaux contenant de l'arsenic peuvent être retenus :.
Dans l'industrie extractive, la technique employée pour limiter les émissions d'arsenic dans les eaux est la précipitation par addition de sels ferriques pour atteindre des niveaux d'arsenic inférieurs à 0,5 mg.L-1 . A titre d'exemple, dans une mine de talc-magnésite en Finlande, les rendements des réactions de précipitation sont les suivants :
- si le pH est inférieur à 6 la précipitation de l'arsenic à la suite de l'ajout de sulfate ferrique est totale ;
- si le pH est supérieur à 6, la précipitation (en présence d'une quantité plus importante de sulfate que celle employée dans le cas précédent) aboutit à une teneur résiduelle en arsenic dans les eaux de 0,4 mg.L-1 .
[37] http://installationsclassees.ecologie.gouv.fr/5-Traitements-des-rejets.html
Dans l'industrie de production du plomb, l'arsenic est éliminé par oxydation par la réaction de l'arsenic avec une solution de nitrate de sodium et de soude caustique suivie d'un écrémage mécanique.
Dans le secteur de la chimie minérale, lors de la production d'acide phosphorique, l'arsenic est séparé de l'acide par précipitation à l'aide d'une solution de Na2S. Le précipité est éliminé par filtration. Le filtrat est traité avec les déchets chimiques dangereux.
Potabilisation des eaux contenant de l'arsenic
Différentes techniques tirées d'un guide « United Nations Synthesis Report on Arsenic in Drinking Water » (WHO, 2001) sont regroupées dans le tableau 8.1. Elles sont principalement adaptées à la potabilisation des eaux. Leur application à des rejets industriels pourrait s'avérer délicate et/ou non économiquement viable.
ARSENIC ET COMPOSES
INORGANIQUES : PANORAMA DES PRINCIPAUX EMETTEURS
Tableau 8.1. Résumé des technologies de potabilisation des eaux contenant de l'arsenic (WHO, 2001).

Réduction des émissions industrielles vers les sols
FTE 2005 Importer
Différents tests de dépollution des sols contaminés par l'arsenic ont été effectués en France. Une synthèse de tels travaux a été rédigée par le BRGM (2004). Nous présentons ci-dessous les méthodes présentées comme les plus prometteuses.
Méthodes physico-chimiques
- Lavage basique pour éliminer la plus grande part de la contamination, suivi d'un lavage aux phosphates (Clozel et al., 2002).
- Le lavage acide peut également être utilisé (Matera et al., 2002).
Extraction de métaux et métalloïde par bio-réduction
FTE 2005 Importer
- Utilisation de bactéries sulfato-réductrices.
Battaglia-Brunet et al.(2002) recensent les différents essais qui ont été effectués avec cette méthode.
- Bio-lixiviation en présence de microorganismes autotrophes ferro-oxydants et thio-oxydants et de soufre natif, en condition aérobie (Bayard et al. 2002).
Cependant cette méthode ne permet pas une réutilisation du sol de part son acidification importante et l'altération de la phase solide.
Phytoréhabilitation
Cette technique (toujours en cours de développement) est basée sur l'emploi de végétaux supérieurs capables de piéger des quantités importantes de métal, en particulier d'arsenic, du sol et de les transférer dans les parties supérieures est une alternative aux traitements physico-chimiques.
L'efficacité à long terme de cette technique demande à être validée par des essais en grandeur réelle même si les premiers résultats sont encourageants (Boisson et al., 1999, Mench et al.,. 2002, Mench et al., 2003).
Depuis l'achèvement des travaux du BRGM, d'autres techniques ont été testées, citons par exemple le couplage de techniques de bioréduction et de physico-chimie (Vaxevanidou et al., 2008). Néanmoins, ces travaux semblent toujours être à l'état de tests.
Selon le BRGM (2004), la méthode utilisée le plus fréquemment pour les sols pollués à l'arsenic reste le confinement avec ou sans étape de stabilisation/solidification préalable.
Réduction dans les déchets
FTE 2005 Importer
Le BREF consacré au traitement des déchets propose l'élimination des déchets arséniés par immobilisation c'est à dire une oxydation de As(III) suivi d'une étape de stabilisation / solidification.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










