Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Plomb (7439-92-1)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
7439-92-1
Nom scientifique (FR)
Plomb
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-100-4
Code SANDRE
1382
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Pb }\)
Code InChlKey
Code SMILES
[Pb]
Familles
Familles chimiques
Familles réglementaires
Classification CLP
Type de classification
Harmonisée
ATP insertion
ATP09/ATP21
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H360Fd |
|---|---|
| Mention du danger - Texte | Peut nuire à la Fertilité. Peut nuire au fœtus. |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M |
M = 10 |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M |
M = 10 |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H362 |
|---|---|
| Mention du danger - Texte | Peut être nocif pour les bébés nourris au lait maternel |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M |
M = 10 |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
207.20 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 11/07/2025
Matrices
Atmosphère
Les composés inorganiques du plomb ne sont pas volatils.
Milieu eau douce
La plupart des composés inorganiques du plomb (II) sont peu solubles ou insolubles dans l'eau (c'est par exemple le cas de PbS, PbCO3, PbSO4), les composés halogénés du plomb (chlorure, bromure) ou les acétates de plomb étant plus solubles (Bodek et al., 1988). Dans le milieu aquatique, le plomb a tendance à être éliminé de la colonne d'eau en migrant vers les sédiments par (1) adsorption sur la matière organique et les minéraux d'argile, (2) précipitation comme sel insoluble (carbonate, sulfate ou sulfure) et (3) réaction avec les ions hydriques et les oxydes de manganèse, mais la quantité de plomb restant en solution sera fonction du pH (HSDB, 2000).
Milieu terrestre
La mobilité du plomb dans le sol est très faible, il a ainsi tendance à s'accumuler dans les horizons de surface (et plus précisément dans les horizons riches en matière organique). Cela s'explique par la grande affinité de la matière organique vis à vis du plomb. Cela est valable pour le plomb naturel mais également pour le plomb anthropique, et spécialement pour des sols ayant au moins 5 % de matière organique et un pH supérieur à 5.
La formation de sulfure de plomb, forme très insoluble, explique également l'accumulation du plomb en surface des sols. L'affinité du plomb pour l'argile est également importante, il peut également être adsorbé par des oxydes de manganèse du sol (Adriano, 1986). Les facteurs affectant la mobilité et la biodisponibilité du plomb dans les sols sont donc le pH, la texture du sol (surtout la teneur en argile) et la teneur en matière organique.
Dans certains cas très particuliers, il a été montré que le plomb peut migrer vers les couches profondes du sol ; par exemple, lors de l'application de fortes quantités de boues (il y a alors production de complexes organo-métalliques solubles ou plus vraisemblablement un processus d'entraînement particulaire ; Juste et al., 1995) ou alors dans le cas de sols forestiers très acides (il y a alors migration avec la matière organique ; Baize, 1997). Le processus d'entraînement des particules du sol par des vers de terres ou d'autres organismes, ou la translocation dans les racines des plantes pourrait également expliquer la migration du plomb dans les couches profondes du sol (Adriano, 1986).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Non pertinent
Dégradabilité abiotique
Le plomb existe sous les états d'oxydation 0, +2 et +4, mais dans l'environnement, il est principalement sous l'état +2. Le degré +4 n'existe que dans des conditions extrêmement oxydantes, rarement rencontrées dans l'environnement. Le degré +2 est stable dans pratiquement toutes les conditions environnementales. Le plomb est rarement sous sa forme élémentaire (Bodek et al., 1988 ; Kabata-Pendias et Pendias, 1992). Le sulfure de plomb est la principale forme présente dans l'environnement (Bodek et al., 1988).
Dans les sols aérobies, la dégradation des composés du plomb très solubles conduit à la formation de composés plus stables comme Pb3(CO3)2(OH)2. Dans les sols anaérobies, la réduction de SO42- en S2- conduit à la formation de PbS, composé très insoluble et non réactif (Adriano, 1986).
Dans l'atmosphère, le plomb inorganique est principalement sous forme particulaire. Les principales formes du plomb (inorganique) dans l'air sont des carbonates, des oxycarbonates, des oxydes et des sulfates.
Dans le milieu aquatique, le plomb sous forme dissoute forme des complexes avec des ligands tels que HCO3-, CO32-, OH-, (OH-)2 en eau douce et tel que Cl-, CO32-, OH-, (OH-)2 ,Cl2, Cl3- en eau de mer. Il peut également se complexer avec des sulfates. La précipitation (pour des pH assez élevés), la sorption (adsorption sur des matières particulaires et sur sédiment) sont également des phénomènes importants. Le plomb dans les rivières est principalement sous forme de particules en suspension (HSDB, 2000).
Dans le sol, pendant la lixiviation, le sulfure de plomb est lentement oxydé et peut former des sulfates et s'incorporer dans des minéraux d'argile, des oxydes de fer ou de manganèse et la matière organique. Pour des pH du sol élevés, le plomb peut précipiter sous forme d'hydroxyde, phosphate ou carbonate, ou alors former des complexes Pb-organiques qui sont assez stables (Kabata-Pendias et Pendias, 1992).
Le plomb inorganique pourrait subir des réactions de méthylation, dans certaines conditions (Adriano, 1986 ; HSDB, 2000 ; Kabata-Pendias et Pendias, 1992).
Bioaccumulation
Organismes aquatiques
De nombreuses données sur la bioaccumulation (BCF, BAF) sont disponibles dans le « Voluntary European Union Risk Assessment Report, VRAR » qui a été élaboré par le « Lead Development Association International » et examiné par le « Scientific Committe on Health and Environmental Risks » (SCHER, 2009). Un récapitulatif des valeurs de BCF est rapporté dans le Tableau ci dessous
|
|
Valeur minimale |
Valeur médiane |
Valeur moyenne |
Valeur maximale |
Nombre total de données |
|---|---|---|---|---|---|
|
Poissons |
5 |
44 |
217 |
1322 |
13 |
|
Crustacés |
110 |
650 |
1257 |
8000 |
11 |
|
Mollusques |
110 |
354 |
598 |
2500 |
11 |
McGeer et al. (2003) ont démontré l’existence d’une relation négative entre la concentration de Pb dans l’eau et les valeurs de BCF et de BAF déterminés. Il apparait que les organismes d’eau douce peuvent réguler leur concentration interne de Pb, ce qui, avec la biodisponibilité, peut expliquer la variabilité des données.
L’ensemble des valeurs de BCF est cité dans le « Voluntary European Union Risk Assessment Report » et examiné par le « Scientific Committe on Health and Environmental Risks » (SCHER, 2009). L’ensemble du dossier VRAR est disponible sur le site de l’ECHA : http://echa.europa.eu/web/guest/voluntary-risk-assessment-reports-lead-and-lead-compounds
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Bioaccumulation du plomb dans les végétaux
Le plomb est absorbé passivement par les racines et est rapidement immobilisé dans les vacuoles des cellules racinaires ou retenu par les parois des cellules de l'endoderme. Son accumulation depuis le sol est assez limitée (Alloway, 1995). Le phénomène de translocation vers les parties aériennes des plantes est faible (Kabata-Pendias et Pendias, 1992).
La voie aérienne est également une voie d’exposition du plomb par les plantes. Mais les avis concernant l'absorption par pénétration foliaire divergent dans la littérature. Néanmoins, certaines études auraient montré qu'une grande partie du plomb déposé par voie atmosphérique sur les plantes peut être éliminé par lavage puisqu'il a peu pénétré dans la plante, (à cause d'une forte
rétention par les membranes cuticulaires fonctionnant comme une barrière efficace) (Juste et al., 1995 ; Kabata-Pendias et Pendias, 1992).
La quantité de matière organique présente dans le sol et le pH du sol ont une certaine influence sur l'absorption du plomb par les plantes. Bien qu'il ait été démontré que l'addition de matière organique au sol diminue la disponibilité du plomb pour les plantes, la décomposition éventuelle des composés organiques peut entraîner le relargage du plomb dans la solution du sol et donc favoriser l'accumulation du plomb par les racines. En plus de l'impact de la matière organique, il a été démontré que la modification du pH du sol par épandage de chaux ou d'engrais phosphaté diminue la quantité de plomb absorbée par les plantes (Adriano, 1986). Le potentiel redox du sol aurait également un effet sur le prélèvement du plomb par les racines.
Facteur de bioconcentration du plomb depuis les sols
L'INERIS recommande de consulter la Base de données sur les teneurs en éléments traces métalliques de plantes potagères - BAPPET V1.2[1] (ADEME, INERIS, CNAM, INP, ENSAT, ISA, INRA, 2012). La base indique des concentrations en plomb dans les végétaux et dans des sols, permettant de calculer un BCF ; pour certaines données, les concentrations dans d’autres milieux environnementaux (eau, air) sont également renseignées. Pour le plomb, 2050 couples de données végétaux-sol sont actuellement disponibles.
Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante, au sol, au contexte environnemental, à l’origine de la pollution, au type expérimental, etc.) afin de se rapprocher des conditions propres à la situation étudiée.
Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des ETM pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
[1] Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les éléments traces métalliques (ETM)[1], dont le plomb, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site http://www.ademe.fr/base-donnees-teneurs-elements-traces-metalliques-plantes-potageres-bappet-presentation-notice-dutilisation et fonctionne sur ACCESS 2003 et 2007.
Bibliographie
Toxicologie
Dernière vérification le 11/07/2025
Introduction
L'ensemble des informations et des données toxicologiques proviennent de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (Cézard et Haguenoer, 1992 ; IARC, 1989, 2006 ; INSERM, 1999 ; Lauwerys, 1998; INRS, 2006 ; ATSDR, 2007 ; Santé Canada, 2011). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Le plomb existe majoritairement sous la forme inorganique (Pb2+ et ses composés), par opposition à sa forme organique (essentiellement tétraalkyl de plomb)… Les connaissances dans ce domaine ne peuvent qu’être très partiellement corrélées aux données toxicologiques. Elles sont, en effet, obtenues à partir d’études expérimentales et épidémiologiques qui ne mentionnent que rarement la ou les formes chimiques du plomb mises en cause. Sauf indications particulières, les données toxicologiques présentées dans ce paragraphe concernent le plomb et ses dérivés inorganiques sans référence à la spéciation.
Le plomb pénètre dans l’organisme essentiellement par voie digestive et par voie pulmonaire.
Inhalation
L’absorption pulmonaire peut jouer un rôle important pour les expositions professionnelles ou pour les personnes vivant sous les rejets atmosphériques d’entreprises polluantes.
Le plomb atmosphérique peut exister sous forme de vapeurs ou de particules. Les vapeurs après migration jusqu’aux alvéoles pulmonaires, passent dans le sang. Les particules métalliques les plus grosses sont éliminées des voies respiratoires hautes par le tapis muco-ciliaire puis dégluties. Les plus fines (< 5 µm) diffusent à travers la muqueuse des voies aériennes profondes et passent dans le sang (Botta et al., 1976). Le taux de déposition des particules inhalées est de l’ordre de 30 à 50 % et dépend de la taille des particules et de la ventilation pulmonaire (Friberg et al., 1986). La solubilité des particules influe sur leur résorption et la demi-vie dans le poumon est de 6 à 12 heures. Les résultats de l’étude de Thompson, 1971 ont montré que 20 à 30 % du plomb inhalé étaient absorbés. Un individu respirant 1 µg Pb.m-3 d’air voit son taux sanguin de plomb augmenter de 3 à 20 µg.L-1 (Azar et al., 1975 ; Griffin et al., 1975).
Voie orale
Par voie digestive, les sources d’exposition environnementales sont les aliments (les légumes, le lait, l’eau, les boissons) et également les écailles de peinture, les poussières présentes en milieu domestique et les poussières présentes en milieu extérieur sur le sol ingérées particulièrement par les jeunes enfants (2 à 3 ans) par portage main-bouche. La biodisponibilité du plomb dans le tractus intestinal dépend de sa solubilité. Pour être absorbé, il doit, en effet, être transformé en sel hydrosoluble. Le transport du plomb à travers la membrane intestinale est actif, la diffusion passive représente moins de 20 % du flux total quelle que soit la concentration intraluminale.
Plusieurs auteurs s’accordent à donner des taux d’absorption par voie orale chez l’adulte compris entre 5 et 10 % pour des consommations journalières de 0,1 à 0,4 mg (DeMichele, 1984 ; Hursh et Suomela, 1968 ; Nriagu, 1978). Chez l’enfant, les taux d’absorption digestive sont beaucoup plus élevés que chez l’adulte. Ils sont de l’ordre de 20 % chez les enfants âgés d’une dizaine d’années et voisins de 50 % chez les enfants de moins de 2 ans (DeMichele, 1984 ; Ziegler et al., 1978).
De nombreux facteurs favorisent l’absorption du plomb : la vitamine D, un régime riche en graisses, les carences en fer, les régimes pauvres en calcium, phosphore, zinc, vitamine B1, magnésium et fibres végétales (DeMichele, 1984 ; Ito et al., 1987).
Voie cutanée
L’absorption cutanée est négligeable, sauf pour le plomb organique qui est très liposoluble (Botta et al., 1976). Des tests in vitro réalisés sur de la peau humaine ont permis de classer différents composés du plomb selon leur taux d’absorption par ordre décroissant : de plomb tétrabutyl > naphténate de plomb > acétate de plomb > oxyde de plomb (indétectable) (Bress et Bidanset, 1991). Pour une application de crème ou de solution contenant de l’acétate de plomb (en thérapeutique antivénérienne) (9 nmol.kg-1 ou 6 nmol.L-1) pendant 12 heures chez 8 volontaires sains, les travaux de Moore ont montré que le taux d’absorption de l’acétate de plomb était compris entre 0 et 0,3 % (Moore et al., 1980).
Distribution
Après absorption pulmonaire ou digestive, le plomb passe dans le sang où il se répartit entre une forme fixée aux hématies (au moins 95 %) non diffusible et une forme plasmatique fixée sur l’albumine qui sera stockable dans les tissus ou éliminée dans les urines (Alessio et al., 1978 ; Baloh, 1974 ; Ong et Lee, 1980). Le plomb sanguin représente environ 2 % du stock total de l’organisme et sa demi-vie chez l’adulte est en moyenne de 20 à 30 jours (Nilsson et al., 1991 ; Rabinowitz et al., 1976). Il correspond à un équilibre entre le plomb absorbé, le plomb stocké et le plomb éliminé par voie urinaire (Cézard et Haguenoer, 1992). Dans certains cas particuliers, comme chez le très jeune enfant, la part qui revient à l’absorption sera plus importante dans cet équilibre. Chez les personnes âgées, la femme enceinte ou en cas de maladies osseuses de sujets ayant été exposés, le plomb sanguin reflètera majoritairement la désorption du plomb stocké (INSERM, 1999). Ceci explique, au moins en partie, que la demi-vie du plomb sanguin a été estimée à 10 mois chez les enfants, ce qui les expose à un risque important d’intoxication par ingestion (Mushak, 1993). En utilisant le dosage des isotopes stables du plomb, une étude a montré chez l’homme faiblement contaminé (10 à 60 µg.L-1) et avec des taux osseux faibles (0,6 à 7 µg Pb.g-1), que le squelette contribue pour 40 à 70 % du plomb sanguin (Smith, 1996).
Les sels de plomb se fixent donc dans les différents tissus et en particulier au niveau de l’os où ils entrent en compétition avec les ions calcium (Ca2+) et sont majoritairement stockés (80 à 90 % du plomb total ; Wedeen, 1988). Cela peut représenter un total de 40 à 50 mg pour un individu soumis à une exposition environnementale, et plus de 200 mg dans le cas d'exposition professionnelle (Drasch et al., 1987 ; Wittmers et al., 1988). Indépendamment de l'activité professionnelle, les quantités de plomb accumulées sont en moyenne plus élevées chez l'homme que chez la femme (Yoshinaga et al., 1989).
La demi-vie du plomb osseux est très différente selon qu'il est présent dans l'os trabéculaire (2,4 ans) ou l'os cortica (Les os trabéculaire et cortical correspondent respectivement aux parties centrale et périphérique de l’os) l(en moyenne 9,5 ans et est très variable selon les os) (Christoffersson et al., 1986 ; Nilsson et al., 1991). Dans la mesure où 75 % du plomb se retrouvent dans l'os cortical, le relargage du plomb dans le sang et les tissus mous est un phénomène très lent, essentiellement lié à la résorption osseuse physiologique.
Les échanges pour le plomb fixé sur les tissus mous (reins, moelle osseuse, foie, rate, cerveau) sont plus rapides, et sa demi-vie y est d’environ 40 à 60 jours. Par ingestion, la fixation du plomb au niveau du foie et des reins est trois fois plus importante que par inhalation (Barthelemy et al., 1975). Les autopsies réalisées sur des salariés ont révélé une accumulation du plomb, par ordre décroissant, dans le foie, les reins, les poumons, le cerveau (Gerhardsson et al., 1995). L’accumulation sélective du plomb dans certaines zones du cerveau (hippocampe amygdale (noyau amygdalien ou amygdale cérébelleuse), plexus choroïdes (Réseau de capillaires situé dans les ventricules cérébraux et formant le liquide céphalorachidien)) et du cortex rénal a pu être observée chez l’homme (Amdur et al., 1996).
Le plomb s’accumule également dans les dents, les ongles et les cheveux. L’utilisation des dents de lait comme marqueurs rétrospectifs de l’exposition cumulée au plomb chez les enfants a progressivement été abandonnée dans les enquêtes épidémiologiques. Les derniers travaux semblent montrer que le plomb présent dans la dentine est davantage lié aux expositions précédant la chute de la dent de lait, et seul le taux sanguin à 57 mois peut être corrélé au taux de plomb de la dentine (Rabinowitz et al., 1993).
Le plomb passe facilement la barrière placentaire par simple diffusion et l’exposition prénatale constitue un risque important d’imprégnation du plomb par les nouveau-nés. Plusieurs études ont en effet montré qu’à la naissance, les plombémies maternelles et fœtales sont fortement corrélées (Goyer, 1990). En règle générale, les teneurs dans le lait maternel sont supérieures à celles mesurées dans le plasma de la mère, probablement en raison d’une mobilisation du plomb stocké dans les os liée aux besoins augmentés en calcium (Lagerkvist et al., 1996 ; Gulson et al., 1997).
Dans des situations particulières (grossesse, allaitement, ménopause) les modifications du métabolisme osseux peuvent entraîner une augmentation ponctuelle du relargage endogène de plomb. De même, certaines pathologies (hyperthyroïdie, ostéoporose, fracture) pourraient entraîner une mobilisation intense du plomb osseux et favoriser l’apparition de diverses manifestations neuropsychologiques ou le développement de perturbations de la fonction rénale (Berlin et al., 1995 ; Goldman et al., 1994).
Élimination
La principale voie d’excrétion est urinaire : 75 % au moins du plomb absorbé est éliminé par cette voie (Haguenoer et Furon, 1982). Le plomb se retrouve dans les urines à partir de l’ingestion quotidienne d’au moins 1 mg d’acétate de plomb, essentiellement sous forme ionisée libre lorsque les plombémies sont dans des limites normales (Kehoe, 1987). Pour des expositions modérées observées en milieu professionnel, les taux de plomb urinaires sont compris entre 0,05 et 0,20 mg.L-1 (Robinson, 1974). La cinétique d’excrétion urinaire serait bien plus lente chez l’enfant que chez l’adulte (Rabinowitz et al., 1977 ; Ziegler et al., 1978). L’excrétion urinaire résulte d’une filtration glomérulaire probablement suivie d’une réabsorption tubulaire partielle (Araki et al., 1986).
Le plomb non absorbé au niveau du tractus gastro-intestinal est éliminé par les fèces. Plus de 85 % du plomb ingéré dans l’eau de boisson par des adultes volontaires (0,3 à 3 mg de plomb.j-1 /16 à 28 semaines) sont excrétés et ce, majoritairement dans les fèces (90 %) (Kehoe, 1987).
Le plomb peut également s’éliminer par la salive, la sueur, les cheveux et les ongles. Négligeable dans des conditions normales, l’exposition à la chaleur peut entraîner chez l’homme une excrétion sudorale supérieure à l’élimination urinaire (Assayama et al., 1975).
Des travaux ont confirmé l’élimination d’une quantité appréciable de plomb par les cheveux (Watt et al., 1995). La teneur en plomb de 14 µg Pb.g-1 de cheveux pour une plombémie de 800 µg.L-1 diffère peu des valeurs plus anciennes qui mentionnaient des taux de 9, 15 et 48 µg Pb.g-1 mesurés dans les cheveux de sujets provenant respectivement de zones rurales, urbaines et de fonderies (Chattopadhyay et al., 1977) ou encore de 70 µg Pb.g-1 dans les cheveux d’un sujet ayant une plombémie de 600 µg.L-1 (Grandjean et Lintrup, 1978).
Autre
Mécanisme d'action :
Le plomb modifie le fonctionnement cellulaire en perturbant de nombreuses voies métaboliques et différents processus physiologiques. Le plomb libre ionisé inhibe l’activité de certaines enzymes et en particulier de l’acide aminolévulinique déshydratase (ALAD) érythrocytaire, qui intervient en présence de zinc dans la synthèse de l’hème. Les principales conséquences de cette inhibition sont l’augmentation des taux sanguins d’acide delta aminolévulinique (ALA) et de protoporphyrines érythrocytaires, généralement mesurées sous forme de protoporphyrines-zinc.
L’activité prooxydante des formes ioniques du plomb a été étudiée et démontrée dans de nombreuses études. Le plomb joue in vitro un rôle de catalyseur des réactions de peroxydation des lipides avec production de radicaux libres. Ce mécanisme de toxicité cellulaire est particulièrement invoqué à propos des troubles des fonctions de reproduction (INSERM, 1999).
Le plomb modifie l’homéostasie calcique et interfère avec les processus cellulaires et moléculaires médiés par le calcium aux niveaux membranaire et cytoplasmique. Quelques études particulièrement pertinentes ont mis en évidence une action spécifique du plomb sur les récepteurs du glutamate (NMDA). Ces modifications sont vraisemblablement à l’origine des effets du plomb sur le système nerveux central (Alkondon et al., 1990).
Chez l'animal
Absorption
La plupart des connaissances acquises à partir des études réalisées chez l’homme (enfants, adultes) et vérifiées chez l’animal ne seront pas mentionnées dans ce paragraphe, à l’exception de certains points particuliers complémentaires aux données humaines présentées ci-dessus.
Les études expérimentales ont confirmé l’influence de l’âge sur l’absorption du plomb par le tractus gastro-intestinal, probablement à cause d'un processus de maturation selon lequel l'intestin perdrait au cours de la vie sa capacité à absorber des particules par pinocytose (US EPA, 1986). En effet, le taux d’absorption intestinal est d’environ 83 % pour un rat de 19 jours et 16 % pour un rat de 89 j ; chez le singe, il est de, 38 % chez les jeunes et de 26 % chez les adultes (Forbes et Reina, 1972 ; IARC, 1980 ; Pounds et al., 1978).
Distribution
La distribution du plomb dans les tissus mous a fait l’objet d’une étude chez le rat qui mentionne après 90 jours d’exposition à deux concentrations différentes de 1,7 et 17 mg Pb.kg-1.j-1, une accumulation préférentielle de plomb au niveau des reins et du cerveau, avec néanmoins une plombémie stable chez les animaux les moins exposés (10 à 20 µg.L-1) identique aux témoins (Areola et al., 1999). À la plus forte concentration, la rate, la prostate, le cœur, les testicules et le foie présentaient également des concentrations anormalement élevées en plomb.
Si, chez les rats immatures, le plomb semble se concentrer dans le cortex frontal (Bradbury et Deane, 1993), l’étude de Widzowski n'a montré aucune accumulation sélective du plomb dans les différentes zones du cerveau chez le rat adulte, à l'inverse des conclusions issues d'autres études chez l’animal (Collins et al., 1982 ; Scheuhammer et Cherian, 1982 ; Widzowski et al., 1994) et également chez l’homme. Ce résultat est néanmoins cohérent avec l’hypothèse selon laquelle il s’agirait plus d’un artefact de préparation que d’une accumulation réelle de plomb (Widzowski et al., 1994).
Une étude expérimentale réalisée par Mc Neill chez des singes d’environ 30 ans, qui n’avaient plus été exposés depuis une dizaine d’années, confirme le relargage du plomb avec une demi-vie osseuse de l’ordre de 3 ans (plus ou moins 1 an) (McNeill et al., 1997).
La transmission placentaire du plomb de la mère au fœtus, très étudiée chez la femme, a également été reproduite expérimentalement. Cette exposition placentaire induit chez le rat nouveau-né une encéphalopathie (Thomas et al., 1971). Des travaux plus récents ont montré chez le singe que 7 à 39 % du plomb transmis au fœtus étaient issus du squelette de la mère (Franklin et al., 1997). Le plomb pourrait augmenter la déminéralisation osseuse en inhibant l’activation de la vitamine D, diminuant la fixation du calcium et également en interférant avec la régulation hormonale du métabolisme osseux (Silbergeld, 1991).
Maldonado-Vega et collaborateursont montré chez des rats que la gestation et la lactation, en augmentant les besoins en Ca2+, favorisaient à la fois l’absorption de plomb et également sa résorption osseuse (Maldonado-Vega et al., 1996). Le lait maternel est responsable approximativement à 25 % (chez la souris) et à 33 % du passage du plomb de la mère à l’enfant (Keller et Dohery, 1980 ; Palminger Hallen et al., 1996). L’intoxication du nouveau-né par le lait contaminé serait donc une voie prépondérante.
Synthèse
L’absorption par voie orale est comprise entre 5 et 10 % chez l’adulte. Elle est de 20 à 50 % chez les enfants. Vingt à trente pour cent sont absorbés au niveau pulmonaire ; l’absorption cutanée est, quant à elle, négligeable. Une fois absorbé, la distribution du plomb inorganique est rapide à partir du plasma sanguin majoritairement vers les érythrocytes, puis le reste vers les tissus mous et les os ; le plomb est alors retrouvé majoritairement dans les os, ainsi que dans le système nerveux central et périphérique, le foie ou les reins. Chez l’adulte, le temps de ½ vie est très variable en fonction du compartiment de stockage, avec un passage possible de la barrière placentaire. L’excrétion se fait soit via les fèces pour le plomb non absorbé, soit via les urines et la bile.
Toxicité aiguë
Généralités
Chez l'homme
Toutes voies
Les effets rapportés dans la littérature concernent majoritairement les composés inorganiques du plomb, formes prédominantes dans l’environnement.
L’intoxication aiguë ne se rencontre plus que très rarement aussi bien dans l’industrie qu’en milieu non professionnel, mais elle peut néanmoins se produire par inhalation ou par ingestion, dans des situations accidentelles. L’essentiel des données rapportées dans la littérature concerne l’absorption de plomb ou ses dérivés par voie orale.
Inhalation
Les seules données disponibles concernent des expositions à des composés organiques.
Voie orale
Les troubles digestifs sont les symptômes les plus précoces. Ils se traduisent par l'apparition de fortes coliques associées à des douleurs et crampes abdominales, ainsi qu'à des vomissements (Awad el Karim et al., 1986 ; Haguenoer et Furon, 1982 ; Pollock et Ibels, 1986 ; Schneitzer et al., 1990 ; Rosenman et al., 2003). Ces effets apparaissent en général pour une plombémie comprise entre 1 000 et 2 000 µg.L-1, mais peuvent se déclarer chez certains sujets à des taux bien plus faibles compris entre 400 et 600 µg.L-1.
Ces symptômes sont décrits lors d’intoxication aiguë de l’enfant par le plomb, à partir de concentrations comprises entre 600 et 1 000 µg.L-1 (NAS, 1972). En plus des coliques, les enfants présentaient des signes de constipation sévère, souffraient d’anorexie et de vomissements intermittents.
L'atteinte rénale a été décrite par différents auteurs, et plusieurs s'accordent à mentionner l'apparition de lésions tubulaires caractérisées par une albuminurie, une glycosurie, une hyperphosphaturie, une diminution de la clairance à la créatinine et une oligurie (Abed et al., 1973 ; Bennett, 1985 ; Cramer et al., 1974 ; Malcolm, 1970). La sévérité des lésions peut aller jusqu'à entraîner la mort des sujets exposés, mais l'administration rapide d'un traitement rend en principe les effets réversibles (Cézard et Haguenoer, 1992).
En cas d’intoxication sévère, les lésions au niveau du système nerveux central se manifestent cliniquement par une encéphalopathie (ralentissement idéo-moteur, troubles de l’humeur, céphalées) puis un coma avec parfois des convulsions. Plutôt rares chez l’adulte et pour des plombémies extrêmement élevées (4 600 µg.L-1 ; Kehoe, 1961), ces manifestations sont plus fréquemment rencontrées chez l’enfant pour des intoxications avec des plombémies de 900 à 8 000 µg.L-1 (NAS, 1972). Des séquelles neurologiques ou psychomotrices graves (retard psychomoteur, épilepsie, cécité, hémiparésie) ont été décrites. Des encéphalites aiguës ont également été observées sur des enfants d’environ 4 mois intoxiqués par voie médicamenteuse et présentant des plombémies comprises entre 490 et 3 310 µg.L-1 (al Khayat et al., 1997).
Dans les intoxications sévères, une hémolyse intra-vasculaire est possible.
L’exposition au plomb entraîne une anémie liée à une perturbation de la synthèse de l’hème. Initialement c’est une anémie normochrome, normocytaire, régénérative (réticulocytose), avec un dosage du fer sérique et de la ferritine augmentés. L’examen cytologique du sang retrouve typiquement des hématies à granulations basophiles. L’acide delta aminolévulinique urinaire est constamment élevé. Chez l’enfant, l’anémie est plutôt hypochrome microcytaire associée à une carence en fer.
Des altérations des performances du métabolisme hépatique ont parfois été observées chez des enfants présentant des signes d’intoxication aiguë par le plomb. Elles se manifestent par la réduction des capacités de métabolisation de certains médicaments (antipyrine, EDTA) qui serait liée à la diminution de la synthèse des cytochromes P450 (Alvares et al., 1975 ; Saenger et al., 1984). Selon Silbergeld et Lamon, seule une exposition aiguë serait responsable de tels effets sur le métabolisme hépatique (Silbergeld et Lamon, 1980).
Synthèse
Chez l’homme, une intoxication aiguë au plomb se traduit par des troubles digestifs, des atteintes rénales tubulaires et hépatiques, des effets sur le système nerveux central ainsi qu’une perturbation de la synthèse de l’hème.
Chez l'animal
Toutes voies
Les études de toxicité aiguë du plomb et de ses dérivés inorganiques sont très limitées chez l’animal. Les doses ou concentrations létales ne sont pas connues. Les rares études (essentiellement par voie orale) mentionnent des atteintes hématologiques, rénales, immunologiques et neurologiques, survenant souvent pour des expositions élevées.
Inhalation
L'étude des macrophages recueillis chez des lapins exposés par inhalation (nez seul) 4 jours, 3 h.j-1, à des concentrations de 0,028 mg.m-3 de particules d'oxyde de plomb (PbO) a montré une diminution de leur pouvoir de phagocytose, une augmentation de la libération spontanée de peroxyde d'hydrogène, ainsi que des modifications de la sécrétion de certaines cytokines (cellules préstimulées aux lipopolysaccharides ; Zelikoff et al., 1993).
Voie orale
Chez le rat, la prise dans l’eau de boisson de doses approximatives de 146 mg d’acétate de plomb kg.jour-1 pendant 6 jours entraîne une diminution significative de l’ALAD érythrocytaire (Simmonds et al., 1995). Les taux de plomb sanguin atteignent après 24 heures des concentrations de 440 µg.L-1 qui baissent ensuite à des concentrations assez stables voisines de 100 µg.L-1.
Les effets sur la synthèse de l’hème, avec une augmentation au niveau rénal et hépatique de l’activité de l’ALA synthase, ont également été mentionnés après l’administration d’une dose unique d’acétate de plomb par gavage, chez le rat (Chmielnicka et al., 1994). L’augmentation du taux de protoporphyrines-zinc (PPZ) sanguin a également été observée chez des rats exposés à une concentration de plomb estimée à 17,5 mg.kg-1.j-1 pendant 10 jours (Minnema et Hammond, 1994). Ces animaux ont, par ailleurs, enregistré une perte pondérale d’environ 20 %, liée à une diminution de la consommation de boisson et de nourriture.
L'atteinte rénale lors d’intoxication aiguë par le plomb se caractérise également par une réduction de la capacité de résorption des composés de faible poids moléculaire, tels que les acides aminés, le glucose et le phosphate (INSERM, 1999).
Les effets sur le système immunitaire ont été étudiés chez des souris immunisées par des globules rouges de mouton et exposées à une dose unique de 2,6 mg.kg-1.j-1 d'acétate de plomb par gavage (Hillam et Ozkan, 1986). Les auteurs ont pu observer chez les animaux exposés une diminution significative du poids du thymus et de la rate, ainsi qu'une baisse du taux de leucocytes circulants.
Les effets du plomb ou de ses dérivés inorganiques sur la physiopathologie du système nerveux ont pu être observés dans plusieurs études réalisées chez de jeunes rats ou souris exposés oralement à de l'acétate ou du carbonate de plomb. Pour des plombémies comprises entre 2 600 et 4 000 µg.L-1, les auteurs ont constaté des diminutions ou retards dans le développement de l'hippocampe (Alfano et al., 1982 ; Slomianka et al., 1989), du cortex cérébral (Petit et Leboutillier, 1979), une réduction du nombre et de la taille des axones du nerf optique (Tennekoon et al., 1979) et une démyélinisation des nerfs périphériques moteurs (Windebank et al., 1980).
Concernant l'aspect neurocomportemental, les études portent en général sur des temps d'exposition dépassant deux semaines et seront donc présentées au paragraphe suivant.
Synthèse
Chez les animaux, les mêmes effets que chez l'homme sont observés.
Toxicité à doses répétées
Effets généraux
Généralités
Si l’exposition par ingestion prédomine dans la population générale, et l’inhalation en milieu professionnel, ces deux voies sont le plus souvent indiscernables l’une de l’autre. Pour pallier la difficulté qui consiste à identifier ces différentes voies et sources d’exposition, les effets du plomb chez l’homme sont identifiés à partir de la dose interne de plomb mesurée dans le sang (plombémie).
Une étude de l’INVS (2011) a investigué la plombémie de la population adulte française (Fréry et al., 2011). Les résultats sont présentés pour la population de 18 à 74 ans non professionnellement exposée au plomb (à partir de l’échantillon de l’étude nationale nutrition santé de 1 949 individus). Aucun dosage de plombémie ne se situait sous la limite de détection (LOD) ; en revanche, 67 valeurs (3,3 %) étaient comprises entre la limite de détection (2 μg.L-1) et la limite de quantification (10 μg.L-1).
La moyenne géométrique des plombémies était de 25,7 μg.L-1 [24,9-26,5], la médiane de 25 μg.L-1, et le 95e percentile était égal à 73 μg.L-1. Les résultats incluant les personnes exposées professionnellement étaient les mêmes pour tous les percentiles et peu différents pour les moyennes géométrique et arithmétique.
Parmi les trois classes d'âge, tous les paramètres de la distribution augmentaient avec l'âge ; la moyenne géométrique des plombémies était égale à 18,7 μg.L-1 [17,8-19,6] dans la classe d'âge des plus jeunes (18-39 ans), à 30,0 μg.L-1 [28,2-30,5] dans la classe d'âge intermédiaire (40-59 ans) et à 39,3 μg.L-1 [37,7-41,1] dans le groupe le plus âgé (60-74 ans).
La moyenne géométrique des plombémies et tous les percentiles étaient plus élevés chez les hommes (mH) que chez les femmes (mF) (mH = 30,0 μg.L-1 [28,7-31,3], mF = 22,1 μg.L-1 [21,2 μg.L-1-23,0 μg.L-1]). En 10 ans (2006-2007 versus 1995), on a observé en France une baisse importante de la moyenne des plombémies (-60 %) et de la prévalence des plombémies élevées (-95 %) chez les hommes âgés en moyenne de 21,5 ans.
Ces valeurs sont plus élevées que celles mesurées dans la population américaine : moyenne géométrique de 15,2 µg.L-1 et médiane de 15 µg.L-1 (CDC, 2009), ces différences sont probablement liées à des mesures de suppression du plomb dans l’essence et dans les canalisations d’eau plus anciennes qu’en France.
En France, chez les femmes et les hommes de moins de 40 ans, la valeur de référence de la plombémie proposée est de 70 μg.L-1 (Fréry et al., 2011). Chez les hommes de 40 ans et plus, elle est de 120 μg.L-1.
Chez l'homme
Toutes voies
De nombreuses études ont été menées pour évaluer les effets d’une exposition au plomb tant par inhalation que par voie orale. Les effets sont généralement décrits en fonction de la plombémie plus qu’en fonction de la voie d’exposition. Compte tenu des effets liés à des expositions élevées, une politique limitant les expositions a été menée tant en Amérique du Nord qu’en Europe. Cependant plusieurs rapports de synthèse soulignent que les études les plus récentes menées pour des plombémies inférieures à 100 µg.L-1 mettaient encore en évidence certains des effets (EFSA, 2010 ; Académie Nationale de Pharmacie, 2011 ; Santé Canada, 2011 ; ANSES, 2013). Il s’agit principalement d’effets neurologiques, rénaux et cardiovasculaires pour des niveaux d’exposition de l’ordre de 15-20 µg.L-1 ce qui conduit à considérer le plomb comme un toxique sans seuil (Il s’agit bien d’un effet pour lequel il n’est pas possible de déterminer le seuil).
Effets sur le système nerveux central
Chez l’adulte, les intoxications chroniques qualifiées de sévères (plombémies > 1 500 µg.L-1) se traduisent par une encéphalopathie saturnine grave, devenue très rare en milieu professionnel (Gilioli et Grazia-Cassitto, 1978 ; Lauwerys, 1998). Les symptômes précoces se développent en quelques semaines et comprennent l’ennui, une certaine irritabilité, une difficulté à maintenir son attention, des maux de tête, une perte de mémoire et des hallucinations.
Pour des intoxications moins importantes (plombémies < 1 000 µg.L-1) des troubles neurologiques ont été observés chez l’adulte comme chez l’enfant : irritabilité, troubles du sommeil, anxiété, pertes de mémoire, confusion, asthénie (Awad el Karim et al., 1986 ; Haenninen et al., 1979 ; Pasternak et al., 1989 ; Lucchini et al., 2000 ; Rosenman et al., 2003). Chez des salariés dont la plombémie oscillait entre 260 et 660 µg.L-1, des perturbations de la mémoire, du temps de réaction et de l’habileté manuelle sont mises en évidence (Hogstedt et al., 1983 ; Schwartz et al., 2005). A partir de symptômes similaires, des relations de type dose-réponse ont pu être observées sur des travailleurs répartis, en fonction de leur taux de plombémies, en trois groupes qualifiés à l’époque de « faibles » (plombémie autour de 200 µg.L-1), moyennes (plombémie entre 210 et 400 µg.L-1) ou fortes (plombémie entre 410 et 800 µg.L-1 ) (Campara et al., 1984 ; Stollery et al., 1991 ; Zimmermann Tansella et al., 1983). Les sujets les plus exposés ont, entre autre, montré de fortes perturbations neurocomportementales et psychomotrices, avec notamment une réduction des capacités de raisonnement et des performances visuo-motrices (Barth et al., 2002 ; Lucchini et al., 2000).
Si la plupart des études réalisées en milieu professionnel mentionnent l'apparition fréquente de ces troubles neurologiques pour des plombémies comprises entre 400 et 800 µg.L-1, d'autres auteurs estiment qu'il n'existe pas de niveau seuil pour l'action toxique du plomb sur le système nerveux central (Betta, 1983 ; Mantere et al., 1982). Enfin, de fortes corrélations ont été obtenues entre l'altération des fonctions neuropsychologiques et l'absorption cumulée de plomb, qui constituerait un meilleur indicateur que la mesure ponctuelle de la plombémie effectuée en même temps que l'examen neuro-psychique (Lindgren et al., 1996).
L'implication du plomb sur la fonction cognitive des personnes âgées a été étudiée. Elle a mis en évidence une diminution des performances cognitives associé aux niveaux de plomb dans les os (Muldoon et al., 1996 ; Payton et al., 1998). Ces effets ont également été mis en évidence récemment chez les travailleurs (Haenninen et al., 1979 ; Bleecker et al., 2005 ; Chen et al., 2005 ; Lindgren et al., 2003). Les scores les plus faibles aux tests (mémoire, orientation spatiale, concentration, dextérité) ont été obtenus par les personnes les plus exposées, présentant cependant des plombémies assez faibles voisines de 200 µg.L-1 (calculées à partir de l’exposition). Les taux de plomb mesurés dans le tibia par fluorescence X sont également assez bien corrélés aux résultats des différents tests malgré une assez grande imprécision de la mesure signalée par les auteurs. Sur la base de ces mêmes tests, des différences significatives en terme de performance ont été observées dans deux groupes de femmes ayant des plombémies > à 80 µg.L-1 ou < à 30 µg.L-1. Une étude, réalisée chez 526 personnes âgées de 67,1 ans en moyenne et présentant une plombémie de 63 µg.L-1 (Rhodes et al., 2003), montre que le taux de plomb patellaire est significativement associé au développement de symptômes psychiatriques tels que l’anxiété, la dépression ou les phobies. L’exposition au plomb limite les réponses aux tests des fonctions cognitives et une part des déficiences cognitives dites « dues à l’âge » pourrait être attribuable à la présence de neurotoxiques dans l’environnement tel que le plomb (Shih et al., 2006).
Chez l’enfant, un effet sur le développement cérébral et les fonctions cognitives a été observé. A la différence des intoxications aiguës, la symptomatologie d’une intoxication à long terme est subtile et peu spécifique. Ce sont les études épidémiologiques qui ont mis en évidence les conséquences à long terme de l'intoxication chronique par le plomb (plombémie inférieure à 400 µg.L-1) sur le développement psychomoteur ou intellectuel et sur le comportement scolaire des enfants.
Les études transversales chez des enfants d'âge scolaire entre 6 et 12 ans montrent dans leur majorité un effet de l'exposition au plomb sur la baisse du QI qui peut varier selon les auteurs de 4 à 7 points (Dudek et Merecz, 1997 ; Lansdown et al., 1986 ; Needleman et al., 1979 ; Winneke et al., 1982). Les méta-analyses donnent par ailleurs une fourchette de 1 à 3 points de baisse de QI pour une augmentation de la plombémie de 100 µg.L-1, et ceci pour des niveaux compris entre 100 et 400 µg.L-1 (Bellinger et al., 1994 ; Needleman et al., 1990). Des troubles du comportement de type hyperactivité, inattention et impulsivité sont également souvent associés à des plombémies supérieures à 110 µg.L-1 ou un taux de plomb dentaire > 8 µg.g-1 (Fergusson et al., 1993 ; Fulton et al., 1987 ; Thomson et al., 1989 ; Winneke et al., 1983). De faibles plombémies peuvent donc être considérées comme un facteur de risque pour le développement d’hyperactivité (Ha et al., 2009).
Des études longitudinales ont mis en exergue le lien entre l'exposition prénatale, consécutive à la mobilisation du plomb contenu dans le squelette de la mère, et le développement psychomoteur des enfants de 3 mois à 2 ans (Bellinger et al., 1987 ; Dietrich et al., 1987 ; Wasserman et al., 1992). Ces études confirment également les effets à long terme d’une exposition au plomb en période postnatale sur le développement psychomoteur, la fonction cognitive et l’intégration visuelle-motrice de l’enfant (Baghurst et al., 1995 ; McMichael et al., 1988), mais aussi sur la mémoire auditive (Counter et al., 2008). L’étude de Tong et collaborateurs a montré que les diminutions de plombémie les plus importantes, enregistrées chez les enfants suivis entre l’âge de 2 ans et l’âge de 11-13 ans, ne sont associées qu’à une amélioration partielle des fonctions cognitives (Tong et al., 1998).
Ce résultat illustre la grande vulnérabilité du système nerveux en développement et des conséquences à long terme des atteintes précoces. Toutefois, l’étude de Chen et al. va plus loin en montrant que l’exposition au plomb est toxique même pour les enfants scolarisés et que les dommages ne sont pas seulement présents lorsqu’ils sont âgés de 2-3 ans (Chen et al., 2005). Certaines études suggèrent que, pour éviter les effets sur le système nerveux central de l’exposition in utero, la plombémie des femmes en âge de procréer ne devrait pas dépasser 100 µg.L-1 mais cette valeur pourrait être révue à la baisse, en fonction des connaissances sur les effets aux plus faibles doses (Sciarillo et al., 1992 ; Shukla et al., 1991).
La toxicité neurologique du plomb est particulièrement préoccupante chez l’enfant (Thacker et al., 1992), d’autant plus que les études récentes sur ce sujet suggèrent l’absence de seuil pour les effets du plomb sur les fonctions intellectuelles des enfants (Lidsky et Schneider, 2003 ;Bellinger, 2004 ; Chiodo et al., 2004 ; Koller et al., 2004; Jedrychowski et al., 2008 ; Needleman, 2004). Comme le rapportent les synthèses publiées en 2010 par l’EFSA et en 2011 aussi bien par l’Académie nationale de Pharmacie que Santé Canada, de nombreuses études chez l’enfant montrent que les effets neurologiques surviennent pour des expositions inférieures à 100 µg.L-1 (Canfield et al., 2003 ; Canfield et al., 2003b ; Chandramouli et al., 2009 ; Chiodo et al., 2004 ; Chiodo et al., 2007 ; Despres et al., 2005 ; Fraser et al., 2006 ; Lanphear et al., 2000 ; Miranda et al., 2007 ; Osman et al., 1999) et nombre d’études font état d’une relation dose-réponse jusqu’à des plombémies de 10 à 20 µg.L-1 (Canfield et al., 2003 ; Chiodo et al., 2004 ; Jedrychowski et al., 2009 ; Jusko et al., 2008 ; Lanphear et al., 2005 ; Miranda et al., 2007 ; Tellez-Rojo et al., 2006).
Des plombémies inférieures à 100 µg.L-1 sont associées à des effets sur le comportement tels que le trouble d’hyperactivité avec déficit de l’attention (Ha et al., 2009 ; Nigg et al., 2008 ; Nigg et al., 2010 ; Wang et al., 2008). Même si un lien commence à être établi entre trouble d’hyperactivité avec déficit de l’attention et exposition au plomb à des niveaux très bas, les données actuelles sont insuffisantes pour conclure (Eubig et al., 2010 ; Santé Canada, 2011).
La baisse du quotient intellectuel (QI), du niveau de lecture, de calcul, des troubles de comportement à des taux inférieurs à 100 µg.L-1 chez les enfants a été mise en évidence dans de nombreuses études (Bellinger et al., 1992 ; Bellinger et Needleman, 2003 ; Bellinger, 2004 ; Bernard, 2003 ; Canfield et al., 2003 ; Canfield et al., 2003b ; Chiodo et al., 2004 ; Chiodo et al., 2007 ; Chandramouli et al., 2009 ; Kim et al., 2010 ; Laidlaw et Taylor, 2011 ; Min et al., 2009 ; Miranda et al., 2007 ; Nigg et al., 2010 ; Surkan et al., 2007). Les effets du plomb entrainent une diminution de QI plus intense pour des plombémies en dessous de 100 µg.L-1. Une perte de 7,4 points de QI entre 10 et 100 µg.L-1 et la perte est de 3 à 4 points de QI pour chaque incrément de 100 µg.L-1 au-delà du seuil de 100 µg.L-1 est également retenue (Canfield et al., 2003 ; Ha et al., 2009 ; Jusko et al., 2008 ; Lanphear et al., 2005 ; Schnaas et al., 2006 ; Surkan et al., 2007 ; Tellez-Rojo et al., 2006). A partir des différentes études l’EFSA a calculé une BMDL01 de 12 µg.L-1 pour le déficit intellectuel chez l’enfant en prenant comme effet critique l’abaissement du score au test du QI ce qui correspond à une dose journalière de 0,50 µg.kg-1.j-1 (EFSA, 2010). D’autres études ont aussi montré que les retards de développement sont d’autant plus significatifs que les expositions ont été plus précoces et surtout au cours du premier semestre de la grossesse (Hu et al., 2006). Enfin, une association entre le volume de matière grise chez l’adulte et l’âge précoce d’exposition au plomb a été également été mise en évidence pour des expositions au faibles doses (Brubaker et al., 2010).
Parmi les études chez l’enfant, celle de Lanphear et al. a été retenue par l’EFSA pour proposer sa benchmark dose (Lanphear et al., 2005 ; EFSA, 2010). Cette étude a collecté à partir d’une population de 1 333 enfants suivis de la naissance jusqu’à l’âge 5-10 ans au cours de 7 études longitudinales de cohortes internationales les résultats aux tests d’intelligence et la plombémie associée. Les plombémies sont de 178 µg.L-1 et diminue à 94 µg.L-1 entre 5 et 10 ans. Après ajustement, une relation inverse entre plombémie et résultats aux tests du QI est mise en évidence. Les diminutions du point de QI estimées en association avec une augmentation de la plombémie de 0,24 à 1 µg.L-1, 1 à 2 µg.L-1 et de 2 à 3 µg.L-1 sont de 3,9 [IC 95 %, 2,4-5,3], 1,9 [IC 95 %, 1,2-2,6] et 1,1 [IC 95 %, 0,7-1,5].
Une nouvelle métaanalyse de 7 cohortes (Bellinger et al., 1992 ; Baghurst et al., 1992 ; Canfield et al., 2003 ; Dietrich et al., 1993 ; Ernhart et al., 1989 ; Schnaas et al., 2000 ; Wasserman et al., 1997) a permis le calcul d’une benchmark Dose BMDL entre 0,1 et 1,0 µg.dL-1 soit 1 à 10 µg.L-1 pour une diminution d’un point de QI chez l’enfant (Budtz-Jorgensen et al., 2013).
Effets sur le système nerveux périphérique
Des plombémies élevées (> 700 µg.L-1) sont associées à des paralysies au niveau des membres supérieurs. Ces effets sont devenus rares, compte tenu des niveaux d’intoxication habituellement rencontrés dans nos régions. La description historique est celle de la paralysie antibrachiale pseudo-radiale (atteinte racine C7) : l’atteinte motrice concerne initialement les 3ème et 4ème doigts de la main avec respect du long supinateur (le sujet « fait les cornes »). Les extenseurs des autres doigts et du poignet sont ensuite touchés.
Plus souvent, il s’agit d’atteintes mineures de type paresthésie, faiblesse musculaire, crampes, etc... Pour des plombémies moyennes de 630 µg.L-1, 26 des 31 personnes examinées présentaient une faiblesse des muscles extenseurs du poignet et 6 des muscles péroniers, entraînant une chute du pied (Yeh et al., 1995).
Les méthodes de détection relatives aux effets du plomb sur le système nerveux périphérique se sont, dans la grande majorité des études, focalisées sur la mesure de la vitesse de conduction nerveuse. Sur la base d’une revue de nombreuses études publiées jusqu’en 1986, Ehle arrive à la conclusion que la modification de la vitesse de conduction et les altérations électromyographiques sont exceptionnelles lorsque la plombémie reste inférieure à 600 µg.L-1 Ehle, 1986. Cette analyse ne tient pas compte des résultats de l’étude de Seppalainen montrant une réduction de la vitesse de conduction des nerfs médian et ulnaire (nerfs du bras et de l’avant bras) chez des hommes après 1 an d’exposition professionnelle au plomb (plombémies entre 300 et 480 µg.L-1, Seppalainen et al., 1983). L’observation de ce groupe après 2 ou 4 ans d’exposition montre une atteinte neurologique persistante au niveau du nerf médian.
La méta-analyse de Davis ou encore l’étude de Chia suggèrent que le niveau sans effet sur les nerfs périphériques est inférieur à 400 µg.L-1 (Davis et al., 1990 ; Chia et al., 1996). Il semblerait cependant que le seuil d’apparition de ces effets soit légèrement supérieur au seuil d’apparition des effets au niveau du système nerveux central.
Chez l’enfant, le réexamen par Schwartz d’études antérieures a permis de déterminer un seuil de 200 à 300 µg.L-1 correspondant à l’apparition de la baisse de vitesse de conduction (Schwartz, 1988). Ces taux sont inférieurs à ceux que l’on croyait antérieurement nécessaires pour provoquer une démyélinisation.
Une diminution de l’action musculaire en liaison avec le nerf moteur péronier ainsi qu’une diminution de la sensibilité vibrotactile au niveau des doigts ont pu être observées dans un groupe de jeunes adultes exposés pendant leur enfance (Stokes et al., 1998).
Effets hématologiques
Le plomb est connu depuis longtemps pour ses effets sur le système hématologique : l’anémie induite est de type microcytaire et hypochrome. Elle résulte de l’inhibition de la synthèse de l’hème et de la diminution de la durée de vie des globules rouges.
L’inhibition de l’activité de l’ALAD (enzyme intervenant dans la synthèse de l’hème) a pu être corrélée de manière inversement proportionnelle à des plombémies comprises entre 30 et 340 µg.L-1 aussi bien chez l’adulte, chez l’enfant, ou encore chez les mères à l’accouchement et les nouveau-nés (adultes - Hernberg et al., 1970 ; Roels et Lauwerys, 1975 ; enfants - Ahamed et al., 2005 ; Jin et al., 2006 ; Roels et Lauwerys, 1987 ; mères - Lauwerys et al., 1978).
La diminution de la biosynthèse de l’hème entraîne l’augmentation de produits intermédiaires « précurseurs » tels que l’acide ∂-aminolévulinique (ALA), les protoporphyrines érythrocytaires, généralement mesurées sous forme de protoporphyrine-zinc ou sous forme protoporphyrine IX libre (FEP). Plusieurs types de corrélations ont pu être établis entre ces différents paramètres : relation exponentielle entre plombémie et ALA sanguin (Meredith et al., 1978), corrélation entre plombémie > à 400 µg.L-1 et log ALA ou log PPZ urinaires chez l’adulte (Gennart et al., 1992), corrélation linéaire entre une plombémie comprise entre 250 et 750 µg.L-1 et le log ALA urinaire chez des enfants âgés de 1 à 5 ans (NAS, 1972).
L’élévation des protoporphyrines urinaires est détectable lorsque la plombémie atteint 300 à 400 µg.L-1 chez l’homme, 200 à 300 µg.L-1 chez la femme et environ 150 µg.L-1 chez l’enfant (Hammond et al., 1985 ; Piomelli et al., 1982 ; Rabinowitz et al., 1986 ; Roels et Lauwerys, 1975 ; Roels et al., 1976 ; Roels et Lauwerys, 1987 ; Stuik, 1974).
L’US EPA considère que l’élévation des protoporphyrines constitue un indicateur biologique de choix de l’exposition au plomb et a établi, pour ce paramètre, des LOAEL correspondant à des plombémies de 400 µg.L-1 chez l’adulte et 350 µg.L-1 chez l’enfant (US EPA, 1986). Ces effets ont également été rapportés mais pour des expositions inférieures à 100 µg.L-1 chez l’enfant et l’adulte (Wang et al., 2010).
L’anémie, résultant de l’effet du plomb sur la lignée érythrocytaire, est en général peu sévère et les taux d’hémoglobine tombent rarement en deçà de 100 g.L-1 (Arsac, 1976). Elle est, de plus, assez tardive et souvent non décelable pour des niveaux d’exposition assez faibles correspondant à des plombémies en moyenne inférieures à 400 µg.L-1 (Gennart et al., 1992 ; Solliway et al., 1996). Deux études ont montré que l’enfant présenterait des signes d’anémie de type microcytaire pour des plombémies voisines de 200 µg.L-1 (Kutbi et al., 1989 ; Schwartz et al., 1990). La microcytose serait entre autres liée à la carence en fer habituellement associée au saturnisme (Secrétariat d’État à la Santé et à l’action sociale 1993).
Les anémies plus sévères s’accompagnent le plus souvent de l’apparition de granulations basophiles dans les hématies (Alleman et al., 1986 ; Awad el Karim et al., 1986 ; Pagliuca et al., 1990).
Effets rénaux
Les atteintes rénales liées au plomb se caractérisent par une néphropathie tubulaire proximale, une sclérose glomérulaire et une fibrose interstitielle (Diamond, 2005).
Plusieurs enquêtes épidémiologiques en milieu professionnel, où prédomine l’exposition par inhalation, ont mis en évidence un excès de mortalité par insuffisance rénale chez les sujets qui avaient subi des expositions chroniques intenses au plomb (Cooper, 1988 ; Davies, 1984 ; McMichael et al., 1988 ; Selevan et al., 1985). Les lésions développées se caractérisent notamment par la présence de tissu interstitiel fibrotique, une atrophie glomérulaire et tubulaire, conduisant à une altération irréversible de la fonction rénale (Albahary et al., 1965).
Pour des expositions plus modérées, les signes cliniques ne sont pas toujours très visibles. L’étude des paramètres biochimiques d’exploration de la fonction rénale, associés ou non à des tests d’épreuves fonctionnelles, ne met pas toujours en évidence l’existence d’une néphrite interstitielle d’évolution lente. C’est notamment le cas des travaux de Roels et Lauwerys (1994) ou Buchet et al. (1980) qui, à partir de l’étude de nombreux paramètres biochimiques de la fonction rénale et de la filtration glomérulaire, n’ont pas mis en évidence d’anomalies chez les travailleurs exposés entre 3 et 30 ans au plomb et présentant en moyenne des plombémies comprises entre 330 et 610 µg.L-1 (Buchet et al., 1980 ; Roels et Lauwerys, 1994). Quoi qu’il en soit, de nombreuses autres études épidémiologiques en milieu professionnel montrent que les altérations de la fonction glomérulaire et/ou tubulaire du rein ne semblent pas associées à des plombémies inférieures à 600 µg.L-1 (Cardenas et al., 1993 ; Gennart et al., 1992 ; Gerhardsson et al., 1992 ; Goyer, 1985). Toutefois, il a été montré des variations dans les niveaux en α-glutathion S-transférase chez des mineurs présentant une plombémie de 387,1+/-99,1 µgPb.L-1 (Garcon et al., 2007).
Cependant dans l’étude de Verschoor et al. (1987), un coefficient de corrélation significatif a été obtenu entre la plombémie et l’activité de la NAG (N-acétyl ß-D-glucosaminidase) urinaire dans une cohorte dont les plombémies étaient comprises entre 207 et 1 030 µg.L-1 (Verschoor et al., 1987).
Pour la population générale, certaines études suggèrent que le plomb, même à de faibles niveaux de plombémie, parfois en dessous de 100 µg.L-1, pourrait exercer un effet négatif sur la fonction rénale (Muntner et al., 2003 ; Vupputuri et al., 2003 ; Weaver et al., 2003 ; Weaver et al., 2005 ; Akesson et al., 2005 ; de Burbure et al., 2006 ; Fadrowski et al., 2010). Une étude transversale a mis en évidence chez des travailleurs l’impact du plomb (plombémie moyenne de 313 µg.L-1) sur leurs fonctions rénales (Weaver et al., 2009). En Belgique, Staessen et al., 1992) ont pu constater, dans le cadre d’une grande enquête épidémiologique, une réduction significative de la filtration glomérulaire chez les personnes âgées pour des plombémies n’excédant pas 200 µg.L-1. Ce résultat a été confirmé pour les personnes âgées ou d’âges moyens dans une autre étude longitudinale (Kim et al., 1996). De plus, une élévation de la plombémie de 100 µg.L-1 a été associée à une réduction de la clairance de la créatinine (Payton et al., 1994).
Une mise à jour des données a été réalisée (Muntner et al., 2005 ; Navas-Acien et al., 2009) ; Fadrowski et al., 2010). Une des études a porté sur 14 778 adultes âgés de plus de 20 ans et présentant des concentrations sanguines moyennes en cadmium et en plomb (moyenne géométrique) respectivement de 4,1 µg.L-1 et 15,8 µg.L-1(Navas-Acien et al., 2009). Elle a montré que ces deux métaux étaient des facteurs de risque pour le développement de maladie rénale chronique dans la population générale. Les odds ratio sont de 1,92 [Intervalle de confiance à 95 %, IC 95 %, 1,53-2,43] pour l’abuminurie, de 1,32 [IC 95 %, 1,04-1,68] pour une diminution du niveau de filtration glomérulaire (< 60 mL .min-1.1,73 m2) et de 2,91 [IC 95 %, 1,76-4,81] pour les deux paramètres.
Relation entre plombémie et maladie chronique du rein (taux de filtration glomérulaire inférieur à 60 mL.min-1.1,73 m-2 de surface corporel (Navas-Acien, 2009 cité dans Anses, 2013).
|
Plombémie (médiane en µg.L-1) |
Nombre de sujets atteints par la maladie chronique rénale |
Nombre de sujets observés |
Odds ratio ajusté [IC95 %] |
|---|---|---|---|
|
8 |
147 |
3 242 |
1 [référence] |
|
13 |
274 |
3 167 |
1,1 [0,8-1,51] |
|
19 |
468 |
3 734 |
1,36 [0,99-1,85] |
|
32 |
779 |
4 635 |
1,56 [1,17-2,08] |
A partir de cette étude, l’ a dérivé une BMDL10 à partir de la plombémie moyenne de 15,8 µg.L-1 (EFSA, 2010).
Chez les enfants vivant à proximité de fonderies de plomb, plusieurs marqueurs de toxicité rénale (retinol binding protein (RBP), ß2-microglobuline, N-acétyl-glucosaminidase (NAG)) ont pu être associés à des plombémies comprises entre 300 et 3 500 µg.L-1 (Bernard et al., 1995 ; Verberk et al., 1996). L’implication du plomb dans l’origine d’une perturbation de la fonction tubulaire chez l’enfant est donc très probable, et certains auteurs ont même établi, à partir d’une étude transversale, un seuil de toxicité rénale chez l’enfant de 100 µg.L-1 (Fels et al., 1998).
Effets sur le système cardio-vasculaire
Pour les faibles niveaux d'exposition, l'implication possible du plomb dans la pathologie de l'hypertension artérielle reste un sujet controversé (CSHPF, 1996).
Plusieurs études réalisées en milieu professionnel font apparaître des corrélations positives entre des plombémies > 300 µg.L-1 et l’augmentation de la pression artérielle systolique (de Kort et al., 1987 ; Pollock et Ibels, 1986 ; Weiss et al., 1986, 1988). Ainsi, une méta-analyse de 31 études publiées entre 1980 et 2001 estime l’augmentation de la pression systolique à 1 mm Hg pour tout doublement de la plombémie (Nawrot et al., 2002). Toutefois, ces résultats sont largement controversés par de nombreuses études ne montrant aucune augmentation du nombre de sujets hypertendus parmi les salariés manipulant des composés inorganiques du plomb (Parkinson et al., 1987 ; Staessen et al., 1990 ; Wu et al., 1996). Ces différences peuvent être expliquées par le fait que la plombémie ne semble pas être le biomarqueur le plus pertinent pour étudier des effets à long terme occasionnant une hypertension. La teneur en plomb osseux apparaît être un meilleur indicateur pour la prédiction d’élévation de la pression artérielle (Cheng et al., 2001 ; Gerr et al., 2002 ; Hu et al., 1996 ; Korrick et al., 1999 ; Rothenberg et al., 2002).
Une étude a également montré que la pré-éclampsie était significativement augmentée chez des sujets présentant un fort taux de plombémie, 377 µg.L-1 versus 145 µg.L-1 chez les témoins (Motawei et al., 2013). De même certains auteurs semblent montrer qu’une exposition à des niveaux élevés de plomb au cours de la grossesse pourrait prédisposer à une hypertension à l’âge adulte (Zhang et al., 2012). Ce phénomène a été observé chez les filles mais n’est pas retrouvé chez les garçons de la même étude.
Plusieurs des méta-analyses réalisées dans des cohortes professionnelles et études environnementales insistent sur le rôle important de facteurs confondants tels que l’hématocrite, la consommation d’alcool ou de tabac qui, lorsqu’ils sont pris en compte, réduisent considérablement l’intensité de l’association entre le plomb et la variation de la tension artérielle (Hense et al., 1993 ; Staessen et al., 1996). Si l'association existe, elle est certainement faible et il n'est pas possible de définir un seuil ou un groupe particulièrement susceptible. De plus, l'interférence de facteurs socio-économiques défavorables n'est pas exclue (INSERM, 1999).
Des études ont démontré des effets observés pour des expositions à des plombémies inférieures à 100 µg.L-1 : augmentation de la pression sanguine systolique et diastolique chez l’adulte entre 50 et 100 µg.L-1 (Scinicariello et al., 2010) et des troubles cardio-vasculaires (Navas-Acien et al., 2007). Enfin, une augmentation de la mortalité toutes causes, par infarctus et par accidents vaculaires cérébraux dès 20 µg.L-1 est rapportée (Menke et al., 2006).
L’EFSA (2010) retient 5 études pour la quantification de la relation dose-réponse entre la fréquence systolique et la concentration de plomb dans la moelle osseuse ou le sang (Cheng et al., 2001 ; Glenn et al., 2003 ; Glenn et al., 2006 ; Nash et al., 2003 ; Vupputuri et al., 2003). Pour chacune de ces études l’EFSA a calculé une BMD à 1 % d’effet et une limite de benchmark dose, ces valeurs sont rapportées ci-dessous. La moyenne de ces valeurs est de 36 µg Pb.L-1 pour les BMDL01 pour la plombémie soit 8,1 pour les BMDL01.
Synthèse des études retenues par l’EFSA pour l’établissement de la relation dose effet
(EFSA, 2011)
|
Populations étudiées |
Augmentation du risque mmHg [intervalle de confiance à 95 %] par µg Pb.g-1 de moelle osseuse (MO) ou µg Pb.L-1 (S) |
BMD01 |
BMDL01 |
Références |
|---|---|---|---|---|
|
519 individus employés aux affaires normatives (région de Boston, USA) |
MO : 0,1 [0,0015-0,20] |
12 |
6,5 |
Cheng et al., 2001 |
|
496 salariés de la chimie (région de New Jersey, USA) |
Valeur annuelle : S : 0,025 [0,0054-0,044] Valeur courante MO : 0,078 [0,024-0,13] |
48
13 |
29
9,7 |
Glenn et al., 2003 |
|
4 404 Afro-américains (cohorte Nhames III) |
0,047 [0,014-0,08] |
26 |
16 |
Vupputuri et al., 2003 |
|
Femmes entre 40-59 ans (cohorte Nhames III) |
S : 0,032 [0,0006-0,0634] |
38 |
21 |
Nash et al., 2003 |
|
Travailleurs d’usine utilisant du plomb (Corée du sud) |
S : 0,009 [0,001-0,016] |
133 |
78 |
Glenn et al., 2006 |
Effets sur les os / dents
Rosenman et al. ont décrit récemment des effets musculo-squelettiques observés chez des travailleurs exposés au plomb et présentant une plombémie supérieure ou égale à 400 µg.L-1 : douleurs fréquentes, endolorissement et/ou faiblesse musculaire (Rosenman et al., 2003).
Campbell et al. ont étudié les effets d’une exposition au plomb sur la densité osseuse chez l’enfant (Campbell et al., 2004). Pour se faire, une cohorte de 35 enfants afro-américains, âgés de 8 à 10 ans, a été séparée en deux groupes : le premier présentait une plombémie moyenne de 65 µg.L-1 (qualifiée de faible) et le second une plombémie moyenne de 236 µg.L-1 (qualifiée de forte). Contrairement à ce qui était attendu, les enfants ayant une forte plombémie présentaient une densité minérale osseuse supérieure à ceux ayant une faible plombémie. Les auteurs avancent l’hypothèse d’une accélération possible de la maturation squelettique par le plomb.
Une association positive a été mise en évidence entre l’exposition au plomb et les caries chez les enfants dans de nombreuses études (Campbell et al., 2000 ; Gemmel et al., 2002 ; Moss et al., 1999). Ainsi, l’augmentation de la plombémie de 50 µg.L-1 est à l’origine d’un odds ratio de 1,8 (IC 95% : 1,3-2,5) chez les enfants âgés entre 5 et 17 ans. De plus, une perte de matière de l’os parodontal a aussi été observée, en lien avec l’augmentation de la plombémie (Dye et al., 2002).
Les enfants sont a fortiori la cible privilégiée des effets du plomb sur la croissance de l’os. Plusieurs études mettent en évidence une corrélation négative entre le plomb d’une part, et le poids, la taille et le périmètre thoracique des enfants d’autre part, y compris pour des expositions très faibles (plombémie < 100 µg.L-1 ; Frisancho et Ryan, 1991 ; Schwartz et al., 1986). Chez des enfants de 18 à 36 mois, la mesure du périmètre crânien a également pu être négativement corrélée à un apport de plomb alimentaire de 4,9 µg par jour ou une plombémie moyenne de 64 µg.L-1 (Stanek et al., 1998).
A l’inverse, quelques études n’ayant pas mis en évidence de tels effets sont décrites dans la littérature (Greene et Ernhart, 1991 ; Sachs et Moel, 1989).
Autres effets
Des études réalisées en milieu professionnel ont montré que le plomb peut exercer un effet dépresseur sur la glande thyroïde pour des niveaux d'exposition élevés (Robins et al., 1983 ; Tuppurainen et al., 1988). Les auteurs ont en effet noté une corrélation négative entre la durée d’exposition et le taux sérique de thyroxine totale et libre chez les sujets ayant des plombémies supérieures à la moyenne du groupe soit 560 µg.L-1. Il semblerait par ailleurs que l’atteinte thyroïdienne soit peu probable lorsque l’exposition au plomb est maintenue à un niveau tel que la plombémie ne dépasse pas 600 µg.L-1 (Gennart et al., 1992). Plusieurs études montrent aussi une altération de la thyréostimuline pour des plombémies comprises entre 400 et 600 µg.L-1 (Lopez et al., 2000 ; Singh et al., 2000).
Par contre, des résultats surprenants montrent l’absence d’effet du plomb sur la thyroïde chez les enfants, y compris pour des plombémies supérieures à 600 µg.L-1 (Siegel et al., 1989). Les enfants ne seraient donc pas plus (voire même moins) sensibles que les adultes à cet effet.
Les effets du plomb sur le système immunitaire se manifestent essentiellement par une réduction du pourcentage et de la valeur absolue des cellules T (CD3+) et cellules T helper (CD4+), observée sur des sujets ayant des plombémies supérieures à 250 µg.L-1 et pouvant atteindre 1 000 µg.L-1 (Fischbein et al., 1993 ; Undeger et al., 1996 ; Basaran et Undeger, 2000). En ce qui concerne l’immunité à médiation humorale, la diminution du taux de certaines immunoglobulines (IgA) n’est pas systématiquement observée dans les diverses études et les personnes exposées ne semblent pas présenter de susceptibilité particulière aux infections (Ewers et al., 1982 ; Pinkerton et al., 1998 ; Sata et al., 1998).
Certains auteurs avaient suggéré que le plomb puisse être un facteur de risque dans le développement d’asthme chez l’enfant (Dietert et al., 2002) mais récemment, Joseph et al. ont montré que l’influence génétique était plus importante que l’exposition au plomb (Joseph et al., 2005).
Les effets du plomb inorganique chez les enfants et les adultes sont présentés dans le tableau de synthèse ci-après, en relation avec la plombémie minimale pour laquelle un tel effet peut être observé (ä : fonction croissante ; æ : fonction décroissante).
Effets observés chez l’adulte et l’enfant en fonction de la plombémie minimale
(d’après INSERM, 2006)
|
Enfants |
Plombémie (µg.L-1) |
Adultes |
|---|---|---|
|
|
|
Décès |
|
|
1 500 |
|
|
Décès |
|
Douleurs abdominales |
|
|
1 000 |
Encéphalopathie |
|
Encéphalopathie |
|
|
|
|
|
Longévité diminuée Troubles de la mémoire, effets sur l’habileté manuelle |
|
Douleurs abdominales |
|
Effets sur la thyroïde |
|
|
500 |
|
|
|
|
æ Vitesse de conduction nerveuse Neuropathie périphérique |
|
|
400 |
Anémie Effets musculo-squelettiques |
|
|
|
Pression artérielle systolique ä (hommes) |
|
Altération synthèse hémoglobine Effets sur les reins æ Métabolisme de la vitamine D |
300 |
Altération de la synthèse d’hémoglobine |
|
|
|
Effets sur le système immunitaire æ Acuité auditive |
|
|
|
ä Protoporphyrines urinaires (hommes) |
|
æ Vitesse de conduction nerveuse Anémie |
200 |
Néphropathie |
|
|
|
ä Protoporphyrines urinaires (femmes) |
|
ä Protoporphyrines urinaires |
150 |
|
|
|
100 |
|
|
æ QI |
10 |
|
|
æ Acuité auditive |
|
|
|
æ Croissance |
|
|
|
Passage placentaire |
|
|
Synthèse
Chez l’homme, les principaux effets sont observés au niveau du système nerveux central et périphérique (encéphalopathie, neuropathies périphériques, troubles mentaux organiques). Une anémie microcytaire hypochrome est aussi observée, de même que des atteintes rénales (néphropathie tubulaire, fibrose interstitielle et atrophie tubulaire, insuffisance rénale avec sclérose glomérulaire), une augmentation de la pression artérielle, des effets sur la thyroïde, le système immunitaire ou la croissance des os chez les enfants.
Chez l'animal
Toutes voies
Effets sur le système nerveux central et périphérique
Les lésions histologiques induites par le plomb sont localisées chez le rat au niveau de l'hippocampe, du cortex cérébral, du système limbique et du cervelet et se traduisent généralement par un retard ou une diminution du développement de ces différentes structures cérébrales (Finkelstein et al., 1998). Une diminution de la taille et du nombre des axones du nerf optique a également pu être observée chez la souris (Tennekoon et al., 1979).
Les systèmes de neurotransmission, notamment glutamatergique, sont également fortement perturbés par des expositions au plomb, avec des effets particulièrement importants pendant la période de développement cérébral (Singh, 1993). L'augmentation de la libération de glutamate est observable uniquement lorsque l'exposition au plomb (0,64 mg.kg-1.j-1), pendant 10 semaines, débute 5 jours après la naissance. En différant l'exposition de 5 semaines, la libération de glutamate retrouve son niveau basal (Singh et Ashraf, 1989). Le plomb a également une action sur de nombreux autres neurotransmetteurs (dopamine, noradrénaline, sérotonine, catécholamines, acétylcholine). Certaines interférences négatives entre les systèmes dopaminergique et glutamatergique, par exemple, pourraient expliquer les effets neurologiques du plomb (Cory Slechta et al., 1997). Par ailleurs, la diminution de la libération de dopamine au niveau du noyau accumbens (Le noyau accumbens est un ensemble de neurones situés à l'intérieur de la zone corticale du cerveau. Il semble qu'il joue un rôle important dans le circuit de la récompense, le rire, le plaisir, l'addiction, la peur et l'effet placebo.) pourrait, selon les auteurs de cette étude, être secondaire aux modifications du métabolisme calcique lié au plomb (Kala et Jadhav, 1995b). En effet, plusieurs études ont montré que le plomb est capable de perturber l'homéostasie calcique des cellules (Finkelstein et al., 1998 ; Goldstein, 1993 ; Simons, 1986).
Les atteintes physiologiques et les dysfonctionnements de certains systèmes de neurotransmission pourraient être directement impliqués dans les déficits de la capacité d'apprentissage, de mémorisation et d'attention observés lors de l'intoxication systémique par le plomb.
Les études de comportement chez l’animal ont permis d’affirmer le lien de cause à effet entre l’imprégnation par de faibles doses de plomb pendant la période de maturation cérébrale et les troubles neuropsychologiques ultérieurs (Banks et al., 1997). Des rats intoxiqués par le plomb pendant l'allaitement présentent dans les tests d'apprentissage des difficultés plus importantes que les animaux imprégnés après le sevrage (Cory Slechta et al., 1992). La vulnérabilité du cerveau immature exposé pendant la période prénatale et/ou postnatale se traduit également par des troubles moteurs, une fatigue musculaire et des anomalies des mouvements rapides de flexion extension (Newland et al., 1996).
Les études comportementales chez l’animal (singe, rat, poulet) permettent également de confirmer le rôle de l’imprégnation par le plomb à faibles doses dans la survenue ultérieure de troubles des apprentissages, de la mémoire spatiale et non spatiale ainsi que des défauts d’attention (Hopper et al., 1986 ; Winneke et al., 1977). Les dysfonctionnements des fonctions visuelles et auditives mises en évidence chez l’animal pourraient contribuer aux effets négatifs de faibles doses de plomb sur le développement cognitif (Levin et al., 1988 ; Lilienthal et Winneke, 1996 ; Rice, 1997).
Par contre, les études animales n'ont pas permis de lever l'ambiguïté sur l'existence ou non d'une relation dose-réponse concernant l'effet neurologique du plomb et l'absence de seuil toxique suspectée chez l'homme (Winneke et al., 1996).
Effets cardio-vasculaires
Chez le rat, l’administration orale de 50 ppm d’acétate de plomb pendant 160 jours entraîne une nette augmentation de la pression sanguine qui passe de 128/98 dans le groupe témoin à 182/138 chez les animaux traités (Iannaccone et al., 1981). Parmi les nombreuses études ayant décrit l’action hypertensive du plomb, y compris pour de faibles concentrations de 0,1 ppm (12 mois) à 1 ppm (3 mois) dans l’eau de boisson (Perry et al., 1988), certaines ont également tenté d’expliquer le ou les mécanismes physiopathologiques impliqués. L’étude de Ding et al. a montré qu’en piégeant les substances réactives oxygénées ou en augmentant pharmacologiquement le taux de NO circulant, les animaux traités au plomb (100 ppm d’acétate de plomb, dans l’eau de boisson, pendant 12 semaines) retrouvaient une pression sanguine proche de celle du lot témoin (Ding et al., 1998).
D’autres mécanismes ont été évoqués : interactions avec l’homéostasie calcique et/ou certains processus contrôlés par le calcium (activation de la voie de la protéine kinase C ou de la calmoduline) (Chai et Webb, 1988 ; Schwartz, 1988, 1991, 1992), interférence avec le transport transmembranaire d’ions comme le sodium ou le potassium (Hajem et al., 1990), interférence avec les systèmes rénine-angiotensine-aldostérone et kallikréine-kinine qui reste très controversée (Staessen et al., 1995), action mécanique par une atrophie des fibres élastiques de l’aorte (Skoczyska et al., 1993). Des résultats contradictoires ont néanmoins montré l’absence d’hypertension chez des rats ayant reçu pendant 5 mois des doses journalières de 5 à 25 ppm dans l’eau de boisson (Victery et al., 1982).
Effets hématologiques
Les données expérimentales soulignent des disparités de la toxicité du plomb en relation avec le mode d’administration, et également la nature chimique du composé étudié.
A titre d’exemple, pour obtenir un même effet comme la baisse de l’hématocrite, des rats doivent recevoir 19,2 mg.kg-1.j-1 d’acétate de plomb (NOAEL de 6,4 mg.kg-1.j-1), administré par gavage (Overmann, 1977), ou 318 mg.kg-1.j-1 d’acétate de plomb via l’alimentation (Walsh et Ryden, 1984). Dans l’eau de boisson, des doses journalières de 34 mg.kg-1.j-1 d’acétate de plomb sont sans effet sur l’hématocrite (Fowler et al., 1980 ; Victery et al., 1982). Une étude réalisée chez des singes a mis en évidence une baisse de l’hématocrite dans le groupe exposé 7 ans à une dose de 2 mg.kg-1.j-1 d’acétate de plomb (Rice, 1996).
Des paramètres beaucoup plus sensibles mettent en évidence l’action du plomb sur la biosynthèse de l’hème. C’est notamment le cas des précurseurs de porphyrines (acide δ-aminolévulinique ou ALA et coproporphobilinogène) qui augmentent dans les urines de rats faiblement exposés 6 à 12 mois à des concentrations de 0,1 mg.kg-1.j-1 d’acétate de plomb dans l’eau de boisson (NOAEL de 0,0015 mg.kg-1.j-1) (Krasovskii et al., 1979).
Des corrélations entre l’augmentation urinaire de ALA ou de protoporphyrines-zinc et l’apport de plomb ont également été obtenues par plusieurs équipes (Cory Slechta, 1990 ; Flora et al., 1993 ; Fowler et al., 1980). A des doses équivalentes, les plus fortes augmentations ont été obtenues avec l’acétate ou l’oxyde de plomb, suivi par le sulfate de plomb (Dieter et al., 1993 ; Freeman et al., 1996).
Les études animales ont par ailleurs montré que les effets du plomb sur la synthèse de l’hème sont variablement répartis dans les différents organes : diminution de l’activité de l’ALA synthétase dans les reins (Fowler et al., 1980) ; diminution de l’activité de l’ALAD dans le cerveau, le foie et la rate (Gerber et al., 1978) ; diminution de l’activité de la ferrochélatase dans les reins (Fowler et al., 1980).
Effets rénaux
La toxicité rénale est caractérisée chez l’animal comme chez l’homme par une réduction de la filtration glomérulaire et l’apparition d’une aminoacidurie globale.
Outre l’atteinte mitochondriale, le plomb forme au niveau des cellules rénales de véritables complexes avec des protéines partiellement dégradées. La présence de ces inclusions intranucléaires a été décrite dans plusieurs études de toxicité subchronique et un NOAEL de 0,5 mg.kg-1.j-1 de plomb, sous forme d’acétate, a pu être déterminé chez le rat mâle, alors que les NOAEL sont de 1,5 mg.kg-1.j-1 de plomb sous forme d’oxyde et de 5 mg.kg-1.j-1 de plomb sous forme de sulfate (Dieter et al., 1993). Il semblerait que le plomb (plus ou moins biodisponible selon le complexe formé) soit absorbé par endocytose, à l’état de complexe Pb-α2-u-globuline, au niveau de l’épithélium du tubule proximal (Fowler et DuVal, 1991 ; Fowler, 1992). Ce complexe ne peut être dégradé par les protéases lysosomiques, et migre jusqu’au noyau où il se fixe sur certaines régions de l’ADN, ce qui a pour effet de déréprimer des gènes et de modifier la nature des protéines synthétisées par ces cellules. Le lien avec l’apparition d’adénocarcinomes du rein n’a pas été démontré.
La β2-globuline urinaire serait le marqueur le plus précoce de l’atteinte toxique au niveau du rein (Vyskocil et al., 1989 ; Vyskocil et al., 1995).
Lorsque l’exposition se poursuit au-delà d’un an, les inclusions nucléaires disparaissent et s’installe progressivement une fibrose interstitielle associée à une insuffisance rénale plus ou moins prononcée (Koller et al., 1985).
Effets sur les os / dents
Des études de toxicité subchronique ont également montré chez le rat la répercussion de l’exposition au plomb sur la croissance et le métabolisme minéral de l’os. Une réduction de 20 % du contenu en calcium et phosphore des os a été observée chez de jeunes animaux ayant des plombémies de 400 µg.L-1 (exposition pré et postnatale), ainsi que pour le groupe le plus exposé (plombémies de 700 µg.L-1) un retard général de croissance (poids et taille) de 10 % (Hamilton et O'Flaherty, 1994). A l’âge adulte, des femelles exposées approximativement à 1 mg.kg-1.j-1 d’acétate de plomb pendant 50 jours présentaient une nette diminution de la structure trabéculaire du fémur et du cartilage (Escribano et al., 1997 ; Gonzalez Riola et al., 1997). Des résultats similaires ont été obtenus chez des mâles après 3 à 12 mois d’exposition au plomb (7,7 mg.kg-1.j-1) (Gruber et al., 1997). Carmouche et al. ont, de plus, mis en évidence une augmentation du délai de réparation de fractures, voire même une absence totale de consolidation pour des plombémies supérieures à 400 µg.L-1 (Carmouche et al., 2005).
Les études réalisées chez les animaux confirment l’impact du plomb sur le développement de caries (Watson et al., 1997) et dans le délai de reminéralisation des dents (Gerlach et al., 2002).
Effets sur le poids
Les données relatives à la perte de poids occasionnée par l’exposition au plomb sont pour la plupart issues des études de toxicité subchronique. Pour une exposition de 30 jours, par apport alimentaire, les différentes valeurs de NOAEL exprimées en plomb sont de 1,5 mg.kg-1.j-1 pour l’acétate et l’oxyde de plomb, 5 mg.kg-1.j-1 pour le sulfate de plomb (Dieter et al., 1993). L’étude de Freeman mentionne une valeur de NOAEL identique pour l’acétate et le sulfate de plomb de 6,4 mg.kg-1.j-1 pour une exposition de 44 jours (rats mâles) (Freeman et al., 1996). Dans une étude 90 jours, un NOAEL de 38 mg.kg-1.j-1 a pu être déterminé pour l’acétate de plomb administré dans l’eau de boisson (Kala et Jadhav, 1995a).
Autres effets
En ce qui concerne les conséquences de l’effet du plomb sur le système immunitaire, une étude a montré qu’une exposition in utero entraînait des lésions persistantes plus importantes qu’une exposition postnatale (Miller et al., 1998). L’immunité à médiation cellulaire est altérée avec une réduction du nombre de cellules T, tandis que l’immunité à médiation humorale serait marquée par une augmentation sérique du taux des IgG et des IgE. Lors d'exposition postnatale, les résultats ne sont pas constants d'une étude à l'autre et ne permettent pas de valider les effets du plomb sur le système immunitaire.
Quelques études montrent aussi l’effet d’une faible exposition répétée au plomb sur le foie. Ainsi, Schepers a exposé pendant 20 semaines des rats albinos mâles et femelles (6/sexe) à 0,0017 et 0,17 mg.kg-1, 5 jours par semaine (Schepers, 1964). Les rats ont tous été sacrifiés un ou deux jours après l’arrêt du traitement et des autopsies ont été réalisées. Les rats exposés à la plus faible dose présentaient des hypotrophies hépatocytaires, associées à des déplétions en glycogène.
Effets systémiques
Tous les effets du plomb inorganique observés chez l’animal sont principalement issus d’études par voie orale mais dans tous les cas sont rapportés à la plombémie associée : c’est pourquoi, les organes cibles ne sont pas différenciés selon la voie d’exposition dans le tableau ci-après. Il faut noter que la plupart des études expérimentales réalisées utilisent des composés du plomb qui ne sont pas utilisés ou en adéquation avec les expositions humaines.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
Substance Chimique |
Voies d’exposition |
Taux d’absorption Homme Animal |
Organes cibles Principal Secondaire |
||
|---|---|---|---|---|---|
|
Plomb inorganique et ses dérivés |
Inhalation |
20 à 30 % (Thompson, 1971) |
- |
Organes communs pour toutes les voies d’exposition |
|
|
Voie orale
|
5 à 10 % (adulte) (Hursh et Suomela, 1968) 20 % (enfant de 10 ans) (DeMichele, 1984 ; Ziegler et al., 1978) 50 % (enfant 2 ans) (DeMichele, 1984 ; Ziegler et al., 1978) |
26 % singe (adulte) 16 % souris
38 % singe (jeune) 15 à 42 % souris
74 à 89 % souris (16 à 22 jours) |
SN* Sang Reins Appareil digestif Os |
Thyroïde Système cardiovasculaire SI** Troubles musculo squelettiques
|
|
|
Cutanée |
négligeable |
|
|
||
*SN : système nerveux central et périphérique
**SI : système immunitaire
Synthèse
Les études réalisées chez les animaux concordent avec les observations réalisées chez l’homme.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | L’acétate de plomb a été classé en Catégorie 2 : Substances préoccupantes pour l’homme en raison d’effets cancérogènes possibles. L’hydrogénoarséniate de plomb a été classé en Catégorie 1A : substance que l’on sait être cancérigène pour l’homme. | 2008 |
| IARC | Groupe 2A - le plomb et ses dérivés inorganiques pourraient être potentiellement cancérigènes pour l'homme (2006). Groupe 1 - les chromates et arséniates de plomb sont considérés séparément et classés comme cancérigènes pour l'homme (1987). Groupe 3 - les composés organiques ne peuvent être classés pour leur cancérogénicité pour l'homme 2006). | 2006 |
| US EPA | Groupe B2 - le plomb et ses dérivés inorganiques pourraient être potentiellement cancérigènes pour l'homme | 1989 |
Chez l'homme
Toutes voies
Chez l’homme, un ensemble de données indique qu'une exposition professionnelle pourrait être associée à un risque accru de cancers des poumons, de l’estomac ou des reins (pour des expositions de longues durées).
Une première méta-analyse de toutes les études de cohortes et cas-témoin publiées jusqu’en 1990, réalisée par Fu et Boffetta, 1995 a permis de constater l’existence d’un risque accru de cancers respiratoires, gastriques et vésicaux. Ainsi, comme le rapporte Garnier, 2005 le risque relatif (RR) de cancer bronchopulmonaire (RR : 1,30 ; IC95 % : 1,15 – 1,46) et de cancer gastrique (RR : 1,34 ; IC95 % : 1,14 – 1,57) est modérément élevé pour des expositions au plomb. Ce risque relatif de cancer bronchopulmonaire (RR : 1,14 ; IC95 % : 1,04 – 1,473) est plus faible après élimination de l’étude de Lundstrom et al. (1997) présentant une co-exposition avec de l’arsenic, mais les différences restent significatives. Globalement, il n’y a pas d’augmentation des risques de cancers rénaux et cérébraux, bien que deux études montrent un risque élevé de cancer rénal et une autre un excès significatif de gliomes (Steenland et Boffetta, 2000). Il subsiste cependant à l’égard de ces analyses des réserves relatives à la prise en compte non systématique de facteurs confondants éventuels, tels que le tabac ou les habitudes alimentaires. Par ailleurs, certains auteurs considèrent que l’excès de cancer bronchique chez les fondeurs de plomb serait multifactoriel, d’autres composés que le plomb comme l’arsenic, le chrome hexavalent ou les hydrocarbures aromatiques polycycliques pouvant jouer un rôle majeur (Gerhardsson et Nordberg, 1993 ; Lundstrom et al., 1997).
Une étude menée à Taïwan entre 1979 et 2007 pour des émissions environnementales de plomb a montré que des zones à fort niveau d’exposition au plomb étaient corrélées avec une augmentation de l’incidence des cancers du cerveau, après ajustement avec des facteurs confondants (Lin et al., 2012).
Les principales études de cohortes, rapportées par l’IARC et détaillées dans le tableau ci-dessous, présentent les mêmes limites d’interprétation (IARC, 2006).
Principales études de cohortes (d'après IARC, 2006)
|
Référence, lieu étude |
Description de la cohorte |
Niveau d’exposition au plomb |
Site de cancer |
Nombre de cas / décès observés |
Risques relatifs |
95% IC |
|---|---|---|---|---|---|---|
|
Fanning, 1988 United Kingdom – usine de batteries |
Etude de mortalité proportionnelle 2073 hommes groupés par tranches de 10 ans d’âge, morts entre 1926 et 1985 |
Niveau bas : population de référence (1206 hommes) Niveau haut : 867 hommes |
Tous sites Poumons Estomac
|
195 76 31 |
PMOR 0,95 0,93 1,34 |
|
|
Wong et Harris, 2000 USA – usine de batteries |
4518 hommes employés au moins 1 an entre 1947 et 1970 Suivi des causes de la mort entre 1947 et 1995 Comparaison avec les taux de mortalité de la population générale des USA |
Pas de données d’exposition [Pb]sang moyenne : 630 µg.L-1 [Pb]urine moyenne : 1300 µg.L-1 |
Tous sites Poumons Estomac Reins Gros intestin Rectum SNC |
624 210 45 7 59 14 10 |
SMR 104,7 113,9 152,8* 50,2 103,9 84,7 75 |
96,6-113,2 99-130,4 111,5-204,5 20,2-103,4 79,1-134 46,3-142,1 35,9-137,9 |
|
Wong et Harris, 2000) USA – fonderies |
2300 hommes employés dans 6 fonderies au moins 1 an entre 1947 et 1970 Suivi des causes de la mort entre 1947 et 1995 Comparaison avec les taux de mortalité de la population générale des USA |
Pas de données d’exposition [Pb]sang moyenne : 800 µg.L-1 [Pb]urine moyenne : 1730 µg.L-1 |
Tous sites Poumons Estomac Reins Gros intestin Rectum SNC |
273 107 15 6 22 8 5 |
SMR 101,8 121,5 133,4 92,3 89 123 74,5 |
90,1-114,6 99,5-146,8 74,6-220 33,9-201 55,8-134,7 53,1-242,4 24,2-173,9 |
|
Steenland et al., 1992 USA - fonderie |
1990 hommes employés au moins 1 an, avec au moins 1 jour de présence entre 1940 et 1965 Sous-cohorte fortement exposée de 1436 hommes |
[Pb]sang moyenne : 560 µg.L-1 [Pb]air moyenne : 3,1 mg.m-3 [As]air moyenne : 14 µg.m-3 |
Cohorte totale Tous sites Poumons Estomac Reins Colorectal Sous cohorte Tous sites Poumons Estomac Reins Colorectal |
192 72 15 9 9
137 49 10 8 8 |
SMR 98 118 136 193 48
98 111 128 239 59 |
84-112 92-148 75-224 88-367 22-90
81-115 82-147 61-234 103-471 25-116 |
|
Cocco et al., 1997 Italie - fonderie |
1388 hommes employés au moins 1 an entre 1932 et 1971 Suivi de la mortalité entre 1950 et 1992 |
[Pb]air moyenne : 48 µg.m-3 |
Tous sites Poumons Estomac Reins Cerveau |
149 35 17 5 4 |
SMR 69 62 49 142 125 |
58-81 43-86 29-79 46-333 34-319 |
|
Gerhardsson et al., 1995 Suède - fonderie |
664 hommes employés au moins 3 mois entre 1942 et 1987 Incidence observée entre 1969 et 1989 |
[Pb]sang 1969 : 620 µg.L-1 [Pb]sang 1985 : 330 µg.L-1 |
Tous sites Estomac Reins SNC Tractus respiratoire |
40 3 1 1 6 |
SIR[1] 127 188 80 75 132 |
91-174 39-550 2-448 2-420 49-288 |
SIR : Standardized Incidence Ratio PMOR : Proportional Mortality Odd Ratio SIR : Standardized Incidence Ratio
Deux études environnementales, réalisées à partir des données du NHANES II (National Health and Nutrition Examination Survey) mettent en évidence l’existence d’une relation dose-réponse entre la plombémie et la survenue de cancer des poumons (Jemal et al., 2002 ; Lustberg et Silbergeld, 2002). Toutefois, ces observations ne concordent pas avec ce qui est observé chez les travailleurs, exposés à des concentrations bien plus importantes (IARC, 2006).
Les conclusions de l’IARC sont les suivantes (IARC, 2006) : chez l’homme, preuves limitées pour le plomb inorganique et inadéquates pour le plomb organique
Synthèse
L’exposition professionnelle pourrait être associée à un risque accru de cancers des poumons, de l’estomac ou des reins.
Chez l'animal
Toutes voies
La classification du pouvoir cancérogène du plomb et de ses composés repose essentiellement sur les résultats d’études expérimentales et, plus spécifiquement, suite à des expositions aux formes inorganiques, à l’acétate de plomb, au sous-acétate de plomb, au chromate de plomb et au phosphate de plomb (IARC, 2006) présentées ci-dessous.
L’oxyde de plomb, l’arséniate de plomb, la poudre de plomb et le tétraéthyle de plomb n’induisent pas d’effet cancérigène chez l’animal (IARC, 2006).
Acétate de plomb
Chez le rat, l’administration orale de plomb sous forme d’acétate de plomb augmente la formation de tumeurs rénales (adénomes et carcinomes), avec la mise en évidence de l’existence d’une relation dose-réponse (Azar et al., 1973 ; Boyland et al., 1962 ; Fears et al., 1989 ; Waszynski, 1977 ; Zawirska et Medras, 1968, 1972 ; Zawirska, 1981). Des gliomes (tumeurs du cerveau issues du tissu de soutien ou glie) ont aussi été observés chez les rats (Zawirska et Medras, 1968, 1972), ainsi qu’un lien entre l’exposition au plomb et la survenue de tumeurs des glandes surrénales, des testicules et de la prostate chez les rats mâles, et la survenue de tumeurs des glandes surrénales chez les rats femelles (Zawirska et Medras, 1968).
Boyland et al. ont exposés 20 rats Wistar mâles, âgés de 10 semaines, à une alimentation contenant 1 % d’acétate de plomb (pureté non précisée) pendant 365 jours, suivi d’une période d’observation de 629 jours (Boyland et al., 1962). Les auteurs ont noté l’apparition de la première tumeur rénale 331 jours après le début de l’exposition et 14 animaux sont ensuite décédés, présentant des tumeurs rénales (15 tumeurs rénales observées dont 14 carcinomes).
Zawirska et Medras ont exposé des rats Wistar (94 mâles et 32 femelles) à une alimentation contenant de l’acétate de plomb (pureté non précisée), afin d’atteindre 3 mg Pb/rat par jour pendant les deux premiers mois d’exposition, puis 4 mg Pb/rat par jour pendant 16 mois (Zawirska et Medras, 1968). Le lot témoin comprenait 19 mâles et 13 femelles. Un examen histologique a été réalisé chez tous les animaux. Après 18 mois, 40 rats ont été euthanasiés et les survivants ont été laissés en vie jusqu’à leur mort naturelle. Chez les témoins, seuls un adénome et un carcinome des glandes mammaires ont été observés. Chez les animaux traités, les tumeurs observées sont recensées dans le tableau ci-après et une incidence significative est mise en évidence pour les tumeurs des reins, des glandes surrénales, des testicules et de la prostate.
Principaux résultats de l’étude de Zawirska et Medras, 1968
|
|
Mâles |
Femelles |
||||
|---|---|---|---|---|---|---|
|
Localisation / type de tumeurs |
Nombre total de tumeurs |
Adénomes |
Carcinomes |
Nombre total de tumeurs |
Adénomes |
Carcinomes |
|
Reins |
58* |
43 |
15 |
14* |
12 |
2 |
|
Glandes surrénales |
23* |
22 |
1 |
9* |
- |
- |
|
Testicules |
23* |
- |
- |
|
|
|
|
Prostate |
22* |
21 |
1 |
|
|
|
|
Poumons |
10 |
8 |
2 |
5 |
4 |
4 |
|
Glandes mammaires |
|
|
|
3 |
|
|
|
Muqueuse nasale |
|
4 |
|
|
1 |
|
|
Foie |
3 |
|
|
2 |
|
|
|
Gliome du cerveau |
3 |
|
|
|
|
|
|
Thyroïde |
|
3 |
|
2 |
|
|
|
Conduit spermatique |
|
|
2 |
|
|
|
|
Leucémie |
1 |
|
|
1 |
|
|
|
Sarcome |
1 |
|
|
2 |
|
|
|
Œsophage |
|
|
|
|
|
1 |
* Incidence significative, p<0,05, two-tailed Fisher’s exact test
Ces mêmes auteurs ont aussi démontré l’existence d’un lien entre l’incidence des tumeurs et la durée de l’exposition au plomb sous forme d’acétate (Zawirska et Medras, 1972 ; Zawirska, 1981). Ils ont exposé des rats Wistar (47 mâles et 47 femelles), âgés de 31 semaines, à une alimentation contenant de l’acétate de plomb (pureté non précisée) à hauteur de 3 mg Pb par jour, du 60ème au 504ème jour. Un lot témoin, composé de 31 mâles et femelles ou 47 mâles et femelles, a été observé pendant 800 jours. Un examen histologique a été réalisé chez tous les rats ; aucune tumeur n’a été observée chez les témoins. Sur les 94 rats traités, 102 tumeurs ont été recensées dont :
- 12 rats avec un adénome rénal,
- 15 rats avec un adénome pulmonaire,
- 17 rats avec un adénome pituitaire,
- 10 gliomes du cerveau,
- 11 adénomes de la thyroïde et 5 des glandes parathyroïdaires,
- 11 adénomes de la prostate et 8 adénomes des glandes mammaires,
- et 13 adénomes des glandes surrénales.
Dans cette étude, toutes les incidences de tumeurs observées sont statistiquement significatives (p<0,05, two-tailed Fisher’s exact test), excepté pour les adénomes des glandes parathyroïdaires.
Azar et al. ont exposé des lots de 50 rats mâles et femelles à 0 - 10 - 50 - 100 - 500 ppm de plomb, sous forme d’acétate de plomb (pureté non précisée), via la nourriture pendant deux ans (Azar et al., 1973). Peu de temps après le début de cette première expérimentation, une seconde étude a démarré avec l’exposition de 20 mâles et 20 femelles à 1 000 et 2 000 ppm de plomb via la nourriture, pendant deux ans. Une diminution du poids a été observée chez les animaux exposés à 1 000 et 2 000 ppm, de même qu’une hausse de la mortalité à partir de 500 ppm. L’examen histologique de tous les animaux a révélé la présence de tumeurs rénales chez les animaux recevant 500 - 1 000 et 2 000 ppm. Les incidences rapportées sont les suivantes :
Incidence des tumeurs rénales (Azar et al., 1973)
|
Doses (ppm) |
Incidence de tumeurs rénales |
|
|---|---|---|
|
|
Mâles |
Femelles |
|
500 |
5/50# |
0/50 |
|
1000 |
10/20# |
0/20 |
|
2000 |
16/20# |
7/20* |
# Incidence significative, p<0,001, test du Khi² / * Incidence significative, p<0,05, two-tailed Fisher’s exact test
De même, Fears et al. ont aussi mis en évidence une incidence significative de tumeurs malignes rénales, chez des rats (24 mâles et femelles Fischer 344) exposés à 0 – 500 – 2 000 - 8 000 ppm de plomb sous forme d’acétate de plomb (pureté non précisée), via la nourriture pendant 725 jours (Fears et al., 1989).
Les incidences rapportées sont les suivantes :
Incidence des tumeurs rénales (Fears et al., 1989)
|
Doses (ppm) |
Incidence de tumeurs rénales |
|
|---|---|---|
|
|
Mâles |
Femelles |
|
500 |
0/24 |
0/24 |
|
2000 |
11/24* |
1/24* |
|
8000 |
19/24# |
4/24* |
# Incidence significative, p<0,001, test du Khi² /* Incidence significative, p<0,05, two-tailed Fisher’s exact test
Sous acétate de plomb
Les études réalisées chez la souris (Van Esch et Kroes, 1969) et chez les rats (Ito et al., 1971 ; Ito, 1973 ; Kasprzak et al., 1985 ; Mao et Molnar, 1967 ; Oyasu et al., 1970 ; Van Esch et al., 1962) montrent une augmentation de l’incidence de cancer des reins par voie orale. Par cette même voie, aucune tumeur pulmonaire n’est observée chez la souris. Par contre, suite à l’administration de sous acétate de plomb par voie intrapéritonéale, les souris de souche A développent des adénomes pulmonaires dès les plus faibles doses testées (Stoner et al., 1986), avec une augmentation de la multiplicité de ces tumeurs (Poirier et al., 1984 ; Stoner et al., 1976).
Van Esch et al. ont exposé entre 11 et 16 rats Wistar mâles et femelles à une alimentation contaminée avec 0,1 % ou 1 % de sous acétate de plomb pendant 29 et 24 mois, respectivement. Une diminution du taux de survie des animaux recevant 1 % de sous acétate de plomb a été observée mais non détaillée (Van Esch et al., 1962). Une augmentation statistiquement significative du nombre de tumeurs rénales est observée, liée à la dose : parmi les rats exposés à 0,1 %, 5/16 mâles et 6/16 femelles, et parmi ceux exposés à 1 %, 6/13 mâles et 7/11 femelles, ont développé des tumeurs rénales (Test de Fisher).
Dans l’étude de Mao et Molnar, 40 rats mâles Wistar ont été exposés à 1 % de sous acétate de plomb via la nourriture jusqu’à leur mort : 31 tumeurs rénales ont été observées, comprenant adénomes et carcinomes (Mao et Molnar, 1967).
Chromate de plomb
Parmi les quelques études réalisées sur le chromate de plomb, les études de Maltoni mettent en évidence, chez les rats, l’induction de sarcomes (rhabdosarcomes et fibrosarcomes) au niveau du site de l’injection sous-cutanée de 30 mg de chromate de plomb (Maltoni, 1976 ; Maltoni et al., 1982).
Suite à l’administration intramusculaire 8 mg de chromate de plomb (pureté 98 %), les rats mâles et femelles exposés présentent à la fois des tumeurs au niveau du site de l’injection mais aussi des carcinomes rénaux (Furst et al., 1976).
Toutefois, l’implication du chrome VI, appartenant au Groupe 1 de l’IARC (), dans la réponse cancérigène observée, doit être prise en compte (IARC, 2006).
Phosphate de plomb
L’injection sous-cutanée de phosphate de plomb, ou en combinaison avec une injection intra-péritonéale, induit l’apparition de tumeurs rénales chez les rats exposés (Baló et al., 1965 ; Roe et al., 1965 ; Tonz, 1957 ; Zollinger, 1953).
Ainsi, des rats albinos (10 par lot) ont reçu des injections sous-cutanées de 20 mg de phosphate de plomb chaque semaine pendant 16 mois (Zollinger, 1953). Parmi les 29 rats ayant survécu au moins 10 mois, 19 rats ont développé des tumeurs rénales (adénomes, cystadénomes, papillomes et carcinomes du cortex). De plus, les auteurs ont montré que l’incidence de ces tumeurs augmentait avec la durée d’exposition.
De même, Tonz a injecté en sous-cutanée 20 mg de phosphate de plomb chaque semaine, pendant 16,5 mois, à des rats albinos (lot de 36, 33, 14 et 29 rats, en fonction des doses) (Tonz, 1957). A la fin de l’étude, les incidences d’adénomes et de carcinomes rénaux observées étaient de 19/29 et 3/29, respectivement.
Une administration combinée de phosphate de plomb par injection sous-cutanée et intrapéritonéale, aux doses de 29 - 145 - 450 mg de phosphate de plomb, induit le développement de tumeurs rénales de manière dose-dépendante (Roe et al., 1965).
Autres composés
D’autres composés comme l’oxyde de plomb ont également démontré un pouvoir co-cancérogène lorsqu’ils étaient administrés en association avec un cancérogène de référence (Hinton et al., 1979 ; Kobayashi et Okamoto, 1974).
De plus, certaines données expérimentales suggèrent que le plomb peut agir comme promoteur. Ainsi, à faibles concentrations, l’ion Pb2+ peut stimuler l’activité de la protéine kinase C (Markovac et Goldstein, 1988a, 1988b). La formation d’inclusions nucléaires, composées de protéines acides complexées au Pb2+, peut également influencer la croissance et la division cellulaire (Beck, 1992).
Les conclusions de l’IARC sont les suivantes (IARC, 2006) : chez l’animal
preuves suffisantes pour le plomb inorganique, l’acétate de plomb, le sous acétate de plomb, le chromate de plomb et le phosphate de plomb
preuves inadéquates pour l’oxyde plomb, l’arséniate de plomb, le plomb organique, le plomb tétraéthyle et la poudre de plomb.
Synthèse
La classification du CIRC qui considère comme probablement cancérogène le plomb et de ses composés repose essentiellement sur les résultats des études expérimentales et plus spécifiquement lors d’expositions aux composés inorganiques, à l’acétate de plomb, au sous acétate de plomb, au chromate de plomb et au phosphate de plomb. Les composés d’oxyde de plomb, d’arséniate de plomb, la poudre de plomb et le tétraéthyle de plomb n’induisent pas d’effet cancérigène chez l’animal.
Effets génotoxiques
Généralités
En 2006, l’IARC rapporte une synthèse et une analyse des principales données disponibles. Ces données sont mentionnées ci-dessous et complétées avec des données plus récentes (Garcia-Leston et al., 2010). Si certaines études n’ont pas démontré d’effets, de nombreuses études présentent des résultats positifs.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le diacétate de plomb, l’hexafluorosilicate de plomb (II), les dérivés du plomb à l’exception de ceux nommément cités à l’annexe, les dérivés alkylés du plomb, l’hydrogénoarséniate de plomb ont été examinés par l’Union Européenne mais n’ont pas été classés. |
Chez l'homme
Toutes voies
Les études réalisées chez l’homme en milieu industriel montrent une génotoxicité évidente, avec des résultats positifs dans de nombreux tests (IARC, 2006). Les études disponibles ont été réalisées au moyen de différents tests : test des comètes (Chen et al., 2006 ; Danadevi et al., 2003 ; Fracasso et al., 2002 ; Grover et al., 2010 ; Martino-Roth et al., 2003 ; Palus et al., 2003 ; Restrepo et al., 2000 ; Steinmetz-Beck et al., 2005 ; Ye et al., 1999), d’altérations de l’ADN ou liaisons ADN-protéines (Wu et al., 2002), de cassure simple brin de l’ADN (Hengstler et al., 2003), du micronoyau (Chen et al., 2006 ; Grover et al., 2010 ; Hamurcu et al., 2001 ; Kapka et al., 2007 ; Martino-Roth et al., 2003 ; Palus et al., 2003 ; Shaik et Jamil, 2009 ; Vaglenov et al., 1997 ; Vaglenov et al., 1998 ; Vaglenov et al., 2001), d’aberrations chromosomiques (Al-Hakkak et al., 1986 ; Forni et al., 1976 ; Grover et al., 2010 ; Huang et al., 1988 ; Madhavi et al., 2008 ; Maki-Paakkanen et al., 1981 ; Nordenson et al., 1978 ; O'Riordan et Evans, 1974 ; Schmid et al., 1972 ; Schwanitz et al., 1970 ; Schwanitz et al., 1975 ; Shaik et Jamil, 2009), d’échanges de chromatides sœurs (Donmez et al., 1998 ; Duydu et Suzen, 2003 ; Duydu et al., 2005 ; Grandjean et al., 1983 ; Huang et al., 1988 ; Leal-Garza et al., 1986 ; Maki-Paakkanen et al., 1981 ; Palus et al., 2003 ; Rajah et Ahuja, 1995 ; Wiwanitkit et al., 2008 ; Wu et al., 2002).
Toutefois, dans l’ensemble de ces études une co-exposition à d’autres composés, rend difficile l’attribution des effets génotoxiques observés au seul plomb. Peu d’études sont disponibles en dehors du milieu professionnel et elles ne mettent en évidence aucune corrélation entre les concentrations en plomb dans le sang et les effets génotoxiques. Les tests qui ont été pratiqués sont les dommages oxydatifs de l’ADN (Merzenich et al., 2001), les échanges de chromatides sœurs (Dalpra et al., 1983) et les aberrations chromosomiques (Bauchinger et al., 1977 ; Bijlsma et de France, 1976)
Synthèse
Le plomb est un métal qui ne semble pas avoir une action directe sur l’ADN pour des plombémies normalement rencontrées. Sa génotoxicité indirecte semble liée d’une part, à l’augmentation et la modulation des espèces réactives de l’oxygène, et d’autre part, à son interaction avec les protéines cellulaires, dont celles impliquées dans les mécanismes de réparation de l’ADN (Silbergeld, 2003 ; Xu et al., 2008). Ces propriétés sont à l’origine de mutations, de modifications dans l’expression des gènes et de proliférations cellulaires, contribuant à la cancérogénicité si l’exposition est maintenue. S’il est donc vraisemblable que les effets soient en grande partie liés à des mécanismes d’action génotoxiques indirects, des effets génotoxiques directs ne peuvent pas être totalement exclus, en l’état actuel des connaissances.
Chez l'animal
Toutes voies
In vivo, les tests ont été réalisés par voies orale, respiratoire, sous-cutanée, intrapéritonéale et intraveineuse. Il faut souligner que les plombémies ne sont pas disponibles pour ces études. Des cassures de brins d’ADN dans les leucocytes (Yuan et Tang, 2001), les cellules hépatiques, rénales, de la cavité nasale, de la moelle osseuse (Valverde et al., 2002) chez la souris ou rénales chez le rat (Robbiano et al., 1999) ont été mises en évidence lors d’exposition à l’acétate de plomb. Des résultats variables ont été observés au niveau des échanges de chromatides sœurs avec des résultats positifs sur cellules de moelle osseuse chez la souris Swiss (Nayak et al., 1989) ou albinos (Dhir et al., 1993) pour des expositions au nitrate de plomb. Chez le rat, certaines études ont montré la présence de micronoyaux dans les cellules de moelle osseuse (Tachi et al., 1985), ou rénales (Robbiano et al., 1999) lors d’exposition à l’acétate de plomb.
Une augmentation de la fréquence des aberrations chromosomiques est observée sur cellules de moelle osseuse (Deknudt et Gerber, 1979) et leucocytes (Muro et Goyer, 1969) chez les souris, sur cellules de moelle osseuse (Tachi et al., 1985) chez les rats et sur lymphocytes (Deknudt et al., 1977) de singes exposés à l’acétate de plomb ou sur cellules de moelle osseuse de la mère et de foie du fœtus chez la souris exposée au nitrate de plomb (Nayak et al., 1989).
Une aneuploïdie est observée sur cellules de moelle osseuse de rat (Nehez et al., 2000) et sur lympocytes de singes (Deknudt et al., 1977) pour des expositions à l’acétate de plomb et sur cellules de moelle osseuse de la mère et de foie du fœtus chez la souris exposée au nitrate de plomb (Nayak et al., 1989).
Enfin, des anomalies de morphologie des spermatozoïdes ont été observées chez les souris (Bruce et Heddle, 1979) et des anomalies sont rapportées chez des singes (Foster et al., 1996) pour des expositions à l’acétate de plomb.
In vitro
Organismes procaryotes
Les études réalisées sur bactéries ne montrent aucune induction de mutation de la part de l’acétate de plomb (Dunkel et al., 1984 ; Nishioka, 1975 ; Rosenkranz et Poirier, 1979) ou du chlorure de plomb (Nestmann et al., 1979 ; Nishioka, 1975), à la différence du chromate de plomb (Nestmann et al., 1979) et du bromure de plomb (Maslat et Haas, 1989).
Toutefois, pour ces deux derniers composés, l’activité génotoxique semble liée aux anions plutôt qu’au plomb, ceci a été clairement démontré pour le chromate de plomb (Douglas et al., 1980).
Organismes eucaryotes
L’acétate et le nitrate de plomb induisent des ruptures de brins d’ADN chez plusieurs cellules de mammifères. Les tests d’échanges de chromatides sœurs et d’aberrations chromosomiques montrent des réponses variables. En pratique, il s’agit de résultats positifs à un certain nombre de tests lors de l’exposition à l’acétate de plomb : de cassures de l’ADN sur culture primaire de cellules de rats (Robbiano et al., 1999), sur cellules transgéniques G12 (Roy et Rossman, 1992), de mutation génique au niveau du locus HPRT sur cellules CHO K1 (Yang et al., 1996), de micronoyau sur cellules V79 (Thier et al., 2003) de transformation cellulaire sur cellules SHE (Zelikoff et al., 1988), de cassure d’ADN sur cellules humaines de reins (Robbiano et al., 1999), de cassures d’ADN simple ou double brins ou de liaisons croisées ADN-protéines sur lymphocytes humains (Wozniak et Blasiak, 2003). De même, pour le nitrate : mutation géniques au locus HPRT sur cellules V79 (Zelikoff et al., 1988), échanges de chromatides sœurs sur cellules CHO (Cai et Arenaz, 1998 ; Lin et al., 1994) et cassures de brins sur cellules transgéniques G12 (Roy et Rossman, 1992). La formation de micronoyaux est présente dès les faibles concentrations.
Aucun résultat de test in vitro n’est disponible pour les composés organiques du plomb.
Synthèse
En conclusion, le plomb est un métal qui ne semble pas avoir une action directe sur l’ADN pour des plombémies normalement rencontrées. Sa génotoxicité indirecte semble liée d’une part, à l’augmentation et la modulation des espèces réactives de l’oxygène, et d’autre part, à son interaction avec les protéines cellulaires, dont celles impliquées dans les mécanismes de réparation de l’ADN (Silbergeld, 2003 ; Xu et al., 2008). Ces propriétés sont à l’origine de mutations, de modifications dans l’expression des gènes et de proliférations cellulaires, contribuant à la cancérogénicité si l’exposition est maintenue.
S’il est donc vraisemblable que les effets cancérogènes soient en grande partie liés à des mécanismes d’action génotoxiques indirects, des effets génotoxiques directs ne peuvent pas être totalement exclus, en l’état actuel des connaissances. C’est pourquoi le plomb doit être considéré comme un cancérogène sans seuil d’effet.
Effets sur la reproduction
Chez l'homme
Toutes voies
Chez l'homme, les études suggèrent qu'une exposition au plomb de l'ordre de 6 à 10 ans (plombémie supérieure à 300 µg.L-1), provoque une réduction de la production des spermatozoïdes et, donc, un risque d'hypofertilité (Alexander et al., 1996 ; Assennato et al., 1987 ; Sallmen et al., 2000).
L’étude de Lin et al., réalisée chez plus de 4 000 sujets exposés professionnellement, a pu mettre en évidence une diminution significative du nombre des naissances par comparaison au groupe témoin (5 000 personnes) dans toutes les catégories d’âges étudiées, hormis le groupe de 51 à 55 ans (Lin et al., 1996). L’allongement de la durée d’exposition au plomb aggrave la diminution de fertilité observée (Lin et al., 1996). De plus, plus la plombémie est forte, plus la baisse de fertilité sera marquée (Shiau et al., 2004). L’ensemble des données disponibles semblent montrer l’existence d’un seuil pour les effets sur la fertilité masculine, correspondant à une plombémie entre 300 et 400 µg.L-1.
La fertilité semble être affectée par l'exposition paternelle au plomb (ATSDR, 1999). L’exposition au plomb affecte la qualité des spermatozoïdes. Plusieurs études ont montré une diminution de la concentration spermatique, des effets sur la chromatine (Bonde et al., 2002) et la présence de spermatozoïdes anormaux pour des plombémies supérieures à 400 µg.L-1 (Alexander et al., 1998 ; Lancranjan et al., 1975 ; Telisman et al., 2000). Une étude récente met en évidence des effets du plomb sur la condensation de la chromatine dans le spermatozoïde (Hernandez-Ochoa et al., 2005). Kasperczyk et al. ont observé une diminution de la motilité des spermatozoïdes, chez des travailleurs présentant une plombémie comprise entre 400 et 810 µg.L-1, probablement consécutive à une augmentation de la péroxydation lipidique (Kasperczyk et al., 2008).
Le plomb agit directement sur les testicules, en perturbant la sécrétion d'hormones sexuelles. Ainsi, la concentration de testostérone est diminuée chez l'homme pour des plombémies supérieures à 600 µg.L-1 (Braunstein et al., 1978 ; Rodamilans et al., 1988).
Il semblerait que ces effets sur les spermatozoïdes et les niveaux de testostérone et estradiol puissent survenir pour des niveaux d’exposition faibles tels que ceux habituellement rencontrés en l’absence d’exposition spécifique au plomb correspondant à une plombémie médiane de 49 µg.L-1 (Telisman et al., 2007).
Enfin, il a été montré une augmentation du délai d’apparition de la puberté chez les garçons en dessous de 100 µg.L-1 (Hauser et al., 2008 ; Williams et al., 2010).
Il existe peu de données disponibles concernant la femme enceinte et l’exposition au plomb. Les conséquences d’imprégnations faibles sont difficilement mesurables, mais lors d’imprégnations fortes de la femme enceinte, des conséquences graves sont possibles telles que des avortements ou un retard de croissance intra-utérin (Has, 2003).
Chez les femmes ayant une plombémie moyenne de 150 µg.L-1, plusieurs études ont montré aucune augmentation du risque d'avortement spontané comparativement à un groupe témoin (Nordstrom et al., 1979 ; Alexander et Delves, 1981 ; McMichael et al., 1986 ; Baghurst et al., 1987 ; Murphy et al., 1990 ; Borja-Aburto et al., 1999). En revanche, Borja-Aburto et al. ont déterminé une augmentation du risque d’avortement de 1,13 fois par élévation de 10 µg.L-1 de plombémie, entre 101 et 120 µg.L-1 (Borja-Aburto et al., 1999). De même une réduction de la durée de gestation et un risque accru de naissance prématurée a été observé pour des plombémies de 72 µg.L-1 (Cantonwine et al., 2010).
Une baisse de fécondité a pu être associée à un groupe de femmes qui présentait des plombémies comprises entre 290 et 500 µg.L-1 (Sallmen et al., 1995). Une augmentation du délai de conception est rapporté pour une plombémie de 100 µg.L-1 (Shiau et al., 2004). Une augmentation du risque d’infertilité chez les femmes est décrit pour des plombémies comprises entre 100 et 150 µg.L-1 (Sallmen et al., 2000) et il est multiplié par 3 pour des plombémies supérieures à 25 µg.L-1 par comparaison à celles inférieures à 25 µg.L-1 (Chang et al., 2006).
Comme pour les avortements spontanés, les résultats relatifs aux accouchements avant terme sont contradictoires. Alors que des études suggèrent que le plomb entraîne une réduction du poids de naissance, des accouchements prématurés et une altération de la croissance et du développement fœtal (Bellinger et al., 1985 ; McMichael et al., 1986), une étude plus récente ne retrouve pas d'effet sur le poids de naissance ou la durée de la grossesse pour les mères dont les plombémies sont inférieures à 150 µg.L-1 (Bellinger et al., 1991). La comparaison de deux groupes de femmes, avec des plombémies moyennes de 190 et 6 µg.L-1, confirme l’absence de lien entre la durée de gestation, le poids à la naissance et l’exposition prénatale au plomb (Factor Litvak et al., 1991). Au contraire, Torres- Sanchez et al. ont observé trois fois plus de naissances prématurées chez les femmes présentant une concentration en plomb dans le cordon ombilical supérieure ou égale à 51 µg.L-1, par rapport aux femmes présentant une concentration inférieure (Torres-Sanchez et al., 1999). Jelliffe-Pawloski et al. ont mis en évidence un risque de naissance prématurée accru dès 100 µg.L-1 (Jelliffe-Pawlowski et al., 2006). Une augmentation du risque de ruptures prématurées de membranes chez les femmes enceintes en dessous de 150 µg.L-1 (Vigeh et al., 2010).
Enfin, un allongement des délais d’apparition de la puberté chez les filles a été mesuré (Kaji et Nishi, 2006 ; Selevan et al., 2003 ; Wang et al., 2005 ; Wu et al., 2003), même en dessous de 50 µg.L-1 (Naicker et al., 2010).
Synthèse
De nombreuses études ont exploré l’existence potentielle d’une relation entre exposition au plomb et effets sur la reproduction. Les résultats sont contradictoires mais globalement les données disponibles suggèrent un lien entre une plombémie élevée et la survenue d’avortements, d’accouchements avant terme mais aussi d’altération du sperme et donc de la fertilité masculine, ainsi que de la fertilité féminine.
Chez l'animal
Toutes voies
Chez l'animal (singe, souris, rat), la spermatogenèse n'est pas altérée, mais des modifications de la qualité des spermatozoïdes sont notées. En effet, aucune modification des paramètres classiquement étudiés pour caractériser les spermatozoïdes (numération, motilité, morphologie) n’a été trouvée dans deux groupes de singes traités chroniquement de la naissance à l’âge de 15 à 20 ans, ayant des plombémies respectives de 100 et 560 µg.L-1 (Foster et al., 1996). C’est également le cas chez la souris mâle pour une intoxication par ingestion d’eau de boisson contenant 1 g.L-1 de chlorure de plomb pendant 3 mois ou encore l’ingestion d’acétate de plomb (5 g.L-1 d’eau contaminée) depuis le premier jour de vie intra-utérine via la mère, jusqu’à l’âge de 60 jours (Johansson, 1989 ; Pinon-Lataillade et al., 1995).
Par contre, des modifications ultrastructurales des spermatozoïdes ont pu être observées chez la souris pour des ingestions d’acétate de plomb plus importantes (10 g.L-1) pendant 8 semaines (Eyden et al., 1978) et également chez le singe (altération de la structure de la chromatine des spermatozoïdes) (Foster et al., 1996).
En revanche, une étude menée chez les rats mâles exposés à l’acétate de plomb par l’eau de boisson aux doses de 0 - 273 – 819 mg.L-1 pendant 45 jours (Anjum et al., 2011). Une diminution significative du poids des organes de la reproduction, des spermatozoïdes (numération, motilité, viabilité) témoigne de la diminution de la production spermatique et de la détérioration de la qualité. Ces effets sont accompagnés par une diminution des niveaux de testostérone sérique. Une autre étude rapporte des augmentations des niveaux de testostérone et d’hormone lutéinisante associées dommages aux niveaux des tubules séminifères chez les rats exposés à 0 – 10 – 15 mg.kg-1.j-1 par voie intrapéritonéale pendant 20 jours (Ait Hamadouche et al., 2013).
Chez la souris femelle, l’ingestion d’acétate de plomb conduisant à des plombémies moyennes comprises entre 220 et 560 µg.L-1 affecte la croissance et le développement des follicules (Junaid et al., 1997).
La taille des portées de souris femelles intoxiquées par ingestion d’eau contenant 5 g.L-1 d’acétate de plomb est réduite de 23 %, alors que le poids des nouveau-nés est en moyenne 11 % plus faible que le lot témoin (Pinon-Lataillade et al., 1995). Dans des conditions expérimentales similaires, d’autres auteurs ont constaté une augmentation significative du nombre de fœtus mort-nés et une réduction du poids des nouveau-nés de 28 % consécutives à l’imprégnation par l’acétate de plomb (Ronis et al., 1996).
En utilisant des isotopes stables du plomb, Franklin et al. ont montré chez le singe que 7 à 39 % du plomb du squelette fœtal provenait du squelette de la mère, le transfert étant plus important au cours des deuxième et troisième trimestres (Franklin et al., 1997). De plus, les taux de plomb osseux du fœtus dépassaient le plus souvent les taux osseux maternels, en moyenne de 150 %.
Effets sur le développement
Chez l'homme
Toutes voies
Lors d’une grossesse, le plomb éventuellement stocké dans les os de la mère, précédemment exposée, est relargué dans le sang et contamine le fœtus, puis se retrouve ensuite dans le lait maternel : le nourrisson est alors contaminé pendant la période d’allaitement. Le suivi d’enfants exposés in utero puis pendant 4 années après leur naissance soulève, comme de très nombreuses autres études, le problème des conséquences de l’exposition à de faibles doses de plomb sur le développement neurocomportemental dans la petite enfance (Wasserman et al., 1994). Ce point essentiel et particulièrement préoccupant est traité dans le paragraphe concernant les effets systémiques.
L’exposition à de faibles concentrations en plomb n’a pas d’effet sur l’apparition d’anomalies congénitales majeures. Toutefois, un lien existe avec l’incidence de malformations mineures (hémangiomes et lymphangiomes, hydrocèle, anomalies de la peau ou non descente des testicules) (Needleman et al., 1984). Des malformations du tube neural ont pu être associées à la consommation d’eau contenant ≥ 10 µg.L-1, ou plus, de plomb (Bound et al., 1997).
Quelques indices anthropométriques ont fait l’objet d’études tels que le gain de poids, le périmètre crânien ou la taille de naissance. Sanin et al. ont ainsi montré que la plombémie de nouveau-nés de 1 mois est inversement proportionnelle à leur gain de poids : une diminution de 15,1 g par µg.dL-1 de plomb sanguin a été déterminée par ces auteurs (Sanin et al., 2001). De même, la plombémie prénatale influe sur le poids de naissance. Bornschein et al. ont mis en évidence une diminution du poids moyen de naissance de 114 g (variable selon l’âge de la maman) pour toute augmentation d’une unité log de la plombémie (Bornschein et al., 1989). Ces auteurs ont ainsi proposé un seuil d’effet de 120-130 µg.L-1.
Les nouveau-nés exclusivement allaités présentent des prises de poids supérieures aux autres nourrissons mais ce gain diminue de manière significative avec l’augmentation des niveaux en plomb patellaire maternel (Sanin et al., 2001). Une relation similaire a été observée pour la taille des nouveau-nés et leur périmètre crânien (Hernandez-Avila et al., 2002). Rothenberg et al. ont même estimé une diminution du périmètre crânien de 0,34 cm concomitante au doublement de la plombémie pendant la 1ère année de vie des nourrissons (de 60 à 125 µg.L-1) (Rothenberg et al., 1999).
Toutefois, certaines études ont aussi montré l’absence de lien entre la plombémie et ces différentes mesures anthropométriques (Sachs et Moel, 1989; Greene et Ernhart, 1991 : Falcon et al., 2003 ; Lamb et al., 2008).
Des plombémies croissantes ont aussi été associées à une diminution de la stature et un retard dans le développement sexuel (Selevan et al., 2003 ; Wu et al., 2003).
Chez l'animal
Toutes voies
Les études réalisées chez le rat indiquent qu’une exposition orale au plomb perturbe la croissance normale des os, avec une diminution de la densité osseuse et du contenu en calcium, une diminution de la densité de l’os trabéculaire et une augmentation de la résorption osseuse (Escribano et al., 1997 ; Gonzalez Riola et al., 1997 ; Gruber et al., 1997 ; Hamilton et O'Flaherty, 1994; Ronis et al., 2001).
Par ailleurs, plusieurs études rapportent des retards dans la maturation sexuelle des animaux exposés au plomb, mais présentant des plombémies bien supérieures à celles mesurées dans les études de Selevan et de Wu (Selevan et al., 2003 ; Wu et al., 2003). Par exemple, un retard dans l’ouverture vaginale a été observé chez des rats femelles exposées in utero et via la lactation et ensuite indirectement, via une alimentation contaminée (plombémies comprises entre 200 et 400 µg.L-1) (Grant et al., 1980). De même, des rats mâles et des femelles prépubères exposés à de l’acétate de plomb via l’eau de boisson (plombémie résultante de 570 µg.L-1) présentent une réduction significative du poids moyen des testicules et des organes sexuels secondaires, un retard dans l’ouverture du vagin et des perturbations des œstrus (Ronis et al., 1996).
Les études chez l’animal ont montré que l’imprégnation par le plomb était responsable d’anomalies de fermeture du tube neural (Zhao et al., 1997). Les conséquences de l’imprégnation par le plomb pendant la période de maturation cérébrale chez l’animal sont décrites dans le paragraphe traitant des effets systémiques.
Synthèse
Chez l’animal, les effets du plomb sur le développement indiquent des retards d’ossification, de la maturation sexuelle et des anomalies neurodéveloppementales.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance dangereuse et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition chronique par inhalation et par voie orale
Plomb inorganique
L’ANSES propose de retenir une plombémie de 15 µg.L-1 pour des expositions chroniques au plomb aussi bien par voie orale que par inhalation (ANSES, 2013).
La construction de la valeur s’appuie sur le raisonnement de l’EFSA, 2010.
Dans son rapport, l’EFSA ne propose pas de VTR, en revanche elle étudie des « mode d’action » (MOA) pour 3 effets critiques et constate que ces effets surviennent pour une plombémie plus basse que la concentration de 100 µg.L-1 habituellement utilisée dans le calcul de VTR. Ces trois effets correspondent à :
- des effets neurologiques (déficit intellectuel) chez l’enfant avec une benchmark dose limite pour 1 % d’effet (BMDL01) correspondant à une plombémie de 12 µg.L-1 à partir de l’étude de Lanphear et al., 2005,
- des effets cardiovasculaires (modification de la pression systolique) avec une benchmark dose moyenne des benchmark dose Limite pour 1 % d’effet (BMDL01) pour une plombémie de 36 µg.L-1 à partir de 5 études (Cheng et al., 2001 ; Glenn et al., 2003 ; Glenn et al., 2006 ; Nash et al., 2003 ; Vupputuri et al., 2003),
- des effets rénaux chroniques avec une benchmark dose limite pour 10 % d’effet (BMDL10) à partir de la plombémie moyenne de 15,8 µg.L-1 à partir de l’étude de Navas-Acien et al., 2009.
Trois principaux modèles toxicocinétiques peuvent être utilisés pour l’évaluation du risque pour le plomb lié à l’alimentation et à l’exposition atmosphérique : le modèle PBPK de O’Flaherty (1998) utilisable chez les enfants et les adultes, le modèle de Carlisle et Wade (Carlisle et Wade, 1992) limité aux adultes et le modèle « integrated exposure uptake biokinetic » (IEUBK) développé pour les enfants (US EPA, 1994). Un autre modèle « adulte lead methodology » (ALM) est également décrit mais n’est utilisable que pour des expositions par voie orale (US EPA, 2001).
L’EFSA réalise le calcul de la dose associée à la plombémie avec le modèle de Carlisle et Wade, 1992, avec des doses chez les adultes de 1,50 µg.kg-1.j-1 et 0,63 µg.kg-1.j-1 respectivement pour les effets cardiovasculaires et rénaux et avec l’IEUBK pour les enfants pour la dose de 0,50 µg.kg-1.j-1. L’EFSA conclue qu’il existe un risque d’effet clinique cardiovasculaire et rénal faible chez l’adulte aux niveaux d’exposition au plomb couramment rencontrés. Chez le nourrisson, l’enfant et la femme enceinte, il existe une préoccupation de potentiels effets neurocomportementaux aux niveaux d’exposition au plomb couramment rencontrés malgré tout la valeur retenue serait protectrice vis-à-vis de ces effets.
La valeur proposée par l’ANSES, qui reprend en partie le raisonnement de l’EFSA, est basée sur une étude épidémiologique de Navas-Acien et al., 2009. Cette étude montre l’association de la concentration sanguine de cadmium et de plomb et une diminution du taux de filtration glomérulaire et avec une augmentation de maladie rénale chronique. Les odds ratio ont été ajustés sur l’âge, le sexe, l’origine ethnique, l’indice de masse corporelle, l’éducation, la consommation de tabac et d’alcool, l’hypertension, le diabète, la ménopause et la concentration sanguine en cadmium. Ces données ont permis une modélisation de la relation dose-réponse.
Par modélisation des données, une plombémie critique de 15 µg.L-1 a été calculée. Cette valeur est retenue pour les enfants et les adultes pour une augmentation de la prévalence de maladie rénale chronique définie comme une augmentation pendant plus de 3 mois d’un taux de filtration glomérulaire inférieur à 60 mL.min-1.1,73 m-2 de surface corporelle. Cette valeur correspond également à la valeur critique impliquée dans les perturbations neuropsychologiques de l’enfant et pour lesquelles les données disponibles n’ont pas permis de modélisation. Elle permet de couvrir toute la population (adultes et enfants).
L’OMS propose une valeur guide de 0,5 µg.m-3 pour le plomb pour des expositions chroniques par inhalation (OMS, 2000).
Cet organisme préconise que la valeur annuelle d’exposition au plomb ne dépasse pas 0,5 µg.m-3. Pour ce faire, l’OMS retient comme valeur critique une plombémie de 100 µg.L-1, concentration supposée protéger 98 % de la population. Une concentration dans l’air de 0,5 µg.m-3 garantit une plombémie inférieure à 24 µg.L-1. Pour dériver sa valeur, l’OMS retient plusieurs arguments :
- En 2000, la plombémie de base associée à l’activité d’origine anthropique minimum est probablement comprise entre 10-30 µg.L-1 ;
- Plusieurs groupes d’experts ont déterminé que les premiers effets identifiés chez de jeunes enfants débutaient à 100-150 µg.L-1. Il ne peut cependant pas être exclu que des effets puissent apparaitre avant, il est donc recommandé de retenir la valeur la plus basse de cette fourchette dans une démarche protectrice ;
- Il est admis que la voie d’exposition principale est l’inhalation chez les adultes, incluant les femmes enceintes, mais qu’elle n’est pas prédominante chez les jeunes enfants chez lesquels d’autres voies d’exposition telle que l’ingestion est généralement plus importante ;
- Il a été établi qu’1 µg.m-3 de plomb dans l’air contribue directement à 19 µg de plomb par litre de sang chez les enfants et environ 16 µg de plomb par litre de sang chez les adultes, bien qu’il soit reconnu que la contribution relative à partir de l’air est moins importante chez les enfants que chez les adultes. Ces valeurs sont approximatives, la relation dose-réponse est curviligne et s’applique essentiellement aux faibles niveaux de plombémie.
En 2011, une nouvelle analyse de l’OMS ne retient plus la valeur de PTWI de 25 µg.kg-1 comme étant protectrice pour la santé.
En effet, les études récentes ont montré qu’à ces niveaux d’exposition une diminution d’au moins 3 points du QI était observée chez les enfants et qu’une augmentation de la pression systolique d’environ 3 mm de Hg pouvait survenir chez les adultes. Une réévaluation est en cours.
Cette valeur était issue de divers travaux qui semblaient montrer que, chez l’enfant, en deçà de 4 µg.kg-1.j-1, il n’était pas rapporté d’augmentation de la plombémie (OMS, 2008). Initialement destinée à la protection des nourrissons et des jeunes enfants, cette valeur avait depuis été adoptée pour la population générale.
Facteurs d'incertitude : l’établissement de cette valeur faisait référence à des études chez l’homme et ne nécessitait donc l’application d’aucun facteur d’incertitude. Un facteur d’incertitude global de 1 avait été donc retenu.
L’US EPA (IRIS) est actuellement toujours en discussion depuis 2004 pour la détermination de la RfD du plomb inorganique (US EPA, 2012).
Le RIVM propose une TDI de 3,6.10-3 mg.kg-1.j-1 pour une exposition chronique au plomb et ses dérivés par voie orale (Baars et al., 2001).
Cette valeur est directement issue de la dose hebdomadaire tolérable (PTWI) de 25 µg.kg-1 proposée par le "Joint Expert Commitee on Food Additives (FAO/WHO)" en 1993 (publiée par l’OMS IPCS, 1995). Cette PTWI, initialement proposée en 1987 pour les enfants, a été étendue à l'ensemble des classes d'âge en 1993, pour protéger notamment les fœtus in utero.
Calcul : 25 µg.kg-1/semaine x 1 / 7 = 3,6 µg.kg-1.j-1
Selon le RIVM, la fiabilité de cette valeur est élevée.
L’ATSDR ne propose, pour le plomb et ses dérivés inorganiques, aucune valeur de référence aussi bien pour les effets non cancérogènes que pour les effets cancérogènes. L’âge, l’état de santé, la charge pondérale en plomb, et la durée de l’exposition sont autant de facteurs qui jouent sur le métabolisme du plomb, et compliquent l’établissement de ces valeurs.
Santé Canada retient une DRS provisoire de 5.10-4 mg.kg-1.j-1 pour des expositions chroniques au plomb aussi bien par voie orale (Santé Canada, 2021).
Santé Canada précise qu’il n’a pas dérivé de VTR pour le plomb. Tel qu’indiqué dans la littérature scientifique disponible, aucun seuil d’effet n’a pu être établi pour l’effet critique identifié pour le plomb (toxicité neuro-développementale). En 2013, Santé Canada a recommandé que le plomb soit considéré comme une substance sans seuil. La dose associée à un risque spécifique (DRS) de l’Efsa (2013) est recommandée comme VTR provisoire.
Cette valeur repose sur la méta-analyse d’études épidémiologiques réalisée sur la période de la naissance ou de la petite enfance jusqu’à l’âge de 5 à 10 ans (Lanphear et al., 2005). L’effet critique retenu est la toxicité neuro-développementale (fonction cognitive). Une approche sans seuil a été retenue pour cet effet. Une BMDL01 de 0,5 µg.kg-1.j-1 a été calculée elle est associée à une diminution d’un point de QI et constitue la DRS.
Effets sans seuil - Exposition chronique par inhalation
Comme exposé au paragraphe « Caractère génotoxique », les données de génotoxicité ne permettent pas, dans l’état actuel des connaissances, d’exclure un mécanisme d’action génotoxique pour le plomb. Dans ces conditions, il semble opportun de proposer des valeurs pour des effets sans seuil.
L'OEHHA propose un ERUi de 1,2.10-5 (µg.m-3)-1 pour une exposition au plomb et ses dérivés inorganiques (OEHHA, 2011).
Cette valeur est construite par extrapolation à partir de l’ERUo dont la construction est décrite plus loin. Les données humaines disponibles indiquent que 50 % du plomb inhalé est absorbé, comparé à 10 % du plomb ingéré (Owen, 1990). Si l'on considère que ces taux d'absorption sont identiques chez le rat, et en considérant un adulte moyen de 70 kg respirant 20 m3 par jour, une ingestion de 1 mg.kg-1.j-1 correspond à une inhalation de 3 500 µg.m-3 par 24 heures. L'ERUo équivaut à un risque par inhalation de 2,4.10-6 µg.m-3, multiplié par 5 pour tenir compte de l'absorption par inhalation qui est 5 fois supérieure à l'ingestion, ce qui donne un ERUi de 1,2.10-5 (µg.m-3). Ceci correspond à une concentration de 0,83 µg.m-3 pour un excès de risque de 10-5 et une concentration de 0,08 µg.m-3 pour un excès de risque de 10-6.
Effets sans seuil - Exposition chronique par voie orale
L'OEHHA propose un ERUo de 8,5.10-3 (mg.kg-1.j-1)-1 pour une exposition au plomb et ses dérivés inorganiques (OEHHA, 2011).
Cette valeur a été calculée à partir d'une étude de cancérogénèse expérimentale chez le rat (Azar et al., 1973). Les rats ont reçu une nourriture enrichie en plomb sous forme d’acétate, aux doses nominales de 0, 10, 50, 100, 500, 1 000 et 2 000 ppm durant deux ans. Des tumeurs rénales ont été observées de façon dose dépendante chez les mâles exposés aux trois plus fortes concentrations. Des tumeurs ont également été observées chez les femelles exposées à 2 000 ppm (7/20).
Données chez les rats mâles exposés au plomb dans l'alimentation (Azar et al., 1973)
|
Ajouté |
Mesuré |
(mg.kg-1.j-1) |
(mg.kg-1.j-1) |
Exposés |
avec tumeurs |
% |
% |
|---|---|---|---|---|---|---|---|
|
Plomb dans la nourriture (ppm) |
Dose / animal |
DEH * |
Nombre de rats |
Rats avec tumeurs |
Mortalité |
||
|
0 0 10 50 100 500 1 000 2 000 |
3 5 18 62 141 548 1 130 2 102 |
0,225 0,39 1,40 4,78 10,88 42,27 79,65 162 |
0,038 0,067 0,238 0,818 1,86 7,22 13,6 27,2 |
20 100 50 50 50 50 20 20 |
0 0 0 0 0 5 10 16 |
0 0 0 0 0 10 50 80 |
50 37 36 36 36 52 50 80 |
* Dose équivalente chez l'homme (dose x 70 / 0,35)
L'utilisation d'un modèle multi-étapes linéarisé a permis de calculer une limite supérieure à 95 % de 8,5.10-3 (mg.kg-1.j-1)-1 (ERUo) ce qui correspond à un dose de 1,17 µg.kg-1.j-1 pour un excès de risque de 10-5 et de 0,12 µg.kg-1.j-1 pour un excès de risque de 10-6.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition chronique par inhalation et par voie orale
L’ANSES propose pour une exposition chronique par inhalation au plomb inorganique la valeur de dose interne de plomb dans le sang (plombémie) de 15 µg.L-1.
Pour l’utilisation de cette valeur, il doit être tenu compte conjointement des apports par voie orale (cf. ci-dessous).
Utilisation de la valeur de plombémie pour l’évaluation quantitative des risques sanitaires des effets à seuil liés à des expositions au plomb inorganique
La valeur de plombémie proposée par l’ANSES n’est pas utilisable en l’état dans un calcul de risque réalisé classiquement dans des études d’évaluation quantitative des risques sanitaires. La démarche de l’EQRS conduit en principe au calcul d’une dose d’exposition externe qui doit être comparé à des VTR externes.
A titre indicatif, l’ANSES (2013) a calculé ces VTR externes à partir de la plombémie en prenant l’hypothèse d’une exposition exclusive atmosphérique ou alimentaire (Tableau 17). Toutefois en pratique il doit être tenu compte conjointement des 2 sources d’exposition.
Synthèse des valeurs calculées par l’Anses en cas d’exposition selon la sous population en partant de l’hypothèse d’une exposition exclusive atmosphérique ou alimentaire (Anses, 2013)
|
Substances chimiques |
Voie d’exposition |
Valeur de référence |
Source, Année de révision |
|---|---|---|---|
|
Plomb inorganique |
Inhalation (chronique) adulte |
0,9 µg.m-3 |
ANSES, 2013 |
|
Orale (chronique) Enfant ou adulte |
0,63 µg.kg-1.j-1 |
ANSES, 2013 |
Chez l’adulte
L’ANSES recommande de retenir la démarche proposée par l’EFSA (2010) pour calculer la concentration en plomb dans le sang d’un adulte en appliquant l’équation de Carlisle et Wade (1992) selon la formule empirique suivante :
Plombémie (µg.L-1) =
[exposition via la nourriture (µg.kg-1.j-1) x poids x 0,4]
+ [concentration sol et poussières (m.kg-1) x 0,025 x 0,18]
+ [concentration atmosphérique (µg.m-3) x 16,4]
Ces coefficients ont été déterminés empiriquement et correspondent aux ratios entre les niveaux d’exposition (alimentaire, cutanée, inhalée) et les concentrations sanguines en plomb.
Ainsi, dans le cas d’une exposition par une seule voie, l’équation peut se réduire à :
- pour le calcul de l’exposition atmosphérique uniquement : Plombémie (µg.L-1) = [concentration atmosphérique (µg.m-3) x 16,4]
- pour le calcul de l’exposition via la voie alimentaire : Plombémie (µg.L-1) = [exposition via la nourriture (µg.kg-1.j-1) x poids x 0,4
A partir de la plombémie critique calculée de 15 µg.L-1, la dose journalière de plomb par voie orale (en supposant que l’exposition par contact avec le sol est négligeable) est de 0,63 µg.kg-1.j-1 et la concentration critique de plomb atmosphérique (en supposant que l’exposition par contact avec le sol et via la nourriture est négligeable) est de 0,9 µg.m-3 ont été calculées au moyen du modèle de Carlisle et Wade.
Chez l’enfant
Les enfants constituant une population sensible, un calcul spécifique doit être effectué chez les enfants en utilisant le modèle IEUBK, développé par l’US EPA pour les enfants (US EPA, 1994).
Selon l’EFSA, les poids par défaut chez l’enfant en fonction de l’âge sont de 5 kg (naissance à 1 an), 12 kg (de 1 à 3 ans) et 20 kg (de 3 à 7 ans) (EFSA, 2012).
Effets à seuil - Exposition chronique par voie orale
L’INERIS propose pour une exposition chronique par voie orale au plomb inorganique la valeur de dose interne de plomb dans le sang (plombémie) de 15 µg.L-1 (ANSES, 2013).
Pour l’utilisation de cette valeur, il doit être tenu compte conjointement des apports par inhalation.
Pour les effets à seuil par voie orale, la VTR proposée par le RIVM (Tiesjema et Baars, 2009) repose sur de nombreux travaux qui semblent montrer que, chez l’enfant, il n’y a pas d’augmentation de la plombémie en deçà de 4 µg.kg-1.j-1. Aucun facteur d’incertitude n’est appliqué. Cette valeur était précédemment retenue par l’OMS mais ne l’est plus car des travaux récents ont démontré qu’à ces niveaux d’exposition, des effets étaient observés chez le jeune ou l’adulte.
Les travaux réalisés depuis ont montré qu’aux niveaux retenus par ces deux organismes, des effets pouvaient être observés. En 2013, l’ANSES propose une valeur de dose interne (plombémie). Dans la mesure où l’ANSES a élaboré une valeur en janvier 2013, celle-ci est retenue.
L’ANSES s’appuie sur la démarche de l’EFSA, 2010, et retient la valeur de plombémie de 15 µg.L-1 à partir de l’étude de Navas-Acien et al., 2009, et retient comme effet critique la maladie chronique rénale. La valeur a été calculée afin de prendre également en compte la sous-population sensible des enfants pour des effets neurologiques.
La valeur de Santé Canada n’est pas une VTR et elle est provisoire, elle n’est donc pas retenue.
Cette valeur est retenue par l’INERIS.
Cette valeur est établie à partir d’études épidémiologiques. Elle prend en compte la sensibilité spécifique des enfants. Toutefois, le niveau à partir duquel les effets sont susceptibles de survenir n’étant pas clairement déterminé, cette valeur sera probablement amenée à évoluer prochainement.
Indice de confiance moyen.
Effets sans seuil - Exposition chronique par inhalation
L'INERIS propose de retenir pour une exposition chronique au plomb inorganique par inhalation la valeur de l’OEHHA : ERUi de 1,2.10-5 (µg.m-3)-1 .
La valeur de l’OEHHA, 2011 pour des expositions par inhalation est obtenue par extrapolation voie à voie à partir de la valeur pour des expositions par voie orale. L’INERIS conseille de retenir cette valeur.
Cette valeur est établie par extrapolation voie à voie à partir de l’ERUo, même si la démarche est recevable, elle limite la confiance dans la valeur qui est dérivée du fait des incertitudes liées à la méthode.
Indice de confiance : moyen
Effets sans seuil - Exposition chronique par voie orale
L'INERIS propose de retenir pour une exposition chronique au plomb inorganique par voie orale la valeur de l’OEHHA : ERUo de 8,5.10-3 (mg.kg-1.j-1)-1.
Seul l’OEHHA, 2011 propose une valeur pour des expositions sans seuil d’effet par voie orale. La valeur est basée sur une étude expérimentale pour des expositions à l’acétate de plomb via la nourriture (Azar et al., 1973). L’effet critique retenu, tumeurs rénales, est pertinent compte tenu des données épidémiologiques. La valeur est obtenue par extrapolation grâce à un modèle multi-étapes linéarisé. L’INERIS propose de retenir cette valeur.
Cette valeur s’appuie sur des études chez l’animal, elle est de bonne qualité.
Indice de confiance élevé
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 11/07/2025
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis.
Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis par Klimisch et al., 1997. Klimisch et al. (1997) ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après :
- Score 1 : valide (sans restriction)
- Score 2 : valide avec restriction
- Score 3 : non valide
- Score 4 : pas suffisamment d'information pour valider le test
On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2).
Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC.
Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Description
Ecotoxicité aquatique
L’ensemble des informations et des données de ce chapitre provient des publications et des rapports scientifiques examinés par les experts européens et rapportés dans le dossier EQS ou « Norme de qualité environnementale » (NQE) pour le Plomb. Ce dossier est publié dans le cadre du second cycle de révision des NQE dans le contexte de la Directive Cadre sur l’Eau (E.C., 2011).
Paramètres d’écotoxicité aiguë :
Un nombre suffisant de résultats d'écotoxicité chronique étant disponible (cf. section 4.1.2), les résultats d'écotoxicité aiguë ne sont pas fournis. Ils sont toutefois consultables dans le document (E.C., 2011).
Paramètres d’écotoxicité chronique:
Organismes d'eau douce
Récapitulatif des principaux résultats pour des organismes d’eau douce lors d’expositions chroniques via l’eau (EC, 2011)
|
|
Espèce |
Paramètre d’effet |
Critère d’effet |
Valeur (µg Pbdissous.L-1) |
Référence |
|---|---|---|---|---|---|
|
Algue |
Pseudokirchneriella subcapitata |
Taux de croissance |
NOEC/EC10 |
8,42 |
E.C., 2011 |
|
Rotifère |
Brachionus calyciflorus |
Croissance de la population |
NOEC/EC10 |
89,5 |
Grosell et al., 2006 |
|
Philodina rapida |
Croissance de la population |
NOEC/EC10 |
10,66 |
E.C., 2011 |
|
|
Mollusques |
Lymnaea stagnalis |
Croissance |
NOEC/EC10 |
1,7 |
Parametrix, 2007 |
|
Crustacés |
Ceriodaphnia dubia |
Reproduction |
NOEC/EC10 |
36,78 |
E.C., 2011 |
|
Hyalella azteca |
Croissance |
NOEC/EC10 |
8,2 |
Besser et al., 2005 |
|
|
Poissons |
Pimephales promelas |
Mortalité |
NOEC/EC10 |
29,29 |
E.C., 2011 |
|
Salvelinus fontinalis |
Poids |
NOEC/EC10 |
39,4 |
Holcombe et al., 1976 |
Synthèse des principaux résultats pour des organismes d’eau douce lors d’expositions chroniques via le sédiment (EC, 2011).
|
|
Espèce |
Paramètre d’effet |
Durée d’exposition |
NOEC/EC10 (mg Pbtotal.Kg-1poids sec) |
Référence |
|---|---|---|---|---|---|
|
Annélides (Polychètes) |
Tubifex tubifex |
Reproduction |
28 j |
573 |
(EC, 2011) |
|
Lumbriculus Variegatus |
Survie |
28 j |
2100 |
(EC, 2011) |
|
|
Crustacés |
Hyalella azteca |
Survie |
28 j |
1416 |
(EC, 2011) |
|
Gammarus pulex |
Croissance |
35 j |
1745 |
(EC, 2011) |
Organismes marins
Synthèse des principaux résultats pour des organismes marins lors d’expositions chroniques via l’eau (EC, 2011).
|
|
Espèce |
Critère d'effet |
Valeur |
Référence |
|---|---|---|---|---|
|
Algues |
Skeletonema costatum |
NOEC/EC10 |
52,9 |
(EC, 2011) |
|
|
Dunaliella tertiolecta |
NOEC/EC10 |
1231,8 |
(EC, 2011) |
|
Annélides (Polychètes) |
Neanthes arenaceodentata |
NOEC/EC10 |
95,9 |
(EC, 2011) |
|
Echinodermes |
Strongylocentrotus purpuratus |
NOEC/EC10 |
111,2 |
(EC, 2011) |
|
|
Dendraster excentricus |
NOEC/EC10 |
249,8 |
(EC, 2011) |
|
Mollusques |
Crassostrea gigas |
NOEC/EC10 |
930,8 |
(EC, 2011) |
|
|
Mytilus galloprovincialis |
NOEC/EC10 |
51,1 |
(EC, 2011) |
|
|
Mytilus trossulus |
NOEC/EC10 |
9,2 |
(EC, 2011) |
|
Poissons |
Cyprinodon variegatus |
NOEC/EC10 |
229,6 |
(EC, 2011) |
Synthèse des principaux résultats pour des organismes marins lors d’expositions chroniques via le sédiment (EC, 2011).
|
Groupe taxonomique |
Espèce |
Paramètre d’effet |
Durée d’exposition |
NOEC/EC10 (mg Pbtotal.Kg-1poids sec) |
Référence |
|---|---|---|---|---|---|
|
Annélides (Polychètes) |
Neanthes Arenaceodentata |
Croissance |
28 j |
680 |
(EC, 2011) |
|
Crustacés |
Leptocheirus Plumulosus |
Croissance |
28 j |
1291 |
(EC, 2011) |
Ecotoxicité terrestre
Les données présentées dans cette section sur l’écotoxicité du Pb via le sol, sont rapportées dans le « Voluntary European Union Risk Assessment Report » qui a été examiné par le « Scientific Committe on Health and Environmental Risks » (SCHER, 2009).
Paramètres d’écotoxicité aiguë :
Un nombre suffisant de résultats d'écotoxicité chronique étant disponibles les résultats d'écotoxicité aiguë ne sont pas fournis.
Paramètres d’écotoxicité chronique :
Synthèse des principaux résultats de toxicité pour des organismes terrestres
|
|
Organisme / processus |
Type de sol |
Concentration dans le sol « control » (mg Pb.kg-1 sol sec) |
Critère d’effet |
NOEC totale (mg Pb.kg-1 sol sec) |
Référence |
|---|---|---|---|---|---|---|
|
Plantes supérieures |
Raphanus sativus L. |
Sable limoneux |
50 |
150 |
Khan et Frankland, 1983 |
|
|
Avena sativa L. |
Sable limoneux |
50 |
150 |
Khan et Frankland, 1984 |
||
|
Trticum aestivum L. |
Sable limoneux |
37 |
287 |
Khan et Frankland, 1984 |
||
|
Hordeum vulgare L. |
Limon sableux |
15 |
65 |
Aery et Jagetiya, 1997 |
||
|
Picea rubens |
Spodosol |
9 |
150,1 |
Seiler et Paganelli, 1987 |
||
|
Pinus taeda |
Limoneux |
11 |
557 |
Seiler et Paganelli, 1987 |
||
|
Raphanus sativus L. |
Loam limoneux |
|
100 |
Zaman et Zereen, 1998 |
||
|
Lactuca sativa |
Argile |
47 |
EC10 |
- |
Hamon et al., 2003 |
|
|
Lactuca sativa |
Sable |
6,9 |
EC10 |
439 |
Hamon et al., 2003 |
|
|
Lactuca sativa |
Sable limoneux |
15 |
EC10 |
1187 |
Hamon et al., 2003 |
|
|
Lactuca sativa |
Argile sableux |
14 |
EC10 |
471 |
Hamon et al., 2003 |
|
|
Triticum aestivum |
Limon argilo-sableux |
25 |
1163 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Triticum aestivum |
Loam limoneux |
143 |
2207 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Triticum aestivum |
Loam limoneux |
16 |
1630 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Zea mays |
Sable limoneux |
|
100 |
Hassett et al., 1976 |
||
|
Invertébrés |
Dendrobaena rubida |
Sableux + excrément de bétail |
1,2 |
130 |
Bengtsson et al., 1986 |
|
|
Eisenia fetida |
OCDE |
- |
608 |
Spurgeon et Hopkin, 1995 |
||
|
Eisenia fetida |
Loam |
- |
3000 |
Davies et al., 2002 |
||
|
Eisenia fetida |
Loam |
- |
400 |
Davies et al., 2002 |
||
|
Folsomia candida |
OCDE |
|
2000 |
Sandifer et Hopkin, 1996 |
||
|
Folsomia candida |
OCDE |
|
400 |
Sandifer et Hopkin, 1996 |
||
|
Folsomia candida |
OCDE |
|
2000 |
Sandifer et Hopkin, 1996 |
||
|
Lumbricus rubellus |
Loam sableux |
26 |
1026 |
Ma, 1982 |
||
|
Eisenia fetida |
OCDE |
12 |
1822 |
Spurgeon et al., 1994 |
||
|
Folsomia candida |
OCDE |
- |
400 |
Sandifer et Hopkin, 1997 |
||
|
Folsomia candida |
LUFA 2.2 |
- |
EC10 |
1300 |
Bongers et al., 2004 |
|
|
Folsomia candida |
Loam argilo-sableux |
25 |
1163 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Folsomia candida |
Loam limoneux |
143 |
2207 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Folsomia candida |
Loam limoneux |
16 |
1630 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Microflore |
Denitrification |
Loam limoneux |
- |
250 |
Bollag et Barabasz, 1979 |
|
|
N-mineralization |
Loam limoneux |
3,1 |
203 |
Chang et Broadbent, 1982 |
||
|
Respiration |
Sable |
- |
188 |
Doelman et Haanstra, 1979 |
||
|
Respiration |
Sable |
- |
1500 |
Doelman et Haanstra, 1979 |
||
|
Respiration |
Argile |
- |
750 |
Doelman et Haanstra, 1979 |
||
|
Respiration |
Sable |
32 |
1032 |
Doelman et Haanstra, 1984 |
||
|
Respiration |
Loam sableux |
13 |
163 |
Doelman et Haanstra, 1984 |
||
|
Respiration |
|
26 |
426 |
Doelman et Haanstra, 1984 |
||
|
Respiration |
Loam limoneux |
3,1 |
EC10 |
96 |
Chang et Broadbent, 1981 |
|
|
Respiration |
Loam sableux |
- |
100 |
Saviozzi et al., 1997 |
||
|
Respiration |
Loam |
- |
4144 |
Speir et al., 1999 |
||
|
Respiration induite par substrat |
Loam limoneux |
- |
2072 |
Speir et al., 1999 |
||
|
Respiration induite par substrat |
Loam sableux |
- |
EC10 |
1450 |
Speir et al., 1999 |
|
|
N-mineralization |
Cambisol sableux |
- |
810 |
Wilke, 1989 |
||
|
Respiration |
Sol de forêt |
- |
EC10 |
2279
|
Frostegård et al., 1993 |
|
|
Teneur en ATP |
Sol de forêt |
- |
EC10 |
787 |
Frostegård et al., 1993 |
|
|
Teneur en ATP |
Loam sableux |
- |
EC10 |
2307 |
Frostegård et al., 1993 |
|
|
Nitrification |
Loam argilo-sableux |
25 |
472 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Nitrification |
Loam limoneux |
143 |
2207 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Nitrification |
Loam limoneux |
16 |
269 |
Waegeneers et al., 2004 dans VRAR (LDAI, 2008) |
||
|
Phosphatase
|
Loam |
- |
2072 |
Speir et al., 1999 |
||
|
Phosphatase
|
Sable limoneux |
- |
16576 |
Speir et al., 1999 |
||
|
Sulphatase |
Loam |
- |
2072 |
Speir et al., 1999 |
||
|
Sulphatase |
Loam limoneux |
- |
4144 |
Speir et al., 1999 |
||
|
Déhydrogénase |
Sol alluvial |
- |
1000 |
Maliszewska et al., 1985 |
||
|
Phosphatase |
Argile |
130 |
EC10 |
3860 |
Doelman et Haanstra, 1989 |
|
|
Phosphatase |
Loam limoneux |
42 |
EC10 |
7170 |
Doelman et Haanstra, 1989 |
|
|
Arylsulphatase |
Sable |
32 |
EC10 |
7137 |
Haanstra et Doelman, 1991 |
|
|
Arylsulphatase |
Loam limoneux |
42 |
EC10 |
7356 |
Haanstra et Doelman, 1991 |
|
|
Urease |
Loam sableux |
13 |
EC10 |
1413 |
Doelman et Haanstra, 1986 |
|
|
Urease |
Loam limoneux |
42 |
EC10 |
2822 |
Doelman et Haanstra, 1986 |
|
|
Urease |
Argile |
130 |
EC10 |
826 |
Doelman et Haanstra, 1986 |
|
|
Urease |
Tourbe de sable |
26 |
EC10 |
2326 |
Doelman et Haanstra, 1986 |
|
|
Activité cellulolytique |
Loam sableux |
50 |
550 |
Khan et Frankland, 1984 |
||
|
Activité cellulolytique |
Loam sableux |
37 |
537 |
Khan et Frankland, 1984 |
||
|
Déhydrogénase |
Loam |
32 |
EC10 |
132 |
Welp, 1999 |
Un aperçu des données de laboratoire sur la toxicité du Pb par empoisonnement secondaire est présenté dans le tableau ci dessous:
Synthèse des principaux résultats de toxicité pour les prédateurs
|
|
Organisme |
Durée d’exposition |
Paramètre d’effet |
NOEC (mg.kg-1 poids frais) |
Référence |
|---|---|---|---|---|---|
|
Oiseaux |
Gallus domesticus |
21 j |
Croissance |
750 |
Donaldson et Leeming, 1984 |
|
|
Gallus sp. |
4 s |
Croissance |
100 |
Damron et al., 1969 |
|
|
Gallus sp. |
4 s |
Alimentation |
100 |
Damron et al., 1969 |
|
|
Gallus sp. |
10 s |
Croissance |
200 |
EDENS et GARLICH, 1983 |
|
|
Colinus virginianus |
6 s |
Croissance |
2000 |
Damron et Wilson, 1975 |
|
|
Colinus virginianus |
6 s |
Alimentation |
2000 |
Damron et Wilson, 1975 |
|
|
Caille japonaise |
32 j |
Poids foie/corps |
100 |
Morgan et al., 1975 |
|
|
Caille japonaise |
6 s |
croissance |
100 |
EDENS, 1985 |
|
Mammifères |
Rattus sp. |
333 j (F0) + 90 j (F1) |
Poids de la progéniture |
64 |
MORRIS et al., 1938 |
|
|
Rat wistar |
10 s |
croissance |
1000 |
Van Esch et al., 1962 |
|
|
Rat wistar |
3 s |
Poids de la progéniture |
1600 |
Mykkänen et al., 1980 |
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
PNEC
Pour les substances qui existent à l’état naturel dans l’environnement il est nécessaire de tenir compte de leur concentration de fond « naturelle ». Les PNECs que nous proposons doivent être utilisées comme des PNECs ajoutées à la concentration naturelle dans l'eau, les sédiments ou le sol. Dans la mesure du possible, les résultats utilisés pour dériver ces PNECs sont exprimés en concentrations "ajoutées" dans le milieu d'essais. Les PNEC proposées dans cette fiche sont celles rapportées dans le dossier EQS du Plomb (EC, 2011). Seule la PNECSOL, qui est une valeur préliminaire, provient du VRAR.
Compartiment aquatique
Eau douce
Etant donné qu’un nombre suffisant de données long terme (NOEC/EC10) existe, la PNECEAU-DOUCE peut être évaluée par la méthode statistique. Les valeurs suivantes ont été calculées à l’aide des données aquatiques d’eaux douces présentées ci-dessus :
HC5-50 = 2,35 µg.L-1 (IC190 %= [0,45 ; 5,94])
Distribution de la sensibilité des espèces (SSD) d’eau douce (toxicité chronique) (EC, 2011)
Le jeu de données utilisé pour tracer la SSD rempli les critères de validité requis (biodisponibilité du plomb, nombre de données et nombre de taxons représentés). Par conséquent, un facteur d’extrapolation de 2 a été appliqué à la HC5-50.
D’où :
PNECEAU-DOUCE = 1,18 µg de Pbdissous.L-1
La plus faible valeur de l’ensemble des données de toxicité chronique pour l’eau douce est celle du mollusque Lymnaea stagnalis (1,7 µg.L-1). Cette valeur est au-dessus de la PNEC EAU-DOUCE proposée.
Une NQE (1,2 µg de Pb.L-1) pour l’eau douce est retenue dans la directive 2013/39/UE du parlement européen et du conseil du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE en ce qui concerne les substances prioritaires pour la politique dans le domaine de l’eau UE (2013).
Eau marine
Il n’y a pas un nombre de données d’écotoxicité chronique suffisant pour le milieu marin. Puisqu’aucune différence statistiquement significative (p>0,05) n’a été trouvée entre les moyennes des NOEC/EC10 marines et d’eau douces, les données marines et d’eau douce ont été utilisées ensemble pour la détermination de la PNECEAU-MARINE. Les valeurs suivantes ont été obtenues à partir des résultats sur organismes d’eau douce et organismes marins réunis :
HC5 = 3,79 µg.L-1 (IC_90 %= [1,05 ; 9,03])
Distribution de la sensibilité des espèces (SSD) marine (toxicité chronique) (EC, 2011)
Les données d’écotoxicité concernent des paramètres d’effet pertinents de point de vue écologique et couvrent plusieurs stades de vie sensibles pour des organismes appartenant à différents niveaux trophiques. Les données marines ont été complétées par des données d’eau douce, en particulier pour les crustacés dont aucune donnée ne provient d’espèces marines. Par conséquent, un facteur d’extrapolation de 3 a été appliqué à la HC5-50.
D’où :
PNECEAU-MARINE = 1,3 µg de Pbdissous.L-1
Les PNEC eau douce et eau marine sont donc équivalentes.
Une NQE (1,3 µg de Pb.L-1) pour l’eau marine est retenue dans la directive 2013/39/UE du parlement européen et du conseil du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE en ce qui concerne les substances prioritaires pour la politique dans le domaine de l’eau UE (2013).
Compartiment sédimentaire
Eau douce
La PNECSED a été calculé selon deux approches : par la méthode statistique (SSD) basée sur les données exprimées en Pb total et par extrapolation en tenant compte de la biodisponibilité du Pb selon les recommandations du SCHER (SCHER, 2009):
- Méthode statistique (SSD) :
Les données disponibles ont servit pour effectuer une SSD. En raison du nombre limité des données de terrain et de mésocosmes, un facteur d’extrapolation de 4 a été appliqué à la HC5-50.
PNECSED = 131 mg de Pb total kg-1 (poids sec)
La PNECSED obtenue ne tient pas compte de la biodisponibilité du Pb et elle est exprimée en Pb total dans le sédiment.
- Méthode d’extrapolation en tenant compte de la biodisponibilité du Pb:
Selon les recommandations du SCHER, un facteur d’extrapolation de 10 a été appliqué à la plus faible NOEC déterminée selon l’approche (SEM/AVS2).
PNECSED = 41 mg de Pb kg-1 (poids sec)
Eau marine
Il n’y a pas un nombre de données suffisant pour le milieu marin. Le PNECSED marine a été obtenue à partir des résultats sur les organismes d’eau douce et les organismes marins réunis. Comme pour l’eau douce, un facteur d’extrapolation de 4 a été appliqué.
PNECSED = 123 mg de Pb kg-1 (poids sec)
Compartiment terrestre
Le VRAR rapporte 44 données d’écotoxicité jugées pertinentes : 14 données pour les plantes supérieures, 12 données pour les invertébrés et 18 données pour les microorganismes. Le SCHER a validé le choix de produire une SSD pour les trois taxons. La SSD a été modélisée à partir des NOEC en prenant en compte une concentration de fond pour le Pb de 15 mg.kg-1.
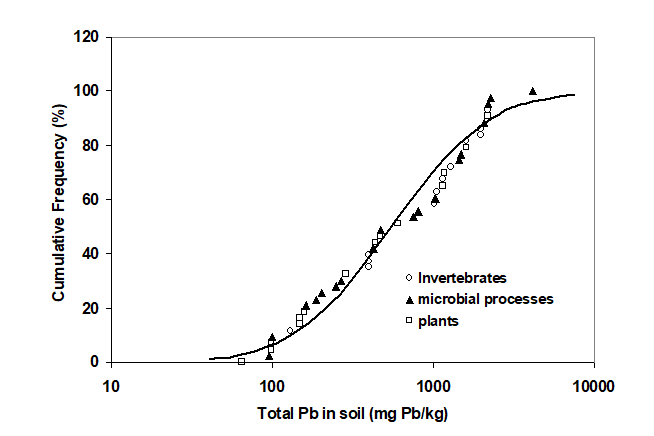
Distribution de la sensibilité des espèces (SSD) terrestres (LDAI, 2008)
Le HC5-50 déterminé est de 333 mg.kg-1 auquel a été appliqué un facteur d’extrapolation de 2 compte-tenu du manque des données de terrain.
D’où :
PNECSOL = 333/2 = 166 mg de Pb .kg-1 (poids sec)
En raison de la variabilité des données due à la spéciation du Pb dans le sol et du manque des connaissances concernant le rôle de la concentration du fond dans la réponse toxicologique, le SCHER préconise de considérer cette PNECSOL comme valeur préliminaire.
Empoisonnement secondaire
La plus faible NOEC pour les mammifères est égale à 64 mg Pb. Kg-1 (Morris et al., 1938). Cette NOEC est plus faible que celle (150 mg Pb. Kg-1) rapportée dans le VRAR (Kao et Forbes 1973). Pour les oiseaux, une valeur de 100 mg Pb. Kg-1, obtenue dans différentes études chez la caille, est utilisée pour dériver la PNEC.
En raison de la disponibilité d’un nombre suffisant de données d’écotoxicité chronique, un facteur d’extrapolation de 30 a été appliqué aux plus faibles NOEC et une concentration de fond de 1,3 mg.kg-1 a été utilisée pour la détermination de la PNEC.
- Pour les mammifères : PNECoral = (64 + 1,3)/30 = 2,2 mg.kg-1 de nourriture
- Pour les oiseaux : PNECoral = (100 + 1,3)/30 = 3,4 mg.kg-1 de nourriture
1/Intervalle de Confiance
2/SEM/AVS : Simultaneously Extracted Metal/Acid Volatile Sulphide approach
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 14/04/2025
Introduction
Le plomb et ses composés sont concernés par la réglementation européenne, notamment la réglementation REACH. En France, plusieurs décrets limitent son utilisation en raison de ses impacts sanitaires (saturnisme principalement). Les usages restreints sont multiples, dans les peintures, les canalisations, les équipements électriques, les véhicules, les munitions, les jouets, les contenants alimentaires, de l'emballage, certains articles destinés aux consommateurs.
Depuis que les carburants automobiles ne contiennent plus de plomb, les principales sources de rejet de plomb dans l'environnement sont liées à l'industrie : industrie des métaux, batteries au plomb, verreries, traitement des déchets.
La production à partir de minerai baisse à cause de l'efficacité de la récupération de plomb dans les déchets et notamment dans les batteries ; cependant l'utilisation de plomb est toujours en croissance dans les batteries, les produits laminés et extrudés, les verres et les pigments.
Les batteries automobiles représentent le principal usage du plomb. Les autres usages sont généralement fortement réglementés et en déclin (substitution) mais le plomb ne semble pas avoir de substituts viables à cour terme pour les batteries automobiles. Toutefois si ces batteries sont produites de façon propre et si elles sont recyclées, il semble possible d'avoir des rejets faibles pour cette activité.
Dans l'industrie du verre, les techniques de recyclage doivent être perfectionnées pour réduire la présence de plomb dans le calcin. Dans l'industrie des métaux, il est sans doute nécessaire d'être particulièrement attentifs aux rejets diffus.
Les émissions de plomb ont été très significativement réduites durant ces dernières années et devraient continuer à diminuer. Il semble cependant impossible d'obtenir des rejets proches de zéro. En premier lieu, les sources majoritaires sont des émissions diffuses (eaux de ruissellement). D'autre part la diversité des sources ponctuelles d'émission et la difficulté de la substitution du plomb pour les batteries automobiles rendent très difficile de fortes réductions des rejets à court terme. Les réductions sont peut-être plus à attendre, à long terme, du remplacement des véhicules à combustion interne par des véhicules électriques, qui font peu appel au plomb pour leurs batteries.
Nota : Une bibliographie importante est disponible sur le plomb et ses principaux composés. Afin de ne pas alourdir cette fiche à l'excès, nous n'avons présenté ici que les données tirées des références les plus significatives. Ce document ne se veut donc en aucun cas exhaustif mais indicatif des aspects technico-économiques de la substance plomb.
ABSTRACT
Lead and its compounds are covered by the European regulations, including REACH. In France, several decrees limit its use because of its health impacts (lead poisoning). The restricted uses are many, in paints, electrical equipment, vehicles, pipes, ammunition, toys, food containers, packaging, certain items for consumers.
Since motor fuels contain no more lead, the main sources of releases to the environment are related to the industry: metal industry, lead batteries, glass, wastes treatment.
Production from ore is declining due to the efficiency of the recovery of lead in the waste and in particular in batteries. However, the use of lead is still growing in batteries, rolled and extruded products, glasses and pigments.
Automotive batteries represent now the main use of lead. Other uses are generally highly regulated and declining (substitution) but lead does not appear to have viable alternatives in the short term for automotive batteries. However, if these batteries are produced cleanly and if they are more recycled, it seems possible to lower releases for this activity
In the glass industry, recycling techniques should be improved to reduce the presence of lead in the cullet. In the metals industry, it is probably necessary to pay particular attention to air releases.
Lead emissions have been reduced very significantly in recent years and should continue to decline. However, it seems impossible to achieve near-zero emissions. The first reason is that the majority of emissions come from diffuse sources. The second reason is the diversity of emission sources and the difficulty of substitution for lead batteries for automobiles make it very difficult strong reduction in short-term releases. The reductions may be expected in the long term from the replacement of internal combustion vehicles with electric vehicles, which make little use of lead for their batteries.
Tableaux de synthèse
Généralités
| CAS | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SANDRE | 1382 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substance prioritaire dans le domaine de l’eau (DCE) | oui | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substance soumise à autorisation dans Reach | non | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substance soumise à restriction dans Reach | non | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substance extrêmement préoccupante (SVHC) | oui | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Réglementations |
Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Le Tableau 1 présente une liste des composés du plomb enregistrés dans le cadre du règlement REACH et mentionne les volumes fabriqués et/ ou importés au sein de l’UE. Les composés ou mélanges complexes de composés contenant du plomb répertoriés ainsi sont en très grand nombre. Un nombre significatif d’entre eux n’ont qu’un usage d’intermédiaire sur des sites industriels. Ils sont identifiés au sein de l’activité de recyclage du plomb mais n’ont pas de fonction dans des produits. Ils ne seront pas étudiés systématiquement et spécifiquement dans le cadre de cette fiche. Tableau 1. Composés du plomb enregistrés dans REACH ou concernées par d’autres procédures REACH (Source : ECHA 2013b).
Les principaux textes réglementaires concernant le plomb, avec notamment le règlement REACH sont présentés dans le Tableau 2.
Articles destinés à l'usage des consommateursLe plomb est restreint dans plusieurs groupes de produits, y compris les peintures (à usage domestique et autres), les équipements électriques, les jouets, les contenants alimentaires, l'emballage et, plus récemment les bijoux. La réglementation REACH (ECHA 2013b, 2013d) interdit le plomb et ses composés dans les articles qui peuvent être mis en bouche par les enfants, et qui sont disponibles pour les consommateurs ou destinés à l'usage des consommateurs. Cette réglementation vise l'article ou une partie d'un article pouvant être placés dans la bouche par les enfants et définit une valeur limite de 0,05% en poids pour les articles pouvant être mis sur le marché. Quelques exemples de ces articles sont des vêtements, chaussures, accessoires, décorations intérieures, des articles de sport et de loisirs, de la papeterie et des clés. Batteries et accumulateurs au plombLa décision de la Commission 2000/532/CE a classé les batteries au plomb comme déchets dangereux1 . Les batteries contenant plus de 0,4 % de plomb (en poids) sont concernées par la directive 91/157/CEE relative aux piles et accumulateurs contenant certaines matières dangereuses. Cette directive prescrit notamment aux États membres :
La directive 93/86/CE vise, entre autres, ces mêmes batteries et impose l'apposition d'un marquage clair indiquant qu'elles contiennent du plomb. Certaines dispositions sont actualisées par la directive 98/101/CE2 . La directive relative aux piles et accumulateurs 2006/66/CE impose comme objectifs (ADEME, 2015) :
[1] Cette décision a été transcrite en droit français par le décret n° 2002-540 du 18 avril 2002 relatif à la classification des déchets. [2] Ces directives ont été transcrites en droit français par les décrets n° 97-1328, 99-374 et 99-1171. En outre, l'arrêté du 26 juin 2001 impose aux entreprises de déclarer la fabrication, l'importation, la distribution, la valorisation et l'élimination d'accumulateurs [3] http://ec.europa.eu/eurostat/fr/web/waste/key-waste-streams/batteries Équipements électriques et électroniquesLa directive 2002/95/CE relative à la limitation de l'utilisation de certaines substances dangereuses dans les équipements électriques et électroniques prescrit aux États membres de veiller à ce que, à compter du 1er juillet 2006, les nouveaux équipements électriques et électroniques mis sur le marché ne contiennent pas de plomb. Les directives 2008/32/CE et 2011/65/UE modifient la directive 2002/95/CE. Cette dernière signale 36 applications exemptées (Commission eurpéenne 2011), parmi lesquelles :
VéhiculesL'usage du plomb est également interdit dans l'industrie automobile (directive 2000/53/CE). De nombreuses exceptions à l'interdiction dans les automobiles sont toutefois prévues (article 4.2.a), la principale étant l'usage dans les batteries. Les usages encore autorisés concernent aussi :
La Commission a prévu de modifier régulièrement cette liste d'exemptions, en fonction des progrès techniques et scientifiques4 et d'en supprimer certaines si l'utilisation du plomb est évitable. La directive 2000/53/CE relative aux véhicules hors d'usage et de leurs composants veille à la réutilisation, le recyclage et la valorisation des véhicules, dans la mesure du possible. [4] Deux amendements ont été réalisés, le 20/04/2011 et le 11/06/2013. Additifs dans l'essenceConformément à la directive 98/70/CE concernant la qualité de l'essence et des carburants diesel, la vente d'essence plombée est interdite sur le territoire des pays de l'Union européenne depuis le 1er janvier 2000. Malgré ces dispositions, les États membres peuvent continuer à autoriser la commercialisation de petites quantités d'essence plombée dont la teneur en plomb ne dépasse pas 0,15 g.L-1, à concurrence de 0,03 % de la quantité totale commercialisée. Peintures au plombLes peintures au plomb ont été progressivement interdites en France depuis 1915. L'interdiction de mise sur le marché n'est effective que depuis le 1er février 1993 (Guillotin 2004). Le décret n° 2003-1254 du 23 décembre 2003 relatif à la prévention du risque chimique et modifiant le code du travail interdit dans tous les travaux de peinture l'emploi de la céruse (hydrocarbonate de plomb), du sulfate de plomb et de toute préparation renfermant l'une de ces substances. Le carbonate et sulfate de plomb sont interdits (sauf exceptions motivées au niveau national) dans les peintures au niveau de l'UE par l'Annexe XVII du règlement REACH. Toutefois d'autres composés du plomb sont encore autorisés et utilisés comme pigments de certaines peintures pour des usages très spécifiques (voir chapitre 2). Eau potableEn France, l'usage du plomb pour les canalisations est interdit depuis 1995. Le code de la santé publique (article R1321-51) interdit la mise en place de canalisations en plomb ou de tout élément en plomb dans les installations de distribution d'eau destinée à la consommation humaine (décret n° 2003-462 du 21 mai 2003 relatif aux dispositions réglementaires des parties I, II et III du code de la santé publique). L'arrêté du 10 juin 1996 relatif à l'interdiction d'emploi de certaines brasures (soudures des canalisations et tuyauteries) interdit d'utiliser des matériaux de brasure contenant du plomb pour les installations fixes de production, de traitement et de distribution des eaux destinées à la consommation humaine. Le décret n° 2001-1220 interdit la mise en place de canalisations en plomb ou de tout élément en plomb dans les installations de distribution d'eau destinée à la consommation humaine. AutresLe règlement 3279/92 du Conseil interdit les capsules en plomb pour les récipients contenant du vin, à partir du 1er janvier 1993. Il existe également des limitations à l'usage de produits de soudure contenant du plomb pour les boîtes de conserve et à celui de plomb dans les ustensiles de cuisine en céramique (OCDE, 1993). En France, l'arrêté 9 mai 2005 interdit l'emploi de la grenaille de plomb dans les zones humides pour la chasse aux oiseaux d'eau (Ministère de l'aménagement du territoire et de l'environnement 2001), car le plomb utilisé dans les granulés comme cartouches de fusil de chasse a été mis en cause pour des impacts sur la santé des oiseaux sauvages dans les zones humides. Substances soumises à autorisation dans le cadre de REACHLe Tableau 2 présenté plus haut recense notamment les composés du plomb soumis à autorisation dans REACH, donc dont l'emploi est destiné à être à terme substitué. Les usages concernés par ces substances sont encore mal connus. Toutefois, pour certaines, des dossiers d'autorisation pour des usages précis en tant que pigments ont été déposés par des industriels et sont indiquées dans le Tableau 3.
Présence dans les milieuxLa directive 1999/30/CE fixe la valeur limite de concentration de plomb dans l'air ambiant à 0,5 µg.m-3 . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification CLP | Voir la classification CLP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valeurs et normes appliquées en France |
Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Seuils de déclaration de rejets industrielsL'arrêté du 26 décembre 2012 relatif au registre et à la déclaration annuelle des émissions polluantes et des déchets établit les seuils suivants pour le plomb et composés par établissement. Tableau 4. Seuil de rejets dans l'environnement du plomb et composés (exprimés en tant que Pb) en France (Source : Ministère de l'écologie du développement durable et de l'énergie 2012).
(*) Pour les installations d'incinération de déchets non dangereux et les installations d'incinération de déchets dangereux, ce seuil est fixé à 0 Valeurs limites d'émissionLa réglementation française des installations classées pour la protection de l'environnement (ICPE) inclut pour de nombreux secteurs d'activité des valeurs limites d'émission pour le plomb dans les rejets industriels. Cas général, métallurgieL'arrêté du 2 février 1998, dit 'arrêté intégré', qui concerne notamment la métallurgie, prévoit des valeurs limites d'émission pour le plomb. La valeur limite de concentration dans les rejets atmosphériques est de 1 mg.m-3 si le flux horaire total de plomb et de ses composés dépasse 10 g/h (arrêté du 15 février 2000, article 1er). Pour les rejets dans l'eau la valeur limite est de 0,5 mg.L-1 si le rejet dépasse 5 g.j-1. VerreriesL'arrêté du 12 mars 2003 relatif à l'industrie du verre et de la fibre minérale fixe des valeurs limites d'émission pour le plomb. Pour les rejets atmosphériques, si le flux horaire total de plomb et de ses composés dépasse 5 g/h, la valeur limite de concentration de rejet de plomb est de 3 mg/Nm³ pour la fabrication des verres de télévision (cônes et écrans) et de 1 mg/Nm³ dans les autres cas. Pour les rejets aqueux, la valeur limite de concentration en plomb est de 0,5 mg.L-1 (ou 1 mg.L-1 pour les installations dont l'arrêté d'autorisation est antérieur à la publication de l'arrêté du 12 mars 2003). Incinération des déchetsL'arrêté du 20 septembre 2002 relatif à l'incinération des déchets, dangereux et non dangereux, fixe à 0,2 mg.L-1 la valeur limite d'émission de plomb dans les rejets aqueux. Pour les rejets atmosphériques, il prescrit une valeur limite d'émission de 0,5 mg/Nm3 pour une dizaine de métaux, dont le plomb. Eau potableLe décret n° 2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine a fixé des limites de concentration en plomb dans les eaux destinées à la consommation humaine :
Autres secteurs
Les arrêtés du 20 juin 2002 et du 30 juillet 2003 prescrivent une VLE de 1 mg/Nm3 pour les rejets atmosphériques de plomb des installations de combustion (de puissance supérieure à 20 MW) consommant des combustibles solides et liquides. Pour les rejets aqueux, ils fixent une VLE de 0,5 mg.L-1 pour les installations existantes (arrêté du 30 juillet 2003) et de 0,1 mg.L-1 pour les installations nouvelles (arrêté du 20 juin 2002). Pour les rejets atmosphériques, les arrêtés ministériels pour les cimenteries incluent des VLE pour un ensemble de métaux lourds comprenant le plomb (0,5 mg.m-3 pour la somme de 14 métaux). Pour les rejets aqueux des cimenteries qui co-incinèrent des déchets, l'arrêté du 20 septembre 2002 prescrit une VLE de 0,2 mg.L-1 (contre 0,5 dans l'arrêté du 10 octobre 1996). La valeur limite relative à la production de dioxyde de titane est de 0,02 kg Pb/kg dioxyde de titane produit, selon l'arrêté du 2 Février 1998 actualisé. NormesIl existe des normes AFNOR concernant le plomb et certains de ses usages : la norme NF EN 12659 pour le plomb et les alliages en plomb, la norme NF EN 12 588 pour les feuilles de plomb laminées pour le bâtiment. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Production et utilisation
Production et ventes
Données économiques
La production mondiale de plomb raffiné en 2014 est évaluée à 11 Millions de tonnes, avec 5 Millions de tonnes de minerai extrait (ILZSG 2015). Le marché mondial de plomb raffiné est estimé à environ 15 milliards d'euros (ILA non daté).
La Chine est le leader du marché de plomb. Elle produit 2 Millions de tonnes de minerai par an (USGS 2015), détient 42% de la production mondiale de plomb raffiné (BRGM s. d.) et en consomme autant.
Les autres producteurs de plomb raffiné sont l'EU-28 avec 16% de la production mondiale et les Etats Unis avec 12% ; suivis par la Corée du Sud, l'Inde, le Mexique, le Canada, le Japon, l'Australie et le Brésil qui détiennent par pays entre 4% à 2% de la production mondiale.
En 2014, environ 1,15 Million de t de plomb secondaire ont été produites (USGS 2015). Presque tout le plomb secondaire a été récupéré dans des métaux usagés et des batteries (post-consommation) par des fonderies secondaires.
La production de plomb à partir de minerai est de plus en plus minoritaire, au profit de la récupération de plomb à partir de déchets et tout spécialement de batteries au plomb. En France, la collecte de métaux non ferreux enregistre une forte hausse, une augmentation de 21% entre 2001 et 2010. En 2010, l'ADEME signale 0,25 Mt de plomb collecté, ce qui représente une augmentation de 28% par rapport à 2009 (Ademe 2010).
Importation et exportation de plomb
Les volumes du commerce international de plomb comme matière première pour l'UE sont présentés dans le Tableau 5.
Tableau 5. Commerce international du plomb -valeurs moyennes 2005-2010 (Source : ECHA 2013b).

Le plomb dans l'économie française
Prix du plomb
Entre 2008 et 2010, la production du plomb est légèrement excédentaire, en générant une progression des stocks et une baisse des prix du métal. Après le pic inédit à 3 958 dollars la tonne en octobre 2007, les cours du plomb sur le LME se sont effondrés jusqu'à moins de 900 dollars fin décembre 2008. Depuis 2011, les prix fluctuent entre 1 700 et 2 450 dollars la tonne (voir les conversions aux euros pour les dernières années dans le Tableau 30). Au cours des premiers mois de l'année 2015 après une baisse notable en fin d'année 2014, les prix se trouvaient dans le bas de cette fourchette, dans la lignée de nombreuses autres métaux cotés (Boursorama s. d.).
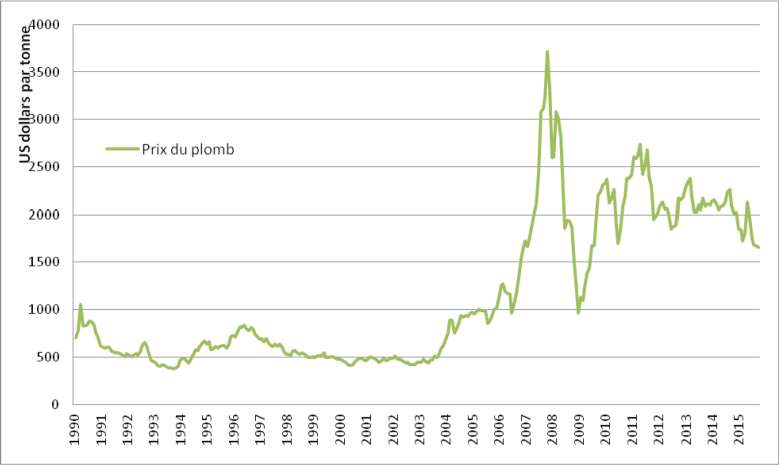
Figure 7. Evolution du prix de plomb (Source : INSEE).
Tableau 30. Prix du plomb (conversion de prix de US cents/Livre à euros/tonne) (Sources : ECHA 2013b; USGS 2015).
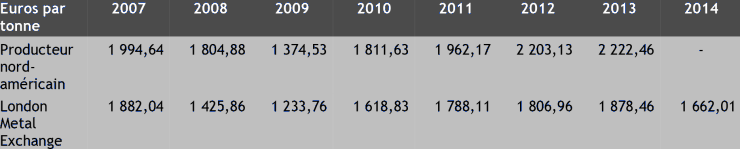
Importance du plomb dans l'économie française
Tableau 31. Données économiques sur les entreprises de 20 personnes et plus dans les secteurs d'activité où le plomb est important en 2003 (Source : MINEFI) et en 2013 (Source : Datainfogreffe).
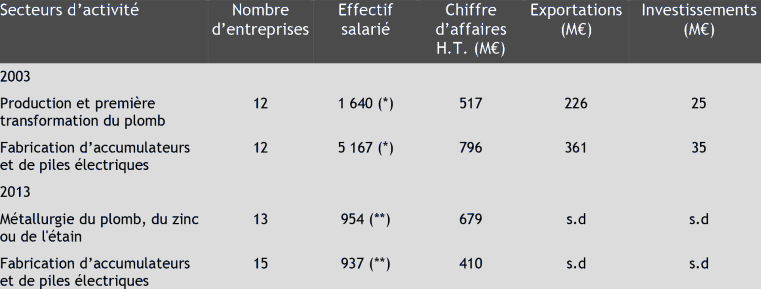
(*) Effectif salarié au 31/12/2003 ; (**) Effectif salarié au 31/12/2013 ; sans donnée.
D'après Thorax et al. (2001), le chiffre d'affaires du marché mondial des batteries automobiles en 1999 est compris entre 6 et 10 milliards de dollars et celui des batteries de secours est d'environ 2,85 milliards de dollars. Le nombre de personnes employées dans l'extraction, la fusion et le raffinage du plomb sont de l'ordre de 70 000 à 90 000, auxquelles s'ajoutent environ 2 000 travaillant dans la production d'oxydes de plomb. La fabrication de batteries emploie entre 60 000 et 70 000 personnes. Le minerai de plomb est actuellement produit par quantité de 4 Mt de concentré par an, contenant 3,1 Mt de plomb. Cette production avait en 1998 une valeur totale de 2,2 G$. En 1998, 6 Mt de plomb furent raffinées, pour une valeur de presque 4 milliards de dollars.
En France, en 2013 la fabrication des accumulateurs et piles électriques représente 410 M€. Les principales entreprises sont : Exide Technologies SAS (200 M€ de CA en 2013), Enersys SARL (142 M€ de CA en 2013) et Blue Solutions (52 M€ de CA en 2013).
Le plomb représente une part élevée d'1/5ème du prix d'une batterie (Vignes et al., 1998), et selon les acteurs contactés pour cette mise à jour, le faible prix du plomb et associé à son poids économique demeure son attrait principal pour les batteries automobiles Si on estime à 9 millions le nombre de batteries automobiles vendues chaque année en France et à 100 € le prix moyen d'une batterie, le chiffre d'affaire annuel du plomb contenu dans les batteries automobiles était de l'ordre de 180 M€.
Sites produisant, recyclant ou utilisant du plomb en France
Les données figurant dans cette section ne prétendent pas à l'exhaustivité mais fournissent des exemples d'activités industrielles liées au Plomb en France.
Production de plomb et recyclage des batteries
La filière des piles et accumulateurs s'organise autour des acteurs de la mise sur le marché (producteurs) de piles et accumulateurs neufs et des acteurs de la collecte (éco-organismes ou producteurs) et du traitement (recycleurs) des déchets de piles et accumulateurs. Conformément à la directive 2006/66/CE, la filière du recyclage est segmentée en trois : portable, automobile et industriel (ADEME 2015). Le Tableau 32 montre l'évolution de tonnage collecté de piles et accumulateur les dernières années.
Tableau 32. Quantités collectées par type de piles et accumulateurs en France (Source :ADEME 2015).
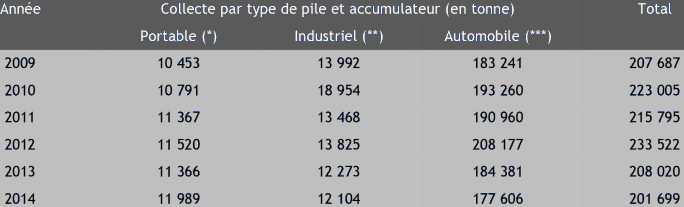
(*) Données des éco-organismes et producteurs ; (**) calculé à partir des données des recycleurs; (***) calculé à partir des données des recycleurs.
L'industrie du plomb (production de plomb et récupération du plomb) en France a connu d'importantes restructurations depuis une dizaine d'années :
- fermeture de sites (la plus médiatisée a été celle de Metaleurop Nord à Noyelles-Godault en janvier 2002) ;
- après la faillite de sa filiale Metaleurop Nord, Metaleurop SA a été mis en redressement judiciaire en octobre 2003, et devenu Recylex en 2007; le groupe est très endetté et n'emploie plus en France que quelques dizaines de personnes réparties sur une dizaine de sites ;
- concentrations (achat d'APSM par la STCM en juin 2002 ; achat du premier producteur français de batteries au plomb, la CEAC, par Exide en 1995) ;
- diminution de la production primaire de plomb au profit de la récupération de plomb par recyclage des batteries.
- Les accumulateurs au plomb sont traités par 5 opérateurs présentés dans le Tableau 33.
Tableau 33. Entreprises operateurs de traitement pour les accumulateurs au plomb en France en 2014 selon le registre national des producteurs de piles et accumulateurs (Source : ADEME (2015).

Les principaux recycleurs de batteries au plomb en France sont actuellement les suivants :
- EPUR, à Stains (93) a une capacité de traitement annuelle de 25 000 tonnes, emploie 15 personnes et a généré un CA 9M€ en 2013.
-
La Société de traitement chimique des métaux (STCM).22 La STCM emploie 90 personnes et possède deux sites en France : Toulouse (31) et Bazoches-les-Gallerandes (45). En outre la STCM contrôle depuis juin 2002 APSM, Affinerie de Pont Sainte Maxence, ex CEAC, à Pont Sainte Maxence – Brenouille (60), qui emploie 60 personnes. Ces trois sites totalisent une capacité d'environ 85 000 tonnes. L'activité de la STCM consiste à traiter des produits en fin de vie qui contiennent du plomb pour les transformer en plomb pur ou en alliages de plomb que ses clients utiliseront pour fabriquer de nouveaux produits. L'approvisionnement de la STCM est principalement constitué de batteries usagées collectées, produits de broyage, tuyaux et planches de plomb et résidus de fabrication sur le marché français.
- Métal Blanc, à Bourg-Fidèle (08) recycle également les batteries au plomb. Cette usine fait de l'affinage de plomb et produit du plomb raffiné et des alliages pour batteries. Sa production s'est élevée à 25 000 tonnes. Elle emploie une quarantaine de personnes. Au sein de l'usine de Bourg-Fidèle la récupération de plomb est assurée dans une unité de broyage des batteries, une unité de fusion et réduction des matières plombeuses, une unité d'affinage et un laboratoire de contrôle(Métalblanc s. d.).
- Le groupe RECYCLEX est présent en France, en Allemagne et Belgique. Les unités de traitement sont basées sur les sites de Villefranche-sur-Saône (69) et d'Escaudœuvres (59) en France, et de Goslar en Allemagne. Ils réceptionnent des batteries usagées entières, les broient et en trient les constituants. RECYCLEX est le troisième producteur de plomb en Europe et emploie près de 675 personnes (RECYCLEX s. d.).
- Guy Dauphin Environnement – GDE a son siège à Rocquancourt (14) et a développé un réseau national de plus de 80 sites, classés en deux catégories : sites de collectes avec les apports des particuliers, professionnels et artisans, et sites de production. GDE emploie plus de 1100 salariés. L'entreprise recycle et valorise près de 3 millions de tonnes de matière par an. Son site de Rocquancourt est entièrement automatisé et a une capacité de recyclage de 30 tonnes/h (GDE s. d.).
[22] Filiale française du groupe Eco-Bat Technologies. Avec une capacité de production de plus de 700 000 tonnes, ce groupe est leader mondial (STCM s. d.).
Fabrication de batteries au plomb industrielles
Suite à la fermeture à Outarville (2013) du site de STECO POWER, il n'y a plus de fabricant français de batteries automobiles. En effet, les entreprises EXIDE et ENERSYS fabriquent exclusivement des accumulateurs au plomb de type industriel(ADEME 2015).
La fabrication des autres types d'accumulateurs industriels est assurée par SAFT et BATSCAP (Groupe Bolloré), spécialiste des batteries Lithium Métal Polymère. D'après l'ADEME (2015), 50 % des piles et accumulateurs portables sont fabriqués en Europe (Belgique, Allemagne et Europe de l'Est) et 50 % proviennent d'Asie et des États-Unis.
En France, les principaux producteurs de batteries industrielles au plomb sont les suivants :
- Exide Technologies a son siège à Gennevilliers et une usine à Lille. C'est un groupe américain qui, en 1995, a acheté le n°1 français, la Compagnie européenne d'accumulateurs (CEAC). Exide fabrique et commercialise trois lignes principales de produits : les batteries automobiles, les batteries de traction, les batteries stationnaires. D'après le site Internet d'Exide, une partie des dépenses en R&D se concentrent sur le développement de batteries intelligentes, les matériaux de pointe et la conception de processus, ainsi que sur les batteries du plomb-acide (auxiliaires) de pointe pour les véhicules hybrides et électriques.
- Enersys. D'après son site Internet, il s'agit du plus grand fabricant européen de batteries au plomb. Il produit des batteries stationnaires (alimentation de secours pour les télécommunications, UPS), des batteries de traction et des chargeurs. Il dispose d'une usine de production de batteries de traction à Arras (62)23
[23] Site Internet d'Enersys-Hawker (http://www.enersys-hawker.com/customerservice/manufacturing.asp?lang=f).
Produits laminés et extrudés
En France l'entreprise D'Huart Industrie – DHI à Marseille (13) fabrique des demi-produits en plomb et alliage tels que tôles et feuilles laminées, extrudés (fils, tubes, tuyaux, etc.), pièces de fonderie injectées ou coulées par gravité. Elle fabrique également des produits de chaudronnerie de plomb et des ensembles complets en plomb pour la chimie ou la protection contre les rayonnements. En 2014, son CA était de 16M€ et son effectif à 46 personnes.
Alliages
Les Établissements Eugène Budin et ses fils (Aubervilliers, 93) fabriquent tous types d'alliages à base d'étain et de plomb, d'alliages pour électronique, de plomb et de pâtes à souder et à étamer. Ils retraitent également des déchets étain/plomb. Leur filiale S.N.E. Berger, située au même endroit, fait de l'étamage à façon, notamment de plomb. L'effectif total de l'entreprise s'élève à environ 20 personnes.
Producteur de pigments
En France, l'usine d'Ecka Granules Poudmet (groupe Eckart), liquidée en 2013, produisait des poudres et pigment de plomb. Située à Bailleval (60), elle avait une capacité totale de production de 6 000 tonnes et un effectif de 70 personnes.
Divers
L'entreprise Le plomb français (filiale du groupe Eco-Bat Technologies), dont l'usine est située à Estrées-Saint-Denis (60) fait de l'affinage de plomb, fabrique des lingots de plomb doux et affinés, des laminés, des tuyaux, des anodes, des grenailles et des produits de soudure plomb-étain. Sa production s'est élevée à 18 000 tonnes par an et ils employaient 44 salariés (les-industries-technologiques.fr non daté).
Utilisations
Introduction
L'utilisation du plomb est toujours en croissance et les usages par application sont présentés dans le Tableau 6.
Le plomb dispose de propriétés intéressantes : flexibilité, résistance à la corrosion et à certains rayonnements, densité élevée, qui le rend utile pour des usages variés. Ainsi sa flexibilité et sa température de fusion peu élevée le rendent facile à travailler. Sa capacité de résistance à la corrosion le fait utiliser comme matériau étanche dans le bâtiment (feuilles de plomb pour les toitures, peintures au plomb) et pour des équipements en contact avec des acides (batteries plomb-acide, production d'acides). Sa densité élevée lui permet d'être une protection efficace contre les radiations ou le bruit (Tukker, 2001).
Tableau 6. Principaux usages du plomb dans les pays de l'OCDE (chiffres de production) en 1990 (Sources : OECD Environment Directorate (1993) ; dans Tukker et al. (2001), dans l'Union européenne en 1998 et en France en 1998 (Sources : ILZSG, 2000 ; en Royal Haskoning (2003), dans le monde en 2011 (Sources ILA ; ECHA en 2013) en kilotonnes de plomb.
Batteries ou accumulateur au plomb-acide
Les batteries plomb-acide contiennent du plomb, des composés du plomb et de l'acide sulfurique pour accumulateurs, le tout contenu dans un boîtier en plastique. Les plaques positives des accumulateurs sont constituées d'une grille en alliage de plomb sur laquelle est déposée du dioxyde de plomb (PbO2) (Vignes et al., 1998). La composition moyenne (en masse) des batteries plomb-acide est la suivante :
- Plomb : sulfate de plomb (24,5 %), alliage de plomb (21 %), oxyde de plomb (16 %), et
- Autres composants : H2SO4 (24 %), polypropylène (7,7 %) et PVC (3,8 %)(Vignes et al., 1998).
Il s'agit de l'usage dominant du plomb (près de 75 % en France, près de 60 % en Europe) : dans le monde, la part du plomb utilisé pour les batteries est passée de 28 % en 1960 à 75 % en 1999 (ILZSG, 2001 ; in Royal Haskoning, 2003). Elles sont principalement destinées aux automobiles et aux motos (batteries de démarrage, ou batteries 'starter lighting and ignition' (SLI) ; 77 % du plomb utilisé pour les batteries dans l'OCDE en 1990). La durée de vie des batteries SLI a été multipliée par deux (de trois à quatre ans en moyenne, actuellement) et la quantité de plomb utilisé a diminué de 12 à 8 kg. Les batteries pour usage 'stationnaire' sont conçues pour durer 25 ans (Vignes et al., 1998).
Le Tableau 7 présente les principales applications des batteries au plomb.
Tableau 7. Applications industrielles des batteries au plomb dans la zone EMEA. (Source : EUROBAT, 2015).

Les accumulateurs automobiles, destinés à alimenter un système de démarrage, d'éclairage ou d'allumage automobile, sont exclusivement au plomb. Cette technologie est stable, peu coûteuse et devient en fin de vie un déchet économiquement valorisable, ce qui favorise la pérennisation de son utilisation pour les batteries de démarrage. En 2014, en France 7,56 millions d'accumulateurs automobiles au plomb ont été mis sur le marché représentant 114 964 tonnes d'accumulateurs automobiles au plomb (ADEME 2015), et environ 65 % de accumulateurs automobiles collectés. L'évolution des tonnages depuis 2009, reprise dans la Figure 1, semble orientée à la baisse :
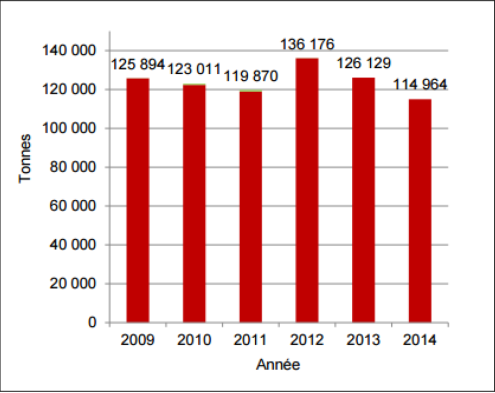
Figure 1. Evolution des quantités (exprimée en poids) de batteries automobiles mises sur le marché en France (Source : ADEME, 2015).
Concernant les applications industrielles des batteries au plomb, EUROBAT(Aschke et Geiger 2015) estime à environ 1,6 milliard d'euros le marché des accumulateurs au plomb dans la zone EMEA5 en 2014.
Les batteries plomb-acide peuvent également servir de batteries de traction pour certains véhicules électriques (14 %), comme batteries d'urgence, en appoint du réseau électrique (dans les hôpitaux et les télécommunications notamment) (8 %) et, très minoritairement, comme batteries portables pour les particuliers.
[5] Europe, Moyen-Orient et Afrique
Produits laminés et extrudés
Ces produits laminés et extrudés servent essentiellement de matériaux de construction, notamment pour les toitures, comme accessoires de couverture (souches de cheminées, chenaux, recouvrement de balcons, 10 000 t.an-1), pour l'entretien et la rénovation des monuments historiques (environ 2 000 tonnes de plomb par an en France), comme protection contre l'humidité ou comme matelas anti-vibrations (Vignes et al., 1998). Ils peuvent également servir de protection contre les radiations, de matériau d'insonorisation, particulièrement pour les basses fréquences.
Figure 2. Consommation de plomb (exprimée en milliers de tonnes de plomb) en France entre 1976 et 2002 (Source : Woodhead Publishing 2006).
L'usage de plomb dans des produits laminés et extrudés dépend principalement de l'industrie de la construction. Le Royaume-Uni est le traditionnel consommateur pour la toiture et les solins, tandis que dans le reste de l'Europe le zinc demeure le matériau préféré. La consommation en France entre 1976 et 2002 est restée en moyenne autour de 21 milliers de tonnes de plomb (Woodhead Publishing 2006).
Gaines de câbles
Le plomb est utilisé pour les gaines de câbles sous-marins et souterrains, haute tension ou de télécommunications, car il est parfaitement imperméable aux liquides. Cependant des produits de substitution, tels le polyéthylène et le PVC, peuvent parfois remplacer le plomb. Actuellement le plomb est principalement utilisé pour les câbles sous-marins, usage pour lequel il est encore supérieur à ses concurrents.
Entre 1965 et 1990, la consommation de plomb dans l'Europe des 15 est passée de 109 kt à 0 kt pour les câbles terrestres et est restée à peu près constante, aux alentours de 58 kt, pour les câbles sous-marins. Cette demande pour les câbles sous-marins est supposée être restée à peu près stationnaire depuis cette période (OCDE, 1993 ; Tukker, 2001).
Plomb à munition
80 % du plomb pour munition sert à produire des munitions et 20 % sont utilisés dans certains alliages d'acier pour améliorer l'usinabilité de l'acier.
Entre 1993 et 1998, la production de plomb pour munition est passée de 7,9 kt à 7,5 kt en France et de 53 à 58 kt dans l'Europe des 15 (ILZSG, 2000 ; Tukker, 2001). Conformément aux accords internationaux signés par la France, le ministère chargé de l'environnement a interdit l'utilisation de la grenaille de plomb dans les zones humides depuis 2006.
Alliages
Les alliages au plomb (principalement la litharge, PbO, et le minium, Pb3O4) ont différents usages :
- produits de soudure, très utilisés dans l'industrie de l'électronique, principalement pour établir des connexions électriques sur des circuits imprimés (Lohse et al., 2003), les produits de soudure utilisés pour les circuits imprimés contiennent généralement 63 % d'étain et 37 % de plomb) ;
- produits de soudure utilisés dans l'industrie automobile, les boîtes de conserve et la plomberie ;
- alliages à base de plomb (associé à de l'étain le plus souvent, parfois à de l'antimoine également) utilisés comme revêtement pour le fer et l'acier pour les protéger de la corrosion ;
- produits en laiton, à des concentrations de l'ordre de 2% de plomb (ECHA 2013b), et en bronze, pour réduire les frottements et l'usure dans certains types de machines. Le plomb est connu pour améliorer l'usinabilité du laiton ;
- des alliages métalliques contenant du plomb ont été identifiés principalement dans les boutons, les fermetures éclair, des rivets et des clous dans les vêtements et accessoires, des clés, des porte-clés, décorations intérieures et de la papeterie (ECHA 2013b). L'utilisation du plomb dans les différentes parties métalliques (en alliages) dans les articles de consommation est souvent involontaire.
Verres
Le numéro atomique élevé du plomb en fait le meilleur élément pouvant entrer dans la composition de verres de protection contre les rayonnements (X et nucléaires).
L'oxyde de plomb a été utilisé dans des verres pour les écrans plasma, mais il semble que cet usage soit très déclinant voire obsolète (du fait de la domination des écrans LED d'une part, et d'autre part de solutions sans plomb pour ces écrans6).
Le plomb entre également dans la composition de verres anti-radiations. Ainsi, l'usine de retraitement des combustibles irradiés de La Hague utilise plus de 200 fenêtres de verre au plomb (jusqu'à 80 % de PbO). Les fenêtres sont formées par des dalles de verre collées les unes aux autres. L'épaisseur peut atteindre 1,2 mètres et la masse plusieurs tonnes (Vignes et al., 1998).
L'oxyde de plomb peut remplacer en majeure partie l'oxyde de calcium pour produire du cristal. Ce type de verre comprend entre 25 et 30 % d'oxyde de plomb. Cette formulation donne au verre une densité et un indice réfringent élevés7 , d'où une sonorité et une brillance excellentes et une forte capacité à être travaillé. La production de cristal en France est sans doute de l'ordre d'une centaine de tonnes par jour (Fédération des chambres syndicales de l'industrie du verre).
Une autre utilisation du plomb dans l'industrie du verre est la production de certaines fibres optiques qui sont constituées d'une peau en verre ordinaire (indice de réfraction de 1,5) et d'un cœur en verre au plomb (50 % de PbO) d'indice 1,62 (Vignes et al., 1998 ; Jacquier, 2012).
Entre les années 1970 et 2000, la consommation de plomb dans l'industrie du verre est restée à peu près stable pour la plupart des applications. La prédominance des écrans plats LED pour les écrans (informatique et télévision) a maintenant provoqué un arrêt de cet usage. Les autres applications devraient continuer à rester stables (Tukker et al., 2001).
[6] http://news.panasonic.com/press/news/official.data/data.dir/en061102-1/en061102-1.html
[7] L'oxyde de plomb augmente l'indice de réfraction des verres : cet indice peut ainsi passer de 1,5 à 1,8.
Stabilisants de PVC
Du plomb est parfois ajouté au PVC pour réduire la dégradation causée par la chaleur et les rayons ultraviolets pendant la production et l'usage de ces plastiques. Ce plomb est souvent utilisé sous forme d'oxyde (litharge). Il est surtout utilisé dans les produits PVC rigides (qui contiennent alors environ 1 % d'oxyde de plomb (Vignes et al., 1998) lorsque ceux-ci sont destinés à des emplois durables, dans le bâtiment notamment : cadres de fenêtres (8 % des applications de PVC) et tuyaux (33 % des applications du PVC) (Tukker et al., 2001).
Les principales propriétés de composés en PVC incorporant des stabilisants au plomb comprennent : la chaleur et la stabilité à la lumière, bonnes propriétés électriques, bonnes propriétés mécaniques à court et à long terme, faible absorption d'eau, une large gamme de traitement et un bon ratio coûts/performances(ECHA 2013b). La réglementation REACH a enregistré les stabilisants suivants (voir Tableau 8).
Tableau 8. Stabilisants à base de plomb enregistrés dans REACH (Source : ECHA 2013b).
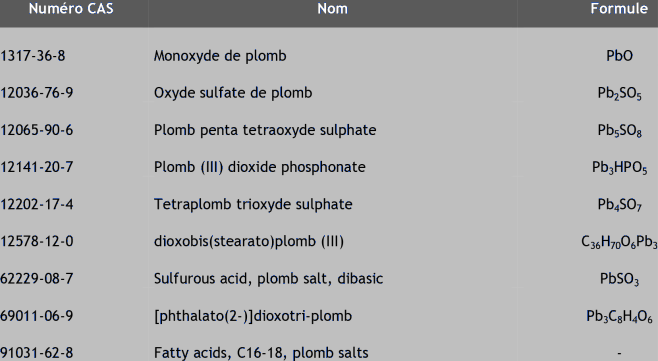
Cette application a diminué de 70 % dans les années 1970 (OCDE, 1993).
D'après l'ESPA (European Stabilisers Producers Association), en 2000, environ 170 kt de stabilisants étaient utilisés annuellement en Europe. 71 % de ces stabilisants étaient à base de plomb8 .
Depuis cette date, l'industrie européenne du PVC (VinyPlus) s'est engagée à volontairement remplacer en Europe tous les stabilisants au plomb du PVC par des stabilisants au calcium, avant la fin de l'année 2015.
[8] Site Internet de l'ESPA (http://www.stabilisers.org/breakdown.htm).
Émaux et céramiques
Le plomb sert à donner une finition lisse et anti-rayures à divers produits céramiques. Pour ce faire, il est souvent employé sous forme de minium (Pb3O4). Utilisé dans les glaçures, il sert d'opacifiant en formant un silicate. Cette application décline lentement depuis longtemps, suite à des changements technologiques (Tukker, 2001). Au début des années 1990, de 70 à 90 % de l'oxyde utilisé dans ce secteur était employé à la fabrication de carrelages (en 1991, 59 g de PbO/m2) (Vignes et al., 1998). Les interdictions récentes (2014/2015) dans le cadre de REACH du Plomb dans les bijoux fantaisie et dans les articles pouvant être mis en bouche par des enfants (voir chapitre 1) vont contribuer à poursuivre la tendance à la substitution du plomb dans ce domaine.
Métallurgie
Il existe diverses applications du plomb en métallurgie :
- De fines couches de plomb peuvent être plaquées par électrolyse sur des pièces en acier pour les protéger contre la corrosion.
- Galvanisation. Une couche de plomb fondu est utilisée dans le fond d'un bain de zinc fondu pour aider à la séparation des impuretés lorsqu'une couche de zinc est appliquée à l'acier.
- Des bains de plomb fondu sont également utilisés lors des procédés de recuit pour refroidir les produits en acier lors de leur fabrication.
Pigments
Bien que l'utilisation de certains mélanges de pigments soit restreinte dans l'annexe XVII de la réglementation REACH, et que plusieurs composés du plomb concernés soient soumis à autorisation dans REACH (voir Chapitre 1), ils peuvent apparaître comme constituants dans des articles fabriqués à l'intérieur et à l'extérieur de l'UE.
Si le sulfate et le carbonate de plomb ont été interdits dans les peintures, d'autres pigments à base de plomb sont disponibles dans les couleurs de base comme le blanc, le rouge et le jaune. Ils sont utilisés pour des applications de niche (peintures et objets de signalisation se sécurité notamment) Ces pigments sont aussi probablement la source du plomb retrouvé dans les polymères colorés utilisés dans la fabrication d'accessoires et de détails des vêtements, ainsi que dans les peintures de surface dans d'autres groupes d'articles. Ils sont également la source de plomb probable dans certaines gravures de plastique sur les textiles. Les substances enregistrées dans la réglementation REACH sont présentées dans le Tableau 9.
Tableau 9. Pigments à base de plomb enregistrés dans REACH (Source : ECHA 2013b)
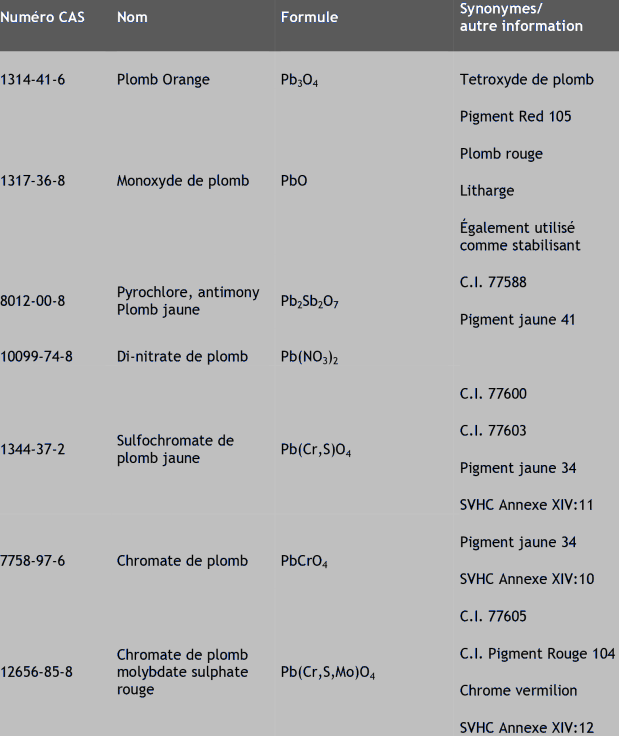
Divers
Il existe d'autres usages, relativement moins significatifs, du plomb :
- quilles de bateau ;
- équilibrage des roues de véhicules ;
- balance de pesée ;
- poids de volet ;
- matériel de pêche ;
- métal d'imprimerie (alliages plomb-étain-antimoine) ;
- Protection contre les radiations dans l'imagerie médicale
- Matériaux pyrotechniques.
- Semi conducteurs (transistors, …)9
[9] http://www.smm.co.jp/E/business/material/product/Leadframe/
Usages historiques
Additifs dans l'essence
Les additifs de plomb dans l'essence (plomb tétra éthyle ou plomb tétra méthyle) ont longtemps été une des principales applications du plomb. Cependant cet usage a été progressivement banni en Europe. En France, la vente d'essence plombée est interdite depuis le 1er janvier 2000.
Canalisations
La pose de nouvelles canalisations ou branchements en plomb ne se pratique plus depuis des années en France. Cependant, certaines canalisations existantes sont encore en plomb, ce qui peut constituer une source d'émissions dans l'environnement. Si les branchements en plomb ont été remplacés sur les réseaux publics, beaucoup resterait à faire dans le domaine des réseaux privés (HCSP, 2014).
Peintures
Le minium (Pb3O4) a été utilisé comme peinture antirouille. Des pigments de couleur étaient élaborés à partir différents composés de plomb : pigments jaunes (chromate : PbCrO4 entrant dans la fabrication de la peinture des anciennes bandes jaunes routières) ou rouges (molybdate : PbMoO4) (Vignes et al., 1998). Ces pigments ne sont plus ou peu utilisés (sauf dans certaines peintures pour signalétique de sécurité, par exemple pour le marquage au sol dans des aéroports). Les peintures au plomb (céruse10) ont été interdites progressivement. En France, l'interdiction de mise sur le marché est effective depuis février 1993.
[10] La céruse est un pigment blanc de carbonate de plomb.
Tubes cathodiques
Le plomb a été utilisé dans les tubes cathodiques pour son exceptionnel pouvoir d'absorption des rayonnements ionisants, en vue de protéger le téléspectateur L'oxyde de plomb (PbO) représentait entre 22 et 23 % du verre des cônes, soit environ 7 % du tube cathodique (Fédération des chambres syndicales de l'industrie du verre).
PVC
Pour ce qui est du PVC produit dans l'UE, conformément à l'engagement de VinylPlus, l'usage de stabilisants au plomb devrait devenir dès 2016 obsolète, et le plomb ne concerner que les stocks de PVC en place ou sous forme de déchets, et des produits importés.
Rejets dans l’environnement
Sources naturelles
Le plomb peut être rejeté par quelques sources naturelles. Les émissions de plomb par les volcans sont estimées entre 540 et 6 000 tonnes/an. (Independent Consultants, 2000 ; in Royal Haskoning, 2003) Une autre source naturelle provient de l'érosion du sol, contenant entre 50 et 75 mg de plomb par kg de sol. Dans les régions agricoles modernes, où le sol est nu la plus grande partie de l'année, cela peut conduire à des émissions importantes (Eurometaux ; en Royal Haskoning, 2003).
Ces sources naturelles ne sont pas négligeables, en effet, d'après Weiss et al.(1999), au niveau global, les émissions atmosphériques mondiales naturelles de plomb sont de l'ordre de 12 kt.an-1, les émissions anthropiques de l'ordre de 332 kt.an-1 mais dont 248 kt provennaient du plomb contenu dans l'essence.
Sources non-intentionelles
Le plomb peut être un contaminant d'autres produits et être émis sans être utilisé directement. Ainsi des engrais au phosphate ou des combustibles fossiles (charbon notamment) peuvent contenir du plomb à cause de la présence naturelle de ce métal dans certains minerais et substances. Cette présence dans les engrais peut notamment contribuer à expliquer les importantes émissions diffuses liées au ruissellement sur des terres agricoles.
L'industrie du métal (hors production de plomb) utilise des minerais ou des matières recyclées qui contiennent du plomb. Dans la production du zinc, le plomb n'est qu'un contaminant des matières premières ; il n'est pas utilisé lors des phases de production. Les producteurs cherchent à récupérer ce plomb pour l'envoyer dans d'autres usines mais une partie de ce métal peut-être émis dans les eaux.
L'industrie du verre utilise des matériaux recyclés contenant du plomb également.
D'autres contaminations peuvent être d'origine anthropique mais indirectes et involontaires, via la réutilisation de déchets contaminés : boues de station d'épuration, fumier, réutilisation de cendres dans le béton et la construction de routes, … (Tukker et al., 2001).
Rejets liés à l’utilisation des produits
Batteries
Les émissions de plomb lors de l'utilisation des batteries sont sans doute très faibles. En fin de vie elles sont très majoritairement recyclées (à plus de 90 % en France).
Le taux de recyclage (tonnages valorisés / tonnages collectés) déclaré par la filière en France est de 83% ; cela signifie qu'environ 7 000 t de Pb ont été perdues lors du recyclage en 2014. Le devenir de ces pertes n'est pas clair, et nous ne connaissons pas la fraction de cette quantité qui est émise dans l'environnement. Par comparaison aux émissions dans l'air et dans l'eau rapportées par ailleurs il pourrait s'agir de quantités très significatives.
Tukker (2001) a estimé les émissions dues à la fin de vie des batteries au plomb dans l'Europe des 15 :
- 30 tonnes en 2000 qui devaient atteindre 40 tonnes en 2015 d'émissions atmosphériques dues à l'incinération des déchets ;
- 16 tonnes en 2000 qui devaient atteindre 29 tonnes en 2015 d'émissions de plomb dans les sols en provenance des décharges (la hausse est due à l'augmentation du stock de plomb dans les décharges).
D'après ces projections anciennes, ces émissions seraient désormais plus faibles que les émissions industrielles, mais ne seraient pas non plus devenues négligeables.
Feuilles de plomb
Les feuilles de plomb utilisées dans la construction peuvent causer des émissions de plomb soit pendant leur utilisation, par corrosion, soit après destruction des bâtiments, si une partie du plomb n'est pas recyclée. D'après l'Association des industries européennes de feuilles de plomb, les feuilles de plomb des toits sont recyclées à plus de 95 % (ELSIA, 2001 ; in Royal Haskoning 2003).
D'après la littérature, la lente corrosion des feuilles de plomb est estimée à 5 g/m2 , ce qui représente un facteur d'émission annuel d'environ 0,008 % du stock de feuilles de plomb présentes dans le bâti existant. Tukker et al. (2001) estimaient que les émissions atmosphériques dues aux feuilles de plomb dans l'Europe des 15 étaient de l'ordre de 10 kt.an-1 en 2000 et les projetaient à 20 kt.an-1 en 2015. Ils estimaient également que les émissions vers le sol étaient de 11 kt.an-1 en 2000 et les projetaient à 17 kt.an-1 en 2015.
Cependant, d'après Eurometaux, le chiffre de 5 g/m2 est surestimé pour au moins deux raisons :
- la composition de l'eau de pluie a beaucoup évolué durant les dernières décennies (moins acides), ce qui a sans doute réduit son pouvoir corrosif ;
- ce chiffre a été estimé à partir de feuilles de plomb neuves ; or les feuilles de plomb exposées à l'air plusieurs années forment une patine protectrice (Eurometaux ; cité dans Royal Haskoning, 2003) qui limite in fine les émissions.
Canalisations
Le plomb des canalisations est une source de plomb dans l'eau encore non négligeable même si les canalisations neuves ne sont plus en plomb depuis des années. En effet en France une quantité relativement importante est encore présente dans les réseaux privés. Dans le réseau public de distribution, les canalisations en plomb ont été progressivement remplacées mais les canalisations de raccordement (c'est-à-dire entre le réseau public et les compteurs individuels et/ou généraux) posées avant 1948 sont encore pour partie en plomb : on compte près de 4 millions de branchements en plomb soit plus du tiers du nombre de branchements existants. De même, pour les tuyauteries intérieures des immeubles, même si les canalisations en plomb ont été progressivement abandonnées après 1948 au profit d'autres matériaux (acier galvanisé, cuivre, polyéthylène, PVC), les soudures de raccordement et certaines tuyauteries en PVC peuvent contenir du plomb : on estimait en 2003 que 10 millions de logements, plutôt construits avant 1949, sont encore équipés de tuyauteries en plomb (Agence nationale pour l'amélioration de l'habitat ANAH 2003). Plus récemment (2013), ce nombre est passé à 1,2 millions de branchements.
Tukker et al. (2001) ont calculé les émissions liées à la corrosion du plomb des canalisations d'eau, pour l'Europe des 15 (en extrapolant des calculs réalisés pour les seuls Pays-Bas), à 280 tonnes en 2000 et l'ont projetée à 240 tonnes en 2015. En principe, les canalisations en plomb sont retirées avant la destruction des bâtiments et recyclées.
Pigments et stabilisants
D'après l'ESPA (European Stabiliser Producers Association), les stabilisants au plomb utilisés dans le PVC sont pris dans la matrice de PVC ce qui rend leurs fuites dans l'environnement insignifiantes.13 Comme pour le verre, c'est plutôt en fin de vie que le PVC est susceptible de relâcher le plomb qu'il contient, d'autant plus que le PVC produit dans l'UE l'est désormais sans stabilisants au plomb.
[13] Site Internet de l'ESPA (http://www.stabilisers.org.L-1EAD.htm).
Alliages
Encore une fois les émissions dues à l'utilisation d'alliages sont a priori négligeables pendant leur utilisation et ne sont significatives qu'après leur fin de vie. Le plomb des soudures dans les automobiles et dans l'électronique est généralement recyclé (Eurometaux in Royal Haskoning, 2003). Le fort taux en plomb dans les alliages pour les soudures des circuits imprimés, par exemple, peut contaminer en fin de vie le plastique de ces circuits et rendre leur recyclage plus difficile (Lohse et al., 2003).
D'après Tukker et al.(2001), dans l'Europe des 15, les émissions de plomb dues à l'utilisation d'alliages s'élèvent en 2000 à 10 tonnes dans l'air (incinération) et à 6 tonnes dans les sols (fuite des décharges) et s'élèveront en 2015 à 10 tonnes dans l'air et à 11 tonnes dans les sols.
Munitions
Les munitions finissent le plus souvent abandonnées dans la nature, notamment dans des zones humides où des animaux sont chassés. Même s'il ne s'agit pas de l'usage principal du plomb, les munitions constituent une source de plomb pour les sols, par corrosion, relativement importante dans la mesure où la majeure partie du plomb est rejetée dans l'environnement et n'est pas récupérée et recyclée.
En Europe, la production de plomb pour les munitions est estimée entre 35 000 t et 45 000 t. en 2011 (ECHA 2013c). En France cela représente des émissions de plomb dans les sols de quelques tonnes par an.
Gaines de câbles
Les gaines de câble peuvent émettre du plomb lors de leur utilisation, par corrosion, ou en fin de vie. Les câbles sont parfois recyclés mais pas toujours, surtout s'ils sont difficiles à récupérer. Lorsqu'ils le sont, c'est davantage pour leur contenu en cuivre que pour leur teneur en plomb (Tukker, 2001).] Leur taux de recyclage est estimé à environ 50 % (Royal Haskoning, 2003).
Rejets liés aux déchets
Tukker et al. (2001) ont essayé d'estimer la quantité de plomb arrivant dans les décharges et les incinérateurs de l'Europe des 15, en 2000 et 2015 (projection) notamment, en fonction de l'usage initial du plomb. Ces projections pour 2015 sont probablement à revoir notamment pour les tubes cathodiques, dont la disparition s'est accélérée après 2000.
Tableau 19. Estimation des quantités de plomb arrivant dans les décharges et les incinérateurs dans l'Europe des 15 en 2000 et 2015 (en kilotonnes) (Source : Tukker et al, 2001).
Ces quantités de plomb sont sources d'émissions dans les eaux de lixiviation des décharges et dans les gaz de sortie et les résidus solides des incinérateurs. Tukker et al. (2001) estiment que ces déchets contenant du plomb étaient responsables dans l'Europe des 15, en 2000, de l'émission de 120 tonnes de plomb dans l'air et de 360 tonnes dans les sols.
Toutefois, d'après LDAI, on ne trouve pas de plomb (et plus généralement pas de métaux lourds) de matière significative dans les fuites des déchets domestiques mis en décharge (Royal Haskoning, 2003).
L'incinération de déchets contenant du plomb peut provoquer des émissions de ce métal. Les émissions atmosphériques des incinérateurs sont en principe traitées. Les cendres sont généralement soit ré-utilisées, soit mises en décharge. D'après Bouillot (2003), le plomb émis par l'incinération des déchets est principalement celui contenu dans les poussières.
Le recyclage du fer et de l'acier des véhicules conduit à des émissions de plomb de l'ordre de 0,4 g de plomb par véhicule dans l'air et de 0,002 g dans l'eau (Independent Consultants, 2000 ; in Royal Haskoning, 2003).
La concentration en plomb des eaux usées domestiques est généralement inférieure à 0,1 mg.L-1 et celle des eaux usées industrielles à 13 mg.L-1 (Wilderer et al., 1997 ; in Thornthon, 2001).
Émissions anthropiques totales
Le principal secteur source de rejets ponctuels de plomb dans l'environnement au sein de l'UE, dans l'air, l'eau et le sol est la production et transformation des métaux (voir Tableau 10).
Tableau 10. Rejets de plomb de l'UE dans l'environnement par secteur économique en 2007 et 2013 (Source : E-PRT 2013).
Sidérurgie, Industrie des métaux ferreux
La production d'acier est le secteur industriel qui rejette le plus de plomb, à la fois dans l'eau et dans l'air.
Dans les aciéries électriques, l'expérience montre que seulement 1 % du plomb émis est le fait de rejets canalisés. 99 % sont dus aux émissions diffuses, qui ne sont ni traitées, ni captées. La situation est similaire pour la métallurgie (Bouillot 2004).
Durant le processus d'agglomération, le plomb se transforme en PbO-PbCl2, PbCl2 et probablement aussi en PbCl4. Ces composés sont relativement volatils et entrent dans la phase gazeuse. Ils atteignent des concentrations élevées dans les gaz de sortie, avant traitement jusqu'à 70 mg Pb/Nm3 , avec 2 100 Nm3/t aggloméré, 150 g Pb/t aggloméré. L'efficacité des précipitateurs électrostatiques communs n'est pas très élevée pour les particules très fines. De ce fait d'importantes émissions de plomb se produisent, de l'ordre du gramme de plomb par tonne d'aggloméré (BREF iron and steel, 2001) (entre 0,04 et 7 grammes de plomb par tonne d'acier liquide, dans cinq installations européennes d'agglomération).
Dans les hauts fourneaux, tout élément contenu dans le minerai en plus du fer se retrouve dans le métal chaud, dans les déchets ou se volatilise et se dépose à différents endroits du haut fourneau. C'est tout spécialement le cas du zinc et du plomb, présents dans les minerais de fer ou dans les sous-produits recyclés. On retire le plomb et le zinc du haut fourneau en maintenant la température au centre de celui-ci à plus de 400°C (BREF iron and steel, 2001).
Des émissions de plomb ont lieu pendant la fabrication d'acier plombé, lorsque le plomb est ajouté à l'acier liquide. Les gaz de sortie sont en principe traités dans un filtre à manche pour limiter la teneur en poussières à moins de 5 mg/Nm3 . Mais un tel filtre n'est pas étanche aux gaz ce qui occasionne d'importantes émissions fugitives qui ne sont généralement ni collectées ni traitées (BREF iron and steel)
Dans certains types d'usines, on utilise des laveurs pour réduire les émissions atmosphériques, ce qui transfère la pollution de l'air vers l'eau. L'eau en provenance des scrubbers contient notamment du plomb. Ces eaux sont généralement recyclées et traitées avant d'être rejetées (BREF iron and steel, 2001).
Les autres procédés de l'industrie des métaux ferreux peuvent également émettre du plomb, tout spécialement lors du tréfilage, opération par laquelle le fil machine et le fil sont étirés dans des cônes percés de section inférieure. En effet d'après le BREF « iron and steel » (2001), parmi les principales incidences environnementales du tréfilage, on compte les émissions et les déchets plombés issus des bains au plomb. Ces bains sont utilisés dans le recuit continu et le patentage.
Le plomb peut être émis via les déchets (entre 1 et 15 kg/t dans le cas du recuit continu et entre 1 et 10 kg/t pour le patentage), dans l'air (entre moins de 0,02 et 1 mg/Nm³ pour le patentage) et dans l'eau (entre 2 et 20 mg.L-1 dans le débordement d'eau de trempe) (BREF iron and steel, 2001).
Les métaux utilisables pour le revêtement par trempage à chaud (opération pendant laquelle la tôle ou le fil sont passés en continu dans un métal fondu ; cela donne lieu à une réaction d'alliage entre les deux métaux, assurant ainsi une bonne liaison entre le revêtement et le substrat) sont ceux qui ont un point de fusion suffisamment bas pour éviter tout changement thermique dans le produit métallique, notamment le plomb ([BREF iron and steel, 2001). Cependant le zinc constitue la grande majorité des revêtements appliqués au trempage à chaud en continu et les revêtements d'aluminium ou plomb-étain ne représentent que des parts minimes.
Verreries
D'après le BREF verreries (2012), les émissions atmosphériques de plomb de l'industrie du verre peuvent avoir les sources suivantes :
- impuretés contenues dans certaines matières premières, calcin de verre recyclé et combustibles ;
- plomb utilisé dans les fondants et les agents colorants dans l'industrie des frittes ;
- plomb utilisé dans certains verres spéciaux.
Quant aux émissions aqueuses de plomb, elles proviennent essentiellement de certains processus de production de verres spéciaux ou de frittes.
D'après le BREF verrerie (2012), les producteurs de verres rejettent du plomb à des concentrations comprises entre 0,05 et 0,3 mg.L-1 dans des eaux usées.
D'après le BREF verrerie, les émissions des fours verriers dépendent fortement de qualité et de la quantité de verre recyclé utilisé. Le plomb des émissions des verreries est celui qui se trouve dans le verre. Cette présence est essentiellement due au recyclage : on réintègre dans la matière première des éléments étrangers au verre, notamment des capsules de bouteilles (faites en plomb jusqu'au années 1980) ; on réintroduit également les verres riches en plomb (cristal, verres dits électroniques comme le verre des écrans). Actuellement le verre d'emballage, notamment le verre creux, contient un ordre de grandeur de 200 ppm de plomb (Bouillot, 2003).
Les émissions de plomb dépendent également du combustible utilisé (fioul ou autre) et de l'ajout ou non de plomb dans le produit. La réduction des émissions de métaux lourds est souvent une des raisons principales pour installer des équipements de dépoussiérage des fumées (BREF verrerie). Les émissions atmosphériques de plomb lors de la production de cristal peuvent s'élever à 700 mg/Nm3 (BREF verrerie)]. Elles peuvent s'élever à 4 mg/Nm3 lors de la production de verre d'emballage et à 1 mg/Nm3 lors de la production de verre plat.
Émissions atmosphériques
Principales sources de rejet dans l'air
Les émissions atmosphériques de plomb ont énormément baissé, de plus d'un facteur 30 sur la période 1990-2013 (CITEPA 2015); essentiellement grâce à la suppression du plomb dans l'essence. Toutefois le transport routier reste l'un des principaux contributeurs aux émissions du plomb, avec l'industrie. Les émissions du secteur des transports hors routier proviennent essentiellement du carburant utilisé par l'aviation. Les émissions du secteur résidentiel/tertiaire sont imputables, en majorité, à la consommation de bois.
Tableau 11. Émissions atmosphériques de plomb en France métropolitaine (en tonnes) (Source : CITEPA 2015).
(e) Estimation préliminaire ; (*) Relativement aux périmètres de la CEE -NU / NEC -les émissions répertoriées hors total national sont les suivantes : les émissions maritimes internationales, les émissions de la phase croisière (≥ 1000 m) des trafics aériens domestique et international, ainsi que les émissions des sources biotiques de l'agriculture et des forêts et les émissions des sources non-anthropiques.
Rejets industriels atmosphériques
Analyse sectorielle
Les rejets industriels de plomb dans l'atmosphère ont des origines similaires aux rejets aqueux. Ils proviennent essentiellement de l'industrie du métal, plus particulièrement de l'industrie de l'acier. Ensuite viennent les verreries, qui rejettent une partie du plomb contenu dans leurs matières premières. L'industrie du raffinage, qui rejette certaines impuretés des combustibles fossiles traités, et l'incinération des déchets sont également des sources non négligeables.
Les rejets industriels de plomb dans l'air en France en 2001 étaient estimés à 140 394 kg.an-1 (EPER) et en 2013 ils atteignaient 29 674 kg.an-1 (BDREP). La forte baisse observée dans le secteur industriel, est liée, d'une part, à la fermeture des sites de production de métaux non ferreux, d'autre part, à la mise en place de dépoussiéreurs sur de nombreuses installations industrielles. En effet, la forte baisse des émissions de ce secteur entre 2008 et 2009 est due à la mise en place en 2009 de nombreux équipements de réduction des particules sur des fours verriers, verre creux en particulier (CITEPA 2015).
Tableau 16. Rejets industriels de plomb dans l'air en France en 2013 en kg.an-1 (Source : BDREP).

Analyse par installations
Selon les bases de données EPER et E-PRT, les installations industrielles les plus émettrices appartiennent presque toutes à l'industrie métallurgique.
Tableau 17. Installations industrielles les plus émettrices de plomb dans l'air et leurs émissions atmosphériques de plomb en kg en 2001 (Source : EPER), en 2007 et 2013 (Source : E-PRT).
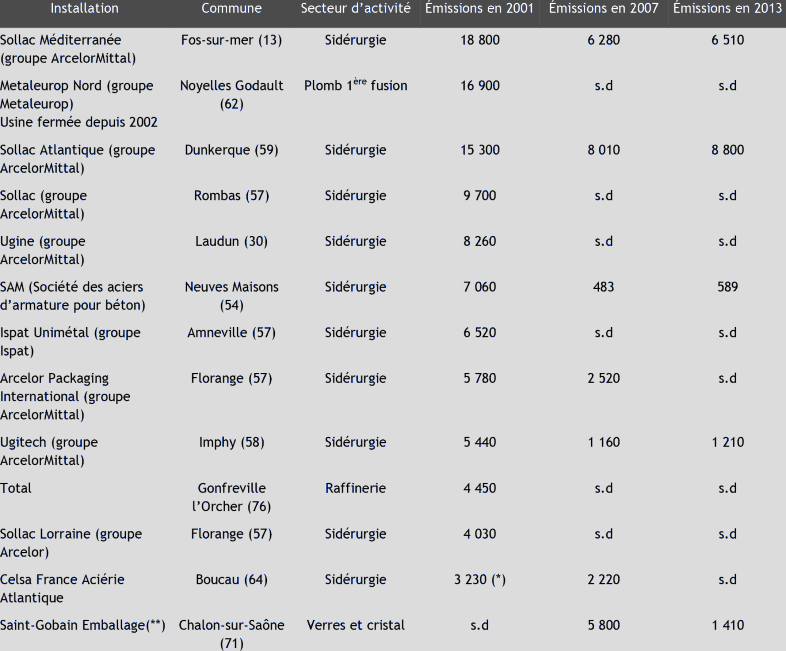
(*) Aciérie de l'Atlantique -groupe Arcelor ; (**) En 2015, Saint-Gobain a cédé l'usine de Chalon-sur-Saône au groupe Verallia ; s.d : sans données idéntifiée.
Émissions vers les eaux
Principales sources de rejet dans l'eau
Le plomb est une substance de l'état chimique des eaux de surface et un polluant spécifique de l'état écologique des eaux de surface à surveiller dans les six bassins versants (Ministère de l'écologie du développement durable et de l'énergie, 2015).
Les principales sources de plomb dans l'eau sont les suivantes :
- les retombées atmosphériques (les émissions atmosphériques proviennent en particulier de l'industrie, notamment du secteur des métaux) ; Ces retombées, ajoutées aux autres sources diffuses (engrais notamment), expliquent que les rejets dans l'eau sont majoritairement le fait des eaux de ruissellement sur les zones urbaines et sur les sols agricoles (AESN, 2008) ;
- les rejets aqueux de l'industrie des métaux ;
- les eaux usées domestiques ;
- l'épandage des boues ;
- les autres rejets aqueux industriels.
En 2013, les émissions directes dans l'eau déclarées dans le registre français des émissions polluantes11 atteignent 20 096 Kg du plomb, sur 475 établissements déclarants. La moyenne des émissions déclarées est de 42 kg.an-1 avec une valeur maximale de 1373 kg.an-1 correspondant à un site industriel destiné à la production d'aluminium, qui représente environ 65% des émissions de 2013.
Annema et al. (1995 ; in Tukker et al., 2001) ont estimé qu'aux Pays-Bas, le plomb contenu dans les boues de station d'épuration en 1990 provenait de la corrosion du plomb des feuilles de plomb utilisées dans le bâtiment (58 %), des émissions industrielles (8 %), de la corrosion du plomb des canalisations d'eau (4 %), des excréments et de l'urine (4 %), de la déposition atmosphérique (essence, 4 % ; autres, 4 %) et d'autres sources non identifiées (17 %). Cette répartition a sans doute évolué depuis 1990 et varie probablement d'un pays à l'autre, mais nous n'avons pas identifié de données plus récentes lors de la mise à jour de cette fiche.
[11] Données BDREP (INERIS) -Registre Français des Emissions Polluantes.
Rejets industriels dans les eaux
Analyse sectorielle
Les rejets industriels de plomb12 dans les eaux proviennent essentiellement de l'industrie du métal, du traitement de surfaces métalliques et de la production de plomb (voir Figure 3). Ensuite viennent les stations d'épuration des eaux usées, qui rejettent une partie du plomb dans l'eau traitée (voir Tableau 13). Le projet AMPERES (Choubert et al. 2011) a estimé un taux abattement moyen pour les plomb d'environ 73% pour les STEP étudiés.
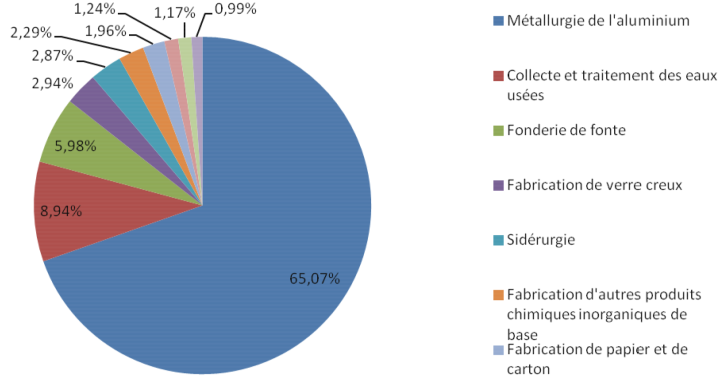
Figure 3. Principales activités émettrices de plomb dans l'eau (émissions directes) en 2013 (Source : BDREP-INERIS).
Tableau 13. Principaux rejets industriels de plomb dans l'eau en France en 2013 (kg.an-1) (Source : BDREP-INERIS).
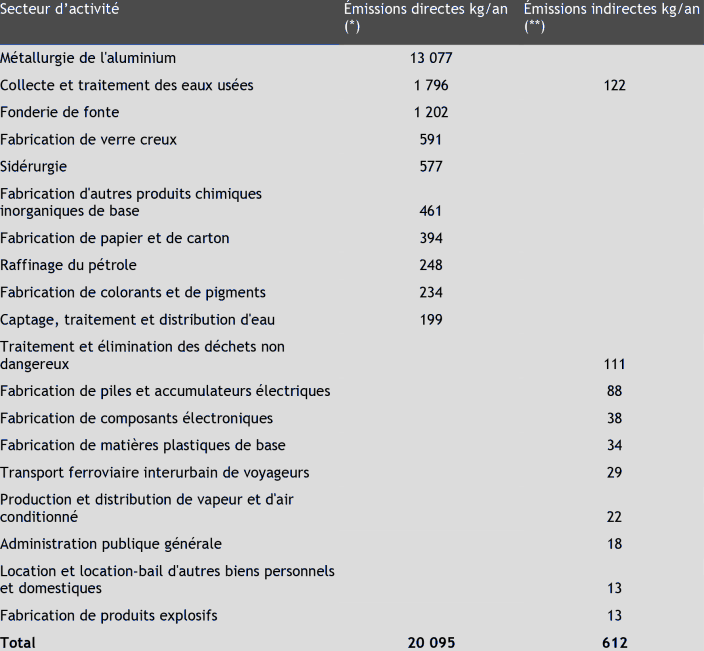
(*) Emission directe : le rejet est direct dans le milieu.
(**) Emission indirecte : le rejet est raccordé et fait l'objet d'un traitement par une station d'épuration.
[12] Données BDREP (INERIS) -Registre Français des Emissions Polluantes.
Analyse par installations
Selon la base de données EPER, les installations industrielles les plus émettrices de plomb dans l'eau en 2001 appartenaient à des secteurs relativement variés : métallurgie, fabrications et productions mettant en jeu du plomb (tubes cathodiques et batteries) mais également mine de potasse. Deux des principaux sites émetteurs on fermé depuis cette date. En 2013, l'usine d'aluminium du groupe Alteo continue à représenter le principal flux de plomb dans l'eau, suivie de l'activité de fonderie du groupe Saint Gobain et des stations d'épuration dans divers région françaises.
Tableau 14. Installations industrielles les plus émettrices de plomb dans l'eau (rejets directs et indirects) et leurs émissions de plomb dans l'eau (en kg.an-1) (Source : EPER données 2001, E-PRTR données 2007,2013).
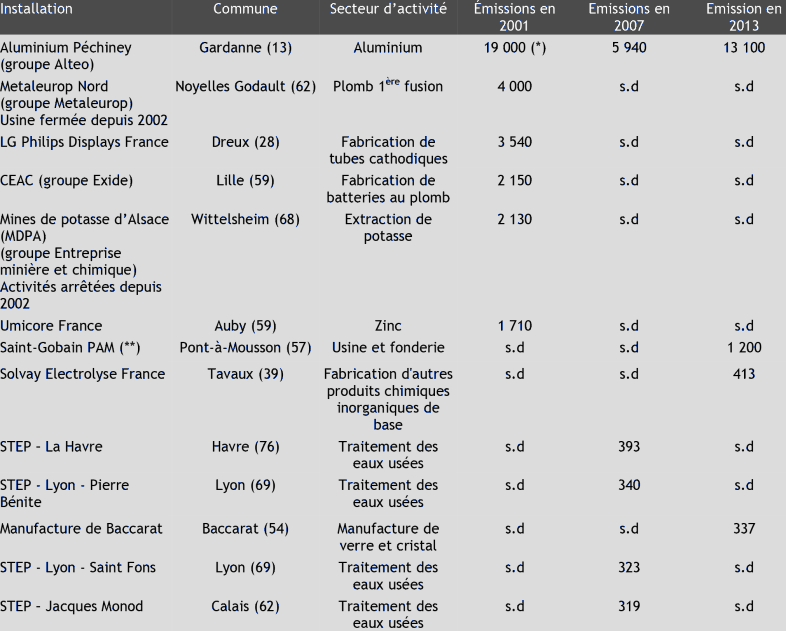
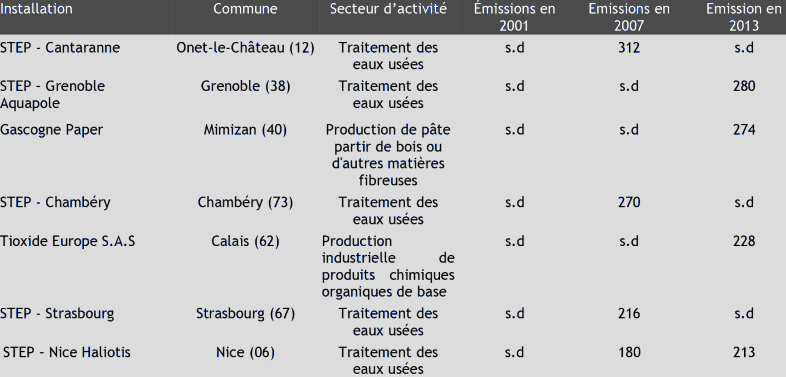
(*)Les rejets de l'usine de Gardanne sont particuliers car ils sont constitués de résidus inertes issus du traitement de la bauxite et déversés en mer dans la fosse Cassidaigne. Le devenir de ces rejets fait actuellement l'objet d'études quant au niveau de traitement nécessaire pour la protection de l'environnement et de la santé (plusieurs métaux autres que le plomb sont également rejetés).
(**) L'usine de Saint Gobain PAM à Pont-à-Mousson a souligné l'impact de la méthode de mesure pour le plomb dans l'eau. En 2013, Il a réalisé une comparaison sur 20 échantillons entre la méthode rapide nanocolor et la méthode normée pour analyser le plomb (ISO 11885-15587/1) ; il a observé que la méthode normée ne détectait pas de plomb dans l'eau contrairement à la méthode nanocolor. L'entreprise signale l'importance de la technique de détection.
s.d : sans donnée identifiée.
L'action de recherche et de réduction des rejets de substances dangereuses dans l'eau – RSDE (INERIS), effectuée entre 2009 et 2014, a identifié que 33% des établissements déclarants, c'est-à-dire 1 070 établissements sur un total de 3 251 sites, ont retrouvé le plomb au moins 3 fois à un flux supérieur à 5g.j-1our. Les secteurs ayant le plus rejeté de plomb sont : l'incinération des ordures ménagères, les blanchisseries, les installations de séchage de prunes, le regroupement et traitement de déchets, la sidérurgie, les « autres traitements de déchets non dangereux », les fonderies de métaux non ferreux, l'activité vinicole, la production et transformation de métaux non ferreux, l'industrie du plastique, de la chimie et les activités industrielles du verre.
Résultats régionaux
Le bassin versant Rhône Méditerranée-Corse contient les principaux flux de rejets de plomb en France (voirTableau 15). On observe une évolution contrastée des rejets, avec des hausses très fortes, ou des baisses sensibles, selon les bassins, qui est difficile à expliquer. On peut formuler l'hypothèse que certaines hausses soient liées à la mise en place de traitements humides de rejets atmosphériques (voir section suivante).
Tableau 15. Emissions de plomb dans l'eau en France par bassin versant (2007, 2013) (Source : E-PRTR).
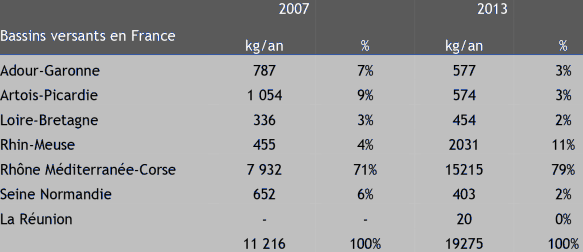
Émissions vers les sols
Principales sources de rejets dans le sol
La fabrication de papier et carton est la principale source des rejets du plomb (via les boues d'épuration), suivie par le traitement des eaux usées non-industrielles. La teneur en plomb dans les boues d'épuration d'après le projet AMPERES (Choubert et al. 2011) est en moyenne de 57 mg de plomb/kg de boue traitée.
Le plomb est davantage piégé par les constituants organiques et minéraux et s'accumule dans la partie superficielle du sol. Environ 1 000 t de plomb sont apportées annuellement en moyenne sur les sols agricoles en France (Bottin, Joassard, et Morard 2014).
Tableau 12. Emissions du plomb dans le sol en 2011, déclarées par les ICPE (Source : Registre National des Emissions Polluantes).

ICPE : Installations classées pour la protection de l'environnement. Les exploitants d'IPCE sont tenus de déclarer chaque année les quantités de polluants rejetés dans les milieux.
Avant de présenter une analyse des rejets par milieux (eau, atmosphère et sols), nous présentons des informations générales pour certains secteurs industriels.
Rejets industriels sur les sols
Analyse sectorielle
La base de données BDREP confirme le poids de la fabrication de papier et carton dans les rejets du plomb dans le sol (via l'épandage des boues d'épuration).
Tableau 18. Rejets industriels de plomb dans le sol en 2013 en kg.an-1 (Source : BDREP-INERIS).
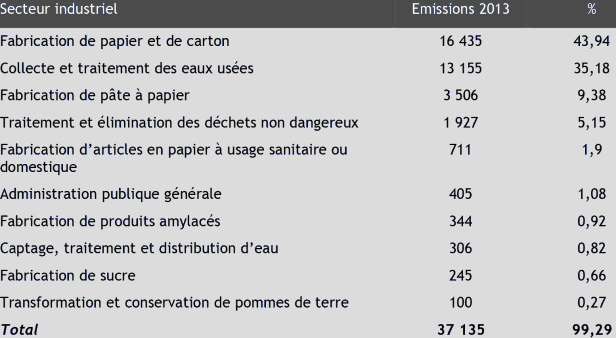
Analyse par installation
Selon la base de données BDREP, on constate une augmentation globale des rejets dans le sol : 22 505 kg.an-1 en 2011, 32 482 kg.an-1 en 2012, et 37 399 kg.an-1 en 2013. Ces rejets sont centralisés dans les régions Haute-Normandie, Ile-de France et Nord-Pas-de-Calais.
Présence environnementale
Aquatique
D’après le Réseau national des données sur l’eau (1999), suite à trois années (1995-1997) d’observations des micropolluants dans les cours d’eau français, une soixantaine de stations avaient été déclassées à cause d’une présence excessive de plomb : deux dans le bassin Adour-Garonne, 35 dans le bassin Artois-Picardie, quatre dans le bassin Loire-Bretagne, sept dans le bassin Rhin-Meuse, trois dans le bassin Rhône-Méditerranée-Corse et quatorze dans le bassin Seine-Normandie. Ces pollutions des eaux au plomb étaient dues dans 24 cas aux rejets d’agglomérations et dans 21 cas à des rejets industriels (les autres pollutions sont d’origine indéfinie).
L’AESN (AESN, 2008) indique de les concentrations dans l’eau à l’exutoire du bassin de la Seine, sont orientées à la baisse sur la période 1990 – 2005, passant d’environ 10 à 2 µg/L entre ces deux dates. Dans les sédiments des cours d’eau et du littoral du bassin Seine-Normandie, les teneurs en plomb moyennes sur la période 2004 – 2006 varient entre <20 et > 600 mg/kg de poids sec, alors que le fond géochimique moyen est de 20 mg/kg p.s.. Les teneurs dans les sédiments sont comprises entre 20 et 100 mg/kg p.s. pour la majorité des points du réseau de suivi, la contamination est plus forte en général à l’aval qu’à l’amont des cours d’eau, et plus élevée dans les sédiments du littoral que dans ceux des cours d’eau.
Si le plomb reste un des micropolluants des eaux de surface les plus fréquemment détectés, il n’est pas dans les polluants les plus quantifiés14. Il ne semble plus responsable de dépassements des normes de qualité de l’eau en France15 (donnée pour 2011). Par comparaison avec les données de la période (1995-1997), la situation serait donc en nette amélioration.
Dans le cadre du Plan national d’action contre les micropolluants engagé sur la période 2010-2013, c’est dans les sédiments marins que les produits de dégradation du plomb (trace de l’usage aujourd’hui interdit du plomb dans l’essence) sont retrouvés dans les 12 sites prélevés.
Toujours pour le milieu marin littoral, la concentration de plomb dans le biote suit une tendance de long terme décroissante, comme l’indique la Figure 4.
Figure 4. Evolution de la concentration du plomb et du cadmium dans les coquillages (Source : extrait de Bottin et al., 2014).
[14] http://www.statistiques.developpement-durable.gouv.fr/Lessentiel/ar/1981/0/micropolluants-plus-rencontres-cours-deau.html
[15] http://www.statistiques.developpement-durable.gouv.fr/Lessentiel/ar/1981/0/respect-normes-micropolluants-cours-deau.html
Perspectives de réduction
Réduction des rejets
Réduction des émissions industrielles
La réduction des émissions de métaux lourds, et notamment de plomb, dans les émissions industrielles vers l'eau ou l'air est une question abondamment étudiée, notamment dans les documents BREF sur les Meilleures Techniques Disponibles. Ainsi, les BREF suivants donnent des valeurs d'émission associées aux meilleures techniques disponibles pour le plomb :
- BREF grandes installations de combustion (eau, < 0,1 mg.L-1) ;
- BREF verreries (eau, < 0,5 mg.L-1) ;
- BREF métaux ferreux ;
- BREF sidérurgie.
On peut donner ici quelques mesures générales visant à réduire la quantité de métaux dans les effluents :
- traitement des gaz de sortie pour retirer les poussières et les gaz acides ;
- collecte et traitement des effluents liquides pour retirer les métaux dissous ou en suspension (Thornton et al., 2001).
Industrie des métaux
Sidérurgie
Les principales émissions dues à l'industrie de l'acier proviennent des installations d'agglomération. Les taux d'efficacité des électrofiltres habituels ne sont pas très élevés pour les particules très fines. De ce fait des émissions importantes de plomb (de l'ordre du gramme de plomb par tonne d'aggloméré) se produisent. Les concentrations de plomb dans l'air ambiant autour des installations d'agglomération restent importantes même si elles sont réduites grâce à l'ajout d'équipements d'épuration humide des gaz à haute efficacité après les électrofiltres communs (UA-OÖ, 1998 ; in BREF Métaux ferreux).
Dans le cas des installations d'agglomération, le BREF sur les métaux ferreux cite notamment comme MTD les techniques ou combinaisons de techniques suivantes :
- Dépoussiérage des effluents gazeux par :
- précipitation électrostatique avancée (ESP) (ESP à électrode mobile, système d'épuration à impulsions, précipitation électrostatique à haute tension) ;
- ou précipitation électrostatique, plus filtre en tissu ;
- ou pré-dépoussiérage (ESP ou cyclones par exemple) associé à une épuration par voie humide à haute pression.
L'emploi de ces techniques permet d'abaisser l'empoussièrement des rejets en dessous de 50 mg/Nm3 dans les conditions normales de fonctionnement. En cas d'utilisation d'un filtre en tissu, ces rejets sont de 10 à 20 mg/Nm3 .
- Recirculation des gaz résiduaires, lorsqu'elle n'affecte significativement ni la qualité ni la productivité de l'aggloméré, par :
- recirculation d'une partie des gaz résiduaires à partir de toute la surface de la bande d'agglomération ;
- ou recirculation des gaz résiduaires par section.
Plus spécialement pour minimiser les rejets de métaux lourds, le BREF propose les MTD suivantes :
- emploi de systèmes d'épuration fine par voie humide en vue d'éliminer les chlorures de métaux lourds solubles dans l'eau (principalement de plomb), avec une efficacité supérieure à 90 %, ou d'un filtre à manche avec addition de chaux ;
- mise en décharge contrôlée (enrobage hermétique, collecte et traitement des lixiviats) des poussières provenant du dernier étage du séparateur électrostatique au lieu de les recycler vers la bande d'agglomération, éventuellement après extraction de l'eau suivie d'une précipitation des métaux lourds, afin de réduire autant que possible les quantités à mettre en décharge.
Enfin, pour minimiser les quantités de déchets solides, le BREF considère les techniques suivantes comme MTD par ordre de priorité décroissant :
- minimisation de la production de déchets ;
- recyclage sélectif vers le procédé d'agglomération ;
- en cas d'obstacle à toute réutilisation interne, on visera à une réutilisation extérieure ;
- si aucune réutilisation n'est possible, la seule option est la mise en décharge contrôlée associée au principe de minimalisation.
Les effluents aqueux peuvent contenir du plomb en cas d'utilisation d'eau de rinçage ou d'un système de traitement des gaz résiduaires par voie humide. Dans ces cas, l'effluent liquide doit être traité par précipitation des métaux lourds, neutralisation et filtration sur sable. On peut ainsi atteindre des concentrations en métaux lourds (Cd, Cr, Cu, Hg, Ni, Pb, Zn) inférieures à 0,1 mg.L-1.
Finalement, il faut relever que le document BREF exploité dans cette section n'a pas été révisé depuis 2001, et que les technologies et leurs performances ont vraisemblablement bénéficié d'améliorations depuis cette date.
Métaux non ferreux
D'après le BREF sur l'industrie des métaux non ferreux et notamment de production de plomb ou le recyclage du plomb issu de batteries, l'usage de différentes technologies permet d'atteindre des rejets de poussière inférieurs à 518 mg/Nm3 .
Tableau 29. Techniques de traitement des poussières et métaux en fonction de la phase du procédé (Source : BREF métaux non ferreux).
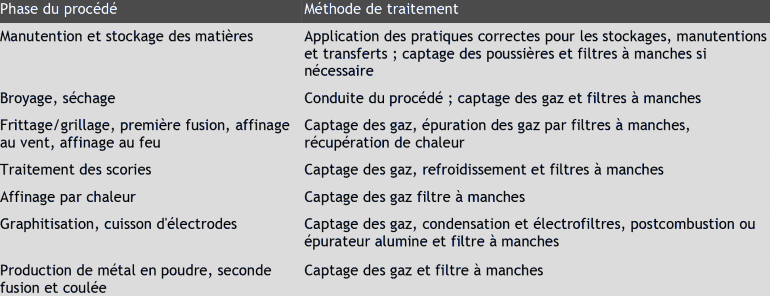
D'après le BREF, l'emploi de MTD doit permettre de rejeter dans les eaux moins de 0,05 mg de plomb par litre (page xvi). Les systèmes de traitement des eaux usées maximiseront l'élimination des métaux s'ils utilisent la sédimentation et au besoin la filtration.
[18] 4 mg/Nm3 pour les poussières, et 1 mg/Nm3 pour le Pb, dans le cas de certaines émissions
Métaux ferreux
D'après le BREF Métaux ferreux, les principales bonnes pratiques pour les bains au plomb sont les suivantes :
- maintenir une couche protectrice ou couverture sur le bain au plomb pour minimiser les pertes de plomb par oxydation et réduire drastiquement les pertes énergétiques du bain de plomb ;
- éviter la formation de poussière lorsque l'on retire les impuretés du bain au plomb ;
- garder les conteneurs contenant des déchets contaminés au plomb dans un endroit séparé et protéger cet endroit de la pluie et du vent ;
- minimiser les pertes par entraînement du plomb avec le fil.
Ces bonnes pratiques permettent d'utiliser au bain de plomb tout en émettant moins de 5 mg de plomb/Nm3 .
Ce BREF liste également des MTD pour d'autres procédés spécifiques :
- pour le recuit en continu des fils à bas carbone et le patentage, diverses MTD permettent d'émettre moins de 5 mg de plomb/Nm³ (p14) :
- mesures de bon entretien concernant les bains au plomb (voir plus haut) ;
- stocker séparément les déchets contenant du plomb et les protéger de la pluie et du vent ;
- recycler les déchets contenant du plomb vers l'industrie des métaux non ferreux ;
- faire fonctionner les bains de trempe en circuit fermé ;
- pour le revêtement par trempage à chaud en continu les MTD (traitement des eaux résiduaires avec une combinaison d'opérations de sédimentation, de filtration et/ou de flottation / précipitation / floculation) permettent d'émettre moins de 0,5 milligramme de plomb par litre.
- pour le revêtement de fil, les MTD (traitement des effluents aqueux par un traitement physico-chimique (neutralisation, floculation, etc.) permettent également d'émettre moins de 0,5 mg de plomb/L.
Verre
Amélioration du recyclage
Les émissions de plomb des verreries proviennent essentiellement du plomb contenu dans la matière première. Celui-ci est dû à la présence de plomb dans certains types de verre (cristal ou verre TV notamment). Il est donc important d'améliorer la collecte sélective du verre pour éviter la réintroduction de verres à forte teneur en plomb dans la matière première.
Des techniques d'extraction du plomb (et d'autres métaux ferreux ou non ferreux) existent, par exemple en utilisant des machines à courants de Foucault. Le tri du verre collecté se fait en plusieurs étapes. Plusieurs procédés permettent de retirer du verre les bouchons, les papiers et matières organiques et tout ce qui est métallique. Les phénomènes physiques liés à la séparation des métaux non ferreux permettent de maintenir séparées les fractions
d'aluminium et celles de plomb ; ils garantissent une récupération spécifique de chaque famille de métaux.
L'entreprise Solover, par exemple, pratique le « démélange » du verre, c'est-à-dire le tri par couleur du verre mélangé pour en extraire le verre blanc. Cela lui permet d'avoir dans ses verres des teneurs en plomb de 2 ppm, alors que le seuil admis est de 30 ppm. L'investissement nécessité par cette installation (hors ligne) s'élève à 7,62 M€. C'est la société autrichienne Binder qui a fourni l'essentiel de l'équipement : machines de tri optoélectronique, système de dépistage et d'élimination. Leur installation est à même de traiter 180 000 tonnes annuelles de calcin, et un projet d'extension de l'usine est en cours19 .
Les centres de traitement Ipaq utilisent également des séparateurs à courant de Foucault pour isoler les objets métalliques ferreux ou non ferreux qui polluent le verre de collecte et soulèvent des problèmes considérables au moment de la fusion du calcin chez le verrier20 .
[19] http://www.solover.fr/index.php/fr/entreprise/actualite
[20] Interview de Bernard Favory, Directeur général des centres de traitement Ipaq, sur www.dechetcom.com (03/11/2000).
MTD pour réduire les émissions aqueuses
Le BREF verreries identifie un certain nombre de techniques pour réduire la présence de plomb dans les effluents aqueux :
- traitements physico-chimiques (tamisage, écumage, décantation, centrifugation, filtration) ;
- traitement biologique (boues activées, biofiltration, neutralisation, aération, précipitation, coagulation et floculation) (p13).
Ainsi, lorsque le verre (verre domestique) est trempé dans une solution d'acide, il a une couche de sulfate de plomb à sa surface. Elle est retirée avec de l'eau chaude mais celle-ci devient acide et contient du sulfate de plomb soluble. Cet effluent peut être traité avec une combinaison de techniques chimiques et physiques : on fait réagir le sulfate de plomb pour faire précipiter le plomb (par exemple avec du carbonate de calcium pour obtenir du carbonate de plomb). Ces précipités de plomb peuvent être retirés, généralement par coagulation et floculation, puis par une séparation physique. (p244)
Ces techniques permettent d'atteindre une concentration en plomb inférieure à 0,3 mg.L-1, en sensiblement inférieures si la production ne concerne pas le cristal.
MTD pour réduire les émissions atmosphériques des fours
Dans ce secteur on considère généralement que la MTD pour réduire les émissions de poussières des fours est un système d'électrofiltre ou de filtre à manches, conjugué au besoin à un système d'épuration des gaz acides par voie sèche ou semi-sèche. Les valeurs situées dans le bas de la fourchette seront en général obtenues par l'emploi de filtres à manches. »
En ce qui concerne plus spécialement les émissions de plomb pour la production de cristal, les MTD citées auparavant permettent d'atteindre des concentrations en plomb de l'effluent atmosphériques comprises entre 0,5 et 1 mg/Nm3 ., correspondant généralement à un flux compris entre 0,001 et 0,003 kg de Pb/t de verre fondu
En France, la mise en place de filtres d'ici fin 2008 pour le verre d'emballage, conformément à l'arrêté du 12 mars 2003, a permis de réduire les émissions atmosphériques à moins de 1 mg/Nm3 (Fédération des chambres syndicales de l'industrie du verre).
Autres
Incinération des déchets
D'après Bouillot (2004), la voie d'amélioration passe par la réduction des émissions de poussière, puisque le plomb émis par les incinérateurs se trouve essentiellement dans les poussières.
Le BREF incinération des déchets propose des meilleures techniques disponibles qui permettent de diminuer les émissions de plomb ou de favoriser sa concentration dans les résidus d'incinération, en vue du recyclage.
La société japonaise, Sumitomo Metal Mining propose un procédé de recyclage de ces cendres. Le traitement consiste à chauffer les cendres a une température moyenne de 1000 degrés Celsius dans un four à calciner. En conséquence, les métaux lourds contenus sont volatilisés et les dioxines éliminées. De plus, après le refroidissement, il est désormais possible de récupérer du chlorure de plomb21 .
[21] « Technologie: Traitement des cendres volantes » (14/01/2003) sur www.dechetcom.
Ciment et chaux
Des MTD pour réduire les émissions de plomb des fours sont notamment :
- baisser la température des gaz de sortie ;
- adsorption sur charbon activé.
Grandes Installations de Combustion
Une méthode efficace pour réduire les émissions de certains métaux est la mise en place de systèmes désulfuration des gaz de sortie avec des laveurs humides ('wet scrubber FGD'). Mais la chaux utilisée peut être une source importante de certains métaux (notamment de plomb). Des systèmes ont été conçus spécifiquement pour réduire certains métaux des effluents gazeux (plomb notamment), initialement pour les incinérateurs de déchets : charbon actif ou systèmes de filtration à coke.
Utilisation et collecte des batteries usagées
La mise en place de bonnes pratiques (entretien régulier, contrôle régulier du niveau d'eau de la batterie) permet de limiter fortement les émissions de plomb lors de la production et de l'utilisation des batteries.
L'amélioration du taux de collecte et de recyclage est également un moyen de réduction des émissions.
La collecte est stable depuis plusieurs années en France, selon les statistiques du registre de l'ADEME (Figure 6). Un des paramètres exogènes d'évolution de la collecte est le prix du plomb, relativement stable sur cette période (cf. Prix du plomb).
Figure 6. Evolution de la collecte des batteries automobiles en France (Source : Ademe, 2014).
Régénération de batteries
Les procédés de « désulfatation », également qualifié de « régénération » par les professionnels du secteur, visent à prolonger la durée d'usage des accumulateurs au plomb de démarrage, de traction ou stationnaire (ADEME 2015). L'ADEME a réalisé en 2011 un état de l'art des technologies de désulfatation des accumulateurs au plomb afin de recenser les procédés existants et les acteurs concernés (ADEME 2011).
En 2015, l'ADEME a répertorié une dizaine de sociétés proposant des prestations de service de désulfatation ou de la vente de matériel de désulfatation. Les efforts en R&D de certains acteurs ont réussi à réduire la durée du procédé de régénération (passant de 10 jours à 2-3 jours) et ainsi assurer une mise à disposition plus rapide pour les utilisateurs. La désulfatation est financièrement intéressante pour les utilisateurs ; elle est facturée entre 30 % et 60 % du prix d'une batterie neuve (ADEME 2015).
Alternatives aux usages
Produits et Technologies de substitution
FTE 2015 Importer
Matériel métallique
Les alternatives au plomb sont d'autres matériaux métalliques comme le fer, l'acier, le zinc et le bismuth, mais également des matériaux non métalliques comme le béton (ECHA 2013b).
Batteries au plomb
D'après un acteur industriel important du domaine, dans les automobiles conventionnelles (moteur à combustion), les batteries restent en quasi-totalité au plomb. La technologie alternative Li-ion n'est pas encore compétitive d'un point de vue économique, car son coût
est plus élevé en raison d'une plus grande sophistication (besoin d'un pilotage électronique embarqué).
Dans le cas des véhicules hybrides ou électriques, les batteries Li-ion sont la solution native. Au fur et à mesure de la croissance de ce marché au détriment des véhicules conventionnels, on peut espérer une réduction des coûts des batteries Li-ion et leur percée croissante pour les véhicules conventionnels.
Pour les applications industrielles, même si le plomb domine en poids (voir Figure 5), les batteries alternatives (Li-ion, Ni-Cd) dominent le marché, notamment dans les domaines qui suivent : batteries de secours (trains à grande vitesse (Ni-Cd), signalisation ferroviaire, avions, les réseaux télécom, stockage des énergies intermittentes dans les réseaux (Li-ion), chariots élévateurs (Li-ion) (Toyota), véhicules industriels et militaires (Li-ion).
Figure 5. Evolution des différentes technologies pour les batteries industrielles.
D'autres technologies que Li-ion et Ni-Cd sont utilisées dans des applications de niche : Nickel-Métal Hydrure, Ag – Zn,…
Le groupe ECOBAT Technologies (ECOBAT s. d.) a estimé un potentiel de remplacement du plomb par le lithium dans les batteries dans divers secteurs industriels pour les années avenir, ces projections sont présentées dans le Tableau 20. Ces projections dénotent une accélération de la substitution. Par ailleurs, il ne semble pas que d'autres technologies puissent apporter une rupture dans les cinq prochaines années.
Tableau 20. Pourcentage estimé de substitution du plomb par du lithium dans les batteries en 2020 et 2025 (Source : Summerfield 2015).
Remplacement dans les alliages
La plupart des alliages de cuivre contiennent du plomb, soit comme un élément fonctionnel soit comme une impureté. Chaque alliage a une composition définie et des caractéristiques uniques. La disponibilité des alternatives dépendent du fait si le plomb est présent comme impureté ou comme un élément fonctionnel dans l'alliage. Dans le premier cas, la substitution est a priori simple lorsque la source de plomb est identifiée. Dans le second cas, la substitution peut être plus problématique, étant donné que le substitut doit avoir certaines fonctions.
Des alternatives existent pour l''eau potable : ces alternatives comprennent des laitons contenant du silicium (remplaçant jusqu'à 0,1% de plomb) ou de bismuth (remplaçant jusqu'à 0,25% de plomb).
Les matériaux qui peuvent être utilisés pour remplacer le laiton au plomb comprennent le bronze, l'acier et d'autres alliages sans plomb.
Enfin, il n'existe pas d'alternatives pour le maillechort (Les maillechorts sont des alliages Cu-Ni-Zn, utilisés en orfèvrerie, connectique, lunetterie, pour des instruments de musique,…) (ECHA 2013b).
En ce qui concerne les alliages utilisés pour les soudures des circuits imprimés, divers substituts ont été développés et introduits sur le marché : alliages d'étain avec de l'argent, du cuivre et/ou du bismuth. Ils occasionnent toutefois un surcoût, notamment dû à des modifications du procédé de soudure. La directive 2002/95/CE relative à la limitation de l'utilisation de certaines substances dangereuses dans les équipements électriques et électroniques signale l'adoption de ces produits de substitution (Lohse et al., 2003).
Le Tableau 21 décrit les alternatives au plomb comme additif dans certains alliages. Un seul métal alternatif ne peut pas satisfaire à toutes les fonctions possibles du plomb.
Tableau 21. Alternatives au plomb comme additifs dans certains alliages (Source : ECHA 2013b).
Pigments
Les pigments à base de plomb sont disponibles dans les couleurs : blanc, rouge et jaune. Plusieurs alternatives sont accessibles sur le marché. Il y a des centaines de différents pigments disponibles dans chaque segment de couleur. Parmi les alternatives disponibles signalées, il y a des pigments contenant du cadmium et du chrome. En raison des risques pour la santé et l'environnement associés à ces substances, ils ne sont pas considérés comme des substituts appropriés à utiliser.
Le Tableau 22 et le Tableau 23 recensent certains pigments sans plomb (ECHA 2013b) .
Tableau 22. Pigments sans plomb (Source : ECHA 2013b).

Les pigments blancs les plus utilisés sont le carbonate de calcium, le dioxyde de titane et oxyde de zinc. L'oxyde de titane est inclus dans le plan d'action continu communautaire (CoRAP) dans le cadre de REACH et évalué en raison de ses propriétés comme allergène respiratoire soupçonné, CMR et vPvB soupçonné. A propos de l'oxyde de zinc, les Pays-Bas ont réalisé une évaluation de risque dans le cadre du règlement (EEC) No. 793/9316 .
Grâce à une consultation publique des informations supplémentaires (ECHA 2013b) sur la composition des pigments sans plomb ont été obtenues.
Tableau 23. Alternatives aux pigments au plomb (Source : (ECHA 2013b).
[16] Le rapport d'évaluation des risques est notifiée sur le site web de l'ECHA (http://echa.europa.eu/information-on-chemicals/information-from-existing-substances-regulation//substance/2743/search/1314-13-2/term)
Stabilisants pour PVC et autres pigments
Les systèmes calcium/zinc et ceux de composés organiques d'étain, sont signalés comme les substituts les plus communs des stabilisateurs au plomb. En raison du risque élevé pour la santé et l'environnement pour les composés d'étain organique, les systèmes de calcium/zinc sont préférés, mais il n'est pas improbable que les composés d'étain organique puissent apparaître comme un substitut au plomb dans les articles importés dans l'UE(ECHA 2013b).
Le remplacement du plomb dans le PVC a donc donné lieu à une croissance rapide du calcium/zinc (Ca/Zn) et des systèmes stabilisants au calcium-organique. Par exemple,l'acétylacétonate de calcium et l'acétylacétonate de zinc sont utilisés comme ingrédients pour des systèmes stabilisants(AkzoNobel s. d.).
Le Tableau 24 et Tableau 25 présentent la production et les ventes des stabilisants publiés par le programme VinylPlus17 .
Tableau 24. Production des stabilisants en EU-27 (Source : Vinyl, 2010 dans ECHA 2013b).

Tableau 25. Ventes de stabilisants en EU-15, Norvège, Suisse et Turquie (Source : Vinyl, 2010 dans ECHA 2013b).

Dans la période 2007-2014, l'utilisation de stabilisants à base de plomb a diminué de 86 228 tonnes (-86%) dans l'UE-28, tandis que l'utilisation de stabilisants à base de calcium, qui sont utilisés comme une alternative, a augmenté de 29 472 tonnes (VinylPlus 2015).
Le programme de VinylPlus comporte un engagement d'abandon total du plomb dans le PVC produit dans l'UE-28 dès la fin 2015.On ne dispose pas encore des chiffres pour 2015 permettant de vérifier cet engagement.
[17] Le programme VinylPlus est un engagement de l'industrie européenne du PVC pour le remplacement de plomb dans l'UE-27. http://www.vinylplus.eu/
Cristal
Des travaux de recherches sont poursuivis depuis des années pour savoir si le plomb entrant dans la composition du cristal pourrait être substitué par un autre composé. Hadeland Glassverk, par exemple, essaie depuis longtemps de supprimer le plomb de son cristal (OCDE, 2000). Pour l'instant, ces travaux ne donnent pas satisfaction dans l'obtention simultanée des caractéristiques recherchées de brillance, de réfraction et de densité. Ainsi, d'après le BREF verreries, l'oxyde de plomb peut être remplacé, en partie ou totalement, par des oxydes de baryum, de zinc ou de potassium. Cela donne ce que l'on appelle du cristallin. Celui-ci a cependant une densité et une brillance moindre que le cristal (BREF verreries, 2001). Les solutions les plus satisfaisantes utilisent des composés dont les gisements sont limités en volume par rapport au besoin (baryum, bismuth) et pour lesquels il n'existe pas à ce jour d'étude de toxicologie. Les solutions évoquées ne sont pas non plus acceptables au niveau économique car ces matières premières sont très chères (Fédération des chambres syndicales de l'industrie du verre).
Munitions
Les alternatives au plomb dans les munitions sont (ECHA 2013c):
- L'acier : la grenaille d'acier est l'alternative la plus largement disponible à la grenaille de plomb. Cependant, les propriétés balistiques du plomb et de l'acier diffèrent significativement.
- Les composites de tungstène : le tungstène (W) a été utilisé pour remplacer du plomb.
- Bismuth/alliage d'étain : le bismuth (Bi) est une autre alternative envisageable dans les munitions, mais il est nécessaire d'ajouter d'une petite quantité d'étain pour réduire sa fragilité. Sa performance est comparable à celle du plomb dans les munitions de fusil de chasse. Asarco Globe a breveté un procédé pour fabriquer des munitions (pour la chasse aux oiseaux aquatiques) où le plomb est remplacé par du bismuth/étain (OCDE, 2000).
Autres
Pour un grand nombre des usages du plomb il existe des produits de substitution, notamment pour certaines applications pour les matériaux de construction, certaines gaines de câble, le verre, les quilles de bateaux, etc. (Bjornstad, 1992 ; Royal Haskoning, 2003).
En revanche, Corden (2000) estimait que l'utilisation comme protection anti-radiations devrait également perdurer encore de nombreuses années.
Coûts de la substitution
Matériel métallique
Le plomb est un métal relativement bon marché, et son faible prix est le principal frein à la substitution. Le prix du marché pour le métal plomb est actuellement d'environ 1,5 EUR/kg (Metal Prices 2015). Les alternatives au plomb sont -à quelques exceptions près (ex. zinc et acier) -souvent plus coûteuses.
Tableau 26. Coûts de métaux de remplacement, prix FOB (Source : ECHA 2013b).

(*) www.metalprices.com ; (**) www.infomine.com. Taux d'échange 1 USD =0,775 EUR (9/12/2012).
Pigments
L'étude ECHA (2013) fait référence au travail du Conseil des ministres en Norvège sur les opportunités et les coûts de remplacement du plomb dans les pigments pour le plastique. Ils ont estimé un large intervalle de 0-33 euros par kg de plomb substitués. Le plomb contenu
dans les produits plastiques lié aux pigments varie de 1% à 23% en fonction du type d'injection sur les plastiques.
Les fabricants européens depuis plusieurs années substituent les pigments à base de plomb dans les matières plastiques destinées aux jouets, aux ustensiles de cuisine et aux contenants alimentaires.
Tableau 27. Référence de prix pour les pigments sans plomb (Source : ECHA 2013b).
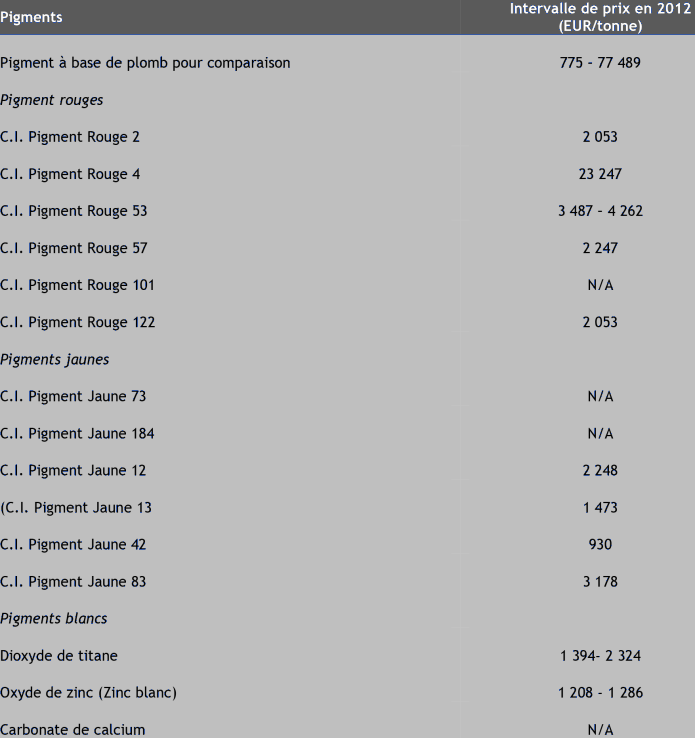
Stabilisants
Le Tableau 28 présente le coût des stabilisants alternatifs à ceux à base de plomb. Les estimations retenues dans une étude ECHA (2013) sont de 4 à 15 euros/kg pour le plomb substitué dans le PVC souple, et d'environ 46 euros/kg pour le PVC rigide. L'étude signale que ces valeurs sont probablement surestimées. Les références prises dans ECHA 2013b sont quelque peu différentes, mais permettent une comparaison avec les alternatives.
Tableau 28. Références de coûts de substances utilisées comme stabilisants alternatives au plomb dans le PVC (Source : ECHA 2013b).
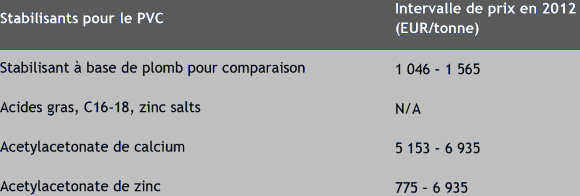
Granulés dans les cartouches
L'étude ECHA (ECHA 2013c) a examiné les coûts de substitution du plomb avec un certain nombre d'autres métaux dans les cartouches pour la chasse dans les zones humides selon l'accord de pays membres de l'UE et l'accord sur la conservation des oiseaux d'eau migrateurs d'Afrique-Eurasie (AEWA).
Conclusion
Depuis que les carburants automobiles ne contiennent plus de plomb, les principales sources de rejet de plomb dans l'environnement sont liées à l'industrie : industrie des métaux, batteries au plomb, verreries, traitement des déchets.
L'usage principal du plomb est les batteries automobiles. Les autres usages sont généralement fortement réglementés et en déclin (substitution). L'utilisation pour les batteries est au contraire en croissance et le plomb ne semble pas avoir de substituts viables à cour terme. Toutefois si ces batteries sont produites de façon propre et si elles sont recyclées intégralement, il semble possible d'avoir des rejets faibles pour cette activité. Il est donc nécessaire d'accroître au maximum les taux de recyclage des batteries plomb-acide.
Dans l'industrie du verre, les techniques de recyclage doivent être perfectionnées pour réduire la présence de plomb dans le calcin. Dans l'industrie des métaux, il est sans doute nécessaire d'être particulièrement attentifs aux rejets diffus.
Les émissions de plomb ont été très significativement réduites durant ces dernières années et devraient continuer à diminuer. Il semble cependant impossible d'obtenir des rejets proches de zéro. En premier lieu, les sources majoritaires sont des émissions diffuses (eaux de ruissellement). D'autre part la diversité des sources d'émission et la non substituabilité du plomb pour une de ses principales applications (batteries automobiles au plomb) rendent très difficile de fortes réduction des rejets à court terme. Les réductions sont peut-être plus à attendre du remplacement des véhicules à combustion interne par des véhicules électriques, qui font peu appel au plomb pour leurs batteries. Des mesures existent cependant pour s'approcher au maximum de cet objectif, notamment en ce qui concerne l'efficacité du recyclage de divers produits (verre, batteries au plomb) et la captation et le traitement des rejets de certains secteurs industriels (industrie des métaux).
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :