Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Oxyde de bis(tributyletain) (56-35-9)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
56-35-9
Nom scientifique (FR)
Oxyde de bis(tributyltétain)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-268-0
Code SANDRE
1773
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C24H54OSn2 }\)
Code InChlKey
Code SMILES
CCCC[Sn](CCCC)(CCCC)O[Sn](CCCC)(CCCC)CCCC
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
596.10 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Dans l’atmosphère, l’oxyde de tributylétain peut exister théoriquement en phase vapeur. Cependant, il est plus fréquemment présent sous forme particulaire (HSDB, 2002).
Milieu eau douce
FDTE/VTR Importer En milieu aqueux, l’oxyde de tributylétain existe soit sous forme de cation de tributylétain (HSDB, 2002) soit sous forme adsorbé sur les particules en suspension (Dobson et Cabricenc, 1990). L’adsorption et la désorption de l’oxyde de tributylétain dépend de la salinité du milieu, de la nature et de la taille des particules en suspension, de la quantité de ces particules, de la température et de la présence de matière organique dissoute.
Milieu sédiment eau douce
FDTE/VTR Importer Il peut réagir avec les sulfures présents dans les sédiments, pour former du sulfure de bis(tributylétain). La volatilisation de l’oxyde de tributylétain à partir d’une solution aqueuse reste négligeable (HSDB, 2002).
Milieu terrestre
FDTE/VTR Importer L’oxyde de tributylétain est fortement lié aux particules du sol (Dobson et Cabricenc, 1990), et il n’est pas susceptible d’être lessivé sur des périodes de plus de 16 semaines, qu’il s’agisse de sols argileux, silteux ou sableux (HSDB, 2002). L’oxyde de tributylétain ne s’hydrolyse pas dans le sol, et ne se volatilise pas à partir de la surface (HSDB, 2002).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
FDTE/VTR Importer L’éventuelle dégradation de l’oxyde de tributylétain implique une débutylation progressive de la susbtance. La dégradation est complète lorsqu’il ne reste plus que du dioxyde d’étain SnO2 (Dobson et Cabricenc, 1990).
La dégradation abiotique des composés de tributylétain dans l’eau est limitée à la photolyse directe ; la demi-vie du cation de tributylétain dans l’eau distillée est supérieure à 89 jours. En l’absence de lumière, dans l’eau distillée et déionisée conservée à l’obscurité à 20°C, à un pH compris entre 2,9 et 10,3, le cation de tributylétain reste stable plus de 63 jours (Dobson et Cabricenc, 1990 ; HSDB, 2002). Dans l’atmosphère, l’oxyde de tributylétain est sensible à la photooxydation et n’est pas stable : suivant les conditions, sa dégradation peut prendre entre quelques jours et quelques semaines (HSDB, 2002).
Milieu sédiment eau douce
FDTE/VTR Importer La biodégradation de l'oxyde de tributylétain survient en quelques jours à quelques mois selon les conditions du milieu (température, salinité) et selon la concentration à laquelle il est présent dans les divers compartiments de l'environnement.
Dans le compartiment sédimentaire d'eau douce, Maguire et Tkacz (1985) ont établi la demi-vie à 20 semaines dans le port de Toronto. Mais lorsque la concentration de l'oxyde de tributylétain augmente, la toxicité de l'étain sur les microorganismes semble ralentir la vitesse de biodégradation (Maguire et Tkacz, 1985).
La biodégradation de l'oxyde de tributylétain est généralement plus rapide dans les sédiments que dans l'eau, probablement en raison de la différence de densité en microorganismes responsables de sa biodégradation. Des phénomènes d'acclimatation des microorganismes à des concentrations élevées (> 2 mg.kg-1) d'oxyde de tributylétain ont été décrits (Argman et al., 1984).
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Les résultats d'expériences de bioconcentration et de bioaccumulation chez plusieurs organismes sont disponibles. Ainsi, les BCF suivants ont pu être relevés dans la littérature
La concentration d'oxyde de tributylétain s'accumulant dans les organes est d'autant plus élevée que le contenu lipidique des tissus qui les composent est également élevé.
Le GRNC (1999) s'est accordé pour utiliser les BCF suivants (GRNC, 1999):
• BCF poissons = 50 000
• BCF mollusques filtreurs (moules) = 50 000
• BCF mollusques non filtreurs (patelles) = 50 000
• BCF crustacés = 50 000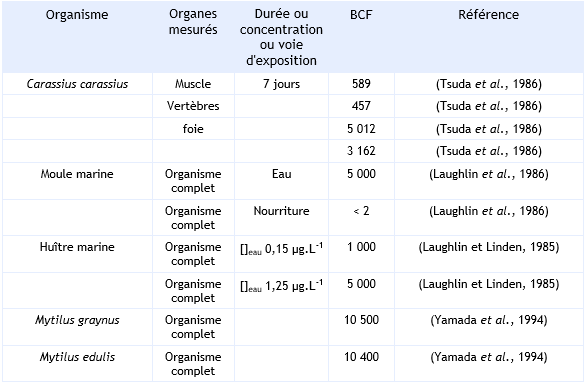
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Pas de données disponibles.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1992 ; HSDB, 2000 ; INRS, 1997 ; OMS IPCS, 1990 ; US EPA (IRIS), 1997). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Chez l’homme, il n’existe pas de données relatives à l’absorption, suite à une exposition par inhalation (ATSDR, 1992 ; INRS, 1997 ; OMS IPCS, 1990).
Distribution
FDTE/VTR Importer Par voie orale, le OTBT (tributyltin oxide) se distribue dans les reins, les poumons, le foie, le système lymphatique et les os. Après biotransformation (désalkylation), environ 5 % d’une dose de OTBT administrée par voie orale à des volontaires sains est éliminée par voie urinaire sous forme de dibutylétain. Les taux urinaires de dibutylétain diminuent rapidement dans les jours suivant l’administration. Par voie cutanée, l’application de 23,4 mg de OTBT sur l’avant-bras d’un volontaire sain se caractérise par une excrétion d’environ 0,2 % de la dose dans les urines sous forme de tributylétain (20 %)(Uhl, 1986). Le OTBT est un inhibiteur de la phosphorylation oxydative dans la mitochondrie et donc du transfert d’énergie (perturbation de la synthèse d’ATP)(INRS, 1997).
Chez l'animal
Absorption
FDTE/VTR Importer Chez le rat, l’absorption par voie orale de OTBT est de 20 à 55 % de la dose administrée en fonction du véhicule utilisé (Humpel et al., 1986).
Distribution
FDTE/VTR Importer Chez le rat et la souris, le OTBT se distribue essentiellement dans le foie, les reins et la rate mais aussi le tissu adipeux, les muscles, les poumons, le sang et le système nerveux central. Les barrières hémato-encéphalique et placentaire sont traversées par le OTBT et ses produits de biotransformation (INRS, 1997). Après une administration par voie orale de 16 mg.kg-1.j-1 de OTBT à des rats, les concentrations en étain les plus élevées (15 mg.kg-1 de tissu sec) sont observées dans le foie et les reins (Krajnc et al., 1984). L’administration réitérée (jusqu’à 30 jours) de OTBT radiomarqué à faibles doses dans l’eau de boisson à des souris, se traduit par une accumulation dans le foie, la rate, les reins et le tissu adipeux après une absorption intestinale. Une distribution secondaire dans le sang, les poumons, le système nerveux central et les muscles est également observée. Par voie cutanée, chez le singe, l’application pendant 7 heures de OTBT radiomarqué se caractérise par un passage de 10 à 15 % de la dose dans la circulation générale (Humpel et al., 1986).
Métabolisme
FDTE/VTR Importer Aucune donnée de métabolisme n’est disponible par inhalation de OTBT chez l’animal (ATSDR, 1992; OMS IPCS, 1997).
Élimination
FDTE/VTR Importer Quinze jours après l’arrêt de l’administration, l’élimination tissulaire du OTBT est de 97 % dans le foie, 73 % dans les reins et 30 % dans le tissu adipeux. Aucune trace de OTBT n’est retrouvée dans le sang. Cette élimination est principalement fécale avec des traces de CO2 radiomarqué dans l’air exhalé (Evans et al., 1979). Le OTBT est désalkylé au niveau de systèmes enzymatiques microsomiaux hépatiques et rénaux, avec production rapide mais progressive d’espèces débutylées (di- et mono-butylétain). L’élimination du OTBT chez l’animal est essentiellement fécale et secondairement urinaire, avec une première phase rapide suivie d’une phase lente. Une demi-vie biologique de 20 à 30 jours est observée expérimentalement suite à des administrations réitérées de OTBT. Aucune bio-accumulation tissulaire de cette substance ou de ses métabolites n’est toutefois enregistrée (INRS, 1997).
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Par inhalation, des vapeurs ou des aérosols de OTBT peuvent provoquer des irritations des muqueuses oculaires (larmoiements, conjonctivite), nasales et des voies aériennes supérieures (toux, dyspnée, douleurs thoraciques, voire un œdème pulmonaire). A ces signes locaux sont le plus souvent associés des symptômes généraux tels que de l’asthénie, des céphalées, nausées et vomissements (INRS, 1997). Il a également été rapporté une crise d’asthme associée à des nausées et de la léthargie chez un salarié travaillant dans un local où une solution de OTBT à 25 % dans l’eau (+ 2 % d’alcool) avait été pulvérisée 36 heures auparavant (Shelton et al., 1992). Aucun cas létal n’a été relaté chez l’homme suite à une exposition aiguë par inhalation (ATSDR, 1992 ; OMS IPCS, 1990).
Voie orale
FDTE/VTR Importer Aucun cas de toxicité aiguë par voie orale liée au OTBT n’a été décrit chez l’homme (ATSDR, 1992 ; OMS IPCS, 1990).
Voie cutanée
FDTE/VTR Importer Par voie cutanée, des cas de dermatites sévères suite à des expositions accidentelles au OTBT ont été décrits chez des salariés malgré un rinçage des zones exposées. Un effet irritant retardé du OTBT est ainsi souligné. Dans un cas, 10 minutes après l’exposition, l’individu exposé a également manifesté des nausées et des vomissements. Dans tous les cas, les symptômes ont disparu dans les jours suivant le contact (Baaijens, 1987). Des peintres en bâtiments ont présenté des éruptions cutanées sévères (lésions vésiculo-bulleuses œdémateuses), extensives au niveau de la face, du cou, du thorax et des membres supérieurs 8 à 10 heures après l’application de peintures contenant 0,6 % de OTBT. Suite à ces dermatites, aucune sensibilisation de type allergique n’a pu être mise en évidence chez ces salariés (Goh, 1985). D’autres auteurs ont mis en évidence des phénomènes de sensibilisation suite à des lésions cutanées sévères (pustules, ulcérations) liées à une exposition à de fortes concentrations de OTBT contenu dans des peintures anti-rouille (Lewis et Emmett, 1987).
Chez l'animal
Inhalation
FDTE/VTR Importer Par inhalation, l'exposition oro-nasale de OTBT chez des rats permet de déterminer des concentrations létales 50 % (CL50) de 77 mg.m-3 pour des gouttelettes et de 65 mg.m-3 pour des aérosols "inhalables" (particules de diamètre inférieur ou égal à 10 mm). Ces expositions se caractérisent par des irritations et de l'œdème pulmonaire (Schweinfurth, 1985). L'exposition de cobayes à des concentrations de 0,1 à 1 mg.L-1 de OTBT pendant 1 heure entraîne de la mortalité à partir de 0,2 mg.L-1 sans autre lésion spécifique que de la congestion pulmonaire. A la concentration de 0,1 mg.L-1, aucune mortalité n'est observée mais les animaux présentent une irritation des muqueuses nasales (Anger et al., 1976).
Une étude de comportement chez des souris a été réalisée après expositions à des aérosols de OTBT à des concentrations de 50 à 400 mg.m-3 pendant une unique heure ou pour 7 expositions consécutives de 1 heure. Il apparaît une augmentation de l'activité exploratoire des animaux pour les faibles doses (42 et 84 mg.kg-1) alors qu'elle est diminuée pour les fortes doses (170 et 340 mg.kg-1)(Truhaut et al., 1979).
Enfin, le temps moyen de survie à un aérosol (concentration non spécifiée) de OTBT est de 22 minutes chez la souris et de 9 minutes chez le cobaye (Truhaut et al., 1981).
Voie orale
FDTE/VTR Importer Par voie orale, différentes études chez le rat et la souris ont permis de déterminer des DL50 comprises entre 85 et 194 mg.kg-1 (Elsea et Paynter, 1958 ; Funahashi et al., 1980 ; Polster et Halacka, 1971 ; Truhaut et al., 1976).
L’administration par intubation gastrique d’une dose de 100 mg.kg-1 de OTBT chez le rat Sprague-Dawley induit des modifications histologiques des surrénales et des follicules thyroïdiens réversibles après 14 jours. Les dosages hormonaux réalisés permettent de mettre en évidence une action directe et indirecte du OTBT sur la thyroïde avec augmentation des taux sériques de T4 et diminution de la TSH circulante, ainsi qu’une modification des taux de cortisol de type ACTH-like (Funahashi et al., 1980).
L'administration par voie intra-péritonéale de 10 mg.kg-1 de OTBT à des rats induit une diminution des taux de noradrénaline cérébraux, surrénaliens et cardiaques pendant 48 heures ainsi que des taux surrénaliens d'adrénaline (Robinson, 1969).
Voie cutanée
FDTE/VTR Importer Par voie cutanée, la DL50 du OTBT chez des lapins est élevée (environ 9 000 mg.kg-1) bien que l'absorption percutanée soit démontrée. L'application pendant 24 heures de 11,7 g.kg-1 de OTBT sur l'abdomen de lapins entraîne une létalité. L'examen histologique de la zone irritée se traduit par un œdème sous-cutané. L'application de 8 mg.kg-1 de OTBT quotidiennement pendant 5 jours provoque un léger érythème pour 25 % des animaux exposés (Elsea et Paynter, 1958).
Enfin, le potentiel sensibilisant du OTBT a été évalué par un test de Magnussen-Kligman chez le cobaye pour des concentrations de 1 % et 5 % en OTBT. Quelle que soit la dose, aucune sensibilisation n'a été mise en évidence (Poitou et al., 1978).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer Il n'existe pas de donnée relative à la toxicité chronique chez l'homme du OTBT par inhalation.
Voie orale
FDTE/VTR Importer Il n'existe pas de donnée relative à la toxicité chronique chez l'homme du OTBT par voie orale.
Voie cutanée
FDTE/VTR Importer Par voie cutanée, le OTBT est essentiellement un irritant (toxicité aiguë) mais aucun phénomène de sensibilisation par contacts réitérés n'a pu être mis en évidence (Gammeltoft, 1978).
Chez l'animal
Inhalation
FDTE/VTR Importer Par inhalation, des rats ont été exposés oro-nasalement pendant 4 à 5 semaines, 4 heures par jour, 5 jours sur 7 à un aérosol de 2,8 mg.m-3 de OTBT. Une mortalité de 50 % chez les mâles et 60 % chez les femelles a été observée ainsi qu'une forte altération de l'état général, des irritations du tractus respiratoire et une déplétion lymphocytaire (Schweinfurth, 1985). Un NOEL de 0,16 mg.m-3 (pression de vapeur à température ambiante) a été établi chez le rat par inhalation.
L'impact par inhalation du OTBT sur le système immunitaire a été évalué en exposant des rats Wistar à des concentrations de 0,03 à 2,8 mg.m-3, 4 heures par jour, 5 jours sur 7 pendant 4 à 5 semaines. À la plus forte concentration, les animaux morts ont présenté une thymolyse et des déplétions lymphocytaires spléniques et ganglionnaires (Schering, 1983).
Voie orale
FDTE/VTR Importer Par voie orale, le OTBT administré à des rats à raison de 80 et 320 mg.kg-1.j-1 dans l'alimentation pendant 4 semaines entraîne des modifications hématologiques (diminution de l'hématocrite, du taux d'hémoglobine, présence de corps de Howell-Jolly) ainsi qu'une augmentation des immunoglobulines Ig M et une diminution des Ig G (Krajnc et al., 1984 ; Vos et al., 1984).
Ces modifications hématologiques ne sont pas rapportées pour une étude sur 24 mois avec des doses réduites en OTBT (0,025 à 2,5 mg.kg-1.j-1). Seules une légère diminution de lymphocytes périphériques et une augmentation des plaquettes sont observées chez les rats femelles après un an d'exposition (Wester et al., 1987).
L'impact du OTBT sur les fonctions endocriniennes n'apparait que pour des doses élevées et se traduit par des diminutions du taux sérique d'insuline, de thyroxine et de thyréotropine associées à une augmentation de la LH (Krajnc et al., 1984 ; Wester et al., 1987).
Ces études montrent également des altérations de l'état général des animaux avec un effet dose et temps dépendant mais surtout un impact non négligeable sur le système immunitaire aussi bien chez le rat que chez le chien (Funahashi et al., 1980 ; Krajnc et al., 1984 ; Schering, 1989 ; Wester et al., 1987). En effet, pour des doses de 3, 6 et 12 mg.kg-1.j-1 administrées en véhicule huileux à des rats pendant 13 et 26 semaines, il est observé une réduction des poids relatif et absolu du thymus ainsi qu'une augmentation du poids relatif des glandes surrénales et de l'hypophyse (Funahashi et al., 1980). Sur la base de ces résultats, un NOEL de 3 mg.kg-1.j-1 pendant 13 semaines a été retenu pour l'impact sur le système immunitaire. De nombreuses études complémentaires ont été effectuées avec des doses journalières variables de OTBT et la réalisation de tests ex vivo des fonctions immunitaires. Les effets les plus pertinents sont une diminution dose et temps dépendante de la résistance à des infections bactériennes (T. spiralis, L. monocytogenes) (Vos et al., 1984 ; Wester et al., 1987). Ainsi, pour des doses de 0,5 à 50 mg.kg-1.j-1 de OTBT administrées à des rats, un NOAEL de 0,025 mg.kg-1.j-1 a été établi sur la base des effets immunosuppresseurs.
D'un point de vue histologique, l'administration de 320 mg.kg-1.j-1 de OTBT pendant 4 semaines à des rats induit une atrophie hépatique associée à des foyers de nécrose hépatique et une hyperplasie des canaux biliaires intra-hépatiques. L'examen histologique révèle également une déplétion lymphocytaire (lymphocytes T essentiellement affectés) au niveau du cortex thymique, une atrophie diffuse de la pulpe blanche splénique (lymphocytes B et T) et des modifications des sinus des nœuds lymphatiques mésentériques (Krajnc et al., 1984).
Voie cutanée
FDTE/VTR Importer Par voie cutanée, l'application de 10 ou 40 mg.kg-1.j-1 de OTBT pendant 50 jours chez des cobayes mâles entraîne une destruction de l'épithélium tubulaire rénal associée à une augmentation de l'excrétion urinaire des ions sodium, chlorures, phosphates ainsi que du glucose et des acides aminés (Mori et al., 1984).
Synthèse
FDTE/VTR Importer Effets systémiques :
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
| IARC | FDTE/VTR Importer Non déterminé. | |
| US EPA | FDTE/VTR Importer Classe D : substance non classifiable quant à sa cancérogénicité chez l’homme | 1997 |
Chez l'animal
Voie orale
FDTE/VTR Importer Seule une étude combinée de toxicité chronique et de cancérogenèse est disponible. Des rats ont été exposés par voie orale (alimentation) à des doses de 0,025, 0,25 et 2,5 mg.kg-1.j-1 de OTBT pendant 106 semaines. Il a été observé une augmentation de l'incidence de tumeurs bénignes (prolactinomes hypophysaires, phéochromocytomes médullaires surrénaliens) dans les deux sexes à la plus forte dose. Chez les mâles, à la dose la plus élevée, une augmentation de l'incidence des adénomes parathyroïdiens est observée et chez les femelles, à cette même dose, des adénocarcinomes pancréatiques. Les conclusions de l'étude montrent que l'apparition de ces tumeurs est liée à une toxicité directe du OTBT sur les glandes endocrines plutôt qu’à un potentiel cancérigène proprement dit (Wester et al., 1987). Toutefois le taux élevé de tumeurs constaté chez les témoins et l’absence de mise en évidence de réponse effet-dose remet en question ces conclusions (Wester et al., 1990).
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
Chez l'animal
Toutes voies
FDTE/VTR Importer La plupart des études in vivo de mutagenèse réalisées avec le OTBT donnent des résultats négatifs.
In vivo, le test du micronoyau chez la souris balb/c mâle est positif à la dose unique de 60 mg.kg-1 (négatif à 30 mg.kg-1 et chez la femelle) (Davis et al., 1987)
In vitro
Organismes procaryotes
FDTE/VTR Importer La plupart des études in vitro de mutagenèse réalisées avec le OTBT donnent des résultats négatifs.
À des concentrations cytotoxiques, le OTBT s’est révélé clastogène in vitro sur cellules ovariennes de hamster chinois et a induit des micronoyaux sur cellules de moelle osseuse de souris in vitro (Davis et al., 1987).
Organismes eucaryotes
FDTE/VTR Importer La plupart des études in vitro de mutagenèse réalisées avec le OTBT donnent des résultats négatifs. À des concentrations cytotoxiques, le OTBT s’est révélé mutagène pour une souche bactérienne (essai de fluctuation avec activation métabolique) (Davis et al., 1987).
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucun cas de toxicité de la reproduction liée au OTBT n’a été décrit chez l’homme (ATSDR, 1992 ; OMS IPCS, 1990).
Voie orale
FDTE/VTR Importer L'administration de 6, 11,7, 23,4 et 35 mg.kg-1.j-1 de OTBT à des souris gestantes NMRI entraîne une augmentation de l'incidence (de 7 à 48 %) de l'apparition de fentes palatines chez les fœtus aux trois plus fortes doses. À la dose de 6 mg.kg-1.j-1, aucune malformation fœtale n'a été observée. D'autres anomalies mineures telles que des foyers de densification vertébrale ont été observées. Ce type de malformations est une particularité de cette souche de souris et le plus souvent en liaison avec un stress maternel. Le potentiel tératogène du OTBT a été considéré comme faible par les auteurs (Davis et al., 1987).
Le potentiel tératogène et embryotoxique du OTBT a été évalué chez des lapines New Zealand intoxiquées par gavage du 6ème au 18ème jour de gestation. Le taux élevé d'avortements à la dose de 2,5 mg.kg-1.j-1 (maximale) a été considéré comme un effet secondaire d'une toxicité maternelle caractérisée par une altération de l'état général à cette dose. L'évaluation des fœtus a permis de conclure à la non-tératogénicité du OTBT chez le lapin. Sur la base des observations maternelles, un NOEL de 1 mg.kg-1.j-1 a été établi (Nemec, 1987).
Effets sur le développement
Chez l'animal
Voie orale
FDTE/VTR Importer L’administration par voie orale à des rats âgés de 5 jours de doses de 40, 50 ou 60 mg.kg-1 de OTBT ne provoque pas de modification persistante de l’activité motrice ou de la réponse comportementale vis à vis du bruit (Crofton et al., 1989).
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer L’US EPA (IRIS) propose une RfD par voie orale de 3.10-4 mg.kg-1.j-1 pour une exposition par voie orale (US EPA (IRIS), 1997).
Cette valeur a été établie à partir d’études sub-chroniques et chroniques chez le rat wistar exposé via l’alimentation jusqu’à 18 mois consécutifs (Vos et al., 1990). Les résultats de ces études d’immunotoxicité ont permis d’établir un NOAEL de 0,025 mg.kg-1.j-1 sur la base d’effets immunosuppresseurs.
Facteurs d’incertitude : un facteur de 100 est appliqué pour tenir compte de l’extrapolation des données animales à l’homme (facteur de 10) et de la variabilité au sein de la population humaine (facteur 10).
Calcul : 0,025 mg.kg-1.j-1 x 1/100 = 0,00025 mg.kg-1.j-1 (soit environ 3.10-4 mg.kg-1.j-1)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Dangers
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Seules des données d'écotoxicité issues de tests sur organismes d’eau douce sont disponibles.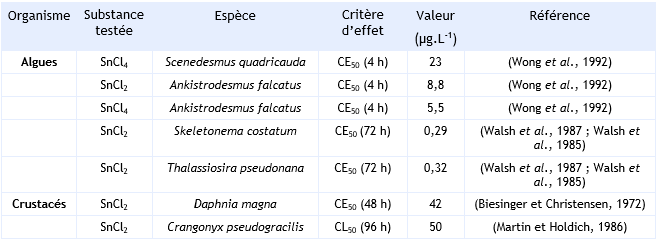
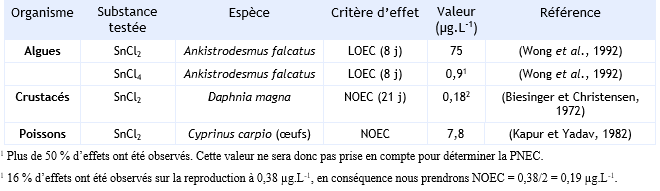
Paramètres d’écotoxicité chronique :
Sol
FDTE/VTR Importer Paramètres d'écotoxicité aiguë:
Tous les résultats de tests d'écotoxicité sur organismes terrestres disponibles concernent des microorganismes ont été effectués sur des durées d'exposition de plusieurs jours et sont donc considérés comme des tests d'effets à long terme
Paramètres d’écotoxicité chronique :
Les données sont issues de Van de Plassche et al. (1992)(Van de Plassche et al., 1992)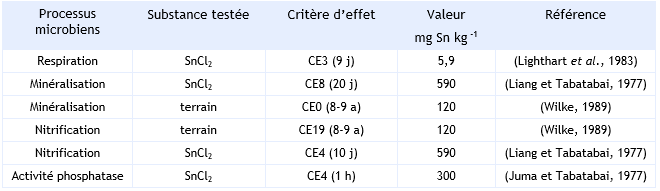
Valeurs écotoxicologiques
Valeurs guides
Synthèse
FDTE/VTR Importer Il existe des données long terme sur crustacés, algues et poissons d'eau douce. La PNEC pour les écosystèmes d’eaux douces peut être extrapolée à partir du résultat de Biesinger et Christensen (1972) sur Daphnia magna (NOEC = 0,19 µg.L-1) en utilisant un facteur d’extrapolation de 10 (Biesinger et Christensen, 1972).
D’où : PNECeau douce = 0,019 µg.L-1
Compte tenu de l’absence de résultats de toxicité vis à vis des organismes benthiques, il n’est pas possible de dériver une PNEC pour les sédiments.
Seuls des résultats d’essais sur des processus microbiens sont disponibles pour le compartiment terrestre. En utilisant un facteur d'extrapolation de 1 000 sur le résultat de (Lighthart et al., 1983)on obtient une PNEC sol de :
PNECsol = 5,9 µg.kg-1 sol sec
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

