Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Benzo(a)Pyrène (50-32-8)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
50-32-8
Nom scientifique (FR)
Benzo(a)Pyrène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-028-5
Code SANDRE
1115
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C20H12 }\)
Code InChlKey
Code SMILES
c1ccc2c(c1)cc3ccc4cccc5ccc2c3c45
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H317 |
|---|---|
| Mention du danger - Texte | Peut provoquer une allergie cutanée |
| Classe(s) de dangers | Sensibilisation respiratoire/cutanée |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Carc. 1B;H350: C ≥ 0,01 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H340 |
|---|---|
| Mention du danger - Texte | Peut induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Mention du danger - Code | H360Fd |
|---|---|
| Mention du danger - Texte | Peut nuire à la Fertilité. Peut nuire au fœtus. |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Carc. 1B;H350: C ≥ 0,01 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Carc. 1B;H350: C ≥ 0,01 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Introduction
Le B(a)P est présent dans de nombreux mélanges de HAP est considéré comme la molécule de référence de cette famille.
Air
Prélèvement
Analyse
Eau
Prélèvement
Analyse
Sol
Analyse
Autres milieux
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
252.31 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Comportement et devenir dans les milieux
Dernière vérification le 09/09/2025
Matrices
Atmosphère
La volatilisation du benzo(a)pyrène depuis les sols ou les surfaces aquatiques est très peu importante.
Milieu eau douce
Il est fortement adsorbé sur les matières particulaires.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Il est peu mobile dans les sols (adsorption importante).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
Les résultats ci-dessous sont principalement issus des monographies de l’IPCS (International Programme on Chemical Safety).
Hydrolyse :
Aucune donnée expérimentale sur l’hydrolyse du benzo(a)pyrène n’a été trouvée. Cependant, compte tenu de sa structure moléculaire, son hydrolyse est probablement négligeable.
Atmosphère
Le benzo(a)pyrène réagit en présence d’ozone et de dioxyde d’azote, avec des durées de vie sont de 1,8 jours et 19 jours respectivement (Kamens et al., 1990).
Milieu eau douce
Eaux de surface
Une demi-vie du benzo(a)pyrène, prenant en compte la volatilisation de la substance à partir de l’eau, de 1 550 h a été calculée par Southworth (1979) dans une rivière de 1 m de profondeur, avec un courant de 0,5 m.s-1 et une vitesse du vent de 1 m.s‑1 (Southworth, 1979).
Milieu terrestre
Le benzo(a) pyrène est peu dégradable : sa demi-vie dans le sol en condition aérobie varie de 57 à 530 jours (pour des variations de température de 10 à 30°C) (Coover et Sims, 1987). Cet ordre de grandeur est confirmé par Bulman et al. (1987) qui ont trouvé des demi-vies de 218 à 347 jours dans l'horizon superficiel du sol (Bulman et al., 1987).
Bioaccumulation
Organismes aquatiques
Un BCF de 2 657 a été estimé par McCarthy et Jimenez, 1985 sur Lepomis macrochirus. a substance a été mesurée et l’essai est basé sur le rapport des constantes d’absorption et d’élimination de la substance dans l’organisme. Cet ordre de grandeur est confirmé par Johnsen et al., 1989 qui ont trouvé un BCF de 2310 sur Salmo salar, même si la validité de ce dernier essai est moindre, seul le 14C ayant été suivi. Des BCF de : 57 981 (mollusques), 11 138 (crustacés et céphalopodes) et 135 (poissons) sont mentionnés dans la fiche « Environnemental Quality Standard » (EQS) (EC, 2011).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
L'INERIS recommande de consulter la Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP 2015 (ADEME, INERIS, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015). La base indique des concentrations en benzo(a)pyrène dans les végétaux et dans des sols, permettant de calculer un BCF ; pour certaines données, les concentrations dans d’autres milieux environnementaux sont également renseignées. Pour le benzo(a)pyrène, 95 couples de données végétaux-sol sont actuellement disponibles. Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante (type de plante : légume feuille, légume tige, légume racine, etc.), le stade de récolte, la maturité, l’organe analysé, le type de préparation (lavage, pelage), au sol texture, teneur en carbone organique, pH), au contexte environnemental (industriel, rural, urbain), à l’origine de la pollution (industrielle, agricole, urbaine, etc.), au type expérimental (champ agricole, potager, etc.)) afin de se rapprocher des conditions propres à la situation étudiée. Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des molécules organiques pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
Bibliographie
Toxicologie
Dernière vérification le 09/09/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1995 ; EU, 2002 ; IARC 2012 ; INRS, 2007 ; OEHHA, 2010, 2011 ; Santé Canada, 2016 ; US EPA, 2017). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Chez l’homme, très peu d’études ont cherché à identifier les effets toxiques du benzo(a)pyrène seul, la plupart des données disponibles concernent des mélanges d’hydrocarbures aromatiques polycycliques (HAP). Dans cette fiche, seule la substance benzo(a)pyrène est considérée, la toxicité du benzo(a)pyrène en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Certains HAP disposent d’une fiche de données toxicologiques cependant il nous est apparu nécessaire de proposer également une fiche « choix de VTR » regroupant les valeurs disponibles pour chacun d’eux ainsi que les autres éléments de comparaison entre ces différents HAP.
Rappelons que dans le concept de facteur d’équivalence toxique (FET) permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le benzo(a)pyrène est la substance de référence à laquelle un potentiel toxique de valeur 1 est arbitrairement donné. Le B(a)P se situe dans la classe des HAP de haut poids moléculaire (5 cycles), avec une absorption théorique majoritaire sous forme particulaire.
Toxicocinétique
Chez l'homme
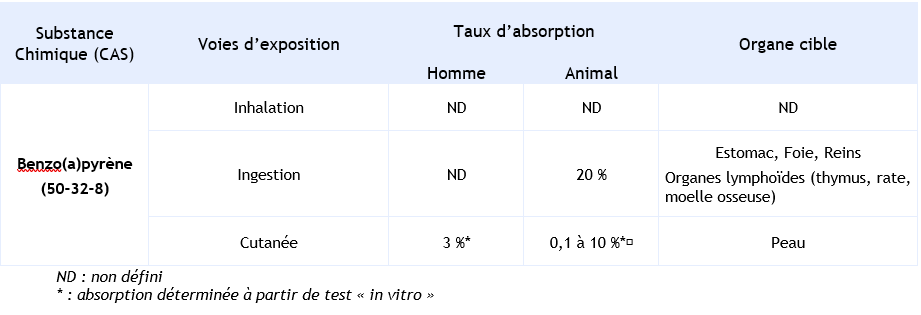
Absorption
Peu d’informations sont disponibles chez l’homme.
Inhalation:
Des études chez des travailleurs ont montré que le benzo(a)pyrène pouvait être absorbé après exposition par inhalation (pas de quantification). L’absorption est alors rapide, mais dépend de la forme sous laquelle se présente le benzo(a)pyrène et plus spécifiquement de la taille des particules sur lesquelles il est adsorbé.
Voie orale:
Pour la population générale, l’alimentation est la principale source d’exposition au benzo(a)pyrène et correspond à environ 97 % de l’apport quotidien, l’eau contaminée représentant une source négligeable (Hattemer-Frey et Travis, 1991).
L’absorption de benzo(a)pyrène chez l’homme est faible après ingestion (non quantifiée) et dépend du véhicule dans lequel il est inclus. Plus le véhicule contient des corps gras, meilleure est l’absorption au niveau gastro-intestinal. L’acidité et la présence d’aliments dans la tractus digestif sont également des paramètres favorisant la mobilisation des HAP en général, du benzo(a)pyrène en particulier (Hack et Selenka, 1996).
Voie cutanée
Par voie cutanée, il n’existe pas de données in vivo, cependant le taux d’absorption a été estimé sur des modèles in vitro.
Le taux d’absorption est estimé à 3 % après 24 heures sur un modèle in vitro de peau d’origine humaine (application de 5 µg de benzo(a)pyrène-H3 dans l’acétone sur un disque d’environ 2 cm2) (Kao et al., 1985). Après 48 heures, l’absorption peut atteindre 24 à 48 % (variable selon les biopsies réalisées sur des personnes plus ou moins jeunes), lorsque le benzo(a)pyrène est appliqué (8 à 13 µg.cm-2) sur la peau humaine en présence d’acétone (Moody et al., 1995).
Distribution
Le benzo(a)pyrène est rapidement distribué dans les différents organes internes en quelques minutes à quelques heures (Kotin et al., 1959). Du fait de sa forte liposolubilité, le benzo(a)pyrène est stocké dans les glandes mammaires et les autres organes riches en graisses tels que la moelle osseuse. Il est ensuite progressivement relargué dans la circulation sanguine (IARC 1983).
Le benzo(a)pyrène a notamment été détecté dans le lait, le placenta et le cordon ombilical (moyennes respectives de 1,8- 6,9 et 16,2 ng.g-1 de lipides) de femmes séjournant à Pékin depuis au moins 6 ans et non fumeuses (Yu et al., 2011) ou encore dans le lait de mères italiennes (0,81 µg.kg-1 de lait)(Santonicola et al., 2017).
Métabolisme
Il existe différentes voies métaboliques du benzo(a)pyrène comprenant de nombreuses réactions. Cependant, au regard du risque cancérogène, la formation d’adduits à l’ADN semble être le mécanisme principal (INRS, 2007 ; INSERM, 2001). Le métabolisme du benzo(a)pyrène a lieu principalement au niveau hépatique en deux phases. Dans un premier temps, métabolisme de phase I, le benzo(a)pyrène subit une oxydation induite par les cytochromes P450 pour donner naissance à des métabolites électrophiles capables de se conjuguer ultérieurement pour être rapidement éliminés, mais aussi à la formation d’époxydes. Selon leur stabilité, ces époxydes vont spontanément ou par l’intermédiaire de différentes voies enzymatiques, mettant à nouveau en jeu à nouveau les cytochromes P450, mais aussi des aldo-kéto réductases, ou des époxy-hydrolases pour ne citer que les principales, conduire à la formation de différents diols époxydes, d’une ortho-quinone et différents métabolites hydroxylés. De plus, les réactions de la première phase de transformation du benzo(a)pyrène génèrent la formation d’espèces réactives de l’oxygène, produites à partir de la réduction partielle de l’oxygène présent dans les cellules, molécules très réactives et instables capables notamment de réagir avec l’ADN pour former des adduits, mais aussi avec les lipides et protéines environnants impliqués dans des phénomènes de mort cellulaire par nécrose ou par apoptose (Jiang et al., 2013 ; US EPA, 2017). Une seconde phase, métabolisme de phase II, fait intervenir ultérieurement différentes enzymes (glutathion S-transferases, les uridine diphosphate glucuro- et sulfotransférases) capables de conjuguer une majorité des métabolites formés au cours de la phase I au glutathion, à l’acide glucuronique ou à un groupement sulfate. La conjugaison avec des groupements hydrophiles permet d’accroitre leur solubilité dans l’eau et de faciliter leur excrétion dans l’urine et les fèces (Bock et Bock-Hennig, 2010 ; Meinl et al., 2007). Le schéma ci-après résume le métabolisme du benzo(a)pyrène (INRS, 2007).
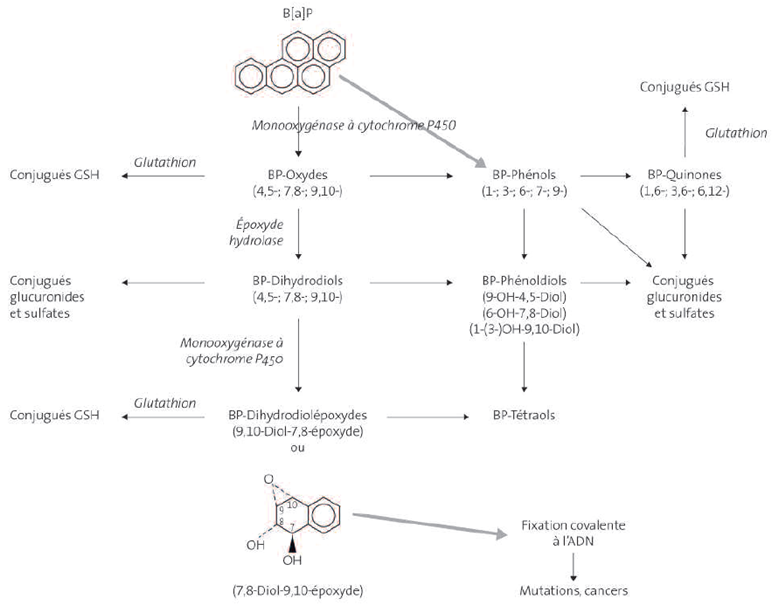
Le passage des hydrocarbures aromatiques polycycliques (HAP) dans le cytoplasme entraîne une induction spécifique de certaines enzymes métabolisant les xénobiotiques. En effet, un récepteur cytoplasmique très spécifique des HAP, « l’aryl hydrocarbon receptor » (AhR) est lié à diverses protéines cytoplasmiques tels que les « Heat shock protein 90 » (Hsp90) et les « AhR interacting protein » (AIP). L’association entre l’AhR, Hsp90 et l’AIP confère au récepteur cytoplasmique une stabilité dans le cytoplasme assurant la reconnaissance spécifique et optimale vis à vis de certains ligands et notamment les HAP dont le benzo(a)pyrène. Il est maintenant établi que la liaison du benzo(a)pyrène au récepteur AhR est déterminante dans l’activation de la transcription des gènes codant pour les enzymes de phase I et de phase II (IARC 2012).. Ainsi, le benzo(a)pyrène induit son propre métabolisme en jouant le rôle tant d’inducteur que de substrat des enzymes métaboliques de phase I et de phase II.
Élimination
Le benzo(a)pyrène et ses métabolites sont principalement éliminés dans les fèces (70 à 75 %). Seuls 4 à 12 % sont éliminés par voie urinaire où l’élimination se fait à 80 % sous la forme de métabolites (métabolites polaires et dérivés phénoliques) et très faiblement sous la forme de benzo(a)pyrène non métabolisé (INRS, 2007 ; Yamazaki et Kakiuchi, 1989).
Chez l'animal
Absorption
Inhalation
Le B(a)P est absorbé rapidement par inhalation. Chez le rat, exposé nez seul à un aérosol pur de B(a)P-H3 (1 mg.m-3 pendant 30 minutes « nose only »), environ 90 % de la charge pulmonaire initiale du benzo(a)pyrène radiomarqué détectée 30 minutes après l’exposition par inhalation sont éliminés des poumons en 4 heures pour atteindre la circulation systémique (Sun et al., 1982).
Voie orale
Chez l’animal, l’absorption du benzo(a)pyrène par voie orale est incomplète. Après exposition d’une dose de 100 mg.kg-1 chez le rat, le pic plasmatique de benzo(a)pyrène (67 % de la dose administrée) est atteint après 8 heures (Ramesh et al., 2001).
Elle dépend de la présence de graisses dans le tractus gastro-intestinal. Cette absorption est estimée à environ 40 % avec une biodisponibilité variant de 7,8 à 11,5 % chez le rat (Foth et al., 1988b). De plus, il a été montré que le taux d’absorption intestinale est corrélé à la quantité de bile. Une étude réalisée chez le rat en présence de bile montre un taux d’absorption intestinale de 22,9 % (Rahman et al., 1986). Une autre étude également réalisée chez le rat retient un taux d’absorption par voie orale variant de 38 à 58 % (Chang, 1943).
Voie cutanée
Par voie cutanée, une estimation du taux d’absorption a été réalisée sur un modèle in vitro constitué d’un disque d’environ 2 cm2. Le taux d’absorption observé 24 heures après l’application de 5 µg de benzo(a)pyrène-H3 dans l’acétone est de 0,1 % chez le cobaye, de 1 à 3 % chez le rat, le lapin et le ouistiti et d’environ 10 % chez la souris (Kao et al., 1985).
Distribution
Après une absorption par voie orale (100 mg.kg-1) chez le rat, une forte concentration au niveau du foie en raison de sa métabolisation (10 % de la dose administrée) a été décrite plus de 24 heures après l’exposition (Ramesh et al., 2001).
Chez le rat, moins de 20 % de la dose administrée par voie orale sont retrouvés dans la lymphe. Ce faible taux mesuré dans la lymphe pourrait être lié soit à une absorption incomplète, soit à un temps de passage court dans la circulation porte (IARC 1983). Le passage transplacentaire a été montré chez des rates gravides exposées par inhalation, des métabolites étant présents chez les petits jusqu’à 15 jours après l’exposition (Wu et al., 2003). Chez le rat et la souris, les concentrations mesurées dans l’embryon sont deux fois moins élevées que celles chez la mère (Baranova et al., 1976 ; Neubert et Tapken, 1988 ; Shendrikova et Aleksandrov, 1974 ; Shendrikova et al., 1974 ; Takahashi, 1974).
Métabolisme
Une étude a confirmé que le métabolisme du benzo(a)pyrène chez le rat était proche de celui chez l’homme. Des rats ont été exposés à 150 µg.kg-1.j-1 pendant 30 jours par voie orale. Les observations au niveau hépatique ont montré que l’activité de la 7-éthoxyrésorufine-O-deéthylase (EROD), mesure de l’induction des cytochromes P450 1A, était augmentée ce qui témoigne du fait que benzo(a)pyrène est inducteur de son propre métabolisme (Elovaara et al., 2007 ; Kang et al., 2007).
Le rôle déterminant de la présence des récepteurs AhR dans le métabolisme du benzo(a)pyrène a été démontré chez des souris dépourvues de ces AhR, réfractaires aux effets cancérogènes du benzo(a)pyrène (Shimada, 2006). La voie de détoxication des métabolites du benzo(a)pyrène, impliquant les enzymes de métabolisme de phase II, a également été confirmée chez la souris (Garg et al., 2008).
Élimination
L’excrétion chez le rat se fait majoritairement par les matières fécales aussi bien après ingestion (60 à 80 %) qu’après inhalation (96 %), l’élimination par voie urinaire étant très minoritaire (Foth et al., 1988a ; Wolff et al., 1989).
L’exposition de ruminants à une dose unique par voie orale (100 mg) a montré un faible passage dans le lait du benzo(a)pyrène et de ses métabolites (< 0,005 %). Ce taux de transfert limité suggère d’une part un faible risque d’exposition via le lait consommé par la population et d’autre part un faible risque d’exposition des petits via le lait de leur mère (Lapole et al., 2007). Ce résultat est confirmé par des études in vitro (Cavret et al., 2005).
Autre
Relation avec le récepteur AhR
Sur les modèles in vitro humains ou animaux, le benzo(a)pyrène présente une bonne affinité pour l’AhR, même si elle reste selon les tests sur cellules animales parfois bien plus faible (5 à plus de 10 fois) que celle du benzo(k)fluoranthène (Barron et al., 2004 ; Jones et Anderson, 1999 ; Misaki et al., 2016 ; Vondráček et al., 2017).
Synthèse
Chez l'homme:
Le benzo(a)pyrène peut être absorbé par ingestion, inhalation et voie cutanée. Son absorption est faible chez l’homme. Il se distribue majoritairement dans les tissus adipeux. Le benzo(a)pyrène est inducteur de son propre métabolisme impliquant la liaison au récepteur AhR, et métabolisé au niveau du foie par des monooxygénases à cytochrome P450 pour donner des métabolites formant des adduits à l’ADN (source principale). Le benzo(a)pyrène et ses métabolites sont principalement éliminés sous forme conjuguée dans les fèces.
Chez l'animal:
Les données chez l’animal confirment ces informations chez l’homme.
Equivalents biosurveillance
Description
Indices biologiques d’exposition : le métabolite urinaire recherché 3-hydroxybenzo(a)pyrène. Les valeurs maximales sont différentes en fonction du tabagisme du patient :
pour un non-fumeur
- valeur maximale <0,05 nmol.mol-1 de créatinine (> 0,12 ng.g-1 de créatinine)
- 90ème percentile <0,02 nmol.mol-1 de créatinine (> 0,05 ng.g-1 de créatinine)
pour un fumeur
- valeur maximale <0,1 nmol.mol-1 de créatinine (> 0,24 ng.g-1 de créatinine)
- 90ème percentile <0,06 nmol.mol-1 de créatinine (> 0,14 ng.g-1 de créatinine)
Toxicité aiguë
Chez l'homme
Inhalation
Aucune étude de toxicité par inhalation chez l’homme n’a été identifiée.
Voie orale
Aucune étude de toxicité par voie orale chez l’homme n’a été identifiée.
Voie cutanée
L’application cutanée d’une solution contenant 1 % de benzo(a)pyrène chez l’homme a montré l’apparition de manifestations cutanée telles que érythème, pigmentation, desquamation, infiltrations et même hyperkératoses verruqueuses, régressant en 2 à 3 mois après l’arrêt du traitement (INRS, 2007).
Synthèse
Chez l’homme, les seules études disponibles ont montré des lésions locales lors d’applications cutanées.
Chez l'animal
Inhalation
Aucune donnée par inhalation n’a été identifiée.
Voie orale
Chez la souris, les DL50 mesurées par voie orale sont supérieures à 1 600 mg.kg-1 (Awogi et Sato, 1989). Chez le rat, l’administration d’une dose unique de benzo(a)pyrène (0, 100, 600 ou 1000 mg.kg-1) par voie orale a permis d’observer 2 semaines plus tard à l’autopsie des animaux une augmentation significative dose-dépendante du poids relatif du foie (plus de 30 %), sans altération histologique associée, plus marquée chez les mâles que chez les femelles (Knuckles et al., 2001).
Des signes hématologiques ont également été rapportés chez les mâles, à savoir une baisse significative (p<0,05) des globules blancs aux deux plus fortes doses, confirmant les effets immuno-suppresseurs du benzo(a)pyrène décrits dans le cadre de l’exposition prolongée au benzo(a)pyrène. Le benzo(a)pyrène est donc peu toxique par voie orale.
Voie cutanée
Chez le rat, la DL50 par voie sous cutanée est de 50 mg.kg-1 (Montizaan et al., 1989).
Chez le cobaye sensibilisé avec 250 µg de benzo(a)pyrène 2 à 3 semaines avant une exposition de 24 heures à des solutions dont les concentrations varient de 0,001 à 1 % de benzo(a)pyrène dans l’acétone ou l’huile d’olive une hypersensibilité de contact a été observée (Old et al., 1963). Chez la souris, des effets analogues ont été décrits et ont permis de déterminer un LOAEL de 120 µg pour l’allergie de contact (Klemme et al., 1987).
Synthèse
Peu d’informations sont disponibles quant à la toxicité aiguë du benzo(a)pyrène chez l’animal. Par voie orale, le benzo(a)pyrène est peu toxique.
Toxicité à doses répétées
Effets généraux
Généralités
Chez l’homme, il est indispensable de prendre également en compte l’apport du benzo(a)pyrène par inhalation via la fumée de cigarette.
Chez l'homme
Inhalation
L’exposition par inhalation au benzo(a)pyrène de travailleurs dans l’industrie du caoutchouc a montré une diminution de la capacité respiratoire, des irritations pulmonaires et de la gorge pour les personnes exposées au benzo(a)pyrène et à des poussières. Il n’a pas été possible de distinguer les effets induits par le benzo(a)pyrène seul ou d’éventuelles co-expositions (Gupta et al., 1993). Les résultats des différentes études existantes sont souvent peu spécifiques au benzo(a)pyrène et peuvent être biaisées par la non-prise en compte du paramètre tabagique (Hu et al., 2006).
Voie orale
L’exposition par voie orale au benzo(a)pyrène est peu documentée pour l’homme.
Voie cutanée
Des lésions d’aspect verruqueux ont été observées lors d’applications de benzo(a)pyrène à la dose de 1 % diluée dans du benzène pendant 4 mois (Cottini et Mazzone, 1939). Les mêmes auteurs ont rapporté des effets cutanés, avec exacerbation de lésions préexistantes, lors de l’application du mélange précédent chez des patients porteurs de pemphigus ou de xeroderma pigmentosum . De telles observations n’ont pas été décrites chez des personnes présentant une peau saine.
Pemphigus : maladie auto-immune rare de la peau ou des muqueuses caractérisée par l’apparition de lésions (bulles ou croutes) à l’intérieur de l’épiderme
Xeroderma pigmentosum : photodermatose d’origine génétique rare se caractérisant par une absence de réparation des photoproduits à l’ADN qui se traduit notamment par la formation de tumeurs cutanées en cas d’exposition aux UV
Synthèse
L’exposition chronique au benzo(a)pyrène par voie cutanée provoque chez l’homme l’apparition de lésions cutanées. L’exposition par inhalation pourrait induire des effets respiratoires.
Chez l'animal
Inhalation
L’exposition par voie nasale de rats Fisher à 7,7 mg.m-3 (0,75 ppm) de benzo(a)pyrène (aérosol),2 heures par jour, 5 jours par semaine, pendant 4 semaines, n’induit aucun effet au niveau pulmonaire, nasal ou rénal (Wolff et al., 1989).
Voie orale
Les effets de l’exposition chronique au benzo(a)pyrène par voie orale chez le rat ont notamment été recherchés dans l’étude de cancérogénèse de Kroese et al., 2001, où les auteurs ont procédé à un sacrifice intermédiaire des animaux après 3 mois de traitement aux doses de 0, 3, 10 et 30 mg.kg-1 (5 jours par semaine). L’analyse des effets non néoplasiques a permis d’identifier le foie et le thymus comme étant les organes cibles de la toxicité du benzo(a)pyrène chez les deux sexes, les effets n’étant visibles le plus souvent qu’uniquement à la plus forte dose testée de 30 mg.kg-1 (augmentation du poids du foie (p<0,05) et diminution du poids du thymus (p<0,01), en dehors de la baisse du poids du foie à la dose intermédiaire de 10 mg.kg-1 chez les mâles uniquement, jugés plus sensibles que les femelles. Les examens histologiques ont confirmé une atrophie au niveau du thymus, alors qu’aucun signe de toxicité hépatocellulaire n’a clairement été observé aussi bien au niveau microscopique que par l’intermédiaire des paramètres biochimiques sanguins (ALAT, ƔGT, LDH). Seule une hyperplasie discrète localisée au niveau de la muqueuse du pré-estomac, a été décrite uniquement chez les mâles exposés à la plus forte dose. La poursuite de l’étude a conduit à l’observation de différents types de tumeurs qui sont détaillées dans la partie rapportant les effets cancérogènes (cf.effets cancérogènes).
Les effets immuno-toxiques observés au niveau du thymus dans l’étude précédente ont été examinés en détail toujours chez le rat exposé par voie orale à différentes doses de 3, 10, 30 ou 90 mg.kg-1 de benzo(a)pyrène (5 jours sur 7) pendant 35 jours (De Jong et al., 1999). Outre la baisse de poids dose-dépendante du thymus (atteinte plus sévère de la zone corticale) à partir de 10 mg.kg-1 (jusqu’à 60 % par comparaison aux témoins), d’autres organes lymphoïdes comme la rate (diminution du nombre de lymphocytes B, p<0,001 à forte dose), la moelle osseuse (baisse du nombre de cellules et diminution du nombre de globules rouges et blancs circulants) et les ganglions lymphatiques (diminution du poids p<0,001 à forte dose), ont été la cible de la toxicité du benzo(a)pyrène.
L’atteinte de la moelle osseuse (baisse du nombre de cellules) a également été observée dans le cadre de la mise au point de tests in vitro d’immunotoxicité, l’exposition concernant toujours des rats exposés à une dose orale de 150 mg.kg-1.j-1 pendant 28 jours (Fischer et al., 2011). Sur les animaux immatures (ratons exposés à des injections 0,1 à 10 mg/kg de benzo(a)pyrène), la réduction de l’érythropoïèse (baisse du nombre de globules rouges circulants) est visible dès l’exposition à 1 mg.kg-1 de benzo(a)pyrène (Matiasovic et al., 2008).
Dans une autre étude de toxicité chronique chez le rat (administration de benzo(a)pyrène par voie orale de 0, 5, 50 et 100 mg.kg-1.j-1), outre l’altération des paramètres hématologiques constante d’une étude à l’autre, les auteurs ont relevé à nouveau une plus forte sensibilité des mâles en particulier à la plus forte dose de 100 mg.kg-1.j-1 se traduisant notamment par une baisse significative de croissance pondérale (p<0,05) et une augmentation significative du poids relatif du foie (23 %), ces effets n’étant pas significativement visibles chez les femelles (à noter que la rate n’a pas été pesée) (Knuckles et al., 2001). Les auteurs ont également relevé la présence de lésions tubulaires rénales, majoritairement représentées par la présence de cylindres chez la grande majorité des mâles (80 à 100 % des animaux exposés aux deux plus fortes doses), et une minorité des femelles (environ 10 % aux mêmes doses). Chez la souris (mâles et femelles), l’augmentation du poids relatif du foie (13 %) a également pu être observée pour une exposition de 180 jours à 120 mg.kg-1.j-1 (Robinson et al., 1975).
Deux études ont montré que, chez la souris possédant un récepteur Ah de forte affinité (dite sensible) et exposée à 120 mg.kg-1.j-1 de benzo(a)pyrène, la mort survient après 3 semaines (Robinson et al., 1975) ou 26 semaines d’exposition (Legraverend et al., 1984). Le mécanisme d’action serait de type myélotoxique. Les souris déficientes en récepteur Ah ne présentent pas d’effets liés à une myélotoxicité après 6 mois du même traitement (Legraverend et al., 1983).
Voie cutanée
Chez la souris, l’application hebdomadaire de benzo(a)pyrène à différentes doses de 16, 32 ou 64 µg pendant 29 semaines, a produit localement, dès les premières semaines à la plus forte dose, la mort des cellules épidermiques suivie par une régénération entraînant à terme une faible augmentation de la taille de l’épiderme (Albert et al., 1991). Ceci a également été observé aux plus faibles doses mais avec un délai d’apparition plus long. Les éventuels effets systémiques n’ont pas été étudiés. L’apparition de lésions tumorales est décrite dans la partie se rapportant aux effets cancérogènes.
Synthèse
Dans les études de toxicité chronique chez l’animal, une altération de l’immunité humorale et cellulaire, des effets hépatiques et intestinaux, ainsi qu’une myélotoxicité dépendante du génotype sont parmi les principaux effets décrits par voie orale. Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition:
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1B : le benzo(a)pyrène doit être assimilé à une substance cancérogène pour l’homme | 2008 |
| IARC | Groupe 1 : le benzo(a)pyrène est cancérogène pour l’homme | 2012 |
| US EPA | Le benzo(a)pyrène est cancérogène pour l’homme. | 2005 |
Chez l'homme
Toutes voies
Les études rapportées dans la littérature ne permettent pas de conclure quant au caractère cancérogène du benzo(a)pyrène seul chez l’homme (IARC 2012). De nombreuses études existent et décrivent la survenue de cancers mais elles portent sur l’exposition au benzo(a)pyrène inclus dans des mélanges particuliers.
En milieu professionnel, des liens entre l’exposition à différents mélanges contenant du benzo(a)pyrène et certains types de cancer ont été établis. Il s’agit essentiellement de cancer du poumon majoritairement associés à tous types d’activités liées au charbon (production, gazéification du charbon, distillation du goudron, brai de houille, suie, etc.) (Baan et al., 2009 ; IARC, 2010 ; Olsson et al., 2010 ; Straif et al., 2005). Des associations avec le cancer de la vessie (également dans les alumineries), mais aussi des cancers de la peau, de l’œsophage ou du système hémato-lymphatique sont également décrits. D’autres activités liées au noir de carbone ou gaz d’échappement diesel ont également mis en évidence une augmentation du risque de cancer (Benbrahim-Tallaa et al., 2012 ; Bosetti et al., 2006).
Par ailleurs, dans les études épidémiologiques où les travailleurs sont exposés dans un contexte professionnel, le tabac reste un facteur de confusion, les mesures d’adduits à l’ADN étant généralement deux fois plus élevées chez les fumeurs que chez les non-fumeurs (Phillips, 2002).
Dans un contexte non professionnel, mais qui n’exclue pas davantage la présence concomitante à d’autres substances potentiellement cancérogènes, l’exposition par voie alimentaire à des mélanges de substances contenant du benzo(a)pyrène (la viande calcinée représentant une source d’exposition au benzo(a)pyrène) a été associée avec des cancers et des adénomes colorectaux, des cancers du pancréas et des cancers du poumon (Santé Canada, 2016).
En milieu résidentiel, dans le cadre d’une étude regroupant 676 cas et 511 témoins, une association significative a pu être observée entre un mélange de plusieurs HAP présents dans les poussières de tapis dont le benzo(a)pyrène (tertile le plus élevé) et le risque de lymphomes à cellules T (OR = 3,04 ;IC 95 % , 1,09 – 8,47) (DellaValle et al., 2016).
Une large étude américaine réalisée entre 1996-1997 sur une population de 1 508 femmes diagnostiquées pour un cancer du sein et 1 556 sujets témoins a recherché une association avec l’exposition au trafic urbain, le benzo(a)pyrène étant utilisé comme marqueur de l’exposition aux HAP. Des associations modérées (1,14 [0,80 – 1,64] ont pu être établies entre les femmes les plus fortement exposées (5 %) par comparaison à la valeur médiane (Mordukhovich et al., 2016).
Synthèse
Aucune information sur le caractère cancérigène spécifique au benzo(a)pyrène seul n’est disponible chez l’homme. Néanmoins, de nombreuses études montrent un risque accru de cancers chez les personnes exposées à des mélanges de substances contenant du benzo(a)pyrène.
Chez l'animal
Toutes voies
Le benzo(a)pyrène induit des tumeurs chez de nombreuses espèces animales quelle que soit la voie d’exposition. Les effets rapportés correspondent à une action à la fois locale et systémique.
Inhalation
Chez le hamster, l’inhalation de 0 - 2,2 - 9,5 et 45,6 mg.m-3 de benzo(a)pyrène pendant 4,5 heures par jour pendant les 10 premières semaines puis 3 heures par jour, 7 jours par semaine jusqu’à 130 semaines, induit, chez les mâles, une augmentation dose-dépendante de l’incidence de papillomes et de carcinomes à cellules squameuses à la fois au niveau des voies supérieures respiratoires (nez, larynx et trachée) et digestives (pharynx, œsophage et pré-estomac) (Thyssen et al., 1981). L’absence de tumeur pulmonaire n’est pas expliquée, la taille des particules de benzo(a)pyrène inhalées étant comprise entre 0,2 et 0,54 µm, soit de la taille des particules inhalables au niveau alvéolaire. L’incidence des tumeurs (papillomes et carcinomes confondus) est rapportée dans le tableau ci–après ; l’étude n’a fait l’objet d’aucune analyse statistique.
incidence tumorale de l’étude de Thyssen et al., 1981:

Voie orale
Le benzo(a)pyrène administré seul par gavage ou dans la nourriture chez la souris entraîne la formation de nombreuses tumeurs localisées dans les tissus lymphoïdes ou hématopoïétiques, et touchant de nombreux organes dont les poumons, le pré-estomac, le foie, l’œsophage et la langue (Badary et al., 1999 ; Culp et al., 1998 ; Estensen et Wattenberg, 1993 ; Estensen et al., 2004 ; Hakura et al., 1998 ; Kroese et al., 1997 ; Sparnins et al., 1986 ; Weyand et al., 1995 ; Wijnhoven et al., 2000).
D’autres études, notamment celle de Neal et Rigdon, 1967, menée chez la souris (mâles et femelles) avec des expositions au benzo(a)pyrène (pureté non précisée) de 0, 1, 10, 20, 30, 40, 50, 100 et 250 ppm correspondant à 0 – 0,2 – 1,8 – 3,6 – 5,3 – 7,1 – 8 – 8,9 – 17,8 – 44,4 mg.kg-1.j-1) pendant 1 à 197 jours avait déjà permis d’observer une augmentation de l’incidence de tumeurs gastriques de 2,5 % à 90 % à partir de 40 ppm, l’effet étant proportionnel à la dose. Les tumeurs gastriques étaient majoritairement représentées par des papillomes à cellules squameuses. A de plus fortes doses (250 à 1000 ppm), en plus des tumeurs du pré-estomac, la survenue d’adénomes pulmonaires et du thymus, de lymphomes et de leucémies ont été observées (Rigdon et Neal, 1969).
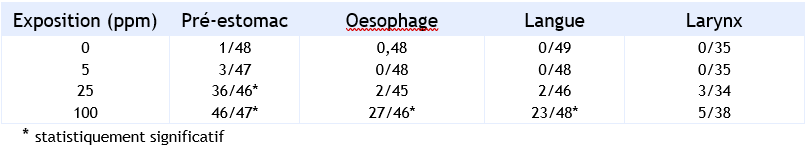
Dans d’autres études également menées chez la souris (B6C3F1) : des femelles ont reçu du benzo(a)pyrène (pureté 98,5 %, dissous dans l’acétone) via l’alimentation aux doses de 0 – 5 - 25 ou 100 mg. kg-1 de benzo(a)pyrène (soit environ 0 – 0,7 – 3,3 ou 16,5 mg.kg-1.j-1) pendant 2 ans (Beland et Culp, 1998 ; Culp et al., 1998). Le traitement a entraîné l’apparition de plusieurs types de tumeurs, avec une plus forte sensibilité au niveau du pré-estomac visible dès 25 ppm (p<0,001) (tableau 9). Une diminution du taux de survie des animaux a été observée dès 25 ppm et serait due à la formation précoce de tumeurs.
Incidence des tumeurs (papillomes et carcinomes combinés) chez les femelles (souris) Beland et Culp, 1998 ; Culp et al., 1998
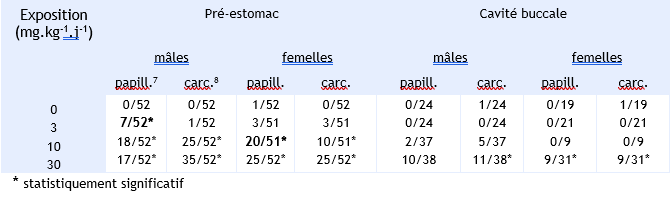
Une étude par gavage chez le rat Wistar, mâles et femelles, aux doses de 0, 3, 10 et 30 mg.kg-1.j-1 de benzo(a)pyrène (pureté 98,6 %) en solution dans l’huile de soja 5 jours par semaine pendant 2 ans, a montré une augmentation significative dose-dépendante de l'incidence de tumeurs malignes et bénignes au niveau du foie et du pré-estomac, mais également des sarcomes des tissus mous au niveau de l'œsophage, de la peau et des glandes mammaires, ou encore des tumeurs du canal auditif, de la cavité buccale, de l'intestin grêle et des reins (Kroese et al., 2001 ; Wester et al., 2012).
Incidence des principales tumeurs observées dans l’étude de Kroese et al.,1999, 2001:
 [7] Papillomes[8] Carcinomes
[7] Papillomes[8] Carcinomes
Les mâles se sont montrés plus sensibles aux effets du benzo(a)pyrène pour l’augmentation significative dose-dépendante de l’incidence des papillomes gastriques (à partir de 3 mg.kg-1) que les femelles (10 mg.kg-1).
Dans une autre étude de cancérogénèse, des tumeurs de l’estomac, de l’œsophage et du larynx avaient été décrites chez le rat exposé, 5 jours par semaine, à 0,15 mg.kg-1 de benzo(a)pyrène (Brune et al., 1981).
Voie cutanée
Des tumeurs cutanées ont pu être observées après l’application de benzo(a)pyrène sur la peau de souris, de rats, de lapin ou de hamster (en absence de promoteur exogène) (US EPA, 2017). Quelques-unes des études réalisées chez la souris, espèce la plus sensible, sont succinctement présentées.
Lors des études de cancérogenèse réalisées sur la peau de souris, le benzo(a)pyrène est l’hydrocarbure aromatique polycyclique qui a induit le plus grand nombre de tumeurs dans le délai le plus court après le dibenzo(a,h)anthracène (IARC, 1973).
Chez la souris, la dose de benzo(a)pyrène induisant des tumeurs varie en fonction du type de véhicule utilisé. Des concentrations déférentes de benzo(a)pyrène dissout soit dans une solution de décaline, soit dans un mélange n-dodécane, décaline ont été appliquées sur le dos des souris pendant 50 semaines. Vingt et un pour cent des animaux présentaient des tumeurs malignes pour une dose de 0,0054 mg.kg-1.j-1 de benzo(a)pyrène lorsque ce dernier est dissout dans le mélange n-dodécane, décaline. Alors que 42 % des tumeurs cutanées ont été observées à partir de 4,8 mg.kg-1.j-1 de benzo(a)pyrène dissout dans de la décaline seule (Bingham et Falk, 1969).
Une application cutanée hebdomadaire pendant 29 semaines aux doses de 16, 32 et 64 µg montre que les premières tumeurs surviennent entre 12 et 14 semaines après le début de l’exposition pour les deux doses les plus élevées et après 18 semaines pour la dose la plus faible. L’évolution du stade de papillome bénin au stade de carcinome malin se produit en 8,1+ 4,5 semaines (Albert et al., 1991a). Il existe une relation dose-effet. Les mécanismes de formation tumorale correspondent à la fois à une prolifération cellulaire et à des dommages génétiques.
Une exposition de 19-20 semaines induit chez la souris la formation de papillomes et de carcinomes (Cavalieri et al., 1988 ; Shibik et Porta, 1957). Le benzo(a)pyrène est un initiateur tumoral. L’application topique sur le dos de souris d’une dose unique induit 80-92 % de papillomes quand il est associé avec l’acétate de tétradécanoyl phorbol (TPA) ou l’huile de croton favorisant la promotion tumorale (Cavalieri et al., 1988). L’application topique de 10 doses de benzo(a)pyrène (0,1 mg.dose-1) sur le dos de souris (Swiss) pendant 20 semaines provoque l’apparition de tumeurs cutanées quand il est associé avec l’huile de croton (Hoffmann et al., 1972).
Synthèse
Chez l’animal, l’exposition au benzo(a)pyrène par inhalation provoque des tumeurs des voies respiratoires alors que par voie orale, elle induit des tumeurs au niveau de différents organes (papillomes et carcinomes du tube digestif, adénomes pulmonaires, leucémies). Par voie cutanée, le benzo(a)pyrène est utilisé en tant que modèle de cancer cutané.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1B | 2008 |
Chez l'homme
Toutes voies
Aucune étude n’a évalué le potentiel génotoxique du benzo(a)pyrène seul chez l’homme, quelle que soit la voie d’exposition. Dans des fonderies, des mesures individuelles réalisées sur des travailleurs exposés à des mélanges de HAP ont permis de relever des concentrations de benzo(a)pyrène comprises entre 2 et 60 ng.m-3. Des prélèvements ont permis d’y associer la présence de 1-hydroxypyrène urinaire, ainsi que la présence d’adduits benzo(a)pyrène-ADN au niveau des leucocytes sanguin (Santella et al., 1993). Plusieurs études ayant réalisés des tests d’aberrations chromosomiques et/ou du micronoyau avec blocage de la cytokinèse sur des leucocytes ont montré les effets génotoxiques de l’exposition aux mélanges de HAP dans les usines de coke (Ada et al., 2013 ; Duan et al., 2009 ; Kalina et al., 1998 ; Qiu et al., 2007 ; Siwińska et al., 2004). Ces résultats sont observés pour des niveaux moyens d’1-hydroxypyrène urinaire de 0,82 µmol.mol-1 créatinine ± [0,05 à 14,99] chez des travailleurs exposés et de 0,23 µmol.mol-1 créatinine ± [0,01 à 2,69] chez les témoins, avec en moyenne 50 personnes par groupe.
1-hydroxypyrène urinaire : Utilisé pour la surveillance biologique des HAP
Synthèse
Aucune étude chez l’homme ne permet d’attribuer la formation d’adduit à l’ADN au benzo(a)pyrène seul en dehors des études in vitro (métabolite du benzo(a)pyrène).
Chez l'animal
Toutes voies
Chez l’animal, des femelles gestantes de singe Erytrocebus patas ont été traitées avec une dose unique de benzo(a)pyrène (5 ou 50 mg.kg-1) par voie orale à J50, J100 et J150 de la gestation (terme à 160 jours). Les fœtus ont été étudiés après césarienne 1 à 50 jours après le traitement. Les organes, le placenta, le foie des mères ont été observés pour vérifier la présence d’adduits. La concentration en adduits ADN-benzo(a)pyrène est très importante dans les organes fœtaux, les placentas et les foies maternels tout au long de la gestation avec un pic au milieu de la gestation (Lu et al., 1993).
Des souris ont été nourries pendant 21 jours avec 0 - 0,0325 – 0,1825 – 1,625 – 3,25 – 6,5 mg.kg-1.j-1 de benzo(a)pyrène. Des observations ont été réalisées sur le foie, les poumons, le pré-estomac afin de vérifier les concentrations en adduits ADN-benzo(a)pyrène. La concentration d’adduits augmente de manière linéaire dans le foie et les poumons alors qu’elle prend une forme de plateau pour les doses les plus élevées au niveau du pré-estomac (Culp et Beland, 1994).
L’exposition par voie orale à une dose de 10 mg.kg-1 chez la souris provoque des mutations génétiques mises en évidence par le test « mouse coat color spot test » (Davidson et Dawson, 1976, 1977). L’exposition par voie orale de souris à une dose unique variable entre 62,5 et 500 mg.kg-1 provoque une augmentation de l’apparition de micronoyaux au niveau des cellules de la moelle osseuse 48 heures après l’administration (Awogi et Sato, 1989). Cette observation a été confirmée dans d’autres études dans lesquelles des doses simple, double ou triple ont été testées chez des rats ou des souris de différentes souches et pour lesquelles différents types cellulaires ont été analysés : érythrocytes polychromatiques de la moelle osseuse, réticulocytes sanguins périphériques (Shimada et al., 1990 ; Shimada et al., 1992).
Une méta-analyse regroupant des études in vivo chez le rongeur relatives aux augmentations de la fréquence de micronoyaux dans le sang a permis d’établir une BMD10 de 1,28 mg.kg-1 de masse corporelle pour le benzo(a)pyrène (Hernández et al., 2011).
Synthèse
Chez l’animal, plusieurs études ont permis d’observer la formation d’adduits benzo(a)pyrène-ADN. Le benzo(a)pyrène est classé génotoxique 1B pour l’Union Européenne, un mécanisme d’action sans seuil étant retenu.
In vitro
Organismes eucaryotes
Les études in vivo étant nombreuses, les études in vitro n’ont pas été rapportées ici.
Le mécanisme d’action génotoxique du benzo(a)pyrène passe par la formation d’espèces très réactives issues de l’activité des CYP450 et époxydes hydrolases, elles-mêmes sous contrôle de la liaison du benzo(a)pyrène à l’AhR (Aryl hydrocarbon receptor). Plusieurs voies métaboliques ont été identifiées, parmi lesquelles celles aboutissant à la formation de diols-époxydes, la plus étudiée, mais aussi d’un radical cation ou de l’ortho-quinone. Les diols-époxydes sont les métabolites les plus réactifs (plusieurs formes stéréochimiques), capables de se lier de façon covalente aux macromolécules cellulaires, en particulier les protéines et l’ADN pour former des adduits (le plus fréquemment par liaison covalente en position N2 de l’ADN). L’implication des adduits à l’ADN dans les mécanismes de cancérogenèse a été largement étudiée. Parmi les diols-époxydes, le benzo(a)pyrène-7,8-diol-9,10-époxyde (BPDE) a été identifié comme étant le plus mutagène, notamment particulièrement impliqué dans le processus tumoral pulmonaire chez la souris et l’humain en étant à l’origine de mutations, notamment dans des gènes sensibles comme le gène suppresseur de tumeurs p53 (Campling et El-Deiry, 2003 ; DeMarini et al., 2001). L’exposition in vitro au BPDE de lymphocytes de sujets diagnostiqués pour des cancers du poumon (Li et al., 2001b) ou des cancers épidermoïdes au niveau de la tête ou du cou (Li et al., 2001a) entraine la formation d’adduits ADN-BPDE (métabolite du benzo(a)pyrène) de manière significativement plus importante que chez des sujets sains. Le nombre d’adduits était de 93,2 ± 89,3 (déviation standard pour 109 nucléotides) pour le cancer du poumon versus 63,7 ± 61,1 chez les témoins, et de 76,8 ± 77,4 (déviation standard pour 107 nucléotides) pour les cancers cutanés versus 47,1 ± 48,0 chez les témoins (p<0,01)). Plus forte susceptibilité des patients nouvellement diagnostiqués (cancer du poumon : étude assez orientée tabac. Un autre mécanisme impliquant la formation d’un cation radical du benzo(a)pyrène (carbone 6) via une oxydation monoélectronique catalysée par les activités peroxydases des cytochromes P450 conduirait également à la formation d’adduits instables avec les bases puriques de l’ADN (C8 et N7 de la guanine et N7 de l’adénine) (Cavalieri et Rogan, 1995). Ces cations constituent une autre classe de métabolites impliqués dans le processus de cancérogénèse (IARC 2012). D’après l’IARC, ces deux mécanismes seraient prépondérants dans le processus de cancérogène associé aux tumeurs cutanées chez la souris (Melendez-Colon et al., 1999). Une troisième voie d’activation métabolique, impliquant la formation de benzo(a)quinone et faisant intervenir des aldo-céto réductases, est la source de formation d’espèces réactives de l’oxygène. Ces espèces sont aussi susceptibles d’entraîner des dommages à l’ADN : formation d’adduits et cassures de brins d’ADN dans les cellules pulmonaires humaines (Mangal et al., 2009 ; Park et al., 2006).
L’analyse globale des données confère au benzo(a)pyrène la capacité de jouer un rôle aussi bien dans la phase d’initiation, que dans la phase de promotion du processus de cancérogénèse notamment par l’intervention de processus épigénétiques impliquant l’hyperméthylation des cadhérines. Le benzo(a)pyrène est considéré comme une substance cancérogène génotoxique dont le mode d’action repose sur une absence de seuil.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 1B | 2008 |
Chez l'homme
Toutes voies
Chez des femmes chinoises exposées à 0 - 0,184 - 0,383 mg.m-3 de benzo(a)pyrène (exposition à des mélanges de HAP en fonction du mode de cuisson des aliments), des adduits benzo(a)pyrène-ADN ont été retrouvés dans le placenta chez 5, 47 et 58 % des femmes respectivement (Mumford et al., 1993a ; Mumford et al., 1993b).
Synthèse
Les rares études disponibles pour les effets sur la reproduction du benzo(a)pyrène chez l’homme montrent la présence d’adduits à l’ADN dans le placenta.
Chez l'animal
Inhalation
Chez des rats exposés par inhalation (« nose only ») à du benzo(a)pyrène (75 µg.m-3, 4 heures par jour) pendant 60 jours, des baisses du poids des testicules (p<0,025), du poids et de la longueur des tubules (p<0,002) et de la production journalière de spermatozoïdes (p<0,05) ont été observées (Archibong et al., 2008 ; Ramesh et al., 2008). Ces effets ont été accompagnés par une diminution des concentrations plasmatique et intra-testiculaire de testostérone et l’augmentation concomitante de LH plasmatique, témoignant de l’atteinte de la fonction endocrine et testiculaire par le benzo(a)pyrène.
Voie orale
Des souris CD-1 gestantes ont été exposées à 10, 40 et 160 mg.kg-1.j-1 de benzo(a)pyrène par voie orale pendant 10 jours. Les effets de cette exposition ont été étudiés sur la génération F1 qui a été accouplée à un lot d’animaux non traités (MacKenzie et Angevine, 1981). Cette étude a permis de révéler que le benzo(a)pyrène administré par gavage chez la souris CD-1 en gestation induit une diminution du nombre de parturitions et une augmentation de la stérilité chez les jeunes. Cette atteinte transgénérationnelle de la fertilité a été confirmée chez des petites femelles exposées in utero (10 mg.kg-1) (accouplées à des mâles non traités) à partir d’un protocole similaire toujours chez la souris (Kristensen et al., 1995).
Sur une autre souche de souris (Swiss), l’exposition par voie orale à 33,3 - 66,7 et 133,3 mg.kg-1.j-1 de benzo(a)pyrène pendant 10 jours n’a permis d’observer aucun effet sur la fertilité (Rigdon et Neal, 1965).
L’exposition par voie orale à 0,1 % de benzo(a)pyrène chez le rat pendant 28 jours n’a pas montré d’effet sur le cycle œstrogénique des femelles mais une diminution du nombre de gestations est rapportée chez le rat femelle exposé au benzo(a)pyrène par contamination de la nourriture, ainsi que des effets sur le développement des petits (Rigdon et Rennels, 1964).
Ces études montrent qu’il existe une toxicité sur la reproduction chez l’animal, mais qu’elle dépend de l’espèce, de la souche et des niveaux de doses administrés.
Des travaux plus récents ont mis en évidence une toxicité ovocytaire chez des femelles exposées à 10 mg.kg-1 de benzo(a)pyrène tous les 2 jours pendant 60 jours notamment marquée à la plus forte dose par une baisse du poids absolu et relatif des ovaires (p<0,05), une diminution du nombre de follicules primordiaux (p<0,05) ainsi qu’une augmentation de la durée des cycles œstraux (p<0,05) et une diminution de la de la sécrétion sérique d’œstradiol (p<0,05) (Xu et al., 2010). Le traitement administré à la dose inférieure de 5 mg.kg-1 n’a eu aucun effet significatif sur les paramètres examinés.
Concernant les mâles, le benzo(a)pyrène administré pendant 10 jours par voie orale à une dose de 50 mg.kg-1 est responsable d’une forte toxicité testiculaire se traduisant à la fin du traitement par une diminution de 40 % du nombre total et de 42 % de la production journalière de spermatozoïdes (p<0,05), associée à une baisse de la mobilité (p<05). Cette toxicité spermatique a été confortée par une diminution du poids relatif des testicules (environ 35 %) et de sévères lésions histologiques des tubes séminifères (Arafa et al., 2009). Un déséquilibre de la balance oxydants/anti-oxydants serait, selon les auteurs de l’étude, au moins en partie à l’origine des effets testiculaires induits par le benzo(a)pyrène.
A de plus faibles doses de 1 ou 5 mg.kg-1 administrée par voie orale chez le rat pendant de 90 jours, une autre voie mécanistique impliquant l’activation des macrophages testiculaires a été suggérée par l’équipe de Zheng (Zheng et al., 2010). L’augmentation de la production d’IL-1β par les macrophages activés agirait comme un inhibiteur de la stéroïdogenèse, et serait donc à l’origine de la baisse de production de testostérone.
Voie cutanée
A notre connaissance, il n’existe pas d’étude disponible.
Synthèse
Chez l’animal le benzo(a)pyrène altère la fertilité des femelles et des mâles après exposition par voie orale et/ou par inhalation de benzo(a)pyrène, y compris après une exposition in utero.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 1B substance devant être assimilée à des substances altérant la fertilité dans l’espèce humaine ou causant des effets toxiques sur le développement dans l’espèce humaine » | 2008 |
Chez l'homme
Toutes voies
Aucune étude n’est disponible chez l’homme concernant les effets de la toxicité du benzo(a)pyrène seul sur le développement. Néanmoins, des effets sur le développement ont été rapportés dans des études humaines d’exposition in utero aux HAP, mentionnant notamment des diminutions du poids de naissance, de la croissance pondérale post-natale, du périmètre crânien, de même que l’augmentation de la fréquence de fausses couches et de naissance prématurée (US EPA, 2017).
Inhalation
Des mesures individuelles de l’exposition environnementale aux HAP (8 dont le benzo(a)pyrène) réalisées pendant 2 jours consécutifs au cours du 3ème mois de grossesse de 263 femmes Dominicaines et Afro-américaines résidents dans les centres urbains de Washington et New York ont permis d’établir un lien significatif avec un petit poids de naissance (p=0,003) et une diminution du périmètre crânien (p=0,01) (Perera et al., 2003). Seule l’inhalation de la concentration totale de HAP en moyenne de 3,7 ng.m-3 sur l’ensemble de l’échantillon est rapportée. Sur cette même cohorte, aucune association significative entre la formation d’adduits (benzo(a)pyrène-ADN sur leucocytes) chez les mères et le poids de naissance n’a été observée (Perera et al., 2004).
Les effets de l’exposition environnementale aux HAP (estimée en moyenne à 2,26 ng.m-3 dans le quartile le plus élevé) sur le développement neurologique ont été plus particulièrement examinés dans deux cohortes évoquant notamment un effet possible, une réduction des facultés cognitives (Perera et al., 2009 ; Tang et al., 2008), des déficits de la fonction neuromusculaire (Tang et al., 2008), des troubles de l’attention et un comportement anxieux ou dépressif consécutifs à une exposition prénatale aux HAP (Perera et al., 2012). Ces résultats sont issues deux cohortes de naissances, l’une en Chine (110 femmes enceintes vivants à proximité d’une centrale thermique recrutées entre mars et juin 2002) et l’autre aux Etats-Unis (exposition de 253 mères recrutées entre 1998 et 2003 à l’environnement urbain et plus particulièrement en 2001 aux fumées des incendies du World Trade Center) où les études ont eu recours à des dosages spécifiques du benzo(a)pyrène (formation d’adduits à l’ADN dans le sang du cordon ombilical).
Voie orale
Par voie alimentaire, deux autres études ont recherché les effets de l’exposition pendant la grossesse au benzo(a)pyrène et d’autres HAP (estimation de l’exposition par questionnaire) sur le poids et la taille à la naissance. La première cohorte espagnole de 657 femmes a mis en évidence une association entre l’exposition au benzo(a)pyrène (consommation moyenne estimée à 0,19 ± 0,6 µg benzo(a)pyrène.j-1) avec la diminution du poids et de la taille à la naissance, ainsi qu’un petit poids pour l’âge gestationnel uniquement chez les femmes dont la consommation de vitamine C était faible (Duarte-Salles et al., 2012). Une seconde étude réalisée sur une plus large population de 50 651 femmes enceintes en Norvège a confirmé l’association entre l’apport alimentaire de benzo(a)pyrène avec une baisse du poids et de la taille des nourrissons chez toutes les femmes, y compris les non-fumeuses (comparaison entre les femmes du 1er tertile, exposition estimée à 125 ± 33 ng benzo(a)pyrène.j-1 et celles du 3ème tertile, exposition estimée à 175 ± 53 ng benzo(a)pyrène.j-1). Chez les femmes consommant moins de 85 mg.j-1 de vitamine C (valeur recommandée), l’association était plus forte, suggérant un effet protecteur par la vitamine C vis-à-vis des effets du benzo(a)pyrène sur le développement in utero (Duarte-Salles et al., 2013).
Dans un contexte similaire, une petite étude (29 cas – 31 témoins) rapporte une augmentation non significative du dosage placentaire de benzo(a)pyrène (moyenne de 13,85 ± 7,06 ppb) chez les femmes ayant accouché prématurément par comparaison au groupe témoin (moyenne de 8,83 ± 5,84 ppb) (Singh et al., 2008). D’autres HAP, fluoranthène et benzo(b)fluoranthène, ont été significativement augmenté (p<0,05), l’exposition aux HAP pendant la grossesse étant d’origine environnementale et alimentaire (principale source).
Synthèse
Aucune information n’est disponible quant aux effets sur le développement du benzo(a)pyrène seul chez l’homme. L’exposition aux HAP contenant notamment du benzo(a)pyrène induit une diminution du poids de naissance, de la croissance pondérale post-natale, du périmètre crânien, de même que l’augmentation de la fréquence de fausses couches et de naissance prématurée.
Chez l'animal
Inhalation
Par inhalation, une augmentation dose-dépendante de la mortalité embryonnaire et fœtale est visible dès la plus faible dose testée de 25 µg.m-3 (-19 %) pour une exposition entre les 11 et 20èmes jours de gestation chez le rat (Archibong et al., 2002 ; Wu et al., 2003). Etude sur le développement pour des expositions par inhalation:

Voie orale
Plusieurs études par voie orale ont montré que l’exposition in utero au benzo(a)pyrène est embryo- et fœtotoxique (résorptions embryonnaires et fœtales), et entraîne une diminution du poids des petits après la naissance.
Principales études sur le développement (exposition au benzo(a)pyrène in utero ou néonatale) pour des expositions voie orale :

Une baisse d’environ 40 % de la taille des portées a été décrite chez des souris traitées par gavage du 7 au 16ème jour de gestation à des doses de 160 mg.kg-1.j-1 de benzo(a)pyrène, l’effet n’étant plus visible aux doses inférieures de 40 et 10 mg.kg-1.j-1 (MacKenzie et Angevine, 1981). Une diminution du poids des petits, apparente à la plus faible dose testée de 10 mg.kg-1.j-1 seulement 42 jours après la naissance est également rapportée.
A de plus faibles doses par voie orale (jusqu’à 1,2 mg.kg-1.j-1), l’exposition de benzo(a)pyrène pendant la gestation est sans effet sur la taille des portées chez le rat (Brown et al., 2007 ; Jules et al., 2012 ; McCallister et al., 2008).
Dans les études où l’exposition a été réalisée après la naissance, une baisse de poids des petits en moyenne de 10 à 20 % a été observée pour des doses se situant dans la fourchette de 2 à 25 mg.kg-1.j-1 (Chen et al., 2012 ; Liang et al., 2012).
Il a par ailleurs été observé chez la souris que ces effets embryo/foetotoxiques dépendent partiellement de la capacité d’induction des récepteurs Ah des cytochromes P450 de la mère et du fœtus. Cette capacité d’induction est elle-même dépendante du patrimoine génétique de chaque individu. Les différents protocoles expérimentaux utilisés montrent également l’importance de la voie d’administration (orale ou intrapéritonéale) dans l’induction des effets (Hoshino et al., 1981 ; Legraverend et al., 1984 ; Shum et al., 1979).
Chez des souris (Ah-/-), génotype non inductible du gène Ah codant pour l’arylhydrocarbone hydroxylase (enzyme impliquée dans le métabolisme du benzo(a)pyrène) exposées par voie orale du 2 au 10ème jour de gestation à 120 mg.kg-1.j-1 de benzo(a)pyrène, la toxicité intra-utérine des embryons Ah-/- (résorptions et malformations) était nettement plus marquée que celle des embryons Ah+/-(Legraverend et al., 1984). Dans les mêmes conditions d’exposition, aucune différence portant sur les allèles des embryons n’est visible quand les mères sont de génotype (Ah+/-). Par des analyses ex-in vivo, il a été montré que la faible activité métabolique des mères Ah-/- (cellules intestinales et hépatiques) conduit à une exposition in situ des embryons plus élevée au benzo(a)pyrène que les mères Ah+/- ; la concentration des métabolites toxiques (1,6-benzo(a)pyrène et 3,6-quinones) est plus importante chez les embryons Ah-/- que chez les embryons Ah-/+. Par voie intrapéritonéale, les résultats sont inversés, (Hoshino et al., 1981), et soulignent l’importance de la voie d’entrée pour des composés tératogènes agissant sur leur propre métabolisme.
En ce qui concerne les effets sur le développement du système nerveux, des études ont examinés en détail les effets du benzo(a)pyrène administré à de faibles doses (0,02 à 20 mg.kg-1.j-1) oralement à de jeunes animaux, rats et souris, juste après la naissance. Les résultats les plus convainquant émanent de deux études qui ont évalué les animaux au moyen d’une batterie de tests neurocomportementaux et qui ont pu observer chez le rat ou la souris des déficits probants aux tests de mémoire, d’apprentissage et de comportements anxieux, ou encore au niveau de l’apprentissage sensorimoteur et de la fonction neuromusculaire, avec le plus souvent des effets sur plusieurs paramètres testés individuellement dans différents tests comportementaux (Bouayed et al., 2009 ; Chen et al., 2012).
Effets du benzo(a)pyrène sur le développement neurologique chez le rongeur:
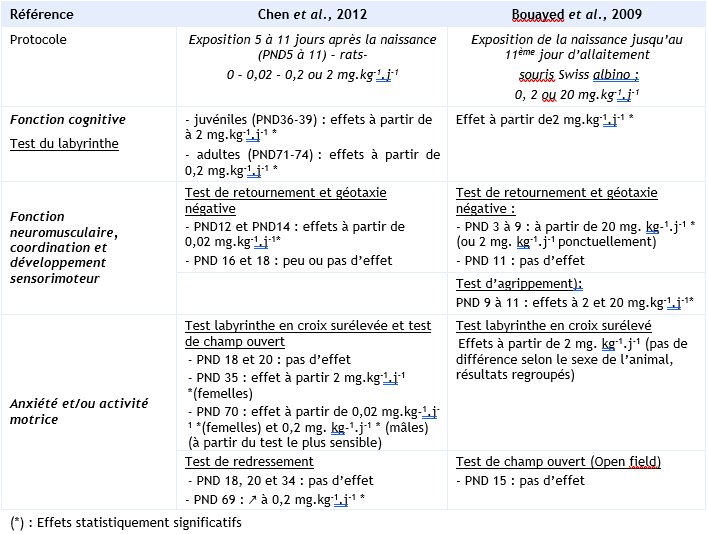
Malgré la différence de protocole de ces deux études (différentes espèces ; exposition via l’allaitement versus par gavage, il persiste une cohérence dans les résultats observés à des doses comparables ≥ à 0,2 mg.kg-1.j-1 (Chen et al., 2012) et ≥ à 2 mg.kg-1.j-1 (Bouayed et al., 2009), et en absence de toxicité maternelle ou de toxicité néonatale. Dans ces études, les déficits neurocomportementaux sont visibles dès la période néonatale jusque chez les jeunes adultes, comprenant des effets du traitement à la fois chez les animaux après sevrage, les animaux pré-pubères et sexuellement matures, ce qui suggère que les effets du benzo(a)pyrène sur le développement neurologique puisse être irréversibles (US EPA, 2017).
Parmi les tests réalisés dans l’étude de Chen et al., 2012, les paramètres les plus convaincants en termes de toxicité neurocomportementale ont été observés à partir des tests de champ ouvert, le labyrinthe aquatique de Morris et le test de labyrinthes surélevés. Les résultats, similaires dans les deux cohortes de rats testés, ont montré que les écarts de comportement persistent, avec notamment un comportement anxieux qui s’aggrave après des semaines et des mois chez les animaux juvéniles et adultes exposés juste après la naissance.
Des effets sur le développement cardio-vasculaire ont également été observés sur la descendance de rates exposées par voie orale (gavage) à différentes doses de 0, 150, 300 ou 600 mg.kg-1.j-1 de benzo(a)pyrène entre le 14 et 17ème jour de gestation. Les auteurs ont observé chez les petits de 53 jours une augmentation significative de la tension artérielle systolique à partir de 300 mg.kg-1.j-1 qui prédispose à des troubles cardiaques plus tard au cours de la vie (Jules et al., 2012).
Synthèse
Chez l’animal, le benzo(a)pyrène passe la barrière placentaire et est embryotoxique/fœtotoxique chez le rat et la souris. Il altère le développement neurologique durablement sur la progéniture.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Qualité des eaux de consommation
France : Décret n° 2001 – 1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l’exclusion des eaux minérales naturelles.
Benzo(a)pyrène : 0,010 µg.L-1
UE : Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine (CE, 1998).
Benzo(a)pyrène : 0,010 µg.L-1
OMS : Directives de qualité pour l’eau de boisson (OMS, 2017).
Benzo(a)pyrène : 0,7 µg.L-1
Qualité de l’air
L’OMS a établi un Excès de Risque Unitaire par inhalation (ERUi) pour un mélange de HAP. Cet ERUi correspond à la probabilité de développer un cancer du poumon après une exposition vie entière à un mélange de HAP. Les effets induits sont attribués au seul benzo(a)pyrène retenu alors comme indicateur. L’ERUi établi par l’OMS est de 8,7.10-2 par µg de benzo(a)pyrène par m3.
UE :
Directive 2004/107/CE du Conseil du 15 décembre 2004 concernant l’arsenic, le mercure, le nickel et les hydrocarbures aromatiques dans l’air ambiant (CE, 2004).
Valeur cible : 1 ng.m-3. Cette valeur ne devra pas être dépassée à partir du 31 décembre 2012.
OMS : Directives de qualité pour l’air (OMS, 2000)
L’OMS a établi un Excès de Risque Unitaire par inhalation (ERUi) pour un mélange de HAP. Cet ERUi correspond à la probabilité de développer un cancer du poumon après une exposition vie entière à un mélange de HAP. Les effets induits sont attribués au seul benzo(a)pyrène retenu alors comme indicateur. L’ERUi établi par l’OMS est de 8,7.10-2 par µg de benzo(a)pyrène par m3.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Informations relatives à l’utilisation des VTR
Seul le benzo(a)pyrène est considéré, la toxicité du benzo(a)pyrène en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Certains HAP disposent d’une fiche de données toxicologiques.
Rappelons que dans le concept de facteur d’équivalence toxique (FET) permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le benzo(a)pyrène est la substance de référence à laquelle un potentiel toxique de valeur 1 est arbitrairement donné.
Même si à ce jour il n’existe pas de VTR pour des expositions cutanées, cette voie d’exposition peut ne pas être négligeable.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition chronique par inhalation
L’US EPA propose une RfC de 2.10-6 mg.m-3 pour une exposition chronique par inhalation au benzo(a)pyrène (2017).
Cette valeur a été calculée à partir d’une étude au cours de laquelle des rats F344 ont été exposés au benzo(a)pyrène par inhalation aux concentrations de 0 – 25 – 75 ou 100 µg.m-3 (« nose only »), 4 heures par jour du 11ème au 20ème jour de gestation (Archibong et al., 2002). L’effet critique retenu est l’augmentation de la mortalité embryonnaire/fœtale (augmentation des résorptions embryonnaires) à partir de 25 µg.m-3 (19 %) (LOAEC).
Cette valeur a été ajustée à une valeur de 4,6 µg.m-3 pour tenir compte du caractère discontinu de l’exposition dans l’étude retenue (PODajusté) :
POD ajusté = 25 µg.m-3 x 4 h/24 h = 4,16 arrondi à 4,2 µg.m-3 (exposition continue)
Une concentration équivalente chez l’homme a ensuite été calculée (PODHEC) à partir d’un facteur RDDRER prenant en compte la masse corporelle (BW), le taux de ventilation (VE) et la fraction totale de déposition (FTOT) à la fois chez l’animal et l’humain (US EPA, 1994) :
PODHEC = PODajusté x RDDRER = PODajusté x BMH/BWA x (VE)A/(VE)H x (FTOT)A/(FTOT)H = 4,2 x 1,1 = 4,62 arrondi à 4,6 µg.m-3
Facteur d’incertitude : Un facteur global de 3 000 a été appliqué correspondant à un facteur de 3 pour l’extrapolation des données animales à l’homme (toxicodynamique), un facteur 10 pour tenir compte de la variabilité entre individus, un facteur 10 car la valeur utilisée est un LOAEL et un facteur 10 en raison des limitations de la base des données.
Calcul : 4,6 10-3 mg.m-3 x 1/3 000 = 1,53 10-6 mg.m-3 arrondi à 2 10-6 mg.m-3
Indice de confiance : Selon l’US EPA, la fiabilité de cette valeur est de faible à moyenne. La confiance dans l’étude source est moyenne. Le niveau de confiance à l’égard des données est jugé faible en raison de l’absence de données issues d’une étude multigénérations et aux différents éléments de toxicité lors d’exposition sub-chronique ou chronique. L’US EPA précise également que la confiance dans la valeur élaborée bénéficie des résultats des études pour des expositions par voie orale et des observations chez l’homme à des mélanges de HAP.
Effets à seuil - Exposition chronique par voie orale
L’US EPA propose une RfD de 3. 10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au benzo(a)pyrène (2017)
Cette valeur est élaborée à partir d’une étude où des ratons ont été exposés par gavage à des doses de 0 – 0,02 – 0,2 ou 2 mg.kg-1.j-1 de benzo(a)pyrène du 5 au 11ème jour après leur naissance (Chen et al., 2012). Les effets sur le développement neurologique, caractérisés par des altérations neurocomportementales persistantes à l’âge adulte, ont été retenus comment étant les plus sensibles vis-à-vis de l’exposition au benzo(a)pyrène. Les mauvais résultats obtenus aux trois tests neurocomportementaux (test du labyrinthe de Morris, test du labyrinthe en croix surélevé et test à champ ouvert) ont été retenus comme étant l’effet critique en raison de la cohérence des résultats (des réponses similaires ont été observées dans deux cohortes de rats différentes, testées à la fois chez l’animal juvénile puis à l’âge adulte ; des effets similaires ont été observés dans plusieurs études), la sensibilité des réponses et la relation dose-effet dans les différents groupes. Par une approche Benchmark Dose sur chacun des trois tests, des BMDL1sd comprises entre 0,092 et 0,16 mg.kg-1.j-1 ont été obtenues. La valeur la plus basse de 0,092 mg.kg-1.j-1 a été retenue comme dose critique.
Facteur d’incertitude : Un facteur global de 300 a été appliqué correspondant à un facteur de 10 pour l’extrapolation des données animales à l’homme, un facteur 10 pour tenir compte de la variabilité entre individus et un facteur 3 en raison des lacunes de la base de données.
Calcul : 0,092 mg.kg-1.j-1 x 1/300 = 3 10-4 mg.kg-1.j-1
Indice de confiance : Selon l’US EPA, la fiabilité de cette valeur est moyenne. Elle correspond à une fiabilité moyenne dans l’étude clé et dans la base de données.
Effets sans seuil chronique par inhalation
L’OMS a établi un ERUi de 8,7.10-5 (ng.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène (OMS, 2000).
Cette valeur a été établie à partir de données épidémiologiques chez des salariés travaillant dans une cokerie (US EPA, 1984). Les effets liés à l’exposition au mélange de HAP émis par la cokerie ont été attribués au seul benzo(a)pyrène retenu alors comme indicateur. L’OMS parle donc d’ERUi pour le benzo(a)pyrène considéré, dans ce cas, comme un indicateur d’un mélange de HAP.
L’OMS a d’abord calculé, en utilisant un modèle linéaire multi-étapes, un excès de risque individuel pour la vie entière associé à une exposition continue à 1 µg.m-3 de la fraction soluble dans le benzène des particules présentes dans les émissions de fours à coke (ancienne méthode de mesure globale des ‘goudrons’ dans les particules de cokeries). Cette valeur a été estimée à 6,2 10-4 (µg.m-3)-1. En utilisant le benzo(a)pyrène comme indicateur du mélange de HAP présent dans les émissions de fours à coke et en tenant compte qu’il y a 0,71 % de benzo(a)pyrène dans la fraction soluble dans le benzène, un ERUi pour le benzo(a)pyrène, considéré comme un indicateur des HAP présents dans l’air, a été estimé par l’OMS à 8,7.10‑2 (µg.m-3)-1.
Il faut noter que cet ERUi a été établi à partir d’une étude dans laquelle les travailleurs ont été exposés à un mélange de HAP et non à du benzo(a)pyrène. De plus, lors de l’établissement de cet ERUi, seules les particules solubles dans le benzène sont prises en considération et l’hypothèse selon laquelle 0,71 % de benzo(a)pyrène sont présents dans la fraction soluble dans le benzène conduit à une surestimation du potentiel cancérigène du benzo(a)pyrène.
Santé Canada propose une valeur 3,1.10-2 (mg.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène (Santé Canada, 2010).Cette valeur a été établie à partir d’une étude de cancérogenèse expérimentale chez le hamster, exposé par inhalation au benzo(a)pyrène à des doses de 0 - 2,2 - 9,5 et 45,6 mg.m-3 durant 96 semaines (7 jours par semaine, 4,5 heures par jour pendant les 10 premières semaines puis 3 heures par jour (Thyssen et al., 1981). L'augmentation de l'incidence des tumeurs (type non spécifié) du tractus respiratoire supérieur (cavités nasales, larynx et trachée) était de 0/27 pour les témoins, 0/27 pour 2,2 mg.m-3, 9/26 (34,6 %) pour 9,5 mg.m-3 et 13/25 (52 %) pour 45,6 mg.m-3. Une augmentation des tumeurs (nature non spécifiée) a été également notée au niveau du pharynx (0, 0, 23 et 56 %), de l'œsophage (0, 0, 0 et 8 %) et de l'estomac (0, 0, 4 et 4 %). Aucune tumeur pulmonaire n'a été observée.La valeur a été estimée à l'aide d'un modèle linéarisé multiples étapes reprenant les données observées au niveau du tractus respiratoire. Le lot exposé à la plus forte dose n'a pas été pris en compte en raison d'une durée de vie trop faible (59 semaines contre 96 semaines dans les autres lots).
L'OEHHA propose un ERUi de 1,1.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène (OEHHA, 2011).Cette valeur a été établie à partir d’une étude de cancérogenèse expérimentale chez le hamster, exposé par inhalation au benzo(a)pyrène à des doses de 0, 2,2, 9,5 et 45,6 mg.m-3 durant 96 semaines (7 jours par semaine, 4,5 heures par jour pendant les 10 premières semaines puis 3 heures par jour) (Thyssen et al., 1981). L'incidence des tumeurs (cellules squameuses néoplasiques) du tractus respiratoire supérieur (cavités nasales, larynx et trachée) était de 0/27 pour les témoins, 0/27 pour 2,2 mg.m-3, 9/26 pour 9,5 (34,6 %) mg.m-3 et 13/25 (52 %) pour 45,6 mg.m-3. L'extrapolation des données expérimentales aux concentrations environnementales a été réalisée en utilisant un modèle multi-étapes linéarisé, en éliminant les données du lot exposé à la plus forte concentration en raison d'une durée de vie trop faible (59 semaines contre 96 semaines dans les autres groupes). En prenant un volume respiratoire de 0,063 m3.j-1 et un poids corporel "standard" de 0,12 kg pour le hamster, une valeur de risque de 0,43 (mg.kg-1.j-1)-1 est obtenue. En utilisant un facteur de correction du poids de (70/0,1)1/3, cette valeur équivaut à un ERUi de 1,1.10-3 (µg.m-3)-1 pour l'homme.
L’US EPA propose un ERUi de 6.10-4 (μg.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène (2017).
Cette valeur a été établie à partir de la même étude de cancérogénèse chez le Hamster de Thyssen et al., 1981que celle choisie par l’OEHHA (2011) et Santé Canada (2010). Il s’agit de la seule étude par inhalation chez l’animal réalisée sur une vie entière.L’excès de risque unitaire a été calculé à partir de l’extrapolation linéaire de la BMCL10 de 0,16 mg.m3, établie selon le modèle multi-étape de Weibull sur la base de l’incidence des tumeurs des voies aériennes supérieures et du pharynx chez le hamster.L’US EPA propose par ailleurs des facteurs d’ajustement (ADAF) pour tenir compte de la susceptibilité des enfants vis-à-vis du risque cancérogène au benzo(a)pyrène : 10 de 0 à 2 ans, 3 de 2 à 16 ans et 1 au-dessus de 16 ans.
L'INERIS propose un ERUi de 1,1.10-3 (µg.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène (2003).
Cette valeur est basée sur celle proposée par l’OEHHA. Afin de proposer un ERUi, l’OEHHA a considéré que le benzo(a)pyrène était un cancérigène sans seuil, puisque de nombreuses études ont montré que le benzo(a)pyrène est génotoxique et qu’il est un initiateur de tumeurs. Cette ERUi provient d’une seule étude expérimentale, correspondant à une exposition au benzo(a)pyrène seul. A ce titre cette valeur peut donc être considérée comme spécifique du benzo(a)pyrène.
L’ANSES propose de retenir un ERUi de 1,1.10-3 (µg.m-3)-1 pour une exposition par inhalation (ANSES, 2010)
Cette valeur est retenue en raison de l’absence de nouvelles VTR depuis la sélection réalisée pour la précédente expertise (AFSSET, 2007). Cette première expertise avait retenu un ERU de 1,1.10-3 (μg.m-3)-1, construit par l’OEHHA en appliquant un modèle linarisé multi-étapes (OEHHA, 2005). Cet ERU prend en compte les tumeurs des voies respiratoires (cavité nasale, larynx, trachée, absence de tumeurs pulmonaires) comme effet critique. Il a été construit en 2002 à partir d’une étude chez le hamster doré syrien mâle exposé par voie inhalée (nasale uniquement) à du benzo(a)pyrène pendant 96 semaines (Thyssen et al., 1981).Cette valeur est identique à l’ERUi développé par l’OEHHA pour une exposition par inhalation.
Effets sans seuil chronique par voie orale
L’US EPA (IRIS) propose un ERUo de 1 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au benzo(a)pyrène (2017).
La valeur s’est appuyée sur deux études d’évaluation de l’induction de tumeurs chez le rat (Kroese et al., 2001) et la souris (Beland et Culp, 1998) lors d’exposition au benzo(a)pyrène par voie orale. Les doses d’exposition (0, 3, 10 et 30 mg.kg-1.j-1 chez le rat et 0 – 0,7 – 3,3 ou 16,5 mg.kg-1.j-1 chez la souris) ont été converties en doses équivalentes humaines, puis un modèle muti-étapes de Weibull a été appliqué pour dériver un excès de risque unitaire pour chaque espèce et type de tumeur associée (extrapolation linéaire à partir de la BMDL10). L’excès de risque unitaire de 1 (mg.kg-1.j-1)-1, basé sur l’induction de tumeur du système digestif (pré-estomac, œsophage, langue et larynx) chez la souris femelle (Beland et Culp, 1998), a été retenu en raison de sa forte sensibilité (valeur la plus élevée parmi les valeurs d’excès de risque associé aux différents types de tumeurs compris entre 0,04 (carcinome urothélial chez le rat) et 0,36 (papillome du pré-estomac et de la cavité buccale chez le rat). Cette valeur d’ERUo de 1 (mg.kg-1.j-1)-1 correspond à 0,01 µg.kg-1.j-1 pour un excès de risque de 10-5 et à 0,001 µg.kg-1.j-1 pour un excès de risque de 10-6.
Le RIVM propose un CRoral de 5.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale au benzo(a)pyrène (Baars et al., 2001).
Cette concentration correspond à un excès de risque cancérogène de 1:10-4 pour une exposition continue durant toute la vie. Elle est issue des données d’une étude expérimentale par gavage chez le rat (0, 3, 10 et 30 mg.kg-1.j-1 durant 2 ans, 5 jours par semaine) (Kroese et al., 2001). Une augmentation dose-dépendante de l'incidence des tumeurs a été observée dans de nombreux organes et tissus, notamment le foie et l'estomac et également l'œsophage, la peau, la glande mammaire, le canal auditif, la cavité orale, l'intestin grêle et les reins. Les auteurs ont conclu à un excès de risque cancérigène 1:106 vie entière de 5 ng benzo(a)pyrène.kg-1.j-1 (soit un ERU = 2.10-1 mg.kg-1.j-1 pour un risque de 10-5).
Selon le RIVM, la fiabilité de cette valeur est élevée.
L'OEHHA propose un ERU0 de 12 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au benzo(a)pyrène (2011).
Cette valeur est issue des données d'une étude de cancérogenèse réalisée chez la souris, exposée au benzo(a)pyrène via l'alimentation durant 4 à 6 mois, à des doses de 50 à 250 mg.kg-1 de nourriture (Neal et Rigdon, 1967). Les animaux ont développé des tumeurs gastriques (papillomes et carcinomes), des adénomes pulmonaires et des leucémies.
Incidence des tumeurs gastriques Neal et Rigdon, 1967
|
Exposition (ppm) |
Dose journalière calculée (mg.kg-1.j-1) |
Incidence des tumeurs gastriques |
|---|---|---|
|
0 1 10 20 30 40 45 50 100 250 |
0 0,078 0,781 1,563 2,344 3,126 3,516 3,908 7,815 19,538 |
0/289 0/25 0/24 1/23 0/37 1/40 4/40 24/34 19/23 66/73 |
Méthode utilisée : modèle multi-étapes linéarisé.
L’ERUo calculé de 12 (mg.kg-1.j-1)-1 correspond à une dose de 0,8 ng.kg-1.j-1 pour un risque de 10-5 et 0,08 ng.kg-1.j-1 pour un risque de 10-6.
Santé Canada propose un ERU0 de 2,3 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au benzo(a)pyrène (2010).
Cette valeur a été construite à partir de la même étude de cancérogénèse expérimentale chez la souris (Neal et Rigon, 1967) que celle choisie par l’OEHHA (2011). L’effet critique retenu a également concerné l’apparition de tumeurs gastriques, principalement des papillomes des cellules squameuses, accompagnées de quelques carcinomes.
Méthode utilisée : extrapolation linéaire en tenant compte de la surface exposée.
L’ERUo calculé de 12 (mg.kg-1.j-1)-1 correspond à une dose de 0,15 ng.kg-1.j-1 pour un risque de 10-5 et 0,015 ng.kg-1.j-1 pour un risque de 10-6.
L’ANSES propose de retenir une valeur de 0,005 µg TEQ.kg-1.j-1 pour une exposition chronique par voie orale à 11 HAP (ANSES, 2016).
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM.
Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
Pour les autres HAP, l’AFSSA recommande l’utilisation de facteurs d’équivalence toxiques (TEF) basée sur le pouvoir cancérigène relatif des HAP. Dans le cadre de l’étude sur l’alimentation totale infantile, l’ANSES (2016) a considéré 11 HAP (benzo(a)anthracène, benzo(a)pyrène, benzo(b)fluoranthène, chrysène, benzo(g,h,i)perylène, benzo(k)fluoranthène, dibenzo(a,h)anthracène, indeno(1,2,3-cd)pyrène, anthracène, benzo(j)fluoranthène et fluoranthène) les plus toxiques et les plus représentatifs de la contamination alimentaire. L’ANSES (2016) a alors considéré qu’il était possible de calculer un excès de risque de cancer de 10-6 sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1 (RIVM 2001). Cette DVS a été établie sur la base d’apparition de tumeurs dans de nombreux organes (dont principalement le foie et le pré-estomac) observée au cours d’une étude réalisée chez le rat exposé par gavage pendant 2 ans au benzo(a)pyrène.
L’INERIS propose un ERUo de 2.10-1 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au benzo(a)pyrène (INERIS, 2003).
Comme précisé ci-dessus, l'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
En 2003, l’INERIS retenait la proposition de l’AFSSA (2003) et proposait donc pour le benzo(a)pyrène l’utilisation de la valeur établie par le RIVM. Le RIVM détermine une dose virtuellement sûre (DVS) de 5 ng.kg-1.j-1, par un modèle d'extrapolation linéaire à l'origine, en retenant la dose critique de 10 mg.kg-1.j-1 de B(a)P administrée à l'animal induisant l'apparition significative de tumeurs, et après ajustement de la durée d’administration et d’observation. Cette DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
Elle correspond à 50 ng.kg-1.j-1 pour un excès de risque de 10-5 et 5 ng.kg-1.j-1 pour un excès de risque de 10-6.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil chronique par inhalation
L’INERIS propose de retenir pour une exposition chronique au benzo(a)pyrène par inhalation la VTR chronique de 2.10-6 mg.m-3 de l’US EPA (2017).
Cette valeur est basée sur la seule VTR disponible, celle de l’US EPA (2017). La qualité de l’étude clé (Archibong et al., 2002) est recevable, mais le schéma expérimental peu adapté à la construction d’une valeur pour des expositions chroniques. L’effet critique retenu (augmentation de la mortalité embryonnaire/fœtale) est cohérent avec le profil toxicologique. La construction de la valeur est justifiée ; l’utilisation d’un facteur global d’incertitude de 3 000 limite la confiance dans cette valeur. Cette valeur est retenue par défaut.
Indice de confiance : retenue « par défaut » du fait de l’utilisation d’un facteur d’incertitude de 3 000.
Effets à seuil chronique par voie orale
L’INERIS propose de retenir pour une exposition chronique au benzo(a)pyrène par voie orale la VTR chronique de 3. 10-4 mg.kg-1.j-1 de l’US EPA (2017).
Cette valeur est basée sur la seule VTR disponible, celle de l’US EPA (2017). L’étude est de bonne qualité (Chen et al., 2012) et l’effet critique (altérations neurocomportementales) cohérent avec le profil toxicologique. La construction de la valeur est justifiée. Cette valeur est retenue.
Indice de confiance : moyen compte tenu de l’indice de fiabilité moyen accordé par l’US EPA.
Effets sans seuil chronique par inhalation
L’INERIS propose de retenir un ERUi de 6.10-4 (µg.m-3)-1 pour une exposition chronique par inhalation au benzo(a)pyrène pour des effets sans seuil (US EPA (IRIS), 2017).
Sur la base des argumentations développées par l’INERIS en 2003, le choix est confirmé en 2010.
Six organismes proposent des VTR pour des expositions chroniques au benzo(a)pyrène par inhalation, pour les effets sans seuil : l’ANSES (2010), l’INERIS (2003), l’OEHHA (2011), l’OMS (2000), Santé Canada (2010) et l’US EPA (2017).
La valeur proposée par l’OMS est construite à partir d’études épidémiologiques dans des cokeries où les travailleurs sont exposés à un mélange de HAP non défini. Le benzo(a)pyrène constitue dans cette étude un indicateur de mélange. Cette valeur surestime probablement le potentiel cancérigène du benzo(a)pyrène. Cette VTR peut être utilisée dans le cas bien précis d’exposition dans, ou à proximité d’une cokerie mais ne peut être utilisé dans les autres cas d’exposition.
Les valeurs de l’OEHHA, Santé Canada, l’US EPA, l’ANSES et l’INERIS sont toutes construites à partir de la même étude expérimentale chez le hamster. Cette étude est de bonne qualité. L’effet critique est l’apparition de tumeurs respiratoires ce qui est cohérent avec les éléments du profil toxicologique. Tous les organismes ont utilisé un modèle linéarisé multi-étapes pour la modélisation des données.
La construction de la valeur de l’OEHHA est bien détaillée et suit une approche classique mais a rejeté le lot exposé à la plus forte dose du fait d’une durée de vie plus courte. C’est cette valeur qui a été retenue par l’ANSES et l’INERIS dans leurs analyses.
En 2017, sur la même base l’US EPA propose une modélisation passant par un calcul de benchmark dose. Cette approche qui intègre l’ensemble des données est actuellement préférée quand elle possible. Les valeurs obtenues par les deux approches sont finalement très proches.
In fine, il est proposé de retenir cette nouvelle construction de l’US EPA : ERUi 6.10-4 (µg.m-3)-1 soit une concentration de 1,67 10-2 µg.m3 pour un risque de 10-5 ou à une concentration de 1,67 10-3 µg.m3 pour un risque de 10-6.
Indice de confiance : élevé du fait de la qualité des données disponibles et de la méthode utilisée.
Effets sans seuil chronique par voie orale
L’INERIS propose de retenir un ERUo de 1 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au benzo(a)pyrène pour des effets sans seuil (US EPA (IRIS), 2017).
Sur la base des argumentations développées par l’AFSSA (2003) et reprises par l’INERIS la même année, le choix réalisé en 2003 avait été confirmé en 2010.
Quatre organismes proposent des VTR pour l’exposition par voie orale pour des effets sans seuil : l’US-EPA (2017), l’OEHHA (2011), le RIVM (2001), Santé Canada (2010). L’OEHHA et Santé Canada ont construit leur valeur à partir d’une étude de cancérogenèse chez la souris (Neal et Rigon, 1967) alors que le RIVM retient une étude chez le rat (Kroese et al., 2001). L’US EPA a retenu les résultats de deux études une chez le rat (Kroese et al., 2001) et l’autre chez la souris (Belan et Culp, 1998).
Les études de Kroese et al. et de Beland et Culp, sont de bonne qualité alors que celle de Neal et Rigon présente des limites. L’effet critique (tumeurs hépatiques et stomacale) et la méthode de construction du RIVM ne sont pas clairement détaillés. C’est cette valeur qui avait été précédemment retenue par l’AFFSA et l’INERIS.
Sur la base deux études de bonne qualité, en 2017, l’US EPA a calculé des doses équivalentes pour l’homme, réalisé une modélisation puis une extrapolation linéaire à partir de la BMDL pour plusieurs effets critiques et a retenu la valeur la plus protectrice. Cette méthode est clairement détaillée et est cohérente avec les pratiques actuelles. Un ERUo de 1(mg.kg-1.j-1)-1 est retenu ce qui correspond à une dose de 10-5 mg.kg-1.j-1 pour un excès de risque de 10-5 et à une dose de 10-6 mg.kg-1.j-1 pour un excès de risque de 10-6.
Indice de confiance : élevé du fait de la qualité des données disponibles et de la méthode utilisée.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/09/2025
Introduction
Le benzo(a)pyrène entre dans la catégorie des hydrocarbures aromatiques polycycliques (HAP) identifiés en tant que substance prioritaire (N°28) par la Directive Cadre sur l’Eau (DCE) (état chimique). Pour chacune de ces substances prioritaires des Normes de Qualité Environnementales (NQE) sont définies au niveau Européen. La méthodologie ainsi que les données utilisées pour le calcul de ces valeurs sont présentées dans des fiches détaillées. Les informations en lien avec l’écotoxicité du benzo(a)pyrène présentées ci-dessous en sont extraites (EC, 2011).
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Ecotoxicité aiguë:
Quatre résultats d’essais d’écotoxicité aigus sur des organismes d’eau douce ont été retenus dans l’évaluation européenne du benzo(a)pyrène comme substance prioritaire de la DCE (EC, 2011) :
- un résultat pour une bactérie (Vibrio fischeri),
- deux pour des invertébrés (Daphnia magna et Daphnia pulex) et
- un résultat sur poisson (Pimephales promelas)
Aucun résultat d’essais d’écotoxicité aigus sur des organismes marins n’est disponibles (EC, 2011).
Le résultat le plus faible est celui sur l’invertébré Daphnia magna avec une EC50 (48 h)> 2,7 µg.L-1 conforté par un autre résultat disponible sur Daphnia pulex CL50 (96 h) à 5 µg.L-1.
Ecotoxicité chronique:
Cinq résultats d’essais d’écotoxicité chronique sur des organismes d’eau douce et couvrant trois niveaux trophiques (algue, invertébré et poisson) sont présentés dans la fiche NQE associée au benzo(a)pyrène (EC, 2011). Six résultats d’essais d’écotoxicité chronique sur des organismes marins) couvrant deux niveaux trophiques sont également disponibles (invertébrés : 5 données sur 3 espèces différentes et les poissons : 1 donnée) (EC, 2011)
Le résultat le plus faible est celui sur le mollusque marin Crassostrea gigas avec une EC10 à 0,22 µg.L-1.
Sédiments marins
Aucune donnée d’écotoxicité aigue ou chronique n’est disponible pour des organismes benthiques.
Sol
Des résultats d’écotoxicité sur des organismes du sol sont disponibles dans le rapport du RIVM, 2012.
Biote
Empoisonnement secondaire (prédateurs) :
Aucune donnée n’est disponible pour le benzo(a)pyrène.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Compartiment aquatique

Compartiment sédimentaire

Compartiment sol

Empoisonnement secondaire (prédateurs):
Aucune valeur disponible
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
La substance d’intérêt fait partie de la famille des HAP (Hydrocarbures Aromatiques Polycycliques), les données technico-économiques ci-dessous proviennent de la fiche technico-économique dédiée à cette famille de substances et non-exclusivement à cette même substance d’intérêt.
Tableaux de synthèse
Généralités
| CAS | 50-32-8 |
|---|---|
| SANDRE | 1115 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | oui |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Émissions et concentrations de HAPDe nombreux textes réglementaires concernent les HAP :
[5] Il s'agit du benzo(b)fluoranthène, du benzo(k)fluoranthène, du benzo(ghi)pérylène et de l'indéno(1,2,3 cd)pyrène. [6] Les six substances sont les suivantes : benzo(3,4)fluoranthène, benzo(11,12)fluoranthène, benzo(1,12)pérylène, benzo(3,4)pérylène, fluoranthène et indéno(1,2,3 cd)pyrène (décret du 3 janvier 1989, annexe 1 1 et 1 3). Utilisation de créosoteEn outre d'autres directives réglementent l'usage de la créosote, vecteur important de HAP dans l'environnement (voir plus loin) :
Combustion domestique
Autres
[7] Proposition de directive du Parlement européen et du Conseil relative aux restrictions à la commercialisation et à l’utilisation de certains hydrocarbures aromatiques polynucléaires contenus dans les huiles de dilution et les pneumatiques (vingt-septième modification de la directive 76/769/CEE du Conseil), COM(2004) 98 final, 13 février 2004. |
| Classification CLP | Voir la classification CLP |
| Informations complémentaires |
Les hydrocarbures aromatiques polycycliques, ou HAP, sont des composés organiques issus de la fusion de cycles benzéniques. Le plus simple des HAP est le naphtalène (deux cycles) et le plus complexe est le coronène (sept cycles). |
Production et utilisation
Production et ventes
Données économiques
Éléments sur certains secteurs économiques concernés
Créosote
La consommation de créosote en France a beaucoup baissé : de l'ordre de 30 000 à 40 000 t.an-1 en 1960, elle était descendue à environ 10 000 t.an-1 au milieu des années 1990 (essentiellement pour traiter les traverses de chemin de fer et certains poteaux de transport des lignes électriques aériennes) [Rayzal et al., 1998].
Depuis le 30 juin 2003, en application de la directive 2001/90/CE, l'utilisation en Europe de la créosote ou de bois est traité à la créosote est très fortement limitée. En Europe, les quantités de HAP impliqués dans la production de créosote sont de l'ordre de plusieurs dizaines de milliers de tonnes par an (40 000 tonnes en 1999 d'après EU RAR, 2000 ; 17 000 tonnes/an de phénanthrène et de naphtalène, soit environ 27 200 tonnes pour le total des HAP, d'après l'International Programme on Chemical Safety, 1998) [Royal Haskoning, 2003a].
En France, seule l'entreprise VFT France18 (filiale de Rütgers VFT) vend de la créosote. Une usine à Forbach19, qui en vendait également, semble avoir fermé. La Société Technique de Découpe ALPI S.A.S20 semble utiliser de la créosote (Source : Kompass UK).
On compte aujourd'hui au maximum une dizaine d'autoclaves d'imprégnation de bois à la créosote en France.
[18] Immeuble Le Nerval / Parc d’activité du bord des eaux / BP3 / 62251 Henin Beaumont Cedex / 03 21 08 19 80
[19] Route de Marienau / 57600 Forbach / 03 87 84 99 01
Production de coke en France
La production de coke a tendance à décliner en Europe. Le nombre de cokeries dans l'Europe des 15 est passé de 104 en 1981 à 42 en 2000 [Holland et al., 2001]. C'est dû essentiellement à une baisse de la demande d'acier et une restructuration dans la métallurgie : l'Europe produit moins de coke et en importe davantage, notamment en provenance de Chine. La hausse des importations de coke devrait se poursuivre pendant les prochaines années (Commission européenne, 2004).
En France, 4 552 tonnes de coke furent produites en 2002, contre 5 091 tonnes en 2001. 4 902 tonnes furent livrées à l'industrie sidérurgique en 2002 (Commission européenne, 2004).
Il existe, semble t il, actuellement cinq cokeries en France.
En France, les cokeries minières appartiennent à Charbonnages de France. Cette entreprise en possédait encore deux en 2002 : Drocourt, fermée en mars 2002 et Carling (en Alsace), qui doit fermer mi 2005. Le groupe a prévu d'avoir cessé toute opération fin 2007. En 2002 le groupe a produit 961 kt de coke (dont 927 à Carling), contre 1 341 kt en 2001.
Les autres cokeries françaises sont une cokerie indépendante et trois cokeries sidérurgiques.
Tableau 14. Cokeries en France
[18] Immeuble Le Nerval / Parc d'activité du bord des eaux / BP3 / 62251 Henin Beaumont Cedex / 03 21 08 19 80.
[19] Route de Marienau / 57600 Forbach / 03 87 84 99 01.
[20] 'GVio Parc du Mandinet' / 1 3, Rue des Campanules / 77185 LOGNES / Tél. : 01 64 27 60 84 / Fax : 01 64 67 79 59 ; 03 23 66 57 96.
[21] Arrêt des activités en 2005.
Industrie sidérurgique
Arcelor est le premier producteur mondial d'acier (44 Mt d'acier produit en 2003). La France est le 11ème pays producteur d'acier (19,8 Mt d'acier produit en 2003 et 1,8 Mt d'exportations nettes) et le 5ème producteur européen, derrière la Russie, l'Allemagne, l'Ukraine et l'Italie. La France emploie 37 000 personnes en 2003 dans l'industrie sidérurgique (contre 105 000 en 1980) (International iron & steel Institute, 2004).
Goudron
Actuellement, le seul fabricant de goudron de houille en France est HGD (Houille Goudron et Dérivés). Il s'agit d'une concentration des groupes Elf Atochem S.A. et Rütgers VfT S.A depuis juillet 1994. Les unités de production sont essentiellement localisées à Marienau (57). La production de goudron de houille de cette société n'est pas remise en question par la fermeture définitive des mines à l'échéance 2005. Elle est principalement destinée au marché des électrodes. Sur l'ensemble de la production annuelle 2001, seulement 30 000 tonnes ont été orientées vers le marché de la construction routière. Les goudrons et brais de houille participent alors à la fabrication d'enrobés spéciaux, protection anti kérosène, et à l'élaboration de fluxant. En 2000, la production de bitume en France atteignait environ 3 000 000 tonnes. [Brazillet, 2001].
Procédés de production
FTE 2005 Importer
La production de HAP est peu importante. Ils sont utilisés dans un nombre limité de produits, notamment des produits de teinture à des fins de recherche et d'analyse. Il est probable que les rejets de HAP liés à leur production et à leur utilisation directe soient marginaux par rapport à leurs rejets totaux [Holland et al., 2001].
En particulier le benzo(a)pyrène n'est produit qu'en très petite quantité, par distillation fractionnée de charbon bitumineux renfermant des hydrocarbures aromatiques polynucléaires (HSDB).
Quant à l'indéno(1,2,3 cd)pyrène, présent dans les charbons bitumineux, il est enrichi par distillation puis extrait par une technique séparative adaptée (dissolution, extraction liquide liquide) avant d'être purifié par chromatographie (INERIS 2003 2004).
Utilisations
Introduction (varitétés d'utilisations)
Les HAP font usage de biocides dans le goudron, la créosote et d'autres produits similaires utilisés pour protéger et préserver des matériaux (principalement le bois). Des composés HAP sont également inclus dans l'asphalte [OSPAR Commission, 2001a].
Utilisations volontaires
FTE 2005 Importer
Certains HAP sont utilisés comme intermédiaires : le naphtalène, l'acénaphthène, l'anthracène, le fluorène, le fluoranthène, le phénanthrène et le pyrène. Ils sont utilisés dans des polymères, des teintures, des pigments, des surfactants, des dispersants, des agents tannants, des solvants, des résines insecticides et des ramollissants de caoutchouc [IPCS, 1998 ; in Royal Haskoning, 2003a].
Plus particulièrement, le benzo(a)pyrène ne trouve actuellement aucune application dans l'industrie. Il entre dans la fabrication de produits étalons. Certains laboratoires d'analyse ou de toxicologie l'utilisent en très faible quantité [Palayer et al., 1997]. Excepté pour la recherche, il n'existe pas d'utilisation connue du benzo(b)fluoranthène ou de l'indéno(1,2,3 cd)pyrène. [INERIS 2003 2004]
[7] Proposition de directive du Parlement européen et du Conseil relative aux restrictions à la commercialisation et à l'utilisation de certains hydrocarbures aromatiques polynucléaires contenus dans les huiles de dilution et les pneumatiques (vingt septième modification de la directive 76/769/CEE du Conseil), COM(2004) 98 final, 13 février 2004.
Mélanges d'HAP dans des produits
Créosote
Parmi les grandes familles de produits de préservation du bois, existe un produit issus de la distillation de la houille, la créosote. Elle comporte à la fois des propriétés biocides et des caractéristiques hydrofuges. Les HAP qu'elles contient sont particulièrement efficaces contre la pourriture [Rayzal et al., 1998].
Elles sont le plus souvent issues de la distillation de goudron de houille (le goudron de houille étant lui même un sous produit du traitement à haute température du charbon pour produire du coke ou du gaz) et parfois de la distillation d'autres produits, comme le bois. La créosote est un mélange épais et huileux, sa couleur va de l'ambre au noir. Elle se compose d'un mélange de composés sélectionnés au moyen d'un intervalle de température de distillation. Le mélange est relativement complexe, riche notamment en hydrocarbures aromatiques polycycliques (naphtalène, fluorène, anthracène notamment). Ces substances sont plus ou moins actives et participent à la préservation du bois. La créosote est plutôt utilisée pour des bois soumis à des conditions difficiles. Il s'agit essentiellement de bois qui doivent supporter une humidité toujours supérieure à 20 % : bois horizontaux en extérieur (balcons, coursives...) et bois en contact avec le sol (poteaux téléphoniques, traverses de chemin de fer, clôtures, etc.) ou avec une source d'humidification prolongée ou permanente.8 On traite le bois à la créosote en répandant celle ci au pulvérisateur ou en plongeant le bois dans un bain de créosote ; le traitement peut aussi avoir lieu par une combinaison de procédés de mise sous vide et sous pression dans des réacteurs fermés.
[8] Page sur la préservation du bois du site Internet du Comité national pour le développement du bois (CNBD) : http://www.bois construction.org/.
L'utilisation de créosote est fortement limitée par la réglementation. Par dérogation, quelques grands organismes peuvent encore en utiliser pour la préservation du bois :
- La SNCF utilise des créosotes lourdes (distillation entre 200 et 450 ° C) pour les traverses de chemin de fer [Rayzal, 1995]. Ces traverses sont traitées à la créosote par un établissement spécialisé de la SNCF. Cependant leur usage décroît au profit des traverses en béton : en effet elles ne sont plus utilisées que pour l'entretien de lignes traditionnelles existantes. Pour les lignes TGV et les lignes neuves, des traverses en béton sont utilisées. Cela limite donc l'utilisation de créosote.
- EDF utilise de la créosote pour les poteaux des lignes électriques (plus précisément pour les pieds de poteaux, la partie en contact avec le sol, en épicéa). EDF utilise des poteaux en bois ou en béton. Ces derniers servent pour les tensions élevées et pour l'ancrage des lignes basse tension (c'est à dire environ un poteau sur cinq, pour bien fixer la ligne). Les autres poteaux sont en bois, traité soit à la créosote, soit aux sels métalliques (environ 2/3 créosote et 1/3 sels métalliques). EDF achète le bois déjà traité et ne les retraite pas une fois en place.
France Télécom utilise (ou a utilisé) des créosotes légères (distillation entre 170 et 400 ° C) pour les poteaux en bois utilisés comme support du réseau téléphonique [Rayzal, 1995].
D'après Rayzal (1998), les créosotes servent encore ponctuellement au traitement de certains équipements agricoles (piquets) ou d'ouvrages de génie civil (retenues de berge).
Traitement des bois créosotés en fin de vie
L'élimination des traverses en bois de la SNCF est effectuée par la société SIDENERGIE (département 46). Cette entreprise produit du charbon de bois domestique (agréé par le ministère de la Santé). Elle traite, en plus de déchets de scierie, 6 000 tonnes de bois par an (soit environ 100 000 traverses par an)10. Le traitement consiste en une valorisation matière par thermolyse. Les bois sont épurés de la créosote d'imprégnation et transformés en charbon végétal.11
Chaque année, quelques milliers de tonnes de poteaux EDF arrivent en fin de vie. Ils sont soit réemployés par des agriculteurs (pour être débités et servir de piquets de délimitation de parcelle par exemple), soit incinérés.
On estime à environ 300 000, le nombre de poteaux retirés annuellement du 'parc installé' de France Telecom. Afin de les protéger des agressions extérieures (intempéries, insectes), ces poteaux ont subi différents traitements chimiques qui sont, ou qui ont été pour l'essentiel, à base de sulfate de cuivre ou de CCA (Cuivre, Chrome, Arsenic) et de créosote. [Le Calvez, 1999]
[10] Source : ADEME (http://www.ademe.fr/midi pyrenees/a_1_13.html).
[11] http://www.recyclot.fr/etsivous.html.
Coke
Le coke est obtenu dans des fours à coke, par chauffage à l'abri de l'air d'un certain type de charbon. Les composés volatils contenus dans le charbon sont ainsi éliminés par évaporation. Il est essentiellement utilisé dans la sidérurgie.
Il remplit trois rôles principaux dans le haut fourneau : il favorise la circulation des gaz montants (rôle perméabilisant), fournit la chaleur nécessaire à la poursuite de la réaction, assure la réduction et la carburation du fer. La plupart des cokeries produisent spécifiquement pour des usines de production de fer et d'acier et sont souvent situées sur le même site.
Goudron de houille
Le goudron de houille est obtenu par pyrolyse de la houille à des températures allant de 400 °C à 1 200 °C dans les cokeries et les usines à gaz. Il est constitué de fortes teneurs (de 20 à 50 %) en HAP (notamment naphtalène, phénanthrène, fluoranthène, pyrène, acénaphtène et anthracène) [Brazillet, 2001]. Les propriétés physico chimiques des HAP recherchées telle leur plasticité à chaud sont corrélées avec leur capacité à devenir volatils et mobilisables.
Le goudron de houille a été abondamment utilisé, depuis la fin du XIXème siècle pour produire des enrobés bitumineux routiers. Son utilisation est actuellement en déclin, au profit de substituts d'origine pétrolière. La production de goudron de houille pour les applications en techniques routières est en constante régression et n'est plus que de quelques dizaines de milliers de tonnes par an.
Toutefois le goudron possède des propriétés de résistance aux solvants pétroliers (carburants et huiles). Il est donc encore utilisé dans les revêtements de sites particuliers (aéroports, parcs de stationnement d'engins agricoles ou de poids lourds, gares routières, aires de stations service, revêtements de sols industriels, en particulier des sites pétrochimiques, aires d'autoroute, etc.). [Brazillet, 2001]
D'après l'OMS IPCS (1998) on peut trouver dans l'asphalte des concentrations de benzo(b)fluoranthène élevées, pouvant atteindre 10 g/kg. (INERIS 2004)
Tableau 9. Teneurs moyennes des constituants principaux du goudron (HAP seulement, pourcentages massiques) (Source : Gosselin, 2000 ; cité dans Brazillet, 2001)
Rejets dans l’environnement
Sources naturelles
FTE 2005 Importer
Certains HAP sont présents naturellement dans quelques matériaux organiques, notamment des dérivés du pétrole.
Tableau 3. Exemples de concentrations en benzo(a)pyrène dans certains matériaux organiques (Source : GTZ, 1995)
Sources non-intentionelles
FTE 2005 Importer
Les HAP sont synthétisés lors de la formation des énergies fossiles (pétrole, charbon) ou bien lors de la combustion incomplète de matières organiques (chauffage au fuel, feux de forêts, etc.). [Palayer et al., 1997] Leur synthèse lors de la formation des énergies fossiles explique leur présence dans le pétrole, le charbon et leurs produits dérivés.
Ils sont donc rejetés dans l'environnement soit à partir de produits dérivés de combustibles fossiles (goudron, coke, créosote, etc.), soit suite à des combustions incomplètes.
On peut distinguer deux types de rejets atmosphériques de HAP :
- Les sources évaporatives (utilisation de produits contenant du goudron de houille, préservation du bois avec de la créosote et du carbolineum, utilisation du goudron pour les toits et les routes).
- Les sources thermiques (HAP dits pyrolytiques). Les rejets des sources thermiques proviennent de la combustion de combustibles solides (bois, tourbe et charbon), de carburants automobiles (diesel surtout) et de quelques procédés industriels [Holland et al., 2001].
Tableau 4. Émissions de benzo(a)pyrène liées à la combustion incomplète de matières fossiles (Source : GTZ, 1995)
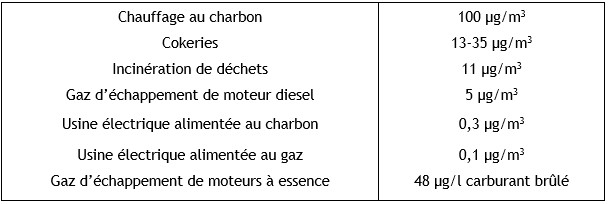
Pendant les années 1990, les rejets des sources évaporatives ont diminué grâce à des restrictions sur l'usage et le contenu en HAP des matériaux [Holland et al., 2001].
Sources thermiques
Combustions domestiques
Les émissions de polluants atmosphériques des appareils de combustion dépendent des conditions de la combustion, de la qualité des installations et de la composition du combustible. Plusieurs types de HAP se forment au cours de la combustion. La quantité de HAP émise par unité d'énergie produite varie de plusieurs ordres de grandeur entre les petites et les grandes unités de combustion (dans les grandes, il est plus facile d'obtenir de bonnes conditions de combustion et de mettre en place des systèmes de contrôle des fumées) [OSPAR Commission, 2001c].
Lors de la combustion, tous les types de HAP sont formés. Le profil des HAP dépend peu du combustible et de la technique de combustion utilisés. Généralement le phénanthrène est le composé dominant et représente environ 40 % des émissions totales de HAP. Le benzo(a)pyrène représente moins de 5 % des émissions de HAP.
Les émissions de particules et de HAP sont généralement plus élevées de plusieurs ordres de grandeur lors de la phase de démarrage du feu que lors de la période de combustion stationnaire.
Les émissions suivantes de HAP ont été mesurées :
Tableau 5. Quelques facteurs d'émission de HAP (Source : OSPAR Commission, 2001c)

Les facteurs d'émission pour la combustion du charbon et du bois dans les petits poêles et les cheminées sont considérées généralement comme étant respectivement de l'ordre de 0,3 mg/kg (environ 0,2 mg/MJ) et 40 mg/kg (environ 3 mg/MJ) [OSPAR Commission, 2001c].
D'après Eurostat (1999), la consommation de bois pour la combustion domestique devrait s'élever en 2010 à 370 PJ [Holland et al., 2001]. D'après les scénarios énergétiques issus du modèle PRIMES, la combustion de biomasse dans le résidentiel et le secteur tertiaire s'élevait à 305 PJ en 1990 et à 315 PJ en 2000. La combustion de la biomasse en général et du bois en particulier est parfois promue comme moyen de réduire les émissions de gaz à effet de serre.
Transport automobile
Les carburants automobiles, particulièrement le diesel, contiennent des proportions significatives de HAP. Leur combustion est à l'origine de rejets de HAP. Les émissions de particules des véhicules diesel contiennent de fortes concentrations de HAP.
Le CITEPA estimait qu'en 1999 le transport était responsable de 5,5 % des émissions atmosphériques totales de HAP en France.
Tableau 8. Facteurs d'émission de HAP dues au transport routier (en g/km) (Source : CORINAIR, 2004)
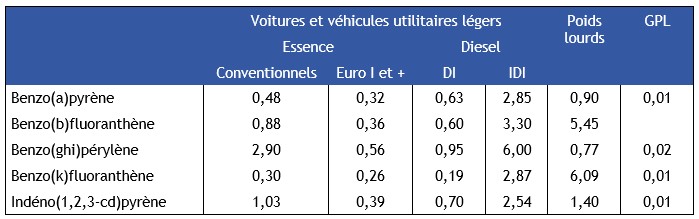
Les facteurs d'émission varient grandement en fonction de la substance considérée et du type de véhicules. Les véhicules légers diesel IDI sont les plus gros émetteurs.
Sources non-thermiques
La créosote
La créosote peut contenir jusqu'à 85 % de HAP. Entre 20 et 40 % du poids total peut être attribué aux 16 HAP définis comme polluants prioritaires par l'EPA. Les niveaux de benzo(a)pyrène sont de l'ordre de quelques centaines de ppm [Royal Haskoning, 2003a].
Tableau 6. Proportion des créosotes en HAP (% en masse) [Source : Rayzal et al., 1998]
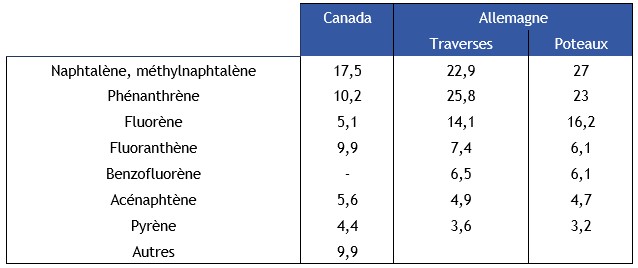
Les émissions de HAP sont surtout dues :
- aux fuites des récipients et des réacteurs dans lesquels sont contenus la créosote et traités les bois,
- à l'évaporation des composés volatils de HAP du bois traité,
- à l'égouttage du bois traité.
Lorsque le bois est stocké à l'horizontale, les HAP migrent à travers le bois ce qui aboutit aussi à des émissions. Les quantités rejetées dépendent du type de créosote, du bois et des méthodes de préservation utilisées [OSPAR, 2001b].
Des HAP sont émis également lorsque des bois traités sont incinérés.
D'après Holland et al. (2001), on estime à 46 kg les émissions atmosphériques de B[a]P dues au traitement du bois avec du carbolineum en 2010 en Europe.
Suite aux diverses applications du bois traité à la créosote, les HAP peuvent être émis par migration dans le bois, par évaporation et par lessivage dans le sol et dans les eaux de surface.
Dans le bois traité à la créosote, les composés de créosote ne sont pas liés aux fibres du bois mais elles migrent à l'intérieur de celui ci. Au soleil, le bois peut transpirer : la créosote apparaît à sa surface. Cela arrive lorsque le bois est saturé en créosote ou lorsque la créosote contient une forte proportion de composés volatils. [Braunschweiler, 1996]
Une étude britannique a montré que les HAP dominants dans la fraction volatile du bois traité à la créosote étaient le phénanthrène, le fluorène et le pyrène, qui sont parmi les HAP les moins toxiques. D'après cette même étude les émissions atmosphériques de HAP dues au bois traité à la créosote étaient estimées au Royaume Uni à environ 100 tonnes, c'est à dire dans le même ordre de grandeur que les émissions dues aux véhicules [Gevao et al., 1998].
Les fuites de créosote du bois vers le sol est un processus long. Une étude finlandaise estime que cela prend entre 5 et 10 ans. [Braunschweiler, 1996]
Les composés solubles dans l'eau de la créosote passent facilement dans les eaux. Des études ont montré que 70 à 80 % des HAP qui fuient dans les eaux et provenant de la créosote sont des naphtalènes et des composés à faible température d'ébullition, phénanthrène, acénaphtène [OSPAR, 2001b].
Les micro organismes sont susceptibles de dégrader biologiquement les HAP dans le sol. Les eaux de surface sont touchées par le lessivage des composés de la créosote solubles dans l'eau, tels que le phénanthrène, l'acénaphtène et le dibenzofurane. Du fait de leur faculté d'adsorption sur les particules, ils s'accumulent aisément dans les sédiments [OSPAR, 2001b].
Les goudrons de houille
Les goudrons de houille sont susceptibles de rejeter des HAP notamment lors de leur fin de vie, qu'ils soient éliminés ou valorisés.
Les eaux de ruissellement peuvent mobiliser les HAP par le lessivage des revêtements routiers. Elles peuvent également emporter les particules atmosphériques chargées d'HAP déposées au sol. Cependant les avis semblent divisés à ce sujet. Ainsi Hugener et al. (1999) contestent l'importance du relargage par lessivage des revêtements dont l'appréciation aurait été exagérée. En effet, le liant et les HAP eux mêmes sont faiblement solubles dans l'eau. En revanche, d'après Pépin (1998), des essais de percolation effectués sur des enrobés bitumineux concassés mettent en évidence un relargage significatif des HAP dans les premiers percolats.
L'impact sur l'environnement est tributaire des propriétés physico chimiques des HAP considérés, de l'abrasion des revêtements superficiels enduits de goudron et du lessivage des goudrons pris dans la masse des enrobés. Cet impact est non négligeable, mais peut être ralenti par la faible solubilité des liants hydrocarbonés et des HAP dans l'eau, mais également par la structure fermée à faible porosité des chaussées. [Brazillet et al., 2001]
Des émissions de HAP peuvent également avoir lieu lors des traitements en fin de vie des déchets routiers. Ainsi, lors du recyclage à chaud par exemple, de faibles teneurs en goudron peuvent déjà conduire à des émissions atmosphériques de HAP qui atteignent des valeurs supérieures à la limite d'exposition admissible [Brazillet, 2001]. Toute augmentation de 12 ° C de la température de traitement des enrobés provoque un doublement des émissions de substances nocives [Hugener, 1999].
Pneumatiques et caoutchouc
Les HAP peuvent être des constituants présents dans des huiles qui sont utilisées comme huiles de dilution dans la production de pneumatiques. L'huile de dilution est incorporée dans la matrice de caoutchouc et demeure incorporée dans le caoutchouc du pneu final. Par conséquent, cette huile de dilution peut être également présente dans les débris de pneumatiques.14
Des HAP peuvent être émis lors de la production des pneumatiques, lors de leur utilisation ou lors de leur élimination.
D'après le Comité scientifique sur la toxicité, l'écotoxicité et l'environnement (CSTEE), les HAP contenus dans les pneumatiques ne contribuent que très marginalement à la présence de HAP dans l'environnement : il estime que l'usure des pneus est responsable de moins de 2 % des émissions anthropogéniques totales de benzo(a)pyrène. L'usure des pneus contribue à environ 1 % des concentrations totales de HAP dans les sédiments (ils représentent environ 4 % des émissions automobiles de HAP, elles mêmes représentant environ 30 % de la concentration des sédiments en HAP). [CSTEE, 2003]
[14] Commission des communautés européennes (2004). Proposition de directive du Parlement européen et du Conseil relative aux restrictions à la commercialisation et à l'utilisation de certains hydrocarbures aromatiques polynucléaires contenus dans les huiles de dilution et les pneumatiques (vingt septième modification de la directive 76/769/CEE du Conseil), COM(2004) 98 final.
Boues de station d’épuration
D'après (Feix, 1995) cité par (Bernal, 2005), la teneur moyenne des boues de 40 stations d'épuration était en moyenne la suivante pour les principaux HAP :
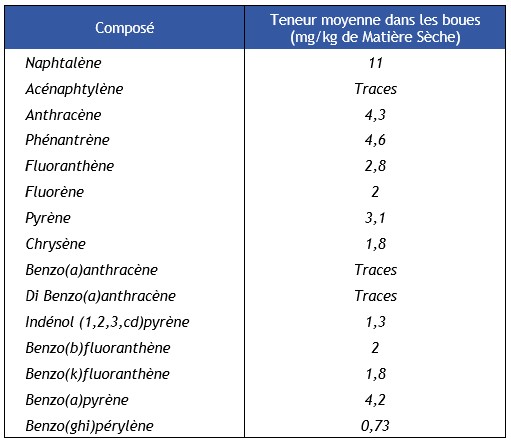
Ces composés sont pour les 8 premiers d'entr eux, presque totalement abattus dans les eaux usées par les stations d'épuration, et sont en très grande partie transférés dans les boues (sauf naphtalène).
Émissions anthropiques totales
FTE 2005 Importer
Niveau national
25 installations françaises sont répertoriées dans la base de données française IREP comme émetteurs de HAP. Les installations les plus émettrices appartiennent aux secteurs du travail des métaux, de la raffinerie et de la chimie.
Tableau 10. Émissions de HAP des installations ICPE en France en 2004 (en kg) (Source : extrait de la base de données IREP)
Rhône-Alpes
Les effluents des 168 entreprises de Rhône Alpes ont été étudiés [DRIRE Rhône Alpes, 2001]. Dans ceux ci le flux de HAP s'élevait à 10 g.j-1 en 1993 et 55 g.j-1 en 1998 (13 établissements en rejetaient).
Tableau 11. Rejets industriels aqueux de HAP en Rhône-Alpes
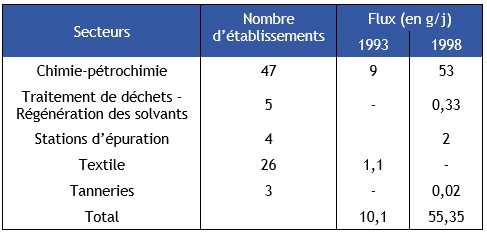
Midi-Pyrénées
Lors d'une campagne de mesures effectuée en 1997 sur 90 établissements industriels de Midi Pyrénées, il a été mesuré un flux total de HAP de 87,29 g.j-1, sur 13 établissements. Le ratio PEC/PNEC est supérieur à 1 pour les établissements suivants : Aluminium Péchiney (09), Aluminium Péchiney (65). Le flux journalier est compris entre 100 g et 1 kg pour les établissements suivants : Grande Paroisse (31) et AP Lanemazan (65) [DRIRE Midi Pyrénées, 1998].
Poitou-Charentes
La DRIRE Poitou Charentes a publié en 1997 un inventaire des rejets de micropolluants dans 27 établissements industriels de la région. Sur les 30 points de rejet examinés, un seul point est concerné par des rejets de HAP : il s'agit de Leroy Somer à Angoulême, fabricant d'entraînements électromécaniques et électroniques pour l'industrie et fabricant/concepteur d'alternateurs (concentration : 6 cg.l-1) [DRIRE Poitou Charentes, 1998].
Émissions atmosphériques
FTE 2005 Importer
Les émissions de HAP proviennent d'une grande diversité de sources.
Les rejets dans l'environnement sont principalement atmosphériques. Les HAP sont généralement associés à des particules mais peuvent également être présents dans la phase gazeuse. (INERIS 2003)
Bien que les sources présentant la plus grande importance varient selon les pays, les principales sources sont les suivantes :
- produits de préservation du bois (bois traité à la créosote) ;
- combustion incomplète de combustibles fossiles et de biomasse dans le secteur résidentiel (en particulier combustion domestique de bois) ;
- combustion incomplète de combustibles fossiles par les véhicules automobiles (surtout les véhicules diesel) ; les moteurs (particulièrement les moteurs diesels) rejettent des HAP généralement fixées sur les particules carbonées (fumées noires) ; cette pollution est accentuée par un mauvais entretien des véhicules et par l'absence de dispositif antipollution ;
- combustion incomplète de combustibles fossiles et de biomasse dans les autres installations fixes (en particulier les installations petites ou anciennes); incinérateurs d'ordures ménagères ;
- quelques procédés industriels : production de goudron et d'asphalte, production de coke, craquage catalytique du pétrole.
On peut citer d'autres sources comme les matériaux de dragage, les rejets des installations offshore, la navigation et les déversements d'hydrocarbures (surtout pétrole brut) [OSPAR Commission, 2001a].
Bien que principalement anthropiques, les sources d'émission de HAP peuvent aussi être le fait de combustions naturelles (feux de forêt, activités volcaniques) [Palayer et al., 1997].
Tableau 12. Rejets atmosphériques de HAP en France (en tonnes) (Source : CITEPA / CORALIE / format SECTEN [Fontelle et al., 2005])
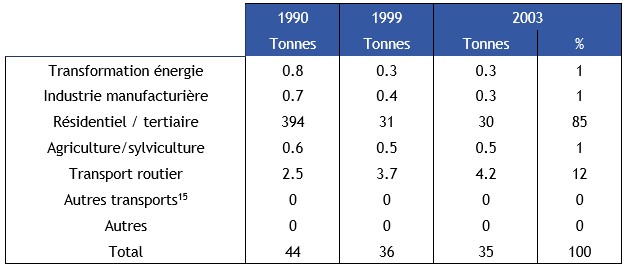
En France, d'après le CITEPA, les rejets atmosphériques de HAP sont causés essentiellement par le secteur résidentiel et tertiaire (92 % des émissions nationales en 1999) et, dans une moindre mesure, par le transport routier, l'agriculture et l'industrie manufacturière. Les émissions du secteur résidentiel/tertiaire sont essentiellement dues à la combustion de bois et de charbon.
[15] Selon les définitions de la CEE NU : les émissions répertoriées hors total ne sont pas incluses, à savoir les émissions maritimes internationales et le trafic aérien au dessus de 1 000 mètres.
Émissions vers les eaux
FTE 2005 Importer
Bilan des rejets dans les eaux
Les sources principales de présence de HAP dans l'eau semblent être les suivantes :
- les eaux de ruissellement en milieu urbain (par temps de pluie, il s'agit d'une cause majeure de pollution des eaux de surface ; il s'agit notamment du ruissellement sur les voiries, contaminées par la circulation automobile) ;
- les effluents urbains par temps sec ;
- les huiles usagées (pollution diffuse, due à des rejets et des fuites + rejet liquide dans la nature d'environ 40 % des huiles de vidange, soit 50 000 t.an-1) ;
- les dépôts atmosphériques (en 2003 EMEP estimait que la déposition de benzo(a)pyrène en France s'est élevée à 8 450 kg en 2001, dont 6 500 kg (77 %) en provenance de France) ;
- les marées noires et dégazages.
D'autres sources sont les suivantes :
- les effluents industriels (pratiques à risques : utilisation de produits de pyrolyse comme le goudron de houille, la créosote, le brai et noir de fumée, l'huile anthracénique ; le lavage des gaz de combustion ; le refroidissement des charbons lors de la production de coke) ;
- les canalisations d'eau potable antérieures à 1949 ;
- les activités pétrolières (hors marées noires), telles que l'extraction, les pertes naturelles des gisements de pétrole et le raffinage [Palayer et al., 1997].
Un bilan de campagnes de mesures nationales dans des rejets industriels a mis en évidence que les rejets dans l'eau de HAP seraient plus le fait des secteurs de la chimie (hors pharmacie et phytosanitaires) et dans une moindre mesure des textiles. (MEDD, 2005)
Rejets aqueux diffus
Thornthon et al. (2001) ont mesuré des concentrations en HAP, liées à la circulation automobile, dans des eaux de ruissellement urbaines, de l'ordre de 2 à 3 mg.l-1. Ils ont également cherché à estimer les teneurs en HAP dans les eaux d'assainissement urbaines. Ils donnent pour la France des teneurs de l'ordre de 0,05 à 0,44 cg.l-1 pour les influents et de 0,02 à 0,09 cg.l-1 pour les effluents.
Blanchard et al. (2001) ont étudié les concentrations en HAP dans plusieurs stations d'épuration des eaux de la région parisienne (notamment celle d'Achères) en 1998 et 1999. La présence de HAP semble être majoritairement due aux ruissellements d'eaux urbaines (eux mêmes chargés en HAP suite aux dépôts polluants des véhicules sur la chaussée) plutôt qu'aux dépôts atmosphériques.
Rejets dans l'environnement
FTE 2005 Importer
Remarque sur la mesure des HAP
La mesure des rejets de HAP ou des concentrations de HAP dans l’environnement est relativement difficile. En outre coexistent différents protocoles de mesure qui prennent en compte des groupes différents de HAP. Ces difficultés expliquent en partie la présence dans cette fiche de chiffres parfois contradictoires (le calcul des émissions de HAP par EPER et par le CITEPA par exemple).
Dans l’eau, les HAP sont généralement présents à l’état de ‘traces’, c’est-à-dire à des niveaux de concentration allant du nanogramme par litre à quelques dizaines de microgrammes par litre et leur concentration varie fortement dans le temps et dans l’espace.
La mise en évidence d’une contamination de l’environnement par les HAP nécessite donc souvent la mise en œuvre de techniques analytiques performantes. Actuellement les normes AFNOR en vigueur4 prévoient le dosage de six HAP par chromatographie liquide à haute performance et fluométrie. Parmi ces six HAP figurent le benzo(a)pyrène (le plus étudié pour sa toxicité) et le fluoranthène (le plus répandu dans l’environnement [Palayer et al., 1997]
Émissions de HAP par secteurs d'activité
Production de coke
D'après la Commission européenne (1996), une usine de production de coke rejette dans ses eaux usées environ 30 mg.l-1 de HAP, soit environ 0,3 kg/tonne de coke. Le traitement des eaux permet de faire baisser cette concentration à 0,003 – 0,2 mg.l-1. Le facteur d'émission global dans les eaux est de l'ordre de 0,001 kg de HAP par tonne de coke [Commission européenne, 1996 ; in Royal Haskoning, 2003a].
L'OMS IPCS (1998) indique une teneur en B[b]F de 3,8 mg/kg dans des boues résiduelles provenant de la cokéfaction du charbon. (INERIS 2004)
Sidérurgie et métallurgie
Des HAP sont émis lors de la production de coke mais également lors de son utilisation dans l'industrie sidérurgique.
En pratique industrielle courante, un haut fourneau consomme, par tonne de fonte, 1 700 kg de minerai aggloméré, 300 kg de coke, 150 kg de charbon et 40 m3 d'oxygène.12 La production mondiale d'acier est passée de 507 Mt en 1975 à 802 Mt en 2002.
Les émissions atmosphériques de HAP dans la sidérurgie peuvent aller de moins de 0,1 mg/t d'acier liquide pour la sidérurgie à l'oxygène à près de 1 000 mg/t d'acier liquide pour les installations d'agglomération.
Tableau 7. Émissions atmosphériques de HAP lors de la production de fer et d'acier (Source : BREF production sidérurgique, 2001)
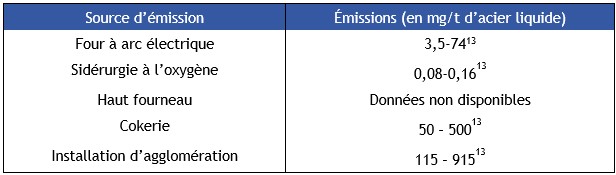
La fusion de câbles de cuivre émet également des HAP. En effet la faible température de fusion (250 à 700 °C) rend la combustion incomplète, ce qui provoque l'émissions de HAP [United Nations Environment Programme, 2004].
Une autre source peut être importante dans certains et l'a sans doute été en France, la technique Söderberg dans l'industrie de l'aluminium de première fusion et les revêtements de coques des navires (au moins dans certaines régions). Cependant, d'après la fédération des métaux non ferreux, cette technique n'est plus utilisée en France depuis plusieurs années.
Raffinage de pétrole
L'OMS IPCS (1998) indique pour des raffineries de pétrole, une concentration de 1,3 g.m-3 de B[b]F dans les émissions gazeuses et une concentration pouvant atteindre 0,2 g.l-1 dans les eaux rejetées (après traitement). (INERIS 2004).
D'après le document BREF sur les raffineries, la concentration en HAP dans les effluents de leurs stations d'épuration en Europe est comprise entre 0.005 et 0.05 mg.l-1, en moyenne annuelle.(European Commission, 2003)
Les émissions de benzo(a)pyrène sont surtout des émissions fugitives lors des opérations de chargement et d'enfournement. Les gaz de sortie de production contiennent également des HAP mais sont soumis à des traitements secondaires. Des émissions fugitives peuvent également se produire lors de la production au travers des joints des portes des fours. Elles sont difficiles à éviter complètement à cause des conditions d'opération (expansion et contraction fortes, pressions élevées à l'intérieur des fours) [Holland et al., 2001].
Le Royal Haskoning (2003a) estimait qu'en France, il y a avait sept usines de production de coke, avec une capacité de production de 7 500 kt.an-1 et qu'elles émettaient 7,5 t.an-1 de HAP dans l'eau. Cette estimation des émissions est sans doute à revoir à la baisse puisque le nombre de cokerie et la production ont significativement baissé. D'après Holland et al. (2001), en France en 2010, huit usines produiront du coke. Leur production s'élèvera à 5 500 tonnes par an et elles émettront, en admettant qu'elles aient mis en place les MTD, 15 kg de benzo(a)pyrène par an.
[12] Yahoo ! Encyclopédie : http://fr.encyclopedia.yahoo.com/articles/do/do_4383_p0.html.
[13] Les valeurs supérieures proviennent des installations les plus anciennes.
Rejets par substance
La présence de benzo(b)fluoranthène dans l'environnement est uniquement anthropique, elle résulte de la combustion incomplète d'hydrocarbures ou de charbon. Le raffinage du pétrole, la cokéfaction du charbon et le trafic automobile constituent également des sources d'exposition importantes.
L'indéno(1,2,3 cd)pyrène est présent naturellement dans les combustibles fossiles, les huiles brutes, les huiles de schiste, dans les feuilles de diverses espèces d'arbres (concentrations comprises entre 26 et 234 g/kg) [HSDB, 2000], dans les feuilles de tabac (18 à 38 g/kg) [HSDB, 2000], dans le terreau et le fumier de cheval (respectivement à des concentrations de l'ordre de 5 g/kg et 50 g/kg) [Verschueren, 1996]. Il a d'autre part été détecté dans les algues. (INERIS 2004)
À titre indicatif, Verschueren (1996) cite les teneurs suivantes pour l'indéno(1,2,3 cd)pyrène :
- essence (suivant l'indice d'octane) : 40 g/kg à 2,9 mg/kg ;
- huile moteur (suivant durée d'utilisation) : 0,03 mg/kg à 83 mg/kg ;
- goudron de houille : 8 g/kg ;
- gaz d'échappement de moteurs à essence : 11 à 87 g.m-3 ;
- fumées d'incinérateurs d'ordures ménagères : 1,8 pg.m-3 après tour de lavage et précipitateur électrostatique, 10 g/kg dans les résidus ;
- condensats d'échappement des moteurs à essence : 268 Kg/g, 32 à 86 g.l-1itre d'essence consommé ;
- fumée de cigarette : 4 ng/cigarette. (INERIS 2004)
Evolution des rejets
Les émissions industrielles et commerciales de HAP devraient avoir beaucoup baissé en 2010. Des changements dans les produits demandés, notamment en ce qui concerne la préservation du bois, les toitures, le pavement des routes devraient réduire les émissions de HAP de ces activités à des niveaux insignifiants. La seule exception est le secteur des cokeries. Même en mettant en place les MTD, les émissions devraient rester significatives. D'après Holland (2001), il semble irréaliste d'envisager des réductions des émissions significatives au delà des MTD, à moins de fermer des usines [Holland et al., 2001].
Synthèse des rejets
Les HAP sont synthétisés lors de la formation des énergies fossiles (pétrole, charbon) ou bien lors de la combustion incomplète de matières organiques (chauffage au fuel, feux de forêts, etc.). Ils sont donc rejetés dans l'environnement soit à partir de produits dérivés de combustibles fossiles (goudron, coke, créosote, dérivés du pétrole, etc.), soit suite à des combustions incomplètes.
Les rejets atmosphériques en France sont essentiellement dus à la combustion de bois et de charbon dans les secteurs résidentiel et tertiaire. D'autres rejets importants sont dus au transport automobile (surtout diesel) et à l'industrie (raffineries, dépôts d'hydrocarbures, cokerie et métallurgie, traitement des déchets, industrie du caoutchouc, chimie, etc.).
La présence dans les eaux est en grande partie provoquée par les mêmes sources, par le biais du ruissellement d'eaux en provenance de zones urbaines ou industrielles ou par celui de dépôts atmosphériques. D'autres sources de présence dans les eaux sont les rejets industriels directement dans les eaux, les huiles usagées, l'industrie du pétrole et ses à côtés (fonctionnement normal de l'industrie mais également marée noire et dégazages) et le traitement du bois à partir de produits dérivés de combustibles fossiles (créosote).
Ces sources nombreuses et variées sont à l'origine d'une présence assez importante de HAP dans l'environnement, à la fois dans les eaux (surtout dans les sédiments et les matières en suspension) et dans les sols.
Pollutions historiques et accidentelles
La base de données BASOL du Ministère chargé de l'Environnement recense 1 460 sites pollués qui sont actuellement en cours d'évaluation ou de travaux de réhabilitation (c'est à dire des sites dont la pollution est avérée et a entraîné l'engagement d'actions de la part des responsables). Sur ces sites, 185, soit 13 %, sont pollués notamment à cause de la présence de HAP dans les eaux superficielles et/ou souterraines. À ces sites s'en ajoutent 19 qui sont toujours en activité et qui doivent faire l'objet d'un diagnostic.
Tableau 13. Sites pollués, eaux superficielles et/ou souterraines polluées par les HAP (Source : BASOL16)
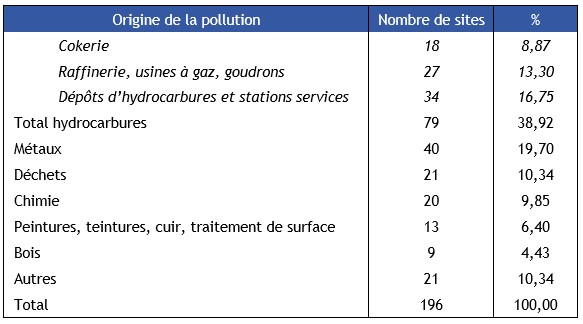
Les pollutions sont majoritairement causées par des activités liées aux hydrocarbures, traitement ou dépôts (presque 40 %), et aux métaux (20 %).
[16] Consultation de la base de données le 11 juin 2004.
Présence environnementale
Atmosphère
FTE 2005 Importer
De 2001 à 2003, un programme pilote national de surveillance des HAP a été réalisé en France. Les principales conclusions en ont été les suivantes : (INERIS, 2004) :
[16] Consultation de la base de données le 11 juin 2004.
- La valeur cible préconisée par la directive fille pour le B(a)P (1 ng.m-3) n'est dépassée que très légèrement et sur un nombre très limité de sites.
- L'étude des concentrations obtenues pour les HAP totaux montre des valeurs de l'ordre de 80 ng.m-3 l'hiver et de 25 ng.m-3 durant l'été.
- Les résultats semblent montrer, que pour les sites choisis dans ce programme pilote, et pour toutes les saisons confondues, les plus fortes concentrations des HAP totaux sont observées pour les sites trafic suivies des sites urbains, et que les plus faibles concentrations sont obtenues pour les sites industriels.
Aquatique
FTE 2005 Importer
La présence de HAP dans les eaux de surface provient notamment du dépôt de particules en suspension dans l'atmosphère, des rejets de lixiviation des aires de stockage de charbon, des effluents des usines de traitement du bois et autres industries, de l'utilisation de composts et de fertilisants. (INERIS 2003)
Dans l'eau, les HAP sont généralement présents à l'état de 'traces', c'est à dire à des niveaux de concentration allant du ng.l 1 à quelques dizaines de cg.l 1 [Palayer et al., 1997].
Le caractère lipophile des HAP se traduit par une tendance à se fixer sur les fractions organiques des matières en suspension (MES) et sédiments. Cela explique que la présence des HAP est très marquée sur les MES alors qu'elle n'est pas visible dans la phase aqueuse. [Remillon, 2003]
Bassin Adour-Garonne
L'agence de l'eau Adour Garonne a publié en 1997 un rapport de synthèse des campagnes de mesure effectuées entre 1992 et 1996 [Agence de l'eau Adour Garonne, 1997]. Plusieurs stations sont contaminées, tant pour les sédiments que pour les matières en suspension (sur la Charente, sur la Dordogne, sur le Lot et sur la Garonne à l'aval de sa confluence avec le Lot). Sur ces stations, la contamination est durable avec un risque probable d'effets écotoxiques (valeurs supérieures à 9 cg/kg de poids sec dans les sédiments).
La station la plus contaminée, pour les sédiments comme pour les MES est sur le Lot : on y a mesuré dans les sédiments des valeurs supérieures à 1 000 cg/kg de poids sec en 1996 pour cinq HAP sur six recherchés, dont le benzo(a)pyrène. L'origine des HAP sur le Lot pourrait être liée à des apports anciens dus à l'activité passée de la fonderie de Fumel (eau de lavage des gaz de fumée). Les HAP peuvent avoir été stockés dans les sédiments du Lot et constituer une pollution rémanente malgré l'arrêt de l'activité industrielle.
Les fortes teneurs mesurées sur la Charente à l'aval d'Angoulême pourraient être liées aux activités industrielles très présentes dans cette agglomération.
Loire-Bretagne
Dans le bassin Loire Bretagne, les concentrations en micropolluants organiques autres que les pesticides sont souvent associées aux agglomérations et à des sources de contamination multiples comme certaines industries ou des activités de combustion et d'incinération : c'est le cas du benzo(a)pyrène dans l'Indre, le Loir et la Mayenne [RNDE, 1999].
Rhin-Meuse
Dans le bassin Rhin Meuse, les fortes contaminations en micropolluants organiques sont liées pour l'essentiel aux HAP et aux PCB. Ces substances sont détectées de manière quasi systématique dans les matières en suspension, confirmant le caractère ubiquitaire de ces polluants. Les fortes contaminations en HAP observées correspondent aux principaux apports connus, ponctuels (certaines activités industrielles) ou semi diffus (zones urbanisées) [RNDE, 1999].
Dans le bassin Rhin Meuse, pour la concentration en fluoranthène dans les matières en suspension, des dépassements significatifs du seuil retenu ont été mesurés, en particulier dans le bassin houiller [Remillon, 2003].
Pour les HAP en général, dans la phase aqueuse les valeurs sont généralement inférieures au seuil de détection. En revanche une forte présence des HAP a été constatée dans les matières en suspension [Remillon, 2003].
D'après Rémillon (2003), la famille des HAP est fortement produite dans le bassin, ce qui a plusieurs raisons :
- la présence d'industries chimique, pétrochimique et sidérurgique est à l'origine d'émissions significatives ;
- la forte pression du trafic automobile provoque des émissions atmosphériques qui se déposent ensuite sur les sols et les surfaces en eau. [Remillon, 2003]
Rhône-Méditerranée-Corse
D'après l'agence de l'eau Rhône Méditerranée Corse, les HAP sont la principale source de déclassement des cours d'eau sur le bassin.
Seine-Normandie
Les HAP sont omniprésents sur l'ensemble du bassin Seine Normandie notamment aux environs des grandes agglomérations urbaines, par exemple la région parisienne, l'Eure à l'aval de Chartres, le Loing à Montargis, la Vesle à l'aval de Reims ou encore les secteurs de Saint Lô et Caen [RNDE, 1999]. Les analyses effectuées, entre 1991 et 1995, sur des sédiments du bassin ont permis d'observer des fréquences de détection variant pour les six HAP de la norme AFNOR de 33 % à 87 % [Palayer et al., 1997].
Des mesures, effectuées en 1996 sur les boues de 15 stations d'épuration du bassin Seine Normandie (AESN, lab. Rouen 1996), ont permis de détecter (dans 100 % des cas) la présence des six HAP de la norme AFNOR. [Palayer et al., 1997]
La contamination de l'estuaire et de la baie de Seine par les HAP a été mise en évidence dans les compartiments dissous et particulaire, à des niveaux de concentrations élevés qui dépassent les critères d'évaluation écotoxicologiques fixés par OSPAR, et qui placent l'estuaire de la Seine parmi les sites les plus contaminés en Europe. Les zones urbaines, industrielles et portuaires de l'estuaire de l'estuaire amont sont à l'origine d'apports internes au système estuarien. Les empreintes caractéristiques des résidus de diesel, et celles classiques de processus de combustion à hautes températures ont été clairement identifiées [Tronczynski J. et al., 1999]
Terrestre
FTE 2005 Importer
Synthèse
FTE 2005 Importer
La multiplicité des sources fait que les HAP sont présents dans l'air, dans l'eau et dans les sols.
Perspectives de réduction
Réduction des rejets
FTE 2005 Importer
L'objectif de rejets anthropiques17 nuls semble extrêmement difficile à atteindre, au moins à court terme, notamment à cause de l'omniprésence et de l'importance des rejets. Les rejets atmosphériques liés au transport automobile ou au chauffage urbain semblent ainsi particulièrement difficiles à réduire significativement.
Une étude menée dans la région du Rhin en France a toutefois montré que le contrôle des polluants organiques des sources ponctuelles a été efficace pour réduire les niveaux de concentration : entre 1985 et 1996, la pollution en HAP et en polychlorobiphényles (PCB) a diminué de plus de 90 % [Thornthon et al., 2001].
[17] L'objectif de rejets totaux nuls semble impossible, à cause de rejets naturels : feux de forêts et de végétation, diagenèse de la matière organique dans les sédiments.
Réduction des émissions liées à l'utilisation de créosote
FTE 2005 Importer
L'OSPAR (2001b) propose un certain nombre de mesures pour empêcher les émissions de HAP du bois traité à la créosote:
- restrictions imposées à l'utilisation du bois traité à la créosote, remplacement du bois traité à la créosote par d'autres matériaux, etc. ;
- interdiction du bois traité à la créosote dans les constructions en contact avec des eaux de surface et avec des eaux phréatiques ;
- utilisation de mélanges modifiés à la créosote ;
- contrôle de la qualité (par exemple, tests de lessivage) des matériaux traités à la créosote ;
- manutention des matériaux traités à la créosote et des déchets correspondants dans les conditions voulues (stockage dans des lieux secs, etc).
Remplacer le bois traditionnellement traité à la créosote par du bois traité avec des mélanges modérés contribuera à réduire les émissions de HAP mais le remplacement par du bois traité avec un mélange protecteur au Cu Cr As n'est peut être pas nécessairement bénéfique du point de vue de l'environnement.
L'enregistrement des volumes annuels de créosote achetés aux fins de la préservation du bois, ou l'enregistrement des volumes annuels des ventes de bois traité à la créosote pourrait peut être être utile à la surveillance de l'efficacité des mesures de réduction des émissions de HAP. [OSPAR, 2001b]
Pour les déchets de bois traités à la créosote, le moyen le plus efficace de s'en débarrasser est sans doute la pyrolyse.
Un traitement associant une molécule de substitution d'origine végétale (anhydride succinique d'alkénoate de méthyle) et un traitement en autoclave est efficace pour des bois n'étant pas en contact avec le sol. Par contre, des recherches (projet en cours cofinancé par l'UE) sur le procédé sont encore nécessaires pour qu'il soit éventuellement efficace sur les bois en contact avec le sol (poteaux, traverses,…) (www.surfasam.com)
Goudron
FTE 2005 Importer
Il existe des substituts au goudron pour fabriquer des enrobés bitumineux routiers. En Suisse ou aux Pays Bas notamment, l'usage du goudron n'a plus cours [Brazillet, 2001].
Pollution automobile
FTE 2005 Importer
La lutte contre les émissions de HAP par les véhicules automobiles est très liée à la réduction des émissions de polluants atmosphériques de ce secteur plus généralement (NOx, COV, SO2, CO, PM). Les mesures envisageables sont donc les mêmes que pour d'autres politiques visant les émissions du transport routier. Il peut s'agir de réduction des émissions unitaires des véhicules (carburants alternatifs, promotion des véhicules répondant à des normes Euro plus sévères, amélioration de l'efficacité énergétique, réduction du poids des véhicules) ou de mesures de réduction du nombre de véhicules.kilomètres (incitation au transfert modal, taxation de l'usage de la route, etc.). Ces mesures sont déjà étudiées dans d'autres cadres : mise en place de la directive Plafonds nationaux d'émission, Plans de déplacements urbains (PDU), Plans régionaux de la qualité de l'air (PRQA), Plan national santé environnement (PNSE), etc.
Chauffage domestique
FTE 2005 Importer
Pour réduire les émissions de HAP provenant de la combustion domestique, il est possible de modifier quatre éléments [voir notamment OSPAR, 2001c] :
- Les appareils de combustion.
- La taille (rendement nominal) des appareils de combustion doit impérativement correspondre à l'essentiel des besoins de production d'énergie, quoique les petits appareils de chauffage ménagers brûlant du combustible minéral conservent leur efficacité sur un large éventail de rendements.
- Remplacement des vieux appareils de combustion par des appareils neufs à la combustion plus efficace.
- Installation de réservoirs accumulateurs aux vieilles chaudières de manière à augmenter le rendement de la combustion.
- Remplacement des appareils brûlant du bois ou du charbon par des appareils fonctionnant au mazout ou au gaz ou par d'autres dispositifs de production d'énergie, tels que des capteurs solaires.
- Le combustible.
- Utilisation de combustible propre et sec (pas de brûlage de bois traité ou d'ordures ménagères). Du bois humide ou contenant des moisissures requiert plus d'énergie : la combustion perd environ 1 % en efficacité (à cause de l'énergie perdue à cause de l'évaporation) pour chaque 10 % de moisissure contenue dans le bois (Holland et al., 2001).
- Utilisation d'un combustible d'une qualité et d'une taille homogène.
- Changement de combustible, passage au fioul, au gaz, etc.
- Le fonctionnement et l'entretien de la combustion des appareils.
- Allumage rapide de l'appareil.
- Chargement fréquent en combustible pour maintenir le rendement à son maximum.
- Éviter de charger insuffisamment et de trop charger.
- Aspiration de l'air réglé pour obtenir des conditions optimales à la combustion.
- Nettoyage régulier de la cendre pour améliorer le flux d'air.
- Éteindre le feu au lieu de le laisser mourir.
- Ramonage régulier des cheminées et entretien/nettoyage régulier de l'appareil.
- Dépôt en lieu sûr de la suie et de la cendre volante.
- Meilleure isolation thermique des locaux à chauffer.
Il est possible de réduire de 45 % les émissions de HAP en utilisant un poêle optimisé par rapport à un poêle ordinaire. Cette optimisation peut jouer sur l'isolation thermique pour permettre au poêle d'atteindre rapidement sa température optimale de fonctionnement, sur les quantités d'air en jeu, etc. [Holland et al., 2001]
Des techniques plus avancées permettent de réduire encore davantage les émissions de HAP : certaines installations de combustion de bois gèrent automatiquement l'arrivée de combustibles, sous la forme de granules de bois. Ces technologies risquent toutefois de pénétrer le marché lentement, si elles le pénètrent [Holland et al., 2001].
Administrativement les mesures envisageables sont les suivantes :
- Information et sensibilisation des populations (bonnes pratiques).
- Incitations fiscales ou autres à la mise en place d'installations plus performantes (subventions aux appareils de chauffage certifiés, accord négocié avec les fabricants ou les importateurs, etc.).
- Interdiction de la combustion domestique, tout particulièrement dans les zones fortement polluées et peuplées (par exemple création de zones de contrôle des fumées, dans lesquelles seuls des combustibles et des appareils n'émettant pas de fumée, conformes à certaines normes, peuvent être utilisés).
Le monoxyde de carbone (CO) est un indicateur de l'efficacité de la combustion et est aussi un paramètre des processus de combustion. Les réglementations nationales du Danemark, de l'Allemagne, de la Norvège et de la Suède comportent des dispositions différentes, interdisant le brûlage de certains matériaux ou indiquant des plafonds d'émission de CO, de particules ou de carbone organique à l'état gazeux en fonction de diverses unités, par exemple de combustible consommé ou de gaz émis.
La pénétration des nouveaux poêles en 2010 devraient atteindre 20 et 60 % dans l'Europe des 21 [Holland et al., 2001].
Limitation des rejets industriels
FTE 2005 Importer
Techniques de traitement dans les effluents aqueux industriels (et urbains)
Un traitement épuratoire des rejets aqueux met généralement en jeu trois processus majeurs d'élimination des polluants organiques, dont les HAP (Marchand, 1989) :
- l'élimination par adsorption sur les matières en suspension (MES) au stade de la décantation primaire et sur les boues activées ;
- l'élimination par entraînement gazeux durant l'aération prolongée du traitement biologique secondaire ;
- l'élimination par dégradation bactérienne durant le traitement biologique secondaire.
Compte tenu du fait qu'en milieu aqueux les HAP présentent une très forte affinité pour les MES, il est possible de calquer leur taux d'abattement sur celui des MES.
Pour les MES, la simple décantation primaire permet un taux d'abattement moyen d'environ 50 %. Les rendements d'épuration les plus importants (98 %) sont observés dans les stations pratiquant un traitement biologique secondaire.
D'après le Royal Haskoning (2003b), les meilleures techniques disponibles pour éliminer les HAP des eaux usées sont les suivantes :
- séparation de l'huile et de l'eau avec un cyclone, de la micro filtration ou un séparateur API (American Petroleum Institute), lorsque l'on peut s'attendre à de grandes quantités de pétrole libre ou d'hydrocarbures ; sinon on peut utiliser comme alternative l'intercepteur à plaques parallèles et l'intercepteur à plaque ondulée ;
- micro filtration, media filtration granulaire ou flottaison des gaz ;
- traitement biologique.
Pour le traitement de l'eau destinée à la consommation humaine, les techniques de clarification sont efficaces mais pas toujours suffisantes. Les HAP résiduels sont alors éliminés par les procédés suivants :
- l'ozonation (conditions habituelles d'utilisation : de 1 à 4 mg.l-1 pour un temps de contact allant de 4 à 10 mn) :
- l'adsorption sur charbon actif en poudre (CAP) ou en grain (CAG) ;
- les procédés d'oxydation avancée. [Agence de l'eau Loire Bretagne, 1996 ; in Palayer et al., 1997]
Production de coke
Le BREF concernant la production sidérurgique (2001) décrit les MTD pour éliminer les HAP des eaux usées.
Un traitement biologique des eaux résiduaires avec nitrification/dénitrification intégrées permet notamment d'obtenir des rejets de HAP (6 Borneff) inférieurs à 0,05 mg.l-1 (concentration basée sur un débit spécifique d'eaux résiduaires de 0,4 m3/t de coke).
Lorsque les eaux rejetées contiennent du goudron, cela peut poser des problèmes au niveau du traitement biologique des eaux usées. En particulier la présence de HAP dans le goudron peut poser problème dans la mesure où les HAP peuvent avoir un effet toxique sur les micro organismes dans la boue activée et sont relativement difficiles à dégrader. Il est donc conseillé de retirer le goudron des eaux usées avant le traitement biologique de l'eau. Il peut être retiré grâce à l'ajout de produits chimiques coagulants puis par la séparation des précipités au moyen d'une des techniques suivantes :
- sédimentation gravitationnelle suivie d'une filtration ;
- centrifugation des eaux de charbon suivie par une filtration ;
- flottaison suivie par une filtration.
Un tel traitement permet de retirer l'essentiel du goudron des eaux usées. [BREF sidérurgie, 2001]
Un autre moyen de retirer le goudron est d'utiliser un filtre tambour rotatif sous vide recouvert de poudre de bois. Ce système permet de diminuer la concentration en HAP avant le traitement biologique. Cependant le filtre à poudre de bois a été remplacé en 1998 par une filtration dans le sable qui atteint le même taux d'élimination des HAP. [BREF sidérurgie, 2001]
D'après Holland (2001), même en appliquant les MTD, les cokeries continueraient à émettre des quantités significatives de benzo(a)pyrène. On ne connaît malheureusement pas de techniques plus performantes que les MTD pour limiter les émissions de HAP des cokeries.
Les autres solutions théoriquement envisageables sont :
- de délocaliser la production de coke (dans des zones faiblement peuplées) [c'est surtout valable pour éviter trop de rejets atmosphériques près des habitations, éviter des points chauds ; pour les rejets dans l'eau c'est sans doute moins pertinent] ;
- d'interdire la production de coke et d'en importer [Holland et al., 2001], ce qui n'est pas une solution réellement acceptable d'un point de vue économique.
- Bref, il ne semble actuellement pas exister de solution simple au problème de la pollution en HAP par les cokeries.
Éléments de coûts pour certains moyens de réduction des émissions
Combustion domestique
D'après l'expérience du TNO MEP, le coût supplémentaire dû à l'optimisation d'un poêle est de l'ordre de 10 à 15 %. En considérant un coût de production moyen de 500 €, cela représente un coût supplémentaire de 70 € par poêle. Cela n'entraîne a priori pas d'augmentation des coûts de maintenance ou des consommations d'énergie [Holland et al., 2001].
Remplacer les cheminées ouvertes par des poêles coûte environ 500 € par poêle [Holland et al., 2001].
Pollution automobile
Les émissions unitaires de polluants atmosphériques du transport routier ont été beaucoup réduites depuis plusieurs décennies. Les réduire davantage, notamment celles de HAP, atteint des coûts à la quantité de polluant non émis très élevés. Il est de ce fait nécessaire d'étudier les politiques de réduction supplémentaires dans un cadre multi polluants, mêlant de préférence pollution atmosphérique et effet de serre [Brignon et al., 2002].
Alternatives aux usages
Produits de substitution pour les pneumatiques
FTE 2005 Importer
L'industrie pétrolière et celle du caoutchouc cherchent des substituts aux HAP dans les pneumatiques. D'après les compagnies pétrolières, il existe principalement deux huiles alternatives possibles : les MES (Mild Extract Solvate) et les TDAE (Treated Distillate Aromatic Extracts). Il n'est pas encore certain qu'ils puissent servir de substituts complets : d'une part la question de leur disponibilité se pose ; d'autre part il n'est pas certain qu'ils permettent d'atteindre les mêmes qualités en termes d'adhérence au sol.
Les membres de l'Association européenne de l'industrie du caoutchouc (BLIC) font des essais depuis 1996 avec des huiles sans HAP. Ils utilisent maintenant des huiles sans HAP pour plusieurs segments de marché (principalement les pneus de camion et les pneus neige pour voitures).
Les producteurs européens de pneus ont annoncé publiquement en juin 2003 qu'ils adoptaient une approche dictée par le principe de précaution. Ils se sont engagés à éliminer l'utilisation d'huiles de dilution riches en HAP. Cette substitution est complexe et ne sera pas achevée avant décembre 2009. [BLIC, 2004]
Conclusion
FTE 2005 Importer
Les hydrocarbures aromatiques polycycliques, ou HAP, sont synthétisés lors de la formation des énergies fossiles (pétrole, charbon) ou bien lors de la combustion incomplète de matières organiques (chauffage au fuel, feux de forêts, etc.). Ils sont donc rejetés dans l'environnement soit à partir de produits dérivés de combustibles fossiles (goudron, coke, créosotes utilisées pour la préservation du bois, dérivés du pétrole, etc.), soit suite à des combustions incomplètes.
Les rejets atmosphériques en France sont essentiellement dus à la combustion de bois et de charbon dans les secteurs résidentiel et tertiaire. D'autres rejets importants sont dus au transport automobile (surtout diesel) et à l'industrie (raffineries, dépôts d'hydrocarbures, cokerie et métallurgie, traitement des déchets, industrie du caoutchouc, chimie, etc.).
La présence dans les eaux est en grande partie provoquée par les mêmes sources, par le biais du ruissellement d'eaux en provenance de zones urbaines ou industrielles ou par celui de dépôts atmosphériques. D'autres sources de présence dans les eaux sont les rejets industriels directement dans les eaux, l'épandage de boues de stations d'épuration, les huiles usagées, l'industrie du pétrole et ses à côtés (fonctionnement normal de l'industrie mais également marée noire et dégazages) et le traitement du bois à partir de produits dérivés de combustibles fossiles (créosote).
Ces sources nombreuses et variées sont à l'origine d'une présence assez importante de HAP dans l'environnement, à la fois dans les eaux (surtout dans les sédiments et les matières en suspension) et dans les sols.
L'objectif de rejets anthropiques nuls semble extrêmement difficile à atteindre, au moins à court terme, notamment à cause de l'omniprésence et de l'importance des rejets. Les rejets atmosphériques liés au transport automobile ou au chauffage urbain semblent ainsi particulièrement difficiles à réduire. En outre les cokeries, même si elles appliquaient les meilleures techniques disponibles actuelles, resteraient significativement émettrices de HAP.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










