Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Fluoranthène (206-44-0)
Informations générales
Dernière vérification le 08/12/2025
Identification
Numero CAS
206-44-0
Nom scientifique (FR)
Fluoranthène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
205-912-4
Code SANDRE
1191
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C16H10 }\)
Code InChlKey
Code SMILES
c1ccc2c(c1)c3cccc4cccc2c34
Familles
Familles chimiques
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Analyse
Autres milieux
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
202.26 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment marin
Le devenir du fluoranthène dans l'environnement mène le plus souvent au compartiment sédimentaire (Payne et al., 1988). L’étude d’adsorption menée par Aarnoutse et al., sur un sédiment à 4 % de carbone organique total a permis d’obtenir un Koc de 398 110 L.kg -1 (Log Koc = 5,6) (Aarnoutse et al., 1996). Comme l’expliquent les auteurs, cette valeur est plus élevée que celles trouvées dans la littérature (4,8 < Log Koc < 5,0) car les méthodes de mesure utilisées peuvent conduire à surestimer les concentrations dans l’eau interstitielle. D’autres valeurs de Koc sont disponibles à partir d’essais de toxicité effectués sur des sédiments marins à différents taux de carbone organique (Swartz et al., 1990). La moyenne de ces valeurs est de 112 200 L.kg -1.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Les rares données expérimentales qui ont pu être trouvées sur des essais en milieux aqueux montrent que le fluoranthène est peu biodégradable : des demi-vies de 560 à 1 760 jours en milieu aqueux sur des souches non adaptées ont été estimées (Howard et al., 1991). En première approche, une demi-vie de 1 500 jours peut être proposée. Même des essais de dégradation par une culture enrichie de bactéries du sol ont montré que la dégradation n’était jamais totale et qu’elle pouvait s’apparenter à un processus d’humification (Ressler et al., 1999).
Dégradabilité abiotique
Aucune donnée expérimentale sur l'hydrolyse du fluoranthène n'a été trouvée. Cependant, compte tenu de sa structure moléculaire, l'hydrolyse du fluoranthène est probablement négligeable.
Aucune donnée spécifiquement reliée à la dégradation abiotique du fluoranthène n'a été trouvée. Par contre des données génériques sur les HAP indiquent que l'oxydation induite par l'ozone, et l'hydroxylation sont les deux mécanismes de dégradation intervenant de manière prédominante dans l'atmosphère. Ces deux réactions sont activées par la lumière naturelle. Les demi-vies dans l'air accompagnant ces mécanismes de photooxydation varient de 0,4 à 68,1 heures (Slooff et al., 1989 ; US EPA, 1990). Cependant, ces mécanismes sont largement dépendants des conditions environnementales, notamment la nature et la taille des particules présentes dans l'air ambiant et sur lesquelles les HAP sont attachés (Behymer et Hites, 1988 ; Korfmacher et al., 1980 ; NRCC, 1983). Les HAP sont plus persistants lorsqu'ils sont liés à des particules de nature organique. Des transformations mineures peuvent également mener à une dégradation des HAP notamment par réaction avec des oxydes d'azote (NOx) et le dioxyde de soufre (SO2) ; de telles réactions ne se produisent toutefois qu'aux points d'émission où la température oscille entre 100°C et 200°C (Atkinson et al., 1979).
Milieu terrestre
Dans les sols, les HAP sont éliminés principalement par volatilisation et par activité microbienne Plusieurs facteurs tels que la température, le type de sol, et la présence d'autres substances conditionnent les processus de dégradation (ATSDR, 1995 ; Beak, 1981 ; Bulman et al., 1985 ; Cooper, 1991 ; PACE, 1988 ; Wild et al., 1991). Les HAP de faible poids moléculaire se volatilisent plus rapidement (Slooff et al., 1989 ; Wild et Jones, 1993).
Bioaccumulation
Organismes aquatiques
De nombreux résultats d'essais sur organismes aquatiques sont disponibles dans la littérature :
Crustacés
Crangon septemspinosa (marin) : BCF (4 j) = 180. La contamination effectuée en continu sur 4 jours à 2,4 µg.L-1 a été suivie d’une phase de décontamination de 14 jours. Dosages HPLC (McLeese et Burridge, 1987).
Daphnia magna : BCF (1 j) = 1 742. La contamination effectuée en statique à une concentration dans l’eau de 9 µg.L-1. Dosages HPLC (Landrum, 1988)
Polychètes
Neiris viorens : BCF (4 j) = 720. La contamination a été effectuée en continu sur 4 jours à 2,4 µg.L-1 a été suivie d’une phase de décontamination de 14 jours. Dosages HPLC (McLeese et Burridge, 1987).
Mollusques
Mya arenaria (marin) : BCF (4 j) = 4 120
Mytilus edulis (marin) : BCF (4 j) = 5 920
Pour ces 2 essais, la contamination effectuée en continu sur 4 jours à une concentration de 2,4 µg.L-1 a été suivie d’une phase de décontamination de 14 jours. Dosages HPLC (McLeese et Burridge, 1987)
Amphibiens
Rana pipiens : BCF (48 h) = 1 660. L’essai a été réalisé sur des larves de 96 à 118 heures exposées en continu à une concentration de 0,892 µg.L-1. Pour des concentrations supérieures, le BCF est plus faible (611 à 30,6 µg.L-1) (Monson et al., 1999).
Poissons
Oncorhynchus mykiss : BCF (21 j) = 378. La contamination a été effectuée en continu sur 21 jours à 3,3 µg.L-1. Dosages HPLC (Gerhart et Carlson, 1978).
Compte tenu de ces données, un facteur de bioconcentration de 5 920 semble correspondre à une valeur conservatrice pour le fluoranthène lorsqu'il est présent dans le milieu aquatique (Payne et al., 1988).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
La Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP* 2015 (ADEME, INERIS, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015) ne comporte pas le fluoranthène dans sa liste des HAP.
Une recherche exhaustive dans la bibliographie scientifique internationale de données suffisamment satisfaisantes ou détaillées pour permettre d’estimer des facteurs de transfert ou présenter ceux proposés, n’a pas été réalisée dans le cadre de la présente fiche en date de la présente mise à jour.
* Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les molécules Organiques Polluantes, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site https://www.ademe.fr/bappop-base-donnees-contamination-plantes-potageres-molecules-organiques-polluantes et fonctionne sur ACCESS
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L’ensemble des informations cité ci-dessous provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1995 ; IARC, 1983, 1987, 2010 ; US EPA, 2012 ; US EPA (IRIS), 1990). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Chez l’homme, très peu d’études ont cherché à identifier les effets toxiques du fluoranthène seul, la plupart des données disponibles concernent des mélanges d’hydrocarbures aromatiques polycycliques (HAP). Dans cette fiche, seule la substance fluoranthène est considérée, la toxicité du fluoranthène en mélange avec d’autres HAP est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Certains HAP disposent d’une fiche de données toxicologiques1 cependant il nous est apparu nécessaire de proposer également une fiche « choix de VTR » regroupant les valeurs disponibles pour chacun d’eux2, ainsi que les autres éléments de comparaison entre ces différents HAP. Le fluoranthène est un HAP de haut poids moléculaire (4 cycles), avec une absorption théorique majoritaire sous forme particulaire.
[1] Acénaphtène, Anthracène, Benzo(b)fluoranthène, Benzo(g,h,i)perylène, Benzo(k)fluornathène, Chrysène, Dibenz(a,h)anthracène, Fluoranthène, Fluorène, Indeno(1,2,3-cd)pyrène, Phénanthrène, Pyrène
[2] Acénaphtène, Acénaphthylène Anthracène, Benz(a)anthracène, Benzo(b)fluoranthène, Benzo(g,h,i)perylène, Benzo(k)fluornathène, Chrysène, Coronène, Cyclopenta(c,d)pyrène, Dibenz(a,c)anthracène, Dibenz(a,h)anthracène, Fluoranthène, Fluorène, Indeno(1,2,3-cd)pyrène, Naphtalène, Phénanthrène, Pyrène
Toxicocinétique
Chez l'homme
Absorption
Très peu de données sur le devenir dans l’organisme du fluoranthène sont disponibles chez l’homme.
Chez l’homme, l’absorption par voie respiratoire, orale ou cutanée n’est pas documentée pour le fluoranthène seul. Néanmoins, son absorption par les voies respiratoires est probable en raison de sa présence dans les tissus pulmonaires de sujets vivants en milieu urbain (Cioroiu et al., 2013).
De même, son absorption par voie cutanée a indirectement été montrée par la présence de fluoranthène dans le sang chez des volontaires sains, exposés 2 jours consécutifs pendant 8 heures, à des applications de 2 % de goudrons sur la peau (Storer et al., 1984).
Distribution
Les données humaines sont très limitées.
Du fluoranthène a été détecté dans la couche lipidique de peau prélevée sur le front de 9 couvreurs à une concentration moyenne de 1,2 ng.mg-1 de lipides (Wolff et al., 1982) ou encore dans le sang d’individus sains traités par des applications topiques de 2 % de goudrons (Storer et al., 1984).
Le fluoranthène a également été détecté dans le lait de mères italiennes, 7,32 µg.kg-1 de lait (Santonicola et al., 2017).
Métabolisme
Aucune donnée spécifique n’a été identifiée. Néanmoins, l’exposition in vitro (fractions microsomales intestinales et hépatiques d’origine humaine) au fluoranthène induit la formation de 2,3-diol-fluoranthène (70 à 95 %), métabolite majoritaire, mais aussi de 8-hydroxy-fluoranthène, et de trans-2,3-dihydroxy-1,10-époxy-1,2,3,10-tétrahydro-fluoranthène (2,3D-fluoranthène) (Walker et al., 2006). Des travaux antérieurs ont pu identifier une activité de métabolisation des fractions microsomales hépatiques chez l’homme (de 50 à 90 %) (Day et al., 1992).
Élimination
La plupart des HAP sont excrétés dans les fèces et les urines.
Des concentrations de fluoranthène urinaires moyennes de 0,4 µg.mol-1 de créatinine ont pu être dosées chez des hommes employés dans des alumineries (Haugen et al., 1992) ou encore dans les cokeries (Rossella et al., 2009). Une autre étude rapporte également des concentrations urinaires de fluoranthène de 241,8 – 1,2 et < 2,2 ng.L-1 chez des salariés travaillant respectivement dans des raffineries (n = 12), au collage de l’asphalte (n = 10) ou non professionnellement exposé (n = 10) (Campo et al., 2011).
Chez l'animal
Absorption
Les données spécifiques au fluoranthène sont issues de deux études par voie orale (Lipniak et Brandys, 1993 ; Walker et al., 2007). Dans la première étude, des rats ont reçu une dose de 20 mg.kg-1 de fluoranthène dilué dans un mélange de Tween 80 et de solution saline isotonique (Lipniak et Brandys, 1993). Dans la seconde étude, le fluoranthène (pureté 97 %) (dose unique de 50 ou 100 µg.kg-1) a été administré au rat en présence d’acides gras saturés (huile de noix de coco) ou mono- ou poly-insaturés (respectivement huile d’arachide ou de maïs) (Walker et al., 2007).
Un pic de fluoranthène sanguin (30 mg.cm-3) est atteint 1 à 2 heures après l’administration (Lipniak et Brandys, 1993). L’absorption est plus efficace en présence d’acides gras saturés qu’insaturés (Walker et al., 2007).
Distribution
La biodisponibilité est comprise entre 62 % et 72 % (Lipniak et Brandys, 1993 ; Walker et al., 2007). Administré en présence d’acides gras saturés, le fluoranthène et ses métabolites ont tendance à s’accumuler dans les tissus graisseux (Walker et al., 2007).
La formation d’adduits a été décrite au niveau foie, des reins, des poumons, du petit intestin, du cœur, de la rate et des lymphocytes de rats exposés chroniquement au fluoranthène par voie orale (80 mg.kg-1.j-1 pendant environ 5 semaines), témoignant de la distribution du composé dans tout l’organisme (Gorelick et al., 1989).
Métabolisme
Les principaux métabolites identifiés chez le rat exposé à une dose unique de 50 ou 100 µg.kg-1 sont le 2,3-diolfluoranthène, majoritaire, le trans-2,3-dihydroxy-1,10-époxy-1,2,3,10-tétrahydro-fluoranthene (2,3D-fluoranthène), ainsi que le 3-hydroxy- et le 8-hydroxy-fluoranthène (Walker et al., 2007).
Une plus forte métabolisation du fluoranthène a été décrite en présence d’acides gras saturés (Walker et al., 2007).
L’affinité du fluoranthène pour l’AhR (récepteurs aux HAP capables d’induire l’activation des cytochromes P450) recherchée à partir de tests in vitro chez l’humain et l’animal est considéré comme très faible (Barron et al., 2004 ; Misaki et al., 2016 ; Vondráček et al., 2017).
Élimination
Le pic d’élimination du fluoranthène et de ses métabolites dans les urines et les fèces est atteint après 6 heures, pour ensuite diminuer progressivement mais varie en fonction des conditions d’administration (Walker et al., 2007). L’élimination urinaire semble être majoritaire chez le rat.
Autre
Relation avec le récepteur AhR
L’affinité du fluoranthène pour l’AhR (récepteurs aux HAP capables d’induire l’activation des cytochromes P450) recherchée à partir de tests in vitro chez l’humain et l’animal est considéré comme très faible (Barron et al., 2004 ; Misaki et al., 2016 ; Vondráček et al., 2017).
Synthèse
Chez l'homme :
Aucune donnée relative au fluoranthène seul n’a été identifiée. L’exposition de sujets à des mélanges de HAP par inhalation ou contact cutané a fourni des preuves indirectes de son absorption. Le 2,3-diol-fluoranthène est le métabolite majoritaire identifié à partir de fractions microsomales d’origine humaine. Il a été détecté dans le lait maternel et dans les urines de sujets exposés à des mélanges de HAP.
Chez l’animal :
Plusieurs métabolites ont été identifiés. L’élimination des métabolites et du fluoranthène se fait à la fois via les urines (préférentiellement) et les fèces. Le fluoranthène est un faible inducteur de son propre métabolisme.
Toxicité aiguë
Chez l'homme
Synthèse
Quelle que soit la voie d’exposition, aucune étude ne traite de l’effet du fluoranthène seul après une exposition aiguë chez l’homme.
Chez l'animal
Inhalation
Aucune donnée relative aux effets de l’exposition aiguë au fluoranthène seul chez l’animal n’a été identifiée.
Voie orale
Pour la voie orale, une DL50 de 2 000 mg.kg-1 poids corporel a été calculée chez le rat (Smyth et al., 1962) et une DL50 de 100 mg.kg-1 chez la souris (RTECS, 1993).
Des rats F-344 mâles et femelles ont été exposés par gavage à 0 - 100 - 200 - 400 mg.kg-1 de fluoranthène présent dans de l’huile de cacahuète (exposition unique). L’activité locomotrice nocturne de ces animaux a été observée toutes les 2 heures pendant 12 heures et pendant 5 jours consécutifs après le traitement. Une diminution significative des déplacements horizontaux et verticaux a été constatée chez les rats traités par rapport aux rats témoins. Une série de tests comportementaux a également été réalisée chez les rats 0 - 2 - 4 - 6 - 12 - 24 - 48 - 72 - 96 heures après l’exposition au fluoranthène. Les rats traités mâles et femelles présentaient une modification significative du comportement incluant une ataxie et une diminution de la réponse à un stimulant sensoriel (Saunders et al., 2003).
Dans une autre étude, des rats mâles et femelles ont reçu une dose unique de 1 000 - 2 000 ou 3 000 mg.kg-1 de fluoranthène administré par gavage dans l’huile de cacahuète (Knuckles et al., 2004). Les effets se sont limités au niveau hématologique à la baisse significative du nombre de leucocytes et à l’augmentation du volume corpusculaire moyen des érythrocytes aussi bien chez les mâles que chez les femelles et à toutes les doses testées.
Voie cutanée
Pour la voie cutanée, une DL50 de 3 180 mg.kg-1 poids corporel a été déterminée chez les lapins (Smyth et al., 1962).
Synthèse
Chez l’animal, le fluoranthène est faiblement toxique lors d’expositions aiguës par voies orale et cutanée. Par voie orale, des effets neurologiques (ataxie, diminution de la réponse aux stimuli sensoriels) ont été observés chez le rat.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Aucune étude spécifique au fluoranthène n’est disponible chez l’homme.
Chez des salariés travaillant dans une fonderie de fer en Pologne (Szczeklik et al., 1994) exposés pendant une durée moyenne de 15 ans à un mélange de HAP comprenant du chrysène du fluoranthène, du pérylène, du pyrène, du B(a)P, du benz(a)anthracène, du dibenz(a,h)anthracène et du benzo(g,h,i)perylène, des variations des taux d’immunoglobulines sériques ont été observées. La signification biologique de ces effets n’est pas claire et aucune conclusion concernant l’effet spécifique du fluoranthène n’a pu être établie.
Synthèse
Aucune étude spécifique concernant les effets systémiques du fluoranthène n’est disponible. Seules des variations des taux d’immunoglobulines sériques ont été observés chez des travailleurs exposés à un mélange d’HAP, dont le fluoranthène.
Chez l'animal
Inhalation
Chez l’animal, aucune étude concernant les effets pouvant être induits par une exposition chronique par voie pulmonaire au fluoranthène seul n’est disponible.
Voie orale
Des souris CD-1 mâles et femelles (20 souris par lot et par sexe) ont été exposées par voie orale (gavage) à 125, 250 ou à 500 mg.kg-1.j-1 de fluoranthène (pureté > à 97 %) pendant 13 semaines (US EPA, 1988a, 1988b, 1988c). Le poids des souris, la consommation de nourriture, la mortalité, le poids des organes et les paramètres hématologiques ont été étudiés. Des analyses histopathologiques des organes cibles du fluoranthène ont été également réalisées. Il a été montré que le fluoranthène à 500 mg.kg-1.j-1 n’induisait pas de détresses respiratoires ou cardiaques, ni de dommages (micro ou macroscopiques) ou nécroses pulmonaires ou cardiaques. De même, aucune atteinte musculo-squelettique n’a été observée. Toutes les souris exposées présentent une augmentation de la salivation, une néphropathie et une augmentation dose-dépendante du taux des enzymes hépatiques. Cependant, ces signes n’étaient pas statistiquement significatifs dans le lot exposé à 125 mg.kg-1.j-1 de fluoranthène et n’étaient pas considérés comme néfastes. Dans les lots exposés à 250 et à 500 mg.kg-1.j-1 de fluoranthène, une augmentation statistiquement significative du taux de gamma Glutamyl Transférase (γGT) et une augmentation du poids relatif et absolu du foie ont été constatées. Des lésions histologiques du foie ont été rapportées dans les lots exposés à 250 et à 500 mg.kg-1.j-1 de fluoranthène dans respectivement 65 et 87,5 % des cas. Sur la base de ces résultats un NOAEL de 125 mg.kg-1.j-1 et un LOAEL de 250 mg.kg-1.j-1 ont été calculés pour une augmentation du taux de la γGT et une augmentation du poids relatif et absolu du foie.
Une seconde étude de toxicité subchronique a été réalisée chez le rat (mâle et femelle) à des doses de 150 - 750 - 1 500 mg.kg-1.j-1 de fluoranthène (pureté de 98 %) administré dans les aliments pendant une période d’environ 90 jours (Knuckles et al., 2004). Le traitement a entraîné une baisse de poids et de la consommation de nourriture de 15 % (p<0,05) chez les mâles les plus fortement exposés. Les auteurs ont identifié la formation de cylindres granuleux dans les tubules rénaux comme étant l’effet le plus sensible, visible en particulier chez les mâles et significatif aux deux plus fortes doses (40, 80 et 100 % aux doses respectives de 150, 750 et 1 500 mg.kg-1.j-1), seules 10 % des femelles étant atteintes aux deux plus fortes doses. Ces altérations histologiques ont été logiquement accompagnées chez les mâles par une augmentation du taux d’urée dans le sang, significative uniquement à la plus forte dose. Chez les mâles, une augmentation du poids relatif du foie a également été observée à la plus forte dose.
Une baisse significative de plusieurs paramètres hématologiques (-12 % du nombre d’érythrocytes,-40 % du nombre de leucocytes, diminution de 9 % de l’hématocrite et de 12 % de la concentration en hémoglobine) a également été observée aussi bien chez les mâles que chez les femelles exposés à la plus forte dose. Les auteurs ont déterminé à partir de cette étude un NOAEL de 150 mg.kg-1.j-1 basé sur les paramètres hématologiques et les altérations rénales, par ailleurs vivement remis en cause par l’analyse des données de l’US EPA mentionnant de nombreuses incohérences dans l’expression des résultats (analyses statistiques, méthodologie) (US EPA, 2012).
Voie cutanée
Aucune étude par voie cutanée n’a été identifiée.
Synthèse
Chez l’animal, l’exposition par voie orale au fluoranthène induit une hypersalivation, des effets rénaux (néphropathie) et hépatiques (augmentation dose-dépendante des enzymes, lésions histologiques).
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :
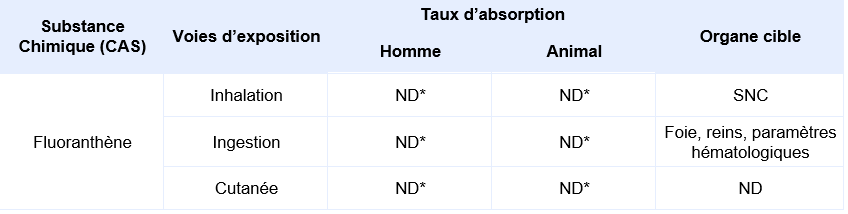
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non Déterminé | |
| IARC | Groupe 3 : l’agent (ou le mélange) ne peut être classé pour sa cancérogénicité pour l’homme | 1987 |
| US EPA | Classe D : Informations inadéquates pour évaluer le potentiel cancérogène | 2012 |
Chez l'homme
Synthèse
Aucune donnée relative au potentiel cancérogène du fluoranthène seul n’a été identifiée chez l’homme.
Chez l'animal
Inhalation
Aucune étude de cancérogenèse par inhalation n’a été réalisée avec le fluoranthène.
Voie orale
Aucune étude de cancérogenèse par voie orale n’a été réalisée avec le fluoranthène.
Voie cutanée
Le processus de mélanogenèse, induit par certains cancérogènes chimiques, a été recherché. L’application de façon ponctuelle pendant 1 ou 2 jours consécutifs de différents HAP dont le fluoranthène sur le dos de souris C57BL/6 a montré que 0,05 mg.cm-2 de fluoranthène n’augmentait pas le nombre de mélanocytes actifs chez ces souris (Iwata et al., 1981).
Dans l’étude de Greife et Warshawsky, 1993, du fluoranthène dilué dans du toluène est appliqué deux fois par semaine pendant 6 mois sur la peau des souris C3H/HeJ mâles (20 souris par lot). L’incidence des tumeurs est déterminée à la fin de l’étude et il apparaît que l’application de fluoranthène seul n’induit aucune tumeur chez les animaux étudiés. Par contre, après co-administration du fluoranthène avec 0,0005 mg de benzo(a)pyrène, 8 % des animaux développent des papillomes en moyenne 95 semaines après le début de l’étude.
Dans un protocole similaire, l’équipe de Van Duuren a également observé une absence d’effet tumorigène du fluoranthène appliqué seul (40 mg par application) trois fois sur le dos de souris (ICR/HA Swiss) (Van Duuren et Goldschmidt, 1976). En présence de benzo(a)pyrène (5 mg), le fluoranthène augmente le nombre de tumeurs par trois et réduit la période de latence de moitié par comparaison aux effets du benzo(a)pyrène seul. En revanche, dans un test de promotion tumorale où les souris initialement traitées par une application de 150 mg de benzo(a)pyrène, ont reçu 40 jours plus tard 3 applications hebdomadaires de fluoranthène (40 mg/application), seule une souris a développé un papillome, montrant que le fluoranthène n’était pas (ou très faiblement) un promoteur tumoral.
Chez les souris C3H (15 souris mâles par lot), l’application de 250 µg/souris (soit environ 20 mg.kg-1) de fluoranthène recristallisé présent dans de la décaline, 2 fois par semaine pendant 82 semaines n’induit aucun papillome ni carcinome. Le nombre de souris ayant développé ces tumeurs en présence du solvant seul est de 2 sur 13 (Horton et Christian, 1974). L’application cutanée (3 fois par semaine pendant la vie des souris) de 0,1 % d’une solution du fluoranthène chez des souris Swiss femelles
(20 par lot) n’induit pas de papillomes ni carcinomes. (Wynder et Hoffmann, 1959).
Synthèse
Chez la souris, seules des études par voie cutanée sont disponibles. Elles révèlent l’absence d’effet cancérogène ou d’effet de promoteur tumoral du fluoranthène seul. En revanche, c’est un co-cancérogène en présence de benzo(a)pyrène.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le fluoranthène n’a pas fait l’objet d’un examen par l’Union Européenne. |
Chez l'homme
Synthèse
Il n’existe pas d’études relatives aux effets du fluoranthène seul chez l’homme.
Chez l'animal
Toutes voies
Une étude réalisée in vivo chez la souris (400 et 750 mg.kg-1) n’a pas montré d’augmentation de la fréquence d’échanges de chromatides sœurs sur les cellules de moelle osseuse chez la souris (Palitti et al., 1986).
La formation d’adduits, principalement par interaction entre le dihydroxy-epoxy-trihydro-fluoranthène et la désoxyguanosine, a été décrite dans de nombreux tissus (foie, reins, poumons, intestin, cœur, rate et lymphocytes) prélevés sur des rats après une exposition d’environ 5 semaines à une dose moyenne de 80 mg.kg-1.j-1 de fluoranthène administré dans la nourriture (Gorelick et al., 1989).
Une étude réalisée à de faibles doses d’exposition par voie orale chez le rat (dose unique de 50 et 100 µg.kg-1) a montré la formation d’adduits, également à partir du dihydroxy-epoxy-trihydro-fluoranthène, dans les poumons, les intestins, les testicules et le foie environ dans les deux à trois heures ayant suivi l’exposition à la plus forte concentration (Walker et al., 2007). Tous les adduits ont été localisés au niveau de la guanine de l’ADN.
In vitro
Organismes procaryotes
FDTE/VTR Importer De nombreux tests réalisés avec le fluoranthène sur différentes souches de Salmonella typhimurium ont montré des résultats positifs et d’autres négatifs.
Organismes eucaryotes
Dans le cadre d’une réalisée à partir de coupes de foie de rat exposées in vitro à différents HAP dont le fluoranthène (3, 10 ou 30 µM pendant 24 heures), peu ou pas d’adduits avec l’ADN (en dessous du bruit de fond) ont été observés (Staal et al., 2007). En revanche, dans les mêmes conditions expérimentales, la présence de fluoranthène a un effet synergique sur la formation d’adduits par le B(a)P.
Concernant la mutagénicité sur cellules de mammifères, les résultats sont également équivoques : des résultats négatifs et positifs ont été obtenus par le test d’aberrations chromosomiques réalisé sur cellules de Hamster Chinois. Un test de mutation génique s’est révélé négatif sur des cellules de lymphoblastes humains, alors que les tests réalisés sur différentes lignées de cellules ovariennes de Hamster Chinois ont été à la fois négatives et positives (US EPA (IRIS), 1990).
Synthèse
Le fluoranthène induit la formation d’adduits lors d’exposition chez l’animal. Les résultats des tests de mutagenèse in vitro sont contradictoires.
Effets sur la reproduction
Chez l'homme
Toutes voies
Aucune donnée concernant l’effet du fluoranthène seul sur la reproduction n’est disponible chez l’homme et ceci quelle que soit la voie d’exposition au fluoranthène.
Synthèse
Les effets du fluoranthène seul sur la reproduction n’ont pas été étudiés chez l’homme.
Chez l'animal
Toutes voies
Peu de données sont disponibles.
Voie orale
Des souris mâles et femelles ont été gavées pendant 13 semaines avec différents HAP (l’acénaphtène, de l’anthracène, du fluoranthène et du fluorène). Contrairement aux autres HAP, aucun effet sur les organes reproducteurs n’a été observé chez les rats mâles et femelles après exposition par voie orale à 500 mg.kg-1.j-1 de fluoranthène (poids et histologie) (US EPA, 1988a, b, c).
Chez le rat, un test utérotrophique réalisé sur de jeunes femelles immatures exposées à 10 mg.kg-1.j-1 de fluoranthène pendant 3 jours a permis de montrer l’augmentation du poids relatif et absolu de l’utérus des femelles (p<0,01), ainsi que par l’augmentation de l’épaisseur de l’épithélium luminal (Kummer et al., 2008).
Synthèse
Le fluoranthène est sans effet sur les organes de la reproduction chez le rat. La fonction de reproduction n’a pas été étudiée.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le fluoranthène n’a pas été examiné |
Chez l'homme
Toutes voies
Aucune étude traitant de l’effet du fluoranthène seul sur le développement n’a été identifiée.
Néanmoins, dans le cadre d’une étude cas-témoins, une augmentation significative du dosage placentaire de fluoranthène (moyenne de 325,91 ± 45,14 ppb) a été rapportée chez les femmes ayant accouché prématurément (29 cas) par comparaison au 31 femmes non exposées du lot témoin (moyenne de 208,6 ± 21,93 ppb) (p<0,05) (Singh et al., 2008).
Synthèse
Les effets du fluoranthène seul sur le développement n’ont pas été étudiés chez l’homme. Toutefois l’exposition aux HAP contenant du fluoranthène est associée à une augmentation des naissances prématurées chez les femmes enceintes.
Chez l'animal
Toutes voies
Aucune étude relative aux effets du fluoranthène seul n’a été identifiée sur le développement chez l’animal par les voies classiques d’exposition.
Synthèse
Les effets du fluoranthène sur le développement n’ont pas été étudiés chez l’animal.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Effets sans seuil
Selon le rapport INERIS de 2003 (Doornaert et Pichard, 2003), une méthode de calcul est proposée par l’OMS IPCS, sur la base d’une valeur de référence multipliée par un FET (facteur d’équivalence toxique). Le principe de FET est fondé sur les hypothèses selon lesquelles l’organe cible et l’activité toxique sont identiques pour chaque molécule apparentée et qu’il n’y a pas d’interaction toxicocinétique ni toxicodynamique. Une telle approche autorise l’addition des risques cancérigènes liés à une co-exposition et permet de quantifier le pouvoir cancérigène d’un mélange de substances en fonction du pouvoir cancérigène d’une substance dite de référence, appartenant à la même famille chimique (OMS IPCS, 1998).
Néanmoins, comme le rappelle l’AFSSA, 2006, cette approche n’est possible que sous 3 conditions :
- les doses et les effets de chacun des composés du mélange sont additifs,
- il n'existe pas d'interactions antagonistes ou synergiques entre les composés du mélange et
- ils agissent selon le même mécanisme d'action toxique.
Or de nombreuses études expérimentales montrent que ces 3 conditions ne sont pas toujours réunies et peuvent conduire à une surestimation ou à une sous-estimation du risque.
Dans le cas des HAP, la molécule de référence est le benzo(a)pyrène car c’est le HAP le plus étudié et donc le mieux connu. Le potentiel toxique relatif de chaque HAP dont l’anthracène est ensuite évalué par rapport à la toxicité du benzo(a)pyrène. Un FET par rapport au benzo(a)pyrène est alors évalué pour l’anthracène. Les FET retenus dans cette approche sont ceux proposés par Nisbet et Lagoy, 1992 et repris dans le document INERIS de 2003. Cette étape est basée sur l’hypothèse selon laquelle le potentiel toxique relatif entre deux HAP estimé chez l’animal est identique ou similaire chez l’homme.
Comme certaines études ont montré que les HAP considérés comme non cancérigènes, pouvaient parfois induire une faible activité cancérigène, un FET de 0,001 a été attribué par Nisbet et Lagoy, 1992 à chaque HAP non cancérigène comme le fluoranthène.
Informations relatives à l’utilisation des VTR:
Dans cette partie, seul le fluoranthène est considéré, la toxicité du fluoranthène en mélange avec d’autres HAP est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP.
Rappelons que dans le concept de facteur d’équivalence toxique (FET) permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le fluoranthène n’est pas une substance cancérogène mais un co-cancérogène en présence de benzo(a)pyrène.
Même si à ce jour il n’existe pas de VTR pour des expositions cutanées, cette voie d’exposition peut ne pas être négligeable.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition sub-chronique par voie orale
L’ATSDR propose un MRL de 0,4 mg.kg-1.j-1 pour une exposition subchronique par voie orale au fluoranthène (ATSDR, 1995).
Cette valeur a été établie à partir de l’étude de l’US EPA, 1988c, étude non publiée, dans laquelle 4 groupes de souris CD-1 (20 souris par lot et par sexe) ont été exposées par voie orale (gavage) à 0 – 125 – 250 - 500 mg.kg-1.j-1 de fluoranthène pendant 90 jours. A partir de cette étude, un NOAEL de 125 mg.kg-1.j-1 et un LOAEL de 250 mg.kg-1.j-1 ont été calculés par l’US EPA pour une augmentation significative du taux de la γGT et une augmentation du poids relatif et absolu du foie associés à des lésions histologiques
Pour établir la MRL, l’ATSDR retient un LOAEL de 125 mg.kg-1.j-1 car une néphropathie, une augmentation de la salivation et une augmentation du taux des enzymes hépatiques ont été observées à cette dose. Dans son étude, l’US EPA précise que ces signes ne sont pas statistiquement significatifs dans le lot exposé à 125 mg.kg-1.j-1 de fluoranthène et qu’ils ne sont pas considérés comme néfastes.
Facteur d’incertitude : un facteur d’incertitude de 300 a été appliqué au LOAEL de 125 mg.kg-1.j-1. Un facteur 3 pour l’utilisation d’un LOAEL, un facteur 10 pour la transposition de l’animal à l’homme et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul : 125 mg.kg-1.j-1 x 1/300 = 0,41 mg.kg-1.j-1 (arrondi à 0,4 mg.kg-1.j-1)
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 4.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au fluoranthène (US EPA (IRIS), 1990).
L’US EPA s’est également appuyé sur sa propre étude (US EPA, 1988c), dans laquelle les souris mâles et femelles ont été exposées par gavage à 0 - 125 - 250 - 500 mg.kg-1.j-1 de fluoranthène pendant 90 jours. Sur la base de cette étude, l’US EPA retient un NOAEL de 125 mg.kg-1.j-1 pour une augmentation significative du taux de la γGT et une augmentation du poids relatif et absolu du foie associés à des lésions histologiques du foie.
Facteur d’incertitude : un facteur d’incertitude de 3 000 est appliqué. Un facteur 10 pour la transposition de l’animal à l’homme, un facteur 10 pour la variabilité au sein de la population humaine, et un facteur 30 pour l’utilisation d’une étude subchronique et pour le manque de données concernant la reproduction et le développement et concernant la toxicologie chez une seconde espèce.
Calcul : 125 mg.kg-1.j-1 x 1/3 000 = 3,75.10-2 mg.kg-1.j-1 (arrondi à 4.10-2)
Indice de confiance : l’indice de confiance est moyen pour l’étude, faible pour la base de données et la valeur proposée.
L’OMS propose une valeur de 1.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au fluoranthène (OMS, 2017)
Cette valeur est construite sur la base d’un NOAEL de 125 mg.kg-1.j-1 pour une augmentation du niveau de transaminases sériques glutamate-pyruvate, des pathologies rénales et hépatiques et des modifications cliniques et hématologiques. L’étude ayant servi à calculer cette valeur est une étude chez la souris de 13 semaines de l’US-EPA (1988c).
Facteur d’incertitude : Un facteur d’incertitude de 10 000 a été utilisé correspondant à 100 pour le facteur inter-espèces et intra-espèces, 10 pour l’utilisation d’une étude subchronique et le manque d’information et 10 pour les preuves de co-cancérogénicité avec le benzo(a)pyrène sur des études cutanées chez la souris
Calcul : 125 mg.kg-1.j-1 x 1/10 000 = 0,0125 mg.kg-1.j-1 (arrondi à 1.10-2)
Effets sans seuil - Exposition chronique par Inhalation
L'INERIS propose un ERUi de 6.10-7 (µg.m-3)-1 pour une exposition chronique par inhalation du fluoranthène (2018).
Pour une exposition par inhalation à un HAP et en l’absence de valeur spécifique, l’INERIS recommande de prendre en compte l’Excès de Risque Unitaire (ERUi) du benzo(a)pyrène proposée par l’US EPA (2017) et retenue par l’INERIS pour le benzo(a)pyrène4 à savoir 6.10-4 (µg.m-3)-1et de lui appliquer le FET correspondant à cet HAP.
Pour le fluoranthène, l’INERIS a retenu en 2003, un FET de 0,001 provenant de la classification de Nisbet et Lagoy, 1992.
Cet ERUi correspond à une concentration de 16,7 µg.m3 pour un risque de 10-5 ou à une concentration de 1,67 µg.m3 pour un risque de 10-6.
Calcul de VTR par inhalation à partir du Facteur Equivalent Toxique (FET) du fluoranthène
|
Inhalation |
ERUi = 6.10-4 (µg.m-3)-1 |
0,001 |
ERUi = 6.10-7 (µg.m-3)-1 |
Effets sans seuil - Exposition chronique par voie orale
L’ANSES propose de retenir une valeur de 0,005 µg TEQ.kg-1.j-1 pour une exposition chronique par voie orale à 11 HAP (ANSES, 2016)
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM.
Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
Pour les autres HAP, l’AFSSA recommande l’utilisation de facteurs d’équivalence toxiques (TEF) basés sur le pouvoir cancérigène relatif des HAP. Dans le cadre de l’étude sur l’alimentation totale infantile, l’ANSES (2016) a considéré 11 HAP (benzo(a)anthracène, benzo(a)pyrène, benzo(b)fluoranthène, chrysène, benzo(g,h,i)perylène, benzo(k)fluoranthène, dibenzo(a,h)anthracène, indeno(1,2,3-c,d)pyrène, anthracène, benzo(j)fluoranthène et fluoranthène) les plus toxiques et les plus représentatifs de la contamination alimentaire. L’ANSES (2016) a alors considéré qu’il était possible de calculer un excès de risque de cancer de 10-6 sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1 (RIVM, 2001). Cette DVS a été établie sur la base d’apparition de tumeurs dans de nombreux organes (dont principalement le foie et le pré-estomac) observée au cours d’une étude réalisée chez le rat exposé par gavage pendant 2 ans au benzo(a)pyrène.
Le RIVM propose un CRoral de 5.10-2 mg.kg-1.j-1 pour une exposition par voie orale (Baars et al., 2001).
Cette concentration correspond à un excès de risque cancérogène de 1.10-4 pour une exposition continue durant toute la vie. Elle est issue des données d'une étude expérimentale par gavage au benzo(a)pyrène chez le rat (0, 3, 10 et 30 mg.kg-1.j-1 durant 2 ans, 5 j.sem-1) (Kroese et al., 1999). Une augmentation dose-dépendante de l'incidence de tumeurs a été observée dans de nombreux organes et tissus, notamment le foie et l'estomac, et également l'œsophage, la peau, la glande mammaire, le canal auditif, la cavité orale, l'intestin grêle et les reins.
A l’aide des deux valeurs, la VTR du benzo(a)pyrène de 0,5 µg.kg-1.j-1 pour un excès de risque cancérigène de 1.104 et le FET de 0,01 attribué au fluoranthène, un CRoral de 5.10-2 mg.kg-1.j-1 pour un excès de risque cancérigène de 1.10-4 a été calculé pour le fluoranthène
Selon le RIVM, la fiabilité de cette valeur est élevée.
L’INERIS propose un ERUo de 10-3 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au fluoranthène (2018).
Comme précisé ci-dessus, l'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
En 2003, l’INERIS retenait la proposition de l’AFSSA (2003) et proposait donc pour le benzo(a)pyrène l’utilisation de la valeur établie par le RIVM. Le RIVM détermine une dose virtuellement sûre (DVS) de 5 ng.kg-1.j-1, par un modèle d'extrapolation linéaire à l'origine, en retenant la dose critique de 10 mg.kg-1.j-1 de B(a)P administrée à l'animal induisant l'apparition significative de tumeurs, et après ajustement de la durée d’administration et d’observation. Cette DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
En 2018, suite à la réévaluation de la valeur de l’US EPA pour le benzo(a)pyrène décrite dans la fiche de données toxicologique et environnementale du benzo(a)pyrène, l’INERIS propose de modifier sa valeur. Cette valeur est basée sur celle proposée par l’US EPA, 2017 et retenue par l’INERIS pour le benzo(a)pyrène à savoir 1 (mg.kg-1.j-1)-1. A partir de cette valeur une approche par l’application de FET a été réalisée.
Cet ERU0 correspond à une dose de 10-2 mg.kg-1.j-1 pour un excès de risque de 10-5 et à une dose de 10-3 mg.kg-1.j-1 pour un excès de risque de 10-6.
Calcul de VTR par inhalation à partir du Facteur Equivalent Toxique (FET) du fluoranthène :

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition sub-chronique par voie orale
L’Ineris propose de retenir pour une exposition sub-chronique au fluoranthène par voie orale la MRL de 0,4 mg.kg-1.j-1 de l’ATSDR (1995)
Cette valeur est basée sur la valeur de l’ATSDR (1995), qui est la seule VTR disponible. L’étude clef est une étude expérimentale de 90 jours chez des souris, étude non publiée, mais qui a été évaluée par l’US EPA (1990) pour l’élaboration de sa VTR chronique. La construction de la valeur est justifiée et le choix des facteurs d’incertitude est cohérent.
Indice de confiance : moyen du fait de l’absence de l’accès aux données de l’étude.
Effets à seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique au fluoranthène par voie orale la RfD de 4.10-2 mg.kg-1.j-1 de US EPA, 1990.
Deux valeurs sont disponibles, celle de l’US EPA (1990) et celle de l’OMS (2017).
Les deux valeurs reposent sur la même étude l’US-EPA (1988c) : étude expérimentale de 90 jours chez des souris, également retenue par l’ATSDR (1995). La dose critique retenue par US EPA et l’OMS est identique NOAEL de 125 mg.kg-1.j-1 mais diffère du choix de l’ATSDR pour l’élaboration de sa valeur pour des expositions subchroniques. En effet, l’ATSDR retient la valeur de 125 mg.kg-1.j-1 comme un LOAEL du fait de l’apparition d’effets de type néphropathie, augmentation de la salivation et augmentation du taux des enzymes hépatiques.
Concernant le choix des facteurs d’incertitude, les deux organismes US EPA et OMS retiennent un facteur 10 pour l’extrapolation de l’animal à l’homme et un facteur 10 pour la variabilité au sein de l’espèce humaine. Les deux organismes ajoutent ensuite un facteur 30 pour l’US EPA et 10 pour l’homme pour tenir compte l’utilisation d’une étude subchronique et le manque d’information relative aux effets du fluoranthène. L’OMS ajoute ensuite un facteur 10 en raison de l’effet co-cancérogène avec le benzo(a)pyrène lors d’exposition cutanée ce qui conduit un facteur 10 000 pour l’OMS ce qui est trop élevé.
La construction de la valeur de l’US EPA est claire et le choix des facteurs d’incertitude plus adapté que l’approche de l’OMS.
La valeur de l’US EPA est retenue pour la voie orale.
Indice de confiance : Cette valeur est donc retenue par défaut pour l’exposition par voie orale.
Effets sans seuil - Exposition chronique par Inhalation
L’Ineris propose de retenir pour une exposition chronique au fluoranthène par inhalation l’ERUi chronique de 6.10-7 (µg.m-3)-1 de l’INERIS.
La seule valeur disponible est celle proposée par l’INERIS. Elle est construite par application du FET à partir de la valeur révision du benzo(a)pyrène. Cette valeur est retenue.
Indice de confiance : Faible en raison du manque de données pour cette voie.
Effets sans seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique au fluoranthène par voie orale l’ERU0 chronique de 10-3 (mg.kg-1.j-1)-1de l’INERIS (2018).
Pour l’exposition par voie orale pour les effets sans seuil, trois valeurs sont proposées, par le RIVM, l’ANSES et l’INERIS. Ces valeurs sont construites à partir d’une même approche basée sur l’utilisation du FET du fluoranthène de valeur 0,01 pour le RIVM et l’ANSES, ou de 0,001 pour l’INERIS. La valeur proposée par l’INERIS est basée sur une approche mise à jour en 2018 par l’US EPA à partir de la même étude que celle utilisée par le RIVM.
Indice de confiance : Faible en raison du manque de données pour cette voie
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Le fluoranthène est une substance dangereuse prioritaire N°15 selon la Directive Cadre sur l’Eau (DCE) (état chimique). Pour chacune de ces substances prioritaires des Normes de Qualité Environnementales (NQE) sont définies au niveau Européen. La méthodologie ainsi que les données utilisées pour le calcul de ces NQE sont présentées dans des fiches détaillées. Les informations en lien avec l’écotoxicité du fluoranthène présentées dans ce document en sont extraites (EC, 2011).
Dangers
Description
Le fluoranthène est phototoxique et la toxicité observée lors des essais dépends des conditions d’éclairement.
Des résultats de tests d’écotoxicité aigus sont disponibles pour 9 groupes taxonomiques d’eau douce (algues, crustacés, poissons, macrophytes, cœlentérés, annélides, mollusques, insectes et amphibiens) et pour 5 groupes taxonomiques marins (crustacés, poissons, annélides, mollusques et échinodermes). Les résultats des tests d’écotoxicité aigus menés en présence de lumière (UV) sont comparables voir inférieurs aux plus faibles résultats obtenus suite à une exposition chronique (NOEC/EC50). L’espèce la plus sensible étant Pleuronectes americanus (poisson marin) avec une LC50lumière UV (96h) à 0,1 µg.L-1. Des LC50 lumière UV (96h) égales à 1,2 µg.L-1 et 2,2 µg.L-1 ont été obtenues pour Lumbriculus variegatus et Hydra americana respectivement. Une LC50 lumière UV (48) de 1,6 µg.L-1 a été obtenue pour Daphnia magna (EC, 2011).
Des résultats d’essais d’écotoxicité chroniques sont disponibles pour 6 groupes taxonomiques d’eau douce (algues, crustacés, poissons, macrophytes, insectes et amphibiens) et pour 4 groupes taxonomiques marins (crustacés, poissons, ascidiaceans, mollusques et échinodermes). L’espèce la plus sensible étant Hyalella azteca avec une LC10 (10 j) (mortalité/UV) à 1 µg.L-1 en eau douce et Mulinea lateralis avec une EC50 (48 h) (test embryo larvaire/développement/UV) à 1,1 µg.L-1 en eau marine (EC, 2011).
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Le fluoranthène est phototoxique et la toxicité observée lors des essais dépends des conditions d’éclairement.
Des résultats de tests d’écotoxicité aigus sont disponibles pour 9 groupes taxonomiques d’eau douce (algues, crustacés, poissons, macrophytes, cœlentérés, annélides, mollusques, insectes et amphibiens).
Les résultats des tests d’écotoxicité aigus menés en présence de lumière (UV) sont comparables voir inférieurs aux plus faibles résultats obtenus suite à une exposition chronique (NOEC/EC50). Des LC50 lumière UV (96h) égales à 1,2 µg.L-1 et 2,2 µg.L-1 ont été obtenues pour Lumbriculus variegatus et Hydra americana respectivement. Une LC50 lumière UV (48) de 1,6 µg.L-1 a été obtenue pour Daphnia magna (EC, 2011).
Des résultats d’essais d’écotoxicité chroniques sont disponibles pour 6 groupes taxonomiques d’eau douce (algues, crustacés, poissons, macrophytes, insectes et amphibiens). L’espèce la plus sensible est Hyalella azteca avec une LC10 (10 j) (mortalité/UV) à 1 µg.L-1(EC, 2011).
Eau marine
Le fluoranthène est phototoxique et la toxicité observée lors des essais dépends des conditions d’éclairement.
Des résultats de tests d’écotoxicité aigus sont disponibles pour 5 groupes taxonomiques marins (crustacés, poissons, annélides, mollusques et échinodermes). Les résultats des tests d’écotoxicité aigus menés en présence de lumière (UV) sont comparables voir inférieurs aux plus faibles résultats obtenus suite à une exposition chronique (NOEC/EC50). L’espèce la plus sensible est Pleuronectes americanus (poisson marin) avec une LC50lumière UV (96h) à 0,1 µg.L-1 (EC, 2011).
Des résultats d’essais d’écotoxicité chroniques sont disponibles pour 4 groupes taxonomiques marins (crustacés, poissons, ascidiaceans, mollusques et échinodermes). L’espèce la plus sensible est Mulinea lateralis avec une EC50 (48 h) (test embryo larvaire/développement/UV) à 1,1 µg.L-1 e (EC, 2011).
Sédiments d'eau douce
Des résultats d’essais d’écotoxicité aigus sur organismes benthiques (invertébrés) sont disponibles pour (EC, 2011): 2 groupes taxonomiques d’eau douce (crustacés et insectes) Des résultats d’essais d’écotoxicité chroniques sur organismes benthiques (invertébrés) sont disponibles pour (EC, 2011) : 3 groupes taxonomiques d’eau douce (annélides, crustacés, insectes)
Sédiments marins
Des résultats d’essais d’écotoxicité aigus sur organismes benthiques (invertébrés) sont disponibles pour (EC, 2011) pour 4 groupes taxonomiques marins (annélides, mollusques, crustacés et échinodermes).
Des résultats d’essais d’écotoxicité chroniques sur organismes benthiques (invertébrés) sont disponibles pour (EC, 2011) pour 1 groupe taxonomique marin (crustacés). Le crustacés marin Schizopera knabeni est le plus sensible d’après les résultats disponibles avec une EC10 (14 j) (reproduction) à 20 mg.kg-1 poids sec (normalisé à 5 % carbone organique tel que recommandé par le TGD EQS).
Sol
Paramètres d’écotoxicité aiguë
Plusieurs résultats d'essais sur organismes terrestres sont disponibles. Le milieu terrestre n’est pas couvert par l’évaluation européenne utilisée pour le milieu aquatique, (EC, 2011) mais le fluoranthène a fait l’objet d’une évaluation collective par les Pays-Bas pour le milieu terrestre et ce sont les résultats de cette étude qui sont reportés ci-dessous (RIVM, 2012).
Paramètres d’écotoxicité chronique
Pour le ver Eisenia fetida et les escargots (Helix aspersa) aucun effet n’a été mesuré à la plus haute concentration testée. Au contraire, sur d’autres taxons (annélides, insectes, macrophytes) des effets sur le poids ou la reproduction ont été observés, et les concentrations sans effets déterminées vont de 55 à 1 411 mg.kg-1 de sol, l’annélide Enchytraeus crypticus étant le plus sensible.
Sur les fonctions du sol, si aucun effet n’a été observé sur les processus de respiration du sol, la nitrification est l’un des paramètres les plus sensibles avec une concentration sans effet de 48 mg.kg-1 de sol.
Biote
Organismes prédateurs (par empoisonnement secondaire) :
Les résultats d’essais sur oiseaux sont rares et aucune NOAEL n’a pu être déterminée à partir de ces derniers. Peu de données de toxicité sur mammifères sont également disponibles, la quasi-totalité des essais à long terme ont été réalisés pour évaluer le pouvoir cancérigène des HAP (essais considérés comme non appropriés pour l'évaluation de l'empoisonnement secondaire"). Un résultat d’essai sur souris obtenu lors d’une étude de 90 jours (administration orale par gavage) peut néanmoins être utilisé pour tenter de dériver une PNECorale. Dans le cadre de cet essai, une NOAEL à 125 mg.kg-1 poids corporel.j-1 et une NOEC à 1 037 mg.kg-1nourriture ont été déterminées.
Compte-tenu du potentiel de bioaccumulation, l’empoisonnement secondaire des prédateurs par la consommation de proie contaminée doit être considéré.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau) :
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes de la colonne d’eau.
Valeur seuil pour les organismes de la colonne d’eau douce :

Valeur seuil pour les organismes de la colonne d’eau marine :

Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :
PNEC eau douce et marine = 0,12 µg.L-1
Valeurs seuil pour la protection des organismes benthiques :
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes benthiques.
PNEC pour le compartiment sédimentaire d’eau douce :

PNEC pour le compartiment sédimentaire d’eau marine :

Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :
![]()
Valeurs seuil pour la protection des organismes terrestres :
En l’absence valeur réglementaire, l’INERIS propose de déterminer une valeur de PNEC : la PNEC suivante, élaborée par le RIVM a été identifiée :
PNEC disponibles pour des organismes terrestres :
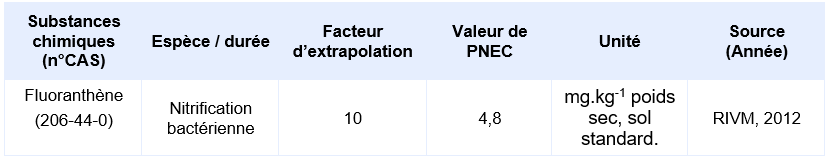
Justification scientifique : Des données sont disponibles sur 3 taxons distincts : plantes (3 espèces), invertébrés (2 résultats incluant annélides et crustacés) et sur les fonctions du sol (respiration, nitrification). La PNEC peut ainsi être déterminée en appliquant un facteur de 10 à la plus basse des valeurs sans effets chroniques NOEC/EC10, c’est-à-dire sur l’EC10 pour le processus de nitrification. Une PNECsol de 4,8 mg.kg-1 poids sec est donc ainsi proposée.

Organisme prédateurs ( par empoisonnement secondaire) :
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes prédateurs.
PNEC pour les prédateurs :

Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Colone d'eau :
PNEC eau douce et marine = 0,12 µg.L-1
Sédiment
![]()
Sol
PNECsol = 4,8 mg.kg-1
Organisme prédateurs ( par empoisonnement secondaire) :
![]()
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Valeurs de référence pour la surveillance des écosystèmes
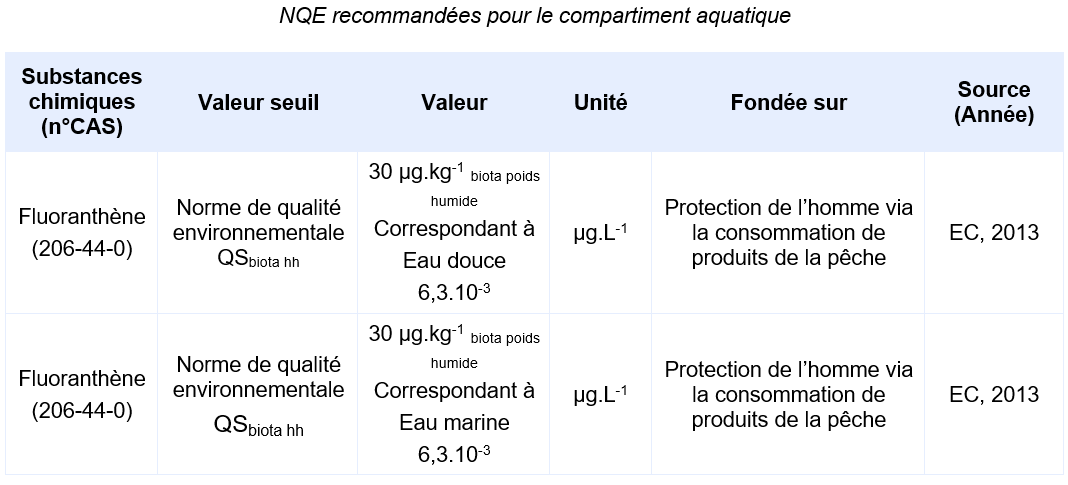
Le fluoranthène est une substance dangereuse prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE, transposée par l’arrêté du 27 juillet 2015).
Elle est réglementée au niveau européen (substance de l’état chimique) par une Norme de Qualité Environnementale, ou NQE, définie comme la « concentration d’un polluant ou d'un groupe de polluants dans l'eau, les sédiments ou le biote qui ne doit pas être dépassée, afin de protéger la santé humaine et l'environnement ».
En pratique, la NQE est la norme de qualité la plus basse parmi 5 objectifs de protection couvrant la protection des organismes aquatique de la colonne d’eau, les organismes sédimentaires, les prédateurs se nourrissant dans les milieux aquatiques, et l’homme via la consommation de produit de la pêche ou d’eau de boisson. La détermination de ces normes suit une méthodologie spécifique qui a été élaborée au niveau européen (Technical Guidance For Deriving Environmental Quality Standards) (EC, 2018).
Le détail des valeurs seuils pour chaque objectif de protection ayant conduit à la valeur de NQE est présenté en section Données écotoxicologiques.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le fluoranthène est un constituant de la famille des hydrocarbures aromatiques polycycliques (HAP) de formule brute C16H10 et de numéro CAS 260-44-0. Le fluoranthène, en tant que tel, ne semble plus être produit industriellement, en France et même à travers le monde. Il n'est pas non plus utilisé, mais en revanche, le fluoranthène en tant que HAP est présent dans de nombreuses applications et émissions atmosphériques, qui génèrent indirectement des rejets de fluoranthène dans les milieux aquatiques, de nature à induire des dépassements généralisés des Normes de Qualité Environnementales.
Les principales sources d'émissions de fluoranthène sont essentiellement à l'origine de rejets atmosphériques (le fluoranthène est d'ailleurs largement le HAP le plus émis dans l'atmosphère en France) à travers des combustions dans les appareils domestiques, le secteur tertiaire et le transport routier. Le fluoranthène est ainsi apporté de façon diffuse dans les milieux aquatiques, de la même façon que les HAP. La baisse des rejets ; largement diffus et non-intentionels,de fluoranthène ne semble pas facile à réaliser, les rejets de HAP étant très diffus et difficiles à maîtriser.
La majeure partie du fluoranthène se retrouve dans les sols (97 %), où les concentrations sont de l'ordre du mg/kg. Dans l'air et dans les eaux, les concentrations sont respectivement de l'ordre du ng.m-3 et du ng.L-1.
Très peu d'informations spécifiques au fluoranthène étant disponibles, on pourra se reporter pour plus d'informations sur l'ensemble des HAP à la fiche ad hoc (INERIS, 2006).
Abstract
Fluoranthene is a constituent of the family of polycyclic aromatic hydrocarbons (PAH), its molecular formula is C16H10 and its CAS number is 260-44-0. Fluoranthene, as such, no longer appears to be produced commercially in France and in the world. It is not used, but on the other hand, fluoranthene as PAH is present in many applications and atmospheric emissions, which indirectly generate fluoranthene releases to aquatic environments likely to generate widespread exceedance of the Environmental Quality Standards.
The main sources of fluoranthene emissions are atmospheric (fluoranthene is also the most widely PAH emitted to the atmosphere in France) and they are combustions in domestic appliances, the tertiary sector and road transport. Fluoranthene is thus brought diffusely in the same way as the PAHs. The decrease in releases of fluoranthene does not seem easy to achieve, releases of PAHs is very diffuse and difficult to control.
Most of the fluoranthene is found in soils (97%), where the concentrations are of the order of mg/kg. In the air and waters, concentrations are respectively about ng.m-3 and ng.L-1.
Very little specific information about fluoranthene is available, reference may be found for more information on all of PAHs to the sheet on PAHs (INERIS, 2006).
Tableaux de synthèse
Généralités
| CAS | 206-44-0 |
|---|---|
| SANDRE | 1191 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | oui |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Directive-Cadre sur l'EauLe fluoranthène est cité dans la directive n°2013/39/UE du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE en ce qui concerne les substances prioritaires pour la politique dans le domaine de l'eau. Il est listé en tant que substance prioritaire mais pas en tant que substance prioritaire dangereuse. REACHLe fluoranthène, n'étant pas produit intentionnellement, n'est pas concerné par le règlement REACH. Émissions et concentrations de HAPDe façon générale, la réglementation relative à cette substance s'inscrit dans les réglementations concernant les HAP (se reporter à la fiche sur ces composés pour plus de détails et une information plus complète). Ainsi :
Action de recherche RSDELe fluoranthène est cité dans l'annexe 1 de la circulaire du 5 janvier 2009 relative à la mise en œuvre de la 2ème phase de l'action RSDE pour les ICPE soumises à autorisation. Cette annexe regroupe les listes par secteurs d'activité industrielle des substances dangereuses. Le fluoranthène est cité pour tous les secteurs d'activité, à l'exception de l'industrie de la céramique et des matériaux réfractaires. Le fluoranthène appartient aussi à la liste des micropolluants à mesurer dans les stations de traitement des eaux usées traitant une charge brute de pollution supérieure ou égale à 600 kg DBO5/jour (Circulaire du 29 septembre 2010 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées). Autres textesLe fluoranthène appartient à la liste des 823 substances du plan micropolluants 2010-20131 . Le fluoranthène est cité dans la liste OSPAR2 des substances potentiellement préoccupantes. [1]http://www.developpement-durable.gouv.fr/Les-micropolluants-dans-les.html (consulté en novembre 2014). |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Seuils de rejets pour les installations classéesL'arrêté du 26 décembre 2012 modifiant l'arrêté du 31 janvier 2008 concerne le registre et la déclaration annuelle des émissions polluantes et des déchets. L'exploitant de l'installation doit déclarer ces rejets dès lors que les seuils d'émissions décrits dans l'annexe II de cet arrêté sont dépassés. Les seuils de rejets de fluoranthène sont :
L'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation indique que, pour la pollution des eaux superficielles, les rejets doivent respecter les valeurs limites de concentrations suivantes : HAP 0,05 mg.L-1 si le rejet dépasse 0,5 g.j-1. Mais l'arrêté ne contient pas de limite spécifique au fluoranthène pour les eaux superficielles. Epandage des boues L'annexe I de l'arrêté précise les seuils à respecter en composés-traces organiques dans les déchets ou effluents. Ces seuils sont présentés dans le Tableau 2. Tableau 2. Seuils du fluoranthène applicables aux épandages de boues issues du traitement des eaux usées sur les sols agricoles. 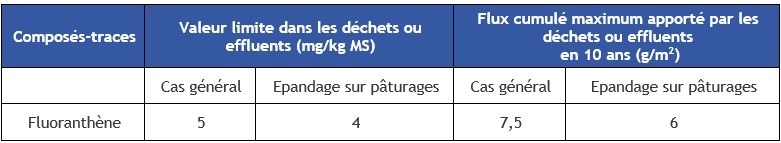
Combustion domestique
Valeurs utilisées pour la population généraleLe décret 2001/1220 du 20 décembre 2001, concernant la qualité des eaux de consommation, impose, de même que la règlementation européenne correspondante, une limite de qualité aux eaux destinées à la consommation humaine. Les eaux doivent respecter une valeur inférieure ou égale à 1 µg.L-1 pour le total des six HAP suivants : fluoranthène, benzo(3,4)fluoranthène, benzo(11,12)fluoranthène, benzo(3,4)pyrène, benzo(1,12)pérylène et indéno(1,2,3-cd)pyrène. |
| Informations complémentaires |
Le fluoranthène est un membre de la famille des hydrocarbures aromatiques polycycliques (HAP). Ces substances résultent de la fusion de cycles benzéniques. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
Le fluoranthène, en tant que tel, ne semble plus être produit industriellement, en France et même à travers le monde. L'ATSDR (1995) indique qu'en 1985, alors que le fluoranthène n'était plus produit aux Etats Unis, 1 tonne seulement a été importée.
PLACE DE LA SUBSTANCE DANS L'ECONOMIE FRANÇAISE
Le fluoranthène n'étant ni produit, ni utilisé en tant que tel, il est préférable de se reporter à la fiche sur les HAP (INERIS, 2006) pour les informations concernant les secteurs fortement émetteurs de HAP.
IMPACT ECONOMIQUE DES MESURES DE REDUCTION
Le fluoranthène n'étant ni produit, ni utilisé en tant que tel, il est préférable de se reporter à la fiche sur les HAP (INERIS, 2006) pour les informations concernant les secteurs fortement émetteurs de HAP.
Utilisations
FTE 2015 Importer
Il n'existe pas d'utilisation de fluoranthène en tant que tel. L'ATSDR (1995), indique toutefois qu'il a pu être utilisé par le passé en revêtement de protection pour l'intérieur des cuves et des tuyaux en acier servant au stockage et à la distribution d'eau potable. Il a été utilisé comme intermédiaire dans la fabrication de teintures, notamment de teintures fluorescentes et dans la fabrication des huiles diélectriques et comme stabilisant pour les colles époxy.
Aujourd'hui nous ne disposons d'aucune information indiquant que ces usages existent toujours. Selon le Kompass (2015), le fluoranthène n'est pas référencé comme un produit fabriqué ou vendu en France.
En revanche, le fluoranthène en tant que HAP est présent dans de nombreuses applications. On peut pour cela se rapporter à la fiche sur les HAP (INERIS, 2006).
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Les éruptions volcaniques, les feux de forêts sont des sources de HAP dans l'atmosphère, donc en particulier de fluoranthène.
Sources non-intentionelles
FTE 2015 Importer
Selon Palayer et al. (1997), les HAP sont synthétisés lors de la formation des énergies fossiles (pétrole, charbon) ou bien lors de la combustion incomplète de matières organiques (chauffage au fuel, feux de forêts, etc.). Leur synthèse lors de la formation des énergies fossiles explique leur présence dans le pétrole, le charbon et leurs produits dérivés.
Ils sont donc rejetés dans l'environnement soit à partir de produits dérivés de combustibles fossiles (goudron, coke, créosote, etc.), soit suite à des combustions incomplètes (chauffage, moteur diesel…).
Émissions anthropiques totales
FTE 2015 Importer
Les rejets dans l'environnement sont principalement atmosphériques. Les émissions des foyers domestiques, des incinérateurs d'ordures ménagères, des unités de production de goudron et d'asphalte, des unités de craquage du pétrole, constituent les principales sources anthropiques atmosphériques. Ces sources stationnaires représentent environ 80 % des émissions. Les sources mobiles sont constituées par les pots d'échappements des véhicules essence et Diesel.
Les HAP sont généralement associés à des particules, surtout les plus fines, mais peuvent également être présents dans la phase gazeuse.
La présence de HAP (et donc de fluoranthène) dans les eaux de surface provient surtout du dépôt de particules en suspension dans l'atmosphère, des rejets de lixiviation des aires de stockage de charbon, des effluents des usines de traitement du bois et d'autres industries, ainsi que de l'utilisation de composts et de fertilisants.
Elle peut également provenir des revêtements routiers, d'hydrocarbures entrainés dans les eaux, ou de l'épandage des boues d'épuration. Le fluoranthène est un HAP « pétrogénique » donc plutôt présent dans les hydrocarbures que formé durant leur combustion. Par conséquent, cette source pourrait théoriquement être significative dans son cas.
On peut également se reporter à la fiche concernant les HAP (INERIS, 2006)
Les émissions industrielles de fluoranthène ne sont pas dues à la production et à l'utilisation de fluoranthène en tant que tel, mais aux activités au cours desquelles le fluoranthène peut être produit avec les autres HAP (incinération, combustion…). On retrouve donc le fluoranthène dans de très nombreux rejets industriels.
Émissions atmosphériques
FTE 2015 Importer
Données INS
En France, selon l'INS5 , les émissions de HAP totaux, toutes sources confondues, en 2007 étaient réparties sur le territoire comme le montre la Figure 1 ci-après.
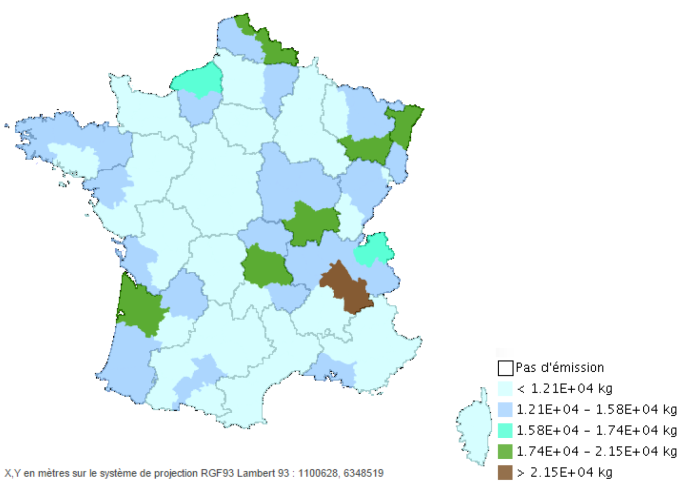
Figure 1. Répartition des émissions de HAP totaux en France en 2007, d'après l'INS.
Le département ayant les émissions de HAP totaux les plus importantes, est l'Isère, puis le Nord, le Bas-Rhin, les Vosges, la Saône-et-Loire, le Puy-de-Dôme et la Gironde.

Figure 2. Secteurs émettant des HAP totaux en France en 2007, d'après l'INS.
Le principal secteur émettant des HAP totaux en France en 2007 était la combustion hors industrie (dans le secteur résidentiel), qui représente près de 90 % des émissions de HAP totaux.
[5] Inventaire National Spatialisé : (consulté en mars 2014). http://90.83.82.201/ins-webapp/
Données CITEPA
Le CITEPA6 évalue les émissions dans l'atmosphère de huit HAP dont le fluoranthène. Les émissions de ces huit HAP étaient de 72,4 tonnes en 2012, représentant une baisse de 51,1 % par rapport à 1990. Les deux principaux secteurs émettant des HAP dans l'atmosphère sont le résidentiel/tertiaire, notamment la combustion de la biomasse dans les appareils domestiques (63,3 %) et le transport routier, en particulier les véhicules diesel (25,8 %).
La Figure 3 ci-après présente les émissions de HAP en France par secteurs.
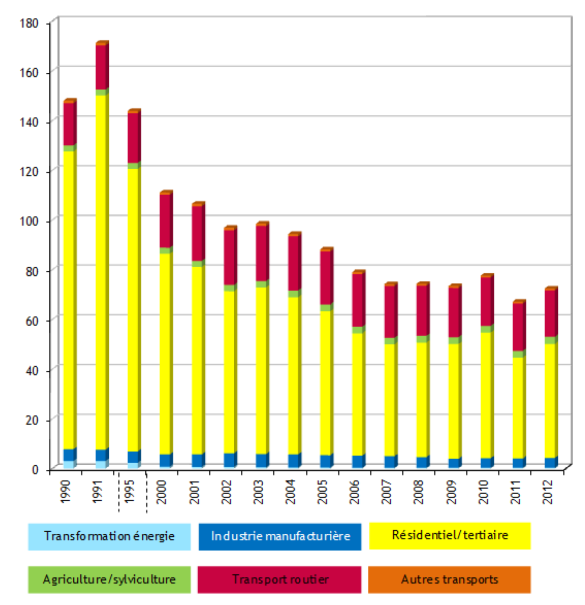
Figure 3. Emissions atmosphériques de HAP en tonnes en France, d'après le CITEPA.
Le résidentiel/tertiaire est donc le principal secteur émetteur de HAP en France mais est aussi celui dont les émissions ont le plus diminué sur la période 1990-2012.
La Figure 4 ci-après montre la répartition des émissions de HAP par secteur.
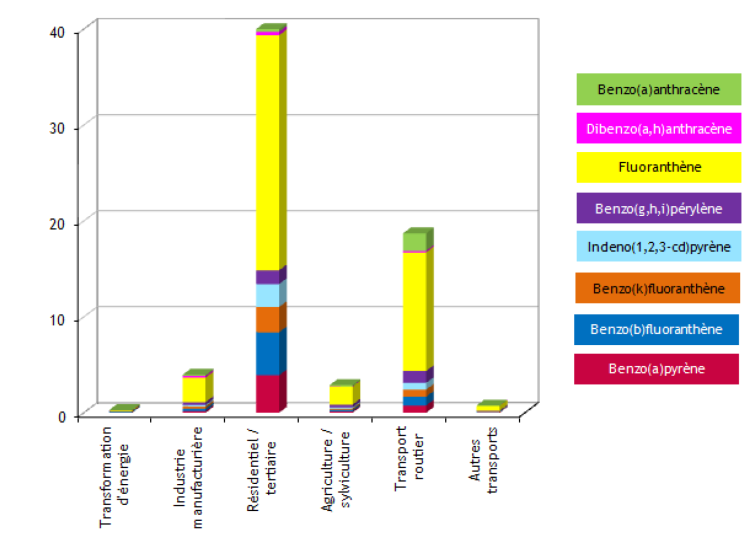
Figure 4. Répartition des émissions de HAP en tonnes par secteur en France en 2012, d'après le CITEPA.
Le fluoranthène est le principal HAP rejeté quel que soit le secteur d'activité. Etant donnée l'importance des rejets atmosphériques pour expliquer la contamination des eaux superficielles (par dépôt), cela laisse penser que les HAP pourraient également être l'un des principaux HAP présents dans les eaux.
[6] (consulté en décembre 2014). http://www.citepa.org/fr/
Émissions vers les eaux
FTE 2015 Importer
Emissions urbaines
Le fluoranthène est recherché dans le cadre du projet AMPERES7 .
Le fluoranthène a été quantifié à des concentrations comprises entre 0,1 et 1 µg.L-1 dans 81 % des eaux usées brutes. Il a été quantifié à des concentrations comprises entre 0,01 et 0,1 µg.L-1 dans 30 à 70 % des eaux traitées secondaires et a des concentrations entre 0,001 et 0,1 µg.L-1 dans moins de 30 % des eaux traitées tertiaires (Coquery, 2011).
Ces chiffres sont confortés par les résultats issus de l'action RSDE STEU8 où l'on observe que les rejets de fluoranthène des stations d'épurations sont pour la plupart de l'ordre du centième de µg.L-1 voire du dixième de µg.L-1.
Au cours du passage en STEP, plusieurs substances organiques (HAP, alkylphénols, DEHP) sont retenues sous forme particulaire et transférées dans les boues Le fluoranthène a été quantifié à des concentrations de 0,1 à 1 mg/kg dans plus de 70 % des boues.
[7] Analyse de micropolluants prioritaires et émergents dans les rejets et les eaux superficielles.
[8] L'action RSDE STEU (Recherche et Réduction des Rejets de Substances Dangereuses dans les Eaux pour les Stations de Traitement des Eaux Usées ou STEU) consiste notamment à analyser des micropolluants lors d'une campagne de surveillance initiale (la liste des substances à surveiller est fonction de la capacité de traitement de la STEU étudiée).
Emissions industrielles
L'action RSDE consiste en la Recherche et la Réduction des Rejets de Substances Dangereuses dans l'Eau pour les installations classées pour la protection de l'environnement.
La Figure 5 ci-après montre les principaux secteurs industriels contributeurs aux flux de fluoranthène, d'après les données RSDE du 28 août 2014.
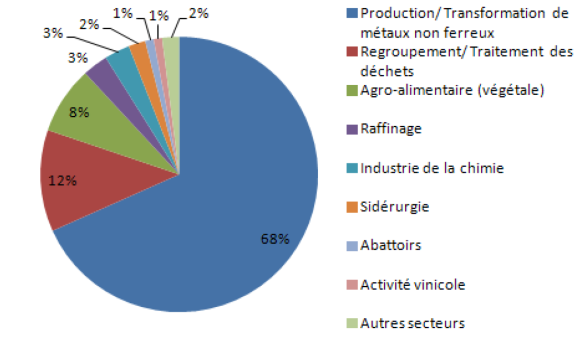
Figure 5. Secteurs contributeurs aux flux de fluoranthène vers les eaux, données RSDE 2.
La Figure 5 montre que plus des deux tiers des flux de fluoranthène proviennent de la production et transformation de métaux non ferreux. Le BREF sur le traitement des métaux non-ferreux (CE, 2001) signale en effet que des émissions vers l'eau de HAP sont possibles dans ce secteur, du fait des émissions atmosphériques de HAP (notamment pour l'industrie de l'aluminium) qui sot traitées par des laveurs de fumées. Il semble également possible que le secteur utilise des lubrifiants à base d'hydrocarbures, qui seraient une source de HAP dans les rejets.
IREP9
Les émissions de fluoranthène déclarées dans le cadre de l'arrêté du 31 janvier 2008 par les industriels, entre 2009 et 2012, sont présentées dans le Tableau 4 ci-après. Les données affichées sont issues du registre français des émissions polluantes IREP. A titre de comparaison, ce tableau comprend également les valeurs de la base de données E-PRTR10 pour les émissions de l'UE 27.
Tableau 4. Emissions de fluoranthène dans l'environnement, d'après IREP et E-PRTR.
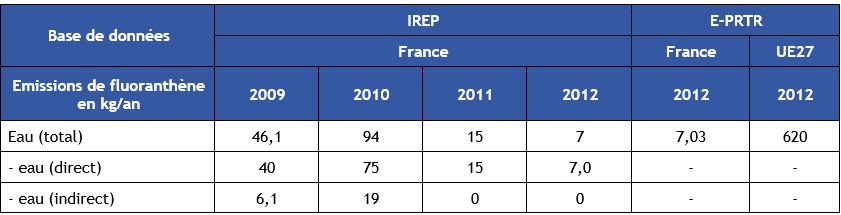
Les émissions industrielles de fluoranthène répertoriées se font exclusivement vers les eaux et ont fortement baissé entre 2009 et 2012.
Les émissions de fluoranthène, en France, vers les eaux sont relativement faibles par rapport à la totalité des émissions de HAP. En effet en 2012 les émissions de HAP vers les eaux étaient de 289 kg.an-1 en direct et de 22 kg.an-1 en indirect. Depuis 2010, les émissions de fluoranthène représentent moins de 10 % de la totalité des émissions de HAP, que se soit en émissions directes ou indirectes vers les eaux.
[9] (consulté en novembre 2014). http://www.irep.ecologie.gouv.fr/IREP/index.php
[10] European Pollutant Release and Transfer Register : (consulté en novembre 2014). http://prtr.ec.europa.eu/PollutantReleases.aspx
Émissions vers les sols
FTE 2015 Importer
Lors de cette étude, nous n'avons pas identifié de source d'information sur des émissions de fluoranthène dans les sols.
Rejets dans l'environnement
FTE 2015 Importer
Dans l'air
Nous n'avons trouvé aucune donnée concernant le Fluoranthène, cependant les HAP peuvent être dégradés par des réactions d'oxydation à l'ozone et l'hydroxylation (INERIS, 2005). Les demi-vies dans l'air accompagnant ces mécanismes de photo-oxydation varient de 0,4 à 68,1 heures d'après la littérature. Mais, ces mécanismes sont largement dépendants des conditions environnementales, notamment la nature et la taille des particules présentes dans l'air ambiant et sur lesquelles les HAP sont agglomérés. Les HAP sont plus persistants lorsqu'ils sont liés à des particules de nature organique. Des transformations mineures peuvent également mener à une dégradation des HAP notamment par réaction avec des oxydes d'azote (NOx) et le dioxyde de soufre (SO2) ; de telles réactions ne se produisent toutefois qu'aux points d'émission où la température oscille entre 100 et 200°C.
Dans l'eau
Les rares données expérimentales qui ont pu être trouvées sur des essais en milieux aqueux montrent que le fluoranthène est peu biodégradable (INERIS, 2005): des demi-vies de 560 à 1760 jours en milieu aqueux sur des souches non adaptées ont été estimées. En première approche, une demi-vie de 1 500 jours peut être proposée. Même des essais de dégradation par une culture enrichie de bactéries du sol ont montré que la dégradation n'était jamais totale et qu'elle pouvait s'apparenter à un processus d'humification.
D'après Seine-Normandie (2008), la demi-vie du fluoranthène dans l'eau est de l'ordre de l'année, donc plutôt élevée au sein des HAP. A titre de comparaison, le naphtalène a une demi-vie dans l'eau de l'ordre du mois.
En outre, le caractère lipophile des HAP se traduit par une tendance à se fixer sur les fractions organiques des matières en suspension (MES) et sédiments. Cela explique que la présence des HAP est très marquée sur les MES alors qu'elle n'est pas visible dans la phase aqueuse (Remillon, 2003).
Dans les sols
Dans les sols, les HAP sont éliminés principalement par volatilisation et par activité microbienne. Plusieurs facteurs tels que la température, le type de sol, et la présence d'autres substances conditionnent les processus de dégradation (INERIS, 2005).
Pollutions historiques et accidentelles
FTE 2015 Importer
BASOL11 est une base de données française sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif.
Le site internet de cette base de données permet d'effectuer des recherche par substance, mais l'entrée « fluoranthène » n'est pas disponible. Les pollutions historiques au fluoranthène étant liées aux pollutions par les HAP, on a recherché des sites ou sols pollués (ou potentiellement pollués) par l'entrée HAP, ce qui aboutit à un résultat de 1281 localisations en France (source consultée en octobre 2014), dont :
- 81 sites traités et libres de toute restriction ;
- 700 sites traités avec surveillance et/ou restriction d'usage ;
- 220 sites en cours de travaux ;
- 246 sites en cours d'évaluation ;
- 34 sites mis en sécurité et devant faire l'objet d'un diagnostic.
Parmi ces sites, 829 ont abouti à un impact dans les eaux souterraines (teneurs anormales) et 9 sites à l'arrêt d'un captage d'alimentation en eau potable.
D'après cette même source d'information, les HAP font d'ailleurs partie des polluants retrouvés (seul ou avec d'autres) dans environ 10 % de cas de sites ou sols pollués.
[11] (consulté en octobre 2014). http://basol.developpement-durable.gouv.fr/recherche.php
Présence environnementale
Atmosphère
FTE 2015 Importer
Une étude citée par COPARLY et ASCOPARG (2004), reprise dans le tableau ci-dessous, donne les concentrations moyennes annuelles typiques des HAP dans l'air ambiant en région Rhône-Alpes, en ng.m -3 .
Tableau 6. Concentrations moyennes annuelles typiques des HAP dans l'air ambiant en région Rhône-Alpes en ng.m -3 (d'après COPARLY et ASCOPARG, 2004).
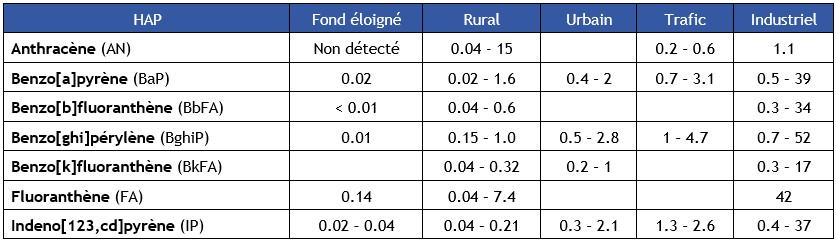
Aquatique
FTE 2015 Importer
Des mesures mensuelles effectuées dans le Rhin, à Karlsruhe, en 2011, montrent des concentrations en fluoranthène comprises entre inférieure à 0,0025 et 0,008 µg.L-1 dans l'eau et entre 220 et 850 µg/kg MS dans les MES12 inférieures à 2 mm de diamètre. Des mesures similaires effectuées dans le Meuse, à Ham-sur-Meuse, en 2013, montrent des concentrations dans l'eau comprises entre inférieures à 0,01 et 0,014 µg.L-1.
D'après Seine-Normandie(2008), le fluoranthène dépassait la NQE (en vigueur au moment de l'analyse) dans 100 % des 17 stations d'Ile-de-France sur la période 2001-2004.
D'après cette même source, le fluoranthène est présent à des concentrations supérieures dans les eaux, à celles des deux HAP suivants : l'anthracène et l'acénaphthène ; mais est présent à des concentrations inférieures à celle du naphtalène.
Le Tableau 7 ci-après présente les concentrations en fluoranthène dans différents compartiments aquatiques.
Tableau 7. Concentration en fluoranthène dans les eaux, d'après Seine-Normandie (2008).
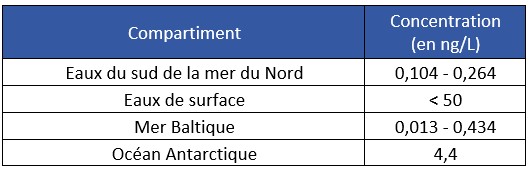
[12] MES : matières en suspension.
Terrestre
FTE 2015 Importer
D'après le GSBL13 , il a été relevé des concentrations moyennes en fluoranthène dans les sols en Allemagne comprises entre 0,2 mg/kg PS et 1,5 mg/kg PS.
D'après Seine-Normandie (2008), le fluoranthène est plus souvent quantifié et présente des concentrations supérieures dans les sédiments, que les trois HAP suivants : l'anthracène, l'acénaphthène et le naphtalène.
Le Tableau 8 ci-après présente les concentrations en fluoranthène dans différents sédiments.
Tableau 8. Concentration en fluoranthène dans les sédiments, d'après Seine-Normandie (2008).
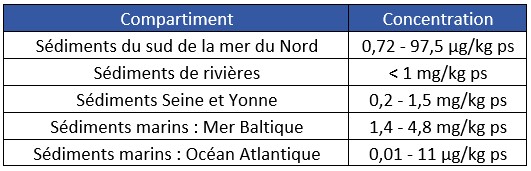
Les concentrations en fluoranthène sont très variables selon le type de sédiments.
[13] (consulté en novembre 2014). http://www.gsbl.de/gsblweb30/directSearch.do?param=GSBL.GSBLRN=114797
Synthèse
Le fluoranthène est un des HAP les plus présents dans l’environnement. Les concentrations ubiquitaires pour le fluoranthène sont reprises dans le tableau suivant (INERIS, 2005).
Tableau 5. Concentrations ubiquitaires pour le fluoranthène (d’après INERIS, 2005).
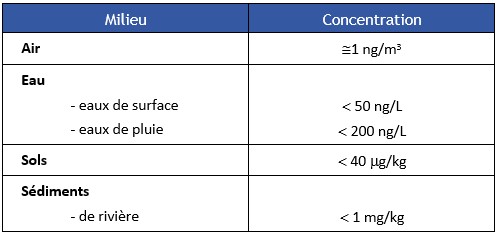
La répartition de fluoranthène dans les différents compartiments de l’environnement est présentée dans la Figure 6 ci-après.
Figure 6. Présence de fluoranthène dans l’environnement, d’après Seine-Normandie (2008).
Perspectives de réduction
Réduction des rejets
FTE 2015 Importer
La réduction des émissions de fluoranthène est liée à la réduction des émissions de HAP. On peut donc se reporter à la fiche sur les HAP pour plus d'information (INERIS, 2006).
Le fluoranthène est recherché dans le cadre du projet AMPERES14 (cf. paragraphe 3.3.1). Il ressort qu'au cours du passage en STEP, le fluoranthène est retenu sous forme particulaire et transféré dans les boues.
Deux rendements sont disponibles dans la documentation du projet AMPERES ::
- le rendement de la filière eau traduit la diminution de la concentration entre l'entrée et la sortie de la STEP : il est en moyenne de 80 % pour le fluoranthène ;
- le rendement d'élimination global prend en compte le flux de micropolluants transférés vers la filière boues et le flux de micropolluants réintroduits dans la filière eau : il est supérieur à 70 % pour le fluoranthène.
Le traitement primaire par décantation primaire physico-chimique a un rendement compris entre 30 et 70 % pour le fluoranthène.
Pour les zones urbaines, le traitement secondaire par décantation primaire physico-chimique et biofiltre, par boues activées, par bioréacteur à membranes donne des rendements d'élimination supérieurs à 70 % pour le fluoranthène.
Pour les zones rurales, les traitements secondaires par lit bactérien et filtre d'écoulement vertical présentent des rendements supérieurs à 70 % pour le fluoranthène (Choubert, 2011).
[14] Analyse de micropolluants prioritaires et émergents dans les rejets et les eaux superficielles.
Alternatives aux usages
FTE 2015 Importer
Comme il n'existe pas d'usage du fluoranthène, il n'existe pas de produit de substitution. Pour les autres produits ou usages émettant du fluoranthène, on peut se reporter à la fiche concernant les HAP (INERIS, 2006).
Conclusion
FTE 2015 Importer
Le fluoranthène est un constituant de la famille des hydrocarbures aromatiques polycycliques (HAP). Le fluoranthène, en tant que tel, ne semble plus être produit industriellement, en France et même à travers le monde. Il n'est pas non plus utilisé, mais en revanche, le fluoranthène en tant que HAP est présent dans de nombreuses applications et émissions atmosphériques, qui génèrent indirectement des rejets de fluoranthène dans les milieux aquatiques, de nature à générer des dépassements généralisés des Normes de Qualité Environnementales.
Les principales sources d'émissions de fluoranthène sont atmosphériques, et il s'agit des combustions dans les appareils domestiques, le secteur tertiaire et le transport routier. Le fluoranthène est ainsi apporté de façon diffuse, de la même façon que les HAP. La baisse des rejets de fluoranthène ne semble pas facile à réaliser, les rejets de HAP étant très diffus et difficiles à maîtriser.
Très peu d'informations spécifiques au fluoranthène étant disponibles, on pourra se reporter pour plus d'informations sur l'ensemble des HAP à la fiche sur les HAP (INERIS, 2006).
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

