Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Anthracène (120-12-7)
Informations générales
Dernière vérification le 08/12/2025
Identification
Numero CAS
120-12-7
Nom scientifique (FR)
Anthracène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
204-371-1
Code SANDRE
1458
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C14H10 }\)
Code InChlKey
Code SMILES
c1ccc2cc3ccccc3cc2c1
Familles
Familles chimiques
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Analyse
Autres milieux
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
178.24 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
L’anthracène se présente à plus de 78 % dans l'atmosphère sous vapeur, ou est adsorbée sur la matière particulaire. (HSDB, 2001).
Milieu eau douce
Etant donné sa constante de Henry, il peut aussi se volatiliser (HSDB, 2001).
Milieu sédiment eau douce
Il s’adsorbe facilement sur la matière en suspension.
Milieu terrestre
L’anthracène est peu à pas mobile dans les sols (HSDB, 2001). L’anthracène peut facilement se volatiliser à partir des sols humides, son adsorption importante sur la matière organique peut cependant atténuer ce phénomène. Par contre, il ne se volatilise que très peu à partir des sols secs (HSDB, 2001).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Dans un test MITI I modifié (ligne directrice OCDE 301 C) seulement 1,9 % de la substance a été dégradée après 28 jours. La substance n’est pas facilement biodégradable (CITI, 1992).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
L’hydrolyse n’est pas une voie attendue de dégradation de l’anthracène dans l’environnement.
Dans de l’eau distillée et exposée à la lumière naturelle, l’anthracène est dégradé par photolyse en quelques heures (Callahan et al., 1979). Dans de l’eau aérée, les produits de dégradation sont l’endopéroxyde et la 9,10-anthraquinone. Dans de l’eau peu oxygénée, les produits de dégradation sont les trois isomères du 10,10’-dihydroxy-9,9’,10,10’-tétrahydro-9,9’-bianthryl (Sigman et al., 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Atmosphère
Dans l’atmosphère, sa demi-vie due aux réactions avec les radicaux hydroxyles est de 3,4 h pour une concentration de 5.105 radicaux hydroxyles/cm3 (Atkinson, 1989).
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
BCF pour les organismes aquatiques : Des BCF de : 3 042 (moyenne géométrique, poisson), 2 536 (moyenne géométrique, crustacés), 2 671 (moyenne géométrique, annélides) et 19 000 (mollusques) sont mentionnés dans le dossier ayant conduit à l’élaboration de la norme de qualité environnementale européenne (EC, 2011).

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Pour les facteurs de bioconcentration dans les végétaux, l’INERIS recommande de consulter la Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP 2015 (ADEME, INERIS, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015). La base indique des concentrations en anthracène dans les végétaux et dans des sols, permettant de calculer un BCF ; pour certaines données, les concentrations dans d’autres milieux environnementaux sont également renseignées. Pour l’anthracène, 74 couples de données végétaux-sol sont actuellement disponibles. Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante (type de plante : légume feuille, légume tige, légume racine, etc.), le stade de récolte, la maturité, l’organe analysé, le type de préparation (lavage, pelage), au sol texture, teneur en carbone organique, pH), au contexte environnemental (industriel, rural, urbain), à l’origine de la pollution (industrielle, agricole, urbaine, etc.), au type expérimental (champ agricole, potager, etc.)) afin de se rapprocher des conditions propres à la situation étudiée. Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des molécules organiques pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L’ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1995 ; EU, 2007 ; IARC 1983 ; IARC, 2010 ; OMS IPCS, 1998). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l'information scientifique mais n'ont généralement pas fait l'objet d'un nouvel examen critique par les rédacteurs de la fiche. Chez l’homme, très peu d’études ont cherché à identifier les effets toxiques de l’anthracène seul, la plupart des données disponibles concernent des mélanges d’hydrocarbures aromatiques polycycliques (HAP). Dans cette fiche, seule la substance anthracène est considérée, la toxicité du l’anthracène en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Certains HAP disposent d’une fiche de données toxicologiques cependant il nous est apparu nécessaire de proposer également une fiche « choix de VTR » regroupant les valeurs disponibles pour chacun d’eux , ainsi que les autres éléments de comparaison entre ces différents HAP. L’anthracène, comme l’acénaphtène et le naphtalène, se trouve être parmi les HAP de plus bas poids moléculaire (PM) (2 à 3 cycles), ce qui lui confère une plus forte volatilité que les autres HAP de haut PM. Pour cette classe de HAP (bas PM), l’inhalation constitue la voie prépondérante d’exposition.
Toxicocinétique
Chez l'homme
Absorption
Chez l’homme, l’absorption par voie respiratoire, orale ou cutanée n’est pas documentée pour l’anthracène seul. Néanmoins, sa présence dans les tissus pulmonaires de sujets vivants en milieu urbain indique que son absorption par les voies respiratoires est probable (Cioroiu et al., 2013).
Distribution
Il n’existe pas de données chez l’homme relatives à la distribution de l’anthracène seul dans l’organisme.
Cependant, l'analyse toxicologique à partir du foie et de graisses prélevés au cours d'autopsie montre la présence d'anthracène chez des sujets pour lesquels l’origine de l’exposition n’est pas précisée (pollution urbaine, tabagisme, etc.) (Obana et al., 1981).
Une concentration sanguine moyenne de 3,6 ppb d’anthracène a été rapportée chez des enfants résidents en Inde, la nature de l’exposition n’étant pas précisée (Singh et al., 2008).
Il a également été détecté dans le lait, le placenta et le cordon ombilical (moyennes respectives de 14,4- 23,4 et 117 ng.g-1 de lipides) de femmes séjournant à Pékin depuis au moins 6 ans et non fumeuses (Yu et al., 2011) ou encore dans le lait de mères italiennes (39,7 µg.kg-1 de lait)(Santonicola et al., 2017).
Métabolisme
Aucune donnée spécifique n’a été identifiée chez l’humain.
Le caractère lipophile des HAP leur confère une grande facilité à franchir les membranes cellulaires et leur permet d’être stockés dans différents tissus. Les HAP sont métabolisés en composés plus hydro-solubles ce qui facilite leur élimination.
Élimination
Aucune donnée spécifique de l’anthracène seul n’a été identifiée chez l’humain. Toutefois, de l’anthracène a pu être dosé dans les urines de salariés employés dans une usine de production d’anodes (Irwin et al., 1997) ou dans les cokeries (Rossela et al., 2009). La plupart des HAP sont excrétés dans les fèces et les urines.
Chez l'animal
Absorption
Inhalation :
L’absorption de l’anthracène seul par inhalation n’est pas documentée chez l’animal. Néanmoins, après une instillation intra-trachéale unique d'anthracène marqué au carbone 14, 99,7 % de la radioactivité sont éliminés par voie respiratoire très rapidement (demi vie de 0,1 heure) et 0,3 % lentement (demi-vie de 25,6 heures) (Bond et al., 1985).
Voie orale:
Des rats ingérant de la nourriture contenant 0,2 à 1,0 % d'anthracène ou 200 mg par gavage éliminent 43 à 84 % de la dose dans les fèces en 2 à 3 jours (Chang, 1943). Le taux d’absorption intestinale est influencé par la présence de bile : en cas de dérivation de la bile par canulation de la vésicule biliaire, l'absorption n'est plus que de 70,8 % (Rahman et al., 1986).
Voie cutanée:
Par voie cutanée, seul 1,3 % de la dose d’anthracène marqué au carbone 14 (9,3 µg/cm2) est détecté dans les tissus, essentiellement le foie et les reins, chez le rat, 6 jours après l’administration (Yang et al., 1986). L’absorption cutanée a été confirmée par des tests in vitro sur peau de rat et de singe (Sartorelli et al., 1999).
L'injection sous-cutanée d'anthracène chez la souris gestante montre un passage transplacentaire (US EPA, 1990).
Distribution
Aucune donnée relative à la distribution de la fraction absorbée d’anthracène n’a été identifiée chez l’animal. Néanmoins, la valeur assez élevée de son coefficient de partage Kow et sa faible solubilité dans l’eau, ne permettent pas d’écarter une éventuelle accumulation dans les tissus riches en graisses (EU, 2007).
Métabolisme
In vivo, le 1,2-dihydrodiol, le 9,10-anthraquinone, 9,10-dihydrodiol et le 2,9,10-trihydroxyanthracène ont été identifiés comme étant des métabolites de l’anthracène présents dans les urines de rats exposés (Sims, 1964).
Le 1,2-dihydrodiol a été identifié comme étant le principal métabolite de l’anthracène lors d’une incubation de préparation de foie de rat en présence d’anthracène (Akhtar et al., 1979).
D’après les résultats des études in vivo et in vitro, le métabolisme de l’anthracène absorbé par voie orale conduirait dans un premier temps à la formation d’un époxyde (en position 1,2), suivie d’une hydrolyse pour former un 1,2-dihydrodiol, puis d’autres métabolites majoritairement conjugués à l’acide glucuronique ou sulfurique. D’autres voies métaboliques, notamment par voie cutanée chez le rat, pourraient conduire à une oxydation de l’anthracène en position 9 et 10 (EU, 2007).
Élimination
Bien qu’il soit probable que les métabolites soient excrétés dans les selles par l’intermédiaire de la bile, la nature et les niveaux d’élimination ne sont pas connus. L’élimination urinaire sous forme de métabolites n’est pas exclue.
Autre
Relation avec le récepteur AhR
L’anthracène semble être un très faible ligan de l’AhR, récepteur spécifique des HAP et des cytochromes P450, l’affinité n’étant quantifiable ni sur les modèles in vitro humain (Vondráček et al., 2017) ou animaux (Barron et al., 2004 ; Machala et al., 2001).
Synthèse
Chez l’homme
Il n’existe pas de données relatives à une exposition spécifique à l’anthracène. Néanmoins, son absorption pulmonaire a indirectement été démontrée chez l’homme, cohérente avec son bas poids moléculaire favorisant une exposition par inhalation.
Chez l’animal, l’absorption intestinale est importante alors que l’absorption cutanée est faible. Son principal métabolite est le 1,2-dihydrodiol, les autres métabolites urinaires sont le 1,2-dihydrodiol, le 9,10-anthraquinone, 9,10-dihydrodiol et le 2,9,10-trihydroxyanthracène. C’est un très faible ligan de l’AhR, récepteur spécifique des HAP (affinité non quantifiable) et des cytochromes P450.
Toxicité aiguë
Chez l'homme
Voie cutanée
Des effets photo-toxiques de l’anthracène sont rapportés lors de son utilisation dans le traitement du psoriasis (en solution dans un mélange de N-méthyl-2-pyrrolidone, d'éthanol et de propylène glycol) (Urbanek, 1980; Walter, 1980).
Synthèse
Chez l’homme, des effets photo-toxiques sont rapportés lors de l’utilisation de l’anthracène dans le traitement du psoriasis.
Chez l'animal
Inhalation
Aucune donnée relative aux effets de l’exposition aiguë à l’anthracène seul chez l’animal n’a été rapportée.
Voie orale
Une dose unique de 1,47 ou 2,44 g.kg-1 d'anthracène commercial ou de 17 g.kg-1 d'anthracène pur n'est pas létale chez la souris (Nagornyi, 1969).
De même, l’exposition à une dose unique de 16 g.kg-1 d’anthracène n’a pas entraîné la mort au cours d’une étude de toxicité aigüe par voie orale chez le rat Wistar (Grote, 1979). Les animaux ont présenté une asthénie, l’autopsie ayant révélé des organes congestionnés (foie, reins, cœur et poumons), ainsi qu’une leucocytose.
Dans une autre étude, une DL50 de 8,12 g.kg-1 a été calculée lors d’une exposition unique par gavage à 5, 10 ou 20 g.kg-1 d’anthracène chez le rat Wistar (Mellon Institute, 1977).
Chez le rat, l’administration par voie orale d’une dose de 100 mg.kg-1.j-1 pendant 4 jours induit une augmentation de 13 % de l’activité carboxylestérase de la muqueuse intestinale (Nousiainen et al., 1984) et une faible augmentation de l'activité de l'aldéhyde déshydrogénase hépatique (Torronen et al., 1981).
Il n'est pas observé de stimulation de la régénération hépatique chez des rats hépatectomisés partiels nourris avec 514 mg.kg-1.j-1 d'anthracène pendant 10 jours (Gershbein, 1975).
Une administration par voie orale de 50 mg d'anthracène dans l'huile de maïs suivie d'une exposition aux ultra-violets pendant une heure entraîne une kératite de la peau exposée (Dayhaw-Barker et al., 1985). Des résultats similaires ont été observés chez le rat et le cochon d’Inde exposés à une dose unique d’anthracène de 10 mg.kg-1, suivi d’une irradiation de 30 minutes (Yonezawa et al., 2015).
Voie cutanée
L’application d’une dose unique de 1 320 mg.kg-1 (5 mâles et 5 femelles) d’anthracène (dilué dans le polyéthylène glycol) n’est pas létale chez le rat : DL50 > 1 320 mg.kg-1 (Worstmann, 1981).
L’anthracène est un irritant de la peau, des yeux, des muqueuses et du tractus respiratoire. L’exposition à la concentration de 4,7 mg.m-3 induit une irritation cutanée moyenne chez 50 % des souris (Montizaan et al., 1989). La valeur moyenne d’activité d’irritation cutanée chez la souris (ID50)* est de 6,6.10-4 mmol soit 118 µg/oreille (Brune et al., 1978).
L’anthracène est par ailleurs un photo-toxique (Burnham et Rahman, 1992 ; Forbes et al., 1976 ; Gerarde, 1960 ; Lovell et Sanders, 1992) ; toutefois ce n’est pas un agent sensibilisant (Old et al., 1963). L’application transcutanée d’une dose de 0,3 % dans l’acétone chez le rat et le cochon d’Inde conduit à une même photo-toxicité cutanée (Yonezawa et al., 2015).
*Dose entrainant une irritation de l’oreille chez 50 % des souris 24 heures après l’application.
Synthèse
Chez le rat, la toxicité aiguë par voie orale ou cutanée est faible. L’anthracène est un photo-toxique de la peau, et un irritant des yeux, des muqueuses et du tractus respiratoire.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Chez l’homme, aucune étude épidémiologique concernant l’effet de l’anthracène seul n’est disponible.
Synthèse
Aucune donnée sur les effets de l’exposition chronique à l’anthracène seul n’est disponible chez l’homme.
Chez l'animal
Inhalation
Aucune étude par inhalation n’a été identifiée.
Voie orale
Chez les souris mâles et femelles exposées par gavage à l’anthracène aux doses de 0 - 250 - 500 - 1 000 mg.kg-1.j-1 pendant au moins 90 jours les paramètres analysés sont la mortalité, les signes cliniques, le poids corporel, la consommation de nourriture, les effets ophtalmiques et hématologiques, les poids et l’histologie de différents organes (US EPA, 1989). Dans cette étude, aucun effet n’est observé, même pour la dose la plus élevée. Un NOAEL de 1 000 mg.kg-1.j-1 est défini.
Dans une autre étude chez le rat, l’anthracène a été introduit dans la nourriture à la dose quotidienne de 5 à 15 mg par animal pendant environ 450 jours pour une dose cumulée de 4,5 g. L’observation est réalisée jusqu’à la mort de l’animal ; le temps moyen de survie est de 700 jours. Certains animaux survivent au-delà de 450 jours après la fin de l’exposition. Aucun effet lié à l’exposition n’a été observé, cependant aucune analyse des paramètres hématologiques n’a été effectuée (Schmähl, 1955).
Voie cutanée
Une injection sous cutanée hebdomadaire de 0,25 mg d’anthracène pratiquée chez la souris pendant 40 semaines induit un dépôt de fer dans les ganglions lymphatiques et une diminution du nombre de cellules lymphoïdes (Hoch-Ligeti, 1941).
Synthèse
Chez l’animal, les rares études disponibles montrent une faible toxicité de l’anthracène par voie orale qui demande à être confirmée. Les autres voies sont insuffisamment investiguées.
Synthèse des principales données relatives aux effets systémiques:

Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | L’anthracène n’a pas fait l’objet d’un examen par l’Union Européenne. | |
| IARC | Groupe 3 : l’agent (ou le mélange) ne peut être classé pour sa cancérogénicité pour l’homme | 1983 |
| US EPA | Classe D : substance non classifiable quant à sa cancérogénicité pour l'homme (US EPA (IRIS), 1991). | 1991 |
Chez l'homme
Voie cutanée
Trois cas d’épithélioma de la main, de la joue et du poignet ont été observés chez des salariés manipulant de l’anthracène non raffiné. Il est à noter que deux des salariés étaient employés depuis 30 ans ou plus et que par ailleurs des salariés manipulant de l'anthracène purifié n'ont pas développé de tumeurs (Kennaway, 1924a, 1924b).
Synthèse
Chez l’homme, 3 cas d’épithélioma de la main, de la joue et du poignet sont observés chez des salariés manipulant de l’anthracène non raffiné.
Chez l'animal
Inhalation
Dans une étude pratiquée chez le rat au moyen d’une seule instillation intra-pulmonaire d’un mélange de 0,05 mL de cire d’abeilles et de glycéryl de tricaprylate (tricaprylin) (1 :1) contenant 0,5 mg d’anthracène aucune tumeur pulmonaire n’est rapportée 1 an après l’injection, alors que l’administration de 3-méthylcholanthrène dans les mêmes conditions induit de nombreux carcinomes épidermoïdes (Stanton et al., 1972).
Voie orale
Un lot de 28 rats a été exposé par voie orale à des doses d’anthracène initialement de 5 mg puis de 15 mg en solution dans l’huile, 6 jours par semaine pendant 78 semaines, pour une dose totale de 4,5 g par rat. Seuls deux animaux ont développé des tumeurs malignes : un sarcome du foie après 18 mois et un adénome de l’utérus après 25 mois. Dans cette étude, il n'y avait pas de lot témoin (Schmähl, 1955). Les deux tumeurs n’ont pas été considérées comme étant liées au traitement (IARC, 2010)
Voie cutanée
Les effets cancérogènes de l’anthracène ont été évalués au cours de différentes études effectuées chez la souris en application cutanée et dans des modèles d’initiation-promotion cutanées. Ces différentes études révèlent l’absence d’effet cancérogène ou d’effet d’initiation.
Aucune tumeur cutanée n’est rapportée chez 100 souris exposées par application cutanée d’une suspension d’anthracène à 40 % dans la lanoline. Dans cette étude, 55 souris meurent après 6 mois de traitement (Kennaway, 1924a, 1924b). Une autre étude de même type montre l’absence de tumeur (Maisin et al., 1926 ; Maisin et al., 1927). Des résultats similaires sont rapportés dans une étude (souris albinos) où l’anthracène est appliqué en solution dans le benzène ou de l’huile de sésame (Pollia, 1939). Dans une autre étude, pratiquée chez la souris (Swiss) par applications cutanées d’anthracène en solution à 10 % dans l’acétone 3 fois par semaine pendant toute la vie de la souris, aucune tumeur n’est observée (Wynder et Hoffman, 1959). La mort des souris survient entre 10 et 20 semaines après le début du traitement. Dans cette même étude, des solutions de 0,01, 0,005 ou 0,001 % de benzo(a)pyrène induisent des papillomes et des carcinomes cutanés avec une incidence de 95 % et 95 % respectivement pour le lot exposé à la dose la plus élevée et de 43 % et 3 % respectivement pour le lot exposé à la dose la plus faible.
Des effets similaires sont rapportés lors de l’exposition cutanée à l’anthracène de 20 souris mâles C3H/HeJ, préalablement rasées (Warshawsky et al., 1993). Cette exposition a été pratiquée pendant 6 mois, à la dose hebdomadaire de 0,05 mg d’anthracène dans du toluène. Aucune tumeur n’est observée chez les 14 animaux exposés uniquement à l’anthracène, en revanche une co-exposition avec du benzo(a)pyrène (0,05 mg) induit la formation d'un papillome chez un des 13 animaux exposés après une période de latence de 85 semaines.
Dans des études d’initiation-promotion cutanées chez la souris, 20 applications de 0,3 mL à 0,5 % d’anthracène dans l’acétone, suivies par 18 autres applications contenant différentes concentrations d’huile de croton sont réalisées. Des papillomes sont observés en nombre identique à la fois chez les lots témoins et exposés (Salaman et Roe, 1956). Dans un autre modèle d’initiation-promotion, les souris reçoivent une seule exposition à l’anthracène en solution dans du benzène suivie, une semaine après, par une exposition au 12-O-tétradécanoylphorbol-13-acétate (TPA) deux fois par semaine pendant 34 semaines. Dans cette étude, une légère augmentation des papillomes cutanés est rapportée (Scribner, 1973). Dans une autre étude d’initiation-promotion utilisant le TPA, il a été montré que l’anthracène n’était pas un initiateur tumoral (LaVoie et al., 1983 ; LaVoie et al., 1985).
Une co-exposition cutanée à l'anthracène et aux rayonnements ultra-violets induit des résultats contradictoires chez la souris. Chez la souris, une solution à 5 % d’anthracène dans un mélange d’huile d’olive et de vaseline, appliquée sur les oreilles 3 fois par semaine pendant toute la vie induit après onze mois de traitement la mort de 43 souris sur 44 traitées (Miescher, 1942). Dans un autre lot (44 souris) exposé à l’anthracène dans les mêmes conditions puis 2 heures après aux ultra-violets pendant 40 à 60 minutes, aucune tumeur cutanée n’est rapportée. Dans ce groupe, seules 5 souris sont encore en vie 7 mois après le début du traitement. La dernière souris meurt à 9 mois. Des résultats similaires sont observés pour un même schéma expérimental au cours duquel l’exposition aux ultra-violets est de 90 minutes. Dans ce lot, la mortalité est encore plus élevée que dans les autres lots.
Une autre étude a été également réalisée chez la souris pour une exposition à une solution d’anthracène à 10 % dans un mélange de vaseline et d’huile d’olive suivie d’une exposition aux ultra-violets et/ou à la lumière visible. Une augmentation des tumeurs cutanées est observée dès 5 à 8 semaines après le début du traitement. Les tumeurs sont de type carcinomes et certaines sont métastasées. Aucune tumeur n’est observée chez les différents lots témoins (Heller, 1950).
Un autre auteur a évalué l’activité photo-cancérogène de l’anthracène chez la souris. Les animaux sont exposés par application cutanée de 40 µL de méthanol contenant 4 µg d’anthracène une fois par jour, 5 jours par semaine, pendant 38 semaines et suivie par une exposition de deux heures aux ultra-violets (300 J.m-2) (Forbes et al., 1976). Dans cette étude un lot témoin positif (4 µg de 8-méthoxypsoralène) et négatif sont inclus. Le délai de survenue des tumeurs de type carcinomes épidermoïdes n’est pas statistiquement différent entre le lot témoin négatif et le lot exposé à l’anthracène, alors qu’il l’est pour le témoin positif.
Synthèse
Chez l’animal, notamment chez la souris et le rat, les différentes études révèlent l’absence d’effet cancérogène ou d’effet d’initiation.
Effets génotoxiques
Généralités
La génotoxicité de l’anthracène a été examinée dans de nombreuses études. La grande majorité d’entre elles, ayant examiné sa capacité d’induire des altérations de l’ADN, des mutations, des aberrations chromosomiques, des échanges de chromatides sœurs ou encore de transformations morphologiques de différents types cellulaires aussi bien à partir de tests in vitro qu’in vivo, se sont révélées négatives. Plusieurs des tests de génotoxicité avec l’anthracène ont été réalisés dans un contexte d’essais inter-laboratoires et de comparaison d’études mises en commun, sur la base de protocole bien définis (Bridges et al., 1981 ; Brookes et Preston, 1981). Pour ces raisons, la tendance générale en faveur de résultats négatifs doit être considérée comme étant valable. Des résultats positifs marginaux ou résultats contradictoires ne sont pas suffisants pour inverser la conclusion générale amenant à considérer que l’anthracène n’est pas génotoxique. De plus, l’absence d’une quelconque activité génotoxique dans les diverses études in vivo suggère fortement que la formation de 9,10-diméthylanthracène, métabolite génotoxique de l’anthracène, est trop faible pour avoir des conséquences biologiques notamment en termes de génotoxicité (EU, 2007).
Des résultats négatifs ont également été obtenus à partir du test des comètes (cassures d’ADN) réalisé sur une lignée de cellules pulmonaires V79 de Hamster-chinois (Platt et al., 2008).
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | L’anthracène n’a pas fait l’objet d’un examen par l’Union Européenne. |
In vitro
Synthèse
Les résultats des tests in vitro et in vivo sont en faveur d’une absence d’effet génotoxique.
Effets sur la reproduction
Chez l'homme
Toutes voies
A notre connaissance, il n’existe pas de donnée disponible.
Synthèse
Les effets de l’anthracène seul sur la reproduction n’ont pas été étudiés chez l’homme.
Chez l'animal
Voie orale
Dans l’étude de toxicité à doses répétées de 90 jours par voie orale chez la souris (exposition à des doses de 0 - 250 - 500 - 1 000 mg.kg-1.j-1), aucune altération histologique des testicules ou des ovaires n’a été observée (US EPA, 1989). L’augmentation du poids absolu et relatif des ovaires, observée uniquement à la dose de 500 mg.kg-1.j-1, n’a pas été considérée comme étant liée au traitement.
Synthèse
Les effets de l’anthracène seul sur la reproduction ne sont pas documentés chez l’animal. Cependant, au cours d’une étude sub-chronique par voie orale, aucun effet sur les organes reproducteurs n’a été observé chez la souris mâle et femelle.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | L’anthracène n’a pas fait l’objet d’un examen par l’Union Européenne. |
Chez l'homme
Toutes voies
Les effets de l’anthracène seul sur le développement n’ont pas été étudiés chez l’homme.
Chez l'animal
Toutes voies
Il a été montré que les effets embryo/foetotoxiques des HAP dépendent au moins partiellement de la capacité d’induction des récepteurs Ah de la mère et du fœtus. Dans ce contexte, il est important de préciser que l’anthracène n’a qu’une faible capacité à se lier à ces récepteurs in vitro (Machala et al., 2001).
Synthèse
Les rares données disponibles chez l’animal ne permet pas de conclure vis-à-vis des effets de l’anthracène sur le développement.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
FDTE/VTR Importer Valeurs utilisées pour la population générale:
UE : Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine (CE, 1998).
Pour l’ensemble des HAP 0,1 µg.L-1.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Effets sans seuil :
Selon le rapport INERIS (2003), une méthode de calcul est proposée par l’OMS IPCS, sur la base d’une valeur de référence multipliée par un FET (facteur d’équivalence toxique) (Doornaert et Pichard, 2003). Le principe de FET est fondé sur les hypothèses selon lesquelles l’organe cible et l’activité toxique sont identiques pour chaque molécule apparentée et qu’il n’y a pas d’interaction toxicocinétique ni toxicodynamique. Une telle approche autorise l’addition des risques cancérogènes liés à une co-exposition et permet de quantifier le pouvoir cancérogène d’un mélange de substances en fonction du pouvoir cancérogène d’une substance dite de référence, appartenant à la même famille chimique (OMS IPCS, 1998).
Néanmoins, comme le rappelle l’AFSSA, 2006, cette approche n’est possible que sous 3 conditions :
- les doses et les effets de chacun des composés du mélange sont additifs,
- il n'existe pas d'interactions antagonistes ou synergiques entre les composés du mélange et
- ils agissent selon le même mécanisme d'action toxique.
Or de nombreuses études expérimentales montrent que ces 3 conditions ne sont pas toujours réunies et peuvent conduire à une surestimation ou à une sous-estimation du risque.
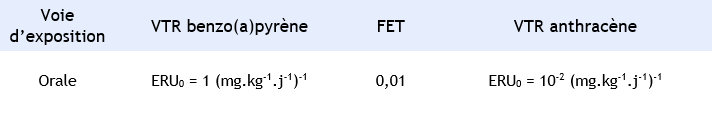
Dans le cas des HAP, la molécule de référence est le benzo(a)pyrène car c’est le HAP le plus étudié et donc le mieux connu. Le potentiel toxique relatif de chaque HAP dont l’anthracène est ensuite évalué par rapport à la toxicité du benzo(a)pyrène. Un FET par rapport au benzo(a)pyrène est alors évalué pour l’anthracène. Les FET retenus dans cette approche sont ceux proposés par Nisbet et LaGoy (1992) et repris dans le document INERIS (2003). Cette étape est basée sur l’hypothèse selon laquelle le potentiel toxique relatif entre deux HAP estimé chez l’animal est identique ou similaire chez l’homme.
Un FET de 0,01 a été attribué à l’anthracène par Nisbet et Lagoy, 1992.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR a établi un MRL de 10 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale à l'anthracène (ATSDR, 1995).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez la souris CD-1 (ICR) BR (US EPA, 1989). Dans cette étude, les mâles et femelles ont été exposés à l’anthracène, par gavage, aux doses de 0 – 250 - 500 – 1 000 mg.kg-1.j-1 pendant au moins 90 jours. Un NOAEL de 1 000 mg.kg-1.j-1 a été déterminé.
Facteurs d’incertitude : un facteur de 100 a été appliqué correspondant à un facteur de 10 pour la variabilité inter-espèces et à un facteur de 10 pour la variabilité intra-espèces.
Calcul : 1 000 x 1/100 = 10 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 0,3 mg.kg-1.j-1 pour une exposition chronique par voie orale à l'anthracène .(US EPA (IRIS), 1990)
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez la souris CD-1 (ICR) BR (US EPA, 1989). Comme décrit précédemment, les animaux mâles et femelles ont été exposés à l’anthracène, par gavage, aux doses de 0, 250, 500 et 1 000 mg.kg-1.j-1 pendant au moins 90 jours. Dans cette étude, aucun effet n’est observé même pour la dose la plus élevée. Un NOAEL de 1000 mg.kg-1.j-1 a été défini.
Facteurs d’incertitude : Un facteur de 3 000 a été appliqué. Un facteur 10 pour la variabilité inter-espèces, un facteur 10 pour la variabilité intra-espèces et un facteur 30 pour tenir compte à la fois de l’extrapolation d’une exposition sub-chronique à une exposition chronique et de l’absence de données sur le développement et la reproduction sur une deuxième espèce.
Calcul : 1000 x 1/3000 = 0,33 mg.kg-1.j-1 = (arrondi à 0,3 mg.kg-1.j-1)
Indice de confiance : Selon l’US EPA, la fiabilité de cette valeur est faible, tout comme la fiabilité de l’étude et de la base de données.
Le RIVM a établi un TDI de 4 10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale à l'anthracène (Baars et al., 2001).
Cette valeur a été élaborée pour les HAP comportant de 10 à 16 carbones et qui ne sont pas considérés comme cancérogènes (Baars et al., 2001). Ces substances sont l’anthracène, le fluorène, le naphtalène et le phénanthrène.
La méthodologie ayant conduit à cette valeur (et aussi à celles correspondant à d'autres fractions du pétrole) est issue des travaux réalisés en 1997 par le TPHCWG (Total Petroleum Hydrocarbons Criteria Working Group) (Edwards et al., 1997 ; Gustafson et al., 1997). Brièvement, afin d’évaluer le risque induit par le pétrole, 7 fractions indépendantes ont été distinguées, 4 fractions aliphatiques et 3 aromatiques. Dans la fraction aromatique comportant des HAP constitués de 10 à 16 carbones, 77 substances ont été identifiées. Des RfD ont été établies pour 8 de ces substances. Ces RfD sont comprises entre 0,03 et 0,3 mg.kg-1.j-1. Quatre substances présentent une RfD de 0,04 mg.kg-1.j-1 et seules 2 substances (fluorène et le mélange naphtalène/méthylnaphtalènes) ont une RfD de 0,03 mg.kg-1.j-1. Une RfD de 0,04 mg.kg-1.j-1 a été considérée par le TPHCWG comme appropriée en tant que valeur seuil pour les effets non cancérogènes induits par la fraction aromatique comportant des HAP constitués de 10 à 16 carbones. Cette valeur a été retenue par le RIVM pour chaque HAP non cancérogène comportant entre 10 et 16 carbones.
Selon le RIVM la fiabilité de cette valeur est élevée.
Effets sans seuil - Exposition chronique par inhalation :
L'INERIS propose un ERUi de 6.10-6 (µg.m-3)-1 pour une exposition chronique par inhalation à l’anthracène (2018).
Pour une exposition par inhalation à un HAP et en l’absence de valeur spécifique, l’INERIS recommande de prendre en compte l’Excès de Risque Unitaire (ERUi) du benzo(a)pyrène proposée par l’US EPA (IRIS), 2017 et retenue par l’INERIS pour le benzo(a)pyrène à savoir 6.10-4 (µg.m-3)-1 et de lui appliquer les FET correspondant à cet HAP.
Pour l’anthracène, l’INERIS a retenu en 2003, un FET de 0,01 provenant de de la classification de Nisbet & LaGoy (1992).
Calcul de VTR par inhalation à partir du Facteur Equivalent Toxique (FET) de l’anthracène :

Effets sans seuil - Exposition chronique par voie orale :
L’ANSES propose de retenir une valeur de 0,005 µg TEQ.kg-1.j-1 pour une exposition chronique par voie orale à 11 HAP (ANSES, 2016)
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM.
Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
Pour les autres HAP, l’AFSSA recommande l’utilisation de facteurs d’équivalence toxiques (TEF) basés sur le pouvoir cancérigène relatif des HAP. Dans le cadre de l’étude sur l’alimentation totale infantile, l’ANSES (2016) a considéré 11 HAP (benzoaanthracène, benzo(a)pyrène, benzo(b)fluoranthène, chrysène, benzo(g,h,i)perylène, benzo(k)fluoranthène, dibenzo(a,h)anthracène, indeno(1,2,3-cd)pyrène, anthracène, benzo(j)fluoranthène et fluoranthène) les plus toxiques et les plus représentatifs de la contamination alimentaire. L’ANSES (2016) a alors considéré qu’il était possible de calculer un excès de risque de cancer de 10-6 sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1 (RIVM 2001). Cette DVS a été établie sur la base d’apparition de tumeurs dans de nombreux organes (dont principalement le foie et le pré-estomac) observée au cours d’une étude réalisée chez le rat exposé par gavage pendant 2 ans au benzo(a)pyrène.
L’INERIS propose un ERUo de 10-2 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale à l’anthracène (2018).
Comme précisé ci-dessus, l'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le benzo(a)pyrène. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
En 2003, l’INERIS retenait la proposition de l’AFSSA (2003) et proposait donc pour le benzo(a)pyrène l’utilisation de la valeur établie par le RIVM, soit une DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, ce qui correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
En 2018, suite à la réévaluation de la valeur de l’US EPA pour le benzo(a)pyrène décrite dans la fiche de données toxicologique et environnementale du benzo(a)pyrène, l’INERIS propose de modifier sa valeur. Cette valeur est basée sur celle proposée par l’US EPA (IRIS), 2017 et retenue par l’INERIS pour le benzo(a)pyrène à savoir 1 (mg.kg-1.j-1)-1. A partir de cette valeur une approche par l’application de FET a été réalisée.
Calcul de VTR à partir du Facteur Equivalent Toxique (FET) de l’anthracène
Cet ERU0 correspond à une dose de 10-1 mg.kg-1.j-1 pour un excès de risque de 10-5 et à une dose de 10-2 mg.kg-1.j-1 pour un excès de risque de 10-6.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de retenir pour une exposition sub-chronique à l’anthracène par voie orale la VTR chronique de 10 mg.kg-1.j-1 de l’ATSDR.
Cette valeur est basée sur la valeur de l’ATSDR (1995), qui est la seule VTR disponible. L’étude clef est une étude expérimentale de 90 jours chez des souris, identique à celle retenue par l’US EPA (1989) pour l’élaboration de sa VTR chronique mais l’adéquation entre la durée de l’étude et le type d’exposition couvert par la VTR est meilleure. L’étude clé n’est pas publiée, la qualité de l’étude est recevable même si elle n’a pas pu être directement évaluée. La construction de la valeur est bonne et le choix des facteurs d’incertitude est cohérent. Cette valeur est retenue.
Indice de confiance : faible en raison de l’absence d’accès à l’étude clé.
Effets à seuil voie - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique à l’anthracène par voie orale la VTR chronique de 0,3 mg.kg-1.j-1 de l’US EPA.
Deux organismes proposent une valeur, l’US EPA (1990) et le RIVM (2001).
La valeur de l’US EPA est établie à partir d’une étude de 90 jours chez la souris (US EPA, 1989), où un NOAEL est établi en l’absence d’effet.
La valeur du RIVM est élaborée à partir d’une étude plus récente, mais qui prend en compte l’ensemble des hydrocarbures aromatiques comportant de 10 à 16 carbones (qui ne sont pas considérés comme cancérogènes). C’est pour cette raison que la valeur de l’US EPA est retenue, car spécifique de l’anthracène.
Indice de confiance : En raison de l’utilisation d’un facteur d’incertitude élevé, cette valeur est retenue par défaut.
Effets sans seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir pour une exposition chronique à l’anthracène par inhalation l’ERUi chronique de 6.10-6 (µg.m-3)-1 de l’INERIS.
Pour l’exposition chronique par inhalation, seul l’INERIS propose une valeur. Celle-ci est construite par application du FET à partir de la valeur du benzo(a)pyrène.
Indice de confiance : Faible en raison du peu de données disponibles
Effets sans seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique à l’anthracène par voie orale l’ERU0 chronique de 10-2 (mg.kg-1.j-1)-1 de l’INERIS (2018).
Deux valeurs sont disponibles pour l’exposition chronique par voie orale à l’anthracène celle de l’ANSES (2016) et celle de l’INERIS (2018). La méthode de construction de ces deux valeurs est identique : elle est basée sur l’application de facteur d’équivalent toxique sur la base de la valeur retenue pour le benzo(a)pyrène. Du fait de la révision en 2017 de la valeur développée par l’US EPA, l’INERIS propose une mise à jour de la valeur de l’anthracène. La valeur de l’ANSES étant plus ancienne, cette mise à jour n’a pas été évaluée.
Indice de confiance : Faible en raison du peu de données disponibles
Seul l’anthracène est considéré, les données de cancérogenèse et de génotoxicité disponibles sont en faveur d’une absence d’effet et ne justifient pas l’approche sans seuil dans le cadre d’une exposition à l’anthracène seul.
La toxicité de l’anthracène en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP. Ces HAP présentant des mécanismes d’action qui peuvent être communs, l’approche par TEF est à retenir dans une démarche protectrice pour la prise en compte des effets sans seuil.
Même si à ce jour il n’existe pas de VTR pour des expositions cutanées, cette voie d’exposition peut ne pas être négligeable.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de ce chapitre est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés ci-dessous. L’anthracène est une substance dangereuse prioritaire (N°2) selon la Directive Cadre sur l’Eau (DCE) (état chimique). Pour chacune de ces substances prioritaires des Normes de Qualité Environnementales (NQE) sont définies au niveau Européen. Les informations en lien avec l’écotoxicité de l’anthracène présentées ci-dessous sont extraites du dossier ayant conduit à l’élaboration de cette NQE (EC, 2011).
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Paramètres d’écotoxicité aiguë :
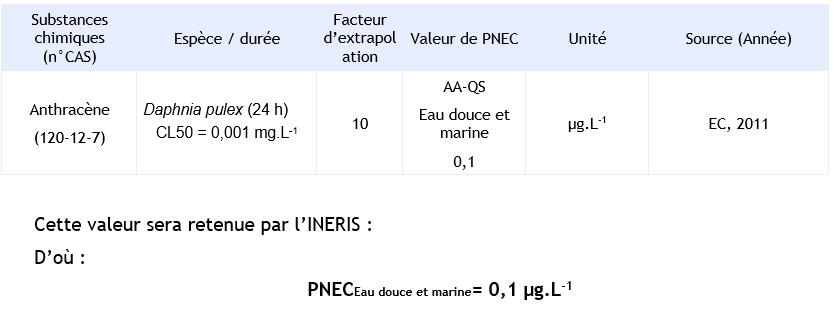
Des résultats d’essais d’écotoxicité aigus sur organismes d’eau douce et marine sont présentés dans la fiche NQE de l’anthracène. Des données sont disponibles pour 3 niveaux trophiques en eau douce (Algue, invertébré, poisson) et pour deux niveaux trophiques en eau marine (algue et invertébré).
L’espèce la plus sensible est Daphnia pulex avec une CE50 (24 h noir + 30 min lumière du soleil) à 1 µg.L-1.
Paramètres d’écotoxicité chronique
Des résultats d’essais d’écotoxicité chronique sur organismes d’eau douce et marine sont disponibles pour 4 niveaux trophiques en eau douce (algue, invertébré, poisson et amphibien) et uniquement pour les invertébrés (mollusques et échinodermes) en eau marine.
L’espèce la plus sensible est Daphnia magna avec une NOECreproduction (21 j) à 1,5 µg.L-1.
Sédiments d'eau douce
Sol
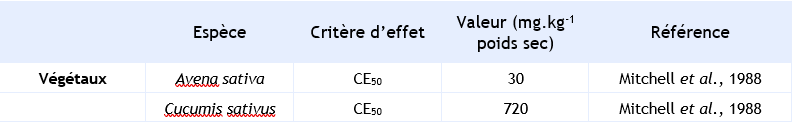
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës :
Biote
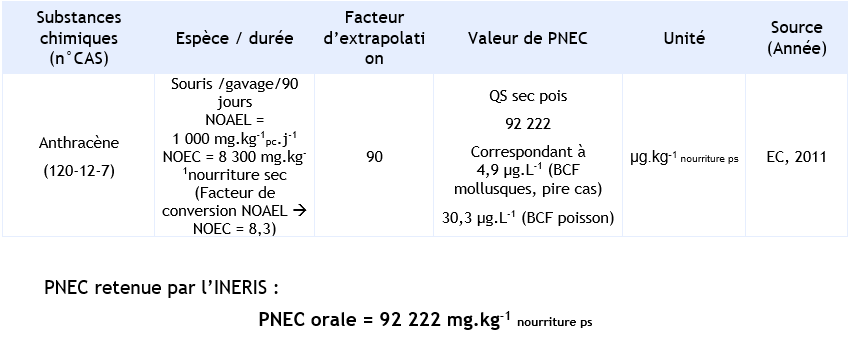
Empoisonnement secondaire des prédateurs supérieurs :
Plusieurs études expérimentales sont disponibles. Une étude expérimentale de 90 jours chez des souris a été sélectionnée pour l’évaluation des dangers pour les prédateurs. Dans cette étude, les mâles et femelles ont été exposés à l’anthracène, par gavage, aux doses de 0 – 250 - 500 – 1 000 mg.kg-1.j-1 pendant au moins 90 jours. Un NOAEL de 1 000 mg.kg-1.j-1 correspondant à la plus haute dose testée a été déterminé (US EPA, 1989).
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
PNEC disponibles pour le compartiment aquatique :
PNEC disponibles pour le compartiment sédimentaire :

PNEC disponibles pour d’empoisonnement secondaire :
Compartiment sol
Pour déterminer la PNECSOL, seuls deux résultats de tests aigus sur végétaux sont disponibles, c’est pourquoi un facteur d’incertitude 1 000 doit être utilisé sur la plus basse valeur :
PNECSOL = 30 µg.kg-1 sol sec = 26,5 µg.kg-1 sol humide
Compte tenu du faible nombre de donnée d’écotoxicité sur organismes terrestres, il est également recommandé de calculer la PNECsol à partir de la méthode de l’équilibre de partage (ECHA, 2012) :
PNECSOL (mg.kg-1 sol humide) = KSOL-EAU/RHOSOL X PNECEAU X 1 000
PNECEAU DOUCE ET MARINE = concentration prévue sans effet pour le compartiment aquatique = 0,0001 mg.L-1
RHOSOL = densité du sol (humide) (valeur par défaut : 1 700 kg.m-3)
KSOL-EAU = coefficient de partage sol eau (m3.m-3)
= FairSOL X KAIR-EAU + FeauSOL + (FsolidSOL X (KpSOL/1000) X RHOSOLID) = 771,2 m3.m-3
KAIR-EAU : coefficient de partage entre l’air et l’eau (négligeable)
FairSOL : fraction d’air dans le sol (défaut : 0,2 m3.m-3)
FeauSOL : fraction d’eau dans le sol (défaut : 0,2 m3.m-3)
FsolidSOL : fraction solide dans le sol (défaut : 0,6 m3.m-3)
KpSOL : coefficient de partage eau-sol (Focsol * koc) = 514 L.kg-1
Foc sol = 0,02 kgom.kgsolid-1
Koc = 25 700
RHOSOLID : densité de la phase solide (2500 kgsolide.msolide-3)
On obtient donc le résultat suivant :
PNECsol = 0,045 mg.kg-1 de sol humide = 0,05 mg.kg-1 de sol sec
La valeur la plus protectrice de l’environnement est retenue soit la PNEC sol à 30 µg.kg-1 sol sec = 26,5 µg.kg-1 sol humide.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 120-12-7 |
|---|---|
| SANDRE | 1458 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | oui |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Plusieurs textes réglementaires européens concernent les HAP, directement ou indirectement (notamment la directive 96/61/CE, dite directive IPPC, la directive 2000/76/CE sur l'incinération des déchets, la directive 1999/31/CE sur la mise en décharge et la directive 98/83/CE). Pour plus de détails, on peut se reporter à la fiche sur les HAP. L'arrêté national du 2 février 1998 impose une valeur limite de 1,5 mg.l-1 en moyenne mensuelle dans les rejets dont le flux dépasse 1 g.j-1. Cette valeur est reprise dans l' Arrêté du 3 avril 2000 relatif à l'industrie papetière. |
Production et utilisation
Production et ventes
Données économiques
Entreprises vendant de l'anthracène en France
Jusqu'en 1989 au plus tard, une usine d'anthracène existait à Rousseau (Nord-Pas-de-Calais).
En France, quelques entreprises produisent et distribuent de l'anthracène :
- Univar distribue de l'anthracène (mais elle n'en produit pas), sous différentes formes.
- Mitsui & Co France S.A.S. distribue de l'anthracène synthétique.
- Bayer SAS produit de l'anthracène synthétique.
- Alfa Aesar (groupe Johnson Matthey), entreprise allemande qui n'a, a priori, pas de site de production en France, fournit de l'anthracène sous de nombreuses formes différentes.
En outre, d'autres entreprises fournissent du benzo(a)anthracène-7,12-dione:
- PCAS (Produits chimiques auxiliaires et de synthèse, Seloc France). PCAS a trois usines de production en France : Bourgoin-Jallieu (38) qui produit des produits optiquement actifs de l'essence de térébenthine (notamment camphène et limonène).
- Couterne (61).
- Limay (78) qui produit des principes actifs pour l'industrie pharmaceutique.
Goudron de houille
En 1999, plus de 1,7 million de tonnes de goudron de houille contenant 25 000 tonnes d'anthracène furent distillées en Europe pour produire des dérivés, spécialement de la créosote (107 000 t.an-1), qui contient 1,5 % d'anthracène (soit 1 605 t.an-1). [EU RAR, 2000 ; in Royal Haskoning, 2003b]
Dans l'Europe des 25, 30 % de la quantité totale de houille est utilisée pour produire du noir de carbone qui contient d'importantes quantités d'anthracène. Ces volumes sont détruits et constituent de ce fait un puits pour l'anthracène et d'autres composés aromatiques [Rütgers Chemicals AG, 2002 ; in Royal Haskoning, 2003b].
Procédés de production
FTE 2005 Importer
L'anthracène est un sous-produit de la distillation du goudron de houille. La production d'anthracène en Europe a beaucoup diminué depuis la fin des années 1980. Elle est ainsi passée de plus de 7 000 tonnes par an en 1987 à 550 tonnes en 1999 [Corden, 2000].
La distillation des goudrons de houille permet de recueillir de l'huile d'anthracène riche en anthracène dans la fraction correspondant à des températures d'ébullition comprises entre 300 et 360 °C. Le phénanthrène et le carbazole également présents dans l'huile d'anthracène sont éliminés par des distillations et des cristallisations successives ou par extraction avec des solvants appropriés permettant d'obtenir de l'anthracène pur à 95 %. De l'anthracène très pur peut être préparé à partir d'anthraquinone de synthèse. [INERIS, 2004]
Utilisations
HAP
FTE 2005 Importer
Les HAP sont principalement utilisés comme biocides dans le goudron, la créosote et d'autres produits similaires utilisés pour protéger et préserver des matériaux (bois notamment). Ils sont également présents dans des huiles de dilution utilisées pour la production de pneumatiques. Des composés HAP sont également inclus dans l'asphalte et dans de nombreux autres dérivés de combustibles fossiles. Pour plus de détails, on peut se reporter à la fiche sur les HAP.
Anthracène
FTE 2005 Importer
D'après (INERIS, 2004) et Rütgers Chemicals, l'anthracène est principalement employé pour la fabrication de l'anthraquinone (intermédiaire pour la fabrication de teintures). Il est également utilisé comme intermédiaire chimique pour la préparation de matières colorantes ; pour la formation de polyradicaux destinés à la fabrication de résines (plastifiant pour des résines thermodurcissables et stabilisant à la lumière pour des polymères) ; comme diluant des produits de protection du bois ; dans les peintures ; comme insecticide et fongicide ; comme matière première pour l'industrie de la cellulose et pour la synthèse de dérivés de l'anthracène. Il est aussi employé pour synthétiser l'agent chimiothérapeutique 'Amsacrine'. En outre, il fait partie des photoconducteurs organiques cristallins utilisés en électrophotographie. Enfin, dans sa forme la plus pure, l'anthracène est fréquemment employé en physique nucléaire comme substance scintillante pour la détection des radiations de haute énergie [INERIS, 2004 ; Rütgers Chemicals ; RPA, 2002].
Divers types de substances peuvent contenir de l'anthracène. Des huiles et des pâtes à base d'anthracène peuvent ainsi servir d'intermédiaire chimique, d'agent de préservation du bois ou de solvant. Tous ces usages peuvent représenter en Europe plus d'un million de tonnes par an [European Chemicals Bureau, 2000 ; in Corden, 2000].
Rejets dans l’environnement
Émissions anthropiques totales
FTE 2005 Importer
Pour les rejets de HAP en général, on peut se reporter à la fiche sur les HAP.
L'anthracène est naturellement présent dans les combustibles fossiles : dans le charbon (12 g/kg), dans le fioul (100 à 300 mg.l-1), dans l'essence (1,55 mg.l-1, voire 2,6 mg.l-1 pour les essences à indice d'octane élevé) [Verschueren, 1996 ; in INERIS, 2004].
Les principales sources anthropiques d'exposition sont :
- les échappements des moteurs d'automobiles (0,02 à 6,45 mg.m-3 [OMS IPCS, 1998 ; in INERIS, 2004]) ;
- la cokéfaction et la gazéification du charbon et plus généralement les émissions des fours à charbon et des fours à fioul ;
- le raffinage du pétrole ;
- l'utilisation des huiles d'imprégnation pour le traitement du bois ;
- la préparation de l'asphalte pour les revêtements routiers ;
- la fumée de charbon de bois ;
- la combustion de déchets de pneumatiques (caoutchouc).
D'une manière générale, l'anthracène est présent dans les fumées émises lors de combustions incomplètes. [INERIS 2004]
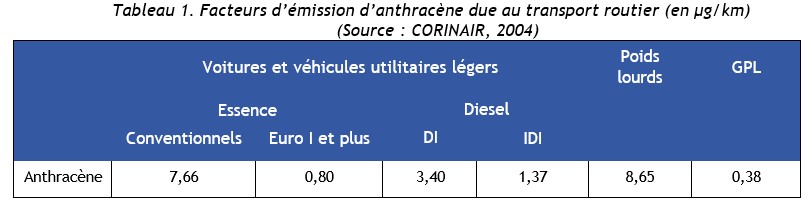
Émissions vers les eaux
FTE 2005 Importer
La DRIRE Rhône-Alpes (2001) a étudié les flux des substances présents dans les effluents des 168 entreprises de la région.
Tableau 2. Rejets industriels d'anthracène dans la région Rhône-Alpes
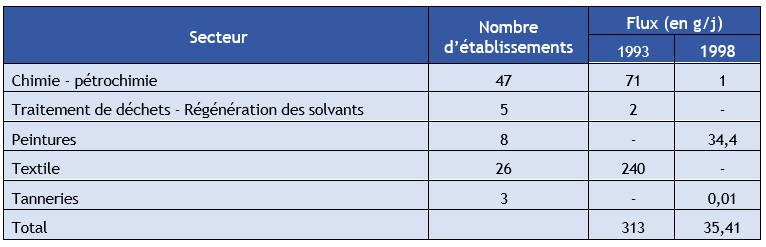
Dans ces effluents les flux d'anthracène étaient de 75 g.j-1 en 1993 et de 35 g.j-1 en 1998 (deux établissements). L'anthracène est rejeté, à 98 %, par les 8 établissements de peinture. Des dépassements des valeurs guides ont été constatés pour l'installation Holliday Dispersion Meyzieu (rejets en station d'épuration urbaine, département 69, peintures).
Émissions vers les sols
Boues de stations d’épuration
D'après (Feix, 1995) cité par (Bernal, 2005), l'anthracène présent dans les eaux usées urbaines est significativement abattu par les stations d'épuration, et très retenu dans les boues (25%). La teneur moyenne des boues de 40 stations d'épuration était en moyenne de 4,3 mg/kg de matière sèche.
Présence environnementale
Aquatique
FTE 2005 Importer
Le paragraphe ci-après présente une valeur de NQE en vigueur à la date de la rédaction de cette rubrique.
Une étude de l'agence de l'eau Rhin-Meuse (2003) a évalué la présence d'anthracène dans différents compartiments aqueux. Dans l'eau brute, phase aqueuse, il n'a pas été détecté de présence significative d'anthracène aux stations de mesure. Dans les matières en suspension, des dépassements significatifs de la NQE (170 g/kg) ont été constatés, notamment à Pte-Rosselle, Creutzwald, Sierck, etc. On constate également une importante adsorption d'anthracène sur les fractions organiques des matières en suspension (MES). Enfin, on relève une importante adsorption d'anthracène sur les fractions organiques des sédiments. En bref, l'anthracène présente une forte présence sur les fractions organiques des MES et des sédiments. [Remillon, 2003].
Un bilan de campagnes de mesures nationales dans des rejets industriels a mis en évidence que l'anthracène était détecté dans environ 10% des rejets étudiés. (MEDD, 2005)
D’après (Feix, 1995) cité par (Bernal, 2005), l’anthracène présent dans les eaux usées urbaines est significativement abattu par les stations d’épuration, et très retenu dans les boues (25%). La teneur moyenne des boues de 40 stations d’épuration était en moyenne de 4,3 mg/kg de matière sèche.
Perspectives de réduction
Réduction des rejets
L’objectif de rejets anthropiques nuls semble extrêmement difficile à atteindre, au moins à court terme à cause de l’omniprésence et de l’importance des rejets. Les rejets atmosphériques liés au transport automobile ou au chauffage urbain semblent particulièrement difficiles à réduire.
Pour plus de détails, on peut se reporter à la fiche sur les HAP.
Conclusion
FTE 2005 Importer
L'anthracène appartient à la famille des hydrocarbures aromatiques polycycliques (HAP). Comme eux, il est synthétisé lors de la formation des énergies fossiles (pétrole, charbon) ou bien lors de la combustion incomplète de matières organiques (chauffage au fuel, feux de forêts, etc.). Il est donc rejeté dans l'environnement soit à partir de produits dérivés de combustibles fossiles (goudron, coke, créosotes utilisées pour la préservation du bois, dérivés du pétrole, peintures, etc.), soit suite à des combustions incomplètes (combustion dans le secteur résidentiel principalement), soit suite à l'épandage de boues d'épuration.
L'anthracène connaît en outre un certain nombre d'usages qui lui sont propres. Il est principalement employé pour la fabrication de l'anthraquinone (intermédiaire pour la fabrication de teintures). Il est également utilisé comme intermédiaire chimique pour la préparation de produits divers (notamment pour la préparation de matières colorantes).
Comme pour l'ensemble des HAP, l'objectif de rejets anthropiques nuls en 2015 semble extrêmement difficile à atteindre. En effet, même si les émissions industrielles sont peu importantes et en forte décroissance, d'autres types de rejets, principalement les émissions atmosphériques liées au transport automobile ou au chauffage urbain sont beaucoup plus diffus, difficilement contrôlables et semblent particulièrement difficiles à réduire à court terme.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

