Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Butadiène-1,3 (106-99-0)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
106-99-0
Nom scientifique (FR)
Butadiène-1,3
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Dénominations d'usage / Noms commerciaux
Code EC
203-450-8
Code SANDRE
-
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C4H6 }\)
Code InChlKey
Code SMILES
C(C=C)=C
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H220 |
|---|---|
| Mention du danger - Texte | Gaz extrêmement inflammable |
| Classe(s) de dangers | Gaz inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H340 |
|---|---|
| Mention du danger - Texte | Peut induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Introduction
FDTE/VTR Importer Le tableau suivant récapitule les méthodes reconnues et validées pour mesurer les niveaux d’exposition professionnelle au 1,3-butadiène, satisfaisant l’ensemble ou la plupart des critères de la norme NF EN 482 (ANSES, 2011 ; INRS, 2017). Depuis 2018, le 1,3-butadiène est considéré comme un des polluants émergents et prioritaires en vue d’une surveillance de l’air ambiant (ANSES, 2018). Le laboratoire central de la surveillance de la qualité de l’air (LCSQA) est en charge de proposer en 2020 des méthodes de mesures pour la mise en place de cette surveillance dans l’air ambiant (LCSQA, 2019). L’INERIS proposera également fin 2019 des méthodes de mesures pour la mise en place de la surveillance de la qualité de l’air autour d’ICPE (mise à jour du guide (INERIS, 2016) prévue fin 2019).
Air
Prélèvement
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
54.09 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
Le 1,3-butadiène se répartit dans l’atmosphère sous forme gazeuse. Il est dégradé par les radicaux hydroxyles principalement, et par l’ozone, les radicaux nitrates et l’oxygène dans une moindre mesure. Ses produits de dégradation sont l’acroléine et le formaldéhyde (OMS CICAD, 2001). D’après des modélisations, 99,97 % du 1,3-butadiène rejeté dans l’environnement se trouve dans le compartiment air (EC, 2002).
Milieu eau douce
Dans l’eau, le 1,3-butadiène évolue rapidement par volatilisation. L’absence du groupement fonctionnel hydrolysable indique que la substance n’est pas susceptible d’être dégradée par hydrolyse dans l’environnement.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
La valeur de Koc disponible (51,6 L.kg-1) indique une faible adsorption sur les sédiments ou les particules en suspension (E.C., 2002).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment marin
La valeur de Koc disponible (51,6 L.kg-1) indique une faible adsorption sur les sédiments ou les particules en suspension (E.C., 2002).
Milieu terrestre
Le 1,3-butadiène s’adsorbe peu dans les sols. Il est modérément mobile et a peu de chances de contaminer les eaux souterraines (OMS IPCS, 2001). Il se volatilise rapidement (HSDB, 2015).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Les informations sur la biodégradation du 1,3-butadiène sont peu nombreuses. Les essais sont de fait difficiles à réaliser compte tenu de la forte volatilité de la substance (EC, 2002). Des cultures bactériennes pures isolées à partir d'échantillons d'eau provenant d'un lac et d'échantillons de sols prélevés dans le New Jersey (Etats-Unis) se sont révélées capables de dégrader le 1,3-butadiène (Hou et al., 1979 ; Hou et al., 1983).
La demi-vie en condition aérobie est de 7 jours et de 28 jours en milieu anaérobie (Capel et Larson, 1995).
Dégradabilité abiotique
Dans l’air, la demi-vie du 1,3-butadiène est calculée à 37 h pour sa réaction avec l’ozone (constante cinétique égale à 7,5.10-18 cm3/molécule.s), à 6 heures pour sa réaction avec les radicaux hydroxyles (constante cinétique égale à 6,6.10-11 cm3/molécule.s) et à 14 h pour sa réaction avec les radicaux nitrates (constante cinétique égale à 5,6.10-14 cm3/molécule.s) (HSDB, 2015).
Concernant la volatilisation du 1,3-butadiène à partir de l’eau, sa demi-vie est modélisée à 1 h en rivière et 70 h dans un lac. Lorsqu’il est fixé aux sédiments, la demi-vie du 1,3-butadiène est estimée entre 41,5 et 125 jours (HSDB, 2015). Dans le sol, elle est estimée entre 7 et 41,5 jours (OMS CICAD, 2001).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Aucun facteur de bioconcentration mesuré (BCF) n’est disponible pour le 1,3-butadiène. Seules les valeurs calculées suivantes sont publiées : - un BCF de 13 a été calculé pour Pimephales promelas exposé pendant 304 jours (US EPA, 1991) - Hansch et Leo, 1982 donnent un BCF sur poisson égal à 19,1 - En utilisant l’équation du Technical Guidance Document (TGD) (CE, 2003), un BCF de 9,8 peut être estimé Les faibles valeurs estimées pour le BCF indiquent une faible probabilité pour que le 1,3-butadiène se bioconcentre ou se bioaccumule dans la chaîne alimentaire.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucune donnée concernant la bioaccumulation du 1,3-butadiène dans les organismes terrestres n’a été trouvée dans la littérature scientifique consultée.
Bibliographie
Toxicologie
Dernière vérification le 31/07/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ANSES, 2011 ; ATSDR, 2012 ; EC, 2002 ; IARC, 2012 ; INRS, 2012, 2017 ; OMS CICAD, 2001 ; US EPA (IRIS), 2002). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
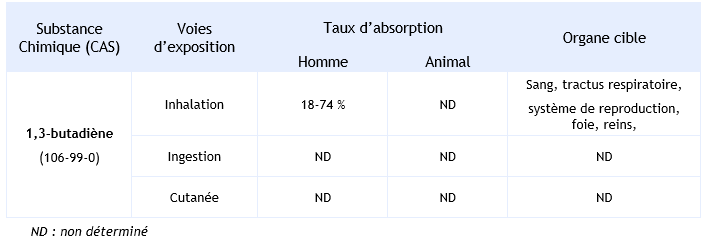
Absorption
La principale voie d’exposition est l’inhalation.
La principale voie d’absorption du 1,3-butadiène est la voie respiratoire. Une étude réalisée chez le volontaire sain exposé à 2 ppm pendant 20 minutes a montré que l’absorption était comprise entre 18 et 74 % (Lin et al., 2001).
La voie d’entrée cutanée, bien que théoriquement probable, est très peu documentée.
Distribution
La formation d’adduits à l’hémoglobine a été montrée chez des travailleurs exposés au 1,3-butadiène (Boysen et al., 2011). Les coefficients de partage sont élevés pour les graisses (18,4) et similaires pour les tissus bien ou faiblement perfusés, respectivement 0,69 ou 0,72 (Brochot et al., 2007).
Métabolisme
Selon les données disponibles le schéma métabolique du 1,3-butadiène est le même pour l’homme et les différentes espèces animales (Krause et Elfarra, 1997). Le 1,3-butadiène est métabolisé sur l’une des deux doubles liaisons en 1,2-époxy-3-butène (EB) sous l’action des cytochromes P450 (CYP2E1 et CYP2A6) puis sur la deuxième double liaison sous l’influence du CYP2E1 et pour une part plus faible du CYP2A et CYP2C9 en 1,2,3,4-diépoxybutane (DEB) ou hydrolysé par l’époxyde hydrolase en 1,2-dihydroxy—3-butène (B-diol) pour former du 1,2-dixydro-3,4-époxybutane (EB-diol) (Krause et Elfarra, 1997 ; Seaton et al., 1995). Le B-diol peut également être métabolisé par l’alcool déshydrogénase (ADH) et le cytochrome P450 (CYP2E1) pour former la 1-hydroxy-3-butène -2-one (hydroxyméthylvinyle cétone) HMVK).
Métabolisme du 1,3-butadiène (Kirman et al., 2010 )
BD : 1,3-butadiène ; EB : 1,2-époxy-3-butène (monoépoxyde) ; B-diol : 1,2-dihydroxy-3-butène ; DEB : 1,2:3,4-diépoxybutane (diépoxyde) ; EBD ou EB-diol : 1,2-dihydroxy-3,4-époxybutane ; HMVK : 1-hydroxy-3-butène-2-one
Élimination
Le 1,3-butadiène est éliminé essentiellement par l’air expiré sous forme de CO2, et dans les urines après transformation par les glutathion S-tranférases (GST) sous forme de métabolites formés par conjugaison du butènediol et de l’époxybutène avec le glutathion (INRS, 2012 ; INSERM, 2001).
Chez l'animal
Absorption
La cinétique d’absorption par voie pulmonaire a été évaluée chez différentes espèces et semble montrer une diminution de la quantité relative absorbée lorsque la concentration augmente ; l’absorption est plus importante chez les rongeurs que chez les primates (ANSES, 2011).
Distribution
Chez des souris ou des rats, après inhalation, le 1,3-butadiène se distribue largement dans les tissus : le sang, le tractus respiratoire, les intestins, le foie, les reins, la vessie et le pancréas (INRS, 2012). La formation des adduits à l’hémoglobine des métabolites époxydes du 1,3-butadiène a été observée chez les souris avec un taux plus important que chez l’homme (Boysen et al., 2007 ; Recio et al., 1992).
Métabolisme
Chez des rats mâles Sprague-Dawley co-exposés au styrène et au 1,3-butadiène, il a été observé une inhibition compétitive du métabolisme du 1,3-butadiène pour des concentrations jusqu’à 90 ppm de styrène (Laib et al., 1992). Ces données tendent à montrer l’implication de plusieurs mono-oxygénases à cytochrome P450 dans le métabolisme du 1,3-butadiène dont le CYP2E1 et CYP2A5 dans le foie et les poumons et le CYP 4B1 dans les reins chez la souris, (ATSDR, 2012 ; Elfarra et al., 2001).
Élimination
L’élimination suit les mêmes voies que chez l’homme.
Synthèse
Chez l’homme, le 1,3-butadiène est absorbé par inhalation. Les métabolites mis en évidence sont le 1,2-époxy-3-butène, le 1,2,3,4-diépoxybutane et le 3-butène-1,2-diol. Le 1,3-butadiène est éliminé essentiellement sous forme de CO2, et dans les urines, après conjugaison avec le glutathion.
Chez l’animal, après inhalation, le 1,3-butadiène se distribue dans la plupart des organes. Le taux de formation d’adduits à l’hémoglobine est plus important que chez l’homme.
Toxicité aiguë
Chez l'homme
Inhalation
Chez des travailleurs exposés au 1,3-butadiène, des irritations oculaires et des voies respiratoires supérieures à des niveaux d’exposition non précisés ont été observées (Wilson, 1944). Certains patients ont décrit des accès de toux, une fatigue et une somnolence qui disparaissent à l’arrêt de l’exposition. Carpenter et al., 1944 ont décrit une irritation des yeux et des difficultés de concentration chez deux hommes exposés pendant 6 à 7 heures à 2 000 et 4 000 ppm (4 500 et 9 000 mg.m-3) de 1,3-butadiène.
Voie orale
A notre connaissance, il n’existe pas de données.
Voie cutanée
Par voie cutanée, le 1,3-butadiène semble peu irritant pour la peau. Cependant, le contact avec le gaz peut entraîner des brûlures par le froid (INRS, 2012). Il n’existe pas de données sur la sensibilisation (ANSES, 2011).
Synthèse
Chez l’homme, le 1,3-butadiène entraîne des irritations oculaires et des voies respiratoires supérieures. Il a également une action délétère sur le système nerveux central. Par voie cutanée, le 1,3-butadiène semble peu irritant pour la peau.
Chez l'animal
Inhalation
La toxicité aiguë par inhalation semble faible. En 1969, Shugaev a calculé des CL50 de 122 000 ppm (274 500 mg.m-3) chez la souris pour une exposition de 2 heures et de 129 000 ppm (590 250 mg.m-3) pour une exposition de 4 heures chez le rat (Shugaev, 1969). Les signes principaux sont une irritation des yeux et du tractus respiratoire, une irritation cutanée et des troubles du système nerveux central.
Une exposition par inhalation provoque également une conjonctivite chez la souris (90 000 – 140 000 ppm) et chez le lapin (150 000 – 250 000 ppm) (INRS, 2012).
Voie orale
Par voie orale, des DL50 de 5 480 mg.kg-1 chez le rat et de 3 210 mg.kg-1 chez la souris ont été déterminées (IUCLID, 2000).
Voie cutanée
A notre connaissance, il n’existe pas de données.
Synthèse
Chez l’animal, la toxicité aiguë par inhalation semble faible. Les signes cliniques principaux à fortes concentrations sont une irritation des yeux, du tractus respiratoire, de la peau et des troubles du système nerveux central. Par voie orale, la toxicité aiguë apparaît aussi faible.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
La toxicité du 1,3-butadiène s’exerce essentiellement après inhalation. Checkoway et Williams, 1982 ont trouvé des changements minimes des paramètres hématologiques chez huit travailleurs exposés par inhalation à environ 20 ppm de 1,3-butadiène (44 mg.m-3), 14 ppm de styrène (60 mg.m-3) et 0,03 ppm de benzène (0,1 mg.m-3) par rapport à 145 travailleurs exposés aux mêmes composés respectivement à moins de 2 ppm (4,4 mg.m-3) de 1,3-butadiène, 2 ppm (8,5 mg.m-3) de styrène et 0,1 ppm (0,3 mg.m-3) de benzène. Une légère diminution du nombre des globules rouges, des plaquettes et des polynucléaires neutrophiles ainsi que de l’hémoglobine a été observée chez les travailleurs les plus exposés. Une étude récente menée par Tsai et al., 2005 ne rapporte pas de lien entre l’exposition au 1,3-butadiène et le développement d’anomalies hématologiques chez des ouvriers de la pétrochimie à l’est de Houston au Texas.
Dans une étude épidémiologique rétrospective, un excès de mortalité par pathologies cardiovasculaires a été observé chez des travailleurs d’une usine de caoutchouc exposés par inhalation, entre autres, au 1,3-butadiène (Matanoski et al., 1990 ; McMichael et al., 1974). Des effets neurotoxiques sont également rapportés par certains auteurs (Cheng et al., 2004 ; Khalil et al., 2007).
Synthèse
Chez l’homme, la toxicité s’observe essentiellement par inhalation. Des effets hématologiques minimes sont retrouvés (20 ppm) ainsi que des effets cardiovasculaires ou neurotoxiques potentiels.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :
Chez l'animal
Inhalation
La toxicité du 1,3-butadiène s’exerce essentiellement après inhalation. Les effets observés sont plus importants chez les souris que chez les rats.
Dans une première étude (NTP, 1984), des souris B6C3F1 ont été exposées 5 j/sem., 6 h/j à des concentrations de 625 ou 1 250 ppm (1 400 ou 2 810 mg.m-3) de 1,3-butadiène pendant 60 semaines. Cette durée d’exposition courte est justifiée en raison de la survie réduite des souris à ces deux concentrations du fait du développement de tumeurs malignes dans plusieurs organes. Un lot n’est pas exposé et sert de témoin pour l’étude. Aux deux concentrations, 625 ou 1 250 ppm (1 400 ou 2 810 mg.m-3), une atrophie ovarienne et à un moindre degré testiculaire est observée. Une nécrose du foie (différentes localisations) est rapportée pour les deux concentrations chez les mâles et à la plus forte concentration chez les femelles. Pour une concentration de 1 250 ppm (2 810 mg.m-3) des modifications importantes des cavités nasales : inflammation chronique, fibrose, métaplasie des cartilages, métaplasie osseuse, atrophie de l’épithélium sensoriel sont observées. Une hyperplasie du pré-estomac et de l’épithélium respiratoire est également notée. Aucune de ces lésions n’est observée dans le lot témoin. De cette étude, il est proposé un LOAEL de 625 ppm (1 400 mg.m-3) pour l’atrophie des gonades dans les deux sexes.
Au cours d’une seconde étude (NTP, 1993), les souris ont été exposées à des concentrations plus faibles (6,25 – 20 - 62,5 – 200 - 625 ppm soit 14 – 45 – 141 – 450 – 1 400 mg.m-3) selon le même protocole pendant 104 semaines. La survie est significativement diminuée dès 20 ppm (45 mg.m-3). Une atteinte des gonades est rapportée chez les mâles et les femelles. Chez les femelles, une atrophie des ovaires et de l’utérus se manifeste dès 6,25 ppm (14 mg.m-3) avec au terme des deux ans une impossibilité de se reproduire. Chez les mâles, l’atrophie des testicules est observée pour les concentrations de 200 ppm et 625 ppm (450 et 1 400 mg.m-3). Une atteinte de la moelle osseuse (atrophie, anémie régénérative) est rapportée à partir de 62,5 ppm (141 mg.m-3) (Melnick et Huff, 1992).
Une anémie macrocytaire mégaloblastique est observée chez des souris B6C3F1 et NIH exposées à 1 250 ppm (2 810 mg.m-3) de 1,3-butadiène pendant 6 à 24 semaines (Irons et al., 1986a, b).
Crouch et al., 1979 ont exposé des rats Sprague-Dawley pendant 13 semaines 6 h/j, 5 j/sem. à des concentrations de 0, 1 000, 2 000, 4 000 ou 8 000 ppm (0, 2 250, 4 500, 9 000 ou 18 000 mg.m-3) de 1,3-butadiène. Aucune anomalie n’est observée pour les paramètres hématologiques mesurés (nombre d’érythrocytes, activité des cholinestérases cérébrales, fragilité osmotique des érythrocytes, phagocytose des polynucléaires neutrophiles). Les autres paramètres comme le gain de poids, la consommation de nourriture ou l’examen anatomopathologique des organes ne sont pas altérés.
Dans une étude exposant des souris B6C3F1 6 h/j, 5 j/sem. pendant 6 à 31 semaines à une concentration de 1 250 ppm (2 810 mg.m-3) de 1,3-butadiène, Leiderman et al., 1986 observent une diminution des cellules souches hématopoïétiques de la rate, suggérant des effets hématotoxiques par le 1,3-butadiène. Owen et al. (1987, 1990) ont rapporté les résultats de l’étude de l’inhalation chronique (2 ans) de 1,3-butadiène chez des rats Sprague-Dawley exposés à 0, 1 000 ou 8 000 ppm (0, 2 250 ou 18 000 mg.m-3). Entre le 2ème et le 5ème mois, chez les rats du lot exposé à 8 000 ppm (18 000 mg.m-3), une sécrétion excessive au niveau des yeux et du nez ainsi qu’une discrète ataxie sont observés. Dans ce lot, le poids du foie est augmenté à 52 semaines comme à 105 semaines. Les poids absolu et relatif des reins sont aussi augmentés et associés à une nécrose. Aucune atrophie des organes de la reproduction n’est observée, mais la présence de tumeurs est rapportée (Owen et al., 1987 ; Owen et Glaister, 1990).
Synthèse
Chez l’animal, les effets induits par inhalation sont : une nécrose hépatique, une atrophie des organes génitaux, des altérations des cavités nasales (inflammation, fibrose, métaplasie…), une hyperplasie de l’estomac et de l’épithélium respiratoire, quelques altérations hématologiques telles qu’une anémie macrocytaire mégaloblastique et des altérations rénales.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1A (substances que l’on sait être cancérogènes pour l’homme) | 2001 |
| IARC | Groupe 1 (l’agent est cancérogène pour l’homme) | 2012 |
| US EPA | Le 1,3-butadiène est cancérogène pour l’homme par l’US EPA | 2002 |
Chez l'homme
Inhalation
Plusieurs études chez les travailleurs de l’industrie du caoutchouc synthétique (styrène-butadiène) ou utilisant du butadiène monomère ont été publiées. Les éléments présentés sont issus des principales conclusions de l’IARC, 2012.
Les principales études épidémiologiques concernent trois cohortes de travailleurs de l’industrie du butadiène monomère (Divine et Hartman, 2001 ; Tsai et al., 2001 ; Ward et al., 1995), et deux cohortes de l’industrie du caoutchouc synthétique (Matanoski et Schwartz, 1987 ; Matanoski et al., 1990 ; Matanoski et al., 1993 ; McMichael et al., 1974 ; McMichael et al., 1976 ; Meinhardt et al., 1982). Les données des études de Meinhardt et al., 1982 et de Matanoski et al., 1982, ont été actualisées par Delzell et al., 1996a et Delzell et al., 1996b.
L’examen actualisé de plus de 17 000 employés de l’industrie du caoutchouc synthétique nord-américaine et canadienne a permis de mettre en évidence une augmentation de mortalité avec un excès de 40 % de leucémies et l’existence d’une relation dose réponse (Cheng et al., 2007 ; Delzell et al., 2006 ; Sathiakumar et Delzell, 2007). Un large excès de mortalité par leucémie est retrouvé chez les travailleurs les plus exposés (zones avec les niveaux d’exposition les plus élevées, durée d’exposition la plus longue). Ces excès sont attribués aux leucémies lymphoïdes ou myéloïdes chroniques avec une relation dose-réponse significative entre l’exposition cumulée au butadiène et la mortalité par leucémie (IARC, 2012). Les analyses les plus récentes ont montré que les leucémies étaient induites par l’exposition au butadiène indépendamment des expositions au benzène, styrène ou diméthyl-dithiocarbamate (Cheng et al., 2007 ; Delzell et al., 2006).
L’étude de Delzell et al., 1996a est une étude de cohorte rétrospective menée sur 5 359 employés issus de 8 usines de fabrication du caoutchouc (6 américaines et 2 canadiennes). Les employés ont été exposés sur des périodes comprises entre 1 et 49 ans. Les niveaux d’exposition en butadiène ont été précisés sur les usines américaines et sont exprimés en exposition cumulée par année et par secteur d’activité. Des co-expositions au styrène, benzène, hexane, cyclohexane et 1-butène ont été également identifiées. Un suivi de la mortalité toutes causes, pour tous les types de cancers, pour les lymphosarcomes, pour les autres cancers hématopoïétiques et pour les leucémies a été réalisé. Aucune relation n’a été constatée entre l’exposition au 1,3-butadiène et la mortalité due à toutes causes et liée à tous types de cancers. En revanche, en ce qui concerne la mortalité induite par les leucémies seules dans l’ensemble de la cohorte, le SMR calculé est 131 (IC à 95 % : 97-174). L’association entre l’exposition au 1,3-butadiène et la mortalité par leucémie est plus importante pour les individus ayant travaillé à l’heure et pendant une longue durée. Cette relation est également plus forte pour les salariés étant décédés après 1985, pour ceux ayant été embauchés entre 1950 et 1959 et pour ceux décédés avant l’âge de 55 ans. Enfin, pour les individus ayant travaillé dans les 3 secteurs d’activités suivant, polymérisation, laboratoire de maintenance et autres laboratoires, le taux de mortalité par leucémie est important et les résultats sont respectivement les suivants : SMR : 251 (IC à 95 % : 140-414) ; SMR : 265 (IC à 95 % : 141-453) et SMR : 431 (IC à 95 % : 207-793). Dans ces 3 secteurs d’activité, les employés ont été exposés au 1,3-butadiène, à des fortes concentrations.
L’association la plus évidente entre l’exposition au butadiène et la survenue de lymphomes non-Hodgkinien est issue des études menées dans l’industrie du butadiène monomère (Divine et Hartman, 2001 ; Ward et al., 1995 ; Ward Jr et al., 1996).
Une étude en expositions environnementales a été menée dans le sud-ouest du Texas pour évaluer l’incidence des cancers hématologiques chez les enfants pour des concentrations ambiantes élevées en butadiène ou en benzène (Whitworth et al., 2008). Pour des concentrations élevées en butadiène, les ratios sont 1,4 (95 % IC : 1,1-1,8), 1,7 (95 % IC : 0,8-3,4) et 1,3 (95 % IC : 1,0-1,8) respectivement pour toutes les leucémies, les leucémies aiguës myéloblastiques et les leucémies aiguës lymphoblastiques. Une relation dose-réponse statistiquement significative a été identifiée pour l’ensemble des leucémies sans association entre les concentrations en butadiène et l’incidence de ces hémopathies.
La mortalité des femmes a également été évaluée dans la cohorte des expositions au styrène butadiène (Sathiakumar et Delzell, 2007, 2009). Aucune augmentation du risque n’a été retrouvée pour les leucémies ou les lymphomes. Cependant, une augmentation statistiquement significative du ratio standardisé de mortalité (SMR) a été observée pour les cancers des poumons et de la vessie.
Aucune étude ne lie l’exposition au 1,3-butadiène avec les lymphomes de Hodgkin ou les myélomes multiples (Delzell et al., 1996a ; Divine et Hartman, 1996).
Un excès de risque de cancer associé aux expositions par inhalation au 1,3-butadiène a été calculé à partir d’une étude épidémiologique nord-américaine chez les travailleurs de l’industrie du caoutchouc. Un excès de risque unitaire (ERU) a été calculé pour la population générale en retenant comme effet critique tous types de leucémies. Cet ERU correspond à une concentration de 0,16 ppm pour un excès de risque de 10-6 (Sielken et Valdez-Flores, 2015).
Synthèse
Chez l’homme, il a été montré qu’il existe un lien entre la survenue de leucémies et les expositions au 1,3-butadiène.
Chez l'animal
Inhalation
Le 1,3-butadiène a été évalué pour des expositions par inhalation par une étude chez le rat et quatre études chez la souris. Les principaux résultats sont présentés ci-dessous.
Dans la première étude, des souris mâles et femelles ont été exposées à des concentrations de 625 ou 1 250 ppm (1 400 ou 2 810 mg.m-3) à du 1,3-butadiène (pureté >99 %) 6 h/j, 5 j/sem. Cette étude, initialement prévue sur 102 semaines, a été interrompue à la 60ème semaine en raison de la forte mortalité par excès de lymphomes (Huff et al., 1985). Les lymphomes, présents au niveau du thymus, ont été observés dès la 20ème semaine. Une forte incidence d’hémangiosarcomes du cœur a également été observée. Les autres localisations tumorales sont les poumons (bronchiolaires et alvéolaires), le pré-estomac, les ovaires, les glandes mammaires et le foie. La relation dose-effet n’est pas claire pour tous les sites de développement des tumeurs, notamment chez les mâles. L’incidence des lymphomes est plus élevée chez les mâles que chez les femelles.
Une seconde étude utilisant le même protocole a été réalisée sur deux ans (Melnick et al., 1990 ; Melnick et al., 1993 ; NTP, 1993). Les concentrations inhalées ont été de 6,25 – 20 - 62,5 – 200 - 625 ppm (14 – 45 – 141 – 450 – 1 400 mg.m-3) de butadiène (pureté > 99 %) 6 h/j, 5 j/sem. pendant 103 semaines. Dix animaux par lot ont été euthanasiés après 40 et 65 semaines d’exposition. Des lots supplémentaires de souris mâles ont été ajoutés pour étudier des durées d’exposition plus courtes : 625 ppm (1 400 mg.m-3) pendant 13 semaines, 200 ppm (450 mg.m-3) pendant 40 semaines, 625 ppm (1 400 mg.m-3) pendant 26 semaines ou 312 ppm (700 mg.m-3) pendant 52 semaines. Des tumeurs se développent dès 13 semaines d’exposition au 1,3-butadiène (Melnick et Sills, 2001). Il a été constaté une incidence élevée de lymphomes chez les souris exposées à 625 ppm (1 400 mg.m-3) dans les deux sexes. Des hémangiosarcomes du cœur sont aussi détectés dans le lot exposé à 200 ppm (450 mg.m-3) après 50 semaines. L’incidence des néoplasies pulmonaires est plus élevée dans le lot des souris femelles exposées à 200 ppm (450 mg.m-3) que dans celui exposé à 625 ppm (1 400 mg.m-3).
Une étude a été menée chez des rats Sprague-Dawley exposés à 0, 1 000 ou 8 000 ppm (0, 2 250, 18 000 mg.m-3) de butadiène (pureté : 99,2 %) 6 h/j, 5 j/sem. pendant 105 semaines pour les femelles, 111 semaines pour les mâles (Melnick et Huff, 1993 ; Melnick et al., 1993 ; Owen et Glaister, 1990). Chez les femelles, des adénomes et carcinomes des glandes mammaires, des adénomes de la glande thyroïde, des sarcomes de l’utérus et des carcinomes des glandes de Zymbal ont été observés. Selon Owen et al., 1987, seules les localisations mammaires et thyroïdiennes sont liées à l’exposition. Chez le rat mâle, un développement d’adénomes du pancréas et des tumeurs des cellules de Leydig a été observé, seules ces dernières sont considérées comme liées à l’exposition au 1,3-butadiène. L’incidence des tumeurs de l’utérus, du cerveau et des glandes mammaires est similaire dans le lot exposé à 8 000 ppm (18 000 mg.m-3) à celle du lot exposé à 1 000 ppm (2 250 mg.m-3).
Voie cutanée
Les métabolites époxydiques du 1,3-butadiène (1,2-époxybutène-3 et 1,2,3,4-diépoxybutane) ont induit des tumeurs locales au point d’application chez des souris Swiss et des rats Sprague-Dawley (Van Duren et al., 1964 ; Van Duuren et al., 1965 ; Van Duuren et al., 1966).
Synthèse
Chez l’animal, le 1,3-butadiène est un cancérogène multi-sites lors d’exposition par inhalation. L’incidence des hémangiosarcomes, lymphomes et tumeurs pulmonaires est augmentée.
Effets génotoxiques
Généralités
De nombreuses études sont maintenant disponibles et tendent vers les mêmes conclusions. Le potentiel génotoxique du 1,3-butadiène est bien démontré ; il est lié à la formation des métabolites époxydiques, 1,2-époxybutène-3 et 1,2,3,4-diépoxybutane (IARC, 2012).
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Muta 1B | 2001 |
Chez l'homme
Toutes voies
Le potentiel mutagène est bien démontré chez l’homme notamment par le test du micronoyaux sur lymphocytes périphériques (Bolognesi et Kirsch-Volders, 2016 ; Cheng et al., 2013 ; Xiang et al., 2011).
Il a été montré (Albertini et al., 2007 ; Boysen et al., 2011 ; Sorsa et al., 1996 ; Uusküla et al., 1995) que les sujets déficients en certains allèles des gènes des glutathion S-transférases (GSTM1 ou GSTT1) pourraient présenter plus de risques mutagènes (échanges de chromatides sœurs ou aberrations chromosomiques) que les sujets non déficients pour cette activité. Les mono- et diépoxy forment des liaisons covalentes avec l’ADN, principalement avec la guanine en position N-7 (Selzer et Elfarra, 1996) ainsi qu’avec des protéines comme l’hémoglobine (N-hydroxybuténylvaline) (Adler et al., 1995). Ainsi, la N-(2-hydroxy-3-butényl)valine (HOBVal), provenant de la réaction de l’époxybutène avec la partie N-terminale de la valine de l’hémoglobine, la N,N-(2,3- dihydroxy-1,4-butadiyl)-valine provenant de la réaction du 1,2, 3,4 diepoxubutane et la N-(2,3,4-trihydroxybutyl)-valine à partir du 3,4-époxy-1,2-butane-diol ont été identifiées chez des travailleurs exposés au 1,3-butadiène (Albertini et al., 2007 ; Boysen et al., 2011 ; Osterman-Golkar et al., 1993).
Chez l'animal
Toutes voies
Le butadiène et ses métabolites époxydes se sont révélés génotoxiques dans de nombreux tissus chez la souris et le rat (Albertini et al., 2010 ; Chappell et al., 2014 ; IARC, 2012 ; Israel et al., 2018). Les principaux adduits à l’ADN se forment en position 7 de la guanine dans le foie, les poumons et les reins chez les rats et les souris (IARC, 2012). Des adduits à l’hémoglobine sont également formés notamment la HOBVal et la N-(2,3,4-trihydroxybutyl)-valine chez la souris (Boysen et al., 2007).
In vitro
Organismes eucaryotes
Les études in vitro ont montré que le diépoxybutane est un inducteur de micronoyaux et de mutations géniques plus puissant que l’époxybutène ou l’époxybutane diol dans les cellules de mammifères (IARC, 2012 ; Meng et al., 2007 ; Walker et al., 2009).
Une activation métabolique est nécessaire pour qu’une exposition au butadiène induise des mutations (Arce et al., 1990. Les époxydes réactifs avec l’ADN formés au cours de biotransformations du butadiène sont des mutagènes directs à l’origine des effets cancérogènes du butadiène (IARC, 2012). Le 1,3-butadiène est un cancérogène génotoxique, une approche sans seuil est donc retenue.
Synthèse
Le potentiel génotoxique du 1,3-butadiène est lié à la formation des métabolites époxydiques (1,2-époxybutène-3 et 1,2,3,4-diépoxybutane).
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2001 |
Chez l'homme
Toutes voies
Aucune information n’est disponible quant aux effets sur la reproduction et le développement du 1,3-butadiène chez l’homme (ATSDR, 2012).
Synthèse
Aucune information n’est disponible quant aux effets sur la reproduction et le développement du 1,3-butadiène chez l’homme.
Chez l'animal
Toutes voies
Des souris B6C3F1 exposées par inhalation à 1 000 ppm (2 250 mg.m-3) de 1,3-butadiène pendant 13 semaines ont présenté une atrophie ovarienne et une perte de poids (Bevan et al., 1996). Chez des souris, des effets sur les testicules (réduction de leur masse, dégénérescence ou atrophie) ont été observés pour des concentrations supérieures à 200 ppm (450 mg.m-3) (Bevan et al., 1996 ; NTP, 1993).
Synthèse
Les souris présentent une atrophie ovarienne et testiculaire après exposition par inhalation.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | non classé | 2001 |
Chez l'homme
Toutes voies
Dans une étude d’exposition environnementale, il a été recherché un lien entre les expositions des mères au cours de la grossesse et l’exposition à des polluants atmosphériques. Une augmentation du risque d’autisme (OR = 1,59 (IC 95 % 1,18-2,15)) au cours de l’enfance a été associée à l’exposition au butadiène des mères exposées au cours de la grossesse (von Ehrenstein et al., 2014). Dans cette étude d’autres polluants ont également été identifiés comme présentant une corrélation.
Synthèse
Une seule étude rapporte un lien possible entre l’exposition au butadiène et le risque d’autisme ; cependant ces résultats à eux seuls ne constituent pas une preuve.
Chez l'animal
Inhalation
Des souris Swiss CD-1 gestantes et des rates Sprague Dawley gestantes ont été exposées à des concentrations de 1,3-butadiène de 0, 40, 200 ou 1 000 ppm (0, 90, 450 ou 2 250 mg.m-3) 6 h/j du 6éme au 15ème jour de la gestation (Hackett et al., 1987 ; Morrissey et al., 1990). Des signes de toxicité maternelle sont rapportés chez les rates pour la concentration de 1 000 ppm (2 250 mg.m-3) et chez les souris dès 200 ppm (450 mg.m-3). Il n’y a pas de fœtotoxicité rapportée chez les jeunes rats. Chez les souriceaux, aucun effet tératogène n’a été observé. Cependant, à partir de 200 ppm (450 mg.m-3), des signes de toxicité sont apparus : poids réduit et anomalies squelettiques.
Dans une autre étude, des signes de toxicité fœtale et maternelle ont été observés chez des rates Sprague-Dawley exposées 6 h/j du 6éme au 15ème jour de la gestation à des concentrations de 0, 200, 1 000 ou 8 000 ppm (0, 450, 2 250 ou 18 000 mg.m-3) de 1,3-butadiène (Irvine, 1981). Les mères ont présenté une diminution du gain de poids corporel et la croissance fœtale a été diminuée pour une exposition à 8 000 ppm (18 000 mg.m-3). La fœtotoxicité s’est exprimée par une augmentation de l’incidence des malformations squelettiques (ossification irrégulière des côtes) pour le lot exposé à 1 000 ppm (2 250 mg.m-3) et par des malformations majeures du crâne, de la colonne vertébrale, du sternum, des os longs et des côtes à 8 000 ppm (18 000 mg.m-3).
Synthèse
Des signes de fœtotoxicité sont rapportés chez les jeunes rats et chez les souriceaux (ossification irrégulière, malformation du crâne, de la colonne vertébrale, des os longs...) pour une exposition induisant une toxicité maternelle.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’ATSDR avait proposé une valeur dans son draft de 2009, cette valeur n’a finalement pas été retenue en raison d’une trop grande différence de métabolisme entre les différentes espèces et du manque de données spécifiques pouvant conduire à une sur-estimation du risque chez l’homme (ATSDR, 2012).
L’OEHHA propose un REL (1 h) de 660 µg.m-3 pour une exposition aiguë par inhalation au 1,3-butadiène (2013)
Cette valeur est établie à partir d’une étude sur le développement par inhalation chez la souris gestante aux concentrations de 0 - 40 - 200 – 1 000 ppm de 1,3-butadiène 6h/j du 6ème au 15ème jour de la gestation (Hackett et al., 1987). L’effet critique retenu est la diminution du poids des fœtus mâles au 18ème jour de gestation à 200 ppm. Une NOAEC de 40 ppm a été retenue (Green, 2003) et une BMCL05 de 17,7 ppm a été calculée. Une concentration équivalente pour l’homme a ensuite été calculée : BMCL05 x DAF = 17,7 ppm x 1,68 = 29,7 ppm.
Facteur d’incertitude : un facteur global de 90 arrondi à 100 correspondant à un facteur d’incertitude de 10½ a été utilisé pour l’extrapolation de données animales à l’homme (pour la composante toxicodynamique), un facteur de 10½ (pour la composante toxicodynamique) x 10 (toxicocinétique) pour la variabilité au sein de la population humaine.
Calcul : 29,7 ppm x 1/100 = 0,297 ppm soit 297 ppb (arrondi à 0,66 mg.m-3)
Indice de confiance : cet organisme ne détermine pas d’indice de confiance
L’OEHHA propose un REL (8 h) de 9 µg.m-3 pour une exposition aigue par inhalation au 1,3-butadiène (2013)
Cette valeur est établie à partir d’une étude chronique par inhalation chez la souris aux concentrations de 6 à 625 ppm de 1,3-butadiène 6 h/j 5 j/sem pendant 9 à 24 mois (NTP, 1993). L’effet critique retenu est l’augmentation de l’incidence des atrophies ovariennes. Une BMCL05 de 1,01 ppm a été calculée. Un ajustement à une exposition continue a été pratiqué : BMCL05ADJ = BMCL05 x 6 h /8 h = 1,01 ppm x 6/8 = 0,758 ppm
Une concentration équivalente pour l’homme a été calculée : BMCL05ADJ x DAF = 0,758 ppm x 1,68 = 1,27 ppm.
Facteur d’incertitude : un facteur global 300 correspondant à un facteur d’incertitude 10 (pour la composante toxicodynamique) a été utilisé pour l’extrapolation de données animales à l’homme, un facteur 10½ (pour la composante toxicodynamique) x 10 (toxicocinétique) pour la variabilité au sein de la population humaine.
Calcul : 1,27 ppm x 1/300 = 4,2.10-3 ppm soit 4,2 ppb (soit 9 µg.m-3)
Indice de confiance : cet organisme ne détermine pas d’indice de confiance
Effets à seuil - Exposition chronique par inhalation :
L’US EPA propose une RfC de 2 µg.m-3 pour une exposition chronique par inhalation au 1,3-butadiène (2002)
Cette valeur a été établie à partir de l’étude du NTP (1993) où des lots de 70 mâles et 70 femelles souris B6C3F1 ont été exposés par inhalation 6 heures par jour, 5 jours par semaine, à 0 – 6,25 – 20 – 62,5 – 200 ppm soit 0 - 14– 45 - 140 ou 450 mg.m-3 de 1,3-butadiène jusqu’à 103 semaines. De plus, des lots de 90 souris de chaque sexe ont été exposés à 625 ppm. Une diminution de la survie des souris femelles est causée principalement par le développement de tumeurs malignes, pour des concentrations supérieures à 20 ppm. Une augmentation de l’incidence des cas d’atrophie ovarienne a été observée dans tous les lots, y compris à 6,25 ppm. Une benchmark concentration (BMCL10) a été calculée. Un ajustement temporel pour une exposition a été pratiqué pour une période de 24 heures (en multipliant par 6 h/24 h et 5 j/7 j). Une concentration équivalente pour l’homme a ensuite été calculée en utilisant RGDR de 1 correspondant à une BMCL10ADJ HEC de 0,88 ppm.
Facteur d’incertitude : un facteur global de 1 000 correspondant à un facteur d’incertitude de 3 a été utilisé pour l’extrapolation de données animales à l’homme, un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 3 pour tenir compte du peu de données disponibles, et un facteur de 10 pour extrapoler à un niveau inférieur aux 10 % d’effets (analogue au facteur utilisé pour l’utilisation d’une LOAEC et non d’une NOAEC). Le facteur d’incertitude global de 900 (3 x 10 x 3 x 10) a été arrondi à 1 000.
Calcul : 0,88 ppm x 1/1 000 = 0,00088 ppm (arrondi à 0,9 ppb, soit 2.10-3 mg.m-3)
Indice de confiance : élevé dans l’étude et la base de données mais modéré pour l’élaboration de la RfC.
L’OEHHA (2013) propose un REL de 2,2 μg.m-3 (1 ppb) pour une exposition chronique par inhalation au 1,3-butadiène.
Cette valeur est basée sur la même étude que la valeur 8 h à savoir celle du NTP, 1993. L’effet critique retenu est l’augmentation de l’incidence des atrophies ovariennes chez la souris. Une BMCL05 de 1,01 ppm a été calculée.
Un ajustement à une exposition continue a été pratiqué : BMCL05ADJ = BMCL05 x 6 h/24 h x 5 j/7 j = 1,01 ppm x 6/24 x 5/7= 0,18 ppm
Une concentration équivalente pour l’homme a été calculée : BMCL05ADJ x DAF = 0,18 ppm x 1,68 = 0,302 ppm.
Facteur d’incertitude : un facteur global de 300 correspondant à un facteur d’incertitude 10 (pour la composante toxicodynamique) a été utilisé pour l’extrapolation de données animales à l’homme, un facteur 10½ (pour la composante toxicodynamique) x 10 (toxicocinétique) pour la variabilité au sein de la population humaine.
Calcul : 0,302 ppm x 1/300 = 0,1 ppb (soit 2,2 µg.m-3)
Indice de confiance : cet organisme ne détermine pas d’indice de confiance.
La Texas Commission on Environmental Quality (TCEQ) propose une valeur de référence chronique (chronic ReV) de 33 µg.m-3 (15 ppb) pour une exposition chronique par inhalation au 1,3-butadiène (Grant et al., 2010).
Cette valeur a été établie à partir de la même expérimentation du NTP (1993) et retient comme effet critique une augmentation de l’incidence des cas d’atrophie ovarienne chez la souris. Une benchmark concentration (BMCL05 = 0,462 ppm) a été calculée. La durée d’exposition a été ajustée à une période de 24 heures (en multipliant par 6 h/24 h et 5 j/7 j).
Facteur d’incertitude : un facteur global de 30 a été appliqué, correspondant à un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour tenir compte du peu de données disponibles.
Calcul : 0,462 ppm x 1/30 = 0,0154 ppm (arrondi à 15 ppb, soit 33 µg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets sans seuil - Exposition chronique par inhalation :
Santé Canada (2017) propose une ERUi de 5,9.10-6 (μg.m-3)-1 pour une exposition chronique par inhalation au 1,3-butadiène.
Cette valeur a été estimée à partir de l’étude épidémiologique de Delzell et al. (1996). Cette dernière consistait en une cohorte rétrospective de plus de 15 000 employés d’usines de production de caoutchouc exposés au styrène et au 1,3-butadiène. Le suivi sur 49 ans de cette cohorte a montré une augmentation de l’incidence des leucémies chez les travailleurs exposés. La CT0,01 correspond ainsi à la concentration de 1,3-butadiène associée à une augmentation de 1 % du taux de mortalité attribué à la leucémie. Cette valeur résulte de la modélisation de la relation entre la mortalité par leucémie dans la cohorte et l’exposition au 1,3-butadiène. L’exposition des travailleurs (8 h/j, 240 j/an) a été convertie en une exposition moyenne cumulée par personne et par an. Les CT01 de chacun des modèles utilisés variaient de 1,4 à 4,3 mg.m-3. Une valeur de 1,7 mg.m-3, correspondant à la valeur la mieux ajustée, a été retenue. L’excès de risque unitaire associé est 0,01/CT01 soit 5,9.10-6 (μg.m-3)-1.
L’US EPA propose un ERUi de 3.10-5 (μg.m-3)-1 pour une exposition chronique par inhalation au 1,3-butadiène (2002)
Cette valeur de l’US EPA se base sur l’analyse faite par Santé Canada (1998) de l’étude de Delzell et al., 1996a. Une première modélisation a été pratiquée utilisant le même modèle que Santé Canada. Une conversion d’une exposition discontinue à continue a été menée. Pour déterminer son ERUi, l’US EPA a utilisé une extrapolation linéaire à partir d’une LEC01 de 0,5715 mg.m-3, qui a été établie à partir de l’incidence des leucémies en fonction de l’âge. Un facteur de correction de 2 a été utilisé car l’extrapolation a été réalisée à partir des cas observés uniquement chez les hommes exposés professionnellement ce qui est considéré comme pouvant sous-estimer le risque pour la population générale. Cette valeur correspond à 0,3 µg.m-3 pour un niveau de risque de 10-5 et à 0,03 µg.m-3 pour un niveau de risque de 10-6.
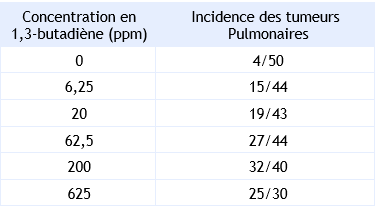
L’OEHHA (2011) propose un ERUi de 1,7.10-4 (μg.m-3)-1 pour une exposition chronique par inhalation au 1,3-butadiène.
Cette valeur a été établie à partir d’une étude réalisée chez des souris exposées à 0 – 6,25 - 20 – 62,5 - 200 ou 625 ppm de 1,3-butadiène par inhalation 6 h/j, 5 j/sem. pendant 65 semaines (Melnick et al., 1990). L’ERUi a été calculé à partir de l’incidence des tumeurs pulmonaires (bronchiolaires et alvéolaires) observées chez les souris femelles qui est l’effet le plus sensible. Une conversion à une exposition continue a été pratiquée puis une concentration équivalente chez l’homme a été calculée en tenant compte des différences d’aire de surface pulmonaire entre les différentes espèces.
Un excès de risque de 1,7.10-4 (µg.m-3)-1 a ainsi été calculé.
Incidence des tumeurs pulmonaires en fonction de la concentration en 1,3-butadiène :
Le TCEQ propose un ERUi de 5,0.10-7 (μg.m-3)-1 pour une exposition chronique par inhalation au 1,3-butadiène (Grant et al., 2009).
Cette valeur est basée sur la même étude épidémiologique de Delzell et al., 1996a qui a été réanalysée par Cheng et al., 2007. Cette valeur est construite à partir d’un modèle log-linéaire de Cox (modèle à risque proportionnels) avec l’âge comme co-variable. Une extrapolation linéaire aux faibles doses a ensuite été pratiquée en utilisant la limite inférieure de l’intervalle de confiance à 95 % comme point de départ. Un facteur d’ajustement en fonction de l’âge a été utilisé pour tenir compte de l’augmentation de la sensibilité pour des expositions chez les sujets jeunes.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’INERIS propose de retenir pour une exposition aiguë au 1,3-butadiène par inhalation la VTR aiguë de 660 µg.m-3 de l’OEHHA (2013).
L’OEHHA (2013) propose deux valeurs pour des expositions aigües : une pour une exposition de 1 h et l’autre pour une exposition de 8 h.
La première valeur (1 h d’exposition) est construite à partir d’une étude expérimentale de qualité recevable. L’effet critique retenu est la diminution de poids corporel des fœtus mâles. La construction de la valeur est détaillée même si l’utilisation des facteurs d’incertitude est spécifique de cet organisme.
La seconde valeur est basée sur une étude d’exposition chronique qui n’est pas adaptée pour la construction d’une valeur pour des expositions aiguës.
Dans ces conditions la valeur qui est retenue est celle développée pour 1 h d’exposition.
Indice de confiance : faible compte tenu des limites de l’étude et du choix des facteurs d’incertitude. L’effet est observé en présence de toxicité maternelle ce qui en limite sa pertinence mais lui donne un caractère protecteur.
Effets à seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir la valeur de 2 µg.m-3 pour une exposition chronique par inhalation au 1,3-butadiène.
Trois organismes proposent une valeur pour des effets chroniques à seuil par inhalation : l’OEHHA (2013), l’US EPA (2002) et TCEQ (2008). Elles sont basées sur la même étude expérimentale du NTP de 1993 qui est une étude de bonne qualité. L’effet critique retenu est recevable.
Dans les approches de l’OEHHA et de l’US EPA, une modélisation a été pratiquée pour déterminer une benchmark concentration. L’OEHHA (2013) utilise un modèle mathématique logarithmique-normal probit, tandis ce que l’US EPA (2002) utilise le modèle mathématique Weibull. Les deux organismes appliquent des facteurs d’incertitude pour tenir compte des différences inter-espèces et intra-espèces, mais les facteurs utilisés ne sont pas les mêmes. De plus, l’US EPA utilise des facteurs supplémentaires pour tenir compte du manque de données disponibles et de l’utilisation d’une benchmark concentration calculée pour un niveau d’effet de 10 %. Actuellement, ce dernier facteur ne serait plus recommandé.
Finalement, les valeurs construites par les deux organismes utilisent une méthode de construction proche qui conduit à des valeurs identiques ; celles-ci sont retenues.
La valeur publiée par le TCEQ est basée sur la même étude et le même effet critique. Le calcul de la benchmarkdose est équivalent à celui proposé par les deux organismes cependant aucune concentration équivalente n’a été calculée et le choix des facteurs d’incertitude apparait peu protecteur. Cette valeur n’est donc pas retenue.
Indice de confiance : moyen
Effets sans seuil - Exposition chronique par inhalation :
L'INERIS propose de retenir la valeur de 3.10-5 (μg.m-3)-1 pour une exposition chronique par inhalation au 1,3-butadiène (US EPA, 2002).
Quatre organismes proposent une valeur pour des effets sans seuil : l’OEHHA (2011), Santé Canada (2017), l’US EPA (2002) et TCEQ (2009). En réalité les trois valeurs ont été élaborées à peu près en même temps
l’OEHHA et Santé Canada ayant reconduit leur proposition dans des documents récents.
Santé Canada se base sur une étude épidémiologique menée sur 15 000 travailleurs (Delzell et al., 1996a). L’étude établie une association entre l’exposition au 1,3-butadiène et l’apparition de leucémies, retenues comme effet critique ; cet effet est pertinent pour l’homme. Il est souligné que les co-expositions de ces travailleurs au styrène et au benzène ont bien été évaluée et n’ont pas été considérées comme étant un biais dans cette étude.
La valeur de l’US EPA se base sur l’analyse faite par Santé Canada : même étude épidémiologique de Delzell et al., 1996a et même modèle mathématique. Un facteur d’incertitude de 2 pour protéger la population générale en raison d’une étude menée essentiellement sur une population de travailleurs masculins a ensuite été ajouté. La pertinence de ce facteur est discutable car il n’a pas été montré de différence de sensibilité en fonction du sexe mais est recevable car elle conduit à une approche plus protectrice.
La valeur proposée par le TCEQ est basée sur la même étude et prend en compte les éléments de ré-évaluation plus récents (Cheng et al., 2007). La valeur est développée sur la relation dose-effet la plus clairement établie pour les populations exposées aux niveaux les plus élevés. Cette démarche est donc moins représentative de l’ensemble des expositions.
L’OEHHA se base sur plusieurs études expérimentales, choisit la plus pertinente et retient l’effet critique le plus faible à savoir les tumeurs pulmonaires chez la souris pour calculer l’ERUi.
En raison du mécanisme d’action cancérogène du butadiène et des différences entre espèces qui sont maintenant bien connues, il apparait raisonnable de retenir une valeur développée sur la base de données humaines. La valeur développée par l’US EPA quoique présentant des limites apparait protectrice.
Indice de confiance : Moyen en raison de la taille de la cohorte malgré le critère de jugement principal retenu (étude de mortalité) et la non prise en compte de certains facteurs de co-exposition.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/07/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu' un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Pour le 1,3-butadiène les données d’écotoxicité présentées ci-après sont extraites du rapport Européen d’évaluation des risques (EC, 2002) disponible pour cette substance. Les données extraites de ce document ayant déjà fait l’objet d’expertise collective au niveau Européen, n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. En raison des propriétés physico-chimiques du 1,3-butadiène, et notamment de sa rapide volatilisation, il n'existe, pour les milieux aqueux et terrestres, aucun résultat d'essai d'écotoxicité disponible dans la littérature scientifique.
Dangers
Description
Paramètres d’écotoxicité aiguë :
En l'absence de donnée expérimentale évaluant l’écotoxicité du 1,3-butadiène, deux approches ont été considérées :
1/ Estimer l’écotoxicité de la substance via des modèles QSAR,
2/ Utiliser des données d’écotoxicité disponibles pour des substances analogues.
Dans le rapport européen d’évaluation des risques disponible pour cette substance, ces deux approches ont été utilisées de façon complémentaire. En effet, des estimations via des modèles QSAR de l’écotoxicité de la substance ont été réalisées et les résultats disponibles (QSAR et expérimentaux) pour deux substances analogues : l'isoprène (2-méthyl-1,3-butadiène) et le 1,3-pentadiène, ont été examinés.
Ces résultats sont présentés dans les Tableaux ci-dessous.
Comparaison des estimations QSAR et des données expérimentales sur la toxicité aquatique du 1,3-pentadiène et de l'isoprène :
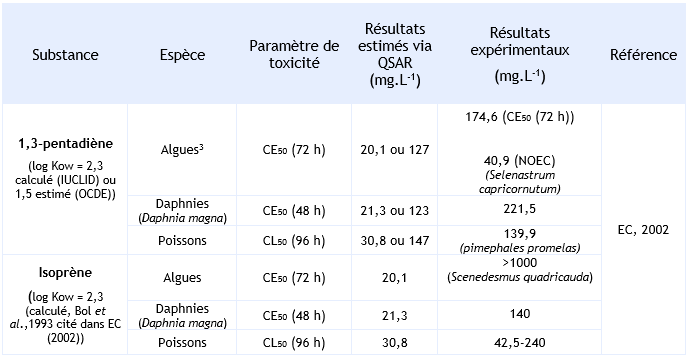
Cette comparaison a permis de constater que les estimations QSAR se situent globalement à un ordre de grandeur des données mesurées. L’estimation QSAR étant ici toujours inférieure à la valeur mesurée de façon expérimentale. Par conséquent, les estimations QSAR disponibles pour le 1,3-butadiène sont considérées comme suffisamment protectrices de la toxicité de la substance. Estimations QSAR de la toxicité aquatique aigue du 1,3-butadiène :
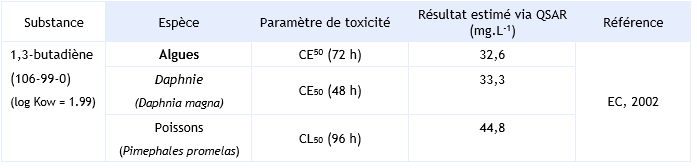
Paramètres d’écotoxicité chronique :
Estimations QSAR de la toxicité aquatique chronique du 1,3-butadiène :

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Sédiments d'eau douce
Aucun résultat d'essai d'écotoxicité aigue ou chronique sur des organismes benthiques n’a été trouvé dans la littérature scientifique consultée.
Sol
Aucun résultat d'essai d'écotoxicité aigue ou chronique sur des organismes du sol n’a été trouvé dans la littérature scientifique consultée.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Compartiment aquatique :
Eau douce :
D'après les comparaisons réalisées, le 1,3-butadiène pourrait être légèrement moins toxique que ce qu’indiquent les estimations QSAR obtenues. En l'absence de données expérimentales, la PNEC est calculée sur la base des estimations QSAR selon deux approches :
1/ En appliquant un facteur 1 000 sur la plus faible donnée aigue disponible d’où, PNECeau douce = 36,2 µg.L-1
2/ En appliquant un facteur 100 sur la plus faible donnée chronique disponible d’où, PNECeau douce = 44 µg.L-1
Par mesure de précaution et afin de se placer dans une situation « pire cas », la plus faible valeur est retenue (EC, 2002).
PNEC disponible pour le compartiment aquatique et retenue par l’INERIS:

Eau marine :
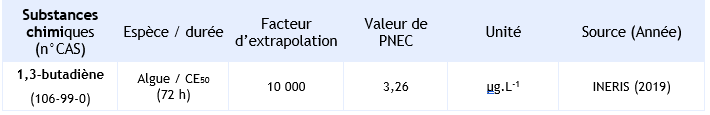
Aucune valeur de PNEC marine n’est proposée dans le rapport européen d’évaluation des risques pour le 1,3-butadiène et aucune donnée d’écotoxicité marine n’est également disponible. Pour le milieu marin, le facteur d’extrapolation appliqué doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d’espèces plus importante. Par conséquent, la PNEC eau marine est calculée en appliquant un facteur d’extrapolation de 10 000 sur la plus faible donnée aigue estimée par QSAR soit PNEC eau marine = 3,26 µg.L-1.
PNEC retenue par l’INERIS pour le compartiment aquatique :
Compartiment sédimentaire :
On ne dispose d'aucune donnée expérimentale ou estimée sur la toxicité du 1,3-butadiène pour les organismes benthiques. Il est néanmoins possible d'estimer PNECsédiment à partir de la PNECeau en utilisant la méthode de l'équilibre de partage (EC, 2002).
PNEC Sédiment eau douce = (Ksusp-eau/RHOsusp)*PNECeau*1000
Avec :
PNEC eau douce = 32,6 µg.L-1
Ksusp-eau (coefficient de partage particules en suspension-eau) = 2,19 m3.m-3
RHO susp (densité des matières en suspension) = 1150 kg.m-3
D'où :
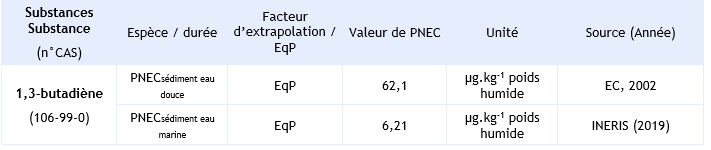
PNECsediment eau douce = 62,1 µg.kg-1 poids humide
PNECsediment eau marine = 6,21 µg.kg-1 poids humide
PNEC pour le compartiment sédimentaire et retenues par l’INERIS:
Compartiment sol :
On ne dispose d'aucune donnée expérimentale ou estimée sur la toxicité du 1,3-butadiène sur les organismes du sol. Il est néanmoins possible d'estimer une PNECsol à partir de la PNECeau en utilisant la méthode de l'équilibre de partage (EC, 2002).
PNECsol (mg.kg-1 sol humide) = Ksol-eau/RHOsol ´ PNECeau ´ 1 000
Avec :
RHOsol = Densité du sol (humide) (valeur par défaut : 1 700 kg.m-3)
Ksol‑eau = Coefficient de partage sol-eau ( 2,38 m3.m-3)
PNEC eau douce = 32,6 µg.L-1
D'où :
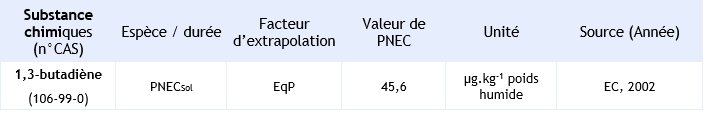
PNECSOL = 45,6 µg.kg-1 sol humide
PNEC disponibles pour le compartiment sol et retenue par l’INERIS:
Empoisonnement secondaire (prédateurs) :
Les propriétés physico-chimiques du 1,3-butadiène, et notamment de sa forte et de son log Kow faible (=1,99) indique un faible potentiel de bioaccumulation. Il n’est ainsi pas nécessaire de procéder à une évaluation de l'empoisonnement secondaire (EC, 2002).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










