Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Chloroforme (67-66-3)
Informations générales
Dernière vérification le 26/06/2025
Identification
Numero CAS
67-66-3
Nom scientifique (FR)
Chloroforme
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-663-8
Code SANDRE
1135
Numéro CIPAC
-
Formule chimique brute
\(\ce{ CHCl3 }\)
Code InChlKey
Code SMILES
ClC(Cl)Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP05
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H331 |
|---|---|
| Mention du danger - Texte | Toxique par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H302 |
|---|---|
| Mention du danger - Texte | Nocif en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Mention du danger - Code | H319 |
|---|---|
| Mention du danger - Texte | Provoque une sévère irritation des yeux |
| Classe(s) de dangers | Lésions oculaires graves/irritation oculaire |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Mention du danger - Code | H372 |
|---|---|
| Mention du danger - Texte | Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organs cibles (exposition répétée) |
| Libellé UE du danger | - |
| Mention du danger - Code | H361d |
|---|---|
| Mention du danger - Texte | Susceptible de nuire au fœtus. |
| Classe(s) de dangers | Toxicité pour la reproduction |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Introduction
Le chloroforme est un composé organo-halogéné volatil (COHV).
Le chloroforme fait partie des substances prioritaires pour la politique dans le domaine de l’eau (directive n°2013/39/UE), une fiche AQUAREF a été établie pour la mesure dans l’eau et le sol.
Air
Prélèvement
Analyse
Eau
Prélèvement
Analyse
Sol
Prélèvement
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
119.50 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 09/09/2025
Matrices
Milieu eau douce
Le chloroforme s’évapore facilement en milieu aqueux ou à partir du sol (constante de la loi de Henry : 287-326 Pa.m3.mol-1). Il est soluble dans l’eau (8,2 g.L-1).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Le chloroforme est très mobile dans le sol et il a peu tendance à s’accumuler dans les couches supérieures du sol. Il peut atteindre l’eau souterraine par lixiviation.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Le chloroforme n'est pas biodégradable en milieu aérobie (eaux de surface, sols). Les résultats disponibles en milieu aérobie sont :
- 0 % de dégradation après 14 jours (méthode OCDE 301C) (CITI, 1992)
- 0 % de dégradation après 175 jours (100 µg/L avec une boue de station d’épuration, à 20°C et à l’obscurité) (Bouwer et al., 1981).
En milieu anaérobie, des demi-vies de 10 à 14 jours ont été mesurées (Van Beelen et Van Keulen, 1990). La dégradation en anaérobie est confirmée par les résultats suivants :
- 15 et 81 % de dégradation après 14 jours pour des concentrations de 16 et 34 µg.L-1 (bactéries méthanogènes) (Bouwer et al., 1981)
- 89 % de dégradation après 30 jours pour des concentrations < 1,57 mg.L-1 (bactéries méthanogènes alimentées en continu) (Rhee et Speece, 1992).
Dans l’air, le chloroforme peut se décomposer par réaction photochimique avec des radicaux OH et NO3. Une demi-vie de 105 jours a pu être estimée (Atkinson, 1985).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse :
La demi-vie (DT50) du chloroforme par hydrolyse à pH 7, pH 9 et pH 11 à 25°C a été estimée respectivement de 1 850 ans, 24 ans et 3 mois par Mabey et Mill (1978) et Jeffers et al. (1989).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Des facteurs de bioconcentration (BCF) ont été mesurés sur plusieurs espèces de poissons :
- Cyprinus carpio (6 semaines : OCDE 305 C) BCF : 1,4 – 13 (CITI, 1992)
- Autres espèces de poissons (autres méthodes, durée d’exposition < 24 heures) BCF : 1,6 - 10,4 (Anderson et Lusty, 1980).
Un BCF de 13 peut être retenu mais de façon générale, la substance présente un faible potentiel de bioaccumulation (ce qui est confirmé par le faible coefficient de partage octanol-eau).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucun résultat d’essai valide n’a pu être trouvé dans la littérature.
Bibliographie
Toxicologie
Dernière vérification le 09/09/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1998 ; IARC, 1999 ; US EPA, 2001 ; OMS IPCS, 1994 ; OMS CICAD, 2004 ; OEHHA, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
Aucune étude, menée chez l'homme ou l'animal, ne permet à l'heure actuelle de déterminer le taux d'absorption pulmonaire du chloroforme (ATSDR, 1998). Il a été montré que les concentrations sanguines à l’équilibre sont comprises entre 7 et 16,2 mg.mL-1 pour des concentrations anesthésiques (de 8 000 à 10 000 ppm). Cet équilibre est atteint en deux heures chez les patients au repos (Smith et al., 1973). Des auteurs ont pu mettre en corrélation l’exposition au chloroforme et les concentrations urinaires et sanguines en chloroforme, chez des utilisateurs de piscines intérieures. De l’eau et des échantillons d’air ont été prélevés dans des piscines allemandes. Des prélèvements sanguins et urinaires ont été effectués chez le personnel de la piscine, chez les nageurs normaux, et chez les nageurs agonistiques[1]. Les taux mesurés dans l’eau de la piscine sont de 3,04 à 27,8 µg.L-1, les concentrations atmosphériques sont de 7,77 à 191 µg.m-3. En général, les niveaux sanguins de chloroforme augmentent avec l’exposition. Les niveaux de chloroforme sanguins varient respectivement de 0,13 à 2,45 µg.L-1, de 0,56-1,65 µg.L-1, et de 1,14-5,53 µg.L-1 pour le personnel de la piscine, chez les nageurs normaux, et chez les nageurs agonistiques. Les auteurs concluent que l’activité physique en piscine augmente l’absorption et/ou l’ingestion du chloroforme (Cammann et Hubner, 1995).
Voie orale
Par voie orale chez l'homme, il a été montré que quasiment 100 % du chloroforme ingéré était absorbé au niveau du tractus gastro-intestinal (Fry et al., 1972). Le pic de concentration sanguine est atteint en 5-6 minutes, en fonction du solvant et des doses (ATSDR, 1998).
Voie cutanée
L'absorption du chloroforme par voie cutanée chez l'homme a été estimée à 8,2 % lorsque ce composé est en solution dans l'eau et à 1,68 % lorsque le chloroforme est dans l'éthanol (Dick et al., 1995).
L’absorption cutanée de volontaires sains exposés 30 minutes seulement à de l’eau de bain (concentrations inférieures à 100 ppb) est de 41,9 et 43,6 µg pour les hommes et 11,5 et 39,9 µg pour les femmes, pour des températures de bains de 35° et 40°C respectivement (Corley et al., 2000).
[1] Système de nage sur place statique (exemple nage avec élastique)
Distribution
Une fois absorbé, le chloroforme, de par son caractère lipophile, se retrouve préférentiellement dans les tissus à fort taux de lipides tels que les graisses, le cerveau, le foie et, dans une moindre mesure les reins, les surrénales et le sang (ATSDR, 1998).
Métabolisme
Environ 50 % du chloroforme est métabolisé en dioxyde de carbone chez l'homme (Fry et al., 1972). Un métabolite intermédiaire toxique, le phosgène, est formé dans le foie au cours de ce processus. Une partie du phosgène formé réagit avec l'ammoniac au niveau hépatique pour être détoxiqué en urée. Le chloroforme donne aussi naissance à des radicaux libres, Le métabolisme du chloroforme chez l’homme semble plus lent que chez les rongeurs.
Élimination
Le chloroforme est éliminé soit sous forme inchangée, soit sous forme de dioxyde de carbone, par voie pulmonaire et dans une moindre mesure par voie urinaire (urée) et fécale (forme non précisée) (ATSDR, 1998).
La cinétique d’élimination du chloroforme par voie respiratoire a été étudiée chez des volontaires sains exposés seulement à de l’eau de bain par voie cutanée (concentrations inférieures à 100 ppb). Une augmentation significative de la quantité de chloroforme exhalée a pu être mise en évidence lorsque la température de l’eau est plus élevée (de 30° à 40°C). A 40°C, aucune différence entre les deux sexes n’a été mise en évidence, par contre les hommes exhalent plus de chloroforme que les femmes pour des températures de 30° et 35°C (différences de flux sanguin au niveau cutané et de coefficient de perméabilité cutanée).
Chez l'animal
Absorption
Voie orale
Par voie orale, des expérimentations chez la souris, le rat ou le singe, ont montré que l'absorption était rapide et quasiment totale. Suite à l'ingestion de 14C-chloroforme dans l'huile d'olive, environ 80 à 96 % de la radioactivité est retrouvée dans l'air expiré, l'urine et la carcasse (Brown et al., 1974 ; Taylor et al., 1974).
L’absorption intestinale du chloroforme dans l’eau ou l’huile administré par voie intragastrique chez des rats est rapide, par contre la biodisponibilité varie grandement (Withey et al., 1983).
Distribution
Les coefficients de partition (tissu/air) du chloroforme chez la souris et le rat ont été estimés à respectivement 21,3 et 20,8 pour le sang, 19,1 et 21,1 pour le foie, 11 et 11 pour le rein et 242 et 203 pour les graisses (Corley et al., 1990). De la radioactivité a été décelée dans le placenta et les fœtus de souris juste après exposition par inhalation à du 14C-chloroforme (Danielsson et al., 1986). Par voie orale chez la souris, des taux plus élevés de radioactivité ont pu être décelés dans le cortex rénal des mâles par rapport aux femelles, apparemment corrélés à la présence de testostérone (Taylor et al., 1974).
Métabolisme
Chez l'animal, le métabolisme du chloroforme a été bien étudié (OMS IPCS, 1994). Il apparaît plus rapide que chez l'homme. Le foie et le rein sont les sites principaux du métabolisme du chloroforme bien que d'autres organes ou tissus puissent aussi le transformer. La biotransformation est assurée au niveau des microsomes par des réactions d'oxydation et de réduction. Dans le foie, les cytochromes P450 oxydent le chloroforme en trichlorométhanol qui se décompose spontanément en phosgène, en hydrogène et en chlore. Le phosgène peut réagir avec l'eau et d'autres constituants cellulaires. Il se forme du CO2, du chlore et divers adduits avec les protéines, les phospholipides polaires et très rarement avec l'ADN. La réaction du phosgène sur les protéines tissulaires entraîne des lésions cellulaires et leur mort. Le glutathion réduit ou la cystéine réagissent aussi avec le phosgène pour former des composés qui préviennent les atteintes cellulaires. La réduction enzymatique (catalysée aussi par les CYP450 essentiellement le CYP 2E1 et, dans une moindre mesure, le CYP2B1) conduit à la formation d'un radical dichlorométhyl qui peut réagir avec les acides gras des phospholipides membranaires. La balance entre l'oxydation et la réduction dépend de divers facteurs comme la concentration en oxygène et en chloroforme, l'espèce animale, le niveau d'induction enzymatique, le site du métabolisme (Gemma et al., 2003). Dans la majorité des cas, c'est la voie d'oxydation qui est prépondérante. Le pré-traitement de rats à l'éthanol a augmenté le taux de métabolisation du chloroforme d'environ 1,5 fois mais sans modifier le contenu des microsomes hépatiques des P450 (Wang et al., 1994). Il a pu être mis en évidence une différence de métabolisme entre les souris mâles et les souris femelles (Taylor et al., 1974). Le chloroforme accumulé et métabolisé dans le cortex rénal est plus important chez les mâles que chez les femelles et inversement pour le métabolisme hépatique. Ces différences, qui ne sont observées que chez les souris, expliquent que les souris mâles sont plus susceptibles aux effets létaux et irréversibles que les souris femelles (Deringer et al., 1953).
D’autre part, il existe des différences inter-espèces pour le métabolisme du chloroforme. La conversion du chloroforme en dioxyde de carbone est élevée chez la souris (80%) et faible chez le singe-écureuil (18%) (Brown et al., 1974).
Élimination
L'élimination du chloroforme et de ses métabolites est rapide.
Après exposition par inhalation à du chloroforme radiomarqué, 92 à 99 % de la radioactivité a été excrétée chez la souris et 58 à 98 % chez le rat (Corley et al., 1990). Chez la souris, 80 à85 % de la radioactivité est sous forme de CO2, 0,4-8 % sous forme de chloroforme, 8-11% sous forme de métabolites urinaires et 0,6-1,4 % sous forme de métabolites fécaux. Chez le rat, 48 à85 % de la radioactivité est sous forme de CO2, 2-42 % sous forme de chloroforme, 8-11 % sous forme de métabolites urinaires et 0,1-0,6% sous forme de métabolites fécaux.
Après des expositions par voie orale, respectivement chez la souris et le rat, 49,6 et 6,5 % du chloroforme sont éliminés sous forme de CO2, 21,1 et 64,8 % sont éliminés sous forme de chloroforme et 4,9 et 3,6 % sous forme de métabolites urinaires (Mink et al., 1986). Ces résultats indiquent que la souris métabolise le chloroforme de manière plus importante que le rat.
Synthèse
Chez l'homme, le taux d'absorption pulmonaire du chloroforme n’est pas déterminé, par voie orale, il est proche de 100 % et par voie cutanée compris entre 1,7 à 8,2 %. Une fois absorbé, le chloroforme se distribue préférentiellement dans les tissus à fort taux de lipides (graisses, cerveau et foie) et, dans une moindre mesure les reins, les glandes surrénales et le sang. Le chloroforme est métabolisé en dioxyde de carbone, avec formation de phosgène comme métabolite intermédiaire toxique au niveau du foie, et donne aussi naissance à des radicaux libres. Le chloroforme est éliminé soit sous forme inchangée, soit sous forme de dioxyde de carbone, par voie pulmonaire et dans une moindre mesure par voie urinaire et fécale.
Les résultats obtenus chez l’animal confirment ce qui est observé chez l’homme.
Toxicité aiguë
Généralités
La pénétration du chloroforme dans l'organisme peut se faire par inhalation, ingestion ou contact cutané.
Chez l'homme
Inhalation
L'inhalation de fortes concentrations de chloroforme induit principalement une dépression du système nerveux central. A des niveaux d'exposition élevés (40 000 ppm soit198 400 mg.m-3), la mort peut survenir en quelques minutes. Des concentrations comprises entre 1 500 et 30 000 ppm (148 800 mg.m-3) induisent une anesthésie, et des teneurs moins élevées (< 1 500 ppm soit 7 440 mg.m-3) pendant environ 3 minutes, provoquent une fatigue, des vertiges et des céphalées. Une sensation d'inconfort peut survenir dès 50 ppm (248 mg.m-3) (ATSDR, 1998).
Divers effets ont été notés chez 1 502 patients anesthésiés au chloroforme à des concentrations inférieures à 22 500 ppm (111 600 mg.m-3) (Whitaker et Jones, 1965).
- Effets respiratoires : augmentation de la fréquence respiratoire lors de l'induction de l'anesthésie dans 44 % des cas puis dépression respiratoire lors de l'anesthésie profonde et prolongée.
- Effets cardiaques : bradycardie (8 % des cas), arythmie (1,5 %), hypotension (27 %).
- Effets gastro-intestinaux : nausées et vomissements.
- Effets hépatiques et rénaux.
Il convient de noter que c'est suite à des décès à court terme ou à des complications hépatiques retardées que l'utilisation du chloroforme a été arrêtée pour l'anesthésie.
Voie orale
Le chloroforme est un irritant des muqueuses, induisant des gastro-entérites accompagnées de nausées persistantes et de vomissements. Les symptômes observés après ingestion de chloroforme sont similaires à ceux observés après inhalation (Van der Heijden et al., 1986). Il existe de grandes différences inter-individuelles. La dose létale moyenne pour un adulte est estimée à 45 g environ (643 mg.kg-1) (Winslow et Gerstner, 1978), sachant qu'une mortalité a pu être observée à la dose de 14,8 g (10 mL) soit 212 mg.kg-1 (Schroeder, 1965).
Le foie est la principale cible après exposition par voie orale. Néanmoins les données suggèrent que les effets sont réversibles (ATSDR, 1998). Chez l’ensemble des patients ayant ingéré du chloroforme, un ictère et des hépatomégalies sont observés. Les observations cliniques sont confirmées par des mesures biochimiques sanguines, en particulier l’augmentation des activités des ALAT, ASAT et lactate déshydrogénase et une augmentation des taux de bilirubine (ATSDR, 1998).
Voie cutanée
Le contact cutané avec le chloroforme peut provoquer des dermatites chimiques caractérisées par des irritations, des érythèmes, des phlyctènes et des brûlures. Le contact du produit avec les yeux induit des brûlures, des douleurs et un érythème conjonctival. Une lésion de l'épithélium cornéen peut être observée et est réversible en quelques jours (Oettel, 1936 ; Winslow et Gerstner, 1978).
Synthèse
Chez l’homme, l’exposition par voie orale ou par inhalation à de fortes concentrations en chloroforme induit principalement une dépression du système nerveux central, pouvant conduire à la mort en quelques minutes. Le chloroforme a été utilisé en anesthésie et la concentration induisant une narcose est d’environ 15 000 ppm (740 400 mg.m-3). Des effets respiratoires, cardiaques, gastro-intestinaux, hépatiques et rénaux sont aussi observés. De plus, le chloroforme est un irritant cutané.
Chez l'animal
Inhalation
Le foie est l'organe cible majeur chez le rat et la plupart des souches de souris. L'atteinte hépatique se caractérise par une infiltration graisseuse qui peut parfois s’accompagner d’une ballonisation des cellules et suivie d’une nécrose centrolobulaire. Le rein est l'organe cible chez certaines souches de souris mâles. Les lésions débutent par une dégénérescence évoluant vers la nécrose des tubes proximaux. Il n'est pas observé d'atteintes rénales chez les souris femelles (OMS IPCS, 1994).
Une CL50 de 1 235 ppm (6125,6 mg.m-3) sur 6 h a été calculée pour des souris femelles de souche OF1 (Gradiski et al., 1978) et de 4 500 ppm (22 320 mg.m-3) sur 9 h pour des femelles Swiss-Webster (Gehring, 1968). La CL50 pour des mâles d'une souche sensible (C3H) est de 692 ppm (3432,3 mg.m-3) pour 1 à 3 h d'inhalation (Deringer et al., 1953).
Après 4 h d'inhalation, une infiltration graisseuse hépatique a été observée à la dose de 98 ppm (490 mg.m-3) chez la souris (Kylin et al., 1963) et une augmentation des activités sériques des glutamate et sorbitol déhydrogénases a été notée pour 282 ppm (1 410 mg.m-3) chez le rat (Brondeau et al., 1983).
La capacité du chloroforme à induire une toxicité et une prolifération cellulaire au niveau nasal, rénal et hépatique par inhalation a été étudiée. Les auteurs ont exposé des souris à des concentrations de chloroforme de 0 à 90 ppm (0 à 446 mg.m-3), par inhalation, 6 h/j, pendant 4 jours consécutifs (Larson et al., 1996). Malgré l’absence de signes cliniques manifestes, quelques effets modérés et transitoires ont été observés au niveau de l’aire ventrale postérieure des voies nasales chez les souris exposées à 10, 30 et 90 ppm (50, 149 et 446 mg.m-3). Les lésions sont caractérisées par des proliférations cellulaires modérées au niveau du périoste (augmentation de l’épaisseur de l’os).
Une autre étude menée chez le rat et la souris exposés à 0 – 1 – 3 – 10 – 30 – 100 – 300 ppm (0 – 5 – 15 – 50 – 150 – 500 – 1 500 mg.m-3) 6 h/j pendant 7 jours a montré que les souris exposées aux deux concentrations les plus élevées présentaient une nécrose des hépatocytes centrolobulaires et une vacuolisation importante des hépatocytes de la zone moyenne et périportale alors qu’une exposition à 10 ou 30 ppm (50 ou 150 mg.m-3) induit une vacuolisation modérée des hépatocytes de la région périportale (Larson et al., 1994a). Une atteinte rénale est également observée au niveau de l’épithélium des tubules proximaux. Chez les rats, une vacuolisation modérée des hépatocytes centrolobulaires et les mêmes effets rénaux que chez la souris sont observés uniquement à la dose la plus élevée. Dans des conditions expérimentales proches (exposition de 7 jours, mais en continu), des lésions (prolifération cellulaire) au niveau des cavités nasales ont été décrites à partir de 10 ppm (50 mg.m-3) chez le rat (Larson et al., 1995a), alors que chez la souris, aucune lésion de ce type n’a été décrite pour des expositions allant jusqu'à 288 ppm (1428 mg.m-3) (Larson et al., 1995a ; Larson et al., 1996).
Le chloroforme présente une toxicité aiguë faible par inhalation.
Voie orale
Par voie orale, de grandes variations sont notées selon la souche, le sexe et le solvant utilisé. Chez la souris, les DL50 vont de 36 à 1 366 mg.kg-1, les mâles apparaissant plus sensibles (Pericin et Thomann, 1979). Chez le rat, les DL50 sont comprises entre 450 et 2 000 mg.kg-1, sans différence entre les mâles et les femelles (Kimura et al., 1971 ; Chu et al., 1980).
L'étude de Larson et al. (1994b) a montré que le chloroforme dans l'huile, administré durant 4 jours par gavage présentait une toxicité plus importante qu’administré ad libitum via l'eau de boisson. Des souris femelles ont reçu des doses de 0 – 3 – 10 – 34 – 90 – 238 – 477 mg.kg-1.j-1 de chloroforme dissous dans de l’huile de maïs administrées par gavage 5 j/7, pendant 4 j. Dans la même étude, les souris ont été exposées en continu via l’eau de boisson aux doses de 0 – 60 – 200 – 400 – 900 -1 800 ppm pendant 4 jours. Cette étude a montré qu’après 4 jours d’exposition via l’eau de boisson à des doses estimées de 53 – 81 – 105 mg.kg-1.j-1 survenait une altération de la coloration du foie caractérisée par une pâle éosinophilie cytoplasmique des hépatocytes de la région centrolobulaire par rapport aux hépatocytes de la région péri-portale. Pour les doses inférieures ou une durée d’exposition plus courte, ces effets ne sont pas retrouvés. Les auteurs ont conclu que les mécanismes de détoxification étaient dépassés quand le chloroforme est administré en grande quantité en une fois alors que le foie peut détoxifier la même dose journalière ingérée en petites quantités tout au long de la journée.
Le chloroforme présente une toxicité aiguë modérée par ingestion.
Voie cutanée
Par voie cutanée, aucune mortalité n'a été observée chez des lapins exposés à des doses allant jusqu'à 3,98 g.kg-1 de chloroforme durant 24 h (Torkelson et al., 1976). Cependant, cette étude a mis en évidence une irritation cutanée et oculaire. Les effets oculaires ont également été retrouvés dans une autre étude chez le lapin (Duprat et al., 1976).
Synthèse
Chez l’animal, le chloroforme présente une toxicité aiguë faible par inhalation, modérée par ingestion et très faible par voie cutanée. Le foie est l'organe cible majeur chez le rat et chez la plupart des souches de souris. Son atteinte se caractérise par une infiltration graisseuse et une ballonisation hépatocytaire puis une nécrose centrolobulaire. Le rein est aussi un organe cible pour certaines souches de souris mâles. Le chloroforme induit des irritations oculaires et cutanées.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
L'exposition chronique aux vapeurs de chloroforme induit des effets sur le foie et le système nerveux central.
Des travailleurs exposés à des concentrations de 75 à 210 ppm (375 à 1 330 mg.m-3) durant 3 à 10 ans avec des pics de concentration allant jusqu'à 1 160 ppm (7 754 mg.m-3), ont présenté les symptômes suivants : lassitude, soif, douleurs gastro-intestinales, mictions fréquentes et douloureuses, manque de concentration, dépression et irritabilité (Challen et al., 1958). Aucun signe d'hépatotoxicité n'a été noté mais les tests utilisés étaient peu sensibles.
D'autres études ont montré des effets sur le foie, se traduisant par une hépatite ou un ictère, ainsi chez des travailleurs exposés à des concentrations de 2 à 200 ppm durant 1 à 4 ans une hépatomégalie a été observée chez 25 % des travailleurs exposés (Bomski et al., 1967). Une hépatite toxique et une stéatose sont retrouvées chez respectivement 5,6 % et 20,6 % des individus présentant une hépatomégalie.
Une autre étude portant sur 13 individus a montré la survenue d’ictères corrélée aux expositions à des concentrations supérieures à 400 ppm (1 984 mg.m-3) durant moins de 6 mois (Phoon et al., 1983). Dans cette même étude, dans un autre groupe de 18 travailleurs des cas d'ictères ont été associés à des expositions de 14 à ppm (69 – 159 mg.m-3) pendant moins de 4 mois.
Une étude épidémiologique chez 61 travailleurs chinois exposés pendant 1 à 15 ans (en moyenne 7,8 ans) a pu mettre en évidence une relation dose-effet. Les concentrations étaient de 0,87 à 28,9 ppm (soit 4,3 à 143 mg.m-3). Les individus ont présenté des vertiges, de la fatigue, une somnolence, des insomnies, une hypomnésie, une anorexie et des palpitations. Les dépressions, les états anxieux et les fatigues chroniques sont également augmentés. Toutefois, les employés semblent avoir été exposés conjointement à d’autres substances (Li et al., 1993).
Voie orale
Peu de données sont disponibles concernant les effets systémiques chez l'homme liés à une ingestion chronique de chloroforme. En se basant sur la toxicité aiguë de ce composé, il est vraisemblable que des effets gastro-intestinaux, hépatiques et rénaux se produisent. Aucune toxicité hépatique et rénale n'a été relevée chez des personnes ayant utilisé un dentifrice leur faisant ingérer une dose évaluée à 0,96 mg.kg.j-1 de chloroforme durant moins de 5 ans (De Salva et al., 1975).
Synthèse
Chez l’homme, l'exposition chronique aux vapeurs de chloroforme induit des effets sur le système nerveux central et sur le foie : lassitude, manque de concentration, dépression et irritabilité, soif, douleurs gastro-intestinales, hépatite et ictère, mictions fréquentes et douloureuses. Peu de données sont disponibles suite à une ingestion chronique de chloroforme ; toutefois en se basant sur la toxicité aiguë de ce composé, il est vraisemblable que des effets gastro-intestinaux, hépatiques et rénaux puissent se produire.
Chez l'animal
Toutes voies
Quelle que soit la voie d'administration (par inhalation ou ingestion), les organes cibles majeurs du chloroforme sont le foie et les reins, ainsi que le système nerveux central.
Inhalation
Par inhalation, des lésions hépatiques (vacuolisation, nécrose cellulaire) et rénales ont été observées chez la souris et le rat, pour des expositions de durée courte ou subchronique.
L'importance des lésions hépatiques observées après inhalation n'est pas seulement influencée par la dose, mais également par le profil d'exposition. Pour une exposition totale similaire sur 4 semaines, des rats exposés en continu à 50 ppm (248 mg.m-3) de chloroforme ont présenté des lésions hépatiques plus importantes que les animaux exposés de façon répétée (6 h par jour, 5 jours par semaine) à 285 ppm, soit 1414 mg.m-3 (Plummer et al., 1990).
Exposition 13 semaines
Des souris et des rats ont été exposés à des concentrations de 12 à 400 ppm (60 à 1 984 mg.m-3) pendant 13 semaines (Kasai et al, 2002). Une augmentation significative des lésions nasales avec une dégénérescence de l’épithélium olfactif a été montrée chez les souris mâles exposées à 25 ppm (124 mg.m-3), un amincissement de la cloison nasale et une éosinophilie des cellules de l’épithélium olfactif et respiratoire chez les souris femelles exposées à 12 ppm (60 mg.m-3) ainsi qu’une minéralisation et une atrophie de l’épithélium olfactif chez les rats mâles exposés à 25 ppm (124 mg.m-3). Une augmentation statistiquement significative de l’incidence des effets hépatiques (augmentation de la taille des hépatocytes, nécrose des hépatocytes et dépôt de céroïdes) au niveau de la région centrolobulaire est observée dès 100 ppm (500 mg.m-3) pour les rats femelles et souris et 200 ppm (1 000 mg.m-3) pour les rats et souris mâles. Les effets rénaux sont essentiellement observés chez les souris mâles dès 12 ppm (60 mg.m-3) et correspondent à une nécrose tubulaire et une dégénérescence. Il a été vérifié que les effets rénaux chez le rat mâle n’étaient pas liés à la production d’α2-µglobuline.
Une étude a évalué l’indice de prolifération des cellules rénales et hépatiques suite à une exposition au chloroforme jusqu’à 30 ppm (150 mg.m-3) 6 h.j-1 et 5 j.sem-1, pendant 13 semaines, chez des souris mâles et femelles (Templin et al., 1998c). Les mâles exposés à 30 et 90 ppm (150 et 450 mg.m-3) présentent une augmentation dose-dépendante de la régénération des tubules du cortex rénal avec une augmentation jusqu’à 31 fois de l’index de prolifération. Aucune lésion rénale ou prolifération cellulaire n’est retrouvée chez les femelles. Une augmentation de la dégénérescence et de la vacuolisation des hépatocytes des régions moyenne et centrolobulaire, associée à une augmentation de l’indice de prolifération des hépatocytes jusqu’à 7 fois la valeur du lot témoin, est observée chez les femelles exposées à 90 ppm (450 mg.m-3) pendant 13 semaines.
Exposition 6 mois
Une étude a évalué les effets d’une exposition aux vapeurs de chloroforme à 25 – 50 – 80 ppm (124 – 250 – 400 mg.m-3) 7 h.j-1 5 j.sem-1 pendant 6 mois chez des lapins, des rats et des cobayes (Torkelson et al., 1976). Des chiens ont été exposés selon le même protocole mais uniquement à la concentration de 25 ppm. Enfin, un lot de rats mâles a été exposé 1 – 2 – 4 h.j-1 à 25 ppm (124 mg.m-3). Chez les différentes espèces, une pneumonie interstitielle a été observée chez les rats mâles et les lapins mâles exposés à 85 ppm (422 mg.m-3), et chez les lapins femelles exposées à 25 ppm (124 mg.m-3). Aucune modification respiratoire n’a été observée chez les cobayes et les chiens exposés respectivement à 85 et 25 ppm de chloroforme. A toutes les doses pour l’exposition 7 h.j-1, des altérations macroscopiques et histologiques des reins ont été observées chez les rats mâles et femelles, l’examen histologique du foie a montré une dégénérescence centrolobulaire marquée chez les rats des deux sexes. Les effets ne sont pas retrouvés pour les expositions de 1, 2 ou 4 h.j-1. Ces effets sont observés chez les lapins mais pas chez les cobayes aux doses de 50 et 85 ppm (422 mg.m-3). Chez les chiens, seuls les effets rénaux sont retrouvés.
Exposition vie entière
Des rats et des souris ont été exposés à 0 – 10 – 30 – 90 ppm ( 0 – 50 – 150 – 450 mg.m-3) de chloroforme pour les rats et 0 – 5 – 30 – 90 ppm (0 – 25 – 150 – 450 mg.m-3) pour les souris à raison de 6 h.j-1, 5 j.sem-1 pendant 104 semaines (Yamamoto et al., 2002). En dehors des effets cancérogènes qui sont décrits plus loin, au niveau hépatique il a été observé des altérations cellulaires localisées ainsi que des modifications lipidiques avec une incidence statistiquement significative chez les souris mâles et femelles. Au niveau rénal, une augmentation de l’incidence des basophilies cytoplasmiques, des caryocytomégalies et une hyperplasie atypique des tubules proximaux dès 30 ppm (150 mg.m-3) a été observée chez les souris mâles ainsi qu’une augmentation de l’incidence des caryocytomégalies des tubules proximaux, une dilatation de la lumière tubulaire chez les rats mâles et femelles dès 30 ppm (150 mg.m-3).
A partir d’un protocole similaire, des rats mâles ont été exposés à 0 – 25 – 50 – 100 ppm (0 – 124 – 250 – 500 mg.m-3) de vapeurs de chloroforme 6 h.j-1, 5 j.sem-1 pendant 104 semaines (Nagano et al., 2006). Chacun des lots exposés a également été exposé via l’eau de boisson de 0 à 1 000 ppm de chloroforme sur la même période de 104 semaines. En dehors des effets tumoraux détaillés dans la partie cancérogénèse, une augmentation significative de l’incidence des basophilies cytoplasmiques et une dilatation de la lumière du tubule proximal ont été observées dans tous les groupes traités par comparaison au groupe témoin. De plus, les incidences ont été nettement augmentées dans le cas de l’exposition combinée (inhalation et eau de boisson) par rapport à l’exposition uniquement par inhalation (pas de dilatation du tubule distal dans le cas d’une exposition uniquement par voie orale).
Voie orale
Exposition 3 à 4 semaines
L'étude de Larson et al. (1994b) des souris femelles ont reçu des doses de 0 – 3 – 10 – 34 – 90 – 238 – 477 mg.kg-1.j-1 de chloroforme dissous dans de l’huile de maïs administrées par gavage 5 j/7, pendant 3 semaines. Dans la même étude, les souris ont été exposées en continu via l’eau de boisson aux doses de 0 – 60 – 200 – 400 – 900 -1 800 ppm pendant 3 semaines. Cette étude a montré que le chloroforme dans l'huile, administré 3 semaines par gavage présentait une toxicité plus importante qu’administré ad libitum via l'eau de boisson.
Dans une étude, des souris ont été exposées à du chloroforme par gavage (150, 225 et 300 mg.kg.j-1) dans un solvant aqueux pendant 30 jours. Les lésions rénales sont évidentes après un jour d’exposition aux trois doses et durant 7 jours, mais sont suivies d’une rémission totale (par régénération tissulaire). Les lésions hépatiques modérées sont observées du 1er au 14ème jour, puis diminuent les jours suivants. Il a été montré une régénération tissulaire hépatique et rénale à partir du 7ème jour mettant en jeu un mécanisme de tolérance adaptative. Les auteurs précisent que la toxicodynamique et la toxicocinétique contribuent largement à la tolérance observée chez l’animal pour des expositions sub-chroniques au chloroforme. Par contre, ni la bioactivation, ni la détoxification ne semblent jouer un rôle dans la mise en place de cette tolérance (Anand et al., 2006).
Par ingestion, les effets du chloroforme varient selon le solvant utilisé. Administré par gavage en mélange dans l'huile, le chloroforme présente une hépatotoxicité plus marquée que sous forme d'émulsion aqueuse (Bull et al., 1986). Dans l'huile, la dose de 60 mg.kg-1.j-1 durant 90 jours induit des effets alors qu'en émulsion aqueuse, aucune toxicité hépatique n'a été notée pour des concentrations allant jusqu'à 270 mg.kg.j-1.
Etudes chroniques
Une étude de cancérogenèse via l’eau de boisson a étudié les effets de l’exposition à 0 – 200 – 400 – 900 – 1 800 mg.L-1 chez les rat mâles et les souris femelles ce qui correspond à des doses administrées de respectivement de 0 – 19 – 38 – 81 – 160 mg.kg-1.j-1 pour les rats et 0 – 34 – 65 – 130 – 263 mg.kg-1.j-1 pour les souris (Jorgenson et al., 1982). Concernant les effets non néoplasiques, une augmentation statistiquement significative des graisses dans le foie est observée après 6 mois d’exposition chez les rats exposés à 160 mg.kg-1.j-1 et chez les souris à 3 mois aux doses dès 38 mg.kg-1.j-1 et 81 mg.kg-1.j-1 à 6 mois d’exposition.
Des chiens ont été exposés au chloroforme via des capsules de dentifrice à des doses de 0, 15 ou 30 mg.kg-1.j-1, 6 j/7 durant 7,5 ans (Heywood et al., 1979). Des observations ont été réalisées après 6, 13 semaines, 6, 9, et 12 mois d’exposition. Des effets hépatiques (effets enzymatiques avec une augmentation de l’ASAT, puis de l’ALAT) ont été observés à partir de 15 mg.kg-1.j-1, de même que la présence de kystes graisseux (6/7 mâles exposés à 15 et 30 mg.kg-1.j-1 et 3/8 et 7/8 chez les femelles exposées respectivement à 15 et 30 mg.kg-1.j-1 versus 1/15 chez les mâles et 0/12 chez les femelles des groupes témoins)
L'ingestion de chloroforme peut induire également des effets gastro-intestinaux de type irritation ou érosion des muqueuses et vomissements (Thompson et al., 1974 ; Heywood et al., 1979).
Pour des durées comprises entre 78 et 104 semaines, les NOAEL pour les effets rénaux sont compris, chez le rat et la souris, entre 160 et 477 mg.kg.j-1 (NCI, 1976 ; Jorgenson et al., 1985). Les effets hépatiques s'observent pour des doses plus faibles. Un NOAEL a été estimé à 100 mg.kg.j-1 chez le rat pour une durée de 78 semaines (NCI, 1976).
Synthèse
Chez l’animal, les organes cibles majeurs du chloroforme sont le foie (vacuolisation, nécrose cellulaire) et les reins quelle que soit la voie d'administration. L’inhalation de chloroforme peut aussi être à l’origine de lésions au niveau des cavités nasales, essentiellement chez le rat et l’ingestion peut également induire des effets gastro-intestinaux de type irritation ou érosion des muqueuses et vomissements.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : substance préoccupante pour l'homme en raison d'effets cancérogènes possibles | 2013 |
| IARC | Groupe 2B : le chloroforme pourrait être cancérogène pour l’homme | 1987 |
| US EPA | Classe B2 : cancérogène probable pour l’homme | 2001 |
Chez l'homme
Inhalation
Il n'existe pas d'études concernant les effets cancérogènes du chloroforme par inhalation chez l'homme (ATSDR, 1998).
Voie orale
Par voie orale, les études épidémiologiques suggèrent une association entre la consommation d'eau de boisson chlorée et des cancers, surtout de la vessie et du tube digestif (colon, rectum) chez l'homme. Cette relation ne peut être corrélée directement à l'exposition au chloroforme car d'autres cancérogènes potentiels sont identifiés dans l'eau de boisson. Il s'agit notamment d'halométhanes bromés, d'autres halométhanes chlorés et de composés organo-volatils. Il n'est cependant pas possible d'exclure le chloroforme car ce dernier est l'espèce majoritaire dans l'eau de boisson chlorée (ATSDR, 1998).
Une étude épidémiologique a permis de suivre les données de cancérologie pour une cohorte de 14 553 hommes et 16 227 femmes résidents depuis au moins 25 ans dans l’Etat de Washington. L’incidence des cancers et le taux de mortalité ont été analysés selon deux sous-cohortes : l’une exposée à de l’eau chlorée (concentration en chloroforme moyenne de 107 µg.L-1) et l’autre non soumise à de l’eau chlorée. Aucune augmentation significative de la prévalence ou du déficit de cancers n’a été observé au niveau du foie, des reins et de la vessie. Seul un excès de risque lié à la mortalité due aux cancers du sein et une significativité limite pour les cancers du foie ont pu être mis en évidence (Wilkins et Comstock, 1981). Une association modérée entre le cancer du sein et le chloroforme a plus récemment été rapportée dans le cadre de l’étude d’une cohorte de femmes espagnoles exposées aux trihalométhanes dans l’eau de boisson (Font Ribera et al., 2017). Une autre étude épidémiologique a été menée chez des femmes de l’Iowa. Les 41 836 femmes âgées de 55 à 69 ans ont été suivies pour déterminer l’incidence des cancers, de 1986 à 1993. L’origine des eaux de boissons est un critère de sélection de la cohorte, ainsi qu’un indicateur de catégorisation au sein de la cohorte : les catégories sont fondées sur les concentrations de chloroforme : 1-2, 3-13 et 14-287 µg.L-1. Dans une étude prospective réalisée sur une des femmes ménopausées de l’Iowa exposé au chloroforme dans l’eau de boisson, des augmentations de l’incidence des cancers du colon, du poumon, de mélanomes et d’autres cancers ont été rapportées (Doyle et al., 1997).
D’autres études de cas décrivent des expositions au chloroforme (pour la plupart, à partir de l’eau de boisson traitée au chloroforme), ainsi que le lien éventuel avec l’apparition de cancer.
Des études cas-témoins sont également disponibles et permettent parfois de mettre en évidence une augmentation de l’incidence de certains cancers multisites, sans pour autant exclure d’autres causes que l’exposition au chloroforme. Le tableau suivant rapporte les principales différentes études cas témoins disponibles.
Synthèse des études cas-témoins en lien avec l’apparition de cancers et l’exposition au chloroforme (selon IARC, 1999)
|
Références |
Population |
Sexe |
Type d’exposition |
Niveaux d’exposition et durées d’exposition |
Résultats |
|---|---|---|---|---|---|
|
Brenniman et al., 1980 |
Analyse de 3208 décès dus à des cancers gastro-intestinaux et urinaires – 43666 contrôles (entre 1973 et 1976) Basé sur l’inventaire des installations d’eau municipales de 1963 |
H / F |
Eaux chlorées et non chlorées |
ND |
Faible excès d’apparition de cancers colo-rectaux et du tractus digestif chez les populations exposées, significatif chez les femmes (p<0,05) |
|
Alavanja, 1980 |
3446 cas de cancers gastro-intestinaux ; 3444 contrôles |
H / F |
Eaux chlorées et non chlorées |
ND 15 ans |
Les odd-ratios en majorité significatifs et élevés sont observés pour les cancers digestifs (p<0,025) (y compris foie uniquement chez les hommes p<0,005) et urinaires (chez les hommes uniquement, p<0,005). Chez les femmes le cancer de la vessie est moins fréquent chez la population exposée. |
|
Gottlieb et al., 1981 ; Gottlieb et Carr, 1982 ; Gottlieb et al., 1982 |
Analyse de 11349 décès dus à un cancer et 22698 décès non liés à un cancer. 1960-1975 |
H / F |
Eaux chlorées et non chlorées. L’eau utilisée à la date du décès est utilisée comme indicateur d’exposition |
ND |
Une incidence accrue des cancers rectal (OR 1,8 [1,3 – 2,6], pulmonaire (OR 1,4 [1,0 – 1,8] et mammaire (OR 1,5 [1,2 – 2,0] est observée pour des concentrations en chlore supérieures ou inférieures à 1,09 ppm comparé aux eaux non chlorées. |
|
Kanarek et Young, 1982 |
Décès dus à des cancers et autres causes |
F |
Eaux chlorées et non chlorées |
ND |
Des odd-ratios élevés et significatifs pour les cancers du colon (OR de 1,5, p<0,02) et du cerveau (OR de 4,7, p<0,03) sont observés |
|
Lawrence et al., 1984 |
395 décès dus à des cancers colo-rectaux, 395 cas témoins |
F |
Eaux chlorées et non chlorées |
ND |
Odd ratio = 1,1 IC 90% [0,8-1,4] |
Voie cutanée
Il n’existe pas d’étude concernant les effets cancérogènes du chloroforme après exposition cutanée (ATSDR, 1998).
Synthèse
Chez l'homme, il n'existe pas d'étude concernant les effets cancérogènes du chloroforme par inhalation et par voie cutanée. Par voie orale, les études épidémiologiques suggèrent une association entre la consommation d'eau de boisson chlorée et la survenue de cancers, surtout de la vessie et du tube digestif (colon, rectum), ces effets ne peuvent pas être imputés au chloroforme seul.
Chez l'animal
Inhalation
Des rats et des souris ont été exposés à 0 – 10 – 30 – 90 ppm (0 – 50 – 150 – 450 mg.m-3) de chloroforme pour les rats et 0 – 5 – 30 – 90 ppm (0 – 25 – 150 – 450 mg.m-3) pour les souris à raison de 6 h.j-1, 5 j.sem-1 pendant 104 semaines (Yamamoto et al., 2002). Les effets non cancérogènes ont été rapportés précédemment. Concernant les effets cancérogènes, une augmentation statistiquement significative de l’incidence combinée des adénomes et carcinomes des cellules rénales et des adénomes et carcinomes hépatocellulaires chez les souris mâles et femelles est rapportée. Chez les rats, aucune augmentation statistiquement significative de l’incidence des tumeurs hépatiques ou rénales n’est retrouvée chez les deux sexes.
Des rats mâles ont été exposés à 0 – 25 – 50 – 100 ppm (0 – 124 – 250 – 500 mg.m-3) de vapeurs de chloroforme 6 h.j-1, 5 j.sem-1 pendant 104 semaines (Nagano et al., 2006). Chacun des lots exposés a également été exposé via l’eau de boisson à 0 – 1 000 ppm de chloroforme sur la même période de 104 semaines. Une augmentation des adénomes et carcinomes des cellules rénales et des hyperplasies atypiques des tubules rénaux ont été induites chez les animaux exposés par les deux voies d’exposition mais pas chez ceux exposés uniquement par une voie. Les tumeurs rénales induites par l’exposition combinée sont plus grandes en taille et leur incidence est augmentée par rapport à celles induites uniquement par une exposition par voie orale que ce soit par gavage ou via l’eau de boisson, ce qui suggère un mécanisme d’additivité des effets.
Voie orale
Le chloroforme administré par gavage dans l'huile de maïs induit des tumeurs bénignes et malignes au niveau du foie et des reins chez les rongeurs. Des adénomes et carcinomes rénaux ont été observés chez des rats après une exposition de 78 semaines à 90 mg.kg-1.j-1 (Dunnick et Melnick, 1993 ; NCI, 1976) et chez des souris femelles à la dose de 200 mg.kg-1.j-1 (Dunnick et Melnick, 1993). Des néoplasmes hépatocellulaires ont par ailleurs été observés chez les souris mâles dès 138 mg.kg-1 et femelles dès 238 mg.kg-1 (Dunnick et Melnick, 1993 ; NCI, 1976). Une augmentation de l'incidence des tumeurs rénales a été observée chez des souris de souche ICI chroniquement exposées à 60 mg.kg-1.j-1 mais pas à la dose de 17 mg.kg-1.j-1. Aucun effet n'a été noté chez les souris de souche C57BL, CBA et CF-1 (Roe et al., 1979). Il a été démontré une action cancérogène du chloroforme chez des souris exposées par gavage (130 et
260 mg.kg-1). Par contre, il n’a pas été observé d’effet cancérogène après une exposition par l’eau de boisson (1800 mg.L-1). Les effets observés sont une augmentation de la prolifération cellulaire hépatique et une diminution de la méthylation du gène c-myc (Coffin et al., 2000).
Aucun cancer n'a été observé chez des rats exposés par gavage à 60 et 165 mg.kg-1.j-1 de chloroforme dans une pâte dentifrice durant respectivement 80 et 52 semaines (Palmer et al., 1979), ni chez des chiens exposés à 30 mg.kg-1.j-1 de chloroforme dans des capsules de dentifrice durant 7,5 ans (Heywood et al., 1979).
Une augmentation de l'incidence des cancers a été notée chez des animaux exposés au chloroforme via l'eau de boisson : cancer du foie chez des rats femelles exposés chroniquement à 200 mg.kg-1.j-1 (Tumasonis et al., 1987), adénocarcinomes rénaux chez des rats exposés à 160 mg.kg-1.j-1 mais pas à 81 mg.kg-1.j-1 (Jorgenson et al., 1985). En revanche, aucune augmentation de l'incidence des tumeurs n'a été observée chez des souris exposées à 263 mg.kg-1.j-1 dans l'eau de boisson durant 2 ans (Jorgenson et al., 1985).
Les études d'initiation/promotion mettent en évidence une action promotrice mais non initiatrice du chloroforme, ce qui laisse penser que ce composé n'est pas mutagène et que son activité cancérogène découle d'un mécanisme cytotoxique non génotoxique. Un certain nombre d'études mettent même en évidence une inhibition par le chloroforme de la croissance des cellules tumorales induites par divers toxiques initiateurs (OMS IPCS, 1994). La cytotoxicité est principalement liée à l’oxydation du chloroforme en métabolites réactifs, tels que le phosgène et l’acide chlorhydrique (OMS, 2005). Il est également précisé (OMS, 2005) que le potentiel cancérogène du chloroforme dépend de la dose atteinte dans les organes cibles, et que les mécanismes de détoxification doivent être saturés avant que les effets cancérogènes n’apparaissent.
Synthèse
Chez l’animal, l’inhalation de chloroforme entraîne l’apparition d’adénomes et de carcinomes hépatiques et rénaux chez la souris, mais pas chez le rat. Des adénomes et des carcinomes rénaux, ainsi que des néoplasmes hépatiques ont été observés chez le rat et la souris lors d’expositions par voie orale.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le chloroforme a été examiné par l’Union Européenne mais n’a pas été classé | 2013 |
Chez l'animal
Toutes voies
Effets génotoxiques
Si les résultats des études in vitro se révèlent généralement négatifs, ceux des études in vivo manquent de cohérence. Ainsi, l’Union Européenne a identifié quatre études menées in vivo, pour l’évaluation des aberrations chromosomiques et des micronoyaux, comme les plus pertinentes mais le manque de données relatives à la cytotoxicité ne permet pas de conclure (Fujie et al., 1990, Hoechst et al., 1988, Shelby et Witt, 1995 ; Whitwell, 2009).
Le mécanisme de cancérogenèse correspondrait à un mécanisme en 4 étapes : la métabolisation du chloroforme en un intermédiaire réactif le phosgène, une cytotoxicité du phosgène suite à la formation de liaisons covalentes avec les molécules porteuses de groupements nucléophiles notamment au niveau hépatique et rénal, une prolifération cellulaire régénérative puis la formation de tumeurs dans le foie et les reins (Anses, 2009).
Ainsi les nombreux résultats expérimentaux montrent que le mécanisme cancérogène du chloroforme chez l’animal (rat et souris) n’est probablement pas génotoxique, et fait intervenir des mécanismes secondaires de cytotoxicité et de prolifération cellulaire (OMS, 2005 ; Constan et al., 2002).
Compte tenu de l’ensemble de ces données, il parait pertinent de retenir l’hypothèse d’un mécanisme de cancérogène non génotoxique ou à seuil.
Synthèse
Les données disponibles indiquent que le chloroforme n’interagit pas directement avec l'ADN ou possède une activité génotoxique. Il est considéré comme un cancérogène non génotoxique ou à seuil d’effet.
In vitro
Organismes procaryotes
Effets mutagènes
La majorité des données de génotoxicité du chloroforme se révèlent négatives (Golden et al., 1997): chez les bactéries comme Salmonella typhimurium et Escherichia coli, le chloroforme ne semble pas mutagène (Gocke et al., 1981 ; Kirkland et al., 1981 ; Simmon V. F. et al., 1977 ; Uehleke et al., 1977 ; Van Abbe et al., 1982).
Organismes eucaryotes
Effets mutagènes
Les résultats sont négatifs pour les cellules eucaryotes, en particulier de mammifères (quelques résultats sont toutefois positifs). Chez Saccharomyces cerevisiae, le chloroforme est mutagène seulement à des concentrations très toxiques, telles que 4 900 et 6 400 ppm (Callen et al., 1980). Pour de concentrations plus faibles, les résultats de mutagénicité sont négatifs (Jagannath D.R. et al., 1981 ; Kassinova G. V. et al., 1981 ; Mehta R. D. et von Borstel R.V., 1981).
Effets génotoxiques
Trois études de micro-noyaux sur quatre révèlent des résultats négatifs pour des cellules de moelle osseuse de souris (Gocke et al., 1981 ; Salamone et al., 1981 ; Tsuchimoto T. et Matter B. E., 1981) et faiblement positifs pour la quatrième étude (San Agustin J.S. et Lim-Sylianco C.Y., 1978). Les tests de dommages à l’ADN, incluant les échanges de chromatides sœurs, sont également pour la plupart négatifs (Kirkland et al., 1981 ; Mirsalis et al., 1982 ; Reitz et al., 1982 ; White et al., 1979).
Synthèse
Compte tenu de l’ensemble de ces données, il parait pertinent de retenir l’hypothèse d’un mécanisme de cancérogène non génotoxique ou à seuil.
Les données disponibles indiquent que le chloroforme n’interagit pas directement avec l'ADN ou possède une activité génotoxique. Il est considéré comme un cancérogène non génotoxique ou à seuil d’effet.
Effets sur la reproduction
Chez l'homme
Toutes voies
Les études sur les liens entre exposition au chloroforme et troubles de la reproduction chez l'homme sont difficiles à interpréter. En effet, les études se rapportent à un type d'activité professionnelle ou à une consommation d'eau contenant des trihalométhanes, et non à une dose d'exposition mesurée.
Synthèse
Aucun effet sur la reproduction n’a pu être démontré pour une exposition seule au chloroforme chez l’Homme.
Chez l'animal
Inhalation
Une augmentation du pourcentage de spermatozoïdes atypiques au niveau de l'épididyme a été observée chez des souris exposées à partir de 400 ppm de chloroforme durant 5 jours (1,88 % versus 1,42 % groupe témoin , p<0,05 ; 2,76 % à 800 ppm, p<0,01) (Land et al., 1981). Néanmoins, la fertilité de ces animaux n’a pas été investiguée.
Voie orale
Une diminution du poids de l’épididyme a été mesurée pour une exposition par gavage pendant 31 semaines chez la souris (Chapin et al., 1997). Une atrophie des gonades a été observée chez des rats mâles et femelles exposés par gavage à 410 mg.kg-1.j-1 de chloroforme dans une pâte dentifrice durant 13 semaines. Le NOAEL pour cet effet est de 150 mg.kg-1.j-1 (Palmer et al., 1979).
L'exposition de souris à 41 mg.kg-1.j-1 n'a pas altéré la fertilité sur deux générations (Gulati et al., 1988). Aucune altération histologique n'a été notée au niveau des organes reproducteurs de rats et souris exposés durant 78 semaines à 200 mg.kg-1.j-1 (NCI, 1976) ou de chiens ayant ingéré durant 7,5 ans jusqu'à 30 mg.kg-1.j-1 de chloroforme dans des capsules de dentifrice (Heywood et al., 1979).
Plusieurs études par voie orale ont mis en évidence des pertes pré-implantatoires (parfois totales) à de fortes doses de chloroforme (> 200 mg.kg-1.j-1) vraisemblablement en lien avec la toxicité maternelle plutôt qu’à un effet direct sur le conceptus (Wiliams et al., 2018).
Synthèse
Chez l’animal, une exposition par inhalation induit une augmentation du nombre de spermatozoïdes atypiques au niveau de l’épididyme.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le chloroforme est classé en catégorie 2 | 2013 |
Chez l'homme
Toutes voies
Le chloroforme passe la barrière placentaire (Dowty, 1976)
Il n'a pas été noté d'association entre l'exposition maternelle au chloroforme au premier trimestre de grossesse et les avortements spontanés dans une étude contrôlée portant sur 206 femmes travaillant en laboratoire (Taskinen et al., 1994).
Plusieurs études bien documentées ont permis de mettre en évidence des associations significatives dose-réponse entre l’exposition au chloroforme dans l’eau de boisson des mères et le poids de naissance des nouveau-nés (Toledano et al., 2005 ; Lewis et al., 2006, Iszatt et al., 2014, Grazuleviciene et al., 2011).
La fréquence des anomalies congénitales de 492 enfants de personnels de laboratoire exposés aux solvants organiques durant le premier trimestre de la grossesse n'était pas plus élevée que le taux attendu. L’exposition au chloroforme a été rapportée par 128 des 782 femmes de l’étude (Axelsson et al., 1984). Une autre étude n'a pas mis en évidence d'association entre la consommation d'eau de boisson chlorée et la survenue d'anomalies congénitales chez 1 039 enfants (Aschengrau et al., 1993).
Synthèse
Le passage de la barrière placentaire a été mis en évidence chez l’homme mais aucun effet sur le développement n’a pu être démontré, en dehors d’un effet possible sur le poids de naissance qui demande à être confirmé.
Chez l'animal
Inhalation
Des rates exposées à des concentrations de 0 – 30 – 100 – 300 ppm (0 – 150 – 500 – 1 500 mg.m-3) de chloroforme par inhalation 7 h/j du 6ème au 15ème jour de la gestation ont présenté une augmentation significative du nombre de pertes post-implantatoires après exposition à 300 ppm (1 500 mg.m-3), ainsi qu’une diminution du nombre de fœtus vivants à 300 ppm et1 500 mg.m-3 (Schwetz et al., 1974). Une diminution statistiquement significative du gain de poids corporel et de la consommation de nourriture des mères est rapportée dès 30 ppm (150 mg.m-3) en l’absence d’effets hépatiques. L’examen des petits a mis en évidence une diminution du poids des fœtus chez les animaux du groupe exposé à la plus forte dose, ainsi que des anomalies et/ou malformations osseuses (retard d'ossification du crâne, déformation de la cage thoracique) dès 30 ppm ou 150 mg.m-3, ou encore une augmentation significative de l'incidence des défections des côtes, de raccourcissement ou d’absence de la queue, d’imperforation de l'anus, d’œdème sous cutané à 100 ppm (500 mg.m-3 (Schwetz et al., 1974).
Dans une autre étude, des souris exposées à 100 ppm (500 mg.m-3) de chloroforme entre le 1er et le 7ème jour de la gestation ont présenté des difficultés au niveau de la gestation, caractérisées par un nombre accru de résorptions fœtales et par un taux de fécondité plus faible (Murray et al., 1979).
Un taux plus important de résorptions fœtales a été observé dès 30 ppm (150 mg.m-3) chez des rates exposées entre les 6 et 15èmes jours de gestation, de même qu’un retard de croissance à 30 ppm (Baeder et Hofmann, 1988)
Chez la descendance de souris, exposées à 100 ppm entre le 8ème et le 15ème jour de gestation, des malformations osseuses et une augmentation de la fréquence des fentes palatines ont également été observées. En revanche, aucun effet tératogène important ou d'anomalies de l'ossification n'ont été observés chez des rats femelles exposées jusqu'à 4 117 ppm de chloroforme durant 1 h/j entre le 7ème et le 14ème jour de gestation (Newell et Dilley, 1978).
Voie orale
Aucun effet tératogène n’a été rapporté par voie orale chez le rat ou le lapin (Ruddick et al., 1983 ; Thompson et al., 1974). Une fœtotoxicité a cependant été observée chez la descendance de rats exposés par gavage à 400 mg.kg-1.j-1 durant la gestation (NOAEL : 200 mg.kg-1.j-1, Ruddick et al., 1983).
Le chloroforme a induit des résorptions accrues chez le rat à 316 mg.kg-1.j-1 et chez le lapin à 100 mg.kg-1.j-1 (Thompson et al., 1974). Des avortements ont été observés chez des lapines exposées à 63 mg.kg-1.j-1 durant la gestation (Thompson et al., 1974).
Synthèse
Chez l’animal, les expositions par inhalation ou par voie orale entraînent une augmentation des pertes post-implantatoires, de même qu’un taux important de résorptions fœtales. Des retards de croissance et des anomalies/malformations du squelette (absence de queue, un nombre accru de défections de côtes) ont été rapportés uniquement pour des expositions par inhalation.
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter se reporter directement sur les sites internet des organismes qui les élaborent.
Le chloroforme est un cancérogène dont le mécanisme d’action est non génotoxique, aucune valeur pour des effets sans seuil n’est retenue.
VTR Existantes
Effets à seuil - Exposition aiguë par inhalation:
L'ATSDR propose un MRL de 488 µg.m-3 (0,1 ppm) pour une exposition aiguë au chloroforme par inhalation (1998).
Cette valeur a été établie en prenant en compte les effets hépatiques (modifications des hépatocytes centrolobulaires) observés chez des souris femelles exposées à 0 – 1 -3 – 10 – 30 – 100 - 300 ppm (0 – 4,96 – 15 – 50 – 150 – 500 – 1 500 mg.m-3) de chloroforme, 6 h/j pendant 7 jours consécutifs (Larson et al., 1994a). A partir de 10 ppm (50 mg.m-3), des effets hépatiques puis rénaux et respiratoires sont observés. Une NOAEC de 3 ppm (15 mg.m-3) a donc été déterminée par les auteurs.
Facteurs d'incertitude : un facteur global de 30 est utilisé : un facteur 3 pour l’extrapolation de l’animal (souris) à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 3 ppm x 1/30 » 0,1 ppm soit 0,488 mg.m-3 ou 488 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice.
Effets à seuil - Exposition sub-chronique par inhalation:
L'ATSDR propose un MRL de 244 µg.m-3 (0,05 ppm) pour une exposition sub-chronique au chloroforme par inhalation (1998).
Cette valeur a été établie en prenant en compte les effets hépatiques (hépatite et ictère) observés chez des femmes exposées au chloroforme, dans deux entreprises différentes, à des concentrations allant jusqu'à 400 ppm (1 984 mg.m-3) durant moins de 6 mois (Phoon et al., 1983). Dès 14 ppm (70 mg.m-3), des vomissements et des hépatites toxiques ont été observés. De cette étude, une LOAEC a été déterminée pour les effets hépatiques.
Facteurs d'incertitude : un facteur global de 300 est utilisé : un facteur 10 est appliqué car la valeur utilisée est une LOAEC et un facteur 10 pour la variabilité au sein de la population. Un facteur supplémentaire de 3 a été appliqué car l'évaluation de la gravité des effets observés a été insuffisante.
Calcul : 14 ppm x 1/300 » 0,05 ppm soit 0,244 mg.m-3 ou 244 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice
Effets à seuil - Exposition chronique par inhalation:
L’ANSES (a intégré l’AFSSET) propose une valeur de 63 µg.m-3 pour une exposition chronique par inhalation au chloroforme (AFSSET, 2009, Anses, 2017)
Cette valeur est établie à partir de l’étude expérimentale subchronique de Templin et al., 1996 menée sur des souris exposées 6 h/j, 5 j/sem. pendant 13 semaines. Les effets, la prolifération cellulaire au niveau rénal chez les mâles, apparaissent à la concentration de 147 mg.m-3 (30 ppm) (LOAEC).Cette étude a été retenue en raison de l’existence de deux études de cancérogénèse (2 ans) par inhalation réalisée avec la même souche de souris et dans les mêmes conditions expérimentales (5- 30 - 90 ppm (25 - 150 - 450 mg.m-3), et pour lesquelles une augmentation de l’incidence des tumeurs rénale avait été observée à partir de 30 ppm soit 150 mg.m-3 (Nagano et al., 1998 ; Yamamoto et al., 1994). L’AFSSET considère que dans ces conditions, l’effet critique et la concentration choisie (5 ppm) pour la construction de la VTR est donc protecteur du cancer et l’ajout d’un facteur d’incertitude « sub-chronique à chronique » n’est pas appliqué car des études long terme aux mêmes concentrations sont disponibles sur les mêmes souches animales. Dans ces conditions, une NOAEC de 5 ppm soit 25 mg.m-3 est retenue. Un ajustement au temps est pratiqué pour tenir compte de la durée d’exposition 6 h/24 h :
NOAECADJ = 25 mg.m-3 x 6/24 = 6,25 mg.m-3
Facteur d’incertitude : Un facteur d’incertitude de 100 est retenu correspondant à un facteur de 10 pour la variation intra-espèce et un facteur de 10 pour prendre en compte la variation inter-espèces.
Calcul : 6,25 mg.m-3 x 1/100 = 0,0625 mg.m-3 soit 63 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice
Effets à seuil - Exposition aiguë par voie orale:
L'ATSDR propose un MRL de 0,3 mg.kg-1.j-1 pour une exposition aiguë au chloroforme par voie orale (1998).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des souris femelles, exposées au chloroforme soit par gavage soit via l’eau de boisson à des doses de 0 – 16 – 26 – 53 - 81 - 105 mg.kg-1.j-1, pendant 4 jours (Larson et al., 1994b). Un NOAEL de 26 mg.kg-1.j-1 a été identifié à partir des effets hépatiques observés pour les doses supérieures (notamment une coloration anormale des hépatocytes).
Facteurs d'incertitude : un facteur global de 100 est appliqué : un facteur de 10 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 26 mg.kg-1.j-1 x 1/100 » 0,3 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice
Effets à seuil - Exposition sub-chronique par voie orale:
L'ATSDR propose un MRL de 0,1 mg.kg-1.j-1 pour une exposition sub-chronique au chloroforme par voie orale (1998).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des chiens, exposés au chloroforme via des capsules de dentifrice à des doses de 0, 15 ou 30 mg.kg-1.j-1 durant 6 semaines (6 j.sem-1) (Heywood et al., 1979). Aucun effet hépatique n'a été observé à la dose de 15 mg.kg-1.j-1. Un ajustement pour une durée d’exposition continue a été pratiqué : NOAELADJ = NOAEL x 6 j/7 j = 12,9 mg.kg-1.j-1.
Facteurs d'incertitude : un facteur 10 est appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population, conduisant à un facteur global de 100.
Calcul : 12,9 mg.kg-1.j-1 x 1/100 » 0,1 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice.
Effets à seuil - Exposition chronique par voie orale:
L'US EPA (IRIS) propose un RfD de 0,01 mg.kg-1.j-1 pour une exposition chronique par voie orale (2001).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des chiens, exposés au chloroforme via des capsules de dentifrice à des doses de 0, 15 ou 30 mg.kg-1.j-1, 6 jours par semaine durant 7,5 ans (Heywood et al., 1979). Des effets sur le foie ont été observés à la dose de 15 mg.kg-1.j-1. Une benchmark dose a été calculée avec une BMDL10 de 1,2 mg.kg-1.j-1 et un ajustement des durées d’expositions à une exposition continue est réalisé : 1,2 mg.kg-1.j-1 x 6 j/7 j = 1,0 mg.kg-1.j-1
Facteurs d'incertitude : un facteur 10 est appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population, aboutissant à un facteur global de 100.
Calcul : 1 mg.kg-1.j-1 x 1/100 » 0,01 mg.kg-1.j-1
Indice de confiance : Un indice de confiance a été établi par l’US EPA, il est moyen pour l’étude source, moyen pour la base de données et moyen pour la valeur proposée.
Effets à seuil - Exposition aiguë par inhalation:
L'OEHHA propose un REL de 150 µg.m-3 pour une exposition aiguë au chloroforme par inhalation (2008).
Cette valeur a été établie à partir d’une étude de toxicité pour le développement au cours de laquelle les rates ont été exposées par inhalation à 30 – 100 – 300 ppm (150 – 500 – 1 500 mg.m-3) de chloroforme, 7 h/j du 6ème au 15 jour de la gestation (Schwetz et al., 1974). L’effet critique retenu est une fœtotoxicité (diminution de la taille du fœtus et retard d’ossification) observée à 30 ppm en présence d’une toxicité maternelle. Une LOAEC de 30 ppm a donc été déterminée.
Facteurs d'incertitude : un facteur global de 1 000 est utilisé : un facteur de 10 pour l’utilisation d’une LOAEC, un facteur 10 pour l’extrapolation de l’animal à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 30 ppm x 1/1 000 = 0,03 ppm soit 0,15 mg.m-3 ou 150 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice.
Effets à seuil - Exposition chronique par inhalation:
L'ATSDR propose un MRL de 98 µg.m-3 (0,02 ppm) pour une exposition chronique au chloroforme par inhalation (1998).
Cette valeur a été établie en prenant en compte les symptômes observés (hépatomégalie) chez des travailleurs exposés au chloroforme à des concentrations allant de 2 à 205 ppm (10 à 1 020 mg.m-3) durant 1 à 4 ans (Bomski et al., 1967). Des effets sur le foie ont été observés dès 2 ppm (10 mg.m-3) dans 25 % des cas. De cette étude, une LOAEC de 2 ppm (10 mg.m-3) pour les effets hépatiques a été déterminée.
Facteurs d'incertitude : un facteur global de 100 est appliqué (10 pour l’utilisation d’une LOAEC et 10 pour la variabilité au sein de la population).
Calcul : 2 ppm x 1/100 = 0,02 ppm
Indice de confiance : Cet organisme ne propose pas d’indice
L’OMS propose une TC de 140 µg.m-3 pour une exposition chronique au chloroforme par inhalation (OMS, 2011).
Cette valeur est obtenue à partir d’une étude expérimentale chez le chien beagle ayant ingéré 15 mg.kg-1.j-1 de chloroforme introduit dans de la pâte dentifrice au sein de capsules de gélatine pendant 7,5 ans (Heywood et al., 1979). Les effets observés sont une hépatotoxicité caractérisée par la formation de kystes graisseux. A partir de cette étude, les niveaux d’exposition chez l’homme pouvant induire ces effets hépatiques ont été estimés pour les deux voies d’exposition au moyen d’une modélisation PBPK développée pour le chien. Le calcul de la TDI est réalisé à partir de la valeur guide sur la base de : 9,8 mg.m-3 de chloroforme dans l’air. La limite inférieure de l’intervalle de confiance de 3,4 mg.m-3 a été retenue.
Facteurs d'incertitude : un facteur global de 25 est appliqué composé d’un facteur de 10 pour la variabilité au sein de la population et d’un facteur de 2,5 pour tenir des différences toxicodynamiques inter-espèces.
Calcul : 3,4 mg.m-3 x 1/25 = 0,136 mg.m-3 arrondi à 0,14 mg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice
Le RIVM propose une TCA de 100 µg.m-3 pour une exposition chronique au chloroforme par inhalation (Baars et al., 2001).
Le RIVM a évalué l’étude de Bomski et al. (1967) et ne l’a pas jugée pertinente pour l’élaboration d’une VTR en raison de d’importantes fluctuations des niveaux d’exposition entre 10 et 1 000 mg.m-3.
Leur valeur est alors basée sur une NOAEC de 110 mg.m-3, qui a été établie lors d'une étude expérimentale chez le rat exposé durant 6 mois au chloroforme par inhalation (Torkelson et al., 1976), pour des effets hépatiques et rénaux observés.
Facteurs d'incertitude : Un facteur d’incertitude 100 a été appliqué mais le détail n’est pas précisé.
Calcul : 110 mg.m-3 x 1/100 = 0,1 mg.m-3 ou 100 µg.m-3
Indice de confiance : Un indice de confiance a été établi par le RIVM, il est élevé pour la valeur proposée.
L'OEHHA propose un REL de 300 µg.m-3 pour une exposition chronique au chloroforme par inhalation (2002).
Cette valeur est basée sur une étude expérimentale chez le rat exposé durant 6 mois (7 h.j-1, 5 jours par semaine) à 0, 25, 50 ou 85 ppm (0 – 124 – 250 – 422 mg.m-3) de chloroforme par inhalation (Torkelson et al., 1976). Une LOAEC de 25 ppm (124 mg.m-3) a été établie pour les effets hépatiques et rénaux. Une LOAEC ajustée a été calculée pour une exposition continue LOAECADJ = 25 ppm x 7 h/24 h x 5 j/7 j = 5,2 ppm (26 mg.m-3). Une concentration équivalente chez l'homme de 15,9 ppm (78 mg.m-3) a été calculée (en retenant comme hypothèse que le chloroforme est un gaz avec des effets systémiques et donc en prenant un RGDG[1] de 3).
Facteurs d'incertitude : un facteur 10 est appliqué car la valeur utilisée est une LOAEC, un facteur 3 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population, aboutissant à un facteur global de 300.
Calcul : 15,9 ppm x 1/300 = 50 ppb = 0,3 mg.m-3 ou 300 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice
Effets à seuil - Exposition chronique par voie orale:
L'ATSDR propose un MRL de 0,01 mg.kg-1.j-1 pour une exposition chronique au chloroforme par voie orale (1998).
Cette valeur a été établie à partir de la même étude expérimentale chez des chiens décrite ci-dessus, dans ce cas, les animaux ont été exposés au chloroforme via des capsules de dentifrice à des doses de 0, 15 ou 30 mg.kg-1.j-1 durant 7,5 ans (Heywood et al., 1979). Les seuls effets sur le foie sont une augmentation de l’ASAT puis de l’ALAT observés à la dose de 15 mg.kg-1.j-1. Cette dose est retenue comme LOAEL. Un ajustement pour une durée d’exposition continue a été pratiqué : LOAELADJ = LOAEL x 6 j/7 j = 12,9 mg.kg-1.j-1.
Facteurs d'incertitude : un facteur 10 est appliqué car la valeur utilisée est un LOAEL, un facteur 10 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population, aboutissant à un facteur global de 1 000.
Calcul : 12,9 mg.kg-1.j-1 x 1/1 000 » 0,01 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice
L’OMS propose une TDI de 0,015 mg.kg-1.j-1 pour une exposition chronique au chloroforme par voie orale (OMS, 2011 ; OMS CICAD, 2004).
Cette valeur est obtenue à partir de la même étude expérimentale chez le chien beagle ayant ingéré 15 mg.kg-1.j-1 de chloroforme introduit dans de la pâte dentifrice pendant 7,5 ans (Heywood et al., 1979). L’effet critique retenu est l’hépatotoxicité. Le calcul de la TDI est réalisé à partir de la valeur guide sur la base de :
12 mg.L-1 : limite inférieure de l’intervalle de confiance à 95 % pour une incidence de 5 % des effets hépatiques, à partir d’une modélisation PBPK
2 litres : consommation journalière d’eau de boisson
64 kg : poids corporel d’un adulte
12 mg.L-1 x 2 L/64 kg = 0,375 mg.kg-1
Facteurs d'incertitude : un facteur global de 25 est appliqué qui correspond à un facteur un facteur de 2,5 pour les différences toxicocinétiques inter-espèces et un facteur de 10 pour la variabilité au sein de la population.
Calcul : 0,375 mg.kg-1 x 1/25 = 0,015 mg.kg-1
Indice de confiance : Cet organisme ne propose pas d’indice
Le RIVM propose une TDI de 0,03 mg.kg-1.j-1 pour une exposition chronique au chloroforme par voie orale (Baars et al., 2001).
Cette valeur est basée sur une étude expérimentale chez la souris exposée chroniquement au chloroforme par l'eau de boisson (Jorgenson et al., 1985). Un LOAEL de 30 mg.kg-1.j-1 a été établi pour les effets hépatiques.
Facteurs d'incertitude : Un facteur d’incertitude de 1 000 a été appliqué mais le détail n’est pas précisé.
Calcul : 30 mg.kg-1.j-1 x 1/1 000 = 0,030 mg.kg-1.j-1
Indice de confiance : Un indice de confiance a été établi par le RIVM, il est élevé pour la valeur proposée.
L’OEHHA propose une dose journalière moyenne « Average Daily Dose » (ADD) de 0,017 mg.kg-1.j-1 pour une exposition chronique au chloroforme par voie orale (OEHHA, 2020).
Cette valeur est basée sur les résultats de deux études de toxicité chronique chez le rat exposé soit par inhalation (0, 10, 30 et 90 ppm, 6 h.j-1, 5 j.sem-1, pendant 104 semaines (Yamamoto et al., 2002) ou au cours d’une exposition mixte (0, 25, 50 et 100 ppm par inhalation et 0 ou 1 000 ppm dans l’eau de boisson pendant 104 semaines) (Nagano et al., 2006). L’effet critique retenu est un effet rénal. Plusieurs BMDL ont été calculées à partir de ces deux études. Celui qui a été finalement retenu prend en compte la basophilie cytoplasmique rénale chez le rat qui survient associée à d’autres altérations histologiques (Nagano et al., 2006). Une BMDL05 de 24,5 mg.kg-1.j-1 a été calculée avec le modèle Weibull, puis une dose équivalente humaine de 3,04 mg.kg-1.j-1 par modélisation PBPK (Sasso et al., 2013).
Facteurs d'incertitude : Un facteur d’incertitude 180 (6 pour l’extrapolation inter-espèce (3 pour la toxicodynamique et 2 pour la toxicocinétique), et 30 pour la variabilité intra-espèce (3 pour la toxicodynamique et 10 pour la toxicocinétique en particulier pour tenir compte de l’âge et du stade du développement).
Calcul : 3,04 mg.kg-1.j-1 x 1/180 = 16,8 10-3 mg.kg-1.j-1 arrondi à 17 10-3 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice
Effets sans seuil - Exposition chronique par inhalation:
L'US EPA (IRIS) propose un excès de risque unitaire au chloroforme par inhalation (ERUi) de 2,3.10-5 (µg.m-3)-1 (2001).
Comme aucune étude de cancérogénèse par inhalation n'est disponible, cette valeur a été calculée à partir de l'étude du NCI (1976), qui a estimé l'incidence de carcinomes hépatocellulaires chez des souris B6C3F1 mâles et femelles après gavage au chloroforme. Les valeurs d'incidence des tumeurs, détaillées ci-dessous, ont été utilisées pour établir des risques de 3,3.10-2 (mg.kg-1.j-1) pour les mâles et 2,0.10-1 (mg.kg-1.j-1) pour les femelles. Le risque unitaire a été calculé en considérant la moyenne géométrique de ces vale
Synthèse des principaux résultats de l’étude du NCI (1976) conduisant à la construction de la VTR
|
Dose |
Incidence des tumeurs |
|
|---|---|---|
|
Administrée (mg.kg-1.j-1) |
Equivalent chez l'homme (mg.kg-1.j-1) |
|
|
Femelles 0 238 477 Mâles 0 138 277 |
0 9,9 19,9
0 6,2 12,5 |
0/20 36/45 39/41
1 |
Méthode d'extrapolation : modèle multi-étape linéarisé.
Un ERUi a été calculé à 2,3.10-5 (µg.m-3)-1 ce qui correspond à une concentration de 4 µg.m-3 pour un risque de 10-4, de 0,4 µg.m-3 pour un risque de 10-5 et de 0,04 µg.m-3 pour un risque de 10-6. Selon les recommandations de l'US EPA, le risque unitaire ne devrait pas être utilisé si la concentration dans l'air dépasse 400 µg.m-3 (non approprié).
L'OEHHA propose un ERUi de 5,3.10-6 (µg.m-3)-1 pour une exposition au chloroforme par inhalation (2002).
Cette valeur a été extrapolée à partir de l’ERUo développé pour la voie orale et présenté ci-dessous.
Effets sans seuil - Exposition chronique par voie orale:
L'OEHHA propose un ERUo de 1,4.10-2 (mg.kg-1.j-1)-1 pour une exposition au chloroforme par voie orale (2020).
Cette valeur a été estimée à partir des données de cancérogénèse issues de 5 études par gavage chez le rat et la souris (Jorgenson et al., 1985 ; NCI, 1976 ; Roe et al., 1979 ; Tumasonis et al., 1987). Des BMD05 et BMDL05 ont été déterminées pour chacune des études retenues. Une estimation du potentiel cancérigène (risque par unité de dose ou le facteur de pente), CSF, a été calculée pour chacune des études selon la formule :
CSFanimal = [0,05.BMDL05-1] x (T.Te-1)3
T = durée de vie moyenne de l’animal
Te = durée de l’étude.
Synthèse des résultats retenus pour la construction de l’ERUo de l’OEHHA.
|
Espèce/Sexe/ Souche
|
Site tumoral |
Benchmark dose (mg.kg-j-1) |
Cancer Slope factor (mg.kg-1.j-1)-1 |
Référence |
|||
|---|---|---|---|---|---|---|---|
|
|
|
BMD05 |
BMDL05 |
CSF animal |
CSF humain |
|
|
|
Souris femelles B6C3F1 |
Carcinome hépatocellulaire |
4,69 |
3,71 |
0,0192 |
0,13 |
NCI, 1976 |
|
|
Rats mâles Osborne-Mendel |
Adénocarcinome ou adénome du tubule rénal |
33,4 |
14,1 |
0,00353 |
0,012 |
||
|
Souris mâles ICI |
Adénome du tubule rénal ou hyper-néphrome |
20,8 |
11,4 |
0,00556 |
0,039 |
Roe et al., 1979 |
|
|
Rats mâles Osborne- Mendel |
Adénocarcinome ou adénome du tubule rénal |
90,2 |
61,1 |
0,000819 |
0,003 |
Jorgenson et al., 1985 |
|
|
Rats mâles Wistar |
Adénocarcinome ou adénome du tubule rénal |
79,6 |
68,3 |
0,000733 |
0,004 |
Nagano et al., 2006 |
|
|
Moyenne géométrique des CSF humain |
0,014 |
|
|||||
La conversion des CSF de l’animal à l’homme a été réalisé à partir de l’équation suivante
CSFhumain = CSFanimal x (poids animal/poids humain)1/4
Avec un poids de 70 kg pour l’humain et de celui variable selon l’espèce, la souche et le sexe chez l’animal.
L’ERUo (ou CSFhumain) à 0,014 (mg.kg-1.j-1)-1 a été calculé à partir de la moyenne géométrique de toutes les valeurs obtenues dans les différentes études.
Aucune information sur le niveau de confiance de cette valeur n’a été trouvée.
[1] « Regional Gaz Dose Ratio » : rapport entre le volume de gaz inhalé par minute et la surface des voies respiratoires d’une des trois régions du système respiratoire (extra thoracique, trachéobronchique et pulmonaire), qui permet d’établir entre l’animal et l’humain un rapport d’équivalence des doses d’exposition aux gaz.
Choix de VTR
Effets à seuil - Exposition aiguë par inhalation:
L’INERIS propose de retenir pour une exposition aiguë au chloroforme par inhalation la VTR de 488 µg.m-3 de l’ATSDR.
Deux organismes proposent des valeurs l’OEHHA (2008) et l’ATSDR (1998). La valeur de l’OEHHA repose sur une étude de toxicité pour le développement, l’effet critique retenu est un effet fœtotoxique observé en présence de toxicité maternelle (Schwetz et al., 1974). Ce type d’étude et cet effet ne sont pas adaptés pour un calcul de VTR pour une exposition aiguë. L’ATSDR utilise une étude expérimentale plus récente (Larson et al., 1994a) et retient comme effet critique les effets hépatiques en cohérence avec le profil toxicologique du chloroforme. La dose critique est un NOAEL qui est plus bas que le LOAEL retenu par l’OEHHA. Le choix des facteurs d’incertitude utilisés par l’ATSDR est adapté.
Indice de confiance : élevé, car le choix de l’effet critique et la construction de la valeur sont pertinents.
Effets à seuil - Exposition sub-chronique par inhalation:
L’INERIS propose de retenir pour une exposition sub-chronique au chloroforme par inhalation la VTR de 244 µg.m-3 de l’ATSDR.
Seul l’ATSDR (1998) propose une valeur à partir d’une étude épidémiologique (Phoon et al., 1983). Malgré un nombre d’individus limité, la qualité de cette étude est recevable. La construction de la valeur est acceptable, le choix des facteurs d’incertitude reflète les limites de la construction de cette valeur. Malgré certaines limites, cette valeur est retenue.
Indice de confiance : faible du fait des limites évoquées ci-dessus.
Effets à seuil - Exposition chronique par inhalation:
L’ANSES propose de retenir pour une exposition chronique au chloroforme par inhalation la VTR de 63 µg.m-3 (AFSSET, 2009).
Cinq organismes proposent des valeurs l’ATSDR (1998), l’OMS (2004), le RIVM (2001), l’OEHHA (2002) et l’AFSSET (2009). Seul l’ATSDR retient une étude épidémiologique (Bomski et al., 1967), les autres organismes ont retenu des études expérimentales Heywood et al., 1979) pour l’OMS, Torkelson et al., 1976) pour le RIVM et l’OEHHA et Templin et al. (1998) pour l’ANSES.L’ATSDR base sa construction sur une étude épidémiologique et applique à la LOAEC retenue un facteur de 100 (intra-espèce et utilisation d’une LOAEC). L’étude épidémiologique est en langue allemande, il n’a pas été possible de formuler un avis circonstancié sur sa qualité cependant le RIVM a jugé qu’elle présentait d’importantes variations en termes d’exposition et a préféré prendre une étude expérimentale comme étude source. Dans son analyse, le TCEQ a retenu cette valeur de l’ATSDR (TCEQ, XXXX).L’OMS utilise une étude pour une exposition par voie orale puis une modélisation PBPK chez le chien pour estimer la concentration induisant ces effets chez l’homme. Cette approche par la dose interne est intéressante mais l’utilisation d’une étude par voie orale pour une exposition par inhalation limite la pertinence de la méthode. La valeur proposée par le RIVM manque de précisions quant à sa construction. L’OEHHA a retenu une étude chez le rat comme étude critique, au cours de laquelle les animaux ont été exposés pendant 6 mois. La LOAEC déterminée à partir des effets hépatiques et rénaux observés est ajustée pour une exposition en continu, avant d’être convertie en « équivalent chez l’homme ». Un facteur d’incertitude de 300 est appliqué : variabilité intra-espèce 10, utilisation d’une LOAEC 10 et 3 pour l’extrapolation de l’animal à l’homme en raison de la limitation des incertitudes assurée par le calcul de concentration équivalent pour l’homme. Enfin, l’AFSSET (2009), propose sur la base d’une étude plus récente chez l’animal (Templin et al., 1998) de protéger des effets précurseurs des effets cancérogènes.
Indice de confiance : L’Ineris accorde un indice élevé, l’étude et la construction sont de bonne qualité
Effets à seuil - Exposition aiguë par voie orale:
L’INERIS propose de retenir pour une exposition aiguë au chloroforme par voie orale la VTR de 0,3 mg.kg-1.j-1 de l’ATSDR.
Seul l’ATSDR (1998) a développé une valeur. Elle repose sur une étude expérimentale (Larson et al., 1994b) de bonne qualité. La durée de l’étude est adaptée pour le développement d’une VTR aiguë. L’effet et la dose critique sont en cohérence avec le profil toxicologique de la substance. Les facteurs d’incertitude sont proportionnés. La valeur de l’ATSDR est recommandée par l’INERIS.
Indice de confiance : élevé compte tenu des commentaires ci-dessus.
Effets à seuil - Exposition sub-chronique par voie orale:
L’INERIS propose de retenir pour une exposition sub-chronique au chloroforme par voie orale la VTR de 0,1 mg.kg-1.j-1 de l’ATSDR.
Seul l’ATSDR (1998) a développé une valeur. Elle repose sur une étude expérimentale (Heywood et al., 1979) de qualité recevable. La durée de l’étude est recevable pour le développement d’une VTR sub-chronique. L’effet et la dose critique sont en cohérence avec le profil toxicologique de la substance. Les facteurs d’incertitude sont recevables. La valeur de l’ATSDR est recommandée par l’INERIS.
Indice confiance : moyen en raison de la durée de l’étude source.
Effets à seuil - Exposition chronique par voie orale:
L’INERIS propose de retenir pour une exposition chronique au chloroforme par voie orale la VTR de 0,01 mg.kg-1.j-1 de l’US EPA
Cing organismes ont élaboré des valeurs : l’ATSDR (1998), l’US EPA (2001), l’OMS (2011), le RIVM (2001) et l’OEHHA (2020). Le RIVM est base sa valeur sur une étude réalisée chez la souris (Jorgenson et al., 1985), au cours de laquelle le chloroforme a été administré via l’eau de boisson. Aucune précision n’est apportée sur la construction de la TDI. De plus, les niveaux auxquels effets sont observés sont plus élevés que ceux chez le chien.L’ATSDR, l’US EPA et l’OMS construisent leur VTR à partir de la même étude chronique chez le chien (Heywood et al., 1979), retiennent les mêmes effets critiques (hépatotoxicité) et la même dose critique un LOAEL de 15 mg.kg-1.j-1. Ensuite, l’ATSDR pratique un ajustement pour une exposition continue à partir de ce LOAEL alors que l’US EPA et l’OMS calculent une benchmarkdose puis appliquent le même ajustement pour une exposition continue. Le calcul d’un benchmark dose permet de s’affranchir des limites liées au choix des doses expérimentales et de prendre en compte l’ensemble de la relation dose-réponse. Cette approche est préférable. L’OEHHA a construit sa valeur à partir de deux études chroniques chez le rat (Yamamoto et al., 2002 ; Nagano et al., 2006), avec des effectifs voisins de 50 animaux par dose, bien supérieurs à celui de l’étude réalisée chez le chien. L’effet critique est une toxicité rénale ce qui est recevable par rapport au profil toxicologique du chloroforme mais pas en cohérence avec celui retenu pour des expositions sub-chroniques. La valeur est construite à partir d’une BMDL comme pour l’étude chez le chien. Concernant le choix des facteurs d’incertitude, les trois organismes (ATSDR, US EPA, OMS) retiennent un facteur 10 pour prendre en compte la variabilité au sein de la population humaine. Seul l’OEHHA applique un facteur 30 pour tenir compte à la fois des différences de toxicodynamique et toxicocinétique au sein de la population, cette valeur est très élevée et n’apparait justifié par une susceptibilité particulière. Les quatre organismes retiennent un facteur pour tenir compte des incertitudes liées à l’extrapolation à partir des données animales, ce facteur est de 10 pour l’ATSDR et l’US EPA, de 2,5 pour l’OMS et de 6 pour l’OEHHA. Le facteur de 2,5 retenu par l’OMS semble plus bas que celui habituellement retenu. Enfin, l’ATSDR retient un facteur pour l’utilisation d’un LOAEL. Compte tenu du choix des études clés, de la méthode de calcul de la VTR et du choix des facteurs d’incertitude, les valeurs proposés par l’US EPA et l’OEHHA sont très proches. Au final et pour rester en cohérence avec le choix de l’effet critique retenu pour des expositions sub-chronique, c’est la démarche suivie par l’US EPA qui est retenue. A noter que les différentes démarches aboutissent à des valeurs très voisines. La valeur de l’US EPA a également été retenue par le TCEQ (XXXX) dans son analyse des valeurs existantes.
Indice de confiance : élevé en raison de la concordance de la valeur développée par l’OEHHA sur la base d’une étude plus récente.
Effets sans seuil - Exposition chronique par inhalation:
Compte tenu du manque de preuve d’un effet génotoxique, l’AFSSET (2009) a retenu un mécanisme cancérogène non génotoxique et propose de ne pas retenir de valeur pour des effets sans seuil par inhalation.
Effets sans seuil - Exposition chronique par voie orale:
En lien avec les travaux de l’AFSSET (2009), l’INERIS propose de ne pas retenir de valeur pour des effets sans seuil (pour les deux voies d’exposition) pour le chloroforme.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/09/2025
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis.
Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). Klimisch et al. (1997) ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après :
- Score 1 : valide (sans restriction)
- Score 2 : valide avec restriction
- Score 3 : non valide
- Score 4 : pas suffisamment d'information pour valider le test
On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2).
Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC.
Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Description
Organismes aquatiques
Paramètres d'écotoxicité aiguë:
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions aiguës
|
|
Espèce |
Critère d’effet |
Valeur (mg.L-1) |
Référence |
|---|---|---|---|---|
|
Algues |
Scenedesmus subspicatus Chlamydomonas reinhardii |
CE50 (48 h) CE50 (72 h) |
560 13,3 |
Kühn et Pattard, 1990 Brack et Rottler, 1994 |
|
Invertébrés |
Daphnia magna Daphnia magna Daphnia magna Crassostrea virginica Artemia salina |
CE50 (48 h) CE50 (48 h) CE50 (24 h) CE50 (48 h) CE50 (24 h) |
29 79 79 0,385 31,1 |
Leblanc, 1980 Abernethy et al., 1986 Kühn et al., 1989 Stewart et al., 1979 Foster et Tullis, 1985 |
|
Poissons |
Ictalarus punctatus Micropterus salmoides Oncorhynchus mykiss Pimephales promelas Cyprinius carpio Pimephales promelas Poecilia reticulata |
CL50 (96 h) CL50 (96 h) CL50 (96 h) CL50 (96 h) CL50 (3-5 j) CL50 (96 h) CL50 (14 j) |
75 51 18 103 97 71 102 |
Anderson et Lusty, 1980 Anderson et Lusty, 1980 Anderson et Lusty, 1980 Mayes et al., 1983 Mattice et al., 1981 Geiger et al., 1990 Könemann, 1981 |
|
Compartiment sédimentaire |
bactéries méthanogènes |
CE50 (11 j) |
6,9 mg.kg-1 |
van Vlaardingen et van Beelen, 1992 |
Tous les essais présentés dans le tableau ci dessus sont considérés comme valides. Les commentaires suivants peuvent être formulés sur les données présentées dans ce tableau.
Algues :
Dans l’étude de Kühn et Pattard (1990), les récipients d’essai sont fermés mais aucun dosage analytique n’a été mis en œuvre. En revanche, Brack et Rottler (1994) ont non seulement dosé la substance d’essai mais ils ont également adapté le dispositif d’essai pour limiter la volatilisation tout en maintenant un pH et des concentrations en dioxyde de carbone favorables à la croissance des algues.
Invertébrés :
Aucun dosage n’a été effectué au cours des essais sur Daphnia magna mais les essais ont été réalisés en récipients fermés pour limiter la volatilité de la substance (Le Blanc, 1980 ; Abernethy et al., 1986 et Kühn et al., 1989). Les résultats des 3 études sont tout à fait cohérents. De même, la sensibilité de l'espèce marine Artemia salina semble être comparable avec celle des organismes d'eau douce (daphnies). En revanche, les larves d’huîtres Crassostrea virginica semblent plus sensibles que le microcrustacé Daphnia magna. Bien que le résultat soit estimé à partir d’un graphe, l’étude est validée dans la mesure où les résultats sont reproductibles. La CL50 (en concentration théorique) obtenue est de 1 mg.L-1. Une concentration d'exposition réelle moyenne de 385 µg.L-1 correspondant à la concentration théorique de 1 mg.L-1 a été estimée en prenant en compte les concentrations mesurées après 5 et 48 heures d'essai pour la concentration théorique de 100 µg.L-1 et en considérant que les pertes de la substance sont équivalentes à 100 et 1000 µg.L-1.
Poissons :
Les essais poissons retenus ont été validés car prenant en compte la volatilité de la substance, soit par des dosages réguliers (Anderson et Lusty, 1980 ; Mattice et al., 1981, Geiger et al., 1990), soit par la mise en œuvre d’un renouvellement continu ou semi-statique du milieu (Anderson et Lusty, 1980 , Mattice et al., 1981 ; Könemann, 1981), ou encore par l’utilisation de récipients fermés (Mayes et al., 1983).
Sédiments
Van Vlaardingen et van Beelen (1992) ont étudié la toxicité du chloroforme sur la production de méthane par les microorganismes d’un sédiment prélevé sur l’estuaire du Rhin. L’étude est valide et pourrait être considérée pour évaluer la toxicité du chloroforme sur le compartiment sédimentaire.
Paramètres d'écotoxicité chronique:
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions chroniques
|
|
Espèce |
Critère d’effet |
CV* |
Valeur (mg.L-1) |
Référence |
|---|---|---|---|---|---|
|
Algues |
Scenedesmus quadricauda Microcystis aeruginosa Scenedesmus subspicatus Chlamydomonas reinhardii |
CE10 (48 h) CE10 (72 h) |
V V V V |
1 100 185 225 3,61 |
Bringmann et Kühn, 1978b, 1980 Kühn et Pattard, 1990 Brack et Rottler, 1994 |
|
Micro-crustacés |
Daphnia magna Daphnia magna |
V V |
15 6,3 |
Hermens et al., 1985 Kühn et al., 1989 |
|
|
Poissons |
Oncorhynchus mykiss Pimephales promelas Oncorhynchus mykiss Oryzias latipes |
CL01 (27 j) CL50 (9 j) NOEC(6/9 m) |
N N N V |
0,0049 > 58 20 >1,46 |
Birge et al., 1979 Black et al., 1982 Slooff, 1979 Toussaint et al., 2001 |
|
Vertébrés |
Hyla crucifer Rana pipiens Rana palustris Bufo fowleri |
CL10 (7 j) CL10 (7 j) CL50 (8 j) CL50 (7 j) |
N N N N |
0,0177 0,383 20,6 35,1 |
Birge et al., 1980 |
|
Compartiment sédimentaire |
Bactéries méthanogènes |
CE10 (11 j) |
V |
5,5 mg/kg |
van Vlaardingen et van Beelen, 1992 |
*CV: critère de validité; V: valide; N: non valide
Les commentaires suivants peuvent être formulés sur les données présentées dans ce tableau.
Algues :
Parmi les 4 références valides sur les algues, l’étude de Brack et Rottler (1994) est celle qui présente le plus de garanties sur le maintien des concentrations d’essai (cf. précisions partie toxicité aiguë). C’est aussi celle qui donne la plus faible valeur en comparaison aux autres résultats basés sur des concentrations théoriques.
Invertébrés :
La NOEC déterminée par Hermens et al. (1985) est relative à une inhibition de la croissance des daphnies tandis que la NOEC définie par Kühn et al. (1989) sur un essai de reproduction est définie à la fois sur un critère de mortalité des mères, inhibition de la reproduction et temps de latence pour les naissances des premières portées. Par ailleurs, la substance a fait l’objet d’un suivi analytique.
Poissons :
Les essais de Birge et al. (1979) et Black et al. (1982) n’ont pu être validés pour plusieurs raisons : des critères de validité non respectés (mortalité dans les témoins), un manque de relation dose-réponse qui ne permet pas de déterminer avec précision les paramètres souhaités, des données brutes « corrigées » en fonction de la mortalité dans les témoins et des paramètres de toxicité inutilisables (CL01). Les résultats de l’essai de Slooff (1979) ne peuvent pas être validés car la substance n’a pas été dosée dans le milieu d’essai et le critère d’effet est difficilement interprétable. Par conséquent, aucun résultat de toxicité chronique sur poissons n’est disponible pour l’évaluation des risques.
Les essais menés par Birge et al. (1980) sur les amphibiens ne sont pas utilisables non plus pour des raisons identiques à celles évoquées pour les essais poissons.
La seule valeur chronique valide provient d'une étude de Toussaint et al. (2001). Des poissons de 14 jours ont été exposés pendant 6 et 9 mois dans un système d'exposition en continu à du chloroforme. Les concentrations d'exposition ont été mesurées et ont varié de 0,017 à 1,463 mg.L-1. Aucun effet sur la survie et la croissance n'a été observé à la plus forte concentration d'exposition. En revanche, des effets histopathologiques ont été observés à de plus faibles concentrations. Par conséquent, la NOEC prise en compte dans l’évaluation des risques européenne (INERIS, 2002) est de 1,46 mg.L-1.
Sédiments :
Les résultats de Van Vlaardingen et van Beelen (1992) pourraient être considérés pour évaluer la toxicité du chloroforme sur le compartiment sédimentaire.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Concentrations sans effet prévisible pour l'environnement (PNEC). Propositions de l'INERIS
Compartiment aquatique:
Des résultats d’essais long terme sont disponibles sur des espèces de trois niveaux trophiques différents. On applique alors un facteur d’extrapolation de 10 à la plus faible NOEC (1,46 mg.L-1 sur Oryzias latipes).
D'où : PNECEAU = 146 µg.L-1
Compartiment sédimentaire:
Pour les sédiments, il est possible de déterminer un PNEC d’après les résultats d’essais présentés précédemment. Un facteur d'extrapolation de 100 peut être appliqué à la CE10 obtenue sur l'inhibition de la production de méthane par des bactéries présentes dans les sédiments. On obtient alors :
PNECSED = 55 µg.kg-1 sédiment sec = 21,15 µg.kg-1 sédiment humide
Compartiment terrestre:
Il n'existe pas de résultats d'essais vis à vis des organismes terrestres. En conséquence, pour extrapoler une PNEC terrestre, la méthode du coefficient de partage peut être utilisée :
PNECSOL = KSOL-EAU/RHOSOL ´ PNECEAU ´ 1000
KSOL-EAU : coefficient de partage entre le sol et l'eau (5,77 m3.m-3)
RHOSOL : densité du sol (humide) (valeur par défaut : 1700 kg.m-3)
D’où :
PNECSOL = 496 µg.kg-1 sol humide = 560 µg.kg-1 sol sec
Concentrations sans effet prévisible pour l'environnement (PNEC). Autres propositions
Les agences françaises de l’eau ont fixé un seuil de qualité de l’eau de 12 µg.L-1 (Agences de l’eau, 1999). Pour cela, l’étude de Birge et al. (1979) avec Oncorhynchus mykiss sur 27 jours a été utilisée. La CL50 de 1,24 mg.L-1, divisée par un facteur d’incertitude de 100 a donné un seuil de 12 µg.L-1.
De même, le programme d’action Rhin (CIPR, 1992) a fixé un objectif de référence de 0,6 µg.L-1 pour cette substance. A nouveau, les résultats de Birge et al. (1979) avec Oncorhynchus mykiss sur 27 jours ont été utilisés. Une CL01 de 6,2 µg.L-1, divisée par un facteur d’incertitude de 10 a donné un seuil de 0,6 µg.L-1.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le chloroforme est un composé organique halogéné de formule chimique CHCl3 et de numéro CAS 67-66-3, d'origines naturelle et anthropique. Néanmoins, ses émissions dans l'environnement sont, avant tout, dues à des sources naturelles. Dans l'environnement, la quasi-totalité du chloroforme se trouve dans le compartiment atmosphérique en raison de sa grande volatilité et de sa faible capacité d'adsorption.
Le chloroforme peut également être produit industriellement. Dans l'Union européenne, en 2012, la production de chloroforme était de 184 000 tonnes. Il est ensuite transformé à plus de 90 % en chlorodifluorométhane. Cette molécule utilisée comme fluide frigorigène (HCFC-22) sert également à la synthèse de fluoropolymères comme le Teflon® (PTFE). Ainsi, même si le HCFC-22 sera définitivement interdit d'utilisation en 2020 dans le cadre de la protection de la couche d'ozone stratosphérique, la demande en chloroforme reste constante à cause de l'augmentation de la demande en fluoropolymères. En France, la production de chloroforme reste constante à 90 000 t.an-1 et est issue des usines du groupe Solvay à Tavaux et Arkema à Lavéra.
Par ailleurs, le chloroforme et les trihalométhanes se forment par action du chlore sur la matière organique présente essentiellement dans les eaux de surfaces. Ainsi, les principales sources anthropiques de chloroforme ont pu être, jusqu'à récemment, les divers traitements de l'eau (potabilisation, circuits de refroidissements) ou de désinfection industrielle au chlore.
Ce phénomène est aujourd'hui mieux pris en compte dans les installations qui sont susceptibles de traiter l'eau par le chlore et de nouveaux procédés peuvent être mis en place (pré-traitement de l'eau, substitutions des procédés au chlore…).
De même, les procédés de traitement des COV (composés organiques volatils) permettent de réduire les émissions de chloroforme des usines produisant ou utilisant cette substance. La généralisation de l'ensemble de ces améliorations techniques pourrait permettre de réduire les rejets de chloroforme encore très importants. En 2012, ils représentaient en France 2 tonnes/an de rejets dans les milieux aquatiques. Le remplacement du PTFE (par ailleurs source de problèmes sanitaires et environnementaux) est également un moyen d'action significatif.
Abstract
Chloroform is a halogenated organic compound, its molecular formula is CHCl3, its CAS number is 67-66-3 and its origin is both natural and anthropogenic. Its main emissions to environment are due to natural sources. In environment, nearly all chloroform is in the atmospheric compartment because of its high volatility and its low adsorption.
It can also be produced industrially. In European Union, in 2012, chloroform production was 184 000t. More than 90% of the produced chloroform is then converted in chlorodifluoromethane. This molecule is used as a refrigerant (HCFC-22) and in synthesis of fluoropolymers such as Teflon® (PTFE). So even if HCFC-22 will be definitively banned from use in 2020 under the protection of stratospheric ozone layer, the chloroform demand remains constant due to the increasing demand in fluoropolymers. In France, chloroform production remains constant at 90 000t/year and comes from the plants of Solvay Group in Tavaux and Arkema in Lavéra.
Moreover, chloroform and trihalomethanes are formed by the action of chlorine on the organic material primarily in the surface waters. Thus, the main anthropogenic sources of chloroform were the various treatments water (drinking water, cooling circuits) or industrial chlorine disinfection.
Nowadays the phenomenon is taken into consideration by installations which could treat water with chlorine and new processes could be implemented (water pre-treatment, chlorine substitution...).
VOC (volatile organic compounds) treatments processes reduce chloroform emissions in plants producing or using this substance. All this technical improvements reduce chloroform rejects still very high. In 2012, 2 tons have been rejected to the aquatic milieu in France. PTFE is also a sanitary and environmental issue and its replacement is a significant way to act.
Tableaux de synthèse
Généralités
| CAS | 67-66-3 |
|---|---|
| SANDRE | 1135 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Textes générauxLe règlement 1907/2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques (REACH) oblige les producteurs et les importateurs de substances en quantité supérieure à une tonne à soumettre une demande d'enregistrement. Ces substances sont ensuite, pour certaines d'entre elles, évaluées. Par la suite, leur usage peut être soumis à autorisation. Le chloroforme est concerné par le règlement REACH. Le chloroforme a été enregistré dans REACH et les restrictions suivantes lui sont appliquées :
Le chloroforme est cité dans la liste de l'annexe I du règlement (CE) 649/2012 relatif à l'export et l'import des substances dangereuses identifiées par ce texte. Il est soumis à notification d'exportation. Directive-Cadre sur l'EauLe chloroforme est cité dans la directive n°2013/39/UE du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE en ce qui concerne les substances prioritaires pour la politique dans le domaine de l'eau. Il est listé en tant que substance prioritaire mais pas en tant que substance prioritaire dangereuse. La directive précédemment citée fixe une norme de qualité environnementale (NQE) pour le chloroforme :
Concernant le HCFC-22Le HCFC-22 est un fluide réfrigérant, fabriqué à partir de chloroforme, soumis au protocole de Montréal sur la réduction des émissions de frigorigènes responsables de la destruction de la couche d'ozone. La production de HCFC-22 est autorisée jusqu'au 31 décembre 2019 et il est autorisé dans les équipements de réfrigérations et de climatisation jusqu'au 31 décembre 2014. Néanmoins par dérogation le HCFC-22 peut être produit, mis sur le marché et utilisé en tant qu'intermédiaire de synthèse, agent de fabrication ou en laboratoire à des fins d'analyse. Action de recherche RSDELe chloroforme est cité dans l'annexe 1 de la circulaire du 5 janvier 2009 relative à la mise en œuvre de la 2ème phase de l'action RSDE pour les ICPE soumises à autorisation. Cette annexe liste les substances dangereuses par secteur d'activité industrielle. Le chloroforme est cité dans la grande majorité des secteurs d'activité. Le chloroforme appartient aussi à la liste des micropolluants à mesurer dans les stations de traitement des eaux usées traitant une charge brute de pollution supérieure ou égale à 600 kg DBO5/jour (Circulaire du 29 septembre 2010 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées). Autres textesLe chloroforme appartient à la liste des 823 substances du plan micropolluants 2010-20134 . Le chloroforme ne fait pas partie des substances potentiellement préoccupantes définies par la convention OSPAR5 . Les composés organohalogénés (dont le chloroforme) sont cités dans la liste des substances et matières nuisibles ou nocives dont le rejet est interdit dans la zone du protocole relatif à la protection de la mer Méditerranée contre la pollution résultant de l'exploration et de l'exploitation du plateau continental, du fond de la mer et de son sous-sol auquel l'Union européenne a adhéré par la décision n°2013/5/UE du 17 décembre 2012. [4]http://www.developpement-durable.gouv.fr/Les-micropolluants-dans-les.html (consulté en avril 2014). [5]http://www.ospar.org/content/content.asp?menu=30950304450153_000000_000000 (consulté en avril 2014). CosmétiquesAu niveau européen, le chloroforme fait partie de la liste des substances interdites dans les produits cosmétiques par le règlement (CE) 2009/1223 relatif à ces produits. Au Canada, l'article 16 de la Loi sur les aliments et les drogues interdit de « vendre un cosmétique qui, selon le cas, contient une substance susceptible de nuire à la santé de la personne qui en fait usage à des fins et de façon normales ou habituelles ». Santé Canada6 a établi en 2005, et révisé en 2007 et 2011, une « Liste critique » qui énumère les substances interdites dans les cosmétiques, dont le chloroforme fait partie. [6] http://www.hc-sc.gc.ca/cps-spc/cosmet-person/hot-list-critique/hotlist-liste-fra.php (consulté en avril 2014). |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Valeurs utilisées en milieu de travailD’après l’INRS (2012), la valeur limite d’exposition professionnelle est : - V.L.E.2 (France) : 50 ppm ou 250 mg/m3 . D’après cette même source, la valeur moyenne d’exposition professionnelle est : - V.M.E.3 (France) : 2 ppm ou 10 mg/m3 . Valeurs utilisées pour la population généraleLe décret 2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l’exclusion des eaux minérales naturelles fixe une teneur maximale en trihalométhanes (dont le chloroforme) à 100 µg/L. Exposition professionnelleD'après l'INRS (2012), la valeur limite d'exposition professionnelle est : D'après cette même source, la valeur moyenne d'exposition professionnelle est : Le décret 2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles fixe une teneur maximale en trihalométhanes (dont le chloroforme) à 100 µg.L-1. Seuils de rejets pour les installations classéesL'arrêté du 26 décembre 2012 modifiant l'arrêté du 31 janvier 2008 concerne le registre et la déclaration annuelle des émissions polluantes et des déchets. L'exploitant de l'installation doit déclarer ces rejets dès lors que les seuils d'émissions décrits dans l'annexe II de cet arrêté sont dépassés. Les seuils de rejets pour le chloroforme sont :
L'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation prévoit les valeurs limites suivantes : Rejets des eaux résiduaires dans le milieu naturel Le Tableau 2 ci-après regroupe les valeurs limites de rejets dans le milieu naturel en concentration et en flux spécifique pour le chloroforme. Ce même texte, précise également que « les dispositifs de rejet des eaux résiduaires sont aménagés de manière à réduire autant que possible la perturbation apportée au milieu récepteur, aux abords du point de rejet, en fonction de l'utilisation de l'eau à proximité immédiate et à l'aval de celui-ci, et à ne pas gêner la navigation ». Tableau 2. Valeurs limites de rejets de chloroforme
Pollution de l'air Rejets total de composés organiques volatils à l'exclusion du méthane : si le flux horaire total des composés organiques (dont fait partie le chloroforme) dépasse 0,1 kg/h, la valeur limite d'émission de la concentration globale de l'ensemble de ces composés est de 20 mg.m-3 . Dans le cas de mélange de composés à la fois visés et non visés par cet arrêté, la valeur limite de 20 mg.m-3 ne s'impose qu'aux composés visés à l'annexe III et une valeur de 110 mg.m-3 , exprimée en carbone total, s'impose à l'ensemble des composés. [1] Le flux spécifique est la quantité de matière pouvant être rejetée pour un secteur d'activité donné. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
D'après Vignes et al. (2014), en 2012, la production de chloroforme dans l'UE était de 184 063 tonnes contre 302 784 tonnes en 2002, soit une réduction de 60 % en dix ans.
La Figure 1 ci-après montre la répartition de la consommation mondiale de chloroforme en 2011.

Figure 1. Répartition de la consommation mondiale de chloroforme en 2011, d'après Vignes et al. (2014).
Sachant que 184 063 tonnes de chloroforme sont produites en Europe en 2011 et que l'Europe de l'Ouest représente un dixième de la consommation mondiale, une estimation grossière de la production mondiale peut ainsi être proposée à près de 2 000 000 tonnes par an.
La Chine consomme plus de la moitié du chloroforme mondial, avec une consommation de 60 %, tandis que les Etats-Unis et l'Europe de l'Ouest (UE, Norvège, Suisse et Turquie) représentent chacun 10 % de la consommation mondiale.
Procédés de production du chloroforme
Le chloroforme peut-être produit par chloration directe du méthane. On obtient alors un mélange des 4 chlorométhanes8 et de chlorure d'hydrogène. Ces différents composés sont ensuite séparés. Ce procédé est utilisé par le groupe Solvay dans son usine de Tavaux en 2014. Le chloroforme peut également être produit à partir du méthanol. KemOne utilise ce procédé et synthétise l'ensemble des chlorométhanes dans son usine de Lavéra. Sa capacité de production des chlorométhanes est de 130 000 tonnes/an (Vignes et al., 2014).
[8] chlorométhane, dichlorométhane (une fiche technico-économique est disponible sur cette substance sur le site ), trichlorométhane et tetrachlorométhane. http://www.ineris.fr/substances/fr/
Place de la substance dans l'économie française
Selon le syndicat des halogènes et dérivés, la production française de chloroforme s'élève à 90 kt.an-1 et est réalisée par les groupes Solvay et Arkema. Selon les chiffres du commerce extérieur 26 , les importations de chloroforme sont assez faibles et s'élèvent à 439 tonnes en 2013 pour une valeur totale de 589 k€.
En ce qui concerne le PTFE, la France en importe de grandes quantités essentiellement en provenance d'Europe. Ainsi, en 2013, les importations de PTFE étaient de 2 867 tonnes pour une valeur totale de 39 219 k€, d'après les chiffres du commerce extérieur. 26
[26] (consulté en novembre 2014). http://lekiosque.finances.gouv.fr/portail_default.asp
Utilisations
Introduction (varitétés d'utilisations)
FTE 2015 Importer
D'après Vignes et al. (2014), le chloroforme est utilisé :
- dans la fabrication du HCFC-22 (ou chlorodifluorométhane CHClF2, CAS 75-45-6) employé en réfrigération et dans la synthèse du tétrafluoroéthylène (F2C=CF2, CAS 116-14-3) qui est utilisé comme monomère9 dans les polymères fluorés comme le PTFE (polytétrafluoroéthylène) ;
- comme solvant dans la préparation de médicaments, pesticides et arômes ;
- comme solvant d'extraction de la quinine, de la nicotine et du caprolactame.
L'utilisation principale concerne la fabrication du chlorodifluorométhane (HCFC-22). Selon l'OMS (2004), cette utilisation représenterait entre 90 et 95 % de la consommation de chloroforme. Mais cette proportion est amenée à chuter fortement dans les cinq ans à venir en raison de restrictions sur le HCFC 22 (cf 2.2.3). Le principal enjeu semble désormais être l'utilisation pour le PTFE.
[9] Un monomère est une substance à la base d'un polymère (assemblage d'un ou plusieurs monomères).
Tétrafluoroéthylène
FTE 2015 Importer
Le tétrafluoroéthylène sert de monomère pour les polymères fluorés et en particulier le polytétrafluoroéthylène (PTFE) commercialement appelé Teflon®.
Il est produit à partir du chloroforme selon l'Équation 1 ci-après. Cette synthèse a lieu en deux temps, avec la formation de chlorodifluorométhane ou HCFC-22 (CHClF2) comme intermédiaire réactionnel.
![]()
Équation 1. Réaction de formation du tétrafluoroéthylène à partir du chloroforme,
d'après Vignes et al. (2012).
Le tétrafluoroéthylène est ensuite polymérisé en PTFE (polytétrafluoroéthylène), selon l'Équation 2 ci-après.

Équation 2. Polymérisation du tétrafluoroéthylène en PTFE, d'après Vignes et al. (2012).
Le PTFE est un polymère fluoré qui possède de nombreux usages (Vignes et al., 2012) :
- Mécanique, automobile, aviation : il sert à fabriquer des mécanismes qui n'ont pas besoin d'être lubrifiés ainsi que des joints. Il intervient notamment dans l'isolement des accessoires de direction assistée, dans les transmissions automatiques et les absorbeurs de chocs, dans les câbles de commande de freins. Il sert à la fabrication de joints résistants au kérosène, et aux lubrifiants, de tuyauteries de pression et de parties du moteur. A titre d'exemple, précisons qu'une automobile européenne moyenne contient environ 100 g de PTFE.
- Industrie, construction, électricité : on le trouve dans le revêtement intérieur des tuyauteries, dans des pompes destinées aux industries chimiques, pharmaceutiques et alimentaires, dans le revêtement des fibres de verre tissées dans les isolants pour les câbles et les fils.
- Protection de l'environnement : on le retrouve dans les procédés de traitement des gaz (désulfuration des gaz issus des centrales thermiques, filtres à poussières dans les procédés industriels...).
- Médecine : on le trouve dans les implants (ligaments artificiels, cœurs artificiels et soins des brûlures) ainsi que dans divers ustensiles (cathéters, tubes capillaires, seringues hypodermiques).
- Le sport et les loisirs : il sert dans les membranes textiles destinées à l'habillement et comme composant dans les fixations de ski. Le tissu Gore-Tex® est obtenu par collage d'un textile sur une membrane en Teflon® expansé et présente une protection contre les intempéries tout en laissant échapper la vapeur d'eau émise par le corps. A titre d'exemple, on trouve environ 20 g de PTFE dans un anorak de ce type.
- Utilisations domestiques : on en trouve dans les revêtements anti-adhérents pour poêles à frire et autres ustensiles (environ 4 g de PTFE pour une poêle), pour fer à repasser, …
Il existe d'autres polymères fluorés à base de chloroforme : le FEP (éthylène-propylène fluoré), le PFA (perfluoroalkoxy), le PVDF (polyfluorovinylidène), ETFE (copolymère modifié d'éthylène et de tétrafluoroéthylène) et l'ECTFE (éthylène/chlorotri-fluoroéthylène). En 2010, la production de polymères fluorés s'élevait à 71 487 tonnes dans l'UE, dont 11 734 tonnes en France. La production mondiale de polymères fluorés est d'environ 230 000 tonnes/an, le PTFE est le premier d'entre eux et représentait 60 % de la production en 2008 (Vignes et al., 2012).
A l'échelle mondiale, les principaux producteurs de polymères fluorés sont Du Pont de Nemours (Etats Unis), Solvay (Belgique), Daikin (Japon). En France, Arkema et Solvay produisent du polyfluorovinylidène (Vignes et al., 2012).
Le marché des fluoropolymères et donc du PTFE est orienté à la hausse pour les prochaines années10 .
[10] http://www.marketsandmarkets.com/Market-Reports/fluor-polymer-market-497.html
HCFC-22
FTE 2015 Importer
En 2007, il a été produit 165 478 tonnes de HCFC-22 dans le monde, hors Chine et Inde, (Schwarz et al., 2011). En 2014, il a été produit ou importé en UE entre 10 000 et 100 000 tonnes/an de HCFC-22, d'après l'ECHA11 .
Le chloroforme est utilisé principalement pour la fabrication du chlorodiflurométhane (HCFC-22) destiné à la réfrigération ou à la production de polymères fluorés. Selon l'OMS (2004), ces utilisations représenteraient d'ailleurs entre 90 et 95 % de la consommation de chloroforme, mais cette proportion est amenée à chuter fortement en raison de restrictions sur le HCFC 22.
En effet, la production de HCFC-22 est autorisée jusqu'au 31 décembre 2019 et il est autorisé dans les équipements de réfrigérations et de climatisation jusqu'au 31 décembre 2014. En revanche, les utilisations des HCFC et en particulier du HCFC-22 (chlorodifluorométhane) dans les laboratoires, comme intermédiaire de synthèse et comme agent de fabrication sont autorisées. Ainsi, le chlorodifluorométhane pourra toujours être produit et utilisé comme intermédiaire réactionnel dans la synthèse de polymères fluorés.
[11] European Chemicals Agency : (consulté en mai 2014). http://echa.europa.eu/
Autres utilisations
FTE 2015 Importer
D'autres utilisations du chloroforme comme notamment les réactifs de laboratoire et les solvants pour l'extraction de produits pharmaceutiques ne représentent qu'une faible fraction de la production (INERIS, 2011).
L'usage du chloroforme comme anesthésiant a été largement répandu dans le passé, mais il est aujourd'hui interdit (INERIS, 2011).
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Selon McCulloch (2003), au niveau mondial, le flux de chloroforme dans l'environnement est apparemment constant à environ 660 000 tonnes par an. 90 % de ces émissions sont d'origine naturelle et proviennent pour 360 000 +/-90 000 t.an-1 de l'eau de mer, 220 000 +/-100 000 des transformations dans les sols, < 20 000 t.an-1 d'autres sources naturelles (comme les activités géologiques et volcaniques) et 66 000 +/-23 000 t.an-1 des activités humaines (OMS, 2004).
Le chloroforme présent dans l'eau de mer pourrait être produit par l'oxydation du chlorure de méthyle produit par l'activité des algues.
Sources non-intentionelles
FTE 2015 Importer
Le chloroforme peut être produit involontairement lors de la désinfection de l'eau par des procédés au chlore. Cette production est difficilement estimable mais, selon l'OMS (2004), elle représente une part importante du chloroforme anthropique rejeté dans l'environnement : ce phénomène dépend de nombreux facteurs comme la température, le pH et les procédés de traitements.
Le chloroforme peut également être présent dans les effluents de papeterie (blanchiment au chlore) et les flux rejetés sont importants.
Cette substance est également présente dans les émissions provenant des eaux de refroidissement, auxquelles il peut être ajouté du chlore ou des substances libératrices de chlore (chloramines par exemple), comme biocide (IPPC, 2001b) (cf. paragraphe 3.1).
Émissions anthropiques totales
FTE 2015 Importer
A l'échelle mondiale
Le Tableau 4 donne les estimations des émissions globales de chloroforme dans l'environnement.
Tableau 4. Estimations des émissions mondiales annuelles de chloroforme dans l'environnement, d'après McCulloch (2003).
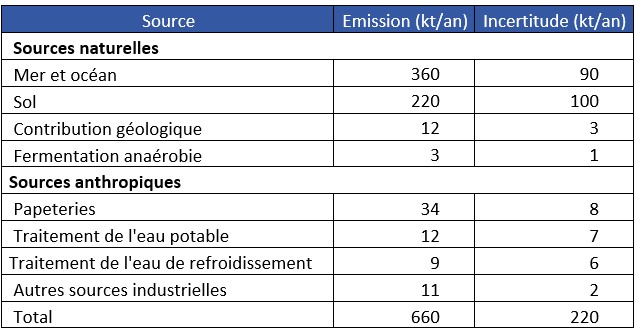
Précisons, qu'à cette échelle mondiale, il n'a pas été possible, lors de la rédaction de cette fiche, d'identifier des données plus récentes que celles présentées dans le tableau ci-dessus : les conclusions qui peuvent en être tirées doivent ainsi être replacées dans le contexte de l'époque.
Néanmoins, selon cette source bibliographique, les principales émissions sont dues à des sources naturelles : à l'échelle mondiale, les sources anthropiques ne représentent que 10 % des émissions totales.
A l'échelle européenne
L'évolution des émissions de chloroforme déclarées dans le cadre de l'arrêté du 31 janvier 2008 par les industriels, entre 2009 et 2012, est présentée dans le Tableau 6 ci-après. Les données affichées sont issues du registre français des émissions polluantes IREP12 . A titre de comparaison, ce tableau comprend également les valeurs de la base de données E-PRTR13 pour les émissions de l'UE 27.
Rappelons que le registre français des émissions polluantes IREP différencie les émissions directes dans l'eau de celles qui sont indirectes. Un rejet direct est défini comme un rejet isolé, après station d'épuration interne au site industriel ou directement dans le milieu naturel, un rejet indirect est défini comme un rejet raccordé à une station d'épuration extérieure à l'installation industrielle émettrice.
De plus, pour l'IREP comme pour l'E-PRTR, seuls les rejets supérieurs à un seuil donné sont soumis à déclaration (seuil définit substance par substance) ; ces seuils sont détaillés dans le Tableau 5 ci-après. Les informations issues de ces deux bases de données ne peuvent donc pas être considérées de même nature ni comme exhaustives.
Tableau 5. Seuils de déclarations pour les industriels aux bases de données IREP et E-PRTR
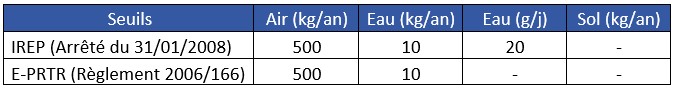
Tableau 6. Emissions de chloroforme dans l'environnement, d'après IREP et E-PRTR
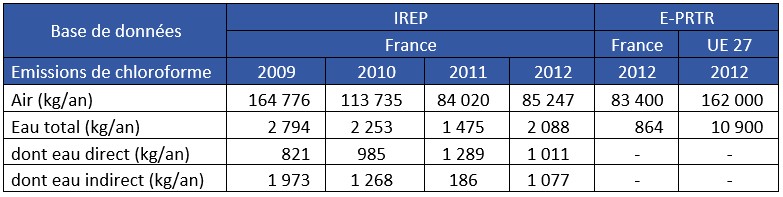
La France semble représenter une grande part des émissions de chloroforme mais il apparaît que peu de pays ont déclaré des émissions de chloroforme.
En France, entre 2009 et 2012, les rejets totaux de chloroforme dans l'environnement sont passés de 167 570 kg.an-1 à 87 335 kg.an-1, soit une diminution de 48 % en 3 ans.
En ce qui concerne les sources anthropiques, le chloroforme peut être relâché dans l'environnement par des processus directs (production, stockage, transfert ou utilisation) ou en raison de sa formation indirecte via d'autres substances, dans les procédés comme le blanchiment du papier avec le chlore et la chloration de l'eau dans des circuits de refroidissement industriel (centrales thermiques notamment). Il est donc coherent que les quantités rejetées soient plus importantes que les quantités produites indiquées au paragraphe 2.1.1.
Les papeteries et les usines de pâte à papier, les stations d'épuration des eaux usées municipales, les usines de chimie et les incinérateurs de déchets représentent les principales sources anthropiques de chloroforme (OMS, 2004)
[12] Registre Français des Emissions Polluantes : (consulté en mai 2014). http://www.irep.ecologie.gouv.fr/IREP/index.php
[13] European Pollutant Release and Transfer Register : (consulté en mai 2014). http://prtr.ec.europa.eu/PollutantReleases.aspx
Émissions atmosphériques
FTE 2015 Importer
Au niveau français, en 2011, d'après l'E-PRTR, les principaux secteurs émettant du chloroforme vers l'atmosphère sont la production industrielle de produits chimiques organiques de base, la production industrielle de produits chimiques inorganiques de base, et la production industrielle de produits pharmaceutiques de base.
La Figure 2, ci-après, donne la répartition des émissions atmosphériques de chloroforme par secteur.
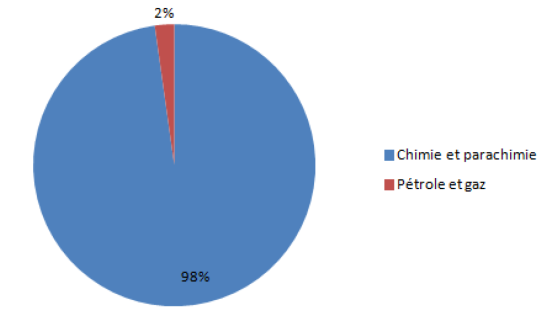
Figure 2. Répartition des émissions atmosphériques de chloroforme par secteur d'activité en France en 2012, d'après l'IREP.
D'après l'E-PRTR, dans l'UE (pour les pays ayant fournis des chiffres), en 2011, la France est le principal émetteur de chloroforme vers l'atmosphère avec 82 tonnes émises, suivie par le Royaume-Uni, le Portugal et l'Estonie avec respectivement 21, 20 et 16 tonnes.
Émissions vers les eaux
FTE 2015 Importer
Données RSDE
La Figure 3 ci-après montre les principaux secteurs contributeurs aux flux de chloroforme, d'après les données RSDE14 du 8 août 2014, de la campagne de mesure 2009-2013.
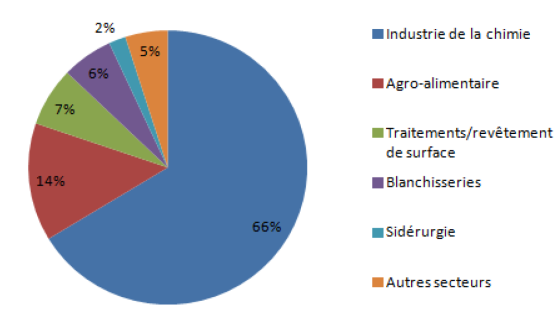
Figure 3. Secteurs contributeurs aux flux de chloroforme vers les eaux, données RSDE 2 (2009-2013).
Le principal secteur d'activité mis en évidence par la Figure 3 est l'industrie de la chimie qui représente près de deux tiers des flux.
[14] Rejets de Substances Dangereuses dans les Eaux.
Données IREP
D'après IREP, au niveau français, en 2012, les principaux secteurs émettant du chloroforme vers les eaux sont la chimie et parachimie pour les émissions directes et la chimie et parachimie et les déchets et traitements pour les émissions indirectes.
Les Figure 4 et Figure 5 ci-après donnent, pour le chloroforme, la répartition des émissions des sites industriels classés pour la protection de l'environnement vers les eaux (respectivement émissions directes et émissions indirectes) par secteur industriel.
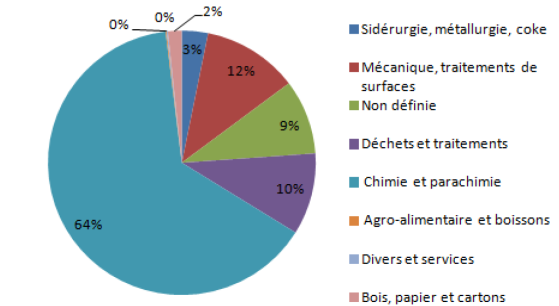
Figure 4. Répartition des émissions directes vers les eaux de chloroforme par secteur d'activité en France en 2012, d'après IREP.
Ces résultats issus d'IREP, notamment la prépondérance du secteur de la chimie et de la parachimie dans les émissions directes, sont cohérents avec les données RSDE 2.

Figure 5. Répartition des émissions indirectes vers les eaux de chloroforme par secteur d'activité en France en 2012, d'après IREP.
Rappelons que ces résultats ne présument pas de l'origine de la présence de chloroforme dans les rejets (formation in-situ ou bien substance rejetée suite à une utilisation de cette dernière) mais uniquement du secteur industriel émetteur de la substance.
Données E-PRTR
D'après l'E-PRTR, dans l'UE (pour les pays ayant fournis des chiffres), en 2011, les principaux émetteurs de chloroforme vers les eaux sont l'Italie, le Portugal, les Pays-Bas et la France, avec respectivement 3,7 ; 3,4 ; 2,4 et 1,2 tonnes.
Bilan des émissions vers les eaux
En France, selon IREP comme E-PRTR, les principales émissions de chloroforme anthropiques vers les eaux proviennent du secteur de la chimie. Dans la mesure où une baisse de la consommation de ce secteur est attendue en Europe et dans le monde (restrictions programmées pour le HCFC 22), une baisse future de ces émissions est possible en France dans les années à venir.
Émissions vers les sols
FTE 2015 Importer
Ni l'IREP, ni l'E-PRTR ne recensent d'émissions de chloroforme vers les sols.
Lors de cette étude, nous n'avons pas identifié d'autres données quant à ces émissions.
Rejets dans l'environnement
FTE 2015 Importer
Le chloroforme est très volatil, il va donc se retrouver essentiellement dans l'atmosphère. L'OMS (2004), considère même que plus de 99 % du chloroforme émis est finalement concentré dans l'air.
Pollutions historiques et accidentelles
FTE 2015 Importer
Base ARIA
La base de données ARIA15 (Analyse, Recherche et Informations sur les Accidents) recense les incidents ou accidents qui ont, ou auraient pu, porter atteinte à la santé ou à la sécurité publique, l'agriculture, la nature et l'environnement. En France, dix accidents impliquant le chloroforme (ou trichlorométhane) ont été recensés depuis 1992.
Parmi ces dix accidents, quatre concernaient la fabrication de produits chimiques organiques de base, trois des transports ferroviaires de fret, un la recherche-développement, un à la fabrication de chaussures et un à la fabrication d'autres produits chimiques. Ces accidents ont été classés sur l'échelle européenne des accidents16:
- 3 ont présenté un indice « matières dangereuses relâchées » de 117 ;
- 1 ont présenté un indice « matières dangereuses relâchées » de 3 ;
- 2 ont présenté un indice « conséquences humaines et sociales » de 1 ;
- 1 ont présenté un indice « conséquences environnementales » de 1 ;
- 5 ont été considérés sans conséquences.
Du fait de la grande volatilité du chloroforme, ces accidents ont principalement entrainé des émissions vers l'atmosphère.
La base de données ARIA recense un accident impliquant le HCFC-22, qui a été considéré sans conséquence.
La base de données ARIA ne recense ni incident ni accident impliquant des polymères fluorés.
[15] (consulté en mai 2014). http://www.aria.developpement-durable.gouv.fr/
[16] (consulté en mai 2014). http://www.aria.developpement-durable.gouv.fr/outils-dinformation/echelle-europeenne-des-accidents-industriels/
[17] L'échelle européenne des accidents est croissante et va de 1 (gravité faible) à 6 (gravité très forte).
E-PRTR
L'E-PRTR recense au niveau européen les émissions de chloroforme accidentelles. En 2012, sept rejets accidentels ont été répertoriés :
- 1 rejet vers l'atmosphère de 3,67 t en Belgique dans le secteur de l'industrie chimique ;
- 1 rejet vers les eaux de 2,49 kg en France dans le secteur de l'industrie chimique ;
- 5 rejets vers les eaux de 4,56 kg en Espagne dans le secteur de la gestion des déchets et des eaux usées.
Pollution du bassin de la Meuse
Selon l'INERIS (2012), à plusieurs reprises en 2011 des valeurs élevées de chloroforme ont été détectées dans la Meuse à hauteur de Chooz, alors que cette substance était jusque là indétectable ou à des teneurs très faibles. A ce jour, la raison de cette présence n'a pas été clairement identifiée même si différentes explications ont été proposées, parmi elles :
- La responsabilité d'un rejet industriel chronique (aucune source n'a pu être identifiée).
- La responsabilité de rejets accidentels (aucun accident industriel ou de transport de matières dangereuses, n'a été signalé).
- La remise en suspension de sédiments entrainant la libération de chloroforme.
- …
Présence environnementale
Atmosphère
FTE 2015 Importer
Selon une étude citée par l'OMS (2004), des concentrations moyennes de l'ordre de 0,09 μg.m-3 ont été mesurées dans l'air à différents points du globe éloignés d'activités humaines. Au dessus de l'océan atlantique, des concentrations allant de 0,05 à 0,1 μg.m-3 ont également été mesurées. Dans des régions habitées, on constate que les concentrations en chloroforme sont plus faibles dans les zones rurales, plus importantes dans les zones urbaines et les plus fortes aux abords de grands axes routiers. Les concentrations moyennes annuelles peuvent alors varier de 0,1 à 0,18 μg.m-3 . Toutefois les plus fortes concentrations moyennes ont été mesurées dans des atmosphères intérieures, en particulier dans des atmosphères enfumées par le tabac où on a pu mesurer des concentrations de 16 μg.m-3 .
Aquatique
FTE 2015 Importer
Les concentrations de chloroforme dans les océans varient entre 0,002 et 0,015 μg.L-1. La concentration de référence dans des rivières non polluées par le chloroforme est de 0,5 μg.L-1. Les concentrations en chloroforme peuvent ensuite fortement augmenter dans des rivières industrialisées. Des niveaux supérieurs à 10 μg.L-1 ont pu être mesurés (OMS, 2004).
Des mesures mensuelles effectuées dans le Rhin, à Karlsruhe, en 2011, montrent des concentrations en chloroforme comprises entre inférieure à 0,01 et 0,03 µg.L-1, des mesures similaires effectuées dans le Meuse, à Ham-sur-Meuse, en 2011, montrent des concentrations toujours inférieures à la limite de quantification de 0,5 ou 1 µg.L-1.
Le Tableau 7 montre les concentrations en chloroforme mesurées dans différents compartiments aquatiques.
Tableau 7. Concentrations en chloroforme dans différents compartiments aquatiques, d'après l'Agence de l'eau Seine-Normandie (2008).
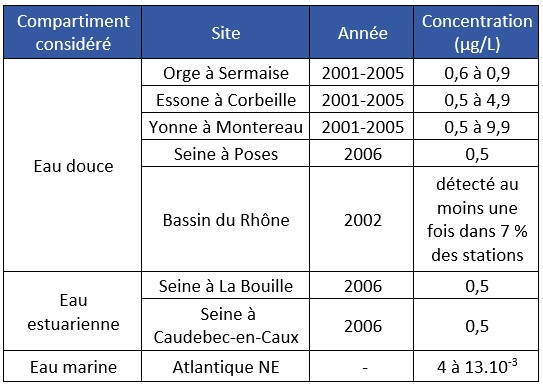
Les valeurs du Rhin sont environ 10 fois inférieures à celle de la Meuse et de l'Agence de l'eau Seine-Normandie.
Dans l'eau potable
Le chloroforme étant un sous produit du traitement de potabilisation de l'eau, on peut retrouver des traces de chloroforme dans de l'eau potable.
Perspectives de réduction
Réduction des rejets
Réduction des émissions de chloroforme
FTE 2015 Importer
Elimination du chloroforme dans l'eau de consommation humaine
Le chloroforme fait partie de la famille des trihalométhanes (THM) qui sont formés par action du chlore sur la matière organique présente essentiellement dans les eaux de surface (acides humique et fulvique principalement). Ils se forment en particulier lors des traitements au chlore (étape de désinfection) des eaux destinées à la consommation humaine. Eliminer le chloroforme de l'eau potable aura également pour effet de réduire sa présence dans les eaux usées urbaines.
Des solutions sont possibles pour limiter la présence de THM dans l'eau de consommation. Pour cela on peut soit éliminer les précurseurs de THM (acide humique et fulvique), soit
éliminer directement les THM. Dans le premier cas, on peut employer les techniques suivantes (Mouchet, 2000) :
- Adsorption sur charbon actif en poudre ou en grains ;
- Préoxydation ;
- Filtration membranaire.
Dans le second cas on peut utiliser la technique d'adsorption sur charbon actif en grains.
Des taux d'élimination de l'ordre de 99 % peuvent ainsi être obtenus en optimisant ces différentes techniques et en les adaptant au mieux aux procédés de décontamination des eaux.
Elimination du chloroforme dans les effluents industriels
Par sa volatilité, le chloroforme est en très grande majorité émis vers l'atmosphère comme tous les autres COV. On peut alors utiliser différentes techniques de traitements de ces composés volatils pour soit les éliminer, soit les récupérer24 .
En ce qui concerne le traitement des effluents aqueux, l'adsorption du chloroforme sur charbon actif est possible et semble être l'une des meilleures techniques de traitements pour les micro-polluants (Boeglin, 2002). De même, comme de nombreux composés organiques volatils, le chloroforme peut être traité par stripping en particulier si l'on souhaite récupérer ce produit en vue de son recyclage (IPPC, 2002).
Le BREF sur l'industrie papetière indique des méthodes de réduction de la formation de chloroforme, notamment le blanchiment ECF (sans chlore élémentaire). Ceci est confirmé par la COPACEL qui nous a indiqué qu'un changement d'agent de blanchiment a permis d'éliminer en grande majorité les émissions de chloroforme.
Le BREF sur le textile indique que l'utilisation du peroxyde d'hydrogène, à la place de l'hypochlorite de sodium, permet d'éviter la formation de chloroforme lors du blanchiment.
Le BREF sur les systèmes de refroidissement propose les options suivantes à l'utilisation du chlore ou de ses dérivés :
- L'acide hypobromeux peut représenter une solution alternative à l'hypochlorite. Il présente comme avantage de se dissocier à un pH plus élevé ce qui conduit à une plus grande efficacité biocide à des concentrations plus faibles que l'hypochlorite. Toutefois l'acide hypobromeux conduit à la formation de composés organiques bromés plus toxiques que leurs équivalents chlorés, bien que qu'ils se dissocient plus rapidement. L'option hypobromeuse peut présenter un léger avantage pour l'environnement par rapport à l'option hypochloreuse.
- Le bromure et l'hypochlorite de sodium, le chloramine et le peroxyde sont utilisés ensemble dans les systèmes à recirculation, ce qui peut permettre également de générer moins de substances dangereuses pour l'environnement. Un inconvénient propre à ce traitement, c'est que pour les solutions à concentrations élevées en oxydant libre, du bromate carcinogène pourrait se former. Une autre source possible peut être l'ozonation des eaux naturelles par l'oxydation des ions bromure.
- Les biocides non oxydants les plus couramment utilisés sont : le 2,2-dibromo-3-nitrilopropionamide (DBNPA), l'aldéhyde glutarique, les composés quaternaires d'ammonium (QAC), les isothiazolones, les bisphénols halogénés et les thiocarbamates. L'application de biocides non oxydants au lieu de biocides oxydants est recommandée uniquement lorsque ces derniers ne sont pas en mesure de fournir une protection suffisante, par exemple dans les systèmes avec des charges organiques élevées, ou dans les systèmes de refroidissement humide à recirculation dans lesquels le contrôle quotidien n'est pas une pratique (IPPC 2001b).
D'après nos informations, il semblerait que l'optimisation de l'emploi de Javel, utilisé comme biocide (notamment dans les eaux de refroidissement) dans les sites industriels, permettrait de limiter la formation de chloroforme. Cette optimisation passe par des investissements permettant une efficacité maximale de la Javel et donc une réduction de la quantité de Javel utilisée. Les coûts estimés seraient de 1 000 €/kg de chloroforme abattu.
[24] Voir par exemple : Techniques de l'ingénieur, 2005. Procédés de traitement des COV ou composés organiques volatils.
Elimination du chloroforme dans les effluents urbains
Le chloroforme est recherché dans le cadre du projet AMPERES25 . Il a été quantifié dans 30 à 70 % des eaux usées brutes de STEU étudiées. Les concentrations moyennes en chloroforme varient entre 1,4 et 2,9 µg.L-1. Le chloroforme a été quantifié dans moins de 30 % des eaux traitées secondaires à des concentrations comprises entre 0,1 et 1 µg.L-1 et dans 30 à 70 % des eaux traitées tertiaires à des concentrations comprises entre 0,1 et 1 µg.L-1 (Coquery, 2011) Il semble paradoxal que le chloroforme soit plus fréquemment quantifié dans les eaux traitées tertiaires, que dans les eaux traitées secondaire. Lors de la rédaction de cette fiche, il n'a pas été possible d'apporter des éléments explicatifs à ce constat : la petite taille de l'échantillon sur lequel est basée cette statistique comme un procédé générant du chloroforme pourraient tout aussi bien être incriminés.
Deux rendements sont disponibles :
- le rendement de la filière eau traduit la diminution de la concentration entre l'entrée et la sortie de la STEP : il est en moyenne de 83 % pour le chloroforme ;
- le rendement d'élimination global prend en compte le flux de micropolluants transférés vers la filière boues et le flux de micropolluants réintroduits dans la filière eau : il est supérieur à 70 % pour le chloroforme (Choubert, 2011).
Les traitements de l'eau présentent une bonne efficacité pour le chloroforme, mais il est probable qu'il y ait des transferts vers l'air en raison de la grande volatilité de la substance.
[25] Analyse de micropolluants prioritaires et émergents dans les rejets et les eaux superficielles.
Alternatives aux usages
Produits de substitution
FTE 2015 Importer
Substitution du réfrigérant HCFC-22
Les HCFCs qui ont servi, dans les années 80, de substituts aux CFCs, présentent également une dangerosité pour la couche d'ozone. Le HCFC-22 qui a pourtant un pouvoir de destruction moins important doit être remplacé au 31 décembre 2014. Pour cela, les hydrofluorocarbones (HFC), qui ne contiennent pas de chlore et pour la synthèse desquels le chloroforme n'est pas utilisé, peuvent être considérés comme une option à long terme pour résoudre le problème des frigorigènes. Le HFC le plus souvent cité est le HFC-134a. Toutefois, dans certaines applications comme les pompes à chaleur géothermiques, l'utilisation directe d'un unique HFC est impossible, et les fabricants développent des mélanges de HFC qui imitent les caractéristiques du HCFC-22. On peut citer par exemple le R-410A qui est un mélange de HFC-32 et de HFC-125, ou encore le R404A qui est un mélange de HFC-134a, de HFC-143a et de HFC-125 (Giguère, 2009).
Yang et al. (2013) ont mené une étude comparant différents substituts possibles au HCFC-22. Il apparaît que chacun des substituts possède des avantages et des inconvénients, qui sont présentés dans le Tableau 8.
Tableau 8. Comparaison des performances de substituts aux HCFC-22, d'après Yang et Wu (2013).
Il existe des alternatives au HCFC-22, notamment parmi les HFC, qui sont utilisés en remplacement des HCFC et des CFC et dont certaines présentent des caractéristiques d'emploi proches de celles des substances à substituer.
D'ailleurs, depuis la limitation des CFC et leur remplacement par les HFC, les émissions atmosphériques de HFC ont considérablement augmenté. Ainsi, selon le CITEPA21 , les émissions de HFC ont augmenté de 312 % entre 1990 et 2011, essentiellement à cause des émissions dues aux secteurs résidentiels et tertiaires et aux transports.
Figure 6. Estimations des émissions atmosphériques de HFC en équivalent kt CO2, d'après le CITEPA.
La Figure 6 montre bien l'augmentation de l'utilisation des HFC dans les équipements de réfrigérations que ce soit pour le résidentiel, le tertiaire ou les transports.
On voit ainsi que la substitution du HCFC-22 par des HFC, même si elle règle en partie le problème des émissions de chloroforme, n'est pas satisfaisante sur le plan environnemental, puisqu'il s'agit en effet de gaz à effet de serre. Les mélanges de HFO ont un faible impact sur le changement climatique et peuvent donc se partager le marché avec les R410A. Néanmoins les principaux inconvénients des mélanges de HFO sont leur coût élevé et le peu de recul sur leur utilisation.
[18] Alcènes contenant des fluors
[19] R744 : dioxyde de carbone
[20] HC-290 : propane
[21] Centre Interprofessionnel Technique d'Etude de la Pollution Atmosphérique : (consulté en mai 2014). http://www.citepa.org/emissions/nationale/Ges/ges_hfc.htm
Substitution du PTFE
L'augmentation du marché des polymères fluorés et en particulier du PTFE pose aujourd'hui, pour les émissions de chloroforme, un problème plus important que l'utilisation du HCFC-22 comme fluide frigorifique. En outre, l'usage du Teflon®, pourrait également poser des problèmes sanitaires (INERIS, 2011).
Le site internet Subsport22 présente un exemple de substitution du PTFE dans les revêtements anti-adhésifs des articles de cuisine. Le produit de substitution est un polymère de silicone.
Le Tableau 9 présente des alternatives au PTFE, d'après le Site internet ERIKS23 .
Tableau 9. Alternatives au PTFE, d'après ERIKS.
Ainsi, selon les informations disponibles, il semble exister des alternatives au PTFE, mais elles sont pour l'instant limitées à des applications bien ciblées en raison de leur prix.
[22] (consulté en août 2014). http://www.subsport.eu/
[23] (consulté en décembre 2014). http://solutions-in-plastics.info/fr/info-produits/plastiques-fluores/alternatives-au-ptfe/
Coûts de la substitution
En ce qui concerne les produits de substitution du HCFC-22, il semble que leur coût devienne compétitif par rapport à celui du HCHC-22, qui, en raison de la diminution de l'offre, aurait fortement augmenté ces dernières annéees27 .
[27] (
Conclusion
FTE 2015 Importer
Le chloroforme est un composé organique halogéné très volatil, dont les émissions dans l'environnement sont essentiellement dues à des sources naturelles. Il peut également être produit industriellement pour être ensuite transformé à plus de 90 % en chlorodifluorométhane. Cette molécule utilisée comme fluide frigorigène (HCFC-22) sert également à la synthèse de fluoropolymères comme le Teflon® (PTFE). Ainsi, même si le HCFC-22 sera définitivement interdit d'utilisation en 2020 dans le cadre de la protection de la couche d'ozone stratosphérique, la demande en chloroforme reste constante à cause de l'augmentation de la demande en fluoropolymères. En France, la production de chloroforme reste constante à 90 kt.an-1 et est issue des usines du groupe Solvay à Tavaux et Arkema à Lavéra.
Par ailleurs, le chloroforme et les trihalométhanes se forment par action du chlore sur la matière organique présente essentiellement dans les eaux de surfaces. Ainsi, les principales sources anthropiques de chloroforme ont pu être jusqu'à récemment les divers traitements de l'eau (potabilisation, circuits de refroidissements) ou de désinfection industrielle au chlore.
Ce phénomène est aujourd'hui mieux pris en compte dans les installations qui sont susceptibles de traiter l'eau par le chlore et de nouveaux procédés peuvent être mis en place (pré-traitement de l'eau, substitutions des procédés au chlore…).
De même, les procédés de traitement des COV permettent de réduire les émissions de chloroforme des usines produisant ou utilisant cette substance. L'ensemble de ces améliorations techniques pourrait permettre de réduire les rejets de chloroforme encore très importants. En 2012, ils représentaient en France 2 tonnes/an de rejets dans les milieux aquatiques. Le remplacement du PTFE (par ailleurs source de problèmes sanitaires et environnementaux) est également un moyen d'action significatif.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :