Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Pentachlorophénol (87-86-5)
Informations générales
Dernière vérification le 15/12/2025
Identification
Code EC
Code SANDRE
Numéro CIPAC
Classement transport
Classification CLP
Méthodes analytiques
Introduction
Air
Eau
Sol
Autres milieux
Programmes
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
266.34 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Compte tenu de ses caractéristiques physico-chimiques, le PCP, lorsqu'il est présent dans le compartiment atmosphérique, est sous forme gazeuse et particulaire. Il est dégradé par réaction photochimique sous forme de radicaux hydroxyles. La demi-vie via ce processus de dégradation est estimée à 29 jours. Sous forme particulaire, il est piégé par les précipitations, et retourne alors dans les compartiments terrestres et aquatiques.
Milieu eau douce
FDTE/VTR Importer Dans l'eau, le PCP possède les caractéristiques physico-chimiques requises pour s'adsorber sur la phase particulaire. Cette adsorption semble dépendre du pH, et est plus importante en conditions acides (Callahan et al., 1979).
Le PCP se volatilise très peu à partir de l'eau de surface. Des expériences de volatilisation en rivières artificielles ont montré que moins de 0,006 % du PCP introduit était volatilisé (Lyman et al., 199) Delaune et al. (1983) ont calculé des koc sédiment compris entre 3 000 et 4 000.
Milieu terrestre
FDTE/VTR Importer La mobilité du PCP dans les sols est fonction du pH. Les valeurs de Koc calculées pour la forme dissociée s'échelonnent de 1 250 à 1 800, alors que pour la forme non dissociée, les valeurs de Koc atteignent 25 000 (Lagas, 1988). Des essais en microcosmes terrestres ont montré que le transfert du sol vers l'atmosphère était possible, à concurrence de 50 % de la quantité introduite (Gile et Gillett, 1979).
Compte tenu de sa constante de Henry, la volatilisation du PCP à partir de sols humides n'est pas un processus significatif. Cependant, des quantités significatives de PCP introduites dans un mésocosme terrestre ont été détectées dans l'air sus-jacent (Gile et Gillett, 1979). Le PCP se volatilise peu à partir des sols humides, ce qui s'explique par sa pression de vapeur. Par contre, la dégradation par photolyse dans les sols humides peut être significative (Donaldson et Miller, 1997). Ces auteurs ont mis en évidence une photodégradation de 55 % en 14 jours du PCP ajouté dans un sol sablo-limoneux.
Le PCP a été détecté dans des sols à des profondeurs de 20 mètres (Ball, 1987) du lieu d'entreposage de bois traité, traduisant une migration verticale qui dans certains cas peut atteindre l'eau souterraine.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
FDTE/VTR Importer Aucune dégradation par hydrolyse n’est attendue. La photolyse du PCP dans l'eau est un processus important, largement dépendant du pH. En effet, la forme ionisée est plus sensible à la photodégradation que ne l'est la forme protonée. Weiss (1982) ont mis en évidence une dégradation de 90 % en 10 heures du PCP dans une eau de surface à pH = 7,3, alors qu'à pH = 3, la dégradation n'est que de 40 % après 90 heures. La dégradation par photolyse dans l'eau conduit à la formation de substances telles que l'acide 2,3-dichloromaléique, le 2,3,5,6- et le 2,3,4,6-tétrachlorophénol, le tétrachlororésorcinol, le tétrachlorocatéchol, des benzoquinones(2-3), et potentiellement des dioxines. La dégradation par photolyse dans les sols humides peut être significative (Donaldson et Miller, 1997). Ces auteurs ont mis en évidence une photodégradation de 55 % en 14 jours du PCP ajouté dans un sol sablo-limoneux.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
FDTE/VTR Importer Eaux de surface: La biodégradation du PCP en milieu aquatique a été décrite. Elle dépend de la concentration de PCP dans la matrice. De plus, la phase de latence, correspondant à l'adaptation de la microflore bactérienne capable de le biodégrader, peut durer plusieurs semaines. Parmi les produits de biodégradation, on retrouve le 3,5-dichlorophénol, le 3,4,5-trichlorophénol, et le 2,3,4,5-tétrachlorophénol (Chang et al., 1995). L'augmentation de la concentration tend à accroître la durée de biodégradation, probablement en raison de la toxicité que le PCP peut exercer vis-à-vis des consortiums bactériens.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
FDTE/VTR Importer La biodégradation du PCP dans le sol a été mise en évidence par plusieurs auteurs. Cependant, en raison de sa toxicité intrinsèque, les taux de biodégradation dépendent largement de la concentration de PCP dans la matrice. Des vitesses maximales de dégradation de 0,3 à 0,5 mg.kg-1.j-1 dans des sols contenant 30 mg.kg-1 de PCP, et un taux de dégradation de 82 % après 7 mois ont été rapportés par Miethling et Karlson (1996). Moins de 2 % du PCP ajouté dans le sol à une concentration de 100 mg.kg-1 était dégradé après la même durée.
Conclusion sur la persistance
FDTE/VTR Importer Le PCP n’est pas dégradé par hydrolyse. La dégradation du PCP par photolyse dans l'eau et les sols humides est un processus important, largement dépendant du pH. La biodégradation en milieu aquatique et dans les sols dépend de la concentration en PCP présente dans la matrice considérée (l'augmentation de la concentration tend à accroître la durée de biodégradation, probablement en raison de la toxicité que le PCP peut exercer vis-à-vis des consortiums bactériens). Parmi les produits de biodégradation, dans l’eau, on retrouve le 3,5-dichlorophénol, le 3,4,5-trichlorophénol, et le 2,3,4,5-tétrachlorophénol.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Compte tenu des résultats présentés dans le tableau ci-dessous, la bioconcentration du PCP dans les organismes aquatiques semble relativement élevée. Kobayashi et Kishino, 1980 ont mis en évidence l’impact du pH sur la bioconcentration du PCP celle-ci étant plus élevée à faible pH.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucune donnée fiable concernant la bioaccumulation du PCP dans les organismes terrestres n'a pu être collectée.
Conclusion sur la bioaccumulation
FDTE/VTR Importer La bioconcentration du PCP dans les organismes aquatiques semble relativement élevée. Un impact du pH sur la bioconcentration du PCP a été mis en évidence. Des valeurs comprises entre 56 et 5 370 ont été déterminées chez les poissons, 34 à 390 pour les mollusques, 114 à 156 pour les plantes aquatiques, 450 pour les insectes, 100 à 400 pour les crustacés et 280 à 3 820 pour les polychètes.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation :
Une absorption de 76 à 88 % a été rapportée chez deux volontaires sains exposés 45 minutes au PCP dans un espace clos (concentration non précisée) (Casarett et al. 1969 ).
Voie orale :
L’absorption du PCP est rapide et efficace par voie orale (environ 90 %). La concentration maximale plasmatique est obtenue au bout de 4 heures (Braun et al., 1979).
Voie cutanée :
Des empoisonnements par voie cutanée témoignent indirectement de l’efficacité de l’absorption du PCP par la peau chez l’humain (Gray et al. 1985, Jones et al. 1986, Smith et al. 1996). L’absorption in vitro est de 16 % en solution aqueuse et 62 % dans l’huile diesel sur la peau humaine (Horstman et al.,1989 ).
Distribution
FDTE/VTR Importer Le PCP se lie aux protéines plasmatiques. La demi-vie plasmatique du PCP est de 30 heures (Braun et al., 1979) et la demi vie d’élimination de 16 jours (Uhl et al., 1986) du fait de la liaison aux protéines plasmatiques. La présence de PCP a été décrite dans le foie, les reins, les poumons et le cerveau de sujets empoisonnés au PCP (NTP, 2013). Il ne s’accumule pas dans l’organisme.
Métabolisme
FDTE/VTR Importer Le métabolisme du PCP est principalement hépatique et correspond majoritairement (80 à 90 % de la dose absorbée) à une conjugaison avec les glucuronides (Braun et al., 1979, ; Uhl et al., 1986). Une fraction, qui n’excède probablement pas 10 à 20 %, subit une déchlorination oxydative par les monooxygénases à cytochrome P450 pour former principalement de la tétrachloro-p-hydroquinone (TCHQ) et de la tétrachloro-1,4-benzoquinone (TCBQ) (Ahlborg et Thunberg, 1974 ; Juhl 1985).
Élimination
FDTE/VTR Importer L’excrétion rénale de PCP sous forme inchangée est faible, notamment en raison de sa forte capacité de fixation aux protéines plasmatiques. Après l’administration d’une dose unique par voie orale, l’élimination se fait majoritairement sous forme conjuguée à l’acide glucuronique (Reigner et al., 1992a, 1993 ). Les métabolites sont également éliminés par ces deux voies dans les mêmes proportions. L’élimination fécale ne dépasse pas 4 %.
Par ailleurs, il faut signaler que l’élimination du PCP est largement conditionnée par la forme sous laquelle il est utilisé. En effet, les sels sodiques de PCP (Na-PCP) ont une demi-vie chez l’homme de 33 heures dans les urines (Braun et al., 1979), alors que dans l’éthanol (solution à 40 %), les temps s’allongent considérablement pour atteindre 18-20 jours (Uhl et al., 1986).
Plus récemment, la présence de PCP a pu être dosée dans les urines de 87 % d’enfants et d’adolescents en Allemagne (moyenne géométrique de 0,19 µg.L-1), longtemps après les restrictions d’utilisation, même si les niveaux restent faibles par rapport aux données relevées aux USA et au Canada (Schmied-Tobies et al., 2021).
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation :
L’absorption par le tractus respiratoire est de 70 à 75 % chez le rat exposé par inhalation (Hoben et al., 1976).
Voie orale :
La plupart des études chez le rat (Reigner et al., 1991 ; Yuan et al., 1994), la souris (Reigner et al., 1992) ou le singe (Braun et Sauerhoff,1976) rapportent un taux d’absorption par voie orale supérieur à 90 %.
Voie cutanée :
Dans des conditions non occlusives, l’absorption cutanée serait d’environ 29 % chez le singe (Wester et al. 1993) et de 29 à 50 % chez le cochon (Qiao et al. 1997 , Qiao and Riviere 2002) .
Distribution
FDTE/VTR Importer Dans la circulation, le PCP se lie en grande majorité (96 à 99,5 %) aux protéines plasmatiques (Uhl et al.,1986 ; Reigner et al., 1993). Les taux post-mortem de PCP chez l’humain se retrouvent par ordre décroissant au niveau du foie, des reins, du cerveau, de la rate et des tissus riches en graisse (Proudfoot et al., 2003). Il a été dosé dans le lait maternel et le sang du cordon ombilical dans plusieurs études chez la femme (IARC, 2019).
Métabolisme
FDTE/VTR Importer Après passage dans le sang, où il se combine au moins en partie aux protéines plasmatiques, une faible proportion du PCP est métabolisée au niveau hépatique par déchloration oxydative pour former majoritairement de la tétrachloro-1,2-hydroquinone (ou tétrachlorocatéchol) et de la tétrachloro-p-hydroquinone (Lin et al., 2002 ; Tsai et al., 2001). D’autres métabolites actifs, de type benzoquinones et semi-quinones ont également été identifiés. Un schéma métabolique a été proposé par l’IARC en 2019.
schéma métabolique du PCP basé sur les données humaines et animales (IARC, 2019) :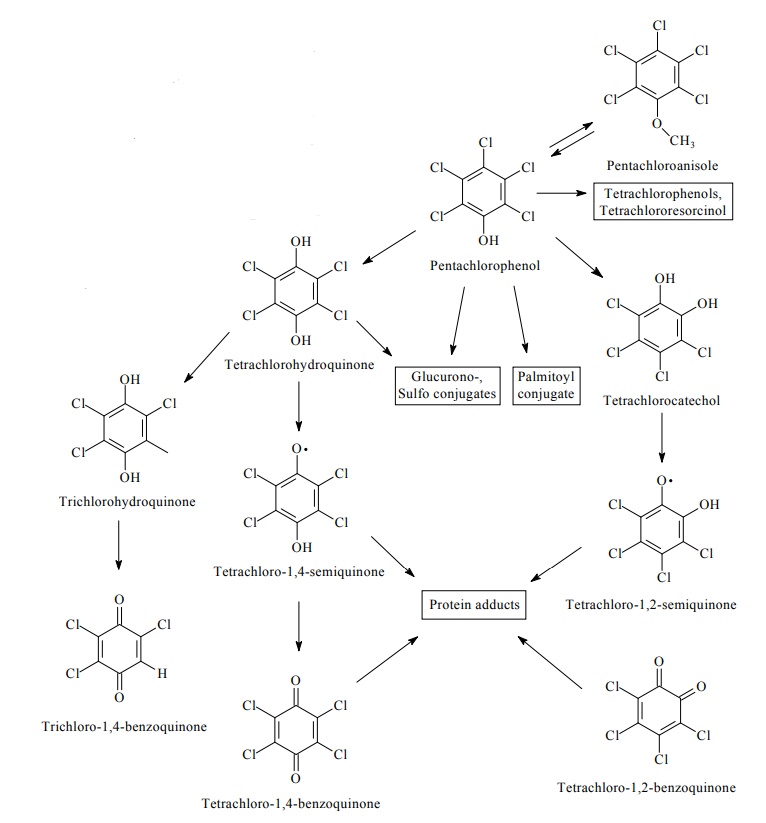
Élimination
FDTE/VTR Importer La voie d’élimination principale du PCP, quelles que soient les espèces et les voies d’exposition, est l’urine, dans laquelle il se retrouve majoritairement sous forme glucuro-conjuguée (60 à 83 % chez les rongeurs, 45 à 75 % chez le singe).
Synthèse
FDTE/VTR Importer Chez l’homme,
l’absorption du PCP est rapide par toutes les voies d’exposition. Dans le sang, le PCP se lie aux protéines plasmatiques, seule une faible proportion de PCP est métabolisée au niveau hépatique. Le PCP est majoritairement éliminé par voie urinaire.
Chez l’animal,
le PCP est rapidement absorbé par la peau (10 à 50 %), par le tractus respiratoire (88 %) et par l’appareil digestif (100 %). Bien que le PCP se lie aux protéines plasmatiques, il se distribue dans le foie, les reins et le cerveau. Une proportion de PCP est métabolisée au niveau hépatique. Il est éliminé essentiellement par voie urinaire sous forme libre ou glucuroconjuguée.
Equivalents biosurveillance
Description
FDTE/VTR Importer 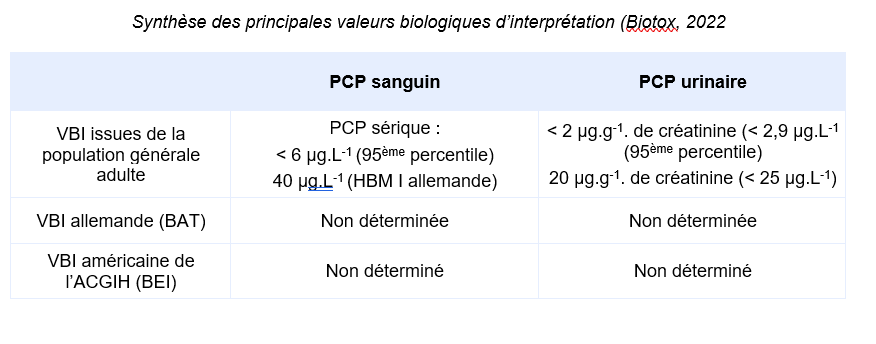
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Les nombreux cas d’intoxications accidentelles ou professionnelles (traitement du bois) au PCP par voie respiratoire ont entraîné dans de nombreux cas la mort de l’individu (Gray et al., 1985 ; Truhaut et al., 1952 ; Wood et al., 1983).
Le décès résulte d’une hyperthermie. Les autres signes cliniques sont une sudation, des douleurs abdominales, des troubles digestifs, une anorexie, des spasmes pulmonaires et une fatigue.
Au-delà de l’irritation des yeux, du nez et des voies aériennes supérieures, un œdème et une congestion pulmonaires peuvent être observés. A l'autopsie, de nombreuses congestions au niveau de la rate, du cœur, du foie, des reins et une dégénérescence des tissus adipeux ont été décrites.
À des concentrations atmosphériques supérieures à 1 mg.m-3, des aérosols de PCP sont irritants pour les yeux, le nez et les voies aériennes supérieures ; une certaine accoutumance est possible puisque des personnes conditionnées peuvent supporter plus de 2 mg.m-3 (INRS, 2013).
Voie orale
FDTE/VTR Importer L’US EPA a estimé que la dose létale par voie orale chez l’homme se situait entre 50 à 500 mg.kg-1 de masse corporelle, en justifiant l’écart par une grande variabilité individuelle, liée notamment au fonctionnement rénal des sujets, de même qu’à la température ambiante au moment de l’exposition (Kozak et al., 1979).
D’un point de vue clinique, le PCP entraîne par voie orale une inflammation gastro-intestinale dont la gravité dépend aussi du solvant associé au PCP.
Voie cutanée
FDTE/VTR Importer Plusieurs cas d’intoxications graves PCP par voie cutanée ont entraîné la mort de l’individu (Armstrong et al., 1969 ; Truhaut et al., 1952 ; Wood et al., 1983). Les signes cliniques sont comparables à ceux décrits par inhalation, les deux voies d’exposition étant souvent simultanées. Si le pouvoir irritant du PCP se traduit souvent pour les différentes voies d’exposition par des lésions de la peau et des muqueuses, des cas de chloracné ont été observés uniquement après contact direct du PCP avec la peau (Bond et al., 1989 ; Cheng et al., 1993 ; Cole et al., 1986 ; O'Malley et al., 1990).
Synthèse
FDTE/VTR Importer Chez l’homme, de nombreuses expositions mortelles au PCP ont été rapportées. Le décès résulte d’une hyperthermie. Les autres signes cliniques sont une sudation, des douleurs abdominales, des troubles digestifs, une anorexie, des spasmes pulmonaires et une fatigue. Le PCP est irritant et peut être à l’origine de chloracné.
Chez l'animal
Inhalation
FDTE/VTR Importer Seule une étude de toxicité aiguë par inhalation chez le rat a permis de montrer que les selsNa-PCP sont plus toxiques par inhalation que par voie orale avec une CL50 de 14 mg.m-3 pour 45 minutes chez le rat (Hoben et al., 1976).
Voie orale
FDTE/VTR Importer Les études concernent très majoritairement la voie orale. L’exposition aiguë au PCP entraîne, très rapidement (dans les 2 minutes), un arrêt cardiaque précédé d’une perte de l’équilibre, d’une augmentation de la respiration et de la température, parfois accompagnées de convulsions.
Outre la sensibilité entre espèces, les fortes variations des valeurs de DL50 obtenues par voie orale, de 27 à 205 mg.kg-1 de masse corporelle dépendent en grande partie du véhicule utilisé et surtout du degré de purification du PCP. Le PCP est plus toxique chez le rat et le lapin par voie orale que les sels Na-PCP (Borzelleca et al., 1985 ; Deichmann et al., 1942 ; Ning, 1984 ; St Omer et Gadusek, 1987 ; Renner et al., 1986). Cependant, la présence d’impuretés, tels que les polychlorodibenzo-p-dioxines (PCDD) et les polychlorodibenzofuranes (PCDF), peut également influencer les résultats.
La sensibilité liée au sexe n’est pas très marquée, même si la toxicité du PCP est un peu plus importante chez les femelles que chez les mâles (Schwetz et al., 1974a, 1974b), de même que les jeunes rats sont plus sensibles que les rats adultes (Schwetz et al., 1978).
Voie cutanée
FDTE/VTR Importer La toxicité du PCP par voie cutanée a été étudiée uniquement chez le rat et le lapin. Alors que le PCP est plus toxique chez le rat par voie orale que par contact cutané, les deux voies sont considérées équivalentes dans les deux espèces lors de l’administration des sels Na-PCP (Deichmann et al., 1942).
Synthèse
FDTE/VTR Importer Chez l’animal, l’ingestion de doses élevées de PCP entraîne rapidement la mort par arrêt cardiaque. Par inhalation, le PCP est plus toxique que par voie orale. Les impuretés des solutions de PCP peuvent également intervenir dans la toxicité.
Toxicité à doses répétées
Effets généraux
Généralités
FDTE/VTR Importer La voie principale d’exposition au PCP en atmosphère professionnelle est l’inhalation. Suivent des contaminations par voie cutanée et plus rarement la voie orale, par l’eau de boisson ou des aliments contaminés. Il existe peu de données chez l’homme sur la toxicité chronique du PCP ou, lorsqu’elles existent, il est impossible de dissocier la toxicité du PCP de celle de ses contaminants.
Chez l'homme
Inhalation
FDTE/VTR Importer L’inhalation chronique de PCP (non purifié) se traduit au niveau systémique chez l’homme par une inflammation du tractus respiratoire, l’apparition de bronchites et une anémie aplasique (Klemmer et al., 1980 ; Roberts, 1981, 1990). Sans que les niveaux d’exposition aient pu être contrôlés, chez des travailleurs une corrélation entre une diminution de la fonction rénale et l’augmentation du niveau sérique de PCP de 5,1 ppm a été établie avec un retour à des valeurs normales à l’arrêt de l’exposition. Une diminution de la clairance de la phosphocréatine est observée (Begley et al., 1977).
Les poussières de PCP et de ses sels sodiques sont particulièrement irritantes pour le nez et les yeux aux concentrations supérieures à 1 mg.m-3 (0,09 ppm).
Dans l’industrie du traitement du bois, de nombreux cas d’inflammation de la peau accompagnés de fortes éruptions cutanées, ainsi que des conjonctivites et des sinusites ont été observés (Klemmer et al., 1980). Dans une cohorte regroupant 293 salariés de l’industrie du bois employés entre 1970 et 1990, des associations positives du risque de maladies respiratoires chroniques (OR 3,04 : IC95% [1,46-6,33]) et de diarrhées récurrentes (OR 2,68 : IC95% [1,46-6,33]) ont été décrites chez les sujets exposés au PCP (n=116) (identifiés à partir d’une matrice emploi-exposition) par comparaison aux sujets non exposés (n=177) (McLean et al., 2009 ). Les auteurs ont également relevé des augmentations du risque de développer de l’eczéma, des désordres thyroïdiens, de la fièvre persistante et un état nauséeux parmi les salariés du groupe le plus exposé (n=58).
Plusieurs études mentionnent également la forte tendance au développement de chloracné au niveau du visage, de la poitrine et des extrémités (Sehgal et Ghorpade, 1983 ; O'Malley et al., 1990). Ces effets peuvent être associés à des altérations hépatiques qui se traduisent par une élévation de l’excrétion des coproporphyrines dans les urines (Hryhorczuk et al., 1998). De plus, Cheng et al. (1993) constatent une élévation des porphyrines urinaires et des concentrations en acide delta-amino-lévulinique urinaires à la fois chez les travailleurs présentant de la chloracné et ceux qui en sont indemnes, pour des expositions au PCP de qualité technique.
Des effets d’origine neurologique comprenant une léthargie et une tachypnée et un œdème cérébral sont rapportés chez un travailleur exposé à des poussières de PCP (Gray et al., 1985). Ces effets sont secondaires à une hyperthermie.
Plusieurs études rapportent également des effets neurospychiques (augmentation de la fatigue, troubles de la concentration, démotivation, dépression) et des altérations à certains tests neurocomportementaux chez 15 femmes exposées à des concentrations élevées de PCP (moyenne de 43,6 µg.L-1) et de lindane (0,085 µg.L-1) (Peper et al., 1999). De même, une réduction de la vitesse de conduction du nerf moteur médian est rapportée chez des hommes travaillant dans une usine de production de PCP (Cheng et al., 1993). Cette réduction n’est statistiquement significative qu’au sein du sous-groupe exposé au PCP dans une zone où des niveaux élevés de dibenzo-p-dioxines chlorées sont mesurés. A l’inverse, aucune altération de la vitesse de conduction des nerfs sensitifs ou moteurs (cubital et/ou médian) n’est observée chez des ouvriers exposés à des faibles niveaux de PCP de qualité technique (0,0003 – 0,18 mg.m-3)(Triebig et al., 1987). Enfin, une association entre l’exposition chronique au PCP (> 15 ans) et la survenue de la maladie de Parkinson est suspectée mais aucune conclusion n’est possible du fait de nombreuses co-expositions (Seidler et al., 1996).
Ces études concernent toutes des expositions au PCP non purifié, et le doute subsiste sur la part de toxicité qui revient au PCP ou aux impuretés.
Voie orale
FDTE/VTR Importer Par voie orale, il n’existe pas de données exploitables chez l’homme.
Voie cutanée
FDTE/VTR Importer En général, la contamination par voie cutanée ne peut pas être dissociée de la contamination par inhalation et les effets systémiques sont comparables à ceux décrits ci-dessus.
Synthèse
FDTE/VTR Importer Chez l’homme, les principaux effets induits par une exposition chronique par inhalation sont des irritations cutanées et des conjonctivites oculaires pouvant être associées ou non à une chloracné. Des altérations hépatiques notamment au niveau du métabolisme des porphyrines et des effets neurologiques avec augmentation de la fatigue, démotivation, dépression sont également identifiés mais il n’est pas certain que ces effets soient imputables au PCP (incertitudes liées à la présence d’impuretés et plus généralement au risque de co-expositions).
Chez l'animal
Inhalation
FDTE/VTR Importer Il n’existe pas dans la littérature de données fiables relatives aux effets systémiques du PCP par inhalation pour des expositions répétées chez l’animal.
Voie orale
FDTE/VTR Importer La toxicité chronique du PCP par voie orale est mieux documentée.
Effets hépatiques :
Les effets hépatiques sont les principaux effets observés lors d’une exposition au PCP par voie orale quelles que soient la durée de l’exposition (sub-chronique ou chronique) et l’espèce étudiée (rongeur, chien).
Chez les rongeurs, des altérations biochimiques, fonctionnelles et histologiques du foie ont été très largement décrites, pour des doses allant de 1 à 30 mg.kg-1.j-1, sur des périodes de 3 à 8 mois (Johnson et al., 1973 ; Kimbrough et Linder, 1978). L’utilisation de PCP purifié réduirait l’importance des lésions observées. Toutefois, un programme de recherche a permis d’observer, pour des expositions de 6 mois, une atteinte similaire du foie à partir de l’utilisation de quatre préparations de PCP différentes en termes de pureté. Ces préparations sont : PCP de qualité technique (tPCP) (pureté de 90,4 %), Dowicide EC-7 (EC-7)(pureté de 91 %), DP-2 (pureté de 91,6 %) ou PCP purifié (pPCP)(pureté de 98,6 %)(NTP, 1989). Les souris B6C3F1 ont été exposées via la nourriture aux doses de 200 – 600 – 1 800 ppm de tPCP, 200 – 600 – 1 200 ppm de EC-7, 200 – 600 -1 200 ppm de DP-2 et 200 – 500 1 500 ppm de pPCP ce qui correspond à des doses estimées de l’ordre de 38 à 458 mg.kg-1.j-1 en fonction du sexe et du degré de pureté de la préparation. Des augmentations statistiquement significatives des poids relatif et absolu du foie sont décrites, pour l’ensemble des doses chez les femelles et pour l’ensemble des doses chez les mâles, pour le tPCP et le pPCP, mais uniquement pour les deux doses le plus élevées pour le DP-2, et la dose la plus élevée pour l’EC-7. Les lésions histologiques hépatiques observées sont une caryomégalie, une cytomégalie, une dégénérescence hépatocellulaire et une nécrose ; elles apparaissent, aussi bien chez les mâles que chez les femelles, et pour l’ensemble des doses et des préparations testées.
Au cours d’autres études, des altérations biochimiques (altérations de l’activité enzymatique hépatique), de la taille (hépatomégalie) et histologiques (hypertrophie, vacuolisation, hyperplasie, fibrose, nécrose et dégénérescence) sont également observées pour des expositions sub-chroniques et chroniques au PCP chez les rongeurs. Aux doses les plus faibles, il s’agit essentiellement d’une induction enzymatique globale. Une augmentation du poids du foie, une hypertrophie hépatocellulaire et une vacuolisation sont observées chez des souris exposées à 41 mg.kg-1.j-1 de PCP pur, pendant 2 semaines (Umemura et al., 1996), chez des rats, pour des doses comprises entre 1 et 40 mg.kg-1.j-1 de PCP technique ou pur pour une exposition sub-chronique (Bernard et al., 2001b ; Blakkey et al., 1998 ; Kimbrough et Linder, 1978 ; Knudsen et al., 1974 ; NTP, 1999), chez les souris exposées à 9 mg.kg-1.j-1 de PCP de qualité technique ou pur de 4 à 12 semaines (Kerkvliet et al., 1982 ; Umemura et al., 1996) et chez les porcs, exposés à 10 mg.kg-1.j-1 de PCP pur pendant 30 jours (Greichus et al., 1979).
Ainsi, des souris exposées à des doses de 41 à 200 mg.kg-1.j-1 de PCP (98,6 % de pureté) pendant 2 à 4 semaines présentent une augmentation absolue et relative du poids du foie, du contenu en ADN hépatique, une prolifération des hépatocytes, de l’aspartate aminotransférase sérique (ASAT) et des altérations de l’ADN nucléaire hépatique (Umemura et al., 1996). Dans une autre étude, des rats exposés deux fois par semaine pendant 28 jours à 2 mg.kg-1.j-1 de PCP (pureté > 99 %, pas d’impureté de dioxines détectées) présentent une augmentation légère mais statistiquement significative du poids relatif du foie (Blakkey et al., 1998).
Une étude de 28 jours a été menée chez des rats F344 exposés via la nourriture, aux doses de 200 – 400 - 800 – 1 600 – 3 200 ppm, soit des doses estimées de 20 -40 - 75 – 150 - 270 mg.kg-1.j-1 de PCP (pureté d’environ 99 %, contenant uniquement du tétrachlorophénol comme impureté) (NTP, 1999). Une augmentation significative des poids hépatiques relatif et absolu est observée à toutes les doses. Une dégénérescence des hépatocytes et une hypertrophie centrolobulaire sont rapportées, à partir de 40 mg.kg-1.j-1 chez les mâles et à partir de 75 mg.kg-1.j-1 chez les femelles.
Chez la souris B6C3F1, des expositions au PCP de qualité technique (tPCP) (pureté de 90,4 %) aux doses de 100 – 200 ppm ou à de l’EC-7 (pureté 91 %) aux doses de 100 – 200 – 600 ppm, en continu pendant 2 ans, complètent ces observations. Les altérations hépatiques sont les principaux effets identifiés pour toutes les doses et pour les deux préparations de PCP chez les animaux des deux sexes (NTP, 1989).
Les résultats des études de Kimbrough et Linder (1978), menées chez le rat Sherman, exposé pendant 8 mois, suggèrent que les impuretés dans le PCP de qualité technique pourraient influencer sa toxicité ; cependant d’autres études, qui ont comparé les effets hépatotoxiques du PCP pur et de qualité technique n’ont pas identifié de potentialisation ou d’effet spécifique (Kerkvliet et al., 1982 ; NTP, 1989).
Enfin, chez le chien, des effets sont également rapportés lors d’une exposition de 52 semaines, aux doses de 0 – 1,5 – 3,5 - ou 6,5 mg.kg-1.j-1 de PCP de qualité technique (pureté de 90,9 %) (rapport non publié de Mecler, 1996). Ils correspondent à une insuffisance hépatique avec des lésions histologiques multifocales, une tuméfaction hépatocellulaire modérée, une dégénérescence des hépatocytes, une fibrose, une hyperplasie des canaux biliaires, une hypertrophie hépatocellulaire localisée et une hyperplasie compatible avec une cirrhose.
Effets hormonaux :
Des altérations significatives des niveaux d’hormones thyroïdiennes sont observées lors d’expositions sub-chroniques ou chroniques. Une diminution statistiquement significative des concentrations moyennes en hormone thyroxine T4 et une augmentation statistiquement significative des concentrations moyennes en insuline, sont observées chez les brebis ayant reçu une dose de 2 mg.kg-1.j-1 de PCP (pureté 99,9 %), par gavage, deux fois par semaine, pendant 43 jours. Les concentrations moyennes sont basées sur des échantillons de sang prélevés chaque heure, pendant 6 heures, après 36 jours de traitement au PCP (Rawlings et al., 1998). Ces résultats ont été confirmés dans une autre étude chez des brebis et également sur de jeunes béliers (Beard et al., 1999a ; Beard et al., 1999b).
Dans une étude sur plusieurs générations chez le vison, une diminution statistiquement significative des niveaux de thyroxine sérique est observée chez les mâles de la première génération (F1) et chez les mâles et les femelles de la seconde génération (F2), exposés à 1 mg.kg.-1.j-1 de PCP (pureté non précisée) (Beard et Rawlings, 1998b). Une diminution du poids relatif de la thyroïde est également observée chez les femelles F2.
Effets hématologiques :
Les effets hématologiques semblent être dus en grande partie aux impuretés présentes dans les préparations industrielles de PCP (Johnson et al., 1973). Dans cette étude, il a été observé une diminution statistiquement significative du nombre d’érythrocytes, des niveaux en hémoglobine et du volume cellulaire chez des rats exposés, pendant 90 jours, au PCP de qualité technique via la nourriture. Cependant, une diminution du nombre des globules blancs circulants a également été décrite chez le jeune porc, après l’administration de PCP purifié, pendant 30 jours (Greichus et al., 1979). Des résultats contradictoires sont rapportés chez des rats exposés pendant 12 semaines via la nourriture à des préparations de PCP purifié ne contenant pas de tétrachlorodibenzo-p-dioxines (2,3,7,8-TCDD) et < 0,03 % d’autres dioxines chlorées (Knudsen et al., 1974). Une augmentation de l’hémoglobine et de l’hématocrite, après 6 semaines de traitement, est suivie par une diminution de l’hémoglobine et du nombre d’érythrocytes.
Effets rénaux :
Chez le rat, une exposition aux doses de 3 – 10 – 30 mg.kg-1.j-1 de PCP purifié, pendant 2 ans, induit, chez les femelles, une accumulation de pigments dans les hépatocytes centrolobulaires et dans les cellules épithéliales des tubules proximaux à 10 mg.kg-1.j-1 ainsi qu’une diminution du gain de poids et une augmentation de l’activité de la transaminase glutamo pyruvique (GTP) sérique (Schwetz et al., 1978). Chez les mâles, une accumulation des pigments à la dose de 30 mg.kg-1.j-1 au niveau hépatique et rénal est rapportée. Les mâles apparaissent moins sensibles que les femelles et aucune altération n’est observée à 10 mg.kg-1.j-1. A 30 mg.kg-1.j-1, une accumulation de la pigmentation et une augmentation de l’activité GPT sont rapportées. Cependant, ces pigmentations ne sont pas considérées comme des effets néfastes.
Effets système respiratoire :
Chez les souris, exposées pendant 2 ans à deux préparations de PCP de qualité technique (tPCP) ou Dowcide (EC-7), une inflammation aiguë localisée au niveau de la muqueuse et des métaplasies de l’épithélium olfactif sont observées chez les mâles à 118 mg.kg-1.j-1 et les femelles à 114 mg.kg-1.j-1 d’EC-7 (NTP, 1989). Ces effets ne sont pas retrouvés chez les souris exposées au tPCP.
Effets sur le système immunitaire :
Une étude menée chez des souris exposées, en parallèle, à deux préparations de 25 mg.kg-1.j-1 purifiées ou non de PCP, pendant 10 à 12 semaines, permet de conclure que les impuretés jouent un rôle essentiel mais non exclusif sur le dysfonctionnement du système immunitaire (Kerkvliet et al., 1982). Il s’agit principalement d’une altération des cellules T cytotoxiques. Chez le rat, des altérations de la fonction immunitaire ont également été mises en évidence (Blakkey et al., 1998).
Effets neurologiques :
Chez le rat, l’administration de PCP (pureté non précisée) dans l’eau de boisson entraîne, après 14 semaines, une réduction des niveaux de glutathion dans les tissus nerveux cérébraux (Savolainen et Pekari, 1979).
Dans l’étude du NTP décrite précédemment chez les souris exposées à différentes préparations de PCP, une baisse de l’activité motrice spontanée et de réaction au bruit a été rapportée après 25 semaines de traitement chez les femelles (pour les différentes préparations de PCP : (tPCP) (pureté de 90,4 %), Dowicide EC-7 (EC-7)(pureté de 91 %), DP-2 (pureté de 91,6 %) ou PCP purifié (pPCP)(pureté de 98,6 %)) et les mâles (tPCP uniquement) (NTP, 1989).
Des lésions dégénératives du nerf sciatique ont été rapportée chez des rats exposés au PCP (pureté non précisée) dans l’eau de boisson (à partir de 1 mM pendant 90 jours) (Villena et al., 1992).
Voie cutanée
FDTE/VTR Importer Des rats Sprague Dawley ont été exposés, pendant 13 semaines, aux doses de 0 – 100 – 500 – 1 000 mg.kg-1.j-1 à du PCP de qualité technique (pureté de 88,9 %), par application au niveau dorsal, 6 heures par jour (Osheroff et al., 1994). Des irritations sont observées chez les deux sexes et à toutes les doses. Une dégénérescence hépatique est également rapportée, pour les deux doses les plus élevées, chez les mâles, et à toutes les doses, chez les femelles. Elle est associée à une augmentation statistiquement significative des niveaux d’alanine aminotransférase (ALT) et aspartate aminotransférase (AST) et du poids relatif du foie et des reins. De cette étude, un LOAEL de 500 mg.kg-1.j-1 et un NOAEL de 100 mg.kg-1.j-1 peuvent être déterminés pour les effets hépatiques.
Synthèse
FDTE/VTR Importer Chez l’animal, les effets induits, par une exposition sub-chronique ou chronique au PCP, sont des altérations hépatiques qui comprennent des altérations biochimiques (altérations de l’activité enzymatique hépatique), de taille (hépatomégalie) et histologiques (hypertrophie, vacuolisation, hyperplasie, fibrose, nécrose et dégénérescence). D’autres effets, hormonaux (T4 sérique), hématologiques, rénaux, neurologiques ou sur le système immunitaire, sont également décrits mais il est probable qu’ils soient plus liés aux impuretés qu’au PCP lui-même.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 2 : substance susceptible de provoquer le cancer | 2008 |
| IARC | FDTE/VTR Importer Groupe 1 : l’agent est cancérigène pour l’homme. | 2019 |
| US EPA | FDTE/VTR Importer Classe B1: Substance probablement cancérigène | 2010 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Les effets cancérigènes du PCP chez l’homme sont difficiles à mettre en évidence du fait de nombreuses co-expositions, du manque d’informations relatives à l’exposition ou en raison de la faible incidence des tumeurs induites. Toutefois, dans sa dernière analyse des données, l’IARC a classé le PCP dans la catégorie 1 des agents cancérogènes pour l’homme (IARC, 2019). Cette évaluation repose principalement sur une augmentation du risque de lymphomes non hodgkiniens rapporté dans les quatre études de cohortes disponibles, ainsi que dans plusieurs études cas-témoins indépendantes, réalisées en Suède et en Nouvelle Zélande et brièvement décrites ci-après et qui concernent les salariés de l’industrie du bois et des pesticides.
Deux études cas-témoins rapportent des sarcomes des tissus mous et des lymphomes non Hodgkiniens en Nouvelle Zélande (Smith et al., 1984 ; Pearce et al., 1986a, 1986b, Pearce et al., 1987). Aucune augmentation du risque associé n’est mise en évidence lors de l’exposition au pentachlorophénate de sodium dans les scieries ou les entreprises de bois d’œuvre. De même, une très légère élévation du risque de myélomes multiples est rapportée.
Une association positive avec le lymphome non hodgkinien a également été observée dans une étude cas-témoins en Suède avec un RR de 8,8 (95 %, IC : 3,4 - 24) (Hardell et al., 1994).
Dans une étude menée sur la population suédoise, une augmentation du risque des sarcomes des tissus mous est identifiée sur la base de l’exposition estimée au PCP avec un odds ratio de 3,9 (95 %, IC : 1,2-12,9) (Eriksson et al., 1990).
Un excès d’incidence des cancers de la peau avec un SIR de 2,7 (95 %, IC : 1,2-5,3) des lèvres, de la bouche et du pharynx avec un SIR de 1,6 (95 %, IC : 0,7-3,4) et des leucémies avec un SIR de 2,3 (95 %, IC : 0,9-4,8) est observé chez une cohorte de travailleurs d’une scierie en Finlande (Jäppinen et al., 1989). Compte tenu de la présence de nombreux autres polluants dans ces environnements, il n’est pas possible de conclure à partir de cette étude à la responsabilité du seul PCP.
En 1991, l’étude réalisée sur une cohorte d’hommes employés dans l’industrie du bois (Gilbert et al., 1990) a été jugée inadéquate par l’IARC pour déterminer les effets cancérigènes du PCP chez l’homme. Il existe de nombreux biais, aussi bien dans le choix des sujets que dans les méthodes d’observation et d’analyse.
En 2019, l’IARC a retenu deux grandes études de cohortes, l’une de 25 685 salariés employés dans des scieries au Canada (Demers et al., 2006) et l’autre de 773 salariés exposés au PCP dans l’industrie des pesticides aux Etats-Unis (Collins et al., 2009). Des augmentations significatives de l’incidence des lymphomes non hodgkiniens ont été rapportés aussi bien chez les salariés du bois avec un RR de 1,88 (95 %, IC : 1,08 -3,2) que dans l’industrie des pesticides avec RR de 2,8 (95 %, IC : 1,1 -5,7) pour une exposition cumulée au PCP. Deux études plus petites, rapportent également des associations positives sur des travailleurs de l’industrie des pesticides entre l’exposition au PCP et le lymphome non hodgkinien (Kogevinas et al., 1995 ; Ruder et al., 2011). Le risque de myélome multiple, maintenant classé comme sous-type de lymphome non hodgkinien, a également été montré dans plusieurs études : RR de 4,18 (95 %, IC : 1,4 -12,9) (Demers et al., 2006) et RR de 1,84 (95 %, IC : 0,68 - 4) (Ruder et al., 2011).
Synthèse
FDTE/VTR Importer Plusieurs études de cohortes et cas-témoins permettent d’établir une association entre l’exposition au PCP et le risque de lymphomes non hodgkiniens, ayant conduit l’IARC à classer le PCP comme cancérogène avéré, même si ce lien reste souvent difficile à établir, du fait notamment de nombreuses co-expositions chez les salariés de l’industrie du bois et des pesticides.
Chez l'animal
Toutes voies
FDTE/VTR Importer Les classifications de l’IARC et de l’US EPA reposent sur une étude réalisée chez des souris B6C3F1 des deux sexes exposées par voie orale (NTP, 1989).
Inhalation
FDTE/VTR Importer Il n’existe pas d’étude de cancérogenèse du PCP par inhalation.
Voie orale
FDTE/VTR Importer Cette étude a été menée, par administration par voie orale, de doses de 0, 100 et 200 ppm de deux préparations de PCP : PCP de qualité technique (90,4 % de pureté), noté tPCP, et Dowicide EC-7 (91 % de pureté), noté EC-7 (NTP, 1989). Les souris ont été exposées pendant 2 ans via la nourriture. Les doses reçues ont été estimées à 0 - 18 – 35 mg.kg-1.j-1 pour les mâles et à 0 – 17 – 34 mg.kg-1.j-1 pour les femelles, avec le tPCP, et à 0 – 18 – 37 – 118 mg.kg-1.j-1 pour les mâles et à 0 – 17 – 34 – 114 mg.kg-1.j-1 pour les femelles, avec l’EC-7. L’analyse de la composition exacte du tPCP est : 90,4 % de PCP, 3,8 % de tétrachlorophénol, 3,56 % de nonachloro-hydroxydiphényl éther, 1,91 % d’octachlorohydroxydiphényl éther, 0,47 % d’heptachloro-hydroxydibenzofurane et 0,01 % de trichlorophénol et celle de l’EC-7 est : 91 % de PCP et 9,4 % de tétrachlorophénol. Une augmentation statistiquement significative de l’incidence des adénomes et carcinomes hépatocellulaires est mise en évidence chez les mâles, pour les deux formulations. Une augmentation statistiquement significative est également observée chez les femelles, mais uniquement chez celles traitées à l’EC-7. Une augmentation de l’incidence des phéochromocytomes est mise en évidence chez les mâles, pour les deux formulations, et chez les femelles, exposées à la dose la plus élevée d’EC-7. Pour chacun de ces effets, une relation dose-effet est clairement identifiée. Enfin, les femelles exposées à la dose la plus élevée, pour chacune des deux formulations, présentent une augmentation statiquement significative de l’incidence des hémangiosarcomes de la rate et/ou du foie. L’ensemble de ces résultats est présenté dans le tableau ci-dessous.
Incidences tumorales observées chez les souris exposées 2 ans au PCP technique ou Dowicide EC-7 (NTP, 1989) : 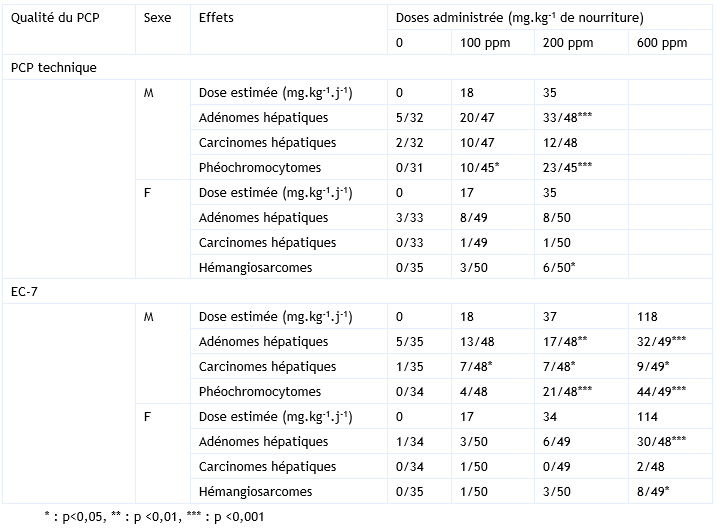
Les rares autres études disponibles sont celles de Innes et al. (Innes et al., 1969) et de Schwetz et al. (1978), pour des expositions par voie orale, et celle du NTIS (1968), pour des expositions sous-cutanées. Ces études ne sont pas retenues par l’IARC dans son évaluation car elles sont jugées incomplètes (IARC, 1991).
Plus récemment, une autre étude a été menée par le NTP chez des rat F344/N mâles et femelles exposés à des doses 0 – 200 – 400 – 600 ppm de PCP (99 % de pureté avec comme seule impureté du tétrachlorophénol) (NTP, 1999). Le PCP est introduit dans la nourriture pendant 105 semaines et les doses de PCP ont été estimées à 0 – 10 – 20 - 30 mg.kg-1.j-1. Un lot supplémentaire a été exposé à la dose de 1 000 ppm (60 mg.kg-1.j-1), pendant 52 semaines (tableau ci-dessous).
L’étude sur 2 ans n’a mis en évidence aucun effet cancérogène chez les mâles et femelles exposés jusqu’à la plus forte dose de 30 mg.kg-1.j-1. Seule une augmentation de l’incidence des mésothéliomes de la tunique vaginale testiculaire et des carcinomes des cellules squameuses nasales a été observée dans le lot satellite de mâles exposés pendant 52 semaines à la dose de 60 mg.kg-1.j-1. L’ensemble de ces résultats est synthétisé dans le tableau ci-dessus.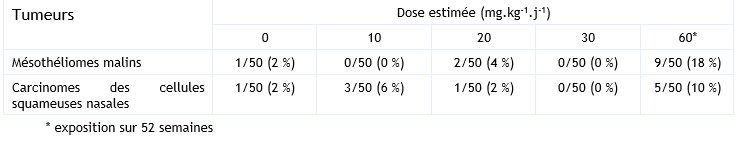
Voie cutanée
FDTE/VTR Importer Un faible effet promoteur tumoral a été décrit chez des souris exposées par voie cutanée à des doses de 2,5 – 50 – 1000 µg de PCP ou tétrachloro-hydroquinone, 2 fois par semaine, pendant 25 semaines, l’initiation tumorale ayant été réalisée au préalable avec le diméthylbenz(a)anthracene (Chang et al., 2002).
Synthèse
FDTE/VTR Importer Chez les rongeurs exposés par voie orale, plusieurs types de tumeurs ont été identifiés qui comprennent des adénomes et carcinomes hépatiques, des phéochromocytomes malins, des mésothéliomes testiculaires malins et des carcinomes des cellules squameuses nasales.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Une augmentation statistiquement significative de l’incidence des chromosomes dicentriques et des fragments acentriques est observée sur des lymphocytes du sang périphérique de travailleurs exposés professionnellement au PCP mais aucune augmentation de la fréquence des échanges de chromatides sœurs n’est mise en évidence (Bauchinger et al., 1982 ; Ziemsen et al., 1987).
Chez l'animal
Toutes voies
FDTE/VTR Importer Si le PCP semble négatif dans la plupart des tests standards de génotoxicité, il semblerait que le PCP puisse générer des espèces réactives de l’oxygène à l’origine d’altérations de l’ADN lors d’expositions prolongées. Ces effets sont identifiés par la formation d’adduits à l’ADN de type de 8-OH-dGuanine hépatiques chez la souris (Umemura et al., 1996 ; Sai-Kato et al., 1995) et le rat (Lin et al., 2002).
In vitro
Organismes eucaryotes
FDTE/VTR Importer Le PCP n’induit pas d’effets dans la plupart des tests de génotoxicité notamment dans le test d’Ames (Seiler, 1991). Des résultats faiblement positifs sont rapportés dans le spot test chez la souris. L’induction d’aberrations chromosomiques dans des cultures cellulaires de rongeurs ou d’homme est observée (IARC, 1991 ; Galloway et al., 1987 ; Fahrig, 1974 ; Tisch et al., 2005). Une faible augmentation des espèces réactives de l’oxygène a été observée sur des lymphocytes humains de sujets sains, exposés in vitro au PCP (0,01 µg.ml-1) (Michalowicz, 2010). Certains métabolites du PCP et plus particulièrement la tétrachloro-p-hydroquinone, la tétrachloro-1,2-hydroquinone, la tétrachloro-p-benzoquinone et tétrachlorocatéchol induisent des cassures simple brin d’ADN dans les tests menés in vitro (Ehrlich, 1990 ; Carstens et al., 1990 ; Lin et al., 2001 ; Puschke et al., 2002). Les effets des tétrahydroquinones sont supprimés en présence d’agent chélateur du fer (déféroxamine) (Cartens et al., 1990 ; Witte et al., 2000).La formation d’adduits (8-OH-dGuanine) et d’espèces réactives de l’oxygène ont été décrits in vitro sur cellules HepG2 avec la tétrachlorobenzoquinone, les effets étant atténués par la présence de N-acétyl-cystéine (anti-oxydant) (Dong et al., 2014). D’un point de vue mécanistique, le PCP agit sur le découplage de la phosphorylation oxydative au niveau de la membrane mitochondriale (chaîne respiratoire) et empêche à terme le métabolisme et la croissance des cellules (White-Stevens, 1971). D’après les données examinées par l’IARC en 2019, le PCP est métaboliquement activé en benzoquinones électrophiles et en semi-quinones, induisant un stress oxydatif. Il conclut par une activité génotoxique et anti-œstrogénique du PCP, ainsi qu’une altération de la voie de signalisation cellulaire, de l’apoptose et de la prolifération cellulaire (IARC, 2019). Il est donc proposé, à ce stade, de retenir, le principe d’une substance cancérogène sans seuil de dose.
Synthèse
FDTE/VTR Importer Les effets génotoxiques observés à partir de tests in vitro impliquent les métabolites réactifs du PCP, à savoir les tétrahydroquinones et tétrabenzoquinones, mettant en jeu la formations de radicaux oxygénés.
Effets sur la reproduction
Chez l'homme
Toutes voies
FDTE/VTR Importer Dans une usine de traitement du bois (exposition au PCP commercial associé à des conservateurs), des troubles importants sur la reproduction (infertilité non expliquée, dérèglements des cycles menstruels, ménopause précoce) ont été observés chez plusieurs femmes (22 sur 90) travaillant depuis 4 à 10 ans. L’augmentation chez ces femmes du niveau sérique de PCP (supérieur à 25 mg.L-1) mais également de lindane (supérieur à 100 ng.L-1) ne permet pas de conclure sur les effets directs et causaux du PCP (Gerhard et al., 1991 ; Gerhard et al., 1998).
Synthèse
FDTE/VTR Importer Chez l’homme, il n’est pas possible d’identifier des effets sur la fertilité du PCP au travers des données épidémiologiques du fait des co-expositions dans les rares études disponibles.
Chez l'animal
Voie orale
FDTE/VTR Importer De nombreuses données suggèrent qu’une exposition chronique au PCP peut induire une diminution de la fertilité, même si le mécanisme ne semble pas lié à des altérations histologiques.
Une étude sur deux générations a été réalisée chez les rats Sprague Dawley exposés à des doses de 0 – 10 – 30 – 60 mg.kg-1.j-1 de PCP de qualité technique (pureté de 88,9 %) administré par gavage, 7 jours par semaine, 70 jours avant l’accouplement, pendant la gestation et la lactation (Beard et al., 1997 ; Beard et Rawlings, 1998a ; Bernard et al., 2002). Une diminution de la fertilité (diminution statistiquement significative du nombre de rats s’accouplant et du ratio des femelles en gestation par rapport au nombre de rats en cohabitation) est observée chez les rats de la première génération (F1) exposés à la dose de 60 mg.kg-1.j-1. Une diminution statistiquement significative de la numération spermatique et une diminution du poids absolu des testicules, du ratio poids des testicules sur poids du cerveau et une infiltration focale/multifocale de leucocytes dans l’épididyme des rats F1 sont observés à 30 ou 60 mg.kg-1.j-1.
Dans une étude sur deux générations chez le vison, où seules les femelles de génération parentale ont été exposées à 1 mg.kg-1.j-1 de PCP (pureté non précisée) pendant 3 semaines avant l’accouplement puis au cours de la gestation et de la lactation, une diminution de la proportion des femelles acceptant un deuxième accouplement et de la proportion des femelles mettant bas a été rapportée (Beard et al., 1997). Aucun effet sur la proportion des femelles acceptant un premier accouplement ou sur la proportion des femelles présentant des sites d’implantation n’a été observé. Une augmentation de la sévérité des kystes utérins est également rapportée. L’étude de la progéniture F1, exposée après sevrage à la même dose de 1 mg.kg-1.j-1 de PCP a permis d’observer chez les mâles, une hyperplasie sévère des cellules interstitielles des testicules et une hyperplasie kystique de la prostate, avec une incidence statistiquement significative (Beard et Rawlings, 1998a). Ces effets se sont accompagnés d’une diminution statistiquement significative de la sécrétion de la thyroxine (T4) sérique chez les mâles de première (F1) et deuxième génération (F2), ainsi que chez les femelles F2. Une diminution du poids relatif de la thyroïde a également été rapportée sur la progéniture, significative uniquement chez les femelles de la seconde génération. De cette étude, un LOAEL de 1 mg.kg-1.j-1 est déterminé pour les effets sur la reproduction.
Chez le mouton, une dégénérescence focale des tubules séminifères et une diminution de la densité spermatique dans l’épididyme sont observées lors d’exposition à 1 mg.kg-1.j-1 de PCP (pureté non précisée), introduit dans la nourriture, pendant la gestation, la lactation et 20 jours après la naissance (Beard et al., 1999a ; Beard et al., 1999b ; Beard et Rawlings, 1999).
Enfin, une dégénérescence, légère à marquée, des cellules germinales et une absence de spermatozoïdes dans les tubes séminifères sont observées chez des rats, exposés à 270 mg.kg-1.j-1 de PCP pur, via la nourriture, pendant 28 jours (Chhabra et al., 1999 ; NTP, 1999). Aucune altération histologique des organes de la reproduction n’est observée chez les rats, mâles ou femelles, exposés à 30 mg.kg-1.j-1 de PCP pur dans la nourriture pendant 2 ans.
Synthèse
FDTE/VTR Importer Chez l’animal, le PCP atteint les organes sexuels chez les mâles (testicules, prostate, épididymes) et réduit la production de spermatozoïdes. Chez les femelles, le PCP semble agir sur le comportement sexuel et entraîne la formation de kystes utérins.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
Chez l'homme
Toutes voies
FDTE/VTR Importer L’analyse de différents composés, dont le PCP, dans le plasma ombilical a révélé des concentrations moyennes de PCP plasmatique de 1 670 pg.g-1 (628-7 680 pg.g-1). Ces résultats suggèrent que le PCP pourrait altérer le statut des hormones thyroïdiennes chez les nouveau-nés, pouvant être à l’origine des effets neurodéveloppementaux chez les enfants. Mais la part des effets de chacun des composés identifiés n’est pas clairement établie (Sandau et al., 2002).
Chez l’homme, les rares études disponibles ne permettent pas d’identifier d’effet du PCP sur le développement.
Chez l'animal
Voie orale
FDTE/VTR Importer Des rats femelles ont été exposés au PCP purifié (pPCP) (pureté : > 98 %) ou de qualité technique (tPCP) (pureté : 88,4 %) en solution dans de l’huile de maïs à des doses de 0 – 5 – 15 - 30 - 50 mg.kg-1.j-1 du 6ème au 15ème jour de la gestation (Schwetz et al., 1974a). Une diminution statistiquement significative du gain de poids des mères est mesurée aux doses de 30 et 50 mg.kg-1.j-1 pour les deux qualités de PCP. Aucun autre signe de toxicité maternelle n’est rapporté. Une augmentation significative du nombre de résorptions est observée à 15, 30 et 50 mg.kg-1.j-1 pour le tPCP et aux doses de 30 et 50 mg.kg-1.j-1 pour le pPCP, le taux de résorption des implantations étant de 100 % à la dose de 50 mg.kg-1.j-1. Le sexe ratio est également altéré de manière statistiquement significative à la dose de 30 mg.kg-1.j-1 pour le pPCP et de 50 mg.kg-1.j-1 pour le tPCP avec une majorité de survivants de sexe masculin. Une diminution significative du poids des fœtus à 30 et 50 mg.kg-1.j-1 pour le tPCP et une diminution de la longueur vertex-coccyx à 30 mg.kg-1.j-1 de pPCP sont également notées. Des malformations fœtales sont observées, dès la dose de 15 mg.kg-1.j-1 pour le tPCP et de 5 mg.kg-1.j-1 pour le pPCP. Les effets visibles à la plus faible dose 5 mg.kg-1.j-1 pour le pPCP correspondent à des œdèmes sous-cutanés et des retards d’ossifications au niveau du crâne, alors que de nombreuses anomalies osseuses des vertèbres, des côtes et du sternum ont été observées à la dose supérieure de 15 mg.kg-1.j-1.
Des rats Sprague Dawley ont été exposés aux doses de 0 – 4 – 13 – 43 mg.kg-1.j-1 de pPCP (pureté > 99 %), 181 jours avant l’accouplement et jusqu’au 20ème jour de la gestation (Welsh et al., 1987). Une toxicité maternelle correspondant à un retard de gain de poids est observée à la dose la plus élevée. Des malformations oculaires (« ringed eye ») et des hémorragies vaginales sont rapportées chez les jeunes à 43 mg.kg-1.j-1. Une diminution de la longueur tête-croupe est diminuée de manière dose dépendante aussi bien chez les mâles que chez les femelles pour des doses supérieures à 13 mg.kg-1.j-1. Le nombre de portées présentant au moins deux fœtus avec des altérations du squelette est augmentée à 13 mg.kg-1.j-1.
Plus récemment, des rats Sprague Dawley ont été exposés, par gavage, à des doses de 0 – 10 – 30 – 80 mg.kg-1.j-1 de tPCP (pureté de 88,9 % dans de l’huile de maïs du 6 au 15ème jour de la gestation Bernard et Hoberman, 2001). Les effets rapportés sont de même type que ceux de l’étude de Schwetz et al. (1974a) mais ils sont moins sévères. Les effets sur le développement sont observés à 80 mg.kg-1.j-1 et correspondent à une augmentation de nombre de résorptions, une diminution de la taille des portées et une diminution du poids des fœtus. Une augmentation statistiquement significative de l’incidence des malformations des viscères (hydrocéphalie, hernie du diaphragme, dilatation rénale pelvienne) et du squelette (vertèbres et sternum) sont rapportées à cette dose. Ces effets sont observés pour des doses induisant une toxicité maternelle. Un NOAEL de 30 mg.kg-1.j-1 et un LOAEL de 80 mg.kg-1.j-1 sont proposés pour les effets sur le développement.
A de plus faibles doses de 0,2 et 2 mg.kg-1.j-1 de PCP administrées du début au 8e jour de la gestation chez la souris, une augmentation significative de la mortalité fœtale et une altération de la structure du placenta (villosités choriales) ont été mises en évidence) (Huang et al., 2019 ).
Chez le hamster, l’administration orale de PCP à des doses variant entre 1,25 et 20 mg.kg-1 a conduit à l’observation de morts fœtales dans plusieurs lots (Hinkle, 1973).
Aucun effet sur le développement n’est observé chez les lapins New Zeland, exposés aux doses de 0 – 7,5 – 15 – 30 mg.kg-1.j-1 de PCP (pureté de 88-89 %), administré par gavage, du 6ème au 18ème jour de la gestation (Bernard et al., 2001b). Une toxicité maternelle est observée aux deux doses les plus élevées sans pour autant induire d’effets chez les jeunes. Des NOAEL de 7,5 mg.kg-1.j-1 et 30 mg.kg-1.j-1 ont respectivement été retenus pour la toxicité maternelle et le développement.
Résumé : Chez l’animal, des effets embryotoxiques, fœtotoxiques et tératogènes sont généralement observés aux doses les plus élevées, mais sont variables selon les espèces. Cependant, il ne peut être exclu qu’une partie des effets soit imputables aux impuretés du PCP. Dans ces conditions, le PCP n’est pas classé par l’Union Européenne.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 5.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale au PCP (ATSDR, 2022).
Cette valeur a été établie à partir d’une étude de développement réalisée sur des rats femelles exposés à des doses de 0 – 5 – 15 – 30 – 50 mg.kg-1.j-1 de PCP purifié administré en gavage du 6ème au 15ème jour de la gestation (Schwetz et al., 1974a). Le LOAEL de 5 mg.kg-1.j-1 retenu dans cette étude prend en compte l’augmentation significative d’un retard d’ossification chez les embryons.
Facteurs d’incertitude : Un facteur de 1 000 est appliqué au LOAEL (10 pour l’usage du LOAEL, 10 pour l’extrapolation de l’homme à l’animal, 10 pour la variabilité au sein de la population).
Calcul : 5 mg.kg-1.j-1 x 1/1 000 = 5.10-3 mg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 5.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au PCP (2010).
Cette valeur est établie à partir d’une étude expérimentale chez le chien, exposé aux doses de 0 – 1,5 – 3,5 - ou 6,5 mg.kg-1.j-1 de PCP, de qualité technique (pureté de 90,9 %), pendant 52 semaines (étude non publiée de Mecler, 1996). Cette étude rapporte de nombreuses altérations hépatiques : insuffisance hépatique avec des lésions histologiques multifocales, tuméfaction hépatocellulaire modérée, dégénérescence des hépatocytes, fibrose, hyperplasie des canaux biliaires, hypertrophie hépatocellulaire localisée et hyperplasie compatible avec une cirrhose. Un LOAEL de 1,5 mg.kg-1.j-1 est retenu.
Facteurs d’incertitude : un facteur d’incertitude de 300 a été appliqué qui correspond à un facteur de 3 pour l’utilisation d’un LOAEL, un facteur de 10 pour tenir des variabilités inter-espèces et un facteur de 10 pour tenir compte des variabilités intra-espèces.
Calcul : 1,5 mg.kg-1.j-1 x 1/300 = 5.10-3 mg.kg-1.j-1
Indice de confiance : l’US EPA accorde une confiance moyenne dans l’étude retenue, élevée dans la base de données et moyenne dans la valeur proposée.
Effets sans seuil - Exposition chronique par inhalation :
L'OEHHA propose un ERUi de 5,1.10-6 (µg.m-3)-1 pour une exposition par inhalation au PCP (OEHHA, 2011).
L’ERUi a été extrapolé à partir de l’ERUo de 1,8.10-2 (mg.kg-1.j-1)-1 de l’OEHHA (cf voie orale présentée plus loin), en utilisant les paramètres par défaut de 70 kg (poids corporel de l'homme adulte) et 20 m3 (volume respiré par jour). La méthode de calcul de l’ERUi n’est pas détaillée. Cet ERUi correspond à une concentration de 2,2 µg.m-3 pour un risque de 10-5 et de 0,22 µg.m-3 pour un risque de 10-6.
Indice de confiance : cet organisme n’attribue pas d’indice de confiance.
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose un ERUo de 0,4 (mg.kg-1.j-1)-1 par voie orale au PCP (2010)
Ces valeurs ont été calculées à partir de l’étude du NTP (1989) ayant conduit à classer le PCP parmi les substances probablement cancérigènes pour l’homme. La relation dose-effet est basée sur l’incidence des adénomes et carcinomes hépatocellulaires, des phéochromocytomes malins, des hémangiomes et hémangiosarcomes chez la souris B6C3F1 mâle et femelle exposée pendant 2 ans au PCP de deux qualités différentes : qualité technique (tPCP) ou Dowcide (EC-7). Sur la base de ces différents types tumoraux, plusieurs BMDL10 (modélisation multi-étapes à partir d’une Benchmark dose) ont été retenus à la fois chez les mâles et les femelles pour les deux préparations de PCP (tableau ).
Les hémangiosarcomes constituent les tumeurs les plus représentatives de l’action du PCP chez l’homme, mais elles ne sont retrouvées que chez la souris femelle. Pour l’établissement de la relation dose-effet, les autres tumeurs ont également été prises en compte.
Le calcul de la dose équivalente chez l’homme est basé sur un ajustement réalisé à partir de l’équivalence :
HED (mg.kg-1.j-1) = dose chez l’animal (mg.kg-1.j-1) x (poids animal/poids humain)0,25
Dose = moyenne dose journalière
Poids animal : 0,037 kg pour les mâles et 0,038 pour les femelles
Poids humain : 70 kg, ainsi qu’un facteur d’ajustement inter-espèce de 0,15.
A partir d’une approche par extrapolation linéaire à faibles doses, des « slope factor » ont été calculés pour chaque type tumoral aussi bien chez les mâles que chez les femelles. La fourchette des valeurs se situe entre 1,7 10-2 et 8,7 10-2 (mg.kg-1.j-1)-1 pour l’EC-7 et entre 4 10-2 et 2,9 10-1 (mg.kg-1.j-1)-1 pour le PCPt.
L’US EPA a retenu une analyse combinée des risques pour le développement de tumeurs hépatiques et des glandes surrénales chez les mâles exposés tPCP avec un slope factor de 0,4.10-1 (mg.kg-1.j-1)-1. Dans la mesure où l’influence du degré de contamination des deux préparations testées, tPCP et EC-7, sur le potentiel cancérigène n’a pas pu être déterminée, l’US EPA a retenu le slope factor le plus sensible de 0,4 (mg.kg-1.j-1)-1 pour le PCP, initialement dérivé du tPCP.
Indice de confiance : US EPA n’a pas attribué d’indice de confiance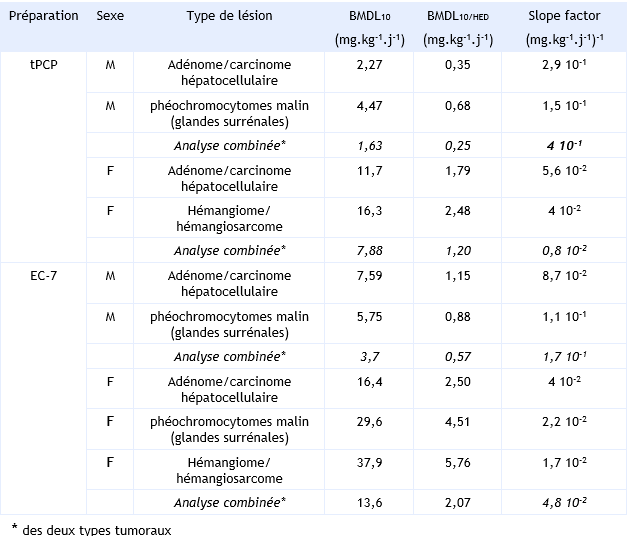
Les hémangiosarcomes constituent les tumeurs les plus représentatives de l’action du PCP chez l’homme, mais elles ne sont retrouvées que chez la souris femelle. Pour l’établissement de la relation dose-effet, les autres tumeurs ont également été prises en compte.
Le calcul de la dose équivalente chez l’homme est basé sur un ajustement réalisé à partir de l’équivalence :
HED (mg.kg-1.j-1) = dose chez l’animal (mg.kg-1.j-1) x (poids animal/poids humain)0,25
Dose = moyenne dose journalière
Poids animal : 0,037 kg pour les mâles et 0,038 pour les femelles
Poids humain : 70 kg, ainsi qu’un facteur d’ajustement inter-espèce de 0,15.
A partir d’une approche par extrapolation linéaire à faibles doses, des « slope factor » ont été calculés pour chaque type tumoral aussi bien chez les mâles que chez les femelles. La fourchette des valeurs se situe entre 1,7 10-2 et 8,7 10-2 (mg.kg-1.j-1)-1 pour l’EC-7 et entre 4 10-2 et 2,9 10-1 (mg.kg-1.j-1)-1 pour le PCPt.
L’US EPA a retenu une analyse combinée des risques pour le développement de tumeurs hépatiques et des glandes surrénales chez les mâles exposés tPCP avec un slope factor de 0,4.10-1 (mg.kg-1.j-1)-1. Dans la mesure où l’influence du degré de contamination des deux préparations testées, tPCP et EC-7, sur le potentiel cancérigène n’a pas pu être déterminée, l’US EPA a retenu le slope factor le plus sensible de 0,4 (mg.kg-1.j-1)-1 pour le PCP, initialement dérivé du tPCP.
Indice de confiance : US EPA n’a pas attribué d’indice de confiance
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale :
L’INERIS propose de retenir pour une exposition aiguë au PCP par voie orale la VTR aiguë de 5.10-3 mg.kg-1.j-1 de l’ATSDR (2001) mise à jour en 2022 sans modification de la valeur.
Seul l’ATSDR (2001) propose une valeur. La valeur est basée sur une étude de toxicité sur le développement de bonne qualité chez le rat (Schwetz et al., 1974). L’effet critique retenu est un retard d’ossification observé chez les jeunes en absence d’effet chez la mère. Cet effet est recevable au regard des données disponibles. Le choix des facteurs d’incertitude est cohérent.
Indice de confiance : faible du fait des limites du type d’étude (étude de reproduction)
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique au PCP par voie orale la VTR chronique de 5.10-3 mg.kg-1.j-1 de l’US EPA (2010).
Quatre organismes proposent une VTR dans cette catégorie : l’ATSDR (2022), le RIVM (2001), l’OMS (1987) et l’US EPA (2010).
Le RIVM utilise une étude sur la reproduction chez le vison (Beard et Rawling, 1998), alors que l’OMS et l’US EPA et l'ATSDR utilisent des études de toxicité à doses répétées, l’une de 2 ans chez le rat (Schwetz, 1978) pour l’OMS et l’autre de 52 semaines chez le chien (étude non publiée de Mecler, 1996).
L’étude chez le vison est plus récente, mais il s’agit d’une étude de reproduction qui n’utilise qu’une seule valeur de dose et le degré de pureté du PCP n’est pas précisé par les auteurs. L’étude menée chez le rat est plus ancienne et est jugée comme incomplète par les différents organismes qui la citent en référence. Elle utilise du tPCP et il n’est pas exclu que des impuretés du PCP puissent être à l’origine des effets rapportés dans l’étude. De plus, les pigmentations ne sont pas considérées comme des effets néfastes.
Le choix d’une étude de toxicité chronique semble plus cohérent dans la démarche de construction de VTR chronique que celui d’une étude sur la reproduction. Par conséquent, la valeur d du RIVM ne est pas retenue.
L’US EPA qui s'est appuyé sur étude de toxicité chronique chez le chien de bonne qualité, étude également retenue par l'ATSDR en 2022 lors de la mise à jour de ses MRL. L’effet critique retenu est la toxicité hépatique qui est l’organe cible de la toxicité du PCP. Bien que cette étude n’ait pas été publiée, l’US EPA, mandataire de l’étude, a pu bénéficier d’une connaissance exhaustive des résultats. La démarche de l’US EPA dans le calcul de la VTR est cohérente et transparente, le choix des facteurs d’incertitude est justifié et adapté. Cette valeur de l’US EPA est retenue.
Indice de confiance : moyen en raison de la non-publication de l’étude clé et de la cohérence des indices de confiances élaborés par l’organisme lui-même.
Effets sans seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir pour une exposition chronique au PCP par inhalation la VTR chronique de 5,1.10-6 (µg.m-3)-1 de l’OEHHA (2011).
Cette valeur est issue de celle de l’OEHHA qui est la seule VTR disponible.
Elle est construite par extrapolation à partir de la valeur pour des expositions par voie orale, établie à partir d’une étude de cancérogénèse par voie orale chez la souris. Si cette étude a également été retenue pour la voie orale, l’analyse combinée des différents types tumoraux a conduit l’INERIS à retenir la valeur de l’US EPA plutôt que celle de l’OEHHA construite uniquement sur l’incidence des tumeurs hépatiques.
Cette valeur de 5,1.10-6 (µg.m-3)-1 correspond à une concentration de 2,2 µg.m-3 pour un excès de risque de 10-5 et une concentration de 0,22 µg.m-3 pour un excès de risque de 10-6.
Indice de confiance : par défaut du fait de l’extrapolation voie à voie de la VTR qui n’est pas retenue pour la voie orale.
Effets sans seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique au PCP par voie orale la VTR chronique de 0,4 (mg.kg-1.j-1)-1 de l’US EPA.
Deux VTR sont proposées par l’OEHHA (2011) et l’US EPA (2010), toutes deux basées sur la même étude de cancérogénèse chez la souris (NTP, 1989). Les effets critiques retenus sont l’augmentation de l’incidence des adénomes et carcinomes hépatiques et/ou des glandes surrénales.
L’OEHHA a fait le choix de construire sa valeur à partir des tumeurs hépatiques observées chez les souris mâles qui représentent l’indicateur le plus sensible, alors que l’US EPA a adopté une analyse combinée des différents types tumoraux dans la construction de sa valeur. Ce choix est justifié par une forte incidence de différents sites tumoraux qui peuvent survenir indépendamment l’un de l’autre, la prise en compte d’un site pourrait conduire selon l’US EPA à une sous-estimation du risque cancérigène.
Les calculs proposés par l’US EPA sont très détaillés, alors que ceux de l’OEHHA manquent de transparence.
La valeur de l’US EPA, plus protectrice, est retenue.
Cette valeur de 0,4 (mg.kg-1.j-1)-1 correspond à une dose de 2,5.10-5 mg.kg-1.j-1 pour un excès de risque de 10-5 et à 2,5.10-6 mg.kg-1.j-1 pour un excès de risque de 10-6.
Indice de confiance : élevé en raison de la qualité de l’étude, de la transparence et de la cohérence de la construction.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose un MRL de 5.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au PCP (ATSDR, 2022).
Cette valeur est établie à partir d'une étude chez le chien exposé pendant 1 an aux doses de 0, 1,5, 3,5 et 6,5 mg.kg-1.j-1 de pentachlorophénol technique. De cette étude, une LOAEL de 1,5 mg/kg/jour a été déterminée pour une inflammation chronique minimale du foie (EPA, 1997)
Facteurs d’incertitude : un facteur d'incertitude de 300 (3 pour l'utilisation d'une LOAEL minimale, 10 pour l'extrapolation de l'animal à l'homme et 10 pour la variabilité humaine).
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L’OMS propose une DJT de 3.10-3 mg.kg-1 de poids corporel pour une exposition chronique par voie orale au PCP (OMS IPCS, 1987).
Cette valeur est établie à partir d’une étude expérimentale chez le rat exposé pendant 2 ans aux doses de 3 – 10 – 30 mg.kg-1.j-1 de PCP (pureté non précisée) dans la nourriture (Schwetz, 1978). De cette étude, un NOAEL de 3 mg.kg-1.j-1 a été déterminé pour l’incidence de la pigmentation du foie et des reins chez le rat.
Facteurs d’incertitude : un facteur d’incertitude de 1 000 qui prend en compte un facteur de 100 pour les variations intra- et interspécifiques et 10 pour le risque de cancérogénicité.
Calcul : 3 mg.kg-1.j-1 x 1/1 000 = 3.10-3 mg.kg-1
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Le RIVM propose une TDI de 3.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au PCP (Baars et al., 2001).
Chez le vison, une diminution plasmatique du taux d’hormone thyroïdienne (T4) a pu être observée chez des nouveau-nés de première et deuxième générations dont les mères avaient reçu du PCP par voie alimentaire (Beard et Rawling, 1998). Dans cette étude, un LOAEL de 1 mg.kg-1.j-1 a été défini.
Facteurs d’incertitude : un facteur de 300 a été appliqué pour tenir compte du fait que le MRL a été établi à partir d’un LOAEL mais pour des effets mineurs (facteur 3), de l’extrapolation de l’homme à l’animal (facteur 10), de la variabilité intra-espèce (facteur 10).
Calcul : 1 mg.kg-1.j-1 x 1/300 = 0,003 mg.kg-1.j-1
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est moyenne.
Effets sans seuil - Exposition chronique par voie orale :
L'OEHHA propose un ERUo de 8,1.10-2 (mg.kg-1.j-1)-1 pour une exposition par voie orale au PCP (OEHHA, 2011).
Cette valeur a été estimée à partir d'une étude de cancérogénèse chez la souris exposée au PCP dans la nourriture pendant 2 ans (NTP, 1989). Deux qualités de PCP ont été utilisées : une qualité technique contenant des impuretés type dioxines et furanes, et une qualité dite EC-7 moins contaminée. Une augmentation dose-dépendante de l'incidence de tumeurs du foie et des surrénales a été observée chez les mâles et les femelles.
Incidences des tumeurs surrénaliennes et hépatiques chez les souris exposés 2 ans au PCP technique ou EC-7 dans l’étude du NTP, 1989 et retenues par l’OEHHA (2011) :
Un slope factor de 8,1.10-2 (mg.kg-1.j-1)-1 a été calculé à partir de ces données, sur la base des tumeurs hépatiques chez la souris mâle, à l'aide d'un modèle multiétape linéarisé (les détails du calcul ne sont pas disponibles).
Indice de confiance : cet organisme n’attribue pas d’indice de confiance.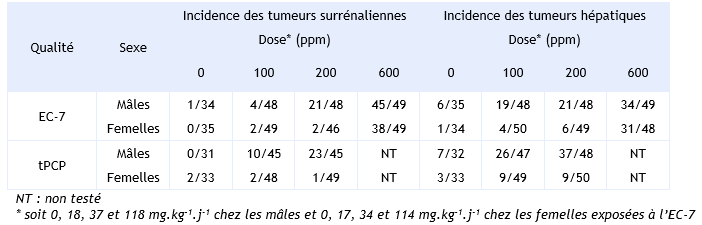
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Le PCP est une substance prioritaire N°27 selon la Directive Cadre sur l’Eau (DCE) (état chimique). Pour chacune de ces substances prioritaires des Normes de Qualité Environnementales (NQE) sont définies au niveau Européen. La méthodologie ainsi que les données utilisées pour le calcul de ces NQE sont présentées dans des fiches détaillées. Les informations en lien avec l’écotoxicité du PCP présentées dans cette rubrique en sont extraites (EC, 2011).
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë et chronique :
De nombreuses données d’écotoxicité sont rapportées dans la fiche EQS (EC, 2011). Ces résultats couvrent un nombre important d’espèces appartenant à différents niveaux trophiques, que ce soit en exposition aigues ou chronique. Des NOEC sont disponibles pour 10 groupe taxonomiques différents (eau douce + eau marine). Pour un même niveau trophique, la sensibilité des espèces marines semble comparable à celles d’eau douce. Les espèces les plus sensibles sont des espèces d’eau douce. Le minimum de données requis étant atteint, la méthode statistique (SSD) est appliquée pour le calcul des PNEC eau douce et marine.
Il a été constaté que la toxicité est largement dépendante du pH dans la matrice testée. La toxicité aiguë du PCP a été étudiée aux pH 4, 6 et 9 chez Chironomus riparius ; cette expérience a montré que la toxicité était maximale à pH = 4, et minimale à pH = 9. Le différentiel de toxicité a été attribué aux variations de pénétration de la substance dans l'organisme testé, puisqu'à pH = 4, le PCP est totalement sous forme protonée donc lipophile. À l'inverse, à pH = 9, le PCP est totalement ionisé ce qui réduit le potentiel de pénétration chez l'organisme, et réduit du même coup les potentiels d'accumulation et d'effets toxiques (Fisher et Wadleigh, 1986).
Sédiments d'eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë et chronique: Aucune donnée d’écotoxicité sur organisme benthique n’est disponible pour le PCP.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité aiguë et chronique: Les résultats d’essais d’écotoxicité sur organismes du sol sur lesquels est basée le seuil proposé par le RIVM ne sont pas détaillés dans la source disponible consultée.
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau)
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes de la colonne d’eau.
Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :
PNECeau douce et marine = 0,35 µg.L-1

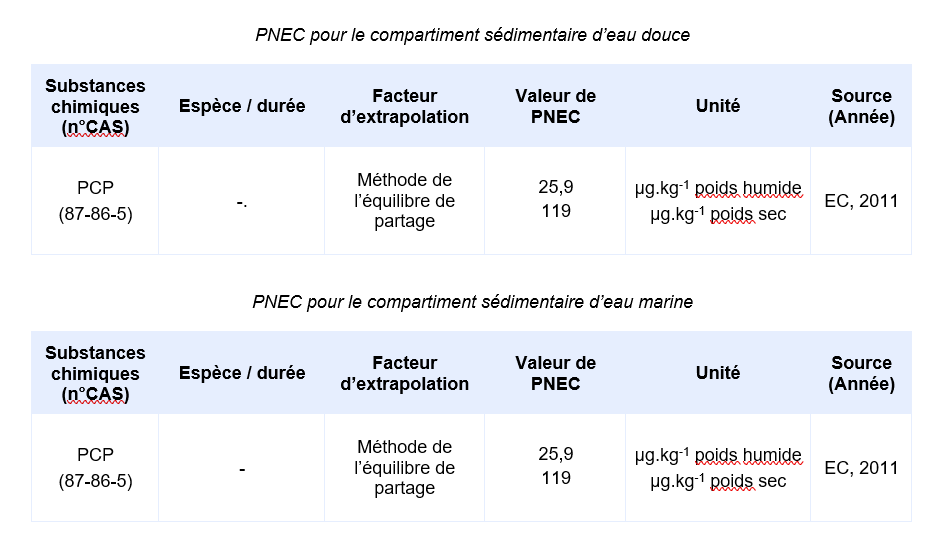
Valeurs seuil pour la protection des organismes benthiques
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes benthiques.
Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :
PNEC sédiment eau douce et marine = 25,9 µg.kg-1 poids humide (119 µg.kg-1 poids sec)
Valeur seuil pour la protection des organismes terrestres:
Compte-tenu des informations disponibles, l’INERIS propose de retenir la valeur seuil proposée par le RIVM à 12 mg.kg-1 poids sec.
Organismes prédateurs (par empoisonnement secondaire):
Compte-tenu du potentiel de bioaccumulation (BCF = 1 000, poisson), l’empoisonnement secondaire des prédateurs par la consommation de proie contaminée doit être considéré.
La valeur ci-dessous a été déterminée dans le contexte de la Directive Cadre sur l’Eau (EC, 2011) et ne doit pas être dépassée pour la protection des organismes prédateurs.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Le PCP est une substance dangereuse prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE, transposée par l’arrêté du 27 juillet 2015).
Elle est réglementée au niveau européen (substance de l’état chimique) par une Norme de Qualité Environnementale, ou NQE, définie comme la « concentration d’un polluant ou d'un groupe de polluants dans l'eau, les sédiments ou le biote qui ne doit pas être dépassée, afin de protéger la santé humaine et l'environnement ».
En pratique, la NQE est la norme de qualité la plus basse parmi 5 objectifs de protection couvrant la protection des organismes aquatique de la colonne d’eau, les organismes sédimentaires, les prédateurs se nourrissant dans les milieux aquatiques, et l’homme via la consommation de produit de la pêche ou d’eau de boisson. La détermination de ces normes suit une méthodologie spécifique qui a été élaborée au niveau européen (Technical Guidance For Deriving Environmental Quality Standards) (EC, 2018). 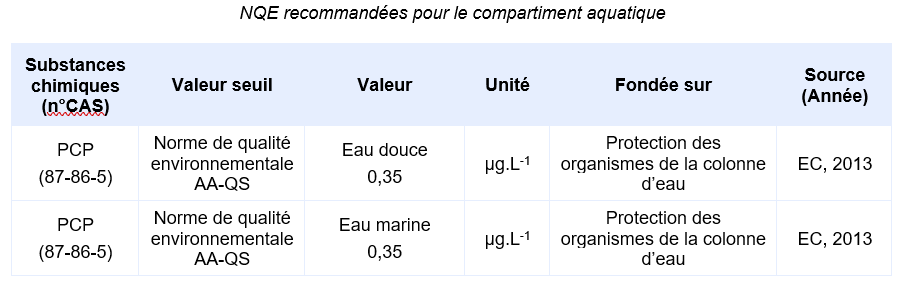
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 87-86-5 |
|---|---|
| SANDRE | 1235 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Interdit dans les produits pour le grand public depuis 1992 (IEP, 2002). L'usage du PCP comme produit phytosanitaire n'est plus autorisé depuis 2003 (ACTA, 2004). Les réglementations européennes ont progressivement mais très fortement réduit les possibilités d'usage du PCP et de ses sels et esters. (Directive 91/173/CE puis Directive 99/51/CE). Actuellement, le seul usage autorisé est un usage professionnel, uniquement dans les cas suivants :
De plus cette autorisation est une mesure dérogatoire qui bénéficie à la France, l'Irlande, le Portugal, l'Espagne et le Royaume Uni, et qui expire fin 2008. Ainsi, à partir de 2009, le PCP, ses sels et ses esters ne devront plus être présents à des concentrations supérieures à 0,1 % dans toute préparation mise sur le marché. Les pays signataires de la Convention OSPAR se sont engagés collectivement à demander à l'UE qu'elle bannisse à partir de 2008 l'importation de produits contenant des PCP. Si cette mesure était prise, il n'y aurait plus théoriquement de rejets possibles dans les milieux aquatiques de l'UE autres que ceux résultant des apports atmosphériques et des PCP déjà présents dans les matériaux et les milieux en Europe. |
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Il n'y a pas de production de PCP ni de NaPCP en Europe depuis 1992.
Il n'y a pas de production de PCPL en France (mais ce composé serait encore produit en Europe par un site d'estérification du PCP en Grande Bretagne). Le PCP a été produit en France dans les années 1980 par Rhône Poulenc en région lyonnaise (FAO/UNEP, 1996).
Utilisations
Usages actuels
FTE 2005 Importer
Les importations de PCP en France ont été de 126 tonnes en 1996, soit un tiers des importations totales dans l'UE. (OSPAR, 2001)
Les importations de NaPCP en France en 1996 ont atteint entre 5 et 10 tonnes soit entre 10 et 20 % du total des importations pour l'UE.
Des données d'exportation vers l'Europe par deux producteurs européens à des dates plus récentes, suggèrent que ces quantités ont du fortement baisser depuis (OSPAR, 2001).
Plusieurs sources indiquent un usage déclinant, certaines évoquent un abandon qui n'est pas cependant vérifié.
Les usages qui subsistent éventuellement à l'heure actuelle sont les suivants :
Traitement du bois contre la coloration de l'aubier causée par des champignons (traitement « anti-bleu »)
Ces attaques causent une coloration bleue verte du bois qui diminue sa valeur commerciale.
Le bois de pin dans les Landes est ou a été traité avec du NaPCP (produit commercial « ALBAPIN »). Le NaPCP était utilisé pour protéger le bois pour palettes jetables, le bois pour construction, le bois pour clôtures, mais ces usages auraient été abandonnés aujourd'hui. (OSPAR, 2001).
Le pentachlorophénol était encore utilisé en 1994 (au plus 100 t) mais en très fort déclin depuis plus d'une vingtaine d'années (ADEME, 1998)
Ces usages auraient représenté au plus 2 tonnes de PCP dans toute l'UE entre 1994 et 1996 (IEP, 2002) et (OKOPOL, 2003).
On peut conclure, avec (Chanrion) que le PCP n'est plus utilisé pour la préservation du bois en France.
Traitement de maçonneries et de bois dégradés dans des bâtiments historiques et culturels
Il n'a pas été possible de rassembler des informations dans le cadre de cette étude.
Protection des textiles
Le PCPL pourrait encore être utilisé en protection des textiles dans un contexte d'emploi militaire (tentes, bâches), ou pour des bâches de poids lourds en France.(OSPAR, 2001). Cette utilisation, notamment pour les articles militaires, est confirmée par l'Union des Industries Textiles.
Conservateur/désinfectant
Un distributeur de produits chimiques français proposait le pentachlorophénol dans sa gamme « détergence » en 2003, mais a cessé la distribution en 2004.
Protection des peaux dans l'industrie de la tannerie
FTE 2005 Importer
A priori le PCP ne serait plus que très peu utilisé en Europe, voire abandonné (Commission européenne, 2003a)
Pesticide, herbicide
FTE 2005 Importer
Le PCP a été utilisé comme biocide dans des circuits d'eau industriels (UNECE, 2003).
Usage domestique pour la préservation du bois dans les intérieurs
FTE 2005 Importer
Si des particuliers détiennent toujours des stocks d'anciens produits, des rejets restent encore possible (également via la mise en décharge de matériaux ayant été traité avec du PCP).
Peintures anti-fouling
FTE 2005 Importer
Le PCP a été un composant de peintures marines « anti fouling » (OKOPOL, 2003)
Huiles minérales
FTE 2005 Importer
Le PCP a été utilisé comme additif dans des huiles minérales pour moteurs au moins jusque dans les années 1980 en Europe (UNEP, 2004).
Rejets dans l’environnement
Rejets dans l'environnement
FTE 2005 Importer
Utilisation et lavage de textiles traités au PCPL
Le processus de dégradation du PCPL en PCP est très long et peut prendre une voire plusieurs dizaines d'années. Ce type de rejets est certainement faible mais se prolonger longtemps après l'interdiction du PCPL qui interviendra en 2008.
Ruissellement sur des matériaux en bois
Ruissellement sur des matériaux en bois ayant été traités (sur site : bâtiments, traverses de voies ferrées, poteaux, etc. ou matériaux dans des décharges)
Utilisation ou finissage de produits importés
Utilisation ou finissage (tannage, teinture notamment) de produits importés (cuirs, textiles, bois) provenant de pays n'ayant pas interdit l'emploi du PCP et de ses dérivés. L'interdiction d'importations de tels articles traités au PCP n'est envisagée qu'au delà de 2008 et elle serait de toute façon difficile à contrôler, comme le montre l'exemple de l'Allemagne qui a déjà procédé à une telle interdiction (OSPAR, 2001).
Notamment, selon les représentants de la profession textile en France, le PCP serait utilisé comme conservateur du coton durant son transport depuis les zones de production. Le traitement du coton en France peut donc occasionner des rejets de PCP dans les eaux. L'emploi qu PCP pour la préservation du coton et le fait que le PCP est ensuite rejeté lors de sa transformation est également attesté dans (UNEP, 2004) (car il s'agit aussi d'une source de dioxines et furannes).
Il existe un label écologique européen pour le linge de lit et les t shirts, qui exige que le pentachlorophénol et ses composés ne peuvent pas entrer dans le cycle de vie du produit avant son utilisation
Le problème se poserait particulièrement pour le coton (Commission européenne, 2003b)
Les pays suivants hors UE ont totalement banni son usage : Inde2, Indonésie, Nouvelle Zélande. En revanche le produit reste autorisé en Chine, pour les textiles et pour le traitement anti germinatif et antifongique du bois.
Production d'acier
Des émissions de PCP liées à la production d'acier sont attestées dans (Commission européenne, 2001). Une entreprise française figure en effet dans le registre EPER avec des émissions de PCP, mais après consultation de cette entreprise, il semble qu'il s'agisse d'une confusion avec les phénols lors de la saisie.
Incinération de déchets
Le PCP peut être émis lors de l'incinération de déchets contenant des produits chlorés, notamment du PVC (UNECE, 2003)
Métabolisation d'autres molécules organochlorées
Une source diffuse peut être la métabolisation d'autres molécules organochlorées (lindane, hexachlorobenzene, pentachlorobenzène, pentachloronitrobenzène) en PCP par des végétaux contaminés.
Déposition atmosphérique
L'importance du transport atmosphérique à longue distance en tant que source de PCP n'est pas connue actuellement. En l'absence de source locale de contamination, il pourrait s'agir d'un facteur non négligeable en termes de présence dans les milieux aquatiques à l'état de traces.
Sources naturelles
Les feux de forets et la combustion du bois en foyer domestique, seraient une source d'émission atmosphérique de PCP (OSPAR, 2001).
Autres
Une étude suédoise a mis en évidence au début des années 90 du PCP présent comme impureté dans de la soude (UNEP, 2004).
Pollutions historiques
Il y a eu plusieurs milliers d'installations utilisant le PCP en France depuis 1950, dans de nombreuses régions françaises. Dans le passé, toutes les précautions n'étaient pas prises pour éviter des fuites accidentelles ou chroniques vers les sols et les eaux souterraines des solutions de traitement et des eaux de lessivage des bois traités.
[2] Discutable, les sources d'information consultées ne sont pas en accord entre elles pour ce pays.
Des études finlandaises et canadiennes ont montré des teneurs en PCP atteignant des concentrations élevées dans les sols (1 000 voire 10 000 mg/kg)
Présence dans les rejets
Le registre européen des émissions EPER ne signale pas d'émissions dans l'eau pour les installations IPPC en France, ni en Europe, et un seul site émettant des PCP dans l'air, situé en France, mais il s'agit probablement d'une erreur (cf. le paragraphe 13.2.6.4, 'Production d'acier').
Le registre EPER ne couvre cependant pas certaines des installations pouvant émettre des PCP, comme celles traitant du bois.
Les émissions atmosphériques de NaPCP dues au traitement du bois en France en 1997 auraient été de 350 kg (OSPAR).
Dans le cadre de l'action nationale de « recherche et de réduction des rejets de substances dangereuses dans l'eau par les installations classées » du MEDD, le pentachlorophénol est recherché dans les rejets d'un grand nombre d'installations en France. Les premiers résultats disponibles en France semblent indiquer que les rejets sont très faibles (total de 0,58 g.j-1 en 2004 pour la Région Champagne Ardennes).
Présence dans les eaux de surface et les sédiments
Il n' a pas été possible de mener une étude complète sur la présence de pentachlorophénol dans les eaux en France. Cependant, des recherches sur les plus grands cours d'eau du bassin Rhin Meuse montrent que le PCP n'y est pas détecté.
Perspectives de réduction
Réduction des rejets
Traitement des rejets dans l'industrie chimique
FTE 2005 Importer
D'après le BREF sur les produits chimiques de base, les concentrations de PCP dans les rejets de l'industrie chimique, après traitement, associées à l'emploi des MTD, sont inférieures à 1 Vg.l-1 (Commission européenne, 2002).
Alternatives aux usages
Produits de substitution
FTE 2005 Importer
Traitement du bois
- créosote,
- CCA (chrome, cuivre, arsenic),
- coco ammonium chloride,
- chlorure de benzalkonium,
- dichlofluanide,
- propiconazole,
- autres…
Tannerie
- thiobenzothiazoles,
- p chlorometacrésol,
- méthylène bis thiocyanate,
- isothiazolone.
Tannerie et textiles banals
D'après (UNEP, 2004), le PCP a été remplacé en Allemagne par les produits suivants :
- phénylphénol (oPP; CAS No. 90 43 7),
- 4 chloro 3 méthylphénol (CMK; CAS No. 59 50 7),
- 2 n octyl 4 isothiazolin 3 one (OIT, CAS No. 26530 26 1).
Ces composés ne sont pas tous sans effets néfastes sur l'environnement.
Protection des textiles spéciaux (militaires, bâches de transport)
Selon la profession textile, les produits de substitution n'offrent pas des performances comparables (durée de vie très inférieure) et sont plus chers : il y a donc une difficulté potentielle dans ce domaine.
Techniques alternatives
FTE 2005 Importer
Lutte contre la coloration du bois : séchage dans un four, pratiqué dans les pays nordiques. (OSPAR)
Couverture et imperméabilisation des aires de traitement et de stockage du bois.
Bilan environnemental et sanitaire des alternatives
FTE 2005 Importer
Traitement du bois
Certaines des alternatives évoquées ci dessus présentent de façon évidente des inconvénients majeurs qui font douter qu'ils constitueraient une solution durable :
- Créosote : source de HAP (notamment contient en assez fortes proportion naphtalène, phénanthrène, anthracène), qui est également une substance dangereuse prioritaire de la DCE.3
- Dichlofluanide : classé très toxique pour les organismes aquatiques.
- Propiconazole : également très toxique pour les organismes aquatiques (R50 53)
- Isothiazolone : également très toxique pour les organismes aquatiques (R50 53)
Traitement du cuir :
Le p chlorométacrésol et les thiobenzothiazoles sont des produits fortement toxiques (Commission européenne, 2003a)
[3] On peut se reporter à la fiche correspondante dans le présent rapport.
Tannerie et textiles
L'o phénylphénol et le 4 chloro 3 méthylphénol sont classés R50 (très toxiques pour les organismes aquatiques).
On constate donc dans l'ensemble que le plupart des substituts sont très toxiques pour les organismes aquatiques.
Conclusion
FTE 2005 Importer
L'usage du pentachlorophénol a fait l'objet de fortes restrictions en Europe. Il n'est plus produit en France et n'est plus utilisé en France que pour des activités bien particulières, avec notamment le traitement de textiles utilisés par l'armée ou comme bâches dans le transport de marchandises.
Son usage sera totalement restreint en Europe après 2008. Après cette date, quelques difficultés résiduelles pour parvenir à une suppression totale des rejets pourraient encore subsister :
- présence de PCP dans du bois, des produits textiles ou du cuir importés depuis des pays n'en ayant pas banni l'usage ;
- rejets de PCP par des matériaux ayant été anciennement traités au PCP
Concernant l'usage actuel pour les textiles militaires et les bâches, dont la terminaison est prévue pour 2008, la profession estime ne pas disposer aujourd'hui des produits de substitution adéquats. Il y a donc un risque que le problème lié à ce cas particulier ne soit réglé qu'après 2008.
Si le PCP a été remplacé quasiment intégralement, il faut tout de même souligner que la majorité des substituts se caractérisent pas leur forte toxicité pour les organismes aquatiques.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

