Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
O-xylène (95-47-6)
Introduction
Dernière vérification le 29/03/2024
Dans la période transitoire de mise en cohérence des données du portail, les informations présentées pour cette substance peuvent ne pas être totalement à jour. Nous vous invitons à consulter la substance mère de cette famille : Xylène
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
95-47-6
Nom scientifique (FR)
o-Xylène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
202-422-2
Code SANDRE
1292
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C8H10 }\)
Code InChlKey
Code SMILES
c(c(ccc1)C)(c1)C
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H226 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H312 |
|---|---|
| Mention du danger - Texte | Nocif par contact cutané |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Mention du danger - Code | H332 |
|---|---|
| Mention du danger - Texte | Nocif par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
106.16 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
D’une manière générale, la plus grande partie (99,68 %) des xylènes libérés dans l’environnement se retrouve dans l’atmosphère (ATSDR, 2007).
Milieu eau douce
Volatilisation :
Etant donné leur volatilité importante, les xylènes ne sont généralement pas persistants dans les eaux de surface à des concentrations très importantes.
Milieu sédiment eau douce
Adsorption :
Les valeurs de Koc (157 à 317 L.kg-1 selon l'isomère considéré) indiquent que cette substance n'est pas susceptible de s'adsorber fortement sur les particules en suspensions dans l'eau et les sédiments.
Milieu terrestre
Comme dans les eaux superficielles, les xylènes présents à la surface des sols seront pour la plus grande partie volatilisés. Dans des sols plus profonds, les xylènes auront tendance à être lixiviés.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
L'o-xylène s'est avéré être moins biodégradable que la m-xylène ou le p-xylène. Il peut être supposé qu'il est dégradable de façon inhérente, mais des essais de simulation en eau de surface ne sont pas disponibles.
La Commission Européenne propose d'utiliser un temps de demi-vie de 150 jours dans les eaux de surface. (IPCS, 1997 Tabak et al., 1989 E.C., 1996)
Sol : Aucune information valide n’est disponible.
Milieu anaérobie : En 63 jours et en présence de bactéries dénitrifiantes, aucune dégradation du m-xylène et de l’o-xylène n'est observée (Hutchins et al., 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse :
Pas d'information disponible.
Photolyse :
Les isomères du xylène sont facilement dégradés dans l’atmosphère, la photooxydation étant le processus le plus important. Les xylènes ne sont pas détruits directement par photolyse (absence de fonction absorbant les radiations supérieures à 290 nm). L’oxydation atmosphérique des xylènes est rapide, elle a lieu par réaction avec les radicaux libres et principalement les radicaux hydroxyles. En se basant sur des données de concentration de radicaux hydroxyles dans l’air, Brice et Derwent (1978) ont calculé des demi-vies atmosphériques de 2,6 h, 1,5 h et 2,4 h respectivement pour le o, m et p-xylène.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Bioaccumulation :
Un BCF a été mesuré sur Oncorhynchus mykiss après 56 jours d'exposition pour chacun des trois isomères :
Pour le o-xylène : BCF = 14.1 Pour le m-xylène : BCF = 14.8 Pour le p-xylène : BCF = 1.8
Ces BCF indiquent un faible potentiel de bioaccumulation quel que soit l'isomère considéré.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucun résultat d’essai valide n’a pu être trouvé dans la littérature.
Conclusion sur la bioaccumulation
Bioaccumulation :
Un BCF a été mesuré sur Oncorhynchus mykiss après 56 jours d'exposition pour chacun des trois isomères :
Pour le o-xylène : BCF = 14.1 Pour le m-xylène : BCF = 14.8 Pour le p-xylène : BCF = 1.8
Ces BCF indiquent un faible potentiel de bioaccumulation quel que soit l'isomère considéré.
Globalement, un BCF de 15 est utilisé dans la détermination des normes de qualité quel que soit l'isomère considéré. (OECD, 2003)
Bibliographie
Toxicologie
Dernière vérification le 09/12/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2007 ; OMS IPCS, 1997 ; US EPA (IRIS), 2003b; Santé Canada, 2015; ANSES, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique.
Toxicocinétique
Chez l'homme
Absorption
Inhalation :
Le taux de rétention pulmonaire mesuré pour chaque isomère du xylène (m-, o-, p-xylène) est compris entre 62 et 64 % après exposition par voie pulmonaire de volontaires sains aux 3 isomères du xylène à des concentrations comprises entre 196 et 391 mg.m-3 (45-90 ppm) pendant 7 heures (Sedivec et Flek, 1976). Une étude a également montré, chez des individus exposés à des concentrations de m-xylène comprises entre 304 et 957 mg.m-3 (70-220 ppm), que le taux de rétention pulmonaire restait relativement constant (moyenne de 59 %), que les individus soient au repos ou en activité physique (Riihimaki, 1979b). Par contre, l’augmentation de la ventilation pulmonaire durant les exercices physiques est associée à une augmentation du taux des xylènes inhalés (Astrand et al., 1978 ; Riihimaki, 1979b). Ernstgard et al. (2003) ont montré que l’exposition au m-xylène à 200 mg.m-3 pendant 2 heures conduisait à une rétention pulmonaire légèrement plus importante chez la femme que chez l’homme (Ernstgard et al., 2003). Ainsi, les xylènes sont bien absorbés par inhalation chez l’homme.
Voie orale:
Aucune donnée n’est disponible quant à l’absorption de xylène par voie orale chez l’homme.
Voie cutanée:
L’absorption du xylène (liquide ou sous forme de vapeur) par voie cutanée a été également étudiée. Il a été montré qu’elle était beaucoup plus faible que celle mesurée lors d’une exposition par inhalation. Dans une étude menée chez 8 volontaires sains, l’absorption du m-xylène liquide a été mesurée en prenant en compte le taux d'acide m-méthylhippurique (métabolite du m-xylène) présent dans les urines après immersion de la main dans du m-xylène liquide pendant 15 à 20 minutes. Ce taux d’absorption est de 2 µg.cm-² par minute (Engström et al., 1977). Le taux d’absorption par voie cutanée pour les 2 mains est environ de 35 mg et correspond pour le même temps d’absorption à celui mesuré après inhalation de 435 mg.m-3 de xylène (100 ppm).
L’exposition par voie cutanée peut aussi se faire lors d’expositions à des vapeurs de m-xylène ou lors de contact direct avec des solvants (Dutkiewicz et Tyras, 1968 ; Engström et al., 1977 ; Kezic et al., 2000 ; Loizou et al., 1999 ; Riihimaki, 1979b ; Riihimaki et Pfaffli, 1978 ; Riihimaki et Savolainen, 1980). L’absorption de vapeurs de m-xylène à travers la peau a été estimée entre 0,1 et 2 % de la dose inhalée (Kezic et al., 2000 ; Loizou et al., 1999 ; Riihimaki et Pfaffli, 1978). L’étude de Riihimaki et Pfaffli (1978) a montré, chez 2 volontaires sains, que le taux d’absorption est environ de 0,01 µg.cm-² par minute après une exposition à 2 610 mg.m-3 (600 ppm) de m-xylène pendant 3 h30. Le taux de perméation maximal lors de l’absorption de m-xylène à travers la peau a été mesuré après 15 à 25 minutes d’exposition à un flux de 4,9 µg.cm-2. min-1 (soit 46 nmol.cm-2.min-1) (Kezic et al., 2001). Chez l’homme, des sujets ont été exposés à 6 770 ppm de vapeur de m-xylène au niveau de la main et de l’avant-bras. Le flux moyen à travers la peau a été mesuré à 0,091 mg.L-1.h-1 pour 20 minutes d’exposition. Cette valeur chute à 0,061 mg.L-1.h-1 pour 180 minutes d’exposition. En même temps, le flux maximal vers le sang a été mesuré à 0,034 mg.L-1.h-1 après 20 minutes d’exposition et atteint 0,063 mg.L-1.h-1 pour 180 minutes d’exposition. Le taux maximal de perméation des vapeurs de m-xylène est atteint après 90 minutes d’exposition (Kezic et al., 2004).
Distribution
Chez l’homme, les informations concernant la distribution des xylènes dans l’organisme sont succinctes. Néanmoins, il a été constaté la présence de xylène dans le sang d’individus exposés à des concentrations comprises entre 435 et 870 mg.m-3 (100-200 ppm), 15 minutes après le début de l’exposition. Un exercice physique léger augmente la concentration de xylène dans le sang (Ahaghotu et al., 2005 ; Astrand, 1982 ; Astrand et al., 1978). Une analyse post mortem, réalisée chez une femme ayant avalé du xylène, a révélé que le xylène se trouvait dans l’estomac, le foie, les reins, le cerveau, le myocarde, les tissus adipeux et le sang. Les ratios des trois isomères, o-, m- et p-xylène sont respectivement de 3, 5, et 2 au niveau de l’estomac, 3, 6 et 1 dans le sang et 4, 4 et 2 dans les tissus adipeux.
Dans le cerveau, le foie et les reins, l’o-xylène représente 80 % du xylène total (Takatori et al., 1982).
Le m-xylène peut s’accumuler dans l’organisme humain (Riihimaki et al., 1982a ; Riihimaki et al., 1979a ; Riihimaki et al., 1982b).
Métabolisme
Le métabolisme des xylènes qui a lieu majoritairement dans le foie, consiste principalement en l’oxydation de la chaine méthyle mettant en jeu les cytochromes P450 et particulièrement l’isoforme 2E1 (CYP2E1) pour obtenir des alcools méthylbenzyliques, voie métabolique saturable et inductible par lui-même (Tassaneeyakul et al., 1996). La poursuite des étapes d’oxydation va conduire à la formation d’acides méthylbenzoïques qui se conjuguent avec la glycine pour former des acides méthylhippuriques, principaux métabolites excrétés dans les urines (Astrand et al., 1978 ; Norstrom et al., 1989 ; Ogata et al., 1970 ; Ogata et al., 1979 ; Riihimaki et al., 1979a ; Sedivec et Flek, 1976 ; Senczuk et Orlowski, 1978). Cette métabolisation est réalisée quelle que soit la dose absorbée, l’isomère considéré, la voie d’exposition et la durée de l’exposition. Le facteur limitant du métabolisme est la capacité de conjugaison des acides méthylbenzoïques à la glycine, qui serait saturée pour une exposition à 780 ppm au repos ou à 270 ppm en cas d’exercice physique important (INRS, 2021).
À moindre degré, le noyau aromatique des xylènes peut être hydroxylé, entraînant la formation de diméthylphénols ou xylénols. Cette voie est minoritaire : les xylénols représentent moins de 2 % des xylènes métabolisés (INRS, 2021) . Le type de diméthylphénol formé varie en fonction de l’isomère du xylène dont il provient. Ainsi chez l’homme, du 2,3- et du 3,4-diméthylphénol sont retrouvés dans les urines après exposition au o-xylène et du 2,4- ou du 2,5-dimétylphénol après exposition au p-xylène, (Engstrom et al., 1984 ; Sedivec et Flek, 1976).
De très faibles quantités de sulfo- ou glucuronoconjugués des acides méthylbenzoïques sont retrouvés chez l’homme, les dérivés mercapturiques n’étant retrouvés qu’à l’état de traces (Norstrom et al., 1988 ). Dans l’étude de Gonzalez-Reche et al. (2003), l’acide diméthylphénylmercapturique (DPMA) a été détecté dans seulement 9 des 27 échantillons de travailleurs exposés aux xylènes et est apparu à un ratio de 0,0003 % par rapport au métabolite principal, l'acide methylhippurique (Gonzalez-Reche et al., 2003).
Schéma du métabolisme du xylène chez l’humain (INRS, 2021) :

Élimination
Chez l’homme, les xylènes absorbés sont principalement excrétés sous forme de métabolites dans les urines (voir schéma 1). De faibles quantités de xylènes sont excrétées dans l'air exhalé et l’excrétion de xylènes non métabolisés dans les excréments paraît peu importante.
Par inhalation, le xylène est principalement excrété dans les urines. Ainsi, après exposition de volontaires à environ 195 mg.m-3 (soit 45 ppm) de o-xylène, de m-xylène ou de p-xylène pendant 8 heures, 95 à 99 % de la dose inhalée sont excrétés dans les urines sous forme d’acide méthylhippurique alors que 0,1 à 2 % de la dose inhalée sont excrétés dans les urines sous forme de diméthylphénol (Sedivec et Flek, 1976). Les mêmes résultats ont été retrouvés après exposition d’individus à 435 mg.m-3 (100 ppm) de m-xylène pendant 4 heures (Campbell et al., 1988 ; Lauwerys et al., 1978). La clairance rénale du p-xylène est de 2,6 L.kg-1.h-1 pour une exposition à 87 mg.m-3 de p-xylène (20 ppm) et de 1,6 L.kg-1.h-1pour une exposition à 304 mg.m-3 (70 ppm) de p-xylène (Wallen et al., 1985). L’excrétion de l’acide méthylhippurique dans les urines est proportionnelle à la quantité de xylène inhalé (Huang et al., 1994 ; Kawai et al., 1991). Une étude a montré que l’excrétion de l’acide méthylhippurique dans les urines, après inhalation de xylène pendant une semaine, suivait deux phases distinctes. En effet, la demi-vie d’excrétion de l’acide méthylhippurique dans les urines est de 3,6 h pendant les 10 premières heures d’exposition et de 30,1 h pour les 2 jours après l’exposition (Engström et al., 1978). Une faible partie du xylène inhalé peut être exhalée. En effet, après exposition d’individus à 870 mg.m-3 (200 ppm) de xylène (Astrand et al., 1978 ; Riihimaki, 1979b ; Riihimaki et al., 1979a ; Sedivec et Flek, 1976), environ 4 à 5 % de la dose de xylène absorbée dans le poumon sont exhalés sans être transformés. L’exposition au m-xylène (200 mg.m-3 pendant 2 heures) montre qu’il existe de légères différences dans le mécanisme d’élimination entre les hommes et les femmes. Les femmes excrètent 31 % de plus (aire sous la courbe) de m-xylènes non métabolisé dans l’air exhalé que les hommes, alors que les hommes éliminent 37 % de plus d’acide m-méthylhippurique (aire sous la courbe) dans l’urine que les femmes (Ernstgard et al., 2003).
Les modèles PBPK ont estimé que la clairance systémique du m-xylène après inhalation est plus importante (131 L.h-1) que celle estimée pour le o-xylène (116 L.h-1) et pour le p-xylène (119 L.h-1) (Adams et al., 2005).
Par voie orale, le xylène absorbé est principalement excrété dans les urines. Après administration par voie orale de 39 mg.kg-1 de o-xylène ou de m-xylène, les taux d’acide o-méthylhippurique et d’acide m-méthylhippurique retrouvés dans les urines, correspondent respectivement à 33,1 et à 53,1 % de la dose de xylène administrée. En comparaison, la voie d’élimination via la formation d’acide o-toluique glucuronique est mineure (Ogata et al., 1979 ; Ogata et al., 1980).
Chez des sujets masculins, exposés par voie cutanée aux vapeurs de m-xylène (6 770 ppm pendant 3 heures), le xylène est détecté au bout de 10 minutes dans l’air exhalé et sa détection se poursuit après la fin de l’exposition (Kezic et al., 2004).
Les personnes les plus sensibles à l’exposition aux xylènes sont les femmes enceintes, les fœtus et les jeunes enfants (Barlow et Sullivan, 1982 ; Mirkova et al., 1983).
La sensibilité du fœtus et des enfants aux xylènes est due comme pour un grand nombre de xénobiotiques à l’immaturité de leur système enzymatique de détoxication (Calabrese, 1978). La consommation d’alcool (Riihimaki et al., 1982b ; Savolainen, 1980), de tabac et d’aspirine augmente la sensibilité des personnes aux xylènes. Enfin, certaines pathologies comme l’épilepsie, certaines maladies respiratoires (asthme) (Hipolito, 1980), les maladies cardiaques, rénales et hépatiques peuvent augmenter la sensibilité des personnes aux xylènes (Hipolito, 1980 ; Morley et al., 1970 ; Von Burg, 1982).
Des modèles PBPK ont été conçus pour décrire la cinétique du m-xylène et validés chez le rat (Tardif et al., 1991, 1992, 1993 cités dans US, EPA 2003) et l’humain (Tardif et al., 1993, 1995 ; Haddad et al., 1999 cités dans US EPA, 2003) et permettent de prédire les concentrations sanguines et tissulaires en m-xylène suite à une exposition par inhalation. Un seul décrit la cinétique du o-xylène validé chez le rat (Dennison et al., 2003).
Un modèle PBPK a également été élaboré pour décrire la cinétique des trois isomères du xylène, il est le seul modèle à considérer le métabolisme pulmonaire en plus du métabolisme oxydatif saturable du foie (Adams et al., 2005).
Une adaptation du modèle humain, publiée en 2015 modélise également la concentration urinaire en acide m-méthylhippurique pour l’interprétation des données de biomonitoring (Marchand et al., 2015).
Chez l'animal
Absorption
Chez l’animal, le xylène, quel que soit l’isomère, est absorbé aussi bien par inhalation que par voie orale ou par voie cutanée.
Inhalation:
L’exposition corps entier à des vapeurs de m-xylène radioactif chez la souris, pendant 10 minutes a montré que l’absorption du m-xylène se faisait dans un premier temps par le tractus respiratoire (Bergman, 1979, 1983).
Voie orale:
Une étude menée sur les rats exposés oralement aux différents isomères du xylène a montré qu’ils étaient tous absorbés (Gut et Flek, 1981). L’absorption par voie orale est quasiment complète (87 à 92 %) après exposition par gavage de 1,8 g de m-xylène et de 1,74 g de o- ou p-xylène chez le rat (Bray et al., 1949).
Voie cutanée:
Le taux d’absorption d’o-xylène liquide a été calculé après application de la molécule (quantité non précisée) sur la peau excisée de rats. Ce taux est de 0,103 µg.cm-² par minute (Tsuruta, 1982). Le passage transcutané (flux) d’o-xylène à travers la peau nue du dos d’un rat a été estimé à 0,22 mg.cm-2.h-1 (Ahaghotu et al., 2005). Aucune information n’est disponible pour les autres isomères ou les mélanges.
Distribution
La distribution des xylènes dans l’organisme a été essentiellement étudiée chez la souris et le rat après des expositions par inhalation.
Dans des études chez le rat mâle Sprague-Dawley exposé à 2 000 ppm de m-xylène, 4 h/j pendant 5 jours consécutifs, les concentrations les plus élevées en m-xylène ont été mesurées dans les tissus suivants : graisse péri-intestinale et graisse sous-cutanée, alors que des concentrations 40 fois inférieures ont été mesurées dans les poumons, la rate, les testicules, le cœur, les poumons, les muscles psoas (Muscles rattachant les membres au tronc). Les concentrations cérébrales sont 3 à 6 fois plus faibles que celles mesurées dans la graisse sous-cutanée. La distribution inégale du m-xylène inhalé au niveau cérébral est associée à des modifications des liaisons aux récepteurs GABAA (Ito et al., 2002).
Chez la souris, le m-xylène inhalé (1 435 mg.m-3, soit 330 ppm, pendant 10 minutes) est immédiatement observé dans la graisse, le cerveau, la moelle épinière, les nerfs spinaux, le foie et les reins alors qu’il est retrouvé dans le système nerveux et dans les tissus adipeux seulement 1 à 8 heures après l’exposition.
Une autoradiographie réalisée sur des souris mâles, après inhalation pendant 10 minutes de p-xylène, a montré une accumulation des métabolites non volatils du p-xylène dans la muqueuse nasale et dans les bulbes olfactifs (Ghantous et al., 1990). Une étude réalisée chez des souris en gestation, exposées à 8 700 mg.m-3 de p-xylène radiomarqué pendant 10 minutes, a montré que ce dernier était capable de passer la barrière placentaire, mais la concentration du xylène dans le fœtus est faible et ne représente que 2 % du taux de xylène présent dans le cerveau de la mère (Ghantous et Danielsson, 1986).
Des concentrations de p-xylène supérieures à celles trouvées dans le sang ont été mesurées dans le nerf ischiatique. Dans le cerveau, le cervelet et les muscles, la concentration de p-xylène est inférieure à celle trouvée dans le sang (Carlsson, 1981).
Chez le rat, l’exposition à 217 mg.m-3 (50 ppm) de p-xylène radiomarqué pendant 8 heures a montré que le p-xylène se retrouvait en forte concentration dans les reins (1 000 nmol.g-1 de tissu) et dans la graisse sous-cutanée (250 nmol.g-1 de tissu)(Bergman, 1983 ; Ghantous et Danielsson, 1986).
L’o-xylène traverse la barrière placentaire. Sa présence dans le sang du fœtus représente 25 à 30 % du taux total présent dans le sang de la mère, 2 heures après l’exposition. L’o-xylène a été aussi détecté dans le liquide amniotique (Ungvary et al., 1980a).
D’autres études ont confirmé des taux élevés au niveau du sang, des poumons, du foie, des reins, 8 heures après l’exposition aux xylènes (mélange) ainsi qu’au niveau des intestins et de la muqueuse bronchique et nasale, plus de 24 heures après l’exposition (Bergman, 1979, 1983).
Métabolisme
Chez l’animal, le métabolisme du xylène a été principalement étudié chez le rat. Comme chez l’homme, il existe 3 voies distinctes permettant la dégradation des xylènes. Ces voies sont plus ou moins développées en fonction du type d’isomère dégradé. La voie principale consiste en une oxydation par la voie des CYP menant à la formation d’acide méthylbenzoïque via l’alcool méthylbenzylique et l’aldéhyde méthylbenzylique. L’acide méthylbenzoïque peut ensuite se conjuguer à la glycine ou à l’acide glucuronique (Elovaara, 1982 ; Ogata et al., 1980 ; Sugihara et Ogata, 1978). La conjugaison de l’acide méthylbenzoïque avec la glycine afin de former l’acide méthylhippurique est prédominante pour le m- et p-xylène (Elovaara, 1982), alors que pour l’o-xylène, la conjugaison de l’acide méthylbenzoïque avec l’acide glucuronique est favorisée Ainsi, la formation de dérivés mercapturiques a été démontrée chez le rat (en particulier pour le o-xylènes, 21 %), entrainant une diminution du taux de GSH et susceptible d’expliquer la différence d’effets toxiques entre animal-homme (Ogata et al., 1980 ; Morel et al., 1998 ; Moriwaki et al., 2004 ).
Une deuxième voie de dégradation des xylènes, est celle de l’hydroxylation du noyau aromatique conduisant à la formation de diméthylphénols (Bakke et Scheline, 1970 ; Elovaara, 1982). La figure 2 schématise le métabolisme du xylène chez l’animal (ATSDR, 2007).
La différence majeure qui existe entre le métabolisme de l’animal et celui de l’homme réside dans le métabolisme des intermédiaires métaboliques (acide méthylbenzoïque). Chez l’homme la quasi-totalité des xylènes est éliminée dans les urines sous forme d’acide méthylhippuriques (o, m ou p) par conjugaison à la glycine alors que cette part est proche de 60 % chez le rat, le reste étant éliminé principalement sous forme de dérivés mercapturiques (glucuro-conjugués) (cette voie est quasiment inexistante chez l’homme).
schéma du métabolisme du xylène chez l’animal (ATSDR, 2007):
Élimination
Les études animales, et principalement chez les rats, ont montré que les xylènes absorbés par inhalation, par voie orale, par voie cutanée, sont majoritairement excrétés dans les urines sous forme d’acide méthylbenzoïque ou d’acide méthylhippurique, mais peuvent être également exhalés sans dégradation ou sous forme conjugués. Ainsi, après exposition de rats Wistar à du m-xylène par voie orale (0,081 ou 0,81 mol.kg-1), ou par inhalation (174 mg.m-3, 40 ppm ou 1 740 mg.m-3, 400 ppm pendant 6 h), le m-xylène absorbé est excrété dans les urines sous forme d’acide m-méthylhippurique (Kaneko et al., 1995). L’absorption de m-xylène (concentration de 50 ppm et 500 ppm) pendant 6 heures provoque immédiatement l’élimination d’acide m-méthylhippurique chez le rat (Kaneko et al., 2000).
Synthèse
Chez l’homme, les xylènes sont bien absorbés par voie pulmonaire (62-64 %), les autres voies d’absorption sont peu documentées. Après absorption, les xylènes sont rapidement distribués. Ils s’accumulent préférentiellement dans les tissus riches en lipides comme les graisses et le cerveau. Leur métabolisation se fait principalement par oxydation des groupements méthyl puis conjugaison avec la glycine pour former des acides méthylhippuriques. La majorité du xylène absorbé est éliminé dans les urines sous cette forme. L’élimination est rapide exceptée pour les xylènes distribués dans les muscles et le tissu adipeux.
Chez l’animal, le métabolisme est quasiment identique à celui observé chez l’homme, avec cependant une part plus importante de glucuronides conjugués dans les urines.
Equivalents biosurveillance
Description

Toxicité aiguë
Chez l'homme
Inhalation
Dans un cas fatal d’exposition accidentelle (10 000 ppm), l’autopsie réalisée par Morley et al. (1970) a mis en évidence un œdème pulmonaire sévère avec hémorragie alvéolaire (Niaz et al.,2015).
L’exposition aiguë à des vapeurs de xylène, ou à des vapeurs de chaque isomère du xylène, induit des irritations du tractus respiratoires, cardiovasculaires, gastro-intestinaux et neurologiques.
Des irritations de la gorge et du nez ont été rapportées chez des individus exposés à 435 mg.m-3 (100 ppm) de p-xylène, 1 à 7h30 par jour pendant 5 jours (Hake et al., 1981). En revanche aucune irritation du nez et de la gorge n’a été constatée, chez 50 hommes après inhalation de 441- 882 ou 1 723 mg.m-3 (soit 100 - 200 ou 400 ppm) d’un mélange de xylènes pendant 30 minutes (Hastings et al., 1986) . Aucun effet sur la fréquence respiratoire, objectivement mesurée, n’a été rapporté. L’exposition de volontaires sains à 870 mg.m-3 (200 ppm) de m-xylène, 4 h/j pendant 4 jours n’engendre aucun effet néfaste au niveau du poumon (Seppalainen et al., 1989). Un travailleur exposé à du xylène (isomère non précisé) à haute température provenant d’un tuyau pressurisé a ressenti une douleur à la gorge et a présenté une dyspnée (Narvaez et Song, 2003).
De très légers troubles cardiaques sont observés après exposition à des vapeurs de xylène. Ainsi sur 9 personnes ayant été exposées pendant 70 minutes à 7 heures à 1 300 mg.m-3 (300 ppm) d’un mélange de xylènes, à 870 mg.m-3 (200 ppm) de m-xylène ou à 660 mg.m-3 (150 ppm) de p-xylène, une personne présentait une tachycardie alors qu’aucun changement de la pression sanguine n’avait été observé (Gamberale et al., 1978 ; Hake et al., 1981 ; Seppalainen et al., 1989).
L’exposition aiguë à un mélange de xylènes ou au m-xylène a induit une perte de mémoire, une détérioration du temps de réaction et de la coordination, ainsi qu’ une altération de l’équilibre corporel (Carpenter et al., 1975 ; Dudek et al., 1990 ; Gamberale et al., 1978 ; Riihimaki et al., 1979a ; Savolainen et Linnavuo, 1979 ; Savolainen et Riihimaki, 1981 ; Savolainen et al., 1979).
Des vertiges ont été constatés chez la majorité des individus exposés à 3 000 mg.m-3 (680 ppm) d’un mélange de xylènes pendant 15 minutes et chez une personne sur 6 exposées à une concentration de 2 000 mg.m-3 (450 ppm) pendant 15 minutes (Carpenter et al., 1975). Une augmentation du temps de réaction a été constatée chez des individus ayant été exposés à 435 mg.m-3 (100 ppm) d’un mélange de xylènes pendant 4 heures (Dudek et al., 1990). Cette étude a permis de calculer une LOAEC de 435 mg.m-3 (100 ppm).
Cinquante-six volontaires sains (28/sexe), entre 20 et 49 ans, ont été exposés dans des chambres d’inhalation pendant 2 h à 50 ppm (220 mg.m-3) de m-xylène ou à de l’air pur (témoin) ou à 150 ppm de 2-propanol. Chaque personne a été exposée aux trois substances. Un délai de 2 semaines a été respecté entre chaque exposition. La fonction respiratoire a été suivie par spirométrie. Ces symptômes ont été suivis tout au long de l’exposition (3, 60, 118 minutes après le début de l’exposition) et après l’exposition (140 et 350 minutes après). Les sujets ont relaté un certain inconfort d’intensité variable au niveau des yeux, du nez, de la gorge et des voies respiratoires, des difficultés respiratoires, des maux de tête, de la fatigue, des nausées, des étourdissements, ainsi qu’une sensation d’intoxication. Des inconforts au niveau de la gorge et des voies respiratoires sont rapportés chez les femmes après 1 h d’exposition. Des difficultés à respirer et des nausées sont observées chez les hommes après 2 h d’exposition et chez les femmes après 1 et 2 h d’exposition. Une fatigue, des céphalées et des vertiges sont également rapportés. Les signes cliniques observés sont statistiquement significatifs par rapport à l’exposition témoin. Trois heures après la fin de l’exposition chez les femmes, la capacité vitale forcée (CVF) était réduite de 2,81 % par rapport à la mesure réalisée avant le traitement (réduction de 0,06 % lors d’exposition à l’air pur, p<0,01), le coefficient de Tiffeneau (rapport VEMS/CVF) était augmenté de 1,09 % (augmentation de 0,34 % lors d’exposition à l’air pur, p<0,03), et le débit expiratoire maximal à 75 % de la capacité vitale forcée (DEM75) était augmenté de 3,32 % (diminution de 5,53 % lors d’exposition à l’air pur, p<0,04). Aucun changement statistiquement significatif n’a été noté chez les femmes immédiatement après la fin du traitement ni chez les hommes immédiatement ou 3 h après le traitement. De cette étude, une LOAEC de 50 ppm (220 mg.m-3) est retenue pour des effets respiratoires ressentis (gêne respiratoires, sensation d’irritation des yeux et des voies respiratoires supérieures) et mesurés (diminution significative de la capacité vitale forcée et augmentation du débit respiratoire chez les femmes) et des symptômes neurotoxiques subjectifs (céphalées, vertiges et sensation d’intoxication) (Ernstgard et al., 2002).
Voie orale
Une personne est décédée après avoir ingéré du xylène. Ce décès a été attribué par l’auteur, à une détresse respiratoire liée à une dépression du centre de respiration cérébral. Cependant, du fait de ses propriétés physico-chimiques, des phénomènes de fausses routes ne peuvent être exclus lors de l’ingestion de xylènes provoquant ainsi une asphyxie. La quantité de xylène ingérée est inconnue, mais les taux de xylènes retrouvés dans le sang, au niveau de l’estomac et du duodénum sont respectivement de 110 - 8 800 mg.L-1 et 33 000 mg.L-1 reflétant une quantité importante de xylènes ingérée (Abu-Al-Ragheb et al., 1986). L’ingestion accidentelle d’une dose inconnue de xylène a provoqué chez un individu un coma qui a persisté plus de 26 heures (Recchia et al., 1985).
Voie cutanée
Le contact direct des vapeurs de xylène avec la peau provoque de l’urticaire chez les individus exposés. Ce symptôme serait dû à une réaction immunitaire (Palmer et Rycroft, 1993). Enfin, après immersion rapide de la main dans du m-xylène non dilué, une irritation transitoire de la peau ainsi qu’une vasodilatation, un dessèchement et une desquamation de la peau ont été observés chez les individus exposés (Engström et al., 1977 ; Riihimaki, 1979b).
voie oculaire
L’exposition, sous forme de vapeurs, à 2 000 mg.m-3 (450 ppm) d’un mélange de xylènes ou à 435 mg.m-3 (100 ppm) de p-xylène provoque chez l’homme une irritation oculaire moyenne (Carpenter et al., 1975 ; Hake et al., 1981 ; Hastings et al., 1986). Aucune sensation d’irritation oculaire n’a été rapportée chez des volontaires exposés pendant 15 minutes à 460 mg.m-3 (106 ppm) de xylène technique (Carpenter et al., 1975). Parmi 50 volontaires exposés à 0 – 441- 882 - 1 723 mg.m-3 (soit 0 – 100 – 200 ou 400 ppm) d’un mélange de xylènes pendant 30 minutes, une irritation des yeux a été ressentie par 56 % des sujets du groupe témoin (air), et 60, 70 et 90 % chez les sujets respectivement exposés à 100, 200 et 400 ppm (Hastings et al., 1984). En revanche, l’exposition n’a pas eu d’effet sur le clignement des yeux par minute, paramètre objectivement mesuré. Dans une autre étude, une irritation oculaire est rapportée chez des individus exposés pendant 3 à 5 minutes à 882 mg.m-3 (200 ppm) d’un mélange de xylènes (Nelson et al., 1943). Ces irritations sont le résultat d’un contact direct des vapeurs de xylène avec les yeux. Les rares cas d’expositions oculaires aux xylènes montrent des effets tels qu’une photophobie, une rougeur de la conjonctive, une perte partielle des epithelia de la conjonctive et de la cornée. Les blessures observées sont de type brûlure chimique de deuxième degré, réversibles au bout d’une semaine (Ansari, 1997). Une hémorragie sous-conjonctivale, des pertes plus importantes de l’épithélium de la cornée et une kératopathie (par fusion du stroma cornéen) ont également été observées pour certains cas de projections oculaires aux xylènes (Narvaez et Song, 2003). Ces lésions ont persisté 4 semaines après l’exposition.
Synthèse
Chez l’homme, l’exposition aiguë aux xylènes (en mélange ou séparément) par inhalation provoque des troubles respiratoires (irritation), gastro-intestinaux et neurologiques (perte de mémoire, vertiges, troubles de la conscience) et de tachycardie. Par ingestion, à forte doses, le xylène provoque une détresse respiratoire liée à une dépression du centre cérébral de respiration. Les xylènes sont irritants pour la peau et les yeux.
Chez l'animal
Inhalation
Les valeurs de CL50 calculées chez les animaux montrent que l’inhalation d’une dose unique de xylène a un faible effet toxique chez les animaux (Hodge et Sterner, 1949). Chez le rat, la CL50 pour 4 heures d’exposition à un mélange de xylènes, est comprise entre 6 350 ppm (28 000 mg.m-3) (Hine et Zuidema, 1970) et 6 700 ppm (29 500 mg.m-3) (Carpenter et al., 1975) et est de 4 740 ppm (20 900 mg.m-3) pour 4 heures d’exposition au p-xylène (Harper et al., 1975). Chez la souris, après 6 heures d’exposition au m-xylène, à l’o-xylène ou au p-xylène, les CL50 sont respectivement de 5 267 ppm (23 200 mg.m-3), 4 595 ppm (20 260 mg.m-3) et 3 907 ppm (17 200 mg.m-3) (Bonnet et al., 1979). Il apparaît une différence de sensibilité aux xylènes en fonction de l’espèce étudiée. Alors qu’aucun rat ne meurt après une exposition de 24 heures à 2 000 ppm (8 800 mg.m-3) de m-xylène, 6 parmi les 10 souris étudiées meurent après avoir inhalé la même dose de m-xylène pendant le même temps (Cameron et al., 1938).
Les capacités respiratoires sont réduites de 50 % chez les souris après une exposition à un mélange de xylènes (3 000 ppm) (Korsak et al., 1990), au m-xylène (2000 ppm)(Korsak et al., 1993) ou au o-xylène (environ 1 000 ppm) (De Ceaurriz et al., 1981). Une diminution du poids des poumons est également observée chez les rats après une exposition à un mélange de xylènes (Savolainen et al., 1978 ; Ungvary, 1990 ; Winiewska-Knypl et al., 1989) ou aux 3 isomères séparément (Elovaara, 1982 ; Patel et al., 1979 ; Simmons et al., 1991 ; Tatrai et Ungvary, 1980 ; Ungvary et al., 1980a ; Ungvary et al., 1980b). Le m-xylène induit chez les rats une diminution de la quantité des cytochromes P-450 et de l’activité de l'enzyme 7-éthoxycoumarine o-dééthylase présentes dans les poumons. A partir de cette étude, une LOAEC de 75 ppm (330 mg.m-3) a été calculée chez le rat pour une exposition au m-xylène de 24 heures (Elovaara et al., 1987).
Les troubles hépatiques induits chez les rats, les souris et les lapins par l’exposition à un mélange de xylènes (Savolainen et al., 1978 ; Ungvary, 1990 ; Winiewska-Knypl et al., 1989) ou à ses isomères (Elovaara, 1982 ; Patel et al., 1979 ; Simmons et al., 1991 ; Ungvary et al., 1980a) sont mineurs pour des doses comprises entre 700 et 1 600 ppm : augmentation de l’activité métabolique et de la capacité de biotransformation hépatique (Tatrai et Ungvary, 1980 ; Ungvary, 1990). Le p-xylène entraîne une augmentation du taux de mortalité induit par le cytomégalovirus murin chez les souris. Cette sensibilité accrue est due à une altération hépatique provoquée par le xylène (Selgrade et al., 1993).
Les études concernant les effets des xylènes sur la fonction rénale ont montré que l'exposition à l’o-xylène induit une diminution des activités enzymatiques rénales, une augmentation du nombre de cytochromes P-450 rénaux et une augmentation du poids relatif des reins (Elovaara et al., 1987 ; Toftgard et Nilsen, 1982).
Les troubles neurologiques induits par l'exposition aiguë à un mélange de xylènes sont des problèmes de coordination des mouvements (Carpenter et al., 1975), une diminution du transport axonal (Padilla et Lyerly, 1989) et une perte de l’ouïe. Les trois isomères du xylène (m-, o-, p-) induisent également chez les rats une léthargie (200 ppm pour des expositions variant de 1 à 4 heures) (Molnar et al., 1986) et le o-xylène réduit la capacité des souris à nager (De Ceaurriz et al., 1983). Des déficits auditifs ont également été observés pour des expositions aiguës et intermédiaires par inhalation. Ils apparaissent chez le rat après une exposition de 1 450 ppm de xylènes mélangés pendant 8 heures, alors qu’une exposition à 1 700 ppm pendant 4 heures n’a aucun effet sur l’audition (Pryor et al., 1987). Ces études montrent que la durée de l’exposition est importante dans l’observation des effets ototoxiques des xylènes. Chez des rats exposés à 1 800 ppm de xylènes mélangés, une perte auditive de 18-30 dB a été observée dans les fréquences moyennes (Crofton et al., 1994). L’amplitude des potentiels évoqués au niveau du tronc cérébral est diminuée de 50 % chez les rats exposés à 2 000 ppm (exposition aiguë), mais pas à 1 700 ppm (Rebert et al., 1995). Des déficits sensoriels ont été observés chez les rats après des expositions aiguës au xylène. Une exposition aiguë à 1 600 ppm de p-xylène (mais pas à 800 ppm) diminue l’amplitude des potentiels évoqués visuels.
Voie orale
D’après la classification de Gerarde en 1959, les DL50 pour le mélange de xylènes et pour le m-xylène indiquent une faible toxicité de ces substances (Gerarde, 1959). La DL50 pour une exposition unique à un mélange de xylènes est de 5 627 mg.kg-1 pour les rats et de 5 251 mg.kg-1 pour les rates (NTP, 1986). Pour le m-xylène, la DL50 par voie orale chez les rats est de 6 661 mg.kg-1 (Smyth et al., 1962).
Les troubles respiratoires observés sont une respiration difficile chez les souris, immédiatement après l’administration d'un mélange de xylènes et une diminution de l’activité enzymatique présente dans les microsomes pulmonaires ainsi qu’une diminution du nombre de cytochromes P-450 chez les rats exposés au p-xylène (Patel et al., 1978).
Les troubles hépatiques induits sont une augmentation du poids du foie chez les rats après une administration unique de m-xylène ou de o-xylène et une augmentation du nombre de cytochrome b et de l’activité enzymatique du foie après une administration des 3 isomères du xylène (Pyykko, 1980).
Les études réalisées après administration par voie orale des 3 isomères du xylène montrent un effet modéré du xylène sur le système rénal. L’augmentation du poids des reins est induite après une exposition au m-xylène (2 000 mg.kg-1.j-1 pendant 10 jours) ; les m-, p- et o-xylène (2 000 mg.kg-1.j-1 pendant 10 jours) augmentent le nombre et l’activité des enzymes microsomiales présentes dans les reins (Condie et al., 1988 ; Pyykko, 1980).
Des troubles hématologiques ont également été observés chez des rats Sprague-Dawley exposés pendant 10 jours à 2 000 mg.kg-1.j-1 à du p-xylène (polycytémie et leucocytose) (Condie et al., 1988).
Une dose unique de 4 000 mg.kg-1 de xylène est à l’origine, chez les rats, de problèmes de coordination, d’une prostration et d’une diminution de la motricité du train postérieur et chez les souris, de tremblements et de prostration (NTP, 1986).
Dans l’étude de Dyer et al. (1988), des électrodes ont été implantées dans le crane des rats mâles Long-Evans, une semaine avant d’être exposés. Les troubles de la vision (déterminés à partir du test de potentiels évoqués visuels et l’analyse de pics positifs P1, P2, P3 et pics négatifs N1, N2, N3) ont été testés dans 2 essais (Dyer et al., 1988). Du p-xylène (pureté 99,8 %) dilué dans l’huile de maïs a été administré par gavage à des lots de 10-11 rats, en dose unique de 0, 500, 1 000 et 2 000 mg.kg-1. Chez les animaux testés 75 minutes après l’exposition, aucune différence significative de l’amplitude des différents pics n’a été observée en dehors du pic N3 (p<0,01). Dans le second essai, les auteurs ont ciblé la réponse uniquement du pic N3 de lots de 14-16 rats, ayant reçu des doses uniques de 0 - 125 et 250 mg.kg-1. Les tests réalisés 45 minutes après l’exposition ont mis en évidence une réduction de l’amplitude du pic N3 de 27 % et 47 % aux deux doses de 125 et 250 mg.kg-1, le seuil de significativité étant atteint uniquement à la plus forte des deux doses. Un LOEL de 250 mg.kg.j-1 et NOAEL de 125 mg.kg-1.j-1 ont été déterminés pour l’altération des potentiels évoqués visuels (Dyer et al., 1988).
Voie cutanée
Un nombre limité de données suggère un effet par voie cutanée d’un mélange de xylènes et de m-xylène chez l’animal. Des DL50 par voie cutanée pour un mélange de xylènes et pour le m-xylène ont été établies et sont respectivement de 114 mg.kg-1.j-1 et de 3 228 mg.kg-1.j-1 pour 4 heures d’exposition ou plus (Hine et Zuidema, 1970 ; Smyth et al., 1962).
L'application aiguë d'un mélange de xylènes (2,3-114 mg.kg-1.j-1) ou d’isomères pur (m-xylène (65-199 mg.kg-1.j-1 o-xylène (66 mg.kg-1.j-1)) sur la peau de lapin, de cobaye et de souris provoque des irritations cutanées qui peuvent être légères ou importantes (Ahaghotu et al., 2005 ; Anderson et al., 1986 ; Chatterjee et al., 2005 ; Hine et Zuidema, 1970 ; Pound, 1970 ; Pound et Withers, 1963 ; Smyth et al., 1962).
L’application de 0,250 mL (1 200 mg.kg-1) de m-xylène sur la peau d’un rat pendant 1 heure provoque une augmentation significative des espèces oxydantes et de la fragmentation de l’ADN (augmentation de l’ADN de bas poids moléculaire) dans les 2 h suivant l’exposition (Gunasekar et al., 2003 ; Rogers et al., 2001). L’application cutanée de m- et de o-xylène augmente le niveau d’oxyde nitrique synthétase et du TNF-α, de cytokines pro-inflammatoires dans la peau, ainsi que des niveaux plasmatiques d’interleukine-1-alpha (IL1-α) (Ahaghotu et al., 2005 ; Chatterjee et al., 2005 ; Gunasekar et al., 2003).
L’application de 69 mg de m-xylène sur l’oreille des souris provoque un gonflement œdémateux conduisant à un épaississement de l’oreille mesuré entre une ½ heure et 25 heures après l’application (Iyadomi et al., 2000) (le pic est constaté 6 heures après l’exposition). Cet effet est également observé lors de l’exposition au o-xylène. Cet effet s’accompagne de perturbation du stratum corneum, d’une infiltration granulocytaire de l’épiderme, une séparation du derme et de l’épiderme avec des signes d’une inflammation locale (accumulation de mastocytes et de plasmocytes (lymphocytes B) (Ahaghotu et al., 2005 ; Chatterjee et al., 2005 ; Gunasekar et al., 2003).
Voie oculaire
Enfin, l’instillation unique d’un mélange de xylènes ou de m-xylène dans les yeux de lapins induit une irritation oculaire (Hine et Zuidema, 1970 ; Smyth et al., 1962).
Synthèse
Les données chez l’animal confirment les informations chez l’homme avec des troubles supplémentaires tels que les troubles hépatiques et rénaux (augmentation du poids des organes), et troubles de la vision.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
De nombreuses études épidémiologiques ont été menées chez des salariés exposés à long terme et de façon répétée aux vapeurs de xylène.
L’interprétation des données recueillies est parfois difficile en raison de connaissances insuffisantes sur les concentrations d'exposition aux xylènes, les durées d’exposition des individus, le nombre d’individus exposés et la possible co-exposition antérieure ou simultanée à d’autres produits chimiques (Niaz et al., 2015).
L’étude d’Uchida et al. (1993), a porté sur 175 travailleurs (107 hommes et 68 femmes) exposés à des mélanges de xylènes dans des usines chinoises de production de bottes en caoutchouc, de fil enduit de plastique ou d’impression. Deux cent quarante et une personnes ont également été retenues pour cette étude (116 hommes et 125 femmes) travaillant dans un environnement professionnel similaire mais non exposées aux xylènes. Les mesures réalisées montrent que le xylène représente 70 % de l’exposition (avec une majorité de m-xylène et dans une moindre mesure du p-xylène et du o-xylène). Les sujets ont été exposés pendant 7 ans (moyenne) à 14 ppm (moyenne) de xylènes, au toluène (1 ppm) et à l’éthylbenzène (3 ppm). Les symptômes subjectifs ont été évalués par un questionnaire et comparés à des paramètres objectifs (biochimiques, sériques, hématologiques et urinaires. L’exposition a été corrélée aux concentrations des métabolites urinaires du xylène. Une augmentation significative des irritations des yeux, du nez et des maux de gorge a été notée chez des salariés exposés à une concentration moyenne de 14 ppm (61 mg.m-3) de vapeurs de xylènes. Une diminution de la force musculaire et une réduction de la capacité à saisir des objets ont également été décrites probablement attribuables à un effet neurologique plutôt qu’à un effet direct du xylène sur les muscles. Ces sujets présentaient également une anxiété accrue, des pertes de mémoire, des problèmes de concentration et étaient souvent sujets à des vertiges.
Des contacts professionnel à long terme avec des mélanges de xylènes (quantité inconnue) ont été associée à des effets pulmonaires (irritation, dyspnée, respiration rapide) (Roberts et al., 1988; Hipolito, 1980). Dans des conditions d’exposition professionnelle à long terme aux xylènes, les salariés rapportent le plus souvent des maux de tête, une irritation des yeux, des palpitations cardiaques, des indigestions, des douleurs thoracique ou encore des électrocardiogramme irrégulier (ECG) (Kilburn et al., 1985; Hipolito, 1980). Cependant, les effets toxiques d’autres produits chimiques ne peuvent être écartés (Niaz et al., 2015) .
Des travailleurs exposés à des mélanges de solvants (contenant des xylènes) pendant des durées comprises entre 10 et 30 ans ont montré des signes significatifs de réduction des vitesses de conduction dans les nerfs tibial et radial. Ces signes semblent dépendant du temps d’exposition (augmentation des crampes, de l’engourdissement avec la durée d’exposition)(Jovanovic et al., 2004). Cependant la composition des mélanges (xylènes et autres solvants) ne permet pas d’attribuer ces effets uniquement à l’exposition aux xylènes.
L’inhalation de concentrations importantes de xylènes peut augmenter le taux d’urée dans le sang, diminuer la clairance urinaire de la créatinine (Morley et al., 1970), augmenter le taux de la b-glucuronidase (Franchini et al., 1983) et l’excrétion d’albumine, d’érythrocytes et de leucocytes dans les urines (Askergren, 1981, 1982). Cependant, aucune conclusion ne peut être établie à partir de ces études concernant l’effet du xylène sur la fonction rénale, car les individus ont été exposés à d’autres composés chimiques.
Une diminution du nombre des lymphocytes et du taux de complément dans le sérum a été observée chez des travailleurs exposés aux xylènes (Moszczynski et Lisiewicz, 1983, 1984 ; Smolik et al., 1973).
Voie orale
Chez l’homme, aucune étude concernant les effets chroniques des xylènes par voie orale n’est disponible.
Voie cutanée
Chez l’homme, aucune étude concernant les effets chroniques des xylènes par voie cutanée n’est disponible. Seules des études où les salariés ont été exposés à la fois par inhalation et par voie cutanée à un mélange de produits chimiques, dont les xylènes, sont disponibles et décrites ci-dessus.
Synthèse
Chez l’homme, l’exposition chronique aux xylènes par inhalation provoque des effets pulmonaires (irritation), cardiovasculaires (palpitations, douleurs thoraciques), neurologiques (baisse de capacité à la préhension, perte de mémoire, anxiété), rénaux (diminution de la clairance de la créatinine), hématologiques (augmentation de l’urée dans le sang) et oculaire (irritation)… Cependant, les co-expositions ne permettent pas de statuer sur les effets propres des xylènes quant aux effets hématologiques, neurologiques et rénaux.

Chez l'animal
Inhalation
Chez les animaux, les effets principaux observés après une exposition aux xylènes par voie pulmonaire à moyen ou à long terme sont des effets hépatiques et neurologiques. Des effets hématologiques peuvent également être observés.
Les effets hépatiques induits chez les rats par une exposition chronique à un mélange de xylènes ou à l'o-xylène correspondent à une induction métabolique non spécifique à une exposition de xylènes. Ils comprennent une augmentation du poids du foie (Kyrklund et al., 1987 ; Tatrai et Ungvary, 1980 ; Tatrai et al., 1981 ; Toftgard et al., 1981 ; Ungvary, 1990 ; Ungvary et al., 1980b), une augmentation de l’activité des cytochromes P-450 (Tatrai et al., 1981 ; Ungvary, 1990 ; Ungvary et al., 1980b), une augmentation de l’activité des enzymes microsomiales du foie (Elovaara et al., 1980 ; Elovaara et al., 1987 ; Tatrai et al., 1981 ; Toftgard et al., 1981 ; Ungvary, 1990 ; Ungvary et al., 1980b) et une prolifération du réticulum endoplasmique lisse ou rugueux du foie (Rydzynski et al., 1992 ; Tatrai et Ungvary, 1980 ; Tatrai et al., 1981 ; Ungvary, 1990). Des effets similaires ont été constatés chez les souris et les lapins (Ungvary, 1990). D’autres altérations sont observées, des altérations des structures hépatiques (Tatrai et Ungvary, 1980 ; Ungvary, 1990),
Ainsi, après exposition des rats à 1,096 ppm (4,76 mg.m-3) d’o-xylène pendant un an, une augmentation de l’activité des enzymes microsomiales et du poids du foie des rats a été observée (Tatrai et al., 1981). Un examen du foie par microscopie électronique a montré une prolifération du réticulum endoplasmique et des effets toxiques mineurs au niveau des mitochondries. Ces effets semblent transitoires. Aucun changement dans les concentrations hépatiques de peroxydant lipidique (niveau de malondialdéhyde), de glutathion ou dans l’activité de la glutathion-S-tranférase n’a été observé chez des rats exposés 5 h/j, 5 j/sem. à 92 ppm de m-xylène pendant 5 mois (Jajte et al., 2003).
L’exposition chronique aux xylènes provoque des effets au niveau neurologique. La concentration en ADN présent dans le cerveau ainsi que le taux de protéines des astrocytes augmentent chez les rats exposés à des concentrations de xylène comprises entre 300 ppm (1 305 mg.m-3) et 320 ppm (1 392 mg.m-3) pendant 3 à 4 mois et demi et chez les gerbilles exposées à 160 ppm (696 mg.m-3) de xylène pendant la même période (Rosengren et al., 1986 ; Savolainen, 1980). De plus, une augmentation du taux d’enzymes présentes dans le cerveau et des changements de comportement ont été observés chez les rats exposés à 300 ppm (1 320 mg.m-3) d’un mélange de xylènes pendant 18 semaines (Savolainen, 1980 ; Savolainen et Linnavuo, 1979). Enfin, après une exposition de 6 semaines à 800 ppm (3 530 mg.m-3) d’un mélange de xylènes, une perte de l’audition a été constatée chez les rats exposés (Pryor et al., 1987). En ce qui concerne les effets neurologiques des isomères du xylène, il a été montré que l’exposition à 160 ppm (700 mg.m-3) de m-xylène pendant 7 semaines entraîne une diminution du ligand a–adrénergique dans l’hypothalamus des souris exposées (Rank, 1985).
Des rats Wistar mâles (12-24/lot) ont été exposés par inhalation à 0, 50 ou 100 ppm (0,217 ou 435 mg.m-3) de m-xylène durant 3 mois (6 h/j, 5 j/sem.) (Korsak et al., 1994). Avant le début de l’exposition et à la fin de chaque mois d’exposition, la coordination motrice des animaux a été examinée (test « rotarod performance ») ainsi que la sensibilité à la douleur. Une altération statistiquement significative (p ≤ 0,05) de la coordination motrice est mesurée à la concentration de 100 ppm 435 mg.m-3), ainsi qu’une augmentation statistiquement significative de la sensibilité à la douleur (une diminution significative (p≤0,05) du temps de latence au test de la plaque chaude) observée dès 50 ppm. Une diminution significative du taux d’hémoglobine et du nombre d’hématies a été observée pour tous les lots exposés ainsi qu’une augmentation significative des globules blancs chez les animaux exposés à 100 ppm.
Chez des rats exposés par intermittence à 900 ppm (3 900 mg.m-3) de p-xylène pendant 13 semaines, une perte des cellules ciliées dans l’organe de Corti a été observée sans effet sur la neurophysiologie auditive (Gagnaire et al., 2001). A 1 800 ppm, une ototoxicité extensive a été observée dès la quatrième semaine d’exposition et ne s’est pas améliorée au cours des 8 semaines de récupération : une altération des potentiels évoqués auditifs du tronc cérébral, un déficit auditif de 35-42 dB et une perte significative des cellules ciliées de l’organe de Corti ont été observés. Ni le o-xylène, ni le m-xylène n’apparaissent ototoxiques dans cette étude. Tous les rats exposés pendant 13 semaines à 1 000 ppm et 2 000 ppm de xylènes mélangés à de l’éthylbenzène montrent une ototoxicité irréversible significative (déficits auditifs et perte de cellules ciliées) (Gagnaire et al., 2006). L’exposition à ce mélange pour des concentrations de 250 et 500 ppm montre une faible perte des cellules ciliées chez 1 des 8 rats exposés par lot mais sans effet sur l’audition. Selon les auteurs, l’éthylbenzène contribue significativement à l’ototoxicité du mélange.
La persistance des effets neurologiques du xylène a été évaluée chez le rat quelques semaines après avoir été exposés. Dans une première étude les rats ont été exposés 6 h/j, 5 j/sem. à une concentration de 100 ou 1 000 ppm de m-xylène pendant 3 mois (Gralewicz et al., 1995). Des effets sur la capacité d’apprentissage spatiale (labyrinthe en étoile) ont été observés aux 2 doses d’exposition, au cours des 2 mois qui ont suivi l’arrêt de l’exposition, suggérant une persistance de l’atteinte du SNC. Dans une autre étude, des rats ont été exposés 6 h/j, 5 j/sem. à une concentration de 100 ppm de m-xylène pendant 4 semaines et ils ont ensuite été testés plusieurs semaines après la fin de l’exposition (Gralewicz et Wiaderna, 2001). Les animaux présentaient une diminution de la capacité d’apprentissage (test d’évitement passif réalisé 5 semaines après la fin de l’exposition) et une diminution de la faculté d’acquisition (test d’évitement actif réalisé 9 semaines après la fin de l’exposition). Les auteurs rapportent également une diminution de la sensibilité à la douleur thermique dans un test de la plaque chaude réalisé 50 jours après l’arrêt de l’exposition et 24 heures après l’induction d’un stress par choc électrique. A noter, qu’aucune différence au test n’a été observée avant l’induction par choc électrique (première mesure) (ANSES, 2020).
Aucun changement de comportement n’a été constaté chez les chiens et les singes exposés de façon continue à 78 ppm (340 mg.m-3) d’o-xylène pendant plus de 4 mois (127 jours) alors que des tremblements sont apparus chez les chiens exposés à des concentrations élevées de 780 ppm (3 400 mg.m-3) d’o-xylène, de façon intermittente pendant 6 semaines (Jenkins et al., 1970). A cette concentration, le nombre de leucocytes est augmenté chez les rats et les chiens.
Voie orale
Condie et al. (1988) ont exposé des rats Sprague-Dawley par voie orale à des xylènes (en mélange et par isomères) pendant 90 jours à des doses de 0 – 150 – 750 et 1 000 mg.kg-1.j-1. Une augmentation du poids du foie sans association avec des anomalies histopathologiques chez les rats pour des doses de 150 mg.kg-1.j-1 et chez les rates pour des doses de 750 mg.kg-1.j-1. Des augmentations significatives du poids du cœur et de la rate ont été observées chez les lots de femelles exposées aux plus fortes concentrations. La taille moyenne des hématies est statistiquement diminuée chez les mâles exposés aux moyennes et fortes doses. Le nombre de leucocytes est statistiquement diminué chez les mâles faiblement exposés et statistiquement augmenté chez les femelles exposées aux moyennes et aux hautes doses. Une polyglobulie et une leucocytose moyenne ainsi qu’une augmentation du poids de la rate chez les rates exposées. Des altérations rénales (apparition de gouttelettes hyalines, accumulation de protéines dans les tubules, lésions tubulaires) sont le signe de l’apparition d’une néphropathie chronique chez les femelles 150 mg.kg-1.j-1. Ces effets accompagnés d’une augmentation de la hyalinisation sont retrouvés chez les rats mâles dès 150 mg.kg-1.j-1. Une augmentation du poids des reins a également été constatée chez les mâles exposés à 750 mg.kg-1.j-1 et chez les femelles à 1 500 mg.kg-1.j-1. Enfin, une augmentation de l’agressivité a été également constatée chez les rats ayant été exposés à 1 500 mg.kg-1.j-1.
Dans une étude sur 13 semaines des rats ont été exposés à 0 – 62,5 – 125 – 250 – 500 –1 000 mg.kg-1.j-1 et des souris à 0 – 125 – 250 – 500 – 1 000 – 2 000 mg.kg-1.j-1 d’un mélange de xylènes (m-xylène (60 %), p-xylène (14 %) o-xylène (9 %), éthylbenzène (17 %) dans de l’huile de maïs 5 j/sem. pendant 13 semaines (NTP, 1986). Les souris exposées à 200 mg.kg-1.j-1 présentent des difficultés à respirer. Concernant les atteintes neurologiques, les souris exposées à 2 000 mg.kg-1.j-1 présentent une faiblesse, une léthargie, des tremblements et une paralysie partielle jusqu'à 60 minutes après le début de l’exposition. Aucune altération histopathologique au niveau du cerveau et de la moelle épinière n’a été observée chez des rats ou les souris exposés à la plus forte dose.
Dans une étude chronique et de cancérogenèse, des rats ont été exposés aux doses de à 0 – 250 – 500 mg.kg-1.j-1 et des souris à 0 – 500 – 1 000 mg.kg-1.j-1 à un mélange de xylènes (m-xylène (60 %),p-xylène (14 %) o-xylène (9 %), éthylbenzène (17 %) dans de l’huile de maïs 5 j/sem. pendant 103 semaines (NTP, 1986). Le poids des rats mâles exposé à 500 mg.kg-1.j-1 a baissé de 5 à 8 % à partir de la 59eme semaine de traitement, alors qu’aucun effet sur le poids des femelles n’a été observé. Une diminution de la survie a été observée à la fin de cette étude chez les rats mâles traités aux xylènes mais significative uniquement pour le lot le plus exposé (20/50, p = 0,04), la survie étant de 25/50 (p = 0,2) dans le lot exposé à 250 mg.kg-1.j-1 et 36/50 chez les témoins (NTP, 1986). Les morts accidentelles observées lors du gavage ont plus fortement impacté les lots traités (8 et 11 animaux dans les lots respectivement exposés à 250 et 500 mg.kg-1.j-1) par comparaison au lot témoin (3 animaux). Aucun effet sur la survie des rats femelles n’a été observé. Chez les souris, le taux de survie n’a pas significativement varié selon les lots exposés ou non. Le poids moyen des souris (mâles et femelles) traités a été comparable à celui des animaux du lot témoin pendant la majeure partie de l’étude. A 1 000 mg.kg-1.j-1, une hyperréactivité chez les souris mâles et femelles a été observée au cours des 5 à 30 minutes qui suivent l’administration du traitement entre la 4ème et la 103ème semaine d’exposition.
Voie cutanée
Par voie cutanée, des irritations modérées ou importantes ainsi que des nécroses modérées ont été constatées chez les lapins ayant été exposés par voie cutanée à du xylène non dilué (quantité inconnue) pendant 2 à 4 semaines (Wolf et al., 1956).
Synthèse
Chez l’animal l’exposition chronique par inhalation induit principalement des effets hépatiques et neurologiques. Par voie orale, les effets se traduisent à une perte de poids, une atteinte essentiellement rénale et/ou hépatique limitée, mais aussi cardiaque et hématologique. Par voie cutanée, la seule étude disponible rapporte des irritations modérées ou importantes ainsi que des nécroses modérées au niveau de la peau.

Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
| IARC | FDTE/VTR Importer Groupe 3 : l’agent (ou le mélange) ne peut être classé pour sa cancérogénicité pour l’homme | 1999 |
| US EPA | FDTE/VTR Importer Classe D : Informations inadéquates pour évaluer le potentiel cancérogène | 2003 |
Chez l'homme
Inhalation
Les données concernant l’effet cancérigène du xylène par voie pulmonaire chez l’homme proviennent d’études réalisées lors d’expositions au travail. Ces études ont regardé la possible relation entre l’exposition au xylène et le développement de leucémies (Arp et al., 1983 ; Wilcosky et al., 1984). Du fait du faible nombre d’individus exposés et du manque d’informations concernant la composition et la concentration du xylène inhalé, aucune conclusion définitive n’a pu être établie concernant l’effet cancérigène du xylène.
Une étude cas-témoin canadienne portant sur plusieurs solvants (benzène, toluène, xylène et styrène) n’a pas mis en évidence d’augmentation significative du risque de développement de cancers du côlon et du rectum après une exposition à des concentrations importantes de xylènes en raison notamment d’exposition conjointes fréquentes (Gerin et al., 1998). Deux études cas-témoins suggèrent une association entre une exposition professionnelle aux xylènes et un risque accru de cancer de la prostate (Blanc-Lapierre et al., 2018) ou du poumon (Warden et al., 2018). Cependant, des associations de force similaire ont été observées avec le benzène et le toluène et les expositions estimées aux trois substances BTX (benzène, toluène et xylène) étaient considérablement corrélées.
Une méta-analyse portant sur 9 études cas-témoins (Demers et al. 1993 ; Baris et al., 2004 ; Costantini et al., 2008 ; Cocco et al., 2010 ; Orsi et al., 2010 ; Ghosh et al., 2011 ; Gold et al., 2011 ; Purdue et al., 2011 ; Nuyujukian et al., 2014), investiguant un lien potentiel entre une exposition professionnelle aux hydrocarbures aromatiques (benzène, toluène et xylènes) estimée au moyen de matrices emplois-expositions et un risque de myélome multiple, a montré que l’exposition à chacun des solvants était associée à un excès de risque de myélome multiple (De Roos et al., 2018). Cependant, la forte corrélation des expositions aux trois solvants (notamment au benzène, cancérogène avéré du système hématopoïétique) limite l’interprétation de la causalité et l’imputabilité de ces effets aux xylènes ne peut être établie.
Une équipe a investigué l’impact d’une exposition aux polluants atmosphériques in utero et lors de la petite enfance sur le développement de cancers infantiles. Une association significative a été observée entre une exposition aux xylènes et les risques de leucémies aiguës myéloblastiques (Heck et al., 2014), de rétinoblastomes (Heck et al., 2015) et de cancers des cellules germinales (Hall et al., 2019). En raison d’une exposition combinée à d’autres polluants atmosphériques cancérogènes connus notamment au benzène, l’imputabilité de ces effets aux xylènes seuls ne peut être établie (ANSES, 2020).
Voie orale
Aucune donnée n’a été identifiée.
Voie cutanée
Aucune donnée concernant l’effet cancérigène du xylène par voie orale ou par voie cutanée n’est disponible chez l’homme.
Synthèse
Chez l’homme, peu d’informations sont disponibles quant à la cancérogénicité des xylènes seuls. La seule voie étudiée est l’inhalation sans résultat probant du fait de co-expositions avec d’autres solvants.
Chez l'animal
Inhalation
Aucune donnée n’est disponible concernant l’effet cancérigène du xylène par voie pulmonaire chez l’animal.
Voie orale
De nombreuses études ont tenté d’évaluer l’effet cancérigène d’un mélange de xylènes et de benzène par voie orale chez l’animal. Malheureusement, l’interprétation de certaines de ces études a été compromise par un taux de mortalité important parmi les rats exposés et par des données et des analyses statistiques insuffisantes (Maltoni et al., 1983 ; Maltoni et al., 1985). Une néoplasie (nature non précisée) a été toutefois observée chez des rats ayant été gavés avec 0 ou 500 mg.kg-1.j-1 de xylène (nature non spécifiée), 4 à 5 jours par semaine pendant 104 semaines. Mais, la localisation de cette néoplasie n’a pas été spécifiée. Du fait de données trop limitées (sur l’effet de l’exposition, sur la composition du mélange), aucune conclusion n’a pu être établie quant à l’effet cancérigène du xylène par voie orale chez l’animal.
Aucun effet néoplasique n’a été rapporté chez des rats et des souris des deux sexes exposés à des doses de 0 – 250 - 500 et 0 – 500 – 1 000 mg.kg-1.j-1, respectivement chez les rats et les souris, 5 jours par semaine, à un mélange de xylènes (60 % m-xylène, 14 % p-xylène, 9 % o-xylène et 17 % éthylbenzène) pendant 103 semaines (NTP, 1986). Les quelques cas de tumeurs testiculaires observés chez les rats exposés à la plus forte dose n’ont pas été attribués au traitement.
Voie cutanée
Par voie cutanée, il a été montré que l’application de xylènes (pureté et concentration inconnues) sur la peau des rats pendant 25 semaines n’induisait aucune augmentation des tumeurs cutanées et n’augmentait pas le nombre de tumeurs induites par le benzo[a]pyrène (Berenblum, 1941).
Synthèse
Chez l’animal, aucun effet cancérigène du xylène n’a été mis en évidence par voie orale. D’éventuels effets promoteur et /ou initiateur tumoral demandent à être examinés plus en détail.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classée | 2008 |
Chez l'homme
Toutes voies
Chez l’homme, les différentes études in vivo sur la génotoxicité des xylènes montrent qu’ils ne sont pas mutagènes et n’induisent pas d’anomalies chromosomiques dans les lymphocytes du sang périphérique de travailleurs exposés aux xylènes (Haglund et al., 1980 ; Pap et Varga, 1987 ; Richer et al., 1993 ; Zhong et al., 1980).
Une étude réalisée chez des professionnels exposés aux xylènes en raison de leur activité dans un laboratoire histologique a montré une augmentation des lésions de l’ADN mises en évidence dans un test des comètes sur le sang périphérique comparativement au groupe témoin. Dans cette étude, l’exposition aux xylènes n’a pas été mesurée, les effectifs étaient faibles (18 exposés, 11 témoins) et une co-exposition probable à d’autres génotoxiques avérés tels que le formaldéhyde n’a pas été prise en considération. Pour les raisons précitées, l’imputabilité des effets observés aux xylènes seuls est fortement limitée (De Aquino et al., 2016 ).
Chez l'animal
Toutes voies
Ces résultats sont confirmés par d’autres études réalisées chez l’animal : in vivo par inhalation (Zhong et al., 1980), par voie orale (Feldt, 1986), et par voie cutanée (quelques études montrent des ruptures de l’ADN vraisemblablement en lien avec l’activité des nucléases survenant dans des cellules exposées à des concentrations cytotoxiques) (Gunasekar et al., 2003 ; Rogers et al., 2001).
Synthèse
FDTE/VTR Importer Les études in vivo chez l’animal n’ont pas mis en évidence d’effet génotoxique à partir de l’exposition aux xylènes et/ou différents isomères Bien que les données actuelles ne puissent pas exclure totalement un effet initiateur, ni un effet de promotion tumorale, en l’absence de données suffisantes une approche sans seuil ne peut être proposée pour les xylènes.
In vitro
Organismes procaryotes
La génotoxicité des mélanges de xylènes et les isomères purs a également été testée sur bactéries et levures. Les résultats se sont avérés négatifs (Bos et al., 1981 ; Connor et al., 1985 ; Demarini et al., 1991 ; Florin et al., 1980 ; Haworth et al., 1983 ; Litton-Bionetics, 1978 ; McCarroll et al., 1981a ; McCarroll et al., 1981b ; NTP, 1986 ; Shimizu et al., 1985).
Des tests réalisés sur bactéries montrent que les métabolites des xylènes, particulièrement le m-xylénol (Epler et al., 1979 ; Florin et al., 1980), le p-xylénol (Epler et al., 1979 ; Florin et al., 1980 ; Hejtmankova et al., 1979 ; Pool et Lin, 1982), le 2,4-dimethylphenol (Szybalski, 1958), et le o-methylbenzyl alcool (Bos et al., 1981) ne sont pas mutagènes.
Organismes eucaryotes
In vitro, aucun effet génotoxique n’a été observé après exposition de cellules de moelle osseuse aux xylènes chez le rat au cours de tests d’aberrations chromosomiques (Litton-Bionetics, 1978), des tests de micronoyaux sur des cellules de moelle osseuse de souris (Mohtashamipur et al., 1985) et de tests de morphologie du sperme de rat (Washington et al., 1983). Des lésions doubles brins de l’ADN ont toutefois été rapportée dans le test des comètes réalisés sur des lymphocytes circulants humains isolés (Chen et al., 2008). Les auteurs ont pu identifier le stress oxydant en tant que mécanisme impliqué dans ce type de lésions.
Lors de co-exposition avec des initiateurs et/ou des promoteurs de tumeurs un rôle de co-cancérogènes des xylènes a pu être rapporté (Pound, 1970) (Pound et Withers, 1963).
Les études in vivo chez l’humain et l’animal, ainsi que les tests in vitro n’ont pas mis en évidence d’effet génotoxique à partir de l’exposition aux xylènes et/ou différents isomères Bien que les données actuelles ne puissent pas exclure totalement un effet initiateur, ni un effet de promotion tumorale, en l’absence de données suffisantes une approche sans seuil ne peut être proposée pour les xylènes.
Synthèse
Les différents tests réalisés sur les xylènes (mélange ou isomères purs) n’ont pas mis en évidence de potentiel génotoxique.
Effets sur la reproduction
Chez l'homme
Inhalation
Chez l'homme, l’effet du xylène sur la reproduction est difficile à déterminer du fait du nombre limité de données.
Une étude transversale sur 1 408 travailleurs dans la pétrochimie en Chine a montré une augmentation de la prévalence de l’oligoménorrhée (OR : 1,64 ; IC95% : 1,04 - 2,53) parmi les employées exposées aux xylènes. La part des xylènes ne peut cependant pas être déterminée car une association de force similaire avec les solvants aromatiques en général (benzène, toluène et styrène) est rapportée (OR : 1,76 ; IC95% : 1,08 - 2,82) (Cho et al., 2001).
Concernant les hommes, Xiao et al. (1999 et 2001) ont mené une étude transversale en Chine incluant 24 travailleurs exposés aux benzène, toluène et xylènes et 37 managers non-exposés. Des prélèvements sanguins et spermatiques ont été réalisés. Seule une diminution statistiquement significative des γ-GT séminales, indicative d’un fonctionnement prostatique altéré est rapportée. Aucun autre effet sur les paramètres spermatiques n’était associé de façon significative à une exposition au xylène. Cette étude souffre cependant de nombreuses limites (effectifs faibles, ajustement des témoins non optimisé, traitement statistique peu renseigné).
Une étude de cohorte rétrospective réalisée par Sallmén et al. (1998), en Finlande, n’a pas mis en évidence d’association significative entre une exposition des pères aux xylènes et le délai de conception.
Voie orale
Aucune étude concernant l’effet du xylène par voie orale sur la reproduction et le développement n’est disponible chez l’homme.
Voie cutanée
Chez l'homme, aucune donnée ne traite de l’effet du xylène par voie cutanée sur la reproduction.
Synthèse
Plusieurs études chez l’homme, suggèrent des effets reprotoxiques liés à l’exposition aux xylènes mais les limites notables de ces études (faible échantillon et présences de co-exposition) ne permettent pas de conclure quant à la reprotoxicité des xylènes et pour les trois voies d’exposition.
Chez l'animal
Inhalation
L’exposition de rats Sprague-Dawley à 1 000 ppm (4 350 mg.m-3) d’un mélange de xylènes pendant 61 jours n’induit aucune altération des testicules, des glandes accessoires ni du taux de testostérone mâle présente dans le sang des rats exposés (Nylen et al., 1989).L’exposition par voie pulmonaire de rats CFY pendant 8 jours, du 7ème au 14ème jour de gestation à 775 ppm (3 371,25 mg.m-3) à un mélange de xylènes induit une diminution de la fertilité des rats exposés (Balogh et al., 1982).
Voie orale
Par voie orale, peu d’études concernant l’effet des xylènes sur la reproduction sont disponibles. Après exposition de rats à 1 000 mg.kg-1.j-1 ou de souris à 2 000 mg.kg-1.j-1 d’un mélange de xylènes pendant 13 semaines, aucun effet néfaste sur la prostate, les testicules, les ovaires, l’utérus ou les glandes mammaires de ces animaux n’a été observé (NTP, 1986). De plus, aucun changement histopathologique des organes reproducteurs n’a été observé entre les animaux contrôles et les rats exposés à 500 mg.kg-1.j-1 à un mélange de xylènes ou les souris exposées à 1 000 mg.kg-1.j-1 à un mélange de xylènes pendant 103 semaines (NTP, 1986). De même, l’examen histopathologique des organes du système reproducteur réalisé chez les rats exposés à 800 mg.kg-1.j-1 de m-xylène ou de p-xylène est similaire à celui réalisé chez les rats témoins (Wolfe, 1988a, 1988b).
Synthèse
Chez l’animal, les quelques études disponibles ne montrent pas d’effets sur le système reproducteur lors d’exposition aux xylènes.
Effets sur le développement
Généralités
Les xylènes sont inscrits au plan d’action continu communautaire (CoRAP) et selon l’Etat Membre responsable de son évaluation (Allemagne), la nécessité d’une classification Repr. 2 H361 (susceptible de nuire à la fertilité ou au fœtus) doit être clarifiée (justification pour la sélection pour une substance candidate pour le CoRAP).
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classée | 2008 |
Chez l'homme
Inhalation
Le lien potentiel entre une exposition professionnelle aux xylènes et une augmentation du nombre d’avortements spontanés a été étudié dans plusieurs études épidémiologiques aux résultats divergents.
Une étude cas-témoins sur les avortements spontanés parmi des travailleurs femmes en Finlande, exposées à des solvants organiques n’a pas montré d’augmentation significative de l’odds ratio en association avec des expositions aux xylènes (Lindbohm et al., 1990). Des résultats similaires ont été rapportés dans l’étude de Windham et al. (1991). En revanche, une étude a montré une augmentation du taux d’avortements spontanés parmi 37 femmes travaillant dans des laboratoires d’histopathologie et ayant inhalé du xylène et une solution aqueuse de formaldéhyde (Taskinen et al., 1994). Toutefois, la contribution du xylène n’a pas pu être évaluée du fait de co-expositions notamment au formaldéhyde. Des résultats similaires ont été décrits à partir d’une étude de cohorte rétrospective américaine chez des femmes travaillant dans l’industrie des semi-conducteurs et exposées aux xylènes, mais la présence de co-expositions limite la portée de cette étude (Swan et al., 1995). Il a été également constaté une augmentation des avortements spontanés parmi les épouses de salariés ayant été exposés à des vapeurs de xylène et à d'autres solvants (Taskinen et al., 1989). Toutefois, comme pour l’étude précédente, aucune conclusion n’a pu être établie puisque les salariés ont été exposés à un mélange de gaz et que le nombre de travailleurs exposés était limité.
Aucune association n’a été établie avec les malformations congénitales chez les travailleuses de laboratoire fréquemment exposées au toluène ou aux xylènes (Taskinen et coll., 1994). Par ailleurs, une étude sur les anomalies du tube neural en fonction des concentrations estimées de xylènes (0,18-8,84 μg.m-3 ) dans l’air ambiant n’a révélé aucune augmentation des taux de spina-bifida, ni d’anencéphalie (Lupo et al., 2011).
De plus, une étude cas-témoin réalisée au Texas n’a pas révélé d’association entre un risque de fente palatine et une exposition environnementale au mélange BTEX (OR = 0,85 ; IC95% = 0,67 - 1,09). Des résultats similaires ont été obtenus avec chacun des solvants (Ramakrishna et al., 2013).
Une étude examinant les effets d’une exposition aux composés organiques volatils sur les lymphocytes T du cordon ombilical n’a pas montré d’association entre … et l’exposition aux xylènes après analyse multivariée (Lehman et al., 2002) (ANSES, 2020).
Plusieurs études épidémiologiques récentes rapportent des effets neurodéveloppementaux (effets sur les fonctions cognitives notamment syndrome autistique) en lien avec l’exposition à des mélanges de polluants dont les xylènes. Cependant, le protocole de ces études, la caractérisation de l’exposition, la co-exposition à d’autres agents neurotoxiques limitent l’imputabilité des effets observés aux seuls xylènes
Une étude cas-témoins suggère une association entre une exposition professionnelle des parents aux xylènes mais également à d’autres solvants pendant les périodes de conception, de grossesse et d’allaitement et la prévalence de troubles autistiques chez l’enfant (McCanlies et al., 2012). Il s’agit cependant d’une étude exploratoire portant sur un faible effectif et dont l’exposition aux nombreux agents investigués n’a été caractérisée que sur la base de questionnaires et d’une évaluation de ces questionnaires réalisée par des hygiénistes industriels.
Une autre étude cas-témoins portant sur l’impact de la pollution atmosphérique à Los Angeles et sur le neurodéveloppement montre également une association significative entre une exposition in utero aux xylènes et des troubles autistiques chez l’enfant (OR = 1,51 ; IC95% = 1,26–1,82). Cependant, des associations de force similaire ont été observées avec divers autres polluants dont les concentrations atmosphériques sont fortement corrélées à celles des xylènes. Dans cette étude, la mesure des expositions à 24 polluants issus des émissions de l'industrie et de la circulation est fondée sur des données de monitoring atmosphérique (Von Ehrenstein et al., 2014). En revanche, 2 autres études cas-témoins n’ont pas mis en évidence d’association significative entre une exposition aux xylènes et des troubles du spectre autistique (Talbott et al., 2015, Yousefian et al., 2018).
Synthèse
Chez l’homme, peu d’informations sont disponibles quant aux effets de l’exposition aux xylènes sur le développement fœtal. Du fait de nombreuses restrictions, les effets neurodéveloppementaux (syndrome autistique) ne peuvent être attribués aux xylènes seuls.
Chez l'animal
Inhalation
L’exposition aux xylènes par inhalation pendant la gestation provoque des effets sur le fœtus chez l’animal (malformations osseuses, hémorragie, diminution de poids…). Cependant, les résultats sont équivoques en fonction des études.
Plusieurs études ont montré que l’exposition au xylène d’animaux en gestation induisait chez les fœtus un retard de l’ossification, une résorption (perte de substance osseuse d'origine physiologique ou pathologique conduisant à une diminution de hauteur des procès alvéolaires et à une réduction de volume des crêtes gingivo-osseuses édentées), une hémorragie dans certains organes et une diminution de poids (Balogh et al., 1982 ; Hass et Jakobsen, 1993 ; Hudak et Ungvary, 1978 ; Litton-Bionetics, 1978 ; Mirkova et al., 1983 ; Ungvary, 1985). La concentration à laquelle les xylènes induisent des effets néfastes sur le développement dépend du type d’isomère du xylène, de la composition du mélange de xylènes, du temps d’exposition, de l’espèce et de la souche des animaux exposés.
Chez le rat, une exposition par inhalation à d’un mélange de xylènes pendant la gestation entre les jours 1 et 21, 6 h/j, 5 j/sem. a montré que des effets embryotoxiques et tératogènes comprenant une augmentation de la mortalité embryonnaire post-implantatoire, un retard de développement fœtal, une augmentation des anomalies de des organes internes et d’ossification) apparaissaient chez le fœtus après exposition de la mère à 12 ppm (53 mg.m-3) (Mirkova et al., 1983).
Après exposition par inhalation de rats, de souris et de lapins à l’o-xylène et au p-xylène du 7ème au 14ème jour de gestation, une diminution du poids et un retard dans le développement du squelette du fœtus ont été observés (Ungvary, 1985 ; Ungvary et al., 1980b ; Ungvary et al., 1981). L’étude d’Ungvary et Tatrai (1985) a permis de montrer les effets d’une exposition à plusieurs solvants dont les xylènes chez le rat, la souris et le lapin. Des effets embryotoxiques (retard dans le développement du squelette et retard pondéral) et une toxicité fœtale en présence de toxicité maternelle est observée chez la rate exposée à 250 mg.m-3. Ces informations ont été complétées par l’étude de Ungvary (1985) : des rats CFY, des souris CFLP et des lapin NZ ont été exposés par inhalation à plusieurs solvants mono-aromatiques dont le xylène à des doses de 0, 250, 1 900 et 3 400 mg.m-3, 24 h/j entre les jours J7 et J15 de la gestation et 2 à 4 h/j entre les jours 18 et 20 pour les rats, à 0, 500 et 1 000 mg.m-3, 24 h/j entre les jours 6 et 15 de la gestation pour les souris et les lapins. Le xylène passe la barrière placentaire. La toxicité maternelle est modérée et dose-dépendante. Des retards dans l’ossification et des retards de croissance ont été observés chez les fœtus de rats et de souris pour tous les solvants testés. A la plus forte concentration, le xylène augmente le nombre des pertes post-implantatoires chez la souris et chez le rat. Une augmentation des avortements spontanés chez le lapin a été observée à partir de 1 000 mg.m-3 pour tous les solvants testés.
Des études comparatives de toxicité sur le développement chez le rat ont été réalisées. L’exposition de rats pendant la gestation (du 6ème au 20ème jour) à 100, 500, 1 000 et 2 000 ppm, 6 h/j à du o-, m-, p- ou du mélanges d’isomères a permis de montrer l’absence d’effets tératogènes de ces substances. Cependant, une toxicité sur le développement apparait à partir des doses 1 000 ppm et 2 000 ppm pour toutes les substances testées mais à ces doses, une toxicité maternelle est également observée. Pour le o-xylène et le mélange d’isomères, la toxicité sur le développement apparait dès 500 ppm d’exposition en l’absence de toxicité maternelle (Saillenfait et al., 2003).
En revanche, des rats Sprague-Dawley ont exposé à 3 500 ou à 7 000 mg.m-3 de p-xylène du 7ème au 16ème jour de la gestation. Le nombre de rats nouveau-nés, leurs malformations ainsi que la toxicité maternelle ont été étudiés et aucun effet néfaste sur le développement, ni aucune toxicité maternelle n’ont été observés (Rosen et al., 1986). Le traitement n’a pas eu d’effets significatifs sur l’activité motrice et le réflexe acoustique chez les petits.
Les effets de l’exposition in utero au xylène sur le développement post-natal ont été décrits par l’équipe de Hass et Jakobsen (1993) qui a exposé des rats Wistar (36/lots) à un mélange de xylènes à 200 ppm, 6 heures par jour entre les jours 4 et J0 de la gestation (Hass et Jakobsen, 1993). Aucun signe de toxicité maternelle n’a été observé. Un déficit neurocomportemental de la progéniture a été mis en évidence après réalisation du test « rotarod performance » chez les petits mâles et femelles au 23e j après la naissance. Un LOAEL de 200 ppm a été évalué pour cet effet chez les rats issus de mères exposées aux xylènes.
La même équipe a observé un effet significatif (femelles uniquement) sur le délai dans l’acquisition du réflexe de redressement en chute chez des ratons de 15-16 jours exposés in utero à 500 ppm de xylène technique (6 h/j du 7ème au 20ème jour de gestation) comparé au groupe témoin (Hass et al., 1995). En l’absence d’effets observés sur le développement général post-natal, les auteurs ont suggéré une atteinte neurologique vestibulaire. Bien que non statistiquement significative, une diminution des performances dans le test « rotarod performance » a également été observée chez les femelles. De plus, une altération des performances dans les tests d’apprentissage et de mémoire (labyrinthe aquatique de Morris) est rapportée de façon plus marquée chez les femelles âgées de 26 jours.
Dans une étude additionnelle, Hass et al. (1997) ont reproduit le même protocole d’exposition et investigué les effets sur l’apprentissage et la mémoire des ratons femelles âgées de 12, 16, 28 et 55 semaines. Une altération des performances dans le test du labyrinthe aquatique de Morris a été observée aux âges de 16, 28 et 55 semaines se traduisant par augmentation de la longueur du trajet parcouru ; la vitesse de nage n’a quant à elle pas été altérée par l’exposition.
Voie orale
Une augmentation de fentes palatines et une diminution du poids du fœtus furent constatées après exposition des souris gestantes à des doses de 2 060 mg.kg-1.j-1 d’un mélange de xylènes du 6ème au 15ème jour de gestation (Marks et al., 1982). Cependant, l’administration de 2 000 mg.kg-1.j-1 de m-xylène chez la souris n’induit aucun effet toxique chez le fœtus. Compte tenu du peu de données, aucune conclusion ne peut être établie concernant une relation entre un effet néfaste sur le développement et l’exposition par voie orale au xylène (Seidenberg et al., 1986).
Voie cutanée
Peu d’études sont disponibles. L’application cutanée de 200 mg.kg-1.j-1 de xylènes (concentrations et isomères non précisés) chez des rats femelles en gestation induit une diminution de l’activité enzymatique (cholinestérase…) dans le cerveau du fœtus et de la mère (Mirkova et al., 1979). Des effets neurocomportementaux ont également été observés après exposition au xylène pendant la gestation (Hass et Jakobsen, 1993).
Synthèse
Chez l’animal, l’exposition aux isomères ou aux mélanges de xylène a des effets fœtotoxiques. Les effets observés sont une augmentation de l’incidence des altérations squelettiques chez le fœtus, un retard d’ossification, des résorptions fœtales, des hémorragies au niveau des organes fœtaux et une diminution du poids corporel fœtal. Un déficit neurocomportemental persistent est rapporté chez les rats exposés in utero.
Autres Effets
Généralités
Effets perturbateurs endocriniens et potentiel neurodéveloppemental : Il n’existe pas de donnée sur les effets gonadiques et endocriniens du xylène chez l’Homme (ANSES, 2020).
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’ATSDR propose pour une exposition aiguë par inhalation à un mélange de xylènes un MRL de 2 ppm (8,8 mg.m-3) (ATSDR, 2007).
Cette valeur a été calculée à partir de l’étude chez 56 volontaires sains exposés à 50 ppm (217 mg.m-3) de m-xylène pendant 2 heures (Ernstgard et al., 2002). Des effets respiratoires (diminution significative de la capacité vitale forcée et de l’inconfort au niveau de la gorge et des voies aériennes chez les femmes, augmentation du débit respiratoire chez les deux sexes) sont mesurés à la concentration testée ce qui permet de déterminer une LOAEC de 50 ppm (217 mg.m-3). Aucun ajustement n’est réalisé.
Facteurs d’incertitude : un facteur global de 30 est appliqué : un facteur 3 car la valeur utilisée est un LOAEL et un facteur de 10 pour la variabilité au sein de la population.
Calcul : 50 ppm x 1/30 = 1,66 ppm (arrondi à 2 ppm (8,7 mg.m-3))
Indice de confiance : cet organisme n’accorde pas d’indice.
L'OEHHA propose un REL de 22 mg.m-3 pour une exposition aiguë (1 h) par inhalation à un mélange de xylènes (OEHHA, 2008).
Cette valeur a été calculée à partir d’une étude épidémiologique sur 50 volontaires en bonne santé exposés pendant 30 minutes à 430, 860 et 1 720 mg.m-3 d’un mélange de xylènes (Hastings et al., 1984). Une irritation des yeux, du nez et de la gorge dès 860 mg.m-3 a été retenue. Une NOAEC de 430 mg.m-3 (100 ppm) a été déterminé pour l’irritation des yeux, du nez et de la gorge.
Une concentration équivalente pour 1 heure d’exposition a été calculée : 50 ppm en utilisant la loi de Haber avec n=1.
Facteurs d’incertitude : un facteur 10 a été appliqué pour tenir compte de la variabilité au sein de la population générale.
Calcul : 50 ppm x 1/10 = 5 ppm soit 22 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
L’Anses propose une VTR 8,7 mg.m-3 (2 ppm) pour une exposition aiguë par inhalation au xylène (Anses, 2020).
L’Anses a mené une revue des valeurs existantes et n’a pas jugé nécessaire de construire une valeur différente de celle de l’ATSDR (2007). Ainsi, L’Anses retient une LOAEC de 50 ppm (217 mg.m-3) pour les effets respiratoires à partir d’une étude chez le volontaire sain (Ernstgard et al., 2002).
Facteurs d’incertitude : un facteur global de 30 est appliqué : un facteur 3 car la valeur utilisée est un LOAEL et un facteur de 10 pour la variabilité au sein de la population.
Calcul : 50 ppm x 1/30 = 1,66 ppm (arrondi à 2 ppm (8,7 mg.m-3))
Indice de confiance : l’Anses accorde un indice de confiance moyen/faible dans cette valeur.
Le TCEQ propose un ReV de 1,7 ppm (7,4 mg.m-3) pour une exposition aiguë de 24 h par inhalation à un mélange de xylène (2015).
Cette valeur a également été établie à partir de l’étude d’Ernstgard et al. (2002) et construite exactement selon le même schéma que la valeur de l’ATSDR (2007).
Le TCEQ applique les mêmes facteurs d’incertitude que l’ATSDR, mais fait le choix de ne pas arrondir la valeur obtenue et de fait abouti à une valeur proche mais différente.
Facteurs d'incertitude : un facteur de 30 est retenu correspondant à un facteur d’incertitude de 3 en raison de l’utilisation d’un LOAEL et un facteur de 10 pour la variabilité au sein de l’espèce.
Calcul : ReVaiguë = 50 ppm / 30 = 1,7 ppm soit 7,4 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par inhalation :
L’ATSDR propose pour une exposition sub-chronique par inhalation à un mélange de xylènes un MRL de 0,6 ppm (2,64 mg.m-3) (ATSDR, 2007).
Cette valeur a été établie à partir d’une étude expérimentale chez le rat exposé par inhalation à 0, 50 ou 100 ppm de m-xylène durant 3 mois (6 h/j, 5 j/sem.) (Korsak et al., 1994). L’effet critique retenu est une altération de la coordination motrice ainsi qu’une une augmentation de la sensibilité à la douleur thermique (diminution du temps de latence au test de la plaque chaude). Pour cet effet, une LOAEC de 50 ppm (soit 217 mg.m-3) a été retenue
Un ajustement allométrique a été réalisé pour établir une LOAECHEC à partir de la méthode de l’US EPA (1994) ; le xylène est considéré comme un gaz de catégorie 3, l’US EPA préconise dans ce cas de retenir la valeur par défaut de 1 pour le ratio (Hb/g)rat / (Hb/g)Homme.
LOAECHEC = LOAEC x (Hb/g)rat / (Hb/g)Homme = LOAEC x1 = 50 ppm
avec (Hb/g) : coefficient de partage (sang/air) du xylène
Facteurs d’incertitude : un facteur 90 est appliqué : un facteur 3 car la valeur utilisée est un LOAEL, un facteur 3 pour l’extrapolation de l’animal à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 50 ppm x 1/90 = 0,55 ppm (arrondi à 0,6 ppm (2,64 mg.m-3))
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par inhalation :
Xylènes totaux
L’ATSDR propose un MRL de 0,05 ppm (0,20 mg.m-3) pour une exposition chronique par inhalation à un mélange de xylènes (ATSDR, 2007).
Cette valeur a été calculée à partir d’une étude épidémiologique sur 175 travailleurs chinois exposés à 14 ppm de xylène pendant 7 ans (Uchida et al., 1993). Ces expositions induisent des effets neurotoxiques tels que des vertiges, une augmentation de l’anxiété, une difficulté à se concentrer, une perte de mémoire, des effets respiratoires (une irritation du nez et des yeux, et des maux de gorge) et oculaire (sensation d’irritation). Une LOAEC de 14 ppm (61 mg.m-3) a été retenue.
Facteurs d’incertitude : un facteur 300 est appliqué correspondant un facteur 10 car la valeur utilisée est une LOAEC, un facteur de 10 pour la variabilité au sein de la population et un autre facteur 3 pour tenir compte du manque d’étude évaluant les effets neurotoxiques lors d’exposition chronique.
Calcul : 14 ppm x 1/300 x 1/3 = 0,047 ppm (arrondi à 0,05 ppm (0,22 mg.m-3))
Indice de confiance : cet organisme n’accorde pas d’indice
L’US EPA (IRIS) propose une RfC de 0,1 mg.m-3 pour une exposition chronique par inhalation au m-xylène (US EPA (IRIS), 2003b).
Cette valeur a été établie à partir d’une étude expérimentale chez le rat exposé par inhalation à 0, 50 ou 100 ppm de m-xylène durant 3 mois (6 h/j, 5 j/sem.) (Korsak et al., 1994). L’effet critique retenu est l’altération de la coordination motrice. Pour cet effet, une NOAEC de 50 ppm (soit 217 mg.m-3) a été retenue.
Un ajustement temporel pour une exposition continu a été pratiqué :
NOAECADJ = NOAEC x 6 h/24 h x 5 j/7 j = 39 mg.m-3
Une concentration équivalente pour l’homme a été calculée pour les effets extrapulmonaires pour un gaz de catégorie 3 et facteur de coefficient de partage air/sang de 1 soit :
NOAECHEC = NOAECADJ = 39 mg.m-3.
Facteurs d’incertitude : un facteur arrondi à 300 est appliqué : un facteur réduit à 3 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour l'extrapolation de données subchroniques à chroniques, et un facteur 3 car il n'existe pas d'étude de reproduction sur deux générations pour le xylène.
Calcul : 39 mg.m-3 x 1/300 = 0,13 mg.m-3 (arrondi à 0,1 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L’OMS propose une Valeur Guide de 0,87 mg.m-3 pour une exposition chronique par inhalation à un mélange de xylènes (1997) .
Cette valeur est établie à partir d’une étude expérimentale chez le rat exposé par inhalation à un mélange de xylènes durant la gestation (Hass et Jakobsen, 1993). Pour une exposition des femelles à 870 mg.m-3 (200 ppm), des altérations comportementales ont été notées chez les petits, indiquant une toxicité sur le système nerveux central des fœtus. Une LOAEC de 870 mg.m-3 (200 ppm) a été retenue.
Facteurs d’incertitude : un facteur global de 1 000 est appliqué : un facteur 10 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour l'utilisation d'une LOAEC.
Calcul : 870 mg.m-3 x 1/1 000 = 0,87 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice.
Santé Canada propose une CT de 0,1 mg.m-3 pour une exposition chronique par inhalation à un mélange de xylènes (Santé Canada, 2021).
Cette valeur est établie à partir d’une étude expérimentale subchronique chez des rats Wistar mâles exposés 6 h/j, 5 j/sem., pendant 3 mois à 0, 50 ou 100 ppm de m-xylène (Korsak et al., 1994). L’effet critique retenu est une atteinte du système nerveux central mis en évidence à partir de la diminution dose-dépendante de la coordination motrice (baisse des performances dans le test du « rotarod ») statistiquement significative uniquement à 100 ppm. Une NOAEC de 50 ppm (217 mg.m-3) a été retenu comme POD (point de départ) pour le calcul de la valeur.
Un ajustement pour tenir compte d’une exposition continue a été calculé :
NOAELADJ = 217 mg.m-3 x (5 j/7 j) x (6 h/24 h) = 38,75 arrondi à 39 mg.m-3
Une concentration équivalente pour l’homme est calculée en prenant comme hypothèse que le xylène est un gaz de catégorie 3 et que le facteur de conversion est de 1.
NOAELHEC = NOAELADJ x 1 = 39 mg.m-3
Facteurs d’incertitude : un facteur d’incertitude global de 300 est appliqué : un facteur 3 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour l'utilisation d'une étude subchronique et un facteur 3 pour les incertitudes des bases de données.
Calcul : 39 mg.m-3 x /300 = 0,1 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
Le RIVM propose une TCA de 0,87 mg.m-3 pour une exposition chronique par inhalation à un mélange de xylènes (Baars et al., 2001).
En 2001, le RIVM a retenu la même étude clé que l’OMS (Hass et Jakobsen, 1993) et a suivi la même démarche que l’OMS pour construire sa TCA à partir de la LOAEC de 200 ppm. Le même facteur d’incertitude de 1000 a été appliqué aboutissant de fait, à une valeur identique.
Facteurs d’incertitude : un facteur global de 1 000 est appliqué : un facteur 10 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour l'utilisation d'une LOAEC.
Calcul : 870 mg.m-3 x 1/1 000 = 0,87 mg.m-3
Indice de confiance : selon le RIVM, la fiabilité de cette valeur est élevée.
L'OEHHA propose un REL de 0,7 mg.m-3 pour une exposition chronique par inhalation à un mélange de xylènes (OEHHA, 2008) .
Cette valeur a été calculée à partir d’une étude épidémiologique sur des travailleurs chinois exposés 14 ppm de xylène pendant 7 ans (Uchida et al., 1993). Une LOAEC de 14,2 ppm (61 mg.m-3) a été retenue pour des effets neurotoxiques tels que des vertiges, une augmentation de l’anxiété, une difficulté à se concentrer, une perte de mémoire, des effets respiratoires (une irritation du nez et des maux de gorge) et oculaire (sensation d’irritation).
Un ajustement pour une exposition continue a été pratiqué :
LOAECADJ = 14,2 ppm x 10 m3/20 m3 x 5 j/7 j = 5,1 ppm
Facteurs d’incertitude : un facteur 30 est : un facteur 3 pour l'utilisation d'une LOAEC et un facteur 10 pour la variabilité au sein de la population humaine.
Un facteur correctif de 10/20 a été utilisé pour tenir compte des différences de taux respiratoire entre des populations de travailleurs et la population générale.
Calcul : 5,1 ppm x 1/30 = 0,17 ppm arrondi à 2 ppm soit 0,7 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
L’Anses retient une VTR de 0,1 mg.m-3 (0,03 ppm) pour une exposition chronique par inhalation à un mélange de xylènes (Anses, 2020)
L’Anses a mené une revue des valeurs existantes et n’a pas jugé nécessaire de construire une valeur différente de celle de l’US EPA (2003). Ainsi, L’Anses retient une NOAEC de 50 ppm (217 mg.m-3) pour les effets neurologiques (altération de la coordination motrice) à partir d’une étude sub-chronique chez le rat (Korsak et al., 1994).
Un ajustement temporel et un ajustement allométrique ont été pratiqués.
Facteurs d’incertitude : un facteur global de 300 est appliqué : un facteur 3 car la valeur utilisée est un LOAEL et un facteur de 10 pour la variabilité au sein de la population.
Calcul : 38,75 mg.m-3 x 1/300 = 0,1 mg.m-3
Indice de confiance : l’Anses accorde un indice de confiance moyen/faible dans cette valeur.
Le TCEQ propose un ReV de 0,14 ppm (0,61 mg.m-3) pour une exposition chronique par inhalation à un mélange de xylènes (TCEQ, 2015).
Le TCEQ s’appuie sur la même étude d’Uchida et al. (1993) (étude épidémiologique sur 175 travailleurs chinois) que l’ATSDR et retient également la valeur de 14 ppm (61 mg.m-3) comme point de départ (POD) pour le calcul de sa valeur à partir des effets neurotoxiques, respiratoires et oculaires.
Facteurs d’incertitude : un facteur 90 arrondi 100 est appliqué correspondant un facteur 3 car la valeur utilisée est une LOAEC, un facteur 10 pour la variabilité au sein de la population et un facteur 3 pour tenir compte du manque d’étude évaluant les effets neurotoxiques lors d’exposition chronique.
Calcul : 14 ppm x 1/100 = 0,14 ppm soit 0,61 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose pour une exposition aiguë par voie orale à un mélange de xylènes un MRL de 1 mg.kg-1.j-1 (ATSDR, 2007).
Cette valeur a été calculée à partir d’une étude expérimentale chez les rats exposés oralement à des doses uniques (125 à 2 000 mg.kg-1) de p-xylène (Dyer et al., 1988). Cette étude qui a évalué l’intégrité du fonctionnement du système visuel a permis de déterminer une NOAEL de 125 mg.kg-1.j-1 pour une altération de la vue (tests des potentiels évoqués visuels).
Facteurs d’incertitude : un facteur 100 est appliqué : un facteur 10 pour l’extrapolation de l’animal à l’homme et un facteur de 10 pour la variabilité au sein de la population humaine.
Calcul : 125 mg.kg-1.j-1 x 1/100 = 1,25 mg.kg-1.j-1 (arrondi à 1 mg.kg-1.j-1)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose pour une exposition subchronique par voie orale à un mélange de xylènes un MRL de 0,4 mg.kg-1.j-1 (ATSDR, 2007).
Cette valeur est établie à partir d’une étude expérimentale pratiquée chez la souris (NTP, 1986). L’exposition aux xylènes est réalisée par gavage dans l'huile de maïs, 5 j/sem. pendant 103 semaines, aux doses de 0, 500 ou 1 000 mg.kg-1.j-1. L’effet critique retenu est une hyperactivité observée entre les 4e et 51e semaines chez les 2 sexes au cours de la première année de l’étude. Pour cet effet, un NOAEL de 500 mg.kg-1.j-1 est retenu.
Un ajustement temporel a été pratiqué :
NOAELADJ = 500 mg.kg-1.j-1 x 5 j/7 j = 360 mg.kg-1.j-1 .
Facteurs d’incertitude : un facteur 1 000 est appliqué : un facteur 10 pour l’extrapolation de l’animal à l’homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour tenir compte de l’absence de données sur la sensibilité neurologique et sur le développement.
Calcul : 360 mg.kg-1.j-1 x 1/1 000 = 0,36 mg.kg-1.j-1 (arrondi à 0,4 mg.kg-1.j-1)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose pour une exposition chronique par voie orale à un mélange de xylènes un MRL de 0,2 mg.kg-1.j-1 (ATSDR, 2007).
Cette valeur est établie à partir d’une étude expérimentale pratiquée chez le rat et la souris (NTP, 1986). L’exposition aux xylènes est réalisée par gavage dans l'huile de maïs, 5 j/sem. pendant 103 semaines, aux doses de 0, 250 ou 500 mg.kg-1 chez le rat. L’hyperactivité observée chez les souris mâles ne peut être retenue comme effet critique, car à la NOAEL de 500 mg.kg-1 une baisse du taux de survie est décrite chez les rats mâles. L’effet critique retenu est un raccourcissement de la survie chez les rats mâles. Pour cet effet, un NOAEL de 250 mg.kg-1.j-1 est retenu.
Un ajustement temporel a été pratiqué :
NOAELADJ = 250 mg.kg-1.j-1 x 5 j/7 j = 179 mg.kg-1.j-1 .
Facteur d’incertitude : un facteur 1 000 est appliqué : un facteur 10 pour l’extrapolation de l’animal à l’homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour tenir compte de l’absence de données sur la sensibilité neurologique et sur le développement.
Calcul : 179 mg.kg-1.j-1 x 1/1000 = 0,2 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
L’US EPA (IRIS) propose une RfD de 0,2 mg.kg-1.j-1 pour une exposition chronique par voie orale à un mélange de xylènes (US EPA (IRIS), 2003b)
Cette valeur est établie à partir d’une étude expérimentale pratiquée chez le rat et la souris (NTP, 1986). L’exposition aux xylènes est réalisée par gavage dans l'huile de maïs, 5 j/sem. pendant 103 semaines, aux doses de 0, 250 ou 500 mg.kg-1.j-1 (rat). L’effet critique retenu est la diminution pondérale et l’augmentation de la mortalité observée chez les rats mâles observée à 500 mg.kg-1.j-1. Pour cet effet, un NOAEL de 250 mg.kg-1.j-1 est retenu.
Un ajustement temporel a été pratiqué :
NOAELADJ = 250 mg.kg-1.j-1 x 5 j/7 j = 179 mg.kg-1.j-1 .
Facteurs d’incertitude : un facteur 1 000 est appliqué : un facteur 10 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour le manque de données disponibles concernant les effets neurotoxiques et développementaux du xylène.
Calcul : 250 mg.kg-1.j-1 x 5 j/7 j x 1/1 000 = 0,18 mg.kg-1.j-1 (arrondi à 0,2)
Indice de confiance : L’US EPA accorde un indice moyen dans l’étude retenue, dans la base de données et dans la valeur élaborée.
L’OMS propose une DJT de 0,179 mg.kg-1.j-1 pour une exposition chronique par voie orale à un mélange de xylènes (OMS, 2017).
Cette valeur est établie à partir de la même étude expérimentale de 103 semaines chez le rat (NTP, 1986) utilisée par l’ATSDR et l'US EPA.. L’effet critique retenu est la diminution du poids chez les rats mâles. Pour cet effet, un NOAEL de 250 mg.kg-1.j-1 est retenu.
Facteurs d’incertitude : un facteur de 1 000 est appliqué qui correspond à un facteur de 100 pour tenir compte des variations intra- et inter-espèces et un autre facteur de 10 pour tenir compte des limites du critère d’effet retenu.
Calcul : 250 mg.kg-1.j-1 x 5 j/7 x 1/1 000 = 0,18 mg.kg-1.j-1 (arrondi à 0,2)
Indice de confiance : cet organisme n’accorde pas d’indice
Santé Canada propose une DJT de 1,3 10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale à un mélange de xylènes (Santé Canada, 2021).
Santé Canada n’a identifié aucune étude par voie orale chez les animaux ou les humains où la relation dose-réponse a été convenablement caractérisée et les effets liés à l’exposition clairement démontrés. Le système nerveux central étant la principale cible des xylènes dans plusieurs contextes d’exposition, l’exposition par inhalation a été jugée par Santé Canada comme étant la mieux indiquée pour le calcul d’une valeur. Une NOAEC (point de départ pour le calcul de la VTR) de 50 ppm a été retenue à partir de l’étude subchronique de Korsak et al. (1994) qui a mis en évidence une diminution de la coordination motrice (diminution dose-dépendante des performances dans le test du « rotarod » statistiquement significative uniquement à 100 ppm) chez des rats Wistar mâles exposés 6 h/j, 5 j/sem, pendant 3 mois à 0, 50 ou 100 ppm de m-xylène.
La concentration interne dans le sang chez les rats exposés pendant 3 mois à 50 ppm a été estimée à l’aide d’une modélisation PBPK à 0,1380 mg.L-1. Cette dose interne a ensuite été utilisée dans le modèle PBPK humain pour déterminer les doses externes humaines nécessaires à l’obtention de concentrations sanguines semblables à celles observées chez le rat, en se fondant sur une consommation quotidienne de 1,5 L d’eau potable. Les doses externes humaines ainsi obtenues, qui correspondent à des concentrations de m-xylène dans le sang de 0,14 mg.L-1, est de 1 mg.kg-1.j-1.
Facteurs d’incertitude : un facteur d’incertitude global de 75 est appliqué : un facteur d’incertitude de 10 pour la variabilité au sein de la population, un facteur d’incertitude de 2,5 pour la variabilité interspécifique et un facteur 3 pour l’utilisation d’une étude subchronique plutôt que chronique.
Calcul : DJT = 1 mg.kg-1.j-1 x 1/75 = 0,013 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
Le RIVM propose une DJA de 0,15 mg.kg-1.j-1 pour une exposition chronique par voie orale à un mélange de xylènes (Baars et al., 2001).
Cette valeur est établie à partir d’une étude expérimentale de gavage chez le rat, exposé à un mélange de xylènes contenant 20 % d’éthylbenzène durant 90 jours (Condie et al., 1988). Chez les animaux exposés à 750 mg.kg-1.j-1, une augmentation de l'agressivité, une augmentation du poids de la rate, une augmentation des transaminases sériques et du poids du foie ont été observées. Aucun effet hépatique n'a été noté chez les animaux exposés à 150 mg.kg-1.j-1 (NOEL).
Facteurs d’incertitude : un facteur 1 000 est appliqué : un facteur 10 pour l'extrapolation de l'animal à l'homme, un facteur 10 pour la variabilité au sein de la population et un facteur 10 pour l'extrapolation d'une durée intermédiaire à chronique.
Calcul : 150 mg.kg-1.j-1 x 1/1 000 = 0,15 mg.kg-1.j-1
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’Anses propose retient la valeur 8,7 mg.m-3 pour une exposition aiguë aux xylènes par inhalation (Anses, 2020).
Trois organismes proposent des valeurs l’OEHHA (2008), l’ATSDR (2007) et le TCEQ (2015). Les trois valeurs s’appuient sur des études d’expositions contrôlées réalisées sur des sujets volontaires sains.
Les effets critiques ont été déterminés à partir des symptômes neurologiques et d’irritation (respiratoires et oculaires).
L’OEHHA s’appuie sur l’étude d’Hastings et al., (1984) chez 50 volontaires exposés à plusieurs concentrations d’un mélange de xylènes pendant 30 minutes. Cette étude est de qualité recevable. L’effet critique retenu repose uniquement sur des symptômes subjectifs d’irritation des yeux, du nez et de la gorge. Cette valeur n’est pas retenue.
L’ATSDR retient l’étude d’Ernstgård et al. (2002) menée sur 56 volontaires exposés pendant 2 h à 50 ppm de m-xylène. La qualité de l’étude est limitée du fait de l’utilisation d’une seule concentration de m-xylène. Les effets critiques retenus auto-estimés subjectifs sont des effets respiratoires objectivement mesurés (capacité vitale forcée) ainsi que d’effet auto-estimés subjectifs (neurologiques et respiratoires). La justification de sa construction et les facteurs d’incertitudes retenus sont pertinents au regard des données disponibles.
Le TCEQ reprend la valeur de l’ATSDR, sans toutefois arrondir la valeur finale et présente de fait une valeur quantitativement un peu différente, mais globalement identique.
L’Anses retient la valeur proposée par l’ATSDR sur la base uniquement des effets objectivés. L’Ineris retient cette approche.
Indice de confiance : L’Anses accorde un indice de confiance moyen/faible à cette valeur.
Effets à seuil - Exposition sub-chronique par inhalation :
L’Ineris propose de ne pas retenir de valeur pour une exposition sub-chronique aux xylènes par inhalation.
La seule valeur disponible est la valeur de l’ATSDR pour des expositions sub-chroniques. L’ATSDR a construit sa valeur à partir d’une étude de toxicité subchronique de 3 mois par inhalation (50 et 100 ppm) chez le rat (Korsak et al., 1994). L’effet critique retenu est l’altération de coordination motrice. En raison de résultats divergents, à savoir une baisse de la sensibilité à la douleur thermique décrite par la même équipe (Gralewicz et al., 2001) dans des conditions expérimentales toutefois différentes (test réalisé 50 jours après une exposition de 4 semaines à 100 ppm et l’induction d’un stress électrique), la sensibilité à la douleur thermique ne devrait pas être retenue comme effet critique.
La construction à partir d’un LOAEL ne parait pas justifiée. La valeur n’est donc pas retenue pour des expositions subchroniques.
Effets à seuil - Exposition chronique par inhalation :
L’Anses retient la valeur de 0,1 mg.m-3 (0,03 ppm) pour une exposition chronique aux xylènes par inhalation (Anses, 2020).
Huit valeurs sont proposées pour les mélanges de xylènes US EPA (2003), ATSDR (2007), OMS (1997), Santé Canada (2021), RIVM (2001), OEHHA (2003), Anses (2020) et TCEQ (2015).
L’ATSDR, le TCEQ et l’OEHHA se basent sur l’étude épidémiologique d’Uchida et al. (1993) chez les travailleurs, alors l’US EPA, Santé Canada et le RIVM se basent sur des études expérimentales (Korsak et al., 1994 ; Hass et Jakobsen, 1993).
L’étude d’Uchida et al., est une étude épidémiologique présentant des limites méthodologiques :
les effets neurotoxiques ou respiratoires sont rapportés via des questionnaires remplis par les personnes exposés (appréciation subjective de l’effet),
les concentrations d’exposition correspondent à des moyennes (géométrique ou arithmétique) mesurées par diffusion passive impliquant des incertitudes non négligeables dans la mesure,
enfin les travailleurs sont exposés à un mélange constitué à 70 % de xylène et d’autres substances (toluène (1 ppm) et à l’éthylbenzène (3 ppm) (70 % du mélange d’exposition correspond au moins à du xylène).
L’US EPA, Santé Canada, l’OMS et le RIVM se basent sur 2 études expérimentales, ayant toutes deux exploré l’altération de la coordination motrice à partir des performances enregistrées au test du « rotarod » (Korsak et al., 1994; Hass et Jakobsen, 1993.
La valeur du RIVM, identique à celle de l’OMS, est construite à partir d’une étude sur le développement (exposition pendant la gestation) et dans laquelle une seule dose a été testée (Hass et al., 1993). De plus, comme le précise les auteurs, le test du « rotarod » n’a pas été réalisé en aveugle. Dans l’étude retenue par l’US EPA et Santé Canada, le même test est réalisé sur des animaux exposés à 2 doses de 50 et 100 ppm (Korsak et al., 1994). La diminution dose-dépendante de la coordination motrice (test « rotarod » significatif uniquement à 100 ppm) justifie le choix de cette étude de bonne qualité.
L’Anses retient la valeur proposée par l’US EPA. L’Ineris retient cette approche
Indice de confiance : L’Anses accorde un indice de confiance moyen/faible dans sa valeur
Effets à seuil - Exposition aiguë par voie orale :
L’Ineris propose de retenir pour une exposition aiguë aux xylènes par voie orale la VTR aiguë de 1 mg.kg-1.j-1 de ATSDR (2007).
La seule valeur disponible est la valeur de l’ATSDR pour des expositions aiguës. L’ATSDR s’appuie sur une étude expérimentale où des rats ont reçu une dose unique par gavage de 125 à 2 000 mg.kg-1 de p-xylène (Dyer et al., 1988). L’étude est construite avec rigueur. L’effet critique retenu est une altération sensorielle (potentiels évoqués visuels), justifié au regard de l’atteinte du système nerveux central, organe cible de la toxicité des xylènes.
La justification de sa construction est pertinente, elle est donc retenue pour des expositions aiguës.
Indice de confiance : moyen
Effets à seuil - Exposition sub-chronique par voie orale :
L’Ineris propose de retenir pour une exposition sub-chronique aux xylènes par voie orale la VTR sub-chronique de 0,4 mg.kg-1.j-1 de l’ATSDR (2007).
La seule valeur disponible est la valeur de l’ATSDR pour des expositions sub-chroniques. L’ATSDR utilise une étude de toxicité chronique par gavage chez la souris et le rat. L’effet critique retenu est une hyperactivité du comportement des souris mâles et femelles qui survient dans les 5 à 30 minutes qui suivent l’administration du mélange de xylènes. Cet effet a également été observé à la même dose au cours des expositions de 13 semaines chez les souris et semble donc survenir indépendamment de la chronicité du traitement. La justification de sa construction est pertinente, elle est donc retenue pour des expositions subchroniques.
Indice de confiance : faible en raison de l’effet critique et d’un facteur d’incertitude global élevé.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique aux xylènes par voie orale la VTR chronique 0,013 mg.kg-1.j-1 de (Santé Canada, 2021).
Cinq VTR sont proposées par les organismes nationaux et internationaux : l’ATSDR (2007), l’US-EPA (2003a), l’OMS (2017), Santé Canada (2021) et le RIVM (2001).
L’ATSDR, l’US-EPA et l’OMS ont construit leur VTR à partir de l’étude expérimentale chronique par voie orale du NTP (1986) alors que le RIVM a construit sa valeur à partir de l’étude expérimentale sub-chronique par voie orale de Condie et al (1988). L’effet critique retenu par le RIVM est une absence d’effet hépatique à une dose où des effets rénaux apparaissent chez les rats mâles et femelles. La VTR du RIVM est écartée du fait de cette anomalie non expliquée.
L’effet critique retenu dans l’étude du NTP varie selon les organismes. L’ATSDR retient la baisse du taux de survie chez les rats mâles qui semble avoir, au moins en partie, une origine accidentelle qui ne peut être totalement élucidée (fausses routes liées à l’expérimentateur ou au traitement lui-même). Cet effet n’est pas considéré comme pertinent. L’US EPA et l’OMS retiennent comme effet critique la baisse de croissance pondérale qui est observée uniquement chez les rats mâles exposés à la plus forte dose. Cet effet est peu spécifique et n’est pas retenu. Santé Canada s’appuie, en justifiant l’absence de données exploitables par voie orale (relation dose-réponse, effet clairement identifié), sur une étude de toxicité subchronique par inhalation (corps entier) chez le rat (Korsak et al. ; 1994). Dans cette étude de bonne qualité, l’effet critique retenu est la baisse de la coordination motrice (test du « rotarod »), cette étude étant celle qui a été retenue pour la construction de la valeur pour des expositions chroniques par inhalation. La construction repose sur des modélisations PBPK et permet à partir de l’estimation de la dose interne chez le rat de calculer une dose externe chez l’humain.
La construction de la valeur est détaillée et les facteurs d’incertitudes sont cohérents. La valeur de Santé Canada est retenue.
Indice de confiance : faible en raison de l’extrapolation voie à voie et du schéma de l’étude (un seul test neurocomportemental).
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
Evaluation existante :
Les xylènes ont fait l'objet d'une évaluation collective par les états membres de l'OCDE, le rapport d'évaluation (SIAP3) étant disponible sur le site de l'OCDE (OECD, 2003). Les études issues de cette évaluation n'ont pas fait l'objet d'une validation supplémentaire.
OCDE Programme HPV (OECD, 2003).
Critères PBT /POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Norme de qualité existante :
OMS : 10 µg.L-1 (WHO, 2003).
Substance(s) associée(s) :
-
Dangers
Description
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC.
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées ont fait l'objet d'un examen collectif et ont été validées dans le cadre des travaux réalisés dans le programme HPVC de l'OCDE.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE AQUATIQUE AIGUË

ECOTOXICITE AQUATIQUE CHRONIQUE

Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biota, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été regardées comme validées puisqu'elles sont issues d'une source considérée fiable.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biota n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen (Tableau 22, page 129, E.C., 2003) et le projet de guide technique européen pour la détermination de normes de qualité (E.C., 2009). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (tableau 23, page 130, E.C., 2003). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les essais présentés ci-dessous ont été réalisés sur un mélange des différents isomères de xylènes. Aucune distinction n'est faite dans les résultats sur l'isomère testé.
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES
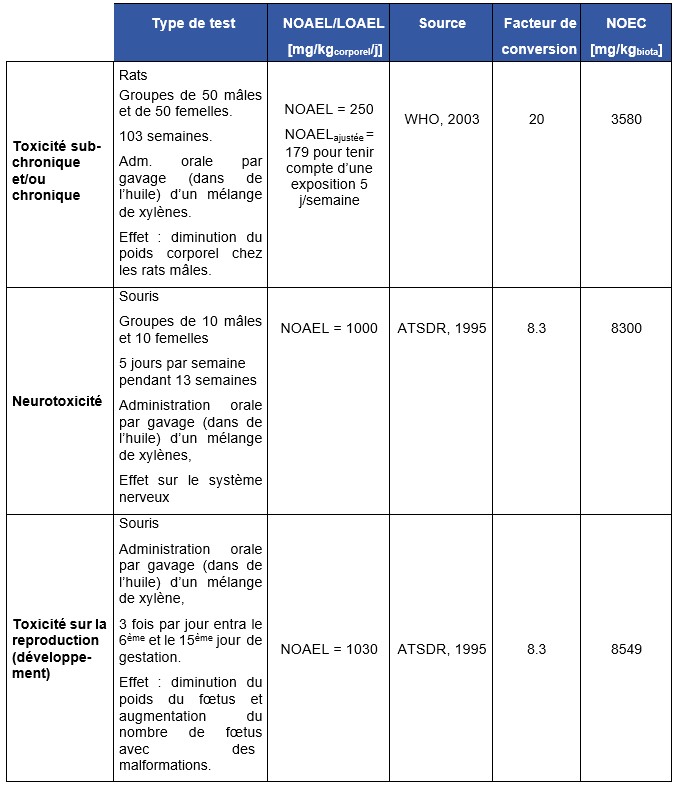
TOXICITE ORALE POUR LES OISEAUX

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
ECOTOXICITE AQUATIQUE AIGUË

ECOTOXICITE AQUATIQUE CHRONIQUE

Eau marine
Voir paragraphe eau douce
Sédiments d'eau douce
Paramètres d’écotoxicité aiguë :
Aucune information n’est disponible.
Paramètres d’écotoxicité chronique :
Aucune information n’est disponible.
Sédiments marins
Paramètres d’écotoxicité aiguë :
Aucune information n’est disponible.
Paramètres d’écotoxicité chronique :
Aucune information n’est disponible.
Sol
Paramètres d’écotoxicité aiguë :
Aucune information n’est disponible.
Paramètres d’écotoxicité chronique :
Aucune information n’est disponible.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour l'évaluation des risques dus aux substances chimiques (E.C., 2003) et au projet de guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2009). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le tableau 16, page 101, du guide technique européen (E.C., 2003).
Moyenne annuelle (AA-QSwater_eco) :
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour l'o-xylène:
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 1000. D'où :
![]()
Pour le m-xylène:
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 1000. D'où :
Pour le p-xylène
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 1000. D'où :
Concentration Maximum Acceptable (MAC)
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées. Pour la détermination de la MAC, le document guide pour l'évaluation des effets des substances avec des rejets intermittents est utilisée (ECHA, 2008, E.C., 2009)
Pour l'o-xylène:
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 100. D'où :
Pour le m-xylène:
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 100. D'où :
Pour le p-xylène
L'invertébré marin, Crangon franciscorum, est l'espèce la plus sensible. La CE50 déterminée lors de cet essai est utilisée avec un facteur 100. D'où :

VALEUR GUIDE DE QUALITE POUR LE SEDIMENT (QSSED)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature.
A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que:
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
NB : La pollution actuelle peut être suivie dans les matières en suspension et les couches superficielles du sédiment. Les couches profondes intègrent la contamination historique sur des dizaines voire des centaines d'années et ne sont pas jugées pertinentes pour caractériser la pollution actuelle. Les paramètres par défaut préconisés par Lepper (2002) et le guide technique européen (E.C., 2003) ont été choisis empiriquement pour caractériser les matières en suspension et les couches superficielles. Matières en suspension et couches superficielles contiennent relativement plus d'eau et de matière organique que les couches profondes du sédiment.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (adaptation de l'équation 70 page 113 du guide technique européen, E.C., 2003) :
Avec :
RHOsup : masse volumique de la matière en suspension en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper, 2002) et le guide technique européen (équation 18 page 44, E.C., 2003) est utilisée : 1150 kg.m-3 .
Kpsusp-eau : coefficient de partage matière en suspension/eau en m 3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par Lepper, 2002) et le guide technique européen (équation 24 page 47, E.C., 2003) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.9 + 0.025 * Koc soit Kpsusp-eau = 6.75 m 3/m3 (o-xylène) ; 4.8 m3/m3 (m-xylène) ; 8.8 m 3/m3 (p-xylène).
Ainsi, on obtient :
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
Avec :
Fsolidesusp : fraction volumique en solide dans les matières en suspension en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 0.1 m 3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 2500 kg.m-3 .
Pour le xylène, la concentration correspondante en poids sec est :
Le LogKow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance
dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.

NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2003). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés dans le tableau 23 page 130 du guide (E.C., 2003).
Pour le xylène, un facteur de 30 est appliqué car la durée du test retenu (NOAEL à 179 mg/kgcorporel/j sur le rat, soit une NOEC de 3580 mg.kg-1biota) est de 103 semaines. On obtient donc :
Cette valeur de PNEC pour l'empoisonnement secondaire peut être ramenée à une concentration dans l'eau du milieu selon la formule suivante :
Avec :
BCF: facteur de bioconcentration,
BMF : facteur de biomagnification.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le tableau 29, page 160, du guide technique européen (E.C., 2003).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le xylène, un BCF de 15 (OECD, 2003) et un BMF de 1 (cf. E.C., 2003) ont été retenus. On a donc :
![]()
Pour rappel, la QSbiota sec pois déterminée couvre l'ensemble des isomères du xylène.

NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (Lepper, 2005):
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour, pour cette substance elle sera considérée égale à 179 µg/kgcorporel/j (Cf. tableau ci-dessus),
- Cons. Journ. Moy : une consommation moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2009).
Pour le xylène, le calcul aboutit à:
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
Pour le xylène, on obtient donc:
Pour mémoire, la QSbiota_hh déterminée couvre l'ensemble des isomères du xylène.

NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité réglementaires dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1). Pour le xylène l'OMS préconise une valeur de 10 µg.L-1 (WHO, 2003).
A titre de comparaison, la norme de qualité pour l'eau de boisson est calculée de la façon suivante (Lepper, 2005) :
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour, pour cette substance elle sera considérée égale à 179 µg/kgcorporel/j (Cf. tableau ci-dessus),
- une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le xylène, on obtient :
Pour mémoire, la QSdw_hh déterminée couvre l'ensemble des isomères du xylène. La valeur la plus protectrice de 10 µg.L-1 recommandée par l'OMS est proposée.

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
PROPOSITION DE NORME DE QUALITE ENVIRONNEMENTALE (NQE)
La NQE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.

Pour le xylène, la norme de qualité pour les organismes aquatiques est la valeur la plus faible pour l'ensemble des approches considérées (elle couvre l'ensemble des isomères du xylène). La proposition de NQE pour le xylène est donc la suivante :

VALEURS GUIDES POUR LE SEDIMENT

Bibliographie
Activité endocrine
Dernière vérification le 29/03/2024
Généralités sur les activités endocrines
Le xylène n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 95-47-6 |
|---|---|
| SANDRE | 1292 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Selon l'arrêté du 20 avril 19941 , le xylène commercial ainsi que tous ses isomères purs sont considérés comme des produits nocifs (Xn ; R20/212), irritants (R383) et inflammables (R104). En revanche, selon ce même arrêté, ils ne sont pas classés comme dangereux pour l'environnement. Leur fabrication, utilisation, transport et stockage sont réglementés, en partie par les législations relatives aux installations classées pour la protection de l'environnement. Les xylènes sont, en particulier, définis comme des liquides inflammables selon les rubriques 1431, 1432, 1433, 1434, de la nomenclature des ICPE5 . Les rejets de xylènes sont réglementés par l'arrêté du 2 février 1998. Le xylène est considéré comme une substance toxique, bioaccumulable ou nocive pour l'environnement. La valeur limite de concentration (moyenne mensuelle) dans des rejets ne doit pas dépasser 1,5 mg.L-1 si le flux du rejet dépasse 10 g.j-1 . Selon l'arrêté du 20 avril 2005 relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses, la norme de qualité des eaux a été fixée pour le xylène à 10 µg.L-1 . En ce qui concerne les réglementations relatives à la qualité des eaux de consommation, les xylènes ne sont ni concernés par le décret n°2001-12206 , ni par la directive 98/83/CE7 . En revanche pour l'OMS8 la teneur limite en xylènes pour des eaux de consommation est de 500 g.L-1 . Enfin, les xylènes étant des COV, leurs utilisations sont soumises à la directive 1999/13/CE qui vise à réduire les émissions de COV en Europe (objectif de réduction globale de 40% en 2010 pour la France (MEDD, 2003). Cette directive peut-être complétée par la directive 94/63/CEE du 20 décembre 1994 relative à la lutte contre les émissions de composés organiques volatils (COV) résultant du stockage de l'essence et de sa distribution des terminaux aux stations-service. [1] Arrêté relatif à la déclaration, la classification, l'emballage et l'étiquetage des substance chimiques complété jusqu'à la directive 2004/73/CE de la commission du 29 avril 2004 portant la 29ème adaptation au progrès technique de la directive 67/548/CEE. [2] Nocif par inhalation et par contact avec la peau [3] Irritant pour la peau [4] Inflammable [5] Décret 53-578 du 20 mai 1953 modifié, relatif à la nomenclature des installations classée pour la protection de l'environnement mise à jour par le ministère de l'environnement et du développement durable. [6] Décret du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles. [7] Directive du conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine. [8] Directive de la qualité pour l'eau de boisson (2004). |
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Les xylènes sont produits à partir de matières premières brutes issues du pétrole par reformage catalytique (entre 85 et 90% de la production de xylène) ou par vapocraquage (IPPC, 2003). La teneur en xylènes dépend de la composition du naphta employé et des conditions de reformage. Le choix des huiles brutes naphténiques permet d'obtenir des fractions de naphta bien adaptées pour le reformage et la production d'aromatiques. La teneur en xylènes des essences obtenues par vapocraquage dépend des hydrocarbures utilisés comme matière première. Seule l'utilisation d'hydrocarbures ayant un point d'ébullition élevé permet d'obtenir des concentrations en xylènes exploitables.
Ces opérations permettent d'obtenir du xylène mélangé, ou xylène commercial. Ce produit contient alors à la fois les trois isomères du xylène, mais également de l'éthylbenzène et quelques autres impuretés comme du benzène, du toluène, du phénol… En fonction des procédés et des conditions opératoires employées, on obtient des compositions de xylènes différentes, pour lesquelles le m-xylène est toujours majoritaire. Par reformage catalytique on obtient par exemple du xylène commercial contenant 44% de m-xylène, 20% de o-xylène, 20% de p-xylène et 15% d'éthylbenzène (ATSDR, 2005).
Les isomères du xylène sont produits à partir du xylène commercial. Le p-xylène est obtenu par cristallisation et extraction au solvant. Le m-xylène et o-xylène sont ensuite séparés par distillation. Le o-xylène peut également être produit par isomerisation du m-xylène.
Paradoxalement, c'est le m-xylène pur qui parmi les trois isomères est le moins produit. Les capacités de production annuelles de xylène étaient en 1995, dans le monde, de (Vignes, J.L., et al, 1998):
- 165 000 t pour le m-xylène;
- 3 098 000 t pour le o-xylène;
- 11 720 000 t pour le p-xylène.
En 1995, la production totale de xylènes en Europe occidentale était de 2,7 millions de tonnes (Ullman, 1996).
En 1993, les capacités de production française étaient de 90 000 t.an-1 pour le o-xylène et de 90 000 t.an-1 pour le p-xylène. Ces xylènes étaient exclusivement fabriqués par le groupe Total dans la raffinerie de Gonfreville l'Orcher (76).
Place de la substance dans l'économie française
En 1993, les capacités de production française étaient de 90 000 t.an-1 pour le o-xylène et de 90 000 t.an-1 pour le p-xylène. Ces xylènes étaient exclusivement fabriqués par le groupe Total dans la raffinerie de Gonfreville l'Orcher (76).
En outre, selon les chiffres du commerce extérieur (Direction générales des douanes, 2005), la France a importé en 2004 14 800 t de xylène commercial, 110 t de o-xylène et 1 879 t de p-xylène. Le prix de ces différents produits 'est établi entre 500 et 650 €/t en 2004. Toutefois, les xylènes étant des hydrocarbures, leurs prix varient entre autres selon le prix du pétrole. On constate donc une forte augmentation du coût de ces matières depuis ces 3 dernières années. Ainsi, le prix du xylène commercial a augmenté de 43% entre 2003 et 2005 (Direction générales des douanes, 2005).
Le p-xylène sert en grande partie à la synthèse du PET. En 2003, la production française de PET à été de 110 000 t alors que sa consommation a été de 410 000 t, en augmentation de 9% par rapport à 2002 (Syndicat des producteurs de matières plastiques, 2003). D'après les prévisions, la demande mondiale de PET devrait passer de 30 Mt en 2004 à 50 Mt en 2010 (technique de l'ingénieur, 2004). Le prix du PET dépend à 80% du prix des matières premières. Il fluctue donc avec le cour du pétrole.
Le o-xylène sert à la synthèse de l'anhydride phtalique. La capacité de production est en France de 90 000 t, et il est synthétisé uniquement par Arkema. Le prix de l'anhydride varie avec celui du o-xylène auxquel il faut ajouter 120 € par tonne (Techniques de l'ingénieur, 2004). L'anhydride phtalique est ensuite transformé en dibutyl phtalate (DBP) utilisé comme plastifiant pour le PVC. Il en a été produit en 1998 près de 26 000 t dans l'union Européenne. Toutefois, cette production est en forte diminution puisqu'en 1994, la production de DBP s'élevait à 49 000 t (ECB, 2004).
Impact économique des mesures de réduction
Comme pour le toluène, la réduction des émissions de xylène est fortement liée à la réduction de son utilisation en tant qu'hydrocarbure. Or l'augmentation probablement durable des cours du pétrole amène les industriels et les pouvoirs publics à développer des solutions susceptibles de diminuer la consommation d'essence (moteur hybride, biocarburants…). Ces mesures représentent un coût très important impossible à chiffrer dans le cadre de notre étude. De plus, même si elles peuvent y contribuer, elles ne sont pas directement liées aux mesures de réduction des émissions de xylène, mais s'inscrivent dans une démarche plus globale de réduction des consommations de pétrole.
En revanche, on peut estimer le coûts de certains procédés de récupération et de traitement des COV :
Les pots catalytiques étant installés de série sur toutes les voitures neuves, le coût de ces derniers est donc intégré au prix général d'un véhicule. Pour les autres véhicules un pot catalytique coûte entre 200 et 500 € (UNECE, 2005). On estime qu'en 2005, la moitié des véhicules sont équipés d'un tel système (MEDD, 2003), et en considérant que le parc automobile de voitures se renouvelle tous les 15 ans, on peut espérer qu'à partir de 2010, toutes les voitures françaises seront équipées d'un pot catalytique.
Les coûts de traitements des COV sont très variables en fonction des techniques. Le tableau ci-dessous indique quelques exemples de coûts13 :

En outre, on peut estimer le coût de la réduction des émissions de COV par les industriels en étudiant le marché de la lutte contre les Composés Organiques Volatils. Celui-ci a été estimé à 32,4 Million € en 2004, en augmentation de +20% par rapport à 2003. Il devrait encore continuer à augmenter de 20% en 2005, pour atteindre 38,8 Million € (Actu® environnement, 2005). Selon l'UFIP, la réduction des émissions de COV, de 91 000t, tout au long de la chaîne pétrolière, a coûté 630 M€ au total, aux industriels du secteur.
Il est également difficile d'établir le coût de traitement des rejets aqueux d'hydrocarbures car ils vont dépendre de la nature des effluents et du milieu de rejet. Selon un industriel interrogé, spécialisé dans le traitement des hydrocarbures, le coût moyen de traitement d'une unité de déshuilage serait de 60€ par tonne d'effluents à traiter. Le BREF sur le traitement des effluents dans la chimie donne également quelques exemples de coûts. Ainsi, une unité de déshuilage coûte 2 M€, une unité de stripping traitant un flux de 30 m3 par heure est de 4 à 5M€, et une unité d'adsorption sur charbon actif de 75 000£ (IPPC, 2002).
Pour ce qui concerne les prix des produits de substitution, ils sont en général plus chers que le xylène, mais ont une plus faible fluctuation car ils dépendent moins du pétrole.
- le produit proposé par une entreprise pour le nettoyage des encres et des peintures et pour le dégraissage des surfaces est vendu en moyenne deux fois plus cher que le produit équivalent à base d'hydrocarbures uniquement.
- Une entreprise propose une gamme de produits dérivés d'esters de colza pour le nettoyage et le dégraissage ou pouvant servir d'additif dans les peintures. Ces produits vendus à partir de 1€.kg-1 sont en moyenne deux fois plus chers que les équivalents pétroliers (white spirit), mais une augmentation de la demande et surtout une augmentation des capacités de production pourraient avoir un effet bénéfique sur le coût de ces produits.
- En revanche, le marché des peintures sans solvants est plus ancien (début des années 50) et beaucoup plus développé. Le prix de ces peintures est donc le même que le prix des peintures contenant des COV.
[13] Voir également le paragraphe sur le traitements des effluents atmosphériques.
Utilisations
Xylène commercial
FTE 2005 Importer
Le xylène est un solvant essentiellement utilisé dans la fabrication des peintures, des vernis, des colles, des encres d'imprimerie, mais également dans la synthèse des insecticides, des matières colorantes, dans l'industrie du caoutchouc et des produits pharmaceutiques (INERIS, 2005). Toutefois, dans le secteur des peintures, encres et vernis, de nombreux efforts ont déjà été réalisés pour réduire les COV. Par exemple, les fabricants de peintures décoratives utilisent aujourd'hui des solvants à base de white spirit désaromatisé. Le xylène n'est utilisé comme solvant que pour des peintures contenant des plastifiants uniquement solubles dans des solvants aromatiques (Akzo Nobel, 2005). La consommation mondiale de xylène s'est élevée en 1995 à environ 1,5 million de tonnes (Vignes, J.L., 1998). En France, le xylène est le solvant hydrocarboné le plus utilisé avec 34 000 t en 2004 (INRS, 2005).
Tableau 2.2.1. répartition des utilisations de xylène en tant que solvant

Isomères
FTE 2005 Importer
p-xylène
Le principal débouché du p-xylène est la fabrication de l'acide téréphtalique (72% du tonnage consommé en 1994 en Europe) ou de son ester, le diméthyltéréphtalate (26% du tonnage consommé en 1994 en Europe), servant à la fabrication du PET (polyéthylènetéréphtalate) et des fibres polyester, comme par exemple, le "Tergal" (Alario, F., et al., 2005).
En 1995, la consommation mondiale de paraxylène était de 10,5 millions de tonnes (Vignes, J.L., 1998). En 2003, la production française de PET à été de 110 000 t. La production de PET en Europe est en croissance d'environ 1% par an depuis quelques années.
o-xylène
L'unique débouché du o-xylène est la fabrication de l'anhydride phtalique utilisé à plus de 60 % pour la fabrication de plastifiants pour PVC (phtalates en particulier le DEHP) ainsi que pour la fabrication de résines polyester insaturées employées dans des composites (domaine maritime et construction) et de résines alkydes servant de revêtement de surface. Il remplace, pour la fabrication de l'anhydride phtalique, de plus en plus, le naphtalène.
Le DEHP est classé en catégorie 2 pour la reproduction et le développement dans l'annexe I de la directive 1967/548/CEE, et est une substance prioritaire de la Directive Cadre Eau. Le marché du DEHP présente une tendance à la baisse dans certains domaines d'emploi (câblerie, films, peintures, caoutchouc). Cette tendance est due à sa classification comme substance de catégorie 2 pour la reproduction et le développement. Elle s'explique également par la concurrence d'autres produits. (Brignon, J.M., et al, 2005)
En 1995, la consommation mondiale de orthoxylène était de 2,6 millions de tonnes (Vignes, J.L., 1998). L'anhydride phtalique a été produit, en 1998, à 26 000 t, dans l'union Européenne, avec une tendance à une forte diminution.
m-xylène
Le m-xylène est employé, quasi exclusivement, dans la production d'acide isophtalique destiné à la synthèse de résines polyester insaturées, de résines alkydes et de comonomère dans la production de résines polyéthylènetéréphtalate.
En 1995, la consommation mondiale de m-xylène était de 140 000 tonnes (Vignes, J.L., 1998).
Carburants
FTE 2005 Importer
Le xylène est un hydrocarbure aromatique, et comme les autres aromatiques issus du pétrole (toluène, benzène…), il est un constituant des essences (Alario, F., et al., 2005). La composition des essences est très variable, et à ce jour, nous n'avons trouvé aucun chiffre concernant la consommation de xylène dans les carburants en France. Mais, selon l'UFIP, le xylène représenterait moins de 1% des essences. Or en 2004, les véhicules français ont consommé 11 675 kt d'essences (CPDP, 2005). Ce qui représenterait donc près de 117 000 t de xylène en mélange utilisé pour les carburants automobiles.
Rejets dans l’environnement
Sources non-intentionelles
FTE 2005 Importer
Comme tous les hydrocarbures aromatiques, le xylène se forme naturellement lorsque des matières organiques sont exposées à des phénomènes de combustion ou de pyrolyse. C'est par exemple le cas lors de feux de forêts, d'éruptions volcaniques, ou dans la fumée de cigarettes. C'est également le cas lors de la combustion de biomasse pour le chauffage. Cette dernière source d'émission semble représenter une source importante de rejets de COV dans l'air, mais à ce jour nous n'avons trouvé aucune étude quantifiant les retombées indirectes de xylènes dans les milieux aqueux.
Rejets dans l'environnement
FTE 2005 Importer
Les isomères du xylène sont facilement dégradés dans l'atmosphère. Le processus le plus important est la photo-oxydation. Cette oxydation atmosphérique est rapide et a lieu par réaction avec les radicaux libres et principalement les radicaux hydroxyles. En se basant sur des données de concentration de radicaux hydroxyles dans l'air, Brice et Derwent, (1978) ont calculé des demi-vies atmosphériques de 2,6 h, 1,5 h et 2,4 h respectivement pour le o, m et p-xylène. En revanche les xylènes ne sont pas détruits directement par photolyse.
Etant donné leur volatilité importante, les xylènes ne sont généralement pas persistants dans les eaux de surface à des concentrations très importantes. Le m-xylène et le p-xylene sont facilement biodégradables : En 13 jours, ces deux isomères ont été dégradés par des microorganismes provenant de boues de station d'épuration (Tabak et al., 1989). En revanche, l'o-xylène s'est avéré être moins biodégradable. La Commission Européenne (1996) propose d'utiliser une demi-vie de 150 jours dans les eaux de surface.
Bien que les xylènes puissent être présents de façon naturelle dans l'environnement (feu de forêt, pétrole brut…), les rejets sont essentiellement d'origine humaine.
Comme les autres COV, le xylène est en très grande majorité rejeté dans l'environnement vers l'atmosphère (INERIS, 2005), en particulier à cause de sa forte présence dans les essences. Dans ce cas, le xylène est émis soit directement lors de la vaporisation des essences (station essence, transport et stockage des carburants…), soit dans les gaz d'échappements des véhicules à essences (imbrûlés, volatilisation…). Les autres émissions proviennent des vapeurs de xylène utilisé comme solvant et des rejets de production (INERIS, 2005).
Les rejets industriels sont à l'origine des principaux rejets directs de xylène dans l'eau. Ces rejets proviennent essentiellement des raffineries qui fabriquent de l'essence et des industriels qui utilisent le xylène comme solvant dans leur processus de fabrication. Ainsi, lors d'un premier inventaire des émissions polluantes réalisé entre 1991 et 2000 dans 9 régions françaises, on estimait que le flux total de xylène, émis par des installations industrielles était de 19 kg.j-1 (République française, 2005). De même, dans le cadre de l'action nationale de recherche et de réduction des substance dangereuses dans l'eau, des mesures ponctuelles ont été réalisées à la sortie de près d'un millier d'ICPE. Il apparaît que le flux total de xylène (somme des trois isomères) issu de ces installations est toujours de près de 19 kg.j-1 . Enfin, en région Rhône-Alpes, où deux inventaires des rejets de micropolluants, par des établissements industriels, ont été réalisé en 1993 et 1998, on constate une baisse des émissions de xylènes. Ainsi, le flux total de xylènes, qui représentait 8,8 kg.j-1 en 1993 a baissé à 2,1 kg.j-1 en 1998. Dans tous ces inventaires, les rejets sont dus pour l'essentiel au secteur des industries pétrolières (raffinage, stockage et distribution, production d'électricité) puis au secteur de la chimie et de la parachimie (peintures et polymères).
Selon (Verschueren, K., 1996), les isomères m et p représentent de 1,3 à 5,6 % des hydrocarbures rejetés dans les fumées d'échappement des moteurs à essence. De même, d'après le tableau 3.5 (Guibet, J. C., 2005) on constate que le xylène représente 5% des émissions d'hydrocarbures imbrûlés dans les gaz d'échappement d'un moteur à essence.
Tableau 3.5 -Exemple de composition des « hydrocarbures imbrûlés » dans les gaz d'échappement d'un moteur à essence9

Ces rejets sont la source principale des rejets indirects du xylène dans les eaux (lessivage de l'atmosphère par la pluie, et rejets d'eaux pluviales polluées).
Les pulvérisations agricoles (insecticides, herbicides), les aérosols domestiques, spécialement les peintures et antirouilles contenant du xylène, la combustion du bois (poêles et cheminées domestiques), la fumée de tabac sont également responsables de la présence de xylène dans l'atmosphère. Ils représentent également tous des sources de rejets indirects dans les eaux.
Le déversement accidentel ou volontaire de produits (peintures, vernis…) peut également être une source importante de rejet direct de xylène dans les eaux, mais à ce jour nous n'avons trouvé aucune étude quantifiant de tels rejets. Toutefois, il est a noter qu'il n'existe pas aujourd'hui de filière nationale de collecte et de traitement des déchets de peintures, encres… (FIPEC, 2005).
[9] Prélèvement en amont du catalyseur de post-traitement.
[10] La teneur totale en HC, dans les gaz d'échappement secs, est de l'ordre de 500 ppm.
Pollutions historiques et accidentelles
FTE 2005 Importer
On peut retrouver des traces de xylène autour de lieux ayant subi des fuites d'hydrocarbures (stockage d'essence…) ou sur des lieux de décharge ou d'entreposage de produits contenant du xylène (peintures, vernis, solvant…).
Présence environnementale
Synthèse
FTE 2005 Importer
Les concentrations ubiquitaires de xylène sont (INERIS, 2005) :

Perspectives de réduction
Réduction des rejets
Réduction des émissions industrielles
FTE 2005 Importer
Sous l'influence des DRIRE et des différentes législations, des actions de réduction des émissions de COV ont été menées par les industriels depuis plusieurs années. Elles auraient permis de réduire de 20% les émissions industrielles de COV entre 2000 et 2003 (MEDD, 2003).
Rejets atmosphériques
Comme pour tous les autres COV, les rejets gazeux représentent la très grande majorité des rejets de xylène. Il existe, pour traiter ces rejets différents procédés, le plus souvent généralisables à l'ensemble des COV (Techniques de l'ingénieur, 2005 ; IPPC, 2001). On distingue les procédés de récupération et les procédés de destruction.
Le tableau ci dessous présente les différents procédés applicable aux traitements des COV (IPPC, 2001)

Traitement des effluents liquides
Les procédés de traitement des xylènes peuvent être très variables. Toutefois citons quelques exemples (IPPC, 2001):
Dans les raffineries de pétrole, on fait appel à des procédés de déshuilage et dégraissage associés généralement à des procédés de flottation et de coagulation. Ils permettent d'extraire des matières flottantes d'une densité inférieure à celle de l'eau comme c'est le cas pour les hydrocarbures (Boeglin j.L., 1998). Dans le cas d'un sytème API (américan pétroleum institute separator) on peut atteindre des performances entre 90 et 95%. Le coût d'un tel procédé est de 2 millions d'€ pour une capacité de traitement de 1200 m3/h.
On peut également citer le procédé de stripping adapté aux polluants volatils (Boeglin, J.L., 1998). Ce procédé correspond à l'entraînement de produits volatils dissous dans l'eau par l'action d'un autre gaz. Les produits ainsi récupérés peuvent être soit réutilisés dans les processus de fabrication, soit détruits par combustion dans un four ou récupérés dans des solutions où ils sont fixés et/ou oxydés (Cf. paragraphe traitement des effluents gazeux). Ce procédé est particulièrement efficace pour les hydrocarbures aromatiques (BTX) pour lesquels on peut atteindre 99% de performances. Le coûts d'une telle installation est de 4 à 5 millions d'€ (exemple d'une raffinerie avec un traitement par stripping d'eau de 30 m3/h).
Il est également possible d'utiliser des procédés par adsorption sur charbon actif dans le cas où les polluants sont peu concentrés. Un tel procédé capable de traiter jusqu'à 60 m3/h d'effluents coûte 75 000 £, auquel il faut ajouter 1000 à 2000 £ pour le retraitement d'une tonne de charbon actif.
Xylène dans les carburants
Les émissions de xylène sont liées d'une part aux pertes par évaporation de carburant, d'autre part aux émissions à l'échappement :
- En Europe, les émissions par évaporation tendent à se réduire, en raison de la généralisation de systèmes de récupération des vapeurs d'essence sur les modèles récents de véhicules. Les constructeurs automobiles installent aujourd'hui des procédés (canister) qui stockent les vapeurs d'essence provenant du réservoir, et permet au moteur de les recycler évitant ainsi une partie des rejets de COV (Peugeot, 2005).
- De même, depuis 2001, les postes de chargement des dépôts et raffineries, les cuves de stations services et les camions de ravitaillement sont équipés d'unités de récupération des COV. Les systèmes de distribution des stations services seront quant à eux progressivement équipés d'un dispositif de récupération des vapeurs d'essence. Grâce à l'emploi de ces techniques, les émissions de COVNM, dus à la chaîne pétrolière hors terminaux pétrolier, ont été réduit de 98 000 t, passant de 153 000 t en 1990 à 55 000 t en 2003 (UFIP, 2005). Il n'y a aujourd'hui, pratiquement plus d'émissions canalisées de COV, mais seulement des émissions diffuses.
- Depuis 1993, les constructeurs ont équipé les voitures nouvellement fabriquées, de filtres et de pots catalytiques. Actuellement, la meilleur technique disponible est le pot catalytique à trois voies et en boucle fermée (UNECE, 2005). Ces pots permettent en théorie de détruire 99% des émissions toxiques. Toutefois, les réactions catalytiques se font entre 300°C et 1000°C, elles n'ont donc pas lieu tant que le pot catalytique n'a pas atteint sa température de fonctionnement, ce qui prend en général 3 minutes (correspondance IFP, 2005). La catalyse des hydrocarbures imbrûlés en sortie de pots d'échappements des moteurs à essence n'a donc pas lieu sur des petits parcours. De plus, les pots perdent de leur efficacité avec le temps et l'usure du moteur. Ils doivent donc être changés régulièrement (2 ans en moyenne). Même si elle ne les supprime pas, l'utilisation des pots catalytiques permet de diminuer sensiblement les rejets de COV.
Grâce à ces procédés, les émissions de COVNM, ont diminué, en France, de 984 tonnes entre 1988 et 2004, passant de 1 176 t à 291 t (CITEPA, 2005). Et la généralisation de ces dispositifs permettrait de diviser par 5 les rejets de COV dus au transport routier, en Europe, entre 1995 et 2000 (MEDD, 2003).
En outre, pour réduire les émissions de xylène à l'échappement on peut modifier la composition des essences, et en particulier réduire les teneurs en aromatiques. La teneur maximale des essences en aromatiques était jusqu'en 2005 de 42 %, mais cette valeur limite est passée à 35 % en Janvier 2005. La Commission pourrait proposer avant 2006 de nouvelles normes sur le benzène et les aromatiques à respecter à compter de Janvier 2009 (IFP, 2003).
De plus, les émissions de COV dépendent de la tension de vapeur saturante des essences. Plus cette tension est faible, plus les émissions diminuent. Les fabricants d'essences, ont donc réduit la tension de vapeur de 80 à 60 kPa.
Pour modifier la composition des carburants on peut également avoir recours aux biocarburants. En effet, l'éthanol, l'ETBE et les huiles végétales pures (EMHV) améliorent la combustion des moteurs à essence, ce qui a pour conséquence de diminuer les émissions d'hydrocarbures imbrûlés. Une introduction de ces biocarburants dans des proportions admissibles par les moteurs actuels (20% au maximum) pourrait donc entraîner une diminution des rejets de xylènes. Toutefois, cette introduction doit tenir compte des normes de qualités des essences. Il ne faut pas en particulier que l'introduction d'éthanol entraîne une augmentations de la pression de vapeur saturante, ce qui aurait pour conséquence d'augmenter les émissions de COV. Pour cela, les producteurs d'essences doivent proposer de nouvelles compositions de leurs produits, ce qui pourrait entraîner des modifications importantes de leurs installations de productions. Dans un contexte français de surproduction d'essences ces modifications ne représentent pas forcément un intérêt économique pour les producteurs français.
Actuellement, les objectifs d'utilisation de biocarburants assignés aux États membres par la Commission européenne sont de 5,75 % de la consommation d'essence et de gazole en 2010, avec un objectif de 8 % en 2020. La France qui, actuellement, n'introduit en moyenne qu'un pour-cent de biocarburants dans les essences, a lancé un programme de développement de ces énergies, dont l'objectif est d'atteindre 10% de biocarburants inclus dans les carburants classiques en 2015.
L'amélioration du rendement des moteurs à essence, le recours à des voitures hybrides moins consommatrices, et l'augmentation du parc de véhicules diesel qui ne contient pas de xylène pourrait également entraîner une diminution des rejets. Toutefois, les réductions d'émission de xylène amenées par ces évolutions technologiques risquent d'être partiellement voire totalement compensées par l'augmentation des volumes de trafic prévue d'ici 2015.
En fait, pour diminuer plus durablement les émissions de xylène dues au trafic routier, il faudrait développer de nouvelles sources d'énergie pour les transports (électricité et piles à combustible…). Toutefois, de tels développements technologiques à grande échelle semblent peu probable d'ici à 2015. De même, une diminution du trafic routier entraînerait automatiquement une diminution des rejets de xylène, mais là encore les perspectives ne sont pas favorables.
Autres solutions
Quelque soit le solvant, un bon moyen de réduire les émissions consiste en la réduction de leur production. On peut, pour cela, les recycler, soit directement sur les sites d'utilisations (en récupérant par exemple les vapeurs) (Cf. § 4.2.1 : les techniques de récupération), soit en les faisant retraiter par des usines spécialisées.
Alternatives aux usages
Produits de substitution
FTE 2005 Importer
Xylène commercial
De façon générale, le meilleur moyen pour réduire les rejets de COV et donc de xylène est de limiter avant tout son utilisation et donc d'agir à la source de la pollution. Pour cela plusieurs solutions sont envisageables lorsque le xylène est en particulier employé comme solvant (ADEME, 2004) .
Il est tout d'abord important de développer des bonnes pratiques au sein des unités utilisant des solvants :
- Bon entretien des équipements ;
- Confinement des machines pour organiser des circuits fermés ;
- Optimisation des rendements des procédés de nettoyage (rinçage à contre courant) utilisant les solvants ;
- Récupération et recyclage des solvants dans les procédés chimiques.
- Sensibilisation et formation du personnel vis à vis de la pollution des COV ;
Le tableau suivant fournit des exemples de produits de substitution pour certaines activités qui pourraient limiter l'usage du xylène :
Tableau 4.1.1.a : substitution des solvants organiques en peinture (toluène, xylène, éthylbenzène…)

En 2003, en France, sur les 840 000 t de peintures et vernis produits, 375 000 t étaient à base de solvant aqueux, 36 000 t à base de poudre thermodurcissable et 5 000 t à séchage UV. Ainsi près de la moitié des peintures et vernis produits en France ne contiennent plus de solvant d'origine minérale (FIPEC, 2004). En dix ans, dans certain secteurs (peintures décoratives), le taux des peintures en phases aqueuse est passé de 40 à 60%. Selon la FIPEC, à cause des réglementations11 , les COV sont amenés à disparaître progressivement du secteur des peintures et encres sauf pour de rares applications pour lesquelles il n'existe pas encore de solutions de remplacement (marine, aérospatiale). Néanmoins, certaines nouvelles solutions comme les peintures à l'eau posent encore quelques problèmes de pollutions. Souvent les utilisateurs nettoient leurs matériels directement à l'eau alors qu'il est préférable de récupérer les eaux de nettoyage ainsi que les restes de produits pour les faire ensuite traiter. Une solution pourrait être des peintures aqueuses composées de plastifiants d'origine végétale.
De nombreuses entreprises proposent aujourd'hui des produits sans solvants dangereux servant à divers usages (décapages, peintures, nettoyage des surfaces, dégraissage). On peut citer une société qui propose un fluide multi-usages à base de solvants oxygénés, en substitution de diluants comme le xylène ou le toluène. D'autres entreprises développent des agro-solvants (Alcimed, 2002).
On peut également utiliser des procédés moins coûteux en matières premières.
Il existe donc de nombreuses autres solutions de substitutions du xylène lorsqu'il est employé comme solvant. Toutefois, avant de faire de telles substitutions, il est important de savoir si le nouveau procédé ou le nouveau produit utilisé aura moins d'impact sur l'environnement que le xylène. On peut faire appel, pour cela, à des études d'éco-conception ou d'analyse du cycle de vie. Il existe pour cela certains guides ou bases de données qui proposent des solvants de substitution12 .
[11] En particulier la directive 1999/13/CE.
[12] citons : l'Integrated solvent substitution data système (http://es.epa.gov/issds/) Le solvent alternative guide (http://clean.rti.org/) Le groupe européen de l'industrie des solvants (http://esig.org)
Isomères du xylène
Nous n'avons pas trouvé de produits pouvant remplacer les isomères du xylène lorsqu'ils sont utilisés comme intermédiaires réactionnels.
Conclusion
FTE 2005 Importer
Les xylènes sont des hydrocarbures aromatiques volatils extraits du pétrole. Il existe trois isomères utilisés soit séparément soit en mélange avec de l'éthylbenzène. Ils forment alors le xylène commercial. Les xylènes sont uniquement produits dans la raffinerie de Gonfreville l'Orcher. On produit ainsi, par an, en France, respectivement près de 90 000 t de o et p-xylène. En France, le xylène commercial est le solvant hydrocarboné le plus utilisé avec 34 000 t en 2004. Il est utilisé essentiellement dans le secteur des peintures et du dégraissage. Les isomères servent quant à eux à la synthèse de polymères (PET, phtalate pour PVC…).
De par leur volatilité, les xylènes sont émis dans l'environnement principalement vers l'atmosphère. Ils peuvent ensuite être introduits indirectement dans les milieux aquatiques. Les rejets directs de xylènes proviennent pour l'essentiel des rejets d'usines produisant ou utilisant les xylènes, mais surtout des usines utilisant des solvants contenant du xylène.
La présence de xylène dans les milieux aquatiques est due tout d'abord aux rejets indirects engendrés par le trafic routier. Ces rejets proviennent soit de la vaporisation des essences (station essence, transport et stockage des carburants…), soit des gaz d'échappements des véhicules à essences (imbrûlés, volatilisation…). En se basant sur les chiffres du CITEPA (2005), on peut constater que les rejets dans l'air de COVNM provoqués par le transport routier ont été divisés par 2,4 entre 1995 et 2003. Ils ont aussi été divisés par 1,5 dans le secteur de la transformation d'énergie.
Ces évolutions ont plusieurs origines :
- Equipement des véhicules routiers en pots catalytiques ;
- Améliorations apportées dans le stockage et la distribution d'hydrocarbures ;
- Augmentation du parc de véhicules diesel de 9,9 % par an entre 1990 et 2004 (CCFA, 2005) ;
- Diminution de la consommation des véhicules à essences (véhicules hybrides, amélioration du couple carburant/moteur…) de –0,9% par an entre 1990 et 2004.
Ces réductions ont même pu avoir lieu dans un contexte d'augmentation du trafic routier de 1,6% par an entre 1990 et 2004 (CCFA, 2005).
On peut donc espérer que ces évolutions permettront une forte réduction, à l'horizon 2015, des rejets indirects de xylène engendrés par le trafic routier.
La seconde source importante de rejet de xylène est due aux rejets indirects par évaporation des solvants aromatiques. Depuis 1999, de nouvelles réglementations imposant la limitation des rejets de COV, ont obligé les industriels à réduire leurs émissions. Pour cela différentes solutions ont été développées.
- Développement de produits contenant peu ou pas de solvants aromatiques (peinture à l'eau, désaromatisation du white spirit…) ;
- Utilisation de techniques sans solvants (peinture poudre, encre UV…) ;
- Utilisation de techniques moins consommatrices de solvant (rinçage à contre courant, pulvérisation plus précise…) ;
- Recyclage des solvants par des techniques récupératives.
Face à ces évolutions, le marché total des solvants en Europe a été en diminution régulière, passant de 5 260 000 t en 1990 à 4 000 000 t en 2000, soit une baisse de 24% (ADEME, 2003).
Parallèlement à cette diminution de consommation de solvants, on observe également une diminution des rejets industriels de COV vers l'atmosphère. Les émissions de COVNM des industries manufacturières ont ainsi diminué de 28% entre 1990 et 2003, passant de 591 kt à 425 kt. Aujourd'hui, les techniques de traitement des COV ont des rendements épuratoires supérieurs à 90% (IPPC, 2001), et elles ne cessent de se développer.
On peut donc espérer là aussi la poursuite de ces diminutions, entraînant par là même une forte réduction des rejets indirects de xylène dans les milieux aquatiques.
Pour ce qui concerne les rejets directs, il est difficile d'évaluer les possibilités de réduction des émissions car il n'y avait jusqu'à présent aucun suivi régulier des émissions et de la concentration des micro-polluants dans les milieux aquatiques français. Il est donc difficile d'établir une évolution des rejets directs de xylènes lors de ces dernières années. Seuls les deux inventaires des rejets de micro-polluants réalisés dans 168 établissements de la région Rhône-Alpes peuvent nous fournir quelques indications (DRIRE Rhône-alpes, 2001). Ces études montrent que entre 1993 et 1998, le flux total de xylène a été divisé par 4 en Rhône-Alpes, région particulièrement représentative de la diversité des activités industrielles françaises. On peut dès lors espérer une baisse des émissions directes de xylène dans les milieux aquatiques français à l'horizon 2015.
La diminution des concentrations de xylènes dans les milieux aquatiques passe cependant par la réduction des émissions indirectes dues aux gaz d'échappement et aux émissions industrielles de COV.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










