Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
2,4,5-T (93-76-5)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
93-76-5
Nom scientifique (FR)
2,4,5-T
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
202-273-3
Code SANDRE
1264
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C8H5Cl3O3 }\)
Code InChlKey
Code SMILES
O=C(O)COc(c(cc(c1Cl)Cl)Cl)c1
Familles
Familles d'usages
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H302 |
|---|---|
| Mention du danger - Texte | Nocif en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Mention du danger - Code | H319 |
|---|---|
| Mention du danger - Texte | Provoque une sévère irritation des yeux |
| Classe(s) de dangers | Lésions oculaires graves/irritation oculaire |
| Libellé UE du danger | - |
| Mention du danger - Code | H335 |
|---|---|
| Mention du danger - Texte | Peut irriter les voies respiratoires |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition unique) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
255.49 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Du fait d’une faible constante de Henry, la volatilisation du 2,4,5-T dans les sols est négligeable (HSDB, 2003).
Milieu eau douce
VGE/NQE Importer
Volatilisation :
Au vu de la valeur de sa constante de Henry < 9.4.10 -6 Pa.m3.mol-1), le 2,4,5-T semble peu volatil en solution aqueuse. (HSDB, 2005)
FDTE/VTR Importer En milieux aqueux, d’après son pKa, le 2,4,5-T est dissocié. La biodégradation de la substance est significative en milieu aquatique et le principal produit de dégradation est le 2,4,5-trichlorophénol. Proche de la surface de l’eau, la demi-vie de la molécule, pour la photolyse, est de 15 jours en été. Les substances humiques présentes dans l’eau photosensibilisent le 2,4,5-T et des photoréactions peuvent alors contribuer de façon majoritaire à la dégradation du composé en milieu aquatique, lorsque la concentration en substances humiques excède 15 mg de C organique par L d’eau (HSDB, 2003).
Milieu sédiment eau douce
VGE/NQE Importer
Adsorption :
Les valeurs de Koc (86 à 280 L.kg-1) suggèrent une adsorption faible à modérée du 2,4,5-T sur les sédiments et les particules en suspension dans l'eau. Cette adsorption est d'autant plus importante pour les substrats à forte teneur en matière organique, en raison de la forte affinité du 2,4,5-T pour les substances humiques.
L'intervalle de valeurs 86-280 L.kg-1 est utilisé dans la détermination de la norme de qualité pour les sédiments. (HSDB, 2005)
Milieu terrestre
FDTE/VTR Importer La mobilité de la substance est élevée dans les sols sableux, et faible dans les sols argileux ou limoneux. Du fait d’une forte affinité pour les substances humiques, la mobilité du 2,4,5-T dans les sols à forte teneur en matière organique est faible. La biodégradation du 2,4,5-T dans les sols est importante et, en conséquence, la lixiviation de ce composé est limitée. La contamination des nappes est toutefois possible si il existe des écoulements préférentiels dans les sols. La persistance de 2,4,5-T dans les sols varie entre 1 et 300 jours, en fonction des conditions climatiques et des populations de microorganismes dans le sol (HSDB, 2003).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
VGE/NQE Importer
Biodégradabilité :
La biodégradation de l'acide 2,4,5-T en conditions aérobies conduit à la formation du 2,4,5-trichlorophénol, premier produit de dégradation. La biodégradation anaérobie est beaucoup plus lente que la biodégradation aérobie, et conduit à la formation de substances telles que les mono-et di-chlorophénols et l'acide 2,5- (HSDB, 2005)
Dégradabilité abiotique
VGE/NQE Importer
Hydrolyse :
La dégradation de l'acide 2,4,5-T par hydrolyse n'est pas significative. (HSDB, 2005 MacKay et al., 2000)
Photolyse :
La photolyse est le mode de dégradation le plus significatif pour le 2,4,5-T : sous des conditions environnementales estivales correspondantes aux zones de latitude 40° et proche de la surface de l'eau, le temps de demi-vie du 2,4,5-T par photolyse a été estimé à 15 jours.
La photodécomposition de la substance peut être favorisée par adsorption sur les molécules humiques : les substances humiques présentes dans l'eau à une concentration excédant les 15 mg.L-1, augmentent la photosensibilité du 2,4,5-T et des photoréactions peuvent alors contribuer de façon majoritaire à sa dégradation en milieu aquatique. Les principaux produits de photodégradation (à pH 10) sont le 2,4,5-trichlorophénol et l'acide 2-hydroxy-4,5-dichlorophénoxyacétique.
(Skurlatov et al., 1983 HSDB, 2005)
FDTE/VTR Importer Le 2,4,5-T est résistant à l’hydrolyse et à l’oxydation. Comme dit précédemment, la photodécomposition de la substance peut être favorisée par adsorption avec les molécules humiques. Le produit principal issu de la photodégradation du 2,4,5-T est alors le 2,4,5-trichlorophénol.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
FDTE/VTR Importer Des expériences de biodégradation en sol tropical ont montré que 5 à 35 % de l' acide 2,4,5-T était biodégradé dans des sols non stérilisés, alors que seulement 1 % était biodégradé lorsque les sols étaient préalablement stérilisés. Des taux de biodégradation de 65 à 70 % ont été observés après 50 jours dans des sols contenant 1 mg/kg d'acide 2,4,5-T ; une expérience similaire avec des concentrations initiales de 15 mg/kg d'acide 2,4,5-T ont permis d'atteindre des taux de biodégradation de 75 à 90 % après 168 jours (Byast et Hance, 1975). La biodégradation aérobie conduit à la formation de 2,4,5-trichlorophénol et de 3,5-dichlorocatéchol ; ces composés étant instables, d'autres métabolites tels que le 4-chlorocatéchol, l'acide cis,cis-2,4-dichloromuconique, l'acide chlorosuccinique et l'acide succinique sont également retrouvés. La biodégradation anaérobie est beaucoup plus lente que la biodégradation aérobie, et conduit à la formation de substances telles que les mono- et di-chlorophénols et l'acide 2,5-dichlorophénoxyacétique (Mikesall et al., 1985 ; Suflita et al., 1984).
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Un facteur de bioconcentration (BCF) de 23 à 25 pour l'acide 2,4,5-T a été mesuré au cours d'un test en écosystème statique sur des poissons (Garten et Trabalka, 1983). En condition dynamique (circuit ouvert), le BCF a été mesuré à 43 (Kenaga et Goring , 1980). Sur la base de ces résultats, qui semblent être les seuls disponibles dans la littérature, la bioconcentration de l'acide 2,4,5-T dans les organismes aquatiques ne semble pas significative.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucune donnée pertinente n’a pu être trouvée dans la littérature.
Conclusion sur la bioaccumulation
VGE/NQE Importer
Bioaccumulation/ Biomagnification :
Des BCF de 23 à 25 pour le 2,4,5-T ont été mesurés au
cours d'un test statique sur poissons. En système dynamique, Kenaga et Goring ont déterminé un BCF de 43 sur poissons.
Sur la base de ces résultats, la bioconcentration du 2,4,5T chez les organismes aquatiques ne semble pas significative. -
Un BCF de 43 est utilisé dans la détermination des normes de qualité. Le document guide technique européen (E.C., 2011) pour la dérivation des NQE recommande l'utilisation des valeurs par défaut suivantes pour ce qui est de la prise en compte de la biomagnification : BMF1 = BMF2 = 1. (Garten et Trabalka, 1983 Kenaga et Goring, 1980 HSDB, 2005)
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (FAO/OMS, 1981 ; HSDB, 2003 ; IARC, 1977, 1986, 1987 ; RTECS, 1992 ; US EPA (IRIS), 1989). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. L'acide 2,4,5-T est le plus souvent cité dans la littérature sous la forme 2,4,5-T et cet acronyme sera donc utilisé dans la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Les voies principales d'exposition au 2,4,5-T sont l'inhalation et la voie cutanée. Une exposition par voie orale est également possible suite à l'ingestion d'eau, de lait ou de fruits contaminés (HSDB, 2003), ainsi qu’une ingestion volontaire (tentative de suicide).
Distribution
FDTE/VTR Importer Les concentrations urinaires et plasmatiques en 2,4,5-T sont proportionnelles au niveau d'exposition chez l'homme et la mesure de ces concentrations est l'outil de surveillance médicale en milieu professionnel (HSDB, 2003).
Métabolisme
FDTE/VTR Importer Sept volontaires sains ont ingéré, par voie orale, une dose de 5 mg/kg de 2,4,5-T pour une étude de toxicocinétique. La clairance plasmatique de ce toxique à une demi-vie de 23,01 heures et son excrétion, une demi-vie de 23,06 heures
Élimination
FDTE/VTR Importer La voie principale d'excrétion est la voie urinaire. Après absorption, 65 % du 2,4,5-T sont localisés dans le plasma où le 2,4,5-T est fixé de façon réversible aux protéines à 98,7 % (FAO/OMS, 1981). Trente six heures après une exposition d’une semaine par voie cutanée, il a été mesuré une concentration moyenne en 2,4,5-T de 3,5 g/mL dans les urines. L'excrétion urinaire sur 24 heures a été approximativement de 1 mg/L (Kolmodin-Hedman et Erne, 1980). Cependant il convient de noter qu’il ne s’agit pas d’une intoxification pure car le 2,4,5-T était mélangé à du 2,4-dichlorophénoxyacétique.
Chez l'animal
Absorption
FDTE/VTR Importer Chez le rat Sprague-Dawley mâle, la demi-vie plasmatique du 2,4,5-T est de 4,2 heures pour des concentrations par voie orale inférieures à 50 mg/kg.
Distribution
FDTE/VTR Importer L'administration chronique de 20 mg/kg/jour en 2,4,5-T entraîne une accumulation apparente de ce dernier. Cette substance ayant une action toxique sur les reins (inhibition du transport anionique rénal), cela suggère une toxicité rénale à long terme (Stroo et al., 1979). Le passage de la barrière hématoméningée du 2,4,5-T a été étudié chez le lapin in vivo par perfusion et in vitro sur plexus choroïdes isolés. In vitro, le transport du 2,4,5-T est actif et les concentrations 20 fois supérieures à celle du milieu de culture sont retrouvées après seulement 5 minutes d'incubation avec 1 M de 2,4,5-T. Vingt minutes après, ces concentrations sont 45 fois supérieures. Il s'agit d'un transport actif (inhibition par la ouabaïne et plusieurs anions organiques). Les résultats de la phase in vivo montrent également un transfert du 2,4,5-T à partir du cerveau et du liquide cérébro-spinal via un système de transport des anions organiques. Une altération de ces mécanismes de transport pourrait influencer fortement la toxicité du 2,4,5-T au niveau du système nerveux central (Kim et Pritchard, 1993).
Élimination
FDTE/VTR Importer Pour des concentrations élevées en 2,4,5-T, l'excrétion urinaire de ce toxique reste inchangée ce qui suggère un mécanisme actif. Des études réalisées in vitro sur des coupes fraîches de reins de rat et de chien montrent que l'élimination rénale du 2,4,5-T s'effectue par sécrétion active (Hook et al., 1974). Chez le chien, la demi-vie plasmatique est de 77 heures (FAO/OMS, 1981).
Toxicité aiguë
Chez l'homme
Voie orale
FDTE/VTR Importer Un cas létal par voie orale chez l'homme a été rapporté suite à une ingestion combinée de 2,4-D et 2,4,5-T. Les concentrations sanguines post-mortem de ces deux toxiques étaient respectivement de 83 et 18 mg/L (Coutselinis et al., 1977).
Chez l'animal
Voie orale
FDTE/VTR Importer Par voie orale, l'administration unique de 100 mg/kg de 2,4,5-T à des porcs se manifeste par de l'anorexie, des vomissements, de la diarrhée et une ataxie. L'autopsie révèle une entérite hémorragique, ainsi qu'une congestion du foie et des reins (IARC, 1977). Des données de toxicité aiguë par voie orale (doses létales 50 %) sont disponibles pour plusieurs espèces animales et sont comprises entre 100 et 500 mg/kg. L'espèce la plus sensible est le chien et la plus résistante, le rat (Hayes et Wayland, 1982).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Voie cutanée
FDTE/VTR Importer Une étude en milieu professionnel a tenté d'évaluer les effets à long terme d'une exposition au 2,4,5-T. Cette exposition s'est caractérisée par la présence de contaminants tels que la TCDD. Chez les 204 salariés exposés (163 non exposés), une chloracné persistante a été mise en évidence chez 55,7 %. Une corrélation avec des ulcères du tractus digestif a également été mise en évidence. De plus, une diminution des paramètres des fonctions pulmonaires (détails non fournis) chez les individus exposés fumeurs a été observée (Suskind et Hertzberg, 1984). Une autre étude a confirmé le développement de chloracné chez 52 % de salariés (226 individus au total) exposés professionnellement pendant 21 ans au 2,4,5-T. Cette chloracné a été observée en moyenne pendant 26 ans et pour 29 salariés, jusqu'à 30 ans. Chez les individus présentant ces lésions cutanées, une augmentation significative des taux sériques de -GT a été également enregistrée ainsi que des troubles sensoriels et une diminution de la libido (Moses et al., 1984).
Chez l'animal
Voie orale
FDTE/VTR Importer Des rats Sprague-Dawley (50/lot/sexe) ont été exposés pendant 2 ans à des doses de 3, 10 et 30 mg/kg/jour de 2,4,5-T dans l'alimentation. Des groupes satellites de 10 animaux par sexe et par lot ont été sacrifiés après 4 mois d'exposition. Aucun effet toxique n'a été enregistré à la dose de 3 mg/kg/jour. Une augmentation de l'excrétion des coproporphyrines urinaires a été observée après 4 mois d'exposition chez les mâles exposés à 10 et 30 mg/kg/jour et les femelles à 30 mg/kg/jour. Cet effet n'est pas retrouvé au terme des 2 ans. Une augmentation dose-dépendante de l'incidence de dépôts minéralisés dans le bassinet rénal a été décrite chez les femelles pour des doses de 10 et 30 mg/kg/jour après 2 ans d'exposition (Kociba et al., 1979). Une administration de 2,4,5-T dans l'alimentation pendant 90 jours chez des rats à des doses de 3, 10, 30 et 100 mg/kg/jour induit une légère anorexie et une augmentation des phosphatases alcalines sériques pour les deux doses les plus élevées (FAO/OMS, 1981).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 1998 |
| IARC | FDTE/VTR Importer Groupe 2B : les chlorophénoxyherbicides dont l'acide 2,4,5-T pourraient être cancérigènes pour l'homme. Il existe des indices limités de cancérogénicité chez l'homme en cas d'exposition professionnelle et des indices insuffisants de cancérogénicité chez l'animal. | |
| US EPA | FDTE/VTR Importer non évalué |
Chez l'homme
Toutes voies
FDTE/VTR Importer Chez l'homme, des études épidémiologiques ont été réalisées pour des expositions professionnelles à la famille des chlorophénoxyherbicides à laquelle appartient le 2,4,5-T. Une étude en Suède montre une corrélation statistiquement significative entre l'apparition de sarcomes des tissus mous et une exposition professionnelle aux chlorophénoxyherbicides. Une étude de cohorte, en Italie, a montré le même type de résultats, néanmoins une autre menée en Nouvelle-Zélande aboutit à des conclusions contradictoires (IARC, 1986). Concernant le risque de développement de lymphomes malins, des études épidémiologiques réalisées dans différents pays montrent des résultats contradictoires ne permettant pas de conclure (IARC, 1986 ; Pearce et al., 1987 ; Woods et al., 1987).
Chez l'animal
Voie orale
FDTE/VTR Importer Chez l'animal, le 2,4,5-T a été testé chez la souris par voie orale (21,5 mg/kg jusqu’à 28 jours d’âge, puis 60 mg/kg/jour jusqu’à 78 semaines d’âge) et sous-cutanée (1 seule injection de 215 mg/kg à 28 jours d’âge). Les résultats de ces études sont de qualité discutable, notamment en raison d'un faible nombre d'animaux exposés. Toutefois, bien qu'une augmentation de l'incidence de tumeurs en diverses localisations ait été observée au cours d'une étude par voie orale, aucune évaluation du potentiel carcinogène de cette substance ne peut être effectuée (données non disponibles) (IARC, 1977). Chez des rats ayant reçu via l'alimentation du 2,4,5-T (3, 10 et 30 mg/kg/jour pendant 2 ans), l'incidence des tumeurs chez les animaux exposés ne diffère pas de celle des animaux témoins à l'exception du développement d'adénomes thyroïdiens interfolliculaires des cellules C (un des types cellulaire de la thyroïde) chez les femelles à la plus faible dose. Cette augmentation ne peut être retenue en raison d'une absence de relation effet-dose (Kociba et al., 1979).
Effets génotoxiques
Chez l'animal
Synthèse
FDTE/VTR Importer Le 2,4,5-T a fait l’objet d’un examen et n'est pas classé génotoxique par l'Union européenne (JOCE, 1998). Toutefois, des données de mutagenèse sont disponibles (RTECS, 1992). Des altérations de l'ADN sont décrites à la dose de 100 mol/L sur lymphocytes de mammifères et spermatozoïdes de saumon. Il induit également des mutations chez des microorganismes (Saccharomyces cerevisiae et Bacillus subtilis) aux concentrations de 35 mg/L et 1 nmol/puit avec activation enzymatique (RTECS, 1992).
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Une étude épidémiologique rétrospective a été effectuée en Arkansas afin d'évaluer l'impact d'une exposition au 2,4,5-T et l'incidence des fentes palatines chez les nouveau-nés. Aucune différence significative n'a pu être observée (Nelson et al., 1979). Les résultats de cette étude ont été confirmés par une autre réalisée en Nouvelle-Zélande sur une cohorte de 37 751 nouveau-nés sur une période de 17 ans. Même dans les zones géographiques où l'exposition au 2,4,5-T a été élevée, l'incidence des malformations (fentes palatines, hypospadias, malformations cardiaques,…) chez les enfants n’est pas augmentée (Hanify et al., 1981).
Chez l'animal
Voie orale
FDTE/VTR Importer Au cours d'une étude de toxicologie de la reproduction sur trois générations, des rats ont été exposés à des doses de 3, 10 et 30 mg/kg/jour en 2,4,5-T. Aucun effet n'a été observé à la faible dose. Pour les doses plus élevées, une diminution du taux de survie néonatale est enregistrée (Smith et al., 1981). D'autres études ont également montré des effets du 2,4,5-T sur la reproduction chez le rat, la souris, le hamster et les primates. Un LOAEL de 15 mg/kg associé à un NOEL de 8 mg/kg, basé sur une réduction du poids corporel fœtal a été déterminé chez la souris. Une mortalité fœtale est induite par l'administration de 40 mg/kg/jour de 2,4,5-T à des hamsters femelles gestantes (US EPA (IRIS), 1989). Chez des souris A/JAX, la dose de 15 mg/kg/jour de 2,4,5-T entraîne l'apparition de fentes palatines. Cet effet n'a pas été évalué pour des doses moins élevées (Cranmer et al., 1978). Des souris CD-1 gestantes ont été exposées à des doses de 30 à 140 mg/kg de 2,4,5-T du 6e au 14e jour de gestation ainsi que des mâles et des femelles non gestantes de la génération F2. Des sacrifices sériés de 1 à 11 jours après le début du traitement ont été effectués. Les animaux moribonds après 2 à 9 administrations ont présenté des lésions myocardiques, une hypocellularité de la moelle osseuse et une déplétion lymphocytaire thymique, splénique et ganglionnaire. Ces lésions ont été associées à des modifications des paramètres hématologiques et biochimiques. Un pour cent de morbidité a été observée chez les femelles de F1 à 140 mg/kg et 53 à 82 % chez les mâles et les femelles de F2 à 120 mg/kg de 2,4,5-T. L’importante altération de l'état général maternel en phase précoce de la gestation n' a pu être corrélée en tant que cause primaire aux anomalies fœtales observées (Highman et al., 1976). Une étude de toxicocinétique a été réalisée chez des souris au 12è jour de gestation avec du 2,4,5-T radiomarqué à la dose de 100 mg/kg. Les femelles ont été sacrifiées 0,25 - 0,5 - 2 et 24 heures après l'administration. A ces différents temps, les pourcentages de la dose exprimée par gramme de tissus (sang maternel, placenta, sacs vitellins et embryons) ont été respectivement de 3 - 0,5 - 0,5 et 0,2 %. Aucun métabolite majeur n'a été retrouvé. De plus, 69-78 % de 2,4,5-T ont été éliminés dans les urines pendant 7 jours et 5-9 % dans les fécès. Dans les deux cas, le 2,4,5-T était sous une forme inchangée (Koshakji et al., 1979). Aucun effet tératogène ou fœtotoxique n'a été observé chez des primates pour des doses jusqu'à 40 mg/kg (Dougherty et al., 1975 ; US EPA (IRIS), 1989).
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 1998 |
Chez l'animal
Voie orale
FDTE/VTR Importer Une exposition prénatale de rats au 2,4,5-T induit des effets à long terme sur le comportement de la descendance. En effet, des anomalies d'apprentissage ont été détectées dans les portées après une exposition unique de 6 mg/kg au 8è jour de gestation (Crampton et Rogers, 1983).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
VGE/NQE Importer
SANTÉ HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
TOXICITE
Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. Contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte.
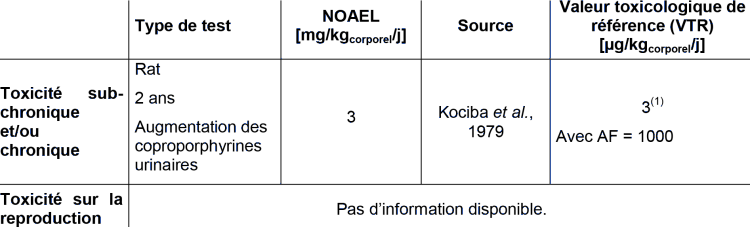
(1) Cette VTR a été déterminée par l'OMS.

FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. L'INERIS présente en première approche les VTR publiées par l'ATSDR, l'US EPA et l'OMS. En seconde approche, les VTR publiées par d'autres organismes, notamment Santé Canada, le RIVM et l'OEHHA, peuvent être retenues pour la discussion si des valeurs existent.
Valeurs de l'ANSES et/ou de l'INERIS
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 10-2 mg/kg/jour pour une exposition chronique par voie orale (1988)
La détermination de cette valeur est basée sur l'augmentation des coproporphyrines urinaires chez le rat exposé à des doses de 3, 10 et 30 mg/kg/jour pendant 2 ans (Kociba et al., 1979). A partir de cette étude, un NOAEL de 3 mg/kg/jour et un LOAEL de 10 mg/kg/jour ont été établis et servent de base au calcul de la RfD.
Facteurs d’incertitude : un facteur de 300 est appliqué. Il correspond à un facteur de 10 pour l’extrapolation des données de l’animal à l’homme, un facteur de 10 pour la variabilité au sein de la population humaine et un facteur de 3 pour les incertitudes liées aux données de toxicité chronique.
L’OMS propose une TDI de 3 µg/kg pour une exposition par voie orale (2003)
La détermination de cette valeur semble basée sur la même étude que la RfD (non précisé). A partir de cette étude, un NOAEL de 3 mg/kg/jour a été établi et sert de base au calcul de la TDI.
Facteurs d’incertitude : un facteur de 1 000 est appliqué. Il correspond à un facteur de 100 pour l’extrapolation des données de l’animal à l’homme et pour la variabilité au sein de la population humaine et un facteur de 10 pour prendre en compte la relation potentielle entre l’exposition l’acide 2,4,5-T et les sarcomes des tissus mou et les lymphomes non-Hodgkinien rapportés dans les études épidémiologiques.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
-
Effets endocriniens :
Le 2,4,5-T est cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004, cf. table 1). Pour la protection de la santé humaine, cette substance fait partie des substances à effets perturbateurs endocriniens démontrés ou potentiels, qui sont déjà réglementées ou qui font actuellement l'objet d'un examen prévu par la législation en vigueur (catégorie 2). Pour la faune sauvage en revanche, les informations sur la substance sont insuffisantes pour pouvoir juger du caractère perturbateur endocrinien (catégorie 3b) (Petersen et al., 2007).
Critères PBT / POP :
La substance n'est pas citée dans les listes PBT/vPvB2 (C.E., 2006) ou
POP3 (PNUE, 2001).
Normes de qualité existantes :
Union Européenne (C.E., 1998) : 0,1 µg.L-1 (pesticide) pour l'eau destinée à la production d'eau potable.
Union Européenne4 : norme de qualité pour la vie aquatique (projet)= 1 µg.L-1 Allemagne: norme de qualité pour les eaux prélevées destinées à la consommation humaine = 0,1 µg.L-1 (ETOX, 20125),
Pays-Bas: objectif de qualité pour les eaux prélevées destinées à la consommation = 0,09 µg.L-1 (valeur cible, fraction totale), 9 µg.L-1 (valeur maximale admissible, fraction dissoute et totale) (ETOX, 2012),
USA : critère de qualité pour la consommation humaine (eau et poisson) = 10 µg.L-1 (ETOX, 2012).
Substance(s) associée(s) :
Métabolites : acide 2-hydroxy-4,5-dichlorophénoxyacétique, 2,4,5-trichlorophénol, mono-et di-chlorophénols et acide 2,5-dichlorophénoxyacétique.
[2] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n°1907/2006 (REACH).
[3] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement bioaccumulables, et qui peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[4] Comité Scientifique consultatif pour l'examen de la Toxicité et de l'Écotoxicité des substances chimiques de la Commission Européenne.
[5] Les données issues de cette source () ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS. http://webetox.uba.de/webETOX/index.do
FDTE/VTR Importer L'objectif de ce document est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme. Les résultats d'essai d'écotoxicité sur organismes aquatique sont limités à quelques espèces. la majorité des études ont été menées dans les années 70. Un résultat plus récent d'essai chronique a été publié en 1991. Aucun résultat de test d'écotoxicité n'est disponible pour les organismes terrestres dans la littérature consultée.
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées ont été validées par l'INERIS.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
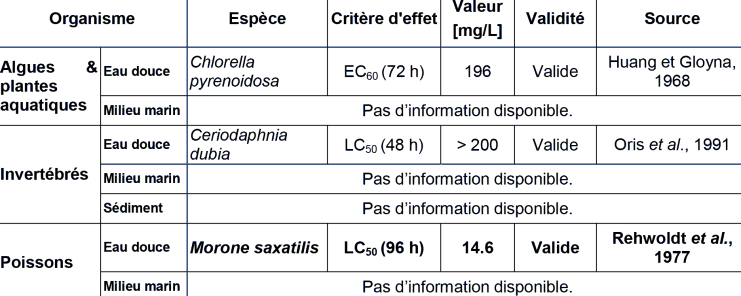
ECOTOXICITE AQUATIQUE AIGUË
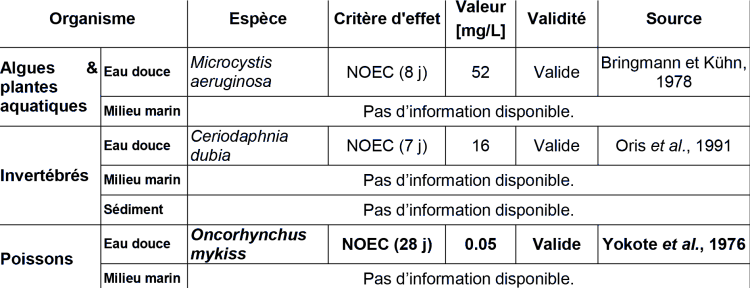
ECOTOXICITE AQUATIQUE CHRONIQUE
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
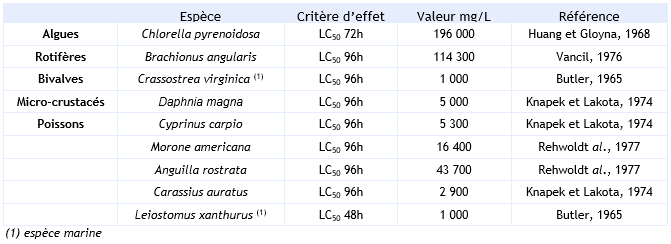
Paramètres d’écotoxicité chronique :
Un seul résultat d'essai d'écotoxicité chronique est disponible dans la littérature consultée :
![]()
Sol
FDTE/VTR Importer Aucun résultats de test d'écotoxicité n'est disponible pour les organismes terrestres dans la littérature consultée.
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biota, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
ECOTOXICITE POUR LES VERTÉBRÉS TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES

TOXICITE ORALE POUR LES OISEAUX

Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITÉ POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon le guide technique pour la détermination de normes de qualité environnementale (E.C., 2011), la sensibilité des espèces marines à la toxicité des substances organiques peut être considérée comme équivalente à celle des espèces dulçaquicoles, à moins qu'une différence ne soit montrée.
Néanmoins, le facteur d'extrapolation appliqué pour déterminer les normes de qualité pour le milieu marin doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d'espèces plus complexe en milieu marin.
Moyenne annuelle (AA-QSwater_eco et AA-QSmarine_eco)
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour le 2,4,5-T, on dispose de données aiguës et chroniques pour trois niveaux trophiques. Il est à noter que malgré le mode d'action destiné à cibler les espèces végétales (régulateur de croissance de type auxinique), ce sont les poissons les plus sensibles pour les deux types d'exposition (court et long terme), avec une NOEC (28 j) de 0.05 mg.L-1 pour Oncorhynchus mykiss. Il est possible que cette toxicité soit attribuable aux impuretés contenues dans le 2,4,5-T, à savoir notamment à la présence de la tétrachlorodibenzodioxine. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 peut être appliqué à cette NOEC.
![]()
En ce qui concerne les organismes marins, on dispose des mêmes données valides et aucun taxon marin additionnel n'est représenté. Pour les mêmes raisons que celles évoquées pour le compartiment eau douce et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), la AA-QSmarine_eco sera déterminée en appliquant un facteur de sécurité de 100 sur la plus faible NOEC disponible (NOEC (28 j) de 0.05 mg.L-1 déterminée pour Oncorhynchus mykiss) :
![]()
Concentration Maximum Acceptable (MAC et MACmarine)
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
On dispose de données aiguës pour 3 niveaux trophiques (algues, invertébrés et poissons), la plus faible étant celle obtenue sur le poisson Morone saxatilis, soit une LC50 (96 h) de 14.6 mg.L-1. Dans la mesure où le mode d'action de la substance connu est la régulation de croissance de type auxinique mais où les poissons semblent être les espèces les plus sensibles, aucune certitude n'existe quant à la présence de l'espèce la plus sensible dans le jeu de données. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 100 est donc appliqué pour calculer la MAC (E.C., 2011).
![]()
Pour le milieu marin, les mêmes données aiguës sont disponibles et aucun taxon additionnel marin n'est disponible. Pour les mêmes raisons que sus citées et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 1000 est appliqué pour calculer la MAC :
![]()
MACmarine = 14.6 µg.L-1
![]()
NORME DE QUALITÉ EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2011). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés (E.C., 2011).
Pour le 2,4,5-T, un facteur de 30 est appliqué car la durée du test retenu (NOAEL de 3 mg/kgcorporel/j sur le rat, soit une NOEC de 60 mg.kg-1biota) est de 2 ans. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- àune concentration dans l'eau douce selon la formule suivante :
![]()
BCF [L.kg-1biota] * BMF1
![]()
![]()
Avec :
BCF : facteur de bioconcentration,
1 BMF: facteur de biomagnification,
BMF2 : facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le 2,4,5-T, un BCF de 43 et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc :
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 3 µg/kgcorporel/j (cf. tableau ci-dessus),
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 5 pour tenir compte de l'effet perturbateur endocrinien suspecté de la substance pour la santé humaine,
- Cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
Pour le 2,4,5-T, le calcul aboutit à:
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- àune concentration dans l'eau douce selon la formule suivante :
- àune concentration dans l'eau marine selon la formule suivante :
![]()
Pour le 2,4,5-T, on obtient donc:
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité réglementaires dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1). Pour le 2,4,5-T, la Directive 98/83/CE fixe une valeur de 0.1 µg.L-1.
A titre de comparaison, une valeur seuil pour l'eau de boisson peut être calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 3 µg/kgcorporel/j (Cf. tableau ci-dessus),
- Cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 5 pour tenir compte de l'effet perturbateur endocrinien suspecté de la substance pour la santé humaine,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le 2,4,5-T, on obtient :
![]()
La valeur la plus protectrice, fixée par la directive 98/83/CE est proposée comme norme de qualité pour l'eau destinée à la production d'eau potable.
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
VGE/NQE Importer
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE) (C.E., 2000).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature.
A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que:
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (E.C., 2011) :
![]()
Avec :
RHOsed : masse volumique du sédiment en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 1300 kg.m-3 .
Ksed-eau : coefficient de partage sédiment/eau en m 3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par le guide technique européen (E.C., 2011) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.8 + 0.025 * Koc, soit Ksed-eau = 2.95 – 7.8 m 3/m3
Ainsi, on obtient:
![]()
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant:
![]()
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0.2 m 3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
QSsed dry_weight = QSsed wet weight * 2.6 = 29.5 – 78 µg.kg-1sed poids sec
Selon la même approche que pour le sédiment d'eau douce, une valeur guide de qualité pour le sédiment marin peut être calculée selon la formule suivante :
![]()
Pour le 2,4,5-T, on obtient :
![]()
La concentration correspondante en poids sec est alors la suivante :
QSsed-marin dry weight = 3 – 7.8 µg.kg-1sed poids sec
Le log Kow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
![]()
SÉLECTION DE LA VALEUR GUIDE ENVIRONNEMENTALE
La VGE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
![]()
Pour le 2,4,5-T, c'est la valeur pour la protection de la santé humaine vis-à-vis de la consommation d'eau potable qui est la plus faible pour l'ensemble des approches considérées.
Pour les eaux qui ne sont pas destinées à la production d'eau potable, la valeur la plus faible est celle fondée sur la protection de la santé humaine exposée par la consommation de produits de la pêche.
VALEURS GUIDES POUR LES ORGANISMES BENTHIQUES
Avec un Koc compris entre 86 et 280 L.kg-1 et un log Kow de 3 environ, la mise en œuvre d'un seuil pour le sédiment n'est pas recommandée par le document guide européen (E.C., 2011).
FDTE/VTR Importer Compartiment aquatique :
Un résultat long terme sur ceriodaphnie est disponible. La Commission Européenne (2002) propose d’appliquer un facteur d’extrapolation de 100 sur la NOEC de l’espèce la plus sensible.
La NOEC de l’essai sur ceriodaphnie sera utilisée.
D’où :
PNECEAU = 19 800/100 = 198 µg/L
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










