Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Naphtalène (91-20-3)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
91-20-3
Nom scientifique (FR)
Naphtalène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
202-049-5
Code SANDRE
1517
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C10H8 }\)
Code InChlKey
Code SMILES
c1ccc2ccccc2c1
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H302 |
|---|---|
| Mention du danger - Texte | Nocif en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Prélèvement
Analyse
Sol
Prélèvement
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
128.18 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 09/09/2025
Matrices
Atmosphère
Le naphtalène est volatil. Son évaporation depuis la surface du sol est importante, de même à partir de l’eau.
Milieu eau douce
Le naphtalène est peu soluble dans l’eau.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Il est relativement mobile dans le sol, et lixiviable (adsorption modérée). Koc de 1 250.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Les résultats du seul essai standardisé pour déterminer la biodégradabilité inhérente ont montré que le naphtalène est faiblement biodégradable (2 % de dégradation après 28 j, méthode OCDE 302 C) (CITI, 1992). Cependant, de nombreux essais non normalisés suggèrent que la substance est rapidement dégradée dans des conditions aérobies et dénitrifiantes, en particulier lorsque des micro-organismes adaptés sont utilisés. Dans ce cas, les concentrations de naphtalène deviennent inférieure au seuil de mesure après 8 à 12 jours dans certains essais (Bauer et Capone, 1985 ; Delfino et Miles, 1985 ; Nielsen et Christensen, 1994). Il n’existe pas de résultat d’essai normalisé de biodégradation en anaérobie. Cependant, certains essais non normalisés suggèrent que la substance est peu biodégradable en anaérobie (Bauer et Capone, 1985 ; Delaune et al., 1980 ; Delfino et Miles, 1985).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse
Il n’existe pas de données expérimentales sur l’hydrolyse du naphtalène. Cependant, l’hydrolyse du naphtalène est probablement négligeable compte tenu de sa structure chimique.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Dans l’eau de surface une demi-vie de 150 jours est proposée par la Commission Européenne (CE, 1996).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
De nombreux essais d’adsorption/désorption ont été trouvés dans la littérature. Les Koc mesurés varient de 378 à 3 200 L.kg-1 (Bouchard et al., 1990 ; Løkke, 1984 ; Rippen et al., 1982). Avec la méthode d’estimation proposée par la Commission européenne (CE, 1996), une valeur de 1 320 L.kg-1 est calculée.
Bioaccumulation
Organismes aquatiques
De nombreux résultats d'essais sont disponibles, dont notamment :
Poissons :
- Cyprinus carpio (56 jours, Méthode OCDE 305 C) BCF : 168 (CITI, 1992)
- Pimephales promelas (28 jours) BCF : 427 (Veith et al., 1979)
Mollusques :
- Mytilus edulis (8 heures) BCF : 27 - 38 (Hansen et al., 1978)
- Ostrea edulis (72 heures) BCF : 58 - 62 (Riley et al., 1981)
En conséquence, nous recommandons la valeur de 427 sur Pimephales promelas.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Le naphtalène peut être prélevé par les parties supérieures des plantes depuis la phase gazeuse de l'air (éventuellement suite à une volatilisation depuis le sol). De plus, étant donné son faible poids moléculaire (par rapport aux autres HAPs), il est assez disponible dans le sol pour être transféré et absorbé par la cuticule des racines, une fraction pouvant ensuite migrer vers la partie intérieure des racines (Kipopoulou et al., 1999). La translocation du naphtalène d'un organe à l'autre des plantes serait faible (Wild et Jones, 1991).
L'INERIS recommande de consulter la Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes – BAPPOP (2016)*, pour la recherche de facteurs de transfert (BCF) dans les végétaux. Cette base concerne une cinquantaine de substances organiques dont les BTEX, les HAP, les COHV, les PCB et les types de plante : légume feuille, légume tige, légume racine, légume tubercule, légume bulbe, légume sec, légume fleur, légume fruit, fruit, fines herbes. Elles renseignent les concentrations en substances organiques dans les plantes couplées avec des teneurs en substances organiques du ou des milieu(x) environnementaux (sol, eau, air).
Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante, au sol, au contexte environnemental, à l’origine de la pollution, au type expérimental, etc. afin de se rapprocher des conditions propres à la situation étudiée.
Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des substances organiques pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
* base gratuite et téléchargeable, fonctionnant sous Access (accompagnée de sa notice d’utilisation) développée par ADEME, INERIS, Université de Lorraine-INRA – GISFI, Groupe ISA, INPT – ENSAT.
Bibliographie
Toxicologie
Dernière vérification le 17/09/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (AFSSET, 2009 ; Anses, 2013 ; ATSDR, 2005 ; CE, 2003 ; IARC, 2002 ; US EPA (IRIS), 1998). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont généralement pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Nous invitons le lecteur à lire le rapport INERIS « Hydrocarbures Aromatiques Polycycliques (HAPs) : Evaluation de la relation dose-réponse pour des effets cancérigènes : Approche substance par substance (facteurs d’équivalence toxique – FET) et approche par mélange ; évaluation de la relation dose-réponse pour des effets non cancérigènes : Valeurs Toxicologiques de Référence (VTR) ».
Toxicocinétique
Chez l'homme
Absorption
Chez l'homme, l’absorption du naphtalène a été très peu étudiée. Compte tenu des effets observés lors de l’exposition, il a été admis que le naphtalène pouvait être absorbé à travers le tractus gastro-intestinal, le tractus respiratoire et la peau (ATSDR, 2005 ; US EPA (IRIS), 1998). La toxicité rapportée chez des nouveau-nés (probablement exposés par voie cutanée même si une participation de la voie respiratoire ne peut être exclue) par contact avec des draps traités au naphtalène renforce cette hypothèse (Dawson et al., 1958 ; Schafer, 1951). Une étude réalisée in vitro sur de la peau humaine avec du JP-8 (carburéacteur, carburant pour moteur à réaction) contenant 0,26 % (p/p) de naphtalène a permis de déterminer un flux de 0,45 µg.cm-2 par heure et un coefficient de perméabilité de 2,17.10-4 cm.h-1 (Kanikkannan et al., 2001).
Distribution
Le naphtalène se distribue dans les tissus graisseux (Stanley, 1986) et sa présence a été détectée dans le lait maternel (Pellizzari et al., 1982).
Métabolisme
Les données concernant le métabolisme du naphtalène chez l'homme sont peu nombreuses. Quelques données d’intoxications aiguës ont montré que le naphtalène pouvait être métabolisé en 1-naphtol, 2-naphtol, 1,2- et 1,4-naphtoquinone. Les études in vitro sur des microsomes de foie humain et de préparations pulmonaires ont montré que l’époxyde hydrolase est impliquée dans le métabolisme avec la formation de naphtalène-1,2-dihydrodiol (CE, 2003). Le premier stade de la métabolisation du naphtalène implique une époxydation catalysée par les cytochromes conduisant à la formation du naphtalène 1,2-oxyde. De nombreuses études ont montré que plusieurs isoenzymes pouvaient catalyser cette réaction. Les enzymes spécifiques seraient le CYP2F et 2F1 chez l’homme et le primate au niveau pulmonaire (Nhamburo et al., 1990 ; Tingle et al., 1993). Plusieurs études menées chez des hommes exposés, professionnellement ou non, aux hydrocarbures aromatiques polycycliques (HAP) rapportent un polymorphisme génétique des CYP1A1 et CYP2E1 et des glutathionS-transférase GSTM1 et GSTM2 (Nan et al., 2001 ; Yang et al., 1999). Les concentrations urinaires en 2-naphtol et 1-napthol sont plus élevées chez les sujets déficients en GSTM1
Le naphtalène peut être méthylé pour former le 1-méthylnaphtalène et le2-méthylnaphtalène. Le 1-méthylnaphtalène serait moins toxique que le naphtalène.
Élimination
La majorité du naphtalène absorbé semble être éliminée sous forme de divers métabolites dans les urines.
Autre
Mécanisme d'action :
La toxicité du naphtalène dépend du taux de glutathion réduit capable de se conjuguer avec les métabolites du naphtalène. Le glutathion oxydé est réduit par la glutathion réductase, une enzyme qui nécessite comme co-facteur le NADPH. La principale source de NADPH dans les globules rouges est l'enzyme glucose-6-phosphate déshydrogénase (G6PD). Les personnes déficientes en G6PD et les nouveau-nés dont le foie a un fonctionnement encore immature sont plus sensibles à l'action du naphtalène. Ainsi, Owa, (1989) a montré que l'exposition au naphtalène était corrélée au développement d'un ictère néo-natal uniquement chez les enfants déficients en G6PD.
Populations sensibles :
Les populations sensibles au naphtalène sont les enfants et les populations d’origine africaine et asiatique (Shannon et Buchanan, 1982). En effet, ces dernières populations présentent plus souvent une déficience pour l’enzyme G6PD (Calabrese, 1986) et s’avèrent particulièrement sensibles aux anémies hémolytiques (Gosselin et al., 1984).
Chez l'animal
Absorption
Des études menées chez le rat ont montré que le naphtalène était rapidement absorbé dans l’organisme (Bock et al., 1979). Chez le rat, l'absorption percutanée du naphtalène a été démontrée et la demi-vie est de 2,1 heures (Turkall et al., 1994).
Distribution
Une fois absorbé, le naphtalène ou ses métabolites sont distribués, par le sang, dans l’organisme. Après une exposition par voie orale de 31 jours chez des poulets, des cochons et des vaches, les concentrations les plus élevées sont mesurées au niveau des poumons, du foie, du cœur et de la rate. Les concentrations dans les graisses sont plus faibles, sauf dans le cas d'une exposition unique (Eisele, 1985). Aucune donnée comparable n'est disponible chez les rongeurs.
Métabolisme
Le métabolisme du naphtalène a été beaucoup étudié chez l’animal. L’une des principales voies métaboliques est une oxydation par les cytochromes P450 suivie d’une conjugaison au glutathion. Les études ont permis d’identifier le mécanisme de métabolisation du naphtalène au niveau hépatique (figure 1). Chez le rat, les métabolites majeurs du naphtalène sont le 1,2-dihydrodiol naphtalène et le 1-naphtol (Bock et al., 1979). L’époxyde peut spontanément se transformer en naphtols, essentiellement le 1-naphtol, qui se conjugueront par voie enzymatique avec l’acide glucuronique ou sulfurique. Les naphtols peuvent être aussi hydratés par une époxyde hydrolase pour donner le 1,2 dihydro-naphatlènediol, réduit par une catéchol réductase en 1,2-naphtalène diol. Le 1,2-naphtalène diol peut être oxydé en 1,2-naphtoquinone et en peroxyde d’hydrogène, ou être transformé en 1,4-naphtoquinone (et vice versa). Le 1-naphtol peut aussi conduire à la formation des naphtoquinones. Ces dernières peuvent former des liaisons covalentes avec des macromolécules et entraîner un stress oxydatif cellulaire expliquant leur toxicité cellulaire (Buckpitt et Franklin, 1989 ; Wells et al., 1989 ; Xu et al., 1992a ; Xu et al., 1992b). L’époxyde peut se conjuguer avec le glutathion, réaction catalysée par la glutathion transférase, conduisant ensuite à des dérivés thioéthers (dérivés conjugués de la cystéine) par perte du radical glutamique ou glycine. Ces thioéthers sont catabolisés en acides pré-mercapturique et mercapturique avant d’être excrétés dans la bile et les urines. Chez le rat, ces composés sont transformés par les bactéries intestinales en 1-naphtol qui est réabsorbé (cycle entéro-hépatique) (Bakke et al., 1985). Ainsi, de nombreux métabolites réactifs ont été retrouvés et pourraient en partie expliquer la toxicité du naphtalène : l’oxyde de 1,2-naphtalène (Jerina et al., 1970), issu d’une oxydation par les cytochromes P450 dans le foie, se réarrange ensuite en naphtols qui peuvent être éliminés dans les urines après conjugaison ou produire la 1,2-naphthoquinone ou la 1,4-naphthoquinone (Kilanowicz et al., 1999). Toutefois, cette métabolisation peut également survenir dans d’autres tissus, notamment les poumons, en fonction de la distribution enzymatique. Cette distribution varie de manière qualitative et quantitative en fonction de l’espèce (Wells et al., 1989 ; Xu et al., 1992a). Ainsi, les isoenzymes des cytochromes P450 permettant de catalyser la première étape de la métabolisation du naphtalène seraient le 2F2 chez la souris (Ritter et al., 1991 et le 2F4 chez le rat Buckpitt et al., 1995 ; Buckpitt et al., 2002 ; Shultz et al., 1999). Les différents compartiments du tractus respiratoire de la souris présentent des niveaux 6 à 30 fois plus élevés de transcrits de CYP2F que ceux du rat. Au sein des poumons chez ces deux espèces de rongeurs, les niveaux d’expression des CYP2F les plus élevés sont retrouvés dans la zone la plus distale. L’épithélium olfactif contient la plus grande quantité de protéines CYP de l’ensemble des tissus. Chez les primates, seul l’éthmoïde contient des niveaux d’expression quantifiables de CYP2F dans les voies supérieures. Les niveaux de CYP2F sont 10 et 20 fois plus faibles chez le primate que chez le rat ou la souris, respectivement. Il semble que la souris soit plus sensible à cette action puisque des inflammations pulmonaires sont observées chez la souris exposée pendant deux ans mais pas chez le rat. Ceci pourrait être lié :
• à la formation d’un composé époxydé énantiomérique spécifique chez la souris (1R,2S-naphtalène oxyde) (ATSDR, 2005) ;
• à un taux de métabolisation du naphtalène dans le tissu pulmonaire murin plus élevé que chez les autres espèces (3, 8 et 100 fois plus élevé que chez le hamster, le rat et le singe respectivement) (CE, 2003).
Élimination
La majorité du naphtalène absorbé est éliminée sous forme de divers métabolites dans les urines, et une faible quantité l’est dans les fèces. Il existe des différences entre les espèces. Chez le rat et la souris, les acides pré-mercapturique et mercapturique représentent une voie majeure (Chen et Dorough, 1979 ; Stillwell et al., 1978), au contraire des primates (Rozman et al., 1982 ; Summer et al., 1979). Rozman et al., (1982) expliquent les différences de formation des conjugués au glutathion par une diminution de l’activité du CYP 450 ou une augmentation de l’activité de l’époxyde hydrolase.
Autre
Mécanisme d’action :
Il semble que la toxicité du naphtalène soit liée à la formation de quinones par la voie du 1- naphtol plutôt qu’au 1,2-oxyde de naphtalène. Les tissus peuvent avoir une sensibilité variable aux métabolites du naphtalène ; la toxicité peut ne se manifester qu’à partir d’une certaine concentration en métabolites (Xu et al., 1992a).
Principales voies métaboliques du naphtalène :
Synthèse
Chez l’homme, l’absorption du naphtalène est peu documentée. Le naphtalène se distribue dans les tissus graisseux et passe dans le lait maternel. La métabolisation hépatique par les cytochromes P450 induit des métabolites le 1-naphtol, le 2-naphtol, les 1,2- ou 1,4-naphtoquinones après formation d’époxydes intermédiaires réactifs. La majorité du naphtalène absorbé semble être éliminée sous forme de divers métabolites dans les urines. Les individus déficients en glucose-6-phosphate déshydrogénase (G6PD) constituent une population sensible tout comme les enfants.
Chez l’animal, l’absorption est rapide. Le métabolisme est essentiellement hépatique mais est également observé dans d’autres tissus comme les poumons. Les principaux métabolites sont le 1,2-dihydrodiol naphtalène et le 1-naphtol mais des différences existent en fonction des tissus et de l’espèce. L’élimination des métabolites s’effectue via les urines.
Toxicité aiguë
Chez l'homme
Inhalation
L’inhalation de naphtalène peut être également létale. Deux enfants ont trouvé la mort après inhalation de naphtalène. Ils présentaient tous deux un ictère sévère et des lésions cérébrales (Valaes et al., 1963). Un de ces enfants était porteur d’une déficience en G6PD et l’autre était hétérozygote pour ce caractère (Dean et al., 1992). Une anémie hémolytique a aussi été constatée chez des nouveau-nés après inhalation de médicaments contenant du naphtalène (Hanssler, 1964 ; Irle, 1964). Enfin, plusieurs études ont montré que les individus présentant une déficience pour l'enzyme G6PD, développaient plus facilement une anémie hémolytique après une exposition aiguë au naphtalène (Dawson et al., 1958 ; Melzer-Lange et Walsh-Kelly, 1989).
Voie orale
Il n’y a que quelques cas de décès rapportés après ingestion de boules d’antimite contenant du naphtalène (Gupta et al., 1979 ; Kurz, 1987), sans informations documentées sur le niveau d’exposition ou les constatations histopathologiques.
L’exception est l’observation de Ijiri et al., (1987) d’un enfant ayant ingéré environ 5 grammes d’antimite. Le décès a été précoce (dans l’heure suivant la prise). L’autopsie a montré des poumons congestifs, œdémateux et hémorragiques. Le foie est le siège d’une infiltration de leucocytes et de lymphocytes. Le taux sanguin de naphtalène était de 0,55 mg.L-1. Cette observation suggère la possibilité d’atteintes des fonctions respiratoires et hépatiques chez l’homme après une exposition par voie orale au naphtalène.
Un décès a été rapporté chez un enfant exposé à des draps conservés avec de l’antimite (Schafer, 1951), mais aucune estimation de l’exposition n’a été possible.
Gerarde en 1962 a rapporté que l’ingestion de 2 g de naphtalène sur 2 jours a entraîné le décès d’un enfant de 6 ans. De cette observation, l’auteur estime que la dose toxique pour l’adulte se situe entre 5 et 15 g. Mais, sans aucune donnée complémentaire, ces valeurs sont très incertaines (Gerarde, 1962).
Dans deux cas de tentative de suicide, avec des doses estimées de 6 g pour une adolescente de 16 ans et de 10 g pour un enfant de 10 ans, il a été constaté une anémie hémolytique (Gidron et Leurer, 1956). Une anémie hémolytique a été décrite chez une femme ayant bu environ 50 mL d’huile contenant a priori une forte quantité de naphtalène (Ostlere et al., 1988). Cette femme n’était pas déficiente en G6PD. Sa sœur qui a bu la même huile n’a pas présenté de signe de toxicité.
Une observation fait état d’une cataracte bilatérale associée à l’ingestion de 5 g de naphtalène (Lezenius, 1902).
Voie cutanée
Par voie cutanée, le naphtalène peut entraîner une anémie hémolytique. Deux cas ont été recensés chez des jeunes enfants, induits par le naphtalène présent dans leurs couches (Schafer, 1951 ; Valaes et al., 1963). Dans un des deux cas, le naphtalène a entraîné une hémolyse, un ictère, une méthémoglobinémie et une cirrhose suivie de la mort du sujet (Schafer, 1951).
Des irritations cutanées et oculaires pour des expositions possibles au naphtalène sont rapportées (Gerarde, 1960).
Synthèse
Chez l’homme, le naphtalène induit des anémies hémolytiques et peut affecter le foie. Un cas de cataracte bilatérale est également rapporté. Les populations déficientes en G6PD sont particulièrement concernées, notamment les jeunes enfants. Le naphtalène peut induire des irritations cutanées et oculaires.
Chez l'animal
Inhalation
L’inhalation de naphtalène (78 ppm pendant 4 heures) n’entraîne pas d’effet létal chez les rats, ni de signe clinique, 14 jours après l’exposition (Fait et Nachreiner, 1985).
L’exposition de souris à 10 ou à 30 ppm de vapeurs de naphtalène pendant 14 jours ne modifie pas les paramètres hématologiques tels que l’hématocrite, la concentration d’hémoglobine, le nombre d’érythrocytes, de réticulocytes et de lymphocytes (Abdo et al., 1992 ; NTP, 1992).
Une exposition par inhalation à des vapeurs de naphtalène pour des concentrations de 0 – 2 –10 – 30 – 75 - 110 ppm (soit 0 – 10,5 – 52 – 157 - 393 – 576 mg.m-3) pendant 4 heures chez le rat mâle Sprague Dawley et la souris mâle Swiss Webster ont permis d’évaluer les effets locaux (West et al., 2001). Chez le rat, aucune atteinte de l’épithélium pulmonaire n’est observée pour des expositions inférieures à 100 ppm (524 mg.m-3). Des expositions dès 2 ppm (10,5 mg.m-3) chez la souris induisent des atteintes des voies aériennes proximales. Ces effets augmentent avec la concentration jusqu’à 75 ppm (157 mg.m-3). Les voies aériennes terminales présentent peu ou pas de lésions à une concentration de 2 ppm (10,5 mg.m-3). Des expositions à 10 ppm (52 mg.m-3) et plus sont nécessaires pour induire des atteintes des cellules de Clara dans les voies aériennes terminales. Cette étude semble montrer que la souris serait plus sensible que le rat.
Voie orale
L’ingestion de naphtalène peut être létale chez les souris, les rats et les lapins. Les souris apparaissent plus sensibles que les rats et les lapins. Ainsi la DL50 est de 533 mg.kg-1 chez les souris mâles, de 710 mg.kg-1 chez les souris femelles (Shopp et al., 1984), de 2 200 mg.kg-1 chez les rats mâles et de 2 400 mg.kg-1 chez les rats femelles (Gaines, 1969). Les lapins semblent tolérer des doses similaires à celles administrées aux rats (Rossa et Pau, 1988).
Les effets induits par une exposition aiguë, par voie orale, au naphtalène diffèrent en fonction de la sensibilité de l’espèce étudiée. Chez les souris CD-1, l’exposition par voie orale à 267 mg.kg-1.j-1 de naphtalène pendant 10 jours n’entraîne aucune modification des systèmes immunitaires, rénaux et hépatiques. Le poids du cerveau de ces animaux n’est pas modifié et aucune anémie hémolytique n’est constatée. Par contre, il a été observé une augmentation du poids des animaux traités, une diminution du poids de leur thymus ainsi qu’une augmentation du poids des poumons et une diminution de 20 % du poids de la rate chez les souris femelles exposées (Shopp et al., 1984). Une étude a montré que l’exposition de rats femelles Sprague-Dawley à 50, 150 ou 450 mg.kg-1.j-1 de naphtalène, pendant 10 jours durant l’organogenèse (du 6ème au 15ème jour de la gestation), induisait chez ces rates, dans la plupart des cas, une léthargie et une bradypnée (NTP, 1991). A partir de cette étude, un LOAEL de 50 mg.kg-1.j-1 a été établi pour des troubles neurologiques. Les chiens sont plus sensibles que les souris et les rats en ce qui concerne le développement de l’anémie hémolytique. Ainsi, des chiens exposés par voie orale à 263 mg.kg-1.j-1 de naphtalène pendant 7 jours développent tous une anémie hémolytique (Zuelzer et Apt, 1949). Enfin, les chinchillas et les lapins développent une cataracte après exposition au naphtalène à des doses respectives de 1 000 mg.kg-1.j-1 pendant 1 jour (Rossa et Pau, 1988) et de 2 000 mg.kg-1.j-1 pendant 5 jours (Srivastava et Nath, 1969).
Voie cutanée
L’application de naphtalène sur la peau de rats (Gaines, 1969) et de lapins (Papciak et Mallory, 1990) n’entraîne aucun effet létal.
Autres voies d'exposition
Voie oculaire
L’instillation de 0,1 mg de naphtalène dans les yeux de lapins induit des irritations oculaires (Papciak et Mallory, 1990). L'effet est réversible 7 jours après l'application.
Voie intrapéritonéale
Par voie intra-péritonéale une dose unique de 6 mg.kg-1 entraîne des modifications mineures de l’épithélium des bronchioles de la souris. Les doses de 128 et de 256 mg.kg-1 de naphtalène entraînent une exfoliation des cellules non ciliées de l’épithélium (cellules de Clara) en 12 à 24 heures, suivie par des modifications morphologiques de la surface des cellules ciliées et une rapide division des cellules restantes. La restauration ad integrum est effective en 5 à 7 jours.
Synthèse
Chez les rongeurs, les DL50 par voie orale sont comprises entre 533 et 2 400 mg.kg-1, les souris étant plus sensibles que les rats. Les chiens sont une espèce sensible pour la survenue de l’anémie hémolytique. Le naphtalène induit des effets irritants locaux pulmonaires et oculaires.
Toxicité à doses répétées
Effets généraux
Généralités
Les données sont peu nombreuses. Les expositions par inhalation, par inhalation et passage cutané, par inhalation et absorption digestive sont responsables d’anémie hémolytique.
Chez l'homme
Inhalation
Linick, (1983) a rapporté le cas d’une femme de 26 ans, de sa fille de 6 ans, et de 7 autres personnes qui souffraient de céphalées, de confusion, de nausées, de vomissements et d’un ictère. Les symptômes ont été mis en relation avec une exposition excessive pendant au moins deux ans au naphtalène provenant de 300 à 500 boules antimites dispersées dans la maison. Le taux de naphtalène dans l’air a été mesuré à 20 ppb, mais a pu être plus élevé lorsque les boules étaient neuves.
Plusieurs cas d’anémie hémolytique ont été décrits après inhalation et pénétration cutanée chez des nouveau-nés dont les vêtements et la literie ont été conservés avec des boules d’antimite (Cock, 1957 ; Dawson et al., 1958 ; Schafer, 1951 ; Valaes et al., 1963). La déficience éventuelle en G6PD n’a pas été précisée ou recherchée.
Un cas probable d’anémie hémolytique, liée à une exposition in utero (inhalation et ingestion de boules antimites par la mère notamment au 3ème trimestre de grossesse a été décrit par Zinkham et Childs, (1958).
Ces anémies ont aussi été décrites après inhalation par des nouveau-nés de médications contenant du naphtalène (Hanssler, 1964 ; Irle, 1964). Les cas survenus chez ces nouveau-nés ont parfois été associés à des troubles neurologiques comme une somnolence et une diminution des cris. Mais il n’est pas possible de dissocier ces troubles de ceux liés à la diminution des capacités de transport de l’oxygène.
Huit cas de cataracte ont été décelés chez un groupe de 21 employés d’une teinturerie industrielle où du naphtalène était utilisé. Sept cas sont survenus avant l’âge de 50 ans. Si l’hypothèse d’une causalité est possible, les niveaux d’exposition ne sont pas disponibles (Ghetti et Mariani, 1956).
Voie orale
Aucune étude concernant l’effet chronique du naphtalène après une exposition par voie orale n'est disponible.
Voie cutanée
Aucune relation directe entre l’exposition à long terme au naphtalène par voie cutanée et le développement de symptômes respiratoires, cardiovasculaires, gastro-intestinaux, rénaux et oculaires n'a été montrée (Ghetti et Mariani, 1956).
Synthèse
Chez l’homme, dans les rares cas décrits d’exposition au naphtalène, les effets observés sont des anémies hémolytiques et des cataractes.
Effets systémiques :
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :

Chez l'animal
Inhalation
L’une des principales études par inhalation (Abdo et al., 1992 ; NTP, 1992) concerne des lots de souris B6C3F1 mâles et femelles (âgés de 6 à 7 semaines) exposés par inhalation, 6 heures par jour, 5 jours par semaine, pendant 2 ans à des vapeurs de naphtalène (> 99 % de pureté). Les lots de souris ont été exposés à des concentrations de 0 (75 animaux/sexe), 10 (75 animaux/sexe) et 30 ppm (150 animaux/sexe).
Le nombre d’animaux exposés à la concentration la plus élevée a été doublé du fait de l’absence de données relatives à la toxicité du naphtalène lors d’exposition chronique à long terme. La mortalité et la morbidité ont été observées deux fois par jour, tous les jours de la semaine. Les animaux sont pesés une fois par semaine au cours des treize premières semaines, puis une fois par mois. Un suivi hématologique a été réalisé. Un examen histopathologique complet a été effectué chez les animaux moribonds ou à la fin de l’étude. Une diminution significative de la survie des animaux à la fin de l’étude a été observée chez les lots de souris mâles témoins par rapport aux souris exposées au naphtalène, s’expliquant par un nombre élevé de combats. Les souris mâles exposées au naphtalène sont restées blotties dans les coins des cages et se sont moins battues. Au bout de 2 ans, le taux de survie chez les souris femelles est identique pour les souris témoins et les souris exposées. Une augmentation significative de l’incidence des lésions non cancéreuses est observée dans les poumons et la cavité nasale des souris mâles et femelles exposées : inflammation chronique des poumons (0/70, 21/69, 56/135 pour les souris mâles et 3/69, 13/65, 52/135 pour les souris femelles), inflammation chronique des muqueuses nasales, hyperplasie de l’épithélium respiratoire du nez (0/70, 66/69, 134/135 pour les souris mâles et 0/69, 65/65, 133/135 pour les souris femelles) et métaplasie de l’épithélium olfactif (0/70, 67/69, 133/135 pour les souris mâles et 1/69, 65/65, 135/135 pour les souris femelles).
L’étude de Abdo et al., 1992 et Adbdo et al., 2001 a été menée chez des rats F344 et confirme les résultats obtenus par le NTP, (1992). Dans cette étude, 49 mâles et 49 femelles ont été exposés par inhalation à des concentrations 0 – 10 – 30 - 60 ppm (0 – 52 – 157 – 314 mg.m-3) 6 heures par jour, 5 jours par semaine, pendant 2 ans (pureté du naphtalène > 99 %) (Abdo et al., 1992 ; NTP, 2000). Chez les animaux des deux sexes, le naphtalène induit de nombreuses lésions non cancéreuses. Il s’agit d’une augmentation significative des lésions nasales comprenant une hyperplasie atypique des cellules basales, une atrophie, une inflammation chronique et une dégénérescence hyaline. Au niveau de l’épithélium respiratoire, une hyperplasie, une métaplasie squameuse, une dégénérescence hyaline et une hyperplasie des cellules caliciformes sont observées. Il induit également une hyperplasie glandulaire et une métaplasie squameuse de l’épithélium glandulaire. De manière générale, la sévérité des effets augmente avec l’augmentation de la concentration. A l’exception de l’hyperplasie atypique qui est probablement impliquée dans la formation des tumeurs, ces lésions non cancéreuses sont habituellement observées lors d’exposition à des agents chimiques irritants. De plus, le naphtalène induit des lésions cancéreuses correspondant à une augmentation de l’incidence des adénomes de l’épithélium respiratoire chez les mâles et des neuroblastomes de l’épithélium olfactif chez les femelles qui sont décrites plus loin.
Voie orale
Par voie orale, une seule étude "vie entière" (Schmähl, 1955) est disponible. Dans cette étude, aucun effet toxique n’a été observé chez des rats exposés pendant 2 ans à des doses d’environ 42 mg.kg-1 de naphtalène. Mais de nombreuses informations manquent quant aux conditions expérimentales et aux résultats.
La seule espèce animale où une anémie hémolytique a été observée est le chien après administration de 262 mg.kg-1.j-1 de naphtalène pendant 7 jours (Zuelzer et Apt, 1949).
Aucun signe d’anémie hémolytique n’a été observé chez les rats F344 (Battelle, 1980a) et chez les souris B6C3F1 (Battelle, 1980b), recevant 5 jours sur 7, pendant 13 semaines respectivement 400 et 200 mg.kg-1 de naphtalène. Il en est de même chez les souris albinos CD-1 recevant 133 mg.kg-1 de naphtalène pendant 90 jours.
Après exposition au naphtalène, une cataracte peut survenir chez les lapins, les rats et les souris. Aucune étude ne permet une évaluation de la relation dose-réponse. Xu et al, (1992) administrent 1 g.kg-1 de naphtalène dans de l’huile minérale pendant 28 jours à des rats et observent le développement d’une cataracte tant chez les souches pigmentées qu’albinos (ces dernières développant la cataracte plus lentement). Chez le lapin, des observations identiques ont été faites par Murano et al., (1993) pour une administration de 1 g.kg-1 de naphtalène pendant 6 semaines ou pour des expositions de 15 à 180 jours à la dose de 0 ou 1 000 mg.kg-1 (Orzalesi et al., 1994). Dans cette dernière étude, une altération de la rétine est également observée.
Les autres effets induits par l'ingestion de naphtalène ont été étudiés par 3 expérimentations chez le rat Fischer 344, la souris B6C3F1 et chez la souris albinos CD-1.
Des lots de 10 rats F344 pour chaque sexe ont reçu des doses croissantes de naphtalène (> 99 % de pureté) de 25 - 50 - 100 - 200 - 400 mg.kg-1 dans de l’huile de maïs administrées par gavage (ajustement par rapport à la durée de l’exposition 17,9 - -35,7 – 71,4 – 142,9 – 285,7 mg. kg-1.j-1), 5 jours par semaine pendant 13 semaines (Battelle, 1980a). Dans le lot exposé à 400 mg.kg-1 de naphtalène, une diarrhée et une léthargie ont été observées. La prise de nourriture n’a pas été affectée, mais une diminution du poids corporel supérieure à 10 % par rapport au lot témoin a été constatée dans plusieurs lots. Il n’y a pas eu de différences supérieures à 10 % pour les paramètres hématologiques entre les lots exposés et le lot témoin sauf dans le lot exposé à 400 mg.kg-1 de naphtalène. Chez les rats mâles exposés à 400 mg.kg-1 de naphtalène une augmentation de 94 % des neutrophiles matures et une diminution de 25,1 % des lymphocytes ont été observées. Chez les rats femelles, une augmentation de 37,2 % des neutrophiles matures a été notée. Les examens histologiques révèlent une faible incidence de lésions au niveau des reins chez les mâles exposés et des thymus chez des femelles exposées ; aucune lésion des reins et des thymus n’a été observée chez les témoins. Des lésions telles qu’une infiltration lymphocytaire localisée à la région corticale ou une régénération tubulaire locale sont observées au niveau du rein de 2/10 rats mâles exposés à la dose de 200 mg.kg-1 de naphtalène et une dégénérescence tubulaire diffuse survient chez 1/10 mâle exposé à 400 mg.kg-1. Les autres lésions, incluant une déplétion des lymphocytes du thymus, surviennent chez 2/10 femelles exposées à 400 mg.kg-1 et ne sont pas retrouvées chez les autres femelles. Ces paramètres n’ont pas été retenus comme anomalie lors de l’examen des reins ou des thymus. La diminution de poids corporel est l’effet le plus sensible dans cette étude et est retenu comme effet critique. Le poids corporel moyen à la fin de l’étude est diminué de plus de 10 % par rapport aux témoins chez les rats mâles pour une exposition par gavage à la dose de 200 mg.kg-1. Ce qui amène à déterminer un LOAEL et un NOAEL basés sur la diminution du poids corporel respectivement de 200 mg.kg-1.j-1 et de 100 mg.kg-1.j-1, soit un LOAELADJ et un NOAELADJ respectivement de 143 et de 71 mg.kg-1.j-1.
Dix souris B6C3F1 des deux sexes ont reçu dans de l’huile, par gavage, du naphtalène pendant 13 semaines, 5 jours sur 7, à des doses de 0, 12,5, 25, 50, 100 ou 200 mg.kg-1 (Battelle, 1980b). Sept souris (3 mâles et 2 femelles du lot exposé à 200 mg.kg-1 de naphtalène, une femelle du lot exposé à 25 mg.kg-1 de naphtalène et un mâle témoin) meurent d’accident ou de traumatisme lié au gavage. Entre les semaines 3 et 5, des signes de léthargie, d’agressivité et de diminution de la consommation de nourriture ont été observés dans le lot exposé à 200 mg.kg-1 de naphtalène. Toutes les souris mâles exposées ont grossi de manière plus importante que les souris mâles témoins, ce qui n’a pas été le cas chez les souris femelles exposées. Le gain de poids entre J0 et la 13ème semaine est de 6,2 g par souris femelles pour le lot exposé à 200 mg.kg-1 de naphtalène contre 8,1 g pour le lot témoin (non significatif pour les expérimentateurs). Les autres paramètres (histopathologiques, hématologiques) n'ont pas montré d’anomalies significatives. Les auteurs ont retenu la dose de 200 mg.kg-1.j-1 comme LOAEL, soit un LOAELADJ de 142,9 mg.kg-1.j-1 en retenant les signes de toxicité générale plutôt que les altérations de poids corporel.
Des lots de souris mâles et femelles albinos CD-1 ont reçu, par gavage, des doses de 0, 5,3, 53 et 133 mg.kg-1 de naphtalène dans de l’huile pendant 90 jours consécutifs (Shopp et al., 1984). Aucune létalité ou diminution du poids n’a été observée quels que soient le sexe des animaux et la dose administrée. Il en est de même avec le poids des organes chez les souris mâles. Une diminution du poids du cerveau, du foie et de la rate a été constatée chez les souris femelles pour les fortes doses de naphtalène. Dans ce même lot, il est observé une légère augmentation de l’hémoglobine. L’urée est abaissée dans tous les lots de femelles exposés ; les taux sériques de globulines et protéines sont augmentés dans les deux lots de souris femelles les plus exposés. La signification physiopathologique de ces modifications n’est pas connue. Se basant sur les modifications du poids des organes, un LOAEL de 133 mg.kg-1 et un NOAEL de 53 mg.kg-1 ont été retenus.
Voie cutanée
L’application de naphtalène sur la peau de rats, 6 heures par jour, 5 jours par semaine pendant 13 semaines, à des doses supérieures à 1 000 mg.kg-1.j-1, ne modifie pas les paramètres histologiques du poumon, du cœur, de l’œsophage, de l’estomac, des intestins et du foie (Frantz et al., 1986).
Les taux d’hémoglobine, l’hématocrite et le nombre d’érythrocytes, de leucocytes et de plaquettes restent également inchangés après traitement des rats au naphtalène. Le NOAEL dans cette étude chez le rat et pour tous les paramètres étudiés est de 1 000 mg.kg-1.j-1.
Autres voies d'exposition
Voie intrapéritonéale
Par voie intra-péritonéale, le naphtalène peut induire des atteintes des cellules des épithélia respiratoires chez les rongeurs, la souris étant l’espèce la plus sensible (Buckpitt et Franklin, 1989).
Synthèse
Chez l’animal, les effets observés retrouvent ceux décrits chez l’homme : anémie hémolytique et cataracte. Pour des expositions par inhalation, le naphtalène induit des lésions pulmonaires de type inflammation chronique.
Effets systémiques :
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :

Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : Substance préoccupante pour l’homme | |
| IARC | Groupe 2B : le naphtalène pourrait être cancérigène pour l’homme | 2002 |
| US EPA | Classe C : le naphtalène est un cancérigène possible pour l’homme | 1998 |
Chez l'homme
Toutes voies
Peu d'études sont disponibles chez l’homme.
Inhalation
Des cas de cancers ont été rapportés chez des salariés travaillant dans une usine de purification de naphtalène dans l'ex-Allemagne de l'Est. Cette usine a fonctionné de 1917 à 1968 et 15 employés y ont travaillé pendant 20 à 30 ans. Parmi ces salariés, sept ont développé un cancer et 4 de ces cancers étaient des cancers du larynx. Le diagnostic a été établi entre 1964 et 1973 et l'âge des individus était compris entre 60 et 71 ans. Les employés ayant développé des cancers du larynx étaient tous fumeurs. Les auteurs concluent qu'aucune déduction concernant l'effet du naphtalène sur l'incidence des cancers ne peut être faite à partir de ces observations (Wolf, 1976, 1978).
Voie orale
Sur 23 patients ayant été admis dans un hôpital au Nigeria pour des carcinomes du colon, Ajao et al., (1988) ont mis en évidence que la moitié des patients avait ingéré un traitement local contenant du naphtalène. Aucune conclusion ne peut, cependant, être déduite de cette étude.
Synthèse
La seule étude disponible chez l’homme ne permet aucune conclusion.
Chez l'animal
Toutes voies
Il existe peu de données concernant l’effet cancérigène du naphtalène chez l’animal.
Inhalation
Dans leur étude, Adkins et al., (1986) ont exposé des lots de 30 souris femelles A/J à des concentrations de 0, 10 et 30 ppm de naphtalène, 6 heures par jour, 5 jours sur 7, pendant 6 mois. La survie des animaux n’est pas différente entre le lot témoin et les lots exposés. Les animaux ont été sacrifiés au bout des 6 mois et les poumons ont été examinés. Une augmentation de l’incidence des tumeurs pulmonaires a été observée dans les lots exposés, mais elle n’est pas statistiquement significative par rapport au lot témoin.
L'étude du NTP, (1992) a exposé des souris B6C3F1, mâles et femelles, à 0 - 10 – 30 ppm de naphtalène (0 - 52 – 157 mg.m-3), 6 heures par jour, 5 jours par semaine pendant 104 semaines (pureté du naphtalène > 99 %). Dans le lot exposé à 30 ppm de naphtalène, une augmentation de l’incidence des adénomes alvéolaires et bronchiolaires a été notée chez les souris femelles (28/134) par rapport au lot témoin. Une augmentation de l’incidence des adénomes est également observée chez les mâles mais de manière marginale du fait du biais lié aux différences de survie entre animaux témoins et animaux exposés. L’analyse histopathologique montre que 5/135 des carcinomes sont des hémangiosarcomes, mais du fait d’une fréquence d’apparition proche de celle des témoins et d’une localisation non spécifique, ces carcinomes ne sont pas considérés comme spécifiques de l’exposition au naphtalène. Les autres tumeurs sont des tumeurs des tissus sous-cutanés (fibromes, fibrosarcome, neurofibrome, sarcome et sarcomes multiples).
Incidence des lésions pulmonaires cancéreuses chez les souris des deux sexes :

En conclusion, cette étude montre que le naphtalène induit une augmentation de l’incidence des adénomes broncho-alvéolaires chez la souris femelle. Toutefois, bien souvent ce type de tumeur est considéré comme bénin. L’augmentation des carcinomes seuls n’est pas statistiquement significative. Pour avoir des résultats statistiquement significatifs, il est nécessaire de prendre en compte les deux types d’altérations adénomes et carcinomes. Ces résultats ne sont pas statistiquement significatifs chez le mâle du fait du fort taux de mortalité chez les lots témoins. Dans cette étude, le naphtalène ne se révèle donc pas cancérigène chez les mâles mais chez les femelles. Le naphtalène induit également une inflammation chronique, une métaplasie de l‘épithélium olfactif et une hyperplasie de l’épithélium respiratoire nasal ainsi qu’une inflammation chronique des poumons chez les souris des deux sexes.
Une LOAEC de 30 ppm (157 mg.m-3) a été établie pour le développement d’adénomes bronchio-alvéolaires chez les souris femelles (NTP, 1992).
Une étude (Adbdo et al., 2001 ; Long et al., 2003 ; NTP, 2000) a été menée chez des rats Fischer mâles et femelles exposés à 0, 10, 30 et 60 ppm de naphtalène (0, 52, 157 et 314 mg.m-3), 6 heures par jour, 5 jours par semaines pendant 105 semaines (pureté du naphtalène > 99 %). Cette étude a montré la présence de neuroblastomes de l'épithélium olfactif chez 0/49, 0/49, 4/48 et 3/48 rats mâles et chez 0/49, 2/49, 3/49 et 12/49 rats femelles respectivement exposés à 0, 10, 30 et 60 ppm de naphtalène. De plus, des adénomes de l'épithélium respiratoire nasal ont été constatés chez 0/49, 6/49, 8/48 et 15/48 rats mâles et chez 0/49, 0/49, 4/49 et 2/49 rats femelles respectivement exposés à 0, 10, 30 et 60 ppm de naphtalène. Les neuroblastomes surviennent chez les rats mâles pour des expositions à 30 et 60 ppm et chez tous les groupes exposés chez les femelles. Une relation dose effet est observée chez les mâles et les femelles. Un mâle pour chacune des deux concentrations de 30 et 60 ppm présente également des métastases pulmonaires. L’incidence chez les femelles est statistiquement différente par rapport au témoin à la concentration de 60 ppm. Une relation dose-effet de l’incidence des adénomes est observée chez les mâles et les femelles mais seulement chez les mâles les incidences sont augmentées de manière statistiquement significative chez tous les lots exposés. La malignité de ces adénomes peut être discutable.
Incidence des lésions cancéreuses chez les rats des deux sexes :
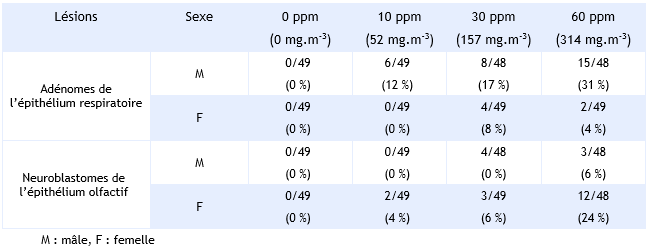
L’analyse microscopique des prélèvements de cette étude a permis d’identifier deux types de lésions cancéreuses, des neuroblastomes et des adénomes de l’épithélium respiratoire (Long et al., 2003). Il s’agit de tumeurs nasales d’un type rare qui surviennent au milieu de nombreuses lésions non cancéreuses de type prolifératives dégénératives, métaplasiques et lésions inflammatoires de l’épithélium olfactif et respiratoire et de la lamina propria de la région olfactive. Presque tous les animaux exposés au naphtalène présentent des lésions non cancéreuses de l’épithélium olfactif et des glandes de Bowman en lien avec les concentrations. L’incidence des lésions non cancéreuses de l’épithélium respiratoire augmente chez tous les animaux exposés par rapport au lot témoin. Ces lésions ont une incidence plus faible que celles de l’épithélium olfactif. De plus, l’incidence des dégénérescences hyalines des épithélia olfactifs et respiratoires et les hyperplasies des cellules caliciformes n’augmentent pas avec l’exposition. Des lésions multiples sont rapportées chez le même animal. Les hyperplasies atypiques de l’épithélium olfactif, les atrophies, l’inflammation chronique et les dégénérescences hyalines et les hyperplasies des glandes de Bowman sont observées chez 80 à 100 % des animaux en fonction des niveaux d’exposition.
Les neuroblastomes de l’épithélium olfactif sont des tumeurs très invasives de formes variables qui se développent dans la région éthmoïdale de la cavité nasale pouvant s’étendre aux épithéliums respiratoires. Il existe 3 types histologiques de neuroblastomes et bien souvent plus d’un type est observé au sein de la même tumeur. Les neuroblastomes et les adénomes rapportés ci-dessus sont considérés comme des effets cancérogènes du naphtalène du fait de la fréquence relativement élevée de l’incidence de ces tumeurs et de l’absence de ces tumeurs aussi bien chez les animaux témoins que chez les témoins historiques du laboratoire. Les cellules basales indifférenciées pourraient être les cellules à l’origine des neuroblastomes olfactifs. Ces cellules ont la capacité de se différencier en cellules de soutien, en cellules sensorielles ou en des cellules du conduit épithélial des glandes de Bowman.
Les hyperplasies atypiques de l’épithélium olfactif sont des lésions non cancéreuses fréquemment observées lors d’exposition par inhalation à des composés irritants. Elles sont en général considérées comme des réponses de type réparation, adaptation ou de protection non spécifiques à des irritations chroniques. Ces hyperplasies des cellules basales olfactives surviennent avec une très haute fréquence chez tous les mâles et les femelles exposés au naphtalène. Ces lésions sont considérées comme inhabituelles car elles n’ont pas été observées au cours des études précédentes. Morphologiquement, ces cellules sont identiques à celles des neuroblastomes. Cette apparence suggère que cette hyperplasie atypique puisse se présenter comme un élément précurseur de la cancérogenèse de l’épithélium olfactif nasal.
Les sites de développement des tumeurs plaident en la faveur de différences de niveau métabolique entre les espèces rat et souris. Les rats seraient donc plus sensibles aux tumeurs de la cavité nasale que les souris.
Les études du NTP, (1992, 2000) ont été réévaluées par un groupe de travail North et al., (2008) et plusieurs critiques ont été formulées : aucune étude de toxicité préalable n’a été menée ce qui fait que les deux études ont été réalisées à des concentrations supérieures aux doses maximales tolérées (MTD) et que l’incidence des inflammations est de 100 % aux deux concentrations (10 et 30 ppm chez la souris et 30 et 60 ppm chez le rat) chez les deux sexes. A ces concentrations, les extrapolations des résultats à l’homme deviennent difficiles. Les données doivent être complétées notamment avec des études à des concentrations plus faibles et des études de toxicité à plus court terme. Des différences de mécanisme d’action semblent exister entre les espèces animales, pouvant expliquer les différences de site de formation des tumeurs (Bogen et al., 2008).
L’analyse des différentes données présentées ci dessus semble indiquer que les effets cancérigènes seraient probablement secondaires à un mécanisme d’inflammation chronique en lien avec un stress oxydatif.
Voie orale
Dans l'étude de Schmähl, (1955), des rats âgés de 100 jours ont été exposés par l'intermédiaire de la nourriture à 10 et à 20 mg.j-1 de naphtalène, 6 jours par semaine pendant 100 semaines. L'adjuvant utilisé était de l'huile. Les animaux ont été observés jusqu'à leur mort, et la moyenne de l'espérance de vie de ces rats était de 800 jours (identique à celui des animaux témoins). Des examens histopathologiques ont été pratiqués et aucune tumeur n'a été observée chez les rats exposés au naphtalène.
Voie cutanée
Deux études ont évalué les effets d’une administration sous-cutanée de naphtalène chez le rats mais les données sont difficilement exploitables compte tenu du faible nombre d’animaux exposés (Knake, 1956 ; Schmähl, 1955). Dans l’une des études, aucune tumeur n’est observée (Schmähl, 1955) et dans la seconde, 5 sarcomes sont rapportés contre un seul dans le lot témoin (Knake, 1956).
Autres voies d'exposition
Voie intra-péritonéale
Des souris nouveau-nés CD-1, mâles et femelles, ont reçu au premier, au huitième et au quinzième jour après la naissance des doses de 0,25 - 0,50 – 1 µmol de naphtalène par voie intra-péritonéale (La Voie et al., 1988). Au bout de la 52ème semaine, les survivants ont été sacrifiés. Aucune différence dans la survie et dans l’incidence des tumeurs hépatiques n'a été observée entre les souris exposées et les souris témoins.
Synthèse
Chez l'animal, des expositions par inhalation au naphtalène induisent le développement d’hémangiosarcomes, d’adénomes de l'épithélium respiratoire nasal et de neuroblastomes de l'épithélium olfactif. On ne peut exclure que les effets cancérigènes soient secondaires à un mécanisme d’inflammation chronique en lien avec un stress oxydatif. Sur la base des effets chez l’animal, le naphtalène est classé en catégorie 2 de l’UE, groupe 2B de l’IARC et classe C de l’US EPA.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le naphtalène a été examiné par l’Union Européenne mais n’a pas été classé | 2004 |
Chez l'animal
Toutes voies
Les études réalisées in vivo correspondent à des transformations néoplasiques (Tsuda et al., 1980), une synthèse non programmée de l’ADN (RTC, 1999), une élution alcaline (Kitchin et al., 1992), trois tests de fragmentation de l’ADN (Bagchi et al., 1998 ; Bagchi et al., 2000 ; Bagchi et al., 2002) et un test de mutation somatique et de recombinaison (test SMART) (Delgado-Rodriguez et al., 1995). Certains de ces tests se sont révélés positifs.
In vitro
Organismes procaryotes
Le naphtalène n’est pas mutagène sur cellules procaryotes (Bos et al., 1988 ; Connor et al., 1985 ; Florin et al., 1980 ; Flowers-Geary et al., 1996 ; Godek et al., 1985 ; Ho et Ho, 1981 ; Kaden et al., 1979 ; Mamber et al., 1983, 1984 ; Mc Cann et al., 1975 ; Mersch-Sundermann et al., 1993 ; Mortelmans et al., 1986 ; Narbonne et al., 1987 ; Purchase et al., 1978 ; Sakai et al., 1985 ; Seixas et al., 1982).
Organismes eucaryotes
Les résultats des tests de cytogénétiques réalisées in vitro sur lignées de cellules de mammifères semblent positifs lors de l’exposition au naphtalène dans un modèle cellulaire, soit disposant d’un système métabolique fonctionnel, soit en présence d’un inducteur métabolique ajouté spécifiquement au milieu de culture (Gollahon et al., 1990 ; NTP, 1992 ; Sasaki et al., 1997 ; Wilson et al., 1995 ; Wilson et al., 1996). Les deux métabolites testés induisant une réponse positive sont les deux naphtoquinones : la 1,2-naphtoquinone et la 1,4-naphtoquinone. Les autres métabolites testés ont donné des résultats négatifs. Les études cytogénétiques (tests du micronoyau), réalisées in vivo sur souris, se sont révélés négatives (Harper et al., 1984 ; Sorg et al., 1985) et n’ont pas permis de confirmer les résultats obtenus in vitro sur cellules de mammifères. Les autres tests ont été pratiqués sur cellules de mammifères lors d’exposition in vitro. Ils correspondent à des tests de transformation cellulaires, de mutations géniques, de synthèse non programmée d’ADN, d’élution alcaline (ou test des comètes), de fragmentation d’ADN ou de formation d’adduits à l’ADN. La majorité de ces études se sont révélées négatives (Bagchi et al., 2001 ; Barfknecht et al., 1985 ; Freeman et al., 1973 ; Probst et al., 1981 ; Purchase et al., 1978 ; Rundell et al., 1983 ; Saeed et al., 2007 ; Sasaki et al., 1997 ; Sina et al., 1983 ; Tonelli et al., 1979).
L’ensemble des résultats de génotoxicité semble indiquer que le naphtalène n’est pas mutagène aussi bien sur cellules procaryotes que sur cellules eucaryotes. Les rares effets génotoxiques rapportés montrent qu’il s’agirait d’effet cytogénétique induit par les métabolites, essentiellement la 1,2-napthoquinone et la 1,4-napthoquinone très probablement par un mécanisme oxydatif. Toutefois, il n’est pas exclu que d’autres mécanismes puissent être impliqués.
Enfin, un symposium sur l’état des connaissances sur le naphtalène conclut que les résultats des différentes études génotoxiques ne montrent pas que les lésions génétiques induites par le naphtalène et ses métabolites puissent conduire aux tumeurs observées chez les rongeurs, dans les études menées par le NTP (Abdo et al., 1992 ; Brusick, 2008 ; Brusik et al., 2008). Une série d’événements, comprenant une toxicité cellulaire au niveau de l’organe cible et l’induction de régénération des cellules, semblerait donc être le mode d’action le plus probable pour le naphtalène.
En 2013, l’Anses conclut que l’analyse globale des données relatives au naphtalène ne permet donc pas d’écarter le potentiel génotoxique. Conformément à la méthode de construction de VTR cancérogènes (AFSSET, 2010), le naphtalène est alors considéré comme une substance cancérogène génotoxique, dont le mode d’action repose sur une absence de seuil.
Synthèse
Le naphtalène n’est pas classé génotoxique pour l’Union Européenne en l’absence de résultats concordants. Certains organismes le considèrent cependant comme génotoxique dans leur évaluation du risque.
Effets sur la reproduction
Chez l'homme
Synthèse
A notre connaissance, il n’existe pas de données disponibles.
Chez l'animal
Inhalation
Aucune étude n’a spécifiquement recherché des altérations de la fertilité chez l’animal. Toutefois, l’étude de cancérogenèse du NTP, (1992) ne rapporte pas d’altération histopathologique de l’épididyme, de la prostate, des vésicules séminales, des testicules et des ovaires lors d’une exposition par inhalation à 30 ppm (150 mg.m-3), pendant 6 heures par jour, 5 jours par semaine, pendant 104 semaines.
Voie orale
Enfin, aucune modification du poids des testicules de souris n’a été observée après administration par voie orale de 133 mg.kg-1.j-1 de naphtalène pendant 90 jours (Shopp et al., 1984). De même, aucune lésion testiculaire n’a été observée chez des rats traités pendant 13 semaines avec des doses de naphtalène allant jusqu'à 400 mg.kg-1.j-1 (Battelle, 1980a).
Synthèse
Les effets du naphtalène sur la reproduction n’ont pas été étudiés.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le naphtalène a été examiné par l’Union Européenne mais n’a pas été classé | 2004 |
Chez l'homme
Voie orale
Il a été montré qu’après ingestion de naphtalène par la mère pendant la grossesse, les fœtus développaient une anémie hémolytique néonatale. Les doses et la durée de l’exposition des fœtus au naphtalène ne sont pas connues (Anziulewicz et al., 1959 ; Athanasiou et al., 1997 ; Zinkham et Childs, 1957, 1958). Ces études ont mis en évidence que le naphtalène passait la barrière placentaire. L’étude de Zinkham et Childs, (1958) rapporte également qu’un nouveau-né souffrait d’une anémie hémolytique sévère. Cette pathologie a été également observée chez la mère qui avait ingéré de manière intermittente des « boules » de naphtaline au cours de la grossesse. Cette mère présentait une déficience en glucose 6-phosphate déshydrogénase (G6PD). Les niveaux d’exposition et la durée de l’exposition ne sont pas précisés. Un cas similaire a été rapporté chez une femme âgée de 26 ans présentant une anémie hémolytique, suite à l’ingestion de boules de naphtaline au cours du troisième trimestre de la grossesse (Anziulewicz et al., 1959). Elle a donné naissance à un enfant de sexe masculin présentant une anémie hémolytique dès le premier jour suivant la naissance. L’appartenance ethnique et le statut en G6PD ne sont pas rapportés, il n’y a pas non plus de précision quantitative relative à l’exposition. Une étude sur les ictères néonataux en lien avec les expositions domestiques et les produits chimiques a été réalisée au Niger (Familusi et Dawodu, 1985). Il a été montré que les cas d’ictères sévères, nécessitant une transfusion sanguine ou induisant la mort de l’enfant, étaient significativement plus fréquents chez les nouveau-nés des familles ayant des antécédents d’exposition au naphtalène. Cependant, il n’a pas été pris en compte dans cette étude notamment une possible contamination par les aflatoxines qui pourraient biaiser les résultats. Les résultats de cette étude sont donc mentionnés ici uniquement à titre informatif.
Chez l'animal
Voie orale
Seul l’impact du naphtalène par voie orale sur le développement a été étudié chez l’animal.
L’exposition de lapines gestantes, du 6ème au 18ème jour de gestation, à des doses de naphtalène pouvant aller jusqu'à 400 mg.kg-1.j-1 n’a aucun effet sur le développement des lapins (adjuvant = méthylcellulose). Aucune anomalie congénitale n'a été observée chez les lapereaux (PRI, 1986). A partir de cette étude, un NOAEL de 400 mg.kg-1.j-1 a été établi pour les effets sur le développement, chez le lapin. De même, l'étude de Navarro et al., (1992) a montré que l'administration, par gavage, de naphtalène allant jusqu'à 120 mg.kg-1, du 6ème au 19ème jour de gestation chez les lapines, n'induisait ni effet néfaste sur le développement des lapereaux ni toxicité maternelle.
Chez la rate, l'administration par voie orale, du 6ème au 15ème jour de gestation, de naphtalène à des doses allant jusqu'à 450 mg.kg-1.j-1, n’induit aucun effet tératogène (Navarro et al., 1991 ; NTP, 1991). Par contre, il a été montré que l'administration, par gavage, de 150 et de 450 mg.kg-1.j-1 de naphtalène, chez des rats Sprague-Dawley, du 6ème au 15ème jour de gestation, induisait une diminution du gain de poids chez les mères et une augmentation du nombre de ratons mal formés ou mort-nés. A la dose de 450 mg.kg-1.j-1, le pourcentage de malformations des fœtus est 2,5 fois plus important chez les animaux exposés par rapport aux témoins mais cette différence n'est pas significative (Navarro et al., 1991).
Chez la souris, l'administration de 300 mg.kg-1.j-1 de naphtalène, incorporé dans de l’huile de maïs (gavage), à des femelles gestantes, du 7ème au 14ème jour de gestation, induit une mortalité relativement importante des souriceaux (Plasterer et al., 1985). Cette concentration induit une diminution du poids des mères, ainsi qu’une augmentation de la létalité maternelle. Toutefois, dans cette étude, aucune anomalie congénitale n'a été observée chez les souriceaux, ce qui conduit les auteurs à établir un NOAEL de 300 mg.kg-1.j-1 pour les effets sur le développement chez la souris.
Synthèse
En l’absence de résultats positifs, le naphtalène n’est pas classé par l’Union Européenne.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition chronique par inhalation :
L’ANSES propose une VTR de 37 µg.m-3 pour une exposition chronique par inhalation (2013).
Cette valeur est établie à partir de l’étude du NTP, (2000) au cours de laquelle des rats des deux sexes ont été exposés au naphtalène aux concentrations de 0 – 52 – 157 – 314 mg.m-3. L’effet critique retenu correspond aux lésions non cancéreuses des épithéliums olfactifs et respiratoires chez les animaux des deux sexes dès 52 mg.m-3. En raison de la proportion élevée d’animaux ayant développé ces lésions dès la première concentration testée, la relation dose-réponse ne permet pas de déterminer une BenchMarck Concentration. La concentration critique est donc la LOAEC de 52 mg.m-3.
Un ajustement allométrique est réalisé pour établir une valeur équivalente pour l’homme (Human Equivalent Concentration) :
La LOAEC (HEC) a été déterminée en prenant pour postulat que le naphtalène, induisant des effets extra thoraciques, était un gaz de catégorie 3 selon l’US EPA, (1994). En l’absence de données spécifiques un facteur de 1 a été appliqué par défaut pour le ratio des coefficients de partage air / sang.
LOAECHEC = LOAECrat x (Hb/g)rat/(Hb/g)homme
Ou (Hb/g) est le coefficient de partition sang/air du naphtalène. Le coefficient de 1 a été appliqué par défaut : LOAECHEC = 52 mg.m-3
Un ajustement temporel pour une exposition continue a été pratiqué en tenant compte des durées et fréquences d’exposition des animaux au cours de l’étude 6 h/j, 5 j/sem :
LOAECHEC ADJ = LOAECHEC x 5 j/7 j x 6 h/24 h = 9,29 mg.m3
Facteur d’incertitude : un facteur 250 a été appliqué. Un facteur 10 pour l’utilisation d’une LOAEC, un facteur 2,5 pour tenir compte de la variabilité toxicodynamique et des incertitudes résiduelles et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul : 9,29 mg.m-3 x 1/250 = 0,037 mg.m-3 soit 37 µg.m-3
Indice de confiance : L’US EPA attribue un indice de confiance moyen dans l’étude clé, faible à moyen dans la base de données et dans la construction de la VTR.
L’ATSDR propose un MRL de 3,5 µg.m-3 (7.10-4 ppm) pour une exposition chronique par inhalation (2005).
Cette valeur a été élaborée à partir de 3 études (Adbdo et al., 2001 ; NTP, 1992 et NTP, 2000). L’étude du NTP, (1992) a été menée chez des souris B6C3F1, celle de Adbdo et al., (2001) chez des rats F344 et celle du NTP, (2000) chez les 2 espèces.
Des lésions non néoplasiques nasales et pulmonaires ont été observées chez les souris B6C3F1 des 2 sexes. L’augmentation de l’incidence des lésions néoplasiques a été uniquement constatée chez les souris femelles, au niveau des poumons. Chez les rats, l’augmentation de l’incidence des lésions néoplasiques et non néoplasiques a été observée seulement au niveau nasal.
Une LOAEC de 10 ppm a été proposée pour les 2 espèces et les 2 sexes pour les lésions non néoplasiques de l’épithélium nasal olfactif et de l’épithélium respiratoire. A partir de cette LOAEC, une LOAEC ajustée sur la durée d’exposition de 1,8 ppm a été calculée pour une exposition continue.
10 ppm x 6 h/24 h x 5 j/7 j = 1,8 ppm (9,4 mg.m-3)
Une LOAECHEC (Human Equivalent Concentration) a ensuite été calculée selon la méthode de l’US EPA en considérant le naphtalène comme un gaz de catégorie 1. Le calcul est le suivant :
LOAECHEC = LOAEC ajusté ´ RGDRET (regional gaz dose ratio in the extrathoracic (ET) region)
RGDRET = [volume minute / surface de l’air extrathoracique]animal ¸ [volume minute / surface de l’air extrathoracique]humain
Volume minute (L/min) = 13,8 (homme) ; 0,137 (rat) ; 0,0368 (souris).
Surface de l’air extrathoracique (cm2) = 200 (homme) ; 15 (rat) ; 3 (souris)
RGDRET (rat/homme) = 0,132 et LOAECHEC = 0,2 ppm
RGDRET (souris/homme) = 0,178 et LOAECHEC = 0,3 ppm
En se basant sur le principe de précaution, le LOAELHEC établi chez le rat a été retenu pour le calcul du MRL.
Facteur d’incertitude : un facteur 300 a été appliqué. Un facteur 10 pour l’utilisation d’une LOAEC, un facteur 3 pour l’extrapolation des données animales à l’homme et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul : 0,2 ppm x 1/300 = 6,66.10-4 ppm (arrondi = 7.10-4 ppm soit 3,5.10-3 mg.m-3)
L’US EPA (IRIS) propose une RfC de 3 µg.m-3 pour une exposition chronique par voie respiratoire (1998).
Cette valeur est établie à partir de l’étude expérimentale du NTP, (1992) réalisée chez la souris B6C3F1 exposées à 0 – 10 -30 ppm (0 – 52 – 157 mg.m-3), 6 heures par jour, 5 jours par semaine pendant 103 semaines. Une LOAEC de 10 ppm est définie qui correspond à une LOAEC ajustée de 9,3 mg.m-3 pour une hyperplasie de l’épithélium respiratoire et une métaplasie de l’épithélium olfactif, l’ajustement a été réalisé sur la durée d’exposition.
Une LOAECHEC (Human Equivalent Concentration) a ensuite été calculée selon la méthode de l’US EPA en considérant le naphtalène comme un gaz de catégorie 3. En l’absence de données spécifiques un facteur de 1 a été appliqué par défaut. Le calcul est le suivant :
LOAECHEC = LOAECajusté ´ RGDRET (regional gaz dose ratio in the extrathoracic (ET) region)
LOAECajusté = 52 mg.m-3 x 6 h/24 h x 5 j/7 j = 9,28 mg.m-3
LOAEC (HEC) = LOAECajusté x 1 = 9,28 mg.m-3 arrondi à 9,3 mg.m-3
Facteur d’incertitude : un facteur de 3 000 est appliqué. Un facteur de 10 pour l’extrapolation de la souris vers l’homme, un facteur de 10 afin de protéger les populations sensibles au naphtalène, un facteur de 10 pour l’extrapolation d’une LOAEC vers une NOAEC et un facteur de 3 pour l'insuffisance des données.
Calcul : 9,3 mg.m-3 x 1/3 000 = 0,0031 mg.m-3 (arrondi à 0,003 mg.m-3)
Indice de confiance : L’US EPA accorde un indice de confiance de faible à modéré pour cette valeur.
L'OEHHA propose un REL de 9 µg.m-3 pour une exposition chronique par inhalation (2003)
Cette valeur est issue d'une étude expérimentale au cours de laquelle des souris ont été exposées aux vapeurs de naphtalène durant 104 semaines (6 heures par jour, 5 jours par semaine), à des concentrations de 0, 10 ou 30 ppm NTP, 1992. Une LOAEC de 10 ppm a été déterminée pour des lésions nasales (inflammation chronique, métaplasie de l'épithélium olfactif) et pulmonaire (hyperplasie de l'épithélium respiratoire). Un ajustement sur la durée d’exposition a été pratiqué.
Facteurs d’incertitude : un facteur 10 a été appliqué pour l'utilisation d'une LOAEC, un facteur 10 pour l'extrapolation à l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : (10 ppm x 6 h/24 h x 5 j/7 j) x 1/1 000 = 2.10-3 ppm (9.10-3 mg.m-3)
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 0,6 mg.kg-1.j-1 pour une exposition aiguë par voie orale (2005).
Cette valeur a été calculée à partir de l’étude NTP, (1991) dans laquelle des rats Sprague-Dawley femelles ont été exposés au naphtalène, par gavage, du 6ème au 15ème jour de gestation aux doses de 0 – 50 – 150 – 450 mg.kg-1.j-1. Un LOAEL de 50 mg.kg-1.j-1 a été établi par les auteurs pour des signes cliniques transitoires (une léthargie et une bradypnée) chez les femelles gestantes.
Facteur d’incertitude : un facteur 90 a été appliqué. Un facteur 3 pour l’utilisation d’un LOAEL, un facteur 10 pour l’extrapolation des données animales à l’homme et un facteur 3 pour la variabilité au sein de la population humaine.
Calcul : 50 mg.kg-1.j-1 x 1/90 = 0,55 mg.kg-1.j-1 (arrondi = 0,6 mg.kg-1.j-1)
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 0,6 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale (2005).
Comme pour l’établissement du MRL pour une exposition aiguë, l’ATSDR a élaboré un MRL pour une exposition subchronique à partir de l’étude du NTP, (1991). Le LOAEL de 50 mg.kg-1.j-1 a été également retenu pour des signes cliniques transitoires chez les femelles gestantes.
Facteur d’incertitude : le même facteur d’incertitude global, que celui utilisé pour calculer le MRL aigu, a été appliqué, soit un facteur de 90. Un facteur 3 pour l’utilisation d’un LOAEL, un facteur 10 pour l’extrapolation des données animales à l’homme et un facteur 3 pour la variabilité au sein de la population humaine.
Calcul : 50 mg.kg-1.j-1 x 1/90 = 0,55 mg.kg-1.j-1 (arrondi = 0,6 mg.kg-1.j-1)
Effets à seuil - Exposition chronique par voie orale :
L’US EPA (IRIS) propose une RfD de 2.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (1998).
Cette valeur a été calculée à partir d’une étude réalisée chez des rats F344 exposés de façon sub-chronique par voie orale (gavage) aux doses de naphtalène de 0 - 25 – 50 – 100 – 200 – 400 mg.kg-1, 5 jours par semaine pendant 13 semaines (Battelle, 1980a). Un NOAEL de 100 mg.kg-1 a été déterminé, il a été ajusté par rapport à la durée de l’exposition (5 j/7 j) à 71,4 mg.kg-1.j-1 pour une baisse de 10 % du poids du corps des rats mâles.
Facteur d’incertitude : un facteur d’incertitude de 3 000 a été appliqué. Un facteur de 10 pour l’extrapolation de l’animal vers l’homme, un facteur de 10 afin de protéger la population sensible au naphtalène, un facteur de 10 pour l’extrapolation des données sub-chroniques vers des données chroniques et un facteur 3 pour le manque d’étude chronique pour des expositions voie orale et d’étude de reproduction sur deux générations.
Calcul : 71,4 mg.kg-1.j-1 x 1/3 000 = 0,023 mg.kg-1.j-1 (arrondi à 0,02 mg.kg-1.j-1)
L’US EPA accorde un indice de confiance faible à cette valeur.
Le RIVM propose un TDI de 4.10-2 mg. kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
Cette valeur a été élaborée pour les hydrocarbures aromatiques comportant de 10 à 16 carbones et qui ne sont pas considérés comme cancérigènes (Baars et al., 2001).
La méthodologie ayant conduit à cette valeur de risque (et aussi à celles correspondant à d'autres fractions du pétrole) est issue des travaux réalisés en 1997 par le TPHCWG (Total Petroleum Hydrocarbons Criteria Working Group) (Edwards, 1997). Elle repose sur une évaluation par groupe de substances en fonction à la fois de la taille de la molécule (nombre de carbone) et de son potentiel cancérigène. Pour le naphtalène, le raisonnement est basé sur les valeurs de l’US EPA mais n’est pas explicite.
Facteurs d’incertitude : un facteur de 1 000 est retenu comprenant un facteur 10 appliqué pour l'utilisation d'une étude sub-chronique, un facteur 10 pour l'extrapolation à l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 40 mg.kg-1.j-1 x 1/1 000 = 4.10-2 mg.kg-1.j-1
Santé Canada propose une DJT de 2.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (2010).
Cette valeur reprend en tout point la RfD de l’US EPA (IRIS), 1998. Cette valeur reste inchangée dans la version 3.0 de 2021.
Effets sans seuil - Exposition chronique par inhalation :
L’ANSES propose un ERUi de 5,6.10-6 (µg.m-3)-1 pour une exposition chronique par inhalation au naphtalène (Anses, 2013).
Cette valeur est établie à partir de l’étude de cancérogenèse chez le rat et la souris (NTP,1992 ,2000). L’effet critique retenu est l’augmentation de l’incidence des neuroblastomes de l’épithélium olfactif chez le rat femelle. Même si cette tumeur est rare à l’âge adulte chez l’homme, le mécanisme a été jugé transposable du fait de l’implication des cytochromes dans le métabolisme du naphtalène et de la gravité et le faible pronostic lié au développement de ce type de tumeur.
Une BenchMark Concentration (BMC) a été calculée à partir des résultats de l’étude de 2000 chez le rat pour l’effet critique « augmentation de l’incidence des neuroblastomes de l’épithélium olfactif » par modélisation des données au moyen de logiciel Proast18.2.
Le modèle retenu est celui qui s’ajuste le mieux aux données expérimentales par la méthode du maximum de vraisemblances (Log Likelihood). Le modèle log-logist est retenu pour l’estimation de la limite inférieure de l’intervalle de confiance à 90% de l’effet critique retenu : neuroblastomes de l’épithélium olfactif chez le rat femelle, et pour une concentration correspondant à une augmentation de 10% de la réponse par rapport au groupe non exposé (le seuil de 10% est généralement retenu dans les études de cancérogenèse). Il a été retenu la limite inférieure de l’intervalle de confiance à 90% de la BMC, construite pour les neuroblastomes chez les femelles et pour un niveau d’effet correspondant à 10 % du niveau d’effet observé chez les témoins et calculé à partir du modèle Weibull.
BMC01 % = 155 mg.m-3 et BMC10 %L90 % = 99,6 mg.m-3
Comme pour les effets à seuil, un ajustement allométrique a été considéré et en l’absence de données spécifiques, la valeur par défaut de 1 a été appliquée.
Un ajustement pour une exposition continue a également été réalisé en tenant compte de la durée et de la fréquence d’exposition dans l’étude source : 6 h/24 h et 5 j/7 j/.
BMC10 %L90 % HEC ADJ = 99,6 mg.m-3 x 5j/7j x 6h/24h = 17,8 mg.m-3
L’excès de risque unitaire est ensuite obtenu par extrapolation linéaire à partir de cette BMC10 %L90 % HEC ADJ : ERU = (0,1/ BMC10 %L90 % HEC ADJ) = 0,0056(mg.m-3)-1 = 5,6.10-3 (mg.m-3)-1 ce qui correspond à une concentration de 0,18 µg.m-3 pour un risque de 10-6 et une concentration de 1,8 µg.m-3 pour un risque de 10-5.
Incidence des neuroblastomes de l’épithélium olfactif chez le rat (NTP, 1992, 2000) :

Effets sans seuil - Exposition chronique par voie orale :
L'OEHHA propose un ERUo de 1,2.10-1 (mg.kg-1.j-1)-1 et un ERUi de 3,4.10-5 (µg.m-3)-1 pour une exposition chronique par voie orale et par inhalation (2011)
Ces valeurs ont été élaborées à partir des études du NTP, (1992, 2000), principalement à partir des données obtenues chez les souris femelles (NTP, 1992) et chez les rats mâles et femelles (NTP, 2000).
L’étude du NTP, (1992) a montré, entre autres, une augmentation de l’incidence des adénomes et des carcinomes broncho-alvéolaires chez les souris B6C3F1 femelles. L’étude du NTP, (2000) a mis en évidence une augmentation de l’incidence des neuroblastomes de l’épithélium nasal olfactif chez les rats F344 mâles et femelles ainsi qu’une augmentation de l’incidence des adénomes de l’épithélium respiratoire chez les rats mâles. Sur la base de ces résultats, l’OEHHA a calculé un ERUo et un ERUi. Comme le montre le tableau ci dessous, un potentiel cancérigène, exprimé en (mg.kg-1.j-1)-1 a d’abord été calculé pour chaque espèce et sexe étudié ainsi que pour chaque type de tumeurs observées, à l’aide d’un modèle linéaire multi étapes (Armitage et Doll, 1954).
Une extrapolation des données animales vers l’homme a ensuite été réalisée pour déterminer le potentiel cancérigène pour l’homme suivant l’équation suivante (Anderson, 1983).
q animal = q humain x [PCh/PCa]1/3
q animal : potentiel cancérigène chez l’animal
q humain : potentiel cancérigène chez l’homme
PCa : poids corporel chez l’animal
PCh : poids corporel chez l’homme
L’excès de risque, exprimé en (mg.m-3)-1, a été ensuite calculé en prenant en compte le taux respiratoire chez l’homme, chez la souris et chez le rat, ainsi que le poids corporel chez l’homme et les animaux.
Taux respiratoire = 20 m3.j-1 (homme), 0,038 m3.j-1 (souris femelle), 0,262 m3.j-1 (rat mâle),0,182 m3.j-1 (rat femelle)
Poids corporel : 70 kg (homme), 0,029 kg (souris femelle), 0,445 kg (rat mâle), 0,258 kg (rat femelle)
Les mêmes calculs ont été réalisés par la méthode de benchmark dose (BMD), conseillée dans le rapport de l’US EPA pour les cancérogènes (US EPA, 2003). Les résultats obtenus sont identiques à ceux présentés dans le tableau ci-dessus.
Le NTP considère que l’augmentation de l’incidence des adénomes de l’épithélium respiratoire nasal et des neuroblastomes de l’épithélium nasal olfactif, qui sont des tumeurs rares, montre clairement l’activité cancérigène du naphtalène.
Les ERU par voie orale et par inhalation, proposés par l’OEHHA, sont ceux qui ont été établis chez les rats mâles pour l’augmentation de l’incidence, à la fois, des adénomes de l’épithélium nasal respiratoire et des neuroblastomes de l’épithélium nasal olfactif.
Un ERUi de 3,4.10-5 (µg.m-3)-1 a donc été calculé ce qui correspond à des concentrations de 0,29 µg.m-3 pour un risque de 10-5 et à des concentrations de 2,9 µg.m-3 pour un risque de 10-6.
Un ERUo de 1,2.10-1 (mg.kg-1.j-1)-1 a également été calculé ce qui correspond à des concentrations de 0,83.10-5 mg.kg-1.j-1 pour un risque de 10-5 et à des concentrations de 8,3.10-5 mg.kg-1.j-1 pour un risque de 10-6.
Utilisation des résultats du NTP (1992, 2000) pour le calcul de l’ERUi (OEHHA, 2011)

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition chronique par inhalation :
L’ANSES propose de retenir pour une exposition chronique au naphtalène par inhalation la VTR chronique de 37 µg.m-3.
Quatre organismes proposent des VTR, l’Anses (2013), l’US EPA (1998), l’ATSDR (2005) et l’OEHHA (2003). Les valeurs reposent sur la même étude qui a donné lieu à deux publications (NTP, 1992, 2000), le même effet critique et le même LOAEC. L’étude est de qualité recevable. Les quatre organismes proposent un ajustement pour tenir compte de la durée d’exposition de l’étude. L’ANSES, l’US EPA et l’ATSDR calculent un équivalent de concentration pour l’homme. La différence entre ces trois organismes réside dans le choix du facteur d’incertitude pour l’extrapolation des données animales à l’homme l’ATSDR retient un facteur de 3, l’US EPA de 10 et l’ANSES de 2,5. L’US EPA prend un facteur supplémentaire pour tenir compte de l’insuffisance des données. Dans la mesure où l’ANSES propose une valeur récente, celle-ci est retenue.
Effets à seuil - Exposition aiguë par voie orale :
L’INERIS propose de retenir pour une exposition aiguë au naphtalène par voie orale la VTR aiguë de 0,6 mg.kg-1.j-1
Cette valeur est basée sur la seule VTR disponible, celle de l’ATSDR (2005). La qualité de l’étude clé est recevable, l’effet critique et la dose critique sont cohérents avec le profil toxicologique, le calcul de VTR est transparent. Cette valeur est retenue.
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de retenir pour une exposition sub-chronique au naphtalène par voie orale la VTR sub-chronique de 0,6 mg.kg-1.j-1.
Cette valeur est basée sur la seule VTR disponible, celle de l’ATSDR. Il faut cependant noter que cette valeur est basée sur une étude aiguë et sur une population sensible et que le facteur d’incertitude appliqué ne prend pas en compte la courte durée d’exposition. Cette valeur est retenue par défaut.
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique au naphtalène par voie orale la VTR chronique de 0,02 mg.kg-1.j-1.
Deux organismes proposent des valeurs, l’US EPA et le RIVM. Celle de l’US EPA est basée sur une étude de bonne qualité mais pour une durée d’exposition sub-chronique. De plus, le manque de données a contraint l’US EPA à prendre un facteur d’incertitude total de 3 000. Celle développée par le RIVM repose sur une démarche générique pour les hydrocarbures aromatiques comportant de 10 à 16 carbones et qui sont considérés comme non cancérigènes ; cette démarche n’est donc pas spécifique au naphtalène car elle ne tient pas compte de la forme de la molécule et des groupements associés. Les valeurs déterminées par les deux organismes s’avèrent très proches. En l’absence de données complémentaires, l’INERIS propose de retenir la valeur de l’US EPA qui est plus spécifique. Ce choix est conforté par la valeur du RIVM. Enfin, cette valeur est la plus pénalisante.
Au niveau international, le caractère génotoxique ou non du naphtalène ne fait pas consensus, en conséquence des VTR sans seuil sont maintenues.
Effets sans seuil - Exposition chronique par inhalation :
L’ANSES propose de retenir pour une exposition chronique au naphtalène par inhalation la VTR chronique de 5,6.10-6 (µg.m-3)-1.
Deux organismes proposent des valeurs l’OEHHA (2011) et l’ANSES (2013). Les deux organismes retiennent la même étude de cancérogenèse (NTP, 2000) et les mêmes effets critiques. Le calcul des ERU correspond à une modélisation des données, le calcul d’une Benchmark concentration puis l’extrapolation aux faibles concentrations. La démarche générale est similaire même si des différences peuvent exister. Dans la mesure où il existe une valeur de l’Anses celle-ci sera préférée.
Effets sans seuil - Exposition chronique par voie orale :
L'INERIS propose de retenir la valeur de 1,2.10-1 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale au naphtalène
Cette valeur est basée sur la seule VTR disponible, celle de l’OEHHA (2011). Elle a été construite par extrapolation voie à voie à partir de l’ERUi de l’OEHHA pour une exposition chronique par inhalation. Cette valeur n’a pas été retenue comme VTR du fait de l’existence d’une VTR développée par l’ANSES. Toutefois, il a été noté que les deux valeurs étaient assez proches. Dans ces conditions, la valeur de l’OEHHA sera retenue par défaut.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/09/2025
Introduction
L'objectif de cette section est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme. L'ensemble des informations et des données de ce chapitre provient de diverses revues bibliographiques publiées dans le dossier EQS ou « Norme de qualité environnementale » (NQE) pour le naphthalène publié dans le cadre du second cycle de révision des NQE dans le contexte de la Directive Cadre sur l’Eau (E.C., 2011). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur recevabilité selon les critères définis ci-dessous :
- - Recevabilité 1 : le résultat peut être utilisé pour le calcul de la PNEC vis-à-vis des organismes aquatiques sans restriction,
- - Recevabilité 2 : le résultat peut être utilisé pour le calcul de la PNEC vis-à-vis des organismes aquatiques mais dans une seconde étape. Généralement ces résultats proviennent de protocoles comportant des dérives par rapport aux normes des essais (durée d’exposition, composition des milieux, températures d’exposition …),
- - Recevabilité 3 : Le résultat ne peut pas être utilisé pour le calcul de la PNEC. Il peut être utilisé pour conforter des résultats. Ces résultats proviennent d’essais pour lesquels l’organisme testé n’est pas un organisme dulçaquicole, ou que le protocole n’est pas disponible, ou que le protocole comporte des modifications majeures par rapports aux normes en vigueurs (durée d’exposition trop courtes …),
- - Non classés : Le résultat provient d’une citation dans un article.
Dangers
Description
Organismes aquatiques :
Paramètres d’écotoxicité aiguë :
Un nombre suffisant de résultats d'écotoxicité chronique étant disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Ils sont toutefois consultables dans le document (E.C., 2011).
Paramètres d’écotoxicité chronique :
L'ensemble des informations et des données provient du document (E.C., 2011).
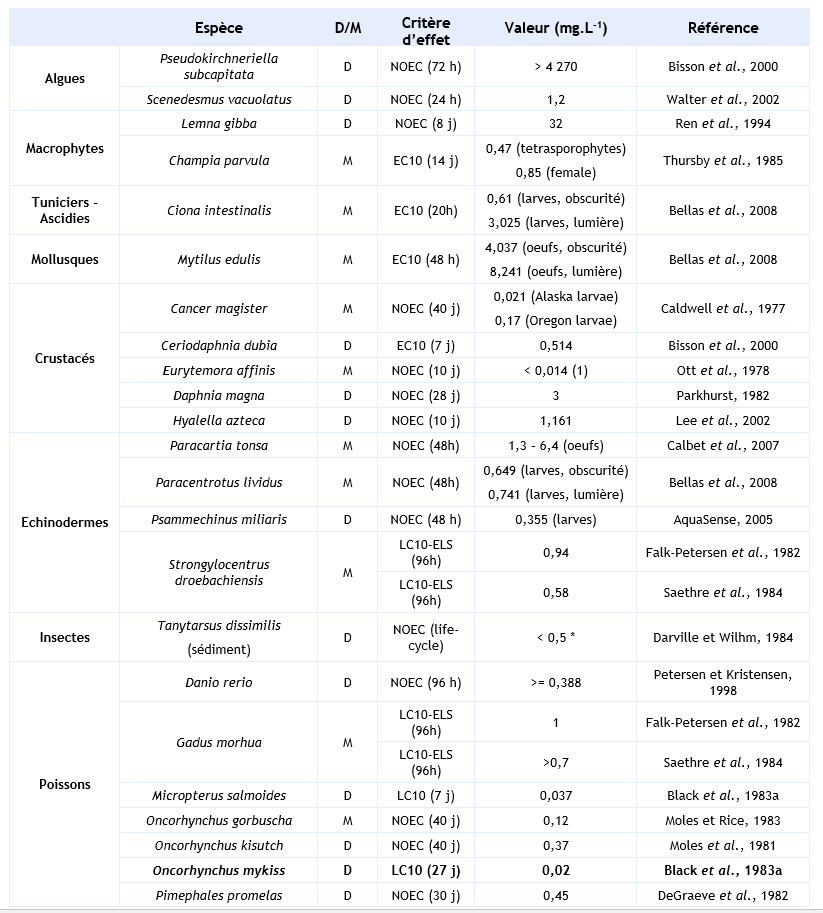
(1) une seule concentration d’exposition testée D : organisme d’eau douce ; M : organisme marin * Dans cette étude sur le cycle de vie entier de l’insecte Tanytarsus dissimilis, les auteurs concluent qu’aucun effet n’est observé en-deçà de 0,5 mg.L-1, mais des informations manquantes sont relevées par l’INERIS (détails concernant la courbe dose-réponse, données manquantes pour un test témoin et un test avec individus traités). Le test ne peut donc être considéré comme valide à des fins d’évaluation des risques et utilisé pour la détermination de la PNEC.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 27/05/2025
Introduction
Le naphtalène est un hydrocarbure Aromatique Polycyclique (HAP) répertorié comme composé organique semi-volatil (COSV) produit à partir de goudron de houille ou de pétrole, le goudron de houille étant la source la plus courante (plus de 90% de la production mondiale de naphtalène).
Le naphtalène est classé cancérigène de catégorie 2 et fait partie des substances prioritaires listées au niveau européen pour la politique dans le domaine de l'eau, cette substance dispose à ce titre d'une norme de qualité environnementale (NQE).
Le naphtalène est employé comme :
- composant de mélanges d'hydrocarbures (créosote, goudron, carburant diesel…),
- intermédiaire réactionnel pour la synthèse de nombreuses substances chimiques destinées à de très nombreux secteurs d'activités (production d'anhydride phtalique, colorants azoïques, superplastifiants, tensioactifs, produits phytopharmaceutiques, produits pharmaceutiques et vétérinaires…)
- substance auxiliaire de procédé, en particulier pour la production d'abrasifs.
Le naphtalène émis principalement dans l'environnement provient de différentes sources : des sources naturelles (feux de forêt), de sources non-intentionnelles issues de combustions d'origine anthropique (chauffage domestique au bois, trafic routier), de sources industrielles (les émissions industrielles de naphtalène sont quasi-exclusivement atmosphériques et proviennent pour moitié de sites de raffinage de pétrole). Les stations-service peuvent aussi être à l'origine de la présence de naphtalène dans le milieu aquatique (du fait, par exemple, du déclenchement intempestif d'une pompe…).
De ces diverses sources d'émission résulte la présence de naphtalène dans 11% des prélèvements d'eau de surface effectués entre 2018 et 2020 et dans l'air mesuré par 4 stations de mesure en continu entre 2013 et 2014 (avec une concentration moyenne comprise entre 0,03 et 0,56 ng.m-3).
La substitution est une des solutions de réduction des émissions de naphtalène. Cependant la substituabilité du naphtalène varie en fonction des utilisations, à titre d'exemple, si la synthèse de l'anhydride phtalique a toujours recours au naphtalène, il semblerait que la méthode la plus courante de production de cette substance soit basée sur l'o-xylène et à l'inverse, la substitution de la créosote pour la préservation des traverses de chemin de fer ne semble pas aussi aboutie.
Abstract
Naphthalene is a Polycyclic Aromatic Hydrocarbon (PAH) listed as a SemiVolatile Organic Compound (SVOC).
Naphthalene is classified as a category 2 carcinogen and is listed as a priority substance at European level for water policy, and as such has an Environmental Quality Standard (EQS).
Naphthalene is used as
- component of hydrocarbon mixtures (creosote, tar, diesel fuel, etc.)
- reaction intermediate for the synthesis of numerous chemical substances for a wide range of sectors (production of phthalic anhydride, azo dyes, superplasticizers, surfactants, phytopharmaceutical products, pharmaceutical and veterinary products, etc.)
- process auxiliary substance in particular for the production of abrasives
Naphthalene is emitted mainly into the atmosphere from different sources: natural sources (forest fires), unintentional sources from anthropogenic combustion (domestic wood heating, road traffic), industrial sources (half of the industrial naphthalene emissions come from oil refining sites). Petrol stations can also be a source of naphthalene in the environment (e.g. a pump at a petrol station is accidentally triggered and causes water pollution).
These various emission sources result in the presence of naphthalene in 11% of the French surface water samples taken between 2018 and 2020 and in the air of 4 continuous measurement French stations between 2013 and 2014 (with an average concentration of between 0.03 and 0.56 ng.m-3).
Substitution is one of the options for reducing naphthalene emissions. However, the substitutability of naphthalene varies according to the use, for example, if the synthesis of phthalic anhydride always uses naphthalene, it would seem that the most common method of production of this substance would be based on o-xylene and conversely, the substitution of creosote for the preservation of railway sleepers does not seem to be so successful.
Tableaux de synthèse
Généralités
| CAS | 91-20-3 |
|---|---|
| SANDRE | 1517 |
| Usages principaux |
-Composant de mélanges de HAP :
- Usage de substances dérivées du naphtalène :
- Sources non-intentionnelles : combustions d'origine anthropique (chauffage domestique au bois, trafic routier) |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
Textes générauxREACHRestrictions d'usage
[2] benzo(a)pyrène, benzo(e)pyrène, benzo(a)anthracène, chrysène, benzo(b)fluoranthène, benzo(j)fluoranthène, benzo(k)fluoranthène et dibenzo(a,h)anthracène Directive cadre eau (DCE)Le naphtalène fait partie des substances prioritaires listées au niveau européen pour la politique dans le domaine de l'eau citées dans la directive 2013/39/UE du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE. Il fait partie du programme de surveillance de l'état chimique des eaux (arrêté du 25 janvier 2010 modifié). Le programme de mesures défini conformément à la DCE par l'article R.212-19 du code de l'environnement comprend toutes les mesures destinées à prévenir l'introduction de cette substance dans les eaux de surface et les eaux souterraines. Règlementation sectorielleProduits phytopharmaceutiquesLe naphtalène n'est plus autorisé comme insecticide. Il fut autrefois utilisé comme répulsif pour les mites pour la protection des textiles (« boules de naphtalines »)3 . JouetsEtant classé CMR 2, le naphtalène ne peut être utilisé dans les jouets et ne doit pas entrer dans la composition de jouets ou de parties de jouets micro-structurellement distinctes4 . CosmétiquesL'utilisation du naphtalène est interdite dans tout produit cosmétique mis sur marché de l'Union européenne5. Eaux de rejetLe naphtalène est concerné par l'action nationale de recherche et de réduction des rejets de stations de traitement des eaux usées urbaines (RSDE STEU), qui a pour objectif l'amélioration de l'état des milieux aquatiques, via la réduction progressive des émissions, rejets et pertes de substances dangereuses. Au titre de la Directive Cadre sur l'Eau et des objectifs de réduction, la note technique du 29 septembre 2020 relative aux objectifs nationaux et à leur déclinaison dans les SDAGE 2022-2027 prévoit une « réduction ambitieuse » de 30% d'ici 2027 pour le naphtalène. Eaux souterrainesAu titre de la Directive Européenne 2006/118/CE sur la protection des eaux souterraines, le naphtalène est cité dans la liste des substances dangereuses de l'arrêté du 17 juillet 2009 relatif aux mesures de prévention ou de limitation des introductions de polluants dans les eaux souterraines. Contact alimentaireLe Règlement de l'UE sur les matériaux et objets en matière plastique destinés à entrer en contact avec des denrées alimentaires interdit le naphtalène comme additif, auxiliaire, monomère ou autre substance de départ.6. [4] Directive européenne n° 2009/48/CE [5] https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=celex%3A32009R1223 [6] Règlement (UE) N°10/2011 de la Commission du 14 janvier 2011 concernant les matériaux et objets en matière plastique destinés à entrer en contact avec des denrées alimentaires |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Seuils de rejets pour les installations classées et les stations de traitement des eaux uséesL'Arrêté du 31/01/08 relatif au registre et à la déclaration annuelle des émissions et des transferts de polluants et des déchets modifié par l'arrêté du 11 décembre 2014 indique que les seuils de déclaration pour le naphtalène sont de :
L'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumise à autorisation prévoit pour le naphtalène, une valeur limite de concentration de 130 µg.L-1 si le rejet dépasse 1g par jour. Valeurs appliquées en milieu professionnelIl existe pour le naphtalène une valeur limite d'exposition professionnelle (VLEP) sur 8 heures de 50 mg.m-3 (10 ppm), cette VLEP est une valeur indicative non réglementaire (INRS, 2021). Valeurs appliquées pour la qualité des eaux de consommationL'arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine ne fixe pas de teneur maximale (annexe I), de valeur limite de qualité (annexe II), ni de valeur guide ou impérative (annexe III) pour le naphtalène. Le naphtalène ne figure pas dans la directive européenne sur l'eau potable mise en vigueur à partir du 12 janvier 2021 (directive (UE) 2020/2184 du 16 décembre 2020, refonte de la directive 98/83/CE). Valeurs appliquées dans l'airProposition de Valeurs guide air intérieur (VGAI) : 10 µg.m-3 pour des effets chroniques non cancérigènes pour une durée d'exposition supérieure à 1 an (AFSSET 2009). Recommandations du Haut conseil en Santé Publique (HCSP 2012) :
|
| Informations complémentaires |
Le naphtalène est un hydrocarbure aromatique polycyclique (HAP) à deux cycles benzéniques. Il se présente sous diverses formes solides (cristaux, poudre, aiguilles ou écailles), de couleur blanche et d’odeur caractéristique de goudron détectable par l’homme à de très faibles concentrations (de l’ordre de 0,1 ppm).
Il réagit violemment avec les oxydants forts, l’anhydride chromique, le chlorure d’aluminium et le chlorure de benzoyle.
Le naphtalène brûle avec une flamme très fuligineuse en dégageant une fumée âcre très dense. Sa décomposition thermique donne naissance à des gaz et vapeurs toxiques, notamment d’oxydes de carbone (INRS, 2007). |
Volume de production
| France |
Pas d'informations |
|---|---|
| UE |
200 000 t.an-1 (2004) |
| Monde |
Pas d'informations |
Consommation
| Volume de consommation en France |
2500t.an-1 (2005) |
|---|---|
| Part de la consommation dédiée à l’usage principal en France |
Pas d'informations |
Présence dans l'environnement
| Eaux de surface |
|
|---|---|
| Eaux souterraines |
|
| Air |
|
| Sols |
Pas d'informations |
Production et utilisation
Production et ventes
Données économiques
- En France
En 2005, l'INRS a réalisé une enquête en France afin d'évaluer l'importance de l'utilisation professionnelle des agents chimiques classés CMR (dont le naphtalène). Pour chaque substance, cette enquête fournit des informations notamment sur les quantités produites, exportées ou importées et les secteurs d'utilisation. Ainsi, en 2005 les importations, la consommation et les exportations de naphtalène en France étaient estimées respectivement à 301 tonnes, environ 2 500 tonnes et 29 990 000 tonnes (pour des raisons des de confidentialité, les détails des flux d'exportation ne sont pas connus) (INRS 2005).
La précédente fiche technico-économique réalisée par l'Ineris dédiée au naphtalène faisait mention d'un unique producteur de naphtalène en France (avec une production d'environ 15 000 tonnes par an), à savoir Rütgers Chemicals VFT France. Ce site a stoppé la distillation de goudron, et donc la production de naphtalène en 2005 (ECHA 2018). L'unique site de production de goudron de houille basé à Marienau (57) mentionné par cette même fiche aurait cessé son activité.
Eurostat9 produit des statistiques concernant l'exportation, l'importation et la production du mélange [Naphtalène et autres hydrocarbures aromatiques (excluant le benzène, le toluène et le xylène)]. Ces statistiques agrégées surestiment les données propres au naphtalène, néanmoins elles permettent de déduire des tendances économiques pour cette substance, à savoir que depuis 2011 les exportations françaises de ce mélange sont stables et que les importations ont connu deux pics en 2011-2012 et en 2015. Les statistiques Eurostat mettent en évidence une production française du mélange [Naphtalène et autres hydrocarbures aromatiques] à des niveaux annuels compris entre 97 664 et 718 962 tonnes.
Figure 1. Evolution des importations et exportations du mélange [Naphtalène et autres hydrocarbures aromatiques] en France entre 2009 et 2019 (Eurostat)
Les données Eurostat diffèrent de celles de l'INRS précédemment citées : elles sont bien plus importantes pour les importations et bien moindres pour les exportations. Cet écart révèle l'incertitude liée à la nature de ces données.
- En Europe
En 2021, la bande de tonnage du naphtalène reflétant la quantité annuelle fabriquée/importée de cette substance en Europe (dans le cadre de REACH) était comprise entre 100 000 à 1 000 000 tonnes10 . En 2021, 18 déclarants étaient répertoriés sur le site de diffusion de l'ECHA, ces derniers étaient situés en République Tchèque (2), en Espagne (3), en Belgique (2), en Allemagne (5), au Danemark (1), en Italie (2), en Suède (1) et en Irlande (2).
Le rapport d'évaluation des risques du naphtalène paru en 2004 et réalisé par l'UE indiquait que les chiffres de production des producteurs individuels de cette substance étaient compris entre 4 000 et 70 000 tonnes/an avec une production totale de l'Union Européenne estimée à 200 000 tonnes/an, dont 60 000 tonnes exportées et 152 000 tonnes utilisées dans l'Union Européenne (Européenne 2004).
D'après les données Eurostat, les acteurs principaux du marché du mélange [Naphtalène et autres hydrocarbures aromatiques] seraient les Pays-Bas, l'Espagne la Belgique, l'Allemagne et la France pour leurs exportations, importations et production de ce mélange.
- Dans le monde
D'après un site d'étude de marché11 , les activités croissantes des secteurs de la construction et de l'agriculture des pays asiatiques comme la Chine et l'Inde en feraient les consommateurs majeurs de naphtalène dans le monde (des dérivés du naphtalène sont utilisés pour la production de béton et de
substances phytopharmaceutiques (cf. paragraphe 1.10). La Figure 2 ci-dessous présente une estimation de la répartition de la consommation mondiale de naphtalène en 202012 .
Figure 2. Répartition de la consommation mondiale de naphtalène en 2020 (IHS Markit)
D'après un site d'étude de marché13 , les pays dont la balance commerciale14 du naphtalène était la plus excédentaire en 2019 seraient l'Espagne, l'Afrique du Sud, le Japon, le Koweït et l'Allemagne. A l'inverse, les pays présentant la balance commerciale la plus déficitaire pour le naphtalène en 2019 seraient la Belgique, les Pays-Bas, l'Inde, le Portugal et la Suisse (cf. Figure 3 ci-dessous).

Figure 3. Balance commerciale du naphtalène 2019 (OEC)
L'extraction du naphtalène (à partir de goudron de houille ou de pétrole) est mise en œuvre par différents producteurs dans le monde, notamment :
- DEZA (République Tchèque)
- Epsilon Carbon (Inde)
- Quimica del Nalon (Espagne)
- JFE Chemical Corporation (Japon)
- Koppers, Inc. (Etats-Unis)
- Rain Carbon (Allemagne)
[9] https://ec.europa.eu/eurostat/fr/web/prodcom/data/database
[10] https://echa.europa.eu/fr/registration-dossier/-/registered-dossier/15924/1/2
[11] https://www.mordorintelligence.com/industry-reports/naphthalene-market
[12] https://ihsmarkit.com/products/naphthalene-chemical-economics-handbook.html
[13] https://oec.world/en/profile/hs92/naphthalene
[14] Différence entre les exportations et les importations
Procédés de production
Le naphtalène peut être produit à partir de goudron de houille ou de pétrole, le goudron de houille étant la source la plus courante (plus de 90% de la production mondiale de naphtalène est issue du goudron de houille) (Business wire 2016).
Production à partir du goudron de houille
Le naphtalène est le constituant principal (70-80%) de l'huile naphtalénique obtenue par distillation de goudron de houille. Le naphtalène peut être extrait de cette huile soit par distillation, soit par cristallisation, soit par la combinaison de ces deux procédés (INRS 2016, ECHA 2018).
L'extraction peut être précédée d'une étape de lavage à la soude diluée afin d'ôter les crésols et xylènols contenus dans l'huile naphtalénique.
Extraction par distillation
La distillation génère trois fractions :
La fraction légère contenant notamment des xylènes, des triméthylbenzènes, de l'indane, de l'indène et des tétraméthylbenzènes
La fraction dite « de cœur » comportant environ 97 % de naphtalène et 2,5 % de thionaphtène
La fraction lourde composée à environ 75% de méthyl-naphtalènes, le reste étant principalement du diphényle et des diméthylnaphtalènes
La fraction concentrée en naphtalène est couramment utilisée pour la fabrication de l'anhydride phtalique. Une qualité plus pure peut être produite par cristallisation de cette fraction pour produire une qualité pure qui ne contient ni thionaphtalène ni d'autres impuretés.
Extraction par cristallisation
Le traitement de cristallisation le plus répandu est le procédé Sulzer-Buchs : le produit riche en naphtalène coule le long de tubes refroidis, ainsi le naphtalène cristallise partiellement sur les parois. À la fin du cycle de refroidissement, les cristaux de naphtalène sont fondus et pompés vers un réservoir de stockage. Si le naphtalène brut ainsi obtenu n'a pas la pureté souhaitée, il est nécessaire d'effectuer quatre à six étapes de cristallisation selon le même principe, pour aboutir à l'obtention de naphtalène pur (99,9 %).
Il existe un procédé alternatif de cristallisation aboutissant à du naphtalène de pureté comparable : le procédé Brodie. Néanmoins, ce procédé est nettement moins utilisé que le procédé Sulzer-Buchs.
Production à partir du pétrole
Le naphtalène peut également être produit à partir de fractions pétrolières riches en méthylnaphtalènes. La désalkylation est effectuée à hautes température et pression en présence d'hydrogène pour produire un mélange contenant du naphtalène pur à 99% et pauvre en soufre.
Noms commerciaux
Les noms commerciaux figurant dans le Tableau 4 sont issus de la page de l'Echa relative au naphtalène (ECHA).
Tableau 4. Autres synonymes et noms commerciaux (ECHA 2021)
Utilisations
Introduction (varitétés d'utilisations)
L'utilisation la plus courante du naphtalène est la production d'autres composés organiques, principalement : l'anhydride phtalique, des colorants azoïques, superplastifiants, tensioactifs, solvants, produits phytopharmaceutiques, produits pharmaceutiques et vétérinaires.
Le naphtalène est également utilisé à moindre échelle pour la fabrication de meules abrasives, la production du caoutchouc, du cuir, de carburants, de parfums…
Les dérivés du naphtalène peuvent être regroupés en différentes familles, dont (BOOTH 2012):
- les acides naphtalènesulfoniques
- les naphtols
- les acides hydroxynaphtanènesulfoniques
- les aminonaphtalènes
- les acides aminonaphtalènesulfoniques
- les aminonaphtols
- les acides aminohydroxynaphtalènesulfoniques
- les naphtalène alkylés
La répartition de l'utilisation du naphtalène comme intermédiaire de synthèse en Europe en 2003 est illustrée par la Figure 4 ci-dessous.
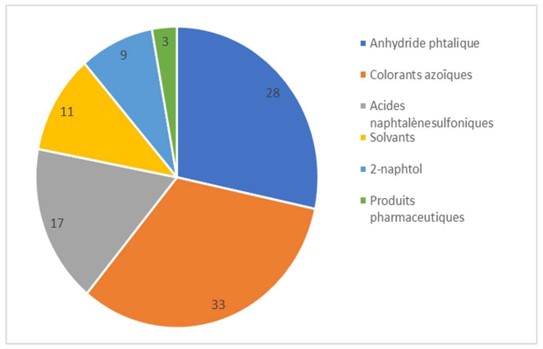
Figure 4. Répartition (%) de l'utilisation du naphtalène comme intermédiaire de synthèse en Europe en 2003 (ECHA)
L'anhydride phtalique est un intermédiaire de chimie organique destiné à la production de plastifiants (plus particulièrement des phtalates), de résines polyesters insaturés et de résines alkydes (cf. paragraphe 1.10.3).
Les colorants azoïques sont largement utilisés pour traiter les textiles, le cuir, les peintures et revêtements, les encres, les produits cosmétiques, les produits de soins personnels et certains aliments (cf. paragraphe 1.10.6.1).
Les acides naphtalènesulfoniques sont des intermédiaires chimiques de la production de nombreuses substances dont des superplastifiants pour matériaux cimentaires (cf. paragraphe 1.10.4).
Le 2-naphtol est principalement employé pour la fabrication d'agents d'anti-oxydants pour la synthèse du caoutchouc (cf. paragraphe 1.10.12).
De plus, le naphtalène est un important constituant de mélanges complexes tels que le goudron ou la créosote et il fait donc l'objet d'utilisations indirectes par exemple lors de la pose d'asphalte ou lors de l'application de traitements de préservation du bois (à base de créosote) (cf. paragraphe 1.10.2).
En mélange avec d'autres HAP dans des produits
Le naphtalène est présent, en mélange avec d'autres HAP15 , dans divers produits :
- Le goudron16 , le brai et le bitume dans le secteur des travaux publics (revêtements routiers) et de la construction (imperméabilisation de toits à faible pente)
- La créosote pour l'industrie de la préservation du bois (à la fois fongicide et insecticide). D'après le rapport d'évaluation émis par la Commission européenne, la créosote est appliquée par imprégnation par les industriels, le bois ainsi traité est destiné à des emplois de classes 3 à 517 (Commission Européenne 2010).
- Le solvant naphta aromatique, une combinaison complexe d'hydrocarbures aromatiques en C10-C12 (n°CAS 64742-94-5 (ECHA 2018) obtenue par distillation de fractions aromatiques et qui compte quelques applications industrielles (INRS 2021):
- diluant pour les peintures, vernis, encres d'imprimerie
- solvant dans l'industrie agrochimique et du bâtiment
- solvant pour la fabrication de caoutchouc, plastiques et bitumes
- préparation de noir de carbone et de résines
- agent de nettoyage industriel
- les huiles aromatiques DAE18 pour la production de caoutchoucs (plastifiants pour la fabrication de pneus automobiles, ustensiles ménagers, chaussures, jouets…), d'adhésifs, de produits d'étanchéité, de solvants et de matériaux de couverture. Notons que l'utilisation des DAE dans les pneus, les produits en caoutchouc et en plastique souple aurait diminué (Gouvernement du canada 2016).
- Les huiles minérales (MOH) principalement employées comme lubrifiants pour moteurs et machines et dans une moindre mesure pour la formulation de pesticides (acaricides, insecticides, adjuvants) et la production d'encres et de colles.
- Les huiles minérales aromatiques (MOAH - Mineral Oil Aromatic Hydrocarbons) pour la formulation d'encres, colles et adhésifs appliqués sur papier et carton (ANSES 2015 ; EFSA 2012)
- Cibles d'argile pour les activités de tir qui correspondent au tir sportif. Les disques en argile, dits pigeons d'argile, se brisent plus ou moins facilement en fonction du mode de fabrication et du matériel utilisé.
Ces disques sont constitués de 70% de poudre de roche et 30% de bitume (brai de houille ou de mazout) contenant des hydrocarbures aromatiques polycycliques (dont le naphtalène fait partie) ayant une fonction de liant.
Les cibles françaises comportent environ 7 g de HAP/kg soit environ 0,77 g de HAP par disque (OFEV 2015).
[15] Hydrocarbures Polycycliques Aromatiques
[16] Le naphtalène est un constituant du goudron de houille (11 %) (EPA 2003)
[17] Classe 3 : Situations dans lesquelles le bois ou le matériau à base de bois est au-dessus du sol et est exposé aux intempéries Classe 4 : Situation dans laquelle le bois ou le matériau à base de bois est en contact direct avec le sol et/ou l'eau douce Classe 5 : Situation dans laquelle le bois ou le matériau à base de bois est immergé dans l'eau salée (eau de mer ou eau saumâtre) de manière régulière ou permanente
[18] Distillate Aromatic Extracts - CAS n°64742-11-6 et CAS n°64742-04-7
Production anhydride phtalique
Une des principales applications du naphtalène est la synthèse de l'anhydride phtalique, un intermédiaire de chimie organique utilisé pour la production de plastifiants (plus particulièrement des phtalates), de résines polyesters insaturés et de résines alkydes. L'anhydride phtalique est également utilisé comme intermédiaire de synthèse d'insecticides, de fongicides, d'acide benzoïque, de colorants (phtaléines notamment), de produits pharmaceutiques, de parfums (INRS 2016).
Superplastifiants
Les superplastifiants sont des additifs développés pour conférer aux matériaux cimentaires une plus grande fluidité.
Leur action peut être perçue de deux manières : soit le superplastifiant permet, sans changer la teneur en eau du béton, d'augmenter son affaissement/étalement, soit le superplastifiant permet de réduire fortement la teneur en eau d'un béton donné sans en changer la consistance. Pour cette raison, ces adjuvants sont également désignés par le terme « réducteurs d'eau ». Leur dosage moyen est de 0,8 à 3 % de la masse du ciment. Toutefois, l'intérêt principal des superplastifiants réside dans la fluidité apportée au ciment : la pâte devient alors très malléable, facile à couler et à mettre en œuvre.
Les sels sulfonés de polycondensés de naphtalène et de formaldéhyde (n°CAS 36290-04-7) (cf. Figure 5), fréquemment nommés les polynaphtalènes sulfonates ou naphtalène sulfonate de sodium formaldéhyde (SNF) représentent une part importante du marché superplastifiants. Cet additif disperse les particules de ciment floculées au moyen d'un mécanisme de répulsion électrostatique.

Figure 5. Structure chimique des sels sulfonés de polycondensés de naphtalène et de formaldéhyde (n°CAS 36290-04-7)
Tensioactifs
Le naphtalène permet de produire des surfactants (les sulfonates de naphtalène et leurs dérivés) utilisés dans les peintures, détergents, cosmétiques…
Cosmétiques et produits de soin personnel
Le polynaphtalènesulfonate de sodium (n°CAS 9084-06-4), le naphtalènesulfonate de sodium (n°CAS 532-05-5 ou 1321-69-3), le disodium méthylène dinaphtalènesulfonate (n°CAS 26545-58-4/14857-90-0) trouvent des applications pour la formulation de produits de maquillage (ombres à paupières, mascara, fards à joues, fonds de teint, rouge à lèvres…) et de produits de soin corporel (shampooings…) (Cosmeticsinfo 2021).
Le polynaphtalènesulfonate de sodium et le naphtalènesulfonate de sodium sont employés comme tensioactifs : ils améliorent la solubilité dans l'eau d'autres ingrédients cosmétiques et aident à répartir ou à mettre en suspension un solide insoluble dans un liquide. Le polynaphtalènesulfonate de sodium est également stabilisateur d'émulsion19 et agent dispersant (Cosmetic Ingredient Review 2019).
[19] il permet d'empêcher le produit final de se séparer en ses composants huileux et aqueux
Détergents
Pour ses qualités tensioactives, le polynaphtalènesulfonate de sodium (n°CAS 9084-06-4) pourrait être présent dans des produits de consommation tels que les assouplissants, les nettoyants liquides de surface et les liquides pour lave-vaisselle (Cosmetic Ingredient Review 2019).
Peintures
Les sels sulfonés de polycondensés de naphtalène et de formaldéhyde (n°CAS 36290-04-7), grâce à leurs propriétés de dispersion sont intégrés aux formulations de peintures en phase aqueuse.
Colorants
Colorants azoïques
Les colorants et pigments azoïques sont des débouchés importants pour les dérivés du naphtalène. Les colorants azoïques sont des composés organiques portant le groupe fonctionnel R-N=N-R′ (dans lequel R et R′ peuvent être des dérivés du naphtalène) largement utilisés pour traiter les textiles, le cuir, les peintures et revêtements, les encres, les produits cosmétiques, les produits de soins personnels et certains aliments.
Les pigments azoïques ont une structure chimique similaire à celle des colorants azoïques, mais sont dépourvus de groupes solubles. Les pigments sont broyés pour obtenir une poudre qui sera ensuite mélangée à un liant afin d'obtenir un produit coloré (cosmétiques, peinture, encre, etc.).
Ces dérivés du naphtalène peuvent jouer le rôle de (BOOTH 2012) :
- colorants directs - les principaux substrats sont la rayonne (fibre textile artificielle à base de cellulose) et le papier - Exemple : le Rouge congo (n°CAS 573-58-0) pour la cellulose
- colorants acides – il s'agit de colorants anioniques hydrosolubles principalement utilisés pour colorer certaines fibres textiles (fibres en nylon, laine, soie et acrylique modifié) et dans une moindre mesure, pour colorer les peintures, encres, plastiques et le cuir – Exemple : Acid Orange 7 (n°CAS 633-96-5)
- colorants réactifs - Ces colorants comportent un groupe dit « réactif » (par exemple, groupement vinylsulfone20 ou triazine chlorée) dont la fonction est de se fixer sur le support, et un groupe colorant dit « chromophore » le plus souvent azoïques ou anthraquinoniques.– Les colorants réactifs sont principalement utilisés pour colorer les fibres textiles cellulosiques (ex. le coton) - Exemple : 7-[[4-chloro-6-(3-sulfoanilino)-1,3,5-triazin-2-yl]amino]-4-hydroxy-3-[(4-methoxy-2-sulfophenyl)diazenyl]naphthalene-2-sulfonic acid (n°CAS 59641-46-2)
- colorants développés - Après avoir fixé un premier composant sur le support (très souvent du β-naphtol (n°CAS 135-19-3), un deuxième composant est ajouté et réagit avec le premier, la synthèse du colorant s'effectuant alors sur le textile
- colorants métallifères - Ces colorants sont des complexes métalliques réalisés avec une ou deux molécules organiques (potentiellement, des colorants azoïques comportant un dérivé du naphtalène) – Exemple : l'acide 4-diazo-3,4-dihydro-7-nitro-3-oxonaphtalène-1-sulfonique (n°CAS 63589-25-3)
Parmi tous les dérivés du naphtalène, notons que l'acide 3-hydroxy-2-naphtoïque (n°CAS 92-70-6) est un intermédiaire important car il s'agit d'un précurseur commun à de nombreux colorants et pigments azoïques. A titre d'exemple, l'acide 3-hydroxy-2-naphtoïque est employé pour la production du pigment Red 57 (n°CAS 5858-81-1) utilisé pour des applications cosmétiques, produits de soins personnels, peintures au doigt, engrais, encres, parfums et produits pharmaceutiques.
Nombre d'autres acides hydroxynaphtoïques sont employés comme composants de couplage pour former des colorants azoïques, citons : l'acide 3-hydroxy-1-naphtoïque (n°CAS 19700-42-6), l'acide 5-hydroxy-1-naphtoïque (n°CAS 2437-16-3), l'acide 7-hydroxy-1-naphtoïque (n°CAS 2623-37-2), l'acide 8-hydroxy-1-naphtoïque (n°CAS 1769-88-6), l'acide 1-hydroxy-2-naphtoïque (n°CAS 86-48-6), l'acide 6-hydroxy-2-naphtoïque (n°CAS 16712-64-4) et l'acide 7-hydroxy-2-naphtoïque (n°CAS 613-17-2).
De nombreux acides mono- et dihydroxynaphtalène mono- et disulfonique utilisés comme composants de couplage de colorants azoïques sont aussi des intermédiaires réactionnels pour les acides aminonaphtalènesulfoniques et les acides aminohydroxynaphtalènesulfoniques qui sont eux-mêmes des intermédiaires importants soit pour la production directe de colorants azoïques, soit pour la conversion en intermédiaires plus fortement substitués pour les colorants azoïques.
Bien que tous les acides aminohydroxynaphtalènesulfoniques soient « diazotables », seul l'acide 1-amino-2-hydroxynaphtalène-4-sulfonique et ses dérivés sont industriellement importants comme composants diazoïques.
Le Tableau 5 ci-dessous cite des dérivés du naphtalène et leurs colorants azoïques associés.
Tableau 5. Dérivés du naphtalène et colorants azoïques associés
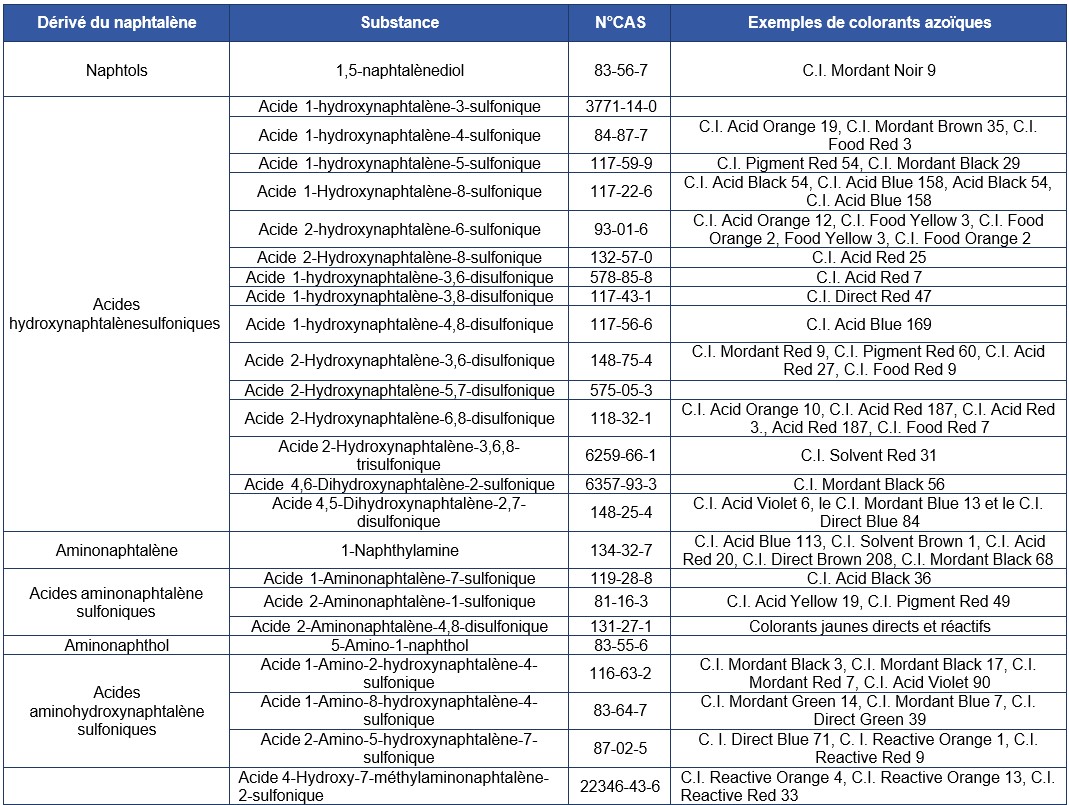
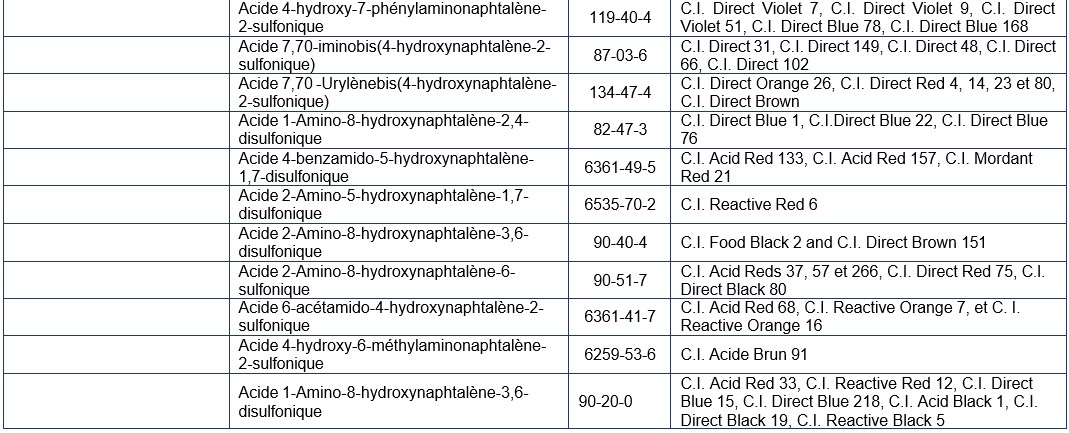
[20] –SO2-CH=CH2
Colorants capillaires
Certains dérivés du naphtalène sont employés comme agents colorants pour cheveux, citons (INCI Beauty 2021) :
- Le 2-méthyl-1-naphthol (n° CAS 7469-77-4)
- Le 1,5-naphtalènediol (n° CAS 83-56-7)
- Le 1-naphthol (n° CAS 90-15-3)
- Le 2,7-naphtalènediol (n° CAS 582-17-2)
Substances phytosanitaires
Des dérivés du naphtalène peuvent constituer des intermédiaires clés dans la production de nombreux produits chimiques autres que les teintures et les pigments, notamment les pesticides (cf.Tableau 6).
Tableau 6. Substances phytosanitaires dérivées du naphtalène (Sources : BNVD21 et Pesticide Properties DataBase22)
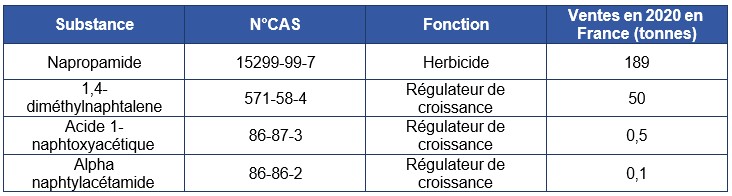
[22] https://sitem.herts.ac.uk/aeru/ppdb/en/index.htm
Produits pharmaceutiques et vétérinaires
Le naphtalène est un intermédiaire réactionnel de la synthèse de plusieurs produits pharmaceutiques et vétérinaires :
- le propranolol (n°CAS 525-66-6) et le nadolol (n°CAS 220045-89-6), deux médicaments faisant partie de la classe des bêta-bloquants, et prescrits en 2020 respectivement à hauteur de 12 et 0,9 tonnes23
- l'acide 1-Aminonaphtalène-4,6,8-trisulfonique (n°17894-99-4) trouve un débouché particulier dans la synthèse du médicament suramine sodique que l'Organisation mondiale de la santé a classé en 2013 parmi ses « médicaments essentiels », la prescrivant, toujours au premier stade, dans le traitement de l'infection par Trypanosoma brucei rhodesiense. Cette maladie n'est présente qu'en l'Afrique.
- la nafcilline, un antibiotique destiné à traiter les affections mammaires des vaches, brebis et chèvres.
Abrasifs
Le naphtalène est utilisé par l'industrie des abrasifs (pour le secteur aérospatial, la production des turbines à gaz industrielles…) comme inducteur de pores dans la fabrication d'abrasifs à liant vitrifié (ECHA 2018)qui améliorent les performances de ces produits abrasifs en formant plus d'arêtes vives au niveau des grains abrasifs (généralement de l'oxyde d'aluminium, AlO). Les meules sont formées en introduisant les matériaux mélangés (oxyde d'aluminium, céramique et naphtalène) dans un moule.
Celui-ci est ensuite chauffé modérément (60-100°C) pendant plusieurs heures afin de permettre la volatilisation du naphtalène. Cette volatilisation laisse les espaces poreux nécessaires à l'intérieur de la roue. Le produit est ensuite cuit sous pression à environ 1200°C dans un four pour vitrifier les matériaux céramiques en liant les grains d'oxyde d'aluminium entre eux tout en laissant les espaces poreux créés par le naphtalène.
Tableau 7. Composition typique des abrasifs agglomérés utilisant du naphtalène (RPA 2000)
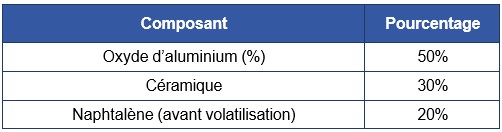
Environ 900 à 1 000 T.an-1 de naphtalène seraient utilisées à cette fin, et environ 20 à 25 entreprises en Europe utiliseraient du naphtalène pour fabriquer des abrasifs.
Carburants – Combustibles
- Le naphtalène est employé dans des additifs pour carburants destinés à favoriser le nettoyage et la protection des systèmes moteurs (substitution-cmr.fr 2019).
- Le naphtalène est présent en mélange avec d'autres HAP dans le coke, un combustible24 principalement utilisé en sidérurgie pour réduire le minerai de fer afin d'obtenir la fonte qui est ensuite transformée en acier.
- Le naphtalène fait partie de la composition des carburants diesel et des carburéacteurs25 :
- Il n'existe pas de spécification portant sur la concentration de naphtalène dans le carburant diesel, de ce fait, les concentrations de naphtalène dans ce carburant ne sont pas contrôlées (et sont donc très peu connues) (Source : communication personnelle IFPEN26). Néanmoins, une analyse assez peu récente (datant de 2001) menée par Schluep et al sur un échantillon de carburant diesel a révélé une concentration de naphtalène de 708 mg.L-1 (Schluep et al 2001).
- La teneur maximale en naphtalène dans les carburéacteurs s'élève à 3% (en volume) (Techniques de l'ingénieur 2011). D'après un expert de l'IFPEN, la teneur en naphtalène dans ce carburant s'élève en pratique approximativement à 0,5%.
[24] Combustible obtenu par pyrolyse de la houille
[25] Carburants destinés à l'alimentation des avions à réaction
[26] Institut Français du Pétrole Energies Nouvelles
Bombes fumigènes
Le naphtalène est utilisé en pyrotechnie pour simuler des explosions (grenades) ou créer des fumées noires (bombes fumigènes à usage militaire).
Caoutchouc
Il existe sur le marché deux antioxydants pour caoutchouc dérivés du naphtalène (plus particulièrement du 2-naphtol n°CAS 135-19-3) : la N-phényl-2-naphtylamine (n°CAS 135-88-6) et la N-phényl-2-naphtylamine (n°CAS 90-30-2) (CCHST , Chemotechnique Diagnostics).
Ces composés sont également employés dans l'industrie du caoutchouc comme accélérateurs de vulcanisation.
Pour mémoire, les plastifiants employés pour la production de caoutchouc (les huiles aromatiques DAE) comportent du naphtalène (cf. paragraphe 1.10.2).
NB : La N-phényl-2-naphtylamine est aussi utilisée comme antioxydant pour le latex, des graisses, et huiles lubrifiantes.
Tannage cuir
Des produits sulfonatés du naphtalène peuvent faire office d'agents tannants (syntans27) du cuir (Commission Européenne 2003).
[27] Nom générique des produits aromatiques ou aliphatiques doués de pouvoir tannant
Fragrances
Des dérivés du naphtalène intègrent les formulations de divers produits (parfums, cosmétiques…) en tant qu'agent parfumant et/ou agent masquant28.
A titre d'exemples :
- le 2-méthoxy-naphtalène (n°CAS 93-04-9) et le 2-éthoxy-naphtalène (n°CAS 93-18-5) apportent une odeur de fleur d'oranger à des produits biocides (désinfectants, produits antiparasitaires), parfums, cosmétiques, produits de soins personnels, cires et cirages, produits de nettoyage (BOOTH 2012)
- le 2-acétonaphthone (n° CAS 93-08-3) est utilisé comme agent parfumant et agent masquant pour des parfums et des matières premières aromatiques (INCI Beauty 2021)
- le méthyl-beta-naphthyl-ether (n° CAS 93-04-9) est un agent parfumant utilisé pour des parfums et matières premières aromatiques (INCI Beauty 2021)
[28] Réduit ou inhibe l'odeur ou le goût de base du produit
Analyses médicales
Le 1,3-naphtalènediol (naphtorésorcinol, n°CAS 132-86-5) est un réactif analytique de chromatographie sur couche mince pour l'identification de sucres (glucose, fructose, galactose, xylulose…) dans l'urine (Abderrazak Marouf 2013).
Les acides aminonaphtalènesulfoniques présentent une fluorescence en solution à la lumière du jour, cette propriété a été exploitée avec le chlorure de dansyle (n°CAS 605-65-2), employé pour le séquençage des protéines.
Polymères
- La 1,5-Naphthalenediamine (n°CAS 2243-62-1) est un intermédiaire dans la fabrication du naphtalène-1,5-diisocyanate (n°CAS 3173-72-6) qui est utilisé pour les polymères de polyuréthane spécialisés (BOOTH 2012).
- Le 4-Amino-1-naphtol (n°CAS 2834-90-4) est utilisé comme inhibiteur de polymérisation.
Rejets dans l’environnement
Sources naturelles
La combustion de biomasse lors de feux de forêt ou de broussaille et les éruptions volcaniques peuvent générer des émissions de naphtalène dans l'atmosphère (AFSSET 2009).
Lors d'un incendie de forêt, les niveaux d'émission de naphtalène varient en fonction de l'activité du feu et des essences de bois, à titre d'exemple, Collet et al rapportent des facteurs d'émissions de naphtalène lors de feux de forêt compris entre 23 667 et 82 008 µg/kg (INERIS 2011).
Sources non-intentionelles
La combustion incomplète du bois de chauffage domestique, le trafic routier, l'utilisation d'encens, le tabagisme représentent des sources non-intentionnelles de naphtalène dans l'atmosphère. A titre d'exemple, Martinet et al. ont étudié les émissions de substances non-réglementées de véhicules diesel et essence et rapportent des facteurs d'émissions de naphtalène compris entre 1 et 25 µg/km pour les véhicules diesel et 3-51 µg/km pour les véhicules essence (Simon Martinet 2017).
Le naphtalène est utilisé comme intermédiaire de synthèse dans la fabrication d'anhydride phtalique employé pour la production de plastifiants, résines, teintures... Cette substance est ainsi susceptible d'être émise par certains matériaux de construction et biens de consommation (AFSSET 2009).
Parmi les huiles minérales (MOH7), les (MOAH8) sont susceptibles de contenir des hydrocarbures aromatiques et de représenter une source non-intentionnelle potentielle de naphtalène. En effet, les encres, colles et adhésifs directement appliqués sur les emballages alimentaires en papier et carton et ceux présents dans ces emballages suite au recyclage sont en partie constitués d'huiles minérales aromatiques qui peuvent migrer vers les aliments (ANSES 2015 ; EFSA 2012).
Le naphtalène entre dans la composition du caoutchouc constituant les pneus automobiles (cf. paragraphe 1.10.2). Durant leur usage ces articles pourraient donc représenter des sources d'émissions potentielles de naphtalène. Ces articles pourraient aussi émettre du naphtalène via leur recyclage en granulés destinés à produire des terrains de jeux, d'athlétisme, du gazon artificiel (ECHA 2022).
Les barrières anti-humidité et joints de plancher à base de goudron, les fuites de réservoirs d'huiles minérales dans des caves et sous-sols, cuirs et textiles importés peuvent aussi représenter des sources d'émission de naphtalène (AFSSET 2009).
[7] Mineral Oils Hydrocarbons
[8] Mineral Oil Aromatic Hydrocarbons
Émissions anthropiques totales
Le naphtalène fait partie des substances déclarées dans E-PRTR (European Pollutant Release and Transport Register, registre européen des rejets et transferts de polluants à partir de sites industriels), qui selon le Règlement 166/2006/CE, impose aux exploitants de sites industriels visés par ce règlement de déclarer leurs rejets, en fonction de seuils prédéfinis, à savoir pour le naphtalène : 100kg.an-1 pour l'air, 10kg.an-1 pour l'eau et 10kg.an-1 pour le sol. Seuls les flux annuels déclarées dans E-PRTR pour l'ensemble des HAP sont disponibles.
En France, le naphtalène fait partie des substances dont les rejets dans l'air, l'eau et le sol doivent être déclarés lorsqu'ils dépassent un certain seuil29 (cf. paragraphe 1.4.1). Cette déclaration annuelle se fait sur le Registre des Emissions Polluantes, via le logiciel de saisie GEREP (Gestion électronique du registre des émissions polluantes) et est gérée dans la base de données nationale du registre des émissions polluantes (BDREP, IREP30). La Figure 6 et le Tableau 8 ci-dessous compilent les données d'émission du naphtalène vers les compartiments « Eau », « Air » et « Sol » entre 2016 et 2020. Cette compilation n'est pas exhaustive car les données BDREP correspondent à des déclarations qui ne concernent que les installations classées pour la protection de l'environnement (ICPE) soumises aux régimes d'autorisation et d'enregistrement, ainsi que les stations de traitement des eaux usées (STEU).
Notons que les données en question ne prennent pas en compte la combustion domestique de bois et de combustibles fossiles qui représente une source d'émission de naphtalène dans l'atmosphère non-négligeable.
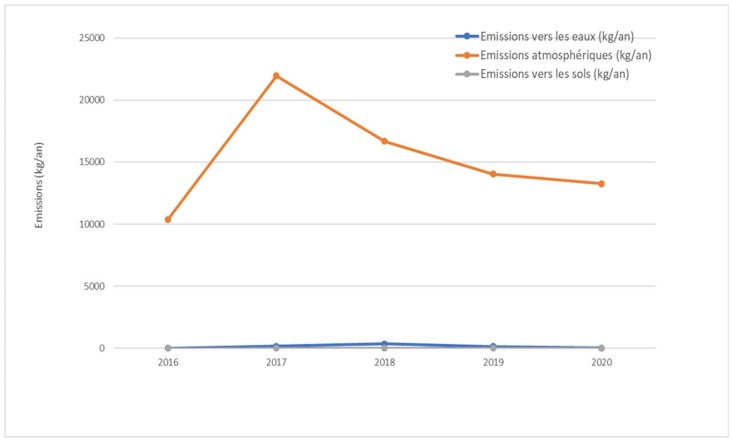
Figure 6. Evolution des émissions de naphtalène entre 2016 et 2020 (Source : BDREP)
Tableau 8. Emissions totales de naphtalène entre 2016 et 2020 (Source : BDREP)
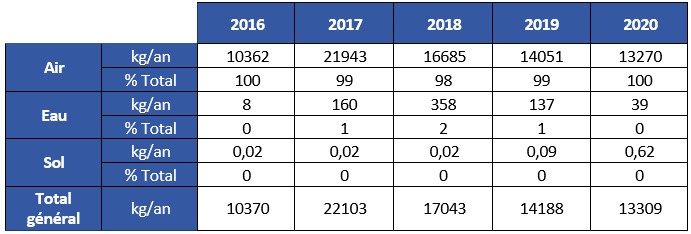
Les émissions atmosphériques de naphtalène déclarées entre 2016 et 2020 représentent la quasi-totalité des émissions totales de cette substance.
[29] Arrêté du 31 janvier 2008 relatif au registre et à la déclaration annuelle des émissions et de transferts de polluants et des déchets
[30] https://www.georisques.gouv.fr/risques/registre-des-emissions-polluantes
Émissions atmosphériques
Les flux de naphtalène émis dans l'atmosphère et déclarés entre 2016 et 2020 via le logiciel GEREP ainsi que le nombre de déclarants sont présentés dans le Tableau 9 et la Figure 7 ci-dessous.
Tableau 9. Emissions atmosphériques de naphtalène entre 2016 et 2020 (Source : BDREP)
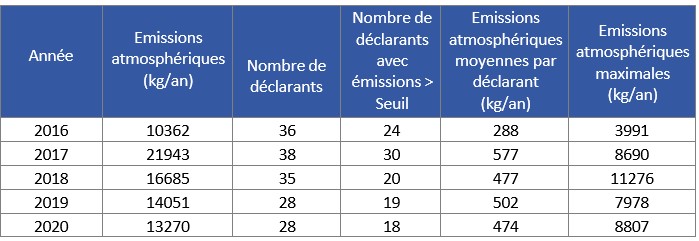

Figure 7. Evolution des émissions atmosphériques de naphtalène entre 2016 et 2020 (Source : BDREP)
Les émissions atmosphériques de naphtalène ont connu un pic en 2017 avec 21 943 kg émis au cours de l'année. Le nombre de déclarations (compris entre 28 et 38) et le nombre de déclarations avec un niveau de rejet supérieur au seuil (compris entre 18 et 30) évoluent de façon similaire : ils diminuent régulièrement depuis 2017. Le Tableau 10, ci-après, compile les dix secteurs d'activité les plus émetteurs de naphtalène dans l'atmosphère entre 2016 et 2020 selon les données issues de la base de données BDREP, ces données sont aussi illustrées par la Figure 8 ci-dessous. Ces secteurs d'activité sont dans l'ensemble cohérents vis à vis des secteurs d'utilisation du naphtalène identifiés précédemment (cf. paragraphe 1.10).
Tableau 10. Dix secteurs d'activité les plus émetteurs de naphtalène dans l'atmosphère entre 2016 et 2020 (Source : BDREP)
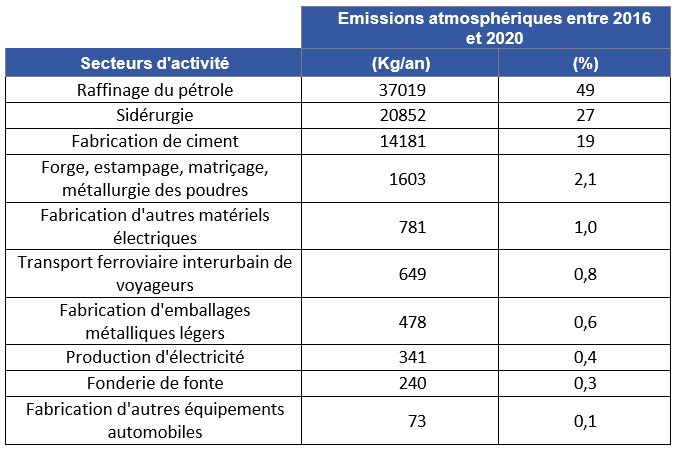
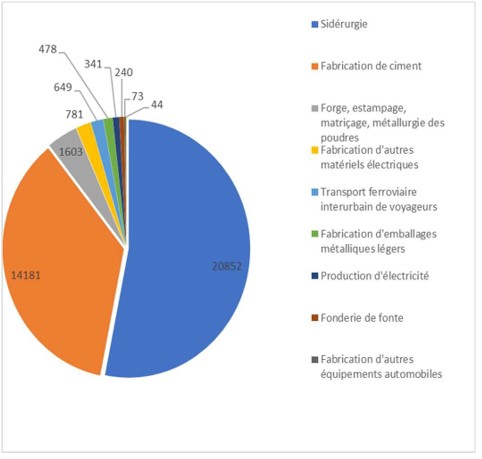
Figure 8. Répartition sectorielle des émissions atmosphériques de naphtalène entre 2016 et 2020 (Source : BDREP)
Le raffinage du pétrole et la sidérurgie représentaient entre 2016 et 2020 respectivement 49% et 27%, soit la moitié et un peu plus du quart des émissions atmosphériques de naphtalène.
La Figure 9 ci-après, illustre la répartition géographique des émissions atmosphériques de naphtalène déclarées entre 2016 et 2020 et consignées dans la base nationale BDREP.
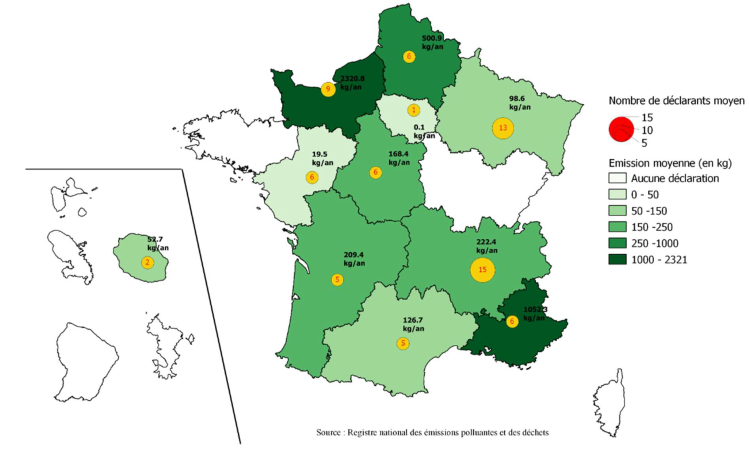
Figure 9. Répartition géographique des émissions atmosphériques moyennes de naphtalène déclarées en France entre 2016 et 2020
Selon les flux d'émission disponibles sur la base de données BDREP une raffinerie située en Normandie et un site de sidérurgie basé en région Provence-Alpes-Côte d'Azur représentent entre 2016 et 2020 respectivement près de la moitié (48%) et 16% des émissions atmosphériques de naphtalène.
Émissions vers les eaux
La base de données BDREP compte deux types de rejets vers les eaux : les émissions directes et les émissions indirectes. Pour les rejets industriels, un rejet direct est défini comme un rejet isolé dans le milieu naturel avec ou sans passage par une station de traitement propre au site industriel, alors qu'un rejet indirect est défini comme un rejet raccordé à une station d'épuration extérieure au site émetteur. L'évolution des rejets de naphtalène industriels totaux, directs et indirects vers les eaux est présentée dans le Tableau 11 et la Figure 10 ci-dessous.
Tableau 11. Evolution des émissions de naphtalène vers les eaux (Source : BDREP)
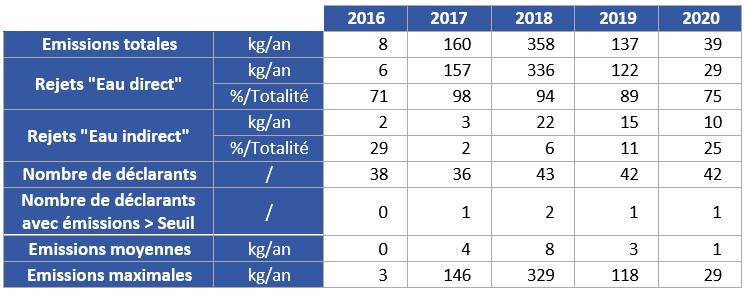
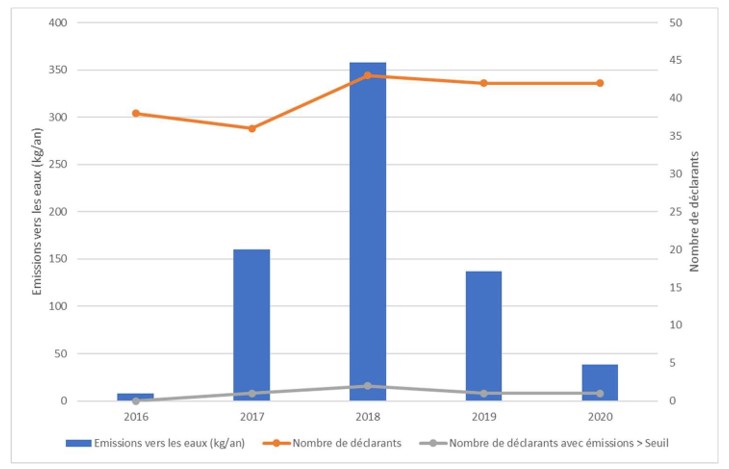
Figure 10. Evolution des émissions de naphtalène vers les eaux entre 2016 et 2020 (Source : BDREP)
Un site de raffinage de pétrole représente à lui-seul la quasi-totalité (entre 86 et 92%) des émissions31 de naphtalène dans les eaux entre 2017 et 2019, il s'agit de la même raffinerie que celle qui a été identifiée comme étant l'établissement le plus émetteur de naphtalène dans l'atmosphère entre 2016 et 2020. Exception faite de ce site, les émissions de naphtalène vers les eaux de 2016 à 2020 sont globalement stables et marginales au regard des émissions atmosphériques de cette substance pour la même période. Entre 2016 et 2020, les émissions « directes » représentent la majeure partie des effluents aqueux de naphtalène.
Le nombre total de déclarations (compris entre 36 et 43) et le nombre de déclarations avec un niveau de rejet supérieur au seuil (compris entre 0 et 2) évoluent de façon similaire, à savoir relativement stable depuis 2016. Le Tableau 12 et la Figure 6 ci-après, illustrent les dix secteurs d'activité les plus émetteurs de naphtalène vers les eaux entre 2016 et 2020 selon les données issues de la base de données BDREP.
Tableau 12. Dix secteurs d'activité les plus émetteurs de naphtalène vers les eaux entre 2016 et 2020 (Source : BDREP)
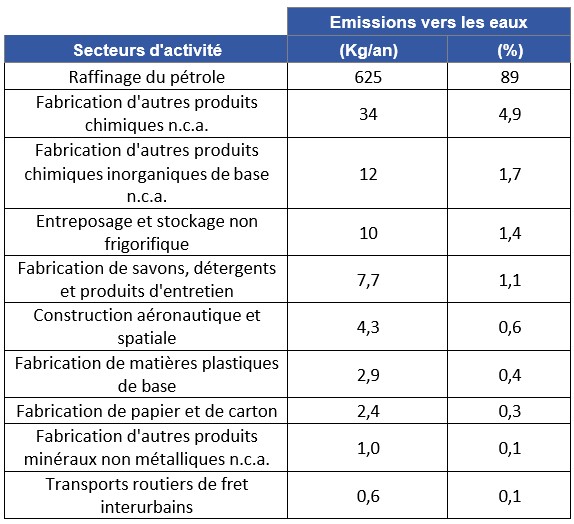
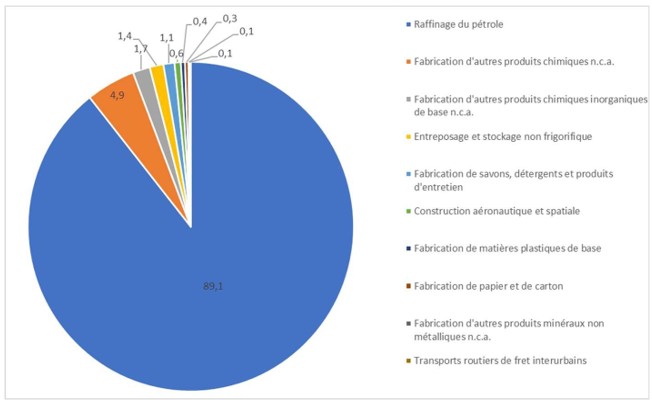
Figure 11. Répartition sectorielle des émissions de naphtalène vers les eaux entre 2016 et 2020 (Source : BDREP)
La Figure 12 et la Figure 13 représentent respectivement les répartitions géographiques des émissions moyennes des rejets directs et des rejets indirects de naphtalène vers les eaux entre 2016 et 2020.

Figure 12. Répartition géographique des émissions moyennes de naphtalène déclarées dans l'eau (rejet indirect) en France entre 2016 et 2020
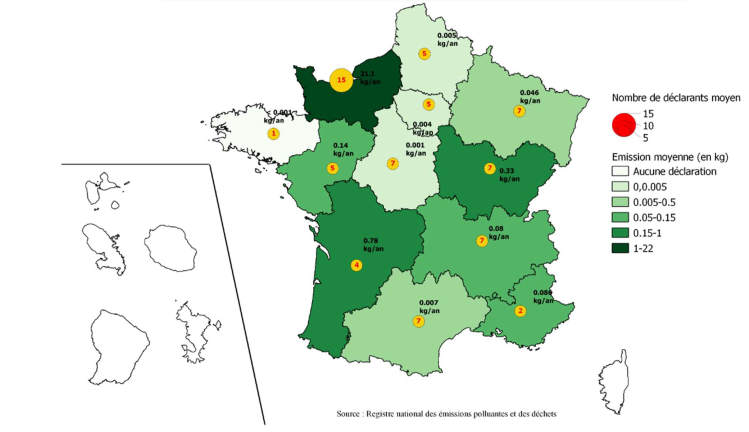
Figure 13. Répartition géographique des émissions moyennes de naphtalène déclarées dans l'eau (rejet direct) en France entre 2016 et 2020
Pour mémoire, entre 2017 et 2019, un seul établissement représentait entre 86 et 92% des rejets directs de naphtalène vers les eaux, il s'agit d'un site de raffinage situé en Normandie.
[31] Il s'agit de rejets « Eau direct »
Émissions vers les sols
Le registre français des émissions polluantes pour les installations soumises à déclaration (BDREP) répertorie d'infimes émissions de naphtalène vers les sols entre 2016 et 2020 (comprises entre 0,000044 et 0,62 kg.an-1).
Pollutions historiques et accidentelles
- Base InfoSols
La base de données InfoSols32 compile les données relatives aux risques de pollution des sols instruites dans deux bases de données : BASOL (base de données sur les sites et sols pollués ou potentiellement pollués) et SIS (Secteurs d'Information sur les Sols).
A la date de rédaction de cette fiche, 34 sites sont répertoriés dans cette base de données (période 1999-2019) pour une pollution (potentielle ou avérée) au naphtalène : 19 sites pour une pollution des eaux souterraines et 15 sites pour une pollution du sol (sur échantillons solides et gazeux).
Ces sites font l'objet d'instructions pour différents motifs :
- 21 sites sont soumis à une surveillance environnementale
- 12 sites pour la mise en œuvre d'une étude Sites et Sols Pollués (SSP) et ingénierie des travaux de réhabilitation
- 1 site pour l'exécution des travaux de réhabilitation
Les secteurs d'activité des sites concernés sont listés dans le Tableau 13 ci-dessous (notons que pour l'ensemble, ces secteurs sont en accord avec les utilisations identifiées dans le paragraphe 1.10).
Tableau 13. Secteurs d'activité des sites référencés dans la base Infosols pour une (potentielle) pollution au naphtalène
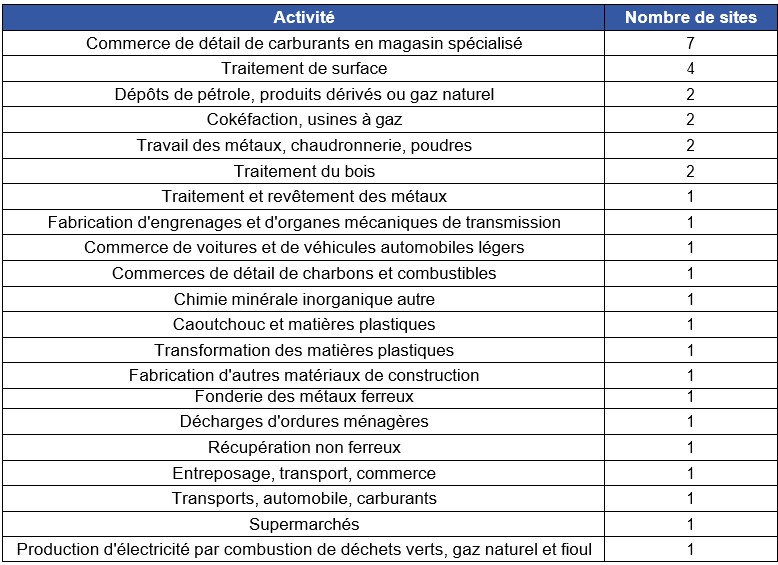
- Base de données ARIA
La base de données ARIA33 (Analyse, Recherche et Information sur les Accidents) répertorie les incidents et accidents (d'origine industrielle, liés au transport de matières dangereuses, etc.) qui ont porté ou auraient pu porter atteinte à la santé ou la sécurité publiques ou à l'environnement.
Depuis 1999, 4 accidents impliquant du naphtalène ont été déclarés sur la base de données ARIA :
- Un incendie dans une cokerie en cours de démantèlement (indice « Matières dangereuses relâchées » de grade 1)
- Un incendie dans un site de fabrication de produits chimiques organiques de base en cours de démantèlement (indice « Matières dangereuses relâchées » de grade 1)
- Une pollution aquatique provenant d'un site de dépôt de produits pétroliers suite au rejet de 30 m³ d'un mélange de produits de nettoyage, à base d'hydrocarbures aromatiques et de naphtalène (indice « matières dangereuses relâchées » de grade 1, indice « conséquences environnementales » de grade 1)
- Une pollution aquatique suite au déclenchement intempestif d'une pompe d'une station-service (indice « conséquences environnementales » de grade 1)
[32] https://monaiot.developpement-durable.gouv.fr/actualite/lancement-dinfosols
Présence environnementale
Atmosphère
Dans l'atmosphère
Il existe en France quatre sites de mesure du naphtalène dans l'air :
- Deux stations en Normandie, l'une en zone urbaine (Blainville) et l'autre en zone périurbaine (Alençon)
- Deux stations dans la région Auvergne-Rhône-Alpes (Lyon et Vénissieux) localisées en zones urbaines
De nombreuses mesures d'une durée de 24h ont été effectuées sur ces sites entre 2013 et 2014 par les associations de surveillance de la qualité de l'air Atmo Normandie et Atmo Auvergne-Rhône-Alpes (cf. Tableau 14). Les résultats de ces mesures sont compilés dans la base nationale de données de qualité de l'air GEOD'AIR38 .
Tableau 14. Données de mesures de concentration atmosphérique du naphtalène (Source : GEOD'AIR)
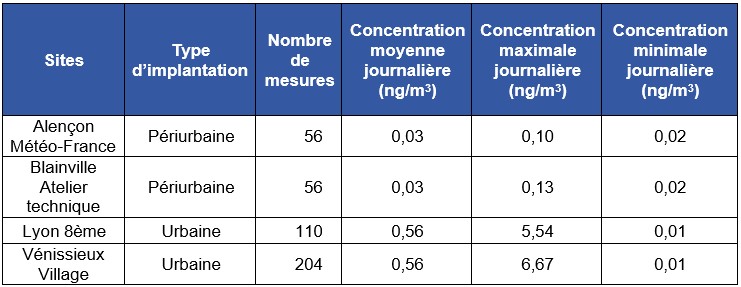
Sur la période 2013-2014, quel que soit le site, les concentrations minimales de naphtalène sont équivalentes, à savoir de l'ordre de 0,01-0,02 ng.m-3 . Néanmoins, pour la même période, des écarts sont constatés selon que la mesure s'effectue en milieu périurbain ou urbain avec des concentrations moyennes respectives de 0,03 et 0,56 ng.m-3 . Il en est de même pour les concentrations maximales : en milieu urbain, la concentration maximale de naphtalène peut atteindre 6,67 ng.m-3 contre 0,13 ng.m-3 en milieu périurbain. Cet écart pourrait être dû au trafic routier qui représente une source d'émission de naphtalène (cf. paragraphe 1.8).
Dans l'air intérieur
La présence de naphtalène dans l'air intérieur résulte principalement du transfert de la pollution atmosphérique extérieure et de combustions incomplètes (en particulier de celles du chauffage domestique au bois). Dans une moindre mesure, le tabagisme ainsi que certains produits de bricolage (diluants, solvants...) peuvent également représenter des sources potentielles de naphtalène de l'air intérieur (ANSES 2009, HCSP 2012).
Une étude menée par l'Ineris en 2008 relative à l'évaluation de l'impact des appareils de chauffage domestique à bois sur la qualité de l'air intérieur et extérieur mentionne des concentrations maximales de naphtalène de 665 ng.m-3 dans le salon de la maison équipée d'un poêle récent fonctionnant en marche nominale et de 1 512 ng.m-3 dans la chambre de la maison avec le foyer ouvert (INERIS 2018).
Aquatique
Les paragraphes ci-après présentent des valeurs de NQE et PNEC en vigueur à la date de la rédaction de cette rubrique.
Dans le milieu aquatique de surface
La base de données Naïades34 recense, entre 2018 et 2020, 40 065 analyses de naphtalène dans des eaux. Parmi ces mesures, 4273 (soit 11%) présentent des concentrations de naphtalène supérieures à la limite de quantification comprise entre 0,001 et 0,125 µg/L et quatre échantillons présentent des concentrations de naphtalène supérieures aux NQE35 et PNEC36 de cette substance (évaluées toutes deux à 2µg/L en 2013). Les concentrations de naphtalène médiane, du 75ème percentile, du 95ème percentile et maximale s’élèvent respectivement à 0,0076 µg/L, 0,011 µg/L, 0,03 µg/L et 73,84 µg/L (le site générant la plus forte teneur en naphtalène est un cours d’eau de la région Centre Val de Loire).
Entre 2018 et 2020, d’après la base de données Naïades, 907 analyses de naphtalène sont recensées sur matrice sédiment. Parmi celles-ci, 409 mesures (soit 45%) présentent des concentrations de naphtalène supérieures à la limite de quantification comprise entre 1 et 170 µg/kg et les concentrations en naphtalène de 84 mesures (soit 9%) sont supérieures à la PNEC (évaluée à 53 µg/kg). La concentration médiane s’élève à 15 µg/kg, celle du 75ème percentile à 42 µg/kg et celle du 95ème percentile à 230 µg/kg. La concentration maximale s’élève à 3 900 µg/kg et correspond à un prélèvement de sédiments effectué en Bretagne. Le naphtalène a été quantifié dans 52 échantillons de matières en suspension entre 2018 et 2020, avec 58% des mesures (soit 30 analyses) supérieures à la limite de quantification de 10 µg/kg. Les concentrations médiane, du 75ème percentile et du 95ème percentile s’élèvent respectivement à 18 ; 54 et 157 µg/kg. La concentration maximale de naphtalène dans des matières en suspension (de 388 µg/kg) a été mesurée dans un échantillon prélevé en région Nouvelle Aquitaine.
Dans les eaux souterraines
D’après la base de données ADES37, entre 2018 et 2020, 13 289 analyses de naphtalène sur des eaux souterraines ont été effectuées pour 2 296 points de mesure. Parmi celles-ci, 1 140 mesures (soit 1%) présentent des concentrations supérieures à la limite de quantification comprise entre 0,001 et 0,5 µg/L. La concentration médiane s’élève à 0,007 µg/L/ La valeur du 75ème percentile est 0,014 µg/L et la valeur du 95ème percentile est 0,094 µg/L. La concentration maximale s’élève à 2 100 µg/L et correspond à un prélèvement effectué dans une commune de Nouvelle Aquitaine.
[34] http://naiades.eaufrance.fr/
[35] Norme de Qualité Environnementale
[36] Predicted No Effect Concentration
[37] https://ades.eaufrance.fr/
Perspectives de réduction
Réduction des rejets
Sources non-intentionnelles
Combustion du bois en foyers domestiques
Un certain nombre de technologies permettent de réduire les émissions de naphtalène :
- les appareils à combustion catalytique ;
- les appareils à combustion avancée (non catalytique) ;
- les poêles de masse, ceux-ci sont conçus pour emmagasiner l’énergie produite lors de la combustion et pour restituer lentement la chaleur dans la pièce à chauffer, jusqu’à 24 h après la fin de la combustion
- les poêles à granulés ;
- les chaudières domestiques : quelles que soient les chaudières (à granulés, à bûches ou à plaquettes), ces installations se caractérisent par de meilleures performances énergétiques et environnementales que les appareils précédents.
Le mode d’allumage du feu de cheminée par le haut permettrait de réduire les émissions polluantes lors des allumages à froid (cf. Figure 14).

Trafic routier
Dans le cadre de la politique de réduction des émissions de gaz à effet de serre, des dispositions devraient être mises en place pour favoriser la mise sur le marché des véhicules fonctionnant à l’électricité ou à d’autres énergies alternatives (hydrogène…) qui ne sont donc pas émettrices de naphtalène)39
[39] https://www.ecologie.gouv.fr/developper-lautomobile-propre-et-voitures-electriques
Réduction des émissions de naphtalène
Enrobés routiers
Les principaux moyens de réduction des émissions de naphtalène lors de la pose d'enrobés routiers est la baisse des températures de mise en œuvre du bitume (utilisation d'enrobés ou d'asphalte tièdes) ou l'emploi de finisseurs (engins mobiles destinés à appliquer les enrobés bitumineux sur les chaussées) équipés de système de captage des fumées (INRS 2021).
Les enrobés coulés à froid sont mis en œuvre à de faibles températures (60°C) en utilisant le bitume sous forme d'émulsion. Dans ce cas, les émissions de fumées sont quasiment nulles. Les enrobés à froid sont apparus en France au début des années 80. Leur usage se limite majoritairement à l'entretien des voieries, leur utilisation en travaux neufs est possible mais reste rare (substitution-cmr.fr 2019).
Une question se pose quant au devenir du naphtalène non-émis dans l'atmosphère, celle de savoir s'il demeure dans la matrice bitumeuse ou est lessivé par les eaux de pluie et donc émis vers le compartiment eau.
Plastifiants pour caoutchouc
Pour mémoire, le naphtalène est présent dans les huiles aromatiques plastifiantes pour caoutchouc (cf. paragraphe 1.10.2).
Pour respecter la règlementation REACH portant sur la teneur en HAP classés cancérigènes dans les caoutchoucs (cf. paragraphe 1.3.1.1), des plastifiants à faibles teneurs en HAP ont été développés (INRS 2009, CONCAWE 2013) :
- Les plastifiants paraffiniques non étiquetables (des huiles minérales raffinées : TDAE ou Treated Distillate Aromatic Extract et MES ou Mild Extract Solvates)
- Les plastifiants aromatiques non étiquetables, il s'agit d'extraits aromatiques sévèrement raffinés (RAE ou Residual Aromatics Extracts)
A ce jour, nous ne savons pas si ces produits non classés contiennent moins ou plus de napthalène que les produits interdits.
Alternatives aux usages
Créosote
La réduction des émissions de naphtalène provenant de la créosote peut s'opérer par une substitution de matériau de base, par exemple, les poteaux en bois sont progressivement remplacés par des alternatives métalliques.
Substitution chimique
L'Ineris a étudié en 2021 la possibilité de substitution des substances employées dans les produits de traitement du bois dont la créosote fait partie (INERIS 2021).
Si des solutions « sans créosote » ne vérifiant pas des critères d'exclusion ou de substitution40 existent, elles sont aujourd'hui marginales, ne concernent qu'une partie des usages de la créosote (aucune alternative ne couvre la classe d'emploi 541 et certaines applications telles que les traverses de chemin de fer posent problème), et sont proposées par un nombre réduit d'acteurs. A titre d'exemple, citons les alternatives suivantes :
- l'Alkyl (C12-16) dimethylbenzyl ammonium chloride (ADBAC/BKC (C12-16) (n°CAS 68424-85-1)
- le Bardap 26 (n°CAS 94667-33-1)
- le Didecyldimethylammonium chloride (DDAC) (n°CAS 7173-51-5)
[40] Les critères d'exclusion et de substitution sont définis par le Règlement (UE) n° 528/2012. La substitution d'une substance active peut être envisagée si celle-ci répond à un des critères de substitution et sauf dérogation, une substance active biocide ne peut être approuvée si elle remplit l'un des critères d'exclusion
[41] Situation dans laquelle le bois ou le matériau à base de bois est immergé dans l'eau salée (eau de mer ou eau saumâtre) de manière régulière ou permanente
Procédés alternatifs
Le traitement haute température (THT)
Le traitement haute température (THT) est un procédé de modification physique du bois. Il consiste à le chauffer à très haute température (200 à 270 degrés) dans un four sous atmosphère inerte avec de
l'azote (on parle alors de bois rétifié), ou avec des injections de vapeur d'eau (bois thermo-traité finlandais).
Le THT comporte différentes actions :
- Il stérilise le bois et élimine ainsi les micro-organismes
- Il freine la progression des moisissures en les privant de l'humidité nécessaire à leur croissance et rend le bois résistant aux attaques fongiques grâce à la disparition de leurs éléments nutritifs et à l'apparition de goudrons durant le procédé
- Il réduit les émissions de terpènes (composés attractifs pour les insectes)
Ce procédé présente l'avantage d'être déjà développé industriellement42 et de valoriser des essences aux débouchés généralement restreints tels que le frêne, le hêtre, le peuplier, tout en restant adapté au traitement des résineux.
Néanmoins, son champ d'action n'est pas aussi large que celui de la créosote : il n'a prouvé son efficacité que jusqu'à la classe d'emploi 3 (pour mémoire, les bois traités avec la créosote sont de classe d'emploi 5).
De plus, il présente des limites connues :
- Si le bois traité bénéficie d'une stabilité dimensionnelle accrue et gagne en dureté, il devient plus cassant, ce qui l'exclut pour un emploi en tant qu'élément de structure. Il est en revanche adapté à des emplois non porteurs en extérieur tels que terrasses et bardages, ou en intérieur pour des parquets et menuiseries.
- En l'état actuel de son développement cette technologie est généralement plus coûteuse que les procédés de préservation chimique (coût d'investissement, temps de mobilisation des installations).
- Le procédé peut générer des huiles ou goudron dont il faudrait étudier l'impact écologique.
- Il ne présente pas de garantie contre les attaques des termites contrairement à la créosote
Oléothermie ou thermo-huilage
Le principe de l'oléothermie est le remplacement de l'eau présente dans le bois par de l'huile sur une profondeur de 2 à 3 mm environ. Pour cela, le bois est immergé pendant 1 à 4 heures dans une cuve contenant un mélange d'huiles d'origine végétale chauffé à des températures comprises entre 60 et 150°C.
Le remplacement de l'eau initialement présente et les propriétés hydrophobes que lui confèrent l'huile rendent le bois moins sensible aux champignons lignivores (dont le développement nécessite de l'eau) et aux insectes que l'eau attire.
En revanche le thermo-huilage n'est pas considéré comme un traitement insecticide (larves xylophages et termites) selon la norme NF B 50-105-343 , contrairement à la créosote. De plus l'oléothermie présente quelques inconvénients :
- le thermo-huilage ne permet aucune application de finition sur le bois ;
- l'aspect du bois thermo-huilé peut être altéré par des salissures (les particules de l'air ont tendance à s'accrocher au surplus d'huile et à créer une fine pellicule noire).
Le bois modifié chimiquement
Il existe sur le marché européen deux procédés modifiant le bois chimiquement : la furfurylation (procédé Kebony) et l'acétylation (procédé Accoya). Les procédés consistent à injecter respectivement de l'acide furfurylique (substance obtenue à partir des déchets issus de productions végétales) et de
l'anhydride acétique (un dérivé du vinaigre) dans le bois pour le rendre partiellement hydrophobe et moins comestible aux agents pathogènes biologiques. A ce jour, les fabricants utilisent du pin sylvestre pour le procédé Kebony et du pin radiata44 pour le procédé Accoya, des essais seraient en cours avec des feuillus (Hêtre et Érable).
Selon leur fabricant, les bois acétylés peuvent être exposés à des situations correspondant à la classe d'emploi 3 (fenêtres et portes, lames de terrasse, bardage). Ils semblent par ailleurs peu susceptibles d'être attaqués par les insectes à larve xylophage et les termites.
Les bois traités avec le procédé Kebony sont, d'après leur fabricant, destinés à des applications de classe d'emploi 2 (charpentes), et 3 (fenêtres et portes, lames de terrasse, bardage, lames de pont de bateaux).
Quel que soit le type de traitement, ni l'un ni l'autre ne parvient à atteindre les performances de préservation du bois de la créosote.
De surcroît, l'emploi des bois chimiquement modifiés comporte deux inconvénients :
- Les substances injectées et qui n'ont pas réagi (acide furfurylique et anhydride acétique) peuvent réagir avec les finitions et la quincaillerie
- Le surcoût
Notons que les traitements sont la propriété de deux acteurs qui s'adressent à des marchés de niche et ne pourraient prétendre à un développement immédiat et général puisqu'ils portent sur des essences particulières.
[42] Entre une et deux dizaines de scieries seraient équipées en France selon les informations obtenues au cours de nos entretiens. Des acteurs importants sont par ailleurs présents en Scandinavie.
[43] Durabilité du bois et des matériaux dérivés du bois - Bois et matériaux à base de bois traités avec un produit de préservation préventif - Partie 3 : spécifications de préservation des bois et matériaux à base de bois et attestation de traitement - Adaptation à la France Métropolitaine et aux DOM
[44] Aussi appelé pin de Monterey, commun en Amérique du Nord et présent en Bretagne et dans le sud-ouest de la France
Production d'anhydride phtalique
Si l'anhydride phtalique est toujours produit par l'oxydation catalytique du naphtalène au contact d'oxyde de vanadium (V2O5), il semblerait que la méthode la plus courante de production de cette substance serait l'oxydation de l'o-xylène (soit en phase gazeuse au contact d'oxyde de vanadium, soit en phase liquide en présence de sels solubles de cobalt, manganèse ou molybdène) (INERIS 2006, West Virginia University, Société chimique de France 2011).
Superplastifiants
Polycarboxylates
Les superplastifiants polycarboxylates (PCE) sont devenus progressivement des alternatives au naphtalène sulfonate de sodium formaldéhyde.
Les sels sulfonés de polycondensés de naphtalène et de formaldéhyde sont des polymères linéaires, tandis que les PCE sont des copolymères possédant une structure en peigne, c'est-à-dire un squelette carboné classique à partir duquel s'étendent des chaînes latérales (Gang Chen J.L. et al., 2017). Les chaînes latérales des polycarboxylates garantissent une forte répulsion stérique entre les particules de ciment pour empêcher leur agglomération.
La structure chimique des polycarboxylates (cf. Figure 15) permet un plus grand degré de modification chimique, ce qui offre la possibilité d'adapter le mélange aux besoins de l'application et de développer des bétons autoplaçants très performants, capables d'épouser la forme de coffrages complexes.

Figure 15. Structure chimique des superplastifiants polycarboxylates
Lignosulfonates
Les lignosulfonates d'ammonium, de calcium, de sodium (cf. Figure 16) sont des superplastifiants extraits de la pulpe de bois dont le mode d'action repose principalement sur la création d'une force de répulsion électrostatique entre les particules minérales (Société chimique de France 2011, Tramaux 2018).
Moins efficaces que les superplastifiants de dernière génération (polycarboxylates…) les lignosulfonates continuent à être utilisés de nos jours car ils sont biosourcés et relativement peu onéreux. Leurs faibles performances s'expliquent en partie par le fait que leur composition et leurs masses molaires sont extrêmement variables ; en effet, la composition chimique varie en fonction du végétal considéré, de son âge, de son milieu de culture, du procédé de fractionnement de la matière végétale employé, etc.
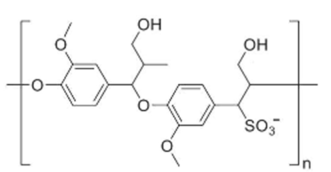
Figure 16. Structure chimique des superplastifiants lignosulfates
Polymélamines sulfonates
Les polymélamines sulfonates (cf. Figure 17) sont synthétisées après sulfonation de la mélamine et condensation en présence de formaldéhyde. Leur structure macromoléculaire est très similaire à celle des sels sulfonés de polycondensés de naphtalène et de formaldéhyde : il s'agit d'un enchaînement de groupements mélamine avec des fonctions sulfonates.
Bien que très comparables aux sels sulfonés de polycondensés de naphtalène et de formaldéhyde, les polymélamines sulfonates présentent l'avantage de retarder très peu la prise du ciment.

Figure 17. Structure chimique des polymélamines sulfonates
Alternatives au béton
L'éditeur Techniques de l'Ingénieur a identifié trois alternatives durables au béton (Techniques de l'ingénieur, 2021) :
- Le béton de chanvre, développé en France depuis les années 1990, ce matériau s'obtient en mélangeant des particules de chanvre (la chèvenotte) avec un liant, de l'eau et des adjuvants
- Les matériaux fibres-ciment, ces matériaux composites sont fabriqués à partir de ciment, d'eau, de fibres et de charges minérales (notamment en cellulose). Couramment utilisé pour la fabrication de plaques de toitures ondulées, le fibre-ciment est aussi de plus en plus employé pour la conception de matériaux de façade et de lames de bardage
- Le béton d'argile, mélangé avec un gravier, ce matériau permet de réaliser des dalles, des chapes et, après mise en forme par coffrage et par compression, des façades porteuses
Toutefois, avant de mettre un matériau alternatif, il conviendrait de vérifier qu'il n'emploie pas d'additifs qui seraient également problématiques pour l'environnement.
Tensioactifs
Pour la formulation de cosmétiques et de produits de soins du corps, des tensioactifs peuvent se substituer aux sulfonates de naphtalène, citons :
- d'autres tensioactifs anioniques (sels d'acide carboxylique, lipoaminoacides, lipo-oligopeptides et dérivés sulfatés), par ex le Sodium coco sulfate (SCS), le Sodium cocoyl isethionate (SCI), l'huile de Ricin sulfatée (Sulfated castor oil), le Sodium lauryl sulfoacetate (SLSA) et le Sodium Lauroyl Sarcosinate
- les tensioactifs amphotères (bétaïnes, dérivés d'acides aminés et d'imidazole), par ex. le Cocamidopropyl Betaïn et la mousse de Babassu (Babassuamidopropyl betaïne)
- les tensioactifs non ioniques (polyoxyéthylènes, alcanolamides, oligopeptides), par ex. le Decyl glucoside, le Cetyl alcohol, les glutamates, le Lauryl glucoside et le Coco glucoside
Colorants azoïques
De nombreuses alternatives aux colorants azoïques dérivés du naphtalène existent (colorants azoïques dont la base est exempte de naphtalène, colorants anthraquinoniques, colorants au triphénylméthane, colorants réactifs…).
Dans le secteur textile, sous l'impulsion de grandes marques de prêt-à-porter, des ennoblisseurs textiles orientent leur stratégie d'innovation vers l'utilisation des colorants naturels pour la teinture et l'impression de différents textiles, les couleurs sont obtenues à partir de végétaux (coréopsis, garance, cosmos, genêt, châtaignier, feuilles de palmier et de mûrier, d'écorces de grenade, d'écorces d'agrumes), de coléoptères, d'excréments de vers à soie… (IFTH 2017).
La voie bactérienne est en cours d'exploitation, à titre d'exemple, l'entreprise française PILI BIOTECH développe la synthèse enzymatique de colorants et pigments pour textiles, encres, polymères, peintures et revêtements à partir de bactéries (Pili 2021).
Abrasifs
- La société Saint Gobain a mis sur le marché des meules abrasives dont la production de nécessite pas d'inducteur de pores chimique, donc pas de naphtalène. Pour supprimer le naphtalène de leur procédé de fabrication, ces produits bénéficient de l'association du grain breveté Norton Quantum de la structure perméable du Vortex 2 et la technologie de l'agglomérant Vitrium3 . D'après la société Saint Gobain, à prix équivalent, ces produits seraient plus performants que leurs homologues produits grâce au naphtalène (Saint Gobain 2021).
- Des options permettant de remplacer le naphtalène par d'autres substances ont également été envisagées, il s'agit notamment (ECHA 2018) :
- l'acide oxalique
- le 1,4-dichlorobenzène (n° CAS 106-46-7)
- des billes creuses d'alumine avec des sphères de verre
- le carbamate de butyle
- des inducteurs de pores d'origine végétale (noix et coquilles de noix broyées, copeaux de bois, riz et noyaux d'olive)
Des obstacles liés à la qualité du produit et à des problèmes de sécurité pour certains produits ont été constatés avec ces alternatives.
Carburants
Le naphtalène peut être remplacé par des acides gras de tallol, composés avec des polyalkylènepolyamines (n°CAS 68911-35-3) pour la formulation d'additifs lubrifiants, détergents, dispersants, anticorrosion et antioxydant pour carburants qui permettent notamment de protéger et nettoyer différentes pièces du véhicule (réservoir, circuit carburant et les injecteurs) (substitution-cmr.fr 2019).
Tir sur cibles d'argile
Des alternatives au bitume des cibles existent, mais il semblerait qu'elles ne soient encore que rarement utilisées, citons (OFEV 2015) :
- des résines colophanes modifiées peuvent des substituer au bitume
- des sous-produits résultant du traitement du bois et de la fabrication de produits alimentaires servent de liant et remplacent le bitume au sein de disques en argile (« Eco résines » Green Clay)
Quelques indices donnent à penser que d'autres polluants issus des liants alternatifs des disques pourraient être libérés. Des cibles composées d'éco-résine ou de colophane peuvent être sensibles aux températures basses ou élevées : elles peuvent par exemple être collantes et déformées à une température élevée ou devenir plus dur à une température basse (ECHA 2021).
Il existe aussi sur le marché des disques à base de goudron de houille ou de brai de pétrole présentant de moindres teneurs en HAP (30 à 70 mg de HAP/kg), toutefois ces derniers présentent quelques problèmes pour les exercices de tir : certains se déforment en vol, d'autres gonflent en présence d'humidité et sont difficiles à ramasser (OFEV 2015).
Des tests comparatifs ont mis en évidence des propriétés de résistance et de rupture identiques pour l'ensemble de ces alternatives en comparaison des cibles d'argile conventionnelles (ECHA 2021).
Conclusion
Le naphtalène appartient à la famille des hydrocarbures aromatiques polycycliques, il intervient soit dans la synthèse de nombreuses substances chimiques utilisées dans divers secteurs d'activités soit en tant que composant de mélanges de HAP employés plusieurs secteurs (travaux publics, préservation du bois…).
Cette substance est émise par différents types de sources : industrielles (raffineries de pétrole…), combustions naturelles (feux de forêts), anthropiques (trafic routier, chauffage domestique au bois) ou liée à l'utilisation du carburant diesel (émissions diffuses, fuites accidentelles…).
Au titre de la Directive Cadre sur l'Eau et des objectifs de réduction, la note technique du 29 septembre 2020 relative aux objectifs nationaux et à leur déclinaison dans les SDAGE 2022-2027 prévoit pour le naphtalène une réduction ambitieuse de 30% d'ici 2027 (INERIS 2018).
Pour atteindre cet objectif, une des solutions résiderait dans la substitution du naphtalène, envisageable pour bon nombre de ses utilisations :
- la synthèse de l'anhydride phtalique peut s'effectuer à partir d'o-xylène ;
- les polycarbonates, les lignosulfonates et les polymélamines sulfonates sont des superplastifiants en mesure de remplacer le naphtalène ;
- des tensioactifs anioniques, amphotères et non-ioniques disponibles sur le marché représentent de bonnes alternatives au naphtalène dans les cosmétiques et soins du corps…
Néanmoins, il subsiste quelques applications où la substitution du naphtalène est difficilement applicable, c'est notamment le cas de la substitution de la créosote pour la préservation des traverses de chemin de fer.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










