Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
2,4,6-trichlorophénol (88-06-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
88-06-2
Nom scientifique (FR)
2,4,6-trichlorophénol
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
201-795-9
Code SANDRE
1549
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C6H3Cl3O }\)
Code InChlKey
Code SMILES
Oc(c(cc(c1)Cl)Cl)c1Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H302 |
|---|---|
| Mention du danger - Texte | Nocif en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Mention du danger - Code | H319 |
|---|---|
| Mention du danger - Texte | Provoque une sévère irritation des yeux |
| Classe(s) de dangers | Lésions oculaires graves/irritation oculaire |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Analyse
Eau
Prélèvement
Analyse
Sol
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
197.45 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Compte tenu de ses caractéristiques physico-chimiques, le 2,4,6-trichlorophénol est uniquement sous forme vapeur lorsqu'il est présent dans l'atmosphère. Dans ce compartiment, il est principalement dégradé en réagissant avec les radicaux hydroxyles formés par réactions photochimiques. La demi-vie via ce processus de dégradation est estimée à 26 jours.
Milieu eau douce
FDTE/VTR Importer Dans l'eau, le 2,4,6-trichlorophénol possède les caractéristiques physico-chimiques requises pour s'adsorber à la phase particulaire. Le 2,4,6-trichlorophénol se volatilise lentement à partir de l'eau de surface. Pour la forme anionique, le phénomène est encore moins significatif.
Milieu terrestre
FDTE/VTR Importer La mobilité du 2,4,6-trichlorophénol dans les sols est faible. Sous forme anionique, la mobilité est plus intense. Le 2,4,6-trichlorophénol sera entraîné significativement vers les eaux souterraines uniquement en présence de sols sableux et de sols n'étant pas le siège d'une biodégradation rapide. Compte tenu de sa constante de Henry, la volatilisation du 2,4,6-trichlorophénol dans les sols humides n'est pas un processus significatif.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
FDTE/VTR Importer Le 2,4,6-trichlorophénol se dégrade sous l’effet des rayons ultraviolets avec une demi-vie de 17 heures (Freitag et al., 1982). Aucune information n’est disponible sur l’hydrolyse.
Milieu eau douce
FDTE/VTR Importer Le 2,4,6-trichlorophénol est facilement biodégradable : en 7 jours, 100 % de la substance ont été dégradés lors d’un essai DBO en présence de microorganismes issus de stations d’épuration (Tabak et al., 1981).
Milieu sédiment eau douce
FDTE/VTR Importer Plusieurs études ont montré que la substance ne se dégrade pas en milieu anaérobie (Baker et Mayfield, 1980 ; OMS IPCS, 1989).
Milieu terrestre
FDTE/VTR Importer En 3 jours, 95 % de la substance ont été dégradés (concentration initiale : 100 µg.g-1 de sol humide) en présence de microorganismes issus d’un sol de type limono-argileuse (Baker et Mayfield, 1980).
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Aucune étude valide n'existe sur des organismes isolés.
Une étude en microcosme (pH neutre, température 20 +/-2 °C) a été effectuée pendant 56 jours. Un apport en 2,4,6-trichlorophénol à une concentration de 0,5 µg.L-1 a été réalisé par un système en continu. Au bout de 35 jours, la substance n’était plus détectable. Une dégradation microbienne est suspectée d’être à l’origine de cette disparition.
Les BCF suivants ont pu être calculés au bout du 36e jour (Virtanen et Hattula, 1982).
Le BCF calculé à partir du Kow et d’une relation (Q)SAR telle que proposée par la Commission Européenne (CE, 1996) est de 273.
Le 2,4,6- trichlorophénol est donc une substance susceptible de se bio accumuler.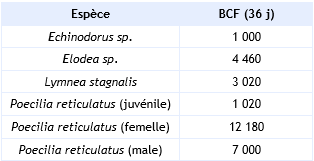
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucun résultat d'essai valide n'a pu être trouvé dans la littérature.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1999 ; HSDB, 2003 ; IARC, 1979, 1999 ; US EPA (IRIS), 1994). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer La population générale est exposée par les voies respiratoire, digestive et cutanée au 2,4,6 trichlorophénol présent dans l’air intérieur, les aliments et l’eau de boisson. Le 2,4,6 trichlorophénol est absorbé par la peau (pour de faibles concentrations), les poumons et le tractus gastro-intestinal (Ambre, 1990 ; Pekari et al., 1991 ; Roberts et al., 1977).
Distribution
FDTE/VTR Importer Le 2,4,6-trichlorophénol se distribue essentiellement dans les reins, mais aussi dans une moindre mesure au niveau du foie, des muscles, du tissu adipeux et du cerveau. Dans le sang, il est fortement lié aux protéines plasmatiques (94%), notamment avec l’albumine (Judis, 1982).
Métabolisme
FDTE/VTR Importer Le 2,4,6-trichlorophénol est principalement métabolisé par isomérisation (notamment en 2,4,6-TCP et 2,3,6-TCP) et par conjugaison avec l’acide glucuronique (Bahig et al., 1981). De manière générale, les études portant sur le métabolisme et la cinétique d'absorption du 2,4,6-trichlorophénol sont très mal documentées.
Élimination
FDTE/VTR Importer Aucune donnée n’est disponible chez l’homme.
Chez l'animal
Absorption
FDTE/VTR Importer Le 2,4,6-trichlorophénol est facilement absorbé par voie orale et par contact cutané (ATSDR, 1999). Aucune donnée n’est disponible pour une exposition par inhalation.
Distribution
FDTE/VTR Importer Le 2,4,6-trichlorophénol se distribue essentiellement au niveau du foie et des reins et, à un degré moindre, dans le cerveau, les muscles et les tissus adipeux. Les demi-vies du 2,4,6 trichlorophénol conjugué sont comprises entre 1,4 et 1,8 heures (Pekari et al., 1986). Après 30 minutes d’exposition par contact oculaire chez des lapins, 4 % du 2,4,6 trichlorophénol est retrouvé au niveau de la cornée, 2,14 % au niveau de la conjonctive, et moins de 2 % au niveau de l’humeur aqueuse, de la choroïde, de l’iris, de la limbe et de la sclérotique (Ismail et al., 1977).
Métabolisme
FDTE/VTR Importer Le 2,4,6-trichlorophénol subit généralement une isomérisation en d’autres trichlorophénols (2,3,6 trichlorophénol, 2,4,5-trichlorophénol) et une conjugaison avec l’acide glucuronique. Chez des rats, 63 % de la dose administrée par voie orale est éliminée dans les urines sous forme d’isomères (2,4,6-trichlorophénol, 2,3,6 trichlorophénol, 2,4,5-trichlorophénol) et 28 % sous forme conjuguée (dont 80 % à l’acide glucuronique) (Bahig et al., 1981). Pour une application cutanée, aucune métabolisation n’est observée. Il semblerait alors que l’absorption par voie cutanée de 2,4,6-trichlorophénol soit plus toxique qu’une ingestion à une dose similaire en raison de l’absence de conversion partielle en conjugués (Huq et al., 1986).
Élimination
FDTE/VTR Importer La cinétique d’élimination du 2,4,6-trichlorophénol a été étudiée à partir de l’administration quotidienne par tubage gastrique d’une dose de 1 ppm de 2,4,6 trichlorophénol radiomarqué pendant 15 jours à 6 rats (Bahig et al., 1981). Au total, trois jours après l’exposition, 92,5 % de la dose administrée a été détectée dans les urines et 6,4 % sous forme inchangée dans les fèces. Après l’arrêt du traitement, le taux d’excrétion diminue progressivement pour atteindre après 72 heures des niveaux de 4,3 % dans les urines et 1,9 % dans les fèces. La demi-vie dans l’organisme du 2,4,6-trichlorophénol est de 18 heures. Le 2,4,6-trichlorophénol est éliminé à l’état libre et sous forme de composés conjugués.
Autre
FDTE/VTR Importer Mécanisme d’action :
Le 2,4,6-trichlorophénol comme les autres chlorophénols agit sur le découplage de la phosphorylation oxydative au niveau de la membrane mitochondriale et empêche à terme la croissance des cellules (White-Stevens, 1971).
Synthèse
FDTE/VTR Importer Chez l’homme,
Le 2,4,6-trichlorophénol est rapidement absorbé par la peau (pour de faibles concentrations), les poumons et le tractus gastro-intestinal. Il se distribue essentiellement dans les reins et dans une moindre mesure au niveau du foie, des muscles, du tissu adipeux et du cerveau. Dans le sang, le pourcentage de liaison à l’albumine est de 94,1 %. Le 2,4,6 trichlorophénol est principalement métabolisé par isomérisation et par conjugaison avec l’acide glucuronique. Aucune donnée concernant l’élimination chez l’homme n’est disponible.
Chez l’animal
Les données confirment celles chez l’homme. Pour une exposition à une dose similaire, il semblerait que le 2,4,6-trichlorophénol soit plus toxique par voie cutanée que par ingestion en raison de l’absence de métabolisation au niveau de la peau. Le 2,4,6 trichlorophénol est principalement éliminé par les urines (92,5 % de la dose ingérée dont 63 % sous forme d’isomères et 28 % sous forme conjuguée) et par les fèces (6,4 %).
Toxicité aiguë
Chez l'homme
Synthèse
FDTE/VTR Importer Chez l’homme, aucune donnée concernant la toxicité aiguë n’est disponible.
Chez l'animal
Inhalation
FDTE/VTR Importer Il n’existe aucune étude de toxicité aiguë par inhalation.
Voie orale
FDTE/VTR Importer La seule étude de toxicité aiguë par voie orale chez le rat n’observe aucun effet toxique du 2,4,6-trichlorophénol à la concentration de 400 mg.kg-1.j-1 administrée pendant 15 jours (Carlson, 1978). En particulier, tous les marqueurs d’hépatotoxicité étudiés (sorbitol déshydrogénase, glucose-6-phosphatase, cytochrome-C réductase) sont restés stables chez les animaux exposés.
Par voie orale, les DL50 déterminées chez les rats sont comprises entre 820 et 2 800 mg.kg-1. Chez les cobayes, une DL50 de 1 000 mg.kg-1 a été établie (IUCLID, 2000).
Synthèse
FDTE/VTR Importer Chez l’animal, les DL50 déterminées pour une exposition par voie orale sont comprises entre 820 et 2 800 mg.kg-1, et par voie cutanée, elles sont comprises entre 400 et 2 000 mg.kg-1.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer Dans un cas d'exposition aux vapeurs de trichlorophénol (sans que soit précisé l'isomère), les personnes exposées sur de longues périodes de 2 à 10 ans se sont plaintes d'irritations au niveau des yeux et des voies aériennes de manière répétitive. L’étude de la fonction respiratoire a montré une réduction du débit expiratoire forcé. Deux des 7 personnes exposées avaient des signes radiologiques témoignant de la réponse inflammatoire au trichlorophénol et ne permettant pas d’exclure à long terme l’apparition de fibrose (Alexandersson et Hedenstierna, 1982). Néanmoins, plusieurs des paramètres de cette étude (nombre insuffisant de sujets, nature de l’isomère, durée et concentration des expositions, etc.) ne permettent pas une interprétation fiable des résultats.
Synthèse
FDTE/VTR Importer Chez l’homme, la seule étude disponible ne permet pas d’évaluer la toxicité chronique du 2,4,5-trichlorophénol.
Chez l'animal
Inhalation
FDTE/VTR Importer Il n’existe aucune étude de toxicité subchronique ou chronique par inhalation.
Voie orale
FDTE/VTR Importer Etudes de mortalité :
Dans une étude chez des rats exposés à 1 075 mg.kg-1.j-1 et des souris exposés à 4 095 mg.kg‑1.j-1 de 2,4,6-trichlorophénol (pureté de 96-97 %), pendant 7 semaines, un rat sur cinq et quatre souris sur dix sont décédés. Aucune mortalité n’est observé chez les rats et les souris pour des doses respectives de 735 et 2 795 mg.kg-1.j-1 (NCI, 1979).
Dans une autre étude, chez des rats exposés par gavage à 1 000 mg.kg-1.j-1, des décès sont observés dès les 4 premières semaines (3/40 chez les mâles et 8/25 chez les femelles) (Blackburn et al., 1986). Pour des doses inférieures à 720 mg.kg-1.j-1, aucun décès n’est observé (Bercz et al., 1990).
Effets hépatiques :
Une augmentation relative du poids du foie est observée chez des rats mâles exposés à 240 et 720 mg.kg-1.j-1, pendant 90 jours, et chez les rates exposées à 720 mg.kg-1.j-1, pendant 90 jours (Bercz et al., 1990).
Chez les rats recevant dans l’eau de boisson du 2,4,6-trichlorophénol à des doses de 3 et 30 mg.kg-1.j-1 pendant 15 semaines, une augmentation du poids du foie et des vacuolisations hépatocellulaires ont été observées (Exon et Koller, 1985).
A l’inverse, l’administration par gavage de 1 000 mg.kg-1.j-1 de 2,4,6-trichlorophénol (pureté de 99 %) repris dans de l’huile pendant 11 semaines n’induit pas de lésions hépatiques ni de modification du poids du foie chez le rat (Blackburn et al., 1986).
Administré sur une période de 7 semaines à de très fortes concentrations (2 300 mg.kg-1.j-1) via l’alimentation, le 2,4,6-trichlorophénol entraîne une atteinte hépatique qui se caractérise par une infiltration graisseuse, un gonflement des cellules et augmentation du poids du foie (NCI, 1979). Pour des durées d’exposition longues (107 semaines) et à des concentrations nettement plus faibles (500 mg.kg-1.j-1) les mêmes auteurs n’ont observé aucune lésion.
Chez la souris exposée à des doses relativement faibles de 650 mg.kg-1.j-1, administrées pendant 105 semaines via l’alimentation, une toxicité hépatique caractérisée par des altérations cellulaires (cellules hyperplasiques) est observée (NCI, 1979). Ces lésions peuvent être des signes précurseurs d’adénomes ou de carcinomes hépatocellulaires qui sont également observés dans cette étude.
Ces études ont montré que les effets du 2,4,6-trichlorophénol administré par voie orale concernent principalement le foie. Les résultats divergent néanmoins d’une étude à l’autre selon les conditions d’administration (eau de boisson ou alimentation) et le véhicule utilisé (eau ou huile). Dans l’étude de Bercz (1990) et de Blackburn (1986), le 2,4,6‑trichlorophénol est administré dans de l’huile de maïs par gavage. Dans l’étude du NCI (1979), le 2,4,6-trichlorophénol est administré via l’alimentation et dans l’étude de Exon et Koller (1985), il est administré dans l’eau de boisson. Par conséquent, l’absorption du 2,4,6‑trichlorophénol est différente et une comparaison de ces différentes études semble donc délicate et difficile.
Effets sur le système immunitaire et hématologique :
Les études de toxicité subchronique et chronique ont révélé chez le rat des modifications du système hématologique. Plusieurs animaux exposés par l’alimentation à 250 mg.kg-1.j-1 présentent une hyperplasie diffuse des cellules de la moelle osseuse (53 % chez les mâles et 32 % chez les femelles), ainsi que des hypermonocytoses et des hyperleucocytoses (de 6 à 14%). D’autre part, une légère augmentation de l’hématopoïèse splénique est observée (NCI, 1979). En revanche, dans d’autres études, aucun effet sur la numération des leucocytes, des érythrocytes, des plaquettes ainsi que sur l’hématocrite et l’hémoglobine n’est observé (Bercz et al., 1990 ; McCollister et al., 1961).
Dans l’étude subchronique réalisée par Exon, une augmentation du poids de la rate a été observée chez des rats exposés par l’eau de boisson à 30 mg.kg-1.j-1 (Exon et Koller, 1985). Dans une autre étude chez des rats et des souris respectivement exposés par l’alimentation à 500 et 1 356 mg.kg-1.j-1, pendant 2 ans, aucune altération histopathologique de la rate, des ganglions lymphatiques ou du thymus n’a été constatée.
Effets rénaux :
Dans une étude chez des rats Sprague-Dawley exposés par gavage à 720 mg.kg-1.j-1 dans l’huile de maïs, pendant 90 jours, une augmentation du poids des reins est observée chez les mâles et une diminution du pH urinaire dans les deux sexes (Bercz et al., 1990).
En revanche, chez des rats Long-Evans exposés par gavage à 1 000 mg.kg-1.j-1 dans l’huile de maïs, 5 jours par semaine, pendant 11 semaines, aucune augmentation n’est rapportée (Blackburn et al., 1986). La différence de souches et des fréquences d’exposition peuvent être à l’origine des différences d’effets observées.
Dans l’étude du NCI, aucun effet sur le rein n’est rapporté chez des rats et des souris exposés respectivement à 500 et 1 356 mg.kg-1.j-1 via l’alimentation (NCI, 1979).
Effets gastro-intestinaux :
Dans deux études réalisées chez des rats et des souris, aucune modification histopathologique du tractus gastro-intestinal n’a été observée pour des doses respectives de 500 et 1 356 mg.kg-1.j-1 et des durées d’exposition de 90 jours à 2 ans (Bercz et al., 1990 ; NCI, 1979).
Effets endocriniens :
Une légère augmentation significative du poids des surrénales est observée chez des rates exposées par gavage à 720 mg.kg-1.j-1, pendant 90 jours (Bercz et al., 1990). Cependant, aucune modification n’est observée chez les rats mâles exposés à 1 000 mg.kg-1.j-1, pendant 11 semaines (Blackburn et al., 1986).
Dans l’étude du NCI, aucune modification histopathologique des surrénales, de la thyroïde, du pancréas ou des glandes parathyroïdes n’est observée chez des rats et des souris respectivement exposés par l’alimentation à 500 et 1 356 mg.kg-1.j-1, pendant 105 semaines (NCI, 1979).
Effets cardiaques :
Dans une étude chez des rats exposés par voie orale à 1 000 mg.kg-1.j-1, pendant 10 à 13 semaines, aucune augmentation du poids du cœur n’est constatée (Bercz et al., 1990 ; Blackburn et al., 1986). Aucune altération histopathologique n’est observée chez des rats et des souris respectivement exposées à 720 et 1 356 mg.kg-1.j-1, pendant 90 jours (Bercz et al., 1990) ou 105 semaines (NCI, 1979).
Effets pulmonaires :
Plusieurs études réalisées chez des rats et des souris exposés par voie orale au 2,4,6‑trichlorophénol n’ont montré aucune modification histopathologique au niveau des poumons (Bercz et al., 1990 ; Blackburn et al., 1986 ; NCI, 1979).
Voie cutanée
FDTE/VTR Importer Il n’existe aucune étude de toxicité subchronique ou chronique par voie cutanée.
Synthèse
FDTE/VTR Importer Chez l’animal, les seules données disponibles concernent une exposition par voie orale. Le 2,4,6-trichlorophénol induit principalement des effets hépatiques (vacuolisation hépatocellulaire, infiltration graisseuse, hyperplasie cellulaire, augmentation du poids du foie), des effets rénaux (diminution du pH urinaire, augmentation du poids des reins) et des effets sur le système immunitaire et hématologique (hypermonocytoses et hyperleucocytoses, hyperplasies diffuses des cellules de la moelle osseuse, légère augmentation de l’hématopoïèse splénique et du poids de la rate).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer catégorie 3: substance préoccupante pour l’homme en raison d’effets cancérogènes possibles mais pour lesquelles les informations disponibles ne permettent pas une évaluation satisfaisante | 1998 |
| IARC | FDTE/VTR Importer Les études étant jugées limitées, le 2,4,6-Trichlorophénol seul n’a pas été classé cancérigène. | |
| US EPA | FDTE/VTR Importer Classe B2 : le 2,4,6-trichorophénol est probablement cancérigène pour l’homme. Il existe des preuves suffisantes chez l’animal et des preuves non adéquates ou pas de preuves chez l’homme. |
Chez l'homme
Toutes voies
FDTE/VTR Importer Il n’existe pas d’études concernant les effets cancérogènes du 2,4,6-trichloréphénol chez l’homme. L’augmentation de la fréquence d’apparition de lymphomes et de leucémies a été évaluée dans une étude cas-témoins réalisée sur des personnes exposées professionnellement par voie cutanée à des produits chimiques dont le 2,4,6-trichlorophénol (Pearce et al., 1988 ; Smith et al., 1984). Malgré une augmentation de l’incidence de ces tumeurs, les co-expositions ne permettent pas d’attribuer les effets cancérogènes à une substance en particulier.
Synthèse
FDTE/VTR Importer Chez l’homme, le peu d’études disponibles ainsi que la présence de co-expositions ne permettent pas de conclure sur le potentiel cancérigène du 2,4,6-trichlorophénol.
Chez l'animal
Toutes voies
FDTE/VTR Importer Chez l’animal, les études de cancérogenèse ont pu démontrer le caractère cancérogène du 2,4,6-trichlorophénol (IARC, 1986). Cependant, la présence de co-expositions ne permet pas d’attribuer les effets observés au 2,4,6-trichlorophénol seul.
Voie orale
FDTE/VTR Importer Deux lots de 18 jeunes souris mâles et femelles âgés de 7 jours, issus chacun du croisement de souches différentes, ont reçu quotidiennement par gavage 100 mg.kg-1 de 2,4,6‑trichlorophénol. Après 3 semaines de traitement, les animaux ont été exposés à des concentrations plus élevées de 260 mg.kg-1 via l’alimentation, pendant 74 semaines. A la fin du traitement, les auteurs ont pu mettre en évidence sur une des deux souches (B6C3F1), l’augmentation significative de l’incidence de tumeurs du foie : des hépatomes chez les femelles (2/18) et des réticulosarcomes chez les mâles (4/18) (Innes et al., 1969).
Dans le cadre de dosages biologiques effectués par le NCI, 50 rats mâles et femelles ont reçu une concentration quotidienne de 5 000 ou 10 000 ppm de 2,4,6-trichlorophénol (contenant 3 à 4 % d’impuretés) dans leur alimentation pendant 106 ou 107 semaines (NCI, 1979). De même, 5 000 ou 10 000 ppm du produit ont été administrés à 50 souris mâles pendant 105 semaines, et 10 000 ou 20 000 ppm pendant 38 semaines, puis 2 500 ou 5 000 ppm pendant 67 semaines à des souris femelles. Les rats mâles exposés ont développé des lymphomes et des leucémies avec une fréquence significativement supérieure à celle des animaux du lot témoin (23/50 pour une concentration de 5 000 ppm et 29/50 pour une concentration de 10 000 ppm). Les auteurs ont également pu observer sur les souris traitées des deux sexes des carcinomes et adénomes hépatocellulaires. Les incidences des adénomes hépatocellulaires pour la faible et la forte dose, sont respectivement de 22/49 et 32/47 pour les souris mâles et de 12/50 et 17/48 pour les femelles. Pour les carcinomes hépatocellulaires, les incidences pour la faible et la forte dose, sont respectivement de 10/49 et 7/47 pour les souris mâles et de 0/50 et 7/48 pour les femelles. La pureté du composé utilisé est de 96-97 % et il contenait jusqu’à 17 contaminants mineurs. Les expérimentateurs n’ont notamment pas fait l’évaluation de la teneur en dibenzo-p-dioxines chlorées.
Le mécanisme par lequel le 2,4,6-trichlorophénol induit des cancers chez l’animal est inconnu.
Synthèse
FDTE/VTR Importer Chez l’animal, le 2,4,6-trichlorophénol induit des tumeurs du foie (hépatomes et réticulosarcomes). Une augmentation de l’incidence des lymphomes, des leucémies, et des adénomes hépatocellulaires sont également rapportées ; cependant la présence de nombreuses impuretés ne permettent pas d’attribuer ces effets au 2,4,6-trichlorophénol seul.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Le 2,4,6-trichlorophénol a été examiné mais n’a pas été classé génotoxique par l'Union Européenne | 1998 |
Chez l'animal
Toutes voies
FDTE/VTR Importer In vivo, dans un essai « spot test », le 2,4,6-trichlorophénol a montré des effets génotoxiques chez des cellules somatiques de souris (Fahrig et al., 1978). Dans une étude chez des rats exposés par voie orale à 164 mg.kg-1 en une seule administration, aucun dommage de l’ADN n’a été observé (Kitchin et Brown, 1988).
Synthèse
FDTE/VTR Importer Plusieurs études in vivo ont évalué le potentiel génotoxique du 2,4,6-trichlorophénol. Les résultats de ces études sont variables et ne permettent pas de conclure sur la génotoxicité du 2,4,6-trichlorophénol.
In vitro
Organismes eucaryotes
FDTE/VTR Importer Dans des études in vitro sans activation métabolique, le 2,4,6-trichlorophénol apparait mutagène sur cellules eucaryotes : chez les bactéries (Bacillus subtilis), les levures (Saccharomyces cervisiae) et génotoxique sur les cellules de mammifères (cellules de hamster V79, cellules de souris L5178Y TK +/-) (Fahrig et al., 1978 ; Hattula et Knuutinen, 1985 ; Kinae et al., 1981 ; McGregor et al., 1988).
Par ailleurs, dans une autre étude sur des cellules de hamster V-79, le 2,4,6-trichlorophénol ne s’est pas révélé mutagène (Jansson et Jansson, 1992). Des résultats négatifs ont également été observés chez les bactéries (Salmonella typhimurium sans activation) et les levures (Saccharomyces cervisiae) (Fahrig et al., 1978 ; Galloway et al., 1987 ; Haworth et al., 1983 ; Kinae et al., 1981 ; Lawlor et al., 1979 ; Rasanen et al., 1977).
Synthèse
FDTE/VTR Importer Plusieurs études in vitro ont évalué le potentiel génotoxique du 2,4,6-trichlorophénol. Les résultats de ces études sont variables et ne permettent pas de conclure sur la génotoxicité du 2,4,6-trichlorophénol.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Il n’existe pas de donnée chez l’homme concernant les effets du 2,4,6-trichlorophénol sur la reproduction.
Chez l'animal
Voie orale
FDTE/VTR Importer Les données concernant les effets du 2,4,6-trichlorophénol sont peu nombreuses et émanent uniquement d’études par ingestion.
L’administration orale via l’eau de boisson de 30 mg.kg-1.j-1, pendant 13 semaines (du sevrage jusqu’à la parturition), à des rates en gestation entraîne une diminution du nombre d’animaux par portée (Exon et Koller, 1985).
Dans une autre étude, des rates ont été exposées par gavage à 1 000 mg.kg-1.j-1, 2 semaines avant l’accouplement et jusqu’au 21ème jour de gestation, et des rats mâles ont été exposés à 1 000 mg.kg-1.j-1, pendant 10 semaines. Pour les deux sexes, aucun effet sur la reproduction et la fertilité n’a été observé. Seule une diminution du poids corporel est observée au 14ème jour de gestation. Cependant, elle n’est plus constatée au 21ème jour (Blackburn et al., 1986).
Dans deux études chez des rats exposés par voie orale, aucun effet sur le poids ni aucune anomalie histologique des testicules et des ovaires n’est observé (Bercz et al., 1990 ; NCI, 1979).
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Il n’existe pas de donnée chez l’homme concernant les effets du 2,4,6-trichlorophénol sur le développement.
Chez l'animal
Voie orale
FDTE/VTR Importer Dans une étude chez des rates exposées par gavage à 1 000 mg.kg-1.j-1, 2 semaines avant l’accouplement et jusqu’au 21ème jour de gestation, une diminution transitoire de 10 % du poids de la progéniture est observée. L’examen général de la descendance n’ayant pas été réalisé, cette étude n’est pas suffisante pour conclure des effets sur le développement du 2,4,6-trichlorophénol (Blackburn et al., 1986).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets sans seuil - Exposition chronique par voie orale et par inhalation :
L’US EPA (IRIS) propose, pour le 2,4,6-trichlorophénol, un excès de risque unitaire par inhalation (ERUi) de 3,1.10-6 par (mg.m-3)-1, un excès de risque unitaire par voie orale (ERUo) de 1,1.10-2 par (mg.kg-1.j-1)-1 et un excès de risque unitaire par absorption via l’eau de boisson (ERUeau) de 3,1.10-7par (mg.L-1)-1 (US EPA (IRIS), 1994).
Ces valeurs ont été calculées à partir d’une étude expérimentale chez des rats (NCI, 1979), en tenant compte uniquement de l’incidence de leucémies chez des rats mâles étant exposés à 5 000 et 10 000 ppm de 2,4,6-trichlorophénol via l’alimentation pendant 106 ou 107 semaines. Dans cette même étud-e, le développement de carcinomes hépatocytaires très probablement liés à la présence de contaminants (1,3,6,8-TCDD) a été écarté dans le calcul de l’évaluation du risque cancérigène. Pour cette même raison, l’étude de Innes et al. (1969) n’a pas été sélectionnée. Le tableau 1 présente l’incidence des leucémies observées chez les rats mâles.
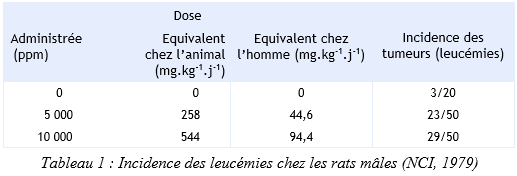
Méthode d'extrapolation : modèle multi-étapes linéarisé.
Selon les recommandations de l’US EPA, le risque unitaire ne devrait pas être utilisé si la concentration dans l’air dépasse 3.102 mg.m-3 (non approprié).
Selon les recommandations de l’US EPA, le risque unitaire ne devrait pas être utilisé si la concentration dans l’eau dépasse 3.104 mg.L-1 (non approprié).
Synthèse
FDTE/VTR Importer Effets sans seuil - Exposition chronique par inhalation :
L’US EPA propose une valeur établie à partir d’une étude chronique de 105 semaines chez les rats mâles par voie orale. L’OEHHA propose une valeur établie à partir de deux études chroniques par voie orale, l’une de 78 semaines et l’autre de 105 semaines. Ces deux valeurs ont nécessité une extrapolation voie à voie à partir d’exposition par voie orale. Pour les mêmes raisons que pour la voie orale, la valeur de l’US EPA semble plus pertinente, elle est donc retenue, même si l’extrapolation voie à voie reste une approche par défaut avec toutes les incertitudes associées.
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA propose deux valeurs établies à partir d’une étude chronique de 106-107 semaines chez les rats mâles par voie orale. L’OEHHA propose une valeur établie à partir de deux études chroniques, l’une de 78 semaines et l’autre de 105 semaines, chez les souris mâles et femelles exposés par voie orale.
En se basant sur une étude réalisée par Firestone et al., l’US EPA considère que le 2,4,6 trichlorophénol est contaminé par la présence de 1,3,6,8-tetrachlorodibenzo-para-dioxine (≤ 4%) (Firestone et al., 1972). Les dibenzodioxines chlorés sont susceptibles d’induire des tumeurs hépatiques et donc pourraient masquer les effets propres au 2,4,6 trichlorophénol observées chez les souris. En revanche, aucun effet cancérigène de type leucémie n’est rapporté. Par conséquent, seules les observations chez les rats sont prises en compte pour la détermination de l’excès de risque unitaire.
L’OEHHA prenant en compte les tumeurs hépatiques observées chez les souris, l’excès de risque unitaire élaboré semble moins pertinent. De plus, le nombre d’animaux utilisés dans l’étude d’Innes et al., est faible et les p-values associées aux hépatomes et aux réticulosarcomes sont supérieures à 0,02.
Au vu de ces observations, les valeurs établies par l’US EPA semblent plus pertinentes, elles sont donc retenues.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets sans seuil - Exposition chronique par voie orale et par inhalation :
L’OEHHA propose, pour le 2,4,6-trichlorophénol, un excès de risque unitaire par inhalation (ERUi) de 2.10-5 (mg.m-3)-1 et un excès de risque unitaire par voie orale (ERUo) de 7.10-2 (mg.kg-1.j-1)-1 (OEHHA, 2009).
Ces valeurs ont été calculées à partir de deux études (Innes et al., 1969 ; NCI, 1979), en tenant compte uniquement des tumeurs chez la souris qui est l’espèce la plus sensible. Dans l’étude du NCI, les souris mâles sont exposées à 5 000 et 10 000 ppm de 2,4,6-trichlorophénol par l’alimentation, pendant 105 semaines. Les souris femelles sont exposées à 10 000 et 20 000 ppm de 2,4,6-trichlorophénol, pendant 38 semaines, puis à 2 500 et 5 000 ppm pendant 67 semaines. Dans l’étude de Innes et al., les souris sont exposées par gavage à 100 mg.kg-1 de 2,4,6-trichlorophénol, pendant les jours 7 à 28 après la naissance, puis à des doses de 260 mg.kg-1, pendant 74 semaines, via l’alimentation. Pour l’établissement de ces valeurs, l’incidence des hépatomes (adénomes et carcinomes) chez les souris mâles et femelles a été retenue pour l’étude du NCI (1979) et pour l’étude d’Innes et al. (1969), il s’agit de l’incidence des hépatomes chez les femelles et des réticulosarcomes chez les mâles.
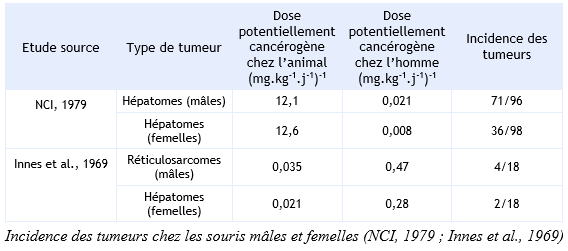
Méthode d'extrapolation : modèle multi-étapes linéarisé.
Pour l’étude du NCI (1979), l’OEHHA a combiné les incidences des carcinomes et des adénomes hépatocellulaires pour les deux concentrations.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'objectif de ce document est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme. L'ensemble des informations et des données de ce chapitre provient de diverses revues bibliographiques publiées par des organismes reconnus pour la qualité scientifique de leurs documents ( ?????????). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur recevabilité selon les critères définis ci-dessous : - Recevabilité 1 : le résultat peut être utilisé pour le calcul de la PNEC vis-à-vis des organismes aquatiques sans restriction, - Recevabilité 2 : le résultat peut être utilisé pour le calcul de la PNEC vis-à-vis des organismes aquatiques mais dans une seconde étape. Généralement ces résultats proviennent de protocoles comportant des dérives par rapport aux normes des essais (durée d’exposition, composition des milieux, températures d’exposition …), - Recevabilité 3 : Le résultat ne peut pas être utilisé pour le calcul de la PNEC. Il peut être utilisé pour conforter des résultats. Ces résultats proviennent d’essais pour lesquels l’organisme testé n’est pas un organisme dulçaquicole, ou que le protocole n’est pas disponible, ou que le protocole comporte des modifications majeures par rapports aux normes en vigueurs (durée d’exposition trop courtes …), - Non classés : Le résultat est provient d’une citation dans un article.
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :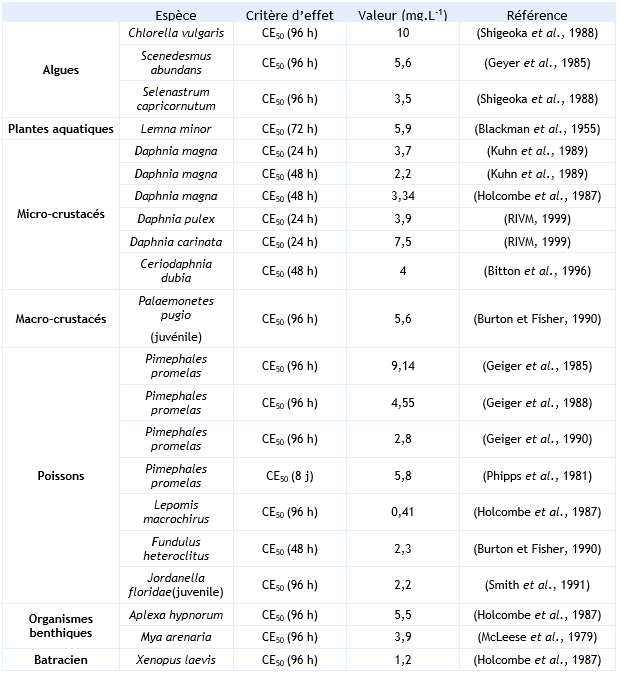
Algues :
Les essais sur Chlorella vulgaris, Scenedesmus abundans, et Selenastrum capricornutum ont été effectués en utilisant un système statique sans contrôle analytique des concentrations. Les résultats sont basés sur les concentrations nominales.
Plantes aquatiques :
L’essai sur Lemna minor a été réalisé en utilisant un système statique sans contrôle analytique des concentrations. Les résultats sont basés sur les concentrations nominales.
Micro-crustacés :
L’essai effectué sur Daphnia magna a été réalisé en utilisant un système semi-statique sans contrôle analytique des concentrations. Les résultats sont basés sur les concentrations nominales.
Les essais sur Daphnia pulex et carinata et Ceriodaphnia dubia ont été effectués en utilisant un système statique sans contrôle analytique des concentrations. Les résultats sont basés sur les concentrations nominales.
Macro-crustacés :
L’essai sur Palaemonetes pugio (juvénile) a été réalisé en utilisant un système statique avec un contrôle analytique des concentrations. Les résultats sont basés sur les concentrations mesurées.
Organismes benthiques
L’essai sur Aplexa hypnorum a été effectué en utilisant un système dynamique avec un suivi analytique des concentrations.
L’essai sur Mya arenaria a été effectué en utilisant un système semi-statique avec un suivi analytique des concentrations.
Poissons :
Les trois essais effectués sur Pimephales promelas et Lepomis macrochirus ont été réalisés en utilisant un système dynamique avec un suivi analytique des concentrations (Geiger et al., 1990 ; Geiger et al., 1988 ; Geiger et al., 1985).
L’essai sur Pimephales promelas a été effectué pendant 8 jours en utilisant un système dynamique avec un suivi analytique des concentrations (Phipps et al., 1981).
Deux essais sur Jordanella floridae ont été effectué (Smith et al., 1991). Un en utilisant un système statique et l’autre en utilisant un système dynamique. Un contrôle analytique des concentrations a été effectué durant les deux essais et les résultats sont basés sur les concentrations mesurées. Les deux essais ont abouti au même résultat (CE50 : 2,2 mg.L-1).
L’essai sur Fundulus heteroclitus a été réalisé en statique avec un suivi analytique des concentrations. Les résultats sont basés sur les concentrations mesurées.
Batraciens :
L’essai sur Xenopus laevis a été effectué en utilisant un système dynamique avec un suivi analytique des concentrations.
Paramètres d’écotoxicité chronique :
Poissons :
Les essais sur Pimephales promelas et Jordanella floridae ont été effectués pendant 28 jours en utilisant un système dynamique avec un suivi analytique des concentrations. Les résultats sont basés sur les concentrations mesurées.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Végétaux :
L’essai sur Lactuca sativa a été réalisé sur un sol artificiel contenant 1,4 % de matière organique, 12 % d’argile avec une température comprise entre 18 et 26° C et un pH de 7,8. Les résultats sont basés sur les concentrations nominales.
Organismes du sol :
L’essai sur Eisenia fetida, Alloobophora caliginosa, Eudrilus eugeniae et Perionys excavatus a été réalisé sur un sol artificiel contenant 8 % de matière organique, 8 % d’argile avec une température de 20° C et un pH de 6. Les résultats sont basés sur les concentrations nominales.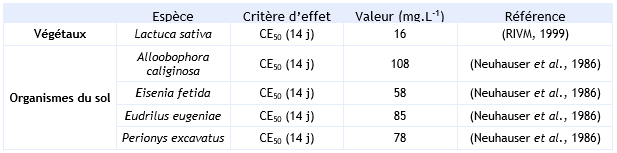
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Compartiment aquatique :
Deux essais longs terme sur poissons sont disponibles. La Commission Européenne (CE, 1996) propose donc d’appliquer un facteur d’extrapolation de 100 sur la NOEC. La NOEC 28 jours calculée pour Pimephales promelas devrait donc être utilisée. Or, cette espèce n’est pas la plus sensible si on considère les essais aigus. Un facteur d’extrapolation de 1 000 sera donc appliqué à l’espèce la plus sensible, Lepomis macrochirus.
D’où : PNECEAU = 0,41/1 000 = 0,41 µg.L-1
Compartiment sédimentaire :
Aucun résultat utilisable n’est disponible sur les organismes benthiques. La PNECsed sera donc estimée par le calcul suivant :
PNECsed (µg.kg-1 sédiment humide) = (KSED-eau/RHOSed) ´ PNECeau ´ 1 000
Avec :PNECeau = concentration prévue sans effet pour le compartiment aquatique (0,41 µg.L-1)
RHOsed = densité des sédiments (humides) (valeur par défaut : 1 300 kg.m-3)
Ksed-eau = coefficient de partage entre les sédiments et l'eau (m3.m-3)
= FeauSED + FsolidSED ´ KpSED ´ RHOsolid
= 18,4 m3.m-3
FeauSED : fraction d'eau dans les sédiments (défaut : 0,8 m3.m-3)
FsolidSED : fraction solide dans les sédiments (défaut : 0,2 m3.m-3)
KpSED : coefficient de partage eau-sédiments (35,35 L.kg-1 d’après la Commission Européenne (CE, 1996))
RHOsolid: densité de la phase solide (défaut 2,5 kg.L-1)
D’où : PNECSED = 5,8 µg.kg-1 de poids frais = 15 µg.kg-1 de poids sec
Compartiment terrestre :
Des essais d’écotoxicité aiguë sont disponibles sur une espèce de plantes terrestre et de vers de terre. La Commission Européenne (CE, 1996) propose donc d’appliquer un facteur d’extrapolation de 1 000 sur l’espèce la plus sensible (Lactuca sativa).
D’où : PNECSOL = 16/1 000= 16 µg.kg-1 de poids frais = 18 µg.kg-1 de poids sec
Étant donné que les facteurs d’extrapolation proposés par la Commission Européenne (CE, 1996) sont pris seulement comme valeurs indicatives, la PNECsol sera donc également estimée par le calcul suivant :
PNECsol (mg.kg-1 sol humide) = Ksol-eau/RHOsol ´ PNECeau ´ 1 000
PNECeau= concentration prévue sans effet pour le compartiment aquatique (valeur calculée 0,41 µg.L-1)
RHOsol = densité du sol (humide) (valeur par défaut : 1 700 kg.m-3)
Ksol-eau = coefficient de partage sol eau (m3.m-3)
= FairSol ´ Kair-eau + FeauSol + FsolidSol ´ KpSol ´ RHOsolid
= 21 m3.m-3
Kair-eau = coefficient de partage entre l'air et l'eau (2,3.10-4 valeur calculée d’après la Commission Européenne (1996))
FairSol : fraction d'air dans le sol (défaut : 0,2 m3.m-3)
FeauSol : fraction d'eau dans le sol (défaut : 0,2 m3.m-3)
FsolidSol : fraction solide dans le sol (défaut : 0,6 m3.m-3)
KpSol: coefficient de partage eau-sol (14,22 L.kg-1 valeur calculée d’après la Commission Européenne (1996))RHOsolid: densité de la phase solide (défaut : 2,5 kg.L-1)
D’où : La PNECsol = 5 µg.kg-1 de sol humide = 5,8 µg.kg-1 de sol sec
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










