Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
1,1,2,2-tétrachloroéthane (79-34-5)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
79-34-5
Nom scientifique (FR)
1,1,2,2-Tétrachloroéthane
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
201-197-8
Code SANDRE
1271
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C2H2Cl4 }\)
Code InChlKey
Code SMILES
C(C(Cl)Cl)(Cl)Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H310 |
|---|---|
| Mention du danger - Texte | Mortel par contact cutané |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H330 |
|---|---|
| Mention du danger - Texte | Mortel par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H411 |
|---|---|
| Mention du danger - Texte | Toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
167.86 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
VGE/NQE Importer
Volatilisation :
Le 1,1,2,2-tétrachloroéthane est facilement volatilisable à partir d'un environnement aqueux et des terrains humides. Son temps demi-vie en milieu aqueux est de l'ordre de quelques jours à quelques semaines dans les eaux naturelles.
En milieu aqueux, les pertes de 1,1,2,2-tétrachloroéthane sont principalement dues à l'évaporation du produit. (INERIS, 2005)
FDTE/VTR Importer Le 1,1,2,2-tétrachloroéthane est facilement volatilisable à partir d’un environnement aqueux et des terrains humides. Sa demi-vie en milieu aqueux est de l’ordre de quelques jours à quelques semaines dans les eaux naturelles.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
VGE/NQE Importer
Adsorption :
D'après la valeur du Koc (79 L.kg-1), en milieu aquatique le 1,1,2,2-tétrachloroéthane est très peu adsorbé sur les sédiments et les matières en suspension.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
FDTE/VTR Importer Le 1,1,2,2-tétrachloroéthane est considéré comme mobile dans le sol et, de ce fait, peut atteindre la nappe phréatique. En milieu aquatique, il est très peu adsorbé sur les sédiments.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
VGE/NQE Importer
Biodégradabilité :
Un test a montré que le 1,1,2,2-tétrachloroéthane n'est pas biodégradé après 28 jours lors d'un essai MITI (OCDE 301C) basé sur la mesure de la consommation d'oxygène dissous. (MITI, 1992)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
VGE/NQE Importer
Hydrolyse :
Pas d'information disponible.
Photolyse :
Pas d'information disponible.
FDTE/VTR Importer Dans le sol, le 1,1,2,2-tétrachloroéthane peut subir une déhydrochloration, particulièrement en sols alcalins (pH >8). Dans l’atmosphère (troposphère), il est quasiment inerte (demi-vie de plus de 800 jours). Il est donc susceptible d'être transporté sur de longues distances. Dans la stratosphère, il est rapidement dégradé par photodissociation. En milieu aqueux, les pertes sont principalement dues à l’évaporation du produit.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
FDTE/VTR Importer Un test a montré que le 1,1,2,2-tétrachloroéthane n’est pas biodégradé après 28 jours lors d’un essai MITI (OCDE 301C) basé sur la mesure de la consommation d’oxygène dissous (CITI, 1992).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
FDTE/VTR Importer Lors d'un essai de 4 mois, le 1,1,2,2-tetrachloroéthane a été dégradé en trichloroéthylène, en cis-1,2 dichloroéthène et en trans-1,2-dichloroéthène en 6 jours. Le trans-1,2-dichloroéthène est la substance qui est produite dans les plus fortes concentrations. Au delà de 6 jours deux autres substances apparaissent, le 1,1,2-trichloroéthane et le 1,2-dichloroéthane (Chun et al., 1996).
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Lors d'un essai dynamique sur Cyprinus carpio de 42 jours le CITI (1992) a mesuré des BCF de 4,5 à 13,2. Barrows et al. (1980) ont mesuré un BCF de 8 sur Lepomis macrochirus lors d'un essai dynamique en système fermé de 14 jours. Le tétrachloroéthane n'a pas de potentiel de bioaccumulation vis à vis des poissons.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucun résultat d'essai valide n'a pu être trouvé dans la littérature.
Conclusion sur la bioaccumulation
VGE/NQE Importer
Bioaccumulation :
Lors d'un essai dynamique sur Cyprinus carpio de 42 jours le CITI a mesuré des BCF de 4.5 à 13.2.
Barrows et al. ont mesuré un BCF de 8 sur Lepomis macrochirus lors d'un essai dynamique en système fermé de 14 jours.
Un BCF de 13.2 est utilisé dans la détermination des normes de qualité.
En l'absence de BMF mesuré, le document guide technique européen pour la dérivation des NQE recommande l'utilisation des valeurs par défaut suivantes pour ce qui est de la prise en compte de la biomagnification : BMF1 = BMF2 = 1. (MITI, 1992 Barrows et al., 1980 E.C., 2011)
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (l’IARC, 1987 ; l’US EPA (IRIS), 1995 ; l'ATSDR, 1996 et HSDB, 2001. Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer La population générale est exposée par les voies respiratoire et digestive au 1,1,2,2-tétrachloroéthane présent dans l’air intérieur et dans l’eau de boisson. Les vapeurs présentes dans l’air peuvent aussi, de façon plus marginale, entrer directement en contact avec la peau et les muqueuses. Une étude réalisée sur volontaires sains a montré que 97 % du 1,1,2,2-tétrachloroéthane inspiré sont absorbés (Morgan et al., 1970). Les taux d’absorption par voie digestive et percutanée n’ont pas été quantifiés. Néanmoins, la gravité des effets observés après ingestion permet de supposer qu’une partie importante du produit est absorbé au niveau du tractus gastro-intestinal.
Distribution
FDTE/VTR Importer Il n'existe aucune données sur la distribution du 1,1,2,2-tétrachloroéthane chez l'homme (ATSDR, 1996).
Métabolisme
FDTE/VTR Importer Il n'existe aucune données sur le métabolisme du 1,1,2,2-tétrachloroéthane chez l'homme (ATSDR, 1996).
Élimination
FDTE/VTR Importer Par inhalation, 3 % du 1,1,2,2-tétrachloroéthane sont immédiatement éliminés dans l’air expiré. Le niveau d’excrétion urinaire correspond à 0,015 % de la dose absorbée par minute (Morgan et al., 1970). Les niveaux d’excrétion ne sont pas connus pour les autres voies d’exposition.
Chez l'animal
Absorption
FDTE/VTR Importer Les rats et souris exposés 6 heures à 10 ppm de 1,1,2,2-tétrachloroéthane présentent des charges corporelles équivalentes à 36 µmoles/kg (6 mg/kg) chez le rat et 128 µmoles/kg (24 mg/kg) chez la souris, soit des taux d’absorption respectifs de 38 et 74 % (calculés approximativement) (Dow Chemical Company, 1988). Par voie orale, les taux d’absorption sont selon les études compris entre 70 et 100 % chez le rat ou la souris (Dow Chemical Company, 1988 ; Mitoma et al., 1985). L’absorption par voie percutanée n’a pas été quantifiée chez l’animal. Les données précisent seulement que plus de 1 mL du produit appliqué sur la peau de souris ou de cobaye est absorbé après une demi-heure (Jakobson et al., 1982 ; Tsuruta, 1975).
Distribution
FDTE/VTR Importer Chez la souris ou le rat, l’administration par voie orale d’une dose unique de 1,1,2,2-tétrachloroéthane radiomarqué a montré que le produit se retrouvait majoritairement au niveau du foie. Le taux de radioactivité liée aux protéines hépatiques est deux fois supérieur chez la souris par rapport au rat (Mitoma et al., 1985). De 60 à 80 % du produit absorbé sont transformés par différentes voies métaboliques (clivage hydrolytique, réduction, oxydation, cytochrome P-450) en tétrachloroéthylène, trichloroéthylène, trichloroéthanol, acide trichloroacétique et acide dichloroacétique. Majoritairement représenté, l’acide dichloroacétique conduit, par une série de réactions, à la formation d’acide formique et de CO2 (Casciola et Ivanetich, 1984 ; Halpert, 1982). Les travaux les plus récents ont montré, par administration intraveineuse (3 mg/kg) chez la souris, que les produits de transformation du 1,1,2,2-tétrachloroéthane issus de la voie du cytochrome P-450 se retrouvaient majoritairement liés à l’épithélium des tractus respiratoire et gastrique (Eriksson et Brittebo, 1991).
Métabolisme
FDTE/VTR Importer Chez l’animal, le métabolisme du 1,1,2,2-tétrachloroéthane est augmenté par la consommation chronique d’éthanol et également au cours des périodes de jeûne (Sato et al., 1980 ; Nakajima et Sato, 1979).
Élimination
FDTE/VTR Importer Les produits de transformation du 1,1,2,2-tétrachloroéthane sont éliminés, 72 heures après l’administration par voie orale ou respiratoire, principalement dans l’air, les urines et dans une moindre mesure par voie fécale (Dow Chemical Company, 1988 ; Mitoma et al., 1985).
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Par inhalation, l’odeur du 1,1,2,2-tétrachloroéthane est perçue par l’homme dès 2,9 ppm, mais n’induit aucune gêne respiratoire au cours d’une exposition de 30 minutes. Des signes d’irritations des muqueuses respiratoires sont ressentis lorsque la concentration d’exposition dépasse 13 ppm. A partir de 116 ppm, les sujets souffrent de vertiges, nausées et vomissements (Lehman et Schmidt-Kehl, 1936). Il semblerait que l’irritation oculaire également ressentie par les sujets soit davantage liée au contact direct des vapeurs du 1,1,2,2-tétrachloroéthane avec la cornée, plutôt qu’à un effet systémique en liaison avec l’inhalation du produit. Deux décès attribués à l’exposition au 1,1,2,2-tétrachloroéthane ont été mentionnés ; l’autopsie a révélé une dégénérescence du foie associée à des zones de nécrose (Willcox et al., 1915).
Voie orale
FDTE/VTR Importer Les rares cas d’intoxications par voie orale décrits dans la littérature proviennent d’individus suicidaires ayant volontairement ingéré du 1,1,2,2-tétrachloroéthane. A partir des quantités retrouvées au niveau de l’estomac, certains auteurs ont pu estimer les concentrations absorbées qui variaient selon les cas de 357 mg/kg (Lilliman, 1949) à approximativement 4 000 mg/kg (Hepple, 1927). Après une perte rapide de conscience au cours de la première heure, les sujets sont décédés entre 3 et 20 heures plus tard selon la présence ou non d’aliments dans l’estomac (Elliot, 1933 ; Forbes, 1943). L’examen post-mortem a révélé le plus souvent la présence d’un œdème pulmonaire et des points hémorragiques au niveau du cœur, de l’œsophage ou de l’estomac (Mant, 1953). L’absorption de 1,1,2,2-tétrachloroéthane, prescrite par erreur à des hommes et femmes africaines, estimée approximativement entre 70 et 117 mg/kg, a provoqué une baisse marquée de la tension et des pulsations cardiaques, qui s’est suivie d’une perte de conscience pendant environ 1 heure (Sherman, 1953 ; Ward, 1955). Les personnes, ne présentant pas de séquelles visibles, ont néanmoins refusé ultérieurement tout suivi médical.
Chez l'animal
Inhalation
FDTE/VTR Importer La majorité des données disponibles proviennent d'études limitées relativement anciennes. Les concentrations mortelles de 1,1,2,2-tétrachloroéthane se situent autour de 5 000 ppm chez le rat et 6 000 ppm chez le cobaye pour une exposition de 30 minutes (Price et al., 1978). La CL50 pour une exposition de 4 heures est d'environ 1 250 ppm chez le rat (Schmidt et al., 1980b). Les effets neurotoxiques du tétrachloréthane ont été observés dans plusieurs espèces. L’activité motrice des rats est fortement réduite par une exposition de 6 heures à 360 ppm (Horvath et Frantik, 1973). De même, une diminution des réflexes est observée chez la souris après 2 heures d’exposition à 1 091 ppm (Lazarew, 1929). Lorsque la durée et la concentration d’exposition au 1,1,2,2-tétrachloroéthane augmentent, ces symptômes peuvent alors apparaître simultanément et s’accompagner également d’ataxie, de narcose et d’un état de stupeur (Pantelitsch, 1933 ; Price et al., 1978).
Voie orale
FDTE/VTR Importer Par voie orale, le 1,1,2,2-tétrachloroéthane présente également une forte toxicité et les DL50 se situent autour de 300 mg/kg/j chez le rat (Gohlke et al., 1977 ; Schmidt et al, 1980a ; Smyth et al., 1969) D'après les résultats d'études de toxicité orale à court terme, le foie semble être l'organe cible principal. Les effets hépatiques les plus fréquemment observés chez les rongeurs se traduisent par des congestions, des dégénérescences graisseuses, des modifications histologiques, des changements des concentrations d’enzymes et une accélération de la synthèse d’ADN (Horiuchi et al., 1962 ; Gohlke et al., 1972 ; Schmidt et al., 1980b). Dans ces études, les conditions d’expositions, l’absence de relation doses-réponses ou temps-réponses, ne permettent pas d'établir des NOAEL ni de LOAEL fiables pour ce qui est de l'hépatotoxicité. Seule l’étude plus récente de Dow Chemical Company (1988), qui indique pour des expositions de 3 à 4 jours la présence de lésions hépatiques chez la souris (œdème centrolobulaire) ou le rat (hyperplasie), a permis de déterminer pour les deux espèces des NOAEL de 25 mg/kg/j (Dow Chemical Company, 1988)..
Voie cutanée
FDTE/VTR Importer La DL50 par voie cutanée est de 6 360 mg/kg chez le lapin (Smyth et al., 1969). Une des rares études de toxicité aiguë mentionne, pour une application cutanée directe de 514 mg/cm2 de 1,1,2,2-tétrachloroéthane sur la peau pendant 16 heures, le développement de lésions cutanées (infiltration de cellules inflammatoires, œdème) chez le lapin (Kronevi et al., 1981).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer L’exposition chronique aux vapeurs de 1,1,2,2-tétrachloroéthane induit principalement des effets sur le foie et le système nerveux central. L’hépatotoxicité du 1,1,2,2-tétrachloroéthane a été décrite dans plusieurs études anciennes réalisées en milieu professionnel. Bien que les niveaux d’exposition soient rarement spécifiés, plusieurs cas d’ictères ou d’hépatites ont été répertoriés (Coyer, 1944 ; Horiguchi et al., 1964 ; Jeney et al., 1957 ; Koelsch, 1915). Dans une étude épidémiologique plus récente réalisée sur une population de 1 099 hommes exposés à des concentrations inconnues de tétrachloréthane (probablement l’isomère 1,1,2,2), aucune augmentation significative de la mortalité n’a été attribuée à des lésions hépatiques ou autres. Par contre, des augmentations de la mortalité non significative sur le plan statistique, attribuables à des cancers des organes génitaux, à des leucémies et à d’autres cancers d’origine lymphatique ont été signalées (Norman et al., 1981). En Inde, une augmentation de la prévalence des tremblements en fonction de la concentration de 1,1,2,2-tétrachloroéthane dans l’air (de 9 à 98 ppm, soit 684 mg/m3) a été signalée chez 380 travailleurs exposés pendant des périodes estimées environ à 18 mois ; toutefois, l’étude n’indiquait pas la prévalence de ces signes dans une population non exposée (Lobo-Mendoca, 1963). Des signes neurologiques de la toxicité du 1,1,2,2-tétrachloroéthane tels que maux de tête, somnolences, vomissements, engourdissements ont également été mentionnés à plusieurs reprises dans des études plus anciennes, également réalisées en milieux professionnels (Hamilton, 1917 ; Minot et Smith, 1921 ; Parmenter, 1921 ; Jeney et al., 1957).
Chez l'animal
Inhalation
FDTE/VTR Importer Chez des rats femelles Sprague-Dawley exposés à une dose de 130 ppm pendant 15 semaines, les auteurs ont observé des effets hépatiques, dont une accélération transitoire de la synthèse de l’ADN, des altérations histopathologiques réversibles et une augmentation de la masse relative du foie (Truffer et al., 1977). Une dégénérescence hépatique a également été observée sur des lapins exposés 7 à 11 mois à 15 ppm (Navrotskiy et Kulinskoya, 1971) et sur un singe exposé à une concentration de 1 974 ppm à raison de 2 h/j durant 9 mois (Horiuchi et al., 1962). La neurotoxicité du 1,1,2,2-tétrachloroéthane se traduit sur des rats exposés à 9 000 ppm pendant 2 heures, 2 fois par jour, pendant quatre semaines, par des pertes de conscience (Horiuchi et al., 1962). Un singe, exposé 2 heures par jour à une concentration de 1 974 ppm pendant 9 mois, a présenté les mêmes symptômes dès la 15ième séance d’exposition (Horiuchi et al., 1962). Des auteurs ont observé une augmentation de l’activité de la corticotrophine au niveau de l’hypophyse de rats exposés par inhalation à une dose de 13,3 mg/kg/j de tétrachloréthane pendant une période allant jusqu’à 325 jours. Les animaux ont également présenté une diminution réversible de la masse corporelle, une augmentation de la teneur du foie en lipides et des altérations des paramètres hématologiques, qui n’ont toutefois différé de façon significative par rapport aux témoins qu’à un seul moment durant l’étude (Schmidt et al., 1972). Une gêne respiratoire a pu être observée chez des rats exposés chroniquement (78 semaines) à des doses élevées supérieures à 108 mg/kg/j de 1,1,2,2-tétrachloroéthane. Parfois accompagnée de sécrétions nasales, cette gêne était présente dès la première année d’exposition, et s’est accentuée avec le vieillissement des animaux (NCI, 1978). Des effets immunologiques, dont l’importance n’est pas nette, ont été signalés chez des lapins soumis pendant 8 mois à l’inhalation de concentrations de 10 et de 100 mg/m3 (1 à 150 ppm) de 1,1,2,2-tétrachloroéthane (Shmuter, 1977 ; Kulinskaya et Verlinskaya, 1972).
Voie orale
FDTE/VTR Importer Les résultats préliminaires d’une étude subchronique (6 semaines) réalisée avant des essais biologiques à long terme, ont montré que l’ingestion de 1,1,2,2-tétrachloroéthane dans l'huile (gavage) n’a eu aucun effet sur le gain pondéral chez des souris, pour des doses allant jusqu'à 1 316 mg/kg/j. Chez les rats par contre, un ralentissement du gain pondéral a été observé dès 100 mg/kg/j chez les femelles et dès 178 mg/kg/j chez les mâles (NCI, 1978). Cependant, les effets d’une exposition à long terme (78 semaines) se sont révélés sévères, dans la mesure où 33 sur 50 des souris de l’étude n’ont pas survécu à une exposition de 284 mg/kg/j (NCI, 1978). Des lésions histologiques mineures ont été signalées au niveau du foie, des reins et de la glande thyroïde de rats ayant reçu par voie orale, pendant des périodes de 2 à 150 jours, des doses de 1,1,2,2-tétrachloréthane allant de 3,2 à 8 mg/kg/j (Gohkle et al., 1977) toutefois, les résultats de cette étude étant mal étayés, il est impossible de valider une relation dose-effet.
Synthèse
FDTE/VTR Importer Le foie est chez l’animal l’organe cible majeur de la toxicité du 1,1,2,2-tétrachloroéthane administré par inhalation ou par voie orale.
Effets systémiques du 1,1,2,2-tétrachloroéthane
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
| IARC | FDTE/VTR Importer Groupe 3: ne peut être classée pour sa cancérogénicité pour l'homme | 1987 |
| US EPA | FDTE/VTR Importer Classe C: cancérigène possible pour l’homme | 1995 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Chez l'homme, il n'existe pas d'étude épidémiologique adéquate, portant sur la cancérogénicité du tétrachloroéthane (ATSDR, 1996).
Inhalation
FDTE/VTR Importer Une augmentation de la mortalité non significative sur le plan statistique, attribuable à des cancers des organes génitaux, à des leucémies et à d’autres cancers d’origine lymphatique ont été signalées dans un groupe de 1 099 travailleurs exposés aux vapeurs de 1,1,2,2,tétrachloroéthane (Norman et al., 1981). Les résultats sont cependant difficiles à interpréter car les niveaux d'exposition n'ont pas été mesurés et les personnes ont pu être exposées à d'autres agents chimiques.
Chez l'animal
Voie orale
FDTE/VTR Importer Chez l'animal, une augmentation de l’incidence des carcinomes hépatocellulaires a été observée chez des souris B6C3F1, mâles et femelles, ayant reçu pendant 78 semaines, par gavage à l’huile de maïs, des doses quotidiennes moyennes pondérées en fonction du temps de 142 et 282 mg/kg/j de 1,1,2,2-tétrachloroéthane. Les incidences étaient respectivement chez les mâles et les femelles de 1/18 et 0/20 dans le groupe témoin recevant le véhicule, de 13/50 et 30/48 pour les animaux recevant la dose faible et de 44/49 et 43/47 pour ceux recevant la dose forte (NCI, 1978). Par contre aucune augmentation significative de l’incidence tumorale n’a pu être observée sur des rats Osborne-Mendel mâles et femelles ayant reçu pendant 78 jours, de la même façon, du tétrachloréthane à raison de 62 et 108 mg/kg/j et 43 et 76 mg/kg/j respectivement. Cependant, dans le groupe ayant reçu la dose forte, les auteurs ont observé des carcinomes hépatocellulaires chez deux mâles et un nodule néoplasique hépatique chez un mâle (NCI, 1978). Les résultats de cette étude ont conduit à une classification un peu divergente entre l’IARC, qui considère qu’il n’est pas possible d’évaluer la pertinence pour l’homme des cas de carcinomes observés chez la souris (groupe 3), et l’US EPA (IRIS), (1995) qui classe le 1,1,2,2-tétrachloroéthane dans la classe C des substances possiblement cancérogènes pour l’homme.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune information n’est disponible concernant la toxicité du 1,1,2,2-tétrachloéthane sur les fonctions de reproduction et le développement fœtal chez l’homme (ATSDR, 1996).
Chez l'animal
Inhalation
FDTE/VTR Importer Des modifications histologiques des testicules ont été signalées chez des rats exposés à ce composé à raison de 2 ppm pendant 10 jours (Schmidt et al., 1972). A l'inverse, aucun effet n'a été noté sur les organes génitaux mâles ou femelles de rats exposés à une concentration de 6 310 ppm pendant 30 minutes (Price et al., 1978). Aucun changement histologique n'a été décelé au niveau testiculaire chez un singe exposé à des doses de 1 000 ppm à 4 000 ppm (6 980 à 27 920 mg/m3) durant 9 mois (Horiuchi et al., 1962). Aucune valeur de NOAEL ou LOAEL ne peut être établie à partir des protocoles suivis et des résultats obtenus dans ces études.
Voie orale
FDTE/VTR Importer Par voie orale, les résultats sont également très discordants. Une première étude, peu fiable, a montré chez des rats exposés à des doses de 3,2 mg/kg/j, 82 jours sur 120, une incidence élevée d’œdème testiculaire, une atrophie des tubes séminifères avec une nécrose partielle, et des altérations de la spermatogenèse (Gohlke et al., 1977). Au cours d’une étude d’exposition chronique (78 sem), aucune altération clinique ou histologique des organes reproducteurs n’a été observée chez les rats mâles recevant 108 mg/kg/j, les rats femelles recevant 76 mg/kg/j ou les souris mâles et femelles recevant 284 mg/kg/j (NCI, 1978).
Synthèse
FDTE/VTR Importer Les données disponibles ne suffisent pas pour permettre d’évaluer les effets d’une exposition au 1,1,2,2-tétrachloroéthane sur la reproduction ou le développement sur l’animal par l’une ou l’autre des voies d’exposition.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
VGE/NQE Importer
SANTE HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
TOXICITE
Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. Contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte.
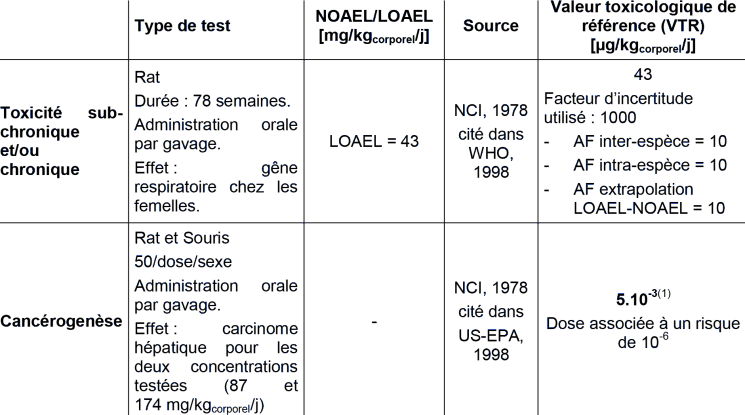
(1) Valeur ERU (Excès de Risque Unitaire) déterminée par US-EPA, 1998.

FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. L'INERIS présente en première approche les VTR publiées par l'ATSDR, l'US EPA et l'OMS. En seconde approche, les VTR publiées par d'autres organismes, notamment Santé Canada, le RIVM et l'OEHHA, peuvent être retenues pour la discussion si des valeurs existent. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition subchronique par inhalation
L’ATSDR propose un MRL de 0,4 ppm (2,8 mg/m3) pour une exposition subchronique par inhalation (1996).
Le MRL a été calculé à partir d’un LOAEL de 130 ppm qui prend en compte la présence de lésions histologiques au niveau du foie chez le rat Sprague-Dawley femelle, exposé 6 h/j, 5 j/sem pendant 15 semaines au 1,1,2,2-tétrachloroéthane (Truffert et al., 1977).
Facteurs d’incertitude : un facteur de 300 a été appliqué (10 pour l’extrapolation de données animales vers l’homme, 10 pour la variabilité intra-espèces et 3 pour l’utilisation d’un LOAEL).
Effets à seuil - Exposition chronique par inhalation
L’ATSDR propose un MRL par voie orale de 0,04 mg/kg/j pour une exposition chronique (1996).
Cette valeur a été établie à partir d’une étude de toxicité chronique mentionnant une gêne respiratoire ressentie par des rats femelles exposées pendant 78 semaines au 1,1,2,2-tétrachloroéthane administré par gavage. Un LOAEL de 43 mg/kg/j a été déterminée chez les femelles (NCI, 1978).
Facteurs d’incertitude : un facteur de 1 000 a été appliqué (10 pour l’utilisation d’un LOAEL, 10 pour l’extrapolation de données animales vers l’homme et 10 pour la variabilité au sein de la population).
Effets à seuil - Exposition subchronique par voie orale.
L’ATSDR propose un MRL par voie orale de 0,6 mg/kg/j pour une exposition subchronique (1996).
Cette valeur est basée sur l’observation de la perte pondérale de rats exposés 6 semaines au 1,1,2,2-tétrachloroéthane administré par gavage. Un NOAEL de 56 mg/kg/j a été déterminé chez les femelles (NCI, 1978).
Facteurs d’incertitude : un facteur de 100 a été appliqué (10 pour l’extrapolation de données animales vers l’homme et 10 pour la variabilité au sein de la population).
Effets sans seuil - Exposition chronique par inhalation
L’US EPA (IRIS) propose une valeur d’excès de risque unitaire par inhalation (ERUi) de 5,8.10-5 (µg/m3)-1 (1994).
Cette valeur a été calculée à partir de l’étude par voie orale du NCI (1978) ayant également conduit au calcul d’un ERU par voie orale (voir ERUo).
Selon les recommandations de l’US EPA (IRIS), le risque unitaire ne devrait pas être utilisé si la concentration dans l’air dépasse 2.102 µg/m3 (non approprié).
L'OEHHA propose un ERUi de 5,8.10-5 (µg/m3)-1 pour une exposition par inhalation (2002).
Cette valeur est identique a celle de l'US EPA et se base sur la même étude de cancérogénèse (NCI, 1978) et la même méthodologie d'évaluation.
Effets sans seuil - Exposition chronique par voie voie orale
L’US EPA (IRIS) propose une valeur d’excès de risque unitaire par voie orale (ERUo) de 2.10-1 (mg/kg/j) –1 et une valeur d’excès de risque unitaire par ingestion d’eau contaminée (ERUeau) de 5,8.10-6 (µg/L)-1 (1994).
Ces valeurs ont été calculées à partir de l’étude du NCI (1978) qui a montré, aux deux concentrations de 87 et 174 mg/kg/j de 1,1,2,2-tétrachloroéthane administrées par gavage, une augmentation de l’incidence de carcinomes hépatocellulaires sur des souris femelles.
Les doses administrées ont été ajustées en terme de fréquence (5 jours/7) et de durée d'exposition (546 jours pour une espérance de vie de 637). Le poids moyen des animaux a été estimé à 0,03 kg. La dose équivalente chez l'homme a été ajustée au poids corporel par la formule (0,03 / 70 kg) x 1/3.
Méthode d‘extrapolation : modèle multiétape linéarisé.
Selon les recommandations de l’US EPA (IRIS), le risque unitaire ne devrait pas être utilisé si la concentration dans l’eau dépasse 2.103 µg/L (non approprié).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
-
Effets endocriniens :
Le 1,1,2,2-tétrachloroéthane n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Critères PBT / POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
Normes de qualité existantes :
Allemagne : Norme de qualité pour les eaux prélevées destinées à la consommation = 10 µg.L-1
Etats-Unis : Normes de qualité pour la consommation d'eau et de poissons = 0.17 µg.L-1
Etats-Unis : Norme de qualité pour la consommation de poisson et la protection de la santé humaine = 11 µg.L-1
(ETOX, 20073)
Substance(s) associée(s) :
-
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement bioaccumulables, et qui peuvent être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement. Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[3] Les données issues de cette source () ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS. http://webetox.uba.de/webETOX/index.do
FDTE/VTR Importer L'objectif de ce document est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme.
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon, uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées ont fait l'objet d'une validation.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
ECOTOXICITE AQUATIQUE AIGUË
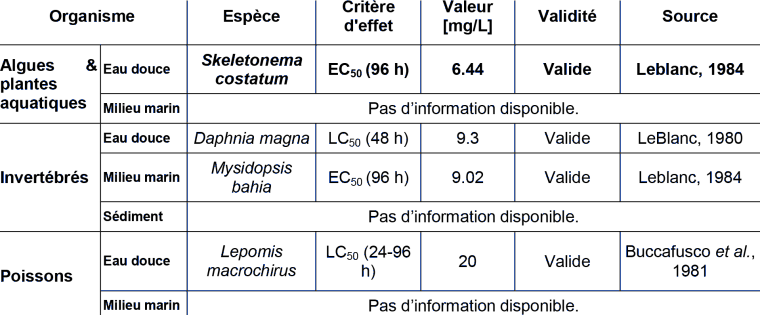
ECOTOXICITE AQUATIQUE CHRONIQUE

FDTE/VTR Importer Paramètres d’écotoxicité aiguë
Algues
Leblanc (1984) utilise des données issues de diverses publications pour comparer la sensibilité des espèces à divers polluants. Cependant, un certain nombre de ces résultats sont issus d'essais réalisés en conditions statiques, sans suivi analytique des concentrations. La validité. de ces essais est donc incertaine.
Behechti et al., (1995) ont réalisé des essais en flacons fermés pour limiter la volatilisation. Les résultats sont basés sur les concentrations mesurées en début d'essai. La validité de ces essais est donc incertaine.
Crustacés
L’essai sur daphnies rapporté par Richter et al., (1983) (décrit dans Ahmad et al., 1984) a été réalisé en système fermé et les résultats sont basés sur des concentrations mesurées. Les essais réalisés par Leblanc sont réalisés en système statique mais fermés et sont exprimés en concentrations nominales. Les résultats de ces essais sont similaires.
Poissons
Les essais de Geiger et al., (1985) ont été réalisés dans des systèmes dynamiques avec contrôle analytique des concentrations.
Buccafusco et al., (1981) expriment leurs résultats en concentrations nominales et leurs essais ont été réalisés dans des conditions statiques. Cependant ils ont recouvert leurs aquariums d'essai afin de limiter la volatilisation des substances testées. Il n'est pas possible d'estimer l'efficacité de leur dispositif. La CL50 estimée est la même après 24 et 96 heures d'exposition. D'autres résultats ayant été jugés moins pertinents ne sont pas présentés.
Il n'existe pas de résultat d'essais valide vis à vis des organismes benthiques.

Paramètres d’écotoxicité chronique
Le résultat de Behechti et al., (1995) est basé sur les concentrations mesurées en début d'essai dans des flacons fermés.
L’essai de Richter et al., (1983) sur Daphnia magna a été réalisé en système fermé et les résultats sont basés sur des concentrations mesurées.
Ahmad et al., (1984) rapportent des essais réalisés en système continu avec mesures des concentrations dans le milieu d'essai. Ces essais sont donc valides.
L'essai réalisé par Noack (1990) a été effectué en système semi-statique et les résultats sont exprimés en concentrations théoriques.

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Sol
FDTE/VTR Importer Il n'existe pas de résultats d'essai valides vis à vis des organismes terrestres.
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES

(1) NOAEL : No Observed Adverse Effect Level
(2) La NOAELcorr correspond à la NOAEL déduite à partir de la LOAEL. Cette étude est à l'origine de la VTR qui a été déterminée par l'US-EPA. L'US-EPA a proposé un facteur de 10 pour extrapoler de la LOAEL à la NOAEL.
TOXICITE ORALE POUR LES OISEAUX

(1) NOAEL : No Observed Adverse Effect Level; LOAEL : Low Observed Adverse Effect Level
Les données de toxicité autres que pour les effets cancérogènes sont réduites, et comme le souligne l'OMS (WHO, 1998), étant donné les limites des études disponibles sur le potentiel toxicologique des effets associés à l'exposition au 1,1,2,2-tétrachloroéthane, il n'est pas possible de déterminer avec certitude un NOAEL ou LOAEL pour les effets non cancérigènes. En effet, l'end-point toxicologique pour lequel la relation dose-réponse est la mieux caractérisée est l'augmentation des carcinomes hépatocellulaires observés dans l'étude du NCI, 1978 (étude à l'appui pour l'ERU, cf. Santé humaine).
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), la sensibilité des espèces marines à la toxicité des substances organiques peut être considérée comme équivalente à celle des espèces dulçaquicoles, à moins qu'une différence ne soit montrée.
![]()
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour le 1,1,2,2-tétrachloroéthane, on dispose de données aiguës et chroniques pour trois niveaux trophiques. En aigu les algues semblent être les plus sensibles alors qu'en chronique se sont les poissons. Cependant, on n'observe pas de différence de sensibilité marquée entre les différents taxa. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 est appliqué sur la plus faible NOEC disponible (NOEC (33j) à 1,4 mg.L-1 obtenue pour Pimephales promelas) pour calculer la AA-QSwater_eco. L'INERIS propose donc la valeur suivante :
![]()
En ce qui concerne les organismes marins une seule donnée aigue est disponible (invertébrés). Le jeu de données disponible ne permet pas de mettre en évidence une différence de sensibilité entre les espèces marines et dulçaquicoles. Pour le milieu marin, le facteur d'extrapolation appliqué doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d'espèces plus importante. Par conséquent et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) un facteur d'extrapolation de 100 est appliqué sur la plus faible NOEC disponible (NOEC (33j) à 1,4 mg.L-1 obtenue pour Pimephales promelas pour calculer la AA-QSmarine_eco. L'INERIS propose donc la valeur suivante :
![]()
Concentration Maximum Acceptable (MAC et MACmarine) :
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
Pour le 1,1,2,2-tétrachloroéthane, on dispose de données aiguës pour trois niveaux trophiques. La plus faible donnée est prise en compte pour le calcul de la MAC, soit l'EC50 (96h) de 6.44 mg.L-1 obtenue pour Skeletonema costatum. Par défaut, un facteur d'extrapolation de 100 s'applique pour
calculer la MAC. Cependant, selon le document guide technique pour la détermination des normes de qualité environnementale (E.C., 2011), pour les substances qui n'ont pas de mode d'action spécifique et pour lesquelles les données disponibles montrent que la variation interspécifique est faible, le facteur peut être diminué. Pour le 1,1,2,2-Tetrachloroéthane, l'écart-type des valeurs Log de L(E)C50 est < 0.5 et cette variation peut être considérée comme faible.
Cependant, bien que la substance ne soit pas classée comme cancérogène selon l'Annexe VI du Règlement (CE) No 1272/2008 (C.E., 2008), la VTR déterminée par l'US-EPA est fondée sur une augmentation des carcinomes hépatiques. En conséquence, vu le potentiel cancérogène de la substance, le groupe d'experts considère que la présence dans l'eau de telles substances doit être limitée et recommande que le facteur d'extrapolation soit maintenu à 100 pour calculer la MAC. La valeur suivante est donc proposée :
![]()
Le guide européen pour la détermination des NQE (E.C.2011) indique qu'il n'est pas recommandé de préconiser une MAC qui soit inférieure à l' AA-QSwater_eco et qu'il est préférable, le cas échéant, de fixer MAC = AA-QSwater_eco.
![]()
En ce qui concerne les organismes marins une seule donnée est disponible (invertébrés). Le jeu de données disponible ne permet pas de mettre en évidence une différence de sensibilité entre les espèces marines et dulçaquicoles. Pour le milieu marin, le facteur d'extrapolation appliqué doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d'espèces plus importante. Par conséquent et selon le même raisonnement que pour l'eau douce, un facteur d'extrapolation de 1000 est appliqué pour déterminer la MACmarine. L'INERIS propose donc la valeur suivante :
![]()
Le guide européen pour la détermination des NQE (E.C.2011) indique qu'il n'est pas recommandé de préconiser une MACmarine qui soit inférieure à l'AA-QSmarine_eco et qu'il est préférable, le cas échéant, de fixer MAC = AA-QSmarine_eco.
![]()
![]()
NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2011). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés (E.C., 2011).
Pour le 1,1,2,2-tétrachloroéthane, il est proposé d'appliquer un facteur de sécurité intermédiaire de 60 pour prendre en compte la durée du test retenu (NOEC = 86 mg.kg-1biota) de 1 an et demi sur le rat. Comme indiqué ci-dessus, la caractérisation de l'effet dose/réponse est difficile pour cette étude et bien que le facteur choisi par l'US-EPA pour extrapoler de la LOAEC à la NOAEC soit élevé et donc relativement protecteur, la valeur calculée ci-après doit être considérée avec précaution :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- àune concentration dans l'eau douce selon la formule suivante :
- àune concentration dans l'eau marine selon la formule suivante :
![]()
Avec :
BCF : facteur de bioconcentration,
1 BMF: facteur de biomagnification,
2 BMF: facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF1 et le BMF2, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le 1,1,2,2-tétrachloroéthane, un BCF de 13.2 et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc :
![]()
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané).
Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 0.005 µg/kgcorporel/j (cf. tableau ci-dessus),
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Le résultat d'un test de cancérogénicité a été retenu pour déterminer la VTR. Par conséquent, aucun facteur supplémentaire ne sera appliqué ici.
- Cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
Pour le 1,1,2,2-tétrachloroéthane, le calcul aboutit à :
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- àune concentration dans l'eau douce selon la formule suivante :
- àune concentration dans l'eau marine selon la formule suivante :
![]()
Pour le 1,1,2,2-tétrachloroéthane, on obtient donc:
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1).
Il n'existe aucune norme de qualité pour la protection de la santé humaine vis-à-vis de la consommation d'eau potable pour le 1,1,2,2-tétrachloroéthane fixée par la directive 98/83/CE ou par l'OMS.
A titre de comparaison, la valeur seuil provisoire pour l'eau de boisson est calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 0.005 µg/kgcorporel/j (cf. tableau ci-dessus),
- Cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
- Fsécurité : facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Le résultat d'un test de cancérogénicité a été retenu pour déterminer la VTR. Par conséquent, aucun facteur supplémentaire ne sera appliqué ici.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
Ainsi, la norme de qualité correspondante dans l'eau brute se calcule de la manière suivante :
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le 1,1,2,2-tétrachloroéthane, on obtient :
![]()
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
VGE/NQE Importer
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE) (C.E., 2000).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature pour les organismes aquatiques.
A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que:
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (E.C., 2011) :
![]()
RHOsed : masse volumique du sédiment en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 1300 kg.m-3 .
Ksed-eau : coefficient de partage sédiment/eau en m 3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par le guide technique européen (E.C., 2011) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.8 + 0.025 * Koc soit Ksed-eau = 2.77 m 3/m3
Pour le 1,1,2,2-tétrachloroéthane, on obtient :
![]()
QSsed wet weight = 299 µg.kg-1poids humide
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0.2 m 3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour le 1,1,2,2-tétrachloroéthane, la concentration correspondante en poids sec est :
![]()
Selon la même approche que pour le sédiment d'eau douce, une valeur guide de qualité pour le sédiment marin peut être calculée selon la formule suivante :
![]()
Pour le 1,1,2,2-tétrachloroéthane, on obtient :
![]()
QSsed-marin wet weight = 29.9 µg.kg-1poids humide
La concentration correspondante en poids sec est alors la suivante:
QSsed-marin dry weight = 77.7 µg.kg-1sed poids sec
Le log Kow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
![]()
PROPOSITION DE VALEUR GUIDE ENVIRONNEMENTALE (VGE)
La VGE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
![]()
Pour le 1,1,2,2-tétrachloroéthane, les normes de qualité pour la protection de la santé humaine vis-à-vis de la consommation de produits de la pêche et d'eau potable sont les valeurs les plus faibles pour l'ensemble des approches considérées. On notera que celle-ci est largement protectrice par rapport à la valeur indicative déterminée pour la protection des prédateurs par empoisonnement secondaire.
VALEURS GUIDES POUR LES ORGANISMES BENTHIQUES
Avec un Koc de 79 L.kg-1 et un log Kow de 2.51, la mise en œuvre d'un seuil pour les organismes benthiques n'est pas recommandée par le document guide européen (E.C., 2011).
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










