Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
1,1-dichloroéthylène (75-35-4)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
75-35-4
Nom scientifique (FR)
1,1-Dichloroéthylène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-864-0
Code SANDRE
1162
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C2H2Cl2 }\)
Code InChlKey
Code SMILES
C(=C)(Cl)Cl
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H224 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs extrêmement inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H332 |
|---|---|
| Mention du danger - Texte | Nocif par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
96.94 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 15/04/2024
Matrices
Milieu eau douce
VGE/NQE Importer
Volatilisation :
Le 1,1-dichloroéthylène est très volatil.
FDTE/VTR Importer Le 1,1-dichloroéthylène est très soluble dans l'eau.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
VGE/NQE Importer
Adsorption :
La valeur de Koc du 1,1-dichloroéthylène est faible : 65 L.kg-1 (Hempfling et al 1997) . Cette substance n'aura donc pas tendance à s'adsorber de façon importante sur les sédiments et les particules en suspension dans l'eau.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
FDTE/VTR Importer Etant donné la large étendue des valeurs de son Koc, sa mobilité dans le sol ne peut être appréciée.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
VGE/NQE Importer
Biodégradabilité :
Pour éviter les pertes d’une substance volatile durant un essai de biodégradation, la méthode de la fiole fermée est la plus adaptée.
L’analyse des résultats des tests permet de conclure que le 1,1-dichloroéthylène n’est pas facilement biodégradable dans les eaux de surface car 0 % de la substance a été dégradée après 28 jours lors de deux essais en fiole fermée (CITI, 1992 ; IUCLID, 2000 ; OCDE 301C ; OCDE 301D).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
VGE/NQE Importer
Hydrolyse :
Un temps de demi-vie de 6 à 9 mois a été observé sans aucune différence notable de valeur pour des pH variant de 4,5 à 8,5.(Cline et Delfino, 1987)
Il est à noter que ces valeurs diffèrent sensiblement de la valeur estimée à pH 7 (DT50 estimée = 2 ans) (Schmidt-Bleek et al., 1982).
Photodégradation :
Dans l'air, il est dégradé rapidement par photo-oxydation, par réaction avec les radicaux hydroxyles OH (DT50 = 11 heures dans de l'air relativement sain) (Edney et al., 1983).
En cas de présence de smog (air pollué), sa DT50 peut descendre à 2 heures (réaction avec le NO2) (Gay et al., 1976). Les produits formés peuvent alors être du chlorure de chloracétyle, de l'oxychlorure de carbone, du formaldéhyde, de l'acide formique, de l'acide chlorhydrique, du monoxyde de carbone et de l'acide nitrique.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
FDTE/VTR Importer Eaux de surface :
Milieu anaérobie :
Dans des conditions simulant une eau souterraine (milieu anaérobie), 50 % du 1,1-dichloroéthylène a disparu en 5-6 mois (Barrio-Lage et al., 1986). Le produit de cette dégradation est du chlorure de vinyle (chloroéthylène).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Un BCF de 2,5 à 6,4 est rapporté sur Cyprinus carpio (CITI, 1992) Pour les poissons, Atri (1985) enregistre un facteur de bioconcentration compris entre 4 et 6,9. Une estimation du BCF pour les poissons de 7 est obtenue à l'aide d'une relation de type structure- activité quantitative (CE, 1996) et du log Kow de 1,85. Le 1,1 dichloroethylène est donc peu bioaccumulable dans les poissons.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucun résultat d'essai valide n'a pu être trouvé dans la littérature.
Conclusion sur la bioaccumulation
VGE/NQE Importer
Bioaccumulation :
Un BCF de 2,5 à 6,4 est rapporté sur Cyprinus carpio (CITI, 1992). Pour les poissons, Atri enregistre un facteur de bioconcentration compris entre 4 et 6,9 (Atri, 1985).
Une estimation du BCF pour les poissons de 7 est obtenue à l'aide d'une relation de type structure-activité quantitative et du log Kow de 1,85.
Le 1,1-dichloroéthylène est donc peu bioaccumulable dans les poissons.
Un BCF de 6,9 est utilisé dans la détermination des normes de qualité.
En l'absence de valeur mesurée, le document guide technique européen pour la dérivation des NQE recommande l'utilisation des valeurs par défaut suivantes pour ce qui est de la prise en compte de la biomagnification : BMF1 = BMF2 = 1 (E.C., 2011)
Bibliographie
Toxicologie
Dernière vérification le 27/05/2024
Introduction
L’ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2009, 2022 ; IARC, 1987, 2019 ; OMS CICAD, 2003 ; OMS IPCS, 1989, 1990 ; US EPA (IRIS), 2002). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Aucune donnée n’a été identifiée, aussi bien par inhalation que par les voies orale et/ou cutanée.
Distribution
La toxicocinétique du 1,1-dichloroéthylène n'est pas décrite chez l'homme pour l'une ou l'autre des voies d'exposition.
Métabolisme
Aucune donnée n’a été identifiée.
Élimination
Aucune donnée n’a été identifiée.
Chez l'animal
Absorption
Par inhalation, le 1,1-dichloroéthylène est rapidement absorbé par les poumons. Chez le rat, entre 25 et 150 ppm (100 et 600 mg.m-3), le taux d'absorption, proche de 100 %, décroît progressivement pour atteindre un taux de 75 à 80 % après environ 1 heure d'exposition. Pour des expositions plus fortes (300 ppm), ce taux n’est jamais atteint, et décroît progressivement au cours du temps (Dallas et al., 1983). Ceci indique une saturation de l’absorption à de fortes concentrations.
L'administration orale de 1,1-DCE dans l'huile à des doses de 10 à 100 mg.kg-1 conduit à une absorption rapide et complète (Jones et Hathway, 1978a, 1978b ; Putcha et al., 1986). L’absorption d’une dose de 200 mg.kg-1 en solution aqueuse est également très rapide, comme en témoigne un fort pourcentage de la dose présent dans l’air exhalé au cours des 15 premières minutes (Chieco et al., 1981 ; Jones et Hathway, 1978a ; Reichert et al., 1979). L’utilisation de 1,1-DCE radiomarqué a permis de quantifier un taux d’absorption proche de 100 % (McKenna et al., 1978a).
Sans pouvoir s’appuyer sur des preuves expérimentales, les propriétés physico-chimiques du 1,1-DCE sont compatibles avec un passage transcutané (US EPA (IRIS), 2002).
Distribution
Après pénétration dans l’organisme par inhalation ou ingestion, le 1,1-dichloroéthylène ou ses métabolites se repartissent préférentiellement dans le foie et les reins, puis sont redistribués dans l’organisme au niveau de tous les tissus (McKenna et al., 1978b ; Jones et al., 1978b).
Métabolisme
Le métabolisme hépatique comprend plusieurs voies.
Dans le foie et le poumon, la voie principale met en jeu les monooxygénases dépendantes du cytochrome P450 (CYP), majoritairement le CYP2E1 et conduit à un époxyde instable, l’époxyde de DCE (Kainz et al., 1993), au chlorure de 2-chloroacétyl et au 2,2-dichloroacétaldéhyde (Costa et Ivanetich, 1982 ; Dowsley et al., 1995a ; Liebler et al., 1985 ; Liebler et al., 1988, Simmonds et al., 2004). Chez la souris, la liaison de l’époxyde aux protéines du foie et du poumon a été corrélée au taux de CYP2E1 (Forkert, 2001 ; Forkert et Boyd, 2001). L’époxyde peut être hydraté en présence d’époxyde hydrolase avec formation d’alcool ou également conjugué à la glutathion S-transférase (GST). Comme présenté dans la Figure 1, des complexes au glutathion réduit (GSH-conjugués) sont formés, tels que le S-(2,2-dichloro-1-hydroxy) éthylglutathion [A], le 2-(S-glutathionyl)acétyl glutathion [B], le 2-S-glutathinyl acétate [C], ou le S-(2-chloroacétyl)-glutathion [D] (Forkert, 1999a, 1999b), libérés dans le plasma, puis éliminés par filtration glomérulaire au niveau du rein (Dekant et al., 1989).
Dans les reins, ces conjugués via la b-lyase peuvent être la source de la formation de nouvelles molécules instables (thiols) réactives. Les principaux métabolites qui résultent de ces transformations sont l’acide thioglycolique, le N-acétyl-S-(2 carboxy-méthyl)cystéine et l’acide monochloroacétique. Certains de ses complexes ont été identifiés : S-carboxyméthyl glutathion, S-(cystéinylacétyl)glutathion et un produit de réarrangement intramoléculaire du métabolite S-(2-chloroacétyl)glutathion (Jones et al., 2003). Pour des expositions par voie orale, il a été montré que la souris métabolise plus rapidement que le rat (Jones et Hathway, 1978a).
schéma métabolique du 1,1-DCE chez les rongeurs (d’après IARC, 2019 ; NTP, 2015) :
Élimination
Aux concentrations comprises entre 25 et 150 ppm (100 et 600 mg.m-3) par inhalation, ou à 1 mg.kg-1 par voie orale, l’élimination après métabolisation s’effectue très majoritairement par les voies urinaire (44 et 80 %) et biliaire (8 à 16 %). Moins de 1 % de 1,1-DCE est présent dans l’air exhalé (Dallas et al., 1983 ; Jones et Hathway, 1978b ; McKenna et al., 1978a ; Reichert et al., 1979). Cependant, lorsque dans ces mêmes études les expositions atteignent 200 à 300 ppm (800 à 1 200 mg.m-3), ou 50 mg.kg-1, la tendance s’inverse et un fort pourcentage de 1,1-DCE non métabolisé (entre 16 et 30 % par voie orale) est alors présent dans l’air exhalé. Ce qui témoigne d’un métabolisme oxydatif saturable (Andersen et al., 1979 ; D'Souza et Andersen, 1988 ; Dallas et al., 1983 ; McKenna et al., 1977b).
Synthèse
Il n’existe pas de données humaines.
Chez l’animal, le 1,1-DCE est bien absorbé par inhalation et par voie orale. Le 1,1-DCE se distribue dans tout l’organisme et de manière préférentielle dans le foie et les reins. La métabolisation est hépatique ; la voie principale passe par les cytochromes P450 (CYP2E1) et la formation d’un époxyde instable puis de complexes GSH-conjugués pouvant aboutir à la génération de conjugués thiols. L’élimination est majoritairement urinaire. La métabolisation apparaît saturable et à de fortes concentrations, le 1,1-DCE est également exhalé.
Toxicité aiguë
Chez l'homme
Inhalation
Il existe très peu de cas d’intoxication aiguë par inhalation au 1,1-DCE décrits dans la littérature.
L’exposition à de fortes concentrations (4 000 ppm soit 16 000 mg.m-3) entraîne une rapide dépression du système nerveux central (SNC) qui se traduit par un état d’ébriété et précède souvent une perte de conscience (Gibbs et Wessling, 1983). En général, les symptômes disparaissent avec l’arrêt de l’exposition et la récupération est rapide.
Le 1,1-DCE entraîne également par inhalation une inflammation des muqueuses de l’appareil respiratoire (HSDB, 2018). Mais son pouvoir irritant vis à vis des yeux, de la peau et des voies respiratoires (25 ppm soit 100 mg.m-3) semble être dû, au moins en partie, à la présence de para-méthoxyphénol utilisé comme stabilisateur (OMS IPCS, 1990).
Les résultats des études de toxicité aiguë chez l’animal permettent de supposer que les effets toxiques du 1,1-DCE peuvent se manifester chez l’homme bien en dessous du seuil olfactif minimum, qui se situe aux environs de 2 000 mg.m-3 (OMS IPCS, 1990).
Voie orale
L'ingestion du liquide provoque des douleurs abdominales, des maux de gorge et peut s'accompagner d'une pneumopathie d'inhalation (OMS IPCS, 1993).
Voie cutanée
Par contact, les seules informations concernent son pouvoir irritant vis à vis de la peau et des yeux (conjonctivite et dommages cornéens réversibles)(US EPA, 1979).
Synthèse
Chez l’homme, l’exposition à de fortes concentrations de 1,1-DCE (4 000 ppm soit 16 000 mg.m-3) entraîne une rapide dépression du SNC, réversible qui se traduit par un état d’ébriété et précède souvent une perte de conscience.
Chez l'animal
Inhalation
Par inhalation, les concentrations létales de 1,1-DCE varient considérablement selon les espèces, les souches, le sexe et l’état de jeûne des animaux.
Chez le rat, les CL50 fluctuent chez les mâles entre 6 000 et 8 000 ppm (environ 24 000 et 32 000 mg.m-3) selon les souches pour des expositions de 4 heures, alors qu’elles se situent chez les femelles autour de 10 000 ppm (40 000 mg.m-3) (Siegel et al., 1971 ; Zeller et al., 1979a).
La souris présente par ailleurs une sensibilité au 1,1-DCE bien plus importante que le rat avec des CL50 de 115 ppm (environ 460 mg.m-3) chez le mâle et 200 ppm (environ 800 mg.m-3) chez la femelle (4 heures d’exposition) (Henschler, 1979). Dans les mêmes conditions, les CL50 chez le hamster sont de 1 660 ppm chez les mâles et 2 945 ppm chez les femelles (Klimisch et Freisberg, 1979a).
Les animaux exposés présentent des lésions localisées au niveau du foie, organe cible principal, des reins et du SNC.
L’hépatotoxicité du 1,1-DCE, mise en évidence par les analyses biochimiques et histologiques, est très bien documentée. La gravité des lésions histologiques augmente en même temps que les concentrations d’exposition. Une dilatation de la région centro-lobulaire est rapportée chez les souris mâles (espèce sensible) dès une exposition unique de 6 heures à 50 ppm (soit 200 mg.m-3) par inhalation en continu. Cet effet n’est pas observé à 10 ppm soit 40 mg.m-3 (Reitz et al., 1980). Dans les études du NTP, les rats et les souris ont été exposés à des concentrations de 1,1-DCE de 25 à 400 ppm (100 à 1 600 mg.m-3), 6 heures par jour, 5 jours par semaine pendant 2 semaines (NTP, 2015). L’augmentation de la mortalité est associée à une nécrose hémorragique centro-lobulaire chez le rat. Dès la plus faible dose testée de 25 ppm (100 mg.m-3), les rats présentent des altérations cytoplasmiques centro-lobulaires (baisse de la coloration, halos périnucléaires, cytoplasme floculant) et à cette même dose, une augmentation significative du poids du foie est rapportée chez les souris mâles (LOAEL). Ces lésions sont accompagnées d’une augmentation sérique d’enzymes hépatiques (sorbitol déshydrogénase, ornithine carbamoyl transférase) (Jackson et Conolly, 1985 ; Jaeger et al., 1977a ; Jaeger et al., 1977b). La mise à la diète des animaux avant l’exposition augmente très nettement les effets délétères du 1,1-DCE au niveau du foie et semble être directement associée à un déficit en GSH qui participe activement à la détoxication du 1,1-DCE décrit précédemment (Jaeger et al., 1974 ; Reynolds et al., 1980 ; McKenna et al., 1977a).
Les lésions rénales peuvent également être très sévères, particulièrement chez les souris mâles, avec l’apparition des premières nécroses dès une exposition unique de 6 heures à 10 ppm (40 mg.m-3), la fréquence et l’intensité des lésions étant plus marquées à 50 ppm (200 mg.m-3) (Reitz et al., 1980 ; Short et al., 1977c ; Watanabe et al., 1980). Elles sont également associées à la diminution de certaines activités enzymatiques (mono-oxygénase et époxyde hydrolase), l’augmentation du poids des reins et des lésions histologiques focalisées au niveau des tubules rénaux, avec une hémoglobinurie (Henck, 1979 ; McKenna et al., 1978b ; Jackson et Conolly, 1985 ; NTP, 2015).
Après exposition à de très fortes concentrations (500 à 15 000 ppm soit 2 000 et 60 000 mg.m-3), les rongeurs présentent à l’autopsie des signes évidents de congestion et d’œdème pulmonaires (Klimisch et Freisberg, 1979a ; Zeller et al., 1979a). À de plus faibles concentrations (20 ppm), la souris développe des lésions emphysémateuses (Zeller et al., 1979c).
Les expositions aiguës s’accompagnent de manière constante dans les différentes espèces d’une dépression du SNC. Les animaux souffrent de dyspnées et de narcoses qui sont le plus souvent la cause du décès (Klimisch et Freisberg, 1979a, 1979b, Zeller et al., 1979a).
Voie orale
Par voie orale, le 1,1-DCE présente également une forte toxicité et les DL50 se situent autour 1 500 mg.kg-1 chez le rat et 200 mg.kg-1 chez la souris (Jones et Hathway, 1978a ; Jenkins et al., 1972 ; Ponomarkov et Tomatis, 1980). Les lésions observées après une exposition aiguë sont, comme pour l’inhalation, principalement localisées au niveau du foie et des reins.
Des signes de toxicité hépatique correspondant à l’augmentation du taux sanguin de certaines transaminases (Alanine amino-transférase (ALAT), Aspartate amino-transférase (ASAT)) sont décrites chez le rat pour des doses uniques de 25 à 50 mg.kg-1 (Andersen et al., 1977 ; Jenkins et Andersen, 1978 ; Moslen et al., 1989). Les analyses histologiques confirment les atteintes morphologiques au niveau des canaux biliaires et des membranes plasmiques (Kanz et Reynolds, 1986). Dans ces études, une sensibilité plus grande des animaux préalablement soumis à la diète est également décrite. Par ailleurs, le 1,1-DCE administré en solution (huiles minérales ou végétales) entraîne une toxicité hépatique (Kanz et Reynolds, 1986).
Aux doses 500 ou 1 000 mg.kg-1, des nécroses hémorragiques hépatiques sont observées chez les rats ou les souris exposés pendant 14 jours par gavage au 1,1-DCE (NTP, 1982). Une augmentation des altérations tubulaires rénales (dilatation, nécrose) et de la fonction rénale (augmentation de l’urée plasmatique et du taux de créatinine) est rapportée chez la souris ou le rat exposés à des doses uniques de 1,1-DCE comprises entre 100 et 400 mg.kg-1 (Ban et al., 1995 ; Ban et al., 1998 ; ATSDR, 2022).
Enfin, une étude réalisée chez la souris pour des expositions par voie orale à une dose unique de 100, 150 ou 200 mg.kg-1 de 1,1-DCE tend à montrer que les lésions hépatiques et/ou rénales pourraient indirectement entraîner des effets immunotoxiques associés à la production sérique de cytokines pro-inflammatoires (Ban et al., 1998).
Voie cutanée
Des effets cutanés, de type sensibilisation ont été recherchés par le test sur ganglions lymphatiques locaux ; le 1,1-DCE ne serait pas sensibilisant (Warbrick et al., 2001).
Synthèse
Les expositions aiguës à des concentrations élevées par inhalation ou par voie orale sont létales chez le rat et la souris, la souris étant l’espèce la plus sensible. Le 1,1-DCE induit des lésions hépatiques (nécrose hémorragique centrolobulaire accompagnée d’une augmentation sérique d’enzymes hépatiques), rénales (poids, lésions histologiques focalisées au niveau des tubules rénaux), pulmonaires (congestion et œdème pulmonaire) et une dépression du SNC. Des effets sur le système immunitaire, consécutifs aux dommages tissulaires hépatiques, ont également été décrits.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Les études par inhalation disponibles chez l’homme sont en général peu exploitables du fait de la présence de contaminants mal identifiés et d’informations imprécises sur les niveaux d’exposition.
Dans une étude réalisée sur 138 salariés américains où le chlorure de vinyle n’a pas été utilisé comme copolymère, l’exposition des sujets au 1,1-DCE a pu être répartie en 3 catégories d’expositions (< 10, entre 10 et 24 et > 25 ppm soit environ < 40, 40 – 95 et > 100 mg.m-3) sur une moyenne d’exposition de 8 heures par jour, valeur estimée à partir du poste de travail et de prélèvements d’air (Ott et al., 1976a). La durée d’exposition a été estimée à partir du nombre d’années de travail dans l’entreprise. Aucune différence significative entre les salariés exposés au 1,1-DCE et un groupe de sujets témoin apparié n’a été rapportée aussi bien pour les paramètres hématologiques, que pour les activités sériques des enzymes hépatiques.
Voie orale
Il n’existe pas de données concernant les effets systémiques chez l’homme liés à l’ingestion répétée de 1,1-DCE.
Synthèse
Chez l’homme, les effets du 1,1-DCE sont trop peu documentés.
Chez l'animal
Inhalation
Par inhalation, les voies nasales (toxicité locale) et le foie (toxicité systémique) sont les deux organes cibles principaux.
Effets sur l’appareil respiratoire
Les effets les plus sensibles de l’exposition au 1,1-DCE sur l’appareil respiratoire sont rapportés dans plusieurs études par inhalation pour des expositions sub-chroniques (14 semaines) et chroniques (104 semaines), réalisées selon les Bonnes Pratiques de Laboratoires (BPL) chez le rat et la souris (NTP, 2015).
Dans l’étude sub-chronique, des lésions non néoplasiques des cavités nasales, caractérisées par une atrophie, une minéralisation et une nécrose de l’épithélium olfactif (tableau ci-dessous), croissantes en fonction de la dose, ont été décrites chez des rats des deux sexes exposés pendant 3 mois aux concentrations de 6,25 à 100 ppm (soit 25 à 400 mg.m-3) de 1,1-DCE, 6 heures par jour, 5 jours par semaine (NTP, 2015).
Incidences des lésions nasales non néoplasiques observées chez le rat exposé pendant 3 mois au 1,1-DCE (NTP, 2015) :
Aucune dose sans effet (NOAEL) n’a pu être déterminée dans cette étude, conduisant à retenir un LOAEL de 6,25 ppm (25 mg.m-3) pour une augmentation significative de la minéralisation (p< 0,01 et 0,05, respectivement chez les rats mâles et les femelles) et de la nécrose (p<0,05, uniquement chez les rats mâles) de l’épithélium nasal. Dans les mêmes conditions expérimentales, de tels effets ont été observés chez les souris uniquement dans le groupe exposé à la plus forte dose de 100 ppm (400 mg.m-3).
Ces mêmes lésions nasales accompagnées dans la plupart des cas d’hyperostose des cornets ont été observées au cours d’une étude chronique (2 ans) chez le rat (mâle et femelle), également réalisée par le NTP, avec une intensité croissante proportionnelle à l’augmentation des concentrations d’exposition de 25 à 100 ppm (soit 100 à 400 mg.m-3) (NTP, 2015).
Lors d’expositions chroniques chez la souris, des lésions nasales ont été observées dès la plus faible dose testée de 6,5 ppm (25 mg.m-3), (NTP, 2015). L’incidence des différents types de lésion est détaillée dans le tableau suivant.
Incidences des lésions nasales non néoplasiques chez la souris exposée par inhalation au 1,1-DCE pendant 2 ans (6 h/j ; 5 j/ sem.) (NTP, 2015) :
Dans cette étude, sur la base des lésions de l’épithélium nasal observées chez les souris mâles, plus sensibles que les femelles, un LOAEL de 6,25 ppm a été déterminé. La plus faible dose testée dans l’étude de toxicité chronique chez le rat étant de 25 ppm (100 mg.m-3), aucune comparaison de la sensibilité liée à l’espèce n’a pu être examinée (NTP, 2015).
En dehors de bronchopneumonies rapportées chez des souris mâles exposées 4 heures par jour, 4 à 5 jours par semaine, pendant 54 semaines à une dose de 25 ppm (100 mg.m-3) (Maltoni et al., 1985), aucune toxicité sur l’appareil respiratoire n’est mentionnée chez la souris, le rat, le chien, le hamster ou le cochon d’inde pour des expositions de 15 semaines à 2 ans à des doses comprises entre 25 et 150 ppm (100 et 600 mg.m-3) (Maltoni et al., 1985 ; Prendergast et al., 1967 ; Quast et al., 1986). A noter cependant que, dans la plupart de ces études, aucun examen histologique des cavités nasales n’a été réalisé.
Effets hépatiques
Chez le rat, les mâles se sont montrés plus sensibles à l’exposition du 1,1-DCE, 6 heures par jour, 5 jours par semaine pendant 14 semaines, avec des altérations cytoplasmiques centro-lobulaires (6/10 rats), caractérisées par une baisse de la coloration cytoplasmique à partir de 12,5 ppm soit 50 mg.m-3 (NOAEL de 6,25 ppm soit 25 mg.m-3), alors que chez les femelles, les effets se sont limités à une vacuolisation cytoplasmique hépatocellulaire observée aux deux plus fortes doses testées de 50et 100 ppm (200 et 400 mg.m-3) (NTP, 2015). Dans l’étude menée en parallèle chez les souris, un NOAEL de 50 ppm (200 mg.m-3) a été retenu pour la toxicité hépatique (nécrose et hypertrophie centro-lobulaire) (mâles et femelles moins sensibles que le rat), malgré une baisse de croissance pondérale significative observée dès la plus faible dose testée de 6,26 ppm (25 mg.m-3) en particulier chez les femelles (LOAEL) (NTP, 2015).
Dans une autre étude de 90 jours, plusieurs espèces (rats, chiens, cobayes, lapins, singes) ont été exposées en continu (23 à 24 heures par jour), par inhalation à des concentrations 0 – 5 – 15 – 25 – 48 ppm (soit 0 – 20 – 61– 101 – 189 mg.m-3) de 1,1-DCE (Prendergast et al., 1967). En même temps qu’une baisse significative de la croissance pondérale dans les groupes exposés à la plus forte dose de 189 mg.m-3 chez toutes les espèces, les auteurs rapportent à cette même dose chez le rat, le chien et le singe des lésions histologiques du foie (foyers de nécrose, infiltration lymphocytaire, prolifération des voies biliaires et fibrose), avec une sévérité des effets plus marquée chez le chien. Les marqueurs sériques de toxicité hépatique, l’ALAT et la PAL (phosphatase alcaline) ont également augmenté significativement chez le rat (respectivement multiplié par 3 et 1,75) et le cobaye (respectivement multiplié par 7 et 2,4) dans les groupes exposés à la plus forte dose de 189 mg.m-3 uniquement, aucun effet n’ayant été observé à la plus faible dose de 20 mg.m-3 (mais pas de dosage aux doses intermédiaires, ni chez les autres espèces). Un NOAEL de 20 mg.m-3 (5 ppm) a été déterminé chez le cobaye (et le rat) en lien avec une augmentation de l’activité des enzymes hépatiques (ALAT et PAL) (Prendergast et al., 1967).
Une sensibilité hépatique, caractérisée par des changements mineurs de la taille des cellules hépatiques, plus marquée chez les femelles que chez les rats mâles, a également été décrite dans le cadre d’une étude de toxicité chronique de 18 mois par inhalation avec des NOAEC respectives de 25 et 75 ppm (100 et 300 mg.m-3) chez les femelles et les mâles (Quast et al., 1986).
Dans les études de toxicité chronique du NTP (2 ans), une stéatose diffuse et une inflammation chronique hépatique sont observées dès la plus faible dose testée chez le rat (25 ppm soit 100 mg.m-3), alors qu’à cette même dose, aucune toxicité hépatique n’est rapportée chez la souris (plus forte dose testée) (NTP, 2015).
Effets rénaux
Certaines des données relatives à la néphrotoxicité du 1,1-DCE sont issues de cette même étude et mentionnent chez le rat pour une exposition de 48 ppm, la présence d’une hypertrophie de l’épithélium au niveau des tubules rénaux (Prendergast et al., 1967). Des nécroses tubulaires ont également été observées chez des souris mâles exposées à 25 ppm, 4 heures par jour, 4-5 jours par semaine, pendant 52 semaines (Maltoni et al., 1985), de même que des néphropathies à partir de 12,5 ppm et une augmentation de l’incidence de kystes rénaux à partir de 25 ppm respectivement dans les études de toxicité sub-chronique (14 semaines) et chronique (2 ans) du NTP (NTP, 2015). Le rat, dans des conditions d’expositions similaires (25 à 75 ppm soit 100 et 300 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 18 mois) n’a pas montré d’atteintes rénales (Quast et al., 1986). Des résultats similaires ont été retrouvés dans l’étude du NTP où les rats ont été exposés pendant 14 semaines ou 2 ans jusqu’à 100 ppm (400 mg.m-3) (NTP, 2015).
Voie orale
Les études de toxicité subchronique et chronique par voie orale sont peu nombreuses, mais il apparaît cependant assez clairement que le 1,1-DCE entraîne par cette voie des lésions hépatiques et rénales bien moins sévères que par inhalation.
En effet, l’étude de Quast relative à l’administration dans l’eau de boisson de 25 mg.kg-1.j-1 (NOAEL) de 1,1-DCE pendant 97 jours n’a révélé aucune toxicité hépatique ou rénale chez le chien (Quast et al., 1983). Le rat développe après un an de traitement (9 à 20 mg.kg-1.j-1) une légère augmentation de la vacuolisation cytoplasmique des hépatocytes (Rampy et al., 1977). Après 2 ans, les modifications morphologiques du foie se confirment par un développement anormal et notamment par la présence de cellules hépatocytaires surchargées en graisse chez les animaux ayant reçu une dose estimée à 9 mg.kg-1.j-1 (Quast et al., 1983). Ces deux études mentionnent par ailleurs l’absence de lésions rénales.
Des rats et des souris ont été exposés par gavage à du 1,1-DCE dans de l’huile de maïs aux doses de 0 – 5 – 15 – 40 – 100 - 250 mg.kg-1.j-1, 5 fois par semaine, pendant 13 semaines (NTP, 1982). Trois rats meurent au cours de la première semaine à 250 mg.kg-1.j-1, l’autopsie révèle une nécrose centrolobulaire hépatique. A 250 mg.kg-1.j-1, chez les autres rats une hépatocytomégalie minime à modérée est observée. A 100 mg.kg-1.j-1 une hépatocytomégalie minime à moyenne est rapportée chez 6/10 rats mâles, 3/10 rates. Aucune altération biologique n’est retrouvée aux doses inférieures chez les rats des deux sexes. Une diminution du poids corporel de 13 % est mesurée chez les rats mâles à 250 mg.kg-1.j-1.
Chez les souris, une nécrose centrolobulaire hépatique est identifiée chez 5/10 mâles et 5/10 femelles à 250 mg.kg-1.j-1 et chez 2/10 mâles et 2/10 femelles à 100 mg.kg-1.j-1. Ces effets ne sont pas retrouvés aux doses inférieures. Une diminution du poids corporel de 14 % est observée chez les souris mâles.
Des rats et des souris ont également été exposés aux doses de 0 - 2 ou 10 mg.kg-1.j-1 pour les souris et de 0 - 1 ou 5 mg.kg-1.j-1 pour les rats au 1,1-DCE par gavage dans de l’huile de maïs pendant 104 semaines (NTP, 1982). Les examens histopathologiques ont montré une augmentation de l’incidence des nécroses hépatiques à la plus forte dose chez les mâles et dès la dose la plus faible chez les femelles. Chez les rats, une inflammation rénale chronique de 26/50, 24 :48, 43/48 chez les mâles et de 3/49, 6/49, 9/44 chez les femelles est observée respectivement pour les doses de 0, 1 ou 5 mg.kg-1.j-1. Aucune toxicité cardiovasculaire n’est rapportée.
Des rats ont été exposés à 0 – 0,5 – 5 – 10 – 20 mg.kg-1 de 1,1-DCE, 4 à 5 jours par semaine, pendant 52 semaines puis suivis jusqu’à leur mort (Maltoni et al., 1985). Aucune altération significative n’a été décelée.
Voie cutanée
Aucune étude concernant l’effet du 1,1-DCE à long terme, par voie cutanée, n’est disponible chez l’animal. Aucune irritation oculaire n’a été rapportée chez des rats exposés pendant 18 mois à des vapeurs de 1,1-DCE (75 ppm soit environ 300 mg.m-3) (Quast et al., 1986).
Synthèse
Chez l’animal, le 1,1-DCE induit une toxicité localisée au niveau des voies nasales par inhalation, ainsi que des effets hépatiques (augmentation de la vacuolisation cytoplasmique des hépatocytes) et rénaux (nécroses tubulaires) pour des expositions par inhalation ou voie orale.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 3 : substance préoccupante pour l’homme en raison d’effets cancérogène possibles | 2004 |
| IARC | FDTE/VTR Importer Groupe 3 : L'agent (le mélange, les circonstances d'exposition) ne peut pas être classé quant à sa cancérogénicité pour l'homme | 1987 |
| US EPA | FDTE/VTR Importer Groupe C : cancérigène possible pour l’homme | 1998 |
Chez l'homme
Toutes voies
L’IARC a considéré en 2019 que les indications de cancérogénicité sont insuffisantes chez l’homme (IARC, 2019).
Inhalation
Chez l’homme, aucune des trois études réalisées en milieu industriel et citant le 1,1-DCE parmi d’autres composés n’a permis d’établir un lien entre l’exposition au 1,1-DCE et le développement d’angiosarcomes ou un risque accru de décès par cancers du poumon (Waxweiler, 1981 ; Ott et al., 1976b ; Thiess et al., 1979). Le nombre et la qualité de ces études sont jugés insuffisants par les différents organismes pour statuer sur le potentiel cancérigène du 1,1-DCE chez l’homme (ATSDR, 2022 ; IARC, 2019 ).
Voie orale
Aucune donnée n’a été identifiée.
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Chez l’homme, aucune des études réalisées en milieu professionnel n’a permis d’établir un lien entre l’exposition au 1,1-DCE et la survenue de cancers.
Chez l'animal
Inhalation
Dans une étude par inhalation relativement ancienne du NTP chez la souris, regroupant les résultats de 2 essais, une exposition à 0 – 10 – 25 ppm (soit 0 – 40 – 100 mg.m-3)(animaux âgés de 16 semaines) et une seconde à 0 – 25 ppm (soit 0 – 100mg.m-3) (animaux âgés de 9 semaines) 4 heures par jour, 4 à 5 jours par semaine pendant 52 semaines , le 1,1-DCE a entraîné une augmentation significative de l’incidence d’adénomes pulmonaires chez les mâles et les femelles, des adénocarcinomes des tubules rénaux chez les mâles, de même que des tumeurs de la glande mammaire (majoritairement des carcinomes) chez les femelles (Maltoni et al., 1985). Dans l’étude réalisée en parallèle chez les rats Sprague Dawley exposés par inhalation à 0 – 10 – 25 – 50 – 100 – 150 ppm (soit 0 – 40 – 100 – 200 – 400 – 600 mg.m-3) de 1,1-DCE, 4 heures par jour, 4 à 5 jours par semaine pendant 52 semaines, aucune augmentation de l’incidence de tumeurs n’est observée chez les mâles. Une augmentation statistiquement significative est observée chez les femelles présentant des fibromes et adénofibromes mammaires. Les incidences sont de 44/56 (78,6 %), 24/24 (100 %), 20/20 (100 %), 21/22 (95,4 %), 21/23 (91,3 %) et 38/43 (88,4 %) respectivement pour les concentrations de 0, 10, 25, 50, 100 et 150 ppm. L’incidence des carcinomes mammaires est plus élevée chez les témoins que chez les animaux traités.
Des cancers des glandes mammaires ont été observés dans une autre étude chez le rat (Quast et al., 1986), mais les auteurs, tout comme dans l’étude citée ci-dessus, mettent en avant la forte prévalence spontanée de ce type de tumeur et ne s’autorisent pas à conclure sur le potentiel cancérigène du 1,1-DCE.
Plus récemment, une augmentation significative de l’incidence des tumeurs rénales (adénomes, carcinomes des tubules rénaux et tumeurs combinées) chez les souris mâles, de même que des tumeurs hépatiques (adénomes, carcinomes et tumeurs combinées) chez les femelles ont été observées dans le cadre d’une étude combinée de toxicité chronique et de cancérogénèse réalisée selon les BPL où les animaux ont été exposés par inhalation à des concentrations de 0 – 6,25 – 12,5 – 25 ppm (0 – 25 – 50 – 100 mg.m-3), 6 heures par jour, 5 jours par semaine pendant 105 semaines (NTP, 2015). Les principaux résultats relatifs à cette étude sont rapportés dans le tableau suivant.
Incidences tumorales chez les souris mâles et femelles exposées par inhalation à des concentrations de 0 – 6,25 – 12,5 – 25 ppm de 1,1-DCE pendant 105 semaines (NTP, 2015) :
Dans cette même étude, les auteurs ont également décrit une augmentation significative des incidences des hémangiosarcomes hépatiques, de même que des hémangiomes et hémangiosarcomes combinés au niveau du système vasculaire. Enfin, le 1,1-DCE a également entraîné la survenue de carcinomes broncho-alvéolaires chez les femelles, l’incidence n’étant significative qu’à la concentration intermédiaire de 12,5 ppm (50 mg.m-3).
Dans l’étude de cancérogenèse menée en parallèle chez le rat à des concentrations de 0 – 25 – 50 -100 ppm (0 – 100 – 200- 400 mg.m-3), seule l’incidence des mésothéliomes malins a significativement augmenté à toutes les concentrations testées chez les mâles, mais les auteurs soulignent également une tendance positive à l’augmentation de l’incidence des adénomes de l’épithélium nasal (NTP, 2015). Chez les femelles, l’incidence des adénomes, et des adénomes/carcinomes combinés de la thyroïde (cellules parafolliculaires) augmente significativement (respectivement à 100 ppm (p<0,01), et à 25 -100 ppm (p<0,01 et 0,001), de même que celle des leucémies à cellules mononucléées, également significatives à la plus forte dose de 100 ppm (p<0,01).
Voie orale
Par ingestion, aucune des études réalisées par le NTP sur le rat ou la souris ne donne de résultats vraiment clairs, en partie liés au niveau de dose d’exposition de 0 – 1 5 mg.kg-1.j-1 chez le rat et 0 – 2 – 10 mg.kg-1.j-1 chez la souris administrées dans l’huile de maïs pendant 104 semaines (NTP, 1982). Sur une période de 2 ans, l’exposition à une dose journalière de 5 mg.kg-1 (plus forte dose administrée) de 1,1-DCE a entraîné le développement de lymphomes chez 13 rats sur 47 exposés. Tenant compte du taux de lymphomes observé dans le lot témoin (6/50), l’incidence de ces tumeurs s’est révélée non significativement dépendante de l’exposition au 1,1-DCE (NTP, 1982). Aucune incidence tumorale n’a été observée chez les femelles. Chez la souris, le NTP ne rapporte aucune augmentation de l’incidence tumorale chez les mâles exposés par gavage à des doses de 0 – 2 – 10 mg.kg-1.j-1 pendant 104 semaines (NTP, 1982). Chez les femelles, l’incidence des lymphomes a augmenté de manière significative uniquement à la plus faible dose testée.
Toujours chez le rat, l’administration dans l’eau de boisson de différentes concentrations (7, 10, 20 mg.kg-1.j-1 chez les mâles et 9, 14, 30 mg.kg-1.j-1 chez les femelles) de 1,1-DCE pendant 2 ans a permis d’observer uniquement aux plus faibles doses chez les femelles l’apparition d’adénofibromes des glandes mammaires. De plus, le taux d’incidence tumorale étant proche de celui des témoins historiques, ce résultat n’a pas été validé par les auteurs (Quast et al., 1983).
Voie cutanée
Chez la souris, le 1,1-DCE semblerait sur la base d’une étude de cancérogenèse, impliquant un traitement par le phorbol myristate d’acétate (promoteur tumoral), agir sur la peau en tant qu’initiateur tumoral (Van Duuren et al., 1979). L’injection sous-cutanée de 2 mg de 1,1-DCE, également chez la souris, n’a entraîné aucune réponse tumorale.
Selon l’IARC, les preuves sont suffisantes pour considérer le 1,1-DCE comme étant cancérogène chez l’animal (IARC, 2019).
Synthèse
Les effets cancérogènes du 1,1-DCE chez l’animal (rat/souris) ont été observés sur différents tissus, comprenant le foie (hépatocytes), les reins (tubules rénaux), les poumons, la glande mammaire, le système hématopoïétique et la thyroïde, ainsi qu’au niveau du tissu épithélial (mésothéliomes) à de multi-sites. Un effet initiateur tumoral (application cutanée) a été décrit chez la souris.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le 1,1-dichloroéthylène a été examiné par l'Union Européenne mais n’a pas été classé génotoxique | 2004 |
Chez l'homme
Toutes voies
Aucune donnée n’a été identifiée.
Chez l'animal
Toutes voies
In vivo, le 1,1-DCE n’induit pas de micronoyaux ou d’aberrations chromosomiques sur cellules de moelle osseuse ou sur érythrocytes fœtaux chez la souris ou de mutation létale dominante chez la souris ou le rat (Sawada et al., 1987a ; Rampy et al., 1977 ; Anderson et al., 1977 ; Short et al., 1977b). De même, la fréquence des micronoyaux des érythrocytes du sang périphérique n’a pas augmenté chez des souris exposées par inhalation à 100 ppm de 1,1-DCE pendant 3 mois (NTP, 2015).
In vitro
Organismes procaryotes
Dans les systèmes bactériens le 1,1-DCE est mutagène après activation métabolique dans les tests sur Salmonella typhimurium et Escherichia coli (Malaveille et al., 1997 ; Jones et Hathway, 1978a ; Simmon et Tardiff, 1978 ; Waskell, 1978 ; Bartsch et al., 1979 ; Oesch et al., 1983 ; Strobel et Grummt, 1987 ; Baden et al., 1977). Sur Saccharomyces cerevisae, le 1,1-DCE induit des mutations réverses et des conversions mitotiques (Bronzetti et al., 1981 ; Koch et al., 1988). La substance étant volatile, les résultats identifiés comme négatifs correspondent à des conditions expérimentales non satisfaisantes (évaporation de la substance).
Organismes eucaryotes
Le 1,1-DCE est mutagène sur les cellules de lymphome de souris mais pas sur cellules pulmonaires de hamster chinois (avec ou sans activateur métabolique) (Drevon et Kuroki, 1979 ; McGregor et al., 1991). En revanche, le 1,1-DCE s’est révélé positif dans les tests d’aberrations chromosomiques et d’échanges de chromatides en présence d’activateur métabolique sur cellules pulmonaires de hamster chinois (Sawada et al., 1987b) (IARC, 2019)
Métabolites :
L’époxyde du 1,1-DCE, le chlorure de 2-chloroacétyl et le 2,2-dichloroacétaldéhyde sont les métabolites réactifs du 1,1-DCE identifiés à partir de cultures d’hépatocytes isolés (NTP, 2015). Le 2,2-dichloroacétaldéhyde induit des coupures d’ADN dans une lignée de cellules lymphoblastiques humaines (Chang et al., 1992), et est mutagène, avec ou sans activation métabolique sur Salmonella typhimurium (Bignami et al., 1980).
Mécanismes d’action :
Trois des métabolites, issus de l’oxydation primaire du 1,1-DCE : l’époxyde du 1,1-DCE, le chlorure de 2-chloroacétyl et le 2,2-dichloroacétaldéhyde sont des molécules extrêmement réactives qui de par leur forte propriété électrophile sont susceptibles de réagir avec de nombreuses macromolécules (hémoglobine, ADN ...) formant alors des liaisons covalentes sur celles-ci, à l’origine de la toxicité hépatique, rénale et pulmonaire du 1,1-DCE (ATSDR, 2009 ; Okine et al., 1985 ; Okine et Gram, 1986a ; Okine et Gram, 1986b ; Woodard et Moslen, 1998).
Par ailleurs, plusieurs études ont montré chez les rongeurs que le métabolisme du 1,1-DCE conduit à une déplétion en GSH (Jaeger et al., 1973 ; Reichert et Henschler, 1978).
Enfin, il existe des différences entre les effets toxiques et l’apparition de tumeurs dans le foie, les poumons et les voies aériennes décrites dans les études de cancérogenèse de 2 ans. L’inflammation et la dégénérescence des cellules adipeuses associées à une nécrose hépatocytaire sont observées chez le rat, aussi bien chez les mâles que chez les femelles, alors que l’induction de tumeurs hépatiques a été décrite uniquement chez les souris femelles (NTP, 2015). Ces différences inter-espèces sont probablement dues à des activations métaboliques différentielles par le CYP2E1, plus importantes pour les microsomes de foie de souris que de rats et à l’origine de la production de métabolite époxyde (Dowsley et al., 1995b ; Forkert et Boyd, 2001). Concernant les voies aériennes, la toxicité sur les cellules de l’épithélium nasal est décrite chez le rat aussi bien chez les femelles que chez les mâles sans que le mécanisme en soit élucidé, les tumeurs quant à elles, ne sont observées que chez les mâles (NTP, 2015).
Bien que les effets mutagènes géniques du 1,1-DCE ne soient pas constants d’un type cellulaire à l’autre, ses effets mutagènes chromosomiques, auxquels s’ajoute un effet potentiellement initiateur par voie cutanée, conduisent à retenir un mécanisme d’action sans seuil.
Synthèse
Aucun effet génotoxique n’a été montré à partir des essais in vivo réalisés chez l’animal. Le 1,1-DCE est mutagène et/ou clastogène en présence d’activateur métabolique sur cellules eucaryotes et bactéries.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | non classé | 2004 |
Chez l'homme
Toutes voies
Aucune information n’est disponible concernant la toxicité par inhalation du 1,1-DCE sur les fonctions de reproduction et le développement fœtal chez l’homme (ATSDR, 1994).
Synthèse
Aucune information n’est disponible chez l’homme quant aux effets du 1,1-DCE sur la reproduction.
Chez l'animal
Inhalation
Par inhalation, les deux études de dominance létale réalisées chez la souris ou le rat mâle, exposés par inhalation à 10 - 30 ppm (40 - 120 mg.m-3) (5 jours pour les souris) et à 50 ppm (200 mg.m-3) (11 semaines pour les rats) de 1,1-DCE, sont négatives (Anderson et al., 1977 ; Short et al., 1977b). Pour ces études, les NOAEL sont respectivement de 30 ppm chez la souris et 50 ppm chez le rat. Les examens des organes sexuels, réalisés à des doses maximales de 100 ppm (400 mg.m-3) après 13 semaines (6 heures par jour, 5 jours par semaine) d’exposition, mettent en évidence une baisse de la mobilité spermatique (environ 5 %) et du nombre total de spermatides par testicule (environ 16 %) chez le rat mâle, sans lésion histologique associée (NTP, 2015). Des effets de même nature sont rapportés chez les souris mâles à partir de 25 ppm (100 mg.m-3) (protocole d’exposition identique). Dans cette même étude, le 1,1-DCE n’a pas eu d’effet sur la fertilité des femelles (durée des cycles œstraux), y compris à la plus forte dose testée de 100 ppm (400 mg.m-3) et aussi bien chez les rates que chez les souris (NTP, 2015).
Voie orale
Par voie orale, une étude de reproduction a été menée chez le rat sur 3 générations pour des expositions via l’eau de boisson à la concentration nominale de 0 – 50 – 100 – 200 ppm correspondant aux doses de 0 – 9 – 14 – 30 mg.kg-1.j-1 de 1,1-DCE (Nitschke et al., 1983). Cette étude n’a pas montré d’effet sur les indices de fertilité.
Synthèse
Une atteinte spermatique (mobilité, numération) est décrite chez les mâles (rat, souris), alors qu’aucun effet du 1,1-DCE n’a été mis en évidence sur la fertilité des femelles (cycles œstraux).
Effets sur le développement
Chez l'homme
Inhalation
FDTE/VTR Importer Aucune information n’est disponible concernant la toxicité par inhalation du 1,1-dichloroéthylène sur le développement fœtal chez l’homme (ATSDR, 1994).
Voie orale
Par voie orale, les défauts de l’ébauche du système nerveux (tube neural) observés chez des nouveau-nés exposés in utero, par exposition de la mère via l’ingestion d’eau contaminée, doivent être considérés comme des résultats à prendre avec prudence, compte tenu des nombreuses co-expositions mises en cause (NJDH, 1992a, 1992b). D’autres études correspondant à des expositions via l’eau de boisson suggèrent une association entre une exposition au DCE et des anomalies congénitales cardiaques, des fentes palatines, des altérations du SNC (tube neural), mais l’isomère n’est pas spécifié et des co-expositions avec d’autres dérivés chlorés sont rapportées, ce qui ne permet pas de conclure (Swan et al., 1985 ; Goldberg et al., 1990 ; Bove et al., 1995).
Synthèse
Les rares résultats disponibles chez l’homme ne permettent pas de tirer de conclusions quant aux effets du 1,1-DCE sur le développement.
Chez l'animal
Inhalation
Des souris ont été exposées à des concentrations de 0 -15 – 30 – 57 – 144 – 300 ppm de 1,1-DCE (soit environ 0 – 60 – 120 – 230 – 580 – 1 200 mg.m-3), 22 à 23 heures par jour, du 6ème au 16ème jour de la gestation (Short et al., 1977a). Une toxicité maternelle est observée dès 30 ppm (120 mg.m-3), mise en évidence par une réduction du gain de poids. Une toxicité fœtale est également rapportée dès 30 ppm (120 mg.m-3), avec une complète résorption des portées. A 15 ppm (60 mg.m-3), il n’y a pas de toxicité maternelle, ni de diminution de poids des fœtus, ni de diminution du pourcentage de fœtus viables. De même, aucune augmentation significative du nombre de malformations embryonnaires n’est rapportée. Dans le groupe exposé à 15 ppm (60 mg.m-3), une augmentation statistiquement significative du nombre moyen de fœtus avec une altération de l’ossification (enclume[1] non ossifiée ou une ossification incomplète des vertèbres) a été identifiée. Chez la rate exposée à 0 – 56 – 283 ppm de 1,1-DCE (0 – 225 – 1 135 mg.m-3), 22 à 23 heures par jour, du 8ème au 20ème jour de la gestation, une toxicité maternelle est observée aux 2 concentrations ainsi qu’une diminution statistiquement significative du poids corporel moyen des jeunes (Short et al., 1977a). En revanche, aucune neurotoxicité développementale n’a été identifiée chez les jeunes testés par une batterie de tests pratiqués entre le 1er et le 21ème jour après la naissance.
Une autre étude chez le rat exposé à 0 – 20 – 80 – 160 ppm au 1,1-DCE, 7 heures par jour du 6ème au 15ème jour de la gestation montre une toxicité maternelle aux 2 concentrations les plus élevées associée à une toxicité fœtale correspondant à une augmentation statistiquement significative de l’incidence des côtes flottantes et d’un retard d’ossification du crâne (Murray et al., 1979). Ces différents effets chez la mère et le fœtus ne sont pas retrouvés aux concentrations plus faibles. Chez la lapine exposée à 0 – 80 -160 ppm de 1,1-DCE, 7 heures par jour du 6ème au 18ème jour de gestation, aucun effet n’est rapporté jusqu’à 80 ppm (Murray et al., 1979). A 160 ppm, une augmentation de l’incidence de la résorption par portée et une altération de l’incidence d’effet mineur sur le squelette (survenue d’une 13ème paire de côtes, augmentation de l’incidence de retard d’ossification de la 5ème côte) sont rapportées.
[1] Osselet de l’oreille interne
Voie orale
Par voie orale, des rats ont été exposés aux doses de 0 – 9 – 14 – 30 mg.kg-1.j-1 de 1,1-DCE au cours d’une étude sur 3 générations (Nitschke et al., 1983). L’administration de 30 mg.kg-1.j-1 (NOAEL) n’a eu aucune incidence sur le développement néonatal des rats exposés sur 3 générations. Seule une toxicité hépatique discrète (légère stéatose hépatique) est rapportée chez les animaux exposés in utero, pendant l’allaitement, puis après sevrage via l’eau de boisson à la plus faible dose de 9 mg.kg-1.j-1.
Une autre étude chez le rat exposé aux doses de 0 - 200 ppm (0 - 40 mg.kg-1.j-1) du 6ème au 15ème jour de la gestation, n’a pas non plus révélé d’effet sur le développement (Murray et al., 1979).
Des rats ont été exposés avant et pendant la gestation au 1,1-DCE aux doses de 0 - 0,15 ou 100 ppm (soit 0 - 0,02 ou 18 mg.kg-1.j-1) (Dawson et al., 1993). Les expositions uniquement avant la gestation n’entrainent pas de malformations cardiaques congénitales. En revanche, les expositions avant et pendant la gestation induisent une augmentation statistiquement significative du nombre de fœtus avec des malformations cardiaques congénitales (altération du septum atrial, de la valve mitrale, de la valve aortique) avec une incidence de 7/232 (3 %), 14/121 (12 %) et 24/184 (13 %) respectivement aux doses de 0, 0,15 et 100 ppm (0 - 0,02 et 18 mg.kg-1.j-1). Pour l’US EPA, le niveau d’exposition des fœtus et la signification biologique des malformations cardiaques chez les fœtus restent questionnables étant donné les faibles doses d’exposition.
Synthèse
Chez l’animal, le 1,1-DCE induit une augmentation du nombre moyen de résorptions fœtales à des doses toxiques pour les mères (baisse de croissance pondérale). Des retards d’ossification pour des expositions par inhalation ont été rapportés en absence de toxicité maternelle. Par voie orale, aucune toxicité embryonnaire et/ou fœtale n’a été décrite, en dehors de malformations cardiaques dont la signification biologique est incertaine.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
Le TCEQ propose un ReV de 0,71 mg.m-3 (0,18 ppm) pour une exposition aiguë de 1 heure par inhalation au 1,1-DCE (TCEQ, 2013).
Cette valeur a été établie à partir d’une étude expérimentale réalisée sur des souris mâles exposées en continu par inhalation à des concentrations de 0 - 10 - 50 ppm (soit 0 – 40 – 200 mg.m-3) de 1,1-DCE pendant 6 heures (Reitz et al., 1980). Le TCEQ a retenu comme effet critique une atteinte hépatique mise en évidence par une dilatation de la région centro-lobulaire observée à la plus forte concentration testée de 50 ppm (200 mg.m-3). La concentration juste inférieure de 10 ppm (40 mg.m-3) a été retenue comme NOAEC et est utilisée comme point de départ (POD) du calcul de la valeur.
Un ajustement sur la durée d’exposition a été réalisé pour tenir compte de l’exposition de 6 heures, ramenée à 1 heure en utilisant la loi de Haber avec n = 3 (PODADJ).
PODADJ = [(10 ppm)3 x (6 h/1 h)]1/3 = 18 ppm
Un ajustement dosimétrique de l’exposition équivalente de l’animal à l’homme de 1 a été appliqué par défaut.
PODHEC = PODADJ x [(Hb/g)A x (Hb/g)H] = 18 ppm x 1 = 18 ppm
Facteurs d'incertitude : un facteur d’incertitude 90 arrondi à 100 a été appliqué. Il correspond à un facteur 3 pour la variabilité inter-espèce (tient compte de l’ajustement dosimétrique), un facteur d’incertitude 10 a été appliqué pour tenir compte des différences de sensibilité de la population et un facteur 3 pour tenir compte des limites de l’étude clé (faible nombre d’animaux par lot et seulement 2 doses testées).
Calcul : ReVaiguë = 18 ppm / 100 = 0,18 ppm (soit 0,71 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par inhalation :
L’ATSDR propose un MRL de 4.10-3 mg.m-3 (0,001 ppm) pour une exposition subchronique par inhalation au 1,1-DCE (ATSDR, 2022).
Cette valeur a été établie à partir d’une étude sub-chronique chez le rat (NTP, 2015). Dans cette étude, les animaux (10 par sexe et par dose) ont été exposés à des concentrations de 0 – 6,25 – 12,5 - 25 – 50 – 100 ppm (0 – 25 – 50 – 200 – 400 mg.m-3) de 1,1-DCE, 6 heures par jour, 5 jours par semaine pendant 14 semaines. L’apparition de lésions nasales est l’effet critique retenu avec une augmentation de l’incidence des nécroses de l’épithélium olfactif chez les rats mâles (plus sensibles que les femelles), significative dès la plus faible dose testée de 6,25 ppm. Une BMCL10 de 1,59 ppm a été calculée à partir d’un modèle multi-étapes de degré 2.
Pour tenir compte de la discontinuité de l’exposition 6 heures par jour, 5 jours par semaine, un ajustement temporel a été effectué : BMCLADJ = BMCL10 X (6 h/24 h) X (5 j/7 j) = 1,59 X (6/24) X (5/7) = 0,28 ppm
La concentration équivalente humaine a été déterminée en tenant compte du rapport animal/ homme de la répartition des gaz dans la région extra-thoracique de l’appareil respiratoire (action locale) (RGDSHEC) (RGDS : “Regional gas dose ratio for the extrathoracic region” ) calculé à partir de l’équation suivante :
RGDSET = (Ve/SET) rat / ((Ve/SET) homme = (131,9 mL/min/ 15 cm2) / (13 800 mL/min/ 200 cm2) = 0,13
Ve: volume inhale par minute (mL/minute)
SET : surface de la région extra-thoracique (cm2)
BMCLHEC = BMCLADJ x RGDRET = 0,28 ppm x 0,13 = 0,036 ppm
Facteurs d’incertitude : un facteur 30 a été appliqué : 3 pour l’extrapolation de données animales vers l’homme (ajustement dosimétrique) et 10 pour la variabilité au sein de la population.
Calcul : 0,036 ppm /30 = 0,0012 ppm (arrondi à 0,001 ppm soit 4.10-3 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par inhalation :
L’ATSDR propose un MRL de 4.10-3 mg.m-3 (0,001 ppm) pour une exposition chronique par inhalation au 1,1-DCE (ATSDR, 2022).
L’ATSDR a initialement élaboré une valeur à partir d’une étude d’exposition chronique par inhalation chez la souris B6C3F1/N (NTP, 2015). Dans cette étude, les animaux (50 par sexe et par dose) ont été exposés à des concentrations de 0 – 6,25 – 12,5 et 25 ppm (soit 0 – 25 – 50 et 100 mg.m-3) de 1,1-DCE, 6 heures par jour, 5 jours par semaine. L’apparition de lésions nasales a été retenue comme effet critique, en particulier une augmentation de l’incidence d’une métaplasie de l’épithélium olfactif significative chez les souris femelles dès la plus faible dose testée de 6,25 ppm (LOAEC). Une BMCL10 de 1,46 ppm a été calculée à partir d’un modèle fréquentiste illimité Probit.
Pour tenir compte de la discontinuité de l’exposition 6 heures par jour, 5 jours par semaine, un ajustement temporel a été effectué : BMCLADJ = BMCL10 X (6 h/24 h) X (5 j/7 j) = 1,46 X (6/24) X (5/7) = 0,261 ppm
La concentration équivalente humaine a été déterminée en tenant compte du rapport animal/ homme de la répartition des gaz dans la région extra-thoracique de l’appareil respiratoire (action locale) (RGDSHEC) (RGDS : “Regional gas dose ratio for the extrathoracic region”) calculé à partir de l’équation suivante :
RGDSET = (Ve/SET) souris / ((Ve/SET) homme = (41,67 mL/min/ 3 cm2) / (13 800 mL/min/ 200 cm2) = 0,20
Ve: volume inhale par minute (mL/minute)
SET : surface de la région extra-thoracique (cm2)
BMCLHEC = BMCLADJ x RGDRET = 0,261 ppm x 0,20 = 0,052 ppm
Facteurs d’incertitude : un facteur 30 a été appliqué : 3 pour l’extrapolation de données animales vers l’homme (ajustement dosimétrique) et 10 pour la variabilité au sein de la population.
Calcul : 0,052 ppm /30 = 0,0017 ppm (arrondi à 0,002 ppm soit 8.10-3 mg.m-3)
Cette valeur étant supérieure à celle obtenue à partir de l’étude sub-chronique, elle a été abandonnée au profit de celle déterminée pour des expositions sub-chroniques.
Au final, la valeur de 4 10-3 mg.m3 déterminée pour une exposition sub-chronique par l’ATSDR a été adoptée pour une exposition chronique.
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
L’US EPA (IRIS) propose une RfC par inhalation de 0,2 mg/m3 (2002a).
Cette valeur a été calculée à partir de 2 études réalisées chez le rat (Quast et al., 1986 ; Rampy et al., 1977). Des rats Sprague-Dawley ont été exposés par inhalation, 6 heures par jour, 5 jours par semaine pendant 18 mois, dans un premier temps à 10 et à 40 ppm (40 et 160 mg.m-3) puis au bout d'un mois d'expérience à 25 et à 75 ppm (100 et 300 mg.m-3) de 1,1-DCE. Les animaux ont été sacrifiés à 1, 6, 12 et à 18 mois après le début de l'exposition. Des changements mineurs dans la taille des cellules hépatiques présentes dans les lobes hépatiques ont été notés chez les rats mâles et femelles, 6 mois et 12 mois après le début de l'exposition. Après 18 mois d'exposition, ces changements persistent seulement chez les rats femelles. Cet effet est significatif uniquement pour la concentration de 75 ppm (300 mg.m-3). Il est réversible et n'induit aucun changement dans le fonctionnement hépatique. Un NOAEL de 25 ppm (100 mg.m-3) et un LOAEL de 75 ppm (300 mg.m-3) ont été établis chez les rats femelles.
Une benchmark concentration, représentant la concentration équivalente à un niveau de réponse connu, a été établie après modélisation des données expérimentales, à l’aide de modèles statistiques de régression. Chez les rats femelles une BMC10 de 15,1 ppm et une BMCL10 (correspondant à la limite inférieure de l’intervalle de confiance à 95 %) de 9,8 ppm ont été proposées.
Les concentrations équivalentes chez l'homme (HEC) ont été calculées comme indiqué ci-dessous (US EPA, 1994) :
BMCL HEC = BMCL ajusté x (H s/g)A / (H s/g)H = 9,8 ppm x 6 h/24 h x 5 j/7 j x1 x 3,97 = 6,9 mg/m3
A = animal, H= homme
1 ppm = 3,97 mg/m3
H s/g = coefficient de partage sang sur gaz.
Le coefficient de partage sang sur gaz est de 5 chez le rat. Aucun coefficient de partage utilisable n'est disponible chez l'homme. Dans ce cas, une valeur de 1 est donnée au ratio H s/g / H s/g.
Facteurs d’incertitude : Un facteur d'incertitude de 30 a été appliqué. Un facteur de 3 pour tenir compte de l'extrapolation inter-espèce utilisant un ajustement allométrique et un facteur de 10 pour la variabilité au sein de la population humaine.
Calcul : 6,9 mg/m3 x 1/30 = 0,23 mg/m3 = 2 10-1 mg/m3
Indice de confiance : élevé dans l’étude, moyen dans la base de données et la RfC.
Le TCEQ propose un ReV de 0,34 mg.m-3 (0,086 ppm) pour une exposition chronique par inhalation au 1,1-DCE (TCEQ, 2013).
Cette valeur a été établie à partir d’une étude réalisée sur plusieurs espèces (rats, chiens, cobayes, singes) exposés en continu par inhalation à des concentrations de 0 – 5 – 15 – 25 – 48 ppm (soit 0 – 20 – 61– 101 – 189 mg.m-3) de 1,1-DCE pendant 90 jours (Prendergast et al., 1967). Le TCEQ a retenu comme effet critique une atteinte hépatique mise en évidence histologiquement par des foyers de nécrose observés à la fois chez le rat, le chien et le singe dans les groupes exposés à 101 mg.m-3 (LOAEC). Le TCEQ précise que la toxicité hépatique, mise en évidence chez le cobaye à partir de l’augmentation des dosages enzymatiques (ALAT et PAL) dans le groupe exposé à la plus forte dose, n’a pas été retenue en raison de l’absence de ces dosages aux 2 doses intermédiaires. Sur la base de l’apparition des lésions histologiques du foie, le TCEQ a retenu la valeur de 25 ppm (101 mg.m-3) comme POD (point de départ) pour le calcul de la valeur.
Les animaux étant exposé au 1,1-DCE en continu dans l’étude clé, aucun ajustement sur la durée d’exposition n’a été réalisé.
Un ajustement dosimétrique de l’exposition équivalente de l’animal à l’homme de 1 a été appliqué par défaut (rapport (Hb/g)A sur (Hb/g)H) pour un effet systémique. Hb/g : coefficient de partition sang/air
PODHEC = POD x [(Hb/g)A x (Hb/g)H] = 25 ppm x 1 = 25 ppm
Facteurs d'incertitude : un facteur 3 pour la variabilité inter-espèce (tient compte de l’ajustement dosimétrique), un facteur d’incertitude 10 a été appliqué pour tenir compte des différences de sensibilité intra-espèce et un facteur 10 pour l’utilisation d’une étude sub-chronique dans l’élaboration d’une valeur pour des expositions chroniques.
Calcul : ReVaiguë = 25 ppm / 300 = 0,086 ppm (soit 0,34 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L’OEHHA propose un REL de 7.10-2 mg.m-3 (0,02 ppm) pour une exposition chronique par inhalation au 1,1-DCE (OEHHA, 2008).
Cette valeur est calculée à partir d’une étude expérimentale sur cobayes exposés à 0 – 5 – 15 – 25 – 48ppm (soit 0 – 20 – 61 – 101 – 189 mg.m-3) de manière continue pendant 90 jours au 1,1-DCE (Prendergast et al., 1967). Une augmentation de la mortalité est rapportée à 61 – 101 – 189 mg.m-3, de même que des effets hépatiques caractérisés par une augmentation des enzymes hépatiques (ALAT et PAL) dans le groupe exposé à 189 mg.m-3 (LOAEC). De cette étude, une LOAEC de 61 mg.m-3 (augmentation de la mortalité) et une NOAEC de 20 mg.m-3 pour l’augmentation de la sécrétion d’enzymes hépatiques sont retenues (à noter que les dosages enzymatiques n’ont pas été réalisés aux doses intermédiaires de 15 et 25 ppm).
Facteurs d’incertitude : un facteur 300 a été appliqué : 3 pour l'extrapolation des données animales à l'homme, 10 pour la variabilité au sein de la population et 10 pour l'extrapolation d'une durée d'exposition subchronique à chronique.
Calcul : 20 mg.m-3 x 1/300 = 0,067 mg.m-3 (arrondi à 0,07 mg.m-3 soit 0,02 ppm)
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
L’OMS CICAD propose un TCA de 0,2 mg.m-3 pour une exposition chronique au 1,1-DCE par inhalation (OMS CICAD, 2003).
Cette valeur est établie à partir de l’étude de Quast et al., 1986) selon le même raisonnement et les mêmes calculs que rapportés par US EPA (IRIS), 2002).
Facteurs d’incertitude : Un facteur d'incertitude 30 a été appliqué. Un facteur 3 pour tenir compte de l'extrapolation inter-espèce utilisant un ajustement allométrique et un facteur 10 pour la variabilité au sein de la population humaine.
Calcul : 6,9 mg.m-3 x 1/30 = 0,23 mg.m-3 arrondi à 2.10-1 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose un MRL par voie orale de 5.10-2 mg/kg/j pour une exposition chronique au 1,1-DCE (ATSDR, 2022).
Cette valeur est basée sur l’apparition d’effets hépatiques chez des rats exposés 2 ans au 1,1-DCE par l’eau de boisson, pour lesquels un LOAEL de 9 mg.kg-1.j-1 a été établi chez les femelles, plus sensibles que les mâles, sur la base d’une faible hypertrophie hépatocellulaire (Quast et al., 1983). L’incidence des lésions non néoplasiques hépatocellulaires telles que rapportées par l’ATSDR sont présentées dans le tableau suivant.
Incidence des lésions non néoplasiques hépatiques chez le rat exposé 2 ans par voie orale (eau de boisson) au 1,1-DCE (ATSDR, 2022 selon Humiston et al., 1978 ; Quast et al., 1983).
A partir des données expérimentales sur l’incidence de la stéatose hépatique chez les femelles, modélisées d’après le modèle Gamma, une BMDL10 de 4,51 mg.kg-1.j-1 a été calculée et retenue comme POD (point de départ).
Facteurs d’incertitude : un facteur 100 a été appliqué (10 pour l’extrapolation de données animales vers l’homme et 10 pour la variabilité au sein de la population).
Calcul : 4,5 mg.kg-1.j-1 x 1/100 = 0,045 mg.kg-1.j-1 arrondi à 0,05 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
L’US EPA (IRIS) propose une RfD par voie orale de 5.10-2 mg/kg/j (2002b).
Cette valeur a été établie à partir des résultats d’une étude expérimentale (Quast et al., 1983). Des rats Sprague-Dawley mâles et femelles ont été respectivement exposés via l’eau de boisson pendant 2 ans à 7, 10 ou à 20 mg.kg-1.j-1 et à 9, 14 ou 30 mg.kg-1.j-1. Le seul effet observé est une légère hypertrophie des hépatocytes. Un NOAEL de 10 mg.kg-1.j-1 et un LOAEL de 20 mg.kg-1.j-1 ont été établis chez le rat mâle alors qu'un NOAEL de 9 mg.kg-1.j-1 et un LOAEL de 14 mg.kg-1.j-1 ont été proposés pour les rates. Une analyse de benchmark dose a été menée et une BMD10 de 6,6 mg.kg-1.j-1 ainsi qu'une BMDL10 de 4,6 mg.kg-1.j-1 ont été calculées chez les rates.
Facteurs d’incertitude : un facteur de 100 a été appliqué. Un facteur de 10 pour l’extrapolation de données animales vers l’homme et un facteur de 10 pour la variabilité au sein de la population humaine.
Calcul :
4,6 mg.kg-1.j-1 x 1/100 = 4,6.10-2 mg.kg-1.j-1 (arrondi à 5.10-2 mg.kg-1.j-1)
Indice de confiance : élevé pour l’étude et moyen pour la base de données et la RfD.
L’OMS CICAD propose une TDI de 5.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au 1,1-DCE (OMS CICAD, 2003)
Cette valeur est établie sur la base de la même étude expérimentale de Quast et al., 1983), que celle retenue par l’US EPA et décrite ci-dessus. Comme rapporté par l’US EPA, une BMDL10 de 4,6 mg.kg-1.j-1 est calculée.
Facteurs d’incertitude : un facteur 100 a été appliqué correspondant à un facteur 10 pour les variations inter-espèces et un facteur 10 pour les variations intra-espèces.
Calcul : 4,6 mg.kg-1.j-1 x 1/100 = 0,046 mg.kg-1.j-1 (arrondi à 5.10-2 mg.kg-1.j-1)
Santé Canada propose une DJT de 3.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au 1,1-DCE (Santé Canada, 2021).
Cette valeur a été établie en 1994 à partir de l’étude de toxicité par voie orale de 2 ans chez le rat, également retenue par tous les autres organismes (Quast et al., 1983). La valeur est construite à partir d’un LOAEL de 9 mg.kg-1.j-1 déterminé sur la base d’une hépatotoxicité (gonflement hépatocellulaire avec modification graisseuse dans la zone médiane) observée à la plus faible dose testée chez les femelles et retenue comme effet critique.
Facteurs d’incertitude : un facteur global 3 000 a été appliqué ; un facteur 10 pour l’extrapolation de données animales vers l’homme, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 10 pour l’extrapolation d’un LOAEL à un NOAEL et un facteur 3 pour des preuves limitées de cancérogénicité.
Calcul : 9 mg.kg-1.j-1 x 1/3 000 = 3.10-3 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
Effets sans seuil - Exposition chronique par voie orale :
L’OEHHA propose un CSF de 0,88 (mg.kg-1.j-1)-1 pour une exposition au 1,1-DCE par voie orale (OEHHA, 2017).
Cette valeur est basée sur les études expérimentales de cancérogénèse par inhalation de 1,1-DCE réalisées chez le rat et la souris par le NTP en 2015 (NTP, 2015). Le 1,1-DCE a été administré à des doses de 0 – 25 -50 – 100 ppm chez le rat F344/N (équivalent à des doses de 0 – 11 – 21 – 43 mg.kg-1.j-1 chez les mâles) et de 0 – 6,25 – 12,5 – 25 ppm chez la souris (équivalent à des doses de 0 – 5,1 – 10 – 20 mg.kg-1.j-1 chez les mâles et 0 – 4,9 – 9,8 – 20 mg.kg-1.j-1 chez les femelles) 6 heures et 10 minutes par jour, 5 jours par semaine, pendant 105 semaines.
Chez le rat mâle, le traitement n’a pas eu d’incidence sur la survie des animaux. Une augmentation significative de l’incidence des mésothéliomes malins a été observée à toutes les doses, de même que des adénomes de l’épithélium nasal uniquement à la plus forte dose testée de 100 ppm (43 mg.kg-1.j-1). Les incidences tumorales retenues par l’OEHHA dans l’estimation du CSF sont présentées dans le tableau suivant.
Incidences tumorales chez les rats mâles déterminées à partir de l’étude par inhalation de 2 ans du NTP de 2015 :
Chez les souris, le traitement a eu une incidence sur la survie aussi bien chez les mâles (25 ppm) que chez les femelles (5 et 25 ppm). Une augmentation significative de l’incidence combinée des adénomes et carcinomes des tubules rénaux a été observée à toutes les doses, alors que chez les femelles, l’incidence combinée des hémangiomes et hémangio-sarcomes ou des adénomes et carcinomes hépatocellulaires, a respectivement augmentée à 25 et 12,5 ppm. Les incidences tumorales retenues par l’OEHHA dans l’estimation du CSF sont présentées dans le tableau suivant.
Incidences tumorales chez les souris mâles et femelles déterminées à partir de l’étude par inhalation de 2 ans du NTP de 2015 :
Le calcul des doses journalières a été réalisée à partir des équations suivantes :
Dose moy = Cair (mg/m3) x Débitair rats (m3/j)/Poids rat x 6,17/24 x 5/7
Dose moy = Cair (mg/m3) x Débitair souris (m3/j)/Poids souris x 6,17/24 x 5/7
avec
Débitair rats = 0,105 x (Poids rat/0,113)2/3
Débitair souris = 0,0345 x (Poids souris/0,025)2/3
La modélisation des données a été réalisée à partir d’un modèle multi-étape pour les rats mâles et les souris femelles, et à partir d’un modèle muti-étape de Weibull pour les souris mâles afin de déterminer un CSF (Cancer Slope factor) chez l’animal correspondant à un excès de risque de 5 %.
Le CSF équivalent chez l’humain a été calculé à partir de l’équation suivante :
CSFhumain = CSFanimal x (Poids humain/poids animal)1/4
Les valeurs de CSF dérivés pour les différents types de tumeurs sont regroupées dans le tableau suivant.
Valeurs de CSFhumain déterminés à partir des CSFanimaux pour l’apparition de différents types de tumeurs observées dans les études de cancérogènes chez le rat et la souris dans les études du NTP, 2015 :
La valeur la plus protectrice CSFhumain de 0,80 (mg.kg-1.j-1)-1 déterminée à partir de l’apparition d’adénomes ou de carcinomes des tubules rénaux chez les souris mâles a été retenue par l’ATSDR.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’Ineris propose de retenir pour une exposition aiguë au 1,1-DCE par inhalation la VTR aiguë de 0,71 mg.m-3 (TCEQ, 2013).
Seul le TCEQ (2013) propose une valeur pour une exposition aiguë.
La valeur est établie à partir d’une étude expérimentale réalisée sur des souris mâles exposées par inhalation à 10 et 50 ppm (40 et 200 mg.m-3) de 1,1-DCE pendant une période unique de 6 heures (Reitz et al., 1980). L’étude présente des limites en termes de protocole (seules deux doses ont été testées) et de la pertinence des effets recherchés relatifs aux mécanismes de synthèse et de réparation de l’ADN L’effet critique retenu, une toxicité hépatique basée sur des lésions histologiques observées à la plus forte dose, est cohérent avec le profil toxicologique du 1,1-DCE. Par ailleurs, des effets rénaux, observés à la plus faible dose de 10 ppm, n’ont pas été jugés pertinents par le TCEQ car considérés comme étant spécifique de l’espèce et du sexe. Un facteur global d’incertitude de 100 est retenu, ce choix est justifié. La construction de la valeur est satisfaisante. L’Ineris propose de retenir cette valeur par défaut compte tenu de la qualité de l’étude et des données.
Indice de confiance : par défaut en raison de l’ancienneté de l’étude et de la qualité des données
Effets à seuil - Exposition sub-chronique par inhalation :
L’Ineris propose de retenir pour une exposition sub-chronique au 1,1-DCE par inhalation la VTR de 4 10-3 mg.m-3 (0,001 ppm) (ATSDR, 2022).
Un seul organisme propose une valeur pour une exposition sub-chronique par inhalation l’ATSDR (2022). Il s’agit d’une étude de bonne qualité (NTP, 2015). Compte tenu de sa durée, cette étude est bien adaptée pour le développement d’une valeur pour une exposition sub-chronique. L’effet critique retenu, les lésions de l’épithélium nasal, est pertinent. La valeur est construite à partir du calcul d’une Benchmark concentration qui est bien documentée, les ajustements temporels et dosimétriques sont justifiés. Les facteurs d’incertitude sont appropriés.
Indice de confiance : élevé en raison de la qualité de l’étude, de l’effet critique et de la construction de la valeur.
Effets à seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique au 1,1-DCE par inhalation la VTR chronique de 4.10-3 mg.m-3 (0,001 ppm) (ATSDR, 2022).
Cinq organismes proposent des valeurs pour une exposition chronique : l’US EPA (2002), l’OEHHA (2000), l’OMS CICAD (2003), le TCEQ (2013) et l’ATSDR (2022)
Tous les organismes s’appuient sur des études expérimentales. L’US EPA et l’OMS CICAD retiennent l’étude chronique de Quast et al., 1986 chez le rat. L’étude de Quast est une étude de 18 mois (chronique) de qualité recevable, malgré une augmentation des concentrations d’exposition en cours d’étude et des niveaux d’exposition relativement élevés. Le TCEQ et l’OEHHA prennent celle de Prendergast et al., 1967 menée sur plusieurs espèces animales (rats, chiens, cobayes, lapins, singes) pendant 90 jours (sub-chronique). L’étude de Prendergast présente l’avantage d’avoir été menée sur plusieurs espèces à des niveaux d’exposition relativement faibles, cependant les dosages des enzymes hépatiques en lien avec l’effet critique retenu, n’ont pas été réalisées aux doses intermédiaires. Enfin, l’ATSDR utilise les études du NTP, 2015 pour des expositions sub-chroniques et chroniques conduites chez le rat et la souris. Ces études du NTP sont de bonne qualité toutefois les concentrations retenues chez le rat pour les expositions chroniques ne sont pas assez basses pour la détermination d’une NOAEC, ce qui limite la pertinence de cette étude.
Tous les organismes, en dehors de l’ATSDR retiennent comme effet critique la toxicité hépatique, cohérent avec les effets du 1,1-DCE. Le TCEQ retient une atteinte hépatique mise en évidence histologiquement par des foyers de nécrose observés à la fois chez le rat, le chien et le singe dans les groupes exposés à 101 mg.m-3. A partir de la même étude (Prendergast et al., 1967), l’OEHHA considère une NOAEC de 20 mg.m-3 pour l’augmentation du taux des enzymes hépatiques. L’US EPA prend en compte des changements mineurs dans la taille des cellules hépatiques présentes dans les lobes hépatiques chez les rats mâles et femelles, 6 et 12 mois après le début de l'exposition. Après 18 mois d'exposition, ces changements persistent seulement chez les rats femelles. Cet effet est significatif uniquement pour la concentration de 75 ppm (300 mg.m-3). Il est réversible et n'induit aucun changement dans le fonctionnement hépatique. A partir de ces éléments une NOAEC de 25 ppm (100 mg.m-3) et une LOAEC de 75 ppm (300 mg.m-3) ont été établies chez les rates.
Seul l’ATSDR retient comme effet critique, des lésions localisées au niveau de l’épithélium nasal documentées dans des études de 90 jours et 2 ans réalisées par le NTP en 2015, à la fois chez le rat et la souris. Ces lésions surviennent à des concentrations plus faibles que les effets hépatiques et correspondent à un effet local du 1,1-DCE. Du fait de sa plus grande sensibilité et de son expression locale, l’effet critique retenu par l’ATSDR au niveau de l’épithélium nasal est jugé plus pertinent que l’effet systémique hépatique considéré par les autres organismes.
L’ATSDR construit initialement sa valeur à partir d’une étude sur 2 ans chez la souris, avec une concentration limite d’exposition inférieure plus faible (6,25 ppm) que chez le rat (25 ppm). L’effet critique retenu correspond à une augmentation de l’incidence d’une métaplasie de l’épithélium olfactif, significative dès la plus faible dose de 6,5 ppm. L’ATSDR développe sa valeur selon le même schéma que celui décrit pour le calcul de la VTR sub-chronique construit à partir d’une étude de 90 jours chez le rat et aboutit à un MRL du même ordre de grandeur, mais légèrement supérieure. L’ATSDR souligne l’incohérence de proposer un MRL de toxicité chronique supérieur au MRL de toxicité sub-chronique et choisit donc de retenir la même valeur de MRL à la fois pour une exposition sub-chronique et chronique.
L’Ineris suit la démarche de l’ATSDR et retient la valeur développée pour les expositions sub-chroniques pour des expositions chroniques.
Indice de confiance : Faible en raison de la qualité du protocole de l’étude.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique au 1,1-DCE par voie orale la VTR chronique de 5.10-2 mg.kg-1.j-1 (US EPA, 2002 ; ATSDR, 2022).
Quatre organismes proposent une valeur l’ATSDR (2022), l’US EPA (2002), l’OMS CICAD (2003) et Santé Canada (2019). Ces quatre valeurs sont basées sur la même étude chronique chez le rat (Quast et al., 1983) qui est de bonne qualité.
Dans tous les cas, l’effet critique retenu est la toxicité hépatique observée chez les 2 sexes et survenant à 14 mg.kg-1.j-1 chez les femelles. Cet effet n’est pas retrouvé à la dose inférieure correspondant à une NOAEL de 9 mg.kg-1.j-1 pour les rates. Néanmoins, 2 paramètres de toxicité hépatique, l’hypertrophie hépatocellulaire et la stéatose hépatique ont été observés avec une faible intensité et leur nature d’origine adaptative ne peut être totalement écartée.
Seul Santé Canada propose d’utiliser un LOAEL pour dériver la VTR alors que tous les autres organismes retiennent une approche reposant sur la construction d’une BMD. Cette dernière méthode est préférable. De plus, Santé Canada applique un facteur d’incertitude de 3 000 prenant notamment en compte les propriétés cancérigènes du 1,1-DCE, ce qui ne semble pas adapté au regard des recommandations actuelles et conduit à un facteur d’incertitude trop élevé. La valeur de Santé Canada n’est pas retenue.
L’US EPA et l’ATSDR proposent le calcul d’une BMD à partir de modèles mathématiques un peu différents, mais qui aboutit à des valeurs très proches. Les deux organismes utilisent un facteur global d’incertitude de 100 prenant en compte les variation inter- et intra-espèces, ce qui est justifié dans les 2 cas. L’US EPA et l’ATSDR aboutissent au même résultat dans le calcul de leur valeur. L’OMS retient le raisonnement et les mêmes calculs que l’US EPA. La démarche de l’US EPA et de l’ATSDR, de même que les raisonnements nous paraissent adaptés et sont préconisés par l’Ineris.
Indice de confiance : moyen avec des limites concernant l’intensité de l’effet critique.
Effets sans seuil - Exposition chronique par voie orale :
L’Ineris propose de ne pas retenir de valeur pour une exposition chronique au 1,1-DCE par voie orale.
Seule une valeur est proposée par l’OEHHA (2017). Cette valeur a été établie à partir de deux études de cancérogénèse de 105 semaines par inhalation de 1,1-DCE chez le rat et la souris réalisées selon les BPL (NTP, 2015). Cette valeur est construite par extrapolation voie à voie et retient des adénomes et carcinomes rénaux observés chez les souris mâles ce qui rend l’extrapolation à l’homme peu recevable. Il est de plus à noter que l’incidence de ces tumeurs ne suit pas une relation dose-réponse. La valeur de l’OEHHA n’est pas retenue.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/07/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
-
Effets endocriniens :
Le 1,1-dichloroéthylène n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) ni dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Critères PBT / POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
Normes de qualité existantes (ETOX, 20073):
Etats-Unis : critère de qualité pour la consommation des produits de la pêche = 3,2 µg.L-1,
Etats-Unis : critère de qualité pour la consommation d'eau de boisson = 0,057 µg.L-1,
Allemagne : norme de qualité pour les eaux prélevées destinées à la consommation = 10 µg.L-1,
Japon: norme de qualité pour l'eau = 20 µg.L-1,
Pays-Bas : objectif de qualité pour l'eau destinée à la consommation humaine =
- 3,4 µg dissous /L
- 34 µg total /L
Canada : critère de qualité pour les eaux destinées à la consommation humaine = 14 µg.L-1.
Substance(s) associée(s) :
-
FDTE/VTR Importer L'objectif de cette rubrique est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme.
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement bioaccumulables, et qui peuvent être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement. Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[3] Les données issues de cette source (http://webetox.uba.de/webETOX/index.do) ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS.
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon, uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées ont fait l'objet d'une validation par l'INERIS.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
ECOTOXICITE AQUATIQUE AIGUË
|
Organisme |
Espèce |
Critère d'effet |
Valeur [mg/L] |
Validité |
Source |
|
|
Algues & plantes aquatiques |
Eau douce |
Chlamydomon as reinhardtii |
EC50 (72h) |
9,12 |
Valide |
Brack et Rottler, 1994 |
|
Scenedesmus abundans |
EC50 (48 h) |
410 |
Non valide |
Geyer et al., 1985 |
||
|
Milieu marin |
|
Pas d’information disponible |
|
|||
|
Invertébrés |
Eau douce |
Daphnia magna |
EC50 (48 h) |
11,6 |
Non valide |
Dill et al., 1980 |
|
Daphnia magna |
EC50 (48 h) |
29 |
Valide |
LeBlanc, 1980 |
||
|
Milieu marin |
Americamysis bahia |
LC50 (96 h) |
224 |
Non validable |
US-EPA, 1978 |
|
|
Sédiment |
|
Pas d’information disponible |
|
|||
|
Poissons |
Eau douce |
Pimephales promelas |
LC50 (7 j) |
29 |
Valide |
Dill et al., 1980 |
|
Milieu marin |
Menidia beryllina |
LC50 (96 h) |
250 |
Non valide |
Dawson et al., 1975 |
|
ECOTOXICITE AQUATIQUE CHRONIQUE
|
Organisme |
Espèce |
Critère d'effet |
Valeur [mg/L] |
Validité |
Source |
|
|
Algues & plantes aquatiques |
Eau douce |
Chlamydomon as reinhardtii |
(72h) |
3,94 |
Valide |
Brack et Rottler, 1994 |
|
Scenedesmus subspicatus |
EC10 (96 h) |
240 |
Non valide |
Korte et Freitag, 1984 |
||
|
Milieu marin |
|
Pas d’information disponible |
|
|||
|
Invertébrés |
Eau douce |
|
Pas d’information disponible |
|
||
|
Milieu marin |
|
Pas d’information disponible |
|
|||
|
Sédiment |
|
Pas d’information disponible |
|
|||
|
Poissons |
Eau douce |
Pimephales promelas |
(13 j) |
20 |
Valide |
Dill et al., 1980 |
|
Milieu marin |
|
Pas d’information disponible |
|
|||
Compte tenu des propriétés physico-chimiques du 1,1-dichloroéthylène et notamment de sa capacité de volatilisation, l'absence d'obturation des flacons ou/et l'absence de mesures des concentrations de la substance testée dans le milieu d'essai sont les raisons principales de l'invalidation des études suivantes : Geyer et al., 1985 ; Dill et al., 1980 ; Dawson et al., 1975 et Korte et Freitag, 1984. L'essai long terme algue de Brack et Rottler (1994) sur Chlamydomonas reinardtii est l'un des rares tests du jeu de données à avoir été réalisé avec une mesure des concentrations dans le milieu et un calcul des concentrations d'effets et sans effet basé sur les concentrations mesurées.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Compte tenu de la volatilité de la substance, il est difficile de maintenir les concentrations d'exposition dans les milieux d'essai. De nombreux résultats présentés sont en conséquence susceptibles de sous-estimer la toxicité de la substance.
Algues :
Les essais sur algues étant effectués généralement en conditions statiques, la substance peut se volatiliser pendant l'essai. Geyer et al.,invalident eux mêmes leurs résultats (compte tenu de la disparition de la substance du milieu d'essai. Les résultats sur algues (Scenedesmus abundans EC50 (96 h) = 410 mg/L) ne sont donc pas valides et sous-estiment la toxicité de la substance.
Crustacés :
Les essais réalisés par Leblanc sont réalisés en statique et exprimés en concentrations nominales (Daphnia magna LC50 (48 h) = 79 mg/L). Les récipients d’essais sont couverts mais il n’est pas possible d’estimer l’efficacité de ce dispositif. L'essai n'est pas valide compte tenu de la volatilité de la substance.
Dans l'essai rapporté par Dill et al., la concentration (Daphnia magna LC50 (24 h) = 11,6 mg/L) n'a pas été mesurée en cours d'essai et le résultat est exprimé en concentration théorique. Les CL50 estimées après 24 et 48 heures d'exposition sont identiques suggérant une volatilisation de la substance. Ce résultat sous-estime en conséquence les effets du 1,1-dichloroéthylène.
Poissons :
Les essais rapportés par Dawson et al. ainsi que Heitmuller et al. sont effectués en statique et exprimés en concentrations nominales. Ils ne sont en conséquence pas valides. Buccafusco et al. expriment également leurs résultats en concentrations nominales et leurs essais ont été réalisés dans des conditions statiques. Cependant, ils ont recouvert leurs aquariums d'essai afin de limiter la volatilisation des substances testées. Il n'est pas possible d'estimer l'efficacité de leur dispositif. Par contre l'essai rapporté par Dill et al. sur Pimephales promelas a été réalisé en continu et les résultats sont exprimés en concentrations mesurées. Cet essai est donc valide.
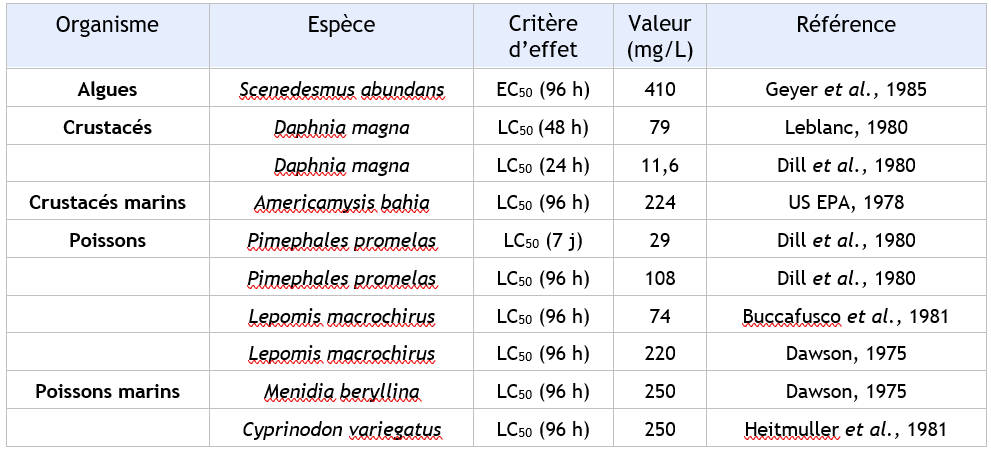
Paramètres d’écotoxicité chronique :
Les essais sur algues ne tiennent pas compte de la volatilité de la substance.
De même l’essai sur Brachydanio rerio a été réalisé en système statique, les concentrations reportées sont les concentrations nominales. Compte tenu de la volatilité de la substance, cet essai est en conséquence considéré comme non valide.
Le résultat rapporté par Dill et al. est valide car le système d'exposition était en continu et les résultats exprimés en concentrations mesurées. Les effets observés étant la mortalité, il est cependant difficile de le considérer comme l'expression d'un effet chronique
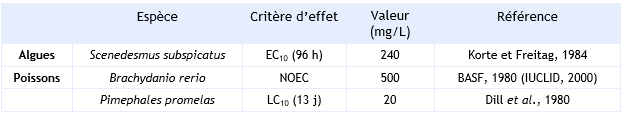
Sédiments d'eau douce
FDTE/VTR Importer Il n’existe pas de données sur organismes benthiques.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Ces résultats sont exprimés en concentrations nominales. Compte tenu de la volatilité de la substance, les essais rapportés ci-dessous ne sont pas valides.
Paramètres d’écotoxicité chronique :
Aucun essai long-terme n’est disponible pour les organismes terrestres.
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2010). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES
|
|
Type de test |
NOAEL (1) [mg/kgcorporel/j] |
Source |
Facteur de conversion |
[mg/kgbiota] |
|
Toxicité subchronique et/ou chronique |
Rat Durée : 2 ans Administration orale via l’eau de boisson Effet : modification morphologique du foie avec notamment la présence de cellules hépatocytaires surchargées en graisse. |
LOAEL= 9 NOAELcorr(2) = 0.9 (AFdose-réponse = 10) |
Quast et al., 1983, cité dans 1994 |
20 |
18 |
(1) NOAEL : No Observed Adverse Effect Level
(2) La NOAELcorr correspond à la NOAEL déduite à partir de la LOAEL disponible. Le facteur d'extrapolation de 10 a été fixé par ATSDR.
TOXICITE ORALE POUR LES OISEAUX
|
|
Type de test |
NOAEL/LOAEL (1) [mg/kgcorporel/j] |
Source |
Facteur de conversion |
[mg/kgbiota] |
|
Toxicité subchronique et/ou chronique |
Pas d’information disponible |
||||
|
Toxicité pour la reproduction |
Pas d’information disponible |
||||
(1) NOAEL : No Observed Adverse Effect Level; LOAEL : Low Observed Adverse Effect Level
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon guide technique pour la détermination de normes de qualité environnementale (E.C., 2011), la sensibilité des espèces marines à la toxicité des substances organiques peut être considérée comme équivalente à celle des espèces dulçaquicoles, à moins qu'une différence ne soit montrée.
![]()
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour le 1,1-dichloroéthylène, on dispose de données pour trois niveaux trophiques (algues, crustacés et poissons) en exposition aiguë et pour deux niveaux trophiques (algues et poissons) en chronique. On observe que pour les deux types d'exposition, l'algue verte Chlamydomonas reinhardtii est l'espèce la plus sensible. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 50 est appliqué sur la plus faible donnée disponible soit, la NOEC(72h) à 3,94 mg.L-1 sur Chlamydomonas reinhardtii, pour déterminer la AA-QSwater_eco. L'INERIS propose donc la valeur suivante :
![]()
En ce qui concerne les organismes marins, seules deux données aiguës (invertébrés et poissons) sont disponibles. Le jeu de données disponible ne permet donc pas de mettre en évidence une différence de sensibilité entre les espèces marines et dulçaquicoles. Pour le milieu marin, le facteur d'extrapolation appliqué doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d'espèces plus importante. Etant donnée l'absence de données marines en exposition chronique, aucun taxon additionnel spécifique du milieu marin n'est donc représenté. Par conséquent et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 500 est appliqué sur la plus faible donnée disponible soit, la NOEC(72h) à 3,94 mg.L-1 sur Chlamydomonas reinhardtii, pour déterminer la AA-QSmarine_eco. L'INERIS propose donc la valeur suivante :
![]()
- Concentration Maximum Acceptable (MAC et MACmarine) :
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
Pour le 1,1-dichloroéthylène, on dispose de données aiguës pour trois niveaux trophiques, parmi lesquels l'algue verte Chlamydomonas reinhardtii s'avère être la plus sensible. Par conséquent et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 100 est appliqué sur l'EC50(72h) de 9,12 mg.L-1 obtenue avec Chlamydomonas reinhardtii pour déterminer la MAC. L'INERIS propose donc la valeur suivante :
![]()
En ce qui concerne les organismes marins, deux données aiguës (invertébrés et poissons) sont disponibles. Le jeu de données disponibles ne permet donc pas de mettre en évidence une différence de sensibilité entre les espèces marines et dulçaquicoles. Pour le milieu marin, le facteur d'extrapolation appliqué doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons clés et une diversité d'espèces plus importante. En revanche, les deux données disponibles sur organismes marins ne représentent pas des taxons spécifiques du milieu marin additionnels par rapport aux données d'eau douce. Par conséquent et conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 1000 est appliqué sur la plus faible donnée disponible soit, l'EC50(72h) de 9,12 mg.L-1 obtenue sur Chlamydomonas reinhardtii, pour déterminer la MACmarine. L'INERIS propose donc la valeur suivante :
![]()
|
Proposition de norme de qualité pour les organismes de la colonne d’eau (eau douce) |
||
|
Moyenne annuelle [AA-QSwater_eco] |
78 |
µg/L |
|
Concentration Maximum Acceptable [MAC] |
91 |
µg/L |
|
Proposition de norme de qualité pour les organismes de la colonne d’eau (eau marine) |
||
|
Moyenne annuelle [AA-QSmarine_eco] |
7,8 |
µg/L |
|
Concentration Maximum Acceptable [MACmarine_eco] |
9,1 |
µg/L |
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE) (C.E., 2000).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature.
A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que :
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (E.C., 2010) :
![]()
RHOsed : masse volumique du sédiment en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2010) est utilisée : 1300 kg.m-3 .
Ksed-eau : coefficient de partage sédiment/eau en m3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par le guide technique européen (E.C., 2010) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0,8 + 0,025 * Koc soit Ksed-eau = 2,4 m3/m3
Pour le 1,1-dichloroéthylène, on obtient :
![]()
![]()
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2011) est utilisée : 0,2 m3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le document guide technique européen (E.C., 2010) est utilisée : 2500 kg.m-3 .
Pour le 1,1-dichloroéthylène , la concentration correspondante en poids sec est :
![]()
Selon la même approche que pour le sédiment d'eau douce, une valeur guide de qualité pour le sédiment marin peut être calculée selon la formule suivante :
![]()
Pour le 1,1-dichloroéthylène, on obtient :
![]()
QSsed-marin wet weight = 14,7 µg.kg-1poids humide
La concentration correspondante en poids sec est alors la suivante:
![]()
Le log Kow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
|
Proposition de valeur guide pour les organismes benthiques (eau douce) |
147 |
µg/kgsed poids humide |
|
382 |
µg/kgsed poids sec |
|
|
Proposition de valeur guide pour les organismes benthiques (eau marine) |
14 |
µg/kgsed poids humide |
|
38 |
µg/kgsed poids sec |
|
|
Conditions particulières Avec un Koc de 65 L/kg et un log Kow de 1,85, la mise en œuvre d’un seuil pour les organismes benthiques n’est pas recommandée par le document guide technique européen (E.C., 2011). |
||
NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2011). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés (E.C., 2011).
Pour le 1,1-dichloroéthylène, un facteur de 30 est appliqué car la durée du test retenu (NOAEL de 0.9 mg/kgcorporel/j sur le rat, soit une NOEC de 18 mg.kg-1biota) est de 2 ans. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
Avec :
BCF : facteur de bioconcentration,
BMF1 : facteur de biomagnification,
BMF2: facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de
valeurs mesurées pour le BMF1 et le BMF2, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le 1,1-dichloroéthylène , un BCF de 6.9 et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc :
![]()
|
Proposition de norme de qualité pour l’empoisonnement secondaire des prédateurs |
600 |
µg/kgbiota |
|
valeur correspondante dans l’eau (douce et marine) |
87 |
µg/L |
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011) :
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 9 µg/kgcorporel/j (cf. tableau ci-dessus),
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Le 1,1-dichloroéthylène étant suspecté d'induire des effets cancérogènes (classé Carc.2 H351) le facteur de sécurité est fixé à 10.
- Cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
Pour 1,1-dichloroéthylène, le calcul aboutit à :
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
Pour 1,1-dichloroéthylène, on obtient donc :
![]()
|
Proposition de norme de qualité pour la santé humaine via la consommation de produits de la pêche |
55 |
µg/kgbiota |
|
valeur correspondante dans l’eau (douce et marine) |
8 |
µg/L |
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1).
Il n'existe aucune norme de qualité pour la protection de la santé humaine vis-à-vis de la consommation d'eau potable pour le 1,1-dichloroéthylène.
A titre de comparaison, la valeur seuil provisoire pour l'eau de boisson est calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 9 µg/kgcorporel/j (cf. tableau ci-dessus),
- Cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
- Fsécurité : facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Le 1,1-dichloroéthylène étant suspecté d'induire des effets cancérogènes (classé Carc.2 H351) le facteur de sécurité est fixé à 10.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
Ainsi, la norme de qualité correspondante dans l'eau brute se calcule de la manière suivante :
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour 1,1-dichloroéthylène, on obtient :
|
Proposition de norme de qualité pour l’eau destinée à la production d’eau potable |
3 µg/L |
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
VGE/NQE Importer
PROPOSITION DE VALEUR GUIDE ENVIRONNEMENTALE (VGE)
La VGE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
![]()
Pour le 1,1-dichloroéthylène, la valeur pour la protection de la santé humaine via l'eau destinée à la production d'eau potable est la valeur la plus faible pour l'ensemble des approches considérées. Pour les eaux qui ne sont pas destinées à la production d'eau potable, c'est la protection de l'homme via la consommation de produits de la pêche qui est l'objectif de protection déterminant pour les eaux douces, et des organismes de la colonne d'eau pour les eaux marines.
VALEURS GUIDES POUR LE SEDIMENT
Avec un Koc de 65 L.kg-1 et un log Kow de 1,85, la mise en œuvre d'un seuil pour le sédiment n'est pas recommandée par le document guide technique européen (E.C., 2011).
FDTE/VTR Importer Concentrations sans effet prévisible pour l'environnement (PNEC). Propositions de l'INERIS
Il n'existe pas de résultats d'essai long terme valides, le seul pouvant être utilisé est le résultat sur Pimephales promelas. Cependant, le résultat court terme sur daphnie est plus faible que le résultat "long terme" sur Pimephales promelas, bien que ce premier sous-estime certainement la toxicité du 1,1-dichloroéthylène.
En conséquence, une PNEC aquatique provisoire peut être obtenue à l’aide d’un facteur d’extrapolation de 1 000 avec la donnée aiguë la plus faible (EC50 (48 h) = 11,6 mg/L vis-à-vis de Daphnia magna). D’où :
PNECEAUprovisoire = 11,6 µg/L
Compte tenu de l'absence de résultats valides sur organismes benthiques ou terrestres et la sur estimation probable de la PNECEAU, nous ne proposons pas de PNEC pour le compartiment sédimentaire ou terrestre.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 75-35-4 |
|---|---|
| SANDRE | 1162 |
| Usages principaux |
Mini-FTE Importer Usage 1 : D'une manière générale production de polymères, produits chimiques, caoutchouc, produits en plastique. Le 1,1 DCE est en particulier une matière première (monomère) de la fabrication du polychlorure de vinylidène (PVDC). Le PVDC contenant 79-90% de 1,1 DCE (polymérisé) est utilisé comme film souple destiné à l'emballage, notamment alimentaire (le polyéthylène additivé semble néanmoins avoir substitué le PVDC pour cet usage). Le PVDC contenant 10-70% de 1,1 DCE (polymérisé) est utilisé dans la fabrication de revêtements ignifugés (adhésifs synthétiques en émulsion pour moquettes et tapis, tuyaux en acier, vêtements, pare-vapeurs, …). Usage 2 : Utilisé dans la fabrication de semi-conducteurs (pour la croissance de SiO2). Usage 3 : Utilisé pour la fabrication de chlorure de chloracétyle, lui-même utilisé dans des synthèses organiques (notamment le chlorure de phénacyle). Usage 4 : Utilisé pour la fabrication de deux réfrigérants, les hydrochlorofluorocarbones HCFC141b et HCFC-142b, qui doivent néanmoins être éliminés au 1er janvier 2020 selon le protocole de Montréal. |
| Autres informations d'usage |
Mini-FTE Importer - Inclusion dans des articles : Non Peut subsister accidentellement sous forme de résidus de fabrication dans certains articles. - Large utilisation dispersive : Non - Principaux produits de dégradation dans l'eau:
- Secteurs NAF identifiés comme usagers : 20.1 Fabrication de produits chimiques de base, de produits azotés et d'engrais, de matières plastiques de base et de caoutchouc synthétique. |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
Mini-FTE Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Substance pertinente au titre du programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses1 . Seuil de déclaration des émissions des installations classées pour la protection de l'environnement ou des stations d'épuration d'eaux urbaines : 300 g.j-1 pour les rejets dans les eaux. Le dépassement de ce flux entraîne l'obligation de déclaration du flux annuel 2 . Restriction sous REACH : le 1,1-dichloroéthène ne peut être mis sur le marché, ni utilisé en tant que substance, en tant que constituant d'autres substances ou dans des mélanges à des concentrations égales ou supérieures à 0,1 % en poids, lorsque la substance ou le mélange est destiné à la vente au grand public et/ou est destiné à des applications diffusives telles que le nettoyage des surfaces et le nettoyage des tissus. Sans préjudice de l'application d'autres dispositions communautaires relatives à la classification, à l'emballage et à l'étiquetage des substances et des mélanges, les fournisseurs veillent à ce que, avant la mise sur le marché, l'emballage de ces substances et des mélanges le contenant à des concentrations égales ou supérieures à 0,1 % en poids, porte la mention visible, lisible et indélébile suivante : « Pour utilisation dans des installations industrielles uniquement ». Par dérogation, cette disposition ne s'applique pas aux médicaments ou produits vétérinaires tels que définis par Directive 2001/82/CE et directive 2001/83/CE et aux produits cosmétiques au sens de la directive 76/768/CEE3 . [2] Arrêté du 31 janvier 2008 modifié relatif au registre et à la déclaration annuelle des émissions polluantes et des déchets [3] REAC H ANNEXE XVII https://echa.europa.eu/documents/10162/47239303-dea1-4d12-8a2f-b95bc7c5f1b8 |
| Classification CLP | Voir la classification CLP |
Volume de production
| France |
Mini-FTE Importer n.c. |
|---|---|
| UE |
Mini-FTE Importer 10 000 – 100 000 t.an-1 (2019) REACH |
| Monde |
Mini-FTE Importer 306 000 t.an-1 (1980) Pas de donnée récente
|
Consommation
| Volume de consommation en France |
Mini-FTE Importer n.c. |
|---|
Présence dans l'environnement
| Eaux de surface |
Mini-FTE Importer La base de données Naïades recense 9 696 mesures de 1,1dichloroéthylène dans les eaux de surface en France en 2018. Parmi ces mesures, 3 prélèvements présentent des concentrations de 1,1dichloroéthylène supérieures à la limite de quantification comprise entre 0,1 et 1 µg.l-1. La concentration maximale en 1,1-dichloroéthylène s'élève à 1,1 µg.l-1 et correspond à un prélèvement effectué dans un cours d'eau de Provences-Alpes-Côte d'Azur. Les 22 mesures de 1,1-dichloroéthylène effectuées en France en 2018 sur des matières en suspension étaient toutes inférieures à la limite de quantification de 10 µg/kg. Sur les 432 mesures de 1,1-dichloroéthylène effectuées sur les sédiments en 2018 en France et accessibles dans la base Naïades, aucune mesure n'est supérieure à la limite de quantification (les limites de quantification étant comprises entre 6 et 62 µg/kg). |
|---|---|
| Eaux souterraines |
Mini-FTE Importer La base de données ADES répertorie 2 484 mesures de 1,1-dichloroéthylène dans les eaux souterraines en France en 2018. Parmi ces mesures, 96 (soit 4 % de la totalité des mesures) présentent une concentration supérieure à la limite de quantification comprise entre 0,2 et 3,8 µg.l-1. La concentration maximale de 1,1-dichloroéthylène s'élève à 355 µg.l-1 (cette mesure correspond à un prélèvement effectué dans la région Hauts de France) et la concentration médiane à 2,55 μg/l. |
| Air |
Mini-FTE Importer Présence en France non-documentée. Présence possible : la substance est volatile. |
| Sols |
Mini-FTE Importer Présence en France non-documentée. Présence possible, sa dégradation dans les sols est lente. |
Rejets dans l’environnement
Sources non-intentionelles
Mini-FTE Importer
Le 1,1-dichloroéthylène peut être un produit de dégradation du PVDC, du trichloroéthylène, du 1,1,1-trichloroéthane, tetrachloroéthylène, et du 1,1,2-trichloroéthane. Sa présence est documentée sur les sites de stockage de déchets dangereux.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










