Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Dichlorométhane (75-09-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
75-09-2
Nom scientifique (FR)
Dichlorométhane
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-838-9
Code SANDRE
1168
Numéro CIPAC
-
Formule chimique brute
\(\ce{ CH2Cl2 }\)
Code InChlKey
Code SMILES
ClCCl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H351 |
|---|---|
| Mention du danger - Texte | Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 19/08/2025
Généralités
Poids moléculaire
84.90 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Toxicologie
Dernière vérification le 30/06/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2000, 2022 ; IARC, 1999, 2014 ; OMS IPCS, 1996; US EPA, 2014; 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
Chez l’homme, l'inhalation est la voie d'exposition principale au chlorure de méthylène. .
Environ 70 à 75 % du chlorure de méthylène inhalé est absorbé au niveau pulmonaire chez l'homme, pour des concentrations comprises entre 180 et 710 mg.m-3 (50 et 200 ppm) (DiVincenzo et Kaplan, 1981a). Au début, l'absorption est rapide, correspondant à une concentration sanguine de 0,2 et 0,6 mg.L-1 durant la première heure d'exposition à respectivement 180 mg.m-3 (50 ppm) et 350-710 mg.m-3 (100-200 ppm). Ensuite, l'absorption s'équilibre avec le métabolisme et l'élimination par exhalation du produit. Les teneurs sanguines maximales en chlorure de méthylène semblent être atteintes en 2 à 4 heures d'exposition (DiVincenzo et Kaplan, 1981 ; McKenna et al., 1980). Une corrélation directe a été obtenue entre les valeurs sanguines en chlorure de méthylène à l'équilibre et la concentration d'exposition, avec une constante de proportionnalité d'environ 8.10-3 ppm dans le sang pour 1 ppm dans l'air (DiVincenzo et Kaplan, 1981).
Voie orale
L'absorption par voie orale ou cutanée du chlorure de méthylène est peu documentée chez l'homme. Des cas d'ingestions accidentelles, à l'origine de narcoses, montrent que ce composé est absorbé via la barrière intestinale (ATSDR, 2000).
Voie cutanée
L'absorption du chlorure de méthylène par voie cutanée a été également mise en évidence. Un volontaire a immergé durant 30 minutes son pouce dans du chlorure de méthylène, tout en étant protégé des vapeurs de ce produit. La concentration en chlorure de méthylène, retrouvée dans l'air alvéolaire, était de 3,1 ppm (11 mg.m-3). Deux heures après, elle était tombée à 0,69 ppm (2,5 mg.m-3) (Stewart et Dodd, 1964).
Distribution
Concernant la distribution du chlorure de méthylène, il n'existe pas de données quantitatives sur la répartition de ce produit dans l'organisme humain. Toutefois, des mesures effectuées dans l’air alvéolaire montrent une diffusion rapide dans les tissus et une distribution en premier lieu, vers les organes les plus vascularisés (cerveau, cœur, foie, reins, glandes endocrines), puis dans les muscles et la peau et enfin dans les tissus adipeux (INRS, 2014).
Le passage du chlorure de méthylène dans le lait maternel a été mis en évidence (INRS, 2014).
Métabolisme
Les données disponibles sur le métabolisme du chlorure de méthylène suggèrent que le taux de métabolisation hépatique est 10 fois supérieur à celui des poumons (INRS, 2014). La dégradation hépatique se fait par deux voies principales présentées dans le schéma suivant :
métabolisme du dichlorométhane (FT n°34 INRS, 2014).
- la voie oxydative sous la dépendance des cytochromes P450 (CYP2E1) conduit à la formation de monoxyde de carbone (CO) via un intermédiaire instable, le chlorure formique.
- la voie de conjugaison par les glutathion-S-transférase (GST) conduit à la formation de composés réactifs comme le formaldéhyde et le dioxyde de carbone.
La voie des cytochromes P450 semble être privilégiée pour les expositions par inhalation. Des volontaires exposés à 500 ppm (1 775 mg.m-3) ou plus de chlorure de méthylène durant 1 ou 2 heures, présentaient des concentrations élevées en carboxyhémoglobine, indiquant que ce composé était métabolisé en CO (Stewart et al., 1972). Elle est prépondérante aux faibles concentrations et arrive rapidement à saturation (vers 200 ppm, soit 710 mg.m-3) (ANSES, 2018).
Une augmentation des teneurs en carboxyhémoglobine a également été détectée chez une femme ayant absorbé environ 300 mL de décapant contenant 75 à 80 % de chlorure de méthylène, ce qui suggère que la voie des cytochromes P450 est également utilisée pour dégrader le chlorure de méthylène ingéré (Hughes et Tracey, 1993).
L’importance de la mise en jeu de ces voies métaboliques est également sous la dépendance d’un polymorphisme génétique qui concerne aussi bien les enzymes de conjugaison (GSTT1) que les enzymes de la voie d’oxydation (CYP2E1). Selon Bos et al., (2006) la variabilité de la biotransformation serait due davantage au polymorphisme des enzymes de conjugaison, 20 % de la population présentant un gène GSTT1 inactif.
Plusieurs modèles PBPK ont été publiés dans la littérature, initialement construit sur la base de 4 compartiments (graisse, foie, tissus richement ou faiblement vascularisés) avec un métabolisme uniquement hépatique (Gargas et al, 1986), ultérieurement enrichi d’un deuxième compartiment extra-hépatique/extra-pulmonaire pour considérer le fort métabolisme du dichlorométhane à faible concentration et construit à partir de données humaines (David et al., 2006). Les modèles les plus récents notamment mis en œuvre par l’US EPA (2011) ont intégré des données plus représentatives de la distribution de GSTT1, mais aussi de CYP2E1 dans la population générale incluant des individus de 6 mois à 80 ans (Schlosser et al., 2015).
Élimination
Le chlorure de méthylène inhalé est éliminé sous forme inchangée principalement dans l'air expiré et en faible quantité dans l'urine. Des sujets exposés à des concentrations de 100 ppm et 200 ppm (350- 710 mg.m-3) de chlorure de méthylène durant 2 heures, ont excrété respectivement dans les urines une quantité moyenne de 22,6 µg (0,003 %) et de 81,5 µg (0,006 %) de ce produit 24 heures après exposition (DiVincenzo et al., 1972). L'élimination dans l'air expiré était importante durant les 30 premières minutes suivant l'exposition. Après une exposition par inhalation à des doses de 50, 100, 150, ou 200 ppm (soit 180, 350, 530 et 710 mg.m-3) de chlorure de méthylène chez des travailleurs 7,5 heures par jour, 5 jours par semaine (durée non précisée), le chlorure de méthylène a été rapidement éliminé du sang et, 6 heures après l’exposition, seules des traces de ce composé étaient encore détectées chez les individus exposés à la plus forte dose (200 ppm ou 710 mg.m-3) (DiVincenzo et al., 1972).
Aucune donnée n'est disponible concernant l'élimination du chlorure de méthylène après exposition par voie orale ou cutanée.
Les demi-vies d’élimination sont fonction de la durée d’exposition : 5 à 40 minutes dans le sang, 50 à 60 minutes dans les tissus richement vascularisés, 50 à 80 minutes dans les muscles et 240 à 400 minutes dans le tissu adipeux (INRS, 2014).
Chez l'animal
Absorption
Inhalation
Des études, effectuées chez le rat et le chien, indiquent que l'absorption par inhalation du chlorure de méthylène est proportionnelle à la durée d'exposition, pour des concentrations comprises entre 100 et 8 000 ppm (350 et 28 400 mg.m-3) (DiVincenzo et al., 1972 ; MacEwen et al., 1972 ; McKenna et al., 1982).
Voie orale
Par voie orale, les quelques données disponibles suggèrent que le chlorure de méthylène est facilement absorbé par le tractus gastro-intestinal, en particulier si le produit est en milieu aqueux. Après administration chez la souris de chlorure de méthylène en milieu aqueux à la dose de 50 mg.kg-1, 75 % de la dose ont été absorbés en 10 minutes et environ 98 % au bout de 20 minutes (Angelo et al., 1986b). En revanche, lorsque le chlorure de méthylène est administré dans l'huile de maïs (50 mg.kg-1), seulement 40 à 45 % de la dose sont absorbés au bout de 2 heures (Stewart et Dodd, 1964).
Voie cutanée
Les données d’exposition par voie cutanée chez le rat sont limitées ; chez la souris l’absorption cutanée est d’environ 70 %. Des valeurs similaires d’absorption ont été obtenues lors d’expérimentation in vitro sur de la peau de rat (INRS, 2014). Un coefficient de perméabilité de 8,66 10-3 cm.h-1 a été déterminé à partir d’un test in vitro sur la peau de cochon (Schenk et al., 2018). Cette valeur a été reprise pour le calcul de l’absorption cutanée au cours des différents scénarii d’expositions pour l’évaluation des risques (US EPA, 2020).
Distribution
Chez le rat, après ingestion unique de 1 ou 50 mg.kg-1 de chlorure de méthylène radiomarqué, la radioactivité a été détectée, après 48 heures, dans le foie, les reins, les poumons, le cerveau, les graisses, les muscles et les testicules. Les concentrations les plus élevées étaient au niveau du foie et des reins et les plus faibles au niveau des graisses (McKenna et Zempel, 1981). D'autres études ont montré une diminution rapide de la radioactivité au niveau des organes, suggérant que le chlorure de méthylène et/ou ses métabolites ne se bioaccumulent pas (Angelo et al., 1986a, 1986b).
Chez le rat exposé par inhalation, le chlorure de méthylène et ses métabolites ont été retrouvés dans le foie, les reins, les poumons, le cerveau, les muscles et les graisses (Carlsson et Hultengren, 1975 ; McKenna et al., 1982). Une heure après exposition, les plus fortes concentrations ont été retrouvées dans les graisses et le foie.
Après exposition de rates gestantes à 500 ppm de chlorure de méthylène (1 775 mg.m-3) durant 1 heure, le produit a été détecté dans le sang maternel et à un niveau moindre dans le sang fœtal (Anders et Sunram, 1982).
Le chlorure de méthylène traverse donc la barrière placentaire et est détectable dans le sang du fœtus (à des concentrations moindres que dans le sang maternel) (INRS, 2014).
Métabolisme
Le métabolisme du chlorure de méthylène chez l'animal apparaît similaire à celui chez l'homme. De la carboxyhémoglobine s'est formée chez des rats exposés au chlorure de méthylène, confirmant que ce dernier est métabolisé en monoxyde de carbone après inhalation (Fodor et al., 1973) ou gavage (Wirkner et al., 1997).
Comme chez l'homme, le chlorure de méthylène est métabolisé par deux voies principales : celle de l’oxydase à fonction mixte faisant intervenir les cytochromes P450, et la GST. L'étude des métabolites, chez le rat et la souris exposés durant 6 heures à 500, 1 000, 2 000 ou 4 000 ppm (1 775 à 14 200 mg.m-3), a montré que la voie GST était plus active chez la souris que chez le rat (Green et al., 1986). La voie MFO, conduisant au monoxyde de carbone et à la carboxyhémoglobine est saturée dès la dose de 500 ppm (1765 mg.m-3), aboutissant chez le rat à une augmentation quasi linéaire des concentrations sanguines en chlorure de méthylène avec la concentration. En revanche, chez la souris, le métabolisme du chlorure de méthylène s'est poursuivi aux plus fortes doses par la voie GST, aboutissant à la formation de dioxyde de carbone (Green et al., 1986). Par voie orale, la contribution relative d'une voie par rapport à l'autre est influencée par le taux d'absorption et la distribution des différents systèmes enzymatiques dans les tissus (ATSDR, 2000).
Élimination
L’élimination tissulaire du chlorure de méthylène diffère d’une espèce à l’autre : chez le rat, la distribution et la métabolisation durent environ 8 heures, alors que chez la souris, l’élimination est plus rapide et s’effectue en 2 heures (INRS, 2014).
Après exposition de rats au chlorure de méthylène durant 6 heures à 50, 100 ou 1 500 ppm (178 à 5 300 mg.m-3), le composé a été éliminé au niveau de l'air exhalé, l'urine et les fèces. Environ 58 à 79 % de la radioactivité se sont retrouvés au niveau de l'air exhalé (McKenna et al., 1982). Chez les rats exposés à 50 ppm (176,5 mg.m-3), seule 5 % de la radioactivité exhalée était du chlorure de méthylène, le reste étant du dioxyde de carbone et du monoxyde de carbone. Avec l'augmentation du niveau d'exposition, les quantités en chlorure de méthylène exhalé étaient plus importantes (30 % à 500 ppm (1 765 mg.m-3) et 55 % à 1 500 ppm (5 295 mg.m-3)). Environ 7,2 à 8,9 % de la dose absorbée ont été éliminés par voie urinaire et 1,9 à 2,3 % par les fèces (McKenna et al., 1982). Par voie orale, l'expiration représente également la voie principale d'élimination. Des rats ayant ingéré 1 ou 50 mg.kg-1 de chlorure de méthylène en solution aqueuse ont éliminé 78 à 90 % de la dose reçue par expiration, 2 à 5 % par l'urine et moins de 1 % par les fèces (McKenna et Zempel, 1981).
Ces données indiquent que le poumon est l'organe majeur impliqué dans l'élimination terminale du chlorure de méthylène sous forme d’oxyde et de dioxyde de carbone, y compris après exposition par voie orale.
Synthèse
Chez l’homme, l'inhalation est la voie d'exposition principale au chlorure de méthylène. L’absorption du chlorure de méthylène au niveau pulmonaire est importante et rapide (70 à 75 %). Les deux principales voies métaboliques sont : la voie oxydative, saturable vers 200 ppm (710 mg.m-3) sous la dépendance des cytochromes P450 conduisant à la formation de monoxyde de carbone et la voie de conjugaison à la GST qui produit du dioxyde de carbone. Le chlorure de méthylène inhalé est éliminé principalement dans l'air expiré et faiblement par les urines.
Chez l’animal, l’absorption du chlorure de méthylène est proportionnelle à la durée d'exposition pour une exposition par inhalation. Par voie orale, l’absorption du chlorure de méthylène est pratiquement totale en solution aqueuse, et réduite de 50 % en présence de graisses. Un passage transplacentaire a été mis en évidence chez le rat. Le métabolisme du chlorure de méthylène chez l'animal apparaît proche de celui chez l'homme mais avec une saturation dès 500 ppm (soit1 765 mg.m-3) chez le rat. Chez l’animal, le chlorure de méthylène est métabolisé par les deux mêmes voies principales que chez l’homme. Les données animales indiquent que le poumon est l'organe majeur impliqué dans l'élimination du chlorure de méthylène, y compris lors d’exposition par voie orale.
Toxicité aiguë
Chez l'homme
Inhalation
La littérature médicale rapporte, depuis 1952, 11 décès liés au chlorure de méthylène, dont 9 consécutifs à l’inhalation du solvant dans des locaux mal ventilés et sans port d’équipements individuels de protection respiratoire (Bonventre et al., 1977 ; Hall et Rumack, 1990 ; Stewart et Hake, 1976). Les niveaux d'exposition n'étaient pas connus mais les teneurs dans divers tissus ont été rapportées : foie (144 mg.L-1), sang (510 mg.L-1), sérum (29 mg.L-1) et cerveau (248 mg.kg-1) (Bonventre et al., 1977 ; Hall et Rumack, 1990). Un cas d’intoxication mortelle chez un travailleur remplissant un réservoir de chlorure de méthylène a été rapporté (Goullé et al., 1999). Les concentrations en chlorure de méthylène mesurées dans les différents viscères et milieux biologiques après autopsies étaient les suivantes : sang (150 mg.L-1), urine (2 mg.L-1), cerveau (122 mg.kg-1), graisse (99 mg.kg-1), foie (44 mg.kg-1), poumons (20 mg.kg-1) et reins (15 mg.kg-1).
Guillou et al.(1999) font état de 25 cas cliniques graves où les effets observés sont : des manifestations neurologiques variables à type de dépression du SNC non spécifiques et proches de celles de l’intoxication au monoxyde de carbone, des troubles digestifs non spécifiques, des troubles respiratoires surtout liés à des fausses routes (Guillou et al., 1999).
Chez des travailleurs exposés au chlorure de méthylène, des anomalies du rythme cardiaque ont été enregistrées (Hall et Rumack, 1990).
Le SNC est la cible principale du chlorure de méthylène inhalé. Tous les cas d'exposition aiguë par inhalation au chlorure de méthylène, recensés au Royaume-Uni entre 1961 et 1980, se sont caractérisés par une dépression du SNC (Bakinson et Jones, 1985). Une perte de conscience a été notée dans 40 % des cas et les autres symptômes fréquemment notés sont des céphalées et des vertiges (Bakinson et Jones, 1985).
Un homme de 67 ans ayant utilisé un décapant pour peinture dans une pièce peu ventilée s'est plaint de maux de tête et de douleurs thoraciques. Il était également désorienté, avait des pertes de mémoires et une tendance progressive à la léthargie (ATSDR, 2000).
Chez des volontaires (6 femmes et 6 hommes), une exposition de 4 heures réparties en séquence de 90 minutes à 195 ppm de chlorure de méthylène (688 mg.m-3 mg.m-3) a significativement diminué les performances visuelles (vision périphérique) et psychomotrices ainsi que les fonctions auditives (Putz et al., 1979).
Des femmes volontaires ont été exposées à 300 – 500 – 800 ppm (1 059, 1 765 ou 2 824 mg.m-3) de vapeurs de chlorure de méthylène pendant 3 à 4 heures et évaluées toutes les 45 minutes au moyen de tests standardisés de neurocomportement mesurant la fréquence critique de fusion (test visuel), la vigilance auditive et les tâches psychomotrices. Une diminution des résultats au test visuel est observée à toutes les concentrations (Winneke, 1974). Le test auditif est altéré à la concentration de 500 ppm. Ces effets étaient réversibles après arrêt de l'exposition. A la concentration de 800 ppm (2 840 mg.m-3) durant 4 heures, les performances psychomotrices (temps de réaction, précision manuelle, stabilité) étaient altérées. L'auteur attribue ces effets au chlorure de méthylène plutôt qu'à la carboxyhémoglobine formée, car l'exposition au monoxyde de carbone à des concentrations allant jusqu'à 100 ppm n'induit pas ces effets. De plus, la rétention du chlorure de méthylène dans les graisses contribue à l’altération des performances psychomotrices (Fodor et Winneke, 1971 ; Winneke, 1974).
Un homme de 65 ans en charge du nettoyage d’une cuve contenant une petite quantité de chlorure de méthylène a perdu connaissance et a été transporté aux urgences. Un mois après l’accident, une diminution considérable du champ visuel persistait chez cet homme et une neuropathie optique était diagnostiquée (Kobayashi et al., 2008). Dans des conditions accidentelles similaires d’exposition principalement au dichlorométhane (présence de butylglycol, méthanol, éthanolamide et d’hydroxyde de sodium), un jeune homme de 28 ans a été retrouvé inconscient, avec des brûlures aux mains et au visage (Pacheco et al., 2016). Le patient a présenté une acidose métabolique sévère, une augmentation de la concentration sanguine de monoxyde de carbone, de même qu’au niveau pulmonaire un œdème aigu et des micro-thromboses. L’oxygénothérapie hyperbare a rapidement conduit à une amélioration clinique, radiologique et gazométrique dans les 24 heures et à l’absence de séquelles après les 10 jours d’hospitalisation.
Jacubovich et al. (2005), font état d’une paralysie du nerf facial chez un soldat, le lendemain d’une exposition à une quantité importante de chlorure de méthylène, lors d’une opération de décapage (Jacubovich et al., 2005). Un possible effet neurotoxique périphérique du chlorure de méthylène est évoqué, aucun autre cas ne semble rapporté dans la littérature.
Voie orale
Différentes manifestations cliniques ont été observées chez 6 patients ayant ingéré du chlorure de méthylène (Chang et al., 1999). Une dépression du SNC, une tachypnée, et une corrosion gastro-intestinale sont les symptômes les plus couramment rapportés après une telle ingestion. Une insuffisance rénale, une insuffisance hépatique et une pancréatite aiguë ont été observées dans les 2 cas les plus sévères.
Voie cutanée
Des brûlures cornéennes et cutanées sévères ont été notées chez un individu ayant été en contact pendant 15 minutes avec un mélange de chlorure de méthylène et de méthanol (Weber et al., 1990). Des brûlures cutanées du 1er ou 2nd degré sont observées dans de nombreuses intoxications avec coma au cours desquelles le sujet reste au contact de flaques de chlorure de méthylène (Hall et Rumack, 1990).
Synthèse
Les intoxications aiguës par inhalation chez l’homme provoquent des dépressions du SNC, des vertiges, des troubles de la coordination des mouvements, des nausées, des céphalées, des vertiges, une perte de conscience, des troubles digestifs non spécifiques, des troubles respiratoires (œdème pulmonaire), des anomalies du rythme cardiaque, voire même des décès. Elle peut également être à l’origine d’hémorragies gastro-intestinales, d’ulcérations duodénales, accompagnées d'une hémoglobinurie. Les effets par voie cutanée sont marqués par des brûlures cornéennes et cutanées sévères.
Chez l'animal
Inhalation
Les données chez l'animal confirment que le chlorure de méthylène peut être létal après inhalation de fortes concentrations. Des expositions aiguës à des concentrations de 16 000- 20 000 ppm (55 500-69 500 mg.m-3) durant 4 à 8 heures induisent une mortalité élevée chez les rats et les souris (NTP, 1986 ; Svirbely et al., 1947). Un singe femelle sur quatre est décédé après 10 jours d'exposition continue à 5 000 ppm (17 300 mg.m-3) de chlorure de méthylène (MacEwen et al., 1972). Les données suggèrent qu'il existe peu d'écart entre les concentrations induisant une anesthésie et la mort. Une CL50 de 16 189 ppm (55 500 mg.m-3) a été déterminée chez la souris pour une exposition de 7 heures suivie d'une période d'observation d'une heure (Svirbely et al., 1947). Chez le rat, une CL50 de 57 600 ppm (200 000 mg.m-3) a été établie pour une durée d'exposition de 15 minutes et chez le cobaye, pour une exposition de 6 heures suivie d'une période d'observation de 18 heures, la CL50 a été établie à 11 600 ppm (40 300 mg.m-3) (Balmer et al., 1976 ; Clark et Tinston, 1982).
La toxicité aiguë du chlorure de méthylène se traduit au niveau du SNC, notamment par une baisse d'activité, une mauvaise coordination motrice et une somnolence (Fodor et Winneke, 1971 ; Heppel et al., 1944 ; Schumacher et Grandjean, 1960). Les potentiels sensoriels évoqués ont été altérés chez des rats après une heure d'exposition à 5 000 ppm (17 350 mg.m-3) ou plus de chlorure de méthylène (Rebert et al., 1989).
Des effets pulmonaires ont été également notés pour des expositions par inhalation. Des souris exposées à 2 000 ppm (6 940 mg.m-3) et plus de chlorure de méthylène durant 6 heures ont présenté une vacuolisation des cellules bronchiques, alors qu'aucun effet n'avait été noté à des concentrations inférieures ou égales à 1 000 ppm (3 530 mg.m-3) (Foster et al., 1994).
Enfin, le chlorure de méthylène inhalé induit des effets hépatotoxiques, se traduisant le plus souvent par une élévation du taux sérique d'enzymes hépatiques ainsi qu’une stéatose hépatique. L'exposition de cobayes à 5 200 ppm (18 000 mg.m-3) de chlorure de méthylène durant 6 heures, a induit une augmentation des triglycérides hépatiques (Morris et al., 1979). Chez le cobaye, cet effet a été également noté pour une exposition à 11 000 ppm (38 200 mg.m-3) durant 6 heures, mais l'exposition conjointe à 21 400-24 100 ppm d'éthanol (40 200-45 300 mg.m-3) a bloqué cette augmentation des triglycérides (Balmer et al., 1976). L'exposition continue de souris par inhalation à 5 000 ppm (17 400 mg.m-3) de chlorure de méthylène a induit des modifications graisseuses au niveau du foie et une nécrose de quelques hépatocytes isolés (Weinstein et al., 1972b).
Voie orale
Par voie orale, des DL50 de 2 100 (Kimura et al., 1971) et 2 300 mg.kg-1 de chlorure de méthylène dans l'huile (Marzotko et Pankow, 1987) ont été déterminées chez le rat. Une mortalité de 95 % a été notée chez des rats ayant ingéré 4 382 mg.kg-1 de chlorure de méthylène dans l'huile (Ugazio et al., 1973).
Chez la souris, des altérations hépatiques ont été notées après gavage à des doses de 133-665 mg.kg-1 (Condie et al., 1983). Chez le rat, l'administration à 17 heures d'intervalle de deux doses de 1 250 mg.kg-1 de chlorure de méthylène n'a pas modifié l'activité de l'alanine aminotransférase sérique, le contenu hépatique en glutathion ou en P450, mais a augmenté l'activité de l'ornithine décarboxylase hépatique chez 3 animaux sur 15 (Kitchin et Brown, 1989).
Voie cutanée
Chez le lapin, le chlorure de méthylène (0,01 - 0,1 ml) provoque une irritation et une inflammation oculaires modérées, un épaississement de la cornée et une augmentation de la tension intra-oculaire ; les effets sont réversibles en 3 à 9 jours. L'exposition aux vapeurs (≥ 490 ppm, 10 minutes) provoque des modifications oculaires identiques, mais plus légères et réversibles en 2 jours (INRS, 2014).
L'application sur la peau du lapin induit une irritation modérée.
Synthèse
Les expositions aiguës à des concentrations élevées par inhalation ou par voie orale sont létales chez de nombreuses espèces. De même que chez l’homme, la toxicité aiguë du chlorure de méthylène se traduit chez l’animal essentiellement par des altérations au niveau du SNC, caractérisées notamment par une baisse d'activité, une mauvaise coordination motrice et une somnolence. Le chlorure de méthylène inhalé ou ingéré induit des effets hépatotoxiques, ou encore une irritation modérée de la peau et un épaissement de la cornée par voie cutanée.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Le SNC est l'organe cible principal du chlorure de méthylène.
Barrowcliff (1978) rapporte le cas d’un homme qui a travaillé pendant trois ans dans un atelier peu ventilé où il nettoyait des roues, utilisant quotidiennement de 15 à 50 litres de chlorure de méthylène (Barrowcliff, 1978). Une démarche instable, des troubles mnésiques et une dysarthrie ont été attribués à l’exposition après élimination des autres causes possibles (aucune donnée sur la réversibilité des effets n’est disponible).
Au sein d'un groupe de 34 ouvriers de l'industrie automobile, exposés professionnellement au chlorure de méthylène pour des durées allant jusqu'à 3 ans, de nombreux signes d’altérations du SNC ont été enregistrées (Kelly, 1988). Les symptômes les plus souvent évoqués incluaient des vertiges, des étourdissements, des pertes de mémoire, des changements d'humeur et une dépression. L'exposition moyenne au chlorure de méthylène était de 68 ppm (240 mg.m-3) entre 3,3 et 154,4 ppm (11,6 mg.m-3 et 545 mg.m-3). Par ailleurs, globalement aucun effet sur le SNC n'a pu être attribué à une exposition chronique au chlorure de méthylène, à des concentrations comprises entre 105 et 306 ppm (370 mg.m-3 et 1080 mg.m-3), entrecoupées de pics allant de 395 à 660 ppm (1 394 mg.m-3 à 2 329 mg.m-3) (Lash et al., 1991). Des résultats similaires ont été rapportés pour des expositions inférieures à 100 ppm chez des salariés exposés en milieu professionnel (Cherry et al., 1981).
DiVincenzo et Kaplan (1981b) ont exposé des volontaires au repos (11 hommes et 3 femmes non-fumeurs) au chlorure de méthylène à des concentrations de 50, 100, 150 ou 200 ppm (176,5 mg.m-3, 353 mg.m-3, 529,5 mg.m-3 ou 706 mg.m-3) pendant 7 heures 30, 5 jours de suite. L’exposition à toutes les concentrations s’est accompagnée d'une augmentation dose-dépendante du taux de carboxyhémoglobine et de la quantité de monoxyde de carbone exhalée. Les pics de carboxyhémoglobine ont été respectivement de 1,9, 3,4, 5,3, et 6,8 % pour les groupes 50, 100, 150 et 200 ppm (176,5 mg.m-3, 353 mg.m-3, 529,5 mg.m-3 ou 706 mg.m-3).
DiVincenzo et Kaplan (1981b) ont aussi mesuré le taux de carboxyhémoglobine dans le sang d’employés exposés au chlorure de méthylène et d’un groupe non exposé (le statut de fumeur ou non-fumeur n’était pas précisé). Les 19 employés exposés (comparés à 8 témoins) avaient des taux moyens de 2,3 % le matin et de 3,9 % à l’arrêt de l’activité le soir. Les valeurs ambiantes estimées pour 57 échantillons variaient de 0 à 200 ppm (706 mg.m-3) avec une concentration moyenne de 40 ppm (141 mg.m-3). Chez 3 employés exposés, une mesure plus précise de l’exposition a révélé un niveau moyen d’exposition de 33 ppm (116 mg.m-3). Les sujets témoins avaient un taux significativement plus bas : 0,8 % le matin et 1,3 % le soir. L’ancienneté dans le travail n’est pas connue.
Une augmentation dose-dépendante de la carboxyhémoglobine a été observée chez des employés non-fumeurs travaillant dans une usine de production de fibres de triacétate (Soden et al., 1996). Les taux de carboxyhémoglobine étaient de 1,8 % à 4 % dans le groupe des non-fumeurs et de 4,95% à 6,35 % chez les fumeurs pour des expositions allant de 6,5 à 89,7 ppm (23 mg.m-3 à 317 mg.m‑3). Le nombre d’employés de cette étude n’est pas précisé.
- Effets pulmonaires
Aucune anomalie des fonctions respiratoires n'a été mise en évidence chez des individus exposés aux vapeurs de chlorure de méthylène à des concentrations de 50 à 500 ppm (173-1 735 mg.m-3) durant 6 semaines (NIOSH, 1974). En revanche, par rapport à la population générale, une prévalence accrue de symptômes liés à une irritation du tractus respiratoire a été notée chez 12 employés chargés de nettoyer les graffitis dans les stations de métro à l'aide de solvants contenant du chlorure de méthylène (Anundi et al., 1993). Les concentrations d'exposition moyennes sur 8 heures allaient de 18 à 1 200 mg.m-3 (5-346 ppm). Toutefois, ces décapants étant fréquemment composés de différents solvants, il est difficile d’incriminer le seul chlorure de méthylène dans la toxicité engendrée par leur utilisation.
- Effets cardiaques
Aucun effet sur la fonction cardiaque n'a été noté chez des cohortes exposées professionnellement pendant plusieurs années au chlorure de méthylène à des concentrations de 26 à 1 700 ppm soit 90 à 5 900 mg.m-3 (Hearne et al., 1990 ; Lanes et al., 1993 ; Ott et al., 1983 ; Soden, 1993). Cependant, certaines études (Allred et al., 1989 ; Kleinman et al., 1989) montrent qu’un taux de 2% de carboxyhémoglobine est susceptible de raccourcir le temps d’apparition des symptômes d’angine de poitrine à l’effort chez des sujets porteurs d’une coronaropathie. Un modèle pharmacocinétique estime qu’une exposition à 340 ppm (1 200 mg.m-3) pendant une heure pour une ventilation minute de 9 L.min-1 entraîne une valeur de carboxyhémoglobine de 2 % (Andersen et al., 1991).
- Effets hépatiques
Il existe peu de données publiées concernant les effets sur le foie du chlorure de méthylène chez l'homme. Un ouvrier de l'industrie automobile, exposé au chlorure de méthylène par inhalation et par voie cutanée durant un an et demi, présentait un foie hypertrophié, en plus d'effets sur le système nerveux et sur le système reproducteur (Kelly, 1988). Les concentrations moyennes relevées sur 8 heures étaient de 68 ppm (240 mg.m-3) entre 3,3 et 154,4 ppm (12 mg.m-3 et 545 mg.m-3). Le travailleur était également exposé à des niveaux faibles en styrène entre 1,5 et 10,4 ppm (6,5 mg.m-3 et 44,7 mg.m-3).
Aucune altération de l'activité de diverses enzymes sériques (phosphatase alcaline, transaminases, lactate déshydrogénase) et de la bilirubine, du calcium et du phosphore sanguin n'a été notée chez des personnes exposées aux vapeurs de chlorure de méthylène entre 50 et 500 ppm (176,5 mg.m-3 et 1765 mg.m-3) durant 6 semaines (NIOSH, 1974). Chez les employés chargés d'effacer les graffitis dans le métro, aucune variation des teneurs sériques en créatinine, transaminases ou γ-GT n'a été observée (Anundi et al., 1993; Soden, 1993). Au vu de ces résultats, le foie ne semble pas être un organe sensible au chlorure de méthylène.
- Effets rénaux
Aucun effet au niveau rénal n'a été mis en évidence après inhalation durant plusieurs semaines de chlorure de méthylène à des concentrations allant jusqu'à 500 ppm (1 735 mg.m‑3) (Anundi et al., 1993 ; NIOSH, 1974).
Voie orale
Il n'existe pas de données chez l'homme sur les effets systémiques du chlorure de méthylène après exposition chronique par voie orale.
Voie cutanée
Il n'existe pas de données chez l'homme sur les effets systémiques du chlorure de méthylène après exposition chronique par voie cutanée.
Synthèse
Chez l’homme, le SNC est l'organe cible principal du chlorure de méthylène. Les symptômes les plus souvent évoqués après exposition prolongée par inhalation sont : malaises, démarche instable, vertiges, étourdissements, troubles mnésiques, dysarthrie, pertes de mémoire, changement d'humeur et dépression.
Chez l'animal
Inhalation
- Effets neurologiques
Comme chez l'homme, le SNC est un organe cible du chlorure de méthylène inhalé. Une diminution des teneurs en succinate déshydrogénase a été observée dans le cervelet de rats exposés à 500 ppm de chlorure de méthylène (1 735 mg.m-3) durant 2 semaines (Savolainen et al., 1981).
Trois lots de gerbilles ont été exposés de manière continue à trois concentrations différentes : 210, 350 ou 700 ppm (0, 741 mg.m-3, 1235 mg.m-3, et 2471 mg.m-3). Chaque lot comporte 10 animaux par sexe et 60 animaux pour le lot témoin. Après exposition, les animaux sont suivis pendant une période de quatre mois. Le lot exposé à des concentrations de 700 ppm présente une forte mortalité (19 animaux sur 20), ce qui a nécessité l’arrêt de l’exposition à la 7ème semaine. De même, le lot exposé à des concentrations de 350 ppm met en évidence une assez forte mortalité (9 animaux sur 20) et a nécessité l’arrêt de l’exposition à la 10ème semaine. Les lots exposés à des concentrations de 350 ppm ont montré une augmentation significative des concentrations en protéines astrogliales (S-100 et GFA) dans le cortex frontal et le cortex sensori-moteur, compatible avec une astrogliose dans ces régions (Rosengren et al., 1986). L’exposition à des concentrations de 210 ppm et 350 ppm entraine une diminution significative des concentrations en ADN dans l’hippocampe ainsi que dans les hémisphères cérébraux pour une exposition de 350 ppm. Les auteurs de l’étude ont montré qu’entre 210 ppm et 350 ppm, la formation de carboxyhémoglobine n’augmentait pas (le métabolisme du chlorure de méthylène est saturable à des niveaux d’exposition en dessous de 210 ppm). On peut donc en déduire que la formation de carboxyhémoglobine induisant une hypoxie cérébrale n’est pas la cause principale de l’atteinte neurotoxique.
Des rats Fischer 344 (mâles et femelles) ont été exposés 6 heures par jour, 5 jours par semaine pendant 13 semaines à des doses de 50 ppm, 200 ppm et 2 000 ppm (176 mg.m-3, 706 mg.m-3 et 6 940 mg.m-3) de chlorure de méthylène. A la fin de la période d’exposition, des tests visuels, auditifs, somatosensoriels et des électroencéphalographes ont été réalisés chez les animaux. L’exposition des rats à du chlorure de méthylène n’a montré aucune modification des potentiels sensoriels évoqués, des réflexes, des attitudes et déplacements des rats (Mattsson et al., 1990).
- Effets hépatiques
Chez l'animal, le foie apparaît sensible à l'action du chlorure de méthylène inhalé.
Huit cobayes et 12 rats ont été exposés 7 h/j, 5 j/7, pendant 6 mois à 5 000 ppm (17 650 mg.m-3) de chlorure de méthylène. Trois cobayes sont morts, et deux ont montré à l’autopsie une dégénérescence graisseuse centrolobulaire modérée et une pneumonie extensive. La consommation alimentaire et le poids corporel étaient diminués chez les animaux exposés. Un rat mort présentait à l’autopsie, des lésions de thrombose veineuse rénale (Heppel et al., 1944). Les chiens et rats exposés à la même concentration n’ont pas montré de lésions. Pour une concentration d’exposition de 10 000 ppm (35 300 mg.m-3), 2 chiens sur 4 ont montré une congestion centrolobulaire et une dégénérescence graisseuse modérée (Heppel et al., 1944).
Des altérations de la masse graisseuse hépatique caractérisées par une vacuolisation des hépatocytes ont été observées chez des singes, des souris et des chiens exposés en continu à 5 000 ppm (17 650 mg.m-3) de chlorure de méthylène durant 4 semaines (MacEwen et al., 1972).
Chez des souris (50 par lot) exposées à 0, 2 000 et 4 000 ppm (0, 7 060 mg.m-3 et 14 120 mg.m-3)6 h/j, 5 j/7, pendant 102 semaines, on observe à 4 000 ppm une augmentation de l’incidence des images de dégénérescence hépatique (NTP, 1986). Cet aspect est observé dès 2 000 ppm chez les femelles. Des rats exposés selon le même protocole à 0, 1 000, 2 000 et 4 000 ppm (0, 3 530 mg.m-3, 7 060 mg.m-3 et 14 120 mg.m-3) montrent une pigmentation ferrique dose-dépendante débutant dès 1 000 ppm. Dans une étude plus récente réalisée selon le même protocole expérimental, des foyers de cellules basophiles et acidophiles, considérés comme étant des lésions prolifératives pré-néoplasiques, ont été décrites à partir de 1 000 ppm (3 530 mg.m-3) chez le rat, aussi bien chez les femelles que chez les mâles (Aiso et al., 2014a).
Plusieurs espèces animales (rat, souris, chien et singe) ont été exposées à des concentrations en chlorure de méthylène plus faibles de 25 et 100 ppm (88 mg.m-3 et 353 mg.m-3) durant 14 semaines (Haun et al., 1972). Aucun effet hépatique n'a été observé chez les singes et les chiens. Les souris ont présenté des altérations hépatiques caractérisées par une vacuolisation cytoplasmique des hépatocytes pour la concentration de 100 ppm. Les rats ont été les plus sensibles, avec des effets hépatiques (vacuolisation cytoplasmique, infiltration graisseuse) et rénaux (dégénérescence tubulaire) observés aux deux doses testées.
Une exposition de souris (16 par lot) de manière continue à 100 ppm (353 mg.m-3) de chlorure de méthylène pendant 1, 2, 3, 4 ou 10 semaines a résulté en une élévation des triglycérides hépatiques commençant après 2 semaines et s’étendant aux 10 semaines d’exposition (Weinstein et Diamond, 1972a). Le rapport des poids du foie et du corps n’a pas été affecté. Après une semaine, des amas graisseux étaient visibles dans les hépatocytes et une diminution du glycogène hépatique était notée. Aucune nécrose n'a été observée jusqu’à la dixième semaine, mais les amas de graisse augmentaient de taille bien que la déplétion en glycogène persistait.
Des lots de 90 rats mâles et 108 femelles Sprague-Dawley ont été exposés à des concentrations de chlorure de méthylène de 0 - 50 - 200- 500 ppm (0 - 176 mg.m-3 - 706 mg.m-3 - 1765 mg.m-3), 6 h/j, 5 j/sem., pendant 2 ans (Nitschke et al., 1988a). Les concentrations sanguines en carboxyhémoglobine sont augmentées de manière dose-dépendante pour des expositions entre 50 et 500 ppm. Des lésions histopathologiques sont limitées au foie et aux tissus mammaires. Une augmentation de la vacuolisation hépatocellulaire était observée chez les rats mâles et femelles exposés à 500 ppm. Les rates exposées à 500 ppm de chlorure de méthylène ont également présenté une augmentation de l’incidence d’hépatocytes multinucléés. Les auteurs retiennent une NOAEC 200 ppm (706 mg.m-3) pour une exposition chronique par inhalation chez le rat.
- Effets respiratoires
Le système respiratoire est également un organe cible du chlorure de méthylène inhalé. Des cas de pneumonie ont été observés chez 3 cobayes sur 14 exposés à 5 000 ppm (17 500 mg.m‑3) de chlorure de méthylène jusqu'à 6 mois et une congestion pulmonaire avec œdème a été mise en évidence chez 3 lapins sur 5 et 2 rats sur 6, exposés à 10 000 ppm (35 300 mg.m-3) jusqu'à 8 semaines (Heppel et al., 1944).
Des souris femelles B6C3F1 ont inhalé du chlorure de méthylène pendant 1 à 26 semaines à une concentration de 2 000 ppm (7 060 mg.m-3) (Kanno et al., 1993). Par comparaison au lot témoin, elles présentaient un taux de renouvellement des cellules bronchiolaires diminué de 40 à 60 %. Toutefois, à cette concentration, il n’a pas été mis en évidence de modification pathologique pulmonaire (aucun signe d’hyperplasie, d’atrophie, de nécrose ou de métaplasie dans les régions bronchiolaires).
Des souris exposées à 4 000 ppm (14 120 mg.m-3) de chlorure de méthylène durant 13 semaines présentaient des lésions morphologiques pulmonaires au niveau des cellules de Clara après 1 jour d'exposition, qui ont régressé après 5 expositions consécutives (Foster et al., 1992). Une métaplasie squameuse des cavités nasales a été notée chez des rats femelles exposés durant 2 ans à 2 000 ppm (7 060 mg.m-3) de chlorure de méthylène (NTP, 1986).
- Effets rénaux
Au niveau rénal, une vacuolisation des tubules a été observée chez des chiens exposés en continu à 1 000 ppm (3 530 mg.m-3) durant 4 semaines et chez des rats exposés à 5 000 ppm (17 650 mg.m-3) durant 14 semaines (NTP, 1986).
L'inhalation durant deux ans de chlorure de méthylène a induit une augmentation de la dégénérescence des tubules rénaux chez des rats femelles à partir de 1 000 ppm (3530 mg.m-3) et chez les souris des deux sexes à partir de 2 000 ppm (7060 mg.m-3) (NTP, 1986).
- Effets hématologiques
Aucune modification des paramètres hématologiques n'a été notée chez des rats exposés chroniquement à des teneurs allant jusqu'à 3 500 ppm (12 355 mg.m-3) (Burek et al., 1984 ; Nitschke et al., 1988a).
Enfin, quelques études ont montré des effets au niveau des organes lymphoïdes secondaires après inhalation de chlorure de méthylène : fibrose de la rate chez le rat (Mennear et al., 1988), atrophie de la rate chez le chien (MacEwen et al., 1972), à des concentrations supérieures ou égales à 1 000 ppm (3 530 mg.m-3).
Voie orale
- Effets hépatiques
Par voie orale, le chlorure de méthylène induit des effets hépatotoxiques chez l'animal de laboratoire. Une nécrose centrolobulaire, une vacuolisation hépatocytaire et une augmentation de la quantité de céroïde et de lipofuscine, qui sont des pigments lipidiques s'accumulant dans les tissus lors de certaines pathologies, ont été notées chez des rats exposés pendant 90 jours à des teneurs égales ou supérieures à 1 200 mg.kg-1.j-1 via l'eau de boisson (Kirschman et al., 1986).
Sur une étude de trois mois, menée en parallèle chez la souris, une altération dose-dépendante de la masse graisseuse centrolobulaire a été observée pour des doses comprises entre 226 et 2 030 mg.kg-1 par jour (Kirschman et al., 1986). L'ingestion chronique de chlorure de méthylène dans l'eau de boisson, a été associée à des altérations histologiques du foie chez les rats exposés à plus de 55 mg.kg-1.j-1 pendant 78 à 104 semaines et à des changements graisseux chez la souris exposée pendant deux ans à plus de 236 mg.kg-1.j-1.
L’administration dans l'eau de boisson de doses de chlorure de méthylène de 0, 5, 50, 125 et 250 mg.kg-1 de poids corporel par jour a été étudiée chez 500 rats Fischer 344 des deux sexes durant 2 ans (Serota et al., 1986b). Un lot supplémentaire a été exposé à une dose de 250 mg.kg-1 de poids corporel par jour durant 78 semaines, suivie d’une période d’observation de 26 semaines. Les sacrifices étaient effectués toutes les 26 semaines. Des effets statistiquement significatifs sur le poids des animaux et les consommations d’eau et de nourriture étaient observés aux deux doses les plus élevées. Une observation histo-morphologique a permis de mettre en évidence des modifications hépatiques liées à l’exposition, chez les deux sexes après 78 semaines d’exposition au chlorure de méthylène. Ces changements consistaient en une augmentation de l’incidence de foyers hépatocellulaires altérés et de modifications graisseuses à toutes les doses exceptée à la plus basse. Dans les conditions expérimentales de cette étude, un NOEL de 5 mg.kg-1.j-1 chez les deux sexes a été établi.
- Effets sanguins
L'ingestion de chlorure de méthylène induit des effets sanguins chez l'animal. Des rats ayant ingéré 420 mg.kg-1.j-1 de chlorure de méthylène dans l'eau de boisson durant 3 mois ont présenté une augmentation des concentrations moyennes en hémoglobine (chez les mâles) et une augmentation du nombre d'érythrocytes (chez les femelles) (Kirschman et al., 1986). Les auteurs ne précisent pas s’il existe un lien entre les effets observés et le taux de carboxyhémoglobine dans le sang.
L’administration dans l'eau de boisson de doses de chlorure de méthylène de 0, 5, 50, 125 et 250 mg.kg-1 de poids corporel par jour a été étudiée chez 500 rats Fischer 344 des deux sexes durant 2 ans (Serota et al., 1986b). Des effets minimes étaient observés sur les paramètres hématologiques et sériques surveillés (élévation du nombre de globules rouges, de l'hématocrite et de l'hémoglobine).
Les mêmes auteurs rapportent une étude similaire menée chez 1 000 souris B6C3F1 (Serota et al., 1986a, 1986b). Des doses de chlorure de méthylène de 0, 60, 125, 185 and 250 mg.kg-1 de poids corporel par jour ont été administrées dans l’eau de boisson durant 2 ans. A la plus forte dose, les mâles et les femelles présentaient une augmentation transitoire du nombre moyen de leucocytes. Des altérations hépatiques ont été observées à la fois chez les femelles et les mâles à la plus forte dose. Les résultats de cette étude ont permis d’établir un NOEL de 185 mg.kg-1 de poids corporel par jour, pour les deux sexes.
Voie cutanée
Aucune étude n’a été identifiée par voie cutanée.
Synthèse
Chez l’animal, le chlorure de méthylène agit sur le SNC (organe cible principal), mais aussi sur le foie (vacuolisation cytoplasmique), les reins (dégénérescence tubulaire) et le système respiratoire (métaplasie cellulaire). Les études par voie orale, mentionnent principalement des effets hépatiques (rat/souris), ainsi que des modifications de la formule sanguine chez le rat.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : le chlorure de méthylène est suspecté d’être cancérogènes pour l’homme | 2008 |
| IARC | Groupe 2A : l'agent est probablement cancérogène pour l’homme. Il existe des indices limités de cancérogénicité chez l’homme et des indices suffisants de cancérogénicité pour l’animal de laboratoire | 2014 |
| US EPA | Susceptible d’être cancérogène pour l’humain | 2011 |
Chez l'homme
Inhalation
Diverses études de cohorte ou des études cas-témoin ont été menées afin de déterminer le risque de cancers lié à une exposition au chlorure de méthylène en milieu professionnel.
La première étude historique concernant les employés masculins de la firme KODAK de Rochester où le chlorure de méthylène était utilisé (Friedlander et al., 1978). Les données d’hygiène au travail disponibles ont permis d’estimer l’exposition moyenne entre 30 et 100 ppm (106 mg.m-3 et 353 mg.m-3). Cette population exposée a été comparée à celle des hommes de l’état de New York (sauf ville de New York) et à celle des employés masculins de KODAK à Rochester. Globalement, la mortalité par cancer dans la population étudiée par Friedlander et al. était plus faible que dans la population de l’Etat de New York et équivalente à celle de la population des salariés de KODAK Rochester.
Les différents tests statistiques appliqués aux résultats n’ont pas permis de mettre en évidence un site de cancer privilégié. Cependant, 9 décès par cancer du pancréas ont été observés contre 3 attendus dans la population de l’état de New York et 2,6 dans la population KODAK Rochester. La relation est suggestive sans être démontrée. Les travaux de Hearne et al. (1987) poursuivant l’étude sur 1 013 hommes retrouvent cette tendance. Les estimations de l’exposition ont permis de déterminer (sur la base de mesures aériennes et de badges portés) des pics de 500 ppm (1765 mg.m-3), 3 fois par jour, 10 à 40 jours par an. D’autres solvants étaient utilisés : le 1,2-dichloropropane et le 1,2-dichloroéthane (Hearne et al., 1987). Les données plus récentes, correspondant à un suivi de la cohorte sur 35 ans, ne mentionnent pas d’excès de risque par cancer avec des SMR le plus souvent < à 1, en dehors des tumeurs au cerveau (SMR de 2,16) et leucémies (2,04) (Hearne et al., 1999).
La santé des employés d’une usine de production de fibres à Rock Hill (Caroline du Sud), où le chlorure de méthylène était un des solvants employé (en association avec le méthanol ou l’acétone) a été évaluée (Ott et al., 1983). L’exposition moyenne sur 8 heures était comprise entre 140 et 475 ppm (494 mg.m-3 et 1677 mg.m-3). Le groupe de comparaison était constitué par les employés d’une autre usine (Narrows en Virginie) où on n’utilisait que de l’acétone. Il n’a pas été mis en évidence d’excès de mortalité par rapport au taux attendu (population américaine). Le taux de mortalité par cancer n’était pas différent entre les deux populations. Un cas de décès par cancer du pancréas a été noté dans la cohorte exposée et dans la cohorte de référence. L’intérêt de l’étude est limité par la non prise en compte du tabagisme, par un effectif faible et une durée de suivi insuffisante.
Une autre étude a été réalisée sur une cohorte de 3 211 travailleurs, dont 2 909 (1 931 hommes et 978 femmes) étaient exposés au chlorure de méthylène, dans une industrie de production de fibres de cellulose (Gibbs et al., 1996). Les employés devaient avoir travaillé au moins trois mois dans l'usine. Chez le personnel masculin exposé, 500 décès dont 163 par cancer ont été enregistrés en 19 ans, ce qui était légèrement inférieur au nombre attendu dans la population générale (SMR : 0,8). La mortalité par cancer du poumon, du foie, du pancréas et des canaux biliaires n'était pas plus importante que dans la population générale. Chez les travailleurs employés depuis plus de 20 ans dans l'usine, une augmentation de la mortalité liée au cancer de la prostate, apparemment corrélée avec la concentration d'exposition, a été observée. Parmi les travailleurs exposés à des concentrations de 50 à 100 ppm (177 à 353 mg.m-3) de chlorure de méthylène pendant plus de 20 ans, 9 décès par cancer de la prostate ont été observés et 13 décès pour des concentrations de 350 à 700 ppm (1236 à 2471 mg.m-3). De même, chez les femmes employées depuis plus de 20 ans, une augmentation de la mortalité liée au cancer du col de l'utérus a été notée, mais apparemment sans relation avec la concentration d'exposition (Gibbs et al., 1996). En effet, 5 décès par cancer du col de l’utérus ont été observés chez ces femmes exposées à des concentrations de 50 à 100 ppm (177 à 353 mg.m-3) de chlorure de méthylène alors qu’un seul décès a été observé pour des concentrations de 350 à 700 ppm (1236 à 2471 mg.m-3). Cette étude n'a pas pris en compte les facteurs confondants potentiels et les intervalles de confiance étaient étendus, ce qui rend l'interprétation des résultats difficile.
Une étude similaire a été menée au Royaume-Uni, sur une cohorte de 1 785 travailleurs masculins (dont 1 473 potentiellement exposés au chlorure de méthylène) (Tomenson et al., 1997). Quatre catégories ont été établies, basée sur l'exposition cumulée au chlorure de méthylène (aucune, < 400 ppm-an (1 412 mg.m-3), 400-799 ppm-an (1 412-2 820 mg.m-3), >.800 ppm-an (2 824 mg.m-3). Cependant, 30 % des travailleurs n'ont pas pu être classés. Sur une durée de 48 ans, 261 décès dont 68 par cancer ont été observés (SMR : 0,7). Seuls les cancers du SNC étaient en excès (SMR : 2,12) mais pas uniquement chez les travailleurs les plus exposés. Le fait que l'exposition de 31 personnes, parmi les 68 décès par cancer, n'ait pas pu être déterminée, limite notablement l'intérêt de l'analyse des expositions cumulées.
Enfin, deux autres études de cohorte ont été menées. L'une a mis en évidence un excès de tous les types de cancers confondus et également de cancers du sein et gynécologiques (8 cancers du sein ou gynécologiques versus 2,67 attendus) chez les travailleurs exposés (Shannon et al., 1988). L'autre a mis en évidence un excès de lymphomes, avec 6 cas, RR 3 (95% IC, 0,9-10), des myélomes multiples chez les hommes, 5 cas, RR 3,4 (95% IC, 0,9-13,2) et un excès de cancers du sein chez les femmes avec 4 cas, RR 3,0 (95%, 1,0-8,8) (Blair et al., 1998). Ces deux études sont cependant d'interprétation difficile en raison du manque d'information sur les niveaux d'exposition et l'existence de co-expositions multiples à d'autres solvants (IARC, 1999).
Une étude cas-témoin a été menée pour étudier la relation entre l'exposition professionnelle à 6 hydrocarbures aliphatiques chlorés (dont le chlorure de méthylène) et le risque de tumeurs du cerveau (Heineman et al., 1994). Une augmentation de l'incidence de la mortalité par ce type de cancer a été observée pour quatre produits (tétrachlorure de carbone, chlorure de méthylène, tétrachloroéthylène et trichloroéthylène). L'association la plus forte a été retrouvée avec le chlorure de méthylène. Mais cette étude ne donne pas d'informations directes sur l'exposition : aucune mesure quantitative n'a été faite, seules des estimations qualitatives ont été réalisées par des hygiénistes industriels, sur la base d'un historique des industries chimiques et des raffineries concernées. Ces conclusions sont donc très limitées.
Dans une autre étude de conception identique, le risque professionnel de cancer du SNC a été étudié chez les femmes (Cocco et al., 1999). Les auteurs ont trouvé que l'exposition potentielle au chlorure de méthylène était associée avec une augmentation modeste mais significative du risque de mortalité par cancer du SNC. Toutefois, cette augmentation n'était pas liée à la probabilité ou à l'intensité de l'exposition.
A l'inverse, aucune association n'a été mise en évidence entre l'exposition au chlorure de méthylène et le cancer du sein (Cantor et al., 1995), de l'œsophage, de l'estomac, du colon, du pancréas, de la prostate, de la vessie, des reins, de la peau, du sang (Siemiatycki, 1991).
Une étude sur le risque de cancer pancréatique est brièvement rapportée, dans les recommandations du SCOEL (Scientific Committee on Occupational Exposure Limits) (Ojajarvi et al., 2001 ; SCOEL, 2007). Il y est mentionné une augmentation des cancers pancréatiques chez les sujets exposés au chlorure de méthylène. Il s’agit d’une méta-analyse des études épidémiologiques relatives au cancer du pancréas chez les salariés exposés à des solvants chlorés. Le risque relatif pour les sujets exposés au chlorure de méthylène est légèrement élevé (RR 1,42) mais de façon non significative (IC 0,8 – 2,53) et sans qu'une relation avec l'exposition soit démontrée. Cette seule étude ne permet donc pas d'établir un lien de causalité entre l'exposition au chlorure de méthylène et la survenue de cancers pancréatiques (AFSSET, 2008).
Dans l’industrie de l’imprimerie, l’exposition au chlorure de méthylène (estimée entre 80 et 540 ppm soit 320 et 2 160 mg.m3) a été associée à une augmentation du risque d’angiosacarcomes (cancers primaires des voies biliaires) observés chez 11 des 51 salariés de l’entreprise (Kumagai et al., 2013). Les effets de la co-exposition au dichloropropane ne peuvent être écartés.
Dans une analyse plus récente des données humaines (IARC, 2014), des associations positives ont notamment été observées entre l’exposition au chlorure de méthylène et le cancer des voies biliaires (cholangiocarcinomes) et les lymphomes non-Hodgkiniens avec une prédisposition génétique liée au polymorphisme sur le CYP2E1 (Cooper et al., 2011 ; Barry et al., 2011).
Synthèse
Les études de cohorte ou des études cas-témoin en milieu professionnel sont souvent difficilement interprétables. Certaines rapportent une augmentation de l’incidence des cancers de la prostate, du sein ou encore des cancers hématologiques et des cancers du SNC et des voies biliaires et du pancréas.
Chez l'animal
Inhalation
Cinq études à long terme ont examiné les effets de l’inhalation du chlorure de méthylène :
2 sur les rats Spartan / Sprague-Dawley (Burek et al., 1984 ; Nitschke et al., 1988a ; US EPA, 1985),
1 sur les rats Fischer-344 (Mennear et al., 1988 ; NTP, 1986),
1 sur les souris B6C3F1 (NTP, 1986),
1 sur le hamster Syrian (Burek et al., 1984).
Dans la première étude chez le rat Sprague-Dawley (Burek et al., 1984), les mâles et les femelles ont été exposés par inhalation à des doses de 0, 500, 1 500 ou 3 500 ppm (0, 1 765, 5 295 et 12 355 mg.m-3), 6 heures par jour, 5 jours par semaine, pendant 2 ans. Mais, durant les 2 premiers mois, une infection virale est survenue (chez les exposés et témoins), responsable d’une acryoadénite des glandes salivaires c'est-à-dire une inflammation aiguë et une nécrose diffuse des glandes salivaires sub-mandibulaires, des parotides et des glandes de Harderian. L’étude a mis en évidence la survenue de sarcomes des aires glandulaires salivaires et cervicales chez le mâle, et des tumeurs mammaires bénignes dans les deux sexes. Burek et al. suggèrent que la combinaison de l’infection virale et l’exposition à de fortes concentrations en chlorure de méthylène aient pu s’associer pour former ces tumeurs. Les femelles ont toutes une incidence de tumeurs mammaires bénignes élevée (> 80 %).
Dans l’autre étude chez les rats, précédemment décrite au §3.1.1. (Nitschke et al., 1988a), 90 rats Sprague-Dawley par sexe ont été exposés à des concentrations de 0, 50, 200 et 500 ppm (0, 176, 706 et 1 765 mg.m-3) de chlorure de méthylène, 6 h/j, 5 j/7 j pendant 20 mois (mâles) et 24 mois (femelles). Les rates exposées à 500 ppm de chlorure de méthylène ont présenté une augmentation de l’incidence d’hépatocytes multinucléés et du nombre de tumeurs mammaires bénignes spontanées non statiquement significative.
Burek et al.(1984) rapportent une exposition de rats et hamsters par inhalation de doses de chlorure de méthylène de 0, 500, 1500, et 3500 ppm (0, 1 765, 5 295 et 12 355 mg.m-3), 6 heures par jour, 5 jours par semaine, pendant 2 ans. Chez les mâles, il n’y a pas d’augmentation de mortalité bien qu’elle soit importante. A 24 mois les femelles témoins sont toutes mortes (et 90,3 % dans le lot exposé à 3 500 ppm). Il n’est constaté aucune relation avec l’induction de tumeurs bénignes ou malignes.
Cinquante rats F344 et 50 souris B6C3F1 des deux sexes ont été exposées 6 heures par jour, 5 jours par semaine pendant 102 semaines à des concentrations de 0, 1 000, 2 000, et 4 000 ppm (0, 3 530, 7 060 et 14 120 mg.m-3) pour les rats, et 0, 2 000, 4 000 ppm (0, 7 060 et 14 120 mg.m-3) pour les souris. Les rats étaient en permanence dans les chambres d’exposition. Dans ces conditions expérimentales, on constate chez les rats femelles une augmentation dose-dépendante de l’incidence des tumeurs mammaires bénignes (p < 0,001). Une augmentation de l’incidence des leucémies est aussi observée pour les expositions à 2 000 et 4 000 ppm, mais également chez les témoins (Mennear et al., 1988). Dans une étude plus récente, le même protocole expérimental a également permis d’observer une augmentation de l’incidence des tumeurs mammaires bénignes (adénofibromes) aussi bien chez les mâles (à partir de 4 000 ppm soit 14 120 mg.m-3, p<0,05) que chez les femelles (tendance positive p<0,01) (Aiso et al., 2014a, 2014b). Les mâles ont par ailleurs développé des fibromes sous-cutanés à partir de 2 000 ppm (7 060 mg.m3 (p<0,05) et des mésothéliomes du péritoine (tendance positive, p<0,05).
L’exposition des souris B6C3F1 à des concentrations de 2 000 et 4 000 ppm (7 060 et 14 120 mg.m-3) de chlorure de méthylène pendant deux ans est associée à une augmentation de l’incidence et de la multiplicité des tumeurs alvéolaires et bronchiolaires (adénomes et carcinomes) chez les mâles et les femelles (NTP, 1986). Pour une exposition respective de 2 000 et 4 000 ppm, 54 % et 80 % des souris mâles ont présenté des tumeurs alvéolaires et bronchiolaires, contre 10 % pour le lot témoin. Chez les femelles, pour une exposition respective de 2 000 et 4000 ppm, 63 % et 85 % des souris ont présenté des tumeurs alvéolaires et bronchiolaires, contre 6 % pour le lot témoin. Il en est de même avec les tumeurs du foie : l’incidence des carcinomes hépatocellulaires et des adénomes ou carcinomes (combinés) pour une exposition de 4 000 ppm (14 120 mg.m-3) est augmentée chez les mâles (67 % des souris contre 44 % pour le lot témoin). Chez les femelles, on observe une augmentation dose-dépendante des adénomes hépatocellulaires et des carcinomes hépatocellulaires. Pour une exposition respective de 2 000 et 4 000 ppm, 33 % et 83 % des souris ont présenté des adénomes ou des carcinomes hépatocellulaires, contre 6 % pour le lot témoin. La survie des mâles et des femelles du lot fortement exposé (4 000 ppm) est significativement diminuée ; en effet, il est observé respectivement 38 décès sur 50 chez les mâles, et 40 décès sur 50 chez les femelles, contre 11 sur 50 pour les mâles témoins et 24 sur 50 pour les femelles témoins (NTP, 1986).
Les effets de l’exposition au dichlorométhane par inhalation sur l’augmentation de l’incidence des adénomes et des carcinomes pulmonaires (tumeurs alvéolaires et bronchiolaires) et hépatiques chez la souris ont été confirmés dans une étude au protocole similaire (0, 1 000, 2 000 et 4 000 ppm, soit 0, 3 530, 7 060 et 14 120 mg.m-3, 6 heures par jour, 5 jours par semaine, pendant 104 semaines (Aiso et al., 2014a, b). L’incidence dose-dépendante des carcinomes broncho-alvéolaires ou adénomes/carcinomes (combinés) est augmentée dès la plus faible dose chez les mâles (p<0,01) et à partir de 2 000 ppm (7 060 mg.m-3) chez les femelles (p<0,05). Au niveau hépatique, on retrouve une augmentation significative de l’incidence des carcinomes uniquement à la plus forte dose (40 % (p<0,01) et 38 % (p<0,05) respectivement chez les mâles et les femelles, versus 20 % et 2 % chez les témoins), alors que l’incidence des adénomes ou carcinomes (combinés) augmente selon une relation dose-dépendante dès 1 000 ppm (3 530 mg.m-3) (p<0,05) chez les femelles et à partir de 2 000 ppm (7 060 mg.m-3) chez les mâles. En revanche contrairement à la précédente étude, le traitement n’a pas eu d’incidence significative sur la survie des mâles et des femelles.
Voie orale
Deux études de cancérogenèse précédemment citées ont été conduites pour les effets non cancérogènes avec administration par voie orale dans l’eau de boisson, une sur le rat F344 et une sur la souris B6C3F1 (Serota et al., 1986a, 1986b).
Des tumeurs hépatiques (carcinomes hépatocellulaires et nodules néoplasiques) ont été observées chez des rats femelles (mais pas chez les mâles) ayant ingéré pendant deux ans, via l'eau de boisson, du chlorure de méthylène à des doses allant jusqu'à 250 mg.kg-1.j-1 (Serota et al., 1986b). L’incidence des carcinomes hépatocellulaires était de 3 % et celle des nodules néoplasiques de 1 %. Ces taux n'étaient cependant pas différents de ceux des témoins historiques de 6,3 % pour les nodules néoplasiques et 1,7 % pour les carcinomes hépatocellulaires. Bien que des cancers hépatiques (adénomes et carcinomes hépatocellulaires) aient été observés chez les souris mâles, l'incidence était dans la gamme de celle des témoins historiques (Serota et al., 1986a). Les souris femelles n'ont pas présenté d'augmentation de cancers du foie (Serota et al., 1986a).
Aucune augmentation de l'incidence des tumeurs n'a été notée après exposition de rats au chlorure de méthylène par gavage dans l'huile aux doses de 100 ou 500 mg.kg-1.j-1 durant 104 semaines (Maltoni et al., 1988). Chez les souris exposées dans les mêmes conditions, mais pour une durée de 64 semaines seulement, une augmentation significative de l'incidence des tumeurs pulmonaires a été mise en évidence, après prise en compte de l'augmentation du taux de mortalité à la plus forte dose (Maltoni et al., 1988).
En se basant sur l'ensemble de ces résultats, l'IARC a conclu que les preuves de la cancérogénicité du chlorure de méthylène chez l'animal étaient suffisantes (IARC, 2014).
Synthèse
Chez l’animal, l’exposition par inhalation au chlorure de méthylène induit une augmentation de l’incidence des adénomes et des carcinomes pulmonaires (tumeurs alvéolaires et bronchiolaires) et hépatiques. Après exposition par voie orale, une augmentation significative de l'incidence des tumeurs pulmonaires est observée chez la souris.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| EU | non classé | 2008 |
Chez l'homme
Toutes voies
Aucune donnée n’a été identifiée.
Chez l'animal
Toutes voies
In vivo, le chlorure de méthylène présente une spécificité d’espèce et de tissu, suggérant une influence du métabolisme (activité GSTT1) sur la génotoxicité (Schlosser et al., 2015).
In vivo, il a été mis en évidence dans des tissus présentant une forte activité GST, des cassures de l’ADN dans le foie et le poumon de la souris (oral, 1 720 mg.kg-1) et le foie du rat (oral, 1 275 mg.kg-1), des aberrations chromosomiques, des échanges entre chromatides sœurs t les poumons et des micronoyaux dans les érythrocytes périphériques de la souris après inhalation de fortes concentrations (> 4 000 ppm, 10 jours) (INRS, 2014). A l’inverse, des résultats négatifs ont été rapportés dans la moelle osseuse, associé à une faible activité GST (Westbrook-Collins et al., 1990).
D’après la monographie de l’IARC (1999), le chlorure de méthylène induit une synthèse non programmée de l’ADN dans des hépatocytes de rats exposés in vivo. Des cassures des brins d’ADN ont été observées au niveau des cellules rénales de souris exposées au chlorure de méthylène.
Le chlorure de méthylène est également à l’origine d’effets létaux dominants chez le rat.
In vitro
Organismes procaryotes
Une étude a montré que le chlorure de méthylène était mutagène sur des souches de Salmonella typhimurium (avec ou sans activation métabolique) (Green, 1983) et Callen et al. (1980) ont mis en évidence des recombinaisons mitotiques sur levures sous l’action du chlorure de méthylène (Callen et al., 1980). Les effets mutagènes ont été associés à l’activité GST des bactéries, des résultats négatifs étant observées sur les souches dépourvues en GST à moins d’être transfectées par un gène GST de mammifères (DeMarini et al., 1997 , Graves et al., 1994a ; Pegram et al., 1997 ; Thier et al., 1993)
Organismes eucaryotes
Les résultats des recherches menées sur des cellules de mammifères étaient généralement négatives, mais certains auteurs ont montré un effet génotoxique du chlorure de méthylène caractérisé par des mutations, des échanges de chromatides sœurs, et une augmentation de la transformation virale (Hatch et al., 1983 ; Price et al., 1978). Des cassures simple brins ont été observées sur des cellules CHO enrichies par la fraction S100 (activité GST) de cytosol hépatique (Graves et al., 1995). Il a été observé une induction de la transformation des cellules d’embryon de rats Fischer (F1706) et une augmentation de la transformation virale sur des cellules d’embryon de hamster Syrien. Dans le test du micronoyau, des résultats négatifs ont été observés (Dearfield et Moore, 2005).
D’après la monographie de l’IARC (1999), le chlorure de méthylène induit une synthèse non programmée de l’ADN dans des hépatocytes de rat en culture. La formation de liaisons ADN-protéines a été décrite sur des cellules V79 de hamster chinois transféctées par un gène murin GST (Hu et al., 2006)
D’autres essais réalisés sur des cellules humaines (lignées ou cellules isolées) ont mis en évidence la formation de micronoyaux, ou échanges de chromatides sœurs à partir de tests réalisés en présence ou en absence d’activation métabolique (Hallier et al., 1993; Doherty et al., 1996; Olvera), alors que la plupart des tests sur la formation de liaisons ADN-protéines, ou synthèse non programmée de l’ADN se sont majoritairement révélés négatifs (Jongen et al., 1981;; Casanova et al., 1997) (IARC, 2014).
Compte tenu des éléments disponibles, effets positifs à des doses non cytotoxiques et sous la dépendance de l’activité GST observée aussi bien in vitro qu’in vivo, un mécanisme sans seuil de dose sera retenu.
Synthèse
Le chlorure de méthylène est faiblement mutagène in vitro. In vivo, il présente une spécificité d’espèce et de tissu suggérant une influence du métabolisme sur la génotoxicité (activité GST).
Effets sur la reproduction
Chez l'homme
Inhalation
Huit travailleurs (sur un groupe de 26), âgés de 20 à 47 ans, exposés au chlorure de méthylène par inhalation (concentrations mesurées dans l'air : 3,3 à 154,4 ppm (12-545 mg.m-3) et par voie cutanée durant 1,4 à 2,9 années, ont présenté des problèmes de fertilité et se sont plaints de douleurs génitales (testicules, épididymes et/ou prostate). Les testicules se sont révélés atrophiés chez 2 personnes et 4 autres individus présentaient un nombre réduit de spermatozoïdes, avec un taux de malformations allant de 38 % à 50 % (Kelly, 1988). Cette étude présente cependant plusieurs limites, notamment le petit nombre de sujets, l'exposition à d'autres produits dont le styrène (1,5 à 4 ppm soit 6 à 17 mg.m-3), le manque de prélèvements sanguins ou urinaires pour quantifier l'exposition au chlorure de méthylène, et l'absence d'un groupe témoin.
A l'inverse, aucune diminution du nombre de spermatozoïdes n'a été mise en évidence chez 4 salariés exposés durant 3 mois à des niveaux en chlorure de méthylène au moins 2 fois plus élevés que dans l'étude précédente (Wells et al., 1989).
Synthèse
Les données humaines sont insuffisantes pour évaluer les effets du chlorure de méthylène sur la fertilité.
Chez l'animal
Inhalation
Aucun effet sur les fonctions de reproduction n'a été observé chez des rats exposés à des concentrations en chlorure de méthylène allant jusqu'à 1 500 ppm (5 295 mg.m-3) durant deux générations (Nitschke et al., 1988b).
Chez des souris mâles exposées à 200 ppm (706 mg.m-3) de chlorure de méthylène durant 6 semaines, aucune lésion microscopique n'a été décelée dans les testicules (Raje et al., 1988). Une atrophie de l'utérus, des ovaires et des testicules a été observée chez des rats et des souris exposés à 4 000 ppm (14 120 mg.m-3) de chlorure de méthylène durant deux ans (NTP, 1986). Dans une étude citée par l’INRS (2009), lors d’une administration de chlorure de méthylène par voie orale (125 mg.L-1 dans l’eau de boisson, 13 semaines avant l’accouplement), aucune modification de l’index de fertilité des femelles n’a été observé, ni de modifications de la survie des petits.
Synthèse
Le chlorure de méthylène ne semble pas avoir d’effet sur la fertilité chez l’animal, mais ces données demandent à être confirmées.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| EU | non classé | 2008 |
Chez l'homme
Inhalation
Les résultats d’une étude rétrospective menée chez des femmes employées dans l’industrie pharmaceutique et exposées à une variété de solvants organiques a été publiée en 1986 (Taskinen et al., 1986). L’exposition aux solvants, et en particulier au chlorure de méthylène, résulte en une augmentation du nombre des avortements spontanés. Mille sept cent quatre vingt quinze grossesses suivies ont été associées à 142 avortements spontanés. L’Odd Ratio pour le chlorure de méthylène varie de 1 à 5,7 (moyenne = 2,3, p <0,06). Cependant, les arguments pour une relation causale manquent.
Aucune relation n'a pu être mise en évidence entre l'exposition à des concentrations en chlorure de méthylène au plus égales à 0,01 ppm (35 µg.m-3) et une altération du poids à la naissance (91 302 naissances simples ont été étudiées entre 1976 et 1987) (Bell et al., 1991). Ces teneurs sont plus faibles que celles retrouvées en milieu professionnel mais significativement plus élevées que le bruit de fond ambiant, estimé à 50 ppt (parties par trillion) soit 0,175 µg.m-3.
Toutefois, il faut tenir compte des effets tératogènes du monoxyde de carbone (métabolite du chlorure de méthylène) en cas de forte exposition potentielle de la femme enceinte (INRS, 2014).
Synthèse
Les données ne permettent pas de conclure sur les effets toxiques sur le développement du chlorure de méthylène.
Chez l'animal
Inhalation
Une étude chez le rat a montré que le chlorure de méthylène traversait la barrière placentaire. En effet, l'exposition de femelles gestantes à 500 ppm (1 765 mg.m-3) de chlorure de méthylène durant 1 heure a entraîné la présence de ce composé dans le sang fœtal, mais à une teneur moindre que dans le sang maternel (Anders et Sunram, 1982). Le monoxyde de carbone étant un agent reprotoxique connu chez l’homme (JOCE, 1996), il a été dosé chez la mère et le fœtus. Le taux de monoxyde de carbone était identique chez la mère et le fœtus, correspondant à celui résultant d’une exposition à 22 ppm (27 mg.m-3) de monoxyde de carbone.
Aucune anomalie organique n'a été décelée chez des fœtus de souris et de rats exposés à 1 250 ppm 4 412 mg.m-3) de chlorure de méthylène durant la gestation, mais un léger retard d'ossification a été noté chez les deux espèces. A cette dose, une augmentation du poids du foie était observée chez les femelles (Schwetz et al., 1975).
Après exposition de rats à 4 500 ppm (15 885 mg.m-3) avant et/ou pendant la gestation, une augmentation du poids du foie de la mère et une diminution du poids des fœtus ont été observées mais aucun effet tératogène n'a été décelé. La vitalité et la croissance n'étaient pas non plus affectées (Bornschein et al., 1980 ; Hardin et Manson, 1980). Par rapport aux témoins, les rats exposés ont montré une lenteur à l’adaptation à un nouvel environnement aux dizième et quinzième jours. Au cent cinquième jour, cette difficulté persistait. L’absence de détermination du taux de monoxyde de carbone ne permet pas d’apprécier la part relative du chlorure de méthylène et du monoxyde de carbone (Bornschein et al., 1980).
L'exposition sur 2 générations à des concentrations en chlorure de méthylène de 1 500 ppm (5 295 mg.m-3) n'a pas affecté la survie ou la croissance néonatale chez le rat (Nitschke et al., 1988b).
L'ensemble de ces résultats montre que le chlorure de méthylène inhalé présente un potentiel tératogène très faible voire nul.
Synthèse
Chez l’animal, l’ensemble des données disponibles, concernant des expositions par inhalation au chlorure de méthylène montrent un potentiel tératogène faible, voire nul de celui-ci.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance dangereuse et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes dont la notoriété internationale est variable.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation:
L’OEHHA propose un REL de 14 mg.m-3 (4 ppm) pour une exposition aiguë d’une heure par inhalation au chlorure de méthylène (OEHHA, 2008)
Cette valeur est basée sur une étude menée chez douze volontaires sains ayant inhalé 195 ppm (688 mg.m-3) de chlorure de méthylène pendant 1,5 h (Putz et al., 1979). A cette concentration, une altération de la vigilance auditive (diminution des temps de réaction à un stimulus auditif) et de la vision périphérique est rapportée. Sur la base de cette observation, une LOAEC pour une heure d’exposition est calculée à partir de la loi de Haber avec n = 2 : C1n x t1 = C2n x t2 d’où C2 = C1 x (t1/t2)(1/n) = 195 x (1,5/1)(1/2) = 240 ppm
Facteurs d'incertitude : Un facteur de 60 a été appliqué, soit 6 pour l’utilisation d’une LOAEC et 10 pour la variabilité intra-espèce.
RELaiguë = LOAEC / facteurs d’incertitudes
Calcul : RELaiguë = 240 ppm / 60 = 4 ppm (14 mg.m-3)
L'ATSDR propose un MRL de 2,1 mg.m-3 (0,6 ppm) pour une exposition aiguë par inhalation au chlorure de méthylène (ATSDR, 2000)
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des volontaires exposés à 300, 500 ou 800 ppm (1 059, 1 765 ou 2 824 mg.m-3) à des vapeurs de chlorure de méthylène durant 3 à 4 heures (Winneke, 1974). L’utilisation de plusieurs tests de neurocomportement a mis en évidence des effets neurologiques (diminution statistiquement significative de la vitesse critique de fusion[1] et altération de la vigilance auditive (diminution des temps de réaction à un stimulus auditif)) dès la plus faible dose (300 ppm), qui constitue donc une LOAEC pour cette étude. Le modèle pharmacocinétique PBPK de Reitz et al., (1997) a été utilisé pour le calcul d’une LOAEC sur 24 heures, estimée à 60 ppm.
Facteurs d'incertitude : un facteur 10 a été appliqué pour l'utilisation d'une LOAEC et un facteur 10 pour la variabilité au sein de la population.
MRL = LOAEC / facteurs d’incertitude
Calcul : MRL = 60 ppm / 100 = 0,6 ppm (2,1 mg.m-3)
Indice de confiance : cet organisme n’attribue pas d’indice de confiance aux valeurs qu’il développe.
Le TCEQ propose un ReV de 12 mg.m-3 (3,5 ppm) pour une exposition aiguë de 1 heure par inhalation au chlorure de méthylène (2013).
Cette valeur a été établie à partir de l’étude de Putz et al. 1979, également retenue par l’OEHHA, et qui a exposé douze volontaires sains à 195 ppm (688 mg.m-3) de chlorure de méthylène pendant 1h30. Le TCEQ a retenu comme effet critique une atteinte du SNC mise en évidence par une altération de la vision périphérique à l’unique concentration testée de 195 ppm. Cette LOAEC a été retenue comme POD (point de départ) du calcul de la valeur.
Un ajustement sur la durée d’exposition a été réalisé pour tenir compte de l’exposition de 1h30, ramenée à 1 h en utilisant la loi de Haber avec n = 3. La valeur étant issue de données humaines, aucun ajustement n’a été utilisé. Le ReV est construit à partir de :
LOAECHEC = [(195 ppm)3 x (1,5 h/1 h)]1/3 = 223 ppm
Facteurs d'incertitude : un facteur d’incertitude de 6,3 est retenu en raison de l’utilisation d’un LOAEL et non d’une NOAEL et un facteur d'incertitude de 10 est retenu pour la variabilité au sein de la population.
Calcul : ReVaiguë = 223 ppm / 63 = 3,54 ppm (arrondi à 3,5 ppm soit 12,5 mg.m-3 arrondi à 12,5 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L'OMS préconise une valeur guide de 3 mg.m-3 (0,84 ppm) pour une exposition de 24 heures par inhalation au chlorure de méthylène (OMS, 2000).
Cette valeur se base sur une étude d'exposition au chlorure de méthylène chez des volontaires sains non-fumeurs (11 hommes et 3 femmes) exposés 7,5 h/j pendant 5 j (DiVincenzo et Kaplan, 1981b). Une augmentation de 1 % de carboxyhémoglobine a été détectée chez les personnes exposées à 90 mg.m-3 de chlorure de méthylène durant 7,5 heures. L'OMS considère que le niveau maximum de carboxyhémoglobine à ne pas dépasser est de 3 % et que la contribution du chlorure de méthylène ne doit pas dépasser 0,1 % de carboxyhémoglobine. Une extrapolation linéaire des données de l'étude a abouti à la valeur guide qui est la concentration en chlorure de méthylène dans l'air induisant une augmentation de carboxyhémoglobine de 0,1 %. Un ajustement par rapport à la durée d’exposition est réalisé : 7 h 30/24 h.
Aucun facteur d’incertitude n’a été utilisé.
Calcul : TCA = 0,1/1 x 7,5/24 x 90 mg.m-3 = 3 mg.m-3 (0,84 ppm)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par inhalation:
L'ATSDR propose un MRL de 0,3 ppm (1,1 mg.m-3) pour une exposition subchronique par inhalation au chlorure de méthylène (ATSDR, 2000)
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats exposés en continu aux vapeurs de chlorure de méthylène durant 14 semaines aux concentrations de 0, 25 ou 100 ppm (0, 88 ou 353 mg.m-3) (Haun et al., 1972). Des effets hépatiques (vacuolisation cytoplasmique, infiltration graisseuse) et rénaux (dégénérescence tubulaire) ont été observés aux 2 doses testées. Une LOAEC de 25 ppm a été établie pour cette étude. Une LOAEC(HEC) a été calculée pour l’homme en tenant compte des coefficients de partage des gaz dans le sang chez l’homme et l’animal (Hb/g : coefficient de partage sang/air) (US EPA, 1994) :
(Hb/g)A = 19,4 (rat) et (Hb/g)H = 8,94 (homme)
Ratio (Hb/g)A / (Hb/g)H = 19,4/8,94 = 2,2
Pour un résultat supérieur à 1, l’US EPA retient la valeur de 1.
Soit LOAEC(HEC) = LOAEC x (Hb/g)A / (Hb/g)H
= 25 x 1
= 25 ppm
Facteurs d'incertitude : un facteur de 90 a été appliqué correspondant à un facteur 3 pour l'utilisation d'une LOAEC, un facteur 3 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
MRL = LOAEC(HEC) / facteurs d’incertitude
Calcul : MRL = 25 ppm / 90 = 0,27 ppm arrondi à 0,3 ppm (1,1 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par inhalation:
L'ATSDR propose un MRL de 0,3 ppm (1,1 mg.m-3) pour une exposition chronique par inhalation au chlorure de méthylène (ATSDR, 2000)
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats, exposés à des concentrations de 0, 50, 200 et 500 ppm (0, 176, 706 ou 1 765 mg.m-3) de chlorure de méthylène à raison de 6 h/j, 5 j/sem, durant 24 mois (Nitschke et al., 1988a). Une NOAEC de 50 ppm pour les effets hépatiques (vacuolisation hépatocellulaire et augmentation statistiquement significative du nombre d’hépatocytes polynucléés) a été déterminée.
Un ajustement de la durée d’exposition a été réalisé afin de prendre en compte les conditions expérimentales de l’étude source (6 h /j, 5 j/sem.) soit une NOAECADJ de 8,92 ppm puis une NOAEC équivalente a été calculée prenant en compte les coefficients de partage des gaz dans le sang soit une NOAEC(HEC) de 8,92 ppm.
NOAECADJ = 50 ppm x 6 h/24 h x 5 j/7 j = 8,92 ppm
(Hb/g)A = 19,4 (rat)
(Hb/g)H = 8,94 (homme)
Ratio (Hb/g)A / (Hb/g)H = 19,4/8,94 = 2,2
Pour un résultat supérieur à 1, l’US EPA retient la valeur de 1.
Soit NOAEC(HEC) = NOAECADJ x (Hb/g)A / (Hb/g)H
= 8,92 x 1,0
= 8,92 ppm
Facteurs d'incertitude : un facteur d’incertitude global de 30 a été appliqué correspondant à un facteur 3 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
MRL = NOAEC(HEC) / facteurs d’incertitudes
Calcul : MRL = 8,92 ppm / 30 = 0,297 ppm arrondi à 0,3 ppm (1,1 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L'US EPA (IRIS) propose un RfC de 0,6 mg.m-3 (0,2 ppm) pour une exposition chronique par inhalation au chlorure de méthylène (US EPA, 2011).
Cette valeur se base sur une étude de 104 semaines chez le rat exposé par inhalation à des concentrations de 0, 50, 200 et 500 ppm (177, 706, 1 765 mg.m-3) (Nitschke et al., 1988a). Des effets hépatiques de type vacuolisation hépatocytaire ont été observés et sont retenus pour le calcul de la valeur. A partir des données de cette étude, une BMDC10 a été estimée chez le rat à partir des doses internes estimées par modélisation PBPK. Après ajustement allométrique, une dose interne équivalente chez l’homme a été établie à l’aide d’une seconde modélisation PBPK (estimation de la distribution des expositions associées à la BMDC10). Le premier percentile de la distribution des doses équivalente chez l’homme a été retenu comme point de départ soit une concentration de 17,2 mg.m-3.
Facteurs d’incertitude : un facteur global de 27 arrondi à 30 est utilisé (3 pour tenir compte des différences de sensibilité au sein de la population, 3 pour l’extrapolation des données de l’animal à l’homme, 3 pour tenir compte du manque de donnée sur le développement).
RfC = BMDC10 (HEC) / facteurs d’incertitude
Calcul : RfC = 17,2 mg.m-3 / 30 = 0,59 mg.m-3 (arrondi à 0,6 mg.m-3) (0,2 ppm)
Indice de confiance : haut pour la qualité de l’étude source, et moyen à élevé pour la complétude de la base de données et la VTR élaborée.
Santé Canada propose une RfC de 0,6 mg.m-3 pour une exposition chronique par inhalation au chlorure de méthylène (Santé Canada, 2021).
Cette valeur est directement issue de celle construite par l’US EPA en 2011, avec la même étude clés et traitements des données.
Le RIVM propose une TCA de 3 mg.m-3 (0,84 ppm) pour une exposition chronique par inhalation au chlorure de méthylène (RIVM, 2001).
Cette valeur est identique à la valeur guide pour une exposition de 24 heures établie par l’OMS (2000) à partir d’une étude chez les volontaires sains non-fumeurs (11 hommes et 3 femmes) exposés 7,5 h/j pendant 5 j (DiVincenzo et Kaplan, 1981b).
Indice de confiance : élevé pour la VTR élaborée
L'OEHHA propose un REL de 0,4 mg.m-3 (0,1 ppm) pour une exposition chronique par inhalation au chlorure de méthylène (OEHHA, 2000).
Cette valeur se base sur une étude réalisée dans le milieu professionnel (DiVincenzo et Kaplan, 1981b). Les 19 travailleurs étaient exposés à une concentration moyenne de 40 ppm (141 mg.m-3) durant les heures de travail (0-250 ppm). Les niveaux moyens en carboxyhémoglobine étaient de 3,9 % à la fin de la période de travail. La durée totale d'exposition n'était pas spécifiée mais une étude sur des volontaires sains a montré que les niveaux en carboxyhémoglobine n'augmentaient plus après 5 jours d'exposition. La concentration de 40 ppm est considérée comme une LOAEC pour les effets sur les niveaux de carboxyhémoglobine. Un ajustement temporel pour passer d’une exposition discontinue à continue a été pratiquée en utilisant la durée d’exposition et les volumes respiratoires : 10 m3/20 m-3 x 5j/7j.
LOAECADJ = 40 ppm x 10 m3/20 m3 x 5 j/7 j = 14,29 ppm
Facteurs d'incertitude : un facteur d’incertitude global 100 a été appliqué correspondant à un facteur 10 pour l'utilisation d'une LOAEC et un facteur 10 pour la variabilité au sein de la population.
REL = LOAECADJ / facteurs d’incertitude
Calcul : REL = 14,29 ppm / 100 = 0,14 ppm arrondi à 0,1 ppm (0,4 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Le TCEQ propose un ReV de 1,3 mg.m-3 (0,36 ppm) pour une exposition chronique au chlorure de méthylène par inhalation (2023)
Cette valeur a été établie à partir d’une étude de 104 semaines chez le rat exposé par inhalation à des concentrations de 0, 50, 199 et 499 ppm (177, 706, 1 765 mg.m-3) (Nitschke et al., 1988a). L’effet critique retenu est l’effet hépatique chez les femelles exposées à la plus forte concentration (augmentation de la vacuolisation hépatocellulaire et des hépatocytes polynucléés), avec une NOAEC (POD) de 199 ppm. Un calcul de BMD a été réalisé mais n’a pas été considéré opportun.
Du fait d’une exposition discontinue des animaux (6 h/j), un ajustement de la NOAEC de 199 ppm a été nécessaire :
NOAEC ADJ = NOAEC x 6 h/24 h x 5 j/7 j= 199 ppm x 6 h /24 h x 5j/7j = 35,5ppm.
Le calcul d’une concentration équivalente pour l’homme a ensuite été réalisé. Dans la mesure où le ratio animal/homme du coefficient de partage sang–air est supérieur à 1 (19,4/8,94 = 2,1), la valeur de 1 a été retenue par défaut d’après les recommandations du guide TCEQ-ESL (Effects Screening Level) de 2006 : NOAEC HEC = NOAECADJ
Facteurs d'incertitude : un facteur 90 arrondi à 100 est appliqué (3 pour les différences pharmacodynamiques entre l’homme et le rat ; 10 pour le polymorphisme chez l’humain qui peut influer sur les voies de métabolisation (GSH/Cyt P450) du chlorure de méthylène et augmenter les effets hépatotoxiques ; 3 en raison du peu de données chez l’humain concernant les effets chroniques du chlorure de méthylène par inhalation (pas de données sur le développement du SNC ou sur le système immunitaire (ATSDR, 2000 ; US EPA 2010).
Calcul : ReVchronique = NOAECHEC / facteurs d’incertitude = 35,5 ppm / 100 = 0,355 ppm arrondi à 0,360 ppm soit 1,3 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition aiguë par voie orale:
L'ATSDR propose un MRL de 0,2 mg.kg-1.j-1 pour une exposition aiguë par voie orale au chlorure de méthylène (ATSDR, 2000).
Les données obtenues au cours de l'étude de Winneke (1974), décrite précédemment, (exposition de volontaires à 300-800 ppm (1 059-2 824 mg.m-3) de chlorure de méthylène pendant 3 à 4 heures et examen des effets neurologiques associés) retenues pour l’établissement d’un MRL pour une exposition aiguë par inhalation, ont également été utilisées ici. Des effets neurologiques avaient été observés à la plus faible dose, permettant d’établir une LOAEC de 300 ppm. Les résultats issus de cette étude (diminution statistiquement significative de la vitesse critique de fusion et altération de la vigilance auditive (diminution des temps de réaction à un stimulus auditif)) ont été modélisés par un modèle PBPK afin de prédire la concentration en chlorure de méthylène nécessaire dans l'eau de boisson pour produire des effets similaires à ceux obtenus suite à une exposition de 300 ppm pendant 4 heures (Reitz et al., 1997). La concentration équivalente dans l’eau de boisson induisant ces mêmes effets a été estimée à 565 mg.L-1.
La consommation quotidienne d’eau de boisson est estimée à 2 litres pour un poids moyen de 70 kg soit une LOAEL de 16 mg.kg-1j-1.
LOAELcalculée = 565 mg.L-1 x 2 L / 70 kg = 16 mg.kg-1.j-1
Facteurs d'incertitude : un facteur de 100 a été appliqué correspondant à un facteur de 10 pour l'utilisation d'un LOAEL et un facteur 10 pour la variabilité au sein de la population.
MRL = LOAELcalculée / facteurs d’incertitude
Calcul : MRL = 16 mg.kg-1.j-1 / 100 = 0,16 mg.kg-1.j-1 arrondi à 0,2 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par voie orale:
L'ATSDR propose un MRL de 6.10-2 mg.kg-1.j-1pour une exposition chronique par voie orale au chlorure de méthylène (ATSDR, 2000).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats et des souris, exposés au chlorure de méthylène dans l'eau de boisson à des doses allant jusqu'à 250 mg.kg‑1.j‑1 durant 104 semaines (Serota et al., 1986a, 1986b). Une augmentation statistiquement significative de la fréquence des effets hépatiques, des altérations cellulaires à toutes les doses sauf à la plus faible chez les rats. Un NOAEL de 6 mg.kg-1.j-1 a été déterminé pour ces effets chez les rats. Il s’agit d’un NOAEL calculé à partir de la consommation d’eau des animaux.
Facteurs d'incertitude : un facteur global de 100 est appliqué correspondant à un facteur de 10 pour l'extrapolation de données animales à l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : MRL = 6 mg.kg-1.j-1 / 100 = 0,06 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
L'US EPA (IRIS) propose un RfD de 0,006 mg.kg-1.j-1 pour une exposition chronique par voie orale au chlorure de méthylène (US EPA, 2011).
Cette valeur se base sur une étude de 104 semaines chez le rat exposé par voie orale (eau de boisson) à des doses nominales de 5, 50, 125 et 250 mg.kg-1.j-1 (doses analytiques de 6, 52, 125 et 235 mg.kg-1.j-1 pour les mâles, et 6, 58, 136, 263 mg.kg-1.j-1 pour les femelles) (Serota et al., 1986b). Les rats mâles et femelles, exposés à des concentrations respectives de 52 mg.kg-1.j-1 et 58 mg.kg-1.j-1, ont montré des effets hépatiques tels qu’une vacuolisation hépatocytaire et des foyers d’altérations cellulaires. A partir des données chez le mâle, une BMDL10 a été estimée pour le rat (dose interne chez le rat estimée pour les altérations cellulaires par modélisation PBPK). Après ajustement allométrique et estimation de la distribution des expositions associées à cette BMDL10 par une seconde modélisation PBPK, le premier percentile a été retenu et une dose de 0,19 mg.kg-1.j-1 a été déterminée chez l’homme.
Facteurs d’incertitude : un facteur de 27 arrondi à 30 est utilisé (3 pour tenir compte des différences toxicodynamiques de sensibilité de la population, 3 pour tenir compte de différence toxicodynamiques résiduelles et 3 pour tenir compte du manque d’étude de reprotoxicité par voie orale sur plusieurs générations).
RfD = BMDL10 (HED) / facteurs d’incertitude
Calcul : RfD = 0,19 mg.kg-1.j-1 / 30 = 0,0063 mg.kg-1.j-1 (arrondi à 0,006 mg.kg-1.j-1)
Indice de confiance : élevé pour la qualité de l’étude source et la VTR élaborée, et moyen à élevé pour la complétude de la base de données.
L'OMS préconise une TDI de 6.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au chlorure de méthylène (OMS, 2022).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats exposés au chlorure de méthylène dans l'eau de boisson à des doses allant jusqu'à 250 mg.kg-1.j-1 durant 104 semaines (Serota et al., 1986a, 1986b). Une NOAEL de 6 mg.kg-1.j-1 a été déterminée pour des effets d’altérations cellulaires hépatiques.
Facteurs d'incertitude : un facteur 10 est appliqué pour l'extrapolation de données animales à l'homme, un facteur 10 pour la variabilité au sein de la population et un facteur 10 pour tenir compte du potentiel cancérogène du chlorure de méthylène.
Calcul : TDI = 6 mg.kg-1.j-1 / 1 000 = 0,006 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
Santé Canada propose une DJT de 1,4.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (Santé Canada, 2021).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats exposés au chlorure de méthylène dans l'eau de boisson à des doses allant jusqu'à 250 mg.kg-1.j-1 durant 104 semaines (Serota et al., 1986a, 1986b). Les changements histopathologiques observés dans le foie ont été retenus comme étant l’effet le plus sensible. Une BMDL10 de 4,2 mg.kg-1.j-1 a été calculée à l’aide du logiciel Benchmark Dose de l’US EPA, à partir de l’incidence de foyers ou de zones de modifications hépatiques chez les rats mâles (plus sensibles que les femelles) de 27/36 (75 %), 25/40 (63 %), 22/34 (65 %), 35/38 (92 %), 34/35 (97 %) aux doses respectives de 0 - 0,6 – 58 - 136 et 263 mg.kg-1.j-1.
Facteurs d'incertitude : un facteur global 300 est appliqué correspondant à un facteur 10 pour l'extrapolation de données animales à l'homme, d’un facteur 10 pour la variabilité au sein de la population et un facteur 3 pour tenir compte des lacunes de la base de données, y compris le nombre restreint d’études développementales sur l’eau potable.
Calcul : DJT = 4,2 mg.kg-1.j-1 / 300 = 0,014 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice
Le RIVM propose une TDI de 6.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale au chlorure de méthylène (RIVM, 2001).
Cette valeur se base sur une NOAEL de 5,85 mg.kg-1.j-1 calculée à partir de l’estimation de la consommation d’eau au cours d'une étude de toxicité par voie orale (eau de boisson) chez le rat (NCA, 1982). Les animaux exposés à 50 mg.kg-1.j-1 et au-delà ont présenté des effets hépatiques (altérations histologiques). L’absence d’effet est observée à la dose la plus faible de 5 mg.kg-1.j-1.
Facteurs d'incertitude : un facteur global de 100 a été appliqué correspondant à un facteur de 10 pour l'extrapolation de données animales à l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : TDI = 6 mg.kg-1.j-1 / 100 = 0,06 mg.kg-1.j-1
Indice de confiance : moyen pour la VTR élaborée
Le TCEQ propose un RfD de 2.1.10-2 mg.kg-1.j-1 pour une exposition par voie orale (TCEQ, 2023).
La construction de cette valeur n’est pas détaillée.
Effets sans seuil - Exposition chronique par inhalation:
L’US EPA a établi un ERUi de 1.10-5 (mg.m-3)-1 pour une exposition par inhalation au chlorure de méthylène (US EPA, 2011).
Cette valeur est issue d’une étude de cancérogenèse chez la souris exposée par inhalation pendant 104 semaines (6 h/j, 5 j/sem.) à des concentrations de 0, 2 000 et 4 000 ppm (0, 7 060, 14 120 mg.m-3) (Mennear et al., 1988 ; NTP, 1986). Une augmentation significative de l’incidence des adénomes et carcinomes hépatiques et pulmonaires a été observée chez les souris mâles. Les données (voir tableau ci-après) ont été traitées à l’aide d’un modèle multi-étape avec extrapolation linéaire. Une modélisation PBPK a également été utilisée afin d’estimer la distribution des expositions (notamment selon les différences de polymorphismes chez l’homme) et la dose interne journalière métabolisée via la glutathion S-transférase (GST) car le métabolite produit (S-(chloromethyl)-glutathion) est la première source de cancérogénicité chez la souris. Enfin, un ajustement allométrique a été réalisé pour extrapoler de l’animal à l’homme. L’extrapolation linéaire aux faibles doses est réalisée à partir d’un modèle multi-étape à partir de la BMDL10.
Incidence des adénomes et carcinomes hépatiques et pulmonaires chez les souris mâles exposés par inhalation (NTP, 1986 ; US EPA, 2011)
|
Type de tumeur |
Poids corporel (g) |
Concentration (ppm) |
Incidence des tumeurs |
Dose interne dans les tissus* |
Dose totale métabolisée** |
|---|---|---|---|---|---|
|
Hépatique |
- |
0 |
22/50 (44 %) |
0 |
0 |
|
34 |
2 000 |
24/47 (51%) |
2 363,7 |
100,2 |
|
|
32 |
4 000 |
33/47 (70 %) |
4 972,2 |
210,7 |
|
|
Pulmonaire |
- |
0 |
5/50 (10 %) |
0 |
0 |
|
34 |
2 000 |
27/47 (55 %) |
475,0 |
100,2 |
|
|
32 |
4 000 |
40/47 (85 %) |
992,2 |
210,7 |
* Milligrammes de chlorure de méthylène métabolisé via la GST hépatique, par litre de tissu hépatique et par jour pour une exposition 6 heures par jour, 5 jours par semaine ; **Milligrammes de chlorure de méthylène métabolisé via la GST pulmonaire, par litre de tissu pulmonaire et par jour pour une exposition 6 heures par jour, 5 jours par semaine; ** Milligrammes de chlorure de méthylène métabolisé via la GST hépatique et pulmonaire, rapportés au poids corporel et par jour
Santé Canada propose un ERUi de 1.10-5 (mg.m-3)-1 pour une exposition par inhalation au chlorure de méthylène (Santé Canada, 2021).
Cette valeur est directement issue de celle construite par l’US EPA en 2011, avec les mêmes études clés et traitements des données.
L'OEHHA propose un ERUi de 10-3 (mg.m-3)-1 pour une exposition par inhalation au chlorure de méthylène (OEHHA, 2019).
Cette valeur est issue des données de cancérogénèse de l'étude du NTP chez des souris exposées à 0, 2 000 ou 4 000 ppm (0, 6 940 ou 13 880 mg.m-3) de chlorure de méthylène durant 102 semaines (NTP, 1986). Seules les tumeurs pulmonaires observées chez les souris femelles ont été prises en compte dans la détermination de l’excès de risque unitaire, car elles représentent l'indicateur le plus sensible. Un modèle PBPK a été utilisé pour l'estimer de la dose interne et un modèle multi-étape linéarisé a permis de déterminer l’excès de risque unitaire.
Le TCEQ propose une valeur un ERUi de 2,8.10-5 (mg.m-3)-1 pour une exposition vie entière au chlorure de méthylène par inhalation (TCEQ, 2023).
La démarche du TECQ suit celle retenue par Santé Canada (1993), en retenant, également comme l’US EPA, l’étude cible de cancérogénèse par inhalation chez la souris (NTP, 1986).
Une procédure en cinq étapes successives peu détaillées mettant en œuvre une modélisation multi-étapes, et l'utilisation d'un modèle PBPK prenant en compte les variations interspécifiques des taux de métabolisation, notamment par la voie GST, a permis de déterminer des valeurs de doses tumorigènes à 0,05 % (TD0,05) :
|
Type de tumeur/organe cible |
TD0,05 femelle (ppm) |
TD0,05 mâles (ppm) |
|
Adénome, Poumon Carcinome, Poumon Tumeurs combinées, Poumon |
1155 2651 645 |
1634 5257 902 |
|
Adénome, Foie Carcinome, Foie Tumeurs combinées, Foie |
4092 2965 2408 |
5590 4467 4106 |
Le calcul proposé par le TCEQ a été réalisé à partir des valeurs obtenues chez les femelles, plus sensibles que les mâles :
ERUi = 0,05/645 + 0,05/2 408 – [0,05/645 ppm x 0,05/2 408 ppm] = 9,8 ppb-1 soit 2,8.10-5 (mg.m-3)-1
Effets sans seuil - Exposition chronique par voie orale:
L’US EPA a établi un ERUo de 2.10-3 (mg.kg-1.j-1)-1 pour une exposition par voie orale au chlorure de méthylène (US EPA, 2011).
Cette valeur est issue d’une étude de cancérogenèse chez la souris exposée par voie orale (eau de boisson) pendant 104 semaines à des concentrations de 0, 60, 125, 185 et 250 mg.kg‑1.j-1. Une augmentation de l’incidence des adénomes et carcinomes hépatiques a été observée chez les mâles pour des doses supérieures ou égales à 125 mg.kg-1.j-1 (Hazlelton Laboratories, 1983 ; Serota et al., 1986a). Les données chez le mâle (voir tableau ci-dessous) ont été traitées à l’aide d’un modèle multi-étape avec extrapolation linéaire à partir de la BMDL10. Une modélisation PBPK a également été utilisée afin d’estimer la distribution des expositions (notamment selon les différences de polymorphismes chez l’homme) et la dose interne journalière métabolisée via la GST car le métabolite produit (S-(chloromethyl)-glutathion) est la première source de cancérogénicité chez la souris. Enfin, un ajustement allométrique a été réalisé pour extrapoler de l’animal à l’homme.
Incidence des adénomes et carcinomes hépatiques chez les souris mâles exposés par voie orale (Serota et al., 1986a ; US EPA, 2011)
|
Dose nominale (analytique) d’exposition (mg.kg-1.j-1) |
Incidence des tumeurs hépatiques chez les souris mâles |
Dose interne métabolisée chez la souris mâle* |
Dose totale métabolisée chez la souris mâle** |
|---|---|---|---|
|
0 (0) |
24/125 (19 %) |
0 |
0 |
|
60 (61) |
51/199 (26 %) |
17,5 |
0,73 |
|
125 (124) |
30/99 (30 %) |
63,3 |
2,65 |
|
185 (177) |
31/98 (32 %) |
112,0 |
4,68 |
|
250 (234) |
35/123 (28 %) |
169,5 |
7,1 |
* Milligrammes de chlorure de méthylène métabolisé via la GST hépatique, par litre de tissu hépatique et par jour ; ** Milligrammes de chlorure de méthylène métabolisé via la GST hépatique et pulmonaire, rapportés au poids corporel et par jour
Santé Canada propose un ERUo de 2.10-3 (mg.m-3)-1 pour une exposition par voie orale au chlorure de méthylène (Santé Canada, 2021).
Cette valeur est directement issue de celle construite par l’US EPA en 2011, avec les mêmes études clés et la même analyse des données.
L’OEHHA propose un ERUo de 3,5.10 -3 (mg.kg-1.j-1)-1 pour une exposition au chlorure de méthylène par voie orale (OEHHA, 2019).
Cette valeur est dérivée par une extrapolation voie à voie non décrite à partir de l’ERUi.
Le TCEQ a établi un ERUo de 9,8.10-5 (mg.kg-1.j-1)-1 pour une exposition par voie orale (TCEQ, 2023).
La construction de cette valeur n’est pas détaillée.
[1] Vitesse critique de fusion : fréquence des stimuli lumineux à laquelle la sensation de papillotement fait place à une sensation de lumière continue.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation:
L’INERIS propose de retenir la valeur de 2,1 mg.m-3 (0,6 ppm) pour des expositions aiguës par inhalation au chlorure de méthylène (ATSDR, 2000).
Trois VTR aiguës ont été déterminées par l’OEHHA (2008), l’ATSDR (2000) et le TCEQ (2013), l’OMS (2000) propose également une valeur guide. Toutes ces valeurs ont été établies à partir d’études réalisées sur des volontaires sains.
La valeur guide de l’OMS est basée sur une étude d’exposition 7,5 h/j pendant 5 j (DiVincenzo et Kaplan, 1981b). Cette étude est de qualité recevable. L’effet critique retenu est le niveau maximum en carboxyhémoglobine, cet effet est compatible avec le profil toxicologique de la substance.
L’étude de Putz et al., 1979 sur laquelle repose la valeur de l’OEHHA et du TCEQ n’est pas disponible ce qui ne permet d’évaluer sa qualité. Bien que les deux organismes n’aient pas retenu exactement le même effet critique, la seule dose testée a été retenue dans les deux cas comme point de départ (LOAEL). Une extrapolation à une durée d’exposition de 1 heure a bien été pratiquée au moyen de la loi de Haber. Les facteurs d’incertitudes sont proches et les VTR obtenues également.
La VTR de 2,1 mg.m-3 de l’ATSDR est établie à partir de l’étude de Winneke (1974) pour des effets neurologiques à la dose de 300 ppm (1 059 mg.m-3), plus faible dose testée. L’étude est de qualité recevable. Dans son analyse pour le choix de l’effet critique, l’ATSDR considère que les effets mesurés par l’étude de Winneke sont plus spécifiques que ceux de l’étude de Putz. A partir de cette LOAEC, le modèle pharmacodynamique de Reitz et al., (1997) et une LOAEC équivalente sur 24 heures a été estimée à 60 ppm (212 mg.m-3). Un facteur 10 a été appliqué pour l'utilisation d'une LOAEC et un facteur 10 pour la variabilité au sein de la population.
Bien que l’étude de Putz, et al., 1979 et de DiVincenzo et Kaplan, 1981b), aient testé de plus faibles concentrations, l’effet critique et la concentration équivalente sur 24 heures calculée avec le modèle de Reitz et al., (1997) par l’ATSDR à partir de l’étude de Winneke apparaissent plus pertinents. La construction de cette valeur est satisfaisante et la plus protectrice.
L’INERIS propose de retenir la valeur de l’ATSDR pour une exposition aiguë par inhalation au chlorure de méthylène.
Indice de confiance : faible en raison de l’ancienneté des études et l’accessibilité des données.
Effets à seuil - Exposition sub-chronique par inhalation:
L’INERIS propose de retenir la valeur de 1,1 mg.m-3 (0,3 ppm) pour des expositions subchroniques par inhalation au chlorure de méthylène (ATSDR, 2000).
L’ATSDR propose une valeur pour l’exposition subchronique. Cette valeur est établie à partir de l’étude de Haun et al., (1972). Cette étude expérimentale a été réalisée chez des rats et l’effet critique retenu est basé sur les effets hépatiques et rénaux avec une LOAEC de 25 ppm (88 mg.m-3). L’étude est de qualité limitée ; la durée est compatible avec une exposition sub-chronique. Un facteur d’incertitude global de 90 est retenu, ce choix est justifié. La construction de cette valeur étant satisfaisante, l’INERIS propose de retenir cette valeur pour une exposition subchronique par inhalation au chlorure de méthylène.
Indice de confiance : faible en raison de l’ancienneté des études et la qualité des données.
Effets à seuil - Exposition chronique par inhalation:
L’INERIS propose de retenir la valeur de l’US EPA et de Santé Canada de 0,6 mg.m-3 (0,2 ppm) pour des expositions chroniques par inhalation au chlorure de méthylène (US EPA, 2011 ; Santé Canada, 2021).
Six VTR sont proposées : le RIVM (2001), l’ATSDR (2000), l’US EPA (2011), l’OEHHA (2000), le TCEQ (2013) et Santé Canada (2021). Celle de l’OMS n’est pas retenue conformément aux critères définis par l’Ineris, car il s’agit d’une valeur guide. Le RIVM reprend intégralement la valeur guide de l’OMS développée pour une exposition de 24 heures. L’étude source utilisée n’est pas de durée compatible avec l’établissement d’une VTR pour des expositions chroniques. Elle n’est donc pas retenue.
L’OEHHA propose une valeur de 0,4 mg.m-3, basée sur une étude de Divencenzo et Kaplan (1981b) menée sur des travailleurs exposés au chlorure de méthylène 7,5 heures par jour, 5 jours par semaine, durant 2 semaines. La dose d’exposition moyenne était de 40 ppm (141 mg.m-3) et est retenue comme LOAEC. La durée d’exposition de l’étude de deux semaines n’est pas compatible avec une exposition chronique. Cette valeur n’est pas retenue.
L’ATSDR, l’US EPA, Santé Canada et le TCEQ propose une valeur basée sur l’étude expérimentale de Nitschke et al. (1988a) réalisée chez des rats exposés au chlorure de méthylène pendant 2 ans. Cette étude est de bonne qualité et de durée compatible avec la construction d’une VTR chronique. L’effet critique retenu par les différents organismes est la vacuolisation hépatocellulaire ; cet effet est adapté au regard du profil toxicologique de la substance. Pour cet effet, l’ATSDR considère une NOAEC de 50 ppm (176 mg.m‑3) alors que le TCEQ prend une NOAEC de 199 ppm (706 mg.m‑3). L’US EPA retient une approche par modélisation PBPK chez l’animal, calcule une BMDC10, puis utilise une modélisation PBPK chez l’homme. Santé Canada reprend intégralement la valeur de l’US EPA.
Concernant le choix des facteurs d’incertitude, les trois organismes prennent un facteur d’incertitude de 3 pour prendre compte les incertitudes résiduelles de l’extrapolation de l’animal à l’homme et pour tenir compte de la variation au sein de population humaine un facteur de 10 pour l’ATSDR et le TCEQ et réduit à 3 pour l’US EPA en raison de l’utilisation d’une modélisation PBPK. Enfin, l’US EPA et le TCEQ utilise un facteur 3 pour prendre en compte le manque de données.
La VTR établie par l’US EPA est retenue pour une exposition chronique par inhalation car le calcul de VTR mené par l’US EPA basé sur la détermination d’une BMDL10 et l’utilisation de modélisations PBPK permettant d’estimer la dose interne, ce qui apparaît plus pertinent que l’utilisation d’une NOAEC retenue par l’ATSDR ou le TCEQ. Par conséquent, l’Ineris propose de retenir la valeur de l’US EPA, également reprise par Santé Canada.
Indice de confiance : élevé en raison de la qualité de l’étude et la construction de la VTR
Effets à seuil - Exposition aiguë par voie orale:
L’INERIS propose de ne pas retenir la valeur de l’ATSDR de 0,2 mg.kg.j-1 pour des expositions aigües par voie orale au chlorure de méthylène.
L’ATSDR est le seul organisme à proposer une valeur pour l’exposition aiguë par voie orale. Cette valeur est établie à partir de l’étude de Winneke (1974) chez des volontaires exposés, par inhalation, à du chlorure de méthylène pendant environ 4 heures. Une modélisation à partir de la valeur de la LOAEC a permis de déterminer une dose orale équivalente de 16 mg.kg‑1.j‑1. Cette démarche d’extrapolation voie à voie n’est pas recommandée. Un facteur 100 a été appliqué en cohérence avec la construction de la VTR. Compte tenu des limites de construction de cette valeur, elle n’est pas retenue.
Effets à seuil - Exposition chronique par voie orale:
L’INERIS propose de retenir la valeur de l’US EPA de 6.10-3 mg.kg-1.j-1 pour des expositions chroniques par voie orale au chlorure de méthylène (US EPA, 2011).
Six VTR sont proposées par l’ATSDR (2000), l’US EPA (2011), l’OMS (2022), Santé Canada (2021), le TCEQ (2023) et le RIVM (2001).
En l’absence d’élément d’explication, la valeur du TCEQ n’est pas retenue.
Les cinq autres organismes retiennent la même étude expérimentale de Serota et al. 1986 (ou l’étude du NCA qui est identique), menée durant 2 ans chez des rats. Cette étude de bonne qualité a été réalisée sur une durée d’exposition compatible avec l’élaboration d’une VTR chronique.
Les différents organismes retiennent tous les mêmes effets critiques hépatiques. Les VTR de l’ATSDR, l’OMS et du RIVM, dont les constructions sont les plus anciennes, sont basées sur le même NOAEL. L’US EPA et Santé Canada, à partir de la même étude, proposent une démarche basée sur la détermination d’une BMDL10 pour les effets hépatiques. Seul l’US EPA enrichit sa démarche par l’utilisation de deux modèles PBPK à la fois chez le rongeur et chez l’humain, avec un ajustement allométrique entre les deux étapes, pour les estimations des doses internes et doses équivalentes humaines.
La valeur de l’OMS n’est pas retenue, un facteur de sécurité de 10 ayant été ajouté pour tenir compte du potentiel cancérogène du chlorure de méthylène. Cette approche n’est pas justifiée dans la mesure où des VTR sans seuil existent et considèrent déjà le potentiel cancérogène de la substance.
Les deux valeurs proposées par l’ATSDR et le RIVM sont identiques et sont basées sur l’application d’un facteur d’incertitude global de 100 (10 pour la variabilité inter-espèce et 10 pour la variabilité intra-espèce) qui est justifiée compte tenu des incertitudes associées à la construction de ces VTR.
Santé Canada qui a construit sa valeur à partir d’une BMDL10, plutôt qu’un NOAEL, applique néanmoins un facteur d’incertitude global de 300 (10 pour la variabilité inter-espèce et 10 pour la variabilité intra-espèce) et un facteur supplémentaire de 3 pour tenir compte des lacunes de la base de données.
Enfin, l’US EPA retient un facteur d’incertitude global de 30 (3 pour la variabilité inter-espèce, 3 pour la variabilité intra-espèce et 3 pour tenir compte du manque d’étude de reprotoxicité par voie orale sur plusieurs générations). Ce dernier est plus bas que celui des autres organismes du fait de la méthode de calcul retenue (modèles PBPK/ajustement allométrique) qui permet de limiter les incertitudes d’extrapolation entre l’animal et l’homme.
En résumé, la démarche retenue par l’US EPA basée sur les méthodes de calcul les plus récentes s’avère plus pertinente que celle des autres organismes. Par conséquent, l’INERIS propose de retenir la valeur de l’US EPA.
Indice de confiance : élevé du fait de la qualité des données et de la méthode de construction.
Effets sans seuil - Exposition chronique par inhalation:
L’INERIS propose de retenir la valeur de l’US EPA et Santé Canada de 1.10-5 (mg.m-3)-1 pour des expositions chroniques par inhalation au chlorure de méthylène (US EPA, 2011 ; Santé Canada, 2021).
Quatre VTR sont proposées : l’US EPA (2011), Santé Canada (2021), l’OEHHA (2019) et TCEQ (2013). Celles-ci sont toutes basées sur la même étude (NTP, 1986). Cette étude est de bonne qualité. Les effets critiques retenus sont l’augmentation de l’incidence des adénomes et carcinomes hépatiques et/ou pulmonaires chez les souris mâles ou femelles. Contrairement à l’US EPA et au TCEQ, l’OEHHA prend uniquement en compte les tumeurs pulmonaires observées chez les souris femelles car elles représentent l'indicateur le plus sensible. Chez l’homme, ces tumeurs ne sont habituellement pas retrouvées (il s’agit essentiellement de cancers de la prostate, du sein, de lymphomes, de myélomes et de cancers du SNC). Les tumeurs hépatiques et pulmonaires n’étant pas observées chez l’homme, il n’est donc pas possible d’évaluer l’effet critique le plus pertinent pour la construction de VTR.
Les valeurs sont déterminées à partir d’un modèle multi-étape avec extrapolation linéaire et d’un modèle PBPK pour estimer la dose interne. L’US EPA utilise la BMDL10 comme point de départ pour l’extrapolation aux faibles doses.
Les calculs proposés par le TCEQ manquent de transparence. Par conséquent, la valeur de l’US EPA basée sur les tumeurs pulmonaires et hépatiques est la plus détaillée et repose sur approche par BMDL. La valeur de l’US EPA, également adoptée par Santé Canda, est retenue.
Indice de confiance : élevé en raison de la qualité de l’étude et de la transparence et de la cohérence de la construction
Effets sans seuil - Exposition chronique par voie orale:
L’INERIS propose de retenir la valeur de l’US EPA et Santé Canada de 2.10-3 (mg.kg-1.j-1)-1 pour des expositions chroniques par voie orale au chlorure de méthylène (US EPA, 2011 ; Santé Canada, 2021).
Quatre VTR sont proposées par l’US EPA (2011), Santé Canada (2021), l’OEHHA et le TCEQ (2013).
En l’absence d’élément d’explication, la valeur du TCEQ n’est pas retenue.
La valeur de l’OEHHA est dérivée par une extrapolation voie à voie à partir de l’ERUi. L’étude clé est une étude de cancérogénèse par inhalation chez la souris (NTP, 1986) et l’effet critique repose sur des tumeurs pulmonaires observées chez les souris femelles. Dans la mesure où des études sont disponibles pour la voie orale, cette valeur n’est pas retenue.
La valeur de l’US EPA est établie à partir d’une étude de cancérogenèse réalisée chez la souris exposée par voie orale via l’eau de boisson (Serota et al., 1986a). Une augmentation de l’incidence des adénomes et carcinomes hépatiques a été observée chez les mâles mais n’est pas différente de celle des témoins historiques (Serota et al., 1986a). La construction de la valeur est cohérente et de bonne qualité. Cette valeur de l’US EPA, également adoptée par Santé Canda, est retenue.
Indice de confiance : par défaut en raison de la non significativé des résultats pour l’effet critique retenu
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le dichlorométhane (ou chlorure de méthylène, DCM) fait partie de la famille des composés organiques halogénés volatils (COHV).
Le DCM est classé cancérogène pour l'homme, et plusieurs législations en France et en Europe limitent son utilisation. Il fait partie des substances prioritaires de la Directive Cadre Eau, des valeurs limites pour des rejets de DCM dans l'environnement ont été définies pour différents secteurs et ses émissions dans l'air, l'eau et le sol, à partir de certains seuils, doivent être déclarées. La mise sur le marché et l'utilisation de décapants de peinture contenant du DCM sont interdits (pour les consommateurs, sauf dérogations pour les professionnels, mais non pour des utilisations industrielles). L'utilisation du DCM dans les pressings l'est également. Les concentrations admises dans les produits cosmétiques et les denrées alimentaires font l'objet de limites règlementaires.
En Europe le DCM est principalement utilisé par l'industrie comme solvant d'extraction ou de synthèse dans l'industrie pharmaceutique, comme solvant de synthèse dans la chimie fine et dans la production des polycarbonates. Des utilisations peu importantes concernent l'utilisation comme agent moussant dans la production des mousses polyuréthanes pour matelas et meubles, comme solvant d'extraction d'arômes, d'huiles et graisses végétales et animales, la décaféination de thé ou café, le dégraissage de cuir, le dégraissage et le nettoyage de métaux et comme solvant d'extraction dans les laboratoires chimiques. Il est présent dans des produits pour les professionnels et les consommateurs comme des adhésifs et décapants d'adhésifs, des sprays insecticides, des peintures et des produits de nettoyage et de dégraissage.
Son utilisation dans la formulation de décapants de peintures et vernis, dans la formulation de peintures et de colles et adhésifs et, dans un moindre degré, comme agent de nettoyage ou dégraissage des métaux semble diminuer depuis quelques années. Selon les informations disponibles via l'ECSA (European Chlorinated Solvents Association) et des interlocuteurs industriels, le DCM reste important dans des applications industrielles, mais perd de l'importance dans les utilisations professionnelles et pour les consommateurs. Dans les applications industrielles, cette substance est généralement utilisée dans des systèmes fermés, lorsque c'est possible.
Les émissions atmosphériques du DCM en France sont actuellement dominées par les secteurs de la pharmacie, chimie, fabrication de textiles et métallurgie. Les industries chimique et pharmaceutique, ainsi que la collecte et le traitement des eaux usées sont responsables de la plus grande partie des émissions dans l'eau. Il est estimé qu'environ 99% de la masse totale du DCM se trouvent dans l'air, 1% dans l'eau et une fraction négligeable dans les sols.
De nombreux substituts potentiels existent pour cette substance, qui diffèrent en fonction des utilisations. Certains de ces substituts paraissent néanmoins relativement polyvalents et applicables à plusieurs usages. Très peu d'informations sont disponibles concernant les coûts des substituts. Il paraît néanmoins que les produits alternatifs sont souvent plus chers que le DCM. Il existe également des technologies de dépollution des effluents industriels et des procédés alternatifs, qui ne sont toutefois pas adaptées à toutes les entreprises.
Abstract
Dichloromethane (or methylene chloride, DCM) belongs to the group of halogenated volatile organic compounds.
As a classified carcinogenic, various regulations in France and Europe limit the use of DCM. The substance belongs to the priority substances of the Water Framework Directive, limit values for emissions of DCM to the environment have been fixed for different sectors and its emissions to air, to water and soil above specified thresholds need to be reported. The sale and use of DCM in paint strippers is prohibited (for use by consumers, except in case of derogations for use by professionals, but not for industrial uses), and so is its use in dry cleaners. For cosmetics and food admissible limit concentrations have been defined.
In Europe, DCM is mainly used in industrial applications as extraction or synthesis solvent in the pharmaceutical industry, as synthesis solvent in the fine chemicals sector and in the production of polycarbonates. Minor applications are the use as foaming or blowing agent in the production of polyurethane foams for mattresses and furniture, as extraction solvent for aromas and vegetable or animal oils or fats, in the decaffeination of tea and coffee, in the degreasing of leather, as degreasing or cleaning agent of metals and as extraction solvent in chemical laboratories. DCM is used by professionals and consumers in adhesives and adhesive removers, in insecticide sprays, in paints and in cleaning and degreasing products.
Its use in the formulation of paint strippers, in the formulation of paints and of glues and adhesives and, to a smaller degree, as cleaning and degreasing agent for metals, appears to have declined over the last years. According to information available on the ECSA (European Chlorinated Solvents Association) website and provided by industry contacts, DCM remains important in industrial applications but is of decreasing importance for professional and consumer uses. In industrial applications, this substance is generally used, where ever possible, in closed systems.
Current atmospheric emissions of DCM in France are dominated by those from the pharmaceutical industry, chemical industry, the manufacturing of textiles and metallurgy. The chemical and pharmaceutical industries, as well as waste water collection and treatment are responsible for the major share of water emissions. 99% of the total mass of DCM is estimated to be in the air, about 1% in water and negligible amounts in soil.
There are numerous potential substitutes for this substance, depending on its specific uses. Some of these substitutes appear however to be rather polyvalent and applicable to several uses. Only little information is available regarding the cost of these substitutes. However, the alternative products appear to be frequently more expensive than DCM. There are also technologies and processes capable of reducing industrial emissions of DCM, but they appear to be expensive and technically not adapted to all companies.
Tableaux de synthèse
Généralités
| CAS | 75-09-2 |
|---|---|
| SANDRE | 1168 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. TEXTES GENERAUXObjectifs de réduction de rejets visant un meilleur état de l'environnement
Obligations de rapportage d'émissions
[2] En revanche il n'est pas considéré comme 'substance dangereuse prioritaire'. [3] Directive 2000/60/CE modifiée par la Directive n° 2008/105/CE et la Directive 2013/39/UE [5] Dont les modalités sont définies par l'arrêté du 31 janvier 2008 et sa circulaire d'application du 13/03/08, puis modifié par l'arrêté du 11 décembre 2014. Interdictions de vente et d'utilisation
Limitations de concentrations dans les produits
[6] Relative au rapprochement des législations des Etats membres concernant les solvants d'extraction utilisés dans la fabrication des denrées alimentaires et de leurs ingrédients. Définition de meilleures technologies disponibles
Classification et étiquetage
ACTION DE RECHERCHE RSDELa Directive Cadre Eau a également donné lieu à l'action nationale de recherche et de réduction des rejets de substances dangereuses (dont le DCM) dans l'eau par les installations classées[9] (« Action RSDE ») ainsi qu'au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses[10] . Ce programme définit différentes listes de polluants. Le DCM fait partie de la liste dite « Liste II de 99 substances ». Pour ces substances, à partir de l'analyse de l'état des milieux aquatiques récepteurs et de l'identification des sources de pollution, le programme fixe des objectifs de prévention, de réduction ou d'élimination de la pollution, détermine les mesures propres à assurer la surveillance et la maîtrise des rejets de ces substances et fixe le calendrier de leur mise en œuvre. Pour le DCM, le seuil de surveillance pérenne prévu dans l'action RSDE est de 20 g.l-1. A partir de ce seuil les établissements doivent mesurer le DCM dans leurs effluents. Un programme d'action est défini à partir d'un seuil de 100 g.l-1. [9] Circulaire du 04/02/02. [10] Article R211-11-1 du code de l'environnement (Livre II : Milieux Physiques -Titre I : « Eau et milieux aquatiques et marins) et Décret n° 2005-378. AUTRES TEXTESLe DCM est mentionné dans les « WHO Guidelines for Drinking-water Quality » (OMS, 2011), qui stipulent une valeur guide pour cette substance dans l'eau potable de 20 µg.l-1 ou 0,02 mg.l-1. Le DCM est également listé dans le résumé des exigeances minimales de l'« International Code for the Construction and Equipment of Ships Carrying Dangerous Chemicals in Bulk (IBC Code) » de l'Organisation Internationale Maritime (IMO, 2014). Le Protocole COV (1991) de la Convention sur la pollution transfrontière à longue distance (CLRTAP) porte également sur le DCM. Ce Protocole vise une réduction d'émissions de substances contribuant à la formation de l'ozone troposphique. L'annexe VIII de la Convention de Bâle11 enfin s'adresse aux chlorométhanes, dans la liste A3 portant sur des Déchets ayant principalement des constituants organiques et pouvant contenir des métaux et des matières inorganiques (catégorie A3170). Le DCM fait aussi partie de la liste des solvants dans l'annexe 1 du guide technique N° 6 relatif à cette convention (SBC, 02/06) qui porte sur les déchets dangéreux et leur traitement. Le DCM n'est en revanche pas cité sur les listes de la Convention OSPAR. |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. EXPOSITION PROFESSIONNELLEEn France, des valeurs limite d'exposition professionnelle contraignantes dans l'air des lieux de travail pour le DCM, applicables à partir du 1 juin 2012, sont définies dans l'article R. 4412-149 du code de travail (Décret n° 2012-746 du 9 mai 2012) :
VALEURS LIMITES D'EMISSIONSLa Directive 2010/75/UE[7] définit une valeur limite d'émissions de 20 mg/Nm3 de COV halogénés auxquels est attribuée la mention de danger H351 ou la phrase de risque R40 – ce qui est le cas du DCM -pour lesquelles le débit massique de la somme des composés justifiant l'étiquetage R40 est supérieur ou égal à 100 g/h. Cette valeur limite d'émission, qui s'applique à toute installation et activité utilisant des solvants organiques, se rapporte à la somme massique des différents composés. Cette valeur limite est reprise dans la réglementation française (cf. arrêté du 2 février 1998, dans la section 1.2.2). [7] Relative aux émissions industrielles. SEUILS DE REJETS POUR LES INSTALLATIONS CLASSEESLa règlementation des installations classées définit des valeurs limites pour différentes catégories de la nomenclature ICPE[8] relevant des régimes de l'enregistrement, de la déclaration et de l'autorisation. Prescriptions générales applicables aux installations relevant du régime de l'enregistrement :
[8] ICPE : Installations classées pour la protection de l'environnement. Prescriptions générales applicables aux installations classées soumises à déclaration :
Prescriptions générales applicables aux installations classées soumises à autorisation :
|
| Informations complémentaires |
Le dichlorométhane (DCM) fait partie de la famille des composés organiques halogénés volatils (COHV) et des hydrocarbures aliphatiques halogénés1. C’est un liquide incolore très volatil. Il est insoluble dans l’eau et miscible avec la plupart des solvants organiques. Il dissout des produits comme des graisses, huiles ou résines (INRS, 2014). Son caractère volatil et sa capacité à dissoudre de nombreux composés organiques font du DCM un solvant idéal pour de nombreux procédés chimiques. [1] http://www.csst.qc.ca/prevention/reptox/pages/fiche-complete.aspx?no_produit=2899 |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
Au début des années 2000 en Europe le DCM était fabriqué par 6 sociétés : Arkema, Dow Europe, Ercros, Ineos Chlor, LII Europe et Solvay (ECSA, 2007).
Deux sites de production ont été identifiés en France en 2015 :
- Solvay à Tavaux avec une capacité de production de chlorométhanes de 50.000 t.an-1[12] ,
- Kem One à Lavéra avec une capacité de production de chlorométhanes de 130.000 t.an-1, selon ce producteur il s'agit de la plus grande unité de production de chlorométhanes en Europe continentale[13] . Kem One produit 4 types de chlorométhanes, dont le DCM, largement employé comme intermédiaire dans le secteur pharmaceutique, la chimie industrielle et la chimie fine.
Les quantités de dichlorométhane produites par des industriels français ayant répondu à notre enquête sont confidentielles.
En Europe :
- Solvay (Inovyn) dispose d'un site de production à Rosignano en Italie avec une capacité de production de chlorométhanes de 28.000 t.an-1 [14] ,
- DOW produit du DCM dans son usine à Stade en Allemagne, pour l'utilisation par exemple dans la fabrication d'aliments et de boissons, de cosmétiques, de produits pharmaceutiques (DOW, non daté).
- Akzo Nobel produit également du DCM en Allemagne.
- INEOS Chlorvynils a une unité de production au Royaume-Unis.
Selon les informations d'un industriel il ne reste actuellement que ces 4 producteurs de DCM en Europe, qui font partie de l'Association européenne des solvants chlorés (ECSA).
Les sociétés enregistrées (producteurs et importateurs/distributeurs) en Europe selon l'ECHA[15] sont les suivantes, situées en Allemagne, au Royaume Uni, en France, en Italie et en Finlande :
- Akzo Nobel Industrial Chemicals GmbH, Ibbenbüren, Germany
- DOW DEUTSCHLAND ANLAGENGESELLSCHAFT mbH, Schwalbach, Germany
[12] http://www.solvay.fr/fr/implantations/tavaux/index.html
[13] http://www.kemone.com/fr/Produits-et-marches/Produits/Chlorochimie/Chloromethanes
[14] http://www.societechimiquedefrance.fr/extras/Donnees/mine/soch/cadsoch.htm
[15] http://apps.echa.europa.eu/registered/data/dossiers
- INOVYN Chlorvinyls Limited, Runcorn Cheshire, United Kingdom
- INOVYN France S.A.S., Paris, France
- INOVYN Produzione Italia S.R.L., Livorno, Italy
- Kem One, LYON, France
- SIGMA-ALDRICH CHIMIE, Saint Quentin Fallavier, France
- Sigma-Aldrich Company Limited, Gillingham, United Kingdom
- Sigma-Aldrich Laborchemikalien GmbH, Seelze, Germany
- Sigma-Aldrich Logistik GmbH, Steinheim, Germany
- SpetsInterProject, Espoo, Finland
Selon le site de l'ECHA entre 100.000 et 1.000.000 tonnes de DCM sont produites en Europe par an. Selon nos informations, la production actuelle de DCM en Europe s'élèverait plutôt à plusieurs centaines de kilotonnes. Euro Chlor (2013) indique pour l'année 2012 des ventes de DCM en Europe de 104,5 kt.
En réponse à notre enquête l'ECSA (European Chlorinated Solvent Association) a fourni les volumes de vente de DCM en France entre 2010 et 2014 (Tableau 4).
Tableau 4 : Volumes de vente de DCM en France, en tonnes
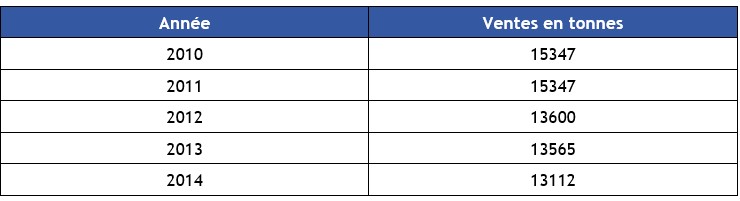
La mise sur le marché du DCM comme solvant chloré a baissé de 60% entre 1988 et 2012 en France (CITEPA, 2014 ; cf. Figure 1). Selon INERIS (2006), en France, 30.000 tonnes de DCM ont été mises sur le marché en 2002.
Figure 1 : Quantités de solvants chlorés mis sur le marché (en vert : DCM, en bleu : TRI, en rouge PER), source : CITEPA, 2014
Procédés de production
FTE 2015 Importer
Le DCM est généralement produit avec d'autres chlorométhanes simultanément, sur la base de méthanol et de chlore, ou de méthane et de chlore (Euro Chlor, 1999 ; INERIS 2011, DOW, non daté) :
- Dans des procédés d'hydro-chloration, l'acide chlorhydrique réagit avec le méthanol à environ 350 °C et forme du chlorure de méthyle (chlorométhane), en présence d'un catalyseur (gel d'alumine, chlorure de zinc, chlorure de cuivre). Cette substance subit ensuite des processus de chloration thermiques, catalytiques ou par photolyse pour former des chlorométhanes plus lourds, dont du DCM. La société DOW précise que les produits de ce processus sont le DCM, le chloroforme et le tétrachlorure de carbone qui sont séparés par distillation.
- Le méthane est utilisé dans les procédés de chloration directe, soit thermique ou catalytique. Le DCM est ici produit en phase liquide à une température de 100 à 150 °C, sous pression, par distillation d'un mélange aqueux contenant du méthanol, de l'acide chlorhydrique et du chlorure de zinc. Ce processus génère également du chlorure d'hydrogène net.
Selon Euro Chlor (1999) le premier procédé est généralement préféré, sauf si des procédés utilisant du HCl, comme des productions de chlorure de vinyle, se trouvent à courte distance.
Noms commerciaux
FTE 2015 Importer
Le Tableau 5 liste les noms commerciaux de différents grades du DCM, ainsi que les régions des marchés où les différentes variantes sont utilisées et les domaines d'application de ces produits lorsque ces informations sont disponibles.
Tableau 5 : Noms du DCM, les régions d'utilisation et les domaines d'utilisations
Utilisations
Introduction (varitétés d'utilisations)
FTE 2015 Importer
Les marchés clé pour le DCM en 2005 en Europe étaient l'industrie pharmaceutique (le plus important), des applications de solvants, le décapage de peintures et les adhésifs (RPA, 2007). Le DCM a également été employé comme propulseur pour les aérosols, comme agent d'expansion pour les mousses polyuréthane et comme intermédiaire de synthèse du bromochlorométhane et autres substances chimiques. Il est également utilisé pour le nettoyage des métaux, l'extraction des graisses et des paraffines, dans la fabrication de films et de fibres cellulosiques, dans la fabrication de composants électroniques et en prothèse dentaire (INERIS, 2011).
Aujourd'hui, les utilisations les plus importantes se situent dans le traitement des surfaces, dans la chimie et dans la pharmacie. Le DCM est toujours commercialisé en Europe pour utilisation dans des aérosols, comme agent de dégraissage et de nettoyage de métaux et plastiques, comme solvant dans l'industrie pharmaceutique, comme agent d'expansion dans l'industrie du plastique et comme solvant d'extraction dans les laboratoires chimiques. En revanche, l'utilisation dans la formulation de décapants de peinture, de peintures et de colles et adhésifs a baissé. En effet, les restrictions qui s'appliquent au DCM concernent l'utilisation professionnelle et du consommateur. Par contre, elles ne concernent pas l'utilisation industrielle (Euro Chlor, 2013) et, effectivement, selon les informations d'un producteur, le DCM serait aujourd'hui essentiellement un solvant pour utilisation industrielle.
La répartition du DCM à travers différents secteurs et/ou utilisations en 2013 pour l'Europe a été fournie par l'ECSA. Selon l'expert ayant répondu à notre enquête cette répartition serait sensiblement la même pour 2014.
Tableau 6 : Répartition du DCM à travers différentes utilisations en 2013 pour l'Europe
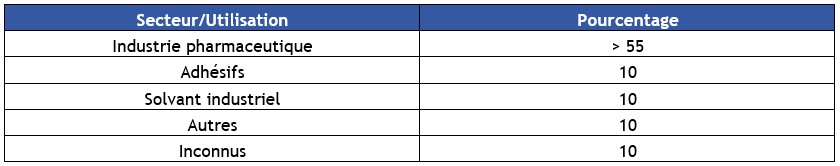
INDUSTRIE PHARMACEUTIQUE (SOLVANT D'EXTRACTION, DE PROCEDE, AGENT D'ENROBAGE)
Dans le domaine pharmaceutique, il y a trois emplois différents pour le DCM :
- solvant d'extraction ;
- solvant de procédé ;
- agent d'enrobage.
A la fin des années 1990, 30% de la consommation du DCM en Europe était utilisés comme solvant par l'industrie pharmaceutique (De Rooij et al., 2004).
Aujourd'hui, en Europe, DOW commercialise le DCM destiné à l'industrie pharmaceutique pour effectuer ces trois usages : solvant pour de procédé, la purification des substances synthétisées, et la formulation d'agents d'enrobage[16] .
Le DCM est également utilisé pour extraire les principes actifs de certaines plantes.
Le site internet de l'Agence de Protection de l'environnement Ecossaise (SEPA, non daté) indique parmi les utilisations les plus importantes du DCM la fabrication de stéroïdes, d'antibiotiques et de vitamines.
Un industriel implanté en France et produisant du DCM pour l'utilisation comme solvant d'extraction dans l'industrie pharmaceutique nous a indiqué que cette production, dans sa société, à été stable sur les dernières 10 années.
FABRICATION DU PLATRE MEDICAL
FTE 2015 Importer
Le DCM est également utilisé dans la formulation de plâtre médical et la fabrication de dispositifs médicaux comme des bandes plâtrées (BSNmedical, 2015). C'est le cas du site de Vibraye de BSN medical (cf. également les chapitres 0 et 5.1 ci-après relatifs aux émissions et aux mesures de réduction des émissions du DCM).La société BSN médical, par exemple, rapporte consommer presque 2 tonnes de DCM par an pour cet usage (BSNmedical, 2015).
SOLVANT D'EXTRACTION DANS LES COSMETIQUES
FTE 2015 Importer
En 2005, une société française spécialisée dans les techniques d'extraction pour l'agroalimentaire et les cosmétiques estimait que le DCM restait encore très largement utilisé dans ces deux domaines.
Une recherche actuelle dans différentes bases de données n'a pas donnée de résultats pour le DCM. Il s'agit des bases « noteo[17] » (qui informe sur la présence de substances "à risque" dans des produits du quotidien, dont l'hygiène et la beauté), « EWG Skin Deep[18] » (base de données des ingrédients de cosmétiques)[19] , « Leflacon[20] » (site d'information sur la composition de produits cosmétiques) et « Cosmetics Info[21] » (base de données portant sur la composition des produits cosmétiques).
De la même façon, aucune société ayant répondu à l'enquête menée par la FEBEA (Fédération des entreprises de la beauté) auprès de ses adhérents n'utilise le DCM dans les produits cosmétiques qu'elle fabrique. La FEBEA souligne que seul l'échelon européen permet d'appréhender la réalité du marché et que les réponses fournies par les entreprises françaises doivent être considérées comme parcellaires.
Toutefois, la société DOW qui produit des DCM pour le marché européen spécifie que ses produits sont adaptés pour l'utilisation dans la fabrication de cosmétiques (DOW, non daté).
[18] http://www.ewg.org/skindeep/
[19] Notre recherche sur ce site à donnée cinq ingrédients comme résultat 5 ingrédients, mais qui sembleraient plutôt contenir du méthylène ou de chlorure, mais pas de chlorure de méthylène.
PRODUITS CHIMIQUES
FTE 2015 Importer
Le DCM est utilisé comme agent de soufflage dans la fabrication des mousses polyuréthanes pour l'ameublement, pour les mousses de faible densité (16 à 20 kg.m-3) et dans les mousses rigides pour l'isolation thermique. Toujours dans le domaine des mousses polyuréthanes, c'est aussi un solvant de nettoyage du matériel d'injection du mélange polyols-isocyanates.
Selon les informations fournies par un producteur, l'utilisation du DCM comme agent moussant dans les mousses polyuréthanes utilisées dans des matelas et meubles s'est réduite de façon importante et représente aujourd'hui une utilisation marginale en Europe.
Pour la synthèse des polycarbonates, le dichlorométhane est en général le solvant dans lequel se déroule la polymérisation. Cette utilisation persiste à ce jour et continue d'être importante. L'enquête menée en 2005 indiquait qu'il pourrait être également utilisé pour la fabrication de résines de polybutadiène, un polymère produit en France par Lanxess (ex-Bayer Elastomères).
Le DCM est un solvant de nettoyage dans l'industrie du polyester en remplacement de l'acétone plus facilement inflammable. En 2005, une société fabricant des résines isocyanates en France a indiqué utiliser aussi le DCM comme solvant de nettoyage des réacteurs de polymérisation.
La bibliographie atteste de l'emploi du DCM dans la fabrication du triacétate de cellulose, mais cette activité semble ne plus exister en France (INERIS, 2006).
La société DOW commercialise actuellement en Europe un produit DCM destiné à la production de mousse uréthane expansive, le MECTHENE PU (cf. chapitre 2.1.3). Ce produit est utilisé comme agent gonflant dans la production de mousses polyuréthannes flexibles (par exemple mousses en bloc et moulées). Il contient un lubrifiant qui permet de doser avec les pompes à haute pression.
Un des producteurs de DCM en France ayant répondu à notre enquête sur les tendances de la production et l'utilisation nous a indiqué que sa production du DCM pour l'utilisation comme agent d'expansion des mousses polyuréthanes et comme solvant de polymérisation est restée stable sur les 10 dernières années.
Le DCM est également utilisé comme solvant de procédé en chimie fine. Cette utilisation est confirmée aussi bien sur le site internet d'ECSA[22] que par un des répondants à notre enquête auprès des producteurs du DCM en 2015. L'utilisation du DCM comme solvant de procédé est également citée comme une des principales utilisations dans ECSA (2007). Il serait ainsi employé dans la production d'esters de cellulose, de triacétate et d'esters de triacétate, qui comptaient, en 2007, pour 10% des intermédiaires de synthèse en Europe.
FORMULATION D'AEROSOLS (PROPULSEUR)
FTE 2015 Importer
Dans les aérosols le DCM est utilisé comme solvant, stabilisateur et séparateur et contribue à réduire l'inflammabilité de l'aérosol et sa pression de vapeur (cf. Oxychem, 2015[23]). En Europe, le DCM servant dans des aérosols est entre autre vendu par DOW. Le DCM fait partie des composés ayant remplacé les CFC dans cet usage. Il est en particulier conseillé comme remplaçant au 1,1,1-trichloroéthane (R140a) par l'US EPA.
Il semblerait que cet usage, qui était notamment intense par le passé pour les produits capillaires (laques en spray etc.), soit devenu très réduit. Il serait plutôt utilisé comme agent de formulation dans les insecticides en spray ou comme solvant dans des peintures aérosols (TNO, 1999). En 2005 cet usage était estimé représenter 10 % des usages totaux du DCM selon l'industrie.
Aujourd'hui, selon un producteur, le DCM serait rarement utilisé dans des aérosols dans des articles destinés aux consommateurs. Il peut encore être présent dans des utilisations professionnelles, mais pas de façon importante. L'utilisation du DCM dans des sprays capillaires serait marginale en Europe. Par ailleurs, selon la FEBEA (Fédération des Entreprises de la Beauté), il y aurait un projet d'interdiction de l'utilisation de DCM dans des produits spray dans les cosmétiques, qui se manifesterait en une modification de l'annexe III du Règlement cosmétiques. La date à laquelle cette interdiction peut intervenir n'est pas connue.
En Europe, la société DOW commercialise 2 types de DCM utilisables pour produire des aérosols[24] , le MECTHENE AS et le Methylene Chloride Technical Grade.
[23] Cf. également http://www.dow.com/gco/app/aerosol/
SOLVANT D'EXTRACTION DANS L'INDUSTRIE AGROALIMENTAIRE
FTE 2015 Importer
Le DCM est utilisé comme solvant d'extraction d'arômes naturels, dans le traitement du houblon et dans le traitement du cacao. D'autres utilisations sont la production de café décaféiné et l'extraction d'herbes (SKB, 2014). Enfin, selon INERIS (2006) le DCM est utilisé pour l'extraction de graisses et d'huiles essentielles et pour l'extraction de la chlorophylle et probablement également du carotène.
Au début des années 2000 il était encore utilisé en France par la société Hag Coffex à Strasbourg pour la décaféination du thé et du café. Il semblerait que la décaféination par le dichlorométhane ait été arrêtée en France avant 2006 (cf. Barret et al., 2007, Vincent, 2006). Selon le CSST[25] l'utilisation du DCM comme solvant d'extraction pour la production de café décaféiné tend à être remplacée par d'autres procédés.
Une recherche de la substance DCM dans la base de données « noteo » (qui informe sur la présence de substances dans des produits du quotidien, entre autres alimentation et boissons non alcoolisées) n'a pas donné de résultat.
[25] http://www.csst.qc.ca/prevention/reptox/pages/fiche-complete.aspx?no_produit=2899
COMPOSANT DE COLLES ET ADHESIFS
FTE 2015 Importer
Le dichlorométhane est aussi présent en tant que diluant dans des colles[26] utilisées notamment sur des polymères, comme le plexiglas, le PVC (colles PVC en plomberie) par exemple. C'est un composant des colles pour les mousses en matière plastique (polyuréthanes) (cf. par exemple ADEME, 2004). Au début des années 2000 cet usage aurait représenté 10 % des usages totaux du DCM selon l'industrie.
Actuellement, en Europe, DOW commercialise deux types de DCM qui sont utilisés comme solvants dans des adhésifs[27] . Il s'agit de dichlorométhane pur utilisable pour produire des revêtement et adhésifs. Selon DOW, le DCM est capable de solubiliser une grande variété d'ingrédients actifs thermoplastiques, il fournit une solvabilité supérieure pour une grande variété d'agents de pénétration, des activateurs, des épaississants et des agents retardateurs d'évaporation.
Le DCM est utilisé dans les colles destinées à coller des pièces en Altuglass ou Plexiglass (résines polyacryliques ou polyméthacryliques) destinées à fabriquer par exemple des enseignes (CRAMIF, 2011).
Selon une brochure de la société Abaqueplast[28] , un fournisseur de matériaux plastiques et de leurs colles, le DCM est utilisé pour coller des objets en altuglas coulé (vitrage, enseigne, pare-brise, hublots, mobilier, pare-douche, garde-corps, PLV, signalétique, écran anti-bruit, carter de protection, décoration, etc.), altuglas extrudé (mobilier urbain enseigne, signalétique, pare-douche, hublots, carters, industrie, tube de niveau, entretoise, carter, décoration, luminaires etc.) et en polystyrène choc (signalétique, maquette, PLV, thermoformage (sauf miroir), décoration).
L'utilisation du DCM dans des colles pour parquet est en train de disparaître selon des informations fournies par un producteur. Un des producteurs de DCM en France ayant répondu à notre enquête sur les tendances de la production et l'utilisation nous a indiqué que la production du DCM pour l'utilisation dans la formulation de colles et adhésifs s'est réduite sur les dernières 10 années.
[26] cf. https://www.olinchlorinatedorganics.com/applications/
[27] http://adhesives.specialchem.com/searchproducts?q=dichloromethane
DETACHANT INDUSTRIEL POUR TEXTILES
FTE 2015 Importer
Selon la bibliographie menée par INERIS (2006) cet emploi était signalé notamment par la société Dow Chemical, dans une fiche produit où apparaît le DCM, et il était confirmé par d'autres sources. Cela semblait cependant être un usage assez marginal du DCM. L'Union des Industries Textiles, en 2005, a confirmé cet usage du DCM, mais estimait qu'il était en baisse.
L'utilisation en tannerie ne semble pas documentée en France[29] mais le DCM a pu être identifié dans des effluents de tanneries en France au début des années 2000 (Action nationale de recherche et de réduction des rejets de substances dangereuses dans les eaux du MEDD).
L'arrêté du 05 décembre 2012 relatif à l'utilisation de solvants pour le nettoyage à sec et le traitement des textiles ou des vêtements interdit l'utilisation du DCM. Néanmoins, l'analyse de Fischer (2014e) sur les activités artisanales a retrouvé des concentrations de cette substance dans des prélèvements sur rejets des eaux de contacts (utilisées en circuit fermé) et quelques boues de 5 pressings et des rejets de 3 aquanettoyages. 3 sur 14 prélèvements ont montré des concentrations de DCM dans des eaux de contacts de pressings, ce qui indiquerait un emploi du DCM.
[29] Mais il est attesté indirectement un emploi en Allemagne dans le document BREF sur les tanneries.
NETTOYAGE DE SURFACES
FTE 2015 Importer
La Figure 2 indique une réduction très significative de l'usage de solvants chlorés dans le nettoyage de surfaces depuis 1988, dont, de façon moins prononcée, du DCM (CITEPA, 2014).
Figure 2 : Evolution des quantités de solvants chlorés utilisés dans le nettoyage de surfaces (en vert : DCM, en bleu : TRI, en rouge : PER)
Cet usage est confirmé par les rejets du secteur industriel (cf. chapitre 3.3 ).
Constituant de décapants de peintures et vernis
Dans le passé, le DCM était un des solvants les plus utilisés comme décapant de peinture et de vernis.
- Selon l'INRS, auparavant, 50% des décapants de peinture étant utilisés en France contenaient du chlorure de méthylène à des concentrations variant entre 52 to 95 % (Boust, 2007).
- Au début des années 2000 une application spécifique de solvants au dichlorométhane était le décapage de tôles, notamment de tôles automobiles présentant des défauts de peinture et qui devaient être décapées puis repeintes, ou le décapage des peintures d'avions.
- Selon Environnement Canada (2003) les décapants utilisés pour la rénovation de meubles contenaient de 70 à 90 % de dichlorométhane. Le DCM était considéré comme le principal composant d'à peu près tous les décapants pour meubles au Canada.
- Le DCM a aussi été identifié comme un des principaux constituants des produits de décapage pour façades, ces produits pouvant contenir entre 50 et 95% de dichlorométhane (Hédouin-Langlet, 2009).
L'utilisation du DCM comme décapant de peintures est aujourd'hui limitée par le Règlement REACH (Annexe XVII) à cause de ses effets nocifs sur la santé et l'environnement. Des décapants de peinture contenant du dichlorométhane à une concentration supérieure ou égale à 0,1 %, en poids ne doivent plus être sur le marché depuis 2011 et ne plus être utilisés par les professionnels depuis 2012. Cette règlementation vise donc une interdiction de l'utilisation du DCM comme décapant de peintures, tout en reconnaissant qu'il peut y avoir des contaminations par traces de ce solvant d'autres décapants.
Une recherche sur le site internet « batiproduit » ne propose que des produits sans DCM et le seul qui en comportait n'est plus commercialisé[30] . La baisse de l'utilisation du DCM dans la formulation de décapants de peintures et vernis a également été confirmée à l'INERIS par un producteur qui souhaite rester anonyme.
L'annexe XVII autorise cependant la mise sur le marché et l'usage du DCM dans des décapants pour peintures au sein d'installations industrielles, et cette utilisation persiste effectivement en pratique selon l'ECSA (European Chlorinated Solvents Association). DOW indique commercialiser en Europe deux types de DCM utilisables pour produire des décapants de peinture[31] . Par ailleurs, le Règlement REACH permet aux Etats Membres d'autoriser, par dérogation, la mise sur le marché et l'utilisation par des professionnels de décapants de peinture contenant du DCM en dehors d'installations industrielles et de ce type de décapants de peinture aux fins de l'approvisionnement de professionnels uniquement. Nous n'avons pas connaissance d'une telle dérogation ayant été accordée en France.
Concernant l'utilisation de cette substance dans les menuiseries, l'étude DCE & Artisanat (Fischer, 2014c) a analysé des rejets et déchets liquides d'entreprises artisanales par rapport aux substances prioritaires et dangereuses, dont le DCM. Dans les menuiseries, le DCM est susceptible d'être encore utilisé dans le décapage de peinture (malgré l'interdiction dans le cadre de REACH), la rénovation de meubles, la peinture et les colles. L'étude indique toutefois n'avoir retrouvé aucune concentration de DCM égale à ou supérieure à la limite de quantification qui est de 5 µg.l-1.
Cette étude a également mesuré les concentrations de DCM dans les rejets d'eaux usées de produits de traitement employés par 3 entreprises spécialisées dans le nettoyage de toiture et/ou le décapage de façades (Fischer, 2014d). La campagne de mesure a porté sur 4 prélèvements correspondant à la dilution de 4 produits commercialisés aux entreprises. Le DCM a été quantifié dans un des 4 prélèvements de produits de décapage de façade, à une concentration de 5 µg.l-1.
Enfin, l'étude a également détecté le DCM dans des effluents de 2 sur 4 garages de mécanique et de carrosserie de l'automobile étudiés (Fischer, 2014b). L'étude a trouvé des concentrations de DCM supérieures à la limite de quantification dans les déchets liquides des réservoirs de machines de nettoyage des pistolets de peinture (circuits fermés). Ces concentrations étaient de 5,7 et 150 µg.l-1 respectivement.
[30] http://www.batiproduits.com/moniteur/RechercheProduits.do
[31] http://www.dow.com/gco/app/paint/index.htm
Agent de nettoyage, de décapage et de dégraissage des métaux
Après avoir largement utilisé des CFC, suite à leur interdiction ces activités se sont tournées vers les solvants chlorés, dont le DCM, en raison de leur moindre risque d'inflammabilité et d'explosibilité des vapeurs par rapport aux solvants pétroliers. Ensuite il a été observé un retour vers les solvants pétroliers, notamment à travers des mélanges de solvants pétroliers et de solvants chlorés ou des mélanges d'éthers de glycols et de solvants chlorés, qui réduisent ces problèmes de sécurité associés mais ne l'éliminent pas. En effet, la présence de solvants chlorés dans le mélange avait pour objectif de monter le point éclair qui est alors masqué, mais lorsque le mélange s'appauvrit en solvant halogéné on retrouve une atmosphère explosive (INRS, 2001).
Les différents documents consultés lors de l'étude de 2005 (ADEME, CETIM,…) et les organismes industriels contactés donnaient globalement le sentiment que le DCM, qui était auparavant perçu comme une alternative au trichloréthylène, était assez largement utilisé, mais de plus en plus dans des conditions limitant l'exposition des travailleurs (machines fermées, …). L'évolution vers les solvants non-halogénés restait encore largement à poursuivre (INERIS, 2006).
Le nettoyage et le dégraissage des métaux reste une activité importante et le DCM est notamment utilisé dans le domaine de la réparation d'automobiles mais également dans de nombreux processus de production d'industries de fabrication et d'assemblage d'éléments en métal (aéronautique, automobile, électronique, chemin de fer[32]. Selon DOW, le DCM est adapté au nettoyage d'interrupteurs thermiques, de thermomètres et d'autres parties sensibles à la température[33]. En Europe, cette société commercialise deux DCM pour des applications de dégraissage[34].
L'ECSA confirme l'utilisation du DCM pour le nettoyage des métaux[35] . L'étude DCE & Artisanat (Fischer, 2014a) pour le carénage à sec, lors de mesures ponctuelles sur les rejets de trois chantiers, n'a pas trouvé des quantités de DCM égales ou supérieures à la limite de quantification (5 µg.l-1) dans les rejets dans le réseau ni dans ceux des bacs à trempage de moteurs (dessalage de moteurs), ni ceux des lavages de coque de bateaux.
Un producteur qui a souhaité rester anonyme a indiqué que sa production du DCM pour l'utilisation de nettoyage et de dégraissage de métaux était en réduction.
On peut citer comme usages spécifiques du DCM dans ce domaine le nettoyage/décapage de pièces automobiles (joints d'arbres de transmission, plaquettes de frein, embrayage).
[32] https://www.olinchlorinatedorganics.com/applications/
[33] http://www.dow.com/gco/app/metal/solvent.htm
[34] http://www.dow.com/gco/app/metal/index.htm
[35] http://www.chlorinated-solvents.eu/toolbox/step-2.asp?s=1&a=1
Nettoyage/décapage/dégraissage de plastiques
Les solvants halogénés sont en général moins adaptés pour les matériaux plastiques que pour les métaux. Cependant, il existe des cas où les solvants halogénés sont adaptés (phénoplastes, aminoplastes, polyoxyméthylène) et où le DCM pourrait éventuellement être employé. Mais il s'agit d'un usage probablement marginal par rapport au cas des métaux (CETIM, 1998).
Un producteur nous a indiqué que la part de sa production de DCM pour l'utilisation de nettoyage et de dégraissage de plastiques a été stable sur les dernières 10 années, sans pour autant révéler le pourcentage de cette utilisation dans la totalité de sa production de DCM.
FLUIDE REFRIGERANT
FTE 2015 Importer
Des sources bibliographiques mentionnent l'usage du DCM pour la fabrication et des applications de climatisation et réfrigération à cause de ses propriétés physiques et thermodynamiques[36] . Toutefois, cet emploi n'a pas été confirmé par l'Association française du froid.
La société DOW produit du DCM destiné à la production d'hydrofluorocarbures (HCFC) qui remplaçaient les CFC (chlorofluorocarbones) entre autre employés pour la réfrigération et l'air conditionné. Cependant étant eux-mêmes nocifs pour la couche d'ozone, l'utilisation des HCFC tend à disparaître pour ces utilisations. Le Règlement (CE) No 2037/2000 impose en effet la réduction successive de l'utilisation HCFC pour les installations existantes et nouvelles à l'horizon 2015.
L'ECSA confirme l'utilisation du DCM dans des fluides réfrigérants[37] mais selon une source industrielle que nous avons contactée cette utilisation serait peu importante.
[36] https://www.olinchlorinatedorganics.com/applications/
[37] http://www.chlorinated-solvents.eu/toolbox/step-2.asp?s=1&a=1
DEVELOPPEMENT PHOTOGRAPHIQUE
FTE 2015 Importer
Selon la société DOW le DCM serait utilisé dans la fabrication de film photographique[38] . Le site de la société OLIN[39] confirme la vente de DCM pour cette utilisation sur le marché européen[40] . Cette utilisation a également été confirmée par un des producteurs européens de DCM interrogés. Il est toutefois imaginable que cette utilisation soit aujourd'hui faible du fait de l'emploi des techniques numériques.
[38] http://www.dow.com/gco/app/chemical/index.htm
[39] Impliquée dans l'industrie du chlore et de la soude et distributeur de produits chimiques. Société américaine.
LABORATOIRES D'ANALYSES CHIMIQUES
FTE 2015 Importer
Le DCM est un solvant d'élution pour colonnes chromatographiques et un solvant d'extraction pour l'extraction liquide-liquide (LLE), l'extraction sur phase liquide (SPE) et l'extraction par solvant pressurisée (ASE). L'utilisation de plusieurs tonnes par an pour un laboratoire de recherche de la taille de l'INERIS est possible. Les quantités peuvent être très largement supérieures pour des laboratoires travaillant avec le DCM en routine.
Un des producteurs français de DCM ayant répondu à notre enquête sur les tendances de la production et l'utilisation du DCM nous a indiqué que sa production pour l'utilisation comme solvant d'extraction par des laboratoires d'analyses chimiques est restée stable sur les 10 dernières années. Cette stabilité a été confirmée par un fournisseur et par un utilisateur de cette substance dans un laboratoire de l'INERIS. Selon un autre contact industriel, en termes de quantités, il s'agit toutefois d'une utilisation peu importante du DCM.
PRODUITS PHYTOSANITAIRES ET ADJUVANT DE FONGICIDES (INTERMEDIAIRE DE SYNTHESE)
FTE 2015 Importer
Le DCM peut être utilisé comme intermédiaire de synthèses chimiques dans l'industrie phytosanitaire. Lors de l'enquête menée par INERIS (2006), d'après la base de données « e-phy[41] » (le catalogue des produits phytopharmaceutiques et de leurs usages des matières fertilisantes et des supports de culture homologués en France) du Ministère de l'Agriculture, le DCM était présent dans un adjuvant pour une bouillie fongicide et insecticide. Cependant, en 2015, la base de données « e-phy » indique que l'utilisation du DCM comme substance active dans les phytosanitaires n'est pas autorisée en France et cette substance ne fait pas non plus partie de la liste des adjuvants autorisés.
L'utilisation sur le marché européen du DCM pour des produits agricoles est confirmée sur le site d'Olin[42] et l'utilisation dans les phytosanitaires pour les particuliers l'est également sur le site internet d'ECSA (European chlorinated solvents association). Dans les deux cas, aucune information spécifique à la France n'a été trouvée.
FORMULATION DE PEINTURES
FTE 2015 Importer
En 2005, le DCM était également présent dans certaines peintures, encres ou vernis en tant que solvant/diluant (et était distribué comme tel par la société UNIVAR en France et une entreprise française du secteur confirmait son emploi). Cela aurait représenté environ 20 % des usages selon l'industrie (INERIS, 2006).
Toutefois, la société DOW ne commercialise pas en Europe du DCM pour produire des peintures (uniquement aux Etats-Unis). Par ailleurs, un des industriels contactés dans notre enquête en 2015 sur les tendances de la production et de l'utilisation du DCM par différents secteurs indique une réduction dans la production de DCM pour l'usage dans la formulation des peintures sur les 10 dernières années.
Enfin, l'étude DCE & Artisanat qui a étudié la présence du DCM entre autres au sein des rejets de 6 entreprises de peinture en bâtiment employant des peintures en phase aqueuse autant qu'en phase solvantée (Ficher, 2014e), n'a pas mesuré de concentration égale ou supérieure à la limite de quantification.
Néanmoins, des peintures contenant du DCM sont listées comme utilisations actuelles dans les trois domaines, industriel, professionnel et du consommateur sur le site d'ECSA.
INDUSTRIE PETROLIERE
FTE 2015 Importer
L'enquête menée par INERIS (2006) indiquait que le DCM était vendu dans ce domaine par le distributeur UNIVAR. Dans l'enquête menée en 2015 nous n'avons pas pu obtenir des réponses confirmant cette utilisation. Toutefois, la Décision d'exécution 2014/738/UE (MTD) pour le raffinage de pétrole et de gaz, mentionne le DCM comme solvant dans les procédés de production d'huile de base (cf. section 5.1).
VERRERIE
FTE 2015 Importer
L'enquête menée par INERIS (2006) a établi que le DCM peut être utilisé comme produit de nettoyage, mais les quantités en jeu en France étaient, selon la profession, très faibles par rapport aux autres usages (de l'ordre d'une tonne par an). Aucune information concernant cette utilisation n'a été trouvée dans l'enquête menée en 2015.
PRODUCTION DE SILICONE
FTE 2015 Importer
Le site internet de la société Olin indique que le DCM est utilisé dans la production de chlorosilanes qui forment une substance intermédiaire dans la fabrication de silicone[43] . Cette utilisation n'a pas pu être confirmée pour la France. Le site internet d'ECSA liste l'utilisation du DCM dans des agents d'étanchéité pour les trois domaines industriel, professionnel et du consommateur.
Synthèse des utilisations
FTE 2015 Importer
En Europe le DCM est principalement utilisé par l'industrie comme solvant d'extraction ou de synthèse dans l'industrie pharmaceutique et cosmétique, comme solvant de synthèse dans la chimie fine, par exemple pour la production de produits chimiques agricoles, et dans la production des polycarbonates. Des utilisations peu importantes concernent l'utilisation comme agent moussant dans la production des mousses polyuréthanes pour matelas et meubles, comme solvant d'extraction d'arômes, d'huiles et graisses végétales et animales, la décaféination de thé ou café, le dégraissage de cuir, comme agent de dégraissage et de nettoyage de métaux et comme solvant d'extraction dans les laboratoires chimiques. Il est utilisé à travers des produits pour des professionnels et des consommateurs, comme des adhésifs et décapants d'adhésifs, des sprays insecticides, des peintures et des produits de nettoyage et de dégraissage.
Son utilisation dans la formulation de décapants de peintures et vernis à usage industriel, dans la formulation de peintures et de colles et adhésifs et, dans un moindre degré, comme agent de nettoyage ou dégraissage des métaux semble baisser depuis quelques années. Selon les informations disponibles via l'ECSA et des interlocuteurs industriels, le DCM reste important dans des applications industrielles, mais perd de l'importance dans les utilisations professionnelles et du consommateur. Dans les applications industrielles, cette substance est généralement utilisée dans des systèmes fermés, lorsque c'est possible.
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Les océans sont identifiés comme source naturelle du DCM dans certaines publications. Le dichlorométhane serait ainsi à 25% d'origine naturelle, et 200 000 tonnes/an seraient émises par les océans (Aquascop/AESN, 2008 ; Khalil et al., 1999). Cette source naturelle d'émissions atmosphériques de DCM est donc importante et, la durée de vie du DCM dans l'atmosphère pouvant se compter en mois, elle pourra contribuer à expliquer un bruit de fond dans les hydro systèmes non soumis à une pression industrielle.
Sources non-intentionelles
FTE 2015 Importer
Dans le passé le DCM a été détecté dans des effluents de l'industrie papetière (Environnement Canada, 1993) et en Suède, mais cet usage ne semble pas confirmé. Néanmoins, le DCM a pu être quantifié dans les effluents d'une usine de pâte à papier en France dans le cadre de l'Action nationale de recherche et de réduction des rejets de substances dangereuses dans les eaux du Ministère de l'Environnement au début des années 2000. Aucune information plus récente n'est disponible. Il est ainsi possible que la présence de DCM dans des effluents de cette industrie soit liée à la formation non intentionnelle du fait d'emploi d'autres composés chlorés, et non à une utilisation intentionnelle.
Émissions atmosphériques
FTE 2015 Importer
L'évolution des émissions industrielles émises dans l'air et déclarées dans BDREP est présentée dans la Figure 5. Elle indique une réduction de 46 % entre 2008 et 2010, mais une stabilité depuis 2010.
Figure 5 : Evolution des émissions de DCM dans l'air de 2008 à 2014, en tonnes
Selon BDREP en 2014, en France, 796 tonnes de DCM ont été émises dans l'atmosphère. Les secteurs et installations à la source de ces émissions sont indiqués dans la Figure 6 et le Tableau 7 respectivement.
Figure 6 : Emissions industrielles de DCM dans l'air rapportées en 2014 pour la France
Ces émissions se répartissent à travers les différents secteurs comme suit :
- Industrie pharmaceutique : 374 tonnes,
- Industrie chimique : 180 tonnes,
- Fabrication de textiles : 87 tonnes,
- Métallurgie : 71 tonnes,
- Fabrication de produits en caoutchouc et en plastique : 24 tonnes,
- Fabrication de machines et équipements n.c.a. : 23 tonnes et
- Fabrication de produits métalliques, à l'exception des machines et des équipements : 6 tonnes.
Le Tableau 7 liste les installations ayant déclaré les émissions dans l'air au dessus du seuil règlementaire.
Tableau 7 : Installations ayant rapporté des émissions égal ou supérieur à 1 tonne de DCM dans l'air en 2014 pour la France
En 2008, des émissions dans l'air s'élevant à 1 468 tonnes étaient rapportées (Figure 7) dans BDREP.
Figure 7 : Emissions industrielles de DCM dans l'air rapportées en 2008 pour la France
Sur les dernières 8 années on note une restructuration des sources les plus importantes. Alors qu'en 2008 les émissions déclarées dans BDREP étaient dominées par le secteur de la chimie, suivie par la fabrication des produits métalliques et des produits en caoutchouc et en plastique, c'est l'industrie pharmaceutique qui domine les émissions en 2014, suivi par la chimie et la fabrication de textiles. Les secteurs dans lesquels les émissions déclarées ont été réduites le plus, en valeurs absolues, entre 2008 et 2014 sont l'industrie chimique, la fabrication de produits métalliques, la fabrication de produits en caoutchouc et en plastique et les industries alimentaires. Les émissions rapportées ont augmenté le plus dans les secteurs pharmacie, métallurgie et fabrication de textiles.
Émissions vers les eaux
FTE 2015 Importer
L'évolution des émissions dans l'eau directe rapportées dans BDREP entre 2008 et 2014 est indiquée dans la Figure 8. Sur cette période les émissions dans l'eau restent fluctuantes. En 2014, elles représentent une baisse de 19% par rapport à 2008.
Figure 8 : Evolution des émissions de DCM dans l'eau directe de 2008 à 2014 en tonnes
Selon BDREP en 2014, en France, 4 tonnes de DCM ont été émises dans l'eau directement. Les secteurs et installations à la source de ces émissions sont indiqués dans la Figure 9 et le Tableau 8 respectivement.
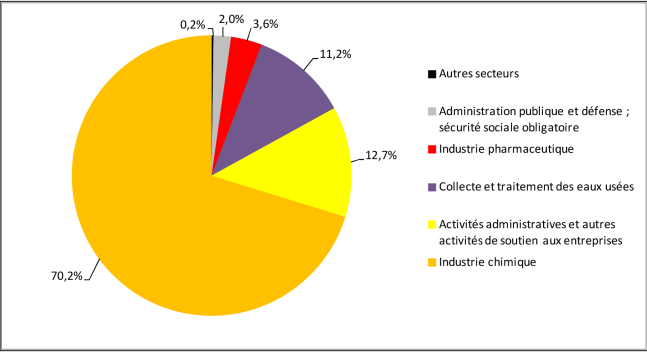
Figure 9 : Emissions directes de DCM dans l'eau rapportées en 2014 pour la France
En 2014, la répartition des émissions dans l'eau par secteurs est la suivante :
- Industrie chimique : 2,8 tonnes,
- Activités administratives et autres activités de soutien aux entreprises : 0,5 tonnes,
- Collecte et traitement des eaux usées : 0,4 tonnes,
- Industrie pharmaceutique : 0,14 tonnes et
- Administration publique et défense ; sécurité sociale obligatoire : 0,08 tonnes.
Tableau 8 : Installations ayant rapporté des émissions de DCM dans l'eau en 2014 pour la France
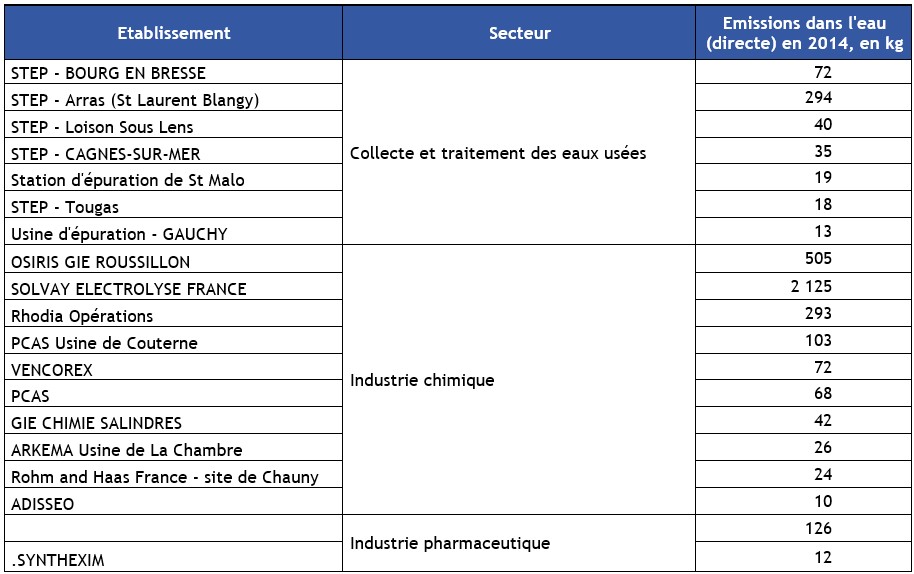
Le DCM a en effet pu être quantifié dans les effluents d'établissements du secteur traitement et revêtement de surfaces dans le cadre de l'Action nationale de recherche et de réduction des rejets de substances dangereuses dans l'eau (RSDE) en France. Ce secteur est actuellement responsable de 7% des flux de DCM et il y a 4 sites dont les flux dépassent le seuil de programme d'action (100 g.l-1).
En 2008, les émissions dans l'eau déclarées s'élevaient à 4,9 tonnes (Figure 10). La large majorité de ces émissions provenait d'activités non productives (non précisées mais il pourrait s'agir de nettoyage), suivies par l'industrie chimique, l'industrie pharmaceutique et les industries alimentaires. Sur la période investiguée, les émissions rapportées ont été réduites de façon significative (sauf dans l'industrie chimique et dans la collecte et le traitement des eaux usées).
On notera le faible nombre de stations d'épuration urbaines rapportant des émissions, alors que les émissions de DCM devraient a priori les concerner de façon plus générale sur le territoire. A l'échelle du bassin Seine-Normandie, les émissions totales de DCM vers l'eau sont presque équitablement réparties entre émissions industrielles et émissions des stations d'épuration urbaines (AESN, 2014).
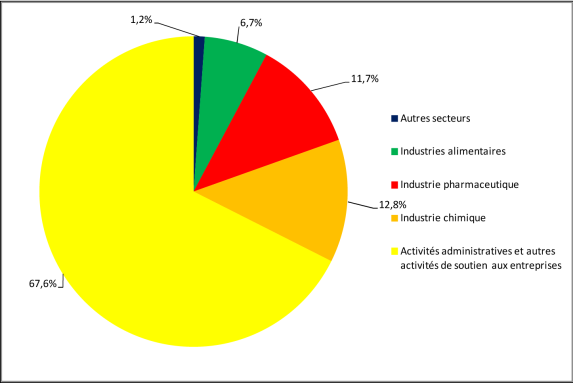
Figure 10 : Emissions de DCM dans l'eau rapportées en 2008 pour la France
L'industrie de la chimie compte par ailleurs pour 89% des flux du DCM mesurés dans le cadre de l'action RSDE. Il y a 15 sites dont les flux dépassent le seuil de déclenchement d'un programme d'action (100 g.l-1).
Émissions vers les sols
FTE 2015 Importer
Sur la période analysée, BDREP ne recense pas d'émissions de DCM vers les sols qui dépasseraient les seuils de déclaration.
Rejets dans l'environnement
FTE 2015 Importer
Les rejets de DCM ont lieu très principalement à l'atmosphère et dans une bien moindre mesure vers les milieux aquatiques.
Les rejets atmosphériques totaux de DCM en France ont été estimés en 1990 par McCulloch et al. à 33 000 tonnes (sur un total mondial de 582 000 tonnes). Nous nous focalisons dans la suite sur les émissions industrielles atmosphériques et sur les émissions vers les milieux aquatiques.
EMISSIONS INDUSTRIELLES EN EUROPE
Une des sources utilisables pour identifier les émissions industrielles de DCM des pays européens est le registre européen des rejets et des transferts de polluants (European Pollutant Release and Transfer Register, E-PRTR[44]). Les seuils de rejets dans l'air, dans l'eau et dans le sol à partir desquels une déclaration annuelle des émissions et des transferts de polluants et de déchets est obligatoire auprès de ce registre sont définis dans le Règlement (CE) No 166/2006 du Parlement européen et du Conseil. Pour le DCM ces seuils sont les suivants :
- dans l'air : 1000 kg.an-1,
- dans l'eau : 10 kg.an-1,
- dans le sol : 10 kg.an-1.
En France, la base de données BDREP, gérée par l'INERIS, recense les déclarations d'émissions des établissements, et alimente l'E-PRTR. BDREP recense davantage d'émissions qu'E-PRTR, certains industriels déclarant leurs émissions de manière volontaire bien qu'elles restent en-dessous des seuils de rapportage obligatoire. Néanmoins, toutes les émissions ne sont pas déclarées.
Les données pour l'Europe présentées ci-après proviennent de l'E-PRTR, celles pour la France de BDREP. Concernant l'analyse pour la France, dans les graphiques présentant les séries de données par milieu et la répartition des émissions par secteur, la totalité des émissions déclarées est prise en compte. Dans les tableaux listant les sociétés ayant déclaré leurs émissions, la présentation est limitée aux établissements ayant déclaré des émissions égales ou supérieures aux seuils.
Les émissions vers l'air (Figure 3) et vers l'eau (Figure 4) des pays européens rapportées dans E-PRTR ont été analysées par Lescot & Le-Gall (2015). Les deux graphiques indiquent que la France est le deuxième plus gros émetteur de DCM en Europe vers l'air et le plus grand émetteur vers l'eau. Seule la République Tchèque rapporte des émissions vers le sol.
Les émissions vers l'eau prennent non seulement les rejets industriels mais aussi les rejets des stations d'épuration urbaines.
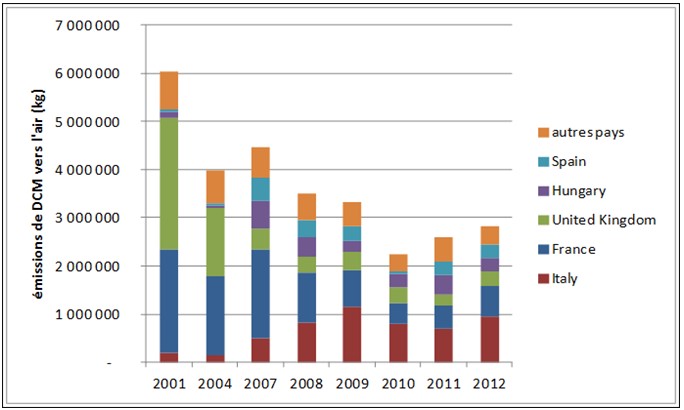
Figure 3 : Évolution des émissions de DCM vers l'air (kg) des pays européens les plus émetteurs
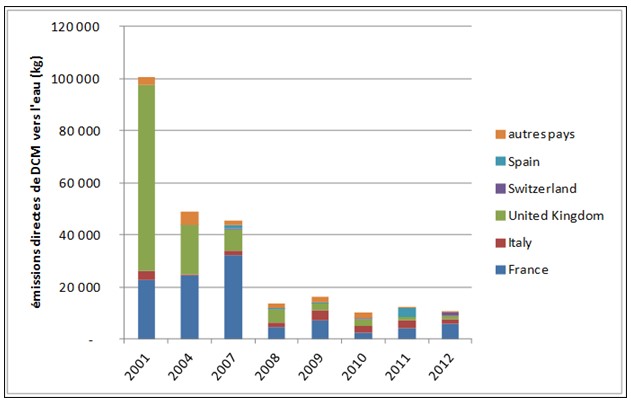
Figure 4 : Évolution des émissions directes de DCM vers l'eau (kg) des pays européens les plus émetteurs
Pollutions historiques et accidentelles
FTE 2015 Importer
Les émissions accidentelles de DCM répertoriées dans BDREP entre 2008 et 2014 sont indiquées dans les Tableau 9 et Tableau 10.
Tableau 9 : Emissions accidentelles dans l'air, en kg

Tableau 10 : Emissions accidentelles dans l'eau, en kg

Par rapport aux émissions non accidentelles rapportées pour les mêmes années ces rejets accidentels restent donc faibles.
Nous n'avons pas d'informations sur des pollutions historiques.
Présence environnementale
Atmosphère
FTE 2015 Importer
Aucune information récente n'a été trouvée sur la quantification de la présence du DCM dans l'atmosphère.
Aquatique
FTE 2015 Importer
Des ordres de grandeur des concentrations de DCM trouvées dans le milieu aquatique du bassin Seine-Normandie ont été rapportées dans Aquascop/AESN (2008), qui indique que cette substance serait présente significativement dans plus de 50 % des rejets des établissements du secteur d'activités "chimie organique de synthèse" sur 340 établissements du bassin Seine-Normandie en 2006. Il s'agit de mesures effectuées entre 2001 et 2005 dans l'eau douce et l'eau estuarienne.
Eau douce :
- Orge à Sermaise : 10 µg.L-1
- Essonne à Corbeil : 10 à 14 µg.L-1
- Yonne à Montereau : 10 à 20 µg.L-1
- Seine à Poses : 4,81 µg.L-1
- Eau estuarienne :
- Seine à La Bouille : 15 µg.L-1
- Seine à Caudebec-en-Caux : 6,13 µg.L-1
Terrestre
FTE 2015 Importer
Aucune information récente n'a été trouvée sur la quantification de la présence du DCM dans le milieu terrestre.
Perspectives de réduction
Réduction des rejets
FTE 2015 Importer
TECHNOLOGIES POUR ELIMINER LE DCM DES REJETS GAZEUX
Les procédés pour éliminer le DCM d'effluents gazeux sont l'incinération, l'adsorption ou encore le dépoussiéreur par voie humide. Selon Bailon et al. (2009) le traitement en phase aqueuse (biofiltre, bioréacteur) peut servir comme d'alternative. Ces alternatives sont présentées comme les moins couteuses, notamment lorsqu'il s'agit d'éliminer des concentrations de DCM relativement faibles de flux de gaz importants. Les deux bioprocédés présentés par Bailon et al. (2009) se basent sur l'activité de biocatalyseurs opérant à température ambiante. Yu et al. (2006) rapportent une efficacité de réduction du DCM de 85% en utilisant des biofiltres.
Le document BREF (2003) relatif au traitement des effluents dans la chimie mentionne la pertinence du biotrickling comme technique déjà utilisée et capable de réduire les émissions du DCM également la condensation cryogénique.
TECHNOLOGIES POUR ELIMINER LE DCM DE L'EAU SOUTERRAINE ET LES EAUX USEES
Shestakova et Sillanpää (2013) comparent différentes technologies par rapport à leur capacité d'éliminer le DCM des eaux souterraines et des eaux usées :
- lavage d'air (air stripping) – élimination de DCM jusqu'à 95%,
- adsorption – élimination de DCM jusqu'à 90% -99%,
- remédiation biologique (traitement aérobie) -élimination de DCM jusqu'à 99,9%,
- ozonation – dégradation seulement de 18% de DCM,
- oxydation par persulfate – dégradation maximale de DCM de 19% seulement,
- réduction chimique et catalyse hétérogène – – élimination de DCM jusqu'à 90% -99%,
- photo dégradation et photo catalyse – décomposition complète du DCM
- cavitation acoustique – élimination de DCM jusqu'à 90%,
- Radiolyse – élimination de DCM jusqu'à 92%,
- Réaction photo-fenton – décomposition complète du DCM.
Selon ces auteurs, la méthodologie de traitement la mieux adaptée dépend des propriétés physiques et chimiques de l'eau. Le traitement des eaux se fait généralement en plusieurs étapes utilisant différentes techniques, ce qui augmente leur efficacité. La technologie de stripping est relativement peu coûteuse, celle d'adsorption relativement chère.
Le document BREF (2003) relatif au traitement des effluents dans la chimie confirme la pertinence du procédé du stripping.
Lors de l'enquête menée par INERIS (2006), un des fabricants français de DCM a indiqué utiliser un stripping pour traiter ses effluents aqueux.
INDUSTRIE PHARMACEUTIQUE (SOLVANT D'EXTRACTION, DE PROCEDE, AGENT D'ENROBAGE)
Un « Guide technique de mise en place de schémas de maîtrise des émissions dans le secteur de la chimie pharmaceutique » a été développé en 2003 (SICOS, 2003). Concernant la réduction des émissions de DCM spécifiquement, ce guide cite la mise en place de la condensation cryogénique.
Le DCM est utilisé comme solvant d'extraction dans la fabrication d'huiles essentielles. Le site Substitution CMR[45] suggère de remplacer l'extraction par distillation par un procédé d'extraction par CO2 supercritique.
PRODUCTION DU PLATRE MEDICAL
Les techniques de recyclage du DCM sur le site de production de Vibraye de bandes plâtrées sont décrites dans BSNmedical (2015) où la quantité de solvants évaporés atteint 700 kg/h. Sur les 1780 tonnes de DCM consommées par an, 1250 tonnes sont recyclées par des techniques de condensation (traitement de l'air sur 4 condenseurs à tubes de cuivre refroidis par de l'eau), 510 tonnes par des techniques d'adsorption (traitement des rejets diffus non condensables par adsorption sur 2 lits de charbons actifs puis désorption à la vapeur) et 2,5 tonnes par des techniques de stripage (traitement de la vapeur condensée à contre courant à l'air sur 3 colonnes d'échange air-eau ; l'air chargé de solvant est réintroduit dans l'adsorption). Le site est actuellement à la recherche d'une technologie alternative à l'usage du DCM, ce qui fait objet d'un projet de recherche CORTEA[46] .
[46] Projet CORTEA 2013 – SUBSOLVPOP.
SOLVANT D'EXTRACTION DANS L'INDUSTRIE AGROALIMENTAIRE
Selon INERIS (2006) une technique qui pourrait remplacer l'utilisation du DCM dans l'industrie agroalimentaire pourrait être la séparation par membranes, techniques mûres d'un point de vue technologique à l'échelle industrielle, mais dont le domaine d'application restera, selon un expert, restreint pour des raisons physiques. Par ailleurs le BREF « Food, Drink and Milk Industries » (BREF, 2006) indique que le CO2 super critique peut être utilisé dans l'extraction du café.
COMPOSANT DE COLLES ET ADHESIFS
Afin de réduire les émissions de DCM émises de colles à base de DCM CRAMIF (2011)[47] propose un captage au plus près, en conduisant l'encollage dans une cabine à aspiration frontale, utilisant un captage enveloppant.
NETTOYAGE DE SURFACES
Dans le nettoyage de surface, la réduction de l'utilisation des solvants chlorés (cf. Figure 2), s'est faite par des actions à la source, comme l'indique le CITEPA (2014). Cette source cite les mesures suivantes de réduction des émissions :
- modification des opérations de nettoyage,
- suppression de certaines opérations de nettoyage
- l'usage de machines à dégraisser hermétiques,
- l'application d'autres procédés de nettoyage déjà existants comme les procédés lessiviels,
- le développement d'autres procédés tels que le CO2 supercritique, la glace carbonique, la vapeur sèche, l'usage d'agro produits et le nettoyage biologique.
Technologies alternatives pour le décapage de peintures et vernis
Dans le domaine du décapage des peintures, par exemple dans le domaine du ravalement de bâtiments, il existe des procédés physiques alternatifs (INERIS, 2006 ; Hédouin-Langlet, 2009) :
- Décapage physique (sablage).
- Décapage à la glace carbonique (décapage cryogénique).
- Décapage mécanique (gommage, ponçage).
- Décapage par laser.
- Décapage thermique.
Ces technologies ne présentent pas que des avantages.
Ainsi le traitement par projection d'éléments abrasifs (décapage physique) risque d'endommager la surface et d'en altérer les propriétés. De plus, le retraitement, souvent indispensable, de ces éléments abrasifs plus ou moins contaminés, entraîne des surcoûts importants. Selon une entreprise spécialisée, il constitue une alternative au décapage chimique de pièces métalliques, sauf dans le cas de pièces très fragiles. Son coût pourrait être supérieur à celui du décapage chimique. Cette entreprise ne l'a pas appliqué pour du bois mais pense que cela est facilement réalisable et qu'une demande existe. D'après une société spécialisée en décapage thermique, celui-ci ne peut s'appliquer que pour des pièces métalliques supportant une chaleur très élevée et donc son domaine d'application est très restreint, en comparaison du décapage chimique. L'impossibilité d'utiliser le décapage thermique par exemple pour décaper du bois et son coût de fonctionnement plus élevé que celui du décapage chimique est confirmé par AtoutSanté[48] . Une autre société réalisant les deux types de décapage indique également que le décapage thermique pose parfois des problèmes lorsqu'il déforme des pièces qui doivent ensuite être repeintes par des robots. Par contre, cette même société signale connaître une autre entreprise qui a opté pour une nouvelle usine entièrement dédiée au décapage thermique. L'ECSA estime que ces techniques alternatives posent également des risques pour le travailleur (dégagement de fumées et poussières de peintures pouvant être toxiques).
Selon AtoutSanté le décapage cryogénique, technique qui utilise le froid, peut s'utiliser sur tous types de surface. Il s'agit d'un décapage par pulvérisation, au moyen d'une lance, de micro-pellets de glace carbonique et c'est la différence de température entre la pièce et la glace carbonique qui décape. Le procédé est par contre très couteux.
Par ailleurs, le site Substitution CMR[49] mentionne comme procédé alternatif pour le décapage dans la fabrication de meubles, le procédé d'aérogommage.
Le CSST[50] confirme que le DCM tend à disparaitre dans son utilisation comme solvant de décapage de peinture et vernis et qu'il tend à être remplacé par des procédés à chaud sans solvant ou d'autres procédés chimiques.
[49] http://www.substitution-cmr.fr/
[50] http://www.csst.qc.ca/prevention/reptox/pages/fiche-complete.aspx?no_produit=2899
Agent de nettoyage, de décapage et de dégraissage des métaux
INERIS (2006) rapporte qu'à défaut d'utiliser un autre solvant, il est possible de grandement diminuer les émissions atmosphériques de DCM, en utilisant :
- à chaud : des machines fermées avec systèmes de condensation par groupes frigorifiques, et traitement au CAG des évents vers l'extérieur ;
- à froid : des capots enveloppants et des couvercles.
En 2003 l'ADEME (2003) considérait que dans la mesure où l'industrie française du traitement de surface avait encore peu adopté ces techniques et utilise des machines encore assez anciennes pour plus de la moitié d'entre elles, il pourrait y avoir une forte marge de progression dans ce domaine.
Une autre technologie alternative pour les secteurs du dégraissage des métaux et de l'agroalimentaire et encore peu adoptée en France en 2005 consiste en l'emploi du CO2 supercritique. Le problème est un coût d'investissement très élevé.
L'INERIS (2006) indique que pour les rejets liquides de bains solvantés, il faut privilégier le recyclage et la régénération in situ des solvants, et un traitement et une élimination des bains usagés par des sociétés spécialisées performantes en matière environnementales. Certains fournisseurs de solvants proposent également à leurs clients un service de régénération. Ce service est aussi proposé par des sociétés spécialisées.
La minimisation des rejets de DCM dans les milieux aquatiques est donc aussi un enjeu au niveau des sociétés spécialisées dans le traitement et la récupération des bains de solvants chlorés, bien que les émissions de polluants liées à ces activités soient surtout des émissions atmosphériques. Le DCM fait partie des solvants couramment recyclés en Europe.
L'ADEME (2013) rapporte une expérience de remplacement du DCM comme solvant de nettoyage d'équipements en inox par un procédé mécanique dans les Etablissements Trakett (secteur de revêtement sur support plastique, revêtement des sols). Le DCM était utilisé pour nettoyer les tabliers métalliques inox dans les fours servant à réaliser les revêtements PVC. Afin que le produit n'accroche pas, le tablier est revêtu de silicone. Durant les opérations de nettoyage les tabliers étaient dégraissés par pulvérisation de DCM. L'opération de brossage et de dégraissage des tabliers avec des solvants a été remplacée par un nettoyage mécanique avec de l'eau à haute pression (1800 bar) combiné au brossage. Ce procédé a permis la suppression totale du DCM et de ces émissions, ainsi que des économies, alors que la consommation d'eau est augmentée.
LABORATOIRES D'ANALYSES CHIMIQUES
La récupération des effluents contenant du DCM par les laboratoires d'analyses chimiques et leur traitement dans des centres spécialisés correspond à la pratique courante des laboratoires en France.
FORMULATION DE PEINTURES
Sans mentionner spécifiquement le DCM, le CITEPA (2014) cite comme mesures de réduction des émissions de composés organiques volatils (et donc non spécifiquement du DCM) :
- la réduction des teneurs en solvant des peintures bâtiment et grand public, réalisée par un usage accru de peinture en phase aqueuse (contenant entre 3 et 10 % de solvant selon les peintures à l'eau contre 34 à 50% pour les peintures solvantées) et de peinture à plus haut extrait sec,
- l'évolution vers des produits en en poudre et des produits à séchage Ultra-Violet,
- la modification des systèmes d'application de peintures industrielles pour obtenir des taux de transfert de peinture sur le support plus élevés,
La même source constate que dans le secteur de la construction automobile des substitutions de produits ont été réalisées (les peintures en phase aqueuse sont très utilisées pour les apprêts et pour certaines laques), la teneur en solvant des peintures a été réduite, des techniques d'application très performantes en termes de coefficient de transfert sont utilisées, la robotisation a également contribué à réduire les émissions.
RAFFINAGE DE PETROLE
Le document BREF (2015) définit les « meilleures techniques disponibles » (MTD) pour l'utilisation de solvants dans le secteur du raffinage de pétrole et de gaz. Parmi les techniques listées afin de réduire les émissions atmosphériques de COV figurent les mesures de récupération des vapeurs (par exemple via l'absorption, l'adsorption, la séparation membranaire du gaz …), la destruction des vapeurs (oxydation thermique ou catalytique), la mise en place de programmes de détection et réparation des fuites, la surveillance des émissions diffuses des COV. Le BREF traite également la question du DCM utilisé comme solvant dans les procédés de production d'huile de base. La MTD consiste en ce cas en une récupération des solvants dans une unité qui comprend une phase de distillation, où les solvants sont récupérés dans le flux d'huile, et une phase d'extraction (à la vapeur ou à l'aide d'un gaz inerte) dans une colonne de fractionnement.
Alternatives aux usages
ALTERNATIVES AUX USAGES DE DICHLOROMETHANE
FTE 2015 Importer
Les alternatives ont été classées par domaines d'applications. Toutefois, certaines d'entre elles, même si elles sont référencées pour un usage particulier, peuvent avoir un spectre d'applications large. Il s'agit par exemple du cas de certains éthers de glycol (certains produits DOWANOL sont par exemple spécifiés pour une vaste gamme d'application par le producteur).
INDUSTRIE PHARMACEUTIQUE (SOLVANT D'EXTRACTION, DE PROCEDE ET AGENT D'ENROBAGE)
Afin de substituer le DCM utilisé comme solvant d'extraction ou de synthèse dans la fabrication d'huiles essentielles, comme solvant de synthèse dans la fabrication de produits pharmaceutiques de base et solvant d'extraction pour la fabrication d'autres produits chimiques organiques de base, le site Substitution CMR[51] propose des substances présentées dans le Tableau 11.
Tableau 11 : Substituts au DCM dans l'industrie pharmaceutique
PRODUCTION DU PLATRE MEDICAL
Le plâtre médical peut être substitué par des bandes de résines sans plâtre.
SOLVANT D'EXTRACTION DANS LES COSMETIQUES
Les substituts au DCM utilisé comme solvant de synthèse dans la fabrication de parfums et de produits pour la toilette et proposés par le site Substitution CMR sont présentés dans le Tableau 12.
Tableau 12 : Substituts au DCM dans la fabrication de parfums et de produits pour la toilette
PRODUITS CHIMIQUES
L'ADEME et la DRIRE Alsace (2005) ont étudié des options de réduction de COV pour la société Carpenter Pur S.A. qui produit de la mousse polyuréthane souple pour des applications dans l'ameublement ou la literie et qui transforme également des matériaux alvéolaires pour des applications industrielles. La solution mise en place n'a pas entraîné de modification de procédé. Le DCM (l'agent d'expansion) a été remplacé par du dioxyde de carbone. Le CO2, liquide sous haute pression dans un mélange liquide, est déposé sur un tapis motorisé. La détente de ce gaz provoque une expansion du mélange pâteux permettant la formation d'une mousse. Alors que cette solution a réduit les émissions de DCM de l'entreprise, ses émissions de CO2 ont augmenté.
Le site Substitution CMR propose comme substituts du DCM utilisé comme agent moussant dans la fabrication d'autres équipements automobiles et dans la fabrication de matelas le diméthoxyméthane (CAS : 109-87-5, formule brute : C3H8O2). Cette substance est notifiée pour des effets de toxicité aigue catégorie 4 (donc nocif).
Les substituts au DCM comme solvant de synthèse et d'extraction dans la fabrication d'autres produits chimiques organiques de base présentés dans le Tableau 13 ont été proposés par le site Substitution CMR.
Tableau 13 : Substituts au DCM utilisé comme solvant de synthèse et d'extraction dans la fabrication d'autres produits chimiques organiques de base
SOLVANT D'EXTRACTION DANS L'INDUSTRIE AGROALIMENTAIRE
Le BREF (2006) indique que le CO2 super critique peut être utilisé dans l'extraction du café. INERIS (2006) rapporte que cet emploi était mis en œuvre en France de façon embryonnaire à cette époque. Le problème était un coût d'investissement très élevé qui ne pouvait être consenti, selon un expert d'une société française spécialisée dans les techniques d'extraction dans l'agroalimentaire, que pour de gros chiffres d'affaires (comme l'extraction de l'arôme du paprika, ou la phytothérapie – société Arkopharma). Dans l'agroalimentaire et les produits cosmétiques, cet expert pensait que le DCM ne pouvait pas être complètement remplacé. Le meilleur solvant de remplacement serait l'hexane. L'hexane est cependant classé R51/53, donc toxique pour les organismes aquatiques.
COMPOSANT DE COLLES ET ADHESIFS
La CRAMIF (2011)[52] propose la substitution de colles à base de DCM par des colles à base de méthacrylate de méthyle (CAS : 80-62-6).
La même source conseille, comme alternative aux colles à base de DCM, le remplacement du collage par du perçage et du vissage.
DETACHANT INDUSTRIEL POUR TEXTILES
Les substituts identifiés dans ce domaine figurent dans le Tableau 14.
Tableau 14 : Substituts au DCM utilisé comme détachant pour textiles
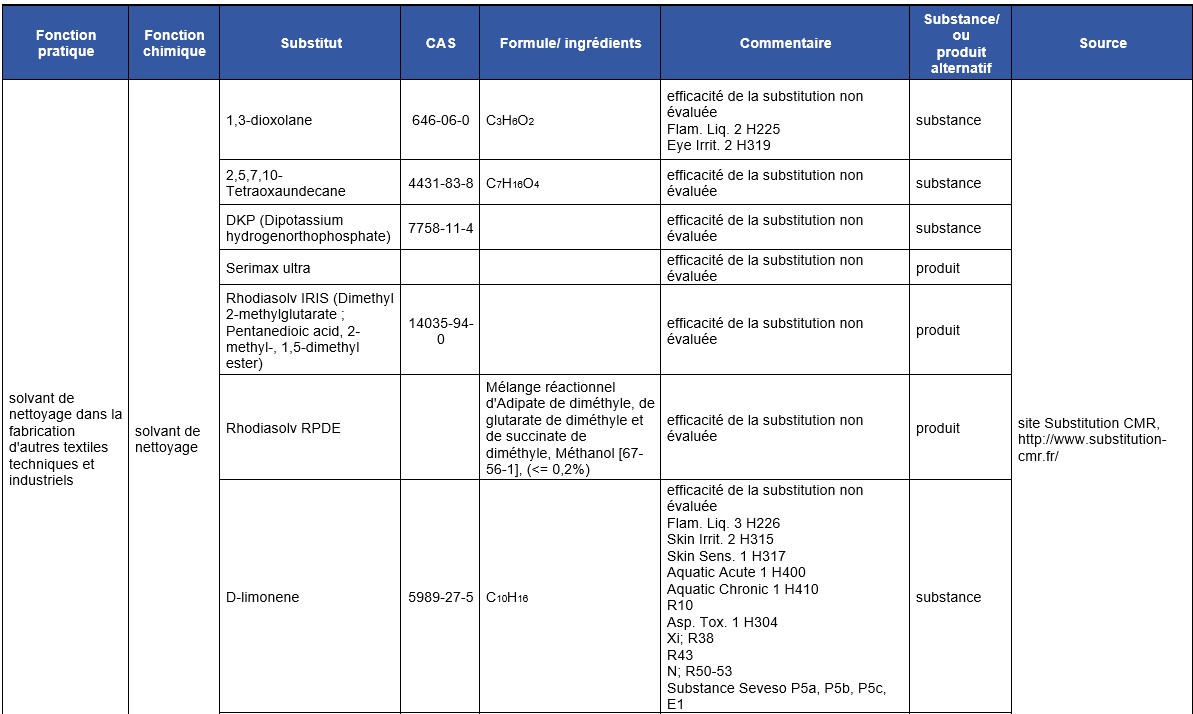

NETTOYAGE DE SURFACES
Constituant de décapants de peintures et vernis
La mise sur le marché et l'utilisation de décapants de peinture contenant du DCM par les consommateurs et professionnels sont aujourd'hui interdites par le Règlement REACH.
Le Tableau 15 résume les informations identifiées relatives aux des différents substituts au DCM dans le décapage de peintures. Les informations se basent sur les références Altnau (2007), Garnier (2009), Hédouin-Langlet (2009), Jacobs et al. (2015), une recherche sur les sites « Substitution CMR » et AtoutSanté[53] , des informations publiées par les sociétés Solvay/Rhodia[54] et Hicam[55] , et une source industrielle demandant l'anonymat.
Tableau 15 : Exemples de substituts à l'utilisation du DCM dans décapage de peintures
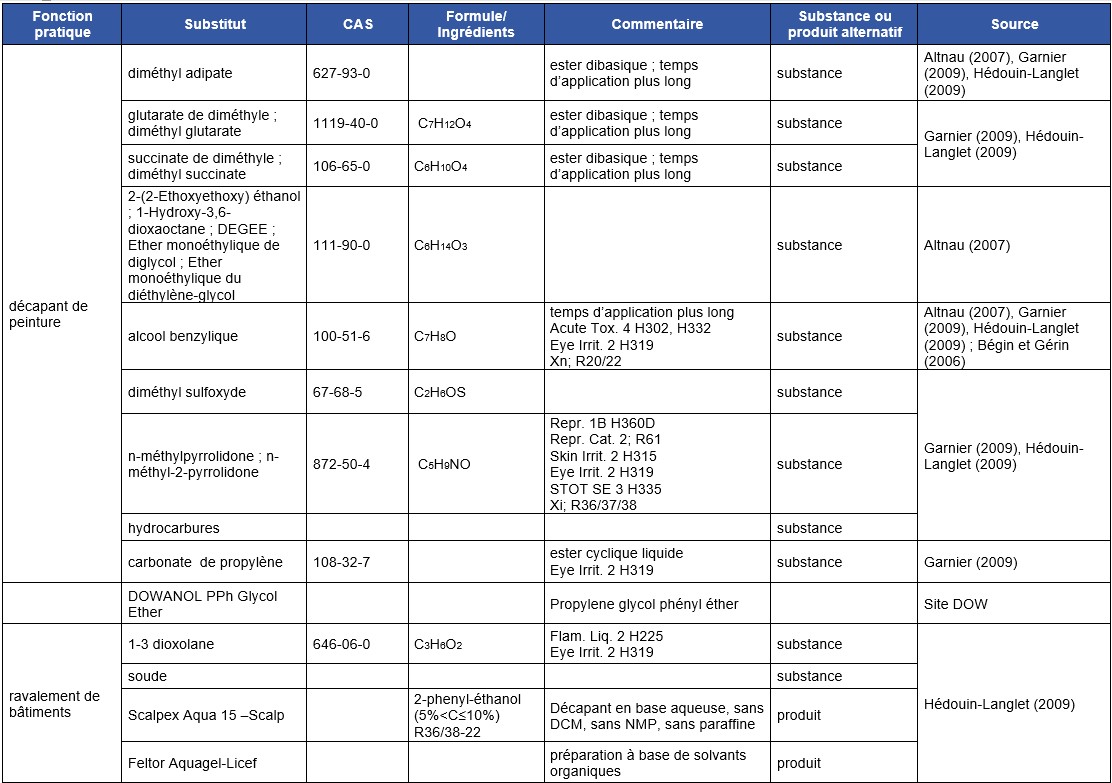
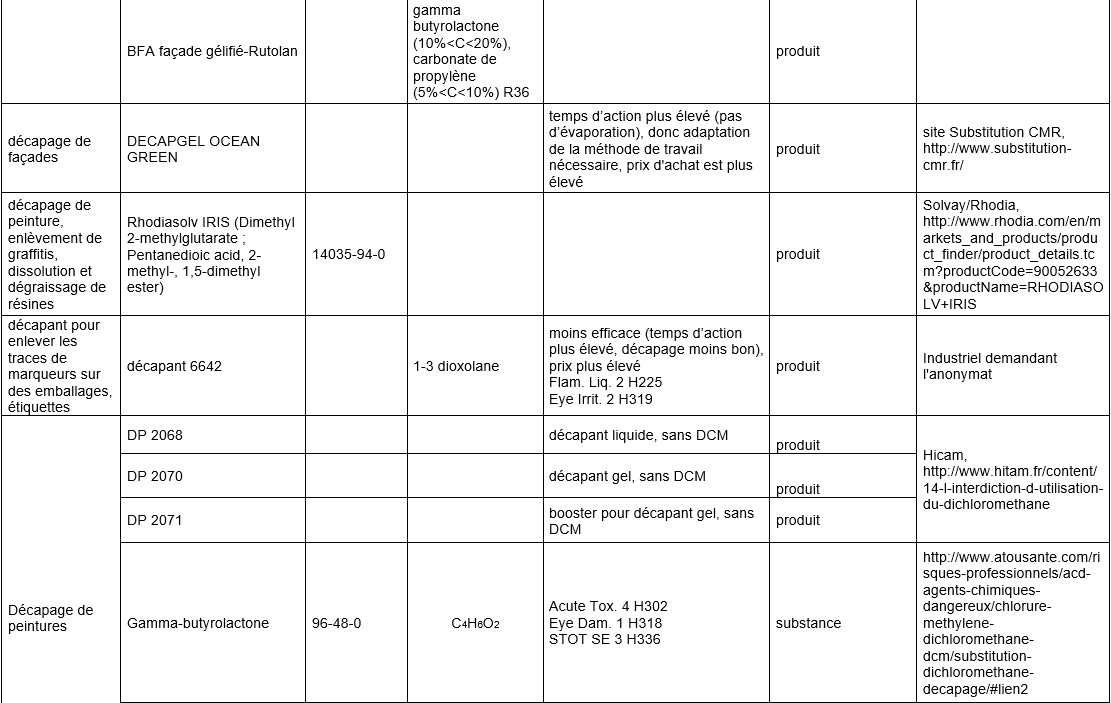
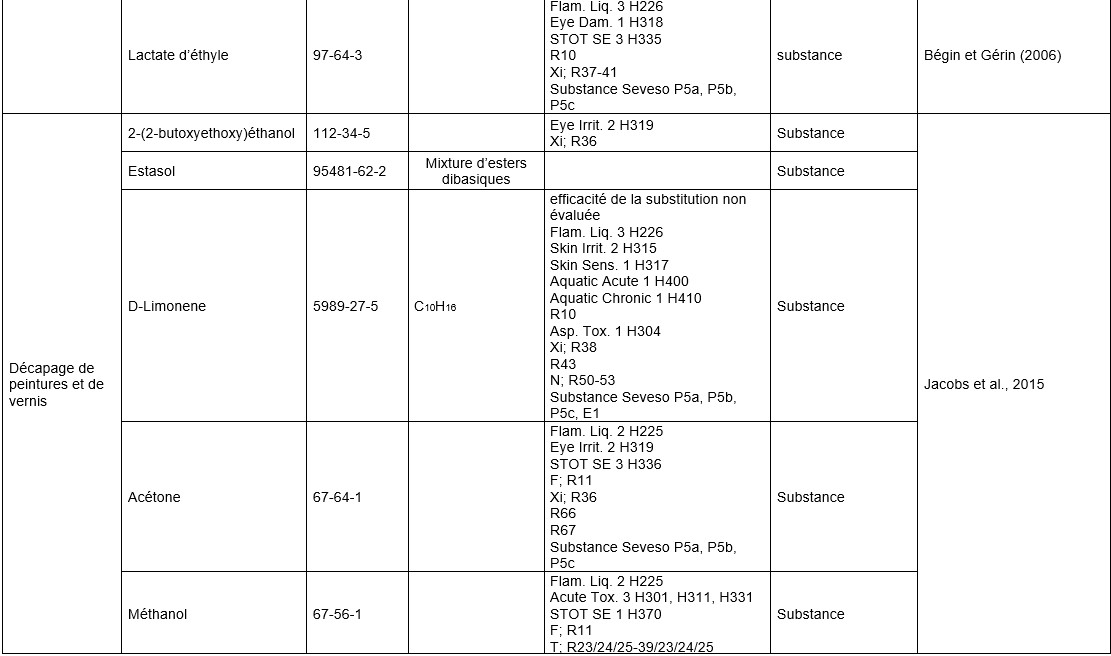
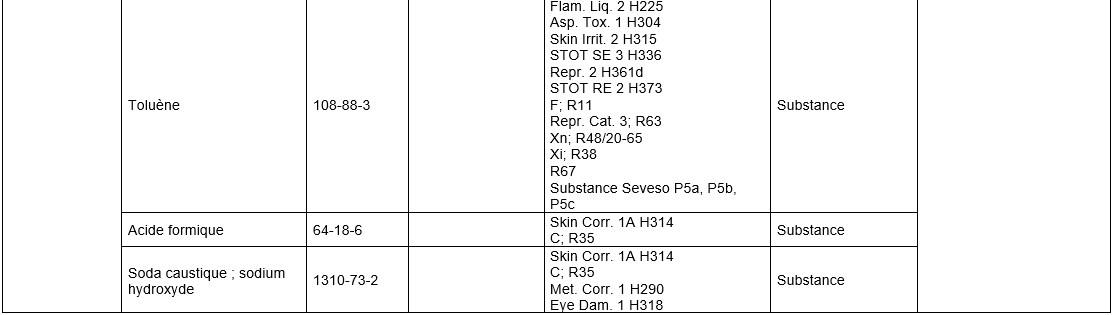
[55] http://www.hitam.fr/content/14-l-interdiction-d-utilisation-du-dichloromethane
Agent de nettoyage, de décapage et de dégraissage des métaux
Le Tableau 16 résume les informations recueillies sur les substituts du DCM utilisé comme agent de nettoyage, de décapage et de dégraissage des métaux. Ces informations se basent sur les sources bibliographiques suivantes : Solvay/Rhodia[56] , Solvay (2014), le site Substitution CMR, le site AtoutSanté et des informations obtenues par une entreprise souhaitant rester anonyme.
Tableau 16 : Substituts du DCM comme agent de nettoyage, de décapage et de dégraissage des métaux
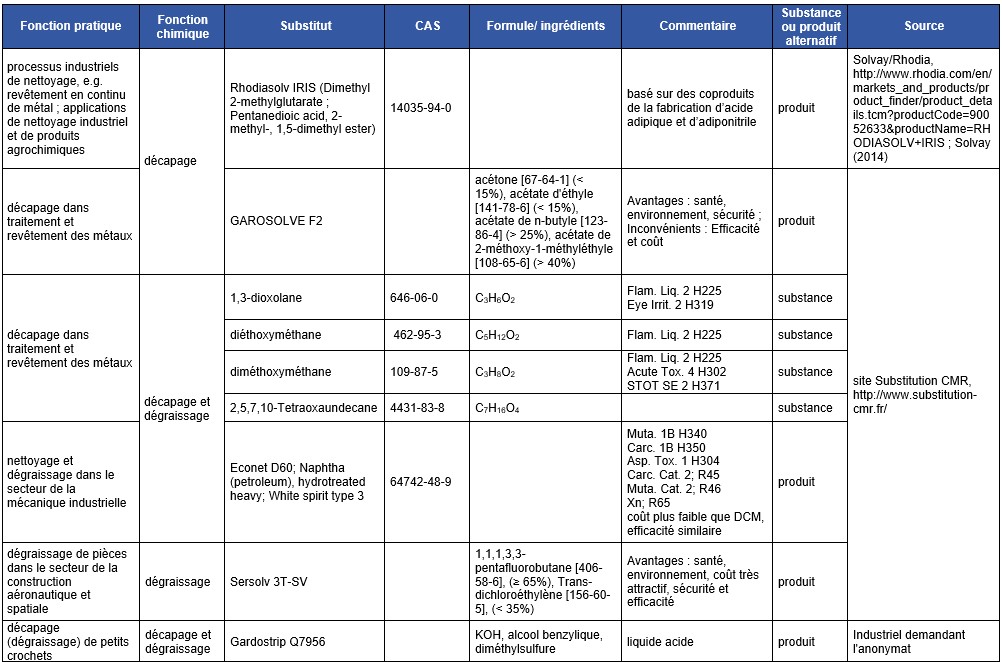
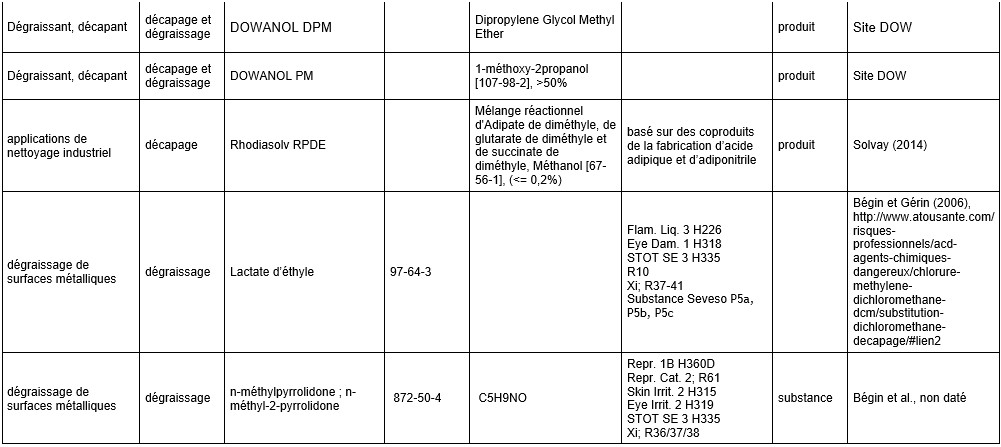
Nettoyage/décapage/dégraissage de plastiques
Un substitut du DCM pour le nettoyage, décapage et dégraissage des plastiques a été rapporté par Solvay/Rhodia[57] (cf. Tableau 17).
Tableau 17 : Substituts au DCM pour le nettoyage, décapage et dégraissage des plastiques
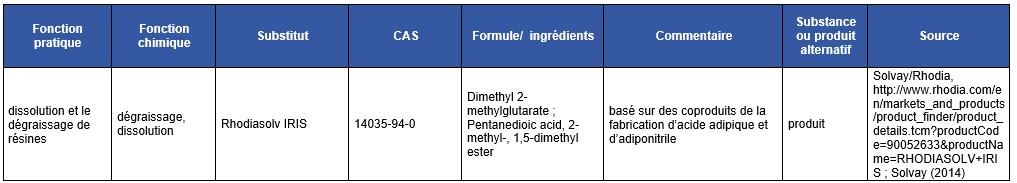
LABORATOIRES D'ANALYSES CHIMIQUES
Selon nos informations, aucune substitution du DCM n'est actuellement envisagée par les laboratoires d'analyses chimiques (cf. section 2.2.12).
PRODUITS PHYTOSANITAIRES ET ADJUVANT DE FONGICIDES (INTERMEDIAIRE DE SYNTHESE)
Des substituts au DCM utilisé comme solvant de synthèse dans la fabrication de pesticides et d'autres produits agrochimiques proposés par le site Substitution CMR et ceux évoqués par Solvay (2014) comme substituts aux solvants à base de DCM dans des formulations de produits agrochimiques sont recensés dans le Tableau 18.
Tableau 18 : Substituts au DCM utilisé pour des produits phytosanitaires
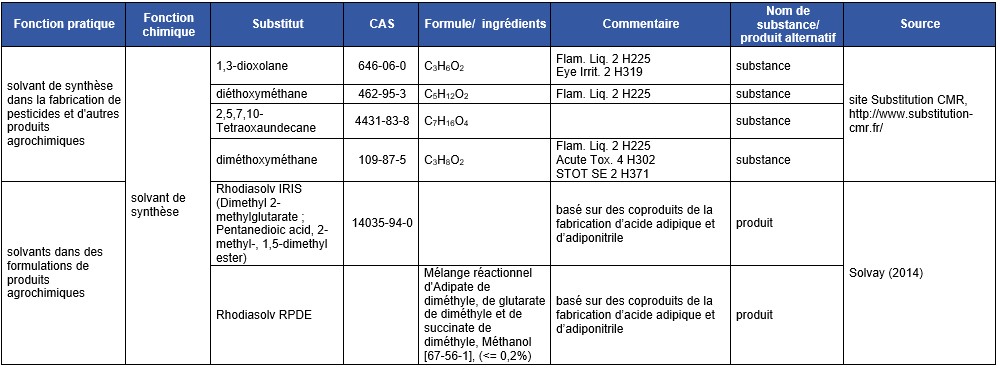
RESUME DES SUBSTITUTS
Le Tableau 19 résume les différents substituts du DCM évoqués ci-dessus et les présente avec les secteurs d'utilisation et la fonction des solvants. Cette vue d'ensemble indique qu'il y a un certain nombre de substituts polyvalents adaptés à un grand nombre d'utilisations. C'est notamment les cas des substances 1-3 dioxolane, 2,5,7,10-tetraoxaundecane, diéthoxyméthane et diméthoxyméthane, et à un moindre degré des produits comme Rhodiasolv IRIS et Rhodiasolv RPDE. Contrairement au DCM, ces substances et produits ne sont pas classés CMR.
Les autres substituts proposés semblent être plutôt adaptés à des utilisations spécifiques. Ils concernent souvent le décapage de peinture, le décapage ou dégraissage des métaux ou plastiques et le nettoyage de textiles. Parmi ceux proposés pour utilisation dans des décapants de peinture, le n-méthylpyrrolidone est classé CMR et le 2-(2-Ethoxyethoxy) éthanol ainsi que le toluène comme pouvant avoir des effets toxiques sur la reproduction. Parmi les substituts proposés pour le décapage/dégraissage des métaux, l'Econet D60 est également classé CMR. Le D-Limonene, solvant de nettoyage pour textiles, est classé toxique pour l'environnement aquatique.
Tableau 19 : Résumé des substituts au DCM avec la fonction des solvants et leur secteur d'utilisation
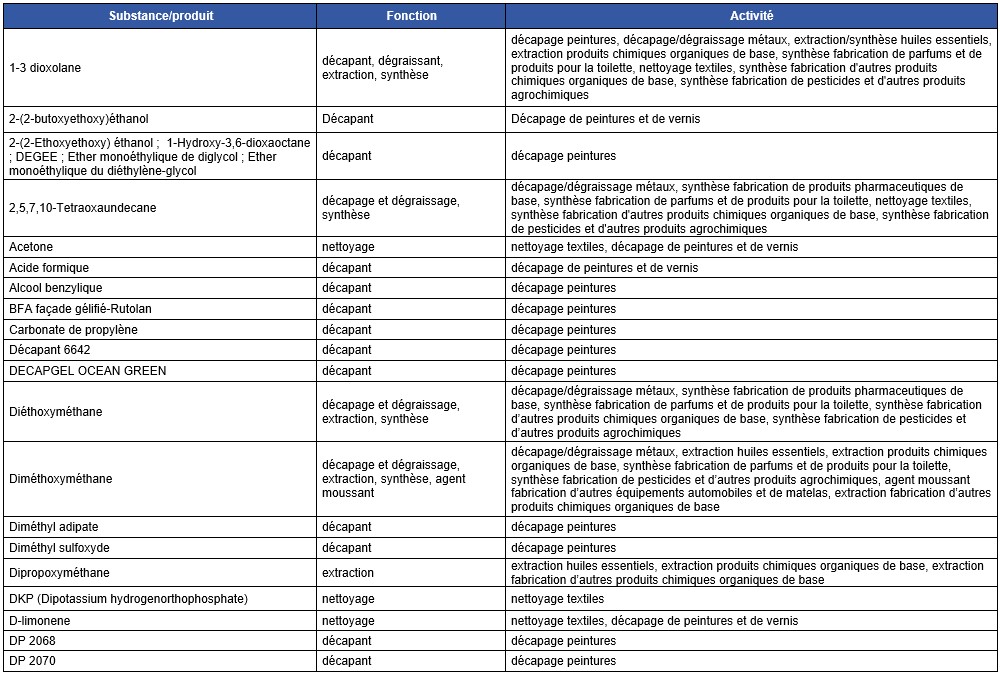
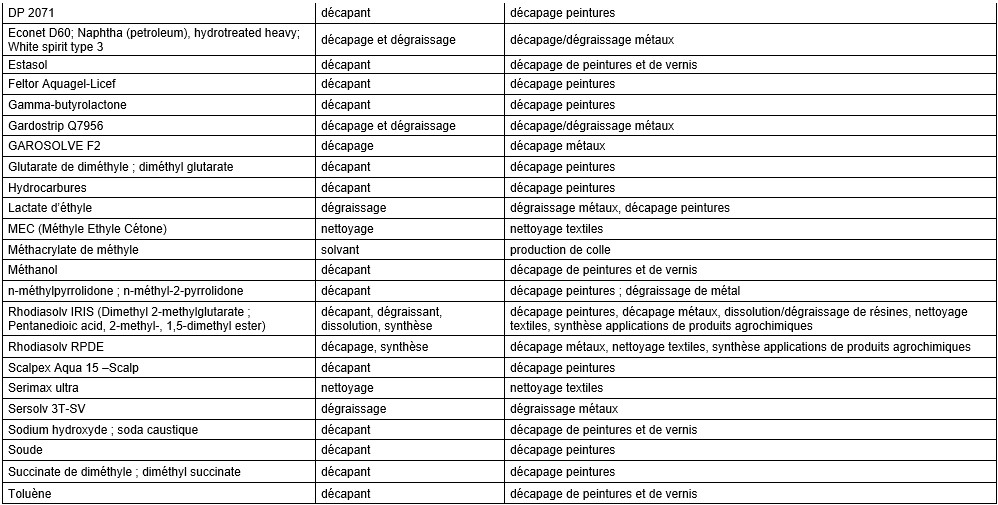
Coûts de la substitution
Concernant les coûts de substitution très peu d'informations sont disponibles via les sources les proposant. Les résultats d'une recherche de prix de vente sur le site de vente Alibaba[58] (cf. Tableau 20) ne peut que donner des indications, car la quantité minimale pour laquelle les prix sont affichés est variable entre les différentes substances de substitution. De plus les facteurs quantitatifs de substitution (c'est-à-dire la quantité d'un substitut nécessaire pour substituer une tonne de DCM) ne sont pas pris en compte.
Tableau 20 : Prix indicatifs des substances en US $/kg
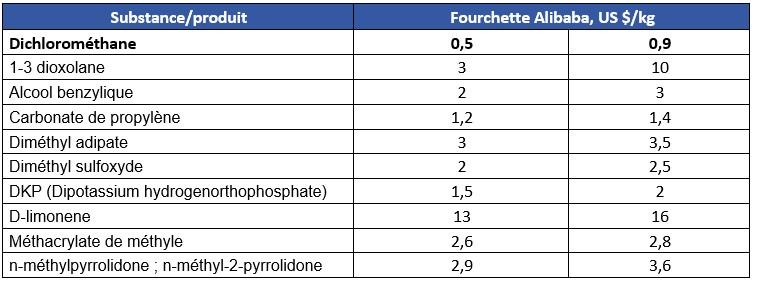
Il apparait néanmoins que les produits alternatifs sont, de façon générale, plus chers que le DCM. De plus les industriels indiquent souvent que des quantités supérieures doivent être employées ou que le temps de travail est augmenté.
Par ailleurs les technologies de dépollution des effluents industriels, et également des procédés alternatifs, supposent également des coûts d'investissement, et ne sont pas techniquement adaptées à toutes les situations.
Ces informations mériteraient d'être confirmées par une enquête plus approfondie du fait des nombreux secteurs d'utilisation du DCM.
Conclusion
FTE 2015 Importer
Du fait qu'il est classé cancérigène pour l'homme, plusieurs législations en France et en Europe limitent le recours au DCM. Il fait partie des substances prioritaires de la Directive Cadre Eau, et des valeurs limites pour des rejets de DCM dans l'environnement ont été définies pour différents secteurs et ses émissions dans l'air, l'eau et le sol, à partir de certains seuils, doivent être déclarées. La mise sur le marché et l'utilisation de décapants de peinture contenant du DCM sont interdits (sauf dérogations), l'utilisation du DCM dans des pressings l'est également. Les concentrations admises dans les produits cosmétiques et les denrées alimentaires sont limitées.
En Europe, le DCM est principalement utilisé par l'industrie comme solvant d'extraction ou de synthèse dans l'industrie pharmaceutique et cosmétique, comme solvant de synthèse dans la chimie fine, par exemple pour la production de produits chimiques agricoles, et dans la production des polycarbonates. Des utilisations moins importantes concernent l'utilisation comme agent moussant dans la production des mousses polyuréthanes pour matelas et meubles, comme solvant d'extraction d'arômes, d'huiles et graisse végétales et animales, dans la décaféination de thé ou café, dans le dégraissage de cuir, comme agent de dégraissage et de nettoyage de métaux et comme solvant d'extraction dans les laboratoires chimiques. Il est présent dans des produits utilisés par des professionnels et des consommateurs, notamment dans des adhésifs et décapants d'adhésifs, des sprays insecticides, des peintures et des produits de nettoyage et de dégraissage.
Son utilisation dans la formulation de décapants de peintures et vernis (interdite pour l'utilisation par les consommateurs et professionnels depuis 2012[59] mais non pour les industriels) semble baisser depuis quelques années, tout comme son utilisation dans la formulation de peintures et de colles et adhésifs et, à un moindre degré, comme agent de nettoyage ou dégraissage des métaux. Selon les informations disponibles via l'ECSA et des interlocuteurs industriels, le DCM reste important dans des applications industrielles (notamment fabrication de produits chimiques, généralement en système clos), mais perd de l'importance dans les produits pour professionnels et consommateurs.
Les émissions atmosphériques du DCM en France sont actuellement dominées par l'industrie pharmaceutique, la chimie, la fabrication de textiles et la métallurgie. Les industries chimique et pharmaceutique, ainsi que la collecte et le traitement des eaux usées sont responsables de la plus grande partie des émissions dans l'eau.
De nombreux substituts potentiels existent pour cette substance, et varient en fonction des utilisations. Certains de ces substituts paraissent relativement polyvalents et applicables à un grand nombre d'utilisations. C'est notamment les cas des substances 1-3 dioxolane, 2,5,7,10tetraoxaundecane, diéthoxyméthane et diméthoxyméthane, et à un moindre degré des produits Rhodiasolv IRIS et Rhodiasolv RPDE. Contrairement au DCM, ces substances et produits ne sont pas classés CMR. Toutefois, il n'y a que peu de substituts pour lesquels une efficacité comparable au DCM a été rapportée par des utilisateurs. Très peu d'informations sont disponibles concernant les coûts des substituts. Il apparaît néanmoins que les produits alternatifs sont souvent plus chers que le DCM. Il existe également des technologies de dépollution des effluents industriels, et des procédés alternatifs, qui supposent également des coûts d'investissement, et ne sont pas techniquement adaptées à toutes les situations. Ces informations mériteraient d'être confirmées par une enquête plus approfondie du fait des nombreux secteurs d'utilisation du DCM.
[59] Plus en détail, les décapants de peinture contenant du DCM ne doivent pas a) être mis sur le marché pour la première fois après le 6 décembre 2010 en vue de la vente au grand public ou aux professionnels; b) être mis sur le marché après le 6 décembre 2011 en vue de la vente au grand public ou aux professionnels; c) être utilisés par les professionnels après le 6 juin 2012.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










