Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Acétaldéhyde (75-07-0)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
75-07-0
Nom scientifique (FR)
Acétaldéhyde
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
200-836-8
Code SANDRE
1454
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C2H4O }\)
Code InChlKey
Code SMILES
O=CC
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP13
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H224 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs extrêmement inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H319 |
|---|---|
| Mention du danger - Texte | Provoque une sévère irritation des yeux |
| Classe(s) de dangers | Lésions oculaires graves/irritation oculaire |
| Libellé UE du danger | - |
| Mention du danger - Code | H335 |
|---|---|
| Mention du danger - Texte | Peut irriter les voies respiratoires |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition unique) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H341 |
|---|---|
| Mention du danger - Texte | Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
44.05 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
L’acétaldéhyde est une substance volatile très réactive qui est générée dans l’atmosphère sous forme de gaz par des processus naturels (feux de forêt, combustion de biomasse, émission par certaines fleurs …) et par des activités anthropiques (transports, fumée de cigarette, industries de différents secteurs, procédés de combustion « incomplète » …). Il est aussi généré secondairement dans l’atmosphère (troposphère) à partir d’autres composés organiques pouvant ou non être naturels (différents précurseurs parmi les terpènes, alcènes, alcanes, composés organiques chlorés, alcools …). Dans l’air urbain, la formation secondaire d’acétaldéhyde peut largement dépasser celle des émissions directes, en particulier lorsque les conditions favorables sont réunies (épisodes photochimiques de l’air).
Remarques :
- retombées sèches de l’acétaldéhyde :
L’acétaldéhyde est essentiellement présent dans l’atmosphère sous forme de gaz. Les dépôts d’acétaldéhyde par voie sèche à la surface de végétaux ou des sols du fait des mouvements d’air vers les sols (gaz adsorbé à des particules, aérosol, gaz) semblent relativement limités. Néanmoins, ce phénomène est peu renseigné expérimentalement et son importance doit être corrélée à la présence de sources émettrices directes.
- concentration dans les nuages et le risque de transport :
Du fait de sa forte solubilité, le transfert d’acétaldéhyde dans les nuages et les précipitations est possible. Toutefois, le composé ne semble pas particulièrement sensible au lessivage de l’atmosphère contrairement à d’autres éléments dont les ratios de lessivage sont plus élevés (ratio de lessivage = concentration dans la pluie / concentration dans l’air). Un ratio de lessivage mesuré à 25 °C montre un ratio compris entre 28 et 37 pour l’acétaldéhyde alors que, pour un composé organique en phase gazeuse efficacement lessivé de l’atmosphère, le ratio est supérieur à 105. Une période de résidence de l’acétaldéhyde dans l’atmosphère sous l’effet de pluies lessivantes (Rain-out) a été estimée à 9,3 ans. Ainsi, le taux de lessivage de l’acétaldéhyde de l’atmosphère laisse penser que le dépôt par voie humide n’est pas un phénomène particulièrement important dans le devenir de l’acétaldéhyde atmosphérique (Santé Canada, 2000 ; Kawamura et al., 2001). Les réactions d’oxydation et de dégradation de CH3COH se déroulant dans l’atmosphère jouent donc un rôle essentiel dans le devenir de l’élément et semblent plus rapides que l’élimination de l’acétaldéhyde par lessivage. Le transport de l’acétaldéhyde dans l’atmosphère sur de longues distances (pouvant être parcourues au sein de la période nécessaire à la dégradation de l’élément) est possible. Néanmoins, du fait de la période de demi-vie courte de l’acétaldéhyde dans l’atmosphère, fondée sur la réactivité globale de la molécule, son transport sur de longues distances suivi de son dépôt semble limité.
L'acétaldéhyde rejeté dans l'air réagit principalement avec les radicaux hydroxyles formés par réaction photochimique, l'ozone, les radicaux hydroperoxyles et les nitrates. De faibles quantités d'acétaldéhyde peuvent être transférées dans l'eau de pluie, la brume et les nuages ou être éliminées sous forme de retombées sèches (Santé Canada, 2000 ; HSDB, 2007).
Étant donné la rémanence diurne généralement courte de l'acétaldéhyde, sa durée de vie nette dans l'atmosphère est également courte. Cette substance ne présente donc pas un grand risque de transport sur de grandes distances (Santé Canada, 2000).
Milieu eau douce
Le ruissellement peut entraîner la migration de l'acétaldéhyde dans les eaux de surface. L'acétaldéhyde peut également être entraîné dans les eaux souterraines par lixiviation à travers les sols. Compte tenu de la valeur de la constante de Henry, la volatilisation de l’acétaldéhyde de la surface de l’eau vers l’atmosphère est possible. (Santé Canada, 2000 ; HSDB, 2007).
Milieu sédiment eau douce
D’après ses Kow et Koc, l’acétaldéhyde ne s’adsorbe pas particulièrement aux matières en suspension et dans les sédiments.
Milieu sédiment marin
D’après ses Kow et Koc, l’acétaldéhyde ne s’adsorbe pas particulièrement aux matières en suspension et dans les sédiments.
Milieu terrestre
Dans les sols, compte tenu de sa valeur Koc, l'acétaldéhyde ne devrait pas s'adsorber facilement aux particules du sol et devrait être considéré comme très mobile dans ce milieu (Santé Canada, 2000 ; HSDB, 2007). Outre la valeur de Koc, les paramètres qui influent sur la lixiviation de l'acétaldéhyde dans l'eau souterraine comprennent le type de sol, l'intensité et la fréquence des précipitations, la profondeur de la nappe et le degré de dégradation de l'acétaldéhyde. Compte tenu de la valeur de la constante de Henry, l’acétaldéhyde peut aussi se volatiliser des sols vers l’atmosphère (Santé Canada, 2000 ; HSDB, 2007).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Air : phase gazeuse
Des boues activées immobilisées dans des lits de gel sont capables de biodégrader rapidement en aérobiose l’acétaldéhyde présent dans des effluents gazeux (Ibrahim et al., 2001). Pour un débit d’effluent donné, le pourcentage de biodégradation est compris entre 65 et 100 % en fonction de la concentration initiale en acétaldéhyde (10 à 100 ppm). Dans ce cas, le pourcentage de dégradation peut être modélisé selon les équations de Michaelis et Menten.
Sol : phase liquide
Selon Santé Canada (2000), l’oxydation aquatique par les radicaux hydroxyles et la volatilisation sont des mécanismes majeurs pour le devenir de l’acétaldéhyde dans l’eau. La biodégradation de l’acétaldéhyde devrait être de quelques jours dans des conditions optimales. Ainsi, OMS IPCS (1995) indique que plusieurs études ont montré que l’acétaldéhyde se dégrade significativement en présence de cultures mixtes obtenues à partir des boues et des eaux de station d’épuration. Par exemple, Hatfield, 1957 a rapporté la capacité de boues acclimatées à oxyder l'acétaldéhyde. De même, Ludzack et Ettinger, 1960 montrent que 93 % de l’acétaldéhyde sont dégradés après 1/3 à 5 jours d’incubation à 20°C en présence d’un inoculum de boue activée acclimatée durant 30 jours. D’autres auteurs comme Thom et Agg, 1975 et Speece, 1983 indiquent également que l'acétaldéhyde est facilement biodégradable par le traitement en station d’épuration. L’acétaldéhyde est également dégradé lors de traitements biologiques en anaérobie par des cultures non acclimatées enrichies en acétate. Un pourcentage d’élimination de la DCO de 97 % a été obtenu à la fin d'une période d'acclimatation de 90 jours (Chou et Speece, 1978). Enfin, selon différents documents (CERI, 2007 ; Santé Canada, 2000 ; OMS IPCS, 1995), l'acétaldéhyde est facilement biodégradable en utilisant l'essai de la biodégradabilité MITI (301C), défini dans les directives de l’OCDE (OCDE, 1992). Ainsi, un taux de biodégradation de l'acétaldéhyde de 80 % est obtenu dans un essai de demande biologique en oxygène (DBO) à une concentration en substance d’essai de 100 mg.L-1 et de 30 mg.L-1 de boue activée, durant une période d’essai de 4 semaines. Les taux de dégradation étaient 93 % et 100 %, respectivement par mesure du carbone organique dissous (COD) et par mesure en chromatographie en phase gazeuse (CERI, 2007).
Dégradabilité abiotique
Atmosphère
Air:
La dégradation abiotique de l’acétaldéhyde dans l’air s’effectue par réaction avec les radicaux hydroxyles (OH.), les radicaux nitrates (NO3), les hydroperoxydes (H2O2, l’ozone (O3) et par photolyse directe (CERI, 2007; Santé Canada, 2000 ; OMS IPCS, 1995). L’oxydation photochimique de l’acétaldéhyde dans l’atmosphère peut produire du nitrate de peroxyacétyle, du formaldéhyde, de l’acide peroxyacétique, de l’acide acétique et de l’acide nitrique (Atkinson et Lloyd, 1984 ; Atkinson, 1989, 1990 ; Atkinson et Arey, 1993, cités par Santé Canada, 2000). La photolyse de l’acétaldéhyde peut produire du méthane et du monoxyde de carbone ou des radicaux méthyles et formyles (CARB (California Air Resources Board), 1993 ; Horowitz et Calvert, 1982 ; Meyrahn et al., 1982, cités par Santé Canada, 2000). La demi-vie de l’acétaldéhyde dépend de l’intensité du rayonnement solaire, de la température et la présence des radicaux hydroxyles ou nitrates (Santé Canada, 2000). À partir de sa réactivité globale, la demi-vie de l’acétaldéhyde dans l’air est estimée à moins de 10 heures (Mackay et al., 1995, cités par Santé Canada, 2000). Pour diverses villes américaines, elle est comprise entre trois heures (le jour par temps clair durant l’été) et 3 000 heures (125 jours la nuit en hiver) (US EPA, 1993, cité par Santé Canada, 2000). Pendant le jour, par temps clair, la rémanence de l’acétaldéhyde dépend principalement de sa réaction avec les radicaux hydroxyles. La photolyse joue un rôle mineur (2 à 5 %) dans son élimination (Santé Canada, 2000).
a. Réaction avec les radicaux hydroxyles (OH.)
La constante de réaction de l’acétaldéhyde avec le radical hydroxyle est de 1,60 ± 0,16 x 10-11 cm3 par molécule par seconde à la température de 26°C (Atkinson et Pitts, 1978, cités par OMS IPCS, 1995). Selon cette constante de réaction, la demi-vie de l’acétaldéhyde est environ de 24 heures (Atkinson, 1989 ; HSDB, 2007). De même, Hustert et Parlar, 1981, cités par OMS IPCS, 1995) déterminent que 49,5 % de l’acétaldéhyde sont chimiquement photodégradés (réaction avec les radicaux hydroxyles) après exposition à un rayonnement (lambda > 230 nanomètres) de 2 h à 25°C (OMS IPCS, 1995).
La réaction de l’acétaldéhyde avec les radicaux hydroxyles est donc un des processus majeurs de sa dégradation (Atkinson et al., 1990 ; CARB, 1993 cités par Santé Canada, 2000).
b. Réaction avec l'ozone (O3)
La constante de réaction de l'acétaldéhyde avec l'ozone est de 6,0 x 10-21 mL par molécule par seconde (25°C, valeur mesurée) dans le ciel troposphérique. A partir de cette valeur, il a été déterminé une demi-vie de 5 ans dans la troposphère (CERI, 2007).
c. Réaction au nitrate
La destruction nocturne de l’acétaldéhyde pourrait être due à une réaction en phase gazeuse avec les radicaux nitrates (US NRC, 1981) ; cette réaction ayant tendance à être importante en zone urbaine, où la concentration des radicaux nitrates est plus élevée qu’en zone rurale (Altshuller et Cohen, 1964 ; Gay et Bufalini, 1971 ; Maldotti et al., 1980, cités par Santé Canada, 2000). La constante de réaction de l'acétaldéhyde avec le radical nitrate est comprise entre 1,34 ± 0,28 x 10-15 et 2,8 x 10-15 cm3 par molécule par seconde (25°C, valeur mesurée) dans le ciel troposphérique (Atkinson et al., 1984, cités par OMS IPCS, 1995 ; CERI, 2007). À partir de cette valeur, la demi-vie de l’acétaldéhyde est comprise entre 2 et 35 jours (Atkinson et al., 1987 ; Atkinson et al., 1990, cités par Santé Canada, 2000 ; OMS IPCS, 1995 ; CERI, 2007).
d. Dégradation par photolyse
L’acétaldéhyde peut être dégradé directement par la lumière (CERI, 2007). Toutefois, selon Santé Canada (2000), la photolyse est un processus mineur de transformation de l’acétaldéhyde. Selon ce processus de réaction, la demi-vie de l’acétaldéhyde est estimée à 80 heures dans la basse troposphère, pour un angle zénithal de 0°.
Milieu eau douce
Eau :
Selon Santé Canada (2000), dans l’eau, l’acétaldéhyde peut réagir avec les radicaux hydroxyles, être oxydé par les radicaux alkyles ou arylperoxyles ou par l’oxygène singulet ou être hydraté (Buxton et al., 1988 ; Foote, 1976 ; Hendry et al., 1974 ; Howard, 1972 ; Jacob et al., 1989 ; Mill, 1979). L’oxydation par les radicaux hydroxyle et la volatilisation sont les principaux facteurs intervenant sur le devenir de l’acétaldéhyde dans l’eau. Toutefois, la rémanence de cette substance dépend des conditions ambiantes telles que la température, la vitesse du vent, les courants, les glaces, etc. Ainsi, von Burg et Stout, 1991, cités par OMS IPCS, 1995) ont rapporté une demi-vie de 1,9 heures pour l'acétaldéhyde en eau de rivière et à partir de sa réactivité globale, Mackay et al., 1995, cités par Santé Canada, 2000) ont estimé entre 30 et 100 heures la demi-vie de l’acétaldéhyde dans les eaux de surface.
Milieu sédiment eau douce
Sédiment :
Santé Canada (2000) indique que compte tenu du faible coefficient de partage entre le carbone organique et l’eau (Koc) de l’acétaldéhyde, il n’existe pas de risque significatif d’adsorption de l’acétaldéhyde par les matières solides en suspension ou les sédiments présents dans l’eau. De ce fait, la dégradation biotique et abiotique devrait avoir une incidence importante sur le devenir de cette substance dans les sédiments. Ainsi, Mackay et al. (1995), cités par Santé Canada, 2000 obtiennent une valeur de demi-vie fondée sur la réactivité d’ensemble variant entre 100 et 300 heures.
Milieu terrestre
Sol :
Selon Santé Canada (2000), compte-tenu de la valeur du log Koc estimée à 0,063, l’acétaldéhyde ne devrait pas s’adsorber facilement aux particules du sol et des sédiments et devrait être considéré comme mobile dans ce milieu. L’acétaldéhyde peut donc migrer dans les eaux de surface via le ruissellement ou dans les eaux souterraines par lixiviation. Outre la valeur de Koc, les paramètres qui influent sur la lixiviation de l’acétaldéhyde dans l’eau souterraine comprennent le type de sol, l’intensité et la fréquence des précipitations, la profondeur de la nappe d’eau souterraine et le degré de dégradation de l’acétaldéhyde (Chou et Speece, 1978 ; Ludzack et Ettinger, 1960 ; Speece, 1983 ; Thom et Agg, 1975).
Bioaccumulation
Organismes aquatiques
Aucune donnée de bioconcentration (BCF) ou de bioaccumulation (BAF), acquise de façon expérimental ou sur le terrain, n’a été répertoriée. Toutefois, à partir du coefficient de partage octanol/eau (Log de Kow : 0,45), le facteur de bioconcentration calculé est compris entre 0,14 et 1,3 (Mackay, 1982 ; Veith et al., 1980, cités par Santé Canada, 2000). Ces faibles valeurs montrent que l’absorption ou la bioconcentration de l’acétaldéhyde devrait être faible (Santé Canada, 2000). De plus, l’acétaldéhyde ne semble pas bioaccumulable. En effet, les substances dont le log Kow est égal ou inférieur à 5 présentent en général peu de risque d’accumulation dans la chaîne alimentaire (Santé Canada, 2000).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucune donnée de bioconcentration (BCF) ou de bioaccumalation (BAF) n’a été répertoriée.
Bibliographie
Toxicologie
Dernière vérification le 13/11/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (Anses, 2014, ECHA, 2016, IARC, 1999 ; INRS, 2004 ; OMS IPCS, 1995 ; US EPA (IRIS), 1991). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les informations rapportées concernent l’acétaldéhyde ; cependant en raison de similitudes d’expositions et d’effets avec le formaldéhyde, il s’est avéré utile d’apporter quelques éléments de comparaison avec ce dernier. Lorsque c’est le cas, cela est clairement précisé.
Toxicocinétique
Chez l'homme
Absorption
Actuellement, aucune étude spécifiquement menée chez l’homme ne traite de l’absorption de l’acétaldéhyde. Cependant, les résultats des études de toxicité indiquent que les deux principales voies d’absorption sont les voies respiratoire et orale. Le pourcentage d’acétaldéhyde retrouvé chez 8 volontaires sains exposés par inhalation aux vapeurs d’acétaldéhyde (100 - 800 mg.m-3) est compris entre 45 et 70 %. Les facteurs critiques déterminants dans l’absorption sont la durée d’exposition et la fréquence respiratoire de chaque individu (Egle, 1970). L’acétaldéhyde est une petite molécule, soluble dans l’eau. Ainsi, il est rapidement absorbé au niveau du tractus gastro-intestinal après une exposition par voie orale puis rapidement métabolisé. Mais il est alors difficile de déterminer les taux d’absorption pour la voie orale (Barry et Williams, 1988). Les propriétés physico-chimiques de l’acétaldéhyde indiquent que l’absorption cutanée est possible.
Distribution
Aucune donnée relative à la distribution de l’acétaldéhyde après exposition directe chez l’homme n’est disponible.
Métabolisme
L’acétaldéhyde est métabolisé au niveau de plusieurs sites, dont le tubule rénal chez l’homme, mais le foie reste le principal site de métabolisation. Aucune étude in vivo spécifique ne traite du métabolisme de l’acétaldéhyde.
Les études in vitro ont permis de mettre en évidence que la voie principale de métabolisation de l’acétaldéhyde est son oxydation en acétate par l’ALDH-NAD dépendante (acétaldéhyde déshydrogénase nicotinamide adénine dinucléotide dépendante). L’acétate rentre dans le cycle de l’acide citrique (cycle de Krebs) pour former l’acétylCoA, comme indiqué dans le schéma ci-après.
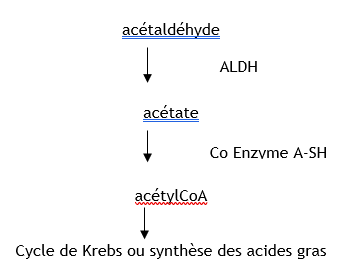
De nombreuses isoenzymes de l’ALDH ont été identifiées dans le foie et dans d’autres tissus chez l’homme. Les sujets présentant une mutation sur le gène de l’ALDH qu’il soit homozygote ou hétérozygote ont une ALDH de faible activité, métabolisent donc plus faiblement l’acétaldéhyde et présentent aussi une intolérance plus importante à l’éthanol (Crabb et al., 1986 ; Goedde et al., 1989 ; Singh et al., 1989).
Aucune donnée n’est disponible sur la métabolisation de l’acétaldéhyde par voie cutanée.
Élimination
Aucune donnée ne traite de l’élimination de l’acétaldéhyde chez l’homme quelle que soit la voie d’exposition.
Chez l'animal
Absorption
Chez l’animal, l’acétaldéhyde peut être absorbé par les tractus respiratoire et gastro-intestinal. Cependant, aucune étude quantitative adéquate n’a été identifiée.
Distribution
Après exposition par inhalation, des études chez le rat ont montré le passage de l’acétaldéhyde dans le sang puis sa distribution dans le foie, les reins, la rate, le cœur et les muscles squelettiques. La concentration d’acétaldéhyde présente dans le foie est relativement basse ce qui est certainement dû à une forte métabolisation. Après exposition par inhalation, l’acétaldéhyde disparaît rapidement du sang, indiquant une rapide distribution de cette substance (Hobara et al., 1985 ; Watanabe et al., 1986).
Aucune donnée sur la distribution de l’acétaldéhyde après exposition par voie orale et cutanée n’est disponible. Par contre, il existe des données par voie intraveineuse. Une minute après une injection intraveineuse chez des souris, une forte concentration d’acétaldéhyde radioactif a été détectée dans le cœur, le diaphragme, le cortex rénal, la muqueuse gastro-intestinale, le pancréas, la salive,… (Johannsson-Brittebo et Tjalve, 1979).
L’acétaldéhyde passe la barrière placentaire pour aller dans la circulation fœtale (Randall et al., 1978). Blakley et Scott, 1984b ont administré 5 injections intrapéritonéales de 200 mg.kg-1 d’acétaldéhyde à des souris au dixième jour de gestation. Cinq minutes après l’injection, l’acétaldéhyde a atteint sa concentration maximale dans le sang et le foie maternel, chez l’embryon et dans le sac vitellin. L’acétaldéhyde a rapidement disparu de la circulation sanguine et est devenu indétectable 2 heures après le traitement. Une autre étude a montré que chez le rat Wistar en gestation, après injection intraveineuse d’acétaldéhyde, il n’est pas détecté dans le sang du fœtus à des concentrations maternelles faibles. Par contre, comme l’acétaldéhyde est métabolisé par l’ALDH au niveau du placenta et du foie du fœtus, lorsque la capacité de métabolisation fœto-placentaire est dépassée, il est retrouvé dans le sang du fœtus (Zorzano et Herrera, 1989).
Métabolisme
Comme chez l’homme, la voie principale de métabolisation de l’acétaldéhyde chez l’animal est son oxydation en acétate par l’ALDH (acétaldéhyde déshydrogénase) pour toutes voies d’exposition. L’ALDH mitochondriale constitue l’enzyme principale d’oxydation de l’acétaldéhyde chez le rat. Elle est surtout hépatique (Horton et Barrett, 1975, 1976 ; Lindros et al., 1972) mais aussi présente au niveau de l’épithélium du tractus respiratoire chez le rat (Bogdanffy et al., 1986) et au niveau du tubule et du cortex rénal chez le chien, le rat, la souris, le babouin et le porc de guinée (Michoudet et Baverel, 1987a, 1987b). L’acétaldéhyde est également métabolisé au niveau des tissus embryonnaires chez le rat et la souris in vitro (Priscott et Ford, 1985).
La métabolisation étant importante, l’acétaldéhyde est majoritairement éliminé sous forme de métabolites dans les urines. Environ 5 % de l’acétaldéhyde est exhalé.
Élimination
Après administration par voie orale d’une dose unique de 600 mg.kg-1 de poids corporel d’acétaldéhyde chez le chien, peu d’acétaldéhyde est excrété sous forme inchangée dans les urines (Baselt et Cravey, 1989).
Aucune étude n’a été réalisée concernant l’élimination de l’acétaldéhyde après exposition par inhalation ou par voie cutanée. Après injection intraveineuse à des rats de 120 microcuries d’acétaldéhyde radioactif, seulement 6 % d’acétaldéhyde radioactif initial sont excrétés dans les urines, sur une période de 7 jours. Après métabolisation, le principal produit retrouvé dans les urines est l’acétate.
Synthèse
Chez l’homme, l’acétaldéhyde est absorbé par les voies respiratoire (45 à 70 %) et orale. Lors d’une exposition par voie orale, il est rapidement absorbé au niveau du tractus gastro-intestinal puis rapidement métabolisé. Il est oxydé en acétate, notamment au niveau hépatique.
Chez l’animal, les données de toxicocinétique sont identiques à celles de l’homme.
Toxicité aiguë
Chez l'homme
Inhalation
La principale voie d’exposition aux vapeurs d’acétaldéhyde est l’inhalation.
Les effets majeurs observés après exposition à des vapeurs d’acétaldéhyde consistent en une irritation des yeux, de la peau et des voies respiratoires. Dans l’étude de Silverman et al., 1946, 12 sujets sains ont été exposés aux concentrations de 25, 50 ou 200 ppm soit 90, 240 ou 360 mg.m-3 d’acétaldéhyde, pendant de courtes périodes. Les volontaires exposés à 90 mg.m-3 pendant 15 minutes n’ont présenté qu’une légère irritation des yeux. Ceux exposés à 240 mg.m-3 pendant 30 minutes présentaient une irritation du tractus respiratoire. Une conjonctivite a été observée chez tous les sujets exposés à 360 mg.m-3 d’acétaldéhyde pendant 15 minutes. À de plus fortes concentrations (supérieures à 200 ppm soit 360 mg.m-3), on observe des dyspnées, puis aux environs de 5 000 ppm (9 000 mg.m-3) une dépression du système nerveux central. La limite exacte de survenue de ces effets n’est cependant pas précisée même si une exposition de 15 minutes à 25 ppm n’est pas irritante (Baselt et Cravey, 1989).
Dans une autre étude, 61 sujets souffrant d’un asthme modéré et 20 sujets ne présentant pas de pathologie ont été exposés à une solution d’acétaldéhyde en aérosol grâce à un nébuliseur (Prieto et al., 2000). Les sujets ont successivement inhalé des concentrations de plus en plus élevées, allant de 5 – 40 mg.mL-1 (soit entre 150 et 1 200 mg.m-3) sur de très courtes périodes (2 minutes). Lorsqu’une diminution de 20 % du volume expiratoire maximal par seconde (VEMS) (bronchoconstriction) n’était pas observée, le sujet était exposé à une concentration deux fois plus élevée. Les asthmatiques ont montré une bronchoconstriction contrairement aux sujets ne présentant pas de pathologie. Chez les asthmatiques, la moyenne géométrique de la concentration en acétaldéhyde dans le nébuliseur induisant une diminution de 20 % du VEMS est de 17,55 mg.mL-1, avec un intervalle de confiance à 95 % (IC95%) de 4,72 – 38,2 mg.mL-1 (Prieto et al., 2000). L’inhalation a également provoqué la toux, des constrictions thoraciques et des irritations pharyngées.
Voie orale
Aucune donnée relative à la toxicité de l’acétaldéhyde après exposition par voie orale n’est disponible chez l’homme.
Voie cutanée
Par voie cutanée, un érythème a été observé après administration d’acétaldéhyde au moyen d’un patch chez 12 volontaires d’ascendance orientale (Wilkin et Fortner, 1985).
Synthèse
Chez l’homme, l’exposition à des vapeurs d’acétaldéhyde induit une irritation des yeux, de la peau et des voies respiratoires.
Chez l'animal
Toutes voies
Les DL50 calculées chez le rat et la souris ainsi que les CL50 chez le rat et le hamster doré montrent que la toxicité aiguë de l’acétaldéhyde est faible.
Inhalation
Par inhalation, Appelman et al., 1982 ont exposé des rats pendant 4 heures à une concentration d’acétaldéhyde dans l’air de 10 436 à 16 801 ppm (respectivement 18 et 785 à 30 242 mg.m-3). Pendant les 30 premières minutes d’exposition, les animaux étaient agités avec une respiration rapide et les yeux clos. Après 1 heure d’exposition, les animaux présentaient une prostration et une détresse respiratoire. Une CL50 de 13 300 ppm, soit 24 000 mg.m-3, a été estimée à partir de cette étude pour des rats exposés à l’acétaldéhyde pendant 4 heures. Dans une autre étude, une CL50 de 20 000 ppm soit 37 000 mg.m-3 a été déterminée pour des rats exposés à l’acétaldéhyde pendant 30 minutes (Skog, 1950).
Après inhalation d’acétaldéhyde à 1 500 ppm pendant 10 minutes (2 700 mg.m-3) et plus, chez des souris mâles, les études de Kane et al., 1980 montrent une irritation du tractus respiratoire et une diminution du rythme respiratoire dès les premières secondes. Basée sur cette étude, une RD50 (concentration qui produit 50 % de diminution du taux respiratoire) de 4 946 ppm, soit 8 000 mg.m-3, a été calculée après 10 minutes d’exposition. Les études de Tanaka et al., 1988 ont également montré des dommages causés au foie après une exposition de 2 heures chez le rat mais les concentrations ne sont pas précisées.
Voie orale
Par voie orale, des DL50 de l’acétaldéhyde ont été calculées chez le rat et la souris et sont indiquées dans le tableau ci-dessous (OMS IPCS, 1995). Aucun détail supplémentaire n’a été donné sur ces études.
DL50 par exposition voie orale à l’acétaldéhyde :

Après administration de 100 mg.kg-1 d’acétaldéhyde à des rats, une sévère diminution de la mobilité a été immédiatement observée s’aggravant dans les 5 à 10 minutes après l’exposition avec un plateau à 15 minutes (Durlach et al., 1988). L’administration d’une dose unique de 600 mg.kg-1 d’acétaldéhyde a été réalisée par sonde gastrique chez des chiens. Ceux-ci ont présenté des tremblements quelques heures après l’exposition (Booze et Oehme, 1986). Tous les chiens présentaient un état normal 24 h après la fin de l’exposition.
Voie cutanée
Aucune donnée n’est disponible pour la voie cutanée.
Voie parenthérale
Après administration parentérale d’acétaldéhyde chez le chat, différents types d’arythmie cardiaque particulièrement une arythmie ventriculaire, ont été observés à des doses de
1 et 2,5 mg.kg-1. Ces effets sont indirectement induits par la libération de catécholamines au niveau du cœur (Condouris et Havelin, 1987). Des résultats similaires chez le cobaye ont été constatés (Mohan et al., 1981). Chez la souris, l’injection intraveineuse de 250 mg.kg-1 d’acétaldéhyde en 10 minutes a produit une déplétion du pôle dopaminergique et une destruction des neurones dopaminergiques (Corsini et al., 1987 ; Zuddas et al., 1987).
Synthèse
Chez l’animal, la toxicité aiguë est faible. Les effets sont essentiellement liés à une détresse respiratoire pour des expositions à des concentrations élevées.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Aucune donnée sur la toxicité chronique directe de l’acétaldéhyde n’est disponible chez l’homme.
Chez l'animal
Inhalation
Exposition subaiguë :
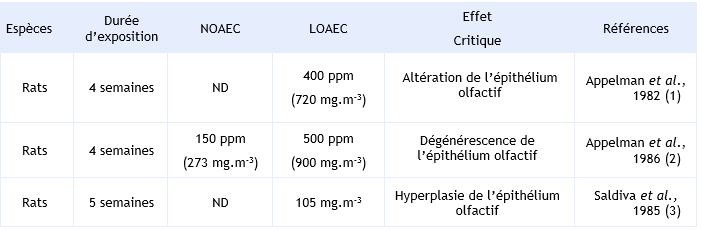
Appelman et al., 1982 ont exposé des rats (10 animaux par sexe et par lot) par inhalation à des concentrations de 0, 401, 941, 2 227 ou 4 975 ppm d’acétaldéhyde (0, 728, 1 820, 4 004 et 9 100 mg.m-3), 6 heures par jours, 5 jours par semaine pendant 4 semaines. Pour les concentrations comprises entre 1 000 et 5 000 ppm, il a été observé une diminution du poids du corps ainsi qu’une diminution du poids du foie. Une augmentation du poids des poumons est observée chez les mâles à la plus forte concentration. Un retard de croissance et des effets hématologiques (augmentation statistiquement significative du nombre de neutrophiles et diminution statistiquement significative du nombre de lymphocytes) sont également rapportés. La cible principale est le tractus respiratoire avec essentiellement des altérations au niveau nasal (changements histologiques). Les rats exposés à 5 000 ppm présentaient une dyspnée sévère dès les premières 30 minutes d’exposition. Une altération de l’épithélium olfactif à 400 ppm a été constatée ainsi qu’une atrophie à 5 000 ppm. À de fortes concentrations (1 000, 2 200 et 5 000 ppm), des lésions du larynx avec une hyperplasie et une métaplasie de la muqueuse épithéliale stratifiée ont été observées. Basé sur les dégénérescences de l’épithélium olfactif observé lors de cette étude, les auteurs ont déterminé une LOAEC de 400 ppm. Aucune NOAEC n’a pu être déterminée à partir de cette étude.
Dans une deuxième étude d’Appelman et al., 1986, des rats (10 animaux par groupe) ont été exposés par inhalation, 6 heures par jour, 5 jours par semaine pendant 4 semaines, aux concentrations de 110 ou 150 et 500 ppm (soit 0, 198 ou 273 et 910 mg.m-3 respectivement). Un premier groupe a été exposé sans interruption, un second groupe avec une période d’interruption de 1,5 heure la première fois puis de 3 heures la seconde, et enfin un troisième groupe avec des périodes d’interruption de 3 heures et des pics de concentration de 3 000 ppm soit 5 400 mg.m-3. Une exposition continue ou interrompue de 500 ppm n’induit pas d’effet visible. Par contre, tous les groupes exposés à des pics de concentration présentaient des irritations, des troubles visuels et une congestion nasale. Les groupes exposés à 500 ppm avec ou sans interruption présentaient une diminution de leur poids corporel et une dégénérescence des cellules de l’épithélium olfactif. Aucun effet n’a été rapporté pour les animaux exposés à 150 ppm avec ou sans interruption. Une NOAEC de 150 ppm basée sur les effets sur l’épithélium olfactif a été déterminée (voir le tableau ci-dessous).
Saldiva et al., 1985 ont exposé des rats (12 par lot) à des concentrations de 0 ou 243 ppm (soit 437 mg.m-3) d’acétaldéhyde, 8 heures par jour, 5 jours par semaine pendant 5 semaines. Les animaux présentent une augmentation de capacité résiduelle, du volume résiduel, de la capacité pulmonaire totale et de la fréquence respiratoire. Une investigation histopathologique a montré une intense réaction inflammatoire avec une hyperplasie de l’épithélium olfactif et une infiltration de polynucléaires. Une LOAEC de 105 mg.m-3 pour les effets sur l’épithélium olfactif a été déterminée (voir tableau ci-dessous).
Le tableau regroupe l’ensemble des NOAEC/LOAEC déterminées dans les 3 études principales par inhalation pour des expositions subaiguës.
Synthèse des principaux éléments relatifs aux études pour des expositions subaiguës par inhalation
Exposition subchronique :
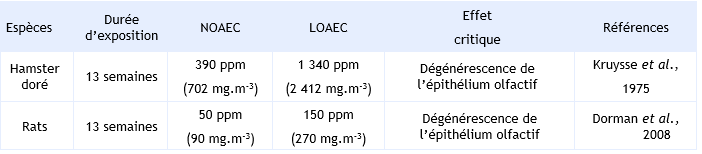
Pour l’exposition par inhalation, les principaux effets constatés sont une dégénérescence de l’épithélium olfactif ainsi qu’une diminution du poids des organes et du corps (Dorman et al., 2008 ; Kruysse et al., 1975).
Dans l’étude de Kruysse et Til (1975) des hamsters (10 animaux par sexe et par concentration) ont été exposés, 6 heures par jour, 5 jours par semaine, pendant 13 semaines à des concentrations de 0, 390, 1 340 ou 4 560 ppm soit 0, 702, 2 412, 8 208 mg.m-3 d’acétaldéhyde. Les effets concernent essentiellement les voies respiratoires supérieures hautes. A 4 560 ppm (8 208 mg.m-3), une diminution du poids corporel et du poids du cœur, du cerveau, et une augmentation du poids des reins et des poumons ont été observées. A cette concentration des lésions pulmonaires de type nécrose, inflammation, hyperplasie et métaplasie sont également décrites. Une dégénérescence de l’épithélium olfactif et de la trachée a été constatée à 1 340 ppm (2 412 mg.m-3) après 13 semaines d’exposition. Une NOAEC de 390 ppm (702 mg.m-3) et une LOAEC de 1 340 ppm (2 412 mg.m-3) pour la dégénérescence de l’épithélium olfactif ont été déterminées.
Dorman et al., (2008) ont exposé des rats mâles (12/dose/durée d’exposition) à des concentrations de 0 – 50 – 150 – 500 – 1 500 ppm soit 0 – 90 – 270 – 900 – 2 700 mg.m-3 d’acétaldéhyde, 6 heures par jour, 5 jours par semaine pendant 13 semaines. Pour certains lots la durée d’exposition a été plus courte à savoir 4 – 9 - 14 -30 - 65 jours d’exposition. Les principaux effets consistent en des atteintes des épithéliums respiratoire et olfactif. Au niveau de l’épithélium respiratoire, une inflammation (2 700 mg.m-3), une hyperplasie (2 700 mg.m-3 et 14 jours à 900 mg.m-3) et une métaplasie des cellules squameuses (2 700 mg.m-3 et ≥ 14 jours à 900 mg.m-3) sont identifiées. Au niveau de l’épithélium olfactif, des altérations ont été observées avec une augmentation de l’espace intercellulaire, mais également une perte des neurones olfactifs (270 mg.m-3). La sévérité de ces lésions de l’épithélium olfactif est dépendante de la dose et de la durée d’exposition. Sur la base de ces résultats, les auteurs ont proposé une construction de VTR. L’effet critique retenu est la dégénérescence de l’épithélium olfactif caractérisée par une NOAEC de 90 mg.m-3. Les auteurs ont utilisé le modèle PBPK de Teeguarden et al. (2008) décrivant l’absorption et la distribution de l’acétaldéhyde au sein de la cavité nasale afin de prendre en compte les différences dosimétriques entre le rat et l’homme, et ainsi estimer la concentration équivalente pour l’homme de 12,51 ppm (22,77 mg.m-3). Les auteurs ont appliqué un facteur d’incertitude de 30 pour prendre en compte la variabilité intra-individuelle et les différences pharmacocinétiques inter-espèces. La valeur attribuée à chacune de ces deux variables n’est toutefois pas spécifiée dans l’étude (Teeguarden et al., 2008). Dorman et al. ont ainsi proposé une RfC de 0,42 ppm soit 0,75 mg.m-3 (12,51 ppm X 1/30 = 0,417 ppm) pour une exposition chronique à l’acétaldéhyde par inhalation.
Le tableau regroupe l’ensemble des NOAEC/LOAEC déterminées dans les 2 études principales par inhalation pour des expositions subchroniques.
Synthèse des principaux éléments relatifs aux études pour des expositions subchroniques par inhalation :
Exposition chronique :
Des rats ont été exposés aux concentrations de 0, 750, 1 500 (0, 1 365, 2 730 mg.m-3) et 3 000 à 1 000 ppm (5 460/1 820 mg.m-3) 6 heures par jour, 5 jours par semaine respectivement pendant 18 mois (Woutersen et al., 1986) et, pendant 52 semaines (Woutersen et Feron, 1987). Pour les deux études, les concentrations élevées ont été diminuées graduellement de 3 000 à 1 000 ppm en raison d’un sévère retard de croissance, d’une forte perte de poids et d’une mort précoce des animaux liées à une occlusion partielle ou totale des cloisons nasales par inflammation et kératinisation. Les rats exposés aux concentrations élevées montraient une salivation excessive et une respiration difficile. Une détresse respiratoire a été observée même lorsque les concentrations étaient diminuées de 3 000 à 1 000 ppm, mais les dyspnées étaient alors moins fréquentes. L’effet le plus sévère était une altération de la cavité nasale avec une hyperplasie et une métaplasie de l’épithélium olfactif, occasionnellement accompagné par une hyperkératinisation. Une LOAEC de 750 ppm a été déterminée pour ces effets. Par contre, aucune NOAEC n’a pu être déterminée.
Voie orale
Expositions subaiguës :
Des rats ont été exposés à 675 mg.kg-1 d’acétaldéhyde (mélange d’eau et d’acétaldéhyde) pendant 28 jours. Il a été constaté que les effets se limitaient à une légère hyperkératose locale du pré-estomac : une NOAEL de 125 mg.kg-1 et une LOAEL de 675 mg.kg-1 ont été déterminées (Til et al., 1988).
Expositions subchroniques :
Après administration d’acétaldéhyde à dose constante par voie orale (0,05 % d’acétaldéhyde dans l’eau) pendant 6 mois (estimation du groupe de travail : 40 mg.kg-1), la synthèse de collagène a été induite dans le foie des rats exposés. Aucun autre effet n’a été examiné (Bankowski et al., 1993).
Expositions chroniques :
Aucune étude chronique n’est disponible pour l’exposition orale.
Voie cutanée
A notre connaissance, il n’existe aucune étude n’est disponible.
Synthèse
Chez l’animal, l’effet toxique à des doses ou concentrations relativement basses est faible et se limite principalement au site initial de contact. A des concentrations plus élevées, pour des expositions par inhalation, une dégénérescence de l’épithélium olfactif pouvant s’accompagner d’une perforation de la cloison nasale, d’une hyperplasie et d’une métaplasie de l’épithélium olfactif sont observées. Une hyperkératose locale du pré-estomac est rapportée pour une exposition voie orale.
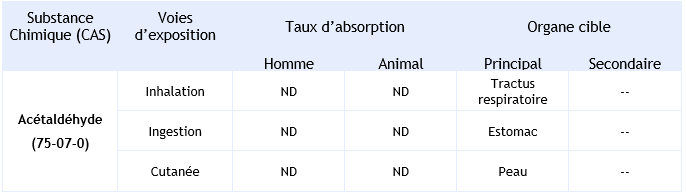
Effets systémiques :
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2 : L’acétaldéhyde est une substance suspectée d’être cancérogène pour l’hommeA noter, qu’en septembre 2016 le « Risk Assessment Committee » de l’ECHA a retenu une modification en 1B (ECHA, 2016). | 2008 |
| IARC | Groupe 2B : l’acétaldéhyde est un cancérogène possible pour l’hommeGroupe 1 : l’acétaldéhyde est cancérogène pour l’homme en association avec la consommation d’une boisson alcoolisée | 1999 |
| US EPA | Classe B2 : l’acétaldéhyde est un cancérogène possible pour l’homme | 1988 |
Chez l'homme
Inhalation
Très peu d’études sont disponibles sur les effets cancérogènes de l’acétaldéhyde chez l’homme. Une seule étude épidémiologique montre une augmentation de l’incidence de l’ensemble des cancers toutes causes chez des travailleurs exposés à l’acétaldéhyde comparés à la population générale (Bittersohl, 1975). Cette étude a été conduite chez 220 personnes travaillant dans une usine en présence de différents produits, dont l’acétaldéhyde retrouvé à une concentration comprise entre 0,56 et 1 ppm soit 1 et 1,8 mg.m-3. La période d’observation était comprise entre 1967 et 1972 (5 ans). Neuf cas de cancer (9 cas sur 150 personnes employées depuis 20 ans) ont été identifiés chez des travailleurs masculins : cinq personnes présentaient des adénocarcinomes des cellules squameuses de l’appareil bronchique, deux des carcinomes des cellules squameuses de la cavité buccale, une des adénocarcinomes au niveau de l’estomac et une personne, un adénocarcinome au niveau du cæcum. Cette étude présente plusieurs biais : les individus étaient tous fumeurs, la présence d’autres composés, l’âge n’a pas été pris en considération, une période d’observation courte, un nombre de témoin limité, un manque d’information sur la distribution. Cette étude a été considérée par l’IARC (1999) et l’US EPA IRIS (1991) comme inadéquate pour évaluer le pouvoir cancérogène de l’acétaldéhyde.
L’acétaldéhyde est également soupçonné de participer aux effets cancérogènes, notamment des voies aérodigestives supérieures, observés à long terme chez les alcooliques (Salaspuro, 2007 ; Seitz et Meier, 2007).
Synthèse
Chez l’homme, une seule étude épidémiologique montre une augmentation de l’incidence des cancers toutes causes confondues chez des travailleurs exposés à l’acétaldéhyde mais le faible nombre de cas ne permet pas de conclure.
Chez l'animal
Inhalation
Les principales études sur lesquelles se basent la classification de l’US EPA (1991) et de l’IARC (1999) sont celles de Feron (1979), de Feron et al. (1982), de Woutersen et al. (1984) et de Woutersen et al. (1986). Elles sont décrites ci-dessous.
Feron (1979) a exposé par inhalation un groupe de 35 hamsters dorés mâles à des concentrations d’acétaldéhyde comprises entre 0 et 1 500 ppm (0 et 2 700 mg.m-3), 7 heures par jour, 5 jours par semaine pendant 52 semaines. Aucun effet néoplasique dû à l’exposition à l’acétaldéhyde seul n’a été observé. Par contre, l’exposition des animaux à un mélange d’acétaldéhyde et de hautes concentrations de benzo[a]pyrène multiplie par 2 l’augmentation de l’incidence des carcinomes des cellules squameuses par rapport à l’exposition au benzo[a]pyrène seul. Dans une seconde partie de l’étude, aucune tumeur du tractus respiratoire n’a été retrouvée chez des hamsters, traités une fois par semaine, par une instillation de 0,2 mL d’acétaldéhyde à 2 % ou 4 % dans une solution de NaCl à 0,9 %, 7 heures par jour, 5 jours par semaine pendant 52 semaines (Feron, 1979).
Dans une autre étude de Feron et al. (1982), des hamsters (36 animaux par lot et par sexe) ont été exposés par inhalation, 7 heures par jour, 5 jours par semaine pendant 52 semaines, à des concentrations d’acétaldéhyde graduellement réduites de 4 500 mg.m-3 à 2 970 mg.m-3. Une augmentation non statistiquement significative des tumeurs nasales et une augmentation statistiquement significative de l’incidence des tumeurs laryngées a été observée. Aucune tumeur n’a été observée au niveau des bronches et des bronchioles (Feron et al., 1982).
Lors des études de Woutersen et al. (1984) et de Woutersen et al. (1986), des rats ont été exposés (105 animaux par lot et par sexe) par inhalation à des concentrations de 0, 750, 1 500, 3 000 ppm d’acétaldéhyde soit 0, 1 350, 2 700, 5 400 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 28 mois. Les concentrations les plus élevées ont été graduellement diminuées de 3 000 à 1 000 ppm en raison d’un sévère retard de croissance, d’une forte perte de poids et d’une mort précoce. Une augmentation statistiquement significative des tumeurs de la muqueuse nasale (épithélium olfactif et respiratoire) a été rapportée chez les deux sexes : adénocarcinomes à toutes les concentrations testées et carcinomes des cellules squameuses pour les moyennes et fortes concentrations (Woutersen et al., 1984 ; Woutersen et al., 1986).
Les études de Feron et al. (1982) et Woutersen et al. (1986) démontrent que l’acétaldéhyde est capable d’induire significativement des tumeurs nasales chez le rat et laryngées chez le hamster après une exposition par inhalation à de l’acétaldéhyde.
Voie orale
Aucune donnée sur les effets cancérogènes de l’acétaldéhyde après exposition par voie orale n’est disponible.
Voie cutanée
Aucune donnée sur les effets cancérogènes de l’acétaldéhyde après exposition par voie cutanée n’est disponible.
Synthèse
Chez l’animal, des expositions à l’acétaldéhyde seul induisent une augmentation statistiquement significative de l’incidence des tumeurs laryngées, de la muqueuse nasale, des épithéliomas olfactifs et respiratoires. Chez le hamster, l’exposition combinée avec du benzo[a]pyrène augmente l’incidence des carcinomes à cellules squameuses par rapport à l’exposition au benzo[a]pyrène seul.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le caractère génotoxique a été étudié mais l’acétaldéhyde n’a pas été classé par l’Union Européenne A noter, qu’en septembre 2016 le « Risk Assessment Committee » de l’ECHA a retenu une classification en catégorie 2 | 2008 |
Chez l'homme
Toutes voies
Les principaux résultats présentés correspondent aux conclusions de l’analyse du « Risk Assessment Committee » de l’ECHA (ECHA, 2016).
Des adduits à l’ADN sont induits dans les granulocytes et les lymphocytes chez les alcooliques et dans les leucocytes chez les fumeurs lors d’expositions à l’acétaldéhyde ce qui indique que l’acétaldéhyde réagit directement avec l’ADN (ECHA, 2016).
Chez l'animal
Toutes voies
Les différentes études montrent que l’acétaldéhyde induit des mutations génétiques dans les cellules de moelle osseuse après injection intrapéritonéale ou chez la souris knockout ALDH2 mais pas chez la souris de génotype sauvage après inhalation (ECHA, 2016). Aucune mutation n’a été retrouvée dans les spermatides des souris mais ceci n’a été évalué qu’au cours d’une seule étude.
In vitro
Organismes procaryotes
L’acétaldéhyde n’est pas mutagène sur bactéries par le test d’Ames (ECHA, 2016).
Organismes eucaryotes
L’acétaldéhyde induit des réponses positives dans de nombreux tests de mutagénicité in vitro sur cellules de mammifères (ECHA, 2016). L’acétaldéhyde induit des mutations sur cellules de lymphomes de souris (L5178Y), des aberrations chromosomiques et des micronoyaux sur fibroblastes cutanés de rat en culture primaire. L’induction de ces mutations géniques et chromosomiques est dose-dépendante. L’acétaldéhyde induit également des aberrations chromosomiques sur fibroblastes diploïdes d’embryon de cobaye et des micronoyaux sur cellules de cobaye (V79).
L’acétaldéhyde induit des mutations génétiques et est génotoxique in vitro, incluant des échanges entre chromatides sœurs (SCE), des aberrations chromosomiques et des micronoyaux sur différentes lignées cellulaires sans addition d’activateur métabolique ce qui suggère un mécanisme d’action direct (ECHA, 2016). Des adduits à l’ADN et des pontages ADN- protéines sont également rapportés (ECHA, 2016).
Dans des lymphocytes humains, l’acétaldéhyde induit des mutations géniques dose-dépendantes, des aberrations chromosomiques et des micronoyaux. Les résultats sont cohérents entre les différentes études (ECHA, 2016). Cependant, il a été noté une absence de mutation au niveau du locus hprt alors que des mutations sont observées au locus tk (Budinsky et al., 2013). Des mutations au niveau du locus hprt sont cependant retrouvées dans d’autres études.
Mécanisme d'action
L’acétaldéhyde est clastogène, mutagène et aneugène in vitro sur cellules de mammifères, ces résultats semblent être confirmés in vivo mais en raison de résultats limités il reste difficile de conclure quant au mécanisme d’action.
Dans son analyse menée lors de l’élaboration de VGAI, l’ANSES rappelle que l’acétaldéhyde et le formaldéhyde présentent de nombreuses similitudes réactionnelles et du fait de cette analogie, retient qu’un seuil de dose puisse exister pour les cancers induits par l’acétaldéhyde lors d’expositions par voie respiratoire (Anses, 2014).
L’INERIS considère que le panel d’études concernant l’acétaldéhyde est moins complet que celui du formaldéhyde et que certains des résultats disponibles tendent à montrer que l’acétaldéhyde lui-même pourrait être un cancérogène génotoxique, ce qui ne permet pas, dans l’état actuel des connaissances, d’exclure complètement un mécanisme d’action génotoxique. En conséquence et par prudence, il est proposé de retenir un mécanisme d’action sans seuil de dose.
Synthèse
L’acétaldéhyde est mutagène, clastogène et aneugène in vitro sur cellules de mammifères. Les résultats in vivo ne sont pas suffisants pour conclure quant au mécanisme d’action. Par prudence, l’INERIS retient une approche sans seuil de dose. Si l’acétaldéhyde n’est pas encore classé par l’Union Européenne, il a été proposé comme mutagène pour la classe 2 en 2016.
Effets sur la reproduction
Chez l'homme
Toutes voies
Aucune étude sur les effets sur la reproduction n’est disponible.
Chez l'animal
Toutes voies
Aucune donnée n’est disponible sur les effets sur la reproduction après exposition par voie orale, inhalation ou cutanée
Autres voies d'exposition
Par contre, lors d’une étude sur la reproduction (Lahdetie, 1988), il a été administré à des souris mâles une injection intrapéritonéale journalière de solutions salines contenant 62,5 - 125 ou 250 mg.kg-1 d’acétaldéhyde pendant 5 jours. Aucun effet significatif n’a été observé sur la fréquence d’apparition de micronoyaux dans le sperme, les testicules ou la vésicule séminale. Cependant, cette étude n’évalue que quelques points de la toxicité et ne permet pas de conclure sur les effets toxiques de l’acétaldéhyde sur la reproduction.
En ce qui concerne la fertilité, des études in vitro ont montré que l’acétaldéhyde est un inhibiteur potentiel de la synthèse des stéroïdes au niveau testiculaire (à 50 µM d’acétaldéhyde, Cicero et Bell, 1980). In vitro à 600 µM, l’acétaldéhyde inhibe la conversion de la prégnénolone en testostérone (Johnston et al., 1981).
Synthèse
Chez l’animal, il n’existe pas de données sur la reproduction pour les voies habituelles d’exposition.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Classification par l’Union Européenne : l’acétaldéhyde n’a pas été classé par l’Union EuropéenneA noter que les effets reprotoxiques n’ont pas été réévalués en 2016 par le « Risk Assessment Committee » de l’ECHA. | 2008 |
Chez l'homme
Toutes voies
Aucune étude sur les effets sur le développement n’est disponible.
Chez l'animal
Toutes voies
Aucune donnée n’est disponible sur la toxicité de l’acétaldéhyde sur le développement après exposition par inhalation ou par voie cutanée et peu d’études existent pour la voie orale.
Une étude (Padmanabhan et al., 1983), après administration par voie orale de 50, 75, 100, 150 mg.kg-1 d’acétaldéhyde entre le 8ème et 15ème jour de gestation chez des rates, a montré une augmentation significative dose-dépendante des malformations fœtales et du nombre de résorptions.
Injection
Il existe plusieurs études sur la toxicité de l’acétaldéhyde sur le développement après injection intraveineuse et intrapéritonéale. Ces études montrent que l’administration par voie parentérale d’acétaldéhyde à des rates et à des souris en gestation induit des malformations fœtales. Dans la majorité de ces études, la toxicité maternelle n’est pas évaluée (OMS IPCS, 1995).
Dans d’autres études menées chez la rate, l’acétaldéhyde s’est avéré tératogène, embryotoxique et entraîne des retards de croissance. Sreenathan et al. (1982) ont évalué le développement des embryons après injection intrapéritonéale de 50, 75 ou 100 mg.kg-1 d’acétaldéhyde à des rates au 10ème, 11ème ou 12ème jour de gestation ou après injection intraveineuse chaque jour du 10ème au 12ème jour de gestation. Une augmentation significative du nombre de résorptions ainsi qu’un retard de croissance ont été observés. Une augmentation des malformations a été montrée pour les concentrations élevées. Aucune relation dose dépendante n’a été notée. Les mêmes auteurs ont étudié l’ossification après injection intrapéritonéale entre le 8ème et 15ème jour de gestation de 50 mg.kg-1 d’acétaldéhyde. L’ossification était retardée de 1 à 2 jours chez le rat (Sreenathan et al., 1982).
Dans une étude réalisée chez des souris, il a été montré que l’acétaldéhyde ne produisait pas d’effet sur le poids des fœtus, le nombre de résorptions, de malformations après cinq injections intrapéritonéales d’acétaldéhyde à 200 mg.kg-1 au 10ème jour de gestation (Blakley et Scott, 1984a). Aucune modification histologique n’a été observée après une injection unique intrapéritonéale de concentrations comprises entre 60 et 480 mg.kg-1 d’acétaldéhyde au 9ème jour de gestation (Bannigan et Burke, 1982). Après une ou deux injections intrapéritonéales chez des souris en gestation de 320 mg.kg-1 d’acétaldéhyde au 6, 7, 8, 9ème jour de gestation, une diminution significative du poids du fœtus et une petite augmentation des malformations ont été observées (Webster et al., 1983). Cependant, il n’a pas toujours été utilisé de groupes témoins.
Par contre, chez des souris, après de multiples injections intraveineuses (de 40 à 80 mg.kg-1.j-1 d’acétaldéhyde du 7ème au 9ème jour de gestation), une augmentation significative, dose dépendante, du nombre de résorptions, une diminution du poids des fœtus, une diminution de la longueur du vertex-coccyx[1] et une légère augmentation des malformations ont été notées (O'Shea et Kaufman, 1979).
Les études in vivo disponibles sur la toxicité de l’acétaldéhyde sur le développement du fœtus sont rassemblées dans le tableau suivant :
Synthèse des principales études sur le développement lors d’exposition à l’acétaldéhyde
|
Espèces |
Voie d’exposition |
Période d’exposition (j.g ;)* |
Concentration (mg.kg-1) |
Effets |
Références |
|---|---|---|---|---|---|
|
Rats |
Orale |
8-15ème |
50, 75, 100, 150 |
des résorptions, des malformations concentration dépendante |
Padmanabhan et al., 1983 |
|
Rats |
IP |
10-12ème |
50, 75, 100 |
du nombre de résorptions, de malformations (aux concentrations élevées) Retard de croissance |
Sreenathan et al., 1982 |
|
Rats |
IP |
8-15ème |
50 |
Ossification retardée |
Sreenathan et al., 1982 |
|
Souris |
IP |
10ème |
200 ´ 5 |
RAS |
Blakley et Scott, 1984a |
|
Souris |
IP |
9ème |
60 - 480 |
Aucun changement histologique |
Bannigan et Burke, 1982 |
|
Souris |
IP |
6, 7,8,9ème |
320 |
Peu significatif |
Webster et al., 1983 |
|
Souris |
IV |
7-9ème 6-9ème |
40-80 50 |
du nombre de résorptions ¯ du poids du fœtus légère des malformations |
O’shea et Kaufman, 1979 |
IP : intrapéritonéale, IV : intra veineuse, * j.g : jour de gestation, : augmentation, ¯ : diminution
[1] Longueur du vertex-coccyx : Distance entre le point culminant de la courbure céphalique et un point situé au milieu de la ligne unissant les sommets des fesses, mesurée en millimètres pour déterminer l'âge de l'embryon
In Vitro
Plusieurs études ont permis d’examiner les propriétés embryotoxiques de l’acétaldéhyde sur des embryons de souris ou de rats in vitro. Ces études sont résumées dans le tableau ci-dessous :
Synthèse des principales études menée in vitro relatives aux effets de l’acétaldéhyde sur le développement
|
Espèces |
Age de l’embryon (jour) |
Concentrations |
Effets |
Référence |
|---|---|---|---|---|
|
Souris |
9 |
7,4 ; 19,7 ; 39,4 mg.mL-1 |
¯ du nombre de somites* et de la synthèse d’ADN |
Thompson et Folb, 1982 |
|
Souris |
8 |
17,6 µg.L-1 à 1,7 g.L-1 |
de la létalité malformations retard de croissance |
Higushi et Matsumoto, 1984 |
|
Rat |
9 |
0,20 à 1,980 mg.L-1 |
retard de croissance malformations La plus basse dose effective : 1,1 mg.L-1 NOAEL =0, 22 mg.L-1 |
Popov et al., 1982 |
|
Rat |
10 |
5, 25, 50, 75 et 100 µM |
retard de croissance ¯ de la synthèse totale de protéines La concentration la plus élevée est létale |
Campbell et Fantel, 1983 |
|
Rat |
11-12 |
100-200 (µM) |
Pas d’effet significatif |
Priscott, 1985) |
somite* : chacune des petites masses de mésoblaste résultant de la segmentation métamérique crânio-caudale du mésoblaste parachordal.
Synthèse
Chez l’animal, l’acétaldéhyde passe la barrière placentaire. Des effets tératogènes, de type retard de croissance, d’ossification ou augmentation du nombre de résorptions sont rapportés pour des expositions intrapéritonéales ou intraveineuses. Le classement de l’acétaldéhyde pour les effets sur la reproduction et le développement n’a pas été réévalué par l’Union Européenne en 2016.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’OMS IPCS propose une concentration tolérable (TC) de 2 000 µg.m-3 pour une exposition aiguë à l’acétaldéhyde par inhalation (1995).
Cette valeur est basée sur l’étude de Silverman et al., 1946 au cours de laquelle 12 volontaires sains (hommes et femmes) ont été exposés aux concentrations de 25 - 50 – 200 ppm soit 45, 90 ou 360 mg.m-3 d’acétaldéhyde, pendant 15 minutes. L’effet critique retenu est l’irritation oculaire à 90 mg.m-3 (NOAEC = 45 mg.m-3).
Facteur d’incertitude : un facteur 20 a été appliqué qui correspond à un facteur 10 pour prendre en compte la variabilité au sein de l’espèce humaine et un facteur 2 pour la qualité insuffisante des données.
Calcul : 45 mg.m-3 x 1/20 = 2,25 mg.m-3 soit 2 250 µg.m-3 arrondi à 2 000 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’OEHHA propose un REL de 470 µg.m-3 pour une exposition aiguë de 1 heure à l’acétaldéhyde par inhalation (2008).
Cette valeur est basée sur l’étude de Prieto et al. (2000) chez 61 adultes asthmatiques exposés à un aérosol d’acétaldéhyde pendant 2 minutes à des doses de 5 à 40 mg.mL-1. Chez les asthmatiques, la moyenne géométrique de la concentration en acétaldéhyde dans le nébuliseur induisant une diminution de 20 % du VEMS est de 17,55 mg.mL-1, avec un intervalle de confiance à 95 % (IC95%) de 4,72 – 38,2 mg.mL-1 (Prieto et al., 2000). Selon les caractéristiques du nébuliseur, la concentration de 4,72 mg.mL-1 est équivalente à 79 ppm, soit 142 mg.m-3 (OEHHA, 2008). L’effet critique retenu est une bronchoconstriction à 142 mg.m-3 (79 ppm). Ces effets pulmonaires sont confortés par ceux de l’étude de Silverman et al. (1946) rapportant des irritations du tractus respiratoire.
Facteur d’incertitude : un facteur d’incertitude de 300 a été appliqué qui correspond à un facteur 30 pour les différences toxicodynamiques intra-espèces liées à l’exacerbation de l’asthme chez les enfants et un facteur 10 pour l’utilisation d’une LOAEC.
Calcul : 142 mg.m-3 x 1/300 = 0,473 mg.m-3 soit 473 µg.m-3 arrondi à 470 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’OEHHA propose un REL de 300 µg.m-3 pour une exposition aiguë de 8 heures à l’acétaldéhyde par inhalation (2013).
Cette valeur est basée sur les études expérimentales (Appelman et al., 1982 ; Appelman et al., 1986) menées chez le rat Wistar pour des expositions par inhalation aux concentrations de 0 – 273 – 728 – 910 – 1 820 – 4 004 -9 100 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 4 semaines. L’effet critique retenu est une dégénérescence de l’épithélium olfactif observé à 720 mg.m-3 (LOAEC de 720 mg.m-3, NOAEC de 270 mg.m-3). Une benchmark concentration a été calculée au moyen d’un modèle polynomial continu, BMC05 de 178 mg.m-3. A partir de cette concentration un équivalent pour l’homme a été calculé en utilisant un facteur d’ajustement dosimétrique de 1,36 sur la base des données issues du modèle PBPK (178 mg.m-3 x 1,36 = 242,1 mg.m-3). Un ajustement au temps a également été réalisé pour tenir compte du caractère discontinu de l’exposition, il comprend une période de respiration intense liée à une activité physique plus importante car la durée d’exposition est de 8 heures, 242,1 mg.m-3 x (6 h/24 h) x (20 m3/10 m3) x (5 j/7 j) = 86,5 mg.m-3.
Facteur d’incertitude : un facteur d’incertitude de 300 a été appliqué qui correspond à un facteur Ö10 pour tenir compte des différences toxicodynamiques inter-espèces, Ö10 pour tenir compte des différences toxicocinétiques intra-espèce, 10 pour tenir compte des différences toxicodynamiques intra-espèce, notamment une potentielle exacerbation de l’asthme chez les enfants et Ö10 pour l’utilisation d’une étude subchronique.
Calcul : 86,5 mg.m-3 x 1/300 = 0,288 mg.m-3 soit 288 µg.m-3 arrondi à 300 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’ANSES propose une VGAI de 3 000 µg.m-3 pour une exposition court terme (1 heure) à l’acétaldéhyde par inhalation (2014)
Cette valeur est basée sur l’étude de Prieto et al., 2000, pour laquelle 61 asthmatiques et 20 volontaires sains ont été exposés avec un nébuliseur pendant 2 minutes à 5 -10 -20 puis 40 mg.mL-1 d’acétaldéhyde en solution saline. L’effet critique retenu est une bronchoconstriction chez les asthmatiques objectivée par une diminution de 20 % du volume expiratoire maximum en une seconde (VEMS). Cette diminution est observée chez les asthmatiques et est caractérisée par une moyenne géométrique de la concentration en acétaldéhyde dans le nébuliseur de 17,55 mg.mL-1 (IC95% : 4,72 – 38,2 mg.mL-1). L’ANSES retient donc une LOAEC de 4,72 mg.mL-1. Une conversion de la concentration en acétaldéhyde dans le nébuliseur en concentration dans l’air est effectuée en tenant compte des caractéristiques du nébuliseur utilisé (débit de 6 L.min-1 et quantité 0,18 mL.min-1 soit 30 mL.min-1). Ainsi, la concentration de 4,72 mg.L-1 correspond à une concentration de 142,3 mg.m-3. L’ANSES précise que la démarche utilisée est analogue à celle de l’OEHHA.
Facteur d’incertitude : un facteur d’incertitude de 45 a été appliqué qui correspond à un facteur 3 pour tenir compte de la variabilité intra-individuelle (manque de données sur la sensibilité des enfants), un facteur 5 pour l’utilisation d’une LOAEC (il a été retenu une valeur supérieure à 3 et inférieure à 10 en raison de la nature de l’effet critique et des sujets testés (bronchoconstriction chez des asthmatiques) et de l’apparition d’une variation de l’indicateur pharmacologique (augmentation de la sensibilité des bronches mise en évidence par une augmentation de la réaction à la métacholine), et un facteur 3 pour le manque de données nécessaires pour extrapoler l’exposition à l’aide d’un nébuliseur à une exposition sous forme gazeuse.
Calcul : 142,3 mg.m-3 x 1/45 = 3,162 mg.m-3 soit 3 162 µg.m-3 arrondi à 3 000 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Effets à seuil - Exposition chronique par inhalation :
L’OEHHA propose un REL de 140 µg.m-3 pour une exposition chronique à l’acétaldéhyde par inhalation (2008).
Comme pour le REL pour 8 heures (décrit pour les expositions aiguës), cette valeur est basée sur les études expérimentales menées chez le rat Wistar pour des expositions par inhalation aux concentrations de 0 – 273 – 728 – 910 – 1 820 – 4 004 -9 100 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 4 semaines (Appelman et al., 1982 ; Appelman et al., 1986). L’effet critique retenu est une dégénérescence de l’épithélium olfactif observé à 720 mg.m-3 (LOAEC de 720 mg.m-3, NOAEC de 270 mg.m-3). Une benchmark concentration BMC05 de 178 mg.m-3 a été calculée au moyen d’un modèle polynomial continu. A partir de cette concentration un équivalent pour l’homme a été calculé en utilisant un facteur d’ajustement dosimétrique de 1,36 sur la base du modèle PBPK (178 mg.m-3 x 1,36 = 242,1 mg.m-3). Un ajustement au temps a également été réalisé pour tenir compte du caractère discontinu de l’exposition
242,1 mg.m-3 x (6 h/24 h) x (5 j/7 j) = 43,2 mg.m-3.
Facteur d’incertitude : Un facteur d’incertitude de 300 a été appliqué qui correspond à un facteur 10 pour la variation inter-espèces (facteur Ö10 pour tenir compte des différences toxicodynamiques inter-espèces et Ö10 pour tenir compte des différences de toxicocinétiques intra-espèce), 10 pour tenir compte des différences toxicodynamiques intra-espèce notamment une potentielle exacerbation de l’asthme chez les enfants, et Ö10 pour l’utilisation d’une étude de durée inférieure à une étude chronique.
Calcul : 43,2 mg.m-3 x 1/300 = 0,144 mg.m-3 soit 140 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’US EPA propose une RfC de 9 µg.m-3 pour une exposition chronique par inhalation à l’acétaldéhyde (1991).
Cette RfC a été établie, sur la base des mêmes études expérimentales chez des rats (10 mâles) ayant inhalé 0, 150 et 500 ppm, soit 0, 273 et 900 mg.m-3 d’acétaldéhyde, 6 heures par jour, 5 jours par semaine pendant 4 semaines (Appelman et al., 1982 ; Appelman et al., 1986). Une NOAEC de 150 ppm (soit 273 mg.m-3) pour la dégénérescence de l’épithélium olfactif des rats a été déterminée à partir de cette étude.
Une NOAEC ajustée (NOAECADJ) a été calculée pour le passage d’une exposition discontinue à une exposition continue :
NOAECADJ = NOAEC ´ (6 h/24 h) ´ (5 j/7 j) = 273 mg.m-3 ´ (6 h/24 h) ´ (5 j/7 j) = 48,75 mg.m-3
Afin de déterminer une NOAECHEC, les doses de l’acétaldéhyde se trouvant dans la région extrathoracique ont été estimées chez l’homme et l’animal :
NOAECHEC = NOAECADJ ´ RGDR = 48,75 mg.m-3 ´ 0,175 = 8,7 mg.m-3
VVa : volume ventilatoire par minute chez l’animal (rat) = 0,23 m3
VVh : volume ventilatoire par minute chez l’homme = 20 m3
Sa(ET) : surface de la région extrathoracique chez l’animal (rat) = 11,6 cm²
Sh(ET) : surface de la région extrathoracique chez l’homme = 177 cm²
RGDR(ET) : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire = (Mva/Sa)/(MVh/Sh) = (0,23/11,6)/(20/177) = 0,175
Facteur d’incertitude : Un facteur d’incertitude de 1 000 a été appliqué qui correspond à un facteur 10 pour couvrir la variabilité inter-espèce et le manque de données, un facteur 10 pour tenir compte de la variabilité intra-espèce et à un facteur 10 pour l’utilisation d’une étude de durée inférieure à une étude chronique.
Calcul : 8,7 mg.m-3 ´ 1/1 000 = 8,7.10-3 (arrondi à 9.10-3 mg.m-3)
Indice de confiance : L’US EPA accorde un indice de confiance moyen dans l’étude source du fait de sa durée jugée courte, un indice de confiance faible dans la base de données du fait de l’absence de données pour des expositions chroniques et la non prise en compte des effets sur la reproduction et le développement. Par conséquent, l’organisme accorde un indice de confiance faible dans la RfC qu’il a élaboré.
L’OMS IPCS (1995) propose une CT (concentration tolérable) de 300 µg.m-3 pour une exposition chronique à l’acétaldéhyde par inhalation (1995).
Cette valeur est basée sur l’étude expérimentale d’Appelman et al. (1986) menée chez le rat pour des expositions par inhalation aux concentrations de 0 – 273 – 910 mg.m-3, 6 heures par jour, 5 jours par semaine pendant 4 semaines. Trois groupes d’exposition ont été formés, un premier exposé pendant 6 heures de manière continue, un second exposé pendant 6 heures avec une interruption de 1,5 heures (2 x 3 h), et un dernier également exposé avec une interruption mais avec des pics de concentration (6 fois la concentration de base). L’effet critique retenu est l’irritation au niveau du tractus respiratoire observé à 900 mg.m-3 avec ou sans interruption de l’exposition (NOEC = 273 mg.m-3).
Facteur d’incertitude : Un facteur d’incertitude de 1 000 a été appliqué, un facteur 10 pour tenir compte de la variabilité inter-espèce, un facteur 10 pour la variabilité intra-espèce, et un facteur 10 pour tenir compte de l’utilisation d’une étude de durée inférieure à une étude chronique et de la sévérité des effets (cancérogénicité associée à l’irritation).
Calcul : 275 mg.m-3 ´ 1/1 000 = 0,275 mg.m-3 arrondi à 0,3 mg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Santé Canada propose une CT (concentration tolérable) de 390 µg.m-3 pour une exposition chronique à l’acétaldéhyde par inhalation (2004).
Pour l’inhalation, les études qui permettent la meilleure caractérisation de la dose-réponse pour les effets critiques non cancérogènes chez l’espèce la plus sensible (rats) sont les études à court terme de Appelman et al., 1982 ; Appelman et al., 1986. En conséquence, il a été calculé une CT (concentration tolérable) à partir d’une CA (concentration admissible) pour la dégénérescence de l’épithélium olfactif nasal chez des rats Wistar exposés à l’acétaldéhyde, par inhalation, pendant quatre semaines. Sur cette base, la CA0,05 (concentration provoquant une hausse de 5 % de la fréquence des lésions non néoplasiques dans l’épithélium olfactif nasal) chez les rats Wistar mâles (sexe le plus sensible), calculée à l’aide du logiciel THRESH (Howe, 1995), a été établie à 357 mg.m-3. La limite inférieure de l’intervalle de confiance à 95 % pour cette valeur (CAI 0,05) est de 218 mg.m-3. Une CT (concentration tolérable) a été calculée à partir de cette CAI 0,05 pour les lésions non néoplasiques de l’épithélium nasal des rats en prenant en compte le passage d’une exposition discontinue (6 heures par jour, 5 jours par semaine) à une exposition continue :
218 mg.m-3 ´ (6 h / 24 h) ´ (5 j / 7 j ) = 39 000 µg.m-3
Facteur d’incertitude : Un facteur d’incertitude de 100 a été appliqué avec un facteur 10 pour la variabilité interspécifique et un facteur 10 pour la variabilité intraspécifique.
Calcul : 39 000 µg.m-3 / 100 = 390 µg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
L’ANSES propose une VGAI de 160 µg.m-3 pour une exposition long terme à l’acétaldéhyde par inhalation (2014)
Cette valeur est basée sur l’étude expérimentale de Dorman et al. (2008) menée chez le rat pour des expositions par inhalation aux concentrations de 0 – 50 – 150 – 500 – 1 500 ppm soit 0 – 90 – 270 – 900 – 2 700 mg.m-3 d’acétaldéhyde, 6 heures par jour et 5 jours par semaine pendant 13 semaines. Les sacrifices ont été effectués au 4e – 9e – 14e -30e – 65e jours d’exposition (12/dose/durée d’exposition). Dorman et al. ont élaboré une VTR sur la base de leurs résultats, et ont utilisé le modèle PBPK de Teeguarden et al. (2008) afin de prendre en compte les différences dosimétriques entre le rat et l’homme. Toutefois cette approche n’a pas été retenue par l’ANSES pour la construction de sa valeur. En effet, le modèle PBPK a été jugé comme limité du fait de l’absence de sa validation chez l’homme et d’analyse de sa sensibilité.
L’Anses a retenu le même effet critique et la même dose critique que Dorman et al., à savoir la dégénérescence de l’épithélium olfactif caractérisée pour une NOAEC de 50 ppm (90 mg.m-3). Puis, une concentration équivalente pour l’homme a été calculée. L’acétaldéhyde est considéré comme un gaz de catégorie 1 selon l’US EPA 1994 car il induit des effets respiratoires au niveau extra-thoracique. La formule suivante a été appliquée :
NOAECHEC = NOAEC x RGDR (ET) = VA/SAA = 50 x 0,2/15 = 6,5 ppm
VH/SAH 20/200
VA : taux de ventilation chez le rat = 0,2 m3.j-1
VH : taux de ventilation chez l’homme = 20 m3.j-1
SA : surface de la région extrathoracique des rats = 15 cm²
SH : surface de la région extrathoracique chez l’homme = 200 cm²
RGDR(ET) : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire
Considérant que les effets de type altération de l’épithélium respiratoire sont davantage dépendants de la concentration d’exposition que de la durée d’exposition, l’Anses n’a pas effectué d’ajustement au temps pour tenir compte du caractère discontinu de l’exposition.
Facteur d’incertitude : Un facteur d’incertitude de 75 a été appliqué qui correspond à un facteur de 2,5 pour la variabilité inter-espèce, un facteur de 10 pour la variabilité intra-espèce et un facteur de 3 pour tenir compte de l’utilisation d’une étude subchronique.
Calcul : 6,5 ppm x 1/75 = 0,087 ppm soit 0,156 mg.m-3 (arrondi à 0,09 ppm et 160 µg.m-3)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Effets sans seuil - Exposition chronique par inhalation :
L’US EPA propose un ERUi de 2,2.10-6 (µg.m-3)-1 pour une exposition chronique à l’acétaldéhyde par inhalation (US EPA 1988)
Cet ERUi a été établi à partir d’une étude par inhalation chez des rats exposés à des concentrations de 0, 750, 1 500, 3 000 ppm soit 0, 1 350, 2 700, 5 400 mg.m-3 d’acétaldéhyde, 7 heures par jour, 5 jours par semaine pendant 27 mois (Woutersen et al., 1984). L’effet critique était l’augmentation de l’incidence des adénocarcinomes et des carcinomes des cellules squameuses de la cloison nasale. Les données sont présentées dans le tableau ci-dessous.
Incidence des adénocarcinomes et des carcinomes des cellules squameuses de la cloison nasale Woutersen et al., 1984 :
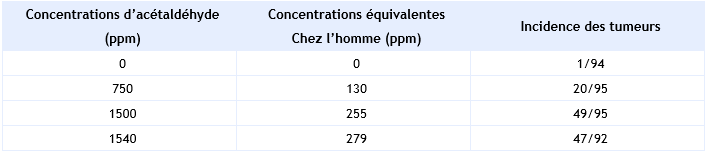
L’ERUi a été calculé à l’aide d’un modèle linéarisé multi-étapes à partir des données citées ci-dessus. L’ERUi calculé pour des rats femelles de 18 mois est de 1,6 10-6 (mg.m-3)-1. L’ERUi pour l’homme a été calculé à partir du résultat obtenu pour l’animal et est de 2,2 10-6 (µg.m-3)-1 ce qui correspond à 5 µg.m-3 pour un risque de 10-5 et à 0,5 µg.m-3 pour un risque de 10-6. Cette valeur ne doit pas être utilisée si la concentration inhalée excède 5 103 µg.m-3 d’acétaldéhyde.
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Santé Canada propose une CT0,05 de 86 mg.m-3 pour une exposition chronique par inhalation à l’acétaldéhyde (Santé Canada, 2000).
Il a été calculé une estimation de la cancérogénicité (CT0,05) fondée sur la fréquence croissante des tumeurs nasales (carcinomes des cellules squameuses, adénocarcinomes et carcinomes in situ) chez les rats Wistar mâles et femelles exposés, par inhalation, à l’acétaldéhyde pour des périodes pouvant atteindre 28 mois (Woutersen et al., 1986). Le lot exposé à la concentration la plus élevée n’a pas été inclus dans le calcul de la CT0,05, puisque les auteurs ont dû réduire graduellement le degré d’exposition de 5 400 à 1 800 mg.m-3 en raison d’un taux de mortalité trop élevé. La valeur de la CT0,05 a été calculée à l’aide d’un modèle multi-étapes. La CT0,05 calculée pour les adénocarcinomes nasaux et les carcinomes des cellules squameuses chez les sujets du sexe le plus sensible (mâle) est de 478 mg.m-3. Avec ajustement d’une exposition discontinue à une exposition continue, la nouvelle valeur calculée est :
CT0,05 = 478 mg.m-3 ´ (6 h / 24 h) ´ (5 j/ 7 j) = 86 mg.m-3
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’INERIS propose de retenir pour une exposition aiguë (1 heure) à l’acétaldéhyde par inhalation la VTR chronique de 3 000 µg.m-3 issue de la VGAI de l’ANSES (2014).
Trois VTR sont disponibles pour des expositions aiguës : une de l'OMS IPCS (1995) et deux de l’OEHHA (2008, 2013) qui a élaboré une valeur pour une durée d’exposition de 1 heure et l’autre pour une durée d’exposition de 8 heures.
L’OMS IPCS a fait une proposition de valeur sur la base de l’étude de Silverman et al. (1946). Toutefois, le protocole employé dans cette étude ancienne manque de transparence et les données ne sont pas précisément rapportées. S’agissant d’une étude de qualité limitée, la valeur n’est pas retenue.
Pour une exposition aiguë de 8 heures, l’OEHHA (2013) a retenu les études d’Appelman et al. (1982, 1986). Toutefois, la durée des études (4 semaines chez des rats) et l’effet critique retenu (dégénérescence de l’épithélium olfactif) ne sont pas pertinents pour une VTR de 8h. L’effet découle d’expositions répétées, la valeur n’est donc pas retenue.
L’OEHHA (2008) a également construit une VTR pour une exposition aiguë d’une heure en se basant sur l’étude jugée de bonne qualité (Prieto et al., 2000). L’effet critique retenu est une bronchoconstriction chez les asthmatiques. Compte tenu des données disponibles, ce choix est cohérant avec le profil toxicologique de l’acétaldéhyde mais l’étude a été menée sur une population sensibilisée.
En 2014, l’ANSES a développé une VGAI aiguë, cette valeur est construite à partir de la même étude que celle retenue par l’OEHHA (Prieto et al. 2000), le même effet et la même concentration critique (LOAEC) pour établir une VGAI aiguë d’une heure. Cependant, les deux organismes n’ont pas retenu les mêmes facteurs d’incertitudes
Détails des facteurs d’incertitudes retenus par l’OEHHA pour construire une VTR aiguë (1 h) et par l’ANSES pour déterminer une valeur guide (1 h) :
UF : facteur d’incertitude, UFH : variabilité inter-individuelle, UFL : utilisation d’une LOAEC, UFD : manque de données
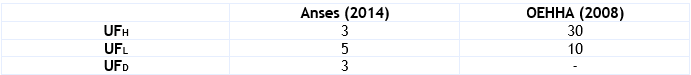
L’OEHHA et l’Anses ont appliqué des facteurs pour prendre en compte la variabilité inter-individuelle et l’utilisation d’une LOAEC. Ces facteurs sont pertinents. Toutefois, les valeurs attribuées par l’OEHHA à ces facteurs sont plus élevées que celles données par l’ANSES. L’OEHHA a retenu un facteur de 30 pour tenir compte des différences toxicodynamiques intra-espèces liées à l’exacerbation de l’asthme chez les enfants, alors que l’étude porte déjà sur une population d’asthmatiques. Ce facteur de 30 parait trop élevé, la valeur de 3 retenue par l’ANSES semble mieux adaptée.
Concernant le facteur d’incertitude appliqué pour l’utilisation d’une LOAEC, l’OEHHA retient une valeur de 10 alors que l’ANSES retient celle de 5. Cette dernière quoique inhabituelle, est clairement argumentée par l’ANSES et semble suffisante.
Par ailleurs, l’ANSES a appliqué un facteur supplémentaire pour tenir compte du manque de données sur la transposition de l’exposition (exposition par nébuliseur-exposition gazeuse). Ce facteur non pris en compte par l’OEHHA semble pertinent.
Malgré la faible durée d’exposition (2 min), l’étude de Prieto et al. (2000) est de bonne qualité et recevable pour une VTR aiguë pour une exposition d’une heure. Les facteurs d’incertitude appliqués par l’ANSES pour construire une VGAI court terme nous paraissent cohérents pour construire une VTR aiguë et plus pertinents que ceux retenus par l’OEHHA. La construction de la VGAI suivant une démarche scientifique similaire à celle d’une VTR, la valeur guide de l’ANSES est retenue par l’INERIS pour une exposition d’une heure à l’acétaldéhyde.
Indice de confiance : L’étude source est de bonne qualité. Cependant la durée de l’étude est courte et représente davantage le scénario d’une exposition accidentelle. L’indice de confiance est donc moyen.
Effets à seuil - Exposition chronique par inhalation :
L’INERIS retient pour une exposition chronique à l’acétaldéhyde par inhalation la valeur de 160 µg.m-3 de l’Anses (2014).
Quatre organismes (US EPA, 1991 ; OMS IPCS, 1995 ; Santé Canada, 2000 ; OEHHA, 2008) proposent des VTR pour une exposition chronique à l’acétaldéhyde par inhalation.
L’US EPA, Santé Canada et l’OEHHA basent leur calcul sur les deux mêmes études expérimentales chez le rat (Appelman et al., 1982 ; Appelman et al., 1986). La qualité de ces deux études est recevable, néanmoins, elles correspondent à des études pour des durées d’expositions subaiguës. La durée de ces 2 études est donc jugée courte pour la construction d’une VTR chronique. L’OMS se base sur une seule de ces études (Appelman et al., 1986), toutefois, il s’agit de l’étude permettant de caractériser la dose critique (NOAEC). Ce choix est donc similaire à celui de l’US EPA, de Santé Canada et de l’OEHHA, aucune de ces 4 VTR n’est retenue par l’INERIS.
En 2014, l‘Anses a construit une VGAI long terme à partir d’une étude plus récente pour une durée d’exposition plus longue (subchronique) (Dorman et al,. 2008) ce qui apparait plus pertinent. L’étude de Dorman et al. jugée de bonne qualité n’était cependant pas disponible au moment de l’élaboration des VTR de l’US EPA, l’OMS, l’OEHHA ou encore de Santé Canada.
Tout comme l’ensemble des organismes ayant construit une VTR chronique, l’Anses a retenu la dégénérescence de l’épithélium olfactif comme effet critique, ce qui est cohérent avec le profil toxicologique de l’acétaldéhyde.
Une NOAEC ajustée a été calculée pour tenir compte des différences dosimétriques entre le rat et l’homme. Ce calcul est détaillé et justifié. Aucun ajustement au temps n’a été pratiqué car l’effet critique est considéré comme dose-dépendant.
L’ANSES a appliqué des facteurs d’incertitude pour tenir compte à la fois de la variabilité toxicodynamique inter-espèce (2,5), de la variabilité intra-espèce (10) et de l’utilisation d’une étude subchronique à défaut d’une étude chronique (3) ce qui est pertinent.
Aucun élément de gestion n’ayant été introduit, cette VGAI long terme peut être considérée comme une VTR. En outre, les choix de l’étude source, des ajustements dosimétriques et des facteurs d’incertitude sont cohérents. Par conséquent, l’INERIS propose de retenir la valeur proposée par l’ANSES pour une exposition chronique à l’acétaldéhyde.
Indice de confiance : L’étude source est de bonne qualité, la démarche est bien détaillée, toutefois, il s’agit d’une étude source subchronique. L’indice de confiance est moyen.
Effets sans seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir pour une exposition chronique à l’acétaldéhyde par inhalation la VTR chronique de 2,2.10-6 (µg.m-3)-1 de l’US EPA (1988).
Deux organismes (US EPA (1988) et Santé Canada (2000) proposent une valeur. Ils se basent tous les deux sur la même étude source rapportée dans deux articles différents (Woutersen et al., 1984) et (Woutersen et al., 1986). Ces études sont de qualité recevable malgré des limites liées notamment à un taux de mortalité élevé.
L’effet critique retenu est l’augmentation de l’incidence des adénocarcinomes et des carcinomes des cellules squameuses de la cloison nasale. Cet effet critique local est cohérent avec le profil toxicologique de la substance.
La démarche rapportée par l’US EPA utilisant le calcul d’une concentration équivalente chez l’homme nous paraît plus clairement décrite.
Le mécanisme d’action identifié (cf. § 3.3.3.1.4) n’invalide pas la possibilité que l’acétaldéhyde puisse aussi être un cancérogène génotoxique, aussi l’INERIS propose de retenir la valeur de l’US EPA pour des effets sans seuil dans l’attente d’éléments plus probants.
Indice de confiance : L’étude présente des limitations. L’indice de confiance est moyen.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. L'ensemble des informations et des données de ce chapitre provient de diverses revues bibliographiques publiées par des organismes reconnus pour la qualité scientifique de leurs documents (CERI, 2007 ; Kegley et al., 2007 ; OMS IPCS, 1995 ; Santé Canada, 2000). Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon des critères définis (Klimisch et al., 1997). Klimisch et al. (1997) ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après : • Score 1 : valide (sans restriction) • Score 2 : valide avec restriction • Score 3 : non valide • Score 4 : pas suffisamment d'information pour valider le test On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2). Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC. Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Synthèse
Eau douce
Paramètres d’écotoxicité aiguë :
Pour les organismes aquatiques, la majorité des résultats correspond à des études de toxicité aiguë. Aucune étude sur insectes, batraciens ou sur le compartiment sédimentaire n’a été répertoriée. Enfin, de nombreuses données, relativement anciennes, ont été générées en semi-statique en absence de suivi analytique. Vis-à-vis des organismes aquatiques, les CE50 ou CL50 de l’acétaldéhyde sont relativement disparates indépendamment des taxons étudiés, de la durée d’exposition des organismes et en utilisant la moyenne géométrique des valeurs obtenues lorsque plusieurs données sont disponibles pour une même espèce. Vis-à-vis des protozoaires, et plus particulièrement pour le Spirostomum ambiguum, la CE50 48 heures est de 48,9 mg.L-1. Les algues sont en général moins sensibles que les protozoaires. Ainsi, les CE50 24 – 120 heures sont comprises entre 4,4 et 270 mg.L-1 avec une moyenne géométrique de 107 mg.L-1. Vis-à-vis des invertébrés dulçaquicoles ou marins, une disparité similaire est observée. Pour ce taxon, les CL50 0,5 – 96 heures sont comprises entre 19,3 et 5 807 mg.L-1. Dans ce cas, la moyenne géométrique est de 129,2 mg.L-1. Pour les poissons dulçaquicoles ou marins, les CL50 24 heures – 14 jours sont comprises entre 2,2 et 131,8 mg.L-1 avec une moyenne géométrique de 24,4 mg.L-1. Pour les stades embryo-larvaires de poissons, les symptômes liés à une exposition à l’acétaldéhyde sont similaires à ceux liés à une exposition à l’éthanol, dont l’acétaldéhyde est le principal métabolite. Les œdèmes péricardiaques sont les principaux effets morphologiques. Dans une moindre mesure, un retard de développement est observé, caractérisé notamment par une diminution de la longueur axiale, des œdèmes du sac vitellin et des malformations des otolithes Reimers et al., 2004.
Protozoaires :
Pour les protozoaires, en utilisant comme critère d’effet la croissance, des CE5 20-72 heures comprises entre 52 et 82 mg.L-1 ont été rapportées par Bringmann, 1978 ; Bringmann et Kühn, 1980 ; Bringmann et al., 1980. En utilisant le même critère, la CE50 9 heures pour Tetrahymena pyriformis est de 44 mg.L-1 (Sauvant et al., 1995). Vis-à-vis de Spirostomum ambiguum, la CE50 48 heures est de 48,9 mg.L-1 (Nalęcz-Jawecki et Sawicki, 2002).
Algues :
Vis-à-vis des algues, aucune donnée de toxicité de l’acétaldéhyde compatible avec le TGD (Technical Guide Document) n’a été répertoriée. Tous les essais sont insuffisamment décrits et ont été réalisés durant des périodes de temps inférieures ou supérieures à 72 heures. Quel que soit le critère d’effet retenu, vis-à-vis des algues dulçaquicoles ou marines, la CE50 48-120 heures est comprise entre 4,4 (Raphidocelis subcapitata, Chen et al., 2005) et 270 mg.L-1 (Chlorococcales, Krebs, 1991).
Invertébrés :
Vis-à-vis des crustacés dulçaquicoles, la moyenne géométrique de la CL50 48–96 heures de l’acétaldéhyde est de 157 mg.L-1. Toutefois, vis-à-vis des invertébrés, la toxicité aiguë de l’acétaldéhyde est très variable. La variabilité est liée principalement à des différences inter essais. Ainsi, vis-à-vis de la daphnie (Daphnia magna), la CE(L)50 48-96 heures est comprise entre 4,7 et 12 423 mg.L-1. Parallèlement, la CL50 48 heures vis-à-vis de Daphnia pulex est de 5 807 mg.L-1 (von der Ohe et al., 2005) et la CL50 en dynamique vis-à-vis de Gammarus pseudolimnaeus est de 19,3 mg.L-1 (Brook, 1987).
Pour les mollusques, un CL50 0,5 heure supérieure à 440 mg.L-1 a été obtenue sur Lymnaea stagnalis (Mills et al., 1990).
Poissons :
Vis-à-vis des poissons, peu de données provenant d’essais réalisés sur une durée supérieure ou égale à 96 heures sont disponibles pour l’acétaldéhyde.
Pour les poissons dulçaquicoles, la CL50 96 heures la plus faible de 2,2 mg.L-1 a été obtenue sur la truite arc-en-ciel (Onchorhynchus mykiss ; Office of Pesticide Programs, 2000, cité par Kegley et al., 2007) et la plus élevée de 28,07 mg.L-1 sur le tête de boule (Pimephales promelas ; Brook, 1987 ; Brook et al., 1984 ; Geiger et al., 1990, cités par Kegley et al., 2007). Pour cette espèce, un essai en flux dynamique mené à 24 °C avec des poissons âgés de 30 jours a conduit à une CL50 96 heures de 30,8 mg.L-1, exprimée en concentration mesurée (Brooke et al., 1984, cités par Santé Canada, 2000). D’autres valeurs sont disponibles pour des essais d’une durée minimale de 96 heures. Ainsi, vis-à-vis du Lepomis macrochirus, la moyenne géométrique sur 3 CL50 96 heures est de 18,07 mg.L-1 (Academy of Natural Sciences, 1960 ; Cairns et Scheier 1968 ; Office of Pesticide Programs, 2000, cité par Kegley et al., 2007). De même, chez le guppy (Poecilia reticulata), une CL50 14 jours de 35 mg.L-1 a été déterminée en semi-statique (Deneer et al., 198888, cités par IPCS, 1995).
Amphibiens :
Aucune donnée sur les amphibiens n’a été répertoriée.
Résumé : Des essais ont été réalisés sur 3 niveaux trophiques (algues, invertébrés, poissons) ainsi que sur des bactéries et protozoaires, cependant beaucoup n’ont pas été validés, ainsi il n’existe pas de données aiguës valides sur les algues et les plantes aquatiques. Une grande variabilité intraspécifique est observée chez les invertébrés notamment chez Daphnia magna qui est probablement due aux différentes conditions d’exposition à cette substance volatile. La CL50 valide la plus faible observée chez les invertébrés est de 4,2 mg.L-1 (pour Daphnia magna) et chez les poissons de 2,1 mg.L-1 (pour Lepomis macrochirus).
Paramètres d’écotoxicité chronique :
Aucune étude de toxicité chronique n’a été répertoriée pour les organismes aquatiques dulçaquicoles.
Eau marine
Paramètres d’écotoxicité aiguë :
Algues :
Vis-à-vis des algues, aucune donnée de toxicité de l’acétaldéhyde compatible avec le TGD (Technical Guide Document) n’a été répertoriée. Tous les essais sont insuffisamment décrits et ont été réalisés durant des périodes de temps inférieures ou supérieures à 72 heures. Quel que soit le critère d’effet retenu, vis-à-vis des algues dulçaquicoles ou marines, la CE50 48-120 heures est comprise entre 4,4 (Raphidocelis subcapitata, Chen et al., 2005) et 270 mg.L-1 (Chlorococcales, Krebs, 1991).
Invertébrés :
Vis-à-vis des crustacés marins, une CL50 96 heures de 27,36 mg.L-1 a été obtenue sur Americamysis bahia (Carr, 1987) et une CL50 48 heures est de 100 mg.L-1 sur la crevette grise Crangon crangon (Portmann et Wilson, 1971).
Poissons:
Aucune valeur de toxicité aiguë 96 heures n’a été recensée pour les poissons d’eau marine. Seuls, Daugherty et Garrett, 1951 (cités par CERI, 2007) indiquent une CL50 24 heures de 70 mg.L-1 pour le Lagodon rhomboides.
Paramètres d’écotoxicité chronique :
Aucune étude de toxicité chronique n’a été répertoriée pour les organismes aquatiques marins.
Sédiments d'eau douce
Paramètres d’écotoxicité aiguë :
Aucune donnée vis-à-vis des organismes du compartiment sédimentaire n’a été répertoriée.
Sédiments marins
Paramètres d’écotoxicité aiguë :
Aucune donnée vis-à-vis des organismes du compartiment sédimentaire n’a été répertoriée.
Sol
Paramètres d’écotoxicité aiguë :
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës :
Microorganismes:
L'acétaldéhyde est employé sous la forme de fumigène pour lutter contre le développement des bactéries et des champignons sur les fruits (Aharoni et Barkai-Golan, 1973 ; Aharoni et Stadelbacher, 1973 ; Yuen et al., 1995, cités par CERI, 2007 ; Santé Canada, 2000). Les concentrations induisant des effets observés pour 11 espèces de champignons sont comprises entre 540 et 357 000 mg.m-3. De plus, la détérioration des fruits par Penicillium italicum et P. digitatum est réduite respectivement de 95 et de 91 %, après une exposition de cinq jours à des vapeurs d’acétaldéhyde de 540 mg.m-3 (0,03 %, v/v ; Yuen et al., 1995, cités par Santé Canada, 2000).
Végétaux:
L’exposition de laitues (Lactuca sativa) durant 4 heures à des concentrations en acétaldéhyde comprises entre 54 000 et 108 000 mg.m-3 induit des modifications de la couleur et des nécroses des feuilles externes. Aucun effet n'a été observé à une concentration de 36 000 mg.m-3 (Aharoni et al., 1979 ; Stewart et al., 1980, cités par CERI, 2007). Par ailleurs, une concentration en acétaldéhyde de 1 520 mg.L-1 durant 3 jours induit un minimum de 50 % d’inhibition de germination des graines d’oignons, de carottes, d’amarantes (Amaranthus palmeri) et de tomates (Bradow et Connic, 1988 ; CERI, 2007).
Animaux:
Pour deux espèces de limace, Arion hortensis et Agriolimax reticulatus, la CL50 96 heures est respectivement de 8,91 et 7,96 mg.L-1 (Henderson, 1970, cité par CERI, 2007). Vis-à-vis des pucerons Myzus persicae et Acythosiphon kondai des concentrations en acétaldéhyde respectivement de 3 600 et 4 500 mg.m-3 induisent 100 % de mortalité indépendamment du stade de vie (Aharoni et al., 1979).
Chez les oiseaux, pour le canard (Anas platyrhynchos) et la caille (Colinus virginianus) les CL50 8 jours sont de 5 000 et 808 mg.kg-1, respectivement (Office of Pesticide Programs, 2000, cité CERI, 2007).
Pour les mammifères, aucune donnée n’a été répertoriée chez les animaux sauvages. Par voie orale chez le rat, la CL50 de l’acétaldéhyde est comprise entre 6 600 et 19 300 mg.kg-1 (Smyth et al., 1951 ; Sprince et al., 1974, cités CERI, 2007). Par inhalation, la CL50 4 heures est de 13 100 ppm (24 000 mg.m-3) (Appelman et al., 1982 ; CERI, 2007). Chez la souris la CL50 est de 102 090 mg.kg-1 (US NRC, 1977, cité par OMS IPCS, 1995) et chez le chien, la CL50 est supérieure à 26 400 mg.kg-1 (Booze et Oehme, 1986), cités par OMS IPCS, (1995)
Paramètres d’écotoxicité chronique :
Aucune étude de toxicité chronique n’a été répertoriée pour les organismes terrestres.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Compartiment aquatique :
Pour les organismes aquatiques, seuls des résultats de toxicité aiguë ont été répertoriés. La majorité des résultats correspond à des études relativement anciennes et ont donc été générés en semi-statique en absence de suivi analytique. Ainsi, sur l’ensemble des données recueillies, aucun résultat n’a pu être validé pour la détermination d’une PNEC du fait des conditions expérimentales ou de la difficulté d’obtention des rapports originaux. De ce fait, en s'appuyant sur la méthodologie européenne recommandée par le TGD, il n'est normalement pas possible de déterminer une PNEC pour le milieu aquatique en l'absence de données validées.
Toutefois, en estimant que les algues sont moins sensibles que les autres organismes aquatiques et en utilisant les études de l’Office of Pesticide Programs (2000), une PNECeau peut être proposée. Ainsi, en utilisant une CL50 48 heures de 4,7 mg.L-1 pour la daphnie (Daphnia magna) et une CL50 96 heures de 2,1 mg.L-1 pour le Crapet arlequin (Lepomis macrochirus), une PNECeau peut être calculée à partir de la valeur la plus faible soit 2,1 mg.L-1 et en utilisant un facteur de sécurité.
Compartiment sédimentaire :
En absence d’essai sur des organismes du sédiment, une PNEC sédiment ne peut pas être évaluée directement.
Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
Compartiment terrestre :
Pour l’acétaldéhyde une étude de toxicité chronique sur mammifère a été répertoriée. La NOECorale la plus faible est de 2 400 mg.kg-1. Elle a été obtenue sur le rat (Ratus norvegicus) en utilisant comme critère des effets histopathologiques hépatiques (Bankowski et al., 1993 ; Matysiak-Budnik et al., 1996).
Synthèse
Compartiment aquatique :
PNEC existantes :
Eau douce
Vis-à-vis des organismes aquatiques, un facteur de 1 000 est appliqué sur la CL50 la plus faible. La PNEC proposée est donc de 2,1/1 000 (mg.L-1), soit :
PNECeau-douce = 2,1 mg.L-1
Eau marine :
Pour prendre en compte la plus grande biodiversité du milieu marin, un facteur de 10 000 est appliqué à la CL50 la plus faible. La PNEC proposée est donc de 2,1/10 000 (mg.L-1), soit :
PNECeau-marine = 0,21 mg.L-1
Compartiment sédimentaire :
PNECmes = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1 150 kg.m-3)
Kmes-eau : Coefficient de partage entre les MES et l’eau (0,929 m3.m-3)
Feaumes + Fsolidmes x Kpmes/1 000) x RHOsolid
Feaumes : Fraction d’eau dans le sol (défaut : 0,9 m3.m-3)
Fsolidmes : Fraction solide dans les MES (défaut : 0,1 m3.m-3)
Kpmes : Coefficient de partage eau-MES (0,1156 L.kg-1)
D'où : PNECmes = 1,70 µg.kg-1 MES humides = 7,80 µg.kg-1 MES secs.
D'où :
PNECmes = 7,80 µg.kg-1 MES secs
Compartiment terrestre :
En accord avec le TGD, un facteur de sécurité de 30 peut être utilisé pour estimer une PNEorale
D'où :
PNECorale = 80 mg.kg-1 de nourriture
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :











