Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Sulfate de magnesium (7487-88-9)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
7487-88-9
Nom scientifique (FR)
Sulfate de Magnésium
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-298-2
Code SANDRE
-
Numéro CIPAC
-
Formule chimique brute
\(\ce{ MgO4S }\)
Code InChlKey
Code SMILES
[Mg++].[O-]S([O-])(=O)=O
Toxicologie
Dernière vérification le 29/03/2024
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
VGE/NQE Importer
SANTÉ HUMAINE
Comme il a été expliqué ci-avant, du fait de leurs propriétés physico-chimiques, les sulfates sont très hydrosolubles et n'ont pas vocation à s'accumuler dans les matrices biologiques. Aussi, il n'est pas jugé pertinent de définir une norme de qualité pour la protection de la santé humaine vis-à-vis de la consommation de produits de la pêche.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
Pas d'évaluation réglementaire connue
Effets endocriniens :
-
Critères PBT / POP :
-
Normes de qualité existantes :
Norme de qualité pour la protection des organismes aquatiques : -British Columbia (BCME, 2013; BCME, 2018) Dureté de l'eau (mg CaCO3/L)
128
Substance(s) associée(s) :
-
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
ECOTOXICITÉ
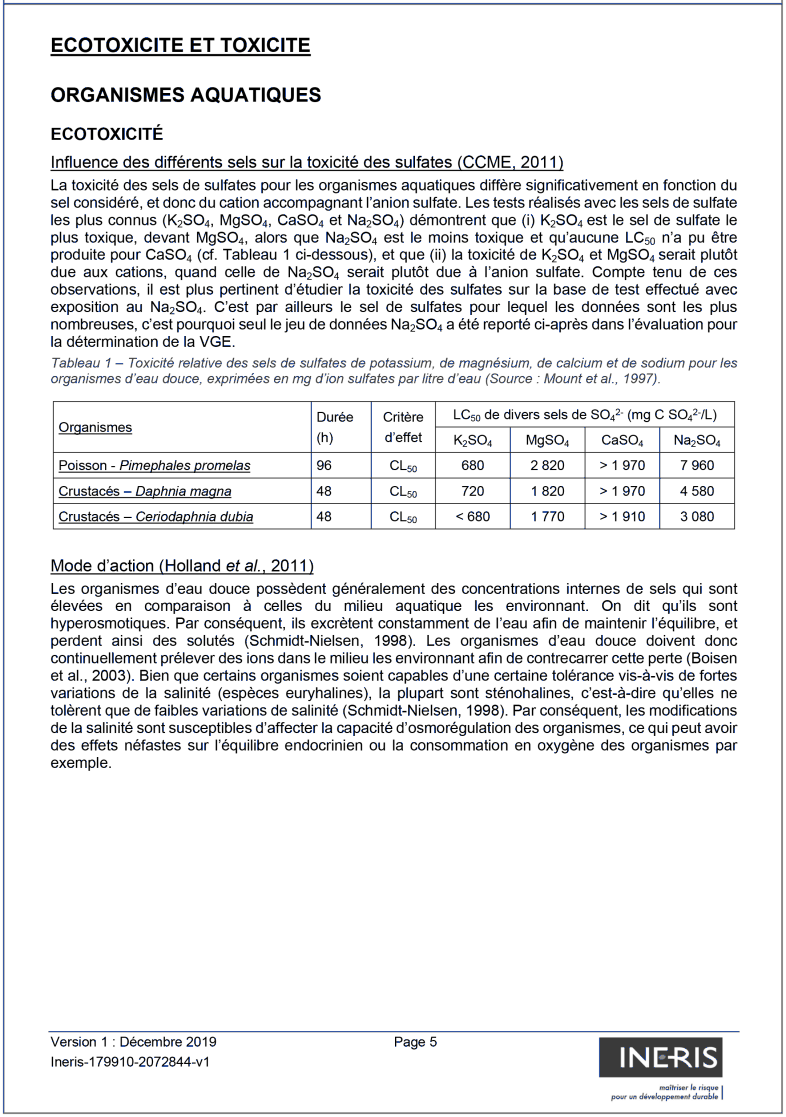
Influence des différents sels sur la toxicité des sulfates (CCME, 2011)
La toxicité des sels de sulfates pour les organismes aquatiques diffère significativement en fonction du sel considéré, et donc du cation accompagnant l'anion sulfate. Les tests réalisés avec les sels de sulfate les plus connus (K2SO4, MgSO4, CaSO4 et Na2SO4) démontrent que (i) K2SO4 est le sel de sulfate le plus toxique, devant MgSO4, alors que Na2SO4 est le moins toxique et qu'aucune LC50 n'a pu être produite pour CaSO4 (cf. Tableau 1 ci-dessous), et que (ii) la toxicité de K2SO4 et MgSO4 serait plutôt due aux cations, quand celle de Na2SO4 serait plutôt due à l'anion sulfate. Compte tenu de ces observations, il est plus pertinent d'étudier la toxicité des sulfates sur la base de test effectué avec exposition au Na2SO4. C'est par ailleurs le sel de sulfates pour lequel les données sont les plus nombreuses, c'est pourquoi seul le jeu de données Na2SO4 a été reporté ci-après dans l'évaluation pour la détermination de la VGE.
Tableau 1 – Toxicité relative des sels de sulfates de potassium, de magnésium, de calcium et de sodium pour les organismes d'eau douce, exprimées en mg d'ion sulfates par litre d'eau (Source : Mount et al., 1997).
Mode d'action (Holland et al., 2011)
Les organismes d'eau douce possèdent généralement des concentrations internes de sels qui sont élevées en comparaison à celles du milieu aquatique les environnant. On dit qu'ils sont hyperosmotiques. Par conséquent, ils excrètent constamment de l'eau afin de maintenir l'équilibre, et perdent ainsi des solutés (Schmidt-Nielsen, 1998). Les organismes d'eau douce doivent donc continuellement prélever des ions dans le milieu les environnant afin de contrecarrer cette perte (Boisen et al., 2003). Bien que certains organismes soient capables d'une certaine tolérance vis-à-vis de fortes variations de la salinité (espèces euryhalines), la plupart sont sténohalines, c'est-à-dire qu'elles ne tolèrent que de faibles variations de salinité (Schmidt-Nielsen, 1998). Par conséquent, les modifications de la salinité sont susceptibles d'affecter la capacité d'osmorégulation des organismes, ce qui peut avoir des effets néfastes sur l'équilibre endocrinien ou la consommation en oxygène des organismes par exemple.
COMPARAISON DES VALEURS SEUILS DISPONIBLES ET DÉMARCHE PROPOSÉE
Une comparaison des valeurs seuils existantes pour les sulfates dans les eaux douces de surface a été réalisée. Il existe au moins 2 valeurs seuils pour la protection des organismes aquatiques vis-à-vis de l'exposition aux sulfates dans les eaux douces de surface (cf. section EVALUATIONS EXISTANTES et INFORMATIONS REGLEMENTAIRES).
Les valeurs seuils proposées par l'IOWA (Iowa Department of Natural Resources, 2009) dépendent de la concentration en chlorures du milieu et de sa dureté. Elles nécessitent donc de connaître ces paramètres sur le site échantillonné afin de pouvoir comparer la concentration en sulfates à la valeur seuil correspondante. C'est une difficulté technique qui n'est pas insurmontable. En revanche, même si la démarche globale est recevable et que certains des principes qui s'y rattachent (prise en considération des facteurs influençant significativement la toxicité des sels de sulfates) sont applicables pour la détermination d'une valeur seuil française, les données sous-jacentes devraient être reconsidérées. En effet, les équations proposées pour l'établissement de ces valeurs seuils sont basées uniquement sur des données d'écotoxicité aiguë sur invertébrés, ce qui n'est pas conforme aux exigences européennes nécessitant 3 niveaux trophiques (algues, invertébrés crustacés, poissons). Ces valeurs seuils ne sont donc pas directement utilisables pour l'établissement d'une valeur seuil pour les sulfates en eaux de surface en France en 2019.
La méthodologie employée par le Ministère en charge de l'Environnement de la Colombie Britannique (BCME, 2013; BCME, 2018) diffère de celle employée par l'IOWA en cela qu'elle se focalise sur un seul facteur affectant de la toxicité des sulfates : la dureté du milieu. La combinaison de plusieurs modèles a été utilisée afin de vérifier l'hypothèse que la variabilité des concentrations toxiques en sulfates est dépendante de la dureté du milieu. L'outil utilisé (Akaike Information Criteria, AIC) mesure le compromis entre le coefficient de détermination du modèle (model fit), c'est-à-dire la compatibilité des courbes dose-réponse avec les données observées, et la complexité du modèle (model complexity), c'est-à-dire le nombre de paramètres nécessaire à la description des courbes. L'AIC permet d'évaluer le poids relatif de chacun des modèles par rapport aux données observées, le poids des modèles étant ensuite utilisé pour estimer des valeurs seuils. Cette démarche a été appliquée sur des données d'écotoxicité (survie et croissance) sur plusieurs espèces pour lesquelles des essais avaient été réalisés à divers niveaux de dureté. L'évaluation statistique des données a révélé que bien que certaines courbes dose-réponses démontrent une toxicité des sulfates dépendante de la dureté (poissons et amphibiens), ce n'est pas le cas de toutes (invertébrés, dont crustacés cladocères et rotifères). Enfin, aucune relation ne peut être établie qui permette de déduire la toxicité pour une espèce à partir de celle d'une autre.
Pour toutes les études pour lesquelles des données d'écotoxicité (LC10, LC25, ou LC50) étaient disponibles, des estimations des valeurs par le modèle ont été recalculées (moyenne pondérée des estimations des modèles individuels et de la variation entre les modèles).
Sur la base de ces données recalculées par les modèles, les auteurs ont considéré qu'Oncorhynchus mykiss était l'espèce la plus sensible lors d'un test sur les stades précoces de la vie (ELS) de 21 jours qui démontre une réduction de la toxicité des ions sulfates avec l'augmentation des niveaux de dureté entre 6 mg CaCO3 /L et 250 mg CaCO3 /L. Ce sont les LC20 issues de ce test sur Oncorhynchus mykiss à différents niveaux de dureté qui ont été utilisées comme valeur seuil, après application d'un facteur de sécurité de 2.
S'il est vrai que cette espèce est celle qui démontre la meilleure corrélation entre augmentation de la dureté et diminution de la toxicité des sulfates, il est à noter que la comparaison des EC10 (et non des EC20, comme dans le document du BCME) entre organismes démontre une plus grande sensibilité du micro-crustacé Ceriodaphnia dubia pour ce qui est des effets sur la reproduction. Les valeurs seuils proposées par le BCME ne sont donc pas non plus jugées directement utilisables pour l'établissement d'une valeur seuil pour les sulfates en eaux de surface en France en 2019.
Les normes de qualité proposées par l'IOWA (Iowa Department of Natural Resources, 2009) et la Colombie Britannique (BCME, 2013; BCME, 2018) pour la protection des organismes aquatiques d'eau douce vis-à-vis de l'exposition aux ions sulfates insistent sur l'influence de la dureté (pour l'IOWA et le BCME), et de la concentration en ions chlorures (pour le BCME). Dans certaines études, la corrélation négative entre dureté du milieu d'exposition et toxicité des ions sulfates est en effet assez évidente, comme pour une mousse aquatique (F. antipyretica), certains crustacés (C. dubia et H. azteca) et pour des espèces de poissons (P. promelas, O. mykiss). Néanmoins, cette corrélation n'est pas établie pour plusieurs autres espèces parmi lesquelles des algues (P. subcapitata), des rotifères (B. calyciflorus) et des amphibiens (P. regilla). Elphick et al. (2011) émettent l'hypothèse de différences physiologiques entre les organismes. Par exemple, les variations de dureté n'affecteraient pas l'accumulation cellulaire des sulfates chez les algues pour la production d'acides aminés soufrés comme la méthionine et la cystéine (Deane et O'Brien, 1975), car ils sont par ailleurs déjà régulés activement par l'intermédiaire de récepteurs membranaires. A contrario, les poissons seraient plus affectés par les variations de salinité car les échanges osmotiques se font par diffusion passive au travers des canaux ioniques dans les branchies. Ainsi, l'augmentation de la dureté, et donc de la force ionique du milieu, pourrait diminuer la toxicité des sulfates chez le poisson du fait d'une entrée en compétition des ions pour le passage à travers les canaux ioniques ou d'effets des ions calcium sur la perméabilité membranaire (Penttinen et al., 1998). Si la plausibilité de l'influence de phénomènes physiologiques est grande, elle est certainement seulement l'un des facteurs influençant la toxicité des ions sulfates. En effet, même si plusieurs études ont en effet démontré que la toxicité des ions sulfates peut varier pour une même espèce biologique et une même concentration d'exposition au sulfate de sodium en fonction de la dureté de l'eau (Davies, 2007; Elphick et al., 2011; Soucek, 2007; Wang et al., 2016), il a également été démontré que d'autres paramètres tels que la balance ionique globale du milieu (Wang et al., 2016) et notamment la concentration en ions chlorures (Soucek, 2007) et calcium (Davies et Hall, 2007) pouvaient faire varier fortement la toxicité des ions sulfates.
Le jeu de données collecté dans le cadre du présent document a été complété autant que possible sur la base des rapports déjà rédigé par l'IOWA et la Colombie Britannique et mis à jour avec des données d'écotoxicité chronique publiées depuis 2013. Bien que consistant, ce jeu de données n'est pas assez complet pour évaluer l'influence de chacun des facteurs influençant la toxicité. La dureté est celui d'entre eux qui est le plus étudié, mais il manque des données pour pouvoir évaluer les effets des autres paramètres comme la balance ionique, avec les concentrations en ions calcium, magnésium, potassium, sodium et chlorures, mais aussi le ratio des ions calcium et magnésium, dont certaines études ont démontré qu'il avait une influence sur la toxicité des sulfates (Davies, 2002; Soucek, 2007; Wang et al., 2016).
Compte tenu des divergences des méthodologies comparées ci-dessus et des jeux de données sous-jacents dans les rapports correspondants pour l'IOWA (norme basée sur des données d'écotoxicité aiguë sur invertébrés) et la Colombie Britannique (norme basée sur des données d'écotoxicité chronique sur poissons, alors que de plus faibles données chroniques sont fournies dans le rapport pour la reproduction invertébrés), il a été décidé de baser l'établissement de la norme de qualité pour la protection des organismes aquatiques vis-à-vis de l'exposition aux sulfates sur un jeu de données qui combine l'ensemble des données d'écotoxicité utilisées par l'IOWA et le BCME. Ce jeu de données a ensuite été complété avec des données d'écotoxicité chronique plus récentes qui n'étaient pas encore disponibles en 2013 (Wang et al., 2016). Ensuite, la méthode d'extrapolation statistique (SSD) telle que recommandée dans le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2018) a été appliquée, avec des propositions qui tiennent compte de la dureté du milieu d'exposition.
Synthèse
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Comme il a été expliqué ci-avant, du fait de leurs propriétés physico-chimiques, les sulfates sont très hydrosolubles et ne s'accumulent dans les matrices biologiques dans lesquelles ils sont régulés. Aussi, il n'est pas jugé pertinent de définir une norme de qualité pour la protection des prédateurs supérieurs vis-à-vis de l'empoisonnement secondaire.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITÉ POUR LA COLONNE D'EAU
Dans un tableau figurant en Annexe, sont reportés pour chaque espèce, tous les résultats des tests d'écotoxicité considérés comme pertinents et fiables par l'IOWA (Iowa Department of Natural Resources, 2009) et la Colombie Britannique (BCME, 2013; BCME, 2018) dans leurs évaluations, ainsi que les résultats d'une étude publiée en 2016 et évaluée par l'INERIS (Wang et al., 2016).
![]()
Une évaluation supplémentaire a été effectuée par l'INERIS afin de qualifier certaines données prises en compte par le BCME et qui n'étaient pas utilisables en tant que telles pour la détermination de la norme de qualité pour la protection des organismes aquatiques selon la méthodologie européenne (E.C., 2018). En particulier, des EC10 ont été préférentiellement utilisées dans un certain nombre de cas où elles avaient été écartées au profit de NOEC ou d'EC20; ces EC10 ont été utilisées pour l'établissement de la SSD.
Les éléments d'information collectés dans la littérature indiquent une corrélation négative fréquente entre toxicité des ions sulfates et dureté du milieu. Même si cette observation ne peut être confirmée avec les données collectées dans ce présent travail que pour P. subcapitata et O. mykiss, il semble préférable d'établir une SSD tenant compte de la dureté. Ainsi, des classes de dureté ont été établies sur la base de la distribution des données d'écotoxicité en fonction de la dureté de l'eau (Figure 1). Celles-ci figurent dans le Tableau 2 et sont ainsi reportées dans le Tableau 3 ci-dessous qui regroupe les données validées pour l'établissement des distributions de sensibilité des espèces (SSD).
Distribution des données d'écotoxicité en fonction de la dureté de l'eau
![]()
Figure 1 – Distribution des données d'écotoxicité des ions sulfates (EC10 en mg SO42-/L) en fonction de la dureté de l'eau (en mg CaCO3/L)
Tableau 2 – Classes de dureté définies selon la répartition des données d'écotoxicité chronique disponibles (cf. Figure 1)
![]()
Tableau 3 – Données d'écotoxicité chronique sélectionnées pour la construction de la SSD. Les données sont classées, au sein de chaque classe de dureté, par dureté croissante du milieu testé puis par EC10 croissante. Chaque couleur représente un taxon différent (Algues, Macrophytes, Rotifères, Mollusques, Crustacés, Insectes, Poissons, Amphibiens).
![]()
Compte tenu du nombre de données disponibles, une courbe de distribution de sensibilité des espèces (SSD) a été réalisée pour les classes de dureté 1 et 2 seulement (données en nombres insuffisants pour les autres classes de dureté).
La normalité est acceptée pour l'ensemble des 3 tests appliqués (Anderson-Darling, Kolmogorov-Smirnov et Cramer von Mises) quel que soit le degré de significativité exigé (de 0,01, 0,25, 0,05 et 0,1) pour les 2 jeux de données correspondants aux classes 1 et 2 de dureté.
Les courbes de distribution de sensibilité des espèces (SSD) ainsi obtenues sont présentées ci-après dans la Figure 2 et la Figure 3.
![]()
![]()
![]()
![]()
Sur la base de ces données, les valeurs suivantes ont été calculées comme concentrations affectant 5 % de la population (HC5, pour Hazardous Concentration 5 %) :
HC5 – classe 1 = 57 mg SO42-/L, avec l'intervalle de confiance suivant : IC (5 – 95 %) = [12 ; 125].
HC5 – classe 2 = 112 mg SO42-/L, avec l'intervalle de confiance suivant : IC (5 – 95 %) = [40 ; 199].
Calcul de la moyenne annuelle pour l'eau douce (AA-QSwater_eco) :
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2018). Lorsqu'un nombre suffisant de données d'écotoxicité est disponible (10 NOEC ou EC10 au minimum, représentant au moins 8 groupes taxonomiques différents), elles peuvent être obtenues en divisant la concentration à laquelle seulement 5 % des espèces sont affectées (HC5 déterminée à partir de la SSD établie sur la base des valeurs de NOEC ou d'EC10 valides) par un facteur d'extrapolation (AF, Assessment Factor), compris entre 1 et 5.
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2018) et le choix réalisé pour les sulfates est argumenté ci-après.
Le facteur d'extrapolation maximal de 5 à appliquer sur la HC5, utilisé par défaut, peut être diminué dans le cas où des éléments peuvent permettre de faire régresser l'incertitude résiduelle sur la valeur de HC5. Ces éléments sont analysés ci-dessous pour le cas des données d'écotoxicité chronique des sulfates :
- connaissance du mode d'action : le mode d'action des sulfates est assez bien décrit. Les sulfates jouent un rôle fondamental dans le maintien de l'équilibre ionique chez les organismes vivants. C'est un élément essentiel à ce processus, mais il est également démontré que des variations des concentrations en sulfates peuvent perturber ces processus d'osmorégulation – notamment chez les organismes aquatiques – et ainsi provoquer des effets adverses (cf. supra).
- qualité globale du jeu de données d'écotoxicité chronique et des critères d'effets couverts, diversité et représentativité des groupes taxonomiques couverts par le jeu de données : le jeu de données est relativement substantiel, avec 11 espèces représentées et 8 taxons (algues, macrophytes, rotifères, mollusques, crustacés, insectes, poissons et amphibiens) représentant ainsi divers modes de vie et de nutrition.
- incertitudes statistiques autour de l'estimation de la HC5: concernant la qualité de l'ajustement du jeu de données (« goodness of fit »), la normalité des 2 jeux de données log-transformées est acceptée pour l'ensemble des 3 tests appliqués (Anderson-Darling, Kolmogorov-Smirnov et Cramer von Mises) et ce, quel que soit le degré de significativité exigé (0,01, 0,25, 0,05 et 0,1) ; concernant l'étendue de l'intervalle de confiance autour de la valeur (12 – 125 mg.L-1, à 5 % de significativité, pour une valeur médiane de 57 mg.L-1 pour la classe 1 de dureté ; 40 – 199 mg.L-1, à 5 % de significativité, pour une valeur médiane de 112 mg.L-1 pour la classe 2 de dureté), il est considéré comme acceptable.
- comparaison entre les données de terrain ou les données de mésocosmes avec la HC5 pour évaluer la cohérence entre les éléments de suivi de terrain et les données obtenues en laboratoire : aucune donnée de terrain avec des expositions chroniques n'a pu être collectée.
Il existe néanmoins des arguments qui sous-tendent la décision de ne pas trop abaisser ce facteur :
![]()
- Certains travaux de recherche ont démontré que des concentrations élevées en sulfates pourraient avoir des effets indirects sur les écosystèmes aquatiques en augmentant la disponibilité de l'élément phosphore et la probabilité d'engendrer ainsi des phénomènes d'eutrophisation ou, dans certains cas, de mobilisation du mercure (BCME, 2013).
- Comme discuté ci-avant, il a été démontré que la toxicité des ions sulfates dans les eaux douces de surface est dépendante de la dureté du milieu, mais également significativement dépendante de la balance ionique, ainsi que d'autres paramètres environnants (par exemple oxygène dissous). Or ceux-ci ne sont pas pris en compte dans la présente évaluation et n'ont pas été précisément étudiés, ce qui implique une incertitude supplémentaire.
Compte tenu de ces éléments et du fait que la proposition de norme de qualité prend en considération la dureté pour les eaux les plus douces, un facteur d'extrapolation de 2 est appliqué à la HC5, ce qui conduit au calcul d'AA-QSwater_eco suivant :
![]()
Ces propositions de QS permettent de protéger l'espèce la plus sensible dans les eaux les plus douces d'après les données disponibles, la plus faible EC10 étant de 53 mg Cl-/L pour la mousse aquatique Fontinalis antipyretica. Elle est donc retenue comme valeur seuil pour la protection des organismes aquatiques. Pour les classes de dureté supérieures à 100 mg.L-1, il n'est pas possible de déterminer une norme de qualité car le jeu de données est trop restreint.
Proposition de norme de qualité pour les organismes de la colonne d'eau
![]()
NORME DE QUALITÉ POUR LA SANTÉ HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0,1 µg.L-1). Pour les sulfates, la Directive 98/83/CE fixe une valeur de 250 mg.L-1.
![]()
Synthèse
VGE/NQE Importer
VALEUR GUIDE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Comme il a été expliqué ci-avant, du fait de leurs propriétés physico-chimiques, les sulfates sont très hydrosolubles.
Aussi, une valeur guide de qualité pour les organismes benthiques n'est pas jugée nécessaire.
PROPOSITION DE VALEUR GUIDE ENVIRONNEMENTALE (VGE) POUR LES EAUX DOUCES DE SURFACE
Elle est définie à partir de la valeur la plus protectrice parmi tous les compartiments étudiés.
![]()
![]()
(2) classe 2 de dureté > 50 mg CaCO3/L et ≤ 100 mg CaCO3/L.
Pour les sulfates, seules la norme de qualité pour la protection des organismes aquatiques et pour la protection de la santé humaine vis-à-vis de la consommation d'eau de boisson ont été déterminées. La norme de qualité la plus faible parmi elles correspond à la norme de qualité pour la protection des organismes aquatiques. C'est donc cette valeur de 28 ou 56 mg SO42-/L selon la dureté du milieu qui est retenue par l'INERIS comme Valeur Guide Environnementale (VGE) pour les sulfates dans les eaux douces de surface. Elle correspond à une valeur en-deçà de laquelle au moins 95 % des espèces aquatiques seront protégées.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

