Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Cuivre (7440-50-8)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
7440-50-8
Nom scientifique (FR)
Cuivre
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-159-6
Code SANDRE
1392
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Cu }\)
Code InChlKey
Code SMILES
[Cu]
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
ATP15
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H411 |
|---|---|
| Mention du danger - Texte | Toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Analyse
Eau
Analyse
Sol
Prélèvement
Analyse
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
63.55 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 30/06/2025
Matrices
Atmosphère
Le cuivre est rejeté dans l’atmosphère sous forme particulaire d'oxyde, de sulfate ou de carbonate ou adsorbé à de la matière particulaire (ATSDR, 2004 ; Dameron et Howe, 1998). La vitesse et la distance de redéposition dépendent des caractéristiques de la source, de la taille des particules et de la vitesse du vent.
Milieu eau douce
L'oxyde cuivreux, Cu2O, est insoluble dans l’eau (Dameron et Howe, 1998). En revanche, le cuivre est légèrement soluble dans l’acide dilué et lentement soluble dans l’eau ammoniaquée (HSDB, 2003). Les formes CuSO4, Cu(OH)2 et CuCl2 sont solubles dans l’eau (Dameron et Howe, 1998).
L’ion Cu+ est instable dans l’eau sauf en présence d’un ligand stabilisateur comme les sulfures, les cyanures ou les fluorures. L’ion Cu2+ forme de nombreux complexes stables avec des ligands inorganiques, comme les chlorures ou l’ammonium, ou avec des ligands organiques (ATSDR, 2004 ; Dameron et Howe, 1998).
Dans les milieux aqueux, le comportement du cuivre est influencé par de nombreux processus : complexation avec des ligands organiques (surtout sur les groupes ‑NH2 et ‑SH, et dans une moindre mesure sur le groupe ‑OH) ou minéraux, adsorption sur des oxydes métalliques, des argiles ou des matières organiques particulaires, bioaccumulation, présence de cations de compétition (Ca2+, Fe2+, Mg2+…), présence de sels (OH‑, S2‑, PO43‑, CO32‑…), échange entre les sédiments et l’eau (ATSDR, 2004 ; Dameron et Howe, 1998).
La majorité du cuivre rejeté dans l’eau est sous forme particulaire (ATSDR, 2004 ; Dameron et Howe, 1998) et tend à se déposer, à précipiter ou à s’adsorber à la matière organique, au fer hydraté, aux oxydes de manganèse ou aux argiles. Dans l’eau, le cuivre particulaire représenterait de 40 à 90 % du cuivre (ATSDR, 2004). Après introduction du cuivre dans le milieu aquatique, l’équilibre chimique est généralement atteint en 24 heures (Dameron et Howe, 1998).
Milieu terrestre
Dans la nature, le cuivre se trouve aux états d’oxydation I ou II, sous forme de sulfures, sulfates, carbonates, oxydes et sous forme native minérale (Juste et al., 1995). Le comportement du cuivre dans le sol dépend de nombreux facteurs : le pH du sol, son potentiel redox, sa capacité d’échange cationique, le type et la distribution de matières organiques, la présence d’oxydes, la vitesse de décomposition de la matière organique, les proportions d’argiles, de limons et de sables, le climat, le type de végétation présente… (Adriano, 1986 ; Dameron et Howe, 1998).
Le cuivre forme des liaisons avec les composants du sol plus fortes que les autres cations divalents et la distribution du cuivre dans la solution de sol est moins affectée par le pH que celle des autres métaux (Adriano, 1986 ; ATSDR, 2004 ; Baker et Senft, 1995 ; Kabata-Pendias et Pendias, 1992). Néanmoins, les grandes tendances suivantes peuvent être mises en évidence : le cuivre est plus soluble et plus mobile à des pH inférieurs à 5 (Adriano, 1986) ; l’adsorption du cuivre par les sols est en général le processus dominant aux 5 < pH < 6 ; au-delà de pH=6, la précipitation devient la réaction prépondérante (ATSDR, 2004) ; au-delà de pH=7, le cuivre n’est pratiquement plus mobile (Adriano, 1986).
Dans les sols, le cuivre se fixe préférentiellement sur la matière organique (cela concerne de 25 à 50 % du cuivre), les oxydes de fer, de manganèse, les carbonates et les argiles minéralogiques (Adriano, 1986 ; Baker et Senft, 1995 ; HSDB, 2003 ; Juste et al., 1995 ; Kabata-Pendias et Pendias, 1992). Inversement, la formation de complexes avec la matière organique augmente pour des pH supérieurs à 7, à cause de la plus grande solubilité de la matière organique du sol aux pH élevés (Adriano, 1986). De fait, la plus grande partie du cuivre reste fortement adsorbée dans les quelques centimètres supérieurs du sol, spécialement sur les matières organiques présentes (Adriano, 1986 ; ATSDR, 2004 ; Dameron et Howe, 1998). Le cuivre migre donc peu en profondeur, sauf dans des conditions particulières de drainage ou en milieu très acide (Adriano, 1986 ; ATSDR, 2004 ; Dameron et Howe, 1998 ; Juste et al., 1995). Par exemple, une mobilisation significative du cuivre ne se produit qu’après une lixiviation prolongée à un pH inférieur à 3 (HSDB, 2003).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Conclusion sur la persistance
Le cuivre est un élément inorganique.
Bioaccumulation
Organismes aquatiques
Seules des valeurs de BCF pour les poissons ont été déterminées. Xiarong et al., 1997 rapporte un BCF de 13 pour Cyprinus carpio. Wepener et al., 2000 ont mesuré des BCF sur 10 espèces de poissons différents dans plusieurs rivières. Ils rapportent 18 valeurs de 20 à 950, avec une moyenne de 184 (écart type : 219).
Il est à noter que l’accumulation du cuivre est dépendant des concentrations d’exposition, ce qui peut expliquer la grande variation des valeurs de BCF observées. Ainsi, il n’est pas pertinent d’utiliser une valeur de BCF unique sans connaître les concentrations d’exposition du milieu.
Principales données de bio-accumulation dans les organismes aquatiques :

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Bioaccumulation du cuivre dans les végétaux:
L’absorption du cuivre par les plantes est fonction du pH du sol, qui contrôle l’activité des ions Cu2+ contenus dans la solution en contact avec les racines. Cependant, l’absorption du cuivre sous forme anionique n’est pas à exclure (Juste et al., 1995). Le zinc, le calcium, le potassium et l’ammonium exercent un effet antagoniste sur l’absorption du cuivre par les racines (Baker et Senft, 1995 ; Juste et al., 1995).
La plus grande partie du cuivre présent dans les racines n’est pas transféré vers les parties aériennes (Adriano, 1986 ; Baker et Senft, 1995 ; Juste et al., 1995 ; Kabata-Pendias et Pendias, 1992).
Par ailleurs, le cuivre adsorbé, par exemple sur des argiles, n’est pas disponible pour les végétaux terrestres (ATSDR, 2004).
Facteur de bioconcentration du cuivre depuis les sols:
L'INERIS recommande de consulter la Base de données sur les teneurs en éléments traces métalliques de plantes potagères - BAPPET V1.2 (ADEME, INERIS, CNAM, INP, ENSAT, ISA, INRA, 2012). La base indique des concentrations en cuivre dans les végétaux et dans des sols, permettant de calculer un BCF ; pour certaines données, les concentrations dans d’autres milieux environnementaux (eau, air) sont également renseignées. Pour le cuivre, 1231 couples de données végétaux-sol sont actuellement disponibles.
Lors de l’interrogation de la base de données, il est possible de choisir les modalités de certains paramètres (paramètres liés à la plante, au sol, au contexte environnemental, à l’origine de la pollution, au type expérimental, etc.) afin de se rapprocher des conditions propres à la situation étudiée.
Il appartient à l’utilisateur averti de sélectionner les données qui lui apparaîtront pertinentes eu égard à son cas d’étude. Ce travail est facilité par la mise en place du filtre de sélection. Les auteurs de la base de données attirent cependant l’attention des utilisateurs sur le travail d’analyse critique des résultats qu’ils doivent mener pour exploiter ces données. Dans ce sens, il est recommandé aux utilisateurs de consulter les informations sur le contexte environnemental accompagnant les données de contamination des plantes et notamment l’origine de la contamination (ces informations sont présentes dans les fiches de renseignement). La variabilité des concentrations des ETM pour une même espèce végétale, cultivée dans des conditions apparemment similaires, peut être importante. Il convient donc de ne pas extraire une ou quelques données et de ne pas utiliser uniquement la moyenne de l’ensemble des données sélectionnées, ce qui aboutirait inévitablement à masquer cette variabilité et à une estimation peu fiable de la contamination des plantes.
BAPPET V1.2: Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les éléments traces métalliques (ETM)2, dont le cuivre, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site http://www.ademe.fr/base-donnees-teneurselements- traces-metalliques-plantes-potageres-bappet-presentation-notice-dutilisation et fonctionne sur ACCESS 2003 et 2007.
Bibliographie
Toxicologie
Dernière vérification le 30/06/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2004 ; ECHA, 2013a, b, c, d, e 2017 ; INRS, 2013 ; OMS IPCS, 1998 ; RAR, 2016 ; RIVM, 2001 ; Santé Canada, 2019 ; US EPA, 2009 ; US EPA (IRIS), 1988). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Devenir dans l'organisme :
Le cuivre est un élément essentiel chez l'homme et l'animal, impliqué dans de nombreuses voies métaboliques, notamment pour la formation d'hémoglobine et la maturation des polynucléaires neutrophiles. De plus, il est un co-facteur spécifique de nombreuses enzymes et métalloprotéines de structure (OMS IPCS, 1998). Le cuivre intervient également dans de nombreux processus physiologiques, notamment la formation des tissus neurologiques, immunologiques et connectifs, ainsi que la régulation thermique (Santé Canada, 2019). La valeur nutritionnelle de référence, c’est-à-dire l’apport quotidien recommandé, est de 1 mg pour le cuivre chez l’adulte (JOCE, 2011).
L'absorption de cuivre est possible par toutes les voies mais elle s'effectue de manière prépondérante par voie orale.
Inhalation:
L'absorption pulmonaire de cuivre sous forme de poussières, de fumées, ou d’aérosol est possible mais le taux d'absorption par cette voie chez l'homme n'est pas déterminé (RIVM, 2001). Une exposition chronique à des vapeurs de "bouillie bordelaise" (sulfate de cuivre) chez des salariés induit une augmentation de l'absorption et de l'accumulation de cuivre dans l'organisme (OMS IPCS, 1998).
Voie orale:
L'absorption digestive a lieu principalement au niveau de l'estomac et du jéjunum. Le taux d'absorption par voie orale est très variable, de 15 à 97 % notamment en fonction de la forme chimique (Barceloux, 1999 ; Collins et Klevay, 2011 ; de Romana et al., 2011 ; Gaetke et al., 2014 ; Strickland et al., 1972). L’absorption suit un processus saturable (quand la dose augmente, la fraction absorbée diminue) (Bügel et al., 2005). Dans les régimes alimentaires typiques des pays développés, l’absorption du cuivre serait en moyenne de 30 à 40 % (Santé Canada, 2019). En se basant sur les études humaines d’Harvey de 2003 (12 sujets) et 2005 (6 sujets), où l’excrétion fécale a été prise en compte dans le calcul de l’absorption réelle de cuivre par voie orale, l’EFSA a retenu une valeur moyenne d’absorption de 50 % pour tous les âges et différents stades de la vie (EFSA, 2015).
Dans la lumière intestinale, le cuivre est en grande partie lié aux acides aminés. Son absorption sous forme ionique (Cu2+ ou Cu+) reste à confirmer (EFSA, 2015). Les nouveau-nés et les nourrissons semblent être plus sensibles au cuivre en raison d’une absorption intestinale accrue et d’un système hépatobiliaire immature (Collins et Klevay, 2011).
Voie cutanée:
Deux études in vitro réalisées à partir de peau humaine (Maas, 2012, 2015) ont permis d’établir des taux d’absorption cutanée d’environ 1 et 9 % pour respectivement des préparations concentrées (1,5 g Cu.L-1) et diluées (0,33 g Cu.L-1) indépendamment de la forme chimique de cuivre ou du type de formulation.
Distribution
Après absorption au niveau de la partie haute de l’intestin grêle, le cuivre est immédiatement lié à l’albumine, à la transcupréine ou à des acides aminés, avant d’atteindre la circulation porte hépatique. Au cours de ce premier passage, environ 40 % du cuivre sont transportés vers le foie où le cuivre est transféré d’une protéine chaperonne à la protéine ATP7B (le transporteur affecté par la maladie de Wilson), puis à la céruloplasmine (Cp). Le complexe Cu++-Cp est ensuite excrété soit dans la bile, soit dans la grande circulation (de Romana et al., 2011 ; Gitlin, 2014). A partir de la circulation générale, il se distribue dans tout l’organisme associé pour une large part à la céruloplasmine (environ 75 à 98 % du cuivre plasmatique), le cuivre libre pouvant se lier à l’albumine et divers acides aminés (Santé Canada, 2019).
Les plus fortes concentrations tissulaires en cuivre sont mesurées au niveau du foie, des muscles et de la moelle osseuse. Le cuivre se distribue majoritairement dans le foie avec des taux physiologiques chez l'adulte de 18 à 45 mg de cuivre.g-1 de matière sèche. La demi-vie du cuivre dans le sang est de 2 à 5 semaines chez l’adulte (Barceloux, 1999 ; Ellingsen et al., 2007). Les valeurs physiologiques de cuivre dans le sérum peuvent varier d’un individu à l’autre et sont généralement inférieures à 1 500 mg.L-1 (Biotox, 2017 ; Cesbron et al., 2013). Ces valeurs sont plus élevées de 10 % chez la femme (OMS, 1996).
L’élimination du cuivre par les phanères est documentée aussi bien par une exposition par inhalation que par voie orale. En effet, une augmentation du taux de cuivre dans les cheveux (705,7 mg.g-1 versus 8,9 mg.g-1 chez les témoins) est rapportée chez des salariés exposés à des concentrations dans l'air de 0,64-1,05 mg Cu.m-3 (Finelli et al., 1981), de même, que sur de jeunes hommes volontaires successivement soumis à un apport journalier en cuivre dans l’alimentation de 1,6 mg (9,2 ± 3,1 µg.g-1 dans les cheveux), puis 7,8 mg (21,1 ± 5,9 µg.g-1 dans les cheveux) (Turnlund et al., 2004).
Des données issues de l’animal permettent d’anticiper une augmentation probable du transfert du cuivre de la mère au fœtus au cours de la grossesse, le métabolisme du cuivre étant similaire dans les deux espèces (EFSA, 2015). Cette hypothèse demande toutefois à être confirmée.
Le cuivre ne s’accumule pas dans l’organisme, sauf dans le cas de maladies génétiques comme la maladie de Wilson ou lors d’administrations chroniques à des doses anormalement élevées (60 mg par personne et par jour) où il s’accumule dans le foie (RAR, 2016).
Métabolisme
Le cuivre est un oligo-élément qui n’est pas métabolisé. Néanmoins il est associé à de nombreuses enzymes pour intervenir notamment dans la régulation des neurotransmetteurs (dopamine b-hydrolase), le métabolisme du fer (via la céruloplasmine), le métabolisme oxydatif du glucose (cytochrome oxydase), l’élimination des radicaux libres (la superoxyde dismutase) ou encore dans la cohésion des fibrilles de collagène sous l’action de la lysyl-oxydase, (ATSDR, 2004). La cytotoxicité du cuivre observée lors d'intoxication se ferait par inhibition enzymatique du système pyruvate-oxydase par compétition au niveau des groupements sulfhydriles des protéines. La glucose-6-phosphate-deshydrogénase (G6PD) et la glutathion-réductase sont inhibées (inhibition compétitive) proportionnellement à la concentration intracellulaire du cuivre (Barceloux, 1999). De plus, le cuivre en excès produit des radicaux libres responsables de lésions cellulaires au niveau de l'ADN et d'organites tels que les mitochondries ou les lysosomes (OMS IPCS, 1998).
Élimination
L’excrétion biliaire représente le principal mécanisme par lequel est régulée la quantité totale de cuivre dans l’organisme (Van Den Berghe et Klomp, 2009), d'où une excrétion majoritairement (90 à 100 %) par voie fécale (Santé Canada, 2019). L'excrétion urinaire de cuivre est très faible (0,5-3 %) soit environ 30-60 mg par jour chez l'adulte (Harris, 1991 ; Turnlund et al., 2005).
L’élimination du cuivre est moindre chez les enfants âgés de moins de 1 an, en raison du faible développement du système de transport biliaire (Muller_Hocker et al., 1988), de même que chez les individus déficients en glucose-6-phosphatase déshydrogénase (Calabrese et Moore, 1979).
Chez la femme, les concentrations en cuivre dans le lait diminuent au cours de l’allaitement, le régime alimentaire n’ayant aucune influence sur sa concentration (EFSA, 2015). La concentration moyenne au cours des 6 premiers mois d’allaitement a été estimée à 350 µg.L-1.
Chez l'animal
Absorption
Inhalation:
L'absorption de cuivre est possible par inhalation. Le cuivre est présent dans les capillaires pulmonaires chez le rat, 3 heures après une exposition à un aérosol d'oxyde de cuivre (Batsura, 1969).
Voie orale:
L’absorption par voie orale serait voisine de 30 à 40 % par 24 heures chez le rat (Linder et Hazegh-Azam, 1996). Sur la base des résultats de l’étude non publiée de Leeming (2003), l’EFSA, 2018 retient une absorption en moyenne de 50 % par voie orale chez l’animal (de 10 % à 50 % pour des apports respectifs d’élevés à faibles).
Il a été montré chez le rat que l’absorption par voie orale (20 mg Cu.kg-1) de différents sels de cuivre (dihydroxyde, oxychlorure, bouillie bordelaise, et sulfate tribasique) était similaire, à savoir rapide avec une demi-vie de 10,13 heures (étude non publiée de 2004) (RAR, 2016, vol. 3). En outre, une plus grande absorption intestinale a été observée chez les ratons à la naissance en raison de l’immaturité des mécanismes digestifs et homéostatiques à ce stade du développement (OMS, 2004).
Distribution
Les études de toxicocinétique menées chez l’animal n’ont en particulier pas montré d’accumulation du cuivre dans l’organisme (INRS, 2013).
Au cours de la gestation, le transfert placentaire du cuivre de la mère au fœtus, se ferait par l’intermédiaire de deux protéines chaperonnes (ATP7A transporterait le cuivre du placenta au fœtus, et l’ATP7B renverrait l’excès de cuivre du fœtus au sang maternel (Hardman et al., 2004 ; Hardman et al., 2006). Chez le rat, le transport du cuivre vers le fœtus aurait tendance à augmenter à partir du 17ème jour de la gestation (21 jours chez le rat), pour se poursuivre au cours de la période post-natale (Lenartowicz et al., 2015). Ces données n’ont pas été confirmées chez la femme, mais le métabolisme du cuivre étant similaire dans les deux espèces, le mécanisme diffère probablement peu (EFSA, 2015).
Métabolisme
Le cuivre n’est pas métabolisé.
Élimination
Les voies d’élimination chez l’animal sont comparables à celles décrites chez l’homme.
Synthèse
Le cuivre est un élément essentiel chez l'homme, impliqué dans de nombreuses voies métaboliques et comme co-facteur spécifique de nombreuses enzymes et métalloprotéines. Le taux d'absorption est de 50 % en moyenne par voie orale et < à 10 % par voie cutanée. Le cuivre présente une large distribution dans l'organisme principalement dans le foie. Il est très majoritairement éliminé par voie fécale. Cette élimination est réduite chez les enfants de moins de 1 an, et les individus déficients en glucose-6-phosphate déshydrogénase.
Chez l’animal, le devenir du cuivre par ingestion ou par inhalation est identique à celui décrit chez l'homme.
Toxicité aiguë
Chez l'homme
Inhalation
Chez des salariés au poste de travail, l’exposition entre 1 et 3 mg.m-3 de poussières de cuivre sur de courtes périodes (non précisées) a entrainé l’apparition d’un goût sucré sans autre symptôme rapporté (Etude non publiée de Whitman, 1957 citée dans OEHHA, 2008).
Voie orale
Les cas d'intoxications aiguës par voie orale sont rares et généralement dus à des contaminations de boissons ou à des ingestions accidentelles ou volontaires (suicides) de grandes quantités (de 0,4 à 100 g de cuivre) de sels de cuivre et notamment de sulfate de cuivre (bouillie bordelaise) (Chuttani et al., 1965). Les cas d'intoxications par l'eau de boisson correspondent également à des doses élevées, de 35 à 200 mg.L-1 de cuivre (Hopper et Adams, 1958 ; Semple et al., 1960). Les effets toxiques observés sont un syndrome dysentérique (nausées, vomissements, douleurs abdominales, diarrhées), une léthargie, une anémie profonde liée à une hémolyse intra-vasculaire, une rhabdomyolyse. Surviennent secondairement une cytolyse hépatique par nécrose centrolobulaire et une insuffisance rénale aiguë par nécrose tubulaire aiguë (Takeda et al., 2000). Une toxicité directe sur la muqueuse digestive est parfois responsable d'hémorragies digestives. Les pertes hydroélectrolytiques peuvent s'accompagner d'une insuffisance rénale aiguë fonctionnelle.
Voie cutanée
Aucune donnée relative à des intoxications aiguës par voie cutanée n'est disponible chez l'homme (ATSDR, 2004 ; OMS IPCS, 1998).
Synthèse
Chez l’homme, les cas d'intoxications aiguës par voie orale sont rares.
Chez l'animal
Inhalation
Chez le rat, la concentration létale 50 % (CL50) varie d’environ 500 à près de 3 000 mg Cu.m-3 selon les différents sels de cuivre étudiés (INRS, 2013). Des valeurs de 450, 2 830 et 2 920 mg Cu.m-3 ont été rapportées chez le rat respectivement pour l’hydroxyde de cuivre, l’oxychlorure de cuivre et l’oxyde de cuivre (RAR, 2016, vol. 1).
Les animaux ont le plus souvent présentés une hypoactivité, une ataxie et dyspnée modérées, ainsi qu’une fréquente piloérection d’intensité variable selon les composés testés. Les autopsies ont en général mis en évidence des décolorations anormales (rouge foncé) au niveau des poumons et dans de rares cas au niveau du foie.
Chez le lapin, une CL50 supérieure à 1 303 mg Cu.m-3 a été calculée pour l'hydroxyde de cuivre (forme physique et durée d'exposition non spécifiées) (Tomlin, 1994).
Des cobayes exposés à des particules d'oxyde de cuivre sous forme d'aérosol pendant 1 heure montrent une diminution du volume résiduel et de la compliance pulmonaire pour une concentration de 1,3 mg Cu.m-3. Ces perturbations des paramètres fonctionnels respiratoires s'observent pendant et après l'exposition (Chen et al., 1991).
Voie orale
Par voie orale, en fonction de l'espèce et du sel de cuivre étudié, les doses létales 50 % (DL50) sont comprises entre 15 et plus de 2 000 mg de Cu.kg-1 de poids corporel (NIOSH, 1993 ; NIPHEP, 1989 ; Santé Canada, 2019 ; Schafer et Bowles, 1985 ; Smyth et al., 1969 ; US EPA, 2009). A titre d’exemple, des DL50 de 15 à 90 mg.kg-1 pour le chlorure de cuivre, de 120 à 300 mg.kg-1 pour le sulfate de cuivre ou encore 500 à 2 000 mg.kg-1 pour le carbonate de cuivre ont été rapportées chez le rat.
Les sels présentant une toxicité aiguë sont l’oxychlorure de cuivre, ainsi qu’avec une intensité sensiblement plus faible le dihydroxyde de cuivre, le sulfate de cuivre et l’oxyde de cuivre.
Des vomissements sont rapportés à partir d’une dose unique de 20 mg de sulfate de cuivre par animal (soit 5 mg de Cu2+) chez le chien (OMS, 2004).
Une étude a été réalisée chez le rat et la souris exposés pendant deux semaines par l’eau de boisson (300 à 10 000 ppm) ou via la nourriture (1 000 ppm à 16 000 ppm)(Hebert et al., 1993). L’effet létal survient chez le rat et la souris à partir d’une dose de 3 000 ppm de sulfate de cuivre administrée dans l’eau de boisson (soit respectivement chez les femelles et les mâles 121 et 175 mg.kg.j-1chez le rat ou 245 et 226 mg.kg.j-1 chez la souris). Aucun signe clinique n’a été rapporté aux doses de 300 et 1 000 ppm. Les analyses histopathologiques ont mis en évidence une faible toxicité rénale chez les rats mâles uniquement (accumulation de gouttelettes protéiniques dans les tubules), y compris à la plus faible dose de 300 ppm (soit un LOAEL de 41 mg.kg-1.j-1) (Hebert et al., 1993). Lors de l’exposition via la nourriture, une réduction significative de la croissance pondérale est observée aux plus fortes doses des rats de 8 000 et 16 000 ppm (soit pour les mâles 769 et 1 121 mg.kg-1.j-1 et pour les femelles 777 mg.kg-1.j-1 et 1 275 mg.kg-1.j-1), et les souris femelles uniquement à la plus forte dose de 16 000 ppm (Hebert et al., 1993). Une toxicité rénale (gouttelettes protéiniques au niveau des tubules) a été observée chez les rats mâles et femelles à partir de 2 000 ppm (soit 180 et 174 mg.kg-1.j-1 chez les mâles et les femelles). A partir de 2 000 ppm, une hyperplasie et une hyperkératose de l’estomac a été observée chez les rats et les souris des deux sexes. Une inflammation hépatique est décrite chez les rats uniquement, les mâles (dès 8 000 ppm) et les femelles (16 000 ppm), de même qu’une diminution de l’hématopoïèse de la moelle osseuse également chez les deux sexes de la même espèce et aux mêmes doses.
Voie cutanée
Par voie cutanée, une DL50 supérieure à 1 124 mg Cu.kg-1 a été déterminée chez des rats exposés à de l'oxysulfate de cuivre (NIOSH, 1993). Une DL50 supérieure à 2 058 mg Cu.kg-1 a également été déterminée chez des lapins traités par de l'hydroxyde de cuivre (Tomlin, 1994).
La plupart des dérivés du cuivre sont peu ou pas irritants et/ou sensibilisants pour la peau et ne sont pas classés pour cette classe de danger par l’Union Européenne (hydroxyde de cuivre, oxychlorure de cuivre, sulfate de cuivre tribasique, l’oxyde de cuivre et la bouillie bordelaise. A ce jour, seul le sulfate de cuivre est classé pour ses effets irritants mais il est probable que cela soit modifié en cas de révision de la substance. Aucune classification pour cette classe d’effet n’a été requise pour le sulfate de cuivre pentahydraté (ECHA, 2013e).
Par voie cutanée, le sulfate de cuivre induit une dermatite de contact allergique prurigineuse. Le niveau de sensibilisation correspond à un contact de 24 à 48 heures avec 0,5 à 5 % de sulfate de cuivre présent dans l'eau ou de l'huile de vaseline (Hackel et al., 1991 ; Nordlind et Liden, 1992).
En revanche, des effets oculaires ont été décrits pour certains composés du cuivre au test d’irritation oculaire chez le lapin (RAR, 2016, vol.3). Le dihydroxyde de cuivre, l’oxyde de cuivre et le sulfate de cuivre pentahydraté sont des composés sévèrement irritants (classés cat.1, H318), alors que d’autres composés, comme l’oxychlorure ou le sulfate de cuivre ne sont pas ou peu irritants.
Synthèse
Chez l’animal, les sels cuivre sont peu toxiques pour des expositions aiguës. Si certains composés du cuivre sont de sévères irritants pour les yeux, aucun ne présente d’effet irritant et/ou sensibilisant en dehors du sulfate de cuivre par voie cutanée.
Toxicité à doses répétées
Effets généraux
Généralités
Les sels solubles du cuivre II (acétate, carbonate, chlorure, hydroxyde, nitrate, oxyde, oxychlorure et sulfate) sont plus toxiques chez l’homme et l’animal que les composés non solubles (OMS, 2004).
Chez l'homme
Inhalation
Les données existantes chez l'homme par inhalation concernent des expositions professionnelles. Une centaine de salariés a fait l'objet d'un suivi médical complet (prélèvements sanguins, dosages sériques de cuivre et de protéines, tests hépatiques) sur une période de 4 ans. Les individus étaient exposés à des poussières de cuivre (granulométrie non reportée) à raison de 464, 132 et 111 mg Cu.m-3 au cours de la première, seconde et troisième année. Une irritation des voies aériennes supérieures et des troubles gastro-intestinaux (anorexie, nausée, diarrhée) sont rapportés (Suciu et al., 1981). Ces manifestations cliniques sont également retrouvées dans une autre étude mais pour des niveaux d'exposition non déterminés (Askergren et Mellgren, 1975).
Une autre étude rapporte chez des salariés exposés à des poussières ou des fumées de cuivre, un syndrome de "fièvre des fumées de métaux" (fièvre, céphalée, sécheresse buccale, sueurs froides et douleurs musculaires) à des concentrations de 0,03 à 0,12 mg Cu.m-3 sans information précise sur la durée d’exposition (Gleason, 1968). L’exposition concomitante à l’oxyde d’aluminium ne semble pas pouvoir être écartée.
Il a été décrit un syndrome interstitiel au niveau pulmonaire "Vineyard Sprayers' Lung" par utilisation de bouillie bordelaise par des ouvriers viticulteurs portugais. Il s'agit d'une pneumopathie interstitielle, avec des granulomes histiocytaires et des nodules fibrohyalins contenant un matériel riche en cuivre. Le passage à la forme fibrosante était très variable. Il a été observé aussi des lésions hépatiques : fibrose, cirrhose micronodulaire, angiosarcome, hypertension portale (Pimentel et Menezes, 1975).
Des pathologies pulmonaires ont également été décrites chez des artisans (dinandiers) travaillant le cuivre et présentant une concentration sérique moyenne en cuivre de 0,93 ± 0,14 mg.L-1 significativement supérieures à celle du groupe témoin (0,70 ± 0,14 mg.L-1 , p<0,05) (Dagli et al., 2010). Cette étude réalisée sur 30 sujets exposés a mis en évidence une prévalence élevée de pneumopathies interstitielles diffuses (17 des 30 scanners examinés), avec la présence fréquente de micronodules pulmonaires chez les ouvriers du cuivre. Néanmoins, le risque de co-exposition ne peut être totalement écarté.
Voie orale
Etudes environnementales :
De nombreux cas d'intoxications au cuivre par l'eau de boisson ont été décrits ainsi que leurs manifestations cliniques (troubles gastro-intestinaux essentiellement) sans toutefois fournir de données sur les niveaux d'exposition. Une famille américaine exposée à des concentrations de 3,1 à 7,8 mg.L-1 de cuivre dans l'eau de boisson a présenté des épisodes récurrents de troubles intestinaux sur une période de 1,5 ans. Les symptômes ont cessé à l'arrêt de l'exposition (Spitalny et al., 1984). Sur la base d'une consommation hydrique matinale de 500 mL, la dose d'exposition en cuivre a été estimée 0,06 mg.kg-1.j-1.
Etudes chez les volontaires :
Plusieurs études réalisées sur des volontaires sains ont cherché à déterminer les doses d’exposition au cuivre dans l’eau de boisson à partir desquelles les symptômes gastro-intestinaux étaient ressentis (Araya et al., 2001 ; Araya et al., 2003 ; Olivares et al., 2001 ; Pizarro et al., 1999b ; Pizarro et al., 1999a ; Pizarro et al., 2001). Dans l’étude de Pizarro et al., 1999a,b, 60 femmes volontaires ont été réparties en 4 groupes et exposées successivement de manière aléatoire à des doses de 0, 1, 3 ou 5 mg Cu.L-1 sous forme de sulfate de cuivre dans l’eau de boisson (soit 0,006 – 0,0272 – 0,0731 – 0,124 mg de Cu.kg-1.j-1). La durée totale de l’étude a été de 11 semaines, divisée en 4 périodes de 2 semaines d’exposition, séparée par des périodes d’une semaine sans exposition. Des prélèvements sanguins étaient réalisés une semaine avant le début de l’exposition et à la fin des deux périodes d’exposition Aucune modification du cuivre sanguin, céruloplasmine, hémoglobine, ou enzyme hépatique n’a été observée à partir des prélèvements sanguins réalisés avant et à la fin des deux périodes d’exposition. Vingt et un sujets ont présenté des symptômes gastro-intestinaux, principalement sous forme de nausée. Chez 9 sujets des diarrhées, avec ou sans douleurs abdominales ont été rapportées, dont 6 sont apparues durant la première semaine de traitement, sans effet dose-dépendant. Douze sujets ont présenté des douleurs abdominales, nausées et/ou vomissements, aux incidences de 3/60, 1/60, 10/60 et 9/60, respectivement dans les groupes 0 - 0,0272 – 0,0731 – 0,124 mg de Cu.kg-1 .j-1. La différence est significative à partir de 0,0731 mg de Cu.kg-1.j-1. Les effets sont réversibles à l’arrêt de l’exposition. Aucune autre différence entre les groupes n’a été retrouvée. Comme 8/12 épisodes de diarrhées ont été observés aux cours des deux premières semaines, un NOAEL de 0,0272 mg de Cu.kg-1.j-1 est donc déterminé pour les effets gastro-intestinaux pour une exposition chez la femme via l’eau de boisson pour une exposition de deux semaines.
Dans une étude complémentaire, des troubles gastro-intestinaux ont été ressentis indépendamment de la forme soluble (sulfate de cuivre) ou insoluble (oxyde de cuivre) de cuivre administré dans l’eau de boisson (5 mg.L-1) sur plusieurs périodes d’une semaine (Pizarro et al., 2001).
Des hommes et des femmes ayant reçu 200 mL d’une solution de 0, 2, 4, 6, 8, 10 ou 12 mg Cu(II).L-1, sous forme de sulfate de cuivre en boisson, une fois par semaine, pendant 12 semaines soit des doses de 0 - 0,4 - 0,8 - 1,2 - 1,6 - 2 et 2,4 mg Cu(II) (Olivares et al., 2001). Une nausée légère après l’ingestion a été fréquemment signalé à partir de la dose de 0,8 mg Cu(II). L’incidence des vomissements dès 1,2 mg était basse (11,5 %), mais augmentait de deux fois entre 2 et 2,4 mg. L’apparition concomitante de la nausée et des vomissements était moins fréquente. Un NOAEL de 0,4 mg et 0,8 mg peut être déterminé dans l’eau respectivement basées sur la nausée et les vomissements (soit 2 et 4 mg Cu.L-1).
Des volontaires sains (1 365 adultes répartis en 4 groupes d’individus hommes et femmes) ont été exposés de manière contrôlée via l’eau de boisson et de cuisson des aliments pendant 2 mois à <0,01 (témoin) – 2 – 4 ou 6 mg de Cu.L-1 sous forme de sulfate de cuivre (Araya et al., 2003 ; Araya et al., 2004). Une augmentation significative des symptômes a globalement été ressentie à partir de 4 mg de Cu.L-1 (p<0,02) et 6 mg de Cu.L-1 (p<0,005), principalement sous forme concomitante de nausées et douleurs abdominales. Une sensibilité particulière des femmes a par ailleurs été observée dans les premières semaines de traitement avec une augmentation significative du risque relatif (RR) à partir de 4 mg de Cu.L-1 pour les femmes (RR = 1,53 ; IC95% [1,02 – 2,05]) et 6 mg de Cu.L-1 pour les hommes (RR = 1,9 ; IC95% [1,02 – 2,79]) au cours de la première semaine. Néanmoins, le suivi régulier des sujets de l’étude a également permis d’observer une diminution des symptômes décrits au cours du temps aussi bien chez les femmes que chez les hommes, suggérant une réponse adaptative à l’exposition répétée de cuivre. Les symptômes ont été significativement ressentis à une dose > à 6 mg. Cu.L-1 (valeur mesurée) dès la 2e semaine chez les hommes et 4e semaine chez les femmes.
Une étude en double aveugle réalisée sur un petit nombre de sujets (14 adultes sains) a recherché les effets d’un apport journalier de capsules de 10 mg de cuivre sous forme de sel de gluconate ou d’un placebo pendant 12 semaines (Pratt et al., 1985). Aucune augmentation de cuivre, de zinc ou de magnésium sérique ou urinaire n’a été rapportée chez les sujets traités. De même, aucune altération significative des marqueurs sériques de toxicité hépatique (cholestérol, triglycérides, ASAT, g-GT et lactate déshydrogénase) n’a été observée entre sujets traités et témoins. Un NOAEL de 0,14 mg.kg-1.j-1 (relatif à l’absence d’effet hématologique, gastro-intestinal ou hépatique) a été retenu.
Les effets du cuivre sur la fonction immunitaire de 9 jeunes hommes traités 5 mois par un apport complémentaire d’une dose d’environ 8 mg de cuivre par jour (0,11 mg.kg-1.j-1 sous forme de sulfate de cuivre) se sont traduits par une diminution significative du taux de neutrophiles circulant (p<0,05) et du taux sérique du récepteur à l’interleukine 2 (p<0,05), ainsi que l’augmentation de la concentration de lymphocytes circulants (p<0,05) par comparaison à des sujets témoins (n=10). Les auteurs ont également observé une diminution du taux d’anticorps dirigés contre une souche virale de vaccin (Influenza Beijing), également significative par comparaison au groupe témoin (Turnlund et al., 2004).
Autres expositions :
Un jeune homme de 26 ans a présenté une cirrhose micronodulaire et une insuffisance hépatique aiguë suite à l'absorption quotidienne pendant 2 ans de comprimés contenant 30 mg de cuivre. Cette première période d'exposition a été suivie par une consommation journalière de 60 mg de cuivre pendant une période indéterminée avant l'apparition des symptômes. Les taux sériques de cuivre et de céruloplasmine étaient normaux mais ce patient présentait une excrétion urinaire de cuivre très élevée (207 mmol.j-1 versus <1,2 mmol.j-1). L'analyse du taux de cuivre contenu dans son foie après transplantation a révélé des concentrations comprises entre 3 à 230 mg Cu.g-1 contre une valeur physiologique de 20-50 mg Cu.g-1 (O'Donohue et al., 1993).
Deux enfants ayant absorbé de fortes teneurs en cuivre pendant une période de moins de 9 mois, ont présenté une hépato-splénomégalie marquée associée à des taux sériques élevés de transaminases et bilirubine. La contamination s'est effectuée via l'eau de boisson contenant de 2,2 à 3,4 mg.L-1 de cuivre. Le niveau de consommation est indéterminé (Muller_Hocker et al., 1988).
L'absorption de 5,7 à 637 mg Cu kg-1.j-1 sous forme de sulfate de cuivre a entraîné chez des adultes une nécrose hépatique centrolobulaire et une nécrose tubulaire rénale (Chuttani et al., 1965). Cette atteinte rénale a été également décrite chez un enfant ayant absorbé une solution contenant environ 3 g de cuivre sous forme de sulfate de cuivre (Walsh et al., 1977).
Voie cutanée
Dans le cadre de tests épicutanés incluant le sulfate de cuivre réalisés sur 2 660 patients, les 3,5 % de tests positifs au cuivre ont clairement été associés à une hypersensibilité au nickel. Seule une personne a présenté une sensibilisation exclusive au cuivre (électricien en contact journalier avec des câbles en cuivre et souffrant d’eczéma), cas extrêmement rare qui a conduit les auteurs à considérer le cuivre comme n’étant pas un sensibilisant (Wöhrl et al., 2001).
Synthèse
Chez l’homme, l’exposition chronique au cuivre par ingestion entraine principalement des troubles gastro-intestinaux (nausée, diarrhée) ; des effets hépatiques et rénaux sont observés pour des expositions à des niveaux élevés. L’exposition au cuivre par inhalation induit une irritation des voies aériennes supérieures et une pneumopathie interstitielle.
Chez l'animal
Inhalation
Une étude chez le lapin a comparé les effets pulmonaires d’une exposition par inhalation à raison de 6 h/j, 5 j/semaine pendant 4 à 6 semaines au chlorure de cadmium, cuivre et cobalt. Les lapins exposés au chlorure de cuivre, n’ont présenté qu’une légère augmentation du volume des cellules alvéolaire de type II sans lésion histologique associée, ni altération de la cellularité évaluée à partir de lavages broncho-alvéolaires à l’unique dose testée de 0,6 mg Cu.m-3 (Johansson et al., 1983 ; Johansson et al., 1984).
Chez le rat, l’exposition à 0,2 – 0,8 et 2 mg.m3 d’oxyde de cuivre par inhalation (corps entier) pendant 4 semaines n’induit qu’une inflammation (augmentation du nombre de polynucléaires neutrophiles dans les lavages broncho-alvéolaires à toutes les doses) transitoire réversible à 13 semaines (Kirkpatrick, 2010, étude non publiée RAR, 2016, vol.3).
Voie orale
La majorité des informations disponibles concernent le sulfate de cuivre
Sulfate de cuivre :
Par voie orale, des rats et des souris ont été exposés à du sulfate de cuivre (respectivement 0 – 500 – 1 000 - 2 000 – 4 000 - 8 000 ppm pour les rats et 0 – 500 – 1 000 - 2 000 – 4 000 - 8 000 – 16 000 ppm pour les souris) dans l'alimentation pendant 13 semaines (Hebert et al., 1993). Les rats ont présenté une diminution de croissance pondérale à partir de 4 000 ppm chez les mâles (66 mg Cu kg-1.j-1) et 8 000 ppm chez les femelles (134 mg Cu kg-1.j-1) sans autres signes cliniques. A partir de 2 000 ppm, des lésions d’intensité variable du pré-estomac (hyperplasie et une hyperkératose) ont été décrites. Des atteintes rénales, à partir de 2 000 ppm (gouttelettes protéiniques au niveau des tubules) généralement moins sévère chez les femelles que chez le mâle, et du foie, à partir de 4 000 ppm, caractérisée par une inflammation multifocale dose-dépendante, sont rapportées. Un NOAEL a été déterminé à 1 000 ppm soit 16,3 mg Cu kg-1.j-1 pour les mâles et 17,3 mg Cu kg-1.j-1 pour les femelles pour les effets sur l’estomac. Les souris sont moins sensibles ; un NOAEL est de 2 000 ppm soit de 97 mg Cu kg-1.j-1 chez les mâles et de 126 mg Cu kg-1.j-1 chez les femelles est retenu (Hebert et al., 1993).
Des rats exposés à des doses de 40 à 250 mg Cu kg-1.j-1 sous forme de sulfate de cuivre pendant 2 à 6 semaines, ont présenté une nécrose hépatique centrolobulaire associée à des variations des activités enzymatiques sériques (ALAT), marqueurs de toxicité hépatique. Pour une exposition de 6 semaines, une hépatite chronique est observée. Ces lésions hépatiques sont associées à une nécrose tubulaire rénale à des doses de 150 à 250 mg Cu kg-1.j-1 pendant 4 à 5 semaines. Néanmoins, les effets hépatiques et rénaux initialement observés à la 6e semaine de traitement ont naturellement régressé au cours des semaines suivantes (entre les 9e et 15e semaines) et ce jusqu’à la fin de l’étude (52 semaines) suggérant une tolérance au cuivre avec réversibilité des effets. (Haywood, 1980, 1985). Les animaux ont même toléré une dose de 300 mg Cu.kg-1.j-1 à partir de la 15e semaine sans conséquence jusqu’à la fin de l’étude (52 semaines).
Toujours chez le rat (Fischer 344), l’administration par voie orale de sulfate de cuivre aux doses de 18 (lot témoin), 750, 1000, 1250, 1500 et 2000 µg Cu.g-1 d’aliments sous forme de CuSO4) pendant 3 mois a entraîné une diminution de la croissance pondérale et des changements morphologiques significatifs au niveau du foie (nécrose, inflammation portale, pigments) à partir de 1250 µg.g-1 de Cu, avec une augmentation graduelle des lésions selon les doses de cuivre (Aburto et al., 2001).
Une diminution du taux d'hémoglobine et de l'hématocrite est observée chez des rats exposés à des doses supérieures ou égales à 40 mg Cu kg-1.j-1 sous forme de sulfate de cuivre pendant 20 à 90 jours (Kumar et Sharma, 1987 ; NTP, 1990 ; Rana et Kumar, 1980) et chez des porcs pour des doses supérieures ou égales à 14,6 mg Cu kg-1.j-1 sous forme de carbonate ou de sulfate de cuivre pendant 48-54 jours (Kline et al., 1971 ; Suttle et Mills, 1966a, 1966b).
Chez la souris, l'administration de sulfate de cuivre dans l'eau de boisson pendant 10 semaines induit une inhibition de la réponse lymphoproliférative vis-à-vis d'agents bactériens (E. coli), une diminution de la réponse anticorps et des réponses de type hypersensibilité retardée pour des doses de 100 et 200 mg Cu kg-1.j-1 (Pocino et al., 1990 ; Pocino et al., 1991).
Les fortes concentrations en cuivre observées dans les différents organes (x29 dans le foie, x3 dans les reins et x1,5 dans le cerveau) chez les animaux exposés jusqu’à 90 jours au sulfate de cuivre (25 ou 51 mg Cu.kg-1.j-1) par comparaison au lot témoin ont pu être corrélées à l’augmentation des enzymes hépatiques (ALAT, ASAT) et de la bilirubine pour ce qui est du foie, de l’urée sanguine en lien avec la toxicité rénale, ou encore aux résultats des différents tests neurocomportementaux en lien avec l’imprégnation de cuivre au niveau du cerveau (Kumar et al., 2015). Une diminution des performances aux tests d’agrippements (tonus musculaire), test de la tige tournante (« rotarod test » coordination motrice) ou encore au test du labyrinthe symétrique (« symmetrical dry Y-maze » activité exploratrice) a été rapportée chez les animaux après 30, 60 ou 90 jours de traitement. Le traitement a par ailleurs entraîné une perte de poids progressive significative dès 30 jours à la plus forte dose et à partir de 60 jours à la seconde dose, avec un déficit respectif de -26 et -21 % par comparaison au lot témoin à la fin de l’étude. Il n’est pas fait mention dans l’étude de l’état général des animaux susceptible d’interférer avec les résultats des différents tests de motricité. A noter également dans cette étude, qu’aucune analyse histologique des organes n’a été réalisée. Les effets étant observés à toutes les doses testées, aucune valeur de NOAEL n’a pas pu être déterminée.
Carbonate de cuivre :
A des doses de 2 000 mg.kg-1.j-1 pendant 13 semaines (carbonate de cuivre), entraînant une forte surcharge en cuivre, les rats soumis à une forte diarrhée, déshydratation et perte de poids n’ont le plus souvent pas survécu (Bertinato et al., 2010). Les autopsies ont révélé une distension de l’estomac et du cæcum, une dilatation des reins et plus modérée de la rate, ainsi qu’une anomalie de pigmentation du foie.
Une autre étude chez des rats montre une augmentation du taux d'hémoglobine pour une dose de 10 mg Cu kg-1.j-1 sous forme de carbonate de cuivre pendant 20 semaines (Liu et Medeiros, 1986).
Gluconate de cuivre :
Une surcharge plus modérée de 7,5 mg de gluconate de cuivre(II).kg-1.j-1 (environ 50 fois l’apport recommandé) administrée via l’alimentation à des singes adultes (2 mâles et 2 femelles) pendant 36 mois n’a entrainé aucune altération hépatique (biopsie, biochimie du sang) (Araya et al., 2012). Aucun signe clinique n’a été observé malgré une concentration hépatique de cuivre plus de 5 fois supérieure à celle des animaux témoins. Seule une augmentation de l’expression de gènes impliqués dans l’inflammation (HGF, TGFβ et NFΚB) ont été observés au niveau du foie. En revanche chez le rat, le gluconate de cuivre administré à une dose de 80 mg Cu.kg-1.j-1 (20 mâles et 20 femelles) dans l’alimentation s’est avéré fatal pour 90 % des animaux après 4 à 8 mois de traitement (Harrisson et al., 1954). La mortalité a été corrélée à l’augmentation importante du cuivre hépatique ainsi qu’à l’augmentation de la concentration d’azote sanguin.
Aucun effet n’a par ailleurs été décrit chez des chiens beagle ayant reçu dans leur alimentation jusqu’à la plus forte dose de 8,4 mg.kg-1.j-1 de gluconate de cuivre pendant 6 à 12 mois du (NRC, 2000). Les légères modifications du taux de transaminases observées à cette dose se sont normalisées après l’arrêt de l’exposition.
Chez la souris (C57BL/6J), l’exposition vie entière à 4,25 mg Cu.kg-1.j-1 sous forme de gluconate de cuivre dans l’eau de boisson a entraîné une baisse de longévité de 12,8 % (réduite de 986 à 874 jours en moyenne) sans pour autant montrer d’effet sur la croissance pondérale jusqu’à 850 jours (Massie et Aiello, 1984). Aucun autre paramètre de toxicité n’a été évalué dans cette étude, en dehors de l’augmentation de la concentration en cuivre observée uniquement au niveau du foie.
Complexe cuprique :
Enfin dans la seule étude de toxicité chronique par voie orale (alimentation) sur deux ans réalisée chez le rat, la plus forte dose d’une préparation de complexe cuprique de sodium et potassium (équivalent à 2,7 -27 et 80 mg. Cu.kg-1.j-1) pendant 104 semaines a entrainé une coloration de plusieurs organes sans lésion cellulaire associée (52 semaines) ou encore des modifications mineures du cortex surrénalien de nature kystique chez 2 animaux, ainsi qu’un petit adénome (104 semaines) (Harrisson et al., 1954). Un NOAEL de 27 mg Cu kg-1.j-1 a été retenu.
Voie cutanée
Synthèse
Chez l’animal, des expositions par voie orale au sulfate de cuivre induisent une diminution pondérale, et des altérations tissulaires au niveau du pré-estomac, du foie et des reins, avec une plus grande sensibilité chez les rats mâles. Une atteinte du système nerveux central a été évoquée mais demande à être confirmée. Des effets hématologiques et une atteinte du système immunitaire sont également observées. Les autres voies d’exposition (inhalation et cutanée) ne sont pas suffisamment documentées pour en évaluer d’éventuels effets.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | non classé pour le cuivre, le chlorure cuivreux, l’oxyde cuivreux, le sulfate de cuivre | 2008 |
| IARC | Classe 3 (ne peut être classée pour sa cancérogénicité pour l'homme ) pour le 8-hydroxyquinoléate de cuivreNon classé pour le cuivre et autres composés | 1987 |
| US EPA | Classe D : substance non classifiable quant à sa cancérogénicité pour l'homme | 1991 |
Chez l'homme
Toutes voies
Les données épidémiologiques disponibles pour lesquelles les taux de cuivre sériques ont été mesurés lors de cancers déclarés (cancers du sein ou de l’œsophage) ne peuvent être retenues en raison d'une étiologie plurifactorielle de ces cancers (Cavallo et al., 1991 ; Dabek et al., 1992 ; Prasad et al., 1992). Au cours d'études prospectives où les taux sériques de cuivre ont été mesurés avant le développement de tumeurs, il est observé des relations entre des taux sériques en cuivre supérieurs à 1,25 mg.L-1 et l'apparition de cancers. Toutefois, aucune certitude n'a pu être établie, ainsi qu'aucune relation dose-effet (Coates et al., 1989 ; Kok et al., 1988 ; Overvad et al., 1993).
Aucune augmentation de l’incidence de cancers n’a été décrite chez les patients porteurs de maladies génétiques susceptibles d’entraîner une accumulation de cuivre dans le foie, les reins et le cerveau (Maladie de Wilson) ou encore au niveau de l’épithélium intestinal, les reins et les fibroblastes (Maladie de Menkes) (RAR, 2016, vol.1).
Une étude cas-témoins réalisée à partir de 171 patients et 309 sujets témoins a mis en évidence un risque accru significatif d’apparition de cancer colorectal avec un apport en cuivre dans l’alimentation (comparaison entre le quartile supérieur et inférieur) (odds ratio = 2,4 IC95%[1,3 -4,6], p<0,01), mais également avec le fer, la vitamine E et aliments à haute teneur énergétique (Senesse et al., 2004).
De même, aucune association entre l’apport en cuivre et le cancer des poumons n’a été observée dans une étude de cohorte rétrospective (Mahabir et al., 2010). Dans une étude de cohorte portant sur les associations entre de multiples antioxydants et des cancers chez les femmes, les risques de lymphome non hodgkinien, de lymphome diffus à grandes cellules B ou de lymphome folliculaire n’augmentaient pas pour les participantes dont l’apport en cuivre était plus important (Thompson et al., 2010 ; Santé Canada, 2019).
Quel que soit le type de données analysées, aucune certitude n'a pu être établie concernant le rôle potentiellement cancérigène du cuivre chez l'homme.
Synthèse
Les données humaines, bien que très partielles, sont plutôt en faveur d’une absence d’effet cancérigène des sels du cuivre.
Chez l'animal
Voie orale
Les données disponibles sont issues des études de toxicité chronique.
Aucun développement spontané de tumeurs n’est observé chez des rats exposés par voie orale à différents sels de cuivre sous forme de complexe cuprique de sodium et potassium (équivalent à 2,7 -27 et 80 mg. Cu.kg-1.j-1) pendant 104 semaines, de sulfate de cuivre (équivalent à 27 et 80 mg. Cu.kg-1.j-1) ou gluconate de cuivre (équivalent à 80 mg. Cu.kg-1.j-1 pendant 44 semaines (Harrisson et al., 1954).
Dans une autre étude de 52 semaines, réalisée uniquement à forte dose (250 mg Cu.kg-1.j-1) chez le rat, il n’est pas fait mention dans ces études de lésions précancéreuses ou de tumeurs au cours des 52 semaines d’exposition (fin de l’étude). (Haywood et Loughran, 1985).
Une absence d’activité co-cancérogène et/ou de promotion tumorale ont pu être déduites à partir d’études (Burki et Okita, 1969 ; Carlton et Price, 1973 ; Howell, 1958) où différents sels de cuivre (acétate ou sulfate de cuivre) ont été administrés en même temps que des cancérogènes avérés tels que le DMBA, la diméthyl-nitrosamine et l'acétylamino-fluorène (RAR, 2016, vol. 1). Ces sels de cuivre semblent même inhiber le développement de tumeurs induites par ces cancérogènes.
Synthèse
Les données disponibles chez l’animal ne sont pas en faveur d’un potentiel cancérogène.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé: chlorure de cuivre, sulfate de cuivreNon classé: oxyde de cuivre, dihydroxyde de cuivre,oxyde de dicuivre, trihydroxychlorure de dicuivre | 2018 |
Chez l'homme
Synthèse
Aucune donnée humaine n’a été identifiée.
Chez l'animal
Toutes voies
L’essai de synthèse non programmée de l’ADN (UDS) réalisé sur les hépatocytes de rats 10 à 12 heures après une exposition par voie orale (gavage) au sulfate de cuivre (632 et 2 000 mg.kg-1 équivalent à 161 et 509 mg Cu.kg-1) s’est révélé négatif (essai BPL non publié de 1994 ; RAR, 2016 vol.3).
Une augmentation des aberrations chromosomiques est observée dans la moelle osseuse de souris 6 heures après l'injection intrapéritonéale de 0,28 et 1,7 mg Cu.kg-1 sous forme de sulfate de cuivre (Agarwal et al., 1990) ou 24 heures après une dose de 20 mg.kg-1 également de sulfate de cuivre administré par gavage (Bhunya et Pati, 1987). Dans ce deuxième essai, sans la prise en compte des délétions (« chromatid gaps ») parmi les aberrations les plus fréquemment observées, les résultats de cet essai auraient été négatifs ; à noter également dans cette étude, l’absence de témoin positif, de témoins historiques et autres lacunes qui demandent à tenir compte de ces résultats avec précaution.
Enfin dans un test du micronoyau sur des érythrocytes prélevés sur des souris (OCDE 474 réalisé sous BLP) préalablement exposées deux jours consécutifs à une dose de 447 mg.kg-1 de sulfate de cuivre (soit 113 mg Cu.kg-1) s’est révélé négatif (étude non publiée de 1994, RAR, 2016, vol.3).
In vitro
Organismes procaryotes
Les tests de mutation génique réalisés sur différentes souches de bactéries (Test d’Ames) avec le sulfate de cuivre (Ballantyne, 1994), l’oxychlorure de cuivre (Dillon et Riach, 1994b) ou la bouillie bordelaise (Dillon et Riach, 1994a) se sont tous révélés négatifs, malgré une faible activité mutagène de l’oxychlorure de cuivre et de la bouillie bordelaise sur la souche TA 100 trop faible (inférieure à deux fois) pour remplir les critères de mutagénicité (RAR, 2016, vol.3).
Le sulfate de cuivre testé sur procaryotes ne présente pas d'activité mutagène (OMS IPCS, 1998). Cependant ce composé testé sur hépatocytes de rats in vitro, induit une augmentation de la synthèse d'ADN non programmée et s'accumule dans le nucléole pour des concentrations de 7,9 ; 15,7 ; 31,4 ; et 78,5 mmol.L-1 (Denizeau et Marion, 1989).
Organismes eucaryotes
Le chlorure de cuivre ne présente pas d'activité mutagène sur cellules procaryotes (Wong, 1988). Le nitrate de cuivre testé sur cellules de hamster chinois provoque une augmentation proportionnelle à la dose de la fréquence des mutations pour des concentrations de 0,01 et 0,1 mmol.L-1 ainsi qu'une augmentation des échanges entre chromatides sœurs pour des concentrations de 0,01 à 0,5 mmol.L-1 (Sideris et al., 1988).
Dans son rapport de 2016, la commission européenne a conclu que les composés du cuivre n’étaient vraisemblablement pas mutagènes (RAR, 2016). Aucune classification n’a été requise.
Synthèse
La majorité des résultats tant in vivo qu’in vitro se sont révélés négatifs. Aucun sel du cuivre n’a été classé mutagène par l’Union Européenne. Dans ses conditions, il n’est pas envisagé d’approche sans seuil pour le cuivre et ses composés.
Effets sur la reproduction
Chez l'homme
Toutes voies
Les stérilets en cuivre augmentent la concentration endométriale en cuivre or le cuivre induit une immobilisation irréversible du sperme in vitro (Holland et White, 1988).
Il n'existe pas d'autres données de toxicité spécifiques de la reproduction chez l'homme pour des expositions au cuivre par inhalation, voie orale ou voie cutanée (ATSDR, 2004 ; OMS IPCS, 1998).
Synthèse
Chez l’homme, le cuivre induit une immobilisation irréversible du sperme ; cet effet est utilisé en contraception (stérilet).
Chez l'animal
Inhalation
Par inhalation, chez des rats mâles exposés à un aérosol de chlorure de cuivre, des modifications du sperme (histomorphologiques, mobilité), du poids des testicules et des taux circulants d'hormones sexuelles sont observées pour une exposition de 4 mois à la concentration de 19,6 mg.m-3 de cuivre (Gabuchyan, 1987).
Voie orale
Chez des souris B6C3F1 mâles et femelles, aucun effet sur les organes de la reproduction n'est enregistré pour des doses de 398 (males) et 537 (femelles) mg Cu kg-1.j-1 sous forme de sulfate de cuivre dans l'alimentation pendant 92 jours (Hebert et al., 1993). Une augmentation significative du poids des testicules chez des rats exposés par l'alimentation à de l'acétate de cuivre est rapportée pour une dose de 130 mg Cu kg-1.j-1 (Llewellyn et al., 1985).
Une étude conduite sur deux générations par voie orale (alimentation) n’a pas mis en évidence chez le rat d’effet sur les différents paramètres de la reproduction y compris à la plus forte dose testée de 1 500 ppm de sulfate de cuivre penta-hydraté (NOAEL équivalent à une dose comprise entre 23 et 56 mg Cu.kg-1.j-1 selon les différentes phases de l’étude (Etude non publiée de 2005, RAR, 2016 vol.1). Les seuls effets attribuables au traitement se sont limités à une baisse du poids de la rate sans lésion histologique associée aussi bien chez les animaux de génération parentale (femelles P1 uniquement) que les animaux F1 et F2 (mâles et femelles après sevrage) à la plus forte dose de 1 500 ppm (NOAEL de 1 000 ppm soit 15,2 à 23,5 mg Cu.kg-1.j-1 pour les mâles et 17 à 26,7 mg Cu.kg-1.j-1 pour les femelles).
En revanche, à des doses similaires de 100 et 200 mg.kg-1.j-1 de sulfate de cuivre (équivalentes à environ 25 et 50 mg Cu.kg-1.j-1), l’exposition pendant 56 jours a eu une forte incidence sur la qualité du sperme (concentration, viabilité et motilité)(p<0,05) et l’histologie des tubes séminifères (rétrécissement de la lumière et déplétion de l’épithélium germinal) (Sakhaee et al., 2012).
Synthèse
Chez l’animal, les sels de cuivre inhalés ou ingérés peuvent induire des altérations chez les mâles (modification de la morphologie et de mobilité du sperme, du poids des testicules et des taux circulants d'hormones sexuelles) sans effet sur la capacité de reproduction.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé: chlorure de cuivre, sulfate de cuivreNon classé: oxyde de cuivre, dihydroxyde de cuivre,oxyde de dicuivre, trihydroxychlorure de dicuivre | 2018 |
Chez l'homme
Toutes voies
Chez la femme, la grossesse est associée à une augmentation de la rétention de cuivre liée à une diminution de l'excrétion biliaire induite par les variations du statut hormonal. Les taux de cuivre sérique et de céruloplasmine augmentent considérablement au cours du dernier trimestre de gestation (Mc Ardle, 1995).
Une étude réalisée au cours des années 1976-1978 aux Etats-Unis, montre qu'il n'existe pas de corrélation entre le risque abortif et une exposition au cuivre présent dans l'eau de boisson à des concentrations supérieures à 1 mg.L-1 (Aschengrau et al., 1989).
Seules les femmes atteintes de la maladie de Wilson (accumulation de cuivre principalement au niveau du foie, du cerveau et des reins) et qui ne suivent aucun traitement présentent fréquemment des avortements spontanés (Santé Canada, 2019).
Une association significative (p<0,0001) entre les concentrations sériques de cuivre au cours du 1er trimestre de la grossesse et le risque de naissance prématurée a récemment été observée dans une étude comprenant 147 cas (concentration moyenne de cuivre de 184 µg.dL-1) et 381 femmes témoins (concentration moyenne de cuivre de 166 µg.dL-1) (Hao et al., 2019). La petite taille des échantillons issus d’une cohorte de 4 229 femmes enceintes limite néanmoins la portée de ces résultats qui doivent être confirmés.
Synthèse
Le cuivre n’induit pas d’effet sur le développement chez l’homme, cependant une augmentation de la fréquence des avortements est rapportée chez les femmes atteintes de la maladie de Wilson.
Chez l'animal
Voie orale
Sulfate de cuivre
Une augmentation de la mortalité fœtale et des anomalies du développement sont observées chez des fœtus de souris C5BL et DBA respectivement pour des doses supérieures ou égales à 3 000 ppm soit 104 mg Cu kg-1.j-1 et 155 mg Cu kg-1.j-1, sous forme de sulfate de cuivre administré pendant le mois précédent l'accouplement (Lecyk, 1980). La portée de cette étude est toutefois limitée en raison de l’absence d’information sur la toxicité maternelle (croissance pondérale, toxicité hépatique).
Des effets sur le poids de naissance, sur le poids des organes et la biochimie sanguine de nouveau-nés de souris sont enregistrés pour une exposition par l'eau de boisson à du sulfate de cuivre pendant la seconde moitié de la gestation, à des doses de 1,3 à 1,6 mg Cu kg-1.j-1 (Kasama et Tanaka, 1988).
Hydroxyde de cuivre
Une étude par gavage sous forme d’hydroxyde de cuivre (7 au 28e jour de gestation à des doses de 0, 6, 9 ou 18 mg Cu.kg-1.j-1) chez la lapine a retenu une NOAEL de 6 mg Cu.kg-1.j-1 pour la toxicité maternelle et fœtale sur la base d’une perte d’appétence et baisse de croissance pondérale des mères et l’augmentation du nombre de variations squelettiques chez les fœtus à la dose supérieure de 9 mg Cu.kg-1.j-1(étude non publiée de 2003, RAR, 2016, vol.3). L’exposition maternelle à l’hydroxyde de cuivre n’a pas été associée à une augmentation de l’incidence des malformations, pertes préimplantatoires ou mortalités embryonnaires et/ou fœtales.
Aucun effet n’a été observé sur de jeunes singes exposés de la naissance jusqu’au 5ème mois à une dose de 6,6 mg.L-1 de sulfate de cuivre (soit 900 µg.kg-1.j-1). Les examens histologiques n’ont en particulier pas mis en évidence de lésions hépatiques, mais uniquement une augmentation de cellules de Kupffer, marqueur d’une inflammation (Araya et al., 2005).
Des résultats similaires, à savoir absence de toxicité hépatique, ont été décrit chez de jeunes singes ayant reçu dès la naissance 5,5 mg de gluconate de cuivre(II).kg-1.j-1 pendant 36 mois, malgré une concentration de cuivre dans le foie environ 4 fois supérieure à celle des animaux non soumis au même régime alimentaire (Araya et al., 2012).
Synthèse
Chez l’animal, si le sulfate de cuivre a mis en évidence une toxicité fœtale sévère (mortalité) dans une étude sans donnée sur la toxicité maternelle, l’hydroxyde de cuivre entraîne qu’une faible toxicité fœtale (côtes surnuméraires) chez la lapine dont l’origine maternelle n’est pas totalement exclue, et aucun effet sur le développement post-natal chez le singe (exposition néo-natale). Aucune de ces études n’a mis en évidence d’effet tératogène (lapin).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’OEHHA propose un REL de 100 µg Cu.m-3 pour une exposition aiguë (1 heure) par inhalation (OEHHA, 2008).
Cette valeur établie à partir d’une exposition de salariés à la poussière de cuivre. Entre 1 et 3 mg.m-3 l’exposition à des poussières de cuivre de courte durée (non précisée) entraine l’apparition d’un goût sucré sans autre symptôme (Whitman, 1957). L’effet critique retenu est la fièvre des fondeurs. De cette étude, une NOAEC de 1 mg Cu.m-3 est déduite.
Facteurs d’incertitudes : un facteur de 10 est appliqué pour prendre en compte la variabilité au sein de l’espèce humaine.
Calcul : 1 mg Cu.m-3/10 = 0,1 mg Cu.m-3.
Indice de confiance : L’OEHHA ne propose pas d’indice de confiance cependant en raison de la limitation des données il recommande une révision de la valeur.
Effets à seuil - Exposition chronique par inhalation :
Le RIVM propose une TCA de 1 mg.m-3 pour une exposition chronique par inhalation (Baars et al., 2001).
Cette valeur est basée sur une étude chez le lapin exposé au chlorure de cuivre à 0,6 mg Cu.m-3 6 h/j, 5 j/sem, pendant 6 semaines (Johansson et al., 1983 ; Johansson et al., 1984). En l’absence d’effet pulmonaire, une NOAEC de 0,6 mg.m-3 est déterminée. Un ajustement pour une exposition continue a été réalisé (5 j/7 j x 6 h/24 h) :
0,6 mg.m-3 x (5 j/7 j x 6 h/24 h) = 0,107 mg.m-3
Facteur d’incertitude : un facteur d'incertitude de 100 a été appliqué pour les variations interspécifiques (10) et intraspécifiques (10).
Calcul : 0,107 mg.m-3 x 1/100 = 0,001 mg.m-3 = 1 µg.m-3
Indice de confiance : Selon le RIVM la fiabilité de cette valeur est moyenne.
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 0,01 mg de Cu.kg-1.j-1 pour une exposition aiguë par voie orale (ATSDR, 2004).
Cette valeur est déterminée à partir de l’étude chez le volontaire sain de Pizarro et al., 1999a, menée sur un groupe total de 60 femmes exposées au cuivre, sous forme de sulfate de cuivre dans l’eau de boisson aux doses de 0,006 – 0,0272 – 0,0731 – 0,124 mg de Cu.kg-1.j-1. La durée totale de l’étude est de 11 semaines, divisée en 4 périodes de 2 semaines d’exposition, séparée par des périodes d’une semaine sans exposition. Vingt et un sujets ont présenté des symptômes gastro-intestinaux, principalement sous forme de nausée. Chez 9 sujets des diarrhées, avec ou sans douleurs abdominales ont été rapportées, dont 6 sont apparues durant la première semaine de traitement, sans effet dose-dépendant. Douze sujets ont présenté des douleurs abdominales, nausées et/ou vomissements, aux incidences de 3/60, 1/60, 10/60 et 9/60, respectivement dans les groupes 0 - 0,0272 – 0,0731 – 0,124 mg de Cu.kg-1 .j-1. La différence est significative à partir de 0,0731 mg de Cu.kg-1.j-1, un NOAEL de 0,0272 mg de Cu.kg-1.j-1 est donc déterminé pour les effets gastro-intestinaux pour une exposition chez la femme via l’eau de boisson pour une exposition de deux semaines.
Facteurs d’incertitudes : un facteur de 3 est appliqué correspondant à la différence de sensibilité au sein de la population humaine, cette valeur tient compte du fait que les effets retenus ne sont pas dépendants de variations toxicocinétiques.
Calcul : 0,0272 mg de Cu.kg-1.j-1/3 = 0,009 arrondi à 0,01 mg de Cu.kg-1.j-1
Indice de confiance : aucun indice de confiance n’est mentionné par l’ATSDR.
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 0,01 mg de Cu.kg-1.j-1 pour une exposition sub-chronique par voie orale (ATSDR, 2004).
Cette valeur est déterminée à partir de l’étude sur volontaires sains d’Araya et al., 2003b, 2004 réalisée chez 1 365 adultes exposés pendant 2 mois à des concentrations de 0 – 2 – 4 – 6 mg de Cu.L-1 sous forme de sulfate de cuivre dans l’eau utilisée pour la boisson et la cuisson des aliments (en plus de l’apport alimentaire estimé à 0,9 mg.j-1). La consommation de cuivre est évaluée à 0 – 0,042 – 0,091 – 0,17 mg de Cu.kg-1.j-1. Les incidences des symptômes gastro-intestinaux ont été de 11,7 – 15,3 – 18,3 – 19,7 % respectivement pour les différents groupes. La plus faible concentration avec effet (troubles gastro-intestinaux) était de 4 mg.L-1 (0,091 mg de Cu.kg-1.j-1) et la dose estimée sans effet (NOAEL) était de 0,042 mg Cu.kg-1.j-1 (2 mg.L-1) (Araya et al., 2003 ; Araya et al., 2004).
Facteurs d’incertitudes : un facteur de 3 est appliqué correspondant à la différence de sensibilité au sein de la population humaine, cette valeur tient compte du fait que les effets retenus ne sont pas dépendant de variations toxicocinétiques.
Calcul : MRL = 0,042 mg de Cu.kg-1.j-1/3 = 0,014 arrondie à 0,01 mg de Cu.kg-1.j-1
Indice de confiance : aucun indice de confiance n’est mentionné par l’ATSDR
Effets à seuil - Exposition chronique par voie orale :
Le RIVM propose une TDI de 140 mg.kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
Des souris mâles C57BL/6J sont exposées au cuivre via l’eau de boisson durant la vie entière (Massie et Aiello, 1984). Un LOAEL de 4,2 mg.kg-1.j-1 a été défini pour une diminution de l’espérance de vie (12,8 % par rapport aux témoins).
Un LOAEL de 4,2 mg.kg-1.j-1 établi chez la souris au cours d'une exposition chronique (ATSDR, 1990).
Facteurs d’incertitude : Selon le RIVM, les facteurs d’extrapolation conventionnels ne sont pas adéquats pour le cuivre. En effet, un facteur d'incertitude de 1 000 - correspondant aux variations interspécifiques (10), intraspécifiques (10) et pour l'extrapolation à un NOAEL (10) – aboutirait à une valeur de 4 µg.kg-1.j-1, inférieure aux valeurs limites minimales requises pour éviter une déficience en cuivre (de 20 à 80 µg.kg-1.j-1). De ce fait, le RIVM recommande de conserver la valeur établie par Vermeire et al., 1991 de 140 µg.kg-1.j-1, ce qui laisse quand même un facteur d’incertitude 30 (Rapport en néerlandais cité dans RIVM, 2001).
Calcul : 4,2 mg.kg-1.j x 1/30 = 0,14 mg.kg-1.j-1
Indice de confiance : Selon le RIVM la fiabilité de cette valeur est moyenne.
Santé Canada propose une DJT pour une exposition chronique par voie orale (2010) de 0,141 mg.kg-1.j-1 chez l’adulte (> à 20 ans), de 0,091 mg.kg-1.j-1 pour les nouveau-nés de 0 et 6 mois, et les enfants de 7 mois à 4 ans, de 0,11 mg.kg-1.j-1 pour les enfants de 5 à 11 ans et de 0, 126 mg.kg-1.j-1 pour les 12 à 19 ans (Santé Canada, 2010).
Cette valeur a été construite sur la base d’une étude chez 14 adultes sains qui ont reçu un apport journalier de capsules de 10 mg de cuivre sous forme de sel de gluconate ou d’un placebo pendant 12 semaines (Pratt et al., 1985). Aucune augmentation de cuivre, de zinc ou de magnésium sérique ou urinaire n’a été rapportée chez les sujets traités. Les effets critiques retenus sont les effets hépatiques et gastrointestinaux. En absence d’effet un NOAEL de 10 mg.j-1 a été retenu et rapporté au poids moyen d’un adulte de 70 kg soit 0,14 mg.kg-1.j-1. Cette valeur a ensuite été rapportée au poids moyen d’un enfant de 5 à 11 ans et au poids moyen d’un jeune enfant (de la naissance à 4 ans).
Facteurs d’incertitude : aucun facteur d’incertitude n’a été appliqué mais une valeur a été calculée selon l’âge.
Calcul : non détaillé
Indice de confiance : aucun indice n’a été établi par l’organisme.
L’EFSA propose une DJA de 0,15 mg.kg-1.j-1 pour une exposition chronique par voie orale (EFSA, 2018).
Une dose journalière de 10 à 12 mg de cuivre a été proposée comme sans danger chez l’adulte sur la base d’études humaines chez les enfants (OMS, 1996), ce qui correspond après ajustement de la masse corporelle à une dose de 0,2 mg.kg-1.j-1 et de 0,15 mg.kg-1.j-1 chez les enfants. Cette valeur est confortée par celle qui pourrait être construite à partir de données animales à partir d’un NOAEL de 16 mg.kg-1.j-1 (mâles) dans une étude de toxicité de 90 jours chez le rat sur la base d’effets sur le foie (inflammation chronique) et le pré-estomac (hyperplasie et hyperkératose de la muqueuse) et l’utilisation d’un facteur d’incertitude de 100 (Hebert et al., 1993 ; RAR, 2016, vol. 1). Après avoir tenu compte des recommandations chez l’adulte, la consultation d’experts de l’OMS a fixé une dose limite supérieure sans danger pour les enfants de 0,15 mg.kg-1.j-1. Cette valeur est considérée comme étant suffisamment protectrice chez les enfants et est étayée par les données d’études épidémiologiques (Scheinberg et Sternlieb, 1994 ; Zietz et al., 2003) qui ont démontré l’absence d’effet sur les enfants (0 à 8 ans) jusqu’à une concentration de 8 mg.L-1 de cuivre dans l’eau de boisson. Cette valeur correspond à une dose de 0,23 mg.kg-1.j-1 en considérant qu’un enfant de 15 kg consomme en moyenne 400 mL d’eau par jour.
Facteurs d’incertitude : un facteur d’incertitude 100 a été appliqué (répartition non détaillée).
Calcul : 16 mg.kg-1.j x 1/100 = 0,16 mg.kg-1.j-1 arrondi à 0,15 mg.kg-1.j-1
Indice de confiance : aucun indice n’a été établi par l’organisme.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’INERIS propose de ne pas retenir pour une exposition aiguë au cuivre par inhalation la VTR aiguë de 100 µg.m-3 de l’OEHHA (2008).
Cette valeur est issue d’une étude non publiée menée chez le travailleur exposé professionnellement. Les conditions d’exposition (notamment durée) ne sont pas précisées mais semblent correspondre à des pics lors d’une exposition continue. L’effet critique retenu i.e. la fièvre des fondeurs ne semble pas spécifique à l’inhalation de cuivre. Cet effet est plus lié à des expositions chroniques et ne semble pas pertinent ici.
Effets à seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir pour une exposition chronique au cuivre par inhalation la VTR chronique de 1 µg.m-3 du RIVM.
Une seule valeur est disponible (RIVM, 2001). L’étude est de qualité recevable. La description de la construction de la valeur est limitée. L’effet critique retenu est pertinent au regard du profil toxicologique et le calcul est cohérent.Cette valeur est retenue malgré les limites de construction.
Indice de confiance : faible en raison des limites de construction de la valeur.
Effets à seuil - Exposition aiguë par voie orale :
L’INERIS propose de ne pas retenir pour une exposition aiguë au cuivre par voie orale la VTR aiguë de 0,01 mg.kg-1.j-1 de ATSDR.
Seul l’ATSDR propose une valeur. Mais compte tenu des limites des résultats de l’étude celle-ci n’est pas jugée pertinente pour la construction d’une VTR.
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de ne pas retenir pour une exposition sub-chronique au cuivre par voie orale la VTR sub-chronique de 0,01 mg.kg-1.j-1 de l’ATSDR.
Seul l’ATSDR propose une VTR. Mais compte tenu des limites des résultats de l’étude celle-ci n’est pas jugée pertinente pour la construction d’une VTR.
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir pour une exposition chronique au cuivre par voie orale la VTR chronique de 150 µg.kg-1.j-1 de l’EFSA (2018).
Trois valeurs sont disponibles élaborées par le RIVM (2001), Santé canada (2010) et l’EFSA (2018).
Aucune des études n’est tout à fait satisfaisante et la construction des valeurs n’est pas toujours transparente même si elles aboutissent toutes les trois à la même valeur. La méthode de construction qui est retenue est la plus récente, celle de l’EFSA.
Indice de confiance : faible en raison du manque de transparence de la construction des valeurs
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 30/06/2025
Introduction
Mise en garde - décembre 2019
Les résultats d’essais rapportés dans cette section n’ont pas été mis à jour lors de la révision de 2019. Ils restent néanmoins informatifs de l’écotoxicité du cuivre sur différents taxons, d’eau douce et marine. Une littérature fournie a depuis été publiée sur l’écotoxicité du cuivre, qui intègre la prise en compte de sa spéciation et de l’affinité de ses espèces chimiques avec les ligands biologiques. On notera comme document de référence le Voluntary Risk Assessment (ECHA, 2008) qui contient à la fois une bibliographie étendue sur l’écotoxicité du cuivre, les éléments explicatifs du concept de Biotic Ligand Model et son application.
L’utilisation de tels modèles prenant en compte la spéciation est aujourd’hui recommandée pour une application réglementaire. Le guide réalisé dans le contexte de la Directive Cadre sur l’Eau donne des indications pratique pour l’application des BLM, et des valeurs de références associées (EC, 2019).
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis.
Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis (Klimisch et al., 1997). Klimisch et al., 1997 ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après :
• Score 1 : valide (sans restriction)
• Score 2 : valide avec restriction
• Score 3 : non valide
• Score 4 : pas suffisamment d'information pour valider le test
On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2).
Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC.
Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Description
Organismes aquatiques de la colonne d'eau
Paramètres d’écotoxicité aiguë
Etant donné le nombre élevé de données d'écotoxicité disponibles pour les algues, les micro-crustacés et les poissons, seuls les essais chroniques sont retenus.
Paramètres d’écotoxicité chronique
L’essentiel des données présentées ci-après provient du RIVM (1999). Nous avons sélectionné les données qui nous paraissaient les plus pertinentes lorsque les informations étaient disponibles (nous n'avons pas pris les données pour lesquels plus de 50 % d'effet étaient observés ; lorsque plusieurs critères d'effet étaient disponibles, nous avons sélectionné le plus sensible). Nous avons pu vérifier la validité de ces résultats dans un certain nombre de cas mais pas dans tous. En particulier, nous n'avons pas été à même de valider les données sélectionnées par le BKH (1995). Lorsque plusieurs résultats étaient disponibles sur une même espèce nous avons fait la moyenne de ces résultats sur le critère d'effet le plus sensible.
|
Espèce |
N/M1 |
Substance testée |
Durée |
Critère d’effet |
Valeur (µgCu /l) |
Référence |
|
Algues |
||||||
|
Communauté de périphyton |
|
|
28 j |
9,5 |
Belanger et al., 1996 |
|
|
Chlamydomonas reinhardtii |
M |
CuSO4 |
72 h |
NOECb |
16 |
BKH, 1995 Moyenne géométrique (n=5) |
|
Chlorella pyrenoidosa |
N |
CuCl2 |
- |
NOECb |
100 |
BKH, 1995 |
|
Chlorella fusca |
N |
CuCl2 |
10 j |
NOECb,w |
5,3 |
BKH, 1995 |
|
Chlorella vulgaris |
M |
CuCl2 |
96 h |
NOECb |
50 |
BKH, 1995 |
|
Chlorella saccarophila |
N |
Cu.. |
10 j |
NOECb,w |
330 |
BKH, 1995 |
|
Melosira spec. |
N |
CuSO4 |
9 j |
10 |
Horne et Goldman, 1974 |
|
|
Oocystus spec. |
N |
CuSO4 |
9 j |
10 |
Horne et Goldman, 1974 |
|
|
Scenedesmus quadricauda |
N |
CuSO4 |
72 h |
NOECb |
50 |
BKH, 1995 |
|
Scenedesmus subspicatus |
N |
CuSO4 |
72 h |
NOECb |
64 |
BKH, 1995 |
|
Selenastrum capricornutum |
N |
Cu2+ |
72 h |
NOECb |
64 |
RIVM, 1999 |
|
M |
CuCl2 |
96 h |
NOECb |
15 |
BKH, 1995 |
|
|
N |
CuSO4 |
72 h |
NOEC b |
19 |
|
|
|
|
|
72 h |
NOECb |
24 |
|
|
|
|
|
5 j |
NOECb |
21 |
|
|
|
N |
CuSO4 |
96 h |
NOECb |
57 |
|
|
|
|
|
|
|
28 |
Moyenne géométrique |
|
|
Lemna minor |
|
|
14 j |
60 |
Jenner et Janssen-Mommen, 1993 |
|
|
Rotifères |
||||||
|
Brachionus calyciflorus |
M |
Cu.. |
48 h |
NOECr |
20 |
BKH, 1995 |
|
Mollusques |
|
|
|
|
|
|
|
Campeloma decisum |
M |
CuSO4 |
6 s |
NOECa |
8 |
Arthur et Leonard, 1970 |
|
Deissena polymorpha |
M |
CuCl2 |
11 s |
NOECf,w |
17 |
BKH, 1995 |
|
Physa integra |
M |
CuSO4 |
6 s |
NOECa,c,r |
8 |
Arthur et Léonard, 1970 |
|
|
|
|
|
|
|
|
|
Crustacés |
||||||
|
Ceriodaphnia dubia |
M |
CuCl2 |
7 j |
NOECr |
12 |
Carlson et al., 1986 |
|
M |
Cu.. |
7 j |
NOECr |
6,3 |
BKH, 1995 |
|
|
M |
Cu.. |
7 j |
NOECr,w |
6,4 |
|
|
|
M |
Cu(NO3)2 |
7 j |
NOECr,w |
23 |
|
|
|
M |
Cu.. |
7 j |
NOECr,w |
27 |
|
|
|
M |
Cu.. |
7 j |
NOECr,w |
40 |
|
|
|
|
|
|
NOECr |
15 |
Moyenne géométrique |
|
|
Daphnia ambigua |
N |
CuSO4 |
6 s |
NOECc |
20 |
Winner et Farrel, 1976 |
|
Daphnia magna |
N |
CuCl2 |
14 j |
NOECr |
10 |
BKH, 1995 |
|
|
- |
- |
21 j |
NOECr |
11 |
Biesinger et Christensen, 1972 |
|
|
M |
CuCl2 |
14 j |
NOECr |
5 |
Van Leeuwen et al., 1988 |
|
|
|
|
|
NOECr |
8,2 |
Moyenne géométrique |
|
Daphnia pulex |
N |
CuCl2 |
21 j |
NOECa |
0,03 |
BKH, 1995 |
|
|
|
21 j |
NOECr |
0,3 |
||
|
Daphnia pulex |
M |
CuSO4 |
6 s |
NOECa |
11 |
BKH, 1995 |
|
M |
CuSO4 |
6 s |
NOECa |
35 |
||
|
M |
CuSO4 |
10 s |
NOECa |
5 |
Ingersoll et Winner, 1982 |
|
|
|
|
10 s |
NOECr |
10 |
||
|
|
|
|
NOECr |
1,7 |
Moyenne géométrique |
|
|
Gammarus pseudolimnaeus |
M |
CuSO4 |
15 s |
NOECc |
5 |
Arthur et Léonard, 1970 |
|
Gammarus pulex |
M |
CuSO4 |
14 s |
NOECc |
11 |
BKH, 1995 |
|
|
M |
CuSO4 |
10 j |
NOECa |
3,3 |
|
|
Insectes |
|
|
|
|
|
|
|
Chironomus tentans |
M |
CuCl2 |
21 j |
NOECa |
34 |
Nebeker et al., 1984 |
|
Clistoronia magnifica |
M |
CuCl2 |
8 m |
NOECr |
10 |
Nebeker et al., 1984 Moyenne géométrique (n=2) |
|
Poissons |
||||||
|
Brachydanio rerio ELS |
N |
CuSO4 |
16 j |
NOECr |
0,063 |
Dave et Xiu, 1991 |
|
Catostomus commersoni, ELS |
M |
CuSO4 |
6 s |
NOECa,c |
13 |
McKim et al., 1978 |
|
Corogonus artedi, ELS |
M |
CuSO4 |
9 s |
NOECa,c |
43 |
McKim et al., 1978 |
|
Cyprinus carpio, |
- |
CuSO4 |
13 s |
NOECa |
50 |
Muramoto, 1982 |
|
Esox lucius, ELS |
M |
CuSO4 |
6 s |
NOECa,c |
35 |
McKim et al., 1978 |
|
Ictalurus punctatus, ELS |
M,p |
CuSO4 |
9 s |
NOECc |
9 |
Sauter et al., 1976 |
|
Lepomis macrochirus |
M |
CuSO4 |
13 s |
NOECa |
21 |
Benoit, 1976 |
|
Micropterus dolomieui ELS |
M |
CuSO4 |
5 s |
NOECa,c |
37 |
McKim et al., 1978 |
|
Noemacheilus barbatulus |
M |
CuSO4 |
9 s |
NOECa |
120 |
Solbe et Cooper, 1976 |
|
Oncorhynchus mykiss, ELS |
M |
CuSO4 |
7 s |
NOECa,r |
11 |
McKim et al., 1978 |
|
M |
CuCl2 |
11 s |
NOECa,r |
31 |
Seim et al., 1984 |
|
|
|
|
11 s |
NOECc |
16 |
|
|
|
Oncorhynchus trutta, ELS |
M |
CuSO4 |
18 s |
NOECa,c |
22 |
McKim et al., 1978 |
|
Pimephales promelas |
M |
CuSO4 |
11 m |
NOECa,c,r |
11 |
Mount et Stephan, 1969 |
|
Pimephales promelas, ELS |
M |
CuSO4 |
4 m |
NOECa |
8 |
|
|
|
|
|
4 m |
NOECc |
11 |
|
|
|
M |
CuSO4 |
11 m |
NOECa,r |
15 |
Mount, 1968 |
|
|
|
|
11 m |
NOECc |
33 |
|
|
Pimephales promelas, ELS |
M |
Cu(NO3)2 |
32 j |
NOECa,c,w |
3,1 |
BKH, 1995 |
|
|
M |
Cu.. |
7 j |
NOECc |
9,9 |
|
|
|
M |
CuSO4 |
28 j |
NOECa |
61 |
|
|
|
|
|
28 j |
NOECc,w |
20 |
|
|
|
M |
CuSO4 |
28 j |
NOECa,r |
340 |
|
|
|
M |
CuSO4 |
8 j |
NOECa |
61 |
|
|
|
|
|
|
NOECc |
13 |
Moyenne géométrique |
|
Salvelinus fontinalis |
M |
CuSO4 |
22 m |
NOECa,c |
9 |
McKim et Benoit, 1971 |
|
|
|
|
22 m |
NOECr |
17 |
|
|
Salvelinus fontinalis, ELS |
M |
CuSO4 |
11 s |
NOECa,c |
22 |
McKim et al., 1978 |
|
|
M,p |
CuSO4 |
9 s |
NOECc |
0,67 |
Sauter et al., 1976[2] |
|
|
M,p |
CuSO4 |
9 s |
NOECa |
10 |
Dans RIVM (1999) |
|
|
M,p |
CuSO4 |
9 s |
NOECc |
2,0 |
|
|
|
M,p |
CuSO4 |
9 s |
NOECa |
19 |
|
|
|
|
|
|
NOECc |
4,0 |
Moyenne géométrique (n=4) |
|
Salvelinus namaycush |
M |
CuSO4 |
13 s |
NOECa,b |
22 |
McKim et al., 1978 |
|
Stizostedion vitreum |
M,p |
CuSO4 |
4 s |
NOECa,b |
10 |
Sauter et al., 1976 |
N : concentration nominale ; M : concentration mesurée, p : concentration ajoutée uniquement.
Les paramètres suivants ont été mesurés : a : mortalité ou immobilité ; b : biomasse, c : croissance ; d : photosynthèse ; f : taux de filtration ; r : reproduction
w : la NOEC a été calculée de la façon suivante : NOEC = EC/2 si 11 à 19 % d’effets étaient observés, NOEC=EC/3 si 20 à 49 % d’effets ont été observés, ou encore NOEC= 0,5 MATC[1] lorsque les résultats étaient exprimés sous la forme d’une MATC.
L’étude de Belanger et al., 1996 est effectuée en microcosme sur une communauté algale de périphyton.
Le résultat de 0,063 µg.L-1 rapporté par Dave et Xiu, 1991 est nettement plus faible que tous les autres résultats. Ce résultat n'est pas documenté : il provient d'une étude non publiée par les auteurs, où un effet sur l'éclosion des œufs a été observé à 0,63 µg.L-1. On ne sait pas précisément quel est cet effet. Dans l'expérience rapportée par Dave et Xiu, 1991, la durée d'éclosion des œufs est significativement rallongée à la plus faible concentration testée, c'est à dire 0,125 µg.L-1 par rapport aux témoins. Par ailleurs, le plan expérimental de cette expérience n'est pas complètement clair. Il n'existe pas d'autres résultats du même ordre sur Danio rerio. Palmer et al., 1998 ont observé un allongement de la durée d'éclosion lors d'une exposition d'œufs de Danio rerio à 8,3 µg.L-1 ce qui correspondait à leur plus petite concentration testée. McKim et al., 1978 ont testé les effets du cuivre sur les stades embryo-larvaires de huit espèces de poissons (mais pas le Danio) et ont trouvé des résultats plus élevés.
Paramètres d’écotoxicité chronique
Les données du RIVM (1999) n’ont pas été validées.
|
Espèce |
N/M |
Substance testée |
Durée |
Critère d’effet |
Valeur (µgCu /L) |
Référence |
|
Algues |
||||||
|
Asterionella glacialis |
N |
CuSO4 |
4-5 s |
64 |
BKH, 1995 |
|
|
Bacteriastrum delicatulum |
N |
CuSO4 |
4-5 s |
130 |
BKH, 1995 |
|
|
Bacteriastrum hyalinum |
N |
CuSO4 |
4-5 s |
6,4 |
BKH, 1995 |
|
|
Biddulphia moluliensis |
N |
CuSO4 |
4-5 s |
250 |
BKH, 1995 |
|
|
Chaetoceros sp. |
N |
CuSO4 |
7 j |
2,5 |
BKH, 1995 |
|
|
Chlorella vulgaris |
N |
CuSO4 |
7 j |
17 |
BKH, 1995 |
|
|
Cyclococcolithina leptopora |
N |
CuSO4 |
4-5 s |
0,64 |
BKH, 1995 |
|
|
Ditylum brightwellii |
N |
CuSO4 |
4-5 s |
250 |
BKH, 1995 |
|
|
Emiliania huxleyi |
N |
CuSO4 |
4-5 s |
66,4[1] |
BKH, 1995 |
|
|
Gephyrocapsa oceanica |
N |
CuSO4 |
4-5 s |
64 |
BKH, 1995 |
|
|
Gymnodinium spec. |
N |
CuSO4 |
4-5 s |
190 |
BKH, 1995 |
|
|
Hemiaulus sinensis |
N |
CuSO4 |
4-5 s |
130 |
BKH, 1995 |
|
|
Hymenomonas carterae |
N |
CuSO4 |
4-5 s |
110[2] |
BKH, 1995 |
|
|
Laminaria saccharina |
N |
CuSO4 |
21 j |
10 |
BKH, 1995 |
|
|
Lithodesmium undulatum |
N |
CuSO4 |
4-5 s |
250 |
BKH, 1995 |
|
|
Peridinium spec. |
N |
CuSO4 |
4-5 s |
6,4 |
BKH, 1995 |
|
|
Prorocentrum spec. |
N |
CuSO4 |
4-5 s |
0,64 |
BKH, 1995 |
|
|
Rhizosolenia stolterfothii |
N |
CuSO4 |
4-5 s |
64 |
BKH, 1995 |
|
|
Rhizosolenia setigera |
N |
CuSO4 |
4-5 s |
130 |
BKH, 1995 |
|
|
Skeletonema costatum |
N |
CuSO4 |
4-5 s |
400[3] |
BKH, 1995 |
|
|
Streptotheca tamesis |
N |
CuSO4 |
4-5 s |
64 |
BKH, 1995 |
|
|
Synechococcus spec. |
N |
CuSO4 |
4-5 s |
0,64 |
BKH, 1995 |
|
|
Thoracosphaera heimii |
N |
CuSO4 |
4-5 s |
0,64 |
BKH, 1995 |
|
|
Thoracosphaera spec. |
N |
CuSO4 |
4-5 s |
6,4 |
BKH, 1995 |
|
|
Umbilicosphaera hulburtiania |
N |
CuSO4 |
4-5 s |
6,4 |
BKH, 1995 |
|
|
Umbilicosphaera sibogae |
N |
CuSO4 |
4-5 s |
130 |
BKH, 1995 |
|
|
Coelentérés |
||||||
|
Campanularia flexuosa |
N |
- |
14 j |
10 |
Stebbing, 1976 |
|
|
Hydra littoralis |
N |
- |
14 j |
2,5 |
Stebbing et Pomroy, 1978 |
|
|
Eirene viridula |
N |
- |
13 s |
10 |
Karbe, 1972 |
|
|
Mollusques |
||||||
|
Busicon canaliculatum |
N |
- |
8 s |
100 |
Betzer et Yevich, 1975 |
|
|
Crassostrea virginica |
N |
- |
14 j |
10 |
Calabrese et al., 1977 |
|
|
Mercenaria mercenaria |
N |
- |
7 j |
5 |
Calabrese et al., 1977 |
|
|
Mytilus edulis |
N |
CuSO4 |
10 j |
0,5 |
BKH, 1995 |
|
|
Mytilus edulis |
M |
CuSO4 |
30 j |
1,3 |
BKH, 1995 |
|
|
Mytilus edulis |
N |
CuCl2 |
15 j |
10 |
BKH, 1995 |
|
|
Mytilus edulis |
M |
CuCl2 |
20 j |
5,6 |
Redpath et Davenport, 1988 |
|
|
Mytilus edulis |
|
|
|
|
2,5 |
Moyenne géométrique |
|
Pecten maximus |
N |
CuCl2 |
15 j |
6,7 |
BKH, 1995 |
|
|
Annélides |
|
|
|
|
|
|
|
Ctenodrilus serratus |
|
- |
21-31 j |
50 |
Reish et Carr, 1978 |
|
|
Nereis diversicolor |
N |
- |
6 s |
100 |
Bryan et Hummerstone, 1971 |
|
|
Ophryotrocha diadema |
|
- |
28 j |
100 |
Reish et Carr, 1978 |
|
|
Crustacés |
||||||
|
Allorchetes compressa |
N |
CuSO4 |
28 j |
3,7 |
BKH, 1995 |
|
|
Callianassa australiensis |
|
- |
14 j |
60 |
BKH, 1995 |
|
|
Cancer anthonyi |
N |
CuCl2 |
7 j |
3,3 |
BKH, 1995 |
|
|
Mysidopsis bahia |
M |
CuCl2 |
5 s |
38 |
BKH, 1995 |
|
|
Pandalus danae |
M |
- |
6 s |
10 |
Young et al., 1979 |
|
|
Poissons |
|
|
|
|
|
|
|
Atherinops affinis |
M |
CuCl2 |
12 j |
55 |
BKH, 1995 |
|
Les données algues (comme les autres) n’ont pas pu être validées et correspondent à des résultats apparemment non classiques puisque les durées expérimentales sont nettement supérieures à la durée standard pour les essais algues. Par ailleurs, il semble évident que les concentrations testées sont, dans un certain nombre de cas, espacées d’un facteur 10 ce qui est très élevé et engendre une grande incertitude autour des valeurs reportées. Faute d’information complémentaire, nous avons cependant utilisé les valeurs en gras dans le tableau ci-dessus.
Sédiment
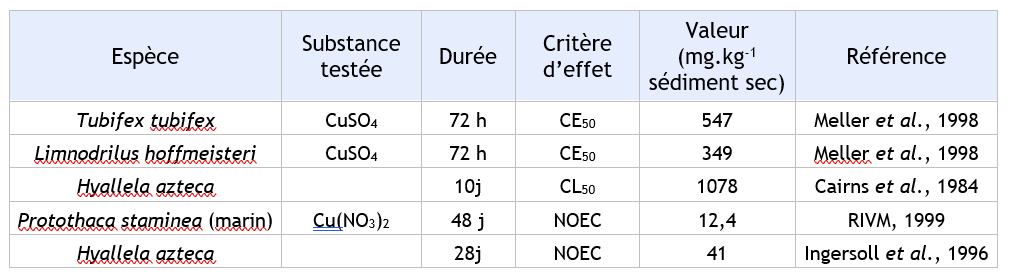
Sol
Paramètres d’écotoxicité aiguë
Etant donné le nombre élevé de données d'écotoxicité disponibles sur les organismes terrestres, seuls les essais chroniques sont retenus.
Paramètres d’écotoxicité chronique
Les données proviennent de RIVM (1999).
|
Espèce/ activité |
Substance testée |
Durée |
Critère d’effet |
Valeur |
Référence |
|
Plantes |
|||||
|
Avena sativa |
CuSO4 |
2 s. |
NOECf,z |
1000 |
BKH, 1995 |
|
Cucumis sativus |
CuSO4 |
2 s. |
NOECf,z |
1000 |
BKH, 1995 |
|
Glycine max |
CuSO4 |
2 s. |
NOECf,z |
1000 |
BKH, 1995 |
|
Céréales |
Cu-acetate |
5 m |
NOECb* |
200 |
Denneman et Van Gestel, 1990 |
|
Oligochètes |
|
|
|
|
|
|
Allolobophora caliginosa |
CuSO4 |
14 j |
NOECd |
50 |
Denneman et Van Gestel, 1990 |
|
|
CuSO4 |
14 j |
NOECb |
100 |
Denneman et Van Gestel, 1990 |
|
Dendrobaena rubida |
Cu(NO3)2 |
13 s |
NOECd |
122 |
Denneman et Van Gestel, 1990 |
|
Eisenia andrei, juvenile |
CuCl2 |
12 s |
NOECb,e |
56 |
BKH, 1995 |
|
Eisenia andrei |
CuCl2 |
3 s |
NOECd |
60 |
BKH, 1995 |
|
Eisenia fetida |
Cu(NO3)2 |
8 s |
NOECd |
32 |
Spurgeon et al., 1994 |
|
Eisenia fetida |
Cu-acétate |
8 s |
NOECb,d |
500 |
Denneman et Van Gestel, 1990 |
|
Lumbricus rubellus |
CuCl2 |
12 s |
NOECd |
30 |
Denneman et Van Gestel, 1990 |
|
Lumbricus rubellus |
CuCl2 |
12 s |
NOECd |
13 |
Denneman et Van Gestel, 1990 |
|
Collemboles |
|||||
|
Onychiurus armatus |
Cu(NO3)2 |
17 s |
NOECb |
2608 |
Denneman et Van Gestel, 1990 |
|
Acariens |
|||||
|
Platynothrus peltifer |
Cu(NO3)2 |
10 s |
NOECc |
168 |
Denneman et Van Gestel, 1990 |
|
Microorganismes |
|||||
|
Ammonification |
CuCl2 |
20 j |
300 |
Van de Meent et al., 1990 |
|
|
Nitrification |
CuCl2 |
19 s |
500 |
BKH, 1995 |
|
|
|
CuCl2 |
10 j |
100 |
Denneman et Van Gestel, 1990 |
|
|
Minéralisation de l'azote |
CuSO4 |
20 j |
318 |
Denneman et Van Gestel, 1990 |
|
|
Respiration |
CuCl2 |
21 m |
400 |
Denneman et Van Gestel, 1990 |
|
|
|
CuSO4 |
8 s |
12,1 |
BKH, 1995 |
|
|
|
CuCl2 |
8 s |
CE10 |
4 |
Denneman et Van Gestel, 1990 |
|
|
CuCl2 |
10 m |
CE10 |
77 |
Denneman et Van Gestel, 1990 |
|
|
CuCl2 |
10 m |
CE10 |
22 |
Denneman et Van Gestel, 1990 |
|
Arylsulphatase |
CuCl2 |
18 m |
CE10 |
6,4 |
Haanstra et Doelman, 1991 |
|
|
CuCl2 |
18 m |
CE10 |
347 |
Haanstra et Doelman, 1991 |
|
|
CuCl2 |
18 m |
CE10 |
286 |
Haanstra et Doelman, 1991 |
|
|
CuCl2 |
18 m |
CE10 |
2667 |
Haanstra et Doelman, 1991 |
|
|
CuCl2 |
18 m |
CE10 |
3321 |
Haanstra et Doelman, 1991 |
|
Phosphatase |
CuCl2 |
8 m |
CE10 |
8,3 |
Doelman et Haanstra, 1989 |
|
|
CuCl2 |
8 m |
CE10 |
438 |
Doelman et Haanstra, 1989 |
|
|
CuCl2 |
8 m |
CE10 |
170 |
Doelman et Haanstra, 1989 |
|
|
CuCl2 |
8 m |
CE10 |
960 |
Doelman et Haanstra, 1989 |
|
|
CuCl2 |
8 m |
CE10 |
58 |
Doelman et Haanstra, 1989 |
|
Urease |
CuCl2 |
18 m |
CE10 |
20 |
Doelman et Haanstra, 1986 |
|
|
CuCl2 |
18 m |
CE10 |
340 |
Doelman et Haanstra, 1986 |
|
|
CuCl2 |
18 m |
CE10 |
520 |
Doelman et Haanstra, 1986 |
|
|
CuCl2 |
18 m |
CE10 |
210 |
Doelman et Haanstra, 1986 |
a : mortalité ou immobilité ; b : croissance ; c : reproduction (nombre de jeunes) ; d : nombre d’œufs ; e : maturation ; f : émergence ; z : extrapolée à partir d’un graphique ; * : valeur estimée par les évaluateurs.
[1] moyenne géométrique de 4 valeurs
[2] moyenne géométrique de 2 valeurs
[3] moyenne géométrique de 2 valeurs
[2] Les essais de Sauter ont été effectués à des duretés très différentes (38 et 187 mg.L-1 CaCO3)
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Eau marine
Sédiments d'eau douce
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Compartiment aquatique :
PNEC établie par l’INERIS :
Etant donné qu’un nombre important de NOEC long terme existe, la PNEC peut être évaluée par la méthode statistique. Le résultat sur poissons rapporté par Dave et Xiu (1991) est nettement inférieur à tous les autres résultats. En conséquence, si nous prenons en compte ce résultat, les données ne suivent pas une loi log normale. Par ailleurs, nous n'avons qu'une confiance réduite dans ce résultat (voir discussion sur les essais long terme). Nous suggérons en conséquence de ne pas en tenir compte pour l'évaluation de la PNEC par la méthode statistique.
Les valeurs suivantes ont été calculées à l’aide des données aquatiques d’eaux douces présentées en gras ci-dessus :
HC5 = 3,15 µg.L-1 (IC_90 % = [1,8; 4,7])
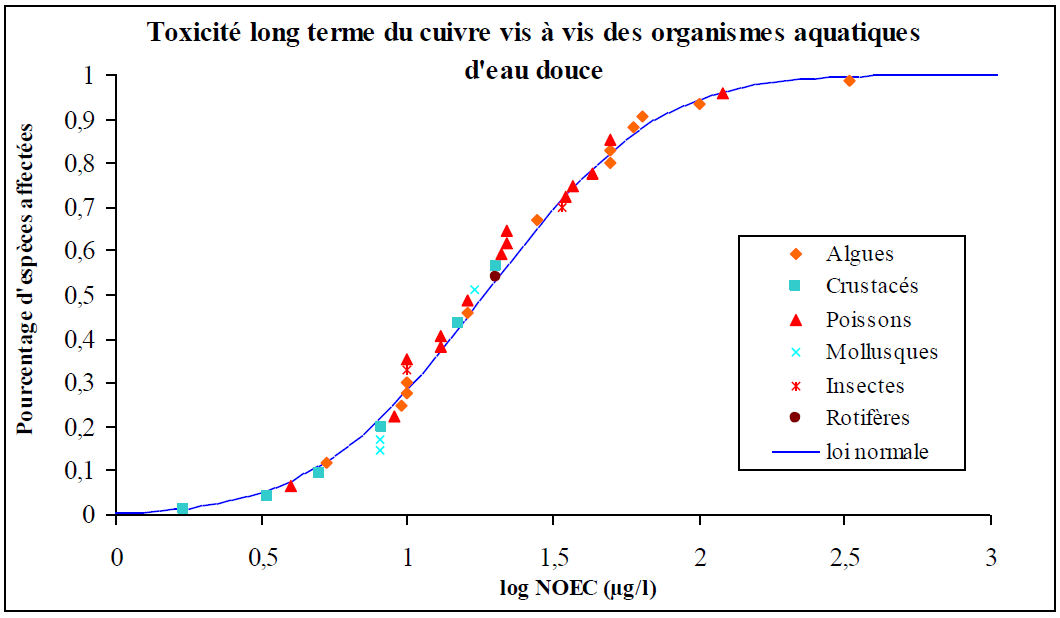
Compte tenu du nombre important de données disponibles (39 espèces différentes) et de l'incertitude relativement faible sur l'estimation de la HC5, à l’exception de l'incertitude autour de la donnée de Dave et Xiu (1991), nous suggérons d'utiliser un facteur d'extrapolation de 2 pour dériver la PNEC.
D'où :
PNECEAU-DOUCE = 1,6 µg.L-1
Pour estimer la PNEC pour les organismes marins, il n’est pas possible d’utiliser la méthode statistique avec les données marines uniquement car il n’existe qu’un seul résultat sur poisson marin. En conséquence nous utiliserons à cette fin l’ensemble des résultats disponibles sur organismes aquatiques. Il est en effet possible de constater (voir graphe ci-dessous) que la distribution de sensibilité des espèces marines et d’eau douce pour lesquelles nous disposons de résultats est sensiblement la même.
Les valeurs suivantes ont été calculées à l’aide des données aquatiques d’eaux douces et marines :
HC5 = 1,6 µg.L-1 (IC_90 % = [1,0; 2,4])
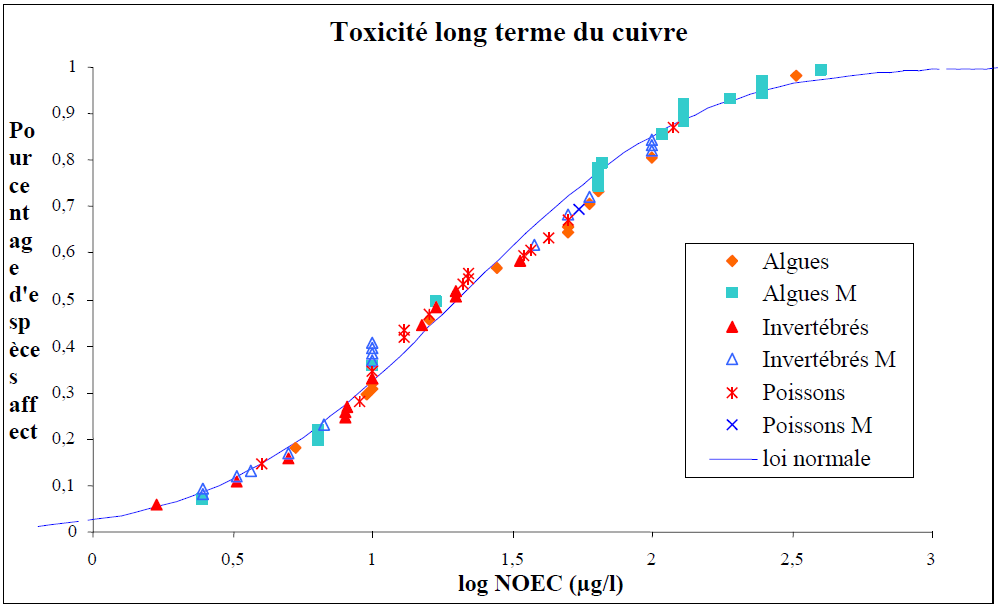
Compte tenu du nombre important de données disponibles (80 espèces différentes) et de l'incertitude relativement faible sur l'estimation de la HC5 mais du fait du manque d’information vis à vis des poissons marins et de la plus grande diversité des espèces marines, nous suggérons d'utiliser un facteur d'extrapolation de 2 pour dériver la PNEC.
D'où :
PNECEAU-MARINE = 0,8 µg.L-1
PNEC retenue par l’INERIS pour le compartiment aquatique :
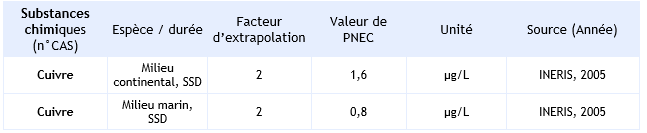
Compartiment sédimentaire :
PNEC établie par l’INERIS :
Il existe des résultats d’essais sur organismes benthiques. Compte tenu du nombre de résultats aigus sur organismes benthiques nous proposons d’utiliser un facteur d’extrapolation de 50 sur le résultat vis à vis de Hyallela.
D’où :
PNECSED-EAU-DOUCE = 0,8 mg.kg-1 sédiment sec.
PNEC retenue par l’INERIS pour le compartiment sédimentaire :

Compartiment sol
Pour le sol, étant donné qu’un nombre important de NOEC long terme existe, la PNEC peut être évaluée par la méthode statistique. Les valeurs suivantes ont été calculées à l’aide des données terrestres présentées en gras ci-dessus :
HC5 = 8,1 mg.kg-1 (IC_90 % = [3,3; 15,8]) (n=37)
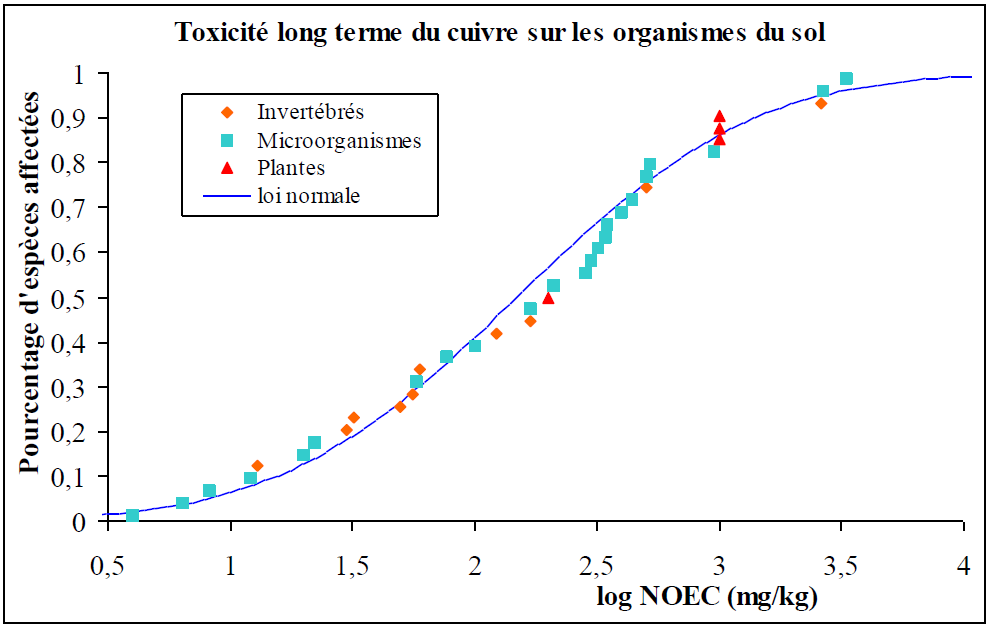
Compte tenu du nombre important de données disponibles, de l'incertitude relativement faible sur l'estimation de la HC5 mais du manque de données vis à vis des plantes, nous suggérons d'utiliser un facteur d'extrapolation de 3 pour dériver la PNEC.
D'où :
PNECSOL = 2,7 mg.kg-1 poids sec = 2,4 mg.kg-1 poids humide
PNEC établie par l’INERIS pour le compartiment sol :
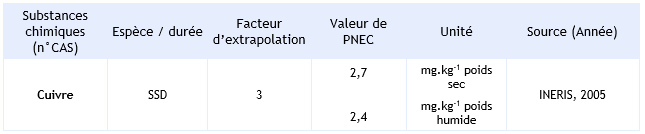
Compartiment Biote
PNEC établie par l’INERIS :
La PNEC prédateur pour le cuivre peut être Calculée à partir de la NOEC obtenue chez le rat à laquelle un facteur d’extrapolation de 30 est appliqué soit :
PNECPREDATEUR = 5,7 mg Cu/ kg de nourriture
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le cuivre est un métal, identifié par son numéro CAS 744-50-8. Les principaux composés du cuivre, étudiés dans cette fiche, sont le sulfate de cuivre (CAS 7758-98-7), l'acétate de cuivre (CAS 142-71-2), le chlorure cuivreux (CAS 7758-89-6), le chlorure cuivrique (CAS 7447-39-4), l'hydroxyde de cuivre (CAS 20427-59-2), l'oxyde cuivreux (CAS 1317-39-1) et l'oxyde cuivrique (CAS 1317-38-0).
Le cuivre est un métal ubiquitaire, très répandu dans la croûte terrestre. Les sources de cuivre sont à la fois naturelles et anthropiques. La majorité du cuivre non recyclé provient des minerais.
Le cuivre, ses composés et ses alliages sont utilisés dans de nombreux secteurs économiques : l'électricité et l'électronique, la construction, les transports, les équipements industriels, l'agriculture, la chimie, le textile, …
En France, les principales sources de cuivre dans l'environnement sont le trafic et l'agriculture.
La production mondiale de cuivre était, en 2012, de 16,7 millions de tonnes.
Les principales émissions ponctuelles déclarées de cuivre vers l'environnement (air, eau, sol) sur le territoire français sont répertoriées : tous milieux confondus, selon l'IREP, les émissions industrielles ponctuelles déclarées étaient d'environ 126 tonnes en 2012. Les émissions diffuses de cuivre dans l'environnement peuvent donc être estimées à 500 tonnes/an.
De nombreux sites industriels sont recensés comme contaminés ou ayant été contaminés au cuivre, dans toutes les régions françaises, d'après la base de données BASOL.
De par ses propriétés physico-chimiques, le cuivre s'adsorbe en milieu aquatique sur les matières en suspension. Les sédiments d'eau douce constituent donc un stock potentiel de cuivre.
Différents substituts du cuivre sont mis en œuvre à l'heure actuelle, dans divers domaines, d'autres sont en cours de développement. De plus, la hausse du prix du cuivre favorise les industriels à le substituer et à le recycler. Le recyclage a déjà en Europe une place importante dans la filière de production du cuivre (41 % en 2007).
Enfin, des techniques de réductions des émissions industrielles existent pour les effluents aqueux et gazeux.
Abstract
Copper is a metal, its CAS number is 7440-50-8. The main compounds of copper, which are studied in this sheet, are copper sulphate (CAS 7758-98-7), copper acetate (CAS 142-71-2), cuprous chloride (CAS 7758-89-6), cupric chloride (CAS 7447-39-4), copper hydroxide (CAS 20427-59-2), cuprous oxide (CAS 1317-39-1) and cupric oxide (CAS 1317-38-0).
Copper is a ubiquitous metal, very common in the Earth's crust. Copper sources are both natural and anthropogenic. Most of natural copper comes from ores.
Copper, its compounds and its alloys are used in many applications: electricity and electronics, building, transportation, industrial equipments, agriculture, chemistry, textile...
In France, the main sources of copper in environment are traffic and agriculture.
In 2012, the global production of copper was 16.7 million tons.
The main point emissions of copper to environment (air, water, soil) in France are listed: according to IREP, industrial punctual emissions were about 126 tons for all medias for 2012. Diffuse emissions can be evaluated at about 500 tons/year.
According to the database BASOL, many industrial sites are registered as polluted by nickel or having been polluted by copper in all regions.
By its physic-chemical properties, copper is adsorbed on suspended solids in aquatic environment. Freshwater sediments are therefore a potential stock of copper.
Different substitutes of copper are currently used in different domains others are under development. In addition, the rising price of copper promotes industry to replace and recycle. Recycling in Europe has an important role in the production of copper (41% in 2007). Techniques exist to reduce industrial emissions in aqueous and gaseous effluents.
Tableaux de synthèse
Généralités
| CAS | 7440-50-8 |
|---|---|
| SANDRE | 1392 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. TEXTES GENERAUXLe règlement 1907/2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques (REACH) oblige les producteurs et les importateurs de substances en quantité supérieure à une tonne à soumettre une demande d'enregistrement. Ces substances sont ensuite pour certaines évaluées, et éventuellement leur usage est ensuite soumis à autorisation. Le cuivre et nombre de ses composés sont concernés par le règlement REACH. Le cuivre et ses composés ne sont pas cités dans la liste de l'annexe I du règlement (CE) 689/2008 relatif à l'export et à l'import de substances dangereuses. Ils ne sont donc pas soumis aux notifications d'exportations. DIRECTIVE-CADRE SUR L'EAULe cuivre et ses composés ne sont pas cités dans la directive 2013/39/CE du 12 août 2013 en ce qui concerne les substances prioritaires dans le domaine de l'eau (liste actualisée des substances prioritaires de la Directive-Cadre sur l'Eau). UTILISATION ET SURVEILLANCE EN AGRICULTURELa Directive 2009/37/CE du 23 avril 2009 de la Commission européenne modifie la directive 91/414/CEE du Conseil pour y inclure les composés de cuivre comme substances actives. Cette directive est entrée en vigueur le 1er décembre 2009. Elle a été transposée en droit français par l'arrêté du 28 avril 2010. Les autorisations de mise sur le marché de produits phytopharmaceutiques contenant, entre autres, des composés de cuivre en tant que substances actives, ont été retirées au plus tard le 31 mai 2010, seules les utilisations en tant que bactéricide et fongicide peuvent être autorisées. Selon ce texte, les États Membres doivent instaurer des programmes de surveillance dans les zones vulnérables. Si il y a lieu, des limites sont fixées, telles que des taux d'application maximaux. Les composés du cuivre concernés sont :
Pour les engrais organiques, divers seuils en métaux lourds sont fixés par les législations européennes et nationales. Les seuils pour le cuivre sont repris dans le Tableau 47 . [6] La bouillie bordelaise contient du sulfate de cuivre avec de l'hydroxyde de calcium. [7] (consulté en février 2014). http://ec.europa.eu/enterprise/sectors/chemicals/files/fertilizers/annexes_16jan2012_en.pdf Tableau 4. Seuils de cuivre pour les engrais organiques.
Pour les engrais minéraux, il n'existe pas de règlementation européenne, néanmoins l'évaluation du règlement CE 2003/2003 relatif aux engrais10 préconise d'inclure dans le règlement des dispositions concernant les teneurs maximales en métaux lourds. CAS DE L'AGRICULTURE BIOLOGIQUELe règlement CE/473/2002 de la Commission du 15 mars 2002 modifie les annexes du règlement CE/2092/91 limitant l'usage du cuivre en agriculture biologique. Ainsi, depuis le 31 mars 2005, les apports de cuivre sont limités à 6 000 g/ha/an de cuivre métal. Notons que cette valeur doit-être considérée comme une moyenne sur 5 ans. Le règlement européen CE/2092/91 du 24 juin 1991 quant à l'utilisation du cuivre en agriculture biologique est modifié par le règlement CE/834/2007 du 28 juin 2007. Le règlement CE/889/2008 du 5 septembre 2008 réitère l'autorisation de l'utilisation du cuivre11) en agriculture biologique en tant que fongicide et dans la limite des 6 000 g/ha/an (moyenne sur 5 ans). [8] European Compost Network. [9] Joint Research Center. [10] (consulté en février 2014). http://ec.europa.eu/enterprise/sectors/chemicals/files/fertilizers/final_report_2010_en.pdf [11] Cuivre sous forme d'hydroxyde de cuivre, d'oxychlorure de cuivre, de sulfate de cuivre (tribasique), d'oxyde cuivreux, d'octanoate de cuivre. CAS DE L'ALIMENTATION ANIMALE AU SEIN DES ELEVAGESLe règlement CE/1334/2003 du 25 juillet 2003 modifie les conditions d'autorisation de plusieurs additifs (dont le cuivre) appartenant au groupe des oligoéléments dans l'alimentation animale. Désormais, la teneur maximale de l'élément cuivre en mg/kg d'aliment complet est présentée dans le Tableau 5 ci-après en fonction de l'animal. Tableau 5. Conditions d'autorisation du cuivre en tant qu'additif dans l'alimentation animale, d'après le règlement CE/1334/2003.
BIOCIDESLa Directive 98/8/CE concernant la mise sur le marché de produits biocides autorise les composés du cuivre suivants :
DECHETSLe décret n°2002-540 du 18 avril 2002 relatif à la classification des déchets consolidé par le décret n°2007-1467 du 12 octobre 2007 liste les déchets pouvant contenir du cuivre et leurs nomenclatures. Les différents types de déchets figurant sur la liste sont définis de manière complète par un code à six chiffres. Les deux premiers chiffres correspondent au chapitre, les deux suivants à la section et les deux derniers à la rubrique. Les déchets classés comme dangereux sont indiqués par un astérisque.
DECLARATIONS ET CONTROLESL'arrêté du 22 novembre 2010 définit la liste des substances prioritaires ainsi que la liste des substances définies à l'article R. 213-48-13 du code de l'environnement relatif à la redevance pour pollutions diffuses qui est entrée en vigueur au 1er janvier 2011. Les redevances sont décrites dans l'Article L213-10-8 du code de l'environnement. La liste définit :
NANOPARTICULESLe décret n°2012-232 du 17 février 2012 relatif à la déclaration annuelle des substances à l'état nanoparticulaire précise que le seuil de la déclaration est fixé à 100 g/an pour la fabrication, l'importation ou la mise sur le marché de nanomatériaux. Les utilisations du cuivre à l'état nanoparticulaire identifiées lors de cette étude sont présentées au paragraphe 2.3.3. ACTION DE RECHERCHE RSDELe cuivre et ses composés sont cités dans l'annexe 1 de la circulaire du 5 janvier 2009 relative à la mise en œuvre de la 2ème phase de l'action RSDE pour les ICPE soumises à autorisation. Cette annexe regroupe les listes par secteurs d'activité industrielle des substances dangereuses potentiellement présentes dans les rejets aqueux des établissements exerçant cette activité industrielle. Le cuivre est cité pour tous les secteurs d'activité, soit seul, soit avec ses composés. Le cuivre appartient aussi à la liste des micropolluants à mesurer dans les stations de traitement des eaux usées traitant une charge brute de pollution supérieure ou égale à 600 kg DBO514/jour (Circulaire du 29 septembre 2010 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées. [14] Demande Biochimique en Oxygène AUTRES TEXTESLe cuivre ne fait pas partie des substances potentiellement préoccupantes définies par OSPAR15 . [15] Convention OSPAR : Convention pour la protection du milieu marin de l'Atlantique du nord-est. http://www.ospar.org/content/content.asp?menu=30200304000000_000000_000000 (consulté en janvier 2014). |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. SEUILS DE REJETS POUR LES INSTALLATIONS CLASSEESL'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation indique que : Pollution de l'airRejets d'antimoine, chrome, cobalt, cuivre, étain, manganèse, nickel, vanadium et zinc, et de leurs composés : si le flux horaire total d'antimoine, chrome, cobalt, cuivre, étain, manganèse[5] , nickel, vanadium, zinc[5] et de leurs composés (gazeux et particulaires) dépasse 25 g/h, la valeur limite de concentration est de 5 mg.m-3 (exprimée en Sb+Cr+Co+Cu+Sn+Mn+Ni+V+Zn). [5] En cas de fabrication de monoxyde de zinc (ZnO) et de bioxyde de manganèse (MnO2), la valeur limite de concentration pour respectivement le zinc et le manganèse est de 10 mg.m-3 . Pollution des eaux superficiellesLes rejets respectent les valeurs limites de concentrations suivantes : cuivre et ses composés (en Cu) 0,5 mg.L-1 si le rejet dépasse 5 g.j-1. Dans le cas de la fabrication ou de la transformation de cuivre, la valeur limite de concentration est 1 mg.L-1. Epandage des bouesL'annexe I de l'arrêté précise les seuils à respecter en éléments-traces pour l'épandage des boues issues du traitement des eaux usées. Ces seuils sont présentés dans le Tableau 3 . En outre, le Tableau 3 précise les valeurs limites en éléments-traces dans les sols et le flux maximum en éléments-traces apporté par les déchets ou effluents pour les pâturages ou sols de pH inférieurs à 6. Tableau 3. Seuils de l'élément cuivre applicables aux épandages de boues issues du traitement des eaux usées sur les sols agricoles.
L'arrêté du 31 janvier 2008 concerne le registre et la déclaration annuelle des émissions polluantes et des déchets. L'exploitant de l'installation doit déclarer ces rejets dès lors que les seuils d'émissions décrits dans l'annexe II de cet arrêté sont dépassés. Les seuils de rejets du cuivre (7440-50-8) et composés (exprimés en tant que Cu) sont :
VALEURS UTILISEES EN MILIEU DE TRAVAILD'après l'INRS (2012), la valeur limite d'exposition professionnelle est :
D'après cette même source, les valeurs moyennes d'exposition professionnelle sont :
-V.M E (France) (Poussières, en cuivre) : 1 mg.m-3 . VALEURS UTILISEES POUR LA POPULATION GENERALEValeurs de référence dans la population générale définies par l'INRS (2009)
[12] VLE : Valeur Limite d'Exposition. [13] VME : Valeur Moyenne d'Exposition. Les concentrations sont exprimées en somme des composés suivant : le cuivre, le sulfate de cuivre, l'oxyde de cuivre (II) et l'oxyde de cuivre (I). Qualité des eaux de consommation :Le décret 2001-1220 du 20 décembre 2001 impose une limite de qualité aux eaux destinées à la consommation humaine. Les eaux doivent respecter une valeur de concentration en cuivre inférieure ou égale à 2,0 mg.L-1. |
| Informations complémentaires |
Le cuivre est un métal de transition1. C’est un oligo-élément indispensable à la vie en faible quantité, toxique en quantité plus importante (IFEN, 2007). [1] Les métaux de transition sont définis comme les éléments (au sens de la classification périodique des éléments) qui ont une sous-couche électronique « d » incomplète ou qui peuvent donner un cation ayant une sous-couche « d » incomplète. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
PRODUCTION MINIERE
D'après Vignes (2013), la production annuelle mondiale de cuivre atteint 16 740.103 tonnes en 2012, dont 823.103 tonnes pour l'Union européenne des 27. La répartition de la production mondiale de cuivre en 2011 est présentée dans la Figure 5 ci-après, d'après LME[26] .
[26] London Metal Exchange : (consulté en janvier 2014). http://www.lme.com/metals/non-ferrous/copper/production-and-consumption/
Figure 5. Répartition géographique de la production mondiale du cuivre en 2011, d'après LME.
En 2011, l'Asie est le producteur majoritaire (46 %) devant l'Amérique (28 %) et l'Europe (19 %), d'après LME.
Selon Vignes (2013), les réserves mondiales sont estimées à 680 millions de tonnes de cuivre contenu. Pour les principaux pays producteurs, la répartition de ces réserves en 2012 est la suivante (exprimées en millions de tonnes de cuivre contenu) : Chili : 190, Australie : 86, Pérou : 76, Etats-Unis : 39, Mexique : 38, Chine : 30, Russie : 30, Indonésie : 28, Pologne : 26 et Zambie : 20.
PRODUCTION PRIMAIRE : DE L'EXTRACTION MINIERE A LA REALISATION DE DEMIPRODUITS
Une augmentation de la production minière mondiale est observée depuis 1980 du fait de la demande croissante en cuivre (innovations multipliant les utilisations du cuivre : énergie renouvelable, efficacité énergétique, bâtiment durable, transport). En effet la production primaire de cuivre est passée de 9,6 millions de tonnes en 1980 à 16,7 millions de tonnes en 2012, d'après ICSG (2013). Les sulfures de cuivre sont les minerais les plus répandus et représentent 80 % de la production mondiale, d'après le CICLA[27] .
A l'échelle du continent européen, en 2012, la Pologne (424 tonnes extraites et 564 tonnes raffinées) et la Fédération de Russie (720 tonnes extraites et 882 tonnes raffinées) occupent une place importante dans la production et l'export de cuivre sur le marché mondial, d'après Vignes (2013).
[27] Centre d'Information du Cuivre, Laitons et Alliages : (consulté en février 2014). http://www.cuivre.org/index-3210.htm
Les raffineries transforment les concentrés et les anodes[28] principalement en cathodes puis en formats pour l'industrie des produits semi-ouvrés.
[28] Lors de l'affinage, les anodes coulées pendant la fusion sont placées dans un bain électrolytique avec une cathode. Lors de l'électrolyse, le cuivre migre de l'anode vers la cathode. Les cathodes ainsi obtenues sont très concentrées en cuivre.
PRODUCTION SECONDAIRE : RECYCLAGE
En 2011, d'après le site internet d'ICSG, plus de 30 % de la consommation mondiale du cuivre proviendrait de cuivre recyclé. En Europe, en 2011, le taux de recyclage du cuivre[29] était de 41 %.
La production mondiale de métal secondaire est en augmentation depuis les années 1960. Depuis cette date, elle est passée de 5 à 20 millions de tonnes en 2011, d'après ECI[30] .
En 2002, la filière de recyclage du cuivre est déjà importante : le taux de récupération des déchets de matériels électriques est de 50 à 60 % alors qu'il n'est que de 45 % pour les alliages de cuivre (Techniques de l'ingénieur, 2002b).
La Chine est le plus gros producteur de cuivre secondaire (1 million de tonnes en 2006) suivi de l'Allemagne (350 000 tonnes). La Chine est également le premier pays recycleur des chutes directement sur sites avec 1,14 millions de tonnes refondues en 2006 (ECI, 2008b).
D'après ECI (2009), une hausse de la production d'environ 30 % est attendue d'ici 2012 par rapport à la production de l'année 2007 (incluant la production minière et la filière de recyclage).
En France, la production en 2007 de demi-produits[31] , de barres et fils alliés, de laminés cuivre et alliages et autres est estimée à 428 000 tonnes (FEDEM, 2010a).
[29] Le taux de recyclage définit la proportion de métal et de produits métalliques qui sont produits à partir de produits finis et des résidus de qualité faible. Ce taux dit « Recycling Input rate » (RIR) est plus une mesure statistique de la disponibilité de matière première qu'un indicateur de l'efficacité de recyclage des produits ou des procédés.
[30] European Copper Institute : (consulté en février 2014). http://www.copperalliance.eu/about-copper/recycling
[31] Un demi-produit ou un «produit semi-fini» est un produit industriel qui n'est pas encore complètement élaboré.
PRIX DU CUIVRE
De 1998 à 2003, le prix d'achat au comptant du cuivre de grade A[32] est resté relativement stable entre 1 000 et 2 000 US$/tonne. Depuis le début de l'année 2004, ce prix a considérablement augmenté et a subi d'importantes variations. En mars 2006 il a atteint 9 000 US$/tonne. La Figure 6 présentée ci-après illustre ces variations. Au cours de l'année 2008, la cotation du cuivre s'effondre (en lien avec la crise financière et économique) et en janvier 2009, le cuivre se vendait à un prix inférieur à 3 000 US$/tonne. Depuis la cotation est remontée, en février 2014 le cuivre de grade A se vendait à environ 7 000 US$/tonne, d'après le site internet du LME.
[32] Le cuivre de grade A est un cuivre pur à 99,9935%, le cuivre standard pur est à 99,9 %.
Figure 6. Evolution du prix du cuivre de grade A (US$/tonne) – prix au comptant de janvier 2007 à février 2014, d'après LME.
Nous n'avons pas d'information significative quant aux prix des composés du cuivre et de ses alliages, néanmoins, rappelons que leurs compositions et leurs puretés influent sur les prix.
Procédés de production
FTE 2015 Importer
La Figure 1, ci-après, présente la filière de production du cuivre[20] . La production primaire de ce métal est réalisée à partir des gisements. La production secondaire désigne le recyclage du cuivre à partir de produits en fin de vie ou de chutes. La partie commune à la production primaire et secondaire est schématisée en vert.
[20] Les termes techniques employés dans ce schéma sont expliqués dans les paragraphes suivants.
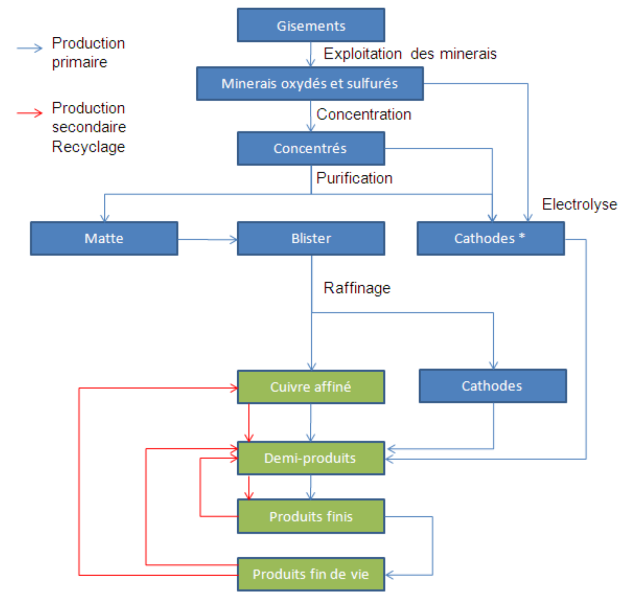
Figure 1. Schéma de principe de la production primaire et secondaire du cuivre , d'après Techniques de l'ingénieur (2002a) et ICSG (2013) modifiés.
*Cette étape permet la valorisation du cuivre contenu dans les scories issues de la production des mattes.
MINERAIS
Les minerais de cuivre sont principalement constitués de sulfures, de sulfosels[25] , d'oxydes, de carbonates, de silicates et de sulfates de cuivre (CICLA, 2010a ; CRPG, 2010) :
- les sulfures de cuivre sont la chalchopyrite (ou chalcopyrite) : CuFeS2 ou (Cu2S, Fe2S3), la bornite Cu5FeS4 ou (5Cu2S, Fe2S3), la digenite (Cu9S5), la covelline CuS et la chalchosine (ou chalcocite) Cu2S.
- les sulfosels de cuivre sont l'enargite : Cu3AsS4 ou (3Cu2S, As2S5) et le tetraédrite (Cu12Sb4S3),
- les oxydes de cuivre sont la cuprite Cu2O à l'état Cu(I) et la tenorite CuO ou à l'état Cu(II),
- les carbonates de cuivres sont l'azurite Cu3(CO3)2(OH)2 ou (2CuCO3, Cu(OH)2) et la malachite Cu2(CO3)(OH)2 ou (CuCO3, Cu(OH)2),
- le silicate de cuivre est la chrysocolle : (Cu, Al)2H2(Si2O5)(OH)4 , n(H2O),
- les sulfates et chlorures de cuivre sont la brochantite Cu4(SO4)(OH)6 et l'atacamite Cu2Cl(OH)3.
[25] Les sulfosels se différencient des sulfures (de structure AmSp où A est un métal) du fait de leur structure AmBnSp où B est un métalloïde qui coexiste avec le soufre.
PROCEDES DE PRODUCTION
Rappelons que le cuivre métal est obtenu à partir de minerai de cuivre (c'est la production dite primaire). La production de cuivre secondaire est réalisée à partir de produits recyclés. Les principaux composés du cuivre sont préparés par des techniques diverses à partir de poudre de cuivre, de solution de cuivre ou à partir d'autres composés cuivrés.
PRODUCTION PRIMAIRE DU CUIVRE
Le cuivre se trouve à des concentrations massiques de l'ordre de 0,5 à 1 % dans le minerai. Quelques cas particuliers tels que certains minerais du Chili présentent des teneurs en cuivre supérieures, de 2 à 5 % (ICSG, 2013).
La première étape pour la fabrication de cuivre primaire est l'enrichissement du minerai. Selon sa composition, l'élaboration des concentrés se fait par voie physique et physico-chimique (dite minéralurgie) ou par voie chimique (dite hydrométallurgie). La minéralurgie concerne 83 % du cuivre primaire produit en 2011. Elle consiste en une flottation, puis un traitement par fusion des concentrés dit pyrométallurgie. L'hydrométallurgie s'applique uniquement aux minerais oxydés qui représentent 17 % du cuivre primaire produit en 2011.
La deuxième étape est la mise en œuvre du cuivre pour un usage industriel : la fabrication des profilés et des laminés. En effet, le cuivre ainsi concentré ne convient pas pour la majorité des usages. Il doit être mis en forme pour les opérations de traitements ultérieurs (Techniques de l'ingénieur, 2002a).
Ces deux étapes sont présentées plus en détails dans les paragraphes suivants.
L'ENRICHISSEMENT DU MINERAI : 1ère ETAPE
Le procédé utilisé pour l'élaboration des concentrés diffère en fonction de la composition des minerais.
Les différents procédés d'enrichissement des minerais de cuivre non oxydés sont présentés par la Figure 2 ci-après en fonction de la composition des minerais de cuivre.
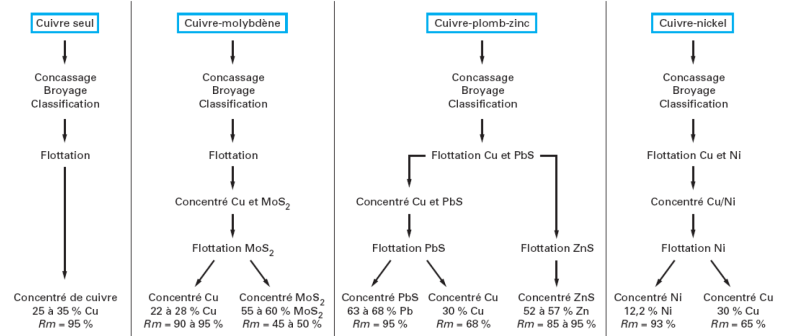
Rm : Récupération en métal ou en minéral pour MoS2[21]
[21] MoS2 : Sulfure de molybdène
Figure 2. Elaboration des concentrés de cuivre par flottation à partir de minerais de cuivre non oxydés, d'après les Techniques de l'ingénieur (2002a).
Les différents procédés d'enrichissement des minerais de cuivre oxydés sont présentés par la Figure 3 ci-après en fonction de la composition des minerais de cuivre oxydés.
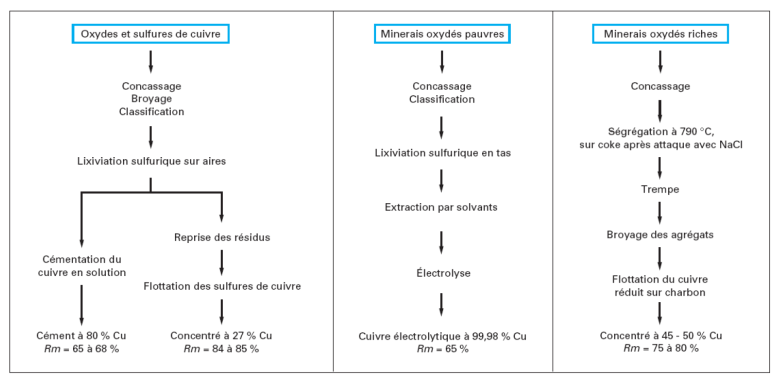
Rm : Récupération en métal
Figure 3. Elaboration des concentrés de cuivre par flottation à partir de minerais de cuivre oxydés, d'après les Techniques de l'ingénieur (2002a).
Selon cette même source, lors du traitement des minerais de cuivre oxydés et sulfurés, la séparation du sulfure de cuivre permet alors le traitement par flottation.
Une étape préliminaire de concassage et/ou de broyage est réalisée en amont du traitement par flottation. En effet, la flottation nécessite une fragmentation poussée afin que les particules cuprifères soient libérées de leur gangue minérale. Le diamètre des particules résultant de cette étape préliminaire est inférieur à 150 µm.
La flottation est une technique d'enrichissement des minerais de cuivre qui s'applique pour des minerais de composition complexe dont la teneur en cuivre est faible.
Dans un second temps, cette technique permet également l'appauvrissement des scories de fusion par la réalisation d'un concentré de cuivre réutilisable dans le four de fusion (Techniques de l'ingénieur, 2002a).
La flottation est réalisée dans des matrices différentes selon la composition du minerai. Le Tableau 7 ci-après illustre les différents procédés de purification et leurs rendements.
Tableau 7. Caractéristiques des traitements des minerais par flottation d'après les Techniques de l'ingénieur (2002a).
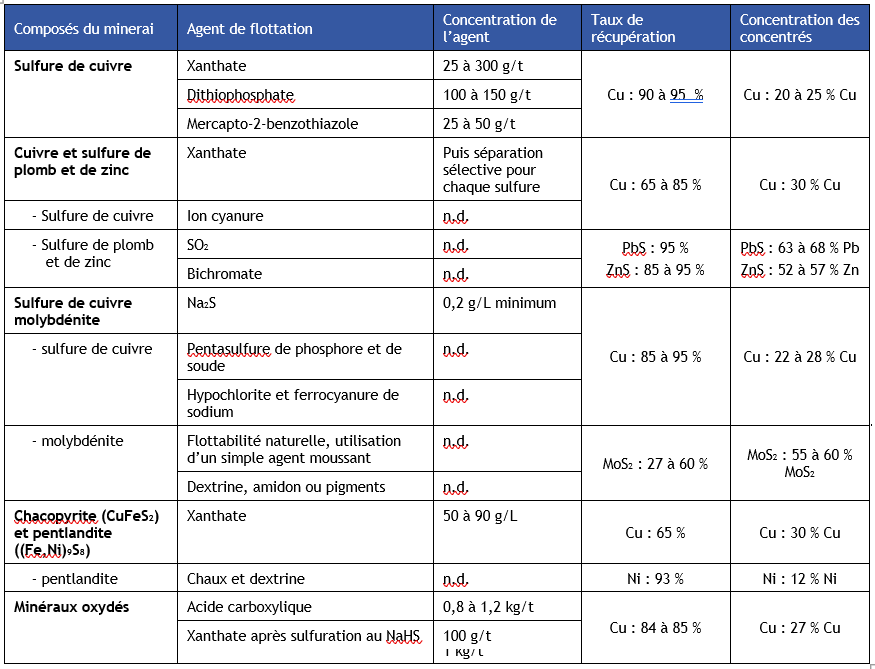
n.d. données non définies
Les principales voies de la métallurgie extractive du cuivre sont présentées dans la Figure 4 ci-après.
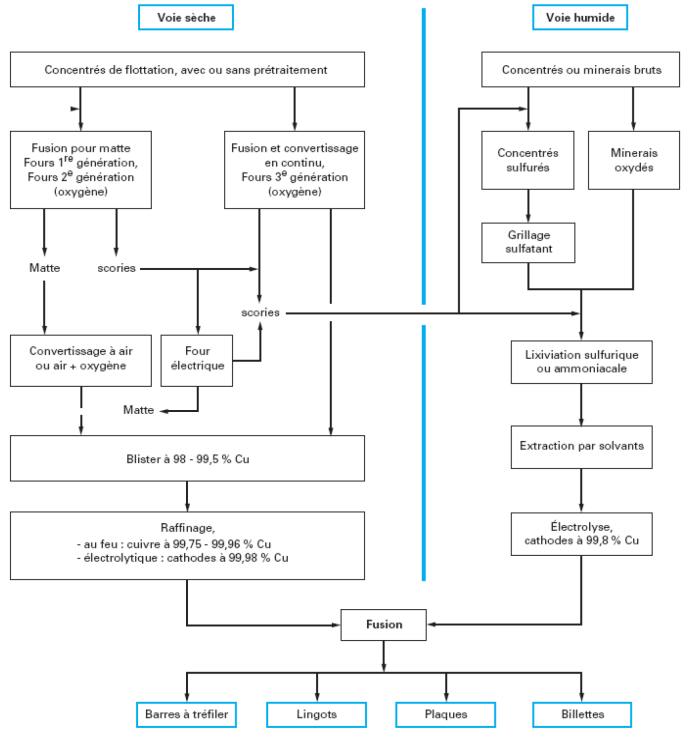
Figure 4. Principales voies de la métallurgie extractive du cuivre, d'après les Techniques de l'ingénieur (2002a).
Elle est destinée aux minerais sulfurés et concerne, en 2011, 83 % de la production. Elle est approvisionnée par des concentrés (représentant 85 % du cuivre traité), et du recyclage de déchets, d'après Vignes (2013).
Les concentrés de cuivre sont traités à haute température. Par gravité et par grillage les composés plus légers sont séparés des sels de cuivre plus lourds. On obtient ainsi des mattes fortement chargées en soufre, contenant 40 à 60 % de cuivre (CICLA, 2010a).
Le cuivre et les autres constituants de la matte sont séparés dans un four rotatif aboutissant à la formation de blisters contenant 98 à 99,5 % de cuivre (CICLA, 2010a).
Parce que leur pureté est insuffisante, les blisters ne sont pas encore utilisables dans l'industrie. Ils doivent subir une étape d'affinage.
L'affinage s'effectue majoritairement par électrolyse dans un bain d'acide sulfurique avec une cathode. Au cours de l'électrolyse, le cuivre migre vers la cathode. Les cathodes ainsi obtenues sont de grande pureté (OECD, 1995).
[22] Les termes affinage et raffinage sont souvent utilisés comme synonymes. Cependant, stricto sensu il existe une différence entre le raffinage qui est la purification du cuivre dans la filière de production primaire (à partir du minerai) et l'affinage qui est la purification du cuivre dans la filière de production secondaire (à partir de produits collectés).
Elle est destinée aux minerais oxydés ou sulfurés pauvres. En 2011, 17 % de la production est traité par hydrométallurgie et ne nécessite pas de raffinage ultérieur. Elle doit cependant être réalisée dans des installations proches de l'extraction minière.
L'hydrométallurgie comporte trois opérations (le procédé est dénommé SX/EW : extraction par solvant/électro-extraction) : une dissolution, une extraction par solvant et une électrolyse, d'après Vignes (2013).
FABRICATION DES LAMINES ET DES PROFILES : 2ème ETAPE
Les produits issus de l'électroextraction et du raffinage électrolytique sont des cathodes de haute pureté. Les cathodes issues de l'extraction classique sont moins pures et présentent parfois du sulfate. Ces cathodes ne conviennent pas pour la majorité des utilisations industrielles. Elles sont alors transformées en produits marchands tels que les fils, les tôles, les tubes et profilés.
Les techniques employées pour la fabrication des laminés et des profilés sont la fusion des cathodes, la coulée des produits parfois suivie d'une transformation des produits, le tréfilage[23] et le laminage (Techniques de l'ingénieur, 2002a).
[23] Le tréfilage est la réduction de la section d'un fil en métal par traction mécanique.
Les fils et barres conducteurs de courants électriques requièrent un cuivre électrolytique de qualité TPHC (Tough Pitch High Conductivity) qui a une concentration en oxygène de 0,015 à 0,035 %. Le cuivre pour les tubes à souder est produit par élimination d'oxygène par un ajout de cuprophosphore (90 % Cu et 10 % P). L'oxygène se retrouve alors sous la forme de P2O5 volatil. Les composants électroniques (nécessitant d'être soudables et conductibles) requièrent un cuivre de qualité OFHC (Oxygen Free High Conductivity) (Techniques de l'ingénieur, 2002a).
PRODUCTION SECONDAIRE DU CUIVRE
Les résidus de production primaire et les déchets sont les sources de cuivre valorisables par recyclage. Les produits récupérés en vue du recyclage sont :
- les scraps nouveaux : ce sont des chutes provenant d'industries fabriquant des semi-produits (tôles, barres, tubes, fils) et des produits finis. Des scraps sont générés au niveau des raffineries de cuivre et de l'élaboration des produits (Techniques de l'ingénieur, 2002b) ;
- les scraps anciens : ils désignent des matériaux obsolètes : machines hors d'usage, débris de manufactures, vieux bateaux, avions, véhicules, câbles, munitions, déchets de démolition (réfrigérateurs, matériel informatique, standards téléphoniques, téléviseurs, moteurs électriques, etc.) (Techniques de l'ingénieur, 2002b) ;
- les cendres et les résidus de l'industrie métallurgique (les scories, les écumes, les crasses, les boues anodiques, les alliages, les déchets de fonderie) : ce sont des produits résiduaires provenant de procédés métallurgiques et de raffinage. Ces produits sont usuellement recyclés à l'usine ou vendus pour un traitement ultérieur ou « inertés[24] » quand ils ne peuvent être valorisés.
[24] Produits inertés ou produits ne présentant pas d'interactions chimiques ou biochimiques avec l'environnement.
Le recyclage du cuivre s'effectue par la fusion avec grillage des résidus et par l'agglomération des particules de cuivre en vue de produire un métal de qualité suffisante pour l'affinage.
La fusion consiste à fondre la matière pour obtenir une matière à 95 % environ de cuivre. Le cuivre est ensuite mélangé avec les débris de cuivre de bonne qualité issus de l'affinage. Le métal est ensuite coulé en forme d'anodes pour l'affinage. Le mélange est alors à une concentration de 99 % en cuivre (OECD, 1995).
Chaque four du procédé de fusion est équipé de filtration pour récupérer les vapeurs émises. Ces émissions sont fortement concentrées en plomb, étain, zinc sous forme d'oxydes et de sulfates. Ces métaux, les oxydes et les alliages étain/plomb peuvent être récupérés par traitement (OECD, 1995).
Les scories qui sont les résidus de métal issus des fours de fusion du métal sont recyclées sur place, sinon commercialisées ou considérées comme des déchets (OECD, 1995). Les scories recyclées sont tout d'abord refroidies très lentement pour favoriser la génération des cristaux. Ces cristaux sont concassés puis envoyés vers la cellule de flottation. Le concentré ainsi récupéré a une concentration de 35 % en cuivre (Techniques de l'ingénieur, 2002a).
Le recyclage représentait 41,5 % du cuivre utilisé en Europe en 2008. En 2008, au niveau mondial, pour une consommation de 24 millions de tonnes, 6 millions de tonnes provenaient de cuivre recyclé après simple fusion et 2,7 millions de tonnes de déchets de cuivre ayant subi un raffinage. La part de cuivre recyclé dans la consommation mondiale était de 36,2 % en 2008, d'après Vignes (2013).
PRODUCTION DES PRINCIPAUX COMPOSES DU CUIVRE
Les oxydes de cuivre sont préparés par oxydation de poudre de cuivre dans l'air. L'oxyde cuivrique est également obtenu par décomposition du carbonate ou de l'hydroxyde de cuivre à 300°C ou par hydrolyse d'une solution de sel de cuivre avec un alcalin (hydroxyde de sodium NaOH). L'oxyde cuivreux est obtenu par chauffage à 750°C d'un mélange d'oxyde cuivrique avec du carbone. L'atmosphère inerte sans oxygène influence la teneur en oxyde.
L'hydroxyde de cuivre s'obtient à partir d'une solution de sel de cuivre et d'un alcalin (par exemple l'hydroxyde de sodium NaOH).
L'acétate de cuivre est produit par la réaction de l'acide acétique sur de l'oxyde de cuivre CuO ou sur le carbonate CuCO3.
Les chlorures de cuivre sont produits par réaction du cuivre métal chauffé avec du chlore. La production de chlorure cuivrique se fait à des températures de l'ordre de 400 à 500°C, alors que la production de chlorure cuivreux se fait à des températures plus élevées entre 450 et 800°C, selon les méthodes. Le chlorure cuivrique s'obtient également par déshydratation du dihydrate de chlorure de cuivre à 120°C ou par réaction de l'oxyde de cuivre (II), du carbonate de cuivre (II) ou de l'hydroxyde de cuivre avec de l'acide chlorhydrique.
Le sulfate de cuivre est préparé par lessivage du minerai de cuivre avec de l'acide sulfurique. Il est aussi obtenu par réaction entre du cuivre (grenaille) ou de l'oxyde de cuivre avec de l'acide sulfurique (INERIS, 2005 ; ECI, 2008a).
Utilisations
Introduction (varitétés d'utilisations)
FTE 2015 Importer
D'après la FEDEM (2010b), les produits à base de cuivre sont : les bandes et tôles, les barres et profilés, les billettes, les câbles et fils à usage électrique, les cathodes de Cu à 99,999 %, les coussinets et bagues, les échangeurs thermiques, les fils, les fils pour soudo-brasure, les flans monétaires, les grenailles, les lingots pour moulage, les plateaux, les poudres et pigments, les toiles métalliques et les tubes.
Ces demi-produits peuvent également être fabriqués à partir de cuivre recyclé.
A l'échelle mondiale
En 2012, d'après Vignes (2013)[33] , la consommation mondiale de cuivre atteignait les 20,5 millions de tonnes.
La demande en cuivre est croissante (en raison des innovations multipliant les utilisations du cuivre : énergie renouvelable, efficacité énergétique, bâtiment durable, transport) ce qui a induit une augmentation de la production minière (ECI, 2009).
Ainsi la consommation mondiale de cuivre raffiné ne cesse d'augmenter (ICSG, 2013) tel que l'illustre la Figure 7 ci-après.
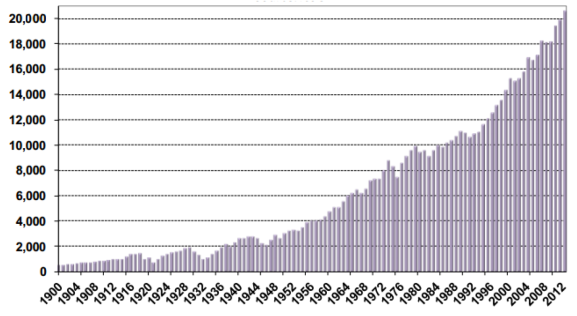
Figure 7. Utilisation mondiale du cuivre raffiné de 1900 à 2012 en milliers de tonnes, d'après ICSG (2013).
La répartition de la consommation industrielle de cuivre selon les secteurs industriels est présentée dans la Figure 8 ci-après.
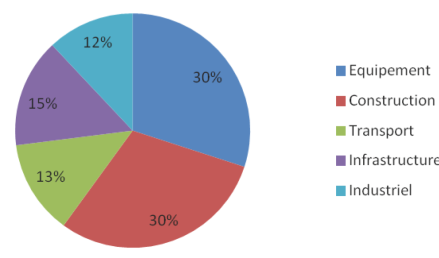
Figure 8. Secteurs d'utilisation en 2012, d'après ICSG (2013).
Au niveau mondial, en, 2012, le cuivre a été utilisé par le secteur de la construction (30 %), le secteur des équipements (30 %), le secteur des infrastructures (15 %), les transports (13 %) et le secteur industriel (12 %).
La Chine est le plus gros consommateur de cuivre, elle a utilisé 8,8 millions de tonnes de cuivre en 2012, d'après Vignes (2013). D'après l'ICSG[34] , en 2012, le continent asiatique utilise 60 %, l'Amérique 14 %, l'Europe 20 % et le reste du monde 6 % du cuivre produit et recyclé.
[33] (consulté en février 2014). http://www.societechimiquedefrance.fr/extras/Donnees/acc.htm
[34] International Copper Study Group : http://www.icsg.org/index.php/component/jdownloads/finish/170/1188 (consulté en février 2014).
A l'échelle européenne
En Europe, en 2012, la consommation de cuivre était d'environ 20 % de la demande mondiale. La demande en cuivre raffiné en UE 28 (pays de l'Union européenne avec la Croatie), en 2012, était estimée à 3 millions de tonnes de cuivre, d'après l'ICSG[35] .
[35] International Copper Study Group : http://www.icsg.org/index.php/component/jdownloads/finish/165/872 (consulté en février 2014).
A l'échelle française
En France, en 2007, la consommation en demi-produit est estimée à 466 000 tonnes, d'après Vignes (2013). En 2008, 410 000 tonnes de cuivre raffiné étaient utilisées (ICSG, 2013).
L'utilisation de matières recyclables est estimée en France, en 2007 à 110 000 tonnes, d'après Vignes (2013).
Le cuivre est principalement employé dans le secteur électrique et électronique, celui des technologies de la communication et celui de la construction. Les fils électriques, les laminés et les tubes comptent pour plus de 70 % de l'utilisation de cuivre pur (Techniques de l'ingénieur, 2002a).
Les différents secteurs d'utilisation du cuivre sont précisés pour le métal, les composés et les alliages dans les paragraphes qui suivent.
VUE D'ENSEMBLE DES COMPOSES CHIMIQUES DU CUIVRE ET LEURS UTILISATIONS
FTE 2015 Importer
Les composés du cuivre ayant été enregistrés dans REACH (selon la base publique de l'ECHA consultée en Février 2014), pour des usages autres que des intermédiaires de synthèse, et à des tonnages supérieurs à 100 t.an-1, sont présentés dans le Tableau 8 ci-après en tonnage décroissant.
Tableau 8. Composés du cuivre enregistré dans REACH.
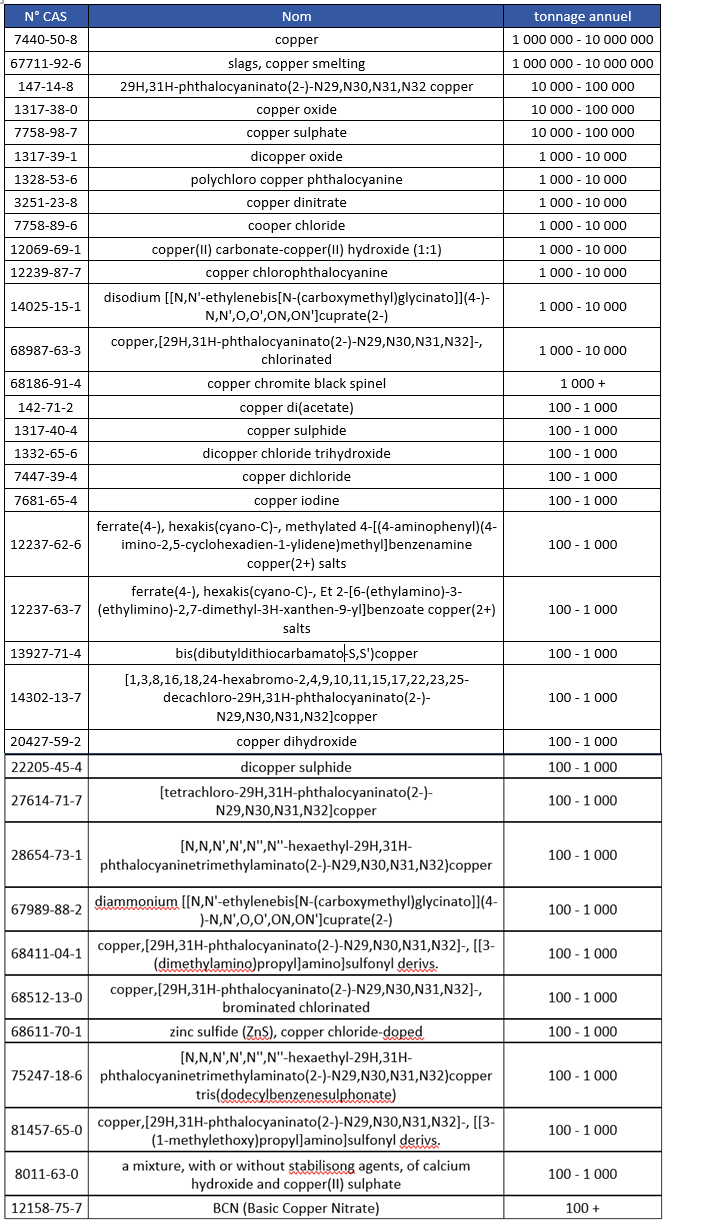
Plus en détail, l'oxyde cuivrique (CuO, 1317-38-0) est utilisé dans les pigments pour verres, céramiques et émaux, les vernis en photographie et les compositions pyrotechniques, les peintures pour bateaux (agent anti-fouling), les insecticides, molluscicides destinés aux filets de pêche et coques de bateaux, bactéricides, herbicides et fongicides (anti-mildiou) et les conservateurs pour le bois. Il est aussi utilisé en galvanoplastie (dans les électrodes de galvanisation, dans les cellules photoélectriques et dans les pates pour brasure) et comme catalyseurs dans les réactions chimiques (synthèse organique).
L'oxyde cuivreux (Cu2O, 1317-39-1) est utilisé dans les pigments pour verres, céramiques et émaux, les peintures pour bateaux (agent anti-fouling), les insecticides, molluscicides destinés aux filets de pêche et coques de bateaux, bactéricides, herbicides et fongicides (anti-mildiou), ainsi qu'en galvanoplastie (dans les électrodes de galvanisation, dans les cellules photoélectriques et dans les pates pour brasure), comme catalyseurs dans les réactions chimiques (synthèse organique) et comme agents de polissage pour les verres optiques.
Le sulfate de cuivre (CuSO4, 7758-98-7) est utilisé dans les pigments pour verres, céramiques et émaux, les vernis en photographie, les compositions pyrotechniques, les insecticides, molluscicides destinés aux filets de pêche et coques de bateaux, bactéricides, herbicides et fongicides (anti-mildiou), la bouillie bordelaise (avec de l'hydroxyde de calcium), la bouillie bourguignonne (avec du carbonate de sodium) et les conservateurs pour le bois. Il est également utilisé en galvanoplastie (dans les électrodes de galvanisation, dans les cellules photoélectriques et dans les pates pour brasure), comme mordant pour la teinture et l'impression des textiles et comme agent de flottation dans le raffinage du pétrole.
Le chlorure cuivrique (CuCl2, 7447-39-4) est utilisé dans les pigments pour verres, céramiques et émaux, les vernis en photographie et les compositions pyrotechniques, les conservateurs pour le bois et les mordants pour la teinture et l'impression des textiles. Il est aussi employé pour le raffinage des métaux cuivre, argent et or, en galvanoplastie (dans les électrodes de galvanisation, dans les cellules photoélectriques et dans les pates pour brasure), comme catalyseur dans les réactions chimiques (synthèse organique) et comme agent désodorisants, de désulfuration et de purification dans l'industrie pétrolière.
Le chlorure cuivreux (CuCl, 7758-89-6) est utilisé comme catalyseur dans les réactions chimiques (synthèse organique) et comme agent désodorisant, de désulfuration et de purification dans l'industrie pétrolière.
L'acétate de cuivre (Cu(CH3COO)2, 142-71-2) est utilisé dans les pigments pour verres, céramiques et émaux, les insecticides, molluscicides destinés aux filets de pêche et coques de bateaux, bactéricides, herbicides, fongicides (anti-mildiou) et comme catalyseur dans les réactions chimiques (production de caoutchouc) (INERIS, 2004, 2005 ; Commission Européenne 2006a).
LES NANOPARTICULES
FTE 2015 Importer
D'après l'ANSES[36] (2013), des composés du cuivre nanoparticulaires ont été enregistrés dans le cadre de la réglementation sur les nanoparticules. Cette procédure d'enregistrement comporte également des informations sur les usages de ces nanoparticules : ces données sont synthétisées dans le Tableau 9 ci-après.
[36] Bilan 2013 de déclarations des substances importées, fabriquées ou distribuées en France en 2012. (consulté en mars 2014). http://www.developpement-durable.gouv.fr/IMG/pdf/Rapport_public_format_final_20131125.pdf
Tableau 9. Composés nanoparticulaires du cuivre, d'après l'ANSES (2013).
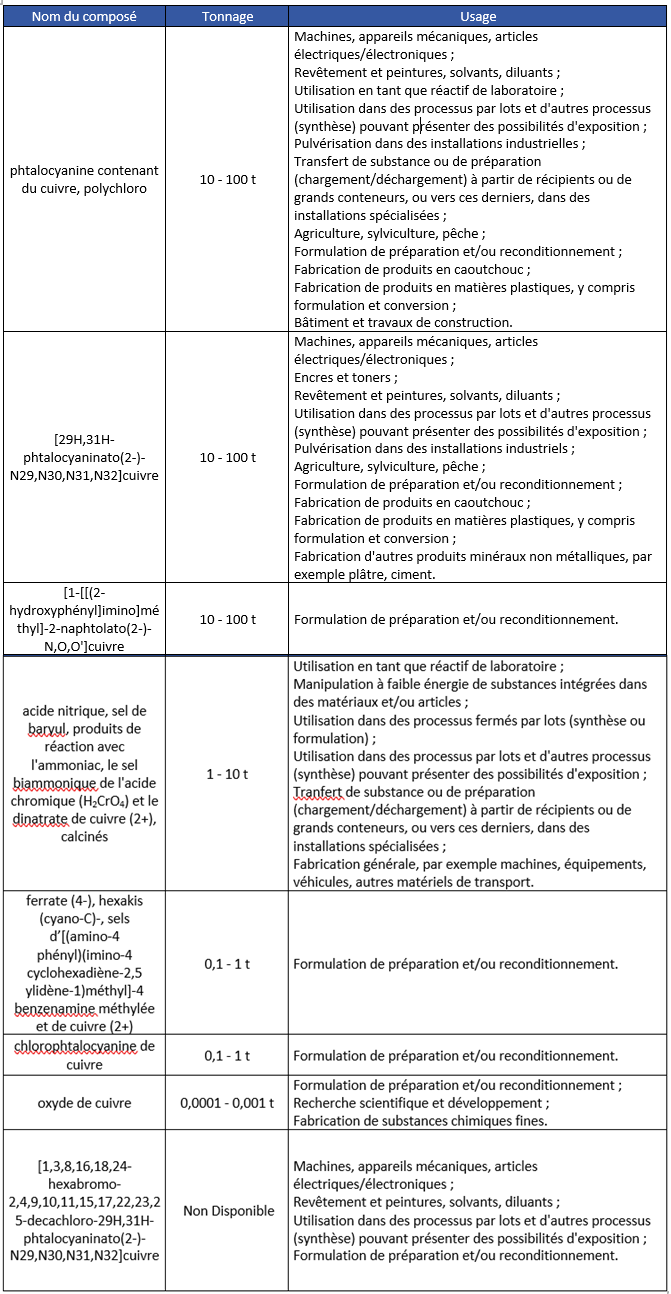
Un exemple d'utilisation potentielle des nanoparticules de cuivre est le secteur de la santé : Pour lutter contre les infections contractées en milieu hospitalier elles pourraient être utilisées pour fabriquer des textiles antibactériens pour les hôpitaux.
C'est l'objectif du projet SONO, («A pilot line of antibacterial and antifungal medical textiles based on a sonochemical process») qui a été financé par la Commission Européenne au début des années 2010. Il se base sur un processus de laboratoire récemment breveté et éprouvé, en une étape, pour imprégner des textiles par des nanoparticules d'oxydes de zinc et de cuivre[37] .
En termes de volume, l'emploi des nanoparticules reste toutefois négligeable par rapport aux quantités totales de cuivre : il est utilisé en Europe plus d'un million de tonnes de cuivre et de ses composés. Les composés nanoparticulaires employés représentent une quantité de l'ordre de la centaine de tonnes en France.
[37] (consulté en juin 2014). http://cordis.europa.eu/result/brief/rcn/11169_fr.html
LE SECTEUR ELECTRIQUE
FTE 2015 Importer
Le secteur électrique est le secteur industriel où l'on identifie la principale utilisation du cuivre pur. Les produits considérés sont les câbles, les fils et les équipements électriques (bobines, dynamos, transformateurs, connecteurs) (LME, 2010).
Le recours intensif au cuivre s'explique par le fait que ce métal est un excellent conducteur d'électricité et qu'il est résistant à la corrosion (Techniques de l'ingénieur, 2002a). En France, en 2007, il a été consommé 268 000 tonnes de cuivre pour fabriquer des fils et des câbles. On estime, en Europe, que 8 millions de km de câbles de cuivre assurent le transport du courant électrique, d'après Vignes (2013).
LE SECTEUR ELECTRONIQUE ET COMMUNICATION
FTE 2015 Importer
Le cuivre joue un rôle important dans les technologies de communication. Il est utilisé dans la transmission de données pour le service internet et les communications téléphoniques.
Il est également utilisé, ainsi que ses alliages, dans les lignes d'abonnés et les réseaux locaux et étendus, dans les ordinateurs et les téléphones portables. Dans le secteur des semi-conducteurs, le cuivre pourrait être, à terme, fortement utilisé dans les transistors (ICGS, 2013).
LE SECTEUR DE LA CONSTRUCTION
FTE 2015 Importer
Le cuivre et l'un de ses alliages, le laiton[38], sont très utilisés dans le domaine de la construction. Les produits le mettant en œuvre sont les canalisations de plomberie, de chauffage, mais aussi les fils électriques, les tôles de cuivre pour la couverture (toit et façade) et les tubes pour les gouttières (LME, 2010). L'usage du cuivre pour la couverture et l'évacuation des eaux pluviales dans le bâtiment, est assez peu répandu en France, et concerne environ 5 000 t.an-1. Cet usage est plus important en Allemagne (70 000 t.an-1) et en Italie (60 000 t.an-1), d'après Vignes (2013).
Les tubes de cuivre sont également employés dans les systèmes de protection incendie. En effet, à la différence des tubes en plastique, les tubes en cuivre ne brûlent pas, ni ne fondent, ils ne relâchent pas non plus de fumées nocives ou toxiques.
Le cuivre est également utilisé pour ses propriétés antibactériennes. Les poignées de porte en cuivre permettent de limiter la prolifération des virus et microbes, d'après l'ICSG (2013). Ce matériau peut donc être rencontré dans les hôpitaux et dans le milieu médical en serrurerie et robinetterie afin de lutter contre les infections nosocomiales (éventuellement sous forme nanoparticulaire).
[38] Le laiton est composé majoritairement de cuivre, auquel est ajouté jusqu'à 30% de zinc.
LE SECTEUR DU TRANSPORT
FTE 2015 Importer
Les alliages de cuivre et de nickel sont utilisés dans la coque des bateaux pour réduire l'encrassement de la coque par les algues et ainsi réduire la trainée et donc la consommation énergétique, d'après l'ICSG (2013).
Dans le secteur automobile, les moteurs, radiateurs, connecteurs, freins peuvent comporter du cuivre. Une automobile comporte environ 22,5 kg de cuivre en moyenne. Les véhicules hybrides, électriques contiendraient plus du double de cuivre (45 kg contre 20 kg) par comparaison avec une voiture classique, d'après Vignes (2013) et l'ICSG (2013).
Les trains et avions de nouvelle génération contiennent également du cuivre. Les trains à grande vitesse peuvent contenir entre 2 et 4 tonnes de cuivre, alors que les trains électriques plus classiques en contiennent entre 1 et 2 tonnes (ICSG, 2013).
LES EQUIPEMENTS INDUSTRIELS
FTE 2015 Importer
Le cuivre, par sa durabilité et de sa malléabilité, est très utilisé dans les équipements industriels pour fabriquer des pales de turbines, des engrenages et des roulements.
Le cuivre a la propriété de transférer la chaleur, et à cause de cette caractéristique, il est utilisé dans les équipements tels que les échangeurs thermiques, les cuves et les équipements sous pression.
Le cuivre et les alliages du cuivre tel que le laiton, le bronze et le cuivre-nickel sont résistants à la corrosion. Ils sont utilisés dans les équipements marins (plate-forme, canalisation, etc.,).
LES PRODUITS GENERAUX DE CONSOMMMATION
FTE 2015 Importer
Le cuivre est utilisé en chaudronnerie (casseroles et marmites), dans les textiles (catalyseur et agent de coloration[39]) et en tannerie (fixateur et agent de coloration) et en tant qu'algicide (sulfate de cuivre utilisé dans les piscines) (INERIS, 2005 ; Commission européenne, 2003a ; 2003b).
Le cuivre est également utilisé dans l'industrie photographique et dans l'industrie de traitement de surface (OECD, 1995). Dans ce dernier secteur, le cuivre peut, entre autres, être utilisé[40] pour le cuivrage acide (dans lequel l'électrolyte est un mélange de sulfate de cuivre (50 à 60 g.L-1) et d'acide sulfurique (60 à 90 g.L-1) et pour la réalisation de cartes de circuit imprimé (préparation de la plaque de cuivre support par décapage avec du chlorure de cuivre pulvérisé).
De nombreux objets de décoration peuvent aussi être composés de cuivre et ses alliages : boutons, fermetures éclair, bijoux, etc. (Commission européenne, 2006a).
Enfin, les pièces de monnaies, telles que les pièces de centimes d'euro, contiennent du cuivre, d'après le site internet de la BCE[41].
[39] Le sulfate de cuivre peut former avec certains colorants azoïques des complexes métalliques résistant à la lumière.
[40] Le cuivre peut aussi être utilisé pour le revêtement en laiton (l'électrolyte est composé de cyanure de cuivre (8 à 15 g.L-1) et de cyanure de zinc (30 g.L-1).
[41] Banque Centrale Européenne : (consulté en mars 2014). http://www.ecb.europa.eu/euro/html/index.fr.html
LE SECTEUR DE L'AGRICULTURE
FTE 2015 Importer
Dans les élevages de bovins, porcins et volailles, le cuivre est utilisé en tant que complément alimentaire (ICSG, 2013). Selon cette même source, le cuivre favorise la croissance et la prévention de certaines maladies.
Depuis plus d'une centaine d'années, le cuivre est utilisé principalement en tant que fongicide (ACTA, 2014) en viticulture majoritairement (83 %) mais aussi pour la culture fruitière (14 %), pour la culture légumière (2 %) et la culture de la pomme de terre (1 %). Il est utilisé pour le traitement des parties aériennes des cultures. Le sulfate de cuivre est utilisé dans les produits phytosanitaires pour traiter les vignobles contre plusieurs espèces de champignons (majoritairement le mildiou, mais aussi l'oïdium) (ADEME-SOGREAH, 2007). Le sulfate de cuivre est le composant actif de la bouillie bourguignonne (CuSO4 avec du CO3Na2) et de la bouillie bordelaise (CuSO4 avec Ca(OH)2) (ADEME-SOGREAH, 2007 ; INERIS, 2004).
Il existe de nombreuses bouillies bordelaises prêtes à l'emploi. Certains traitements anticryptogamiques peuvent être effectués par poudrage au moyen de poudres cupriques renfermant 2,5 % minimum de cuivre métal sous forme de composés insolubles. Parmi les produits cupriques utilisables en pulvérisation, il faut citer l'hydroxyde de cuivre, l'oxyde cuivreux en émulsion huileuse et l'oxychlorure tétracuivrique. Ce dernier est un sel insoluble (poudres mouillables à 50 % de cuivre métal) que l'on associe souvent aux fongicides organiques de synthèse (ACTA, 2014).
Le traitement au cuivre se pratique sur les vignes et sur les arbres fruitiers avec des doses moyennes respectivement de 1 000 à 2 500 g Cu/ha/an et de 3 750 à 5 000 g Cu/ha/an (ADEME-SOGREAH, 2007).
LES SECTEURS INNOVANTS
FTE 2015 Importer
Des utilisations novatrices du cuivre se développent dans différents secteurs. Ces nouvelles utilisations induisent une augmentation de la demande en cuivre ; les principales sont :
- les cellules photovoltaïques des panneaux solaires (CDA, 2006),
- les puces en cuivre développées par l'industrie des semi-conducteurs, application décrite ci-dessus dans le secteur électronique et communication (ICSG, 2013).
AUTRES SECTEURS
FTE 2015 Importer
D'autres secteurs pour lesquels nous disposons de moins d'informations pourraient également employer du cuivre :
- La préservation du bois (sel de cuivre) : certaines tours de refroidissement peuvent utiliser du bois pour leur structure de soutien. Dans ce cas, les bois sont traités pour assurer leur longévité. D'après la Commission Européenne (2001), le traitement est basé sur le CCA (sulfate de cuivre, dichromate de potassium et pentaoxyde d'arsenic) grâce à sa capacité à rester sur le bois. Étant donné que le CCA contient du cuivre et de l'arsenic, il semble peu probable que ce produit continue à être utilisé à l'avenir.
De manière plus générale, les composés du cuivre utilisés pur la conservation du bois sont le sulfate de cuivre et l'oxyde et le chlorure cuivrique (INERIS, 2005). De même, bien que le fait soit peu documenté, les produits suivant à base de cuivre, semblent employés dans le domaine de la préservation du bois : ACQ (composé quaternaire de cuivre aminé) et le CBA (composé de type azole de cuivre et de bore).
- Les peintures antisalissures marines : selon un expert interrogé en 2010, depuis l'interdiction de l'usage des TBT (tributylétain), 90 à 95 % des peintures antifouling contiennent du cuivre comme biocide.
- La chimie (catalyseurs, additifs) : le cuivre est employé en tant que catalyseur dans de nombreuses réactions chimiques. Selon l'INERIS (2005) les formes du cuivre les plus employées pour cet usage sont l'oxyde cuivreux et cuivrique, le chlorure cuivrique et cuivreux (destiné à la synthèse organique) et l'acétate de cuivre (destiné à la production du caoutchouc).
Un exemple quant à l'usage du cuivre en tant que catalyseur est lié à l'oxydation des gaz contenant des composés chlorés et des COV. Pour cet usage l'utilisation d'oxydes de cuivre est rapportée par le BREF « traitement des eaux usées du secteur de la chimie » de 2003.
- L'industrie textile : les composés du cuivre sont utilisés en tant que mordants[42] pour la teinture et l'impression des textiles. Il s'agit du chlorure cuivrique et du sulfate de cuivre (INERIS, 2005).
- L'industrie du papier : cette industrie semble utiliser du cuivre à travers certaines encres. En revanche, selon nos informations, le cuivre n'est pas directement utilisé lors de la production de papier. Néanmoins cet élément peut être rejeté par les sites industriels réalisant cette production du fait de l'utilisation de papiers recyclés au cours du procédé (PRID, 2001).
Notons qu'il est fort probable que d'autres secteurs industriels non identifiés au cours de ce travail emploient et/ou rejettent du cuivre.
[42] Le mordançage (utilisation d'un mordant lors de l'impression des textiles) consiste à imprégner le tissu d'un produit qui retiendra ensuite les pigments ou les tanins afin de fixer la couleur durablement et obtenir des couleurs vives.
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Le cuivre est présent naturellement dans la croûte terrestre et dans les océans, les lacs, les rivières sous différentes formes et concentrations. C'est un des métaux existant à l'état natif, cependant il est majoritairement présent sous la forme de minerais (ECI, 2010). La teneur moyenne en cuivre de l'écorce terrestre est de 55 ppm[18] . La concentration moyenne en cuivre varie entre 13 et 24 mg/kg dans les sols.
Le FOREGS[19] construit des cartes (voir paragraphe 4.2) montrant les concentrations en cuivre dans 26 pays européens et dans différents milieux (sol couche profonde et de surface, humus, sédiments de cours d'eau et de plaines alluviales et cours d'eau).
[18] (consulté en janvier 2014). http://www.societechimiquedefrance.fr/extras/Donnees/acc.htm
[19] Forum of the European Geological Surveys : Atlas Géochimique de l'Europe : (consulté en décembre 2013). http://weppi.gtk.fi/publ/foregsatlas/
Sources non-intentionelles
FTE 2015 Importer
Sans objet
Émissions anthropiques totales
FTE 2015 Importer
Le suivi du cuivre dans l'environnement est régi par la réglementation française et européenne. Les principales émissions de cette substance dans l'environnement sont donc recensées au niveau français (à travers les bases de données BASOL[43] , IREP[44] , …) et au niveau européen (notamment à travers la base de données E-PRTR[45]).
Les apports de cuivre anthropique ont principalement pour origine (IFEN, 2007) :
- les activités industrielles qui émettent majoritairement dans les eaux et les sols ;
- les activités urbaines et le trafic routier qui émettent principalement dans l'air ;
- les activités agricoles (les épandages des fumiers et lisiers de bovins, porcins et de volailles ; les traitements phytosanitaires des cultures des vignes et des arbres; l'utilisation d'engrais minéraux ; l'épandage de composts et des boues issues des STEP) qui émettent principalement vers les sols (ADEME-SOGREAH, 2007).
A titre d'illustration et même si la données est un peu ancienne, les émissions de cuivre dans les différents compartiments en fonction des différentes sources (trafic, agriculture, traitement des déchets, résidentiel et industrie) sont données pour l'UE 15 dans la Figure 9, d'après ECI (2008a).
[43] Base de données Basol sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif (consulté en février 2014). http://basol.developpement-durable.gouv.fr/recherche.php
[44] Registre français des émissions polluantes (consulté en mars 2014). http://www.irep.ecologie.gouv.fr/IREP/index.php
[45] European Pollutant Release and Transfer Register : (consulté en mars 2014). http://prtr.ec.europa.eu/PollutantReleases.aspx
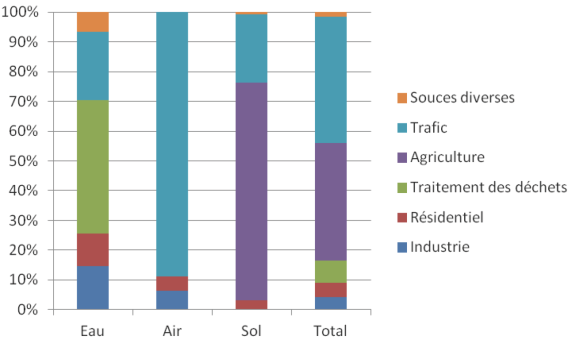
Figure 9. Distribution des émissions de cuivre par compartiment environnemental et par source dans l'Union Européenne en 2008 (EU15), d'après ECI (2008a).
Les principaux émetteurs de cuivre vers l'eau sont le traitement des déchets, le secteur des transports et l'industrie. Le secteur des transports représente près de 90 % des émissions de cuivre vers l'atmosphère. Le principal émetteur de cuivre vers le sol est l'agriculture (plus de 70 %). De façon agrégée pour tous les compartiments de l'environnement, les principaux émetteurs de cuivre sont l'agriculture et secteur des transports, donc des sources principalement diffuses.
L'évolution des émissions du cuivre et ses composés déclarées dans le cadre de l'arrêté du 31 janvier 2008 par les industriels, entre 2008 et 2012, est présentée dans le Tableau 10 ci-après. Les données affichées sont issues du registre français des émissions polluantes IREP[46] . A titre de comparaison, ce tableau comprend également les valeurs de la base de données EPRTR[47] pour les émissions de l'UE 27.
Rappelons que le registre français des émissions polluantes IREP différencie les émissions directes dans l'eau de celles qui sont indirectes. Un rejet direct est défini comme un rejet isolé, après station d'épuration interne au site industriel ou directement dans le milieu naturel, un rejet indirect est défini comme un rejet raccordé à une station d'épuration extérieure à l'installation industrielle émettrice.
[46] (consulté en mars 2014). http://www.irep.ecologie.gouv.fr/IREP/index.php
[47] European Pollutant Release and Transfer Register : (consulté en mars 2014). http://prtr.ec.europa.eu/PollutantReleases.aspx
De plus, pour IREP comme pour E-PRTR, seuls les rejets supérieurs à un seuil donné sont soumis à déclaration (seuil défini substance par substance) ; de façon globale, les seuils appliqués par E-PRTR sont plus élevés que ceux appliqués dans IREP. Les informations issues de ces deux bases de données ne peuvent donc pas être considérées comme exhaustives, ni directement comparées.
Tableau 10. Emissions du cuivre et ses composés dans l'environnement, d'après IREP et E-PRTR.
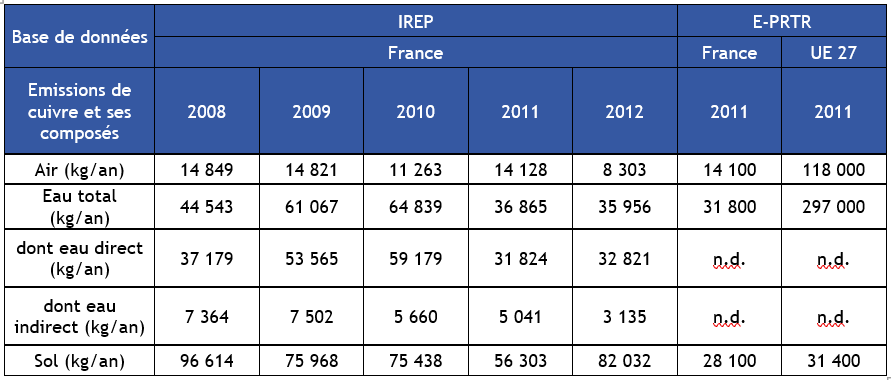
n. d. : non défini
Selon IREP, en 2012, en France, les émissions vers le sol (environ 82 tonnes soit 65 % des émissions totales dans l'environnement) et vers les eaux (environ 36 tonnes soit 28 % du total) sont plus importantes que celles vers l'air (environ 8 tonnes soit 7 % du total).
La France occupe une place importante dans les émissions de cuivre à l'échelle de l'Union Européenne. En 2011, les émissions vers le sol, l'eau et l'air représentent respectivement 90 %, 11 % et 12 % du total des émissions déclarées dans l'UE (27). Toutefois, au niveau européen, il semblerait que la France est sur-représentée quant aux déclarations des émissions vers les sols : ces données doivent donc être utilisées prudemment.
D'autre part, de façon générale, pour l'année 2011, les données de IREP (2014) sont cohérentes avec les émissions industrielles déclarées dans le registre européen des rejets et des transferts de polluants E-PRTR, à l'exception des émissions vers les sols. Néanmoins, les différences observables entre ces deux sources de données sont liées aux faits que :
- la base de données IREP peut contenir des informations volontairement fournies par les industriels sur les rejets non soumis à déclaration (rejets inférieurs aux seuils de
déclaration) alors que, par construction, la base de données E-PRTR exclut la prise en compte de ces données ;
- la base de données IREP prend en compte les rejets d'un plus grand nombre de secteurs d'activité industrielle par rapport à ceux considérés dans E-PRTR.
Les évolutions des émissions sont disparates selon les milieux. Les émissions vers l'air varient sur ces 5 années d'environ 8 000 à 15 000 kg.an-1 avec pour écart type 2 853 kg.an-1, celles vers l'eau d'environ 36 000 à 65 000 kg.an-1 avec un écart type de 13 538 kg.an-1, celle vers les sols d'environ 56 000 à 97 000 kg.an-1 avec un écart type de 14 505 kg.an-1.
Émissions atmosphériques
FTE 2015 Importer
EMISSIONS FRANÇAISES
En France, selon l'INS[48] , les émissions atmosphériques de cuivre en 2007 étaient réparties sur le territoire comme le montre la figure ci-après.
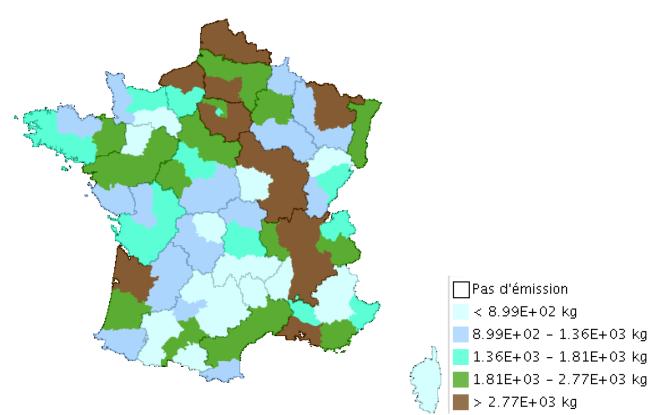
Figure 10. Répartition des émissions atmosphériques de cuivre en France en 2007, d'après l'INS.
[48] Inventaire National Spatialisé : (consulté en avril 2014). http://90.83.82.201/ins-webapp/
Les départements ayant émis le plus de cuivre en 2007 étaient le Nord, le Pas-de-Calais, la Moselle, l'Oise, la Seine-Maritime, la Seine-et-Marne, l'Essonne, les Yvelines, l'Yonne, la Côte-d'Or, la Saône-et-Loire, le Rhône, l'Ain, l'Isère, la Drôme, les Bouches-du-Rhône et la Gironde.
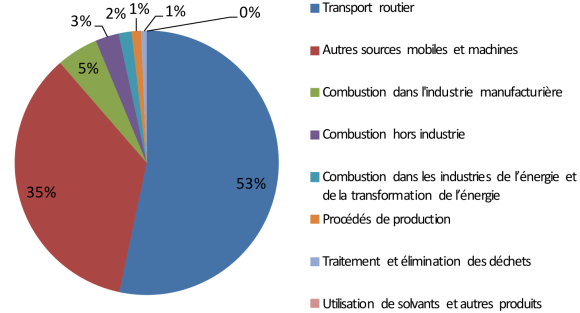
Figure 11. Secteurs émettant du cuivre dans l'atmosphère en France en 2007, d'après l'INS.
Les deux secteurs émettant le plus de cuivre en France en 2007 étaient le transport routier (53 %) et les autres sources mobiles et machines (35 %).
Selon le CITEPA[49] , le cuivre et ses composés sont principalement rejetés dans l'air par les sous-secteurs suivants (sous-secteurs prépondérants en 2011 pour la France métropolitaine) :

Ces mêmes données peuvent être présentées sous forme graphique (Figure 12).
[49] Centre Interprofessionnel Technique d'Etudes de la Pollution Atmosphérique (consulté en février 2014). http://www.citepa.org/fr/pollution-et-climat/polluants/metaux-lourds/cuivre
Selon ces chiffres, deux secteurs prédominent dans les émissions de cuivre : le transport routier (usure des plaquettes de freins) et les autres transports (notamment le transport ferroviaire avec l'usure des caténaires).
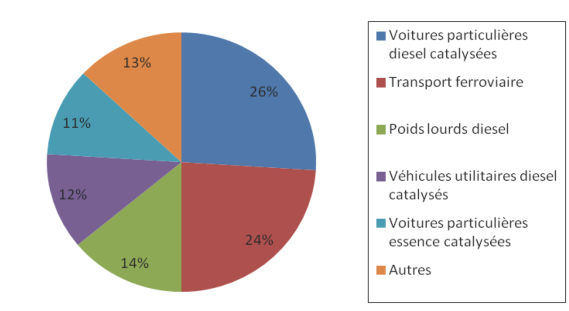
Figure 12. Secteurs responsables des rejets atmosphériques de cuivre et de ses composés, d'après les données du CITEPA.
Les rejets atmosphériques ont représenté 226 tonnes en 2011. Ce chiffre représente une augmentation de 1,8 % par rapport à 2009 (rejets les plus bas enregistrés depuis 1990). La diminution observée de 1990 à 2011 équivaut à -4,9 % (cf. Figure 13 ci-après).
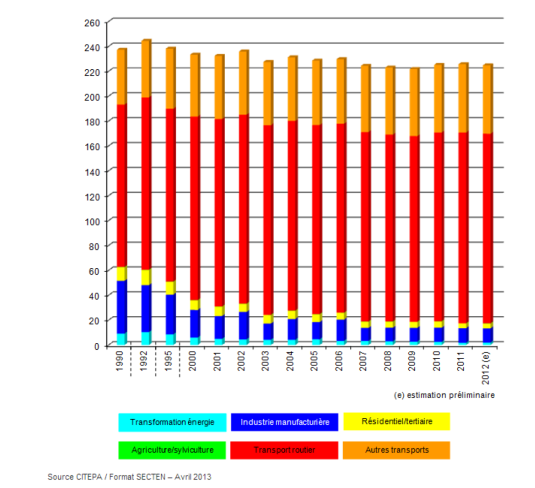
Figure 13. Emissions de cuivre dans l'air en France métropolitaines en tonnes, d'après le CITEPA.
LE SECTEUR DES TRANSPORTS ROUTIERS ET FERROVIAIRES
La pollution atmosphérique en cuivre et ses composés vient principalement du secteur des transports. Comme illustré par la figure précédente, le secteur du transport routier représente 68 % des émissions atmosphériques totales de cuivre en France en 2011 et le secteur des transports ferroviaires 24 %.
Le Tableau 11 ci-après présente l'évolution des données des émissions de cuivre vers l'atmosphère et la part relative aux transports et plus particulièrement aux transports routiers, d'après le CITEPA.
Tableau 11. Emissions atmosphériques de cuivre dans le domaine des transports, d'après le CITEPA.
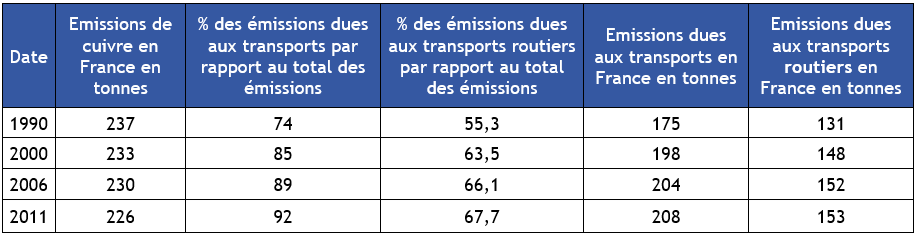
Malgré le fait que les émissions totales de cuivre sont en diminution depuis 1990, les émissions de cuivre dues aux transports ont augmenté. En effet, ces émissions représentaient 131 tonnes en 1990 et 153 tonnes en 2011.
En 2011, la part des transports en tant que contributeur aux émissions de cuivre est importante : 92 % des émissions totales de cuivre sont dues aux transports et 74 % des émissions de cuivre dues aux transports correspondent aux transports routiers (soit 66,1 % des émissions totales de cuivres). De 1990 à 2007, en France, les émissions de cuivre (non réglementées) dues aux transports ont augmenté de 31 % pour les transports routiers et de 20 % pour les transports ferroviaires.
LES EMISSIONS INDUSTRIELLES
En Europe, en 2011, les principaux émetteurs industriels de cuivre vers l'atmosphère sont la Pologne, l'Allemagne, la France et l'Espagne. Ils représentent respectivement 25 % (29 tonnes), 15 % (17 tonnes) et 12 % (14 tonnes) et 10 % (19 tonnes) des émissions industrielles européennes[50] vers l'air. Les secteurs les plus significatifs sont la production de métaux non ferreux à partir de minerais, de concentrés et de matériaux secondaires (27,2 %), la production du fer et de l'acier brut incluant le moulage continu (24,1 %) et les centrales thermoélectriques et autres installations de combustion (16,1 %), d'après l'E-PRTR.
En France, d'après les données E-PRTR de l'année 2011, les secteurs les plus importants quant à leurs émissions de cuivre et de ses composés dans l'atmosphère sont :
- la production de métaux non ferreux à partir de minerais, de concentrés et de matériaux secondaire (36,7 %) ;
- la production à l'échelle industrielle de produits chimiques organiques (26,6 %) ;
- le grillage ou le frittage des minerais métalliques (y compris de minerais sulfurés) (9,7 %) ;
- les fonderies de métaux ferreux (8,4 %).
[50] Les données européennes considérées ci-dessus sont les données issues des 27 membres actuels de l'Union Européenne.
Le secteur de la production de métaux non ferreux à partir de minerais, de concentrés et de matériaux secondaires émet plus de 5,181 tonnes de cuivre et de ses composés, en 2011.
D'après IREP, les émissions industrielles atmosphériques de l'année 2011 se répartissent sur les régions françaises suivantes :
- Lorraine (41 % répartis sur 6 sites) ;
- Provence Alpes Côtes d'Azur (24 % répartis sur 2 sites) ;
- Nord Pas de Calais (15 % répartis sur 5 sites) ;
- Champagne Ardenne (7 % répartis sur 4 sites) ;
- Aquitaine (5 % répartis sur 1 site) ;
- Midi-Pyrénées (4 % répartis sur 1 site) ;
- Rhône-Alpes (3 % répartis sur 2 sites) ;
- Haute Normandie (1 % réparti sur 1 site) ;
Émissions vers les eaux
FTE 2015 Importer
Selon l'Agence de l'eau Seine Normandie (2009) et, à titre d'exemple, l'origine du cuivre dans la Seine à Poses (estuaire) en 2006 est :
- urbaine (60 %) ;
- naturelle (15 %) ;
- autre dont industrielle (25 %).
LES EMISSIONS INDUSTRIELLES VERS LES EAUX
Dans l'Union européenne, en 2011, les principaux émetteurs sont le Royaume-Uni, la Roumanie, l'Allemagne, l'Italie et la France. Ils représentent respectivement 18 % (52 tonnes), 12 % (36 tonnes), 12 % (34 tonnes), 11 % (32 tonnes) et 11 % (32 tonnes) des émissions industrielles européennes[51] vers l'eau, d'après E-PRTR.
D'après cette même source, en 2011, à l'échelle de l'UE 27 et de la France, un des secteurs les plus significatifs correspond aux installations de traitement des eaux résiduaires urbaines. Ce secteur représente 50,4 % (16 tonnes) du total des émissions françaises de cuivre et de ses
composés vers les eaux. En France, un autre secteur important est la production de métaux non ferreux à partir de minerais, de concentrés et de matériaux secondaires (6 tonnes soit 19,8 % du total des émissions françaises de cuivre et de ses composés vers les eaux pour l'année 2011).
[51] Les données européennes considérées ci-dessus sont les données des 27 membres actuels de l'Union Européenne.
Par ordre d'importance décroissante, les bassins versants français les plus émetteurs (émissions industrielles) de cuivre et de ses composés vers les eaux pour l'année 2011 sont (E-PRTR, 2014) :
- le bassin RMC Rhône Méditerranée Corse (49 %) ;
- le bassin Seine Normandie (21 %) ;
- le bassin du Rhin (9 %) ;
- le bassin Adour Garonne (8 %) ;
- le bassin Loire Bretagne (6 %) ;
- le bassin Artois Picardie (6 %) ;
- le bassin de la Meuse (1 %).
D'après les données RSDE[52] , les principaux flux de cuivre proviennent des centrales thermiques de production d'électricité (72 %) et de l'industrie agro-alimentaire (pour la catégorie « produit d'origine animale » de ces industries) (22 %).
[52] Rejets de Substances Dangereuses dans les Eaux (consulté le 13 juin 2014).
LES EMISSIONS NON INDUSTRIELLES
Selon les résultats du projet de recherche AMPERES (2009), le cuivre fait partie des composés toujours détectés (à plus de 90 % des cas) en entrée des STEP et en sortie de STEP (traitements secondaires). Dans une STEP possédant un traitement tertiaire, le cuivre ne fait pas partie des composés toujours détectés en sortie.
Selon cette même source, le cuivre fait partie des composés les plus concentrés en entrée de STEP, en effet, la concentration est en général supérieure à 10 µg.L-1. Le cuivre est généralement retrouvé en sortie de STEP à une concentration comprise entre 1 et 10 µg.L-1.
Les métaux représentent 82 % en masse du flux total des polluants étudiés dans le cadre de cette étude, et le cuivre représente 2,1 % du flux total en entrée par équivalent habitant[53]. En sortie de STEP, les métaux représentent 97,4 % en masse du flux total et le cuivre représente 1 % du flux total par équivalent habitant. De manière générale, le cuivre est donc peu représenté parmi les métaux dans les rejets aqueux non industriels.
Nous n'avons pas de précision sur le type de traitements utilisés dans les STEPs étudiées.
[53] Equivalent habitant: unité de mesure utilisée pour les stations d'épuration.
Émissions vers les sols
FTE 2015 Importer
Les apports de cuivre et de ses composés dans les sols ont différentes origines : les activités industrielles, les activités agricoles, les activités urbaines et les activités liées aux transports.
LES EMISSIONS INDUSTRIELLES
En Europe, en 2011, les émissions industrielles vers les sols recensées dans E-PRTR se situent en France, Allemagne, Pologne et Espagne avec respectivement 90 % (28 tonnes), 9 % (3 tonnes), 1 % (0,2 tonne) et 0,1 tonne. Ces émissions représentent les seules émissions industrielles européennes[54] déclarées vers les sols. Les activités les plus significatives sont la production de pulpe à partir de bois et autres matériaux fibreux similaires (52,5 %), la mise en décharge de déchets non dangereux (20,1 %).
En France, d'après les données de 2011, les secteurs les plus importants quand à leurs émissions de cuivre et de ses composés vers les sols sont :
- la production de pulpe de papier à partir des arbres ou d'autres matériaux fibreux similaires (58,6 %, 16,5 tonnes) ;
- la mise en décharge de déchets non dangereux (22,4 %, 6,3 tonnes) ;
- la production de papier, de carton et autres produits primaires du bois (12,8 %, 3,6 tonnes) ;
- les traitements et les mises en œuvres de matières animales et végétales pour la production de boissons et de nourritures (5,1 %, 1,4 tonnes) ;
- les abattoirs (0,9 %, 0,3 tonnes).
[54] Les données européennes considérées ci-dessus sont les données des 27 membres actuels de l'Union Européenne.
LES EMISSIONS SUR LES SOLS AGRICOLES
Les apports annuels en France de cuivre et de ses composés sur les sols agricoles sont estimés à environ 4 869 tonnes/an, d'après l'ADEME (2007)[55] .
[55] (consulté en février 2014). http://www2.ademe.fr/servlet/KBaseShow?sort=-1&cid=96&m=3&catid=15725
Les principales sources identifiées sont (ADEME) :
- les déjections animales (53 %) ;
- les traitements phytosanitaires (34 %) ;
- les boues et composts (5 %) ;
- les retombées atmosphériques (5 %) ;
- les engrais minéraux (2 %) ;
- les amendements calciques et magnésiens (1 %).
LES EMISSIONS LIEES A DES EPANDAGES DE BOUES ET DE DECHETS
BOUES ET DECHETS D'ORIGINE URBAINE
D'après l'Agence de l'eau Rhône Méditerranée Corse[56] , le traitement des eaux usées urbaines produit, sur les bassins Rhône Méditerranée et Corse (d'une superficie de 130 000 km2), 280 000 tonnes de matière sèche de boues par an. L'apport des éléments traces métalliques aux sols a lieu par l'épandage et par le compostage des boues.
Sur le territoire de l'Agence de l'eau Rhône-Méditerranée et Corse, en 2009, 4 % des stations d'épuration produisaient des boues non conformes vis-à-vis des éléments traces métalliques (pour rappel, la valeur seuil réglementaire pour le cuivre est de 1 000 mg/kg). 60 % de ces dépassements sont dus au cuivre (Agence de l'eau Rhône Méditerranée Corse). La concentration moyenne en cuivre des boues urbaines des bassins Rhône Méditerranée Corse est d'environ 350 mg/kg en 2010.
[56] (consulté en février 2014). http://www.eaurmc.fr/fileadmin/documentation/brochures_d_information/qualite_eaux_boues/qualite _boues_rapport_2011.pdf
BOUES ET DECHETS D'ORIGINE AGRICOLE
Les déjections animales représentent un apport important dans les sols (53 % du cuivre entrant dans les sols agricoles). Cela s'explique par le fait que l'alimentation des élevages bovins, porcins et de volailles est complémentée en cuivre. Ces animaux sont sensibles au cuivre qui favorise leur croissance et prévient l'apparition des maladies. Cependant, le cuivre est peu assimilable, il est donc ajouté en quantité importante dans l'alimentation et se retrouve ensuite dans les déjections. Les épandages des déjections animales sont importants sur les sols agricoles (environ 300 000 millions de tonnes de matières brutes (données de l'année 2000) (ADEME-SOGREAH, 2007).
EMISSIONS LIEES A LA FERTILISATION DES SOLS ET A LA PROTECTION DES CULTURES
34% du cuivre entrant dans les sols agricoles sont issus des traitements phytosanitaires. Le cuivre provient de différentes sources[57] :
- traitement à la « bouillie bordelaise » dans les zones de vignes ou d'arboriculture ;
- produits phytosanitaires dans des parcelles exploitées pour certaines cultures intensives ;
- épandage de lisiers de porcs.
D'autre part, les engrais minéraux et les amendements calciques et magnésiens ont un rôle (bien que faible) quant aux apports de cuivre sur les sols agricoles (moins de 5 %) (ADEMESOGREAH, 2007).
[57] (consulté en février 2014). http://etm.orleans.inra.fr/webetmqu.htm
EMISSIONS DIFFUSES D'ORIGINE ATMOSPHERIQUE
Les retombées atmosphériques jouent un faible rôle quant aux apports de cuivre sur les sols agricoles (moins de 5 %) (ADEME-SOGREAH, 2007).
Pollutions historiques et accidentelles
FTE 2015 Importer
BASOL[58] est une base de données française sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif. Le site internet de cette base de données permet d'effectuer des recherches par substance : la recherche des sites ou sols pollués (ou potentiellement pollués) par du cuivre aboutit à un résultat de 1 127 localisations en France, dont :
- 61 sites traités et libres de toute restriction,
- 593 sites traités avec surveillance et/ou restriction d'usage,
- 187 sites en cours de travaux,
- 255 sites en cours d'évaluation,
- 31 sites mis en sécurité et devant faire l'objet d'un diagnostic,
- 643 sites ayant abouti à un impact dans les eaux souterraines (teneurs anormales),
- 5 sites ayant abouti à l'arrêt d'un captage AEP[59] .
[58] (consulté en février 2014). http://basol.developpement-durable.gouv.fr/recherche.php
[59] Captage AEP : captage destiné à l'alimentation en eau potable.
Présence environnementale
Atmosphère
FTE 2015 Importer
Nous n'avons pas identifié de données quantitatives sur la présence de cuivre dans l'air en France. La difficulté est que les mesures réglementaires de particules n'isolent généralement pas la contribution en cuivre et que le cuivre ne fait pas partie de la liste des métaux lourds à surveiller dans l'air ambiant en accord avec la Directive 2004/107/EC (l'arsenic, le cadmium, le nickel et le mercure sont visés).
Aquatique
FTE 2015 Importer
Milieux aquatiques
D'après le FOREGS, les teneurs en cuivre total dans les cours d'eau, présentées dans la Figure 14 ci-après, peuvent atteindre 3 µg.L-1 dans la plupart des pays européen.
[61] Forum of European Surveys Geological : (consulté en mars 2014). http://weppi.gtk.fi/publ/foregsatlas/index.php
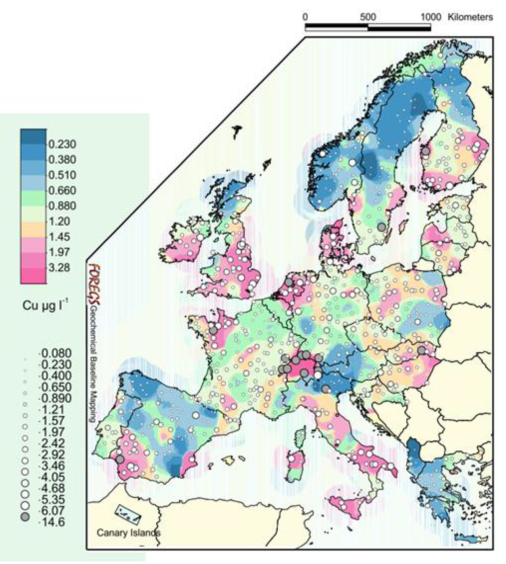
Figure 14. Distribution géographique du cuivre dans les cours d'eau, d'après FOREGS.
D'après FOREGS (2010), en France, la majorité du territoire est concernée par des concentrations dans les eaux inférieure à 1,4 µg.L-1 (valeur de la NQE à la date de rédaction de la rubrique).
Le cuivre est présent dans les eaux douces du bassin Seine Normandie à des concentrations de 3 à 4 µg.L-1 (analyses de 1995 à 2005). Dans les eaux marines le cuivre se retrouve à des concentrations variant de 0,1 à 4 µg.L-1 (Agence de l'eau Seine-Normandie, 2009).
Les matières en suspension des cours d'eau sont fortement chargées en cuivre. Les analyses réalisées dans le bassin de la Seine montrent que le cuivre est présent à des concentrations de 7 à 130 mg/kg. Dans le Rhône, la concentration en cuivre peut atteindre 320 mg/kg (Agence de l'eau Seine-Normandie, 2009).
Sédiments
Les sédiments du bassin de la Seine ont une concentration en cuivre inférieure à 50 mg/kg ps[62] , ceux du canal de la Deûle (62) sont à 380 mg/kg ps et ceux de la Seine en Ile de France varient de 150 à 350 mg/kg ps (analyse de 2001 à 2003) (Agence de l'eau Seine-Normandie, 2009).
Les sédiments des ports français présentent une concentration moyenne en cuivre importante avec 24 mg/kg ps. Au niveau de la Manche-Mer du Nord, les concentrations en cuivre dans les sédiments varient de 18 à 35 mg/kg ps, dans l'Atlantique de 10 à 53 mg/kg ps et dans la Méditerranée 107 à 745 mg/kg ps (Agence de l'eau Seine-Normandie, 2009).
Les Figure 15 et Figure 16 ci-après présentent les teneurs en cuivre dans les sédiments à l'échelle de l'Europe.
[62] ps: Poids sec.
Figure 15. Distribution géographique du cuivre dans les sédiments des plaines alluviales en Europe, d'après FOREGS.
D'après le FOREGS, en France, la majorité du territoire est concernée par des concentrations dans les sédiments des plaines alluviales supérieures à 14 mg/kg.
Figure 16. Distribution géographique du cuivre dans les sédiments des cours d'eau, d'après FOREGS.
D'après le FOREGS, le Sud-est de la France présente des teneurs en cuivre supérieures à 50 mg/kg dans les sédiments des cours d'eau. Au contraire deux zones pauvres en cuivre s'identifient clairement :
- zone nord de l'intersection des bassins versants de la Seine et la Loire ;
- zone entre les bassins versant de la Garonne–Dordogne et de l'Adour.
Terrestre
FTE 2015 Importer
Les teneurs naturelles moyennes en cuivre (à l'état de trace) dans la croûte terrestre varient de 40 à 70 mg/kg. Les valeurs extrêmes relevées dans les roches varient de 80 à 150 mg/kg (IFEN, 2007).
La représentation des teneurs en cuivre dans les sols des couches de surfaces et des couches profondes en Europe est proposée par le FOREGS et présentée dans les Figure 18 et Figure 17 ci-après.
Figure 17. Distribution géographique du cuivre dans les couches superficielles des sols, d'après FOREGS.
D'après FOREGS (2014), en France, les concentrations en cuivre dans les couches superficielles des sols peuvent atteindre 46 mg/kg.
Figure 18. Distribution géographique du cuivre dans les couches profondes du sol, d'après FOREGS.
D'après FOREGS (2014), en France, les concentrations en cuivre dans les couches profondes du sol peuvent atteindre 44 mg/kg.
Les teneurs en cuivre dans les sols (couches profondes et de surface confondues) les plus importantes se retrouvent principalement dans le Sud de la France et l'Ouest de la Bretagne.
Synthèse
Le cuivre a été analysé dans différents compartiments environnementaux. Les résultats sont présentés dans le Tableau 12 ci-après.
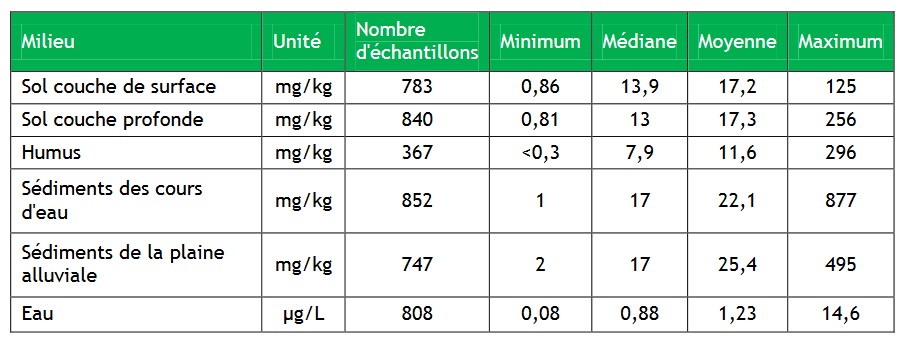
Le nombre d’échantillons pour chacun des milieux est important. Les concentrations en cuivre des milieux à l’échelle de l’Europe sont bien représentées numériquement. Par comparaison des moyennes, les milieux solides les plus pollués sont les sédiments de plaine alluviale avec 25,4 mg/kg, les sédiments des cours d’eau avec 22,1 mg/kg, puis les sols des couches profondes avec 17,3 mg/kg et ceux des couches de surface avec 17,2 mg/kg. La concentration maximale mesurée est de 877 mg/kg (plus de 40 fois supérieure à la valeur moyenne) et se trouve dans des sédiments des cours d’eau. Les 808 échantillons d’eau analysés ont une moyenne de 1,23 μg/L. La valeur maximale mesurée est de 14,6 μg/L, elle correspond à un peu plus de 10 fois la valeur moyenne.
[61] Forum of European Surveys Geological : http://weppi.gtk.fi/publ/foregsatlas/index.php (consulté en mars 2014).
Perspectives de réduction
Réduction des rejets
REDUCTION DES EMISSIONS INDUSTRIELLES
FTE 2015 Importer
ACROISSEMENT DU RECYCLAGE DU CUIVRE
De façon générale, le recyclage du cuivre permet de réduire les émissions de cuivre dans l'environnement et de diminuer l'énergie utilisée pour la production de cuivre. De plus en plus utilisé, son recyclage est très rentable. Cependant quelques difficultés persistent. Le recyclage est passé de 5 à 20 millions entre les années 1960 et 2011.
INTERET DU RECYCLAGE
La demande en cuivre augmente et le coût de la production de cuivre primaire est devenu suffisamment important pour que la filière de recyclage soit financièrement avantageuse. En effet, le cuivre peut être recyclé sans perte de qualité ni de performance. D'après ICSG (2013), il n'existe pas de différence de qualité entre le métal recyclé et le métal issu de l'extraction minière.
LES DIFFICULTES DU RECYCLAGE
Les déchets sont toujours très variables, en composition, en taille et en forme, ce qui complique l'application des procédés métallurgiques et limite le taux de récupération (Techniques de l'ingénieur, 2002b).
La possibilité de recycler le cuivre dépend de la nature parfois complexe des produits en fin de vie. Ces produits peuvent contenir des métaux variés qui rendent très difficile, voire impossible la valorisation du cuivre qu'ils contiennent. Le tri et la collecte sont également importants notamment dans le cas des câbles pour lesquels il faut retirer le fil de cuivre de la gaine constituée éventuellement de tissu, de fils d'acier ou de plomb et/ou d'isolants tel que du caoutchouc ou des matières plastiques.
Une classification européenne pour les débris métalliques non ferreux a été établie en collaboration avec les consommateurs de débris de métaux non ferreux en Europe et d'autres associations nationales et internationales dont l'association américaine des industries secondaires. Cette classification a pour objectif que la catégorisation de ces déchets métalliques soit identique en terme de qualité d'un pays à l'autre (OECD, 1995).
REDUCTION DES EMISSIONS VERS LES MILIEUX AQUATIQUES
RECUPERATION DU CUIVRE DANS LES EFFLUENTS INDUSTRIELS
Différentes techniques permettent le traitement ou la récupération du cuivre présent dans les rejets industriels. Elles sont particulièrement utilisées dans le secteur du traitement de surface des métaux et des matières plastiques.
Selon la teneur de cuivre en solution, il convient de concentrer le cuivre avant de procéder à sa récupération. L'osmose inverse est une technique qui peut concentrer le cuivre en solution. Par la suite, des techniques de récupération du cuivre que sont la précipitation, la cristallisation à froid, l'échange ionique sur résine, l'échange ionique liquide-liquide et l'électrolyse, sont nécessaires.
L'osmose inverseL'osmose inverse[63] permet la récupération de cuivre issu des bains de cuivrage acide et cyanuré. Cette technique permet la réalisation de solutions concentrées en impuretés métalliques pour une élimination ultérieure. La technique fonctionne sous des pressions élevées entraînant une demande énergétique importante (Commission européenne, 2006a).
La précipitation par augmentation du pH
Plusieurs procédés utilisent cette technique de précipitation :
- Le chlorure de cuivre peut être précipité sous la forme d'hydroxyde de cuivre dans une solution alcaline, puis séparé mécaniquement (par filtration ou centrifugation) et évacué en tant que déchet. Cette technique est notamment appliquée dans le secteur des traitements de surface (Commission européenne, 2006a).
- La précipitation du cuivre par ajout d'eau de chaux Ca(OH)2 est suivi d'une floculation et d'une filtration sur sable. Les résidus solides sont ensuite envoyés dans un four à 400°C pour former l'oxyde de cuivre CuO. Cette technique applicable pour le traitement des effluents industriels a été utilisée par exemple par le groupe KME (filiale française de Tréfimétaux qui fabrique des bandes et des rouleaux en cuivre) (Bérut, 2008).
La précipitation par ajout de dithionite de sodium
Dans le cas de cuivre présent sous la forme d'un complexe, parfois utilisé dans les traitements de surface, le cuivre peut être précipité par réduction au moyen d'une solution de dithionite de sodium.
Dans le cas de la présence simultanée de cuivre libre et de cuivre sous la forme de complexe, il est préférable de retirer le cuivre libre préalablement pour précipiter efficacement le cuivre complexé. Le cuivre libre peut être retiré par le procédé éléctrolytique (Commission européenne, 2006a).
[63] L'osmose inverse est la filtration d'ions au travers d'une membrane semi-perméable sous une pression élevée.
L'électrolyse
Le chlorure et le sulfate de cuivre peuvent être recyclés par électrolyse. Le cuivre en solution migre vers la cathode. Le cuivre métal est ainsi récupéré. Ce procédé peut être rentable pour les métaux de transition tels que le cuivre. L'électrolyse engendre des coûts d'investissement et en personnel ainsi que des dépenses d'énergie étant donné le faible rendement du procédé. Cet inconvénient peut être compensé par la revente ou la réutilisation du cuivre (Commission européenne, 2006a).
Le procédé de cellule à lit fluidisé peut être utilisé pour la plupart des métaux. Son coût peut limiter son application. Les unités de traitement peuvent récupérer de 1 à 150 kg/semaine de métal pur. Les solutions traitées de la sorte peuvent être très diluées et contiennent généralement de 100 à 500 ppm de cuivre.
Les coûts habituellement rencontrés pour cette technique sont présentés dans le Tableau 13, ci-après.
Tableau 13. Coûts d'investissement et de fonctionnement habituels pour une cellule électrolytique à lit fluidisé, d'après Commission européenne (2006a).
Au niveau européen, cette technique est appliquée pour la récupération de cuivre notamment par un fabricant de circuit imprimé (Commission européenne, 2006a).
La cristallisation à froid
Les solutions cuivrées d'acide sulfurique-peroxyde peuvent être cristallisées par refroidissement. En effet, l'abaissement de la température de la solution diminue la solubilité des sels métalliques (Commission européenne, 2006a).
Echange ionique sur résine
La technique d'échange ionique sur résine concentre le métal dans la résine. Le métal est ensuite récupéré par libération du métal sous forme dissoute ou par incinération de la résine (le cuivre est alors contenu dans les cendres résiduelles). Cette technique permet de réaliser des solutions concentrées en cuivre avec un rendement de plus de 95 %.
Cette technique est particulièrement rentable pour les métaux à forte valeur ajoutée dont les coûts de traitement sont élevés (Commission européenne, 2006a).
Echange ionique liquide-liquide
La technique d'échange ionique liquide-liquide est mise en place en circuit fermé pour le recyclage des agents d'attaque alcalins (ammoniac) utilisés dans le traitement d'attaque du cuivre métallique des cartes de circuits imprimés avec récupération du cuivre (Commission européenne, 2006a).
Le procédé est le suivant : l'attaque des cartes de circuits imprimés génère une solution de chlorure cuivrique Cu(NH3)4Cl2. Afin de récupérer le cuivre, il est d'abord complexé avec une molécule organique puis extrait par de l'acide sulfurique sous forme de sulfate de cuivre. Le cuivre présent dans la solution électrolytique (dans ce cas : le sulfate de cuivre c'est à dire l'électrolyte) est déposé sur la cathode dans la cellule d'électro-extraction. Ce procédé permet également de régénérer la solution d'attaque chimique d'ammoniac alcalin (Commission européenne, 2006a).
L'investissement pour la réalisation de ce procédé est de 100 000 à 150 000 euros (basé sur l'année 2003). D'après les informations publiées par la Commission européenne (2006a), ce procédé est rentable dès 3 ans d'exploitation grâce à la revente de cuivre de haute qualité, à la diminution du traitement des effluents et du coût de réapprovisionnement de la solution d'attaque chimique.
Ce procédé a d'autres avantages : il permet l'amélioration des conditions de production des cartes de circuits imprimés, notamment par la diminution des transports et de la manipulation des produits chimiques dangereux.
Ce procédé breveté est applicable aux solutions de cuivre alcalin (Commission européenne, 2006a).
Ces différentes techniques qui permettent la récupération industrielle du cuivre en milieux aqueux sont disponibles sur le marché.
TRAITEMENT DU CUIVRE DANS LES EAUX USEES
L'élimination du cuivre dans les stations d'épuration varie en fonction des filières. Les techniques disponibles sont la coagulation-floculation-décantation, la filtration sur sable et sur charbon actif en grain (CAG), la pré-chloration et la décarbonatation. Les techniques de
filtration, notamment sont adaptées aux stations industrielles, mais ne sont pas employées sur les eaux d'origine urbaine pour des raisons techniques et économiques.
La coagulation-floculation-décantation
La coagulation par les sels d'aluminium et de fer peut éliminer le cuivre. L'utilisation du charbon actif en poudre (correspondant à 20 g.m-3) a couramment peu d'influence sur le cuivre comme pour les autres métaux lourds et n'améliore pas significativement l'efficacité du traitement (Degrémont-Suez, 2005).
La filtration sur sable
La filtration sur sable n'élimine par les métaux lourds, elle permet juste de récupérer les flocs encore présents après le passage dans le décanteur (Degrémont-Suez, 2005).
Filtration sur charbon actif en grain (CAG)
La filtration sur CAG permet une réduction du cuivre ionique (Degrémont-Suez, 2005).
La pré-chloration
La chloration combinée à la coagulation-décantation, à la filtration sur sable et à la filtration sur CAG améliore nettement la réduction des métaux lourds (Degrémont-Suez, 2005).
La décarbonatation
La décarbonatation à la chaux réduit notablement les métaux lourds dont le cuivre (Degrémont-Suez, 2005).
Généralement, le rendement d'épuration des métaux est élevé (80 % pour 15 pays européens : European Commission, 2003 and ICON, 2001). En effet, la majorité du cuivre étant sous forme particulaire, les procédés de filtration sont efficaces. Cette filtration peut être précédée d'étapes de chloration et de décarbonatation qui interviennent sur la précipitation du cuivre en Cu(Cl)2 ou Cu(OH)2, ces étapes permettent également un bon rendement d'élimination du cuivre dissous.
Dans le cadre du projet AMPERES[64] , le rendement de STEP urbaines a été estimé.
[64] Analyse de micropolluants prioritaires et émergents dans les rejets et les eaux superficielles.
Deux rendements sont disponibles :
- le rendement de la filière eau traduit la diminution de la concentration entre l'entrée et la sortie de la STEP : il est en moyenne de 83 % pour le cuivre ;
- le rendement d'élimination global prend en compte le flux de micropolluants transférés vers la filière boues et le flux de micropolluants réintroduits dans la filière eau par le retour en tête. Ce rendement permet d'évaluer si la substance est transformée ou simplement stockée dans les boues : il est inférieur à 30 % pour le cuivre (Choubert, 2011).
REDUCTION DES EMISSIONS VERS L'ATMOPHERE
D'après Commission Européenne (2006b), la filtration est une méthode qui permet de réduire les concentrations d'émissions fugitives de métaux, dont le cuivre. Les inconvénients sont le nettoyage des filtres et l'énergie utilisée par le procédé.
Les électrofiltres et les filtres à manches sont utilisés pour extraire les particules des fumées. Les métaux se trouvent généralement dans les particules de petite taille, qui sont plus efficacement éliminer par les filtres à manches que par les électrofiltres (Commission européenne, 2006c).
L'usine Arkema de la zone industrielle de Carling-L'Hôpital (57) utilise un combustible autoproduit sur son site « Lourds Acryliques » pour produire de l'électricité et de la vapeur. Pour réduire les émissions de cuivre à l'atmosphère, des filtres à manches ont été installés pour abattre les poussières (cuivre particulaire notamment) avant les rejets à l'atmosphère. Les mesures effectuées dans l'air ambiant ont permis de constater des émissions de cuivre près dix fois inférieures à l'état antérieur (Lacour-Teitgen et Jantzem, 2013[65] ; Lacour-Teitgen, 2014).
Dans l'atmosphère, le cuivre est essentiellement sous forme particulaire. D'après un fabricant d'installations de traitement des fumées, l'épuration des poussières dans les fumées est d'environ 40 %.
[65] Présentation que Françoise Lacour-Teitgen nous a adressée suite à notre prise de contact.
Alternatives aux usages
FTE 2015 Importer
DANS L'AGRICULTURE
Depuis une vingtaine d'années, des efforts ont été effectués en termes de réduction des émissions de cuivre à la source par l'amélioration de la qualité de certains produits et/ou la réduction des quantités émises. Cela concerne notamment l'ajustement de la fertilisation phosphatée, la diminution des apports en cuivre dans l'alimentation porcine, l'amélioration de la qualité des boues résiduaires urbaines, la réduction des émissions atmosphériques des sources fixes (ADEME-SOGREAH, 2007).
Dans la viticulture, afin de réduire l'impact des traitements, des études de « lessivabilité » des produits cupriques ont été menées. En effet, SUMI AGRO développe depuis plusieurs années une gamme de produits cupriques, destinée à la lutte contre le mildiou qui offre une grande résistance au lessivage par les pluies. Selon le fabricant, le cuivre est sous forme hydroxyde, plus performant que les sels classiques, ce qui permet de réduire la dose de cuivre apportée à l'hectare.
Le programme Européen REPCO (2004-2007) a étudié le remplacement des fongicides au cuivre dans la production des grappes de raisin et des pommes en Europe. En France le GRAB, Groupe de Recherche en Agriculture Biologique a étudié plusieurs pistes pour réduire les quantités de cuivre métal. D'après ce groupe, les pistes existantes sont : la réduction des doses de cuivre, les produits faiblement dosés, l'association de produits alternatifs avec des faibles doses de cuivre et l'amélioration du positionnement des traitements cupriques.
Les produits alternatifs sont : les éliciteurs[66] , les antagonistes[67] , les biostimulants[68] , les fongicides biologiques. Le Tableau 14 ci-après reprend les résultats des études de recherche d'alternative.
[66] Les éliciteurs : molécules appliquées sur les végétaux qui, une fois reconnue vont déclencher (par mimétisme avec des agents pathogènes) un ensemble d'événements qui sont responsables des phénomènes de résistance des ces végétaux.
[67] Les antagonistes sont des bactéries ou des champignons entomopathogènes, dit antagonistes des champignons pathogènes.
[68] Un biostimulant n'est ni un fertilisant ni un pesticide, c'est une substance qui améliore la santé et la croissance de la plante.
Tableau 14. Produits alternatifs aux fongicides classiques, d'après GRAB (2007).
La substance active du Trichodex (ou Trianum) est connue sous le nom de Trichodermia hazernium, cette substance est autorisée et vendue en France notamment par Kopper Fr. Le Mycosin est non homologué en France mais autorisé dans certains pays européens (comme la Suisse) comme intrant destiné à l'agriculture biologique.
Le phosphate de potassium est autorisé en France dans trois produits : Etonan, LBG-01F34 et Pertinan (ACTA, 2014).
D'après GRAB (2007), les produits comme le Trichodex et le Mycosin semblent présenter une efficacité satisfaisante. Cependant, d'un point de vue économique et dans une situation de forte pression de mildiou, le Trichodex montre une efficacité jugée insuffisamment satisfaisante.
Les éliciteurs semblent être une piste intéressante. Leur efficacité semble satisfaisante quand la pression du champignon n'est pas trop forte. En situation normale, l'association d'un éliciteur avec une faible dose de cuivre permet un résultat satisfaisant. Le Chitoplant semble par exemple stimuler les défenses naturelles de la plantes, cependant il s'est avéré phytotoxique.
Des recherches de formulations originales sont à l'étude pour permettre l'utilisation de ce produit.
DANS L'INDUSTRIE
D'après le document de référence recensant les « meilleures techniques disponibles sur les systèmes de refroidissement industriels » rédigé par la Commissions Européenne (2001), dans les systèmes de refroidissement, les échangeurs de chaleur, les conduites, les pompes, … sont, entre autres, réalisés en cuivre ou dans un des alliages à base de cuivre.
Ces produits sont utilisés notamment dans les centrales thermiques qui utilisent parfois des eaux fluviales ou marines comme sources de refroidissement. Pour ces usages, l'utilisation de produits et/ou de canalisations en cuivre permet de réduire la prolifération des algues et de certaines bactéries dans le système de refroidissement.
De plus, afin de réduire les émissions de cuivre dues à la corrosion de ces produits, l'utilisation de ce métal peut être remplacée par celle d'une gamme de matériaux, qui, par ordre croissant de résistance, sont :
- l'acier au carbone ;
- l'acier galvanisé ;
- l'alliage d'aluminium ;
- le laiton ;
- l'acier inoxydable ;
- le titane.
Le choix des matériaux alternatifs portera sur les critères suivants : la résistance à la corrosion, la résistance à l'érosion mécanique et à la pollution biologique.
Outre l'acier inoxydable, parmi les matériaux ayant une résistance égale ou supérieure à celle de l'alliage de cuivre, il existe :
L'alliage d'aluminium
Des échangeurs thermiques constitués d'alliages d'aluminium, sont proposés à l'échelle industrielle, par exemple les unités de dessalement de l'eau de mer (Techniques de l'ingénieur, 1995). En effet, dans un environnement corrosif (tel que l'eau de mer), le cuivre se corrode facilement.
Dans un environnement moins réducteur, l'inconvénient des installations constituées d'alliages d'aluminium est que la stérilité biologique n'est plus assurée, contrairement à celles constituées de cuivre.
Le titane
Outre sa forte résistance à la corrosion, même dans de l'eau extrêmement polluée, ce matériau présente plusieurs avantages :
- il est possible d'utiliser des tuyaux extrêmement minces ;
- la conductivité de la chaleur est excellente ;
- le matériau est bien adapté à la réutilisation ;
- la durée de vie probable du matériau est longue.
Cependant, la prolifération biologique est plus importante qu'avec des matériaux contenant du cuivre. Il nécessite donc une utilisation supplémentaire de biocides. Un autre inconvénient est que le titane peut difficilement être utilisé dans un environnement réducteur car aucune couche protectrice d'oxyde ne se forme.
Quoiqu'il en soit, la substitution du cuivre par le titane est limitée par le coût de ce matériau alternatif. La Figure 19 ci-après montre les variations du coût du titane entre 1992 et 2014.
Figure 19. Coût du titane en dollars US par livre US, d'après l'INSEE[69] .
Après avoir fortement augmenté entre 2003 et 2005, le titane est redescendu entre 3 et 4 dollars US la livre US.
[69] Institut National des Statistiques et des Etudes Economiques : (consulter en juin 2014). http://www.bdm.insee.fr/bdm2/affichageSeries.action?periodeDebut=1&anneeDebut=1992&periodeFin=7&anneeFin=2014&page=graphique&recherche=idbank&codeGroupe=298&idbank=000852060
ALTERNATIVE AU CUIVRE DANS LE SECTEUR DES TRANSPORTS
Le cuivre est de plus en plus utilisé dans le secteur des transports en raison de sa bonne conductivité électrique (ECI, 2007) : dans les voitures (dans les systèmes de freinage et dans les dispositifs électroniques embarqués) et dans les trains à grande vitesse (dans les moteurs et dans les caténaires). Les performances qu'il permet de réaliser ne favorisent pas sa substitution.
Néanmoins, les alternatives proposées sont détaillées ci-après pour les voitures et pour les trains.
DANS LES VOITURES
Les plaquettes de freins
Le décret 2002-258 (transcription en droit français de la directive amiante et véhicules automobiles), précise l'interdiction de vente de véhicules équipés de plaquettes de frein en amiante (Chambre Régionale de Métiers de Basse-Normandie, 2003). Suite à cette interdiction, les fibres artificielles métalliques de cuivre ont été utilisées (embrayages, isolateurs électriques, joints) (INRS, 2003).
Les plaquettes de freins actuelles sont composées de deux éléments : le socle en tôle d'acier et le matériau de friction. Le cuivre est contenu dans la garniture de friction[70] : il a une fonction technique (Techniques de l'ingénieur, 1990).
Les fibres de substitution au cuivre validées techniquement sont les fibres minérales (fibres de verre, de carbone, de céramique, de bore et de silice), les fibres organiques (fibres aramides), les fibres naturelles (le sisal et le coton), les fibres synthétiques (polyamides) et les fibres métalliques (fils d'acier) (Techniques de l'ingénieur, 1990).
[70] Les garnitures de friction sont composées de liants, de fibres de renforcement (anciennement l'amiante et plus récemment des fibres synthétiques, des fibres métalliques (dont le cuivre) et les fibres de verres) et les charges diverses (Techniques de l'ingénieur (1990). Technologie du freinage. b5571: 11.
DANS LES TRAINS
Les moteurs
Pour concevoir des trains modernes, les moteurs en cuivre sont de plus en plus employés. Le train à très grande vitesse espagnol « Velaro » (Siemens) comporte par exemple entre 3 et 4 tonnes de cuivre notamment en raison d'un nombre important de moteurs assurant la traction du train (16 moteurs), alors qu'un train classique en compte 1 à 2 tonnes de ce métal (ECI, 2007).
Les caténaires
Une caténaire est constituée d'un ensemble de câbles porteurs et d'un ensemble de câbles conducteurs destinés à l'alimentation des trains électriques par captage du courant. Les câbles porteurs sont en bronze ou en aluminium/acier et les câbles conducteurs sont en cuivre-cadmium. Cet alliage de cuivre est utilisé principalement comme conducteur électrique dans les lignes électriques, les caténaires, les fils de contact pour traction électrique du fait de sa résistance mécanique élevée. En effet, le cuivre-cadmium[71] a une plus grande résistance mécanique que le Cu/Al. Celui-ci est un cuivre à oxydules[72] ayant subi une ultime purification par électrolyse dans laquelle on retrouve les impuretés H2O et les oxydules Cu2O qui se sont formées lors de la fusion des cathodes purifiées et de leur coulées en produits utilisables (plaques, lingots…) (Techniques de l'ingénieur, 1981).
La résistance des câbles inférieurs des caténaires constitués d'un alliage de cuivre et de magnésium permet d'assurer des vitesses de 400 km/h contre 160 km/h pour les trains classiques. L'autre avantage de ces câbles est que leur durée de vie serait 4 fois supérieure à celle des câbles classiques (ECI, 2007).
D'autres recherches (n'ayant pas encore abouties du point de vue opérationnel) confirment l'avenir du cuivre : elles portent sur la possibilité d'élaborer de nouveaux câbles faits d'alliage de cuivre-chrome-zirconium qui assureraient des résistances à la tension et des durées de vie encore plus intéressantes (ECI, 2007).
Le développement de voitures hybrides et de trains à grande vitesse ne favoriserait pas la substitution du cuivre dans le secteur des transports.
[71] Le cuivre au cadmium a une concentration de 0,7 à 1% de cadmium.
[72] Les oxydules sont des globules d'oxyde dans le métal. Il existe deux types principaux de cuivre pur l'un avec 0,02 à 0,06 % d'oxygène (sous forme de globules d'oxydes, Cu2O) et l'autre sans oxygène.
ALTERNATIVE AU CUIVRE DANS LE SECTEUR DE L'ELECTRICITE ET DES TECHNOLOGIES DE L'INFORMATION
Le cuivre pour les fils et câbles électriques peut être substitué par les matériaux présentés dans le Tableau 15 ci-après.
Tableau 15. Substitution du cuivre dans le secteur de l'électricité et de la communication, d'après les Techniques de l'ingénieur (1995).
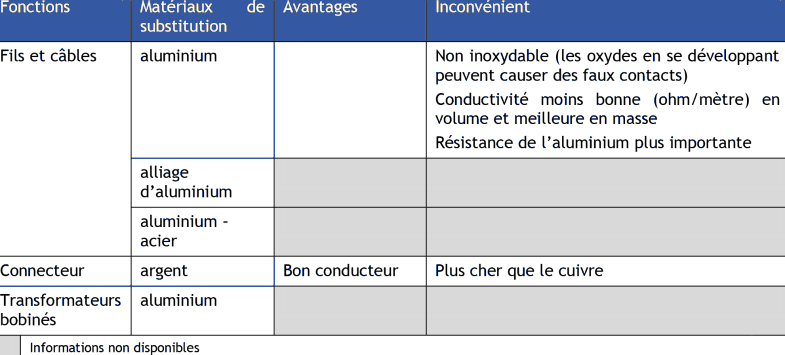
L'utilisation du cuivre dans le secteur électrique provient du fait que c'est un très bon conducteur de l'électricité.
L'aluminium est un métal disponible en grande quantité. Il est déjà utilisé pour les lignes hautes tensions et pour les câbles 230 V de distribution d'EDF.
L'association canadienne de développement du laiton et du cuivre CCBDA (2010) a étudié la possibilité de substituer le cuivre par de l'aluminium dans les raccords des câbles.
Les conditions de corrosion cyclique et d'éclatement sous courant de forte intensité ont permis de mettre en avant que la meilleure performance obtenue après 200 h d'essai est obtenue grâce au système « tout cuivre » (CCBDA, 2010).
ALTERNATIVE AU CUIVRE DANS LE SECTEUR DU BATIMENT
TOITURE
Le cuivre est utilisé dans les toitures pour le revêtement complet par la jonction de tôle de cuivre.
Les solutions alternatives au cuivre sont beaucoup moins couteuses. En effet, la réalisation d'une toiture neuve avec un recouvrement de toiture en cuivre reviendrait à 120 €/m2 alors qu'un recouvrement de toiture en zinc reviendrait à environ 90 €/m2 . Néanmoins, le zinc[73] est également visé par des plans d'actions sur les micropolluants. Ce matériau est donc difficilement envisageable comme substitut au cuivre.
Une autre solution rapportée pour substituer le cuivre dans les toitures consiste en l'emploi d'autres matériaux tels que les bardeaux d'asphalte, de bois, de plastique et de fibres de verre, les tuiles de plastique, les tuiles de béton, ...
Cependant, il est important de mentionner que ces alternatives peuvent avoir un impact sur l'environnement plus important que le cuivre. En effet, l'asphalte contient par exemple des HAP, et les matériaux plastiques peuvent également libérer des composés chimiques indésirables.
Les autres couvertures de toiture sont également moins chères que le cuivre, il en va ainsi des tuiles de terre cuite (50 à 60 €/m2), des ardoises naturelles (environ 110 €/m2), des tôles ondulées (environ 45 €/m2) et des tuiles Sneldek (environ 30 €/m2)[74] .
[73] Une fiche technico-économique sur le zinc est disponible sur le site http://www.ineris.fr/substances/fr/.
[74] Les prix indicatifs de toitures et zingueries viennent du site : . http://www.livios.be/fr/_build/_guid/_roov/492.asp?content=Prix%20indicatifs%20toiture%20et%20zinguerie
CHAUFFAGE
Le chauffage électrique est moins cher à l'installation qu'un système au fuel ou au gaz, car il contient moins de cuivre. En effet, le système électrique ne nécessite pas de canalisations pour la circulation de l'eau chaude telles que celles nécessaire à un système classique de chauffage central.
CANALISATION D'ADDUCTION D'EAU POTABLE
En réponse aux problèmes de santé publique soulevés par le saturnisme, la réglementation en vigueur imposait le remplacement complet des canalisations vétustes contenant du plomb d'ici 2013.
Ces tuyaux sont de plus en plus remplacés par des plastiques[75] ou bien par du cuivre.
D'après le centre d'information du cuivre (2010), par ses caractéristiques techniques et sanitaires et environnementales, le cuivre est le substitut adéquat. En effet, ses propriétés bactéricides, algicides et fongicides réduisent la présence des micro-organismes indésirables dans l'eau.
A titre d'exemple, d'après le CSTB (2007), les systèmes de canalisations de distribution d'eau en polyéthylène (PE-Xb[76]) ont une durée de vie équivalente aux systèmes traditionnels.
[75]
[76] Le PE-Xb est un polyéthylène réticulé. Dans son appellation, le PE signifie polyéthylène et le Xb signale qu'il est réticulé selon la méthode «B » (il existe 4 méthodes différentes de réticulation).
D'après le centre d'information du cuivre (CICLA, 2010b), le coût des installations sanitaires et de chauffages avec des tubes de cuivre est d'un niveau comparable, voire inférieur à celui des installations réalisées avec d'autres matériaux de canalisations.
ALTERNATIVE AU CUIVRE DANS LES ECHANGEURS THERMIQUES
D'après les Techniques de l'ingénieur (Techniques de l'ingénieur, 1995), les matériaux de substitution pour les conditionneurs d'air, convecteurs, radiateurs, échangeurs divers sont l'alliage d'aluminium et l'association d'acier inoxydable et aluminium. Le choix du matériau est contraint par sa capacité à transmettre la chaleur.
Les canalisations des systèmes de récupération de chaleur peuvent aussi être remplacées par des canalisations neuves en acier inoxydables (Commission européenne, 2001).
AUTRES SECTEURS
ALTERNATIVES AU CUIVRE DANS LES USTENSILES DE CUISINE
L'inox, l'aluminium et la fonte sont des alternatives au cuivre utilisées pour les ustensiles de cuisine.
ALTERNATIVES AU CUIVRE DANS LES TEXTILES
Dans les textiles, selon nos informations, l'utilisation du cuivre ne peut être facilement substituée pour les cas précisés ci-après. En effet, d'après la Commission européenne (2003a), dans le secteur industriel des textiles, les meilleures techniques disponibles sont les suivantes :
- le sulfate de cuivre est utilisé pour dissoudre la cellulose de la pate à bois[77] ;
- le sulfate de cuivre forme avec certains colorants azoïques des complexes métalliques ayant une meilleure résistance à la lumière ;
- le cuivre est également utilisé en tant que catalyseur qu'il convient ensuite d'éliminer des tissus.
[77] Dans l'industrie textile, deux catégories de fibres sont utilisés : les naturelles et les chimiques. Les fibres chimiques regroupent à la fois les matières purement synthétiques d'origine pétrochimique et les matières cellulosiques régénérées fabriquées à partir de fibres de bois.
ALTERNATIVES AU CUIVRE DANS LA PROTECTION DU BOIS
Les composés du cuivre principalement utilisés dans la protection du bois sont l'oxyde de cuivre, le carbonate de cuivre. Ils sont considérés comme des alternatives possibles à la créosote. Néanmoins, selon l'INERIS (2012), il existe d'autres alternatives (substances autorisées par la directive biocides) :
- l'acide borique ;
- le tebuconazole ;
- le propiconazole.
Conclusion
FTE 2015 Importer
Le cuivre est un métal de transition et un oligoélément. Présent naturellement dans la croûte terrestre, il est extrait majoritairement des minerais soufrés. En France, il n'y a pas de gisements exploités.
La production mondiale de cuivre augmente chaque année pour répondre à la demande industrielle. En Europe, le recyclage des produits cuivrés représente près de la moitié de la production du cuivre. Les secteurs d'utilisations du cuivre, de ses alliages et de ses composés sont nombreux : électrique, électronique et communication (câbles et fils), bâtiment (canalisations et toitures), transport (freins et caténaires), agriculture (fongicides, insecticides, herbicides, molluscicides), catalyseurs ou additifs (industrie du caoutchouc, pétrolière, etc.). Ils se retrouvent dans des produits tels que les pigments, les peintures, les cellules photovoltaïques des panneaux solaires, les puces de l'industrie des semi-conducteurs et dans les produits de consommations courantes tels que les chaudronneries et les pièces de monnaie.
Les milieux les plus exposés au cuivre en France sont les sols et les eaux du fait des activités agricoles et industrielles. Dans une moindre mesure, l'air est également exposé du fait du trafic routier et ferroviaire. Dans l'Union Européenne, les émissions vers l'eau, le sol et l'air représentent respectivement 43 %, 15 % et 13 %.
Le cuivre est utilisé en substitut à d'autres substances dans de nombreuses applications telles que le plomb dans les canalisations et l'amiante dans les systèmes de freinage. La hausse du prix du cuivre favorise les industriels à le substituer et à le recycler. Le recyclage a déjà en Europe une place importante dans la filière de production du cuivre (41 % en 2007).
Le cuivre peut être substitué dans nombre de ses applications, comme en agriculture où des traitements alternatifs sans composés de cuivre existent. Pour d'autres applications, le cuivre peut être substitué ou associé à d'autres métaux ou alliages, tels que le titane, l'aluminium, l'acier.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :