Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Tungstène (7440-33-7)
Informations générales
Dernière vérification le 26/03/2024
Identification
Numero CAS
7440-33-7
Nom scientifique (FR)
Tungstène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-143-9
Code SANDRE
2797
Numéro CIPAC
-
Formule chimique brute
\(\ce{ W }\)
Code InChlKey
Code SMILES
[W]
Familles
Familles chimiques
Toxicologie
Dernière vérification le 26/03/2024
Introduction
FDTE/VTR Importer Le tungstène est un minerai extrait de mines souterraines qui est utilisé dans de très nombreuses applications industrielles, militaires et médicales notamment en raison de son extrême dureté et de son point de fusion élevé. C’est un métal de transition utilisé sous sa forme pure, ou sous forme de composés ou d’alliages parmi lesquels des composés solubles et d’autres peu ou pas solubles.
Du point de vue toxicologique, la forme la plus étudiée est le tungstate de sodium qui est un composé soluble. Les données relatives aux formes insolubles sont limitées mais semblent montrer une moins grande toxicité probablement liée à la disponibilité.
TOXICITE DES NANOPARTICULES DE TUNGSTENE
Pour le tungstène comme les autres métaux, la taille nanométrique (diamètre aérodynamique moyen inférieur à 100 nm) des particules présente des caractéristiques physico-chimiques spécifiques, avec en particulier une réactivité de surface bien supérieure à celle des particules de taille micrométrique, qui peuvent potentiellement influencer leur toxicité.
Les études réalisées avec ces nanomatériaux ne sont pas abordées dans cette rubrique. Néanmoins, on peut retenir que les nanoparticules tungstène métal, carbure de tungstène et disulfure de tungstène de taille nanométrique paraissent relativement inertes au regard des résultats obtenus à partir des tests in vitro de viabilité cellulaire, alors que les nanoparticules WC et WS2 sont en revanche capables de déclencher un stress oxydatif.
Par ailleurs, des travaux supplémentaires s’imposent afin d’élucider les premiers résultats équivoques de mutagénèse obtenus avec des nanoparticules de trioxyde de tungstène, ou encore confirmer à partir de modèles animaux in vivo les effets neurotoxiques du carbure de tungstène observés in vitro (Lemus et Venezia, 2015).
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation :
Le passage sanguin de la fraction alvéolaire des particules de tungstène n’a pas été quantifié, mais semble suffisamment important pour entraîner une augmentation des concentrations de tungstène dans le sang, les urines, les cheveux ou les ongles chez les ouvriers employés dans les industries du tungstène ou des métaux durs (De Palma et al., 2010 ; Nicolaou et al., 1987).
Voie orale :
Chez l’homme, l’absorption digestive serait d’environ 66 % (composés du tungstène non précisés) (ATSDR, 2005).
Voie cutanée :
L’absorption par voie cutanée n’a pas été étudiée chez l’homme ou l’animal. Néanmoins, des études in vitro utilisant un liquide de transpiration artificiel suggèrent que les composés solubles ou non du tungstène ne sont pas absorbés par voie cutanée (Lemus et Venezia, 2015).
Distribution
FDTE/VTR Importer Après inhalation, la distribution n’a pas été particulièrement étudiée chez l’humain, même si la présence de tungstène dans différents compartiments (sang, urine, cheveux, ongles) atteste de sa répartition dans l’organisme. L’ingestion accidentelle par un jeune homme de tungstène métallique présent dans une boisson a permis d’observer que celui-ci se distribue dans le sang, les urines, les cheveux et les ongles (Marquet et al., 1997). Aucune étude chez l’homme ou l’animal n’a été identifiée, pour la distribution par voie cutanée. Enfin, dans le cas particulier des dispositifs médicaux (stent, cathéters, implants prosthodontiques et orthopédiques) plusieurs publications ont montré la dissolution progressive intracorporelle de tungstène, avec diffusion dans le sang, en raison principalement de la faible résistance à la corrosion du métal pur dans les solutions aqueuses (Idil et Donaldson, 2018). De même, le tungstène antérieurement déposé et accumulé dans l’os peut être à distance de l’exposition initiale lentement libéré dans le sang, avant d’être éliminé principalement par les urines (ATSDR, 2005).
Métabolisme
FDTE/VTR Importer L’ion tungstène n’est pas connu pour être métabolisé (ATSDR, 2005).
Élimination
FDTE/VTR Importer Chez l’homme, la cinétique d’excrétion urinaire du tungstène, voie principale d’élimination, observée en milieu professionnel ou dans le cas d’ingestion contrôlée ou accidentelle n’a pas été quantifiée (ATSDR, 2005). Néanmoins, les concentrations urinaires en début et fin de poste peuvent respectivement passer de 4,20 à 7,06 µg.L-1 (De Palma et al., 2010). Des traces de tungstène ont été dosées dans les urines (2 à 13 µg/24 h) et les fèces (1,6 à 5,7 µg/24 h) de jeunes hommes « sains » pour un apport alimentaire estimé (forme non précisée) entre 8 et 12 µg/24 h (Wester, 1974).
L’ingestion de formes insolubles du tungstène conduit à une élimination majoritairement fécale (ATSDR, 2005).
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation :
Chez le rat, de récentes études par inhalation de composés solubles (tungstate de sodium, valence IV) ou non (oxyde de tungstène bleu, valence (mixte V et VI) du tungstène confirment que les deux formes sont facilement absorbées par voie pulmonaire (Radcliffe et al., 2009 ; Radcliffe et al., 2010 ; Rajendran et al., 2012). Chez le chien, l’absorption pulmonaire d’un aérosol d’oxyde de tungstène a été estimée à environ 33 %, une fraction supplémentaire de 14 % serait absorbée secondairement par voie gastro-intestinale suite à l’élimination pulmonaire par clairance mucociliaire (ATSDR, 2005).
Voie orale:
Chez l’animal, les études réalisées essentiellement à partir de l’administration de tungstate de sodium dans l’eau de boisson mentionnent des taux d’absorption de 92 % chez le rat, et 55 à 65 % chez le chien, selon les doses et durées d’expositions (Le Lamer et al., 2000 ; Poucheret et al., 2000).
Voie cutanée :
L’absorption par voie cutanée n’a pas été étudiée chez l’homme ou l’animal. Néanmoins, des études in vitro utilisant un liquide de transpiration artificiel suggèrent que les composés solubles ou non du tungstène ne sont pas absorbés par voie cutanée (Lemus et Venezia, 2015).
Distribution
FDTE/VTR Importer Après administration de tungstène radio-marqué (181WO3) chez le chien, la demi-vie d’élimination pulmonaire est triphasique (4 heures (70 %), 20 heures (20 à 23 %) et 6,3 jours (environ 5 %)). Les concentrations les plus élevées sont mesurées dans l’os (37 %), les poumons (31 %), les reins (15 %), le foie (9,7 %) et les muscles (5,7 %) (Aamodt, 1975). Chez le rat, le profil de distribution est sensiblement similaire, avec des concentrations de tungstène particulièrement élevées au niveau des poumons, des os (fémur) et les reins, les concentrations au niveau de la rate ou de la thyroïde étant plus faibles (Radcliffe et al., 2010 ; Rajendran et al., 2012). De récents travaux ont également montré que le transport olfactif jouait un rôle minime dans la distribution du tungstène vers le cerveau (Radcliffe et al., 2009).
Les études animales (rat, souris) confirment que les composés solubles du tungstène atteignent rapidement la circulation générale et sont distribués dans tout l’organisme. Après 24 heures d’une administration unique par gavage (1 à 100 mg.kg-1), pratiquement tout le tungstène sanguin est associé à la fraction plasmatique (McDonald et al., 2007) ; les plus fortes concentrations sont mesurées au niveau du tractus gastro-intestinal, suivi par la rate, les reins, la peau et le squelette, ou encore selon les études également au niveau de l’utérus. Environ 100 jours après le traitement, la concentration de tungstène concentrée au niveau du squelette ne dépasse pas 0,4 % de la dose administrée (ATSDR, 2005). Le cerveau semble relativement protégé après une exposition par voie orale (62,5 à 200 mg-1.kg-1.j-1 pendant 28 jours) de composés solubles du tungstène (0,11 mg.kg-1 dans le cerveau versus 61 à 63 mg.kg-1 dans les os) (Guandalini et al., 2011).
La distribution de formes solubles du tungstène varie selon les espèces (rapport de la concentration de tungstène rat/souris de 25, 20 et 0,15 respectivement dans les fémurs, les reins et l’utérus) et l’état de gestation ou non des femelles (Weber et al., 2008).
Plusieurs études d’exposition par voie orale chez l’animal ont montré que le tungstène passe la barrière placentaire ; les concentrations fœtales chez la souris sont à doses comparables 8 fois plus importantes que chez les fœtus rat (Weber et al., 2008). Après la naissance, les concentrations les plus importantes de tungstène se retrouvent au niveau des os et du tractus gastro-intestinal (McInturf et al., 2011).
Aucune étude chez l’homme ou l’animal n’a été identifiée, pour la distribution par voie cutanée.
Métabolisme
FDTE/VTR Importer L’ion tungstène n’est pas connu pour être métabolisé (ATSDR, 2005).
Élimination
FDTE/VTR Importer Chez l’animal, l’excrétion du tungstène, indépendamment de la voie d’exposition, est principalement rénale. Chez le rat, une cinétique triphasique est décrite avec des demi-vies de 10 heures, 44 et 1 100 jours (Baud et Garnier, 2017). L’ingestion de formes insolubles du tungstène conduit à une élimination majoritairement fécale (ATSDR, 2005).
Autre
FDTE/VTR Importer Mécanisme d'action :
Le tungstène peut inhiber les enzymes activées par le molybdène en se substituant à ce dernier, les rendant non ou partiellement fonctionnelles. Dans différentes espèces animales (rat, poulet, chèvre, vache), il diminue les activités de la sulfite-oxydase et de la xanthine-oxydase, augmentant la sensibilité de l’exposition aux sulfites et au SO2 (ATSDR, 2005).
Le tungstène, de la même manière que le molybdène, peut se substituer au phosphate dans l’os (NTP, 2003).
Des études in vivo (Sachdeva et al., 2013) et in vitro (Stefaniak et al., 2009) suggèrent également un mode d’action des composés solubles ou peu solubles du tungstène impliquant la formation d’espèces radicalaires oxygénées.
Synthèse
FDTE/VTR Importer Le tungstène est absorbé par inhalation et par voie orale. Les formes solubles semblent être mieux absorbées. Une fois absorbé, il se distribue dans tout l’organisme préférentiellement dans les os et les reins et passe la barrière placentaire. Il n’est pas métabolisé et est éliminé par voie urinaire. Dans l’organisme, le tungstène peut inhiber les enzymes activées par le molybdène en se substituant à ce dernier, les rendant non ou partiellement fonctionnelles. Le tungstène, de la même manière que le molybdène, peut se substituer au phosphate dans l’os. Un mode d’action des composés solubles ou peu solubles du tungstène impliquerait la formation d’espèces radicalaires oxygénées.
Equivalents biosurveillance
Description
FDTE/VTR Importer Valeurs dans la population générale :
Des concentrations sériques de 6 µg.L-1 (30nM) et urinaire de 0,21 µg.L-1 (1,1 nM) de tungstène ont été rapportées chez des sujets sains non exposés. Aux Etats-Unis, la concentration urinaire de tungstène est en moyenne de 0,085 µg.L-1 (IC95 % [0,077 – 0,093] (n=2338 personnes de plus de 6 ans).1,1 nM (Haneke et al., 2003).
Chez l’adulte, des concentrations en tungstène ont été mesurées dans l’os (14 nmoles.kg-1), les cheveux (87 nmoles.kg-1), le plasma (< 0,7 mg.L-1), le sérum (< 0,07 mg.L-1), la peau (0,14 à 0,87 µmoles.kg-1), l’émail dentaire (1,31 µmoles.kg-1) (Haneke et al., 2003).
Toxicité aiguë
Chez l'homme
Voie orale
FDTE/VTR Importer Seul un cas possible d’intoxication aigue au tungstène est rapporté dans la littérature. Un militaire français âgé de 19 ans a présenté des convulsions 15 minutes après avoir ingéré 250 mL d’un vin (contaminé par environ 385 mg de tungstène métal) qui avait séjourné dans un canon fraichement utilisé ; au décours de cet épisode, il a développé une insuffisance rénale due à une nécrose tubulaire ; il a finalement guéri sans séquelles ; des concentrations élevées de tungstène dans le sang et les urines du patient ont été retrouvées. La responsabilité du tungstène dans la genèse des troubles observés est incertaine et, en particulier, une intoxication associée au composé nitré utilisé comme amorce n’a pas été éliminée (Baud et Garnier, 2017).
Synthèse
FDTE/VTR Importer Le tungstène métal, de même que les composés du tungstène (solubles ou non) présentent globalement une faible toxicité aiguë. Différents composés solubles ou non du tungstène ne présentent pas d’effet d’irritation cutanée, oculaire ou de sensibilisation cutanée.
Chez l'animal
Voie orale
FDTE/VTR Importer Les principales DL50 sont synthétisées dans le tableau ci-dessous (ATSDR, 2005 ; Haneke et al., 2003)
Le tungstène métal, de même que ses composés présentent globalement une faible toxicité aiguë. Les valeurs de DL50 sont généralement plus élevées pour les composés peu ou pas solubles (DL50 11 300 mg.kg-1 pour le phosphotungstate de sodium) que pour les composés solubles (DL50 entre 1 000 et 2 000 mg.kg-1 pour le tungstate de sodium) pour une même voie. La mort est généralement précédée d’une hémorragie gastrique, d’un dysfonctionnement cardiovasculaire et d’une paralysie (Santé Canada, 2018).
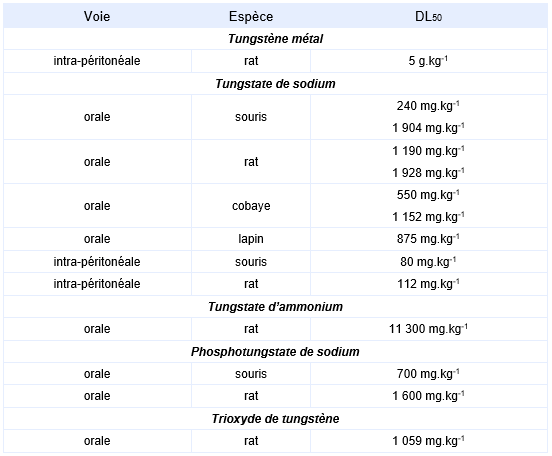
L’administration orale d’une dose massive de tungstate de sodium est suivie de tremblements et d’une dépression du système nerveux central, susceptible d’entraîner la mort des animaux au-delà de 780 mg.kg-1 (ATSDR, 2005).
A la dose 238 mg.kg-1.j-1 de tungstate de sodium (soit 148 mg W.kg-1.j-1) administrée 15 jours par voie orale, une augmentation de la concentration plasmatique des transaminases hépatiques (ALAT et l’ASAT), accompagnée de l’augmentation significative de la concentration d’espèces réactives de l’oxygène a été décrite (Sachdeva et al., 2013). A cette même dose, la toxicité rénale s’est manifestée chez les mâles uniquement par une augmentation significative de l’urée plasmatique (Sachdeva et al., 2013).
Voie cutanée
FDTE/VTR Importer Différents composés solubles ou non du tungstène ne présentent pas d’effet d’irritation cutanée, oculaire ou de sensibilisation cutanée (Lemus et Venezia, 2015).
Les effets de l’exposition aiguë par voie cutanée reposent sur une seule étude où des lapins ont été traités par une dose unique de 100, 200 ou 1 000 mg.kg-1 de chlorure de tungstène (étude non publiée de Dow Chemical Company, 1982 rapportée dans ATSDR, 2005). Les animaux (2 par dose) n’ont pas survécu aux deux plus fortes doses, une dermatose de contact a été décrite à la plus faible dose.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
FDTE/VTR Importer EFFETS CARDIO-VASCULAIRES :
Plusieurs études réalisées sur de larges cohortes nationales américaines (NHANES 1999-200 ; 1999-2006 ; 1999-2010 ou 2006-2007) ont recherché des liens possibles entre les concentrations urinaires de tungstène et le risque de pathologies cardiovasculaires (Agarwal et al., 2011 ; Mendy et al., 2012 ; Navas-Acien et al., 2004 ; Tyrrell et al., 2013). Si des associations positives ont été rapportées avec le risque de maladies cardio- et/ou cérébro-vasculaires dans les études d’Agarwal et al., en 2011 (OR 1,78 ; IC95% [1,28 – 2,48]) ou de Tyrrell et al. en 2013 (OR 1,53 ; IC95% [1,14 – 2,05]), les auteurs soulignent que des liens bien supérieurs ont été observés avec d’autres métaux durs comme le cobalt, le cadmium ou le plomb. De plus en raison du grand nombre de liens testés dans ces études, le risque de faux positifs est élevé. A noter également que la source d’exposition au tungstène n’a pas été identifiée.
Les derniers résultats issus d’une cohorte de 2 726 indiens d’Amérique n’ont pas mis en évidence d’association significative entre les concentrations urinaires de tungstène et la prévalence des maladies cardiovasculaires, en raison semble-t-il d’une association avec des concentrations urinaires élevés de molybdène (Nigra et al., 2018).
EFFETS HEPATIQUES :
Le plus souvent, aucune toxicité hépatique n’a été rapportée chez les hommes ou femmes présentant des concentrations urinaires de tungstène élevées (OR 0,64 ; IC95% [0,27 – 1,54)]) (Mendy et al., 2012).
EFFETS RENAUX:
Aucune donnée n’a été identifiée chez l’homme.
EFFETS HEMATOLOGIQUES:
Aucune donnée n’a été identifiée chez l’homme.
EFFETS IMMUNOLOGIQUES ET OSSEUX :
En milieu industriel, c’est le cobalt seul qui est responsable des maladies allergiques cutanées (urticaires, eczémas) et pulmonaires (rhinites et asthmes) lors de l’exposition répétée aux poussières de carbures métalliques frittés.
Néanmoins, un cas de sensibilisation et d’asthme professionnel au tungstène a été rapporté (Baud et Garnier, 2017).
Un cluster de cas de leucémies lymphoblastiques aiguës décrit chez des enfants vivant dans la région de Fallon au Nevada, où des niveaux élevés de tungstène dans l’environnement ont été identifiés, a conduit plusieurs équipes à intensifier leurs recherches sur la déposition du tungstène dans la moelle et le tissu osseux.
EFFETS NEUROLOGIQUES :
Les effets possibles de l’association entre la sévérité de l’autisme chez l’enfant et les concentrations urinaires de tungstène ont été recherchés dans une étude réalisée sur 54 cas et 44 sujets témoins appariés (sexe et âge) (Adams et al., 2013). Si la concentration de tungstène était significativement plus élevée dans le groupe d’enfants malades par comparaison au groupe témoin (44 %, p = 0,0005), d’autres métaux comme le plomb (74 %, p = 0,02), le thallium (77 %, p = 0,0001) ou l’étain (115 %, p = 0,01) ont également été identifiés. Les limites de cette étude (taille des échantillons, médication des enfants autistes, etc.) ne permettent pas de conclure.
EFFETS ENDOCRINIENS :
Dans une étude réalisée sur la population générale américaine incluant 1 587 sujets (étude NHANES entre 2007 et 2008), seule une association entre les concentrations urinaires de tungstène et l’augmentation sérique de TSH (impliquée dans la fonction thyroïdienne) a été décrite (Christensen, 2013). A, l’inverse, de nombreux autres métaux (cobalt, plomb, mercure, etc.) ont été associé à une diminution de la concentration sérique de TSH. Dans la même cohorte, aucune association entre le tungstène et des problèmes thyroïdiens n’a été observée (Mendy et al., 2012).
Inhalation
FDTE/VTR Importer EFFETS SYSTEMIQUES GENERAUX :
Les informations disponibles chez l'homme se limitent à l'exposition professionnelle aux poussières contenant du carbure de tungstène en association avec d’autres métaux tel que le cobalt dans l'industrie des métaux durs. Il est généralement admis que les effets systémiques observés chez les salariés (maladie des métaux durs caractérisée par une rhinite spasmodique, de l’asthme, la toux, un amaigrissement, une fibrose, etc.) résultent majoritairement de la toxicité du cobalt ou d’autres métaux (comme le nickel par exemple), mais pas au tungstène (ATSDR, 2005). Si le carbure de tungstène se comporte comme une poussière inerte, associé au cobalt cependant, il augmenterait considérablement la biodisponibilité et la toxicité pulmonaire du cobalt (Lasfargues et al., 1995 ; Lison et Lauwerys, 1995 ; Lison et al., 1996).
EFFETS RESPIRATOIRES :
Dans une usine métallurgique, où les salariés ont été exposés chroniquement à des particules de tungstène métallique (5 mg.m-3 soit 0,7 ppm), aucun n’a développé de pneumoconiose (Haneke et al., 2003).
Dans une cohorte constituée de 922 hommes et 935 femmes américains (étude NHANES entre 2007 et 2008), une association significative a été observée entre l’augmentation de la concentration urinaire de tungstène et le risque d’asthme (OR[2] de 1.72; IC95% [1,15 – 2,59]). L’origine professionnelle de l’exposition n’a pas pu être totalement écartée (Mendy et al., 2012). En effet, l’association entre le tungstène et l’asthme a souvent été décrit au cours de l’exposition professionnelle aux carbures de tungstène et de cobalt et il est établi que l’agent pathogène est généralement le cobalt (Stefaniak et al., 2009).
Voie orale
FDTE/VTR Importer EFFETS SYSTEMIQUES GENERAUX :
Dans le cadre d’un essai clinique, ayant examiné l’efficacité du tungstène contre l’obésité, 30 sujets obèses non diabétiques ont été traités pendant 6 semaines avec des doses de 100 mg de tungstate de sodium administrées per os 2 fois par jour pendant 6 semaines (Hanzu et al., 2010). Aucune activité pharmacologique du tungstate de sodium n’a été retenue en raison de l’absence d’effet observé.
EFFETS GASTRO-INTESTINAUX :
Aucune donnée n’a été identifiée chez l’homme.
Voie cutanée
FDTE/VTR Importer Bien que des dermatoses (eczéma, urticaire) aient été rapportées chez les salariés de l’industrie de métaux durs, les résultats des tests épicutanés ont mis en cause le cobalt et non le tungstène (ATSDR, 2005).
Synthèse
FDTE/VTR Importer Lors d’exposition chronique par inhalation à des poussières de carbure de tungstène en présence de cobalt ou d’autres métaux il a été décrit une pathologie appelée maladie des métaux durs caractérisée par une rhinite spasmodique, de l’asthme, la toux, un amaigrissement, une fibrose et un développement de tumeurs. Ces effets ne sont pas retrouvés lors d’une exposition au tungstène seul.
Chez l'animal
Inhalation
FDTE/VTR Importer EFFETS SYSTEMIQUES GENERAUX :
Les seules données chez l’animal font référence à l’apparition d’une fibrose chez des rats exposés 1 heure par jour à une concentration de 600 mg.m3 de carbure de tungstène pendant 5 mois (Mezentseva, 1967).
EFFETS RESPIRATOIRES :
En ce qui concerne les études chez l’animal, seul un auteur décrit l’apparition de fibrose (modérée) chez des rats exposés par inhalation pendant 5 mois (600 mg.m3 de carbure de tungstène) ou dans les huit mois ayant suivi une instillation trachéale (tungstène métallique, trioxyde de tungstène ou carbure de tungstène (Mezentseva, 1967).
Dans les autres publications, les instillations de différents composés du tungstène (non solubles) n’ont pas entraîné de fibroses aussi bien chez la souris, le rat ou le hamster dans les 8 à 12 mois suivant le traitement (Delahant, 1955 ; Lardot et al., 1998 ; Lasfargues et al., 1992). Aucun effet sur les marqueurs de l’inflammation pulmonaire n’a en particulier été observé chez des rats traités par instillation trachéale de 9,2 ou 18,4 mg.kg-1 de tungstène pur (Roedel et al., 2012). A la dose supérieure de 36,8 mg.kg-1 seule une discrète inflammation dont l’origine est indissociable d’une surcharge pulmonaire, a été décrite.
A contrario, des rats exposés à des instillations répétées de carbure de tungstène et de cobalt en mélange développent dans un premier temps une réaction inflammatoire pulmonaire sévère évoluant vers une fibrose interstitielle diffuse (Lasfargues et al., 1995 ; Roedel et al., 2012).
D’autres travaux ont testé les effets d’aérosols d’oxyde de tungstène bleu à des concentrations de 0 – 0,081 – 0,331 ou 0,652 mg.L-1, (soit environ 0 – 15 – 62 ou 124 mg .kg-1.j-1) 6 heures par jour, pendant 28 jours chez le rat (Rajendran et al., 2012). Une augmentation du poids absolu et relatif des poumons des mâles et des femelles aux deux plus fortes doses a été décrite à la fin du traitement, persistante 15 jours après l’arrêt du traitement chez les femelles, plus modestement chez les mâles. L’augmentation du poids des poumons a été attribuée aux dépôts d’oxyde de tungstène et l’afflux de macrophages alvéolaires.
EFFETS CARDIO-VASCULAIRES :
Aucune étude n’a été identifiée chez l’animal.
Voie orale
FDTE/VTR Importer EFFETS SYSTEMIQUES GENERAUX :
Seuls les travaux d’un ancien groupe de recherche (1941, 1943) rapportent des baisses d’environ 4 à 10 % de croissance pondérale chez des rats exposés à doses sub-létales de 0,5 % de tungstate d’ammonium, de 0,1 % de tungstate de sodium ou d’oxyde de tungstène (ATSDR, 2005). La même équipe n’a pas observé d’effet sur le poids des animaux soumis au même traitement avec 2 ou 5 % de tungstène métal.
Plusieurs études plus récentes sur le tungstate de sodium ne mentionnent pas d’effet (survie, croissance pondérale, poids des organes) chez des rats (de 30 à 185 mg-1.kg-1.j-1) ou des souris (de 4 à 250 mg-1.kg-1.j-1) exposés sur des périodes variant de 2 à plus de 9 mois (Kelly et al., 2012 ; Osterburg et al., 2014 ; Pandey et al., 2011 ; Sato et al., 1999).
Seule une étude de toxicité subchronique (90 jours), rapporte une baisse de croissance pondérale chez les mâles uniquement à la plus forte dose tungstate de sodium testée de 200 mg.kg-1.j-1, accompagnée d’une baisse significative du poids absolu du cœur, du foie et des reins (McCain et al., 2015).
EFFETS GASTRO-INTESTINAUX :
Dans le cadre d’une étude de toxicité à doses répétées de 90 jours à du tungstate de sodium (0 -10 – 75 -125 ou 200 mg.kg-1.j-1 soit environ 0 – 6 – 47 – 78 ou 125 mg W.kg-1.j-1) administré par gavage chez le rat, l’examen des coupes histologiques a permis d’observer une augmentation de l’inflammation de la muqueuse ainsi que la présence de cellules caliciformes métaplasiques dans la zone glandulaire de l’estomac, aux deux plus fortes doses aussi bien chez les mâles que chez les femelles (soit 8/9 et 8/10 chez les mâles et 8/10 et 10/10 chez les femelles aux deux doses respectives de 125 et 200 mg.kg-1.j-1) (McCain et al., 2015). Un NOAEL de 75 mg.kg-1.j-1 de tungstate de sodium (soit 47 mg W.kg-1.j-1) pour les deux sexes a été retenu pour cette étude.
EFFETS HEPATIQUES :
Aucun des marqueurs de toxicité hépatique n’a été rapporté chez le rat ou la souris exposés au tungstène par gavage ou via l’eau de boisson (poids du foie, ou enzymes hépatiques) (Kelly et al., 2012 ; Pandey et al., 2011).
Dans l’étude de toxicité subchronique par voie orale de 90 jours, la baisse du poids absolu (et non relatif du foie) n’a pas été accompagnée de lésions tissulaires (McCain et al., 2015).
EFFETS RENAUX :
En dehors de la baisse du poids absolu (mais non relatif) du poids des reins chez les mâles uniquement, les examens histologiques ont révélé dans les deux sexes une dégénérescence modérée à sévère des tubules corticaux du rein aux doses de 125 mg.kg-1.j-1 (respectivement 1/9 et 1/10 chez les mâles et les femelles) et 200 mg.kg-1.j-1 (respectivement 10/10 et 8/10 chez les mâles et les femelles) de tungstate de sodium administrée 90 jours dans l’eau de boisson (McCain et al., 2015). Les analyses d’urine n’ont pas révélé d’anomalies.
La néphrotoxicité décrite dans cette étude est cohérente avec la voie d’élimination, majoritairement urinaire, du tungstène.
EFFETS HEMATOLOGIQUES :
Des variations transitoires notamment de la numération des globules blancs ont été décrites à la fois chez le rat (inhalation d’oxyde de tungstène) ou la souris (doses orales de tungstate de sodium) (Kelly et al., 2012 ; Rajendran et al., 2012).
EFFETS IMMUNOLOGIQUES ET OSSEUX :
Après avoir montré in vitro les effets du tungstate de sodium dans les lymphocytes B en développement et leur sensibilité aux dommages à l’ADN (Guilbert et al., 2011), l’équipe de Kelly a pu observer les effets de l’exposition au tungstène via l’eau de boisson chez la souris sur les lymphocytes B résidant de la moelle osseuse (Kelly et al., 2012). La déposition rapide de tungstène dans l’os visible dès la première semaine d’exposition à différentes doses de tungstate de sodium (0, 15, 200 ou 1 000 mg.L-1 soit des doses estimées d’environ 4 - 50 et 250 mg W.kg-1.j-1) a pu être corrélée à une augmentation transitoire de lymphocytes B matures au cours des 8 premières semaines de traitement aux deux plus fortes doses. A la fin des 16 semaines de traitement, une augmentation significative des lymphocytes B à différentes stades du développement (Pro-B et pré-B) a été décrite dans tous les groupes traités au tungstène. De plus et en accord avec les données in vitro (Guilbert et al., 2011), les dommages à l’ADN des cellules de la moelle et des lymphocytes B isolés ont été rapportés en particulier aux doses les plus faibles.
Dans une autre étude d’exposition de souris à des doses de 0 – 2 – 62,5 - 125 et 200 mg.kg-1.j-1 de tungstate de sodium pendant 28 jours, suivi d’une stimulation du système immunitaire par injection de staphylocoque B, les effets sur le système immunitaire se sont traduits à la plus forte dose par une diminution significative des populations de lymphocytes T cytotoxiques et T auxiliaires de la rate (Osterburg et al., 2014). De plus, une baisse significative de la production in situ d’interféron Ɣ (INF-Ɣ) par les cellules de la rate des animaux exposés à la plus forte dose a été décrite par comparaison au groupe témoin. Parallèlement, les auteurs ont montré les effets immunosuppresseurs du tungstène (aux deux plus fortes doses de 20 et 200 mg.kg-1.j-1) dans un modèle d’hypersensibilité retardée, renforçant les conclusions sur la réduction de l’immunité adaptative en présence de tungstène. Un NOAEL de 125 mg.kg-1.j-1 de tungstate de sodium (soit 78 mg W.kg-1.j-1) relatif à la suppression du système immunitaire a été identifié à partir de cette étude de tungstate de sodium.
Le NTP a également lancé des travaux en 2012, visant à évaluer les effets du tungstène sur le système immunitaire de souris (femelles de 8 à 9 semaines) (Frawley et al., 2016). Les résultats, en contradiction avec ceux observés précédemment, mentionnent, chez des souris exposées à 0 – 250 – 500 – 1 000 ou 2 000 mg.L-1 de tungstate de sodium (soit approximativement 0 – 62,5 – 125 – 250 ou 500 mg.kg-1.j-1) pendant 1 mois dans l’eau de boisson, une absence d’effet sur le poids de la rate ou du thymus, aucune lésion histologique au niveau des tissus du système immunitaire, des effets limités de l’immunité humorale et innée ou le phénotype des splénocytes, en particulier à la plus forte concentration de 2 000 mg.L-1 (500 mg.kg-1.j-1). Les auteurs rapportent néanmoins à la concentration intermédiaire de 1 000 mg.L-1 (250 mg.kg-1.j-1) une diminution de l’activité des lymphocytes T, par ailleurs augmentée aux plus faibles concentrations.
D’autres travaux récents, réalisés sur des souris plus jeunes (4 à 5 semaines) traitées pendant 1, 4 ou 12 semaines via l’eau de boisson à une concentration de 1 000 mg.L-1 de tungstate de sodium, se sont focalisés sur la distribution localisée du tungstène dans tous les principaux composants du tissu osseux) (VanderSchee et al., 2018). Les auteurs ont pu observer une répartition non uniforme du tungstène dans l’os), avec une présence dans la couche corticale de l’os et une accumulation dans la moelle osseuse et le tissu osseux spongieux, soulignant la vulnérabilité des personnes jeunes et en croissance. Les analyses ont de plus permis de montrer une transformation du tungstène dans l’organisme sous forme de phosphotungstate, un catalyseur actif d'oxydo-réduction susceptible d’interférer sur les processus biologiques de la moelle osseuse et des tissus osseux spongieux – notamment la formation de cellules immunitaires et la croissance osseuse.
EFFETS ENDOCRINIENS :
Chez l’animal, aucun effet sur le pancréas (poids et histologie) ou l’homéostasie du glucose n’a été décrit chez des souris exposées pendant 3 semaines à environ 500 mg-1.kg-1.j-1 de tungstate de sodium (Oliveira et al., 2013). Dans les mêmes conditions expérimentales, le tungstène normalise la tolérance au glucose en réprimant l’apoptose et en augmentant la réplication des cellules pancréatiques β de souris déficientes en récepteur à l’insuline (Irs2-/-).
Synthèse
FDTE/VTR Importer Lors d’expositions répétées par voie orale au tungstate de sodium (78 ou 125 mg W.kg-1.j-1) chez le rat, des effets gastrointestinaux se traduisant par une inflammation de la muqueuse ainsi que la présence de cellules caliciformes métaplasiques dans la zone glandulaire de l’estomac ont été décrits. Cet effet est associé à une dégénérescence modérée à sévère des tubules corticaux du rein.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| IARC | FDTE/VTR Importer Groupe 2A | 2006 |
Chez l'homme
Inhalation
FDTE/VTR Importer En dehors de l’augmentation de la mortalité par cancer pulmonaire observée chez les salariés employés dans l’industrie des métaux durs (se référer à la fiche de données toxicologiques et environnementales relative au cobalt, INERIS, 2006), aucune étude épidémiologique ou animale relative à l’exposition de tungstène seul pour les effets cancérogènes n’a été identifiée. Dans une récente étude regroupant 32 354 salariés de l’industrie des métaux durs (Autriche, Allemagne, Suède, Royaume-Uni, Etats-Unis), aucun excès de risque de mortalité par cancer du poumon n’a été identifié en fonction de la durée, l’intensité ou l’exposition cumulée au tungstène (Marsh et al., 2017).
Le carbure de tungstène associé au cobalt est répertorié en France dans le tableau des Maladies Professionnelles et a été classé cancérogène probable par l’IARC en 2006 (groupe 2A).
Voie orale
FDTE/VTR Importer L’étude, réalisée par le Centre de Contrôle et de prévention des maladies (CDC) aux Etats-Unis et portant sur des cas de leucémies lymphoblastiques aiguës chez des enfants (14 cas et 55 témoins), dans la commune de Churchill, région de Fallon au Nevada, est la première à avoir recherché l’existence possible d’un lien avec des concentrations élevées de tungstène dans la nappe d’eau souterraine approvisionnant la ville en eau potable (CDC, 2003a, 2003b). Les dosages de tungstène dans l’eau potable (moyenne de 4,66 µg.L-1 IC95% [2,98 – 7,30]) et les échantillons biologiques (concentration urinaire moyenne de 1,19 µg.L-1 (IC95% = [0,89 -1,59]) versus 0,08 µg.L-1 (IC95% = [0,07 – 0,09]) dans la population non exposée) de la commune de Churchill ont montré des concentrations anormalement élevées de tungstène (Rubin et al., 2006). Bien qu’aucun lien significatif n’ait été trouvé entre le tungstène et l’incidence de leucémies (odds ratio de 0,78 (p = 0,57)), cette étude a néanmoins eu pour conséquence d’alerter à la fois les autorités compétentes (substance prioritaire pour le NTP) et la communauté scientifique pour relancer les investigations liées à la toxicité du tungstène. Plusieurs autres agents identifiés (métaux et pesticides) pourraient avoir contribués à la cancérogénicité de l’eau consommée par les enfants dans la commune de Churchill (Daughton, 2005 ; Sheppard et al., 2007). Enfin, des concentrations élevées de tungstène dans l’eau potable ont été relevées dans d’autres régions voisines de celle de Churchill, sans que des cas anormaux de leucémies soient observés (Rubin et al., 2006).
Chez l'animal
Voie orale
FDTE/VTR Importer Chez l’animal, le tungstate de sodium administré dans l’eau de boisson (de 5 à 100 mg.L-1) n’induit pas de tumeurs (ATSDR, 2005). Deux études de cancérogénèse de 2 ans (OCDE 451/453) sont toutefois en cours chez le rat (doses estimées de 0 - 25 - 50 et 100 mg.kg-1.j-1) et la souris (doses estimées de 0 –100 – 250 et 500 mg.kg-1.j-1) de tungstate de sodium (Lemus et Venezia, 2015).
Les études in vivo d’initiation et de promotion tumorales réalisées avec le tungstène ou le tungstate de sodium suggèrent une activité de promotion, mais aucune donnée ne démontre que le tungstène agit seul comme cancérogène (ENSP, 2004).
Effets sur la reproduction
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune étude épidémiologique n’a été identifiée pour les effets sur la fertilité. Seuls des données chez l’animal sont disponibles.
Chez l'animal
Inhalation
FDTE/VTR Importer Une diminution de la mobilité de 10 à 12 % a été rapportée chez des rats exposés à des concentrations de 1 et 0,5 mg.m-3 de poudre de tungstate de sodium (Idiyatullina, 1981).
Voie orale
FDTE/VTR Importer Deux études sur 1 génération, l’une chez le rat et l’autre chez la souris ont été réalisées avec du tungstate de sodium (McInturf et al., 2008 ; Osterburg et al., 2014). Une étude sur deux générations réalisée par le NTP serait en cours de réalisation (résultats non publiés à ce jour).
L’étude chez le rat (réalisée par l’US Navy en 2007, puis publiée une première fois par McInturf en 2008 avec une dose faible et une dose forte, puis en 2011 avec une dose intermédiaire) ne rapporte pas d’effet sur les fonctions de reproduction (indice d’accouplements) ou le nombre de petits par portée aux différentes doses de 0 – 5 – 62,5 ou 125 mg.kg-1.j-1 de tungstate de sodium administrées de 2 semaines avant l’accouplement jusqu’au 20ème jour d’allaitement, soit un total de 70 jours. Les auteurs rapportent néanmoins une augmentation significative de la durée de la gestation à la plus forte dose de 125 mg.kg-1.j-1 par comparaison au groupe témoin. L’augmentation n’étant que de 2 % (22,08 jours versus 21,55 dans le groupe témoin), l’US EPA ne considère pas cette augmentation biologiquement significative et a donc retenu un NOAEL pour la reproduction de 125 mg.kg-1.j-1 de tungstate de sodium (soit 78 mg W.kg-1.j-1).
Dans la seconde étude réalisée chez la souris (Osterburg et al., 2014) avec une exposition à 0 – 2 – 62,5 – 125 –ou 200 mg.kg-1.j-1 de tungstate de sodium de 12 semaines avant l’accouplement, pendant l’accouplement, la gestation et 3 semaines après la mise bas, soit un total de 19 semaines pour la génération parentale – aucun effet sur la reproduction n’a été identifié (nombre de petits vivants, taille des portées , ex ratio, etc.) (NOAEL de 200 mg.kg-1.j-1 de tungstate de sodium soit 125 mg W.kg-1.j-1).
Des mâles traités par gavage à une dose quotidienne de 50 mg.kg-1.j-1 de tungstate de sodium (soit 31,2 mg W.kg-1.j-1) pendant 60 jours, ont été accouplés après 55 jours de traitement (Pandey et al., 2011). Aucun effet sur la fertilité, les concentrations hormonales sériques, le poids des organes reproducteurs ou l’histologie des testicules n’a été rapporté.
Des résultats similaires ont été décrits dans le cadre d’une exposition au tungstate de sodium administré via l’eau de boisson (2 000 mg.L-1 soit une dose estimée de 147 mg W.kg-1.j-1) à des rats mâles pendant 3 mois, et accouplés après 10 semaines de traitement (Ballester et al., 2005). Un NOAEL de 147 mg W.kg-1.j-1 a été déterminé pour la fertilité des mâles à partir de cette étude.
Concernant les femelles, accouplées avec des rats mâles non traités après 12 semaines d’exposition au tungstate de sodium administré dans l’eau de boisson (2 000 mg.L-1 soit une dose estimée de 160 mg W.kg-1.j-1), aucun effet n’a été observé sur la fertilité, taille des portées, taux d’hormones sériques, l’histologie des ovaires ou l’expression utérine ou ovarienne des niveaux d’œstrogène, de progestérone, FSH, LH ou prolactine (Ballester et al., 2007). Un NOAEL de 160 mg W.kg-1.j-1 a été déterminé pour la fertilité des femelles à partir de cette étude.
Effets sur le développement
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune étude épidémiologique n’a été identifiée pour les effets sur le développement. Seuls des données chez l’animal sont disponibles.
Chez l'animal
Voie orale
FDTE/VTR Importer Dans l’étude de reproduction sur 1 génération chez la souris mentionnée précédemment (Osterburg et al., 2014), l’exposition au tungstate de sodium des petits de la génération F1 s’est poursuivie après sevrage pendant une période de 90 jours, avec in fine l’étude de la réponse immunitaire adaptive (stimulation par injection intrapéritonéale de staphylocoque B 24 avant le sacrifice). L’exposition au tungstate de sodium n’a pas eu d’incidence sur la viabilité des petits à la naissance. Les analyses hématologiques ont uniquement permis d’observer une baisse de la concentration des monocytes chez les animaux F0 et F1 (analyse combinée). Par ailleurs, de même que chez les animaux F0, les auteurs ont également décrit une diminution de la réponse immunitaire dans le groupe ayant été traité par le staphylocoque et exposé à la plus forte dose de tungstène. Ces effets ayant été observés 15 à 16 semaines après la naissance, les effets semblent davantage liés à l’exposition post-natale de 90 jours au tungstène, plutôt qu’à l’exposition au cours du développement. Dans cette étude (hématologique et immunitaire), aucun NOAEL /LOAEL sur le développement n’a pu être déterminé.
Concernant l’étude de reproduction réalisée par l’équipe de McInturf (2008, 2011), aucun effet du traitement sur la croissance pondérale des femelles au cours de la gestation n’est rapporté. De même le traitement au tungstate de sodium au cours de la gestation et de l’allaitement n’a pas eu d’incidence sur la croissance pondérale de la progéniture. Aucune malformation externe n’a été décrite chez les petits 20 ou 70 jours après la naissance. Des tests neurocomportementaux (séparations des petits de 7 jours de leur mère au 7ème jour après la naissance) ont toutefois mis en évidence une augmentation de la réaction (enregistrement des cris), apparenté au stress et à l’anxiété, uniquement chez les petits du groupe exposés à la plus forte dose (augmentation significative de 76 % par comparaison au groupe témoin). Si l’augmentation non significative de 18 % dans le groupe exposé à la plus faible dose est clairement mentionnée, la réponse à la dose intermédiaire n’est pas rapportée. Le traitement n’a, en revanche, pas eu d’effet sur le test de retournement (destiné à explorer le développement moteur) réalisés sur les petits de 4 jours (pas de données quantitatives). Des tests neuro comportementaux ont également été réalisés sur les mères (test d’anxiété « Open field » au 27ème jour après la mise bas soit 7 jours après la fin de l’exposition ; test du réflexe de sursaut auditif 8 jours après la fin de l’exposition et enfin le test de mémoire « Moris Water Maze » 15 à 18 jours après la fin de l’exposition), sans qu’aucune relation claire effet-dose ne soit démontrée. L’US EPA a retenu un NOAEL sur le développement de 125 mg.kg-1.j-1 de tungstate de sodium (soit 78 mg W.kg-1.j-1), la signification biologique du test de séparation des petits de leur mère étant incertaine, ainsi qu’un NOAEL pour la toxicité systémique des mâles et des femelles F0 également de 125 mg.kg-1.j-1 de tungstate de sodium (soit 78 mg W.kg-1.j-1).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
FDTE/VTR Importer Aucune valeur française réglementaire en milieu professionnel n’a été identifiée.
En Allemagne (réglementation TRG900 ; BAuA, 2006)
MAK-TWA : tungstène : 5 mg.m-3 ;
MAK-STEL : tungstène : 10 mg.m-3
Aux Etats-Unis (ACGIH, 2013 ; NIOSH, 2015)
TLV-TWA : composés solubles : 1 mg.m-3 ; composés insolubles : 5 mg.m-3
TLV-STEL : composés solubles : 3 mg.m-3 ; composés insolubles : 10 mg.m-3
En se basant sur les études réalisées par McCain et al., 2015 et Rajendran et al., 2012, Jackson et al., 2013 en ont déduit, dans le cadre du règlement européen REACH , des DNEL long terme en milieu professionnel de :
Tungstate de sodium : 3 mg.m-3 ; soit (1,7 mg W.m-3)
Oxyde de tungstène (WO) : 7,3 mg.m-3 ; soit (5,8 mg W.m-3) (valeur déduite de la précédente valeur
Valeurs guides
FDTE/VTR Importer Valeurs guides dans l'eau de boisson :
À ce jour, l’Organisation mondiale de la santé (OMS) n’a pas publié de directives sur l'eau potable, alors que la Russie a une limite de 0,05 mg.L-1 pour l'eau potable (Koutsospyros et al., 2006). Aux États-Unis, le Commonwealth a établi dans le Massachusetts des niveaux d'action à partir de 15 mg.L-1 (ASTWSWMO, 2008).
En suivant les équations standard de l’US EPA, Schell et Pardus (2009) ont calculé une concentration basée sur les risques liés à l'eau potable pour le tungstène de 2,28 mg.L-1.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition sub-chronique par voie orale :
US EPA (2015) propose une RfD provisoire de 8 10-3 mg.kg-1.j-1 pour une exposition subchronique par voie orale aux composés solubles du tungstène
Cette valeur a été déterminée à partir d’une étude de toxicité à doses répétées de 90 jours de 0 - 6 – 47 – 78 et 125 mg.kg-1.j-1 de tungstate de sodium chez le rat initialement non publiée (USACHPPM, 2007a, 2007b), puis ultérieurement rapportée par McCain (McCain et al., 2015). L’effet critique retenu pour l’établissement de cette VTR est l’augmentation de l’incidence de cellules glandulaires métaplasiques de l’estomac chez les mâles. A partir des résultats de l’étude, l’US EPA a dérivé une Benchmark Dose 10 (BMDL10 : limite inférieure de l’intervalle de confiance à 95 % de la dose pour laquelle une augmentation du nombre de cellules métaplasiques de 10 % est observée) de 2,3 mg W.kg-1.j-1.
Facteur d’incertitude : un facteur d’incertitude de 300 a été appliqué à la BMDL10. Ce facteur se décompose de la manière suivante :
Un facteur 10 pour tenir compte de l’extrapolation des données de l’animal à l’homme ;
Un facteur 10 pour tenir compte de la variabilité de la susceptibilité chez l’homme, en absence d’information de données sur la toxicocinétique et toxicodynamique sur les composés solubles du tungstène chez l’homme.
Un facteur 3 pour tenir compte dans la base de données d’études dans lesquelles aucun effet sur le système reproducteur, le développement ou le système immunitaire (Kelly et al., 2012 ; McInturf et al., 2008 ; McInturf et al., 2011 ; Osterburg et al., 2014) n’a été collectivement rapporté à la dose ayant permis d’observer l’effet critique, à savoir l’augmentation des lésions de l’estomac glandulaire (USACHPPM, 2007a, 2007b). De plus, il existe des éléments en faveur d’un effet neurotoxique (Nadeenko, 1966), qui n’a pas été exhaustivement exploré.
Calcul : 2,3 mg W.kg-1.j-1 x 1/300 = 0,0076 mg W.kg-1.j-1 arrondi à 8.10-3 mg W.kg-1.j-1
Indice de confiance : L’US EPA considère que la qualité de l’étude est bonne, la base de données et la valeur élaborée étant de qualité moyenne.
Effets à seuil - Exposition chronique par voie orale :
US EPA (2015) propose une RfD provisoire de 8 10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale aux composés solubles du tungstène
En l’absence d’étude chronique suffisante, l’US EPA retient la même étude que celle utilisée pour l’élaboration de la RfD subchronique. La même BMDL10 de 2,3 mg W.kg-1.j-1 a été retenue pour l’augmentation de l’incidence de cellules glandulaires métaplasiques de l’estomac chez les mâles.
Facteur d’incertitude : un facteur d’incertitude de 3 000 a été appliqué à la BMDL10. Ce facteur se décompose de la manière suivante :
- Un facteur 10 pour tenir compte de l’extrapolation des données de l’animal à l’homme ;
- Un facteur 10 pour tenir compte de la variabilité de la susceptibilité chez l’homme, en absence d’information de données sur la toxicocinétique et toxicodynamique sur les composés solubles du tungstène chez l’homme.
- Un facteur 3 pour tenir compte dans la base de données d’études dans lesquelles aucun effet sur le système reproducteur, le développement ou le système immunitaire (Kelly et al., 2012 ; McInturf et al., 2008 ; McInturf et al., 2011 ; Osterburg et al., 2014) n’a été collectivement rapporté à la dose ayant permis d’observer l’effet critique, à savoir l’augmentation des lésions de l’estomac glandulaire (USACHPPM, 2007a, 2007b). De plus, il existe des éléments en faveur d’un effet neurotoxique (Nadeenko, 1966), qui n’a pas été exhaustivement exploré.
- Un facteur 10 pour tenir compte de l’incertitude relative à l’utilisation d’une étude subchronique pour dériver une RfD chronique.
Calcul : 2,3 mg W.kg-1.j-1 x 1/3 000 = 0,00076 mg W.kg-1.j-1 arrondi à 8.10-4 mg W.kg-1.j-1
Indice de confiance : L’US EPA considère que la qualité de l’étude est bonne, la base de données et la valeur élaborée étant de faible qualité.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - exposition sub-chronique par voie orale :
Avis de l’INERIS :
Cette valeur est établie à partir d’une étude de bonne qualité, le choix de l’effet critique est justifié et cohérent. La construction de la valeur repose sur un calcul de benchmark dose, les facteurs d’incertitude sont justifiés et appropriés. La valeur de l’US EPA est retenue pour des expositions subchroniques aux composés solubles du tungstène.
Effets à seuil - Exposition chronique par voie orale :
Avis de l’INERIS :
Deux valeurs sont disponibles une de l’US EPA (2015) et une de Schell et Pardus (2009). La valeur de l’US EPA est établie à partir d’une étude de bonne qualité, le choix de l’effet critique est justifié et cohérent. La construction de la valeur repose sur un calcul de benchmark dose, les facteurs d’incertitude sont justifiés. La valeur de Schell et Pardus (2009), est basé sur un effet critique qui survient à des niveaux de doses plus élevés et semble donc moins pertinent. La valeur de l’US EPA est retenue pour des expositions chroniques aux composés solubles du tungstène.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par voie orale :
Schell et Pardus (2009) propose une RfD de 9,3 10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale aux composés solubles du tungstène
Cette valeur n’est pas issue d’un organisme reconnu ; elle a été publiée dans la littérature. Elle a été déterminée à partir de l’étude de toxicité à doses répétées de 90 jours par voie orale de McCain (McCain et al., 2015) et d’une étude sur la reproduction toujours chez le rat (McInturf et al., 2008) en suivant les recommandations de l’US EPA. Un calcul de BMD a été réalisé à partir de chacune des deux études. L’effet critique le plus sensible retenu est une BMLD10 de 102 mg.kg-1.j-1 pour la toxicité rénale dans l’étude de toxicité répétée et une BMDL10 de 93 mg.kg-1.j-1 pour la toxicité sur le développement. La plus faible des deux valeurs, soit la BMDL10 de 93 mg.kg-1.j-1 pour la toxicité sur le développement a finalement été retenue.
Facteur d’incertitude : un facteur d’incertitude de 1 000 a été appliqué correspondant à un facteur 10 pour la variabilité inter-espèces, un facteur 10 pour la variabilité intra-espèce, et un facteur 10 pour l’extrapolation d’une durée subchronique à chronique.
Calcul : 93 mg W.kg-1.j-1 x 1/1 000 = 0,093 mg W.kg-1.j-1 soit environ 0,1 mg W.kg-1.j-1
Indice de confiance : aucun indice de confiance n’a été mentionné par les auteurs.
Bibliographie
Exporter la substance
Choisissez le format de l'export :

