Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Platine (7440-06-4)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
7440-06-4
Nom scientifique (FR)
Platine
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-116-1
Code SANDRE
2793
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Pt }\)
Code InChlKey
Code SMILES
[Pt]
Familles
Familles chimiques
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
195.08 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Aucune donnée sur le comportement du platine inorganique n'est documentée dans la littérature. Les données sur le comportement de ses composés organiques n'ont pas été recherchées.
Persistance
Biodégradabilité
FDTE/VTR Importer Aucune donnée sur la biodégradation des composés organiques du platine n'a été recherchée.
Dégradabilité abiotique
FDTE/VTR Importer Aucune donnée sur la dégradation abiotique du platine et de ses composés inorganique n'est documentée dans la littérature.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Il n’existe pas de résultats d’accumulation sur organismes entiers. Le BCF de 225 peut être pris comme une valeur maximale.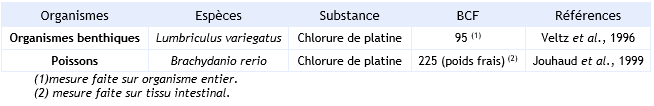
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucun résultat d'essai valide n'a pu être trouvé dans la littérature
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer De nombreuses informations et données toxicologiques proviennent des monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 1991 ; OMS, 2000). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Le cisplatine (cis-diamine dichloroplatine (II)) est un sel de platine utilisé pour ses propriétés pharmacologiques comme médicament anticancéreux, les effets toxicologiques de ce sel ne seront pas rapportés ici. Cependant, certaines informations pourront être fournies afin de mieux comprendre les effets des autres sels de platine.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer
Distribution
FDTE/VTR Importer Il existe très peu de données concernant le devenir dans l'organisme du platine chez l'homme. L'équipe de Merget et al., (2002) a étudié la possible relation entre la concentration de platine dans le sérum, l'exposition aux sels de platine et la sensibilisation aux sels de platine chez des salariés. Des tests cutanés et des dosages de platine dans le sérum ont été réalisés chez 6 salariés et chez des sujets témoins non exposés aux sels de platine. Des tests cutanés s'avérant négatifs au début de l'étude se sont avérés positifs au cours de l'étude chez 3 salariés sur 6. La concentration de platine mesurée dans le sérum est élevée seulement chez un des trois salariés présentant un test cutané positif, mais cette concentration élevée n'est pas retrouvée pour chaque mesure. Des concentrations élevées de platine dans le sérum ont été mesurées chez des individus faiblement ou non exposés aux sels de platine portant un alliage dentaire. Cette étude réalisée chez peu d'individus n'a pas mis en évidence de relation entre la concentration de platine dans le sérum des individus et l'effet sensibilisant induit par les sels de platine.
Élimination
FDTE/VTR Importer Le platine est excrété dans les urines. Dans l'étude de Schierl et al., (1998), la concentration de platine dans les urines a été mesurée 2 à 6 fois pendant 6 mois le matin et en fin de journée chez 34 salariés travaillant dans une industrie utilisant le platine. De plus, deux volontaires sains de sexe masculin ont été exposés pendant 4 heures par voie pulmonaire à de la poussière de platine à un poste de travail typique d'une raffinerie de platine. Chez les salariés, la concentration de platine dans les urines mesurée après le travail est supérieure à 6,270 µg/g de créatinine ce qui correspond à 1 000 fois la concentration médiane de platine présent dans les urines de personnes non exposées. La concentration de platine dans les urines est maximale dix heures après l'exposition par voie pulmonaire aux poussières de platine. Cette étude a montré une corrélation directe entre la concentration d'exposition au platine et la concentration de ce composé mesurée dans les urines. Une autre étude de Schierl (Schierl et al., 2001) dans laquelle un examen d'échantillons de salive et d'urine a été réalisé chez 50 individus portant un alliage dentaire contenant du platine et de l'or et chez des individus témoins ne portant pas d'alliage dentaire a mis en évidence que la concentration de platine dans les urines et dans la salive était significativement supérieure chez les individus portant un alliage dentaire.
Chez l'animal
Absorption
FDTE/VTR Importer Des études réalisées avec des composés radio-marqués au platine 191 (chlorure de platine (IV), oxyde de platine, sulfate de platine et platine métal) chez le rat lors d’expositions par inhalation ont montré qu’il n’y avait pas de différence de clairance pulmonaire entre les différents composés. Une élimination rapide est observée pendant les 24 premières heures puis une phase plus lente lui fait suite (Moore et al., 1975c). Cette clairance pulmonaire correspond en fait à une élimination par remontée œsophagique puis une excrétion dans les fèces, l’élimination rénale est alors très faible.
Distribution
FDTE/VTR Importer Les organes cibles du platine sont les reins, la rate et les testicules. De plus, il a été montré que ce composé pouvait se stocker dans les os (Moore et al., 1975 a et b ; Sato et al, 2001 ; Holbrook, 1977 ; Artelt et al., 1998 ; Artelt et al., 1999 ; Misawa et al, 2000).
Plus de 90 % du platine biodisponible sont liés aux protéines dans les différents tissus et liquides corporels, le reste est présent sous la forme de composants de faible poids moléculaire, le plus souvent sous la forme de complexes ioniques (Artelt et al., 1999).
Élimination
FDTE/VTR Importer L’élimination se fait essentiellement dans les fécès (Artelt et al., 1998). Contrairement aux sels simples de platine, les sels complexes de diamines comme le cisplatine sont éliminés principalement par voie urinaire (Hoeschele et Van Camp, 1972 ; Lange et al., 1972 ; Litterst et al., 1976a et b ; Cvitkovic et al., 1977).
Toxicité aiguë
Chez l'homme
Voie orale
FDTE/VTR Importer Le seul cas d'intoxication aiguë aux sels de platine présent dans la presse médicale est celui d'une intoxication, après une ingestion accidentelle de papier contenant 8 g de chloroplatinate de potassium chez un enfant âgé de 2 mois. Une heure à heure et demie après l'ingestion, l'enfant a été admis à l'hôpital. Il souffrait de douleurs abdominales et présentait des vomissements, une baisse de la température corporel, une respiration superficielle ainsi que des pupilles dilatées. Cinq heures après l'ingestion du poison, l'enfant décéda d'une syncope cardiaque (Hardman et Wright, 1896). Cette publication est une communication très courte datant de 1896, les résultats sont donc à prendre avec précaution.
Chez l'animal
Voie orale
FDTE/VTR Importer La toxicité aiguë du platine dépend de la forme chimique du composé. Les DL50, établies chez le rat par voie orale sont présentées dans le tableau ci-après. Les composés les plus solubles sont les plus toxiques. Chez le rat, les composés peuvent être classés du plus toxique au moins toxique : le chlorure de platine (IV), le sulfate de platine (IV), le chlorure de platine (II) et l’oxyde de platine (IV). Les signes d’empoisonnement par le tétrachloroplatinate (II) d’ammonium sont une hypokinésie, une piloérection, des diarrhées, des convulsions, une gêne respiratoire et une cyanose (Degussa, 1989a). Le platine est un irritant cutané et oculaire (Campbell et al. 1975 ; Johnson, 1978d, e, f, 1981c, 1977d, e, g ; Degussa, 1988a, b, 1989b).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer Les études les plus anciennes rapportant les effets du platine sur la santé lors d’expositions professionnelles décrivent des effets irritants (Hunter et al., 1945 ; Karasek et Karasek, 1911 ; Roberts, 1951).
L'étude de Karasek et Karasek, (1911) réalisée dans les studios photographiques de Chicago a montré que l'exposition aux sels de platine complexes (complexes de coordinations) pendant une période non précisée induisait des irritations du nez et de la gorge (éternuements, rhinorhée, toux). Dans l'étude de Hunter et al., 1945. ; les salariés exposés à des concentrations de platine comprises entre 0,9 et 1 700 µg/m3 présentaient des irritations des voies respiratoires pouvant entraîner une cyanose. Enfin, l'étude de Roberts, 1951 réalisée chez 21 salariés travaillant dans une raffinerie de platine des états Unis et ayant été exposés pendant 5 ans à du platine, a mis en évidence que tous les salariés présentaient des symptômes liés au platine. Ces symptômes ne sont pas bien définis dans l'étude et sont regroupés sous le nom de 'platinosis' par l'auteur. Selon la classification de Roberts, 40 % des salariés atteints, présentaient des symptômes atypiques alors que 60 % des salariés présentaient des symptômes bien définis (symptômes non précisés dans l'OMS, 1991). Dans les 2 cas, les salariés souffraient d'une inflammation des conjonctives et des muqueuses de l’appareil respiratoire supérieur (Roberts, 1951).
Les symptômes observés dans l'étude de Roberts ont été rapportés dans d’autres études plus récentes (Bolm-Audorff et al, 1992 ; Schultze-Werninghaus et al., 1978 ; Linnett, 1987 ; Hughes, 1980) et ont été mieux définis. Ils correspondent aux symptômes typiques de la sensibilisation aux sels de platine (Roshchin et al., 1979, Health and safety executive, 1983 ; Brooks et al., 1990). Il s’agit d’un tableau clinique comprenant un écoulement oculaire et nasal, une oppression de la poitrine, des symptômes asthmatiformes, une toux, des lésions érythémateuses et eczématiformes de la peau et une inflammation des muqueuses (Hughes, 1980 ; Biagini et al., 1985, 1986 ; Merget et al., 1988 ; Schultze-Werninghaus et al., 1989). Quelques études (Calverley et al., 1995 ; Venables et al., 1989) ont mis en évidence que le tabagisme pouvait accroître le risque de sensibilisation au platine. Dans l'étude de Venables et al., 1989, des tests cutanés aux sels de platine ont été réalisés tous les 3 à 6 mois chez 91 salariés travaillant dans une raffinerie de platine. La présence de symptômes respiratoires a été également notée par le service de santé de la raffinerie. Il a été constaté que la majorité des salariés fumeurs présentaient un test cutanée positif aux sels de platine et que le nombre de cigarette consommé par jour était lié à la gravité des symptômes respiratoires. De même, le tabagisme a été montré comme étant directement lié à l'augmentation de l'incidence de la sensibilisation aux sels de platine chez 78 salariés travaillant dans une raffinerie de platine localisée en Afrique du Sud (Calverley et al., 1995).
Les irritations pulmonaires liées au platine peuvent s’accompagner d’irritations cutanées correspondant à des dermatites érythémateuses des mains et des avant-bras. Dans certains cas, une atteinte de la face et du cou ainsi qu’un urticaire sont décrits. Les effets irritants pulmonaires persistent pendant toute la journée de travail et pendant l’heure suivant l’arrêt du travail. La période de latence entre la première exposition professionnelle et l’apparition des symptômes varie entre quelques mois et 6 ans (Parrot et al., 1969, Schultze-Werninghaus et al., 1978 ; Ruff et al., 1979 ; Biagini et al., 1985) mais dans certain cas ils peuvent apparaître en quelques semaines (Roberts, 1951 ; Hughes, 1980 ; Merget et al., 1988). Lorsque la sensibilisation respiratoire et cutanée sont établies, les symptômes s’aggravent tant que le salarié est exposé de manière professionnelle (Hunter et al., 1945).
Les études les plus récentes ont mis en évidence une corrélation entre les niveaux d’exposition et la survenue des symptômes (Bolm-Audorff et al., 1988 ;Merget et al., 1988). Depuis l’adoption de valeurs limites d’exposition pour les sels de platine solubles (2 µg/m3 pour des expositions de 8 heures), une diminution de l’incidence de l’hypersensibilité aux sels de platine est observée. Une étude transversale a montré une sensibilisation cutanée chez 19 % des individus parmi les 65 salariés exposés. Dans cette étude, les niveaux d’exposition sont compris entre 0,08 et 0,1 µg/m3 dans un département et inférieurs à 0,05 µg/m3 dans les autres sites (Bolm-Audorff et al., 1988). Dans une autre usine, les niveaux généralement rencontrés sont en dessous de 0,08 µg/m3. Dans ce cas, 20 % des salariés sont sensibilisés (Merget et al., 1988). Il n’est cependant pas exclu que des expositions courtes à des concentrations élevées soient à l’origine des effets observés. En effet, dans une étude de 4 mois réalisée dans une raffinerie de platine aux États Unis, et dans laquelle une forte incidence des rhinites et d’asthme était observée, la mesure des concentrations aux postes de travail était supérieure à la limite réglementaire de 2 µg/m3 pendant 50 à 75 % du temps (Calverley et al., 1995).
Les différentes études réalisées montrent bien l’effet sensibilisant des sels de platine halogénés pour des expositions à des concentrations supérieures aux limites réglementaires de 2 µg/m3. Cependant, il n’est pas exclu que des réactions de sensibilisation puissent avoir lieu pour des expositions à des concentrations plus faibles de l’ordre de 0,05 µg/m3. à partir des différentes études épidémiologiques, l’OMS (2000) propose un LOAEL de 0,05 µg/m3 pour les effets sensibilisants des sels de platine en milieu professionnel et Merget et Rosner (2001) proposent de retenir comme NOEL la valeur de 1500 µg/m3. Le platine métal n’est pas connu comme étant un allergène pulmonaire. Par contre, il a été montré qu'il induisait des dermatites de contact (Sheard, 1955).
Les sels halogénés du platine sont les plus sensibilisants. Les composés principalement responsables sont l’acide hexachloroplatinique et les sels chlorés du platine tel que l’hexachloroplatinate d’ammonium, le tétrachloroplatinate de potassium, l’hexachloroplatinate de potassium et le tétrachloroplatinate de sodium. Il semblerait que le pouvoir allergénique soit lié au nombre d'atomes de chlore (Cleare et al., 1976). Les dérivés bromés et iodés sont également des allergènes, mais avec un pouvoir moins marqué que les dérivés chlorés. Il a été montré que les dérivés non halogénés des sels de platine n’étaient pas sensibilisants, très certainement parce qu’ils n’interagissent pas directement avec les protéines et ne se présentent donc pas comme un antigène complet. Les rares cas de réactions anaphylactiques induites par l’injection intraveineuse de fortes doses de cisplatine (Khan et al., 1975 ; Von Hoff et al., 1979) sont très probablement liées à la présence d’impuretés contenant des sels halogénés de platine (Pepys, 1983). Enfin, il a été démontré que des réactions croisées avec les autres métaux du groupe du platine (iridium, rhodium ou palladium) ne sont observées que chez certains individus (Santucci et al., 2000).
Les symptômes cutanés sont souvent la première manifestation de la sensibilisation aux sels de platine (Hughes, 1980).
Si les symptômes diminuent avec l’arrêt de l’exposition professionnelle, il a été montré que la réversibilité n’était pas complète lorsqu’il s’agit d’expositions professionnelles longues (Schultze-Werninghaus et al., 1989 ; Biagini et al., 1985). Les individus présentaient une réponse positive au test d’injection cutanée même 4 ans après l’arrêt de l’exposition professionnelle.
Le mécanisme de l’allergie aux sels de platine est une réaction de type I médiée par les IgE (Weissman et Lewis, 2000). Il a été montré que le sel de platine (II) réagit avec les sulfures des six groupes méthionine de l’albumine sérique humaine et que la méthionine 123 est le premier site de liaison (Grootveld, 1985).
Compte tenu de la présence d'articles relatant les effets du cisplatine sur le système nerveux (Gregg et al., 1992 ; Screnci et al., 2000) et sur les reins dans le milieu médical, il est important de noter, malgré l'absence de publication, que le platine pourrait induire des troubles neurotoxiques et néphrotoxiques.
Très peu d’auteurs ont cherché à identifier les effets des sels de platine liés aux expositions environnementales. La présence d’effets immunologiques chez l’homme lors d’expositions environnementales a été recherchée par Cleare (1977). L’étude a été réalisée chez des individus connus pour être sensibilisés aux sels de platine. Chez ces individus, l’inoculât intra-dermique d’extraits de particules diesel contenant plus de 5 µg/mL de platine total pour la concentration la plus élevée n’entraîne pas de réaction allergique. Un autre auteur a cherché à identifier s’il existait une différence de sensibilisation aux sels de platine entre les populations exposées professionnellement et les populations de zone urbaine exposées via l’environnement (Santucci et al., 2000). Il apparaît que, si des réactions positives aux tests par patch ou par inoculât intra-dermique sont retrouvées lors d’expositions à des concentrations élevées aux sels de platine chez les salariés, ceci n’est pas observé chez les populations exposées via l’environnement, même si la présence de platine observée dans l'environnement et dans les sols témoigne d’une exposition moyenne similaire à celle retrouvée dans les industries utilisant du platine.
Chez l'animal
Inhalation
FDTE/VTR Importer Lors d’exposition par inhalation en « nose-only » à 200 ou à 2 000 µg/m3, 4 heures par jour, 2 fois par semaine pendant 12 semaines à l’hexachloroplatinate de sodium chez le singe, les animaux exposés à la plus faible dose présentent un grand déficit pulmonaire 2 semaines après l’arrêt du traitement et les paramètres pulmonaires sont modifiés. Aucune hypersensibilité cutanée n’est rapportée. Les singes exposés à 2 000 µg/m3 ne présentent aucun changement par rapport aux animaux contrôles. Les mécanismes d'action de l'hexachloroplatinate de sodium n’ont pas été mis en évidence (Biagini et al., 1983).
Chez le singe, lors de l’exposition par inhalation pendant 12 semaines à l’hexachloroplatinate d’ammonium (200 µg/m3) ou à l’ozone (2 000 µg/m3 ou 1 ppm) ou à une combinaison des deux une hypersensibilité cutanée est observée (Biagini et al., 1986). Une hypersensibilité pulmonaire est également rapportée, mais uniquement lors d’une exposition concomitante à l’ozone. Il semblerait que les lésions cellulaires induites par l’ozone favorisent la pénétration des sels de platine dans l’épithélium pulmonaire et les autres tissus pulmonaires, ce qui induirait une augmentation des sites de fixation des protéines ou de l’absorption des sels de platine.
Voie cutanée
FDTE/VTR Importer Les effets observés chez l’homme sont retrouvés chez l’animal. Les sels de platine chlorés sont des sensibilisants cutanés chez le lapin, le cobaye et la souris lors d’administration sous cutanée ou intraveineuse de sulfate de platine 3 fois par semaine pendant 4 semaines à des concentrations de 0,05 à 0,3 mg/kg en présence ou non de chlorure d’ammonium (Kolpakova et Kolpakov, 1983, Taubler, 1977, Murdoch et Pepys, 1985). Une réaction croisée est retrouvée pour certains sels complexes tels que le tétrachloroplatinate d’ammonium et l’hexachloroplatinate d’ammomnium (Murdoch et Pepys, 1985).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Il n’y a pas de données disponibles chez l’homme.
Chez l'animal
Toutes voies
FDTE/VTR Importer Il n’existe pas de données expérimentales disponibles en dehors de celles concernant le cisplatine.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classés | 1998 |
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 1998 |
Chez l'homme
Toutes voies
FDTE/VTR Importer A notre connaissance, il n’existe pas de données concernant les effets du platine sur la fonction de reproduction chez l’homme.
Chez l'animal
Toutes voies
FDTE/VTR Importer Seules de rares études sont disponibles chez l’animal. La présence d’un fil de platine dans l’utérus de rates diminue l’implantation des œufs fertilisés (Chang et al., 1970 ; Tobert et Davies, 1977). Aucun effet embryotoxique ou foetotoxique n’est rapporté lors de l’introduction d’un fil de platine au sixième jour après l’implantation (Chang et Tatum, 1975). Dans tous les cas cités, les rares effets observés sont attribués à la présence d’un corps étranger dans l’utérus, et non à une action spécifique (Barlow et Sullivan, 1982).
Effets sur le développement
Chez l'animal
Toutes voies
FDTE/VTR Importer A notre connaissance, il n’existe pas de données concernant les effets du platine sur le développement chez l’homme.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'objectif de cette rubrique est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme.
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Crustacés :
Les essais réalisés par Biesinger et Christensen (1972) sur Daphnia magna sont effectués en conditions semi-statiques et les concentrations sont des concentrations nominales. On peut considérer ces essais comme valides.
Rauch et Morrison (1999) ont réalisés des essais sur Asellus aquaticus. Les résultats sont donnés en concentrations nominales. Les échantillons d’organismes testés ont été prélevés en milieu naturel.
Poissons :
Jouhaud et al., (1999) ont réalisé un test sur Brachydanio rerio en conditions semi-statiques et le résultat est basé sur des concentrations mesurées. La dureté de l’eau était de 400 mg/L CaCO3. Cet essai est donc valide.
Ferreira et Wolke (1979) ont effectué un test sur Oncorhynchus kisutch en conditions semi-statiques et les résultats sont donnés en concentrations nominales. La dureté de l’eau lors de l’essai était de 55,9 mg/L CaCO3.
Invertébrés benthiques :
Khangarot (1991) a réalisé un test sur Tubifex en conditions statiques par contamination de la colonne d’eau.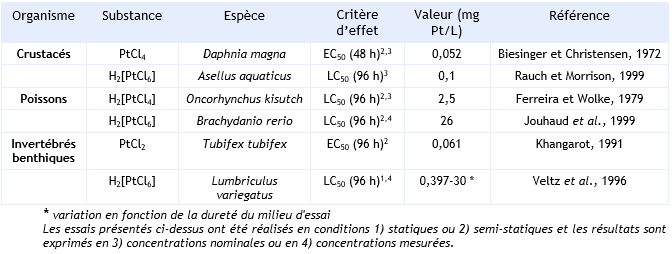
Paramètres d’écotoxicité chronique :
Les résultats d’essais réalisés par Biesinger et Christensen (1972) sur Daphnia magna correspondent à 16% d’effets sur la reproduction (EC16 = 14 µg/L). Ceci correspond au plus faible effet qu’ils aient pu détecter de façon reproductible. Les essais sont réalisés en conditions semi-statiques et les concentrations sont des concentrations nominales. Nous utiliserons ces résultats divisés par deux pour obtenir une NOEC (21 j). Ces essais sont valides.
Sol
FDTE/VTR Importer Il n’existe pas de données d’essais sur organismes terrestres.
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Compartiment aquatique :
Il existe des données long terme uniquement sur crustacés. Il existe des données aiguës vis à vis des poissons et invertébrés mais aucune donnée n'est disponible sur algues.
La PNEC pour les écosystèmes d’eaux douces peut être extrapolée de façon provisoire avec le résultat sur Daphnia magna de Biesinger et Christensen (1972) en utilisant un facteur d’extrapolation de 100. D’où :
PNECEAU-provisoire = 0,07 µg/L
Compartiment sédimentaire et terrestre :
Il n’est pas possible d’obtenir une PNEC pour les sédiments et le sol, car il n’existe pas de résultats vis à vis des organismes benthiques et terrestres.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

