Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Manganèse (7439-96-5)
Informations générales
Dernière vérification le 16/07/2025
Identification
Numero CAS
7439-96-5
Nom scientifique (FR)
Manganèse
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-105-1
Code SANDRE
1394
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Mn }\)
Code InChlKey
Code SMILES
[Mn]
Familles
Familles chimiques
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
54.94 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
Le Mn élémentaire et ses différents dérivés ne sont pas ou peu volatils. Leur présence dans l’air est essentiellement particulaire. Par déposition sèche ou humide, cette phase particulaire peut rejoindre la surface terrestre (HSDB 2003) ; (ATSDR 2000).
Le Mn présent dans l’atmosphère sous forme particulaire est principalement (à 80 %) associé à des particules ayant un diamètre équivalent inférieur à 5 µm (50 % de ces particules ayant même un diamètre équivalent inférieur à 2 µm), ce qui favorise le transport aérien de ces particules (ATSDR 2000).
Milieu eau douce
Dans l’eau, la mobilisation du Mn est favorisée par un potentiel redox faible et/ou un pH acide (IUCLID 2000a, IUCLID 2000b).
Le principal anion associé avec le Mn est le carbonate. La concentration en Mn est donc limitée par la relativement faible solubilité de MnCO3 (ATSDR 2000).
Les différents dérivés du Mn, y compris les dérivés organiques, sont le plus souvent transportés sur les matières en suspension dans l’eau et les sédiments. Dans les îles britanniques, il a été trouvé que 67 à 84 % du Mn total sont présents dans le milieu aquatique soit sur le littoral ou plus au large des îles (HSDB 2003) ; (ATSDR 2000) ; (OMS IPCS 1981).
Milieu terrestre
Le Mn et ses dérivés sont fortement retenus dans les sols, soit par des réactions d’échanges de cations (les ions Mn réagissent avec les composés chimiques présent à la surface de sol formant des oxydes, des hydroxydes et des oxyhydroxydes de Mn) soit par des réactions d’échanges de ligands (le Mn est alors adsorbé sur d’autres oxydes, hydroxydes ou oxyhydroxydes). Quand les eaux des sols se saturent sous forme d’oxydes, hydroxydes et oxyhydroxydes de Mn, ceux-ci précipitent entraînant une nouvelle phase qui va agir comme une nouvelle surface sur laquelle d’autres substances pourront s’adsorber (Evans 1989) cité par (ATSDR 2000).
Un autre exemple de modification existe dans le cas de sols calcaires : la chimiosorption sur les surfaces de particules de CaCO3,mécanisme important de fixation du Mn, qui peut aller jusqu’à la précipitation de MnCO3 (Adriano 1986).
Dans les sols, il existe un équilibre entre les formes divalentes et trivalentes du Mn : le Mn divalent est transformé par oxydation biologique en une forme trivalente, qui est elle-même réduite biologiquement en Mn divalent (IUCLID 2000a, IUCLID 2000b). Une dynamique d’équilibre peut s’établir entre les valences du Mn. Dans un sol faiblement aéré, la réduction biologique peut intervenir pour toutes les valeurs de pH. Dans le cas d’une aération usuelle, la réduction par les matières organiques dans les sols acides est importante et l’oxydation bactérienne est pratiquement inexistante : la forme divalente du Mn est dominante dans les sols acides (pH < 5,5). À l’inverse dans un sol basique (pH > 7), l’oxydation bactérienne est rapide et la réduction par les matières organiques lente : la forme trivalente domine (IUCLID 2000a, IUCLID 2000b) ; (Smith and Paterson 1995) ; (Adriano 1986). Quand la forme divalente du Mn est dominante, elle peut entrer en compétition avec d’autres cations dans les réactions d’échange, ou bien peut être fortement impliquée dans des réactions de complexation avec la matière organique des sols ou les racines des végétaux supérieurs (Kabata-Pendias and Pendias 1992) ; (Adriano 1986).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
Le carbonate de Mn se décolore lentement à l’air, et se décompose en oxyde manganeux avec dégagement de CO2 (IUCLID 2000a).
Le dioxyde de Mn n’est pas dégradable par photolyse (IUCLID 2000a).
Milieu eau douce
Paragraphe non concerné.
Milieu terrestre
La forme divalente du Mn en suspension argileuse ou limoneuse est oxydée par des microorganismes, ce qui entraîne la précipitation de minéraux de Mn (ATSDR 2000).
Le dioxyde de Mn est considéré comme non biodégradable (IUCLID 2000b).
Bioaccumulation
Organismes aquatiques
La bioaccumulation du Mn dépend de plusieurs facteurs, notamment de l'espèce dans laquelle elle se produit. Des facteurs de bioconcentration de 1 000, 5 000 et 10 000 ont été fixés respectivement pour les poissons, les crustacés et les mollusques par le GRNC (Groupe Radioécologie Nord Cotentin) (GRNC 1999).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Les plantes absorbent le Mn principalement sous sa forme divalente. En conséquence, le Mn est plus biodisponible dans les sols acides que dans les sols alcalins. Le chaulage des surfaces agricoles réduit ainsi la disponibilité du Mn pour les végétaux. En revanche, l’absorption du Mn par les végétaux est favorisée par la présence de microorganismes (Smith and Paterson 1995) ; (Kabata-Pendias and Pendias 1992) ; (Adriano 1986) ; (OMS IPCS 1981).
Plusieurs études conduisent à proposer des facteurs de bioconcentrations (BCF) pour des végétaux consommables. Les sols cultivés dans les études concernées ne correspondent pas à des sols présentant des teneurs en Mn au-delà des teneurs médianes (de l’ordre de 680 mg.kg-1) observées sur le territoire français (Baize 1997).
Dans l’étude de Tüzen (2003), les échantillons de sol sont prélevés, sur une profondeur de 15 cm environ, dans des sols agricoles non contaminés, où sont cultivés les végétaux étudiés. Les caractéristiques générales des sols prélevés ne sont pas données dans l’étude. La tomate (espèce non précisée) est le seul végétal décrit ci-après (le poivrier, le maïs et cinq variétés de champignons étant également abordés dans cette étude). Les échantillons de sol sont séchés à 110°C, broyés afin de passer au tamis à 0,2 mm, et conservés dans des bocaux en polyéthylène. Pour la digestion des échantillons de sol, 0,25 g de sol sont mis en contact pendant 26 min dans un four à micro-ondes avec 6 mL de HCl (30 %), 2 mL de HNO3 (65 %) et 2 mL de HF (40 %). Les échantillons de tomate sont nettoyés à l’eau distillée, séchés pendant 24 heures à 105°C, broyés et homogénéisés, et conservés dans des bocaux en polyéthylène. Pour la digestion des échantillons de tomate, 0,25 g de tomate sont mis en contact pendant 23 min dans un four à micro-ondes avec 6 mL de HNO3 (65 %) et 1 mL de H2O2 (30 %).
Les teneurs en Mn dans les échantillons ainsi préparés ont été analysées par Spectrométrie d’Absorption Atomique dans un four en graphite. Le tableau suivant donne la valeur de BCF proposée par cette étude (Tüzen 2003).
|
Concentration en Mn dans le sol (mg.kg-1 poids sec) |
Concentration en Mn dans la tomate (µg.kg-1 poids sec) |
BCF (poids sec) calculé à partir des données de l’étude |
|---|---|---|
|
139 |
76 |
5,5.10-4 |
Dans l’étude d’En et al. (2003), les sols étudiés sont des sols irrigués à proximité de déserts. Les caractéristiques générales des sols étudiés ne sont pas données dans l’étude. Les sols sont amendés avec du salpêtre, mais les quantités et les fréquences des apports ne sont pas précisées dans l’étude. Des blettes (espèce non précisée) sont cultivées sur ces sols (l’étude aborde également le cas du coton, qui ne sera pas repris ici). Les échantillons de végétaux sont prélevés à maturité, et différentes parties des plantes sont analysées. Seuls les résultats de la partie comestible (partie interne des tiges) sont repris ici. Tous les échantillons de sol (profondeur de prélèvement non précisée) et de végétaux sont séchés à l’air et conservés dans des sacs en polyéthylène. Les teneurs en Mn sont déterminées par l’analyse instrumentale d’activation de neutrons (INAA). Le tableau suivant donne la valeur de BCF proposée par cette étude (En, Vasidov et al. 2003).
|
Concentration en Mn dans le sol (mg.kg-1 poids sec) |
Concentration en Mn dans les blettes (mg.kg-1 poids sec) |
BCF (poids sec) calculé à partir des données de l’étude |
|---|---|---|
|
556 |
24,5 |
4,4.10-2 |
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents ((US EPA (IRIS) 1992, US EPA (IRIS) 1993, US EPA (IRIS) 1996a, US EPA (IRIS) 1996b) ; (INRS 1997) ; (ATSDR 2000); (ATSDR 2012); Santé Canda, 2016). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique.
Toxicocinétique
Chez l'homme
Absorption
Le Mn est un élément essentiel à la vie des humains et des animaux ; il joue un rôle de premier plan dans la constitution d'enzymes et de métalloenzymes. Il est impliqué dans le métabolisme énergétique (carbohydrates, lipides, protéines, phosphorylation oxydative), dans la synthèse de mucopolysaccharides ou de vitamines et dans la lutte contre le stress oxydant avec notamment la superoxyde dismutase qui est une métalloprotéine piégeant les radicaux libres (Sule, 2020). En France, la dose journalière recommandée est de 2 mg.j-1 (JORF 2010) et la consommation de Mn chez les adultes est estimée entre 0,7 et 10,9 mg.j-1 via la nourriture (OMS 2004).
Inhalation
Le taux d’absorption des composés du Mn par voie respiratoire n’est pas connu avec précision. D’une façon générale, l’absorption est fonction de la granulométrie des particules inhalées (seule la fraction de diamètre aérodynamique < 5 µm parvient jusqu’aux alvéoles) et l’hydrosolubilité des espèces concernées. Les particules de taille plus importante se déposent dans les voies respiratoires supérieures et l’arbre trachéobronchique, puis sont en grande partie éliminées vers le tractus digestif où l’absorption est faible. (Mena, Horiuchi et al. 1969) ; Lison, 2018).
Le Mn inhalé lors d’une exposition en milieu professionnel peut également être transporté au cerveau par l’appareil olfactif ou la partie haute de l’arbre respiratoire sans être soumis à une régulation homéostatique de l’absorption intestinale et du premier passage hépatique (Aschner et al., 2005; Roth, 2006).
Voie orale
Le niveau d’absorption du Mn dépend de la concentration intestinale en Mn et de la charge corporelle totale en Mn. Il est estimé entre 3 à 5 %, mais peut considérablement varier d’un individu à l’autre (Davidsson, Cederblad et al. 1988, Davidsson, Cederblad et al. 1989) ; (Mena, Horiuchi et al. 1969). Le Mn ingéré est soumis à un contrôle homéostatique par la régulation de son absorption dans le tube digestif et de son excrétion hépato-biliaire (cycle entéro-hépatique) (US EPA 2003, ATSDR 2012, Santé Canada 2016) : Ainsi, un apport élevé en Mn dans l’alimentation chez des adultes en bonne santé aboutit à une diminution de son absorption et à une augmentation de son excrétion biliaire et pancréatique (Finley et al. 2003, Aschner, Erikson, et Dorman 2005, Santé Canada 2016). Le déficit d’apport en fer ou une alimentation pauvre en protéines augmente l’absorption du Mn, un apport de calcium ou de phosphore la diminue ((Cotzias 1958) ; (Pollack, George et al. 1965) ; (Kilburn 1987)) Finley et al., 1999).
Le Mn (2+) est oxydé en Mn (3+) dans le duodénum du fait de son milieu alcalin ((Cotzias 1961)). Des données moléculaires récentes indiquent que l’absorption et l’excrétion du cation Mn2+ sont régulées par le transporteur divalent metal transporter-1 (DMT1) qui contrôle de l’homéostasie du Mn au niveau digestif. En effet, le fer et le Mn partagent ce même transporteur DMT1, dont il est connu que les expressions intestinale et biliaire sont régulées de manière coordonnée mais inverse (une réduction d’expression au niveau de l’entérocyte s’accompagne d’une augmentation au niveau biliaire). Alors que DMT1 transporte le Mn sous sa Mn2+, le récepteur de la transferrine (TfR) transporte le Mn Mn3+ lié à la transferrine (Lison, 2018) [)..
Voie cutanée
La seule étude disponible chez l’homme correspond à un cas d’exposition à une solution acide chaude contenant 6 % de Mn au cours de laquelle une légère augmentation du niveau de Mn dans les urines a été observée (Laitung and Mercer 1983).
Distribution
Le Mn, non soumis à la régulation homéostatique par inhalation et donc plus bio-disponible que par voie orale, diffuse passivement dans le système vasculaire capillaire pulmonaire.
Dans le sang, la plus grande partie du Mn se répartit principalement dans les érythrocytes (environ 66 %) et dans les leucocytes et les plaquettes (environ 30 %), la fraction plasmatique ne représentant que de 4 % du Mn, en partie lié à la transferrine (compétition avec le fer) impliquée dans son transport extra-hépatique (EFSA, 2013).
Les concentrations tissulaires les plus élevées de Mn sont retrouvées (par ordre décroissant) dans la moelle osseuse, le cerveau, les reins, le pancréas et le foie ((Cotzias 1958)). Environ 40 % du contenu corporel en Mn sont concentrés dans la moelle osseuse. Le Mn se concentre dans les tissus qui sont riches en mitochondries, où il va pouvoir altérer l'homéostasie calcique et accentuer les oxydations. Le Mn se trouve principalement dans les mitochondries et le compartiment nucléaire ((Wedler 1993), EFSA, 2013).
Le cerveau absorbe facilement le Mn de la circulation sanguine, et les niveaux peuvent augmenter dans le cerveau à la suite de fortes expositions. Chez les humains, le noyau caudé/le putamen et le globus pallidus ont été caractérisés comme étant les principaux organes cibles de neurotoxicité après une exposition au Mn (Pal et al., 1999; Aschner et al., 2005). Sa demi-vie dans le cerveau est de 53 jours chez l’Homme (ATSDR, 2000 ; Santé Canada 2016)..
Le corps humain contient environ 10 à 20 mg de Mn dont 5 à 8 mg qui sont échangés chaque jour ((Cotzias 1958) ; (Misselwitz, Muhler et al. 1995)).
La demi-vie du Mn a été étudiée chez l’homme : elle dépend de son état physiologique et de son exposition antérieure au Mn. La demi-vie plasmatique après injection intra-veineuse est de 1,34 minutes chez le sujet normal, de 2,03 minutes chez le mineur en bonne santé et de 1,44 minutes chez le sujet exposé chroniquement ((Cotzias, Horinchi et al. 1968)[1]). La demi-vie corporelle varie de 15 à 37,5 jours. Les sujets sains ont le taux d’élimination le plus faible, les sujets fortement exposés le taux le plus élevé.
Chez l’homme, les concentrations tissulaires varient entre 0,1 et 1 µg de Mn.g-1 de poids sec, avec les concentrations les plus élevées au niveau du foie, du pancréas et des reins, et les plus faibles au niveau des os et de la graisse ((Tipton and Cook 1963) ; (Sumino, Hayakawa et al. 1975)). Les concentrations sanguines, urinaires et sériques de personnes en bonne santé et non exposées d’Italie du nord ont été mesurées respectivement à 8,8 ± 0,2 µg.L-1, 1,02 ± 0,05 µg.L-1 et 0,6 ± 0,014 µg.L-1 ((Minoia, Sabbioni et al. 1990)). La concentration sanguine chez les adultes en bonne santé se situerait entre 4 et 15 μg.L-1 (ATSDR, 2012).
Les fœtus sont exposés au Mn qui peut traverser la barrière placentaire (Santé Canada 2016). De plus, les concentrations dans le sang du cordon ombilical sont deux à trois fois plus élevées que celles du sang maternel ((Wilson, Tubman et al. 1991)) ((Arnaud and Favier 1995)), EFSA, 2013 ; Henn, 2017).
Le Mn est également présent dans le lait maternel ; sa concentration est généralement comprise entre 4 et 10 µg.L-1 (Baud et Garnier, 2017).
[1] Publication non disponible
Métabolisme
Le Mn peut exister sous différents degrés d’oxydation : 2+,3+ et 4+.
Le Mn ne semble pas être métabolisé et l’excrétion n’est pas affectée par la présence ou l’absence d’autres ions métalliques.
Élimination
Le Mn (3+) est rapidement excrété dans la bile puis il est en partie réabsorbé (cycle entérohépatique). Le Mn est principalement éliminé par les fèces (jusqu’à 99 %) ((Cotzias 1961)).
Les nourrissons, et en particulier les nouveau-nés, ont une excrétion réduite puisque leur capacité d’excrétion biliaire n’est pas encore développée (US EPA 2003, ATSDR 2012, Santé Canada 2016).
Le Mn est absorbé et excrété sous forme inchangée. Cependant, des données limitées suggèrent qu’il peut changer d’état d’oxydation dans l’organisme ((ATSDR 2000)). Le taux et l’ampleur des réactions de réduction et d’oxydation du Mn peuvent être des facteurs déterminants dans la rétention et la toxicité du Mn dans l’organisme (Gibbons, Dixon et al. 1976)). L’élimination du Mn se fait principalement par voie biliaire et est régulée par un cycle entéro-hépatique (réabsorption intestinale) (Santé Canada 2016).Bien que majoritairement présent dans les fèces, de faibles quantités de Mn peuvent aussi être trouvées dans l’urine, la sueur et le lait maternel ((Schroeder, Balassa et al. 1966)), ATSDR, 2012).
Chez l'animal
Absorption
Inhalation
L’absorption du Mn par inhalation chez le rat est plus facile pour les formes chimiques solubles (Roels, Meiers et al. 1997).
Voie orale
Par voie orale, l’absorption du Mn est fonction de l’âge. En effet, l’administration de façon intermédiaire ou chronique de tétraoxyde de Mn à des rats a entraîné une augmentation plus importante de la concentration tissulaire en Mn chez les jeunes rats que chez ceux plus âgés (Rehnberg, Hein et al. 1980, Rehnberg, Hein et al. 1981, Rehnberg, Hein et al. 1982). Cette augmentation serait due à une plus grande absorption du Mn chez les nouveau-nés, résultant d’un transport plus lent au niveau de l’intestin (Rehnberg, Hein et al. 1985). Chez les rats, l’absorption intestinale du dichlorure de Mn a été estimée entre 2,5 et 8,2 % (Pollack, George et al. 1965) ; (Davis, Zech et al. 1993).
Voie cutanée
Il n’existe pas de données.
Distribution
Le cerveau constitue l’organe cible des expositions par inhalation avec un tropisme spécifique pour le bulbe olfactif, le striatum et le cervelet (Dorman, Struve et al. 2001, Dorman, Struve et al. 2001, Dorman, McManus et al. 2004a, Dorman, McManus et al. 2004b, Dorman, McElveen et al. 2005a, Dorman, McElveen et al. 2005b, Dorman, Struve et al. 2006a) ; Evans, 2020) et dans le ganglion basal chez les primates (Brenneman, Cattley et al. 1999, Aschner, Erikson et al. 2005, Dorman, Struve et al. 2006b, Bock, Paiva et al. 2008). La principale voie de pénétration du Mn dans le cerveau à partir de la circulation sanguine est le passage par les cellules endothéliales des capillaires sanguins de la barrière hémato-encéphalique et par le liquide cérébral via les plexus choroïdes (Crossgrove and Yokel 2005, Bock, Paiva et al. 2008). Plusieurs mécanismes de transport pourraient être impliqués (Crossgrove and Yokel 2004, Aschner, Erikson et al. 2005, Crossgrove and Yokel 2005, Roth 2006, Aschner, Guilarte et al. 2007). Sa demi-vie dans le cerveau est comprise entre 51 et 74 jours chez le rat, et est de 53 jours chez le macaque (Santé Canada, 2016).
Le passage placentaire lors d’expositions répétées au Mn par inhalation est limité mais possible (Crossgrove and Yokel 2004, Aschner, Erikson et al. 2005, Crossgrove and Yokel 2005, Dorman, McElveen et al. 2005a, Dorman, McElveen et al. 2005b, Roth 2006, Aschner, Guilarte et al. 2007).
Métabolisme
Le Mn n’est pas métabolisé. Des données limitées suggèrent que le Mn inorganique peut subir des changements d’état d'oxydation dans les systèmes biologiques et en particulier une conversion du Mn II en Mn III (ATSDR 2012). Dans le foie et la circulation sanguine, une partie du Mn II est oxydée en Mn III lié à la transferrine. Il en est de même dans le compartiment cellulaire en réagissant avec des espèces radicalaires tels que des anions superoxydes (Santé Canada 2016).
Élimination
Différentes études réalisées chez des animaux ont indiqué que chez les jeunes, l’élimination n’était pas bien développée et qu’il pouvait en résulter une accumulation du Mn dans l’organisme. (Cotzias, Miller et al. 1976) ont ainsi observé que chez des souris, des rats et des chats, l’excrétion était presque complètement absente pendant la période néonatale.
Autre
Modèles PBPK
Plusieurs modèles PBPK existent. Les premiers développements ont été proposés par (Andersen, Gearhart et al. 1999) puis d’autres ont développé des modèles chez le rat et le singe (Teeguarden, Dorman et al. 2007, Teeguarden, Dorman et al. 2007, Teeguarden, Gearhart et al. 2007, Nong, Teeguarden et al. 2008, Nong, Taylor et al. 2009), pour les effets neurologiques ((Schroeter, Dorman et al. 2012) et pour le transport depuis la muqueuse olfactive jusqu’au striatum (Leavens, Rao et al. 2007)) ou pour la période de gestation et de lactation chez le rat ((Yoon, Nong et al. 2009, Yoon, Nong et al. 2009) ou chez l’homme pour l’adulte, le fœtus et le nouveau-né (Schroeter, Nong et al. 2011, Yoon, Schroeter et al. 2011).
Synthèse
Il n’existe pas de données quantitatives chez l’homme concernant l’absorption du Mn par inhalation. L’absorption digestive est faible (entre 3 à 5 %). Le Mn est distribué dans la moelle osseuse, le cerveau, les reins, le pancréas et le foie. Il peut s’accumuler au niveau du cerveau. Le Mn (3+) est rapidement excrété dans la bile puis en partie réabsorbé (cycle entérohépatique). Le Mn est principalement éliminé par les fèces (jusqu’à 99 %).
Toxicité aiguë
Chez l'homme
Inhalation
L’exposition aiguë au Mn est responsable de divers syndromes pulmonaires : fièvre des métaux, pneumonie au Mn. La fièvre des métaux est causée par l’inhalation de petites particules métalliques (0,05 à 0,1 µm) qui pénètrent profondément dans l’arbre respiratoire. Les particules activent les macrophages, entraînent une inflammation locale et des réactions vasomotrices. Ces particules de Mn ne causent pas d’atteinte structurelle ; les signes sont réversibles sans séquelles.
Les manifestations cliniques débutent par une sensation de sécheresse et d’un goût métallique dans la bouche. Puis survient une fièvre, des sueurs, des nausées, une irritation oropharyngée, une toux, des myalgies, des arthralgies et des céphalées. Ces signes se manifestent plusieurs heures après l’exposition. Ces symptômes régressent aux environs de 36 heures après l’arrêt de l’exposition (Lesser and Weiss 1995).
La pneumonie au Mn a été décrite dans l’industrie minière, dans les usines de fabrication du permanganate de potassium ou de batteries sèches (Rodier 1955) ; (Davies 1946). Il existe une atteinte directe de l’épithélium respiratoire et une action immunosuppressive (Davies 1946). La symptomatologie est caractérisée par une dyspnée et une fièvre, rarement accompagnée de toux et d’une expectoration visqueuse. La radiographie pulmonaire montre des images de pneumonie ou d’hémorragie pulmonaire.
Voie orale
La toxicité aiguë au Mn chez l'homme se caractérise par une détérioration neurologique avec une bradykinésie, des tremblements, une altération des réflexes posturaux et une dystonie, associés à des taux urinaire, sanguin et fécal de Mn élevés (Finley, 2004).
Aucune des études de cas répertoriées dans la littérature ne permettent de faire un lien direct de causalité entre l’exposition au Mn et les effets observés (faiblesse musculaire et perturbations neurologiques dans un cas (Holzgraefe et al., 1986), et léthargie, vomissements, douleurs abdominales diffuses, diarrhée abondante, insuffisance hépatique, atteinte rénale aiguë, détresse respiratoire aiguë, dysfonction du myocarde, et choc avec acidose lactique dans le second cas (Sanchez et al., 2012) (Santé Canada, 2012).
Voie cutanée
Nous ne disposons pas de données.
Synthèse
L’exposition aiguë au Mn, essentiellement par inhalation, est responsable de deux syndromes pulmonaires : la fièvre des métaux et une pneumonie au Mn. La pneumonie au Mn est caractérisée par une fièvre, une toux, une expectoration visqueuse, suivies de signes cliniques et radiologiques d’une pneumonie. Par voie orale, les dérivés du Mn ont une faible toxicité aiguë.
Chez l'animal
Toutes voies
Une augmentation de la mortalité liée à la dose a été observée chez des souris DC-1 exposées par inhalation à différentes concentrations de tétraoxyde de Mn pendant 2 heures, puis exposées à un aérosol de Streptococcus pyogenes pendant 20 minutes (Adkins, Luginbuhl et al. 1980).
L’administration intra-trachéale d’oxydes de Mn a entraîné une congestion, un œdème pulmonaire et des modifications histologiques des poumons chez de jeunes rats (Stokinger 1981).
Voie orale
Par voie orale, les dérivés du Mn ont une faible toxicité aiguë.
Le tableau suivant présente des valeurs de DL50 obtenues pour différents dérivés du Mn après exposition par voie orale ou par injection.
Un certain nombre d’effets neurologiques ont été constatés chez des rats ayant été exposés par gavage à une seule dose de MnCl2 aqueux (50 mg.kg-1 MnCl2·H2O), caractérisés par une diminution importante et réversible de l’activité générale, des retards aux tests d’évitements et de réflexes conditionnés (Shukakidze et al., 2003).
Toxicité aiguë de différents dérivés du Mn
|
|
Dérivés |
DL50 (mg.kg-1) |
Espèces |
Références |
|---|---|---|---|---|
|
Voie orale |
Dichlorure de Mn tétrahydraté |
1 484 |
Rats Sprague-Dawley |
(Holbrook, Washington et al. 1975) |
|
|
Dichlorure de Mn |
1 715 |
Souris |
(Lewis and Sweet 1984) |
|
|
|
804 |
Rats albinos (M) |
(Kostial, Kello et al. 1978) |
|
|
|
642 |
Rats Wistar albinos (M) |
(Singh and Junnarkar 1991) |
|
|
|
412 |
Rats Sprague-Dawley (M) |
(Holbrook, Washington et al. 1975) |
|
|
|
331 |
Rats Wistar (F) |
(Kostial, Kello et al. 1978) |
|
|
Acétate de Mn |
3 730 |
Rats |
(Lewis and Sweet 1984) |
|
|
|
1 082 |
Rats |
(Smyth, Carpenter et al. 1969) |
|
|
Sulfate de Mn |
782 |
Rats Wistar albinos (M) |
(Singh and Junnarkar 1991) |
|
|
Permanganate de potassium |
1 090 |
Rats |
(Stokinger 1981) |
|
Injection |
Dichlorure de Mn tétrahydraté |
190 (IP) |
Souris |
(Lewis and Sweet 1984) |
|
|
|
138 (IP) |
Rats |
(Lewis and Sweet 1984) |
|
|
Dichlorure de Mn |
121(IP) 255 (IM) |
Souris |
(Lewis and Sweet 1984) |
IP : intrapéritonéale, IM : intramusculaire, M : mâle, F : femelle
Voie cutanée
Aucune donnée n’est disponible
Synthèse
Les données chez l’animal confirment l’atteinte pulmonaire par inhalation et la faible toxicité aiguë par voie orale.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Effets neurologiques
Le système nerveux central est une cible cruciale de la toxicité du Mn chez les humains.
Lors d’expositions chroniques au Mn, ce sont des atteintes du SNC qui prédominent (manganisme). Les symptômes sont à la fois des troubles psychiatriques et des atteintes purement neurologiques. Les troubles psychiques précèdent habituellement les déficits moteurs (Calne, Chu et al. 1994). Le Mn agit sur les noyaux gris centraux au niveau du cerveau, principalement à l’origine d’une dégénérescence du segment médian du globus pallidus (Mergler, Huel et al. 1994). A un moindre degré, le noyau caudé et le putamen sont atteints (Pal et al., 1999; Aschner et al., 2005). La substance noire est rarement altérée ce qui permet de différencier le pseudoparkinson manganique de l’authentique maladie de Parkinson (Lu, Huceny et al. 1994).
Différents mécanismes interdépendants semblent participer à la genèse de ces lésions cérébrales tels qu’un dysfonctionnement mitochondrial (Zheng et al., 1998), la formation de radicaux libres (Taylor et al., 2006), ou encore la diminution des taux de catécholamines, de sérotonine, de dopamine (Takeda 2003) ; (Mergler, Huel et al. 1994) ; (Archibald and Tyree 1987). Les travaux les plus récents montrent en effet qu’il s’accumule en particulier dans les neurones riches en dopamine où il peut moduler les transporteurs ou récepteurs à la dopamine, altérer le système GABAergique qui s’accompagne d’une accumulation extracellulaire de glutamate et donc d’une atteinte de la neurotransmission (Santé Canada, 2019).
Trois stades ont été décrits dans l’intoxication chronique au Mn : prodromal, intermédiaire et le manganisme.
Le plus souvent les premiers troubles concernent la sphère cognitive et des troubles émotionnels. Une asthénie, une anorexie, des troubles musculaires, une nervosité, une irritabilité, des accès de violence, une insomnie, une baisse de la libido, et une labilité des effets sont observés (Mergler, Huel et al. 1994).
La phase intermédiaire est marquée par des rires avec des cris inappropriés, des troubles de la parole, des mouvements désordonnés, des réflexes ostéo-tendineux des membres inférieurs vifs, un facies figé, des hallucinations visuelles, une hypersialorrhée et une confusion. Les patients ont conscience de leurs troubles.
A la phase d’état, les troubles sont proches de ceux de la maladie de Parkinson. Les plaintes les plus fréquentes sont des douleurs musculaires généralisées suivies par des difficultés à marcher et à parler.
Expositions professionnelles
Les signes explicites de manganisme ont été observés pour des expositions de 2 à 22 mg de Mn.m-3 après environ 1 à 2 ans d’exposition. Dans certains cas, ces durées peuvent atteindre une dizaine d’années (Rodier 1955, Schuler, Oyanguren et al. 1957, Whitlock, Amuso et al. 1966, Tanaka and Lieben 1969, Cook, Fahn et al. 1974, Saric, Markicevic et al. 1977).
Typiquement, les signes cliniques ne surviennent qu’après quelques années d’exposition, mais chez certains individus, ils peuvent apparaître après 1 à 3 mois d’exposition (Rodier 1955). Peu de données sont disponibles au sujet de la réversibilité des effets. Ils paraissent en grande partie irréversibles dans les phases évoluées, mais une amélioration peut survenir lors de l’arrêt de l’exposition (Smyth, Ruhf et al. 1973).
Au cours des dernières années, les niveaux d’exposition ont diminué et les effets neurologiques sont moins marqués. Aussi, de nombreuses études épidémiologiques ont évalué les effets psychologiques et neurologiques d’une exposition à de faibles niveaux de Mn sur le lieu de travail (Roels, Lauwerys et al. 1987, Iregren 1990, Wennberg, Iregren et al. 1991, Roels, Ghyselen et al. 1992, Chia, Foo et al. 1993, Chia, Gan et al. 1995, Lucchini, Selis et al. 1995) ; (Roels, Ortega Eslava et al. 1999) ; (Beuter, Edwards et al. 1999, Crump and Rousseau 1999, Gibbs, Crump et al. 1999, Deschamps, Guillaumot et al. 2001, Bouchard, Mergler et al. 2003, Myers, teWaterNaude et al. 2003, Myers, Thompson et al. 2003, Bast-Pettersen, Ellingsen et al. 2004, Bouchard, Mergler et al. 2005, Blond and Netterstrom 2007, Blond, Netterstrom et al. 2007, Bouchard, Mergler et al. 2007a, Bouchard, Mergler et al. 2007b, Summers, Summers et al. 2011) ou via le milieu environnemental dans la zone à proximité de site industriels émettant du Mn (Mergler, Baldwin et al. 1999, Rodriguez-Agudelo, Riojas-Rodriguez et al. 2006, Lucchini, Albini et al. 2007, Standridge, Bhattacharya et al. 2008, Solis-Vivanco, Rodriguez-Agudelo et al. 2009, Riojas-Rodriguez, Solis-Vivanco et al. 2010, Hernandez-Bonilla, Schilmann et al. 2011, Kim, Bowler et al. 2011, Menezes-Filho, Novaes Cde et al. 2011).
Certaines de ces études ont montré une différence statistiquement significative entre les groupes exposés et non-exposés ou une association statistiquement significative entre niveaux d’exposition et effets neurologiques (Roels, Lauwerys et al. 1987, Iregren 1990, Wennberg, Iregren et al. 1991, Roels, Ghyselen et al. 1992, Chia, Foo et al. 1993, Mergler, Huel et al. 1994, Lucchini, Selis et al. 1995) ; (Lucchini, Apostoli et al. 1999, Bast-Pettersen, Ellingsen et al. 2004) et sont synthétisées dans le tableau ci-dessous alors que d’autres ne retrouvent pas d’association statistiquement significative (Gibbs, Crump et al. 1999, Deschamps, Guillaumot et al. 2001, Myers, teWaterNaude et al. 2003, Myers, Thompson et al. 2003, Young, Myers et al. 2005, Summers, Summers et al. 2011). Ces différents résultats sont présentés dans le tableau ci-dessous.
Synthèse des principales études présentant des résultats statistiquement significatifs aux tests neurologiques (d’après (Bailey, Goodman et al. 2009) et ATSDR, 2012)
|
Référence Pays |
Population exposée |
Population non-exposée |
Durée moyenne d’exposition (ans) |
NOAEC / LOAEC (µg.m-3) |
Résultats statistiquement significatifs associés à l’exposition au Mn |
|---|---|---|---|---|---|
|
Roels et al. (1992) Belgique |
92 employés d’une usine de fabrication de piles sèches |
101 employés d’une usine de polymères |
5,3 |
LOAEC : Moyenne géométrique Mn inhalable 150 µg.m-3 |
Temps de réaction visuel Coordination œil main Stabilité de la main |
|
Chia et al. (1993) Singapore |
17 employés d’une usine d’ensachage de plantes |
17 employés du nettoyage en milieu hospitalier |
7,4 |
LOAEC : Moyenne en Mn total 1 590 IC 95 % [1 190-1 990] |
Vitesse motrice Balayage visuel Coordination visio-motrice Vitesse de réponse visio-motrice Stabilité de la coordination visio-motrice |
|
Mergler et al. (1994) Québec |
115 employés d’une usine ferro/silico Mn |
145 employés des usines environnantes |
16,7 |
LOAEC : Moyenne arithmétique Mn inhalable 122 |
État émotionnel Fonctions motrices Flexibilité cognitive Seuil de perception olfactif |
|
Bouchard et al. (2006, 2007) Suite de la cohorte de Mergler et al. 1994 Québec |
77 employés d’une usine ferro/silico Mn |
81 employés des usines environnantes |
15,7 |
LOAEC : Moyenne arithmétique Mn inhalable 122 |
Dépression et anxiété Faibles résultats : (Echelle motrice de Luria, Stabilité de la main, test tri des mots par couleurs et test de confusion de désorientation |
|
Gibbs et al. 1999 Mississippi du Nord USA |
Employés d’une usine de piles avec des expositions récentes (63) et/ou ancienne (12) |
73 employés d’une usine de pigment de dioxyde de titane et 2 d’une usine de production de chlorate de sodium |
12,7 |
NOEC : moyenne arithmétique Mn inhalable (SD) 66 (59) |
- |
|
Lucchini et al., 1995 Italie |
58 hommes usines d’alliage au cours d’un arrêt de travail forcé : 19 expositions élevées, 19 expositions moyennes et 20 expositions faibles |
Aucun |
13,8 (élevé) 11,8 (moyen) 12,9 (faible) |
Étendue des moyennes géométriques (au cours des années) : 270-1 590 |
Additions Test de reconnaissance symbole-chiffre Test de tapotement des doigts Test de reconnaissance de chiffre |
|
Lucchini et al., 1999 Suite de l’étude de Lucchini et al., 1995 Italie |
58 hommes usines d’alliage |
87 ouvriers de maintenance ou auxiliaires d’un hôpital local |
15,2 |
Moyenne géométrique en Mn total : 97 |
Irritabilité, perte d’équilibre et rigidité Test de reconnaissance symbole-chiffre Test de tapotement des doigts Test de reconnaissance de chiffre |
|
Crump et Rousseau (1999) Belgique |
114 ouvriers de l’oxyde de Mn |
104 ouvriers d’usine chimique |
14 |
Médiane de Mn total : 970 |
- |
|
Deschamps et al., (2001) France |
138 ouvriers de l’émail |
137 techniciens des services publics et travailleurs issus d’opérations municipales |
19,9 |
NOAEC : Moyenne arithmétique (SD) Mn inhalable : 57 (84) |
|
|
Bat Pettersen et al. (2004) Pas localisée |
100 employés d’usine d’alliage de Mn |
100 employés d’usine de production de silicium et micro silicium et poussières de dioxyde de titane et de fonte |
20,2 |
LOAEC : moyenne arithmétique (étendue) Mn inhalable : 64 (3-356) |
Test de Tremblement postural positif Augmentation des temps de réaction Large dispersion des fréquences de tremblement Augmentation des tremblements chez les fumeurs exposés versus non-fumeurs exposés |
|
Young et al. 2005 Afrique du Sud |
509 employés d’une fonderie de Mn |
67 ouvriers d’une usine d’assemblement de composants électriques |
18,2 |
NOAEL : médiane (étendue) Mn inhalable :58 (3-510) |
Test de reconnaissance symbole-chiffre Test de tapotement des doigts Test de reconnaissance de chiffre Batterie de test neuropsychiques de Luria-Nebraska |
Différentes études épidémiologiques ont étudié l’apparition de signes neurologiques précliniques précoces de la maladie. Une altération du temps de réaction, de la mémoire audio-verbale à court terme, de la coordination œil-main, ainsi que des tremblements des mains ont été observés chez des travailleurs exposés (Roels, Lauwerys et al. 1987, Iregren 1990, Roels, Ghyselen et al. 1992, Mergler, Huel et al. 1994). Ainsi, une étude transversale a été réalisée chez 92 ouvriers d’une usine de fabrication de piles sèches, exposés pendant une durée moyenne de 5,3 ans (5 jours par semaine, 8 heures par jour) à une concentration moyenne de 215 µg de Mn.m-3 dans les poussières inhalables, et 948 µg de Mn.m-3 dans les poussières totales, sous forme de dioxyde de Mn (Roels, Ghyselen et al. 1992). La population témoin appariée a été sélectionnée chez des travailleurs non-exposés. En comparaison avec le groupe de 92 témoins appariés, les travailleurs exposés ont présenté des performances moindres sur les tests neurocomportementaux, notamment au niveau du temps de réaction, de la coordination œil-main, et de la stabilité de la main.
Les signes précoces de toxicité au niveau du système nerveux seraient observés pour des expositions comprises entre 0,007 et 0,97 mg de Mn.m-3, mesurés en Mn total ou en considérant la fraction particules inhalables pour des durées d’expositions de 5 à 15-20 ans (Roels, Lauwerys et al. 1987, Iregren 1990, Wennberg, Iregren et al. 1991, Roels, Ghyselen et al. 1992, Chia, Foo et al. 1993, Mergler, Huel et al. 1994, Chia, Gan et al. 1995, Lucchini, Selis et al. 1995).
Expositions environnementales
Plusieurs études ont également évalué l’effet d’une exposition environnementale au Mn.
Une étude a porté sur 168 femmes et 120 hommes issus de 8 communautés à proximité de sites d’extraction ou d’utilisation de Mn (Rodriguez-Agudelo, Riojas-Rodriguez et al. 2006). Si les résultats de 3 des 24 tests neurocomportementaux pratiqués se sont révélés statistiquement significatifs avec un OR de 1,99 (IC 95 %) [1,15 – 3,43] pour la coordination des mouvements et la performance de la main gauche, de 1,98 IC 95 % [0,99 – 3,95] pour le changement de position de la main gauche et de 2,08 IC 95 % [1,17 – 3,71] pour une réaction conflictuelle, un test de la régulation verbale de déplacement. Ces différents tests n’ont pas été jugés suffisants. Ces résultats ont été confirmés au cours d’une nouvelle série de tests pratiqués sur la même population (Solis-Vivanco, Rodriguez-Agudelo et al. 2009).
Dans la même région, une étude menée chez 79 enfants âgés de 7 à 11 ans exposés au Mn à des concentrations de 0,13 µg.m-3 pendant au moins 5 ans a montré une association statistiquement négative entre l’exposition au Mn et des altérations des capacités verbales et des résultats obtenus par l’échelle d'intelligence de Wechsler révisée pour les enfants (Riojas-Rodriguez, Solis-Vivanco et al. 2010). Sur la même population d’enfants, seule une très légère altération des performances de vitesse motrice et de coordination a été constatée à l’issue d’une autre étude utilisant une nouvelle batterie de tests ; il n’y a pas de corrélation entre les niveaux de Mn dans le sang, les cheveux et les effets dans les tests moteurs (Hernandez-Bonilla, Schilmann et al. 2011). Des résultats similaires ont été retrouvés au cours d’une étude menée auprès de 83 enfants âgés de 6 à 12 ans résidants dans un rayon de 2 km d’une usine d’alliage de ferro-manganèse émettant des niveaux élevés de Mn depuis plus de 40 ans (Menezes-Filho, Novaes Cde et al. 2011). Les résultats des différents tests montrent que l’exposition à des niveaux de Mn dans l’air présente des effets défavorables sur la fonction de cognition aussi bien chez les adultes que chez les enfants et plus particulièrement dans le domaine verbal. Les niveaux de Mn sanguin et dans les cheveux mesurés dans cette population étaient respectivement de 8,2 µg.L-1[2,7 -23,4] et 5,83 µg.g-1 [0,1 – 86,68]. Une autre étude menée chez des enfants âgés de 7 à 11 ans de la région de Mexico a montré une association négative entre exposition au Mn et la capacité de mémorisation et d’apprentissage (Torres-Agustin, Rodriguez-Agudelo et al. 2013).
Enfin, une étude menée en Italie, dans la région de Brescia, chez des populations voisines de sites industriels utilisant des alliages fer-Mn a montré que des désordres de type parkinsonien étaient augmentés de manière statistiquement significative pour les niveaux d’exposition au Mn les plus élevés sans pour autant qu’une relation dose-effet soit établie (Lucchini, Albini et al. 2007). Sur le même site, une étude menée chez les adolescents a montré, à partir d’une batterie de tests, qu’une augmentation statistiquement significative des tremblements et une altération des fonctions olfactive et motrice sont associés aux niveaux de Mn sanguin (11,11 µg.L-1) et dans les cheveux (0,17 ppm) )Lucchini, Guazzetti et al. 2012).
Si les études relatives aux expositions environnementales ont décelé des altérations des performances neurocomportementales aussi bien chez l’enfant que chez l’adulte ou des désordres de type parkinsonien, les résultats ne sont le plus souvent pas suffisants pour conclure.
Des études ont montré que la co-exposition entre le plomb et le Mn doit être prise en compte spécialement chez les jeunes enfants du fait d’une synergie possible )Claus Henn, Schnaas et al. 2012)
Effets pulmonaires
L’exposition par inhalation de dioxyde ou de tétraoxyde de Mn peut également entraîner une réponse inflammatoire au niveau des poumons, avec de la toux, des bronchites, et parfois des pneumonies (ATSDR 2000). Des travailleurs exposés à une concentration moyenne de 0,97 mg.m-3 de Mn (sous les formes dioxyde, tétraoxyde, sulfate, carbonate et nitrate) pendant une durée moyenne de 7,1 ans, ont présenté, par rapport à un groupe témoin, une fréquence plus importante de toux, de dyspnées pendant l’exercice, d’épisodes de bronchites aiguës et d’altération des paramètres ventilatoires (Capacité Vitale Forcée, VEMS (Volume Expiratoire Maximale Seconde), Débit Expiratoire de Pointe) (Roels, Lauwerys et al. 1987).
Voie orale
Il existe peu de données concernant la toxicité chronique du Mn, en particulier neurologique, chez l’homme après ingestion, probablement parce que l’organisme exerce un fort contrôle homéostatique sur la quantité de Mn absorbée suite à une exposition par voie orale. Ce contrôle protège ainsi l’organisme des effets toxiques du Mn (ATSDR 2000).
Six familles japonaises (environ 25 personnes) exposées à de fortes concentrations de Mn dans l’eau potable (14 mg.L-1) ont présenté des symptômes de type manganisme (Kawamura, Ikuta et al. 1941). Les symptômes observés étaient une rigidité musculaire, des tremblements, une perturbation mentale, et deux personnes sont décédées. Cependant certains aspects de cette étude suggèrent que le Mn n’est pas le seul responsable de ces effets. En effet, le syndrome s’est développé rapidement (2 à 3 semaines), l’évolution a été rapide (dans un cas, il s’est passé 3 jours entre les premiers symptômes et la mort), et les symptômes ont disparu avant que la concentration de Mn dans l’eau ne soit significativement diminuée.
Plusieurs études ont cherché à mettre en évidence les effets d’une consommation chronique d’eau présentant des niveaux élevés de Mn : 1,8 – 2,3 mg.L-1 (Kondakis, Makris et al. 1989) et 0,3 mg.L-1 (Vieregge, Heinzow et al. 1995) mais les résultats de ces études sont difficilement interprétables notamment en raison des tests utilisés qui sont plus spécifiques du diagnostic de la maladie de Parkinson.
Des difficultés d’apprentissage chez des enfants de 11 à 13 ans ont été associées à une ingestion excessive de Mn (He, Liu et al. 1994, Zhang, Liu et al. 1995). Cependant, une telle association n’est pas suffisante pour établir une relation de cause à effet puisque de nombreux autres composés, dont le plomb, ont pu être impliqués (Pihl and Parkes 1977).
Une étude transversale a investigué la fonction intellectuelle chez 142 enfants âgés de 10 ans au Bangladesh ayant consommé de l’eau présentant une concentration de 793 µg.L-1 de Mn et de 3 µg.L-1 d’arsenic (Wasserman, Liu et al. 2006). Après ajustement des résultats, les enfants qui ont été exposés au Mn au niveau le plus élevé (en moyenne 0,07 mg Mn.kg-1.j-1) ont présenté une diminution significative de l’ensemble des performances aux tests du quotient intellectuel (QI) et aux tests verbaux. Des résultats similaires ont été retrouvés dans une autre étude menée dans la même région sur 151 enfants âgés de 8 à 11 ans (Wasserman, Liu et al. 2011). Après ajustement pour les facteurs sociodémographiques, une association négative statistiquement significative entre les concentrations en Mn dans le sang et le travail de mémoire et le raisonnement perceptif est mesurée par les tests d’intelligence chez les enfants a été mise en évidence. D’autres contaminants (arsenic) ayant pu interférer sur ces résultats ne sont pas exclus.
Différentes études ont signalé qu’une augmentation des concentrations sanguines et cérébrales en Mn chez des individus cirrhotiques, ou souffrant de pathologies chroniques du foie, pourrait être une cause de l’encéphalopathie et des symptômes neurologiques rencontrés (Devenyi, Barron et al. 1994, Hauser, Zesiewicz et al. 1994, Spahr, Butterworth et al. 1996, Pomier Layrargues, Rose et al. 1999).
Voie cutanée
Nous ne disposons pas de données.
Synthèse
Chez l’homme, les atteintes du SNC (ou manganisme) prédominent lors d’expositions chroniques par inhalation, caractérisées par des signes généraux non spécifiques, des manifestations neurocomportementales psychiques avec altération des fonctions cognitives, des manifestations neurologiques liées à l’atteinte du système extrapyramidal (trouble parkinsonien distinguable de la maladie de Parkinson) parfois appelées Parkinson manganique. Ces signes apparaissent généralement après plusieurs années d’exposition.
Une réponse inflammatoire au niveau des poumons, avec de la toux, des bronchites, des pneumonies, peut aussi être observée pour certains dérivés. Très peu de données sont disponibles concernant les effets après ingestion : l’organisme exerce un fort contrôle homéostatique sur la quantité de Mn absorbée, protégeant ainsi l’organisme de ces effets toxiques.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
Substance Chimique (CAS) |
Voies d’exposition |
Taux d’absorption |
Organe cible |
|---|---|---|---|
|
Manganèse |
Inhalation |
ND |
SNC*, Poumon |
|
Ingestion |
3 à 5 % |
Foie, pancréas, reins, SNC* |
|
|
Cutanée |
ND |
ND |
*SNC : Système nerveux central
Chez l'animal
Inhalation
Des singes rhésus exposés par inhalation de 0 à 30 mg.m-3 de poussières de Mn, 6 h/j, 5 j/sem pendant deux ans (Bird, Anton et al. 1984), ont présenté une diminution significative des concentrations en dopamine dans diverses régions du cerveau (noyau caudé et globus pallidus).
Plus récemment, de jeunes singes (4 à 6 par dose) ont été exposés à des aérosols de 0 – 0,06 – 0,3 ou 1,5 mg Mn.m-3 de sulfure de Mn 6 h.j-1, 5 j/sem. pendant 65 jours (Dorman et al., 2005). Seuls les animaux exposés à la plus forte concentration ont présenté une bronchiolite subaiguë, visible après les 15 premiers jours d’exposition et caractérisée par une infiltration de cellules inflammatoires (neutrophiles, lymphocytes) dans le tissu conjonctif péribronchiolaire, évoluant progressivement vers un plus grand nombre de bronchiolites au cours de l’exposition, pour régresser rapidement après l’arrêt de l’exposition et n’être plus visible 45 jours après les 13 semaines d’exposition. Les auteurs n’ont observé aucun signe clinique de toxicité lié à l’exposition des aérosols de sulfure de Mn.
Les tests neurocomportementaux chez la souris ont détecté des signes tels qu’uneaugmentation de l’activité en liberté et une diminution du délai de récupération des petits, pour des niveaux élevés d’exposition au Mn 60-70 mg Mn.m-3 (Lown, Morganti et al. 1984, Morganti, Lown et al. 1985).
Plusieurs études ont mis en évidence une association entre une diminution du nombre de cellules neuronales dans le globus pallidus et les altérations neurocomportementales (augmentation de l’activité locomotrice) chez les rats pour une exposition pendant 13 semaines à un mélange de sulfate et phosphate de Mn (1,05 mg Mn.m-3) ou de sulfate de Mn seul pour des concentration allant jusqu’à 1,1 mg Mn.m-3 (Normandin, Carrier et al. 2002, Salehi, Krewski et al. 2003, Salehi, Normandin et al. 2006, Tapin, Kennedy et al. 2006). D’autres études de 13 semaines chez le rat ont mis en évidence une augmentation des concentrations de Mn au niveau du cerveau et une augmentation des activités locomotrices pour des expositions supérieures à 3,75 mg Mn. m-3 sous forme de Mn métallique (St-Pierre, Normandin et al. 2001) et une augmentation des concentrations de Mn dans le cerveau sans augmentation des concentrations de la protéine acide de la fibre gliale (GFAP) au niveau du bulbe olfactif, du cervelet ou du striatum pour des expositions à 0,5 mg Mn.m-3 de sulfate de Mn ou à 0,1 mg Mn.m-3 de phosphate de Mn (Dorman, McManus et al. 2004b). Cette protéine est un marqueur des altérations des astrocytes.
Voie orale
Dans une étude du National Toxicological Program (NTP 1993), des rats et des souris ont été exposés par voie orale à du sulfate de Mn pendant 2 ans. Il a été observé une hyperplasie, une érosion et une inflammation du pré-estomac chez les souris mâles (à 585 mg.kg-1.j-1) et femelles (à 731 mg.kg-1.j-1). De plus, à la fin de la période d’exposition, les rats mâles exposés jusqu’à 200 mg.kg-1.j-1 ont présenté un poids moyen 10 % inférieur à celui des témoins.
Des souris exposées par la nourriture à 284 mg de Mn.kg-1.j-1 pendant 100 jours (Komura and Sakamoto 1994) ont présenté une diminution du nombre de globules rouges (pour une exposition au dichlorure et à l’acétate de Mn), de globules blancs (pour une exposition au dichlorure, à l’acétate et au dioxyde de Mn), et de l’hématocrite (carbonate de Mn).
Peu d’études chez l’animal montrent des effets similaires à ceux observés chez l’homme après ingestion (ATSDR 2012). Des singes exposés à 25 mg de Mn.kg-1.j-1 (sous forme de dichlorure) pendant 18 mois ont développé une faiblesse musculaire et une rigidité des membres inférieurs (Gupta, Murthy et al. 1980). Des concentrations plus élevées de Mn au niveau du cerveau (globus pallidus en particulier) ont été observées chez des rats ayant une cirrhose du foie, une insuffisance hépatique aiguë ou un shunt porto-cave, en comparaison du groupe témoin (Rose, Butterworth et al. 1999).
La majorité des études récentes menées chez l’animal ont montré des altérations chimiques au niveau du cerveau comprenant les concentrations en neurotransmetteurs ou des altérations de l’activité motrice (hypo- ou hyperactivité). Ces effets sont observés pour des expositions par voie orale comprises entre 1 et 2 000 mgMn.kg-1.j-1 (sous forme de chlorure de Mn, d’acétate de Mn ou de tétraoxyde de Mn) (Bonilla 1978, Gray and Laskey 1980, Gianutsos and Murray 1982, Chandra 1983, Bonilla and Prasad 1984, Lai, Leung et al. 1984, Nachtman, Tubben et al. 1986, Eriksson, Lenngren et al. 1987, Komura and Sakamoto 1991, Subhash and Padmashree 1991, Komura and Sakamoto 1992).
Les études les plus récentes ont poursuivi les investigations pour des expositions sub-chroniques par voie orale (Ranasinghe, Liu et al. 2000, Calabresi, Ammassari-Teule et al. 2001, Morello, Zatta et al. 2007). Peu d’études ont identifié des neuropathies à la suite d’une exposition au Mn (Spadoni, Stefani et al. 2000, Liu, Sullivan et al. 2006, Avila, Gubert et al. 2008). Des changements neurocomportementaux ont été mesurés : peur, activité locomotrice, performance cognitive (Calabresi, Ammassari-Teule et al. 2001, Shukakidze, Lazriev et al. 2003, Vezer, Papp et al. 2005, Vezer, Kurunczi et al. 2007). Dans certaines de ces études, des anomalies électrophysiologiques cérébraux sont associées aux changements de comportement (Calabresi, Ammassari-Teule et al. 2001, Vezer, Papp et al. 2005, Vezer, Kurunczi et al. 2007).
Voie cutanée
Nous ne disposons pas de données.
Synthèse
Les études expérimentales par inhalation et par voie orale rapportent des signes neurologiques notamment des modifications des neurotransmetteurs dans différentes régions du cerveau. Par voie orale, des effets sont observés au niveau de l’estomac, et des cellules sanguines.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
Substance Chimique (CAS) |
Voies d’exposition |
Taux d’absorption |
Organe cible |
|---|---|---|---|
|
Manganèse |
Inhalation |
ND |
SNC*, Poumon |
|
Ingestion |
2,5 à 8,2 % |
Foie, pancréas, reins, SNC* |
|
|
Cutanée |
ND |
ND |
*SNC : Système nerveux central
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| US EPA | Classe D (substance non classifiable quant à sa cancérogénicité pour l’homme) | 1996 |
Chez l'homme
Toutes voies
Gerber, Léonard et al. 2002 considèrent que les rares données épidémiologiques disponibles ne permettent pas de conclure à un potentiel cancérigène du Mn seul chez l’homme compte tenu des co-expositions ce qui soutient les conclusions, plus anciennes, de l’Union Européenne, de l’IARC et de l’US EPA.
Chez l'animal
Inhalation
Aucune étude n’a identifié les effets cancérogènes d’une exposition par inhalation.
Voie orale
Des rats F344/N et des souris B6C3F1 ont été exposés pendant 2 ans au sulfate de Mn (97 % de pureté) introduit dans la nourriture (NTP 1993). Les rats mâles et femelles (70 par lot) ont reçu des doses de 0, 1 500, 5 000 ou 15 000 ppm de sulfate de Mn ce qui correspond à des doses quotidiennes de 60, 200 ou 615 mg.kg-1 p.c. pour les mâles et des doses de 70, 230 ou 715 mg.kg-1 p.c. pour les femelles. Chez les rats, il n’y a pas d’augmentation des tumeurs. Les souris mâles et femelles (70 par lot) ont reçu des doses de 0, 1 500, 5 000 ou 15 000 ppm de sulfate de Mn ce qui correspond à des doses quotidiennes de 160, 540 ou 1 800 mg.kg-1 p.c. pour les mâles et des doses de 200, 700 ou 2 250 mg.kg-1 p.c. pour les femelles. Une dilatation folliculaire de la thyroïde et une hyperplasie, toutes deux significatives, sont rapportées chez les souris mâles et femelles exposées à la dose de 15 000 ppm par rapport au témoin. Un adénome des cellules folliculaires est observé chez un rat mâle exposé à la dose de 15 000 ppm après 15 mois d’exposition et chez 3 rats mâles exposés à la dose de 15 000 ppm après deux ans d’exposition. Cette observation n’est pas retrouvée aux doses inférieures. Les mêmes adénomes sont également retrouvés chez 2 femelles témoins, chez une femelle exposée à 1 500 ppm et chez 5 femelles exposées à 15 000 ppm pendant les 2 ans. Une augmentation statistiquement significative des hyperplasies du pré-estomac est aussi mesurée chez les mâles exposés à la dose de 15 000 ppm et chez les femelles exposées (quelle que soit la dose). Ces hyperplasies sont associées à des ulcères et à une inflammation chez certains animaux, particulièrement les mâles.
Voie cutanée
Il n’y a pas de données.
Voie sous-cutanée ou intra-péritonéale
Des souris DBA/1 exposées par voie sous-cutanée ou intra-péritonéale à 0,1 mL d’une solution à 1 % de chlorure de Mn, 2 fois par semaine pendant 6 mois, ont présenté une augmentation statistiquement significative du nombre de lymphosarcomes par rapport aux témoins (DiPaolo 1964). Des rats F344 et des souris Swiss femelles ont été exposés par voie intramusculaire à de la poudre de Mn ou du dioxyde de Mn (9 injections de 10 mg), ou à de la poudre de Mn par gavage (24 doses de 10 mg) (Furst 1978). Des rats ont aussi été traités par de l’acétyl acétonate de Mn (6 injections intra-musculaires de 50 mg). Aucune différence de l’incidence des tumeurs n’a été observée entre les animaux traités et les animaux témoins pour l’exposition à la poudre de Mn ou au dioxyde de Mn. Une augmentation de l’incidence des fibrosarcomes au point d’injection a été notée pour l’exposition à l’acétyl acétonate de Mn. Cependant, les données obtenues sur ce composé organique du Mn ne peuvent pas nécessairement être extrapolées au Mn pur, ni à d’autres dérivés inorganiques du Mn (US EPA (IRIS) 1996a).
Synthèse
Chez l’animal, des adénomes des cellules folliculaires thyroïdiennes et des hyperplasies du pré-estomac sont observées suite à l’ingestion de sulfate de Mn.
Le dioxyde de Mn et le sulfate de Mn ont été examinés mais ne font pas l’objet de classification par l’Union Européenne. Le Mn appartient à la classe D de l’US EPA (substance non classifiable quant à sa cancérogénicité pour l’homme).
Effets génotoxiques
Chez l'homme
Toutes voies
A notre connaissance, il n’existe pas de données disponibles.
Chez l'animal
Voie orale
Aucune translocation héréditaire n’a été détectée chez des souris exposées au sulfate de Mn par voie alimentaire pendant 7 semaines. De même, aucune mutation létale dominante chez des rats exposés par gavage pendant 1 à 5 jours n’a été mise en évidence (Newell et al., 1974 cités dans NTP, 1993).
Une augmentation du nombre d’anomalies de la tête des spermatozoïdes et une fréquence accrue d’aberrations chromosomiques et de micronoyaux dans les cellules de la moelle osseuse ont été rapportées chez des souris exposées par voie orale à du sulfate de Mn (de 33 à 132 mg Mn.kg-1.j-1) ou du permanganate de potassium (de 23 à 132 mg Mn.kg-1.j-1 pendant 3 semaines (Joardar et Sharma, 1990).
Aucune altération chromosomique importante n’a été relevée dans la moelle osseuse ou les spermatogonies de rats mâles exposés à 0,014 mg Mn.kg-1.j-1 (sous forme de chlorure de Mn) pendant 180 jours (Dikshith et Chandra, 1978) (Santé Canada, 2016).
Synthèse
Les données disponibles relatives aux effets in vivo et in vitro ne sont pas suffisantes pour conclure à un potentiel effet génotoxique du Mn.
In vitro
Organismes procaryotes
Les études de génotoxicité et de mutagénicité du Mn in vitro sont équivoques et semblent dépendre du système d’essai et du protocole utilisés. Les essais de mutation gèniques chez la bactérie in vitro ont abouti à des résultats positifs et négatifs (ANSES, 2018).
Organismes eucaryotes
Les études de génotoxicité et de mutagénicité du Mn in vitro sont équivoques et semblent dépendre du système d’essai et du protocole utilisés. Les essais de mutation gèniques in vitro sur levures et cellules de mammifères sont principalement positifs (ANSES, 2018).
Effets sur la reproduction
Généralités
De nombreuses études épidémiologiques, écologique, transversales et de cohortes réalisées au cours des dix dernières années n’ont pu être intégrées dans ce paragraphe. Une description détaillée et analyse de ces données sont disponibles dans le rapport de l’ANSES, 2018. Les résultats évoquent un lien possible entre l’exposition maternelle au Mn et un plus faible poids à la naissance pour l’enfant, ainsi que des déficits psychomoteurs et neuropsychologiques détectables dans les premières années de vie (troubles de la motricité et de la dextérité, du comportement, du langage, de la mémoire, et du développement cognitif global de l’enfant). Cependant, ces résultats doivent encore être considérés avec prudence.
Chez l'homme
Inhalation
Des travailleurs exposés de 1 à 19 ans à des poussières de Mn à des concentrations n’entraînant pas de manganisme (0,97 mg.m-3) ont présenté une altération de la fertilité, mesurée en terme de diminution du nombre d’enfants par couples mariés (Lauwerys, Roels et al. 1985).
Une étude portant sur 314 hommes exposés professionnellement pendant une durée allant jusqu’à 35 ans à une concentration moyenne de 0,145 mg.m-3 de dioxyde de Mn (Jiang, Lu et al. 1996) n’a mis en évidence ni impuissance ni manque de désir sexuel dans le groupe exposé.
Une augmentation du temps de liquéfaction du sperme, une diminution du nombre et de la viabilité des spermatozoïdes ont été observées chez trois groupes de travailleurs exposés au moins un an à des concentrations de Mn de 0,14 à 5,5 mg.m-3 sous forme de dioxyde de Mn (Wu, Zhang et al. 1996).
Voie orale
Une étude menée en Chine chez des hommes, âgés de 20 à 59 ans, en bonne santé et non exposés professionnellement aux métaux montre une augmentation du risque de tératospermie pour des concentrations sériques en Mn supérieures à 19,40 µg.L-1 avec un odds ratio ajusté de 2,27 [1,18-4,37] (Li, Wu et al. 2012).
Voie cutanée
Il n’existe pas d’études.
Synthèse
Chez l’homme, une altération de la fertilité (diminution du nombre d’enfants par couples mariés) et de la qualité du sperme ont été mises en évidence.
Chez l'animal
Inhalation
L’exposition de lapins par instillation intra-trachéale à une dose unique de 158 mg.kg-1 de Mn (sous forme de dioxyde de Mn) a entraîné des effets dégénératifs sévères au niveau des tubes séminifères et une stérilité (Chandra, Ara et al. 1973, Seth, Nagar et al. 1973). Ces effets se sont développés dans les 4 à 8 mois après l’exposition.
Aucun effet n’est retrouvé chez les femelles suivant une exposition par inhalation de Mn sous forme de dioxyde de Mn (Lown, Morganti et al. 1984) ou d’aérososl de sulfate de Mn aux concentrations de 0 – 0,05 – 0,5 – 1 mg Mn.m-3 (Dorman, McElveen et al. 2005a).
Voie orale
Le Mn altère la formation de sperme et les performances de reproduction chez les mâles pour des expositions sub-chroniques (Joardar and Sharma 1990, Elbetieha, Bataineh et al. 2001, Ponnapakkam, Bailey et al. 2003, Ponnapakkam, Sam et al. 2003). Une exposition de 23 à 198 mg.kg-1.j-1 pendant 21 jours à du sulfate de Mn chez la souris induit des anomalies de la tête des spermatozoïdes et le pourcentage de spermatozoïdes anormaux est significativement augmenté chez tous les individus exposés (Joardar and Sharma 1990). Une augmentation de l’incidence de la dégénérescence des testicules chez les rats mâles exposés à des doses supérieures ou égales à 137,2 mg Mn. kg-1.j-1 sous forme d’acétate de Mn. Cet effet n’est pas retrouvé aux doses plus basses (Ponnapakkam, Sam et al. 2003).
Des rats Long-Evans ont été exposés pendant la gestation et après le sevrage à 0, 350, 1 050 et 3 500 mg de Mn.kg-1.j-1 (sous forme de tétraoxyde de Mn) en combinaison avec un régime pauvre ou équilibré en fer (respectivement 20 mg.kg-1.j-1 et 200 mg.kg-1.j-1) (Laskey, Rehnberg et al. 1982). Les jeunes ont été accouplés à J100 post-partum et la fécondité a été évaluée. Il a été observé une diminution du poids des testicules chez les jeunes rats mâles âgés de 40 et 100 jours (uniquement dans le groupe avec un faible apport en fer), ainsi qu’une diminution de la concentration sérique de testostérone. Les tentatives d’accouplements des rats à 100 jours ont été associées à une diminution du nombre de gestations à la plus forte dose.
Dans 2 autres études, l’exposition de rats par voie orale à des doses allant de 22 (par gavage) à 620 mg (dans l’eau de boisson) de Mn.kg-1.j-1 (sous forme de chlorure de Mn) n’a pas entraîné d’effets toxiques au niveau de la reproduction (Grant, Blazak et al. 1997, Pappas, Zhang et al. 1997).
Une altération de la fertilité des souris femelles est observée lors d’une exposition par voie orale au chlorure de Mn dans l’eau de boisson à la dose de 277 mg Mn.kg-1.j-1 au cours des 12 semaines qui précèdent l’accouplement avec des mâles non exposés (Elbetieha, Bataineh et al. 2001).
Voie cutanée
Il n’existe pas d’études.
Synthèse
Chez l’animal, le Mn occasionne des lésions des testicules notamment au niveau de qualité du sperme.
Effets sur le développement
Chez l'homme
Inhalation
Il n’existe pas d’études.
Voie orale
Un effet potentiel du Mn a été suggéré du fait d’un fort taux de mortalité chez les enfants de moins d’un an dans une communauté au Bangladesh chez laquelle des niveaux élevés de Mn ont été mesurés dans les eaux de boisson (quantité ingérée estimée à 0,26 mg Mn.kg-1.j-1), mais ces effets ne peuvent pas être imputés aux seules expositions au Mn (Hafeman, Factor-Litvak et al. 2007). Une situation similaire a été rapportée en Caroline du Nord, pour laquelle il n’est pas possible de proposer de relation dose-effet (Spangler and Spangler 2009).
Synthèse
Les études disponibles chez l’homme ne permettent pas de conclure quant aux effets sur le développement d’une exposition au Mn.
Chez l'animal
Inhalation
Une diminution du poids a été mesurée chez des jeunes dont les mères ont été exposées à 61 mg.m-3 sous forme de dioxyde de Mn 7 h.j-1, 5 j par semaine, au cours des 16 semaines précédant la conception (Lown, Morganti et al. 1984).
Voie orale
Des souris mâles ont été exposées à partir du quinzième jour postnatal à 1 050 mg de Mn.kg-1.j-1 par la nourriture, sous forme de tétraoxyde de Mn, et sacrifiées au 53e, 73e et 90e jour (Gray and Laskey 1980). Une diminution de la croissance de la glande préputiale, de la vésicule séminale et des testicules a été observée.
Une augmentation des pertes post-implantatoires, un retard de développement du squelette et des organes internes (non clairement précisés), ainsi que des malformations externes comme un pied-bot, ont été observés chez des rats exposés à du chlorure de Mn par gavage pendant la gestation, à la concentration de 33 mg.kg-1.j-1 (Szakmary, Ungvary et al. 1995).
Des expositions au chlorure de Mn au cours de la gestation induisent des effets sur la différenciation de l’hippocampe chez les jeunes du fait d’une action directe du Mn au niveau cérébral plus que par une légère modification des hormones thyroïdiennes (Ohishi, Wang et al. 2012).
Plusieurs études ont évalué les effets d’une exposition post-natale au Mn ou chez les jeunes sur le développement neurologique. Les altérations des systèmes dopaminergiques, noradrénergiques, sérotoninergiques observées concernent des modifications biochimiques dans le cerveau, une augmentation des monoamines oxydases et une diminution des niveaux de fer (Chandra and Shukla 1978, Deskin, Bursian et al. 1981, Kristensson, Eriksson et al. 1986, Dorman, Struve et al. 2000, Tran, Chowanadisai et al. 2002, Tran, Chowanadisai et al. 2002, Reichel, Wacan et al. 2006, Anderson, Cooney et al. 2007, Anderson, Fordahl et al. 2009, Moreno, Yeomans et al. 2009, Kern, Stanwood et al. 2010, Kern and Smith 2011);Tran et al., 2006).
Une étude a évalué les effets du Mn sur le neurodéveloppement au moyen d’une batterie de tests neurologiques réalisés chez des rats mâles (Sprague Dawley) âgés de 23 jours (espace ouvert, labyrinthe en croix surélevé) ou de 33 à 46 jours (labyrinthe radial à huit branches) (Kern et al., 2010). Les rats ont été exposés à des doses de 25 ou 50 mg Mn.kg-1.j-1 sous forme de chlorure de Mn administrées par voie orale à l’aide d’une micropipette, pendant 21 jours après leur naissance. Chez les rats de 23 jours, seules des différences significatives aux tests d’espace ouvert (baisse de 20 % de l’activité locomotrice et une désinhibition des comportements) ont été rapportées uniquement dans le lot exposé à la plus forte dose. En revanche, des déficits d’apprentissage et de mémorisation, mesurés à l’aide d’un labyrinthe radial à huit branches, ont été décrits chez les mâles exposés à 25 et 50 mg Mn.kg-1.j-1 et testés de 33 à 46 jours après leur naissance. Les auteurs ont également observé une baisse significative des récepteurs dopaminergiques de type D1 aux 2 doses de 25 et 50 mg. kg-1.j-1 (soit respectivement 71 ± 7 % (p<0,05) et 54 ± 9 % (p<0,01 versus 100 ± 5 % dans le lot témoin) dans le striatum, ainsi que des récepteurs de type D2 et transporteurs de la dopamine (DAT) chez les animaux exposés à la plus forte dose (p<0,01) dans le cortex préfrontal et le noyau accumbens). Un LOAEL de 25 mg.kg-1.j-1 a été retenu pour cette étude.
Dans les mêmes conditions expérimentales que l’étude précédente (exposition de 25 et 50 mg Mn.kg-1.j-1 entre les 1er et 21e jours après la naissance), l’équipe de Kern n’a pas mis en évidence d’effets sur les résultats aux tests neurocomportementaux (espace ouvert) chez les rats adultes (107 jours) et exposés au Mn en début de vie (Kern et Smith, 2011). En revanche, l’analyse des récepteurs dopaminergiques dans le cortex préfrontal, le striatum, et le noyau accumbens ont permis d’observer une augmentation significative des récepteurs D1 dans le noyau accumbens chez les adultes (107 jours) du lot exposé à 25 mg.kg-1.j-1 (LOAEL), de même que celle des récepteurs D2 (à environ 800 % de la valeur des témoins) aussi bien après sevrage (24e jour) que chez l’adulte (107e jour) dans le cortex préfrontal des animaux ayant reçu la dose la plus forte. Aucun changement du nombre de DAT n’a été observé chez les adultes témoins ou traités avant sevrage au Mn. Les auteurs indiquent qu’il est intéressant de noter que les concentrations de Mn relevées dans le sang et le cerveau chez l’adulte n’étaient pas statistiquement différentes de celles des témoins (malgré l’augmentation observée au 24e jour) (Kern et Smith, 2011), ce qui laisse à penser qu’une exposition au Mn en début de vie entraînerait des effets sur le système dopaminergique, qui persisteraient même après que les concentrations de Mn soient revenues à ce qu’elles étaient avant l’exposition (Santé Canada, 2016).
Les mêmes auteurs ont montré que la fonction sensori-motrice fine testée chez des rats (Long-Evans) mâles adultes exposés pendant la vie entière (1 an dès la naissance) était plus largement déficitaire (test de l’escalier, capacité à saisir et manger les granules) que chez les animaux exposés pendant une courte période de 21 jours après leur naissance aux 2 doses testées de 25 ou 50 mg Mn.kg-1.j-1(Beaudin et al., 2013). Toujours avec le même protocole, ces auteurs ont montré une altération des taux de dopamine et de norépinéphrine dans le striatum et le cortex préfrontal (Beaudin et al. 2015) et une altération dose-dépendante de l’attention ciblée et de l’attention sélective ainsi que des troubles dans la régulation de l’éveil ont été rapportés (Beaudin et al. 2017).
Une gliose[1] est observée chez des jeunes exposés au Mn via leurs mères traitées avant, pendant la gestation et au cours du mois suivant la parturition aux doses de 0 – 4,4 – 20 mg Mn.kg-1.j-1 (Lazrishvili, Shukakidze et al. 2009).
[1] Prolifération pathologique de la névroglie
Synthèse
Chez l’animal, une augmentation des pertes post-implantatoires, un retard de développement du squelette et des organes internes, ainsi que des malformations externes ont été observés chez des rats exposés à du chlorure de Mn par gavage pendant la gestation. Une augmentation de la mortalité fœtale a été observée chez des souris. Des altérations cérébrales sont également identifiées liés à une action directe du Mn : effets comportementaux et déficits d’apprentissage en lien avec une altération du système dopaminergique.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
L’OMS propose une valeur de 0,15 µg.m-3 pour une exposition chronique par inhalation au Mn (OMS, 2000).
Cette valeur a été établie à partir d’une étude réalisée chez des ouvriers d’une usine de fabrication de piles sèches, exposés pendant une durée moyenne de 5,3 ans (8 h/j, 5 j/sem.) à une concentration moyenne de 215 µg de Mn.m-3 dans les poussières inhalables, et 948 µg de Mn.m-3 dans les poussières totales, sous forme de dioxyde de Mn (Roels, Ghyselen et al. 1992). Des effets neurologiques ont été observés. En comparaison avec le groupe témoin, les travailleurs exposés ont présenté des performances moindres sur des tests neurocomportementaux, notamment au niveau du temps de réaction, de la coordination œil-main, et de la stabilité de la main.
L’OMS a utilisé une approche benchmark dose (BMD) pour proposer une BMDL5 de 30 µg.m-3. Cette valeur a été ajustée à 7,14 µg.m-3 pour tenir compte d’une exposition continue (30 µg.m-3 x 5 j /7 j x 8 h/24 h).
Facteur d’incertitude : un facteur de 50 a été appliqué qui correspond à un facteur d’incertitude de 10 pour la variabilité au sein de la population humaine, et un facteur de 5 pour tenir compte de la susceptibilité particulière des enfants.
Calcul : 7,14 µg.m-3 x 1/50 = 0,142 µg.m-3 (arrondi à 0,15 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur toxicologique de référence (VTR) est établie à partir de la relation entre une dose externe d'exposition à une substance dangereuse et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition chronique par inhalation
L’ATSDR propose une valeur de 0,3 µg.m-3 pour une exposition chronique par inhalation au Mn fraction inhalable (ATSDR, 2012).
Cette valeur a été établie à partir de la même étude de (Roels, Ghyselen et al. 1992), au cours de laquelle des ouvriers d’une usine de fabrication de piles sèches ont été exposés pendant une durée moyenne de 5,3 ans (5 j/sem., 8 h/j) à une concentration moyenne de 215 µg de Mn.m-3 dans les poussières inhalables et 948 µg de Mn.m-3 dans les poussières totales, sous forme de dioxyde de Mn. Des effets neurologiques ont été observés. En comparaison avec le groupe témoin, les travailleurs exposés ont présenté des performances moindres sur les tests neurocomportementaux, notamment au niveau du temps de réaction, de la coordination œil-main et de la stabilité de la main.
L’ATSDR a proposé une analyse de benchmark concentration (BMC) utilisant plusieurs modèles, celle retenue est obtenue avec le modèle Logistic : une BMCL10 de 142 µg.m-3 qui correspond à la limite inférieure de l’intervalle de confiance à 95 % de la concentration estimée donnant 10 % d’effet. Cette valeur a été ajustée à 33,81 µg.m-3 pour tenir compte d’une exposition continue (74 µg.m-3 x 5 j/7 j x 8 h /24 h).
Facteur d’incertitude : un facteur de 100 a été appliqué qui correspond à un facteur d’incertitude pour la variabilité au sein de la population humaine, et un facteur de 10 pour tenir compte des incertitudes et de la limitation des données pour des expositions par inhalation.
Calcul : 33,81 µg.m-3 x 1/100 = 0,34 µg.m-3 (arrondi à 0,3 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale
L’INSPQ a établi une dose de référence (RfD) de 0,055 mg.kg-1.j-1 pour une exposition chronique au Mn (INSPQ, 2017)
L’INSPQ s’est appuyé sur les mêmes études expérimentales que Santé Canada (Kern et al. (2010) ; de Kern et Smith (2011) ; Beaudin et al. (2013) ; Beaudin et al., 2017). La valeur est construite à partir d’un LOAEL de 25 mg.kg-1.j-1 identifié à partir des effets neurologiques observés après une exposition post-natale de rats lors du développement et persistants à l’âge adulte.
Facteur d’incertitude : un facteur de 450 a été appliqué (10 pour tenir compte de la variabilité inter-espèce, 5 pour tenir compte de la variabilité interindividuelle, 3 pour tenir compte de l’utilisation d’un LOAEL plutôt qu’un NOAEL, 3 pour tenir compte des lacunes dans les données disponibles).
Calcul : 25 mg.kg-1.j-1 x 1/450 = 0,055 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation
L’Ineris propose de ne pas retenir de valeur pour une exposition aiguë par inhalation au Mn.
Deux valeurs développées par le TCEQ (2017) pour deux durées d’exposition différentes, l’une sur 1 heure et l’autre sur 24 heures. Ces deux valeurs sont élaborées à partir d’une étude sub-chronique (Dorman et al., 2005), le calcul d’ajustement au temps n’est pas adapté avec une exposition aiguë, elles ne sont donc pas retenues.
Effets à seuil - Exposition chronique par inhalation
L’INERIS propose de retenir pour une exposition chronique par inhalation au Mn inhalable la valeur de l’ATSDR de 0,3 µg.m-3 (ATSDR , 2012).
Les VTR disponibles sont celles de l’ATSDR (2012), l’OEHHA (2008), l’OMS (2000), l’US EPA (1993) et le TCEQ (2017) qui retiennent toutes la même étude épidémiologique (Roels et al., 1992). Cette étude est de bonne qualité. L’effet critique retenu est la diminution des performances aux tests neurocomportementaux. L’OMS et l’OEHHA élaborent une BMCL05 à partir des données de l’étude, l’ATSDR élabore une BMCL10, également retenue par le TCEQ. L’’US EPA définit la moyenne géométrique d’exposition au Mn des travailleurs, qui est assimilée à une LOAEC. La démarche par calcul d’une BMCL est préférée car elle permet de s’affranchir des conditions de l’étude. L’utilisation d’une BMCL5 ou 10 est recevable. Les BMCL05 ou BMCL10 déterminées sont ajustées pour tenir compte soit d’une exposition continue par l’OMS (7,14 µg.m-3) et l’ATSDR (33,81 µg.m-3), soit des volumes inhalés par l’OEHHA (26 µg.m-3) et le TCEQ (50,7 µg.m-3). La démarche utilisée par l’US EPA en 1993 est moins fiable que l’établissement de BMCL et n’est donc pas retenue. L’OMS, l’OEHHA, l’ATSDR et le TCEQ appliquent ensuite des facteurs d’incertitude différents, respectivement de 50, 300, 100 et 60 pour prendre en compte une toxicité potentiellement plus élevée en fonction des différentes formes (taille des particules) de Mn, notamment pour la fraction inhalable qui est particulièrement adaptée d’autant plus que les données de l’étude fournissent cette information. Les valeurs de l’ATSDR et du TCEQ couvrent ces deux aspects et aboutissent à des valeurs proches ; néanmoins le choix d’un facteur d’incertitude de 6 choisi par le TCEQ pour cet aspect semble moins adapté que le facteur 10 retenu par l’ATSDR : c’est donc la valeur de l’ATSDR, qui est retenue.
Indice de confiance : moyen en raison de la qualité des données.
Effets à seuil - Exposition chronique par voie orale
L’INERIS propose de retenir pour une exposition chronique par voie orale au Mn la valeur de l’INSPQ de 0,055 mg.kg-1.j-1 (2017)
Quatre organismes proposent des valeurs : l’US EPA (2004), Santé Canada (2021) et l’INSPQ (2017)[1].
La valeur de l’US EPA, est construite à partir de données humaines basées sur l’absence d’effets observés chez les adultes ayant un régime alimentaire occidental contenant jusqu’à 10 mg.j-1 de Mn. L’effet critique retenu ne tient pas compte des effets spécifiques du Mn : sur les atteintes neurologiques. La valeur retenue (NOAEL) de 10 mg.j-1 semble avoir été déterminée à partir des résultats de plusieurs études chez l’adulte qui sont mal identifiées. Aucun facteur d’incertitude de 3 est retenu pour tenir compte de la biodisponibilité du Mn dans l’eau de boisson pour la construction d’une valeur pour l’exposition par l’eau de boisson. Cette valeur n’est pas retenue.
Santé Canada et l’INSPQ ont basé la construction de leurs valeurs sur une série de 3 études mesurant les effets sur le neurodéveloppement chez l’animal (Kern et al. (2010) ; Kern et Smith (2011); Beaudin et al. (2013). L’INSPQ s’est appuyé sur une étude supplémentaire (Beaudin et al, 2017). Ces études sont de bonne qualité. L’effet critique retenu est une atteinte du développement du SNC ce qui est représentatif des effets du Mn. La même valeur de LOAEL de 25 mg.kg-1.j-1 a été retenue par les deux organismes. Santé Canada a appliqué un facteur d’incertitude de 1 000, alors que l’INSPQ a appliqué un facteur de 450. Les deux organismes prennent un facteur 10 pour prendre en compte la variabilité interespèces, ce qui habituel. Concernant le facteur de variabilité intraespèces, Santé Canada prend un facteur 10 alors que l’INSPQ retient un facteur 5, la valeur retenue par l’INSPQ est faible compte tenu de l’effet mesuré. Concernant la prise en compte de l’utilisation d’un LOAEL, les deux organismes prennent un facteur 10 pour Santé Canada et 3 pour l’INSPQ. La valeur retenue par l’INSPQ semble la plus appropriée. Enfin, l’INSPQ prend un facteur concernant les limitations de la base de données, ce qui apparait justifié.
L’effet critique retenu par Santé Canada et l’INSPQ apparait plus pertinent que celui choisi par l’US EPA car il prend en compte les effets neurodéveloppementaux. Les valeurs proposées par les deux organismes Santé Canada et INSPQ diffèrent uniquement dans le choix des facteurs d’incertitude qui sont appliqués. La valeur de l’INSPQ est la plus cohérente au regard de la dose journalière recommandée en France à ce jour. La valeur de l’INSPQ est retenue.
Indice de confiance : moyen en raison de la base de données.
[1] A noter que l’ATSDR a proposé en 2012 une valeur indicative provisoire de 0,16 mg.kg-1.j-1 pour une exposition chronique au manganèse, compte tenu de son caractère indicatif et provisoire, cette valeur n’a pas été considérée dans le présent choix.
Autres valeurs des organismes reconnus
Description
Effets à seuil - Exposition aiguë par inhalation
Le TCEQ propose une ReV[1] de 9,1 µg.m-3 pour une exposition aiguë de 1 heure par inhalation au Mn (TCEQ, 2017).
Cette valeur a été établie à partir de l’étude de Dorman et al. (2005), dans laquelle de jeunes singes ont été exposés à des concentrations de 0 – 0,06 – 0,3 ou 1,5 mg Mn.m-3 de sulfure de Mn 6 h/j, 5 j/sem pendant 65 jours (Dorman et al., 2005). Le TCEQ a retenu comme effet critique une inflammation faible à modérée de l’appareil respiratoire (bronchiolite) observée uniquement chez les animaux exposés après 3 semaines à la plus forte concentration de 1,5 mg Mn.m-3. Cette concentration est retenue comme une LOAEC pour le point de départ (POD) du calcul de la valeur.
Un ajustement sur la durée d’exposition a été réalisé pour tenir compte de l’exposition de 6 h, ramenée à 1 h en utilisant la loi de Haber avec n = 3. La valeur étant issue de données chez le primate, aucun ajustement n’a été utilisé en raison de l’anatomie similaire de l’appareil respiratoire entre le singe et l’homme. Le ReV est construit à partir de :
PODHEC 1h = [(1,5 mg Mn.m-3)3 x (6 h/1 h)]1/3 = 2,72 mg Mn.m-3
Facteurs d'incertitude : un facteur d’incertitude de 360 ramené à 300 comprenant un facteur d’incertitude de 2 en raison de l’extrapolation à partir d’une LOAEL ; un facteur d'incertitude de 10 pour la variabilité au sein de la population ; un facteur 3 pour tenir compte des différences toxicodynamiques entre l’homme et le singe ; un facteur 6 pour tenir compte des limites et incertitudes de la base de données sur la toxicité aiguë/subaiguë, englobant notamment l’absence de données chez l’homme ou sur les effets du SNC.
Calcul : ReVaiguë 1h. = 2,72 mg Mn.m-3/ 300 = 9,1 µg Mn.m-3
Indice de confiance : Le TCEQ attribue un indice de confiance moyen à élevé à l’étude, faible à la base de données.
Le TCEQ propose une ReV de 5 µg.m-3 pour une exposition aiguë de 24 heures par inhalation au Mn (TCEQ, 2017).
La construction est calquée sur celle précédemment décrite par le TCEQ pour une exposition aiguë de 1 heure, à partir de la même étude (Dorman et al., 2005). Une LOAEC de 1,5 mg Mn.m-3, 6h/j, 5 j/sem pendant 3 semaines retenu comme POD (point de départ).
Aucun ajustement sur la durée d’exposition n’a été réalisé pour une durée de 24 heures, car l’exposition a été plus longue (90 heures puisque 6 h/j, 5j/sem pendant 3 semaines) et les données de l’étude ont permis d’observer que la déposition de Mn dans les voies pulmonaires prédominait au cours des 3 premières semaines d’exposition. La valeur étant issue de données chez le primate, aucun ajustement n’a été utilisé en raison de l’anatomie similaire de l’appareil respiratoire entre le singe et l’homme.
Facteurs d'incertitude : un facteurs d’incertitude de 360 ramené à 300 comprenant un facteur d’incertitude de 2 en raison de l’extrapolation à partir d’une LOAEC ; un facteur d'incertitude de 10 pour la variabilité au sein de la population ; un facteur 3 pour tenir compte des différences toxicodynamiques entre l’homme et le singe ; un facteur 6 pour tenir compte des limites et incertitudes de la base de données sur la toxicité aiguë/subaiguë, englobant notamment l’absence de données chez l’homme ou sur les effets du SNC.
Calcul : ReVaiguë 24h. = 1,5 mg Mn.m-3/ 300 = 5 µg Mn.m-3
Indice de confiance : Le TCEQ attribue un indice de confiance moyen à élevé à l’étude, faible à la base de données.
Effets à seuil - Exposition chronique par inhalation
L’US EPA (IRIS) propose une RfC de 0,05 µg.m-3 pour une exposition chronique par inhalation au Mn (US EPA, 1993).
L’US EPA utilise la même étude que l’OMS (Roels, Ghyselen et al. 1992). Pour chaque ouvrier, une exposition cumulée annuelle est calculée. La moyenne géométrique des valeurs obtenues est calculée pour l’ensemble des travailleurs, elle est de 0,793 mg Mn.m-3 par an. En divisant cette valeur par la durée moyenne d’exposition (5,3 ans), l’US EPA propose une LOAEC de 0,15 mg.m-3 (0,793 mg.m-3/an x 1/5,3). Une LOAEC équivalente de 0,05 mg.m-3 a été calculée en tenant compte d’une exposition professionnelle de 8 h/j à 10 m3 d’air contaminé par du Mn sur un total de 20 m3 d’air inhalé par jour pendant 5 j/sem.
LOAEC(HEC) = 0,15 mg.m-3 x 10 m3/20 m3 x 5 j/7 j = 0,0535 mg.m-3 (arrondi à 0,05 mg.m-3)
Facteur d’incertitude : un facteur de 1 000 a été appliqué qui correspond à un facteur d’incertitude de 10 pour protéger les individus sensibles, un facteur de 10 pour l’utilisation d’une LOAEC à la place d’une NOAEC, et un facteur de 10 pour tenir compte du peu de données disponibles ainsi que de la différence de toxicité entre les différentes formes du Mn.
Calcul : 0,05 mg.m-3 x 1/1 000 = 5.10-5 mg.m-3, soit 0,05 µg.m-3
Indice de confiance : L’US EPA considère que la confiance dans la base de données, dans l’étude clef et dans la valeur de RfC est moyenne.
L’OMS propose une valeur de 0,15 µg.m-3 pour une exposition chronique par inhalation au Mn (OMS CICAD, 2000).
Cette valeur a été établie à partir d’une étude réalisée chez des ouvriers d’une usine de fabrication de piles sèches, exposés pendant une durée moyenne de 5,3 ans (8 h/j, 5 j/sem.) à une concentration moyenne de 215 µg de Mn.m-3 dans les poussières inhalables, et 948 µg de Mn.m-3 dans les poussières totales, sous forme de dioxyde de Mn (Roels, Ghyselen et al. 1992). Des effets neurologiques ont été observés. En comparaison avec le groupe témoin, les travailleurs exposés ont présenté des performances moindres sur des tests neurocomportementaux, notamment au niveau du temps de réaction, de la coordination œil-main, et de la stabilité de la main.
L’OMS a utilisé une approche benchmark dose (BMD) pour proposer une BMDL5 de 30 µg.m-3. Cette valeur a été ajustée à 7,14 µg.m-3 pour tenir compte d’une exposition continue (30 µg.m-3 x 5 j /7 j x 8 h/24 h).
Facteur d’incertitude : un facteur de 50 a été appliqué qui correspond à un facteur d’incertitude de 10 pour la variabilité au sein de la population humaine, et un facteur de 5 pour tenir compte de la susceptibilité particulière des enfants.
Calcul : 7,14 µg.m-3 x 1/50 = 0,142 µg.m-3 (arrondi à 0,15 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L’OEHHA propose une REL de 0,09 µg.m-3 pour une exposition chronique par inhalation au Mn (OEHHA, 2008).
Cette valeur a également été établie à partir de la même étude de (Roels, Ghyselen et al. 1992).
L’OEHHA a utilisé une analyse de benchmark dose (BMD) et propose une BMCL05 de 72 µg.m-3. Cette valeur a été ajustée à 26 µg.m-3 en tenant compte d’une exposition professionnelle de 8 heures par jour à 10 m3 d’air contaminé par du Mn sur un total de 20 m3 d’air inhalé par jour sur 5 jours par semaine :
72 µg.m-3 x 10/20 x 5/7 = 25,7 µg.m-3 (arrondi à 26 µg.m-3)
Facteur d’incertitude : un facteur de 300 a été appliqué qui correspond à un facteur d’incertitude de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour tenir compte de la susceptibilité particulière des enfants (faible capacité d’excrétion biliaire) et un facteur de 3 pour l’extrapolation à une durée chronique (5,3 ans représentant selon les auteurs entre 8 et 12 % de la durée de vie).
Calcul : 26 µg.m-3 x 1/300 = 0,09 µg.m-3
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
L’OEHHA propose une REL de 0,17 µg.m-3 pour une exposition chronique de 8 h par inhalation au Mn (OEHHA, 2008).
Sur la même base de réflexion, l’OEHHA propose une deuxième valeur développée pour des expositions de 8 h/j.
L’OEHHA a utilisé une analyse de benchmark dose (BMD) et propose une BMCL05 de 72 µg.m-3 qui correspond à la limite inférieure de l’intervalle de confiance à 95 % de la concentration estimée donnant 5 % d’effet. Cette valeur a été ajustée (d’une exposition discontinue à une exposition continue) à 51 µg.m-3 en tenant compte du fait que l’exposition professionnelle ne dure que 5 jours par semaine :
72 µg.m-3 x 5 j/7 j = 51,4 µg.m-3 (arrondi à 51 µg.m-3)
Facteur d’incertitude : un facteur de 300 a été appliqué qui correspond à un facteur d’incertitude de 10 pour l’absorption et la déposition dans l’organisme accrues chez les enfants, un facteur de 10 pour tenir compte de la susceptibilité particulière des enfants et un facteur de 3 pour l’extrapolation à une durée chronique (5,3 ans représentant selon les auteurs entre 8 et 12 % de la durée de vie).
Calcul : 51 µg.m-3 x 1/300 = 0,17 µg.m-3
Indice de confiance : cet organisme ne propose pas d’indice de confiance
Le TCEQ propose une ReV de 0,84 µg.m-3 pour une exposition chronique au Mn par inhalation (TCEQ, 2017)
Cette valeur a été établie à partir de la même étude de Roels, Ghyselen et al. (1992).
Le TCEQ s’est appuyé sur l’analyse benchmark concentration (BMC) de l’ATSDR et a retenu la même BMCL10 de 142 µg.m-3 comme point de départ (POD) qui correspond à la limite inférieure de l’intervalle de confiance à 95 % de la concentration estimée donnant 10 % d’effet.
Du fait d’une exposition discontinue dans l’étude retenue, un ajustement sur la durée en continue a été réalisée :
PODHEC = 142 µg.Mn.m-3 x 10 m3/20 m3 x 5 jours/7 jours = 50,7 µg.Mn.m-3
Facteurs d'incertitude : un facteur d'incertitude de 60 a été retenu correspondant à un facteur 10 pour la variabilité au sein de la population, un facteur 6 pour tenir compte des limites et incertitudes de la base de données sur les effets de formes solubles du Mn sur la population générale, toxicité sur le SNC et sur le développement.
Calcul : ReVchronique = PODHEC / facteurs d’incertitude = 50,7 µg.Mn.m-3/ 60 = 0,845 µg.Mn.m-3 arrondi 0,84 µg.m-3
Indice de confiance : Le TCEQ accorde un indice de confiance moyen à l’étude et à la base de données.
Effets à seuil - Exposition chronique par voie orale
L’(US EPA (IRIS) 1996b) propose une RfD de 0,14 mg.kg-1.j-1 pour une exposition chronique par voie orale au Mn (1996, 2004).
L’apport journalier en Mn par l’alimentation, estimé sans danger pour les adultes, varie de 2 à 5 mg.j-1 (NRC 1989), 2,5 à 7 mg.j-1 (Freeland-Graves, Bales et al. 1987), 2 à 3 mg.j-1 (sans danger) et 8 à 9 mg.j-1 (« parfaitement sans danger ») (OMS 1973). A partir de ces informations, l’US EPA conclut qu’une dose de référence appropriée pour le Mn (NOAEL chronique) est de 10 mg.j-1 soit 0,14 mg.kg-1.j-1 pour un adulte de 70 kg.
Facteur d’incertitude : aucun facteur d’incertitude n’a été utilisé car les informations proviennent d’études sur de larges populations, l’organisme humain exerce une régulation efficace de l’homéostasie du Mn, donc le stock corporel reste constant, il n’y a pas de sous populations plus sensibles, et le Mn est un élément essentiel à la croissance et au maintien de la santé.
Facteur Modifiant : Cependant, pour l’évaluation de l’exposition au Mn par l’eau de boisson ou le sol, un facteur de 3 est recommandé en raison de l’étude de (Kondakis, Makris et al. 1989), de la variation d’absorption à partir de l’eau de boisson, de la plus faible excrétion de Mn chez le nourrisson et de la possible surexposition des enfants nourris au lait artificiel.
Calcul : 0,14 mg.kg-1.j-1 x 1/1 = 0,14 mg.kg-1.j-1
Indice de confiance : L’US EPA considère que la confiance dans la base de données, dans les études source et dans la valeur de RfD est moyenne.
Santé Canada propose une DJT de 0,025 mg.kg-1.j-1 pour une exposition chronique par voie orale au Mn (Santé Canada, 2021)
Santé Canada a proposé une VTR sur la base des effets sur le neurodéveloppement, décrits dans les études des équipes de Kern et Beaudin (Kern et al. (2010) ; de Kern et Smith (2011) ; Beaudin et al. (2013) menées chez l’animal. Ces études expérimentales ont mis en évidence l’altération de la fonction du système dopaminergique, associée aux déficits comportementaux et cognitifs consécutifs à une exposition post-natale (21 jours dès la naissance) de Mn par voie orale dès la plus faible dose testée de 25 mg.kg-1.j-1. Cette dose est retenue comme LOAEL pour établir une DJT en Mn.
Facteur d’incertitude : un facteur de 1 000 a été appliqué (10 pour tenir compte de la variabilité inter-espèce, 10 pour tenir compte de la variabilité intra-espèce et 10 pour tenir compte de l’utilisation d’un LOAEL plutôt qu’un NOAEL).
Calcul : 25 mg.kg-1.j-1 x 1/1000 = 0,025 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice.
[1] « Reference value » ou valeur de référence
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette rubrique est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme.
Dangers
Synthèse
Eau douce
Paramètres d'écotoxicité aiguë
|
|
Espèce |
Critère d’effet |
Valeur (mg.L-1) |
Référence |
|---|---|---|---|---|
|
Crustacés eau douce |
Austropotamobius pallipes |
CL50 (96 h) |
28 |
(Boutet and Chaisemartin 1973) |
|
|
Austropotamobius pallipes |
CL50 (96 h) |
17,5 |
(Boutet and Chaisemartin 1973) |
|
|
Crangonyx pseudogracilis |
CE50 (96 h) |
694 |
Martin et Holdich, 1986 |
|
|
Orconectes limosus |
CL50 (96 h) |
51 |
(Boutet and Chaisemartin 1973) |
|
Crustacés eau douce |
Daphnia magna |
CL50 (48 h) |
9,8 |
(Biesinger and Christensen 1972) |
|
|
Daphnia magna |
CE50 (48 h) |
40 |
(Bowmer, Hooftman et al. 1998) |
|
|
Brachionus calyciflorus |
CL50 (24 h) |
38,7 |
(Couillard, Ross et al. 1989) |
|
Poissons eau douce |
Basilichthys australis |
CL50 (96 h) |
50 |
(Trucco, Inda et al. 1991) |
|
|
Oryzias latipes |
CL50 (48 h) |
1 000 |
(Tsuji, Tonogai et al. 1986) |
|
Macrophytes eau douce |
Lemna minor |
CE50 (4 j) |
31 |
(Wang 1986) |
|
Amphibiens |
Gastrophryne carolinensis |
CL50 (7 j) |
1,42 |
(Birge, Black et al. 1979) |
|
|
Microhyla ornata |
CE50 (96 h) |
14,3 |
(Rao and Madhyastha 1987) |
Paramètres d'écotoxicité chronique
|
|
Espèce |
Critère d’effet |
Valeur (µg.L-1) |
Référence |
|---|---|---|---|---|
|
Micro-crustacés |
Daphnia magna
|
NOEC (21 j)(1) |
2 |
(Biesinger and Christensen 1972) |
|
Poissons |
Salmo trutta |
NOEC (62 j) |
4,55 |
(Stubblefield, Brinkman et al. 1997) |
(1) 16% d’effet sur la reproduction ont été observés à 4,1 µg.L-1, en conséquence nous prendrons
NOEC = 4,1/2 = 2 µg.L-1
Eau marine
Paramètres d'écotoxicité aiguë
|
|
Espèce |
Critère d’effet |
Valeur (mg.L-1) |
Référence |
|---|---|---|---|---|
|
Algues eau marines |
Ditylum brightwellii (marin) |
CE50 (5 j) |
1,5 |
(Canterford and Canterford 1980) |
|
|
Asterionella japonica |
CE50 (24-72 h) |
4,8 |
(Fisher and Jones 1981) |
|
Crustacés |
Artemia salina |
CL50 (48 h) |
51,8 |
(Gajbhiye and Hirota 1990) |
|
|
Nitocra spinipes |
CL50 (96 h) |
70 (52-94) |
(Bengtsson 1978) |
|
Mollusques eau marine |
Crassostrea virginica |
CL50 (48 h) |
16 (14,2-19,1) |
(Calabrese, Collier et al. 1973) |
|
Echinodermes eau marine |
Asterias rubens |
CL50 (72 h) |
50 |
(Hansen and Bjerregaard 1995) |
Sol
Paramètres d'écotoxicité aiguë
Il n'existe pas de données d'essais sur organismes terrestres.
Paramètres d'écotoxicité chronique
Il n'existe pas de données d'essais sur organismes terrestres.
Valeurs écotoxicologiques
Valeurs guides
Description
Concentration sans effet prévisible pour l'environnement (PNEC) - Proposition de l'Ineris
Compartiment aquatique
Il existe des données long terme pour les crustacés et les poissons, mais aucune donnée n’est disponible pour les algues d'eau douce. Par ailleurs, la donnée court terme sur l’algue marine est plus faible que la donnée long terme pour les poissons et les crustacés. Par conséquent, la PNECeau douce peut être extrapolée avec la donnée sur Dytilum brightwellii (1 500 µg.L-1) en utilisant un facteur d’extrapolation de 100. D’où :
PNEC EAU DOUCE = 15 µg.L-1
Pour le milieu marin, seule une donnée aiguë est reportée pour Dytilum brightwellii. Aucune donnée chronique sur organismes marins n’est disponible, cependant des données chroniques existent pour 2 niveaux trophiques dans l’eau douce. Ces 2 valeurs ne sont pas représentatives du niveau trophique de plus faible valeur d’écotoxicité aiguë, par conséquent un facteur d’extrapolation de 1 000 s’applique à la CE50 de 1,5 mg.L-1 sur Dytilum brightwellii reportée par (Canterford and Canterford 1980). D’où :
PNEC EAU MARINE = 1,5 µg.L-1
Compartiment sédimentaire
Compte tenu de l’absence de résultat de toxicité vis à vis des organismes benthiques, il n’est pas possible de dériver une PNEC pour les sédiments.
Compartiment terrestre
Compte tenu de l’absence de résultat de toxicité vis à vis des organismes terrestres, il n’est pas possible de dériver une PNEC pour les organismes du sol.
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le manganèse est un métal de transition très répandu dans la croûte terrestre.
Le manganèse et ses composés ne font pas partie de la liste des substances prioritaires dans le domaine de l'eau (DCE) et ne disposent ni de Norme de Qualité Environnementale (NQE), ni de Valeur Guide Environnementale (VGE). Les rejets de cette substance dans le milieu naturel par des installations classées font l'objet de seuils de rejets.
En 2018, la production minière mondiale de manganèse s'élevait à 20,3 millions de tonnes de Mn contenu et était répartie dans 30 pays dont l'Afrique du Sud, l'Australie et le Gabon.
Les dérivés du manganèse employés par les industriels sont nombreux : carbonate de manganèse, chlorure de manganèse, oxyde de manganèse, sulfate de manganèse, mancozèbe, manganèse tricarbonyle (MMT), acétate de manganèse…. Plus de 90% du manganèse produit est destiné au secteur de la sidérurgie, le reste est employé dans des secteurs industriels variés (production de batteries et piles, carburant, produits phytosanitaire…).
Les émissions industrielles de manganèse dans l'environnement se font majoritairement vers le milieu aquatique, même si cette prépondérance a tendance à s'estomper. Les principaux secteurs d'activité émetteurs de manganèse sont la fabrication de produits chimiques, la production de papier et de carton, la collecte et le traitement des eaux usées et la sidérurgie.
Des traitements faisant appel à des mécanismes de précipitation, oxydation, co-précipitation ou adsorption par voie physique, chimique ou biologique permettent de réduire les émissions de manganèse vers les eaux. Plutôt qu'être remplacé par d'autres substances, le manganèse semble parfois être envisagé comme substitut pour d'autres substances considérées comme plus dangereuses
Abstract
Manganese is a very common transition metal in the earth's crust.
Manganese and its compounds are not included in the priority list of substances of the Water Framework Directive (WFD). They neither have an Environmental Quality Standard (EQS) nor an Environmental Guidance Value (EGP). In France, release thresholds are defined for releases of this substance to the natural environment from so called “classified installations” (industrial installations subject to authorization or declaration requirements).
In 2018, world manganese mining production amounted to 20.3 million tonnes of Mn contained and was spread over 30 countries including South Africa, Australia and Gabon.
The manganese derivatives used in industry are numerous: manganese carbonate, manganese chloride, manganese oxide, manganese sulphate, mancozeb, tricarbonyl manganese (MMT), manganese acetate.... More than 90% of the manganese produced is used in the steel industry, the rest is used in various industrial sectors (battery production, fuel production, plant protection products etc.).
Industrial emissions of manganese into the environment occur mainly to the aquatic environment, although this preponderance is decreasing. The main manganese-emitting activity sectors are chemical manufacturing, paper and cardboard production, waste water collection and treatment, and steelmaking.
Treatments using precipitation, oxidation, co-precipitation or adsorption mechanisms by physical, chemical or biological means can reduce manganese emissions to water. In some areas, rather than a tendency towards manganese substitution, manganese seems to be considered as a substitute for more hazardous substances.
Tableaux de synthèse
Généralités
| CAS | 7439-96-5 |
|---|---|
| SANDRE | 1394 |
| Usages principaux |
FTE 2015 Importer Sidérurgie - 91% |
| Autres informations d'usage |
FTE 2015 Importer Alliages métaux non-ferreux - 4%, batteries et piles - 3%, divers -2% (industrie de la chimie, traitement de l'eau, produits phytosanitaires…) |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes (en vigueur à la date de la rédaction de cette fiche) encadrant la fabrication, les usages et les émissions de manganèse et de ses composés. Cet inventaire n'est pas exhaustif. Textes generauxREACHDans le cadre du règlement REACH concernant la mise sur le marché des substances chimiques1 , le manganèse (Mn) et ses composées ne font pas à l'heure actuelle partie de la liste des substances soumises à restrictions quant à leurs fabrication, mise sur le marché et utilisations (Annexe XVII), ni de la liste des substances soumises à autorisation (Annexe XIV). Le permanganate de potassium a été toutefois inscrit au CoRAP (Community Rolling Action Plan) en 2017 en vue de son évaluation par la France initialement sur la base des préoccupations suivantes :
[1] Règlement (CE) n° 1907/2006 du 18/12/06 concernant l'enregistrement, l'évaluation et l'autorisationdes substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), instituantune agence européenne des produits chimiques Directive Cadre Eau (DCE)Le manganèse et ses composés ne font pas partie des substances prioritaires pour la politique dans le domaine de l'eau citées dans la directive 2013/39/UE du 12/08/2013 modifiant les directives 2000/60/CE et 2008/105/CE, néanmoins, le manganèse fait l'objet d'analyses dans les eaux souterraines et les eaux de surface dans le cadre du programme de surveillance de l'état des eaux (cf. paragraphes 1.4.2et 1.4.3) Règlementation d'usagesProduits phytopharmaceutiquesLe mancozèbe fait partie de la liste des substances actives dont l'incorporation est autorisée dans les produits phytopharmaceutiques2 en Europe (avec toutefois une date d'expiration de l'inscription proche de la date de rédaction de cette fiche, car fixée au 31 janvier 2020). En revanche, l'emploi du manèbe n'est plus autorisé en Europe depuis le 21/01/20173 . Une limite de teneur maximale en résidus de mancozèbe (comprise entre 0,05 mg/kg et 25 mg/kg selon les cas) s'applique à un grand nombre de produits agricoles dans l'Union Européenne : des légumes, des fruits, des céréales, des viandes porcines, bovines, ovines4 … [4] Règlement (UE) 2017/171 de la Commission du 30 janvier 2017 JouetsLe manganèse est cité dans l'annexe III de la directive 2009/48/CE du Parlement Européen et du Conseil relative à la sécurité des jouets Pour le manganèse, des valeurs limites de migration des jouets ou composants de jouets ne doivent pas être dépassées :
CosmétiquesLe Bis(orthophosphate) de trimanganèse (n°CAS 14154-09-7) fait partie de la liste des colorants que peuvent contenir les produits cosmétiques5 . [5] Règlement (CE) No 1223/2009 du Parlement Européen et du Conseil du 30 novembre 2009 relatif aux produits cosmétiques Contact alimentaireSelon le règlement (UE) n°10/2011 concernant les matériaux et objets en matière plastique destinés à entrer en contact avec des denrées alimentaires, les composés du manganèse suivants peuvent être utilisés comme additifs ou auxiliaires de production de polymères :
De plus, selon ce même règlement, les matériaux et objets en matière plastique ne peuvent libérer du manganèse en quantité supérieure à la limite de migration spécifique de 0,6 mg/kg de denrée alimentaire ou de simulant de denrée alimentaire. Autres textesEaux de rejetLe manganèse n'est pas concerné par l'action nationale de recherche et de réduction des rejets de substances dangereuses dans les eaux (RSDE) organisée dans le cadre du programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses13 (PNAR) et dont l'objectif est de mieux connaître les émissions industrielles des ICPE (Installations Classées pour la Protection de l'Environnement) et des stations de traitement des eaux usées (STEU). [13] Arrêté du 30/06/05 relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses Eaux souterrainesLe manganèse fait partie des paramètres de l'analyse régulière du contrôle de surveillance de l'état chimique des eaux souterraines14 . [14] Arrêté du 17 octobre 2018 modifiant l’arrêté du 25 janvier 2010 établissant le programme de surveillance de l’état des eaux en application de l’article R. 212-22 du code de l’environnement Eaux de surfaceLe manganèse fait partie des substances pertinentes à surveiller dans les eaux de surface en métropole et DOM15 . [15] Arrêté du 17 octobre 2018 modifiant l’arrêté du 25 janvier 2010 établissant le programme de surveillance de l’état des eaux en application de l’article R. 212-22 du code de l’environnement AlimentationLe manganèse est cité dans l'annexe I de la Directive 2008/100/CE du 28/10/2008 relative à l'étiquetage nutritionnel des denrées alimentaires en ce qui concerne les apports journaliers recommandés, les coefficients pour le calcul de la valeur énergétique et les définitions. L'apport journalier recommandé en Mn est de 2 mg. Réglementation Extra EuropéenneConvention OSPAR Le manganèse et ses composés ne figurent pas dans la liste de produits chimiques devant faire l'objet de mesures de surveillance prioritaires8 au titre de la convention OSPAR (ou « Convention pour la protection du milieu marin de l'Atlantique du Nord-Est »). Convention de Rotterdam Le manganèse et ses composés ne font pas partie de la liste des produits chimiques soumis à la « procédure de consentement préalable en connaissance de cause »9 de la convention de Rotterdam. |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Seuils de rejets pour les installations classées et les stations de traitement des eaux uséesL'Arrêté du 31/01/08 relatif au registre et à la déclaration annuelle des émissions et des transferts de polluants et des déchets modifié par l'arrêté du 11 décembre 2014 indique que les seuils de rejet pour le manganèse et ses composés (exprimé en Mn) sont de :
L'Arrêté du 02/02/98 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation fixe la valeur limite de concentration des rejets dans un cours d'eau à 1 mg.L-1 pour le manganèse et ses composés si le rejet dépasse 10 g.j-1 . Spécifiquement, les rejets dans l'eau des ICPE de production par distillation d'alcools de bouche d'origine agricole (rubrique n° 2250) sont limités à 1 mg.l-1 quel que soit le flux 6 . De plus, différents arrêtés fixent des limites de rejets dans l'environnement des effluents liquides et gazeux de plusieurs installations nucléaires7,8,9. [6] Arrêté du 14/01/11 relatif aux prescriptions générales applicables aux installations relevant du régimede l'enregistrement au titre de la rubrique n° 2250 de la nomenclature des installations classées pour laprotection de l'environnement [7] Arrêté du 19/03/15 portant homologation de la décision n° 2015-DC-0498 de l'Autorité de sûreténucléaire du 19 février 2015 fixant les limites de rejets dans l'environnement des effluents liquides etgazeux des installations nucléaires de base n° 46, n° 74 et n° 100 exploitées par Electricité de France- Société Anonyme (EDF-SA) dans la commune de Saint-Laurent-Nouan (département de Loir-et-Cher) [8] Arrêté du 04/03/14 portant homologation de la décision n° 2014-DC-0414 de l'Autorité de sûreténucléaire du 16 janvier 2014 fixant les limites de rejets dans l'environnement des effluents liquides etgazeux des installations nucléaires de base n° 127 et n° 128 exploitées par Electricité de France-SociétéAnonyme (EDF-SA) dans les communes de Belleville-sur-Loire et Sury-près-Léré (département duCher) [9] Arrêté du 11/01/16 portant homologation de la décision n° 2015-DC-0536 de l'Autorité de sûreténucléaire du 22 décembre 2015 fixant les valeurs limites de rejet dans l'environnement des effluentsliquides et gazeux des installations nucléaires de base n°s 33 (UP2-400), 38 (STE2 et AT1), 47 (ELANII B), 80 (HAO), 116 (UP3-A), 117 (UP2-800) et 118 (station de traitement des effluents STE3) exploitéespar AREVA NC sur le site de La Hague (département de la Manche) Valeurs appliquées en milieu professionnelL'arrêté du 27 septembre 2019 fixe des valeurs limites d'exposition professionnelles indicatives pour certains agents chimiques et transpose la directive (UE) 2017/164 du 31 janvier 2017 établissant une quatrième liste de valeurs limites indicatives d'exposition professionnelle. Pour le manganèse et ses composés inorganiques (exprimé en Mn) :
Valeurs appliquées pour la qualité des eaux de consommationLe manganèse est considéré comme un élément indésirable dans l'eau de consommation humaine (EDCH) car sa présence à des concentrations supérieures à 20 μg.L-1 est directement perceptible par le consommateur avec les effets observés suivants : flaveur de l'eau pour des concentrations supérieures à 100 μg.L-1 , particules noires en suspension dans l'eau et taches induites sur le linge ou les équipements sanitaires dès que la concentration dépasse 20 μg.L-1 , formation de dépôts dans les canalisations de distribution des EDCH avec possibilité d'un relargage ultérieur de manganèse dans l'eau, dégradation des systèmes de traitement de l'EDCH à domicile (adoucisseurs notamment) (Anses, 2018). Une limite de 50 µg.l-1 est appliquée au manganèse pour les EDCH pour des raisons organoleptiques et esthétiques mais aussi parce que le manganèse fait partie des paramètres indicateurs de qualité témoins du fonctionnement des installations de production et de distribution d'eau10,11. Pour ce paramètre, les valeurs guide pour les eaux douces superficielles utilisées pour la production d'EDCH, à l'exclusion des eaux de sources conditionnées, sont de 50 μg.L-1 pour les eaux de type A1, de 100 μg.L-1 pour les eaux de type A2 et de 1 000 μg.L-1 pour les eaux de type A3.12 [10] Arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eauxdestinées à la consommation humaine (EDCH) transposant la directive 98/83/CE relative à la qualitédes EDCH [11] Décret n° 2001-1220 du 20/12/01 relatif aux eaux destinées à la consommation humaine, à l'exclusiondes eaux minérales naturelles [12] Les eaux douces superficielles sont classées selon leur qualité dans les groupes A1, A2 et A3 (Code de la santé publique, article R1321-38). Leur utilisation pour la consommation humaine est subordonnée pour les eaux classées en : - A1 : à un traitement physique simple et à une désinfection ; - A2 : à un traitement normal physique, chimique et à une désinfection ; - A3 : à un traitement physique et chimique poussé, à des opérations d'affinage et de désinfection. |
| Informations complémentaires |
Le manganèse est un métal de transition gris-blanc du groupe VIIB. Le 55Mn est son seul isotope stable et représente la totalité du manganèse naturel. Le métal et ses ions les plus communs sont paramagnétiques. Le manganèse existe sous des formes organiques et inorganiques qui présentent des caractéristiques physico-chimiques différentes. Le manganèse est le 11e métal par ordre d’abondance dans la croûte terrestre, dont il constitue 0,1 %. Il est présent à une teneur de 2 à 15 % dans les roches magmatiques et métamorphiques et de 8 % dans les roches sédimentaires. Il n'est pas trouvé naturellement sous sa forme élémentaire, mais il peut exister sous différents états d’oxydation dont les plus courants sont +2 et +4 suivis par +7, +3 et +6 (OMS 2011, Santé Canada 2019). Le manganèse entre dans la composition de plus de cent minéraux, les principaux sont : la pyrolusite (MnO2), le psilomélane (oxyde hydraté), l’hausmannite (Mn3O4), la rhodochrosite (MnCO3) et la rhodonite (silicate de manganèse) (Santé Canada 2019). Le dioxyde est le composé de manganèse le plus répandu dans la nature et la pyrolusite constitue le principal minerai du métal. Le manganèse est un élément essentiel pour un grand nombre d’organismes, y compris l’homme, et il est présent dans de nombreux aliments (IOM, 2001). C’est un oligo-élément qui joue un rôle indispensable dans l’activation de certaines enzymes. Chez l'homme, il participe activement au métabolisme des sucres (équilibre glycémique) et à la synthèse des lipides, en particulier du cholestérol. Il participe aussi à la formation du squelette et du tissu conjonctif (tissu de soutien de l'organisme). Les plantes et les légumes ont aussi besoin de manganèse. Une carence conduit à une diminution de la concentration en chlorophylle, nuisant de ce fait au développement par photosynthèse. |
Volume de production
| France |
FTE 2015 Importer 98 000 t de ferrosilicom anganèse 146 000 t de ferromanga nèse carburé t.an-1 |
|---|---|
| UE |
FTE 2015 Importer 579 000 t d'alliages de manganès e t.an-1 |
| Monde |
FTE 2015 Importer 20,3 millions de t de manganèse contenu Million s de t.an-1 (2018) |
Consommation
| Volume de consommation en France |
FTE 2015 Importer NA |
|---|---|
| Part de la consommation dédiée à l’usage principal en France |
FTE 2015 Importer NA |
Présence dans l'environnement
| Eaux de surface |
FTE 2015 Importer Sur les 2 842 mesures de manganèse effectuées sur sédiments entre 2016 et 2018 en France et accessibles dans la base Naïades, seules 2 mesures sont inférieures à la limite de quantification (limites de quantification comprises entre 0,4 et 5,3 mg/kg). Les concentrations médiane et maximale de manganèse s'élèvent respectivement à 407 et 87 169 mg/kg. La concentration maximale correspond à un échantillon prélevé dans le ruisseau du Buternay en région Centre-Val de Loire. D'après la base de données Naiades, 7 mesures de manganèse dans les eaux interstitielles des sédiments ont été effectuées sur un même site (un lac situé en région Pays de la Loire) entre 2016 et 2018, les concentrations obtenues étant comprises entre 1 310 et 7 300 µg.l-1 avec une médiane de 2 020 µg.l-1. En se référant aux mesures du programme FOREGS, les concentrations de manganèse dans les sédiments de cours d'eau sont pour la plupart inférieures à 795 mg/kg sur le territoire français avec des niveaux maximaux en Corse et dans le nord-est du territoire (de l'ordre de 795 - 1097 mg/kg). |
|---|---|
| Eaux souterraines |
FTE 2015 Importer La base de données ADES répertorie 38 492 mesures de manganèse dans les eaux souterraines en France entre 2016 et 2018. Parmi ces mesures, 14 462 (soit 38 % de la totalité des mesures) présentent une concentration supérieure à la limite de quantification comprise entre 0,05 et 2500 µg.l-1, une médiane de 6,07 µg.l-1 et une concentration maximale de 37 000 µg.l-1, cette dernière correspond à un prélèvement effectué dans la région Nouvelle-Aquitaine. |
| Air |
FTE 2015 Importer - |
| Sols |
FTE 2015 Importer D'après FOREGS, la majorité des couches profondes et superficielles des sols du territoire français présentent des teneurs en manganèse supérieures à 240 mg/kg. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
Le Tableau 5 rassemble les données de production mondiale disponibles pour différents éléments liés au manganèse : la production minière du minerai de manganèse, la production de différents alliages (Ferrosilicomanganèse, Ferromanganèse carburé, Ferromanganèse affiné), du dioxyde de manganèse, composé oxydé de manganèse par exemple utilisé dans les piles, et du manganèse métal électrolytique17 . Ce dernier est obtenu par électrolyse de solutions aqueuses de sulfate manganeux et sulfate d'ammonium qui donne du manganèse (dénommé EMM) à 99,98 % de teneur en manganèse.
La production minière mondiale du manganèse s'élève à 20,3 millions de tonnes de manganèse contenu en 2018. La production du minerai montre une croissance depuis 2001 (Tableau 5). Selon Elementarium18 , en 2018, les plus grands pays producteurs sont l'Afrique du Sud (7000 kt en manganèse contenu), Australie (3500 kt), Gabon (2100 kt), Chine (1300 kt), Brésil 1300 kt), Ghana (1200 kt), Inde (800 kt), Kazakhstan (800 kt), Ukraine (400 kt) et Malaisie (400 kt). Toutefois, le manganèse est extrait dans plus de 30 pays19 .
Dans la même année les principaux producteurs de minerai étaient South32 (5541 kt), Ningxia Tianyuan Manganese Industry (4800 kt), Eramet (4338 kt), Assmang Ltd. (3717 kt), Anglo-American 3607 kt), Compania Minera Autlan (1630 kt) et Vale (1572 kt).
Les exportations en 2018 ont porté sur un total de 39,734 millions de t de minerai. Les pays Européens importateurs de minerai sont notamment la Norvège (1982 kt), l'Espagne (392 kt) et la France (384 kt).
Tableau 5 : Production globale de manganèse entre 2001 et 2018
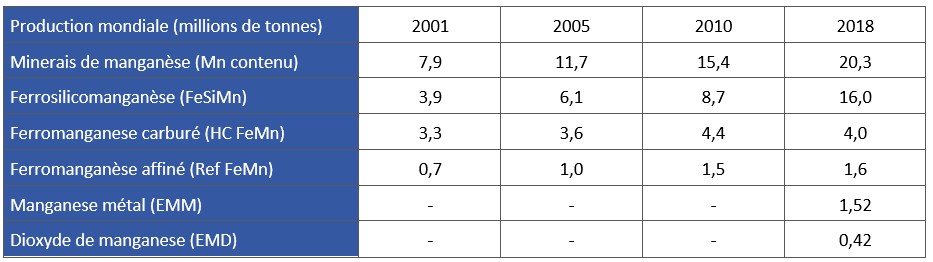
Source : IMnI (2016)20 & IMnl (2019)21
La production d'alliages de manganèse, directement liée à celle de l'acier, s'élève en 2018 à environ 21 millions de t dans le monde, dont 73% de ferrosilicomanganèse (FeSiMn), 20% de ferromanganèse carburé 20 % et 7% de ferromanganèse affinés (Elementarium). Depuis 2001, la quantité de production agrégée de ces trois alliages a augmenté (8 millions de t en 2001, 11 millions de t en 2005 et 15 millions de t en 2010).
Dans l'Union Européenne la production se fait principalement en France et en Espagne et s'élevait en 2015 à 579 000 t dont 259 000 t de ferrosilicomanganèse, 298 000 t de ferromanganèse carburé et
21 800 t de ferromanganèse affiné. Parmi les pays importateurs en Europe se trouvent l'Allemagne (450 kt) et les Pays-Bas (445 kt).
Les principaux producteurs du ferrosilicomanganèse sont en 2018 la Chine (64%), l'Inde (14%), l'Ukraine (5%), la Russie, la Norvège, la Géorgie et la Malaisie (2% chacun) (IMnl, 2019). Concernant le ferromanganèse carburé les principaux producteurs sont la Chine (40%), l'Inde (9%), le Japon et la Malaisie (8% chacun), la Russie (5%), la Corée du Sud, l'Afrique du Sud, l'Australie (chacun 4%), l'Ukraine (3%) et la Norvège (2%). Concernant enfin le ferromanganèse affiné les plus grands producteurs sont la Chine (47%), la Norvège (16%), la Corée du Sud (9%), le Japon (8%), l'Inde (5%), l'Afrique du Sud (4%), les Etats-Unis, le Mexique (chacun 3%), l'Espagne (2%) et le Brésil (1%).
Concernant la France (Tableau 6), la compagnie française ERAMET est le 2ème producteur au niveau mondial de minerai de manganèse et elle exploite une mine au Gabon (Elementarium). ERAMET produisait en 2018 4,338 millions de tonnes de minerai, en exportait 52 376 t vers l'Espagne, l'Allemagne et l'Italie et importait 382 563 t du Gabon et d'Afrique du Sud. Nous n'avons pas trouvé de statistiques sur les années antérieures. Les quantités d'alliages produites, importées et exportées en 2001 et en 2018 sont également indiquées dans le Tableau 6.
Tableau 6 : Manganèse - production et commerce extérieur de la France en 2001 et 2018 (en tonnes)
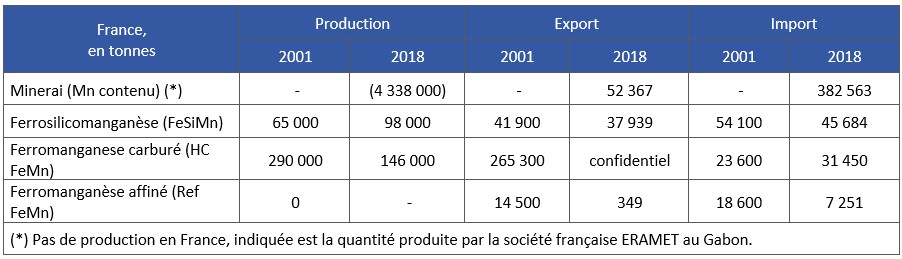
Source : Elementarium, ; IMnI (2016) https://www.lelementarium.fr/element-fiche/manganese/
Des informations sur des prix des alliages du manganèse sont publiées par Arcelor Mittal (2019)22 . La baisse des prix entre 2018 et 2019 (Tableau 7 indique des prix moyens) a son origine notamment en Europe, la réduction a été plus limitée aux Etats-Unis.
Tableau 7 : Prix des alliages du manganèse – prix moyens

Source : Arcelor Mittal (2019)
[17] https://www.eramet-comilog.com/Les-produits.html
[18] https://www.lelementarium.fr/element-fiche/manganese/
[19] https://www.manganese.org/about-manganese/
[20] IMnI (2016), Public Annual Market Research Report 2013, The International Manganese Institute.
[21] IMnl (2019), IMnl Statistics 2019, Statistics Report, International Manganese Institute, https://www.manganese.org/wp-content/uploads/2019/05/IMnI_statistics_2019.pdf
[22] Arcelor Mittal (2019), Interim Financial Report, Half Year ended June 30, 2019, Luxembourg.
Procédés de production
FTE 2015 Importer
Manganèse
Le manganèse est obtenu (INERIS, 2012) :
- Par aluminothermie à partir de minerais riches en dioxyde de manganèse ou tétraoxyde de manganèse
- Par électrolyse à partir de sulfate (obtention de manganèse pur à plus de 99 %)
Chlorure de manganèse
Le chlorure de manganèse est produit soit par réaction entre l'acide chlorhydrique dilué et des oxydes de manganèse (monoxyde, dioxyde ou trioxyde) soit par chloration directe de manganèse ou de ferromanganèse (INERIS, 2012).
Sulfate de manganèse
Le sulfate de manganèse est obtenu par réaction entre de l'acide sulfurique et de l'hydroxyde, du carbonate, de l'oxyde, ou du minerai de manganèse.
Le sulfate de manganèse est également un sous-produit de la fabrication de l'hydroquinone (INERIS, 2012).
Oxyde de manganèse
La synthèse d'oxyde de manganèse résulte (INERIS, 2012) :
- de la réduction du dioxyde de manganèse dans l'hydrogène
- du chauffage de carbonate de manganèse sans air
Dioxyde de manganèse
Le dioxyde de manganèse peut être produit
- par des techniques strictement chimiques :
- oxydation de sels ou de monoxyde de manganèse,
- décomposition thermique de nitrate de manganèse (méthode permettant d'obtenir un produit de pureté élevée),
- décomposition thermique/oxydation de carbonate de manganèse,
- par une technique électrochimique dans laquelle le minerai dioxyde de manganèse est réduit en monoxyde qui réagit avec de l'acide sulfurique en formant une solution de sulfate de manganèse dont l'électrolyse permet d'obtenir du dioxyde de manganèse (INERIS, 2012).
Tétraoxyde de manganèse
Le tétraoxyde de manganèse est présent naturellement dans l'environnement (hausmannite). Il peut être obtenu en oxydant dans l'air une suspension aqueuse de manganèse métal finement divisée (en présence de sels d'ammonium, à une température comprise entre 30 et 100 °C) ou en chauffant d'autres oxydes de manganèse à une température supérieure à 950 °C en présence d'air (INERIS, 2012).
Acétate de manganèse
L'acétate de manganèse est obtenu par réaction entre de l'acide acétique et de l'hydroxyde de manganèse (INERIS, 2012).
Carbonate de manganèse
Le carbonate de manganèse est naturellement présent dans l'environnement (rhodochrosite). Il peut aussi être produit suivant plusieurs méthodes (INERIS, 2012) :
- par précipitation résultant de l'addition de carbonate de sodium à une solution de sel de manganèse,
- par précipitation suite à l'ajout de carbonates de métaux alcalins ou de carbonates d'hydrogène à une solution de sulfate de manganèse,
- à partir du minerai de fer manganoferreux par traitement hydrométallurgique.
MMT
Le MMT est produit par réaction :
- entre le méthylcyclopentadiène et le manganèse carbonyle ;
- entre du bromure de cyclopentadienylmagnésium et du chlorure de manganèse. Le bis-cyclopentadienylmanganèse synthétisé forme du tricarbonyle après réaction avec du monoxyde de carbone qui est ensuite méthylé en présence d'un catalyseur pour former le MMT (INERIS, 2012).
Manèbe
Le manèbe est synthétisé à partir de la réaction entre du disulfure de carbone et de l'éthylène-diamine en présence d'hydroxyde de sodium ou d'ammonium, suivie d'un traitement par des sels de manganèse (INERIS, 2012).
Mancozèbe
Le mancozèbe est un complexe de zinc et de manèbe contenant 20 % de manganèse et 2,55 % de zinc produit par réaction d'une suspension aqueuse de manèbe avec une solution concentrée de sulfate de zinc (INERIS, 2012).
Utilisations
Introduction (varitétés d'utilisations)
FTE 2015 Importer
Le manganèse est le quatrième métal le plus utilisé en termes de tonnage dans le monde (après le fer, l'aluminium et le cuivre) (ERAMET; International Manganese Institute).
Comme illustré par la Figure 1, 90% du manganèse produit est destiné au secteur de la sidérurgie, et les 10% restants sont employés dans des secteurs industriels variés (production de batteries et piles, carburant, produits phytosanitaire…). Les diverses utilisations du manganèse ou de ses composés sont répertoriées dans les paragraphes suivants.
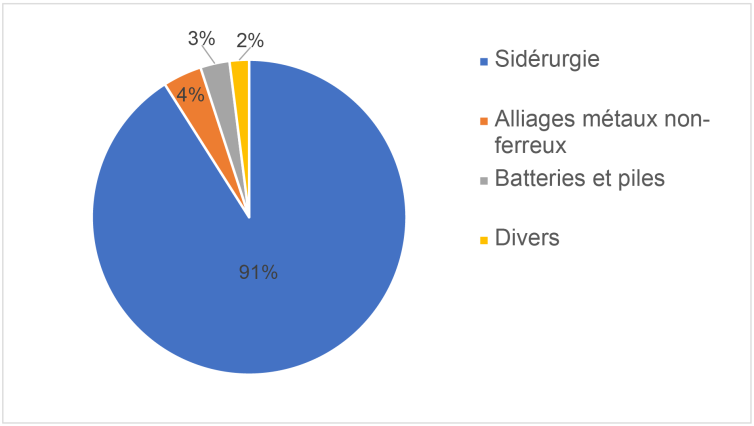
Figure 1. Répartition des utilisations de manganèse en 2014, d'après (ELEMENTARIUM, 2018b).
Métallurgie
FTE 2015 Importer
Alliages
Le manganèse est principalement utilisé pour la production d'acier. Les autres utilisations sont ensuite en alliage avec l'aluminium et le cuivre (dans une moindre mesure, le manganèse peut aussi se combiner avec d'autres métaux tels que le zinc, le magnésium…) (Alliance des minerais minéraux et métaux; ERAMET; International Manganese Institute).
Sidérurgie - Production d'acier
Le manganèse est employé dans les secteurs de la sidérurgie :
- en tant que composant d'alliages pour les propriétés qu'il confère au matériau final,
- en tant qu'agent désoxydant et désulfurant lors des traitements métallurgiques.
L'utilisation du manganèse en tant qu'élément d'alliage représente 70% du manganèse employé dans le secteur de la sidérurgie, les 30% restants correspondent à son emploi en tant qu'agent désoxydant et désulfurant (ERAMET).
Lorsqu'il est employé en tant que constituant d'un alliage, le manganèse que l'on incorpore se trouve lui-même sous forme d'alliage : il s'agit soit d'un alliage ferromanganèse, soit d'un alliage silicomanganèse. Le silicomanganèse, en plus d'améliorer les propriétés mécaniques, permet d'intégrer l'élément silicium, un puissant désoxydant. Le ferromanganèse, l'un des alliages de manganèse les plus utilisés, est un alliage à forte teneur en manganèse (de 65 à 90% de manganèse, en poids). Intégré à l'acier, le manganèse augmente son élasticité, sa dureté, sa résistance à l'usure, et facilite son travail. Le manganèse figure parmi les éléments d'alliage améliorant les propriétés mécaniques (résistance à l'usure et la solidité) les moins coûteux(ERAMET).
De plus, par ses propriétés désulfurantes, le manganèse permet de limiter un phénomène lié à la présence de soufre dans l'acier appelé "hot shortness" qui provoque des fissurations superficielles à haute température (Alliance des minerais minéraux et métaux; ERAMET; International Manganese Institute)
L'acier peut être faiblement allié au manganèse (avec des taux inférieurs à 5 %) ou fortement allié (avec des taux compris entre 11 et 14 %) (J.Tasker, 2001).
Les aciers faiblement alliés sont utilisés pour la production d'outils, éléments de carrosserie, rambardes, portes, barrières, tôles, outils, lames de couteaux… (METONORM, 2012)
Un taux élevé de manganèse confère à cet alliage une structure austénitique23 réputée pour son importante capacité de durcissement sous l'effet de certaines sollicitations telles que les chocs répétés ou les forces de frottement. L'emploi des aciers austénitiques au manganèse est indiqué pour les pièces soumises à des chocs répétés et les pièces d'usure telles que les équipements de concassage utilisés dans les mines métalliques et les carrières de roches, les équipements pour les voies ferroviaires (cœurs de croisement d'aiguillages et de passages à niveau) et les équipements de travaux (godets de pelle mécanique, de pelles de dragage, patins de chenilles…) (Harzallah, 2010).
Alliages d'aluminium
Le manganèse peut être allié à de l'aluminium (avec un taux compris entre 1 et 1,5 %), il améliore alors sa résistance à la corrosion (du magnésium peut aussi être intégré à cet alliage avec un niveau de concentration compris entre 0,05 et 1,3 %).
Les alliages [Aluminium-Manganèse] et [Aluminium-Manganèse-Magnésium] sont principalement utilisés pour la production de canettes, mais trouvent aussi des applications telles que les ustensiles de cuisine, les toitures, les radiateurs de voiture… (International Manganese Institute; ELEMENTARIUM, 2018a).
Alliages de cuivre
Le manganèse est employé (avec des taux compris entre 0,05 et 12 %) pour la production d'alliages de cuivre pour désoxyder et améliorer leurs propriétés mécaniques et de coulabilité24 (International Manganese Institute; ELEMENTARIUM, 2018b) (AVIVA METALS).
Ces alliages peuvent être utilisés pour l'industrie aéronautique, les fixations, la construction navale, l'industrie du pétrole et du gaz avec pour applications les pièces de trains d'atterrissage, les bagues entretoises, vis, pièces usinées, roulements, douilles, composants électriques, engrenages et écrous… (AVIVA METALS).
Production de divers alliages
Le manganèse est un composant entrant dans la composition de plusieurs alliages : les alliages de zinc ainsi que les alliages de magnésium contiennent du manganèse, mais on retrouve aussi cet élément dans la production d'or, d'argent et de bismuth. Néanmoins, dans certains cas, les quantités concernées sont très faibles (International Manganese Institute).
[23] Acier caractérisé par une structure moléculaire cubique à faces centrées (un atome au centre de chaque face)
[24] Aptitude d'un métal ou d'un alliage à remplir un moule dans tous ses détails, lorsqu'on l'y verse à l'état liquide.
Soudage
Le soudage à l'arc mis en œuvre dans de nombreux secteurs d'activités (métallurgie, nucléaire, électronique, automobile, aéronautique…) nécessite l'emploi d'électrodes dont l'enrobage comporte des oxydes de manganèse (INRS, 2015).
Production de piles et batteries
FTE 2015 Importer
Le principal secteur non-métallurgique d'utilisation du manganèse est l'industrie des batteries et piles (alcalines et lithium) (International Manganese Institute).
- Dans le cas des piles (alcaline ou lithium), le dioxyde de manganèse fait office de cathode. Les piles sont employées pour des applications d'usage domestique (télécommandes, lampes torche, horlogeries, etc.) et industriel.
Figure 2. Coupe d'une pile
- Les batteries lithium-ion ou accumulateurs Li-ion sont basées sur l'échange réversible de l'ion lithium entre une électrode négative en graphite et une cathode dont les matériaux peuvent comporter du manganèse (Nickel-Cobalt-Manganèse, LiMn2O4, Nickel-Cobalt-Aluminium, LiFePO4) (Devie, 2013).
Les applications de ces batteries sont variées : véhicules électriques, satellites, produits électroniques (téléphones, ordinateurs portables, etc.) ou encore l'outillage manuel sans fil.
Industrie chimique
FTE 2015 Importer
Le manganèse et ses principaux composés sont employés dans l'industrie chimique en tant que réactif, catalyseur ou oxydant.
En tant que réactif :
Le permanganate de potassium fait partie des produits chimiques les plus courants synthétisés à partir du manganèse (cf. paragraphe 2.2.5). Malgré l'existence d'un procédé chimique (par voie humide ou sèche), la synthèse du permanganate de potassium est majoritairement effectuée via un procédé électrochimique avec pour réactif du dioxyde de manganèse (ELEMENTARIUM, 2018b) :
1ère étape :
![]()
2ème étape : Oxydation des ions MnO42-en ions MnO4– par électrolyse de la solution de manganate (MnO42-) en présence de KOH, à 60°C.
Le permanganate est ensuite obtenu par cristallisation après refroidissement de la solution.
En tant que catalyseur :
Les oxydes de manganèse sont utilisés comme catalyseurs de réactions d'oxydation (les composés de manganèse peuvent être employés comme catalyseur dans la production d'arômes artificiels tels que celui de la vanille) (France Schmit, 2015) (International Manganese Institute). De même, les sels de manganèse sont aussi des catalyseurs en chimie organométallique, à titre d'exemple, le chlorure de manganèse (MnCl2) est un catalyseur l'acylation de composés organomagnésiens (Société chimique de France).
En tant qu'oxydant :
Le dioxyde de manganèse peut est utilisé en synthèse organique, il fait alors office d'oxydant sélectif des alcools : les alcools comportant des insaturations (les alcools benzyliques, allyliques et propargyliques) sont oxydés plus rapidement que les alcools saturés.
Cependant, cette réaction présente certains inconvénients dont la nécessité d'un large excès de dioxyde de manganèse (parfois plus de 40 équivalents) et des temps de réaction longs (George S. Zweife, 2007).
Traitement de l'eau
FTE 2015 Importer
Le permanganate de potassium est utilisé pour le traitement des eaux destinées à la consommation humaine : principalement en tant qu'oxydant pour la purification de l'eau potable (pour l'élimination du manganèse et du fer en solution), et dans une moindre mesure pour la prévention du développement d'algues dans les réservoirs d'eaux brutes, pour la pré-oxydation d'eaux naturelles afin d'éliminer des couleurs, goûts et odeurs et afin de minimiser la formation de THM25 dans une étape de chloration ultérieure. Néanmoins, l'action d'oxydation du permanganate vis-à-vis des composés organiques est sélective, par conséquent une attention particulière doit être portée aux doses de permanganate ajoutées pour éviter l'excès de cette substance qui colorerait l'eau en rose. De ce fait, l'emploi du permanganate de potassium pour ces applications relatives à l'oxydation de la matière organique reste limité (SUEZ), (ELEMENTARIUM, 2018b).
Le permanganate de potassium est aussi destiné au traitement des eaux usées (traitement par oxydation) et à la désodorisation des rejets industriels (peinture, conditionnement du poisson…) (ELEMENTARIUM, 2018b) (Commission Européenne, 2016; ELEMENTARIUM, 2018b).
Selon l'ECHA, quatre autres composés du manganèse sont employés comme produits de traitement des eaux (mais aussi régulateurs de pH), il s'agit : de l'acétate de manganèse, du sulfate de manganèse, du carbonate de manganèse, du chlorure de manganèse et du tétraoxyde de manganèse.
[25] TriHaloMéthanes (chloroforme, dichlorobromométhane, chlorodibromométhane, bromoforme)
Carburants
FTE 2015 Importer
Le MMT (Méthylcyclopentadiényle tricarbonyle de manganèse) est un additif antidétonant pour carburants destiné à augmenter l'indice d'octane, qui est synthétisé à partir de composés du manganèse.
Agriculture
FTE 2015 Importer
Produits phytosanitaires
Le mancozèbe correspond à la combinaison de deux substances : le zinèbe et le manèbe26 , un dithiocarbamate aussi nommé éthylène-bis-dithiocarbamate de manganèse et de zinc.
Selon l'index phytosanitaire ACTA 2019, l'utilisation du mancozèbe comme fongicide est destinée à une grande variété de cultures comprenant (2019) :
- Les grandes cultures – blé, triticale, épeautre, pois
- Les cultures légumières – ail, asperges, carottes, laitues, oignons, poireaux, pommes de terre…
- Les cultures fruitières – abricotier, cassissier, poirier, prunier…
- Les cultures porte-graine – betterave porte-graine, légumineuses fourragères porte-graine, plantes florales porte-graine, plantes potagères porte-graine…
- Les cultures ornementales – arbres et arbustes d'ornement toutes espèces florales, bulbes ornementaux, chrysanthème, rosier
- Les cultures tropicales – igname
- La viticulture
Le mancozèbe est un fongicide à large spectre agissant sur une multitude de champignons : mildiou, rouilles, septorioses, anthracnose, botrytis, cladosporiose, tavelures…
Cette substance peut être utilisée seule ou en association avec d'autres fongicides tels que le flutolanil ou le cymoxanil.
[26] Le manèbe est un fongicide à base de manganèse voisin du mancozèbe dont le domaine d’utilisation est sensiblement le même, néanmoins l’emploi de cette substance seule n’est plus autorisé en Europe depuis le 21/01/2017.
Alimentation animale
Le manganèse fait partie de la liste des huit oligo-éléments d'importance majeure en alimentation animale27 . A titre d'exemple, le manganèse est essentiel au développement du squelette du porc, et entre dans la composition de nombreuses enzymes impliquées dans le métabolisme des protéines, des lipides et des glucides de l'animal. Un régime alimentaire de la truie déficient en manganèse peut induire des troubles de la reproduction (IFIP, 2015).
Des composés de manganèse font partie des additifs nutritionnels autorisés pour les compléments alimentaires destinés à tous les animaux d'élevage28 , le Tableau 8 ci-après énumère les substances en question.
Tableau 8. Composés du manganèse autorisés en tant qu'additifs nutritionnels pour des compléments alimentaires à destination des animaux d'élevage

Le manganèse peut aussi être intégré à des compléments alimentaires sous forme de chélates29 (d'acides aminés hydraté, de manganèse d'hydrolysats de protéine, de manganèse de glycine hydraté).
[27] Avec le cuivre, le zinc, le sélénium, l'iode, le cobalt et, dans une moindre mesure, le fer et le molybdène.
[28] RÈGLEMENT D'EXÉCUTION (UE) 2017/1490 DE LA COMMISSION du 21 août 2017 concernantl'autorisation du chlorure manganeux tétrahydraté, de l'oxyde de manganèse (II), du sulfate manganeuxmonohydraté, du chélate de manganèse d'acides aminés hydraté, du chélate de manganèsed'hydrolysats de protéine, du chélate de manganèse de glycine hydraté et du trihydroxyde de chlorurede dimanganèse en tant qu'additifs pour l'alimentation de toutes les espèces animales
[29] Complexes entre un ligand et un cation métallique
Engrais
Le manganèse est un oligo-élément d'importance pour les plantes : il entre dans la composition de nombreuses enzymes nécessaires à la photosynthèse (Paul Mathis, 2015).
Le manganèse est incorporé aux produits fertilisants via l'ajout des substances suivantes (ECHA, 2019a; ECHA, 2019c):
- Sulfate de manganèse
- Oxyde de manganèse
- Acétate de manganèse
- Carbonate de manganèse
- Chlorure de manganèse
Electronique
FTE 2015 Importer
La ferrite de manganèse (produite à partir d'oxydes de manganèse) est utilisée en électronique pour la production de composants destinés à des applications de puissance (condensateurs électrolytiques) et de haute perméabilité pour antiparasitage (réduit les parasites électromagnétiques sur des câbles) (Technique de l'ingénieur, 2005).
Le carbonate de manganèse et le tétraoxyde de manganèse sont des matériaux semi-conducteurs employés dans les appareils électroniques et optiques (K.U. Madhu, 2013; ECHA, 2019a).
NB : dans le secteur de l'électronique, le manganèse peut aussi être employé pour des activités de soudage (cf. paragraphe 2.2.2.2).
Autres utilisations du manganèse
FTE 2015 Importer
Le manganèse et ses composés peuvent être employés dans une moindre mesure dans les secteurs suivants :
- Analyse chimique/Médecine : le permanganate est un puissant agent oxydant utilisé en analyse quantitative et en médecine (FOREGS);
- Enseignement : des dosages colorimétriques sont effectués par les élèves grâce à du permanganate de potassium
- Industries du verre, de la porcelaine, de la faïence, de la céramique, des briques et tuiles : des composés de manganèse (dont le dioxyde de manganèse pour le verre et les céramiques) sont utilisés comme agent de coloration, de plus, l'industrie du verre emploie l'oxyde de manganèse pour son action lors du polissage du verre (Delphine Clozel, 2008; Commission Européenne, 2012; INRS, 2015; Smart.Conseil, 2019) ;
- Industrie textile, du cuir et de la fourrure : le sulfate de manganèse, le chlorure de manganèse et l'acétate de manganèse sont destinés entre autres à l'élaboration de produits de traitement et colorants pour ces matériaux ;
- Peintures, vernis et encres : des composés du manganèse (sulfate de manganèse, oxyde de manganèse, dioxyde de manganèse (INRS, 2015), chlorure de manganèse, tétraoxyde de manganèse (ECHA, 2019c; ECHA, 2019g) sont employés comme siccatifs ;
- Industrie pharmaceutique : le chlorure de manganèse, le gluconate de manganèse, le carbonate de manganèse, le sulfate de manganèse, le citrate de manganèse et le glycérophosphate de manganèse font partie des substances vitaminiques et minérales pouvant être utilisées pour la fabrication de compléments alimentaires30 , de plus, le carbonate de manganèse entre dans la composition de produits homéopathiques (ANSM, 2017).
Le tableau, ci-après, synthétise d'autres utilisations des composés du manganèse (ECHA, 2019a; ECHA, 2019c; ECHA, 2019b; ECHA, 2019f; ECHA, 2019e; ECHA, 2019d; ECHA, 2019g).
Tableau 9. Synthèse des utilisations des composés du manganèse non-développées dans la FTE


[30] https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32002L0046&from=FR
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Avec une concentration d'approximativement 0,1 %, le manganèse est un élément relativement abondant dans la croûte terrestre. Cette substance n'est pas présente à l'état naturel sous forme élémentaire, mais entre dans la composition de plus de 100 minéraux dont divers sulfures, oxydes, carbonates, silicates, phosphates et borates (WHO, 2005).
L'Atlas géochimique européen FOREGS16 comporte des cartes illustrant les concentrations de manganèse dans 26 pays européens et dans différents milieux (sol couche profonde et de surface, sédiments de cours d'eau et de plaines alluviales et cours d'eau) (cf. paragraphe 4.3).
La concentration atmosphérique de manganèse est susceptible d'augmenter lors d'éruptions volcaniques, d'incendies de forêts, de l'érosion des sols (ANSES, 2018).
[16] Forum of the European Geological Surveys http://weppi.gtk.fi/publ/foregsatlas/ (consulté en septembre 2019).
Sources non-intentionelles
FTE 2015 Importer
Sans objet
Émissions anthropiques totales
FTE 2015 Importer
Le manganèse ne fait pas partie des substances déclarées dans E-PRTR (European Pollutant Release and Transport Register, registre européen des rejets et transferts de polluants), qui selon le Règlement 166/2006/CE, impose aux exploitants de sites industriels visés par ce règlement de déclarer leurs rejets, en fonction de seuils prédéfinis. Les émissions de manganèse dans l'eau, le sol et l'air ne sont donc pas répertoriées au niveau européen.
En revanche, en France, le manganèse et ses composés font partie des substances dont les rejets dans l'air, le sol et l'eau doivent être déclarés lorsqu'ils dépassent un certain seuil31 (cf. paragraphe 1.3.1 Seuils de rejets pour les installations classées et les stations de traitement des eaux usées). Cette déclaration annuelle se fait sur le Registre des Emissions Polluantes, l'IREP, via le logiciel dit GEREP (Gestion électronique du registre des émissions polluantes) et est gérée dans la base de données nationale du registre des émissions polluantes (BDREPIREP32).
La Figure 3 et le Tableau 10 ci-dessous compilent les données d'émission industrielles du manganèse et de ses composés vers tous les compartiments environnementaux entre 2008 et 2018.
Tableau 10. Emissions industrielles totales de manganèse et de ses composés entre 2008 et 2018 (Source : BDREP)
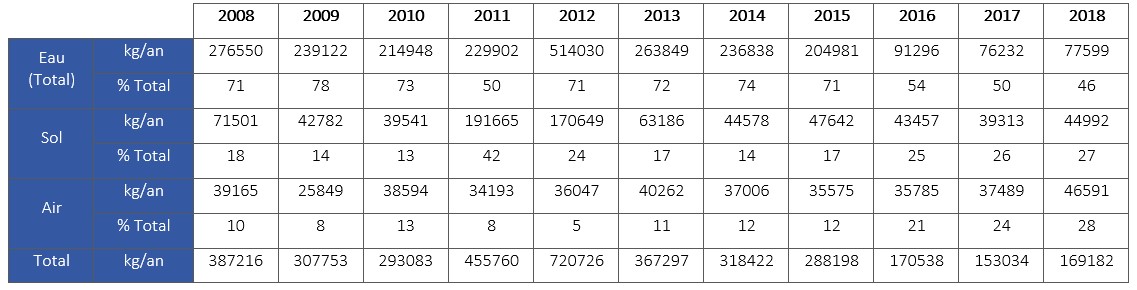
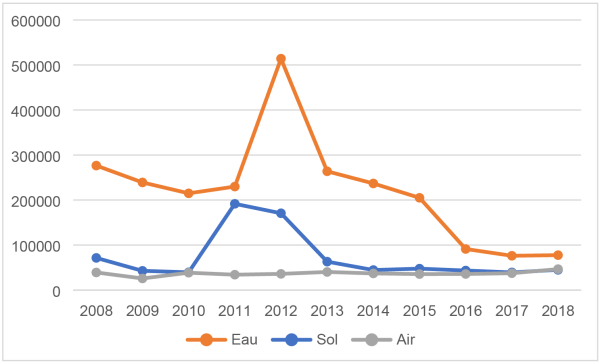
Figure 3. Evolution des émissions industrielles de manganèse et de ses composés entre 2008 et 2018 (Source : BDREP)
Depuis 2012, quel que soit le milieu récepteur (air, eau ou sol), les émissions industrielles de manganèse et de ses composés ont tendance à baisser. En dépit de l'écart qui tend à se réduire depuis 2015, notons que les effluents aqueux constituent, sur la période 2008 et 2018, les rejets les plus importants, jusqu'à 78% des émissions industrielles totales.
[31] Arrêté du 31/01/08 relatif au registre et à la déclaration annuelle des émissions et des transferts de polluants et des déchets modifié par l'arrêté du 11 décembre 2014
[32] http://www.georisques.gouv.fr/dossiers/irep-registre-des-emissions-polluantes
Émissions atmosphériques
FTE 2015 Importer
Les rejets liés à la production de ferro-alliages ainsi qu'aux activités des fonderies de fer et d'acier sont à l'origine de la majeure partie du manganèse présent dans l'atmosphère. D'autres rejets de manganèse dans l'atmosphère sont susceptibles de se produire dans les cas suivants : combustion de combustibles fossiles (centrales électriques, fours à coke) et entrainement de particules de sol33 (Jean-Claude Amiard, 2011).
Les flux de manganèse et de ses composés émis dans l'atmosphère et déclarés entre 2008 et 2018 via le logiciel GEREP ainsi que le nombre de déclarants sont présentés dans le Tableau 11 et la Figure 4 ci-dessous.
Tableau 11. Emissions atmosphériques de manganèse et de ses composés entre 2008 et 2018 (Source : BDREP)
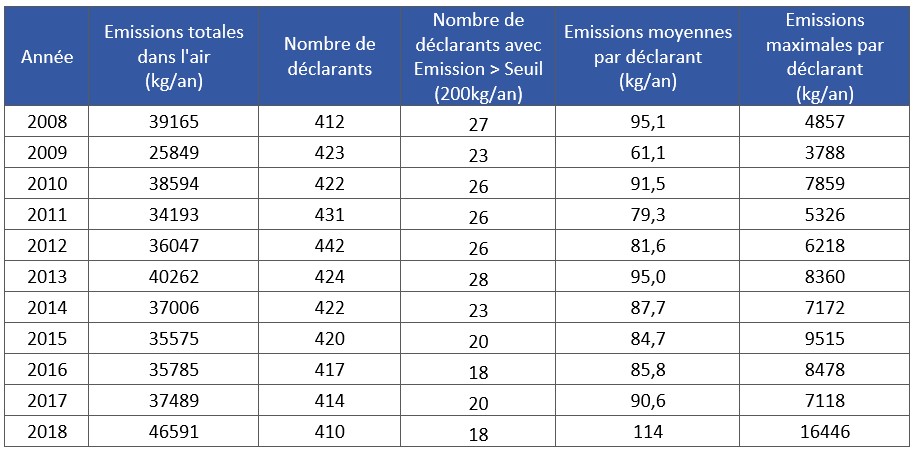
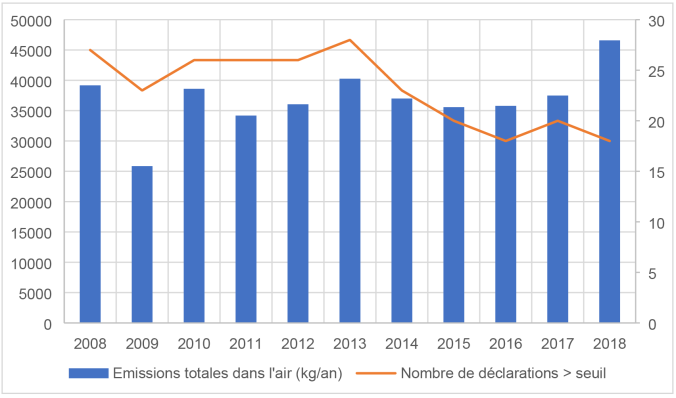
Figure 4. Evolution des émissions atmosphériques de manganèse et de ses composés entre 2008 et 2018 (Source : BDREP)
Les flux de manganèse et de ses composés émis dans l'atmosphère entre 2008 et 2018 sont relativement stables (compris entre 25 000 et 45 000 kg.an-1), de même pour le nombre de déclarations avec un niveau de rejet supérieur au seuil (nombre compris entre 18 et 28, cf. Tableau 11), même si leur nombre tend à décroître depuis 2013.
La Figure 5, ci-après, illustre la répartition géographique des émissions de manganèse et de ses composés déclarées en 2016 et consignées dans la base nationale BDREP.
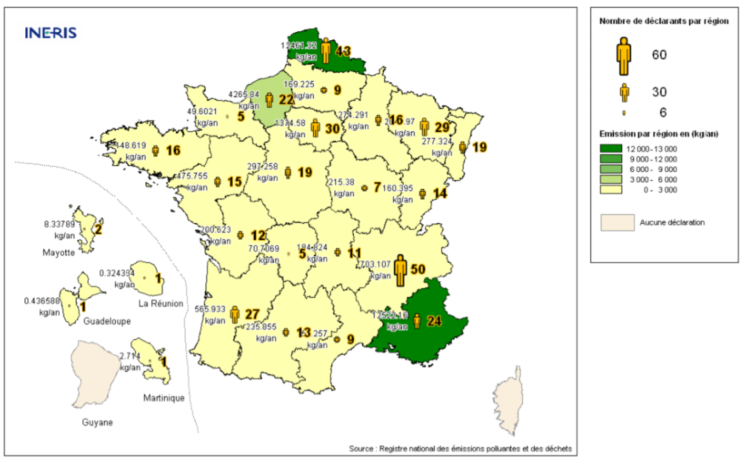
Figure 5. Répartition géographique des émissions atmosphériques de manganèse et de ses composés déclarées en 2016 (Source : BDREP)
Selon les flux d'émission disponibles sur la base de données BDREP, cinq établissements concentraient en 2018 les ¾ des émissions de manganèse dans l'atmosphère :
- le site le plus émetteur est un site de fabrication de pâte à papier,
- le secteur d'activité auquel appartiennent les quatre autres établissements est la sidérurgie.
Concernant le site de fabrication de pâte à papier, il semblerait selon un expert que cette donnée soit à considérer avec précaution car elle ne reflète pas le niveau des flux habituellement émis et déclarés par ce secteur d'activité. Ces flux seraient liés à l'emploi spécifique à ce site d'une chaudière biomasse dont la combustion d'écorce de bois serait susceptible d'émettre du manganèse.
Le Tableau 12, ci-après, compile les dix secteurs d'activité les plus émetteurs de manganèse et de ses composés dans l'atmosphère en 2018 selon les données issues de la base de données BDREP.
Tableau 12. Dix secteurs d'activité les plus émetteurs de manganèse et de ses composés dans l'atmosphère en 2018 (Source : BDREP)
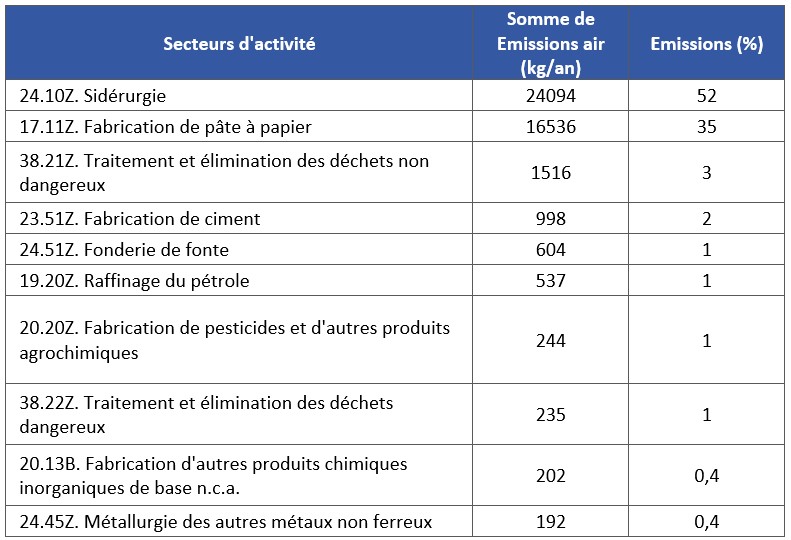
En 2018, la sidérurgie représentait plus de la moitié des émissions de manganèse et de ses composés. Notons que le secteur d'activité « Fabrication de pâte à papier » est en 2e position mais que 75% de ses émissions correspondent aux émissions d'un seul site qui rappelons-le, n'est pas représentatif des émissions usuelles de ce secteur d'activité.
[33] Pour mémoire, le manganèse représente environ 0,1 % de la croûte terrestre
Émissions vers les eaux
FTE 2015 Importer
Le registre français des émissions polluantes IREP compte deux types d'émissions vers les eaux : les émissions directes et les émissions indirectes. Un rejet direct est défini comme un rejet isolé dans le milieu naturel avec ou sans passage par une station de traitement propre au site industriel, alors qu'un rejet indirect est défini comme un rejet raccordé à une station d'épuration extérieure au site émetteur.
L'évolution des rejets de manganèse et de ses composés industriels totaux, directs et indirects vers les eaux dans est présentée dans le Tableau 13 et la Figure 6.
Tableau 13. Evolution des émissions de manganèse et de ses composés dans le compartiment « eau » (Source : BDREP)
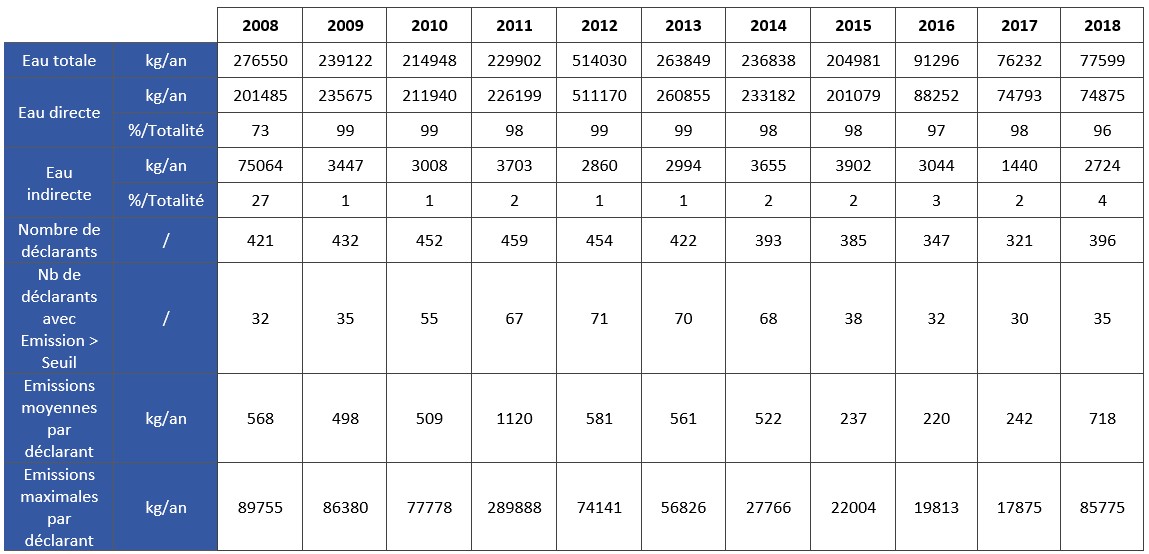
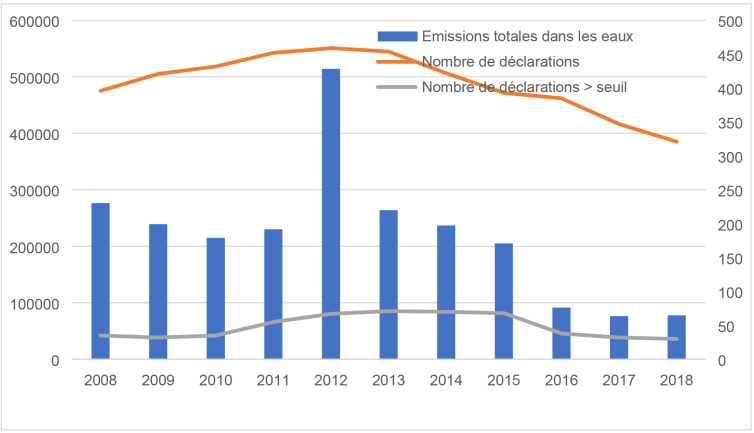
Figure 6. Evolution des émissions totales (rejets directs et indirects) de manganèse et de ses composés dans les eaux entre 2008 et 2018 (Source : BDREP)
Malgré un pic en 2012, les émissions totales de manganèse et de ses composés ont tendance à diminuer depuis 2013. Depuis 2009, les émissions « directes » représentent la quasi-totalité des effluents aqueux de manganèse et de ses composés.
La Figure 7 représente la répartition géographique des flux « directs » de manganèse et de ses composés vers les eaux en 2016.
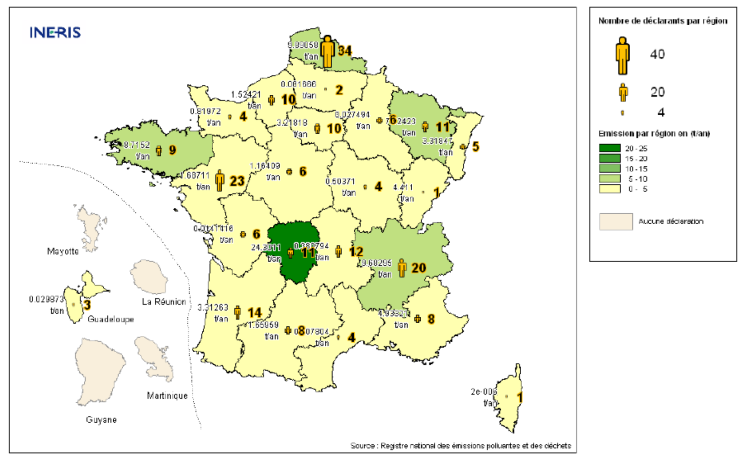
Figure 7. Répartition géographique des émissions « directes » dans le milieu eau de manganèse et de ses composés déclarées en 2016 (Source : BDREP)
D'après les données de la BDREP, un établissement représente à lui seul près d'un quart des émissions aqueuses de manganèse et de ses composés, il s'agit d'un site de fabrication de papier et de carton dont les émissions ne reflètent pas les émissions-type de ce secteur d'activité. Parmi les 9 autres sites les plus émetteurs de manganèse dans les eaux figurent 5 établissements du secteur de la chimie, un site sidérurgique, 2 sites de collecte et traitement des eaux usées et un site appartenant au secteur « Autres activités extractives n.c.a.34».
Les Tableau 14 et Figure 8, ci-après, illustrent la répartition sectorielle des effluents industriels aqueux de manganèse et de ses composés en 2018.

Figure 8. Répartition sectorielle des émissions de manganèse et de ses composés dans les eaux en 2018 (Source : BDREP)
Tableau 14. Dix secteurs d'activité les plus émetteurs de manganèse et de ses composés dans l'eau en 2018 (Source : BDREP)
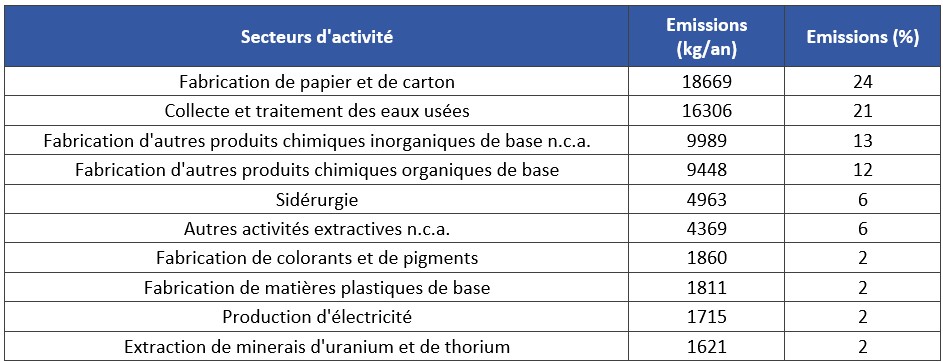
La moitié des effluents aqueux de manganèse et de ses composés proviennent du secteur de la chimie (fabrication de produits chimiques organiques et inorganiques) et de la fabrication de papier et de carton (un seul site est à l'origine de ces émissions qui ne sont pas représentatives des rejets classiques de ce secteur), 20% des effluents sont liés à la collecte et traitement des eaux usées et les 30% restants sont issus de nombreux secteurs dont la sidérurgie, la fabrication de colorants et de pigments…
Bien que ne disposant pas de données chiffrées données chiffrées, nous pouvons citer le lessivage par les eaux de pluie des décharges et des sols pollués comme sources d'émission de manganèse et de ses composés vers les eaux de surface (Jean-Claude Amiard, 2011).
[34] n.c.a. : Non Classées Ailleurs
Émissions vers les sols
FTE 2015 Importer
Emissions industrielles vers les sols
Le manganèse présent dans les eaux souterraines ou dans les sols peut être d'origine anthropique (déversements industriels, activités minières et lixiviation à partir de sites d'enfouissement, épandage de boues de STEP) ou naturelle (lixiviation des dépôts atmosphériques, tissus végétaux, feuilles d'arbres, excréments animaux).
Les émissions de manganèse et de ses composés dans les sols entre 2008 et 2018 issues de la base de données BDREP (émissions industrielles) sont présentées dans le Tableau 15 et la Figure 9 ci-dessous.
Tableau 15. Emissions de manganèse et de ses composés d'origine industrielle dans les sols entre 2008 et 2018 (Source : BDREP)
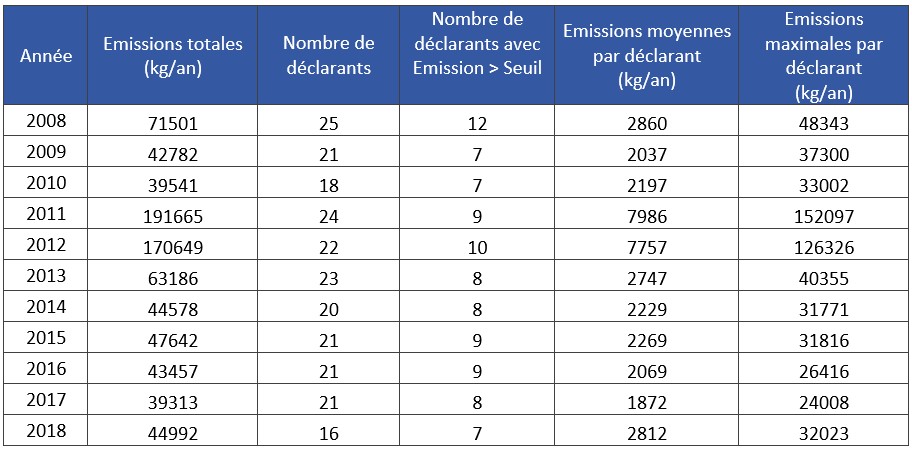
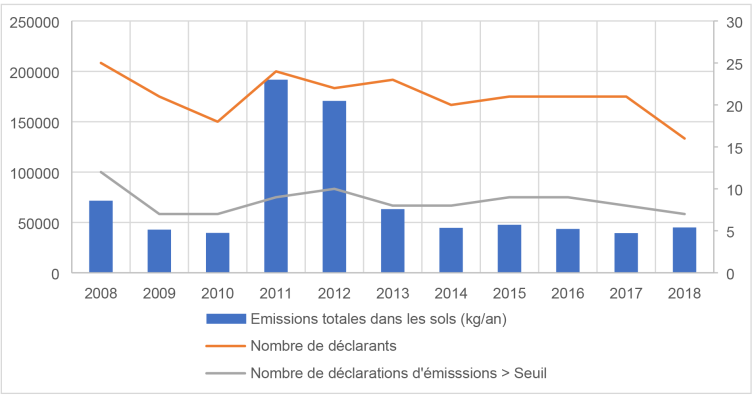
Figure 9. Evolution des émissions industrielles de manganèse et de ses composés dans les sols entre 2008 et 2018 (Source : BDREP)
Hormis un pic en 2011 et 2012, les émissions de manganèse et de ses composés dans les sols sont assez stables entre 2008 et 2018 : elles oscillent entre approximativement 40 000 et 70 000 kg.an-1. Sur cette même période, le nombre de déclarations d'émissions supérieures au seuil s'est lui aussi maintenu à un niveau relativement constant, compris entre 7 et 12. Les pics d'émissions en 2011 et 2012 sont liés aux rejets d'un seul et même site de production de sucre qui représentait à lui seul 79% des émissions en 2011 et 74% en 2012.
La Figure 10 ci-dessous décrit la répartition géographique des émissions de manganèse et de ses composés dans les sols déclarées en 2016 (cf. BDREP).

Figure 10. Répartition géographique des émissions dans le milieu sol de manganèse et de ses composés déclarées en 2016 (Source : BDREP)
Selon les données disponibles sur BDREP, un site représentait à lui seul en 2018 plus de 70% des émissions de manganèse et de ses composés dans les sols, il s'agissait d'un établissement de fabrication de papier et de carton. Selon un expert, le manganèse présent naturellement dans les fibres du bois nuit au blanchiment de la pâte à papier en dégradant les agents de blanchiment peroxydés, il est par conséquent éliminé par complexation avec de l'EDTA et se retrouve dans les boues susceptibles d'être épandues.
Le Tableau 16, ci-après, récapitule tous les secteurs d'activité ayant fait l'objet de déclarations d'émission dans les sols en 2018 (cf. BDREP).
Tableau 16. Dix secteurs d'activité les plus émetteurs de manganèse et de ses composés dans les sols en 2018 (Source : BDREP)
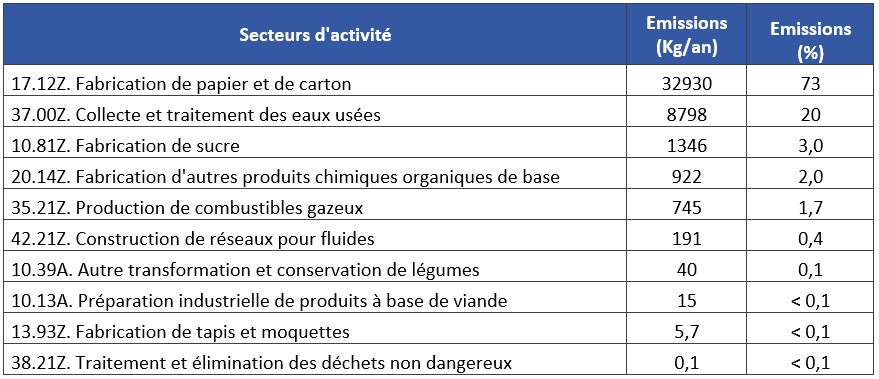
Le site de fabrication de papier évoqué précédemment impacte la répartition sectorielle des rejets de manganèse et de ses composés. Pour une meilleure exploitation, les mêmes données de rejet ont été traitées après le retrait des données de ce site (cf. Figure 11 ci-dessous).
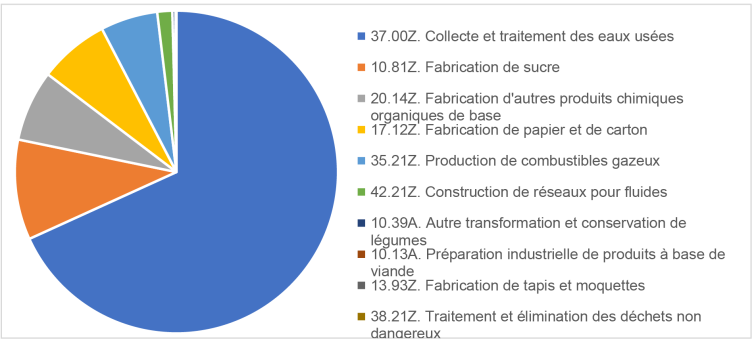
Figure 11. Répartition sectorielle des émissions de manganèse et de ses composés dans les sols en 2018 après retrait du site de fabrication de papier (Source : BDREP)
Il apparait qu'en 2018, le secteur d'activité de loin le plus émetteur de manganèse et de ses composés dans les sols était celui de la collecte et du traitement de eaux usées (avec 68% des rejets totaux). Ces rejets sont probablement liés à l'épandage des boues de STEP.
Emissions non-industrielles vers les sols
L'atmosphère peut être à l'origine, via des retombées, de la contamination des sols en manganèse. L'INERIS propose des niveaux de référence de retombées mesurés dans différentes typologies de contextes environnementaux, ces dernières sont compilées dans le Tableau 17 ci-dessous (INERIS, 2013).
Tableau 17. Concentrations moyenne en manganèse attendues dans différents contextes environnementaux (INERIS, 2013)
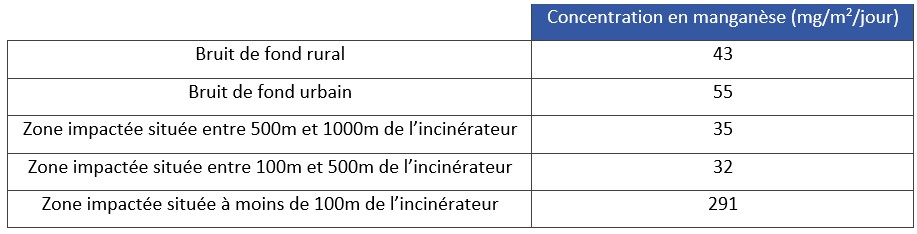
Pollutions historiques et accidentelles
FTE 2015 Importer
BASOL35 est une base de données française sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif. Le site internet de cette base de données permet d'effectuer des recherches par substance parmi les 7233 sites répertoriés. Sur les 21 sites pollués au manganèse identifiés sur la base de données, 12 ont abouti à un impact dans les eaux souterraines et dans les sols, 7 uniquement dans les eaux souterraines et 2 uniquement dans les sols. Dix-sept de ces sites sont traités avec surveillance et/ou restriction d'usage, 3 sont en cours d'évaluation et un site est traité et libre de toute restriction.
La base de données BDREP répertorie également les émissions accidentelles de manganèse et de ses composés dans l'environnement (cf. Tableau 18).
Tableau 18. Emissions accidentelles déclarées via le logiciel GEREP entre 2008 et 2018

[35] (consulté en décembre 2019). https://basol.developpement-durable.gouv.fr/
Présence environnementale
Atmosphère
FTE 2015 Importer
Pour rappel, le manganèse et ses composés sont peu voire non-volatils mais peuvent être présents dans l'atmosphère en phase particulaire. Les particules contenant du manganèse quittent le compartiment atmosphérique principalement par déposition sèche ou humide (WHO, 2005).
Aquatique
FTE 2015 Importer
La base de données Naïades37 recense 24 515 mesures de manganèse dans les eaux de surface en France entre 2016 et 2018. Parmi ces mesures, 23 087 (soit 94%) présentent des concentrations de manganèse supérieures à la limite de quantification comprise entre 0,05 et 50 µg.L-1. La concentration médiane en manganèse des échantillons dont la concentration est quantifiable s'élève à 7,65 µg.L-1 et est inférieure à la PNEC proposée par l'INERIS de 15 µg.l-1 dans l'eau douce. La concentration maximale en manganèse s'élève à 4 850 µg.L-1 et correspond à un prélèvement effectué dans un plan d'eau de la région Pays de la Loire (BRGM).
D'après les mesures du programme FOREGS, en France, la grande majorité du territoire est concernée par des concentrations en manganèse dans les eaux inférieures à 36,3 μg.L-1 avec des niveaux maximaux dans le département du Nord (cf. Figure 12) (FOREGS).

Figure 12. Distribution géographique des teneurs en manganèse dans les cours d'eau (mesures effectuées selon les pays entre 1998 et 2001) (FOREGS)
Sur les 2 842 mesures de manganèse effectuées sur matrices solides entre 2016 et 2018 en France et accessibles dans la base Naïades, seules 2 mesures sont inférieures à la limite de quantification (ces limites de quantification s'élevant à 0,4 et 5,3 mg/kg). Les concentrations médiane et maximale de manganèse s'élèvent respectivement à 407 et 87 169 mg/kg. La concentration maximale correspond à un échantillon prélevé dans le ruisseau du Buternay en région Centre-Val de Loire.
Sept mesures de manganèse dans les eaux interstitielles des sédiments ont été effectuées en un même site (lac situé en région Pays de la Loire) entre 2016 et 2018, les concentrations obtenues étant comprises entre 1 310 et 7 300 µg.l-1 avec une médiane de 2 020 µg.l-1 (BRGM).
En se référant aux mesures du programme FOREGS, les concentrations de manganèse dans les sédiments de cours d'eau sont pour la plupart inférieures à 795 mg/kg sur le territoire français avec des niveaux maximaux en Corse et dans le nord-est du territoire (de l'ordre de 795 - 1097 mg/kg) (cf. Figure 13) (FOREGS).

Figure 13. Distribution géographique des teneurs de manganèse dans les sédiments de cours d'eau (mesures effectuées selon les pays entre 1998 et 2001) (FOREGS)
Les concentrations les plus élevées de manganèse dans les sédiments français de plaines alluviales (680 - >1500 mg/kg) ont été constatées dans le Finistère, le Poitou, le nord du Massif Central et les Alpes occidentales (FOREGS).

Figure 14. Distribution géographique des teneurs de manganèse dans les sédiments des plaines alluviales (mesures effectuées selon les pays entre 1998 et 2001) (FOREGS)
La base de données ADES répertorie 38 492 mesures de manganèse dans les eaux souterraines en France entre 2016 et 2018. Parmi ces mesures, 14 462 (soit 38 % de la totalité des mesures) présentent une concentration supérieure à la limite de quantification comprise entre 0,05 et 2500 µg.l-1, une médiane de 6,07 µg.l-1 et une concentration maximale de 37 000 µg.l-1, cette dernière correspond à un prélèvement effectué dans la région Nouvelle-Aquitaine.
Terrestre
FTE 2015 Importer
Les teneurs en manganèse dans les sols des couches profondes et superficielles en Europe issues du programme FOREGS de 1998 à 2001 en fonction des pays sont représentées sur les Figure 15 et Figure 16.
D'après FOREGS, la majorité des couches profondes et superficielles des sols du territoire français présentent des teneurs en manganèse supérieures à 240 mg/kg.

Figure 15. Distribution géographique des teneurs de manganèse dans la couche profonde des sols (mesures effectuées selon les pays entre 1998 et 2001) (FOREGS)
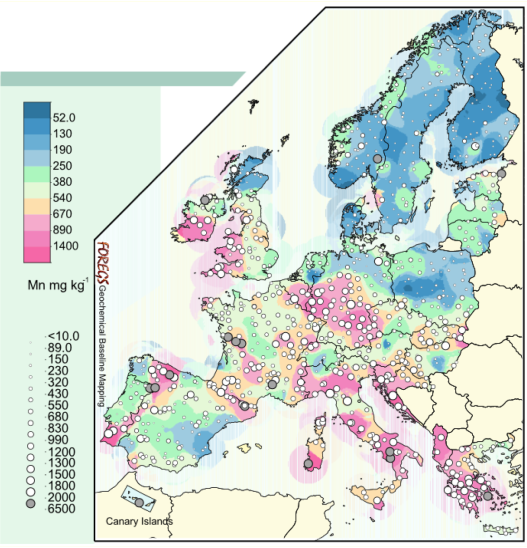
Figure 16. Distribution géographique des teneurs de manganèse dans la couche superficielle des sols (mesures effectuées selon les pays entre 1998 et 2001) (FOREGS)
Synthèse
FTE 2015 Importer
A l'échelle européenne
Dans le cadre du programme FOREGS36 , le manganèse a été quantifié entre 1998 et 2000 dans différents compartiments environnementaux en Europe (échantillons de sols, d'eaux et de sédiments), le Tableau 19, ci-après, récapitule les résultats de ces analyses.
Tableau 19. Concentrations en manganèse et oxyde de manganèse dans différents milieux environnementaux à l'échelle de l'Europe, d'après le FOREGS
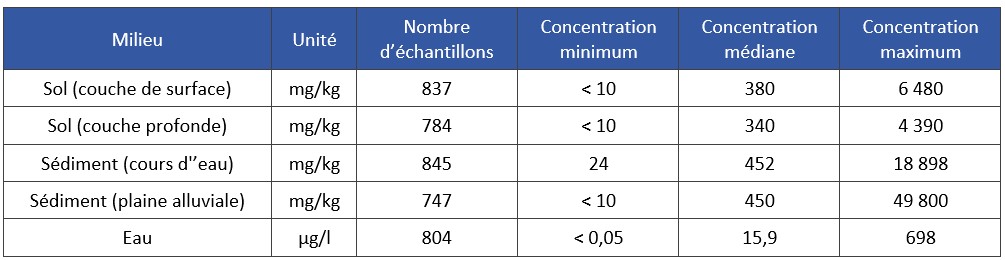
En se basant sur les concentrations médianes, le manganèse est présent de façon relativement uniforme dans les milieux solides (à savoir les sols et les sédiments), les concentrations étant de l'ordre de 0,06–0,08%.
En revanche, on observe une grande amplitude de concentrations du manganèse dans les cours d'eau : celles-ci couvrent une plage large de cinq ordres de grandeur allant de <0,05 à 698 μg.l-1.
[36] Forum of the European Geological Surveys http://weppi.gtk.fi/publ/foregsatlas/ (consulté en septembre 2019).
Perspectives de réduction
Réduction des rejets
FTE 2015 Importer
Traitement des eaux issues des sites miniers
Les eaux issues des sites miniers sont souvent des sources importantes de pollution des rivières en métaux, dont en manganèse. Des moyens spécifiques permettent de traiter le manganèse dans les eaux usées pour diminuer la concentration du manganèse dans les eaux (Brunet & Artignan, 200638). Le traitement actif repose sur l'utilisation d'un excès de réactif alcalin et d'oxydants puissants, dont les inconvénients sont leur coût, des pH incompatibles avec des normes de rejet, des réactifs polluants et la consommation énergétique.
Différents traitements passifs existent: ils font appel à des mécanismes de précipitation, oxydation, coprécipitation ou adsorption par voie physique, chimique ou biologique. Des exemples sont
- l'oxydation biologique utilisant entre autres des bactéries du type leptothrix ou hiphomicrobium,
- la sorbtion sur matière organique utilisant par exemple des algues, des bactéries, des champignons et des levures qui se lient au métal,
- la sorption sur les minéraux reposant sur une réaction de précipitation du manganèse qui peut également entraîner une coprécipitation et le piégeage d'autres métaux,
- la sorption sur les minéraux reposant sur l'adsorption du manganèse en solution par des matrices minérales.
Une combinaison de ces mécanismes permettrait d'éliminer plus de 95% de manganèse initialement présent dans les eaux usées.
Par ailleurs il existe également des traitements préventifs appliqués en amont des drainages et des rivières : la biolixivation du minerai (certains types de levure permettent de dissoudre le manganèse en produisant des acides organiques qui attaquent le manganèse) et les plantes hyper accumulatrices (accumulant le manganèse dans leurs feuilles). Leur efficacité est relative.
[38] Brunet, J. F. & Artignan, D., 2006, Synthèse bibliographique sur l'élimination du manganèse dans les eaux d'origine minière, rapport final, BRGM.
Traitement des eaux usées urbaines
Le manganèse fait partie des micro-éléments les plus abondants en termes de concentration des eaux usées urbaines. A l'issue des différentes phases de traitement des eaux usées, la grande partie des micropolluants métalliques s'accumule dans les boues résiduaires. Le rendement moyen global de l'épuration du manganèse dans une station d'épuration d'eaux usées urbaines, exprimé en pourcentage du métal entrant fixé par les boues, s'élève à 40%. L'efficacité de cette rétention dépend en effet de la nature des métaux, et le manganèse et le nickel sont moins facilement fixés que par exemple le mercure, le cuivre, le cadmium ou le zinc (Bouallegue, 201039).
[39] Bouallegue, M. M., 2010, Des métaux dans les boues de stations d'épuration ? Conséquences, origines et prévention, Synthèse Technique, AgroParisTech – ENGREF.
Elimination dans les eaux naturelles
Le manganèse est un élément très souvent présent dans les sols, et donc dans les eaux naturelles. Des concentrations de manganèse dans les eaux destinées à la consommation (eau potable) peuvent être réduites par des méthodes qui constituent également la base de réduction du manganèse dans les eaux issues de sites industriels. Les méthodes d'oxydation40 et de filtration permettent en générale d'atteindre des concentrations de 0,05 mg.l-1 (WHO, 201141). Plus en détail les procédés de démanganisation retenues dans la littérature sont les suivants (ANSES, 201842 , Brunet & Artignan, 2006, SUEZ43) :
- L'oxydation par l'oxygène ne permet pas une exploitation industrielle, car les temps de contact restent trop longs.
- C'est également le cas de l'oxydation par le chlore et de l'oxydation par le dioxyde de manganèse. Même si la présence de dioxyde de manganèse à pH élevé catalyse la réaction, cet effet est insuffisant pour obtenir une eau traitée complètement dépourvue de manganèse. A pH moindre, le MnO2 joue plutôt un rôle d'oxydant et doit régulièrement être regénéré.
- L'oxydation par le dioxyde de chlore n'est pas recommandée car elle produit des chlorites et ne peut pas être utilisée dans le cas d'eaux présentant une forte demande en
- oxydant. -Une autre option est l'oxydation par l'ozone.
- L'oxydation par le permanganate de potassium (KMnO4) est la plus utilisée en démanganisation physico-chimique.
- L'adsorption et oxydation catalytique sont des procédés de plus en plus utilisés aujourd'hui. Ils sont simples à mettre en œuvre, assez passifs et permettent de garantir des concentrations faibles en manganèse.
- Les traitements biologiques reposent essentiellement sur les bactéries permettant l'oxydation du manganèse (Leptothrix, Crenothrix, Sphaerotilus, Siderocapsa, Pseudomonas manganooxidans). La démanganisation biologique n'a pas besoin de réactifs, de plus la capacité de rétention est plus élevée qu'en mode physico-chimique. Un autre avantage du traitement biologique est la vitesse de filtration qui est plus élevée que dans le cas de l'oxydation chimique mais la présence d'autres ions (fer, ammonium) dans l'eau à traiter perturbe l'élimination par voie biologique.
- Les procédés d'adoucissement ou de décarbonatation à la chaux ou à la soude, éliminent le manganèse car les pH alcalins utilisés permettent son oxydation rapide.
- Pour les eaux de source et les eaux minérales il existe également la possibilité de nanofiltration pour éliminer le manganèse. L'eau est filtrée sur filtres à sable.
- Il existe enfin la possibilité de chélation et séparation sur membrane. L'addition d'un chélatant, tel que le polylère de l'acide polyacrylique, au moyen de membrane peut atteindre un taux d'élimination du manganèse de 90%.
[40] L'oxydation peut être obtenue par trois méthodes : oxygénation, ozonisation et catalyse (Brunet & Artignan, 2006).
[41] WHO, 2011, Manganese in Drinking-water, Background document for development of WHO Guidelines for Drinking-water Quality, World Health Organization.
[42] AVIS de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail relatif à la détermination d'une valeur sanitaire maximale admissible pour le manganèse dans l'eau destinée à la consommation humaine, Avis de l'ANSES, Saisine n°2016-SA-0203.
Fabrication du verre
Le document de référence (BREF – Best available techniques REFerence document) établissant les meilleures techniques disponibles (MTD) pour la fabrication du verre, au titre de la directive 2010/75/UE relative aux émissions industrielles (CE, 2013) propose deux MTD relatives au manganèse (cf. également CE, 2012). Les MTD identifiées visent à réduire les émissions de métaux du four de fusion. Elles consistent à:
- Sélectionner les matières premières de manière à obtenir un mélange vitrifiable à faible teneur en métaux : notamment réduire l'apport de manganèse utilisé pour la production de laine de verre comme oxydant dans le mélange vitrifiable,
- Appliquer un système de filtration.
Alternatives aux usages
Métallurgie
FTE 2015 Importer
Une alternative pour certains produits à l'acier au manganèse est l'acier de pointe Hardox 55044 . Par exemple pour des plaques de véhicules qui ont besoin d'une résistance forte à l'usure mécanique, et qui doivent par ailleurs rester faciles à profiler, à souder et à usiner. Le Hardox 550 est caractérisé par une résistance à l'abrasion très élevée.
Plutôt qu'être remplacé par d'autres substances, le manganèse semble parfois être envisagé comme substitut pour d'autres substances. C'est par exemple le cas dans la métallurgie où le manganèse substitue parfois d'autres métaux. Selon ERAMET45 , le manganèse est l'élément d'alliage le moins cher parmi ceux qui améliorent des propriétés mécaniques fondamentales de l'acier comme la résistance et la solidité. Dans le cas particulier de l'acier inoxydable, le manganèse est un substitut du nickel, matériau cher, dans certains types d'alliages austénitiques appelés Série 200.
Piles et batteries
FTE 2015 Importer
Le remplacement du manganèse dans les piles et batteries ne semble pas être envisagé non plus. Au contraire, il est envisagé que des oxydes de nickel et de manganèse puissent remplacer les oxydes de cobalt toxiques utilisés dans les batteries lithium-ion46 .
Imagerie à résonance magnétique
FTE 2015 Importer
Un autre secteur dans lequel le manganèse pourrait substituer d'autres métaux actuellement utilisés est l'imagerie à résonance mécanique (IRM). Des études sont en cours sur la possibilité de remplacer les agents de contraste actuellement utilisés dans l'IRM par un agent basé sur du manganèse47 . Les agents actuellement utilisés contiennent du gadolinium. Il y a des craintes que tout le gadolinium injecté pour le scan ne soit pas éliminé par l'organisme et que les traces de gadolinium laissées dans les tissus puissent être nocives à long terme pour la santé humaine. Dans les tests avec le substitut manganèse, les chercheurs n'ont pas trouvé de traces d'accumulation de manganèse dans les tissus.
Conclusion
FTE 2015 Importer
Les rejets de manganèse et de ses composés dans le milieu naturel par des installations classées font l'objet de seuils de rejets. Néanmoins, ni le manganèse, ni ses composés ne disposent de Norme de Qualité Environnementale (NQE) ou de Valeur Guide Environnementale (VGE).
Le manganèse est employé principalement dans le secteur de la sidérurgie pour produire de l'acier, et de façon moindre pour produire des alliages non-ferreux et des piles et batteries (d'autres usages du manganèse ont été identifiés dans les secteurs de l'industrie chimique, du traitement de l'eau de l'agriculture et de l'électronique).
Les émissions de manganèse et de ses composés ont tendance à diminuer depuis 2012. Les secteurs d'activité les plus émetteurs de manganèse dans l'environnement sont la sidérurgie, l'industrie chimique, la collecte et le traitement des eaux usées et la fabrication de papier et carton. Le compartiment « eau » est le milieu récepteur qui recueille le plus de rejets de manganèse et de ses composés.
Dans l'environnement, le manganèse est naturellement présent dans le sol (sa concentration dans la croûte terrestre s'élève à environ 0,1 %), sa concentration dans les eaux de surface est inférieure à 36,3 µg.l-1 pour la grande majorité du territoire français.
Mis à part l'objectif de réduire l'apport de manganèse utilisé pour la production de laine de verre comme oxydant dans le mélange vitrifiable afin de réduire les émissions de métaux du four de fusion dans la fabrication du verre, la réduction d'émissions de manganèse n'est pas une cible dans les documents européens de référence pour les meilleurs techniques disponibles (BREFs – Best available techniques REFerence Documents). Au contraire, des composés du Manganèse sont utilisés pour l'oxydation et le traitement d'autres polluants dans les effluents industriels.
Des traitements permettant de réduire le manganèse contenu dans les eaux et ses émissions vers les eaux sont largement documentés, tels que les traitements faisant appel à des mécanismes de précipitation, oxydation, co-précipitation ou adsorption par voie physique, chimique ou biologique. Concernant la substitution, plutôt qu'être remplacé par d'autres substances, le manganèse semble parfois être envisagé comme substitut pour d'autres substances, dont le nickel pour la production de l'acier inoxydable et les oxydes de cobalt utilisés dans les batteries lithium-ion.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :


