Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Oxyde de tert-butyle et de méthyle (1634-04-4)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
1634-04-4
Nom scientifique (FR)
Oxyde de tert-butyle et de méthyle
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
216-653-1
Code SANDRE
1512
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C5H12O }\)
Code InChlKey
Code SMILES
O(C(C)(C)C)C
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H225 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs très inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
88.15 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 05/03/2025
Matrices
Atmosphère
FDTE/VTR Importer Le MTBE se volatilise facilement de l’eau vers l’air du fait de la valeur élevée de la constante de Henry.
Milieu eau douce
FDTE/VTR Importer Le MTBE est très soluble dans l’eau.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
FDTE/VTR Importer La faible valeur du coefficient de partage carbone organique-eau (Koc) permet de conclure que le MTBE a une mobilité élevée dans les sols.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
FDTE/VTR Importer Hydrolyse
En milieu très acide, le MTBE peut être hydrolysé mais le pH nécessaire est très inférieur au pH existant dans le milieu naturel.
Photolyse dans l'eau
Le spectre UV du MTBE indique que la photolyse directe dans l'eau ne peut pas avoir lieu.
Dégradation dans l'air
D'après les données existantes, la demi-vie de dégradation du MTBE dans l'air est de 3 à 6 jours selon les conditions environnementales.
En utilisant un taux de dégradation constant de 2,84.10-12 et une concentration en radicaux OH de 5.105 radicaux.cm-3, une demi-vie de 5,65 jours a été calculée.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
FDTE/VTR Importer Le MTBE n'est pas facilement biodégradable dans l'environnement aquatique : Dans un test de la "bouteille fermée" (OCDE Ligne Directrice 301D) avec 2 mg de substance, aucune dégradation n'est observée après 28 jours (Huels, 1991c). Ce même test a été réalisé avec également 2 mg de substance, il a montré 1,8 % de dégradation après 28 jours (RBM,1996). Aucun résultat de test standardisé sur la biodégradation inhérente n'est disponible. Les seules données disponibles proviennent de tests non standards qui indiquent que le MTBE n'est pas biodégradable de façon inhérente, bien que de forts taux de minéralisation aient été observés dans ces tests utilisant des inoculum de caractéristiques spéciales (Salanitro et al., 1994; Sun et al., 1993). En anaérobie, une étude faite par Mormile et al., (1994) sur un microcosme eau/sédiment statique a montré que le MTBE a été dégradé lentement. Après 152 jours, seul un échantillon a montré approximativement une diminution de 50 % de la concentration du MTBE. Après 249 jours d'incubation, le MTBE n'est pas dégradé dans des conditions d’anaérobie (Suflita et Mormile, 1993).
Milieu terrestre
FDTE/VTR Importer D'après les études disponibles, le MTBE n'est pas biodégradable dans le sol. La CE (2001) a retenu une de demi-vie de 106 jours.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Un BCF de 2,7 pour 28 jours d'exposition des Pimephales promelas est mentionné dans OMS IPCS (1998) (Veith et Kosian, 1983).
Des BCF du corps entier de 1,5 et 1,4 ont été enregistrés pour des carpes japonaises exposées à 10 et 80 mg.L-1 de MTBE dans un système continu à 25°C. Les poissons exposés pendant 28 jours et ensuite transférés dans une eau propre ont éliminé presque tous les résidus de MTBE en 3 jours (Fujiwara et al., 1984).
Ces BCFs ainsi que la faible valeur du Kow indiquent un faible potentiel de bioconcentration. La CE (2001) a retenu un BCF de 1,5.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucun résultat d’essai valide n’a pu être trouvé dans la littérature.
Bibliographie
Toxicologie
Dernière vérification le 07/07/2025
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1998 ; OMS IPCS, 1998 ; IARC, 1999 ; CE, 2000). Les références bibliographiques sont citées pour permettre un accès direct à l'information scientifique mais n'ont généralement pas fait l'objet d'un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Le méthyl tertio-butyl éther (ou MTBE) peut pénétrer dans l'organisme par inhalation, ingestion, et dans une moindre mesure par contact cutané. L'essentiel des données provient d'études expérimentales réalisées chez des volontaires sains et d'études épidémiologiques réalisées chez des personnes exposées à l'essence oxygénée (contenant environ 15 % de MTBE). Le MTBE est rapidement absorbé par inhalation chez l'homme. Chez 10 volontaires mâles exposés durant 2 heures d'exercice physique léger à des concentrations de 5, 25 ou 50 ppm (18, 90 ou 180 mg.m-3), le taux d'absorption pulmonaire variait de 32 à 42 % (Johanson et al., 1995). Les taux assez élevés s'accompagnent d'une diminution de la fréquence ventilatoire de l'ordre de 50%. Les calculs correctifs effectués par Nihlen et al., (1998b) montrent un taux d'absorption de 42 à 49 %. Ce taux peut-être modifié selon que l'on respire par le nez et la bouche ou seulement la bouche. Les taux sanguins de MTBE augmentent rapidement dès le début de l'exposition et s'effondrent à la fin de l'exercice. A 50 ppm de MTBE, le pic sanguin est de 1,14 mg.L-1 (Johanson et al., 1995). Il existe une forte corrélation entre les niveaux de MTBE dans l'air (variant entre 0,02 et 2,92 mg.m-3) et les variations des concentrations sanguines mesurées chez des travailleurs exposés avant (moyenne : 1,15 µg.L-1) et après (moyenne : 1,8 µg.L-1 ) une journée de travail (Moolenaar et al., 1994). Les taux moyens sont proportionnels à la concentration inhalée (Johanson et al., 1995 ; Nihlen et al., 1998b) au moins jusqu'à 50 ppm. Selon Pekari et al., (1996), il en est de même jusqu'à 75 ppm (270 mg.m-3) pour 4 heures d'exposition. A l'arrêt de l'exposition, la concentration sanguine chute rapidement en raison de la métabolisation du MTBE et de son élimination par voie respiratoire. Il n'y a pas de données sur la pénétration cutanée du MTBE. Par voie digestive, en raison de son faible poids moléculaire et de son caractère très lipophile, on peut s'attendre à une absorption rapide et importante. Historiquement, le MTBE a été administré par voie per cutanée et trans hépatique pour dissoudre des calculs de la vésicule. Les taux sanguins observés étaient similaires à ceux observés par Pekari.
Distribution
FDTE/VTR Importer Le MTBE est une petite molécule lipophile qui franchit facilement les barrières biologiques. Il se distribue à tous les organes par voie sanguine. Chez les sujets traités pour la dissolution des calculs biliaires, le MTBE est retrouvé dans le sang, le tissu graisseux et le lait maternel. A la fin du traitement, la concentration dans le lait est identique à celle du sang, et 3 à 4 fois plus élevée dans la graisse (Leuschner et al., 1991).
Métabolisme
FDTE/VTR Importer Le MTBE qui n'est pas directement éliminé par expiration est métabolisé initialement en tert-butanol (TBA) et formaldéhyde. Chez l'homme, des taux élevés de TBA ont été mesurés après exposition au MTBE, les taux étant comparables à ceux du MTBE (Prah et al., 1994 ; Johanson et al., 1995 ; Cain et al., 1996 ; Nihlen et al., 1998b). Les composés secondaires du métabolisme sont le méthanol, l'acide formique et le dioxyde de carbone. Des traces de méthanol ont été détectées dans le sang et l'urine de patients traités par le MTBE pour des calculs de la vésicule (Leuschner et al., 1991). Ces métabolites sont également éliminés rapidement de l'organisme, dans l'air exhalé ou dans l'urine.
Élimination
FDTE/VTR Importer L'élimination respiratoire du MTBE inhalé représente 32 à 47 % de la quantité absorbée. Moins de 0,1 % est excrété inchangé dans les urines et moins de 1 % sous forme de TBA dans les urines des 24 heures. Le MTBE est éliminé sous forme des métabolites finaux (Nihlen et al., 1998b).
Autre
FDTE/VTR Importer
Chez l'animal
Absorption
FDTE/VTR Importer Les données obtenues chez l'animal confirment le taux d'absorption élevé du MTBE au niveau pulmonaire ou oral. Des rats exposés par inhalation au 14C-MTBE à la dose de 400 ou 8 000 ppm durant 6 h ont présenté une augmentation rapide des concentrations plasmatiques en MTBE, avec un plateau obtenu au bout de 2 h (Miller et al., 1997). Par voie orale, des rats ayant reçu une dose unique de 40 ou 400 mg.kg-1 de 14C-MTBE, ont présenté un pic de concentration plasmatique en moins de 15 min, suggérant une absorption rapide. En 48 h, de 80 à 95 % de la radioactivité de départ (inhalée ou ingérée) a été récupérée dans l'air exhalé et l'urine, suggérant un taux d'absorption élevé (Miller et al., 1997). Par voie cutanée, l'absorption du MTBE est moins importante, et augmente avec la dose. Chez le rat, elle a été estimée à 14,5 % à la dose de 40 mg.kg-1 et 35,7 % à la dose de 400 mg.kg-1 (Miller et al., 1997). L'absorption cutanée se produit probablement par diffusion passive (ATSDR, 1998).
Métabolisme
FDTE/VTR Importer Le MTBE absorbé passe dans le sang où sa demi-vie est de l'ordre de 0,5 à 0,8 h, une partie étant éliminée par inhalation, l'autre partie étant déméthylée en tert-butanol (TBA) et formaldéhyde via les cytochromes P4502E1 et P4502B1 (Brady et al., 1990). Le formaldehyde peut être ensuite réduit en méthanol et oxydé en acide formique (Snyder, 1979), qui peut à son tour être métabolisé en dioxyde de carbone. Le TBA est métabolisé en 2-méthyl-1,2-propanediol et en acide a-hydroxyisobutyrique, qui sont éliminés par voie urinaire. Le MTBE et son métabolite majeur, le TBA, ont été retrouvés dans le cerveau, le foie, le tissu graisseux et les reins (Savolainen et al., 1985 ; Borghoff et al., 1998).
Élimination
FDTE/VTR Importer L'exposition de rats à du MTBE radiomarqué, par inhalation (400 ou 8 000 ppm durant 6 h) ou voie orale (40 ou 400 mg.kg-1 en une prise), a montré que l'élimination de ce composé et de ses métabolites était quasiment totale au bout de 48 h et se produisait essentiellement par voie pulmonaire et rénale, et ce quelle que soit la voie d'administration (Miller et al., 1997). Il n'y a donc pas d'accumulation significative dans l'organisme.
Autre
FDTE/VTR Importer
Equivalents biosurveillance
Description
FDTE/VTR Importer Le MTBE n'existant pas à l'état naturel, les teneurs en cette substance dans les différents milieux biologiques devraient être nulles chez des personnes non exposées. Suite à l'utilisation de MTBE dans les carburants comme additif, la concentration sanguine en cette substance chez des banlieusards faisant chaque matin le trajet domicile-travail en voiture a été estimée à 0,18 µg.L-1 (0,05-0,3 µg.L-1). Après la suppression de ces carburants reformulés, la concentration sanguine est tombée à 0,09 µg.L-1 (<0,05-0,41 µg.L-1) (Moolenaar et al., 1994). Une forte corrélation existe entre les teneurs sanguines et les concentrations dans l'air.
Toxicité aiguë
Généralités
FDTE/VTR Importer Afin d'augmenter l’indice d’octane des carburants et plus récemment, afin de réduire l'émission de dioxyde de carbone, le MTBE a été utilisé comme additif à l'essence, à raison de 15% en volume. En 1992, peu de temps après l’addition de MTBE dans les carburants, en Alaska notamment, de nombreux utilisateurs se sont plaint de maux de tête, d’irritation oculaire et de toux (Beller et Middaugh, 1992 ; Chandler et Middaugh, 1992). Diverses études épidémiologiques et expérimentales ont été initiées. Dans cette partie sont décrites uniquement les études d'exposition contrôlée, les études de terrain, concernant des expositions répétées, étant développées dans la rubrique "Toxicologie à doses répétées".
Chez l'homme
Inhalation
FDTE/VTR Importer Aucune donnée n'est disponible concernant la mortalité chez l'homme après inhalation de MTBE.
L'exposition de volontaires sains à des doses correspondant à l'exposition de populations durant un trajet de banlieue (5-6 mg.m-3 durant 1 h), n'a induit aucune inflammation des muqueuses oculaires ou nasales et aucun symptôme tel que céphalée, fatigue, irritation, hormis une sensation de gêne liée à l'odeur, surtout chez les femmes (Prah et al., 1994 ; Cain et al., 1996). Des résultats similaires ont été observés pour des expositions à des niveaux plus élevés : 18, 90 ou 180 mg.m-3 (5, 25 ou 50 ppm) durant 2 h (Johanson et al., 1995 ; Nihlen et al., 1998a). Des effets légers, essentiellement une sensation de lourdeur dans la tête, et dans une moindre mesure une irritation des muqueuses, ont été décelés chez des volontaires exposés durant 3 h à 268 mg.m-3 (75 ppm) (Riihimaki et al., 1996). Au cours de ces études, l'odeur du MTBE a entraîné une gêne importante chez les personnes exposées. En effet, le MTBE a une odeur nauséabonde, détectable dès 0,1 à 0,2 mg.m-3 et identifiable dès 0,2 à 0,5 mg.m-3 pour le produit pur (TRC, 1993 ; Smith et Duffy, 1995). En mélange dans l'essence, la limite de détection se situe entre 0,3 et 3 mg.m-3 (HEI, 1996).
D'après ces résultats, il est peu probable que le MTBE puisse, à lui seul, exercer des effets toxiques aigus sur la population générale dans les conditions habituelles d'exposition par la voie respiratoire. Il est cependant à noter que les effets potentiels d'essences additionnées de MTBE, dans les conditions où la plupart des gens sont exposés à cet additif lorsqu'ils utilisent des carburants oxygénés, n'ont été étudiés ni expérimentalement, ni par le biais de méthodes épidémiologiques prospectives. Par ailleurs, le rôle de facteurs tels que la perception de la présence de MTBE, explicable en partie par l'odeur particulière de ce composé, n'a pas été étudié non plus.
Voie orale
FDTE/VTR Importer Aucune donnée n'est disponible concernant la mortalité chez l'homme après ingestion de MTBE.
Chez l'animal
Inhalation
FDTE/VTR Importer Chez diverses espèces animales, le MTBE présente une toxicité aiguë faible par inhalation. Par inhalation, une CL50 de 39 460 ppm (142 000 mg.m-3) sur 4 heures a été établie chez le rat (ARCO Chemical Company, 1980). Les animaux présentaient une irritation oculaire et nasale, une mauvaise coordination et une respiration irrégulière et rapide. Aux plus fortes concentrations, la respiration était superficielle et épisodique, aboutissant à la mort des animaux. Les survivants avaient totalement récupéré en 24 h. Chez la souris, une CL50 de 180 000 ppm pour 10 min d'exposition a été déterminée (Snamprogetti, 1980). Aucune mortalité n'a été notée chez des rats, souris ou lapins, exposés par intermittence entre 1 et 13 jours à 8 000 ppm de MTBE (Dodd et Kintigh, 1989 ; Vergnes et Chun, 1989 ; Vergnes et Chun, 1994), ou exposés durant la gestation (Conaway et al., 1985 ; Tyl, 1989). Les deux organes cibles privilégiés du MTBE par inhalation sont le système respiratoire et le système nerveux central. Des rats exposés à 400 ou 8 000 ppm de MTBE durant 6 heures ont présenté une ataxie en 30 minutes et un assoupissement au bout de 1 h 30 (Biosereach Laboratories, 1990a). Une neurotoxicité a été observée chez des souris exposées par intermittence durant 2 jours à 3 000 ppm (hypoactivité) et 8 000 ppm (hypoactivité, respiration abdominale, ataxie et prostration) (Vergnes et Chun, 1994). Chez le rat, un NOAEL de 800 ppm a été établi pour 6 heures d'exposition (Gill, 1989).
Voie orale
FDTE/VTR Importer Chez diverses espèces animales, le MTBE présente une toxicité aiguë faible par voie orale. Par voie orale, la DL50 a été estimée à 3 800 mg.kg-1 chez le rat (ARCO Chemical Company, 1980) et 4 000 mg.kg-1 chez la souris (Little et al., 1979). Le système nerveux central (SNC) est la cible principale du MTBE. Des doses fortes par voie orale (≥ 4 080 mg.kg-1) causent une forte dépression du SNC, une ataxie, des tremblements et une respiration pénible chez le rat (ARCO Chemical Company, 1980). Ces signes apparaissent rapidement mais disparaissent ou sont fortement atténués au bout de 24 h. Un NOAEL de 40 mg.kg-1 pour les effets neurologiques a été identifié (Biosereach Laboratories, 1990b). Outre des effets respiratoires, le MTBE par voie orale a des effets irritants sur le tractus gastro-intestinal, se traduisant notamment par des diarrhées chez le rat (Robinson et al., 1990).
Voie cutanée
FDTE/VTR Importer Chez diverses espèces animales, le MTBE présente une toxicité aiguë faible par voie cutanée. Par voie cutanée, aucune mortalité n'a été observée chez des rats exposés à 400 mg.kg-1 (Biosereach Laboratories, 1990b) ou chez des lapins exposés à 10 000 mg.kg-1 (ARCO Chemical Company, 1980) durant 24 h. Chez ces derniers, une irritation locale cutanée a été observée, se traduisant par des érythèmes, œdèmes, épaississements et nécroses. Le MTBE ne semble pas avoir de potentiel sensibilisant (Cuthbert, 1979 ; Litton Bionetics, 1980). Le MTBE a également induit des irritations oculaires réversibles chez des lapins, après instillation de 0,1 mL au niveau de la conjonctive, caractérisées par une congestion, une opacification de la cornée et une lacrymation (Snamprogetti, 1980).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer Après addition du MTBE à l'essence, divers utilisateurs se sont plaint de maux de tête, nausées, vertiges (voir paragraphe 3.2). Un certain nombre d'études épidémiologiques ont été initiées par le centre de prévention et de contrôle des maladies (CDC) aux Etats-Unis.
Une étude pilote a été réalisée en Alaska, pour établir un lien éventuel entre l'exposition au MTBE et les symptômes observés (Moolenaar et al., 1994). Durant le programme d'oxygénation des carburants (phase I) et trois mois après sa suspension (phase II), l'exposition a été évaluée par mesure des concentrations en MTBE dans l'air et des teneurs sanguines en MTBE et tert-butanol (TBA), chez des travailleurs fortement exposés aux vapeurs d'essence (pompistes, mécaniciens). Un questionnaire a permis d'établir la prévalence de 15 symptômes, dont 7 symptômes clés, issus des plaintes enregistrées (céphalée, irritation oculaire, brûlures de la gorge et du nez, toux, nausées ou vomissements, vertiges, désorientation) et 8 autres (fatigue, fièvre, transpiration ou frissons, diarrhée, malaise, irritation cutanée, douleur musculaire et difficultés respiratoires). Les teneurs sanguines en MTBE, bien qu'environ six fois plus élevées durant la phase I par rapport à la phase II, étaient globalement faibles (inférieures à 0,5 µmol.L-1 soit 44 µg.L-1). L'apparition des symptômes clés a été plus importante durant la phase I (céphalées : 13/18, irritations oculaires : 12/18, nausées : 6/18, vertiges : 8/18, désorientation : 6/18) par rapport à la phase II (céphalées : 1/28, irritations oculaires : 2/28, nausées : 1/28, vertiges : 0/18, désorientation : 0/18). Les travailleurs présentant les teneurs sanguines en MTBE les plus élevées (jusqu'à 38 µg.L-1) ont rapporté le plus de symptômes, bien que la relation ne soit pas significative. Un résultat similaire a été observé sur une population de 37 travailleurs et 14 banlieusards (White et al., 1995).
Dans une étude visant à déterminer les effets du MTBE sur le système immunitaire, aucun effet n'a été noté sur les teneurs sanguines en interleukine 6 chez des personnes exposées à des émanations de carburants oxygénés (Duffy, 1994).
Une étude de cohorte a examiné la prévalence de divers symptômes chez 115 garagistes exposés à l'essence oxygénée, par rapport à un groupe de 122 garagistes, 10 semaines après arrêt de l'emploi de ce type de carburant (Mohr et al., 1994). L'examen des questionnaires a montré que l'ensemble des travailleurs se plaignaient de "symptômes associés au MTBE" (sans plus de précision) à l'issue d'une journée de travail. Toutefois, aucune différence significative entre les deux populations n'a été notée.
Une étude téléphonique a été menée dans le Wisconsin en 1995, afin d'apprécier la prévalence et l'étendue des plaintes suite à l'utilisation de carburant reformulé (Anderson et al., 1995). Environ 1 500 personnes ont été questionnées. Les résultats de cette étude ont montré que les symptômes enregistrés (irritation de la gorge, difficultés à respirer, congestion des sinus) étaient en relation avec l'âge, le statut allergique et le fait d'avoir eu récemment une affection respiratoire type rhume ou grippe, mais pas avec le fait d'avoir acheté du carburant (et donc d'avoir été exposé). De plus, les individus sensibilisés au problème et reconnaissant avoir acheté du carburant contenant du MTBE se plaignaient plus que les autres, ce qui suggérait un biais dans la perception et l'attribution aux carburants oxygénés de tout symptôme inhabituel. Au vu de ces résultats, une commission d'experts indépendants a conclu que cette étude ne permettait pas de prouver que l'exposition aux carburants reformulés était associée à des effets conséquents sur la santé (HEI, 1996).
Une étude a été menée en Finlande pour apprécier la prévalence de symptômes neurophysiologiques (sensoriels et moteurs) chez des conducteurs de camions-citernes exposés à de l'essence contenant 10 % de MTBE, par rapport à des livreurs de lait non exposés (Hakkola et al., 1996). Une corrélation a été trouvée entre la prévalence des symptômes et l'âge ou les maladies chroniques. Bien qu'il y ait plus de symptômes nerveux chez les conducteurs de camions-citernes, cette différence n'était pas significative et sans relation avec la durée du travail.
L’état des lymphocytes présents dans le sang périphérique a été examiné chez un groupe de 60 patients (38 hommes et 22 femmes dont l’âge moyen est de 42 ans, allant de 18 à 71 ans) ayant été exposés par voie orale à de l’eau contaminée par du MTBE (1 à 76 µg.mL-1) et du benzène (0,2 à 14 µg.mL-1). L’examen a été réalisé 1 an après la dernière exposition (Vojdani et al., 1997). Le groupe témoin (17 hommes et 15 femmes) utilisé dans cette étude comprenait des volontaires sains habitant dans la même région que les patients mais n’ayant pas été contaminés par voie orale ou par voie respiratoire par du MTBE ou par d’autres substances. Le groupe de patients présentait de sévères maux de têtes, des malaises, une fatigue, un épuisement, une difficulté à se concentrer, une anxiété, des étourdissements, des insomnies et une perte de mémoire à court terme. Les résultats ont montré que 1 à 58 % des lymphocytes du sang périphérique rentraient en apoptose alors que ce pourcentage était de 1 à 28 % chez le groupe témoin. De plus, alors que 52 % des cellules étaient en phase S du cycle cellulaire (phase de réplication de l’ADN) ou en mitose (phase de division cellulaire), 89 % des cellules du groupe témoin étaient en phase stationnaire. Cette étude a mis en avant des changements concernant les cellules immunocompétentes mais aucune conclusion concernant les causes de ce changement ne peut être établie.
Chez l'animal
Toutes voies
FDTE/VTR Importer L'exposition réitérée au MTBE a été étudiée chez le rat et la souris.
Au cours de ces études, des effets sur le système nerveux central (hypoactivité, ataxie) ont été observés à la fin de chaque exposition journalière, chez des animaux par inhalation à des doses supérieures à 4 000 ppm (Dodd et Kintigh, 1989 ; Chun et Kintigh, 1993 ; Lington et al., 1997). On peut considérer que ces manifestations correspondent plus à des effets aigus que chroniques.
Outre ces symptômes, une augmentation du poids relatif du foie et des reins a été fréquemment observée (Dodd et Kintigh, 1989 ; Burleigh-Flayer et al., 1992 ; Chun et al., 1992 ; Chun et Kintigh, 1993).
Chez le rat cependant, la toxicité hépatique du MTBE apparaît peu importante : des animaux exposés jusqu'à 8 000 ppm de MTBE durant 4-5 semaines (Chun et Kintigh, 1993) ou 13 semaines (Dodd et Kintigh, 1989), n'ont pas présenté de signes cliniques ou histologiques de toxicité hépatique.
La toxicité hépatique du MTBE apparaît légèrement plus importante chez la souris, se traduisant notamment par une hypertrophie cellulaire centrilobulaire à des doses de 8 000 ppm durant 28 jours (Chun et Kintigh, 1993) ou 3 000 ppm durant 18 mois (Burleigh-Flayer et al., 1992).
Chez le rat mâle, le MTBE induit spécifiquement une néphropathie se traduisant par une dégénérescence hyaline au niveau des tubules proximaux. Cet effet a été observé pour des expositions par inhalation à des doses de 8 000 ppm durant 13 semaines (Dodd et Kintigh, 1989). La formation de gouttelettes hyalines au niveau des cellules tubulaires rénales suggère une accumulation d'a2u-globuline, qui est une protéine spécifique des rats mâles (ATSDR, 1998). Ces derniers, à la différence des femelles, ont présenté une augmentation de la quantité d'a2u-globuline après exposition à plus de 800 ppm de MTBE durant 13 semaines. Cette accumulation n'était cependant pas dose-dépendante et présentait un caractère atypique (Swenberg et Dietrich, 1991). L'utilisation d'un anticorps anti-a2u-globuline n'a pas mis en évidence d'accumulation de cette protéine au niveau des lésions rénales observées chez des rats mâles après exposition à 8 000 ppm de MTBE durant 4 semaines (Chun et Kintigh, 1993). Ceci suggère un autre mode d'action, peut-être l'accumulation d'une autre protéine spécifique aux rats mâles (ATSDR, 1998). En raison de la spécificité probable de cette atteinte, cet effet du MTBE ne serait pas à considérer chez l'homme.
Enfin, l'exposition réitérée au MTBE par inhalation (1 000-8 000 ppm durant 13 semaines) a induit des effets légers au niveau de la numération sanguine (Dodd et Kintigh, 1989 ; Robinson et al., 1990).
Voie orale
FDTE/VTR Importer L'exposition réitérée au MTBE a été étudiée chez le rat et la souris.
Au cours de ces études, des effets sur le système nerveux central (hypoactivité, ataxie) ont été observés à la fin de chaque exposition journalière, chez des animaux soumis par voie orale à des doses comprises entre 440 et 1 200 mg.kg-1.j-1 (Robinson et al., 1990 ; IITRI, 1992). On peut considérer que ces manifestations correspondent plus à des effets aigus que chroniques.
Outre ces symptômes, une augmentation du poids relatif du foie et des reins a été fréquemment observée (Robinson et al., 1990 ; IITRI, 1992 ; Zhou et Ye, 1999).
Chez le rat cependant, la toxicité hépatique du MTBE apparaît peu importante : des rats exposés par voie orale à 1 750 mg.kg-1.j-1 durant 4 semaines (IITRI, 1992) ou à 1 000 mg.kg-1.j-1 durant 104 semaines (Belpoggi et al., 1995). Une modification de l'activité de certaines enzymes hépatiques a pu être observée (Greenough et al., 1980 ; Dodd et Kintigh, 1989) mais la signification biologique de ces effets est peu claire. Une diminution significative de l'urée sanguine a été observée chez des rats dès 100 mg.kg-1.j-1 durant 90 jours (Robinson et al., 1990).
Chez le rat mâle, le MTBE induit spécifiquement une néphropathie se traduisant par une dégénérescence hyaline au niveau des tubules proximaux. Cet effet a été observé pour des expositions par voie orale à des doses de 1 428 mg.kg-1.j-1 durant 14 jours (Robinson et al., 1990) ou 440 mg.kg-1.j-1 durant 4 semaines (IITRI, 1992). La formation de gouttelettes hyalines au niveau des cellules tubulaires rénales suggère une accumulation d'a2u-globuline, qui est une protéine spécifique des rats mâles (ATSDR, 1998). En raison de la spécificité probable de cette atteinte, cet effet du MTBE ne serait pas à considérer chez l'homme.
Enfin, l'exposition réitérée au MTBE par voie orale (1 200 mg.kg-1.j-1 durant 13 semaines) a induit des effets légers au niveau de la numération sanguine (Dodd et Kintigh, 1989 ; Robinson et al., 1990).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
| IARC | FDTE/VTR Importer Groupe 3 : ne peut être classé pour sa cancérogénicité pour l’homme | 1999 |
Chez l'homme
Synthèse
FDTE/VTR Importer Aucune donnée n'est disponible concernant la cancérogénicité du MTBE chez l'homme, et ce, quelle que soit la voie d'administration (ATSDR, 1998).
Chez l'animal
Inhalation
FDTE/VTR Importer Une étude d'inhalation a été menée chez des rats Fischer 344 exposés à 400, 3 000 et 8 000 ppm (1 430, 10 700 et 28 600 mg.m-3) de MTBE (Chun et al., 1992). L'étude a duré 104 semaines dans le groupe faiblement exposé, 97 semaines dans le groupe moyennement exposé et 82 semaines dans le groupe fortement exposé, en raison d'une mortalité élevée, due à une néphropathie chronique progressive chez les mâles.
L'étude montre, malgré une fréquence élevée dans le groupe témoin, une augmentation statistiquement significative de l'incidence des tumeurs testiculaires intertitielles dans le groupe moyennement et fortement exposé, avec une relation dose réponse nette (témoins : 32/50, 400 ppm : 33/50, 3 000 ppm : 41/50 et 8 000 ppm : 47/50). Toutefois, les rats Fischer développent souvent des tumeurs testiculaires, comme en témoigne l'incidence élevée chez le groupe témoin. De plus, les incidences aux deux plus fortes doses étaient dans l'intervalle des témoins historiques, alors que l'incidence dans le groupe témoin était anormalement basse.
Une augmentation de l'incidence des tumeurs rénales (adénomes et carcinomes tubulaires) a été observée chez les mâles exposés aux deux doses les plus fortes (témoins : 1/50, 400 ppm : 0/50, 3 000 ppm : 8/50 et 8 000 ppm : 3/50). L'augmentation était statistiquement significative à 3 000 ppm mais pas à 8 000 ppm, ce qui pourrait s'expliquer par un taux de mortalité élevé et une diminution de la durée de vie des animaux dans ce groupe. Tenant compte des critères spécifiés par l'US EPA (1992), l'augmentation des tumeurs rénales chez les rats n'est pas liée à une accumulation d'a2u-globuline, qui est une protéine spécifique aux rats mâles.
Chez les souris exposées durant 18 mois (6 heures par jour, 5 jours par semaine) à 400, 3 000 ou 8 000 ppm de MTBE, une augmentation de l'incidence des adénomes hépatiques a été observée chez les femelles à la plus forte dose (témoins : 2/50, 400 ppm : 1/50, 3 000 ppm : 2/50 et 8 000 ppm : 10/50). Les mâles à cette dose ont présenté également une augmentation de l'incidence des adénomes et carcinomes hépatocellulaires mais non significative (Burleigh-Flayer et al., 1992).
Le MTBE, dans un essai d'initiation/promotion de tumeurs hépatiques chez la souris, est apparu inactif (Moser et al., 1996).
Voie orale
FDTE/VTR Importer Belpoggi et al., (1995) ont observé une augmentation significative de la formation de tumeurs testiculaires (adénomes des cellules de Leydig) chez des rats Sprague-Dawley, avec des témoins montrant une plus faible incidence de tumeurs que dans l'étude de Chun (témoins : 2/26, 250 mg.kg-1.j-1 : 2/25, 1 000 mg.kg-1.j-1 : 11/32).
Le MTBE a été administré par gavage, dans l'huile d'olive, 4 fois par semaine pendant 104 semaines, les animaux étant ensuite sacrifiés à 130 semaines.
Aux doses de 250 et 1 000 mg.kg-1.j-1, une augmentation de la fréquence des leucémies et des lymphomes a été observée chez les rats femelles, avec une relation dose réponse (témoins : 2/60, 250 mg.kg-1.j-1 : 6/60, 1 000 mg.kg-1.j-1 : 12/60).
Cette étude supporte les conclusions de Chun et al, 1992 (étude par inhalation) et souligne que le rat Sprague-Dawley est un meilleur modèle d'étude des tumeurs testiculaires que le rat Fischer 344.
La cancérogénèse des deux principaux métabolites du MTBE, que sont le tert-butanol (TBA) et le formaldéhyde, a été étudiée chez l'animal. Le TBA n'est pas considéré comme mutagène mais, administré dans l'eau de boisson, il a induit une augmentation de l'incidence des adénomes et carcinomes tubulaires rénaux chez les rats mâles. Chez les souris femelles, le TBA a induit des adénomes thyroïdiens, et, chez les deux sexes, une inflammation et une hyperplasie de la vessie (Cirvello et al., 1995). Pour le rat mâle, l'augmentation des tumeurs est observée à des niveaux d'exposition inférieurs aux doses maximales tolérables par voie digestive.
Le formaldéhyde est classé mutagène et cancérigène probable chez l'homme (catégorie 1 de l'IARC).
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
| US EPA | FDTE/VTR Importer non génotoxique sans activation métabolique | 1993 |
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer non classé | 2004 |
Chez l'homme
Synthèse
FDTE/VTR Importer Aucune donnée n'est disponible concernant les effets du MTBE sur les fonctions de reproduction et le développement, et ce, quelle que soit la voie d'administration (ATSDR, 1998).
Chez l'animal
Inhalation
FDTE/VTR Importer Par inhalation, l'exposition aiguë ou à plus long terme d'animaux au MTBE ne semble pas modifier les fonctions de reproduction. Aucun effet n'a été noté sur les appareils reproducteurs mâles et femelles de rats exposés à 3 000 ppm de MTBE durant 9 jours (Biodynamics, 1981). L'exposition de rats et de souris durant la gestation à 2 500 ppm de MTBE n'a pas modifié le nombre moyen d'implantations utérines, de résorption ou de fœtus vivants (Conaway et al., 1985). Un résultat similaire a été noté chez des lapines exposées durant 13 jours (Tyl, 1989) ou chez des souris exposées durant 10 jours (Tyl et Nepper-Bradley, 1989) à 8 000 ppm pendant la gestation. L'exposition de souris mâles durant 13 jours à 8 000 ppm de MTBE n'a induit aucun changement au niveau testiculaire (Dodd et Kintigh, 1989). Aucun effet sur les fonctions de reproduction n'a également été noté chez des rats mâles et femelles exposés à 250-2 500 ppm de MTBE durant 16-28 semaines (Biles et al., 1987), chez des rats exposés à 8 000 ppm de MTBE durant 13 à 19 semaines (Greenough et al., 1980 ; Dodd et Kintigh, 1989 ; Nepper-Bradley, 1991) ou chez des rats ou des souris exposés chroniquement (18-24 mois) par intermittence à 8 000 ppm de MTBE (Burleigh-Flayer et al., 1992 ; Chun et al., 1992).
Voie orale
FDTE/VTR Importer Par voie orale, Le MTBE a également peu d'effets sur les fonctions de reproduction. Aucune modification des appareils reproducteurs mâles et femelles n'a été notée chez des rats exposés à 1 428 mg.kg-1.j-1 de MTBE durant 14 jours (Robinson et al., 1990), à 1 750 mg.kg-1.j-1 durant 4 semaines (IITRI, 1992), à 1 200 mg.kg-1.j-1 durant 90 jours (Robinson et al., 1990) ou à 1 000 mg.kg-1.j-1 durant 104 jours (Belpoggi et al., 1995). Toutefois, une augmentation significative de tumeurs des cellules de Leydig testiculaires a été notée chez les mâles.
Effets sur le développement
Chez l'animal
Inhalation
FDTE/VTR Importer Concernant les effets sur le développement, le MTBE inhalé à court terme (10 ou 13 jours durant la gestation) ne semble pas être tératogène chez le rat et le lapin pour des expositions respectives de 2 500 ppm (Conaway et al., 1985) ou 8 000 ppm (Tyl, 1989). A plus long terme (16-28 semaines), aucun effet n'a été noté chez des rats exposés à 250-2 500 ppm (Biles et al., 1987). Une diminution du poids des fœtus a été notée à 3 000 et 8 000 ppm de MTBE (Nepper-Bradley, 1991). Des effets plus importants ont été mis en évidence chez la souris, mais à des doses causant une toxicité maternelle. L'exposition de femelles à 8 000 ppm durant 10 jours pendant la gestation a induit une augmentation des résorptions tardives et une diminution des implantations et du poids des fœtus. Une augmentation des malformations du squelette a également été notée. A 4 000 ppm, les fœtus présentaient des retards d'ossification et une diminution de poids. Le NOAEL pour cet effet est de 1 000 ppm (Tyl et Nepper-Bradley, 1989).
Voie orale
FDTE/VTR Importer Aucune étude n'est disponible concernant les effets du MTBE administré oralement sur le développement.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L'ATSDR propose un MRL de 7,2 mg.m-3 (2 ppm) pour une exposition aiguë par inhalation (1996). Existence d'une valeur draft de 2022
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats, exposés jusqu'à 8 000 ppm de MTBE durant 6 heures (Gill, 1989). Un NOAEL de 800 ppm pour les effets neurologiques a été déterminé et a servi à calculer un MRL de 2 ppm pour les expositions aiguës par inhalation.
Facteurs d'incertitude : un facteur 10 a été appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 800 ppm x 6 h/24 h x 1/100 = 2 ppm
Effets à seuil - Exposition sub-chronique par inhalation :
L'ATSDR propose un MRL de 2,5 mg.m-3 (0,7 ppm) pour une exposition intermédiaire par inhalation (1996). Existence d'une valeur draft de 2022
Cette valeur a été établie à partir d'une étude de reproduction chez le rat. Les animaux ont été exposés jusqu'à 8 000 ppm de MTBE, à raison de 5-7 jours par semaine, 6 heures par jour (Nepper-Bradley, 1991). L'exposition à 8 000 ppm durant 10 semaines avant l'accouplement et jusqu'au 19ème jour de gestation a entraîné une hypersalivation et une baisse d'activité chez les générations F0 et F1. Une hypoactivité a été également notée à 3 000 ppm. Le NOAEL pour cette étude est de 400 ppm et a servi à calculer un MRL de 0,7 ppm pour les expositions intermédiaires par inhalation.
Facteurs d'incertitude : un facteur 10 a été appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 400 ppm x 6 h/24 h x 5 j/7 j x 1/100 = 0,7 ppm
Effets à seuil - Exposition chronique par inhalation :
L'US EPA (IRIS) propose un RfC de 3 mg.m-3 (0,8 ppm) pour une exposition chronique par inhalation (1993).
Cette valeur se base sur un NOAEL de 400 ppm (1 450 mg.m-3), 6 heures par jour, 5 jours par semaine, dans une étude d'inhalation de 24 mois sur rats (Chun et al., 1992). Les animaux exposés à 3 000 ppm et au-delà ont présenté des effets rénaux et hépatiques ainsi qu'une prostration accrue chez les femelles.
Facteurs d'incertitude : un facteur 3 a été appliqué pour l'extrapolation de données animales vers l'homme (un facteur 10 n'a pas été jugé nécessaire en raison de l'utilisation d'ajustements dosimétriques), un facteur 10 pour la variabilité au sein de la population et un facteur 3 en raison d'un manque de données biologiques et cliniques au cours de cette étude. Le produit de ces facteurs a été arrondi à 100.
Calcul : 1 450 mg.m-3 x 6 h/24 h x 5 j/7 j x 1/100 = 2,6 mg.m-3
L'ATSDR propose un MRL de 2,5 mg.m-3 (0,7 ppm) pour une exposition chronique par inhalation (1996). Existence d'une valeur draft de 2022
Cette valeur, similaire à celle obtenue pour une exposition intermédiaire, a été établie à partir d'une étude expérimentale réalisée chez des rats, exposés jusqu'à 8 000 ppm de MTBE à raison de 5-7 jours par semaine, 6 heures par jour durant 24 mois (Chun et al., 1992). Un NOAEL de 400 ppm pour les effets rénaux a été déterminé et a servi à calculer un MRL de 0,7 ppm pour les expositions chroniques par inhalation.
Facteurs d'incertitude : un facteur 10 a été appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 400 ppm x 6 h/24 h x 5 j/7 j x 1/100 = 0,7 ppm
L'OEHHA propose un REL de 8 mg.m-3 pour une exposition chronique par inhalation (2003).
Cette valeur est issue de la même étude que celle utilisée par l'US EPA pour le calcul de la RfC. Elle se base sur un NOAEL de 400 ppm (1 450 mg.m-3), 6 heures par jour, 5 jours par semaine, dans une étude d'inhalation de 24 mois sur rats (Chun et al., 1992). Les animaux exposés à 3 000 ppm et au-delà ont présenté des effets rénaux et hépatiques ainsi qu'une prostration accrue chez les femelles.
Facteurs d'incertitude : un facteur 3 a été appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Rem : L'OEHHA n'a pas repris le facteur 3 supplémentaire utilisé par l'US EPA (manque de données biologiques et cliniques au cours de cette étude) en raison d'un manque de clarté dans la justification de l'emploi de ce facteur.
Calcul : 1 450 mg.m-3 x 6 h/24 h x 5 j/7 j x 1/30 = 8 mg.m-3
Effets à seuil - Exposition aiguë par voie orale :
L'ATSDR propose un MRL de 0,4 mg.kg-1.j-1 pour une exposition aiguë par voie orale (1996).
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats, exposés au MTBE par gavage à des doses de 40 et 400 mg.kg-1 (Biosereach Laboratories, 1990b). Les rats exposés à la plus forte dose ont présenté des signes de somnolence. Un NOAEL de 40 mg.kg-1 a été établi pour cet effet et a servi à calculer un MRL de 0,4 mg.kg-1.j-1 pour les courtes durées.
Facteurs d'incertitude : un facteur 10 est appliqué pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 40 mg.kg-1 x 1/100 = 0,4 mg.kg-1.j1
Effets à seuil - Exposition sub-chronique par voie orale :
L'ATSDR propose un MRL de 0,3 mg.kg-1.j-1 pour une exposition intermédiaire par voie orale (1998). Existence d'une valeur draft de 2022
Cette valeur a été établie à partir d'une étude expérimentale réalisée chez des rats, exposés au MTBE par gavage dans l'huile de maïs à des doses de 0, 100, 300, 900 ou 1 200 mg.kg-1.j-1 durant 90 jours (7 jours par semaine) (Robinson et al., 1990). A la plus faible dose (100 mg.kg-1.j-1), des effets hépatiques ont été notés chez les mâles et les femelles. Ce LOAEL a servi à calculer un MRL de 0,3 mg.kg-1.j-1 pour les durées intermédiaires.
Facteurs d'incertitude : un facteur 3 est appliqué pour l'utilisation d'un LOAEL, un facteur 10 pour l'extrapolation de données animales vers l'homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 100 mg.kg-1.j-1 x 1/300 = 0,3 mg.kg-1.j-1
NB : Aucun MRL n'a été calculé pour une exposition orale chronique car la seule étude
Effets sans seuil - Exposition chronique par inhalation :
L'OEHHA propose un ERUi de 2,6.10-7 (µg.m-3)-1 pour une exposition par inhalation (2002).
Cette valeur a été calculée à partir de deux études de cancérogenèse chez le rat exposé par inhalation (Chun et al., 1992) ou par gavage (Belpoggi et al., 1995). Une augmentation significative des adénomes et carcinomes rénaux a été observée chez les mâles exposés par inhalation (Chun et al., 1992). Par voie orale, une augmentation dose-dépendante de l'incidence des lymphomes et leucémies a été observée chez les femelles et une augmentation du nombre de tumeurs des cellules interstitielles de Leydig a été notée chez les mâles (Belpoggi et al., 1995).
Les données du groupe 8 000 ppm ont été exclues de l'analyse.
A partir des données expérimentales, les doses induisant une augmentation de 10 % de l'incidence des tumeurs ont été calculées (LED10), aboutissant à des valeurs de cancers slope factors (CSF) après ajustements pharmacodynamiques. Les valeurs de CSF obtenues étant très proches, leur moyenne géométrique, égale à 1,8.10-3 (mg.kg-1.j-1)-1, a été utilisée. L'OEHHA a estimé que l'homme absorbe 50 % du MTBE inhalé à faibles doses, ce qui donne un ERUi de 2,6.10-7 (µg.m-3)-1, considérant un poids moyen de 70 kg et un volume inhalé de 20 m3 par jour.
Calcul : ERUi = 1,8.10-6 (µg.kg-1.j-1)-1 x 20 m2 x 1/70 kg x 0,5 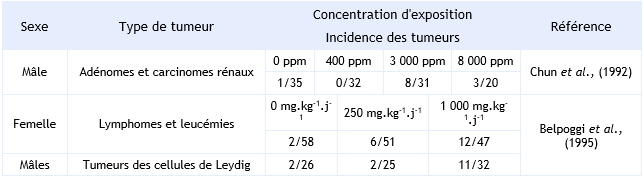
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 05/03/2025
Introduction
FDTE/VTR Importer L'objectif de cette rubrique est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme. Le MTBE est en cours d'évaluation par la Commission Européenne dans le cadre du Règlement 793/93. Les résultats présentés ci-après sont issus de Commission Européenne (2001). Nous souhaitons, en effet, rester homogènes avec les décisions prises au sein de l'Union Européenne.
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres décotoxicité aiguë :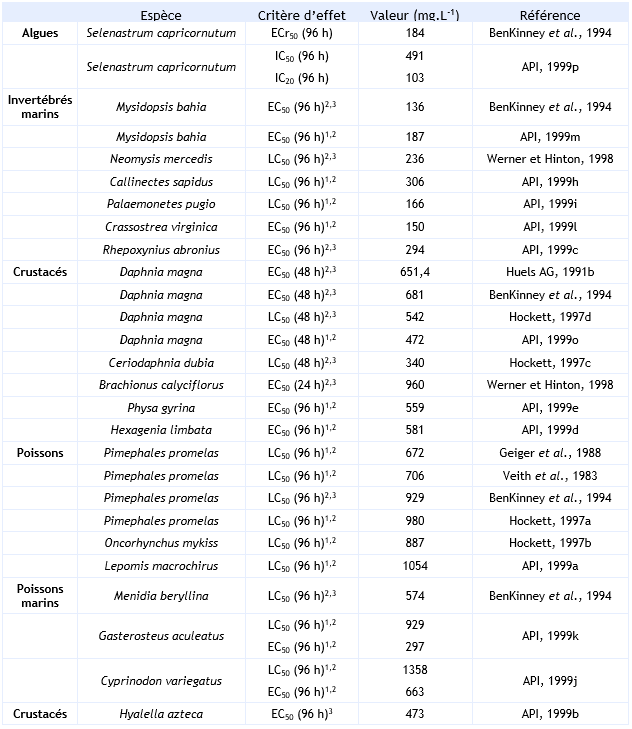

Paramètres décotoxicité chronique :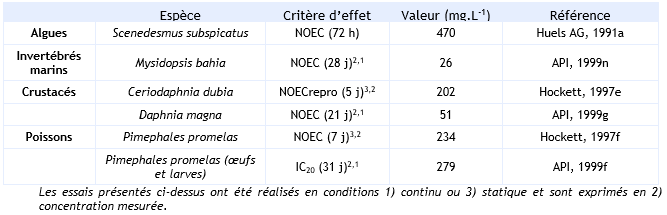
Sédiments d'eau douce
FDTE/VTR Importer Il n'existe pas de résultats valides vis à vis des organismes benthiques.
Sol
FDTE/VTR Importer Il n'existe pas de résultats d'essais court-terme sur les organismes terrestres.
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Synthèse
FDTE/VTR Importer Compartiment aquatique :
Il existe des essais long terme sur trois niveaux trophiques. Un facteur d'extrapolation de 10 peut être appliqué à la donnée la plus faible (Mysidopsis bahia : NOEC = 26 mg.L-1) pour dériver une PNEC pour le compartiment aquatique.
D'où :
PNECEAU = 2,6 mg.L-1
Compartiment sédimentaire :
Comme il n'existe pas de données valides vis à vis des organismes benthiques, il est possible, en première approche, de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996).
PNECSED = KSED-EAU/RHOSED ´ PNECEAU ´ 1 000
RHOSED : densité des sédiments (humides) (valeur par défaut : 1 300 kg.m-3)
KSED-EAU : coefficient de partage entre l'eau et les sédiments (1,03 m3.m-3)
D'où :
PNECSED = 2,05 mg.kg-1 sédiment humide = 5,33 mg.kg-1 sédiment sec
Compartiment terrestre :
Comme il n'existe pas de données valides vis à vis des organismes terrestres, il est possible, en première approche, de déterminer une PNEC pour le sol en utilisant la méthode du coefficient de partage (CE, 1996).
PNECSOL : KSOL-EAU/RHOSOL ´ PNECEAU ´ 1 000
RHOSOL : densité du sol (humide) (valeur par défaut : 1 700 kg.m-3)
KSOL-EAU : coefficient de partage sol eau (0,477 m3.m-3)
D'où :
PNECSOL = 0,73 mg.kg-1 sol humide = 0,82 mg.kg-1 sol sec
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 1634-04-4 |
|---|---|
| SANDRE | 1512 |
| Usages principaux |
Mini-FTE Importer Usage 1* : Additif dans les carburants ; |
| Autres informations d'usage |
Mini-FTE Importer * :
*la répartition actuelle des usages est inconnue en raison d'un processus de substitution du MTBE par l'ETBE en cours pour son premier usage d'additif dans les carburants et de changements significatifs dans la structure et les volumes de production du MTBE en France et en Europe. Inclusion dans des articles : Non Large utilisation dispersive : Oui Principaux produits de dégradation dans l'eau : 2-Méthylpropan-2-ol (CAS 75-65-0) Secteurs NAF identifiés comme usagers : 19.2, 20.1, 20.3, 20.4, 20.5, 22.1, 32.3, 46.1, 46.7,
|
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
Mini-FTE Importer
PNEC (Predicted No Effect Concentration) – Eau douce : 136 µg.l-1 au 17/04/2018 (PNEC Ineris basée sur des données expérimentales). |
| Classification CLP | Voir la classification CLP |
Volume de production
| France |
Mini-FTE Importer 0 t.an-1 (2014) |
|---|---|
| UE |
Mini-FTE Importer 1 600 000 t.an-1 (2010) |
| Monde |
Mini-FTE Importer Pas d'information |
Consommation
| Volume de consommation en France |
Mini-FTE Importer Pas d'information |
|---|
Présence dans l'environnement
| Eaux de surface |
Mini-FTE Importer En France, sur les 12 792 mesures effectuées (12 792 points de prélèvements) dans les eaux de surface et recensées dans la base Naïades entre 2014 et 2017, 0,33% sont supérieures à la limite de quantification (comprise entre 0,2 et 0,5 µg.L-1). La médiane des valeurs supérieures à la limite de quantification est de 0,95 µg.L-1. La valeur maximale observée est de 5,7 µg.L-1 à Pougny. En Europe, 3 552 mesures de MTBE dans les eaux de surface (rivières) entre 2010 et 2016 sont enregistrées dans la base EMPODAT, 87% ont été réalisés aux Pays-Bas, 13% en Allemagne et 0,28% en Belgique. Ces relevés couvrent au total 71 stations. Parmi ces 3 552 mesures, 55% présentent des concentrations inférieures à la limite de quantification et 45% supérieures aux limites de quantification. La valeur médiane des concentrations supérieures aux limites de quantifications est 0,12 µg.L-1. La valeur maximale est de 13 µg.L-1 à Lobith aux Pays-Bas (Rhin). |
|---|---|
| Eaux souterraines |
Mini-FTE Importer En France, sur 5 597 des mesures effectuées dans les eaux souterraines entre 2014 et 2017 sur 1 783 communes et recensées dans la base de données ADES, 0,14% présentent des concentrations supérieures à la limite de quantification. La valeur maximale observée est de 0,6 µg.L-1 à Villeneuve-La-Garenne. |
| Air |
Mini-FTE Importer L'ANSES a estimé le niveau d'exposition environnemental au MTBE (environnement intérieur et extérieur) pour la population en France : il varie de 0,15 à 23 µg.m-3, les valeurs moyennes et médianes sont respectivement 1,2 et 1 µg.m-3 . L'ANSES indique que ces estimations ne tiennent pas compte de la diminution de l'utilisation du MTBE en France dans l'industrie pétrolière. L'ANSES indique que cette exposition peut être plus importante lors de la distribution de carburants ou la fréquentation des stations-services. |
| Sols |
Mini-FTE Importer Les sites contaminés sont les sites des stations-services. |
Réduction des émissions et substitutions
| Autres commentaires |
Mini-FTE Importer
|
|---|
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










