Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
2,4-dichlorophénol (120-83-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
120-83-2
Nom scientifique (FR)
2,4-Dichlorophénol
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
204-429-6
Code SANDRE
1486
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C6H4Cl2O }\)
Code InChlKey
Code SMILES
Oc(c(cc(c1)Cl)Cl)c1
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H314 |
|---|---|
| Mention du danger - Texte | Provoque de graves brûlures de la peau et de graves lésions des yeux. |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H311 |
|---|---|
| Mention du danger - Texte | Toxique par contact cutané |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H302 |
|---|---|
| Mention du danger - Texte | Nocif en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H411 |
|---|---|
| Mention du danger - Texte | Toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
163.00 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Compte tenu de sa pression de vapeur, le 2,4-dichlorophénol émis dans l'atmosphère n'est présent que sous forme de vapeur. En cas de précipitations, le 2,4-dichlorophénol peut être entraîné par la pluie et s'introduire dans les compartiments terrestres (sols, eau et sédiments).
Milieu eau douce
VGE/NQE Importer
Volatilisation :
Le temps de demi-vie du 2,4-dichlorophénol est estimé à 70 jours dans une rivière et à 514 jours dans un lac. Au vu de ces résultats et de sa constante de Henry (0.35 Pa.m3.mol-1), la substance en solution aqueuse aura une faible tendance à se volatiliser. (HSDB, 2003)
FDTE/VTR Importer Lorsqu'il atteint les eaux de surface, le 2,4-dichlorophénol a une forte tendance à s'adsorber sur les particules en suspension. La phase demeurant libre dans l'eau se volatilise dans l'atmosphère, des demi-vies de 70 à 514 jours, obtenues par modélisation, ont été rapportées. D'autres études de modélisation ont montré que la demi-vie du 2,4-dichlorophénol dans les systèmes aquatiques variait respectivement de 94 à 306 jours, selon la prise en considération ou non du compartiment "sédiment" dans le modèle.
Milieu sédiment eau douce
VGE/NQE Importer
Adsorption :
D'après les valeurs de Koc (comprises entre 125 et
5000 L.kg-1), la substance semble être adsorbable. L'adsorption sur les particules de sol ou les sédiments est gouvernée par le pH. Dans les milieux alcalins (pH > 7), le 2,4-dichlorophénol sera présent sous forme principalement ionisée donc dissociée, ce qui réduit son adsorption sur le matériel particulaire. A l'inverse, dans des milieux à tendance acide (pH < 7), l'adsorption sera plus élevée, ce qui limitera sa mobilité.
L'intervalle de valeurs 125-5000 L.kg-1 est utilisé dans la détermination de la norme de qualité pour les sédiments. (INERIS, 2005)
Milieu terrestre
FDTE/VTR Importer Lorsqu'il est présent dans le sol, le 2,4-dichlorophénol a une mobilité faible à modérée. Compte tenu de sa constante de Henry, la volatilisation du 2,4-dichlorophénol à partir de sols humides constitue un processus de transfert important. Pour les mêmes raisons, la volatilisation à partir d'un sol sec est relativement faible. Dans les sols alcalins (pH = 10), le 2,4-dichlorophénol sera présent sous forme principalement ionisée donc dissociée, ce qui réduit son adsorption sur le matériel particulaire, à l'inverse, dans des sols acides, l'adsorption sera plus élevée, ce qui limitera sa mobilité.
L'adsorption sur les particules de sol est gouvernée par le pH et le pourcentage d'ions oxydes (Artiola-Fortuny et Fuller, 1982). Ces même auteurs rapportent des valeurs de Koc de 200 à 5 000 selon la nature du sol. Compte tenu du pKa de 7,8 à 20 °C, le 2,4-dichlorophénol est sous forme ionisée à pH 10 et sous forme non dissociée à pH <7. La forme ionisée ne s'adsorbe pas sur les sols organiques neutres ou chargés négativement. Il en est de même pour la forme non-ionisée (Johnson et al., 1985).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
VGE/NQE Importer
Biodégradabilité :
98-100% de dégradation après 120 heures (OECD 302B, population microbienne adaptée). Le 2,4-dichlorophénol est considéré comme intrinsèquement biodégradable.
La substance est non facilement biodégradable (OECD 301 C) après 28 jours (boues d'origine domestique).
La majeure partie de la biodégradation du 2,4dichlorophénol aboutit à la formation de 4-chlorophénol. -
(UNEP, 2006 INERIS, 2005)
FDTE/VTR Importer
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
VGE/NQE Importer
Hydrolyse :
Aucune réaction d'hydrolyse n'est attendue en raison de la structure de la molécule : présence de groupes aromatiques halogénés et de phénols non hydrolysables.
60% de dégradation après 40 jours (pH = 7.1, 20°C, obscurité, eau stérilisée).
(UNEP, 2006)
Photolyse :
Le temps de demi-vie du 2,4-dichlorophénol est inférieur à 3 heures avec une concentration de 25 µg.L-1 dans l'eau distillée. (UNEP, 2006)
FDTE/VTR Importer La dégradation abiotique dans l'atmosphère est gouvernée par la constante de réaction photochimique ; ce taux est évalué à 1,06.10-12 cm3/molécule-s à 25 °C, qui correspond à une demi-vie de 15 jours et à la formation de 5.105 radicaux hydroxyles par cm3.
En raison de l'absence de groupes fonctionnels hydrolysables, le 2,4-dichlorophénol est faiblement hydrolysé dans l'eau.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
FDTE/VTR Importer En culture statique inoculée par une eau usée de station d'épuration, le 2,4-dichlorophénol est rapidement dégradé à 99 % en 7 jours, et ne requiert pas de processus d'adaptation de la flore microbienne (Tabak et al., 1981). La dégradation complète du 2,4-dichlorophénol se produit en 5 jours dans un montage DBO inoculé par une boue activée (Ingols et al., 1966).
Milieu sédiment eau douce
FDTE/VTR Importer La biodégradation anaérobie, étudiée dans les sédiments de deux plans d'eau a permis d'observer une dégradation complète du 2,4-dichlorophénol en quatre semaines (Rogers et Hale, 1987). La biodégradation du 2,4-dichlorophénol se fait à la fois par voie aérobie et anaérobie. Le devenir du 2,4-dichlorophénol dans le milieu aquatique a été largement étudié. La persistance est considérablement réduite en présence de microflore adaptée capable de les métaboliser. Cependant, les conditions abiotiques de température et de pH peuvent conduire à une persistance plus élevée (Krijgsheld et Van Der Gen, 1986). Des expériences effectuées dans les sédiments ont montré une dégradation de 45 à 73 % sur une période de 15 à 30 jours. La majeure partie de la biodégradation du 2,4-dichlorophénol aboutit à la formation de 4-chlorophénol.
Milieu terrestre
FDTE/VTR Importer Des valeurs de 79 - 82 % de dégradation après 12 - 14 jours ont été rapportées dans des sols riches en argile dans des conditions aérobies. Des expériences similaires effectuées dans les sédiments ont montré une dégradation de 45 à 73 % sur une période de 15 à 30 jours. La majeure partie de la biodégradation du 2,4-dichlorophénol aboutit à la formation de 4-chlorophénol.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer La bioaccumulation chez les organismes aquatiques est relativement faible. (Krijgsheld et Van Der Gen, 1986). Des facteurs de bioconcentration (BCF) de 7,1 à 69 ont été calculés pour la carpe (CITI, 1992). Des BCF de 34 à 100 ont été calculés pour Crassius auratus, et de 257 à 263 pour les algues planctoniques d'eau douce (Suntio et al., 1988). Ces mêmes auteurs ont mesuré un BCF de 10 pour la truite. Le 2,4-dichlorophénol s'accumule principalement dans la bile des poissons. Plusieurs auteurs ont mesuré des concentrations élevées de 2,4-dichlorophénol. Soderstrom et al. (1994) ont mesuré des concentration de 240 à 7 700 ng/g de bile chez la perche (Perca fluviatilis). Des concentrations de 7 à 20 µg/L ont été mesurées par Hodson et al. (1984) dans la bile de catostomes (Catostomus commersoni) prélevés en amont et en aval d'une usine papetière utilisant le procédé kraft. L'accumulation de 2,4-dichlorophénol dans le tissu musculaire des poissons demeure cependant relativement faible.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Aucune donnée précise sur la bioaccumulation du 2,4-dichlorophénol n'a été trouvée dans la littérature.
Conclusion sur la bioaccumulation
VGE/NQE Importer
Bioaccumulation :
BCF = 7.1-69 pour Cyprinus carpio après 56 jours à
25°C (OECD 305C).
BCF = 34 pour Carassius auratus après 25 heures à
20°C.
Le 2,4-dichlorophénol ne peut pas être considéré comme bioaccumulable.
La valeur maximale de 69 est utilisée dans la détermination des normes de qualité. (UNEP, 2006E.C., 2002)
Bibliographie
Toxicologie
Dernière vérification le 31/07/2025
Toxicocinétique
Chez l'homme
Absorption
Inhalation
Par inhalation, les données relatives au 2,4-dichlorophénol (2,4-DCP) sont inexploitables en raison de co-expositions avec d’autres chlorophénols. Néanmoins, l’absorption des chlorophénols par inhalation est considérée pratiquement complète (ATSDR, 2022).
Voie orale
Du fait de sa forte solubilité lipidique, le 2,4-DCP est vraisemblablement très rapidement absorbé par le tractus gastro-intestinal chez l’humain (HSDB, 1998).
Voie cutanée
Par voie cutanée, le 2,4-DCP est rapidement absorbé par la peau. Lors d’un contact accidentel à du 2,4-DCP sous forme liquide au niveau des bras et des jambes (moins de 10 % de la surface du corps), un salarié s’est rapidement effondré avant de décéder dans les 20 minutes qui ont suivi (Kintz et al., 1992).
Distribution
Le 2,4-DCP a été dosé post-mortem dans le sang (24,3 mg.L-1) d’un salarié accidentellement exposé à une solution pure de 2,4-DCP au niveau des membres (Kintz et al., 1992).
Il a été montré à partir de tests in vitro réalisés sur du sang humain qu’une grande partie du 2,4-DCP (87,7 %) se lie aux protéines plasmatiques (albumine ; globuline) (Judis, 1982).
Métabolisme
Il est considéré chez l’humain que les chlorophénols sont métabolisés au niveau hépatique principalement par conjugaison (sulfo- ou glucuro-) (ATSDR, 2022).
Les 2 principaux métabolites du 2,4-DCP identifiés à partir de fractions microsomales et de levures exprimant les cytochromes P450 (CYP) humains (isoforme CYP3A4) sont la 2-chloro-1,4-hydroxyquinone et la 2-chloro-1,4-benzoquinone (Mehmood et al., 1997). Un autre métabolite intermédiaire, le 1,2,4-hydroxybenzène a été identifié uniquement chez la levure. La déchloration d’un ou deux atomes de chlore par les CYP conduit à la formation respective de 2-chloro-1,4-hydroxyquinone et de 1,2,4-hydroxybenzène. La formation de 2-chloro-1,4-benzoquinone à partir de 1,4-hydroxyquinone fait probablement intervenir une déshydrogénase.
Élimination
Des données limitées, réalisées post-mortem, rapportent une élimination par les voies urinaire et biliaire (respectivement de 5,3 et 18,7 mg.L-1) chez un sujet accidentellement exposé au 2,4-DPC par voie cutanée (Kintz et al., 1992).
Chez l'animal
Absorption
Inhalation
Aucune donnée spécifique du 2,4-DCP n’a été identifiée.
Voie orale
L’absorption est rapide et efficace par voie orale. Chez le rat, environ 69 % de la dose de 2,4-DCP administrée dans l’eau de boisson sont retrouvés dans les urines au bout de 48 heures (Psacal-Lorber et al., 2012). Le 2,4-DCP est très rapidement absorbé par le tractus gastro-intestinal du fait de sa forte solubilité lipidique.
Voie cutanée
L’absorption par voie cutanée a été indirectement démontrée, mais non quantifiée, à partir de la mortalité et/ou des effets systémiques observés à partir d’études où le 2,4-DCP a été appliqué sur la peau des animaux (ATSDR, 2022).
Distribution
Les seules données disponibles indiquent, après une administration par voie intraveineuse, une rapide distribution dans les reins, le foie, les tissus adipeux et le cerveau, les concentrations les plus fortes étant localisées dans le foie et les reins (Somani et Khalique, 1982). La demi-vie de ce composé et de ses conjugués dans le plasma, le cerveau, le foie et les reins se situe dans une fourchette de 4 à 30 minutes.
Métabolisme
Le métabolisme du 2,4-DCP est principalement hépatique et conduit majoritairement à une conjugaison avec les glucuronides (Somani et Khalique, 1982).
Le métabolisme du 2,4-DCP n’a pas été spécifiquement étudié chez l’animal, mais les métabolites principaux sont vraisemblablement la 2-chloro-1,4-hydroxyquinone et le 1,2,4-hydroxybenzène, Des métabolites mineurs, 2 dichlorométhoxy-phénols, ont été identifiés à partir de foies isolés perfusés de rat (Somani et al., 1984).
Élimination
Les chlorophénols sont majoritairement éliminés par les urines (80 à 90 %), sous forme de glucuronates ou de sulfates (HSDB, 1998). Aucune donnée quantitative spécifique de l’élimination du 2,4-DCP n’a été identifiée chez l’animal.
Synthèse
Chez l'homme:
Chez l’homme, bien que les données soient limitées, l’absorption du 2,4-DCP est considérée comme étant rapide et efficace par toutes les voies d’exposition. Le 2,4-DCP peut se lier aux protéines plasmatiques dans le sang. Une partie de 2,4-DCP est métabolisé dans le foie par l’intermédiaire des CYP par déchloration. Le 2,4-DCP et ses métabolites sont éliminés par voies urinaire et biliaire.
Chez l'animal:
Chez l’animal, l’absorption est également rapide et efficace par toutes les voies d’exposition (environ 70 % par voie orale). Il se distribue principalement dans le foie, les reins, le cerveau et les tissus adipeux. Son métabolisme est comparable à celui décrit chez l’humain. L’élimination est majoritairement urinaire sous forme de glucuro- et de sulfoconjugués.
Toxicité aiguë
Chez l'homme
Toutes voies
Le 2,4-DCP présente une toxicité aiguë plus modérée que les tri-, tétra- ou pentachlorophénols.
Inhalation
Par inhalation, la sensation de brûlure s'accompagne d'une toux avec irritation de la gorge (OMS IPCS,1989).
Dans un cas d’une exposition accidentelle en milieu industriel à des vapeurs de 2,4-DCP (concomitante à l’exposition cutanée), le sujet a été pris de convulsions dans les 20 minutes qui ont suivies, avant de rapidement succomber. L’autopsie a révélé la présence d’œdèmes hémorragiques au niveau des poumons et de l’estomac, ainsi que des congestions et des hémorragies pétéchiales dans le cerveau (CDC, 2000).
Voie orale
Des crampes abdominales sont fréquemment ressenties lors de l’ingestion de 2,4-DCP (OMS IPCS,1989).
Voie cutanée
Plusieurs cas de morts accidentelles survenues entre 1980 et 1998 en milieu industriel par projection sur le corps de 2,4-DCP chauffé (utilisé dans la fabrication d'un herbicide, l'acide 2,4-dichlorophénoxyacétique (2,4-D)) ont été rapportés aux Etats-Unis (CDC, 2000). Un cas est survenu en France (Kintz, 1992). Les zones de contamination ont été selon les cas limitées au niveau du visage et du cou, ou étendues aux avant-bras, et aux membres inférieurs.
Le décès des 5 individus a été rapidement provoqué par un collapsus cardiovasculaire, précédé par une ataxie, une perte de conscience et des convulsions. Les autopsies mentionnent la présence de brûlures au niveau des zones de contact avec le 2,4-DCP. Les analyses biologiques post-mortem réalisées sur 2 sujets ont également permis de mesurer des concentrations de 2,4-DCP de 13,1 mg.L-1 et 24,3 mg.L-1 dans le sang, 6,2 mg.L-1 et 5,3 mg.L-1 dans les urines, ou encore dans le second cas des valeurs de 18,7 mg.L-1 dans la bile et 1,2 mg.L-1 au niveau de l’estomac.
Synthèse
Chez l’homme, des expositions par projection de 2,4-DCP au niveau du visage et des membres ont rapidement entrainé la mort. Les principaux signes cliniques caractérisés par une ataxie et un coma convulsif ont rapidement évolué vers une issue fatale par collapsus cardiovasculaire. Le 2,4-DCP est irritant pour la gorge et les poumons à de plus faibles concentrations dans l’atmosphère
Chez l'animal
Inhalation
Par inhalation, la CL50 est de 0,97 mg.L-1 chez le rat pour une exposition de 4 heures (étude non publiée Rhône Poulenc, 1980).
Voie orale
Des tissus hémorragiques au niveau des poumons, de l’estomac et des intestins ont été observés chez des rats ayant reçu par gavage une dose unique létale de 2,4-DCP (2 400 mg.kg.j-1) (Wil Research Laboratories, 1982).
Les valeurs des DL50 établies par voie orale chez la souris sont de 1 352 mg.kg-1 pour les femelles et 1 276 mg.kg-1 pour les mâles (Borzelleca et al., 1985).
Dans les études du NTP où les rats et les souris ont reçu pendant 14 jours une concentration maximum de 40 000 ppm (soit respectivement 2 000 et 5 200 mg.kg-1.j-1 chez les rats et les souris) de 2,4-DCP via l’alimentation, seule 1 des 5 souris chez les mâles, présentant par ailleurs un état léthargique, n’a pas survécu (NTP, 1989). Les signes cliniques (posture voutée, pelage terne, signes de déshydratation) et la perte de poids (> à 10 %) observés aux 2 plus fortes doses (2 000 et 1 000 mg.kg-1.j-1 chez les rats, 5 200 et 2 600 mg.kg-1.j-1 chez les souris) sont vraisemblablement liés à la baisse d’appétence (20 à 50 % par rapport au groupe témoin), consécutive à l’appétibilité de la nourriture contenant le 2,4-DCP. Aucune donnée histologique n’est rapportée.
Dans une étude focalisée sur la fertilité des souris mâles, une dose de 1 000 ppm (soit 270 mg.kg-1.j-1) administrée pendant 15 jours dans l’eau de boisson a entraîné une augmentation significative (p<0,05) de l’activité sérique des enzymes hépatiques (Alanine aminotransférase (ALAT), Aspartate aminotransférase (ASAT) et Lactate déshydrogénase (LDH)), sans altération du poids du foie (Aydin et al., 2009).
Voie cutanée
Un test de toxicité cutanée a permis de définir une DL50 de 780 mg.kg-1 pour une application de 2,4-DCP chauffé chez le rat (étude non publiée de Rhône Poulenc, 1992). Une application unique sur la peau abdominale chez le lapin entraîne un état léthargique à partir d’une dose de 250 mg.kg-1, alors que des lésions cutanées sont visibles à partir de 200 mg.kg-1 (ATSDR, 2022). Les lésions, fonctions de la dose, ont été caractérisées par des érythèmes de légers à modérés, et des œdèmes de légers à marqués, suivis par des nécroses et des plaies.
Synthèse
Chez l’animal, les effets létaux surviennent plus rapidement par inhalation et/ou voie cutanée (forte pénétration) que par voie orale. Par voie orale, les signes cliniques correspondent à une accélération de la respiration, un état léthargique accompagné de convulsions à des doses létales. A fortes doses, des hémorragies sont décrites dans les poumons, l’estomac et les intestins alors qu’à des doses plus faibles le 2,4-DCP induit une augmentation des activités sériques hépatiques (ALAT, ASAT, LDH). Les lésions par voie cutanée sont sévères (nécrose, plaie).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Toutes voies
Il existe peu d'informations quantitatives sur les expositions humaines au 2,4-DCP qui est de plus souvent associé à d'autres composés toxiques. C'est sans doute ce qui explique le peu de données dans la bibliographie mentionnant les effets systémiques du 2,4-DCP chez l'homme, en particulier en milieu professionnel.
Inhalation
La valeur moyenne de 2,4-DCP retrouvée dans les urines de travailleurs exposés aux pesticides se situe autour de 203 mg.L-1 (Fatiadi, 1984).
Aucune anomalie des électrocardiogrammes ou des analyses hématologiques n’est rapportée chez 3 sujets exposés professionnellement (inhalation et voie cutanée) au 2,4-DCP et au 2,4,5-trichlorophénol et atteints de chloracné (Bleiberg et al., 1964). En revanche, une toxicité hépatique (augmentation des transaminases sériques (ALAT et ASAT) et une régénération cellulaire identifiée à partir de biopsies), est observée chez les sujets atteints de porphyrie cutanée tardive, sans toutefois pouvoir identifier le ou les chlorophénols incriminés.
Les troubles neurologiques et psychologiques parfois associés à l'exposition aux chlorophénols ne sont pas documentés en ce qui concerne le 2,4-DCP.
Voie orale
Dans une étude transversale réalisée aux Etats-Unis auprès de 2 211 enfants de plus de 6 ans et adultes faisant partie de la cohorte NHANES, enquête nationale sur la Santé et la Nutrition entre 2005-2006, seule une interaction significative (p<0,01) entre les dosages urinaires de 2,4–DCP et l’augmentation de l’absentéisme (école, emploi) en raison d’une respiration sifflante chez les sujets atopiques (n = 156 sujets présentant une respiration sifflante auto-déclarée au cours de l’année ayant précédée l’étude) a été observée (Jerschow et al., 2014). Aucune association significative n’a été retrouvée chez les sujets non atopiques (à la fois pour le 2,5 et 2,4-DCP). Néanmoins, les auteurs ont trouvé une association positive entre la concentration sérique d’IgE (asthme allergique) et les concentrations urinaires de 2,4-DCP (p<0,055) observée à partir d’une analyse par régression à variables multiples réalisée sur l’ensemble de la population (sujets atopiques ou non).
Au cours d’une seconde enquête regroupant 3 617 adultes (NHANES, 2007-2010), aucune association entre la prévalence de maladies respiratoires (asthme, chronique bronchique ou emphysème), cardiaques (maladie coronarienne, crise cardiaque, insuffisance cardiaque chronique ou accident vasculaire cérébral) ou hépatiques (pathologies non néoplasiques auto-rapportées) et les concentrations urinaires de 2,4-DCP n’a été rapportée (Rooney et al., 2018).
Toujours dans le cadre de la cohorte NHANES, regroupant 2 267 hommes de plus de 20 ans, 1 145 femmes pré-ménopausées et 1 033 post-ménopausées, une association entre la concentration urinaire de 2,4-DCP et une faible densité minérale osseuse chez les hommes est rapportée, ainsi qu’une plus forte prévalence de l’ostéopénie et de l’ostéoporose associées (Wang et al., 2020). Aucune association n’a en revanche été retrouvée chez les femmes aussi bien pour la densité minérale osseuse, l’ostéopénie ou l’ostéoporose.
Chez les plus de 50 ans (10 122 adultes de l’étude NHANES enrôlés entre 2003 et 2004), une association positive entre la concentration urinaire de 2,4-DCP et des symptômes auto-rapportés de sifflements et de bourdonnements dans les oreilles ont été décrits (Shiue et al., 2013). Des troubles de l’odorat (détermination du seuil olfactif) en lien avec l’augmentation de la concentration urinaire de 2,4-DCP ont également été rapportés dans cette même cohorte (n= 3 708 hommes et femmes de plus de 40 ans, suivis entre 2013 et 2014) (Noel et al., 2017).
Dans une étude transversale norvégienne regroupant 496 adultes, aucune association entre les concentrations urinaires de 2,4-DCP et la prévalence auto-rapportée d’eczéma, de rhinite allergique ou d’asthme n’a été observée (Vindenes et al., 2021). Néanmoins, les auteurs ont trouvé une association positive entre l’exposition au 2,4-DCP (objectivée par la mesure dans les urines) et la réponse immunitaire (dosage sérique d’IgE).
La plupart des études transversales ne mettent en évidence aucune association entre les concentrations urinaires de 2,4-DCP et l’obésité, l’indice de masse corporelle (IMC), le tour de taille, les triglycérides et le cholestérol sérique, ou encore la tension artérielle aussi bien chez l’adulte que chez l’enfant et l’adolescent (Parastar et al., 2018 ; Shiue, 2014 ; Shiue et Hristova , 2014). Des associations positives avec les IMC et le tour de taille ont toutefois été observées chez des adolescents de 6 à 19 ans de la cohorte NHANES suivis entre 2007-2010 (Buser et al., 2014).
Voie cutanée
En milieu professionnel, quelques cas de chloracné et de porphyrie ont été décrits aux États-Unis dans des usines de fabrication des 2,4 et 2,4,5-chlorophénols (Bleiberg et al., 1964). Dans cette même étude, l'augmentation de l'excrétion de coproporphyrines chez les ouvriers de la maintenance a été observée, sans pour autant être associée à des troubles hépatiques.
Dans le cadre d’une étude de cas, le 2,4-DCP a été identifié comme étant l’agent causal d’une dermatite (éruption eczémateuse et prurigineuse dans la région des bretelles et du dos) consécutive à une allergie de contact avec un maillot de bain (Pesqué et al., 2021).
Synthèse
Les effets observés en milieu professionnel se limitent à des effets sur la peau (chloracné et porphyrie cutanée). Des effets pulmonaires (respiration sifflante d’origine allergique) chez les enfants et les adultes, osseux (densité minérale osseuse, ostéopénie et ostéoporose) chez les hommes et ORL (sifflements, bourdonnements) pourraient être associés à des expositions au 2,4-DCP mais demandent à être confirmés.
Chez l'animal
Inhalation
Il n’existe pas dans la littérature de données relatives aux effets systémiques du 2,4-DCP par inhalation pour des expositions répétées chez l’animal.
Voie orale
Plusieurs études du NTP (13 semaines à des doses de 2 500 à 40 000 ppm soit 105 à 2 000 mg.kg-1.j-1 chez les rats et 215 à 5 200 mg.kg-1.j-1 chez les souris et, 2 ans à des doses de 5 000 et 10 000 ppm soit 210 à 440 mg.kg-1.j-1 chez les rats et 800 à 1 300 mg.kg-1.j-1 chez les souris), ont évalué les effets du 2,4-DCP incorporé dans l’alimentation. Dans ces études, le 2,4-DCP a lourdement interféré sur l’appétibilité des aliments, en particulier aux fortes concentrations de 20 000 et 40 000 ppm, entraînant une forte diminution de la prise de nourriture de 50 à 80 % (NTP, 1989). De ce fait, les doses réellement administrées aux animaux restent relativement incertaines et les résultats parfois difficiles à interpréter du fait de la malnutrition des animaux.
Dans les études de 13 semaines, où les rats et les souris ont été exposés à des concentrations de 2 500 à 40 000 ppm via l’alimentation, une mortalité de toutes les souris (10/dose/sexe) est rapportée au cours des 3 premières semaines de traitement à la plus forte concentration de 40 000 ppm (soit 5 200 mg.kg-1.j-1) (NTP, 1989). La perte de poids est importante aussi bien chez les rats (> à 20 % et à 11 % chez les femelles), que chez les souris (12 % chez les mâles et transitoire chez les femelles) à partir de 20 000 ppm (environ 840 mg.kg-1.j-1 chez le rat et 2 600 mg.kg-1.j-1 chez la souris), probablement lié à la présence de 2,4-DCP dans la nourriture entrainant une forte diminution de la prise de nourriture (plus de 70 % aux fortes doses).
Effets respiratoires
Chez le rat, des lésions nasales (dégénérescences multifocales de l’épithélium) sont observées uniquement chez les mâles traités aux 2 doses de 240 et 440 mg.kg-1.j-1 (5 000 et 10 000 ppm) de 2,4-DCP pendant 2 ans via l’alimentation (NTP, 1989). De tels effets n’ont été retrouvés ni chez les rates (120 et 240 mg.kg-1.j-1), ni chez les souris des 2 sexes dans l’étude de toxicité chronique réalisée à partir du même protocole expérimental (5 000 et 10 000 ppm, soit respectivement 800 – 1 300 mg.kg-1.j-1 chez les mâles et 430 – 820 mg.kg-1.j-1 chez les femelles) (NTP, 1989). Aucun effet pulmonaire (poids/histologie) n’a été rapporté dans ces 2 études, y compris à la plus forte dose testée aussi bien le rat que chez la souris.
Effets hématologiques
L’administration pendant 3 mois de 2,4-DCP dans l’eau de boisson à des souris des 2 sexes correspondant à des doses journalières comprises entre 50 et 491 mg.kg-1.j-1 chez les femelles ou entre 40 et 383 mg.kg-1.j-1 chez les mâles n’a entraîné aucune perturbation dans la prise de poids des animaux (Borzelleca et al., 1985). Les quelques différences hématologiques observées chez les mâles (augmentation des leucocytes à la plus forte dose) et celles des paramètres biochimiques chez les femelles (diminution de la créatinine sanguine) ne constituent pas des signes de toxicité importants.
En revanche une atrophie de la moelle osseuse, caractérisée par une déplétion des cellules érythroïdes et myéloïdes est observée chez tous les rats des 2 sexes exposés aux 2 plus fortes concentrations (20 000 et 40 000 ppm) de l’étude de toxicité de 13 semaines (soit à partir de 840 et 1 000 mg.kg-1.j-1 respectivement chez les mâles et les femelles) et sur 6/10 femelles exposées à 10 000 ppm (soit 500 mg.kg-1.j-1) (NTP, 1989). De tels effets, ou autres effets hématologiques ne sont toutefois pas rapportés dans l’étude sub-chronique chez la souris, de même que dans aucune des études de toxicité chronique (2 ans) chez le rat ou la souris.
Effets hépatiques
Une augmentation dose-dépendante de l’incidence de nécroses hépatiques est décrite dans l’étude de 13 semaines chez la souris mâle dès la plus faible concentration testée de 2 500 ppm (soit 325 mg.kg-1.j-1), la sévérité des lésions étant qualifiée par les auteurs de faible aux 3 plus faibles doses testées de 2 500, 5 000 et 10 000 ppm (soit 325, 650 et 1 300 mg.kg-1.j-1) (NTP, 1989). Une augmentation du nombre des hépatocytes multi-nucléés est également mentionnée à partir de 10 000 ppm (environ 1 200 mg.kg-1.j-1), de même que dans l’étude de 2 ans (800 mg.kg-1.j-1) également chez les souris mâles. Aucune lésion histologique du foie n’a été associée à l’exposition de 2,4-DCP via l’alimentation chez les femelles dans l’étude chronique chez le rat et la souris et sub-chronique chez le rat (NTP, 1989). Toutefois le poids du foie et les activités des enzymes hépatiques n’ont pas été examinés dans ces études du NTP.
Dans une étude, où les souris ont reçu dans l’alimentation des doses journalières d’environ 230 mg.kg-1.j-1 pendant 6 mois, les auteurs ont observé l’augmentation transitoire du volume des hépatocytes (Kobayashi et al., 1972). Les activités sériques de l’ALAT et de l’ASAT n’ont pas été modifiées. C’est sur la base de l’hyperplasie hépatique qu’un NOAEL de 100 mg.kg-1.j-1 a été retenu par les auteurs dans cette étude.
Effets rénaux
En dehors d’une nécrose tubulaire rénale observée sur 3/10 souris mâles mortes prématurément et exposées à la plus forte dose de 5 200 mg.kg-1.j-1 dans l’étude de 13 semaines du NTP, aucune toxicité rénale (histologie) n’est rapportée dans les études de 13 semaines et de 2 ans chez le rat et/ou la souris (NTP, 1989). Des NOAEL pour la toxicité rénale de 2 000 et 440 mg.kg-1.j-1 sont respectivement retenus chez le rat dans les études de 14 semaines et de 2 ans (NTP, 1989), ainsi que des valeurs de 230, 2 600 et 1 300 mg.kg-1.j-1 respectivement dans les études de 90 jours, 14 semaines et 2 ans chez la souris (Kobayashi et al., 1972 ; NTP, 1989).
Effets sur le système immunitaire
Dans une étude sur la reproduction et le développement chez le rat, l’exposition néonatale (in utero et lactation) et post-natale (15 semaines après sevrage via l’eau de boisson), le 2,4-DCP a entraîné une diminution de l’hypersensibilité retardée à partir d’une dose de 4,6 mg.kg-1.j-1 (NOAEL de 0,46 mg.kg-1.j-1) (Exon et al., 1984 ). L’étude et les effets s’y rapportant, notamment sur le système immunitaire sont ultérieurement détaillés dans le paragraphe 3.3.4.2 relatifs aux effets sur le développement.
En dehors de l’augmentation significative du poids de la rate observée chez les animaux exposés à la dose de 46 mg.kg-1.j-1 dans l’étude d’Exon et al. (1984), le poids et l’histologie des organes du système immunitaire (rate, thymus, ganglions lymphatiques) n’ont le plus souvent pas été altérés par les expositions au 2,4-DCP aussi bien dans les études d’expositions sub-chronique et chronique du NTP, qu’au cours de l’étude d’exposition de 6 mois chez la souris jusqu’à une dose de 230 mg.kg-1.j-1 chez la souris (Kobayashi et al., 1972 ). On peut néanmoins remarquer que le NOAEL de 0,46 mg.kg-1.j-1 relatif aux effets sur le système immunitaire (Exon et al., 1984) est bien inférieur au NOAEL de 100 mg.kg-1.j-1 établi par Kobayashi et al. (1972) mentionné précédemment.
Effets sur le système nerveux
En dehors d’une posture voutée, observée chez les rats exposés pendant 13 semaines à une dose de 2 000 mg.kg-1.j-1 de 2,4-DCP via l’alimentation, aucun effet sur le système nerveux (signes cliniques, histologie du cerveau, du nerf sciatique et de la moelle épinière) n’est rapporté dans les études de toxicité sub-chronique et chronique du NTP (NTP, 1989). Chez la souris, le poids du cerveau n’a pas été altéré par l’exposition au 2,4-DCP via l’eau de boisson pendant 6 mois à des doses respectives de 491 et 383 mg.kg-1.j-1 chez les femelles et les mâles (Borzelleca et al., 1985a, b).
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Les effets de l’exposition par inhalation de 2,4-DCP ne sont pas documentés. Par voie orale, une nécrose rénale et une atrophie de la moelle osseuse sont décrites uniquement à fortes doses. A de plus faibles doses, une toxicité hépatique (nécrose d’intensité variable), des voies nasales (dégénérescences multifocales de l’épithélium) et du système immunitaire (hypersensibilité retardée au cours du développement) sont rapportées avec des spécificités liées à l’espèce et au sexe (mâles plus sensibles).
Effets cancérigènes
Généralités
En l’absence de données spécifiques, le 2,4-DCP n’a pas été évalué par l’IARC (1987), mais il existe plusieurs études suggérant l’effet de mélanges de chlorophénols ; seules les principales données sont brièvement décrites ici.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé cancérigène | 2008 |
| IARC | Polychlorophénols et leurs sels : Groupe 2B (l’agent (ou le mélange) pourrait être cancérogène pour l’homme) | 1999 |
| US EPA | Classe D : Informations inadéquates pour évaluer le potentiel cancérogène | 1987 |
Chez l'homme
Toutes voies
Aucune donnée épidémiologique ne permet d’évaluer spécifiquement les potentiels effets cancérogènes du 2,4-DCP.
Inhalation
Plusieurs études cas-témoins suggèrent des associations possibles entre l’exposition aux chlorophénols (di-, tri- et tétra-chlorophénols) et la survenue de lymphomes non hodgkiniens, les sarcomes des tissus mous et le cancer du sinus nasal. Toutefois, dans ces études, une co-exposition au pentachlorophénol n’est pas exclue (Garabedian et al., 1999; Hoppin et al., 1998; Mirabelli et al., 2000; Richardson et al., 2008).
Plusieurs études épidémiologiques (Eriksson et al, 1981, 1990; Hardell et Eriksson, 1988; Hardell et al., 1981, 1995; Hooiveld et al., 1998; Kogevinas et al., 1997; Lynge, 1985; Saracci et al., 1991; Zendehel et al., 2014) ont évalué le lien possible entre le cancer et les expositions professionnelles au cours de la fabrication ou de l’utilisation d’herbicides du type phénoxy. Dans ce secteur, les travailleurs peuvent avoir été exposés au pentachlorophénol, aux composés herbicides phénoxy, ainsi qu’à des contaminants polychlorés du type dioxines et furanes, en plus des chlorophénols initialement ciblés dans cette évaluation. La plupart des études qui ont évalué des sous-groupes exposés uniquement aux chlorophénols autres que le pentachlorophénol (Lynge, 1985; Saracci et al., 1991) n’ont mis en évidence aucune association. De même, dans la méta-analyse de Zendehel regroupant des études où les sujets ont été exposés uniquement aux chlorophénols, aucune association avec le cancer du poumon n’a été observée (Zendehel et al., 2014).
L'étude de Lynge a décrit l'augmentation de cancers du poumon et des sarcomes des tissus conjonctifs dans certaines sous-populations travaillant dans des usines de production d’herbicides du groupe des chlorophénols (DCP et 4-chloro-ortho-crésol) au Danemark entre 1951 et 1959. Bien que l’exposition des personnes à la 2,3,7,8-tétrachlorodibenzodioxine semble peu probable dans la mesure où les usines de production de trichlorophénol ont été écartées, les auteurs n’excluent cependant pas la présence de nombreux autres biais et ne peuvent conclure quant au pouvoir cancérogène du 2,4-DCP (Lynge, 1985).
Dans une autre étude réalisée sur 4 500 travailleurs, exposés non exclusivement au 2,4-DCP, une augmentation significative de l’incidence des cancers du poumon, des cancers du rectum et des sarcomes des tissus conjonctifs a été observée chez les hommes. Chez les femmes, les tumeurs se situaient au niveau ORL. La présence de nombreuses substances en mélange ne permet pas dans cette étude de conclure sur le caractère cancérogène du 2,4-DCP (US EPA, 1987).
Une étude ayant suivi 878 salariés exposés professionnellement au 2,4-DCP entre 1945 et 1983 montre un excès de cancers lymphatiques et hématopoïétiques. L'exposition à d'autres chlorophénols ou contaminants n'est pas non plus exclue (Bond et al., 1988).
Voie orale
Une étude écologique a été menée dans le sud de la Finlande pour déterminer si la consommation d’eau potable contaminée par les chlorophénols (70 à 140 µg.L-1), essentiellement tri- et tétra-chlorophénols était associée à la morbidité liée aux cancers (Lampi et al., 2008). Cependant l’approvisionnement en eau auquel la collectivité était exposée a également pu être contaminé par le penta-chlorophénol, en plus des autres chlorophénols. Une augmentation de l’incidence des lymphomes non hodgkiniens (SIR de 2.08 ; IC95% 1.14 – 3.49) et des cancers des tissus mous (SIR de 3,19 ; IC95% 1.17 – 6,95) est rapportée au cours de la période d’exposition (1972-1986) par rapport au taux d’incidence pour la région où le village était situé.
Voie cutanée
Aucune étude d’exposition exclusivement cutanée n’a été identifiée.
Synthèse
Les effets cancérogènes du 2,4-DCP seul ne sont pas documentés. Une augmentation de l’incidence des lymphomes non hodgkiniens, des sarcomes des tissus mous et des cancers du sinus nasal visant plus spécifiquement les tri- et tétra-chlorophénols a été suggérée. Cependant, la présence de pentachlorophénol ne peut pas être écartée.
Chez l'animal
Inhalation
Aucune étude n’a été identifiée.
Voie orale
Aucune activité cancérogène du 2,4-DCP n'a été mise en évidence dans les 2 études menées chez la souris (B6C3F1) et le rat (F344/N) pour des administrations quotidiennes par voie orale dans la nourriture jusqu’à des doses de 440 mg.kg-1.j-1 chez le rat et 1 300 mg.kg-1.j-1 chez la souris sur une période de 2 ans (NTP, 1988).
Voie cutanée
Le 2,4-DCP a présenté une activité de promotion tumorale dans une étude d’initiation-promotion cutanée de 15 semaines chez la souris où le 2,4-DCP a été appliqué 2 fois par semaine (25 μL d’une solution à 20 %) après une seule application de 7,12-diméthylbenzo[a]anthracène (DMBA) (Boutwell et Bosch, 1959). Une augmentation du nombre de tumeurs cutanées a été observée après les applications de 2,4-DCP par rapport au traitement au DMBA seul.
Synthèse
Aucun effet cancérogène n’a été observé après exposition du rongeur au 2,4-DCP par voie orale. Il présente une activité de promotion tumorale par voie cutanée.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le 2,4-dichlorophénol a été examiné par l’Union Européenne mais n’a pas été classé | 2008 |
Chez l'homme
Toutes voies
Aucune donnée n’a été identifiée
Chez l'animal
Voie orale
Le 2,4-DCP n’induit pas d’échanges de chromatides sœurs dans les cellules testiculaires et de moelle osseuse de souris exposées respectivement par voie orale (gavage dans l’huile de maïs) à des doses allant jusqu’à 638 mg.kg-1.j-1 pendant 15 jours ou jusqu’à 500 mg kg-1.j-1 (dans l’eau potable) pendant 90 jours (Borzelleca et al. 1985a).
In vitro
Organismes procaryotes
Le 2,4-DCP n’est pas mutagène sur des souches de Salmonella typhimurium (TA98, TA100, TA1535, TA1537) avec ou sans activation métabolique (S9) (Haworth et al. 1983; Kubo et al. 2002; NTP ; 1989; Probst et al. 1981; Rapson et al. 1980; Rasanen et al. 1977; Simmon et al. 1977; Zeiger et al. 1990), mais il est positif dans le test umu sans activation métabolique (Ono et al., 1992) et également sur E. Coli avec activation métabolique dans un test d’induction de prophages (DeMarini et al. 1990).
Organismes eucaryotes
Le 2,4-DCP n’est également pas mutagène sur cellules V79 du hamster chinois (Hattula et Knuutinen, 1985; Jansson et Jansson 1986).
Le test d’induction de micronoyaux dans un modèle d’épiderme reconstruit humain est négatif (EpiSkinTM) (Chen et al. 2021), mais le 2,4-DCP induit des aberrations chromosomiques sur cellules V79 (Onfelt, 1987) et ovariennes (CHO) du hamster chinois (Hilliard et al., 1998), de même qu’une augmentation de la synthèse d'ADN sur cellules hépatiques de rat (Probst et al., 1981).
Même si certains résultats ne permettent pas d’exclure un effet promoteur tumoral et/ou faiblement génotoxique, les données actuellement disponibles concernant le 2,4-DCP ne sont pas suffisantes pour conclure sur le mécanisme, à seuil ou sans seuil. De plus, aucun effet cancérogène n’a été décrit pour le 2,4-DCP chez l’animal.
Synthèse
Dans les tests in vivo chez l’animal et la plupart des tests in vitro sur cellules procaryotes et eucaryotes, le 2,4-DCP n’est pas mutagène. Néanmoins, quelques résultats contradictoires ne permettent pas d’écarter avec certitude une activité génotoxique.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2008 |
Chez l'homme
Toutes voies
La concentration urinaire maternelle de 2,4-DCP a été significativement associée à une baisse de l’âge des premières règles (ménarche) (écart de - 0,8 mois, IC95% [1,6 – 0]) de 179 filles incluses dans le cadre d’une cohorte californienne des naissances (CHAMACOS) (Harley et al., 2019).
A l’inverse, aucune association entre la concentration urinaire de 2,4-DCP d’adolescentes et l’âge de la ménarche n’est rapportée dans une étude transversale réalisée à partir des données de n = 440 filles de 12 à 16 ans participant à la cohorte de suivi des naissances NHANES (2003-2008) aux Etats-Unis (Buttke et al., 2012). Cependant dans cette étude, les premières règles se sont parfois produites avant les dosages urinaires de 2,4-DCP ; dans ce cas, la temporalité entre les 2 évènements n’a pas pu être évaluée dans l’étude.
Concernant les autres marqueurs du développement sexuel (développement de la poitrine, gonardache (volume testiculaire chez les garçons), apparition de poils pubiens), aucun effet significatif en lien avec la concentration urinaire de 2,4-DCP n’a été décrit aussi bien chez les filles que chez les garçons (Binder et al., 2018 ; Harley et al., 2019).
Aucun effet sur la fécondabilité n’a également été rapporté pour le 2,4-DCP (Vollmar, 2023).
Synthèse
Des effets sur l’âge d’apparition des premières règles sont suggérés dans une seule étude dont les résultats demandent à être confirmés notamment en raison de l’exposition concomitante à d’autres composés de la famille des chlorophénols.
Chez l'animal
Voie orale
Aucun effet sur la reproduction (taux de conception, mortinatalité, taille des portées) n’a été rapporté dans une étude où seules les rates ont été exposées pendant 90 jours à partir du sevrage, puis au cours de l’accouplement (avec des mâles non traités) et de la gestation à des doses de 0 – 3 – 30 – 300 ppm (soit 0 – 0,46 – 4,6 – 46 mg.kg-1.j-1) de 2,4-DCP administrées dans l’eau de boisson (Exon et al., 1984). A de plus fortes doses de 0 – 500 – 2 000 – 8 000 ppm administrées par voie alimentaire (soit 0 – 33,4 – 134 – 543 mg.kg-1.j-1 chez les rats mâles et 0 – 49,1 – 194 – 768 mg.kg-1.j-1 chez les rates), aucun effet sur les paramètres de la reproduction (indices d’accouplements, de fertilité, de gestation, de viabilité, sex ratio) n’a été décrit dans une étude sur 2 générations (exposition de 10 semaines avant les accouplements pour la génération parentale), en dehors d’une diminution significative du nombre d’implantations chez les femelles F1 exposées à la plus forte dose de 768 mg.kg-1.j-1 (Aoyama et al., 2005). Le poids de ces femelles a en parallèle significativement diminué par rapport à celui des femelles F1 du groupe témoin.
La pénétration, évaluée à partir d’un test de fertilisation in vitro, et la mobilité des spermatozoïdes n’ont pas été altérées par une exposition des souris mâles à des doses de 0 – 50 – 150 – 500 mg.kg-1.j-1 de 2,4-DCP via l’eau de boisson pendant 90 jours (Seyler et al., 1984).
Concernant les organes sexuels, le 2,4-DCP est sans effet sur la durée des cycles œstraux, le nombre de follicules primaires ovariens ou sur l’histologie des ovaires et de l’utérus dans les études chez le rat et/ou la souris où ces paramètres ont été évalués (Aoyama et al., 2005 ; NTP, 1989).
Chez les mâles, les données sont parfois contradictoires. Bien que l’appareil reproducteur (augmentation de la nécrose cellulaire au niveau des tubes séminifères) et la spermatogénèse (diminution de la mobilité et augmentation du nombre de spermatozoïdes anormaux) soient la cible du 2,4-DCP chez les souris mâles exposées pendant 14 jours à environ 260 mg.kg-1.j-1 via l’eau de boisson, la fertilité des mâles (mobilité et pénétration des spermatozoïdes dans le cadre de test in vitro) n’a néanmoins pas été altérée par une exposition jusqu’à 500 mg.kg-1.j-1 également administrée dans l’eau de boisson pendant 90 jours (Aydin et al., 2009 ; Seyler et al., 1984). De plus, aucune différence des paramètres spermatiques n’est rapportée chez les mâles F0 et F1 dans l’étude de reproduction sur 2 générations, ni aucun effet sur l’histologie des organes reproducteurs dans les études sub-chroniques et chroniques du NTP réalisées chez le rat et la souris (Aoyama et al., NTP, 1989).
Synthèse
Le 2,4-DCP est sans effet sur la fonction de reproduction chez le rat et la souris des 2 sexes. Toutefois, une atteinte de l’appareil reproducteur des mâles (nécrose cellulaire testiculaire) et de la spermatogénèse a été décrite chez la souris.
Effets sur le développement
Chez l'homme
Toutes voies
Dans une étude cas-témoins de petite taille, l’exposition urinaire de 2,4-DCP des mères n’a pas été associée à des variations de la taille pour l’âge gestationnel des bébés à la naissance (Bommarito et al., 2021).
Une étude cas-témoins nichée dans 2 cohortes françaises (EDEN et PELAGIE) et regroupant 72 cas (garçons nés avec hypospadias ou non descente des testicules) et 216 témoins, a inversement corrélé la concentration de 2,4-DCP urinaire des mères avec le poids de naissance et le périmètre crânien à la naissance (Philippat et al., 2012).
Chez les enfants de 3 ans (Guo et al., 2019) ou de 5 ans (Berger et al., 2021), respectivement réalisées sur 377 et 309 paires mère-enfant, les paramètres physiques du développement de l’enfant (taille, indice de masse corporelle) ont été mesurés. Ce dernier auteur a pu établir une association entre la prévalence de l’asthme ou une altération de la fonction pulmonaire chez les enfants et la concentration de 2,4-DCP urinaire des mères (319 paires mères – enfant de la cohorte californienne CHAMACOS) (Berger et al., 2020).
Synthèse
Des effets sur le développement, l’asthme ou l’altération de la fonction pulmonaire chez l’enfant sont évoqués, mais demandent à être confirmés.
Chez l'animal
Voie orale
L’administration de doses croissantes de 2,4-DCP administrées par gavage à des rates entre les 6e et 15e jours de gestation a entraîné une perte de poids dès 375 mg.kg-1.j-1 et une mortalité (4/34) des mères exposées à la plus forte dose de 750 mg.kg-1.j-1 (Rodwell et al., 1989). A cette même dose, un retard d’ossification, une augmentation du nombre de résorptions et une réduction du poids des fœtus non viables ont été observés. Aucun signe évident de malformations n’a été décrit dans cette étude.
Dans l’étude de reproduction sur 2 générations chez le rat décrite précédemment, un retard significatif des marqueurs physiques du développement (ouverture des yeux) est observé à la fois chez les petits F1 et F2 exposés à la plus forte dose (Aoyama et al., 2005). Toujours à la plus forte dose, l’âge de la séparation du prépuce des petits F1 est significativement augmenté, mais l’effet ne peut pas être dissocié de la baisse de croissance pondérale. A l’inverse, dans ce même groupe, l’âge de l’ouverture vaginale est plus précoce, malgré un même effet du traitement que chez les mâles sur la croissance pondérale. De plus, une augmentation significative du poids de l’utérus est rapportée chez les petites femelles F1 et F2 des groupes exposés à la plus forte dose. Les analyses histologiques de l’utérus révèlent dans ce même groupe F2 une augmentation du nombre de cellules épithéliales (7/10 femelles versus 1/10 dans le groupe témoin).
Dans une étude sur le développement où les petits ont été traités in utero, puis au cours de la période post-natale via le lait maternel et après sevrage via l’eau de boisson à des doses de 0 – 3 – 30 – 300 ppm dans l’eau potable pendant 12 semaines après la naissance (soit environ 0 – 0,46 – 4,6 – 46 mg.kg-1.j-1), aucun effet sur le poids des petits à la naissance et/ou au sevrage, de même qu’au cours de la croissance post-natale après sevrage n’a été observé (Exon et al., 1984). L’autopsie des petits en fin d’étude n’a pas mis en évidence d’effet sur le poids corporel mais une augmentation du poids du foie et de la rate (p<0,05), à la plus forte dose. Parmi les paramètres de la fonction immunitaire recherchés dans cette étude (production d’anticorps, réponse d’hypersensibilité retardée, activité phagocytaire), les auteurs ont mis en évidence chez les jeunes rats de 13 semaines une augmentation dose-dépendante de l’immunité humorale par la production d’anticorps, significative à la plus forte dose. A l’inverse, une diminution de l’immunité cellulaire mesurée par l’hypersensibilité retardée a été observée aux 2 plus fortes doses d’exposition (diminution significative de la réponse à l’injection sous-cutanée (mesure de l’œdème) chez les animaux exposés aux concentrations de 4,6 et 46 mg.kg-1.j-1 de 2,4-DCP) (Exon et al., 1984). Sur la base de la diminution de l’hypersensibilité retardée, un NOAEL de 0,46 mg.kg-1.j-1 a été établi dans cette étude.
Synthèse
La 2,4-DCP n’est pas toxique pour l’embryon et/ou le fœtus à des doses non toxiques pour les mères. Il n’est pas tératogène. En revanche, un retard des marqueurs physiques et sexuels (chez les mâles uniquement) du développement sont décrits chez les petits exposés in utero et après la naissance à des doses où la croissance pondérale est également altérée. Des effets sur le développement du système immunitaire (augmentation de l’immunité humorale et diminution de l’hypersensibilité retardée) sont observés à de faibles doses chez le rat.
Autres Effets
Généralités
Effets sur le système endocrinien
Une atteinte de la fonction thyroïdienne est suggérée à partir d’une étude américaine cas-témoins nichée dans une cohorte de suivi des naissances et réalisée sur 439 femmes enceintes dont 116ayant accouché avant terme et 323 témoins (Aker et al., 2018). La collecte des urines et des prélèvements de sang a été réalisée 4 fois au cours de la grossesse afin de doser les concentrations urinaires de 2,4 et 2,5-DCP et les concentrations sanguines d’hormones thyroïdiennes. Lorsque les données ont été stratifiées sur l’âge gestationnel, la concentration urinaire de 2,4-DCP est significativement associée à une diminution de la concentration sérique de Triidothyronine (T3) (p<0,05), et marginalement à l’augmentation de la thyréostimuline (TSH) entre les 21 et 31e semaines de gestation (p<0,1) et la diminution de TSH à moins de 21 semaines de gestation (p<0,1). Dans une étude similaire, également réalisée aux Etats-Unis sur 338 femmes enceintes, la concentration urinaire de 2,4-DCP dosée 2 fois au cours de la grossesse a été significativement inversement associée avec la thyroxine libre (T4) maternelle, mais pas avec la T4 totale ou la TSH (Berger et al., 2018).
En revanche, aucune des études de toxicité sub-chronique chez le rat ou chez la souris (doses maximales respectives de 2 000 et 2 600 mg.kg-1.j-1) et chronique (doses maximales respectives de 440 et 1 300 mg.kg-1.j-1) n’a mis en évidence des effets sur l’histologie des différentes glandes endocrines (les surrénales, l’hypophyse, la thyroïde et le pancréas) (NTP, 1989).
Concernant les hormones sexuelles, des changements significatifs des taux sériques de progestérone et de folliculostimuline (FSH) ont été associés aux concentrations urinaires de 2,4-DCP chez 143 femmes en bonne santé pré-ménopausées (Pollak et al., 2018). Aucune association n’a été retrouvée pour l’hormone lutéinisante (LH) et l’œstradiol, mais les auteurs précisent que le 2,4-DCP se situait en dessous des limites de détection dans de de nombreux échantillons urinaires.
Chez l’animal, les taux hormonaux de FSH, de LH, de prolactine, d‘œstradiol et de progestérone ne sont pas sensibles à l’exposition au 2,4-DCP chez les femelles F1 de l’étude de reproduction par voie orale sur 2 générations (Aoyama et al., 2005). Toutefois, dans cette même étude, une augmentation du poids de l’utérus a été décrite chez les petites femelles des groupes exposés aux deux plus fortes doses de 194 – 768 mg.kg-1.j-1.
Des données chez le poisson zèbre indiquent que le 2,4-DCP pourrait perturber la stéroïdogenèse (concentration plasmatique de testostérone et d’œstradiol) et avoir des effets néfastes sur la reproduction chez les poissons, avec notamment une diminution du taux d’éclosion des œufs (Ma et al., 2012). De plus, les auteurs ont montré in vitro que le 2,4-DCP pouvait altérer la production de d’œstradiol et de testostérone dans les cellules humaines H295R.
Le 2,4-DCP est répertorié dans la catégorie II de la liste DeDuCT (effets PE rapportés à l'appui d'expériences in vivo (sur des rongeurs) et in vitro sur des cellules humaines), ainsi que dans la liste I de l’Anses des substances suspectées d’avoir des effets de perturbation endocrinienne. En revanche, il ne figure pas parmi les substances reconnues comme perturbateurs endocriniens (PE) dans la réglementation européenne, ni dans les EDlists européennes.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Valeurs de l'ANSES et/ou de l'INERIS
Description
Voie orale - Exposition sub-chronique
L’ATSDR propose un MRL de 2.10-2 mg.kg-1.j-1 pour une exposition sub-chronique au 2,4-DCP par voie orale (ATSDR, 2022).
Cette valeur a été établie à partir des effets observés sur le développement du système immunitaire de jeunes animaux exposés au cours de la période prénatale (in utero) et post-natale pendant 12 semaines (via l’allaitement après sevrage via l’eau de boisson), à des doses de 0 - 3 – 30 – 300 ppm de 2,4-DCP (soit 0 – 0,46 – 4,6 – 46 mg.kg-1.j-1) (Exon et al., 1984). Une diminution significative de la réponse au test d‘hypersensibilité retardée (immunité à médiation cellulaire), a été observée chez les petits exposés aux 2 plus fortes doses (NOAEL de 0,46 mg.kg-1.j-1). Le détail des mesures réalisées au niveau de la patte (gonflement en réponse au test cutané), est rapporté dans le tableau suivant.
Effets de l’immunité à médiation cellulaire chez des rats exposés au 2,4-DCP dès la conception et y compris jusqu’au sevrage, sur une période de 15 semaines post-natale (Exon et al., 1984).
Dose (mg.kg-1.j-1) | Nombre de rats | Œdème de la patte (taille en mm) Moy. | Erreur standard sur la moyenne | Déviation standard (calculée) |
| 0 | 10 | 1,1 | 0,13 | 0,41 |
| 0,46 | 10 | 0,85 | 0,11 | 0,35 |
| 4,6 | 10 | 0,67 | 0,11 | 0,35 |
| 46 | 10 | 0,63 | 0,11 | 0,35 |
Une modélisation des données a été menée pour la détermination d’une BMD. Elle a conduit à retenir un modèle exponentiel et pour la valeur la plus protectrice, soit BMDL1DS de 2,07 mg.kg-1.j-1.
Facteurs d’incertitude : un facteur d’incertitude global 100 a été appliqué correspondant à un facteur 10 pour l’extrapolation de l’animal à l’homme et un facteur 10 pour la variabilité intra-espèce.
Calcul : 2,07 mg.kg-1.j-1 x 1/100 = 2,07.10-2 arrondi à 2,1 10-2 mg.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice.
Voie orale - Exposition chronique
L’US EPA (IRIS) propose une RfD de 3.10-3 mg.kg-1.j-1 pour une exposition chronique par voie orale au 2,4-DCP (US EPA, 2015).
Cette valeur a initialement été construite en 1987 par l’US EPA à partir de l’étude ayant montré une altération de la fonction immunitaire chez le rat exposé au cours du développement pré- et post-natale à des doses de 0 - 3 – 30 – 300 ppm de 2,4-DCP (Exon et al., 1984). Cette étude dont le protocole et les principaux résultats sont détaillés ci-dessus a permis de déterminer un NOAEL de 3 ppm en raison de la baisse significative de l’hypersensibilité retardée observée aux 2 doses justes supérieures de 30 et 300 ppm (LOAEL de 30 ppm). Le NOAEL de 3 ppm a été converti en une dose de 0,3 mg.kg-1.j-1 (calcul non détaillé).
Facteurs d’incertitude : un facteur 100 a été appliqué qui correspond à un facteur 10 pour l’extrapolation de l’homme à l’animal et un facteur 10 pour la variabilité intra-espèce.
Calcul : 0,3 mg.kg-1.j-1 x 1/100 = 3.10-3 mg.kg-1.j-1
Indice de confiance : l’US EPA accorde une confiance faible dans l’étude retenue (système immunitaire rarement utilisé dans cette démarche), faible dans la base de données (données isolées et ordre de grandeur NOAEL/LOAEL très différent des autres études) et faible dans la valeur proposée.
Le RIVM propose une TDI de 3.10-3 mg.kg-1.j-1 pour une exposition chronique au 2,4-DCP par voie orale (Baars et al., 2001).
Cette valeur a également été construite à partir de la même étude d’Exon et al., (1984), dans laquelle des modifications de la réponse immunitaire (diminution de l’hypersensibilité retardée) ont été observées chez le rat exposé au 2,4-DCP dans l'eau de boisson (exposition néonatale in utero et via le lait maternel, puis post-natale pendant 15 semaines) à des doses de 0 – 3 – 30 – 300 ppm (Exon et al., 1984). Pour cette étude, un NOAEL de 0,3 mg.kg-1.j-1 a été établi.
Facteur d'incertitude : un facteur 100 a été appliqué qui correspond à un facteur 10 pour l’extrapolation de l’homme à l’animal et un facteur 10 pour la variabilité intra-espèce.
Calcul : 0,3 mg.kg-1.j-1 x 1/100 = 3.10-3 mg.kg-1.j-1
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est faible.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Voie orale - Exposition sub-chronique
L’Ineris propose de retenir pour une exposition sub-chronique au 2,4-DCP par voie orale la VTR sub-chronique de 2.10-2 mg.kg-1.j-1 (ATSDR, 2022).
Seul l’ATSDR (2022) propose une valeur. La valeur est basée sur une étude de toxicité sur le développement de bonne qualité chez le rat (Exon et al., 1984). L’effet critique retenu est une atteinte du système immunitaire à médiation cellulaire (hypersensibilité retardé) observée chez de jeunes rats exposés 15 semaines incluant la période néo-natale (exposition in utero et via le lait maternel). Cet effet est recevable au regard des données disponibles et d’une sensibilité bien supérieure (ordre de grandeur de 10 à 100) aux effets observés dans la littérature (atteinte hépatique et de la moelle osseuse). La modélisation des données et le choix de la dose critique retenue (BMDL) sont bien documentés et transparents. Le choix des facteurs d’incertitude est cohérent.
L’Ineris retient la valeur de l’ATSDR
Indice de confiance : moyen en raison des limites concernant le choix de l’effet critique et de sa sensibilité
Voie orale - Exposition chronique
L’Ineris propose de retenir pour une exposition chronique au 2,4-DCP par voie orale la VTR chronique de 3.10-3 mg.kg-1.j-1 (US EPA, 2015 ; RIVM, 2001).
Seuls l’US EPA (1987) et le RIVM (2001) proposent une valeur pour des expositions chroniques. Cette valeur est la même pour les 2 organismes et est construite à partir d’une même étude sur le développement post-natal (Exon et al., 1984), également retenue en 2022 par l’ATSDR pour la construction d’une valeur sub-chronique.
L’effet critique retenu, une diminution de la réponse immunitaire à médiation cellulaire, est également identique et jugé recevable. L’US EPA et le RIVM retiennent comme dose critique, le même NOAEL de 3 ppm converti en une dose de 0,3 mg.kg-1.j-1. Les 2 organismes ne calculent pas de BMD et ne procèdent à aucun ajustement. Ils utilisent un facteur d’incertitude 100 pour tenir compte des variations inter- et intra-espèces. La construction de la valeur est transparente et cohérente.
Dans ce contexte, la même valeur de l’US EPA et du RIVM est retenue par défaut.
Indice de confiance : faible qualité (choix de l’effet critique et de sa sensibilité et durée de l’étude)
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
VGE/NQE Importer
Evaluations existantes :
UNEP (2006). “SIDS Initial Assessment Report for 2,4-dichlorophenol (120-83-2).”
Effets endocriniens :
Le 2,4-dichlorophénol fait partie des substances à effets perturbateurs endocriniens démontrés ou potentiels (catégorie 2) (Petersen et al., 2007).
Pour l'homme : La substance est classée en catégorie 2 (voir ci-dessus).
Pour la faune sauvage : La substance est classée en catégorie 3 : les informations sur la substance sont insuffisantes pour pouvoir juger du caractère perturbateur endocrinien.
Critères PBT / POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou
POP2 (PNUE, 2001).
Normes de qualité existantes :
Union Européenne : norme de qualité pour l'eau douce = 10 µg.L-1 (projet). 3
Allemagne : norme de qualité pour les eaux prélevées destinées à la consommation = 10 µg.L-1, (ETOX, 2007) 4
Etats-Unis : critère de qualité pour l'eau douce = 365 µg.L-1, (ETOX, 2007) 4
Etats-Unis : critère de qualité pour la consommation d'eau et de poissons = 93 µg.L-1 (ETOX, 2007), 4
Canada : critère de qualité pour l'eau de consommation = 0.3 µg.L-1
(ETOX, 20074)
Colombie Britannique : valeurs guides pour la vie aquatique : entre 0.3 et 10 µg.L-1 pour des pH compris entre 5.7 et 9.2 (Warrington, 1997).
Substance(s) associée(s) :
Chlorophénols : 3-chlorophénol (CAS n° : 108-43-0), 4-chlorophénol (CAS n° : 106-48-9), 2,4-dichlorophénol (CAS n° : 120-83-2)
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[3] Comité Scientifique consultatif pour l'examen de la Toxicité et de l'Écotoxicité des substances chimiques de la Commission Européenne.
[4] Les données issues de cette source () ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS. http://webetox.uba.de/webETOX/index.do
Dans le cadre des travaux de l'OCDE réalisés pour les substances produites à fort tonnage (programme HPV), le 2,4-dichlorophénol a été évalué et le dossier SIDS5 de la substance est disponible sur le site de l'UNEP (UNEP, 2006). La plupart des données présentées dans cette fiche sont issues de cette évaluation et n'ont donc pas fait l'objet d'une évaluation supplémentaire.
FDTE/VTR Importer L'objectif de ce document est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme.
Dangers
Description
VGE/NQE Importer
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. La majorité des données présentées a été validée dans le cadre des travaux réalisés dans le programme HPVC de l'OCDE. Seule l'étude réalisée sur Carassius auratus a fait l'objet d'une validation par l'INERIS.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
ECOTOXICITE AQUATIQUE AIGUË

ECOTOXICITE AQUATIQUE CHRONIQUE
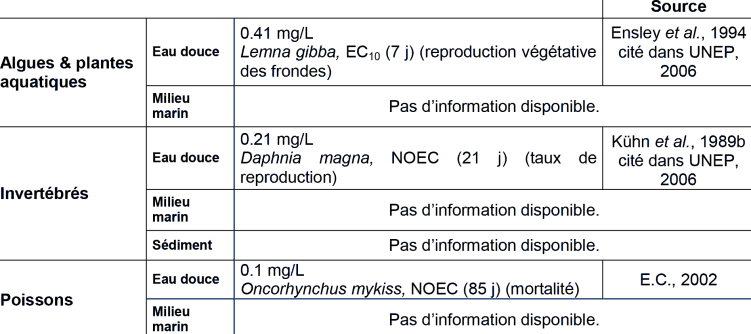
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
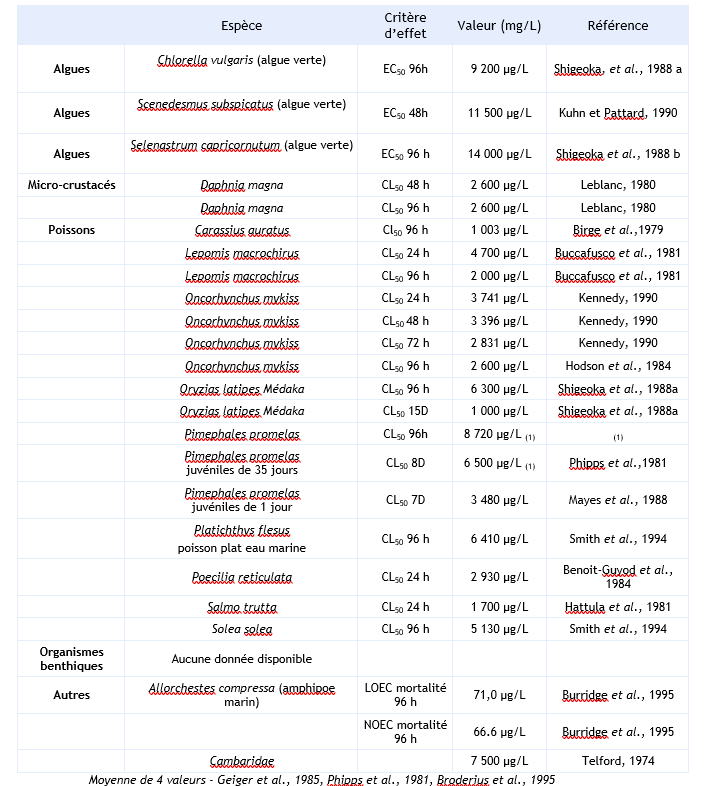
Eau douce
FDTE/VTR Importer Paramètres d'écotoxicité aiguë
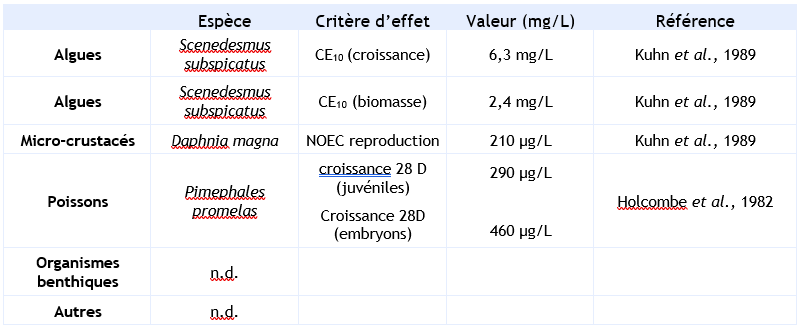
Paramètres d'écotoxicité chronique
Sédiments d'eau douce
FDTE/VTR Importer Aucun résultat de toxicité sur organismes benthiques n’est disponible dans la littérature.
Sédiments marins
FDTE/VTR Importer Aucun résultat de toxicité sur organismes benthiques n’est disponible dans la littérature.
Sol
FDTE/VTR Importer Aucun résultat avec des organismes terrestres n’est disponible.
Biote
VGE/NQE Importer
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biota, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été jugées valides puisqu'elles sont issues de rapports ayant fait l'objet d'une expertise collective internationale.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biota n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen (Tableau 22, page 129, E.C., 2003) et le projet de guide technique européen pour la détermination de normes de qualité (E.C., 2009). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (tableau 23, page 130, E.C., 2003). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES
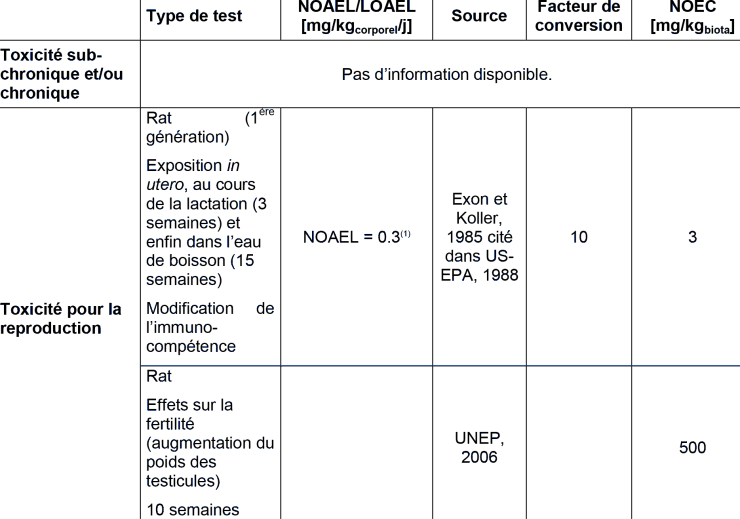
(1) Cette valeur a été utilisée par l'US-EPA pour la détermination de la VTR.
TOXICITE ORALE POUR LES OISEAUX

Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
VGE/NQE Importer
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour l'évaluation des risques dus aux substances chimiques (E.C., 2003) et au projet de guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2009). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le tableau 16, page 101, du guide technique européen (E.C., 2003).
Moyenne annuelle (AA-QSwater_eco) :
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour le 2,4-dichlorophénol, on dispose de données valides pour 3 niveaux trophiques en chronique et en aigu. En chronique, la plus basse NOEC a été observée pour Oncorhynchus mykiss, (NOEC 85 j à 0.1 mg.L-1). Un facteur d'extrapolation de 10 est donc appliqué à cette NOEC (cf. note d du tableau 16, page 101 de E.C., 2003). On obtient donc :
![]()
Concentration Maximum Acceptable (MAC) :
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées. Pour la détermination de la MAC, le document guide pour l'évaluation des effets des substances avec des rejets intermittents est utilisée (ECHA, 2008, E.C., 2009)
On dispose de données aiguës sur les trois niveaux trophiques (algues, invertébrés, poissons), la plus faible étant celle sur Carassius auratus, LC50 (96 h) = 1 mg.L-1. Par défaut, un facteur d'extrapolation de 100 s'applique pour calculer la MAC. Cependant, selon le projet de document guide technique pour la détermination des normes de qualité environnementales (E.C., 2009), pour les substances qui n'ont pas de mode d'action spécifique et pour lesquelles les données disponibles montrent que la variation interspécifique est faible, le facteur peut être diminué. Pour le 2,4-dichlorophenol, l'écart-type des valeurs de L(E)C50 est < 1 et cette variation peut être considérée comme faible. En conséquence, il est proposé de d'abaisser le facteur d'extrapolation à 10.
![]()
![]()
VALEUR GUIDE DE QUALITE POUR LE SEDIMENT (QSSED)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature.
A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que:
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
NB : La pollution actuelle peut être suivie dans les matières en suspension et les couches superficielles du sédiment. Les couches profondes intègrent la contamination historique sur des dizaines voire des centaines d'années et ne sont pas jugées pertinentes pour caractériser la pollution actuelle. Les paramètres par défaut préconisés par Lepper (2002) et le guide technique européen (E.C., 2003) ont été choisis empiriquement pour caractériser les matières en suspension et les couches superficielles. Matières en suspension et couches superficielles contiennent relativement plus d'eau et de matière organique que les couches profondes du sédiment.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (adaptation de l'équation 70 page 113 du guide technique européen, E.C., 2003) :
![]()
Avec :
RHOsup : masse volumique de la matière en suspension en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper, 2002) et le guide technique européen (équation 18 page 44, E.C., 2003) est utilisée : 1150 kg.m-3 .
Kpsusp-eau : coefficient de partage matière en suspension/eau en m 3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par Lepper, 2002) et le guide technique européen (équation 24 page 47, E.C., 2003) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.9 + 0.025 * Koc soit Kpsusp-eau = 4.025-125.9 m 3/m3 .
Ainsi, on obtient :
![]()
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec :
Fsolidesusp : fraction volumique en solide dans les matières en suspension en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 0.1 m 3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 2500 kg.m-3 .
Pour le 2,4-dichlorophénol, la concentration correspondante en poids sec est :
![]()
Le LogKow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substance dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
![]()
NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2003). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés dans le tableau 23 page 130 du guide (E.C., 2003).
Pour le 2,4-dichlorophénol, un facteur de 90 est appliqué car la durée du test retenu (NOEC à 3 mg.kg-1biota sur rat) est de 90 jours. Cette durée de test n'est pas assez élevée pour pouvoir appliquer un facteur 30. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée à une concentration dans l'eau selon la formule suivante :
![]()
Avec :
BCF: facteur de bioconcentration,
BMF : facteur de biomagnification.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biota. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biota.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biota et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le tableau 29, page 160, du guide technique européen (E.C., 2003).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biota, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le 2,4-dichlorophénol, un BCF de 69 (valeur maximale sur Cyprinus carpio (UNEP, 2006) et un BMF de 1 (cf. E.C., 2003) ont été retenus. On a donc:
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (Lepper, 2005) :
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit
- 0.1)permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles,
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle est considérée égale à 3.10-3 mg/kgcorporel/j (cf. tableau ci-dessus) = 3 µg/kgcorporel/j,
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte du fait que la substance présente des effets perturbateurs endocriniens démontrés ou potentiels pour l'homme, et des effets cancérogènes possibles,
- Cons. Journ. Moy : une consommation moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa
distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2009).
Pour le 2,4-dichlorophénol, le calcul aboutit à :
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
![]()
Pour le 2,4-dichlorophénol, on obtient donc:
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
La norme de qualité pour l'eau de boisson est calculée de la façon suivante (Lepper, 2005):
![]()
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR) ; pour cette substance elle est considérée égale à 3.10 -3 mg/kgcorporel/j (cf. tableau ci-dessus) = 3 µg/kgcorporel/j,
- une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- Fsécurité : facteur de sécurité supplémentaire de 10 pour tenir compte du fait que la substance présente des effets perturbateurs endocriniens démontrés ou potentiels pour l'homme, et des effets cancérogènes possibles,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
QSeau brute [µg.L-1] QSdw_hh [µg.L-1] = --------------------------------1 – fraction éliminée
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le 2,4-dichlorophénol, on obtient :
![]()
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
VGE/NQE Importer
PROPOSITION DE NORME DE QUALITE ENVIRONNEMENTALE (NQE)
La NQE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
![]()
Pour le 2,4-dichlorophénol, la norme de qualité pour la santé humaine via la consommation de produits de la pêche est la valeur la plus faible pour l'ensemble des approches considérées. La proposition de NQE pour le 2,4-dichlorophénol est donc la suivante :
![]()
VALEURS GUIDES POUR LE SEDIMENT
Avec un Koc de 125-5000 L.kg-1 et un Log Kow = 3.2, la mise en œuvre d'un seuil pour le sédiment peut être recommandée selon le projet de guide européen (E.C., 2009).
Le seuil proposé n'est fondé que sur la méthode du coefficient de partage à l'équilibre : il est calculé à partir de la norme de qualité dans l'eau et du Koc. L'incertitude de cette méthode devrait être prise en compte lors la mise en application du seuil sédiment
![]()
FDTE/VTR Importer On dispose d'une donnée de toxicité chronique sur microcrustacé (Daphnia magna) à partir de laquelle on peut dériver une PNEC aquatique en appliquant un facteur 10 : PNEC eau = 21 µg/L
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










