Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Hexachlorobenzène (118-74-1)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
118-74-1
Nom scientifique (FR)
Hexachlorobenzène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
204-273-9
Code SANDRE
1199
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C6Cl6 }\)
Code InChlKey
Code SMILES
Clc1c(Cl)c(Cl)c(Cl)c(Cl)c1Cl
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Mention du danger - Code | H372 |
|---|---|
| Mention du danger - Texte | Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
284.80 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer Dans l’environnement, selon le modèle de Mackay (Barber et al., cité par Euro Chlor, 2005), 48,3 % de l’hexachlorobenzène se trouve dans le compartiment air, 1,1 % dans l’eau, 26,2 % dans le sol et 24,4 % dans les sédiments. Une autre étude rapportée par le BUA (1993) et utilisant le modèle de Mackay (niveau I) révèle une répartition similaire de l’hexachlorobenzène dans l’environnement mais avec une prépondérance plus marquée pour le compartiment air (70 % dans l’air, 1,3 % dans l’eau, 14,8 % dans les sols et 13,9% dans les sédiments). Une revue sur les niveaux d’émission d’hexachlorobenzène, sa distribution et son devenir a été réalisée par Barber et al., cité par Euro Chlor (2005).
La constante de Henry de l’hexachlorobenzène est de 131Pa.mol-1.m-3. De ce fait, dans des conditions de laboratoire, Howard (1989) a mesuré une demi-vie de 8 heures pour l’hexachlorobenzène (Barber et al. cité par Euro Chlor, 2005).
Milieu eau douce
FDTE/VTR Importer Ce chapitre est sans objet du fait que l’hexachlorobenzène est peu soluble dans l’eau.
Milieu terrestre
FDTE/VTR Importer L’hexachlorobenzène a une forte affinité pour les sols. La volatilisation semble être la voie majeure pour la décontamination des sols.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
FDTE/VTR Importer Dans l’eau, il n’y a pas d’hydrolyse de l’hexachlorobenzène (HDU, 1984 cité par BUA, 1993). MacKay et al., (1992) suggèrent que la demi-vie de l’hexachlorobenzène dans l’eau est supérieure à 6 ans alors que Howard et al., (1991) prédisent une demi-vie comprise entre 2,7 et 5,7 ans (Euro Chlor, 2002). Selon Hustert et al., (1981) la demi-vie de l’hexachlorobenzène mesurée dans l’eau est comprise entre 41 et 785 jours (BUA, 1993). La variabilité des résultats obtenus est certainement liée à la très faible solubilité de l’hexachlorobenzène et à sa pression de vapeur relativement élevée.
Dans l’air, l’hexachlorobenzène se dégrade par réaction avec les radicaux hydroxyles (OH-) mais également par photolyse. La vitesse de réaction de l’hexachlorobenzène avec les radicaux OH- a été mesurée par différents auteurs. Ballschmiter (1992) calcule une vitesse de réaction de 2,0.10-12 cm3/mol/sec en utilisant un modèle QSAR (BUA, 1993). De même, Hites et al. (1997, dans Bailey, 1998, Euro Chlor, 2002) estiment une vitesse moyenne de la réaction de 2,5.10-14 cm3/mol/sec. En utilisant une concentration OH- de 5.105 radicaux/cm3, la demi-vie correspondante dans l’air est de 1,76 années. Prinn et al. (1995) suggèrent une demi-vie d’environ 1 an (Euro Chlor, 2002). Dans ce cas, la dégradation conduit à la formation de pentachlorophénol (Brown et al., 1975 cité par BUA, 1993). Mill et Haag (1986) rapportent une photolyse directe de l’hexachlorobenzène avec, dans ce cas, une demi-vie de 80 jours (Californie) beaucoup plus rapide que lorsqu’il y a réaction avec les radicaux hydroxyles (BUA, 1993)
Dans les sols, seule une très faible dégradation de l’hexachlorobenzène peut être détectée (BUA, 1993). La demi-vie estimée de l´hexachlorobenzène liée à la dégradation en aérobiose et anaérobiose est comprise entre 2,7 et 22 ans (Euro Chlor, 2002). Dans deux essais de laboratoire en parallèle, Beck et Hansen (1974) montrent que la demi-vie de l’hexachlorobenzène appliquée à une dose équivalente de 10 kg/ha est de 969 à 2 089 jours (BUA, 1993). Dans ce cas, l’absence de métabolisme tend à démontrer que le transport de l’hexachlorobenzène est la principale voie d’élimination (Müller, 1982 cité par BUA, 1993).
Milieu eau douce
FDTE/VTR Importer Dans des essais normalisés (MITI. Bouteille fermée. Test Warburg. Boue activée en aérobiose) aucune biodégradation de l’hexachlorobenzène n’a été observée sur une période allant de 5 à 28 jours (Kubota, 1979 ; Tabak et al., 1981 ; Verschueren, 1983 ; Freitag et al., 1979 ; Scheubel, 1984 ; BUA, 1993). Toutefois, en aérobiose des bactéries du genre Pseudomonas peuvent être à l’origine de la biodégradation de l’hexachlorobenzène en pentachlorophénol. Mais, dans ce cas, la dégradation reste très partielle (Haider, 1980 cité par BUA, 1993). De même, Renner (1981) rapporte que l’hexachlorobenzène peut être partiellement dégradé par différents champignons (BUA, 1993).
Milieu sédiment eau douce
FDTE/VTR Importer Un minimum de 3 à 4 % de dégradation des liaisons chlorure a été rapporté dans un milieu anaérobie où les espèces du genre Clostridium sont particulièrement actives (BUA, 1993).
Milieu terrestre
FDTE/VTR Importer Dans des sols, Isensee et al. (1976) et Beck et Hansen (1974) n’observent aucune biodégradation de l’hexachlorobenzène respectivement en 1 an et 600 jours (BUA, 1993).
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Une étude de Ramanand et al. (1993) montre que l’hexachlorobenzène subit une dégradation réductive bactérienne en pentachlorobenzène en condition méthanogène (Zitko, 2003). Ce dernier métabolite est alors dégradé en tétra, tri, di et chlorobenzène. Il est à noter que tous les isomères ne sont pas déchlorés dans ces conditions.
Chez la moule bleue (Mytilus edulis), Bauer et al. (1989) ont identifiés comme métabolites de dégradation de l’hexachlorobenzène le pentachlorothioanisol, l’acide S-(pentachlorophényl)
thioglycolique et le 1,4-bis(méthylthio)-2,3,5,6-tétrachlorobenzene (BUA, 1993).
L’hexachlorobenzène est bioaccumulable du fait notamment de sa très forte capacité d’adsorption (log Koc = 5,11) et d’un coefficient de partage n-octanol/eau (log Kow) supérieur à 3.
Les revues bibliographiques effectuées notamment par l'institut Fraunhofer (Environmental Quality Standards, 2005) et le BUA (1993) répertorient différentes valeurs de facteurs de bioconcentration (BCF) ou de bioaccumulation de l’hexachlorobenzène (BAF).
Les facteurs d’accumulation sont très variables d’un organisme à un autre ainsi que d’un essai à un autre.
Ainsi, chez les algues, alors que chez Oedogonium cardiacum le BCF est compris entre 522 et 3 969 L.kg-1, il peut atteindre 120 000 L.kg-1 chez Chlorella fusca. Il est à noter que dans ce dernier cas, les concentrations en HCB utilisées étant bien au-delà de la solubilité, l'HCB est probablement adsorbé sur la surface des algues.
La dépuration des algues peut être également rapide, ainsi, Autenrieth et De Pinto (1991) obtiennent un relargage en 48 heures de 14,6 % et 24,3 % de l’HBC accumulé respectivement chez Scenedesmus quadricauda et Cyclotella meneghiniana. De même, Laseter et al. (1976) mesurent une diminution de 90 % de la concentration en HCB dans l’algue Oedogonium cardiacum après 8 jours de dépuration.
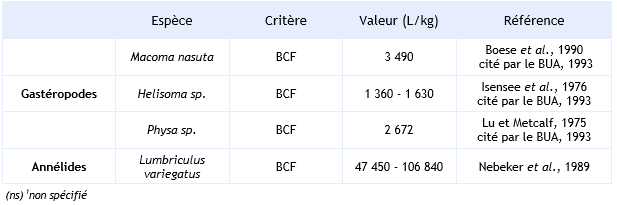
Chez les invertébrés, le BCF est compris entre 16 et 106 840 L.kg-1 selon les différents essais répertoriés. Toutefois, il peut atteindre une valeur de 5 936 000 L.kg-1, lorsqu’il se réfère uniquement aux lipides (Nebeker et al., 1989). Le BCF est sous la dépendance de la durée de l’essai, de la concentration en HCB dans le milieu, de l’espèce et de l’organe étudié. L’HCB se concentre préférentiellement dans l’hépatopancréas et dans les branchies. En eau de mer, Boese et al. (1990) montrent que l’exposition de la moule Macoma nasuta à une concentration de 2,5 µg.L-1 d’HCB induit un BCF de 3 490 L.kg-1 (BUA, 1993). Dans ce cas, la demi-vie de l’HCB liée au relargage de ce dernier est de 16 jours (BUA, 1993).
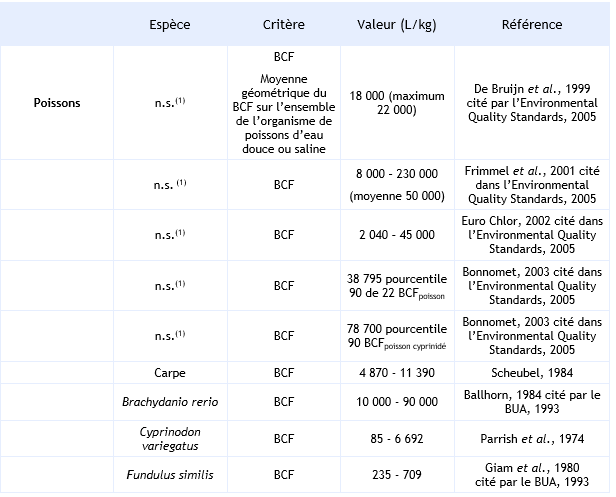
Pour les poissons, le BCF de l’HCB est compris entre 85 et 230 000 L.kg-1 avec un percentile 90 de 38 795 et 78 700 respectivement pour l’ensemble des poissons et pour les cyprinidés (Vincent Bonnomet, 2003, Environmental Quality Standards, 2005). Comme pour les invertébrés, le BCF dépend de la durée d’exposition, de la concentration en HCB, de l’espèce et de l’organe dans lequel l’HCB est dosé.
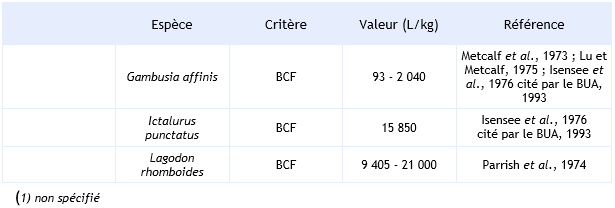
Ainsi, par exemple Parrish et al. (1974) mesurent un BCF compris entre 21 000 et 34 000 L.kg-1 dans le muscle et 39 000 et 47 000 L.kg-1 dans le foie de Lagodon rhomboides exposé durant 48 jours à des concentrations en HCB de 0,1 et 5 µg.L-1 et après 28 jours de recouvrement en absence d’HCB.
Les facteurs de bioaccumulation sont très variables d’une mesure à une autre et sont du même ordre de grandeur que les facteurs de bioconcentration. Ainsi, à partir d’essais effectués sur le Lepomis macrochirus, Laseter et al. (1976) montrent que le niveau de contamination des poissons par la voie trophique est très inférieur à celui engendré par l’eau.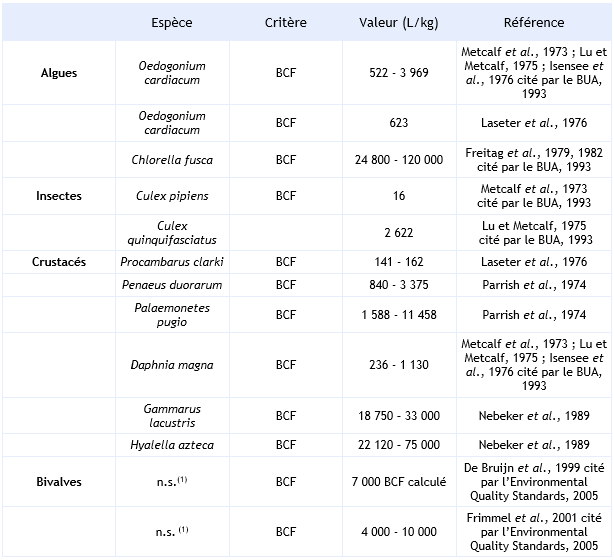
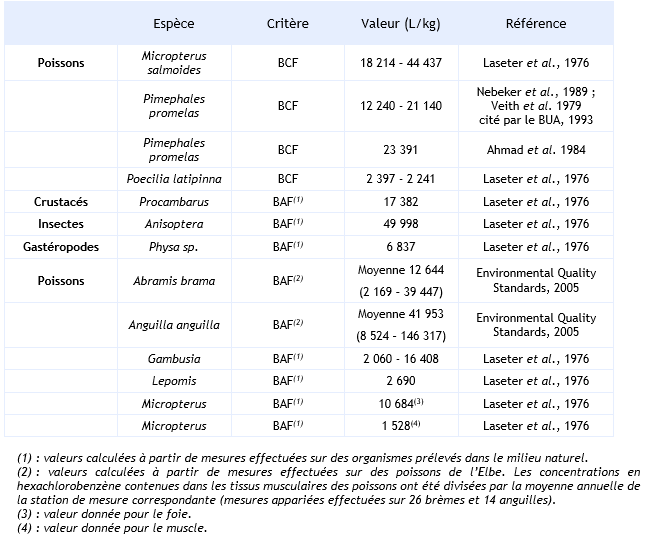
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Selon le rapport Euro Chlor (2002), les espèces supérieures comme les oiseaux ou les mammifères peuvent métaboliser et excréter l’hexachlorobenzène. Par exemple, Braune et Norstrom (1989) dans une étude de terrain sur la concentration dans le corps de goélands argentés (Larus argentatus) calculent un facteur de biomagnification de 31 (ensemble du corps, poids humide). Il a été proposé que pour une faible exposition continue le BCF pour des animaux à sang chaud est probablement compris entre 1 et 10 et peut être inférieur à 1 dans de nombreux cas. Ainsi, Avrahami et Steele (1972) montrent que l’exposition de poules pondeuses à l’hexachlorobenzène par voie trophique (0,1-100 mg.kg-1) induit une accumulation dans les tissus adipeux d’un facteur 21 à 31 après 6 mois (BUA, 1993). La concentration dans les œufs après 6 mois d’exposition était 4,5 à 6,5 fois supérieure à celle de la nourriture (BUA, 1993). De même, Vos et al. (1972) montrent que la concentration en hexachlorobenzène dans le corps de goélands argentés peut être 10,5 fois supérieure à la concentration en hexachlorobenzène de la nourriture.
Toutefois, selon le rapport Euro Chlor (2002), un rapport de l’EPA Suédois (Swedish Environmental Protection Agency) sur les POPs (1998) et Muir et al. (1992), indiquent que les oiseaux et les mammifères ne semblent pas accumuler l’hexachlorobenzène. Cette remarque est cohérente avec les travaux de Vos et al. (1971) qui montrent que la concentration en hexachlorobenzène dans le foie et le cerveau de cailles est 0,20 à 2,32 fois supérieure à celle de la nourriture après 90 jours d’exposition
Selon le rapport du BUA (1993), l’hexachlorobenzène est métabolisé chez les organismes à sang chaud très lentement et en très faible proportion. Ce métabolisme conduit selon Debets et Strick (1979) à la formation de :
- dérivés benzéniques moins chlorés par déchloration,
- dérivés phénols plus ou moins chlorés, notamment les hydroquinones chlorés et les quinones par adjonction de groupements OH. Ces substances, très réactives, peuvent être conjuguées par le glutathion ou par des liaisons covalentes aux protéines ou à l’ADN (Van Ommen et van Bladeren, 1989),
- thiophénols et de substances dérivées après conjugaison avec le glutathion.
Dans les plantes supérieures, les essais de Schroll et Scheunert (1992) ne rapportent qu’un faible taux de bioaccumulation. Ainsi, après une exposition de 7 jours dans un sol contenant 1 mg d’hexachlorobenzène par kg de matière sèche, le facteur d’accumulation (BAF) est compris entre 0,8 et 31,6 en fonction de l’organe (racine ou feuille) et de l’espèce
(BUA, 1993).
Les résultats des essais de Schroll et Scheunert (1992) sont regroupés dans le tableau ci-dessous :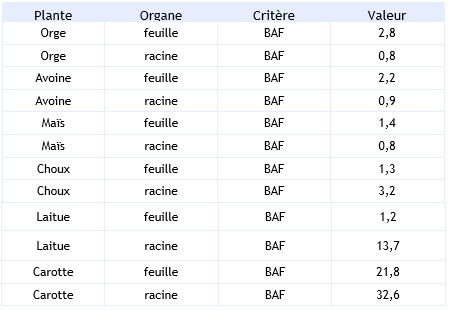
Conclusion sur la bioaccumulation
FDTE/VTR Importer De part ses propriétés physico-chimiques, l’HCB peut s’accumuler dans de très grandes variétés d’organismes vivants.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2015 ; IARC, 2001 ; et OMS-IPCS, 1997 ; NTP, 2021). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation
Du fait de sa faible volatilité, l’exposition par inhalation est généralement faible. Toutefois, il peut être inhalé sous forme de vapeurs et de fines particules présentes à proximité des sites industriels de production de solvants chlorés. Son absorption, peu documentée chez l’humain, a indirectement été décrite à partir des concentrations sanguines moyennes de 39,8 ng.mL-1 (versus 4,13 ng.mL-1 dans la population témoin barcelonaise, n=100) rapportées sur une population de 600 riverains résidant à proximité. d’une usine électrochimique de production de solvants organochlorés à Flix, en Espagne. (Grimalt et al., 1994, Herrero et al., 1999, Sala et al., 1999, To-Figueras et al., 1997 ; Sunyer et al., 2002, 2008). Les concentrations sanguines ont atteint en moyenne de 93,4 ng.mL-1 chez les 185 résidents également salariés de l’usine, mais une exposition concomitante par voie cutanée ne peut être totalement exclue.
Plusieurs autres études réalisées en milieu professionnel (usines d’incinération, usines chimiques de production de tétrachlorure de carbone et de tétrachloroéthylène) rapportent également une augmentation des concentrations sanguines d’HCB chez les salariés, où l’exposition par inhalation semble avoir largement contribué à l’absorption d’HCB (ATSDR, 2015).
Voie orale
L’alimentation, en particulier les aliments riches en graisses favorisant sa solubilisation du fait de sa lipophilie représente l’une des principales causes d’exposition à l’HCB par voie orale. Un taux d’absorption de 70 à 82 % est rapporté dans une étude réalisée sur 4 volontaires sains âgés de 24 à 36 ans, mais diminue fortement avec l’âge (Schlummer et al., 1998). Ce taux d’absorption diminue également proportionnellement en fonction de la concentration sanguine d’HCB (de 0,2 % pour l’augmentation d’1 ng d’HCB par gramme de lipide dans le sang).
Voie cutanée
Aucune donnée relative à l’absorption cutanée de l’HCB n’a été identifiée chez l’humain.
Distribution
FDTE/VTR Importer Plusieurs études rapportent des augmentations de la concentration sanguine HCB après exposition par inhalation chez les résidents vivants à proximité d’usines polluantes, décrites précédemment (Sala et al., 1999, To-Figueras et al., 1997 ; Sunyer et al., 2002, 2008). De fortes concentrations ont été également mesurées dans le foie, la moelle osseuse, le cerveau et plus largement dans tous les tissus adipeux du fait de sa lipophilie (ATSDR, 2015). Il possède une demi-vie longue comprise entre 4 et 8 ans (To-Figueras, et al., 2000). Le facteur de bioconcentration de l’HCB chez l’homme est estimé à 320 (IARC, 2001).
L’HCB franchit la barrière placentaire et est retrouvé chez le fœtus. Par ailleurs, du fait de ses propriétés lipophiles, son excrétion dans le lait maternel est facilitée.
Plusieurs études rapportent des corrélations linéaires significatives entre les concentrations dans le placenta, le cordon ombilical, et le lait maternel chez des femmes enceintes (36) exposées par ingestion au Japon (Ando et al., 1985), ou entre le sang maternel et le cordon ombilical de jeunes femmes de la région de Flix (Espagne) exposées par inhalation, à la fois chez les populations fortement exposées (proche de l’usine) et chez les populations moins exposées (villages environnants) (Sala et al., 2001a ; Ribas-Fitó et al. 2003a, 2003b, 2007; Sunyer et al. 2002, 2008). Les moyennes géométriques d’HCB pour les femmes les plus exposées étaient de 3,98 ng.mL-1 (0,50-20,78 mL) et 1,40 ng.mL-1 (0,30-5,77 ng.mL-1) respectivement dans le sang maternel et du cordon ombilical et chez les populations plus éloignées de 2,51 ng.mL-1 (0,36 – 7,46 ng.mL-1) et 0,85 ng.mL-1 (0,13 - 2,45 ng.mL-1) respectivement dans le sang maternel et dans le cordon ombilical. Des données similaires ont été recueillies dans les zones contaminées de la mer d’Aral en Ouzbékistan, avec des concentrations sanguines d’HCB dans le sang maternel et le cordon ombilical respectivement en moyenne de 0,167 ng.mL-1 (0,072–9,92 ng.mL-1) and 0,07 ng.mL-1 (0,025–1,3 ng.mL-1) et la contamination de 93 % des échantillons de lait maternel (28 ng.g-1 lipides (range 10–109 ng.L-1) (Ataniyazova et al., 2001).
De nombreuses études rapportent le passage de l’HCB dans le lait maternel lors d’exposition par voie orale (Craan et Haines, 1998, Czaja et al., 1997, Gladen et al., 1999, Gocmen et al., 1989, Lunden et Noren, 1998, Newsome et Ryan, 1999). Chez les mères de la population espagnole décrite ci-dessus, exposée par inhalation, la concentration moyenne d’HCB mesurée dans le colostrum est élévée (0,90 µg.g-1 de lipides), alors que les concentrations d’HCB dans le lait maternel sont généralement inférieures au ng par gramme de lipide dans la population générale (ATSDR, 2015). Il s’agit d’une concentration très élevée (Ribas-Fitäo et al., 2003).
Métabolisme
FDTE/VTR Importer Les métabolites sanguins identifiés chez des enfants de 4 ans exposés à l’HCB atmosphérique sont principalement le pentachlorophénol, et dans une moindre mesure le pentachlorobenzène (Carrizo et al., 2008). Outre le pentachlorophénol, To-Figueras et al. identifie le pentachlorobenzènethiol comme métabolite urinaire majoritaire de l’HCB chez les adultes avec des concentrations sanguines d’HCB comprises entre 1,1 et 953 ng.mL-1 (To-Figueras et al., 1992, 1997).
Élimination
FDTE/VTR Importer Quelle que soit la voie d’absorption, l’HCB non métabolisé est éliminé majoritairement par voie fécale. To-Figueras et al. (2000) estiment une élimination de 4 à 6,4 % de la quantité totale d’HCB sanguin par cette voie. L’élimination des métabolites se fait par voie urinaire avec des demi-vies longues (de 4 à 8 ans) (ATSDR, 2015).
A notre connaissance, il n’existe pas de donnée spécifique à une exposition par voie cutanée.
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation
Aucune donnée relative à l’absorption par inhalation n’a été identifiée chez l’animal.
Voie orale
Par voie orale, l’absorption digestive dépend fortement du solvant de dilution de l’HCB. Chez le rat, le taux d’absorption de l’HCB dans l’huile d’olive est d’environ 80 %, alors qu’il varie selon la dose ingérée de 20 % (16 mg.kg-1) à moins de 5 % (120 mg.kg-1) en solution aqueuse (Koss et Koransky (1975)). D’autres auteurs confirment ces résultats et proposent un taux d’absorption de 72 à 82 % (3 jours après administration d’HCB aux doses de 12 ou 30 mg.kg-1 dans l’huile de graine de cotonnier) chez le rat mâle CD (Albro et Thomas, 1974) ou encore chez le chien (10 à 100 mg.kg-1 dans l’huile de maïs) (Sundlof et al., 1982).
Voie cutanée
L’absorption cutanée cumulée d’HCB est de 1,05 % après 6 heures d’exposition, de 2,67 % après 24 h et de 9,71 % après 72 heures chez des rats exposés à une dose de 2,5 mg.kg-1 (pansement occlusif) (Koizumi (1991).
Distribution
FDTE/VTR Importer Chez le rat, l’HCB administré par voie orale (0,4 mg.kg-1 d’HCB radiomarqué en solution dans de l’huile d’arachide) est rapidement distribué dans l’organisme et préférentiellement. dans les graisses ou les organes riches en graisses en raison de sa nature lipophile (Ingebrigtsen et Nafstad,1983). En dehors des graisses, les tissus présentant la plus forte radioactivité étaient la peau, la moelle osseuse, la glande de Harder, la muqueuse nasale, la glande préputiale et le tractus intestinal. Pour des expositions répétées de 0,5 à 32 mg.kg-1 pendant 15 semaines, les concentrations tissulaires, ayant atteind un d’état d’équilibre, se stabilisent à partir de la 8e semaine (Kuiper-Goodman et al., 1977). Chez le chien, des niveaux élevés d’HCB, 5 à 10 fois supérieurs à celui du foie, sont mesurés au niveau de la peau, des glandes surrénales et de la glande thyroïde (Sundlof et al., 1982). Les dosages dans les reins, le cœur, le cerveau, la rate, le pancréas et les muscles étaient comparables à ceux du foie.
Par voie orale, plusieurs études ont montré que les niveaux d’HCB mesurés dans les différents tissus augmentaient de manière dose-dépendante pour des doses jusqu’à 100 mg.kg-1.j-1 chez le rat (Foster et al., 1995b), chez le chien (Sundlof et al., 1982) et chez le singe (Jarrell et al. 1993).
Les études réalisées par voie orale confirment le passage placentaire de l’HCB chez la souris (Courtney et al., 1976, Courtney et Andrews, 1985), chez le rat (Courtney et al., 1979, Nakashima et al., 1997, Villeneuve et Hierlihy, 1975) et chez le lapin (Villeneuve et al., 1974).
Métabolisme
FDTE/VTR Importer Par voie orale, l’HCB est métabolisé très lentement en pentachlorophénol par les cytochromes P450 hépatiques (notamment par les isoformes CYP3A1, CYP3A2, CYP3A4) (Den Besten et al., 1994, Mehmood et al., 1996, Schielen et al., 1995) puis est transformé en tétrachlorohydroquinone (Mehmood et al., 1996, Van Ommen et Van Bladeren, 1989). Chez des rates exposées à des doses de 0,03 à 25 mg.kg-1.j-1 d’HCB pendant 13 semaines une augmentation au niveau hépatique des activités de l’acétanilide-4-hydroxylase (A4H), de la pento xyrésorufine-O-déethylase (PROD) et de la 7-éthoxyrésorufine-O-déethylase (EROD), correspondant respectivement à l’induction des CYP1A2, CYP2B et CYP1A1 a été montrée (NTP, 2021). Ces résultats confirment que l’HCB est un inducteur de son propre métabolisme. Cette induction mixte est au moins en partie sous la dépendance du récepteur Ah, auquel l’HCB peut se fixer, mais aussi du récepteur CAR (constitutive androstane receptor) (Hahn et al., 1989 ; Gustafson et al., 2000). Le rôle déterminant de la présence des récepteurs Ah dans le métabolisme de l’HCB a été montré chez des souris (Han et al., 1986).
L’HCB peut également être conjugué avec le glutathion pour former le pentachlorothiophénol ou subir une déchloration réductive pour former le pentachlorobenzène (Koss et al., 1979, Renner, 1988). Les autres métabolites formés correspondent à des dérivés du benzène moins chlorés, des chlorophénols, des phénols S-conjugués et des benzènes (Den Besten et al., 1994, Koss et al., 1986).
Les métabolites urinaires majoritaires sont le pentachlorophénol, le pentachlorobenzène, le tétrachlorobenzène, et le pentachlorothiophénol. Les autres métabolites urinaires notables sont la tétrachlorohydroquinone, le 2,4,5-trichlorophénol et les 2,3,4,6- et 2,3,5,6-tétrachlorophénols. Les 2,4,6 et 2,3,4-trichlorophénols et les autres tétrachlorophénols sont présents à l’état de traces. Les principales voies métaboliques et métabolites de l’HCB sont présentés dans la figure suivante (ATSDR, 2015) :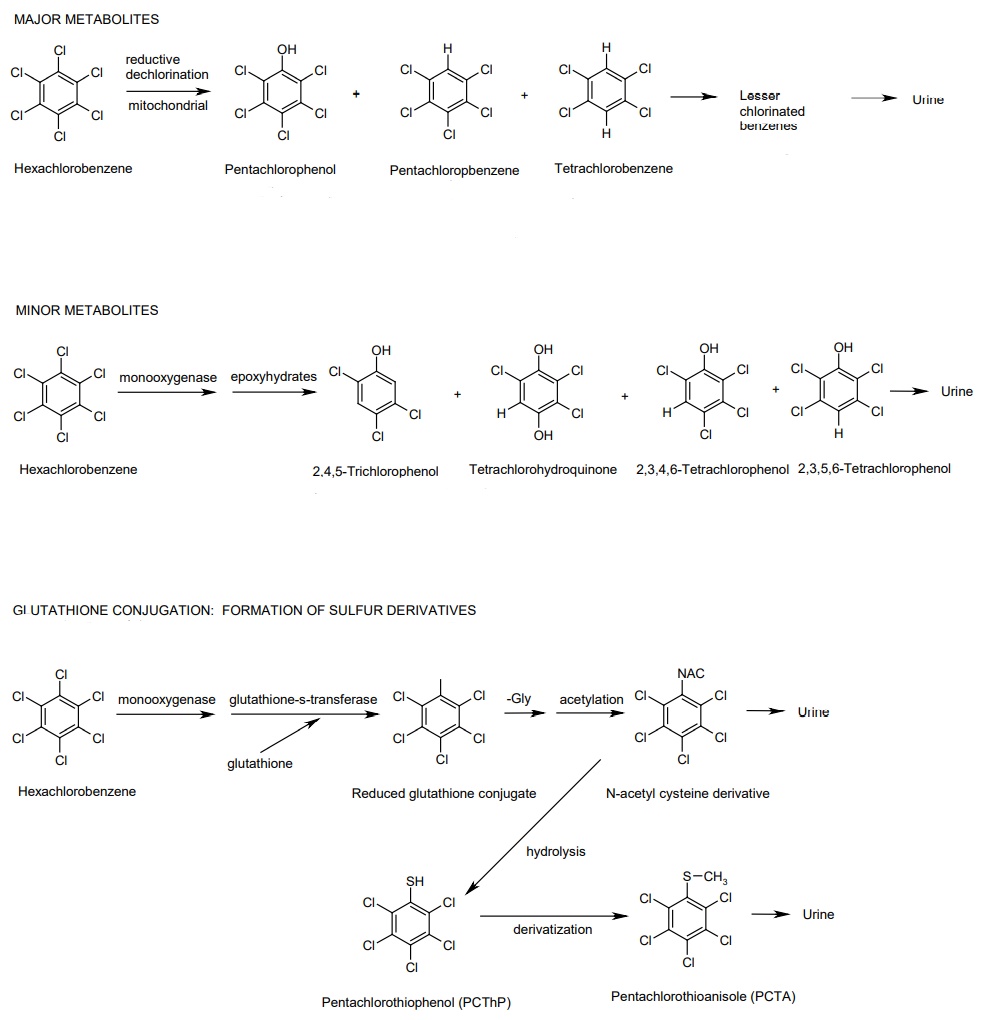
Élimination
FDTE/VTR Importer L’HCB non métabolisé est excrété dans les fèces. Les métabolites sont excrétés soit sous forme conjuguée soit sous forme libre dans les urines (Mehendale et al., 1975, Engst, et al., 1976, Koss et al., 1976, Renner et Schuster, 1977).
Chez les animaux exposés par voie orale, l’élimination de l’hexachlochlorobenzène via le lait maternel est non négligeable (Courtney et Andrews, 1985 ; Nakashima et al., 1997 ; Nakashima et Ikegami, 2000).
Bien que la demi-vie biologique n’ait pas pu être précisément quantifiée, les chercheurs ont observé une diminution progressive de la vitesse d’élimination de l’HCB qui pourrait s’étendre sur plusieurs années (ATSDR, 2015). La demi-vie d’élimination sanguine se situerait entre 53 et 48 jours chez le rat pour des expositions respectives de 0,03 et 25 mg.kg-1.j-1 pendant 3 mois (NTP, 2021).
Autre
FDTE/VTR Importer Mécanisme d'action
L’HCB interfère avec le métabolisme de l’hème, c’est un inducteur de l’acide aminolévulinique synthase (l’ALA-S) et un inhibiteur de l’uroporphyrinogène décarboxylase (UROD) (Starek-Swiechowicz et al., 2017) qui conduit à une augmentation des porphyrines, produits intermédiaires de la synthèse de l’hème dans l’organisme. L’ALA-S contrôle le taux des précurseurs de l’hème, et l’UROD converti l’uroporphyrinogène III en coproporphyrinogène, produits intermédiaires de la synthèse de l’héme.
Modèles pharmacocinétiques basés sur la physiologie
Des modèles PBPK pour l’hexachlorobenzène ont été développés par Yesair et al. (1986), Freeman et al. (1989), et Lu et coll. (2006) (ATSDR, 2015). Seuls les deux derniers modèles ont été développés à partir de données expérimentales chez le rat par voie orale. Le modèle de Lu et al. (2006) a été validé pour les études pharmacocinétiques réalisées à de fortes doses, mais non pour les études réalisées par voie orale à de plus faibles doses telle que celle de Kuiper-Goodman et al., (1977) (Aylward et al., 2010).
Synthèse
FDTE/VTR Importer Chez l’homme, l’HCB est majoritairement absorbé par voie orale, mais aussi par inhalation au cours d’épisodes de pollution environnementale et/ou d’exposition professionnelle. Etant très lipophile, sa distribution est privilégiée vers les tissus riches en graisse, passe dans le lait maternel et franchit la barrière placentaire. Les principaux métabolites identifiés chez l’humain sont le pentachlorophénol, l’hexachlorophénol et le pentachlorobenzènethiol. L’HCB non métabolisé est éliminé par voie fécale mais uniquement après une exposition orale, alors que les métabolites sont éliminés par voie urinaire avec des demi-vies longues.
Chez l’animal, l’HCB est largement absorbé par voie orale et plus faiblement par voie cutanée. En raison de ses propriétés lipophiles, l’HCB s’accumule dans tissus riches en graisses. Il traverse la barrière placentaire et son passage dans le lait maternel est largement facilité. L’HCB est inducteur de son propre métabolisme impliquant la liaison au récepteur Ah, il est majoritairement métabolisé dans le foie par l’intermédiaire des cytochromes P450 pour conduire à la formation de nombreux métabolites, dont le pentachlorophénol, le pentachlorobenzène, le tétrachlorobenzène. Ils sont éliminés dans les urines sous forme libre ou conjuguée, alors que l’HCB non métabolisé est éliminé dans les fèces.
Equivalents biosurveillance
Description
FDTE/VTR Importer VBI issues de la population générale adulte
HCB sérique:
< 73 ng.g-1. de lipides (< 0,53 µg.L-1) (95ème percentile)
< 0,65 µg.L-1 chez les femmes (95ème percentile)
et < 0,3 µg.L-1 chez les hommes (95ème percentile)
Pentachlophénol urinaire:
< 3,3 µg.g-1 de créatinine (< 2,9 µg.L-1) (95ème percentile)
Toxicité aiguë
Généralités
FDTE/VTR Importer A notre connaissance, il n’existe pas de données chez l’homme pour des expositions par inhalation et par voie orale.
Chez l'homme
Synthèse
FDTE/VTR Importer Les effets de l’exposition aiguë à l’HCB ne sont pas documentés chez l’humain.
Chez l'animal
Inhalation
FDTE/VTR Importer Seule une étude chez le rat rapporte une légère altération des cellules pulmonaires de la défense immunitaire (baisse de l’activité bactéricide et augmentation de l’activité phagocytaire des macrophages alvéolaires) pour une exposition à 33 mg.m-3, 4 h/j pendant 4 jours (Sherwood et al., 1989). Une NOAEL de 4,4 mg.m-3 a été retenue.
Voie orale
FDTE/VTR Importer L’HCB présente une faible toxicité aiguë par voie orale avec des DL50 comprises entre 3 500 et 10 000 mg.kg-1 chez le rat, de 4 000 mg.kg-1 chez la souris, 2 600 mg.kg-1 chez le lapin et 1 700 mg.kg-1 chez le chat (Savitskii, 1965, Booth et Mc Dowell, 1975). Un rat (sur 10 exposés) est mort après administration unique par gavage d’une dose de 600 mg.kg-1 d’HCB dans l’huile de maïs (Lecavalier et al., 1994).
Lors d’expositions aiguës par voie orale chez le rat, les principaux effets observés correspondent au niveau hépatique à uneaugmentation des porphyries et altérations enzymatiques (augmentation de l’activité de l’acide aminolévulinique synthase (ALA-S), de l’ornithine décarboxylase et du poids du foie) (NOAEL de 5 mg.kg-1.j-1 pour une exposition d’une semaine chez le rat) (Billi de Catabbi et al., 2000a ; Goldstein et al., 1978 ; Kennedy et Wigfield, 1990 ; Kitchin et Brown, 1989 ; Krishnan et al., 1991 ; Michielsen et al., 2001), ou rénales (augmentation du poids du rein, dégénérescence et régénérescence focalisées au niveau des tubules, accumulation de protéines localisées dans les cellules tubulaires) (LOAEL de 100 mg.kg-1.j-1 pour une exposition de deux semaines chez le rat) (Bouthillier et al., 1991), neurologiques (faiblesse progressive et tremblements) (LOAEL de 50,8 mg.kg-1.j-1 pour une exposition de deux semaines chez le rat) (Michielsen et al., 2001) et endocrines (diminution de la thyroxine sérique) (Foster et al., 1993 ; Kleiman de Pisarev et al., 1990 ; van Raaij et al., 1993a). Des lésions cutanées secondaires aux troubles du métabolisme (au niveau de la tête et du coup) sont visibles chez le rat à partir du 10e jour d’exposition (LOAEL de 50,8 mg.kg-1.j-1 pour une exposition de deux semaines chez le rat) (Michielsen et al., 2001).
Voie cutanée
FDTE/VTR Importer Aucune donnée n’a été identifiée.
Synthèse
FDTE/VTR Importer Chez l’animal, les principaux effets observés lors d’une exposition par voie orale sont des altérations hépatiques (trouble du métabolisme des porphyrines), rénales, neurologiques et hormonales (diminution de la thyroxine sérique). Les deux autres voies d’exposition (inhalation et cutanée) sont trop peu documentées.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer Les effets systémiques liés à l’exposition chronique d’HCB par inhalation ont été recherchés dans des études réalisées sur une cohorte de 1 800 résidents vivants à proximité d’une usine électrochimique d’organo-chlorés à Flix, en Espagne (Sala et al., 1999 ; Sala et al., 2001 ; Sunyer et al., 2002). L’exposition a été caractérisée à la fois dans l’air ambiant (35 ng.m-3 sur 24 h) et les milieux biologiques de 604 résidents incluant 185 salariés de l’entreprise. Les concentrations sanguines sont très élevées chez les ouvriers de l’usine (moyenne géométrique de 54,6 µg.L-1) et basses chez ceux qui n’ont jamais travaillé à l’usine (femmes : 14,9 µg.L-1 ; hommes : 9,0 µg.L-1). Ces études n’ont globalement pas mis en évidence d’effets sur la prévalence de pathologies attendues aussi bien au niveau de la peau (porphyrie cutanée tardive), de la thyroïde (taux circulants de TSH (thyroid stimulating hormone), T4 (thyroxine), goitre, hypothyroïdisme), du système nerveux (maladie de Parkinson), en particulier chez les salariés présentant des concentrations sanguines d’HCB cinq fois supérieures à celles des résidents plus faiblement exposés. Seule une corrélation positive, statistiquement significative, entre l’activité sérique de la gamma-glutamyl transpeptidase et la concentration sanguine d’HCB a été décrite chez les travailleurs les plus exposés. Aucune corrélation n’a été observée avec les autres enzymes hépatiques (alanine aminotransférase (ALAT), aspartate aminotransférase (ASAT)), ni même avec les concentrations de porphyrines urinaires.
Au Brésil, une augmentation des IgG (p<0,05) et des IgM (p < 0,01) a été observée chez 52 salariés exposés à l’HCB utilisé comme sous-produit dans l’industrie chimique (concentration sanguine moyenne HCB de 38,4 µg.L-1 (1 - 160 µg.L-1)). Le groupe témoin est constitué de sujets non exposés apparié en âge et en sexe. Les concentrations en IgM sont corrélées positivement avec la durée de l’exposition (r = 0,367), avec les activités de l’ASAT (r = 0,367) et de l’ALAT (r = 0,507) (Queiroz et al., 1998a).
Toujours en milieu professionnel, une étude menée sur 9 travailleurs de l’industrie de l’aluminium a montré une augmentation faible, mais statistiquement significative, des porphyrines urinaires pour des expositions comprises entre 1 et 19 ans à de l’HCB et à d’autres composés organochlorés (Selden et al., 1999).
Les troubles métaboliques de personnes vivant à proximité d’une usine de production d’HCB mais non-exposées professionnellement (concentrations sanguines d’HCB de 3,6 µg.L-1) se sont limitées à une augmentation anormalement élevées des concentrations plasmatiques en coproporphyrines (Burns et Miller, 1975).
Voie orale
FDTE/VTR Importer Une épidémie correspondant à 4 000 cas de porphyrie cutanée tardive (trouble du métabolisme des porphyrines entraînant la survenue d’éruptions cutanées bulleuses sur les parties exposées à la lumière) est décrite en Turquie entre 1955 et 1959 suite à la consommation de céréales traitées avec de l’HCB. L’intoxication d’HCB a été estimée entre 50 et 200 mg.j-1 pendant plusieurs mois avant l’apparition des symptômes (Peters et al., 1966 ; Mazzei et Mazzei, 1973 ; Peters, 1976 ; Peters et al., 1978). La majorité des patients étaient des enfants, essentiellement des garçons âgés de 4 à 14 ans (Cam et Nigogosyan, 1963). Un taux de mortalité de 14 % a été mesuré pendant plusieurs années (Peters et al., 1966, 1978). Les symptômes le plus souvent cités sont la formation de vésicules cutanées de grande taille au niveau des zones cutanées exposées au soleil, une hyperpigmentation, une hypertrichose et une porphyrinurie. Chez les jeunes enfants (avant l’âge de 4 ans), la porphyrie est rarement rapportée. En revanche, la mortalité néonatale et les autres effets sévères décrits chez les enfants exposés in utero et/ou du fait de l’allaitement sont décrits dans le paragraphe dédié aux effets sur le développement.
Le suivi de 204 patients issus de cette même population montre la persistance de troubles neurologiques (faiblesse, paresthésie, névrite, myotonie) et des lésions cutanées importantes liées aux vésicules initiales, une hyperpigmentation et de l’hirsutisme. Lorsque les expositions ont débuté au cours de l’enfance, on observe chez les patients une stature et des mains de petite taille et une arthrite indolore. Une hypertrophie de la thyroïde est rapportée chez 25 % des hommes et 60 % des femmes exposées (5 % chez les non exposés) (Cripps et al., 1984 ; Peters et al., 1986). Ces résultats ont été confirmés par une étude réalisée chez 252 personnes issues de la même population (Gocmen et al., 1989).
Dans une étude transversale réalisée sur une cohorte de 1 016 personnes âgées de 70 ans, la concentration sanguine d’HCB a été significativement associée à une hypertrophie ventriculaire gauche, ainsi qu’à l’augmentation de la paroi du ventricule gauche, y compris après ajustement pour le sexe, la pression artérielle, le traitement antihypertenseur, le diabète et l’IMC (P <0,0001) (Sjöberg Lind et al., 2013).
Voie cutanée
FDTE/VTR Importer Nous ne disposons pas de données pour des expositions par voie cutanée.
Synthèse
FDTE/VTR Importer Chez l’homme, l’HCB induit des effets sur la peau (porphyrie cutanée tardive), sur le système nerveux (troubles neurologiques persistants du type paresthésie, névrite, myotonie, ...) et au niveau de la thyroïde (hypertrophie). Des anomalies du métabolisme des porphyrines au niveau du foie et de leur excrétion dans les urines sont rapportées, de même que des effets sur les taux d’anticorps (IgM, IgG).
Chez l'animal
Inhalation
FDTE/VTR Importer Nous ne disposons pas de données pour des expositions par inhalation.
Voie orale
FDTE/VTR Importer De nombreuses données animales permettent d’identifier le foie, en particulier lié aux troubles de la biosynthèse de l’hème souvent associé à un stress oxydant, comme organe cible de la toxicité d’HCB par voie orale (ATSDR, 2015).
Lors d’expositions subchroniques (4 mois) à l’HCB (pureté 93 à 95 %) à des concentrations de 1 000 mg.kg pc-1 une hypertrophie et une nécrose hépatocellulaire, ainsi qu’une porphyrie sont rapportées. Les taux de survie sont de 70 % et 5 % chez les mâles et les femelles respectivement (Kimbrough et Linder, 1974). Dans une autre étude, des rats nourris avec 0,3 % d’HCB pendant 8 semaines présentent une excrétion urinaire d’acide d-aminolévulinique (ALA), de coproporphyrines et d’uroporphyrines augmentée respectivement de 2,4 - 3,3 - 3,8 fois par rapport au témoin. Au niveau hépatique, les activités de la d-aminolévulinate synthétase sont augmentées et les activités de la d-aminolévulinate déshydrogénase et de l’uroporphyrinogène décarboxylase sont diminuées (Kondo et Shimizu, 1986). Chez le rat, l’exposition à des doses de 0,03 – 0,1 – 0,3 - 1 – 3 - 10 -25 mg.kg-1.j-1 d’HCB pendant 13 semaines a été suivie au niveau hépatique, par une augmentation significative du poids relatif et absolu du foie (25 mg.kg-1.j-1, p<°0,01), ainsi qu’à partir de la 14e semaine de traitement par l’augmentation des activité de l’acétanilide-4-hydroxylase (A4H) et de la pentoxyrésorufine-O-déethylase (PROD) à toutes les doses (p<0,01) et de la 7-éthoxyrésorufine-O-déethylase (EROD) à partir de 0,3 mg.kg-1.j-1. Une hypertrophie hépatocytaire significative est rapportée aux deux plus fortes doses (NTP, 2021).
D’autres études chez le rat confirment ces résultats pour des expositions chroniques à des doses d’HCB comprises entre 50 et 1 000 mg.kg pc-1 (Koss et al., 1978 ; Rios de Molina et al., 1980 ; Krishnan et al., 1991). Dans tous les cas, une porphyrie est décrite. Elle est associée à une inhibition de l’UROD (Doss et al ; 1976. Kuiper-Goodman et al., 1977). Enfin, chez le rat exposé à des doses de 200 mg.kg-1 via la nourriture pendant 4 à 29 semaines, certaines femelles présentent une élévation de l’activité des gamma-glutamyl transpeptidases (gamma-GT) dans la région périportale. Cet effet n’est observé qu’au bout de 90 semaines chez le mâle (Manson et Smith, 1984).
Des lésions hépatiques ont également été rapportées dans une étude où les rats de première génération F1 ont été exposés pendant 130 semaines à partir du sevrage via l’alimentation à des doses de 0 – 0,32 – 1,6 – 8,0 – 40 ppm (soit 0 – 0,022 – 0,11 – 0,22 – 1,1 mg.kg-1.j-1) d’HCB (étude de cancérogénèse décrite au paragraphe 3.3.2.2) (Arnold et al., 1985 ; Arnold et Krewski, 1988). Les auteurs rapportent chez les deux sexes une hyperpigmentation (chromogenèse basophile centrilobulaire) hépatique à partir de 8 ppm (relation dose-réponse, p<0,01), une péliose hépatique chez les femelles à toutes les doses (y compris dans le groupe témoin), et chez les mâles une augmentation significative de l'incidence de la déplétion du glycogène périportal à 1,6 ppm (p<0,05), de la lymphocytose péribiliaire à 0,32 - 1,6 et 40 ppm (p<0,05) et de la fibrose péribiliaire à 0,32 et 40 ppm (p<0,05). Ces effets ont été considérés par l’ATSDR comme des « effets minimes ». A noter que les incidences de la lymphocytose et de la fibrose péribiliaire sont des lésions spontanées fréquentes chez les rats âgés, survenant chez environ 30 % des témoins de cette étude.
Des atteintes sévères du système nerveux, telles que des convulsions, des tremblements, une léthargie, et une faiblesse progressive ont été décrits aussi bien chez le rat, la souris, le lapin, le cochon ou le singe, en association le plus souvent avec une mortalité (ATSDR, 2015). Des souris exposées à des doses de 26 mg.kg-1.j-1 d’HCB pendant 17 semaines présentent des tremblements sévères avant de mourir (Hahn et al., 1988). Des fibrillations, des décharges répétitives ou pseudomyotoniques et une vitesse de conduction réduite sont observées au niveau du nerf sciatique chez des rats ayant ingéré des doses de 40 mg.kg-1.j-1 d’HCB pendant 20 semaines ou de 3,75 mg.kg-1.j-1 pendant 2 ans (Sufit et al., 1986). Des effets plus sensibles, tels que l’augmentation du seuil auditif (fréquence de 2 et 16 Hz), sont rapportés chez des rats mâles exposés pendant 4 semaines à des doses de 4 ou 16 mg.kg-1.j-1 (NOAEL de 0,16 mg.kg-1.j-1) (Hadjab et al., 2004).
Des hamsters Syriens mâles ont été exposés à l’HCB via la nourriture à des doses de 100 mg.kg-1 pendant 28 semaines, 200 mg.kg-1 pendant 18 ou 28 semaines ou 500 mg.kg-1 pendant 6 semaines. Chez tous les animaux exposés, une augmentation de la taille de la thyroïde d’un facteur 2,5 à 3 est rapportée ; elle semble correspondre à un élargissement de certains follicules. Les concentrations en thyroxine (T4) ne sont pas altérées. En revanche, celles en triiodothyronine (T3) sont diminuées de plus de 60 % (Smith et al., 1986,1987).
Dans une autre étude, les femelles Wistar sont exposées pendant 8 semaines à des doses quotidiennes de 1 g.kg pc-1d’HCB par gavage. Les concentrations en T4 sont diminuées ainsi que les protéines liées à l’iode. Les concentrations en T3 ne sont pas altérées significativement. A la fin de l’exposition, les rats présentent une porphyrie (Kleiman de Pisarev et al., 1990). Des résultats comparables (baisse des concentrations de T4 uniquement, pas d’effet sur les concentrations de T3 et de TSH) ont également été rapportés chez des femelles Sprague-Dawley exposées pendant 45 jours à une dose de 500 mg.kg.j-1 d’HCB par gavage (Castilla et al., 2018). A des doses plus faibles de 4 et 16 mg.kg-1.j-1 d’HCB administrées par gavage pendant 28 jours toujours chez le rat, les auteurs ont mis en évidence les effets histologiques irréversibles de l’atteinte thyroïdienne (hypertrophie et hyperplasie des cellules folliculaires) 28 jours après l’arrêt du traitement (Chalouati et al., 2014). De même, la diminution dose-dépendante de T4 et l’augmentation de TSH persistent après l’arrêt du traitement.
Une augmentation statistiquement significative du poids des glandes surrénales est rapportée chez des rats mâles et femelles Sherman nourris avec de la nourriture contaminée aux doses de 25 mg.kg-1.j-1d’HCB pendant 4 mois (Kimbrough et Linder, 1974).
Une altération du système immunitaire est fréquemment observée.
Une atrophie du thymus est observée chez les rats femelles Wistar nourris avec une nourriture contaminée à la dose de 15 mg.kg-1.j-1 pendant 13 semaines (Schielen et al., 1995). Une stimulation des réponses humorale et cellulaire est rapportée chez les jeunes rats Wistar dont les mères ont été exposées via la nourriture aux doses de 0,2- 1- 5 mg.kg-1 d’HCB pendant la gestation et la lactation. Les jeunes ont ensuite continué d’être exposés aux mêmes doses que leurs mères jusqu’à l’âge de 7 mois (Vos et al., 1983). A la dose de 0,2 mg.kg-1.j-1 une augmentation significative de la réponse des IgG et des IgM à l’anatoxine tétanique, un retard de réponse à la réaction d’hypersensibilité à l’ovalbumine et une accumulation des macrophages dans les poumons sont observés. A la dose de 1 mg.kg-1.j-1 et au-delà, une augmentation du poids du ganglion poplité est mesurée correspondant à une prolifération cellulaire. Une prolifération cellulaire est également observée au niveau des cellules endothéliales des capillaires et des veinules pulmonaires. A la dose de 5 mg.kg-1.j-1, une augmentation des poids des ganglions de la rate, des poumons et du mésentère, des niveaux sériques en IgM et du nombre relatif des basophiles sanguins ainsi qu’une hématopoïèse extra-médullaire dans la rate sont observée. Par ailleurs, il a été montré que les lymphocytes T et les macrophages étaient les cellules directement impactées dans les effets de l’HCB sur le système immunitaire (augmentation des IgE et IgM sérique, augmentation du poids de la rate et des ganglions lymphatiques) chez des rats exposés pendant 21 jours à la dose de 450 mg.kg-1.j-1 d’HCB (Ezendam et al., 2004).
Très peu d’études décrivent des effets sur le système cardiovasculaire. Chez le chien exposé à 110 mg.kg-1.j-1 d’HCB pendant 1 an (LOAEL), il est observé des lésions de type inflammation des petites artères et artérioles avec une endartérite proliférative localisée (inflammation de la paroi de la tunique interne des artères), une nécrose fibrinoïde, une thrombose et occasionnellement une fibrose et une inflammation des artérioles adjacentes du cœur et du foie (Gralla et al., 1977). Des observations similaires au niveau cardiaque sont décrites chez le rat (Kimbrough et Linder, 1974). Une fibrose et une dégénérescence des fibres musculaires du cœur sont rapportées pour des expositions à 50 mg.kg-1.j-1 ou plus pendant 4 mois (p<0,05). Une augmentation significative de la tension artérielle systolique en lien avec un épaississement de la paroi de l’aorte abdominale a été rapportée chez des rats exposés à une dose de 500 mg.kg-1.j-1 (solution aqueuse dans 0,5 % de Tween 20) pendant 35, 40, et 45 jours (fin de l’étude subchronique) (p <0,05) (Castillo et al., 2018). De tels effets ne sont pas observés à la dose de 5 mg.kg-1.j-1. Dans les autres études, où une recherche des atteintes des tissus cardiovasculaires a été réalisée, aucun effet n’est rapporté (Goldstein et al., 1978 ; Iatropoulos et al., 1976 ; Sundlof et al., 1981).
Une anémie significative est rapportée chez le chien exposé à 110 mg.kg-1.j-1 pendant 1 an (Gralla et al., 1977), chez le lapin exposé à 245 mg.kg-1.j-1 pendant 3 mois (De Matteis et al., 1961), chez le cochon exposé à 50 mg.kg-1.j-1 pendant 3 mois (Den Tonkelaar et al., 1978) ou chez le singe exposé à 10 mg.kg-1.j-1 pendant 90 jours (Foster et al., 1995a). Cette anémie est parfois associée à une neutrophilie qui survient dès la dose de 11 mg.kg-1.j-1 chez le chien (Gralla et al., 1977) ou à une leucocytose rapportée chez le cochon à la dose de 0,05 mg.kg-1.j-1 pendant 90 jours (Den Tonkelaar et al., 1978). Ces effets ne sont pas retrouvés chez le singe (Foster et al., 1995a).
Enfin, des atteintes osseuses et musculaires sont rapportées dans plusieurs études (ATSDR, 2015). Plus spécifiquement, Andrews et al. (1989,1990) ont examiné cet aspect de la toxicologie de l’HCB. Des rats mâles, exposés par gavage à des doses de 1 mg.kg-1.j-1 d’HCB et au-delà en solution dans de l’huile de maïs pendant 15 semaines, présentent une ostéosclérose. Il n’y a aucun effet observé à la dose de 0,1 mg.kg-1.j-1. La longueur du fémur, le poids et le volume ne sont pas modifiés. On note une augmentation de la zone corticale pour une exposition à 1 mg.kg-1.j-1 et une diminution de la zone médullaire à 10 mg.kg-1.j-1. Ces effets sont associés à une diminution des phosphatases alcalines sériques et à une augmentation de la 1,25-dihydroxy-vitamine D3 sérique et des hormones parathyroïdes. Toujours chez le rat, des lésions dégénératives des incisives maxillaires, d’intensité croissante aux doses de 1 à 25 mg.kg-1.j-1 sont rapportées après 13 semaines de traitement (NOAEL de 0,3 mg.kg-1.j-1) (Long et al., 2004).
Synthèse
FDTE/VTR Importer Chez l’animal, les effets associés à l’HCB par voie orale sont principalement hépatotoxiques et neurotoxiques. Des troubles du métabolisme, une atteinte des glandes thyroïde et parathyroïde, du système immunitaire, ainsi que des atteintes osseuses et musculaires sont également rapportées.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 1B : Substance dont le potentiel cancérogène pour l’être humain est supposé, la classification dans cette catégorie s’appuyant largement sur les données animales. | 2008 |
| IARC | FDTE/VTR Importer Groupe 2B : substance possiblement cancérigène + cancérigène pour l’homme | 2001 |
| US EPA | FDTE/VTR Importer Classe B2 : substance probablement cancérigène pour l'homme | 1996 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Le risque de cancer du sein a été étudié lors de l’exposition à l’HCB au travers de plusieurs études.
Cinq de ces études sont des études cas-témoin incluant un nombre restreint de cas de cancers du sein (< 50 cas/étude). Elles ont été réalisées sur différentes populations (finlandaise, américaine, canadienne, allemande et suédoise). Aucune relation entre la concentration en HCB dans les tissus graisseux du sein et la survenue de cancer n’a pu être établie (Falck et al., 1992 ; Dewailly et al., 1994 ; Güttes et al., 1998 ; Liljegren et al., 1998). L’analyse d’une sous-population de l’étude suédoise a permis d’établir chez les femmes ménopausées présentant un cancer (estrogen receptor-positive cancer) un lien avec un odds ratio de 7,1 (1,1-45) pour un petit nombre de cas (23 cas, 21 témoins) (Liljegren et al., 1998).
D’autres études cas-témoin réalisées sur une population plus grande sont également disponibles. Une étude a été conduite par Moysich et al. (1998) sur la population des régions Erié et Niagara (USA) au cours de la période 1986-1991. Il s’agit d’une étude cas-témoin sur les cancers du sein post-ménopause réalisée sur 439 cas et 494 témoins. Une seconde étude a porté sur 304 cas de patientes traitées chirurgicalement entre 1994 et 1999 au Connecticut (USA) et 186 témoins. Une autre étude cas-témoin a été réalisée à Rio de Janeiro (Brésil) par Mendonça et al. (1999) et a porté sur 177 femmes atteintes d’un cancer invasif du sein entre 1995 et 1996 et 350 témoins. Enfin, une étude canadienne menée par Aronson et al. (2000) a porté sur des femmes pour lesquelles une biopsie avait été réalisée dans le cadre d’une suspicion de cancer du sein dans l’Ontario (Canada). Une population de 213 témoins a participé à l’étude. Dans trois de ces études, les concentrations biologiques ont été mesurées (graisses sériques ou tissus graisseux des seins) au moment du diagnostic de cancer. Aucune augmentation du risque de cancer du sein n’est retrouvée chez les femmes présentant une concentration élevée.
Dans une étude cas-témoin nichée dans une cohorte à Colombia (USA), Dorgan et al. (1999) ont examiné la relation entre l’exposition aux pesticides organo-chlorés et aux polychlorobiphényles et la survenue de cancer du sein. Les échantillons de sérum sanguin de 6 426 femmes ont été analysés avant le diagnostic de cancer, ce qui a permis de déterminer la charge corporelle en HCB. Le risque de cancer du sein pour les femmes pour lesquelles les échantillons étaient dans les trois quartiles les plus élevés est double du risque pour celles qui étaient dans le premier quartile. Cependant, aucune relation dose-effet n’a été mise en évidence.
D’autres auteurs ont tenté de mettre en évidence un lien entre l’exposition à l’HCB et d’autres localisations de cancer.
Une autre étude cas-témoin menée par Weiderpass et al. (2000) a été réalisée en Suède chez des femmes âgées de 50 à 74 ans présentant un cancer de l’endomètre au cours de la période 1996-1997. Cent cinquante-quatre cas et 205 témoins ont participé à l’étude. Les concentrations sériques en HCB et en d’autres composés organochlorés ont été mesurées. Les odds ratios trouvés ne permettent pas d’établir de lien entre exposition à l’HCB et le cancer de l’endomètre.
Une étude cas-témoin réalisée dans la région de la baie de San Franscico (USA) n’a pas non plus révélé de lien entre l’exposition à l’HCB et la survenue de cancer du pancréas (Hoppin et al., 2000). L’étude a porté sur 611 patients atteints d’un cancer du pancréas et 253 témoins. Le niveau d’HCB dans les lipides sériques est de 28 ng.g-1 chez les sujets atteints de cancer et de 22 ng.g-1 chez les témoins. Les odds ratios pour le cancer du pancréas pour les catégories d’exposition moyenne et élevée sont de 0,9 (95 % ; IC : 0,4 - 1,9) et 1,6 (95 % ; IC : 0,8 - 3,4) respectivement.
Enfin, sur une petite population issue d’une étude cas-témoin suédoise, Nordström et al. (2000) ont pris en compte 54 hommes présentant une leucémie entre 1987 et 1992 et 54 témoins. Une mesure de l’HCB et des composés organochlorés dans les lipides sériques a été réalisée : 44,5 ng.g-1 chez les sujets atteints de leucémie et 45,2 ng.g-1 chez les témoins. Lorsque l’on prend une concentration moyenne de 43,9 ng.g-1 comme valeur de référence pour les témoins, le odd ratio est de 1,0 (95 % ; IC : 0,4-2,7). Si l’on prend en compte une sous-population particulière de sujets ayant un titre élevé d’anticorps contre les antigènes précoces du virus Epstein-Barr et une forte concentration en HCB, l’odds ratio pour les leucémies est élevé : 11 (95 % ; IC : 2,2 - 69).
Une méta-analyse regroupant 6 études cas-témoin emboitées (Rothman et al.,1997 ; Quintana et al., 2004 ; Laden et al., 2010 ; Engel et al., 2007 ; Cantor et al., 2002 ; Bertrand et al., 2010), une étude de cohorte (Bräuner et al., 2012) et six études cas-témoin (Hardell et al., 1996, 2001, 2009 ; Spinelli et al. 2007 ; De Roos et al., 2005 ; Cocco et al., 2008), a mis en évidence une association entre l’augmentation de l’exposition à l’HCB et le risque de lymphomes non hodgkiniens (OR=1,54, 95% IC95% : [1,20 – 1,99]) (Luo et al., 2016). Cette étude regroupe l’analyse de plusieurs pesticides organochlorés et les résultats demandent à être confirmés.
Synthèse
FDTE/VTR Importer Plusieurs études ont tenté d’établir un lien entre l’exposition à l’HCB et l’augmentation de l’incidence de cancers, toutefois ce lien n’est pas clairement défini en raison de l’exposition souvent concomitante à d’autres solvants chlorés.
Chez l'animal
Inhalation
FDTE/VTR Importer Aucune donnée n’a été identifiée par cette voie d’exposition.
Voie orale
FDTE/VTR Importer Plusieurs études réalisées chez l’animal rapportent le développement de tumeurs dont les localisations sont, pour la plupart, hépatiques et thyroïdiennes.
Des groupes de souris Swiss mâles et femelles âgés de 6 à 7 semaines (30 à 50 individus par lot) ont ingéré des doses de 0, 50, 100 ou 200 mg.kg-1 d’HCB (pureté > 99,5 %) jusqu’à l’âge de 120 semaines (Cabral et al., 1979 ; Cabral et Shubik, 1986). Un lot supplémentaire a reçu la dose de 300 mg.kg-1 pendant 15 semaines. Il n’y a pas d’augmentation des cancers des cellules hépatiques chez les lots témoins et exposés à 50 mg.kg-1. En revanche, des tumeurs des cellules hépatiques sont retrouvées chez les mâles 3/12, 7/29 et 1/3 et chez les femelles 3/12, 14/26 et 1/10 pour les groupes exposés aux doses de 100, 200 et 300 mg.kg-1 respectivement. Ce qui correspond à la survenue de tumeurs des cellules hépatiques (hépatocarcinomes) aux doses de 12 à 24 mg.kg pc-1.j-1 .
Des groupes de 12 et 14 rats Argus et de 4 et 6 femelles MRC-Wistar âgés de 5 à 7 semaines ont été nourris avec de la nourriture contenant 0 ou 100 mg.kg-1 d’HCB (99,5 % de pureté) pendant 90 semaines (Smith et Cabral, 1986). L’incidence des tumeurs des cellules hépatiques (hépatocarcinomes) est de 0/12 et 14/14 chez les rats Argus témoins et exposés, respectivement et de 0/4 et 4/6 chez les rats MRC-Wistar témoins et exposés respectivement.
Une autre étude a été réalisée sur des lots de 10 à 12 mâles et 10 femelles chez le rat Fischer 344 (âgés de 6 à 7 semaines) et alimentés avec de la nourriture contenant de l’HCB aux doses de 0 ou 200 mg.kg-1 pendant 90 semaines (Smith et al., 1985). Les tumeurs hépatiques ne sont observées que chez les femelles vivantes exposées. L’incidence dans ce lot est de 5/10 pour les nodules néoplasiques et de 5/10 pour les carcinomes.
Au cours d’une autre étude, 94 jeunes mâles et 94 jeunes femelles rats Sprague Dawley ont été nourris avec de la nourriture contenant 0, 75 ou 150 mg.kg-1 d’HCB (pureté > 99,5 %) jusqu’à 104 semaines (Ertürk et al., 1986 ; Lambrecht et al., 1983a,b). Une augmentation de l’incidence des tumeurs hépatiques et rénales est rapportée. Les tumeurs hépatiques observées sont de différents types : carcinomes hépatocellulaires, adénomes et hémangiomes des canaux biliaires alors que les tumeurs rénales sont des adénomes.
Incidence des différents types de tumeurs hépatiques observées chez des rats après 2 ans d’exposition à l’HCB (Ertürk et al., 1986)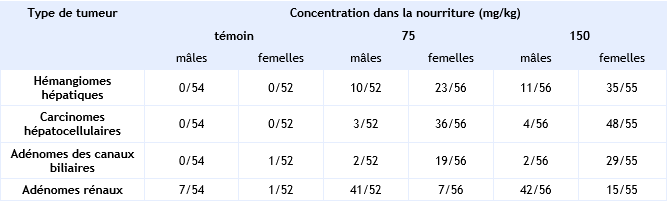
Des hamsters (Syrian golden), au total 159 femelles et 157 mâles, âgés de 6 semaines, ont été exposés via la nourriture à des doses de 0, 50, 100 ou 200 mg.kg-1 d’HCB (pureté > 99,5 %) pendant toute leur vie ce qui correspond à une dose quotidienne de 0, 4, 8 ou 16 mg.kg pc-1 (Cabral et al., 1977 ; Cabral et Shubik, 1986). L’incidence des hépatomes, des hémangioendothéliomes hépatiques et des adénomes des cellules folliculaires de la thyroïde est augmentée lors de l’exposition à l’HCB. L’incidence des hépatéliomes est de 0/40, 14/30, 26/30 et 49/57 chez les mâles et de 0/39, 14/30, 17/30 et de 51/60 chez les femelles exposées à 0, 50, 100 et 200 mg.kg-1 respectivement. L’incidence des hémangioendothéliomes chez les mâles et les femelles recevant la plus forte dose est de 20/57 et 7/60 respectivement par comparaison avec les lots témoins 0/40 chez les mâles et 0/39 chez les femelles. Trois de ces hémangioendothéliomes étaient associés à des métastases. Enfin, une augmentation statistiquement significative en adénomes alvéolaires de la thyroïde est trouvée (0/40, 0/30, 1/30 et 8/57) chez les mâles et (0/39, 2/30, 1/30 et 3/60) chez les femelles exposées à 0, 50, 100 et 200 mg.kg-1 respectivement.
Des lots de rats mâles et femelles Sprague Dawley ont reçu de l’HCB dans leur alimentation aux doses de 0 – 0,32 – 1,6 – 8 – 40 mg.kg-1 (Arnold et al., 1985 ; Arnold et Krewski, 1988). Après 90 jours, les animaux de la génération F0 ont été accouplés. Les jeunes de la première génération (F1) ont été sevrés à l’âge de 21 jours puis exposés via la nourriture à l’HCB jusqu’à 130 semaines. Les courbes de mortalité sont les mêmes chez les 2 générations. Il n’y a pas d’augmentation statistiquement significative de l’incidence des tumeurs des cellules folliculaires de la thyroïde chez les jeunes de la génération F1, en revanche, on note une augmentation marginale de l’incidence des tumeurs des autres sites. Chez les mâles, on observe des adénomes des glandes parathyroïdes 2/48, 4/48, 2/48, 1/49 et 12/49 (p < 0,05, avec le test exact de Fisher) respectivement pour les doses de 0 – 0,32 – 1,6 – 8 et 40 mg.kg-1. Chez les femelles, l’incidence des nodules néoplasiques hépatiques est de 0/49, 0/49, 2/50, 2/49 et 10/49 (p < 0,01, par le test exact de Fisher). L’incidence des phéochromocytomes des glandes surrénales est augmentée de manière linéaire (p < 0,05, par le test de Cochran-Armitage) chez les deux sexes : chez les mâles 10/48, 12/48, 7/48, 13/48, et 17/40, chez les femelles 2/49, 4/49, 4/50, 5/49 et 17/49 (p < 0,01, par le test exact de Fisher).
Par ailleurs, les résultats d'un certain nombre d'études semblent indiquer que l’HCB agit en tant que promoteur tumoral. Chez la souris, l’exposition concomitante à l’HCB favorise l'apparition de tumeurs hépatiques causées par le terphényle polychloré (Shirai et al., 1978) ou d’hépatocarcinomes et de tumeurs mammaires par la nitroso-diéthyl-amine (Pereira et al., 1982; Herren-Freund et Pereira, 1986; Stewart et al., 1989 ; Randi et al., 2006 ). Les effets de l’HCB sur la glande mammaire seraient associés à une augmentation de la prolifération, l’invasion et la migration tumorale mettant en jeu différentes voies de signalisation ainsi que les récepteurs aux œstrogènes et/ou l’AhR (Pena et al., 2012 ; Pontillo et al., 2013 ; Miret et al., 2016), alors que pour les hépatocarcinomes, un mécanisme mettant en jeu le récepteur Ah, l’activation de proto-oncogènes et du cycle cellulaire semble privilégié (Randi, 2003 ; De Tomaso Portaz et al., 2015).
Voie cutanée
FDTE/VTR Importer Aucune donnée n’a été identifiée.
Synthèse
FDTE/VTR Importer Le lien entre l’exposition orale à l’HCB et l’induction de tumeurs du foie, de la thyroïde, des reins et des glandes surrénales a été observé chez différentes espèces de rongeurs. L’HCB semble présenter un effet promoteur de l’induction de tumeurs hépatiques et mammaires initiées par d’autres substances.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Une augmentation de l’incidence des micronoyaux a été observée dans les lymphocytes du sang périphérique de 41 salariés de la chimie au Brésil, exposés à un mélange de solvants chlorés comprenant de l’HCB, mais aussi du tétrachlorure de carbone et du perchloroéthylène (Da Silva et al., 1997). La portée de cette étude reste très limitée en raison de l’exposition à de nombreux composants chimiques autres que l’HCB.
Chez l'animal
Toutes voies
FDTE/VTR Importer Une augmentation de l’incidence des micronoyaux a été observée dans les lymphocytes du sang périphérique de 41 salariés de la chimie au Brésil, exposés à un mélange de solvants chlorés comprenant de l’HCB, mais aussi du tétrachlorure de carbone et du perchloroéthylène (Da Silva et al., 1997). La portée de cette étude reste très limitée en raison de l’exposition à de nombreux composants chimiques autres que l’HCB.
Synthèse
FDTE/VTR Importer L’HCB a été évalué mais n’a pas été classé génotoxique par l’Union Européenne (CE, 2008).
Dans la plupart des tests in vivo chez l’animal et in vitro sur cellules procaryotes et eucaryotes, l’HCB n’est pas génotoxique. Néanmoins, quelques résultats contradictoires ne permettent pas d’écarter avec certitude une activité mutagène.
In vitro
Organismes procaryotes
FDTE/VTR Importer L’HCB n’est pas mutagène sur des souches de Samonella typhimurium (TA98, TA100, TA1535, TA1537) ou d’Escherichia coli (WP2), avec ou sans activation métabolique (S9) (NTP, 2021 ; Siekel et al., 1992). Ces résultats sont cohérents avec ceux précédemment obtenus sur différentes souches de S. typhimurium traitées, avec ou sans activation S9 (Haworth et al., 1983). Toutefois, Gopalaswamy et Aiyar (1986) rapportent une activité positive à une faible dose sur la souche TA98 en présence de S9 ; en absence d’activation métabolique, aucune activité mutagène n’est rapportée à faible dose.
Organismes eucaryotes
FDTE/VTR Importer Une activité mutagène de l’HCB sur cellules eucaryotiques V-79 de hamster Chinois est également décrite in vitro en absence d’activation S9, mais ces résultats semblent douteux à cause de la faiblesse de l'augmentation observée (Kuroda, 1986).
Le test du micronoyau est négatif sur des lymphocytes humains testés sans activation métabolique jusqu’à une concentration de 0,1 mM (Ennaceur et al., 2008). A l’inverse, des augmentations significatives des coupures doubles brins de l’ADN (test des comètes) et des micronoyaux sont observées sur des cultures primaires d’hépatocytes humains exposés in vitro à des concentrations de 0,56 mM d’HCB (Canonero et al., 1997). Dans des conditions expérimentales similaires, le test des comètes est négatif, alors que celui des micronoyaux est positif sur les hépatocytes de rats. Des altérations de l’ADN également mesurées par le test des comètes sur deux lignées embryonnaires de fibroblastes humaine (WS1) et murine (3T3) ont été observées à partir d’une concentration de 1 µg.ml-1 (Salmon et al., 2002). Enfin, malgré les observations de dommages induits à l’ADN et micronoyaux, aucune aberration chromosomique n’a été détectée in vitro dans les cultures de lymphocytes du sang périphérique humain après exposition jusqu’à 0,1 mM d’HCB (Sieckel et al., 1992).
Au regard des données disponibles, l’HCB ne semble pas provoquer directement des mutations géniques, des lésions chromosomiques ou de la réparation de l'ADN. Toutefois, des altérations primaires de l’ADN (test des comètes) ont été rapportées et il est faiblement mutagène lors de quelques études portant sur des bactéries et des levures, et des signes d'un faible taux de liaison à l'ADN in vitro et in vivo ne permettent pas d’écarter avec certitude un mécanisme d’action non génotoxique. La formation de tumeurs par un mécanisme de promotion tumorale impliquant des mécanismes non-génotoxiques demande à être confirmée. Aussi, d’après les données disponibles à ce jour, un mécanisme d’action sans seuil est retenu par défaut pour les effets cancérogènes.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer L’hexachlorobenzène a été évalué mais n’a pas été classé reprotoxique par l’Union Européenne | 1996 |
Chez l'homme
Toutes voies
FDTE/VTR Importer L’HCB affecte à la fois la reproduction et le développement.
Aucune donnée n’est disponible sur les effets de l’HCB sur la fonction de reproduction après exposition par voie orale chez l’homme.
Une étude rétrospective a été menée, dans la région de Turquie lors de l’intoxication collective des années 1950, sur trois groupes de 42 femmes (témoins en dehors d’une zone exposée, et femmes exposées à l’HCB avec ou sans porphyrie cutanée tardive). Cette étude a montré qu’une augmentation du risque des avortements spontanés est corrélée avec une porphyrie cutanée pour des taux d’HCB supérieurs à 1,0 ng.mL-1 (Jarrell et al., 1998). En revanche, ces résultats n’ont pas été retrouvés dans l’étude de Gerhard et al., (1998) (concentration sanguine maternelle = 0,679 ng.mL-1), de Leoni et al., (1986 et 1989)(concentration sanguine maternelle = 1,6 ng.mL-1) ou de Sugiura Ogasawara et al. (2003 ).
associated with recurrent miscarriage. Am J Reprod Immunol 50(6):485-489.
Synthèse
FDTE/VTR Importer Chez l’humain, le risque d’avortement spontané est augmenté avec l’exposition à l’HCB. De plus, l’HCB induit une légère diminution en FSH.
Chez l'animal
Voie orale
FDTE/VTR Importer Plusieurs études ont évalué les effets de l’HCB sur la fonction de reproduction.
Les études menées chez l’animal ont identifié les ovaires comme un organe cible particulièrement sensible aux effets de l’HCB. Les différentes études rapportent des atteintes dès la dose de
0,01 mg.kg-1.j-1 (Alvarez et al., 2000 ; Babineau et al., 1991 ; Bourques et al., 1995 ; Foster et al., 1992a, b, 1995a, b ; Jarrell et al., 1993 ; Lecavallier et al., 1994 ; Iatropoulos et al., 1976 ; Knauf et Hobson, 1979 ; MacPhee et al., 1993 ; Muller et al., 1978 ; Sims et al., 1991). Les altérations rapportées correspondent à une modification pondérale, des altérations histologiques dégénératives et ultrastructurales des ovaires et une modification des niveaux sériques en hormones (œstrogènes et progestérone). Il a aussi été montré une perturbation de la stéroïdogenèse.
Une étude de 90 jours réalisée chez le singe femelle Cynomolgus (5 /lot à des doses de 0,01 – 0,1 – 1 – 10 mg.kg-1.j-1) a montré une atteinte des ovaires dès 0,01 mg.kg-1.j-1 d’HCB (Bourque et al., 1995). Les analyses ultrastructurales ont mis en évidence un changement mitochondrial pour lequel une dose-réponse a été établie. La présence de crêtes anormales est observée dès 0,01 mg.kg-1.j-1. Des matrices mitochondriales plus granulaires, présentant occasionnellement une morphologie irrégulière, sont rapportées pour une dose de 0,1 mg.kg-1.j-1. A la dose de 10 mg.kg-1.j-1, une altération de la matrice mitochondriale et une réduction de l’intégrité de la membrane mitochondriale sont identifiées. Des augmentations similaires au niveau du noyau (irrégularités de la membrane nucléaire avec apparition de vacuoles intranucléaires) en termes de fréquence et d’intensité des lésions des cellules folliculaires sont observées. Des noyaux anormaux sont observés dans certaines cellules pour une exposition à la dose de 0,01 mg.kg-1.j-1, alors que la membrane nucléaire est entière à 0,1 mg.kg-1.j-1. Des espaces anormaux sont visualisés entre les cellules folliculaires à la dose de 1 mg.kg-1.j-1 et des accumulations de lipides sont retrouvées dans les cellules folliculaires ainsi que des membranes nucléaires complètement repliées à la dose de 10 mg.kg-1.j-1. Les cellules de la thèque présentent également des altérations nucléaires mais uniquement à la dose de 10 mg.kg-1.j-1. De cette étude, une LOAEL de 0,01 mg.kg-1.j-1 est retenue
Les autres études menées chez le singe Cynomolgus et Rhésus confirment ces résultats (Babineau et al., 1991 ; Foster et al., 1992a, b, 1995a, b ; Jarrell et al., 1993 ; Iatropoulos et al., 1976 ; Knauf et Hobson, 1979 ; Muller et al., 1978 ; Sims et al., 1991). En effet, à partir d’un schéma expérimental similaire où des femelles Cynomolgus (4 /lot) ont reçu pendant 90 jours des capsules de gélatine contenant des doses de 0,1 – 0,1 – 1 – 10 mg.kg-1.j-1 HCB, une toxicité ovocytaire dose-dépendante est décrite dès la plus faible dose (Jarrell et al., 1993). Une dégénérescence ovocytaire, d’intensité croissante en fonction de la dose est observée à partir de coupes histologiques, de même qu’à la plus forte dose de 10 mg.kg pc-1.j-1 (p<0,05) une réduction du nombre de follicules primordiaux est rapportée.
En revanche, toujours chez les femelles, aucune atteinte histopathologique n’est retrouvée chez le chien Beagle pour une exposition à des doses pouvant atteindre 100 mg.kg-1.j-1 administrées dans des gélules de gélatine pendant 21 jours (Sundlof et al., 1981). Les études menées chez le rat confortent les résultats obtenus chez les primates toutefois, les doses étudiées sont plus élevées et les temps d’exposition sont plus courts (21 à 30 jours) (Alvarez et al., 2000 ; Foster et al., 1992a ; MacPhee et al., 1993). Les principales différences concernent les altérations des niveaux de progestérone qui seraient probablement liées à la différence de durée des cycles. Ainsi, des rates Wistar exposées par gavage à des doses de 1 000 mg.kg-1.j-1 d’HCB pendant 30 jours présentent des lésions dégénératives (augmentation du nombre de follicules atrésiques, infiltration inflammatoire des follicules primaires, stratification et prolifération des cellules épithéliales de la surface des ovaires et présence de noyaux irréguliers dans les cellules épithéliales). Elles présentent également des changements hormonaux et des niveaux de récepteurs hormonaux (diminution des niveaux sériques d’estradiol et de prolactine, augmentation de FSH et diminution des niveaux de récepteurs aux œstrogènes) (Alvarez et al., 2000).
Des souris CD-1 ont été exposées du 6ème au 17ème jour de la gestation à des doses de 10 ou 50 mg.kg pc-1 à l’HCB (Courtney et al., 1984). Une augmentation statistiquement significative de la mortalité chez les jeunes est mesurée. L’HCB induit des altérations histopathologiques et endocrinologiques des gonades chez les femelles. Ainsi, il induit une dégénérescence folliculaire et augmente l’atrésie chez les rongeurs et les primates (Sims et al., 1991 ; Jarrell et al., 1993), il affecte le cycle chez les rongeurs et les primates (Foster et al., 1992a,b, 1995a,b) et la stéroïdogenèse dans les gonades (Foster et al., 1992a,b, 1993, 1995a,b). Une altération de la morphologie des ovaires et de la stéroïdogenèse est observée chez le singe Cynomolgus dès la dose de 0,1 mg.kg pc-1.j-1 administrée pendant 90 jours (Foster et al., 1996). Alvarez et al. (2000) rapportent également des altérations du cycle et une réduction de l’ovulation lors d’expositions quotidiennes de rats mâles par gavage à la dose de 1 g.kg pc-1 d’HCB pendant 30 jours.
Les autres altérations sont des atteintes des testicules observées chez le rat dès 10 mg.kg pc-1.j-1 (Gralla et al., 1977 ; Smith et al., 1985) et des atteintes de la fonction de reproduction dès 16 mg.kg-1.j-1 (Grant et al., 1977 ; Simon et al., 1979). Le traitement de souris mâles à des doses de 100 - 400 - 1 600 mg.kg-1.j-1 pendant 7 jours confirme l’apparition de lésions testiculaires caractérisées par une augmentation de la lumière des tubes séminifères et une diminution non dose-dépendante de la paroi associée à une baisse de la spermatogénèse (Dou et al., 2021). Les activités de la superoxyde dismutase aux deux plus fortes doses et de la catalase (à la plus forte dose uniquement), témoignant d’un stress oxydant, sont significativement augmentées (p<0,05).
Synthèse
FDTE/VTR Importer Plusieurs études montrent que l’HCB affecte la fonction de reproduction des femelles et des mâles dans plusieurs espèces animales. Les ovaires sont des organes particulièrement sensibles.
Effets sur le développement
Généralités
FDTE/VTR Importer Les expositions professionnelles (Grimalt et al. 1994) et les intoxications collectives de la population turque dans les années 50 (Peters et al., 1987) ont fourni de nombreuses données d’exposition humaine à l’HCB.
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
Chez l'homme
Toutes voies
FDTE/VTR Importer L’HCB passe dans le lait maternel et représente une source de contamination majeure des nourrissons. Les fortes concentrations sont responsables d’effets cutanés, neurologiques et cardiovasculaires pouvant être létaux. Le risque d’apparition d’une porphyrie cutanée est augmenté avec l’exposition à l’HCB.
Voie orale
FDTE/VTR Importer Les expositions professionnelles (Grimalt et al. 1994) et les intoxications collectives de la population turque dans les années 50 (Peters et al., 1987) ont fourni de nombreuses données d’exposition humaine à l’HCB.
La contamination des nourrissons par l’intermédiaire du lait maternel est rapportée dans plusieurs études. Des corrélations significatives ont été établies entre les concentrations d’HCB dans le lait maternel et le sang des enfants de 1 an vivant dans la région de Flix (Ribas-Fitó et al. (2005)). Dans une autre région d’Espagne, zone rurale de Ribera d’Ebra également contaminée par des concentrations atmosphériques d’HCB, les concentrations sanguines des enfants de 4 ans nourris au lait maternel étaient significativement supérieures à celles des enfants ayant reçu du lait maternisé (p<0,001) (Carrizo et al. 2008). Des résultats comparables ont été observés chez des enfants de 10 ans en Allemagne (Link et al., 2005). Toutefois, les dernières publications rapportent une diminution de la concentration d’HCB dans le lait maternel dans plusieurs régions, comme par exemple de 56 % en Norvège (Polder et al., 2008), de 43% en Allemagne (Zietz et al. (2008), ou encore d’un facteur 9 à 10 en Croatie et en République Tchèque (Klinčić et al., 2014 ; Mikeš et al., 2012).
L’exposition de la population turque (estimée à 0,7-2,9 mg.kg-1.j-1 entre 1955 et 1959) a montré chez les enfants exposés in utero ou exposés via le lait maternel un taux de mortalité supérieur à 95 %. Les nouveau-nés contaminés présentaient un ensemble de symptômes appelés pembe yara (« lésion rose »), comportant des lésions cutanées (association d’une épidermolyse bulleuse et d’un érythème annulaire) et des troubles neurologiques et cardio-respiratoires à l’origine de la mort de de ces enfants au cours de leur 1ère année de vie (Cam, 1960 ; Peters et al., 1966 ; Peters, 1976). Chez les enfants plus âgés, une atteinte cutanée appelée « plaie noire » est décrite. Elle correspond à une photosensibilité évoluant en 6 mois vers une hyperpigmentation, une fragilité cutanée et un hirsutisme (Cam et Nigogosyan, 1963 ; Dogramaci, 1964 ; Gocmen et al., 1989). Ces deux types de lésions cutanées sont regroupés sous le terme de porphyrie cutanée tardive liée à un déficit en UROD. Une étude plus récente a montré que la porphyrie cutanée tardive n’est pas associée à des concentrations sériques en HCB supérieures à 1 ng.mL-1 (Jarrell et al., 1998). Plusieurs études rapportent des symptômes persistants à l’âge adulte lors d’une exposition de 7,6 ans pendant l’enfance (Cripps et al., 1984 ; Gocmen et al., 1989 ; Peters et al., 1982). Il s’agit d’une stature plus petite chez 42,1 % des patients et d’une ostéoporose des phalanges des mains associée à des mains de taille plus petite, douloureuses, boursouflées et noueuses chez 66,6 % des patients.
Une association positive entre la concentration en HCB dans le lait maternel (> 146 µg.kg-1 de graisses) et la survenue d’otites au cours de la première année a été mise en évidence chez les Inuits du Canada (Dewailly et al., 2000).
Parmi les études plus récentes, la plupart n’ont pas mis en évidence d’associations significatives entre les concentrations d’HCB dans le sang des mères, du cordon ombilical ou du lait maternel et les différents marqueurs de la croissance et/ou du développement post-natal (natal (Basterrechea et al., 2014 ; Burns et al., 2012 ; Cheslack-Postava et al., 2013 ; Cupul-Uicab et al., 2013 ; Darvill et al., 2000 ; Denham et al., 2005 ; Eggesbø et al., 2009 ; Fenster et al., 2006 ; Forns et al., 2012 ; Gladen et al., 2003 ; Guo et al., 2014 ; Mendez et al., 2011 ; Sagiv et al., 2007 ; Schell et Gallo, 2010 ; Sioen et al., 2013 ; Smink et al., 2008 ; Strøm et al., 2014 ; Szyrwińska et Lulek, 2007 ; Torres-Arreola et al., 2003), ou la cryptorchidie (Axelsson et al., 2020 ; Freire et al., 2011 ; Julvez et al., 2011 ; Pierik et al., 2007). Les principales limites de ces études sont liées au manque de données quantifiables de l’exposition à l’HCB, au faible nombre de sujets, et/ou l’exposition concomitante à d’autres solvants chlorés.
Toutefois, dans une cohorte de 159 mères suédoises, un petit poids de naissance pour l’âge gestationnel a significativement été associé à la concentration sanguine d’HCB des mères au cours de la grossesse (OR = 5,62 , IC95% [1,26 – 25,1]) (Lauritzen et al., 2017). De même, une association négative entre le poids de naissance et l’augmentation de la concentration sanguine d’HCB (ß -154,3, IC95% [-300,8 ; -7,9]) est rapportée dans une cohorte de 1 117 mère-enfant en Grèce (Vafeiadi et al. 2014). Dans une étude espagnole, Lopez-Espinosa et al. (2011), rapporte une baisse marginale, mais significative de 0,39 cm de la taille à la naissance pour chaque augmentation d’un facteur 10 de la concentration sanguine d’HCB sur une cohorte de 494 mère-enfant. Toujours en Espagne, la concentration sanguine d’HCB des mères (> à 73 ng.g-1 de lipides) est positivement associée à une croissance rapide significative au cours des 6 et 14 premiers mois des enfants, par comparaison aux enfants dont les mères ont les plus faibles concentrations sanguines d’HCB (< à 22,6 ng.g-1 lipides) (Valvi et al., 2014).
Deux études cas-témoin, réalisées l’une en Italie et l’autre en Suède, ont rapporté une augmentation significative du risque d’hypospadias avec chaque augmentation de 10 pg.g-1 de lipides dans le sang des mères ou chez les mères avec une concentration d’HCB > à 0,26 ng.mL-1 par comparaison aux mères ayant les plus faibles concentrations sanguines d’HCB (Giordano et al. 2010; Rignell-Hydbom et al. 2012).
Par ailleurs, dans les études où les concentrations sériques d’HCB ont été recherchées chez des adolescents filles et garçons, des effets significatifs sur les marqueurs du développement sexuel ont été rapportés (Croes et al. 2014a, 2014b; Lam et al. 2014).
La plus forte sensibilité des enfants et des adolescents liée à l’exposition d’HCB a fait l’objet d’une revue regroupant 68 études (Casado et al., 2019). La relation causale entre l’exposition à l’HCB et les principaux effets cliniques identifiés (le développement neuromoteur, le développement sexuel, le système immunitaire et respiratoire, l’obésité et les pathologies métaboliques), au regard des résultats parfois contradictoires, reste incertaine. Enfin, des troubles du langage de petites filles testées à 15 mois (16 %, p = 0,007) et 38 mois (3 %, p = 0,03) ont été significativement associés aux concentrations maternelles d’HCB (ng-1 de lipides) (tertile le plus élevé) par comparaison avec les mères du plus faible tertile (Jeddy et al., 2018).
Chez l'animal
Toutes voies
FDTE/VTR Importer Chez l’animal, l’HCB est fœtotoxique. Il est observé chez les nouveaux nés des atteintes hépatiques et neurologiques.
Voie orale
FDTE/VTR Importer Des expositions à l’HCB réalisées in utero et au cours de la période de lactation sont à l’origine d’une mortalité néonatale chez des rats (via la nourriture à des doses de 60-140 mg.kg-1) (Kitchin et al., 1982) et chez les singes exposés par gavage à des doses de 64 mg.kg-1 pc .j-1 pendant 60 jours (Bailey et al., 1980). Les études réalisées chez les singes exposés par gavage à des doses de 64 mg.kg-1 pc .j-1 pendant 22, 38 ou 60 jours par Bailey et al. (1980) et Iatropoulos et al. (1978) ont montré chez les jeunes des effets neurotoxiques, un œdème pulmonaire et des atteintes hépatiques précédant la mort des animaux. L’examen histopathologique pratiqué révèle une hypertrophie hépato-cellulaire limitée chez les jeunes survivants et une stéatose hépatique, une vacuolisation du tubule proximal rénal et une gliose cérébrale modérée chez un ou deux jeunes après la mort. Lors d’expositions in utero plus limitées en durées, l’HCB induit des malformations de structure comprenant une non-fermeture de la voûte palatine, une hypertrophie rénale et une hydronéphrose chez les souris CD-1. Ces effets sont rapportés chez les jeunes des mères exposées aux doses de 10 ou 50 mg.kg-1 pc.j-1 du 6ème au 16ème jour de la gestation (Andrews et Courtney, 1986). Il est toutefois noté que ces altérations sont en tous points similaires à celles rapportées lors d’exposition in utero aux dioxines, ce qui serait en faveur d’une présence de traces de dioxines dans l’HCB utilisé.
Des expositions prénatales induisent des effets supplémentaires. Barnett et al. (1987) rapportent que la souris BALB/c exposée via la nourriture à des doses quotidiennes de 0,5 à 5 mg.kg-1 pc d’HCB du 1er au 18ème jour de la gestation présente des altérations des paramètres immunologiques. A la dose de 0,5 mg.kg-1.j-1, une diminution statistiquement significative des résultats au test d’e hypersensibilité de contact à un allergène (épaisseur de la peau au point de contact de l’allergène au niveau de l’oreille) réalisé au 45ème jour après la naissance est rapportée (Barnett et al., 1987). Des effets sur la rate, comprenant une diminution du nombre de cellules B et de la réponse des lymphocytes, sont observés à 5 mg.kg-1.j-1 mais ne sont pas retrouvés à la dose de 0,5 mg.kg-1.j-1. Des études menées chez le rat Wistar confirment ces effets immunitaires (Vos et al., 1983). Aux doses élevées, on note une augmentation de la mortalité chez les jeunes, une augmentation des poids hépatique et des ganglions lymphatiques poplités à la dose de 5 mg.kg-1.j-1. Le poids des glandes surrénales et les concentrations en immunoglobulines (IgM et IgG) sont également augmentés aux doses de 7,5 mg.kg-1.j-1 (Vos et al., 1979, 1983).
Deux études ont été menées pour identifier les effets d’une exposition à l’HCB au cours du développement sur le comportement de la progéniture. Des rates Sprague-Dawley ont été exposées avant la gestation par gavage aux doses de 0 - 2,5 - 25 mg.kg-1.j-1 d’HCB pendant 4 jours (Goldey et Taylor, 1992). Les femelles ont été ensuite accouplées à des mâles non-exposés. Les tests ont été réalisés chez les jeunes issues de ces femelles. La réponse aux tests comportementaux des jeunes issus des femelles exposées à l’HCB est plus rapide aussi bien pour les tests de géotaxie négative (animaux testés 6, 8 et 10 jours après la naissance) que pour les tests de discrimination olfactive (animaux testés 9, 10 et 11 jours après la naissance) réalisés avant le sevrage, la moyenne globale de chacun des 3 tests chez les animaux traités étant supérieure à celle du groupe témoin (p<0,05), sans effet lié à la dose. L’analyse séparée par jour et par dose des résultats au test d’exploration dans les cages des petits non sevrés entre 15 et 20 jours montre également une augmentation significative uniquement au 19 et 20ème jour (p<0,01). Les jeunes issus de femelles exposées sont plus actifs également jusqu’à 60 jours après la naissance. En revanche, l’amplitude du test de sursaut auditif est significativement réduite chez les petits de 23 jours dans le groupe exposé à la plus forte dose uniquement par comparaison au groupe témoin (p<0,0001), l’effet étant inversé chez les mêmes mâles testés à 90 jours (p<0,01). Les autres tests explorant l’apprentissage ou l’activité motrice n’ont pas mis en évidence d’effet du traitement sur les animaux de 40 à 100 jours (water T-maze ; Open area). Les auteurs rapportent la présence d’HCB dans le sang et le cerveau des fœtus (20ème jour de gestation) et des petits de 4 (pics de concentration) à 14 jours après la naissance, en faveur d’un passage via le lait maternel (forte dose uniquement).
Dans une autre étude, des rates Wistar WU ont été nourries avec des aliments imprégnés d’HCB aux doses de 4, 8 ou 16 mg.kg-1 avant et pendant la gestation et la lactation. Ensuite, les jeunes ont été nourris comme leurs mères. Aucun changement n’est rapporté dans le comportement ordinaire jusqu’au 21ème jour après la naissance. Cependant, un allongement du temps de réponse aux tests d’apprentissage pratiqués au 150ème jour est mesuré (Lilienthal et al., 1996).
Enfin, les études réalisées pour des expositions chroniques chez le rat Sprague Dawley révèlent une toxicité sur le développement (Arnold et al., 1985 ; Grant et al., 1977). Ces études ont été décrites au paragraphe 3.3.2 et 3.3.3 puisqu’elles mettent également en évidence une fibrose et une lymphocytose péribilaire.
Autres Effets
Chez l'homme
Toutes voies
FDTE/VTR Importer De nombreuses données animales mettent en évidence les effets de l’HCB sur différents organes endocriniens, comprenant notamment les glandes thyroïde et parathyroïde, les glandes surrénales et les ovaires (ATSDR, 2015). Les effets se traduisent au niveau hormonal par une diminution des concentrations sériques de thyroxine (hypothyroïdisme), une augmentation de l’hormone parathyroïdienne (hyperparathyroïdisme), une diminution de la libération de corticostérone par les glandes surrénales, ou encore par des changements des taux d’œstradiol et de progestérone chez les femelles à certains stades du cycle menstruel. Le changement des hormones sexuelles coïncident avec des lésions ovariennes et l’altération des cycles de la reproduction, avec secondairement une baisse de la fertilité. L’HCB est également un faible ligand au récepteur AR, qui contribuerait par de multiples facteurs de régulation à la progression et l’aggravation de l’endométriose observée expérimentalement chez la souris (Chiappini et al., 2019, 2022) ou encore au développement de tumeurs des glandes mamaires chez les rongeurs (Miret et al., 2019). D’autres travaux menés sur l’appareil reproducteur des mâles ont permis d’identifier une atteinte de la prostate, des testicules et de la spermatogénèse chez plusieurs espèces animales, avec notamment l’implication probable d’un mécanisme de stress oxydatif (Dou et al., 2021).
Chez l'animal
Toutes voies
FDTE/VTR Importer De nombreuses données animales mettent en évidence les effets de l’HCB sur différents organes endocriniens, comprenant notamment les glandes thyroïde et parathyroïde, les glandes surrénales et les ovaires (ATSDR, 2015). Les effets se traduisent au niveau hormonal par une diminution des concentrations sériques de thyroxine (hypothyroïdisme), une augmentation de l’hormone parathyroïdienne (hyperparathyroïdisme), une diminution de la libération de corticostérone par les glandes surrénales, ou encore par des changements des taux d’œstradiol et de progestérone chez les femelles à certains stades du cycle menstruel. Le changement des hormones sexuelles coïncident avec des lésions ovariennes et l’altération des cycles de la reproduction, avec secondairement une baisse de la fertilité. L’HCB est également un faible ligand au récepteur AR, qui contribuerait par de multiples facteurs de régulation à la progression et l’aggravation de l’endométriose observée expérimentalement chez la souris (Chiappini et al., 2019, 2022) ou encore au développement de tumeurs des glandes mamaires chez les rongeurs (Miret et al., 2019). D’autres travaux menés sur l’appareil reproducteur des mâles ont permis d’identifier une atteinte de la prostate, des testicules et de la spermatogénèse chez plusieurs espèces animales, avec notamment l’implication probable d’un mécanisme de stress oxydatif (Dou et al., 2021).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale
L’ATSDR propose un MRL de 8.10-3 mg.kg-1.j-1 pour une exposition aiguë par voie orale à l’hexachlorobenzène (2015).
Cette valeur est établie à partir d’une étude expérimentale chez le rat Sprague Dawley. Des femelles ont été exposées par intubation gastrique à des doses de 0 – 2,5 – 25 mg.kg-1.j-1 pendant 4 jours correspondant à une dose totale de 0 – 10 – 100 mg.kg-1 pour les 4 jours (Goldey et Taylor, 1992). Un LOAEL de 2,5 mg.kg-1.j-1 est déterminé pour une hyperactivité des jeunes nés des femelles exposées.
Facteur d’incertitude : un facteur d’incertitude de 300 est appliqué correspondant à un facteur de 3 du fait de l’utilisation d’un LOAEL, à un facteur de 10 pour la transposition rat - homme et à un facteur de 10 pour la variabilité intra-espèce.
Calcul : 2,5 mg.kg-1.j-1 /300 = 0,0083 mg.kg-1.j-1 (arrondi à 8.10-3 mg.kg-1.j-1)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Effets à seuil - Exposition sub-chronique par voie orale
L’ATSDR propose un MRL de 1.10-4 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale à l’hexachlorobenzène (2015).
Cette valeur est établie à partir de deux études expérimentales réalisées chez le singe Cynomolgus. Dans la première étude des lots de 4 femelles sont exposés aux doses de 0 – 0,1 - 1 – 10 mg.kg-1.j-1 d’hexachlorobenzène encapsulé pendant 90 jours (Jarrel et al., 1993). Dans la deuxième étude, des lots de 4 femelles ont été exposés aux doses de 0 – 0,01 – 0,1 – 1 – 10 mg.kg-1.j-1 d’hexachlorobenzène encapsulé (Bourque et al., 1995). A partir de ces deux études, un LOAEL de 0,01 mg.kg-1.j-1 est déterminé pour des lésions dégénératives des follicules ovariens.
Facteur d’incertitude : un facteur d’incertitude de 90 est appliqué correspondant à un facteur de 3 du fait de l’utilisation d’un LOAEL, à un facteur de 3 pour la transposition singe - homme et à un facteur de 10 pour la variabilité intra-espèce.
Calcul : 0,01 mg.kg-1.j-1 /90 = 1.10-4 mg.kg-1.j-1
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale
L’ATSDR propose un MRL de 7.10-5 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’hexachlorobenzène (2015).
Cette valeur est établie à partir d’une étude expérimentale sur deux générations de 130 semaines chez le rat Sprague Dawley des deux sexes exposés via la nourriture à des doses de 0 – 0,32 – 1,6 – 8,0 – 40 ppm d’hexachlorobenzène (Arnold et al., 1985). Les doses d’exposition ont été converties sur la base des valeurs de référence de l’US EPA, 1986 : poids des rats Sprague Dawley et consommation (soit 0 – 0,022 – 0,11 – 0,55 – 2,8 mg.kg-1.j-1 pour les mâles de la génération F1 et 0 – 0, 026 – 0,13 – 0,64 –
3,2 mg.kg-1.j-1pour les femelles de la génération F1) . De cette étude, un LOAEL de 0,022 mg.kg-1.j-1 est déterminé pour l’apparition d’une lymphocytose péribiliaire et une fibrose hépatique chez les animaux de la génération F1.
Facteur d’incertitude : un facteur d’incertitude de 300 est appliqué correspondant à un facteur de 3 du fait de l’utilisation d’un LOAEL, à un facteur de 10 pour la transposition rat - homme et à un facteur de 10 pour la variabilité intra-espèce.
Calcul : 0,022 mg.kg-1.j-1 /300 = 7,33.10-5 mg.kg-1.j-1 (arrondi à 7.10-5 mg.kg-1.j-1)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Effets sans seuil - Exposition chronique par inhalation
L’OEHHA a établi un ERUi de 5,1.10-4 (µg.m-3)-1 pour une exposition par inhalation d’HCB (2011).
Le risque unitaire, exprimée en (mg.m-3)-1, a été calculé à partir de l’ERUo de 1,8 (mg.kg-1.j-1)-1 multiplié par le taux respiratoire de l’homme (20 m3.j-1), divisé par le poids corporel moyen (70 kg) m3.j-1.
Indice de confiance : Cet organisme n’accorde pas d’indice de confiance à cette valeur.
Effets sans seuil - Exposition chronique par voie orale
L’OEHHA a établi un ERUo de 1,8 (mg.kg-1.j-1)-1 pour une exposition par voie orale à l’HCB (2011).
Cette valeur est établie à partir des études expérimentales de Cabral et al. (1977) (exposition vie entière de hamsters dorés), de Lambrecht et al. (1983a,b), d’Ertürk et al., (1986) (exposition de 2 ans chez le rat) et de Arnold et al. (1985) (rat F1 de première génération exposée in utero puis pendant 130 semaines à partir du sevrage). Ces études ont montré la survenue d’hépatomes chez le hamster et le rat, de carcinomes hépatocellulaires chez les rates et de phéochromocytomes surrénaliens chez les rats. A partir d’un modèle multi-étapes linéarisées, les relations dose-réponse pour l’induction d’hépatomes chez les hamsters mâles (Cabral et al., 1977), d’hépatocarcinomes (Lambrecht et al. (1983a,b) et de phéochromocytomes (Lambrecht et al. (1983a,b) ; Arnold et al., 1985) chez la rate ont conduit au calcul de facteurs potentiels de cancérogénèse, ultérieurement transformés en valeur humaine en tenant compte d’un poids moyen chez l’homme de 70 kg, ceux chez le hamster et le rat étant respectivement de 0,1 et 0,353 (ajustement allométrique). Une valeur équivalente humaine de 1,7 (mg.kg-1.j-1)-1 a été obtenue pour les hépatomes chez les hamsters mâles et les carcinomes hépatocellulaires chez les rates, et une valeur de 1,8 (mg.kg-1.j-1)-1 pour les phéochromocytomes également chez les rates. La valeur de 1,8 (mg.kg-1.j-1)-1 a été retenue par l’OEHHA.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par voie orale
L’INERIS propose de retenir la valeur de 8.10-3 mg.kg-1.j-1 de l’ATSDR (2015) pour une exposition aiguë par voie orale à l’hexachlorobenzène.
Cette valeur est basée sur une étude expérimentale (Goldey et Taylor, 1992) où les mères ont été traitées pendant 4 jours avant la gestation. L’effet critique retenu est une hyperactivité chez les jeunes non sevrés issus de femelles exposées avant la gestation. Bien que l’effet neurodéveloppemental observé soit compatible avec le profil toxicologique de l’HCB, les analyses statistiques ont été réalisées à partir de données le plus souvent groupées et aucune relation dose-réponse n’a été observée sur la progéniture. De plus, la durée d’exposition des petits pendant la gestation et la lactation (documentée dans l’étude et justifiée par les données toxicocinétiques) n’est pas représentative d’une exposition aiguë. Le choix des facteurs d’incertitude est cohérent. La seule VTR disponible, celle de l’ATSDR est retenue.
Indice de confiance : par défaut en raison du scénario d’exposition et du traitement statistique des résultats.
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de retenir la valeur de 1.10-4 mg.kg-1.j-1 pour une exposition subchronique par voie orale à l’hexachlorobenzène (ATSDR, 2015).
Cette valeur est basée sur 2 études expérimentales (Jarrel et al., 1993 ; Bourque et al., 1995) de bonne qualité réalisées chez les femelles Cynomolgus présentant un même schéma expérimental et des résultats reproductifs. L’atteinte des structures (mitochondriale et nucléaire) des cellules et de la fonction ovarienne, observée en absence de toxicité systémique (marqueur de toxicité hépatique et porphyrie urinaire), représente un effet particulièrement sensible de la toxicité de l’HCB. L’effet critique est pertinent. Le calcul de la VTR suit les critères habituels, avec en particulier un facteur d’incertitude global réduit à 90 en raison d’un facteur de 3 justifié par le choix de l’espèce étudié, le singe. La seule VTR disponible, celle de l’ATSDR est retenue.
Indice de confiance : élevé en raison du choix de l’espèce, l’effet critique retenu et la durée de l’exposition.
Effets à seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique à l’HCB par voie orale la VTR chronique de 7.10-5 mg.kg-1.j-1 de l’ATSDR (2015).
Deux organismes proposent des valeurs pour des expositions chroniques par voie orale (ATSDR, 2015 ; US EPA, 1991).
L’ATSDR et l’US EPA se basent sur la même étude de reproduction sur 1 génération chez le rat avec une exposition chronique des animaux F1 (Arnold et al., 1985). La durée de l’exposition de 130 semaines est compatible avec une exposition chronique, bien que s’étalant sur toute la durée de vie des animaux et pouvant prêter à confusion en raison de l’apparition de lésions spontanées chez les rats âgés.
L’effet critique retenu par l’ATSDR est l’augmentation du nombre des lymphocytes et des fibroses péribiliaires hépatiques chez les mâles F1 (plus faible dose testée, LOAEL de 0,32 ppm soit 0,016 mg.kg-1.j-1). L’US EPA prend en compte des atteintes hépatiques (chromogenèse centrolobulaire basophilique) observées à la fois chez les mâles et les femelles à une dose intermédiaire (LOAEL de 8 ppm) en considérant que les effets survenant à doses inférieures, étant aussi observés chez les témoins, n’étaient pas considérés comme néfastes. Les effets retenus par les 2 organismes sont cohérents avec le profil toxicologique de l’HCB, dont le foie est l’organe cible principal. Toutefois les effets retenus par l’ATSDR apparaissent pour des niveaux d’exposition plus faibles que ceux de l’US EPA, et ont été considérés par l’ATSDR comme des « effets minimes », s’agissant de lésions spontanées fréquentes chez les rats âgés. L’ATSDR conclut que ces résultats suggèrent un effet hépatique « minimal » de l'HCB chez les rats mâles dès la plus faible dose avec observation de l’augmentation de l'incidence des lésions hépatiques liées à l'âge. Ces effets critiques sont retenus par l’Anses (2019). En 2015, l’ATSDR a recalculé de manière plus précise les doses ingérées, ce qui modifie la valeur finale mais pas les conclusions. Les différences entre les facteurs d’incertitude retenus sont liées au choix de l’effet critique et sont cohérentes. L’Ineris retient la même valeur que l’Anses.
Indice de confiance : Moyen car la durée de l’étude peut induire des lésions spontanées liées au vieillissement.
Effets sans seuil - Exposition chronique par inhalation
L’Ineris retient la VTR sans seuil de 5,1.10-4 (µg.m-3)-1 pour une exposition chronique à l’HCB par inhalation (OEHHA, 2011).
Trois organismes proposent des valeurs : l’OEHHA (2011), l’US EPA (2003) et le RIVM (2001). Ces valeurs sont toutes établies par dérivation à partir des valeurs pour des expositions par voie orale. Bien que l’Ineris ne recommande pas ce type de démarche, si une valeur devait être retenue, l’Ineris propose de se baser sur celle de l’OEHHA qui a été retenue par voie orale dans le paragraphe suivant. L’extrapolation voie à voie est clairement décrite.
Indice de confiance : par défaut du fait de l’extrapolation voie à voie de la VTR retenue par la voie orale.
Effets sans seuil - Exposition chronique par voie orale
L’Ineris retient pour une exposition chronique à l’HCB par voie orale la VTR chronique de 1,8 (mg.kg-1.j-1)-1 de l’OEHHA (2011).
Quatre organismes proposent de valeurs l’US EPA (1996), le RIVM (2001), l’OEHHA (2011) et l’OMS (2022). Toutes sont basées sur la survenue de tumeurs hépatiques chez le rongeur, en dehors de l’OEHHA qui retient en plus des tumeurs hépatiques, les phéochromocytomes surrénaliens chez le rat.
L’étude retenue par l’OMS (Crump et Howe, 1982) n’est pas publiée et les données ne sont pas vérifiables. Le RIVM, s’appuie sur une autre étude chez le rat (Arnold et al., 1985 ; Arnold et Krewski, 1988). La construction de ces valeurs utilise un facteur d’incertitude de 5 000 qui n’est pas conforme à la méthode habituelle de construction d’une VTR. Les valeurs de l’OMS et du RIVM ne sont pas retenues.
Les démarches de l’US EPA et de l’OEHHA sont similaires, mais seul l’OEHHA s’appuie sur plusieurs études mettant en évidence des tumeurs hépatiques chez plusieurs espèces. L’OEHHA retient également la glande surrénale (phéochromocytomes) comme organe cible. La construction de la valeur est transparente et se révèle protectrice au regard des données de génotoxicité. C’est pour cela que l’Anses (2019) retient la valeur proposée par l’OEHHA. L’Ineris suit également ce choix.
Indice de confiance : moyen en raison de la réserve concernant le mécanisme sans seuil/à seuil de cette substance.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par voie orale
L’US EPA propose une RfD de 8.10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’hexachlorobenzène (1991).
Cette valeur est établie à partir d’une étude sur deux générations de 130 semaines chez le rat Sprague Dawley des deux sexes exposés via la nourriture à des doses de 0 – 0,32 – 1,6 – 8,0 – 40 ppm d’hexachlorobenzène (ce qui correspond à des doses de 0 – 0,016 – 0,08 – 0,4 – 2 mg.kg-1.j-1) (Arnold et al., 1985). De cette étude, un NOAEL de 1,6 ppm et un LOAEL de 8,0 ppm sont déterminés pour l’atteinte hépatique chez les animaux de la génération F1, correspondant respectivement à des doses de 0,08 et 0,29 mg.kg-1.j-1.
Facteur d’incertitude : un facteur d’incertitude de 100 est appliqué qui correspond à un facteur de 10 pour les variabilités inter-espèces et un autre facteur de 10 pour la variabilité intra-espèce.
Calcul : 0,08 mg.kg-1.j-1 /100 = 0,0008 mg.kg-1.j-1 (8.10-4 mg.kg-1.j-1)
Indice de confiance : L’indice de confiance dans l’étude est moyen de même que dans la valeur élaborée et élevé pour la base de données.
Effets sans seuil - Exposition chronique par inhalation
L’US EPA a établi un ERUi de 4,6.10-4 (µg.m-3)-1 pour une exposition par inhalation à l’hexachlorobenzène (1996).
Cette valeur est estimée à partir des données d’exposition par voie orale par une extrapolation voie à voie. Elle n’est pas applicable pour des concentrations dans l’air supérieures à 20 µg.m-3. Aucune donnée complémentaire n’est mentionnée dans le document de l’US EPA.
En 2003, une revue de la littérature menée par l’US EPA n’a pas identifié de nouvelles données nécessitant une révision de cette valeur.
Indice de confiance : Cet organisme n’accorde pas d’indice de confiance à cette valeur.
Le RIVM a établi un CRinhalation provisoire de 0,75 µg.m-3 pour une exposition par inhalation à l’hexachlorobenzène (2001).
Cette valeur est dérivée directement de la valeur proposée pour la voie orale. Elle reste provisoire en raison de l’extrapolation voie à voie.
Indice de confiance : Cet organisme accorde un indice de confiance faible à cette valeur.
Effets sans seuil - Exposition chronique par voie orale
L’US EPA a établi un ERUo de 1,6 (mg.kg-1.j-1)-1 pour une exposition par voie orale à l’hexachlorobenzène (1996).
Cette valeur est établie à partir d’une relation dose-réponse chez le rat Sprague Dawley femelle pour la survenue de carcinomes hépatocellulaires (Ertürk et al., 1986). Le calcul de la dose est basé sur la consommation de nourriture et le poids corporel de l’animal. Les animaux pris en compte sont ceux qui ont survécu à la première année d’expérience et à partir de la survenue de la première tumeur. La méthode d’extrapolation est une linéarisation multi-étapes.
En 2003, une revue de la littérature menée par l’US EPA n’a pas identifié de nouvelles données nécessitant une révision de cette valeur.
L’US EPA propose également un ERUeau de 4,6.10-5 (µg.L-1)-1 pour une exposition par voie orale à l’HCB dans l’eau de boisson (1996). Cette valeur est estimée à partir des données d’exposition par voie orale. Elle n’est pas applicable pour des concentrations dans l’eau supérieures à 2.102 µg.L-1. Aucune donnée complémentaire n’est mentionnée dans le document de l’US EPA.
Incidence tumorale (carcinomes hépatocellulaires) chez les rats femelles exposées au cours de la première année à l’HCB (US EPA, 1996)

Le RIVM a établi un CRoral de 0,16 µg.kg-1.j-1 pour une exposition par voie orale à l’hexachlorobenzène (2001).
Cette valeur est établie à partir des études expérimentales de cancérogenèse sur une génération chez le rat (Arnold et al., 1985 ; Arnold et Krewski, 1988). A partir d’un modèle multi-étapes une valeur de TD5 de 0,81 mg.kg-1.j-1 pour la survenue de nodules néoplasiques hépatiques chez les femelles, est proposée par l’OMS IPCS (1997). Un facteur d’incertitude de 5 000 est appliqué (le détail de cette valeur n’est pas expliqué) et permet la détermination d’une valeur guide de 0,16 µg.kg-1. C’est cette valeur que propose de retenir le RIVM.
L’OMS a établi une DJT de 0,16 µg.kg-1.j-1 pour une exposition par voie orale à l’hexachlorobenzène (2022).
Cette valeur est établie à partir de l’étude expérimentale chez le rat sur deux générations de Crump et Howe (1982). Une dose tumorigène de 0,05 % ou TD5 de 0,81 mg.kg-1.j-1 pour la survenue de nodules néoplasiques chez les femelles est proposée par l’OMS IPCS (1997) jugée plus sensible que la TD5 de 2,01 mg.kg-1.j-1 pour les adénomes parathyroïdiens chez les mâles. Un facteur d’incertitude de 5 000 est appliqué (le détail de cette valeur n’est pas expliqué) et permet la détermination d’une valeur guide de 0,16 µg.kg-1.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). Klimisch et al. (1997) ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque. Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après : • Score 1 : valide (sans restriction) • Score 2 : valide avec restriction • Score 3 : non valide • Score 4 : pas suffisamment d'information pour valider le test On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC. Les tests pour lesquelles certaines informations non cruciales sont manquantes, ou pour lesquelles des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2). Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC. Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë
Algues:
Sur l’ensemble des essais de toxicité aiguë algues répertoriés, seuls les essais réalisés par Calamari et al. (1983) sur Selenastrum capricornutum et conduisant à une CL50 96 heures supérieure à
30 µg.L-1 sont compatibles avec les critères du TGD (CE, 1996) et peuvent être retenus. Ils ont été réalisés dans des flacons fermés avec suivi analytique de la concentration en HCB (Euro chlor, 2002).
Invertébres:
Neuf essais de toxicité aigüe sur invertébrés dulçaquicoles ont été répertoriés. Sur l’ensemble de ces données, quatre CL50 peuvent être considérées comme valides selon les critères du TGD. Les CL50 sont respectivement > 3,3 µg.L-1 sur Gammarus lacustris (Nebecker et al., 1989), > 5 µg.L-1 sur Daphnia magna (Nebecker et al., 1989), > 5,8 µg.L-1 sur Tanytarsus dissimilis (Call et al., 1983) et > 27 µg.L-1 sur Procambarus clarki (Laska et al., 1978).
Poissons:
Douze CL50 sur poissons dulçaquicoles ont été répertoriées. Toutefois dans la majorité des cas, les essais sont réalisés sur une durée trop courte ou en condition statique, sans précaution pour limiter la volatilisation de l’HCB et sans suivi analytique. De ce fait seul les essais de Call et al. (1983) peuvent être considérés comme compatibles avec les exigences du TGD. Dans ces essais, les CL50 96 heures sur Lepomis macrochirus et Oncorhynchus mykiss sont respectivement supérieures à 78 µg.L-1 et à 81 µg.L-1 .
Paramètres d'écotoxicité chronique
Algues :
En eau douce, 6 essais de toxicité chronique sur algues ont été répertoriés. En utilisant la CE12 comme une LOEC, puis en évaluant la NOECà partir de cette valeur (= 13,5 µg.L-1) , seuls les essais conduits par Calamari et al. (1983) sur Selenastrum capricornutum sont compatibles avec les critères du TGD et peuvent être retenus (Euro Chlor, 2002). Ceux-ci ont été réalisés dans des flacons fermés avec suivi analytique de la concentration en hexachlorobenzène (Environmental Quality Standards, 2005).
Invertébrés :
Treize essais sur organismes dulçaquicoles ont été répertoriés. Dans ces essais, les NOEC sont comprises entre 0,13 et 45 µg.L-1. Selon les rapports de l’Environmental Quality Standards (2005) et Euro Chlor (2002) seuls les essais de Scheubel (1984), Caspers et al. (1993) et Nebeker et al. (1989) peuvent être considérés comme compatibles avec les exigences du TGD.
Une NOEC vis-à-vis des organismes invertébrés de 0,13 µg.L-1 peut donc être retenue.
Poissons :
Sur poissons dulçaquicoles, 6 NOEC sont disponibles. Elles sont comprises entre 2 et 25,8 µg.L-1. La NOEC de ≥ 4,8 µg.L-1 peut être retenue en accord avec le TGD (Environmental Quality Standards, 2005 ; Euro Chlor, 2002). Cet essai a été réalisé par Ahmad et al. (1984) sur les stades embryo-larvaires du Pimephales promelas avec pour critères de toxicité le taux de survie, le taux d’éclosion et la croissance. Les animaux ont été exposés à l’hexachlorobenzène en milieu dynamique avec un suivi analytique des concentrations.
Eau marine
FDTE/VTR Importer Paramètres d’écotoxicité aiguë
Algues:
En eau de mer, l’étude rapportée par Biggs et al. (1979) a été réalisée sur une culture mixte de Thalassiosira pseudonana et Dunaliella tertiolecta. Il n'y a pas eu de moyen particulier pour limiter la volatilisation et les concentrations dans la solution d'essai n'ont pas été suivies analytiquement, il ne peut pas être considéré comme valide (BUA, 1993).
Invertébrés:
Dans l’essai de McLeese et Metcalfe (1980), une CL50 96 heures supérieure à 7,2 µg.L-1 est obtenue sur Crangon septemspinosa dans un essai pouvant être considéré comme valide. Sept essais sur invertébrés marins ont sinon été répertoriés. Les essais de Parrish et al. (1974) sur Palaemonetes pugio et Penaeus duorarum ont été réalisés en flux continu avec un suivi analytique. Les CL50 ainsi obtenues sont respectivement supérieures à 17 et 25 µg.L-1. Elles peuvent être considérées comme valides même si elles sont supérieures à la solubilité de l’HCB. L'HCB est donc probablement adsorbé à la surface cellulaire des algues.
Poissons:
En eau de mer, sur les 6 essais référencés, seuls les essais réalisés par Parrish et al. (1974) sont compatibles avec les exigences du TGD. Les deux études ont été conduites en flux continu avec mesures analytiques. Aucune mortalité n’a été observée après 96 heures d’exposition à la concentration la plus élevée testée. Les CL50 96 heures ainsi retenues sont supérieures à 8,4 µg.L-1 pour le Lagodon rhomboides et à 13,3 µg.L-1 pour le Cyprinodon variegatus.
Paramètres d'écotoxicité chronique
Algues :
En eau de mer, l’étude rapportée par Biggs et al. (1979) a été réalisée sur une culture mixte de Thalassiosira pseudonana et Dunaliella tertiolecta. L’essai ayant été effectué sans moyen particulier pour limiter la volatilisation et sans suivi analytique des concentrations dans la solution d'essai, il ne peut pas être considéré comme valide (BUA, 1993).
Invertébrés :
Un seul essai, réalisé par Anderson et al., (1981) donne une valeur de toxicité chronique pour des invertébrés marins. Ainsi une LOEC de 0,001 µg.L-1 a été obtenue pour le mollusque marin Mercenaria mercenaria après 18 semaines d’exposition (BUA, 1993).
Poissons:
Vis à vis des poissons marins, seule l’étude de Laska et al. (1978) est disponible et conduit à une NOEC de 5,7 µg.L-1. Toutefois, le temps d'exposition (10 jours) et le critère d'effet observé (survie) ne sont pas compatibles avec les recommandations du TGD pour les études chroniques.
Sédiments d'eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë
Trois essais sur des espèces benthiques ont été répertoriés. Dans ces essais, aucune mortalité n’a été observée à la plus forte concentration testée soit 4,7 µg.L-1 et 1 000 mg/kg pour Hyalella azteca (Nebeker et al., 1989) et les deux oligochètes Tubifex tubifex et Limnodrilus hoffmeisteri (Meller et al., 1998).
Paramètres d'écotoxicité chronique
Quatre essais chroniques sur des organismes benthiques dulçaquicoles. Dans ces essais, aucune mortalité n’a été observée après 14 jours d’exposition à la plus forte concentration testée soit 84 mg.kg-1 pour Chironomus tentans (Barber et al., 1997 ; Fuchsman et al., 1998) et Hyalella azteca (Barber et al., 1997 ; Fuchsman et al., 1998). Toutefois, les durées des essais ne sont pas suffisamment longues pour que ces valeurs puissent être utilisées.
Sédiments marins
FDTE/VTR Importer Paramètres d'écotoxicité chronique
Les NOEC obtenues dans les essais chroniques sur des organismes benthiques marins sont comprises entre 2,1 et 120 mg.kg-1 de sédiment normalisé à 2 % CO (Fuchsman et al., 1998). Comme pour les organismes dulçaquicoles, les durées des essais ne sont pas suffisamment longues pour que ces valeurs puissent être utilisées.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité aiguë
Aucun essai de toxicité aiguë sur organisme terrestre n’a été répertorié.
Paramètres d’écotoxicité chronique
Micro-organismes :
Selon le BUA (1993), une étude menée par Welp et Brümmer (1988) montre que l’utilisation de l’hexachlorobenzène comme fongicide n’a pas d’effet sur les bactéries aérobies du sol après 5 jours d’exposition à la concentration de 1 993 mg.kg-1 de sol. Les paramètres de mesure sont basés sur la réduction du Fe(III) et la production de gaz carbonique après l’addition de glucose.
De même, l’étude de Maas et al. (1988) montre que l’hexachlorobenzène à la concentration de 1 000 mg.kg-1 de sol n’a pas d’effet sur l’activité déshydrogénase après deux semaines d’exposition (BUA, 1993).
Végétaux :
Selon le BUA (1993), l’exposition à l’hexachlorobenzène à la concentration de 1 000 mg.kg-1 de sol durant 14 jours n’induit pas d’effet apparent sur l’avoine (Avena sativa L.) (Maas et al., 1988 ; Scheunert, 1984) ou sur le navet sauvage (Brassica rapa L.) (Maas et al., 1988; Scheubel, 1984; Scheunert, 1984).
Invertébrés :
Viswanathan (1984) et Scheubel (1984) montrent que l’hexachlorobenzène, aux concentrations de 100 mg.kg-1 de substrat sec et 1 000 mg.kg-1, n’a pas d’effet respectivement sur des vers de terre (espèces non spécifiées) âgés de 3 à 6 mois et sur Eisenia fetida. De plus aucun effet négatif n’a été observé sur le gain de poids et la production de cocons durant un test de 28 jours à la concentration de 1 000 mg.kg-1 (BUA, 1993).
Vertébrés :
Parmi les mammifères, les mustélidés semblent particulièrement sensibles à l’hexachlorobenzène. Ainsi, Van de Plassche (1994) rapporte une NOEC pour les mammifères comprise entre 0,5 et 88 mg.kg-1. La NOEC la plus faible est obtenue dans deux essais couvrant une période correspondant à une génération sur Mustela putorius et Mustela vision avec pour critère de toxicité la mortalité et la reproduction.
Vis-à-vis des oiseaux, Vos et al. (1972) montrent que dans un essai de 90 jours sur la caille (Coturnix c. japonica) la NOEC pour la reproduction est de 5 mg/kg mais que cette valeur n’est plus que de 1 mg.kg-1 lorsque le critère d’hépatotoxicité est retenu.
Valeurs écotoxicologiques
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Compartiment aquatique :
Des essais long terme sont disponibles avec trois espèces de trois niveaux trophiques. Un facteur d’extrapolation de 10 peut être appliqué au résultat de l’essai long terme sur daphnies pour évaluer la PNEC.
D’où : PNECEAU = 0,013 µg/L
Selon les essais répertoriés, la toxicité de l’hexachlorobenzène vis-à-vis des organismes marins est comparable à celle observée vis-à-vis des organismes d’eau douce. Il est proposé d’utiliser la PNEC eau douce comme PNEC eau marine.
Rejet intermittent compartiment aquatique :
Des essais de toxicité aiguë sont disponibles pour au moins trois espèces de trois niveaux trophiques différents.
En accord avec le TGD, une PNECeau intermittente peut être dérivée en utilisant un facteur de sécurité de 100 sur la plus faible CL50 ou CE50.
D’où : PNECEAU intermittente = 0,05 µg/L
Compartiment sédimentaire :
Les essais sur des organismes du sédiment sont trop peu nombreux pour dériver une PNEC à partir des essais écotoxicologiques. Pour ces organismes, la NOEC est comprise entre 84 et 120 mg/kg d’hexachlorobenzène
Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
PNECmes = (Kmes-eau/RHOmes) x (PNECeau/10) x 1 000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1 150 kg/m3)
PNECeau = Concentration prévue sans effet pour le compartiment aquatique ( µg/L)
Kmes-eau : Coefficient de partage entre les MES et l’eau (3 251 m3/m3)
=Feaumes + Fsolidmes x Kpmes / 1 000) x RHOsolid
Feaumes : Fraction d’eau dans le sol (défaut : 0,9 m3/m3)
Fsolidmes : Fraction solide dans les MES (défaut : 0,1 m3/m3)
Kpmes : Coefficient de partage eau-MES (13 000 L/kg)
10 : Facteur permettant la prise en compte d’une autre voie d’exposition pour des substances ayant un log Kow > 5.
D'où : PNECmes = 3,7 µg/kg MES humides = 16,90 µg/kg MES secs.
D'où :PNECmes = 16,90 µg/kg MES secs
Compartiment sol :
Une PNEC pour le compartiment sol peut être déterminée en utilisant la méthode du coefficient de partage (CE, 1996).
PNECsol = KSOL-EAU/RHOSOL ´ PNECEAU ´ 1 000
RHOsol = Densité du sol (humide) (valeur par défaut : 1 700 kg/m3)
PNECeau = Concentration prévue sans effet pour le compartiment aquatique (µg/L)
Ksol‑eau= Coefficient de partage sol eau (3 900 m3/m3)
= Fairsol ´ Kair-eau + FeauSol + FsolidSol ´ (KpSol /1 000) ´ RHOsolid
Kair-eau : Coefficient de partage entre l’air et l’eau (0,055)
Fairsol : Fraction d’air dans le sol (défaut : 0,2 m3/m3)
Feausol : Fraction d’eau dans le sol (défaut : 0,2 m3/m3)
Fsolidsol : Fraction solide dans le sol (défaut : 0,6 m3/m3)
Kpsol : Coefficient de partage eau-sol (2 600 L/kg)
RHOsolid : Densité de la phase solide (défaut 2 500 kg/m3)
10 : Facteur permettant la prise en compte d’une autre voie d’exposition pour des substances ayant un log Kow > 5.
D'où :
PNECSOL = 2,98 µg/kg sol humide = 3,38 µg/kg sol sec
D’où : PNECSOL = 3,38 µg/kg sol sec
Compartiment terrestre :
Pour l’hexachlorobenzène des études de toxicité chronique sur les oiseaux et mammifères ont été répertoriées. La NOECorale la plus faible est de 0,5 mg/kg. Elle a été obtenue sur le putois et le vison d’Amérique en utilisant comme critère d’effet la survie et la reproduction.
En accord avec le TGD, un facteur de sécurité de 30 peut être utilisé pour dériver une PNECorale.
D’où : PNECorale = 16,7 µg/kg de nourriture
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 118-74-1 |
|---|---|
| SANDRE | 1199 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer ClassificationL'hexachlorobenzène compte parmi les douze polluants organiques persistants (POP) de la Convention de Stockholm (2000) qui vise à réduire et/ou éliminer les rejets de ces substances dans l'environnement. À ce titre, il fait l'objet de contrôles internationaux. Il figure sur la liste des substances candidates de la stratégie OSPAR (1998). Il est classé cancérogène de catégorie 2. Phrases de risques : R25 R45 R48 R50 R53. Sécurité : S45 S53 S60 S61 Valeurs limites de rejet dans les eauxEn France, des valeurs limites de concentration et de flux dans les eaux superficielles sont fixées par arrêté pour les rejets d'hexachlorobenzène issus de la production de perchloréthylène (PER) et de tétrachlorométhane (CCl4) par perchloration et de la production de trichloréthylène (TRI) et de tétrachloréthylène par tout autre procédé1 :
|
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Production
L'hexachlorobenzène est interdit en France depuis 1988. En Europe, il n'est plus ni produit intentionnellement, ni commercialisé depuis 1993. Il peut être produit de façon involontaire au cours de certaines fabrications, principalement dans l'industrie du chlore et des solvants chlorés (cf. paragraphe 7.2.5) ou de l'incinération des déchets.
Les coûts associés à une suppression des rejets d'hexachlorobenzène sont liés à la recherche et à la mise en œuvre :
- de technologies de production permettant d'éviter ou de limiter la formation accidentelle de HCB ;
- de techniques de traitement des effluents.
Les informations collectées n'ont pas permis de quantifier l'impact économique de telles mesures.
Utilisations
Utilisation actuelle
FTE 2005 Importer
L'hexachlorobenzène ne connaît selon toute vraisemblance plus aucun usage en France et en Europe.
Utilisation historique
FTE 2005 Importer
L'hexachlorobenzène était utilisé jusqu'aux années 1980, surtout en tant que fongicide pour l'enrobage des semences et le traitement des sols. Ce produit avait aussi d'autres applications en France ou à l'étranger. Il intervenait dans plusieurs procédés industriels : comme agent fondant dans la fusion de l'aluminium, comme régulateur de porosité dans la fabrication d'électrodes en graphite, comme agent peptisant du caoutchouc. Il servait à la fabrication de produits militaires pyrotechniques et entrait dans la composition de produits
[1] Arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation.
de préservation du bois. Il était un intermédiaire de synthèse dans la production de certains caoutchoucs et de composés aromatiques chlorés.
Utilisation non intentionnelle
FTE 2005 Importer
L'hexachlorobenzène peut se retrouver comme impureté dans les solvants chlorés. Les teneurs résiduelles de HCB sont néanmoins très faibles : < 2 ppb dans le trichloréthylène et dans le perchloréthylène (WHO UPCS, 1997) ; < 20 ppb dans le trichloréthylène, le perchloréthylène et le tétrachlorométhane (HSIA, 1997) – données Eurochlor. À cause de son point d'ébullition élevé et de sa faible volatilité, les possibilités d'émission d'hexachlorobenzène à partir de ces solvants sont en outre minimes.
L'hexachlorobenzène pourrait être présent à l'état de trace dans certains pesticides (Ritter et al.) mais les informations collectées auprès de la profession n'ont pas confirmé ce fait. L'US EPA réglemente les teneurs en HCB dans plusieurs pesticides dont certains appartiennent encore à la liste des substances actives de la base « e phy » recensant les substances autorisées en France : chlorothalonil, piclorame, simazine. Une étude américaine estime les teneurs en hexachlorobenzène dans ces substances à 40 ppb, 50 ppb et 1 ppb respectivement [Bailey, 2001].
Rejets dans l’environnement
Rejets dans l'environnement
FTE 2005 Importer
Comparés à la pollution historique et aux émissions d'origine agricole, les rejets industriels sont considérés comme des sources mineures d'hexachlorobenzène dans l'environnement –air et eau – (Royal Haskoning, 2003). S'agissant de la contamination des eaux, une recherche documentaire et les contacts pris avec différents domaines d'activité ont permis d'identifier les sources suivantes :
Chimie
Des mesures effectuées en 1998/1999 dans les effluents de 168 établissements industriels de la région Rhône Alpes ont révélé la présence d'hexachlorobenzène dans les rejets de quatre sites de chimie organique et minérale (sur un total de 36 sites de chimie pétrochimie). Le flux journalier de HCB rejeté par ces établissements est de 36 grammes.
Deux activités sont notamment connues comme sources potentielles d'hexachlorobenzène :
- Solvants chlorés.
Les activités émettrices de HCB dans ce domaine sont :
- la production de perchloréthylène et de tétrachlorométhane (quantités significatives de HCB produit) ;
- la production de trichloréthylène (quantités très faibles de HCB produit, de l'ordre de la ppm).
L'utilisation comme matière première de résidus de production de monochlorure de vinyle (MVC) accroît les niveaux de HCB produits. Les rejets de HCB sont néanmoins faibles et en décroissance du fait des progrès technologiques accomplis (Eurochlor). Depuis 1985, Eurochlor a enregistré une baisse de 87 % des émissions de HCB dans les eaux et de 97 % des émissions de HCB dans l'air. Celles ci seraient respectivement de 100 kg.an-1 et de 4 kg.an-1 pour l'ensemble des membres d'Eurochlor. Eurochlor et l'ESCA participent à la mise en place du contrôle des émissions et des rejets, dans le cadre de l'application de la directive sur l'eau. En France Atofina et Solvay produisent du tétrachloréthylène, du trichloréthylène et du tétrachlorométhane (deux ou trois usines pour Atofina, une usine pour Solvay). D'autres régénèrent des solvants chlorés et produisent ainsi du trichloréthylène : Brabant chimie, Caldic (une usine chacun).
Remarque : Le marché des solvants chlorés en Europe occidentale est en décroissance : –11 % de baisse pour le trichloréthylène et –3,5 % pour le tétrachloréthylène de 1997 à 2002 (Eurochlor). Cette décroissance s'explique par l'amélioration du recyclage, par une meilleure maîtrise des solvants et par la récente classification du trichloréthylène comme substance cancérogène de catégorie 2.
- Monochlorure de vinyle (MVC).
La production de MVC est susceptible d'engendrer des rejets de HCB (Best Available Techniques for the Vinyl Chloride Industry, 1996, Source Screening, 2003). L'ECVM (conseil européen des producteurs de PVC) recommande une valeur limite d'émission dans les eaux de 10 Rg.m-3.
Pyrolyse de résidus chlorés
De l'hexachlorobenzène est détecté dans les effluents à de très faibles concentrations (< 100 Rg.l-1). À de telles teneurs, il est impossible d'envisager un traitement (SPMP).
Textile
La présence d'hexachlorobenzène dans les laines avant lavage est mentionnée dans le BREF textile : des teneurs totales en organochlorés (dont l'HCB) allant de 0,10 à 5,05 grammes par tonne de laine sale ont été mesurées (INTERLAINE, 1999). Cette contamination peut se retrouver dans les effluents aqueux avant traitement (le taux de pesticides rejetés dans les eaux est estimé à 70 % des pesticides extraits de la laine).
Autres
D'autres industries sont susceptibles de rejeter de l'hexachlorobenzène (Royal Haskoning, 2003) : production de caoutchouc synthétique, fabrication de produits pyrotechniques, auxquelles s'ajoute l'incinération de déchets.
Activités ne rejetant pas d'hexachlorobenzène, selon les informations fournies par les professions concernées :
- Production de magnésium.
En France, le magnésium est obtenu par réduction thermique par le silicium (procédé Magnétherm) et non pas par électrolyse de chlorure de magnésium (www.sfc.fr). En outre, l'hexachlorure n'est pas employé comme additif de couverture contre l'oxydation du magnésium (d'autres gaz sont utilisés).
- Fabrication de PVC.
Substance indétectable dans les effluents des ateliers (source : SPMP).
- Fabrication de produits phytosanitaires.
L'HCB n'est pas recensé parmi les sous produits de fabrication d'après les spécialistes du domaine contactés par l'union des industries de la protection des plantes.
- Chlore et soude.
Les électrodes en graphite, sources de carbone, sont remplacées par des électrodes en métal (BREF chlore et soude).
Apports à partir de l'atmosphère
Le dépôt de HCB sur les eaux de surface est considéré comme une voie d'apport mineure (Existing and future controls (…), 2003). Dans les océans, le dépôt de HCB à partir de l'atmosphère représenterait cependant 70 % des apports de cette substance. Le dépôt annuel de HCB mesuré de novembre 1999 à octobre 2000 sur cinq villes françaises (Pleumeur –27–, Paris –75–, Coulommiers –77–, Eclaron –52– et Abreschviller –57–) varie entre 1,4 Rg.m 2.an 1 (Pleumeur) et 3,5 Rg.m 2.an 1 (Coulommiers). Il était estimé à 4,4 Rg.m 2.an 1 en 1992 à Paris (Garban et al., 2003).
Selon les données du CITEPA, les émissions atmosphériques de HCB en France depuis 1990 varient entre 1 600 et 1 800 kg (1 763 kg pour l'année 2001). La production d'aluminium de seconde fusion représente 72 % de ces émissions (année 2001). Le deuxième émetteur est l'incinération des déchets (27,6 %) et le troisième émetteur est le transport routier (0,4 %). L'émission de composés organiques chlorés lors de la production d'aluminium secondaire s'explique par la combustion incomplète de la matière organique contenue dans le matériau refondu et par l'utilisation de mélanges chlorés (pour le dégazage) et de chlorures (pour prévenir l'oxydation et absorber les impuretés).
Notons que l'aluminium secondaire, issu du recyclage, représente une part significative de la production totale française d'aluminium.
Production d'aluminium de première et de seconde fusions (en kilotonnes)

Les entreprises de recyclage de l'aluminium comprennent les producteurs d'alliages de fonderie (affineurs) et les producteurs d'alliages de corroyage (remelters). En Europe occidentale, il existe 165 affineurs et 110 remelters (2001). En 2001, on dénombrait en France 21 affineurs, dont deux produisent plus de 50 000 tonnes par an et huit produisent entre 10 000 et 40 000 tonnes par an.
Apports agricoles
Quoique l'hexachlorobenzène ne soit plus employé comme fongicide en Europe, les rejets liés aux activités agricoles représenteraient une source majeure d'hexachlorobenzène dans les eaux (via le dépôt, la lixiviation, l'érosion et le ruissellement, le drainage) (Royal Haskoning, 2003). Ils proviendraient de la contamination des pesticides par l'hexachlorobenzène.
Présence environnementale
Aquatique
FTE 2005 Importer
Dans le Rhin, l'hexachlorobenzène est considéré comme substance prioritaire depuis 1987. De 1990 à 1996, les teneurs en hexachlorobenzène étaient supérieures à l'objectif de référence dans la majorité des stations mesurant cette substance dans les eaux du Rhin (sauf à la station de Village Neuf en Alsace et de Mosel en Allemagne). Alors qu'en 1997 et 1998 ces concentrations ont sensiblement diminué, s'approchant de l'objectif de 0,001 Rg.l-1, elles ont de nouveau augmenté en 1999 en raison d'une succession exceptionnelle de crues et de la remise en suspension de sédiments que celles ci ont provoquée. En 2000, l'évolution des concentrations est revenue à la baisse.
Contamination des eaux par HCB en France

Norme française pour la qualité de l'eau potable : 0,01 Rg.l-1.
Norme de l'US EPA pour la qualité de l'eau potable : 0,001 Rg.l-1.
Valeur guide de l'OMS pour la qualité de l'eau potable : 1 Rg.l-1.
L'HCB a fait l'objet d'une surveillance dans le cadre de la Commission OSPAR pour la protection du milieu marin de l'Atlantique Nord Est. Les concentrations de HCB mesurées dans un petit nombre d'échantillons d'eau de mer sont de quelques ng.l-1 voire sont inférieures au seuil de détection. Ainsi, dans les eaux côtières de la Manche, les concentrations de HCB étaient comprises entre 1 et 10 ng.l-1 (1995 1996, Eurochlor). Ces faibles valeurs s'expliquent par le caractère hydrophobe de la substance. En revanche, de hautes teneurs en HCB sont signalées dans les sédiments de l'estuaire de l'Escaut.
Perspectives de réduction
Réduction des rejets
Techniques de traitement dans les effluents industriels
FTE 2005 Importer
Différentes techniques sont capables de réduire les concentrations d'hexachlorobenzène dans les eaux usées d'origine industrielle ou domestique.
Le document Meilleures Techniques Disponibles dans l'industrie du chlorure de vinyle (OSPAR, 1998) indique que :
- les concentrations maximales d'hexachlorobenzène dans les effluents de sites de production appliquant les meilleures techniques disponibles sont de 10 Rg.l-1 ;
- ces teneurs maximales n'excèdent pas 1 Rg.l-1 si les eaux sont traitées par voie biologique.
Dans les eaux usées, le taux d'élimination de l'hexachlorobenzène sous influence de la coagulation est de 59 % (BREF Traitement des eaux).
Procédés de production ou modalités d'usage permettant de réduire les rejets
FTE 2005 Importer
Solvants chlorés (réduction des rejets atmosphériques et aqueux)
Selon les données d'Eurochlor les mesures mises en place ont permis une réduction significative des rejets.
Textiles
Pour un meilleur contrôle des émissions de polluants, le document BREF Industrie des textiles incite les fabricants de textiles à s'informer auprès de leurs fournisseurs sur les caractéristiques des substances qui ont servi à traiter les fibres (agents de préparation, pesticides, etc.).
Aluminium (réduction des rejets atmosphériques)
Des techniques permettant de réduire les émissions polluantes sont proposées dans le document BREF Industrie des métaux non ferreux. Leur mise en place a nécessairement un coût pour le producteur mais des améliorations de rendement et des économies d'énergie sont possibles. Aucune donnée propre à la réduction des émissions d'hexachlorobenzène n'est fournie.
Conclusion
FTE 2005 Importer
Capable d'être transporté sur de longues distances, l'hexachlorobenzène compte parmi les polluants organiques persistants de la Convention de Stockholm. Anciennement utilisé comme fongicide, l'hexachlorobenzène (HCB) n'est plus fabriqué ni commercialisé en Europe mais il peut être un sous produit involontaire de certaines activités, par exemple de la fabrication de solvants chlorés. Les dépôts atmosphériques et les pollutions résiduelles sont aussi des sources d'hexachlorobenzène dans les eaux de surface.
Ses émissions ont beaucoup décru et les sources résiduelles, notamment celles liées à la fabrication de solvants chlorés, sont également en baisse.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










