Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Ethylbenzène (100-41-4)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
100-41-4
Nom scientifique (FR)
Ethylbenzène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
202-849-4
Code SANDRE
1497
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C8H10 }\)
Code InChlKey
Code SMILES
c(cccc1)(c1)CC
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP06
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H225 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs très inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H332 |
|---|---|
| Mention du danger - Texte | Nocif par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H304 |
|---|---|
| Mention du danger - Texte | Peut être mortel en cas d'ingestion et de pénétration dans les voies respiratoires |
| Classe(s) de dangers | Danger par aspiration |
| Libellé UE du danger | - |
| Mention du danger - Code | H373 |
|---|---|
| Mention du danger - Texte | Risque présumé d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
106.00 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 09/09/2025
Matrices
Atmosphère
Compte tenu de ses caractéristiques physico-chimiques, l'éthylbenzène est uniquement sous forme vapeur lorsqu'il est présent dans l'atmosphère.
Milieu eau douce
Volatilisation :
Au vu de la valeur de sa constante de Henry (617 Pa.m3.mol-1) estimée, l'éthylbenzène semble être volatile en solution aqueuse. (E.C., 2007)
Dans l'eau, l'éthylbenzène possède les caractéristiques physico-chimiques requises pour s'adsorber sur la phase particulaire.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Adsorption :
D'après le Koc (431.8 L.kg-1), la substance semble être modérément adsorbable. (E.C., 2007)
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
La mobilité de l'éthylbenzène dans les sols est modérée. Compte tenu de sa constante de Henry, la volatilisation de l’éthylbenzène dans les sols humides est un processus significatif.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Biodégradabilité facile :
L'éthylbenzène est considéré comme facilement biodégradable (temps de demi-vie égal à 15 jours). (E.C., 2007)
L’éthylbenzène est facilement biodégradable puisque :
- 50 % de dégradation ont été observés après 28 jours lors d’un essai respirométrique : (BOD/ThOD) (BASF, 1988a),
- 68 % de dégradation ont été observés après 33 jours lors d’un deuxième essai respirométrique (BOD/ThOD) (BASF, 1988b).
De plus, un essai de biodégradabilité inhérente a démontré que la substance était dégradable : 81-126 % de dégradation ont été observés après 14 jours lors d’un essai MITI II (méthode OCDE 301C) (CITI, 1992).
Eaux de surface :
La dissipation de l’éthylbenzène a été mesurée dans un essai mésocosme. A une concentration initiale de 3,3 µg/L et à des températures de 3 à 7°C, 8 à 16°C et 20 à 22 °C, la demi-vie était respectivement de 13, 20 et 2,1 jours (Wakeham et al., 1983).
Comme ces résultats incluent l’élimination par volatilisation, la demi-vie par biodégradation dans l’eau de surface peut être estimée en première approche à 40 jours.
Sol :
Aucune information n’est disponible.
Milieu anaérobie :
En 63 jours et en présence de bactéries dénitrifiantes, une dégradation de l’éthylbenzène est observée (Hutchins et al., 1991). Les produits de cette dégradation ne sont pas connus.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse :
Aucune réaction d'hydrolyse n'est attendue en conditions environnementales. (E.C., 2007).
Photolyse :
Aucune photolyse directe n'est attendue en conditions environnementales. (E.C., 2007)
Dans l’air, l’éthylbenzène est principalement dégradé en réagissant avec les radicaux hydroxyles formés lors de réactions photochimiques. En effet, après 2,9 jours, la substance a été entièrement dégradée (Wagner et al., 1984).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Plusieurs résultats d'essais sont disponibles :
Poissons :
- Oncorhynchus mykiss (42 jours) BCF : 1 (Roubal et al., 1978)
- Platichthys stellatus (42 jours) BCF : 4 (Roubal et al., 1978)
Mollusques :
- Tapes semidecussa (2-8 jours) BCF : 4-5 (Nunes et Benville, 1979)
Les essais sur poissons et mollusques ont montré que les facteurs de bioaccumulation étaient très faibles. L’éthylbenzène n’est donc pas considéré comme une substance bioaccumulable pour ces espèces. Le BCF calculé à partir du Kow et d’une relation QSAR telle que proposée par la Commission Européenne (CE, 1996) est de 91.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucun résultat d'essai valide n'a pu être trouvé dans la littérature.
Conclusion sur la bioaccumulation
Bioaccumulation :
La valeur de BCF de 91 calculé à partir du log Kow (3.13) utilisée dans l'évaluation des risques européenne de l'éthylbenzène est retenue pour la détermination des normes de qualité.(ECB., 2007)
Bibliographie
Toxicologie
Dernière vérification le 09/09/2025
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1999 , 2010 ; IARC, 2000 ; IARC, 1987 ; OMS IPCS, 1996, OMS, 2003, 2017; US EPA (IRIS), 1991); Santé Canada, 2016; ANSES, 2016). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation:
Les études humaines sur l’inhalation d’éthylbenzène ont montré qu’il est rapidement absorbé (Tardif et al, 1997; Knecht et al., 2000). Le taux d’absorption de l’éthylbenzène inhalé pendant 8 heures par des volontaires sains à des concentrations de 23, 43, 46 et 86 ppm (101,4, 189,6, 202,8 et 379,2 mg.m-3) varie de 49 à 64 % (Bardodej et Cirek, 1988). L’inhalation est la plus grande source d’exposition chez l’Homme (99 %) (Tang et al., 2000).
Voie orale:
Aucune donnée concernant l’absorption de l’éthylbenzène par voie orale n’est disponible chez l’Homme.
Voie cutanée:
Par voie cutanée, l’éthylbenzène sous forme de vapeur est très mal absorbé. En effet, chez des volontaires sains, les taux des métabolites de l’éthylbenzène présents dans les urines sont identiques à celui de personnes non exposées. L’éthylbenzène sous forme liquide ou dispersé dans l'eau est, par contre, facilement absorbé par voie cutanée. Le taux d’absorption par voie cutanée est compris entre 24 et 33 mg.cm-2.h-1 pour l’éthylbenzène liquide et de 0,11 à 0,23 mg.cm-2.h-1 pour l’éthylbenzène en solution aqueuse (Dutkiewicz et Tyras, 1967). La quantité moyenne d’éthylbenzène absorbée chez 6 volontaires sains ayant immergé une de leurs mains pendant 2 heures dans une solution aqueuse d’éthylbenzène contenant 112 ou 156 ppm (493 ou 688 mg.m-3) d’éthylbenzène est respectivement de 39,2 et de 70,7 mg (Gromiec et Piotrowski, 1984).
Distribution
FDTE/VTR Importer Chez l’Homme, aucune donnée concernant la distribution de l’éthylbenzène n’est disponible, quelle que soit la voie d'absorption. Toutefois, les études in vitro suggèrent que la répartition de l’éthylbenzène absorbé par inhalation soit similaire à celle observée chez le rat, c’est-à-dire distribué dans tout l’organisme (Pierce et al., 1996). La demi-vie plasmatique de l’éthylbenzène est estimée à 27,5 heures chez un homme décédé après une exposition massive à l’essence (Matsumoto et al., 1992). Il a aussi été établi que l’éthylbenzène traverse la barrière placentaire chez l’humain (OMS, 2003a; INRS, 2008).
L’éthylbenzène a été détecté, mais non quantifié, dans le lait maternel chez 8 des 17 mères exposées à une atmosphère urbaine aux Etats-Unis (Pellizzari et al., 1982).
Métabolisme
FDTE/VTR Importer Des études réalisées chez l’Homme et chez l’animal ainsi que des études in vitro ont permis de schématiser le métabolisme de l’éthylbenzène chez l’Homme (Engstrom et al., 1984). Dans un premier temps, la chaîne CH2CH3 de l’éthylbenzène est hydroxylée, conduisant à la formation du 1-phényléthanol. Cette hydroxylation met en jeu les cytochromes P-450 (CYP)2E1 et 2B6 (Filipovic et al., 1992 ; McMahon et al., 1969 ; (Sams et al., 2004). Le 1-phényléthanol est ensuite oxydé en acétophénone et cette oxydation est suivie d'une succession d'oxydations conduisant à la formation du 2–hydroxyacétophénone, du 1-phényl-1,2-éthanediol, de l'acide mandélique (64 %) et de l'acide phénylglyoxylique (25 %), ces deux derniers composés étant également des métabolites du styrène. Tous ces dérivés hydroxylés de l'éthylbenzène se conjuguent avec des glucuronides et des sulfates, et ces complexes sont éliminés dans les urines. Il s’agit en réalité d’une étape mineure de la dégradation de l’éthylbenzène (ATSDR, 2010).
Chez 4 volontaires exposés à 150 ppm (662 mg.m-3) d’éthylbenzène, les 2 acides mandélique et phénylglyoxylique représentent 90 % des métabolites, les 10 % restant étant représentés par le 4-éthylphénol, la p-hydroxyacétophénone et la m-hydroxyacétophénone (Engstrom et al., 1984). D’autres études confirment que chez l’Homme l’acide mandélique (environ 64-71 %) et l’acide phénylglyoxylique (environ 19-25 %) sont les deux principaux métabolites ( Knecht et al., 2000; Jang et al., 2001) .Ils font également l’objet d’un suivi de l’exposition croisée à l’éthylbenzène et au styrène dans le cadre de l’étude National Health and Nutrition Examination Survey (NHANES) sur le suivi de la population américaine, avec des concentrations urinaires particulièrement élevées chez les fumeurs (Capella et al., 2019)
Schématisation du métabolisme de l’éthylbenzène (d’après OEHHA, 2007) :

Élimination
FDTE/VTR Importer Inhalation:
La différence entre le taux d’acide mandélique excrété après absorption de l'éthylbenzène par inhalation (64 à 71 %) (Bardodej et Bardodejova, 1970 ; Engstrom et al., 1984) et par voie cutanée (4,6 %) (Dutkiewicz et Tyras, 1967) laisse penser à des voies métaboliques différentes de l’éthylbenzène lorsqu’il est absorbé par ces 2 voies respectives.
La majorité de l’éthylbenzène absorbé est excrété sous forme d’acide mandélique et de phénylglyoxylique dans les urines. L’excrétion d’acide mandélique est biphasique (3,1 et 24,5 heures) (Gromiec et Piotrowski, 1984).
L’étude de Holz et al. compare la concentration des métabolites de l’éthylbenzène dans les urines chez 25 salariés exposés à de faibles concentrations d’éthylbenzène comprises entre 365 µg.m-3 (0,08 ppm) et 2 340 µg.m-3 (0,53 ppm) et chez 25 salariés peu exposés employés dans la même compagnie, c’est-à-dire respirant des concentrations d’éthylbenzène comprises entre 145 µg.m-3 (0,03 ppm) et 290 µg.m-3 (0,06 ppm)(Holz et al., 1995). En fin de poste, les concentrations des métabolites de l’éthylbenzène dans les urines sont supérieures chez les salariés exposés à l’éthylbenzène. La concentration des métabolites dans les échantillons d’urines des salariés exposés à l’éthylbenzène sont de 43,9 mg.g-1 de créatinine pour l’acide mandélique et de 22,3 mg.g-1 de créatinine pour l’acide phénylglyoxylique, alors qu’elle est de 4,3 mg.g-1 de créatinine pour l’acide mandélique et de 0,5 mg.g-1 de créatinine pour l’acide phénylglyoxylique chez les salariés non exposés. De la même façon, en début de poste, la concentration des métabolites de l’éthylbenzène est supérieure chez les salariés exposés à l’éthylbenzène. Les concentrations sont de 13,3 mg.g-1 de créatinine pour l’acide mandélique et de 10,7 mg.g-1 de créatinine pour l’acide phénylglyoxylique chez les salariés exposés à l’éthylbenzène, alors qu’elles sont de 5,5 mg.g-1 de créatinine pour l’acide mandélique et de 2,8 mg.g-1 de créatinine pour l’acide phénylglyoxylique chez les salariés non exposés à l’éthylbenzène.
Enfin, la concentration d’éthylbenzène mesurée dans l’atmosphère de travail (moyenne de 9,3 mg.m-3 (2,14 ppm) et un maximum de 200 mg.m-3, (46 ppm) a pu être directement corrélé à la concentration urinaire d’éthylbenzène non métabolisé (moyenne de 4,6 µg.L-1 et un maximum de 38,7 µg.L-1) dans les urines de 49 travailleurs en fin de poste exposés professionnellement à l’éthylbenzène (Kawai et al., 2019).
Quatre à cinq pour cent de l’éthylbenzène absorbé sont exhalés sans transformation (Astrand et al., 1978).
Voie orale:
Aucune donnée ne traite de l’excrétion des métabolites de l’éthylbenzène absorbé par voie orale chez l’Homme.
Voie cutanée:
Très peu d’informations concernant l'élimination de l'éthylbenzène absorbé par voie cutanée sont disponibles. Cependant, il a été montré que le pourcentage d’acide mandélique excrété dans les urines après absorption de l’éthylbenzène par voie cutanée est de 4,6 % (Dutkiewicz et Tyras, 1967).
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation :
Chez l’animal, l’éthylbenzène est absorbé principalement par voie orale et, à un moindre degré, par voie pulmonaire. Comme chez l’Homme, l’absorption cutanée est importante pour l’éthylbenzène liquide.
Le taux d’absorption de l’éthylbenzène, chez des rats Harlan-Wistar exposés par inhalation à de l’éthylbenzène radiomarqué, est de 44 % (Chin et al., 1980b). Ce résultat est similaire à ceux obtenus chez l’Homme. L’absorption varie d’une espèce à l’autre. La concentration sanguine en éthylbenzène est de 6 µg.mL-1 chez le rat et de < 2 µg.mL-1 chez le cobaye pour des expositions de 3 jours (8 heures par jour) (Cappaert et al., 2000). Chez la souris, la concentration à l’équilibre est obtenue dans les deux heures suivant l’exposition et est approximativement de 0,71 mg.L-1 à 75 ppm (330 mg.m-3), 2,3 mg.L-1 à 200 ppm (882 mg.m-3) et 20 mg.L-1 à 500 ppm (2 205 mg.m-3) (Charest-Tardif et al., 2006). Enfin, il a été montré que les concentrations sanguines chez les rats adultes et les nouveau-nés étaient proportionnelles au niveau d’exposition (Faber et al., 2006).
Voie orale :
Par voie orale, l'éthylbenzène est rapidement et facilement absorbé. Le taux des métabolites de l’éthylbenzène retrouvé dans les urines de lapin, 24 heures après administration par voie orale à 593 mg.kg-1 d’éthylbenzène, représente 72 à 92 % de la dose administrée (El Masri et al., 1956). De même, 48 heures après administration d’une simple dose d’éthylbenzène radiomarqué (30 mg.kg-1), 84 % de la radioactivité sont retrouvés dans les urines des rates Wistar exposées (Climie et al., 1983).
Voie cutanée :
Dans une étude plus récente, la concentration en éthylbenzène dans le sang de rats Fischer 344 exposés par voie cutanée a été mesurée 0,5 - 1 - 2 - 4 - 8 -12 - 24 heures après le début de l’exposition. Les rats ont été exposés pendant 24 heures à de l’éthylbenzène liquide pur, à de l’eau saturée en éthylbenzène (134 µg.mL-1), à de l’eau saturée au 2/3 d’éthylbenzène (84 µg.mL-1) ou à de l’eau saturée au 1/3 d’éthylbenzène (47 µg.mL-1). Un pic d’éthylbenzène à 5,6 µg.mL-1 est atteint une heure après l’exposition à l’éthylbenzène pur. Ce pic est suivi d’une baisse de la concentration en éthylbenzène dans le sang 2 - 4 - 8 - 12 - 24 heures après l’exposition. Vingt-quatre heures après l’exposition, le volume d’éthylbenzène absorbé par voie cutanée est respectivement de 0,24, 0,20, 0,18 et 0,17 mL pour l’éthylbenzène pur, l’eau saturée, l’eau saturée au 2/3 d’éthylbenzène et l’eau saturée au 1/3 d’éthylbenzène (Morgan et al., 1991). Chez la souris, le taux d’absorption cutanée est estimé à 37 µg.cm-2.min-1 (Susten et al., 1990).
In vitro, l’absorption de l’éthylbenzène liquide a été calculée 3, 4 et 5 heures après application d’éthylbenzène sur la peau excisée de rats. Le flux d’absorption de l’éthylbenzène liquide est respectivement de 0,002 - 0,003 - 0,004 mg.cm-2.h-1. Le flux d’absorption de l’éthylbenzène liquide est plus faible chez le rat que chez l’Homme (Tsuruta, 1982).
Distribution
FDTE/VTR Importer Inhalation :
Chez l’animal, la distribution de l’éthylbenzène après son absorption par inhalation se fait à travers tout l’organisme (Chin et al., 1980b). Chez le rat, après une exposition de 6 heures par inhalation à de l’éthylbenzène radiomarqué, la quantité la plus importante de radioactivité, 42 heures après l’exposition, a été trouvée dans le foie, le tractus gastro-intestinal et dans la carcasse. Une quantité plus faible de radioactivité a été trouvée dans le tissu adipeux (Chin et al., 1980b).
Voie orale :
Aucune étude ne traite de la distribution dans l’organisme de l’éthylbenzène absorbé par voie orale.
Voie cutanée :
Après une application cutanée d’éthylbenzène radioactif chez des souris rasées, 65,5 % de la dose appliquée sont retrouvés dans les excrétas, 15,5 % dans la carcasse, 14,3 % dans l’air expiré et 4,5 % au niveau de la zone cutanée où a été appliqué l’éthylbenzène (Susten et al., 1990).
Métabolisme
FDTE/VTR Importer Chez l’animal, les métabolites principaux de l’éthylbenzène ainsi que le pourcentage de chaque métabolite formé varient en fonction de l’espèce étudiée. Chez les rats exposés par inhalation ou par voie orale à l’éthylbenzène, les métabolites principaux sont les acides benzoïque et hippurique (38 %), le 1-phényléthanol (25 %), l’acide mandélique (12,5 %) et l’acide phénylglyoxylique (10 %) (Climie et al., 1983 ; Engstrom et al., 1984; Engstrom et al., 1985 ; Zhang et al., 2010). Des études in vivo chez le rat et des études in vitro sur des microsomes de foie de rats ont montré que la dégradation de l’éthylbenzène induisait également la formation du 4-éthylphénol (Bakke et Scheline, 1970 ; Kaubisch et al., 1972). L’acétophénone est considérée comme le précurseur de l’acide mandélique, de l’acide benzoylformique et de l’acide benzoïque. La plupart de ces intermédiaires sont conjugués à des glucuronides ou à des sulfates et sont excrétés.
Chez les lapins, les métabolites les plus importants de l’éthylbenzène sont l’acide hippurique qui est probablement formé après la décarboxylation oxydative de l’acide phénylglyoxylique et les glucoronides conjugués (El Masri et al., 1958). Des études au cours desquelles des lapins ont été exposés par voie orale à l’éthylbenzène ont montré que la voie principale du métabolisme de l’éthylbenzène est l’hydroxylation de l'alpha-carbone en 1-phényléthanol (El Masri et al., 1956 ; Smith et al., 1954a). Ce composé est ensuite oxydé en plusieurs intermédiaires et métabolites.
L'étude de Nakajima et Sato (1979) suggère une différence dans le métabolisme de l’éthylbenzène en fonction du sexe de l’animal. En effet, la vitesse du métabolisme est plus importante chez des rats mâles à jeun que chez des rates à jeun. Cependant, cette différence n’a pas été mise en évidence chez les animaux ayant reçu une alimentation normale. Ces différences de métabolisation peuvent s’expliquer par des différences de distribution des CYP selon les organes et les espèces animales. Une étude in vitro a montré, chez le rat et la souris, que les cytochromes pulmonaires 2E1 et 2F2 contribueraient à la formation de métabolites réactifs alors qu’au niveau hépatique, seuls les cytochromes 2E1 seraient impliqués (Saghir et al., 2010). Cette métabolisation d’origine pulmonaire pourrait expliquer au moins en partie que, par inhalation, la clairance de l’éthylbenzène soit plus rapide chez la souris que chez le rat ou l’humain (Nong et al., 2007).
Les capacités de métabolisation de l’éthylbenzène sont saturables (Charest-Tardif et al., 2006).
Élimination
FDTE/VTR Importer Chez l’animal, les métabolites formés après absorption d'éthylbenzène par inhalation ou par voie orale sont rapidement excrétés dans les 24 à 48 heures, très majoritairement (60 à 91%) dans les urines (Chin et al., 1980a, Chin et al., 1980b ; Engstrom et al., 1984, Engstrom et al., 1985 ; Climie et al., 1983) mais également, dans une moindre mesure, dans les excréments et l’air exhalé sous forme de dioxyde de carbone (Chin et al., 1980b). Treize pour cent de la dose inhalée sont éliminés pendant les 6 premières heures de l’exposition (Engstrom et al., 1984).
Le métabolite majeur est l’acide mandélique (23 %) suivi de l’acide hippurique, alors que le 1-phényléthyl glucuronide est considéré comme un métabolite mineur. Chez le rat, les métabolites largement excrétés dans les urines sont l’acide mandélique, l’acide hippurique et l’acide phénylglyoxylique, alors que chez les lapins, des glucuronides conjugués sont excrétés en quantité importante (El Masri et al., 1956 ; Smith et al., 1954a, 1954b). Chez les lapins, les glucuronides conjugués excrétés dans les urines représentent 32 % de la dose administrée alors que l’acide mandélique excrété représente 2 % de la dose administrée (El Masri et al., 1956). Ces résultats confirment ceux obtenus par Smith et Williams (1954a, 1954b) qui ont mesuré que 32 %, de la dose administrée d’éthylbenzène chez des lapins, sont excrétés sous forme de glucuronides conjugués dans les urines.
Après une application cutanée d'éthylbenzène chez des souris rasées, l'étude de Susten et al. (1990) a montré que 65,5 % de la dose absorbée étaient retrouvés dans les excrétions et 14,3 % dans l'air expiré.
Synthèse
FDTE/VTR Importer Chez l’Homme, l’éthylbenzène est principalement absorbé par inhalation et par voie cutanée. Une faible part d’éthylbenzène inhalé est exhalé sans transformation. Par voie cutanée, l’éthylbenzène est facilement absorbé sous forme liquide. L’acide mandélique et l’acide phénylglyoxylique forment 90 % des métabolites produits par voie oxydative mettant en jeu les CYP qui sont excrétés dans les urines, les 10 % restant sont des dérivés conjugués avec des sulfates et des glucuronides.
Chez l’animal, l’éthylbenzène est facilement absorbé par voie orale, par voie cutanée et par inhalation. L’éthylbenzène se distribue dans tout l’organisme, majoritairement dans le foie, le tractus gastrointestinal et les os. En plus des métabolites déjà décrits chez l’Homme, d’autres métabolites sont identifiés : l’acide hippurique, l’acide benzoïque et le 1-phényléthanol. L’élimination des métabolites est urinaire.
Equivalents biosurveillance
Description
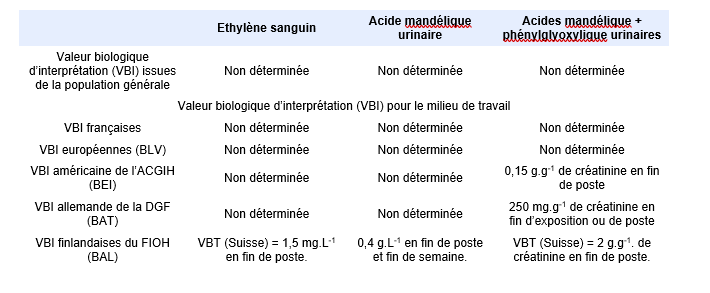
FDTE/VTR Importer Synthèse des principales valeurs biologiques d’interprétation (Biotox, 2021)
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Le principal effet des vapeurs d’éthylbenzène est l’irritation des yeux, du nez et des muqueuses à des concentrations d’environ 200 ppm. Les concentrations les plus élevées peuvent entraîner une dépression du système nerveux central et des atteintes transitoires hépatiques et rénales.
Après exposition à 1 000 ppm (4 410 mg.m-3), 6 volontaires sains ont présenté une sévère irritation des yeux et un larmoiement, ces signes diminuant d’intensité après 1 à 2 minutes (Yant et al., 1930). Pour les mêmes sujets exposés à 2 000 ppm, l’exposition est intolérable mais l’irritation diminue avec la persistance de l’exposition. Un volontaire resté 5 minutes dans la chambre d’exposition rapporte que l’irritation des yeux et de la gorge disparaît graduellement mais que des vertiges apparaissent. A 2 000 ppm (8 820 mg.m-3), les volontaires se plaignent aussi d’une sensation d’oppression thoracique. Une exposition pendant 6 minutes à 2 000 ppm, est accompagnée pour 4 sujets d’une irritation modérée du nez, et modérée à forte des yeux. Des vertiges surviennent à la sortie de la chambre d'exposition. Trois volontaires exposés à 5 000 ppm (22 g.m-3) se sont plaints d’une irritation insupportable des yeux, du nez et de la gorge. Cette étude est toutefois limitée car l’éthylbenzène respiré contenait des impuretés (benzol et diéthylbenzène) et la durée d’exposition entraînant les symptômes n’est pas clairement indiquée.
Une irritation des yeux a également été observée chez des Hommes exposés de façon aiguë par inhalation à des vapeurs d’éthylbenzène (Cometto Muniz et Cain, 1995). Cette irritation survenait à partir de 10 000 ppm (44,1 g.m-3) d’éthylbenzène. Neuf sujets exposés pendant 8 heures à 100 ppm (441 mg.m-3) d’éthylbenzène ne se sont pas plaints, alors que 11 sujets exposés à 180 ppm (794 mg.m-3) ont présenté une irritation conjonctivale et des voies respiratoires (Bardody, 1961). De plus, ces onze sujets se sont plaints de céphalées et de somnolence. Enfin, dans une étude où un homme et une femme furent exposés pendant 15 minutes dans une chambre d’inhalation à 55,3 ppm (244 mg.m-3) d‘éthylbenzène, aucun effet respiratoire n’a été observé (Moscato et al., 1987).
Voie orale
FDTE/VTR Importer Aucune donnée concernant les effets induits par une exposition aiguë par voie orale à l’éthylbenzène n’est disponible chez l’Homme.
Voie cutanée
FDTE/VTR Importer Chez l’Homme, il n’y a pas d'étude traitant de l’effet seul de l’éthylbenzène après une application cutanée.
Synthèse
FDTE/VTR Importer Chez l’Homme, les vapeurs d’éthylbenzène sont irritantes pour les yeux, le nez et les muqueuses. Les concentrations les plus élevées peuvent entraîner une dépression du système nerveux central et des atteintes transitoires hépatiques et rénales. Aucune donnée n’existe concernant les effets induits lors d’une exposition aiguë par voie orale ou cutanée.
Chez l'animal
Inhalation
FDTE/VTR Importer La mortalité induite par l’exposition par inhalation à l’éthylbenzène dépend de l’espèce étudiée. Des rats Fischer 344, des souris B6C3F1 et des lapins New Zealand ont été exposés à 400 - 1 200 - 2 400 ppm (1 764 – 5 292 – 10 584 mg.m-3) d’éthylbenzène 6 h/j pendant 4 jours (Bio/dynamics, 1986 ; Cragg et al., 1989). Les souris meurent à partir de 1 200 ppm (5 292 mg.m-3) d’éthylbenzène et les rats à partir de 2 400 ppm (10 584 mg.m-3), alors que tous les lapins survivent quelle que soit la concentration d’éthylbenzène à laquelle ils ont été exposés. L’examen microscopique des tissus des rats Fischer 344 ou des souris B6C3F1 exposés à 1 200 ou à 2 400 ppm (5 292 – 10 584 mg.m-3) d’éthylbenzène montre une congestion pulmonaire. Par contre, aucune information sur la cause de la mort de ces animaux n’a été donnée (Bio/dynamics, 1986 ; Cragg et al., 1989). Chez le rat, la CL50 est de 4 000 ppm (17 640 mg.m-3) pour 4 heures d’exposition (Smyth et al., 1962) et de 13 367 ppm (59 g.m-3) pour 2 heures d’exposition (Ivanov, 1962).
Yant et al. ont exposé des cobayes à 100 ppm (441 mg.m-3) d’éthylbenzène (Yant et al., 1930). Après 3 minutes, 3 animaux présentent des signes d’irritation nasale, et après 8 minutes une irritation des yeux avec larmoiement (Yant et al., 1930). Les cobayes montrent des signes modérés d’irritation des yeux après 1 minute à 2 000 ppm (8 820 mg.m-3) , des troubles de l’équilibre après 390 minutes et une ataxie après 480 minutes. A 5 000 ppm (22 050 5 292 mg.m-3), des troubles de l’équilibre sont observés après 26 minutes, une ataxie après 30 minutes, des tremblements des extrémités après 178 minutes. A 10 000 ppm (44,1 g.m-3), des troubles de l’équilibre et une ataxie sont observés après 4 à 10 minutes d’exposition, une perte de conscience après 18 minutes, des tremblements des membres après 5 à 18 minutes et une bradypnée/diminution de la fréquence respiratoire après 260 minutes.
Une narcose est observée dans un lot de 8 rats exposés pendant 4 heures à de l’éthylbenzène à des concentrations de 2 180 ppm (9 614 mg.m-3), mais pas à 1 500 ppm (6 615 mg.m-3) (Molnar et al., 1986). Pour des concentrations de 400 à 1 500 ppm et des expositions de 1 - 2 - 3 - 4 heures, une augmentation modérée de la mobilité est rapportée.
Des troubles du comportement ont été également constatés chez les souris albinos mâles adultes exposées à 2 000 - 4 000 - 8 000 ppm (8 820 – 17 640 – 35 280 mg.m-3) d’éthylbenzène pendant 20 minutes (Tegeris et Balster, 1994). Enfin, des variations de la concentration de dopamine ont été observées chez les rats Sprague-Dawley (Andersson et al., 1981) et chez les lapins New Zealand White (Mutti et al., 1988 ; Romanelli et al., 1986) exposés par inhalation respectivement à 2 000 et à 750 ppm (8 820 et 3 307 mg.m-3) pendant 3 à 7 jours. L'exposition aiguë par inhalation à l'éthylbenzène induit également une diminution de la fréquence respiratoire (RD50 = 1 432 ppm soit 6 315 mg.m-3 chez les souris mâles) (de Ceaurriz et al., 1981), des troubles hépatiques (Bio/dynamics, 1986; Cragg et al., 1989; Elovaara et al., 1985 ; Toftgard et Nilsen, 1982) et une augmentation de l'activité enzymatique rénale (Toftgard et Nilsen, 1982).
Pour des expositions à des concentrations plus faibles, de 0 – 300 – 400 – 550 ppm (0 – 1 323 - 1 764 – 2 425 mg.m-3) d’éthylbenzène (99 % de pureté), 8 h/j pendant 5 jours, des troubles de l’audition sont mesurés chez les rats au moyen de deux tests spécifiques de la fonction auditive : électrocochléographie dans la gamme des fréquences de 1 à 24 kHz (enregistrement de l'activité électrique du nerf auditif par mesure des potentiels évoqués auditifs en réponse à des stimuli sonores) ; mesure des émissions oto-acoustiques (EOA) par produits de distorsion dans la gamme des fréquences de 4 à 22,6 kHz (réponse de la cochlée à une stimulation acoustique reposant sur la normalité du fonctionnement des cellules ciliées externes de l’organe de Corti), complétés par une analyse histologique de la perte des cellules ciliées externe de la cochlée (analyse quantitative) (Cappaert et al., 2000). Des altérations statistiquement significatives des seuils auditifs et une perte des cellules de l’organe de Corti (25 %) sont observées pour des expositions à 400 ppm (1 764 mg.m-3) mais ne sont pas retrouvées à 300 ppm (1 323 mg.m-3).
Voie orale
FDTE/VTR Importer Pour l'éthylbenzène, la DL50 par voie orale est de 4 769 mg.kg-1 chez les rats Carworth Wistar (Smyth et al., 1962) et de 3 500 mg.kg-1 chez une autre espèce de rat non précisée (Wolf et al., 1956).
Voie cutanée
FDTE/VTR Importer Par voie cutanée, la DL50 chez les lapins est de 15 433 mg.kg-1 (Smyth et al., 1962). L’application directe d’éthylbenzène sur la peau des lapins provoque une irritation de la peau caractérisée par des rougeurs, des vésicules cutanées et des exfoliations (Wolf et al., 1956). D’autres études ont également montré que l’application d’éthylbenzène (quantité et durée inconnues) directement dans les yeux des lapins induisait une légère conjonctivite (Wolf et al., 1956), ainsi qu’une légère lésion de la cornée (Smyth et al., 1962 ; Wolf et al., 1956).
Après 4 semaines d’exposition à 382 ppm d’éthylbenzène, les rats présentaient une augmentation de la sécrétion lacrymale, alors qu’aucun effet oculaire n’est apparu chez les souris et les lapins exposés respectivement à 782 ppm (3 449 mg.m-3) et à 1 610 ppm (7 100 mg.m-3) d’éthylbenzène par inhalation (Cragg et al., 1989). Les effets oculaires constatés sembleraient plutôt liés à un contact direct des vapeurs d’éthylbenzène avec les yeux. Une étude d’exposition de rats à 800 ppm (3 528 mg.m-3) d’éthylbenzène, 8 heures par jour pendant 5 jours, montre une atteinte toxique de l’oreille interne (Cappaert et al., 1999).
Synthèse
FDTE/VTR Importer Chez l’animal, les mêmes effets que chez l’Homme sont décrits. La toxicité aiguë de l’éthylbenzène est faible pour les différentes voies d’exposition.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer L’exposition à l’éthylbenzène étant le plus souvent mesurée conjointement à d’autres polluants dans les atmosphères en milieu professionnel, il est difficile d’individualiser les effets qui lui sont propres (Santé Canada, 2015).
Dans l'étude de Bardodej et Cirek, où 200 salariés sont exposés pendant 20 ans à une concentration d'éthylbenzène non précisée, aucun effet néfaste sur le système hématologique ou hépatique n’est observé (Bardodej et Cirek, 1988). Les niveaux d’exposition sont considérés comme inférieurs à 200 mg.m-3 (46 ppm) pour 8 heures d’exposition.
L'étude de Angerer et Wulf a mis en évidence chez des salariés exposés à des alkylbenzènes (dont l’éthylbenzène), une augmentation du nombre de lymphocytes (p = 0,05) ainsi qu’une diminution du taux d’hémoglobine (p = 0,01) (Angerer et Wulf, 1985). Le taux moyen d’éthylbenzène présent dans le sang des individus exposés, corrélé avec les effets hématologiques décrits précédemment, est de 41,4 µg.L-1. Dans cette étude, chez les salariés de sexe masculin examinés en 1983 et en 1984, l’augmentation du nombre de lymphocytes est respectivement de 68,8 % et de 41,5 % par rapport aux témoins, alors que la diminution du taux moyen d’hémoglobine était de 7,1 % en 1983 et de 5,2 % en 1984. Cependant, dans cette étude il est impossible de savoir si les troubles du système hématopoïétique sont dus au mélange des alkylbenzènes ou à un alkylbenzène en particulier. Compte tenu du manque d’information sur la concentration et le mélange de substances (xylènes, n-butanol, hydrocarbures aromatiques) auquel les salariés ont été exposés, l’US EPA indique que ces résultats ne permettent pas de conclure.
Une étude transversale a été menée auprès de travailleurs de deux usines pétrochimiques (Zhang et al., 2013). Dans ces deux usines, 246 et 307 travailleurs ont été classés dans deux groupes d’exposition à l’éthylbenzène : groupe pétrochimique 1 et groupe pétrochimique 2. Les travailleurs avaient des expositions à l’éthylbenzène bien spécifiques, étant donné que les concentrations d’autres hydrocarbures aromatiques polycycliques (styrène, benzène, toluène et xylène) étaient inférieures à la limite de détection. Deux groupes témoins, 290 travailleurs exposés au bruit seul dans une centrale électrique et 327 travailleurs faisant partie du personnel de bureau ont été constitués. Les concentrations d’éthylbenzène dans l’air étaient de respectivement 122,83 ± 22,86 mg.m-3 et 134,64 ± 31,97 mg.m-3 dans les groupes pétrochimiques 1 et 2. La prévalence de la perte de l’ouïe pour les travailleurs exposés à l’éthylbenzène était plus élevée par rapport aux deux groupes de référence en ajustant sur l’âge, la consommation de cigarettes et d’alcool. Une altération de la fonction neurocomportementale (altération de la mémoire à court terme, des mouvements de mains rapides et de la coordination des yeux) a été observée chez ces travailleurs exposés. Les niveaux sanguins de dopamine (0,21 ± 0,011 mg.L-1) et de l’activité de l’acétylcholinestérase (0,321 ± 0,066 U.L-1) chez les travailleurs exposés (n= 246) ont diminué significativement par rapport à ceux du groupe témoin (n=122). Aucun effet hématologique n’a été rapporté.
Dans le cadre d’une étude transversale réalisée sur un ensemble de 3 950 sujets dans le cadre du suivi de la population canadienne, une association positive entre les taux sanguins d’éthylbenzène et des paramètres hématologiques, de même que deux des trois marqueurs de la fonction hépatique et de la fonction rénale (créatinine) a été rapportée (Cakmak et al.,2020).
Voie orale
FDTE/VTR Importer Aucune donnée concernant les effets systémiques induits par une exposition chronique par voie orale à l’éthylbenzène n’est disponible chez l’Homme.
Voie cutanée
FDTE/VTR Importer Aucune donnée concernant les effets systémiques induits par une exposition chronique par voie cutanée à l’éthylbenzène n’est disponible chez l’Homme.
Synthèse
FDTE/VTR Importer Chez l’Homme, des effets hématologiques (augmentation du nombre de lymphocytes, diminution du taux d’hémoglobine dont l’attribution à l’éthylbenzène demande à être confirmée), neurocomportementaux (diminution des niveaux sanguins de neurotransmetteurs) et baisse de l’audition sont rapportés chez des sujets exposés professionnellement à l’éthylbenzène et/ou à un mélange d’alkylbenzènes par inhalation.
Chez l'animal
Inhalation
FDTE/VTR Importer Chez l’animal, les organes cibles de l’éthylbenzène après une exposition chronique par inhalation sont le foie et les reins.
Foie :
De nombreuses études mettent en évidence les effets sur le foie induit par l’éthylbenzène. Ainsi, une augmentation relative du poids du foie a été constatée chez les rats Fischer et chez les souris B6C3F1, exposés à 782 ppm d’éthylbenzène pendant 4 semaines (Cragg et al., 1989). Une augmentation du poids du foie est rapportée après exposition à de l’éthylbenzène chez les rats mâles et femelles (400 - 600 - 1 250 - 2 200 ppm pour les seuls mâles), chez les cobayes (600 ppm) et chez les singes (600 ppm). L’exposition était de 7 à 8 h/j, 5 j/sem pendant 6 mois. L’atteinte hépatique n’est pas observée pour des expositions de 400 à 1 250 ppm chez des cobayes, ou à 400 ppm chez le singe (Wolf et al., 1956). Cependant, l’interprétation des résultats de cette étude est limitée par un manque global de détails méthodologiques (absence de données d’exposition) et par le faible effectif des groupes d’exposition (1 à 2 lapins ou singes par groupe).
L’étude NTP (1992) a montré une augmentation du poids relatif du foie chez les rats Fischer 344/N et chez les souris B6C3F1 exposés respectivement à 249 et à 740 ppm d’éthylbenzène 6 h/j, 5 j/7 pendant 90 jours) (NTP, 1992). Toutefois, aucune altération du fonctionnement du foie ni aucun changement histopathologique n’a été observé. L’étude d’Elovaara et al. a montré une augmentation des protéines microsomiales, du taux de la NADPH-cytochrome réductase, de la 7-éthoxycoumarine O-dééthylase et de l’UDP glucuronyl-transférase présents dans le foie et les reins chez les rats exposés, par inhalation à 300 ppm d’éthylbenzène pendant 5 semaines ou à 600 ppm pendant 16 semaines (Elovaara et al., 1985). Deux semaines après le début de l’exposition, les rats présentaient une prolifération du réticulum endoplasmique lisse et une légère dégranulation du réticulum endoplasmique rugueux au niveau des cellules hépatiques. Ces altérations indiquent une activation du métabolisme.
Au cours d’une autre étude du NTP, des souris B6C3F1 et des rats F344/N ont été exposés à 0 – 75 – 250 – 750 ppm d’éthylbenzène 6 h/j, 5 j/7 pendant 104 semaines (NTP, 1999). Des effets hépatiques sont retrouvés chez les souris ; la présence d’îlots éosinophiles chez les femelles exposées à 750 ppm et des plages d’altérations syncytiales, une hypertrophie et une nécrose hépatique chez les mâles exposés à 750 ppm. Ces effets ne sont pas retrouvés chez les rats.
Enfin des travaux évoquent un mécanisme de toxicité hépatique impliquant le stress oxydant et l’apoptose chez des rats mâles exposés à des concentrations de 0 - 100 - 1 000 - 1 500 ppm ( 0 – 433,5 – 4 335 – 6 500 mg.m-3) d’éthylbenzène par inhalation 6 h/j pendant 13 semaines (Zhang et al., 2015). Des augmentations significatives du malondialdéhyde (marqueur de stress oxydant) et du nombre de cellules hépatiques en apoptose (vacuolisation et pertes des crêtes mitochondriales) ont été rapportées chez les mâles du groupe exposé à la plus forte concentration.
Reins :
L’exposition de longue durée à l’éthylbenzène induit des effets rénaux chez les animaux étudiés. En effet, comme il a été précisé précédemment, une augmentation du taux de la 7-éthoxycoumarine O-dééthylase, de l’UDP glucuronyl-transférase et du glutathion dans les reins a été observée chez les rats Wistar après exposition de ces animaux pendant 5 à 16 semaines à des concentrations d’éthylbenzène comprises entre 50 et 600 ppm (Elovaara et al., 1985). Dans la même étude, une augmentation significative du poids relatif des reins a été observée la 2ème et la 9ème semaine chez les animaux exposés à 400 ppm d’éthylbenzène.
Dans l’étude de Wolf et al. , une faible augmentation du poids des reins est observée pour des expositions de 400 - 600 - 1 250 - 2 200 ppm d’éthylbenzène pendant 186 jours, uniquement chez les rats femelles (Wolf et al., 1956).
L’exposition pendant une à quatre semaines, de rats Fischer 344 mâles et femelles et de souris B6C3F1 à l’éthylbenzène, s’accompagne de modifications au niveau rénal. Chez les rats mâles exposés à 750 ppm, une accumulation précoce d’alpha-2-microglobuline dans les cellules corticales du tubule proximal est observée, qui doit accélérer la progression de la néphropathie chronique liée à l’éthylbenzène. Durant cette première période d’exposition, il est noté une augmentation de la prolifération cellulaire (Stott et al., 2003).
Le NTP rapporte une augmentation du poids absolu des reins, sans lésions histologiques associées, uniquement chez le rat à partir de 500 ppm chez les mâles et 750 ppm chez les femelles dans une étude où des rats et des souris ont été exposés à 0 - 100 - 250 - 500 - 750 - 1 000 ppm ( 0 – 430 – 1 075 – 2 150 – 3 225 – 4 300 mg.m-3) d’éthylbenzène 6 h/j, 5 j/7 pendant 13 semaines (NTP, 1992). Un NOAEC de 430 mg.m-3 (100 ppm) a été retenu pour cette étude.
Des altérations rénales, ainsi qu’une baisse significative du poids corporel chez les mâles uniquement (250 et 750 ppm) sont également observées chez les rats pour des expositions à 0 – 75 – 250 – 750 ppm d’éthylbenzène 6 h/j, 5 j/sem pendant 104 semaines (NTP, 1999). Il s’agit d’une hyperplasie des tubules rénaux chez les femelles, observée à toutes les concentrations et d’une augmentation de la sévérité de ces effets rénaux chez les mâles à 750 ppm ; ces effets ne sont pas observés chez les souris des deux sexes dans les mêmes conditions expérimentales.
Des lésions histologiques (dégénérescence hydropique, nécrose et lyse des cellules épithéliales tubulaires rénales et lumière tubulaire irrégulière) et ultra-structurales (dépôts lysosomaux et destruction des organites, condensation de la chromatine des cellules épithéliales) au niveau des tubules rénaux ont également été observées à la plus forte concentration dans une étude où des rats mâles ont été exposés à 0 - 100 – 1 000 - 1 500 ppm (0 – 433,5 – 4 335 – 6 500 mg.m-3) d’éthylbenzène par inhalation 6 h/j pendant 13 semaines (Zhang et al., 2010). Le mécanisme de toxicité rénale identifié impliquerait l’apoptose des cellules épithéliales tubulaires rénales. L’activation de l’apoptose serait initiée au niveau des mitochondries par la fuite de cytochrome c, puis l’activation des caspases-9 et 3 (augmentation significative de l’expression de ces protéines à toutes les doses d’exposition, p<0,05).
Système nerveux central :
Des rats Sprague Dawley mâles ont été exposés à des concentrations de 0 – 200 – 400 – 600 – 800 ppm d’éthylbenzène (pureté de 99 %) 6 h/j, 5 j/sem. pendant 13 semaines (Gagnaire et al., 2007). L’ototoxicité est évaluée par des mesures neurophysiologiques (électrocochléographie dans la gamme des fréquences de 1 à 24 kHz et mesure des émissions oto-acoustiques (EOA) par produits de distorsion dans la gamme des fréquences de 4 à 22,6 kHz) après 4, 8 ou 13 semaines d’exposition et par le comptage du nombre total de cellules cochléaires 8 semaines après arrêt de l’exposition, en complément des tests auditifs également effectués. Une augmentation statistiquement significative des seuils audiométriques à 2 – 4 – 8 – 16 kHz est mesurée chez les animaux exposés à 400 - 600 - 800 ppm. A 200 ppm, une altération de la morphologie de l’organe de Corti (pertes significatives de cellules ciliées externes chez 4 animaux sur 8) est observée, avec une sévérité de plus en plus marquée en rapport avec l’augmentation de la concentration en éthylbenzène (perte quasiment complète dans les lots exposés à 600 et 800 ppm).
Chez la souris, une augmentation de l'incidence de l'hyperplasie du lobe antérieur de l’hypophyse est rapportée (250 et 750 ppm chez les femelles uniquement) pour des expositions à 0 – 75 – 250 – 750 ppm d’éthylbenzène 6 h/j, 5 j/sem pendant 104 semaines (NTP, 1999).
Poumons :
Peu d’études se sont intéressées aux modifications du tissu pulmonaire. Elles suggèrent une altération du potentiel métabolique ou la perte de cellules de Clara, précocement lors de l’exposition à l’éthylbenzène, puis un ralentissement du renouvellement cellulaire (Boyd, 1977 ; LaKritz et al., 1996 ; Stott et al., 2003).
Pour des expositions plus longues sur deux ans, une augmentation statistiquement significative des métaplasies de l’épithélium alvéolaire sont rapportées à 750 ppm chez la souris mâle, ces effets ne sont pas observés chez les femelles ni chez les rats des deux sexes pour des conditions expérimentales identiques (NTP, 1999).
Système hématologique :
Compte tenu des résultats contradictoires obtenus dans différentes espèces animales, il est difficile de conclure quant à l’effet de l’éthylbenzène sur le système hématologique. Des expériences réalisées chez les rats Fischer 344, exposés à 782 ppm d’éthylbenzène pendant 4 semaines, ont montré une augmentation significative du nombre de plaquettes chez les rats mâles et une diminution significative du nombre total de leucocytes chez les rats femelles (Cragg et al., 1989). Par contre, ces paramètres hématologiques ne sont pas modifiés chez les souris B6C3F1 et chez les lapins New Zealand White exposés à la même concentration ou à des concentrations supérieures d’éthylbenzène. De plus, après exposition à des concentrations de vapeurs d’éthylbenzène allant jusqu'à 975 ppm pendant 90 jours, aucun effet hématologique n’a été observé chez les rats Fischer 344/N et chez les souris B6C3F1
Système immunitaire :
Chez le rat (jeune adulte) exposé, par inhalation à 0 – 25 – 100 – 500 ppm (0 – 110 – 441 – 2 205 mg.m-3) d’éthylbenzène (soit des doses calculées de 26 – 90 – 342 mg.kg-1.j-1) 6 heures par jour pendant 28 jours, l’immunotoxicité a été évaluée au moyen du test d’anticorps spléniques des cellules formant plaques chez des animaux sensibilisés aux érythrocytes de mouton (Li et al., 2010). Aucun effet immunotoxique n’est mis en évidence aux concentrations étudiées. Une NOAEC de 500 ppm (soit 342 mg.kg-1.j-1) a été retenue par les auteurs à partir de l’absence d’effet sur le système immunitaire.
Voie orale
FDTE/VTR Importer Par voie orale, les données chez l’animal concernant l’effet de l’éthylbenzène à long terme sont beaucoup plus succinctes que celles concernant l’inhalation. Dans une étude ancienne présentant des lacunes méthodologiques, aucune atteinte des systèmes respiratoire et cardiovasculaire, ou modifications des paramètres hématologiques ne sont rapportées chez des rats exposés, par gavage (véhicule : huile d’olive), aux doses d’éthylbenzène, 13,6 - 136 - 408 - 680 mg.kg-1.j-1 pendant 6 mois (182 j) (Wolf et al., 1956). Seuls des changements histo-pathologiques du foie et une augmentation du poids du foie sont rapportés à 408 mg.kg-1.j-1 d’éthylbenzène.
Des expositions de 13 semaines (90 j) ont été réalisées chez des rats Wistar par gavage aux doses de 0 - 75 – 250 – 750 mg.kg-1.j-1 d’éthylbenzène (Mellert et al., 2007). Une diminution statistiquement significative du poids corporel des mâles est mise en évidence à la dose la plus élevée. Des altérations hépatiques ont été observées correspondant à une augmentation des activités enzymatiques sériques (ALT et GGT) chez les mâles dès 250 mg.kg-1.j-1 et 750 mg.kg-1.j-1 chez les femelles, une augmentation des poids relatif et absolu du foie chez les deux sexes dès 250 mg.kg-1.j-1 et une augmentation dose-dépendante de l’incidence des hypertrophies centrolobulaires chez les deux sexes dès 250 mg.kg-1.j-1. Des altérations rénales sont également observées chez les mâles incluant une augmentation de créatinine sérique à 750 mg.kg-1.j-1, une augmentation de l’incidence des cellules épithéliales transitionnelles ainsi que la présence de cylindres granuleux dans les urines dès 250 mg.kg-1.j-1, une augmentation des poids absolu et relatif des reins dès 250 mg.kg-1.j-1 et une augmentation dose-dépendante de la sévérité des néphropathies dès 250 mg.kg-1.j-1. Ces altérations rénales observées uniquement chez les rats mâles étant associées à une accumulation d’alpha-2-microglobuline, ces effets ne sont pas extrapolables à l’Homme. Une augmentation statistiquement significative du poids absolu des reins est également décrite chez les femelles mais n’est pas associée à des altérations histopathologiques ni à des modifications des paramètres urinaires. Une diminution du poids relatif et absolu du thymus est mise en évidence chez les femelles dès 250 mg.kg-1.j-1 sans s histopathologiques associées.
Les effets neurotoxiques de l’éthylbenzène ont été évalués chez le rat (jeune adulte) exposé par gavage, deux fois par jour pendant 90 jours à 0 – 50 –250 – 500 mg.kg-1.j-1 au moyen d’un batterie de tests fonctionnels, de tests d’activité motrice et d’un examen neuropathologique (Li et al., 2010). Aucun effet neurologique n’est rapporté aux doses étudiées. Une diminution des poids relatifs du foie et des reins est observée chez les mâles à 250 et 500 mg.kg-1.j-1. Le NOAEL fixé sur la base des effets observés sur le foie et les reins par les auteurs est de 50 mg.kg-1.j-1 et de 500 mg.kg-1.j-1 pour la neurotoxicité.
Voie cutanée
FDTE/VTR Importer Aucune étude concernant l’effet de l’éthylbenzène à long terme, par voie cutanée, n’est disponible chez l’animal.
Synthèse
FDTE/VTR Importer Chez l’animal, les organes cibles après une exposition chronique par inhalation sont le foie (augmentation du poids, altération, hypertrophie ou nécrose des hépatocytes), les reins (augmentation du poids des reins), et chez les rats mâles une accumulation d’α-2-µglobuline non transposable à l’humain) et les poumons (altération du potentiel métabolique, perte de cellules de Clara). Des effets hématologiques sont également observés (diminution des lymphocytes, augmentation des plaquettes). Par voie orale, les données sont plus rares, et il n’existe aucune étude sur les effets à long terme par voie cutanée.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2014 |
| IARC | FDTE/VTR Importer Groupe 2B : l’agent (ou le mélange) pourrait être cancérogène pour l’Homme | 2000 |
| US EPA | FDTE/VTR Importer Classe D : Informations inadéquates pour évaluer le potentiel cancérogène | 1991 |
Chez l'homme
Inhalation
FDTE/VTR Importer Chez l’Homme, aucune association n’a été trouvée entre l’apparition de cancer et l’exposition par voie respiratoire à l’éthylbenzène. La seule étude disponible a montré que 200 salariés exposés par inhalation principalement à l’éthylbenzène pendant 20 ans ne présentaient pas d’excès de tumeurs malignes dans les 10 dernières années (Bardodej et Cirek, 1988). Dans cette étude, les concentrations d’éthylbenzène auxquelles ont été exposés les salariés ne sont pas connues, mais semblent avoir été très faibles (estimée à environ 6,4 mg.m-3 d’après les concentrations urinaires moyennes d’acide mandélique chez les sujets). De plus, le suivi pendant 20 ans semble insuffisant pour détecter des tumeurs à long temps de latence chez l’Homme.
Voie orale
FDTE/VTR Importer Aucune étude sur l’effet cancérigène de l’éthylbenzène par voie orale n’est disponible chez l’Homme.
Voie cutanée
FDTE/VTR Importer Aucune étude sur l’effet cancérigène de l’éthylbenzène par voie cutanée n’est disponible chez l’Homme.
Synthèse
FDTE/VTR Importer Les rares données pour des expositions par inhalation ne permettent pas de conclure chez l’Homme.
Chez l'animal
Inhalation
FDTE/VTR Importer Depuis les travaux de classification de l’Union Européenne, de l’IARC et de l’US EPA, l’information concernant l’effet cancérigène de l’éthylbenzène inhalé chez l’animal a été complétée par une étude du NTP en 1999. Dans cette étude, des rats Fischer 344/N mâles et femelles (50 par groupe) ainsi que des souris B6C3F1 ont été exposés à 0 - 75 - 250 - 750 ppm d’éthylbenzène (pureté > 99 %) 6 h/j, 5 j/sem. pendant 104 semaines pour les rats et 103 semaines pour les souris.
La mortalité des rats mâles du lot exposé à 750 ppm a été plus élevée que le lot témoin. Dans ce lot, l’incidence des adénomes des tubules rénaux (0/50, 3/50, 2/50, 4/50), l’incidence combinée des adénomes et des carcinomes rénaux (3/50, 5/50, 8/50,21/50) ont été significativement plus élevées. L’incidence des hyperplasies des tubules rénaux (2/50, 2/50, 4/50, 12/50) était aussi augmentée. Enfin, une augmentation de l’incidence des adénomes des cellules interstitielles des testicules (36/50, 33/50, 40/50,44/50) est aussi notée dans ce lot. L’étude approfondie des coupes histologiques des reins des rats exposés à 750 ppm montre chez les deux sexes une augmentation significative de l’incidence des adénomes des tubules rénaux et de l’hyperplasie.
Dans les lots de souris, une augmentation significative de l’incidence combinée des adénomes et des carcinomes alvéolaires et bronchiolaires, des adénomes bronchiolaires (7/50, 10/50, 15/50, 19/50) est observée, dans le lot des souris mâles à 750 ppm par rapport aux témoins. Cependant, ces incidences restent dans les limites des données historiques du NTP. Il en est de même pour l’augmentation de l’incidence des adénomes hépatocellulaires (6/50, 9/50, 12/50, 16/50) ou l’augmentation de la combinaison adénomes-carcinomes hépatocellulaires (13/50, 12/50, 15/50, 25/50), chez le lot de souris femelles exposé à 750 ppm.
Les résultats de ce rapport NTP mettent en évidence un effet cancérigène de l’éthylbenzène chez les rats mâles.
Hard décrit l’étude histologique attentive menée sur les coupes de reins des rats du groupe exposé à 750 ppm (Hard, 2000, 2002). Cette étude a permis de préciser que le développement de tumeurs malignes rénales chez les rats mâles résulte de l’exacerbation de lésions de néphropathie chronique. Ce mécanisme est considéré comme non pertinent chez l’Homme, car impliquerait l’accumulation d’α-2-microglobuline spécifique de l’espèce (Sweeney et al., 2015). Hard précise qu’il n’existe pas d’analogue clair à la néphropathie chronique chez l’humain (Hard et al., 2009).
Voie orale
FDTE/VTR Importer L’effet cancérigène d’une exposition chronique à l’éthylbenzène par voie orale a été évalué chez des rats Sprague-Dawley (Maltoni et al., 1985). Une augmentation statistiquement significative de la totalité des tumeurs malignes a été observée chez les rats femelles et chez les rats mâles exposés à 500 mg.kg-1.j-1 d’éthylbenzène. Les animaux ont été gavés pendant 104 semaines et les tumeurs ont été observées jusqu'à 141 semaines après l’exposition. L’interprétation de ces résultats est difficile car aucune information concernant le type de tumeur n’a été donnée. De plus, une seule dose d’éthylbenzène a été administrée aux rats et le nombre de rats vivants n’a pas été mentionné dans l’étude.
Voie cutanée
FDTE/VTR Importer Chez l’animal, aucune donnée n’est disponible sur l’effet cancérigène de l’éthylbenzène après une exposition cutanée.
Synthèse
FDTE/VTR Importer chez l’animal, l’éthylbenzène induit une augmentation de l’incidence des tumeurs des tubules rénaux et des cellules interstitielles des testicules chez les rats mâles par inhalation. Ces effets rénaux ne sont pas extrapolables à l’Homme du fait du mécanisme impliqué. Par voie orale, les données sont peu exploitables et aucune donnée n’a été identifiée par voie cutanée.
Effets génotoxiques
Généralités
FDTE/VTR Importer Mécanismes d’action :
Le mécanisme de cancérogenèse de l’éthylbenzène semble lié, au moins en partie, aux altérations de l’ADN induites par les métabolites actifs dihydroxylés produits au cours de la métabolisation (Midorikawa et al., 2004).
Plusieurs modes d’action non génotoxiques concernant la cancérogénicité de l’éthylbenzène ont été proposés, y compris un mode d’action pour les tumeurs rénales (causée par un métabolite d’éthylbenzène primaire, le 1-phényléthan-1-ol), qui peut impliquer l’accumulation d’alpha-2-microglobuline, un mode d’action pour les tumeurs du poumon (prolifération chronique des cellules, secondaire à la métabolisation de l’éthylbenzène en métabolites cytotoxiques par des CYP2F2), un mode d’action pour les tumeurs hépatiques (secondaire à une induction enzymatique de type phénobarbital et à la prolifération des cellules) (Sequeira et al.1992), et un mode d’action pour les tumeurs dans les cellules de Leydig (hyperplasie des cellules de Leydig, secondaire à l’induction des cytochromes P450 hépatiques déclenchée par l’éthylbenzène qui entraîne une augmentation de l’hydroxylation et de la clairance de la testostérone) (Santé Canada, 2016).
Le stress oxydant, secondaire à l’épuisement du glutathion à forte dose (GSH) et/ou l’induction des CYP450 au cours du métabolisme, est l’un des mécanismes mis en cause au cours du processus tumoral (Sweeney et al., 2015).
Bien que le ou les modes d’action pour la cancérogénicité de l’éthylbenzène ne soient pas entièrement élucidés, les données mécanistiques semblent indiquer que les doses inférieures à un seuil de toxicité ne devraient pas entraîner la formation de tumeurs de type promoteur compatible avec une induction des cytochrome de la sous famille 2B1 (mécanisme d’action avec seuil). D’après l’Anses, une VTR pour des expositions par inhalation basée sur des effets non néoplasiques (ototoxicité) mis en évidence pour une exposition subchronique à 200 ppm protégerait a priori de l’apparition de tumeurs rénales chez l’animal, observées pour des expositions chroniques à 750 ppm (ANSES, 2016).
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2014 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Holz et al. (1995) n’ont rapporté aucune augmentation des échanges de chromatides sœurs, de la formation d'adduits à l'ADN, de micronoyaux ou de cassures de l'ADN simple brin dans les lymphocytes périphériques chez des travailleurs exposés à de faibles niveaux d’éthylbenzène atmosphérique en mélange avec d'autres hydrocarbures aromatiques (benzène, toluène et xylènes) dans une usine de styrène.
Des aberrations chromosomiques ont été observées dans les lymphocytes du sang périphérique chez des travailleurs exposés de manière concomitante à l’éthylbenzène (0,2 à 13,1 mg.m-3) et au benzène (0,4 à 15,1 mg.m-3) atmosphériques (Sram et al., 2004). Les résultats de cette étude montrent qu’une diminution de l'exposition des travailleurs (sans que les auteurs n’aient rapporté les concentrations d’éthylbenzène et de benzène correspondantes) réduit le nombre d’aberrations chromosomiques observées ; néanmoins, en raison de l'exposition simultanée au benzène, il n’est pas possible d’établir une association entre les lésions chromosomiques et l'exposition à l’éthylbenzène seul.
Les concentrations de 8-hydroxy-désoxyguanosine (8-OHdG), marqueur du stress oxydatif, ont été dosées dans les urines de 64 travailleurs (15 travailleurs exposés à la peinture au pistolet et deux groupes de travailleurs non exposés : 19 travailleurs utilisant des machines à jet de sable et 30 employés de bureau) (Chang et al., 2011). Une corrélation significative entre les concentrations de 8-OHdG dans les urines et l'exposition à l'éthylbenzène (mesurée à l’aide des concentrations urinaires d’acide mandélique) a été retrouvée chez les peintres, bien que l’éthylbenzène ne soit probablement pas la seule substance responsable des dommages oxydatifs mesurés sur l’ADN des travailleurs exposés à la peinture.
D’autres travaux réalisés toujours sur des peintres (11 peintres au rouleau et 6 peintres au pistolet) et un groupe de sujet non exposé (18 employés de bureau) ont mis en évidence les effets combinés de plusieurs solvants (xylènes, toluène, éthylbenzène) sur les lésions oxydatives à partir du test des comètes sur les cellules sanguines, test du micronoyau sur cellules buccales ou encore l’augmentation de cytokines inflammatoires (IL-6, IL-8, TNF-α) au niveau sérique (Sisto et al., 2020 ; Cavallo et al., 2021).
Chez l'animal
Synthèse
FDTE/VTR Importer In vivo, l’éthylbenzène ne s’est pas révélé génotoxique chez les mammifères au cours des différents tests mesurant les cassures d’ADN, la formation d’adduits à l’ADN, les micronoyaux, les échanges de chromatides sœurs ou la synthèse non programmée d’ADN (ANSES, 2016).
In vitro
Organismes procaryotes
FDTE/VTR Importer L’éthylbenzène n’est pas mutagène chez les bactéries et les levures.
Organismes eucaryotes
FDTE/VTR Importer In vitro, il n’induit pas d’échanges de chromatides sœurs dans la lignée cellulaire CHO. Il n’est pas clastogène mais il induit la formation de micronoyaux dans des lignées cellulaires. Des résultats positifs sont également rapportés au cours de tests de transformation dans des cellules SHE. Les résultats équivoques au test de mutations géniques sur cellules de mammifères ne sont pas suffisants pour conclure quant au potentiel mutagène de l’éthylbenzène (Henderson et al., 2007).
Synthèse
FDTE/VTR Importer Chez l’animal, l’éthylbenzène ne présente pas d’activité mutagène ou clastogène lors des essais in vivo ; la plupart des tests de mutagénicité in vitro sont négatifs. L’éthylbenzène n’est pas considéré comme étant génotoxique.
Effets sur la reproduction
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune étude concernant l’effet de l’éthylbenzène sur la reproduction n’est disponible chez l’Homme, quelle que soit la voie d’exposition.
Chez l'animal
Inhalation
FDTE/VTR Importer Chez l’animal, Ungvary et Tatrai ont évalué l’effet toxique de l’éthylbenzène sur les embryons (Ungvary et Tatrai, 1985). Des rats CFY, des souris CFLP et des lapins New Zealand White en gestation ont été exposés par inhalation de façon continue durant l’organogenèse à différentes concentrations d’éthylbenzène à 600 - 1 200 - 2 400 mg.m-3 (138 - 276 - 552 ppm) pour les rats et à 500 et 1 000 mg.m-3 (115 - 230 ppm) pour les souris et les lapins. Chez les rats, une augmentation de la résorption embryonnaire a été observée pour le lot exposé à 552 ppm, alors qu’aucun effet néfaste n’est mentionné chez la souris. Chez les lapins, pour la concentration la plus élevée d’éthylbenzène (230 ppm), une augmentation des avortements spontanés a été constatée.
Après un examen histopathologique des testicules, aucune anomalie n’a été notée chez les rats Fischer 344 et chez les souris B6C3F1 exposés par inhalation à 782 ppm d’éthylbenzène pendant 4 semaines. Il en est de même chez les lapins New Zealand White exposés pendant 4 semaines à 1 610 ppm d’éthylbenzène (Cragg et al., 1989).
Le rapport NTP de 1992 a montré que l’éthylbenzène n’avait aucune incidence sur la morphologie des spermatozoïdes et des testicules, ni sur la longueur du cycle œstral chez les rats Fischer 344/N ou chez les souris B6C3F1 exposés à 975 ppm d’éthylbenzène pendant 90 jours.
Par contre, chez des singes Rhésus mâles ou chez des lapins, l’exposition par inhalation à 600 ppm d’éthylbenzène pendant 6 mois induit chez un des singes et chez un des lapins une dégénérescence de l’épithélium des testicules (Wolf et al., 1956). Du fait de l’insuffisance de détails dans les protocoles utilisés et du nombre d’animaux présentant des effets, aucune conclusion n’a pu être établie à partir de cette étude.
Une étude sur deux générations a été menée chez des rats exposés à 0 – 25 – 100 – 500 ppm d’éthylbenzène, 6 h/j, pendant une période de 70 jours avant l’accouplement, au cours de la période d’accouplement, de la gestation et de la lactation (Faber et al., 2006). Au cours des 4 premiers jours de la lactation, l’exposition à l’éthylbenzène a été effectuée par gavage aux doses de 0 - 26 – 90 - 342 mg.kg-1.j-1. Cette étude montre l’absence d’effets sur la fonction de reproduction mâle et femelle pour des expositions jusqu’à 500 ppm.
Voie orale
FDTE/VTR Importer Par voie orale, la seule étude disponible indique qu’une exposition aiguë par voie orale à 500 ou à 1 000 mg.kg-1 d’éthylbenzène induit une diminution du taux d’hormones et peut retarder ou bloquer le cycle œstral chez les rats femelles (Ungvary, 1986). La diminution du taux d’hormones (hormone lutéinisante, progestérone et 17beta-estradiol) est accompagnée de changements utérins qui se caractérisent par une augmentation du tissu stromal et par une réduction du lumen. Dans cette étude, aucune relation dose-réponse n’a été donnée et les données statistiques sont insuffisantes.
Synthèse
FDTE/VTR Importer Chez l’animal, après une exposition par inhalation, seuls des avortements spontanés chez le lapin ont été observés. Ces effets ne sont pas retrouvés chez le rat. Les données disponibles pour des expositions par voie orale ne permettent pas de conclure.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2014 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune étude concernant l’effet de l’éthylbenzène sur le développement n’est disponible chez l’Homme, quelle que soit la voie d’exposition.
Chez l'animal
Toutes voies
FDTE/VTR Importer Résumé : Chez le rat, l’exposition par inhalation à l’éthylbenzène entraîne un retard dans le développement du squelette, ainsi que la présence de côtes surnuméraires et des anomalies du tractus urinaire. En revanche, aucun effet neurodéveloppemental n’est identifié. Aucune donnée concernant l’effet de l’éthylbenzène par voie orale et par voie cutanée sur le développement n’est disponible.
Inhalation
FDTE/VTR Importer L’effet d’une exposition par inhalation à l’éthylbenzène sur le développement a été étudié chez le rat, la souris et le lapin (Andrew et al., 1981 ; Hardin et al., 1981 ; Ungvary et Tatrai, 1985).
Dans l’étude de Ungvary et Tatrai décrite ci-dessus, des rats CFY ont été exposés par inhalation à 138 - 276 - 552 ppm d’éthylbenzène, 24 h/24 du 7e au 15e jour de gestation (Ungvary et Tatrai, 1985). Les souris CFLP et les lapins New Zealand White ont été exposés à 115 et à 230 ppm d’éthylbenzène, en continu du 6e au 15e jour de gestation. Chez le rat, l’exposition à de l’éthylbenzène (138 - 276 - 552 ppm) induit une résorption fœtale et un retard dans le développement du squelette chez les fœtus vivants. La présence de côtes surnuméraires et d’anomalies du tractus urinaire a été observée à des concentrations de 552 ppm. Chez les souris, l’exposition à 115 ppm d'éthylbenzène pendant la gestation induit des anomalies du tractus urinaire chez le fœtus. Mais la nature de la malformation rénale n’a pas été caractérisée. Chez les lapins, une réduction du poids des fœtus a été observée lorsque les mères ont été exposées à 115 ppm d’éthylbenzène. Ces résultats ne sont pas retrouvés après des expositions plus longues à des concentrations d’éthylbenzène plus élevées. Dans cette étude, la toxicité maternelle est modérée et quels que soient les animaux testés, l’éthylbenzène n’apparaît pas comme tératogène.
L’équipe de Andrew et al. a étudié l’effet tératogène de l’exposition par inhalation à l’éthylbenzène chez des rats Wistar et des lapins New Zealand White. Les femelles ont été exposées corps entier à 0 - 100 - 1 000 ppm d’éthylbenzène, 7 h/j, du 1er au 19e jour de gestation chez le rat et du 1er au 24e jour de gestation. chez le lapin (Andrew et al., 1981 ; Hardin et al., 1981). Un groupe distinct de rats a été exposé avant la gestation (7 h/j, 5 j/sem pendant 3 semaines avant l'accouplement), puis pendant la gestation. Les animaux ont ensuite été euthanasiés en fin de gestation, soit au 21e jour pour les rats et 30e pour les lapins, ainsi que leurs portées, et ont été examinés. Chez les rats exposés uniquement pendant la gestation, aucune altération histologique n’a été rapportée sur les différents organes maternels examinés, malgré une augmentation des poids relatif et absolu du foie, des reins et de la rate dans le groupe exposé à 1 000 ppm. La principale observation était l’augmentation significative de l’incidence des côtes surnuméraires et des côtes rudimentaires chez les fœtus, dans le groupe exposé à 1 000 ppm. Chez les rats femelles exposées 3 semaines avant l'accouplement et pendant la gestation, une augmentation significative de l’incidence de côtes surnuméraires a été observée chez les fœtus dans le groupe exposé à 1 000 ppm. Aucun effet sur la fertilité ou sur l'un des autres facteurs évaluant l’intégrité de la fonction de reproduction n’a été relevé. Aucune toxicité fœtale n’a été observée, quel que soit le niveau d'exposition. Le poids corporel, le poids du placenta, et les sexes ratios étaient normaux. Les poids absolu et relatif du foie et de la rate étaient augmentés chez les rates gravides exposées à 1 000 ppm ; seul le poids relatif des reins était augmenté de façon significative. Aucune altération histologique n’a été rapportée dans les différents organes examinés. Un NOAEL de 100 ppm a été établi, à partir de cette étude, pour la présence de côtes surnuméraires chez le rat. Chez le lapin, l’exposition à l’éthylbenzène n’a pas eu d’effet sur le nombre d’implantations. Les auteurs n’ont constaté qu’une augmentation du poids relatif et absolu du foie à 1 000 ppm d’éthylbenzène. Chez les lapins, l’exposition à 100 ou 1 000 ppm d’éthylbenzène n’induit aucun effet tératogène, aucune toxicité pour l’embryon, ni retard dans le développement du fœtus.
Ces observations sont confortées par celles réalisées au cours d’une série d’expérience menée chez le rat Spague-Dawley exposé à 0 - 100 – 500 – 1 000 – 2 000 ppm d’éthylbenzène par inhalation, 6 heures par jour du 6ème au 20ème jour de la gestation (Saillenfait et al., 2003, Saillenfait et al., 2006, Saillenfait et al., 2007). Une toxicité maternelle est observée pour des concentrations supérieures ou égales à 1 000 ppm. Une réduction statistiquement significative du poids corporel des jeunes a été mise en évidence dès 1 000 ppm mais n’est pas retrouvée aux concentrations inférieures. Une augmentation statistiquement significative du nombre de fœtus présentant des malformations, essentiellement d’ossification, est rapportée dès 1 000 ppm.
Une étude sur deux générations a été menée chez des rats exposés à 0 – 25 – 100 – 500 ppm d’éthylbenzène 6 h/j (Faber et al., 2007), de 70 jours avant l’accouplement, la période d’accouplement, la gestation et la lactation. Au cours des 4 premiers jours de la lactation, l’exposition à l’éthylbenzène est réalisée par gavage aux doses de 0 - 26 – 90 - 342 mg.kg-1.j-1. Cette étude montre l’absence d’effet sur le développement et plus spécifiquement d’effets neurodéveloppementaux pour des expositions jusqu’à 500 ppm.
Voie orale
FDTE/VTR Importer Chez l’animal aucune donnée concernant l’effet de l’éthylbenzène par voie orale sur le développement n’est disponible.
Voie cutanée
FDTE/VTR Importer Chez l’animal aucune donnée concernant l’effet de l’éthylbenzène par voie cutanée sur le développement n’est disponible.
Autres Effets
Chez l'homme
Toutes voies
FDTE/VTR Importer Effets sur le système endocrinien :
Aucune altération des glandes endocrines n’a été constatée chez des rats exposés par inhalation à des concentrations d’éthylbenzène comprises entre 75 et 750 ppm pendant 2 ans (NTP, 1999). Cependant, les souris exposées aux mêmes concentrations (de 75 à 750 ppm) pendant 2 ans présentaient, pour la concentration la plus élevée (750 ppm), une augmentation de l’incidence de l’hyperplasie des cellules folliculaires de la glande thyroïde. Chez les souris femelles exposées à des concentrations d’éthylbenzène comprises entre 250 et 750 ppm, une augmentation significative de l’incidence des hyperplasies de la glande pituitaire a été constatée.
Chez l'animal
Toutes voies
FDTE/VTR Importer Effets sur le système endocrinien :
Aucune altération des glandes endocrines n’a été constatée chez des rats exposés par inhalation à des concentrations d’éthylbenzène comprises entre 75 et 750 ppm pendant 2 ans (NTP, 1999). Cependant, les souris exposées aux mêmes concentrations (de 75 à 750 ppm) pendant 2 ans présentaient, pour la concentration la plus élevée (750 ppm), une augmentation de l’incidence de l’hyperplasie des cellules folliculaires de la glande thyroïde. Chez les souris femelles exposées à des concentrations d’éthylbenzène comprises entre 250 et 750 ppm, une augmentation significative de l’incidence des hyperplasies de la glande pituitaire a été constatée.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
VGE/NQE Importer
SANTE HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
TOXICITE
Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. Contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte.
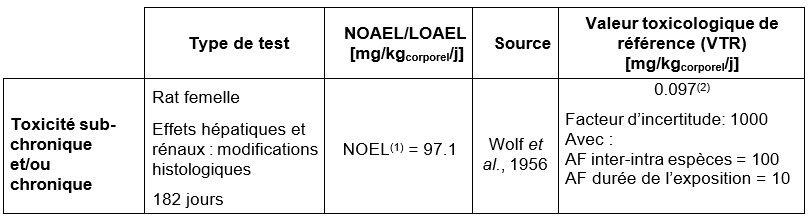
(1) No observed Effect Level. (2) Cette VTR a été déterminée par l'OMS.
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L’Anses retient la VTR de 22 mg.m-3 pour une exposition aiguë par inhalation à l’éthylbenzène (Anses, 2016)
Lors de son analyse des données existantes, l’Anses a considéré que l’étude retenue et la construction menée par l’ATSDR était de bonne qualité et qu’il n’était pas utile de procéder à la construction d’une valeur différente au regard des données disponibles. La valeur de l’ATSDR a donc été retenue.
Indice de confiance : L’Anses accorde un indice de confiance fort à cette valeur.
Effets à seuil - Exposition sub-chronique par inhalation :
L’Anses propose une VTR de 4,3 mg.m-3 pour une exposition subchronique par inhalation à l’éthylbenzène (Anses, 2016)
Cette valeur a été établie à partir de l’étude de Gagnaire et al. (2007), pour laquelle des effets ototoxiques par inhalation ont été observés chez les rats après une exposition subchronique (13 semaines). Cette étude, jugée par l’Anses comme étant de bonne qualité, a également été choisie par l’ATSDR pour la construction de sa VTR subchronique. L’effet critique retenu est un effet ototoxique (perte de cellules ciliées externes). A partir des données expérimentales, modélisées d’après la méthode du maximum de vraisemblance (Log Likelihood), une benchmark concentration BMC0,5 de 136,9 ppm correspondant à une augmentation de 50 % de la réponse par rapport au lot témoin a été calculée, de même que la limite inférieure de son intervalle de confiance à 90 % BMC0,5L90 de 119,7 ppm.
Pour le calcul de la concentration équivalente humaine (HEC), un ajustement dosimétrique de 1, plus protecteur, est retenu par défaut car selon les données disponibles dans les modèles PBPK, le coefficient de partition sang/air (Hb/g) de l’éthylbenzène pour l’animal est supérieur à celui de l’Homme.
BMC0,5L90 HEC = BMC0,5L90 x (Hb/g)rat / (Hb/g)Homme = 119,7 x 1 = 119,7 ppm.
Pour tenir compte de la discontinuité de l’exposition 6 h/j, 6 j/semaine, un ajustement temporel a été effectué :
BMC0,5L90 HEC ADJ = BMC0,5L90 HEC X (6/24) X (6/7) = 119,7 X (6/24) X (6/7) = 25,6 ppm
Facteur d’incertitude : un facteur d’incertitude global de 25 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine, et d’un facteur d’incertitude de 2,5 pour l’extrapolation des données animales chez l’Homme utilisant un ajustement dosimétrique.
Calcul : 25,6 ppm / 25 = 1,024 ppm arrondie à 1 ppm soit 4,3 mg.m-3
Indice de confiance : fort (choix de l’effet critique, choix de l’étude clé et choix de la dose critique).
Effets à seuil - Exposition chronique par inhalation :
L’Anses propose une VTR de 1,5 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (ANSES, 2016)
Cette valeur a été établie à partir de l’étude de Gagnaire et al. (2007), pour laquelle des effets ototoxiques par inhalation ont été observés chez les rats après une exposition subchronique (13 semaines). L’effet critique retenu est la perte de cellules ciliées externes. L’Anses a mené une démarche globale dans la construction de la VTR subchronique et chronique, telle qu’elle est décrite ci-dessus.
L’Anses a donc établi sa VTR à partir d’une BMC0,5L90 de 119,7 ppm (modèle de Hill – logiciel PROAST 38.9) et une BMC0,5L90 HEC ADJ = 25,6 ppm
Facteur d’incertitude : un facteur d’incertitude global de 75 est retenu, il correspond à un facteur d’incertitude 10 pour la variabilité au sein de l’espèce humaine, d’un facteur d’incertitude de 2,5 pour l’extrapolation des données animales chez l’Homme utilisant un ajustement dosimétrique et un facteur d’incertitude de 3 pour l’extrapolation d’une exposition subchronique à chronique.
Calcul : 25,6 ppm / 75 = 0,34 ppm soit 1,5 mg.m-3
Indice de confiance : L’Anses accorde un indice moyen/fort (moyen pour l’absence d’étude chronique, fort pour le choix de l’effet critique, le choix de l’étude clé et le choix de la dose critique).
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 0,4 mg.kg-1.j-1 pour une exposition subchronique par voie orale à l’éthylbenzène (ATSDR, 2010)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat Wistar (Mellert et al., 2007). Les lots ont été exposés à des doses de 0 – 75 - 250 - 750 mg.kg-1.j-1 pendant 13 semaines. Les doses étaient ingérées une moitié le matin, et l’autre le soir. L’effet critique retenu est l’hépatotoxicité (augmentation de l’activité enzymatique, augmentation du poids relatif et absolu du foie, augmentation dose-dépendante de l’incidence des hypertrophies des hépatocytes centrolobulaires). De cette étude, une BMDL10 de 48,2 mg.kg-1.j-1 a été calculée. L’utilisation d’un modèle PBPK permet de calculer une dose équivalente de 10,68 mg.kg-1.j-1.
Facteur d’incertitude : un facteur d’incertitude global de 30 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine et à un facteur d’incertitude de 3 pour l’extrapolation des données animales chez l’Homme en utilisant un ajustement dosimétrique.
Calcul : 10,68 mg.kg-1.j-1 / 30 = 0,356 mg.kg-1.j-1 (arrondi à 0,4 mg.kg-1.j-1)
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
Santé Canada propose une DJT de 0,022 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’éthylbenzène (2021)
Cette valeur a été établie à partir d’une étude expérimentale chez la souris B6C3F1 exposée par inhalation à des doses de 0, 75, 250 ou 750 ppm (0 - 330,75 - 1 102 - 3 307 mg.m-3) d’éthylbenzène, 6 heures par jour, 5 jours par semaine pendant 2 ans (NTP, 1999). Un NOAEL de 75 ppm a été retenu sur la base de l’hyperplasie de l’hypophyse et l’altération des cellules hépatiques chez la souris observées à la concentration supérieure de 250 ppm.
Pour établir une dose orale pertinente pour l’humain, les concentrations internes dans le sang et le foie des souris à 0,324 et 0,08 mg.L-1, respectivement, ont été estimées à l’aide d’une modélisation PBPK. La concentration dans le foie a été retenue pour calculer une DJT, car elle était plus faible que la concentration sanguine associée au NOAEL. Cette dose interne a ensuite été utilisée dans le modèle PBPK humain pour déterminer la dose externe humaine nécessaire à l’obtention d’une concentration sanguine semblable à celle observée chez le rat, en se fondant sur une consommation quotidienne de 1,5 L d’eau potable. La dose externe humaine ainsi obtenue, qui correspond à une concentration dans le foie de 0,08 mg.L-1, est de 0,54 mg.kg-1.j-1. Cette valeur a été utilisée pour calculer la DJT.
Facteur d’incertitude : un facteur global de 25 est retenu, il correspond à un facteur de 10 pour la variation intra-espèce, un facteur de 2,5 pour la variabilité humaine
Calcul : DJT = 0,54 mg.kg-1.j-1 / 25 = 0,022 mg.kg-1.j-1.
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L’Anses retient la valeur de 22 mg.m-3 pour une exposition aigüe par inhalation à l’éthylbenzène (Anses 2016).
Les deux valeurs proposées par l’ATSDR (2010) et le TCEQ (2013) ont été élaborées à partir des données de la même étude expérimentale (Cappaert et al., 2000). L’Anses a mené une analyse de ces valeurs en 2016. L’étude est de bonne qualité. L’effet critique retenu est un effet ototoxique traduisant une baisse de l’audition, cet effet est spécifique de l’éthylbenzène.
Le TCEQ construit sa valeur à partir d’une NOAEC, alors que l’ATSDR fait le choix de retenir une approche par BMC. Une extrapolation à une durée d’exposition de 1 heure a été pratiquée au moyen de la loi de Haber chez le rat par le TCEQ, avec un ajustement pour une concentration équivalente chez l’Homme. Les facteurs d’incertitudes utilisés par les deux organismes sont identiques et justifiés
La construction de la VTR aiguë de l’ATSDR a été jugée pertinente par l’Anses qui n’a pas considéré qu’il était possible de proposer une valeur de meilleure qualité au regard des données disponibles lors de son analyse. L’Ineris retient la valeur de l’Anses.
Indice de confiance : L’Anses accorde un indice de confiance élevé à cette valeur.
Effets à seuil - Exposition sub-chronique par inhalation :
L’Anses retient la valeur de 4,3 mg.m-3 pour une exposition subchronique par inhalation à l’éthylbenzène (Anses, 2016).
L’ATSDR (2010) et l’Anses (2016) proposent une valeur pour cette voie et cette durée d’exposition. Ces valeurs sont établies à partir d’une même étude de toxicité subchronique par inhalation chez le rat, de bonne qualité. L’ATSDR a été contraint de retenir comme effet critique la modification des seuils auditifs car aucun des modèles testés ne permettait d’ajuster correctement les données modélisées sur les données expérimentales concernant la perte de cellules ciliées externes.
L’Anses a pu modéliser les données expérimentales retenues comme effet critique sur la perte de cellules ciliées externes à l’aide des modèles mathématiques utilisés par le logiciel Proast élaboré par le RIVM afin d’établir une BMCL. Les ajustements dosimétriques et temporels sont justifiés, ainsi que les facteurs d’incertitude. L’Ineris retient la valeur de l’Anses.
Indice de confiance : L’Anses accorde un indice de confiance fort dans sa valeur.
Effets à seuil - Exposition chronique par inhalation :
L’Anses propose de retenir la valeur de 1,5 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (Anses, 2016).
Sept organismes proposent une valeur : l’Anses (2016), l’US EPA (1996), l’ATSDR (2010), le RIVM (2001), l’OEHHA (2000), Santé Canada (2021) et le TCEQ (2015). L’OMS propose une valeur guide (1996).
Ces différentes valeurs reposent sur 4 études différentes :
Une étude de développement effectuée chez le rat et le lapin (Andrew et al., 1981). Dans ces études réalisées à partir de protocoles rigoureux, les effets observés sont des variations au niveau du squelette des fœtus chez les rats. Ils apparaissent à la plus forte dose testée de 1 000 ppm et constituent une forme bénigne de toxicité fœtale.
Une étude subchronique (13 semaines) chez le rat, réalisée selon des normes de qualité strictes rapporte comme effet le plus sensible une augmentation significative du poids absolu du foie chez les mâles à partir de 250 ppm d’éthylbenzène, sans changements de l’histologie hépatique (NTP, 1992).
Une étude chronique réalisée sur des rats et des souris exposés 104 semaines à des concentrations de 0 – 75 - 250 – 750 ppm d’éthylbenzène, étude réalisée sous assurance qualité, rapporte chez les rats une baisse du taux de survie (mâles) et une néphrotoxicité (mâles et femelles) à partir de 250 ppm (NTP, 1999). Chez les souris, les effets les plus sensibles s’observent à la même concentration de 250 ppm au niveau du foie chez les mâles (hypertrophie et nécrose hépatocytaire) et de l’hypophyse (hyperplasie du lobe antérieur) chez les femelles.
Les effets retenus par l’OEHHA et Santé Canada sont ceux sur le foie et la glande pituitaire chez la souris, qui apparaissent à 250 et 750 ppm, alors que ceux retenus par le TCEQ sont la néphrotoxicité sévère chez le rat également observée à partir de 250 ppm.
Une étude subchronique, réalisée dans de bonnes conditions expérimentales (Gagnaire et al., 2007) met en évidence des effets ototoxiques qui apparaissent dès 200 ppm, 8 semaines après une exposition de 13 semaines chez le rat. La persistance de la perte de cellules ciliées externes chez le rat, la sensibilité de l’effet et la pertinence de l’effet transposable à l’Homme ont conduit l’ANSES à développer une VTR à partir de cette étude.
L’Anses construit une VTR chronique de la même manière que sa VTR subchronique à partir de l’étude de Gagnaire et al. avec le calcul d’une Benchmark concentration.
En accord avec l’analyse des données disponibles réalisée par l’ANSES et sur la base de l’effet critique le plus sensible, l’ototoxicité, c’est la valeur de l’ANSES qui est retenue.
Indice de confiance : L’Anses accorde un indice confiance moyen dans sa valeur.
Effets à seuil - Exposition sub-chronique par voie orale :
L’INERIS propose de retenir la valeur de 0,4 mg.kg-1.j-1 pour une exposition subchronique voie orale à l’éthylbenzène (ATSDR, 2010).
Cette valeur proposée par l’ATSDR (2010) provient d’une étude de toxicité subchronique par voie orale chez le rat (Mellert et al., 2007). L’étude est de bonne qualité. L’effet critique hépatique est un effet adaptatif plus que néfastes, les effets néfastes rénaux qui sont mieux caractérisés surviennent à des niveaux d’exposition plus élevés. La construction de la VTR clairement expliquée et l’utilisation des facteurs d’incertitude justifiée ; cette valeur est retenue.
Indice de confiance : moyen (en raison des limites relatives au choix des effets critiques) (qualité de l’étude, choix de l’effet critique et construction de la VTR)
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir la valeur de 22 µg.kg-1.j-1 pour une exposition chronique voie orale à l’éthylbenzène (Santé Canada, 2021).
Quatre organismes proposent une valeur : l’US EPA (1991), l’OMS (2017), le RIVM (2001) et Santé Canda (2021).
L’US EPA, l’OMS et le RIVM proposent la même valeur à partir de la même construction basée sur l’étude de Wolf et al. (1956) qui est ancienne, les données sont très parcellaires et non vérifiables (Wolf et al. 1956). Néanmoins, la toxicité rénale et hépatique retenue comme effet critique, reste cohérente au regard du profil toxicologique de l’éthylbenzène. Les facteurs d’incertitudes utilisés sont identiques pour chacun des trois organismes (facteur global de 1 000). Le RIVM a révisé sa valeur en 2001, l’ajustant pour obtenir une exposition continue, obtenant ainsi la même valeur que l’US EPA et l’OMS.
Santé Canada s’appuie sur une étude plus récente de toxicité chronique de 2 ans chez le rat et la souris (NTP, 1999) réalisée par inhalation. Parmi les effets critiques retenus, l’hyperplasie de l’hypophyse et la toxicité hépatique est pertinente dans la mesure où elle est également observée dans les études de toxicité par voie orale et a été retenue comme effet critique dans le calcul de la VTR sub-chronique réalisé par l’ATSDR. Toutefois, cette étude n’a pas été retenue dans le choix de la VTR chronique par inhalation en raison de la construction d’une VTR récente par l’Anses à partir d’un effet plus sensible (l’ototoxicité) qui ne semble pas nécessairement pertinent dans le cadre d’une exposition par voie orale. L’extrapolation des données voie à voie est justifiée par le calcul d’une dose interne (modèle PBPK). La construction de la VTR et les facteurs d’incertitude sont cohérents.
La VTR de Santé Canada, plus protectrice, s’appuie sur des données plus récentes, Elle est retenue.
Indice de confiance : faible (en raison de l’extrapolation voie à voie)
Effets sans seuil - Exposition chronique par Inhalation :
L’Anses propose de ne pas retenir de valeur pour une exposition chronique à l’éthylbenzène par inhalation (Anses, 2016).
En l’état actuel des données, les résultats des études de génotoxicité semblent écarter l’hypothèse d’un mécanisme génotoxique ce qui laisse présager l’existence d’un seuil de dose pour les effets cancérogènes. Pour des expositions par inhalation, l’Anses considère que l’élaboration d’une VTR chronique basée sur des effets ototoxiques mis en évidence pour une exposition subchronique à 200 ppm protégerait a priori de l’apparition de tumeurs rénales chez l’animal, observées pour une exposition chronique à une concentration de 750 ppm. L’Ineris retient l’approche de l’Anses.
Effets sans seuil - Exposition chronique par voie orale :
L’Ineris propose de ne pas retenir de valeur pour une exposition chronique à l’éthylbenzène par voie orale pour des effets sans seuil.
Dans l’état actuel des données, l’éthylbenzène ne peut pas être considéré comme un cancérogène génotoxique ce qui ne justifie pas le choix d’une VTR pour des effets sans seuil .
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L’ATSDR a établi un MRL de 22 mg.m-3 pour une exposition aiguë par inhalation à l’éthylbenzène (ATSDR, 2010)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat Wag/rij (Cappaert et al., 2000). Les lots ont été exposés à des concentrations de 0 – 300 - 400 - 550 ppm d’éthylbenzène pur, 8 h/j, pendant 5 jours. Une BMCL1sd de 81,10 µmol.L-1 a été calculée pour la détérioration du système auditif (altération de l’audition), ce qui correspond à une concentration équivalente pour l’Homme de 154,26 ppm après ajustement.
Facteur d’incertitude : un facteur d’incertitude global de 30 est retenu, il correspond à un facteur d’incertitude 10 pour la variabilité au sein de l’espèce humaine et un facteur d’incertitude 3 pour l’extrapolation des données animales chez l’Homme après ajustement dosimétrique.
Calcul : 154 ppm / 30 = 5,13 ppm (arrondi à 5 ppm, soit 22 mg.m-3).
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Le TCEQ propose un ReV de 86 mg.m-3 (20 ppm) pour une exposition aiguë de 1 heure par inhalation à l’éthylbenzène (2013).
Cette valeur a été établie à partir de l’étude de Cappaert et al. (2000), également retenue par l’ATSDR, dans laquelle des rats ont été exposés à des doses de 0 – 300 - 400 - 550 ppm d’éthylbenzène, 8 h/j, pendant 5 jours. Le TCEQ a retenu comme effet critique l’ototoxicité et une NOAEC de 300 ppm sur la base d’un déplacement du seuil auditif à partir de 400 ppm et la perte de cellules ciliées externes dans l’organe de Corti. Cette NOAEC a été retenue comme POD (point de départ) du calcul de la valeur.
Un ajustement sur la durée d’exposition a été réalisé pour tenir compte de l’exposition de 8 h, ramenée à 1 h en utilisant la loi de Haber avec n = 3.
PODADj = [(300 ppm)3 x (8 h/1 h)]1/3 = 600 ppm
Le coefficient de partition sang/air (Hb/g) de l’éthylbenzène pour l’animal étant supérieur à celui de l’Homme, une valeur de 1 par défaut a été retenue pour le calcul de la concentration équivalente chez l’Homme (HEC).
PODHEC = PODADj x 1 = 600 ppm
Facteurs d'incertitude : un facteur global d’incertitude de 30 est appliqué avec un facteur d'incertitude de 10 pour la variabilité au sein de la population et un facteur d’incertitude de 3 pour la variabilité entre espèces.
Calcul : ReVaiguë = 600 ppm / 30 = 20 ppm soit 86 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition sub-chronique par inhalation :
L’ATSDR a établi un MRL de 8,28 mg.m-3 pour une exposition subchronique par inhalation à l’éthylbenzène (ATSDR, 2010)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat Sprague-Dawley (Gagnaire et al., 2007). Les animaux ont été exposés à des doses de 0 – 200 – 400 - 600 - 800 ppm d’éthylbenzène (pureté de 99 %), 6 heures par jour, 6 jours par semaine pendant 13 semaines. La concentration de 200 ppm (882 mg.m-3) est retenue comme LOAEC. L’effet critique observé est la détérioration du système auditif (perte d’audition) par altérations morphologiques de l’organe de Corti (perte de cellules ciliées externes). Aucun ajustement sur la durée d’exposition n’est proposé du fait de son absorption rapide et de l’atteinte d’un équilibre sanguin dans les deux heures suivant le début de l’exposition à des concentrations de 75 à 500 ppm.
La plupart des modèles disponibles ne permettaient pas d’ajuster de manière adéquate les données modélisées aux données expérimentales pour les seuils auditifs. Cependant, en écartant les 2 lots exposés aux concentrations les plus élevées, un ajustement plus fidèle de plusieurs ensembles de données a été possible en utilisant différents modèles. Concernant la perte de cellules ciliées externes, aucun des modèles testés ne permettait d’ajuster correctement les données modélisées sur les données expérimentales.
La plus faible Benchmark concentration de 19,94 µmol.L-1, calculée à partir du modèle polynomial d’ordre deux (sans tenir compte des deux plus fortes concentrations de l’étude) et correspondant à une modification des seuils auditifs en réponse à des stimuli sonores de 8 kHz après 4 semaines d’exposition a été retenue. Elle correspondant à la plus faible concentration équivalente chez l’Homme de 63,64 ppm, calculée au moyen d’un modèle PBPK humain. Cette valeur de 63,64 ppm a été choisie par l’ATSDR en tant que concentration critique comme point de départ du calcul du MRL.
Facteur d’incertitude : un facteur d’incertitude global de 30 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine, et d’un facteur d’incertitude de 3 pour l’extrapolation des données animales chez l’Homme utilisant un ajustement dosimétrique.
Calcul : 63,64 ppm / 30 = 2,12 (arrondie à 2 ppm soit 8,28 mg.m-3).
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par inhalation :
L’US EPA propose un RfC de 1 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (US EPA (IRIS), 1991)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat Wistar et le lapin New Zélande (Andrew et al., 1981 ; Hardin et al., 1981 ). Les lots ont été exposés à des doses de 0 - 100 – 1 000 ppm (0 – 434 – 4 342 mg.m-3) d’éthylbenzène du 1er au 19ème jour ou du 1er au 24ème jour de gestation, 6 à 7 h/j et 7 j/7. La concentration de 434 mg.m-3 est retenue comme NOAEC et celle de 4 340 mg.m-3 comme LOAEC. L’effet critique observé est la toxicité au niveau du développement (côtes surnuméraires chez le rat) ainsi qu’une augmentation du poids du foie, des reins et de la rate des femelles en cours de gestation (rat). Les concentrations ajustées sur la durée et équivalentes ont été calculées :
NOAEL = NOAELADJ (dans le cas des effets sur le développement)
NOAELHEC = NOAELADJ x [(Hb/g)A / (Hb/g)H] = 100 ppm x [1] = 100 ppm
avec (Hb/g)A et (Hb/g)H les coefficients de partition sang/gaz chez l’Homme et l’animal (une valeur de 1 est utilisée pour le ratio, car les coefficients sont inconnus de l’US EPA).
100 ppm x 4,34 = 434 mg.m-3.
Le facteur de conversion utilisé par l’US EPA est 106,18 (masse molaire de l’éthylbenzène) / 24,45 (volume d’une mole) = 4,34
Facteur d’incertitude : un facteur d’incertitude global de 300 est retenu, il correspond à un facteur d’incertitude 10 pour la variabilité humaine, un facteur d’incertitude 10 pour l’absence d’études de reproduction et multi-générations et un facteur d’incertitude 3 pour l’extrapolation des données animales chez l’Homme.
Calcul : 434 mg.m-3 x 1/300 = 1,44 mg.m-3 (arrondi à 1 mg.m-3)
L’indice de confiance : L’US EPA accorde un indice de confiance faible que ce soit pour l’étude source, pour la base de données ou pour la valeur élaborée.
L’ATSDR propose un MRL de 0,3 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (2010)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat F344 et la souris B6C3F1 (NTP, 1999). Les lots ont été exposés à des doses de 0 – 75 - 250 - 750 ppm d’éthylbenzène, 6 h/j, 5 j/7 pendant 2 ans. La concentration de 75 ppm est retenue comme LOAEC. Les effets critiques observés sont des néphropathies sévères chez les rats mâles (dilatation des tubules rénaux, fibroses interstitielles, infiltration de cellules inflammatoires, régénérations tubulaires, hyperplasie transitoire de la papille rénale). Une LOAEC équivalente a été calculée pour l’Homme : LOAEC[HEC] (ppm) = 17,45 ppm.
Aucun ajustement sur la durée d’exposition n’est proposé du fait de l’absorption rapide de l’éthylbenzène et de l’atteinte d’un équilibre sanguin dans les deux heures suivant le début de l’exposition à des concentrations de 75 à 500 ppm.
Facteur d’incertitude : un facteur d’incertitude global de 300 est retenu, il correspond à un facteur d’incertitude 10 pour la variabilité au sein de la population humaine, un facteur d’incertitude 3 pour l’extrapolation des données animales chez l’Homme, et un facteur d’incertitude 10 pour l’utilisation d’un LOAEC.
Calcul : 17,45 ppm / 300 = 0,0581 ppm (arrondi à 0,06 ppm = 0,3 mg.m-3).
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
L’OMS propose une Valeur Guide de 22 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (1996)
Cette valeur guide a été établie à partir d’une étude de toxicité subchronique menée chez le rat (NTP, 1992). De cette étude, une NOAEC est retenue pour la concentration de 2 150 mg.m-3 (500 ppm) à partir de l’augmentation statistiquement significative du poids relatif du foie sans modifications de l’histologie hépatique (effet critique) observée à la dose supérieure de 3 225 mg.m-3 (750 ppm) chez les mâles.
Aucun ajustement n’a été réalisé.
Facteurs d’incertitude : un facteur global de 100 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine, un facteur d’incertitude de 5 pour la variabilité inter-espèce et un facteur d’incertitude de 2 pour tenir compte du manque de données relatives à la toxicité chronique.
Calcul : 500 ppm / 100 = 5 ppm soit 22 µg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Le RIVM propose un TCA de 770 µg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (Baars et al., 2001)
Cette valeur a été établie à partir d’une étude de toxicité subchronique menée chez le rat (NTP, 1992). De cette étude, une NOAEC est retenue pour la concentration de 430 mg.m-3. Les effets critiques sont observés sur le foie et les reins.
Un ajustement pour une exposition continue a été calculé : 430 mg.m-3 x (5 j /7 j) x (6 h/24 h) = 77 mg.m-3
Facteurs d’incertitude : un facteur global de 100 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine et un facteur d’incertitude de 10 pour la variabilité inter-espèce.
Calcul : 77 mg.m-3 / 100 = 770 µg.m-3
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
L’OEHHA propose un REL de 2 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (OEHHA, 2000)
Cette valeur a été établie à partir d’une étude expérimentale chez la souris B6C3F1 et le rat F344/N (NTP, 1999). Les lots ont été exposés à des concentrations de 0, 75, 250 ou 750 ppm (0 - 330,75 - 1 102,5 - 3 307,5 mg.m-3) d’éthylbenzène, 6 h/j, 5 j/7 pendant 2 ans. Une NOAEC a été retenue pour la concentration de 75 ppm et une LOAEC de 250 ppm. Les effets critiques observés sont une néphrotoxicité, une baisse de poids corporel (rats), une hyperplasie de la glande pituitaire et des altérations et des nécroses des cellules hépatiques (souris). Un ajustement pour une durée d’exposition continue a été pratiqué (6 h/24 h) x (5 j/7 j). Une NOAECHEC équivalente pour l’Homme a été calculée, avec un facteur par défaut de 1 car l’éthylbenzène est considéré comme un gaz ayant des effets systémiques.
75 ppm x (5 j/7 j) x (6 h/24 h) = 13 ppm
Facteur d’incertitude : un facteur d’incertitude global de 30 est retenu, il correspond à un facteur de 10 pour la variabilité humaine et un facteur de 3 pour la variabilité inter-espèce.
Calcul : 13 ppm / 30 = 0,4433 ppm = 2 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Santé Canda retient une CT de 2 mg.m-3 pour une exposition chronique par inhalation à l’éthylbenzène (Santé Canda, 2021)
Cette valeur est basée sur celle de l’OEHHA établie en 2000 à partir d’une étude expérimentale chez la souris B6C3F1 et le rat F344/N (NTP, 1999). La démarche de la construction est en tout point similaire à celle proposée par l’OEHHA, avec une NOAEC de 75 ppm retenue sur la base de la toxicité chez les souris sur l’hypophyse (femelles) et hépatotoxicité (altérations cellulaires et nécroses du foie) (mâles), ajusté pour une exposition continue et concentration équivalente pour l’homme.
75 ppm x (5 j/7 j) x (6 h/24 h) = 13 ppm
Facteur d’incertitude : un facteur d’incertitude global de 30 est retenu, il correspond à un facteur 10 pour la variabilité humaine et un facteur 3 pour la variabilité inter-espèce.
Calcul : 13 ppm / 30 = 0,4433 ppm = 2 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Le TCEQ propose un ReV de 570 µg.m-3 (0,135 ppm) pour une exposition chronique par inhalation à l’éthylbenzène (2015)
Cette valeur a été établie à partir d’une étude de 2 ans chez le rat exposé par inhalation à des concentrations de de 0, 75, 250 ou 750 ppm (0 - 330,75 - 1 102,5 - 3 307,5 mg.m-3) d’éthylbenzène, 6 h/j, 5 j/7 (NTP, 1999). L’effet critique retenu est la sévérité de la toxicité rénale (rat), l’effet hépatique (souris) ayant contribués à la mortalité avec une NOAEL de 75 ppm.
Du fait d’une exposition discontinue des animaux (6 h/j), 5 j/7 un ajustement a été réalisé :
PODADJ = POD x 6 h/24 h x 5 j/7 j= 75 ppm x 6 h /24 h x 5j/7j = 13,4 ppm.
Le calcul d’une concentration équivalente pour l’Homme a ensuite été réalisé, avec une valeur par défaut de 1 dans la mesure où le ratio animal/Homme du coefficient de partage sang–air est supérieur à 1.
Facteurs d'incertitude : un facteur d’incertitude de 30 est appliqué (un facteur d’incertitude 10 pour la variabilité au sein de l’espèce humaine et un facteur d’incertitude 3 pour la variabilité inter-espèce).
Calcul : ReVchronique = PODHEC / facteurs d’incertitude = 13,4 ppm / 30 = 0,45 ppm soit 1,9 mg.m-3
Indice de confiance : cet organisme n’accorde pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA propose un RfD de 0,1 mg.kg.-1.j-1 pour une exposition chronique par voie orale à l’éthylbenzène (US EPA (IRIS), 1991)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat (Wolf et al., 1956). Les lots ont été exposés à des doses de 13,6 – 136 - 408 - 680 mg.kg-1.j-1 d’éthylbenzène en solution dans de l’huile d’olive par gavage, 5 j/7 pendant 182 jours. Les effets critiques observés sont des changements histopathologiques du foie et des reins. La dose de 136 mg.kg-1.j-1 est retenue comme NOAEL et celle de 408 mg.kg-1.j-1 comme LOAEL. Un ajustement pour une exposition continue a été réalisé (5 j/7 j) :
NOAELadj = 136 mg.kg-1.j-1 x (5 j/7 j) = 97,1 mg.kg-1.j-1
Facteur d’incertitude : un facteur d’incertitude global de 1 000 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine, un facteur d’incertitude de 10 pour la variabilité inter-espèce et un facteur d’incertitude de 10 pour tenir compte de la durée de l’étude.
Calcul : 97,1 mg.kg-1.j-1 / 1 000 = 0,097 (arrondi à 0,1 mg.kg-1.j-1)
L’indice de confiance : faible que ce soit pour l’étude source, pour la base de données ou pour la valeur élaborée.
L’OMS propose un DJA de 97 µg.kg.-1.j-1 pour une exposition chronique par voie orale à l’éthylbenzène (OMS, 2017)
Cette valeur est établie à partir d’une étude expérimentale menée chez le rat (Wolf et al., 1956). Les lots ont été exposés à des doses de 13,6 – 136 - 408 - 680 mg.kg-1.j-1 d’éthylbenzène en solution dans de l’huile d’olive par gavage, 5 j/7 pendant 182 jours. Les effets critiques observés sont des changements histopathologiques du foie et des reins. La dose de 136 mg.kg-1.j-1 est retenue comme NOAEL et celle de 408 mg.kg-1.j-1 comme LOAEL. Un ajustement pour une exposition continue a été réalisé (5 j/7 j) :
NOAELadj = 136 mg.kg-1.j-1 x (5 j/7 j) = 97,1 mg.kg-1.j-1
Facteur d’incertitude : un facteur d’incertitude global de 1 000 est retenu, il correspond à un facteur d’incertitude de 10 pour la variabilité au sein de l’espèce humaine, un facteur d’incertitude de 10 pour la variabilité inter-espèce et un facteur d’incertitude de 10 pour tenir compte de la durée de l’étude.
Calcul : 97,1 mg.kg-1.j-1 / 1 000 = 0,097 mg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Le RIVM propose un TDI de 0,1 mg.kg-1.j-1 pour une exposition chronique par voie orale à l’éthylbenzène (Baars et al., 2001)
Cette valeur a été établie à partir d’une étude expérimentale menée chez le rat (Wolf et al., 1956). Les lots ont été exposés à des doses de 13,6, 136, 408 ou 680 mg.kg-1.j-1 d’éthylbenzène, 5 j/7, pendant 182 jours. De cette étude, un NOAEL de 136 mg.kg-1.j-1 a été retenu pour une toxicité hépatique et rénale.
Un ajustement a été pratiqué pour une exposition continue :
NOAELADJ = 136 x 5 j/7 j = 97,1 mg.kg-1.j-1
Facteur d’incertitude : un facteur global de 1 000 est retenu, il correspond à un facteur de 10 pour la variation intra-espèce, un facteur de 10 pour la variabilité humaine et un facteur de 10 pour l’extrapolation des données sub-chroniques en données chroniques.
Calcul : 97,1 mg.kg-1.j-1 x1/1 000 = 0,097 mg.kg-1.j-1 (arrondi à 0,1 mg.kg-1.j-1).
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
Effets sans seuil - Exposition chronique par voie orale :
L’OEHHA propose un ERUi de 2,5.10-6 (µg.m-3)-1 pour une exposition par inhalation et un ERUo de 0,011 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale (OEHHA, 2009)
Cette valeur a été établie à partir d’une étude expérimentale menée chez le rat F344/N et la souris B6C3F1 (NTP, 1999), principalement avec les résultats obtenus chez le rat mâle.
L’étude du NTP a montré, entre autres, une augmentation de l’incidence des adénomes et carcinomes des tubules rénaux chez le rat mâle, une augmentation des adénomes des tubules rénaux chez les femelles, une augmentation de l’incidence des carcinomes et adénomes broncho-alvéolaires chez les souris B6C3F1 mâles, et une augmentation de l’incidence des carcinomes ou adénomes hépatiques pour les souris femelles. Sur la base de ces résultats, l’OEHHA a calculé un ERUo et un ERUi. Comme le montre le tableau suivant, un potentiel cancérigène, exprimé en (mg.kg-1.j-1)-1 a d’abord été calculé pour chaque espèce et sexe étudié ainsi que pour chaque type de tumeurs observé, à l’aide d’un modèle linéaire multi-étapes et selon la procédure d’élaboration de la BMD.
Une extrapolation des données animales à l’Homme a ensuite été réalisée pour calculer le potentiel cancérigène pour l’Homme en appliquant l’équation suivante (Watanabe et al., 1992).
q humain = q animal x [BWh/BWa]1/4
q humain : potentiel cancérigène chez l’Homme
q animal : potentiel cancérigène chez l’animal
BWa = PCa : poids corporel chez l’animal
BWh = PCh : poids corporel chez l’Homme
Le risque unitaire, exprimée en (mg.m-3)-1, a été calculé à partir de la dose moyenne pour une exposition vie entière basée sur la dose métabolisée du modèle PBPK a été multipliée par le taux respiratoire de l’Homme (20 m3.j-1), divisée par le poids corporel (70 kg) et multipliée par le facteur d'absorption estimée par inhalation chez l'Homme (0,77 pour l’éthylbenzène). Ainsi, une valeur est calculée pour l’unité de risque unitaire chez l’Homme, en termes de concentration dans l’air extérieur.
Le tableau suivant résume les résultats obtenus avec le modèle linéaire multi-étapes :
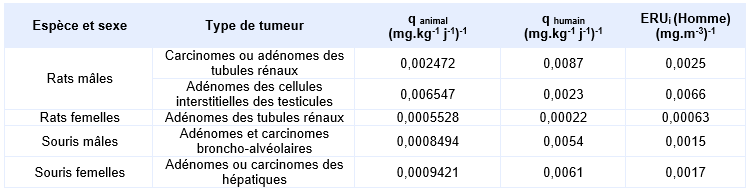
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 09/09/2025
Introduction
Evaluation existante :
La substance a fait l'objet d'une évaluation de risque qui a été réalisée conformément au règlement 793/93 (ECB., 1993) et dont le rapport final est disponible sur le site de l'Ex-Bureau Européen des substances chimiques (ECB, 2007 European Union Risk Assessment Report for Ethylbenzene (CAS n°100-41-4). Les données issues de ce rapport n'ont pas fait l'objet d'une validation supplémentaire.
Critères PBT / POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
Normes de qualité existantes :
Union Européenne3 : norme de qualité (projet) pour la vie aquatique = 10 µg.L-1,
Allemagne : norme de qualité pour les eaux prélevées destinées à la consommation = 10 µg.L-1 (ETOX, 20074),
Pays-Bas : objectif de qualité pour les eaux prélevées destinées à la consommation = 4 µg.L-1 (valeur cible, fraction totale), 370 µg.L-1 (valeur maximale admissible, fraction totale) (ETOX, 20074),
Canada : critère de qualité pour la vie aquatique, l'eau douce = 90 µg.L-1 (fraction totale) (ETOX, 20074),
critère de qualité pour l'eau potable = 2.4 µg.L-1 (fraction totale) (ETOX, 20074),
USA : critère de qualité pour l'eau de consommation et la consommation de poisson = 3100 µg.L-1 (ETOX, 20074),
critère de qualité pour la consommation de poisson et la protection de la santé = 29000 µg.L-1 (ETOX, 20074).
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
[3] Comité Scientifique consultatif pour l'examen de la Toxicité et de l'Écotoxicité des substances chimiques of the European Commission.
[4] Les données issues de cette source () ne sont données qu'à titre indicatif ; elles n'ont donc pas fait l'objet d'une validation par l'INERIS. http://webetox.uba.de/webETOX/index.do
Substance(s) associée(s) :
-
Dangers
Description
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, pour chaque taxon sont reportés uniquement les résultats des tests d'écotoxicité montrant la plus forte sensibilité à la substance. Toutes les données présentées sont issues de l'évaluation des risques européenne et n'ont pas fait l'objet d'une validation supplémentaire.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
En raison du caractère volatil de la substance, seuls les résultats d'essais relatifs à des tests réalisés en système clos ou avec renouvellement continu de la substance sont mentionnés dans les tableaux qui suivent. De plus, les concentrations reportées correspondent à des concentrations mesurées.
ECOTOXICITE AQUATIQUE AIGUË
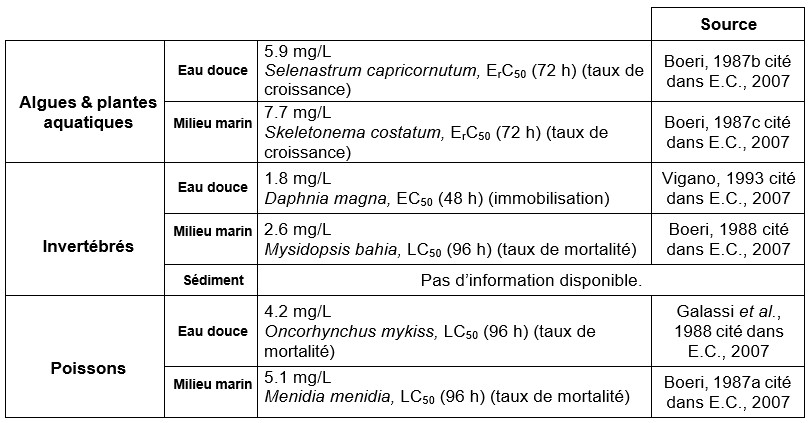
ECOTOXICITE AQUATIQUE CHRONIQUE
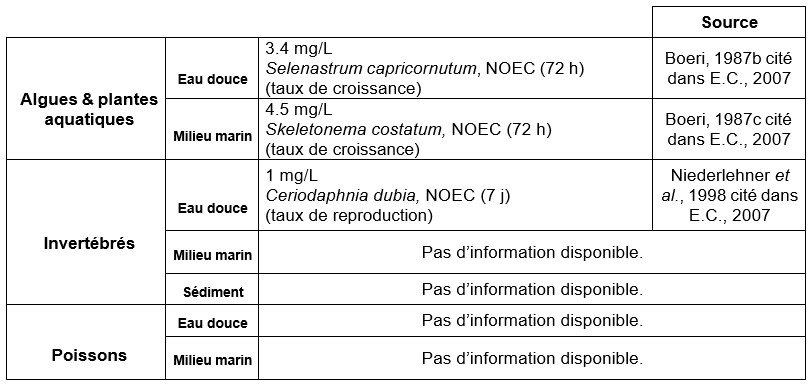
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biota, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été jugées valides puisqu'elles sont issues d'une source fiable.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biota n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen (Tableau 22, page 129, E.C., 2003) et le projet de guide technique européen pour la détermination de normes de qualité (E.C., 2009). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (tableau 23, page 130, E.C., 2003). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
TOXICITE ORALE POUR LES MAMMIFERES

(1) No observed Effect Level
TOXICITE ORALE POUR LES OISEAUX

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Biote
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour l'évaluation des risques dus aux substances chimiques (E.C., 2003) et au projet de guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2009). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le tableau 16, page 101, du guide technique européen (E.C., 2003).
- Moyenne annuelle (AA-QSwater_eco) :
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour l'éthylbenzène, on dispose de données valides pour 3 niveaux trophiques en aigu et pour 2 niveaux trophiques en chronique. En aigu comme en chronique, ce sont les invertébrés qui apparaissent les plus sensibles avec une EC50 (48 h) à 1.8 mg.L-1 pour Daphnia magna et une NOEC (7 j) à 1 mg.L-1 pour Ceriodaphnia dubia. Conformément au TGD (cf. note c du tableau 16, page 101 de E.C., 2003) un facteur d'extrapolation de 50 devrait être appliqué à la plus faible NOEC. Toutefois, il a été souligné par les États membres que l'éthylbenzène est une substance chimique narcotique ; cela a été confirmé par une homogénéité entre les données expérimentales et celles issues des équations QSAR. C'est pourquoi, un facteur d'extrapolation de 10 peut être appliqué à la plus faible NOEC disponible pour l'éthylbenzène comme proposé pour toutes les substances de cette catégorie (E.C., 2007). On obtient donc :
![]()
Notons que cette valeur a été validée comme PNECaqua (concentration prédite sans effet) lors de l'évaluation européenne de la substance (E.C., 2007).
Concentration Maximum Acceptable (MAC)
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées. Pour la détermination de la MAC, le document guide pour l'évaluation des effets des substances avec des rejets intermittents est utilisée (ECHA, 2008, E.C., 2009)
On dispose de données aiguës sur les trois niveaux trophiques (algues, invertébrés, poissons), la plus faible étant celle sur Daphnia magna, EC50 (48 h) = 1.8 mg.L-1.
Compte tenu du mode d'action de la substance (effet narcotique), un facteur d'extrapolation de 10 s'applique pour calculer la MAC :

VALEUR GUIDE DE QUALITE POUR LE SEDIMENT (QSSED)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) pour protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Aucune information d'écotoxicité pour les organismes benthiques n'a été trouvée dans la littérature. A défaut, une valeur guide pour le sédiment peut être calculée à partir du modèle de l'équilibre de partage.
Ce modèle suppose que:
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
NB : La pollution actuelle peut être suivie dans les matières en suspension et les couches superficielles du sédiment. Les couches profondes intègrent la contamination historique sur des dizaines voire des centaines d'années et ne sont pas jugées pertinentes pour caractériser la pollution actuelle. Les paramètres par défaut préconisés par Lepper (2002) et le guide technique européen (E.C., 2003) ont été choisis empiriquement pour caractériser les matières en suspension et les couches superficielles. Matières en suspension et couches superficielles contiennent relativement plus d'eau et de matière organique que les couches profondes du sédiment.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (adaptation de l'équation 70 page 113 du guide technique européen, E.C., 2003) :
![]()
Avec
RHOsup : masse volumique de la matière en suspension en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper, 2002) et le guide technique européen (équation 18 page 44, E.C., 2003) est utilisée : 1150 kg.m-3 .
Kpsusp-eau : coefficient de partage matière en suspension/eau en m3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par Lepper, 2002) et le guide technique européen (équation 24 page 47, E.C., 2003) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.9 + 0.025 * Koc soit Kpsusp-eau = 11.695 m3/m3 .
Ainsi, on obtient :
![]()
QSsed wet weight = 1017 µg/kg (poids humide)
Notons que cette valeur a été retenue comme PNEC sed poids humide lors de l'évaluation européenne de la substance (E.C., 2007).
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec :
Fsolidesusp : fraction volumique en solide dans les matières en suspension en [m3solide/m3susp]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 0.1 m 3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par Lepper (2002) et le guide technique européen (tableau 5 page 43, E.C., 2003) est utilisée : 2500 kg.m-3 .
Pour l'éthylbenzène, la concentration correspondante en poids sec est :
QSsed dry_weight = 1017 * 4.6 = 4678 µg.kg-1sed poids sec
Le LogKow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substances dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.

NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2003). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés dans le tableau 23 page 130 du guide (E.C., 2003).
Pour l'éthylbenzène, un facteur de 90 est appliqué car la durée du test retenu (NOEC à 971 mg.kg-1biota sur rat) est de 182 jours. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée à une concentration dans l'eau selon la formule suivante :
![]()
Avec :
BCF : facteur de bioconcentration,
BMF : facteur de biomagnification.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le tableau 29, page 160, du guide technique européen (E.C., 2003).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour l'éthylbenzène, un BCF de 91 (calculé à partir du log Kow (3.13), E.C., 2007) et un BMF de 1 (cf. E.C., 2003) ont été retenus. On a donc:
![]()

NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (Lepper, 2005) :
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 97 µg/kgcorporel/j (cf. tableau dans Toxicologie Valeurs de référence),
- un poids corporel moyen de 70 kg,
- Cons. Journ. Moy : une consommation moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2009).
Pour l'éthylbenzène, le calcul aboutit à :
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
![]()
Pour l'éthylbenzène, on obtient donc:
![]()

NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
La norme de qualité pour l'eau de boisson est calculée de la façon suivante (Lepper, 2005):
![]()
Ce calcul tient compte de:
- la valeur toxicologique de référence (VTR) ; pour cette substance elle sera considérée égale à 97 µg/kgcorporel/j,
- une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour l'éthylbenzène, on obtient:
![]()

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
PROPOSITION DE NORME DE QUALITE ENVIRONNEMENTALE (NQE)
La NQE est définie à partir de la valeur de la norme de qualité la plus protectrice parmi tous les compartiments étudiés.
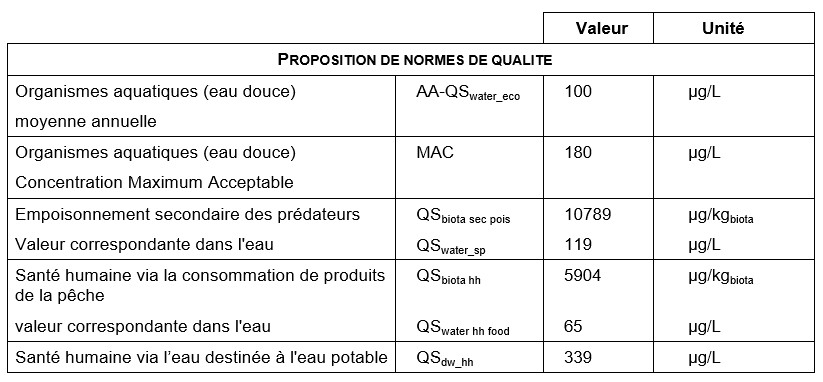
Pour l'éthylbenzène, la norme de qualité pour la santé humaine via la consommation des produits de la pêche est la valeur la plus faible pour l'ensemble des approches considérées. La proposition de NQE pour l'éthylbenzène est donc la suivante :

VALEURS GUIDES POUR LE SEDIMENT

Bibliographie
Activité endocrine
Dernière vérification le 09/09/2025
Généralités sur les activités endocrines
L'éthylbenzène n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 100-41-4 |
|---|---|
| SANDRE | 1497 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Selon l’arrêté du 20 avril 19941, l’éthylbenzène est considéré comme un produit nocif (Xn ; R202), et facilement inflammable (F, R113). En revanche, selon ce même arrêté, il n’est pas classé comme dangereux pour l’environnement. Sa fabrication, son utilisation, son transport et son stockage sont réglementés, en partie par les législations relatives aux installations classées pour la protection de l'environnement. Les rejets d'éthylbenzène sont réglementés par l'arrêté du 2 février 1998. L'éthylbenzène est considéré comme une substance toxique, bioaccumulable ou nocive pour l'environnement. La valeur limite mensuelle de concentration dans ces rejets ne doit donc pas dépasser 4 mg.L-1 si le flux du rejet dépasse 10 g.j-1 . En ce qui concerne les réglementations relatives à la qualité des eaux de consommation, l'éthylbenzène n'est ni concerné par le décret n°2001-12204 , ni par la directive 98/83/CE5 . En revanche pour l'OMS6 la teneur limite en éthylbenzène pour des eaux de consommation est de 300 g.L-1 . Enfin, l'éthylbenzène étant un COV, son utilisation est soumise à la directive 1999/13/CE qui vise à réduire les émissions de COV en Europe (objectif de réduction globale de 40% en 2010 pour la France (MEDD, 2003). Cette directive est complétée par la Directive 94/63/CEE du 20 décembre 1994 relative à la lutte contre les émissions de composés organiques volatils (COV) résultant du stockage de l'essence et de sa distribution des terminaux aux stations-service. [1] Arrêté relatif à la déclaration, la classification, l'emballage et l'étiquetage des substance chimiques complété jusqu'à la directive 2004/73/CE de la commission du 29 avril 2004 portant la 29ème adaptation au progrès technique de la directive 67/548/CEE. [2] Nocif par inhalation [3] Facilement inflammable [4] Décret du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles. [5] Directive du conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine. [6] Directive de la qualité pour l'eau de boisson (2004). |
| Classification CLP | Voir la classification CLP |
| Informations complémentaires |
L’éthylbenzène est un hydrocarbure aromatique qui se présente sous la forme d’un liquide incolore. Il est un composant naturel du pétrole dont il peut être extrait en mélange avec les xylènes. Cette substance est composée d’un noyau benzénique auquel est ramifié un |
Production et utilisation
Production et ventes
Données économiques
Place de la substance dans l'économie française
La production d'éthylbenzène est réalisée, en France, uniquement par le groupe Total dans ses deux raffineries de Gonfreville l'Orcher et Carling. Il semble en outre que la demande de cette substance ait été en augmentation depuis 2003. En effet alors qu'en 2003, la France avait une balance commerciale excédentaire de 17 656 t pour l'éthylbenzène, elle a aujourd'hui une balance déficitaire de 16 492 t, en raison notamment des exportations vers l'Allemagne. Entre ces deux périodes, il semble donc que les besoins français en éthylbenzène aient augmenté de 38 000 t, sauf si la capacité de production française a changé entre temps. Le prix de cette substance s'établit aujourd'hui autour de 1100 €.t-1 (Direction générale des Douanes, 2005).
Une très grande majorité d'éthylbenzène est transformée directement en styrène, dans les deux raffineries citées du Groupe Total. Les capacités de production de styrène sont respectivement de 390 000 t.an-1 à Gonfreville l'Orcher et 330 000 t.an-1 à Carling. En outre, là aussi la balance commerciale française relative au styrène s'est inversée entre 2003 et 2005. En effet, les exportations de styrène ont diminué de 43% durant cette période, passant de 224 856 t à 127 862 t. Dans le même temps, les importations sont elles passées de 352 460 t à 377 691 t, essentiellement en provenance des Pays-bas. Les besoins en styrène ont donc augmenté de 122 225 t. Le prix du styrène a également augmenté, passant de 800 €.t-1 à 1100€.t-1 (chimie pharma hebdo, 2003-2005).
Le styrène est ensuite transformé en différents polymères dont le principal est le polystyrène. En France, on comptabilise 3 producteurs de polystyrène (J.L. Vignes, 1998):
- Arkema (groupe Total) avec deux sites de production à Gonfreville l'Orcher (160 000t.an-1 de Polystyrène) et Carling (150 000 t.an-1 de Polystyrène) ;
- BP avec un site à Wingles (120 000 t.an-1 de polystyrène et 60 000 t.an-1 de Polystyrène expansés) ;
- Shell avec un site à Berre (55 000 t.an-1 de polystyrène expansés).
En 1996, la production de Polystyrène a été, en France, de 527 kt, dont 186 kt de Polystyrène expansé. Et sa consommation a été pour la même année de 365 kt dont 95 kt de PSE (Vignes, J.L., 2005). Parmi ce PSE, une grande partie sert dans les emballages. En France, en 2003, cette consommation a été de 33 000 t, en baisse depuis 1999, où elle était de 37 000 t. En revanche, la production française de Polystyrène (PE et PSE) a augmenté de 10,9% en 2003 (SPMP, 2003), ce qui correspond bien à un marché des matières plastiques en pleine expansion.
On mesure donc à travers ces quelques éléments l'importance économique de l'ethylbenzène.
Place de la substance dans l'économie européenne
La production européenne d'éthylbenzène s'élève à 5 700 kt.an-1 (OECD SIDS, 2002), alors qu'elle était de 3 000 kt en 1983 (INERIS, 2005)
Procédés de production
FTE 2005 Importer
L'éthylbenzène est présent dans les essences de reformage7 aux cotés des xylènes dont c'est un isomère. Il est d'ailleurs un constituant (20 %) du xylène commercial qui sert comme solvant dans de nombreuses applications. Toutefois l'extraction de l'éthylbenzène n'est pas toujours rentable et on préfère, en général, le synthétiser à partir du benzène et de l'éthylène (Vignes, J.L. et al. 1998). Il existe trois procédés principaux d'alkylation du benzène avec l'éthylène qui diffèrent par le catalyseur employé (Sengel, J.L., 2005):
- Le procédé au chlorure d'aluminium (AlCl3) est le plus ancien et le plus utilisé. Il a lieu en phase gazeuse et a un rendement de 40 à 45%.
- Le procédé au trifluorure de bore n'est aujourd'hui plus utilisé.
- Les procédés utilisant des Zéolithes sont les plus récents. Ils se déroulent généralement en phase gazeuse, mais pour améliorer la durée de vie des zéolithes on développe actuellement des procédés en phase liquide.
[7] Les essences de reformage, sont les essences obtenues à la suite du reformage catalytique de la fraction d'essence lourde issue de la distillation du pétrole brut.
Utilisations
FTE 2005 Importer
L'éthylbenzène est utilisé dans sa très grande majorité pour fabriquer du styrène. Plus de 99% de l'éthylbenzène produit, dans le monde, en 1984 servait à cette utilisation (ATSDR, 1999). Cette production est réalisée en France par Total sur ses deux sites de Gonfreville l'Orcher et Carling. La capacité de production française de styrène s'élevait en 1993 à 680 000 tonnes par an (Vignes, J.L., 1998). Le styrène est ensuite transformé en différents polymères : Polystyrène (65%) ; latex styrène-butadiène (6%) ; Copolymères styréniques (13%); Caoutchouc styrène butadiène (6%) ; Polyesters insaturés (4%).
En 1996, la production de Polystyrène a été, en France, de 527 kt, dont 186 kt de Polystyrène expansé. Et sa consommation a été pour la même année de 365 kt dont 95 kt de PSE (Vignes, J.L., 2005). Parmi ce PSE, une grande partie sert dans les emballages. En France, en 2003, cette consommation a été de 33 000 t, en baisse depuis 1999 (37 000 t).
L'éthylbenzène est également utilisé comme solvant aromatique pour les peintures, vernis, dégraissants. On en a utilisé, en France, en 2004, 3 160 t. Il sert également d'intermédiaire réactionnel pour la fabrication du diéthylbenzène, de l'acétophénone et de diverses autres substances.
Enfin, en tant que dérivé pétrolier, on peut retrouver de l'éthylbenzène dans l'asphalte et le naphta utilisés pour les routes. L'éthylbenzène rentre également dans la composition des essences où il est employé pour son pouvoir antidétonant. Diverses sources (INERIS, 2005 ; ATSDR, 1999) indiquent qu'il représente 2% du poids des essences, toutefois, selon l'UFIP, il représente moins de 0,1% de la composition des carburants.
Rejets dans l’environnement
Sources naturelles
L'éthylbenzène se forme naturellement lorsque des matières organiques sont exposées à des phénomènes de combustion ou de pyrolyse. C'est par exemple le cas lors de feux de forêts d'éruptions volcaniques ou dans la fumée de cigarettes. C'est également le cas lors de la combustion de biomasse pour le chauffage. Cette dernière source d'émission semble représenter une source importante de rejet de COV dans l'air, mais à ce jour nous n'avons trouvé aucune étude quantifiant les retombées indirectes de ces substances dans les milieux aquatiques.
Sources non-intentionelles
FTE 2005 Importer
Le rejet principal d'éthylbenzène, dans l'environnement, est du à sa présence dans les essences. Les émissions d'éthylbenzène sont liées d'une part aux pertes par évaporation de carburant, d'autre part aux émissions à l'échappement. D'après le tableau 3.5 (Guibet, J. C., 2005) on constate que l'éthylbenzène représente 10% des émissions d'hydrocarbures imbrûlés dans les gaz d'échappement d'un moteur à essence. Ces rejets constituent d'ailleurs la principale source de rejets indirects d'éthylbenzène dans l'eau.
Tableau 3.5 -Exemple de composition des « hydrocarbures imbrûlés » dans les gaz d'échappement d'un moteur à essence8
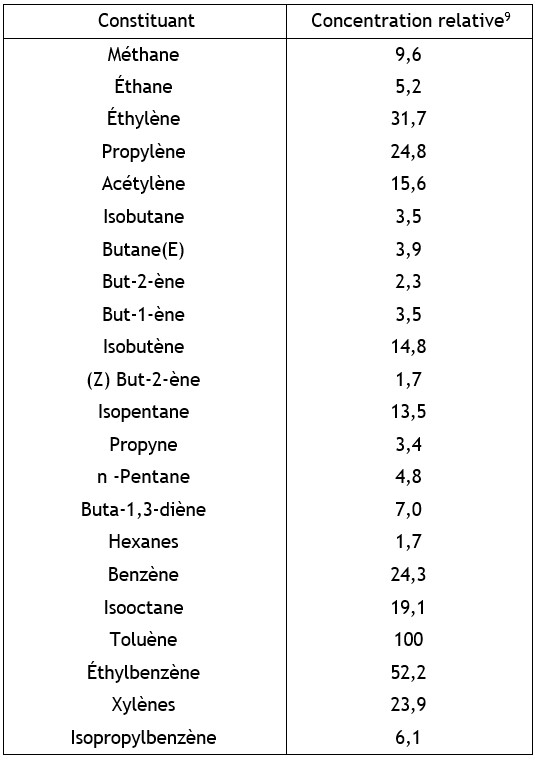
L'utilisation d'éthylbenzène comme solvant peut également constituer une source de rejet indirect. Mais cette consommation est assez limitée, et ce flux d'émissions doit être beaucoup moins important que les autres.
[8] Prélèvement en amont du catalyseur de post-traitement.
[9] La teneur totale en HC, dans les gaz d'échappement secs, est de l'ordre de 500 ppm.
Émissions anthropiques totales
FTE 2005 Importer
Bien que l'éthylbenzène soit présent de façon naturelle dans l'environnement (feux de forêt, pétrole brut…), les rejets sont essentiellement d'origine humaine. L'éthylbenzène étant un composé organique volatil, la plus grande partie de ses molécules rejetées dans l'environnement se retrouve donc dans l'air (INERIS, 2005). D'ailleurs, selon l'OECD SIDS (2002), plus de 99% des émissions d'éthylbenzène se font vers l'atmosphère.
Sa principale source de rejet est liée au trafic routier (INERIS, 2005). La production et les utilisations industrielles d'éthylbenzène constituent également des sources de rejet importantes.
Émissions vers les eaux
A la différence du toluène et du xylène, l'éthylbenzène est avant tout utilisé comme intermédiaire réactionnel. Les rejets d'origine industrielle représentent donc une proportion importante des rejets d'éthylbenzène. Ils sont d'ailleurs la principale source d'émissions directes d'éthylbenzène dans les milieux aquatiques.
Dans le cadre de l'action nationale de recherche et de réduction des substances dangereuses dans l'eau, des mesures ponctuelles ont été réalisées à la sortie de près d'un millier d'ICPE. Il apparaît que le flux total d'éthylbenzène issu de ces installations est de près de 586 g.j-1 . Or d'après la base EPER, il y aurait environ 25 t.an-1 de BTEX (soit près de 70 kg.j-1) rejetés directement dans l'eau en France par l'industrie en 2001. La comparaison montre que, même si il y a une forte incertitude sur le chiffre de 0.5 kg.j-1, l'éthylbenzène constitue sûrement une faible fraction des rejets de BTEX. Enfin, en région Rhône-Alpes, où deux inventaires des rejets de micropolluants, par des établissements industriels, ont été réalisés en 1993 et 1998, on constate une baisse des émissions d'éthylbenzène. Ainsi, le flux total qui représentait 12kg.j-1 en 1993 a baissé à 500 g.j-1 en 1998. Ces résultats, semblent donc montrer que les émissions d'éthylbenzène dans les milieux aquatiques ont sensiblement diminué. Les rejets directs dans l'eau d'éthylbenzène en Rhône-Alpes sont dus pour l'essentiel au secteur de la chimie et de la parachimie, et en particulier les industries de la chimie, du chlore, et des polymères (peintures…).
Pollutions historiques et accidentelles
FTE 2005 Importer
Aucune source de pollution historique n'a été trouvée. Dans les bases de données, l'éthylbenzène est souvent confondu avec le xylène, le toluène et le benzène, qui forment la famille des BTEX.
Présence environnementale
Synthèse
FTE 2005 Importer
Les concentrations ubiquitaires mesurées pour l'éthylbenzène sont (INERIS, 2005) :
Air : < 2 μg.m-3
Eau : Rivières, mers, eaux souterraines : < 0,1 μg.L-1.
Eau de pluie < 0,01 μg.L-1
Perspectives de réduction
Réduction des rejets
FTE 2005 Importer
Sous l'influence des DRIRE et des différentes législations, des actions de réduction des émissions de COV ont été menées par les industriels depuis plusieurs années. Elles auraient permis de réduire de 20% les émissions industrielles de COV entre 2000 et 2003 (MEDD, 2003).
Rejets industriels gazeux
Comme pour tous les autres COV, les rejets gazeux représentent la très grande majorité des rejets d'éthylbenzène. Il existe pour traiter ces rejets différents procédés, le plus souvent généralisables à l'ensemble des COV (Techniques de l'ingénieur, 2005 ; IPPC, 2001). On distingue les procédés de récupération et les procédés de destruction.
Le tableau ci dessous présente les différents procédés applicable aux traitements des COV (IPPC, 2001)
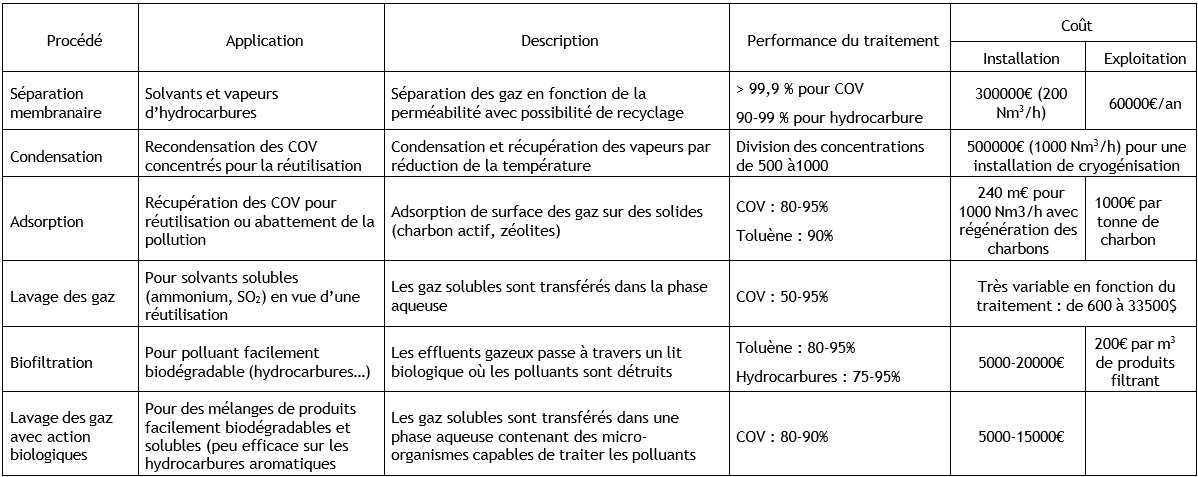
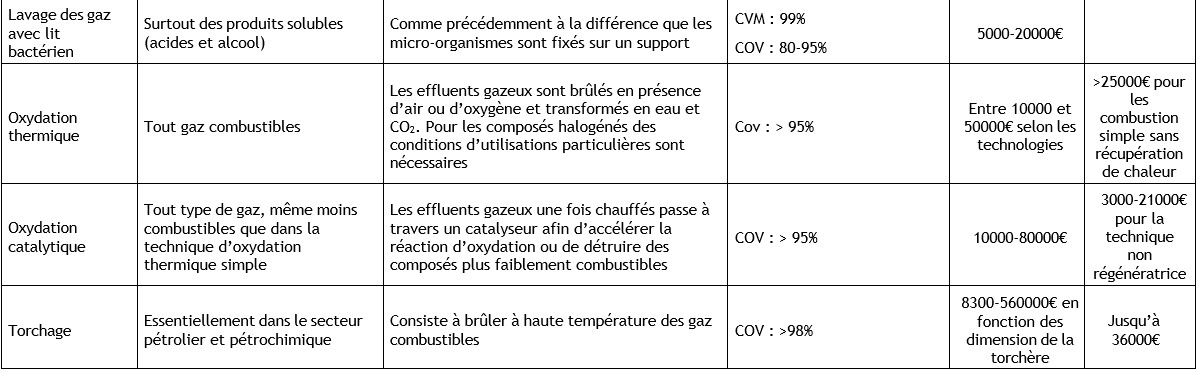
Traitement des effluents industriels aqueux
Dans le cas de l'éthylbenzène, le traitement des effluents industriels est important car ce produit est peu présent dans les préparations chimiques et il sert quasi-exclusivement d'intermédiaire réactionnel.
Il n'existe pas de traitement spécifique, mais les traitements classiques des stations d'épuration des sites pétrochimiques permettent d'atteindre des rendements épuratoires de plus de 99%. Ces procédés de traitement correspondent de façon générale aux procédés de traitement des hydrocarbures ou des polluants volatils. Citons quelques exemples :
Dans les raffineries de pétrole, on fait appel à des procédés de déshuilage et dégraissage associés généralement à des procédés de flottation et de coagulation. Ils permettent d'extraire des matières flottantes d'une densité inférieure à celle de l'eau comme c'est le cas pour les hydrocarbures (Boeglin j.L., 1998). Dans le cas d'un sytème API (américan pétroleum institute separator) on peut atteindre des performances entre 90 et 95%. Le coût d'un tel procédé est de 2 millions d'€ pour une capacité de traitement de 1200 m3/h. (IPPC, 2001).
On peut également citer les procédés d'oxydation par voie humide, ou le procédé de stripping adapté aux polluants volatils (Boeglin, J.L., 1998). Ce dernier procédé correspond à l'entraînement de produits volatils dissous dans l'eau par l'action d'un autre gaz. Les produits ainsi récupérés peuvent être soit réutilisés dans les processus de fabrication, soit détruits par combustion dans un four ou récupérés dans des solutions où ils sont fixés et/ou oxydés. Ce procédé est particulièrement efficace pour les hydrocarbures aromatiques (BTX) pour lesquels on peut atteindre 99% de rendement. Le coûts d'une telle installation est de 4 à 5 millions d'€ (exemple d'une raffinerie avec un traitement par stripping d'eau de 30 m3/h).
Ethylbenzène dans les carburants
Les émissions d'éthylbenzène sont liées d'une part aux pertes par évaporation de carburant, d'autre part aux émissions à l'échappement :
- En Europe, les émissions par évaporation tendent à se réduire, en raison de la généralisation de systèmes de récupération des vapeurs d'essence (sur les modèles récents de véhicules et sur les postes de chargement des dépôts et raffineries, les cuves de stations services et les camions de ravitaillement) Grâce à l'emploi de ces techniques, les émissions de COVNM, dues à la chaîne pétrolière hors terminaux pétroliers et gaz d'échappement, ont été réduites de 98 000 t, passant de 153 000 t en 1990 à 55 000 t en 2003 (UFIP, 2005).
- Depuis 1993, les constructeurs ont équipé les voitures nouvellement fabriquées, de filtres et de pots catalytiques. Ces pots permettent en théorie de détruire 99% des émissions toxiques. Toutefois, les réactions catalytiques se font entre 300°C et 1000°C, elles n'ont donc pas lieu tant que le pot catalytique n'a pas atteint sa température de fonctionnement, (correspondance IFP, 2005). en particulier sur des petits parcours. De plus, les pots perdent de leur efficacité avec le temps et l'usure du moteur. Ils doivent donc être changés régulièrement (2 ans en moyenne). Même si elle ne les supprime pas, l'utilisation des pots catalytiques permet de diminuer sensiblement les rejets de COV.
Grâce à ces procédés, les émissions de COV par le transport routier auraient diminué de 59% entre 1990 et 2002, (Lepeltier S., 2002), ce que tendent à confirmer les chiffres du CITEPA (2005). On peut alors constater que les rejets dans l'air de COVNM provoqués par le transport routier, on été divisés par 2,4 entre 1995 et 2003. Et la généralisation de ces dispositifs aurait permis de diviser par 5 les rejets de COV dus au transport routier en Europe, entre 1995 et 2000 (MEDD, 2003). On peut supposer que les émissions d'éthylbenzène on baissé dans les mêmes proportions.
En outre, pour réduire les émissions d'éthylbenzène à l'échappement on peut modifier la composition des essences, et en particulier réduire les teneurs en aromatiques. La teneur maximale des essences en aromatiques était jusqu'en 2005 de 42 %, mais cette valeur limite est passée à 35 % en Janvier 2005. La Commission pourrait proposer avant 2006 de nouvelles normes sur le benzène et les aromatiques à respecter à compter de Janvier 2009 (IFP, 2003).
De plus, les émissions de COV dépendent de la tension de vapeur saturante des essences. Plus cette tension est faible, plus les émissions diminuent. Les fabricants d'essences, ont donc réduit la tension de vapeur de 80 à 60 kPa.
Pour modifier la composition des carburants on peut également avoir recours aux biocarburants. En effet, l'éthanol, l'ETBE et les huiles végétales pures (EMHV) améliorent la combustion des moteurs à essence, ce qui a pour conséquence de diminuer les émissions d'hydrocarbures imbrûlés. Une introduction de ces biocarburants dans des proportions admissibles par les moteurs actuels (20% au maximum) pourrait donc entraîner une diminution des rejets d'étylbenzène. Toutefois, cette introduction doit tenir compte des normes de qualité des essences. Il ne faut pas en particulier que l'introduction d'éthanol entraîne une augmentation de la pression de vapeur saturante, ce qui aurait pour conséquence d'augmenter les émissions de COV. Pour cela, les producteurs d'essences doivent proposer de nouvelles compositions de leurs produits, ce qui pourrait entraîner des modifications importantes de leurs installations de production. Dans un contexte français de surproduction d'essences ces modifications pourraient ne pas représenter un intérêt économique pour les producteurs.
Actuellement, les objectifs d'utilisation de biocarburants assignés aux États membres par la Commission européenne sont de 5,75 % de la consommation d'essence et de gazole en 2010, avec un objectif de 8 % en 2020. La France qui, actuellement, n'introduit en moyenne qu'1% de biocarburants dans les essences, a lancé un programme de développement de ces énergies, dont l'objectif est d'atteindre 10% de biocarburants inclus dans les carburants classiques en 2015.
L'amélioration du rendement des moteurs à essence, le recours à des voitures hybrides moins consommatrices, et l'augmentation du parc de véhicules diesel qui ne contient pas d'éthylbenzène pourraient également entraîner une diminution des rejets. Toutefois, les réductions d'émission d'éthylbenzène amenées par ces évolutions technologiques risquent d'être partiellement voire totalement compensées par l'augmentation des volumes de trafic prévue d'ici 2015.
Pour diminuer plus durablement les émissions d'éthylbenzène dues au trafic routier, il faudrait développer de nouvelles sources d'énergie pour les transports (électricité et piles à combustible…). Toutefois, de tels développements technologiques à grande échelle semblent peu probables d'ici à 2015. De même, une diminution du trafic routier entraînerait automatiquement une diminution des rejets d'éthylbenzène, mais là encore les perspectives ne sont pas favorables.
Impact économique des mesures de réduction
La réduction des émissions d'éthylbenzène est fortement liée à la réduction de son utilisation en tant qu'hydrocarbure. Or l'envolée des prix du baril de pétrole au delà des 60$, amène les industriels et les pouvoirs publics à développer des solutions susceptibles de diminuer la consommation d'essence (moteur hybride, biocarburants…). Ces mesures représentent un coût très important qu'il serait naïf de vouloir calculer ici. De plus, même si elles peuvent y contribuer, elles ne sont pas directement liées aux mesures de réduction des émissions d'éthylbenzène, mais s'inscrivent dans une démarche plus globale de réduction des consommations de pétrole.
En revanche, on dispose d'estimations des coûts de certains procédés de récupération et de traitement des COV. Il est cependant impossible de savoir quelle fraction de ces coûts, probablement marginale, doit être attribuée à la réduction de l'éthybenzene.
Les pots catalytiques étant installés de série sur toutes les voitures neuves, le coût de ces derniers est donc intégré au prix général d'un véhicule. Pour les autres véhicules un pot catalytique coûte entre 200 et 500 € (UNECE, 2005). On estime qu'en 2005, la moitié des véhicules sont équipés d'un tel système (MEDD, 2003), et en considérant que le parc automobile de voitures se renouvèle tous les 15 ans, on peut espérer qu'à partir de 2010, toutes les voitures françaises seront équipées d'un pot catalytique.
Les coûts de traitements des COV est très variable en fonction des techniques. Le tableau ci-dessous indique quelques coûts13 :
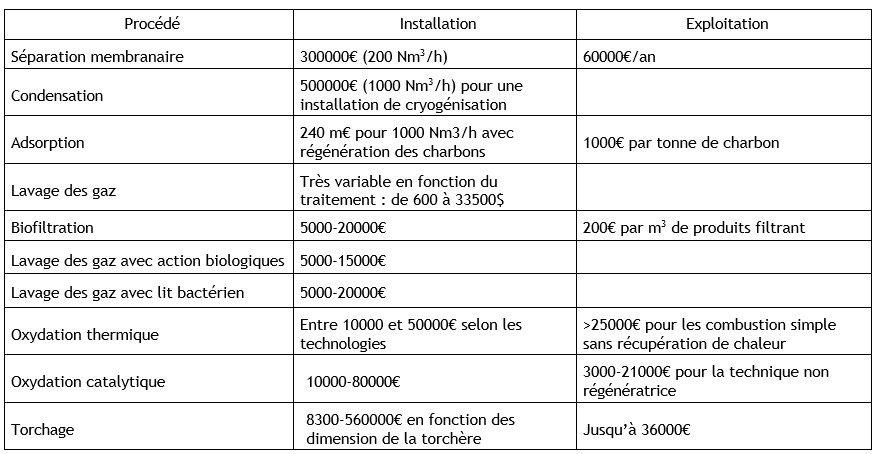
En outre, on peut estimer le coût de la réduction des émissions de COV par les industriels en étudiant le marché de la lutte contre les Composés Organiques Volatils. Celui-ci a été estimé à 32,4 Millions € en 2004, en augmentation de 20% par rapport à 2003. Il devrait encore continuer à augmenter de 20% en 2005, pour atteindre 38,8 Millions € (Actu® environnement, 2005). Selon l'UFIP, la réduction des émissions de COV, de 91 000t, tout au long de la chaîne pétrolière, a coûté, au total, aux industriels du secteur, 630 M€.
Il est également difficile d'établir le coût de traitement des rejets aqueux d'hydrocarbures car ils vont dépendre de la nature des effluents et du milieu de rejet. Selon un industriel interrogé, spécialisé dans le traitement des hydrocarbures, le coût moyen de traitement d'une unité de déshuilage serait de 60€ par tonne d'effluents à traiter. Le BREF sur le traitement des effluents dans la chimie donne également quelques exemples de coûts. Ainsi, une unité de déshuilage coûte 2 M€, une unité de stripping traitant un flux de 30 m3 par heure est de 4 à 5M€, et une unité d'adsorption sur charbon actif de 75 000£, soit environ 100 000 € (IPPC, 2002).
En revanche, le marché des peintures sans solvants est beaucoup plus ancien (début des années 50) et beaucoup plus développé. Le prix de ces peintures est donc le même que le prix des peintures contenant des COV.
[13] Voir également le paragraphe sur le traitements des effluents gazeux.
Recyclage
FTE 2005 Importer
Un autre moyen pour réduire l'utilisation d'éthylbenzène et de réduire la production de PSE. Pour cela, il est aujourd'hui possible de recycler les emballages en PSE en fin de vie afin de faire de la valorisation matière. Les industriels du secteur ont créé l'association Eco-PSE qui vise à promouvoir et organiser le recyclage des emballages en PSE des professionnels. L'objectif est de recycler 22,5% des emballages en PSE produits en France. Ainsi en 2003, alors que la France produisait 33 000 t d'emballage en PSE, le taux de recyclage était de 21%, ce qui représentait 7 000 t de PSE.
Alternatives aux usages
FTE 2005 Importer
Intermédiaire réactionnel
L'éthylbenzène sert en quasi totalité à la synthèse du styrène. Il existe pour cela deux procédés (Vignes, J.L., 1998):
Le styrène peut être produit par déshydrogénation de l'éthylbenzène. Dans ce procédé, l'éthylbenzène est mis en contact direct avec de l'eau, ce qui peut engendrer par la suite des rejets d'éthylbenzène dans les effluents industriels.
Le second procédé est le procédé « Arco », dans lequel on n'a pas recours directement à l'éthylbenzène. Dans ce procédé, la synthèse d'oxyde de propylène à partir du propylène et de l'hydroperoxyde de 1-phényléthyle amène à la formation d'alcool α-méthylbenzylique qui, par déshydratation, donne du styrène. Toutefois il est à noter que l'hydroperoxyde de 1-phényléthyle est lui même formé à partir de l'éthylbenzène, qu'on utilise donc quand même indirectement dans ce procédé.
Pour les autres utilisations d'éthylbenzène comme intermédiaire réactionnel, nous n'avons identifié à ce jour aucun autre produit de substitution.
En utilisant des substituants aux différents polymères fabriqués à partir du styrène, on diminuerait d'autant la synthèse de l'éthylbenzène.
Utilisation de l'éthylbenzene comme solvant
De façon générale, le meilleur moyen pour réduire les rejets de COV et d'éthylbenzène est de limiter avant tout leur utilisation et d'agir à la source de la pollution. Pour cela plusieurs solutions sont envisageables lorsque l'éthylbenzène est en particulier employé comme solvant (ADEME, 2004) .
Il est tout d'abord important de développer de bonnes pratiques au sein des unités utilisant des solvants :
- Sensibilisation et formation du personnel vis à vis de la pollution des COV ;
- Bon entretien des équipements ;
- Confinement des machines pour organiser des circuits fermés ;
- Optimisation des rendements des procédés de nettoyage (rinçage à contre courant) utilisant les solvants ;
- Récupération et recyclage des solvants dans les procédés chimiques.
On peut également substituer les solvants par d'autres produits :
Tableau 4.1.1.a : substitution des solvants organiques en peinture (toluène, xylène, éthylbenzène…)
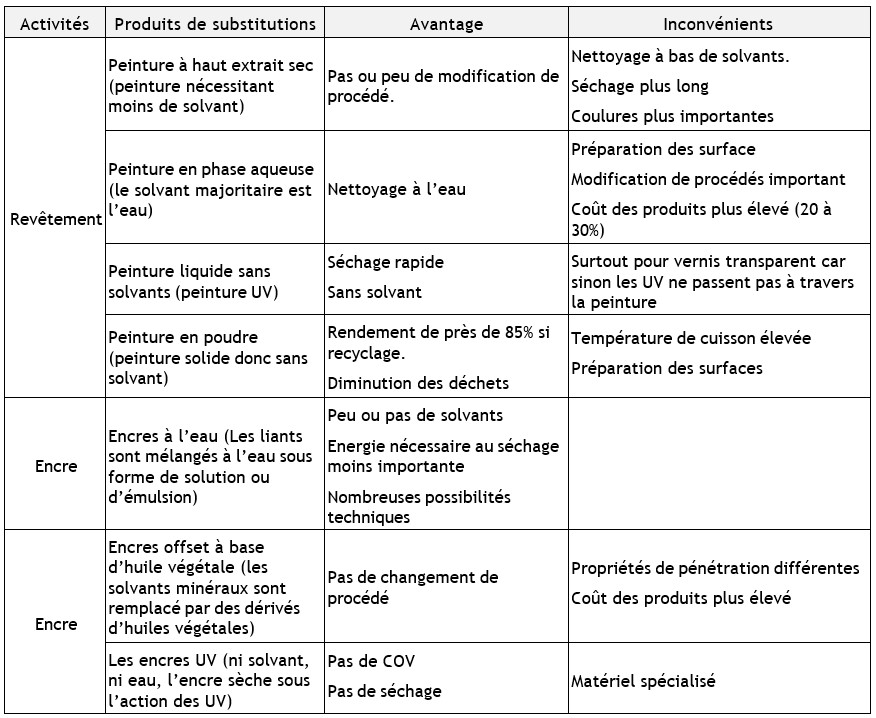
En 2003, en France, sur les 840 000 t de peintures et vernis produits, 375 000 t étaient à base de solvant aqueux, 36 000 t à base de poudre thermodurcissable et 5 000 t à séchage UV. Ainsi près de la moitié des peintures et vernis produits en France ne contiennent plus de solvant d'origine organique (FIPEC, 2004). En dix ans, dans certain secteurs (peintures décoratives), le taux des peintures en phase aqueuse est passé de 40 à 60%. Selon la FIPEC, à cause des réglementations10 , les COV sont amenés à disparaître progressivement du secteur des peintures et encres sauf pour de rares applications pour lesquelles il n'existe pas encore de solutions de remplacement (marine, aérospatiale). Néanmoins, certaines nouvelles solutions comme les peintures à l'eau posent encore quelques problèmes de pollution. Souvent les utilisateurs nettoient leurs matériels directement à l'eau alors qu'il est préférable de récupérer les eaux de nettoyage ainsi que les restes de produits pour les faire ensuite traiter. Une solution pourrait être des peintures aqueuses composées de plastifiants d'origine végétale.
De nombreuses entreprises proposent aujourd'hui des produits sans solvants dangereux servant à divers usages (décapage, peinture, nettoyage des surfaces, dégraissage). On peut citer, l'exemple de la société SID11 qui propose un fluide multi-usages à base de solvant oxygéné, en substitution de diluants comme l'éthylbenzène, le xylène ou le toluène. Des entreprises développent des agro-solvants (Alcimed, 2002).
On peut également utiliser des procédés moins coûteux en matières premières.
Il existe donc de nombreuses solutions de substitution de l'éthylbenzène lorsqu'il est employé comme solvant. Toutefois, avant de faire de telles substitutions, il est important de savoir si le nouveau procédé ou le nouveau produit utilisé aura moins d'impact sur l'environnement que l'éthylbenzène. On peut faire appel, pour cela, à des études d'éco-conception ou d'analyse du cycle de vie. Il existe certains guides ou bases de données qui proposent des solvants de substitution12 .
[10] En particulier la directive 1999/13/CE.
[11] SID : société industrielle de diffusion : www.sid.tm.fr
[12] citons : l'Integrated solvent substitution data système (http://es.epa.gov/issds/) Le solvent alternative guide (http://clean.rti.org/) Le groupe européen de l'industrie des solvants (http://esig.org)
Coûts de la substitution
Pour ce qui concerne les prix des produits de substitution, ils sont en général plus cher que l'éthylbenzène, mais ont une plus faible fluctuation car ils dépendent moins du pétrole.
- le produit proposé par une entreprise pour de nettoyage des encres et des peintures et pour le dégraissage des surfaces est vendu en moyenne deux fois plus cher que le produit équivalent à base d'hydrocarbures uniquement.
- Une entreprise propose une gamme de produits dérivés d'ester de colza pour le nettoyage et le dégraissage, ou pouvant servir d'additif dans les peintures. Ces produits vendus à partir de 1€.kg-1 sont en moyenne deux fois plus chers que les équivalents pétroliers (white spirit), mais une augmentation de la demande et surtout une augmentation des capacités de production pourraient avoir un effet bénéfique sur le coût de ces produits.
Conclusion
FTE 2005 Importer
L'éthylbenzène est un hydrocarbure aromatique volatil. Bien que présent dans les essences de réformage avec les xylènes, il est produit par alkylation du benzène avec de l'éthylène au sein de raffineries. Il existe deux sites de production en France à Gonfreville l'Orcher et Carlling. Sur ces deux sites, l'éthylbenzène est ensuite quasi exclusivement transformé en styrène qui va entrer à son tour dans la composition de nombreux polymères (PS, PSE…).
L'éthylbenzène peut également être utilisé comme solvant, mais cette utilisation reste minime.
Les rejets principaux d'éthylbenzène dans l'environnement se font vers l'atmosphère, ils peuvent ensuite être introduits indirectement dans les milieux aquatiques. Ces rejets ont majoritairement pour origine les gaz d'échappements des voitures à essences. Les rejets directs d'éthylbenzène ont pour origine les industries qui fabriquent ou transforment ce produit. Toutefois certaines utilisations mineures d'éthylbenzène, comme solvant par exemple, peuvent induire également des rejets directs.
Dans ces conditions, une réduction des émissions d'éthylbenzène dans les milieux aquatiques passerait tout d'abord par une diminution des rejets indirects due aux gaz d'échappements. De nombreuses améliorations ont d'ailleurs été apportées depuis plusieurs années, en particulier grâce à l'utilisation des pots catalytiques. On peut donc espérer qu'à l'horizon 2015, les émissions indirectes d'éthylbenzène auront fortement diminué.
En revanche, la réduction des rejets directs d'éthylbenzène ne pourra se faire que par une meilleure prise en compte, par les industriels, des rejets des unités de fabrication de styrène.
Les procédés de traitement de rejets liquides permettent aujourd'hui d'atteindre des taux d'épuration de l'ordre de 99%, mais ils ne sont pas forcément adaptés à de faibles pollutions comme c'est le cas pour les micro-polluants. Il est préférable d'agir sur la réduction des pollutions à la source, en substituant par exemple l'éthylbenzène lorsqu'il est utilisé comme solvant, en recyclant les polymères issus du styrène ou en optimisant davantage les chaînes de production.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










