Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Tétrachlorure de Carbone (56-23-5)
Informations générales
Dernière vérification le 15/12/2025
Identification
Code EC
Code SANDRE
Numéro CIPAC
Classement transport
Classification CLP
Méthodes analytiques
Introduction
Air
Eau
Sol
Autres milieux
Programmes
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
153.82 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (IARC, 1999 ; ATSDR, 2005 ; INRS, 2009 ; OMS IPCS, 1999 ; US EPA, 2010, 2020 ; ANSES, 2017). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
Les cas d’intoxication par inhalation laissent supposer une forte absorption par les voies aériennes (ATSDR, 2005). Des donnés anciennes rapportent un taux d’absorption de 60 % au cours d’une exposition de 30 minutes à la concentration de 4 200 mg.m-3 chez un volontaire (Lehmann et Schmidt-Kehl, 1936).
Voie orale
Malgré l’absence de données quantitatives, les cas d’intoxications aiguës par ingestion permettent de supposer une absorption importante à partir du tube digestif chez l’humain (US EPA, 2010).
Voie cutanée
Bien que non quantifiée, le TCC en solution semble également être rapidement absorbé après contact cutané (US EPA (IRIS), 2010). Chez des individus ayant immergé leur pouce dans du TCC liquide pur, la substance est retrouvée dans l’air alvéolaire 10 minutes après l’exposition (Stewart et Dodd, 1964). Toutefois, en raison de la forte volatilité de ce solvant, cette voie d’absorption est négligeable pour des expositions sous forme de vapeurs (US EPA, 2020).
Distribution
Aucune donnée concernant la distribution du TCC n’est disponible chez l’homme.
Métabolisme
Le TCC est principalement métabolisé par le foie, mais aussi par le rein, les poumons et les autres tissus contenant des cytochromes P450 (CYP). Chez l’homme, il a été montré à partir de microsomes hépatiques humains que la déchloration du TCC est majoritairement réalisée par les CYP2E1 et 3A4 (Zangar et al., 2000). Le radical chlorométhyle CCl3* ainsi formé peut se fixer à des molécules cellulaires (ADN, protéines, lipides) (Boll et al., 2001a ; Recknagel et Glende, 1973). Dans des conditions d’anaérobie, le radical peut réagir avec l’hydrogène pour former du chloroforme, de même que de l’hexachloroéthane après dimérisation ou enfin subir une réduction plus poussée qui aboutit à la formation de monoxyde de carbone.
Dans des conditions d’aérobie, le radical CCl3* peut également réagir avec l’oxygène pour conduire à la formation d’un radical trichlorométhyl peroxyde (CCl3OO*) hautement réactif (Boll et al., 2001b ; Galelli et Castro, 1998). Ce radical peut initier la chaîne des réactions de peroxydation lipidique ou réagir davantage pour former du trichlorométhanol, précurseur de phosgène qui est rapidement hydrolysé en dioxyde de carbone (Pohl et al., 1984 ; Shah et al., 1979). Le phosgène peut aussi se conjuguer au glutathion (GSH) ou à la cystéine pour former de l’acide oxothiazoline carboxylique (US EPA, 2010). Le schéma des différentes voies métaboliques empruntées par le TCC sont résumées dans la figure 1.
Comme c’est le cas pour d’autres solvants chlorés aliphatiques, le polymorphisme génétique des CYP et de la glutathion-S-transférase influence la métabolisation du TCC induisant une sensibilité différente selon les individus (Lipscomb et al., 1997) (Snawder et al., 2000[Dob1] [BM2] ). Cependant, aucune étude n’a étudié l’impact de ces polymorphismes.
[Dob1] Snawder, JE; Lipscomb, JC. (2000). Interindividual variance of cytochrome P450 forms in
human hepatic microsomes: correlation of individual forms with xenobiotic metabolism
and implications in risk assessment. Regul Toxicol Pharmacol 32: 200-209.
[BM2]: Lipscomb, JC; Garrett, CM; Snawder, JE. (1997). Cytochrome P450-dependent metabolism of
trichloroethylene: Interindividual differences in humans. Toxicol Appl Pharmacol 142:
311-318
Élimination
Quelle que soit la voie d’exposition, le TCC est excrété majoritairement sous forme inchangée et sous forme de métabolites dans l’air expiré (US EPA (IRIS), 2010). Peu de données qualitatives ou quantitatives ont été identifiées chez l’humain.
Après une exposition par inhalation en une seule inspiration, environ 33 % de la dose absorbée est excrétée dans l’air exhalé au cours de la première heure (Morgan et al., 1970).
La présence de TCC a été détectée dans l’air exhalé de 3 sujets, 10 minutes après une exposition par voie cutanée (utilisé comme détachant) (Stewart et Dodd, 1964). Les concentrations dans l’air alvéolaire variaient de 0,11 à 0,83 ppm (4,29 à 5,3 mg.m-3) à la fin des 30 minutes d’exposition, avec un pic de concentration 30 minutes après l’arrêt de l’exposition, suivie par une diminution progressive dans l’heure qui a suivi ; après 5 heures, les concentrations étaient de 0,12 à 0,14 ppm. A partir d’un modèle physiologique à quatre compartiments, Sato et Nakajima (1987) ont calculé que 93 % du TCC inhalé étaient éliminés sous forme inchangée par les poumons (en supposant un taux de ventilation de 336 L.h-1), tandis que 7 % ont été éliminés sous forme de métabolites chez l’homme.
Chez l'animal
Absorption
Inhalation
Le TCC est globalement bien absorbé par inhalation, même si des écarts sont observés selon les espèces et les doses d’exposition. La charge corporelle des équivalents du TCC marqué au C14 est respectivement de 12,1 - 1,97 - 3,65 µmol chez le rat, la souris et le hamster, immédiatement après une exposition de 20 ppm (128 mg.m-3 pendant 4 heures (Benson et al., 2001). Un taux d’absorption de 84 % est rapporté chez la souris exposée pendant 10 minutes à 5 µL de TCC radiomarqué, alors qu’il est voisin de 30 % chez le singe exposé à 46 ppm (294 mg.m-3) de TCC pendant 2 à 6 heures (Bergman, 1979; McCollister et al., 1950 ; McCollister et al., 1951).
Voie orale
Le TCC est rapidement et efficacement absorbé par le tractus gastro-intestinal, avec des taux d’absorption de 80 à 86 % rapportés chez le rat (Marchand et al., 1970). L’absorption par voie orale dépend du solvant administré. Pour une administration dans l’huile de maïs, l’absorption est de 83,1 %, et dans l’eau elle est de 91,9 %, alors qu’elle est de 62,8 % lorsque le composé est administré pur (Kim et al., 1990).
Voie cutanée
L’absorption cutanée du TCC liquide, estimée à 8,3 µg.cm-2 par minute chez le souris (Tsuruta, 1975), a également été rapportée chez le cobaye (Jakobson et al., 1982) et chez le rat (Morgan et al., 1991). En revanche, l’absorption cutanée est négligeable chez le singe exposé pendant 4 h à des vapeurs de TCC radiomarqué (McCollister et al., 1951).
Distribution
Après absorption, le TCC gagne rapidement la circulation sanguine pour se distribuer dans tous les organes, en particulier ceux riches en graisses, comme le tissu adipeux, le foie, le rein, le cerveau, les poumons et la moelle osseuse (Dambrauskas et Cornish, 1970; Marchand et al., 1970; Bergman, 1983; Paustenbach et al., 1986b; Sanzgiri et al., 1997; Benson et al., 2001). Le pic sanguin est atteint entre 1 et 6 heures, et est variable selon les espèces, les voies, les doses et les concentrations d’exposition (US EPA, 2020).
Dans une étude comparant l’exposition au TCC par inhalation (1 000 ppm soit 6 390 mg.m-3) pendant 2 heures ou par voie orale (179 mg.kg-1) (bolus par gavage ou infusion gastrique pendant 2 heures), les concentrations maximales sont plus rapidement atteintes par voie orale (gavage), entre 1 et 120 minutes selon les organes, que par inhalation, entre 30 et 240 minutes ou que par infusion gastrique (entre 2 et 6 h). Quelle que soit la voie d’exposition, 2 à 4 heures après exposition, les concentrations dans le tissu adipeux sont très supérieures à celles observées dans les autres tissus (Sanzgiri et al., 1997).
Métabolisme
Chez l’animal, le métabolisme du TCC est similaire à celui observé chez l’homme. La première étape de bioactivation fait également intervenir les CYP2E1 (Gruebele et al., 1996 ; Raucy et al., 1993), mais aussi les CYP2B1 ou 2B2, et les CYP3A (aux fortes concentrations) pour former un radical trichlorométhyle (CCl3*) (ATSDR, 2005). La transformation de ce radical dépend de la biodisponibilité de l’oxygène, les conditions aérobies ou anaérobies favorisant une voie métabolique plutôt qu’une autre, tel que décrit chez l’humain.
Les niveaux d’expression et d’activité enzymatique des CYP2E1 et CYP2B ont été mesurés chez le rat, la souris et le hamster exposés à des concentrations de 0, 5, 20 et 100 ppm (0 – 31,5 – 126 – 630 mg/m3) de TCC 6 h/j, 5 j7 pendant 12 semaines (Benson et Springer, 1999). Chez toutes les espèces, des augmentations des niveaux protéiques associées à des inhibitions des activités enzymatiques sont observées aux faibles doses de TCC (non liées aux effets hépatotoxiques), à l’origine des différences de toxicité observées chez l’homme et l’animal.
Il semble en effet exister quelques variations liées notamment à l’activité des CYP450 entre l’humain et l’animal. L’inactivation des cytochromes P450, observée chez l’homme, est nettement plus importante chez le rat. (Manno et al., 1988 ; Manno et al., 1992).
Élimination
Inhalation
Chez le singe exposé par inhalation à 46 ppm de TCC pendant 6 heures, 11 % de la dose absorbée sont éliminés sous forme de CO2 et 40 % sont éliminés dans l’air exhalé sous forme inchangée ou sous forme de métabolites (McCollister et al., 1951).
Chez des rats, des souris et des hamsters exposés par inhalation pendant 4 heures à 20 ppm de TCC, 65 à 87 % de la dose administrée (marquage au C14) sont éliminés dans l’air exhalé sous forme de CO2 et de COV (Benson et al., 2001). L’élimination dans les urines et les fèces ne dépasse pas 10 % chez le rat, mais atteint plus de 20 % chez les souris et les hamsters. La demi-vie d’élimination du CO2 est de 7,4 heures et celle des COV est de 4,3 heures (Benson et al., 2001). L’élimination s’effectue préférentiellement via les fèces lors d’une exposition journalière prolongée (8 à 11,5 h), vraisemblablement en raison d’une absorption dans les tissus adipeux (Paustenbach et al., 1986a).
Dans d’autres études, l’élimination sous forme inchangée dans l’air exhalé de 30 à 50 % du TCC inhalé, serait consécutive à une saturation du métabolisme hépatique (McCollister et al., 1951 ; Page et Carlson, 1994 ; Paustenbach et al., 1987, 1988 ; Reynolds et al., 1984).
Voie orale
Dans une étude chez le rat exposé par voie orale à des doses de 15 et 600 mg.kg-1, 19 à 76 % de la dose administrée sont excrétés dans l’air exhalé sous forme inchangée, 2 à 28 % sous forme de CO2, 0,11 à 0,40 % sous forme de chloroforme ; 3 à 9 % des métabolites sont excrétés dans les urines et 7 à 30 % dans les fèces (Reynolds et al., 1984). A faible dose, l’élimination de premier passage hépatique est probablement responsable de la faible quantité de TCC disponible pour l’élimination pulmonaire. En revanche, à fortes doses, la fraction récupérée sous forme de métabolites a diminué, ce qui pourrait indiquer que la capacité de métaboliser le TCC soit dépassée ou altérée (Santé Canada, 2010).
Voie cutanée
Aucune donnée n’a été identifiée chez l’animal.
Autre
Mécanisme d’action
Les métabolites radicalaires (radicaux trichlorométhyle et trichlorométhylperoxy) produit au cours du métabolisme du TCC expliquent l’essentiel des effets toxiques non seulement en se liant avec les sites nucléophiles des constituants cellulaires, mais aussi aux molécules anti-oxydantes comme le GSH (Unsal et al., 2021). La diminution du pouvoir anti-oxydant de la cellule, associée à la baisse d’ATP et de NADPH, va initier par l’intermédiaire d’un stress oxydant la chaîne des réactions de peroxydation lipidique (Yoshioka et al., 2017). Il en résulte une destruction d’acides gras poly-insaturés, en particulier ceux associés aux phospholipides (Fanelli et Castro, 1995). La perméabilité des mitochondries, du réticulum endoplasmique et des membranes plasmiques est altéréeconduisant à un trouble de l’homéostasie calcique (Hemmings et al., 2002 ; Limaye et al., 2003). Parmi les produits de dégradation des acides gras, il est retrouvé des aldéhydes comme la 4-hydroxynonénal, qui inhibe de nombreuses enzymes et se fixe sur des groupements fonctionnels de protéines (Hartley et al., 1999).
Dans plusieurs études, une augmentation des concentrations cytosoliques en calcium (d’un facteur 100 par rapport aux concentrations physiologiques) a été observée chez les animaux exposés au TCC (Agarwal et Mehendale, 1984, 1986 ; Kroner, 1982 ; Long et Moore, 1986). Cette augmentation est liée à une diminution du transport de calcium à travers la membrane plasmique (Hemmings et al., 2002), à une activation de certains transporteurs membranaires de calcium (Feng et al., 1992), à une activation des cystéines protéases calcium-dépendantes (Limaye et al., 2003) et des phospholipases (Glende et Pushpendran, 1986 ; Gonzalez Padron et al., 1993).
Cette perturbation de l’homéostasie calcique est susceptible d’induire une mort cellulaire (Faber, 1981).
Pour de fortes concentrations, il semblerait que le métabolisme du TCC par le CYP2E1, la cytotoxicité et la prolifération des cellules régénératives à l’origine d’un processus cirrhotique avec la formation de travées de fibrose et nodules de régénération inefficaces, soient impliqués dans le développement précoce d’un processus cancérigène. Pour de faibles expositions non cytotoxiques, un mécanisme d’action linéaire semble plus pertinent qu’un mécanisme lié à la relation dose-réponse (US EPA (IRIS), 2010).
Modèles pharmacocinétiques basés sur la physiologie
Plusieurs modèles pharmacocinétiques basés sur la physiologie (PBPK) sont disponibles pour une exposition au TCC par inhalation (Benson et Springer, 1999 ; Evans et al., 1994 ; Fisher et al., 2004 ; Gargas et al., 1986 ; Paustenbach et al., 1987 ; Paustenbach et al., 1988 ; Thrall et al., 2000 ; Delic et al., 2000; Yoon et al., 2007) et par voie orale (Fisher et al., 2004 ; Gallo et al., 1993 ; Semino et al., 1997). La majorité de ces modèles sont basés sur des études réalisées chez les rongeurs. Toutefois, un modèle permet de déterminer les taux de métabolisation chez l’homme à partir de données in vitro chez l’homme et des ratios in vivo/in vitro chez l’animal (Thrall et al., 2000). Des taux constants de transformation ont été retenus par l’US EPA (IRIS) dans son programme d’extrapolation inter-espèces (rat-humain, souris-humain) ou encore pour les extrapolations voie à voie du TCC par inhalation dans les modèles PBPK chez l’homme (US EPA, 2020).
Synthèse
Chez l’homme, l’absorption du TCC par les différentes voies d’exposition est efficace, mais n’a pas été formellement quantifiée. Le TCC est métabolisé majoritairement dans le foie par les CYP (en particulier les CYP2E1 et CYP3A4) pour former des radicaux trichlorométhyle (CCl3*). Chez l’humain, le TCC non métabolisé a été retrouvé dans l’air expiré, indépendamment de la voie d’exposition.
Chez l’animal, après absorption, le TCC s’accumule principalement dans le tissu adipeux, le foie, les poumons et la moelle osseuse. Le métabolisme est comparable à celui décrit chez l’homme, avec un probable effet de premier passage hépatique qui limite à faible dose l’élimination dans l’air exhalé. Le TCC est éliminé principalement dans l’air expiré, sous forme inchangée, et sous forme de métabolites, ainsi que par voie fécale.
Toxicité aiguë
Chez l'homme
Inhalation
L’inhalation est la voie d’exposition principale lors d’intoxications accidentelles. Lors de ce type d’exposition, une atteinte du système nerveux central et des effets gastro-intestinaux se traduisant par des nausées, des vomissements, des maux de tête, une tachycardie, une accélération de la respiration, une somnolence, des vertiges, des pertes de conscience et une mort immédiate sont rapportés dans les cas les plus sévères (Von Oettingen, 1964).
Le seuil des effets sur le système nerveux central se situerait entre 20 et 50 ppm (soit 128 mg.m-3 et 320 mg.m-3) pour une exposition de 8 heures chez l’homme (Baud et Garnier, 2017).
Dans une études où 6 volontaires ont été exposés 3 fois en 4 semaines à des vapeurs de TCC aux concentrations de 49 ppm (314 mg.m-3) pendant 70 minutes ou à 10 ppm (64,1 mg.m-3) pendant 3 heures, aucun effet (irritations, nausées, troubles lors d’exposition à la lumière, perturbations de la coordination) n’est rapporté, de même qu’aucune augmentation des transaminases hépatiques (aspartate amino-transférase ou ASAT) (Stewart et al., 1961). Seuls 2 des 4 sujets exposés à la plus forte dose ont présenté une diminution des concentrations en fer sérique.
Dix-sept employés sur 25 exposés à du TCC (concentrations estimées entre 300 à 500 ppm (1 917 à 3 195 mg.m-3)), utilisé pour nettoyer une pompe d’un système d’air conditionné ont présenté une hépatite révélée 10 jours après l’intoxication (Deny et al., 1987).
Chez des salariés exposés à de fortes concentrations de TCC pendant 2 heures, des atteintes hépatiques et rénales sévères (provoquée par une nécrose tubulaire) n’ont été observées que chez 2 sujets connus pour avoir une consommation alcoolique importante, ce qui suggère un effet synergique entre l’alcool et le TCC (Manno et al., 1996). De même, Folland et al. (1976) ont fait état de plusieurs cas de lésions hépatiques et rénales chez des travailleurs d’une usine d’emballage d’alcool isopropylique après une exposition accidentelle au TCC. Les cas les plus graves présentaient une insuffisance rénale aiguë et ont dû être dialysés. Enfin, la mort d’un homme ayant des antécédents d’alcoolisme a été rapportée après une exposition de 15 min à 250 ppm de TCC en raison d’une insuffisance hépatique, rénale et pulmonaire (Santé Canada, 2010)
Les concentrations minimales toxiques pour le rein sont légèrement plus élevées que celles qui sont hépatotoxiques, probablement de l’ordre de 200 ppm pour une exposition de 8 heures (Baud et Granier, 2017). L’atteinte rénale se manifeste principalement par une tubulopathie aiguë, souvent de type anurique réversible en 3 à 15 jours.
Voie orale
Les principaux effets de l’exposition aiguë lors d’expositions par voie orale sont la dépression du système nerveux central, des troubles hépatiques et des lésions rénales (ATSDR, 2005 ; US EPA (IRIS), 2010).
Des cas sévères d’intoxication au TCC par voie orale (doses estimées entre 45 à 68 mg.kg-1) ont présenté des symptômes gastro-intestinaux (nausées, vomissements, diarrhée et douleurs abdominales) et neurotoxiques (somnolence, coma ou convulsions) lié à l’effet lipophile des solvants organiques chlorés aliphatiques (Ruprah et al., 1985; Stewart et al., 1963; New et al., 1962). L’atteinte hépatique s’est traduite par une hypertrophie et l’élévation des transaminases sériques (>100 fois plus élevées pour les taux d’alanine aminotransférase (ALAT) ou d’ASAT et de bilirubine.
Voie cutanée
Trois personnes ont appliqué une lotion contre la gale contenant 67 g de TCC dans 100 g de produit. Toutes ont souffert de nausées, vomissements, coliques dans les 2 à 48 heures. Deux patients ont présenté entre 24 et 48 heures une hémorragie conjonctivale et une hépatite anictérique. Ces 3 victimes ont développé une insuffisance rénale oligurique entre le 3ème et le 7ème jour. Au 7ème jour, les tests hépatiques étaient normaux et la fonction rénale redevenue normale dans un délai de 2 à 4 semaines (Perez et al., 1987). Cette observation souligne que l’exposition parles voies cutanées et respiratoires altère plus sévèrement la fonction rénale qu’hépatique.
Lors de l’exposition cutanée continue aux vapeurs de TCC, un blanchiment cutané spontané transitoire est observé au bout de 5 minutes. Après 10 à 20 minutes, un érythème cutané transitoire survient (Wahlberg, 1984). Un résultat similaire avait été obtenu dans une autre étude (Stewart et Dodd, 1964).
Synthèse
Chez l’homme, l’exposition au TCC induit des troubles gastro-intestinaux (nausées, vomissements, diarrhées), une dépression du système nerveux central (maux de tête, vertiges, troubles de la conscience), des troubles hépatiques (hépatite cytolytique aiguë, élévation des transaminases), des atteintes rénales (tubulopathie, insuffisance rénale) et dans certains cas, des troubles respiratoires. Une exposition cutanée entraîne un blanchiment cutané puis l’apparition d’un érythème transitoire.
Chez l'animal
Inhalation
Chez la souris, la CL50 se situe entre 7 176 ppm et 7 800 ppm (45 998 mg.m-3 et 50 000 mg.m-3 (Gradiski et al., 1978 ; Svirbely et al., 1947).
Chez des rats exposés par inhalation à 50, 250 et 1 000 ppm (320, 1 698 et 6 390 mg.m‑3), 6 heures par jour pendant 4 jours, le TCC induit une augmentation significative des activités enzymatiques sériques (augmentation des niveaux de alanine transférase sérique) et des lésions hépatiques (stéatose hépatocystique, dégénérescence hydropique, nécrose) (David et al., 1981).
Des rats ont été exposés par inhalation à 4 600, 7 300 et 12 000 ppm (29 394, 46 647, 76 680 mg.m-3) de TCC pendant 7 heures. Pour la dose intermédiaire, une incoordination a été observée et une perte de conscience à la plus forte dose. Un jour après l’exposition, une augmentation du poids du foie ainsi qu’une stéatose (dégénérescence graisseuse) centro-lobulaire sont constatées (Adams et al., 1952).
Dans une autre étude chez des rats exposés par inhalation pendant 5 jours (11,5 h/j) à une concentration de 100 ppm (639 mg.m-3), une dégénérescence graisseuse hépatique et un syndrome néphrotique sont observés (Paustenbach et al., 1986b).
Des rats ont été exposés par inhalation en continu à 16 ppm (100 mg.m-3) de TCC pendant 4semaines (24 h/24, 7 j/7) ou par périodes de 6 h/j, 5 j/7 à 87 ppm (540 mg.m-3. Pour les 2 modes d’exposition, les rats sont exposés à des doses cumulées proches respectivement de 10,507 ppm.h-1 et 10,458 ppm.h-1 Les analyses histopathologiques ont mis en évidence des cirrhoses et des fibroses hépatiques quel que soit le mode d’exposition(Plummer et al., 1990).
Voie orale
Les différentes DL50 par voie orale sont rapportées dans le tableau suivant. Il apparaît clairement que la toxicité aiguë du TCC est très faible.
|
Espèces |
DL50 (mg.kg-1) |
Auteurs |
|---|---|---|
|
Souris |
12 100 - 14 400 |
(Dybing et Dybing, 1946) |
|
Rat (femelle) |
2 821 |
(Smyth et al., 1970), (Klaassen et Plaa, 1969) |
|
Rat (male) |
10 054 |
(Kennedy et al., 1986) |
|
Chien |
2 300 |
(Klaassen et Plaa, 1967) |
L’exposition à une dose unique de 20 à 2 000 mg.kg-1 de TCC chez le rat entraîne dès 24 heures, une augmentation significative des enzymes hépatiques et une vacuolisation hépatocytaire à partir de 50 mg.kg-1, ainsi qu’une nécrose hépatique chez les animaux à partir de 160 mg.kg-1 (Bruckner et al., 1986 ; Sun et al., 2014). Après 11 jours, une hépatotoxicité progressivement sévère a été observée pour chacune des doses uniques. Les mécanismes de toxicité hépatique, impliquant initialement la formation du radical trichlorométhyle, puis la peroxydation lipidique avec notamment la formation de malondialdéhyde ont également été observés au niveau du cerveau de rat exposés oralement à une dose unique de 1 ml.kg-1 (Ritesh et al., 2015). Les auteurs ont notamment montré une baisse drastique du GSH dans les différentes régions du cerveau, baisse plus importante qu’au niveau hépatique, traduisant un impact de la toxicité radicalaire plus importante sur le cerveau que le foie.
Des rats sont exposés par gavage au TCC, pendant 10 jours, à des concentrations de 0, 5, 10, 20, 40, 80 et 160 mg.kg-1.j-1 (Smialowicz et al., 1991). Pour des expositions de 5, 10 et 20 mg.kg-1.j-1, une dégénérescence vacuolaire bénigne et une légère nécrose hépatique a été constatée. Les taux sériques de transaminases sont significativement augmentés (de 1 à 5 fois par rapport aux valeurs physiologiques) à partir de la dose de 20 mg.kg‑1.j-1. A partir de 40 mg.kg‑1.j-1, une augmentation significative du poids du foie est observée et les analyses histologiques ont montré une dégénérescence vacuolaire ainsi qu’une nécrose hépatocellulaire modérée. Par ailleurs, une réduction significative du gain de poids est observée chez les animaux exposés à 80 et 160 mg.kg-1.j-1. Aucun effet rénal n’a été observé jusqu’à la dose de 40 mg.kg-1.j-1 (la toxicité rénale n’a pas été recherchée aux plus fortes doses). Aucun effet sur le système immunitaire n’a été observé pour des concentrations de 160 mg.kg-1.j-1.
Des souris sont exposées par voie orale (gavage) dans l’huile de maïs à 0, 50, 100, 500 et 1 000 mg.kg‑1.j-1 de TCC pendant 14 jours. Une augmentation significative du poids du foie (23 %) est observée pour des doses de 500 mg.kg-1.j-1 et l’analyse histopathologique a mis en évidence une nécrose centrolobulaire des hépatocytes. Une augmentation du taux sérique d’ALAT (d’un facteur 19 à 50 mg.kg-1.j-1), de protéines (9 % à 100 mg.kg-1.j-1), de l’urée (34 % à 500 mg.kg-1.j-1) et des globulines (20 % à 1000 mg.kg-1.j-1) ainsi qu’une diminution du glucose sanguin (20 % à 1 000 mg.kg-1.j-1) ont été observées. A partir de 50 mg.kg-1.j-1, une diminution de la réponse immunitaire humorale est constatée, caractérisée par une suppression de la réponse immunitaire via les anticorps IgM. Par ailleurs, les auteurs ont montré un effet immunosupresseur du TCC à partir de deux modèles d’infection de bactéries pathogènes, l’un par le Streptococcus pneumoniae et l’autre par la Listeria monocytogenes, avec une plus grande sensibilité vis-à-vis de la seconde (Guo et al., 2000).
Les effets sur le système immunitaire ont été analysés dans une étude chez des souris exposées par voie orale (gavage) à 1 590 mg.kg-1, 2 fois par semaine, pendant 4 semaines. Une augmentation du poids du foie (12 %), une diminution du poids du thymus (6 %) et de la rate (25 %) sont observées. Une inhibition de 40 à 56 % de la réponse immunitaire dépendante des lymphocytes T est constatée chez les souris exposées. De plus, les réactions d’hypersensibilité retardée sont significativement augmentées indiquant une altération de la fonction des lymphocytes T auxiliaires par le TCC. L’activité des cellules Natural Killer, de l’activité phagocytaire ainsi que du nombre de leucocytes circulants sont significativement diminués de 61, 40 et 34 % respectivement. Le TCC altère donc la réponse immunitaire à médiation humorale et à médiation cellulaire (Ahn et Kim, 1993). D’après certains auteurs, les effets immunologiques liés au TCC seraient secondaires à l’hépatotoxicité et au processus de régénération hépatique qui implique l’interaction de plusieurs types cellulaires ainsi que des médiateurs cellulaires (IL-2, IFN-γ) et des facteurs de croissance (TGF-ß1) (Delaney et Kaminski, 1994 ; Jeon et al., 1997 ; Luster et al., 2000).
A noter que chez les rongeurs, la toxicité rénale est moins sensible aux effets de l’exposition aiguë au TCC que la toxicité hépatique (ATSDR, 2005). Seules des lésions histologiques marginales sont décrites chez la souris exposée à des doses de 2 500 mg/kg/j pendant 14 jours (fortement hépatotoxiques) et les lésions rénales (décoloration, œdème, altérations morphologiques des cellules épithéliales des tubules proximaux) observées chez le rat exposé à une dose une unique de 4 000 mg/kg/j après 2 jours, se sont révélées totalement réversibles après 5 jours (Hayes et al. 1986 ; Striker et al. 1968).
Voie cutanée
La DL50 par voie cutanée est estimée supérieure à 15 g.kg-1 chez le lapin et le cobaye (Roudabush et al., 1965).
Le TCC est un irritant modéré cutané et oculaire (Duprat et al., 1976 ; Roudabush et al., 1965).
Synthèse
Chez l’animal, la toxicité aiguë du TCC est faible. Par inhalation et par voie orale, le foie est l’organe cible de la toxicité aiguë du TCC avec des altérations des activités enzymatiques et des lésions hépatiques (stéatose, dégénérescence graisseuse, cirrhose, nécrose, fibrose). Des effets sur le système nerveux central (incoordination, perte de conscience) et des effets immunitaires sont également rapportés. Le TCC est un irritant modéré cutané et oculaire.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Une étude transversale a été menée dans 3 usines de produits chimiques en Angleterre où les salariés ont été classés à partir de données d’échantillonnage individuelles historiques au TCC en 3 groupes d’exposition : un groupe faible avec des taux inférieurs ou égaux à 1 ppm (6,4 mg.m-3), un groupe modéré compris entre 1 et 4 ppm (6,4 et 25,6 mg.m-3) et un groupe élevé à 4 ppm (25,6 mg.m-3), les sujets étant également répartis selon la durée d’exposition (<1 an, de 1 à 5 ans, > 5 ans) (Tomenson et al., 1995). L’analyse de différents paramètres biochimiques et hématologiques n’a pas révélé de différences entre le groupe témoin et le groupe exposé à la plus faible dose, la consommation d’alcool ayant été prise en compte. En revanche, une augmentation significative d’ALAT et de la gamma-glutamyl transférase (γGT) est rapportée pour l’ensemble des groupes exposés au TCC par comparaison au groupe témoin, mais aucune différence significative n’apparait entre les différentes catégories d’exposition.
Dans une étude chez 17 employés exposés plus de 3 mois au TCC (45 à 100 ppm (288 à 639 mg.m-3)), 15 des sujets se plaignaient de nausées, d’anorexie, de vomissements, de douleurs épigastriques, de céphalées, d’étourdissements, ou de troubles anxieux. Une semaine après la réduction des expositions à 0-9 ppm (0-56 mg.m-3), les signes avaient disparu (Kazantzis et Bomford, 1960).
Dans une cohorte de 99 paires de jumeaux d’âge moyen de 66,2 ans (vétérans de guerre) dont l’un des jumeaux est atteint d’une maladie de Parkinson, les auteurs ont recherché un lien possible entre l’exposition aux solvants (6 solvants sélectionnés a priori et évalués par questionnaires auto-rapportés) et le risque de la maladie de Parkinson (Goldman et al., 2012). Des associations positives ont été mises en évidence avec d’autres solvants chlorés (le trichloréthylène et le perchloroéthylène), celle avec le TCC étant à la limite de la significativité (OR 2,3 ; IC à 95 % 0,9-6,1).
Chez l’enfant, le syndrome autistique n’a pas été associé à une exposition de la mère au TCC pendant la grossesse (n= 325 cas et 22 101 témoins) (Roberts et al., 2013).
Synthèse
Chez l’homme, le TCC induit une toxicité hépatique (augmentation de l’activité des ALAT et de la γGT, ainsi que des effets réversibles (nausées, anorexie, céphalées) ; mais l’exposition à d’autres solvants et la consommation d’alcool n’ont pas toujours été prises en compte.
Effets systémiques
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
40 % |
80 % environ |
Foie, SNC, Rein, Poumons, Sang |
|
|
Foie, SNC, Rein, Poumons |
|||
Chez l'animal
Inhalation
Exposition sub-chronique
Des rats, des souris et des hamsters sont exposés par inhalation à 0, 5, 20 et 100 ppm (0 ‑ 31,5 ‑ 126 ‑ 630 mg.m‑3) de TCC pendant 12 semaines (6 h/ j, 5 j/7). Une augmentation significative de la concentration sérique en ALAT et GSH est observée chez les souris exposées à plus de 20 ppm et chez les rats et les hamsters pour la concentration de 100 ppm (630 mg.m‑3). Pour ces mêmes concentrations, des lésions nécrotiques du parenchyme hépatique sont également observées (Benson et Springer, 1999).
Des rats (15 /lot), des cobayes (15 /lot), des lapins (3 /lot), des chiens beagles (2 /lot) et des singes (3 /lot) ont été exposés à des concentrations de TCC de 1 - 10 - 80 ppm (soit 6,4 - 64 - 512 mg.m-3) pendant 90 jours sauf pour la concentration la plus élevée (exposition de 42 jours) (Prendergast et al., 1967). Chez toutes les espèces, exceptées chez les rats, des cas de mortalité sont rapportés à la plus forte dose associés à une perte de poids, une atteinte hépatique et pulmonaire. Dans les lots exposés à 10 ppm (64 mg.m-3), une diminution de la croissance et des altérations hépatiques histologiques sont rapportées chez toutes les espèces. Pour les lots exposés à 1 ppm, la diminution de la croissance et les altérations hépatiques sont jugées mineures.
Chez la souris, une exposition corps entier aux concentrations de 0, 10, 30, 90, 270 ou 810 ppm (0, 64, 192, 577, 1 731, ou 5 192 mg.m-3) de TCC, 6 h/j, 5 j/7 pendant 13 semaines, montre une diminution du gain pondéral chez le mâle pour des expositions à des concentrations supérieures ou égales à 30 ppm (192 mg.m‑3), une diminution légère mais significative des paramètres hématologiques chez le mâle exposé à 810 ppm (5 192 mg.m-3) et chez la femelle exposée aux concentrations de 270 ou 810 ppm (1 731, ou 5 192 mg.m-3) (respectivement diminution du taux d’hémoglobine, de hématocrite et du nombre d’érythrocytes) (Etude non publiée du JBRC, 1998; Nagano et al., 2007b). Une augmentation des enzymes hépatiques dans le sang est observée chez les 2 sexes pour les concentrations de 90, 270 ou 810 ppm (577, 1 731 ou 5 192 mg.m-3). Une altération cytologique hépatique est observée même pour la concentration la plus faible chez les mâles. Aux concentrations les plus élevées, ces altérations correspondent à un effondrement du tissu parenchymateux dans la région centro-lobulaire des dépôts de céroïdes, une prolifération des canaux biliaires et une augmentation des mitoses hépatocytaires. Une étude similaire menée par les mêmes auteurs chez le rat confirme les résultats observés chez la souris. Une néphrotoxicité a également été observée chez les rats et les souris, mais à des niveaux d’exposition plus élevés que l’hépatotoxicité. Un LOAEL de 10 ppm a été retenu chez le rat et la souris pour les effets hépatiques.
Exposition chronique
Des rats et des cobayes ont été exposés par inhalation à des concentrations de TCC de 5, 10, 25, 50, 100, 200 ou 400 ppm (32, 64, 160, 320, 640, 1 278 ou 2 556 mg.m-3), 7 h/j, 5 j/7, pendant 6 à 7 mois (Adams et al., 1952). Une augmentation du poids du foie et de larges inclusions graisseuse au niveau du foie sont observées dès 2 ou 3 semaines après le début de l’exposition pour les animaux exposés aux concentrations de 100, 200 ou 400 ppm (630, 1 282 ou 2 520 mg.m-3). Une mortalité importante de plus de la moitié des animaux par dose est rapportée aussi bien chez les rats que chez les cobayes exposés à 200 et 400 ppm. Des cirrhoses sont observées pour des expositions supérieures à 100 ppm (630 mg.m-3). Chez les animaux exposés à des concentrations de 50 ppm (320 mg.m-3), une atteinte de l’épithélium tubulaire rénal est rapportée chez les mâles, ce qui serait à l’origine d’une augmentation de la mortalité. L’atteinte rénale et le retard de croissance est net à 50 ppm. La sévérité des effets augmente avec les doses. Une hépatotoxicité apparaît chez les 2 espèces dès 10 ppm se manifestant par une augmentation du poids du foie, une augmentation des lipides et du taux de cholestérol estérifié. Pour une exposition à 5 ppm (32 mg.m-3), aucun effet n’est rapporté, en dehors d’une augmentation significative du poids du foie des femelles chez le cobaye uniquement. Sans tenir compte de cette augmentation, les auteurs retiennent un NOAEL de 5 ppm . Cependant, les données disponibles pour cette expérimentation sont incomplètes (données statistiques uniquement chez les animaux exposés à 5 ppm).
Des rats et des souris (50 par dose/sexe) ont été exposés au TCC par inhalation, pendant 104 semaines, 6 h/j, 5 j/7, à des concentrations de 5, 25 et 125 ppm (32, 160 et 799 mg.m-3) (JBRC, 1998 ; Nagano et al., 2007a). Une baisse significative du taux de survie a été observée chez les rats et les souris exposés à 125 ppm, ainsi que chez les souris femelles exposées à 25 ppm. Chez les rats, une néphropathie chronique (glomérulonéphrose progressive) accompagnée d’une protéinurie a été observée à la plus forte dose chez les 2 sexes, ainsi que chez les femelles uniquement exposées à la dose de 25 ppm (160 mg.m-3). Chez les animaux exposés à des concentrations de 25 ppm, des effets hépatiques ont été observés tels qu’une augmentation du poids du foie, des enzymes sériques (bilirubine, transaminases) et des modifications histo-pathologiques (stéatose, dépôts de céroïdes, fibrose,). Une augmentation des dépôts d’hémosidérine dans la rate a également été rapportée à toutes les doses chez le rat mâle, et aux 2 plus fortes doses chez les souris (mâles et femelles). Pour une exposition de 5 ppm, aucun effet hépatique significatif n’a été observé. Il est précisé par les auteurs de l’étude qu’en raison du faible nombre d’animaux ayant survécu à l’exposition de 125 ppm de TCC, les effets observés ne sont pas statistiquement significatifs.
Plusieurs études montrent que la toxicité hépatique est secondaire à la métabolisation du TCC par les CYP en particulier le CYP2E1 (Avasarala et al., 2006) et serait donc dépendante des inducteurs (éthanol) (Jaeschke et al., 2002 ; Takahashi et al., 2002) et des inhibiteurs (SKF-525A, colchicine, silymarine) (Letteron et al., 1990 ; Martinez et al., 1995) de celui-ci.
Voie orale
Exposition sub-chronique
Chez des rats exposés au TCC en solution dans de l’huile de maïs par voie orale aux doses de 50, 150, 450 ou 1 350 mg.kg-1 de poids corporel pendant 15 jours, le poids des reins et la fonction rénale (hématurie, enzymurie, diminution de la concentration en glucose sérique) sont significativement altérés uniquement à la plus forte dose testée de (Kluwe, 1981).
Chez la souris exposée par voie orale (gavage) à des doses de 0, 12, 120, 540 ou 1 200 mg.kg‑1.j-1 de TCC en solution dans l’huile de maïs pendant 90 jours, une augmentation dose-dépendante des niveaux sanguins de lactate déshydrogénase (LDH), d’ASAT, d’ALAT, de phosphatases alcalines (PA), de cholestérol et de bilirubine est observé, ainsi qu’une diminution du niveau du glucose sanguin, reflétant une altération hépatique (Hayes et al., 1986). De plus, chez les 2 sexes, une augmentation pondérale relative et absolue du foie, de la rate, et du thymus est rapportée à toutes les doses. Une autre étude menée chez la souris exposée à 0 – 1,2 – 12 - 120 mg.kg‑1.j-1 de TCC dans de l’huile de maïs par voie orale (gavage), 5 j/7 pendant 12 semaines, a permis de déterminer un NOAEL pour les effets hépatiques de 1,2 mg.kg-1.j-1 (Condie et al., 1986).
Des rats mâles (15 à 16 par dose) ont été exposés par voie orale (gavage dans l’huile de maïs) à des doses de TCC de 0 ‑ 1 – 10 – 33 mg.kg-1.j-1, 5 j/7 pendant 12 semaines (Bruckner et al., 1986). A la plus forte dose de 33 mg.kg-1.j-1, une augmentation des activités sériques de la sorbitoldéshydrogénase (SDH), de l’ornithine-carbamyl transférase (OCT) et de l’ALAT est observée pendant la période d’exposition de 12 semaines, mais est revenue à la normale dans les 2 semaines suivant l’arrêt de l’exposition à l’exception de l’ALAT (p<0,05). L’analyse histopathologique des foies montre une cirrhose caractérisée par une prolifération des canaux biliaires, une fibrose, des nodules de régénération et une nécrose. Chez les animaux exposés à la dose de 10 mg.kg-1.j-1, une augmentation des niveaux sériques de SDH (p<0,05) réversible après l’arrêt de l’exposition et une vacuolisation centrolobulaire hépatique sont décrites. De cette étude, un NOAEL de 1 mg.kg-1.j-1 pour la survenue d’une atteinte hépatique est établi. Des résultats similaires sont rapportés chez le rat pour des expositions par gavage au TCC en solution dans l’huile de maïs à des doses comprises entre 20 et 100 mg.kg-1.j-1 pendant 12 à 13 semaines (Allis et al., 1990; Koporec et al., 1995), ou chez le chien exposé par voie orale à la dose de 797 mg.kg-1.j-1 pendant 28 jours (Litchfield et Gartland, 1974).
Dans la cadre d’une approche mécanistique, une corrélation entre la diminution des concentrations en GSH et l’apparition de cirrhose est rapportée chez les rats exposés au TCC par voie intra-péritonéale. En effet, le glutathion qui est un puissant antioxydant intracellulaire est considéré comme un hépatoprotecteur s’opposant au stress oxydant induit par les métabolites du TCC (Cabre et al., 2000 ; Chiu et al., 2003). Dans une autre étude, l’administration de N-Acétyl-cystéine (précurseur du GSH) chez des rats exposés au TCC permet de limiter les effets hépatotoxiques (De Ferreyra et al., 1974).
Exposition chronique
Des rats (50 animaux /sexe/dose) sont exposés par voie orale (gavage dans l’huile de maïs) à 47 ou 94 mg.kg-1.j-1 chez les mâles et 80 ou 159 mg.kg-1.j-1 chez les femelles de TCC, 5 jours par semaine pendant 78 semaines. Pour les 2 doses, une hépatotoxicité caractérisée par une fibrose, une cirrhose et une prolifération des canaux biliaires a été observée. Dans cette même étude, des souris sont exposées par voie orale (gavage) à 1 250 ou 2 500 mg.kg-1.j-1 de TCC, 5 j/7 pendant 78 semaines. Les mêmes effets hépatiques que chez le rat sont observés (NCI, 1976a, 1977 ; Weisburger, 1977).
Voie cutanée
Aucune donnée n’a été identifiée pour des expositions par voie cutanée.
Synthèse
Chez l’animal, l’exposition au TCC entraîne des atteintes hépatiques (nécrose, fibrose, cirrhose), rénales, pulmonaires et hématologiques. La sévérité des effets augmente avec la dose, indépendamment de la voie d’exposition (inhalation ou orale).
Effets systémiques
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition
|
40 % |
80 % environ |
Foie, SNC, Rein, Poumons, Sang |
|
|
Foie, SNC, Rein, Poumons |
|||
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 2: Substance dont la capacité d’induire des cancers chez l’homme est suspectée. | 2008 |
| IARC | Groupe 2B: l’agent (ou le mélange) pourrait être cancérogène pour l’homme | 1999 |
| US EPA | Classe B2: substance cancérogène possible pour l'homme. Il existe des preuves suffisantes chez l'animal et des preuves non adéquates ou pas de preuve chez l'homme | 1991 |
Chez l'homme
Toutes voies
Le risque de survenue de cancers suite à l’exposition au TCC a été évalué essentiellement lors d’expositions en milieu professionnel.
Expositions professionnelles
Le nombre de morts par cancers et autres causes sur une cohorte de 5 365 membres des syndicats des teinturiers aux États-Unis a été analysé (Blair et al., 1990). Le TCC a été utilisé de manière intensive en teinturerie entre 1930 et 1960, ainsi que d’autres solvants tels que le solvant « stoddard » (White spirit). Cette étude prend en compte le niveau d’exposition aux solvants, mais pas le type de solvant. Le SMR pour les décès est de 0,9 et de 1,2 pour les morts par cancers. Un excès statistiquement significatif de cancers de l’œsophage est rapporté (SMR 2,1 à 95 % ; CI 1,1-3,6), ainsi qu’un excès non statistiquement significatif des autres types de cancer. La survenue de cancers lymphatiques et hématopoïétiques semble liée aux niveaux d’expositions.
Une étude de mortalité a porté sur 14 457 employés pendant au moins 1 an entre 1952 et 1956 à la maintenance des avions aux États Unis (Blair et al., 1998). Dans cette cohorte, 6 737 employés ont été exposés au TCC (Stewart et al., 1991). Chez les femmes, l’exposition au TCC est associée à une augmentation du risque de lymphomes non-hodgkiniens (RR 3,3, à 95 %, CI 0,9-12,7) et de myélomes multiples (RR : 2,0 à 95 %, CI 0,4-9,1). Chez les hommes, le risque est moindre : RR de 1,2 à 95 % (CI 0,4-3,3) pour les lymphomes non-hodgkiniens et de 1,2 à 95 % (CI 0,4-3,7) pour les myélomes multiples. Aucune association n’est trouvée avec le cancer du sein. Concernant les myélomes multiples, aucune association significative n’a été retrouvée chez des salariés exposés au TCC, d’autres solvants chlorés étant incriminés (Gold et al., 2011).
Une étude cas-témoins nichée au sein d’une cohorte de 6 678 employés en activité ou à la retraite entre 1964 et 1973 de l’industrie du caoutchouc a été réalisée pour identifier une relation entre l’exposition à 24 solvants (dont le tétrachloroéthylène) et la survenue de cancers (Checkoway et al., 1984 ; Wilcosky et al., 1984). Une association a pu être établie entre l’exposition pendant au moins 1 an au TCC et les leucémies lymphoïdes (OR 15,3, p<0,0001) et les lymphosarcomes (OR 4,2, p<0,05) après ajustement par rapport à l’année de naissance. Cependant, la présence de nombreux agents cancérogènes dans les industries de caoutchouc amène à considérer ces résultats avec précaution.
Dans l’une des études cas-témoins nichées dans une cohorte portant sur 308 cas de décès par cancer du poumon chez les salariés de la chimie, aucune association n’a pu être établie avec l’exposition au TCC (Bond et al., 1986). De même, aucune association entre l’étiologie du cancer du poumon (total de 2 926 cas comprenant 2 276 hommes et 650 femmes) et l’exposition professionnelle au TCC n’a été observée dans une étude multicentrique cas-témoins française réalisée entre 2001 et 2006 (Marrei et al., 2014). Toutefois, les analyses combinées de 2 études cas-témoins canadiennes (2 016 cas et 2 001 témoins) rapportent une augmentation significative du cancer du poumon chez les salariés exposés au TCC (OR = 2,5; 95% IC : 1,1-5,7) (Vizcava et al., 2013). Le niveau d’exposition non quantifié a été évalué par des chimistes et hygiénistes à partir des matrices emplois-expositions.
Au cours de 7 études cas-témoins, il n’a pas été établi d’association entre l’exposition au TCC et la survenue de leucémies lymphoïdes chroniques (Linet et al., 1987), de cancers du cerveau (Heineman et al., 1994), de cancers du sein chez la femme (Cantor et al., 1995), de mélanomes intra-oculaires (Holly et al., 1996), de carcinomes rénaux (Dosemeci et al., 1999; Purdue et al., 2016) et de cancers rectaux (Dumas et al., 2000). Dans une autre étude cas-témoins, aucune association entre l’exposition au TCC (pompiers, mécaniciens et électriciens) et l’incidence de lymphomes non-hodgkiniens n’a été établie, alors qu’un risque significatif a été observé pour les cancers rectaux (OR 2,0 à 90 % ; IC 1,2-3,3) (Siémiatycki et al., 1991). Si parmi les études plus récentes, l’une confirme l’absence d’association avec les tumeurs du cerveau (salariés non agricoles) (Ruder et al., 2013), 2 autres ont pu établir une association significative (Nelson et al., 2012) ou une suggestion d’association (Neta et al., 2012). Dans la première étude, une association entre le risque de glioblastomes (9 cas) et l’exposition professionnelle au TCC (RR de 26,59 ; IC à 95 % 2,9-243,5) a été observée dans le cadre d’une étude de cohorte prospective de 8 006 hommes américano-japonais suivis pendant 30 années (Etat d’Hawaï). Le taux de cancer est multiplié par 10 chez les sujets exposés (n=2) par comparaison aux sujets non exposés (n=7) (p=0,012) (Nelson et al., 2012). La seconde étude regroupant 489 cas de gliomes, 197 cas de méningiome et 799 témoins, conduite dans 3 hôpitaux américains rapporte une augmentation du risque de gliomes parmi les sujets hautement exposés professionnellement au TCC (OR de 7,1 ; IC 95% 1,1-45,2) par comparaison aux sujets faiblement exposés (Neta et al., 2012). Aucun risque significatif de gliomes et/ou méningiomes n’a été clairement observé entre les cas et les sujets témoins.
Une étude rapporte que l’exposition à des solvants (notamment le TCC et le benzène) est significativement associée à une augmentation de l’incidence des leucémies chez les travailleurs (OR=1,03) (Kubale et al., 2005). Concernant également l’exposition aux solvants, aucun lien n’a pu être établi entre le risque de carcinomes épidermoïdes de la tête et du cou chez les femmes (296 cas) et l’exposition au TCC évaluée à partir des matrices emplois-expositions (OR de 0,36, IC 95 % 0,09-1,55) dans une étude française comprenant également 775 témoins (Carton et al., 2017).
Dans une cohorte chez des travailleurs finlandais exposés au TCC et à d’autres produits chimiques, aucune augmentation de l’incidence des cancers n’a été observée. Toutefois, la durée d’observation de cette cohorte (15,7 ans) est probablement trop courte pour mettre en évidence un éventuel effet sur la survenue de cancers (Kauppinen et al., 2003).
Expositions environnementales
Dans une cohorte de 112 378 enseignantes exposées uniquement via l’environnement, une augmentation significative du risque de cancers du sein diagnostiqué chez 5 676 d’entre-elles a été associée au TCC mesuré dans l’air ambiant (différence entre le 5e et le 1er quintile) (mesure des concentrations atmosphériques en lien avec l’adresse des participantes) (RR de 1,08, IC à 95 % (1,00-1,18) (Garcia et al., 2015).
Synthèse
Chez l’homme, d’après les études épidémiologiques chez les travailleurs, le TCC semble induire une augmentation de l’incidence des cancers totaux (poumons, œsophage, leucémies, lymphomes, myélomes), mais le fait que l’exposition est fréquemment concomitante à d’autres solvants chlorés amène à considérer ces résultats avec précaution.
Chez l'animal
Inhalation
Une étude a évalué les effets du TCC chez les souris et les rats (JBRC, 1998 ; Nagano et al., 2007a). Chez la souris, l’inhalation de TCC (de pureté supérieure à 99 %) aux concentrations de 0, 5, 25 ou 125 ppm (0, 32, 157 ou 787 mg.m-3), 6 h/j 5 j/7, pendant 104 semaines induit une augmentation significative de l’incidence des adénomes et/ou des carcinomes hépatocellulaires pour les concentrations de 25 et 125 ppm (157 et 787 mg.m-3), aussi bien chez les mâles que chez les femelles, de même que l’incidence d’adénomes à la plus faible dose testée de 5 ppm (32 mg.m-3) chez les femelles uniquement (JBRC, 1998 ; Nagano et al., 2007a). De plus, une augmentation de l’incidence des phéochromocytomes (tumeurs bénignes des glandes surrénales) est mise en évidence chez les mâles exposés aux concentrations de 25 et 125 ppm (157 ou 787 mg.m-3) et chez les femelles exposées aux concentrations de 125 ppm (787 mg.m‑3). Chez le rat, l’inhalation de TCC selon un protocole expérimental rigoureusement identique induit une incidence significative des adénomes et des carcinomes hépatocellulaires chez les rats exposés à la plus forte concentration (125 ppm (787 mg.m-3)). Le tableau 1 ci-après présente l’incidence des tumeurs observées chez les souris et les rats.
Incidences des tumeurs (JBRC, 1998 ; Nagano et al., 2007a)
|
Espèce, sexe |
Type de tumeurs |
Concentration (ppm) |
Incidence des tumeurs |
|---|---|---|---|
|
Souris, mâles |
Adénomes hépatocellulaires |
0 5 25 125 |
9/50 10/50 27/50** 16/50 |
|
Carcinomes hépatocellulaires |
0 5 25 125 |
17/50 12/50 44/50** 47/50** |
|
|
Phéochromocytomes des glandes surrénales |
0 5 25 125 |
0/50 0/50 16/50** 31/50** |
|
|
Souris, femelles |
Adénomes hépatocellulaires |
0 5 25 125 |
2/50 8/49* 17/50** 5/49 |
|
Carcinomes hépatocellulaires |
0 5 25 125 |
2/50 1/49 33/50** 48/49** |
|
|
Phéochromocytomes des glandes surrénales |
0 5 25 125 |
0/50 0/49 0/50 22/49** |
|
|
Rats, mâles |
Adénomes hépatocellulaires |
0 5 25 125 |
0/50 1/50 1/50 21/50** |
|
Carcinomes hépatocellulaires |
0 5 25 125 |
1/50 0/50 0/50 32/50** |
|
|
Rats, femelles |
Adénomes hépatocellulaires |
0 5 25 125 |
0/50 0/50 0/50 40/50** |
|
Carcinomes hépatocellulaires |
0 5 25 125 |
0/50 0/50 3/50 15/50** |
** p<0,01
Voie orale
Dans une étude de courte durée d’exposition avec un protocole non standardisé, des souris sont exposées par voie orale au TCC administré en solution dans de l’huile d’olive aux doses de 0,16 - 0,32 - 0,64 - 1,28 ou 2,5 g.kg-1 pc (30 fois une exposition tous les 1 à 5 jours selon les lots, pour une durée maximum d’exposition de 5 mois) (Eschenbrenner et Miller, 1944). Une augmentation significative des hépatomes est observée chez les souris exposées au moins à la dose de 0,16 g.kg-1 pc sur une période d’au moins 3 mois. Ces effets ne sont pas retrouvés à la plus forte dose pour une exposition d’un mois. Aucun hépatome n’est observé pour une exposition à la dose de 2,5 g.kg-1 pc sur une période de 30 jours.
Dans une autre étude de protocole non standardisé, des souris mâles et femelles ont été exposées par voie orale au TCC à des concentrations de 260 et 2 100 mg.kg-1, 2 à 3 fois par semaine pendant 4 mois (Edwards et al., 1942). Cette étude a montré une augmentation significative de l’incidence des tumeurs hépatiques (71 %) chez les souris mâles et femelles exposés à 2 100 mg.kg-1.
Le TCC en solution dans l’huile de maïs, utilisé comme témoin positif dans une étude de cancérogénèse du NCI sur 2 solvants chlorés, a été administré à des souris et des rats (NCI, 1976a, 1976b ; Weisburger, 1977).Les souris ont été exposées par gavage aux doses de 1 250 et 2 500 mg.kg-1 5j/7, pendant 78 semaines. En fin d’étude (90 semaines), la quasi-totalité des souris traitées (98 %) ont développé un carcinome hépatocellulaire. De même, un carcinome hépatocellulaire a été rapporté chez 80 % et plus de 94 % des animaux exposés respectivement à 1 250 et 2 500 mg.kg-1 morts prématurément, ce taux étant de 30 % dans le groupe témoin. Les rats sont exposés aux doses de 47 et 94 mg.kg-1 pc chez le mâle et de 80 et 160 mg.kg-1 pc chez la femelle, 5 j/7 pendant 78 semaines. Une faible augmentation des carcinomes hépatocellulaires est rapportée chez les mâles et les femelles (2/50 aux 2 doses chez les mâles, 4/49 pour la faible dose et 1/49 pour la forte dose chez les femelles). La présence de nodules hépatiques néoplasiques est observée chez les mâles et les femelles (2/50 pour la faible dose et 1/50 pour la forte dose chez les mâles, 2/49 pour la faible dose et 3/49 pour la forte dose chez les femelles).
Chez le rat, l’administration par voie orale à 2,6 à 510 mg.kg-1 pc une fois par semaine pendant 30 semaines induit la survenue de carcinomes hépato-cellulaires (Frezza et al., 1994).
Voie cutanée
Aucune donnée n’a été identifiée par voie cutanée.
Synthèse
Chez l’animal, le TCC induit une augmentation de l’incidence d’apparition des adénomes et carcinomes hépatocellulaires (rat/souris) ou encore de phéochromocytomes chez la souris uniquement.
Effets génotoxiques
Chez l'homme
Toutes voies
Aucune donnée in vivo n’a été identifiée.
Chez l'animal
Voie orale
Les tests in vivo chez l’animal exposé par voie orale au TCC suggèrent qu’un effet génotoxique est probable mais uniquement à des doses entrainant une hépatotoxicité.
Chez des rats et des souris exposés par voie orale, aucune augmentation de la fréquence des aberrations chromosomiques, des échanges de chromatides sœurs, ou des micronoyaux dans le foie (pour le rat) et dans la moelle osseuse (pour la souris) n’a été observée (Sawada et al., 1991 ; Suzuki et al., 1997).
Plusieurs études rapportent des résultats négatifs dans le foie pour la synthèse non programmée d’ADN (Mirsalis et Butterworth, 1980 ; Mirsalis et al., 1982). Dans un test des comètes, 24 heures après exposition, une forte dose unique de TCC entraîne des cassures d’ADN dans le foie chez la souris (Sasaki et al., 1998). Ces effets sont observés uniquement à partir de 24 heures après l’exposition. Chez le rat, les mêmes effets sont observés pour une faible dose (Bermudez et al., 1982 ; Kadiiska et al., 2005).
Une augmentation des adduits endogènes à l’ADN (malondialdehydes-ADN) liés à la peroxydation lipidique est observée dans le foie et le rein d’hamsters ainsi que dans le foie de rats exposés à du TCC (Chaudhary et al., 1994 ; Wang et Liehr, 1995 ; Chung et al., 2000 ; Wacker et al., 2001).
In vitro
Organismes procaryotes
Les tests in vitro de génotoxicité (avec et sans activation) effectués sur des bactéries sont généralement négatifs pour Salmonella typhimurium (Araki et al., 2004 ; Nakamura et al., 1987 ; Roldan-Arjona et al., 1991). Cependant, une augmentation de la fréquence des mutations est observée à certaines doses sans qu’il n’y ait de relation dose-réponse (Varma et al., 1988) et sur certaines souches pour des doses de 10 000 ppm (Araki et al., 2004). Pour les essais utilisant Escherichia coli, une majorité de résultats sont négatifs (Brams et al., 1987 ; Hellmer et Bolcsfoldi, 1992). Des résultats positifs (recombinaison inter-chromosomique, mutation réverse) sont observés pour Saccharomyces cerevisae mais uniquement à des doses cytotoxiques (Brennan et Schiestl, 1998 ; Galli et Schiestl, 1996).
Organismes eucaryotes
Plusieurs tests in vitro ont été réalisés sur cellules humaines. Des résultats négatifs sur des lymphocytes humains ont été observés dans des essais d’aberrations chromosomiques ou d’échanges de chromatides sœurs (Garry et al., 1990). Dans l’essai du micronoyau dans des cellules lymphoblastoïdes humaines, des résultats négatifs sont observés pour une lignée ayant une faible activité CYP1A1 mais positives pour les lignées avec une forte activité des CYP2E1, CYP1A2, CYP2A6 ou CYP3A4 (Doherty et al., 1996).
Aucun effet clastogène n’est observé dans des lymphocytes humains (Beddowes et al., 2003). Aucune augmentation de la synthèse non programmée d’ADN n’a également été observée dans des lymphocytes humains exposés au TCC (sans activation). Avec activation, de faibles résultats positifs sont observés dans des lymphocytes humains pour des concentrations induisant une cytotoxicité (Perocco et Prodi, 1981 ; Selden et al., 1994).
Les résultats des tests in vitro sur les cellules de mammifères sont cohérents avec ceux observés in vivo. Des résultats négatifs ont été observés sur des hépatocytes de rats, et des cellules ovariennes de hamsters dans des essais d’aberrations chromosomiques (Dean et Hodson-Walker, 1979 ; Loveday et al., 1990 ; Sivikova et al., 2001) ou d’échanges de chromatides sœurs (Loveday et al., 1990). Dans des hépatocytes de rats traités par le TCC, on a pu détecter une augmentation dose-dépendante des adduits malondialdéhyde-désoxyguanosine, de même qu’une hausse des adduits 8-oxo-désoxyguanosine à la plus forte dose, qui était aussi cytotoxique (Beddowes et al., 2003). Dans cette même étude, les adduits de type 3-(2-désoxy-βd-érythro-pentofuranosyl)-pyrimido [1,2-a] purin-10(3H)-one (=M1dG) ont également été mesurés alors que ceux-ci sont formés secondairement à la lipopéroxydation. En effet, il a été démontré que M1dG est l’adduit à l'ADN le plus abondant formé à partir du malondialdéhyde, lui-même produit de la péroxydation lipidique. M1dG est mutagène pour les cellules de mammifères (Wauchope et al, 2015).
Une augmentation des cassures d’ADN simple brin est observée dans des hépatocytes de rats exposés à des concentrations cytotoxiques de TCC (Beddowes et al., 2003). Aucune augmentation de la synthèse non programmée d’ADN n’a été observée dans des hépatocytes de rat exposés au TCC (sans activation).
L’examen critique de l'ensemble des données amène à la conclusion que le TCC n’agit probablement pas selon un mode d’action génotoxique direct et que les dommages oxydatifs à l'ADN sont plutôt indirects/secondaires aux phénomènes de lipopéroxydation. La peroxydation des lipides peut être induite par le radical trichlorométhyle et conduire à la destruction des acides gras polyinsaturés, particulièrement les phospholipides, avec une perte de l’intégrité membranaire au niveau des mitochondries, du réticulum endoplasmique et des membranes plasmatiques (Weber et coll., 2003). La peroxydation des lipides provoque aussi la formation d’aldéhydes réactifs tels que le 4-hydroxynonénal et le malondialdéhyde, qui peuvent se lier aux protéines et à l’ADN (Weber et coll., 2003). Le mode d’action de la cancérogénèse hépatique n’est pas encore bien établi. L’hypothèse du métabolisme par le CYP2E1 en un radical trichlorométhyle et autres espèces réactives de l’oxygène (ROS) dont les produits de la peroxydation lipidique conduisent à une cytotoxicité soutenue et d’une prolifération par régénération cellulaire est proposée comme mode d’action (ANSES, 2017). Dans ces conditions, l’Anses conclu à un mécanisme génotoxique indirect correspondant à un cancérogène à seuil de dose. L’US EPA souligne toutefois que cette approche mécanistique n’est pas nécessairement adaptée à d’autres types tumoraux, comme en particulier aux tumeurs cérébrales chez l’humain ou des glandes surrénales chez la souris (US EPA, 2020). A ce stade des connaissances, l’Ineris retient l’hypothèse d’un mécanisme d’action génotoxique indirect, notamment justifié par les résultats globalement négatifs aux tests de mutations géniques in vitro et in vivo, et aux tests de mutations chromosomiques in vivo et s’oriente vers un mécanisme à seuil.
Synthèse
L’ensemble des tests suggère que les effets génotoxiques n’apparaissent qu’aux doses et concentrations induisant une toxicité hépatique. Les effets génotoxiques observés résulteraient de la cytotoxicité, liée notamment aux dommages oxydatifs secondaires/indirects aux phénomènes de lipopéroxydation. Le TCC n’est donc pas considéré comme génotoxique.
Effets sur la reproduction
Chez l'homme
Toutes voies
À notre connaissance, il n’existe pas de données disponibles chez l’homme.
Chez l'animal
Inhalation
Les effets de l’exposition au TTC par inhalation sont décrits dans 2 anciennes études peu exploitables. La première rapporte chez le rat une atrophie testiculaire chez 6 et 2 des 15 mâles ayant respectivement survécu au traitement de 200 ppm et 400 ppm (1 260 et 2 520 mg.m-3) de TCC pendant 6 mois (7 h/j, 5 j7) (Adams et al., 1952).
Dans la seconde étude (non consultable) sur plusieurs générations, des groupes de rats mâles et femelles ont été exposés par inhalation à des doses de 50, 100, 200 ou 400 ppm 315, 630, 1 260, 2 520 mg.m-3mg.m-3) de TCC 8 h/j, 5 j/7, pendant environ 10 mois (Smyth et al., 1936 ; Santé Canada, 2010). Seule une baisse de la fertilité est rapportée aux 2 plus fortes doses de 200 et 400 ppm.
Voie orale
Par voie orale, des rats ont été traités pendant 10 semaines à une dose de 0,25 ml.kg-1 (7 animaux représentant le groupe témoin positif) de TCC (Sömnez et al., 2014 ; Yüce et al., 2014). Une baisse significative du poids absolu et relatif des testicules (p<0,01), des épididymes (p<0,001), des vésicules séminales (p<0,05) et de la prostate (p<0,05) est rapportée. Les tissus testiculaires ont également révélé une augmentation de la concentration en malondialdéhyde (p<0,001), témoin de la peroxydation lipidique et une baisse de l’activité des enzymes anti-oxydantes (glutathion peroxydase, catalase p<0,001). Les analyses de sperme ont également montré une baisse de motilité et de la quantité de spermatozoïdes (p<0,001), de même que l’augmentation d’anomalies du sperme (tête, queue) par comparaison au groupe témoin. Les coupes histologiques ont révélé une nécrose, une dégénérescence, une desquamation, une désorganisation et une réduction des cellules germinales, une atrophie des tubules, un épaississement de la membrane basale, un œdème interstitiel et un arrêt de la spermatogénèse dans le groupe traité au TCC. De plus, ces effets ne sont pas retrouvés chez des animaux co-exposés à la quercétine, composé capable de prévenir la peroxydation des lipides en piégeant les radicaux.
Voies non usuelles
La toxicité testiculaire du TCC a également été documentée à partir d’études, parfois anciennes, réalisées par voie intra-péritonéale. L’administration de 2 378 mg.kg-1 pc TCC dans l’huile de noix de coco a conduit, 15 jours après l’injection, à une augmentation pondérale de la glande pituitaire et une diminution pondérale des testicules et des glandes séminales. L’examen histologique a montré une atrophie testiculaire et des anomalies de la spermatogenèse (Chatterjee, 1966). Depuis, les travaux étudiant les effets de traitements antioxydants sur la toxicité testiculaire du TCC administré par des voies non usuelles (intra-péritonéale, sous-cutanée) chez le rat ont largement été documentés (Elsawy et al., 2019 ; Shah et al., 2017 ; Abdel et al., 2016 ; Al-Olayan et al., 2014 ; Rafiec et al., 2016 ; Kamal et al., 2013).
Les seules données chez la femelle sont issues d’une étude chez le rat réalisée par voie intra-péritonéale (2 378 mg.kg-1 pc). Les effets sur l’appareil reproducteur des femelles observés 10 jours après l’injection se sont traduits par une modification du rythme œstral, une baisse du poids et de vascularisation des ovaires et de l’utérus, ainsi que par une augmentation du poids de la glande surrénale et d’une diminution de la gonadotrophine pituitaire (Chatterjee, 1968).
Synthèse
Chez l’animal, le TCC induit par voie orale chez les mâles une atrophie testiculaire, des anomalies de la spermatogenèse et chez les femelles par voie intrapéritonéale des modifications du cycle œstral ainsi que des anomalies de vascularisation des ovaires et de l’utérus. Par inhalation, une atrophie testiculaire a été observée à des doses ayant entrainé une forte mortalité chez les mâles.
Effets sur le développement
Chez l'homme
Toutes voies
Dans une étude ayant recherché les effets de l’exposition aux produits chimiques au cours de la grossesse sur le poids de naissance des bébés pour l’âge gestationnel, aucun effet significatif n’a été retrouvé chez les 3 418 femmes sur 3 946 qui avaient été exposées au TCC quand elles étaient enceintes (86,6 %) (OR de 1,2 ; IC à 95 % : 0,6-2,7 et de 2,4 ; IC à 95 % : 0,2-25, respectivement pour les groupes faiblement et modérément exposés (Seidler et al., 1999)).
Dans une étude américaine (Los Angeles) ayant recensé 75 cas de neuroblastomes chez l’enfant et comprenant 14 602 témoins, les auteurs ont mis en évidence un risque significatif chez les mères exposées au cours de la grossesse au TCC (OR de 2,65, IC à 95 % 1,07-6,53) (Heck et al., 2013). Les expositions ont été déterminées dans un rayon de 5 km du lieu de vie des sujets de l’étude à partir des mesures pour la surveillance de la qualité de l’air.
Chez l'animal
Inhalation
Lors de l’exposition par inhalation de rates à des concentrations de 300 ou 1 000 ppm (1 917 ou 6 390 mg.m-3), 7 heures par jour du 6e au 15e jour de la gestation, une diminution dose-dépendante de la consommation de nourriture et du poids corporel est observée chez les mères (p<0,05), de même qu’une toxicité hépatique identifiée à partir des dosages sanguins d’ALAT (p<0,05) et de l’augmentation du poids relatif du foie (p<0,05) (Schwetz et al., 1974). Le traitement n’a pas eu d’effet significatif sur le nombre de résorptions (résorption totale d’une portée à la plus forte dose), le nombre de fœtus par portée, mais a entraîné une diminution significative du poids des fœtus et de la longueur vertex-coccyx[1] aux 2 doses (p<0,05). L’examen des fœtus a permis d’observer des œdèmes sous-cutanés chez les fœtus des mères exposées à la plus faible dose (300 ppm) (p<0,05) ainsi qu’une augmentation statistiquement significative des anomalies du sternum (bipartite et retard d’ossification) pour la plus forte dose (1 000 ppm) (p<0,05) et de toutes anomalies du squelette confondues à 300 ppm (p<0,05).
[1] Cranio-caudale
Voie orale
Des rates gestantes sont exposées par voie orale à 0 - 112,5 - 150 mg.kg-1.j-1 de TCC entre les 6 et 19e jour de gestation. Aucune rate n’est morte durant l’étude mais une réduction du poids corporel a été observée. Des résorptions totales des portées sont observées aux 2 concentrations (44 % pour 112,5 mg.kg-1.j-1 et 71 % pour 150 mg.kg‑1.j-1) (Narotsky et Kavlock, 1995).
L’administration par gavage de rats femelles du 6e au 15e jour de la gestation aux doses de 0, 25, 50 ou 75 mg.kg-1.j-1 de TCC en solution dans l’huile de maïs ou dans une solution aqueuse contenant 10 % d’Emulphor®[1] induit une toxicité chez la mère à la dose la plus élevée (75 mg.kg-1.j-1) (Narotsky et al., 1997). Une résorption complète de la portée est observée pour l’exposition à 50 ou 75 mg.kg-1.j-1 (42 % et 67 %). Aucune toxicité maternelle ni pour le développement n’a été rapportée à la dose de 25 mg.kg-1.j-1.
Une étude réalisée chez la souris exposée par voie orale par gavage aux concentrations de 82,6 ou 826 mg.kg-1 de poids corporel de TCC en solution dans l’huile de maïs, pendant 5 jours consécutifs, à partir du 1er, 6ème ou 11ème jour de la gestation, n’a montré d’effet ni chez la mère ni sur les différents paramètres de l’analyse néonatale (poids corporel, taille) ou de malformations post-partum (Hamlin et al., 1993) chez les petits.
[1] Emulsifiant anionique (éthers sulfates de masse moléculaire élevée) qui permet d’obtenir des propriétés recherchées telles que la taille de particules ou la stabilité des émulsions.
Synthèse
Chez l’animal, le TCC induit des effets fœtotoxiques (diminution de la taille et du poids corporel des fœtus, anomalies du sternum et retards d’ossification) pour une exposition par inhalation ou par voie orale mais uniquement en présence d’une toxicité maternelle.
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation
L’OEHHA a établi un REL de 0,3 ppm (1,9 mg.m-3) pour une exposition aiguë d’une heure par inhalation au TCC (OEHHA, 2008).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez des rates gestantes exposées du 6 au 15ème jour de gestation, 7 h/j, à des concentrations de 300 et 1 000 ppm (1 917 et 6 390 mg.m-3) (Schwetz et al., 1974). Une LOAEC de 300 ppm est définie et correspond à un retard de croissance fœtale (diminution de la longueur vertex-coccyx et du poids corporel).
Facteur d’incertitude : un facteur de 1 000 est appliqué (10 pour la variabilité inter-espèce, 10 pour tenir compte des différences de sensibilité de la population et 10 pour l’utilisation d’une LOAEC).
Calcul : 300 ppm x 1/1 000 = 0,3 ppm (1,9 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice.
Effets à seuil - Exposition sub-chronique par inhalation
L’ATSDR a établi un MRL de 0,03 ppm (0,19 mg.m-3) pour une exposition sub-chronique par inhalation au TCC (2005).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez des rats exposés pendant 173-205 jours, 7 h/j, 5 j7, pendant 6 à 7 mois, à des concentrations de 5 – 10 – 25 – 50 – 100 – 200 - 400 ppm (32 – 64 – 160 – 320 – 640 - 1 278 - 2 556 mg.m-3) (Adams et al., 1952). Une NOAEC de 5 ppm (32 mg.m-3) est définie, ainsi qu’une LOAEC de 10 ppm (64 mg.m-3) pour les effets hépatiques (augmentation du poids du foie, des lipides et du cholestérol estérifié).
Un ajustement pour une durée d’exposition continue (5 j/7, 7 h/j) est réalisé. L’extrapolation à l’homme a été réalisé à partir de la valeur 1 du rapport des coefficients de partage sang/gaz chez le rat et l’homme, retenue par défaut :
NOAEC Adj HEC = 5 ppm x 5 j/7 j x 7 h/24 h = 1,04 ppm.
Facteur d’incertitude : un facteur de 30 est appliqué (10 pour tenir compte des différences de sensibilité de la population et 3 pour l’extrapolation de l’animal à l’homme).
Calcul : 1,04 ppm x 1/30 = 0,03 ppm (0,19 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition chronique par inhalation
L’ANSES a établi une VTR de 0,0184 ppm (0,11 mg.m-3) pour une exposition chronique par inhalation (ANSES, 2017).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez le rat et la souris exposés pendant 104 semaines, 6 h/j, 5 j/7, à des concentrations de 5 - 25 - 125 ppm (32 – 160 - 799 mg.m-3) (Nagano et al., 2007a). L’effet critique retenu est l’augmentation de l’incidence des adénomes et carcinomes hépatiques chez la souris qui survient dès 5 ppm (32 mg.m-3). Une concentration d’exposition a été modélisée à l’aide du logiciel BMDS de l’US EPA pour cet effet. Une BMD de 4,2 ppm a été déterminée ainsi qu’une BMDL95% de 2,6 ppm.
Un ajustement pour une durée d’exposition continue (5 j/7, 6 h/j) est réalisé : 2,6 ppm x 5 j/7 j x 6 h/24 h = 0,46 ppm (2,91 mg.m-3).
Un ajustement allométrique a été réalisée, le TCC étant considéré comme un gaz à action systémique et les coefficients de partage sang/air pour l’homme et la souris n’étant pas connus, une valeur par défaut de 1 a été retenue (US EPA, 1994).
Facteurs d’incertitude : un facteur de 25 est utilisé (2,5 pour l’extrapolation de l’animal à l’homme et 10 pour tenir compte des différences de sensibilité de la population ).
Calcul : 2,91 mg.m-3 x 1/25 = 0,1164 mg.m-3, arrondi à 0,11 mg.m-3 (0,0184 ppm)
Indice de confiance : moyen /fort (Fort pour la nature et la qualité des données, l’étude source, la dose critique, et moyen pour le choix de l’effet critique et le mode d’action).
Effets à seuil - Exposition aiguë par voie orale
L’ATSDR a établi un MRL de 0,02 mg.kg-1.j-1 pour une exposition aiguë par voie orale au TCC (2005).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez les rats mâles exposés pendant 10 jours par gavage à des concentrations de 5 – 10 – 20 – 40 – 80 - 160 mg.kg-1.j-1 (Smialowicz et al., 1991). Un LOAEL de 5 mg.kg-1.j-1 est défini pour une dégénérescence vacuolaire des cellules hépatiques.
Facteurs d’incertitude : un facteur de 300 est utilisé (10 pour tenir compte des différences de sensibilité de la population, 10 pour l’extrapolation de l’animal à l’homme et 3 pour l’utilisation d’un LOAEL).
Calcul : 5 mg.kg-1.j-1 x 1/300 = 0,02 mg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice.
Effets à seuil - Exposition sub-chronique par voie orale
L’ATSDR a établi un MRL de 0,007 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale au TCC (2005).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez les rats exposés pendant 12 semaines (5 jours par semaine) par gavage à des concentrations de 1 – 10 – 33 mg.kg-1.j-1 (Bruckner et al., 1986). Un NOAEL de 1 mg.kg-1.j-1 a été déterminé pour les effets hépatiques (vacuolisation centrolobulaire et augmentation des activités de SDH sérique). Un ajustement pour une durée d’exposition continue (5 j/7) est réalisé :
1 mg.kg-1.j-1 x 5 j/7 j = 0,71 mg.kg-1.j-1.
Facteurs d’incertitude : un facteur de 100 est utilisé (10 pour tenir compte des différences de sensibilité de la population et 10 pour l’extrapolation de l’animal à l’homme).
Calcul : 0,71 mg.kg-1.j-1 x 1/100 = 0,007 mg.kg-1.j-1
Effets à seuil - Exposition chronique par voie orale
L’US EPA a établi une RfD de 0,004 mg.kg-1.j-1 pour exposition chronique par voie orale au TCC (2010).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez les rats exposés pendant 12 semaines (5 j/7) par gavage à des concentrations de 1 – 10 - 33 mg.kg-1.j-1 (Bruckner et al., 1986). L’effet critique retenu est l’augmentation de l’activité de la SDH sérique.
Une BMD 7,32 mg.kg-1.j-1 et une BMDL de 5,46 mg.kg-1.j-1 ont été déterminées. Un ajustement pour une durée d’exposition continue (5 j/7) est réalisé à partir de la BMDL : 5,46 mg.kg-1.j-1 x 5 j/7 j = 3,9 mg.kg-1.j-1.
Facteurs d’incertitude : un facteur de 1 000 est utilisé (10 pour tenir compte des différences de sensibilité de la population, 10 pour l’extrapolation de l’animal à l’homme, 3 pour l’extrapolation des effets sub-chroniques aux effets chroniques et 3 pour l’absence d’étude de reprotoxicité sur plusieurs générations).
Calcul : 3,9 mg.kg-1.j-1 x 1/1 000 = 0,004 mg.kg-1.j-1
Indice de confiance : moyen tant pour la qualité de l’étude source, la complétude de la base de données ainsi que la VTR élaborée.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation
L’Ineris propose de retenir la valeur de 1,9 mg.m-3 pour une exposition aiguë au TCC par inhalation (OEHHA, 2008).
L’OEHHA (2008) propose une valeur pour une exposition aiguë de 1 heure par inhalation basée sur une étude sur le développement. L’effet critique, à savoir un retard de croissance intra-utérin est cohérent avec le profil toxicologique du TCC. Toutefois, dans cette étude, l’exposition réalisée entre les 6 et 15e jours de gestation ne couvre qu’une partie de l’exposition fœtale. De plus, la toxicité maternelle observée aux 2 doses testées ne permet pas d’attribuer avec certitude les effets sur la croissance des fœtus à l’exposition in utero du TCC. Enfin, le choix de ce type d’étude pour une brève exposition d’une heure n’est pas recommandé. Néanmoins, le choix des facteurs d’incertitudes est cohérent. Compte-tenu des limites relatives à qualité de l’étude, la valeur est retenue par défaut.
Indice de confiance : par défaut (en raison de la qualité de l’étude).
Effets à seuil - Exposition sub-chronique par inhalation
L’Ineris propose de retenir la valeur de 0,19 mg.m-3 pour une exposition sub-chronique au TCC par inhalation (ATSDR, 2005).
L’ATSDR (2005) propose une VTR pour une exposition sub-chronique par inhalation à partir d’une étude sub-chronique de 173-205 jours. Si l’effet critique retenu, une toxicité hépatique, est pertinent au regard du profil toxicologique de la substance, la qualité de l’étude présente des limites importantes. Les données que très partiellement rapportées dans cette étude ne permettent pas d’évaluer la pertinence de la NOAEC retenue par les auteurs. Cette valeur est la seule disponible, elle est retenue par défaut.
Indice de confiance : par défaut (en raison de la qualité de l’étude).
Effets à seuil - Exposition chronique par inhalation
L’Anses retient la valeur de 0,0184 ppm (0,11 mg.m-3) pour une exposition chronique au TCC par inhalation de l’ANSES (ANSES, 2017).
Cinq organismes proposent une valeur pour une exposition chronique au TCC par inhalation (ANSES, 2017, ATSDR, 2005; US EPA, 2010 ; OEHHA, 2003 ; RIVM, 2001).
La valeur établie par le RIVM (2001) est une valeur dont la construction n’est pas transparente quant à l’étude utilisée et au choix des facteurs d’incertitude. Cette valeur n’est pas retenue.
L’OEHHA (2003) propose une VTR basée sur une étude expérimentale (Adams et al., 1952) vraisemblablement la même étude que celle utilisée par le RIVM et dont la qualité fait défaut (données partielles des résultats et mortalité de la quasi-totalité des animaux exposés à la plus forte dose). Cette valeur n’est pas retenue.
L’ATSDR (2005), l’US EPA (2010) et l’Anses (2017) proposent une VTR établie à partir de la même étude de toxicité chronique de 104 semaines chez le rat et la souris (Nagano, 2007a), réalisée suivant les lignes directrices de l’OCDE et conduite selon les bonnes pratiques de laboratoire. Cette étude est de bonne qualité.
L’ATSDR (2005) et l’US EPA (2010) retiennent le même effet critique, à savoir la stéatose hépatique, cohérent avec le profil toxicologique du TCC, le foie étant l’organe cible identifié chez le rat pour des expositions par inhalation. La VTR a été déterminée à partir d’une NOAEC pour l’ATSDR alors que l’US EPA utilise une modélisation et calcule une « benchmark dose » qui permet de prendre en compte l’intégralité de la relation dose-réponse. Concernant le choix des facteurs d’incertitude, les 2 organismes prennent un facteur 30 (3 x 10) pour l’extrapolation intra et inter-espèces mais l’application est inversée. L’US EPA ajoute un facteur d’incertitude supplémentaire pertinent prenant en compte l’absence d’étude de reprotoxicité sur plusieurs générations.
L’ANSES (2017) propose une VTR établie à partir de la même étude que l’ATSDR et l’US EPA mais retient comme effet critique les effets cancérogènes chez la souris. Ce choix est motivé par l’hypothèse d’un mécanisme de cancérogenèse à seuil de dose et l’absence de pathologies non cancérogènes décrits dans cette étude. En effet, le TCC n’agissant très probablement pas selon un mode d’action génotoxique direct, les dommages oxydatifs à l'ADN sont plutôt indirects/secondaires aux phénomènes de lipopéroxydation. Le TCC est donc une substance cancérogène à seuil. Une BMD est déterminée pour les effets cancérogènes hépatiques. Un ajustement temporel et un ajustement allométrique ont été retenus. Par conséquent, la valeur de l’ANSES permet de prendre en compte les effets cancérogènes à seuil. Cette approche est retenue par l’Ineris.
Indice de confiance : L’Anses accorde un indice de confiance moyen-fort dans sa valeur.
Effets à seuil - Exposition aiguë par voie orale
L’Ineris propose de retenir pour une exposition aiguë au TCC par voie orale la VTR aiguë de 0,02 mg.kg-1.j-1 de l’ATSDR (2005).
L’ATSDR (2005) propose une valeur pour une exposition aiguë par voie orale à partir d’une étude de qualité moyenne chez les rats où seuls des mâles ont été exposés pendant 10 jours. L’effet critique retenu, une dégénérescence vacuolaire des cellules hépatiques, est cohérent avec le profil toxicologique de la substance. Cette valeur est la seule disponible pour une exposition aiguë et sa construction est satisfaisante, elle est donc retenue.
Indice de confiance : moyen (en raison du choix de l’étude, de l’effet critique et de la construction de la valeur).
Effets à seuil - Exposition sub-chronique par voie orale
L’Ineris propose de retenir la valeur de 0,007 mg.kg-1.j-1 pour une exposition subchronique au TCC par voie orale (ATSDR, 2005).
L’ATSDR (2005) propose une valeur pour une exposition sub-chronique par voie orale à partir d’une étude de bonne qualité réalisée chez les rats exposés pendant 12 semaines. Le choix de l’effet critique est pertinent au regard du profil de toxicité de la substance. Cette valeur est la seule disponible pour une exposition sub-chronique et sa construction est satisfaisante, elle est donc retenue.
Indice de confiance : élevé (en raison du choix de l’étude, de l’effet critique et de la construction de la valeur).
Effets à seuil - Exposition chronique par voie orale
L’Ineris propose de retenir pour une exposition chronique au TCC par voie orale la VTR chronique de 0,004 mg.kg-1.j-1 de US EPA (2010).
Les valeurs établies par l’OMS (2011), le RIVM (2001), l’US EPA (2010) et Santé Canada (2021) ont été déterminées à partir de la même étude sub-chronique de Bruckner et al. (1986). Bien que la durée d’exposition de 12 semaines soit un peu courte pour dériver une VTR chronique, cette pratique est acceptée, la qualité de l’étude est satisfaisante. Tous les organismes ont retenu la toxicité hépatique comme effet critique, cohérent avec le profil toxicologique du TCC.
L’OMS, le RIVM et Santé Canada proposent des VTR établies à partir d’un NOAEL, alors que pour l’US EPA, elle est établie à partir d’une « benchmark-dose » ce qui permet de prendre en compte l’intégralité de la relation dose-réponse.
Un facteur d’incertitude est utilisé par l’US EPA (3), l’OMS (10), le RIVM (3) permettant l’extrapolation à des durées d’exposition chronique a été utilisé. L’US EPA prend également en compte un facteur d’incertitude supplémentaire pertinent pour l’absence d’étude de reprotoxicité sur plusieurs générations.
Par conséquent, au vu de ces observations, la valeur de l’US EPA semble la plus pertinente, elle est donc retenue
Indice de confiance : moyen (en raison de la durée de l’étude).
Effets sans seuil - Exposition chronique par inhalation
L’Anses propose de ne pas retenir de valeur pour une exposition chronique au TCC par inhalation pour des effets sans seuil (Anses, 2017).
Trois organismes ont établi des valeurs pour une exposition chronique au TCC par inhalation pour des effets sans seuil (l’US EPA, 2010 , Santé Canada, 2021 et l’OEHHA, 2011). En l’état actuel des données, les résultats des études de génotoxicité semblent écarter l’hypothèse d’un mécanisme génotoxique direct, ce qui laisse présager l’existence d’un seuil de dose pour les effets cancérogènes. Pour des expositions par inhalation, l’Anses a construit une VTR chronique à seuil basée sur des effets cancérogènes (tumeurs hépatiques) mis en évidence à partir d’une étude de cancérogénèse chez le rat (Nagano et al., 2007).
Cette valeur, couvrant de fait les effets cancérogènes, l’Ineris retient l’approche de l’Anses ce qui conduit à ne retenir aucune des valeurs existantes pour les effets sans seuil.
Effets sans seuil - Exposition chronique par voie orale
L’Ineris propose de ne pas retenir de valeur pour une exposition chronique au TCC par voie orale.
Deux organismes ont établi des valeurs pour une exposition chronique au TCC par voie orale pour des effets sans seuil (l’US EPA, 2010 et l’OEHHA, 2011). La valeur de l’US EPA a été construite à partir d’une extrapolation voie à voie. L’INERIS n’ayant pas retenu la valeur par inhalation, celle par extrapolation voie à voie est de fait non retenue. L’OEHHA construit une valeur sans seuil alors qu’en l’état actuel des données, les résultats des études de génotoxicité semblent écarter l’hypothèse d’un mécanisme génotoxique direct, ce qui laisse présager l’existence d’un seuil de dose pour les effets cancérogènes.
La construction de la valeur à partir d’un mécanisme d’effet sans seuil par l’OEHHA n’est donc pas retenue.
Autres valeurs des organismes reconnus
Description
Effets à seuil - Exposition chronique par inhalation
L’ATSDR a établi un MRL de 0,03 ppm (0,19 mg.m-3) pour une exposition chronique par inhalation au TCC (2005).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez le rat et la souris exposés pendant 104 semaines, 6 h/j, 5 j/7, à des concentrations de 5 – 25 - 125 ppm (32 – 160 - 799 mg.m-3) (JBRC, 1998 ; Nagano et al., 2007a). Une NOAEC de 5 ppm (32 mg.m-3) est définie, ainsi qu’une LOAEC de 25 ppm (160 mg.m-3) pour les effets hépatiques telles qu’une augmentation du poids du foie, des enzymes sériques et des modifications histopathologiques du foie (stéatose, dépôts de céroïdes, fibrose,) chez le rat. Un ajustement pour une durée d’exposition continue (5 j/7, 6 h/j) est réalisé : 5 ppm x 5 j/7 j x 6 h/24 h = 0,89 ppm arrondi à 0,9 ppm. Un facteur de 1 a été retenu par défaut (rapport des coefficients de partage sang/gaz chez le rat et l’humain) pour l’extrapolation des données à l’homme.
Facteurs d’incertitude : un facteur de 30 est utilisé (10 pour tenir compte des différences de sensibilité de la population et 3 pour l’extrapolation de l’animal à l’homme).
Calcul : 0,9 ppm x 1/30 = 0,03 ppm (0,19 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice.
L’US EPA a établi une RfC de 0,015 ppm (0,1 mg.m-3) pour une exposition chronique par inhalation au TCC (2010).
Cette valeur est établie à partir de la même étude expérimentale réalisée chez le rat et la souris exposés pendant 104 semaines, 6 h/j, 5 j/7, à des concentrations de 5 – 25 - 125 ppm (32 – 160 - 799 mg.m-3) (JBRC, 1998 ; Nagano et al., 2007a). L’effet critique retenu est l’atteinte hépatique (stéatose du foie) chez les rats.
A partir des données issues de ces 2 études, une BMC10%L95% de 14,3 mg.m-3 (2,24 ppm), après modélisation avec un modèle PBPK humain, a été déterminée chez les rats mâles (valeur plus protectrice que chez les femelles).
Facteur d’incertitudes : un facteur de 100 est utilisé (10 pour tenir compte des différences de sensibilité de la population, 3 pour l’extrapolation de l’animal à l’homme et 3 pour l’absence d’étude de reprotoxicité sur plusieurs générations).
Calcul : 14,3 mg.m-3 x 1/100 = 0,1 mg.m-3 (0,015 ppm)
Indice de confiance : haut pour la qualité de l’étude source, et moyen pour la complétude de la base de données et la VTR élaborée.
L’OEHHA a établi une REL de 0,006 ppm (0,04 mg.m-3) pour une exposition chronique par inhalation au TCC (OEHHA, 2003).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez les cobayes pendant
7,3 mois, 7 h/j, 5 j/7, à des concentrations de 5 – 10 – 25 – 50 – 100 – 200 - 400 ppm (32 – 64 – 160 – 320 – 640 - 1 278 - 2 556 mg.m-3) (Adams et al., 1952). Une LOAEC de 5 ppm (32 mg.m-3) a été déterminée pour les effets hépatiques (augmentation du poids du foie, des lipides et du cholestérol estérifié). Un ajustement pour une durée d’exposition continue (5 jours par semaine, 7 heures par jour) est réalisé : 5 ppm x 5 j/7 j x 7 h/24 h = 1,04 ppm (6,6 mg.m-3), ce qui correspond à une concentration équivalente chez l'homme de 1,7 ppm (10,9 mg.m-3) en appliquant un ratio de 1,7 (Gargas et al., 1989).
Facteur d’incertitude : un facteur de 300 est utilisé (3 pour la variabilité inter-espèce, 10 pour tenir compte des différences de sensibilité de la population, 3 pour l’utilisation d’une LOAEC et 3 pour l’extrapolation des effets sub-chroniques aux effets chroniques).
Calcul : 1,7 ppm x 1/300 = 0,006 ppm (0,04 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice.
Le RIVM a établi une TCA de 0,009 ppm (0,06 mg.m-3) pour une exposition chronique par inhalation au TCC ((Baars et al., 2001).
Cette valeur est établie à partir d’une étude expérimentale (source non précisée mais correspondant à l’étude d’Adams et al. (1952)) réalisée chez des rats exposés pendant 200 jours, 5 j/7, 7 h/j ). Une NOAEC de 31 mg.m-3 (5 ppm) a été déterminée pour les effets hépatiques. Un ajustement pour une durée d’exposition continue (5 j/7, 7 h/j) est réalisé : 31 mg.m-3 x 5 j/7 j x 7 h/24 h = 6,46 mg.m-3.
Facteur d’incertitude : un facteur de 100 est utilisé (10 pour la variabilité inter-espèce et 10 pour tenir compte des différences de sensibilité de la population).
Calcul : 6,46 mg.m-3 x 1/100 = 0,06 mg.m-3 (0,009 ppm)
Indice de confiance : élevé pour la VTR élaborée
Effets à seuil - Exposition chronique par voie orale
L’OMS a établi une DJT de 0,0014 mg.kg-1.j-1 pour une exposition chronique par voie orale au TCC (2017).
Cette valeur a été établie à partir de l’étude expérimentale de Bruckner et al. (1986), décrite précédemment. Un NOAEL de 1 mg.kg-1.j-1 est défini pour les effets hépatiques. Un ajustement pour une durée d’exposition continue (5 jours par semaine) est réalisé :
1 mg.kg-1.j-1 x 5 j/7 j = 0,71 mg.kg-1.j-1.
Facteurs d’incertitude : un facteur de 500 est appliqué (100 pour tenir compte des variations intra-espèces et inter-espèces, 10 pour tenir compte de la durée de l’étude et un facteur additionnel de 0,5 car il s’agit d’une « bolus study »).
Calcul : 0,71 mg.kg-1.j-1 x 1/500 = 0,0014 mg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice.
Le RIVM a établi une TDI de 0,004 mg.kg-1.j-1 pour une exposition chronique par voie orale au TCC (Baars et al., 2001).
Cette valeur a été établie à partir d’une étude réalisée chez les rats exposés pendant 12 semaines (5 jours par semaine) par gavage (Bruckner et al., 1986). Le RIVM considère que la dose de
10 mg.kg-1.j-1 peut être considérée comme un LOAEL pour les effets hépatiques et que la dose de
1 mg.kg-1.j-1 est un NOAEL.
Facteurs d’incertitude : un facteur de 300 est appliqué (10 pour tenir compte des différences de sensibilité de la population, 10 pour l’extrapolation de l’animal à l’homme et 3 pour l'extrapolation aux durées chroniques).
Calcul : 1 mg.kg-1.j-1 x 1/300 = 0,004 mg.kg-1.j-1
Indice de confiance : élevé pour la VTR élaborée
Santé Canada a établi une DJT de 0,00071 mg.kg-1.j-1 pour exposition chronique par voie orale au TCC (2021).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez les rats exposés pendant 12 semaines (bolus 5 jours par semaine) par gavage à des concentrations de 0 ‑ 1 – 10 – 33 mg.kg-1.j-1 (Bruckner et al., 1986). L’effet critique retenu est une hépatoxicité (augmentation des activités sériques de SDH et une vacuolisation centrolobulaire légère du foie). Un NOAEL de 1 mg.kg-1.j-1 a été retenu pour les effets hépatotoxiques. Un ajustement du NOAEL pour une exposition hebdomadaire continue a été réalisé :
NOAELadj = 1 mg.kg-1.j-1 x 5j/7 = 0,71 mg.kg-1.j-1
Facteurs d’incertitude : un facteur de 1 000 est utilisé (10 pour tenir compte des différences de sensibilité de la population, 10 pour l’extrapolation de l’animal à l’homme, 10 pour les lacunes dans la base de données, y compris l’absence d’études chroniques adéquates et le mode d’action cancérogène chez l’animal).
Calcul : 0,71 mg.kg-1.j-1 x 1/1 000 = 0,00071 mg.kg-1.j-1
Indice de confiance :cet organisme ne propose pas d’indice.
Effets sans seuil - Exposition chronique par inhalation
L’US EPA a établi un ERUi de 6.10-6 (µg.m-3)-1 pour une exposition par inhalation (2010).
Cette valeur est issue d’une étude de cancérogenèse chez les rats et les souris exposés par inhalation pendant 104 semaines (6 heures par jour, 5 jours par semaine) à des concentrations de
5 – 25 - 125 ppm (32 – 160 - 799 mg.m-3). Au cours de cette étude, une augmentation de l'incidence des tumeurs hépatiques (carcinomes et adénomes hépatocellulaires) a été observée chez le rat et la souris, ainsi qu’une augmentation des phéochromocytomes chez la souris (JBRC, 1998 ; Nagano et al., 2007a). Les données ont été traitées à l’aide d’un modèle multi-étape avec extrapolation linéaire.
Santé Canada a établi un ERUi de 6.10-6 (µg.m-3)-1 pour une exposition par inhalation (2021).
Cette valeur est directement issue de celle construite par l’US EPA en 2010, avec les mêmes études clés retenues et traitements des données.
L'OEHHA a établi un ERUi de 4,2.10-5 (µg.m-3)-1 pour une exposition par inhalation (2011).
Cette valeur a été établie à partir d’une étude de cancérogenèse chez les souris exposés pendant
4 mois (2 à 3 fois par semaine) par voie orale à des concentrations de 260 et 2 100 mg.kg-1, au cours de laquelle une augmentation de l’incidence des tumeurs hépatiques a été observée (Edwards et al., 1942). Les données ont été traitées à l’aide d’un modèle multi-étape avec extrapolation linéaire et une extrapolation voie à voie a été réalisée avec ajustement allométrique.
Effets sans seuil - Exposition chronique par voie orale
L’US EPA a établi un ERUo de 7.10-2 (mg.kg-1.j-1)-1 pour une exposition par voie orale (2010).
Cette valeur a été établie à partir de celle déterminée pour une exposition par inhalation, une extrapolation voie à voie a été réalisée par modélisation PBPK.
L’OEHHA a établi un Slope factor de 1,5.10-1 (mg.kg-1.j-1)-1 pour une exposition par voie orale (2011).
Cette valeur a été établie à partir d’une étude de cancérogenèse chez les souris exposés pendant
4 mois (2 à 3 fois par semaine) par voie orale à des concentrations de 260 et 2 100 mg.kg-1, au cours de laquelle une augmentation de l’incidence des tumeurs hépatiques a été observée (Edwards et al., 1942).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 21/07/2025
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 56-23-5 |
|---|---|
| SANDRE | 1276 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Protocole de MontréalLe Tétrachlorure de Carbone a été identifié en tant que substance responsable de la destruction de la couche d'ozone stratosphérique, et il a été décidé dans le cadre du Protocole de Montréal de très fortement restreindre ses usages. Ces dispositions ont été reprises par la réglementation européenne (cf. Directives européennes.). Directives européennesLa Directive 76/464/CEE du 4 mai 1976 relative à la pollution causée par certaines substances dangereuses rejetées dans l'environnement aquatique concerne le tétrachlorure de carbone (substance listée en liste I de cette directive). A travers différentes actions réglementaires, ce texte incite les Etats membres à prendre les mesures appropriées pour éliminer la pollution des eaux (eaux intérieures de surface, eaux de mer territoriales, eaux intérieures du littoral et eaux souterraines) par certaines substances dangereuses. Le règlement (CE) N°2077/2004 de la Commission du 3 décembre 2004 modifiant le règlement (CE) no 2037/2000 du Parlement européen et du Conseil concernant l'utilisation d'agents de fabrication précise que les utilisations autorisées pour le TCC sont celles en tant qu'agent de fabrication dans les procédés suivants :
Textes françaisLe décret n°89-112 du 21 février 1989 (paru au journal officiel du 23 février 1989) relatif aux substances qui appauvrissent la couche d'ozone transcrit dans le droit français le protocole de Montréal signé le 16 septembre 1987. Ce texte impose une réduction de la production de TCC en 1995 de 85 % par rapport aux niveaux calculés en 1989 (amendement de Londres de 1990), puisque appartenant au groupe IV des substances réglementées pour son potentiel d'appauvrissement de la couche d'ozone. De plus, ce décret précise qu'au 1er janvier 1996, la production de cette substance devait être abandonnée selon l'amendement de Copenhague de 1992. Selon l'arrêté du 7 août 1997 (paru au JO du 17 août 1997), les substances et préparations destinées à la vente au grand public ou pour des applications conduisant à une diffusion (tel le nettoyage de surface ou de tissus) ne doivent pas contenir une concentration supérieure ou égale à 0,1 % en poids à l'exception des utilisations industrielles. Le décret n°2001-1052 du 5 novembre 2001 (paru au journal officiel du 13 novembre 2001) transcrit dans le droit français les décisions prises par la commission OSPAR sur les plafonds d'émission et de rejets liés à la fabrication de chlorure de vinyle monomère (CVM). En effet, le TCC fait partie des hydrocarbures chlorés utilisés lors de sa fabrication. Les émissions d'hydrocarbures chlorés ne doivent pas dépasser 0,7 g de TCC par tonne de CVM produite. Le tétrachlorure de carbone est également visé par :
Ces textes indiquent que la présence de TCC dans l'air est à surveiller lors de la fabrication de chaussures, de médicaments, de papiers et de cartons. Toute la réglementation sur les COV (Composés Organiques Volatils) est également à prendre en compte pour le tétrachlorure de carbone. La concentration limite dans les rejets dans l'air des composés organiques par les entreprises est de 20 mg.m-3 pour un flux horaire de composés organiques supérieur à 0,1 kg.h-1 selon l'arrêté du 2 février 1998 modifié par l'arrêté du 29 mai 2000 paru au journal officiel du 13 août 2000 (transcription en droit français la directive européenne du 11 mars 1999 « 1999/13/CE »). Le TCC fait partie des 18 substances de la liste 1 du décret n°2005-378 du 20 avril 2005 (paru au journal officiel du 23 avril 2005) relatif au programme national d'action contre la pollution des milieux aquatiques par certaines substances dangereuses. L'arrêté du 20 Avril 2005 fixe les valeurs limites des rejets de tétrachlorure de carbone dans les eaux continentales de surface, les eaux d'estuaires et de mers territoriales à 12 µg.L-1 . [1] Arrête ministériel qui fixe les prescriptions générales applicables aux installations soumises à déclaration Autres textesLa concentration limite est de 4 µg.L-1 pour l'eau de consommation selon l'OMS (INERIS, 2005a). |
| Classification CLP | Voir la classification CLP |
| Informations complémentaires |
Dérivé du méthane, ce solvant chloré s'apparente aux solvants tels que le chloroforme et le dichlorométhane. Stable à température ambiante, il se décompose à partir de 400°C en acide chlorhydrique, anhydride carbonique et phosgène (COCl2). Sa solubilité est maximale dans les solvants organiques tels que le chloroforme et l’éthanol, dans l’eau elle est de 0,8 g.L-1 . Fortement réactif, le contact du TCC avec les métaux légers et les alliages de fer et de cuivre peut causer une explosion (INRS, 1997a ; site internet de l’académie de Nancy-Metz). Le tétrachlorure de carbone est un COV (INERIS, 2005a). |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Sites de production et quantités produites
D'après les données du Programme des Nations Unies pour l'Environnement de 2002, la production européenne de CFC2 , de tétrachlorure de carbone, de trichloroéthane et de halons (hydrocarbures halogénés) a sensiblement diminué entre 1989 et 1999. La vente et la consommation suivent une évolution similaire. Ainsi, la production de tétrachlorure de carbone, des CFC et de trichloroéthane en Europe occidentale est passée d'environ 440 000 tonnes en 1989 à 100 000 tonnes en 1999 (Conseil économique et social des Nation Unies, 2002). Malgré l'interdiction de son utilisation et de sa production au sein de l'Union Européenne depuis 1994, le TCC est encore produit par certaines entreprises en Europe ayant des dérogations (la liste de ces dérogations est remise à jour annuellement).
D'autre part, selon la décision n°2003/316/CE du 28 mars 2003 (parue au journal officiel n°L 115 du 9 mai 2003), la quantité de tétrachlorure de carbone autorisée pour des utilisations essentielles en laboratoire (ceux-ci sont cités dans cette décision) en 2003 s'élevait à 134 tonnes pondérées PACO3 (à l'échelle européenne).
L'importation en 2004 dans la communauté s'élevait à 9 621 tonnes pondérées PACO selon la décision de la commission n°2004/176/CE du 20 janvier 2004 alors qu'en 2006 cette quantité s'élevait à plus de 12 000 tonnes PACO selon la décision de la commission n°2006/373/CE du 11 mai 2006. Les quotas d'importation de 2006 pour usage en tant que produit intermédiaire ne sont fournis qu'à des entreprises hors de France.
Un site SOLVAY Electrolyse en France en Franche-Comté dispose d'une autorisation de fabrication de TCC pour une capacité maximale de 70 t.j-1 . Le TCC est utilisé sur ce site comme intermédiaire de synthèse pour la production de pentachlorobutane, lui-même intermédiaire pour la synthèse de pentafluorobutane et d'hydrofluoroethane, utilisés respectivement comme agent d'expansion de mousse polyuréthanne et fluide réfrigérant. Le TCC utilisé par ce site est en fait synthétisé « involontairement », comme résultat de la pyrolyse de composés indésirables produits lors de la synthèse de chlorométhanes (DRIRE Franche-Comté, communication personnelle).
[2] Les chlorofluorocarbones appartiennent à la famille chimique des haloalcanes. Ces substances servent principalement dans les applications liées à l'industrie du froid. Néanmoins, on rencontre également des usages dans l'industrie des nettoyants industriels et des mousses isolantes.
[3] Potentiel d'Appauvrissement de la Couche d'Ozone.
Place de la substance dans l'économie française
Sauf dérogation, la production de tétrachlorure de carbone est interdite au sein de l'Union Européenne depuis 1995 (Conseil économique et social des Nation Unies, 2002).
Procédés de production
Selon le site internet de la Société Française de Chimie (SFC), le tétrachlorure de carbone fabriqué industriellement s'obtient majoritairement de trois façons (cf. figure 2.1 ci-après) :
- par chloration du méthane :
La chloration du méthane se fait à haute température (480°C en moyenne) et à haute pression (10 à 12 bars), on obtient un mélange de différents chlorométhanes et du chlorure d'hydrogène. Ce dernier est dissout dans l'eau, le tétrachlorométhane est alors séparé par distillation (site internet SFC).
- par chloration du méthanol :
A partir du méthanol, en ajoutant de l'acide chlorhydrique en excès, les conditions d'obtention sont moins drastiques, la température et la pression sont moins élevées que pour le procédé précédent (site internet SFC).
Ces deux premières voies de synthèse sont aussi celles qui permettent d'obtenir les autres chlorométhanes. Aujourd'hui, le tétrachlorure de méthane est plutôt considéré comme un
sous-produit indésirable de la synthèse des autres chlorométhanes ; des sites de production l'éliminent par incinération (site internet Arkema).
- lors de la synthèse de perchloréthylène.
Lors de la synthèse de perchloréthylène, le tétrachlorométhane est obtenu par chloration d'hydrocarbures de 1 à 3 carbones ou de leurs dérivés chlorés (site internet SFC).
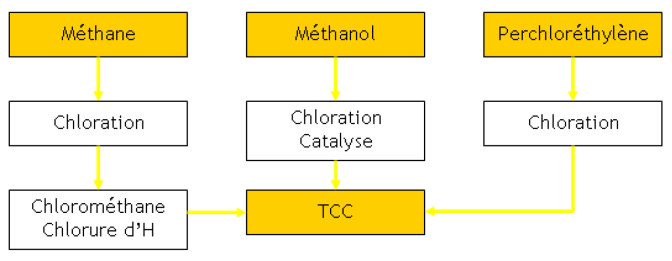
Figure 2.1. Voies de synthèse du TCC (d'après le site internet de la SFC).
Utilisations
FTE 2005 Importer
En France, en 2005, le tétrachlorure de carbone était majoritairement utilisé dans le secteur de la fabrication de produits chimiques organiques de base et représente une consommation de 10 000 tonnes. Il intervient également dans la synthèse d'analgésiques. En raison des atteintes possibles à la couche d'ozone, les utilisations industrielles du tétrachlorure de carbone sont limitées à celles figurant dans le paragraphe "Réglementations". (INRS, 2006).
Certains des industriels contactés ont mentionné une utilisation marginale réservée à leurs ventes de TCC : une utilisation en tant que consommable pour la spectroscopie UV. Pour ce faire, la substance est purifiée à plus de 99 % pour obtenir une transparence optique utile en spectroscopie. On citera pour exemple son utilisation par des laboratoires environnementaux dans la recherche de micropolluants en spectroscopie UV. Le prix de tels solvants peut atteindre plus de 500 € le litre.
Rejets dans l’environnement
Sources non-intentionelles
FTE 2005 Importer
Le TCC peut être, en fonction des gammes de température du procédé, un sous-produit indésirable lors de la récupération sous forme HCl du Chlore dégagé par la fabrication de silicates par procédé de pyrogénation. (Commission Européenne, 2006)
Le TCC peut être un sous produit de la synthèse du tétrachloroéthylène par chloration du propylène.
Le TCC peut être présent en tant qu'impureté dans certains solvants (tri et tetrachloroéthylène à hauteur de 0,005 % maximum).
Rejets dans l'environnement
FTE 2005 Importer
La présence de tétrachlorure de carbone dans l'environnement est d'origine anthropique (site internet Environnement Canada). Actuellement en France, le TCC est essentiellement (95% des rejets) rejeté par les industries du secteur chimique et parachimique (Direction de la prévention des pollutions et des risques et Direction de l'eau, 2006). Vient ensuite le secteur du traitement des textiles.
Le TCC dans l'environnement peut aussi provenir de la dégradation dans le milieu naturel d'autres composés organohalogénés, comme par exemple le tétrachloroéthylène.
En France, entre 2003 et 2005 des traces de tétrachlorure de carbone ont été retrouvées dans les eaux de rejet de certaines installations industrielles, répertoriées selon les secteurs d'activité suivants : métallurgie, stations d'épuration urbaines, fabrication de pigments, colorants, plastiques, chimie et parachimie, traitement des textiles, traitement des cuirs et peaux, papeterie, industrie agroalimentaire (végétale).
Description des rejets
Les principaux rejets de tétrachlorure de carbone sont liés à sa production et son utilisation comme intermédiaire de réaction ou solvant. Certains sites de rejets directs dans l'eau sont répertoriés dans le registre français des émissions polluantes (site internet iREP).
Selon le registre français des émissions polluantes (site internet iREP édité par le Ministère de l'Ecologie et du Développement Durable) 24 sources industrielles d'émission de tétrachlorure de carbone sont répertoriées en France métropolitaine en 2005 (figure 3.1.).
Figure 3.1. Cartographie des entreprises émettrices de TCC en France (d'après les données du site internet de l'iREP).
Les quantités de tétrachlorure de carbone déclarées émises dans l'eau, dans l'air et sous forme de déchets pour chaque entreprise sont répertoriées dans le tableau 3.1. Les quantités sont données en kg.an-1 avec l'année pour laquelle elles ont été déclarées. Les émissions dans l'eau sont dites directes car elles sont effectuées directement dans le milieu naturel (site internet iREP).
Tableau 3.1. Quantités de TCC émises en France (site internet iREP) ; données en kg.an-1
Dans la période 2003 / 2005, parmi les industries ayant déclaré des émissions de tétrachlorure de carbone,GIE Spiral est l'entreprise ayant émis la plus grande quantité de TCC avec 73 kg pour l'année 2004 directement dans l'eau. Durant cette même période, l'entreprise Arkema a déclaré la plus importante émission de TCC dans l'air avec 15 000 kg en 2005. L'entreprise Chloralp a déclaré la plus forte émission de TCC sous forme de déchets avec 174 000 kg en 2005. Une entreprise du secteur agroalimentaire rejette des emballages contenant des résidus de tétrachlorure de carbone ou contaminés par des résidus de cette substance.
Mis à part l'évacuation des déchets, ces données illustrent le fait que les rejets directs dans l'environnement se font majoritairement dans l'air.
Evolution des rejets
Le site internet eurochlor illustre l'évolution depuis 1985 des rejets dans l'eau et dans l'air de TCC. Depuis 1985, la réduction des rejets dans l'air est proche de 100 % (cf. figure 3.2). De plus, d'autres réductions de plusieurs dizaines de pourcents sont annoncées pour 2010 (sur la base des données de 2001)
Figure 3.2. Evolution des rejets dans l'eau et dans l'air de tétrachlorure de carbone au niveau europeen (d'après le site internet eurochlor).
Plus généralement pour l'ensemble des COV, le CITEPA (centre interprofessionnel technique d'études de la pollution atmosphérique), estime qu'en 2002, les émissions totales atmosphériques de COV (Composés Organiques volatils) en France étaient de l'ordre de 1,6 millions de tonnes. Les émissions connaissent une décroissance régulière depuis 10 ans, de 3 à 4 % par an.
La France s'est engagée sur le plan international, dans le cadre du protocole de Göteborg de 1999, à réduire ses émissions de COV d'environ 40 % entre 1999 et 2010 (site internet CITEPA).
Pollutions historiques et accidentelles
FTE 2005 Importer
En 1970, l'accident d'un camion contenant du tétrachlorure de carbone, à Benfeld (Bas Rhin), provoqua la libération de 6 tonnes de TCC qui a infiltré la nappe phréatique (site internet Institut de physique du globe de Paris).
En 1987, dans le Jura, une pollution des eaux souterraines par des produits organochlorés et notamment du tétrachlorure de carbone a été décelée. Cette pollution était liée à une mauvaise étanchéité d'une alvéole de stockage de résidus de produits organiques (site internet de la DRIRE).
Mis à part quelques cas isolés4 , il n'existe pas de grandes pollutions historiques liées au tétrachlorure de carbone en France.
[4] Par exemple, une pollution à Epernay par épandage du contenu d'un nombre indéterminé d'extincteurs fabriqués avant 1960 sur le sol d'un appentis et probablement dans une fosse septique voisine a entraîné une importante pollution du sol ainsi que des pavillons attenants par le bromure de méthyle et le tétrachlorure de carbone (site internet du Ministère en charge de la Santé).
Perspectives de réduction
Réduction des rejets
Techniques d'élimination
FTE 2005 Importer
L'incinération est utilisée par ARKEMA pour éliminer le TCC produit lors de la synthèse des chlorométhanes. (Site Internet ARKEMA).
Dans le domaine de la recherche, certains nanomatériaux (metalloporphyrinogènes) sont testés pour leur capacité à dégrader le TCC et d'autres composés.
Sur le Site SOLVAY producteur de TCC, les rejets dans l'eau sont très faibles. Pour les rejets atmosphériques, les principaux moyens de réduction des rejets consistent à fiabiliser les installations de traitement (oxydation des dégazages) qui sont déjà en place.
Alternatives aux usages
FTE 2005 Importer
Usage domestique et industriel
Il existe plusieurs substituts du TCC qui le remplacent d'ores et déjà. Ces solvants sont le trichloroéthane, le dichlorométhane et le chloroforme. L'INERIS a publié des fiches toxicologiques et des fiches de données technico-économiques pour certaines de ces substances.
Le trichloroéthane (substance ayant également fait l'objet de la rédaction d'une fiche technico-économique) se substitue au TCC pour son usage dans les produits de nettoyage, les dégraissages et les adhésifs (site internet IFEN).
Le dichlorométhane (substance ayant également fait l'objet de la rédaction d'une fiche technico-économique) est aussi utilisé comme substitut dans l'industrie pharmaceutique et en laboratoire.
Quant à lui, le chloroforme est surtout utilisé comme substitut pour la préparation de médicaments, de pesticides et d'arômes (site internet Société Française de Chimie).
Caractéristiques du trichloroéthane
Le trichloroéthane est un liquide incolore, très volatil, d'odeur éthérée, pratiquement insoluble dans l'eau, mais miscible à la plupart des solvants organiques (INRS, 1997b). Il existe une fiche de données technico-économiques de l'INERIS pour chacun des isomères 1,1,1trichloroéthane et 1,1,2-trichloroéthane.
Caractéristiques du dichlorométhane
Le dichlorométhane est un liquide incolore, très volatil, d'odeur éthérée, peu soluble dans l'eau mais miscible dans la plupart des solvants organiques. Il est ininflammable et inexplosible dans des conditions normales d'utilisations. Cependant, des propriétés mutagène et cancérogène sont suspectées. Lors de sa décomposition, des fumées toxiques sont émises (INRS, 1997c). Cette substance est classée comme prioritaire dans la directive cadre sur l'eau. Son utilisation est en baisse régulière depuis la fin des années 1990 (INERIS, 2005b).
Caractéristiques du chloroforme
Le chloroforme est un liquide incolore, considéré comme substance toxique et irritante. Des effets cancérigènes sont suspectés. Cette substance fait partie des substances prioritaires dans le domaine de l'eau d'après la directive n° 2000/60/CE du Parlement européen (site
internet AIDA). Il existe une fiche toxicologique et une fiche de données technico-économiques publiées par INERIS pour cette substance.
Coûts de la substitution
Aucune donnée ne nous permet de connaître l'impact économique des mesures de réduction de l'utilisation du tétrachlorure de carbone en France. Les prix du TCC et de ses produits de substitution varient beaucoup selon la pureté recherchée.
Conclusion
FTE 2005 Importer
Le tétrachlorure de carbone est un solvant organochloré très volatil et peu soluble dans l'eau. Du fait de son importante vaporisation à partir des sols et de l'eau, le TCC est principalement présent sous forme de gaz dans l'atmosphère et contribue à l'appauvrissement de la couche d'ozone. Grâce à une prise de conscience politique des dangers des substances chlorées sur la couche d'ozone, des mesures de réduction de la production et de l'utilisation du TCC sont actuellement en vigueur.
En Europe, la production et l'utilisation de TCC sont interdites depuis 1994, son exportation est interdite depuis 2000. Néanmoins, des dérogations subsistent quant à certaines utilisations, notamment comme solvant en spectroscopie. Malgré une baisse notable des activités liées au TCC, il subsiste des émissions en France dans les eaux et dans l'air de l'ordre de quelques tonnes par an. Plusieurs tonnes de déchets contenant du TCC (solvants, emballages souillés, etc…) sont également cependant produites chaque année.
Il existe différentes techniques de traitements de l'eau et des rejets gazeux. Trois solvants remplacent d'ores et déjà le TCC à cause de ses effets néfastes sur la couche d'ozone : le chloroforme, le dichlorométhane et le trichloroéthane. Mais ces solvants ont eux-mêmes des effets néfastes sur la santé humaine et tendraient à disparaître. Les informations recueillies au cours de cette étude ne nous permettent pas de connaître les surcoûts éventuels liés à la mise en œuvre des techniques de dépollution.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

