Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Benzène (71-43-2)
Informations générales
Dernière vérification le 02/06/2025
Identification
Numero CAS
71-43-2
Nom scientifique (FR)
Benzène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
200-753-7
Code SANDRE
1114
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C6H6 }\)
Code InChlKey
Code SMILES
c1ccccc1
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H225 |
|---|---|
| Mention du danger - Texte | Liquide et vapeurs très inflammables |
| Classe(s) de dangers | Liquides inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H315 |
|---|---|
| Mention du danger - Texte | Provoque une irritation cutanée |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Mention du danger - Code | H319 |
|---|---|
| Mention du danger - Texte | Provoque une sévère irritation des yeux |
| Classe(s) de dangers | Lésions oculaires graves/irritation oculaire |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H304 |
|---|---|
| Mention du danger - Texte | Peut être mortel en cas d'ingestion et de pénétration dans les voies respiratoires |
| Classe(s) de dangers | Danger par aspiration |
| Libellé UE du danger | - |
| Mention du danger - Code | H340 |
|---|---|
| Mention du danger - Texte | Peut induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Mention du danger - Code | H372 |
|---|---|
| Mention du danger - Texte | Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organs cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
78.11 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 21/07/2025
Matrices
Atmosphère
Dans l’atmosphère, le benzène existe sous forme gazeuse. Il est principalement dégradé en réagissant avec les radicaux hydroxyles formés par réaction photochimique.
Milieu eau douce
A partir des eaux superficielles, le benzène se volatilise rapidement. Le benzène étant relativement soluble, une partie du benzène présent dans l’atmosphère est déposé sur le sol ou dans les eaux par précipitation.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Dans les sols, le benzène est mobile. De par sa pression de vapeur et sa solubilité élevées, le benzène se volatilise à partir de la surface du sol, il est entraîné vers les eaux superficielles par ruissellement et vers les eaux souterraines par lixiviation.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
De nombreux essais de biodégradation en aérobie sont disponibles pour le benzène, qui montrent une grande variabilité de résultats. Les résultats d’essais suivants sont rapportés par (CE, 2001).
- Dégradation facile :
- 39 - 41 % de dégradation après 14 jours (méthode OCDE 301C),
- 81 - 100 % de dégradation à la fin de la fenêtre des 10 jours lors de deux essais (méthode OCDE 301F),
- 4 - 88 % de dégradation ont été déterminés dans 6 laboratoires (méthode OCDE 301D),
- 29 % de dégradation après 20 jours lors d’un essai à l’aide de boues domestiques. Cependant, le même essai ayant été répété avec des boues acclimatées, 80 % de dégradation ont été observés après 20 jours.
- Biodégradabilité inhérente : 90 % de dégradation après 6 jours (méthode OCDE 302B).
- Essai de simulation : 42 %, 22 % et 10 % de dégradation ont été observés après 20 jours respectivement avec l’eau d’une rivière, l’eau souterraine et de l’eau d’un port. Des demi-vies de 28 et 16 jours en eau de rivière et eau souterraines ont ainsi pu être estimées.
L’ensemble de ces essais montre que la substance peut être considérée comme facilement dégradable, une demi-vie de 15 jours dans l’eau pouvant être estimée d’après la méthode proposée par la (CE, 1996).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Hydrolyse
Il n’existe pas de données expérimentales sur l’hydrolyse du benzène. Cependant, l’hydrolyse du benzène est négligeable en raison de sa stabilité chimique.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau de mer
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Plusieurs résultats d'essais sont disponibles :
- pour les poissons : Leuciscus idus (exposition de 3 jours) BCF < 10 (Freitag et al., 1985),
- pour les mollusques : Tapes semidecussa (2-8 jours) BCF < 1 (Nunes et Benville, 1979).
La substance présente un faible potentiel de bioaccumulation.
Un BCF de 13 peut être estimé à partir du log Kow (2,13) en utilisant une relation de type structure-activité quantitative (CE, 1996). Cette valeur sera retenue préférentiellement.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Il existe des preuves de la contamination des plantes telles que le cresson et l’orge à partir du sol (Topp et al., 1989). Une part importante de la contamination des plantes pourrait être liée au transfert air-feuilles.
Aucun résultat d'essai valide permettant de déterminer des facteurs de bioconcentration du benzène dans les plantes n'a pu être trouvé dans la littérature.
Bibliographie
Toxicologie
Dernière vérification le 21/07/2025
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2007, 2015 ; CE, 2008 ; IARC, 1987, 2012, 2018 ; OMS IPCS, 1993 ; US EPA, 1998, 2002, 2007; INRS, 2019). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l'information scientifique mais n'ont généralement pas fait l'objet d'un nouvel examen critique par les rédacteurs de la rubrique.
Toxicocinétique
Chez l'homme
Absorption
Inhalation
La voie d’exposition principale pour le benzène est l’inhalation. Cinquante pour cent de la quantité inhalée sont absorbés par cette voie (Nomiyama et Nomiyama, 1974a ; Pekari et al., 1992). Pour des concentrations de 32 à 69 ppm (104 à 224 mg.m-3) dans la fumée de cigarette, l’absorption atteint 64 % (IARC, 2018).
Voie orale
Les rares données disponibles chez l’homme, pour des expositions par voie orale, issues d’ingestions accidentelles ou intentionnelles, montrent que l’absorption du benzène serait complète (Thienes et Haley, 1972; Arnold et al., 2013).
Voie cutanée
L’absorption cutanée est possible par diffusion passive de 0,4 mg.cm-2.h-1 mais demeure une source secondaire d’exposition (Franz, 1984). L’application directe de benzène sur la peau de volontaires sains (0,1 mL sur une surface de 25,8 cm2) conduit à un taux d’absorption de 0,07 et 0,13 %, respectivement au niveau des avant-bras et de la paume des mains (Modjtahedi et Maibach, 2008).
Distribution
Le benzène est rapidement distribué via le sang à l’ensemble de l’organisme. Du fait de sa grande lipophilie, les concentrations tissulaires seront plus élevées dans la moelle osseuse et dans les graisses (Winek et Collom, 1971). Des niveaux de benzène de 0,01 à 0,18 µg.kg-1 ont également été détectés dans le lait maternel (Fabietti et al., 2004), ainsi que dans le placenta et le sang du cordon ombilical chez de femmes exposées par inhalation (Arnold et al., 2013).
Métabolisme
La transformation métabolique du benzène est majoritairement hépatique, et médullaire mais aussi pulmonaire. Le métabolisme du benzène est complexe et semble qualitativement similaire chez l’homme et l’animal (Bernauer et al., 2000 ; Henderson et al., 1989 ; Sabourin et al., 1988 ; Snyder et Hedli, 1996). La quasi-totalité des métabolites a une structure cyclique.
Figure 1 : schéma simplifié des différentes voies métaboliques du benzène (d’après IARC, 2018)
La première étape, déterminante dans la toxicité du benzène, consiste en une oxydation catalysée principalement par le cytochrome P450 2E1 conduisant à la formation d’un benzène-époxyde (qui est en équilibre avec la forme oxépine) (Seaton et al., 1994). D’autres CYP450 peuvent également intervenir (IARC, 2018). Le benzène est par l’intermédiaire des CYP2E1 un inducteur de son propre métabolisme (Koop et al., 1990).
Dans une deuxième étape, trois voies métaboliques peuvent être empruntées par cet intermédiaire très électrophile :
- Réarrangement spontané non enzymatique du benzène–époxyde en phénol (Koop et al., 1989). Le phénol peut être hydroxylé en hydroxyquinone qui conduit à la production de p-benzoquinone ou de 1,2,4-trihydroxybenzène (Nebert et al., 2002). Le phénol peut aussi être hydroxylé en catéchol qui formera soit de la o-benzoquinone soit du 1,2,4-trihydroxybenzène (THB) (Nebert et al., 2002). Ce dernier composé apparaît chez l’homme principalement formé à partir de l’hydroquinone (Eastmond et al., 1987 ; Schlosser et Kalf, 1989 ; Smith et al., 1989). Tous ces métabolites subiront des réactions de phase II conduisant à leur excrétion sous forme de glucuro- et sulfo-conjugués, d’acide mercapturique, voire d’adduits à l’ADN (Hedli et al., 1996 ; Snyder et Hedli, 1996).
- Transformation du benzène-époxyde en benzène-dihydrodiol sous l’action d’une enzyme époxyde-hydrolase. Ce diol suit deux voies métaboliques : soit la réduction sous l’action d’une déshydrogénase formant le catéchol (qui suivra les transformations décrites ci-dessus), soit l’ouverture en trans du cycle formant un aldéhyde, la trans-muconaldéhyde. Cet aldéhyde est alors oxydé en acide trans, transmuconique éliminé dans les urines (demi-vie d’environ 6 heures) (Nebert et al., 2002 ; Ross, 2000 ; Witz et al., 1996).
- Conjugaison au glutathion catalysée par une glutathion-S-époxyde transférase en 1 glutathionyl 2-OH-3,5 cyclohexadiène puis en acide S-phénylmercapturique en milieu acide, qui s’élimine dans les urines (Nebert et al., 2002 ; Sabourin et al., 1988 ; Schafer et al., 1993 ; Schlosser et al., 1993 ; Schrenk et al., 1992 ; van Sittert et al., 1993).
Toutefois, d’autres cytochromes peuvent également être impliqués notamment les CYP2A13, CYP2B1 et CYP2F2, CYP2F1 (Gut et al., 1996a ; Gut et al., 1996b ; Powley et Carlson, 2000, 2001 ; Snyder et al., 1993a ; Snyder et al., 1993b)..
Des différences de susceptibilités génétiques peuvent moduler fortement la réponse de chaque individu (INSERM, 2001; Arnold et al., 2013). Ainsi, il a été montré que les individus présentant une toxicité hématologique au benzène avaient une activité CYP2E1 forte et une activité NAD(P)H quinone oxydoréductase (NQO1) faible (Manini et al., 2010 ; Rothman et al., 1997). De même, le polymorphisme des glutathion-S-transférases (GST-T1 et GST-M1), joue un rôle prépondérant sur la toxicité du benzène dans les populations déficientes (Wan et al., 2002).
Élimination
La majorité du benzène est éliminée sous forme de métabolites urinaires.
Le benzène est éliminé sous une forme inchangée dans les urines, 1 %, et dans l’air expiré, 10 à 50 %, selon l’activité physique et l’importance du tissu adipeux (Sherwood, 1988). La fraction expirée augmente avec l’exposition du fait d’une saturation des voies métaboliques.
Autre
Modèles PBPK / Mécanismes d’actions
Plusieurs modèles PBPK ont été développés pour le benzène (Bois et Paxman, 1992 ; Medinsky et al., 1989a ; Medinsky et al., 1989b ; Medinsky et al., 1989c ; Sato, 1988 ; Travis et al., 1990a ; Travis et al., 1990b; Brown et al., 1998; Yokley et al., 2006)). Chacun de ces modèles présente des avantages et permet de décrire l’absorption, le métabolisme et l’excrétion chez les souris, les rats et les humains. Cependant, l’utilité de ces modèles reste limitée pour prédire la dose de métabolites toxiques dans les organes cibles chez l’homme du fait d’une connaissance incomplète de l’ensemble des métabolites toxiques et des difficultés à identifier un modèle animal représentatif de l’homme. L’évaluation de ces différents modèles par Hays et al., (2012) a conduit à une validation du modèle de Brown (1998) pour ce qui est de l’estimation des concentrations sanguines de benzène, mais aucun modèle ne semble adapté pour prédire les métabolites urinaires du benzène (Arnold et al., 2013).
Malgré de nombreux travaux et des progrès récents, les mécanismes conduisant aux effets hématotoxiques du benzène demeurent non totalement élucidés (IARC, 2018 ; Arnold et al., 2013) . Toutefois, le rôle déterminant du métabolisme fait consensus. Si les responsabilités de l’époxybenzène et du trans-muconaldéhyde ont été initialement suspectés, les métabolites phénoliques du benzène, en particulier les métabolites quinoniques et/ou semi-quinoniques jouent un rôle majeur. Ces métabolites transportés du sang vers la moelle osseuse vont pouvoir agir directement par l’intermédiaire de plusieurs mécanismes ou être convertis en espèces réactives (comme la transformation d’hydroquinone en benzoquinones), notamment par la myélopéroxydase et d’autres enzymes. La faible activité de la quinone oxydoréductase NADPH-dépendante dans la moelle (NQO1), enzyme qui réduit (détoxifie) efficacement les quinones, pourrait expliquer en partie la toxicité hématologique du benzène. Plusieurs des mécanismes identifiés sont brièvement énumérés :
- Liaisons covalentes avec des macromolécules cellulaires : déplétion de la GSH, un antioxydant important et inhibition de l’ADN polymérase par les benzoquinones et benzène triol ;
- Production d’espèces réactives de l’oxygène par les benzoquinones et d’autres métabolites qui peuvent causer des lésions oxydatives de l’ADN et cassures de brins d’ADN ; la formation de ces espèces réactives oxygénées est favorisée par l’absence de SOD dans la moelle osseuse,;
- Inhibition de la synthèse d’ADN par les benzoquinones : inhibition de l’IL-2 qui est un facteur de la croissance cellulaire,
- Effet inhibiteur de de la topoisomérase II par certains métabolites : cette enzyme modifie la topologie de l’ADN et, au cours de son cycle catalytique, elle entraîne une coupure d’un brin de l’ADN. Si des molécules interfèrent avec cette activité, elles pourraient stabiliser cette coupure et conduire aux effets leucémogènes observés.
- Induction des cytochromes P450 2E1 par l’administration répétée de benzène, stimulant ainsi son propre métabolisme
Chez l'animal
Absorption
Inhalation
Par inhalation, la souris présente un taux d’absorption du benzène (20 %) plus élevé que le rat ou le singe (3-4 %) (Henderson, 1996).
Voie orale
Le benzène est facilement absorbé par voie orale chez les espèces animales. Chez le rat, la souris, le lapin et le hamster, plus de 97 % de la dose administrée par gavage (en présence de liquide huileux pour supprimer la volatilisation dans l’estomac) sont absorbés (Matthews et al., 1998 ; Parke et Williams, 1953 ; Sabourin et al., 1987). Compte tenu de ces données, l’absorption de solutions aqueuses est estimée de l’ordre de 100 % (US EPA, 2002).
Voie cutanée
Dans les différentes études pratiquées chez l’animal, l’absorption par voie cutanée est estimée inférieure à 1 % (Franz, 1983 ; Maibach et Anjo, 1981 ; Susten et al., 1985). Le coefficient d’absorption cutanée calculé est de 0,619 cm.h-1 (Tsuruta, 1989).
Distribution
Chez l’animal, le benzène se distribue principalement dans les tissus riches en lipides ou largement perfusés principalement les reins et le foie et dans une moindre mesure les glandes de Zymbal, les tissus des cavités nasale et orale, le cerveau, la rate et les glandes mammaires pour des expositions par inhalation (Ghantous et Danielsson, 1986 ; Rickert et al., 1979) et par voie orale (Low et al., 1989 ; Low et al., 1995 ; NTP, 1986). Le benzène passe la barrière placentaire (Ghantous et Danielsson, 1986).
Métabolisme
Le métabolisme du benzène est le même chez l’animal que chez l’homme d’un point de vue qualitatif mais il existe des différences quantitatives (CE, 2008 ; Daiker et al., 1996 ; Valentine et al., 1996).
La souris présente une métabolisation du benzène plus rapide que le rat ou le singe (Henderson, 1996). A forte dose, le métabolisme est saturable chez la souris pour des expositions par voie orale et par inhalation, mais ce phénomène n’est pas retrouvé chez le rat (Sabourin et al., 1987). La quantité de métabolites totale est plus importante chez la souris (Sabourin et al., 1988).
Élimination
Le mécanisme d’élimination étant saturable, aux doses élevées (> 50 mg.kg-1 chez la souris et > 150 mg.kg-1 chez le rat), le benzène non métabolisé est exhalé (Henderson, 1996 ; Sabourin et al., 1987).
Synthèse
Chez l’homme, la voie d’exposition principale pour le benzène est l’inhalation. L’absorption du benzène est importante par inhalation et voie orale. La distribution est rapide dans tous les organes avec un tropisme vers les tissus graisseux dont la moelle osseuse. La métabolisation du benzène est principalement hépatique et médullaire. Ce métabolisme comprend une oxydation catalysée par le cytochrome P450 2E1 pour produire un dérivé époxyde, un réarrangement non enzymatique, une transformation du benzène-époxyde en benzène-dihydrodiol et enfin, une conjugaison au glutathion, à l’acide glucuronique ou aux sulfates. Les métabolites sont éliminés dans les urines, alors que benzène sous une forme inchangée est éliminé dans les urines (1 %) et dans l’air expiré (10 à 50 %).
Chez l’animal, l’absorption est presque totale par inhalation ou voie orale et reste très faible par voie cutanée (< 1 %). Le benzène se distribue principalement dans les tissus riches en lipides ou largement perfusés (reins, poumons, foie, cerveau ou rate). Le métabolisme est le même que chez l’homme mais la souris métabolise plus vite que d’autres espèces tels que le rat ou le singe selon un mécanisme saturable.
Toxicité aiguë
Chez l'homme
Inhalation
Les effets sur l’homme résultent principalement de l’inhalation du benzène, et les concentrations élevées entraînent une narcose, similaire à celle observée pour d'autres gaz anesthésiants, habituellement précédée d’une phase d’excitation. Cette dépression du système nerveux central peut s’accompagner de convulsions, et la mort résulte d’une dépression respiratoire. L’exposition à 20 000 ppm (64 980 mg.m-3) pendant 5 à 10 minutes est fatale (Flury, 1928 ; Gerarde, 1960).
Une fibrillation ventriculaire peut survenir du fait d’une sensibilisation myocardique. Trois décès sont survenus après une intoxication aiguë résultant d’un accident industriel dans un cargo (Gist et Burg, 1997).
Dans les formes légères d’intoxication, une excitation puis des troubles de la parole, des céphalées, des vertiges, des insomnies, des nausées, des paresthésies dans les mains et les pieds et de la fatigue sont rapportés (Lauwerys, 1999).
L’inhalation de 50 à 100 ppm (162 à 325 mg.m-3) pendant 30 minutes entraîne fatigue et maux de tête ; 250 à 500 ppm (812 à 1 625 mg.m-3) sont responsables de vertiges, céphalées, sensations de malaise et nausées (Hathaway et al., 1991; Galbraith et a:., 2010).
Il n’est pas constaté d’atteinte rénale lors d’expositions accidentelles (Winek et Collom, 1971).
Voie orale
Par voie orale, la dose létale de 15 mL (12,99 g) habituellement citée ne peut être documentée ; des décès avec 9 à 12 g sont rapportés mais les observations datent de 1861 et 1889 et n’ont pu être vérifiées (Sollmann, 1957.). Selon Gosselin et al. (1984), la dose létale se situe entre 50 et 500 mg.kg-1 (Gosselin et al., 1984). L’ingestion de benzène liquide cause des irritations locales au niveau des muqueuses de la bouche, de la gorge de l’œsophage et de l’estomac (Gerarde, 1960), mais peut s’accompagner de fausses routes à l’origine de pneumopathies sévères.
Voie cutanée
Dans trois cas d’accidents mortels, les lésions observées sont des brûlures de la face, du tronc, des membres avec hémorragies et œdème pulmonaire (Avis et Hutton, 1993).
Lors d’expositions professionnelles à des vapeurs de benzène (60 ppm) pendant 3 semaines, des irritations cutanées et des dyspnées sont rapportées (Midzenski et al., 1992).
La projection oculaire s’accompagne d’une sensation de brûlure avec une atteinte légère et transitoire de l’épithélium, rapidement réversible (Grant, 1986).
Synthèse
Chez l’homme, des expositions massives au benzène induisent des effets anesthésiants, une narcose, habituellement précédée d’une phase d’excitation et la mort résulte d’une dépression respiratoire. Pour des expositions à des concentrations plus faibles, les effets correspondent à une excitation puis des troubles de la parole, des céphalées, des vertiges, des insomnies, des nausées, des paresthésies dans les mains et les pieds et de la fatigue. Des irritations locales pulmonaires, cutanées et du tube digestif sont également rapportées.
Chez l'animal
Inhalation
L’exposition au benzène par inhalation pendant 4 heures permet d’estimer la CL50 à 44,5 g.m-3 (13 700 ppm) chez le rat femelle (Drew et Fouts, 1974) ou à 34 g.m-3 (10 450 ppm) pour 7 heures d’exposition (Svirbely et al., 1943). Les effets cliniques observés correspondent à une instabilité psychomotrice, des tremblements, des secousses musculaires élémentaires, une altération du rythme respiratoire, une incoordination et une narcose (Svirbely et al., 1943). Une congestion pulmonaire et hépatique constitue un des signes cliniques majeurs (Drew et Fouts, 1974 ; Svirbely et al., 1943). A des doses comprises entre 2 000 et 8 000 ppm, l’exposition de 30 minutes au benzène entraine chez le rat des effets de type anxiolytique, des altérations de l’apprentissage, ainsi qu’une antinoception concentration-dépendante (Armenta-Resendiz et al., 2019).
Des souris C57Bl/6J exposées à des concentrations de 32 – 99,2 – 320 – 960 mg.m-3 (10 – 31 – 100 – 300 ppm) de vapeur de benzène 6 heures par jour pendant 6 jours présentent une diminution du nombre de lymphocytes à toutes les concentrations et des érythrocytes aux deux concentrations les plus élevées (Rozen et al., 1984). Une diminution du nombre de lymphocytes B dans la moelle des fémurs et une réduction des lymphocytes T de la rate sont également rapportées à ces deux concentrations, ainsi qu’une réduction de la prolifération en réponse aux mitogènes pour les lymphocytes T et les lymphocytes B.
Sur la même souche de souris (mâles uniquement), l’exposition à 160 mg.m-3 (50 ppm) de benzène 6 heures par jour pendant 2 semaines a eu pour effet une augmentation significative des concentrations plasmatique de glucose (p=0,005) et d’insuline (p=0,03), et des résultats significatifs au test de résistance à l’insuline (HOMA-IR) (p=0,05) (Abplanalp et al., 2019).
Voie orale
Chez le rat, la DL50 par voie orale est estimée comme étant supérieure à 810 mg.kg-1 de poids corporel, la mort des animaux est observée pour des doses de 1 870 mg.kg-1 de poids corporel pour une exposition de 20 minutes (Cornish et Ryan, 1963), ou pour des doses supérieures à 1 000 mg.kg-1 de poids corporel (Smyth et al., 1962), ou pour des doses de l’ordre de 5 600 mg.kg-1 de poids corporel (Wolf et al., 1956). Les jeunes rats étant plus sensibles que de jeunes adultes ou des adultes âgés (Kimura et al., 1971).
Une exposition courte à de fortes doses de benzène par voie orale chez la souris (800 mg.kg-1 de poids corporel pendant 3 jours) induit une activation non spécifique de la réponse immunitaire de la moelle osseuse (Laskin et al., 1989). A de plus faibles doses d’exposition à 10 ppm (32 mg.m-3) 6 heures par jour pendant 6 jours, il altère l’immunité cellulaire (nombre total de lymphocytes) et humorale (production d’anticorps), toujours chez la souris (Rozen et al., 1984).
Voie cutanée
Chez le lapin et le cobaye, la DL50 par voie cutanée est supérieure à 8,260 g.kg-1 de poids corporel (Roudabush et al., 1965).
Le benzène est un irritant de la peau et induit des lésions oculaires sévères chez l’animal (Jacobs, 1992 ; Smyth et al., 1962 ; Wolf et al., 1956).
Synthèse
A forte concentration, le benzène induit une neurotoxicité, une congestion pulmonaire et hépatique. A de plus faibles doses, le benzène est immuno- et hématotoxique. Le benzène est un irritant de la peau et induit des lésions oculaires sévères.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Effets hématotoxiques
La plupart des atteintes hématologiques (fatigue, troubles digestifs, légère polynucléose avant la pancytopénie et l’aplasie) ont été associés à des expositions par inhalation pour des expositions de type professionnel de plusieurs mois à plusieurs années à partir de 1 ppm (3,25 mg.m-3) pendant 8 heures par jour (ATSDR, A2007 ; Lan et al., 2004 ; Qu et al., 2002 ; Qu et al., 2003 ; Rothman et al., 1996a ; Rothman et al., 1996b).
De nombreuses études ont mis en évidence des effets hématotoxiques et immunotoxiques. L’atteinte de la moelle osseuse est un des tous premiers signes de la toxicité chronique du benzène : aplasie médullaire ou syndrome myéloprolifératif. La présence d’anomalies chromosomiques semble associée au passage anémie aplasique vers le syndrome myéloprolifératif et au développement d’une leucémie.
Les premiers cas d’atteinte hématologique ont été décrits en 1897 par Santesson chez 9 femmes : 4 sont mortes d’aplasie médullaire (Santesson, 1897). En 1942, sur 11 104 employés d’usines de caoutchouc exposés à environ 200 ppm (682 mg.m-3), 83 ont montré une altération de leur numération de formule sanguine et pour 25 une pancytopénie (ATSDR, 2007 ; Smith, 1996c). Des études de cohortes plus récentes ont été conduites notamment en Turquie, en Chine et en Italie. Deux cent dix-sept hommes travaillant dans l’industrie de la chaussure ont été suivis ; le benzène y est employé depuis 1960 (Aksoy et al., 1971). Le niveau d’exposition est estimé de 15 à 30 ppm (49-97 mg.m-3) avec des pics d’expositions jusqu’à 200 ppm (682 mg.m-3) en cas d’utilisation d’adhésifs au benzène. Vingt et un cas de leucopénie, 4 cas de thrombocytopénie, 10 cas de leucopénie et thrombocytopénie, 6 cas de pancytopénie et 5 cas d’hyperéosinophilie ont été identifiés. Dans une autre cohorte de 32 salariés fortement exposés (150 à 640 ppm) (487 à 2 079 mg.m-3) pour des durées variant de 4 mois à 15 ans, il est observé chez 28 sujets des altérations sévères à type de pancytopénie, hypoplasie ou hyperplasie médullaire. Huit salariés sont morts de pancytopénie.
Une étude transversale a été conduite auprès de 250 salariés (dont 2/3 de femmes) de l’industrie de la chaussure en Chine (Lan et al., 2004). L’exposition au benzène a été mesurée individuellement dans l’air et dans les urines. Une analyse hématologique a été menée chez les sujets. Les ouvriers ont été exposés au benzène en moyenne pendant 6,1 ± 2,9 ans. Les sujets ont été regroupés en 4 groupes correspondant aux niveaux d’exposition : 140 témoins, 109 sujets exposés à < 1 ppm, 110 exposés à 1- < 10 ppm, 31 exposés à ≥ 10 ppm). Tous les types cellulaires de la lignée blanche sont diminués significativement ainsi que le nombre de plaquettes dans le groupe le plus faiblement exposé au benzène ce qui correspond à une diminution d’environ 8 à 15 % par rapport au groupe témoin. Aux niveaux d’exposition plus élevés, une diminution des lymphocytes CD4+, du ratio CD4+/CD8+ et des lymphocytes B est mesurée. La concentration d’hémoglobine est significativement diminuées pour le groupe le plus exposé au benzène.
Les résultats d’une étude de cohorte rétrospective d’ouvriers exposés au benzène : 28 460 salariés issus de 233 usines sont comparés à 28 257 témoins (Yin et al., 1987a ; Yin et al., 1989). Les expositions vont de 3 à 307 ppm (10 à 998 mg.m-3), la majorité se situant dans l’intervalle 15 à 153 ppm (49 à 497 mg.m-3). Il est constaté des leucopénies et des anémies aplasiques. La cohorte a été étendue à un total de 74 828 salariés exposés, les plus anciens depuis 1949, comparés à 35 805 témoins. Neuf cas d’anémie aplasique, 2 cas d’agranulocytose, 7 cas de syndromes myélodysplasiques (SMD) sont identifiés. Il n’y a aucune anomalie dans le groupe témoin (Yin et al., 1996).
Dans la cohorte Pliofilm (1940-1975) (Ward et al., 1996), il est constaté chez les ouvriers de l’industrie du caoutchouc une diminution du nombre absolu de lymphocytes corrélée à une augmentation de l’exposition au benzène ; ceci suggère que l’exposition au benzène même à des niveaux inférieurs à 5 ppm (16 mg.m-3) puisse entraîner une diminution du nombre de lymphocytes.
Une autre étude a été menée sur 130 travailleurs chinois exposés de manière chronique au benzène et un groupe de 51 témoins appariés en âge et en genre (Qu et al., 2002 ; Qu et al., 2003). Une diminution statistiquement significative des leucocytes, des érythrocytes et des neutrophiles est observée chez les travailleurs exposés pendant 4 semaines à des niveaux moyens de 0,08 à 54,5 ppm (0,26 à 177 mg.m-3), de même que dans un sous-groupe de 73 de ces travailleurs, exposés en moyenne à 2,26 ppm (7,4 mg.m-3). Ces résultats semblent montrer une relation dose-effet mais certaines données ne sont pas cohérentes aux faibles concentrations.
En Chine également, 12 paramètres hématologiques ont été examinés chez 855 salariés employés dans 5 usines et exposés à une large gamme de concentrations en benzène allant de 0,02 à 270 ppm (0,07 à 872 mg.m-3) versus un groupe de 73 témoins non exposés (Schnatter et al., 2010). Les effets les plus marquants concernent la lignée des globules rouges caractérisés par des anémies et macrocytoses au-delà de 10 ppm (32 mg.m-3), les plus sensibles correspondant à une diminution des neutrophiles (7,77 ppm soit 25 mg.m-3) et du volume moyen des plaquettes (8,24 ppm soit 27 mg.m-3).
Dans une étude rétrospective réalisée sur 62 234 salariés employés dans 672 usines en Chine 412 cas d’anomalies (lymphopénie et thrombocytopénie) liés à l’exposition de plus de 6 mois au benzène ont été rapportés (Dosemeci et al., 1996). Les risques relatifs pour des expositions < 5 ppm (16 mg.m-3), de 5-19 ppm (16 à 65 mg.m-3), de 20-39 ppm (65 à 127 mg.m-3) et > 40 ppm (130 mg.m-3), sont respectivement de 1 - 2,2 - 4,7 - 7,2.
Une étude longitudinale rétrospective a été conduite sur une cohorte de 459 ouvriers du caoutchouc (Kipen et al., 1988). Ils observent une corrélation négative entre les concentrations en benzène et le nombre de cellules sanguines de la lignée blanche. Ces données ont été ré-analysées en 1993 et montrent une diminution significative du nombre de globules blancs et rouges dans un groupe de 161 salariés par comparaison aux données avant exposition pour la période 1946-1949 (Cody et al., 1993). Crump a réalisé l’évaluation de l’exposition et calculé une fourchette d’exposition de 30 à 54 ppm (97 à 175 mg.m-3) (Crump, 1994). Cependant, les salariés pour lesquels la surveillance régulière montrait une diminution d’une des lignées sanguines ont été affectés à des postes moins exposés. Ceci introduit un biais notable dans l’étude.
Dans une étude cas-témoin, 44 travailleurs (hommes et femmes) de Shangaï exposés à des niveaux élevés de benzène (31 ppm soit 101 mg.m-3, en moyenne pour 8 heures de travail) ont été comparés à 44 sujets témoins appariés (Rothman et al., 1996a ; Rothman et al., 1996b). L'exposition au benzène a été mesurée par des badges individuels, portés durant 5 jours et en analysant les métabolites urinaires du benzène. L'exposition "historique" au benzène a été évaluée via le parcours professionnel des individus. La durée d'exposition moyenne au benzène était de 6,3 ans. L'exposition moyenne au benzène sur 8 heures était de 31 ppm. Les travailleurs ont été répartis en deux groupes : un groupe exposé à moins de 31 ppm (22 personnes, exposition moyenne : 13,6 ppm) et un groupe exposé à plus de 31 ppm (22 personnes, exposition moyenne : 91,9 ppm). Six paramètres sanguins ont été évalués : nombre d'hématies, de leucocytes, de lymphocytes, de plaquettes, hématocrite et volume corpusculaire moyen (VCM). Tous ces paramètres ont été diminués (sauf VCM augmenté) chez les travailleurs fortement exposés. Dans le sous-groupe de 11 salariés exposés en moyenne à 7,6 ppm (25 mg.m-3) de benzène et sans exposition à des concentrations supérieures à 31 ppm (101 mg.m-3), seul le nombre absolu de lymphocytes était significativement abaissé (p<0,001) par comparaison au groupe des témoins.
La mortalité et les paramètres hématologiques d’une cohorte de 454 ouvriers (de sexe masculin) de raffineries ont été examinés (Tsai et al., 1983). L’exposition mesurée par des capteurs individuels est en moyenne de 0,53 ppm (1,72 mg.m-3). La durée d’emploi maximale est de 7,4 ans. Les paramètres hématologiques, 4 prélèvements annuels chez 303 ouvriers, n’ont pas été altérés.
Les données de la surveillance du groupe industriel Monsanto ont été étudiés (Collins et al., 1997) ; elles comprennent 387 salariés exposés à une moyenne de 0,55 ppm (1,8 mg.m-3) pour 8 heures de travail (variation de 0,01 ppm à 87,69 ppm (0,03 à 285 mg.m-3), moins de 5 % de l’effectif dépassant 2 ppm (6,5 mg.m-3)) comparés à 553 témoins. Il n’est pas décelé de lymphopénie considérée comme un indicateur précoce de la toxicité médullaire du benzène après prise en compte de l’âge, du sexe et du tabagisme. Il n’y a pas d’augmentation du risque chez les salariés exposés plus de 5 ans.
Dans le cadre d’une étude réalisée en zone urbaine, une corrélation inverse a été décrite chez 215 policiers entre l’augmentation du benzène sanguin et la diminution des leucocytes, neutrophiles et lymphocytes (Casale et al., 2016). Les mesures individuelles réalisées sur un petit nombre de sujets (8 policiers de la circulation et 4 conducteurs) rapportent des concentrations d’exposition de benzène dans l’air en moyenne de 17 et 11 µg.m-3, respectivement.
Effets immunitaires
Des effets sur le système immunitaire ont été décrits dans le cadre d’expositions professionnelles au benzène. Le benzène affecte à la fois l’immunité humorale et cellulaire (ATSDR, 2007).
Les salariés exposés à des concentrations de 3 à 7 ppm (10 à 23 mg.m-3) sur une période de 1 à 21 ans, ont présenté une diminution des taux sériques d’IgA et d’IgG mais les taux sériques d’IgM étaient faiblement augmentés (Lange et al., 1973). Il est à noter que dans cette étude, des co-expositions au toluène et aux xylènes sont également rapportées. Des salariés exposés au benzène à des concentrations inférieures à 30 ppm (98 mg.m-3), ont montré une augmentation de la susceptibilité aux allergies (OMS IPCS, 1993). Une diminution des leucocytes et d’autres éléments cellulaires sanguins ont été signalés chez des salariés exposés à des concentrations variant entre 15 et 75 ppm (49 à 244 mg.m-3) (Aksoy et al., 1971 ; Aksoy, 1987).
Une diminution de la concentration sérique d’IL-8 et IL-10 a été rapportée dans une étude cas-témoin, chez les 66 sujets exposés au benzène (mesures individuelles air par capteur passif, sanguines et urinaires), mais aussi à d’autres solvants (toluène, xylènes) dans une station-essence au Brésil (Moro et al., 2015 ; 2019).
Les métabolites du benzène hydroquinone, catéchol, benzène-quinone, 1,4-benzoquinone provoquent de fortes altérations de la prolifération des lymphocytes T humains par inhibition de l’interleukine 2 (Post et al., 1985).
Une corrélation positive a pu être établie entre la concentration atmosphérique de benzène et le score d’atteinte cutanée[1] chez 88 patients atteints de sclérose systémique[2] (Borghini et al., 2017).
Effets neurologiques
Plusieurs études montrent des altérations neurologiques (Baslo et Aksoy, 1982 ; Kahn et Muzyka, 1973 ; Tondel et al., 1995) qui semblent liées à des expositions au benzène mais les co-expositions, ou le manque de données relatives aux niveaux d’exposition, limitent la portée des conclusions.
Effets sur le tractus respiratoire
Des irritations nasales et de la gorge sont rapportés chez travailleurs exposés à 33 ou 59 ppm (107,25 ou 191,75 mg.m-3) respectivement pour les hommes et les femmes pendant plus de 1 an (Yin et al., 1987b).
Dans la cadre d’une enquête plus récente réalisée sur 352 enfants d’1 an et à des concentrations bien plus faibles de l’ordre de 1,46 µg.m-3, aucune association n’a été rapportée entre les symptômes respiratoires (toux, infections pulmonaires, respiration sifflante) et la concentration d’air intérieur de benzène au domicile des enfants (Ferrero et al., 2017).
[1] L’atteinte cutanée est considérée comme un marqueur pronostique de la sclérose systémique avec un risque plus élevé de sévérité et d’atteinte d’organe, en cas de progression de l’atteinte de la peau. On la mesure par un score qui consiste à définir l’intensité de l’épaississement de la peau en 17 zones du corps.
[2] La sclérose systémique est une maladie auto-immune qui affecte les vaisseaux sanguins et les tissus conjonctifs du corps, comme le collagène.
Synthèse
Chez l’homme, l’atteinte de la moelle osseuse est un signe précoce de la toxicité chronique du benzène : thrombocytopénie et/ou leucopénie évoluant vers aplasie médullaire ou l’apparition d’un syndrome myéloprolifératif. Une atteinte du système immunitaire est également fréquemment rapportée.
Chez l'animal
Inhalation
Effets hématopoïétiques et immunitaires
Concernant le système hématopoïétique, les effets observés varient en fonction de l’espèce, de la souche et de la durée de l’exposition et du mode d’exposition continu ou intermittent. Toutes ces études sont concordantes avec les données humaines.
Chez la souris, quelle que soit la voie d’administration, le système hématopoïétique est l’organe cible du benzène. Les expositions répétées induisent des altérations dès les concentrations de 10 ppm (32 mg.m-3) par inhalation (Baarson et al., 1984). Dans les études par expositions réitérées chez la souris, le benzène induit de manière dose-dépendante des lymphopénies (Baarson et al., 1984 ), des leucopénies (Aoyama, 1986) pour une exposition de 14 jours à 50 ppm, des anémies plutôt de type macrocytaire et hypochrome (Hsieh et al., 1988b ; Ward et al., 1985), une diminution des cellules souches de la moelle (Baarson et al., 1984 ; Cronkite et al., 1982 ; Farris et al., 1997 ; Green et al., 1981a, 1981b ; Neum et al., 1992 ; Seidel et al., 1989 ; Toft et al., 1982). L’altération qualitative des cellules souches de la moelle osseuse semble être un paramètre plus sensible que la modification quantitative pour l’identification des effets induits par le benzène (Gill et al., 1980 ; Toft et al., 1982).
Selon les conditions expérimentales, ces effets apparaissent dès 10 ppm (32 mg.m-3) chez la souris. Des souris C57B1/6J exposées à 10 ppm (32 mg.m-3) de benzène 6 heures par jour, 5 jours par semaine pendant 178 jours présentent une dépression du nombre d’érythrocytes circulants et de lymphocytes (Baarson et al., 1984). A la fin de l’exposition, une diminution des cellules spléniques nucléées est également observée.
Dans une autre étude, une exposition au benzène induit une lymphopénie persistante et une diminution des érythrocytes dès la première semaine d’exposition chez les souris mâles AKR/J exposées à 100 ppm (320 mg.m-3) ou chez les souris C57B1/6J exposées à 300 ppm (974 mg.m-3), 6 heures par jour, 5 jours par semaine pendant toute la vie (Snyder et al., 1980).
Dans une autre étude, une exposition à 300 ppm (974 mg.m-3) de benzène, 6 heures par jour, 5 jours par semaine pendant 26 semaines chez la souris CD-1 mâle induit une diminution du poids de la rate, une dépression marquée des lignées cellulaires médullaire et splénique avec une dépression des CFU-S et des CFU-Gm[1] médullaire et splénique, une dépression marquée des leucocytes et des érythrocytes et une diminution du pourcentage de lymphocytes alors que le nombre de neutrophiles semble élevé (Green et al., 1981a, 1981b). Des anomalies morphologiques des neutrophiles, des érythrocytes et des cellules médullaires et spléniques nucléées sont également rapportées.
Les effets sur les cellules souches de la moelle osseuse et du sang circulant ont été évalués chez la souris BDF1 femelle exposée à 100 – 300 – 900 ppm (324,1 – 974 – 2922 mg.m-3) de benzène, 6 heures par jour, 5 jours par semaine pendant 16 semaines (Seidel et al., 1989). Des effets dépresseurs ont été identifiés sur les cellules germinales des différents compartiments. Une récupération complète est observée entre 73 et 185 jours après la fin de l’exposition à 300 ppm (974 mg.m-3).
Les études chez le rat sont moins nombreuses. Des leucopénies et des lymphopénies ainsi que des hypoplasies myéloïdes sont rapportées (Ward et al., 1985). L’absence de modification du nombre de cellules de la moelle osseuse a été mise en évidence mais montrent une diminution pondérale de la rate et du thymus, du nombre de cellules de la rate et du nombre de lymphocytes T et B chez le rat exposé au benzène (Robinson et al., 1997).
Chez la souris mâle C57BL/6 exposée à 0 – 10 - 30 - 100 ppm (0 – 32,5 – 97,5 – 325 mg.m-3) de benzène pendant 6 heures par jour, 5 jours par semaine pendant 20 jours, aucune altération du nombre des lymphocytes B ou T spléniques et des sous populations de lymphocytes T n’est rapportée à 100 ppm avec toutefois une altération de l’activité cytotoxique des lymphocytes T à cette concentration (Rosenthal et Snyder, 1987). En revanche, un retard de prolifération lymphocytaire est observé suite à l’incorporation de thymidine tritiée par réaction mixte lymphocytaire. Ce délai de réponse serait lié à une altération de la capacité fonctionnelle des lymphocytes T.
Effets neurologiques
Par inhalation, le benzène induit également des effets neurologiques : ralentissement de la transmission de l’influx cérébral chez le rat et la souris (Frantik et al., 1994), diminution des réflexes involontaires et déclenchement d’une narcose chez le lapin (Carpenter et al., 1944). Chez la souris, une diminution de la puissance de déploiement des membres postérieurs, des tremblements (Dempster et al., 1984) ainsi qu’une narcose (Evans, 1981) ont été rapportés.
Chez la souris mâle, une inhalation de benzène 2 heures par jour, 6 jours par semaine pendant 30 jours à une concentration de 0 - 0,78 - 3,13 - 12,52 ppm (2,53, 10 et 41 mg.m-3) induit une augmentation significative de la contraction des membres antérieurs dès 0,78 ppm (2,53 mg.m-3) puis une diminution de ces effets aux concentrations supérieures (Li et al., 1992). Une augmentation de l’activité locomotrice a également été observée pour la plus faible concentration (0,78 ppm soit 2,53 mg.m-3), un retour à des valeurs proches de celles du lot témoin pour la concentration intermédiaire (3,13 ppm soit 10 mg.m-3) puis une diminution des effets pour la concentration la plus élevée (12,52 ppm soit 41 mg.m-3). Dans cette même étude, une diminution non significative de l’activité de l’acétylcholinestérase cérébrale a été notée.
[1] Les CFU sont des cellules souches de l’hématopoïèse
Voie orale
Effets hématologiques et immunitaires
Le benzène est un dépresseur de l’immunité cellulaire et humorale chez la souris pour des administrations de 40 mg.kg-1 de poids corporel/jour pendant 4 semaines ( (Hsieh et al., 1988b ).
Des atteintes de la réponse immunitaire sont également rapportées pour des expositions par voie orale à une dose de benzène de 8 mg.kg-1 de poids corporel pendant 4 semaines chez la souris CD-1 (Hsieh et al., 1988b). Au cours de cette étude, les souris ont été exposées via l’eau de boisson à 8 – 40 – 180 mg.kg-1.j-1 de benzène pendant 4 semaines. Une diminution significative dose-dépendante des érythrocytes périphériques, des leucocytes sanguins et des lymphocytes est mesurée. Une augmentation dose-dépendante du volume globulaire moyen (VGM) et une diminution dose dépendante du poids de la rate. Le poids du thymus est également diminué mais de manière non significative. Enfin, le nombre total de splénocytes est également diminué à toutes les doses.
Les rares études menées pour des expositions plus longues sont celles réalisées par le National Toxicology Program (Huff et al., 1989 ; NTP, 1986). Une première série d’études a été menée chez le rat F344/N et la souris B6C3F1 exposés à 0 ou 600 mg.kg-1 de benzène dans de l’huile de maïs par gavage, 5 jours par semaine pendant 17 semaines. Chez les souris, des tremblements sont observés à la dose de 600 mg.kg-1.j-1 ainsi qu’une leucopénie et une déplétion lymphoïde chez les rats.
La seconde série d’études a été menée chez le rat F344/N et la souris B6C3F1, exposés au benzène (pureté > 99,7 %) dans de l’huile de maïs par gavage, 5 jours par semaine pendant 103 semaines. Les doses administrées ont été de 0 – 50 – 100 – 200 mg.kg-1.j-1 chez les rats mâles et de 0 – 25 – 50 – 100 mg.kg-1.j-1 chez les rats femelles et les souris des deux sexes. Les effets hématologiques sont limités à une lymphopénie et à une leucocytopénie associées de manière dose dépendante aussi bien chez les rats que chez les souris. Ces effets sont observés à 3 et 18 mois chez les rats et les souris mâles et de 12 à 18 mois chez les souris femelles. Il est plus faible chez les rates. Le benzène augmente la fréquence des érythrocytes périphériques normochromatiques micronucléés chez les souris des deux sexes. Cet effet n’a pas été recherché chez les rats. Une hyperplasie hématopoïétique de la moelle osseuse et une hématopoïèse splénique sont observées à toutes les doses chez les souris. Chez les rats, une déplétion lymphoïde de la rate et du thymus est rapportée à toutes les doses. Les effets tumoraux sont rapportés plus loin.
Une diminution du poids du thymus, de la rate et du nombre de lymphocytes T est également rapportée dans une étude chez le rat à une dose de 0 et 0,6 mg.kg-1.j-1 pendant 45, 90 ou 135 jours a été testée (Karaulov et al., 2017). Par une approche mécanistique, les auteurs ont identifié les les lymphocytes T particulièrement CD4+ comme étant les cellules cibles de la toxicité du benzène sur le système immunitaire.
Effets neurologiques
Une première étude a rapporté une augmentation de norépinéphrine dans l’hypothalamus, le bulbe rachidien et le cervelet pour des expositions aux doses de 31, 166 et 790 mg.L-1 pendant 4 semaines (Hsieh et al., 1988a). La concentration en dopamine est augmentée de manière statistiquement significative dans l’hypothalamus et les corps striés. Une augmentation de plusieurs métabolites des catécholamines et de sérotonine dans de nombreuses régions du cerveau est rapportée. Les auteurs en déduisent que le benzène induit une augmentation des taux de synthèse et de catabolisme des neurotransmetteurs norépinéphrine, dopamine et de sérotonine. Les catécholamines du cerveau peuvent agir indirectement sur le système immunitaire via l’axe hypothalamo-hypophysaire.
Chez la souris exposée à des doses de 0 – 8 – 40 – 180 mg.kg-1j-1 dans l’eau de boisson pendant 4 semaines (Hsieh et al., 1991), des effets neurologiques sont observés à des doses de 8 mg.kg-1 de poids corporel par jour. Il s’agit d’une augmentation des concentrations en catécholamines cérébrales, en adrénocorticotropine (ACTH) et en corticostérone sanguines. Cette stimulation de l’axe hypothalamo-hypophysaire pourrait avoir une action sur le système immunitaire.
Effets hépatiques
Aucun effet histopathologique n’est observé au niveau du tissu hépatique dans une expérience sur des rats Fischer 344 mâles et femelles lors de l’administration par la voie orale de 0, 25, 50, 100, 200, 400, ou 600 mg.kg-1.j-1 de benzène dans l’huile de maïs pendant 120 jours ou lors de l’exposition pendant 2 ans chez le rat mâle à des doses comprises entre 50 et 200 mg.kg-1.j-1 et le rat femelle entre 25 et 100 mg.kg-1.j-1 (NTP, 1986).
Voie cutanée
Aucun effet neurologique n’est rapporté chez l’animal lors de l’exposition cutanée (ATSDR, 2007)
Synthèse
Chez la souris en particulier (espèce la plus sensible), quelle que soit la voie d’administration, le système hématopoïétique est l’organe cible des effets du benzène. Le benzène est un dépresseur de l’immunité cellulaire et humorale et un neurotoxique.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Catégorie 1A Substance dont le potentiel cancérogène pour l’être humain est avéré, la classification dans cette catégorie s’appuyant largement sur les données humaines. | 2008 |
| IARC | Groupe 1 l’agent (ou le mélange) est cancérogène pour l’homme | 2018 |
| US EPA | Classe A substance cancérogène pour l'homme | 1998 |
Chez l'homme
Toutes voies
Les données rapportées ci-dessous s’appuient sur la dernière mise à jour de l’IARC synthèse (IARC, 2018). Dans un souci de simplification, seules les principales conclusions sont rapportées ci-dessous en lien avec les études sur lesquelles se basent les valeurs toxicologiques de référence. De nombreuses études ont rapporté une augmentation de l’incidence des cancers au cours d’expositions professionnelles au benzène essentiellement les leucémies myéloïdes. Les leucémies aiguës non lymphocytaires (LANL), dont les leucémies myéloïdes aiguës (LMA) sont les pathologies les plus souvent observées dans les études de cas mais les différentes études épidémiologiques ont permis de montrer une association significative avec les leucémies de tout type, voire avec d’autres affections du tissu hématopoïétique comme les lymphomes malins non hodgkiniens (LMNH) et les myélomes multiples.
Parmi ces études il est possible d’individualiser :
- Une première cohorte Pliofilm regroupe les salariés de deux usines de caoutchouc situées dans l’Ohio aux USA. Elle a donné lieu à de nombreuses publications. à la fin du 20e siècle. Elle a inclus jusqu’à 1 212 travailleurs employés dans l’industrie du caoutchouc et comprend 9 décès par leucémie. Dans cette étude, un excès de 7,9 morts par leucémie pour 1 000 salariés exposés pendant 45 ans à 10 ppm de benzène et un excès de 0,5 pour 1 000 salariés exposés à 1 ppm ont été observés. C’est cette étude qui sert de base pour les modèles de calcul du risque aux faibles doses. Cependant, cette étude est critiquée car l’évaluation de l’exposition ne prend pas en compte l’exposition par voie percutanée, et pour la grande variation des taux de risque obtenus, de 1 à 100 (Infante et al., 1977 ; Paxton et al., 1994a ; Paxton et al., 1994b ; Rinsky et al., 1981 ; Rinsky et al., 1987).
Les résultats ont été complétés au fur et à mesure du temps en tenant compte des nouveaux cas et de l’évolution des méthodes de calcul. De ces études, des SMR ont été calculés pour la mortalité par leucémie de 5,60 pour des expositions pendant au moins 5 ans (Rinsky et al., 1981), de 3,60 (Paxton et al., 1994), et de 3,37 [1,54-6,41] (Rinsky et al., 2002). L’évaluation de Richardson en 2008 portait sur un total de 1 845 travailleurs et 17 décès par leucémies, le type de leucémie n’étant pas précisé. Un excès de risque (RR) de 1,05 [1,02-1,08] (Intervalle de confiance à 95 %) de décès par leucémies aiguës est calculé pour une exposition cumulée de 10 ppm-année au benzène, cet excès de risque étant plus sévère dans les 10 premières années suivant la fin de l’exposition (RR) de 1,19 [1,10-1,29].
Les dernières données sur cette cohorte Pliofilm sur 1 696 travailleurs blancs masculins, font état du décès de 893 sujets à la fin de la période de suivi (Rhomberg et al., 2016). Les évaluations de l’exposition au benzène réalisées avec davantage de précision, et la prise en compte du type de leucémies a conduit à un excès de mortalité par leucémie aiguë non lymphocytaire (7 cas) (SMR de 9,94 [4 – 20,48]), dont 6 cas par LMA (SMR de 10,11 [3,71 – 22,01] pour une exposition ≥ à 80 ppm-an, sans temps de latence).
- Une deuxième cohorte L’étude de Wong en 1987 qui a réévalué la mortalité d’une cohorte de 7 676 employés de l’industrie chimique américaine ayant eu au moins 6 mois d’exposition au benzène entre 1946 et 1975 (Wong, 1987). Le risque relatif de cancer lymphatique et hématopoïétique est de 3,93 pour une exposition cumulée d’au moins 720 ppm-mois et l’association entre l’exposition continue au benzène et la leucémie est fortement significative (il n’a pas été retrouvé de LMA mais 4 leucémies lymphoïdes ou myéloïdes chroniques). Utilisant divers index d’exposition cumulée, les auteurs démontrent une relation dose-réponse pour les cancers hématopoïétiques et lymphatiques.
Une première étude rétrospective a été menée chez 594 salariés exposés au benzène au cours de la fabrication de résine chimique et organique de 1940 à 1973 (Ott et al., 1978). Cette étude a été poursuivie jusqu’en 1982 sur un total de 956 salariés (Bond et al., 1986). L'étude a donc inclus les 594 salariés de l’étude de Ott et al. (1978) et 362 salariés supplémentaires exposés au benzène. De l’étude de Bond, un SMR de 1,94 [0,52-4,88] a été déterminé pour la mortalité par leucémies et leucémies aleucémiques.
- Une troisième cohorte de travailleurs chinois (CAPM[1] + NCI[2]), de 545 usines réparties dans 12 villes chinoises. La répartition des entreprises selon l’activité est la suivante : Peinture en spray (49%), peinture (14%), fabrication de chaussures (9,2%), isolation thermique (6,2%), industrie chimique (5%), impression (4,8%), caoutchouc (4,4%), production de peinture (2,4%), raffinerie du benzène (1,6%), autres (3,8%) (Portengen et al 2016). Une étude de cohorte comprenant 74 828 personnes exposées au benzène et 35 805 non exposées de différents secteurs industriels, a mesuré une augmentation du risque pour la combinaison des LANL et des SMD avec un SMR de 4,3 [1,1 – 16,0] et 3,6 [1,1 – 11,6] pour des expositions cumulées au benzène respectivement de 40-99 et ≥100 personne –ans (Hayes et al., 1997). Les données actualisées de cette cohorte rapportent une augmentation du risque LMA/SMD combinées significative avec l’augmentation de l’exposition cumulée de 40 à 100 ppm-an (RR = 5,58 [1,65 – 19,68]) et ≥ à 100 ppm-ans (4,50 [1,22 – 16,68]) (Linet et al., 2019 ; 2020). En ce qui concerne les leucémies myéloïdes chroniques et les cancers lymphoïdes, les résultats ne sont pas concluants.
De nombreuses études de cohortes confirment le lien entre l’exposition au benzène et la genèse des LANL, avec en particulier les LMA dans de nombreuses industries implantées dans différents pays tels que les USA, le Royaume Uni, la Chine, le Danemark, la Norvège, la Suède, la Finlande, la France, l’Australie, le Canada (Bloemen et al., 2004 ; Collins et al., 2003, 2015 ; Divine et al., 1999 ; Glass et al., 2003 ; Schnatter et al., 2012; Guénel et al., 2002 ; Gun et al., 2006 ; Hayes et al., 1997 ; Kirkeleit et al., 2008 ; Rushton et Romaniuk, 1997). Ainsi par exemple pour le risque de LMA, un SMR de 27,2 [3,3 - 98,2] pour des expositions cumulées au benzène comprises entre 200 et 400 ppm-an est rapporté (Wong et Raabe, 1995).
Les résultats de la méta-analyse réalisée par le groupe de travail de l’IARC en 2018 et regroupant 16 études publiées entre 1993 et 2015 confirment le lien établi entre l’exposition au benzène et l’apparition de LMA avec un OR de 1,54 [1,16 – 2,05] (13 études retenues de 1993 à 2015) (IARC, 2018). Les études cas-témoins n’apportent que peu d’éléments supplémentaires. Cependant, une étude cas-témoin a montré une augmentation du risque de LANL chez des enfants de moins de 15 ans dont les mères ont été exposées professionnellement au benzène pendant la grossesse avec un OR = 4,0 [1,8 – 9,3] (Shu et al., 1988).
L’analyse groupée de 3 études cas-témoins nichées dans des cohortes de travailleurs employés dans l’industrie pétrolière au Canada, UK et Australie ont identifié 60 cas de LMA (241 témoins appariés) et 29 cas de SMD (129 témoins appariés), avec une relation dose-réponse uniquement pour les SMD ((OR de 4,33 [1,31 – 14,3] entre les tertiles les plus élevés versus les plus faibles) (Schnatter et al., 2012).
L’analyse de 4 417 travailleurs de l’une des industries de la cohorte Pliofilm montre qu’il n’y a pas de lien clair entre l’ensemble des leucémies, les myélomes multiples ou les cancers hématopoïétiques et une augmentation de l’exposition à de faibles niveaux d’exposition pour des expositions cumulées (1-72 ppm-an (Collins et al., 2003 ; Ireland et al., 1997). Le nombre de pics d’exposition au-delà de 100 ppm pour une exposition ≥ 40 ans est un bon facteur prédictif du risque de l’ensemble des leucémies et des myélomes multiples. Une méta-analyse des études cas-témoins n’a pas montré d’association entre les expositions professionnelles au benzène et les produits contenant du benzène et une incidence de myélome multiples à partir des sources catégorisées de benzène et/ou de solvants organiques (Sonoda et al., 2001). Les taux d’incidence des myélomes multiples et des leucémies lymphoïdes chronique restent en deçà de la significativité chez les salariés de l’industrie pétrolière (Stenehjem et al., 2015). D’après la méta-analyse réalisée par l’IARC (10 études retenues de 1993 à 2015), le lien entre l’exposition au benzène et les leucémies lymphoïdes chroniques reste discutable avec un OR de 1,32 [0,97 – 1,80] (IARC, 2018). Il en est de même, toujours d’après les conclusions de l’IARC pour les myélomes multiples (Rapport IARC, 2018).
Enfin, une revue de la littérature a permis de vérifier le lien existant entre exposition au benzène et lymphomes non hogkiniens (Lamm et al., 2005). Cette revue a porté sur 18 études correspondant à 21 groupes ; il s’agit de 11 études cas-témoins, 3 études nichées dans des études cas-témoins en milieu professionnel et 7 cohortes exposées au benzène professionnellement. Seuls 2 des 21 groupes présentent une association statistiquement significative. Mais les travailleurs de ces deux groupes étant soumis à des expositions multiples, il est difficile de conclure positivement. Sur l’ensemble de la population étudiée, le nombre de cas observés (404) est supérieur au nombre de cas attendus (390) avec un OR de 1,04 [0,94-1,14], mais lorsque les co-expositions sont exclues le nombre de cas observés chute à 359 pour 373,2 attendus soit un OR de 0,96 [0,86-1,06]. Globalement l’étude a conclu à l’absence de lien entre les expositions industrielles au benzène et les lymphomes non hodgkiniens, incriminant les co-expositions industrielles dans les liens positifs rapportés par certaines études. Suite à l’actualisation de la cohorte chinoise (CAPM + NCI), de nouveaux liens significatifs ont été établis pour les lymphomes non hodgkiniens (RR de 4,0 [1,6 – 13,4]) (Linet et al., 2015), mais non sur la population générale dans une cohorte de 241 465 sujets recrutés dans 10 pays européens (Saberi et al., 2013). L’IARC considère en 2018 que les données permettant d’établir un lien entre l’exposition au benzène et les lymphomes non hodgkiniens restent limitées (IARC, 2018).
Autres sites
Si des cancers pulmonaires et rénaux ont été observés dans certaines études (Greenland et al., 1994 ; Sorahan et al., 2005 ; Linet et al., 2015), ils n’ont pas été retrouvés dans d’autres (Koh et al., 2011 ; 2014 ; Collins et al., 2015 ; Bove et al., 2014 ; Yuan et al., 2014). Pour l’IARC, seuls les cancers pulmonaires peuvent être associés à l’exposition au benzène, mais les données sont insuffisantes pour l’affirmer.
Synthèse
Chez l’homme, les leucémies aiguës myéloblastiques et lymphoblastiques sont les affections les plus souvent rapportées dans les études cas-témoins. Les données suggèrent aussi un lien possible avec les leucémies chroniques non lymphoblastiques, lymphoblastiques ou la plupart des SMD, mais ces résultats demandent à être confirmés.
Chez l'animal
Toutes voies
De nombreuses études ont mis en évidence le pouvoir cancérigène du benzène chez l’animal pour des expositions réalisées par voie orale ou par inhalation. Les études réalisées sur des souches de souris ou de rat génétiquement modifiées (approches mécanistiques ne sont pas rapportées) (French et Saulnier, 2001 ; Storer et al., 2001 ; NTP, 2007 ; Kawasaki et al., 2009).
Système hématopoïétique
Les organes cibles sont le système hématopoïétique et les tissus d’origine épithéliale. Lors d’expositions par inhalation, les tumeurs les plus souvent rencontrées sont celles du système hématopoïétique et plus particulièrement les lymphomes. Chez la souris, ce sont les tumeurs lymphocytaires qui sont le plus souvent observés (Cronkite et al., 1984 ; Cronkite et al., 1985 ; Farris et al., 1997 ; NTP, 1986 ; Snyder et al., 1980). Cependant, d’autres auteurs n’ont pas clairement mis en évidence d’augmentation des cancers lymphatiques (Snyder et al., 1988).
Chez le rat, la survenue de lymphomes n’est pas aussi clairement établie que chez la souris lors de l’exposition au benzène. Lors de l’administration de benzène par voie orale pendant 2 ans chez le rat Fischer 344, il n’a pas été montré d’augmentation de l’incidence des tumeurs du système lymphatique (NTP, 1986). En revanche, une augmentation de ce type de tumeur a été observée chez la femelle Sprague Dawley et le mâle et la femelle Wistar (Maltoni et al., 1989). Une augmentation des leucémies est également rapportée chez les rats Sprague Dawley et Wistar (Maltoni et al., 1989).
Autres types tumoraux
Dans les études de cancérogenèse par voie orale, l’exposition au benzène induit le développement de tumeurs localisées dans plusieurs organes. Dans le cas d’études de cancérogénèse par inhalation, le nombre d’organes développant des tumeurs est moins important. De façon générale, la majorité des tumeurs rencontrées en dehors du système hématopoïétique est d’origine épithéliale.
Ainsi, par inhalation et par voie orale chez la souris, le benzène induit une augmentation des tumeurs de la glande de Zymbal (Cronkite et al., 1984 ; Cronkite et al., 1985 ; Drew et Fouts, 1974 ; Farris et al., 1993 ; Maltoni et al., 1989 ; NTP, 1986 ; Snyder et al., 1988), des poumons (Farris et al., 1993 ; Maltoni et al., 1989 ; NTP, 1986 ; Snyder et al., 1988), de la glande de Harder (NTP, 1986), de la glande prépuciale (Farris et al., 1993 ; NTP, 1986), de l’estomac (Farris et al., 1993 ; NTP, 1986), de la glande mammaire (Maltoni et al., 1989 ; NTP, 1986) et du foie (Maltoni et al., 1989). De plus, une augmentation des tumeurs des ovaires est rapportée lors de l’exposition au benzène (Cronkite et al., 1984 ; Cronkite et al., 1985 ; NTP, 1986).
Par inhalation et par voie orale chez le rat, le benzène induit une augmentation des tumeurs de la glande de Zymbal (Maltoni et al., 1989 ; NTP, 1986), de la cavité orale (Maltoni et al., 1989 ; NTP, 1986), de l’estomac (Maltoni et al., 1989), de la cavité nasale (Maltoni et al., 1989) et de la peau (Maltoni et al., 1989 ; NTP, 1986). Certaines de ces tumeurs sont spécifiques chez le rat et ne sont pas transposables à l’homme.
Principaux résultats de l’étude du NTP, 1986 publiée par Huff et al., 1989
|
Espèces |
Conditions expérimentales |
Hyperplasie en lien avec la réponse tumorale |
Réponse tumorale |
|---|---|---|---|
|
Souris B6C3F1 |
Gavage 0 – 25 – 50 – 100 mg.kg-1.j-1 |
Hyperplasie hématopoïétique de la moelle (M : 11/48, 0/50, 25/49 vs 0/49 T, F : 14/45, 8/50, 13/49, vs 3/49 T) Hyperplasie des glandes de zymbal (M : 4/34, 12/40, 10/39 vs 0/42 T, F : 1/32, 2/37, 6/31 vs 1/43 T) Hyperplasie alvéolaire et bronchiolaires (M : 3/48, 7/50, 10/49 vs 2/49 T, F : 11/48, 12/50, 14/49 vs 1/49 T) Hyperplasie de la glande préputiale (M : 18/28, 9/29, 1/35 vs 1/21) |
Lymphomes malins : M : 9/48, 9/50, 15/49, vs 4/49 T F : 24/45, 24/50, 20/49 vs 15/49 Carcinomes de glande de zymbal : M : 1/34, 4/40, 21/39 vs 0/43 T F : 0/32, 1/37, 3/31 vs 0/43 Carcinomes et papillomes des cellules squameuses du préestomac : M : 2/42, 3/44, 5/38 vs 2/45 T F : 23/40, 6/45, 5/42, vs 1/42 T Carcinomes alvéolaire et bronchiolaire : M : 11/48, 12/50, 14/49 vs 5/49 T F : 3/42, 6/50, 6/49 vs 0/49 T Adénomes alvéolaire et bronchiolaire : F : 2/42, 5/50, 9/49 vs 4/49 T Adénomes et carcinomes alvéolaire et bronchiolaire : M : 16/48, 19/50, 21/49 vs 10/49 T F : 5/42, 10/50, 13/49 vs 4/49 T Adénomes de la glande de Harder : M : 9/46, 13/49, 11/48 vs 0/49 T Adénomes et carcinomes de la glande de Harder : F : 6/44, 10/50, 10/47 vs 5/48 T Carcinomes squameux de la glande préputiale : M : 3/28, 18/29, 28/35 vs 0/21 T Sarcomes mammaires : F : 0/45, 1/50, 4/49 vs 0/40 T Tumeurs des cellules ovariennes de la granulosa F : 1/44, 6/49, 7/48 vs 1/47 T Adénomes hépatocellulaires : F : 8/44, 5/50, 4/49 vs 1/49 T Adénomes et carcinomes hépatocellulaires : 12/44, 13/50, 7/49 vs 4/49 T |
|
Rat F-344 |
M : 0 – 50 – 100 – 200 mg.kg-1.j-1 F : 0 – 25 – 50 – 100 mg.kg-1.j-1 |
|
Carcinomes de la glande de zymbal M : 6/46, 10/42, 17/42, vs 2/32 T F : 5/40, 5/44, 14/46 vs 0/45 T Papillomes des cellules squameuses cutanées : M : 2/50, 1/50, 5/50 vs 0/50 T Carcinomes des cellules squameuses cutanées : M : 5/50, 3/50, 8/50 vs 0/50 T Carcinomes et papillomes des cellules squameuses de la cavité orale : M : 9/50, 16/50, 19/50 vs 1/50 T F : 5/50, 12/50, 9/50 vs 1/50 T |
M : mâle, F : femelle, T : témoins
Synthèse
Chez l’animal, de nombreuses études ont mis en évidence le pouvoir cancérigène du benzène pour des expositions réalisées par voie orale ou par inhalation. Les organes cibles sont le système hématopoïétique et les tissus d’origine épithéliale. Lors d’expositions par inhalation, les tumeurs les plus souvent rencontrées sont celles du système hématopoïétique et plus particulièrement les lymphomes.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Le benzène est classé mutagène catégorie 1B | 2008 |
Chez l'homme
Toutes voies
Des résultats positifs ont été obtenus pour les tests d’aberrations chromosomiques (Karacic et al., 1995 ; Major et al., 1994 ; Picciano, 1979 ; Sarto et al., 1984 ; Sasiadek, 1992 ; Tompa et al., 1994) , pour les tests du micronoyau (Hogstedt et al., 1991 ; Liu et al., 1996), pour les tests d’aneuploïdie (Ding et al., 1983 ; Erdogan et Aksoy, 1973), d’autres se sont révélés négatifs. Certains tests comme le test des comètes sur lymphocytes circulants pourraient même être utilisés comme biomarqueurs d’exposition au benzène (Fracasso et al., 2010).
Il a été clairement démontré que les métabolites du benzène produisent seuls ou en association des effets génotoxiques multiples induisant des altérations chromosomiques chez l’homme à un niveau en lien avec ceux pour lesquels des cancers hématopoïétiques sont retrouvés. De nombreuses études menées chez différentes populations de travailleurs dans différents pays pendant plus de 30 ans ont montré une variété d’altérations génotoxiques incluant des aberrations chromosomiques dans des lymphocytes de travailleurs exposés au benzène (IARC, 2012). Les résultats d’une méta-analyse, regroupant 68 études confirment des associations significatives entre l’exposition professionnelle au benzène et l’augmentation de la fréquence de différents types d’anomalies génétiques (micronoyaux, échanges de chromatides sœurs, aberrations chromosomiques, lésions au test des comètes) (p<0,05) dès 1 ppm (Zhou et al., 2020).
Chez l'animal
Toutes voies
Le benzène est génotoxique chez les mammifères : il induit des aberrations chromosomiques (Ciranni et Adler, 1991 ; Fujie et al., 1992 ; Styles et Richardson, 1984) et la formation de micronoyaux (Au et al., 1990 ; Chen et al., 1994 ; Erexson et al., 1986 ; Farris et al., 1996 ; MacGregor et al., 1990). Il entraine également des résultats positifs dans le test des comètes (Tuo et al., 1996), d’échanges de chromatides sœurs (Erexson et al., 1986) de mutations géniques chez la souris transgénique (Mullin et al., 1995).
In vitro
Organismes eucaryotes
In vitro, la majorité des résultats sont négatifs sur bactéries et sur cellules de mammifères (CE, 2008, Chen et al. 2008).
Mécanismes d’action :
La première étape de transformation du benzène en benzène-époxyde est déterminante dans la toxicité du benzène. Les métabolites urinaires sont réduits de 90 % chez les souris déficientes en CYP2E1, de même qu’on observe l’absence concomitante d’effets génotoxiques et cytotoxiques sur les organes hématopoïétiques et tissus lymphoïdes (IARC, 2018).
La toxicité du benzène sur la moelle osseuse (dépression de l’activité médullaire et effet leucémogène) est liée à l’action de certains métabolites (Schlosser et al., 1995 ; Snyder et al., 1989). Il s’agit d’altérations génétiques dans les cellules souches CD34+ ou des cellules progénitrices de la moelle osseuse (Morgan et Alvares, 2005 ; Passegué et Weisman, 2005). Les effets potentiellement toxiques des différents métabolites ont été initialement observés chez la souris au cours d’essais observant la relation dose-effet de l’incorporation du fer dans les globules rouges (pris comme évaluation de l’érythropoïèse) (Lee et al., 1993). Dans cette expérience, le 1,2,4-trihydroxybenzène (THB) n’apparaît pas toxique alors qu’il induit l’apoptose dans des cultures cellulaires humaines.
L’IARC a réalisé une cartographie des différents mécanismes impliqués au cours de la cancérogénèse pour certains des métabolites du benzène, à savoir le phénol, le catéchol, l’hydroquinone et le 1,4-benzoquinone (IARC, 2018). Les mécanismes sont multiples et communs en proportions variables avec la 1,4-benzoquinone pour le score le plus élevé, suivi par l’hydroquinone, le catéchol, puis le phénol :
- altération de la prolifération cellulaire, apoptose,
- induction d’une inflammation chronique (régulation des protéines d’adhésions, sélectines, cytokines, etc),
- induction d’altérations épigénétiques (liaison de manière covalente à des macromolécules cellulaires inhibant la synthèse de l’ARN des macrophages, bloquant l’hématopoïèse et supprimant la synthèse protéique intracellulaire ; liaison à l’ADN pouvant conduire à un effet mutagène s’exprimant par une leucémie (Badham et Winn, 2010 ; Hedli et al., 1996 ; Mazzullo et al., 1989 ; McDonald et al., 1994),
- stress oxydatif (cassures de brins d’ADN dans les cellules de la moelle notamment) (Rao et Snyder, 1995),
- liaison aux récepteurs de régulation tels que l’AhR, AR, récepteur aux corticoïdes, etc.
La formation de métabolites à haut potentiel toxique serait proportionnellement plus importante à faibles doses qu’à doses élevées (INSERM, 2001; Price et al., 2012; Cox et al., 2017; McNally et al., 2017).
Le pouvoir génotoxique du benzène démontré aussi bien chez l’homme que chez l’animal conduit à retenir un mécanisme d’action sans seuil de dose.
Effets sur la reproduction
Chez l'homme
Toutes voies
Chez la femme, les études sont insuffisantes pour mettre en évidence une association causale du fait du faible nombre d’études disponibles et du manque d’informations relatives à l’exposition au benzène et aux autres composés chimiques (Michon, 1965 ; Mukhametova et Vozovaia, 1972 ; Stucker et al., 1994 ; Vara et Kinnunen, 1946; Ekpenyong et al., 2013.). Il n’existe pas d’étude chez l’homme.
Synthèse
Les données chez l’homme sont insuffisantes pour pouvoir conclure.
Chez l'animal
Inhalation
Plusieurs auteurs ont cherché à mettre en évidence un effet du benzène sur les fonctions de reproduction mâle et femelle chez l’animal exposé par inhalation (Gofmekler, 1968 ; Kuna et al., 1992b ; Ungvary et Tatrai, 1985 ; Ward et al., 1985 ; Wolf et al., 1956). Ces différentes études ont permis de déterminer un NOAEL (lors d’une exposition intermittente par inhalation) compris entre 30 ppm (97 mg.m-3) chez les souris mâles (atrophie testiculaire/ diminution du nombre de spermatozoïdes et augmentation de spermatozoïdes anormaux) et femelles (kystes ovariens) (Ward et al., 1985) et 300 ppm (975 mg.m-3) chez le rat femelle (index de fertilité) (Kuna et al., 1992a)
Voie orale
L’exposition au benzène par voie orale du rat et de la souris ne révèle pas d’effet toxique sur la fonction de reproduction du mâle et de la femelle après 17 semaines pour des expositions au benzène pouvant atteindre jusqu’à 600 mg.kg-1.j-1 (NTP, 1986). Cependant, après 2 ans d’exposition pour des doses comprises entre 25 et 100 mg.kg-1.j-1 des polypes sont retrouvés au niveau de l’endomètre chez la rate, des lésions ovariennes chez la souris femelle ainsi que des lésions au niveau du prépuce chez la souris mâle (NTP, 1986).
Synthèse
Chez l’animal, des altérations de la fonction de reproduction ont été identifiées uniquement pour des expositions par inhalation avec des NOAEL de 30 ppm chez les souris et de 300 ppm chez les rats.
Effets sur le développement
Chez l'homme
Toutes voies
Le benzène passe la barrière placentaire et est retrouvé dans la moelle osseuse du fœtus à des niveaux supérieurs ou égaux à ceux mesurés chez la mère exposée par inhalation (Dowty et al., 1976)
Dans le secteur de la pétrochimie, une étude cas-témoin (354 femmes enceintes exposées au benzène et 428 femmes non exposées) a mis en évidence une association négative entre l’exposition au benzène et le poids de naissance (-58 g IC95% [-115 à -2]) (Chen et al., 2000). Toutefois, les effets concomitants liés au stress ou à d’autres solvants ne peuvent être totalement écartés.
Les résultats d’une étude longitudinale brésilienne incluant 3 671 femmes enceintes ont mis en évidence un risque significatif de naissance prématurée chez les mères exposées au benzène dans une fenêtre de 5 jours précédant la naissance (OR = 1,12, IC95% (1,01- 1,23) (Dos Santos et al., 2019). Dans la mesure où les autres fenêtres d’exposition (au cours des consultations) de 10, 15, 30, 60 ou 90 jours n’ont pas entraîné d’effet significatif (mesures de sources environnementales de la qualité de l’air pour le benzène et le toluène), les auteurs concluent sur une toxicité de type aiguë associée au benzène, mais également au toluène (résultats comparables).
Inhalation
Les études sur les effets par inhalation du benzène sur le développement intra-utérin ou après la naissance (Budnick et al., 1984 ; Forni et al., 1971 ; Funes-Cravioto et al., 1977 ; Goldman et al., 1985 ; Health, 1983 ; Olsen, 1983; Protano et al., 2012) ne sont pas suffisantes pour établir une relation causale.
Parmi les études plus récentes réalisées en milieu urbain pour de plus faibles expositions, aucune n’a pu établir d’association entre l’exposition au benzène pendant la grossesse et des anomalies fœtales ou encore d’effets sur le développement psychomoteur des enfants (Vincetti et al., 2016 ; Janitz et al., 2018 ; Lertxundi et al., 2015).
Voie orale
Dans une étude cas-témoin de 669 enfants présentant de sérieuses anomalies congénitales, aucune association n’est trouvée avec la consommation d’eau contenant plus de 1 ppb de benzène durant le premier trimestre de la grossesse (Bove et al., 1995).
En 1997, une association entre le lieu de résidence de la mère proche de décharges contenant du benzène et 517 enfants présentant des anomalies du tube neural (OR de 2,5 [1,0 – 6,1]) a été montrée (Croen et al., 1997). Une interférence avec d’autres polluants également présents, comme le toluène (OR de 2,7 (1,0 – 6,4) ou le 1,2-dichloroéthane (OR de 2,6 (1,0 – 7,2) ne peuvent être écartés. Une augmentation de la fréquence des avortements spontanés est constatée chez 485 femmes exposées professionnellement au benzène durant le premier trimestre (Xu et al., 1998). D’autres études ne retrouvent pas ces anomalies (Axelson et al., 1983 ; Taskinen et al., 1994).
Synthèse
Chez l’homme, certaines études suggèrent un lien entre l’exposition au benzène et anomalies du tube neural chez les fœtus mais ces effets ne sont pas toujours retrouvés ni imputés au benzène seul.
Chez l'animal
Inhalation
Différentes études réalisées lors de l’exposition par inhalation chez différentes espèces animales ont montré des effets fœtotoxiques pour des concentrations supérieures ou égales à 47 ppm (153 mg.m-3). Ces effets correspondent à une diminution du poids du fœtus et/ou de la taille du squelette (Coate et al., 1984 ; Green et al., 1978 ; Kuna et Kapp, 1981 ; Murray et al., 1979 ; Seidenberg et al., 1986 ; Tatrai et al., 1980a ; Tatrai et al., 1980b ; Ungvary et Tatrai, 1985). Le benzène n’a pas d’action tératogène spécifique ; la fœtotoxicité observée pour des expositions à des concentrations élevées serait liée à une toxicité maternelle.
Ces effets ne sont pas retrouvés pour des expositions intermittentes par inhalation à de faibles concentrations de l’ordre de 10 à 40 ppm (32 et 130 mg.m-3) (Coate et al., 1984 ; Kuna et Kapp, 1981 ; Kuna et al., 1992b). Par ailleurs, des modifications hématopoïétiques sub-cliniques pour des concentrations proches de 20 ppm (65 mg.m-3) ont été rapportées (Keller et Snyder, 1986, 1988). Dans cette étude, des souris gestantes ont été exposées 6 heures par jour du 6ème au 15ème jour de la gestation à des concentrations de 0, 5, 10 ou 20 ppm (0 - 16,2 - 32,5 – 65 mg.m-3) de benzène. Les jeunes âgés de deux jours présentent une diminution des précurseurs des érythrocytes à toutes les doses et ceux exposés à 20 ppm présentent également une augmentation du nombre de cellules souches hématopoïétiques intra-hépatiques et des précurseurs granulopoïétiques accompagnée par une diminution des précurseurs érythropoïétiques. Ces altérations sont également observées 6 semaines après la naissance.
Des rates gestantes ont aussi été exposées à 0 - 1 – 10 – 40 – 100 ppm (0 - 3,25 – 32,5 – 130 – 325 mg.m-3) de benzène du 6ème au 15ème jour de la gestation (Coate et al., 1984). Aucun signe clinique ni aucune toxicité maternelle n’a été observée chez les mères. Une diminution statistiquement significative des poids corporels des jeunes mâles et femelles est observée à 100 ppm. Une légère diminution de la taille des fœtus (non statistiquement significative), ainsi qu’un léger retard d’ossification (non statistiquement significatif) à 100 ppm (325 mg.m-3) sont rapportés.
Voie orale
Les rares études réalisées par voie orale montrent que le benzène présenterait un effet embryotoxique chez la souris pour des expositions par gavage à des doses de 1 300 mg.kg-1.j-1 du 8ème au 12ème jour de la gestation (Seidenberg et al., 1986). Une autre étude pratiquée chez le rat pour des expositions à 0, 50, 250, 500 ou 1 000 mg.kg-1.j-1 du 6ème au 15ème jour de la gestation ne montre pas d’anomalies du développement lors du sacrifice pratiqué au 20ème jour de la gestation (Erexson et al., 1986).
Synthèse
Chez l’animal, une exposition par inhalation au benzène induit une diminution du poids des fœtus et de la taille des squelettes, ainsi que des modifications hématopoïétiques. Ces effets ne sont pas retrouvés pour des expositions par voie orale.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation:
L’ATSDR propose un MRL de 28 µg.m-3 (0,009 ppm) pour une exposition aiguë au benzène par inhalation (ATSDR, 2007).
Cette valeur est établie à partir d’une étude expérimentale réalisée par inhalation chez la souris C57BL/6J exposée par inhalation à 0 - 10,2 – 31 – 100 – 301 ppm (0 – 33 – 100 – 325 – 978 mg.m-3) 6 heures par jour, pendant 6 jours (Rozen et al., 1984). Cette étude a permis de définir une LOAEC de 10,2 ppm (33 mg.m-3) pour la diminution de la prolifération lymphocytaire après une stimulation par des mitogènes. La concentration a été ajustée pour une journée continue d’exposition (6 h/24 h) :
LOAECADJ = 10,2 ppm x (6 h/24 h) = 2,55 ppm
Un équivalent pour l’homme est calculé en prenant comme hypothèse que le benzène est un gaz de catégorie 3 et que le facteur de conversion est de 1 (US EPA, 1994).
LOAECHEC = LOAECADJ x 1 = 2,55 ppm
Facteurs d’incertitude : un facteur d’incertitude de 300 est appliqué. Celui-ci correspond à un facteur de 10 car cette valeur est établie à partir d’une LOAEC, un facteur de 3 pour l’extrapolation des données de l’animal à l’homme et un facteur de 10 pour la variabilité au sein de l’espèce humaine.
Calcul : 2,55 ppm /300 = 0,0085 ppm (arrondi à 9.10-3 ppm soit 0,028 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
OEHHA propose un REL aigu de 27 μg.m-3 pour une exposition aiguë (1 h) au benzène par inhalation (OEHHA, 2014).
Cette valeur est basée sur une étude expérimentale chez la souris gestante Swiss Webster exposée à 0 – 5 – 10 - 20 ppm soit 0 - 16,2 - 32,5 – 65 mg.m-3 de benzène 6 heures par jour du 6ème au 15ème jour de gestation (Keller et Snyder, 1988). Un effet statistiquement significatif sur les cellules de la moelle osseuse est observé à toutes les concentrations chez les jeunes. Il s’agit d’une diminution dose-dépendante du nombre d’érythroblastes basophiles allant jusqu’à l’absence de cellules à la dose la plus élevée. De cette étude, un LOAEL de 5 ppm (16,2 mg.m-3) est déterminé pour la diminution du nombre d’érythroblastes. Un équivalent pour l’homme a été calculé en retenant par défaut comme facteur d’équivalence la valeur 1.
Facteurs d’incertitude : un facteur de 600 est retenu correspondant à un facteur de √10 pour l’utilisation d’un LOAEL, 10*√10([1]) pour la variabilité au sein de l’espèce humain et un facteur de 2√10 pour prendre en compte les différences inter-espèces.
Calcul : 5 ppm x 1/600 = 0,008 ppm (0,027 mg.m-3 soit 27 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
OEHHA propose un REL aigu (8 heures) de 3 μg.m-3 pour une exposition aigüe de 8 heures au benzène par inhalation (OEHHA, 2015).
Cette valeur reprend intégralement la valeur développée pour des expositions chroniques et rapportée plus bas car l’OEHHA considère qu’aucune information n’est connue pour la réversibilité de cet effet à l’arrêt de l’exposition au benzène.
Indice de confiance : cet organisme n’accorde pas d’indice.
Le TCEQ propose un ReV de 580 µg.m-3 (180 ppb) pour une exposition aiguë de 1 heure au benzène par inhalation (2007).
Cette valeur a été établie à partir de l’étude de Rozen et al.(1984) qui a exposé par inhalation des souris à 0 - 10,2 – 31 – 100 – 301 ppm (0 – 33 – 100 – 325 – 978 mg.m-3) 6 heures par jour, pendant 6 jours. L’effet critique retenu est une atteinte du système hématopoïétique mise en évidence par une diminution du nombre de lymphocytes périphériques ainsi qu’une diminution de la prolifération lymphocytaire après une stimulation par des mitogènes (LOAEC de 10,2 ppm soit 33 mg.m-3). Cette LOAEC a été retenue comme POD (point de départ) du calcul de la valeur.
Un ajustement sur la durée d’exposition a été réalisé pour tenir compte de l’exposition de 6 h, ramenée à 1 h en utilisant la loi de Haber avec n = 3.
PODADJ = [10,2 x (6 h/1 h)]1/3 = 18,5 ppm
Dans la mesure où le ratio animal/homme du coefficient de partage sang–air est supérieur à 1 (17,44/8,12 = 2,15), la valeur de 1 a été retenue par défaut d’après les recommandations du guide TCEQ-ESL (Effects Screening Level) de 2006 : POD HEC = PODADJ.
Facteurs d'incertitude : un facteur de 90 est retenu correspondant à un facteur d’incertitude de 3 en raison de l’utilisation d’un LOAEL, un facteur d'incertitude de 3 pour l’extrapolation des données animales à l’homme et un facteur de 10 pour la variabilité au sein de l’espèce. In fine, ce facteur de 90 arrondi à 100 a été appliqué.
Calcul : ReVaiguë = 18,5 ppm / 100 = 180 ppb (580 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Le TCEQ propose un ReV de 320 µg.m-3 (100 ppb) pour une exposition aiguë de 24 heures au benzène par inhalation (2014).
Cette valeur a également été établie à partir de l’étude de Rozen et al.(1984) et retient comme effet critique une atteinte du système hématopoïétique avec une LOAEC de 10,2 ppm soit 33 mg.m-3.
Aucun ajustement sur la durée d’exposition de 6 à 24 heures n’a été réalisé, justifié par le fait que la durée totale d’exposition est de 6 fois 6 heures, soit 36 heures et que la clairance est insuffisante vis-à-vis de l’organe cible (présence probablement croissante des métabolites hématotoxiques du benzène dans la moelle au-delà de 6 jours). Le ReV est construit à partir de :
LOAEC = (10,2 ppm)3 x (1) = 10,2 ppm
Facteurs d'incertitude : un facteur de 90 est retenu correspondant à un facteur d’incertitude de 3 en raison de l’utilisation d’un LOAEL et non d’une NOAEL, un facteur d'incertitude de 3 pour l’extrapolation des données animales à l’homme et un facteur de 10 pour la variabilité au sein de l’espèce. In fine, ce facteur de 90 arrondi à 100 a été appliqué.
Calcul : ReVaiguë = 10,2 ppm / 100 = 0,102 ppm (arrondi à 100 ppb soit 320 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition sub-chronique par inhalation:
L’ATSDR propose un MRL de 19 µg.m-3 (6.10-3 ppm) pour une exposition sub-chronique par inhalation (2007).
Cette valeur est établie à partir d’une étude expérimentale par inhalation chez la souris mâle C57BL/6 exposé à 0 – 10 - 30 - 100 ppm (0 – 32,5 – 97,5 – 325 mg.m-3) de benzène 6 heures par jour, 5 jours par semaine pendant 20 jours (Rosenthal et Snyder, 1987). Cette étude a permis de définir une LOAEC de 10 ppm (32,5 mg.m-3) pour une prolifération lymphocytaire significativement retardée. Un ajustement au temps a été réalisé pour ramener à une exposition continue :
LOAECADJ = 10 ppm x (5 j/7 j) x (6 h/24 h) = 1,78 ppm
Un équivalent pour l’homme est calculé en prenant comme hypothèse que le benzène est un gaz de catégorie 3 et que le facteur de conversion est de 1.
LOAECHEC = LOAECADJ x 1 = 1,78 ppm
Facteurs d’incertitude : un facteur d’incertitude de 300 est appliqué. Celui-ci correspond à un facteur de 10 car cette valeur est établie à partir d’une LOAEC, un facteur de 3 pour l’extrapolation des données de l’animal à l’homme et un facteur de 10 pour la variabilité au sein de l’espèce humaine.
Calcul : 1,78 ppm / 300 = 0,0059 ppm (19 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effets à seuil - Exposition chronique par inhalation:
L’ATSDR propose un MRL de 9,75 µg.m-3 (3.10-3 ppm) pour une exposition chronique au benzène par inhalation (2007).
Cette valeur est établie à partir d’une étude épidémiologique réalisée chez 250 salariés de l’industrie de la chaussure en Chine et une population témoin appariée en âge et en sexe de 140 salariés non exposés au benzène (Lan et al., 2004). Cette étude a permis de définir un BMCL0,25sd de 0,10 ppm pour une diminution statistiquement significative du nombre de lymphocytes B. Un ajustement au temps a été réalisé pour ramener à une exposition continue (6 j/7 j) (8 h/24 h).
BMCL0,25sd ADJ = 0,10 ppm x (6 j/7 j) x (8 h/24 h) = 0,03 ppm
Facteurs d’incertitude : un facteur d’incertitude de 10 est appliqué pour tenir compte de la variabilité au sein de l’espèce humaine.
Calcul : 0,03 ppm/ 10 = 0,0028 ppm (arrondi à 0,003 ppm soit 9,75.10-3 mg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
L'US EPA (IRIS) propose une RfC de 30 µg.m-3 (9.10-3 ppm) pour une exposition chronique au benzène par inhalation (US EPA (IRIS), 2003).
Cette valeur a été établie à partir d'une étude cas-témoin réalisée sur 44 travailleurs (dont 21 femmes) de Shangaï exposés au benzène par inhalation (Rothman et al., 1996b). Le nombre d'hématies, de leucocytes, de lymphocytes, de plaquettes, et l’hématocrite ont été diminués chez les travailleurs fortement exposés (31 ppm de benzène). Dans le groupe faiblement exposé, seul le nombre de lymphocytes a été significativement diminué.
Une modélisation des données de numération lymphocytaire a abouti à une dose repère (BMC) de 13,7 ppm (sur 8 heures) avec une limite inférieure à 95 % de 7,2 ppm soit 23 mg.m-3 (BMCL). Cette dose, qui entraîne une variation dans le nombre de lymphocytes égale à l'écart-type de la moyenne des témoins, a permis de calculer une BMCLADJ après ajustement à une exposition continue en tenant compte de la durée d’exposition par semaine et du volume respiratoire chez l’homme (10 m3/20 m3 x 5 jours/7 jours) :
BMCLADJ = 23 mg.m-3 x 10 m3 / 20 m3 x 5 /7 j = 8,2 mg.m-3
Facteurs d’incertitude : un facteur 270 arrondi à 300 a été appliqué correspondant à un facteur 3 pour l'utilisation d'une BMCL au lieu d'un NOAEL, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour l'extrapolation d'une durée subchronique d'exposition (< 7 ans) à une durée chronique et un facteur 3 pour le manque de données sur les effets du benzène sur la reproduction et le développement.
Calcul : 8,2 mg.m-3 x 1/300 = 0,027 mg.m-3 (arrondi à 0,03 mg.m-3 soit 9.10-3 ppm)
Indice de confiance : La confiance dans l’étude, la base de données et la RfC est moyenne.
OEHHA propose un REL chronique de 3 μg.m-3 pour une exposition chronique au benzène par inhalation (2014).
Cette valeur est basée sur une étude épidémiologique chez 250 travailleurs chinois (hommes et femmes) d’une entreprise de chaussures qui utilisent une colle contenant entre 0,6 et 34 % de benzène (Lan et al., 2004). Ils ont été exposés 8 heures par jour, 6 jours par semaine au benzène pendant 6,1 ± 2,1 ans. Deux cent dix-neuf des 250 travailleurs ont été exposés à des doses inférieures à 10 ppm. Un effet significatif sur les lymphocytes de type B est observé. Dans cette étude, un LOAEL de 0,57 ± 0,24 ppm (1,86 ± 0,78 mg.m-3) est déterminé pour la diminution du taux des lymphocytes B. Une BMCL 0,5 SD.de 0,476 ppm est calculée et un ajustement à une durée d’exposition continue a été pratiqué : BMCL0,5SD ADJ = BMCL0,5SD x 10 m3/20 m3 x 6 j/7 j = 0,204 ppm. La concentration humaine équivalente a ensuite été calculée en utilisant le facteur par défaut de 1.
Facteurs d’incertitude : un facteur de 200 est retenu correspondant à un facteur de √10 pour l’incertitude liée au fait que l’étude retenue est une étude sub-chronique et 60 (2) pour la variabilité au sein de l’espèce humaine. Ce facteur de 60 est employé pour tenir compte des différences intra-espèces qui regroupent les différences de polymorphisme des gènes et les différences de toxicocinétique au sein d’une population (nouveau-né, enfant et adulte).
Calcul : 0,204 ppm x 1/200 = 0,001 ppm (3 μg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Le TCEQ propose une ReV de 280 µg.m-3 pour une exposition chronique au benzène par inhalation (2015)
Cette valeur a été établie à partir de l’étude de Rothman et al. (1996a), réalisée en milieu professionnel sur 44 salariés exposés au benzène et 44 sujets non exposés (témoins). L’effet critique retenue est la baisse du nombre total de lymphocytes observée dans le groupe des 22 travailleurs les moins exposés au benzène (effet le plus sensible), conforté par l’hématotoxicité également observée dans l’étude de Lan et al., (2004).
Le TCEQ s’est appuyé sur l’analyse benchmark concentration (BMC) de l’US EPA et a retenu la même BMCL de 7,2 ppm (soit 23 mg.m-3) comme point de départ (POD) qui correspond à la limite inférieure de l’intervalle de confiance à 95 % de la dose repère sur 8 heures de 13,7 ppm.
Du fait d’une exposition discontinue dans l’étude retenue, un ajustement sur la durée en continue a été réalisée :
PODHEC = 7,2 ppm x 10 m3/20 m3 x 5 jours/7 jours = 2,6 ppm
Facteurs d'incertitude : un facteur d'incertitude de 30 a été retenu correspondant à un facteur 10 pour la variabilité au sein de la population, un facteur 3 pour tenir compte des limites et incertitudes de la base de données (absence d’étude de reproduction sur 2 générations).
Calcul : ReVchronique = = 2,6 ppm / 30 = 0,086 ppm (280 µg.m-3)
Indice de confiance : Le TCEQ accorde un indice de confiance moyen à l’étude et à la base de données.
Effets à seuil - Exposition chronique par voie orale:
L’ATSDR propose un MRL 5.10-4 mg.kg-1.j-1 pour une exposition chronique au benzène par voie orale (2007)
Cette valeur est basée sur la même étude épidémiologique (Lan et al., 2004) que celle retenue pour l’élaboration du MRL pour une exposition chronique par inhalation. De la même manière, cette étude a permis de définir un BMCL0,25sd de 0,10 ppm pour une diminution significativement du nombre de lymphocytes B. Un ajustement au temps a été réalisé pour ramener à une exposition continue (6 j/7 j) (8 h/24 h).
LOAECADJ = 0,10 ppm x (6 j/7 j) x (8 h/24 h) = 0,03 ppm
Une conversion a été pratiquée en tenant compte du poids moléculaire du benzène 78,11 à 25 °C et 760 mm de Hg. Puis, une extrapolation voie à voie a été réalisée prenant un volume inhalé pour l’homme de 20 m3/jour, un poids corporel pour l’homme de 70 kg et un facteur d’ajustement pour prendre en compte les différences d’absorption entre les deux voies de 0,5.
0,03 ppm x 78,11/24,45 x 20 m3/j x 0,5/70 kg = 0,014 mg.kg-1.j-1
Facteurs d’incertitude : un facteur d’incertitude de 30 a été appliqué correspondant à un facteur 10 la variabilité au sein de la population et un facteur de 3 pour les incertitudes liées à l’extrapolation voie à voie.
Calcul : 0,014 mg.kg-1.j-1 x 1/30 = 0,00046 mg.kg-1.j-1 (arrondi à 0,0005 mg.kg-1.j-1)
Indice de confiance : cet organisme n’accorde pas d’indice
L'US EPA (IRIS) propose une RfD de 4.10-3 mg.kg-1.j-1 pour une exposition chronique au benzène par voie orale (US EPA (IRIS), 2003).
Cette valeur est basée sur une extrapolation voie à voie de la dose repère modélisée à partir de l'étude de Rothman et al. (Rothman et al., 1996b). La BMCL, égale à 8,2 mg.m-3 (après ajustement pour une exposition continue) a servi à calculer une RfD de 4.10-3 mg.kg-1.j-1, en se basant sur un taux d'absorption de 50 % par inhalation, et de 100 % par voie orale, soit un coefficient de 0,5. La dose est alors rapportée à un individu de 70 kg :
8,2 mg.m-3 x 20 m3/j x 0,5/70 kg = 1,171 mg.kg-1.j-1
Facteurs d’incertitude : Les mêmes facteurs d'incertitude que pour la RfC ont été appliqués. Un facteur 270 arrondi à 300 a été appliqué correspondant à un facteur 3 pour l'utilisation d'une BMCL au lieu d'un NOAEL, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour l'extrapolation d'une durée subchronique d'exposition (< 7 ans) à une durée chronique et un facteur 3 pour le manque de données sur les effets du benzène sur la reproduction et le développement.
Calcul : 1,171 mg.kg-1.j-1 x 1/300 = 4.10-3 mg.kg-1.j-1
Indice de confiance : La confiance dans l’étude, la base de données et la RfD est moyenne.
Effets sans seuil - Exposition chronique par inhalation:
L’US EPA (IRIS) a établi un ERUi de entre 2,2 et 7,8.10-6(µg.m-3)-1 pour une exposition au benzène par inhalation (US EPA, 1998).
Ces valeurs ont été établies à partir d’études épidémiologiques rapportant la survenue de leucémies lors d’exposition professionnelles par inhalation à des vapeurs de benzène dans la cohorte Pliofilm de 1 165 employés ayant travaillé au moins 1 jour dans l’une des deux usines (industrie du caoutchouc) avec un suivi du risque de décès par leucémies allant de 1965 à 1981 (Ott et al., 1978 ; Rinsky et al., 1981 ; Rinsky et al., 1987 ; Wong, 1987). Le calcul d’extrapolation utilise un modèle d’extrapolation linéaire aux faibles concentrations. Compte tenu des incertitudes liées au mécanisme d’action du benzène, le choix d’un modèle linéaire d’analyse aux faibles doses comme approche par défaut a été retenu pour le calcul de l’excès de risque à partir de l’estimation de l’exposition des travailleurs (Cronkite et al., 1985 ; Crump et Allen, 1984 ; Paustenbach et al., 1992; Crum et al., 1994). Les ERU données par Crump et al. (1994) et retenus par l’US EPA s’étendent de 2,2 10-6 à 7,8 ((µg.m-3)-, la plus faible dérivant des expositions cumulées estimées par Paustenbach et al. (1992) et la plus forte des expositions estimées par Crump et al. (1984).
L’OMS propose une valeur d’ERUi de 6.10-6 (µg.m-3)-1 pour une exposition au benzène par inhalation (OMS, 2000).
Cette valeur a été retenue par le conseil supérieur d’hygiène publique de France dans le cadre de la directive relative à la pollution de l'air ambiant (1997). Il s’agit de la valeur retenue par la directive de la qualité de l’air et confirmée en 2000 par l’OMS. Les études retenues par l’OMS sont celles de la cohorte Pliofilm (Rinsky et al., 1981 ; Rinsky et al., 1987) et celles de Crump, Nomiyamaet Paustenbach (Crump et Allen, 1984 ; Nomiyama et Nomiyama, 1974a ; Paustenbach et al., 1992). Deux types de modèles mathématiques intégrant la multiplication des risques et l’accumulation des concentrations de benzène ont été utilisés pour calculer le risque, un modèle linéaire et un modèle non linéaire. Les risques obtenus pour une même matrice d’exposition et pour les deux types de modèles (linéaire et non linéaire) sont soient identiques pour la matrice de Crump et Allen, 1984 (risque de 7,5.10-6 pour 1 μg.m-3 de benzène) soient très proches pour la matrice de Paustenbach et al. (1992) (risque de 4,7.10-6 pour 1 μg.m-3 de benzène avec un modèle linéaire et risque de 4,4.10-6 pour 1 μg.m-3 de benzène avec un modèle non linéaire).
Santé Canada propose une valeur d’ERUi de 1,6.10-5 (µg.m-3)-1 pour une exposition chronique au benzène par inhalation (Santé Canada, 2021).
Cette valeur a été établie à partir des études épidémiologiques réalisées sur les cohortes de travailleurs du Pliofilm (Etats-Unis) et des travailleurs chinois exposés au benzène, ce dernier étant le seul solvant hématotoxique présent sur le lieu de travail (Rinsky et al., 1987; Paxton et al., 1994; Hayes et al., 1997). Concernant l’analyse des données épidémiologiques, un modèle de régression de Poisson et un modèle de risque relatif linéaire ont été utilisés. Des plages acceptables d’excès de risque unitaire de leucémies ont été estimées entre 0,010 et 0,048 ppm-1 (0,0031 et 0,015 (mg/m3)-1) pour la cohorte Pliofilm et entre 0,0054 et 0,087 ppm-1 (0,0017 et 0,027 (mg/m3)-1) pour la cohorte de travailleurs chinois. Santé Canada a retenu la moyenne géométrique des risques unitaires les plus justifiables de la cohorte Pliofilm (0,044 ppm-1 (0,014 mg/m3)-1) et de la cohorte de travailleurs chinois (0,056 ppm-1 (0,018 mg/m3)-1), soit 0,050 ppm-1 (0,016 mg/m3)-1 sur la base de l’incidence totale de la leucémie.
Le RIVM propose un CRinhal de 2.10-2 mg.m-3 soit une valeur de 5.10-6 (µg.m-3)-1 pour une exposition chronique au benzène par inhalation (Baars et al., 2001).
Cette concentration dans l'air correspond à un excès de risque cancérogène de 1.10-4 pour une exposition continue durant toute la vie. Elle correspond à la limite inférieure de l'estimation du risque cancérogène issu du groupe de travail de l'Union Européenne (CE, 1999). Cette valeur est aussi considérée comme protectrice pour les effets hématotoxiques du benzène. Le CRinhal de 2.10-2 mg.m-3 correspond à 5.10-3 (mg.m-3)-1 soit 5.10-6 (µg.m-3)-1.
Selon le RIVM, la fiabilité de cette valeur est élevée.
L’OEHHA propose un ERUi de 2,9.10-5 (µg.m-3)-1 pour une exposition chronique au benzène par inhalation (OEHHA, 2011).
Cette valeur a été établie à partir de données issues d’expérimentations animales (NTP, 1983 ; Maltoni et al., 1983) et d’études épidémiologiques humaines issues des cohortes de travailleurs exposés au benzène par inhalation dans l’industrie de la chaussure (Aksoy et al., 1974, 1976 et 1977) et dans l’industrie du caoutchouc (cohorte américaine Pliofilm) (Rinsky et al., 1981 ; Infante et al.1984.. Des relations dose-réponses pour les cancers des glandes de Zymbal, du prépuce, des mamelles, des lymphomes ou leucémies ont retenues chez l’animal, et des leucémies chez l’humain. La VTR est la moyenne des 12 relations dose-réponses de cancers obtenues à partir des études expérimentales et épidémiologiques, soit 0,050 ppm-1 ou 2,9.10-5 (µg.m-3)-1. A noter que dans les calculs, la conversion des mg.kg-1.j-1 en µm.m-3 fait par l’OEHHA utilise un poids corporel de 60 kg et un débit respiratoire de 20 m3.j-1.
L’ANSES propose un ERUi de 2,6.10-5 (µg.m-3)-1 pour une exposition chronique au benzène par inhalation (Anses, 2014).
Cette valeur est établie sur la base des données de la cohorte Pliofilm de l’Ohio et notamment l’actualisation de 2002 (Rinsky et al., 2002) ré-analysée en 2008 par Richardson. L’effet critique retenu est l’augmentation des leucémies aiguës au cours d’expositions professionnelles au benzène. L’excès de risque (RR) de 1,19 [1,10-1,29] (Intervalle de confiance à 95 %) pour une exposition cumulée de 10 ppm-année au benzène dans les 10 ans suivant la fin de l’exposition. C’est la borne supérieure de l’intervalle de confiance qui est retenue afin de prendre en compte les différences de sensibilité au sein de la population. La valeur d’excès de risque unitaire a été calculée selon la formule ci-dessous. Pour convertir les ppm-années en µg.m-3 d’exposition continue, la même démarche que celle utilisée par l’US EPA a été retenue : exposition professionnelle discontinue, soit 250 jours par an et 10 m3 d’air inhalé sur 20 m3.j-1 soit 0,34 ppm d’exposition continue pour 1 ppm d’exposition discontinue au travail. Le facteur de conversion des ppm en µg.m-3 est de 3200 µg.m-3 par ppm. Au total, 1 ppm de benzène en exposition professionnelle est égale à 1,096 mg.m-3 de benzène pour une exposition continue.
RR/ppm-année-1
ERU = ---------------------------------------------------------------------
Facteur de conversion x exposition (ppm-année en µg.m-3)
Avec :
- RR : limite supérieure de l’intervalle de confiance du risque relatif soit 1,29
- Facteur de conversion : 1 ppm de benzène en exposition professionnelle est égale à 1,096 mg.m-3 de benzène pour une exposition continue
ERU : 2,6.10-5 (µg.m-3)-1 soit une dose de 0,038 µg.m-3 pour un risque de 10-6 , une dose de 0, 38 µg.m-3 pour un excès de risque de 10-5 une dose de 3,8 µg.m-3 pour un risque de 10-4.
Indice de confiance : L’ANSES attribue un niveau de confiance fort dans cette valeur, ce qui correspond à un niveau élevé dans le choix de l’effet critique, un niveau fort dans la qualité de l’étude, un niveau fort dans le choix de la dose critique.
Le TCEQ propose une valeur un ERUi de 2,2.10-6 (µg.m-3)-1 pour une exposition vie entière au benzène par inhalation (TCEQ, 2014).
La démarche du TECQ est similaire à celle réalisée par l’US EPA, et se base également sur l’excès de risque de mortalité par leucémie dans la cohorte Pliofilm (Ott et al., 1978 ; Rinsky et al., 1981 ; Rinsky et al., 1987 ; Wong, 1987). Le TCEQ fait le même choix d’un modèle linéaire à faibles doses mais ne retient que la plus faible des valeurs ERU de 2,2 10-6 ((µg.m-3)-1 donnée par Crump et al. (1994) et qui correspond à la plus forte valeur d’exposition cumulée. Le TCEQ retient une concentration de 4,5 µg.m-3 (1,4 ppb) pour un excès de risque de 10-5 et 0,45 µg.m-3 (0,14 ppb) pour un excès de risque de 10-6 pour les leucémies myéloblastiques et monocytiques aiguës.
Effets sans seuil - Exposition chronique par voie orale:
L’US EPA (IRIS) a établi un ERUo entre 1,5 et 5,5.10-2 (mg.kg-1.j-1)-1 pour une exposition par voie orale (US EPA (IRIS), 2000).
Cette valeur est extrapolée à partir de la relation dose-effet lors d’une exposition par inhalation. Le taux d’absorption par inhalation est estimé à 50 % de celui de la voie orale. Cette estimation du taux d’absorption est effectuée à partir de nombreuses données d’études réalisées chez l’homme ou l’animal principalement celles utilisées pour l’établissement de l’ERUi à savoir les études épidémiologiques réalisées en milieu professionnel lors d’expositions par inhalation à des vapeurs de benzène (Rinsky et al., 1981 ; Rinsky et al., 1987). Les concentrations associées à différents niveaux de risque sont :
- entre 0,18.10-4 et 0,66.10-4 mg.kg-1.j-1 pour un risque de 10-6,
- entre 1,8.10-4 et 6,6. 10-4 mg.kg-1.j-1 pour un risque de 10-5.
-
Le RIVM propose un CRoral provisoire de 3,3.10-3 mg.kg-1.j-1 pour une exposition par voie orale (Baars et al., 2001).
Cette concentration correspond à un excès de risque cancérogène de 1.10-4 pour une exposition continue durant toute la vie. En appliquant une extrapolation voie à voie, il a été estimé que la valeur de 2.10-2 mg.m-3 correspondait à une absorption par voie orale de 3,3.10-3 mg.kg-1 (en considérant 50 % d'absorption par inhalation et 100 % d'absorption par voie orale). Par analogie avec l'exposition par inhalation, le RIVM considère que cette valeur protège également la population contre les effets non cancérogènes du benzène. La valeur de 3,3.10-3 mg.kg-1.j-1 correspond à une valeur de 1.10-4 x 1/3,3.10-3 mg.kg-1.j-1 soit 0,03 (mg.kg-1.j-1)-1.
Selon le RIVM, la fiabilité de cette valeur est moyenne, en raison de l'extrapolation voie à voie. Pour cette même raison, cette valeur est considérée comme provisoire.
L’OEHHA a établi un ERUo de1.10-1 (mg.kg-1.j-1)-1 pour une exposition par voie orale (2011).
Cette valeur est calculée par extrapolation voie à voie. Elle a été proposée par le CDHS en 1988. Le détail du calcul n’est pas précisé. Les concentrations associées à différents niveaux de risque sont :
- 10-5 mg.kg-1.j-1 pour un risque de 10-6,
- 10-4 mg.kg-1.j-1 pour un risque de 10-5.
-
Santé Canada a établi un ERUo de 8,3.10-2 (mg.kg-1.j-1)-1 pour une exposition par voie orale (2021).
Cette valeur est établie à partir d’une étude expérimentale chez les rats et les souris exposées au benzène par gavage (huile de maïs), 5 jours par semaine pendant 2 ans (NTP, 1986). L’effet critique retenu est la survenue de lymphomes malins chez les rats femelles et d’hyperplasies de la moelle chez les rats mâles. La valeur a été dérivée au moyen d’un modèle linéarisé multi-étapes et un ajustement allométrique. La valeur est basée sur l’estimation de la limite supérieure de ERUeau de 4,17.10-6 (µg.L-1)-1 pour l’hyperplasie hématopoïétique de la moelle chez le rat mâle et qui correspond à la sensibilité la plus élevée. L’’ERU de 2,03.10-6 (µg.L-1)-1 correspondant à un excès de risque pour les lymphomes malins chez le rat femelle, moins sensible n’a pas été retenu.
Le TCEQ a établi un ERUo de 1,5.10-2 (mg.kg-1.j-1)-1 pour une exposition par voie orale (TCEQ, 2001).
Le TCEQ reprend la plus faible des valeurs recommandées par l’US EPA (2000), celles-ci étant construites à partir d’une extrapolation voie à voie des données humaines de la cohorte Pliofilm.
-
Attention : à date du 13/02/2025 un document de l'ATSDR est en projet qui pourra conduire prochainement à une modification de ses valeurs de référence
[1] Les différences au sein de l’espèce humaine considérées correspondent à un polymorphisme du métabolisme entre les individus (facteur 10) et un changement de l’activité de l’hématopoïèse chez l’enfant par rapport à un adulte ou un nouveau-né (facteur √10).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation:
L’Ineris propose de retenir pour une exposition aiguë au benzène par inhalation une valeur de 28 µg.m-3 arrondie à 30 µg.m-3 (ATSDR, 2007).
Trois organismes proposent des valeurs : l’ATSDR (2007), l’OEHHA (2014) et le TCEQ (2015). L’OEHHA propose deux valeurs, l’une pour une exposition aiguë et l’autre pour une exposition de 8 heures. Celle pour une exposition aiguë est basée sur une étude sur le développement qui n’est pas recommandée pour l’élaboration de ce type de valeur. Celle pour une exposition de 8 heures étant élaborée à partir d’exposition chronique n’est pas jugée pertinente. Les valeurs établies par l’ATSDR et le TCEQ sont construites à partir de la même étude aiguë par inhalation chez la souris (Rozen et al.1984). Cette étude est de bonne qualité. L’effet critique correspondant à une atteinte du système hématopoïétique mise en évidence par une diminution du nombre de lymphocytes périphériques ainsi qu’une diminution de la prolifération lymphocytaire après une stimulation par des mitogènes est cohérent avec le profil toxicologique du benzène. Les deux organismes envisagent un ajustement temporel. Pour sa valeur pour 1h d’exposition, le TCEQ pratique un ajustement sur 1h, mais aucun ajustement pour sa valeur de 24h. L’ATSDR propose un ajustement pour tenir compte du caractère discontinu de l’exposition. La démarche de l’ATSDR est celle habituellement retenue. Concernant l’application des facteurs d’incertitude, les deux organismes appliquent un facteur 3 pour tenir compte de l’extrapolation de l’animal à l’homme et un facteur 10 pour la variabilité au sein de la population humaine ce qui apparait justifié. La seule différence réside dans le choix du facteur pour prendre en compte l’utilisation d’une LOAEC : l’ATSDR retient un facteur 10 alors que le TCEQ prend un facteur 3. Le raisonnement relatif à la construction de la valeur et les facteurs d’incertitude utilisés par l’ATSDR sont jugés plus pertinents.
La valeur de l’ATSDR ainsi obtenue est de bonne qualité et a été retenue par l’AFSSET pour l’élaboration d’une VGAI pour une exposition aiguë. Au final, c’est donc la valeur de l’ATSDR qui est recommandée par l’Ineris.
Indice de confiance : élevé en raison de la pertinence de l’étude clé et de la transparence de la construction de la VTR
Effets à seuil - Exposition sub-chronique par inhalation:
L’Ineris propose de retenir pour une exposition subchronique au benzène par inhalation une valeur de 19 µg.m-3 arrondie à 20 (ATSDR, 2007).
Cette valeur est basée sur la valeur de l’ATSDR qui est la seule VTR disponible. L’étude est de bonne qualité et la construction de la VTR est adaptée. Cette valeur a été évaluée par l’AFSSET pour l’élaboration d’une VGAI pour une exposition subchronique par inhalation et a été retenue car jugée comme étant de bonne qualité.
Indice de confiance : L’Anses accorde un indice élevé à sa valeur
Effets à seuil - Exposition chronique par inhalation:
L’Ineris propose de retenir pour une exposition chronique au benzène par inhalation une valeur de 9,75 µg.m-3 arrondi à 10 (ATSDR, 2007).
Quatre organismes proposent des VTR, l’ATSDR (2007), le TCEQ (2007), l’US EPA (2003) et l’OEHHA (2014). Ces différentes valeurs reposent sur des études épidémiologiques différentes : Lan et al. (2004) pour l’ATSDR et l’OEHHA, et Rothman et al.(1996b) pour l’US EPA et le TCEQ. Ces deux études sont de suffisante qualité. Les effets critiques retenus sont proches et correspondent aux effets sensibles les plus pertinents chez l’homme, c'est-à-dire des altérations des paramètres hématologiques. Les quatre organismes pratiquent une approche par benchmark concentration. L’étude retenue par l’ATSDR et l’OEHHA permet d’accéder à des informations convergentes mais plus précises que celles de l’US EPA et le TCEQ. La différence entre les valeurs proposées par l’ATSDR et l’OEHHA réside essentiellement dans le choix des facteurs d’incertitude. Les facteurs d’incertitude proposés par l’OEHHA ne sont pas en accord avec ceux usuellement retenus.
En accord avec l’analyse des VTR disponibles réalisée par l’AFSSET (2008) et développée dans le cadre des valeurs guides pour l’air intérieur, l’Ineris propose de retenir la valeur de l’ATSDR de 9,75 µg.m-3 arrondi à 10 µg.m-3.
Indice de confiance : élevé en raison de la qualité des données et de la transparence de la construction
Effets à seuil - Exposition chronique par voie orale:
L’Ineris propose de retenir une valeur de 5.10-4 mg.kg-1.j-1 pour une exposition chronique au benzène par voie orale (ATSDR, 2007).
Deux organismes proposent des valeurs, l’US EPA (2003) et l’ATSDR (2007). Dans les deux cas, ces valeurs sont établies par extrapolation voie à voie à partir des VTR par inhalation selon une démarche identique. Cette démarche est acceptable dans ce cas puisque les organes cibles sont les mêmes pour les deux voies d’exposition. Par souci de cohérence, dans la mesure où la VTR de l’ATSDR a été retenue pour une exposition par inhalation c’est la valeur de l’ATSDR qui sera retenue pour une exposition par voie orale.
Indice de confiance : faible compte–tenu de la démarche d’extrapolation voie à voie.
Effets sans seuil - Exposition chronique par inhalation:
L’Anses propose de retenir une valeur de 2,6.10-5(µg.m-3)-1 pour une exposition chronique au benzène par inhalation (Anses, 2014).
L’US EPA (1998), l’OMS (2000), Santé Canada (2021), le RIVM (2001), le TCEQ (2007), l’OEHHA (2011) et l’ANSES (2014) proposent des valeurs différentes. La démarche retenue par Santé Canada, le RIVM et l’OEHHA manque de transparence ; seules les méthodes de calcul et d’extrapolation de l’OMS, de l’US EPA et du TCEQ sont bien décrites. Les valeurs proposées par ces trois organismes sont basées sur les mêmes études et les valeurs obtenues sont du même ordre de grandeur. En 2014, l’ANSES propose une nouvelle valeur basée sur le même corpus de données que celles retenues par l’US EPA, le TCEQ et l’OMS, mais bénéficie des données actualisées de la cohorte Pliofilm en 2002. Cette valeur construite sur l’occurrence des leucémies aiguës est retenue, bien que des données plus récentes concernant notamment une cohorte chinoise soient susceptibles de modifier cette valeur. L’Ineris retient la valeur de l’Anses.
Les concentrations associées à différents niveaux de risque sont :
- 0,038 µg.m-3 pour un risque de 10-6,
- 0, 38 µg.m-3 pour un excès de risque de 10-5
3,8 µg.m-3 pour un risque de 10-4.
Indice de confiance : élevé pour la qualité des données et transparence de la construction.
Effets sans seuil - Exposition chronique par voie orale:
L’Ineris propose de retenir une valeur de 1,5 et 5,5.10-2 (mg.kg-1.j-1)-1 pour une exposition chronique au benzène par voie orale (US EPA, 2000).
Quatre organismes proposent des valeurs le RIVM (2001), l’US EPA (2000), l’OEHHA (2011) et Santé Canada (2021).
Le RIVM, l’US EPA et l’OEHHA proposent des valeurs élaborées par extrapolation voie à voie à partir des valeurs retenues par inhalation. Santé Canada propose une valeur basée sur les données chez le rat à partir d’une étude par voie orale. Ces valeurs sont peu détaillées et ne permettent pas de juger de la qualité de chacune des étapes.
Dans la mesure où les valeurs de l’US EPA ont été jugées pertinentes pour des expositions par inhalation, ce sont également celles de l’US EPA qui seront retenues pour des expositions par voie orale. Cette valeur est de qualité faible. Les concentrations associées à différents niveaux de risque sont :
- entre 0,18.10-4 et 0,66.10-4 mg.kg-1.j-1 pour un risque de 10-6,
- entre 1,8.10-4 et 6,6. 10-4 mg.kg-1.j-1 pour un risque de 10-5.
La valeur développée par Santé Canada à partir des données expérimentales chez le rat pour une exposition par voie orale est très proche de celle proposée par l’US EPA.
Indice de confiance : faible en raison de l’utilisation d’une extrapolation voie à voie.
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 21/07/2025
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC
Dangers
Description
Ecotoxicité aquatique
Paramètres d’écotoxicité aiguë :
|
Daphnia magna |
10 |
Janssen et Persoone, 1993 |
|||
|
Artemia salina |
CL50 (48 h) |
20 |
Price et al., 1974 |
||
|
Oncorhynchus mykiss |
CL50 (96 h) |
5,3 |
DeGraeve et al., 1982 |
||
*Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
Algues
L’essai avec Selenastrum capricorntum a été réalisé en système clos et les concentrations ont été suivies analytiquement.
Invertébrés
Aucun dosage n'a été effectué au cours de l’essai sur Daphnia magna mais l’essai a été réalisé en récipients fermés pour limiter la volatilisation de la substance. La validité des essais sur invertébrés marins n’a pas pu être établie, faute d’informations précises. Les résultats sont cependant cohérents avec ceux trouvés pour Daphnia magna.
Poissons
Les essais poissons retenus sont des essais qui ont été validés car prenant en compte la volatilité de la substance par des dosages réguliers ainsi que par la mise en œuvre d'un renouvellement continu du milieu. De nombreux autres résultats sont disponibles qui confirment les résultats ci-dessus. Aucune différence significative entre organismes d’eaux douces et organismes marins n’a pu être observée.
Paramètres d’écotoxicité chronique:
|
CE10 (72 h)b** |
8,3 |
||||
|
Ceriodaphnia dubia |
3 |
Niederlehner et al., 1998 |
|||
|
Pimephales promelas |
NOEC (32 j) |
0,8 |
Russom et Broderius, 1991 |
||
** b : biomasse, c : taux de croissance
Invertébrés
Les résultats obtenus avec Ceriodaphnia dubia sont basés sur des concentrations mesurées.
Poissons
L’essai rapporté ci-dessus a été réalisé en système dynamique avec suivi analytique des concentrations et est donc considéré comme valide.
D’autres essais sur le poisson Oncorhynchus mykiss et les amphibiens Rana pipiens et Ambystoma gracile ont été rapportés par Black et al. (1982) mais ne sont pas considérés comme valides car ils n'ont jamais pu être reproduits
Sédiments
Aucun résultat avec des organismes benthiques n’est disponible.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Ecotoxicité aiguë
Algues : la CE50 (72 h) est de 29 mg.L-1 pour Selenastrum capricornutum.
Invertébrés : la CE50 (48 h) est de 10 mg.L-1 pour Daphnia magna.
Poissons : la CL50 (96 h) est de 5,3 mg.L-1 pour Oncorhynchus mykiss.
Ecotoxicité chronique
Algues : la CE10 (72 h) est de 8,3 mg.L-1 pour Selenastrum capricornutum
Invertébrés : la NOEC (7 j) est de 3 mg.L-1 pour Ceriodaphnia dubia.
Poissons : la NOEC (32 j) est de 0,8 mg.L-1 pour Pimephales promelas.
Sédiments d'eau douce
Aucun résultat avec des organismes benthiques n’est disponible.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Valeurs de référence pour la surveillance des écosystèmes
Le benzène est une substance dangereuse prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE, transposée par l’arrêté du 27 juillet 2015).
Elle est réglementée au niveau européen (substance de l’état chimique) par une Norme de Qualité Environnementale, ou NQE, définie comme la « concentration d’un polluant ou d'un groupe de polluants dans l'eau, les sédiments ou le biote qui ne doit pas être dépassée, afin de protéger la santé humaine et l'environnement ».
En pratique, la NQE est la norme de qualité la plus basse parmi 5 objectifs de protection couvrant la protection des organismes aquatique de la colonne d’eau, les organismes sédimentaires, les prédateurs se nourrissant dans les milieux aquatiques, et l’homme via la consommation de produit de la pêche ou d’eau de boisson. La détermination de ces normes suit une méthodologie spécifique qui a été élaborée au niveau européen (Technical Guidance For Deriving Environmental Quality Standards) (EC, 2018).
Les valeurs réglementaires ici mentionnées sont extraites des fiches NQE établies par la Commission Européenne.
Bibliographie
Données technico-économiques
Dernière vérification le 28/04/2025
Tableaux de synthèse
Généralités
| CAS | 71-43-2 |
|---|---|
| SANDRE | 1114 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | oui |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. Substance prioritaire de la directive cadre sur l'eau. La directive 1999/13/CE sur la réduction des émissions des COV a pour conséquence indirecte de réduire l'emploi du benzène La directive 87/677/CE limite à 0,1 % en poids la teneur en benzène des préparations industrielles (sauf pour les carburants et les préparations industrielles ne permettant pas l'émission de benzène en quantité supérieure à la législation existante). La directive 98/70/CE limite la concentration en benzène dans les carburants à 1 % en volume. La directive 94/63/CEE du 20 décembre 1994 relative à la lutte contre les émissions de composés organiques volatils (COV) résultant du stockage de l'essence et de sa distribution des terminaux aux stations service, tend à réduire les émissions atmosphériques de benzène. Enfin, la Directive n° 2000/69/CE du 16 novembre 2000 fixe les limites suivantes relatives aux concentrations moyennes annuelles en benzène dans l'atmosphère :
L'arrêté national du 2 février 1998 impose une valeur limite de 1,5 mg.l-1 en moyenne mensuelle dans les rejets dont le flux dépasse 1 g.j-1. La Circulaire du 13 juillet 2004 relative aux Installations classées, et portant sur la stratégie de maîtrise et de réduction des émissions atmosphériques toxiques pour la santé, indique qu'il faut améliorer la connaissance des émissions de benzène par les cokeries, et que les émissions de benzène des raffineries doivent être réduites via les actions de réduction des COV |
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
Dans l'Union européenne des 15, la capacité de production de benzène était en 2000 de 8 100 kt.an-1, répartie sur 57 sites de production (Commission européenne, 2002).
En France, en 2000, la capacité de production était de 1030 kt.an-1 (Commission européenne, 2002), répartie sur huit sites de production :

La production effective aurait été sur la période 1994 2002 de 880 kt.an-1, dont environ 5 % à partir de charbon, selon (Commission européenne, 2002/2003)
La production européenne est actuellement stable ou en légère régression, après une période de croissance passée (Commission européenne, 2002).
Le prix du benzène s'est situé entre 200 et 400 $ par tonne sur la période 1993 1998, avec une tendance à la baisse et une forte variabilité (de l'ordre de 30 à 40 %). La baisse s'est arrêtée depuis 2002 par rapport aux prix du naphta [IFP, 2003]. Depuis, les cours du benzène ont subi une envolée en 2004 et ont dépassé les 1 000 $ par tonne. La raison serait la hausse des cours du pétrole et surtout une faiblesse de l'offre, due à une fermeture de sites et simultanément une demande mondiale soutenue.
Historiquement, les marchés des aromatiques sont en général très volatils et en général caractérisés par un surplus de production. Leur profitabilité est donc variable. (Commission européenne, 2002). Les prix bas du benzène ont incité certain producteurs à se désengager. Aujourd'hui, la situation est inverse et les prix devraient rester très élevés tant que de nouvelles capacités de production ne seront pas mises en service. (Plastics News International Magazine, 2004) (Chimie Pharma Info, 2004).
Cette situation économique montre bien toute l'importance stratégique du benzène pour la chimie organique et la faible élasticité de la demande par rapport au prix.
Procédés de production
Le benzène est obtenu par récupération, principalement à partir des deux sources suivantes, dans les raffineries :
- l'essence de pyrolyse (« pygas »)
- les essences de reformage (« reformates »)
En général, les unités qui produisent du benzène co produisent également du toluène et du xylène, qui sont ensuite soit séparés du benzène soit convertis en benzène (Commission européenne, 2002).
Le benzène peut également être récupéré, mais en quantités bien inférieures, dans les goudrons de houille (« coal tar »).
Enfin, on récupère parfois un mélange BTX contenant 60 % de benzène dans des gaz de cokeries (« coke oven gas ») (Commission européenne, 2000).
Utilisations
Chimie organique
Le benzène est une des molécules qui sont à la base de la chimie organique. C'est donc un intermédiaire pour une très grande gamme de produits organiques de base.
La demande de benzène mondiale a été orientée à la hausse entre 1998 et 2003 en moyenne, avec un taux de croissance annuel d'environ 3 %, qui devrait se poursuivre.
Le benzène est utilisé pour produire de nombreux produits chimiques, principalement le styrène via l'éthylbenzène (50 % du benzène utilisé), le cumène (dont dérive le phénol)
(21 %), le cyclohexane (13 %) (Commission européenne, 2002), le nitrobenzène, des nitrophénols, les alkylbenzènes, l'anhydride maléique et les chlorobenzènes.
Ces produits donnent lieu à leur tour à la production d'une vaste gamme de produits de très grande diffusion : des polymères et caoutchoucs, des détergents, parfums, colorants, additifs alimentaires, des solvants, des pesticides, des explosifs, des plastifiants, des médicaments.
Dans le domaine de la pharmacie, le benzène reste utilisé comme solvant et réactif pour des productions spécifiques, mais cet usage semble ne concerner que peu de sites en France.
Carburants
Le benzène est utilisé comme additif dans l'essence sans plomb à une concentration inférieure à 1 %.
Industrie cosmétique
Le benzène peut être utilisé comme solvant d'extraction dans l'industrie des parfums, mais un acteur du secteur pense que cet usage est quasiment voire complètement abandonné.
Laboratoires
Le benzène est utilisé comme solvant et réactif de laboratoire, en très petites quantités et son usage est déclinant.
Utilisation en tant que solvant dans l'industrie
Il semble que cet usage soit cantonné à des applications très spécifiques (extraction particulières). Le benzène pourrait être présent dans des solvants ou diluants utilisés en imprimerie, dans des peintures, des produits de nettoyage/dégraissage. (Huez D., 2001)
Utilisation dans des produits domestiques
Très mal connue (dissolvant, décapant, cirage,…), mais probablement très marginale.
Rejets dans l’environnement
Sources naturelles
Le benzène est présent naturellement à de très faibles concentrations dans l'environnement. Des sources sont les émanations de certaines plantes, la combustion de biomasse, donc, outre la combustion du bois, les feux de forêt.
Émissions atmosphériques
Les rejets de benzène dans l'environnement sont essentiellement atmosphériques.
Ces rejets entraînent une contamination chronique de l'air par le benzène, notamment dans les agglomérations, ce qui conduit également à une contamination d'une part par dépôt sec, d'autre part par les eaux de pluie, qui constituent donc une voie d'apport pour les eaux de surface.
La concentration dans les eaux de pluie peut atteindre 0,5 µg.l-1 dans certaines agglomérations (Commission européenne, 2002/2003), mais est probablement inférieure en moyenne d'un facteur supérieur à 10 en France.
Très peu de données sont disponibles sur le dépôt sec de benzène.
Dans les rejets atmosphériques, sur un total de 40 kt en 2002 en France, les principales contributions sont celles du secteur résidentiel/tertiaire (combustion de biomasse, avec près de 60 % des émissions nationales en 2002) et des transports routiers (combustion d'hydrocarbures, environ 25 % des émissions) (CITEPA, 2002 et 2004). Les principales sources atmosphériques sont donc diffuses donc a priori plus délicates à contrôler que les émissions ponctuelles.
Les émissions atmosphériques de benzène sont orientées à la baisse ( 17 % entre 1999 et 2002 selon le CITEPA), suivant en cela la tendance générale pour les COV non méthaniques.
Concernant les rejets atmosphériques des sources industrielles, le registre européen des émissions des installations IPPC (EPER) enseigne que les principaux contributeurs en 2001 seraient le raffinage, la chimie, les aciéries. Les installations de combustion appartenant à d'autres secteurs peuvent aussi émettre du benzène. À cet égard, les combustibles ne sont pas équivalents : le gaz naturel est plus émetteur que le charbon, lui même plus émetteur que le fuel (CITEPA, 2004). Le total des émissions industrielles EPER est de 535 t pour la France (donc effectivement négligeables devant les secteurs résidentiel et des transports routiers).
Émissions vers les eaux
- Rejets directs dans les milieux aquatiques
Le benzène est a priori présent dans les rejets d'installations industrielles qui le produisent et de celles qui l'utilisent. Les rejets liés à l'utilisation seraient plus importants que ceux liés à la production de benzène.
Des rejets directs dans le milieu aquatique ont lieu suite à la production de benzène et de ses produits dérivés.
Dans ces deux cas, les concentrations en benzène dans ces rejets sont en général de l'ordre ou inférieures au µg.l-1 (Commission européenne, 2002) et (Commission européenne, 2002/2003).
Les raffineries et usines pétrochimiques ne fabricant pas de benzène sont également une source possible de benzène, via leurs stations d'épuration.
Dans ce cas, le niveau d'émission « courant » se situerait entre 0 et 1 mg.l-1 d'après le BREF sur les raffineries. (Commission européenne, 2003)
À la raffinerie Total de Feyzin, il y a effectivement des rejets de benzène, actuellement sous le seuil de détection, et des investigations sont en cours pour mieux connaître ces rejets.
Les données sur les rejets industriels de benzène en France sont rassemblées dans le Tableau 1 page suivante. Les rejets de benzène dans les milieux aquatiques sont le fait de l'industrie chimique et pétrochimique.
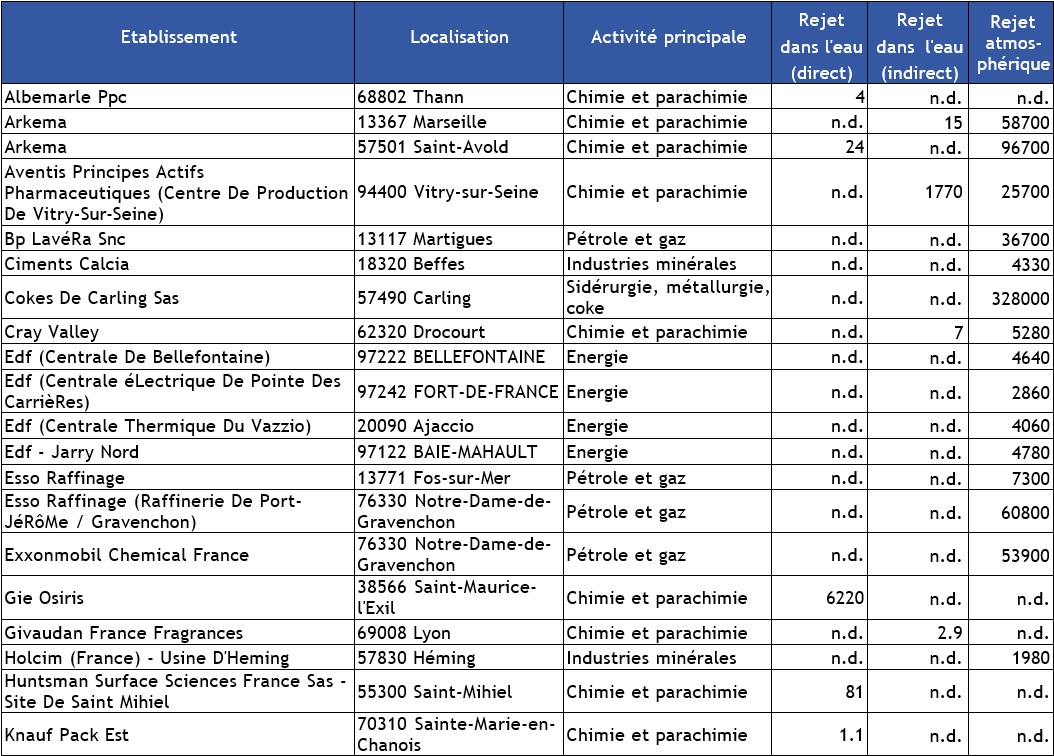
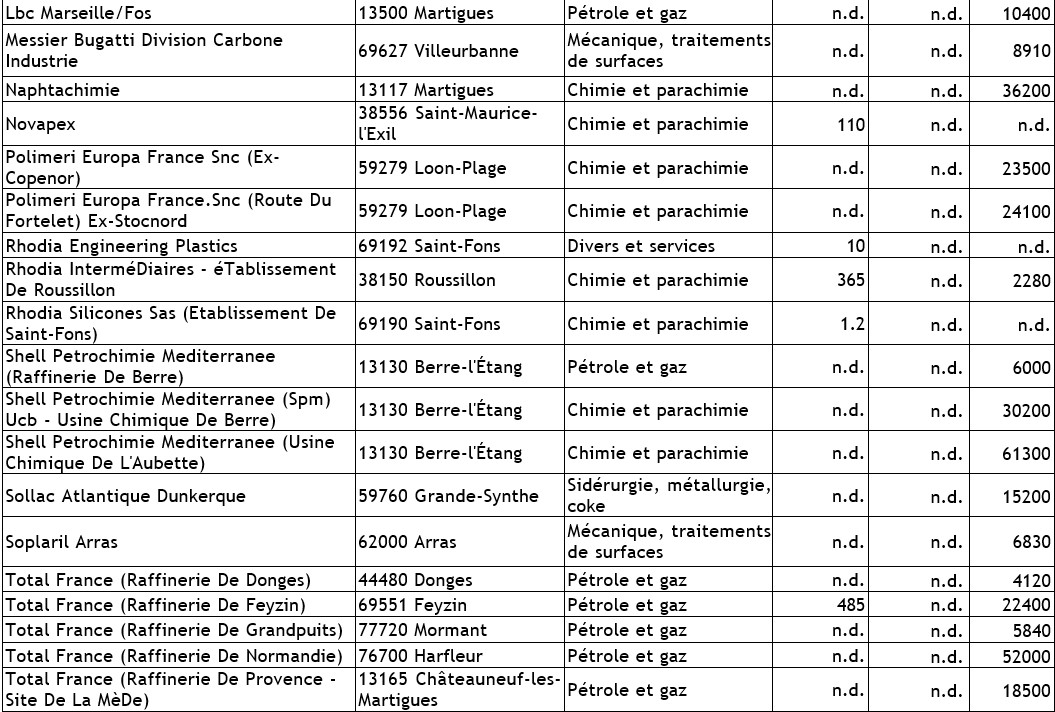
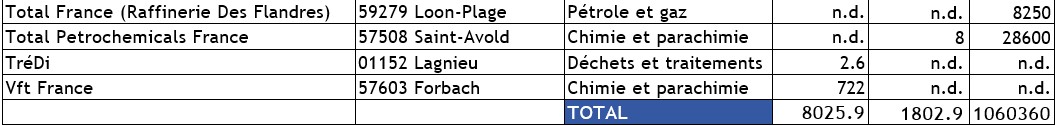
Tableau 1. Rejets de benzène en 2004 en kg.an-1 (Source : IREP, Registre Français des Emissions Polluantes)
Un site pharmaceutique indique utiliser le benzène comme solvant et réactif, ce qui génère un rejet de 1,5 mg.l-1 pour 400 m3/h avant traitement par la station d'épuration collective.
Deux sites de production d'intermédiaires chimiques indiquent que leur rejet commun comporte, après traitement, des concentrations inférieures au seuil de détection de 0,1 mg.l-1.
- Rejets aquatiques indirects1
Les rejets indirects, notamment liés au trafic (cf. paragraphe sur les émissions atmosphériques) et à l’utilisation domestique de produits contenant du benzène, sont très supérieurs aux rejets directs décrits ci-dessus. Le benzène est également présent :
- dans des produits de préservation du bois dérivés du goudron, à une concentration inférieure à 1 % ;
- en tant qu’impureté dans de nombreux produits chimiques (produits photographiques, peintures, adhésifs
Le benzène peut donc être présent en théorie dans les rejets ou dans les boues des stations d’épuration urbaines mais les quantités sont probablement très faibles et quelques mesures faites sur des boues de stations d’épuration en Allemagne ont fourni des valeurs inférieures aux seuils de détection.
Du benzène à des concentrations significatives a pu être détecté dans des lixiviats de décharges, mais les flux correspondants sont faibles.
Dans les rejets des systèmes d’évacuation des eaux pluviales de stations service et de dépôts de carburants, des concentrations pouvant être importantes (de l’ordre du mg/l) ont pu être détectées en Allemagne : ce type d’apports indirects pourrait donc conduire à des concentrations détectables dans les eaux de surface (RIZA, 2004).
Enfin, des rejets dans le sol (via des sites de stockage d’hydrocarbures notamment) peuvent conduire à la contamination d’eaux souterraines.
Les principaux composés benzéniques comme les chlorobenzènes, l’éthylbenzène, ne semblent pas se dégrader dans l’environnement aquatique en benzène (Balke et al., 2004 ; Corckery et al., 1994). Cependant, une présence dans certains milieux de benzène résultant de la dégradation d’autres hydrocarbures polycycliques n’est pas à exclure.
[1] Informations extraites essentiellement de Commission européenne, 2002/2003.
Pollutions historiques et accidentelles
Des sols, et par voie de conséquence des eaux souterraines (voire de surface), sont parfois contaminés par des solvants non halogénés, parmi lesquels le benzène est susceptible de se trouver.
On peut citer à titre d'exemple le cas de l'ancienne usine Lambiotte en Bourgogne, qui fabriquait du charbon de bois et produisait des produits chimiques par distillation (ADEME, 2004), ou le cas du site SCAPA TAPE qui pratique l'enduction des rouleaux plastiques utilisés principalement dans le BTP au moyen de colles solvantées (BASOL).
Présence environnementale
Atmosphère
Les concentrations moyennes annuelles de benzène dans l'air extérieur relevées en France par les associations agréées de surveillance de la qualité de l'air (AASQA) sont comprises entre 1 µg.m-3 en sites urbains de fond et plus de 10 µg.m-3 en sites de proximité au trafic. Entre 1994 et 2001, les concentrations moyennes en sites urbains de fond ont été divisées par trois, alors qu'en sites de proximité du trafic, elles ont été globalement divisées par quatre.
Aquatique
Entre 1993 et 2000, le benzène n'a pas été détecté à des teneurs supérieures à 2 µg.l-1 dans l'eau du Rhin (dans le cadre des mesures faites pour la Commission Internationale du Rhin). Le benzène est recherché dans l'eau sur un grand nombre de stations du bassin Rhin Meuse. En 2003, il n'a quasiment jamais été détecté à des valeurs supérieures au seuil de détection (0,2 µg.l-1). Il semble ne pas avoir été détecté dans les eaux souterraines suivies dans le cadre du RNB.
Sur le bassin Rhône Mediterrannée Corse, le benzène n'a été détecté dans l'eau que deux fois, à deux stations différentes, sur les 15 stations où il est suivi trimestriellement, depuis 1995. Sur les MES, il a été détecté à des valeurs maximales de quelques centaines de µg/kg (poids sec), sur 12 des 15 stations du réseau RNB, en général à plusieurs reprises. Il est également détecté sur une dizaine de stations supplémentaires à l'occasion d'études ponctuelles. Le benzène est également détecté dans les sédiments.
Sur les stations RNB du bassin Loire Bretagne, le benzène n'est pas non plus mesuré à des quantités chiffrables dans les eaux de surface et n' a été quantifié dans des sédiments que sur un échantillon.
D'après les données partielles analysées, on peut avancer que, si le benzène semble rarement détecté dans les eaux superficielles, il est en revanche assez largement présent dans les MES et les sédiments des grands cours d'eau.
Perspectives de réduction
Réduction des rejets
Pétrochimie
Les informations qui suivent proviennent notamment de (Commission européenne, 2002).
La production de benzène, comme la production des produits chimiques dont il est à la base occasionne essentiellement des rejets de composés organiques volatils à l'atmosphère.
Cependant, pour la production de ces composés, on a recours à des eaux de procédé, notamment pour améliorer les performances des solvants d'extraction du benzène. Ces circuits d'eaux sont en général utilisés en circuit fermé et les rejets associés sont donc faibles et intermittents. Le benzène contenu dans ces eaux est efficacement éliminé par les procédés de traitement mis en œuvre dans les stations d'épuration des sites pétrochimiques (rendement d'élimination supérieur à 99 %).
Normalement, après traitement de l'effluent par la station d'épuration d'un site pétrochimique, les teneurs en benzène des effluents peuvent être inférieures à des concentrations de l'ordre du µg.l-1. Concernant les flux spécifiques d'émission de benzène de
sites pétrochimiques, les deux sources consultées (Commission européenne, 2002 et Commission européenne 2002/2003) sont extrêmement divergentes2 et il n'est pas possible de fournir ici un chiffre. Dans le cas où des effluents aqueux sont très concentrés en aromatiques et donc en benzène, des procédés sont mis en œuvre pour récupérer ces substances du flux. Après récupération, le flux est dirigé vers la station d'épuration du site.
[2] 0,003 kg / tonne de benzène produit selon (Commission européenne, 2002) et 0,003 tonne/tonne pour (Commission européenne , 2002/2003).
Pharmacie
Un site pharmaceutique français qui utilise le benzène comme solvant réactif indique avoir tenté sans succès un traitement par stripping de ses effluents aqueux. Des traitements par adsorption pourraient être envisagés.
Aciéries3
Trois méthodes sont utilisées pour récupérer les BTX des gaz de fours à coke :
- réfrigération et compression ;
- adsorption sur support solide ;
- absorption par solvant.
Cette dernière méthode semble privilégiée, mais de toute façon la production de benzène comme sous produit de l'acier est plus chère, marginale, et donc en régression continue par rapport à la production pétrochimique (www.steel.org).
Par ailleurs, la prévention et le traitement des émissions de COV des aciéries, qui se pratique toute au long de la chaîne de fabrication du minerai, est un autre moyen de réduire les émissions de benzène.
[3] Informations de Commission européenne, 2000.
Émissions du transport routier
Le premier moyen pour réduire les émissions de benzène par les transports routiers est la modification de la composition des essences.
Les émissions de benzène sont liées d'une part aux pertes par évaporation de carburant, d'autre part aux émissions à l'échappement.
Les émissions par évaporation tendent à se réduire en Europe, en raison de la généralisation de systèmes de récupération des vapeurs d'essence sur les modèles récents de véhicules et de la récupération des vapeurs aux stations service prévue par les normes Auto Oil.
En ce qui concerne la réduction des émissions à l'échappement, le principal moyen mis en œuvre est la réduction des teneurs en benzène et en aromatiques des carburants. La réduction des teneurs en benzène des essences en Europe est en cours. La teneur maximale actuelle des essences en benzène est fixée à 1 % et celle des aromatiques à 42 % La valeur limite pour les aromatiques doit passer à 35 % en Janvier 2005, mais l'impact sur les émissions de benzène devrait être assez faible. La Commission pourrait proposer avant 2006 de nouvelles normes sur le benzène et les aromatiques à respecter à compter de Janvier 2009 [IFP, 2003].
Un second moyen est le recours aux biocarburants. L'introduction d'éthanol et d'ETBE dans les essences dans des proportions compatibles avec les exigences des moteurs actuels diminue les émissions de benzène de 10 à 20 %. L'utilisation d'esters d'huiles végétales (dits EMVH) fait également baisser les émissions d'hydrocarbures.
Actuellement, les objectifs d'utilisation de biocarburants assignés aux États membres par la Commission européenne sont de 5,75 % de la consommation d'essence et de gazole en 2010, avec un objectif de 8 % en 2020, alors qu'actuellement la proportion pour la France est d'environ 1 %.
L'impact des biocarburants sur les émissions de benzène est positif, pour les esters d'huiles végétales mais l'effet de certains biocarburants sur d'autres toxiques cancérigènes comme le formaldéhyde peut être négatif.
Il est toutefois clair qu'étant données les perspectives d'introduction des biocarburants en Europe, leur contribution à la réduction de la pollution des hydrosystèmes par le benzène ne serait que très faible.
Les réductions d'émission de benzène engendrées par ces évolutions technologiques peuvent être partiellement voire totalement compensées par l'augmentation des volumes de trafic prévue d'ici 2015. Il est donc clair que la contribution du secteur des transports aux émissions atmosphériques de benzène ne variera pas sensiblement à l'horizon 2015.
Alternatives aux usages
Pour les substituts du benzène dans l'essence, on se reportera à la rubrique "Réduction des rejets - Émissions du transport routier".
Dans le domaine des solvants, le benzène a été remplacé par d'autres molécules comme le toluène, qui fait l'objet lui même l'objet de substitutions car il s'agit aussi d'un composé dangereux pour les milieux aquatiques et visé par les Directives européennes sur l'Eau.
Utilisation du benzène pour la synthèse d'autres molécules organiques
Pour des composés normalement obtenus à partir du benzène, il peut exister des voies de synthèse alternatives.
Ainsi, par exemple, la synthèse de l'éthylbenzène peut être opérée à partir de butadiène, en passant par le vinylcyclohexène (Sengel). La question est ensuite de savoir si ces alternatives ont un intérêt environnemental et sanitaire global au delà de la seule question du benzène, ainsi qu'un intérêt et une faisabilité industriels.
Pharmacie
Dans le cas d'un site pharmaceutique français concerné par des rejets significatifs de benzène dans les eaux de surface, le remplacement du benzène n'est pas considéré comme possible pour des raisons techniques.
Un autre site, qui utilise le benzène pour fabriquer des nitrophénols (et dont les rejets sont inférieurs à 1 kg.j-1), ensuite utilisés pour produire du paracétamol, estime que le contexte économique de l'atelier impliquerait une fermeture de préférence à la recherche d'une alternative au benzène.
Conclusion
Le benzène est une des molécules qui sont à la base de la chimie organique. C'est donc un intermédiaire pour une très grande gamme de produits organiques de base. Son importance tient également au fait qu'il est un additif pour les carburants automobiles
Son usage en tant que solvant semble désormais révolu, mais il reste produit et utilisé en France, comme additif dans les carburants automobiles, comme intermédiaire dans l'industrie chimique organique et, ponctuellement, dans l'industrie pharmaceutique. Les quantités de benzène produites et utilisées en Europe ne semblent pas orientées à la baisse et les prix actuellement très élevés du benzène indiquent une sous capacité de production dans le monde.
La réduction des émissions atmosphériques liées aux carburants va se poursuivre dans le futur, via les normes européennes sur les carburants et les stations services, sans qu'il soit pour autant prévu de se passer totalement du benzène à l'horizon 2015.
Concernant les rejets directs dans les milieux aquatiques, le benzène est significativement dégradé dans les stations d'épuration industrielles des raffineries et des sites pétrochimiques concernés, mais il n'y a pas de traitement spécifique mis en place. Les performances exactes et les marges de progression des traitements actuels ne sont pas connues.
Pour certains rejets isolés de benzène, liés par exemple à l'industrie pharmaceutique, il n'y aurait pas de possibilité de substitution. En tant qu'intermédiaire de l'industrie chimique, le benzène semble également encore largement incontournable.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










