Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Ammoniac, anhydre (7664-41-7)
Informations générales
Dernière vérification le 21/01/2026
Identification
Numero CAS
7664-41-7
Nom scientifique (FR)
Ammoniac, Anhydre
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Dénominations d'usage / Noms commerciaux
Code EC
231-635-3
Code SANDRE
1351
Numéro CIPAC
-
Formule chimique brute
\(\ce{ NH3 }\)
Code InChlKey
Code SMILES
N(H)(H)H
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H314 |
|---|---|
| Mention du danger - Texte | Provoque de graves brûlures de la peau et de graves lésions des yeux. |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H331 |
|---|---|
| Mention du danger - Texte | Toxique par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H221 |
|---|---|
| Mention du danger - Texte | Gaz inflammable |
| Classe(s) de dangers | Gaz inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Analyse
Autres milieux
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
17.03 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Dangers physiques
Dernière vérification le 29/03/2024
Explosivité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Inflammabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
La présence de l’ammoniac dans l’atmosphère est majoritairement d’origine anthropique (fertilisation, élevage, eaux usées …) et partiellement d’origine naturelle (cycle de l’azote, dégradation de la matière organique). Une fois présent dans l’atmosphère, l’ammoniac peut réagir avec des gaz acides présents (H2SO4, HNO3, HCl) et former des aérosols d’ammonium qui peuvent être lessivés de l’atmosphère par dépôt sec ou humide. L’ammoniac gazeux peut aussi être absorbé par les eaux de surface et le système foliaire des végétaux lorsque les concentrations atmosphériques sont élevées localement. Il peut aussi être rapidement adsorbé par les sols à des concentrations relativement faibles. Le temps de séjour dans l’atmosphère de l’ammoniac gazeux varie de 2,8 heures à 4 jours et est inférieur au temps de séjour des aérosols d’ammonium (7 à 19 jours). Ces brièvetés de temps de séjour s’expliquent par la rapidité de la conversion du NH3 en particules d’ammonium et par la grande vitesse de dépôt sec de l’ammoniac (HSDB, 2005 ; ATSDR, 2004 ; Loubet, 2000 ; Environnement Canada, 1999).
Milieu eau douce
En solution, l’ammoniac est présent sous deux formes qui sont en équilibre : l’ammoniac non-ionisé (NH3) et l’ammoniac ionisé (NH4+). L’équilibre entre ces deux formes est gouverné par une réaction sensible aux variations de pH (Environnement Agency, 2007 ; ATSDR, 2004).
NH4+ (aq) Û NH3 (aq) + H+ (aq)
En solution, ces deux formes sont en équilibre dynamique et la forme ionisée est souvent prépondérante du fait du pH des eaux naturelles (pour un pH de 7,25 et de 8,25, la proportion d’ammoniac ionisé (NH4+) est respectivement de 99 % et 90 %). Le pKa du couple ammoniac non-ionisé et ammoniac ionisé est de 9,25 (ATSDR, 2004).
La volatilisation de l’ammoniac (NH3) des eaux de surface vers l’atmosphère est considérée comme un processus majeur. Elle se déroule au niveau de l’interface et est influencée par le pH (si > 7), la température et par d’autres paramètres tels que le débit des eaux, la vitesse du vent, la concentration en azote ammoniacal, ou encore la salinité. Généralement, l’ammoniac se transforme rapidement en autres composés azotés puisqu’il est un intermédiaire du cycle de l’azote (Environment Agency, 2007 ; ATSDR, 2004 ; Environnement Canada, 1999).
Dans l’eau, l’adsorption de l’ammoniac peut être importante dans certaines conditions. Globalement, l’adsorption sur les sédiments est supposée augmenter avec le contenu organique des particules, la quantité d’ions métalliques et la diminution du pH. Il est aussi important de considérer que l’ammoniac peut aussi être produit et émis par les sédiments des milieux (ATSDR, 2004).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Dans les sols, le temps de résidence de l’ammoniac est supposé court du fait de sa volatilisation vers l’atmosphère, de sa transformation par les micro-organismes en nitrites et nitrates (cycle de l’azote), de son absorption par les plantes. Tout comme pour les eaux, l’ammoniac dans les sols est présent sous forme ionisée et sous forme non-ionisée (ATSDR, 2004).
La volatilisation est considérée comme un processus majeur et est fortement corrélée au pH. Des mesures réalisées, en conditions expérimentales contrôlées, ont montré que les taux de volatilisation étaient plus importants sur des sols fraîchement amendés en fumier et présentant des pH élevés. Elle semble fortement réduite à partir de pH assez acides qui sont peu rencontrés dans les sols de façon naturelle (pH 3,5 – 4). La concentration en ammonium, la température, la vitesse du vent et le degré d’humidité du sol sont aussi des facteurs qui ont un impact favorable sur la volatilisation de NH3 (Rodriguez et al., 2005 ; ATSDR, 2004).
L’ammoniac non-ionisé est plutôt faiblement adsorbé sur les particules du sol comparativement à l’ammoniac ionisé qui est plus fortement lié en tant qu’ion échangeable. Le NH3 est physiquement adsorbé aux particules du sol et est supposé plus sensible au mouvement de l’eau dans les sols que le NH4+ dont l’adsorption chimique est plus stable. Généralement, l’adsorption de l’ammoniac non-ionisé augmente avec la présence de la matière organique, l’humidité du sol, et diminue lorsque le pH augmente (Dontsova et al., 2005 ; ATSDR, 2004).
L’ammoniac n’est pas supposé être lessivé significativement à travers les sols. Toutefois, sa présence peut aboutir à la formation de nitrates qui sont plus facilement lessivés par les eaux de pluie (ATSDR, 2004 ; Mikalajkow, 2003).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Lorsque l’ammoniac est introduit dans l’eau, en aérobiose, il est rapidement converti en nitrate par nitrification. La température, l’oxygène et le pH de l’eau sont les facteurs déterminants du taux d’oxydation (IUCLID, 2000). La nitrification induite par des bactéries, principalement du genre Nitrobacter, est la principale voie de dégradation de l’ammoniac créant ainsi une demande biologique en oxygène (DBO). Ces bactéries ont une tolérance à l’ammoniac libre comprise entre 0,1 et 1,0 mg.L-1 dépendant du pH, de la durée d’exposition (acclimatation) et de la concentration en biomasse (Suthersan et Ganczarczyk, 1986). De plus, d’autres bactéries comme les cyanobactéries marines, Synechococcus sp. SF1 sont capables d’une croissance eutrophique utilisant l’ammoniac ionisé, à la concentration initiale de 5 mM, comme seule source d’azote (Spiller et Shanmugam, 1987). L’assimilation de l’ammoniac peut être comme chez les Arthrobacter P1, NADP-glutamate déshydrogénase dépendante et nécessiter la glutamine synthétase (De Boer et al., 1989).
Dégradabilité abiotique
Dans l’air, l’ammoniac ne subit pas de photoréaction aux longueurs d’ondes supérieures à 290 nm dans des conditions atmosphériques normales (OMS IPCS, 1986, cité par Johnson et al., 2007).
Toutefois, en présence de radicaux hydroxyles OH. ou d’espèces photochimiquement réactives, l’ammoniac réagit selon les réactions secondaires suivantes (Santé Canada, 2005) :
NH3 + OH- à NH2- + H2O
NH3 + O à NH2- + O H-
Ainsi, la demi-vie de l’ammoniac dans l’air est d’environ 2 mois en présence de radicaux hydroxyles (National Pollutant Inventory Substance Profile, 2004, cité par Santé Canada, 2005). De même, l’IUCLID (2000) indique une demi-vie de l’ammoniac de 100,3 jours pour une concentration en hydroxyles de 500 000 molécules.cm-3.
De plus, l’ammoniac se décompose en azote et en hydrogène lors d’une exposition à une décharge électrique. Les principaux produits de sa combustion sont l’azote et l’eau, ainsi que des traces de nitrate d’ammonium et de dioxyde d’azote (Santé Canada, 2005).
La volatilisation de l’ammoniac est un processus majeur de décontamination des sols et de l’eau.
Milieu eau douce
Eaux de surface:
L’ammoniac est un élément du cycle de l’azote. En milieu aquatique et oxygéné, l’ammoniac est rapidement oxydé (Environment Canada, 1993 ; Johnson et al., 2007) par des bactéries nitrifiantes du genre Nitrosomonas en nitrites (nitritation) puis par des bactéries du genre nitrobacter en nitrates (nitratation), selon les réactions ci-dessous :
NH3 + O2 à NO2− + 3H+ + 2e− (nitritation)
NO2− + H2O àNO3− + 2H+ + 2e− (nitratation)
La température, la concentration en oxygène dissous et le pH de l’eau sont les principaux facteurs qui contrôlent la nitrification de l’ammoniac.
Cette transformation qui utilise l’oxygène et libère de l’hydrogène peut conduire sous des conditions particulières à une eutrophisation et/ou une acidification des milieux aquatiques (Environment Canada, 1993).
De plus, l’ammoniac est assimilé par les plantes aquatiques en tant que source d’azote (Johnson et al., 2007).
Milieu terrestre
Dans les sols oxygénés, comme dans les milieux aquatiques, l’ammoniac est nitrifié en nitrates et en nitrites par des processus bactériens (Johnson et al., 2007). De plus, l’absorption par les plantes peut être un processus significatif de diminution de la concentration en ammoniac du sol (ATSDR, 2004).
Conclusion sur la persistance
L’ammoniac est un intermédiaire du cycle de l’azote, il se transforme rapidement en composés azotés, est n’est pas persistant.
Bioaccumulation
Organismes aquatiques
Il n'existe pas de donnée sur l'accumulation de l'ammoniac dans les organismes aquatiques. Cependant l’IUCLID (2000) rapporte un coefficient de partage octanol/eau de l'ammoniac de -1,14 à 25°C, suggérant un très faible potentiel d'accumulation dans les organismes aquatiques. Les organismes disposent de systèmes d’excrétion de l’ammoniac mais peuvent néanmoins l’accumuler lorsque le gradient de diffusion de l’ammoniac s’inverse (concentration externe > concentration interne) ou encore suite à un dysfonctionnement physiologique du système d’excrétion (Environment Canada, 1993).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Aucune donnée pertinente n’a été répertoriée. Toutefois, comme pour les organismes aquatiques, il semble que l’ammoniac ait un faible potentiel d’accumulation. Le mécanisme d’action ne semble pas identique pour toutes les espèces. Ainsi chez les mammifères la toxicité cérébrale de l’ammoniac semble principalement liée au dysfonctionnement du système glutamatergique (accumulation de glutamine induisant un gonflement des astrocytes). Chez les organismes terrestres, l’eau étant moins abondante, l’ammoniac est excrété après métabolisation sous la forme de composés moins toxiques. Ainsi, les mammifères éliminent l’ammoniac sous forme d'urée. Les oiseaux et les reptiles produisant peu d’urine éliminent l’azote sous forme d'acide urique. Chez les plantes terrestres (Castro et al., 2006), l’ammoniac gazeux absorbé par les feuilles peut être métabolisé dans le cycle glutamine/glutamate synthétase, augmentant la concentration en azote des végétaux ainsi que de leurs métabolites.
Conclusion sur la bioaccumulation
L’ammoniac a un potentiel de bioaccumulation négligeable.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2004 ; ANSES, 2017 ; INERIS, 2003 ; INRS, 2008 ; OMS IPCS, 1986 ; US EPA, 1991). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
La principale voie d’exposition est l’inhalation.
L’ammoniac est absorbé essentiellement par inhalation. Une absorption par voie orale ou par voie oculaire est également décrite. En revanche, l’absorption par voie cutanée ne semble pas possible.
Par inhalation, la majorité de l’ammoniac inhalé est dissoute au niveau des voies respiratoires supérieures et peut être éliminée dans l’air expiré.
À faibles concentrations, l'ammoniac inhalé se dissout essentiellement dans le mucus des voies aériennes supérieures. Le taux de rétention pulmonaire initial est de 83 à 92 % chez l'homme et est inférieur à 30 % après 27 minutes pour une exposition de l’ordre de 25 à 500 ppm (18 à 353 mg.m-3) (Landahl et Herrman, 1950 ; Silverman et al., 1949).
Les ions ammonium sont naturellement produits dans le tractus digestif chez l’homme par la dégradation bactérienne des composés azotés ingérés. Environ 4 200 mg.j-1 sont ainsi produits et plus de 70 % sont synthétisés ou libérés par le colon et dans les selles. La quantité absorbée est de 4 150 mg.j-1 soit 99 % de la quantité produite (Summerskill et Wolpert, 1970). L’absorption des NH4+ est également totale (Fürst et al., 1969).
L’ammoniac est absorbé par voie oculaire par diffusion en quelques secondes mais celle-ci n’est pas quantifiée (Beare et al., 1988 ; Jarudi et Golden, 1973).
Distribution
Lors d’exposition par inhalation, la distribution est faible.
Métabolisme
Pour les expositions par inhalation, l’ammoniac est métabolisé en urée et glutamine avec un fort effet du premier passage hépatique en urée et glutamine. Les ions ammonium absorbés par le tractus gastrointestinal sont transportés via le système porte directement dans le foie où ils sont métabolisés. Par cette voie, une quantité très faible gagne la circulation systémique sous forme d’ammoniac ou de dérivés de l’ammonium (Brown et al., 1957 ; Pitts, 1971 ; Salvatore et al., 1963 ; Summerskill et Wolpert, 1970).
Élimination
L’excrétion de l’ammoniac est majoritairement urinaire, sous forme d’urée ou de dérivés urinaires de l’ammonium. L’excrétion dans les selles ou via l’air exhalé est mineure.
Chez l'animal
Absorption
Les rares études disponibles chez l’animal confirment les données humaines. Le taux dissolution dans les voies respiratoire chez le chien est de 80 % (OMS IPCS, 1986).
Synthèse
Chez l’homme, la majorité de l’ammoniac inhalé est dissoute au niveau des voies respiratoires supérieures et peut être éliminée dans l’air expiré. À faibles concentrations, l'ammoniac inhalé se dissout essentiellement dans le mucus des voies aériennes supérieures. Pour des expositions à des concentrations élevées, il existe une capacité d’adaptation ou un phénomène de saturation. L’ammoniac est faiblement distribué dans l’organisme et est métabolisé lors du premier passage hépatique en urée et glutamine. L’excrétion de l’ammoniac est majoritairement urinaire, sous forme d’urée ou de dérivés urinaires de l’ammonium.
Chez l'animal, les données sont similaires aux données humaines.
Toxicité aiguë
Chez l'homme
Inhalation
Il existe de nombreuses données relatant des accidents mortels chez l’homme lors d’une exposition aiguë à l’ammoniac (Arwood et al., 1985 ; Burns et al., 1985 ; Close et al., 1980 ; Couturier et al., 1971 ; George et al., 2000 ; Heifer, 1971 ; Price et al., 1983; ; Sobonya, 1977 ; Walton, 1973 ; Weiser et Mackenroth, 1989 ; Yang et al., 1987). Les études les plus anciennes rapportent des accidents rapidement mortels pour des niveaux d’exposition de 5 000 à 10 000 ppm (3 535 à 7 070 mg.m-3) (Ineris, 2003 ), les études plus récentes décrivent des niveaux d’exposition de 2 500 à 4 500 ppm (1 767 à 3 181 mg.m-3), entraînant la mort en 30 minutes (Helmers et al., 1971 ; Millea et al., 1989). Ces accidents sont mortels par obstruction des voies respiratoires. Pour les sujets qui ne décèdent pas dans les minutes suivant l’exposition, la mort peut survenir rapidement à la suite de complications ou de surinfections.
De manière générale, l'ammoniac est un gaz qui réagit avec l’eau (NH3 + H20 => NH4(OH)) provoquant des irritations sévères voire des brûlures au niveau des muqueuses en raison de sa forte solubilité dans l'eau (alcalinisation locale importante, action caustique). Ces irritations sévères sont également observées au niveau oculaire, provoquant un larmoiement, une hyperhémie conjonctivale, des ulcérations conjonctivales et cornéennes, une iritis. Une cataracte ou un glaucome peut apparaître jusqu'à 10 jours après exposition (INRS, 1997 ; OMS IPCS, 1986 ; Withers, 1986).
À faibles concentrations, les signes cliniques observés sont de la toux, une pharyngite, une laryngite, une trachéo-bronchite, des nausées, des vomissements, une asthénie, des céphalées, une hypersalivation et éventuellement une bradycardie (INRS, 1997 ; OMS IPCS, 1986).
À concentrations élevées, l'inhalation d'ammoniac se caractérise par une détresse respiratoire intense liée à un bronchospasme d'intensité variable et au développement d'un œdème des muqueuses de l'ensemble du tractus respiratoire avec de la toux et une dyspnée asthmatiforme. À court terme, le pronostic dépend de l'évolution des troubles respiratoires et de l'apparition retardée d'un œdème aigu pulmonaire lésionnel après une phase de rémission apparente. Secondairement, l'hypersécrétion bronchique et la desquamation de la muqueuse sont responsables d'obstructions tronculaires et d'atélectasies, aggravées par des surinfections bactériennes. Les séquelles les plus fréquentes sont des sténoses bronchiques, une bronchiolite oblitérante, des bronchiectasies, une fibrose pulmonaire, des opacités cornéennes, de la cataracte ou un glaucome (INRS, 1997 ; Withers, 1986).
Des expositions importantes aiguës à de l'ammoniac peuvent induire le développement d'un syndrome de dysfonctionnement réactionnel des voies respiratoires (RADS ou syndrome de Brooks) voire d'un asthme de type "irritant-induced" (asthmes non immunologiques induit par des substances irritantes). Ces manifestations se traduisent par de la toux, de la dyspnée et des sifflements thoraciques (ATSDR, 2004).
Le seuil olfactif de détection de l'ammoniac est très variable (de quelques dixièmes de ppm à plus de 100). Ce seuil est en moyenne de 32,6 mg.m-3 (46,8 ppm) avec une valeur minimale, en général, de 3,7 mg.m-3 (3,9 ppm) pour les individus les plus sensibles.
Ces différents effets sont décrits par plusieurs auteurs, notamment :
Silverman et al. (1949) ont exposé 7 volontaires à une concentration de 500 ppm (355 mg.m-3) d’ammoniac pendant 30 minutes au moyen d’un masque oro-nasal. Tous les volontaires présentent une irritation qui devient sévère chez 2 sujets. Seuls 2 sujets sont capables de pratiquer une respiration nasale pendant les 30 minutes de l’exposition. Les effets observés sont des irritations nasales et trachéales, une hypoesthésie cutanée (déficit de la sensibilité de perception) et des larmoiements. Chez 2 sujets, l’irritation du naso-pharynx persistait pendant 24 heures après la fin de l’exposition.
Dans une autre étude, 16 sujets ont été exposés à des concentrations de 50, 80, 110 ou 140 ppm (36, 57, 78 ou 99 mg.m-3) d’ammoniac pendant 2 heures, 8 ont déjà été exposés précédemment et 8 sont exposés pour la première fois (Verberk, 1977). Les sujets exposés pour la première fois ne supportent pas la concentration de 140 ppm (99 mg.m-3) pendant 2 heures et présentent des symptômes lors d’une exposition de 1 heure à 110 ppm (78 mg.m-3). Au cours de cette étude, aucun des sujets ne présente une diminution de la fonction pulmonaire (capacité vitale, Volume Maximum Expiré en une Seconde). Les résultats mettent en évidence une plus grande sensibilité du groupe exposé pour la première fois pour les tests d’odeur, l’irritation des yeux, la toux, un inconfort général, les céphalées, et une irritation thoracique.
Dans une autre étude, 5 ou 6 volontaires ont été exposés à l’ammoniac aux concentrations de 30 et 50 ppm (21 et 36 mg.m-3) pendant 10 minutes (MacEwen et al., 1970). Il n’y a pas d’irritation modérée ou forte rapportée à la dose la plus faible. Quatre des six sujets exposés à 50 ppm (35 mg.m-3) font état d’une irritation modérée.
Dix sujets présentent des irritations lors d’une exposition aux concentrations de 32, 50, 72 et 134 ppm (23, 36, 51 et 95 mg.m-3) d’ammoniac (Industrial Bio-Test Laboratories, 1973). Des irritations des yeux, du nez, de la bouche, de la gorge et de la cage thoracique sont rapportées tout au long de l’exposition (5 minutes). À 72 ppm (51 mg.m-3), 3 sujets présentent des irritations oculaires, 2 des irritations nasales et 3 des irritations thoraciques. À 134 ppm (95 mg.m-3), 5 sujets montrent des larmoiements et des irritations oculaires, 7 se plaignent d’irritations nasales, 8 d’irritations nasales et d’irritations thoraciques.
Enfin, des volontaires exposés aux concentrations de 0 -5 – 25 ppm d’ammoniac sous forme de solution aqueuse à 25 % pendant 3 h n’ont pas présenté de modifications de la fonction pulmonaire ou d’hyperactivité bronchique ni de réponse inflammatoire (Sundblad et al., 2004 ). Les effets observés à 5 ppm correspondent à une augmentation de la note attribuée à l’inconfort et/ou l’irritation oculaire, la perception d’une odeur de solvant, des céphalées, des vertiges et des sensations d’intoxication. A 25 ppm, les mêmes effets sont rapportés au niveau du nez, de la gorge et des yeux et des difficultés à respirer sont également notées. Ces différents effets sont transitoires. Ces effets ne sont pas des objectivés.
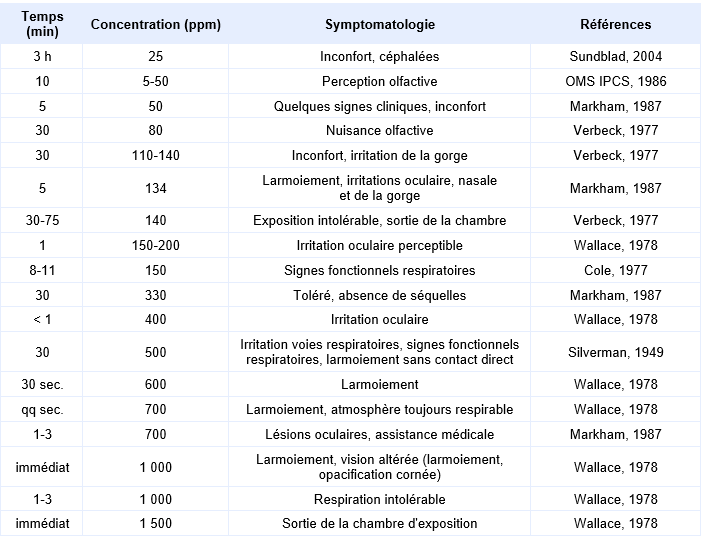
Les différents effets toxiques observés chez l'homme suite à une exposition aiguë sont rapportés dans le tableau ci-après (d’après INERIS, 2003).
Synthèse des différents effets observés chez l’homme suite à une exposition aiguë
Voie orale
Plusieurs jeunes enfants (âgés de 2 à 3 ans) ont été intoxiqués par l’absorption accidentelle de capsules contenant de l’ammoniac (Lopez et al., 1988 ; Rosenbaum et al., 1998). Deux de ces enfants présentent des ulcérations de la langue et/ou de la muqueuse buccale, un enfant présente des lésions superficielles de la paroi de l’œsophage, d’autres des œdèmes et des érythèmes des lèvres avec des zones de desquamation et des escarres du palais, des œdèmes et des érythèmes des structures supraglottiques et de la trachée supérieure. Tous les enfants présentent au moins une fois les symptômes suivants : vomissements, dysphagies, toux, brûlures orales ou pharyngiennes. Ces effets disparaissent en quelques jours. Chez les adultes, des lésions œsophagiennes et des œdèmes sont rapportés chez 5 individus ayant ingéré de l’ammoniac contenu dans des produits ménagers (sous forme de d’hydroxyde d’ammonium).
Synthèse
Chez l'homme, l'ammoniac est un gaz provoquant des irritations sévères voire des brûlures au niveau des muqueuses. Ces irritations sévères sont également observées au niveau oculaire, provoquant un larmoiement, une hyperhémie conjonctivale, des ulcérations conjonctivales et cornéennes, une iritis. Une cataracte ou un glaucome peuvent apparaître jusqu'à 10 jours après exposition. Des expositions importantes aiguës peuvent induire le développement d'un syndrome de dysfonctionnement réactionnel des voies respiratoires (RADS ou syndrome de Brooks) voire d'un asthme de type "irritant-induced" (asthmes non immunologiques induits par des substances irritantes). Ces manifestations se traduisent par de la toux, de la dyspnée et des bronchospasmes.
Chez l'animal
Inhalation
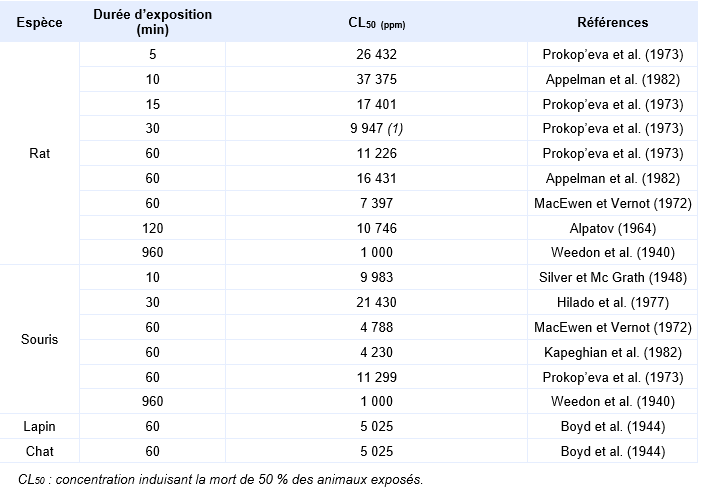
Plusieurs études déterminent des concentrations létales pour 50 % des animaux exposés (CL50), elles sont regroupées dans le tableau ci-dessous (d’après ATSDR, 2004). Il est difficile de comparer la sensibilité des différentes espèces à partir de ces données car les durées d’exposition ne sont pas toutes identiques. En revanche, une analyse plus fine des données de létalité réalisée par l’INERIS (2003) permet d’indiquer que la souris est le rongeur le plus sensible.
Plusieurs études font état des effets observés au niveau du tractus respiratoire lors d’une exposition aiguë à l’ammoniac chez l’animal. Des irritations oculaires et des altérations du système cardio-vasculaire et du foie sont également rapportées.
Un système dynamique d'exposition par inhalation a été utilisé pour intoxiquer des lots de 12 souris mâles albinos, à 3 séries de 4 concentrations (de 1 190 à 4 860 ppm soit de 841 à 3 436 mg.m-3) d’ammoniac pendant 60 minutes (Kapeghian et al., 1982). Une période d'observation de 14 jours a suivi cette exposition. Les signes cliniques observés sont des irritations oculaires et nasales, une dyspnée et des convulsions tonico-cloniques pré-mortem. Les animaux survivants ont présenté une dyspnée et une léthargie persistantes, associées à une importante altération de l'état général dépendante de la dose. Une létalité retardée est également enregistrée. À l'autopsie, les animaux morts en cours d'exposition ont présenté une congestion vasculaire aiguë pulmonaire et des foyers d'hémorragies intra-alvéolaires. Chez les animaux survivants, une pneumonie chronique focale d'intensité également dose-dépendante est notée lors de l'examen histologique, ainsi que des zones d'atélectasie pour la plus forte concentration. Des lésions hépatiques nécrotiques sont également observables pour des expositions supérieures à 3 440 ppm (2 432 mg.m-3).
L'impact d'une exposition à l'ammoniac sur l'activité ciliaire trachéale a été étudié chez des rats Wistar mâles au cours d’une autre étude (Dalham, 1956). Deux à trois animaux par lot ont été exposés en corps entier, sous anesthésie, trachée ouverte (exposition directe) pendant 10 minutes à des concentrations de 3 à 90 ppm (2,12 à 36,63 mg.m-3) d'ammoniac. Les temps de cessation de l'activité ciliaire sont évalués par des observations microscopiques et sont les suivants : 7-8 minutes pour 3 ppm (2,12 mg.m-3), 150 secondes pour 6,5 ppm (4,60 mg.m-3), 20 secondes pour 20 ppm (14 mg.m-3),10 secondes pour 45 ppm (32 mg.m-3) et 5 secondes pour 90 ppm (64 mg.m-3) (relation dose-dépendante). Toutefois, à l'arrêt de l'exposition, une reprise de l'activité ciliaire s'observe en 20 à 30 secondes.
Dans une autre étude, des lots de 8 rats mâles ont été exposés pendant 24 heures à des concentrations en ammoniac de 15, 32, 310, et 1 157 ppm soit 11, 23, 219 et 818 mg.m-3 (Schaerdel et al., 1983). Les paramètres sanguins de ces animaux ont été dosés via une canule intra-aortique en fin d'exposition puis 8, 12 et 24 heures après. Aux différents temps d'observation, les animaux ne présentent pas de signes d'irritation oculaire ou des muqueuses respiratoires. La pression sanguine en CO2 et le pH ne sont pas modifiés par l'exposition ; seule la pression en O2 est modifiée. De plus, l'ammoniémie révèle une augmentation de ce paramètre dépendante de la dose. Dans une seconde phase de l'étude, les animaux (7/lots) ont été exposés pendant 3 ou 7 jours à des concentrations de 4, 24, 44, 165, ou 714 ppm (2,83, 17, 31, 117 ou 505 mg.m-3). Les activités enzymatiques microsomiales étudiées montrent de légères variations suite à l'exposition. De plus, des lésions histologiques minimes de l'épithélium respiratoire sont observées, mais le niveau de concentration induisant ces lésions n'est pas mentionné.
Une autre étude a été réalisée chez des souris mâles Swiss exposées à 78, 257 ou 711 ppm (55, 182 ou 503 mg.m-3) d'ammoniac, 6 h.j-1 pendant 4, 9 ou 14 jours (Zissu, 1995). L'examen histologique de l'ensemble du tractus respiratoire a permis de mettre en évidence une rhinite métaplasique associée à des foyers nécrotiques au sein de la muqueuse nasale à la concentration de 711 ppm (503 mg.m-3). L'intensité de ces lésions s'accroît avec la durée de l'exposition. Aucune lésion n'est observée pour les concentrations plus faibles.
Vingt chats anesthésiés et canulés, ont été exposés à 1 000 ppm (707 mg.m-3) d'ammoniac pendant 10 minutes dans une chambre pléthysmographique d'exposition (tête entière) afin d'évaluer les fonctions respiratoires (Dodd et Gross, 1980). Des sacrifices sériés ont été réalisés 24 heures, 7 jours, 21 et 35 jours après l'exposition pour un examen histo-pathologique. Les résultats montrent que les modifications des paramètres fonctionnels respiratoires sont corrélées aux lésions histologiques observées. Vingt-quatre heures après l'exposition, les lésions pulmonaires sont une congestion, de l'œdème, un emphysème interstitiel et des foyers hémorragiques. Sept jours après, les lésions aiguës des muqueuses sont résorbées et quelques foyers d'inflammation chronique péribronchiolaires sont présents. Pour les deux autres sacrifices, des lésions classiques de bronchite, bronchiolite et broncho-pneumonie d'intensité variable sont observées. Des foyers disséminés d'emphysème sont également présents et considérés comme des séquelles de l'exposition. Concernant les fonctions respiratoires, les variations des paramètres tels que la résistance pulmonaire persistent après l'exposition caractérisant le développement des lésions chroniques.
Enfin, une bradycardie est rapportée chez le lapin exposé à la concentration de 2 500 ppm(1 767 mg.m-3), (Richard et al., 1978). Une hypertension et une arythmie cardiaque conduisant à un collapsus cardiovasculaire sont rapportées pour des expositions à 5 000 ppm (3 535 mg.m-3).
Synthèse des différents CL50 chez l’animal suite à une exposition aiguë :
Synthèse
Les effets décrits chez l’homme sont retrouvés chez l’animal. Les CL50 1 h sont comprises entre 5 300 et 7 940 mg.m-3 chez le rat et 300 et 7 990 mg.m-3 chez la souris.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Quelques études rapportent les effets d’une exposition chronique par inhalation à l’ammoniac chez l’homme. Une étude a suivi 58 ouvriers et 31 témoins (sexe masculin) le premier et le dernier jour d’une semaine de travail. Elle a évalué l’odorat, la prévalence des symptômes respiratoires (toux, bronchite, respiration sifflante), oculaires, et les paramètres de la fonction respiratoire pour une exposition moyenne de 12,2 ans dans une usine de carbonate de soude (Holness et al., 1989). L’exposition moyenne de chaque ouvrier a été mesurée par la quantité d’ammoniac dans l’air au niveau de leur col sur une journée de travail (8,4 heures). Il n’y a pas de différence significative dans la prévalence des symptômes rapportés ou de mise en évidence d’une détérioration de la fonction pulmonaire pour une exposition moyenne à l’ammoniac de 9,2 ± 1,4 ppm. De même, lorsque les ouvriers sont regroupés en fonction de leur exposition (Tableau 7), il n’y a pas de différence significative dans la prévalence des symptômes rapportés ou de mise en évidence d’une détérioration de la fonction pulmonaire.
Distribution des concentrations d’exposition à l’ammoniac des sujets d’après les données rapportées dans Holness et al., 1989 :
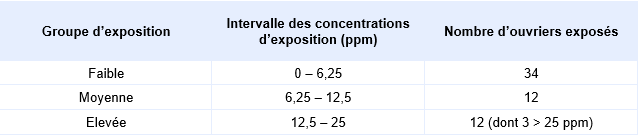
En revanche, trois autres études menées chez des ouvriers d’usines de production d’engrais ont établi une association entre une exposition chronique à l’ammoniac et une augmentation des symptômes respiratoires et/ou une diminution des fonctions respiratoires.
L’étude de Ballal et al. (1998) menée sur 161 ouvriers (sexe masculin) de 2 usines de production d’engrais à base d’urée et 355 sujets témoins (personnel administratif de la région) a évalué la prévalence de symptômes respiratoires, de bronchites chroniques et d’asthme bronchique pour une exposition moyenne à l’ammoniac d’environ 4 ans (51,8 mois). Une augmentation significative de la prévalence des symptômes respiratoires est observée pour des expositions comprises entre 2 et 27,1 mg.m-3*, mais pas entre 0,02 et 7 mg.m-3. L’étude a montré par analyse de régression logistique que la concentration en ammoniac est associée de manière significative à l’augmentation de symptômes respiratoires dont la toux, l’expectoration, la respiration sifflante et l’asthme bronchique.
L’étude de Ali et al. (2001) menée chez 73 ouvriers d’usines de production d’ammoniac dans une province de l’Arabie Saoudite a évalué la prévalence des symptômes respiratoires et l’effet sur les fonctions respiratoires par mesure de la capacité de force vitale forcée (CVF) et du volume expiratoire maximum en 1 seconde (VEMS). Les résultats obtenus ont été comparés à ceux d’un groupe témoin formé du personnel administratif (348 sujets) de 4 usines de la région (ammoniac, amiante, ciment, pétrochimie). Les ouvriers fortement exposés (>50 mg.m-3.an-1) présentent une diminution significative des fonctions respiratoires (% du VEMS et du CVF prédits) par rapport aux ouvriers exposés plus faiblement (≤ 50 mg.m-3.an-1). De même, les sujets présentant au moins un des symptômes respiratoires chroniques (toux, expectoration, sifflement, dyspnée) ont une diminution significative de paramètres de la fonction respiratoire (% du VEMS et % du rapport VEMS/CVF prédits) par rapport aux sujets asymptomatiques.
Enfin, une autre étude a été menée chez des ouvriers travaillant dans une usine de production d’engrais à base d’urée et ayant été exposés pendant une moyenne de 16,4 ans à l’ammoniac (Rahman et al., 2007). L’exposition à l’ammoniac des ouvriers de l’usine d’urée, mesurée par Dräger PAC III, est en moyenne de 6,9 ppm soit 4,9 mg.m-3 (2 à 8 mg.m-3). Cette concentration n’a pas induit d’effet sur la prévalence des symptômes respiratoires (toux, constriction thoracique, congestion nasale, écoulement nasal ou éternuement) ou sur les paramètres de la fonction respiratoire (CVF, VEMS et débit expiratoire de pointe (DEP)) des ouvriers. En revanche, l’exposition des ouvriers de l’usine d’ammoniac est plus élevée, avec une concentration moyenne en ammoniac de 26,1 ppm soit 18,5 mg.m-3 (9 à 31 mg.m-3). Chez ces derniers, les résultats montrent une augmentation de la toux (28 %) et de constrictions thoraciques (33 %) par rapport au personnel administratif ainsi que des éternuements (22 %) par rapport aux ouvriers de l’usine d’ammoniac. En outre, une diminution du VEMS et de la CVF est observée chez les ouvriers de l’usine d’ammoniac.
L’utilisation de l’ammoniac comme produit d’entretien est associé à l’augmentation de l’asthme ou des symptômes de l’asthme chez des travailleurs dans le secteur de la santé avec des Odds-Ratios entre 1,5 et 2,0 (Anses, 2017). Des effets sur la fonction respiratoire chez des agents d’entretien (Medina-Ramon et al., 2006) ou chez des enfants (Casas et al., 2013) sont également rapportés (Anses, 2017). Ces effets sur la fonction respiratoire sont plus difficilement retrouvés dans des contextes d’exposition agricole notamment en raison de co-exposition (Anses, 2017).
*Les employés les plus fortement exposés (lieu de stockage : 90 – 130,4 mg.m-3) ne sont pas pris en compte car ils doivent porter des équipements de protection, ce qui réduit l’exposition.
Synthèse
Chez l’homme, l’exposition professionnelle à l’ammoniac induit une augmentation de la prévalence de symptômes respiratoires (incluant toux, sifflement, et autres symptômes reliés à l’asthme), ainsi qu’une diminution des fonctions respiratoires.
Chez l'animal
Inhalation
Très peu d’études ont évalué les effets d’une exposition chronique à l’ammoniac chez l’animal. Les rares résultats à notre disposition rapportent des études d’exposition courtes (3 mois).
Des rats mâles et femelles (Sprague-Dawley et Long Evans) ont été exposés en continu à des concentrations de 0, 40, 127, 262, 455 ou 470 mg.m-3 (0, 57, 180, 370, 643 ou 665 ppm) d’ammoniac pendant 90 jours minimum (114 j à la concentration de 40 mg.m-3) (Coon et al., 1970). Des altérations histologiques hépatiques sont rapportées pour une exposition à 455 mg.m-3 (643 ppm). Une calcification des tubules rénaux est également observée aux concentrations de 455 ou 470 mg.m-3 (643 ou 665 ppm). Une LOAEC de 262 mg.m-3 (370 ppm) est déterminée pour des écoulements nasaux chez 25 % des animaux exposés, des altérations de la circulation non spécifiques, une dégénérescence des poumons et des reins mais dont le lien avec l’exposition est difficile à mettre en évidence. Les mêmes auteurs ont également exposé plusieurs espèces animales (rats, cobayes, lapins, chiens et singes) aux concentrations de 0, 155 et 770 mg.m-3 (0, 219 et 1 089 ppm) 8 h.j-1, 5 j.sem-1 pendant 6 semaines. Aucune altération hématologique n’est observée chez le cobaye, le rat et le lapin pour une exposition à 770 mg.m-3 (1 089 ppm). Une LOAEC de 770 mg.m-3 (1 089 ppm) est déterminée pour une inflammation pulmonaire chez le rat et le cobaye. Des irritations nasales sont observées à 770 mg.m-3 (1 089 ppm) chez le lapin et le chien. Aucun examen du tractus respiratoire supérieur n’a été réalisé.
Des cobayes ont été exposés à des concentrations de 0 ou 170 ppm (118 mg.m-3) 6 h.j-1, 5 j.sem-1, pendant 18 semaines (Weatherby, 1952). Une augmentation des concentrations en hémosidérine est mesurée dans la rate de cobayes exposés à 170 ppm (118 mg.m-3). Ceci suggèrerait une accélération possible du renouvellement des cellules sanguines de la lignée rouge. Des anomalies des tubules rénaux d’intensité moyenne sont également décrites.
Voie orale
Une exposition à 79 mg d’ammonium.kg-1.j-1 sous forme de sulfate d’ammonium pendant 90 jours via l’eau de boisson n’induit pas d’anomalies gastro-intestinales, hépatiques ou sanguines (niveau d’hémoglobine et numération cellulaire) chez le rat (Gupta et al., 1979).
Synthèse
Chez l’animal, l’ammoniac induit des irritations nasales, une inflammation pulmonaire, des altérations histologiques hépatiques et une calcification des tubules rénaux.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2008 |
Chez l'homme
Toutes voies
Chez l’homme, aucune étude n’est disponible.
Chez l'animal
Toutes voies
À notre connaissance, il n’existe pas de données.
Effets génotoxiques
Chez l'homme
Toutes voies
A notre connaissance, une seule étude a évalué la génotoxicité de l’ammoniac chez l’homme. Cette étude menée sur des échantillons de sang chez des ouvriers dans une usine de fertilisants a rapporté une augmentation des aberrations chromosomiques et des échanges de chromatides sœurs (Yadav et Kaushik, 1997, Anses, 2017)
Chez l'animal
Toutes voies
D’autres études ont été menées chez Drosophila melanogaster. Un test de mutation létal a révélé un résultat positif, alors qu’un test de mutation létale récessive liée au sexe et un test de mutation létale dominante se sont avérés négatifs (Auerbech et Robson, 1947).
In vitro
Organismes eucaryotes
L’ammoniac s’est avéré mutagène sur Escherichia coli (Demerec et al., 1951), et dans des cellules fibroblastiques de poussin (Rosenfeld, 1932) et de souris (Capuco, 1977 ; Visek et al., 1972).
Effets sur la reproduction
Chez l'homme
Toutes voies
À notre connaissance, il n’existe pas de données relatives aux effets sur la reproduction lors d’une exposition par voie orale, respiratoire et cutanée.
Chez l'animal
Inhalation
Chez le porc exposé à des concentrations de 7 ou 35 ppm (5 ou 25 mg.m-3) d’ammoniac pendant 6 semaines avant l’accouplement et jusqu’au 30ème jour de la gestation par inhalation, aucune altération du poids des ovaires ou de l’utérus et de la taille des fœtus après 30 jours de gestation n’est observée (Diekman et al., 1993). Il n’y a pas non plus de différences dans la survenue de l’âge de la puberté, dans le nombre de fœtus vivants, dans le ratio fœtus-corps lutéal à la concentration de 35 ppm (25 mg.m-3) par rapport à celle de 7 ppm (5 mg.m-3). Aucun lot témoin n’a été inclus dans cette étude, ce qui rend difficile l’interprétation des données.
À notre connaissance, il n’existe pas de données relatives aux effets sur la reproduction lors d’une exposition par voie orale et cutanée.
Synthèse
La seule étude chez le porc ne montre pas d’effet.
Effets sur le développement
Chez l'homme
Toutes voies
À notre connaissance, il n’existe pas de données relatives aux effets sur le développement lors d’une exposition par voie orale, respiratoire et cutanée.
Chez l'animal
Toutes voies
À notre connaissance, il n’existe pas de données relatives aux effets sur le développement lors d’une exposition par voie orale et cutanée.
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’ANSES propose une VTR de 5,9 mg.m-3 (8,3 ppm) pour une exposition aiguë par inhalation à l’ammoniac (2018).
Cette valeur est construite à partir d’une étude chez le volontaire sain exposé à 0 – 5 - 25 ppm d’ammoniac, solution aqueuse à 25 % vaporisée pendant 3 h (Sundblad et al. (2004). L’effet critique est la fonction pulmonaire. Dans cette étude, aucun effet objectivé n’est rapporté pour une exposition à 25 ppm (NOAEC). Les seuls effets rapportés correspondent à des effets ressentis et non mesurables par une méthode quantifiable. Cette observation est supportée par une autre étude chez le volontaire sain (Cole et al., 1977). Dans cette étude, des effets objectivés sur la fonction pulmonaire sont observés à 150 ppm.
L’ANSES précise que la concentration critique se situe dans l’écart de seuil olfactif (0,04 à 53 ppm).
Aucun ajustement temporel n’a été réalisé car l’ammoniac entraine des effets irritants locaux. Aucun ajustement allométrique n’a été pratiqué car l’étude a été menée chez l’homme.
Facteur d’incertitude : Un facteur d’incertitude de 3 est retenu pour tenir compte de la différence de sensibilité au sein de l’espèce humaine.
Calcul : 25 ppm x 1/3 = 8,3 ppm soit 5,9 mg.m-3
Indice de confiance : L’Anses accorde un indice de confiance moyen/fort à sa valeur avec un indice fort en ce qui concerne la nature et la qualité des données, le choix de l’effet critique et le mode d’action et un indice moyen en ce qui concerne le choix de l’étude clé et le choix de la dose critique.
L’ATSDR propose un MRL de 1,7 ppm (1,2 mg.m-3) pour une exposition aiguë par inhalation à l’ammoniac (2004).
Cette valeur est basée sur une étude chez le volontaire sain. Les individus ont été exposés pendant 2 heures aux concentrations de 50 – 80 – 110 et 140 ppm (35 – 57- 78 ou 99 mg.m-3) d’ammoniac, avec un écart d’une semaine entre chaque exposition (Verberk, 1977). De cette étude, une LOAEC de 50 ppm (35 mg.m-3) est déterminée pour une irritation modérée des yeux, du nez et de la gorge pour une exposition de 2 heures.
Facteur d’incertitude : Un facteur d’incertitude de 30 est retenu, qui comprend un facteur de 10 pour tenir compte de la différence de sensibilité au sein de l’espèce humaine, et un facteur de 3 pour tenir compte de l’utilisation d’une LOAEC.
Calcul : 50 ppm x 1/30 = 1,667 ppm soit 1,18 mg.m-3 (arrondi à 1,7 ppm et 1,2 mg.m-3)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
L’OEHHA propose un REL de 4,5 ppm (3,2 mg.m-3) pour une exposition aiguë par inhalation à l’ammoniac (2000).
Cette valeur est basée sur 4 études chez l’homme (Industrial Bio-Test Laboratories 1973 ; MacEwen et al., 1970 ; Silverman et al., 1949 ; Verberk, 1977), exposés à des concentrations comprises entre 32 et 500 ppm. Les durées d’exposition rapportées dans ces études sont très variables, allant de 5 à 120 minutes. Les concentrations d’exposition ajustées à 1 heure d’exposition (C4,6 x T = K) ont donc été calculées pour déterminer une BMC05 de 13,6 ppm (9,7 mg.m-3) associée à l’incidence de l’irritation oculaire et respiratoire.
Facteur d’incertitude : Un facteur d’incertitude de 3 est retenu pour tenir compte de la différence de sensibilité au sein de l’espèce humaine.
Calcul : 13,6 ppm x 1/3 = 4,53 ppm soit 3,22 mg.m-3 (arrondi à 4,5 ppm et 3,2 mg.m-3)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
Effets à seuil - Exposition sub-chronique par inhalation :
L’ANSES retient la valeur de 0,5 mg.m-3 pour une exposition sub-chronique par inhalation à l’ammoniac de l’US EPA (2016) (ANSES, 2018).
Cette valeur est identique sur celle proposée par l’US EPA (2016) pour expositions chroniques et présentée plus loin. Compte tenu de la qualité de cette valeur, l’ANSES a retenu cette valeur sans modifications pour des expositions chroniques et considère que cette valeur peut être utilisée pour des expositions sub-chroniques.
Indice de confiance : L’Anses accorde un indice de confiance moyen à sa valeur avec un indice fort en ce qui concerne le choix de l’effet critique et le mode d’action et un indice moyen en ce qui concerne le choix de l’étude clé et le choix de la dose critique et un indice faible en ce qui concerne la nature et la qualité des données.
Effets à seuil - Exposition chronique par inhalation :
L’US EPA propose un RfC de 0,5 mg.m-3 pour une exposition chronique par inhalation à l’ammoniac (2016).
Cette valeur est basée sur une étude épidémiologique chez des ouvriers exposés professionnellement à l’ammoniac (Holness et al., 1989) et confortée par 3 autres études épidémiologiques plus récentes mais pour lesquelles la relation dose effet est moins évidente (Rahman et al., 2007 ; Ballal et al., 1998 ; Ali et al., 2001). L’effet critique retenu correspond aux effets respiratoires, caractérisés par l’augmentation des symptômes respiratoires auto-rapportés par les ouvriers et une diminution des fonctions respiratoires mesurées. En l’absence d’effets pulmonaires dans l’étude d’Holness et al., le groupe d’ouvriers le plus exposé (12,5 – 25 ppm soit 8,8 – 17,7 mg.m-3) est retenu pour calculer la dose critique, en excluant les 3 ouvriers pour lesquels l’exposition est supérieure à 17,7 mg.m-3. Si les données brutes d’exposition des ouvriers ne sont pas précisées, Holness et al. ont tout de même rapporté des gammes de données sur la distribution de l’exposition (Tableau 6). A partir de ces données et de l’hypothèse qu’elles suivent une distribution log-normale, l’US EPA a estimé l’exposition moyenne du groupe d’ouvriers le plus exposé, et l’intervalle de confiance à 95 % autour de cette moyenne. La borne inférieure de cet l’intervalle de confiance à 95% (IC95) a été retenue comme une NOAEC (13,6 mg.m-3). Pour tenir compte de l’aspect discontinu de l’exposition (10 m3/20 m3, 5 j/7 j), une NOAEC ajustée de 4,9 mg.m-3 est calculée :
NOAECADJ = 13,6 mg.m-3 x (10 m3/20 m3) x (5 j/7 j) = 4,857 mg.m-3 arrondi à 4,9 mg.m-3
Facteur d’incertitude : Un facteur d’incertitude de 10 est retenu pour tenir compte de la différence de sensibilité au sein de l’espèce humaine.
Calcul : 4,9 mg.m-3 x 1/10 = 0,49 mg.m-3 (arrondi à 0,5 mg.m-3)
Indice de confiance : L’US EPA accorde un indice de confiance moyen dans l’étude retenue, la base de données et la valeur élaborée.
L’ATSDR propose un MRL de 0,1 ppm (0,07 mg.m-3) pour une exposition chronique par inhalation à l’ammoniac (2004).
Cette valeur est basée sur la même étude épidémiologique (Holness et al., 1989) que celle retenue par l’US EPA. De cette étude, une NOAEC de 9,2 ppm (6,4 mg.m-3) est déterminée pour l’altération de la fonction pulmonaire, correspondant à la concentration d’exposition moyenne des ouvriers. Le MRL est calculé à partir d’une NOAEC ajustée de 2,19 ppm (xx mg.m-3) pour tenir compte de l’aspect discontinu de l’exposition (8 h/24 h, 5 j/7 j).
NOAECADJ = 9,2 ppm x (8 h/24 h) x (5 j/7 j) = 2,19 ppm (1,55 mg.m-3)
Facteur d’incertitude : Un facteur d’incertitude de 30 est retenu, qui comprend un facteur de 10 pour tenir compte de la différence de sensibilité au sein de l’espèce humaine, et d’un facteur supplémentaire de 3 pour tenir compte du manque de données sur la reproduction et le développement.
Calcul : 2,19 ppm x 1/30 = 0,073 ppm (arrondi à 0,1 ppm soit 0,07 mg.m-3)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
L’OEHHA propose un REL de 0,3 ppm (0,2 mg.m-3) pour une exposition chronique par inhalation à l’ammoniac (2000).
Cette valeur est basée sur l’étude de Holness et al., (1989) déjà retenue par l’ATSDR et l’US EPA. De cette étude, une NOAEC de 9,2 ppm (6,4 mg.m-3) correspondant à la concentration d’exposition moyenne des ouvriers est déterminée en l’absence d’altérations de la fonction pulmonaire et d’irritations respiratoires, oculaires et cutanées. Une NOAEC ajustée de 2,3 mg.m-3 est calculée pour tenir compte de l’aspect discontinue de l’exposition (10 m3/20 m3, 5 j/7 j).
NOAECADJ = 6,4 mg.m-3 x (10 m3/20 m3) x (5 j/7 j) = 2,286 mg.m-3 arrondi à 2,3 mg.m-3
Facteur d’incertitude : Un facteur d’incertitude de 10 est retenu pour tenir compte de la différence de sensibilité au sein de l’espèce humaine.
Calcul : 2,3 mg.m-3 x 1/10 = 0,23 mg.m-3 (arrondi à 0,2 mg.m-3)
Indice de confiance : Cet organisme ne détermine pas d’indice de confiance.
L’ANSES retient la valeur de 0,5 mg.m-3 pour une exposition chronique par inhalation à l’ammoniac de l’US EPA (2016) (ANSES, 2018).
Cette valeur est identique sur celle proposée par l’US EPA (2016). Compte tenu de la qualité de cette valeur, l’ANSES a retenu cette valeur sans modifications.
Indice de confiance : L’Anses accorde un indice de confiance moyen/fort à sa valeur avec un indice fort en ce qui concerne le choix de l’effet critique et le mode d’action et un indice moyen en ce qui concerne la nature et la qualité des données, le choix de l’étude clé et le choix de la dose critique.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’ANSES retient pour une exposition aiguë à l’ammoniac par inhalation la VTR aiguë de 5,9 mg.m-3 (2018)
Trois organismes proposent une valeur (ATSDR, 2004 ; OEHHA, 2000 ; ANSES, 2017) élaborée exclusivement à partir d’études chez l’homme. L’ATSDR se base sur une seule étude (Verberk et al.,1977) dont la caractérisation des effets est réalisée par une auto-évaluation (réponses subjectives) induisant des limites quant à l’interprétation. La durée d’exposition (2 h) est courte. Malgré ces limites, cette étude est de qualité recevable. L’OEHHA se base sur quatre études (Industrial Bio-Test Laboratories 1973 ; MacEwen et al., 1970 ; Silverman et al., 1949 ; Verberk, 1977), incluant l’étude retenue par l’ATSDR. Les trois autres études, plus anciennes, rapportent des expositions plus courtes (5 à 30 min). L’étude de Silverman et al. (1949) comportent les mêmes limites que celle de Verberk et al.. Les deux autres études ne sont pas disponibles et n’ont pas pu être analysées. Ce jeu de données quoique plus complet présente des limites tant au niveau de l’estimation des effets (auto-évaluations) que des durées d’expositions qui sont courtes. L’ANSES retient une étude d’une durée légèrement plus longue (3 h) avec des résultats objectivés (mesurables par une méthode quantifiable).
Les effets critiques retenus sont identiques : irritation oculaire et respiratoire et sont en adéquation avec le profil toxicologique de l’ammoniac.
Pour la caractérisation du danger, l’ATSDR a défini une LOAEC. Un facteur de 30 a été retenu pour tenir compte de la variabilité inter-individuelle et de l’utilisation d’une LOAEC, ce qui est cohérent.
L’OEHHA a construit une benchmark dose associée à l’augmentation de 5 % de l’incidence des irritations. Cette approche est mieux adaptée que l’utilisation d’une NOAEC car elle permet notamment de s’affranchir des conditions spécifiques de l’étude. Par ailleurs, un facteur d’incertitude de 3 a été retenu pour tenir compte de la variabilité inter-individuelle. Compte tenu de la distribution de l’ammoniac après une exposition par inhalation et l’effet local de la substance, ce facteur est recevable.
L’ANSES retient une absence d’effet, aucun ajustement temporel ou allométrique n’a été retenu car il n’est pas attendu de variations pour ce type d’effets locaux. Un facteur d’incertitude de 3 a été appliqué pour tenir compte de variation au sein de la population.
La valeur de l’ANSES est retenue par l’Ineris.
Indice de confiance : L’Anses accorde un indice de confiance moyen/fort à sa valeur avec un indice fort en ce qui concerne la nature et la qualité des données, le choix de l’effet critique et le mode d’action et un indice moyen en ce qui concerne le choix de l’étude clé et le choix de la dose critique.
Effets à seuil - Exposition sub-chronique par inhalation :
L’ANSES retient pour une exposition sub-chronique à l’ammoniac par inhalation la VTR chronique de 0,5 mg.m-3 (ANSES, 2017).
En l’absence d’autres valeurs, l’ANSES considère que la valeur retenue pour des expositions chroniques est applicables pour des expositions sub-chroniques. L’Ineris est d’accord avec ce choix.
Indice de confiance : L’Anses accorde un indice de confiance moyen à sa valeur avec un indice fort en ce qui concerne le choix de l’effet critique et le mode d’action et un indice moyen en ce qui concerne le choix de l’étude clé et le choix de la dose critique et un indice faible en ce qui concerne la nature et la qualité des données.
Effets à seuil - Exposition chronique par inhalation :
L’Anses propose de retenir pour une exposition chronique à l’ammoniac par inhalation la VTR chronique de 0,5 mg.m-3 de l’US EPA (2016).
Trois organismes proposent une valeur (ATSDR, 2004 ; OEHHA, 2000 ; US EPA, 2016) en se basant sur la même étude (Holness et al., 1989), qui de surcroît est de bonne qualité. Les organismes retiennent également le même effet critique, des effets pulmonaires caractérisés par une altération des fonctions respiratoires, éventuellement associée à une augmentation des symptômes respiratoires. Ces effets sont en adéquation avec le profil toxicologique de l’ammoniac.
Les différences dans le calcul de la VTR résident au niveau de la détermination de la dose critique, de l’ajustement au temps et les facteurs d’incertitude retenus.
Dans l’étude de Holness et al., 1989, les concentrations d’exposition des ouvriers n’ont pas permis d’identifier des effets pulmonaires. L’ATSDR et l’OEHHA ont donc caractérisé leur NOAEC sur la base de l’exposition moyenne de l’ensemble des ouvriers exposés. L’US EPA a en revanche révisé et ajusté sa NOAEC en émettant l’hypothèse que les données d’exposition des ouvriers suivent une distribution log-normale. L’organisme a ainsi pu estimer l’exposition moyenne du groupe d’ouvriers le plus exposé et son intervalle de confiance (IC95). L’US EPA a réalisé une estimation plus précise de la NOAEC en retenant la borne inférieure de l’IC95 de l’exposition moyenne des ouvriers les plus exposés au sein de l’usine.
Pour tenir compte de l’aspect discontinu de l’exposition, l’ATSDR a ajusté la NOAEC en fonction du temps. L’US EPA et l’OEHHA ont préféré prendre en compte les volumes respiratoires. Les deux méthodes sont relativement équivalentes et recevables.
Pour les facteurs d’incertitude, l’US EPA, l’ATSDR et l’OEHHA ont retenu un facteur de 10 pour tenir compte de la différence de sensibilité au sein de l’espèce humaine, ce qui est adapté. L’ATSDR a également retenu un facteur de 3 du fait de l’absence de données sur la reproduction. Ce dernier facteur n’est pas retenu par l’OEHHA et l’US EPA, et ne parait pas justifié.
En 2017, l’ANSES a analysé les différentes VTR disponibles et a retenu celle de l’US EPA (2016). L’étude retenue est de bonne qualité et soutenue par d’autres études épidémiologiques. L’estimation de l’exposition des ouvriers a été modélisée et les facteurs d’incertitude sont adaptés. La valeur est retenue par l’Anses. L’Ineris est en accord avec ce choix.
Indice de confiance : L’Anses accorde un indice de confiance moyen/fort dans la valeur retenue.
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés ci-après.
A noter que lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC.
Dangers
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
L'ensemble des informations et des données de cette rubrique proviennent majoritairement des revues bibliographiques effectuées par Johnson et al. (2007) et Mummert et al. (2003). Cette rubrique a pour objectif de présenter la diversité des données de toxicité aiguë plus que d’effectuer un recensement exhaustif des données existantes. Ces données ne sont d’ailleurs présentées qu’à titre indicatif, les données de toxicité chronique étant nombreuses. Pour plus d’information, le lecteur pourra notamment se rapporter au document de l’US EPA (1999). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la rubrique. Il est important de rappeler que la toxicité de l’ammoniac vis-à-vis des organismes aquatiques est étroitement liée à sa spéciation chimique. Cette spéciation est contrôlée principalement par le pH, la température et la composition ionique du milieu (Environment Canada, 1993). C’est pourquoi, en 1999 l’US EPA a réévalué la toxicité de l’ammoniac en tenant compte de la forme chimique de l’ammoniac, ionisée ou non ionisée, et exprime les résultats sous la forme d’azote total à pH 8 et 25°C. Toutefois, de la même manière que le travail réalisé par Johnson et al. (2007) et afin de conserver l’homogénéité des résultats avec la littérature scientifique, il a été décidé, dans ce chapitre d’exprimer les résultats en mg.L-1 d’azote sous la forme NH3 (N-NH3).Les résultats donnés ci-après sont calculés sur l’ensemble des essais réalisés et indépendamment de leur recevabilité, en utilisant la moyenne géométrique des résultats lorsque plusieurs essais sont disponibles pour une même espèce.
Paramètres d’écotoxicité aiguë:
Sur l’ensemble des données, la moyenne géométrique des CE(L)50 de l’ammoniac pour les organismes aquatiques est de 0,94 mg.L-1 (N-NH3) avec un minimum de 0,030 mg.L-1 et un maximum de 22,32 mg.L-1. Les données recueillies se répartissent selon une distribution statistique log-normal. Il est à noter qu’aucune valeur anomale n’a été observée. Selon ces données, 5 % des CL50 sont inférieures à 0,127 mg.L-1 (intervalle de confiance à 95 % : 0,08 – 0,187 mg.L-1). La toxicité de l’ammoniac vis-à-vis des organismes dulçaquicoles semble similaire à celle des organismes marins, la moyenne géométrique des C(E)L50 pour ces deux groupes est respectivement de 0,85 et 1,14 mg.L-1 (N-NH3). La différence de sensibilité dans ce cas semble davantage liée aux essais réalisés qu’à des différences biologiques.
Les algues sont relativement peu sensibles avec des CE50 comprises entre 2 et 17 mg.L-1 (NH3) pour les algues dulçaquicoles et marines respectivement.
Vis-à-vis des invertébrés, la moyenne géométrique des C(E)L50 est de 0,85 et 1,14 mg.L-1 (N-NH3) respectivement pour les organismes dulçaquicoles et les organismes marins. Toutefois, les stades précoces (embryo-larvaires et juvéniles) des échinodermes marins et mollusques dulçaquicoles (i.e. Unionidae) ou marins semblent des maillons particulièrement sensibles à l’ammoniac avec des CL50 minimaux de 0,03 mg.L-1 (N-NH3).
Enfin, les poissons dulçaquicoles et marins font partie des organismes les plus sensibles avec des CL50 moyennes de 0,85 et 1,14 mg.L-1 respectivement.
Algues:
Il existe relativement peu de données sur la toxicité de l’ammoniac vis-à-vis des algues. Vis-à-vis des organismes dulçaquicoles, Przytoca-Jusiak, (1976, cité par Johnson et al., 2007) indique que la CE50 5 jours pour Chlorella vulgaris est de 2 mg.L-1 (N-NH3) en utilisant pour critère d’effet l’abondance. Vis-à-vis de la diatomée marine, Phaeodactylum tricornutum, une CE50 1,5 heures de 17 mg.L-1 (N-NH3) est obtenue en utilisant l’activité photosynthétique comme critère de toxicité (Azoz et Goldman, 1982, cités par Johnson et al., 2007). D’autres valeurs existent dans la littérature, mais les résultats sont limités et souvent contradictoires. Toutefois, ces données semblent indiquer que les espèces végétales tolèrent mieux l’ammoniac que les invertébrés ou les poissons.
Invertébrés:
Vis-à-vis des invertébrés, la moyenne géométrique des C(E)L50 de l’ammoniac est de 1,156 mg.L-1. Elle est de 1,199 et 1,100 respectivement pour les invertébrés dulçaquicoles et les invertébrés marins.
Pour les organismes dulçaquicoles, la moyenne géométrique des C(E)L50 est de 4,04 (1,72 – 10,13), 3,32 (2,4 – 4,6), 1,46 (0,963 – 2,21), 1,42 (0,210 – 22,315), 1,2 et 0,518 (0,159 – 2,373) mg.L-1 (N-NH3) respectivement pour les insectes, rotifères, les annélides, les crustacés, les plathelminthes et les mollusques. La variabilité des résultats est liée aux conditions physico-chimiques des milieux d’essais influençant la concentration en NH3 mais également à la sensibilité particulière de certains stades de développement. Ainsi, par exemple, les stades embryo-larvaires et juvéniles des mollusques bivalves (i.e. Corbicula fluminea, Lampsilis fasciola, Utterbackia imbecillis, Villosa iris) sont particulièrement sensibles à l’ammoniac. De même, en eau de mer, la moyenne géométrique des C(E)L50 est de 8,6, 1,96 (0,07 – 12,78), 1,18 (0,13 – 3,5) et 0,041 (0,03 – 0,057) mg.L-1 (N-NH3) respectivement pour les rotifères, les mollusques, les crustacés et les échinodermes. Tout comme pour les organismes dulçaquicoles, les mollusques bivalves (Ruditapes philippinarum) ou gastéropodes (Haliotis rufescens) et les échinodermes (Dendraster excentricus, Strongylocentrotus purpuratus) sont particulièrement sensibles à l’ammoniac.
Poissons:
Les poissons dulçaquicoles et marins sont des organismes sensibles à l’ammoniac. La moyenne géométrique des CL50 est de 0,668 mg.L-1 (N-NH3). Pour les poissons dulçaquicoles, les CL50 96 heures sont comprises entre 0,068 (Oncorhynchus gorbuscha) et 4,3 mg.L-1 (N-NH3 ; Clarias batrachus) avec une moyenne géométrique de 0,632 mg.L-1. Vis-à-vis des poissons marins, ces valeurs sont respectivement de 0,390 (Sciaenops ocellatus), 1,7 (Cyprinodon variegatus) et 0,86 mg.L-1 (N-NH3).
Paramètres d’écotoxicité chronique:
En 1998, l’US EPA a effectué une revue bibliographique des données de toxicité de l'ammoniac, reprise dans US EPA (1999). La pertinence et la validité des données ont été évaluées selon l’US EPA (1986) et les normes E1193, E1241 et E1295 de l’ASTM (ASTM, 1997a, b, c). L’US EPA a estimé par régression les concentrations en ammoniac total en termes d’azote induisant 20 % d’effet. Dans son évaluation, l’US EPA (1999) a utilisé les CE20, les CE10 étant majoritairement non significativement différentes des témoins. Dans ce rapport, les CE10 sont donc retenues comme NOEC et considérées comme valides.
De même, les essais effectués par Hickey et al. (1999, Deleatidium sp., NOEC : 0,066 mg.L-1), Thurston et al. (1984a, Oncorhynchus mykiss, NOEC : 0,07 mg.L-1), Solbé et Shurben (1989, Oncorhynchus mykiss, NOEC : 0,011 mg.L-1), Jofre et Karasov (1999, Rana clamitans, NOEC : 1 mg.L-1) et Alderson (1979, Solea solea, NOEC : 0,066 mg.L-1) ont été revus et considérés comme valides par Johnson et al. (2007). Ils seront également considérés comme valides dans ce document.
Indépendamment de la qualité des données, en eau douce ou marine, pour l’ammoniac les LOEC vis-à-vis des algues sont comprises entre 0,2 et 3 mg.L-1. La moyenne géométrique des NOEC pour les invertébrés et les poissons est respectivement de 0,23 et 0,18 mg.L-1. Plus précisément, pour les organismes dulçaquicoles, la NOEC ou la moyenne géométrique des NOEC lorsque plusieurs données sont disponibles pour un même taxon est de 0,09, 0,18, 0,26, 0,33 et 1 mg.L-1 (N-NH3) respectivement pour les mollusques, les poissons, les crustacés, les insectes et les amphibiens. Pour les organismes marins, un nombre inférieur de données est disponible. Dans ce cas, ces valeurs sont de 0,19 et 0,16 mg.L-1 respectivement pour les poissons et les crustacés.
Algues:
Vis-à-vis des algues dulçaquicoles et marines, deux LOEC ont été répertoriées. La première a été obtenue en milieu dulçaquicole sur une population mixte d’algues et la seconde sur des diatomées benthiques en milieu marin. Dans ces essais, les LOEC croissance sont respectivement de 3 et 0,2 mg.L-1 (N-NH3) pour des durées d’exposition de 14 et 10 jours.
De ces deux données, seule la LOEC en milieu dulçaquicole a été validée par Johnson et al. (2007). Cette valeur a été obtenue dans une étude en mésocosmes ne comportant qu’une seule concentration. Pour l’évaluation du risque de l’ammoniac faite dans ce document, cette dernière donnée ne sera pas retenue compte tenu de la durée d’exposition et du critère mesurée (LOEC). Toutefois, cette étude montre que, comme dans les études de toxicité aiguë, les algues sont moins sensibles à l’ammoniac que les invertébrés. Cette observation est cohérente avec le fait que l’ammoniac peut être une source d’azote pour de nombreux végétaux.
Invertébrés:
Indépendamment de la validité des données vis-à-vis des invertébrés, la moyenne géométrique des NOEC de l’ammoniac est de 0,24 et 0,16 mg.L-1 (N-NH3) respectivement pour les organismes dulçaquicoles et les organismes marins.
Vis-à-vis des organismes dulçaquicoles, 9 NOEC ou CE10 ont été validées par l’US EPA (1999) ou par Johnson et al. (2007) dont 6 sur crustacés, 1 sur insecte et 2 sur mollusques. Ces valeurs sont comprises entre 0,026 (Musculium transversum, Sparks et Sandusky, 1981) et 1,118 mg.L-1 (Ceriodaphnia dubia, N-NH3). La CE10 de 0,283 mg.L-1 (N-NH3) obtenue par Anderson et al. (1978) sur Musculium transversum et la CE10 de 0,038 mg.L-1 obtenue sur Hyalella azteca (N-NH3, Borgmann, 1994) ne pouvant pas être validées, la plus faible NOEC 29 jours validée au niveau de l’espèce est de 0,066 mg.L-1 (N-NH3). Cette valeur, obtenue par Hickey et al. (1999) sur Deleatidium sp., semble toutefois peu protectrice par rapport aux résultats obtenus dans d’autres études chroniques, mais également par rapport à des mesures de CL50 long terme sur d’autres mollusques (Lampsilis cardium, CL50 10 jours 0,05 mg.L-1 N-NH3, Newton et al., 2003).
Pour les organismes marins, dans leur étude de 2007, Johnson et al. ont validé la LOEC croissance 42 jours de 0,1 mg.L-1 (N-NH3), correspondant à une CE2 sur la crevette Macrobrachium rosenbergii (Wickens, 1976). Cet essai a été réalisé en flux dynamique avec un suivi analytique de la concentration en ammoniac. Dans cette étude, l’auteur exprime les concentrations en ammoniac en N-NH3. Cette valeur sera donc retenue également comme valide pour l’évaluation des risques faite dans ce document.
Boardman et al. (2004) ont exposé à l’ammoniac des larves de Palaemonetes pugio durant 7 jours. Les essais sont réalisés en semi-statique avec renouvellement journalier du milieu dans des aquariums d’un litre. Durant l’essai, les animaux sont nourris 2 fois par jour avec des nauplii d’artémie. Les essais sont réalisés dans de l’eau de mer synthétique à une température de 25°C, une concentration en oxygène dissous supérieure à 4 mg.L-1, un pH de 8,2 ± 0,1, et une salinité de 25 ppt. Le nombre de concentrations en ammoniac testées n’est pas indiqué. Pour chaque concentration testée , 4 répliques et un suivi analytique sont réalisés. Dans ces conditions, la NOEC survie et la NOEC croissance sont respectivement de 0,81 et 0,27 mg.L-1 N-NH3.
Les essais sont peu décrits et les résultats bruts ne sont pas indiqués. Un suivi analytique est réalisé mais la durée des essais est trop courte. Les résultats sont considérés comme non valides (niveau de validité : 3).
Vertébrés:
Vis-à-vis des poissons, indépendamment de la validité des données, 25 NOEC ou CE10 ont été recensées. La moyenne géométrique de ces valeurs est de 0,17 et 0,19 mg.L-1 (N-NH3) respectivement pour les organismes dulçaquicoles et les organismes marins.
Parmi ces valeurs considérées comme valides pour le milieu dulçaquicole, 16 ont été obtenues sur 8 espèces. Les NOEC sont comprises entre 0,05 (Lepomis macrochirus, Smith et al., 1984) et 0,44 mg.L-1 (Xyrauchen texanus, Fairchild et al., 2005, N-NH3) avec une moyenne géométrique de 0,160 mg.L-1 (N-NH3). Toutefois, Solbé et Shurben (1989) ont montré que l’exposition des premiers stades de vie de la truite arc-en-ciel (Oncorhynchus mykiss) à la concentration de 0,022 mg.L-1 (N-NH3) pouvait induire un taux de mortalité important (> 70 %). Seule la NOEC de 0,066 mg.L-1 (Solea solea, Alderson, 1979, N-NH3) est disponible pour le milieu marin. Cette valeur, obtenue en utilisant comme critère de toxicité la croissance, a été considérée comme valide par Johnson et al. (2007), l’essai ayant été conduit selon une procédure bien définie, en flux continu avec un suivi analytique des concentrations en ammoniac.
Une étude de toxicité chronique sur amphibien est disponible. La NOEC survie/croissance obtenue est de 1 mg.L-1 (N-NH3) vis-à-vis du têtard de la grenouille verte Rana clamitans (Jofre et Karasov, 1999). Johnson et al. (2007) ont considéré l’essai comme valide, ce dernier ayant été conduit selon une procédure bien décrite, en flux continu avec un suivi analytique des concentrations en ammoniac.
Boardman et al. (2004) ont exposé à l’ammoniac trois espèces de poissons marins le Paralichthys dentatus, au stade juvénile, le Cyprinodon variegatus et le Menidia menidia au stade larvaire durant 7 jours. Les essais sont réalisés en semi statique avec renouvellement journalier du milieu dans des aquariums de 0,6 à 2 litres. Les juvéniles ou les larves proviennent de laboratoires ou d’écloseries. Durant l’essai, les animaux sont nourris 2 fois par jour avec des nauplii d’artémie ou des granulés en fonction de l’espèce. Les essais sont réalisés dans de l’eau de mer synthétique à une température de 25°C, une concentration en oxygène dissous supérieure à 4 mg.L-1, un pH de 8,2 ± 0,1, et une salinité de 25 ppt pour le Cyprinodon variegatus et de 30 ppt pour les deux autres espèces. Le nombre de concentrations en ammoniac testées n’est pas indiqué. Pour chaque concentration testée 4 répliques (Cyprinodon variegatus) ou 3 répliques (Paralichthys dentatus, Menidia menidia) sont réalisées. Un suivi analytique est effectué. Dans ces conditions, la NOEC survie est de 1,07 ; 0,52 et 0,28 mg.L-1 N-NH3 respectivement pour le Cyprinodon variegatus, le Menidia menidia et le Paralichthys dentatus. Parallèlement, la NOEC croissance est de 0,28 et 0,39 mg.L-1 N-NH3 pour le Cyprinodon variegatus et le Menidia menidia.
Les essais sont peu décrits et les résultats bruts ne sont pas indiqués. Toutefois un suivi analytique est réalisé mais la durée des essais est trop courte. Les résultats sont considérés comme non valides (niveau de validité : 3).
Fairchild et al. (2005) ont exposé à l’ammoniac trois espèces de poissons dulçaquicoles, le Pimephales promelas, le Ptychocheilus lucius et le Xyrauchen texanus au stade larvaire durant 28 jours. Les essais sont réalisés en semi-statique avec renouvellement journalier du milieu dans des aquariums d’un litre. Les larves âgées de 1 jour proviennent de laboratoires ou d’écloseries. Les essais débutent avec des larves au stade nourriture exotrophe (4, 8 et 9 jours après éclosion respectivement pour le Pimephales promelas, le Ptychocheilus lucius et le Xyrauchen texanus). Durant l’essai, les larves sont nourries 2 fois par jour avec des nauplii d’artémie. Les essais sont réalisés dans de l’eau de forage à une température de 19,9 ± 1,0°C, une concentration en oxygène dissous de 7,4 ± 0,8 mg.L-1, un pH de 8,24 ± 0,01 une conductivité de 660 ± 76 µSiemens.cm-1, une alcalinité de 245 ± 12 mg.L-1 (CaCO3) et une dureté de 273 ± 12 mg.L-1 (CaCO3). Les essais sont réalisés à 4 concentrations en ammoniac (2,5 ; 5 ; 10 et 15 mg.L-1 d’ammoniac total exprimé sous la forme N introduit sous la forme chlorure d’ammonium) plus un témoin. Pour chaque concentration testée, 3 répliques sont réalisées. Un suivi analytique est effectué. Dans ces conditions, les NOECs survie sont de 0,25 ; 0,44 et inférieure à 0,44 mg.L-1 N-NH3 respectivement pour le Pimephales promelas, le Ptychocheilus lucius et le Xyrauchen texanus. Les NOECs croissance sont respectivement de 0,25 ; 0,24 et inférieure à 0,44 mg.L-1 N-NH3.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Les résultats sont indiqués pour chaque concentration testée et le taux de mortalité chez les témoins est au minimum de 93 %. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2).
Smith et al. (1984) ont étudié la toxicité de l’ammoniac sur les premiers stades de vie du Lepomis macrochirus. L’essai a été réalisé en flux continu durant une période d’exposition de 30 jours au chlorure d’ammonium. Cinq concentrations et un témoin ont été testés avec 4 répliques. Cinquante embryons (£ 28 heures) ont été utilisés par réplique. Un suivi analytique des concentrations d’essai sous forme d’ammoniac total a été réalisé 2 fois par semaine et les concentrations en ammoniac non ionisé (NH3) ont été dérivées à partir de celles-ci suivant la méthode de Thurston et al. (1979). La dureté, l’alcalinité et la concentration en oxygène dissous ont été mesurées une fois par semaine. Les éclosions ont été examinées et dénombrées deux fois par jour, les embryons morts étaient retirés des enceintes d’essai. Après éclosion totale (au 3ème jour d’essai), les survivants ont été déterminés une fois par jour, de même que la présence de larves déformées et les individus morts ont été ôtés. Les larves ont été nourries avec des nauplii d’artémia ad libitum 4 fois par jour. Au bout de 14 jours d’exposition, le nombre d’individus par enceinte d’essai a été réduit à 20 individus. A la fin de l’essai, tous les poissons survivants ont été pesés. La NOEC déterminée à partir des concentrations mesurées et par rapport aux poids des individus et au pourcentage de survivants obtenus au bout de 30 jours d’exposition à pH 7,76 ± 0,72 et 22,5°C ± 0,3 est de 1,64 ± 0,29 mg (ammoniac total).L-1, soit 0,05 ± 0,009 mg (N-NH3) .L-1. Le taux de survie des œufs témoins était de 92,5 % à l’éclosion et le taux de survie des larves est de 100 % à la fin de l’essai.
Le protocole d’essai est relativement bien renseigné et globalement satisfaisant avec néanmoins certains paramètres qui s’écartent quelque peu de ceux recommandés par la Ligne directrice 210 de l’OCDE : la température devrait être de 28 °C, la durée de l’essai de 32 jours et la fréquence des apports alimentaires de 3 fois par jour. Par ailleurs, aucune information sur la concentration en oxygène dissous n’est fournie, mais il est indiqué que celle-ci a été contrôlée et mesurée chaque semaine. Compte tenu de ces remarques, l’essai est considéré comme valide sous restrictions (niveau de validité : 2).
Sédiments d'eau douce
Paramètres d’écotoxicité aiguë:
Vis-à-vis des organismes du compartiment sédimentaire dulçaquicole, la moyenne géométrique des CL50 96 heures sur l’Unionidae Lampsilis cardium est de 0,145 mg.L-1 (N-NH3, Newton et al., 2003). Cette valeur est similaire à celle obtenue sur la même espèce en absence de sédiments.
Paramètres d’écotoxicité chronique:
Newton al. (2003) ont exposé des larves de Lampsilis cardium durant 10 jours à l’ammoniac. Les essais sont réalisés en flux dynamique dans des aquariums de 1,2 litres dont le fond est recouvert d’une couche de sable de silice de 1,5 cm puis de 3 cm de sédiment. Deux essais, durant lesquels les animaux ne sont pas nourris, sont réalisés à une température de 21 ± 0,1°C et 21,3 ± 0,1°C, une concentration en oxygène dissous de 7,7 ± 0,1 et 7,8 ± 0,1 mg.L-1, un pH de 7,9 ± 0,1 et 8,1 ± 0,1, une alcalinité de 90 ± 4 et 75 ± 8 mg.L-1 (CaCO3), une dureté de 132 ± 1 et 123 ± 1 mg.L-1 (CaCO3) et une conductivité de 3 502 ± 24 et 3 640 ± 41 µS.cm-1. Six concentrations en ammoniac comprises entre 5,7 et 57,4 mg.L-1 d’azote total sont testées avec 6 (premier essai) ou 3 (second essai) répliques. Un suivi analytique est réalisé. Dans ces conditions, les CL50, CEproportion affectée et CEcroissance 10 jours sont respectivement de 0,1396, 0,0991 et 0,0762 mg.L-1 N-NH3 lors du premier essai et de 0,0932, 0,0712 et 0,051 mg.L-1 N-NH3 lors du second essai.
Les essais sont relativement bien décrits mais les résultats obtenus pour chaque concentration ne sont pas indiqués. Un suivi analytique est réalisé. La durée des essais est courte mais est liée notamment à la durée de vie des larves dans les conditions de laboratoire. Le taux de survie des témoins est élevé. Les résultats sont exprimés en termes de CL50. Les résultats sont considérés comme non valides (niveau de validité : 3).
Sol
Paramètres d’écotoxicité aiguë:
Pour les organismes terrestres, aucune donnée fiable de toxicité aiguë de l’ammoniac n’a été répertoriée pour une contamination via le sol ou la voie trophique.
Paramètres d’écotoxicité chronique:
Aucune donnée n’est disponible sur la toxicité chronique de l’ammoniac sur les organismes terrestres comme les abeilles, les prédateurs, les parasites, les oiseaux et les mammifères (Santé Canada, 2005). De même, différents auteurs ont étudié la toxicité de l’ammoniac atmosphérique vis-à-vis des plantes. Toutefois, aucune étude fiable concernant l’étude de la toxicité par le sol n’a été répertoriée. Santé Canada (2005) indique que les végétaux utilisent l’ammonium comme élément nutritif, mais de fortes concentrations de ce composé peuvent se révéler toxiques pour ces espèces.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Paramètres d’écotoxicité aiguë:
Sur l’ensemble des résultats de toxicité aiguë répertoriés, les algues et plantes aquatiques semblent être les organismes les moins sensibles à l’ammoniac, cette observation est cohérente avec le fait que l’ammoniac peut être une source d’azote pour de nombreux végétaux. L’ensemble des résultats de toxicité aiguë pour les invertébrés et les poissons dulçaquicoles comme marins indique peu de variabilités inter-espèces. La CL50 la plus faible observée est de 0,030 mg.L-1 et provient d’un essai sur un échinoderme marin.
Paramètres d’écotoxicité chronique:
Comme dans les études de toxicité aiguë, les algues sont les moins sensibles à l’ammoniac, cette observation est cohérente avec le fait que l’ammoniac peut être une source d’azote pour de nombreux végétaux. Des études de toxicité chronique ont été validées aussi bien pour le milieu d’eau douce que pour le milieu marin et l’ensemble de ces résultats indique peu de variabilités interspécifiques. Ainsi, il peut être retenu une NOEC de 0,066 mg.L-1 (Deleatidium sp.) et de 0,05 mg.L-1 (Lepomis macrochirus) respectivement pour les invertébrés et les poissons.
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau):
Détermination de la PNEC selon la méthode statistique (SSD)
- l’HC5 ainsi calculée étant inférieure à l’ensemble des NOEC valides pour chaque espèce étudiée,
- l’ensemble des groupes taxonomiques sensibles (i.e. mollusques) dans les études de toxicité aiguë n’étant pas représenté,
- il est proposé d’utiliser un facteur de sécurité de 5 :
PNECeau = 0,037/5 soit : 0,074 mg.L-1(N-NH3)
En utilisant la même matrice de données et conformément au TGD (CE, 2003), une PNECaqua peut être dérivée également en utilisant la méthode des facteurs de sécurité.
Dans ce cas, en mettant pour postulat que les algues ne sont pas le groupe le plus sensible, pour le milieu dulçaquicole, une PNECeau peut être dérivée en appliquant un facteur de 10 sur la NOEC la plus faible. PNECeau dulçaquicole = 0,05/10 soit :
PNECeau dulçaquicole = 0,005 mg.L-1 soit 5 µg.L-1 (N-NH3)
Pour le milieu marin, en mettant pour postulat que les algues ne sont pas le groupe le plus sensible, en l’absence de données chroniques vis-à-vis des stades embryo-larvaires des mollusques, une PNECeau marine peut être dérivée en appliquant un facteur de 100 sur la NOEC la plus faible. PNECeau marine = 0,066/100 soit :
PNECeau marine = 0,00066 mg.L-1 soit 0,66 µg.L-1 (N-NH3)
Valeurs seuil pour la protection des organismes benthiques:
Compartiment sédimentaire:
Les essais valides sur des organismes du sédiment sont trop peu nombreux pour dériver une PNEC à partir des essais écotoxicologiques.
Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
PNECmes = (Kmes-eau/RHOmes) x (PNECeau) x 1 000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1 150 kg.m-3Kmes-eau : Coefficient de partage entre les MES et l’eau (3,375 m3.m-3)
= Feaumes + Fsolidmes x Kpmes/1 000) x RHOsolid
Feaumes : Fraction d’eau dans le sol (défaut : 0,9 m3.m-3)
Fsolidmes : Fraction solide dans les MES (défaut : 0,1 m3.m-3)
Kpmes : Coefficient de partage eau-MES (9,9 L.kg-1)
D'où : PNECmes = 14,67 µg.kg-1 MES humides = 67,50 µg.kg-1 MES secs.
Soit : PNECmes= 67,50 µg.kg-1MES secs
Compartiment sol
Une PNEC pour le compartiment sol peut également être déterminée en utilisant la méthode du coefficient de partage selon le TGD.
PNECsol = Ksol-eau/RHOsol x PNECeau x 1 000
RHOsol = Densité du sol (humide) (valeur par défaut : 1 700 kg.m-3)
Ksol‑eau = Coefficient de partage sol eau (1,80 m3.m-3) = Fairsol x Kair-eau + FeauSol + FsolidSol x KpSol /1 000) x RHOsolid
Kair-eau : Coefficient de partage entre l’air et l’eau (7,98)
Fairsol : Fraction d’air dans le sol (défaut : 0,2 m3.m-3)
Feausol : Fraction d’eau dans le sol (défaut : 0,2 m3.m-3)
Fsolidsol : Fraction solide dans le sol (défaut : 0,6 m3.m-3)
Kpsol : Coefficient de partage eau-sol (0,006 L.kg-1)
RHOsolid : Densité de la phase solide (défaut 2,5 kg.L-1)
D'où :
PNECSOL = 44,3 µg.kg-1 sol humide = 50,2 µg.kg-1 sol sec
Soit : PNECSOL = 50,2 µg.kg-1 sol sec
Synthèse
Organismes pélagiques:
Pour le milieu dulçaquicole, la PNEC de 5 µg.L-1 déterminée selon la méthode des facteurs de sécurité sera retenue, la PNEC déterminée selon la méthode d’extrapolation statistique étant supérieure. Toutefois, des études complémentaires seraient nécessaires pour conforter cette PNEC. En effet, les études de toxicité chronique ont montré que les stades embryo-larvaires des mollusques et des poissons et principalement les premières heures suivant la fécondation étaient particulièrement sensibles à l’ammoniac. Or ces données sont manquantes dans les études de toxicité chronique (Solbé et Shurben, 1989). C’est pourquoi, pour ce milieu, Johnson et al. (2007) ont proposé une PNEC de 1,1 µg.L-1 (N-NH3). Cette PNEC a été dérivée en appliquant un facteur de 2 pour la conversion d’une LOEC en NOEC puis d’un facteur de sécurité de 10. Toutefois, dans l’étude de Solbé et Shurben (1989) utilisée pour ce calcul, la LOEC 73 jours de 0,022 mg.L-1 (N-NH3) sur la truite arc-en-ciel (Oncorhynchus mykiss) induit un taux de mortalité de 67 %, ne permettant pas de dériver une PNEC conformément au TGD.
Dans ce cas, en mettant pour postulat que les algues ne sont pas le groupe le plus sensible, pour le milieu dulçaquicole, une PNECeau peut être dérivée en appliquant un facteur de 10 sur la NOEC la plus faible. PNECeau dulçaquicole = 0,05/10 soit :
PNECeau dulçaquicole = 0,005 mg.L-1 soit 5 µg.L-1 (N-NH3)
Pour le milieu marin, en mettant pour postulat que les algues ne sont pas le groupe le plus sensible, en l’absence de données chroniques vis-à-vis des stades embryo-larvaires des mollusques, une PNECeau marine peut être dérivée en appliquant un facteur de 100 sur la NOEC la plus faible. PNECeau marine = 0,066/100 soit :
PNECeau marine = 0,00066 mg.L-1 soit 0,66 µg.L-1 (N-NH3)
Organismes benthiques:
PNECmes= 67,50 µg.kg-1MES secs
Organismes terrestres:
PNECSOL = 50,2 µg.kg-1 sol sec
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










