Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Aldrine (309-00-2)
Informations générales
Dernière vérification le 15/12/2025
Identification
Code EC
Code SANDRE
Numéro CIPAC
Classement transport
Classification CLP
Méthodes analytiques
Introduction
Air
Eau
Sol
Autres milieux
Programmes
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
364.91 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
FDTE/VTR Importer La volatilisation étant un phénomène important de transfert de l'aldrine des sols vers l'atmosphère, il serait plausible que des concentrations sensibles soient mesurées dans l'air à proximité des terrains traités. Cependant, les concentrations mesurées dans l'air peuvent paraître faibles (0,1 à 25 ng/m3 quand l'aldrine était utilisée) (OMS IPCS 1989). Deux mécanismes peuvent justifier ces valeurs, d'une part la précipitation (humide ou sèche) entraîne la redéposition sur les terrains à proximité des zones de traitement, d'autre part l'aldrine peut être dégradée en phase vapeur par photolyse (Meylan 1993), cette dégradation mettant en jeux des radicaux hydroxyles
Milieu eau douce
FDTE/VTR Importer Compte de la faible solubilité de l'aldrine (17 µg/L) et de sa forte adsorption sur les particules en suspensions, Les concentrations qui peuvent être déterminées dans l'eau sont très faibles. De plus, bien qu'atténuée par l'adsorption sur les particules en suspensions, la volatilisation doit être considérée pour la diminution des concentrations dans l'eau. La lixiviation ne doit pas être considérée comme un facteur de transfert de l'aldrine depuis les sols traités vers les masses d'eaux. Le ruissellement sur les sols traités peut, grâce à la matière en suspension permettre le transfert de l'aldrine. Cependant, la présence de solvants organiques peut augmenter sensiblement la solubilisation et l'entraînement de l'aldrine présente dans les sols vers des ressources en eau. La volatilisation depuis l'eau semble aussi être phénomène de transfert important même s'il est limité par l'adsorption sur la matière en suspension et les sédiments.
Milieu terrestre
FDTE/VTR Importer L'aldrine a été largement utilisée pour la lutte contre les insectes terrestres. Après le traitement l'aldrine est rapidement adsorbé sur la matière organique mais plus modérément sur les sols argileux. L'aldrine pénètre donc peu dans les sols et elle est peu concernée par la lixiviation. La volatilisation est un phénomène prépondérant pour la disparition de l'aldrine dans les sols. Une perte de 50 % est observée une à deux semaines après un traitement en surface et après 10 à 15 semaines si l'aldrine est incorporée dans le sol lors du traitement (HSBD 2002). Dans les sols, la transformation de l'aldrine en dieldrine est rapide, il en résulte que, bien que l'aldrine ait été plus largement appliquée que la dieldrine, la fréquence de détection est moindre pour l'aldrine que pour la dieldrine.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Dégradabilité abiotique
FDTE/VTR Importer Selon l’OMS IPCS (1989), les processus abiotiques jouent un rôle limité dans la dégradation de l'aldrine. Rosen et Carey (1968) ont démontré la formation d’analogues non époxydés de l'aldrine suite à une irradiation par lumière du soleil ou par des UV en conditions abiotiques. En milieu aqueux, Henderson et Crosby (1968) montrent que des solutions d'aldrine exposées à la lumière du soleil produisent de la photodieldrine. Toutefois, cette transformation est faible dans des solutions oxygénées en absence de catalyseur (Ross et Crosby, 1974, 1975). De même, dans de l’eau de rizière, l'aldrine est époxydée mais pas en l'absence de l'irradiation. Ross et Crosby (1985) montrent que différents acides aminés ou acides humiques présents dans les eaux naturelles sont susceptibles d’initialiser la photo-oxydation de l'aldrine en dieldrine à la lumière du soleil. Dans les sols, Lotz et al. (1983) montrent que la transformation de l'aldrine par irradiation dépend de la nature du sol étudié. Cependant, la pertinence de certaines des études de laboratoire avec la situation pratique est incertaine en raison de l'utilisation fréquente d'UV très dur comme source de rayonnement. En effet, il s'avère que la photodieldrine n’est pas produite en grandes quantités dans des sols traités à l’aldrine. Ainsi, Lichtenstein et al.(1970) montrent que dans le sol d’un champ contenant de très fortes concentrations en aldrine, 98 à 99 % des résidus observés sont sous forme de dieldrine, 6 à 10 ans après le dernier traitement. La photodieldrine ne représente que 1,6 % des résidus de dieldrine.
Milieu eau douce
FDTE/VTR Importer L’aldrine est métabolisée par de nombreux organismes. Ainsi, par exemple, Benimeli et al. (2003) ont isolé des bactéries actinomycètes gram+, d’une station d’épuration d’eau chargée en cuivre, capables de biodégrader l’aldrine en milieu liquide. Sur 93 souches isolées, 88 % de ces dernières sont capables de croître dans un milieu contenant de l’aldrine. Avec certaines souches, le pourcentage de disparition atteint 82 % en 7 jours. De même, Kennedy et al. (1990) ont montré que les champignons Phanerochaete chrysosporium (BKM-F-1767) qui dégradent la lignine (un biopolymère complexe) se sont avérés également susceptibles de dégrader l’aldrine. Dans des cultures liquides à environ 1,1 mg/L, 36,5 % de l’aldrine radiomarquée se sont dégradés mais seulement 0,6 % se sont minéralisés en 30 jours. Dans ce cas, de la dieldrine est formée mais également un autre métabolite.
Milieu terrestre
FDTE/VTR Importer Dans les sols, de même que dans les milieux aqueux, l’aldrine est époxydée en dieldrine. Cette réaction, essentiellement d’origine biologique (Lichtenstein et Schulz, 1960, cités par l’OMS IPCS, 1989), se produit dans tous les sols aérobies et biologiquement actifs. Environ 50 à 70 % des résidus restants dans un sol à la fin des saisons de cultures sont composés de dieldrine. L’époxydation dépend notamment du type de sol. Ainsi, Lichtenstein et Schulz (1959) ont montré que l'époxydation était plus lente dans la tourbe que sur des sols minéraux. Dans ce cas l’époxydation est inhibée à basse température et est très faible à 7 °C. Un grand nombre de micro-organismes sont capables de favoriser l'époxydation, une revue a été réalisée par Tu et Miles (1976, cités par l’OMS IPCS, 1989). Par exemple, en milieu aérobie et à 39 °C des sols limoneux contenant des champignons Phanerochaete chrysosporium (BKM-F-1767), inoculés à une concentration en aldrine radiomarquée d’environ 38 µg/kg, ont dégradé 85,7 % de cette dernière mais seulement 0,8 % se sont minéralisés en CO2 en 60 jours (Kennedy et al., 1990).
Milieu anaérobie
L'aldrine n'est pas époxydée en anaérobiose (US EPA, 1980). Dans leurs études sur la dégradation de l'aldrine dans les cultures anaérobies de boue d'épuration, Hill et McCarty (1967, cités par l’OMS IPCS, 1989) n'ont pas trouvé de dieldrine, bien que l'aldrine ait été complètement décomposée en 60 jours. De même, Sethunathan (1973, cité par l’OMS IPCS, 1989) a rapporté que l'époxydation de l'aldrine est arrêtée dans les sols inondés.
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer Selon Ritter et al. (rapport non daté), des résidus de l'aldrine ont été détectés dans les poissons en Egypte, la concentration moyenne était 8,8 μg/kg, avec une concentration maximum de 54,27 μg/kg. Freitag et al. (1985) indiquent un BCF de 2 760 pour le poisson Leuciscus idus melanotus. Toutefois, il est important d’observer que le BCF de l’aldrine pour les poissons et les bivalves d’eau de mer est estimé être le même que celui de la dieldrine (Van de Plassche, 1994). De ce fait, les études de bioconcentration sont réalisées principalement en utilisant la dieldrine (Ritter et al., rapport non daté, van de Plassche, 1994). Ainsi, le lecteur pourra trouver plus d’amples informations dans la fiche de données toxicologiques et environnementales relative à la dieldrine.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
FDTE/VTR Importer Comme pour les organismes aquatiques, vis-à-vis des organismes terrestres, l’aldrine ayant le même comportement que la dieldrine, son métabolite principal, les études de bioaccumulation ont été principalement menées sur ce dernier. Le lecteur pourra donc se référer à la fiche dieldrine ainsi qu’aux revues bibliographiques effectuées par l’OMS IPCS (1989) et l’US EPA (1980). Toutefois, vis-à-vis des plantes, l’OMS IPCS (1989) indique que l’absorption de l'aldrine par les plantes à production de racines est supérieure à celle des plantes à production de grains. Ainsi, Harris et Sans (1967) ont constaté que les carottes, les radis et les navets ont des niveaux de résidus plus élevés. Les oignons, la laitue et le céleri ont une contamination intermédiaire et les choux ne sont pas contaminés (Lichtenstein, 1959). L’absorption est sous la dépendance des concentrations en aldrine dans les sols (Lichtenstein et al., 1970 ; Edwards, 1973a, b). Elle est également liée à la disponibilité de l'aldrine et notamment à la force d’adsorption du sol en relation particulièrement avec la fraction de matière organique. Ainsi, Harris et Sans (1967), Beall et Nash (1969), et Nash et al. (1970) ont démontré que les récoltes absorbent plus de résidus lorsqu’elles proviennent d’un sol contenant peu de matières organiques que lorsqu’elles proviennent d’un sol en contenant beaucoup.
Conclusion sur la bioaccumulation
FDTE/VTR Importer L’aldrine est métabolisée par l’aldrine époxydase en dieldrine, plus persistante et aussi toxique (US EPA, 1980). Ce métabolisme a été mis en évidence chez plusieurs espèces incluant des mammifères, des oiseaux (Jongbloed et al., 1995), des insectes, des micro-organismes, des poissons (Gakstatter, 1968) et des invertébrés aquatiques dont des protozoaires, des coelentérés, des vers, des arthropodes, des mollusques, des crustacés… (US EPA, 1980). L'aldrine est également époxydée par les plantes, comme cela a été démontré par Gannon et Decker (1958). De même, Yu et al. (1971) montrent que des homogénats de racine sont des promoteurs de l'époxydation de l’aldrine en dieldrine ( OMS IPCS, 1989). Ainsi, du fait du métabolisme rapide, des résidus d'aldrine sont rarement trouvés et uniquement en faible concentration dans la nourriture et les animaux. Les concentrations en dieldrine mesurées dans les organismes vivants sont donc liées aussi bien à l’exposition à l’aldrine qu’à la dieldrine (Ritter et al., rapport non daté). De ce fait, en raison de son métabolisme et de son hydrophobicité, l’aldrine est connue pour se bioconcentrer, principalement en terme de métabolites (Ritter et al. rapport non daté). Ainsi, dans une étude, utilisant un écosystème aquatique comme modèle, Metcalf et al. (1973, cités par OMS IPCS, 1989) montrent que l’aldrine se convertie en dieldrine rapidement et presque quantitativement. Dans ce cas, seulement 0,5 % de l'aldrine radioactive originale est stockée comme aldrine dans la gambouse (Gambusia affinis), organisme terminal de cette chaîne alimentaire.
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 1989; US EPA (IRIS), 2000; ATSDR, 2002). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Une fois dans l’organisme, l’aldrine étant rapidement transformée en dieldrine, peu de données concernant le devenir et la toxicité propre à l’aldrine sont disponibles. C’est pourquoi, certaines données toxicologiques de la dieldrine sont présentées.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer La pénétration de l’aldrine dans l’organisme peut se faire par inhalation, ingestion ou contact cutané, aussi bien chez l’homme que chez l’animal.
L’absorption pulmonaire semble être la voie d’exposition la plus probable et apparaît importante : des volontaires humains exposés à une concentration en aldrine de 1,31 µg/m3 absorbent et retiennent entre 20 et 50 % des aérosols d’aldrine inhalées (Beyerman et Eckrich, 1973; Bragt et al., 1984). Par ailleurs, une étude menée auprès de femmes vivant dans des habitations traitées par des pesticides, a mis en évidence une corrélation entre le traitement et les niveaux de dieldrine mesurés dans le lait maternel (Stacey et Tatum, 1985).
Aucune donnée quantitative décrivant l’absorption de l’aldrine suite à son ingestion n’est disponible dans la littérature. Pourtant, l’exposition par voie orale est possible car l’aldrine est susceptible d’être présente dans l’eau de boisson et dans certains aliments.
L’absorption de l’aldrine à travers la peau semble débuter rapidement. Seulement 4 heures après l’application d’aldrine sur l’avant bras de 6 volontaires (0,004 mg/cm² d’aldrine marquée au carbone 14, dans de l’acétone), l’aldrine est détectée dans l’urine. L’excrétion urinaire permet d’estimer à environ 7-8 % la quantité d’aldrine absorbée par la peau intacte (Feldman et Maibach, 1974).
Distribution
FDTE/VTR Importer Une fois absorbée, l’aldrine est rapidement transformée par époxydation en dieldrine (OMS IPCS, 1989; ATSDR, 2002). La conversion aldrine-dieldrine se déroule principalement dans le foie sous l’action de mono-oxygénases mais aussi, dans une moindre proportion, dans d’autres tissus comme les poumons.
Après passage dans le sang, l’aldrine se répartit entre les différents organes et tissus, principalement à contenu lipidique (tissu adipeux, foie, reins, cœur et cerveau), sous la forme de dieldrine. Les concentrations en dieldrine, retrouvées dans le sang et les tissus adipeux, augmentent avec la dose, sont corrélées et proportionnelles à la dose journalière ingérée (Hunter et Robinson, 1967). L’existence d’une relation entre les concentrations dans le sang et les tissus adipeux reflète l’équilibre dynamique de la distribution de la dieldrine entre ces tissus. Quand l’exposition prend fin, la concentration en dieldrine dans les tissus diminue selon une loi exponentielle (OMS IPCS, 1989).
La dieldrine est également capable de passer la barrière placentaire, avec accumulation dans les mêmes organes et tissus que chez l’adulte, dans des concentrations moindres. Le transfert de l’aldrine de la mère au fœtus a été étudié chez 100 femmes et a permis de mettre en évidence des corrélations entre la concentration en pesticide (dans le sang maternel, le placenta et le sang du cordon ombilical) et l’âge, les habitudes alimentaires et les lieux d’habitation des femmes enceintes (Saxena et al., 1981).
Métabolisme
FDTE/VTR Importer La métabolisation de l’aldrine (ou de la dieldrine) dans le foie conduit à la formation des mêmes métabolites à caractères hydrophile et polaire prononcés, principalement excrétés via la bile. Chez l’homme, le principal métabolite est l’hydroxy-9 dieldrine, éliminé par voie fécale. Par comparaison, l’examen des urines de cinq ouvriers a montré que l’excrétion de la dieldrine et de ses quatre métabolites par voie urinaire est minime.
Élimination
FDTE/VTR Importer Chez l’homme, la demi-vie de la dieldrine varie de 9 mois (Jager, 1970) à 1 an (Hunter et al., 1969) ; les taux d’excrétion sont approximativement équivalents aux quantités quotidiennes ingérées (WFPHA, 2000).
Chez l'animal
Absorption
FDTE/VTR Importer L’absorption pulmonaire est très rapide. Une étude in vitro menée sur des poumons de lapins isolés montre une absorption rapide de l’aldrine, avant sa métabolisation en dieldrine, détectée seulement 3 minutes après le début de l’expérience (Mehendale et El-Bassiouni, 1975).
De même, l’absorption de l’aldrine par voie orale semble débuter rapidement. Des rats exposés à de l’aldrine marquée présentent des niveaux de radioactivité élevés dans le foie, le sang et l’estomac et/ou le duodénum seulement 1 à 5 heures après l’exposition (Heath et Vandekar, 1964; Iatropoulos et al., 1975). Vingt-quatre heures après l’administration d’une dose unique de 10 mg/kg d’aldrine, 50 % de la dose est retrouvée dans les tissus adipeux (Hayes 1974).
L’application d’aldrine sur la peau de rats femelles (0,006 - 0,06 et 0,6 mg/cm²) conduit à détecter la substance dans la peau seulement 1 heure après l’application (Graham et al., 1986). La quantité absorbée est proportionnelle à la dose appliquée et s’avère complète après 80 min.
Distribution
FDTE/VTR Importer La voie métabolique principale, chez toutes les espèces étudiées, implique la conversion de l’aldrine en dieldrine : jusqu’à 70 % de l’aldrine est époxydée en 1 h, dans le cas de faibles doses (3 µmol) (Mehendale et El-Bassiouni, 1975). Comme pour l’homme, la conversion se déroule principalement dans le foie, sous l’action de mono-oxydases (Wong et Terriere, 1965) et, dans une moindre mesure, dans les poumons (Lang et al., 1986) et la peau (Graham et al., 1986; Lang et al., 1986). Chez les rats, après l’administration par voie orale d’une dose unique de dieldrine marquée au 14C (0,43 mg/kg), l’absorption par le foie est très rapide (pendant les 3 premières heures), suivie par une diminution et une redistribution de la substance majoritairement dans les tissus adipeux mais aussi au niveau du foie, du cerveau, du sang, des reins ou des ganglions lymphatiques (Robinson et al., 1969; Iatropoulos et al., 1975). Comme chez l’homme, l’affinité de la dieldrine pour les tissus adipeux est importante (Hayes, 1974).
Métabolisme
FDTE/VTR Importer Le principal métabolite est l’hydroxy-9 dieldrine. Il est retrouvé dans les déjections et l’urine, sous forme libre ou conjuguée. Chez les animaux d’expériences, trois métabolites mineurs ont été mis en évidence : un dérivé 6,7-dihydroxylé en position trans, un acide dicarboxylique dérivé du composé hydroxylé et une pentachlorocétone pontée (OMS IPCS, 1989). Leur excrétion est relativement lente : un mélange de métabolites hydrophiles, associés à de faibles quantités d’aldrine et de dieldrine inchangées, est majoritairement retrouvé dans les fèces (90 % en 12 semaines) et, dans une moindre mesure, dans les urines (10 %) (Parke, 1968; Hutson, 1976). Toutefois, des différences de métabolisme existent en fonction de l’espèce considérée et de son sexe (ATSDR, 2002).
Élimination
FDTE/VTR Importer Chez le rat, la demi-vie de la dieldrine est estimée à 1,3 et 10,2 jours, dans le cas d’une élimination rapide et lente respectivement (Robinson et al., 1969).
Toxicité aiguë
Généralités
FDTE/VTR Importer L’aldrine présente une forte toxicité par voie orale, une toxicité par voie cutanée modérée, tandis que la toxicité par inhalation est très faible. L’organe cible est le système nerveux central.
Chez l'homme
Voie orale
FDTE/VTR Importer Les symptômes liés à l’ingestion ou au contact cutané avec des doses toxiques d’aldrine sont, entre autre, des maux de tête, des étourdissements, des nausées, des vomissements associés à un malaise général, suivis de contractions involontaires des muscles (secousses myocloniques), convulsions. Ces effets apparaissent 20 minutes à 24 h après l’absorption et disparaissent quelques semaines après l’exposition. Dans les cas d’intoxication grave, une dépression respiratoire peut survenir, entraînant la mort des patients (Nelson, 1953; Hayes, 1957; OMS IPCS 1989). La dose létale d’aldrine, par voie orale, serait d’environ 5 g (Hodge et al., 1967; Jager, 1970). En ce qui concerne la population générale, des cas d’empoisonnement ont été rapportés par ingestion du produit formulé, soit de manière accidentelle en ce qui concerne les enfants, soit de manière volontaire lors de tentatives de suicide. La plupart des cas d’empoisonnement recensés lors d’expositions professionnelles résultent d’une lente accumulation de l’aldrine dans le corps, l’apport journalier étant supérieur à l’excrétion (Fletcher et al., 1959; Jager, 1970). Aucun empoisonnement mortel n’a été rapporté lors de la production ou la formulation de l’aldrine (Jager, 1970). L’intoxication à l’aldrine se manifestant par des symptômes non spécifiques, sa confirmation ne peut s’obtenir que par dosage du taux de dieldrine dans le sang (Brown et al., 1964; Jager, 1970). La concentration maximale dans le sang, critique pour une intoxication, est de 150-200 µg/L.
Chez l'animal
Inhalation
FDTE/VTR Importer Compte tenu de la faible pression de vapeur de l’aldrine, la toxicité par inhalation d’aérosols d’aldrine est très faible. L’exposition de chats, cobayes, lapins, rats et souris à des vapeurs d’aldrine (générées par sublimation de l’aldrine à 200°C), présentant une concentration de 108 mg/m3, pendant 1 h, entraîne la mort de 9 rats sur 10, de 3 lapins sur 4, de 2 souris sur 10. Les chats et les cobayes apparaissent moins sensibles : seulement 1 chat est décédé suite à une exposition pendant 4 h à d’aérosols d’aldrine à la concentration de 215 mg/m3 (Treon et al., 1975).
Voie orale
FDTE/VTR Importer Comme chez l’homme, l’organe cible est le système nerveux central. Les symptômes observés sont une irritabilité croissante, des tremblements, suivis de convulsions. Chez le rat, les convulsions apparaissent dans l’heure suivant l’ingestion, pour les fortes doses, la mort survenant entre 6 heures et 7 jours plus tard selon le contenu intestinal, la concentration en aldrine/dieldrine et le type de solvant (Borgmann et al., 1952; Heath et Vandekar, 1964). Différentes études, menées chez de nombreuses espèces, ont permis de déterminer les DL50 de l’aldrine, par voie orale. Chez les rongeurs, les DL50 établies sont de 44 mg/kg p.c. pour la souris (Borgmann et al., 1952), 38 à 67 mg/kg p.c. pour le rat (Lehman, 1951; Worthing et Walker, 1983), 320 mg/kg p.c. pour le hamster (Gak, Graillot et al. 1976) et 33 mg/kg p.c. pour le cobaye (Borgmann et al., 1952). Borgmann et al. (1952) ont également établi les DL50 chez le lapin (50-80 mg/kg p.c.) et le chien (65-96 mg/kg p.c.). De même, (Radeleff et al., 1955) ont établi les DL50 de l’aldrine pour différentes espèces de bétail, comprises entre 2,5 mg/kg p.c. chez le veau et 10 mg/kg p.c. chez le mouton. L’administration de 0-2 ou 4 mg/kg pc d’aldrine, par gavage pendant 7 jours à des souris albinos, est à l’origine d’une diminution du poids et de chutes de tension observées chez les souris recevant 2 mg/kg (Al-Hachim, 1971).
Voie cutanée
FDTE/VTR Importer Par voie cutanée, la toxicité de l’aldrine dépend du solvant utilisé pour l’administration. La dose létale minimum de l’aldrine, mélangée à de l’huile ou administrée sous forme de poudre sur la peau intacte de femelles lapins pendant 24 h, est comprise entre 600 et 1 250 mg/kg p.c. (Treon et al., 1953). L’utilisation de solvants tels que le xylène ou le phtalate de diméthyl augmente la toxicité cutanée de l’aldrine : les DL50 établies chez le rat et le lapin sont alors comprises entre 100 et 150 mg/kg p.c. (Lehman, 1952; Gaines, 1960). L’application d’aldrine technique sur la peau intacte de lapin est à l’origine d’un érythème léger (Treon et al., 1953). Par contre, l’application de 0,5 mL d’aldrine concentrée pendant 24 h, sur une peau intacte ou scarifiée de lapin, entraîne une irritation sévère et une nécrose de la peau. Au niveau des yeux, une douleur initiale sévère et une irritation moyenne sont observées (Rose, 1982).
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer De multiples études ont été réalisées chez les travailleurs en contact avec l’aldrine lors de sa production, formulation ou de son utilisation comme pesticide (contre les termites notamment) : aucune n’a montré de cas d’intoxication (Mick et al., 1972), d’incidence de maladies ou d’infirmité (Warnick et Carter, 1972) ou d’anomalies respiratoires (Princi et Spurbeck, 1951). Une étude épidémiologique, menée entre 1955 et 1970, sur des ouvriers travaillant dans une usine de fabrication d’aldrine et de dieldrine, n’a mis en évidence aucune modification des paramètres physico-chimique, neurologique ou hématologique. A partir de ces observations, le niveau d’aldrine dans le sang sans effet a pu être fixé à 200 µg/L, équivalent à un apport quotidien par voie orale de 33 µg/kg p.c. (Hunter et Robinson, 1967).
Voie orale
FDTE/VTR Importer La consommation répétée de farine de blé, contaminée accidentellement par de l’aldrine en Inde, a entraîné l’apparition de phénomènes neurotoxiques. En effet, après ingestion pendant 6 à 12 mois de ce blé, les symptômes cliniques typiques d’une intoxication aux organochlorés (tels que les convulsions ou la modification de l’électroencéphalogramme) sont apparus (Gupta, 1975). Dans la majorité des cas, les convulsions apparaissent sans aucun signe avant-coureur (Patel et Rao, 1958; Kazantzis et al., 1964; Hoogendam et al., 1965). Les électroencéphalogrammes enregistrés peu de temps après les convulsions, montrent des irrégularités dans les ondes alpha (Kazantzis et al., 1964). Lors d’une exposition à la dieldrine, la réponse physiologique la plus précoce est l’augmentation de l’activité enzymatique microsomale hépatique. Aucune induction enzymatique n’est retrouvée dans le sang de salariés exposés présentant des concentrations en dieldrine inférieures ou égales à 105 µg/L. Par conséquent, la concentration limite en dieldrine dans le sang (ou dose limite sans effet décelable), en dessous de laquelle aucun n’effet n’est attendu, est de 105 µg/L. Une étude a été réalisée sur 13 adultes volontaires afin d’examiner les effets sur la santé d’une exposition orale prolongée à la dieldrine. Pendant 2 ans, les sujets ont reçu 0 – 10 - 50 ou 211 µg de dieldrine par jour, administrée dans des capsules de gélatine. Tous sont restés en excellente santé, la plupart des paramètres cliniques ou physiologiques surveillés demeurant inchangés au cours de l’étude et encore 8 mois après l’exposition (Hunter et Robinson, 1967; Hunter et al., 1969).
Voie cutanée
FDTE/VTR Importer Aucune donnée n’est disponible concernant la toxicité chronique de l’aldrine par voie cutanée. Toutefois, l’aldrine n’est pas un sensibilisant cutané : aucun cas de sensibilisation n’a été rapporté sur une période 20 ans chez des utilisateurs professionnels impliqués dans la formulation de l’aldrine (Jager, 1970).
Chez l'animal
Inhalation
FDTE/VTR Importer Par inhalation, aucun effet indésirable n’est observé que ce soit chez les souris, les hamsters ou les cobayes, exposés à un aérosol d’aldrine de 18 mg/m3 pendant 178 jours (Baker, Whitney et al. 1959).
Voie orale
FDTE/VTR Importer Lors d’expositions prolongées ou répétées, la cible privilégiée de l’aldrine est le foie. Chez les rongeurs, les altérations observées au niveau du foie sont désignées sont le nom de « foie de rongeur sous insecticide organochloré » et se traduisent par une augmentation du poids de l’organe associée à des modifications histologiques (accroissement des hépatocytes centrolobulaires, légère augmentation de l’oxyphilie cytoplasmique et de la migration périphérique des granules basophiles) (Treon et Cleveland, 1955; Ortega et al., 1957). L’OMS IPCS (1989) mentionne que des études anciennes (Treon et al., 1951; Borgmann et al., 1952) réalisées chez des rats exposés à des concentrations en aldrine pouvant atteindre 300 mg/kg de nourriture pendant 3 à 9 mois, ont permis d’établir un NOAEL de 5 mg/kg et un LOAEL de 25 mg/kg basé sur l’apparition des symptômes du foie de rongeur sous insecticide organochloré. L’augmentation de la mortalité est observée pour des doses supérieures ou équivalentes à 150 mg/kg. Des rats Osborne-Mendel (12/sexe) exposés à 0 - 0,5 – 2 – 10 – 50 -100 ou 150 ppm d’aldrine dans la nourriture pendant 2 ans présentent une croissance normale (Fitzhugh et al., 1964). Toutefois, leur survie diminue fortement dès 50 ppm, de manière dose dépendante. Dès 0,5 ppm, les lésions hépatiques caractéristiques d’une intoxication aux organochlorés sont observées. A partir de 50 ppm, les rats présentent des hémorragies au niveau de la vessie ainsi que des néphrites. Les chiens semblent plus sensibles à l’aldrine que les rats. L’administration d’aldrine à des chiens (Beagle), par la nourriture, n’entraîne ni perturbation de la croissance ni modification hématologique. Un LOAEL de 0,25 mg d’aldrine/kg a pu être établi, basé sur une hépatomégalie observée pour un des mâles testés et sur la dégénérescence des hépatocytes et la vacuolisation de l’épithélium dans les tubules rénaux distaux pour les femelles (Treon et Cleveland 1955). Des chiens de race mélangée ont été exposés pendant 25 mois quotidiennement, par l’intermédiaire de la nourriture, à 0,2 - 0,5 – 1 - 2 ou 5 mg de dieldrine/kg. Tous les animaux exposés aux plus fortes doses (i.e. 2 et 5 mg/kg) sont morts entre la 3ème et la 4ème semaine et présentaient les symptômes suivants : perte de poids, perturbations du métabolisme lipidique au niveau du foie et du rein, diminution du nombre de granulocytes matures et d’érythrocytes au niveau de la moelle osseuse. Les chiens exposés à 1 mg/kg de nourriture ont survécu jusqu’à la 15ème et la 49ème semaine et présentaient les mêmes lésions que celles décrites précédemment. En ce qui concerne les animaux exposés à 0,5 mg/kg, un seul animal a présenté des convulsions durant les 2 derniers mois. Cette étude a permis d’établir un NOAEL de 0,2 mg/kg p.c (Fitzhugh et al., 1964).
Synthèse
FDTE/VTR Importer Effets systèmiques :
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 3 : l’aldrine est préoccupante pour l’homme en raison d’effets cancérigènes possible, mais les informations disponibles ne permettent pas une évaluation satisfaisante | 1993 |
| IARC | FDTE/VTR Importer Groupe 3 : l’aldrine ne peut être classée pour sa cancérogénicité pour l’homme | 1987 |
| US EPA | FDTE/VTR Importer Classe B2 : l’aldrine est probablement cancérigène pour l’homme. Il existe des preuves suffisantes chez l’animal et des preuves non adéquates chez l’homme | 2000 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Des études épidémiologiques, menées chez des salariés exposés à l’aldrine, ont permis d’évaluer la cancérogénicité de cette substance. Une première étude, réalisée sur 166 personnes exposées pendant 20 ans, n’a pas permis de mettre en évidence une incidence supérieure de cancers chez ces travailleurs. Un cas de cancer de l’estomac a été observé chez un homme seulement après 5 ans d’exposition moyenne, ainsi qu’un cas de lymphosarcome après 7 ans (Versteeg et Jager, 1973; Van Raalte, 1977). De même, l’observation d’un groupe de 233 hommes, exposés pendant 24 ans, ne montre aucun signe d’activité cancérigène spécifique. Vingt cinq morts, dont 9 par cancer (3 cancers du poumon et 6 autres chacun différent), ont été recensés sur les 38 attendus et aucune tumeur primitive du foie n’a été observée (Ribbens, 1985).
Une étude épidémiologique, menée au sein d’une usine produisant de l’aldrine, la dieldrine et l’endrine pendant 30 ans, chez 1 155 travailleurs, a mis en évidence une mortalité due à des tumeurs malignes inférieure à celle attendue. Toutefois, une légère augmentation du nombre de cancers de l’œsophage (2 cas), du rectum (3 cas), du foie (2 cas) et du système lymphatique et hématopoïétique (6 cas) a été observée (Ditraglia et al. ,1981).
La comparaison du nombre de décès dus à un cancer du foie aux États-Unis à la fin de l’utilisation domestique des pesticides organochlorés, entre 1962 et 1972, a montré une diminution du nombre de cancers primitifs du foie de 61,3 % à 56,9 %. Le taux de mortalité, associé à ces cancers primitifs hépatiques, est alors passé de 3,46 à 3,18 (Deichman et Macdonald, 1977).
Chez l'animal
Voie orale
FDTE/VTR Importer De nombreuses études de cancérogénicité par voie orale ont été réalisées chez des souris de souches différentes. Toutes les études montrent une incidence accrue des changements hépatiques, pouvant être de nature bénigne ou des hépatocarcinomes, avec une sensibilité plus importante des mâles.
Des souris C3HeB/Fe, ayant reçu de la nourriture non contaminée ou contaminée par 10 mg d’aldrine/kg pendant 2 ans, présentent une augmentation significative du nombre de tumeurs bénignes du foie, associée à une diminution de l’espérance de vie de 2 mois chez les souris traitées (Davis et Fitzhugh, 1962). Dans une autre étude réalisée sur la souche B6C3F1, ayant reçu 4 ou 8 mg/kg d’aldrine pendant 80 semaines, les souris traitées présentent une mortalité accrue, en liaison avec la dose administrée, ainsi qu’une augmentation de l’incidence des tumeurs hépatocellulaires chez les mâles : le pourcentage de tumeurs passe de 16 % à 33 % et 56 % pour les souris recevant respectivement 4 et 8 mg d’aldrine/kg de nourriture (NCI, 1978).
Contrairement aux résultats observés chez la souris, les études réalisées chez le rat ne mettent en évidence aucune augmentation de l’incidence des tumeurs du foie ou de tout autre organe ou tissu (Cleveland, 1966; Deichmann et al., 1970; Deichmann, 1974; NCI, 1978). Ainsi, une étude réalisée chez des rats Sprague-Dawley, ayant reçu pendant 2 ans de la nourriture contaminée par 0 – 5 – 10 – 50 - 100 ou 150 mg d’aldrine/kg, ne montre qu’une augmentation de la mortalité pour les 2 plus fortes doses, associée à un grossissement du foie (Borgmann et al., 1952). De même, Treon et Cleveland (1955), dans une étude réalisée chez des rats Carworth, ne rapportent qu’une augmentation du poids du foie ainsi que des modifications hépatocellulaires, caractéristiques du foie de rongeur sous insecticide organochloré. À partir de ces études, un NOEL de 0,5 mg/kg de nourriture peut être fixé. Dès 1 mg/kg, une hépatomégalie et des changements histologiques sont visibles ; pour les doses supérieures à 10 mg/kg, les signes caractéristiques d’une intoxication aux organochlorés apparaissent tels que l’irritabilité, les tremblements et les convulsions.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer L’aldrine a été examinée mais n’est pas classée par l’Union Européenne | 1993 |
Chez l'animal
Synthèse
FDTE/VTR Importer De nombreux tests de génotoxicité réalisés (in vitro et in vivo) se sont avérés négatifs.
Effets sur la reproduction
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer l’aldrine a été examiné mais n’est pas classée | 1993 |
Chez l'homme
Toutes voies
FDTE/VTR Importer Aucune étude de reprotoxicité ou de tératogénicité n’a été réalisée suite à des expositions par inhalation ou par voie cutanée. Les concentrations en aldrine, mesurées dans le sang et les tissus placentaires de femmes ayant accouché prématurément ou avorté de manière spontanée, sont significativement supérieures à celles rencontrées chez les femmes ayant accouché normalement (Saxena et al., 1980). Toutefois, l’interprétation de ses résultats est délicate car les femmes concernées ont été exposées non seulement à l’aldrine mais aussi à d’autres pesticides organochlorés. Il semble néanmoins évident que l’aldrine puisse traverser le placenta et s’accumuler dans le fœtus en développement.
Chez l'animal
Toutes voies
FDTE/VTR Importer Le principal effet observé sur la reproduction est l’augmentation du taux de mortalité chez les jeunes avant la fin du sevrage. Au cours d’une étude réalisée chez des souris blanches, ayant reçu de la nourriture contaminée par 3 – 5 - 10 ou 25 mg d’aldrine/kg, pendant 6 générations, la plus forte dose testée s’est avérée trop toxique et a entraîné une mortalité importante des portées. Pour les groupes recevant 5 et 10 mg d’aldrine, la survie des jeunes pendant le sevrage a été fortement diminuée (Keplinger et al., 1970). De même, une étude réalisée chez des rats Carworth, ayant reçu 2,5 - 12,5 ou 25 mg d’aldrine pendant 3 générations, a montré une diminution du nombre de grossesses ainsi qu’une augmentation de la mortalité des jeunes pendant le sevrage, dès 12,5 mg/kg (Treon et Cleveland, 1955). Ces effets pourraient être liés à une forte concentration en dieldrine dans le lait maternel. Néanmoins, les capacités reproductives en elles-mêmes ne sont pas atteintes mais peuvent être altérées pour des doses entraînant une toxicité maternelle. Une étude réalisée chez des chiens a montré les mêmes effets sur le taux de survie de jeunes pendant le sevrage (Kitselman, 1953).
Toutefois, aucune donnée adéquate n’étant disponible concernant les effets de l’aldrine sur la reproduction, il s’avère impossible d’établir un NOEL.
Des résultats contradictoires ont été observés lors des études de tératogénicité menées pour évaluer la capacité de l’aldrine à induire des malformations externes ou des anomalies du squelette. Une étude réalisée chez des souris CD-1 en gestation, ayant reçu une dose unique de 25 mg d’aldrine/kg p.c. (équivalente à la moitié de la DL50), n’a montré aucun effet de la substance ni sur le taux de survie des fœtus, ni sur leur poids (Ottolenghi et al., 1974). Le pourcentage total de fœtus malformés est de 33 % chez les souris traitées et pourrait être la conséquence d’une toxicité maternelle. Les malformations observées sont des pattes palmées, des fentes palatines ou des yeux ouverts. A contrario, une étude similaire, réalisée chez des hamsters en gestation ayant reçu une dose unique d’aldrine de 50 mg/kg p.c. au 7ème, 8ème ou 9ème jour de gestation, montre une diminution du nombre de fœtus vivants et de leur poids, ainsi qu’une augmentation de l’incidence de malformations (pattes palmées, fentes palatines ou yeux ouverts) (Ottolenghi et al., 1974). Les effets observés sont plus prononcés suite à l’administration de la dose au 7ème et au 8ème jour de gestation. Les pattes palmées et les yeux ouverts étant fréquemment associés au faible poids des fœtus, les effets observés semblent donc seulement refléter un retard de croissance. La signification de l’apparition de ces malformations, concomitante à une toxicité maternelle importante, est donc ambiguë mais ne peut exclure totalement un potentiel tératogène spécifique à l’aldrine.
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par inhalation :
Le RIVM propose une TCA de 3,5.10-4 mg/kg par jour pour une exposition chronique par inhalation chez le rat (2000).
Pour le RIVM, aucune étude valable n’est disponible à partir de laquelle fixer une concentration tolérable dans l’air (TCA). Les données de toxicocinétique de l’aldrine indiquant que l’absorption se produit bien suite à son ingestion ou son inhalation, le RIVM a donc opté pour une extrapolation à partir de la TDI de 10-4 mg/kg/j.
Calcul : 10-4 x 1/20 m3/j x 70 kg = 3,5.10-4 mg/ m3
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 0,002 mg/kg par jour pour une exposition aiguë par voie orale chez le rat (2002).
Cette valeur a été établie à partir de la diminution du poids et des chutes de tension observées, chez des souris traitées par 0 - 2 ou 4 mg/kg d’aldrine par gavage, dès 2 mg/kg (Al-Hachim, 1971). Le LOAEL de 2 mg/kg par jour a servi à calculer un MRL de 0,002 mg/kg par jour pour les expositions aiguës par voie orale.
Facteur d’incertitude : un facteur de 1 000 est appliqué : un facteur 10 car la valeur utilisée est un LOAEL, un facteur 10 pour l’extrapolation de données animales à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 2 x 1/1 000 = 0,002 mg/kg/j
Effets à seuil - Exposition chronique par voie orale :
L’ATSDR propose un MRL de 3.10-5 mg/kg par jour pour une exposition chronique par voie orale chez le rat (2002).
Cette valeur a été établie à partir des effets hépatiques observés chez des groupes de 24 rats (12/sexe) nourris pendant 2 ans avec un aliment contenant 0-0,5-2-10-50-100 ou 150 ppm d’aldrine (Fitzhugh et al., 1964). Dès 0,5 ppm, des lésions hépatiques caractéristiques d’une intoxication aux insecticides organochlorés ont été observées. Le LOAEL de 0,025 mg/kg par jour (soit 0,5 ppm) a servi à calculer un MRL de 0,00003 mg/kg par jour pour les expositions chroniques par voie orale.
Facteur d’incertitude : un facteur de 1000 est appliqué : un facteur 10 car la valeur utilisée est un LOAEL, un facteur 10 pour l’extrapolation de données animales à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 0,025 x 1/1 000 = 3.10-5 mg/kg/j
L’US EPA propose une RfD de 3.10-5 mg/kg par jour pour une exposition chronique par voie orale chez le rat (1988).
Comme pour le MRL de l’ATSDR, la RfD a été établie à partir des effets hépatiques observés chez des groupes de 24 rats (12/sexe) nourris pendant 2 ans avec un aliment contenant 0-0,5-2-10-50-100 ou 150 ppm d’aldrine (Fitzhugh et al., 1964). Dès 0,5 ppm, des lésions hépatiques caractéristiques d’une intoxication aux insecticides organochlorés ont été observées. Le LOAEL de 0,025 mg/kg par jour (soit 0,5 ppm) a servi à calculer une RfD de 0,00003 mg/kg par jour pour les expositions chroniques par voie orale.
Facteur d’incertitude : un facteur de 1000 est appliqué : un facteur 10 car la valeur utilisée est un LOAEL, un facteur 10 pour l’extrapolation de données animales à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 0,025 x 1/1 000 = 3.10-5 mg/kg/j
Effets sans seuil - Exposition chronique par inhalation :
L’US EPA propose un ERUi de 4,9.10-3 (µg/m3)-1 inhalation (1993).
Un modèle mathématique linéaire multiétape a permis de déterminer l’excès de risque unitaire par inhalation, à partir de l’ERUo précédent. Cet ERUi ne doit pas être utilisé si la concentration en aldrine dans l’air excède 2 µg/m3.
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA propose un ERUo de 17 (mg/kg/j)-1 par voie orale (1993).
Cette valeur a été obtenue en faisant la moyenne géométrique de trois ERUo calculés expérimentalement à partir de données de carcinomes hépatiques obtenues chez différentes souches de souris, pour les deux sexes : 23 (mg/kg/j)-1 pour les souris femelles C3H, 18 (mg/kg/j)-1 pour les souris mâles C3H et 12 (mg/kg/j)-1 pour les souris mâles B6C3F1 (Davis et al, 1965 ; NCI, 1978).
Calcul : 3√ [ 23 (femelles C3H) x 18 (mâles C3H) x 12 (mâles B6C3F1)] = 17 (mg/kg/j)-1
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir les valeurs du RIVM de 3,5.10-4 mg.m-3
En ce qui concerne l’inhalation, seul le RIVM propose une VTR chronique pour cette voie, elle est donc à retenir par défaut.
Effets à seuil - Exposition aiguë par voie orale :
L’INERIS propose de retenir la valeur de l’ATSDR de 2.10-3 mg.kg-1.j-1 pour une exposition aiguë à l’aldrine par voie orale.
Pour des expositions aiguës, seul l’ATSDR propose une MRL basée sur une étude réalisée sur 5 à 7 jours : cette valeur est donc retenue.
Effets à seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir les valeurs de l’ATSDR et de l’US EPA de 3.10-3 mg.kg-1.j-1 pour une exposition chronique à l’aldrine par voie orale.
Dans les cas d’expositions chroniques par voie orale, l’ATSDR et l’US EPA d’une part et le RIVM et Santé Canada d’autre part, ont établi les mêmes VTR. Tous ces organismes se basent sur la même étude (Fitzhugh et al., 1964) et le même LOAEL établi pour les mêmes effets (0,025 mg.kg-1.j-1, effets hépatiques). Toutefois, alors que l’ATSDR et l’US EPA appliquent un facteur d’incertitude global de 1 000 (10x10x10), le RIVM et Santé Canada appliquent un facteur de 250. Ces derniers considèrent que les effets observés sur le foie sont minimes et diminuent donc de 10 à 2,5 le facteur tenant compte de l’utilisation d’un LOAEL à la place d’un NOAEL.Les effets observés à la première dose testée sont certes légers, comme le reconnaissent les auteurs, mais sont typiques d’une exposition aux organochlorés et augmentent en intensité et sévérité avec les doses. C’est pourquoi, nous considérons que la réduction du facteur d’incertitude n’est pas adéquate et que les valeurs de l’US EPA et l’ATSDR sont à retenir en cas d’exposition chronique.
Effets sans seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir les valeurs de l’US EPA de 4,9.10-3 (mg.m-3)-1 pour une exposition chronique à l’aldrine par inhalation.
Concernant les effets sans seuil, l’US EPA et l’OEHHA proposent les mêmes excès de risques unitaires. Ces valeurs peuvent donc être retenues indifféremment.
Effets sans seuil - Exposition chronique par voie orale :
L’INERIS propose de retenir les valeurs de l’US EPA de 17 (mg.kg-1.j-1)-1 pour une exposition chronique à l’aldrine par voie orale.
Concernant les effets sans seuil, l’US EPA et l’OEHHA proposent les mêmes excès de risques unitaires. Ces valeurs peuvent donc être retenues indifféremment.
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par voie orale :
L’OMS propose un TDI provisoire de 1.10-4 mg/kg/j pour une exposition orale (2006).
Cette valeur a été établie à partir d’un NOAEL de 1 mg/kg/j déterminé lors d’une étude réalisée chez le chien et de 0,5 mg/kg/j chez le rat lors d’exposition à un mélange d’aldrine dieldrine via la nourriture. Ce qui correspond à équivalent de 0,025 mg/kg pc/j dans les deux espèces. Les études sur lesquelles sont basées ces données ne sont pas précisées par le document.
Facteur d’incertitude : un facteur d’incertitude de 250 a été appliqué au NOAEL, avec un facteur 10 pour l’extrapolation inter-espèce, un autre facteur 10 pour la variabilité individuelle dans la population et un facteur de 25 lié aux effest cancérigènes rapportés chez la souris.
Calcul : 0,025 mg/kg/j x 1/250 = 1.10-4 mg/kg/j.
Le RIVM propose un TDI de 10-4 mg/kg par jour pour une exposition chronique par voie orale chez le rat (2000).
Cette valeur a été établie à partir des effets hépatiques observés chez des rats et des chiens (Fitzhugh et Nelson, 1963; Fitzhugh et al., 1964). Des groupes de rats (12/sexe), nourris pendant 2 ans avec un aliment contenant 0 - 0,5 – 2 – 10 – 50 - 100 ou 150 ppm d’aldrine, et de chiens exposés pendant 15 mois, présentent des lésions hépatiques caractéristiques dès 0,5 ppm (correspondant à une concentration de 0,025 mg/kg). Le LOAEL de 0,025 mg/kg par jour a servi à calculer un TDI de 10-4 mg/kg par jour pour les expositions chroniques par voie orale (rat).
Facteur d’incertitude : un facteur de 250 est appliqué : un facteur 2,5 car la valeur utilisée est un LOAEL (facteur que le RIVM juge suffisant vu l’effet marginal observé pour ce LOAEL), un facteur 10 pour l’extrapolation de données animales à l’homme et un facteur 10 pour la variabilité au sein de la population.
Calcul : 0,025 x 1/250 = 10-4 mg/kg/j
Santé Canada propose une ADI de 10-4 mg.kg-1.j-1 pour une exposition chronique par voie orale (1995).
Cette valeur a été établie à partir des effets hépatiques observés chez des rats et des chiens (Fitzhugh and Nelson 1963; Fitzhugh, Nelson et al. 1964). Des groupes de rats (12/sexe), nourris pendant 2 ans avec un aliment contenant 0 - 0,5 – 2 – 10 – 50 - 100 ou 150 ppm d’aldrine, et de chiens exposés pendant 15 mois, présentent des lésions hépatiques caractéristiques dès 0,5 ppm (correspondant à une concentration de 0,025 mg.kg-1). Le LOAEL de 0,025 mg.kg-1.j-1 a servi à calculer un TDI de 10-4 mg.kg-1.j-1 pour les expositions chroniques par voie orale (rat).
Facteur d’incertitude : un facteur de 250 est appliqué, sans détail.
Calcul : 0,025 x 1/250 = 10-4 mg.kg-1.j-1
Effets sans seuil - Exposition chronique par inhalation:
L’OEHHA propose un ERUi de 4,9.10-3 (µg.m-3)-1 inhalation, repris de l’US EPA (2009).
Effets sans seuil - Exposition chronique par voie orale :
L’US EPA propose un ERUeau de 4,9.10-4 (µg/L)–1 par voie orale (1993).
Un modèle mathématique linéaire multiétape a permis de déterminer l’excès de risque unitaire par voie orale, à partir de l’ERUo précédent. Cet ERUeau ne doit pas être utilisé si la concentration en aldrine dans l’eau excède 20 µg/L.
L’OEHHA propose un ERUo de 17 (mg.kg-1.j-1)-1 par voie orale, repris de l’US EPA (2009).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'objectif de ce chapitre est d'estimer les effets à long terme sur la faune et la flore, les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aiguë ne sont pas fournis. Lorsque l'écotoxicité chronique n’est pas suffisamment connue, les résultats d'écotoxicité aiguë sont présentés et peuvent servir de base pour l'extrapolation des effets à long terme. L'ensemble des informations et des données de ce chapitre provient de diverses revues bibliographiques publiées par des organismes reconnus pour la qualité scientifique de leurs documents (OMS IPCS, 1989 ; US EPA, 1980). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Dangers
Synthèse
Eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Les résultats donnés ci-après sont calculés sur l’ensemble des essais réalisés et indépendamment de leur recevabilité, en utilisant la moyenne géométrique des résultats lorsque plusieurs essais sont disponibles pour une même espèce. Les valeurs de toxicité aiguë sont comparables à celles obtenues avec la dieldrine. Ainsi, de même qu’avec la dieldrine, une grande disparité des résultats est observée vis-à-vis des organismes aquatiques dulçaquicoles et marins. Dans bien des cas, la toxicité mesurée est très supérieure à la solubilité de la molécule. Chez les organismes dulçaquicoles, la CE50 72 heures des algues pour l’aldrine est environ 100 000 µg/L. La CL50 48 - 96 heures des invertébrés est comprise entre 0,15 µg/L et 16 543 µg/L avec une moyenne géométrique de 53,2 µg/L. Pour les vertébrés, ces valeurs pour des CL50 supérieures à 96 heures sont respectivement de 4,1 - 150 et 19,2 µg/L. Pour les organismes marins et plus particulièrement vis-à-vis des algues marines, seule une valeur aiguë indique une diminution 84,6 à 84,8 % de la productivité après 4 heures d’exposition. Vis-à-vis des invertébrés, les CL50 48 - 96 heures minimales et maximales sont respectivement de 0,37 µg/L et 100 000 µg/L avec une moyenne géométrique de 37,3 µg/L. Pour les vertébrés, ces valeurs pour des CL50 supérieures à 96 heures sont respectivement de 3,5 - 100 et 11,5 µg/L.
Algues
Vis-à-vis des algues, il semble que la toxicité de l’aldrine soit bien supérieure à sa solubilité. Ainsi, vis-à-vis des algues dulçaquicoles, les CE50 72 heures exprimées sous la forme de la réduction de la concentration en ATP, sont supérieures ou égales à 100 000 µg/L (Clegg et Koevenig, 1974). Pour les algues marines, une étude menée sur une communauté de phytoplancton indique une diminution 84,6 à 84,8 % de la productivité après 4 heures d’exposition à l’aldrine (Butler, 1963, cité par US EPA, 1980).
Invertébrés
Vis-à-vis des invertébrés, la toxicité aiguë de l’aldrine est très variable. Cette variabilité semble principalement liée à des différences interspécifiques. Ainsi, vis-à-vis des crustacés dulçaquicoles, la moyenne géométrique des CL50 48 – 96 heures est de 62,2 µg/L. Dans ces essais, le Paratelphusa jacquemontii est l’organisme le plus sensible avec des CL50 48 et 96 heures respectivement de 0,21 et 0,11 µg/L en semi statique (Patil et al., 1991). Le Gammarus lacustris est l’espèce la moins sensible avec des CL50 48 et 96 heures respectivement de 12 000 et comprises entre 9 800 et 38 500 µg/L en statique (Gaufin et al., 1965 ; Sanders, 1969). Vis-à-vis des crustacés marins, la moyenne géométrique des CL50 48 heures à 96 heures est de 12,6 µg/L. La CL50 96 heures la plus faible et la plus élevée sont de 0,74 et 850 µg/L. Elles ont été obtenues respectivement sur Palaemon macrodactylus (Schoettger, 1970) et Palaemonetes vulgaris (Eisler, 1969).
D’une façon générale, la toxicité de l’aldrine vis-à-vis des insectes dulçaquicoles est comparable à celle obtenue chez les crustacés avec une moyenne géométrique de 27 µg/L. En statique, les CL50 96 heures minimales et maximales ont été obtenues sur Pteronarcys californica. Elles sont de 1,3 µg/L (Sander et Cope, 1968 ; Johnson et Finley, 1980) et 180 µg/L (Jensen et Gaufin, 1966) correspondant à une moyenne géométrique de 27,0 µg/L.
Les mollusques marins semblent moins sensibles à l’aldrine. Pour ces organismes, les CL50 48 heures - 12 jours sont comprises entre 25 µg/L (Crassostrea virginica) (Butler, 1963) et plus de 10 000 µg/L (Mercenaria mercenaria) stade œuf (Davis et Hidu, 1969).
Poissons
Chez les poissons, comme vis-à-vis des autres organismes, une disparité des résultats est observée. Pour les individus dulçaquicoles, la moyenne géométrique des CL50 96 heures est de 17,5 µg/L. Elle est comprise entre 1,2 et 1 700 µg/L, c’est deux valeurs ayant été obtenues sur le Clarias batrachus (Bhatnagar et al., 1988 ; Kudesia et Bali, 1984). Pour les poissons marins, la moyenne géométrique des CL50 96 heures est de 11,53 µg/L. Les CL50 96 heures minimale et maximale sont 2,03 et 100 µg/L. Ces valeurs ont été obtenues sur le Micrometrus minimus (Earnest et Benville, 1972) et le Mugil cephalus (Eisler, 1970b).**************La toxicité est donc dépendante de l’espèce, mais d’autres paramètres influencent les résultats. Ainsi, comme pour la dieldrine, Macek et al. (1969) montrent qu'une élévation de la température augmente la toxicité de l'aldrine pour le Lepomis macrochirus et l’Oncorhynchus mykiss.
Amphibiens
Vis-à-vis des amphibiens, Sanders (1970) obtient une CL50 96 heures de 150 µg/L sur le stade têtard du Bufo woodhousii fowleri.
Paramètres d’écotoxicité chronique :
Les données de toxicité chronique vis-à-vis des organismes aquatiques répertoriées par
l’OMS IPCS (1989), Kegley et al. (2007) et l’US EPA (1980) ne sont pas suffisamment nombreuses pour dériver une PNEC.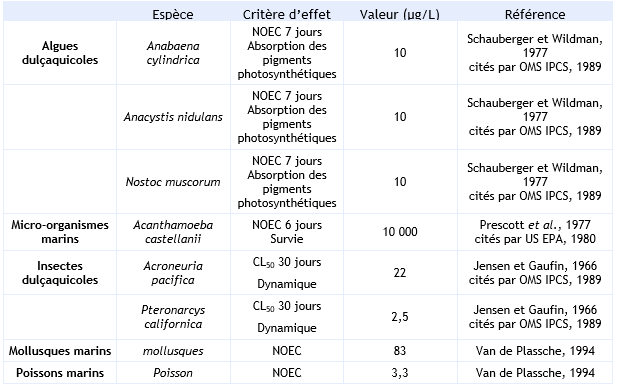
Algues
Schauberger et Wildman (1977), cités l’OMS IPCS, 1989), ont exposé trois espèces d’algues d'eau douce (Anabaena cylindrica, Anacystis nidulans, Nostoc muscorum) à l'aldrine à des concentrations comprises entre 0 – 1 000 µg/L. Après 7 jours exposition, aucun effet significatif n’a été observé sur l'absorption photosynthétique des pigments des trois espèces jusqu'à la concentration de 10 µg/L (nominale). Cependant, à 1 mg/L, l'aldrine a presque totalement stoppé l'absorption des pigments photosynthétiques (chlorophylle et phycocyanine), utilisés comme indicateurs de santé et de croissance physiologiques.
Invertébrés
Jensen et Gaufin (1966, cités par l’OMS IPCS, 1989) ont étudié la toxicité de l’aldrine vis-à-vis des nymphes de deux espèces d’insectes. Après 30 jours d’exposition en flux dynamique, la LC50 est de 2,5 µg/L pour le Pteronarcys californica et de 22 µg/L pour Acroneuria pacifica.
Sol
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Vis-à-vis des organismes terrestres, la toxicité aiguë de l’aldrine est similaire à celle de la dieldrine.
Selon Ritter et al. (Rapport non daté), l'aldrine est faiblement phytotoxique.
Vis-à-vis des insectes, van de Plassche (1994) indique une CL50 de 0,55 mg/kg, toutefois sans indiquer l’organisme cible. Les annélides sont moins sensibles avec une CL50 6 semaines de 155 mg/kg.
Comme pour les organismes aquatiques, les études sur les espèces aviaires génèrent des résultats très disparates. La toxicité aiguë de l’aldrine est également très disparate avec des CL50 comprises entre 34 mg/kg de nourriture (Coturnix coturnix, Hill et al., 1975) et 9 241 mg/kg de nourriture (Anas platyrhynchos, Tucker et Crabtree, 1970) avec une moyenne géométrique de 242 mg/kg de nourriture. Cette disparité des résultats semble être liée à des différences de sensibilités interspécifiques, vraisemblablement à l’utilisation de facteurs de conversion pour transformer les DL50 en CL50 mais également aux conditions expérimentales. Ainsi, vis-à-vis du canard (Anas platyrhynchos), la CL50 est comprise entre 155 et 9 241 mg/kg de nourriture
De manière similaire, chez les mammifères, la CL50 est comprise entre 365 mg/kg de nourriture (Mus musculus) (Borgmann et al., 1952) et 3 800 mg/kg de nourriture (Canis domesticus) (Borgmann et al., 1952) avec une moyenne géométrique de 894 mg/kg de nourriture.
Paramètres de toxicité chronique:
Micro-organismes
Vis-à-vis des bactéries du sol, van de Plassche (1994) indique que des NOEC pour l’aldrine de 125 mg/kg. De même, selon l’OMS IPCS (1989), l’aldrine n’a pas d’effet significatif sur les populations de micro-organismes du sol ou d’eaux douces à des concentrations réalistes. Ainsi, Tu et Miles (1976, cités par l’OMS IPCS, 1989) montrent que sur 15 souches testées, l'aldrine n'a pas perturbé la croissance de 11 espèces bactériennes (cultures simples) mais induit une inhibition de croissance pour quatre espèces. A la concentration de 2 000 mg/kg de sol, la dieldrine n'a pas eu d’effet sur des bactéries dans des études de laboratoire. Les champignons du sol ont également été peu affectés. Dans des études en pot, l’aldrine, à des concentrations de 4 et 120 mg/kg de sol, a induit une inhibition de la croissance de Rhizoctonia solani de 20 % ou plus aux concentrations supérieures ou égales à 6,2 mg/L. La respiration des organismes du sol mesurée par l’évolution de l'anhydride carbonique (CO2) est réduite par l'aldrine à des concentrations de 25 mg/kg de sol. Des effets sur la nitrification ont été observés à court terme (1 semaine) lorsque l'aldrine est incorporée à la concentration de 2 000 mg/kg dans un sol argilo-sableux, l'inhibition diminuant considérablement après 3 mois. Par ailleurs, cinq applications annuelles d'aldrine (5,5 – 22 kg/ha) dans un sol argilo sableux n'ont eu aucun effet mesurable sur la croissance bactérienne et fongique dans le sol, n'ont pas influencé la capacité de ces organismes du sol à décomposer les résidus des plantes, et n'ont pas changé l'agrégation du sol.
Végétaux
Selon l’OMS IPCS (1989), à la dose de 22 kg/ha, l'aldrine affecte quelques récoltes, les haricots et les céréales étant les plus sensibles. Les études en serres chaudes montrent qu’une administration hebdomadaire d’aldrine sous la forme d’un concentré émulsifiable à une dose de 16 kg /ha sur des plants de 2 à 3 semaines de tomates, de choux-fleurs et de choux de chine inhibe le développement racinaire et réduit le taux de croissance du chou-fleur et du chou de chine. A une dose 10 fois inférieure, ces effets n’ont pas été observés (Hagley, 1965). De même, les tomates et les concombres sont sensibles à l'aldrine mais à des doses d'application non réalistes (Edwards, 1965).
Invertébrés
Pour l’aldrine, van de Plassche (1994) indique pour les nématodes une NOEC de 1,5 mg/kg.
Vertébrés
Comme pour d’autres substances organochlorées, le foie est l'organe cible principal de l’aldrine ainsi que mis en évidence par des modifications du rapport poids du foie/poids corporel total, l'hypertrophie du foie et des modifications histopathologiques. En utilisant la moyenne géométrique des résultats lorsque plusieurs essais sont disponibles pour une même espèce, vis-à-vis des mammifères, la moyenne géométrique des NOEC est de 7,09 mg/kg de nourriture. Toutefois, comme pour les organismes aquatiques, les résultats des essais sont très disparates avec des NOEC comprises entre 1,25 mg/kg et 40 mg/kg de nourriture. Ces résultats ont été obtenus sur Rattus norvegicus (van de Plassche, 1994) et Oryctolagus cuniculis (van de Plassche, 1994).
Vis-à-vis des oiseaux, les NOEC de l’aldrine sont comprises entre 1 et 5 mg/kg de nourriture avec une moyenne géométrique de 1,19 mg/kg de nourriture. Les valeurs minimales ont été obtenues sur la caille (van de Plassche, 1994) et le faisan (Phasianus colchicus) (Brown et al., 1965 ; DeWitt, 1956). La valeur maximale a été obtenue sur le faisan (Phasianus colchicus) (van de Plassche, 1994).
Valeurs écotoxicologiques
Valeurs réglementaires
Description
FDTE/VTR Importer Concentrations sans effet prévisible pour l'environnement (PNEC).
Propositions de l'INERIS
Les données valides de toxicité chronique de l’aldrine vis-à-vis des organismes aquatiques sont insuffisantes pour dériver une PNEC. Par ailleurs, l’aldrine est rapidement métabolisée et presque quantitativement (OMS IPCS, 1989) en dieldrine plus persistante et ayant une toxicité similaire. De ce fait, il n’est pas justifiable de dériver une PNEC chronique à partir des données de toxicité aiguë de l’aldrine. Ainsi, il est proposé d’utiliser les PNEC de la dieldrine pour l’aldrine. Ces dernières sont détaillées dans la fiche de données toxicologiques et environnementales de la dieldrine. Seules les valeurs retenues sont rappelées ici pour mémoire.
Synthèse
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Tableaux de synthèse
Généralités
| CAS | 309-00-2 |
|---|---|
| SANDRE | 1103 |
| Substance prioritaire dans le domaine de l’eau (DCE) | oui |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2005 Importer ClassificationClassification toxicologique
Conseils de prudenceS1/2 – S22 -S36/37 – S45 -S60 -S61 (d'après le site internet du CNRS).  Substance cancérogène, troisième catégorie. Textes législatifs de référenceSur le plan de la réglementation des produits phytopharmaceutiques :
[2] La norme fixe à 0,03 µg par litre la concentration pour l'aldrine et 0,5 µg par litre la concentration totale en pesticides, dans les eaux de consommation humaine. 3 la Convention de Stockholm : ce texte vise une interdiction progressive de la production et de l'utilisation de 12 POP. Il a pour objectif principal de protéger la santé humaine et l'environnement de leurs effets néfastes. La convention énonce une série de mesures visant à réduire et, lorsque c'est possible, éliminer les rejets de POP et les émissions de sous-produits POP. La convention vise également à sécuriser le mode de gestion des stocks ou des déchets contenant des POP. Cette convention est entrée en vigueur le 17 mai 2004. Concernant l'aldrine, cette convention impose l'élimination de la substance. [4] le Protocole d'Aarhus : ce texte, signé en juin 1998 dans le cadre de la Convention de Genève sur la Pollution Transfrontalière Longue Distance, sous l'égide de la Commission Economique des Nations Unies pour l'Europe (CEENU), a pour objet de contrôler, de réduire ou d'éliminer les émissions de 16 de ces substances dans l'environnement. Concernant l'aldrine, le protocole interdit catégoriquement la production et l'utilisation de cette substance. |
| Classification CLP | Voir la classification CLP |
Production et utilisation
Production et ventes
Données économiques
FTE 2005 Importer
Suite au bannissement international de cette substance, il est admit que depuis 1996 il n'y a plus de production notable d'aldrine au niveau mondial (PNUE, 1996).
Avant son interdiction, l'aldrine était fabriquée par la condensation du hexachlorocyclopentadiene avec du bicycloheptadiène à 120°C et à pression atmosphérique. Le bicycloheptadiène en excès était éliminé par distillation. Le produit final était habituellement encore épuré par recristallisation (Sittig, 1980 cité par ATSDR, 2002).
En 1967, la composition de l'aldrine de qualité technique5 a été analysée (IARC, 1974 cité par ATSDR, 2002) : ce mélange était pur à 90,5 %.
Suite à l'interdiction de l'aldrine il y a plus de 15 ans, il n'a pas été possible de recueillir des éléments probants quant aux aspects économiques de l'interdiction de l'aldrine.
Utilisations
Introduction
FTE 2005 Importer
En France depuis 1994, tous les usages de l'aldrine sont interdits. Selon la FAO/PNUE (1991), les motifs des mesures de réglementation sont les suivants :
- forte toxicité de la substance ;
- persistance de la substance (notamment dans les régions tempérées) ;
- bioaccumulation des résidus de la substance dans la chaîne alimentaire.
Rejets dans l’environnement
Rejets dans l'environnement
FTE 2005 Importer
Pour cette substance aucune source naturelle n'a été identifiée. De plus, l'usage de cette substance étant prohibé, aucun rejet anthropique n'est à attendre.
[5] D'après Sigma-aldrich (2005), la qualité technique d'une substance correspond à une classification basée sur la pureté chimique. Cette classe correspond à un titre pouvant être fluctuant d'un lot à l'autre mais toujours supérieur à 90 % (exprimé sous la forme de substance sèche). Ceci implique une certaine variabilité dans la couleur et la forme possible de la substance.
Rubrique sans objet du fait de l'interdiction d'usage de cette substance.
Suite à l'interdiction de la substance aucun rejet n'est rapporté à l'échelle européenne.
Pollutions historiques et accidentelles
FTE 2005 Importer
Aucune information disponible.
Par définition, une substance POP est persistante dans l'environnement et mobile. Ainsi, même si aucune pollution historique n'a été identifiée en France, une pollution diffuse et transfrontière est possible par effet « retard ». Le tableau 3.1. présente les propriétés de cette substance vis à vis de différents phénomènes de dissipation.
Tableau 3.1. Quantification des principaux phénomènes de dissipation de l'aldrine dans l'environnement (d'après FAO, 2000 et le site internet Deutsche Gesellschaft für Technische Zusammenarbeit).

Présence environnementale
Synthèse
FTE 2005 Importer
Aldrine dans les sols
Selon le site internet Deutsche Gesellschaft für Technische Zusammenarbeit, l'aldrine tend à s'accumuler dans le sol en raison de sa forte persistance.
Aldrine dans le compartiment aérien
Selon le site internet Deutsche Gesellschaft für Technische Zusammenarbeit, dans l'atmosphère, l'aldrine subit assez rapidement une transformation photochimique.
Aldrine dans les eaux
Selon le site internet Deutsche Gesellschaft für Technische Zusammenarbeit, l'adrine présente à la fois une forte toxicité pour les organismes et une forte persistance dans l'eau.
L'IFEN rapporte qu'en 2000, sur 215 recherches dans les eaux superficielles françaises, l'adrine n'a jamais été quantifiée. De nos jours, du fait de l'ancienneté de l'interdiction de cette substance en France, l'adrine n'est plus recherché dans l'environnement lors des inventaires de pollution
Métabolite de l'aldrine dans l'environnement
En préambule à ce paragraphe, rappelons que la dieldrine est à la fois un produit phytosanitaire employé en tant que tel (mais interdit en même temps que l'aldrine) et le principale métabolite de l'aldrine.
Selon le site internet de l'EFSA (EFSA Journal, 2005), des résidus de dieldrine sont encore décelables dans l'environnement et les tissus humains, mais les concentrations ont régulièrement diminué au cours de ces 30 dernières années. Néanmoins, l'IFEN (2002) rapporte qu'en 2000, sur 1 506 recherches dans les eaux superficielles françaises, la dieldrine a été retrouvée dans 3 % des échantillons (à l'inverse, cette même année, sur 664 recherches dans les eaux souterraines, la dieldrine n'a été quantifiée qu'une fois).
Néanmoins, à partir de ces données, on ne peut pas faire la part des choses entre la contamination directe liée à l'usage de dieldrine et la contamination indirecte en tant que sous-produit de l'aldrine.
Conclusion
FTE 2005 Importer
Le retour à la pureté des eaux française vis à vis de l'aldrine semble déjà atteint. Cet exemple démontre dans ce cas l'efficacité des mesures d'interdiction en ce qui concerne le compartiment « eau » de l'environnement. De même, cela souligne la portée d'une action conjointe avec les pays voisins pour traiter une problématique de pollution par une substance persistante.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

