Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Zinc (7440-66-6)
Informations générales
Dernière vérification le 02/07/2025
Identification
Numero CAS
7440-66-6
Nom scientifique (FR)
Zinc
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
231-175-3
Code SANDRE
1383
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Zn }\)
Code InChlKey
Code SMILES
[Zn]
Familles
Familles chimiques
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Règlementations
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
65.38 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bioaccumulation
Organismes aquatiques
Le zinc est un métal essentiel, c’est à dire nécessaire en quantité généralement faible, à la vie d’un grand nombre d’organismes.
L’accumulation du zinc dans l’organisme est régulée pour de nombreuses espèces, par exemple chez les mollusques, les crustacés, les poissons et les mammifères.
Le zinc peut s’accumuler dans les organismes aquatiques, mais les valeurs de BCF décroissent lorsque l’on monte dans la chaîne trophique. Cela peut s’expliquer par une régulation plus importante dans les organismes “ supérieurs ”.
En conséquence, il semble que le potentiel de biomagnification soit faible.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Chez les mammifères en particulier, l’absorption et l’excrétion du zinc sont régulés afin de maintenir une teneur constante en zinc quel que soit le niveau d’exposition. En conséquence, le potentiel de bio-accumulation du zinc est faible chez les mammifères.
Le zinc est plus facilement mobile et disponible dans les sols légers (sous conditions oxydantes) et acides, et lorsque le sol a une faible capacité d’échange de cations.
La fraction de zinc liée aux oxydes de fer et de manganèse est la plus facilement assimilable par les plantes. Parmi les facteurs qui affectent la disponibilité du zinc dans les sols, les paramètres du sol, tels que la quantité totale de zinc, le pH, la matière organique, les sites d’adsorption, l’activité microbienne, l’humidité, jouent un rôle important (Alloway, 1995 ; Adriano, 1986). Il existe probablement une compétition avec les autres métaux mobiles sur les sites d’adsorption du zinc.
L’immobilisation du zinc a un impact important sur les déficiences dans les plantes. Cette rétention du zinc intervient dans les sols riches en Ca et P, dans les sols aérés contenant des composés sulfurés et dans les sols contenant de grandes quantités de minéraux saturés en Ca ou en hydroxydes. Le zinc présent dans les boues de station d'épuration, sous forme de complexes organiques est très mobile dans le sol et facilement biodisponible (Kabata-Pendias et Pendias, 1992). Cependant, une étude réalisée sur des plantations à différents temps d’incubation de boues (ZnSO4) sur le sol a montré que le zinc des boues devenait moins biodisponible avec le temps (Mortvedt et Giordano, 1975).
Généralement, une augmentation de la concentration en zinc dans le sol provoque une augmentation dans les tissus des plantes. Cette concentration est plus élevée pour les plantes matures recevant un traitement aux boues que pour les plantes ayant poussé sur un sol traité avant culture (Mortvedt et Giordano, 1975).
Henry et Harrison, 1992 (op cit Alloway, 1995) ont classé des légumes en fonction du taux d’absorption de Zn : laitue>carottes>tomates. Les formes de zinc absorbées par les plantes sont surtout le zinc hydraté et Zn2+, et aussi les formes complexées du zinc. Halvorsen et Lindsay, 1977 (op cit Kabata-Pendias et Pendias, 1992) ont trouvé que seulement Zn2+ était absorbé par les racines de plants de céréales. L’absorption de zinc par les plantes est plus faible par un traitement aux boues que pour une quantité équivalente de zinc apportée sous forme ZnSO4 en solution (Mortvedt et Giordano, 1975). La fraction de zinc liée à la matière organique pourrait expliquer sa forte mobilité dans les plantes.
Le zinc se concentre préférentiellement dans les feuilles matures de la plante. Dans les écosystèmes où le zinc est un polluant atmosphérique, il se concentre plutôt au sommet des plantes. Par contre, les plantes ayant poussé dans un sol contaminé par du zinc accumulent du métal dans les racines (Kabata-Pendias et Pendias, 1992).
Facteur de bioconcentration depuis le sol
Une étude rapportée dans la littérature porte sur une région minière des Etats Unis (Bingham Creek), où l'activité a démarré dans les années 1860 et sur la problématique de l'accumulation du zinc depuis le sol dans les radis, tomate, laitue et haricot vert (Cobb et al., 2000). Ces divers végétaux ont été cultivés, en serre, dans des pots, sur des sols aux teneurs en zinc différentes. Les sols utilisés correspondent à des mélanges de sols témoins (issus de la région) et de déchets issus de la mine (sol superficiel) avec différentes proportions de déchets dans les mélanges. Les végétaux ont été cultivés jusqu'à maturité sur les sols. Les sols ont globalement un contenu en matière organique de 1,1 % et un pH de 6,5. Les facteurs de bioconcentration du zinc dans les divers végétaux (partie comestible) en poids sec calculés à partir de la moyenne géométrique des concentrations relevées dans les végétaux et la moyenne géométrique des concentrations mesurées dans les sols sont présentés dans le tableau suivant.
|
Csol (ppm) |
pH du sol |
C choux (ppm) (poids sec) |
BCFchoux (poids sec) |
|---|---|---|---|
|
73,2 +/-3,2 (sol témoin) |
5,7 |
18 +/- 3 |
0,24 |
|
831,7 +/- 41,8 |
5,5 |
446 +/- 67 |
0,54 |
|
498,3 +/- 24,4 |
4,3 |
424 +/- 78 |
0,85 |
|
444,5 +/- 3,7 |
5,2 |
148 +/- 26 |
0,33 |
|
385,7 +/- 28,9 |
7,0 |
26 +/- 4 |
0,067 |
|
335 +/- 2,2 |
5,7 |
171 +/- 22 |
0,51 |
|
236,4 +/- 1,9 |
6,6 |
31 +/- 8 |
0,13 |
|
148,1 +/- 0,3 |
6,4 |
18 +/- 4 |
0,12 |
|
369 (moyenne) |
|
160 (moyenne) |
0,35 (moyenne) |
(Concentration dans le sol : sont indiquées les moyennes géométriques des concentrations et entre parenthèse l'étendue des valeurs.)
Une étude a été menée par Xian, 1989 sur sept sites pollués des alentours d'une fonderie de zinc, dont l'activité a démarré à la fin des années 1930, à Annaka au Japon. Les sols superficiels de ces 7 sites (plus celui d'un site témoin) ont été collectés et placés en pots, dans lesquels des choux ont été plantés. Pour chaque sol, trois répliquats ont été réalisés. Les pots ont été placés sous serre, la durée de culture a été de 90 jours. Avant analyse, les choux ont été lavés, les parties souterraines et aériennes séparées et séchées. Les facteurs de bioconcentration du zinc pour les choux (partie aérienne) déterminés à partir de cette étude sont présentés dans le tableau suivant.
|
Csol (ppm) |
pH du sol |
C choux (ppm) (poids sec) |
BCFchoux (poids sec) |
|---|---|---|---|
|
73,2 +/-3,2 (sol témoin) |
5,7 |
18 +/- 3 |
0,24 |
|
831,7 +/- 41,8 |
5,5 |
446 +/- 67 |
0,54 |
|
498,3 +/- 24,4 |
4,3 |
424 +/- 78 |
0,85 |
|
444,5 +/- 3,7 |
5,2 |
148 +/- 26 |
0,33 |
|
385,7 +/- 28,9 |
7,0 |
26 +/- 4 |
0,067 |
|
335 +/- 2,2 |
5,7 |
171 +/- 22 |
0,51 |
|
236,4 +/- 1,9 |
6,6 |
31 +/- 8 |
0,13 |
|
148,1 +/- 0,3 |
6,4 |
18 +/- 4 |
0,12 |
|
369 (moyenne) |
|
160 (moyenne) |
0,35 (moyenne) |
Une étude sur des sites pollués par l'activité minière a été réalisée en Grande Bretagne (Davies et White, 1981). Divers végétaux ont été cultivés dans des parcelles de ces sites. Les concentrations en zinc dans les sols varient de 254 à 4 981 ppm (moyenne : 1 438 ppm). Le pH des sols varie de 5,4 à 7,3. Avant analyse, les végétaux ont été lavés, séparés en différents compartiments (racine, feuille…) et séchés. Les facteurs de bioconcentration du zinc dans les divers végétaux (partie comestible) en poids sec calculés à partir de la moyenne des concentrations relevées dans les végétaux et la moyenne des concentrations mesurées dans les sols sont présentés dans le tableau suivant.
|
Végétaux |
Concentration dans la plante en poids sec (mg/g) |
BCF en poids sec (moyen) (-) |
|---|---|---|
|
Carotte |
89,6 (23,5-190,8) |
0,0623 |
|
Choux de Bruxelles |
86,0 (39,8 – 205,0) |
0,0598 |
|
Oignon |
246,0 (39,1 – 710,0) |
0,171 |
|
Laitue |
284,0 (55,3 – 530,0) |
0,197 |
Une étude concernant les radis a été menée, au Pays de Galles dans une région ayant connu une activité minière depuis le milieu du XIX siècle (Davies et Roberts, 1975). Ces végétaux ont été cultivés dans 17 jardins dont le sol comporte du zinc suite à cette activité passée ; la déposition atmosphérique est considérée comme négligeable, et le zinc accumulé dans les plantes provient uniquement du sol. Il est à noter qu’après la récolte, le lavage des radis a été effectué avec de l’eau distillée. Parmi les échantillons mentionnés sont retenus les seize cultivés sur un sol au pH supérieur à 6. Les facteurs de bioconcentration du zinc pour le radis déterminés à partir de cette étude sont présentés dans le tableau suivant.
|
Concentration dans le sol (ppm) |
Concentration dans le sol (ppm) |
Concentration dans le sol (ppm) |
|||||
|---|---|---|---|---|---|---|---|
|
189 - 741 |
1 142 – 2 219 |
3 758 – 9 064 |
|||||
|
C radis (ppm) (poids sec) |
BCF radis [mg.kg-1 sec de végétal] / [mg.kg-1 de sol] |
C radis (ppm) (poids sec) |
BCF radis [mg.kg-1 sec de végétal] / [mg.kg-1 de sol] |
C radis (ppm) (poids sec) |
BCF radis [mg.kg-1 sec de végétal] / [mg.kg-1 de sol] |
||
|
127 - 1540 |
1,17 (0,474 – 2,30) |
844 - 1 252 |
0,855_ (0,38 – 1,36) |
1 750 – 2 078 |
0,467 (0,193 – 0,76) |
||
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 1994, 2005 ; RIVM, 2001 ; US EPA, 1990, 1992, 1996, 2005 ; OMS IPCS, 2001 ; Santé Canada, 2019 ; INRS, 2020).
Le zinc est l'un des oligo-éléments les plus abondants chez l'homme. L’ion métallique, co-facteur de plus de 200 systèmes enzymatiques, est indispensable à de nombreuses fonctions telles que la croissance, le développement osseux et cérébral, la reproduction, le développement fœtal, le goût et l'odorat, les fonctions immunitaires et la cicatrisation des blessures. Les besoins nutritionnels moyen journaliers en zinc sont de 3,6 à 8,8 mg chez les enfants (1-14 ans), 9,9 et 11,8 mg chez respectivement les adolescentes et adolescents de 15 à 17 ans, 8,9 mg chez la femme et 11 mg chez l'homme (ANSES, 2021)(NAS/NRC, 1989). La Commission des Communautés Européennes recommande toutefois des niveaux journaliers plus faibles de: 9,5mg.j-1 et 7 mg.j-1 pour respectivement les hommes et les femmes (SCF, 1993; EFSA, 2006).
Toxicocinétique
Chez l'homme
Absorption
En milieu professionnel, l'exposition par inhalation peut être également importante. La voie cutanée reste marginale, d’ailleurs le zinc est utilisé dans certaines préparations cosmétiques.
Inhalation
Le taux d'absorption du zinc inhalé n'est pas connu mais dépend de la taille et de la solubilité des particules. Chez les salariés exposés aux fumées d’oxyde de zinc, les augmentations des concentrations sanguines et urinaires de zinc sont en faveur d’une absorption pulmonaire (RAR, 2008).
Voie orale
Chez l'homme, la pénétration du zinc dans l'organisme se fait principalement suite à une exposition par voie orale via la nourriture. Le taux d'absorption du zinc, pris en complément alimentaire, varie de 8 à 81 % et dépend de la quantité et de la qualité de la nourriture ingérée. Le phylate par exemple (présent dans le son des céréales) forme des complexes insolubles avec le zinc et limite son absorption (Kim et al., 2007 ; Santé Canada, 2018).
Des personnes non carencées en zinc absorbent environ 20 à 30 % du zinc présent dans les aliments, l’absorption étant plus largement facilitée (60 à 70 %) dans l’eau de boisson (Sandstrom et Abrahamsson, 1989 ; Knudsen et al., 1995 ; Hunt et al., 1998. Le taux d’absorption moyen chez l’humain serait d’environ 33 % (Roohani et al., 2013). Ce taux est augmenté en cas de carence (Johnson et al., 1988). Par ailleurs, la présence de protéines en facilite l'absorption (Hunt et al., 1991). L’absorption du zinc est concentration dépendante, avec un contrôle de type feed back, et a lieu au niveau de l’intestin grêle avec un maximum d’absorption au niveau du jejunum. Une partie est cependant absorbée au niveau du colon (Lee et coll 1989 ; Sandstrom et al 1986).
Voie cutanée
Aucune donnée relative à l’absorption sur la peau saine n’a été identifiée (ATSDR, 2005).
Distribution
Le zinc absorbé est transporté de façon active au niveau du plasma (Cousins, 1985). Il est en majorité (98 %) complexé à des ligands organiques ((Gordon et al., 1981) tels que l'albumine (60 à 85 %) ou certains acides-aminés ((Giroux et al., 1976). Sous cette forme, le zinc est facilement échangeable et peut se lier à diverses protéines tissulaires dont les métallothionéines dans le foie et les reins (Hess et al., 2007). Une faible partie du zinc circulant est piégée au niveau de l'2 macroglobuline (12 %) et ce complexe ne peut se dissocier qu'au niveau du foie (Henkin, 1974).
Le zinc se répartit largement dans tout l’organisme. Des niveaux élevés de zinc ont été mesurés principalement dans les os (30 %), les muscles (60 %), mais aussi au niveau du foie (5 %), du tractus gastro-intestinal et du pancréas (3 %), de la prostate, des poumons, du cœur, des reins, du cerveau, de la rétine, de la peau et cheveux (8 %) (Schroeder et al., 1967 ; Forssen, 1972 ; Llobet et al., 1988a ; Bentley et Grubb, 1991 ; Wastney et al., 1986 ; Lowe et al., 2009).
Les niveaux en zinc peuvent varier considérablement d'un individu à l'autre (Forssen, 1972) et peuvent évoluer avec l'âge (Schroeder et al., 1967). Les concentrations érythrocytaires et urinaires en zinc sont significativement supérieures chez les sujets de 55 à 70 ans (p<0,05), par rapport à ceux de plus de 70 ans (Andriollo-Sanchez et al., 2005).
Le zinc diffuse lentement à travers le placenta : seulement 3 % du zinc maternel atteint le compartiment fœtal en 2 heures (Beer et al., 1992).
Métabolisme
Le zinc est présent dans le corps sous forme de cation divalent. Il n’est pas métabolisé. Il interagit de manière électrostatique avec les anions (carbonate, hydroxyde, oxalate) et avec les macromolécules chargées négativement telles que les protéines. Il peut également former des complexes chélatés solubles avec les acides aminés ou avec certains acides organiques.
Élimination
La voie d'élimination du zinc inhalé est peu connue. Une partie au moins est éliminée via les urines (Hamdi, 1969).
Le zinc ingéré est excrété principalement dans les fécès, et, dans une moindre mesure, dans les urines de l’ordre de 4 à 14 %, pouvant atteindre 25 % lors d’exposition à des fortes doses (Wastney et al., 1986; Kim et al.,2004; 2007). L’élimination urinaire est deux fois plus élevée chez les hommes que chez les femmes, de même que chez les enfants (Dlugaszek et al., 2011).
Selon les modèles cinétiques, l’élimination du zinc est biphasique : une phase initiale rapide avec une demi-vie chez l’humain de 10,2 ± 1,5 jour, et une phase plus lente avec une demi-vie de 376 ± 73,2 jours (Poddalgoda et al, 2019).
Une faible partie du zinc est également éliminée par la salive, les cheveux et la transpiration (Greger et Sickles, 1979 ; Rivlin, 1983).
Les nourrissons sont également exposés via le lait maternel (Rossowska et Nakamoto, 1992; Arbuckle et al., 2013)). Les concentrations de zinc dans le lait maternel sont plus élevées dans le colostrum et diminuent au cours de la lactation (Santé Canada, 2019).
Chez l'animal
Absorption
Inhalation
Les taux ou pourcentages d'absorption du zinc inhalé ne sont pas connus. Cependant, des données existent sur le pourcentage de rétention du zinc au niveau pulmonaire. Après inhalation de 3,5-9,1 mg Zn.m-3 sous forme d'oxyde durant 2-3 heures, les taux de rétention étaient de 19,8 % chez le cobaye, 11,5 % chez le rat et 4 % chez le lapin. Le diamètre moyen de l'aérosol de zinc était de l'ordre de 0,17 µm (Gordon et al., 1992). Le diamètre moyen de l'aérosol de zinc était de l'ordre de 0,17 µm (Gordon et al., 1992).
Voie orale
Par voie orale, le taux d'absorption du zinc radiomarqué était de 40 à 48 % chez des rats nourris avec un aliment contenant 0,81 mg Zn.kg-1 de nourriture, sous forme de chlorure ou de carbonate (Galvez-Morros et al., 1992).
L’absorption gastro-intestinale des formes hydrosolubles du zinc, sous forme ion zinc, est biphasique : une phase initiale rapide puis une phase saturable d’absorption plus lente (Davies, 1980 ; Gunshin et al., 1991).
Par ailleurs, il a été montré chez la souris que l’absorption chez l’adulte est plus faible que chez les souriceaux et animaux juvéniles (US EPA, 2005).
Voie cutanée
Diverses études ont montré que le zinc pouvait pénétrer par voie cutanée.
Le taux d'absorption du zinc radiomarqué (65Zn) sous forme de chlorure ou d'oxyde, a été estimé à 1,6-6,1 %, au niveau de l'épiderme dorsal de rat rasé mais intact (Hallmans et Liden, 1979). La pénétration était rapide : le maximum de radioactivité au niveau du sérum est apparu dans l'heure suivant l'application. Plus le pH de la solution de zinc était acide, meilleur était le taux d'absorption.
Ce rôle du pH a également été mis en évidence dans une étude sur le cobaye, pour lequel un taux de pénétration percutanée du chlorure de zinc de moins de 1 % a été montré en 5 heures d'application (entre 1 et 2 % pour le zinc en solution acide, pH = 1,8) (Skog et Wahlberg, 1964). Sur peau lésée, 12 % d'oxyde de zinc (0,25 mg Zn.cm-2) se sont retrouvés au niveau de la blessure pour 65 % de sulfate de zinc (0,066 mg Zn.cm-2), pour une application de 48 h. Ce dernier, plus soluble, serait transféré plus rapidement (dès 4 heures d'application) au niveau sanguin (Agren et al., 1991).
Distribution
Chez le chat, la teneur en zinc au niveau pulmonaire était maximale immédiatement après une exposition aiguë par inhalation à 12-61 mg Zn.kg-1.j-1 sous forme d'oxyde durant 3 heures. Cette teneur s'est maintenue pendant 2 jours. Les niveaux dans le pancréas, le foie et les reins ont augmenté lentement (Drinker et Drinker, 1928).
La distribution du zinc est mieux documentée par voie orale. Chez le rat, 6 heures après administration unique de 0,1 µCi de 65Zn sous forme de chlorure, la radioactivité s'est retrouvée dans l'intestin grêle, suivi par les reins, le foie et le gros intestin. Des quantités plus faibles étaient présentes dans les poumons et la rate. Quatorze jours après l'administration, des niveaux élevés en radioactivité pouvaient être décelés dans les poils, les testicules, le foie et le gros intestin (Kossakowski et Grosicki, 1983).
Chez le rat, après absorption de 191 mg Zn.kg-1.j-1 sous forme d'acétate durant trois mois, des teneurs élevées en zinc étaient détectées dans le cœur, le foie, la rate, les reins, les os et le sang (Llobet et al., 1988a). L'augmentation la plus importante se situait au niveau des os (258 %) et du sang (520 %).
Des teneurs élevées en zinc ont aussi été décelées dans les reins et le foie de souris recevant 76,9 mg Zn.kg-1.j-1 sous forme de sulfate (Schiffer et al., 1991) ou 38 mg Zn.kg-1.j-1 sous forme de nitrate (Cooke et al., 1990) durant environ 1 mois. Du zinc a également été mis en évidence dans la rétine et le sperme (Bentley et Grubb, 1991).
Métabolisme
Le zinc n’est pas métabolisé. Toutefois, l'analyse de la bile a montré que le zinc forme un complexe avec le glutathion réduit. Le traitement des animaux avec le diéthylmaléate, qui se conjugue au glutathion réduit et donc limite sa biodisponibilité, diminue l'excrétion biliaire de zinc. Ceci confirme qu'il existe une relation entre le zinc et le glutathion et suggère que le zinc est transféré du foie vers la bile par un processus glutathion dépendant.
Élimination
Comme chez l'homme, le zinc est éliminé essentiellement par les fèces. Chez le rat, entre 70 et 80 % de la dose ingérée sont excrétés dans les fèces (Davies et Roberts, 1975).(Davies et Nightingale, 1975). Il ne semble pas y avoir de différence dans l'élimination des différentes formes de zinc. Des rats recevant 2,65 mg Zn.kg-1.j-1 sous forme de chlorure, sulfate, phosphate ou citrate ont excrété 87 à 98 % des doses ingérées sur 4 jours (Seal et Heaton, 1983). Une étude a montré que le zinc était également excrété dans la bile des rats (Alexander et al., 1981).
Autre
Modèles toxicocinétiques : Aucun modèle n’a été développé pour le zinc aussi bien chez l’homme que chez l’animal.
Synthèse
Chez l’homme, le zinc est un oligo-élément abondant intervenant au niveau de la croissance, du développement osseux et cérébral, de la reproduction, du développement fœtal, du goût et de l’odorat, des fonctions immunitaires, de la cicatrisation. Il joue le rôle de co-facteur enzymatique. Il se distribue préférentiellement dans les os et les muscles squelettiques. Il passe la barrière placentaire et est également retrouvé dans le lait maternel. Le zinc est éliminé dans les fèces et dans une moindre mesure dans les urines.
Chez l’animal, les données confirment celles retrouvées chez l’homme.
Toxicité aiguë
Chez l'homme
Inhalation
Plusieurs cas de mortalité ont été rapportés dans la littérature chez des hommes exposés à des fumées riches en chlorure de zinc au cours de conflits armés dans des circonstances accidentelles (explosion de bombes) à des concentrations qui ont parfois été ponctuellement estimées à 33 000 mg de zinc.m-3), (Evans, 1945) (Milliken et al., 1963 ; Hjortso et al., 1988; Homma et al., 1992; Pettila et al., 2000)). Suite aux décès qui surviennent parfois plusieurs jours (25 à 32 jours) après l’exposition par détresse respiratoire, les autopsies ont révélé selon les sujets un œdème pulmonaire, une hémorragie sous-pleurale, une fibrose pulmonaire interstitielle et intra-alvéolaire, ainsi qu'une occlusion des artérioles pulmonaires, des lésions emphysémateuses et une nécrose.
Dans des conditions non léthales (concentrations de chlorure de zinc non précisée), les soldats ont présenté une atteinte de la fonction respiratoire caractérisée par des diminutions statistiquement significatives de la capacité de diffusion pulmonaire du CO une semaine après l’exposition et de la capacité pulmonaire totale 2 et 4 semaines après l’arrêt de l’exposition (Zerahn et al., 1999). Les niveaux plasmatiques en fibrogène se sont révélés élevés pendant toute la durée du suivi de 1 à 8 semaines post-exposition. Ces observations ont été confirmées dans une étude de cohorte rétrospective réalisée à partir du suivi de 20 soldats également exposés à des fumées de bombes fumigènes (présence concomitante d’oxydes de zinc, de fer et d’aluminium, d’hexachloroéthane) (Hsu et al., 2005). Les scanners et les tests de la fonction pulmonaire réalisés entre 3 et 21 jours après l’exposition rapportent des opacités du parenchyme pulmonaire plus ou moins diffuses, associées à une baisse générale de la fonction pulmonaire (capacité vitale forcée, capacité totale) et trouble des échanges gazeux (capacité de diffusion du monoxyde de carbone).
La poudre de stéarate de zinc a été à l'origine d'inflammations pulmonaires qui se sont révélées létales chez des enfants (BIBRA, 1989). Toutefois, il n’a pas été déterminé si ces effets ont été causés par le stéarate de zinc en lui-même ou par la grande quantité de poussière inhalée (Walsh et al., 1994).
En milieu professionnel, certaines opérations très spécifiques se déroulant à hautes températures, comme le découpage ou la soudure d'acier galvanisé, peuvent conduire à la formation de fumées contenant des particules ultrafines d'oxyde de zinc (< 0,1 µm de diamètre). L'exposition à ces fumées peut causer ce que l'on appelle la "fièvre des fondeurs", caractérisée par les symptômes suivants : gorge sèche et douloureuse, toux, dyspnée, fièvre, douleurs musculaires, céphalée et goût métallique dans la bouche (Heydon et Kagan, 1990 ; Gordon et al., 1992). Des effets cardiaques (Mueller et Seger, 1985) et gastro-intestinaux (NIOSH, 1975) peuvent également être associés à l'exposition à ces fumées. A noter que la fièvre des fondeurs qui ne concerne pas l'industrie de production et d'utilisation de l'oxyde de zinc de grade commercial, devient rare à l'heure actuelle (Marquart et al., 1989).
Quatre volontaires exposés à 5 mg.m-3 de particules d'oxyde de zinc durant 4 h ont développé les symptômes typiques de la fièvre des fondeurs, 4 à 8 h après l'exposition. Ces symptômes ont disparu dans les 24 h (Gordon et al., 1992). Une autre étude rapporte également des symptômes pour une exposition de 2 h à 5 mg.m-3 de particules d'oxyde de zinc (Fine et al., 1997). En revanche, une exposition de 6-8 h à la fumée d'oxyde de zinc (0,34 mg Zn.m-3) ou de 2 h à 0,5 mg.m3 de particules fines ou ultrafines d’oxyde de zinc n'a provoqué aucun des symptômes en relation avec la fièvre des fondeurs (Marquart et al., 1989; Martin et al., 1999; Beckett et al., 2005). A l’état de particules nanométriques, des effets inflammatoires sanguin (protéine C réactives, neutrophiles) ont été observés à partir d’une exposition de 4 h à 1 mg.m3 de ZnO chez des volontaires sains exposés en double aveugle (Monsé et al., 2018).
Voie orale
Par voie orale, un adolescent de 16 ans ayant ingéré 12 g de zinc métal en deux jours (144 mg.kg-1 le premier jour puis 57 mg.kg-1 le second), a présenté les symptômes suivants : vertige, léthargie, difficulté à marcher et à écrire mais pas de lésions gastro-intestinales (Murphy, 1970).
Il a été montré que l'ingestion de sulfate de zinc pouvait induire des désordres gastro-intestinaux à la dose de 2 mg Zn2+.kg-1 (Moore, 1978 ; Samman et Roberts, 1987).
Voie cutanée
L'oxyde, le sulfate et le stéarate de zinc ne sont pas irritants. A noter que certaines préparations pharmaceutiques (collyres, crèmes…) et cosmétiques (déodorants, ombres à paupières…) contiennent des composés du zinc à des concentrations allant jusqu'à 50 %.
Synthèse
Chez l’homme, l’exposition accidentelle à des fumées chargées en chlorure de zinc ou à des formes pulvérulentes de stéarate de zinc ou d’oxyde de zinc conduit au décès par détresse respiratoire. Des effets cardiaques et gastro-intestinaux peuvent également être observés pour des expositions à l’oxyde de zinc. Des effets d’ordre neurologique ont été observés après exposition accidentelle par voie orale de zinc métal.
Chez l'animal
Inhalation
De nombreuses études ont été réalisées, elles sont regroupées dans les tableaux suivants (d'après ATSDR, 1994 et CE, 1999).
CL50 pour le zinc et ses principaux composés.
|
Substance chimique |
Voie d'exposition |
CL50 (g Zn.m-3) |
Espèce |
Durée de l'exposition |
|---|---|---|---|---|
|
Zn poudre |
Inhalation |
> 5,41 |
Rat |
4 h |
|
Chlorure de zinc ZnCl2 |
Inhalation |
= 1,975 ZnCl2 (= 0,947) |
Rat |
10 min |
|
Oxyde de zinc ZnO |
Inhalation |
2,5 ZnO (2) > 5,7 ZnO (4,6) |
Souris Rat |
Inconnue 4 h |
|
Stéarate de zinc Zn(C18H35O2)2 |
Inhalation |
200 stéarate Zn (20,7) |
Rat |
1 h |
Comme chez l'homme, les composés du zinc inhalés ont pour organe cible principal le système respiratoire.
Le chlorure de zinc apparaît toxique par inhalation : des rats, exposés au chlorure de zinc par voie intratrachéale à des doses allant jusqu'à 5 mg ZnCl2.kg-1, ont présenté des œdèmes intra-alvéolaires de façon dose dépendante. La dose de 0,5 mg ZnCl2.kg-1 est un NOAEL pour cet effet (Richards et al., 1989).
L'oxyde de zinc est moins corrosif pour les muqueuses du nasopharynx et du tractus respiratoire. Une altération légère de la fonction pulmonaire a cependant été observée chez des cobayes exposés à 7,8 mg ZnO.m-3 durant 3 h (Lam et al., 1982) ou 0,9 mg ZnO.m-3 durant 1 h (Amdur et al., 1982).
Voie orale
De nombreuses études ont été réalisées, elles sont regroupées dans les tableaux suivants (d'après ATSDR, 1994 et CE, 1999).
DL50 voie orale pour le zinc et ses principaux composés.
|
Substance chimique |
Voie d'exposition |
DL50 |
Espèce |
|---|---|---|---|
|
Zn poudre |
Orale |
> 2 g Zn.kg-1 |
Rat |
|
Chlorure de zinc ZnCl2 |
Orale |
1,26 g ZnCl2.kg-1 (0,61 g Zn.kg-1) 1,1 g ZnCl2.kg-1 (0,53 g Zn.kg-1) |
Souris Rat |
|
Oxyde de zinc ZnO |
Orale |
> 7,95 g ZnO.kg-1 (> 6,39 g Zn.kg-1) > de 5 à 15 g ZnO.kg-1 (> 4 à 12 g Zn.kg-1)
|
Souris Rat
|
|
Phosphate de zinc Zn3(PO4)2, 2-4 H2O |
Orale |
> 5 g phosphate Zn.kg-1* |
Rat |
|
Sulfate de zinc ZnSO4, 2-7 H2O |
Orale |
0,926 à 1,891* g sulfate Zn.kg-1 (0,337 g Zn.kg-1)
0,920* à 2,949* g sulfate Zn.kg-1*
|
Souris Rat
|
|
Stéarate de zinc Zn(C18H35O2)2 |
Orale |
> 5 g stéarate Zn.kg-1 (> 0,5 g Zn.kg-1) |
Rat |
|
Acétate de zinc |
Orale |
0,086 g Zn.kg-1 0,237 g Zn.kg-1 |
Souris Rat |
|
Nitrate de zinc |
Orale |
0,204 g Zn.kg-1 0,293 g Zn.kg-1 |
Souris Rat |
* Type de composé (di, tétra ou heptahydraté) non précisé.
En général, les souris apparaissent plus sensibles que les rats lors de l'exposition par voie orale. Les composés peuvent être classés par ordre croissant de toxicité :
Voie cutanée
De nombreuses études ont été réalisées, elles sont regroupées dans les tableaux suivants (d'après ATSDR, 1994 et CE, 1999).
DL50 voie cutanée pour le zinc et ses principaux composés.
|
Substance chimique |
Voie d'exposition |
DL50 |
Espèce |
|---|---|---|---|
|
Sulfate de zinc ZnSO4, 7 H2O |
Cutanée |
2 g sulfate Zn.kg-1 (> 0,46 g Zn/kg) |
Rat |
|
Stéarate de zinc (C17H35COO)2Zn |
Cutanée |
2 g stéarate Zn.kg-1 (> 0,21 g Zn.kg-1) |
Lapin |
L'application sur la peau de 1 mg ZnCl2.cm-2 (0,48 mg Zn2+.cm-2) a causé des brûlures chez les souris et les lapins (Lansdown, 1991). Le chlorure de zinc est classé comme corrosif par la Commission Européenne, cet effet n’étant pas lié à celui du zinc mais à celui de l’ion chloré.
L'oxyde, le sulfate et le stéarate de zinc ne sont pas classés irritants.
Synthèse
Chez l’animal, le chlorure de zinc est l’espèce chimique la plus corrosive par inhalation, suivi par l’oxyde de zinc, avec pour organe cible principal le système respiratoire. Par voie orale, l’acétate et le nitrate de zinc présentent une plus faible toxicité que le zinc métal, l’oxyde, le stéarate et le phosphate de zinc. Par voie cutanée, les différents sels de zinc sont peu toxiques à l’exception du chlorure de zinc qui s’avère corrosif.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Peu d’informations sur la toxicité à long terme du zinc par inhalation sont disponibles. Il a été rapporté que des travailleurs dans la métallurgie présentaient une fréquence plus élevée de problèmes gastro-intestinaux. Sur 15 travailleurs ayant entre 7 et 20 ans d'expérience, 12 avaient fréquemment des douleurs abdominales ou épigastriques, des nausées, des vomissements, des ulcères et des épisodes de constipation. Toutefois, ces individus avaient pu être exposés à d'autres composés chimiques (arsenic, sulfure d'hydrogène) (McCord et al., 1926) et on ne peut exclure une contribution de la voie orale par ingestion partielle du zinc inhalé (notamment des grosses particules qui vont être piégées dans la sphère oro-faciale).
Par contre, 24 travailleurs, ayant été exposés entre 2 et 35,5 ans à des concentrations inférieures à 130 mg Zn.m-3 sous forme métal, sulfure et oxyde, ne présentaient qu'un léger trouble digestif. Aucun effet hépatique ou rénal n'a été décelé chez des travailleurs exposés durant plusieurs années au zinc (Batchelor et al., 1926 ; Hamdi, 1969).
Voie orale
Par voie orale, des crampes d'estomac, des nausées et des vomissements ont été observés chez des volontaires ayant ingéré du sulfate de zinc en tablette (2 mg Zn.kg-1.j-1) durant 6 semaines (étude en double aveugle) (Samman et Roberts, 1987). L'ingestion d'oxyde de zinc a également été associée à de tels symptômes (Callender et Gentzkow, 1937). De nombreux cas d'anémie ont été décrits chez des personnes supplémentées en zinc durant de longues périodes (1 à 8 ans) ((Porter et al., 1977 ; Patterson et al., 1985 ; Hale et al., 1988 ; Hoffman et al., 1988 ; Broun et al., 1990 ; Gyorffy et Chan, 1992)). Une exposition à 2 mg Zn.kg-1.j-1 sous forme de sulfate a également induit une anémie (Hoffman et al., 1988).
Une diminution de l'hématocrite, de la ferritine sérique (p<0,05) et de l'activité de la superoxyde dismutase (SOD)[1] érythrocytaire (p<0,05) a été notée chez 18 femmes volontaires sains (âgées de 25 à 40 ans) ayant reçu 50 mg Zn.j-1 sous forme de gluconate durant 10 semaines par comparaison aux valeurs obtenues dans le même groupe de femmes avant la prise de supplément en zinc (Yadrick et al., 1989). A noter que les effets du zinc sur l’hématocrite et la ferritine sérique ont significativement été altérés dès la 6e semaine de traitement (dosages intermédiaires). Lorsque les analyses ont été réalisées pour chaque individu (différences intra-individuelles) et non entre groupes, seule la diminution de la ferritine (8,4 µg.L-1) avant et après la prise de supplément en zinc est restée significative.
Des volontaires sains (sexe masculin) ont également été supplémentés avec du gluconate de zinc à la dose de 0 ou 25 mg deux fois par semaine pendant 6 semaines ce qui correspond à une dose journalière de 0,94 mg.kg-1.j-1 (Fischer et al., 1984). Dans cette étude, une diminution de l’activité SOD érythrocytaire a été mesurée à 4 semaines, statistiquement significative (p<0,05) à 6 semaines par comparaison avec les témoins. Une autre étude a été menée chez des femmes post-ménopausées supplémentées en zinc et en cuivre pendant une période de 200 jours (Davis et al., 2000 ; Milne et al., 2001). Au cours de cette étude les sujets ont été nourris avec une nourriture équilibrée contenant 0,6 mg Cu et 3 mg de Zn par jour. Pendant les 10 premiers jours, tous les sujets ont reçu une dose de 1,4 mg Cu par et de 6 mg de Zn par jour soit au total une dose de 2 mg Cu par et 9 mg de Zn par jour. Les sujets ont alors été séparés en deux groupes : un groupe (noté groupe 1) de 12 sujets dont la nourriture de base a été supplémentée avec 0,4 mg Cu par jour (soit une dose totale de cuivre de 1,0 mg par jour) et un autre groupe (noté groupe 2) de 13 sujets dont la nourriture de base a été supplémentée avec 2,4 mg Cu par jour (soit une dose totale de cuivre de 3,0 mg par jour). Les groupes 1 et 2 n’ont pas été supplémentés en zinc au cours des 90 premiers jours mais l’ont été au cours des 90 jours suivants à raison d’une dose de 50 mg Zn par jour soit une dose totale de zinc de 53 mg par jour. La supplémentation en zinc entraine une diminution non statistiquement significative SOD érythrocytaire. L’activité glutathion peroxydase érythrocytaire est augmentée pour un faible apport en zinc et diminuée lors d’un fort apport en zinc.
Cependant, certaines études ne retrouvent pas ces effets. Ainsi, 14 patients souffrants d’ulcères ont été supplémentés avec 600 mg.kg-1.j-1 de zinc sous forme de sulfate ou de lactate pendant 4 mois (Brewer et al., 1967).
Le zinc joue un rôle dans le développement et le maintien de l'intégrité du système immunitaire. Chez les personnes de plus de 60 ans présentant souvent une déficience en zinc, l’apport de zinc contribue à restaurer les fonctions du système immunitaire, en particulier chez les sujets présentant un polymorphisme particulier de l’IL-6 (Mocchegiani et al., 2013). Cependant des doses trop élevées en zinc altèrent les réponses immunes et inflammatoires. Onze volontaires ayant ingéré du sulfate de zinc durant 6 semaines à raison de 4,3 mg Zn.kg-1.j-1 ont présenté des altérations fonctionnelles des lymphocytes et des polynucléaires sanguins (Chandra, 1984). De même, il a été observé une augmentation statistiquement significative des marqueurs plasmatiques de la lipoperoxydation et des oxydation de l’ADN chez des individus supplémentés quotidiennement avec 45 mg de zinc sous forme de gluconate de zinc pendant 8 semaines (Prasad et al., 2004).
En revanche aucun effet sur le système immunitaire (taux circulants de leucocytes et sous-populations de lymphocytes) n’a été rapportée chez 19 volontaires sains soumis à un régime supplémenté en zinc de 30 mg Zn par jour sous forme de zinc chélaté par la glycine pendant 14 semaines, suivi par un apport en cuivre de 3 mg par jour pendant 8 semaines supplémentaires (Bonham et al., 2003a, b). A noter que le groupe traité comme le groupe témoin (19 sujets également) ont reçu une dose journalière de base de 10 mg de Zn par jour dans l’alimentation. Les auteurs n’ont également pas observé d’effet du traitement sur le statut en cuivre, déterminé à partir des dosages des activités de la céruloplasmine oxydase, de la concentration sérique de céruloplasmine (protéine) et SOD (protéine) sur sang total, tous les dosages de l’étude étant réalisés à 2, 14, 16, 18 et 22 semaines.
[1] SOD érythrocytaire : enzyme anti-oxydante à cuivre-zinc qui reflète la teneur en cuivre
Voie cutanée
Nous ne disposons pas de données par voie cutanée.
Synthèse
Chez l’homme, peu d’informations sont disponibles pour la toxicité chronique par inhalation. Par voie orale, l’exposition au sulfate de zinc et à l’oxyde de zinc conduit à des nausées et vomissements. Des effets hématologiques ont également été observés (diminution de l’hématocrite, diminution de la ferritine sérique…) pour des expositions à du gluconate de zinc. Des expositions à des doses élevées de sulfate de zinc conduisent également à des effets immunitaires (altérations fonctionnelles des lymphocytes et des polynucléaires sanguins).
Chez l'animal
Inhalation
Des lésions de l'appareil respiratoire (alvéolite, emphysème, infiltration macrophagique, fibrose) ont été observées chez des cobayes après exposition au chlorure de zinc à la dose de 199 mg Zn.m-3 durant 3 semaines (Marrs et al., 1988). Treize mois après une exposition chronique (20 mois) au chlorure de zinc, les rats et les souris ayant été exposés à 121,7 mg Zn.m-3 présentaient un taux élevé de macrophages dans les poumons (Marrs et al., 1988).
Voie orale
Par voie orale, le zinc induit des effets aux niveaux gastro-intestinal et sanguin. Des hémorragies intestinales ont été observées chez des furets ayant ingéré 390 mg Zn.kg-1.j-1 sous forme d'oxyde durant 2 semaines (Straube et al., 1980). La dose de 195 mg.kg-1.j-1 est un NOAEL pour cet effet. Des souris et des rats recevant une nourriture contenant jusqu’à ’30 000 mg de sulfate de zinc.kg-1 d'aliment durant 13 semaines (dose estimée 1 107 mg Zn.kg-1 poids corporel.j-1) ont présenté des ulcérations stomacales et lésions histologiques. Aucune lésion n'a été notée à la dose de 104 mg Zn.kg-1.j-1 chez la souris et 85 mg Zn.kg-1.j-1 chez le rat (soit 3 000 mg de sulfate de zinc .kg-1 d'aliment) (Maita et al., 1981).
Une diminution des taux d'hémoglobine, de l'hématocrite, du nombre d'hématies et/ou de leucocytes a été observée après ingestion de composés du zinc chez le rat (Smith et Larson, 1946 ; Maita et al., 1981), la souris (Walters et Roe, 1965 ; Maita et al., 1981), le lapin (Bentley etand Grubb, 1991), le chien (Meurs et al., 1991 ; Robinson et al., 1991) et le furet (Straube et al., 1980).
Des lésions rénales ont également été observées après ingestion de sulfate de zinc à la dose de 1 100 mg Zn.kg-1.j-1 durant 13 semaines chez la souris (Maita et al., 1981), d'oxyde de zinc à la dose de 195 mg Zn.kg-1.j-1 durant 7 à 97 jours chez le furet (Straube et al., 1980) ou d'acétate de zinc à la dose de 191 mg Zn.kg-1.j-1 durant 3 mois chez le rat (Llobet et al., 1988a1988).
Des anomalies au niveau du pancréas (altération des îlots cellulaires, nécrose, métaplasie, fibrose, pancréatite) ont été notées après ingestion de zinc chez le rat (sulfate de zinc à 0,56 g Zn.kg-1.j-1 durant 13 semaines) (Maita et al., 1981), la souris (sulfate de zinc à 0,07 g.kg-1.j-1 durant 4-14 mois) (Aughey et al., 1977 ; ) (sulfate de zinc à 1,1 g Zn .kg-1.j-1 durant 13 semaines) (Maita et al., 1981), le chat (oxyde de zinc) (Drinker et al., 1927), le furet (oxyde de zinc à 0,39 g Zn.kg-1 durant 97 jours) (Straube et al., 1980). Une atrophie du pancréas a également été rapportée dans une étude de toxicité chronique chez le rat exposé à la plus forte dose de 500 ppm de carbonate de zinc (soit 17,6 et 19,9 mg Zn.kg-1.j-1 respectivement chez les mâles et les femelles) avec des taux d’incidence de 13/48 chez les mâles (p<0,01) (3/49 groupe témoin) et 10/19 chez les femelles (p<0,05) (2/50 groupe témoin) (NTP, 2019).
Très peu d’études ont cherché à évaluer les effets du zinc sur le système nerveux. Une étude chez la souris exposée en post-natal à une dose de 0,5 mg.Zn.kg-1.j-1 sous forme d’acétate de zinc pendant 28 jours ne présente pas d’altération de la formation de la mémoire mais une diminution graduelle de la capacité d’apprentissage tout au long de l’étude (Oliveira et al., 2001).
Voie cutanée
Nous ne disposons pas de données par cette voie.
Synthèse
Chez l’animal, lors d’exposition par inhalation, les altérations sont essentiellement pulmonaires (alvéolite, emphysème, infiltration macrophagique, fibrose). Les principaux effets d’une exposition au zinc par voie orale sont des effets gastro-intestinaux (hémorragies intestinales, ulcérations stomacales) et sanguin (diminution des taux d'hémoglobine, de l'hématocrite, du nombre d'hématies et/ou de leucocytes). Des lésions rénales et des anomalies du pancréas (non néoplasiques) sont également rapportées.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | plusieurs dérivés : Non classé | 2004 |
| US EPA | Zinc et dérivés : Classe D: Informations inadéquates pour évaluer le potentiel cancérogène | 1991 |
| IARC | non évalué |
Chez l'homme
Inhalation
Deux études réalisées en milieu professionnel et correspondant à des expositions par inhalation, n'ont pas montré d'augmentation significative de l'incidence des cancers en relation avec l'exposition au zinc.
Une étude de cohorte sur 4 802 travailleurs employés entre 1940 et 1975 dans 9 raffineries de zinc et de cuivre a montré un taux de mortalité légèrement réduit chez les 1 247 travailleurs exposés au zinc seul (978) ou en combinaison avec le cuivre (269). Aucun lien n'a pu être établi entre la mortalité par cancer et l'exposition au zinc (Logue et al., 1982).
Neuberger et Hollowell, 1982 ont étudié la relation entre un excès de mortalité par cancer pulmonaire et le fait de résider dans une zone d'exploitation minière du fer et du zinc. Les taux de mortalité corrigés ont été comparés aux taux nationaux. L'analyse a montré que la mortalité par cancer pulmonaire était élevée dans la région mais aucune association n'a pu être établie avec l'exposition à des niveaux environnementaux en fer ou zinc.
Voie orale
Dans une étude portant sur l’occurrence du cancer de la prostate au sein d’une cohorte de 46 974 hommes aux Etats Unis suivis entre 1986 et 2000, 2 901 cas de cancers de la prostate ont été identifiés dont 434 à un stade avancé (Leitzmann et al., 2003). Il a été montré que les hommes supplémentés en zinc à des doses quotidiennes supérieures à 100 mg, présentaient une probabilité supérieure d’avoir un cancer à un stade avancé (RR de 2,37 [1,42 – 3,95]), avec néanmoins un lien possible avec le calcium qui ne peut être écarté. A l’inverse, une baisse significative du zinc plasmatique (6,57 ± 3,3 µg.L-1) a été rapportée chez les individus qui développent un cancer cutané de la tête et du cou par comparaison à un groupe témoin (Mellow et al., 1983).
Une méta-analyse basée sur l’examen de 19 études épidémiologiques n’a pas pu établir d’associations entre les apports en zinc et les cancers de l’estomac, de l’œsophage ou le cancer colorectal (Li et al., 2014).
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Chez l’homme, l’exposition par inhalation n’affecte pas l’incidence des cancers, les effets par voie orale restent très controversés.
Chez l'animal
Inhalation
Des souris femelles, exposées à un mélange de vapeurs d'oxyde de zinc et d'hexachloroéthane à la dose de 121,7 mg Zn.m-3 durant 20 semaines, ont présenté une augmentation significative de l'incidence des carcinomes alvéolaires (30 % contre 8 % chez les témoins), 13 semaines après la fin de l'exposition. Aucune augmentation n'a été notée chez les souris exposées à 1 - 1,3 - 12,8 mg Zn.m-3. En revanche, des rats et des cobayes exposés aux différentes doses en co-exposition n'ont pas développé de cancers particuliers (Marrs et al., 1988). Un certain nombre de facteurs limite la portée de cette étude, notamment la présence de plusieurs composés dans la fumée pouvant avoir un potentiel cancérigène (comme le tétrachlorure de carbone potentiellement également présent), l'utilisation d'animaux femelles uniquement et la faible durée de l'exposition (20 semaines) (ATSDR, 1994).
Voie orale
Par voie orale, l'incidence de diverses tumeurs (hépatome, lymphome, adénome pulmonaire, hyperplasie de l'épithélium pulmonaire) n'a pas été augmentée chez des souris exposées à 1 000 ou 5 000 ppm de sulfate de zinc dans l'eau de boisson (environ 200 et 1 000 mg Zn.kg-1.j-1) durant 45-53 semaines (Walters et Roe, 1965). Cette étude est cependant limitée en l'absence de précisions concernant le sexe et l'âge des animaux, le nombre total d'animaux par lot, la pureté du sulfate de zinc utilisé. Les taux de survie dans les différents lots (y compris les témoins) étaient faibles, ce qui diminue la sensibilité de l'étude.
Aucun effet néoplasique n’est rapporté dans une étude où des rats Sprague Dawley mâles et femelles ont été exposés dans l’alimentation au carbonate de zinc pendant 2 ans à des doses de 3,5 – 7 ppm (régime carencé soit 0,1 et 0,3 mg Zn.kg-1.j-1 ), 38 ppm (groupe témoin correspondant 1,4 mg zinc.kg-1.j-1), 250 – 500 ppm (excès de zinc, soit 8,7 et 17,6 mg Zn.kg-1.j-1 ) (NTP, 2019). Seule une augmentation non significative de l’incidence des adénomes du pancréas a été rapportée chez les mâles carencés en zinc (21/50 et 19/48), versus 11/49 dans le lot témoin.
Le taux de croissance et la fréquence des tumeurs transplantées ou induites chimiquement sont toutefois influencés par la quantité de zinc apportée dans l'alimentation. Des études chez les rongeurs suggèrent que la croissance tumorale est retardée en cas de déficience en zinc et qu'une quantité importante de zinc ingérée peut agir comme promoteur. Ces effets peuvent s'expliquer par le fait que le zinc est nécessaire pour la synthèse d'ADN et la réplication cellulaire (Deknudt et Gerber, 1979 ; Leonard et al., 1986).
Voie cutanée
Aucune donnée n’a été identifiée.
Synthèse
Chez l’animal, une augmentation de l’incidence des carcinomes alvéolaires a été observée chez la souris lors de l’exposition par inhalation à l’oxyde de zinc en co-exposition (fumée). Aucun effet cancérogène n’a été montré chez les animaux exposés au zinc par voie orale.
Effets génotoxiques
Généralités
Les études de génotoxicité menées au moyen d’une batterie de tests n’ont pas mis en évidence d’effet mutagène. En revanche, un faible pouvoir génotoxique a été détecté lors de l’exposition au zinc (ATSDR, 2005).
Chez l'homme
Toutes voies
A notre connaissance, il n’existe pas de donnée disponible chez l’homme.
Chez l'animal
Voie orale
Si certaines études n’ont pas observé d’effet mutagène par le test de dominance léthale chez la souris (Vilkina et al., 1978), d’autres rapportent des effets génotoxiques lors d’études in vivo.
Ainsi des aberrations chromosomiques ont été observées sur cellule de moelle osseuse après une exposition in vivo au zinc (Vilkina et al., 1978). Ces effets sont observés chez des rats exposés à 14,8 mg.kg-1.j-1 de zinc administré sous forme de chlorate de zinc via l’eau de boisson (Kowalska-Wochna et al., 1988), et chez les souris exposées à l’oxyde de zinc par inhalation (Voroshilin et al., 1978). Des aberrations chromosomiques induites par le zinc sont observées dans la moelle osseuse chez les souris soumise à un faible taux de calcium dans la nourriture (Deknudt et Gerber, 1979). Le calcium est probablement déplacé par le zinc dans des conditions de déplétion en calcium, ce qui conduit à des cassures de chromosomes et/ou des interférences avec les processus de réparation (Deknudt et Gerber, 1979).
Des cassures simples brins, mesurées par le test des Comètes, sont également induites chez la souris lors d’expositions au zinc (Banu et al., 2001). Une augmentation de l’incidence des échanges de chromatides sœurs a été observée dans les cellules de moelle osseuse chez les rats exposés à 17,5 mg.kg-1.j-1 sous forme de chlorate dans les eaux de boisson (Kowalska-Wochna et al., 1988).
Chez les rats exposés jusqu’à 12 mois à des doses de 0,1 à 19,9 mg Zn.kg-1.j-1 administré sous forme de chlorate de zinc via l’alimentation et balayant un manque ou excès de zinc, les résultats aux tests des micronoyaux réalisés sur érythrocytes se sont révélés négatifs (NTP, 2019). En revanche, des lésions à l’ADN ont été rapportés (tests des comètes) à la fois sur les leucocytes chez les mâles et femelles des lots carencés en zinc (9 et 12 mois), ainsi que dans le lot ayant reçu la plus forte dose de zinc (12 mois), et sur les cellules épithéliales aussi bien chez les rats carencés ou les plus fortement exposés au zinc (NTP, 2019).
In vitro
Organismes eucaryotes
Des expositions au sulfate de zinc ou au chlorure de zinc n’induisent pas d’augmentation de la fréquence des mutations chez les bactéries ou les cellules de mammifères en culture (Amacher et Paillet, 1980 ; Gocke et al., 1981 ; Marzin et Phi, 1985 ; Nishioka, 1975 ; Thompson et al., 1989 ; Venitt et Levy, 1974 ; Wong, 1988).
Synthèse
Le zinc et ses dérivés ne sont pas mutagènes, des études menées in vivo semblent montrer un faible pouvoir génotoxique qui ne suffit pas pour justifier une classification par l’Union Européenne.
Effets sur la reproduction
Chez l'homme
Toutes voies
Aucune donnée n'est disponible concernant la toxicité du zinc inhalé ou administré par voie orale sur la reproduction et le développement humain (ATSDR, 1994).
Chez l'animal
Inhalation
Peu de données sont disponibles concernant les effets du zinc inhalé sur la reproduction chez l'animal. L'exposition de rats, souris et cobayes à des vapeurs de chlorure de zinc (et à d'autres composés) durant 20 semaines à des doses allant jusqu'à 121,7 mg Zn.m-3, n'a pas induit d'altérations au niveau des glandes mammaires, des ovaires, des trompes de Fallope et de l'utérus (Marrs et al., 1988).
Voie orale
Par voie orale, les effets d'un excès de zinc sur la reproduction sont bien documentés.
Aucun effet n'a été noté sur la durée de la gestation et la taille des portées chez des visons ayant ingéré une dose moyenne de 20,8 mg Zn.kg-1.j-1 sous forme de sulfate durant environ 25 semaines (Bleavins et al., 1983). Aucune altération histologique des testicules et des ovaires n'a été relevée chez des souris ayant reçu 1 100 mg Zn.kg-1.j-1 sous forme sulfate durant 13 semaines (Maita et al., 1981). Des rats mâles et femelles supplémentés en carbonate de zinc à raison de 50 mg Zn.kg-1.j-1 dans la nourriture n'ont pas présenté de troubles de la reproduction sur plusieurs générations.
En revanche, un pourcentage plus élevé d'embryons mort-nés a été décelé chez des rats ayant ingéré 250 mg Zn.kg-1.j-1, sous forme de carbonate, durant 14-17 semaines et aucune reproduction ne s'est produite à la dose de 500 mg Zn.kg-1.j-1 (Sutton et Nelson, 1937). Dans une étude plus récente, seuls les rats mâles les plus carencés en carbonate de zinc (3,5 ppm soit 0,1 mg Zn.kg-1.j-1) ont développé une atrophie bilatérale de l’épithélium germinal testiculaire (10/50, p<0,05), les incidences étant de 0/50 (groupe témoin avec 1,4 mg Zn.kg-1.j-1) ou de 0/50 et 1/50 dans les groupes exposés à un excès de zinc (8,7 et 17,6 mg Zn.kg-1.j-1) (NTP, 2019).
Une altération de la structure quaternaire de la chromatine des spermatozoïdes a été notée chez des rats ayant ingéré du chlorure de zinc en excès à la dose de 227 mg Zn.kg-1.j-1 durant 8 semaines (Evenson et al., 1993). Des rats ayant reçu 200 mg Zn.kg-1.j-1 sous forme de sulfate durant les 18 premiers jours de la gestation ont présenté des résorptions accrues, alors que la même dose administrée durant 21 jours avant l'accouplement n'a induit aucun effet sur les fonctions de reproduction (Pal et Pal, 1987).
Dans une autre étude, des rats Sprague Dawley, mâles et des femelles ,ont été exposés par gavage à des doses de 0- 3,6 – 7,2 – 14,4 mg Zn.kg-1.j-1 sous forme de chlorure de zinc (Khan et al., 2001 ; Johson et al., 2011). Les animaux ont été exposés 7 jours par semaine pendant 77 jours avant la période d’accouplement, pendant la période d’accouplement pour les mâles et les femelles, pendant la période de gestation et de lactation pour les femelles. Il n’y a pas eu de modification significative du poids des rats exposés avant la naissance, mais une diminution statistiquement significative du poids des mères aux doses moyenne ou élevée est rapportée après la parturition. Ces expositions ont induit une diminution statistiquement significative de l’indice de fertilité chez tous les groupes sans lien avec la dose. Dans tous les groupes exposés au zinc, une diminution du nombre de petits vivants par portée et du poids des petits à 21 jours a également été rapportée.
De la même manière, une exposition jusqu’à 8 mg Zn.kg-1.j-1 pendant 14 jours n’a pas révélé d’anomalie du sperme chez des rats Wistar (Piao et al., 2003).
Synthèse
Chez l’animal, peu de données sont disponibles pour les effets du zinc sur la reproduction. Un excès de zinc dans l’alimentation avant et/ou durant la gestation serait à l’origine d’une augmentation des résorptions fœtales et d’une diminution de l’indice de fertilité, avec une atteinte de la chromatine des spermatozoïdes.
Effets sur le développement
Chez l'homme
Inhalation
Aucune donnée n'est disponible concernant la toxicité du zinc inhalé sur le développement humain (ATSDR, 1994).
Voie orale
Par voie orale, des femmes enceintes supplémentées en sulfate de zinc à la dose de 0,3 mg Zn.kg-1.j-1 durant les six derniers mois de grossesse, n'ont pas présenté de troubles de la reproduction : gain de poids et pression sanguine normales, pas d'augmentation des hémorragies ou des infections après l'accouchement (Mahomed et al., 1989).
Le zinc est nécessaire au développement fœtal. Une carence en zinc peut-être à l'origine de troubles chez les embryons. D'autres études n'ont pas mis en évidence d'effets sur le développement fœtal après consommation, durant les six derniers mois de grossesse, de sulfate de zinc (Mahomed et al., 1989) ou de citrate de zinc (Simmer et al., 1991) à la dose de 0,3 mg Zn.kg-1, ou encore d'aspartate de zinc à la dose de 0,06 mg Zn.kg-1.j-1 (Kynast et Saling, 1986). Dans une plus récente méta-analyse, les effets bénéfiques de l’apport en zinc de 5 à 50 mg.j-1 au cours de la grossesse sur le risque d’accouchements prématurés (RR =0,86 IC95% [0,75 -0,99]) seraient selon les auteurs liés à une diminution des infections maternelles (première cause d’accouchement prématuré) (Chaffee et al., 2012).
Du lait maternisé supplémenté en zinc (concentration finale de 5,8 mg Zn.L-1 sous forme de sulfate de zinc) a été donné à des bébés (19 garçons et 15 filles) de 4 à 6 jours sur une période de 6 mois, le groupe témoin (18 garçons et 16 filles) ayant reçu du lait maternisé non supplémenté en zinc avec une concentration de 1,8 mg Zn.L-1) (Walravens et Hambidge, 1976). A 3 mois, les auteurs ont observé une augmentation significative de la concentration plasmatique de zinc chez les bébés (filles p<0,025 et garçons p<0,01) du groupe traité par comparaison au groupe témoin, de même qu’à 6 mois chez les garçons uniquement (p<0,025). Dans le groupe traité, les petits garçons de 6 mois étaient significativement plus grands (2,1 cm p<0,025) et plus gros (535 g p<0,05) que ceux du groupe témoin. Aucun effet du traitement sur la croissance staturo-pondérale n’a été observé chez les petites filles, ni sur les paramètres sanguins (hématocrite, protéines totales, transaminases, cholestérol, etc) aussi bien chez les filles que chez les garçons. En revanche les troubles gastro-intestinaux (constipations, diarrhées) ont été significativement moins fréquents (p<0,05) chez les enfants nourris au lait supplémenté au zinc (5/34) que dans le groupe témoin (13/34). L’apport en zinc (lait maternisé) n’a pas été accompagné de signes de toxicité.
Synthèse
Chez l’homme, le zinc est nécessaire au développement fœtal. Les effets de l’apport en zinc sur le développement de l’embryon et/ou du fœtus ne sont pas suffisamment documentés.
Chez l'animal
Inhalation
Aucune étude ne s'est intéressée aux effets du zinc inhalé sur le développement (ATSDR, 1994).
Voie orale
Un excès de zinc dans l'alimentation avant et/ou durant la gestation est à l'origine d'une augmentation des résorptions fœtales, d'une diminution du poids des fœtus, d'une altération des concentrations tissulaires en fer et cuivre et d'une diminution de la croissance des jeunes. Des rats soumis à une alimentation supplémentée en oxyde de zinc durant 21 jours à la dose de 200 mg ZnO.kg-1.j-1 avant l'accouplement et durant les 15 premiers jours de gestation ont présenté 100 % de résorptions fœtales. La dose de 100 mg ZnO.kg-1.j-1 est un NOAEL pour cet effet. Lorsque les 200 mg ZnO.kg-1.j-1 ont été administrés durant la gestation uniquement, le pourcentage de résorptions n'était que de 4 à 29 % (Schlicker et Cox, 1968). En revanche, aucune résorption, malformation ou retard de croissance n'ont été observés chez les fœtus de rats femelles ayant ingéré 250 mg Zn.kg-1.j-1 durant 53 jours avant l'accouplement et durant la gestation (Kinnamon, 1963). De façon similaire, des fœtus de rats dont les mères avaient été supplémentées en carbonate de zinc à la dose de 25 mg Zn.kg-1.j-1 durant la gestation n'ont présenté aucune malformation ou altération de croissance (Uriu-Hare et al., 1989).
L'administration de 200 mg Zn.kg-1.j-1 sous forme d'oxyde durant la gestation induit une diminution de croissance et une baisse des concentrations tissulaires en cuivre et fer chez les fœtus de rats (Schlicker et Cox, 1968 ; Cox et al., 1969). Bien que les femelles exposées à 100 et 200 mg Zn.kg-1.j-1 aient des teneurs tissulaires élevées en zinc, seuls les fœtus issus des mères exposées à la plus forte dose présentaient également des niveaux en zinc plus élevés. Ceci laisse penser que le placenta a agi comme barrière pour le zinc au niveau le plus faible.
D'autres études suggèrent que l'exposition à de forts niveaux en zinc dans l'alimentation entraîne une diminution du poids des fœtus, une alopécie, une diminution de l'hématocrite et une déficience en cuivre chez les descendants. Ainsi, des souris de deuxième génération exposées au carbonate de zinc durant la gestation et la lactation (mères exposées à 260 mg Zn.kg-1.j-1), puis durant 8 semaines après la naissance, ont présenté une diminution de poids corporel, une alopécie et des signes de carence en cuivre (diminution de l'hématocrite, perte de pigmentation des poils) (Mulhern et al., 1986).
Chez les petits exposés in utero, puis pendant l’allaitement à des doses maternelles de 0- 3,6 – 7,2 – 14,4 mg Zn.kg-1.j-1 sous forme de chlorure de zinc, une augmentation de la distance anogénitale des petits mâles significative uniquement dans le groupe le plus exposé (Johnson et al., 2011). Une précocité des marqueurs du développement post-natal (ouverture des yeux, éruption des incisives) est rapportée par les auteurs à toutes les doses chez les petites femelles et uniquement à la plus forte dose chez les petits mâles (p<0,05). En revanche, le traitement n’a pas eu d’effet significatif sur le poids des petits avant le sevrage.
Synthèse
Chez l’animal, les effets de l’exposition in utero au zinc se limitent à une diminution du poids des fœtus, une altération des concentrations tissulaires en fer et cuivre et une diminution de la croissance des jeunes à fortes doses. A de plus faibles doses, il pourrait accélérer les marqueurs du développement post-natal (ouverture des yeux, éruption des incisives).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
La disponibilité d’une VTR élaborée par l'ATSDR, l’OEHHA, l'OMS, le RIVM, Santé Canada et l'US EPA est systématiquement vérifiée. Le cas échéant, il s’y ajoute les valeurs toxicologiques de référence élaborées par les institutions françaises et/ou d’autres organismes de référence.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition sub-chronique par voie orale
L'ATSDR propose un MRL de 0,3 mg Zn.kg-1.j-1 pour une exposition sub-chronique ou chronique au zinc et à ses composés par voie orale (ATSDR, 2005).
Cette valeur a été établie en prenant en compte les effets sanguins (diminution de l'hématocrite, de la ferritine sanguine et de l'activité de la SOD érythrocytaire observés chez 18 femmes supplémentées en gluconate de zinc à raison de 50 mg Zn.j-1, correspondant à 0,83 mg.kg-1.j-1 durant 10 semaines (pour un poids moyen de 60 kg) (Yadrick et al., 1989). Une diminution statistiquement significative de la SOD érythrocytaire et des niveaux de ferritine sanguine sont mesurés à 0,83 mg.kg-1.j-1. L’ATSDR juge que ces effets sont sub-cliniques, raison pour laquelle ils ne sont pas considérés comme néfastes. De ce fait, un NOAEL de 0,83 mg.kg-1.j-1 a été défini pour cette étude.
Facteurs d'incertitude : un facteur d’incertitude de 3 a été appliqué pour tenir compte de la variabilité au sein de la population humaine.
Calcul : 0,83 mg.kg-1.j-1x 1/3 = 0,28 mg.kg-1.j-1 arrondi à 0,3 mg.kg-1.j-1
Indice de confiance : Cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale
L'US EPA (IRIS) propose une RfD de 0,3 mg.kg-1.j-1 pour une exposition chronique au zinc et à ses composés par voie orale (US EPA (IRIS), 2005).
Cette valeur a été établie en prenant en compte les effets sanguins (diminution de l'activité de la SOD érythrocytaire) observés chez des femmes supplémentées en gluconate de zinc à raison de 50 mg Zn.j-1, soit 0,99 mg.kg-1.j-1, durant 10 semaines (calculé pour un poids moyen de 50 kg) (Yadrick et al., 1989). Fischer et al., 1984 ont exposé des hommes volontaires sains à raison de 0 et 25 mg de gluconate de zinc deux fois par jour pendant 6 semaines. Davis et al., 2000 et Milne et al., 2001 ont exposé des femmes ménopausées à différentes concentrations de zinc et de cuivre dans l’alimentation. L’ensemble des résultats est concordant et les LOAEL pour la diminution de l'activité de la SOD érythrocytaire sont de 0,81 mg.kg-1.j-1(Davis et al., 2000 ; Milne et al., 2001) 0,94 mg.kg-1.j-1 (Fischer et al., 1984) et 0,99 mg.kg-1.j-1 (Yadrick et al., 1989). Comme les méthodologies des 4 études et les résultats sont similaires un LOAEL moyen a été calculé : 0,81 mg.kg-1.j-1 + 0,94 mg.kg-1.j-1 + 0,99 mg.kg-1.j-1 x 1/3 = 2,74 mg.kg-1.j-1 x 1/3 = 0,91 mg.kg-1.j-1
Facteurs d'incertitude : Un facteur intra-espèce de 3 a été utilisé pour tenir compte des variations de susceptibilité au sein de la population générale. Les facteurs d’incertitude pour l’utilisation d’un LOAEL ou d’une exposition subchronique à chronique n’ont pas été jugés nécessaires notamment du fait que le zinc est un élément essentiel et que l’effet critique retenu est un indicateur biologique sensible pour un niveau d’effet faible.
Calcul : 0,91 mg.kg-1.j-1x 1/3 = 0,303 mg.kg-1.j-1 arrondi à 0,3 mg.kg-1.j-1
Indice de confiance : L’US EPA attribue un indice moyen à élevé pour l’étude, élevé pour la base de données et moyen à élevé pour la RfD.
Le RIVM propose une TDI de 0,5 mg.kg-1.j-1pour une exposition chronique au zinc par voie orale (Baars et al., 2001).
Cette valeur est issue d'un LOAEL de 1 mg.kg-1.j-1 défini par l'ATSDR en 1994, pour les effets sanguins chez l'homme (diminution de l'hématocrite, de la ferritine sanguine et de l'activité de la SOD érythrocytaire). Des femmes supplémentées en gluconate de zinc à raison de 50 mg Zn.j-1 (0,83 mg.kg-1.j-1 sur la base d’un poids moyen de 60 kg durant 10 semaines ont été étudiés (Yadrick et al., 1989). Un LOAEL de 1 mg.kg-1.j-1 a été défini en ajoutant cette dose à l'estimation de l'apport journalier en zinc chez les femmes (0,16 mg.kg-1.j-1) établi par la FDA (Pennington et al., 1986).
Facteur d’incertitude : un facteur de 2 a été appliqué pour tenir compte de l’utilisation d’un LOAEL.
Calcul : 1 mg.kg-1.j-1 x 1/2 = 0,5 mg.kg-1.j-1.
Indice de confiance : Selon le RIVM, la fiabilité de cette valeur est élevée.
L’OMS, dans son guide pour les eaux de boisson, recommande une PMTDI de 1 mg Zn.kg-1.j-1 pour une exposition chronique au zinc par voie orale (OMS, 2022).
Cette valeur a été proposée en 1982 par le JEFCA et reste valable en 2022. Elle a été établie à partir d’une étude chez l’homme au cours de laquelle 14 patients souffrants de d’ulcères ont été supplémentés avec 600 mg.j-1 de zinc sous forme de sulfate ou de lactate pendant 4 mois (Brewer et al., 1967). Un suivi des individus n’a pas révélé d’effet toxique.
Les détails des calculs n’ont pas été précisés ni le choix des facteurs d’incertitude.
L’EFSA, dans son guide pour les vitamines et minéraux, recommande une AMT de 0,42 mg Zn.kg-1.j-1 pour une exposition chronique au zinc par voie orale (EFSA, 2006).
L’EFSA a construit cette valeur à partir de l’absence d’effets néfastes observés chez des volontaires sains exposés à des suppléments en zinc (Bonham et al., 2003a, 2003b ; Milne et al., 2001 ; Davis et al., 2000). Ces études ont été réalisées sur respectivement 25 et 21 femmes post-ménopausées dans les études de Davis (2000) et Milne (2001) et 19 jeunes hommes dans l’étude de Bonham (2002a, 2002b). Les données métaboliques ont permis de déterminer rigoureusement l’apport en zinc et en cuivre dans les études de Davis et Milne, avec une dose journalière de 53 mg Zn.kg.j-1. Dans l’étude de Bonham, une dose journalière totale de 40 mg Zn.kg.j-1 a été retenue pour prendre en compte à la fois la dose de supplément en zinc (30 mg Zn.kg.j-1) et l’apport journalier dans la nourriture estimé à 10 mg Zn.kg.j-1. Ces études ont collectivement permis d’établir un NOAEL de 50 mg Zn.j-1 en lien avec l’absence d’effet sur le statut en cuivre déterminé à partir du dosage de plusieurs marqueurs sanguins (taux circulants de leucocytes et sous-populations de lymphocytes).
Facteur d’incertitude : un facteur de 2 a été appliqué pour tenir compte du faible nombre de sujets et des expositions relativement courtes dans ces études, tout en soulignant la rigueur du contrôle des marqueurs métaboliques.
Calcul : 50 mg.j-1 x 1/2 x 1/60 kg = 0,416 arrondi à 0,42 mg.kg-1.j-1
Santé Canada propose une DJT pour une exposition chronique par voie orale (2021) (DJT où LLS : Limite Supérieure de Sécurité (de l’anglais Upper Intake Level))
- de 0,57 mg.kg-1.j-1 chez l’adulte (> à 20 ans),
- de 0,49 mg.kg-1.j-1 pour les nouveau-nés de 0 à 5 mois,
- de 0,48 mg.kg-1.j-1 pour les enfants de 6 mois à 4 ans,
- de 0,51 mg.kg-1.j-1 pour les enfants de 5 à 11 ans et
- de 0,54 mg.kg-1.j-1 pour les jeunes de 12 à 19 ans (Santé Canada, 2021).
Ces valeurs ont été construites sur la base de deux études épidémiologiques prospectives réalisées pour la première chez des femmes adultes (Yadrick et al., 1989), et sur des nourrissons (0 à 6 mois) pour la seconde (Walravens et Hambidge, 1976).
De la première étude, un LOAEL de 60 mg.j-1 (supplément de 50 mg.j-1, plus 10 mg.j-1 correspondant à une estimation de l’apport journalier) a été retenu sur la base des effets du traitement sur le statut en cuivre indirectement évalué à partir du dosage de la SOD érythrocytaire. Un facteur d’incertitude de 1,5 a été appliqué pour dériver la DJT chez l’adulte.
A partir de la seconde étude, un NOAEL de 5,8 mg Zn.L-1 dans le lait maternisé a été retenu sur la base d’une absence d’effet sur la santé de nouveau-nés nourris pendant 6 mois. Ce NOAEL a été ajusté pour tenir compte de la consommation moyenne estimée de lait maternel humain de 0,78 L par jour, soit un NOAELadj de 4,5 mg.j-1 arrondi à 4 mg.j-1. Des ajustements de la DJT chez le nourrisson ont été réalisés en fonction du poids corporel relatif pour dériver les valeurs chez les enfants et les adolescents. Les calculs ne sont pas détaillés.
Facteurs d’incertitude : un facteur d’incertitude de 1,5 pour la variabilité intra-espèce et l’extrapolation de LOAEL à NOAEL a été appliqué pour l’étude réalisée chez les femmes adultes.
Concernant l’étude réalisée chez les nouveau-nés, un facteur d’ajustement de 1 a été retenu en raison du manque de preuve que l’ingestion de préparations à des concentrations de 5,8 mg de zinc par litre entraîne une toxicité pour les nourrissons.
Calcul : 60 mg.j-1 x 1/1,5 x 1/70 kg = 0,57 mg.kg-1.j-1.
Indice de confiance : aucun indice n’a été établi par l’organisme.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effets à seuil - Exposition sub-chronique par voie orale
Une valeur de l’ATSDR de 3.10-1 mg.kg-1.j-1 est retenue pour une exposition sub-chronique par voie orale pour le zinc et ses composés (ATSDR, 2005)
Cette VTR est établie à partir d’une étude chez des femmes supplémentées en gluconate de zinc pendant 10 semaines (Yadrick et al., 1989). Il s’agit d’une étude de bonne qualité mais dont la durée d’exposition reste limitée. Les seuls effets mesurés, diminution statistiquement significative de la SOD érythrocytaire et des niveaux de ferritine sanguine, ne sont pas considérés comme néfastes ne permettent pas d’être retenus. Le calcul de la VTR à partir du NOAEL est considéré comme cohérent et le choix des facteurs d’incertitude est pertinent. L’INERIS propose de retenir cette valeur de l’ATSDR.
Indice de confiance : faible en raison de l’utilisation d’un NOAEL au lieu d’un LOAEL
Effets à seuil - Exposition chronique par voie orale
Une valeur de l’US EPA de 0,3 mg.kg-1.j-1 est retenue pour une exposition chronique par voie orale pour le zinc et ses composés (US EPA, 2005)
Cinq VTR sont proposées par les organismes (US EPA (IRIS), 2005 ; le RIVM ; l’OMS eau de boisson, 2017 ; l’EFSA, 2006 ; Santé Canada, 2021) pour le zinc par voie orale.
La valeur de l’OMS est une valeur ancienne qui a été reprise en 2017 même si elle reste provisoire alors qu’elle a établie en 1982. Les éléments relatifs à sa construction ne sont pas détaillés et l’étude clé n’est pas accessible, il est donc difficile de porter un jugement sur leur pertinence.
Les valeurs du RIVM et de Santé Canada sont basées sur une même étude épidémiologique (Yadrick et al., 1989) de bonne qualité, il s’agit de la même étude que celle retenue par l’ATSDR pour sa VTR sub-chronique. L’effet critique retenu est la diminution de la SOD érythrocytaire cet effet est représentatif du zinc. La valeur proposée par le RIVM est basée sur une ancienne valeur de l’ATSDR. A partir de cette étude, le RIVM et Santé Canada proposent respectivement un LOAEL de 1 mg.kg-1.j-1 et 0,6 mg.kg-1.j-1 alors que l’ATSDR retient en 2005 un NOAEL de 0,83 mg.kg-1.j-1 pour la même étude dans le cadre d’une VTR sub-chronique. Les effets étant faibles, le choix de l’ATSDR de retenir un NOAEL ayant été argumenté est recevable de même que celui de l’US EPA et du RIVM qui préfèrent retenir un LOAEL.
La valeur proposée par le RIVM prend en compte un facteur d’incertitude de 2, valeur non conventionnelle qui n’est pas justifiée par l’organisme. De même le facteur d’incertitude de 1,5 appliqué par Santé Canada est faible au regard de l’utilisation d’un LOAEL.
L’US EPA et l’EFSA se sont appuyées sur les résultats de plusieurs études pour déterminer un LOAEL moyen comme point de départ dans le calcul de la VTR. L’US EPA retient trois études chez le volontaire sain (Yadrick et al., 1989 ; Fischer et al., 1984 ; Davis et al., 2000 et Milne et al., 2001) avec des protocoles d’exposition assez proches et un effet critique similaire diminution de l'activité de la SOD érythrocytaire. L’EFSA a retenu un jeu d’étude différent (Bonham et al., 2003a, 2003b ; Milne et al., 2001 ; Davis et al., 2000). Ces études sont plus récentes et mieux contrôlées en termes d’exposition à la fois en zinc, mais aussi en cuivre, élément déterminant dans les effets du zinc. L’effet critique retenu par l’EFSA pour la construction de sa valeur est le taux de leucocytes circulants et sous-populations de lymphocytes. Cet effet est bien corrélé avec les niveaux d’exposition en zinc mais probablement moins représentatif des effets néfastes que la SOD érythrocytaire.
La valeur de l’US EPA retient un facteur d’incertitude de 3 qui est cohérent par rapport à l’étude source. L’étude source est de bonne qualité et la construction de la VTR est solide. Toutefois, compte tenu de la durée de l’étude source, l’ATSDR propose une valeur pour une exposition sub-chronique (cf paragraphe précédent) alors que l’US EPA propose une valeur pour une exposition chronique. Même si l’EFSA aurait dû appliquer un facteur d’incertitude supplémentaire pour prendre en compte la durée de l’étude source, du fait que le zinc est un élément essentiel, il nous parait raisonnable de considérer que la valeur de l’EFSA peut être retenue pour des expositions chroniques par voie orale 4,2.10-1 mg.kg-1.j-1
Indice de confiance : faible en raison de la non prise en compte suffisante de la durée des études sources
Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC.
Dangers
Description
Ecotoxicité aquatique
Paramètres d'écotoxicité aiguë
Etant donné le nombre élevé de données d’écotoxicité disponibles, seuls les essais chroniques sont retenus
Paramètres d'écotoxicité chronique
Les données présentées ici sont extraites de l’évaluation des risques pour l’environnement du zinc en cours d’élaboration dans le cadre du règlement (CEE) 793/93 sur les substances existantes. Ces données ont été sélectionnées et validées sur la base des paramètres toxicologiques, des caractéristiques du milieu et des conditions d’essai. Cette évaluation n’étant pas finalisée il se peut que des valeurs soient modifiées dans les mois à venir. Par soucis de cohérence au niveau européen nous avons cependant souhaité présenter ces données.
Les concentrations reportées sont des concentrations “ ajoutées dans le milieu d’essai ”. Il s’agit généralement des concentrations nominales. Lorsque les concentrations mesurées ainsi que des indications sur la concentration “ naturelle ” dans le milieu d’essai étaient disponible, cette dernière a été retranchée de la concentration mesurée.
Les valeurs en gras dans les tableaux ci-dessous sont les valeurs utilisées pour l’estimation de la PNEC.
Toxicité aquatique chronique envers les espèces d’eau douce
|
Espèce |
Substance testée |
Critère d’effet 1 |
Valeur (µg/L) |
Référence |
|
|
Algues rdrw15 |
Chroococcus paris |
ZnSO4 |
NOECg (10 j) |
200 |
Les et Walker, 1984 |
|
Selenastrum capricornutum |
Zn poudre |
NOECg (3 j) |
50 |
Van Woensel, 1994 |
|
|
|
ZnO |
NOECg (3 j) |
24 |
Van Ginneken, 1994 |
|
|
|
|
NOECg |
35 |
Moyenne géométrique |
|
|
Synechococcus |
ZnSO4 |
NOECg (14 j) |
390 |
Mohanty, 1989 |
|
|
Cladophora glomerata |
|
NOECg (3 j) |
60 |
Whitton, 1967 |
|
|
Porifères |
Ephydatia fluviatilis |
ZnCl2 |
NOECd (7 j) |
43 |
Van de Vyver, 2001 |
|
Ephydatia muelleri |
ZnCl2 |
NOECd (7 j) |
43 |
Van de Vyver, 2001 |
|
|
Spongilla lacustris |
ZnCl2 |
NOECd (7 j) |
65 |
Van de Vyver, 2001 |
|
|
Enapius fragilis |
ZnCl2 |
NOECd (7 j) |
43 |
Van de Vyver, 2001 |
|
|
Mollusques rdrs |
Dreissena polymorpha |
ZnCl2 |
NOECs (10 s) |
400 |
Kraak et al., 1994 |
|
Potamopyrgus jenkinsi |
ZnCl2 |
NOECg (16 s) |
75 |
Dorgelo et al., 1995 |
|
|
Crustacés |
Ceriodaphnia dubia |
|
NOECr (1 s) |
17-50 |
Belanger et Cherry, 1990 |
|
|
ZnCl2 |
NOECr (4 j) |
14-50 |
Masters et al., 1990 |
|
|
|
ZnCl2 |
NOECr (7 j) |
50-100 |
Masters et al., 1990 |
|
|
|
|
NOECr |
33 |
Moyenne géométrique (n=13) |
|
|
Daphnia magna |
ZnCl2 |
NOECr,s(21 j) |
42-97 |
Chapman et al., 1980 |
|
|
|
ZnSO4 |
NOECr (7 s) |
25-150 |
Paulauskis et Winner, 1988 |
|
|
|
ZnCl2 |
NOECr (3 s) |
35 |
Biesinger et Christensen, 1972 |
|
|
|
ZnCl2 |
NOECr (3 s) |
74 |
Biesinger et al., 1986 |
|
|
|
ZnCl2 |
NOECr,s (3 s) |
310-420 |
Enserink et al., 1991 |
|
|
|
|
NOECr,s (3 s) |
25-100 |
Münzinger et Monicelli, 1991 |
|
|
|
|
NOECr |
78 |
Moyenne géométrique (n=13) |
|
|
Hyalella azteca |
|
NOECr,s(10 s) |
42 |
Borgmann et al., 1993 |
|
|
Insectes |
Ephoron virgo |
ZnCl2 |
NOECs (10 j) |
1 100 |
Van der Geest et al., 2001 |
|
Chironomus tentans |
ZnCl2 |
NOECs,g,e, (8 s) |
137 |
Sibley et al., 1996 |
|
|
Poissons |
Danio rerio |
ZnSO4 |
NOECh(2 s) |
180-2 900 |
Dave et al., 1987 |
|
|
|
|
660 |
Moyenne géométrique (n=9) |
|
|
Jordanella floridae |
ZnSO4 |
NOECg(14 s) |
26-75 |
Spehar, 1976 |
|
|
|
|
|
44 |
Moyenne géométrique (n=2) |
|
|
Phoxinus phoxinus |
ZnNO3 |
NOECs,g(5 m) |
50 |
Bengtsson, 1974 |
|
|
Pimephales promelas |
ZnSO4 |
NOECr(8 m) |
78 |
Benoit et Holcombe, 1978 |
|
|
Oncorhynchus mykiss |
ZnSO4 |
NOECs(2 ans) |
130 |
Sinley et al., 1974 |
|
|
|
ZnSO4 |
NOECs(25 j) |
25 |
Sinley et al., 1974 |
|
|
|
ZnCl2 |
NOECs(72 j) |
440 |
Cairns et Garton, 1982 |
|
|
|
|
|
113 |
Moyenne géométrique (n=3) |
|
|
Salvelinus fontinalis |
ZnSO4. |
NOECh(3 ans) |
530 |
Holcombe et al., 1979 |
|
1- Les NOEC reportées se réfèrent à des effets sur la survie (s), la reproduction (r), le développement (d), la croissance (g), des changements morphologiques (mc)
Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
Ecotoxicité pour les organismes benthiques
Paramètres d'écotoxicité chronique
|
Espèce |
Substance testée |
Durée d’essai |
NOEC (µg/g poids sec) |
Référence |
|
|---|---|---|---|---|---|
|
Crustacés |
Hyalella azteca |
ZnCl2 |
4 s. |
1 200 |
Borgmann et Norwood, 1997 |
|
|
|
4 s. |
250[1] |
Farrar et Bridges, 2000 |
|
|
|
ZnCl2 |
10 j |
³ 750 |
Liber et al., 1996 |
|
|
Insectes |
Chironomus tentans |
ZnCl2 |
8 s. |
800 |
Sibley et al., 1996 |
|
|
ZnCl2 |
10 j |
³ 750 |
Liber et al., 1996 |
|
[1] Des effets sur la croissance ont été observés à cette concentration
Des essais sont actuellement en cours vis à vis de Chironomus tentans.
Ecotoxicité terrestre
Paramètres d'écotoxicité chronique
Lorsque les NOEC ne peuvent pas être estimées à partir des données, elles sont estimées à partir des résultats d’essais suivant les critères suivant (dans l’ordre de préférence) :
- EC10
- NOEC = LOEC/2 si inhibition est comprise entre 10 et 20 %
- NOEC = LOEC/3 si inhibition est comprise entre 20 et 30 %
La variabilité des résultats d’essais correspond à la variation des conditions expérimentales.
|
|
Espèce |
Substance testée |
Durée d’essai |
NOEC (µg/g poids sec) |
Référence |
|---|---|---|---|---|---|
|
Végétaux |
Medicago sativa |
Zn(NO3)2 |
67 jours |
300 |
Boawn et Rasmussen, 1971 |
|
Zea mays |
ZnSO4 |
6 sem. |
83 |
MacLean, 1974 |
|
|
|
Zn(NO3)2 |
28 jours |
300 |
Boawn et Rasmussen, 1971 |
|
|
|
Zn(NO3)2 |
28 jours |
200 |
|
|
|
|
|
|
170 |
moyenne géométrique |
|
|
Lactuca sativa |
Zn(NO3)2 |
40 jours |
400 |
Boawn et Rasmussen, 1971 |
|
|
Avena sativa |
Zn(Ac)2 |
5 mois |
100 |
De Haan et al., 1985 |
|
|
|
Zn(Ac)2 |
5 mois |
200 |
|
|
|
|
Zn(Ac)2 |
5 mois |
200 |
|
|
|
|
Zn(Ac)2 |
5 mois |
400 |
|
|
|
|
|
|
200 |
moyenne géométrique |
|
|
Hordeum vulgare |
ZnCl2 |
48 jours |
33 |
Luo et Rimmer, 1995 |
|
|
|
ZnSO4 |
45 jours |
215 |
Aery et Jagetiya, 1997 |
|
|
|
Zn(NO3)2 |
33 jours |
100 |
Boawn et Rasmussen, 1971 |
|
|
|
|
|
89 |
moyenne géométrique |
|
|
Allium cepa |
ZnSO4 |
|
200 |
Dang et al., 1990 |
|
|
Trigonella poenum graceum |
ZnSO4 |
8 sem. |
200 |
Dang et al., 1990 |
|
|
Vigna mungo |
ZnSO4 |
45 jours |
100 |
Kalyanaraman et Sivagurunathan, 1993 |
|
|
Sorghum bicolor |
Zn(NO3)2 |
35 jours |
100 |
Boawn et Rasmussen, 1971 |
|
|
|
Zn(NO3)2 |
35 jours |
200 |
|
|
|
|
|
|
140 |
moyenne géométrique |
|
|
Triticum vulgare |
Zn(NO3)2 |
33 jours |
200 |
Boawn et Rasmussen, 1971 |
|
|
Pisum sativum |
Zn(NO3)2 |
- |
400 |
Boawn et Rasmussen, 1971 |
|
|
Spinacea oleracea |
Zn(NO3)2 |
- |
200 |
Boawn et Rasmussen, 1971 |
|
|
Beta vulgaris |
Zn(NO3)2 |
42 jours |
300 |
Boawn et Rasmussen, 1971 |
|
|
Lycopersicon esculentum |
Zn(NO3)2 |
|
400 |
Boawn et Rasmussen, 1971 |
|
|
Trifolium pratense |
ZnCl2 |
24 jours |
100 |
Van der Hoeven et Henzen, 1994a |
|
|
|
ZnCl2 |
24 jours |
84 |
|
|
|
|
ZnCl2 |
25 jours |
32 |
|
|
|
|
ZnCl2 |
25 jours |
32 |
|
|
|
|
ZnCl2 |
25 jours |
32 |
Hooftman et Henzen, 1996 |
|
|
|
ZnCl2 |
25 jours |
32 |
|
|
|
|
ZnCl2 |
25 jours |
180 |
|
|
|
|
|
|
55 |
moyenne géométrique (n=7) |
|
|
Vicia sativa |
ZnCl2 |
24 jours |
32 |
Van der Hoeven et Henzen, 1994b |
|
|
Annélides |
Aporrectodea caliginosa |
ZnSO4 |
8 sem. |
600 |
Khalil et al., 1996 |
|
Eisenia andrei |
ZnCl2 |
21 j |
320 |
Van Gestel et al., 1993 |
|
|
Eisenia fetida |
Zn(NO3)2 |
21 j |
350 |
Spurgeon et al., 1997 |
|
|
|
ZnCl2 |
21 j |
237 |
Spurgeon et Hopkin, 1995 |
|
|
|
Zn(NO3)2 |
56 j |
199 |
Spurgeon et al., 1994 |
|
|
|
Zn(NO3)2 |
21 j |
85-553 |
Spurgeon et Hopkin, 1996 |
|
|
|
|
|
230 |
moyenne géométrique (n=13) |
|
|
Insectes |
Folsomia candida |
ZnCl2 |
4 sem. |
275-685 |
Smit et Van Gestel, 1998 |
|
|
Zn(NO3)2 |
4 sem. |
300-620 |
Sandifer et Hopkin, 1996 |
|
|
|
Zn(NO3)2 |
6 sem. |
300 |
Sandifer et Hopkin, 1997 |
|
|
|
ZnCl2 |
4 sem. |
399 |
Van Gestel et Hensbergen, 1997 |
|
|
|
|
|
370 |
moyenne géométrique (n=9) |
|
|
Autres |
Respiration |
ZnSO4 |
8 sem. |
3 |
Cornfield, 1977 |
|
|
Respiration |
ZnSO4 |
3 mois |
17 |
Chang et Broadbent, 1981 |
|
|
Respiration |
ZnCl2 |
1,5 ans |
150 |
Doelman et Haanstra, 1984 |
|
|
|
|
1 an |
150 |
|
|
|
|
ZnCl2 |
1,5 ans |
3 000 |
|
|
|
|
ZnCl2 |
1,5 ans |
400 |
|
|
|
|
|
1,5 ans |
400 |
|
|
|
Respiration |
ZnSO4 |
45 j. |
110 |
Lighthart et al., 1983 |
|
|
|
ZnSO4 |
45 j. |
327 |
|
|
|
|
ZnSO4 |
45 j. |
165 |
|
|
|
|
ZnSO4 |
45 j. |
110 |
|
|
|
|
ZnSO4 |
45 j. |
17 |
|
|
|
Respiration |
ZnCl2 |
4 sem. |
50 |
Saviozzi et al., 1995 |
|
|
Minéralisation de l’azote |
ZnSO4 |
3 sem. |
164 |
Liang et Tabatabai, 1977 |
|
|
|
ZnSO4 |
3 sem. |
164 |
|
|
|
|
ZnSO4 |
3 sem. |
164 |
|
|
|
ZnSO4 |
3 sem. |
164 |
|
|
|
|
Minéralisation de l’azote |
ZnSO4 |
3 mois |
100 |
Chang et Broadbent, 1982 |
|
|
Minéralisation de l’azote |
ZnSO4 |
7 sem. |
233 |
Necker et Kunze, 1986 |
|
|
Ammonification |
ZnSO4 |
3 sem. |
1 000 |
Premi et Cornfield, 1969 |
|
|
Nitrification |
ZnSO4 |
10 j. |
109 |
Liang et Tabatabai, 1978 |
|
|
Nitrification |
ZnSO4 |
3 sem. |
100 |
Premi et Cornfield, 1969 |
|
|
Nitrification |
ZnSO4 |
7 sem. |
100 |
Wilson, 1977 |
|
|
|
ZnSO4 |
7 sem. |
100 |
|
|
|
|
ZnSO4 |
7 sem. |
50 |
|
|
|
Dénitrification |
Zn(NO3)2 |
3 sem. |
100 |
Bollag et Barabasz 1979 |
|
|
Glucose |
ZnCl2 |
96 h |
300 |
Ohya et al., 1985 |
|
|
Glucose |
ZnSO4 |
9 sem. |
80 |
Stadelmann et Santschi-Fuhrimann, 1987 |
|
|
Glutamicacid |
ZnCl2 |
1,5 ans |
92 |
Haanstra et Doelman, 1984 |
|
|
|
ZnCl2 |
1,5 ans |
400 |
|
|
|
|
ZnCl2 |
2 j |
100 |
Notenboom et Posthuma, 1994 |
|
|
|
ZnCl2 |
2 j |
100 |
Notenboom et Posthuma, 1995 |
|
|
|
ZnCl2 |
2 j |
30 |
|
|
|
|
ZnCl2 |
2 j |
55 |
|
|
|
|
ZnCl2 |
2 j |
91 |
Notenboom et Posthuma, 1996 |
|
|
Acétate |
ZnCl2 |
18 h |
303 |
Van Beelen et al., 1994 |
|
|
|
ZnCl2 |
|
212 |
Van Beelen et Notenboom, 1996 |
|
|
Amidase |
ZnSO4 |
12 sem. |
200 |
Hemida et al., 1997 |
|
|
|
ZnSO4 |
12 sem. |
200 |
|
|
|
Arylsulphatase |
ZnSO4 |
30 min |
820 |
Al-Khafaji et Tabatabai, 1979 |
|
|
|
ZnSO4 |
30 min |
140 |
|
|
|
|
ZnSO4 |
30 min |
164 |
|
|
|
|
ZnSO4 |
30 min |
820 |
|
|
|
Arylsulphatase |
ZnCl2 |
6 sem. |
105 |
Haanstra et Doelman, 1991 |
|
|
|
ZnCl2 |
6 sem. |
728 |
|
|
|
|
ZnCl2 |
6 sem. |
151 |
|
|
|
|
ZnCl2 |
6 sem. |
2 353 |
|
|
|
Dehydrogenase |
ZnSO4 |
3 mois |
76 |
Maliszewska et al., 1985 |
|
|
|
ZnSO4 |
3 mois |
500 |
|
|
|
Dehydrogenase |
ZnSO4 |
24 h |
48 |
Rogers et Li, 1985 |
|
|
|
ZnSO4 |
24 h |
145 |
|
|
|
Nitratereductase |
ZnSO4 |
12 sem. |
67 |
Hemida et al., 1997 |
|
|
Phosphatase |
ZnSO4 |
1 h |
508 |
Svenson, 1986 |
|
|
Phosphatase |
ZnCl2 |
6 sem. |
1 341 |
Doelman et Haanstra, 1989 |
|
|
|
ZnCl2 |
6 sem. |
2 623 |
|
|
|
|
ZnCl2 |
6 sem. |
160 |
|
|
|
Phosphatase |
ZnSO4 |
|
164 |
Juma et Tabatabai, 1977 |
|
|
|
ZnSO4 |
|
164 |
|
|
|
Phytase |
ZnSO4 |
1 h |
590 |
Svenson, 1986 |
|
|
Pyrophosphatase |
ZnSO4 |
30 min |
1 640 |
Stott et al., 1985 |
|
|
|
ZnSO4 |
30 min |
1 640 |
|
|
|
|
ZnSO4 |
30 min |
1 640 |
|
|
|
Uréase |
ZnSO4 |
30 min |
109 |
Tabatabai, 1977 |
|
|
|
ZnSO4 |
30 min |
52 |
|
|
|
|
ZnSO4 |
30 min |
64 |
|
|
|
Uréase |
ZnCl2 |
6 sem. |
70 |
Doelman et Haanstra, 1986 |
|
|
|
ZnCl2 |
6 sem. |
30 |
|
|
|
|
ZnCl2 |
6 sem. |
30 |
|
|
|
|
ZnCl2 |
6 sem. |
460 |
|
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Eau douce
Les critères d’effet pour les plantes aquatiques sont égale à NOECg(10j)= 200 µg.L-1 pour le ZnSO4, NOECg (3j)= 50 µg.L-1 pour le Zn (poudre), NOECg est comprise entre 24 et 35 µg.L-1 pour le ZnO, la NOECg(14j) = 390 µg.L-1 et NOECg(3j) = 60 µg.L-1 pour le ZnSO4.
Pour les porifères, la NOECd(7j) est comprise entre 43 et 65 µg.L-1pour le ZnCl2. Pour les mollusques la NOECs (10s) est égale à 400 µg.L-1 et la NOEC g(16s) est égale à 75µg.L-1 pour le ZnCl2.
Pour les crustacés, en fonction des espèces étudiées, des composés du zinc, de la durée d’exposition, du paramètre biologique, la NOEC est comprise entre 17 et 420 µg.L-1.
Pour les insectes la NOECs (10j) est égale à 1100 µg.L-1 et NOEC s,g,e (8s) est égale à 137 pour le ZnCl2.
Pour les poissons, en fonction des espèces étudiées, des composés du zinc, de la durée d’exposition et du paramètre biologique, la NOEC est comprise entre 26 et 2900 µg.L-1.
Pour les crustacés, pour le ZnCl2, pour des durées d’essai comprises entre 4 semaines et 10 jours, la NOEC est comprise entre 250 et 1200 µg.g-1.
Pour les insectes, pour le ZnCl2, pour des durées d’essai comprises entre 8 semaines et 10 jours, la NOEC est proche de 800 µg.g-1
Sol
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Synthèse
Pour les substances qui existent à l’état naturel dans l’environnement il est nécessaire de tenir compte de leur concentration de fond “ naturelle ”. Les PNEC présentées ci-dessous sont des “ PNECs ajoutées ”, c’est-à-dire qu’elles correspondent à des concentrations ajoutées à une concentration de fond naturelle.
Compartiment aquatique
Les valeurs suivantes ont été calculées à l’aide des données présentées paragraphe 4.2 :
HC5 = 17,2 µg.L-1 (IC1_90 %= [8,1; 29,2])
Il n’existe pas encore de consensus concernant une PNECaquatique pour le zinc pour l’évaluation des risques dans le cadre du règlement (CEE) 793/93. Pour l’instant, compte tenu de la base de données existante, un facteur d’incertitude de 2 est proposé, ce qui conduit à la PNEC suivante :
PNECaquatique = 8,6 µg.L-1
Compartiment terrestre
En ce qui concerne le sol, les valeurs suivantes ont été calculées
HC5 = 21 mg.kg-1 sol sec (IC_90 %= [13 ; 30]) pour les microorganismes
HC5 = 60 mg.kg-1 sol sec (IC_90 %= [36 ; 86]) pour les plantes et les invertébrés
Il n’existe pas encore de consensus concernant le choix du facteur d’incertitude dans le cadre du règlement (CEE) 793/93. Pour l’instant, compte tenu de la base de données existante, un facteur d’incertitude de 1 sur la HC5 pour les microorganismes est proposé, ce qui conduit à la PNEC suivante :
PNECajoutée_sol = 21 mg.kg-1 sol sec.
1 IC : Intervalle de Confiance
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le zinc est un métal, son numéro CAS est 7440-66-6. Les principaux composés du zinc, étudiés dans cette fiche, sont le chlorure de zinc (CAS 7646-85-7), le sulfate de zinc (CAS 7733-02-0), le sulfure de zinc (1314-98-3), l'oxyde de zinc (CAS 1314-13-2), le phosphure de zinc (CAS 1314-84-7), le chromate de zinc (CAS 13530-65-9) et le stéarate de zinc (557-05-1).
Le zinc est un métal ubiquitaire, très répandu dans la croûte terrestre. Les sources de zinc sont à la fois naturelles et anthropiques. La majorité du zinc naturel provient des minerais.
Le zinc est utilisé dans différents secteurs industriels : la galvanisation, le laiton, les alliages, les demi-produits, les usages chimiques.
En France, le zinc dans l'environnement est principalement d'origine anthropique.
La production mondiale de zinc était, en 2012, de 13 604 milliers de tonnes de zinc, et de 732 milliers de tonnes pour l'Union européenne en 2011.
Les émissions françaises industrielles de zinc vers l'environnement sont, tous milieux confondus, selon IREP, d'environ 756 tonnes en 2012 en France. De plus, de nombreux sites industriels sont recensés comme contaminés ou ayant été contaminés au zinc, dans toutes les régions françaises, d'après la base de données BASOL.
Les émissions diffuses de zinc proviennent essentiellement du secteur routier pour le milieu atmosphérique, et de l'agriculture pour le milieu terrestre.
De par ses propriétés physico-chimiques, le zinc s'adsorbe en milieu aquatique sur les matières en suspension. Les sédiments d'eau douce constituent donc un stock potentiel de zinc.
Différents substituts du zinc sont mis en œuvre à l'heure actuelle, notamment dans les domaines des produits phytosanitaires, des toitures. D'autre part, des techniques de réduction des émissions industrielles existent pour les effluents aqueux et gazeux, comme par exemple des techniques de filtration.
Abstract
Zinc is a metal, its CAS number is 7440-66-6. The main compounds of zinc, which are studied in this report, are zinc chlorite (CAS 7646-85-7), zinc sulphate (CAS 7733-02-0), zinc sulphur (CAS 1314-98-3), zinc oxide (CAS 1314-13-2), trizinc diphosphide (CAS 1314-84-7), zinc chromate (CAS 13530-65-9) and zinc stearate (CAS 557-05-1).
Zinc is a ubiquitous metal, very common in the Earth's crust. Zinc sources are both natural and anthropogenic. Most of natural zinc comes from ores.
Zinc is used in different industrial applications: galvanization, brass, alloys, semi products and chemicals.
In France, zinc in the environment is mainly anthropogenic.
In 2012, the global production of zinc was 13 604 thousand tons and 732 thousand tons for European Union in 2011.
According to IREP, the French industrial emissions of zinc to environment were about 756 tons for all medias for 2012 in France. Moreover, according to the database BASOL, many industrial sites are registered as polluted by zinc or having been polluted by zinc in all regions.
Diffuse emissions of zinc come mainly from road transport for the atmosphere and from agriculture for terrestrial.
By its physic-chemical properties, zinc is adsorbed on suspended solids in aquatic environment. Freshwater sediments are therefore a potential stock of zinc.
Different substitutes of zinc are currently used, especially in pesticides or roofing. On the other hand, techniques exist to reduce industrial emissions in aqueous and gaseous effluents, like for example techniques of filtration.
Tableaux de synthèse
Généralités
| CAS | 7440-66-6 |
|---|---|
| SANDRE | 1383 |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. TEXTES GENERAUXLe règlement 1907/2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques (REACH) oblige les producteurs et les importateurs de substances en quantité supérieure à une tonne à soumettre une demande d'enregistrement. Ces substances sont ensuite pour certaines évaluées, et éventuellement leur usage est ensuite soumis à autorisation. Le zinc et nombre de ses composés sont concernés par le règlement REACH. Le zinc et ses composés ne sont pas cités dans la liste de l'annexe I du règlement (CE) 649/2012 relatif à l'export et à l'import de substances dangereuses. Ils ne sont donc pas soumis aux notifications d'exportations. DIRECTIVE-CADRE SUR L'EAULe zinc et ses composés ne sont pas cités dans la directive n°2013/39/UE du 12 août 2013 modifiant les directives 2000/60/CE et 2008/105/CE en ce qui concerne les substances prioritaires pour la politique dans le domaine de l'eau. De ce fait il n'a pas été fixé de normes de qualité environnementale (NQE) pour le zinc et ses composés. UTILISATION ET SURVEILLANCE EN AGRICULTURELa Directive 91/414/CEE du Conseil liste les substances actives dont l'incorporation dans les produits phytopharmaceutiques est autorisée. Les seuls composés autorisés du zinc sont :
Cas de l'élevage et de l'agriculture biologiqueLe règlement CE/889/2008 du 5 septembre 2008 autorise l'utilisation de l'oxyde de zinc et du sulfate de zinc en agriculture biologique en tant qu'additif pour l'alimentation des animaux. Ce même règlement autorise l'utilisation de déchets ménagers en tant qu'engrais, dans la limite de 200 g Zn/kg de matière sèche. Cas de l'alimentation animale au sein des élevagesLe règlement CE/1334/2003 du 25 juillet 2003 modifie les conditions d'autorisation de plusieurs additifs (dont le zinc) appartenant au groupe des oligoéléments dans l'alimentation animale. Désormais, la teneur maximale de l'élément zinc en mg/kg d'aliment complet est présentée dans le Tableau 4 ci-après en fonction de l'animal. Tableau 4. Conditions d'autorisation du zinc en tant qu'additif dans l'alimentation animale, d'après le règlement CE/1334/2003.
ACTIONS DE RECHERCHE RSDELe zinc et ses composés sont cités dans l'annexe 1 de la circulaire du 5 janvier 2009 relative à la mise en œuvre de la 2ème phase de l'action RSDE pour les ICPE soumise à autorisation. Cette annexe regroupe les listes par secteurs d'activité industrielle des substances dangereuses. Le zinc et ses composés sont cités pour tous les secteurs d'activité, à l'exception de la fabrication de colles et adhésifs. Le zinc appartient aussi à la liste des micropolluants à mesurer dans les stations de traitement des eaux usées traitant une charge brut de pollution supérieure ou égale à 600 kg DBO5/jour12 (Circulaire du 29 septembre 2010 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées). [12] DBO5: demande biochimique en oxygène. NANOPARTICULESCertains composés du Zinc, notamment l'oxyde de zinc, peuvent être employés sous forme nanoparticulaire (par exemple, dans des textiles pour ses propriétés biocides). Le décret n° 2012-232 du 17 février 2012 relatif à la déclaration annuelle des substances à l'état nanoparticulaire précise que le seuil de la déclaration est fixé à 100 g/an pour la fabrication, l'importation ou la mise sur le marché de nanomatériaux. ENGRAISPour les engrais organiques, divers seuils en métaux lourds sont fixés par les législations européennes et nationales. Les seuils pour le zinc sont repris dans le Tableau 513 . Tableau 5. Seuils de zinc pour les engrais organiques
Pour les engrais minéraux, il n'existe pas de règlementation européenne, néanmoins l'évaluation du règlement CE 2003/2003 relatif aux engrais16 préconise d'inclure dans le règlement des dispositions concernant les teneurs maximales en métaux lourds. [13] (consulté en février 2014). http://ec.europa.eu/enterprise/sectors/chemicals/files/fertilizers/annexes_16jan2012_en.pdf [14] European Compost Network. [15] Joint Research Center. [16] (consulté en février 2014). http://ec.europa.eu/enterprise/sectors/chemicals/files/fertilizers/final_report_2010_en.pdf AUTRES TEXTESLe zinc appartient à la liste des 823 substances du plan micropolluants 2010-201317 . Le zinc ne fait pas partie de la liste OSPAR18 . Protocole relatif à la protection de la mer Méditerranée19 : Le zinc est cité dans la liste des substances et matières nuisibles ou nocives dont le rejet dans la zone du protocole est assujetti à permis spécial [17] (consulté en févirer 2014). http://www.developpement-durable.gouv.fr/IMG/pdf/plan_micropolluants_dv.pdf [18] Convention OSPAR: Convention pour la protection du milieu marin de l'Atlantique du nord-est : (consulté en mars 2014). http://www.ospar.org/content/content.asp?menu=30950304450153_000000_000000 [19] Il s’agit du protocole relatif à la protection de la mer Méditerranée contre la pollution résultant de l’exploration et de l’exploitation du plateau continental, du fond de la mer et de son sous-sol auquel l’Union européenne a adhéré par la décision n°2013/5/UE du 17 décembre 2012. |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer SEUILS DE REJETS POUR LES INSTALLATIONS CLASSEESEn France, le zinc est concerné par les rubriques suivantes de la Nomenclatures des Installations Classées (selon le Décret n°53-578 du 20 mai 1953 relatif à la nomenclature des installations classées pour la protection de l'environnement). Les rubriques ICPE relatives au zinc sont mentionnées ci-dessous de façon indicative : cette liste ne se veut donc pas exhaustive quant aux secteurs industriels où le zinc et ses composés sont ou peuvent être rencontrés4 :
[4] (consulté en janvier 2014). http://www.ineris.fr/aida/sites/default/files/gesdoc/30296/Nomenclature_octobre.pdf [5] Cette rubrique est une rubrique de définition et non une rubrique de classement. Elle sert à préciser le classement dans d'autres rubriques. En conséquence, aucune installation ne peut être classée sous la rubrique 1430. L'arrêté du 26 décembre 2012 modifiant l'arrêté du 31 janvier 2008 concerne le registre et la déclaration annuelle des émissions polluantes et des déchets. L'exploitant de l'installation doit déclarer ces rejets dès lors que les seuils d'émissions décrits dans l'annexe II de cet arrêté sont dépassés. Les seuils de rejets du zinc et composés6 (exprimés en tant que Zn) sont :
L'arrêté du 2 février 1998 modifié relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation indique que : Pollution de l'airRejets d'antimoine, chrome, cobalt, cuivre, étain, manganèse, nickel, vanadium, zinc, et de leurs composés6 : si le flux horaire total d'antimoine, chrome, cobalt, cuivre, étain, manganèse7 , nickel, vanadium, zinc7 et de leurs composés8 dépasse 25 g/h, la valeur limite de concentration est de 5 mg.m-3 (exprimée en Sb+Cr+Co+Cu+Sn+Mn+Ni+V+Zn). [6] L'arrêté ne précise pas les composés du zinc concernés. [7] En cas de fabrication de monoxyde de zinc (ZnO) et de bioxyde de manganèse (MnO2), la valeur limite de concentration pour respectivement le zinc et le manganèse est de 10 mg.m-3 . [8] L'arrêté ne précise pas les composés concernés. Pollution des eaux superficiellesLes rejets respectent les valeurs limites de concentrations suivantes : Zinc et ses composés (en Zn) 2 mg.L-1 si le rejet dépasse 10 g.j-1. Epandage des bouesL'annexe I de l'arrêté précise les seuils à respecter en éléments-traces pour l'épandage des boues issues du traitement des eaux usées. Ces seuils sont présentés dans le Tableau 3. Le Tableau 3 présente les teneurs limites en éléments-traces dans les boues, les valeurs limites en éléments-traces dans les sols et le flux maximum en éléments-traces apporté par les déchets ou effluents pour les pâturages ou sols de pH inférieurs à 6. Tableau 3. Seuils de zinc applicables aux épandages de boues issues du traitement des eaux usées sur les sols agricoles, d'après l'arrêté du 2 février 1998 modifié.
VALEURS UTILISEES EN MILIEU DE TRAVAILD'après l'INRS (2012), les valeurs moyennes d'exposition pour certains composés du zinc sont les suivantes : 3 VME 9 (chlorure de zinc, fumées) : 1 mg/m(en Zn) ; [9] VME : Valeur Moyenne d'Exposition. VALEURS UTILISEES POUR LA POPULATION GENERALEValeurs de références dans la population générale :Le zinc est présent naturellement dans le corps humain. Selon l'INRS (2009), les valeurs de références des substances10 présentes dans les urines et le sang sont précisées ci-dessous : Valeur de référence du zinc dans le sang : 4-7,5 mg.L-1 ; [10] Les substances concernées sont le chlorure de zinc, le diphosphure de trizinc, l'oxyde de zinc, le sulfate et le sulfure de zinc. Qualité de l'eau de consommation :La Directive 98/83/CE du conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine n'indique pas de valeurs spécifiques pour le zinc. Le Décret n°2001-1220 du 20 décembre 2001 relatif aux eaux brutes destinées à la consommation humaine (consolidé par la version du 27 mai 2003) indique que la limite de qualité des eaux brutes et des eaux douces superficielles utilisées pour la production d'eau destinées à la consommation humaine est de 5 mg (en Zn) /L. Qualité des rejets d'eau résiduaire urbaine :L'Arrêté du 2 février 1998 relatif aux rejets des eaux résiduaires dans le milieu naturel indique que les rejets de zinc et de ses composés doivent respecter la valeur limite de concentration suivante : 2 mg (en Zn)/L si le rejet dépasse 20 g.j-1. Produits alimentaires :Le Règlement 10/2011 précise que les matériaux et objets en matière plastique destinés à entrer en contact avec les denrées alimentaires ne peuvent pas libérer plus de 25 mg Zn/kg de denrée alimentaire. De plus, l'oxyde de zinc, le sulfure de zinc et l'hydroxyde de zinc sont autorisés comme additif ou auxiliaire de production de polymères, mais sont interdits comme monomère11 ou substance de départ. [11] Un monomère est une substance à la base d'un polymère, qui consiste en un assemblage d'un ou plusieurs monomères. |
Production et utilisation
Production et ventes
Données économiques
D'après la CNUCED28 , la consommation mondiale de zinc se situe au quatrième rang des métaux après celle du fer, de l'aluminium et du cuivre. Il est exploité dans de nombreuses régions. Les principaux pays producteurs représentant 65 % de la production mondiale sont la Chine, l'Australie, le Pérou, le Canada et les Etats Unis.
Selon Vignes (2013), la dernière mine exploitée en France a fermé en décembre 1993.
Néanmoins, s'il n'y a plus d'exploitation, la France continue à produire du zinc, à partir de minerai importé et de recyclage. En 2012, la production française de zinc était de 161 000 tonnes (Vignes, 2013).
Selon l'INSEE29 , sur une base de production de 100 % en 2005, la production de « plomb, zinc, étain » a diminué en France jusqu'en 2008 où elle ne représentait plus que 71 % et 31 % de la production en 2005, puis est remontée. En 2012, elle représente 81 % de la production de 2005.La Figure 5 ci-après présente les variations de la production de plomb, zinc, étain.
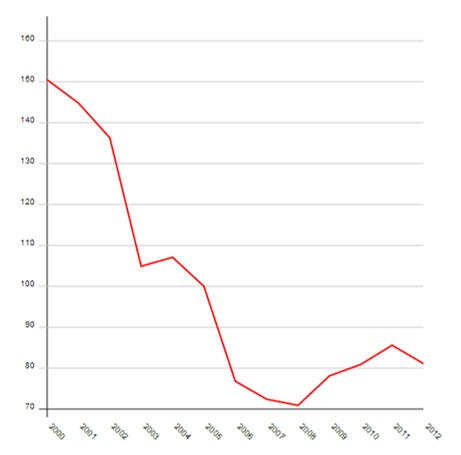
Figure 5. Production de «Plomb, Zinc et Etain» 30 de 2000 à 2012 en France (Base 100 : 2005), d'après l'INSEE.
Les cotations du zinc brut sont présentées dans la Figure 6 ci-après.
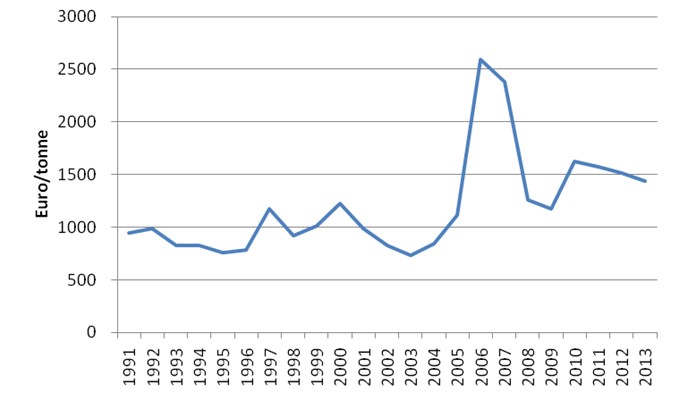
Figure 6. Prix du zinc brut sur le marché de Londres (LME) en euro/tonne (AGORIA31).
Le prix moyen en janvier 2014 du zinc brut était d'environ 1 500 euro/tonne. Les cotations du zinc laminé sont présentées dans la Figure 7 ci-après.

Figure 7. Prix du zinc laminé en euro/tonne (AGORIA).
Le prix moyen du zinc laminé, qui suit à une translation d'environ + 2 200 €/tonne celui du zinc brut, était d'environ 3 700 euro/tonne en janvier 2014.
Le Tableau 7 ci-après présente les prix des principaux composés du zinc trouvés sur le site commercial Alibaba32 .
Tableau 7. Prix des principaux composés du zinc en mai 2014, d'après Alibaba.
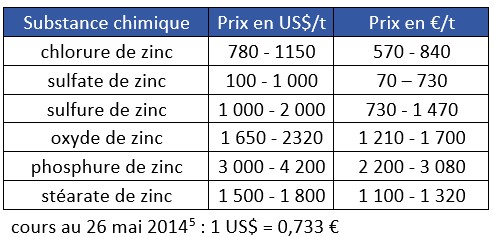
[28] Conférence des Nations Unies sur le Commerce et le Développement : (consulté en février 2014). http://r0.unctad.org/infocomm/francais/zinc/marche.htm
[29] Institut National de la Statique et des Etudes Economiques : (consulté en mai 2014). http://www.bdm.insee.fr/bdm2/affichageSeries.action?anneeDebut=2000&anneeFin=2012&page=graphique&recherche=idbank&codeGroupe=960&idbank=001563495
[30] En France, le secteur du zinc est représenté par le code NAF 27.4F (Production de plomb, de zinc ou d'étain) :
- la production de plomb, de zinc et d'étain (première ou deuxième fusion);
- la production d'alliages de plomb, de zinc et d'étain.
[31] (consulté en février 2014). http://www.agoria.be/FR/Mercuriale-des-materiaux-tableaux-synoptiques-67005?vWebsessionID=65599&vUserID=999999
[32] (consulté en mai 2014). http://www.alibaba.com/
[33] Banque Central Européenne : (consulté en mai 2014). http://www.ecb.europa.eu/stats/exchange/eurofxref/html/eurofxref-graph-usd.en.html
Procédés de production
FTE 2015 Importer
MINERAIS
Selon Vignes (2013)23 , la teneur moyenne de l'écorce terrestre en zinc est de 80 mg/kg. Dans les minerais, le zinc est très souvent associé au plomb et au cadmium, ainsi qu'au fer, cuivre, bismuth, antimoine, arsenic, germanium, indium, or et argent.
Le zinc et ses composés sont présents naturellement dans la croûte terrestre à des concentrations de l'ordre de 40 à 120 mg/kg dans les roches magmatiques, les sédiments argileux24 et les schistes (ATSDR, 2005 ; Agence de l'eau Seine-Normandie, 2009).
Les principaux minerais du zinc sont les suivants :
- les minerais sulfurés (blende, ZnS ou sulfure de zinc macroscopiquement associé à du sulfure de plomb) ;
- les minerais carbonatés (smithsonite, ZnCO3) ;
- les minerais silicatés et oxydés (hémimorphite, Zn4SiO7(OH)2, H2O et willémite, Zn2SiO4) regroupés sous le nom de calamine (Techniques de l'ingénieur, 1988).
[23] (consulté en février 2014). http://www.societechimiquedefrance.fr/extras/Donnees/acc.htm
[24] Dans ces sédiments argileux, le zinc est présent à des concentrations comprises entre 80 et 120 mg/kg.
PRODUCTION MINIERE
Selon Vignes (2013), la production mondiale de zinc, très majoritairement à base de blende, était, en 2012, de 13 604 milliers de tonnes de zinc contenu et de 732 milliers de tonnes (5 %) pour l'Union européenne en 2011.
Selon cette même source, en 2012, les réserves mondiales étaient estimées à 250 millions de tonnes de zinc contenu. La répartition de ces réserves est la suivante (en millions de tonnes) : Australie : 70, Chine : 43, Pérou 18, Mexique : 16, Inde : 12, Etats-Unis : 11, Kazakhstan : 10 et Canada : 8.
Il existe encore des mines en Europe, la plus importante étant en Irlande. Lors de cette étude, nous n'avons pas identifié de mine en France.
PROCEDES
La production de zinc est réalisée par extraction à partir des minerais de zinc. Les sources principales sont les minerais sulfurés (blende), les minerais carbonatés (smithsonite), les minerais silicatés et oxydés (hémimorphite et willémite) (Techniques de l'ingénieur, 1988). Ces derniers sont en voie d'épuisement (CNUCED, 2009 ; Techniques de l'ingénieur, 2000).
Selon la CNUCED (2009), la transformation du minerai en un produit commercialisable est constituée de 2 étapes principales :
- le minerai est broyé puis traité chimiquement afin de séparer les impuretés et les différents concentrés de zinc ;
- l'affinage permet d'obtenir du métal brut. Deux procédés sont utilisés pour cette étape, l'hydrométallurgie et la pyrométallurgie. Ces deux procédés sont détaillés dans le paragraphe suivants, les informations sont issues de CNUCED (2009) et des Techniques de l'ingénieur (2000).
Hydrométallurgie (extraction par voie humide ou électrolyse)
Selon nos informations, l'hydrométallurgie semble bien développée pour la production de métaux tels que le zinc. Ce procédé est principalement utilisé pour le traitement des roches riches en fer. Il se réalise en 4 étapes.
L'étape 1 est le grillage consistant à transformer le sulfure de zinc en oxyde (cf. Figure 1 pour les réactions). Cette oxydation dégage du SO2 qui est transformé en SO3, puis en acide sulfurique H2SO4. Le procédé utilisé est un procédé de contact à double catalyse. L'oxyde de zinc issu du grillage est appelé calcine.
![]()
![]()
(2)
Figure 1. Réactions lors du procédé de contact à la double catalyse – catalyseur V2O5, d'après Vignes (2013).
L'étape 2 est la lixiviation qui consiste à solubiliser le zinc et à précipiter le fer. La première lixiviation est neutre. On obtient une solution de sulfate de zinc à 150 g.L-1. Puis la lixiviation acide avec une solution d'acide sulfurique (180 à 190 g.L-1) traite les résidus de la lixiviation neutre. Le fer est précipité sous forme de goethite. A cette étape, la solution de zinc contient encore des impuretés.
L'étape 3 est une purification de la solution. La cémentation25 va permettre l'élimination d'impuretés comprenant du cuivre, du cobalt et du cadmium. Cette élimination nécessite l'utilisation de poudre de zinc récupérée ensuite par filtration. La solution de sulfate de zinc est alors purifiée.
L'étape 4 est l'électrolyse de la solution purifiée. Dans la cellule d'électrolyse du zinc massif se dépose sur la cathode d'aluminium. Il est récupéré par pelage ou stripping et est ensuite raffiné par fusion. Le zinc obtenu est très pur (99,995 %) et contient principalement du plomb comme impureté.
A ce stade, le zinc est fondu et moulé en plaque pour acquérir sa forme commerciale.
[25] Dans le domaine de la métallurgie, la cémentation est un traitement thermochimique de diffusion. La cémentation superficielle de l'acier par le carbone (cémentation la plus employée) permet de durcir la surface de diverses pièces mécaniques : engrenages, axes, cames, arbres, etc.
Pyrométallurgique (l'extraction par voie sèche ou voie thermique)
La pyrométallurgie est la technique traditionnelle d'extraction des métaux. Elle permet de purifier le minerai au moyen d'énergie thermique. Elle est constituée de 3 étapes.
Comme pour l'hydrométallurgie, l'étape 1 est le grillage. L'objectif de l'oxydation du minerai en calcine (cf. Figure 2 pour les réactions) est de préparer le minerai pour un rendement approprié à l'étape 2. La teneur en soufre total (sulfure et sulfate) doit être inférieure à 0,5 % et la porosité du minerai importante.
![]()
(1)
![]()
(2)
- (1)Réaction exothermique qui s'amorce à environ 700°C.
- (2)Réaction parasite menant à la production de ZnSO4.
Figure 2. Réaction d'oxydation catalytique par voie sèche (Techniques de l'ingénieur, 1998 ; CNUCED, 2009).
A ce stade, l'anhydride sulfureux issu des gaz est transformé par oxydation catalytique en de l'anhydride sulfurique et de l'acide sulfurique.
L'étape 2 est la réduction de l'oxyde avec du carbone et de l'oxyde de carbone selon les réactions ci-après.
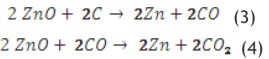
- (3)Température de la réaction 950°C.
- (4)Température de la réaction entre 1 300 et 1 400°C.
Figure 3. Réduction de l'oxyde de zinc (Techniques de l'ingénieur, 1998 ; CNUCED, 2009).
La température de réduction de l'oxyde de zinc est supérieure à la température d'ébullition du métal. Le zinc étant gazeux lors de sa formation, il se sépare de la gangue du minerai26 .
Le zinc issu de cette étape a une pureté d'environ 98,5 %, la production du zinc métal pourrait s'arrêter à cette étape. Cependant, ce taux de pureté limite l'utilisation à la galvanisation au trempé.
L'étape 3 est l'affinage du zinc brut. Les métaux plomb, fer, plus rarement cadmium, arsenic, antimoine et cuivre sont encore présents. L'affinage peut se faire dans un four à liquidation et/ou dans une colonne à distiller. A la sortie du four, 3 produits sont récupérés :
- le zinc purifié à 99 % ;
- le plomb zincifère (5 à 6 % de zinc) ;
- les mattes27 (5 à 6 % de fer).
La distillation fractionnée permet d'obtenir des métaux plus purs. Le zinc ainsi obtenu a une pureté de 99,995 %.
[26] La gangue est constituée des mineraux sans valeur commerciale enveloppant le minerai convoité.
[27] Les mattes de zinc sont générées lors de la décantation des composés insoluble (Zn et Fe) qui forment des cristaux de FeZn7.
Production des principaux composés du zinc
Le chlorure de zinc est principalement produit par traitement de matières premières secondaires (ou de récupération). Ces dernières sont d'abord dissoutes dans de l'acide chlorhydrique, avant purification et raffinage de la solution. Lors de la production sont également produites des boues contenant soit du plomb, soit d'autres métaux lourds (cuivre, cadmium). Ces boues sont précipitées puis séparées, procurant par là-même des matières premières secondaires (Commission Européenne, 2008c).
Le sulfate de zinc est produit à partir de matériaux contenant du zinc, tels que des cendres de zinc, du carbonate de zinc. Le zinc est d'abord séparé des matériaux de départ par lixiviation à l'acide sulfurique, suivie de divers procédés de purification. Les sulfates de plomb sont séparés par précipitation et vendus comme matières premières secondaires. Les autres métaux lourds et impuretés (cuivre, cadmium, manganèse) sont séparés par précipitation. Le sulfate de zinc pur est cristallisé (Commission Européenne, 2008b).
L'oxyde de zinc est produit par des procédés directs et indirects. Pour le procédé direct, le réactif de départ est constitué de minerais contenant du zinc, que l'on oxyde pour former de l'oxyde de zinc. Dans le procédé indirect, le réactif est du zinc métal (de pureté 92-99,995 %). Le métal est vaporisé et les vapeurs sont oxydés pour produire de l'oxyde de zinc. Des procédés différents, ainsi que des variations de procédés et de matières premières, résultent une grande variété de types d'oxydes de zinc, chacun avec des particules de taille différentes et contenant des impuretés. L'oxyde de zinc produit par le procédé direct est moins pur que celui produit par le procédé indirect (Commission Européenne, 2008f).
Le phosphure de zinc est produit par réduction électrothermique de l'oxyde de zinc en présence de carbone et de phosphate (Bettermann, 1986).
Le chromate de zinc peut être produit soit par la réaction d'oxyde de zinc finement broyé dans l'acide sulfurique concentré, soit par la réaction d'un sel de zinc soluble dans l'eau (ZnCl2 ou ZnSO4) avec du dichromate de potassium ou d'ammonium (Anger, 1986).
Le stéarate de zinc peut être produit par trois méthodes : la méthode de double décomposition, le procédé de transformation directe et le procédé de fusion. Seul le premier de ces procédés génère des eaux usées.
Dans la méthode de double décomposition, on ajoute à de l'acide stéarique de la soude pour former un alkalistéarate. Il est ensuite ajouté à cet alkalistéarate du chlorure de zinc. Le stéarate de zinc précipite et est séparé par filtration, puis lavé et séché.
Dans le procédé de transformation directe, de l'acide stéarique et de l'oxyde de zinc sont mélangés avec de l'eau. La température du mélange réactionnel est juste en dessous de la température de fusion des réactifs. La réaction a lieu selon la réaction suivante :
![]()
L'eau est ensuite éliminée.
Le procédé de fusion est similaire à celui de transformation directe. L'unique différence est la température du mélange réactionnel, qui est au-delà de la température de fusion des réactifs. L'eau formée est évaporée durant la réaction (Commission Européenne, 2008e).
RECYCLAGE
Le zinc recyclé représente environ 40 % de la consommation mondiale. En 2012, aux Etats-Unis, la production de zinc secondaire était de 150 000 tonnes, contre 115 000 tonnes pour la production primaire.
Le zinc recyclé provient soit de produits en fin de vie, soit de chutes et de déchets des usines métallurgiques. Le zinc récupéré est soit réutilisé directement, soit réemployé après refusion, soit retraité en suivant le circuit de la métallurgie de 1ère fusion, d'après Vignes (2013).
D'après cette même source, en 2003, dans le monde occidental, les principales sources de zinc recyclé étaient l'industrie du laiton (42 %), la galvanisation (27 %), la fonderie (16 %), le zinc laminé (6 %), les poussières d'aciéries (6 %) et l'industrie chimique (2 %).

Figure 4. Principales sources de zinc recyclé par secteur industriel en 2003, d'après Vignes (2013).
Utilisations
FTE 2015 Importer
En 2003, le zinc est utilisé à 75 % sous forme métallique. Les autres 25 % sont très majoritairement constitués des oxydes de zinc et des sulfures de zinc (CNUCED, 2009). Les secteurs d'utilisation sont détaillés dans les paragraphes ci-dessous : zinc métal et composés du zinc.
UTILISATIONS DU ZINC
FTE 2015 Importer
D'après Vignes (2013), en 2012, à l'échelle mondiale, les principaux secteurs d'utilisation du zinc sont la galvanisation : 50 %, le laiton : 17 %, les autres alliages : 17 %, les demi produits : 6 %, les usages chimiques : 6 % et les autres produits : 4 %. D'après la CNUCED, de manière générale, à l'échelle internationale, en 2003, le zinc métal est utilisé à 45 % dans la construction, 25 % dans les transports, 23 % dans les produits domestiques et biens électriques et 7 % dans les machines.
Le zinc métal est principalement utilisé pour les revêtements, dans les alliages tels que le laiton, les alliages moulés sous pression et le zinc plaqué ou forgé. Il est également utilisé pour produire des composés du zinc, des pigments et d'autres produits chimiques (Commission Européenne, 2008a). La répartition de la consommation du zinc est illustrée dans le Tableau 8 ci après, pour le Monde, les Etats-Unis et la France.
Tableau 8. Consommation du zinc métal pour chaque secteur industriel, d'après Vignes (2013)
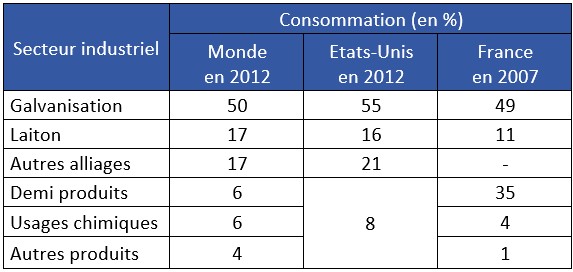
Revêtement
Le zinc métal est utilisé dans les revêtements anticorrosion des métaux par les techniques de galvanoplastie, métallisation ou immersion et dans les peintures (ATSDR, 2005 ; INRS, 2002). Il protège les métaux de la rouille et les bâtiments des altérations (INRS, 2002).Dans le secteur de la protection des métaux, le zinc en lui-même n'est pas très stable thermodynamiquement. Cependant il est utilisé, car il libère des ions Zn2+ qui en précipitant forment des produits protecteurs tels que le carbonate de zinc, un hydroxycarbonate de zinc et l'hydroxyde de zinc (Techniques de l'ingénieur, 2004).
Batteries
Il est utilisé dans les cellules de batteries sèches (ATSDR, 2005). Le zinc et/ou ses composés sont utilisés dans de nombreuses piles électriques :
- Zinc-carbone ;
- Zinc-chlorure ;
- Alkaline (zinc et dioxyde de manganèse) ;
- Nickel oxy hydroxyde ;
- Zinc-air ;
- Argent oxyde (argent et zinc ; pile rechargeable) (d'après le site de l'IZA34).
[34] International Zinc Association : (consulté en mars 2014). http://www.zincworld.org/index.html
Autres
Les pièces de monnaie (y compris certaines pièces d'euro) peuvent être réalisées à partir de l'alliage de zinc et de cuivre d'après le site ECB35 . Il est également utilisé pour préparer des alliages de fonderie type Zamak36 (INRS, 2002).
[35] European Central Bank : (consulté en mars 2014). http://www.ecb.europa.eu/ecb/html/index.en.html
[36] Le Zamak est un alliage de zinc, d'aluminium et de magnésium et parfois de cuivre.
VUE D'ENSEMBLE DES COMPOSES CHIMIQUES DU ZINC ET LEUR UTILISATION
FTE 2015 Importer
Les composés du zinc ayant été enregistrés dans REACH (selon la base publique de l'ECHA, consultée en février 2014), pour des usages autres que des intermédiaires de synthèse, et à des tonnages supérieurs à 100 tonnes37 , sont présentés dans le Tableau 9 ci-après.
Tableau 9. Composés du zinc et tonnages, d'après l'ECHA (2014)
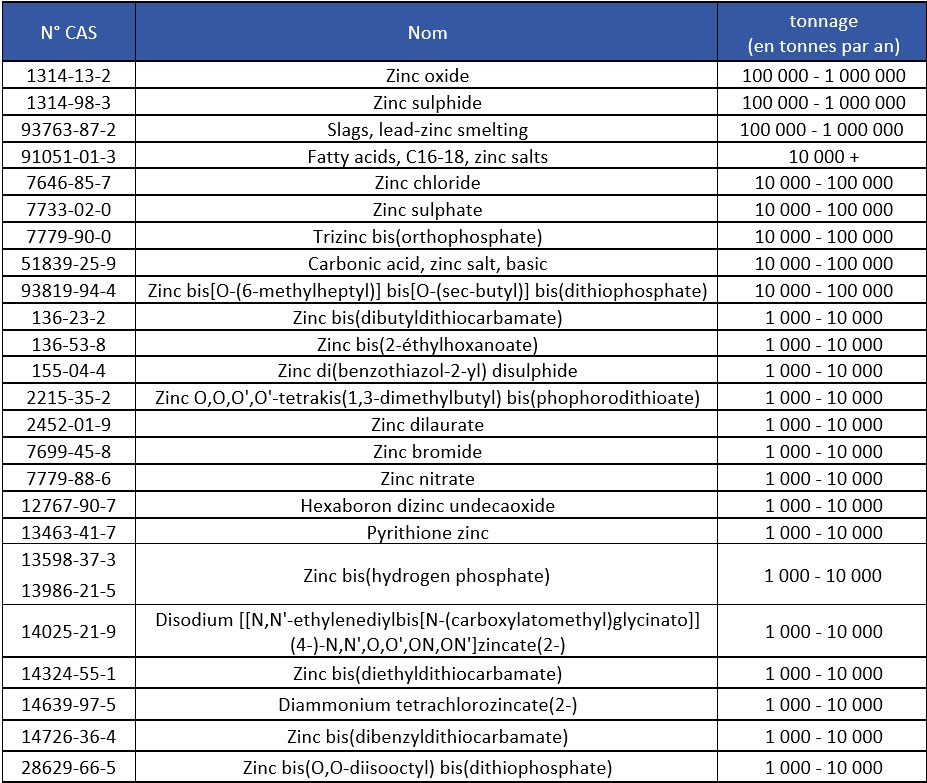

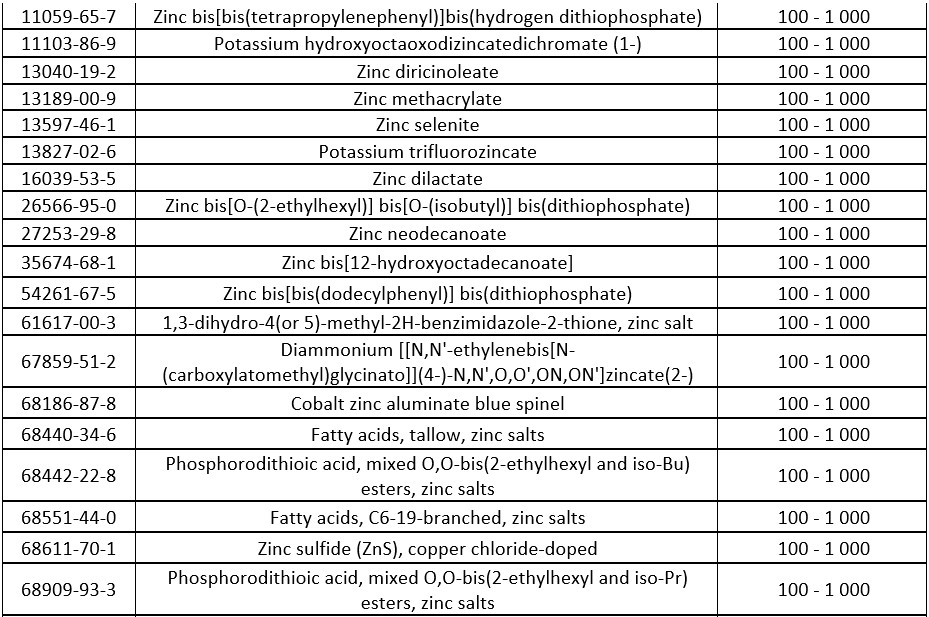

Les composés du zinc sont utilisés dans l'industrie des peintures, des caoutchoucs, des teintures, dans les produits de conservation du bois et dans les produits pharmaceutiques. Les secteurs d'utilisation des composés du zinc tels que reportés dans l'ATSDR (2005), l'INRS (2002), les Techniques de l'ingénieur (2004) et la CNUCED (2009) sont détaillés (de façon non exhaustive) ci-après pour les principaux composés de cet élément.
Le chlorure de zinc (ZnCl2) est utilisé dans l'industrie chimique (régulateur de process, catalyseurs) (37 %), le secteur de la galvanisation (28 %), l'industrie des piles (électrolyte) (15 %), dans l'industrie agroalimentaire (en tant que fongicide) (13 %) et l'industrie des peintures et colorants (7 %). Il est aussi utilisé dans l'industrie textile et papetière, dans le secteur pharmaceutiques et vétérinaires et dans le secteur du bois (agent de conservation pour ce dernier) (Commission Européenne, 2008c).
Le sulfate de zinc (ZnSO4) est utilisé dans les revêtements anticorrosion des métaux par les techniques de galvanoplastie, métallisation ou immersion et dans les peintures (en tant que pigments et/ou de substances anticorrosion). Il est aussi utilisé dans l'industrie textile, papetière, pour la conservation du bois et des peaux, pour la fabrication d'engrais et de pesticides (60 %), de produits pharmaceutiques et vétérinaires (tels que des additifs d'aliments pour animaux) (20 %) (Commission Européenne, 2008b). Le sulfate de zinc est employé par l'industrie chimique (20 %).
Le sulfure de zinc (ZnS) est utilisé dans la réalisation d'écrans de télévision et de lampes fluorescentes (tubes cathodiques). Il est aussi utilisé dans la fabrication de pigments pour peintures, émaux, matières plastiques et caoutchouc.
L'oxyde de zinc (ZnO) est employé dans la fabrication des caoutchoucs et plastiques (36 %), dans l'industrie du verre et de la céramique (27 %), dans les produits tels que les varistors, les aimants en ferrite et en tant que catalyseur (12 %), dans l'industrie agroalimentaire (complément alimentaire pour animaux) (9 %), des peintures (4,5 %), dans la production des composés du zinc (borate de zinc, phosphate de zinc, silicate de zinc, stéarate de zinc, thiocarbamate de zinc, diacrylate de zinc)38 (4,5 %), dans les carburants en tant qu'additif (4,5 %), dans le secteur pharmaceutique et cosmétique (2 %). Son utilisation dans la fabrication des produits à base de caoutchouc a pour objectif d'accélérer la vulcanisation39 . Pour l'industrie de la céramique et du verre, l'oxyde de zinc est employé pour réduire la fissuration et pour améliorer l'opacité. Dans les peintures, l'oxyde de zinc agit contre les moisissures et comme biocide38 . Le zinc est également utilisé dans les encres d'impression, les textiles, dans les savons et les produits nettoyants (Commission Européenne, 2008f).
Le chromate de zinc (ZnCrO4) est principalement utilisé dans les traitements de surface pour la chromatation. Il est également utilisé dans les peintures pour métaux (peinture d'apprêt anticorrosion) et les vernis ; comme pigment pour peintures automobiles, colorant pour artistes et comme agent anticorrosion dans les stratifiés époxy (INRS, 2005).
Le stéarate de zinc (C36H72O4Zn) est principalement utilisé dans l'industrie des polymères (en tant que stabilisateur, lubrifiant) (55 %), dans l'industrie des peintures, laques et vernis en tant que qu'agent décapant (18 %), dans l'industrie du bâtiment (agent imperméable du ciment) (5 %), dans l'industrie du carton, papier et du textile (agent imperméable) (2 %), dans le secteur pharmaceutique et cosmétique (1 %), dans l'industrie chimique (1 %) et dans le secteur des métaux (1 %) (Commission Européenne, 2008e).
Les Dialkyldithiophosphates de zinc sont utilisés comme additif des lubrifiants de toute nature (automobiles, moteurs, pompes,…). Les quantités en jeu peuvent être importantes, puisque ils sont présents dans la plupart des lubrifiants présents sur le marché40 .
Les carbonates et hydroxydes de zinc tels que le ZnCO3, Zn(OH)2 et Zn5(CO3)2(OH)6 sont utilisés dans les revêtements anticorrosion des métaux et des peintures.
Les scories (slags, lead-zinc smelting) sont utilisées comme additifs dans la production de matériaux de construction et comme agent de fluidification dans les procédés pyrométallurgiques41 .
Ces composés ainsi que de nombreux autres composés du zinc sont utilisés en tant que catalyseur par l'industrie chimique. Face à la multiplicité de ces usages, il n'est pas possible de les citer dans cette fiche.
[37] Quant à lui, le Pentazinc chromate octahydroxide est enregistré pour des tonnages inférieurs à 100 tonnes.
[38] (consulté en juin 2014). http://www.zn-oxide.com/
[39] La vulcanisation est un exemple de réticulation c'est-à-dire de création de liaison entre les macromolécules
[40] (consulté en septembre 2015). http://apps.kemi.se/flodessok/floden/kemamne_eng/zinkdialkyl_eng.htm.
LES NANOPARTICULES
FTE 2015 Importer
D'après l'ANSES42 (2013), seuls deux composés nanoparticulaires du zinc ont été enregistrés dans le cadre du registre français sur les nanoparticules, l'oxyde de zinc et le stéarate de zinc. Leurs usages sont repris dans le Tableau 10 ci-après.
Tableau 10. Composés nanoparticulaires du zinc, d'après l'ANSES (2013)
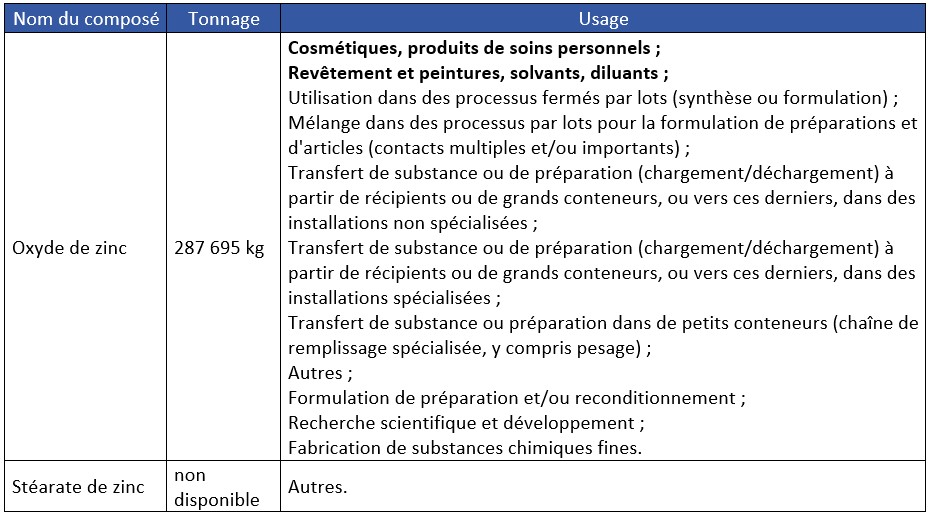
Un exemple d'utilisation potentielle des nanoparticules de zinc est le secteur de la santé : Pour lutter contre les infections contractées en milieu hospitalier elles pourraient être utilisée fabriquer des textiles antibactériens pour les hôpitaux.
C'est l'objectif du projet SONO, («A pilot line of antibacterial and antifungal medical textiles based on a sonochemical process») qui a été financé par l'UE. Il se base sur un processus de laboratoire récemment breveté et éprouvé, en une étape, pour imprégner des textiles par des nanoparticules d'oxydes de zinc et de cuivre43 .
[42] Bilan 2013 de déclarations des substances importées, fabriquées ou distribuées en France en 2012. (consulté en mars 2014). http://www.developpement-durable.gouv.fr/IMG/pdf/Rapport_public_format_final_20131125.pdf
[43] (consulté en juin 2014). http://cordis.europa.eu/result/brief/rcn/11169_fr.html
PRECISIONS SUR LES USAGES DU ZINC EN METTALURGIE
FTE 2015 Importer
Les paragraphes ci-après apportent des informations quant à la galvanisation et aux alliages ayant recours au zinc.
Galvanisation
La galvanisation est un procédé de revêtement des métaux ferreux, dont l'acier. Le recouvrement peut se faire par immersion des pièces dans un bain de zinc fondu (galvanisation à chaud), ou par électrolyse (galvanisation à froid) (CNUCED, 2009). Ces deux procédés détaillés ci-après permettent notamment une protection contre la corrosion liée à l'air et l'eau.
Les produits les plus souvent galvanisés sont l'acier en feuilles, les tubes, les fils et les câbles métalliques (CNUCED, 2009).
D'après Vignes (2013), en 2007, en France, les produits en acier galvanisés sont utilisés dans le bâtiment, la construction (40,0 %), le mobilier urbain (16,5 %), l'énergie (6,2 %), l'agriculture (14,2 %), l'équipement industriel (10,0 %), les transports (12,0 %) et la visserie (1,1 %).
Galvanisation à chaud
La galvanisation à chaud nécessite de préparer soigneusement la surface à recouvrir, les premières étapes sont le dégraissage, le décapage, puis le fluxage qui permet de réoxyder la surface de façon homogène. Ensuite la pièce est immergée dans un bain de zinc fondu. Ce procédé crée un alliage entre le zinc et l'acier.
Selon l'association Galvazinc44 , les secteurs d'utilisation de la galvanisation à chaud de produits finis sont principalement le bâtiment-construction à 45,7 %, le mobilier urbain à 15,3 % et l'agriculture et horticulture à 13 %.
Galvanisation à froid ou électrozingage
La galvanisation à froid (i.e. la galvanoplastie) est basée sur le principe de l'électrolyse : c'est-à-dire la réalisation d'un dépôt de zinc métallique sur un objet mis à la charge négative immergé dans une solution de sels de zinc (notamment les chlorures et sulfates de zinc) (CNUCED, 2009).
[44] (consulté en mars 2014). http://www.galvazinc.com/la-galvanisation/la-galvanisation-%C3%A0-chaud/march%C3%A9.html
Alliages
L'alliage de zinc le plus connu est le laiton. Il est utilisé pour remplacer le cuivre en raison du moindre prix du zinc, il présente une bonne résistance à la corrosion et peut recevoir des traitements de surface. Il peut également être moulé, travaillé à chaud et à froid. De plus il supporte les déformations importantes. Il existe différents laitons :
- les laitons simples : contenant de 5 à 45 % de zinc et de 55 à 95 % de cuivre, utilisés dans la quincaillerie, la cartoucherie, la bijouterie, les douilles de lampes, les instruments de musique, la visserie, la serrurerie et les appareils sanitaires ;
- les laitons au plomb : contenant 1 à 3,7 % de plomb et 35 à 40 % de zinc, utilisés pour la fabrication de pièces décolletées45 ;
- les laitons spéciaux : contenant de l'aluminium (moins de 3 % du mélange) destiné à augmenter la résistance des alliages utilisés dans la plomberie, ou de l'étain (moins de 2 % du mélange) pour que les alliages utilisés dans l'industrie navale résistent à la corrosion causée par le sel de mer d'après la CNUCED et Vignes (2013).
D'autres alliages moins fréquemment rencontrés contiennent du zinc notamment le maillechort ou argentant, le métal anglais, tombac et le zamak46 , d'après la CNUCED.
[45] Pièces usinées par enlèvement de matière à partir de barres de métal.
[46] Maillechort ou Argentan: alliage inaltérable de cuivre, de zinc et de nickel. On l'utilise notamment dans la fabrication de pièces d'orfèvrerie ou d'instruments scientifiques, d'après la CNUCED. Métal anglais : alliage à base de zinc et d'antimoine. Ce mélange contient entre 70 et 94 % de zinc, 5 à 24% d'antimoine, du cuivre jusqu'à concurrence de 5% et parfois du plomb jusqu'à 9%. Il est notamment employé dans la fabrication de services de table, de couverts ou de théières, d'après le CNUCED. Tombac : ce nom est donné à différents alliages à base de cuivre et de zinc (laitons) contenant plus de 80% de cuivre et pouvant renfermer de petites quantités d'étain. Il possède une couleur proche de celle de l'or. Il est souvent utilisé en bijouterie sous forme de bandes ou de fils, d'après la CNUCED. Zamak : (nom déposé) c'est la dénomination commerciale désignant un alliage à base de zinc, d'aluminium (3,9 à 4,3%), de magnésium (0,03 à 0,06%) et éventuellement de cuivre (1 à 3%). Dans l'industrie automobile, il est utilisé dans la fabrication de poignées, de corps de pompe et de carburateurs. Dans l'industrie radio-électrique et de la téléphonie mobile, il sert à réaliser des pièces de petite taille. Enfin, il trouve un large éventail de débouchés dans la serrurerie et la quincaillerie, d'après la CNUCED.
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Le zinc et ses composés sont présents naturellement dans la croûte terrestre à des concentrations de l'ordre de 40 à 120 mg/kg dans les roches magmatiques, les sédiments argileux21 et les schistes (ATSDR, 2005 ; Agence de l'eau Seine-Normandie, 2009).
Les apports naturels de zinc se font principalement par transport éolien de particules du sol, émissions liées aux éruptions volcaniques, génération d'aérosols marins et par émissions suite aux feux de forêts (Agence de l'eau Seine-Normandie, 2009 ; INERIS, 2005 ; Commission Européenne, 2008f, 2008a).
Le FOREGS22 construit des cartes (qui sont présentées paragraphe 4.2) montrant les concentrations en zinc dans 26 pays européens et dans différents milieux (sol couche profonde et de surface, sédiments de cours d'eau et de plaines alluviales et cours d'eau). Ces cartes montrent de grandes différences entre les régions. Les régions présentant de faibles concentrations en zinc sont la Pologne, les pays baltes et la Finlande. Les régions présentant de fortes concentrations sont l'Angleterre, l'Autriche et la République tchèque.
La France présente des concentrations assez fortes en ce qui concerne les couches profondes et superficielles des sols, ainsi que les sédiments de plaines alluviales, les concentrations dans les cours d'eau et les sédiments de cours d'eau sont plus faibles.
[21] Dans ces sédiments argileux, le zinc est présent à des concentrations comprises entre 80 et 120 mg/kg.
[22] Forum of the European Geological Surveys : Atlas Géochimique de l'Europe : (consulté en janvier 2014). http://weppi.gtk.fi/publ/foregsatlas/
Sources non-intentionelles
FTE 2015 Importer
Sans objet
Émissions anthropiques totales
FTE 2015 Importer
Les émissions de zinc et de ses composés dans l'environnement peuvent être d'origine naturelle ou anthropique.
Les apports de zinc anthropique ont principalement pour origine :
- les activités industrielles qui émettent majoritairement dans les milieux aquatiques et les sols ;
- les bâtiments et mobiliers urbains et le trafic routier qui émettent principalement dans l'atmosphère et dans les milieux aquatiques ;
- les activités agricoles (les épandages des fumiers et lisiers de bovins, porcins et de volailles ; les traitements phytosanitaires des cultures et notamment des vignes) qui émettent principalement vers les sols (ADEME-SOGREAH, 2007).
Le suivi du zinc émis depuis les industries dans l'environnement est régi par la réglementation française et européenne. Les émissions sont donc recensées dans l'environnement au niveau français par différents organismes et registres (Agences de l'eau, DRIRE, BASOL, IREP, IFEN, BRGM) et au niveau européen (E-PRTR (U27), FOREGS).
En France, les secteurs industriels de traitement des métaux sont des émetteurs importants de zinc et de ses composés. Pour ces secteurs, parmi tous les rejets, les rejets vers les milieux aquatiques sont les plus importants d'après l'IREP. Parmi les autres émissions, les processus de galvanisation et de zingage de l'acier génèrent des résidus riches en zinc. La fusion des ferrailles d'acier galvanisé produit des poussières contenant du zinc, d'après le site Galvazinc .
Ces secteurs sont cohérents avec les utilisations recensées et la présence ubiquitaire de zinc dans l'environnement hormis le secteur « pétrole et gaz » qui n'avait pas été identifié dans les utilisations. A ce jour, nous n'avons pas relié les émissions de ce secteur à une source de zinc clairement identifiée.
Une synthèse des rejets industriels français connus est proposée dans le Tableau 11 ci-après pour les trois compartiments environnementaux.
De plus, pour l'IREP comme pour l'E-PRTR, seuls les rejets supérieurs à un seuil donné sont soumis à déclaration (seuil défini substance par substance) ; de façon globale, les seuils appliqués par l'E-PRTR sont plus hauts que ceux appliqués par l'IREP. Les informations issues de ces deux bases de données ne peuvent donc pas être considérées comme exhaustives.
Tableau 11. Rejets industriels français du zinc et ses composés, d'après l'IREP.
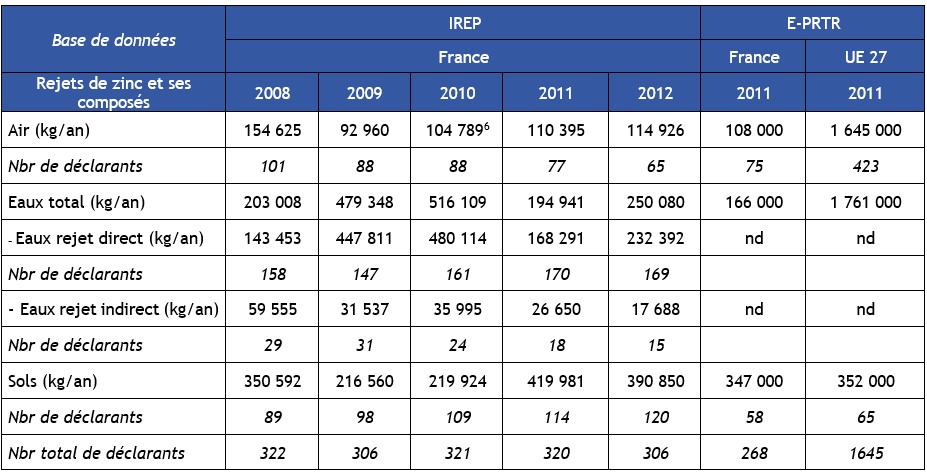
En 2012, en France, les émissions vers le sol (environ 390 tonnes) et vers les eaux (environ 250 tonnes) sont plus importantes que celles vers l'air (environ 115 tonnes). En effet les émissions vers le sol et les eaux représentent respectivement environ 50 % et 30 % du total des émissions industrielles de zinc et de ses composés recensées par le registre IREP en France. La Figure 8 ci-dessous représente la répartition de ces émissions vers le sol, l'air et les eaux.

Figure 8. Répartition des rejets de zinc et de ses composés en 2012 d'après l'IREP.
La France a une place importante dans les émissions de zinc à l'échelle de l'Union Européenne. Les émissions vers le sol, l'eau et l'air représentaient respectivement 99 %, 9 % et 12 % du total des émissions déclarées dans l'UE (27) en 2011 d'après l'E-PRTR. Pour les émissions vers les sols, ce chiffre doit plus être vu comme un bon renseignement de la base de données de l'E-PRTR par la France, plutôt que comme un indicateur de l'importance des rejets.
[47] Dans la base de l'IREP,une valeur d'émission vers l'air de 1 030 000 kg.an-1 a été donné par Tarnaise des Panneaux SAS. Cette valeur semble aberrante et a donc été exclue.
Émissions atmosphériques
FTE 2015 Importer
En France, selon l'INS48 , les émissions de zinc, toutes sources confondues, en 2007 étaient réparties sur le territoire comme le montre la Figure 9 ci-après.
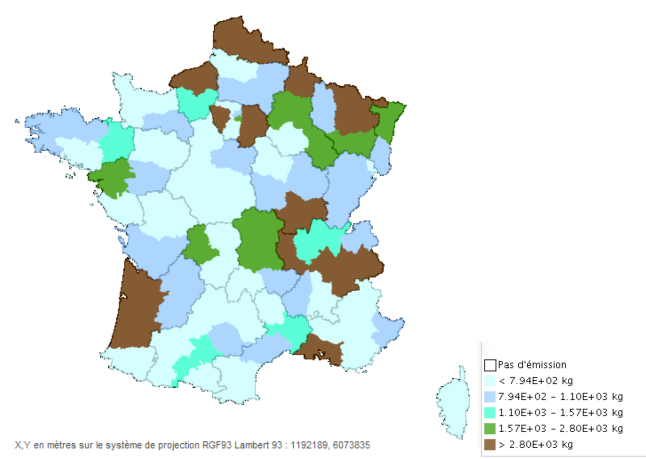
Figure 9. Répartition des émissions de zinc en France en 2007, d'après l'INS.
Les départements ayant les émissions de zinc les plus importantes, sont le Nord, le Pas-de-Calais, les Ardennes, la Moselle, la Seine-Maritime, les Yvelines, la Seine-et-Marne, la Saône-et-Loire, la Loire, la Savoie, l'Isère, les Bouches-du-Rhône, la Gironde et les Landes.
Parmi les dix premiers émetteurs industriels français répertoriés par l'IREP, un est situé dans les Bouches-du-Rhône, un en Moselle, trois dans le Nord et un en Savoie, ce qui explique que ces départements enregistrent des émissions importantes de zinc.
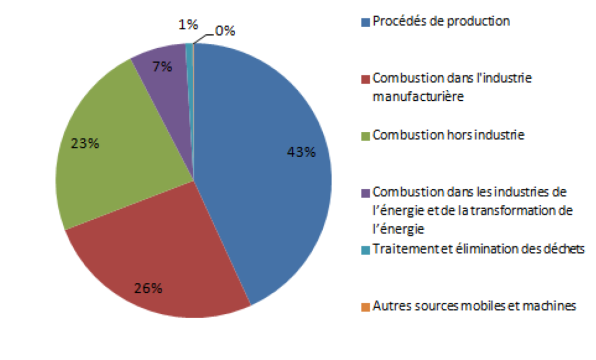
Figure 10. Secteurs émettant du zinc en France en 2007, d'après l'INS.
Les deux secteurs émettant le plus de zinc en France en 2007 étaient les procédés de production (43 %) et la combustion dans l'industrie manufacturière (26 %).
Selon l'INS, les émissions totales de zinc vers l'atmosphère étaient en 2007 de 201 523 kg, tandis que les émissions industrielles de l'IREP étaient cette même année de 164 495 kg, soit environ 80 % des émissions de l'INS. Précisons que, pour le zinc, l'INS, ne tient pas compte des émissions liées au transport (L. Létinois, communication personnelle).
Selon le CITEPA, le zinc et ses composés sont principalement rejetés dans l'atmosphère par les sous-secteurs suivants (sous-secteurs prépondérants en 2011 pour la France métropolitaine) :
- Voitures particulières diesel catalysées : 27 % ;
- Métallurgie des métaux ferreux : 14 % ;
- Voitures particulières essence catalysées : 11 % ;
- Véhicules utilitaires diesel catalysées : 11 % ;
- Poids lourds diesel : 9 %.
Ces mêmes données peuvent être présentées sous forme graphique (Figure 11).

Figure 11. Secteurs responsables des rejets atmosphériques de zinc et de ses composés, d'après les données du CITEPA.
Selon cette même source, les rejets atmosphériques de zinc en France ont atteint 441 tonnes en 2011. Ce chiffre représente une augmentation de 1,9 % par rapport à 2009 (rejets les plus bas enregistrés depuis 1990), ce qui est comparable avec les chiffres de l'IREP, pour ce qui est de la part industrielle. La diminution observée de 1990 à 2011 équivaut à -79,6 %.
Selon les chiffres publiés par le CITEPA, les rejets de zinc dus à l'industrie manufacturière ont diminué de 93 % entre 1990 et 2011. Ces émissions sont notamment dues à la métallurgie des métaux ferreux (57 % des émissions de l'industrie manufacturière en 2011). La baisse des émissions est due à la mise en place de techniques de réduction dans les aciéries électriques et à la fermeture d'un important site de métallurgie de métaux non ferreux en 2003. Les émissions de zinc du secteur routier proviennent d'une part de la remontée d'une partie de l'huile moteur dans la chambre de combustion et d'autre part de l'abrasion des routes, des pneus et des freins.
La Figure 12 ci-après montre les émissions de zinc dans l'air entre 1990 et 2012 selon différents secteurs.
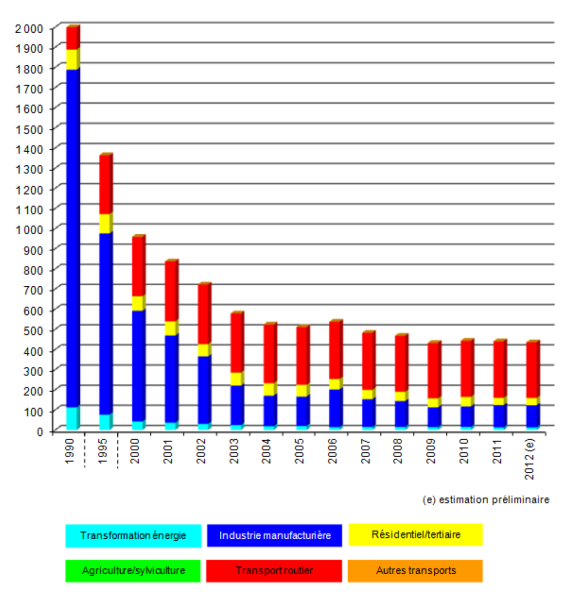
Figure 12. Emissions de zinc dans l'air en France métropolitaine, en tonnes, d'après CITEPA.
En France, d'après les données E-PRTR de l'année 2011, les secteurs industriels dont les émissions de zinc vers l'atmosphère sont les plus importants sont :
- Production de fonte et d'acier y compris en coulée continue (52,0 %) ;
- Fonderies de métaux ferreux (14,7 %) ;
- Centrales thermiques et autres installations de combustions (5,9 %) ;
- Production de métaux non-ferreux bruts à partir de minerais, de concentrés ou matériaux de récupération (5,7 %).
Notons que ces estimations de zinc vers le compartiment aérien varient d'une source à l'autre, néanmoins, cette variabilité est à mettre en regard avec l'importance des émissions de zinc vers l'atmosphère qui, selon IREP ne représentent que 15 % des émissions totales à l'environnement.
[48] Inventaire National Spatialisé : (consulté en mars 2014). http://90.83.82.201/ins-webapp/
Émissions vers les eaux
FTE 2015 Importer
A L'ECHELLE DE LA FRANCE
Selon l'Agence de l'eau Seine Normandie (2009), l'origine du zinc dans la Seine à Poses (estuaire) en 2006 est :
- urbaine (65 %) ;
- naturelle (15 %) ;
- autre, dont industrielle (20 %).
D'après les données RSDE49 , près de 90 % des flux totaux de zinc proviennent des centrales thermiques de production d'électricité.
Selon le projet de recherche AMPERES (2009), le zinc fait partie des composés toujours détectés (c'est-à-dire dans plus de 90 % des cas) en entrée des STEP et en sortie de STEP (traitements secondaires). Suite à un traitement tertiaire, le zinc peut être éliminé (cf 5.1.6).
Les métaux représentent 82 % en masse du flux total de micropolluants et le zinc représente 5,5 % du flux total de micropolluants en entrée par équivalent habitant (médianes du flux total pour toutes les STEPs étudiées durant ce projet de recherche). En sortie de STEP, les métaux représentent 97,4 % en masse du flux total de micropolluants et le zinc représente 7 % du flux total de micropolluants par équivalent habitant.
Ce même projet, indique que le zinc est majoritairement adsorbé dans les eaux résiduaires brutes alors que ce même élément est majoritairement dissous dans les eaux résiduaires traitées.
Nous n'avons pas de précision sur le type de traitements utilisés dans les STEPs étudiées au cours de ce projet.
L'IREP différencie les émissions directes dans l'eau de celles qui sont indirectes. Un rejet direct est défini comme un rejet isolé, après station d'épuration interne au site industriel ou directement dans le milieu naturel, un rejet indirect est défini comme un rejet raccordé à une station d'épuration extérieure à l'installation industrielle émettrice. Ces deux types de rejets sont explicités dans les paragraphes 3.3.1.1 et 3.3.1.2 ci-après.
[49] Réduction des Substances Dangereuses dans l'Eau, consulté le 16 juin 2014.
Rejets directs
En France, en 2012, 169 établissements ont déclarés des rejets directs vers les eaux de zinc, ces rejets atteignaient 232 392 kg.an-1. Les rejets directs vers les eaux représentent environ 31 % des rejets totaux de zinc vers l'environnement et 93 % des rejets vers les eaux. Les 10 premiers émetteurs nationaux émettaient entre 3 300 et 58 400 kg.an-1. Ces 10 premiers émetteurs sont les STEP de plus de 100 000 habitants, la sidérurgie, métallurgie et coke et la chimie et parachimie et le traitement des déchets d'après l'IREP.
Il a été estimé aux Pays-Bas que les rejets de zinc dans les eaux de surface, dus aux toitures en zinc, étaient de l'ordre de 40 tonnes/an pour une surface d'environ 33 km2 . En France, les toitures en zinc sont essentiellement situées en région parisienne ; à Paris la surface de toitures en zinc est estimée à 5 km2 , on peut donc estimer que les rejets dus aux toitures sont de l'ordre de 6 tonnes/an en France.
Rejets indirects
Selon ces mêmes déclarations, les émissions dans l'eau de zinc et ses composés par rejets indirects atteignaient en France 17 688 kg.an-1 en 2012. Les rejets indirects vers les eaux représentent environ 2 % des rejets totaux de zinc vers l'environnement et 7 % des rejets vers les eaux Les 10 premiers émetteurs nationaux émettaient entre 140 et 12 600 kg.an-1. Les secteurs concernés sont la chimie et parachimie, le traitement des déchets, la mécanique et traitement de surface, et l'agro-alimentaire et boissons d'après l'IREP. Ces secteurs semblent cohérents avec ceux recensés précédemment en termes d'utilisation.
A L'ECHELLE DE L'UNION EUROPEENNE
En Europe, en 2011, selon l'E-PRTR, les principaux émetteurs (en termes de sources fixes couvertes par ce registre) sont l'Allemagne, la Pologne, le Royaume-Uni, la France et l'Italie. Ils représentent respectivement 17 % (293 tonnes), 14 % (245 tonnes), 10 % (173 tonnes), 9 % (166 tonnes) et 9 % (163 tonnes) des émissions industrielles européennes50 vers les milieux aquatiques.
Selon cette même source, à l'échelle de l'UE 27, les sources ponctuelles les plus émettrices de zinc et de ses composés en 2011 correspondent aux stations de traitement des eaux résiduaires urbaines (48,2 %). Les autres sources ponctuelles majeures sont l'exploitation minière souterraine et les opérations connexes (14,4 %), la production de fonte et d'acier y compris en coulée continue (6,3 %), la production de pulpe à partir de bois ou d'autres matériaux fibreux similaires (5,4 %), les centrales thermiques et autres installations de combustion (4,1 %), la production à l'échelle industrielle de produits chimique inorganiques (3,4 %), la production à l'échelle industrielle de produits chimique organiques (3,4 %), la production de métaux non-ferreux bruts à partir de minerais, de concentrés et de matériaux de récupération (2,6 %) et la mise en décharge des déchets non dangereux (2 %).
[50] Les données européennes considérées ci-dessus sont issues des données provenant des 27 membres actuels de l'Union Européenne.
Émissions vers les sols
FTE 2015 Importer
En France, les déclarations pour l'année 2012 indiquent que les émissions de zinc et ses composés atteignaient 390 850 kg.an-1, ce qui représente environ 52 % des émissions de zinc dans l'environnement. Les 10 premiers émetteurs nationaux émettaient entre 3 500 et 133 000 kg.an-1 51 . Ces 10 premiers émetteurs sont dans le secteurs de l'agroalimentaire et des boissons, du bois, du papier et du carton, du traitement des eaux usées (STEP de plus 100 000 habitants), des déchets et des traitements, d'après l'IREP.
En Europe, en 2011, d'après l'E-PRTR (2014), le principal émetteur est la France, qui représente 99 % (346 955 kg) des émissions industrielles européennes vers les sols. Le principal secteur est le traitement et la transformation de matières animales et végétales dans la production d'aliments et de boissons (78,7 %). Néanmoins, ce chiffre soit plutôt être lu comme un indicateur de remplissage de la base de données et non pas comme un indicateur de l'importance des rejets.
Selon l'ADEME52 et SOGREAH (2007), les apports annuels sur les sols agricoles en France de zinc et de ses composés sont estimés à environ 15 200 tonnes/an. Ils proviennent des traitements phytosanitaires (3 %, soit environ 462 tonnes en 2013, d'après le BNV-D53), des engrais minéraux (2 %), des déjections animales (78 %), des amendements calciques et magnésiens (1 %), des boues et composts (7 %) et des retombées atmosphériques (11 %). L'importance des déjections animales dans les émissions de zinc vers les sols agricoles est soulignée par la Commission Européenne (2008a).
D'après l'ADEME et SOGREAH (2010), l'utilisation du zinc dans les produits phytosanitaires est essentiellement vouée aux traitements des vignes (99 %), et minoritairement aux laitues, pommes de terre et tomates.
[51] Les rejets dans le sol repertoriés dans IREP sont issus des déchets traités en milieu terrestre (par exemple : épandage de boue, biodégradation de déchets liquides ou de boues dans les sols...) ou liés à des injections en profondeur (par exemple : injection des déchets pompables dans des puits, des dômes de sel ou des failles géologiques naturelles...). Les effluents d'élevage ne sont pas soumis à cette obligation. En cas d'épandage de boues industrielles, seules les substances n'ayant pas d'intérêt agronomique avéré pour les sols ou pour la nutrition des cultures (tels que métaux, substances dangereuses...) devront être déclarées, dès lors qu'elles sont rejetées en quantité supérieure aux seuils.
[52] (consulté en février 2014). http://www2.ademe.fr/servlet/KBaseShow?sort=-1&cid=96&m=3&catid=15725
[53] Banque nationale des ventes de produits phytopharmaceutiques par les Distributeurs agréés : (consulté en juin 2014). https://bnvd.ineris.fr
Pollutions historiques et accidentelles
FTE 2015 Importer
BASOL est une base de données française sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif. Le site internet de cette base de données permet d'effectuer des recherches par substance : la recherche (effectuée en mars 2014) des sites ou sols pollués (ou potentiellement pollués) par du zinc aboutit à un résultat de 367 localisations en France, dont :
- 19 sites traités et libres de toute restriction ;
- 224 sites traités avec surveillance et/ou restriction d'usage ;
- 51 sites en cours de travaux ;
- 64 sites en cours d'évaluation ;
- 9 sites mis en sécurité et devant faire l'objet d'un diagnostic ;
- 191 sites ayant abouti à un impact dans les eaux souterraines (teneurs anormales) ;
- 2 sites ayant abouti à l'arrêt d'un captage AEP54 .
La base de données BASOL recense 5 587 sites pour 26 types de polluants (pour donner un ordre d'idée, cinq fois moins de sites industriels sont recensés pour le cuivre).
[54] Captage AEP : captage destiné à l'alimentation en eau potable.
Présence environnementale
Atmosphère
FTE 2015 Importer
Le zinc dans l'atmosphère est principalement lié aux aérosols. Le zinc gazeux compte pour moins de 1 % de la totalité du zinc atmosphérique. Les particules de zinc trouvées dans l'air sont le sulfure de zinc, le phosphure de zinc, le chlorure de zinc et le zinc métallique (Commission Européenne, 2008a).
Aquatique
FTE 2015 Importer
Dans l'Union européenne, les teneurs en zinc mesurées dans les cours d'eau sont comprises entre inférieure à 0,09 et 310 µg.L-1 avec une valeur médiane de 2,68 µg.L-1.
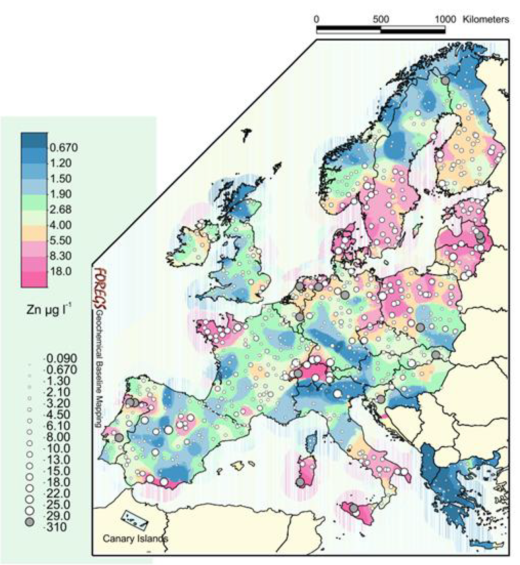
Figure 13. Distribution géographique du zinc dans les cours d'eau entre 1997 et 2001, d'après le FOREGS.
En France, on note une forte concentration en zinc dans les cours d'eau en Bretagne, le reste de la France présentant ces valeurs plus moyennes.
Les sédiments de la Seine (en amont du barrage de Poses) et de la Garonne (en amont de Bordeaux) ont été analysés, les teneurs minimum et maximum en zinc sont respectivement de 267 à 1 749 µg.L-1 et 167 à 1 013 µg.L-1 (IFEN, 2009).
Dans l'Union européenne, les teneurs en zinc dans les sédiments de la plaine alluviale varient entre 6 et 4 910 mg/kg avec une valeur médiane de 65 mg/kg.
Figure 16. Distribution géographique du zinc dans les sédiments de la plaine alluviale entre 1997 et 2001, d'après le FOREGS.
En France, des concentrations importantes en zinc dans les sédiments de la plaine alluviale sont présentes dans le nord-ouest de la France.
Dans l'Union européenne, les teneurs en zinc dans les sédiments de cours d'eau varient entre 4 et 13 900 mg/kg avec une valeur médiane de 71 mg/kg.
Figure 17. Distribution géographique du zinc dans les sédiments de cours d'eau entre 1997 et 2001, d'après le FOREGS.
Le sud-ouest de la France présentent une faible concentrations en zinc, tandis que la Bretagne présente la plus forte concentration en zinc française.
Terrestre
FTE 2015 Importer
Dans l'Union européenne, les valeurs médianes des teneurs en zinc sont 47 et 52 mg/kg pour respectivement la couche profonde du sol et la couche superficielle. Les teneurs mesurées varient entre inférieure à 3 et 3 060 mg/kg pour la couche profonde du sol et inférieure à 3 et 2 900 mg/kg pour la couche superficielle.
Figure 14. Distribution géographique du zinc dans la couche profonde du sol entre 1997 et 2001, d'après le FOREGS.
En France, des concentrations importantes en zinc dans la couche profonde du sol ont été relevées dans plusieurs régions : en Bretagne et dans le sud-est de la France.
Figure 15. Distribution géographique du zinc dans la couche superficielle du sol entre 1997 et 2001, d'après le FOREGS.
Des concentrations importantes en zinc en France ont été relévées dans le nord et l'est de la France, ainsi que d'une ligne allant de la Bretagne au sud-est de la France.
Synthèse
Le zinc est présent dans l’eau, l’air, le sol et est présent dans tous les aliments (ATSDR, 2005). Les concentrations mesurées dans les différents milieux à l’échelle de l’Union Européenne sont présentées dans le Tableau 12 ci-dessous et correspondent à des analyses de 350 à 900 sites d’après le FOREGS.
Tableau 12. Présence du zinc dans l’environnement à l’échelle de l’Union Européenne entre 1997 et 2001, d’après le FOREGS.
Les concentrations moyennes en zinc les plus importantes sont observées dans les sédiments des cours d’eau (120 mg/kg) et dans les sédiments de plaine alluviale (107 mg/kg). Dans une moindre mesure, le zinc se retrouve dans les sols (61 à 68 mg/kg) et l’humus (57 mg/kg). Dans les eaux, le zinc est présent à une concentration moyenne de 6 µg/L. Tous milieux confondus, la concentration maximale observée se trouve dans les sédiments des cours d’eau à une valeur très largement au dessus des autres milieux avec 13 900 mg/kg.
Perspectives de réduction
Réduction des rejets
FTE 2015 Importer
La réduction des émissions industrielles peut être réalisée par la valorisation et le recyclage des résidus et poussières, tels que la valorisation des poussières des aciéries électriques (Techniques de l'ingénieur, 2000), le traitement des résidus d'épuration de fumées d'incinération d'ordures ménagères (Pasquini, 2002), la valorisation de résidus riches en zinc et en sulfates (Roth et Bontemps, 2008) et le recyclage du zinc à partir d'acier galvanisé (Galvazinc Association, 2009).
A l'échelle mondiale, 40 % du zinc produit est issu d'une filière de recyclage. Sur la base d'estimations fondées sur des données historiques de consommation et les cycles de vie des produits, 60 % du zinc disponible pour le recyclage serait effectivement recyclé, d'après l'IZA (2011).
Le recyclage des métaux non ferreux (MNF) est une activité industrielle traditionnelle. Les métaux non ferreux recyclés sont Zn, Al, Cu, Pb et Ni. Ils sont issus des chutes de production, des chutes de l'industrie de transformation et des produits en fin de vie après collecte ou en premier traitement (sortie de l'incinération ou du 1er broyage). Il n'y a pas de différence entre le métal raffiné (produit à partir du minerai) et le métal affiné (métal secondaire) (Miquel, 1999).
Les produits de fin de vie représentent 50 % des ressources de MNF55 . La récupération de ces produits est organisée à travers une organisation professionnelle. Par exemple, le zinc de toiture est recyclé à hauteur de 95 % (Miquel, 1999).
La récupération fournit 37 % des besoins nationaux en MNF, 20 % correspondent à la récupération des produits en fin de vie. La production de minerai a disparu en France, l'importation ou la récupération sont les solutions actuelles de gestion des MNF. Le procédé de récupération du zinc permet d'économiser 90 % de l'énergie nécessaire à le produire à partir de minerai ce qui revient 3 à 4 fois moins cher (Miquel, 1999).
[55] MNF: Métaux Non Ferreux.
RECYCLAGE DES CHUTES DE PRODUCTION DE LA FILIERE HYDRO-METALLURGIQUE, VALORISATION DE RESIDUS RICHES EN ZINC ET EN SULFATES
Plusieurs procédés dont certains brevetés (US4, 072,503 ; WO2005/005674 et WO2002/068700) décrivent les techniques de traitement et de valorisation des résidus issus de l'extraction hydro-métallurgique du zinc. Ces procédés sont différents mais le principe général est proche. Il comprend, soit une étape de désulfuration par oxydation des sulfures en sulfates puis une réduction des oxydes par un réducteur carboné ; soit une réduction par un réducteur carboné suivie d'une fusion oxydante. Les produits résultant sont la fonte, le laitier (contenant du fer), un mélange d'oxydes contenant des métaux Zn, Pb, Ag, In, Ge, Ga et des fumées formées par des particules et des gaz. Les produits valorisables sont la fonte, le laitier stable et inerte utilisable dans la fabrication des ciments ou comme ballast et le mélange d'oxydes.
Le procédé développé par Roth and Bontemps (2008), a l'avantage de recycler quasiment l'intégralité des résidus. Le zinc et le fer sont recyclés, répondant ainsi aux exigences environnementales et aux exigences économiques pour la valorisation des métaux non ferreux.
RECYCLAGE DU ZINC A PARTIR D'ACIER GALVANISE
Les filières concernées sont le recyclage des ferrailles d'acier galvanisé et des résidus de galvanisation.
Dans la filière des ferrailles d'acier galvanisé, les produits proviennent des chutes de production et des ferrailles en fin de vie (automobiles, réfrigérateurs,). Les produits qui arrivent en fin de vie et/ou de conception obsolète et ne sont pas corrodés, sont alors recyclés.
Dans la filière de la galvanisation, les résidus sont les mattes de galvanisation (produites par la réaction du zinc avec l'acier) et les cendres écumées en surfaces des bains de galvanisation (produit par oxydation du zinc au cours du processus). Ces résidus de procédé sont actuellement recyclés (Galvazinc Association, 2009).
L'acier et le zinc combinés dans l'acier galvanisé et les tôles d'acier électro-zinguées sont des matériaux séparables de par l'importante volatilité du zinc. Le zinc est alors récupéré dans les poussières de cheminée d'un four électrique (Galvazinc Association, 2009).
VALORISATION DE POUSSIERES DES ACIERIES ELECTRIQUES
Selon les Techniques de l'ingénieur (2000), les aciéries européennes émettent 600 000 tonnes de poussières d'acier qui comprennent 20 à 25 % de zinc, 5 % de plomb, 20 à 25 % de fer, 5 % de sels et de la chaux. Les métaux sont sous forme d'oxydes et de ferrites. Afin d'éviter l'enfouissement de ces poussières en tant que déchets ultimes, deux procédés de recyclage ont été conçus. Ils permettent de séparer le zinc, le plomb et le résidu du traitement. Le traitement nommé EZINEX est développé par Engitec56 Inpianti. Le traitement nommé REZEDA a été développé par le groupe Usinor (aujourd'hui Arcelor-Mittal). Les deux procédés de traitements ont quelques différences mais ils ont le même principe de conception, ils sont tout les deux constitués des 3 étapes suivantes : la lixiviation des poussières, la cémentation et l'électrolyse.
Selon les Techniques de l'ingénieur (2000), les deux procédés sont rentables et concurrentiels, ils recyclent la solution appauvrie issue de l'électrolyse et produisent du cément de plomb, de la poudre de zinc et des cathodes de zinc massif.
[56] ( ). http://www.engitec.com/zinc.htm
TRAITEMENT DES RESIDUS D'EPURATION DE FUMEES D'INCINERATION D'ORDURES MENAGERES
Une tonne d'ordures ménagères génère 200 à 250 kg de mâchefer, environ 30 kg de cendres volantes nommées REFIOM (Résidus d'Epuration des Fumées d'Incinération d'Ordures Ménagères). Ces REFIOM sont collectés au niveau de la filtration des gaz et sont riches en éléments métalliques tels que le mercure, le plomb, le cadmium ou encore le zinc. En raison de leur dangerosité, ces résidus doivent être stabilisés et enfouis dans les CET57 appropriés. La vitrification est une des méthodes de stabilisation permettant de limiter la lixiviation des métaux toxiques dans l'environnement. D'après l'ADEME (2010b), les autres techniques de stabilisation des REFIOM sont la solidification à base de liants hydrauliques (ciments, chaux) et l'encapsulation qui enveloppe le déchet afin qu'il soit imperméable et chimiquement inerte vis-à-vis de l'extérieur (PVC, PET, bitume…).
Un procédé breveté (EP 0 779 082 A1) permet d'augmenter ou de diminuer le taux de métaux lourd dont le zinc dans le vitrifiat. Dans le premier cas, le vitrifiat enrichi en métaux permet de limiter la quantité de déchets ultimes lors du traitement total des REFIOM à moins de 1 % du total des déchets. L'autre cas peut amener à la production d'un vitrifiat appauvri en éléments métalliques et un solide valorisable dans le secteur métallurgique. Ce solide est assimilable à un minerai riche en métaux valorisables en pyrométallurgie ou en hydrométallurgie. Dans le premier cas, le vitrifiat obtenu contient 0,2 % de zinc au lieu de 2,3 % sans ajout de carbone (Pasquini, 2002).
[57] CET : Centre d'Enfouissement Technique.
ELIMINATION DU ZINC DANS LES FUMEES
Dans l'atmosphère, le zinc est essentiellement sous forme particulaire. D'après un fabricant d'installations de traitement des fumées, l'épuration des poussières (PM 2,558) dans les fumées est d'environ 40 %.
Suite à la filtration par des filtres à manche et des électrofiltres, les poussières sont récupérées et valorisées.
[58] Particules dont le diamètre est inférieur à 2,5 µm.
ELIMINATION DU ZINC DANS LES EFFLUENTS
Le zinc est recherché dans le cadre du projet AMPERES59 . Il a été quantifié dans plus de 90 % des eaux usées brutes étudiées. Les concentrations moyennes en zinc varient entre 100 et 1 000 µg.L-1. Le zinc a été quantifié dans plus de 70 % des eaux traitées secondaires à des concentrations comprises entre 10 et 100 µg.L-1 et dans plus 70 % des eaux traitées tertiaires à des concentrations comprises entre 10 et 100 µg.L-1 (Coquery, 2011).
Au cours du passage en STEP, plusieurs substances sont retenues sous forme particulaire et transférées dans les boues. Le zinc est quantifié dans plus de 70 % des boues à des concentrations comprise entre 100 et 1 000 mg/kg (Coquery, 2011).
Deux rendements sont disponibles :
- le rendement de la filière eau traduit la diminution de la concentration entre l'entrée et la sortie de la STEP : il est en moyenne de 57 % pour le zinc ;
- le rendement d'élimination global prend en compte le flux de micropolluants transférés vers la filière boues et le flux de micropolluants réintroduits dans la filière eau par le retour en tête. Ce rendement permet d'évaluer si la substance est transformer ou simplement stocké dans les boues : il est inférieur à 30 % pour le zinc (Choubert, 2011).
[59] Analyse de micropolluants prioritaires et émergents dans les rejets et les eaux superficielles.
CONCLUSIONS SUR LES DEMARCHES DE RECYCLAGE DU ZINC METAL
Ces démarches de recyclage du zinc métal semblent déjà bien installées au niveau français. A partir de nos informations il est difficile de savoir si l'intensification de cette approche permettrait une diminution significative des rejets de zinc dans l'environnement.
Alternatives aux usages
FTE 2015 Importer
DIFFICULTE DE LA SUBSTITUTION
Pour les applications actuelles, le zinc n'est pas concurrencé par d'autres matériaux (Techniques de l'ingénieur, 1988). Nous n'avons pas trouvé mention d'alternatives au zinc et à ses composés pour les principaux secteurs d'application. Notons que, pour certaines applications, le zinc est déjà employé en tant que substitut à d'autres composés chimiques. Par exemple, dans le secteur du traitement de surface, le zinc-nickel alcalin sans acide60 est une alternative performante à l'usage du Chrome VI dans les passivations bichromatées. Ce procédé va de pair avec l'élimination du PFOS61 dans les bains de placage de métaux tel que le chrome hexavalent (Commission Européenne, 2005).
L'évolution du parc automobile vers des voitures électriques favoriserait l'utilisation des batteries en zinc plus performantes que les systèmes actuels au plomb (CNUCED, 2009).
Dans le secteur de l'informatique, l'utilisation de batteries « zinc-air » remplace progressivement les piles à mercure. Outre la substitution du mercure, ces batteries permettraient une meilleure autonomie. De plus, elles ont l'avantage d'être recyclables sans perte de leurs qualités chimiques et physiques (CNUCED, 2009).
[60] Le zinc-nickel alcalin sans acide est un revêtement électrolytique de zinc allié à du nickel à hauteur de 12 à 15%.
[61] Le PFOS ou le SPFO est le sulfonate de perfluorooctane.
PISTES DE REDUCTION DES EMISSIONS
Les produits phytosanitaires
Le Tableau 13 ci–après présente la liste des produits phytosanitaires contenant du zinc, leurs applications et le nombre de leurs possibles substances de substitution.
Tableau 13. Liste des produits phytosanitaires contenant du zinc, leurs applications et le nombre de leurs possibles substances de substitution (ACTA, 2014; E-phy, 2014).
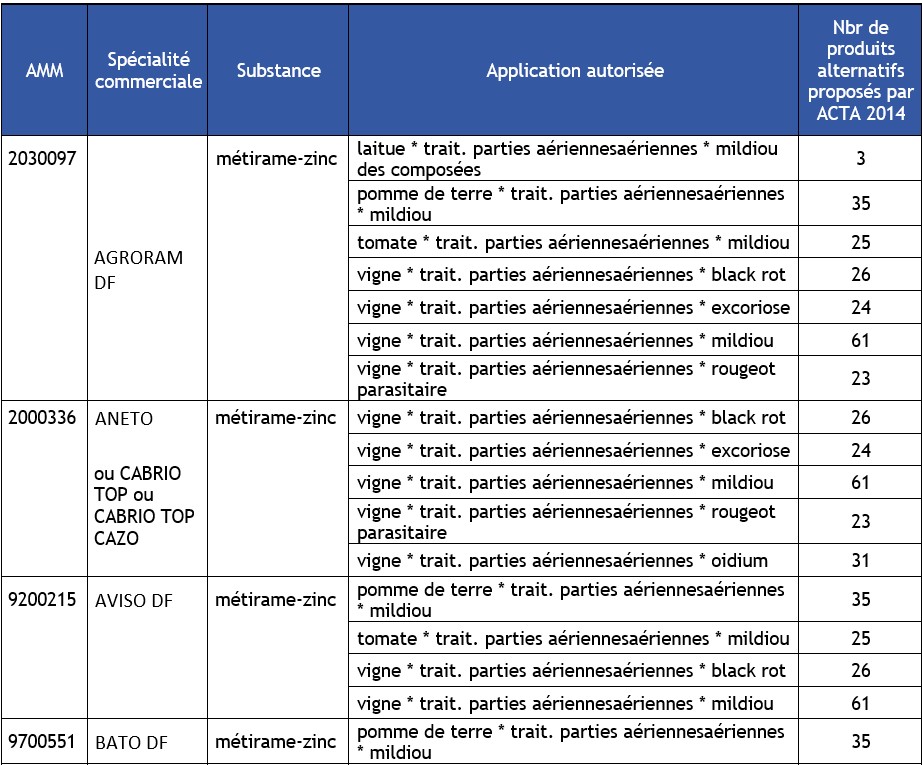
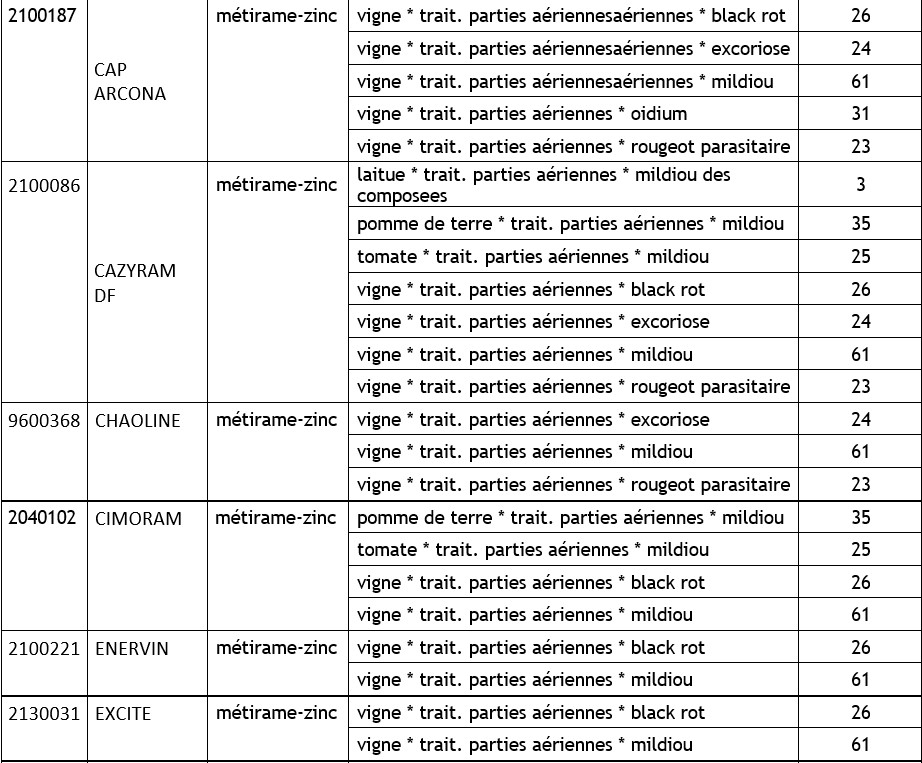

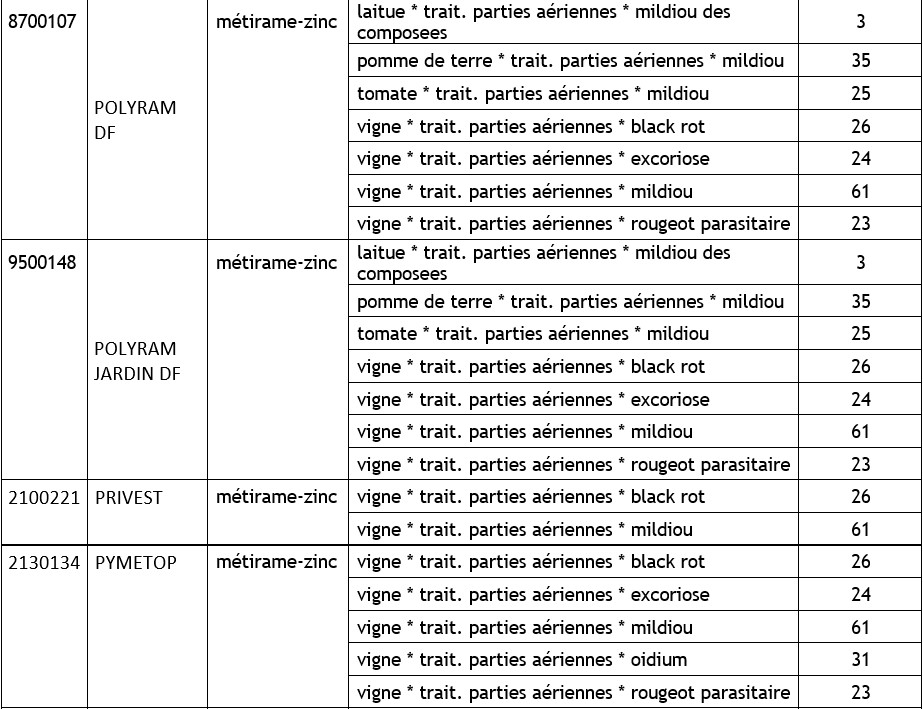
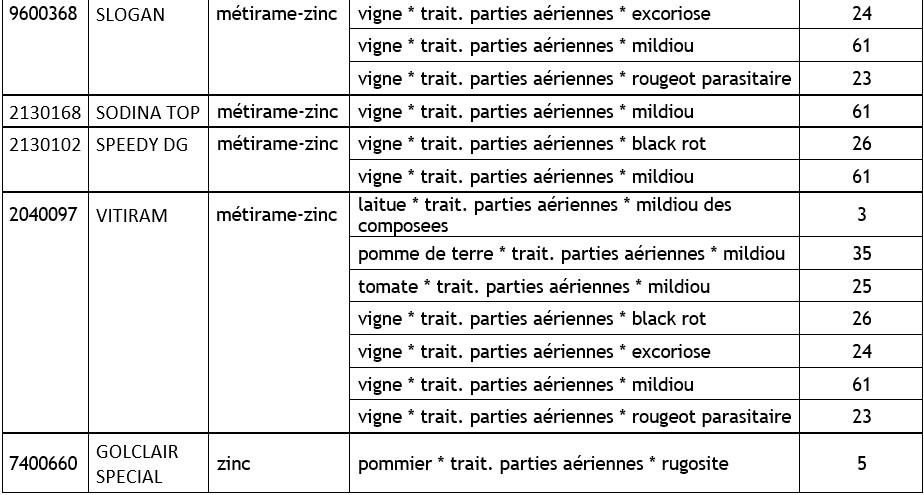
D'après ACTA (2014), de nombreuses substitutions sont possibles quant à l'usage du zinc en tant que substance active de produits phytosanitaires ou en tant qu'additif. Sans porter de jugement sur la portée agronomique de ces alternatives, notons que des substituts sans zinc sont identifiés pour les toutes les applications citées dans le Tableau 13.
Les toitures
Le zinc est utilisé dans les toitures pour le revêtement complet ou partiel par la jonction de tôle de zinc.
Le remplacement du zinc par un autre métal est une solution alternative coûteuse. En effet, la réalisation d'une toiture neuve avec un recouvrement de toiture en cuivre reviendrait à 120 €/m2 alors qu'un un recouvrement de toiture en zinc reviendrait à environ 90 €/m2 . De plus, le cuivre fait aussi l'objet de l'action de réduction des substances dangereuses dans l'eau dite RSDE (notons qu'une fiche technico-économique sur le cuivre est également disponible). Ce matériau est donc difficilement envisageable comme substituant au zinc.
Une autre solution rapportée pour substituer le zinc dans les toitures consiste en l'emploi d'autres matériaux non-métalliques tels que les bardeaux d'asphalte, de bois, de plastique et de fibres de verre, les tuiles traditionnelles, les tuiles de plastique, les tuiles de béton, … Mais certaines au moins de ces alternatives ont des inconvénients puisqu'elles ont recours à d'autres substances chimiques : HAP pour les asphaltes, additifs et monomères pour les plastiques, …
Les couvertures de toiture alternatives aux revêtements en zinc sont généralement moins chères que l'usage du zinc :
- tuiles de terre cuite (50 à 60 €/m2) ;
- les tuiles Sneldek (environ 30 €/m2)62 ;
- ...
[62] Les prix indicatifs de toitures et zingueries viennent du site : (consulté en mars 2014). http://www.livios.be/fr/etapes-de-construction/gros-oeuvre/toiture/prix-indicatifs-toiture/
Les lisiers animaux
Les lisiers animaux sont responsables d'une partie des apports diffus en zinc aux sols. Un contrôle plus strict des quantités de cet élément administré aux animaux en tant que supplément alimentaire pourrait être à étudier.
En effet, les lisiers animaux représentant près de 12 tonnes/an de zinc en France (cf. paragraphe 3.4), la mise en œuvre d'une telle mesure pourrait permettre le gain de plusieurs tonnes de rejet de zinc par an vers les sols.
Les chauffages individuels au bois
La consommation de bois libère le zinc contenu dans la biomasse par des fumées de combustion. La réduction de ces émissions peut donc s'envisager par le remplacement de ces systèmes de chauffage, notamment en privilégiant la combustion de bois non transformé(ADEME 2010a, DGEMP 2010).
Autres produits ou utilisation du zinc
Le chromate de zinc est utilisé dans la fabrication de peintures anticorrosion. D'après l'INRS (2011), il est possible de le substituer dans la plupart de ses applications. Les substituts envisagés sont :
- phosphates mixte de zinc-aluminium ;
- phosphate de zinc ;
- phosphate de calcium ;
- phosphate de magnésium ;
- molybdate de zinc ;
- ferrite de calcium…
Néanmoins de nombreux substituts possibles au chromate de zinc sont aussi des composés du zinc.
Le chlorure de zinc est utilisé comme agent de conservation pour le bois. D'après le TURI, le chlorure de zinc peut être substitué par l'acétate de cuivre, le carbonate de cuivre, le citrate de cuivre ou l'oxyde cuprique63 .
[63] (consulté en juin 2014). http://www.turi.org/TURI_Publications/TURI_Chemical_Fact_Sheets/Arsenic_and_Arsenic_Compounds_Fact_Sheet/Arsenic_and_Arsenic_Compounds_Facts/Alternatives
Conclusion
FTE 2015 Importer
Le zinc et ses composés sont naturellement présents dans la croûte terrestre. Leur présence dans l'eau, le sol et l'air a également une origine anthropique.
Les secteurs d'activités principalement concernés sont la sidérurgie, la métallurgie et le coke. Les émissions sont majoritairement des émissions vers les sols (50 %) et des émissions vers les milieux aquatiques (30 %). Le secteur industriel de l'agroalimentaire et des boissons, et le secteur agricole (émissions dues aux déjections animales et à l'usage de produits phytosanitaires) sont émetteurs du zinc et de ses composés dans les sols. Les émissions dans l'eau sont principalement dues aux secteurs du traitement d'eau urbaine, la sidérurgie, la métallurgie et le coke, la chimie et la parachimie, les déchets et les traitements des déchets, la mécanique et les traitements de surfaces ; et au secteur du textile, habillement, teinture, impression et laverie. Les émissions vers l'air représentent environ 20 % des émissions totales et sont majoritairement dues à l'activité de la métallurgie des métaux ferreux. L'usure des toitures, des gouttières et des pneus contenant du zinc et la consommation de bois de chauffage induit également des émissions de zinc vers les eaux et vers l'air.
Nous n'avons pas identifié de substitut générique au zinc et à ses principaux composés pour leurs principaux secteurs d'utilisation. Néanmoins, des pistes alternatives sont disponibles pour un grand nombre de secteurs d'utilisation directs ou indirects de ces substances :
- Usages phytosanitaires ;
- Usages comme matériaux de couverture ;
- Combustion pour la production d'énergie ;
- …
D'autre part, des techniques de réduction des émissions industrielles existent, ce sont le traitement des effluents industriels aqueux, le recyclage des chutes de production de la filière hydro-métallurgique, la valorisation des résidus riches en zinc et en sulfates, le recyclage du zinc à partir d'acier galvanisé, la valorisation de poussières des aciéries électriques et le traitement des résidus d'épuration des fumées d'incinération d'ordures ménagères.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :