Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Phénol (108-95-2)
Informations générales
Dernière vérification le 18/12/2025
Identification
Numero CAS
108-95-2
Nom scientifique (FR)
Phénol
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
203-632-7
Code SANDRE
5515
Numéro CIPAC
-
Formule chimique brute
\(\ce{ C6H6O }\)
Code InChlKey
Code SMILES
Oc(cccc1)c1
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H314 |
|---|---|
| Mention du danger - Texte | Provoque de graves brûlures de la peau et de graves lésions des yeux. |
| Classe(s) de dangers | Corrosion / Irritation cutanée |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Skin Corr. 1B;H314: C ≥ 3 % Skin Irrit. 2;H315: 1 % ≤ C < 3 % Eye Irrit. 2;H319: 1 % ≤ C < 3 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H301 |
|---|---|
| Mention du danger - Texte | Toxique en cas d'ingestion |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H311 |
|---|---|
| Mention du danger - Texte | Toxique par contact cutané |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Mention du danger - Code | H331 |
|---|---|
| Mention du danger - Texte | Toxique par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Skin Corr. 1B;H314: C ≥ 3 % Skin Irrit. 2;H315: 1 % ≤ C < 3 % Eye Irrit. 2;H319: 1 % ≤ C < 3 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H341 |
|---|---|
| Mention du danger - Texte | Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Mutagénicité sur les cellules germinales |
| Libellé UE du danger | - |
| Mention du danger - Code | H373 |
|---|---|
| Mention du danger - Texte | Risque présumé d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Toxicité spécifique pour certains organes cibles (exposition répétée) |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Skin Corr. 1B;H314: C ≥ 3 % Skin Irrit. 2;H315: 1 % ≤ C < 3 % Eye Irrit. 2;H319: 1 % ≤ C < 3 % |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
94.11 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Dangers physiques
Dernière vérification le 29/03/2024
Explosivité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Inflammabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
Dans l'atmosphère, le phénol existe surtout en phase gazeuse (Eisenreich, Looney, & Thornton, 1981). Sa demi-vie estimative y varie en général selon des conditions atmosphériques précises (p. ex., température, moment de l'année); les publications donnent des temps de 2,28 à 22,8 h pour sa réaction avec les radicaux hydroxyle (Canton, Van der Heijden, & al., 1986) ; (Howard, 1989) ; (Howard, Boethling, Stiteler, Meylan, & Beauman, 1991). En raison de sa courte durée de vie, le phénol ne devrait pas franchir de grandes distances dans l'atmosphère.
Milieu eau douce
Au-dessus de 68,4 °C, le phénol est complètement miscible à l'eau (Sorensen & Arlt, 1980).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu terrestre
D’après les différentes valeurs de Koc retrouvées dans la littérature, mise à part la borne supérieure de l’intervalle que donne (Hempfling et al., 1997), le phénol serait mobile à moyennement mobile dans les sols.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Photodégradation
Dans l'atmosphère, le phénol réagit avec les radicaux hydroxyles formés photochimiquement. Une demi-vie de 14 heures pour la dégradation photochimique dans l'atmosphère est mentionnée sur la base d'une concentration atmosphérique en radicaux OH égale à 5 x 105 molécules.cm-3 (Canton et al., 1986).
En plus de la dégradation photochimique due aux radicaux hydroxyles, la dégradation par les radicaux NO3 peut aussi jouer un rôle important dans l'atmosphère. Une demi-vie approximativement égale à 44 minutes peut être calculée pour le phénol (CE, 2002).
Hydrolyse
Aucune investigation n'est disponible sur la dégradation du phénol par hydrolyse. Cependant, selon sa structure chimique, il n'est pas attendu d'hydrolyse sur le phénol.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau douce
La biodégradabilité du phénol a été démontrée dans un certain nombre d’expériences, sous les conditions les plus variées. Seuls, deux tests standardisés de biodégradabilité sont disponibles. Dans ces tests MITI I, les niveaux de dégradation se situent entre 60 et 70 % (après 4 jours) et 85 % (après 14 jours) (Urano & Kato, 1986 ; CITI, 1992). Avec ces résultats, le phénol peut être classé comme facilement biodégradable.
Hwang, Hodson, & Lee, 1986 ont déterminé le taux de dégradation microbienne du phénol biomarqué avec du 14C dans un échantillon d'eau d'estuaire, les concentrations en phénol étaient de 25 mg.L-1. Les expériences ont eu lieu en été (24 °C) et en hiver (10 °C). Les demi-vies pour la minéralisation du phénol étaient de 7 jours (k = 0,095 j-1) en été et 73 jours (k = 0,01 j-1) en hiver. En calculant la moyenne arithmétique de ces taux, on obtient un taux moyen de k = 0,05 j-1.
Rheinheimer, Gericke, & Wesnigk, 1992 ont examiné la minéralisation du phénol en eaux douces, en eaux estuariennes et en eaux de mer avec une concentration en phénol de 1 µg.L-1. La minéralisation a été déterminée en mesurant la formation de 14CO2 à partir du 14C marqué sur la substance testée. En eaux douces, la minéralisation après 24 h était de 31,4 %. Après 200 h elle était de 50 % et est restée constante jusqu'à la fin de l'expérience (50 jours). En eaux estuariennes, la minéralisation était, après 40 heures, seulement de 2 % mais a atteint 80 % après 200 heures. Dans les échantillons d'eaux de mer, la minéralisation variait entre 60 % après 21 jours et 93,5 % après 50 jours.
La biodégradabilité du phénol en eaux souterraines, eaux de rivière et eaux portuaires a été examinée par (Vaishnav & Babeu, 1987). Les concentrations en phénol étaient de 0,8, 1,6 et 3,2 mg.L-1. La biodégradation était de 60 % (eaux de rivière) et 45 % (eaux souterraines) après 20 jours, et 88 % (eaux portuaires) après 15 jours.
Les tests cités ci-dessus montrent que le phénol peut être minéralisé en eaux douces et en eaux de mer.
Haider, Jagnow, Kohnen, & Lim, 1981 ont étudié la biodégradation dans le sol du phénol marqué au 14C. Après 3 jours, 1, 2, 5 et 10 semaines, la minéralisation était respectivement de 45,5 %, 48 %, 52 %, 60 % et 65 %.
Une minéralisation incomplète dans les sols a été trouvée au cours d'autres expériences. (Scow, Simkins, & Alexander, 1986) ont mesuré moins de 50% de minéralisation dans le sol. Les auteurs ont conclu que cela était peut-être le résultat de l'adsorption de la substance testée.
Bioaccumulation
Organismes aquatiques
La bioaccumulation du phénol a été étudiée par (Butte, Willing, & Zauke, 1985) chez Brachydanio rerio comme organisme test. Le test a été conduit selon les lignes directrices 305 E de l'OCDE. Les poissons ont été exposés dans un système continu à une concentration en phénol de 2 mg.L-1. Un BCF de 17,5 a pu être calculé. La concentration maximale en phénol dans le poisson était de 35 mg.kg-1.
Freitag, Ballhorn, Geyer, & Korte, 1985 ont mesuré la bioaccumulation du phénol marqué au 14C sur Leuciscus idus. Un BCF de 20 a été trouvé.
Kobayashi & Akitake, 1975 ont étudié l'absorption et l'excrétion du phénol par Carassius auratus. Ces poissons ont été exposés à des concentrations en phénol variant de 5 à 100 mg.L-1 dans un système semi statique pendant 5 jours. Des facteurs de bioconcentration variant entre 1,2 et 2,3 ont été trouvés.
L'élimination et le métabolisme du phénol par Pimephales promelas ont été étudiés par (Call, Brook, & Lu, 1980). Les poissons ont été exposés à un système continu pendant 28 jours à du phénol radiomarqué ayant pour concentration 2,5 et 32,7 µg.L-1. Les facteurs de bioconcentration se trouvaient entre 14 500 et 17 000. Cependant le phénol a été rapidement métabolisé par les poissons et ces résultats indiquent une rétention de certains métabolites du phénol. Un BCF de 4 300 a pu être estimé à partir des concentrations en phénol dans les poissons. Cependant ces résultats sont en contradiction avec tous les autres, et doivent être utilisés avec précaution.
En conclusion, il peut être statué que le phénol a un faible potentiel de bioaccumulation. Cela se confirme par le log Kow égal à 1,47. Selon l'équation de (Veith, De Foe, & Bergstedt, 1979) donnée dans le Technical Guidance Document de l’Union Européenne, un BCFpoisson de 3,5 peut être dérivé de cette valeur.
Un BCF de 17,5 a été sélectionné (CE, 2002).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Importer Aucun résultat d’essai valide n’a pu être trouvé dans la littérature
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (IARC, 1989, 1999 ; ATSDR, 1998, 2008 ; OMS IPCS, 1994 ; UE, 2006 ; US EPA (IRIS), 2002 ; INRS, 2011, 2021 ; EFSA, 2013). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Le phénol est rapidement absorbé par toutes les voies d’exposition.
Inhalation
L’absorption est estimée à 70 à 80 % chez des volontaires exposés pendant 6 heures, par inhalation uniquement, à des vapeurs de phénol pour des concentrations comprises entre 6 et 20 mg.m-3 (Piotrowski, 1971).
Voie orale
L’absorption est quasi-totale par voie orale puisque environ 90 % d'une dose unique de 0,01 mg.kg-1 de phénol 14C administré via la nourriture ou l’eau de boisson à trois volontaires sont éliminés dans les urines en 14 heures (Capel et al., 1972a).
Voie cutanée
Dans une autre expérience, des volontaires ont été exposés uniquement par voie cutanée aux vapeurs de phénol à des concentrations de 1,3 – 2,6 – 6,5 ppm pendant 6 heures (Piotrowski, 1971). Le coefficient moyen d’absorption cutanée a été évalué à 0,35 m3.h-1, par comparaison à celle mesurée pour des expositions par inhalation seule. Dans cette étude, les sujets sont mis sous masque respiratoire permettant une inhalation d’air pur.
Une absorption 13 % en 30 minutes d’une solution aqueuse de phénol appliquée sur les avant-bras (15,6 cm2) a été mesurée chez des volontaires pour des doses de 2,5 – 5,0 – 10,0 g.L-1 pendant 60 minutes soit une dose de 0,08 mg.cm-2.h-1 (Baranowska-Dutliewicz, 1981). La voie cutanée est considérée comme étant la principale voie d’entrée en milieu professionnel (ACGIH, 2005).
L’absorption cutanée réalisée à partir d’un test in vitro sur de la peau humaine est de 20 % et atteint 47 % lorsque la peau est recouverte de téflon (Hotchkiss et al., 1992).
Distribution
Les données sont limitées chez l’homme, mais les caractéristiques physico-chimiques du phénol laissent penser qu’il est rapidement distribué dans tous les tissus.
Dans les cas d’ingestion volontaire ou accidentelle, le phénol a pu être dosé dans le cerveau, les reins, le foie, la bile et les poumons (Lo Dico et al., 1989 ; Tanaka et al., 1998 ; Boatto et al., 2004).
Métabolisme
Le foie, les poumons, les reins et la muqueuse gastro-intestinale sont les principaux sites de métabolisation du phénol. Ceux-ci dépendent de la voie d’exposition. L’ensemble des voies de métabolisation est présenté ci-dessous.
Métabolisme du phénol (ATSDR, 2008).
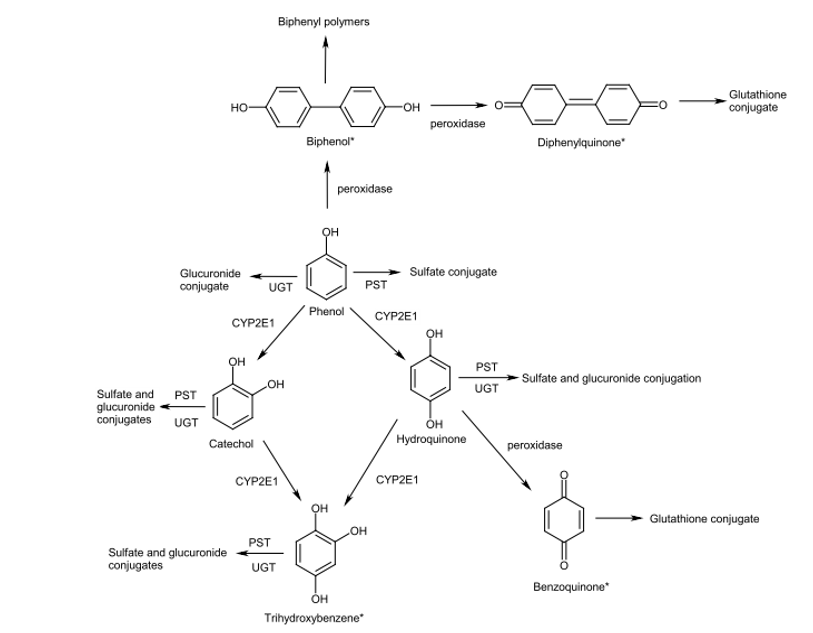
PST : phénol sulfotranférase, UGT : transférase dépendant de l’UDP-glucurosyl * métabolites identifiés uniquement in vitro
Les voies métaboliques sont principalement la conjugaison (majoritaire) et l’hydroxylation.Le phénol subit une phase de conjugaison soit par la phénol sulfotransférase (PST) ou la glucuronosyl transférase UDP-dépendante (UGT) pour former des sulfo- et glucurono-conjugués. Le phénylsulfate est le principal métabolite (77 % sont excrétés dans les urines en 24 heures). Cette sulfatation se réalise dans la plupart des tissus, les sites majeurs de conjugaison étant le foie, les poumons et la muqueuse gastro-intestinale (INRS, 2014). Le phénolglucuronide retrouvé dans les urines représente 16 % de la dose administrée (Capel et al., 1972a). Le phénol peut également être hydroxylé par le cytochrome P450 2E1 et conduire à la formation d’hydroquinone et dans une moindre mesure de catéchol et subir) secondairement l’action des enzymes de phase II (Buxton, 2006 ; Campbell et al., 1987 ; Gut et al., 1996 ; Koop et al., 1989 ; Powley et Carlson, 2001 ; Snyder et al., 1993). L’hydroquinone pourra également subir une peroxydation pour former de la benzoquinone ultérieurement conjuguée au glutathion ou de nouvelles oxydations pour former du trihydroxybenzène. Par ailleurs, la formation de métabolites réactifs comme le 4,4-biphénol ou le diphénoquinone est rapportée, lors d’études réalisées in vitro, avec des neutrophiles humains activés ou des leucocytes (Eastmond et al., 1986 ; Post et al., 1986).
Élimination
Le phénol est essentiellement éliminé par voie urinaire (Deichmann, 1944a, Capel et al., 1972a, Capel et al., 1972b).
Le phénol est normalement éliminé dans les urines des sujets sans exposition connue (Bruce et al., 1987). Cependant, il existe une corrélation entre les concentrations urinaires en phénol et l’exposition humaine.
Les concentrations urinaires en phénol sont de 13,8 mg.L-1 chez des individus non exposés et de 67,8 mg.L-1chez des travailleurs exposés (Bieniek, 1994). Une autre étude a mesuré une concentration urinaire en phénol de 5,1 mg.L-1 chez des individus non exposés (Quint et al., 1998). Ces concentrations urinaires semblent dépendre notamment du régime alimentaire (Ling et Hanninen, 1991).
Les principaux métabolites urinaires sont le phénylglucuronide, le phénylsulfate, 1,4-dihydroxybenzène glucuronide et le 1,4-dihydroxybenzène-sulfate (Capel et al., 1972b ; Tremaine et al., 1984 ; Wheldrake et al., 1978).
Chez l'animal
Absorption
Inhalation
Chez le rat, plus de 90 % de la concentration inhalée (25 ppm de phénol 14C pendant 6 heures soit 98 mg.m-3) est détectée dans les urines 30 minutes après le début de l’exposition (Hiser et al., 1994).
Voie orale
Chez le rat, le porc et le mouton, il a été montré que plus de 95 % de la dose administrée par voie orale sont absorbés lors d’une administration unique de 25 mg.kg-1 de phénol 14C en solution aqueuse (Kao et al., 1979).
Voie cutanée
Chez le rat, l’absorption cutanée est estimée à 1 à 5 % de la dose de 0,03 mg.kg-1 de phénol 14C à 72 heures (Hughes et Hall, 1995). Chez le porc, l’absorption cutanée est également décrite mais n’a pas été quantifiée (Pullin et al., 1978).
Distribution
Le phénol est rapidement distribué dans tous les tissus (EU, 2006 ; Hughes et Hall, 1995 ; Hiser et al., 1994). Environ la moitié du phénol plasmatique est transportée sous forme conjuguée (Liao et Oehme, 1981).
Métabolisme
Chez le rat, le phénol est majoritairement sulfaté mais cette voie est saturable et à forte dose les glucurono-conjugaisons deviennent majoritaires (Hiser et al., 1994). Les autres voies métaboliques, notamment la formation d’hydroquinone, sont minoritaires (Capel et al., 1972a, Capel et al., 1972b).
Chez la souris, il a été montré que la formation d’hydroquinone est catalysée par les cytochromes 2E1 (Powley et Carlson, 2001). Ces cytochromes sont impliqués dans la moitié des transformations au niveau hépatique et les cytochromes 2E1 et 2F2 sont majoritaires au niveau pulmonaire.
Compte tenu des différences métaboliques entre espèces, le chat et le cochon qui présentent une faible activité phénol glucuronyltranférase et métabolisent presque exclusivement le phénol en phényl sulfate (Capel et al., 1972a, Capel et al., 1972b ; French et al., 1974 ; Miller et al., 1976) ne sont pas de bons modèles pour les extrapolations à l’homme.
Élimination
La voie urinaire est la principale voie d’élimination (Deichmann, 1944a ; Kao et al., 1979 ; Dow Chemical Compagny, 1994).
Autre
Mécanisme d’action
Les études chez la souris ont montré que l’application cutanée de phénol augmente la formation de radicaux libres cutanés et diminue la capacité antioxydante locale conduisant à la formation de dommages aux protéines, à l’ADN et aux lipides (Murray et al., 2007).
Le phénol pourrait induire des effets cardiaque par blocage d’un sous-type de canal sodium et des effets mineures au niveau des muscles squelettiques également par inhibition des canaux sodiques (Zamponi et French, 1994).
Modèles pharmacocinétiques
Le premier modèle pharmacocinétique a été développé afin d’appréhender le phénol en tant que métabolite principal du benzène (Bois et al., 1991). Deux autres modèles ont ensuite été développés : un à deux compartiments (Schlosser et al., 1993 ; Medinsky et al., 1995) et un autre à un compartiment (Pierrehumbert et al., 2002).
Synthèse
Chez l’homme, le phénol est rapidement absorbé quelle que soit la voie d’exposition. Les organes cibles sont le cerveau et les reins. Le foie, les poumons, les reins et la muqueuse gastro-intestinale sont les principaux sites de métabolisation du phénol. Le phénylsulfate est le principal métabolite. Le phénol est essentiellement éliminé par voie urinaire. Les concentrations urinaires en phénol sont corrélées avec les niveaux d’exposition.
Chez l’animal, le phénol est bien absorbé par inhalation (90 %) ou par voie orale (95 %) et faiblement par voie cutanée (1 à 5 %). Au niveau hépatique, le phénol est métabolisé en dérivés sulfatés mais cette voie est saturable. Les cytochromes, principalement les 2E1, sont également impliqués dans la métabolisation. L’élimination du phénol est majoritairement urinaire. Le phénol engendrerait une dégénérescence axonale du système nerveux périphérique.
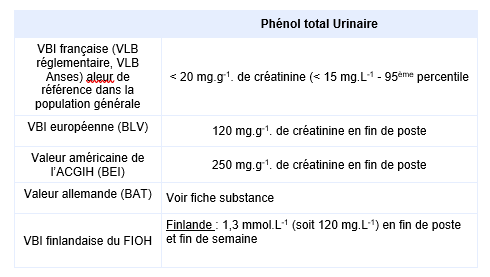
Equivalents biosurveillance
Description
Synthèse des principales valeurs biologiques d’interprétation (Biotox, janvier 2022)
Toxicité aiguë
Chez l'homme
Inhalation
Une étude sur l’absorption par inhalation a été menée sur 8 volontaires (7 hommes et une femme) exposés, au moyen d’un masque à inhalation, à des vapeurs de phénol de concentrations comprises entre 5 et 25 mg.m-3 (1,3 et 6,5 ppm) pendant 8 heures (avec 2 arrêts de 30 minutes après 2h30 et 5h30) (Piotrowski, 1971). Les seuls paramètres évalués concernant la toxicocinétique, il n'y a pas eu de recherche spécifique
Voie orale
Différents cas d’intoxications sont rapportés lors d’ingestions accidentelles ou intentionnelles de phénol, les symptômes sont similaires à ceux observés lors de l’exposition par voie cutanée. Dans un cas l’ingestion de 4,8 g de phénol a entraîné le décès en 10 minutes (Andersen, 1869). Les décès sont généralement rapportés pour des doses de 140 à 290 mg.kg-1 (INRS, 2011).
Un cas d’intoxication par ingestion d’eau de boisson contaminée par du phénol est survenu dans le Wisconsin en 1974. Les quantités ingérées ont été estimées entre 10 et 240 mg de phénol par personne. Chez les personnes exposées, une augmentation statistiquement significative des diarrhées, des inflammations et des brûlures buccales est observée, ainsi que la présence d’urines colorées en noir. Ces anomalies ne sont pas retrouvées lors d’un examen pratiqué 6 mois après l’exposition (Delfino et Dube, 1976; Baker et al., 1978).
Dans une étude similaire, menée en Angleterre, les concentrations en phénol dans les eaux de boisson ont été estimées à 10 µg.L-1 dans la zone la plus exposée et 4,7 µg.L-1 dans les zones les moins exposées le premier jour de la contamination. Puis les concentrations ont été mesurées à 4,7 µg.L-1 dans les deux zones à 24 heures et à 0,9 µg.L-1 au bout de 2 jours (Jarvis et al., 1985). Même si des effets gastro-intestinaux ont été observés chez les individus exposés par rapport à ceux non exposés un lien de causalité avec le phénol reste difficile à déterminer.
Une étude cas-témoin a été menée chez 6 913 individus vivants à proximité d’une rivière contaminée accidentellement par 30 tonnes de phénol pur en Corée (Kim et al., 1994). Des nausées, des vomissements, des diarrhées et des douleurs abdominales ont été diagnostiquées chez 1 824 individus exposés par comparaison avec 1 064 individus non exposés. Le niveau de contamination n’a pas été quantifié.
Voie cutanée
Le phénol a été utilisé comme désinfectant et antiseptique, mais son usage est maintenant limité suite à différentes intoxications lors de l’exposition par voie cutanée.
Les effets locaux rapportés sont des érythèmes ou des dépigmentations cutanées (Dreisbach, 1983) et, dans les cas les plus sévères, des corrosions pouvant même atteindre le stade de nécrose (Schmidt et Maibach, 1981). L’utilisation de solutions de 5 à 10 % de phénol comme antiseptique pour les vêtements a induit de nombreuses nécroses nécessitant parfois l’amputation de doigts ou d’orteils (Cronin et Brauer, 1949 ; Deichmann, 1949 ; De Groote et Lambotte, 1960 ; Abraham, 1972).
Lors de l’exposition par voie cutanée, une intoxication systémique a été observée. Il s’agit d’une acidose métabolique sévère et d’un choc cardiovasculaire pouvant entraîner la mort. Des arythmies cardiaques (supra-ventriculaires et ventriculaires) sont rapportées chez 10 des 42 patients dans les 10 minutes qui suivent une application cutanée d’un traitement cosmétique du visage contenant 5 % de phénol (Truppman et Ellenby, 1979). Des hyperventilations, des atteintes rénales, méthémoglobinémies sont également rapportées dans plusieurs cas d’exposition cutanée.
Le phénol a également été utilisé pour des techniques de chirurgie plastique pendant 30 ans (Ersek, 1991). Le mélange utilisé était classiquement constitué de 3 mL de phénol à 50 %, de 2 mL d’eau et de 8 gouttes de savon et 8 gouttes d’huile de croton. En application cutanée, ce mélange permettait une dépigmentation. Dans ce type d’utilisation, il a été rapporté que plus de 30 % des adultes présentaient des dysrythmies (Morrison et al., 1991). Le seul cas publié dans la littérature correspond à l’utilisation d’un mélange de composition voisine (40 % de phénol, 0,8 % d’huile de croton dans du savon à base d’hexachlorophène et d’eau) chez un enfant âgé de 10 ans. Ce mélange a été appliqué sous anesthésie sur 1,9 % de la surface corporelle. Cinquante-cinq minutes après le traitement, des extrasystoles ventriculaires polymorphes sont observées en l’absence de modification de la pression artérielle et des concentrations en sodium et potassium plasmatiques (Warner et Harper, 1985).
Dans le cadre de l’utilisation détournée de créoline (désinfectant vétérinaire à base d’environ 26 % de phénol, variable selon les formulations) pour un traitement anti-poux, les applications sur la tête et le torse d’un enfant de 9 ans ont entraîné les signes d’une toxicité cutanée et systémique au phénol (Vearrier et al., 2014). Après des troubles rapides de la conscience, sensations de brulures avant l’appel des secours, puis sous dépression respiratoire et arythmie cardiaque à son arrivée aux urgences, l’enfant mis sous ventilation artificielle présentait des érythèmes localisés aux sites d’applications du produit qui se sont rapidement répandus jusqu’aux bras en s’accompagnant d’une hyperpigmentation brunâtre, puis une desquamation partielle au 3e jour. En plus de la coloration des urines au 2e jour, des pics transitoires des transaminases hépatiques (ALAT et ASAT) ont été rapportées, respectivement au 1er et 3e jour d’hospitalisation. L’enfant est rentré à son domicile au 4e jour. A noter que la créoline renferme aussi des goudrons de houille qui peuvent partiellement participer au toxidrome et peut être faussement aggraver les signes cliniques. Un cas d’exposition accidentelle en milieu professionnel est observé chez un salarié partiellement immergé pendant quelques secondes dans une solution contenant 20 % de phénol dans du dichlorométhane. Malgré les soins immédiats, un collapsus est observé. La victime a été brûlée à 50 %, elle présente des nausées, des vomissements, une anurie et une détresse respiratoire. Une polyurie «marginale» est encore observée un an après l’accident (Foxall et al., 1991).
Le phénol ne semble pas induire de signe d’allergie de contact (Wantke et al., 1996).
Synthèse
Chez l’homme, le phénol induit :
- Des effets locaux : en cas d’application cutanée, une dépigmentation cutanée et un érythème ou une nécrose de la peau et, en cas d’ingestion, des brûlures buccales et des irritations gastro-intestinales.
- Des effets systémiques : quelle que soit la voie d’exposition, un choc cardiovasculaire, une acidose métabolique sévère, une hyperventilation, des effets neurologiques, des atteintes rénales et hépatiques, de la méthémoglobinémie, ainsi que des urines colorées en noir.
Chez l'animal
Toutes voies
Lors d’exposition aiguë, la mort survient le plus souvent suite à une dépression du SNC.
Inhalation
Aucune CL50 n’a été publiée.
Des rats Harlan-Wistar femelles sont exposés par lot de 6 pendant 8 heures à un aérosol de phénol à 900 mg.m-3 (234 ppm). Le diamètre des gouttelettes est < 1 µm (Flickinger, 1976). Cette exposition n’entraîne pas la mort des animaux mais des irritations oculaires et nasales sont observées ainsi qu’une légère perte de la coordination motrice associée à des spasmes des muscles squelettiques dans les 4 heures suivant l'exposition. Des tremblements et une prostration ont également été observés chez un rat (1/6) dans les 8 heures suivant l’inhalation de phénol.es effets rénaux (dégénérescence tubulaire), hépatiques (nécrose) et thymiques (nécrose) ont été notés chez des rats femelles exposés par gavage 40 mg.kg-1.j-1 (véhicule aqueux) durant 14 jours (Berman et al., 1995).
Des atteintes du SNC qui se traduisent par un réflexe d’agrippement et à une atteinte des fonctions vestibulaires sont rapportées chez le rat exposé en continu à 100 mg.m-3 (26 ppm) de phénol pendant 15 jours (Dalin et Kristofferson, 1974). Dans cette étude, une augmentation des activités sériques des enzymes hépatiques est observée.
En revanche, aucun effet notable n’est rapporté dans une étude où des rats (mâles et femelles) ont été exposés à des concentrations de 0 – 0,5 – 5 – 25 ppm (soit 0 - 1,96 – 19,55 - 97,75 mg.m-3) de phénol administré sous forme de vapeur (nez seul), 6 h.j-1, 5 j.sem-1, pendant 2 semaines (soit une exposition totale de 60 h)(Hoffman et al., 2001). Des cas isolés d’animaux présentant une chromodacryorrhée, caractérisée par des écoulements rouges au niveau des yeux et des naseaux, sont selon les auteurs sans lien avec l’exposition au phénol (non détaillé dans l’article). Les variations de la prise de nourriture des animaux exposés à la plus forte concentration de 25 ppm (diminution au cours de la deuxième de traitement chez les femelles et augmentation au cours de la première semaine qui a suivi l’arrêt du traitement chez les mâles) ont été sans effet sur la croissance pondérale des animaux aussi bien pendant la phase d’exposition qu’au cours des deux semaines suivant l’arrêt du traitement. Les paramètres sanguins (hématologiques et biochimiques), de même que les examens macroscopiques et histologiques des organes (nasopharynx, larynx, trachée, bronches, poumons, reins, foie, rate) n’ont globalement pas été altérés pendant le traitement par comparaison au lot témoin, de même, ainsi qu’au cours des deux semaines de récupération.
Le phénol est un irritant respiratoire, avec une RD50 (diminution de 50 % de la fréquence respiratoire) chez la souris de 166 ppm (650 mg.m-3) (De Ceaurriz et al., 1981).
Voie orale
Le tableau suivant résume les DL50 pour des expositions par voie orale chez l’animal. Les DL50 par voie orale varient de 340 à 530 mg.kg-1 chez le rat, de 300 à 427 mg.kg-1 chez la souris et de 400 à 600 mg.kg-1 chez le lapin. Les résultats montrent une faible variabilité inter-espèces.
Les signes cliniques généralement décrits regroupent une respiration ralentie et irrégulière, une salivation, une dyspnée, des tremblements et des convulsions, de même qu’un état léthargique évoluant en coma (INRS, 2011).
Toxicité aiguë au phénol par voie orale :

Voie cutanée
Les principales DL50 pour des expositions cutanée chez l’animal sont rapportées dans le tableau suivant.
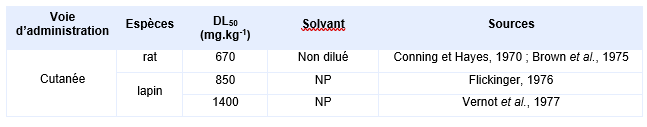
Le rat est plus sensible que le lapin à des expositions au phénol par voie cutanée. En plus de la létalité, des effets rénaux (hémoglobinurie sévère), cardiovasculaires (arythmie cardiaque et tachycardie ventriculaire) et neurologiques (tremblements musculaires, convulsions, prostration et perte de conscience) ont été rapportés (US EPA, 2002)
Tout comme chez l’homme, des irritations cutanées sont rapportées lors de l’exposition au phénol. Il s’agit d’érythèmes, d’inflammation, de décoloration, d’eczéma, de papillomes et de nécrose (Deichmann, 1949 ; Deichmann et al., 1950 ; Conning et Hayes, 1970 ; Pullin et al., 1978).
Le phénol n’induit pas de sensibilisation cutanée dans le test de Magnusson et Kligmann (Itoh, 1982).
Synthèse
Chez l’animal, le phénol est un irritant nasal et oculaire par inhalation pouvant entrainer des effets sur le SNC (baisse de coordination, spasmes musculaires, tremblement). Pour des intoxications aiguës par voie orale, La mort survient le plus souvent suite à une dépression du SNC. Par voie cutanée, les lésions cutanées sévères (érythèmes suivis de nécrose) s’accompagnent, comme par voie orale, d’effets neurologiques, rénaux et cardiovasculaires.
Toxicité à doses répétées
Effets généraux
Chez l'homme
Inhalation
Expositions professionnelles
Plusieurs études réalisées en milieu professionnel rapportent des cas d’intoxication chronique au phénol connus sous le nom de marasme phéniqué. Chez un salarié exposé pendant 13 ans à des vapeurs de phénol, les symptômes observés sont une anorexie, une perte de poids, des céphalées, des vertiges, une hyper-salivation et des urines colorées en noir (Merliss, 1972).
Dans une usine de bakélite où le niveau d’exposition atteignait 3,3 ppm (13 mg.m-3) aucun effet indésirable n’est rapporté (Ohtsuji et Ikeda, 1972).
Une étude de mortalité par pathologie cardio-vasculaire a été menée sur une population de 1 282 salariés de type caucasien dans l’industrie du caoutchouc et du pneu (Wilcosky et Tyroler, 1983). Les salariés étaient exposés à 25 solvants différents. Le suivi a été réalisé sur une période de 15 ans. Un lien entre la mortalité par maladie cardio-vasculaire (augmentation statistiquement significative de la mortalité par ischémie cardiaque) et l’exposition au phénol a pu être établi. Cependant, cette étude n’a pas pris en compte les habitudes tabagiques, les cas d’hypertension artérielle et d’hypercholestérolémie.
Les autres études qui ont tenté d’associer l’exposition au phénol et différents effets n’ont pas permis de conclure en raison de la présence d’autres substances toxiques comme le formaldéhyde.
Exposition via l’environnement
Une exposition accidentelle est survenue au Wisconsin du Sud (USA) en juillet 1974, les familles dont les puits ont été contaminés ont continué à consommer l’eau pendant plusieurs semaines (Baker et al., 1978). Chez 17 individus, ayant consommé cette eau contaminée, des signes de marasme phéniqué ont été décrits pour des expositions estimées à 0,14 - 3,42 mg.kg-1.j-1.
Synthèse
Chez l’homme, l’exposition par inhalation aux vapeurs de phénol induit un « marasme phéniqué » caractérisé par une anorexie, une perte de poids, des céphalées, des vertiges, une hyper-salivation et des urines teintées en noir. Des troubles digestifs ont été identifiés lors d’expositions environnementales au phénol via l’eau de boisson mais le lien de causalité reste difficile à établir.
Chez l'animal
Inhalation
Dans plusieurs études non publiées réalisées par Sandage (1961) et rapportées par plusieurs organismes (OMS IPCS, 1994 ; ATSDR, 1998 ; US EPA, 2002 ), des mâles singes (10), rats ( 50) ou souris (100) ont été exposés par inhalation à des vapeurs de phénol à la concentration de 5 ppm (19 mg.m-3) 8 h.j-1, 5 j.sem-1 pendant 90 jours. Aucune des études ne rapporte d’effet de l’exposition sur le poids des animaux, de même que des différents paramètres examinés (hématologiques, analyse urinaire, biochimie sanguine, fonction rénale, poids corporel). Le NIOSH (1976) rapporte chez la souris une augmentation du stress (nage sur parois lisses jusqu’à épuisement), mais dans les autres monographies, il n’est pas mentionné d’effet significatif de l’exposition sur le stress aussi bien chez les souris, les rat ou les singes. Par ailleurs, des examens histologiques du foie, des poumons, des reins, du cerveau et du cœur ont été réalisés en routine dans ces différentes études. Une augmentation du pourcentage d’animaux exposés présentant des « altérations pathologiques » au niveau du foie et reins est rapportée sans plus de précision. Toutefois, les auteurs ont conclu qu’aucun des signes cliniques ou histologiques ne présentaient d’importance d’un point de vue toxicologique. Par ailleurs, il n’est pas clairement mentionné si des effets irritants au niveau de l’arbre respiratoire supérieurs ont été recherché (OMS IPCS, 1994; ATSDR, 1998 ; US EPA, 2002). Le TCEQ a procédé à une nouvelle analyse des données qui est détaillée dans la partie VTR (TCEQ, 2014).
Chez le cobaye, une exposition aux vapeurs de phénol à raison de 100 à 200 mg.m-3 (26 à 52 ppm) 7 h.j-1, 5 j.sem-1,pendant 6 semaines entraîne une diminution pondérale, des difficultés respiratoires et des paralysies (Deichmann et al., 1944b). À l’examen histologique, des nécroses myocardiques, des pneumonies lobulaires aiguës et des atteintes rénales et hépatiques sont mises en évidence. Une mortalité importante survient dès la 20ème exposition. Chez le lapin exposé dans des conditions similaires, les altérations sont moins importantes et surviennent après 88 jours d’exposition.
Voie orale
Dans une étude du National Cancer Institute, des rats et des souris ont été exposés pendant 13 ou 103 semaines (NCI, 1980).
Des rats F344 ont été exposés à 0 – 100 – 300 – 1 000 – 3 000 – 10 000 ppm dans l’eau de boisson ce qui correspond à une dose estimée de 0 – 16 -48 – 160 – 480 – 800 mg.kg-1.j-1 pour les mâles et 0 – 17 – 51 – 170 – 510 – 1 140 mg.kg-1.j-1 pour les femelles et les souris B6C3F1 ont été exposées à 0 – 100 – 300 – 1 000 – 3 000 – 10 000 ppm dans l’eau de boisson ce qui correspond à une dose estimée de 0 – 25 – 75 – 250 – 450 – 500 mg.kg-1.j-1 pour les mâles et 0 – 26 – 78 – 260 – 468 – 520 mg.kg-1.j-1 pour les femelles de phénol dans l’eau de boisson pendant 13 semaines (NCI, 1980). Aucune anomalie histologique hépatique ou rénale n’a été observée. Seules des diminutions de poids corporel et de consommation de l’eau de boisson sont rapportées.
Au cours d’une seconde série d’études, des rats F344 ont été exposés à des doses de 0 – 2 500 – 5 000 ppm soit 0 – 260 – 585 mg.kg-1.j-1 pour les mâles et 0 – 280 – 630 mg.kg-1.j-1 pour les femelles et les souris ont été exposées à 0 – 2 500 – 5 000 ppm soit 0 – 450 – 660 mg.kg-1.j-1 de phénol dans l’eau de boisson pendant 103 semaines (NCI, 1980). Aucune anomalie de l’histologie hépatique ou rénale n’a été retrouvée chez les rats ou les souris.
Une autre étude a été menée chez le rat Sprague Dawley exposé au phénol (> 99 %) aux doses de 0 -200 – 1 000 ppm dans l’eau de boisson ce qui correspond à une dose calculée de 0 – 18 – 83,1 – 308 mg.kg-1.j-1 chez les mâles et 0 – 24,6 – 107 – 360 mg.kg-1.j-1 chez les femelles pendant 13 semaines (CMA, 1998b). Une analyse des atteintes neurologiques a été menée par une série de tests d’observations fonctionnelles et des tests d’activité motrice. Une diminution des activités motrices dès 360 mg.kg-1.j-1 chez les femelles, une diminution du poids corporel chez les mâles et les femelles ainsi qu’une diminution de la consommation d’eau de boisson sont rapportées.
Une autre étude a été menée chez la souris CD-1 exposée pendant 28 jours aux doses de 0 – 4,7 – 19,5 – 95,2 ppm dans l’eau de boisson ce qui correspond à une dose estimée de 0 – 1,8 – 6,2 – 33,6 mg.kg-1.j-1 (Hsieh et al., 1992). Une baisse de la production d’anticorps en réponse à un antigène dépendant des cellules T (érythrocytes de mouton) a été décrite aux deux plus fortes doses. Cette baisse de l’immunité a été confirmée à la plus forte dose par d’autres effets immunitaires réalisés sur différents tests (tests de stimulation des lymphocytes B, test de phyto-hémagglutinine des cellules T, baisse de la capacité de prolifération des lymphocytes, etc). . Une diminution du nombre d’érythrocytes est mesurée à toutes les doses en absence de modification de l’hématocrite, sauf à la dose la plus élevée. Une diminution dose dépendante des concentrations cérébrales de plusieurs neurotransmetteurs (noradrénaline, indoleamine, sérotonine et dopamine) et de leurs métabolites est aussi rapportée. Une LOAEL de 1,8 mg.kg-1.j-1 a été retenue sur la base des effets hématologiques et neurochimiques.
Voie cutanée
Des lapins ont reçu des applications répétées de phénol en solution aqueuse à des concentrations de 1,18 – 2,37 – 3,56 – 4,75 – 5,93 – 7,12 %, 5 h/j, 5 j/sem pendant 18 jours (Deichmann et al., 1950). Dans les lots exposés aux doses jusqu’à 4,75 %, la moitié des animaux ont été soumis à une application occlusive. Ces applications répétées de phénol induisent des tremblements à des concentrations supérieures ou égales à 2,37 % ainsi que des hyperkératoses au niveau de l’épiderme et des ulcérations aux concentrations supérieures à 3,56 %.
Synthèse
Chez l’animal, les effets rapportés se traduisent généralement au niveau systémique par une atteinte du SNC et périphérique (tremblements, baisse de motricité, paralysies), des poumons (difficultés respiratoires, pneumonies lobulaires), du foie (augmentation de l’activité des enzymes sériques hépatiques et nécroses), du cœur (nécroses myocardiques) et des reins (dégénérescences tubulaires).
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2004 |
| IARC | Groupe 3: l’agent (ou le mélange) ne peut être classé pour sa cancérogénicité pour l’homme | 1999 |
| US EPA | Classe D: Informations inadéquates pour évaluer le potentiel cancérogène | 2002 |
Chez l'homme
Toutes voies
Très peu d’études sont disponibles aussi bien chez l’homme que chez l’animal.
Inhalation
Dans une étude cas-témoin pratiquée chez 6 678 salariés de l’industrie du caoutchouc utilisant du phénol, aucune relation entre une augmentation des cancers du tractus respiratoire, de l’estomac, de la prostate, de lymphosarcomes ou de leucémie lymphatique et l’exposition au phénol n’a été mise en évidence (Wilcosky et al., 1984).
Dans une étude de mortalité réalisée chez 14 861 salariés de type caucasien employés avant 1966 dans 5 industries américaines, produisant ou utilisant du phénol et du formaldéhyde, aucun excès de cancers de la cavité buccale, du pharynx, de l’estomac, du foie, du pancréas, de la peau, de la prostate, des testicules, du cerveau ou de leucémies n’est rapporté (Dosemeci et al., 1991). Aucune augmentation des cancers du larynx SMR* = 1,1 [0,5-2,3 ; n = 7], des poumons SMR = 1,1 [0,9-1,3 ; n = 146], de la vessie SMR = 1,1 [0,6-1,4 ; n = 13], des reins SMR = 1,3 [0,7-2,1 ; n = 13] et du rectum SMR = 1,4 [0,8-2,2 ; n = 18] est observée. Chez les salariés exposés uniquement au phénol, un excès de cancer de l’œsophage SMR = 1,6 [0,9-2,6 ; n = 15] et de maladie de Hodgkin SMR = 1,7 [0,8-3,1 ; n = 10] est rapporté ; cependant, aucune relation dose-effet ne peut être établie. De plus, les effets observés ne sont pas statistiquement significatifs et il est très difficile de faire la part entre les différentes co-expositions.
Une étude cas-témoin, relative aux cancers du tractus respiratoire, a été menée au sein d’une étude de cohorte de 7 307 salariés finlandais de l’industrie du bois (Kauppinen et al., 1993). Une relation entre l’exposition au phénol et la survenue de cancer du tractus respiratoire semble possible : OR**] = 3,2 [1,8-5,6 ; n = 14] soit OR = 3,5 [1,8-7,0 ; n = 6] pour une période d’induction de 10 ans ou OR = 2,5 [1,2-5,0 ; n = 9] après ajustement avec les habitudes tabagiques. Cependant, les salariés exposés sur une période longue, supérieure à 5 ans, présentent un risque augmenté en dessous de la significativité statistique, OR = 1,4 [0,6-3,6 ; n = 7] que ceux exposés sur une période courte, comprise entre un mois et 5 ans : OR = 3,3 [1,0-11,0 ; n = 7]. Même si les salariés exposés au phénol sont exposés à d’autres substances chimiques, le phénol présente une relation plus forte que les autres substances.
* Ratio standardisé de mortalité : rapport du nombre de décès observés dans une cohorte d’individus au nombre de décès attendus, si le taux de mortalité de la population s’appliquait aux individus de cette étude.
** Odds Ratio : Probabilité d’être malade sur la probabilité de ne pas l’être chez les individus exposés et non exposés.
Synthèse
Chez l’homme, le phénol pourrait être à l’origine d’une augmentation de la survenue de certains cancers ; mais le lien n’est pas clairement établi.
Chez l'animal
Inhalation
A notre connaissance, il n’existe pas de données chez l’animal pour des expositions par inhalation.
Voie orale
Comme décrit précédemment, une étude de cancérogenèse par voie orale a été menée chez la souris, exposée au phénol (avec des impuretés) par l’eau de boisson à des doses de 0, 2 500 et 5 000 mg.L-1 (soit environ 281 et 375 mg.kg-1.j-1) pendant 103 semaines et sacrifiés entre une et trois semaines après la fin de l’exposition (NTP, 1980). Pendant toute la durée de l’exposition, une diminution pondérale dose-dépendante est observée chez les deux sexes. Conjointement une diminution de la consommation de l’eau de boisson est rapportée. Aucune incidence de tumeur n’est mise en évidence chez les deux sexes.
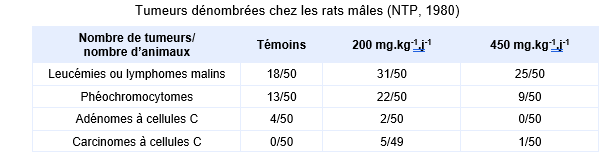
Dans une étude similaire, pratiquée chez le rat pour un protocole d’exposition rigoureusement identique à des doses d’environ 200 et 450 mg.kg-1.j-1, une réduction pondérale et une diminution de la consommation d’eau de boisson sont également rapportées, mais celles-ci surviennent après 20 semaines d’exposition (NTP, 1980). Une augmentation statistiquement significative de l’incidence des phéochromocytomes du tissu médullaire de la glande surrénale, des leucémies, des lymphomes et des carcinomes de la thyroïde est rapportée chez les mâles pour la dose la plus faible (2 500 mg.L-1 ou 200 mg.kg-1.j-1).
Voie cutanée
FDTE/VTR Importer Des expositions moyen-terme (3 applications deux fois par semaine pendant 20 semaines à 3 mg de phénol sur le dos) chez des souris FVB/N et leur lignée transgénique TG.AC ne provoquent pas d’augmentation de tumeur cutanée mais une inhibition de la pilosité et des irritations chroniques cutanées (Spalding et al., 1993 ; Tennant et al., 1995).
Dans un modèle d’initiation-promotion, l’application cutanée de phénol induit une augmentation du nombre de tumeurs cutanées chez des souris Swiss ICH/Ha : 4 papillomes et 1 carcinome squameux pour 20 femelles) après initiation au 7,12-diméthylbenz[α]anthracène (DMBA) (Van Duuren et al., 1968).
Synthèse
La seule étude disponible, ne montre pas d’effet chez la souris pour une exposition par voie orale. En revanche, chez le rat, une augmentation de l’incidence des phéochromocytomes des tissus médullaires de la glande surrénale, des leucémies des lymphomes et des carcinomes de la thyroïde est décrite.
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Mutagène catégorie 2 (substance préoccupante pour l’homme en raison d’effets mutagènes) | 2008 |
Chez l'homme
Synthèse
A notre connaissance, il n’existe pas d’étude relative aux effets génotoxiques chez l‘homme.
Chez l'animal
Toutes voies
Dans les études in vivo réalisées chez le rat, des résultats négatifs sont rapportés pour des tests d’aberrations chromosomiques (moelle osseuse) (Thompson et Gibson, 1984), cassures d’ADN testiculaire (Skare et Schrotel, 1984) et formation d’adduits à l’ADN (moelle osseuse, foie, rate (Reddy et al., 1990 ; Kolachana et al., 1993). Dans les études in vivo chez la souris, les résultats au test du micronoyau sur cellules de moelle osseuse de rongeurs sont faiblement positifs (Ciranni et al., 1988a, Ciranni et al., 1988b ; (Marrazzini et al., 1994) ; (Shelby et al., 1993) ; (Chen & Eastmond, 1995) ou négatifs Gad-el-Karim et al., 1985, Gad-El Karim et al., 1986 ; McFee et al., 1991 ; Barale et al., 1990, ; Wild et al., 1980 ;). La fréquence des micronoyaux est extrêmement faible même aux doses proches de DL50. L’induction des micronoyaux à la dose la plus élevée pourrait être dépendante d’un mécanisme indirect (UE, 2006).
In vitro
Organismes procaryotes
Le phénol n’induit pas de mutations géniques chez les bactéries (test d’Ames) (Gilbert et al., 1980 ; Haworth et al., 1983; Glatt et al., 1989 ; Wild et al., 1980 ; Gocke et al., 1981).
Organismes eucaryotes
Des réponses positives sont rapportées lors d’études sur lignées cellulaires pour différents tests d’aberrations chromosomiques sur cellules ovariennes de hamster (Ivett et al., 1989), du micronoyau sur cellules ovariennes de hamster(Miller et al., 1995, Glatt et al., 1989 ; de lymphocytes humaines Yager et al., 1990) et de mutation génique (locus hprt et Na+/K+) sur lignées ovariennes de hamster (Paschin Yu et Bahitova, 1982) ou de lymphomes de souris (Wangenheim et Bolcsfoldi, 1988 ; McGregor et al., 1988). D’autres tests se sont également révélés positifs comme les échanges de chromatides sœurs sur lymphocytes humains (Morimoto et Wolff, 1980; Morimoto et al., 1983, (Erexson et al., 1985) sur cellules ovariennes de hamster Ivett et al., 1989 , cellules de moelle osseuse humaine Khalil et Odeh, 1994 ou cellules embryonnaires de hamster Syrien Tsutsui et al., 1997), synthèse non programmée de l’ADN (Tsutsui et al., 1997), cassures de brins d’ADN sur cellules de lymphome de souris (Garberg et al., 1988) ou formation d’adduits à l’ADN sur lignée myéloïde humaine (Kolachana et al., 1993). Un test d’induction d’aneuploïdie s’est révélé négatif sur cellules embryonnaires de hamster Syrien (Tsutsui et al., 1997).
Même si certains résultats ne permettent pas d’exclure un effet mutagène et/ou cancérigène et donc un mécanisme sans seuil, les données actuellement disponibles ne sont pas suffisantes pour conclure.
Synthèse
Le phénol n’est pas mutagène chez les bactéries mais induit des réponses positives in vitro dans différents tests sur cellules de mammifères. Ces résultats ne sont pas ou peu retrouvés in vivo chez l’animal.
Effets sur la reproduction
Chez l'homme
Toutes voies
Il n’existe pas à ce jour de données relatives aux effets d’une exposition au phénol seul sur les fonctions de reproduction et le développement fœtal chez l’homme.
Chez l'animal
Voie orale
La première étude de reproduction a consisté en l’exposition de rats à des doses de 100 à 12 000 mg.L-1 de phénol dans l’eau de boisson, ce qui correspond à une dose journalière de 10 à 1 200 mg.kg-1 de phénol (Heller et Pursell, 1938). La croissance et la fécondité des rats ne sont pas modifiées pour ceux exposés à des doses comprises entre 100 et 1 000 mg.L-1 de phénol (dose estimée à 114 mg.kg-1.j-1) sur 5 générations, et pour ceux exposés à des doses comprises entre 3 000 et 5 000 mg.L-1 sur 3 générations (dose estimée à 571 mg.kg-1.j-1). Un retard de croissance est noté chez les jeunes des rats exposés à la dose de 7 000 mg.L-1. De nombreux décès sont observés chez les jeunes rats exposés à la dose de 8 000 mg.L-1, suite à un abandon de la mère. À la dose de 10 000 mg.L-1, les jeunes meurent à la naissance.
Dans une étude de reproduction sur deux générations, le phénol a été administré dans l’eau de boisson aux doses de 0 - 200 - 1 000 - 5 000 ppm soit 0 – 14,7 – 70,9 – 301 mg.kg-1.j-1 pour les mâles de la génération P1 et 0 – 20 – 93 – 320,5 mg.kg-1.j-1 pour les femelles de la génération P1 (Ryan et al., 2000). Les animaux des générations P1 et F1 ont été traités pendant 10 semaines avant l’accouplement, et pendant les périodes d’accouplement, de gestation et de lactation. Une diminution de la consommation d’eau et de nourriture est observée chez les animaux des deux générations exposés à 5 000 ppm. Aucune diminution des capacités d’accouplement et de fertilité n’est observée chez les deux générations, ni d’altération de la cytologie vaginale ou des fonctions de reproduction chez le mâle. L’ouverture vaginale et la séparation préputiale sont retardées chez les animaux exposés à 5 000 ppm, et sont considérées comme secondaires à la réduction de poids rapportée chez les animaux de la génération F1. Le nombre de portées vivantes est diminué chez les animaux des deux générations exposées à 5 000 ppm. Les poids absolus de l’utérus et de la prostate sont diminués chez les animaux de la génération F1 exposés, quelle que soit la dose. Ceci n’est associé à aucune pathologie ou diminution des performances de reproduction. De cette étude, un NOAEL de 1 000 ppm (70,9 mg.kg-1.j-1) est défini pour les effets sur la fonction de reproduction chez le rat exposé au phénol par l’eau de boisson.
Synthèse
Chez l’animal, l’exposition au phénol ne semble pas entraîner d’effet sur la reproduction.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2004 |
Chez l'homme
Toutes voies
Il n’existe pas à ce jour de données relatives aux effets d’une exposition au phénol seul sur les fonctions de reproduction et le développement fœtal chez l’homme.
Chez l'animal
Voie orale
Jones-Price et al., 1983a ont évalué l’influence de l’exposition au phénol sur le développement fœtal dans le cadre du « National Toxicology Program » (NTP). Les rats femelles ont été exposés par gavage à des doses de 0 - 30 - 60 - 120 mg.kg-1.j-1 du 6e au 15e jour de la gestation. Dans cette étude, les différents paramètres observés concernent la mère, le développement fœtal jusqu’à l’observation clinique des nouveau-nés. Une baisse de 7 % du poids corporel moyen des fœtus par portée par comparaison au lot témoin a été observée pour une exposition à la dose la plus élevée (120 mg.kg-1.j-1). Cette diminution du poids des fœtus liée à la dose a permis de déterminer pour cette étude un NOAEL de 60 mg.kg-1.j-1 (LOAEL de 120 mg.kg-1.j-1). Aucune toxicité maternelle, ni effet tératogène n’ont été observés dans les lots traités Il est toutefois important de noter que le poids moyen des fœtus du lot témoin de l’étude se situait très au-dessus (22 %) des valeurs des témoins historiques. En l’absence de données individuelles, aucune explication ne peut être avancée.
Une étude similaire a été réalisée dans le même cadre chez des souris exposées au phénol par gavage à des doses de 0 – 70 – 140 - 280 mg.kg-1.j-1 du 6e au 15e jour de la gestation (Jones-Price et al., 1983b). Une toxicité maternelle est rapportée pour l’exposition à la dose la plus élevée (280 mg.kg-1.j-1) ; elle correspond à une augmentation de la mortalité, des tremblements et une ataxie, une diminution pondérale chez la mère ainsi qu’à une réduction de l’accroissement pondéral et une légère diminution pondérale hépatique chez les mères.
Une diminution du taux de gestation est rapportée, mais il n’y a pas de diminution de la taille des portées, d’augmentation de la mortalité prénatale ni d’incidence de malformations excepté une absence de fermeture des fentes palatines qui est une malformation fréquente chez les souris lorsque les mères ont été soumises à un stress. Une légère diminution pondérale des fœtus est rapportée chez les jeunes nés des mères exposées à la dose la plus élevée (280 mg.kg-1.j-1).
L’exposition de rats femelles aux doses de 0 – 100 – 333 - 667 - 1 000 mg.kg-1 de phénol le 11ème jour de la gestation n’induit pas d’altération du développement fœtal jusqu’au 6ème jour après la naissance pour les doses de 100 et 333 mg.kg-1 (Kavlock, 1990). En revanche, des paralysies des membres postérieurs sont observées pour les nouveau-nés des rats femelles exposés aux doses de 667 et 1 000 mg.kg-1.
Dans une autre étude, des rates (lot témoin de 21 femelles et lots exposés de 17 femelles) ont été exposées par gavage à 0 – 40 – 53,3 mg.kg-1.j-1 du 6ème au 19ème jour de la gestation et ont présenté des effets respiratoires sévères (3 mères exposées à la forte dose et 1 à la dose faible dose) et une baisse de croissance pondérale significative après 4 et 10 jours de traitement dans le lot exposé à la plus forte dose (((Narotsky & Kavlock, 1995)). Des résorptions totales et mortalité périnatale importante ont été décrites chez respectivement 3 et 1 des 4 femelles présentant des difficultés respiratoires sévères. A noter, qu’à la fin de l’étude, aucune différence significative du poids des femelles (corrigé du poids de l’utérus gravide) traitées n’a été observée par comparaison au lot témoin. Les effets sur le développement, baisse significative du nombre de petits nés vivants à la plus forte dose, ont été observés uniquement chez les femelles présentant une forte toxicité maternelle (effets respiratoires sévères et baisse de croissance pondérale d’environ 20 %). Des malformations de la queue ont été rapportées chez 2 des 4 petits vivants de la portée fortement impactée par une mortalité néonatale (forte dose). Aucun effet significatif sur le développement n’a été observé à la plus faible dose testée de 40 mg.kg-1.j-1.
Une étude non publiée sur le développement fœtal (Argus Research Laboratories, 1997) a été réalisée sur des rats Sprague-Dawley femelles (25/lot) exposés par gavage entre le 6e et 15e jour de la gestation. Le phénol est administré 3 fois par jour pour une dose quotidienne totale de 0 – 60 - 120 - 360 mg.kg-1.j-1. Une diminution statistiquement significative du poids corporel des mères (8 %) ainsi que de la prise de poids (38 %) est rapportée pour la dose de 360 mg.kg-1.j-1. Une diminution statistiquement significative de la prise de poids (11 %) est également observée pour une exposition à la dose de 120 mg.kg-1.j-1. Chez les fœtus, une diminution statistiquement significative du poids corporel (5-7 %) est mesurée pour la dose de 360 mg.kg-1.j-1. A cette dose, une diminution statistiquement significative des sites d’ossification des métatarses est rapportée, mais cette observation n’a pas de signification biologique. Une ossification incomplète ou absente des côtes est également observée mais cette diminution n’est pas statistiquement significative. Enfin, la relation entre l’exposition au phénol et le nombre de portée présentant des anomalies n’est pas clairement établie (relation dose-effet non statistiquement significative). Un NOAEL de 60 mg.kg-1.j-1 pour la toxicité maternelle a été retenu en raison de la baisse de croissance pondérale chez des mères exposées à 120 mg.kg-1.j-1, et un NOAEL de 120 mg.kg-1.j-1 pour le développement sur la base de la baisse de poids des fœtus et retards d’ossification à 360 mg.kg-1.j-1 (LOAEL).
Sur cette même espèce et dans le but de confirmer les résultats de l’étude précédente, les auteurs ont exposées des femelles (20 par groupe) du 5e au 20e jour de gestation à des doses de 0 – 15 – 30 - 60 - 120 – 240 mg.kg-1.j-1- de phénol administré par gavage (eau distillée) (Wang et al., 2020). Une forte toxicité liée au traitement a été observée à partir de 60 mg.kg-1.j-1- chez les femelles gestantes avec respectivement 4, 5 et 14 décès par ordre croissant aux trois plus fortes doses. Chez ces animaux, une perte du pelage dorsal et des convulsions ont été rapportés. Chez les femelles ayant mené leur gestation à terme, aucun effet significatif dose-dépendant n’a été observé sur la croissance pondérale, le poids des femelles ou le poids de l’utérus gravide. Une augmentation marginale du poids des femelles est rapportée à la dose de 30 mg.kg-1.j-1. Des pertes pré-implantatoires (6,2 %, p<0,05), post-implantatoires et résorptions fœtales (p<0,05) et une diminution du nombre de petits vivants par portée (p<0,05) ont été rapportées uniquement dans le lot exposé à la plus forte dose. Une baisse significative du poids des fœtus et du poids du placenta (p<0,01) est rapportée à partir de 30 mg.kg-1.j-1. Les examens externes et internes des fœtus n’ont pas mis en évidence d’effet significatif lié au traitement (malformations externes, viscérales et/ou squelettiques). Les auteurs ont retenu un NOAEL sur le développement de 15 mg.kg-1.j-1 sur la base des effets du traitement sur le poids des fœtus et du placenta à la dose de 60 mg.kg-1.j-1.
Synthèse
Chez l’animal, l’exposition au phénol conduit à une baisse de poids des fœtus est observée, indépendamment de la toxicité maternelle. Toutefois aux doses fortes, certaines études rapportent également des paralysies des membres postérieurs, ou des altérations de l’ossification, le plus souvent en présence de toxicité maternelle.
Autres Effets
Généralités
Aucun effet perturbateur endocrinien n’a clairement été démontré pour le phénol aussi bien chez l’homme que chez l’animal (ATSDR, 2008). In vitro, son activité œstrogénique mesurée à partir de tests de gènes rapporteurs chez la levure est négative (Nishihara et al., 2000) et le phénol a une très faible affinité pour le récepteur purifié recombinant humain aux œstrogènes (Hu et Aizawa, 2003).
Le phénol ne figure pas dans la liste des 906 substances d’intérêt du fait de leur action endocrine potentielle publiée par l’ANSES (ANSES, 2019).
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Le rapport de valeurs seuils de toxicité aiguë françaises est accessible dans la rubrique « Archives ». L’intégralité des rapports de valeurs seuils de toxicité aiguë françaises actuellement en vigueur est consultable dans le tableau des VSTAF.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effet à seuil - Exposition aiguë par inhalation
L'OEHHA propose un REL de 5,8 mg.m-3 pour une exposition aiguë de 1 heure par inhalation au phénol (OEHHA, 2008).
Cette valeur est basée sur l’étude chez 8 volontaires exposés uniquement par inhalation à des concentrations jusqu’à 6,5 ppm (25 mg.m-3) de phénol pendant 8 heures (Piotrowski, 1971). En l’absence d’effet observé pour les effets critiques retenus, irritation oculaire, nasale et de la gorge un NOAEL de 5,2 ppm (20 mg.m-3) a été déterminé pour une exposition de 8 heures. Une extrapolation a été réalisée pour une heure d’exposition : 5,22 ppm x 8 h = C2 x 1 h = 15 ppm où C représente la concentration pour une exposition de 1 heure.
Facteurs d'incertitude : un facteur de 10 est appliqué 10 pour la variabilité au sein de la population humaine.
Calcul : 15 ppm x 1/10 = 1,2 ppm soit 5,8 mg.m-3
Indice de confiance : cet organisme ne propose pas d’indice de confiance
Le TCEQ propose un ReV de 960 µg.m-3 (250 ppb) pour une exposition aiguë de 1 heure par inhalation au phénol (TCEQ, 2014).
Cette valeur a été établie à partir d’une étude chez le rat exposé par inhalation (nez seul) à 0 – 0,5 - 5 - 25 ppm (0 – 1,96 – 19,55 - 97,75 mg.m-3) de phénol, 6 h.j-1, 5 j.sem-1, pendant 2 semaines (Hoffman et al., 2001). Le TCEQ a retenu une NOAEC de 25 ppm en l’absence d’effet irritant aussi bien au niveau nasal qu’oculaire et d’effets neurologiques.
Une extrapolation de la NOAEC déterminée pour une durée d’exposition de 6 à 1 heure a été réalisée à partir de la loi de Haber en considérant que n = 3 (tient compte de la durée et de la concentration d’exposition sur l’effet critique retenu) :
Cn1 x T1 = C2n x T2 ou C = la concentration, n = la constante de Haber et T = la durée d’exposition
C2 =[ (C1)3 x (T1/T2)]1/3 = [(25 ppm)3 x (6 h./ 1h.)] 1/3 = 45,428 ppm.
Facteurs d'incertitude : un facteur d'incertitude total de 180 a été appliqué. Il correspond à un facteur 3 pour l’extrapolation des données animales vers l’homme, un facteur 10 pour la variabilité au sein de la population, et un facteur supplémentaire de 6 pour la qualité des données (absence de données humaines par inhalation, manque de robustesse sur la qualité des données animales par inhalation et du manque d’information sur les sujets sensibles).
ReV = PODadj / facteurs d’incertitude
Calcul : ReVaiguë = 45,428 ppm / 180 = 0,252378 ppm soit 252 ppb arrondi à 250 ppb (960 µg.m-3)
Indice de confiance : cet organisme n’accorde pas d’indice
Effet à seuil - Exposition chronique par inhalation
Le RIVM propose une TCA provisoire (pTCA) de 2.10-2 mg.m-3 pour une exposition chronique par inhalation (Baars et al., 2001).
Cette valeur a été calculée à partir d'une NOAEC de 20 mg.m-3 (5 ppm) pour les effets hépatiques, pulmonaires, rénaux et cardiovasculaires, déterminés lors d'une étude par inhalation de 90 jours chez des singes, des rats et des souris, exposés à 0 ou 5 ppm (Sandage, 1961, cité dans ATSDR, 1998). Cette valeur est provisoire en raison du peu de données toxicologiques concernant les effets par inhalation du phénol.
Facteurs d'incertitude : un facteur de 1 000 est appliqué correspondant à un facteur 10 pour l'extrapolation des données animales vers l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 10 pour l'extrapolation des données de toxicité subchronique à une exposition vie entière.
Calcul : 20 mg.m-3 x 1/1 000 = 2.10-2 mg.m-3
Indice de confiance : selon le RIVM, la fiabilité de cette valeur est basse.
L'OEHHA propose un REL de 0,2 mg.m-3 pour une exposition chronique par inhalation (OEHHA, 2008).
Cette valeur a été établie à partir de la même étude que celle retenue par le RIVM pour sa pTCA, et pour laquelle une NOAEC de 20 mg.m-3 (5 ppm) pour les effets hépatiques, pulmonaires, rénaux et cardiovasculaires, a été déterminée pour une exposition par inhalation de 90 jours chez diverses espèces (singes, rats, souris) (Sandage, 1961). La concentration de 20 mg.m-3 (5 ppm) était la seule testée mais une autre étude, chez le rat, a montré que des effets hépatiques et nerveux se produisaient après exposition à 26 ppm durant 15 jours (Dalin et Kristofferson, 1974).
Facteurs d'incertitude : un facteur de 90 arrondi à 100 est appliqué correspondant à un facteur 3 pour l'extrapolation des données animales vers l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l'extrapolation de données de toxicité subchronique à une exposition vie entière.
Calcul : 20 mg.m-3 x 1/100 = 0,2 mg.m-3
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Le TCEQ propose un REV de 11 µg.m-3 pour une exposition chronique par inhalation OEHHA, 2000, 2014).
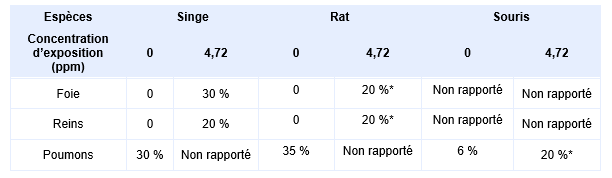
Cette valeur a été établie à partir des mêmes études non publiées que celles retenues par le RIVM et l’OEHHA, à savoir les études d’exposition par inhalation de 90 jours chez le singe, le rat et la souris (Sandage, 1961). La concentration de 20 mg.m-3 (4,7 ppm) était la seule testée. Le TCEQ a procédé à une nouvelle analyse des données décrites par Sandage et al. (1961) et a résumé le pourcentage d’animaux présentant une pathologie dans différents organes pour les trois espèces
Bien que les auteurs des études aient présenté les données histologiques comme étant « essentiellement négatives » (sans données détaillées comme par exemple le type de lésion), le TCEQ a tenu compte des effets significatifs mentionnés par les auteurs et a établi un nouveau LOAEL de 4,72 ppm basé sur les pathologies hépatiques et rénales observées chez les rats exposés au phénol par comparaison au lot témoin. Les effets pulmonaires n’ont pas été retenus en raison du manque de données sur le type des lésions et la fréquence des pathologies assez élevée (30 % chez le singe et 35 % chez le rat) dans les différents los témoins. Ce LOAEL est considéré comme le point de départ (POD) dans le calcul de la VTR.
Aucun ajustement temporel (étude de toxicité subchronique en continu de 90 jours) ou dosimétrique (valeur de 1 appliqué par défaut en raison de l’absence de données sur les coefficients de partage sang/gaz (Hb/g) chez l’homme (H) et l’animal (A)) n’a été appliqué.
PODHEC = PODadj x ((Hb/g)A/ Hb/g)H) = 4,72 ppm x 1 = 4,72 ppm
Facteurs d'incertitude : un facteur de 1 620 est appliqué correspondant à, , un facteur 3 pour de tenir compte de l'extrapolation des données de l’animal vers l'homme, un facteur 10 pour la variabilité au sein de la population humaine un facteur 3 pour l'extrapolation de données de toxicité subchronique à une exposition chronique (tient compte de la demi-vie d’élimination relativement rapide (< 4 heures (ATSDR, 2008) et du logKow bien inférieur à 4), un facteur 6 pour tenir compte des effets « essentiellement négatifs » rapportés par les auteurs malgré les résultats positifs des tests statistiques (LOAEC) et enfin un facteur 3 pour tenir compte du manque de données de toxicité chronique chez l’humain ou chez l’animal).
Calcul : ReV = PODHEC / (3 x 10 x 3 x 6 x 3) = 4,72 ppm / 1 620 = 0,0029135 ppm arrondi à 2,9 ppb (soit 11,3 µg.m-3).
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Pourcentage d’animaux présentant une pathologie dans chacun des organes (foie, reins, poumons) parmi les groupes témoins ou traités au phénol (4,72 ppm pendant 90 jours) chez les trois espèces * effet significatif rapporté par les auteurs à partir du « Fisher exact test »
Effet à seuil - Exposition aiguë par voie orale
L’ATSDR a établi un MRL de 1 mg.kg-1.j-1 pour une exposition aiguë au phénol par voie orale (ATSDR, 2008).
L’établissement de cette MRL est basé sur une étude, non publiée a été menée chez le rat (Argus Research Laboratories, 1997). Des femelles gestantes ont été exposées au phénol par gavage entre le 6ème et le 15ème jour de gestation, à des doses de 0 - 60 - 120 – 360 mg.kg-1.j-1 de phénol (réparties en 3 gavages par jour), dans un volume de 10 mL.kg-1. Une diminution de la prise de poids des mères est observée, elle est dépendante de la dose, et est statistiquement significative à partir de 120 mg.kg-1.j-1. Si cet effet est considéré comme effet critique, le LOAEL est de 120 mg.kg-1.j-1 et le NOAEL est de 60 mg.kg-1.j-1. Si l’altération du développement fœtal est retenue comme effet critique, le LOAEL devient 360 mg.kg-1.j-1 et le NOAEL, 120 mg.kg-1.j-1. Le MRL a été dérivé d’une BMD, linéaire, à variance homogène, établie à partir du NOAEL maternel, dose à laquelle les premiers effets néfastes apparaissent (mères et portées confondues).
BMD = 152 mg.kg-1.j-1, BMDL = 125 mg.kg-1.j-1.
Facteurs d’incertitude : Un facteur 100 est appliqué, correspondant à un facteur 10 pour l’extrapolation à l’homme et à un facteur 10 pour les différences de sensibilité dans la population humaine.
Calcul : 125 mg.kg-1.j-1/100 = 1,25 mg.kg-1.j-1 (arrondi à 1 mg.kg-1.j-1)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effet à seuil - Exposition chronique par voie orale
L’US EPA (IRIS) a établi une RfD de 0,3 mg.kg-1.j-1 pour une exposition chronique par voie orale (2002).
Cette valeur a été établie à partir de la même étude expérimentale que celle utilisée par l’ATSDR pour une exposition aiguë (Argus Research Laboratories, 1997). Un NOAEL de 60 mg.kg-1.j-1 a été retenu pour les effets sur les mères basé sur une légère diminution pondérale à 120 mg.kg-1.j-1, et un NOAEL de 120 mg.kg-1.j-1 a été établi pour les effets sur les fœtus, basé sur une diminution du poids corporel et un retard d’ossification à 360 mg.kg-1.j-1. À partir du NOAEL maternel, une benchmark dose de 93 mg.kg-1.j-1 a été calculée à l'aide d'un modèle polynomial.
Facteurs d'incertitude : un facteur de 300 est appliqué, correspondant à un facteur 10 pour l'extrapolation des données animales vers l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l'incertitude sur la pertinence des effets biologiques observés.
Calcul : 93 mg.kg-1.j-1 x 1/300 = 0,31 mg.kg-1.j-1 (arrondi à 0,3 mg.kg-1.j-1).
Indice de confiance : selon US EPA, la fiabilité de cette valeur est de moyenne à élevée (fiabilité de l’étude : moyenne à élevée, fiabilité de la base de données : moyenne à élevée).
Le RIVM propose une TDI de 4.10-2 mg.kg-1.j-1 pour une exposition chronique par voie orale (Baars et al., 2001).
Cette valeur a été établie à partir d'une étude expérimentale chez des rates exposées au phénol entre les jours 6 et 19 de la gestation (Narotsky et Kavlock, 1995). Dans cette étude, 3 lots comportant chacun 16 à 23 femelles, sont exposés au phénol par un gavage quotidien, aux doses de 0 - 40 - 53,3 mg.kg-1.j-1. Toutefois dans l’étude Narotsky et Kavlock, 1995, des signes respiratoires sévères sont apparus chez 4 mères (3 exposées à la forte dose et 1 à la dose faible), dont 3 ont complètement résorbées leurs portées et une dont la mortalité périnatale a été importante. L’effet critique retenu est une diminution du nombre de fœtus pour la dose de 53 mg.kg-1.j-1 (LOAEL), le NOAEL étant de 40 mg.kg-1.j-1
Facteurs d'incertitude : un facteur de 900 arrondi à 1 000 est appliqué qui correspond à un facteur 10 pour l'extrapolation des données animales à l'homme, un facteur 10 pour la variabilité au sein de la population humaine, un facteur 3 pour l'extrapolation de données de toxicité aiguë à une exposition vie entière (le RIVM n'a pas retenu un facteur de 10 en raison de l'élimination rapide du phénol ingéré) et un facteur 3 en raison du peu de données toxicologiques disponibles concernant les effets par voie orale du phénol.
Calcul : 40 mg.kg-1.j-1 x 1/1 000 = 4.10-2 mg.kg-1.j-1.
Indice de confiance : selon le RIVM, la fiabilité de cette valeur est élevée.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Effet à seuil - Exposition aiguë par inhalation
L’Ineris propose de ne pas retenir de valeur pour une exposition aiguë au phénol par inhalation.
Deux valeurs sont proposées pour des expositions aiguës par inhalation (OEHHA, 2008 ; TCEQ, 2014).
La valeur de l’OEHHA a été établie à partir d’une étude réalisée sur des volontaires sains exposé pendant 8 heures à 5,2 ppm (Piotrovsky et al., 1971). Cette publication, de 1971 présente un certain nombre de limites : absence de groupe témoin, faible échantillon (7 hommes et 1 femme), contrôle de l’exposition, deux interruptions de 30 minutes au cours des 8 heures d’exposition. Il s’agit d’une étude de toxico-cinétique sur le phénol avec la recherche des métabolites urinaires, et nullement d’une étude destinée à observer les effets de l’exposition aiguë au phénol. Cette étude n’est considérée pas comme recevable.
La valeur du TCEQ a été établie à partir d’une étude de toxicité aiguë chez le rat exposé 2 semaines par inhalation (Hoffman et al., 2001). Cette étude est de bonne qualité.
Le TCEQ pratique un ajustement pour calculer une valeur pour 1 heure d’exposition. La démarche du TCEQ est détaillée, et clairement énoncée (Loi de Haber avec n=3).
Le TCEQ retiennent un facteur d’incertitude de 10 en raison de la variabilité au sein de la population humaine, un facteur limité à 3 pour l’extrapolation à partir des données animales, et un facteur 6 pour notamment tenir compte de l’absence de donnée humaine. Les facteurs utilisés ne sont pas usuels : même si le facteur 3 est un peu faible, l’approche dans son ensemble est recevable.
Compte tenu des limites de construction de ces deux valeurs et du peu de pertinence du scénario d’exposition, l’Ineris ne retient pas de valeur.
Effet à seuil - Exposition chronique par inhalation
L’Ineris propose de retenir pour une exposition chronique au phénol par inhalation la VTR chronique de 0,2 mg.m-3 de l’OEHHA.
Trois organismes proposent une valeur, le RIVM (2001), qui propose une valeur provisoire, l’OEHHA (2003) et le TCEQ (2014).
Les VTR sont basées sur les mêmes études non publiées de toxicité subchronique réalisées chez le rat, la souris et le singe (Sandage, 1961), cité dans l’ATSDR, 1998, l‘US EPA (2002) et le TCEQ (2014). Dans ces études, une seule concentration de 20 mg.m-3 a été testée. Le RIVM et l’OEHHA s’appuient sur la conclusion des auteurs et retiennent cette concentration comme étant une NOAEC, alors que le TCEQ tient compte des effets significatifs (pathologies rénales et hépatiques) décrits par les mêmes auteurs pour considérer cette valeur comme une LOAEC..
L’OEHHA applique un facteur d’incertitude de 100 correspond à un facteur de 3 pour l’extrapolation des données d’une étude subchronique à une VTR chronique, un facteur 3 pour l’extrapolation des données animale à l’homme et un facteur 10 pour les différences de sensibilité au sein de l’espèce humaine. Le RIVM applique quant à lui, un facteur d’incertitude de 1 000 correspondant à un facteur 10 pour l’extrapolation des données d’une étude subchronique à une VTR chronique, un facteur 10 pour l’extrapolation des données animale à l’homme et un facteur 10 pour les différences de sensibilité au sein de l’espèce humaine. Le TCEQ applique des facteurs supplémentaires à ceux mentionnés par le RIVM pour tenir compte notamment de l’utilisation d’une LOAEC (facteur 6), et de l’absence de données de toxicité chronique par inhalation chez l’homme et l’animal (facteur 3), pour arriver à un facteur global de 1 620. Ce facteur très élevé n’est pas adapté.
La différence entre les démarches des trois organismes réside donc dans le choix des facteurs d’incertitude. Le raisonnement suivi par le TCEQ, qui tient compte des effets significatifs décrits par les auteurs eux-mêmes, ne parait pas justifié, de même que les facteurs d’incertitudes y étant associés. De plus la valeur du RIVM est provisoire. La valeur retenue est donc celle de l’OEHHA.
Indice de confiance : faible (analyse uniquement d’1 dose, qualité des données, de plus il existe peu de données relatives aux effets du phénol lors d’une exposition par inhalation, valeur globalement élevé du facteur d’incertitude)
Effet à seuil - Exposition aiguë par voie orale
L’Ineris propose de retenir pour une exposition aiguë au phénol par voie orale la VTR chronique de 1 mg.kg-1.j-1 de l’ATSDR (2008).
Cette valeur est basée sur la seule VTR disponible, celle de l’ATSDR (2008). L’étude clé est une étude sur le développement chez le rat (NTP, 1983a). L’étude est de bonne qualité, mais l’effet critique retenu correspond à un effet chez les mères et couvre à la fois les mères et les jeunes. La construction de la VTR est raisonnée utilisant un calcul de benchmark dose et le choix des facteurs d’incertitude cohérent. Cette étude est retenue bien que des données plus récentes (Wang et al., 2020) basées sur le même protocole expérimental aient montré une toxicité maternelle significative à partir de 60 mg.kg-1.j-1 et une toxicité fœtale à partir de 30 mg.kg-1.j-1, remettant en question le NOAEL de 60 mg.kg-1.j-1 établi pour cette étude.
Indice de confiance : faible (étude développementale, avec un effet critique remis en cause par des données plus récentes)
Effet à seuil - Exposition chronique par voie orale
L’INERIS propose de retenir pour une exposition chronique au phénol par voie orale la VTR chronique de 0,3 mg.kg-1.j-1 de l’US EPA.
Deux organismes proposent une valeur, l’US EPA (2002) et le RIVM (2001).
Les deux organismes ont construit leur valeur à partir des effets observés au cours de deux études de toxicité sur le développement prénatal. L’US EPA s’appuie sur une étude BPL non publiée de 1997, pour laquelle l’effet critique retenu est la baisse de croissance pondérale des mères (NOAEL de 60 mg.kg-1.j-1). Le RIVM s’appuie sur une autre étude (Narotsky et Kavlock, 1995) dans laquelle seules 2 doses ont été testées. L’effet critique retenu est la diminution du nombre de fœtus. Dans cette étude, de sévères effets respiratoires sont rapportés chez certaines des femelles exposées aux deux doses. L’effet critique retenu par le RIVM, fortement impacté par la toxicité maternelle (3 des 4 femelles soufrant de difficultés respiratoires ont eu des résorptions totales) apparait difficile à retenir.
L’US EPA retient une BMD de 93 mg.kg-1.j-1, établie à partir du NOAEL maternel (absence d’effet sur le gain de poids durant la gestation). Les facteurs d’incertitude appliqués par l’US EPA sont cohérents (10 pour l'extrapolation des données animales vers l'homme, un facteur 10 pour la variabilité au sein de la population humaine et un facteur 3 pour l'incertitude sur la pertinence des effets biologiques observés.
Aucune des deux valeurs n’est parfaitement adaptée pour établir une VTR chronique. Par défaut, l’INERIS propose de retenir la valeur déterminée pour l’effet critique le plus pertinent, c'est-à-dire celle de l’US EPA1. Toutefois, les données plus récentes issues d’une étude sur le développement pourraient remettre en cause les doses sans effets retenues aussi bien par l’US EPA que le RIVM (Wang et al., 2020).
Indice de confiance : faible (effet critique chez le fœtus alors que les mères présentent des signes respiratoires, et utilisation d’une étude de développement pour établir une VTR chronique, cependant les facteurs d’incertitude couvrent ces défaillances)
Autres valeurs des organismes reconnus
Description
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC.
Dangers
Description
Ecotoxicité aquatique
Paramètre d'écotoxicité aiguë
|
|
Espèce |
Critère d’effet |
Valeur (mg.L-1) |
Référence |
|---|---|---|---|---|
|
Algues |
Selenastrum capricornutum |
EC50 (96 h)e |
61,1 |
(St-Laurent, Blaise, Mac Quarrie, Scroggins, & Trottier, 1992) |
|
|
Selenastrum capricornutum |
EC50 (120 h)e |
67 |
(Cowgill, Milazzo, & Landenberger, 1989) |
|
|
Selenastrum capricornutum |
EC50 (96 h)e |
150 |
(Shigeoka, Sato, Takeda, Yoshida, & Yamauchi, 1988) |
|
|
Selenastrum capricornutum |
EC50 (8 j)e |
7,5 |
(Beaubien, Lapierre, Bouchard, & Jolicoeur, 1986) |
|
|
Selenastrum capricornutum |
IC50 (14 j)e |
175 |
(Gaur, 1988) |
|
|
Skeletomena costatum |
EC50 (120 h)e |
49,6 |
(Cowgill et al., 1989) |
|
|
Chlorella vulgaris |
EC50 (96 h)e |
370 |
(Shigeoka et al., 1988) |
|
|
Lemna minor |
EC50 (7 j)e |
171 |
(Cowgill, Milazzo, & Landenberger, 1991) |
|
Crustacés |
Daphnia magna |
EC50 (24 h)d,e |
12 |
(V. G. Bringmann & Kuhn, 1982) |
|
|
Daphnia magna |
EC50 (48 h)d,e |
12 |
(Leblanc, 1980) |
|
|
Daphnia magna |
EC50 (48 h)d,e |
10 |
(Kühn, Pattard, Pernak, & Winter, 1989) |
|
|
Daphnia magna |
EC50 (48 h)b,d |
4,2 - 10,7 |
(Lewis, 1983) |
|
|
Daphnia magna |
EC50 (48 h)b,c |
12,6 |
(Holcombe, Phipps, Sulaiman, & Hoffman, 1987) |
|
|
Daphnia magna |
EC50 (48 h) |
13 |
(Cowgill & Milazzo, 1991) |
|
|
Ceriodaphnia dubia/affinis |
LC50 (48 h) |
4,3 - 12,1 |
(Cowgill, Takahashi, & Applegath, 1985) |
|
|
Ceriodaphnia dubia |
LC50 (48 h) |
20 |
(Cowgill & Milazzo, 1991) |
|
|
Ceriodaphnia dubia |
LC50 (48 h)b |
3,1 |
(Oris, Winner, & Moore, 1991) |
|
|
Asellus aquaticus |
LC50 (96 h)b,c |
180 |
(Green, Williams, & Pascoe, 1985) |
|
|
Gammarus pulex |
LC50 (96 h)b,c |
69 |
(Green et al., 1985) |
|
|
Artemia salina (marin) |
LC50 (48 h)d,e |
56 |
(Price, Waggy, & Comway, 1974) |
|
|
Baetis rhodani |
LC50 (96 h)b,c |
15,5 |
(Green et al., 1985) |
|
|
Palaemonetes pugio (marin) |
LC50 (96 h)d,e |
5,8 |
(Tatem, Cox, & Anderson, 1978) |
|
|
Brachinonus rubens |
LC50 (24 h) |
600 |
(Halbach, Siebert, Westermeyer, & Wissel, 1983) |
|
Poissons |
Oncorhynchus mykiss |
LC50 (48 h)a |
5,4 - 9,8 |
(V. M. Brown, Jordan, & Tiller, 1967) |
|
|
Pimephales promelas |
LC50 (96 h)b |
24 - 36 |
(Ruesink & Smith, 1975) |
|
|
Rutilus rutilus |
LC50 (48 h)b,c |
10 |
(Solbe, Cooper, Willis, & Mallett, 1985) |
|
|
Carassius auratus |
LC50 (96 h)d,e |
44,5 |
(Pickering & Henderson, 1966) |
|
|
Lepomis macrochirus |
LC50 (96 h)b,d |
17 |
(Holcombe et al., 1987) |
|
|
Pimephales promelas |
LC50 (96 h)b,c |
24,9 - 67,5 |
(DeGraeve, Geiger, Meyer, & Bergman, 1980) |
|
|
Phoxinus phoxinus |
LC50 (96 h)b,c |
9,5 |
(Oksama & Kristoffersson, 1979) |
|
|
Oncorhynchus mykiss |
LC50 (96 h)a,b |
10,5 |
(Holcombe et al., 1987) |
|
|
Oncorhynchus mykiss |
LC50 (96 h)b,c |
9,7 |
(Hodson, Dixon, & Kaiser, 1984) |
|
|
Oncorhynchus mykiss |
LC50 (96 h)a |
5,02 |
(Mc Leay, 1976) |
|
|
Lebistes reticulatus |
LC50 (96 h)a,b |
47,5 |
(Gupta, Mujumdar, Rao, & Durve, 1982) |
|
|
Oncorhynchus mykiss |
LC50 (96 h)b,c |
8,9 |
(DeGraeve et al., 1980) |
|
|
Leuciscus iduss |
LC50 (48 h)d,e |
14 |
(Juhnke & Lüdermann, 1978) |
|
|
Brachydanio rerio |
LC50 (96 h)b,c |
29 |
(Fogels & Sprague, 1977) |
|
|
Jordanella floridae |
LC50 (96 h)b,c |
36,3 |
(Fogels & Sprague, 1977) |
|
|
Brachydanio rerio |
EC50 (48 h) |
7,9 - 41 |
(Schulte & Nagel, 1994) |
Les essais présentés ci-dessus ont été réalisés en conditions c) continu, d) statique ou a) semi-statique et sont exprimés en b) concentration mesurées ou e) en concentration nominale.
Paramètre d'écotoxicité chronique
|
|
Espèce |
Critère d’effet |
Valeur (µg.L-1) |
Référence |
|---|---|---|---|---|
|
Algues |
Selenastrum capricornutum |
IC10 (14 j) |
93 000 |
(Gaur, 1988) |
|
|
Skeletomena costatum |
NOEC (120 h) |
13 000 |
(Cowgill et al., 1989) |
|
|
Scenedesmus quadricauda |
NOEC (8 j) |
7 500 |
(G. Bringmann & Kühn, 1978) |
|
|
Microcystis aeruginosa |
NOEC (8 j) |
4 600 |
(G. Bringmann & Kühn, 1978) |
|
|
Lemna minor |
NOEC (7 j) |
5 000 |
(Cowgill et al., 1991) |
|
Crustacés |
Daphnia magna |
EC10 (16 j) |
460 |
(Deneer, Seinen, & Hermens, 1988) |
|
|
Ceriodaphnia dubia |
MATC (4 j) |
1 770 |
(Masters, Lewis, Davidson, & Bruce, 1991) |
|
|
Ceriodaphnia dubia |
NOEC (8 j) |
840 |
(Cowgill & Milazzo, 1991) |
|
|
Daphnia magna |
NOEC (11 j) |
500 |
(Cowgill & Milazzo, 1991) |
|
Poissons |
Oncorhynchus mykiss |
EC10 (22-30 j)a |
2 -65 |
(Birge, Black, Hudson, & Bruser, 1979) |
|
|
Oncorhynchus mykiss |
EC10 (27 j) |
5 |
(Black et al., 1982), (Black, Birge, Westerman, & Francis, 1983) |
|
|
Oncorhynchus mykiss |
NOEC (58 j) a |
100 |
(DeGraeve et al., 1980) |
|
|
Pimephales promelas |
EC10 (9 j) |
282 |
(Black et al., 1982), (Black et al., 1983) |
|
|
Pimephales promelas |
NOEC (32 j)a |
1 830 |
(Holcombe, Phipps, & Fiandt, 1982) |
|
|
Cyprinus carpio |
MATC (60 j)b |
110 - 130 |
(Verma, Tonk, & Dalela, 1981) |
|
|
Cirrhina mrigala |
MATC (60 j) |
77 - 94 |
(Verma, Tonk, Gupta, & Saxena, 1984) |
|
Amphibiens |
Ambystoma grazile |
EC10 (10 j) |
14 |
(Black et al., 1982), (Black et al., 1983) |
|
|
Rana termporaria |
EC10 (9 j) |
5 |
(Black et al., 1982), (Black et al., 1983) |
|
|
Xenopus laevis |
EC10 (6 j) |
200 |
(Black et al., 1982), (Black et al., 1983) |
|
|
Rana pipiens |
EC10 |
5,2 |
(Birge, Black, & Kuehns, 1980) |
Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.
Organismes terrestres
Paramètres d’écotoxicité aiguë
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës

Paramètres d’écotoxicité chronique
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions chroniques

Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau)
Des tests long-terme avec des espèces de 3 niveaux trophiques sont disponibles pour le phénol. Les plus sensibles sont les poissons.
Les résultats des tests réalisés par Birge et al., (Birge et al., 1979, Birge et al., 1980) sur plusieurs substances sont toujours plus faibles que les tests réalisés par d'autres auteurs. Aucune explication n'a pu être donnée. Néanmoins, il a été décidé par les états membres de l'Union Européenne que ces données ne seraient pas utilisées pour dériver la PNEC pour le compartiment aquatique si d'autres résultats valides sont disponibles.
Sans tenir compte des résultats de Birge et al., (1979, 1980), la NOEC la plus basse a été trouvée par Verma et al., (1984) sur Cirrhina mrigala. Ces résultats sont cohérents avec ceux trouvés sur Cyprinus carpio et Onchorhynchus mykiss par DeGraeve et al., 1980 Une « maximal acceptable toxicant concentration » (MATC) comprise entre 77 et 94 µg.L-1 a été enregistrée. Une NOEC de 77 µg.L-1 peut être dérivée de ce test. Pour le calcul de la PNECEAU, un facteur d’extrapolation de 10 est appliqué.
D'où :
PNECEAU = 7,7 µg.L-1
Valeurs seuil pour la protection des organismes benthiques
Pour les sédiments, il n'existe pas suffisamment de données montrant la présence de phénol dans ces derniers. Par ailleurs, compte tenu des propriétés physico chimiques du phénol il y a peu de chances que celui ci s'accumule dans les sédiments. Cependant, on peut tout de même estimer une PNECSED à l’aide de la méthode du coefficient de partage.
PNECSED = (KSED-EAU/RHOSED) ´ PNECEAU ´ 1 000
RHOSED : densité des sédiments (humides) (valeur par défaut : 1 300 kg.m-3)
KSED-EAU : coefficient de partage entre les sédiments et l’eau (2,875 m3.m-3)
D’où :
PNECSED = 17 µg/kg sédiment humide = 44,2 µg/kg sédiment sec
Valeurs seuil pour la protection des organismes terrestres
Pour déterminer la PNECSOL, seuls des tests aigus sont disponibles, c'est pourquoi un facteur d’extrapolation de 1 000 doit être utilisé sur la plus basse des valeurs : PNECSOL = 136 à µg/kg sol sec
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










