Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Sulfure d'hydrogène (7783-06-4)
Informations générales
Dernière vérification le 25/04/2024
Identification
Numero CAS
7783-06-4
Nom scientifique (FR)
Sulfure d'hydrogène
Nom scientifique (EN)
Autres dénominations scientifiques (FR)
Autres dénominations scientifiques (Autre langues)
Code EC
Code SANDRE
Numéro CIPAC
Formule chimique brute
\(\ce{ H2S }\)
Code InChlKey
Code SMILES
S
Classement transport
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H220 |
|---|---|
| Mention du danger - Texte | Gaz extrêmement inflammable |
| Classe(s) de dangers | Gaz inflammables |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H330 |
|---|---|
| Mention du danger - Texte | Mortel par inhalation |
| Classe(s) de dangers | Toxicité aiguë |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Introduction
Air
Eau
Sol
Autres milieux
Programmes
Physico-Chimie
Dernière vérification le 25/04/2024
Généralités
Poids moléculaire
34.08 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dangers physiques
Dernière vérification le 25/04/2024
Réactivité
Explosivité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Inflammabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Propriétés explosives
Comportement et devenir dans les milieux
Dernière vérification le 25/04/2024
Matrices
Atmosphère
FDTE/VTR Importer
L’H2S est gazeux à température ambiante ; il peut donc se retrouver dans l’air à partir d’autres milieux (eaux, sols).
Dans l’air, il est oxydé par l’oxygène moléculaire ou les radicaux hydroxydes, pour former du dioxyde de soufre puis des sulfates, qui peuvent être éliminés de ce compartiment par absorption par les plantes, le sol, ou les précipitations.
Milieu eau douce
FDTE/VTR Importer
L’H2S est modérément soluble dans l’eau. Dans ce compartiment, l’H2S ne reste sous sa forme qu’en l’absence d’oxygène. Il peut s’oxyder rapidement en présence d’oxygène dans les eaux de surface, et en présence de peroxyde d’hydrogène dans les eaux de pluie et les aérosols.
L’H2S est naturellement présent dans l’air. Du fait de sa solubilité dans l’eau et l’huile, il peut passer du compartiment air vers les compartiments eaux de surface, eaux souterraines ou sols humides, et ainsi être transporté sur de grandes distances (OMS IPCS, 2003).
Depuis le compartiment eau, le sulfure d’hygrogène peut s’évaporer rapidement dans l’air en fonction de conditions telles que la température ou le pH.
Milieu eau de mer
Milieu sédiment eau douce
Milieu sédiment marin
Milieu terrestre
FDTE/VTR Importer
L’H2S s’adsorbe facilement dans les sols à partir de l’air, où il est oxydé, sous forme de soufre élémentaire. De nombreux micro-organismes ont la propriété d’adsorber et de dégrader l’H2S en soufre élémentaire et en sulfates. L’H2S est également adsorbé par les argiles, et par certains végétaux au niveau des racines.
Persistance
Biodégradabilité
FDTE/VTR Importer
Eaux de surface :
En aérobiose, l’H2S est oxydé en sulfates ou en soufre élémentaire par les systèmes biologiques naturels (HSDB, 2005 ; Santé Canada, 1987). Il s’agit notamment de micro-organismes de genres Beggiatoa, Thioploca et Thiotrix vivant dans des zones de transition aérobies et anaérobies, où l'oxygène moléculaire et l’H2S sont présents (HSDB, 2005). De même, selon HSDB (2005), quelques bactéries photosynthétiques oxydent l’H2S en soufre élémentaire. Notamment, des Chlorobiaceae et Chromatiaceae (bactéries pourpres) sont trouvées dans des eaux ayant des concentrations élevées en H2S. Les interactions avec ces organismes font partie du cycle global de soufre.
La réduction du sulfate en sulfure survient dans la nature en milieu anaérobie en présence de bactéries sulfato-réductrices et d’une source de carbone organique (Santé Canada, 1987). Ainsi, dans des puits d’eau profonde à Elgin, dans l’Illinois, la concentration en H2S est de 6,4 mg.L-1 alors que la concentration en sulfate n’est que de 2,0 mg.L-1.
Sol :
Dans son rapport, l’HSDB (2005) indique que des micro-organismes du sol et de l'eau sont impliqués dans les réactions d'oxydation/réduction qui oxydent l’H2S en soufre élémentaire. Il s’agit notamment de micro-organismes des genres Beggiatoa, Thioploca et Thiotrix vivants dans des zones de transition aérobies et anaérobies, où l'oxygène moléculaire et l’H2S sont présents.
Dégradabilité abiotique
FDTE/VTR Importer
Eaux :
Une revue bibliographique réalisée par Santé Canada (1987) indique que l’H2S et les sulfures de métaux alcalins et alcalino-terreux sont solubles dans l’eau. Les sels de sulfures solubles se dissocient en ions sulfure qui réagissent avec les ions hydrogène de l’eau pour former l’ion hydrogénosulfure (HS–) ou l’H2S . Les concentrations relatives de ces espèces dépendent des conditions physico-chimiques du milieu notamment du pH, de la température, de la salinité, de la force ionique et de la concentration en oxygène dissous. Ainsi, Broderius et Smith (1977), cités par Broderius et al., (1977) indiquent la relation :
pKH2S = 3,122 + 1132/T avec T en degré Kelvin.
À un pH de 9, environ 1 % du H2S est sous forme non dissociée, alors qu’aux pH de 6,7 et de 5, 50 % et environ 99 % respectivement sont sous la forme non dissociée (Smith et Oseid, 1975). C’est pourquoi, selon Santé Canada (1987), les concentrations en H2S augmentent avec la diminution du pH et la diminution de la salinité. De même, le taux d’oxydation du H2S augmente avec la température. Les sulfures peuvent aussi réagir chimiquement avec l’oxygène dissous. L’oxydation génère divers produits comme le thiosulfate, le sulfite et le sulfate. L’oxydation du sulfure aqueux par l’oxygène s’effectue en quelques jours, mais peut être accélérée par la présence de catalyseurs comme, par ordre décroissant de réactivité, Mn2+, CO2+, Ni2+, Fe2+ et Cu2+. Ainsi, en présence de nickel, l’oxydation du sulfure s’effectue en quelques minutes. C’est pourquoi, dans les stations d’épuration, l’H2S est ordinairement éliminé de l’eau par aération ou par oxydation chimique. L’élimination du H2S par aération est optimale à un pH inférieur à 6.
Air :
Selon l’HSDB (2005), l’H2S n’absorbe pas les radiations solaires. De ce fait, il ne subit pas de photolyse et ne réagit pas photochimiquement avec l’oxygène. La durée de vie du H2S dans l’atmosphère dépend de la température et de divers paramètres comme le taux d’humidité, le rayonnement solaire, les concentrations en ozone et en radicaux OH. ainsi que de la présence d’autres polluants (Bowyer, 2003 ; HSDB, 2005). Dans les régions nordiques, la diminution de la température et de la concentration en hydroxyde durant l’hiver augmentent la durée de vie de l’H2S (Bottenheim et Strausz, 1980, cités par HSDB, 2005). La durée de vie du H2S dans l’atmosphère est comprise entre 18 heures et 42 jours en fonction de la saison, de la latitude et des conditions atmosphériques (Bowyer, 2003 ; National Research Council Canada, 1981, cité par HSDB, 2005). L’IUCLID (2000) indique qu’à la concentration en OH. de 500 000 molécules/cm3 la constante de réaction est de 4,8 10-12 cm3 (mole x sec) soit une demi-vie de 80,2 heures.
Atmosphère
Milieu eau douce
Milieu eau de mer
Milieu sédiment eau douce
Milieu sédiment marin
Milieu terrestre
Conclusion sur la persistance
Bioaccumulation
Organismes aquatiques
FDTE/VTR Importer
Selon l’HSDB (2005), l’H2S n’est pas potentiellement bioaccumulable dans les organismes aquatiques.
Organismes terrestres
FDTE/VTR Importer
Selon l’HSDB (2005), l’H2S n’est pas potentiellement bioaccumulable dans les organismes terrestres, y compris les végétaux.
Organismes sédimentaires
Conclusion sur la bioaccumulation
FDTE/VTR Importer
Selon l’HSDB (2005), l’H2S n’est pas potentiellement bioaccumulable.
L’H2S présent dans les organismes peut être d’origine endogène ou exogène. Dans le règne animal, l’H2S endogène a un rôle vasoactif (relaxation-contraction) ou un rôle multiphasique (contraction-relaxation-contraction) pour l’ensemble des vertébrés (agnathes, chondrichtyens, amphibiens, reptiles, aviaires, mammifères ; Dombkowski et al., 2005). Chez les mammifères, l’H2S est un gaz endogène synthétisé directement dans les tissus artériels et veineux et qui peut être produit dans les tissus par deux enzymes pyridoxal-S-dépendantes, la cystathionine ß-synthétase et la cystathionine γ-lyase (Dombkowski et al., 2004, 2005 ; HSDB, 2005). Il a une action sur de nombreux tissus incluant le cerveau, le système vasculaire, gastro-intestinal, reproducteur, pulmonaire et cardiaque. L’H2S agit sur une cible spécifique du muscle lisse, le canal potassium ATP-sensible (KATP). Chez les poissons, son rôle est encore peu connu. Toutefois, Dombkowski et al. (2004) montrent que, chez la truite arc-en-ciel (Oncorhynchus mykiss), l’H2S a une activité vaso-régulatrice comme décrit chez les mammifères. C’est l’une des premières molécules vasodilatatrices mesurée dans le plasma des poissons à une concentration physiologique significative, et l’étude bibliographique indique qu’il a vraisemblablement un rôle prépondérant dans l’homéostasie cardiovasculaire piscicole. De même, chez les invertébrés, Julian et al. (2002, 2005) rapportent que l’H2S est synthétisé par des homogénats de tissus de bivalves (Tapes philippinarum) ou de ver marin (Urechis caupo) à partir de la L-cystéine via une voie « L-sérine sulphydrase » formant de l’H2S et un thioéther. Chez le ver marin Urechis caupo, l’H2S induit la contraction de fragment de muscle circulaire. De même, Gainey et Greeberg, (2005) montrent que chez Mercenaria mercenaria, l’H2S est synthétisé dans les branchies et agit sur la contraction des muscles branchiaux. Le taux de synthèse varie avec la saison, vraisemblablement en relation avec la concentration naturelle en H2S de l’environnement. Ces auteurs indiquent que certains bivalves comme Geukensia demissa utilisent directement l’H2S comme source d’énergie. Dans ce cas, les cils latéraux sont stimulés par l’H2S. Enfin, des symbioses se sont développées entre des invertébrés marins et des bactéries métabolisant les sulfures, dans de nombreux habitats riches en H2S, incluant les sources hydrothermales marines et beaucoup d’habitats riches en matières organiques en décomposition (Gainey et Greeberg, 2005 ; Powell et Somero, 1986). Les animaux exploitent alors l’énergie de l’H2S en évitant son effet toxique sur la respiration aérobie (Powell et Somero, 1986). Ainsi, Powell et Somero (1986) montrent que les homogénats de tissus d’invertébrés ont une activité sulfure oxydante liée à une enzyme spécifique parfois en association avec des bactéries endosymbiotiques. Dans ce cas, les bactéries ont un rôle de détoxication pour les invertébrés.
Selon Santé Canada (1987) et l’HSDB (2005), l’H2S exogène est rapidement absorbé par l’organisme. Au pH physiologique moyen (environ 7), la moitié du H2S se trouve sous forme non dissociée et l’autre moitié sous forme d’ion hydrosulfure. L’H2S non dissocié est une molécule lipophile capable de diffuser au travers des membranes et de la peau. Les sulfures solubles sont rapidement et complètement hydrolysés dans les fluides organiques pour produire du H2S. Il n’est donc pas possible de différencier l’effet toxique des sulfures solubles et du H2S. Chez les mammifères, après inhalation, l’H2S est distribué dans le plasma sanguin, (principalement lié à l’albumine), le cerveau, le foie, les reins, le pancréas, la rate, les poumons, l’intestin grêle et les os. Le métabolisme du H2S s’effectue par (i) l’oxydation en sulfate et en thiosulfate, la principale voie métabolique, (ii) la méthylation et (iii) la réaction avec des métalloprotéines ou des protéines disulfurées. Les deux premières voies métaboliques peuvent être considérées comme des voies de détoxication, alors que la réaction du H2S avec des protéines essentielles est largement responsable de l’effet toxique. Des mécanismes similaires ont été montrés notamment chez des poissons (Fundulus parvipinnis, Bagarinao et Vetter, 1993) ou des invertébrés comme les vers polychètes Hediste diversicolor et Neanthes virens (Vismann, 1990) ou la langoustine (Nephrops norvegicus, Butterworth et al., 2004). Pour ces organismes, le sulfure, oxydé en thiosulfate, s’accumule respectivement dans le sang ou l’hémolymphe et les tissus. Chez les mammifères, l’oxydation du sulfure en sulfate et son excrétion subséquente par le rein constituent la principale voie d’excrétion métabolique (Santé Canada, 1987). Chez le rat, après administration de sulfure de sodium radiomarqué par voie orale, intrapéritonéale ou intraveineuse, l’excrétion se fait par voie urinaire sous forme de sulfate pendant les 6 à 12 heures qui suivent l’administration. Les principaux effets toxiques sont liés à l’inactivation d’enzymes, soit par la rupture des ponts disulfures, soit par la liaison du sulfure avec des co-facteurs métalliques comme le Fe2+, le Mg2+ ou le Cu2+. De cette manière, des enzymes clés comme la cytochrome oxydase, la phosphatase alcaline et l’anhydrase carbonique peuvent subir une dénaturation irréversible. C’est pourquoi, Ip et al. (2004) indiquent que la meilleure caractérisation de l’effet toxique du sulfure est l’inhibition irréversible de la cytochrome c oxydase, l’élément terminal de la chaîne mitochondriale transporteuse d’électron, bloquant la production d’ATP via la phosphorylation oxydative dans le système de transport des électrons. La liaison de l’H2S à la cytochrome c oxydase se fait au niveau du site ferrique (Fe III) de l’hème du cytochrome aa3. Il en résulte une inhibition immédiate et irréversible de la respiration cellulaire aérobie. Cette action sur la respiration cellulaire explique notamment la sensibilité des cellules spermatiques de l’oursin au H2S (Losso et al., 2004).
Toxicologie
Dernière vérification le 25/04/2024
Introduction
L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (ATSDR, 2006, 2016 ; INERIS, 2000 ; Baars, 2001 ; INRS, 2014 ; US EPA, 2003 ; ANSES, 2016, 2016 ; ECHA, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
Inhalation :
Après une exposition par inhalation, l’H2S est absorbé rapidement à travers les alvéoles (Adelson et Sunshine, 1966 ; Allyn, 1931 ; Breysse, 1961 ; Deng et Chang, 1987 ; Hagley et South, 1983 ; Kimura et al., 1994 ; NIOSH, 1989 ; Osbern et Crapo, 1981 ; Parra et al., 1991). L’H2S est dissocié à pH physiologique en anion (hydrogénosulfure), qui est probablement la forme absorbée. Aucune donnée quantitative n’est disponible sur l’absorption du H2S chez l’homme.
Voie orale :
L’H2S étant un gaz, l’exposition orale est uniquement accidentelle lors de l’ingestion d’un liquide contenant entre autres de l’H2S (Freireich, 1946 ; Imamura, 1996 ; Kimura et al., 1994 ; Osbern et Crapo, 1981).
Voie cutanée :
Aucune étude relative à l’absorption du H2S après absorption par voie cutanée n’est disponible.
Distribution
Une fois absorbé, le H2S se distribue dans tout l’organisme en faible proportion sous forme libre ou soluble (H2S ou HS-), la plus grande portion étant fixée à l’ion ferreux de l’hémoglobine ou réagissant avec les résidus de cystéine (Haouzi et al., 2020). Il a été montré que la proportion de H2S dissous est variable (Ng et al., 2019).
Une exposition accidentelle et mortelle au H2S révèle des concentrations inhalées estimées entre 550 et 650 ppm (764,5 et 930,5 mg.m-3) (Kimura et al., 1994 ; Nagata et al., 1990). L’autopsie a indiqué, chez les hommes intoxiqués, des concentrations de H2S de 1,30 à 1,56 µg.g-1 dans le foie ; de 0,32 à 0,64 µg.g-1 dans la rate ; de 0,47 à 1,50 µg.g-1 dans les reins (Kimura et al., 1994). Vingt-quatre heures après leur mort, des concentrations de 0,2 à 1,06 µg.g-1 dans le cerveau et de 0,21 à 0,68 µg.g-1 dans les poumons ont été retrouvées (Nagata et al., 1990).
En revanche, aucune étude n’est disponible après administration par voie orale ou cutanée chez l’homme.
Métabolisme
La métabolisation de l’H2S peut s’effectuer selon 3 voies : - oxydation (voie principale) dans le foie par action de l’enzyme sulfure oxydase conduisant à la formation de thiosulfate puis en sulfate (Kangas et Savolainen, 1987), - méthylation conduisant à la formation de méthanethiol et de diméthylsulfure, c’est une voie mineure - liaison avec les métalloprotéines ou protéines contenant un groupement disulfure (Beauchamp et al., 1984 ; US EPA, 1987a). Le schéma ci-après, adapté de Beauchamps et al., 1984), donne les étapes de cette métabolisation. Aucune étude du métabolisme de l’H2S chez l’homme n’est disponible après exposition par voie orale ou cutanée. principales voies de métabolisation de l’H2S
Principales voies de métabolisation de l’H2S :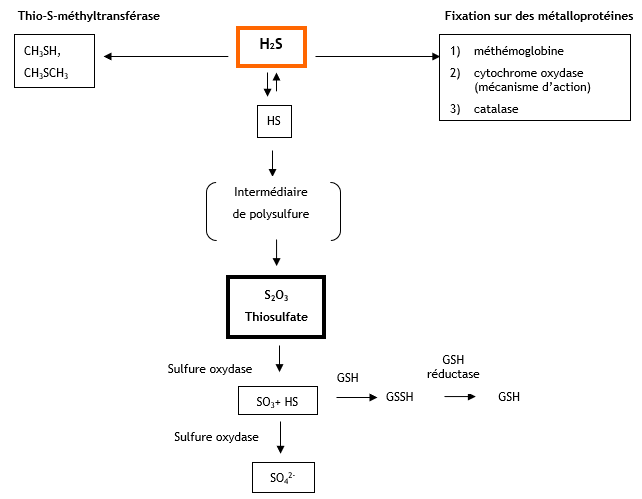
Élimination
L’élimination est à 90 % urinaire sous forme de sulfate, de thiosulfate, de sulfite et sous forme non oxydée. Moins de 10 % sont éliminés par voie biliaire et la voie pulmonaire est négligeable.
Chez l'animal
Absorption
Inhalation :
L’absorption du H2S au niveau des alvéoles s’effectue rapidement, mais aucune donnée quantitative ne permet de déterminer la proportion de la dose inhalée qui est absorbée (Beck et al., 1979 ; Kage et al., 1992 ; Khan et al., 1990 ; Lopez et al., 1989 ; Nagata et Kimura, 1990 ; Prior et al., 1988 ; Smith et Gosselin, 1964 ; Tansy et al., 1981).
Voie orale :
Pour la voie orale, une seule étude animale suggère que le H2S peut être absorbé par le tractus gastro-intestinal. Dans cette étude, des cochons sont nourris avec de l’herbe contenant une concentration élevée en H2S (1,5 - 3,1 ou 6,7 mg.kg-1.j-1) pendant 105 jours (Wetterau et al., 1964).
Voie cutanée :
L’absorption du H2S par voie cutanée était possible lorsque la surface de peau exposée était grande. Ainsi, chez des lapins exposés au H2S (concentrations non précisées) pendant 1 à 2 heures, une relation entre l’exposition cutanée au H2S et la mort des animaux a été mise en évidence (Laug et Draize, 1942).
Distribution
Après inhalation, les données chez l’animal suggèrent que le H2S est rapidement distribué. Des rats mâles adultes exposés à 550 ou 660 ppm (764,5 ou 917,5 mg.m-3) de H2S présentent une concentration de 0,48 µg.g-1 de H2S dans le sang, juste après leur mort (Nagata et al., 1990). Le H2S s’est rapidement distribué dans les poumons, le cerveau et les tissus musculaires et abdominaux. Toutefois, la concentration diminue rapidement dans tous ces organes quelques heures après la mort. Dans une autre étude, des rats Wistar mâles ont été exposés à 75 ppm (104 mg.m-3) de H2S par inhalation pendant 20, 40 ou 60 minutes (Kohno et al., 1991). Les concentrations de H2S mesurées sont de 10 µg.mL-1 dans le sang ; 20 µg.g-1 dans les poumons, 20 µg.g-1 dans le foie, 25 µg.g-1 dans le cerveau, 25 µg.g-1 dans la rate, 30 µg.g-1 dans le rein et 37 µg.g-1 dans le cœur. Les concentrations dans le cerveau, les poumons, le cœur, le foie, la rate et les reins sont significativement supérieures aux concentrations dans le sang. Il a été montré que la persistance d’H2S dans les tissus est essentiellement sous forme liée (Haouzi et al.,2020 ; Klingerman et al., 2013).
Voies orale et cutanée :
Aucune étude chez l’animal n’est disponible après administration par voie orale ou cutanée.
Métabolisme
Comme chez l’homme, la métabolisation du H2S chez l’animal s’effectue selon 3 voies dont la voie principale est l’oxydation en thiosulfate, métabolite majeur. Une étude réalisée sur des lapins blancs japonais, exposés à 500 - 1 000 ppm (695 – 1 390 mg.m-3) de H2S par inhalation, rapporte des concentrations de thiosulfate dans le sang de 0,08 µmol.mL-1, de 0,095 µmol.g-1 dans les poumons et de 0,023 µmol.g-1 dans le cerveau (Kage et al., 1992). Dans la même étude, le taux de thiosulfate dans le sang a atteint un pic de 0,061 µmol.mL-1 immédiatement après exposition (lapins exposés à 100-200 ppm soit 139-278 mg.m-3 pour une exposition de 60 minutes) et était devenu indétectable 4 heures après (Kage et al., 1992).
Dans une étude in vitro, réalisée sur une muqueuse intestinale de rat, Weisiger et al. (1980) ont mis en évidence la métabolisation du H2S par méthylation (voir schéma ci-avant).
Chez l’animal, aucune étude relative au métabolisme du H2S n’est disponible pour des expositions par voie orale ou cutanée.
Élimination
L’élimination du H2S est essentiellement urinaire sous forme de son principal métabolite le thiosulfate. Le taux de thiosulfate dans les urines chez des lapins blancs exposés à 100-200 ppm (139-278 mg.m-3) par inhalation pendant 60 minutes était au maximum de 1,2 µmol.mL-1 1 à 2 heures après exposition et était encore détectable 24 heures après l’exposition à des taux supérieurs témoin (Kage et al., 1992).
Aucune étude n’est disponible chez l’animal concernant l’élimination du H2S après exposition par voie orale. L’excrétion de H2S par exhalaison a été rapportée après une exposition cutanée chez des lapins pendant 1,5 - 2 heures (doses non précisées)(Laug et Draize, 1942).
Autre
Mécanisme d'action :
Le principal mécanisme d’action toxique est l’inhibition directe par liaison directe au fer de l’enzyme cytochrome oxydase aa3. Il en résulte un blocage de la chaîne respiratoire mitochondriale, un métabolisme anaérobie avec production d’acide lactique. Les tissus à forte demande en oxygène (cerveau ou cœur) sont les tissus les plus sensibles à cette altération du métabolisme oxydatif (Ammann, 1986). Il n’y a pas de production de sulfhémoglobine.
Une interaction entre l’H2S et les protéines (Paul et Snyder, 2012) incluant les canaux ioniques (Zhang et al., 2012) révèlent une série de mécanismes complexes pouvant conduire à une dépression neuronale aiguë. Ces mécanismes peuvent agir sur les canaux ioniques cardiaques (Cheung et al., 2018 ) ou neurologiques (Ng, 2019). L’H2S serait également impliqué dans l’activation de potentiel récepteurs transitoire (TRP) (Ogawa et al., 2012 ). Il est aussi proposé (Nicholson et al., 1998) une inhibition de l’anhydrase carbonique, des perturbations directes des potentiels de membranes ou une augmentation des concentrations cérébrales de neuromédiateurs comme l’alanine, la sérotonine, le glutamate, la glycine (Reiffenstein et al., 1992, Garcia-Bereguiain et al., 2008 , Haouzi, 2020).
Synthèse
Chez l’homme, l’inhalation est la principale voie d’exposition à l’H2S. Par cette voie, l’H2S est absorbé rapidement à travers les alvéoles. L’H2S peut également être absorbé par le tractus gastro-intestinal et la peau. L’H2S se distribue dans les différents organes notamment le cerveau, le foie et les reins. La métabolisation du H2S peut s’effectuer selon 3 voies, la voie principale est l’oxydation dans le foie par action de l’enzyme sulfure oxydase conduisant à la formation de thiosulfate. La méthylation conduisant à la formation de méthanethiol et de sulfure de diméthyle est une voie mineure de même que la liaison avec les métalloprotéines ou protéines contenant un groupement disulfure. L’élimination est majoritairement urinaire sous forme de sulfate, de thiosulfate, de sulfite et sous forme non oxydée.
Les données chez l'animal confirment celles chez l’homme et permettent d’identifier le principal mécanisme d’action : l’inhibition directe par liaison au fer de l’enzyme cytochrome oxydase est à l’origine d’un blocage de la chaîne respiratoire mitochondriale et d’un métabolisme anaérobie avec production d’acide lactique. Le cerveau ou le cœur sont les tissus les plus sensibles à cette altération. Une inhibition de l’anhydrase carbonique, des perturbations directes des potentiels de membranes ou une augmentation des concentrations cérébrales de neuromédiateurs comme l’alanine, la sérotonine, le glutamate, la glycine pourraient également survenir.
Equivalents biosurveillance
Toxicité aiguë
Chez l'homme
Inhalation
L’exposition par inhalation est l’exposition la plus courante lors d’une intoxication aiguë au H2S. Les expositions en milieu professionnel concernent des niveaux généralement élevés alors que les études menées chez le volontaire sont pratiquées à des niveaux proches de ceux rencontrés dans l’environnement.
EXPOSITIONS PROFESSIONNELLES (niveaux d’exposition élevés)
L’exposition par inhalation à des concentrations élevées de H2S( ≥ 500 ppm soit 695 mg.m-3) est mortelle (Beauchamps et al., 1984). En 1997, les statistiques du NIOSH indiquent que l’H2S serait la première cause de mortalité par accident professionnel. Ainsi, 29 morts et 5 563 expositions ont été attribués au H2S durant la période de 1983 à 1992 (Snyder et al., 1995) majoritairement en espace confiné (Adelson et Sunshine, 1966 ; Breysse, 1961 ; Allyn, 1931 ; NIOSH, 1985 ; Campanya et al., 1989 ; Freireich, 1946 ; Hagley et South, 1983 ; Morse et al., 1981 ; Osbern et Crapo, 1981 ; Deng et Chang, 1987 ; Parra et al., 1991). Les individus perdent très rapidement conscience parfois même après seulement quelques inspirations (Adelson et Sunshine, 1966 ; Deng et Chang, 1987 ; INERIS, 2000 ; NIOSH, 1989 ; Osbern et Crapo, 1981). Malgré les précautions mises en œuvre les expositions à des niveaux élevés restent fréquentes et le plus souvent fatales dans différents secteurs d’activité en milieu professionnel (Hedlund et Madsen, 2018 ; Ventura Spagnolo et al., 2019 ; Barbera et al., 2017 ; Christia-Lotter et al., 2007 ; Mooyaart et al., 2016 ; Shivanthan et al., 2013) ou surviennent dans de rares cas accidentels en population générale (Sastre et al., 2013 ; Daldal et al., 2010).
De manière générale, deux formes d’intoxication sont distinguées en fonction du niveau d’exposition : la forme suraiguë et la forme subaiguë.
L’intoxication suraiguë s’observe pour de fortes concentrations (environ 1 000 ppm soit 1 390 mg.m-3) et de courtes durées d’exposition (quelques secondes à quelques minutes). Elle se traduit par une atteinte du SNC (perte de conscience surnommée « coup de plomb des vidangeurs ou coup de plomb des égoutiers ») et des symptômes de détresse respiratoire et d’apnée. Si l’exposition n’est pas instantanément fatale (réanimation pendant la phase d’apnée), l’apparition d’un œdème pulmonaire retardé est fréquemment observée. Une amnésie rétrograde avec une diminution des facultés intellectuelles est également possible (INERIS, 2000).
Les signes systémiques en rapport avec l’anoxie cellulaire peuvent apparaître dès 250 ppm : toux, douleur thoracique, dyspnée (hémoptysie très rare mais l’œdème pulmonaire est observé dans 4 à 16 % des cas), hypotension, tachycardie, troubles du rythme, ischémie sous endothéliale (Leikin, 2001). Les signes neurologiques qui peuvent se manifester dès 200 ppm et sont constants et sévères dès 500 ppm comportent : des céphalées, des vertiges, des troubles de la coordination, des nausées, des vomissements, une asthénie intense, une désorientation, un nystagmus, une perte de connaissance et un coma.
Des irritations oculaires de type photophobie, conjonctivite sont rapportées dès 70 à 280 mg.m-3 (50 à 200 ppm) pour des durées d’expositions inférieures à une heure. Lorsque l’exposition se prolonge pendant quelques heures une kératite et une altération durable de la vision sont également possible (Anses, 2016).
A distance des intoxications aigues, des séquelles neurologiques ont pu être observées sous la forme de troubles amnésiques, de tremblements, d’ataxie, d’altération de la vision, de l’audition et une démence.
ÉTUDES SUR LES VOLONTAIRES (faibles niveaux d’exposition)
Plusieurs études ont été menées chez des volontaires sains, hommes et femmes (Bhambhani, et Singh, 1991 ; Bhambhani et al., 1994, 1996a, 1996b, 1997). Les sujets ont été exposés à des concentrations de 0,5 à 10 ppm (0,7 à 14 mg.m-3), pour des durées allant jusqu’à 30 minutes. Les expositions ont été effectuées au repos et pendant des exercices d’intensités variables.
Pour une concentration de 5 ppm (6,95 mg.m-3) pendant 30 minutes, au cours d’un exercice physique intense, une augmentation de la consommation en oxygène est observée, ainsi qu’une augmentation du taux de lactate dans le sang. Aucune altération de la fréquence cardiaque ni de la ventilation pulmonaire n’est mise en évidence.
Pour une exposition de 30 minutes, à 5 ppm (6,95 mg.m-3) de H2S lors d’une activité physique maximale, quelques variations transitoires d’activités enzymatiques sanguines et musculaires sont rapportées.
Pour une exposition de 15 minutes à la concentration de 10 ppm (14 mg.m-3), même lors de phases d’activité physique intenses, aucun signe clinique n’est observé chez les volontaires. Une augmentation des taux métaboliques et ventilatoires est notée, mais sans altération de la fonction pulmonaire. Enfin, il apparaît qu’une exposition au H2S modifie les besoins en oxygène des muscles en activité intense.
Une étude a évalué la fonction pulmonaire chez 3 hommes (âge : 33-50 ans) et 7 femmes (âge : 31-61 ans) présentant un asthme nécessitant un traitement médicamenteux depuis 1 à 13 ans (Jäppinen et al., 1990). Aucun de ces sujets n’est atteint d’asthme sévère. Au cours de l’étude, les sujets sont exposés à une concentration de 2 ppm de H2S pendant 30 minutes. Tous les sujets ont identifié une odeur désagréable et ressentent une sécheresse du nez et du pharynx en début d’exposition. Les sujets s’accommodent rapidement de l’odeur. Trois des sujets ont signalé après l’exposition des céphalées. Il n’y a pas eu de modification des paramètres respiratoires habituels. La réponse de la fonction respiratoire est étudiée lors d’une adjonction d’histamine avant et après l’exposition. Seuls deux individus présentent une augmentation de la résistance et de la conductance des voies respiratoires, ce qui suggère une obstruction bronchique. De plus, 3 des 10 sujets présentent des céphalées à la fin de l’exposition.
Une étude a été réalisée sur 75 sujets (35 femmes et 39 hommes en bonne santé, exposés à 0,05 – 0,5 – 5 ppm (0,07 – 0,7 - 7 mg.m-3) d’H2S pendant 2 heures dans un ordre aléatoire en chambre d’exposition (Fiedler et al., 2008). Une diminution significative du rappel cognitif par l’apprentissage verbal auditif a été constatée à tous les niveaux d’exposition mais qui, selon les auteurs, pourraient être due à la fatigue. Ces effets sont considérés par les auteurs comme significatifs mais mineurs.
Expositions environnementales
L’influence de pic d’exposition environnementale dans des zones riches en H2S d’origine géothermique sur la survenue de maladie cardiaques, respiratoires et d’accident vasculaire cérébral en premier diagnostic a été menée sur la population de Reykjavik (Islande)(Finnbjornsdottir et al., 2016). Elle a mis en évidence une association entre les visites aux urgences pour pathologies cardiaques chez les hommes âgées de plus de 73 ans le jour où un pic d’H2S dépassant 7 µg.m-3 est mesuré.
SEUIL OLFACTIF
Le H2S étant très odorant est facilement reconnaissable (odeur d’œuf pourri), son seuil olfactif est très faible et sa détermination précise difficile car elle varie en fonction de la sensibilité individuelle. Les niveaux de perception olfactive du H2S ont été évalués chez 16 individus (0,012 – 0,069 ppm soit 20 - 100 µg.m-3) avec une moyenne géométrique de 0,029 ppm (40 µg.m-3). Cette valeur a été retenue comme seuil de détection olfactif pour le H2S (California State Department of Public Health, 1969). Sur la base des données mentionnées par Amoore et al. (1983), l’INRS retient un seuil à 0,008 ppm (soit 0,013 mg.m-3) qui correspond à la valeur détectée par 50 % des sujets exposés (INRS, 2005 ). Enfin, certains considèrent que ce seuil ne protège pas entièrement la population et devrait être reconsidéré (Reynolds et Kamper, 1984). Une exposition prolongée peut entrainer une fatigue olfactive, correspondant à une adaptation sensorielle à l’odeur (Santé Canada, 2017). A 100 ppm (139 mg.m-3), le sens de l’odorat disparait après 2 à 15 minutes (Malone Rubright et al., 2017).
Voie orale
À notre connaissance, il n’existe pas de données relatives aux expositions par voie orale.
Voie cutanée
À notre connaissance, il n’existe pas de données relatives aux expositions par voie cutanée.
Synthèse
Chez l’homme, l’intoxication suraiguë à de fortes concentrations se traduit par une atteinte du SNC (perte de conscience surnommée « coup de plomb des vidangeurs ou des égoutiers ») et une détresse respiratoire par apnée. Si l’exposition n’est pas instantanément fatale, l’apparition d’un œdème pulmonaire retardé peut être observée. Une amnésie rétrograde avec une diminution des facultés intellectuelles est également possible.
Les signes systémiques en rapport avec l’anoxie cellulaire peuvent apparaître dès 250 ppm : toux, douleur thoracique, dyspnée, hypotension, tachycardie, troubles du rythme, ischémie sous endothéliale. Les signes neurologiques peuvent se manifester dès 200 ppm et sont sévères dès 500 ppm. Ils comportent : des céphalées, des vertiges, des troubles de la coordination, des nausées, des vomissements, une asthénie intense, une désorientation, un nystagmus, une perte de connaissance et un coma. Des séquelles neurologiques ont pu être observées sous la forme de troubles mnésiques, de tremblements, d’ataxie, d’altération de la vision, de l’audition et une démence.
A des niveaux d’exposition plus bas (<250 ppm), une augmentation de la consommation d’oxygène, et d’activités enzymatiques peuvent être accompagnées de céphalées, puis surviennent des irritations des muqueuses oculaires et respiratoires.
Chez l'animal
Inhalation
Les CL50 chez le rat sont comprises entre 335 et 587 ppm (466 et 816 mg.m-3), en fonction de la souche et de la durée d’exposition, comprise entre 2 et 6 heures (Prior et al., 1988 ; Tansy et al., 1981). Les principaux effets rapportés lors d’une exposition aiguë sont synthétisés dans le tableau suivant, d’après INERIS (2000).
Une exposition à 200 ppm (280 mg.m-3) d’H2S 3 h/j, pendant 1 ou 5 jours chez le rat induit la survenue de lésions bénignes initiales de l’épithélium respiratoire accompagnées d’une légère inflammation et d’une perte de la structure cellulaire basale (Roberts et al., 2008). Ces effets sont réversibles.
Une étude chez le rat exposé à 0 – 1 – 10 - 100 ppm (0 – 1,4 – 14 – 140 mg.m-3) d’H2S 8 h/j 5j/sem pendant 5 semaines a montré une réduction significative de l’activité cytochrome oxydase dans les mitochondries pulmonaires dès 10 ppm (14 mg.m-3) (Khan et al., 1998 ).
Le mode d’action pour les effets neurotoxiques a été étudié chez le rat (Warenycia et al., 1989). L’inhibition des activités monoamine oxydase (MAO) et l’augmentation des niveaux de neurotransmetteurs du tronc cérébral jouent un rôle primordial dans la perte du contrôle respiratoire au niveau central.
Synthèse de principaux effets d’une exposition aiguë par inhalation chez l’animal :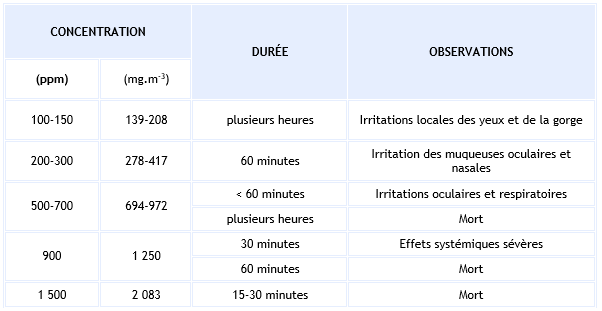
Voie orale
À notre connaissance, il n’existe pas de données relatives aux expositions par voie orale.
Voie cutanée
À notre connaissance, il n’existe pas de données relatives aux expositions par voie cutanée.
Synthèse
Chez le rat, les principaux effets sont des irritations oculaires et pulmonaires et des effets systémiques sévères. Les effets neurotoxiques sont liés à une inhibition des activités monoamine oxydase (MAO) et une augmentation des niveaux de neurotransmetteurs du tronc cérébral.
Toxicité à dose répétées
Effets généraux
Chez l'homme
Inhalation
De manière générale, pour des expositions intermittentes mais répétées à des concentrations de l’ordre de 50 à 100 ppm (69,5 à 139 mg.m-3), des manifestations subjectives et variables de « malaise » (céphalée, asthénie, troubles de la mémoire, nausées, anorexie,…) sont décrites.
Très peu de données sont disponibles pour une exposition chronique au H2S par voie respiratoire. Une étude épidémiologique sur la population de la ville de Roturua en Nouvelle Zélande, utilisant l’énergie géothermique comme chauffage industriel et domestique dans les années 1970, a été conduite par Bates et al. (1997, 1998, 2002). Une campagne de mesures, menée en 1978, indiquait que la concentration moyenne en H2S était de 20 µg.m-3 (14 ppb) avec 35 % des mesures aux environs de 70 µg.m-3 (50 ppb), 10 % des mesures au-dessus de 400 µg.m-3 (284 ppb) et la concentration la plus élevée de 1 mg.m-3 (710 ppb). En l’absence de donnée significative, les auteurs ont conclu à l’absence d’augmentation du taux de mortalité de la population à Roturua, par comparaison au reste de la population Néo-zélandaise. En revanche, une augmentation significative du taux de mortalité, lié à une pathologie respiratoire (SMR = 1,18 ; p< 0,001), est observée par comparaison au reste de la population Néo-zélandaise.
Plus récemment, une étude rétrospective, toujours conduite par Bates et al. (2002), a évalué l’incidence d’une exposition au H2S (niveaux d’exposition faible, moyen ou élevé) sur les pathologies respiratoires. Toutefois, l’interprétation des données de cette étude est délicate par manque de données quantitatives et qualitatives d’évaluation de l’exposition. Cette étude permet de voir, à partir des registres hospitaliers, sur la période 1993-1996, l’influence de la localisation des logements sur les pathologies respiratoires. Elles sont, en général, significativement plus élevées dans les 3 groupes. Une augmentation significative de l’incidence des pathologies cardiovasculaires et du système nerveux a également été mise en évidence (Bates et al., 1998). Ces effets sur le SNC ont également été retrouvés pour des expositions plus récentes (SIR = 1,11 ; p < 0,001) aussi bien du SNC (SIR = 1,22 ; p< 0,001) que du système nerveux périphérique (SIR = 1,35 ; p < 0,001) chez les habitants de Roturua, par comparaison à la population générale de Nouvelle Zélande (Bates et al., 2002). Les effets sont encore plus marqués chez le groupe soumis aux concentrations les plus élevées, respectivement SIR = 2,59 (1,91-3,44) pour les effets sur le SNC, et SIR = 2,27 (1,97-2,61) pour les effets sur le système nerveux périphérique. Enfin, des effets oculaires ont aussi été notés. Bates et al. (1997) ont montré une augmentation significative de atteintes oculaires et plus particulièrement de la cataracte (SIR = 1,26 ; p<0,001), de la conjonctive (SIR = 2,09 ; p< 0,001) et des désordres orbitaux (SIR =1,69 ; p = 0,005).
Les évaluations plus récentes sur cette cohorte n’ont pas mis en évidence d’augmentation du risque d’asthme ou de symptômes liés à l’asthme chez les personnes résidant dans les zones les plus exposées au H2S (Bates et al., 2013) ni d’atteinte de la fonction pulmonaire et du taux de broncho-pneumopathie chronique obstructive (BPCO) quelle que soit la tranche d’âge (15 à 65 ans) et pour un niveau d’exposition continu compris entre 29,1 µg.m-3 (dans les habitations) à 37,8 µg.m-3 (au travail) (Bates et al., 2015). Il n’a pas non plus été mis en évidence d’association entre les expositions au H2S environnemental et des troubles de l’attention, de la rapidité psychomotrice, de la mémoire, de la motricité fine ou de l’humeur (Reed et al., 2014).
Deux études, menées chez des travailleurs exposés professionnellement au H2S, rapportent quelques rares atteintes pulmonaires (essoufflement, respiration sifflante) (Hessel et al., 1997 ; Richardson, 1995). D’autres études menées sur des populations résidant dans des zones polluées semblent aussi mettre en évidence des effets pulmonaires. Toutefois, les co-expositions à d’autres polluants, notamment les particules, n’ont pas pu être individualisées, ce qui complique l’interprétation de ces résultats (Jaakkola et al., 1990 ; Martilla et al., 1995, 1994 ; Partti-Pellinen et al., 1996).
Synthèse
Chez l’homme, l’H2S est associé à une augmentation de la mortalité par pathologies pulmonaires et de l’incidence des pathologies cardiovasculaires et du système nerveux (central et périphérique), mais il existe des coexpositions. Des atteintes oculaires (conjonctivite et kératite) sont également rapportées.
Chez l'animal
Inhalation
Des rats CD mâles âgés de 10 semaines (12/lots) ont été exposés aux concentrations de 0, 10, 30 ou 80 ppm (0, 14, 42 ou 111 mg.m-3) de H2S 6 h/j, 7 j/semaine pendant 10 semaines (Brenneman et al., 2000). L’étude a porté exclusivement sur l’analyse histopathologique de la cavité nasale. A la fin de l’exposition des lésions nasales au niveau de la muqueuse olfactive sont observées aux concentrations de 30 et 80 ppm (42 et 111 mg.m-3). Des lésions multifocales bilatérales avec perte des neurones olfactifs et hyperplasie des cellules basales affectent les régions médianes et dorsales de la cavité de l’éthmoïde. La sévérité des lésions varie entre modérée et sévère. Ces effets ne sont pas retrouvés chez les témoins et les animaux exposés à la concentration de 10 ppm (14 mg.m-3).
D’autres études ont été réalisées chez le rat F-344 (CIIT, 1983b) et le rat Sprague Dawley (CIIT, 1983c), exposés au H2S à des concentrations de 0 – 10 - 30 - 80 ppm (0 – 14 - 42 – 111 mg.m-3), 6 h/j, 5 j/sem pendant 90 jours. Les échantillons issus de ces études ont été ré-observés par Dorman et al. (2004). Chez le rat F-344, les seuls effets observés correspondent à une altération du nerf olfactif au niveau de l’épithélium nasal à la concentration de 30 ppm (42 mg.m-3). Les mêmes effets sont retrouvés chez le rat Sprague Dawley, mais une hyperplasie de l’épithélium bronchiolaire est également rapportée à la même concentration ainsi qu’une perte de poids (10 %) chez les femelles, à la concentration de 80 ppm (111 mg.m-3). Chez les souris B6C3F1, pour le même protocole expérimental, une altération du nerf olfactif au niveau de l’épithélium nasal à la concentration de 30 ppm (42 mg.m-3) est également rapportée, ainsi qu’une inflammation de la muqueuse nasale à la concentration de 80 ppm (111 mg.m-3) et une diminution du poids (7 - 10 %) (CIIT, 1983a). Ces études ne révèlent pas d’altération histopathologique de la rate ou des ganglions lymphatiques chez les rats Sprague Dawley et F-344 et les souris.
Enfin, lors d’une exposition subchronique par inhalation chez le rat Sprague Dawley à des concentrations de 0 ou 50 ppm (0 ou 69,5 mg.m-3) de H2S (5 j/sem, pendant 25 semaines), aucun effet neurotoxique n’est observé (Gagnaire et al., 1986). Une série d’expériences visant à évaluer les capacités d’apprentissage et de mémorisation à l’aide du test du labyrinthe chez le rat exposé à 175 mg.m-3 (125 ppm) d’H2S 4 h/j, 5 j/sem. pendant 5 ou 11 semaines (Partlo et al., 2001) a montré que les résultats ne sont pas altérés après 5 semaines d’exposition mais le sont à 11 semaines.
Voie orale
À notre connaissance, il n’existe pas de donnée relative aux expositions par voie orale.
Voie cutanée
À notre connaissance, il n’existe pas de donnée relative aux expositions par voie cutanée.
Synthèse
Chez l’animal, pour des expositions subaiguës des lésions de la muqueuse olfactive avec perte des neurones olfactifs et hyperplasie des cellules basales affectent les régions médianes et dorsales de la cavité de l’éthmoïde. Des inflammations de la muqueuse nasale ou des hyperplasies bronchiolaires sont aussi décrites. Une étude rapporte une altération de la capacité de d’apprentissage et de mémorisation.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2004 |
| US EPA | Données insuffisantes pour l’évaluation d’un éventuel pouvoir cancérigène | 2003 |
Chez l'homme
Inhalation
Une seule population a été étudiée de manière rétrospective, il s’agit de résidents de la ville de Rotorua, Nouvelle Zélande (Bates et al., 1998). Dans cette ville, la géothermie est utilisée à la fois dans l’industrie et pour le chauffage résidentiel. Les résultats de cette étude sont difficilement utilisables en raison de l’absence de mesure des niveaux d’exposition au H2S. Les auteurs rapportent cependant que les expositions au mercure et au H2S pourraient avoir un impact sur les habitants. Une étude préliminaire avait montré que les concentrations moyennes en H2S dans cette zone étaient de 20 µg.m-3, dans 30 % des cas de 70 µg.m-3 et, dans 10 % des cas, au-delà de 400 µg.m-3 (Bates et al., 1997). Les ouvriers (pas de précision quant à l’activité) de cette zone présentaient un excès de risque de cancer nasal significatif (SIR 3,17 ; p = 0,01) par rapport aux résidents et au reste de la population de Nouvelle Zélande. De plus, un excès de risque de cancer de la trachée, des bronches et des poumons a aussi été mis en évidence (SIR = 1,48, p = 0,02) chez les femmes Maoris, population majoritaire de cette zone, en Nouvelle Zélande, en comparaison avec celles du reste du pays. L’interprétation des résultats reste délicate en l’absence de données complémentaires.
Voie orale
À notre connaissance, il n’existe pas de donnée pour des expositions par voie orale
Voie cutanée
À notre connaissance, il n’existe pas de donnée pour des expositions par voie cutanée.
Synthèse
Une seule étude chez l’homme est disponible. Elle rapporte des excès de risque de cancer nasal et un excès de risque de cancer de la trachée, des bronches et des poumons mais son interprétation reste délicate et ne permet pas de conclure.
Chez l'animal
Toutes voies
À notre connaissance, il n’existe pas de donnée pour des expositions par voie orale, cutané ou par inhalation chez l’animal.
Effets génotoxiques
Généralités
Etudes chez l'homme
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé | 2004 |
Chez l'homme
Toutes voies
Une analyse toxicogénomique in vitro dans des cellules épithéliales intestinales humaines montre que l’H2S peut moduler l’expression de gènes impliqués dans le cycle cellulaire et conduire à des réponses inflammatoires, des dommages à l’ADN et des réparations de l’ADN (Attene-Ramos et al., 2010).
In vitro
Organismes procaryotes
Des vapeurs de H2S se sont révélées non mutagènes dans le test d’Ames (Hughes et al., 1984). Il semblerait que ce soit la seule étude à ce sujet.
Organismes eucaryotes
Synthèse
Les données de génotoxicité disponibles ne permet pas de conclure.
Effets sur la reproduction
Chez l'homme
Synthèse
Aucune données relatives aux effets du H2S sur la reproduction chez l’homme n’a été identifiée
Chez l'animal
Inhalation
Les seules données disponibles chez l’animal correspondent à des expositions par inhalation.
Aucune altération histopathologique n’a été retrouvée au niveau des organes de la reproduction chez les mâles et les femelles aussi bien chez des rats (F-344 ou Sprague-Dawley) que des souris (B6C3F1) exposés à des concentrations de 10 - 30 - 80 ppm (14 – 42 – 111 mg.m-3) de H2S 6 h/j, 5 j/sem pendant 90 jours (CIIT, 1983a, 1983b, 1983c). Aucune altération de la durée de la gestation, la viabilité ou la taille de la portée n’a été observée chez des rats Sprague Dawley exposés aux concentrations de 20, 50 ou 75 ppm (27,8 – 70 – 104 mg.m-3) de H2S, 7 h/j du 6ème au 21ème jour de gestation (Hayden et al., 1990b). Cependant, une augmentation apparente de la durée moyenne de parturition est rapportée mais celle-ci n’est pas statistiquement significative.
Enfin, Dorman et al. (2000) n’ont trouvé aucune altération de la durée de la gestation chez les rats Sprague-Dawley exposés aux concentrations de 0, 10, 30 ou 80 ppm (0, 14, 42 ou 111 mg.m-3) de H2S 6 h/j, 7 j/sem, 2 semaines avant l’accouplement, puis 2 semaines pendant la période d’accouplement et du premier au 19ème jour de la gestation. Cette étude rapporte également l’absence d’altération de la fertilité, du nombre de femelles ayant des petits vivants, de la taille des portées et du nombre d’implants par femelles. Il n’y a pas non plus d’altération histologique des organes de la reproduction et des organes secondaires chez des lots témoins exposés à la concentration la plus élevée de 80 ppm (111 mg.m-3). Une légère augmentation non statistiquement significative de l’incidence de la dégénérescence des testicules est malgré tout observée à la concentration de 80 ppm (111 mg.m-3). De plus, des altérations non statistiquement significatives du nombre de spermatozoïdes et de leur morphologie sont observées. Cette étude ne révèle pas d’altération du développement ou des performances au cours de tests neuro-développementaux, ou d’anomalies histopathologiques au niveau du cerveau.
Synthèse
Les différentes études chez l’animal ne permettent pas d’identifier d’effet sur la reproduction.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Non classé | 2004 |
Chez l'homme
Inhalation
Une étude a été menée en Finlande sur les taux d’avortement spontané et le lien éventuel entre une exposition professionnelle ou environnementale du père ou de la mère au H2S (Hemminki et Niemi, 1982). Une augmentation non statistiquement significative des avortements spontanés a été mise en évidence chez les femmes vivant dans une zone où les concentrations en H2S étaient supérieures à 2,85 ppm (3,96 mg.m-3). Toutefois l’interprétation de ces résultats reste impossible car cette étude portait aussi sur l’influence du dioxyde de soufre et du disulfure de carbone sur le nombre d’avortements spontanés chez les femmes exposées.
Une étude rétrospective a été menée sur les avortements spontanés chez une population de femmes travaillant dans l’industrie de la pétrochimie en Chine (Xu et al., 1998). Une augmentation statistiquement significative du risque d’avortement spontané, lors d’expositions fréquentes aux composés pétrochimiques (OR : 2,7, 95 % CI = 1,8-3,9), a été observée. Le risque spécifique relatif au H2S a été calculé de 2,3 (95 %, CI = 1,2 – 4,4).
Voie orale
A notre connaissance, il n’existe pas de données relatives aux effets sur le développement, suite à une exposition par voie orale.
Voie cutanée
A notre connaissance, il n’existe pas de données relatives aux effets sur le développement, suite à une exposition par voie cutanée.
Synthèse
Chez la femme, une augmentation du taux d’avortement spontanés a été décrite mais les résultats sont difficilement interprétables du fait de co-expositions.
Chez l'animal
Inhalation
Aucune modification des protéines sériques, des activités lactate déshydrogénase (LDH), SGOT ou phosphatase alcaline n’est rapportée chez les nouveau-nés de rats Sprague-Dawley exposés à des concentrations de 20, 50 ou 75 ppm (27,8 – 70 – 104 mg.m-3) de H2S 7 j/sem, du premier jour de gestation au 21ème jour après la naissance (Hayden et al., 1990a). Il n’y a pas non plus d’augmentation des taux de glucose sérique chez les nouveau-nés alors que ces taux augmentent de 50 % chez des femelles exposées à 21 jours après l’exposition. Des retards du redressement du pavillon de l’oreille et de l’apparition du pelage ont été décrits dès la plus faible dose d’exposition. Un LOAEL pour le développement de 28 mg.m-3 a été retenu pour cette étude.
D’autres études ne montrent pas d’effet sur les jeunes pour une exposition chez le rat Sprague Dawley aux concentrations de 0, 70, 140 ou 210 mg.m-3 (0, 50, 100 ou 150 ppm) de H2S 6 h/j, du 6ème au 20ème jour de gestation (Saillenfait et al., 1989).
Plusieurs auteurs ont cherché à mettre en évidence les effets d’une exposition périnatale sur le développement du SNC et plus spécifiquement sur les cellules de Purkinje chez le rat (Hannah et Roth, 1991 ; Skrajny et al., 1992). Toutefois, ces effets ne sont pas clairement mis en évidence et aucune relation dose–effet n’a pu être établie.
Synthèse
Les données animales disponibles ne mettent pas en évidence d’effet embryo- et/ou fœtotoxique. Les effets sur le développement post-natal se limitent à des marqueurs physiques (pavillon de l’oreille, pelage).
Autres Effets
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Autres seuils accidentels
Valeurs réglementaires
Valeurs guides
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets à seuil - Exposition aiguë par inhalation :
L’ATSDR propose un MRL de 0,07 ppm (100 µg.m-3) pour une exposition aiguë au H2S par inhalation (2016)
Cette valeur est basée sur l’étude chez le volontaire de Jäppinen et al. (1990). Au cours de cette étude, trois hommes et sept femmes atteints d’asthme non sévère ont été exposés à 2 ppm (2,8 mg.m-3) de H2S pendant 30 minutes. Une LOAEC de 2 ppm est mesurée pour une altération de la résistance et de la conductance des voies respiratoires.
Facteur d’incertitude
Un facteur d’incertitude de 27 est retenu qui correspond à un facteur de 3 pour l’utilisation d’une LOAEC, d’un facteur de 3 pour la variabilité au sein de la population humaine (du fait de l’utilisation d’une population sensible, asthmatique, ce facteur a été réduit à 3) et d’un facteur de 3 pour le manque de données pour des durées d’exposition plus longues que 30 minutes.
Calcul : 2 / 27 = 0,07 ppm (0,1 mg.m-3)
Indice de confiance : cet organisme n’attribue pas d’indice de confiance
L’OEHHA propose REL de 42 µg.m-3 pour 1 h d’exposition au H2S par inhalation (2008).
Cette valeur a été établie à partir de l’analyse de plusieurs études réalisées chez l’homme (California State Department of Public Health, 1969 ; CARB, 1984 ; Reynolds et Kamper, 1985 ; Amoore, 1985). Une LOAEC pour la survenue de céphalées et de nausées comprise entre 0,012 et 0,069 ppm (moyenne géométrique de 0,03 ppm soit 0,042 mg.m-3) a été retenue. Ce niveau est proche de celui de la détection de l’odeur (0,03 à 0,14 mg.m-3, INERIS, 2000 ).
Facteur d’incertitude : Aucun facteur d’incertitude n’est appliqué.
Calcul : 0,042/1 = 0,042 mg.m-3 (0,03 ppm)
Indice confiance : cet organisme n’attribue pas d’indice de confiance
L’OMS propose valeur guide de 150 µg.m-3 pour une exposition aiguë de 24 heures au H2S par inhalation (2000).
Cette valeur est basée sur l’étude de Savolainen (1982) qui correspond à une synthèse de données et qui retient la valeur de 15 mg.m-3 comme limite (LOAEC) basse d’apparition des effets irritants oculaires.
Facteur d’incertitude : Un facteur d’incertitude global de 100 est appliqué pour tenir compte des lésions oculaires graves survenant dès 70 mg.m-3.
Calcul : 15 mg.m-3 x 1/100 = 0,15 mg.m-3
Indice de confiance : cet organisme n’attribue pas d’indice de confiance
L’OMS CICAD propose une CT de 100 µg.m-3 pour une exposition aiguë au H2S par inhalation (2003).
Cette valeur est basée sur la même approche que celle de l’ATSDR à savoir l’étude chez le volontaire de Jäppinen et al. (1990). Au cours de cette étude, trois hommes et sept femmes atteints d’asthme non sévère ont été exposés à 2 ppm (2,8 mg.m-3) de H2S pendant 30 minutes. Une LOAEC de 2 ppm est mesurée pour une altération de la résistance et de la conductance des voies respiratoires.
Un facteur d’incertitude de 30 est retenu qui correspond à un facteur de 10 pour l’utilisation d’une LOAEC, d’un facteur de 3 pour la variabilité au sein de la population humaine notamment les populations les plus sensibles comme les asthmatiques.
Calcul : 2 / 30 = 0,07 ppm (arrondi à 0,1 mg.m-3)
Indice de confiance : cet organisme n’attribue pas d’indice de confiance
Effets à seuil - exposition sub-chronique par inhalation :
L’ATSDR propose un MRL de 0,02 ppm (20 µg.m-3) pour une exposition sub-chronique par inhalation au H2S par inhalation (2016)
Cette valeur a été établie à partir d’une NOAEC déterminée lors d’une étude réalisée chez des rats (12 mâles) ayant inhalé du H2S (0, 10, 30, 80 ppm soit 0, 14, 42, 111 mg.m-3) 6 heures par jour, 7 jours par semaine, pendant 10 semaines (Brenneman et al., 2000). Une NOAEC de 10 ppm (soit 14 mg.m-3) pour des lésions de la muqueuse nasale olfactive des rats a été retenue à partir de cette étude car l’approche par l’utilisation d’une benchmark dose ne s’est pas révélée pertinente en raison de résultats de modélisation irrecevables.
Une NOAEC ajustée (NOAECADJ) a été calculée pour le passage d’une exposition discontinue (6 h/24 h) x (7 j/7 j) à une exposition continue :
NOAECADJ = NOAEC x (6 h/24 h) x (7 j/7 j) = 10 x (6/24) = 2,5 ppm
La concentration équivalente humaine (HEC) a été calculée en utilisant l’équation suivante (US EPA 1994b) pour un gaz de catégorie 1 :
NOAECHEC = NOAECADJ x RGDRET = 2,5 x 0,184 = 0,46 ppm
Avec :
VE(rat) volume par minute inhalé chez le rat = 0,190 L/min
VE(humain) volume par minute inhalé chez l’homme = 13,8 L/min
SA(rat) : surface de la région extra-thoracique chez le rat = 15 cm²
SA(humain) surface de la région extra-thoracique chez l’homme = 200 cm²
RGDRET : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire = (VE / SAET)RAT / (VE / SAET)HUMAIN = (0,19/15) / (13,8/200) = 0, 184
Facteur d’incertitude :
Un facteur de 30 a été appliqué : un facteur 10 pour la variabilité intra-espèce et un facteur de 3 pour les variations inter-espèces (le facteur de 10 habituellement utilisé pour la variation inter-espèces est réduit à 3 du fait de l’utilisation d’un ajustement allométrique qui prend en compte les différences de volumes respiratoires entre le rat et l’homme).
Calcul : MRL = 0,46/30 = 0,015 ppm (2.10-2 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
L’OMS CICAD propose un CT de 20 µg.m-3) pour une exposition sub-chronique par inhalation au H2S par inhalation (2003)
Cette valeur est construite sur la même étude que celle décrite pour l’ATSDR (Brenneman et al., 2000). La construction de la valeur repose sur le même point de départ la NOAEC de 14 mg.m-3 pour les lésions de la cavité nasale. Une NOAEC ajustée (NOAECADJ) a été calculée pour le passage d’une exposition discontinue (6 h/24 h) x (7 j/7 j) à une exposition continue :
NOAECADJ = NOAEC x (6 h/24 h) x (7 j/7 j) = 14 x (6/24) = 3,5 mg.m-3
La concentration équivalente humaine (HEC) a été calculée en utilisant l’équation suivante (US EPA 1994b) pour un gaz de catégorie 1 :
NOAECHEC = NOAECADJ x RGDRET = 3,5 x 0,18 = 0,63 mg.m-3
Avec :
VE(rat) volume par minute inhalé chez le rat = 0,275 m3/j
VE(humain) volume par minute inhalé chez l’homme = 20 m3/j
SA(rat) : surface de la région extra-thoracique chez le rat = 15 cm²
SA(humain) surface de la région extra-thoracique chez l’homme = 200 cm²
RGDRET : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire = (VE / SAET)RAT / (VE / SAET)HUMAIN = (0,275/15) / (20/200) = 0, 18
Facteur d’incertitude :
Un facteur de 30 a été appliqué : un facteur 10 pour la variabilité intra-espèce et un facteur de 3 pour les variations inter-espèces (le facteur de 10 habituellement utilisé pour la variation inter-espèces est réduit à 3 du fait de l’utilisation d’un ajustement allométrique qui prend en compte les différences de volumes respiratoires entre le rat et l’homme).
Calcul : MRL = 0,63/30 = 2.10-2 mg.m-3)
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par inhalation :
L’US EPA propose une RfC de 2 µg.m-3 pour une exposition chronique au H2S par inhalation (2003b).
Cette RfC a été établie à partir d’une NOAEC déterminée par la même étude que pour la construction de la MRL (Brenneman et al., 2000). Une même NOAEC de 10 ppm (14 mg.m-3) pour des lésions de la muqueuse olfactive des rats a été retenue à partir de cette étude.
Une NOAEC ajustée (NOAECADJ) a été calculée pour le passage d’une exposition discontinue à une exposition continue, comme indiqué ci-dessous :
NOAECADJ = NOAEC x (6 h/24 h) x (7 j/7) = 13,9 x (6/24) = 3,475 mg.m-3
Afin de déterminer une NOAECHEC, les doses du H2S se trouvant dans la région extra-thoracique ont été estimées chez l’homme et l’animal.
Le calcul est le suivant :
NOAECHEC = NOAECADJ x RGDRET = 3,475 x 0,184 = 0,639 mg.m-3
avec :
VE(rat) volume par minute inhalé chez le rat = 0,19 L/min
VE(humain) volume par minute inhalé chez l’homme = 13,8 L/min
SA(rat) : surface de la région extra-thoracique chez le rat = 15 cm²
SA(humain) surface de la région extra-thoracique chez l’homme = 200 cm²)
RGDRET : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire = (VE / SAET)RAT / (VE / SAET)HUMAIN = (0,19/15) / (13,8/200) = 0, 184
Facteur d’incertitude :
Un facteur de 300 a été appliqué à la NOAECHEC de 0,639 mg.m-3 :
Un facteur de 10 pour l’extrapolation des données sub-chroniques aux données chroniques, un facteur 10 pour la variabilité intra-espèce et un facteur de 3 pour les variations inter-espèces. On ne tient pas compte du facteur 10, dû à l’ajustement dosimétrique présenté ci-dessus.
Calcul : RfC = 0,639 / 300 = 2 10-3 mg.m-3
Indice de confiance : L’US EPA accorde un indice de confiance moyen dans l’étude clé, moyen à élevé dans la base de données et dans la valeur qui a été élaborée. L’étude est considérée comme de bonne qualité concernant sa conception et sa réalisation ainsi que le choix de l’effet mesuré et la durée de l’exposition, cependant elle présente une limite car seuls des rats mâles ont été exposés ce qui conduit à un indice de confiance moyen. La confiance dans la base de données est bonne car elle couvre les différents effets notamment le développement et la reproduction et a investigué dans le détail les tissus cibles.
L’OEHHA propose REL de 10 µg.m-3 pour une exposition chronique au H2S par inhalation (OEHHA, 2008).
Cette valeur est établie à partir d’une étude expérimentale réalisée chez la souris B6C3F1 exposée à des concentrations de 0 – 10 – 30 – 80 ppm (0 – 14 – 43 – 111 mg.m-3) de H2S 6 h/j, 5 j/sem pendant 90 j (CIIT, 1983a). Une NOAEC de 30 ppm (43 mg.m-3) et une LOAEC de 80 ppm (111 mg.m-3) ont été établies pour une inflammation de la muqueuse nasale.
Une NOAEC ajustée (NOAECADJ) a été calculée pour le passage d’une exposition discontinue à une exposition continue, comme indiqué ci-dessous :
NOAECADJ = NOAEC ´ (6 h/24 h) ´ (5 j/7j) = 30 ´ (6/24) x (5/7) = 5,4 ppm
Afin de déterminer une valeur équivalente pour l’homme, une NOAECHEC a été calculée, les doses de H2S se trouvant dans la région extra-thoracique ont été estimées chez l’homme et l’animal en retenant un facteur RGDR de 0,16 pour un gaz présentant des effets extrathoraciques (US EPA, 1994).
Où VE(rat) volume par minute inhalé chez la souris = 0,033 L/min
VE(humain) volume par minute inhalé chez l’homme = 13,8 L/min
SA(rat) : surface de la région extra-thoracique chez la souris = 3 cm²
SA(humain) surface de la région extra-thoracique chez l’homme = 200 cm²
RGDRET : rapport de dose pour un effet observé d’un gaz dans la région extra-thoracique du tractus respiratoire = (VE / SAET)souris / (VE / SAET)HUMAIN = (0,033/3) / (13,8/200) = 0, 16
Le calcul est le suivant :
NOAECHEC = NOAECADJ ´ RGDRET = 5,4 ´ 0,16 = 0,85 ppm
Facteur d’incertitude :
Un facteur d’incertitude de 100, est retenu qui correspond à un facteur de 3 pour l’extrapolation d’une exposition sub-chronique à chronique, un facteur 3 pour l’extrapolation de l’animal à l’homme, un facteur de 10 pour tenir compte de la variabilité au sein de l’espèce humaine.
Calcul : 0,85/100 = 0,0085 ppm (10 µg.m-3)
Indice de confiance : cet organisme n’attribue pas d’indice de confiance
Synthèse
Effets à seuil - Exposition aiguë par inhalation :
L’INERIS propose de retenir pour une exposition aiguë au H2S par inhalation la VTR aigue de 100 µg.m-3 de l’ATSDR (2016).
Quatre valeurs sont disponibles l’OMS (2000), l’OMS CICAD (2003), l’OEHHA (1999) et l’ATSDR (2016). La valeur de l’OMS est une valeur guide, cette valeur ne sera pas retenue d’autant plus que l’étude sur laquelle elle repose est difficilement accessible, et que le choix du facteur d’incertitude est arbitraire .
Le choix de l’effet critique est basé sur des études chez l’homme mais diffère selon les organismes : la valeur de l’ATSDR et de l’OMS CICAD est basée sur l’irritation des voies respiratoires, celle de l’OEHHA sur la survenue d’une réponse physiologique aux odeurs. Dans son analyse l’OEHHA retient le positionnement de l’American Thoracic Society qui considère comme un effet néfaste une diminution de la qualité de vie en lien avec la santé. Si chacun de ces effets est compatible avec le profil toxicologique de la substance, l’irritation respiratoire chez des asthmatiques apparait à un niveau de concentration plus bas que l’irritation oculaire. De plus, il est difficile d’objectivité les symptômes liés à la réponse physiologique aux odeurs. Ainsi, l’irritation respiratoire apparait comme l’effet critique le plus pertinent. Compte tenu des effets retenus aucun ajustement temporel n’a été réalisé.
Dans chacun des cas, le choix des facteurs d’incertitude est adapté et justifié.
Comparaison des différentes valeurs disponibles pour le H2S
|
Organismes (année) |
ATSDR (2016) |
OMS CICAD (2003) |
OEHHA (2008) |
OMS (2000) |
|---|---|---|---|---|
|
Valeur |
100 µg.m-3 |
42 µg.m-3 |
150 µg.m-3 |
|
|
Effet critique |
Irritation respiratoire |
Réponse physiologique aux odeurs |
Irritation oculaire |
|
|
Concentration critique |
LOAEC = 2 ppm (2,8 mg.m-3) |
LOAEC = 0,03 ppm (0,042 mg.m-3) |
LOAEC = 15 mg.m-3 |
|
|
UF |
27 |
30 |
aucun |
100 Sans détail |
|
UFH |
3 |
3 |
- |
- |
|
UFL |
3 |
10 |
- |
- |
|
UFD |
3 |
- |
- |
- |
La méthode de construction de l’ATSDR et de l’OMS CICAD sont presque identiques et les plus transparentes. L’étude est réalisée sur une population sensible et dans des conditions d’exposition maitrisées. Le choix des facteurs d’incertitude est presque identique celui de l’ATSDR est mieux adapté car il prend en compte à la fois le type d’effet et le manque de données pour des expositions plus longue. Pour ces raisons, l’INERIS retient la valeur de l’ATSDR.
De plus dans cette approche, la survenue de céphalée n’est pas directement prise en compte car l’effet est difficile à objectiver. Cependant, il est décrit dans l’étude clé retenue par l’ATSDR chez 3 des 10 sujets exposés. La concentration retenue étant une LOAEC. Ces effets sont donc bien couverts par cette valeur.
Indice de confiance : Moyen l’étude est de bonne qualité mais le nombre d’individu de l’étude et la durée courte d’exposition limite la confiance dans la valeur qui est proposée.
Effets à seuil - Exposition sub-chronique par inhalation :
L’INERIS propose de retenir pour une exposition sub-chronique au H2S par inhalation la VTR chronique de 0,020 µg.m-3 de l’ATSDR (2016) et OMS CICAD (2003).
Deux valeurs sont disponibles pour des expositions sub-chroniques OMS CICAD (2003) et ATSDR (2016). Les deux valeurs reposent sur la même étude sub-chronique expérimentale de bonne qualité (Brenneman et al., 2000). L’effet critique retenu est le seul investigué dans l’étude et correspond à l‘histologie de la cavité nasale. Cet effet est cohérent avec le profil toxicologique su H2S de même que la NOAEC de 14 µg.m-3 qui lui est associée. La construction des deux valeurs est similaire et transparente. Elle repose sur le calcul d’un ajustement temporel pour tenir compte de l’exposition discontinue dans l’étude clé et du calcul d’une concentration équivalente chez l’homme pour prendre en compte les différences de toxicocinétiques entre le rat et l’homme selon les recommandations de l’US EPA. Ces démarches même si elles différent légèrement sont bien détaillées et recevables. Dans les deux cas, l’application des facteurs d’incertitude est adaptée : elle prend un facteur réduit à 3 pour l’extrapolation des données de l’animal à l’homme en raison de l’ajustement allométrique qui a permis de limiter les incertitudes et un facteur 10 pour tenir compte de la variabilité de sensibilité au sein de l’espèce humaine. Ce choix est bien argumenté et pleinement justifié.
Indice de confiance : élevé en raison de la qualité de l’étude et de la démarche
Effets à seuil - Exposition chronique par inhalation :
L’INERIS propose de retenir pour une exposition chronique au H2S par inhalation la VTR chronique de 2 µg.m-3 de l’US EPA (2003b).
Deux organismes proposent des valeurs pour des expositions chroniques l’US EPA (2003b) et l’OEHHA (OEHHA, 2008). Ces valeurs sont basées sur deux études expérimentales de 90 j l’une menée chez le rat mâle (Brenneman et al., 2000) et l’autre chez la souris (CIIT, 1983a). . La réanalyse des résultats de l’étude chez la souris menée par Doorman et al., 2004 a montré une perte neuronale olfactive observée dès la concentration de 30 ppm dans l’étude menée chez la souris. Ces observations conduisent à ne pas retenir la démarche de l’OEHHA.
Par ailleurs, la démarche retenue par l’US EPA est identique à celle retenue l’ATSDR ou par l’OMS CICAD pour l’élaboration d’une valeur pour une exposition sub-chronique. Le choix des facteurs d’incertitude est cohérent avec les paramètres de l’étude clé et ceux de la construction de la VTR. Ils comprennent un facteur 10 pour la variation de sensibilité au sein de l’espèce humaine, un facteur réduit à 3 pour l’extrapolation des données animales à l’homme et enfin un facteur 10 pour l’extrapolation d’une exposition sub-chronique à chronique.
Indice de confiance : moyen en raison du facteur d’incertitude pour l’extrapolation du sub-chronique au chronique.
Autres valeurs des organismes reconnus
Ecotoxicologie
Dernière vérification le 25/04/2024
Introduction
FDTE/VTR Importer
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, es références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis Klimisch et al. (1997). Klimisch et al. (1997) ont établi une cotation des études expérimentales en prenant en compte la fiabilité des études (méthodes standardisées, Bonnes Pratiques de Laboratoire), le détail de description de la publication ainsi que la pertinence et l’utilité des données dans le cadre de l’évaluation du risque.
Cette cotation est comprise entre 1 et 4. Le détail de ces cotations est rappelé ci-après :
- Score 1 : valide (sans restriction)
- Score 2 : valide avec restriction
- Score 3 : non valide
- Score 4 : pas suffisamment d'information pour valider le test On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une PNEC.
Les tests pour lesquels certaines informations non cruciales sont manquantes, ou pour lesquels des déviations mineures par rapport aux normes sont constatées, sont valides sous réserve de ces restrictions (score 2). Les tests pour lesquels des informations cruciales sont manquantes, pour lesquels les conditions expérimentales ne sont pas satisfaisantes, ou qui ne sont pas pertinents, sont notés par le code 3, et ne pourront pas être pris en compte pour dériver la PNEC. Les tests pour lesquels la publication originale ou le rapport d'essai ne sont pas disponibles ou n'ont pas été vérifiés sont notés par le code 4. Ils ne pourront également pas être pris en compte pour dériver la PNEC.
Dangers
Description
Eau douce
FDTE/VTR Importer
Paramètres d’écotoxicité aiguë :
Algues:
Seuls 2 essais, vis-à-vis des algues dulçaquicoles ou marines ont été répertoriés. La CE50 4 heures à 24 heures est comprise entre 105,6 µg.L-1 et 1 874 µg.L-1 en fonction du paramètre mesuré (croissance ou mesure de l’activité photosynthétique).
Küster et al. (2005) exposent des algues vertes unicellulaires (Scenedesmus vacuolatus) au H2S durant au moins une génération soit 24 heures. L’essai est mené à une température de 28°C, un pH de 6,5 – 6,6 et une concentration en oxygène dissous > à 50 % de la saturation. Afin de limiter la volatilisation des sulfures, l’essai est réalisé dans des tubes de 10 mL fermés. Dans ces conditions, la CE50 24 heures est de 1 874 µg.L-1 d’H2S.
Invertébrés:
Küster et al. (2005) exposent des daphnies (Daphnia magna) au H2S durant 48 heures. L’essai est réalisé selon la ligne directrice OCDE 202 modifiée, 2004, notamment, des tubes de 15 mL fermés sont utilisés afin de limiter la volatilisation des sulfures. L’essai est mené à une température de 20°C, un pH de 6,4 – 6,5 et une concentration en oxygène dissous > à 50 % de la saturation. Il débute avec des individus de 24 à 48 heures. Pour chaque concentration testée, 4 répliques de 5 individus sont réalisées. Un suivi analytique est effectué. Dans ces conditions, la CE50 48 heures est de 122,7 mg.L-1 d’H2S.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les essais débutent avec des animaux de moins de 48 heures alors que la ligne directrice demande des animaux de moins de 24 heures. Les résultats de chaque concentration testée sont donnés sous la forme d’un graphique. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1974b) étudient sur des invertébrés d’eau douce des facteurs influençant la toxicité du H2S. Les essais sont menés sur Caecidotea militaris, Crangonyx richmondensis, Gammarus pseudolimnaeus, Baetis vagans, Ephemera simulans et Hexagenia limbata. Tous les animaux ont été capturés dans le milieu naturel. Les essais sont menés en flux dynamique (dureté totale : 220 mg.L-1). Chaque essai comporte 5 concentrations en H2S et un témoin. Pour chaque espèce, entre 4 et 39 essais sont réalisés. Un suivi analytique est effectué quotidiennement. La concentration en H2S non dissocié est calculée. Selon ce protocole, la CL50 96 heures est de 59 ; 20 ; 1 070 ; 840 ; 316 et 111 µg.L-1 d’H2S respectivement pour Gammarus pseudolimnaeus, Baetis vagans, Caecidotea militaris, Crangonyx richmondensis, Ephemera simulans et Hexagenia limbata.
Du fait de l’objectif de la publication, tous les essais ne sont pas décrits ; ainsi différentes informations sont manquantes en fonction de l’espèce étudiée. De plus, différents essais sont menés à de très faibles concentrations en oxygène dissous. Un suivi analytique montrant la stabilité des concentrations est réalisé. De ce fait, les essais menés à des concentrations en oxygène dissous d’environ 2 mg.L-1seront considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997), même s’ils sont représentatifs des conditions environnementales. Seuls les résultats obtenus à des concentrations en oxygène dissous supérieures ou égales à 5,9 mg.L-1 (Gammarus pseudolimnaeus, Baetis vagans) sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1974a) exposent des amphipodes (Gammarus pseudolimnaeus) adultes au H2S durant 96 heures. Les animaux ont été capturés dans le milieu naturel. L’eau utilisée est une eau de puits (dureté totale CaCO3 : 220,0 mg.L-1 ; alcalinité totale CaCO3 : 222 - 232,0 mg.L-1). Le pH est ajusté pour obtenir les concentrations désirées en H2S, à partir d’une solution de sulfure de sodium. Les essais sont réalisés en flux dynamique à une température comprise entre 17,8 et 18,1°C, un pH compris entre 7,7 et 7,9 et une concentration en oxygène dissous comprise entre 5,8 et 7,4 mg.L-1. Quatre essais sont réalisés. Pour chaque essai, 5 concentrations en H2S comprises entre 8 et 61 µg.L-1 d’H2S et un témoin sont réalisés. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée. Dans ces conditions, la moyenne géométrique des CL50 96 heures est de 22,2 µg.L-1 d’H2S.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, dans la publication d’origin, des données sont manquantes (concentrations testées, taux de mortalité chez les témoins). Malgré ces manques, les CL50 96 heures sont comprises entre 21 et 24 µg.L-1 d’H2S, ce qui démontre la répétabilité des résultats. De ce fait, les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et Oseid (1975) exposent des amphipodes (Gammarus pseudolimnaeus) adultes au H2S durant 96 heures. Les animaux ont été capturés dans le milieu naturel. L’eau utilisée est une eau de puits (température : 18°C ; dureté totale CaCO3 : 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1). Le pH est ajusté pour obtenir les concentrations désirées en H2S, à partir d’une solution de sulfure de sodium. Les essais sont réalisés en flux dynamique. Deux essais sont réalisés. Quatre ou 5 concentrations en H2S suivant un pas logarithmique et un témoin sont testés, de façon à ce que le taux de survie soit de 100 % à la plus faible concentration testée et supérieur à 50 % à la plus forte concentration testée. Un suivi analytique est effectué 3 fois par jour. La concentration en H2S non dissocié est calculée. Dans ces conditions, la CL50 96 heures est de 22 µg.L-1 d’H2S.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, dans la publication d’origine des données sont manquantes (taux de mortalité chez les témoins, nombre de répliques, condition d’élevage des animaux avant les essais, taux de mortalité avant les essais, la concentration en oxygène dissous n’est pas indiquée mais dans un essai chronique des valeurs comprises entre 6,4 et 7,3 mg.L-1 pour une température de 23°C sont indiquées). Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1975) exposent des insectes (Hexagenia limbata) au stade nymphe au H2S durant 96 heures. Les animaux ont été capturés dans le milieu naturel. Ils sont maintenus au laboratoire dans les mêmes conditions que celles de l’essai. L’eau utilisée est une eau de puits (température : 17,8 – 18,3°C ; dureté totale CaCO3 : 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1 ; pH : 7,67 – 7,99 ; O2 : 4,53 – 6,63 mg.L-1). Cinq concentrations en sulfure sont testées (25,1 ; 46,6 ; 107,8 ; 289,0 et 472,3 µg.L-1) et un témoin sans réplique. L’essai est réalisé en flux dynamique dans des aquariums de 25 litres dont le fond est couvert par 3 cm de sédiment naturel. Les animaux sont nourris avant l’essai mais pas durant ce dernier. Un suivi analytique est effectué 3 fois par jour. La concentration en H2S non dissocié est calculée. Dans ces conditions, les CL50 48 heures et 96 heures sont respectivement de 312 et 165 µg.L-1 d’H2S.
Les essais sont relativement bien décrits et les résultats de chaque concentration testée sont indiqués et un suivi analytique est réalisé. Toutefois, l’essai est effectué sans réplique. Malgré ce manque, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Jayamanne (1986) expose des crevettes géantes d'eau douce juvéniles (Macrobrachium rosenbergii) au H2S durant 96 heures. Deux essais sont réalisés sur des animaux âgés de 21 jours et de deux mois. Les animaux ne sont pas alimentés 24 heures avant le début de l’essai et durant ce dernier. L’eau utilisée est une eau de puits vieillie. Les caractéristiques physico-chimiques sont données pour les deux essais (température : 21,6 ± 1°C ; 26,6 ± 0,5°C ; pH : 8,0 ± 0,2 ; 8,8 ± 0,15 ; oxygène dissous : 5,4 ± 1,21 mg.L-1 ; 6,1 ± 1,32 mg.L-1 ; dureté totale CaCO3 : 290 ± 2,78 mg.L-1 ; 301 ± 3,83 mg.L-1 ; alcalinité totale CaCO3 : 224 ± 4,26 mg.L-1 ; 242 ± 5,68 mg.L-1). Les essais sont réalisés en semi-statique avec renouvellement de l’eau toutes les 24 heures dans des aquariums de 2 litres. Pour chaque stade de développement, deux essais sont réalisés en 5 concentrations (1 000, 2 000, 4 000, 6 000 et 8 000 µg.L-1) plus un témoin. Chaque concentration est testée avec 3 répliques. Un suivi analytique est effectué. Au cours des essais les concentrations mesurées en H2S ne sont jamais inférieures à 88 % de la concentration nominale. Dans ces conditions, les CL50 48 et 96 heures sont respectivement de 4 250 et 2 570 µg.L-1 d’H2S lors du premier essai (animaux de 21 jours) et de 4 790 et 4 200 µg.L-1 d’H2S lors du second essai (animaux de 2 mois). Des mouvements erratiques des animaux sont observés plus ou moins rapidement en fonction des concentrations testées. Ce symptôme est lié à l’altération du SNC par l’H2S. À un pH plus élevé, une proportion plus importante d’H2S est sous une forme ionisée et donc moins toxique.
Les essais sont relativement bien décrits. Les essais sont réalisés sur des stades juvéniles de plus de 24 heures. Un suivi analytique montrant la stabilité des concentrations est réalisé. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Poissons:
Chez les poissons, comme vis-à-vis des autres organismes, une disparité des résultats est observée. Pour les individus dulçaquicoles, les CL50 96 heures sont comprises entre 7 et 54 µg.L-1 avec une moyenne géométrique de 24 µg.L-1. Pour les poissons marins, ces valeurs sont respectivement de 112,5, 3 570 et 522 µg.L-1.
L’apparente disparité des résultats obtenus entre les espèces dulçaquicoles et marines est expliquée notamment par les espèces étudiées. En effet, pour le H2S peu de données sont disponibles pour les espèces marines. De plus, ces données générées sur poissons d’eau chaude proviennent d’études destinées à connaître la tolérance de ces derniers au H2S pour l’aquaculture. Comme pour les invertébrés, la toxicité du H2S chez les poissons est principalement dépendante de l’espèce étudiée, du stade de développement et des conditions physico-chimiques du milieu. Ainsi, par exemple, la CL50 96 heures est de 17 et 7 µg.L-1 respectivement pour des stades larvaires de Catostomus commersoni et Sander vitreus. De même, pour cette dernière espèce, la CL50 96 heures est de 7 et 66 µg.L-1 respectivement pour le stade larve et oeuf. Enfin, vis-à-vis du Pimephales promelas au stade juvénile, la CL50 96 heures est de 775,6 µg.L-1 et 24,3 µg.L-1 respectivement à une température de 6,5°C et comprise entre 19,8 et 22°C.
Adelman et Smith (1970) exposent des brochets (Esox lucius) au H2S durant 96 heures aux stades œufs ou larves vésiculées à deux concentrations en oxygène dissous. L’eau utilisée est de l’eau de puits (dureté totale CaCO3 290-300 mg.L-1 ; alcalinité 245 – 300 mg.L-1). Les essais sont réalisés en flux dynamique à un pH compris entre 7,5 et 7,76, une température de 13°C et une concentration en oxygène dissous de 2 mg.L-1 ou de 6 mg.L-1. Pour chaque essai 5 concentrations comprises entre 4 et 86 µg.L-1 d’H2S et un témoin sont réalisés. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH et de la concentration en sulfure totale. Dans ces conditions, la CL50 96 heures est :
-de 34 (moyenne 4 essais) et 37 µg.L-1 d’H2S (moyenne 3 essais) pour le stade œuf à une concentration en oxygène dissous de 2 et 6 mg.L-1 respectivement,
-de 9 (moyenne 3 essais) et 26 µg.L-1 d’H2S (moyenne 3 essais) pour le stade larve vésiculée à une concentration en oxygène dissous de 2 et 6 mg.L-1 respectivement.
Les essais sont relativement bien décrits et les résultats biologiques et physico-chimiques sont indiqués pour chaque concentration testée. Un suivi analytique est réalisé. Toutefois, seuls les résultats obtenus à une concentration en oxygène dissous d’environ 6 mg.L-1 sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et Oseid (1972) exposent au H2S durant 96 heures trois espèces de poissons dulçaquicoles (Sander vitreus, Catostomus commersonii, Oncorhynchus mykiss) à partir du stade œuf ou larve, à des températures comprises entre 12 et 15°C et des concentrations en oxygène dissous comprises entre 3 et 6 mg.L-1. Les œufs proviennent d’écloseries. L’eau utilisée est une eau de puits filtrée sur charbon actif (dureté totale CaCO3 : 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1). Le CO2 de l’eau est extrait et le pH est ajusté (7,6 – 8,0) par aération. De même la concentration en oxygène est ajustée (3, 4 ou 6 mg.L-1) après désoxygénation de l’eau. Les essais sont réalisés en flux dynamique. Chaque essai est réalisé entre 1 et 3 fois. La concentration en H2S testée est comprise entre 13 et 87 µg.L-1 pour les essais sur les œufs, et entre 5 et 86 µg.L-1 pour les essais sur les larves plus un témoin. La concentration en H2S non dissocié est calculée à partir de la concentration en sulfure totale, de la température et du pH. Dans ces conditions, la CL50 96 heures est :
-comprise entre 52 et 87 µg.L-1 d’H2S pour Sander vitreus au stade œuf en fonction de la température (12 ou 15°C) et de la concentration en oxygène dissous (3, 4 ou 6 mg.L-1),
-de 7 µg.L-1 d’H2S pour Sander vitreus au stade larvaire à la température de 15°C et à une concentration en oxygène dissous de 6 mg.L-1,
-de 28 µg.L-1 d’H2S pour Catostomus commersonii au stade œuf à la température de 15°C et à une concentration en oxygène dissous de 6 mg.L-1,
-comprise entre 13 et 26 µg.L-1 d’H2S pour Catostomus commersonii au stade larvaire en fonction de la température (12 ou 15°C) et de la concentration en oxygène dissous (3 ou 6 mg.L-1),
-de 49 µg.L-1 d’H2S pour Oncorhynchus mykiss au stade œuf à la température de 15°C et à une concentration en oxygène dissous de 6 mg.L-1.
Par ailleurs, lors de ces essais, il est montré qu’à des concentrations induisant une augmentation du taux de mortalité, l’H2S induit des effets sur la croissance des individus ainsi que sur le pourcentage d’animaux malformés. Les effets induits augmentent avec la diminution de la concentration en oxygène dissous.
Les essais sont relativement bien décrits. Toutefois, dans la publication d’origine des données sont manquantes (taux de mortalité chez les témoins pas toujours indiqué, nombre de répliques, taux de mortalité avant les essais, concentrations en H2S testées pas toujours indiquées). De plus, il n’est pas indiqué si un suivi analytique est réalisé. Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et Oseid (1975) exposent au H2S durant 96 heures quatre espèces de poissons dulçaquicoles (Carassius auratus, Lepomis macrochirus, Pimephales promelas, Salvelinus fontinalis) à des stades de vie (œuf à adulte) et des températures (6,1 à 24°C) variés. Les animaux ont été capturés dans le milieu naturel ou proviennent d’élevages. L’eau utilisée est une eau de puits (dureté totale : CaCO3 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1). Le pH est ajusté pour obtenir les concentrations désirées en H2S, à partir d’une solution de sulfure de sodium. Les essais sont réalisés en flux dynamique. Chaque essai est réalisé entre 1 et 21 fois. Quatre ou 5 concentrations en H2S suivant un pas logarithmique et un témoin sont testés, de façon à ce que le taux de survie soit de 100 % à la plus faible concentration testée et supérieur à 50 % à la plus forte concentration testée. Un suivi analytique est effectué 3 fois par jour. La concentration en H2S non dissocié est calculée. Dans ces conditions, la CL50 96 heures est comprise entre :
-21,6 et 30,8 µg.L-1 d’H2S pour Salvelinus fontinalis en fonction du stade de développement (larve endotrophe à juvénile) et de la température (8 à 12,5°C),
-9 et 30,0 µg.L-1 d’H2S pour Lepomis macrochirus en fonction du stade de développement (œuf à adulte) et de la température (20 à 22°C),
-7,1 et 515 µg.L-1 d’H2S pour Pimephales promelas en fonction du stade de développement (oeuf à sub-adulte) et de la température (6,1 à 24°C), la toxicité la plus faible (515 µg.L-1) étant observée à la température la plus faible,
-22 et 145 µg.L-1 d’H2S pour Carassius auratus en fonction du stade de développement (œuf à sub-adulte) et de la température (14,1 à 26,0°C), la toxicité la plus faible (145 µg.L-1) étant observée à la température la plus faible.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, dans la publication d’origine des données sont manquantes (taux de mortalité chez les témoins, nombre de répliques, condition d’élevage des animaux avant les essais, taux de mortalité avant les essais, la concentration en oxygène dissous n’est pas indiquée, mais dans un essai chronique des valeurs comprises entre 6,4 et 7,3 mg.L-1 pour une température de 23°C sont indiquées). Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1972) exposent des crapets arlequin (Lepomis macrochirus) juvéniles durant 96 heures au H2S. Les juvéniles proviennent du milieu naturel. Les animaux sont acclimatés et un traitement prophylactique leur est administré. L’eau utilisée est de l’eau de puits (dureté totale CaCO3 : 220 mg.L-1 ; alcalinité : 235 mg.L-1). Les essais sont réalisés en flux dynamique à un pH de 7,90 ± 0,05, une température de 20,0 ± 0,1°C et une concentration en oxygène dissous de 6,2 ± 0,4 mg.L-1. Les essais sont menés dans des chambres de 6 litres. Chaque essai se compose de 4 concentrations testées et un témoin. Chaque concentration est étudiée en 2 répliques (aquarium divisé en deux). Trois essais sont effectués. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH et de la concentration totale en sulfure totale. Dans ces conditions, la CL50 96 heures est de 32,2 µg.L-1 d’H2S.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les concentrations testées et les résultats bruts ne sont pas mentionnés. Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et al. (1976a) exposent des crapets arlequin (Lepomis macrochirus) durant 96 heures à différents stades de vie depuis le stade œuf jusqu’au stade adulte. Les œufs ont été obtenus au laboratoire. Les animaux géniteurs et les juvéniles proviennent du milieu naturel. Les animaux sont acclimatés et un traitement prophylactique leur est administré. L’eau utilisée est de l’eau de puits (dureté : CaCO3 220 mg.L-1). Les essais sont réalisés en flux dynamique à un pH compris entre 7,8 et 8,0, une température comprise entre 19,8 et 21,9°C et une concentration en oxygène comprise entre 5,8 et 6,4 mg.L-1. Les essais sont menés dans des chambres de 6 litres placées dans des aquariums de 36 litres ou dans des aquariums de 25 litres (essais sur juvéniles). Pour chaque essai, 5 concentrations et un témoin sont réalisés. L’essai sur œuf et un essai sur adulte sont menés avec dix concentrations et 2 témoins. Les essais sont réalisés entre 1 et 7 fois. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH et de la concentration en sulfure totale. Dans ces conditions, la CL50 est :
-de 19,0 µg.L-1 d’H2S pour le stade œuf après 72 heures d’exposition,
-supérieure à 43,5 et de 13,1 µg.L-1 d’H2S après 96 heures d’exposition respectivement pour le stade larve vésiculée et le stade larve exotrophe,
-en moyenne de 47,8 et 44,8 µg.L-1 et 776,1 µg.L-1 après 96 heures d’exposition respectivement pour le stade juvénile (5 essais) et le stade adulte (7 essais).
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les concentrations testées et les résultats bruts ne sont pas mentionnés. Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et al. (1976b) ont exposé des poissons tête de boule (Pimephales promelas) durant 96 heures depuis le stade œuf jusqu’au stade juvénile. Les œufs ont été obtenus au laboratoire. Les animaux géniteurs et certains juvéniles proviennent du milieu naturel. Les animaux sont acclimatés et un traitement prophylactique leur est administré. L’eau utilisée est de l’eau de puits (pH : 7,5 ; dureté totale CaCO3 : 220 mg.L-1). Les essais sont réalisés en flux dynamique dans des chambres de 3,2 litres placées dans des aquariums de 25 litres. Pour chaque essai, 5 concentrations et un témoin sont réalisés. Les essais sont réalisés entre 1 et 6 fois. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH, de la température mesurée et de la concentration en sulfure totale. Dans ces conditions, la CL50 96 heures est :
-de 53,6 µg.L-1 d’H2S pour Pimephales promelas au stade œuf à une température comprise entre 23,8 et 24,2°C et une concentration en oxygène dissous comprise entre 5,6 et 6,0 mg.L-1.
-de 10,7 µg.L-1 d’H2S pour Pimephales promelas au stade larve exotrophe à une température de 24,0°C et une concentration en oxygène dissous comprise entre 5,4 et 6,2 mg.L-1.
-comprise entre 24,3 µg.L-1 et 776,1 µg.L-1 pour Pimephales promelas au stade juvénile en fonction de la température, comprise entre 6,5 et 25°C, et de l’origine des individus (sauvages ou de laboratoire).
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les concentrations testées ne sont pas mentionnées. Malgré les manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Broderius et al. (1977) ont exposé des poissons tête de boule (Pimephales promelas) juvéniles durant 96 heures au H2S. Les juvéniles de 13 semaines environ proviennent de l’élevage du laboratoire. L’eau utilisée est de l’eau de puits (dureté totale CaCO3 : 220 mg.L-1 ; alcalinité : 235 mg.L-1 en CaCO3). Les essais sont réalisés en flux dynamique dans des chambres contenant 20 litres de milieu à tester à une température de 20°C et une concentration en oxygène dissous de 7,5 mg.L-1. Le pH du milieu est, en fonction de l’essai, compris entre 6,46 et 8,69. Pour chaque essai, 5 concentrations et un témoin sont réalisés en trois répliques. Un suivi analytique est effectué quotidiennement. La concentration en H2S non dissocié est calculée à partir du pH, de la température mesurée et de la concentration en sulfure totale. Dans ces conditions, la CL50 96 heures est comprise entre 14,9, 18,4 et 57,2 µg.L-1 d’H2S respectivement pour les pH de 8,69, 8,43 et 7,10.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les concentrations testées ne sont pas mentionnées et le taux de mortalité des témoins n’est pas indiqué. Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides. De ce fait, les résultats obtenus dans une gamme de pH comprise entre 6,0 et 8,5 sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Bagarinao et Lantin-Olaguer (1998) ont exposé des chanos (Chanos chanos) et des tilapias (Oreochromis mossambicus) juvéniles durant 96 heures au H2S. Les animaux proviennent du milieu naturel. Les animaux sont acclimatés durant 1 à 2 semaines au laboratoire. L’eau utilisée est de l’eau de mer (pH : 8,0 - 8,5; température : 26 – 30°C ; oxygène dissous : 4 – 6 mg.L-1 ; salinité : 28 – 35 ‰). Les essais sont réalisés en flux dynamique dans des aquariums de 25 litres. Pour chaque essai, 6 concentrations en H2S et 1 témoin sont réalisés en 3 répliques. Un et deux essais de 96 heures sont effectués respectivement sur Chanos chanos et Oreochromis mossambicus. Un suivi analytique est effectué. Dans ces conditions, la CL50 96 heures est de 112,5 et 129,7 µg.L-1 d’H2S respectivement pour Chanos chanos et Oreochromis mossambicus.
Les essais sont relativement bien décrits. Les résultats sont donnés en temps de durée d’exposition nécessaire pour obtenir 50 et 100 % de mortalité. Un suivi analytique est réalisé. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Bagarinao et Vetter (1993) ont exposé des Killifish (Fundulus parvipinnis) juvéniles ou adultes durant 96 heures au H2S. Les animaux proviennent du milieu naturel. L’eau utilisée est de l’eau de mer (pH : 8,3 ; température : 14 – 18°C ; oxygène dissous : 50 à 80 % de la saturation). Dix concentrations en H2S et 1 témoin sont réalisés sans réplique. Dans ces conditions, la CL50 96 heures est de 14 321 ± 744 µ.L-1 d’H2S.
Les essais sont relativement bien décrits. Les résultats sont donnés sous la forme d’un graphique. Toutefois, du fait de l’absence de réplique, l’incertitude sur le résultat est très importante. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Ip et al. (2004) ont exposé des mudskipper (Boleophthalmus boddarti) de 2 poids différents (11,6 – 14,2 g et 4,6 – 6,7 g) durant 96 heures au H2S. Les animaux proviennent du milieu naturel. L’eau utilisée est de l’eau de mer diluée à 50 % tamponnée à pH 7 avec 10 mM de tampon Tris (pH : 7; température : 25°C ; oxygène dissous : 8 mg.L-1 ; salinité : 15 ‰). L’essai est réalisé en flux dynamique. Onze concentrations en sulfure (0,05 ; 0,07 ; 0,1 ; 0,12 ; 0,15 ; 0,20 ; 0,4 ; 0,5 ; 0,7 ; 0,9 et 1,2 mM) et 1 témoin sont réalisés sans réplique, mais l’essai est mené 3 fois. Un suivi analytique est réalisé. Dans ces conditions, en estimant qu’à un pH de 7, la concentration en H2S est équivalente à 50 % de la concentration en sulfure total, la CL50 96 heures est de 7 958 et 1 602 µ.L-1 d’H2S respectivement pour les individus dont le poids est compris entre 11,6 et 14,2 g et entre 4,6 et 6,7 g.
Les essais sont relativement bien décrits. Un suivi analytique est réalisé, mais le pH est stabilisé avec un tampon tris, aucun témoin Tris n’est donné. Par ailleurs la concentration en H2S est calculée en estimant que le pH est stable et de 7. Les résultats sont donnés en terme de CL50, sans autre information. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Paramètres d'écotoxicité chronique :
Algues
Aucune étude de la toxicité chronique du H2S vis-à-vis des algues n’a été répertoriée.
Invertébrés
Vis-à-vis des invertébrés dulçaquicoles, la NOEC survie-reproduction est comprise entre 1,2 µg.L-1 (Gammarus pseudolimnaeus) et 6,0 µg.L-1 (Paracentrotus lividus). Pour ce dernier organisme, Losso et al. (2004) montrent qu’un essai sur cellules spermatiques de 60 heures conduit à la détermination d’une NOEC similaire à celle obtenue sur le développement embryo-larvaire de l’organisme. Cette similarité des résultats est expliquée par le mode d’action du H2S. Pour la détermination de la PNEC, une seule donnée valide avec restriction (niveau de validité 2 selon la cotation de Klimisch et al., 1997) est disponible pour les invertébrés, la NOEC retenue est donc de 2 µg.L-1 (Gammarus pseudolimnaeus).
Smith et Oseid (1975) exposent des amphipodes (Gammarus pseudolimnaeus) adultes au H2S durant 65 à 95 jours. Les animaux ont été capturés dans le milieu naturel. L’eau utilisée est une eau de puits (température : 17,2 à 17,8°C, dureté totale CaCO3 : 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1). Le pH est ajusté à une valeur comprise entre 7,7 et 7,9 pour obtenir les concentrations désirées en H2S, à partir d’une solution de sulfure de sodium. Les essais sont réalisés en flux dynamique. Deux essais sont réalisés, un de 65 jours et un de 95 jours. Pour chaque essai, 4 concentrations en H2S (0,7 ; 1,9 ; 3,1 et 12,8 pour l’essai de 65 jours et 1,2 ; 3,2 ; 6,4 et 15,3 pour l’essai de 95 jours) et un témoin sont testés. Un suivi analytique est effectué tous les 2 jours. La concentration en H2S non dissocié est calculée. Dans ces conditions, et pour des gammes de concentrations comprises entre 0,7 et 15,3 µg.L-1 d’H2S, la NOEC est comprise entre 1,2 et 1,9 µg.L-1 d’H2S en utilisant la reproduction comme paramètre de mesure.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, dans la publication d’origine, des données sont manquantes (nombre de répliques, condition d’élevage des animaux avant les essais, taux de mortalité avant les essais, la concentration en oxygène dissous n’est pas indiquée mais dans un essai chronique des valeurs comprises entre 6,4 et 7,3 mg.L-1 pour une température de 23°C sont indiquées). De plusn dans l’essai de 95 jours, la NOEC annoncée de 1,2 µg.L-1 ne semble pas en adéquation avec les données de la publication. Malgré ces manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction pour l’essai de 65 jours (niveau de validité : 2 selon la cotation de Klimisch et al., 1997) et non valides pour l’essai de 95 jours (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1974a) exposent des amphipodes (Gammarus pseudolimnaeus) adultes au H2S durant 65 à 105 jours. Les animaux ont été capturés dans le milieu naturel. L’eau utilisée est une eau de puits (température : 17,1 à 18,2°C, dureté totale CaCO3 : 220,0 mg.L-1). Le pH est ajusté à une valeur comprise entre 7,60 et 7,86 et la concentration en O2 est comprise entre 7,4 et 8,9 mg.L-1. Les essais sont réalisés en flux dynamique. Quatre essais sont réalisés. Deux essais de 65 jours, un de 95 jours et un de 105 jours. Pour chaque essai, 4 concentrations en H2S (comprises entre 0,7 et 19,2 µg.L-1 d’H2S) et un témoin sont testés. Un suivi analytique est effectué 3 fois par semaine. La concentration en H2S non dissocié est calculée. Dans ces conditions, la NOEC est comprise entre 1,2 et 6,4 µg.L-1 d’H2S en utilisant la reproduction et la croissance comme paramètres de mesure. Les auteurs estiment que la NOEC est de 2 µg.L-1.
Les essais sont relativement bien décrits. L’ensemble des données biologiques et analytiques est indiqué. Les essais sont réalisés sans réplique, mais quatre essais sont réalisés avec des gammes de concentrations différentes. De ce fait, les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Vertébrés
Vis-à-vis poissons dulçaquicoles, de nombreuses données de toxicité chronique du H2S sont disponibles. Pour ces organismes, les NOECs sont homogènes et comprises entre 0,4 (survie-croissance) et 14,6 µg.L-1 (survie). Seul un essai sur les stades embryo-larvaires du poisson marin Rhombus maeticus conduit à des valeurs beaucoup plus élevées, avec une CL100 comprise entre 2 400 et 3 100 µg.L-1. Pour la détermination de la PNEC, de nombreuses données valides avec restriction (niveau de validité 2 selon la cotation de Klimisch et al., 1997) sont disponibles. Il est proposé de retenir la valeur de 2,2 µg.L-1 correspondant à la moyenne géométrique des NOECs obtenues sur le crapet arlequin (Lepomis macrochirus).
Reynolds et Haines (1980) ont exposé des larves de truite de mer (Salmo trutta) au stade sac vitellin au H2S durant 8 et 22 jours. Les larves au stade sac vitellin proviennent d’une écloserie privée. Les animaux sont acclimatés aux conditions du laboratoire durant 7 jours avant le début des essais. Durant cette période, le taux de mortalité n’excède pas 2 %. L’eau utilisée est de l’eau du lac Ontario filtrée sur laine de verre et charbon actif et maintenue à température constante par une unité de réfrigération (température : 13 ± 1C ; pH : 7,1 ± 0,1 : CaCO3 : 84,5 mg.L-1). Les essais sont réalisés en flux dynamique dans des aquariums en verre de 3,8 litres. Deux essais sont réalisés en 5 concentrations (2, 3, 5, 7 et 13 µg.L-1) plus un témoin. Un suivi analytique est effectué. Au cours des essais, les concentrations mesurées en H2S ne dévient pas de plus de 2 % de la concentration nominale. La concentration en H2S non dissocié est calculée à partir du pH mesuré et de la concentration en sulfure totale. Dans ces conditions, la NOEC survie est de 5 µg.L-1 d’H2S. Le taux de survie et la croissance en longueur des larves augmentent aux concentrations en H2S comprises entre 2 et 5 µg.L-1 par rapport aux témoins. Toutefois, dès la concentration de 2 µg.L-1 (LOEC), la taille des lamelles branchiales est significativement diminuée.
Les essais sont relativement bien décrits et un suivi analytique montrant la stabilité des concentrations est réalisé. Un seul aquarium est utilisé par concentration, mais deux essais sont réalisés. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et Oseid (1975) exposent au H2S durant 45 à 826 jours quatre espèces de poissons dulçaquicoles (Carassius auratus, Lepomis macrochirus, Pimephales promelas, Salvelinus fontinalis) dès les stades initiaux de vie (œuf à adulte) et à des températures variées (11,8 – 24°C). Les animaux ont été capturés dans le milieu naturel ou proviennent d’élevages. L : 230,0 mg.L-1). Le pH est ajusté pour obtenir les concentrations désirées en H2S, à partir d’une solution de sulfure de sodium. Les essais sont réalisés en flux dynamique. Un suivi analytique est effectué tous les 2 jours. La concentration en H2S non dissocié est calculée. Dans ces conditions, la NOEC est comprise entre :
-5,5 et 6,7 µg.L-1 d’H2S pour Salvelinus fontinalis en fonction du stade de développement (alevin ou adulte) et du paramètre mesuré (reproduction ou croissance) pour des gammes de concentrations testées entre 1,5 et 14,2 µg.L-1,
-0,4 et 2,6 µg.L-1 d’H2S pour Lepomis macrochirus en fonction du stade de développement (oeuf à adulte), de la température (11,8 à 24,0°C) et du paramètre mesuré (survie, reproduction ou croissance) pour des gammes de concentrations testées entre 0,4 et 14,6 µg.L-1,
-3,7 et 6,6 µg.L-1 d’H2S pour Pimephales promelas en fonction du stade de développement (œuf ou juvénile) et du paramètre mesuré (survie, reproduction ou croissance) pour des gammes de concentrations testées entre 0,4 et 19,4 µg.L-1,
-5 et 10 µg.L-1 d’H2S pour Carassius auratus en fonction du stade de développement (œuf à adulte) pour des gammes de concentrations testées entre 2 et 25 µg.L-1,
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, la température de l’eau durant les essais est rarement en accord avec les recommandations pour chaque espèce de la ligne directrice OCDE 210, 1992. De plus dans la publication d’origine, des données sont manquantes (taux de mortalité chez les témoins pas indiqué systématiquement, nombre de répliques, condition d’élevage des animaux avant les essais, taux de mortalité avant les essais, gamme de concentrations testées, la concentration en oxygène dissous n’est pas indiquée mais dans un essai chronique des valeurs comprises entre 6,4 et 7,3 mg.L-1 pour une température de 23 °C sont indiquées). Malgré les manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Oseid et Smith (1972) exposent au H2S des crapets arlequin (Lepomis macrochirus) juvéniles durant 126 à 148 jours. Les animaux proviennent du milieu naturel. Durant la période d’acclimatation de 14 jours, un traitement prophylactique leur est administré. L’eau utilisée est de l’eau de puits (dureté totale CaCO3 : 220 mg.L-1). Les essais sont réalisés en flux dynamique à un pH compris entre 7,72 et 7,91, une température comprise entre 23,5 et 24,1°C et une concentration en oxygène comprise entre 5,87 et 6,66 mg.L-1. Les essais sont menés dans des aquariums de 26,7 litres divisés en deux parties. Quatre concentrations comprises entre 0,4 et 14,6 µg.L-1 d’H2S et un témoin sont réalisés. Dans la seconde partie de l’aquarium, la concentration en H2S est inférieure à la première partie. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH, de la température et de la concentration totale en sulfure. Dans ces conditions, les NOEC survie et croissance sont respectivement de 14,6 et 6,7 µg.L-1 d’H2S. La LOEC irritation des branchies est de 0,4 µg.L-1. Dans ce même essai, il est montré que l’H2S peut induire des modifications des capacités d’endurance de la nage dès la concentration de 0,4 µg.L-1 d’H2S.
Les essais sont relativement bien décrits et les résultats biologiques et physico-chimiques sont indiqués pour chaque concentration testée. Un suivi analytique est réalisé. De ce fait, les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Smith et al. (1976a) exposent au H2S des crapets arlequin (Lepomis macrochirus) durant 97 à 316 jours à différents stades de vie depuis le stade œuf jusqu’au stade adulte. Les œufs ont été obtenus au laboratoire. Les animaux géniteurs et les juvéniles proviennent du milieu naturel. Les animaux sont acclimatés et un traitement prophylactique leur est administré. L’eau utilisée est de l’eau de puits (dureté totale CaCO3 : 220 mg.L-1). Les essais sont réalisés en flux dynamique à un pH compris entre 7,6 et 8,0, une température comprise entre 7,4 et 25,8°C en fonction de la saison et une concentration en oxygène comprise entre 6,3 et 9,0 mg.L-1. Les essais sont menés en fonction du test et du stade de développement dans des aquariums de 20 à 503 litres. Pour chaque essai, 3 à 4 concentrations comprises entre 1 et 14,9 µg.L-1 d’H2S et un témoin sont réalisés. Un suivi analytique est effectué. La concentration en H2S non dissocié est calculée à partir du pH, de la température et de la concentration en sulfure totale. Compte tenu de la diversité des protocoles des essais réalisés, il est difficile de déterminer une NOEC. Toutefois, il peut être indiqué qu’en utilisant les paramètres de mortalité, croissance et fécondité, la toxicité de l’H2S dépend du stade de développement lors du début de l’exposition. Ainsi, la LOEC croissance 316 jours, lorsque l’exposition débute au stade œuf est d’environ 3,1 µg.L-1 d’H2S, alors qu’une exposition à partir du stade adulte durant 97 jours à la concentration de 4,1 µg.L-1 semble sans effet. Le paramètre de fécondité semble le plus sensible, avec une LOEC 97 jours de 1 µg.L-1. Dans ce cas, il est important de noter que l’échec de la fécondation est lié à des modifications comportementales, notamment à une diminution de l’activité.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, les concentrations testées et les résultats bruts ne sont pas mentionnés. De plus, compte tenu de la diversité des protocoles des essais réalisés, il est difficile de déterminer une NOEC. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Smith et al. (1976b) ont mené 12 essais chroniques sur des poissons tête de boule (Pimephales promelas). Les animaux sont exposés à partir du stade larve vésiculée ou juvénile durant 80 à 297 jours. Cette exposition comporte dans un cas deux générations. Les animaux proviennent d’un stock sauvage ou sont obtenus au laboratoire. Les animaux sauvages géniteurs ou juvéniles sont acclimatés aux conditions du laboratoire et un traitement prophylactique CaCO3 : 220 mg.L-1). Les essais sont réalisés en flux dynamique dans des aquariums en verre divisés en deux (deux répliques) contenant 12,6 litres ou en aquarium de 20 litres divisés en trois (3 répliques) ou quatre (4 répliques) compartiments. Les essais débutent avec 10 ou 20 animaux par compartiment. Chaque essai est constitué d’un témoin et de 3 ou 4 concentrations testées. Un suivi analytique est effectué et les concentrations en H2S sont indiquées en concentrations mesurées. La concentration en H2S non dissocié est calculée à partir du pH, de la température et de la concentration en sulfure totale. Dans ces conditions :
-la NOEC survie 191 - 345 jours est de 8,3 µg.L-1 (résultat non valide),
-la NOEC croissance 107 - 121 jours est de 10,3 µg.L-1 (résultat non valide)
-la NOEC survie 80 - 297 jours est de 3,4 µg.L-1 (résultat valide avec restriction),
-la NOEC croissance 56 - 112 jours est de 4,2 µg.L-1 (résultat valide avec restriction),
-la NOEC fécondité 274 - 297 jours est de 5,9 µg.L-1 (résultat valide avec restriction).
Les essais sont bien décrits et un suivi analytique est réalisé. Tous les résultats (survie, fécondité, croissance) sont indiqués pour chaque concentration testée. Un seul aquarium est utilisé par concentration, mais les essais sont répétés. Cependant, dans trois séries d’essais le taux de survie des témoins est faible (34 à 65 % en fin d’essai). Dans ces conditions, seuls les résultats provenant des essais dont les témoins ont un taux de survie > 90 % sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Eau marine
Paramètres d’écotoxicité aiguë :
Bactéries:
Küster et al. (2005) exposent des bactéries Vibrio fischeri (NRRL B-11177) au H2S durant 30 minutes. L’essai est réalisé selon la norme ISO 11348, utilisant des bactéries fraîchement préparées. Les bactéries, provenant d’un laboratoire extérieur, sont additionnées directement dans le milieu d’essai et la luminescence est mesurée après 15 et 30 minutes d’incubation. L’essai est effectué à la température de 15°C, à un pH compris entre 6,2 et 6,5 et une concentration en oxygène dissous supérieure à 50 % de la saturation. Pour chaque concentration en H2S testée, 10 répliques sont réalisées. Onze concentrations en H2S et 1 témoin sont testés. La sensibilité de la souche est vérifiée par l’ajout d’un témoin positif. Dans ces conditions, la CE50 30 minutes est de 9 406 µg.L-1 d’H2S.
Algues:
Seuls 2 essais, vis-à-vis des algues dulçaquicoles ou marines ont été répertoriés. La CE50 4 heures à 24 heures est comprise entre 105,6 µg.L-1 et 1 874 µg.L-1 en fonction du paramètre mesuré (croissance ou mesure de l’activité photosynthétique).
Küster et al. (2005) exposent des algues vertes unicellulaires (Scenedesmus vacuolatus) au H2S durant au moins une génération soit 24 heures. L’essai est mené à une température de 28°C, un pH de 6,5 – 6,6 et une concentration en oxygène dissous > à 50 % de la saturation. Afin de limiter la volatilisation des sulfures, l’essai est réalisé dans des tubes de 10 mL fermés. Dans ces conditions, la CE50 24 heures est de 1 874 µg.L-1 d’H2S.
Invertébrés:
Vis-à-vis des invertébrés, la toxicité aiguë du H2S est très variable. Ainsi, alors que la moyenne géométrique des CL50 est de 174 µg.L-1 pour les invertébrés marins, les CL50 sont comprises entre 9,5 et 17 040 µg.L-1 pour les organismes marins.
Vis-à-vis des crustacés marins, la moyenne géométrique pour des CL50 de 22,5 heures à 96 heures est de 444 µg.L-1. La CL50 96 heures la plus faible et la plus élevée sont de 13,1 et 17 040 µg.L-1. Elles ont été obtenues respectivement sur Metapenaeus monoceros et Nephrops norvegicus.
Vis-à-vis des mollusques et échinodermes marins, des CL50 similaires ont été obtenues avec des valeurs minimales et maximales de 9,5 et 43 µg.L-1 .
Plus que des différences entre individus dulçaquicoles et marins, la variabilité de la toxicité du H2S est liée principalement à des différences interspécifiques (épibenthique, endobenthique ou pélagique), au stade de développement et aux conditions physico-chimiques du milieu (pH, température). Ainsi, par exemple, la CL50 48-96 heures est de 30,7 et 3 285 µg.L-1 respectivement pour Gammarus pseudolimnaeus et Macrobrachium rosenbergii. De même, pour cette dernière espèce, la CL50 96 heures est de 2 570 et 4 200 µg.L-1 respectivement pour des individus de 21 jours et de 2 mois. Enfin, vis-à-vis du crustacé marin Fenneropenaeus indicus la CL50 96 heures est de 117 µg.L-1 à un pH de 6,0 – 6,3 et de 342 µg.L-1 à un pH de 8,1 – 8,3.
Knezovich et al. (1996) exposent au H2S durant 48 heures 4 espèces d’invertébrés marins, deux amphipodes (Rhepoxynius abronius, Eohaustorius estuarius), un bivalve (Mytilus edulis) et un échinoderme (Strongylocentrotus purpuratus). Les essais sur amphipodes sont menés sur des animaux adultes provenant d’un laboratoire. Les essais sur bivalves et sur échinodermes sont réalisés sur des stades embryonnaires obtenus au laboratoire à partir d’adultes achetés à des fermes aquacoles ou à des laboratoires. Les essais sont menés en flux dynamique dans de l’eau de mer (salinité 32 ‰), à une température de 15°C, un pH de 8,0 ± 1 et une concentration en O2 de 8,9 ± 0,9 mg.L-1. Les essais sur les bivalves et les échinodermes sont réalisés dans 4 cylindres placés dans des aquariums de 1 litre. Huit concentrations en sulfure sont testées (10, 29, 83, 115, 205, 256, 448 et 640 µg.L-1). Les essais sur amphipodes sont menés aux concentrations de 0, 320, 610, 800, 990, 1 470 et 2 500 µg.L-1 de sulfure pour Rhepoxynius abroniuset aux concentrations de 0,010, 350, 900, 1 220, 1 920, 2 720, 3 710 et 4 350 µg.L-1 de sulfure pour Eohaustorius estuarius. Les amphipodes sont exposés par groupe de 20 individus. Dans ces conditions, les CL(E)50 48 heures sont de 9,5, 18,1, 152 et 315,4 µg.L-1 d’H2S respectivement pour Mytilus edulis, Eohaustorius estuarius, Rhepoxynius abronius et Strongylocentrotus purpuratus.
Les essais sont relativement bien décrits mais des informations sont manquantes comme le nombre de répliques dans les essais menés. Dans l’essai sur bivalves et échinodermes une concentration en H2S d’environ 0,95 µg.L-1 est présente, toutefois le taux de mortalité n’est pas affecté sur au moins 2 concentrations consécutives. Un suivi analytique montrant la stabilité des concentrations est réalisé. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Losso et al. (2004) exposent des cellules spermatiques (60 minutes) ou des stades embryo-larvaires (72 heures) d’oursin (Paracentrotus lividus) au H2S. Les géniteurs ont été prélevés dans l’environnement un mois avant l’induction des pontes. Les essais sont réalisés en statique dans de l’eau de mer artificielle (salinité 35 ‰), à une température de 18°C, un pH de 8,32 et en aérobiose. Les essais sont menés à 4 concentrations en sulfure total (110 ; 360 ; 720 et 1 440 µg.L-1 pour l’essai sur cellules spermatiques – 100 ; 330 ; 670 ; 1 330 µg.L-1 pour l’essai sur les stades embryo-larvaires) plus un témoin. Pour chaque concentration testée, 3 répliques sont effectuées. Dans ces conditions, les CE50 sont de 72 µg.L-1 d’H2S et 25,8 µg.L-1 d’H2S respectivement sur cellules spermatiques et sur les stades embryo-larvaires.
Les essais sont relativement bien décrits. Un essai permettant de vérifier la sensibilité sur réactif biologique est réalisé avec une substance de référence. Toutefois, les résultats des essais sont donnés en concentration nominale alors que les essais sont menés en statique et que le suivi analytique montre une diminution rapide de la concentration en sulfure. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Kang et Matsuda (1994) exposent des crevettes mouchetées (Metapenaeus monoceros) à trois stades de développement différents (zoé, mysis et juvénile) au H2S durant 48 heures. Les essais sont réalisés en flux continu en eau de mer. Dans ces conditions, les CL50 48 heures sont de 9,44, 12,11 et 19,7 µg.L-1 d’H2S respectivement pour le stade zoé, mysis et juvénile.
L’article est écrit en japonais avec un résumé en anglais. La validité de ces résultats ne peut donc pas être établie. Les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Gopakumar et Kuttyamma (1996) exposent au H2S durant 96 heures des crevettes Fenneropenaeus indicus et Metapenaeus dobsoni de différentes tailles et à divers pH. Les animaux sont prélevés dans le milieu naturel et acclimatés aux conditions du laboratoire durant 2 semaines. Pour chaque essai, 2 ou 3 classes de tailles d’individus sont testées : 20 – 25 mm ; 35 – 40 mm et 85 – 90 mm. Les essais sont menés en flux dynamique et répétés deux fois. L’eau de mer artificielle utilisée a une salinité de 32 - 33 ‰ et une température de 28 – 29°C. Trois gammes de pH sont testées : 6 – 6,3 ; 7 - 7,3 et 8,1 – 8,3. Un suivi analytique est réalisé et la concentration en H2S est calculée à partir de la concentration en sulfure totale et du pH. Dans ces conditions, la CL50 96 heures est comprise entre 63 et 342 µg.L-1 d’H2S pour Fenneropenaeus indicus et entre 77 et 378 µg.L-1 d’H2S pour Metapenaeus dobsoni en fonction de la taille des individus et du pH de l’eau.
Les essais sont peu décrits et de nombreuses informations sont manquantes (concentrations testées, taux de survie, méthode de stabilisation du pH…) malgré la réalisation d’un suivi analytique. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Dillon et al. (1993) exposent au H2S des vers marins Neanthes arenaceodentata juvéniles durant 96 heures. Les essais sont menés en semi-statique avec renouvellement journalier des animaux. L’eau de mer artificielle utilisée a une salinité de 30 ‰. Les essais sont réalisés dans des récipients de 1 litre contenant 800 mL de milieu à tester. Quatre concentrations mesurées en H2S sont testées (1 400, 3 400, 5 500 et 15 000 µg.L-1) et deux témoins aux concentrations en oxygène dissous de 6,5 et 1,5 mg.L-1 avec 5 répliques par concentration. Dans chaque récipient, 5 individus âgés de 3 semaines sont introduits. Dans ces conditions, la survie des juvéniles n’est pas affectée jusqu’à une concentration en H2S de 3 400 µg.L-1 et est affectée (44 % de survie) à la concentration de 5 500 µg.L-1.
Les essais sont relativement bien décrits et un suivi analytique est réalisé. Toutefois, la concentration en oxygène dissous est proche de celle induisant un effet négatif sur les vers dans les milieux où la concentration en H2S induit un effet. L’effet de l’H2S ne peut donc être dissocié de l’effet de la concentration en oxygène dissous. Les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Poissons:
Chez les poissons, comme vis-à-vis des autres organismes, une disparité des résultats est observée. Pour les individus dulçaquicoles, les CL50 96 heures sont comprises entre 7 et 54 µg.L-1 avec une moyenne géométrique de 24 µg.L-1. Pour les poissons marins, ces valeurs sont respectivement de 112,5, 3 570 et 522 µg.L-1.
L’apparente disparité des résultats obtenus entre les espèces dulçaquicoles et marines est expliquée notamment par les espèces étudiées. En effet, pour le H2S peu de données sont disponibles pour les espèces marines. De plus, ces données générées sur poissons d’eau chaude proviennent d’études destinées à connaître la tolérance de ces derniers au H2S pour l’aquaculture. Comme pour les invertébrés, la toxicité du H2S chez les poissons est principalement dépendante de l’espèce étudiée, du stade de développement et des conditions physico-chimiques du milieu. Ainsi, par exemple, la CL50 96 heures est de 17 et 7 µg.L-1 respectivement pour des stades larvaires de Catostomus commersoni et Sander vitreus. De même, pour cette dernière espèce, la CL50 96 heures est de 7 et 66 µg.L-1 respectivement pour le stade larve et oeuf. Enfin, vis-à-vis du Pimephales promelas au stade juvénile, la CL50 96 heures est de 775,6 µg.L-1 et 24,3 µg.L-1 respectivement à une température de 6,5°C et comprise entre 19,8 et 22°C.
Reynolds et Haines (1980) ont exposé des larves de truite de mer (Salmo trutta) au stade sac vitellin au H2S durant 96 heures. Les larves au stade sac vitellin proviennent d’une écloserie privée. Les animaux sont acclimatés aux conditions du laboratoire durant 7 jours avant le début des essais. Durant cette période, le taux de mortalité n’excède pas 2 %. L’eau utilisée est de l’eau du lac Ontario filtrée sur laine de verre et charbon actif et maintenue à température constante par une unité de réfrigération :13 ± 1°C ; pH : 7,1 ± 0,1 ; oxygène dissous : 9,48 ± 0,3 mg.L-1 ; dureté totale CaCO3 : 127,2 mg.L-1 ; alcalinité totale CaCO3 : 84,5 mg.L-1). Les essais sont réalisés en flux dynamique dans des aquariums en verre de 3,8 litres. Deux essais sont réalisés en 5 concentrations (2, 3, 5, 7 et 13 µg.L-1) plus un témoin, sans réplique. Un suivi analytique est effectué. Au cours des essais les concentrations mesurées en H2S ne dévient pas de plus de 2 % de la concentration nominale. La concentration en H2S non dissocié est calculée à partir du pH mesuré et de la concentration totale en sulfure. Dans ces conditions, la CL50 96 heures est de 7 µg.L-1 d’H2S.
Les essais sont relativement bien décrits. Un seul aquarium est utilisé par concentration, mais deux essais sont réalisés. Un suivi analytique montrant la stabilité des concentrations est réalisé. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Bagarinao et Lantin-Olaguer (1998) ont exposé des chanos (Chanos chanos) et des tilapias (Oreochromis mossambicus) juvéniles durant 96 heures au H2S. Les animaux proviennent du milieu naturel. Les animaux sont acclimatés durant 1 à 2 semaines au laboratoire. L’eau utilisée est de l’eau de mer (pH : 8,0 - 8,5; température : 26 – 30°C ; oxygène dissous : 4 – 6 mg.L-1 ; salinité : 28 – 35 ‰). Les essais sont réalisés en flux dynamique dans des aquariums de 25 litres. Pour chaque essai, 6 concentrations en H2S et 1 témoin sont réalisés en 3 répliques. Un et deux essais de 96 heures sont effectués respectivement sur Chanos chanos et Oreochromis mossambicus. Un suivi analytique est effectué. Dans ces conditions, la CL50 96 heures est de 112,5 et 129,7 µg.L-1 d’H2S respectivement pour Chanos chanos et Oreochromis mossambicus.
Les essais sont relativement bien décrits. Les résultats sont donnés en temps de durée d’exposition nécessaire pour obtenir 50 et 100 % de mortalité. Un suivi analytique est réalisé. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Bagarinao et Vetter (1993) ont exposé des Killifish (Fundulus parvipinnis) juvéniles ou adultes durant 96 heures au H2S. Les animaux proviennent du milieu naturel. L’eau utilisée est de l’eau de mer (pH : 8,3 ; température : 14 – 18°C ; oxygène dissous : 50 à 80 % de la saturation). Dix concentrations en H2S et 1 témoin sont réalisés sans réplique. Dans ces conditions, la CL50 96 heures est de 14 321 ± 744 µ.L-1 d’H2S.
Les essais sont relativement bien décrits. Les résultats sont donnés sous la forme d’un graphique. Toutefois, du fait de l’absence de réplique, l’incertitude sur le résultat est très importante. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Ip et al. (2004) ont exposé des mudskipper (Boleophthalmus boddarti) de 2 poids différents (11,6 – 14,2 g et 4,6 – 6,7 g) durant 96 heures au H2S. Les animaux proviennent du milieu naturel. L’eau utilisée est de l’eau de mer diluée à 50 % tamponnée à pH 7 avec 10 mM de tampon Tris (pH : 7; température : 25°C ; oxygène dissous : 8 mg.L-1 ; salinité : 15 ‰). L’essai est réalisé en flux dynamique. Onze concentrations en sulfure (0,05 ; 0,07 ; 0,1 ; 0,12 ; 0,15 ; 0,20 ; 0,4 ; 0,5 ; 0,7 ; 0,9 et 1,2 mM) et 1 témoin sont réalisés sans réplique, mais l’essai est mené 3 fois. Un suivi analytique est réalisé. Dans ces conditions, en estimant qu’à un pH de 7, la concentration en H2S est équivalente à 50 % de la concentration en sulfure total, la CL50 96 heures est de 7 958 et 1 602 µ.L-1 d’H2S respectivement pour les individus dont le poids est compris entre 11,6 et 14,2 g et entre 4,6 et 6,7 g.
Les essais sont relativement bien décrits. Un suivi analytique est réalisé, mais le pH est stabilisé avec un tampon tris, aucun témoin Tris n’est donné. Par ailleurs la concentration en H2S est calculée en estimant que le pH est stable et de 7. Les résultats sont donnés en terme de CL50, sans autre information. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Paramètres d'écotoxicité chronique :
En utilisant la moyenne géométrique des résultats lorsque plusieurs données sont disponibles pour une même espèce, l’étude des résultats montre qu’indépendamment de la qualité des données, la toxicité chronique du H2S vis-à-vis des organismes aquatiques testés est relativement homogène. Pour les échinodermes marins (Paracentrotus lividus), la moyenne géométrique des NOEC est de 6,3 µg.L-1. Les organismes du compartiment sédimentaires semblent moins sensibles. Pour ces organismes, les NOEC et LOEC sont comprises entre 15,2 et 1 210 µg.L-1. Tout comme observé lors des études de toxicité aiguë, la variabilité de la toxicité est liée principalement à des différences interspécifiques (épibenthique, endobenthique ou pélagique), les espèces endobenthiques étant certainement les espèces les plus tolérantes au H2S.
Algues
Aucune étude de la toxicité chronique du H2S vis-à-vis des algues n’a été répertoriée.
Invertébrés
Vis-à-vis des invertébrés marins, la NOEC survie-reproduction est de 6,0 µg.L-1 (Paracentrotus lividus). Pour ce dernier organisme, Losso et al. (2004) montrent qu’un essai sur cellules spermatiques de 60 heures conduit à la détermination d’une NOEC similaire à celle obtenue sur le développement embryo-larvaire de l’organisme.
Losso et al. (2004) exposent des cellules spermatiques (60 minutes) ou des stades embryo-larvaires (72 heures) d’oursin (Paracentrotus lividus) au H2S. Les géniteurs ont été prélevés dans l’environnement un mois avant l’induction des pontes. Les essais sont menés en statique dans de l’eau de mer artificielle (salinité 35 ‰), à une température de 18°C, un pH de 8,32 et en aérobiose. Les essais sont effectués à 4 concentrations en sulfure total (110 ; 360 ; 720 et 1 440 µg.L-1 pour l’essai sur cellules spermatiques et 100 ; 330 ; 670 ; 1 330 µg.L-1 pour l’essai sur les stades embryo-larvaires, plus un témoin et avec 3 répliques par concentration. Dans ces conditions, les NOEC sont de 6,6 et 6 µg.L-1 d’H2S respectivement sur cellules spermatiques et sur les stades embryo-larvaires.
Les essais sont relativement bien décrits. Un essai permettant de vérifier la sensibilité sur réactif biologique est réalisé avec une substance de référence. Toutefois, les résultats des essais sont donnés en concentration nominale alors que les essais sont menés en statique et que le suivi analytique montre une diminution rapide de la concentration en sulfure. De ce fait, les résultats sont considérés comme non valides (niveau de validité : 3 selon la cotation de Klimisch et al., 1997).
Vertébrés
Reynolds et Haines (1980) ont exposé des larves de truite de mer (Salmo trutta) au stade sac vitellin au H2S durant 8 et 22 jours. Les larves au stade sac vitellin proviennent d’une écloserie privée. Les animaux sont acclimatés aux conditions du laboratoire durant 7 jours avant le début des essais. Durant cette période, le taux de mortalité n’excède pas 2 %. L’eau utilisée est de l’eau du lac Ontario filtrée sur laine de verre et charbon actif et maintenue à température constante par une unité de réfrigération (température : 13 ± 1C ; pH : 7,1 ± 0,1 : CaCO3 : 84,5 mg.L-1). Les essais sont réalisés en flux dynamique dans des aquariums en verre de 3,8 litres. Deux essais sont réalisés en 5 concentrations (2, 3, 5, 7 et 13 µg.L-1) plus un témoin. Un suivi analytique est effectué. Au cours des essais, les concentrations mesurées en H2S ne dévient pas de plus de 2 % de la concentration nominale. La concentration en H2S non dissocié est calculée à partir du pH mesuré et de la concentration en sulfure totale. Dans ces conditions, la NOEC survie est de 5 µg.L-1 d’H2S. Le taux de survie et la croissance en longueur des larves augmentent aux concentrations en H2S comprises entre 2 et 5 µg.L-1 par rapport aux témoins. Toutefois, dès la concentration de 2 µg.L-1 (LOEC), la taille des lamelles branchiales est significativement diminuée.
Les essais sont relativement bien décrits et un suivi analytique montrant la stabilité des concentrations est réalisé. Un seul aquarium est utilisé par concentration, mais deux essais sont réalisés. Les résultats sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Sédiment d'eau douce
Paramètres d’écotoxicité aiguë :
Vis-à-vis des organismes du compartiment sédimentaire dulçaquicole, la CL50 96 heures est de 165 µg.L-1 (Hexagenia limbata). Tout comme pour les autres organismes, la différence de toxicité observée entre milieu dulçaquicole et milieu marin est certainement attribuable majoritairement à des différences de sensibilité inter-spécifiques.
Paramètres d'écotoxicité chronique :
Vis-à-vis des organismes du compartiment sédimentaire les NOEC et LOEC sont comprises entre 15,2 et 1 210 µg.L-1. Toutefois, seule une NOEC de validité 2 (selon la cotation de Klimisch et al., 1997) est disponible, permettant de retenir la valeur de 15,2 µg.L-1.
Oseid et Smith (1975) exposent des insectes (Hexagenia limbata) au stade nymphe au H2S durant 138 jours. Les animaux ont été capturés dans le milieu naturel. Ils sont maintenus au laboratoire dans les mêmes conditions que celles de l’essai. L’eau utilisée est une eau de puits (température 17,5 – 18,0°C ; dureté totale CaCO3 : 210,0 mg.L-1 ; alcalinité totale CaCO3 : 230,0 mg.L-1 ; pH : 7,8 – 8,2 ; O2 : 4,75 – 7,65 mg.L-1). Deux essais sont réalisés sans réplique. Quatre concentrations en sulfure sont testées (1,1 ; 6,0 ; 15,2 et 34,8 µg.L-1 pour le premier essai ; 4,2 ; 12,9 ; 29 et 76,2 µg.L-1 pour le second essai) et un témoin. L’essai est réalisé en flux dynamique dans des aquariums de 25 litres dont le fond est couvert par 3 cm de sédiment naturel. Les animaux sont nourris avant l’essai mais pas durant ce dernier. Un suivi analytique est effectué 3 fois par semaine. La concentration en H2S non dissocié est calculée. Le taux de mortalité des nymphes et l’émergence des sub-imagos sont déterminés quotidiennement. Dans ces conditions, la NOEC 138 jours est de 15,2 µg.L-1 d’H2S.
Les essais sont relativement bien décrits, un suivi analytique est réalisé et les résultats de chaque concentration testée sont indiqués. L’essai est effectué sans réplique mais deux essais sont réalisés. Malgré les manques, les résultats en provenance de l’université du Minnesota sont considérés comme valides avec restriction (niveau de validité : 2 selon la cotation de Klimisch et al., 1997).
Sédiment marin
Paramètres d’écotoxicité aiguë :
Vis-à-vis des organismes du compartiment sédimentaire marin, la CL50 96 heures est de plus de 3 400 µg.L-1 (Neanthes arenaceodentata). Tout comme pour les autres organismes, la différence de toxicité observée entre milieu dulçaquicole et milieu marin est certainement attribuable majoritairement à des différences de sensibilité inter-spécifiques.
Sols
Vis-à-vis des plantes terrestres, l’IUCLID (2000) décrit de nombreux essais effectués sur diverses plantes (oignon, haricot, épinard, laitue, betterave à sucre, radis, soja, pommier, poirier, fraisier, herbe, tomate, tabac, sarrasin …). Dans ces essais, les plantes ont été exposées au H2S par voie atmosphérique, ils ne peuvent donc pas être retenus pour évaluer une PNEC sol. Les effets toxiques y apparaissent pour les plantes les plus sensibles (i.e. trèfle) à des concentrations d’environ 1,4 mg.m-3 avec pour symptômes des décolorations et des nécroses. Au contraire, d’autres plantes paraissent beaucoup plus résistantes avec une absence d’effet à une concentration de 600 mg.m-3 (i.e. pommier, cerisier, herbe, fraisier).
Oiseaux et Mammifères
Paramètres d'écotoxicité aiguë :
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës :
Vis-à-vis des oiseaux et des mammifères, aucune donnée de toxicité aiguë par voie orale n’a été répertoriée pour le H2S (IUCLID, 2000).
Toutefois, Santé Canada (1987) indique que les DL50 orales du sulfure de sodium sont de 205 et de 208 mg.kg-1 pour la souris et le rat respectivement. Par voie intrapéritonéale, chez la souris la DL50 du H2S est de 17 mg.kg-1 de poids corporel (Elovaara et al., 1978, cités par IUCLID, 2000). De plus Santé Canada (1987) mentionne que pour cette même voie d’exposition, la DL50 du sulfure de sodium est comprise entre 40 et 50 mg.kg-1.
Valeurs de danger
Synthèse
Eau douce
FDTE/VTR Importer
Paramètres d’écotoxicité aiguë :
D’une façon générale, la toxicité du H2S vis-à-vis des organismes dulçaquicoles est similaire à celle des organismes marins (Küster et al., 2005).
En utilisant la moyenne géométrique des résultats lorsque plusieurs données sont disponibles pour une même espèce, l’étude des résultats montre qu’indépendamment de la qualité des données, la toxicité aiguë du H2S est très variable en fonction notamment de l’espèce étudiée, de son mode de vie (épibenthique, endobenthique ou pélagique), des conditions physico-chimiques du milieu (température, pH) et du stade de développement de l’organisme.
Ainsi, en eau douce ou marine, la CE50 du H2S vis-à-vis des algues est comprise entre 105,6 et 1 874 µg.L-1.
Vis-à-vis des crustacés, la CL50 est comprise entre 13,1 µg.L-1 (Metapenaeus monoceros) et 17 040 µg.L-1 (Nephrops norvegicus).
Vis-à-vis des mollusques et échinodermes, la CL50 est comprise entre 9,5 (Mytilus edulis) et 43 µg.L-1 (Paracentrotus lividus).
Enfin, vis-à-vis des insectes, la CL50 est comprise entre 20 (Baetis vagans) et 316 µg.L-1 (Ephemera simulans).
Vis-à-vis des poissons, la CL50 est comprise entre 7 µg.L-1 (Salmo trutta) et 3 570 µg.L-1 (Boleophthalmus boddarti).
Pour le compartiment sédimentaire, la CL50 est comprise entre 165 µg.L-1 (Hexagenia limbata) et > 3 400 µg.L-1 (Neanthes arenaceodentata).
Paramètres d'écotoxicité chronique :
En utilisant la moyenne géométrique des résultats lorsque plusieurs données sont disponibles pour une même espèce, l’étude des résultats montre qu’indépendamment de la qualité des données, la toxicité chronique du H2S vis-à-vis des organismes aquatiques testés est relativement homogène. Vis-à-vis des crustacés dulçaquicoles, la moyenne géométrique des NOEC est de 1,7 µg.L-1 (Gammarus pseudolimnaeus). Vis-à-vis des poissons dulçaquicoles, la moyenne géométrique des NOEC est de 4,6 µg.L-1. Les organismes du compartiment sédimentaires semblent moins sensibles. Pour ces organismes, les NOEC et LOEC sont comprises entre 15,2 et 1 210 µg.L-1. Tout comme observé lors des études de toxicité aiguë, la variabilité de la toxicité est liée principalement à des différences interspécifiques (épibenthique, endobenthique ou pélagique), les espèces endobenthiques étant certainement les espèces les plus tolérantes au H2S.
Eau marine
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
D’une façon générale, la toxicité du H2S vis-à-vis des organismes dulçaquicoles est similaire à celle des organismes marins (Küster et al., 2005).
En utilisant la moyenne géométrique des résultats lorsque plusieurs données sont disponibles pour une même espèce, l’étude des résultats montre qu’indépendamment de la qualité des données, la toxicité aiguë du H2S est très variable en fonction notamment de l’espèce étudiée, de son mode de vie (épibenthique, endobenthique ou pélagique), des conditions physico-chimiques du milieu (température, pH) et du stade de développement de l’organisme.
Ainsi, en eau douce ou marine, la CE50 du H2S vis-à-vis des algues est comprise entre 105,6 et 1 874 µg.L-1.
Vis-à-vis des crustacés, la CL50 est comprise entre 13,1 µg.L-1 (Metapenaeus monoceros) et 17 040 µg.L-1 (Nephrops norvegicus).
Vis-à-vis des mollusques et échinodermes, la CL50 est comprise entre 9,5 (Mytilus edulis) et 43 µg.L-1 (Paracentrotus lividus).
Enfin, vis-à-vis des insectes, la CL50 est comprise entre 20 (Baetis vagans) et 316 µg.L-1 (Ephemera simulans).
Vis-à-vis des poissons, la CL50 est comprise entre 7 µg.L-1 (Salmo trutta) et 3 570 µg.L-1 (Boleophthalmus boddarti). Pour le compartiment sédimentaire, la CL50 est comprise entre 165 µg.L-1 (Hexagenia limbata) et > 3 400 µg.L-1 (Neanthes arenaceodentata).
Paramètres d'écotoxicité chronique :
En utilisant la moyenne géométrique des résultats lorsque plusieurs données sont disponibles pour une même espèce, l’étude des résultats montre qu’indépendamment de la qualité des données, la toxicité chronique du H2S vis-à-vis des organismes aquatiques testés est relativement homogène. Pour les échinodermes marins (Paracentrotus lividus), la moyenne géométrique des NOEC est de 6,3 µg.L-1. Les organismes du compartiment sédimentaires semblent moins sensibles. Pour ces organismes, les NOEC et LOEC sont comprises entre 15,2 et 1 210 µg.L-1. Tout comme observé lors des études de toxicité aiguë, la variabilité de la toxicité est liée principalement à des différences interspécifiques (épibenthique, endobenthique ou pélagique), les espèces endobenthiques étant certainement les espèces les plus tolérantes au H2S.
Sédiments d'eau douce
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Vis-à-vis des organismes du compartiment sédimentaire dulçaquicole, la CL50 96 heures est de 165 µg.L-1 (Hexagenia limbata). Tout comme pour les autres organismes, la différence de toxicité observée entre milieu dulçaquicole et milieu marin est certainement attribuable majoritairement à des différences de sensibilité inter-spécifiques.
Paramètres d'écotoxicité chronique :
Vis-à-vis des organismes du compartiment sédimentaire les NOEC et LOEC sont comprises entre 15,2 et 1 210 µg.L-1. Toutefois, seule une NOEC de validité 2 (selon la cotation de Klimisch et al., 1997) est disponible, permettant de retenir la valeur de 15,2 µg.L-1.
Sédiments marins
FDTE/VTR Importer Paramètres d’écotoxicité aiguë :
Vis-à-vis des organismes du compartiment sédimentaire marin, la CL50 96 heures est de plus de 3 400 µg.L-1 (Neanthes arenaceodentata). Tout comme pour les autres organismes, la différence de toxicité observée entre milieu dulçaquicole et milieu marin est certainement attribuable majoritairement à des différences de sensibilité inter-spécifiques.
Sol
FDTE/VTR Importer
Vis-à-vis des plantes terrestres, l’IUCLID (2000) décrit de nombreux essais effectués sur diverses plantes (oignon, haricot, épinard, laitue, betterave à sucre, radis, soja, pommier, poirier, fraisier, herbe, tomate, tabac, sarrasin …). Dans ces essais, les plantes ont été exposées au H2S par voie atmosphérique, ils ne peuvent donc pas être retenus pour évaluer une PNEC sol. Les effets toxiques y apparaissent pour les plantes les plus sensibles (i.e. trèfle) à des concentrations d’environ 1,4 mg.m-3 avec pour symptômes des décolorations et des nécroses. Au contraire, d’autres plantes paraissent beaucoup plus résistantes avec une absence d’effet à une concentration de 600 mg.m-3 (i.e. pommier, cerisier, herbe, fraisier).
Vis-à-vis des oiseaux et des mammifères, aucune donnée de toxicité aiguë par voie orale n’a été répertoriée pour le H2S (IUCLID, 2000).
Biote
Paramètres d'écotoxicité aiguë :
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions aiguës :
Toutefois, Santé Canada (1987) indique que les DL50 orales du sulfure de sodium sont de 205 et de 208 mg.kg-1 pour la souris et le rat respectivement. Par voie intrapéritonéale, chez la souris la DL50 du H2S est de 17 mg.kg-1 de poids corporel (Elovaara et al., 1978, cités par IUCLID, 2000). De plus Santé Canada (1987) mentionne que pour cette même voie d’exposition, la DL50 du sulfure de sodium est comprise entre 40 et 50 mg.kg-1.
Vis-à-vis des oiseaux et mammifères, aucune donnée valide de toxicité chronique par voie orale n’a été répertoriée pour le H2S (IUCLID, 2000).
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
FDTE/VTR Importer Compartiment aquatique
Sur l’ensemble des résultats de toxicité chronique répertoriés, la toxicité du H2S semble similaire pour les invertébrés et les poissons. Les organismes de l’endobenthos ou vivant dans des eaux hypoxiques semblent plus tolérant au H2S. De nombreuses études de toxicité chronique peuvent être considérées comme valides notamment du fait de l’instabilité du H2S dans l’eau, qui a rendu nécessaire l’utilisation de flux dynamiques avec suivi analytique des concentrations. Toutefois, aucune donnée chronique sur algue n’a été répertoriée.Dans ce cas, pour le calcul de la PNEC il est proposé de retenir les NOEC de 2,0 et 2,2 µg.L-1 obtenues respectivement sur le crustacé dulçaquicole Gammarus pseudolimnaeus et le poisson Lepomis macrochirus. Pour ce dernier organisme, la NOEC correspond à la moyenne géométrique des NOECs obtenues pour cette espèce. Ces deux NOEC ont été obtenues sur des espèces représentant deux niveaux trophiques et ayant démontré leur sensibilité dans les essais de toxicité aiguë.En s'appuyant sur la méthodologie européenne recommandée par le TGD, il est donc possible de d’évaluer une PNEC pour les organismes aquatiques.
Synthèse
FDTE/VTR Importer Compartiment aquatique
Eau douce
Vis-à-vis des organismes aquatiques, un facteur de 50 est appliqué sur la NOEC la plus faible.
La PNEC proposée est donc de 2,0/50 (µg.L-1), soit :
PNECeau-douce = 0,04 mg.L-1 soit 40 ng.L-1
Eau marine :
Pour prendre en compte la plus grande biodiversité du milieu marin, un facteur de 500 est appliqué à la NOEC la plus faible. La PNEC proposée est donc de 2,0/500 (µg.L-1), soit :
PNECeau-marine = 0,004 mg.L-1 soit 4 ng.L-1
Compartiment sédimentaire:
Il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
PNECmes = (Kmes-eau/RHOmes) x (PNECeau/10) x 1000
RHOmes = Densité des matières en suspension (humide) (valeur par défaut : 1150 kg.m-3)
Kmes-eau : Coefficient de partage entre les MES et l’eau (m3.m-3)
=Feaumes + Fsolidmes x Kpmes / 1000) x RHOsolid
Feaumes : Fraction d’eau dans le sol (défaut : 0,9 m3.m-3)
Fsolidmes : Fraction solide dans les MES (défaut : 0,1 m3.m-3)
Kpmes : Coefficient de partage eau-MES (L.kg-1)
10 : Facteur permettant la prise encompte d’une autre voie d’exposition pour des substances ayant un log Kow > 5.D'où :
Un essai de chronique valide sur des organismes du compartiment sédimentaire est disponible et conduit à une NOEC 138 jours de 15,2 µg.L-1.Dans ce cas, en accord avec le TGD, il est possible de déterminer une PNEC pour le compartiment sédimentaire en appliquant un facteur de 100 sur la NOEC observée. La PNEC proposée est donc de 15,2/100 (µg.L-1), soit :
PNECsed = 0,152 mg.L-1 soit 152 ng.L-1
Compartiment sol:
Une PNEC pour le compartiment sol peut être déterminée en utilisant la méthode du coefficient de partage selon le TGD.
PNECsol = Ksol-eau/RHOsol ´ PNECeau ´ 1 000
RHOsol = Densité du sol (humide) (valeur par défaut : 1 700 kg/m3)
Ksol‑eau= Coefficient de partage sol eau (0,33 m3/m3
)= Fairsol ´ Kair-eau + FeauSol + FsolidSol ´ (KpSol /1 000) ´ RHOsolid
Kair-eau : Coefficient de partage entre l’air et l’eau (0,198)
Fairsol : Fraction d’air dans le sol (défaut : 0,2 m3/m3)
Feausol : Fraction d’eau dans le sol (défaut : 0,2 m3/m3)
Fsolidsol : Fraction solide dans le sol (défaut :0,6 m3/m3)
Kpsol : Coefficient de partage eau-sol (0,06 L/kg)
RHOsolid : Densité de la phase solide (défaut : 2,5 kg/L)
D'où :PNECSOL = 0,393 µg/kg sol humide = 0,445 µg/kg sol sec
D’où :PNECSOL = 0,445 µg.kg-1 sol sec
Valeurs réglementaires
Archives
Dernière vérification le 25/04/2024
Introduction
Documents
Exporter la substance
Choisissez le format de l'export :










