Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Dibenzo[a,h]anthracène (53-70-3)
Informations générales
Dernière vérification le 18/04/2024
Identification
Numero CAS
53-70-3
Nom scientifique (FR)
Dibenzo[a,h]Anthracène
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
Code SANDRE
Numéro CIPAC
Formule chimique brute
\(\ce{ C22H14 }\)
Code InChlKey
Code SMILES
c(c(c(c(c1)ccc2)c2)cc(c3c(c(c4)ccc5)c5)c4)(c1)c3
Classement transport
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP01
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H350 |
|---|---|
| Mention du danger - Texte | Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) |
| Classe(s) de dangers | Cancerogénicité |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Carc. 1B; H350: C ≥ 0,01 % |
| Facteur M |
M=100 |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H400 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Mention du danger - Code | H410 |
|---|---|
| Mention du danger - Texte | Très toxique pour les organismes aquatiques, entraîne des effets à long terme |
| Classe(s) de dangers | Danger pour le milieu aquatique |
| Libellé UE du danger | - |
| Limites de concentration spécifique |
Carc. 1B; H350: C ≥ 0,01 % |
| Facteur M |
M=100 |
| Estimation de toxicité aigüe | - |
Méthodes analytiques
Introduction
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Analyse
Autres milieux
Analyse
Programmes
Physico-Chimie
Dernière vérification le 18/04/2024
Généralités
Poids moléculaire
278.35 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Comportement et devenir dans les milieux
Dernière vérification le 18/04/2024
Matrices
Atmosphère
Le DB(a,h)A est présent dans les combustibles fossiles, et est émis, généralement dans l'atmosphère, sous forme de produits de leur combustion incomplète. Sa pression de vapeur indique que cette substance n'est que rarement présente dans la phase gazeuse de l'atmosphère. La phase particulaire est physiquement soustraite de l'atmosphère sous forme de dépôts secs ou humides.
Milieu eau douce
Dans le milieu aquatique, le DB(a,h)A est préférentiellement associé à la phase particulaire de la colonne d'eau ou du sédiment. Sa volatilisation directe à partir de la colonne d'eau est faible (Lyman et al., 1990).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu eau de mer
Milieu sédiment eau douce
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Milieu sédiment marin
Milieu terrestre
Compte tenu de la valeur élevée de son Koc, le DB(a,h)A présent dans le sol est relativement peu mobile (Sims et Overcash, 1983). Compte tenu des valeurs de constante de Henry et de pression de vapeur, sa volatilisation à partir du sol est faible et ne constitue pas une voie de dissémination importante dans l'environnement (Meylan et Howard, 1991).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Dégradabilité abiotique
Dans l'air, le DB(a,h)A absorbe la lumière dans le spectre visible, ce qui laisse supposer une photolyse directe importante (Callahan et al., 1979); 45,3 % du DB(a,h)A adsorbé sur gel de silice est dégradé après 17 heures d'irradiation. La demi-vie du DB(a,h)A adsorbé sur des oxydes d'aluminium associé à la photolyse par lampe au mercure a été établie à 4,63 heures (Cooke et Dennis, 1985). Les produits de dégradation par photolyse identifiés à l'issue de l'expérimentation comprennent des quinones, des dialdéhydes et des cétones D'autres mesures de photolyse effectuées par Sanders et al., 1993 ont permis d'établir une demi-vie de 12 heures. Faute de groupement fonctionnel facilement hydrolysable, le DB(a,h)A n'est pas soumis à hydrolyse (Lyman et al., 1990).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Atmosphère
Dans l'air, le DB(a,h)A absorbe la lumière dans le spectre visible, ce qui laisse supposer une photolyse directe importante.
Milieu eau douce
Le DB(a,h)A est biodégradable en milieu aquatique : 43 % du DB(a,h)A présent dans une eau ont pu être dégradés en 36 jours par une station de traitement d'eau usée utilisant des boues activées. Cependant une partie non négligeable (31 %) de la masse initiale a été adsorbée sur les boues alors que 26 % ont été rejetés par l'effluent (Smith et al., 1993). D'autres auteurs ont mis en évidence une toxicité du DB(a,h)A vis-à-vis de l'activité microbienne en station d'épuration fonctionnant avec des boues activées (Malaney et al., 1967).
Milieu eau de mer
Milieu sédiment eau douce
Milieu sédiment marin
Milieu terrestre
La biodégradation du DB(a,h)A est relativement lente dans les sols (361 à 750 jours). Une demi-vie de 750 jours à 20°C a été mesurée sur un sol incubé durant 240 jours dans un sol contenant une flore bactérienne non-acclimatée (Coover et Sims, 1987). Dans des sols standards, Park et al., 1990 ont mesuré des demi-vies variant de 361 et 420 jours selon le pH et le contenu en carbone organique total.
Conclusion sur la persistance
Bioaccumulation
Organismes aquatiques
Principales données de bio-accumulation dans les organismes aquatiques:
Le RIVM (2009) retient un BCF de 50 119 chez Daphnia magna, ce qui constitue un facteur de bioconcentration élevé. La bioconcentration du DB(a,h)A chez les organismes est largement dépendante de leur capacité métabolique à dégrader, par l'intermédiaire de leur système enzymatique, les molécules complexes telles que les HAP. Chez les organismes plus évolués tels que les poissons en milieu aquatique, ou encore les vertébrés en milieu terrestre, de tels systèmes enzymatiques favorisent l'élimination des HAP (Santodonato et al., 1981). Ainsi, un facteur de bioconcentration de 10 a été mesuré pour le DB(a,h)A chez le poisson Leuciscus idus melanotus (Freitag et al., 1985). Chez les organismes aquatiques dépourvus de systèmes enzymatiques hydroxylase, notamment le phytoplancton, le zooplancton, les bivalves et les gastéropodes, l'accumulation des HAP est plus prononcée, et les facteurs de bioconcentration sont plus élevés. Le DB(a,h)A se trouvant principalement associé à la phase particulaire du milieu aquatique, notamment les sédiments, les organismes qui y sont inféodés (benthos) sont susceptibles plus que les autres d'accumuler des concentrations élevées dans leurs tissus (Malins, 1977). Cette bioaccumulation préférentielle est d'autant plus marquée chez les espèces benthiques qu'elles appartiennent en général à des ordres peu évolués, qui ne disposent généralement pas d'un potentiel de dégradation enzymatique développé.
Organismes terrestres
Une recherche exhaustive dans la bibliographie scientifique internationale de données suffisamment satisfaisantes ou détaillées pour permettre d’estimer des facteurs de transfert ou présenter ceux proposés, n’a pas été réalisée dans le cadre de la présente section en date de la présente mise à jour.
La Base de données sur la contamination des Plantes Potagères par les molécules Organiques Polluantes - BAPPOP 2015* (Ademe, Ineris, Université de Lorraine-INRA-GISFI, INPT-ENSAT, ISA Lille, 2015) ne comporte pas le DB(a,h)A dans sa liste des HAP.
*Cette base regroupe sur un support unique des informations documentaires relatives à la contamination des plantes potagères par les molécules Organiques Polluantes, issues principalement des publications scientifiques récentes. Elle est gratuite et téléchargeable sur le site https://www.ademe.fr/bappop-base-donnees-contamination-plantes-potageres-molecules-organiques-polluantes et fonctionne sur ACCESS.
Organismes sédimentaires
En ce qui concerne les organismes du sédiment, un BCF de 2 000 000 a été rapporté pour l’oligochète Lumbriculus variegatus. Dans son analyse, le RIVM indique que le système n’est probablement pas à l’équilibre, seule la phase d’accumulation a été conduite, sans phase d’élimination.
Conclusion sur la bioaccumulation
Des études de bioaccumulation sont disponibles pour les invertébrés et les poissons. Il est très bioaccumulable chez Daphnia magna (BCF = 50 190) et beaucoup moins sur les poissons (BCF = 10). Une valeur de 2 000 000 est également disponible pour un invertébré du sédiment.
Toxicologie
Dernière vérification le 18/04/2024
Introduction
L’ensemble des informations citées ci-dessous provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents ATSDR, 1995 ; IARC 1983 ; IARC, 1987, 2010 ; US EPA (IRIS), 1990). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Chez l’homme, très peu d’études ont cherché à identifier les effets toxiques du DB(a,h)A seul, la plupart des données disponibles concernent des mélanges d’hydrocarbures aromatiques polycycliques (HAP). Dans cette fiche, seule la substance DB(a,h)A est considérée, la toxicité du DB(a,h)A en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP.
Le DB(a,h)A se situe dans la classe des HAP de haut poids moléculaire (5 cycles), avec une absorption théorique majoritaire sous forme particulaire.
Toxicocinétique
Chez l'homme
Absorption
Chez l’homme, aucune étude spécifique concernant le devenir dans l’organisme du DB(a,h)A n’est disponible.
Aucune donnée n’a été identifiée pour l'absorption.
Distribution
Sa présence a été détecté dans le lait maternel (moyenne de 0,129 ng.g-1 de poids frais) de femmes séjournant à Pékin depuis au moins 6 ans et non fumeuses (les niveaux d’expositions ne sont pas précisés) (Yu et al., 2011) ou encore dans le lait de mères italiennes (4,36 µg.kg-1 de lait) (Santonicola et al., 2017).
Métabolisme
Le métabolisme du DB(a,h)A n’a pas été spécifiquement étudié chez l’homme. Toutefois, des études in vitro réalisée à partir d’enzymes microsomales hépatiques d’origine humaine ont montré que le métabolite majoritairement formé était le trans-3,4-dihydrodiol, suivi par le 1,2- dihydrodiol sous la dépendance des formes 2C9 et 1A2 de la famille des cytochromes P450 (Shou et al., 1996).
Élimination
Des concentrations urinaires de DB(a,h)A de 1,9 - <1,1 et < 1,1 ng.L-1 ont respectivement été dosées chez des salariés travaillant dans des raffineries (n=12), au collage de l’asphalte (n=10) ou non professionnellement exposé (n=10) (Campo et al., 2011).
Chez l'animal
Absorption
Les études animales montrent que l’absorption du DB(a,h)A est effective après exposition par voie orale, cutanée ou par inhalation, mais aucune n’a été quantifiée.
Distribution
Chez le rat, le DB(a,h)A se distribue dans de nombreux tissus lors de l’administration par gavage du composé marqué radioactivement. Cinq pour cent se retrouvent dans les canaux lymphatiques thoraciques dans les 24 heures avec un pic plasmatique à 3 ou 4 heures. Les organes présentant les niveaux de radioactivité les plus élevés sont le foie et les reins, puis les glandes surrénales, les ovaires et le sang, avec un délai d’apparition de 10 heures. Au bout de 3 à 4 jours, la radioactivité est détectée uniquement dans les glandes surrénales, les ovaires et la graisse (Daniel et al., 1967).
Métabolisme
Aucune donnée in vivo ne traite du métabolisme du DB(a,h)A administré seul chez l’animal.
A partir d’études in vitro, le métabolisme du DB(a,h)A implique la formation de dihydrodiols (1,2-, 3,4- et 5,6-dihydrodiols). Le 3,4-dihydrodiol est le principal métabolite identifié au niveau des microsomes du foie de rat (de 24 à 28 % du total des métabolites). Le 3,4-dihydrodiol est considéré comme le précurseur du DB(a,h)A diol-époxique, composé considéré comme cancérogène ultime (Buening et al., 1979a ; Buening et al., 1979b ; Nordqvist et al., 1979 ; Platt et al., 1983 ; Wood et al., 1978). D’autres travaux réalisés à partir de fibroblastes embryonnaires de souris ont confirmé la transformation métabolique du dibenzo(a ,h)anthracène en 3,4-dihydrodiol- DBA, suivi par la formation de diol-oxide-DBA et 3,4,10,11-bis-diol-DBA (Nesnow et al., 1994).
L’activation métabolique du DB(a,h)A, réalisée à partir d’enzymes microsomales hépatiques et pulmonaires de souris, fait intervenir les cytochromes P450 de la famille 1 (1A1 et 1B1) par la voie du récepteur Ah (AhR)(Shimada et Fujii‐Kuriyama, 2004).
Élimination
Plus de 90 % du DB(a,h)A administré par gavage (200 mg) ou alimentation (250 mg) sont excrétés dans les fèces (Chang, 1943).
Autre
Relation avec le récepteur AhR : Sur les modèles in vitro humains ou animaux, le DB(a,h)A présente une affinité environ 5 à 10 fois plus importante que celle du BaP pour le récepteur des arylhydrocarbures (AhR)(Barron et al., 2004 ; Jones et Anderson, 1999 ; Misaki et al., 2016 ; Vondráček et al., 2017). Le DB(a,h)A est donc un activateur de son propre métabolisme.
Synthèse
Chez l'homme :
Aucune donnée n’est disponible sur la toxicocinétique du DB(a,h)A seul chez l’homme. Il a été dosé dans les urines de sujet exposés à des mélanges de HAP.
Chez l’animal, son absorption est effective, mais n’a pas été quantifiée. Après absorption, le DB(a,h)A se distribue dans tout l’organisme. Les principaux métabolites sont le 3,4-dihydrodiol, et le DB(a,h)A diol-époxique, composé considéré comme cancérogène ultime. Le DB(a,h)A est un activateur de son propre métabolisme mettant en jeu une forte liaison aux AhR.
Equivalents biosurveillance
Toxicité aiguë
Chez l'homme
Synthèse
Aucune donnée concernant l’effet induit par une exposition aiguë au DB(a,h)A n’est disponible chez l'homme.
Chez l'animal
Inhalation
Aucune donnée relative aux effets de l’exposition aiguë au DB(a,h)A seul n’a été identifiée chez l’animal.
Voie orale
L’administration pendant 10 jours de 51,4 mg.kg-1.j-1 de DB(a,h)A présent dans la nourriture n’induit aucune augmentation du poids relatif du foie chez des rats mâles partiellement hépatectomisés (Gershbein, 1975)
En revanche, des effets immunosuppresseurs du DB(a,h)A ont pu être observés chez des souris exposées par gavage à une dose unique de 0,1 à 100 mg.kg-1 de chrysène 12 heures avant d’être immunisées par une injection intraveineuse de globules rouges de moutons (Silkworth et al., 1995).
Voie cutanée
Une application cutanée de DB(a,h)A (dose non indiquée) sur le dos rasé des souris Swiss induit une suppression des glandes sébacées (Bock et Mund, 1958).
Synthèse
Les effets de l’exposition aiguë au DB(a,h)A seul sont peu documentés. Des effets immunosuppresseurs ont été décrits par voie orale, de même que la disparition des glandes sébacées par application cutanée chez la souris.
Toxicité à dose répétées
Effets généraux
Chez l'homme
Toutes voies
Aucune étude ne permet d’évaluer spécifiquement les effets induits par le DB(a,h)A chez l’homme.
Chez des salariés travaillant dans une fonderie de fer en Pologne (Szczeklik et al., 1994) exposés pendant une durée moyenne de 15 ans à un mélange de HAP comprenant du chrysène du fluoranthène, du pérylène, du pyrène, du B(a)P, du benz(a)anthracène, du dibenz(a,h)anthracène et du benzo(g,h,i)perylène, des variations des taux d’immunoglobulines sériques ont été observées. La signification biologique de ces effets n’est pas claire et aucune conclusion concernant l’effet spécifique du DB(a,h)A n’a pu être établie.
De même, dans le cadre d’une étude transversale réalisée sur des salariés exposés (cookerie et métallurgie) et témoins, une corrélation entre le niveau d’exposition aux HAP et plus particulièrement au dibenz(a,h)anthracène (prélèvements d’air) et l’altération des concentrations sériques d’immunoglobulines (IgE et IgA) et pour le TNF-α (cytokine pro-inflammatoire) a été observée (Jeng et al., 2011).
Synthèse
Aucune étude spécifique concernant les effets systémiques du DB(a,h)A n’est disponible. Seules des variations des taux d’immunoglobulines sériques ont été observés chez des travailleurs exposés à un mélange d’HAP, dont le DB(a,h)A.
Chez l'animal
Inhalation
Chez l’animal, aucune étude ne traite des effets pouvant être induits par une exposition chronique par voie pulmonaire au DB(a,h)A seul.
Voie orale
A l’autopsie, aucun signe de toxicité n’a été décrit chez des souris transgéniques mâles exposées 28 jours à des doses de 6,25 – 12,5 ou 25 mg.kg-1.j-1 de DB(a,h)A par gavage (pureté > 98 %) (Malik et al., 2013).
L’étude de Lee et Strickland, 1993 a montré qu’aucun anticorps anti-DB(a,h)A n’était synthétisé chez les souris BALB/c même après exposition par voie orale à 0,5 ou à 5 mg.kg-1 de DB(a,h)A, 2 fois par semaine pendant 8 semaines.
L’administration ad libitum à des souris DBA/2 de DB(a,h)A (0,2 mg.mL-1 dans une émulsion eau/huile d’olive) pendant 279 jours chez les souris mâles et 237 jours chez les souris femelles a été accompagnée d’une accélération du développement d’une péricardite calcifiante. Cette lésion survient spontanément dans cette lignée et sa fréquence augmente avec l’âge (Snell et Stewart, 1962).
Voie cutanée
Hoch-Ligeti, 1941 a administré à des souris par voie sous-cutanée du DB(a,h)A (0,05 mL d’une solution à 0,05 % de DB(a,h)A dans de la gélatine) chaque semaine pendant 40 semaines. Il a constaté une augmentation du nombre des cellules des glandes lymphatiques, une diminution du nombre des cellules lymphoïdes, une dilatation des sinus lymphatiques et une diminution significative du poids de la rate. Une dégénérescence graisseuse du foie, des dépôts ferriques dans les cellules de Kupffer au niveau du cortex des surrénales et des aspects dégénératifs des tubules rénaux ont été également notés.
L’administration à des rats 5 fois par semaine de 0,278 mg de DB(a,h)A pendant plusieurs semaines par voie sous-cutanée a entraîné une extravasation de globules rouges dans les espaces lymphatiques et la présence de grandes cellules pigmentées anormales (Lasnitzki et Woodhouse, 1944).
L’activité thyroïdienne déterminée à partir d’un test in vitro est perturbée (augmentation de l’activité thyroïde peroxydase) par la présence de DB(a,h)A (Song et al., 2012).
Synthèse
Chez l’animal, les rares données disponibles semblent indiquer une faible toxicité par voie orale (suspicion d’une péricardite calcifiante) et une atteinte du système lymphatique, du foie et des reins par voie sous-cutanée.
Synthèse des taux d’absorption et organes cibles en fonction des voies d’exposition :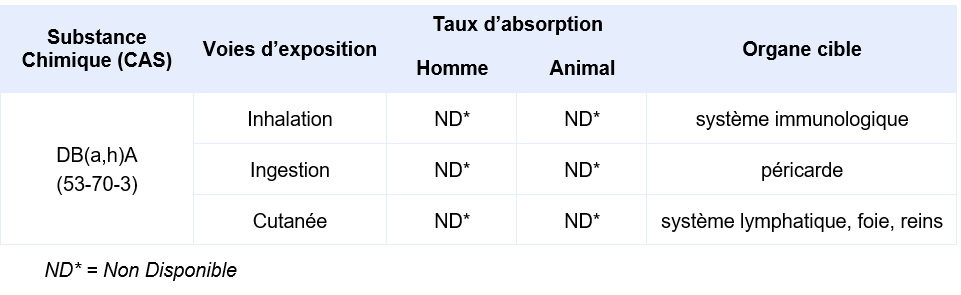
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Catégorie 1B: Substance dont le potentiel cancérogène pour l'êre humain est supposé | 2008 |
| IARC | FDTE/VTR Importer Groupe 2A: l’agent (ou le mélange) est probablement cancérogène pour l’homme. | 2010 |
| US EPA | FDTE/VTR Importer Classe B2: substance cancérogène possible pour l'homme. | 1990 |
Chez l'homme
Toutes voies
Aucune étude spécifique au DB(a,h)A seul n’est disponible chez l’homme.
Dans le cadre d’une étude environnementale, le risque de neuroblastome chez l’enfant (75 cas) a pu être significativement associé à l’exposition maternelle aux HAP (OR = 1,39, IC 95 % 1,05 – 1,84), le DB(a,h)A et l’indéno[1,2,3-c,d)pyrène étant plus particulièrement ciblés (Heck et al., 2013).
Synthèse
Aucune étude épidémiologique n’a recherché les éventuels effets cancérogènes de l’exposition au DB(a,h)A seul chez l’homme.
Chez l'animal
Inhalation
Aucune étude concernant l’effet cancérigène du DB(a,h)A administré par inhalation n’est disponible chez l’animal.
Des instillations intra-trachéales de 300 ou 900 µg de DB(a,h)A ont été administrées dans des préparations saline contenant 0,4 % de Tween 80 à des hamster (Syrian golden) pendant 20 semaines (Pott et al., 1978). Des tumeurs des voies respiratoires ont été observées chez 55 et 65 % des animaux exposés respectivement à la faible ou forte dose, tandis que dans le lot témoin (0,4 Tween 80), seuls 3 % des animaux ont développé une tumeur.
Par instillations intra-trachéales, les rats exposés à 5 administrations de 0 – 0,5 – 2 – 10 ou 20 mg de DB(a,h)A (préparation dans l’encre noire) ont développé à la fin des 30 mois de l’étude, des carcinomes épidermoïdes pulmonaires respectivement chez 0/15 (groupe témoin), 0/18, 1/27, 4/21 et 6/13 dans les groupes exposés par doses croissantes (Ianysheva et Balenko, 1966).
Des carcinomes pulmonaires ont également été observés chez des rats traités par un implant pulmonaire d’une dose unique de 100 µg de DB(a,h)A (pureté 99,3 %).
Voie orale
Les études de Snell et Stewart (1962, 1963), mentionnés ci-avant (paragraphe 3.3.1), ont étudié l’effet de l’exposition chronique par voie orale au DB(a,h)A (en émulsion dans l’huile d’olive) chez les souris mâles et femelles DBA/2. L’exposition moyenne des souris (21 mâles et 21 femelles) au DB(a,h)A a été estimée à 0,85 mg.j-1 pour les souris mâles et à 0,76 mg.j-1 pour les souris femelles. La durée l’exposition est de 279 jours chez les souris mâles et de 237 jours chez les souris femelles des lots exposés au DB(a,h)A (Snell et Stewart, 1962 ; Snell et Stewart, 1963)
Le lot témoin (25 mâles et 10 femelles) a reçu uniquement l’émulsion d’huile d’olive et d’eau pendant 351 jours chez les souris mâles et 226 jours chez les souris femelles.
Les souris n’ont pas bien toléré cette émulsion et, dans tous les lots étudiés, une perte de poids a été observée quelques semaines après le début de l’exposition, ainsi qu’une déshydratation. Les animaux morts spontanément ou proches de la mort ont été examinés afin de rechercher d’éventuelles tumeurs. Quinze animaux traités et 6 témoins sont morts précocement et n’ont pas pu être analysés.
Au jour 200, toutes les souris traitées survivantes (27) ont développé des adénomes pulmonaires (14/14 souris mâles, 13/13 souris femelles). Vingt-quatre avaient un carcinome pulmonaire (14/14 souris mâles, 10/13 souris femelles), 16 avaient un hémangio-endothéliome du pancréas et des nodules lymphatiques mésentériques (10/14 souris mâles, 6/13 souris femelles). Enfin, 12 femelles sur 13 présentaient un carcinome mammaire. Chez les souris témoins, 2 adénomes pulmonaires ont été comptabilisés mais aucun carcinome.
Dans les études de Biancifiori et Caschera, 1962, des carcinomes mammaires ont été observés chez les souris femelles BALB/c (1/20) et chez les souris pseudo-gestantes (accouplement des femelles vierges avec des mâles vasectomisés) BALB/c (13/24). Les souris ont été exposées par gavage 2 fois par semaine pendant 15 semaines à 0,5 % de DB(a,h)A dans de l’huile d’olive (dose totale 15 mg.animal-1). Il faut toutefois noter que des carcinomes mammaires ont été observés chez les souris pseudo-gestantes non traitées au DB(a,h)A (2/30 souris) et que dans une étude antérieure (Biancifiori et al., 1959), aucun carcinome mammaire n’a été constaté chez les souris femelles BALB/c vierges traitées au DB(a,h)A.
Enfin, une étude a montré qu’une simple dose de 1,5 mg de DB(a,h)A administrée par gavage dans du polyéthylène glycol induisait des papillomes du préestomac chez 2 souris mâles Swiss sur 42 étudiées, 30 semaines après l’exposition au DB(a,h)A (Berenblum et Haran, 1955).
Voie cutanée
Par voie cutanée, il a été montré que l’application de DB(a,h)A à des doses comprises entre 0,001 % (0,0012 mg.kg-1.j-1) et 0,1 % sur la peau des souris Swiss entraînait des carcinomes et des papillomes sur la zone où le DB(a,h)A a été appliqué (Wynder et Hoffmann, 1959). Pour les doses les plus faibles, l’augmentation des papillomes et des carcinomes est dose dépendante, alors qu’à la dose la plus importante, le taux de carcinomes et de papillomes diminue, reflétant ainsi la toxicité du DB(a,h)A et l’augmentation du nombre d’animaux morts après le traitement.
Dans une autre étude, 50 souris femelles NMRI ont été exposées par voie cutanée (application sur le dos des souris) à différentes doses de DB(a,h)A (0, 136, 448 ou 1 358 nmol soit 38, 125 et 378 µg) dans de l’acétone, 3 fois par semaine pendant 112 semaines. Des papillomes ont été respectivement observés dans 6, 8 et 32 % des groupes traités (Platt et al., 1990).
Une injection sous-cutanée de DB(a,h)A (308 nmol par animalsoit environ 86 µg par animal) chez des souris NMRI adultes a entraîné la formation de fibrosarcomes au point d’injection (Platt et al., 1990). Chez des souriceaux MNRI de 2 jours, 400 nmol de DB(a,h)A (soit 111 µg) ont été injectés par voie sous-cutanée. A 40 semaines, 92 % des souris ont développé des adénomes pulmonaires (Platt et al., 1990). L’étude de Flesher et al., 2002 a confirmé la cancérogénicité du DB(a,h)A. En effet, l’injection sous cutanée de 20 doses de 1 µmol de DB(a,h)A (soit 300 µg), administrée à raison de 3 doses par semaine, induit chez tous les rats Sprague-Dawley femelles traités 33 semaines après l’arrêt de l’exposition des sarcomes.
Certaines études ont été réalisées afin de connaître le pouvoir initiateur ou promoteur du DB(a,h)A. L’application de DB(a,h)A suivie d’une promotion avec de l’acétate de tétradécanoyl phorbol (TPA) pendant 25 semaines induit une augmentation des tumeurs de la peau. Cette augmentation est dose dépendante et est décelée à partir de 0,028 µg de DB(a,h)A (Buening et al., 1979b). Dans une autre étude d’initiation et de promotion, les souris femelles NMRI (50) ont été exposées par voie cutanée à 0 - 300 et 600 nmol (soit 0 - 83,5 et 167 µg) de DB(a,h)A. Sept jours après cette application, du TPA a été appliqué sur la peau des souris, 2 fois par semaine pendant 25 semaines. Dans cette étude, le DB(a,h)A est un initiateur de tumeur pour la plus forte dose testée (600 nmol).
Synthèse
Des tumeurs (adénomes, papillomes ou carcinomes) sont observées chez la souris exposée au DB(a,h)A par voie orale ou cutanée (poumons, glandes mammaires, peau, système lymphatique). Des tumeurs se développent également aux sites d’injection par voie sous-cutanée ou au niveau de l’appareil respiratoire dans le cas d’instillations intra-trachéales (hamster) ou implant pulmonaire (rat).
Effets génotoxiques
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | Non classé |
Chez l'homme
Toutes voies
Aucune donnée spécifique au DB(a,h)A n’a été identifiée chez l’homme.
Les données issues de plusieurs études épidémiologiques ont conduit des auteurs à proposer comme marqueur de risque du cancer du poumon, le dosage des adduits du DB(a,h)A au niveau des cellules nasales chez les sujets exposés à la pollution de l’air (Okona-Mensah et al., 2005).
Chez l'animal
Toutes voies
Une étude in vivo réalisée chez des hamsters chinois a montré que le DB(a,h)A induisait des échanges de chromatides sœurs mais pas d’aberrations chromosomiques (IARC 1983).
L’exposition de souris transgéniques mâles à 6,25 - 12,5 ou 25 mg.kg-1.j-1 de DB(a,h)A pendant 28 jours entraîne une augmentation dose-dépendante de la formation d’adduits à l’ADN au niveau du foie (moins fréquente qu’avec le BaP et de la fréquence des mutations (LacZ) (Malik et al., 2013). Une analyse toxicogénomique réalisée en parallèle a permis d’identifier la perturbation de l’expression de plus de 135 gènes régulés positivement et 104 gènes régulés négativement. Plusieurs de ces gènes sont impliqués dans le processus cancérogène et les fonctions biologiques vitales telles que le rythme circadien, le métabolisme du glucose et des lipides, la réponse immunitaire, le cycle cellulaire et l’apoptose.
In vitro
Organismes eucaryotes
La plupart des études in vitro montrent que le DB(a,h)A induit une détérioration de l’ADN et des mutations (Andrews et al., 1978 ; Hermann, 1981 ; Huberman, 1975 ; Mersch-Sundermann et al., 1992a ; Mersch-Sundermann et al., 1992b).
Dans le cadre d’une étude réalisée à partir de coupes de foie de rat exposées in vitro à différents HAP dont le DB(a,h)A (3, 10 ou 30 µM pendant 24 heures), les auteurs ont pu observer une augmentation dose-dépendante des d’adduits à l’ADN (plus de 12 adduits par 108 nucléotides) (Staal et al., 2007). La formation d’adduits a également été observée à partir de travaux réalisés sur des fibroblastes embryonnaires de souris en culture suivi d’un post-marquage au P32, la liaison du DB(a,h)A à l’ADN (24 % à 2,5 µg.ml-1) faisant majoritairement intervenir la dGuo (Nesnow et al., 1994).
L’analyse globale des données confère au DB(a,h)A la capacité de jouer un rôle dans la phase d’initiation tumorale, par un mécanisme encore incertain impliquant vraisemblablement la formation d’un diol-époxyde (formation d’adduits à l’ADN sur plusieurs système cellulaires) (IARC, 2010). Il est considéré comme une substance cancérogène dont le mode d’action repose sur une absence de seuil.
Le DB(a,h)A présente un fort pouvoir mutagène, mais les tests de promotion tumorale sont négatifs (Misaki et al., 2016).
Synthèse
Le DB(a,h)A induit, in vivo, des échanges de chromatides sœurs et la formation d’adduits à l’ADN et de mutations. Les études in vitro confirment les résultats observés chez l’animal.
Effets sur la reproduction
Chez l'homme
Toutes voies
Aucune étude ne traite de l’effet du DB(a,h)A seul sur la reproduction et ceci quelle que soit la voie d’exposition.
Synthèse
Aucune donnée sur les effets sur la reproduction de l’exposition au DB(a,h)A seul n’est disponible chez l’homme.
Chez l'animal
Inhalation
Aucune étude concernant l’effet du DB(a,h)A par voie pulmonaire sur la reproduction n’a été réalisée chez l’animal.
Voie orale
Chez l’animal, seul l’effet du DB(a,h)A par voie orale sur la reproduction et le développement a été étudié. Une étude réalisée chez le rat a montré que l’exposition par voie orale au DB(a,h)A pouvait avoir une incidence sur la reproduction (Wolfe et Byran, 1939). D’après les auteurs le traitement au cours de la gestation (5 mg/rat de DB(a,h)A tous les jours à partir du premier jour de gestation) peut affecter la fertilité à venir des mères (Wolfe et Byran, 1939). Il faut rester prudent quant à l’interprétation de ces résultats, car les auteurs soulignent le faible nombre d’animaux étudiés.
Voie cutanée
Aucune étude concernant l’effet du DB(a,h)A par voie cutanée sur la reproduction n’a été réalisée chez l’animal.
Synthèse
Les données relatives aux effets DB(a,h)A seul sur la fertilité sont trop succinctes pour pouvoir conclure.
Effets sur le développement
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Le DB(a,h)A a été examiné mais non classé par l’Union Européenne. |
Chez l'homme
Toutes voies
Aucune étude ne traite de l’effet du DB(a,h)A seul sur le développement et ceci quelle que soit la voie d’exposition.
Chez l'animal
Inhalation
Aucune étude concernant l’effet du DB(a,h)A par voie pulmonaire sur le développement n’a été réalisée chez l’animal.
Voie orale
Une étude réalisée chez le rat a montré que l’exposition par voie orale au DB(a,h)A pouvait avoir une incidence sur le développement. Ainsi, l’administration quotidienne par voie orale de 5 mg de DB(a,h)A à partir du premier jour de gestation induit une augmentation de la mortalité chez les fœtus et du taux de résorption (Wolfe et Byran, 1939). Il faut rester prudent quant à l’interprétation de ces résultats, car les auteurs soulignent le faible nombre d’animaux étudiés.
Une étude, seulement rapportée sous forme de résumé, suggère que le DB(a,h)A ou ses métabolites peuvent traverser la barrière placentaire (Reno, 1969).
Voie cutanée
Aucune étude concernant l’effet du DB(a,h)A par voie cutanée sur le développement n’a été réalisée chez l’animal.
Synthèse
Seule une étude de qualité discutable par voie orale évoque un effet du DB(a,h)A sur l’embryon et le fœtus (mortalité).
Autres Effets
Valeurs accidentelles
Valeurs seuils de toxicité aigüe françaises
Autres seuils accidentels
Valeurs réglementaires
Valeurs guides
Valeurs de référence
Introduction
Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes.
Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Effets à seuil:
Il n’existe pas de VTR concernant les effets avec seuil engendrés par le DB(a,h)A.
Effets sans seuil :
Selon le rapport INERIS (2003), une méthode de calcul est proposée par l’OMS IPCS, sur la base d’une valeur de référence multipliée par un FET (facteur d’équivalence toxique) (Doornaert et Pichard, 2003). Le principe de FET est fondé sur les hypothèses selon lesquelles l’organe cible et l’activité toxique sont identiques pour chaque molécule apparentée et qu’il n’y a pas d’interaction toxicocinétique ni toxicodynamique. Une telle approche autorise l’addition des risques cancérigènes liés à une co-exposition et permet de quantifier le pouvoir cancérigène d’un mélange de substances en fonction du pouvoir cancérigène d’une substance dite de référence, appartenant à la même famille chimique (OMS IPCS, 1998).
Néanmoins, comme le rappelle l’AFSSA, 2006, cette approche n’est possible que sous 3 conditions :
- les doses et les effets de chacun des composés du mélange sont additifs,
- il n'existe pas d'interactions antagonistes ou synergiques entre les composés du mélange et
- ils agissent selon le même mécanisme d'action toxique.
Or de nombreuses études expérimentales montrent que ces 3 conditions ne sont pas toujours réunies et peuvent conduire à une surestimation ou à une sous-estimation du risque.
Dans le cas des HAP, la molécule de référence est le BaP car c’est le HAP le plus étudié et donc le mieux connu. Le potentiel toxique relatif de chaque HAP dont l’acénaphtène est ensuite évalué par rapport à la toxicité du BaP. Un facteur d’équivalence toxique par rapport au BaP est alors évalué pour l’acénaphtène. Les FET retenus dans cette approche sont ceux proposés par Nisbet et Lagoy, 1992 et repris dans le document INERIS (2003)*. Cette étape est basée sur l’hypothèse selon laquelle le potentiel toxique relatif entre deux HAP estimé chez l’animal est identique ou similaire chez l’homme.
Dans le cas particulier du DB(a,h)A, l’Ineris a choisi de substituer un FET de 1 au lieu de 5** valeur initialement attribuée par Nisbet et Lagoy, 1992 (Doornaert et Pichard, 2003).
* Selon INERIS (2003) et AFFSA (2003) : La table proposée par Nisbet et Lagoy, 1992 est sans doute la plus documentée et la plus transparente, le modèle mathématique utilisé est expliqué et toutes les données expérimentales prises en compte sont mentionnées. Les deux organismes proposent donc d’utiliser la table proposée par Nisbet et Lagoy, 1992.
** Comme rapporté par INERIS (2003) : Pour le dibenz(a,h)anthracène, Nisbet et Lagoy, 1992 sur la base des données de Wynder et Hoffmann, 1959, proposent un FET de 5 pour des expositions environnementales (expositions à de faibles doses). En effet, selon Nisbet et Lagoy, 1992 les données de Wynder et Hoffmann ont montré que le potentiel cancérigène du dibenz(a,h)anthracène par rapport au BaP était de 1 pour des fortes concentrations de dibenz(a,h)anthracène et de 5 pour des faibles concentrations. Pourtant, les résultats de ces expérimentations ont montré que le dibenz(a,h)anthracène a le même effet sur le développement des tumeurs et sur la mortalité des animaux que le BaP pour des concentrations identiques, soit 0,01 %. A des concentrations plus faibles de benz(a,h)pyrène (0,001 %), les effets observés sur le développement de tumeurs et sur la mort des souris sont moins importants que ceux observés pour une concentration de 0,01 %. Au vu de ces résultats, l’INERIS propose un FET de 1 pour le dibenz(a,h)anthracène.
Informations relatives à l’utilisation des VTR
Dans cette rubrique, seul le DB(a,h)A est considéré, la toxicité du DB(a,h)A en mélange avec d’autres hydrocarbures aromatiques polycycliques est donc exclue. Cependant, il s’agit le plus souvent de co-expositions à plusieurs HAP.
Rappelons que dans le concept de facteur d’équivalence toxique (FET) permettant d’établir une valeur toxicologique pour des effets cancérigènes induits par un mélange de HAP, le DB(a,h)A est la substance cancérogène à laquelle un potentiel toxique de valeur 1 équivalent à celui attribué au BaP.
Même si à ce jour, il n’existe pas de VTR pour des expositions cutanées cette voie d’exposition peut ne pas être négligeable.
Valeurs de l'ANSES et/ou de l'INERIS
Description
Effets sans seuil - Exposition chronique par inhalation :
L'OEHHA propose un ERUi de 1,2.10-3 (µg.m-3)-1 pour une exposition par inhalation (OEHHA, 2020).
Cette valeur a été établie en 2002 à partir d’une étude de cancérogenèse expérimentale chez la souris, exposée par voie orale via l'eau de boisson au DB(a,h)A à la dose de 28,3 mg.kg-1.j-1 (Snell et Stewart, 1962). Une augmentation de l'incidence des carcinomes alvéolaires a été notée chez les mâles (témoins : 0/25 ; exposés : 14/21).
A partir de ces données, un ERUo de 4,1 (mg.kg-1.j-1)-1 a été calculé en utilisant un modèle multi-étapes linéarisé. Les facteurs d'équivalence classiques (poids moyen adulte : 70 kg et volume respiratoire journalier 20 m3) ont été utilisés pour définir un risque par inhalation, en faisant l'hypothèse que l'absorption du DB(a,h)A et son potentiel cancérigène sont similaires par les deux voies.
L'INERIS propose un ERUi de 6.10-4 (µg.m-3)-1 pour une exposition chronique par inhalation au DB(a,h)A (2018).
Pour une exposition par inhalation à un HAP et en l’absence de valeur spécifique, l’INERIS recommande de prendre en compte l’Excès de Risque Unitaire (ERUi) du BaP proposé par l’US EPA (2017) et retenue par l’INERIS à savoir 6.10-4 (µg.m-3)-1 et de lui appliquer le FET correspondant à cet HAP. Pour le DB(a,h)A, l’INERIS a retenu en 2003 (INERIS, 2003) un FET de 1 dérivant de de la classification de Nisbet et LaGoy (1992). Cet ERUi correspond à une concentration de 1,67 10-2 µg.m3 pour un risque de 10-5 ou à une concentration de 1,67 10-3 µg.m3 pour un risque de 10-6.
Calcul de VTR par inhalation à partir du Facteur Equivalent Toxique (FET) du DB(a,h)A :
Effets sans seuil - Exposition chronique par voie orale :
L’ANSES propose une valeur de 0,005 µg TEQ[1].kg-1.j-1 pour une exposition chronique par voie orale à 11 HAP (ANSES, 2016)
L'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 (AFSSA, 2003) dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le BaP. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM.
Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur.
Pour les autres HAP, l’AFSSA recommande l’utilisation de facteurs d’équivalence toxiques (TEF) basés sur le pouvoir cancérigène relatif des HAP. Dans le cadre de l’étude sur l’alimentation totale infantile, l’ANSES (2016) a considéré 11 HAP (benzo(a)anthracène, BaP, benzo(b)fluoranthène, chrysène, benzo(g,h,i)perylène, benzo(k)fluoranthène, DB(a,h)A, indeno(1,2,3-cd)pyrène, anthracène, benzo(j)fluoranthène et fluoranthène) les plus toxiques et les plus représentatifs de la contamination alimentaire. L’ANSES (2016) a alors considéré qu’il était possible de calculer un excès de risque de cancer de 10-6 pour ces 11 HAP sur la base d’une dose virtuellement sûre (DVS) de 5 ng TEQ.kg pc-1.j-1 de BaP qui est celle proposée par le RIVM (Baars et al., 2001) en appliquant à chaque HAP un FET. Cette DVS a été établie sur la base d’apparition de tumeurs dans de nombreux organes (dont principalement le foie et le pré-estomac) observée au cours d’une étude réalisée chez le rat exposé par gavage pendant 2 ans au BaP.
L'OEHHA propose un ERUo de 4,1 (mg.kg-1.j-1)-1 pour une exposition chronique par voie orale (OEHHA, 2020).
A partir de ces données, un ERUo de 4,1 (mg.kg-1.j-1)-1 a été calculé en utilisant un modèle multi-étapes linéarisé.
Le RIVM propose un CRoral de 5.10-4 mg.kg-1.j-1 pour une exposition par voie orale (Baars et al., 2001).
Cette concentration correspond à un excès de risque cancérogène de 1.104 pour une exposition continue durant toute la vie. Elle est issue des données d'une étude expérimentale par gavage au BaP chez le rat (0, 3, 10 et 30 mg.kg-1.j-1 durant 2 ans, 5 jours par semaine) (Kroese et al., 2001). Une augmentation dose-dépendante de l'incidence de tumeurs a été observée dans de nombreux organes et tissus, notamment le foie et l'estomac mais également l'œsophage, la peau, la glande mammaire, le canal auditif, la cavité orale, l'intestin grêle et les reins.
A l’aide des deux valeurs, la VTR du BaP de 0,5 µg.kg-1.j-1 pour un excès de risque cancérigène de 1.10-4 et le FET de 1 attribué au DB(a,h)A, un CRoral de 5.10-4 mg.kg-1.j-1 (soit un excès de risque unitaire de 0,2 mg.kg-1.j-1)-1) a été calculé pour le DB(a,h)A.
Selon le RIVM, la fiabilité de cette valeur est élevée.
Comme précisé ci-dessus, l'Agence Française de Sécurité Sanitaire des Aliments a publié un avis le 29 juillet 2003 () dans lequel les méthodes et le choix des études critiques retenues par l’US EPA et par le RIVM pour l’établissement des ERUo ont été analysés pour le BaP. Après comparaison des deux justifications scientifiques, l'AFSSA a retenu la proposition du RIVM. Selon l’AFSSA (2003), la valeur proposée par le RIVM apparaît actuellement la plus adaptée pour une approche d’évaluation des risques liés aux HAP, car le calcul de cette valeur est basé sur une dose expérimentale issue d’une étude récente (2001) et sur un modèle simple d’extrapolation aux faibles doses, certes imparfait mais protecteur
En 2003, l’INERIS retenait la proposition de l’AFSSA (2003) et proposait donc pour le BaP l’utilisation de la valeur établie par le RIVM. Le RIVM détermine une dose virtuellement sûre (DVS) de 5 ng.kg-1.j-1, par un modèle d'extrapolation linéaire à l'origine, en retenant la dose critique de 10 mg.kg-1.j-1 de B(a)P administrée à l'animal induisant l'apparition significative de tumeurs, et après ajustement de la durée d’administration et d’observation. Cette DVS de 5 ng.kg-1 p.c.j-1 pour un excès de risque de cancer de 1 10-6, correspond à un ERUo de 0,2 (mg.kg-1.j-1)-1.
En 2018, suite à la réévaluation de la valeur de l’US EPA pour le BaP décrite dans la fiche de données toxicologique et environnementale du BaP, l’INERIS propose de modifier sa valeur. Cette valeur du DB(a,h)A est basée sur celle proposée par l’US EPA, 2017 et retenue par l’INERIS pour le BaP à savoir 1(mg.kg-1.j-1)-1. A partir de cette valeur une approche par l’application de FET a été réalisée.
Calcul de VTR par voie orale à partir du Facteur Equivalent Toxique (FET) du DB(a,h)A :
Cet ERU0 correspond à une dose de 10-5 mg.kg-1.j-1 pour un excès de risque de 10-5 et à une dose de 10-6 mg.kg-1.j-1 pour un excès de risque de 10-6.
Synthèse
Effets sans seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique au DB(a,h)A par inhalation l’ERUi chronique de 6.10-4 (µg.m-3)-1 de l’Ineris.
Deux valeurs sont disponibles pour l’exposition chronique par inhalation au DB(a,h)A, celles de l’OEHHA (2020) et de l’INERIS (2018).
La valeur construite par l’OEHHA est spécifique du DB(a,h)A. Elle est construite sur une étude par voie orale (Snell et Stewart, 1962 ; Snell et Stewart, 1963) de qualité limitée avec une forte mortalité chez les animaux traités et les témoins, une durée d’exposition courte (< 1 an), l’utilisation d’une seule dose et l’absence d’analyse statistique). Une extrapolation voie à voie a ensuite été réalisée sur la base de paramètres par défaut
La valeur de l’INERIS est construite à partir d’une approche basée sur l’utilisation du FET du DB(a,h)A de valeur 1 appliquée à l’ERUi du BaP. Du fait de la révision en 2017 de la valeur développée par l’US EPA, la valeur du DB(a,h)A a été recalculée
Etant donné la qualité de l’étude sur laquelle repose la valeur de l’OEHHA, l’INERIS choisit de s’appuyer sur la valeur plus récente développée par l’US EPA pour le BaP et d’appliquer le TEF de 1
Indice de confiance : Moyen du fait de l’utilisation d’un TEF
Effets sans seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique au DB(a,h)A par voie orale l’ERU0 chronique de 1 (mg.kg-1.j-1)-1de l’Ineris.
Quatre valeurs sont disponibles pour l’exposition chronique par voie orale au DB(a,h)A, celle du RIVM (2001), de l’OEHHA (2020), de l’Anses (2016) et de l’INERIS (2018)
La valeur construite par l’OEHHA est spécifique du DB(a,h)A. Elle est construite sur une étude par voie orale (Snell et Stewart, 1962 ; Snell et Stewart, 1963) de qualité limitée par une forte mortalité chez les animaux traités et les témoins, une durée d’exposition courte (< 1 an), l’utilisation d’une seule dose et l’absence d’analyse statistique).
Les valeurs du RIVM, de l’ANSES et de l’INERIS sont construites à partir d’une même approche basée sur l’utilisation du FET du DB(a,h)A de valeur 1 appliquée à l’ERUo du BaP. Du fait de la révision en 2017 de la valeur développée pour le BaP par l’US EPA, l’INERIS propose une mise à jour de la valeur du DB(a,h)A. La valeur de l’ANSES étant plus ancienne, cette mise à jour n’a pas été évaluée
Etant donné la qualité de l’étude sur laquelle repose la valeur de l’OEHHA, l’INERIS choisit de s’appuyer sur la valeur plus récente développée par l’US EPA pour le BaP et d’appliquer le TEF de 1.
Indice de confiance : Moyen du fait de l’utilisation d’un TEF
Autres valeurs des organismes reconnus
Description
Ecotoxicologie
Dernière vérification le 18/04/2024
Introduction
L'objectif de cette section est d’évaluer les effets sur la faune et la flore aquatique et terrestre. Les résultats nécessaires à cette évaluation sont présentés. Lorsqu'un nombre suffisant de résultats d'écotoxicité chronique est disponible, les résultats d'écotoxicité aigus ne sont pas fournis. Lorsque les informations de ce chapitre proviennent d’un rapport d’évaluation ayant fait l’objet d’une expertise collective au niveau européen ou international, les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait systématiquement l’objet d’un nouvel examen critique par les rédacteurs de la fiche. Les références bibliographiques ayant été évaluées sont indicées d’une valeur en fonction de leur validité selon les critères définis par Klimisch et al., 1997. On définit comme valides (scores 1 ou 2), les essais susceptibles d'être pris en compte pour le calcul d'une valeur seuil.
Dangers
Description
Valeurs de danger
Synthèse
Eau douce
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions aiguës:
Sans exposition à la lumière (comme pour d’autres HAP, la phytotoxicité du DB(a,h)A est supposée) il n’a pas été observé de toxicité jusqu'à la limite de solubilité de la substance. Des essais valides ont été réalisés sur invertébrés et poissons mais les concentrations testées maximales n’ont pas démontré d’effet. Il n’existe pas de CE50 sur algues, elle est supposée supérieure à la valeur de 0,14 µg.L-1 qui correspond à la CE10 obtenue sur le critère de la croissance de P.subcapitata lors d’un essai chronique de 72h.
Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent considérés comme des essais chroniques. Toutefois, par convention dans un contexte d’évaluation des risques, on utilise aussi l’EC50 issue de ces essais comme valeur aiguë, la NOEC étant utilisée pour une évaluation à long terme.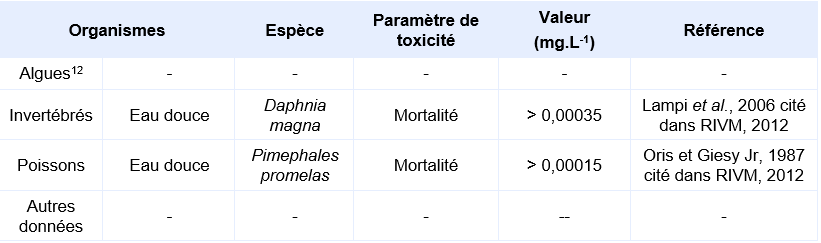
Synthèse des principaux résultats pour des organismes aquatiques lors d’expositions chroniques :
Le seul essai qui a mis en évidence un effet néfaste est celui réalisé sur l’algue P. subcapitata. Il en résulte une CE10 de 0,14 µg.L-1.
Les essais sur algues réalisés dans des conditions normalisées (par exemple selon la ligne directrice de l’OCDE 201 sur 72 heures) sont des essais sur plusieurs générations et sont par conséquent considérés comme des essais chroniques. 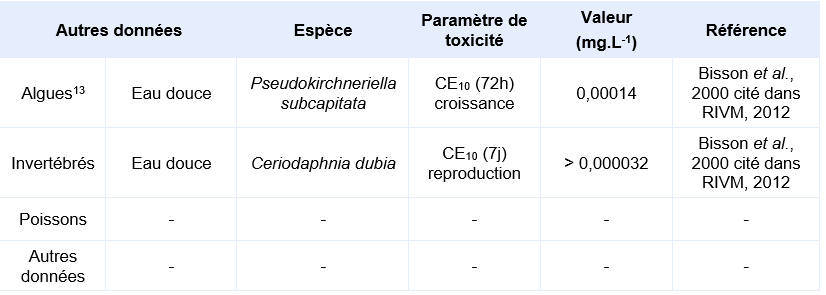
Sol
Ecotoxicité aiguë:
Aucune donnée disponible.
Ecotoxicité chronique:
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions chroniques
Il n’y a que seule étude réalisée sur organisme terrestre qui corresponde aux critères de validité. Lors de cet essai chronique 21j réalisé sur des collemboles Folsomia fimetaria, aucun effet significatif n’a été observé sur le critère de la reproduction à la concentration maximale testée. La CE10 est donc supérieure à la concentration mesurée de 2870 mg.kg-1ps dans le sol normalisé avec 10% de matière organique (Sverdrup et al., 2002 cités dans RIVM, 2012).
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Synthèse
Valeurs seuil pour la protection des organismes aquatiques (colonne d’eau)
PNEC disponible pour des organismes pélagiques d’eau douce: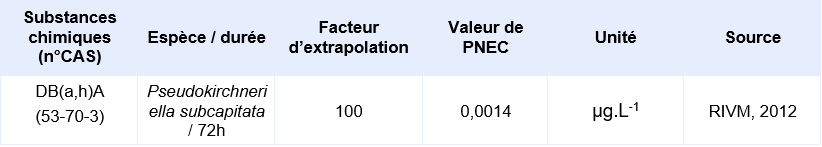
PNEC disponibles pour des organismes pélagiques d’eau marine: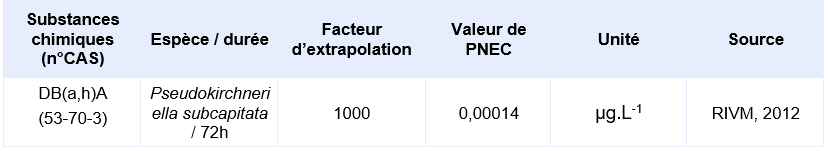
PNEC retenue par l’Ineris pour le compartiment aquatique:
La seule étude valide pour permettre le calcul d’une PNEC provient d’une étude d’écotoxicité chronique de 72h sur le critère de l’inhibition de la croissance de l’algue Pseudokirchneriella subcapitata. Elle a permis d’obtenir une CE10 de 0,14 µg.L-1. En supposant une CE50 sur algue supérieure à cette CE10, Il est considéré que le jeu de données court terme est complet. Le jeu de données long terme ne comprend pas de résultat valide sur poisson. Un facteur d’extrapolation de 100 est appliqué sur la valeur de la CE10 (0,14 µg.L-1) pour obtenir la PNECeau douce. Il n’existe pas de donnée validée sur organisme marin, la PNECeau marine est obtenue en appliquant un facteur de 1000 sur cette même valeur de CE10.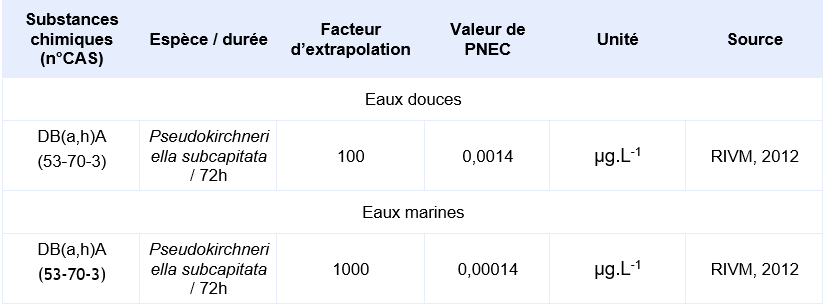
Valeurs seuil pour la protection des organismes benthiques (sédiments)
Il n’existe pas de données valides issues de tests réalisés sur organismes benthiques. Cependant, il est possible de déterminer une PNEC pour le compartiment sédimentaire en utilisant la méthode du coefficient de partage (CE, 1996). La PNEC sédiment est calculée en utilisant les valeurs du TGD relatives aux matières en suspension (MES).
PNEC disponibles pour des organismes benthiques d’eau douce: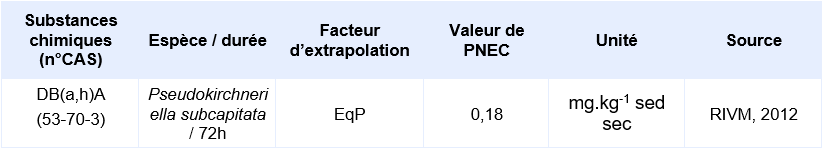
PNEC disponibles pour des organismes benthiques d’eau marine: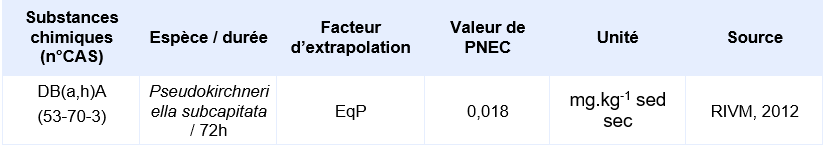
PNEC retenue par l’Ineris
Il n’existe pas de données valides obtenues sur organismes benthiques. Les PNEC pour les sédiments d’eau douce et marins sont calculées depuis les PNEC aquatiques d’eaux douces et marines en utilisant la méthode du coefficient de partage à l’équilibre.
Compte-tenu des informations disponibles, l’INERIS propose la valeur suivante :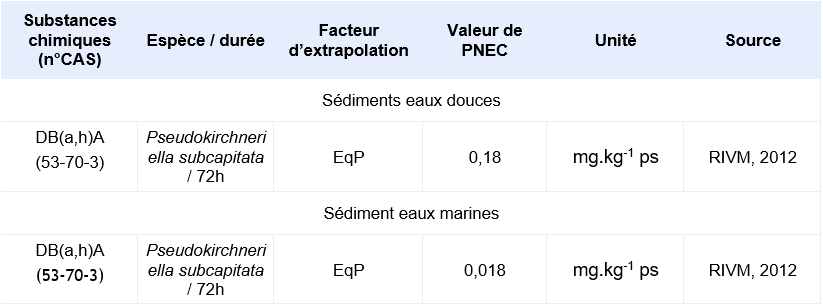
Valeurs seuil pour la protection des organismes terrestres
Les PNEC suivantes, élaborées par d’autres organismes internationaux, ont été identifiées :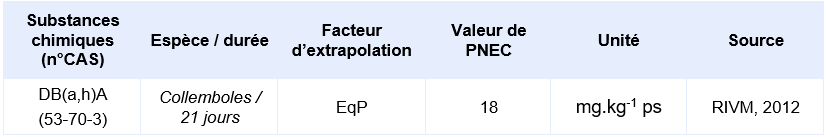
PNEC retenue par l’Ineris
Le jeu de données d’écotoxicité disponible n’est pas suffisant pour calculer une PNEC pour les organismes du sol. Elle a été calculée depuis la PNEC aquatique d’eau douce en utilisant la méthode du coefficient de partage à l’équilibre.
Organismes prédateurs (par empoisonnement secondaire)
La bioamplification des HAP n’est pas un phénomène attendu dans les écosystèmes aquatiques comme terrestres. Il n’a pas été calculé de valeur pour l’empoisonnement secondaire. Il n’a pas été trouvé de PNECorale dans la littérature scientifique.
Valeurs de référence pour la surveillance des écosystèmes
Le DB(a,h)A n’est pas une substance prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE, transposée par l’arrêté du 27 juillet 2015). Il n’est pas concerné par une valeur de référence pour la surveillance des écosystèmes.
Il n’existe pas de valeur réglementaire pour la protection des écosystèmes pour le DB(a,h)A.
L’INERIS propose néanmoins des valeurs seuils pour l’ensemble des compartiments (cf. ci-dessus)
Valeurs réglementaires
Synthèse
FDTE/VTR Importer Le DB(a,h)A n’est pas une substance dangereuse prioritaire de la Directive Cadre sur l’Eau (Directive n° 2013/39/UE, transposée par l’arrêté du 27 juillet 2015). Il n’est pas concerné par une valeur de référence pour la surveillance des écosystèmes. Il n’existe pas de valeur réglementaire pour la protection des écosystèmes pour le DB(a,h)A.
Archives
Dernière vérification le 18/04/2024
Introduction
Documents
Exporter la substance
Choisissez le format de l'export :










