Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
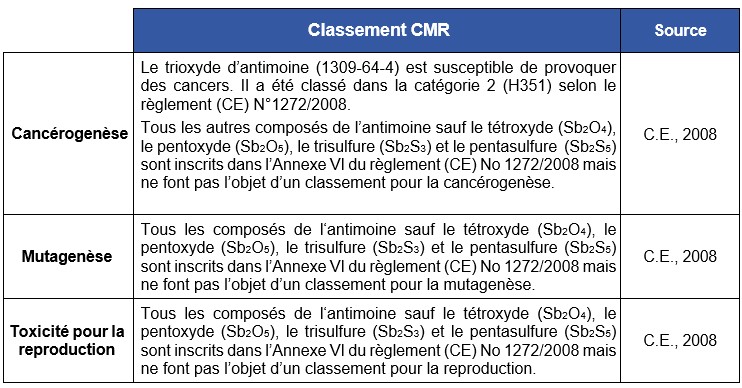
Antimoine (7440-36-0)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
7440-36-0
Nom scientifique (FR)
Antimoine
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
231-146-5
Code SANDRE
1376
Numéro CIPAC
-
Formule chimique brute
\(\ce{ Sb }\)
Code InChlKey
Code SMILES
[Sb]
Familles
Familles chimiques
Méthodes analytiques
Air
Prélèvement
Analyse
Eau
Analyse
Sol
Analyse
Autres milieux
Analyse
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
121.75 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Atmosphère
L’antimoine peut être associé à des dépôts de minerai non ferreux, et c’est sous cette forme qu’il est le plus souvent émis dans l’atmosphère (Adriano, 1986 ; Kabata-Pendias et Pendias, 1992). En effet, l’antimoine est un métal relativement volatil et sous forme vapeur suite , à un proces de combustion, il se condense sur la matière particulaire en suspension fine dont le diamètre est inférieure au micromètre (ATSDR, 1992). La demi-vie de l’antimoine dans l’atmosphère est estimée à 1,9 jours, et peut aller jusqu’à 3,2 jours pour le trioxyde d’antimoine (ATSDR, 1992). L’antimoine peut donc être transporté sur de longues distances depuis son point d’émission. Les plus fortes concentrations d’antimoine dans l’atmosphère ont été relevées aux alentours de fonderies de cuivre, de zinc ou de plomb (Adriano, 1986 ; Kabata-Pendias et Pendias, 1992 ; Edwards et al., 1995).
Milieu eau douce
L’antimoine est peu présent dans les eaux. Ses spéciations ainsi que les phénomènes chimiques et biochimiques qui se produisent dans les eaux sont peu connus (ATSDR, 1992). Il semble convenu que l’antimoine dans les eaux est principalement présent sous des formes associées à la matière particulaire.
Milieu sédiment eau douce
Adsorption :
L'antimoine dans les eaux est principalement présent sous des formes associées à la matière particulaire.
Le log kpsediment de 3,4 correspond à la moyenne des résultats obtenus dans différentes études portant sur l'adsorption du trioxyde d'antimoine au sédiment dans différents cours d'eau (E.C., 2008a)
Milieu terrestre
L’antimoine est présent dans la lithosphère sous forme de sulfures d’antimoine, d’antimonides métalliques ou d’oxydes d’antimoine (Edwards et al., 1995). Plusieurs auteurs sont d’accord pour reconnaître que le comportement géochimique de l’antimoine dans les sols reste peu connu, tout en le rapprochant de celui de l’arsenic (Adriano, 1986 ; ATSDR, 1992 ; Kabata-Pendias et Pendias, 1992 ; Edwards et al., 1995). Ces mêmes auteurs sont en revanche d’avis partagés sur la plus ou moins grande mobilité de l’antimoine dans les sols. Ainsi Adriano (1986) et Edwards et al. (1995) précisent que, quand l’antimoine est présent dans les sols sous forme soluble, il est le plus souvent sous forme d’antimonate. Kabata-Pendias et Pendias (1992) et Edwards et al. (1995) signalent que l’antimoine est souvent présent sous forme soluble complexée avec les acides humiques du sol. En revanche, Kabata-Pendias et Pendias (1992) considèrent que cette forme est très mobile dans l’environnement, alors que Edwards et al. (1995) estiment cette mobilité comme très modérée. De la même façon, Edwards et al. (1995) considèrent que l’antimoine s’accumule globalement en surface, alors que Kabata-Pendias et Pendias (1992) affirment que sa migration dans les horizons profonds est aisée.
L’ATSDR (1992) se fait également l’écho de cette discussion en présentant à la fois des auteurs penchant pour une grande mobilité de l’antimoine dans diverses configurations environnementales et des auteurs considérant que l’antimoine est fortement adsorbé dans les sols. L’antimoine forme des espèces anioniques et son adsorption est plus importante dans des conditions faiblement acides. Cette adsorption est corrélée avec les teneurs en fer, manganèse et aluminium des sols dans la mesure où l’antimoine coprécipite avec les oxyhydroxydes de ces éléments (ATSDR, 1992).
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Biodégradabilité :
Non applicable.
Dégradabilité abiotique
Hydrolyse :
Dans l'environnement, l'antimoine sera principalement sous les degrés d'oxydation Sb(III) et Sb(V). Ces deux formes peuvent facilement être hydrolysées en Sb(OH)3 et Sb(OH)6- respectivement. Le trioxyde d'antimoine se dissout dans l'eau formant un ion trivalent qui s'hydrolyse vers la forme neutre Sb(OH)3. En milieu oxique, ce dernier est oxydé pour donner l'ion pentavalent Sb(OH)6 -. En milieu oxygéné, la forme pentavalente Sb(OH)6 - est dominante, en milieu anoxique, la forme trivalente Sb(OH)3 est dominante. (E.C., 2008a)
Photolyse :
Pas d'information disponible.
Conclusion sur la persistance
L'antimoine, en tant qu'élément chimique, ne peut pas être dégradé. Cependant, il peut être transformé par des facteurs abiotiques ou biotiques.
Dans l'environnement, l'antimoine sera principalement sous les degrés d'oxydation Sb(III) et Sb(V). Ces deux formes peuvent facilement être hydrolysées en Sb(OH)3 et Sb(OH)6- respectivement.
D'après les potentiels redox, la forme Sb(V) sera majoritaire en milieu oxique tandis que la forme Sb(III) sera préférentiellement retrouvée en milieu anoxique.
Cependant, la forme Sb(III) peut aussi être retrouvée dans les eaux oxiques, et plus particulièrement dans la zone photique de la colonne d'eau. La présence de la forme Sb(III) dans cette zone a pu être interprétée comme le résultat d'une réduction photochimique ((Cutter et al., 2001)) ou de l'activité métabolique du phytoplancton (Benson, 1998).
L'antimoine peut aussi être méthylé suite à l'action de microorganismes (Gurleyuk et al., 1997). L'antimoine sous forme méthylé a été retrouvé dans les eaux de surface (représente en proportion jusqu'à 10 % de l'antimoine dissous), dans les biotes (Filella et al., 2002) et dans les émanations gazeuses des boues d'épuration (Hirner et al., 1994).
Bioaccumulation
Organismes aquatiques
Les données concernant la bioconcentration de l'antimoine chez les organismes aquatiques (eaux douces et marines) sont très variables selon les auteurs (US-EPA, 1978 ; (Mulder et al., 1986)). Ainsi, selon Bonotto et al., (1983) et Mann et Fyfe, (1988), l’accumulation de l'antimoine chez les algues était très faible, voire insignifiante. En revanche, Chapman et al., (1968) met en évidence des BCFs de 16 000 et 40 chez des invertébrés et poissons marins, respectivement. Ainsi, la bioconcentration de l’antimoine pourrait être significative chez les invertébrés. Néanmoins, compte tenu des faibles concentrations retrouvées chez les prédateurs, la concentration de l’antimoine le long de la chaîne trophique semble peu probable.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Organismes terrestres
Dans l’étude de Cawse et al. (1976), le sol du site d’une usine d’extraction d’étain a été prélevé sur les premiers 45 cm, puis séché à l’air, débarrassé des matériaux les plus grossiers (de diamètre supérieur à 2 cm), et homogénéisé avant que des lots de 500 g ne soient individualisés. Chaque lot est utilisé pour remplir un pot en plastique de 18 cm de diamètre. Les végétaux étudiés sont le pois (dwarf french « phoenix stringless »), la carotte (« early scarlet horn »), la laitue (cabbage « fortune ») et le radis (« scarlet globe »). Pour chaque végétal, trois graines sont plantées, chacune dans un pot différent. De l’azote est apporté à la période de l’ensemencement sous forme de solution de NH4NO3, de sorte que chaque pot reçoive environ 50 mg d’azote. Les tissus aériens ont été coupés au couteau, puis rincés trois fois à l’eau distillée. Les racines des carottes et des radis ont été grattées au couteau pour éliminer tout élément visible de sol, puis ont été rincées trois fois à l’eau distillée. Tous les échantillons de plantes sont ensuite séchés au four à 60°C pendant une nuit. Les parties comestibles des plantes ont fait l’objet d’analyses de concentration en antimoine total, exprimée en poids sec. Le tableau suivant donne les valeurs de BCF calculées à partir des résultats de cette étude. L’étude ne précise pas la nature du sol utilisé.
L’étude de Hammel et al. (2000) porte sur des terrains agricoles ou résidentiels localisés aux endroits d’anciens dépôts résultant d’anciennes activités minières. Sur différents types de terrains (champs, prairies et jardins), des analyses de teneurs en antimoine ont été réalisées sur les végétaux et sur les sols. Les végétaux concernés sont la carotte (daucus carota), la betterave rouge (beta vulgaris), l’oignon (allium cepa), la pomme de terre (solanum tuberosum), l’endive (cichorium endiva), la mâche (valerianella locusta), le chou (brassica oleracea), les épinards (spinacia oleracea), le persil (petroselinum crispum) et la tomate (lycopersicon esculentum). Tous les sols sont de type « sables limoneux » ne présentant pas de capacité d’échange cationique significative. Pour les champs et les prairies, le pH varie entre 4,0 et 7,3, et le carbone organique entre 0,9 et 5,0 %. Pour les jardins, le pH varie entre 6,2 et 7,2, et le carbone organique entre 2,7 et 5,5 %. Tous les échantillons de sol ont été prélevés à proximité des lieux de prélèvement des végétaux : pour chaque prélèvement d’un végétal, 2 prélèvements de sols ont été réalisés. Les plantes ont été prélevées au stade de la maturité. Elles ont été lavées, préparées « selon les pratiques culinaires » (par exemple, les feuilles fânées ou épluchées ont été enlevées), puis séchées et broyées. Les sols ont été prélevés sur les 30 premiers centimètres des champs agricoles et des prairies, et sur les 20 premiers centimètres des jardins. Les échantillons de sol ont été séchés à température ambiante, tamisés à 2 mm, broyés et conservés dans des flacons en PET à température ambiante. Les analyses de teneurs en antimoine ont été réalisées avec des réactifs de qualité « Suprapure ». Les parties comestibles des végétaux (prises d’essai de 200 à 500 mg) ont été digérées dans un four à micro-ondes en présence de 1 mL de H2O2 et de 5 mL de HNO3 (65 %), enrichies avec 0,5 mL de H2SO4 (98 %), chauffées à 230°C pendant 30 min, concentrées par évaporation jusqu’à 0,5 mL, puis complétées à 15 mL avec du HCl molaire. Les sols (prises d’essai de 100 mg) ont été digérés dans un four à micro-ondes en présence de 0,5 mL de H2O2, de 5 mL de HNO3 (65 %) et de 2 mL de HCl (30 %). Les analyses ont été réalisées par spectrométrie d’absorption atomique, en doublon pour chaque échantillon. Le tableau suivant donne les valeurs de BCF calculées à partir des résultats de cette étude pour certaines plantes ; l’étude propose également des résultats pour la betterave sucrière, le maïs, le blé, l’orge, le seigle et l’avoine.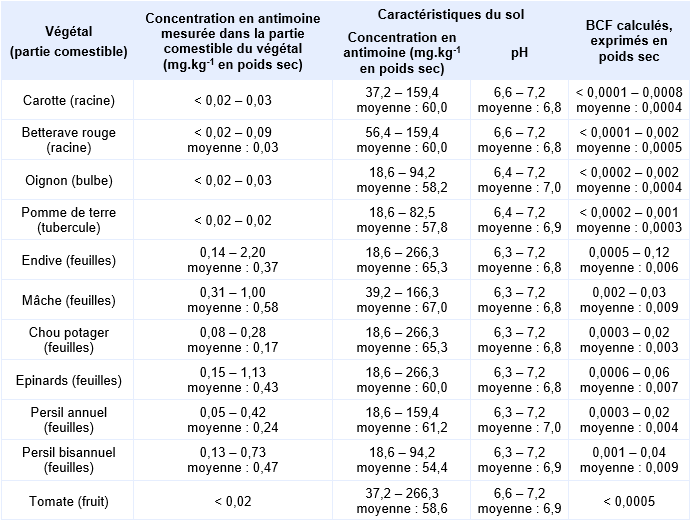
Conclusion sur la bioaccumulation
Bioaccumulation :
Les données concernant la bioconcentration de l'antimoine chez les organismes aquatiques (eaux douces et marines) sont très variables selon les auteurs et les espèces. Des BCFs de 16 000 pour l'huître et de 40 chez des poissons marins ont été mesurés. En revanche, l'accumulation de l'antimoine chez les algues est très faible, voire insignifiante. (Bonotto et al., 1983 Chapman et al., 1968)
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Introduction
FDTE/VTR Importer L'ensemble des informations et des données toxicologiques provient de diverses monographies publiées par des organismes reconnus pour la qualité scientifique de leurs documents (IARC, 1989 ; ATSDR, , 2019, US EPA IRIS, 1995, 2008 ; OEHHA, 2016 ; Santé Canada, 2018, 2020). Les références bibliographiques aux auteurs sont citées pour permettre un accès direct à l’information scientifique mais n’ont pas fait l’objet d’un nouvel examen critique par les rédacteurs de la fiche.
Toxicocinétique
Chez l'homme
Absorption
FDTE/VTR Importer Inhalation:
Il n’existe pas de données quantitatives chez l’homme concernant l’absorption de l’antimoine et de ses composés par inhalation (ATSDR, 1992).
Néanmoins, un taux d’absorption de 6,82 % a été déterminé à partir d’un modèle MPPD (mutiple-path particle deposition) de prédiction basé sur des données humaines, en considérant une déposition dans la région alvéolaire (6 %) et les voies respiratoires supérieures (0,82 %), ainsi que le transport par l’intermédiaire du tapis mucociliaire (81,6 %) vers le tractus gastro-intestinal, où 1 % est supposé être absorbé (UE, 2008 ) ; ATSDR, 2019).
Voie orale:
L’absorption est dépendante de nombreux facteurs, comme la forme chimique, la taille des particules, la solubilité dans l’eau, l’âge et le régime alimentaire (ATSDR, 1992). L’ International Commission on Radiological Protection (ICRP, 1981) recommande de prendre des valeurs d’absorption gastro-intestinale de 10 % pour le tartrate d’antimoine et de 1 % pour toutes les autres formes d’antimoine ( ATSDR, 2017). Chez l’homme, d’après de très rares données observées lors d’intoxications, l’absorption du TAP, composé très soluble dans l’eau, serait de l’ordre de 5 % (ANSES, 2004).
Cependant, des données plus récentes ne permettent pas de confirmer ces estimations, dans la mesure où l’absorption a été suffisante, dans plusieurs cas d’expositions intentionnelles ou accidentelles, pour entraîner des effets toxiques et même parfois une mortalité (Belzile et al., 2011 ; NTP, 2018).
Voie cutanée:
Il n’existe pas de données quantitatives chez l’homme concernant l’absorption de l’antimoine et de ses composés par voie cutanée (ATSDR, 2019). Étant donné la faible solubilité de la plupart des substances contenant de l’antimoine, l’EPA de la Californie ne considère pas comme importante l’exposition générale par voie cutanée (OEHHA 2016).
Distribution
FDTE/VTR Importer De l’antimoine a été détecté dans les poumons, le sang et les urines de travailleurs exposés professionnellement par inhalation au trioxyde d’antimoine, y compris après l’arrêt de l’exposition (NTP, 2017). L’accumulation d’antimoine au niveau des poumons a été rapporté chez 7 salariés accidentellement exposés à de l’antimoine radioactif (125Sb, sous forme d’oxyde et trioxyde d’antimoine) (Garg et al., 2003).
Aucune donnée concernant la distribution de l’antimoine chez l’homme après exposition par voie orale ou cutanée n’est recensée (ATSDR, 1992).
De faibles concentrations d’antimoine sont retrouvées chez des personnes non exposées. Des valeurs de 0,096 µg.g-1 ont été mesurées dans la peau (Sumino et al., 1975), et de 0,096 à 0,12 µg.g-1 dans les cheveux (Muramatsu et Parr, 1988 ; Takagi et al., 1986).
Métabolisme
FDTE/VTR Importer La principale voie métabolique de l’antimoine est l’oxydation de la forme trivalente en antimoine pentavalent (Ogra 2009; OEHHA 2016). À l’inverse, l’antimoine pentavalent peut aussi être réduit en antimoine trivalent en présence de glutathion (Lopez et al. 2015, Hansen et al. 2011, Prezard et al. 2001).
Élimination
FDTE/VTR Importer L’antimoine absorbé est éliminé par l’urine et les fèces, dans des proportions variables en fonction de la forme chimique (ATSDR, 1992). Des études menées chez l’homme par injection intramusculaire ou intraveineuse d’antimoine pentavalent et trivalent ont montré que l’antimoine pentavalent est éliminé majoritairement dans les urines, alors que le trivalent l’est dans les fèces (Edel et al., 1983 ; Goodwin et Page, 1943; Tylenda et al., 2015). Des concentrations urinaires importantes d’antimoine (forme non spécifiée) ont été rapportées chez les salariés employés dans les usines de batteries au plomb (Kentner et al., 1995) ou encore chez les travailleurs portuaires (oxydation de sulfure et sulfate d’antimoine des plaquettes de freins en trioxyde d’antimoine) (Quiroz et al., 2009).
Chez l'animal
Absorption
FDTE/VTR Importer Inhalation:
L’absorption de l’antimoine après inhalation est fonction de la taille des particules.
D’après les études par inhalation du NTP réalisées chez le rat et la souris aussi bien sur une courte (15 jours) ou longue période (2 ans) d’exposition au trioxyde d’antimoine, le taux d’absorption, indirectement évalué à partir des concentrations sanguines, varie au cours du temps, et selon l’espèce (NTP, 2017). Les concentrations sanguines d’antimoine sont 4 à 5 fois supérieures au 551e jour par comparaison à celles observées à 61 jours d’exposition chez le rat. A la fin des 2 années d’exposition, la concentration sanguine représente 7 % de la concentration pulmonaire chez le rat et seulement 0,002 % chez la souris.
Par instillation intra-trachéale, un taux d’absorption supérieur à 12,6 % a été déduit à partir de l’exposition de particules de 19,5 ou 7 μm de trioxyde d’antimoine chez le hamster (Leffler et al., 1984).
Voie orale:
Par voie orale, le taux d’absorption du tartrate et du trichlorure d’antimoine a été estimé de 2 à 7 % (Felicetti et al., 1974b ; Gerber et al., 1982).
Après une exposition par voie orale à 100 ou 1 000 mg.kg-1 de trioxyde d’antimoine, la biodisponiblité estimée serait de 0,3 % pour de faibles concentrations et seulement de 0,05 % à forte concentration (TNO, 2005). L’absorption pourrait atteindre 15 % au cours de l’exposition par voie orale d’une dose unique d’antimoine radiomarqué sous la forme de TAP, très soluble (Tylenda et al., 2015).
Voie cutanée:
L’absorption de l’antimoine à travers la peau a été évoquée (Myers et al., 1978).
Distribution
FDTE/VTR Importer L’antimoine absorbé par inhalation est véhiculé par le sang. Il se concentre au niveau des poumons et du foie, mais aussi dans la rate, la thyroïde, les parathyroïdes, les hématies, la peau, le squelette, les reins et le cerveau (INRS, 2000). La répartition entre les érythrocytes et le plasma est fonction de la valence. Une exposition à de l’antimoine trivalent conduit à de plus fortes concentrations d’antimoine dans les érythrocytes que dans le plasma, alors que l’exposition à de l’antimoine pentavalent donne des résultats inverses (Felicetti et al., 1974b; Barrera et al. 2016, Lopez et al. 2015, Quiroz et al. 2013).
Après une exposition par voie orale, les sites majeurs d’accumulation de l’antimoine en dehors du tractus gastro-intestinal sont le foie, les reins, les os, les poumons, la rate et la thyroïde (ATSDR, 1992; TNO, 2005). Les données sont insuffisantes pour déterminer si la valence de l’antimoine influe sur la distribution après administration par voie orale (ATSDR, 1992).
Métabolisme
FDTE/VTR Importer Les données relatives à la conversion entre les formes trivalentes et pentavalentes d’antimoine chez l’animal sont limitées aux agents médicamenteux et concernent des voies d’entrée non usuelles (intramusculaire, intraveineuse, etc.).
Élimination
FDTE/VTR Importer L’antimoine est éliminé à la fois par les urines et les fèces, mais le profil peut varier selon les espèces et les voies d’exposition. L’élimination de l’antimoine III serait plus lente que l’antimoine V et généralement plus abondant dans les fèces. L’excrétion fécale est favorisée par le cycle entéro-hépatique et l’élimination dans la bile de l’antimoine III lié au glutathion (NTP, 2018).
Synthèse
FDTE/VTR Importer Chez l’homme, l’absorption par voie orale est faible, comprise entre 1 et 10 % selon la solubilité des composés. Après absorption pulmonaire, le trioxyde d’antimoine se concentre au niveau des poumons essentiellement. L’antimoine peut changer de degré d’oxydation. Généralement, l’antimoine pentavalent est éliminé dans les urines alors que le trivalent est plutôt éliminé dans les fèces.
Chez l’animal, l’antimoine est absorbé par voie orale, par inhalation et par voie cutanée. Il est distribué via les hématies ou le plasma en fonction de la valence. L’antimoine est éliminé par les urines et les fèces, en proportions variables selon la valence de l’antimoine, les voies d’entrée et les espèces considérées.
Equivalents biosurveillance
Description
FDTE/VTR Importer VBI issues de la population générale adulte (Biotox, 2022):
Antimoine sanguin < 0,18 µg.L-1
Antimoine urinaire < 0,25 µg.g-1 de créatinine ( < 0,32 µg.L-1) (95ème percentile)
Toxicité aiguë
Chez l'homme
Inhalation
FDTE/VTR Importer Des effets gastro-intestinaux (douleurs abdominales, vomissements, anorexie) et pulmonaires (toux, douleur thoracique, dyspnée asthmatiforme et œdème) ont été signalés chez des travailleurs exposés à des poussières d’antimoine en raison vraisemblablement du caractère très irritants de certains sels, comme le trichlorure d’antimoine dans cette étude (73 mg Sb.m-3) (Taylor et al., 1966). Des troubles digestifs résultant certainement du transport des poussières des poumons au niveau digestif par une action mucocilliaire ont également été rapportés (ATSDR, 1992).
Voie orale
FDTE/VTR Importer L’ingestion accidentelle par voie orale de trioxyde d’antimoine a entraîné des sensations de brûlures dans l’estomac en raison du caractère irritant, des coliques, des nausées, des vomissements, et parfois des collapsus (IARC, 1989). Peu de temps après avoir ingéré une boisson contaminée par une dose équivalente à 0,53 mg Sb.kg-1 sous forme de TAP, des travailleurs ont été pris de vomissements (Dunn, 1928).
Voie cutanée
FDTE/VTR Importer Une application cutanée de trioxyde d’antimoine pendant 24 heures n’a pas entraîné d’effet dermatologique ou systémique (IBTL, 1972).
Synthèse
FDTE/VTR Importer Chez l’homme, l’exposition professionnelle au trichlorure d’antimoine provoque des effets respiratoires (toux, douleur thoracique, dyspnée asthmatiforme et œdème) et douleurs gastriques. L’ingestion accidentelle de trioxyde d’antimoine provoque des brûlures d’estomac, des coliques, des nausées, des vomissements et parfois un collapsus.
Chez l'animal
Inhalation
FDTE/VTR Importer Des rats et des cobayes exposés par inhalation pendant 30 minutes à 1 395 mg Sb.m-3, sous forme d’hydrure d’antimoine, ont présenté des œdèmes pulmonaires ou sont morts (Price et al., 1979). À la dose de 799 mg Sb.m-3, une dilatation tubulaire rénale est observée. Chez la souris, la concentration létale d’hydrure d’antimoine est de 100 ppm (519 mg.m-3) pour une exposition de 20 minutes (INRS, 1992). Des hamsters exposés à 65 ppm (337 mg.m-3) d’hydrure d’antimoine pendant une heure ont présenté rapidement une hémolyse (INRS, 1992).
Des lapins exposés pendant 5 jours à 19,94 mg Sb.m-3, sous forme de trisulfure d’antimoine, ont présenté une inflammation des poumons, une dégénérescence graisseuse et parenchymateuse du foie, et des altérations de l’électrocardiogramme (Brieger et al., 1954).
Plus récemment, le NTP a exposé des rats (Wistar Han) et des souris (B6C3F1/N) par inhalation (corps entier) à 0 – 3,75 – 7,7 – 15 – 30 – 60 mg.m-3 de trioxyde d’antimoine (pureté 99,9 %), 6 h/j, 5 j.sem-1 sur une période de 16 jours (soit 12 jours d’exposition) (NTP, 2017). Le diamètre moyen des particules était de 1,3 à 1,5 µm. Le traitement n’a pas eu d’incidence sur la survie des animaux, ni sur leur croissance pondérale. Une augmentation du poids absolu des poumons a été décrite chez les mâles à partir de 30 mg.m-3 chez les rats et 7,5 mg.m-3 chez les souris, de même que chez les femelles à partir de 30 mg.m-3 chez le rat et 15 mg.m-3 chez les souris. Le poids relatif des poumons a significativement augmenté chez les mâles à partir de 30 mg.m-3 chez les rats et 60 mg.m-3 chez les souris, de même que chez les femelles à partir de 30 mg.m-3 chez les rats et à toutes doses chez les souris. L’incidence des principaux effets observés sur le tractus respiratoire des mâles et des femelles aussi bien chez le rat que chez la souris sont rapportés sur le tableauci-dessous :
Outre une augmentation des métaplasies squameuses de l’épiglotte, significative uniquement chez les souris à partir de 30 mg.m-3 (mâles et femelles), les auteurs ont également pu observer chez le rat une inflammation pulmonaire statistiquement significative à partir de 30 et 60 mg.m-3 respectivement chez les mâles et les femelles. Cette inflammation est caractérisée par une augmentation du nombre des macrophages alvéolaires et une infiltration péri-vasculaire de lymphocytes, monocytes et neutrophiles. Le NTP n’a pas déterminé de concentrations sans effet à partir de ces études.
Incidence des effets observés sur le tractus respiratoire des mâles et des femelles chez le rat et la souris (NTP,2017)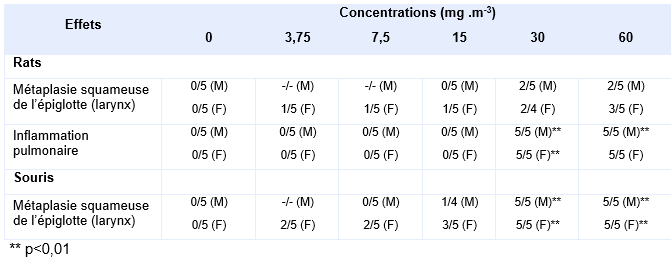
Voie orale
FDTE/VTR Importer Par voie orale, la DL50 du trioxyde d’antimoine est supérieure à 20 g.kg-1 chez le rat (Merck, 1996). L’administration d’une dose unique de 300 mg Sb.kg-1 sous forme de TAP a entraîné la mort de rats (Bradley et Frederick, 1941). Au contraire, l’administration unique de doses plus élevées d’antimoine inorganique (métallique, oxyde, trioxyde d’antimoine) allant jusqu’à 16 714 mg.kg-1 n’a pas entraîné la mort des rats (ATSDR, 1992). Des vomissements et des diarrhées ont été observés après une exposition aiguë d’animaux à du trioxyde d’antimoine ou du TAP (Houpt et al., 1984 ; Myers et al., 1978).
Le NTP a également réalisée des études de toxicité aiguë chez des rats et des souris exposés quotidiennement pendant 2 semaines via l’eau de boisson à des doses de 0 – 0,15 - 0,30 – 0,65 – 1,25 – 2,5 mg.mL-1 de TAP (pureté 99-100 %) chez le rat, soit une consommation de 0 – 16 - 28 - 59 – 94 – 168 mg.kg-1.j-1 et de 0 - 0,30 – 0,65 – 1,25 – 2,5 – 5,0 mg.mL-1 chez la souris (pureté 99-100 %), soit une consommation de 0 - 59 – 98 – 174 – 273 – 407 mg.kg-1.j-1 de TAP (0 - 21 – 36 – 63 – 99 – 150 mg Sb.kg-1.j-1 de TAP) (NTP, 1992 ; Dieter et al., 1991).
Chez les rats, une diminution de la consommation d’eau a été observée chez les mâles aux doses de 94 et 168 mg.kg-1 TAP, sans signe clinique associé. Des augmentations du poids relatif du foie (mâle et femelle), et des reins (femelles) ont été observées dans les lots exposés à la plus forte dose. Aucune altération histopathologique n’a été observée sauf chez le rat mâle qui a présenté des gouttelettes de protéines habituellement rencontrées dans le cytoplasme de l’épithélium des cellules tubulaires rénales en quantité plus importante que chez les témoins. Cette étude n’a permis d’établir aucune relation dose-effet claire.
Chez les souris, une des femelles exposées à la dose la plus élevée n’a pas survécu. Une diminution de la consommation d’eau a été décrite à toutes doses. Après une semaine de traitement, une diminution statistiquement significative réversible du poids corporel a été observée chez les mâles aux 2 doses les plus élevées et chez les femelles à la dose la plus élevée. Un amaigrissement, des postures anormales, une diminution de l’activité et une diminution de la quantité de fèces est observée ainsi qu’une augmentation relative du poids du foie. Les lésions hépatiques (vacuolisation minimale à modérée des hépatocytes au niveau centrolobulaire mais aussi des zones portales chez certaines souris mâles avec généralement des altérations plus marquées que chez les femelles) et du pré-estomac (nodules en lien avec une zone d’ulcération avec une nécrose et une inflammation des muqueuses) sont rapportées chez les animaux des 2 sexes exposés à la plus forte dose. Un NOAEL de 99 mg Sb.kg-1.j-1 a été retenu dans cette étude sur la base des lésions observées au niveau du foie et du pré-estomac chez les animaux exposés à la plus forte dose.
Voie cutanée
FDTE/VTR Importer L’application cutanée à des lapins de 1 584 mg Sb.kg-1 sous forme d’oxyde d’antimoine (solvant de dilution non précisé) (IBTL, 1972) ou de 6 686 mg Sb. kg-1 sous forme trioxyde d’antimoine (solvant de dilution non précisé) (Myers et al., 1978) a entraîné leur mort en une journée.
Une ancienne étude, peu documentée, rapporte le décès de cobayes 1 ou 2 jours après avoir été exposés à une application cutanée de trichlorure d’antimoine estimée à environ 315 mg/kg (DL50 <0,1 mL.kg-1) (ECHA, 2019) Sa classification relative aux effets corrosifs repose sur la formation d’HCl.
Synthèse
FDTE/VTR Importer Chez l’animal, l’inhalation aiguë d’hydrure d’antimoine ou de trisulfure d’antimoine provoque des effets pulmonaires (œdèmes), rénaux (dilatations tubulaires), sanguins (hémolyse), hépatiques (dégénérescence graisseuse et parenchymateuse), cardiaques (altération de l’électrocardiogramme). A de plus faibles concentrations, les effets se concentrent au niveau du tractus respiratoire (métaplasie squameuse de l’épiglotte et inflammation pulmonaire) pour des expositions par inhalation et au niveau du foie (vacuolisation hépatocytaire), du pré-estomac (ulcérations, nécroses) et des reins par voie orale.
Toxicité à dose répétées
Effets généraux
Chez l'homme
Inhalation
FDTE/VTR Importer L’exposition professionnelle par inhalation à du trioxyde d’antimoine et/ou des poussières de pentoxyde d’antimoine (8,87 mg Sb.m-3 ou plus) a entraîné des effets respiratoires incluant une stibiose (pneumoconiose stibiée), de la bronchite chronique, de l’emphysème chronique, des adhésions pleurales et des effets pulmonaires obstructifs (Cooper et al., 1968 ; Potkonjak et Pavlovich, 1983).
Des travailleurs exposés à 0,58 à 5,5 mg Sb.m-3 sous forme de trisulfure d’antimoine pendant 8 mois à 2 ans ont présenté une augmentation de la pression sanguine (10 %) et des altérations de l’électrocardiogramme chez 5 % des sujets (anomalies de l’onde T) (Brieger et al., 1954). Cependant, ces travailleurs étaient également exposés à une résine à base de phénol et de formaldéhyde.
Des travailleurs exposés moins de 5 mois à des fumées d’oxyde d’antimoine à des concentrations de 4,69 à 11,82 mg.m-3 ont présenté des rhinites, dermatites, laryngites, bronchites, pneumonites et conjonctivites (Renes, 1953). Cependant, ces travailleurs étaient également exposés à de faibles concentrations d’arsenic (0,39 à 1,10 mg.m-3). Il est possible que l’antimoine majore les effets toxiques de l’arsenic (ANSES, 2004).
Les effets de l’exposition professionnelle sur le système immunitaire ont été rapportés dans 2 études cas-témoins réalisées l’une en Corée du Sud dans une usine de production de trioxyde d’antimoine (Kim et al., 1999 ) et l’autre à Taiwan, regroupant les salariés de production du trioxyde d’antimoine, de production du verre et des matières plastiques (Wu et al.,2017 ). Dans la première étude, l’exposition de 12 salariés à des concentrations dans l’air de 766 µg.m-3 de trioxyde d’antimoine pendant une durée moyenne de 30 mois (concentration urinaire de 410 µg Sb.g-1 de créatinine) a été associée à une diminution des concentrations d’IgG1 et IgE circulants par comparaison à 2 lots témoins, l’un de 22 salariés non exposés et un second de 33 volontaires non-salariés avec des concentrations urinaires respectives de 112,5 et 27,8 µg Sb. g-1 de créatinine (Kim et al., 1999). Aucune association n’a été retrouvée pour les autres sous-populations d’immunoglobulines, de même que pour les concentrations d’IL-2 ou d’interféron-γ entre les sujets exposés et témoins. Dans la seconde étude (Wu et al., 2017), une baisse significative (p<001) des concentrations d’IgG, d’IgA et d’IgE de 91 salariés exposés à l’antimoine (14 employés à la production de trioxyde d’antimoine (2,51 mg Sb.m-3), 55 à la production de verre (0,14 Sb mg.m-3) et 22 la production de matière plastique (0,21 mg Sb.m-3)) par comparaison à un lot témoin (n=42) représenté par le personnel administratif. Les auteurs ont également pu établir des corrélations négatives entre les concentrations d’IgG, IgA et IgE et les concentrations d’antimoine dans l’atmosphère de travail et les cheveux des salariés (p<0,05), ainsi que des corrélations négatives entre les IgA (p<0,001) et les IGE (p<0,05) avec les concentrations urinaires et sanguines d’antimoine.
Voie cutanée
FDTE/VTR Importer Le contact cutané avec des particules aéroportées de trioxyde d’antimoine a été associé à l’apparition d’une dermatite chez des ouvriers (Stevenson, 1965). Celle-ci est caractérisée par une nécrose cellulaire épidermique avec des réactions cellulaires inflammatoires aiguës, et résulte de l’action du trioxyde d’antimoine sur le derme après sa dissolution dans la sueur et sa pénétration dans les glandes sudoripares.
Synthèse
FDTE/VTR Importer Les expositions professionnelles sont associées à des pathologies respiratoires (stibiose, rhinites, laryngites bronchite chronique, emphysème, adhérences pleurales, syndrome obstructif) de ainsi qu’à des effets sur la tension, le rythme cardiaque et le système immunitaire. L’exposition chronique par voie cutanée peut provoquer une dermatite.
Chez l'animal
Inhalation
FDTE/VTR Importer Des rats et des lapins exposés 7 h.j-1, 5 j.sem-1, pendant au moins 6 semaines à des poussières contenant du trisulfure d’antimoine à des concentrations de 3,07 à 5,6 mg.m-3, ont présenté une dégénérescence parenchymateuse du cœur et des modifications de l’électrocardiogramme (Brieger et al., 1954).
Des rats exposés par inhalation à du trioxyde d’antimoine pendant 13 semaines ou plus ont présenté une augmentation du nombre de macrophages alvéolaires et/ou intra-alvéolaires (Bio/dynamics, 1985, 1990). Une inflammation interstitielle chronique a également été observée chez les rats exposés à 0,07 mg.m-3 pendant un an.
Une fibrose interstitielle et une pneumonie lipoïdique ont été observées chez des rats exposés à du trioxyde d’antimoine ou du trisulfure d’antimoine pendant un an (Bio/dynamics, 1990 ; Gross et al., 1952 ; Groth et al., 1986 ; Wang et al., 1979 ; Watt, 1983; Boreiko et al., 2020). Ces effets ont été observés pour des expositions comprises entre 1,6 et 83,6 mg Sb.m-3.
Dans une première étude, des lots de 50 rats mâles et femelles, ont été exposés au trioxyde d’antimoine, 6 h.j-1, 5 j.sem-1 pendant 13 semaines, à des concentrations de 0 - 0,25 – 1,08 – 4,92 – 23,46 mg.m-3 (Bio/dynamics, 1990 ; Newton et al., 1994). A partir de 4,92 mg.m-3, une augmentation du poids absolu et relatif des poumons, accompagnée d’une infiltration de macrophages et de nodules péri-bronchiolaires ont été rapportés aussi bien chez les mâles que chez les femelles. Afin de limiter les effets d’une surcharge, les auteurs ont lancé une seconde étude à de plus faibles concentrations d’exposition ou des lots de 65 rats rats Fischer 344/sexe/groupe ont été exposés 6 h/j, 5 j/sem, pendant un an à 0 - 0,06 - 0,5 ou 5 mg.m-3 (puis réduite à 4,5 en cours d’étude) de trioxyde d’antimoine (degré de pureté 99,68 %), et observés pendant une période supplémentaire d’un an (Bio/dynamics, 1990 ; Newton et al., 1994). Aucune différence n’a été notée par rapport au lot témoin en ce qui concerne la survie, et les effets sur le poids corporel ou le poids absolu et/ou relatif des poumons. Une augmentation de l’incidence des cas de conjonctivites et de cataractes a été signalée, cependant il existe une grande part d’incertitude dans la désignation de ces lésions (US EPA (IRIS), 1995). A la plus forte concentration testée, une inflammation interstitielle des poumons, une inflammation granulomateuse et une fibrose interstitielle ont été observées. A cette concentration, une augmentation des demi-vies de clairance pulmonaire est rapportée du fait de la toxicité du trioxyde d’antimoine localement.
Le NTP a également réalisée une étude ou des lots de 60 rats et de souris, mâles et femelles, ont été exposés par inhalation (corps entier) au trioxyde d’antimoine à des concentrations de 0 – 3 – 10 - 30 mg.m-3, 6 h/j, 5 j/sem pendant 105 semaines (NTP, 2017). Chez les rats, la protéinose pulmonaire serait à l’origine de la diminution du taux de survie aux 2 plus fortes concentrations chez les femelles et à la plus forte concentration chez les mâles. Une augmentation significative du poids des poumons a été rapportée dans tous les lots traités (mâles et femelles) après la première année d’exposition, de même qu’une protéinose, une inflammation chronique, une hyperplasie de l’épithélium alvéolaire et une fibrose interstitielle. Une inflammation généralisée à de nombreux organes (pancréas, intestins, reins) est également rapportée en fin d’étude. Des résultats similaires ont été rapportés chez les souris. Les effets néoplasiques observés dans ces 2 études sont décrits dans la partie consacrée aux effets cancérogènes.
Des cobayes ont été exposés à 38,1 mg Sb.m-3 sous forme de trioxyde d’antimoine 2 h/j, 7 j/sem. pendant 2 semaines, puis 3 h/j jusqu’à 265 jours (Dernehl et al., 1945). Il a été observé une pneumonie interstitielle (chez tous les animaux), une augmentation du poids des poumons et des hémorragies pétéchiales sous-pleurales (pour une exposition supérieure à 30 jours), une augmentation du poids du foie et une dégénérescence albumineuse et graisseuse du foie (chez 73 % des animaux exposés plus de 48 jours), une diminution des globules blancs, ainsi qu’une hypertrophie et une hyperplasie de la rate.
Voie orale
FDTE/VTR Importer Dans le but de rechercher les effets tout au long de la vie de l’exposition de différents éléments à l’état de trace, l’administration chronique (du sevrage à leur mort naturelle) par voie orale dans l’eau de boisson de faibles doses de TAP (0,262 mg.kg-1.j-1) (1 seule dose testée) à des rats Log-Evans a entraîné une diminution de leur durée de vie (106 et 107 jours de moins en moyenne respectivement chez les mâles et les femelles que les témoins), une augmentation du taux de cholestérol sérique (p<0,005), et une diminution de la glycémie post-prandiale (p<0,005) (un seul dosage réalisé sans indication sur la période à laquelle l’analyse a été réalisée) par comparaison au lot témoin (Schroeder et al., 1970). Une diminution du poids du corps est rapportée seulement pour les mâles et aucune augmentation du nombre de tumeurs n’est mentionnée.
Dans une autre étude, des rats Sprague-Dawley ont été exposés (15 animaux par sexe et par dose) au TAP dans l’eau de boisson pendant 90 jours aux concentrations de 0 - 0,5 - 5,0 - 50 et 500 mg Sb.L-1 (Poon et al, 1998). Ceci correspond à une dose ingérée de 0,06 - 45,39 mg.kg-1 de poids corporel chez les femelles et de 0,06 - 42,17 mg.kg-1 de poids corporel chez les mâles. Un groupe additionnel de 10 rats par sexe a été exposé à 0 ou 500 mg Sb.L-1 d’eau de boisson pendant 90 jours et observé à 4 semaines pour vérifier la réversibilité des effets de cette exposition ou l’absence d’effet. Aucun signe d’atteinte clinique n’est rapporté. À la dose la plus élevée chez les mâles, une diminution de la croissance pondérale est observée très certainement liée à la diminution de prise de nourriture et de boisson. Des modifications histologiques ont été rapportées dans la glande thyroïde, la rate, le foie (anisokaryose, hyperchromicité nucléaire associée à la dose) avec une fibrose non adaptative chez des animaux exposés à la plus forte dose , le thymus et l’hypophyse. A partir des modifications des lésions histologiques de la thyroïde chez les mâles (augmentation d’épaisseur de l’épithélium et réduction de la taille du follicule), les auteurs proposent un NOAEL de 0,5 mg Sb L-1 dans l’eau de boisson ce qui correspond à un NOAEL de 0,06 mg Sb.kg pc.j-1 sur la basedes altérations biochimiques, lésions histologiques et rétention d’antimoine au niveau de la rate et dans les globules rouges. Ces résultats ont par la suite été ré-analysés (Lynch et al, 1999), pour finalement ne pas considérer comme pertinent les effets observés à partir des analyses histologiques. Une nouvelle valeur de NOAEL de 6,0 mg Sb.kg pc.j-1 correspondant à la concentration de 50 mg Sb.L-1 (Poon et al, 1998), a été proposée. Ce NOAEL est établi suite à l’observation de la diminution de croissance pondérale et de l’altération de la consommation de nourriture et de boisson dans la même étude pour la dose de 500 mg Sb.L-1. Il s’agit donc d’une LOAEC de 500 mg correspondant à un LOAEL de 60 mg Sb kg pc.j-1 (Lynch et al, 1999).
Les substances de l’antimoine hautement solubles dans l’eau, comme le TAP et le trichlorure d’antimoine, ont probablement un plus grand potentiel de toxicité par voie orale que les autres substances de l’antimoine. Il existe aussi une différence entre les potentiels de danger en fonction de l’état d’oxydation, les formes trivalentes semblant être plus toxiques que les formes pentavalentes (ATSDR 2017, OEHHA 2016).
Des rats exposés à 500 ou 1 000 mg d’antimoine métallique.kg-1.j-1 pendant 12 ou 24 semaines ont présenté une diminution des taux d’hématocrite, d’hémoglobine et de protéines plasmatiques (Hiraoka, 1986 ; Sunagawa, 1981).
Synthèse
FDTE/VTR Importer Chez l’animal, l’exposition au trioxyde ou au trisulfure d’antimoine par inhalation provoque des effets pulmonaires (augmentation du nombre de macrophages alvéolaires et/ou intra-alvéolaires, inflammation interstitielle chronique, fibrose et pneumonie lipoïdique). Des effets cardiaques ont également été observés (dégénérescence parenchymateuse et modifications de l’électrocardiogramme) ainsi que des effets hépatiques. Par voie orale, l’exposition chronique au TAP provoque une augmentation du taux de cholestérol sérique, une diminution de la glycémie postprandiale, des altérations hépatiques, thyroïdiennes et sanguines.
Effets cancérigènes
Classifications
| Organisme | Classification | Année |
|---|---|---|
| UE | FDTE/VTR Importer Carc. 2 | 2008 |
| IARC | FDTE/VTR Importer Groupe 2A : Trioxyde d’antimoine Groupe 3: dérivé pentavalent |
2022 |
Chez l'homme
Inhalation
FDTE/VTR Importer L’exposition par inhalation à 8,87 mg Sb.m-3 sous forme d’oxyde pendant 9 à 31 ans n’a pas affecté l’incidence des cancers chez des travailleurs (Potkonjak et Pavlovich, 1983).
Le NTP a procédé en 2018 à un examen des effets cancérogènes de l’antimoine à partir des données de 2 études de cohortes de travailleurs employés dans des fonderies d’antimoine au Royaume-Uni (Jones, 1994) et aux États-Unis (Schnorr et al., 1995), une étude de cohorte de travailleurs d’une fonderie d’étain au Royaume-Uni (Jones et al., 2007) et une étude cas-témoins réalisée sur des artisans verriers en Suède (Wingren et Axelson, 1993) (Boreiko et al., 2020).
En ce qui concerne le cancer du poumon, une mortalité élevée a été observée dans toutes les études réalisées sur les travailleurs exposés à l’antimoine dans les fonderies, avec un SMR de 1,55 (1,11 -2,11) dans l’étude de Jones (1994), un SMR de 1,39 (1,01 – 1,88) dans celle de Schnorr (1995) et un SMR de 5,26 (1,75 – 43,38) dans l’étude de Jones (2007) ; toutefois, l’excès de risque ne peut être clairement attribué à l’antimoine seul en raison de l’impact d’erreurs de classification non différenciée (probabilité d’une classification erronée dans une catégorie autre que celle normalement assignée, liée notamment à l’absence de donnée individuelle d’exposition, manque d’information sur les expositions antérieures à l’embauche …) et de nombreux biais liés à l’exposition simultanée à d’autres métaux.
Un excès risque accru de cancers de l’estomac a été rapporté dans l’étude de cohorte de fonderie d’antimoine aux États-Unis, SMR non significatif de 1,24 (0,5 – 2,55 ) (Schnorr et al., 1995) et l’étude cas-témoins suédoise (SMR de 2 (1,30 3,10) (Wingren et Axelson, 1993), mais pas dans l’étude de cohorte de fonderie d’antimoine du Royaume-Uni (Jones, 1994).
Les données issues de ces études sont jugées insuffisantes par le NTP pour apprécier la relation directe entre l’exposition d’antimoine et la survenue de cancers chez l’humain (NTP, 2018).
Voie orale
FDTE/VTR Importer Aucune donnée n’a été identifiée
Voie cutanée
FDTE/VTR Importer Aucune donnée n’a été identifiée
Synthèse
FDTE/VTR Importer Chez l’homme, les données disponibles ne permettent pas d’évaluer les effets de l’exposition à l’antimoine seul sur le risque de cancer, en raison notamment de la co-exposition à des agents potentiellement cancérogènes.
Chez l'animal
Inhalation
FDTE/VTR Importer L’exposition de rats (Fischer) femelles par inhalation à du trioxyde d’antimoine 6 h/j, 5 j/sem pendant un an à des concentrations de 0 - 1,9 et 5 mg.m-3 a entraîné une augmentation de l’incidence des tumeurs pulmonaires à la plus forte concentration (épithélioma squirrheux, épithélioma spinocellulaire, et adénomes bronchoalvéolaires) (Watt, 1983).
Des rats Wistar (mâles et femelles) ont été exposés 7 h/j, 5 j/sem pendant 52 semaines au trioxyde d’antimoine (37,8 mg Sb.m-3) ou du minerai d’antimoine contenant principalement du trisulfure d’antimoine (17,5 mg Sb.m-3) (Groth et al., 1986). Une augmentation de l’incidence des tumeurs pulmonaires (épithélioma spinocellulaire, adénomes et carcinomes bronchoalvéolaires, et épithélioma squirrheux) a été observée chez 27 % des femelles exposées au trioxyde d’antimoine, et chez 25 % des mâles exposés au minerai d’antimoine.
Plus récemment, le NTP a réalisé 2 études de cancérogénèse sur des lots de 60 rats (Han Wistar) et 60 souris (B6C3F1/N), mâles et femelles, exposés par inhalation (corps entier) de 0 - 3 - 10 et 30 mg.m-3 de trioxyde d’antimoine 6 h/j, 5 j/sem pendant 105 semaines (NTP, 2017). L’incidence des principaux effets néoplasiques observés aussi bien chez les rats que chez les souris sont résumés dans le tableau suivant :
Principaux résultats de l’étude du NTP (2017) relatifs aux effets néoplasiques observés chez le rat et la souris exposés 105 semaines par inhalation au trioxyde d’antimoine :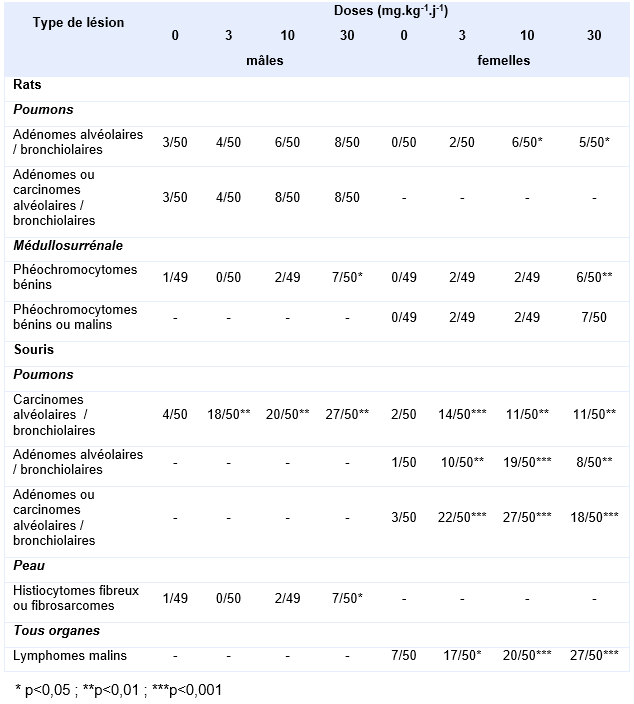
Une augmentation de l’incidence combinée des adénomes et carcinomes broncho-alvéolaires pulmonaires a été observée chez le rat, et significative à toutes les doses d’exposition chez les souris. L’étude de la surcharge pulmonaire menée en parallèle à l’étude de cancérogène (79 semaines), a conduit le NTP à conclure que les tumeurs observées chez les souris à la plus faible concentration de 3 mg.kg-1.j-1 n’étaient pas liées à la surcharge pulmonaire, contrairement aux lots exposés aux 2 plus fortes concentrations.
Une incidence accrue des tumeurs des glandes surrénales a également été observée chez les rats, significative uniquement à la plus forte concentration, de même que chez les souris une augmentation de lymphomes à toutes les concentrations (femelles uniquement) et des tumeurs cutanées chez les mâles (significative à la plus forte concentration).
Le NTP a procédé à une analyse groupée des études de cancérogénèse sur le trioxyde d’antimoine, jugées pertinentes et brièvement décrites dans le tableau suivant (NTP, 2018) :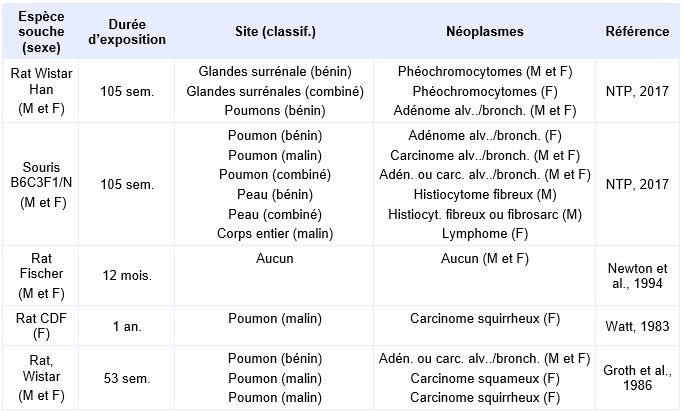
Quatre études par inhalation de trioxyde d’antimoine ont montré des augmentations de l’incidence de néoplasies pulmonaires chez les rats et les souris des 2 sexes. Les néoplasmes pulmonaires comprenaient les carcinomes squirrheux et squameux chez les rats Wistar femelles et les carcinomes scirrheux (caractérisé par sa dureté) chez les rats CDF femelles, les carcinomes alvéolaires/bronchiolaires chez les souris B6C3F1/N mâles ou femelles et les adénomes alvéolaires/bronchiolaires chez les rats mâles et femelles Wistar ou Wistar Han et les souris femelles B6C3F1/N. Les incidences combinées des adénomes ou des carcinomes alvéolaire/bronchiolaire ont augmenté chez les rats Wistar Han mâles et chez les souris B6C3F1/N mâles et femelles. L’augmentation de l’incidence des tumeurs en dehors du poumon ont été observées dans les études du NTP réalisée sur 2 ans aussi bien chez la souris que chez le rat (décrites précédemment au niveau des glandes surrénales, de la peau et divers organes (lymphomes)) (NTP, 2017). Dans sa conclusion, le NTP considère que les preuves de cancérogénicité du trioxyde d’antimoine provenant d’études expérimentales fondées sur l'augmentation combinée de l’incidence des tumeurs malignes et bénignes de plusieurs sites tissulaires chez les rats et les souris, sont suffisantes. Aucune étude de cancérogène par inhalation de trichlorure d’antimoine n’a été identifiée (ECHA, 2019).
Voie orale
FDTE/VTR Importer Chez des rats (Schroeder et al., 1970) ou des souris (Kanisawa et Schroeder, 1969 ; Schroeder et al., 1968) exposés par voie orale pendant toute leur vie, respectivement à 0,262 ou 0,35 mg Sb.kg-1 sous forme de TAP introduit dans l’eau de boisson, aucune augmentation de l’incidence des cancers n’a été observée.
Voie cutanée
FDTE/VTR Importer Aucune donnée n’a été identifiée
Synthèse
FDTE/VTR Importer Chez l’animal, l’augmentation de l’incidence des tumeurs pulmonaires suite à l’exposition par inhalation au trioxyde d’antimoine ou au trisulfure d’antimoine, contribue à considérer ces substances comme étant potentiellement cancérogènes. L’exposition par voie orale au TAP ne montre pas l’apparition de cancers.
Effets génotoxiques
Généralités
FDTE/VTR Importer La grande majorité des études in vivo chez l’humain et l’animal, ainsi que les tests in vitro n’ont pas mis en évidence d’effets génotoxiques à partir de l’exposition des différents composés de l’antimoine. Les seuls résultats positifs ont été observés en présence de cytotoxicité. Une surcharge pulmonaire semble être à l’origine de l’augmentation des tumeurs pulmonaires observées chez le rat et la souris. Le mode d’action permettant d’expliquer la toxicité des composés de l’antimoine est encore largement débattue. En dehors des données suggérant un potentiel cancérogène du trioxyde d’antimoine, il n’a pas été mis en évidence d’effet cancérogène pour les autres dérivés. Dans ces conditions, une approche sans seuil pour les dérivés de l’antimoine n’est pas retenue.
Chez l'homme
Toutes voies
FDTE/VTR Importer Des études avec des travailleurs ont conduit à des résultats négatifs en ce qui a trait à la formation de micronoyaux et d’échanges de chromatides sœurs sur les lymphocytes circulants (Cavallo et al., 2002).
Chez l'animal
Toutes voies
FDTE/VTR Importer Globalement, les études in vivo par voie orale chez la souris et le rat n’ont mis en évidence d’effet clastogène (Elliott et al. 1998; Gurnani et al. 1992a, 1992b; Kirkland et al. 2007). Les tests d’aberrations chromosomiques (cellules de moelle osseuse) et la formation de micronoyaux (lymphocytes périphériques) réalisés à partir d’études in vivo par voie orale ont aussi conduit à des résultats négatifs (Kirkland et al. 2007 ; Elliott et al. 1998 ; Gurnani et al. 1992a, 1992b).Toutefois, quelques réponses positives ont été observées avec le trichlorure et le pentachlorure d’antimoine (substance très soluble) lors de tests de formation de micronoyaux et d’aberrations chromosomiques (ATSDR, 2019).
In vitro
Organismes eucaryotes
FDTE/VTR Importer Les tests in vitro donnent généralement des résultats négatifs pour les mutations géniques (Santé Canada, 2020). Toutefois, quelques réponses positives ou équivoques ont été observées avec le trichlorure, le pentachlorure d’antimoine (substance très soluble) ou l’antimoine métal lors de tests du micronoyau et d’aberration chromosomique sur cellules humaines (Elliot et al., 1998 ; Paton et al., 1972) ou animales (Asakura et al., 2009 ; Huang et al., 1998; Boreko et al., 2020).Les résultats sont considérés comme équivoques en raison d’une cytotoxicité concomitante (Asakura et al. (2009)
Synthèse
FDTE/VTR Importer La plupart études disponibles réalisés sur les différents composés de l’antimoine ne rapportent pas d’effets génotoxiques.
Effets sur la reproduction
Chez l'homme
Inhalation
FDTE/VTR Importer Des femmes ont été exposées professionnellement à des poussières contenant de l’antimoine métallique, du trioxyde d’antimoine et du pentasulfure d’antimoine sur une période de 2 ans (Belyaeva, 1967). Le niveau d’exposition à l’antimoine ainsi que la présence d’autres composés n’est pas connu. Il a été observé une augmentation de l’incidence des perturbations du cycle menstruel (61,2 % contre 35,7 % pour les témoins).
Synthèse
FDTE/VTR Importer La seule étude disponible semble montrer que l’exposition à des poussières d’antimoine pourrait entraîner des perturbations du cycle menstruel chez la femme.
Chez l'animal
Toutes voies
FDTE/VTR Importer Aucune donnée sur les effets de l’exposition au trichlorure d’antimoine sur la fertilité et/ou la fonction de reproduction n’a été identifiée (ECHA, 2019).
La plupart des données issues des études de toxicité à doses répétées sub-chronique et chronique réalisées avec le trioxyde d’antimoine, aussi bien par voie orale (Hext et al., 1999 ) que par inhalation (NTP, 2017) ou le TAP (James et al., 1966 ; NTP, 1992 ; Omura et al., 2002 ; Poon et al., 1998) ne semble pas indiquer d’effet de l’antimoine sur la fertilité.
Toutefois, il est décrit dans une étude, présentant des lacunes méthodologiques (pas de contrôle de l’exposition, pas de données sur la pureté ou la taille des particules, pas d’analyse statistique...) chez le rat exposé par inhalation au trioxyde d’antimoine (0 – 0,027 -0,082 – 0,27 mg.m-3 pendant 21 jours sans plus de précision), une augmentation des pertes pré-implantatoires (Grin et al., 1987) ou encore une forte diminution (67 %) du nombre de femelles gestantes.
Chez les femelles exposées avant la conception et pendant la gestation à 209 mg Sb.m-3 sous forme de trioxyde d’antimoine (Belyaeva, 1967). Il est également rapporté une métaplasie de l’utérus et des perturbations dans le processus de maturation de l’ovule. Ces effets ne sont pas observés chez les femelles ayant réussi à concevoir.
Synthèse
FDTE/VTR Importer Chez l’animal, l’inhalation d’antimoine semble également la maturation de l’ovule et favoriser les pertes pré-implantatoires et échec de gestation. Ces effets demandent à être confirmés car non constants d’une étude à l’autre.
Effets sur le développement
Chez l'homme
Inhalation
FDTE/VTR Importer Dans une étude prospective réalisée à partir de femmes exposées professionnellement à différents composés d’antimoine (trioxyde d’antimoine, pentasulfure d’antimoine et antimoine métallique) dans une usine métallurgique (n = 161 fortement exposées, n = 157 faiblement exposées et n = 115 non exposées), une augmentation de l’incidence des avortements spontanés (12,5 % versus 4,1 % dans le groupe témoin) a été rapportée, de même qu’une augmentation de l’incidence des naissances prématurées (3,4 % contre 1,2 % pour les témoins) (Belyaeva, 1967). La présence d’autres composés ne peut être écartée. Une autre étude rapporte une augmentation significative des concentrations d’antimoine et de titane dans le sang du cordon ombilical du groupe de femmes présentant des complications au cours de la grossesse (principalement des naissances prématurées) par comparaison au groupe témoin (Zheng et al., 2014). Les données humaines sont insuffisantes en raison de co-expositions possibles pour déterminer d’éventuels effets de l’exposition à l’antimoine sur le développement.
Chez l'animal
Toutes voies
FDTE/VTR Importer Chez l’animal, seule la toxicité fœtale (baisse de croissance pondérale et retard d’ossification) est observée en absence de toxicité maternelle, particulièrement sévère chez la lapine (plus sensible que le rat).
Inhalation
FDTE/VTR Importer Aucun effet sur le développement n’a été rapporté dans une étude par inhalation réglementaire (OCDE 414) non publiée de 2003 réalisée avec du trioxyde d’antimoine. Seule l’étude préliminaire (également non publiée) rapporte à la plus forte dose testée de 6,07 mg.m-3 une diminution non significative du poids des fœtus (8 %) et une diminution significative (4 %) de la longueur vertex-coccyx, en absence de toxicité maternelle (ECHA, 2019 ).
A l’inverse, une augmentation des pertes post-implantatoires ont été décrites dans une étude par inhalation chez le rat de qualité discutable, où les femelles ont été exposées à 0 – 0,027 – 0,082 – 0,27 mg.-3 de trioxyde d’antimoine (Grin et al., 1987 ).
Voie orale
FDTE/VTR Importer Aucun effet sur le développement (nombre de nouveau-nés par portée et effets tératogènes macroscopiques) n’a été observé chez les nouveau-nés de rats exposés par voie orale pendant la gestation et la lactation à 0 – 0,16 et 1,6 mg Sb d’antimoine.kg-1.j-1 sous forme de trichlorure d’antimoine (Rossi et al., 1987) (Santé Canada, 2020). La pureté n’est pas mentionnée et les concentrations d’exposition non contrôlées.
Deux études réglementaires (OCDE 414) d’exposition prénatale non publiées ont été réalisée par voie orale de 0 - 100 – 300 et 1 000 mg.kg-1.j-1 d’antimonate de sodium (NaSb(OH)6 (forme pentavalente) (soit 0 – 49 – 148 et 493 mg Sb.kg-1.j-1) chez le rat (ECHA, 2014a) ou d’antimoine métal à des doses de 0 – 30 – 100 – 300 mg Sb.kg-1.j-1 chez le lapin (étude de 2016) (2017) (Santé Canada, 2020). Chez le rat, des retards d’ossification en absence d’une toxicité maternelle sont rapportés aux 2 plus fortes doses. Des NOAEL de 49 mg Sb.kg-1.j-1 pour le développementet 493 mg Sb.kg-1.j-1 pour la toxicité maternelle ont été retenus pour cette étude.Chez le lapin, une forte toxicité maternelle nécessitant une réduction de la dose de 300 à 220 mg Sb.kg-1.j-1 en fin d’étude s’est traduite par une baisse de croissance pondérale, des lésions macroscopiques au niveau du foie et du tractus gastro-intestinal aux 2 plus fortes doses également associées à des pertes post-implantatoires. Les effets observés sur le développement, baisse de poids des fœtus et retards d’ossification ont été attribués à la toxicité maternelle, plutôt qu’à l’antimoine.
Autres Effets
Chez l'homme
Toutes voies
FDTE/VTR Importer Effets sur le système endocrinien :
Fonction reproductrice :
Le TAP agirait sur la croissance et l’invasion de cellules d’une lignée tumorale de la prostate sensible aux androgènes observées aussi bien in vitro qu’ in vivo après implantation chez la souris, par un mécanisme, selon les auteurs, faisant intervenir la phosphorylation des récepteurs aux androgènes (Zhang et al., 2018). Cette étude rapporte également une augmentation de la concentration sérique d’antimoine chez les patients atteints du cancer de la prostate, et une corrélation avec un faible bilan thérapeutique. On peut noter dans ce contexte, l’augmentation de l’incidence d’une hyperplasie de la prostate chez les rats exposés chroniquement au trioxyde d’antimoine (NTP, 2017). De plus, une activité œstrogénique du trichlorure d’antimoine a été observée in vitro à partir d’un essai de transactivation aux récepteurs d’œstrogènes (0,16 % par comparaison à l’œstradiol) (Choe, 2003).
Chez l'animal
Toutes voies
FDTE/VTR Importer Effets sur le système endocrinien :
Fonction reproductrice :
Le TAP agirait sur la croissance et l’invasion de cellules d’une lignée tumorale de la prostate sensible aux androgènes observées aussi bien in vitro qu’ in vivo après implantation chez la souris, par un mécanisme, selon les auteurs, faisant intervenir la phosphorylation des récepteurs aux androgènes (Zhang et al., 2018). Cette étude rapporte également une augmentation de la concentration sérique d’antimoine chez les patients atteints du cancer de la prostate, et une corrélation avec un faible bilan thérapeutique. On peut noter dans ce contexte, l’augmentation de l’incidence d’une hyperplasie de la prostate chez les rats exposés chroniquement au trioxyde d’antimoine (NTP, 2017). De plus, une activité œstrogénique du trichlorure d’antimoine a été observée in vitro à partir d’un essai de transactivation aux récepteurs d’œstrogènes (0,16 % par comparaison à l’œstradiol) (Choe, 2003).
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs réglementaires
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
SANTE HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. De plus, contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
TOXICITE
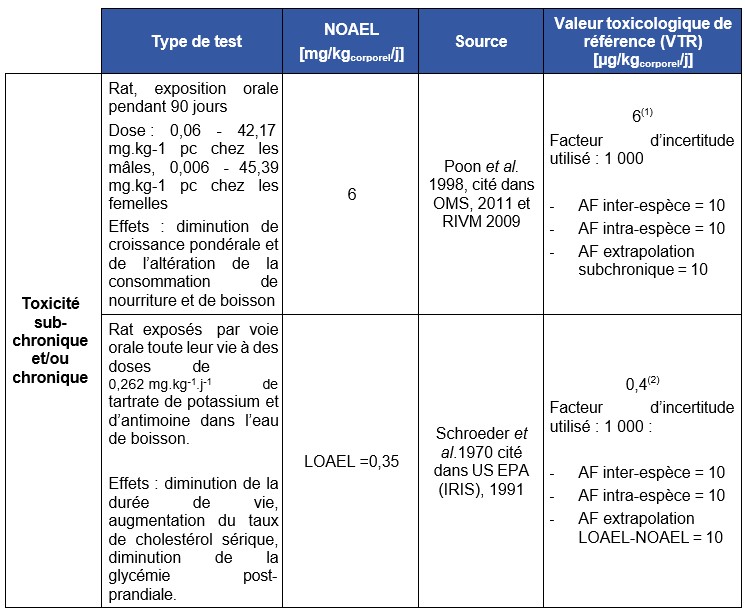
(1) Cette VTR a été déterminée par l'OMS (2011) et par le RIVM (2009).
(2) Cette VTR a été déterminée par l'USEPA (1991). Cette valeur est retenue par l'INERIS.
Choix de VTR
L'INERIS propose de retenir pour une exposition chronique à l'antimoine par voie orale la VTR chronique de 4.10-4 mg.kg-1.j-1 de l'US EPA
Trois VTR sont proposées par les organismes OMS, 2011 ; US EPA (IRIS), 1991 ; RIVM, 2009 pour des expositions chroniques à l'antimoine par voie orale. La valeur de l'US-EPA est construite à partir d'une étude chronique (Schroeder et al., 1970) réalisée avec du tartrate d'antimoine et de potassium et portant sur des effets critiques biochimiques (glucose sanguin et cholestérol). Un facteur d'incertitude de 1 000 a été utilisé pour tenir compte des paramètres inter-et intra-espèces ainsi que de l'utilisation d'un LOAEL. L'OMS se base sur une étude plus récente, subchronique (90 jours) utilisant également du tartrate d'antimoine et de potassium (Poon et al., 1998) mais dans laquelle les effets critiques sont le gain de poids corporel et la diminution de la prise alimentaire. Ces deux études sont sensiblement équivalentes mais les effets critiques retenus pour la construction de la VTR de l'US EPA sont cohérents par rapport au profil toxicologique de la substance. Enfin, le RIVM reprend en 2009 intégralement la valeur de l'OMS de 2008 qui a été reconduite en 2011. L'INERIS propose la valeur de l'US EPA pour des expositions chroniques par voie orale.
Le trioxyde d'antimoine est classé par l'Union Européenne (catégorie 2, susceptible de provoquer des cancers) et par le CIRC (groupe 2B, peut-être cancérogène pour l'homme) pour ses effets cancérigènes. Le trisulfure d'antimoine est classé dans le groupe 3 (inclassable quant à sa cancérogénicité pour l'homme) par le CIRC pour ses effets cancérigènes. L'antimoine ne fait pas l'objet d'une classification par l'US -EPA.
Plusieurs composés de l'antimoine ont été étudiés par l'Union Européenne mais n'ont pas été classés quant à leur caractère génotoxique.
Chez l'homme, la seule étude disponible ne montre pas d'incidence sur les cancers. Chez l'animal, l'exposition par inhalation au trioxyde d'antimoine ou au trisulfure d'antimoine entraîne une augmentation de l'incidence des tumeurs pulmonaires. Cependant, l'exposition par voie orale au tartrate de potassium et d'antimoine ne montre pas d'incidence sur l'apparition des cancers.
FDTE/VTR Importer Une Valeur Toxicologique de Référence (VTR) est un indice qui est établi à partir de la relation entre une dose externe d'exposition à une substance et la survenue d'un effet néfaste. Les valeurs toxicologiques de référence proviennent de différents organismes. Pour accéder à une information actualisée, nous conseillons au lecteur de se reporter directement sur les sites internet des organismes qui les élaborent.
Valeurs de l'ANSES et/ou de l'INERIS
Description
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L’ATSDR propose un MRL de 1 µg Sb.m-3 pour une exposition aiguë à l’antimoine par inhalation (ATSDR, 2019).
Cette valeur est établie à partir d’une étude expérimentale réalisée par inhalation chez la souris C57BL/6J exposée (corps entier) à 0 – 3,75 – 7,7 – 15 – 30 – 60 mg.m-3 de trioxyde d’antimoine soit 0 – 3,1 – 6,3 -12 – 25 - 50 mg Sb.m-3 6h/j, 5j/sem pendant 16 jours (soit un total de 12 expositions) (NTP, 2016). L’incidence des métaplasies squameuses de l’épiglotte pour les souris mâles et femelles représente l’effet le plus sensible retenu survenant à 12 mg Sb.m-3. Une BMCL10 de 0,94 mg Sb.m-3 a été calculée au moyen d’un modèle multi-étapes (valeur la plus protectrice).
La BMCL10 a été ajustée pour une exposition en continue :
BMCL10 Adj = 0,94 mg Sb.m-3 x6 h/24 h x 5 j/7 j = 0,168 mg Sb.m-3.
Une concentration équivalent pour l’homme a été calculée au moyen d’un ajustement dosimétrique en utilisant un RDDR de 0,206 (poids moyen chez la souris de 0,0281 kg) :
BMCLHEC = 0,168 x 0,206 = 0,0346 mg Sb.m-3 arrondie à 0,035 mg Sb.m-3
Facteurs d’incertitude : un facteur d’incertitude de 30 est appliqué. Celui-ci correspond à un facteur limité à 3 pour l’extrapolation des données de l’animal à l’homme en raison de l’utilisation d’un ajustement dosimétrique et un facteur de 10 pour la variabilité au sein de l’espèce humaine.
Calcul : 0,035 mg Sb.m-3 /30 = 0,001 mg Sb.kg-1.j-1 soit 1 µg Sb.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition sub-chronique par inhalation :
L’ATSDR propose un MRL de 1 µg Sb.m-3 pour une exposition sub-chronique par inhalation (2019).
L’ATSDR choisit de retenir pour une exposition sub-chronique, la VTR calculée pour une exposition aiguë. Dans sa réflexion l’ATSDR a sélectionné des études de toxicité à doses répétées (6 à 13 semaines) chez le rat (Newton et al., 1994 ; Brieger et al., 1954), le chien (Brieger et al., 1954) et le lapin (Brieger et al., 1954), pour retenir dans sa première analyse une BMCL10 de 0,66 mg Sb.m-3 correspondant à une inflammation interstitielle pulmonaire chronique (effet le plus sensible) chez des rats exposés 13 semaines par inhalation à des concentrations de 0,01 – 0,09 et 0,8 mg.m-3 de trioxyde d’antimoine (Newton et al.,1994). Les ajustements réalisés à partir de cette étude ont conduit à une valeur proche de celle obtenue pour des expositions aigües qui n’a pas été jugée de meilleure qualité (légèrement supérieure 2.10-3 mg Sb.m-3). Dans ces conditions, l’ATSDR a fait le choix de retenir la valeur de MRL aiguë pour une exposition sub-chronique.
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition chronique par inhalation :
L’ATSDR propose un MRL de 0,3 µg Sb.m-3 pour une exposition chronique par inhalation d’antimoine (2019).
Cette valeur a été établie à partir de la même étude que celle retenue par l’US EPA et décrite ci-dessous à savoir une étude réalisée chez des rats Fischer 344 exposés 6 h/j, 5 j/sem, pendant un an à 0 - 0,05 - 0,5 ou 5 mg.m-3 de trioxyde d’antimoine soit 0 – 0,05 – 0,43 – 3,8 mg Sb.m-3 (Newton et al., 1994). L’incidence des effets toxiques pulmonaires (inflammation interstitielle) a été retenue comme point de départ et utilisée pour calculer une benchmark concentration (BMCL10) chez les femelles (jugées plus sensibles que les mâles) de 0,10 mg Sb.m-3 (modèle Gamma). A noter que l’ATSDR n’a pas retenu l’étude de toxicité chronique par inhalation du NTP de 2017, dans laquelle les effets pulmonaires ont été observées à des concentrations supérieures à celles observées dans cette étude.
La BMCL10 a été ajustée pour une exposition en continue :
BMCL10 Adj = 0,10 mg Sb.m-3 x6 h/24 h x 5 j/7 j = 0,0178 mg Sb.m-3.
Un ajustement dosimétrique en utilisant un RDDR de 0,436 a été appliqué (poids moyen chez la rate de 0,229 kg et taille moyenne des particules de 3,76 µm) pour définir une BMCL équivalente pour l’homme :
BMCLHEC = 0,0178 x 0,436 = 0,00778 mg Sb.m-3 arrondie à 0,008 mg Sb.m-3
Facteurs d’incertitude : un facteur d’incertitude de 30 est appliqué. Celui-ci correspond à un facteur limité à 3 pour l’extrapolation des données de l’animal à l’homme en raison d’un ajustement dosimétrique et un facteur de 10 pour la variabilité au sein de l’espèce humaine.
Calcul : 0,008 mg Sb.m-3 /30 = 0,00026 arrondi 3 10-4 mg Sb.kg-1.j-1 soit 0,3 µg Sb.kg-1.j-1
Indice de confiance : cet organisme n’accorde pas d’indice.
Effets à seuil - Exposition aiguë par voie orale :
L’ATSDR propose un MRL de 1 mg Sb.kg-1.j-1 pour une exposition aiguë par voie orale à l’antimoine (2019).
Cette valeur est établie à partir d’une exposition chez la souris au TAP dans l’eau de boisson aux doses de 0 - 0,30 – 0,65 – 1,25 – 2,5 – 5,0 mg.mL-1 soit 0 – 21 – 36 – 63 – 99 – 150 mg Sb.kg-1.j-1 pendant 14 jours (NTP, 1992 ; Dieter et al., 1991). Des lésions hépatiques de type vacuolisation minimale à modérée des hépatocytes au niveau centriolobulaire mais aussi des zones portales ont été observées chez certaines souris mâles avec généralement des altérations plus marquées que chez les femelles. De cette étude, un NOAEL de 99 mg Sb.kg-1.j-1 est retenu pour les effets hépatiques. Il n’a pas été réalisé de modélisation par BMD car les lésions ne sont observées que chez les animaux exposés à la dose la plus élevée.
Facteur d’incertitude : un facteur 10 a été utilisé pour la variabilité au sein de la population humaine et un facteur 10 pour l’extrapolation de données animales à l’homme.
Calcul : 99 mg Sb.kg-1.j-1 x 1/100 = 0,99 mg Sb.kg-1.j-1 arrondi à 1 mg Sb.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice de confiance.
Effets à seuil - Exposition chronique par voie orale :
L’OMS propose une DJT de 6,0 µg.kg-1.j-1 pour une exposition chronique par voie orale à l’antimoine (OMS, 2022).
Cette valeur est établie à partir de l’étude expérimentale de 90 jours chez le rat Sprague Dawley exposé aux concentrations de 0 - 0,5 - 5,0 - 50 et 500 mg Sb.L-1 (TAP) (Poon and al 1998), ce qui correspond à des doses journalières de 0,006 - 45,39 mg.kg-1 pc chez les femelles et 0,06 - 42,17 mg.kg-1 pc chez les mâles. Les résultats ont par la suite été ré-analysés par Lynch and al. (1999). La diminution de croissance pondérale et de l’altération de la consommation de nourriture et de boisson pour la dose de 500 mg Sb.L-1 a permis d’établir un LOAEL de 500 mg correspondant à un LOAEL de 60 mg Sb. kg-1 pc.j-1 (Lynch et al., 1999). La valeur de NOAEL de 6,0 mg Sb. kg-1 pc.j-1 est proposée à partir de cette étude. Cette valeur correspond à la concentration de 50 mg Sb.L-1 (Poon and al 1998).
Facteur d’incertitude : un facteur global de 1 000 a été utilisé correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour l’extrapolation de données animales à l’homme, et un facteur de 10 pour l’utilisation d’une étude sub-chronique.
Calcul : 6 mg.kg-1.j-1 x 1/1 000 = 6 µg.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
FDTE/VTR Importer Effets à seuil - Exposition aiguë par inhalation :
L’Ineris propose de retenir pour une exposition aiguë à l’antimoine par inhalation la VTR aiguë de 1 µg.m-3 de l’ATSDR (2019).
Le seul organisme proposant une VTR pour une exposition aiguë par inhalation est l’ATSDR. Cette valeur est établie à partir d’une étude expérimentale chez la souris du NTP (2016) de bonne qualité. La durée de l’étude (12 jours d’exposition) est adaptée à l’élaboration d’une VTR pour une exposition aiguë. L’effet critique, l’apparition de métaplasies squameuses de l’épiglotte, est un effet cicatriciel consécutif à une agression observée uniquement chez la souris. La construction de la VTR est claire et le choix des facteurs d’incertitude est pertinent au regard de l’étude critique et des méthodes de calcul de la valeur utilisées. Cette valeur est recommandée par l’INERIS.
Indice de confiance : moyen en raison de la pertinence de l’effet critique retenu.
Effets à seuil - Exposition sub-chronique par inhalation :
L’Ineris propose de retenir pour une exposition sub-chronique à l’antimoine par inhalation la VTR aiguë de 1 µg.m-3 de l’ATSDR.
Le seul organisme proposant une VTR pour une exposition sub-chronique par inhalation est l’ATSDR. Cette valeur est celle établie par le même organisme pour une exposition aiguë à partir d’une expérimentale du NTP (2016). La durée de l’étude (14 jours d’exposition) n’est pas adaptée à l’élaboration d’une VTR pour une exposition sub-chronique, mais la construction d’une VTR sub-chronique initialement envisagée par l’ATSDR à partir d’une étude de toxicité de 13 semaines chez le rat (Newton et al., 1994) a conduit à une valeur moins protectrice, légèrement supérieure (2 µg.m-3) que la VTR aiguë (1 µg.m-3). L’ATSDR a donc fait le choix de garder la même VTR pour une exposition aiguë et sub-chronique. L’Ineris suit la même logique et recommande cette valeur.
Indice de confiance : faible en raison de la durée de l’étude clé et de la pertinence des effets
Effets à seuil - Exposition chronique par inhalation :
L’Ineris propose de retenir pour une exposition chronique au trioxyde d’antimoine par inhalation la VTR chronique de 0,3 µg.m-3 de l’ATSDR (2019).
Deux organismes proposent des VTR pour des expositions chroniques par inhalation, l’US EPA (1995) pour le trioxyde d’antimoine et l’ATSDR (2019) pour l’antimoine. Ces deux valeurs ont été construites à partir de la même étude clé où des rats mâles et femelles ont été exposés au trioxyde d’antimoine pendant une année (Newton et al., 1994). L’inflammation interstitielle pulmonaire, a été retenue par les 2 organismes comme effet critique. Cet effet est pertinent au regard du profil toxicologique de la substance. Les 2 organismes ont procédé à un calcul de benchmark concentration. L’US EPA a construit sa VTR à partir d’une BMCL10 de 0,87 mg.m-3 de trioxyde d’antimoine (soit 0,72 mg Sb mg.m-3) pour les mâles et les femelles, alors que l’ATSDR retient une BMCL10 de 0,1 Sb mg.m-3, pour les femelles, plus sensibles que les mâles. Les 2 organismes ont procédé à des ajustements temporels et allométriques pour déterminer des valeurs équivalentes chez l’homme. En plus des facteurs d’incertitudes de 3 et 10, appliqués par les deux organismes pour l’extrapolation des données à l’homme et la variabilité au sein de l’espèce humaine, l’US EPA applique un facteur supplémentaire de 3 pour la durée d’exposition jugée trop courte, ainsi qu’un facteur 3 en raison du manque de données. Ces 2 ajustements ne paraissent pas justifiés ; la durée de l’étude est compatible avec une exposition chronique, et de nouvelles données postérieures à l’analyse de l’US EPA sont disponibles (NTP de 201.
Au regard des choix évoquées précédemment dans la construction de la VTR, BMCL10 plus sensible et facteurs d’incertitudes mieux adaptés, l’Ineris retient la valeur de l’ATSDR. .
Indice de confiance : élevé en raison de la pertinence de l’étude clé et de la transparence de la construction de la VTR
Effets à seuil - Exposition aiguë par voie orale :
L’Ineris propose de retenir l’antimoine la valeur de 1 mg Sb.kg-1.j-1 pour des expositions aiguë par voie orale (ATSDR, 2019).
L’ATSDR (2019) est le seul organisme à proposer une VTR pour une exposition aiguë à l’antimoine. L’étude expérimentale de Dieter et al. (1991) est de bonne qualité. La durée de l’étude (14 jours d’exposition) est adaptée à l’élaboration d’une VTR pour une exposition aiguë. L’effet critique, la toxicité hépatique, est recevable. La construction de la VTR est claire et le choix des facteurs d’incertitude est pertinent. Cette valeur est retenue par l’INERIS.
Indice de confiance : élevé en raison du choix de l’étude et la construction de la valeur.
Effets à seuil - Exposition sub-chronique par voie orale :
L’Ineris propose de ne pas retenir de valeur pour des expositions sub-chroniques par voie orale à l’antimoine .
L’ATSDR (2019) est le seul organisme à proposer une VTR pour une exposition sub-chronique à l’antimoine. L’étude expérimentale de Poon et al., 1998 est de bonne qualité. La durée de l’étude (90 jours d’exposition) est adaptée à l’élaboration d’une VTR pour une exposition sub-chronique. Cependant, le seul effet critique recevable est celui retenu pour la construction de VTR chronique.. Cette valeur n’est pas retenue par l’Ineris.
Effets à seuil - Exposition chronique par voie orale :
L’Ineris propose de retenir pour une exposition chronique à l’antimoine par voie orale la VTR chronique de 6 µg.kg-1.j-1 de l’OMS, 2022.
Quatre VTR sont proposées par les organismes (OMS 2022) ; US EPA (IRIS) 1991); RIVM 2009) et l’OEHHA (2016) pour des expositions chroniques à l’antimoine par voie orale.
La valeur de l’US EPA est construite à partir d’une étude chronique (Schroeder, Mitchener et al. 1970) réalisée avec du TAP (1 seule dose testée) et portant sur des effets critiques biochimiques (glucose sanguin et cholestérol). La qualité de l’étude est limitée en raison de son design expérimental (choix des paramètres et une seule dose testée).
L’OMS, le RIVM et l’OEHHA se basent sur une étude plus récente, sub-chronique (90 jours) utilisant également du TAP (Poon et al 1998). Cette étude est de bonne qualité. L’OMS comme le RIVM retiennent comme effet critique, le perte de poids corporel et la diminution de la prise alimentaire, l’Ineris juge pertinent l’effet retenu par l’OMS. L’OEHHA a procédé à une nouvelle analyse des données histologiques et a retenu comme effet critique, une anisocaryose nucléaire observée sur les cellules hépatiques des rats mâles. Cet effet repose sur une lésion histologique isolée qui n’est pas jugée pertinente.
Concernant le choix des facteurs d’incertitude, l’OMS et l’OEHHA prennent un facteur 10 pour les variations inter-espèces. L’OMS prend ensuite un facteur 10 pour la variabilité au sein de l’espèce humaine alors que l’OEHHA applique un facteur 30 ce qui ne semble pas justifié. Enfin, les 2 organismes prennent un facteur pour tenir compte l’utilisation d’une étude sub-chronique 10 pour l’OMS que l’OEHHA prend un facteur . Ceci au final correspond pour chacun des 2 organismes à un facteur global de 1 000.
L’Anses a réalisé un choix de VTR (2016), reconduit en 2018, et recommande la DJT de 6.10-3 mg Sb.kg-1.j-1 de l’OMS 2011 et reconduite en 2022 (Anses, 2018). Selon l’Anses 2016, cette DJT reste encore discutée au sein de la communauté scientifique notamment du fait du manque d’études approfondies à long terme sur la toxicité par voie orale de l’antimoine et de ses composés. Elle reste néanmoins protectrice pour la population générale. Cette DJT, considérée pour toutes les formes d’antimoine (antimoine total), est retenue dans le cadre de l’EATi, malgré l’absence d’études pertinentes sur la reprotoxicité et la toxicité relative au développement, qui ne permet pas de se positionner sur son applicabilité aux enfants de moins de 3 ans.
L’Ineris suit les recommandation de l’Anses
Indice de confiance : faible en raison manque des données relatives aux mécanismes toxicologiques et à la robustesse des effets et du facteur d’incertitude élevé
Autres valeurs des organismes reconnus
Description
FDTE/VTR Importer Effets à seuil - Exposition chronique par inhalation :
L’US EPA (IRIS) 1995) propose une RfC de 0,2 µg.m-3 pour une exposition chronique par inhalation au trioxyde d’antimoine (1995).
Cette valeur a été établie à partir d’une étude réalisée chez des rats Fischer 344 exposés 6 heures par jour, 5 j/sem, pendant un an à 0 - 0,05 - 0,5 ou 5 mg.m-3 de trioxyde d’antimoine (Newton, Bolte et al. 1994). L’incidence des effets toxiques pulmonaires (inflammation interstitielle et granulomateuse) a été utilisée pour proposer une analyse de benchmark concentration (BMC). Ainsi, l’analyse des données brutes de l’étude avec des modèles de Weibul et linéaire a permis de calculer une benchmark concentration BMC10 de 0,87 mg.m-3, qui correspond à la limite inférieure de l’intervalle de confiance à 95 % pour une augmentation de 10 % de la probabilité de réponse. Cette valeur a été ajustée pour une exposition continue, ce qui donne une BMC10(ADJ) de 0,16 mg.m-3 (0,87 mg.m-3 x 6 h/24 h x 5 j/7 j). Pour l’extrapolation à l’homme, une BMC10(HEC) a été calculée en multipliant la valeur précédente par une valeur de ‘regional deposited dose ratio’ de 0,46 :
BMC10(HEC) = 0,16 mg.m-3 x 0,46 = 0,0736 mg.m-3 (arrondi à 0,074 mg.m-3)
Facteur d’incertitude : un facteur de 10 a été utilisé pour la variabilité au sein de la population humaine, un facteur de 3 pour l’extrapolation de données animales à l’homme, un facteur de 3 en raison du peu de données disponibles et un facteur de 3 pour tenir compte d’une durée d’exposition plus courte que la vie entière de l’animal. Le facteur d’incertitude total de 270 (10 x 3 x 3 x 3) a été arrondi à 300.
Calcul : 0,074 mg.m-3 x 1/300 = 0,00024 mg.m-3 (arrondi à 2.10-4 mg.m-3)
Indice de confiance : l’indice attribué par l’US EPA est moyen aussi bien pour l’étude, la base de données que la valeur proposée.
Effets à seuil - Exposition sub-chronique par voie orale :
L’ATSDR propose un MRL de 6 10-4 mg.kg-1.j-1 pour une exposition sub-chronique par voie orale à l’antimoine (2019).
Cette valeur est établie à partir à partir de l’étude expérimentale de 90 jours chez le rat exposés aux concentrations de 0 - 0,5 - 5,0 - 50 et 500 mg Sb (TAP) par litre (Poon et al, 1998), ce qui correspond à des doses journalières de 0,06 – 0,64 – 6,13 - 45,69 mg Sb.kg-1 pc.j-1 chez les femelles et 0,06 – 0,56 – 5,58 - 42,17 mg Sb.kg-1 pc.j-1 chez les mâles.
Le NOAEL de 0,06 mg Sb.kg-1 pc.j-1 a été retenu pour la diminution du glucose sérique chez les rats femelles.
Facteur d’incertitude : un facteur de 10 a été utilisé pour la variabilité au sein de la population humaine et un facteur de 10 pour l’extrapolation de données animales à l’homme.
Calcul : 0,06 mg Sb.kg-1.j-1 x 1/100 = 0,6 10-4 mg Sb.kg-1.j-1 soit 0,6 µg Sb.kg-1.j-1
Indice de confiance : cet organisme ne propose pas d’indice.
Effets à seuil - Exposition chronique par voie orale :
L’US EPA propose une RfD de 0,4 µg.kg-1.j-1 pour une exposition orale chronique à l’antimoine (US EPA, 1991).
Cette valeur a été établie à partir d’une étude pour une exposition chronique chez des rats par voie orale dans l’eau de boisson à une seule dose de TAP (0,262 mg.kg-1.j-1) pendant leur vie entière (Schroeder, Mitchener et al. 1970). Une diminution de leur durée de vie, une augmentation du taux de cholestérol sérique, et une diminution de la glycémie post-prandiale ont été observées. L’US EPA indique que la dose de 5 ppm a été convertie en une exposition de 0,35 mg.kg-1.j-1 par les auteurs, ainsi un LOAEL de 0,35 mg.kg-1.j-1 est déterminé.
Facteur d’incertitude : un facteur de 1 000 a été utilisé correspondant à un facteur de 10 pour la variabilité au sein de la population humaine, un facteur de 10 pour l’extrapolation de données animales à l’homme, et un facteur de 10 pour l’utilisation d’un LOAEL et non d’un NOAEL.
Calcul : 0,35 mg.kg-1.j-1 x 1/1 000 = 0,00035 mg.kg-1.j-1 (arrondi à 4.10-4 mg.kg-1.j-1 soit 0,4 µg.kg-1.j-1)
Indice de confiance : l’indice est faible aussi bien pour l’étude, la base de données que la valeur proposée.
L’OEHHA propose une DJT de soit 0,14 µg.kg-1.j-1 pour une exposition orale chronique à l’antimoine (2016).
Cette valeur a également été établie à partir de l’étude expérimentale de 90 jours chez le rat Sprague Dawley exposé aux concentrations de 0 - 0,5 - 5,0 - 50 et 500 mg Sb.L-1 (TAP) (Poon and al 1998). L’OEHHA a procédé à une analyse de benchmark dose à partir d’un système de graduation histologique prenant en considération les lésions hépatiques (anisocaryose nucléaire).
Une BMDL10 de 0,14 mg.kg-1.j-1 a été retenue comme point de départ sur la base de l’anisocaryose nucléaire observée au niveau du foie chez les mâles. A noter que cette valeur diffère peu du NOAEL de 0,06 mg Sb.kg-1.j-1 (soit 0,5 mg.L-1) initialement déterminé par les auteurs de l’étude sur la base de la présence de lésions histologiques au niveau de la thyroïde.
Facteur d’incertitude : un facteur 1 000 a été utilisé correspondant à un facteur un facteur de 10 pour l’extrapolation de données animales à l’homme, de 30 pour la variabilité au sein de la population humaine (10 pour la pharmacocinétique et racine carrée de 10 pour la pharmacodynamique) et un facteur racine carrée de 10pour l’utilisation d’une étude sub-chronique correspondant à une durée de 8 à 12 % de la vie de l’animal (arrondi à 1000).
Calcul : 0,14 mg.kg-1.j-1 x 1/1000 = 0,0002 mg.kg-1.j-1 (soit 0,2 µg.kg-1.j-1)
Indice de confiance : cet organisme ne propose pas d’indice.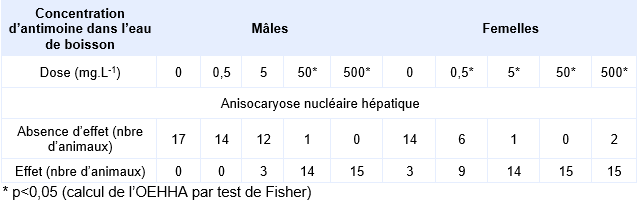
Le RIVM (2009) propose une TDI de 6,0 µg.kg-1.j-1 pour une exposition orale chronique à l’antimoine.
Cette valeur est construite sur la même étude que celle de l’OMS et reprend le même raisonnement.
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
Evaluations existantes :
European Union Risk Assessment Report for DIANTIMONY TRIOXIDE (CAS-No.: 1309-64-4, EINECS-No: 215-175-0) (Final report) (E.C., 2008a)
Environmental Risk Limits for Nine Trace Elements. (RIVM, 2005)
Re-evaluation of some human-toxicological Maximum permissible Risk levels earlier evaluated in the period 1991-2001. (RIVM, 2009)
Guidelines for drinking-water quality. (OMS, 2011)
Antimoine et ses dérivés (INERIS, 2007)
Effets endocriniens :
L'antimoine n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Critères PBT / POP :
La substance n'est pas citée dans les listes PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n° 1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Normes de qualité existantes :
Union européenne (E.C., 2008a)
- PNEC aquatic (Sb2O3) = 0.113 mg Sb/l
- PNECsediment (Sb2O3) = 11.2 mg Sb/kg sec
- PNECmarine water (Sb2O3) = 11.3 µg Sb/l
- PNECmarine sediment (Sb2O3) = 2.24 mg Sb/kg dw
Canada, Antimoine,
- Eau potable = 6 µg.L-1
Allemagne, Antimoine (ETOX, 2013) :
- Organismes aquatiques = 20 µg.L-1
- Organismes sédimentaires = 6 mg/kg
- Eau potable = 5µg.L-1
Pays-Bas, Antimoine (SB, Sb2O3)(RIVM, 2012) :
- Eau de surface = 5,6 µg.L-1 (basé sur la valeur pour la consommation humaine de poisson)
- Sédiment = 14 mg/kg sec
- Eau potable = 21 µg.L-1
Substance(s) associée(s) :
Dangers
Description
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon plusieurs résultats des tests d'écotoxicité. Les données sont issues d'évaluations des risques de la Communauté Européenne, des Etats Unis et du RIVM, elles n'ont donc pas fait l'objet de validation supplémentaire.
Les études d'écotoxicité citées dans la littérature concernent principalement la forme Sb(III). Les données disponibles sont insuffisantes pour permettre de mettre en évidence une éventuelle différence de toxicité entre la forme Sb(III) et la forme Sb(V). Le rapport de l'UE et du RIVM considèrent ainsi indifféremment les données pour les sels d'antimoine sous ces deux valences. C'est également cette approche qui est reprise dans cette fiche.
En revanche, il peut y avoir des différences importantes dans les temps de dissolution des différents sels (par exemple les sels de chlorure d'antimoine se dissolvent plus rapidement que les sels d'oxyde d'antimoine). Pour juger de la validité des tests, il est donc important de vérifier que les sels ont été correctement dissous ou que les résultats ont été exprimés en termes de concentrations mesurées à partir de la fraction dissoute.
Seules les données publiées et considérées comme valides sont présentées.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
ECOTOXICITE
ECOTOXICITE AQUATIQUE AIGUË
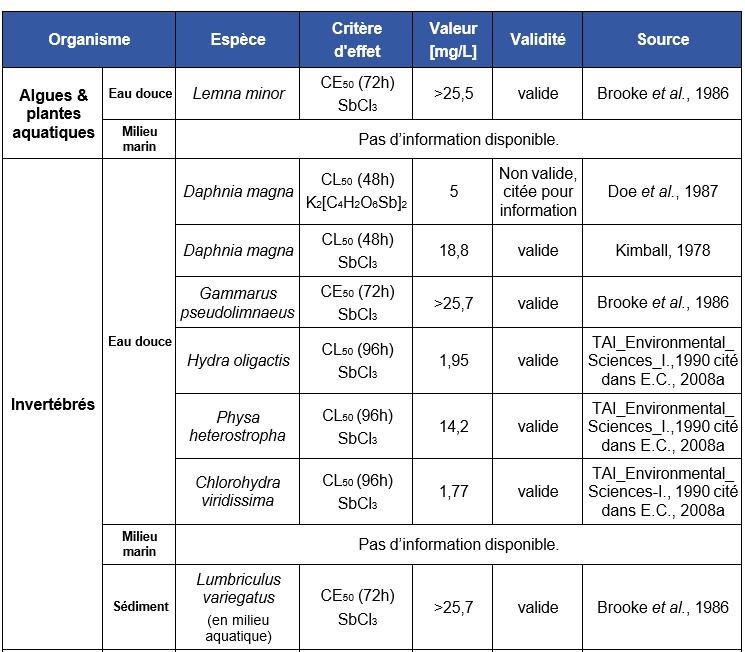
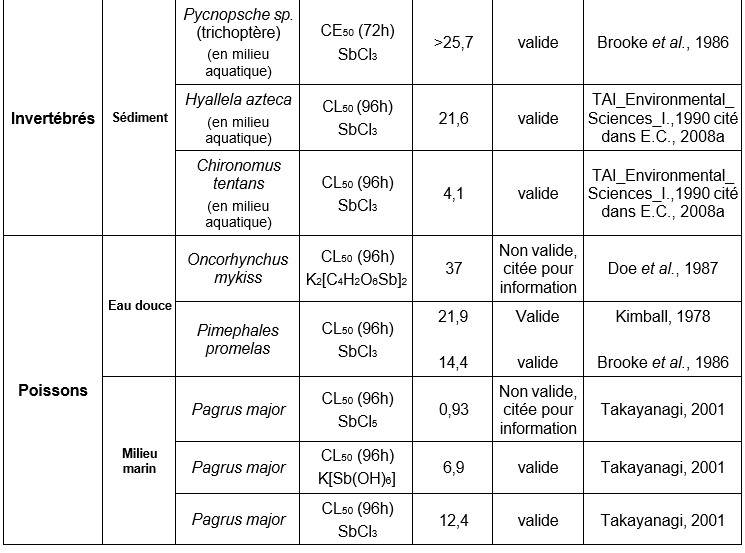
![]() Les données obtenues lors de l'essai de Takayanagi (2001) n'ont pas été considérées dans leur intégralité comme suffisamment robustes dans le rapport de risque européen (E.C., 2008a). Une grande différence est observée entre les CE50 (13 fois plus toxique) obtenus avec l'antimoine trivalent et l'antimoine pentavalent de solubilité comparable. Une grande différence est également observée entre les CE50 (un facteur de 7) obtenues avec des Sb(V) issus tous deux d'antimoine pentavalent dissous et mesurables dans l'eau. Ces deux constatations ne sont pas cohérentes avec les informations issues de la littérature scientifique contrairement à la toxicité voisine observée entre les résultats issus des essais avec du K[Sb(OH)6] et du SbCl3. C'est pourquoi le rapport de risque européen (E.C., 2008a) recommande de ne pas considérer la donnée obtenue avec du SbCl5 comme une donnée valide.
Les données obtenues lors de l'essai de Takayanagi (2001) n'ont pas été considérées dans leur intégralité comme suffisamment robustes dans le rapport de risque européen (E.C., 2008a). Une grande différence est observée entre les CE50 (13 fois plus toxique) obtenus avec l'antimoine trivalent et l'antimoine pentavalent de solubilité comparable. Une grande différence est également observée entre les CE50 (un facteur de 7) obtenues avec des Sb(V) issus tous deux d'antimoine pentavalent dissous et mesurables dans l'eau. Ces deux constatations ne sont pas cohérentes avec les informations issues de la littérature scientifique contrairement à la toxicité voisine observée entre les résultats issus des essais avec du K[Sb(OH)6] et du SbCl3. C'est pourquoi le rapport de risque européen (E.C., 2008a) recommande de ne pas considérer la donnée obtenue avec du SbCl5 comme une donnée valide.
ECOTOXICITE AQUATIQUE CHRONIQUE
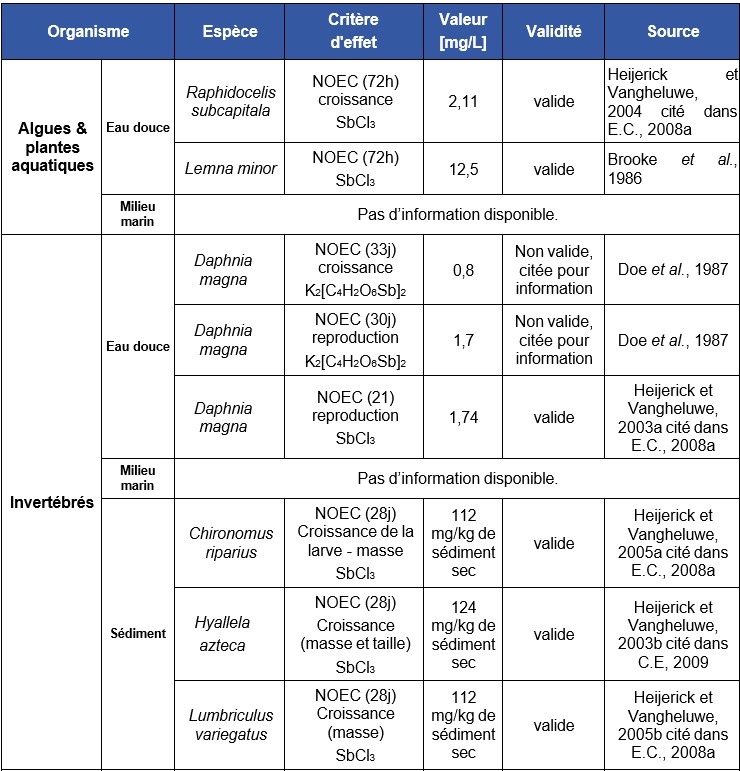
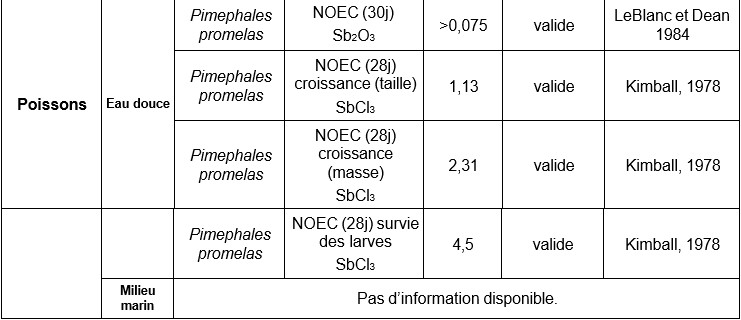
Les données obtenues lors de l'essai de Doe et al. (1987) n'ont pas été considérées comme suffisamment robustes dans le rapport d'évaluation des risques européen (E.C., 2008a) car les informations sur le nombre d'individus testés, les concentrations testées, le nombre de réplicas ou les méthodes statistiques employées ne sont pas disponibles.
L'étude de Leblanc et Dean (1984) a été réalisée avec 5 concentrations (de 0,6 à 7,5 Sb µg.L-1), la concentration la plus élevée n'a pas provoqué d'effets significatifs par rapport aux témoins (E.C., 2008a).
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2010). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
ECOTOXICITE POUR LES VERTEBRES TERRESTRES
TOXICITE ORALE POUR LES MAMMIFERES
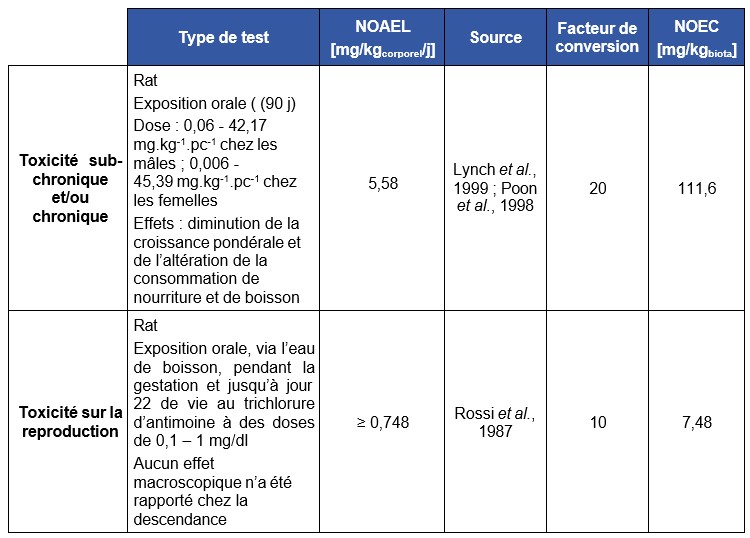
Dans l'étude sur la reproduction aucun effet macroscopique n'a été observé chez la descendance. Ainsi donc, le NOAEL à retenir est celui de l'étude de Poon (1998), 5,58 mg/kg pc/j, soit 11,6 ppm pour la diminution de la croissance et de la diminution de la consommation alimentaire et de l'eau de boisson observé chez le rat.
TOXICITE ORALE POUR LES OISEAUX
 Organismes du sol
Organismes du sol
Paramètres d’écotoxicité chronique :
Synthèse des principaux résultats pour des organismes terrestres lors d’expositions chroniques :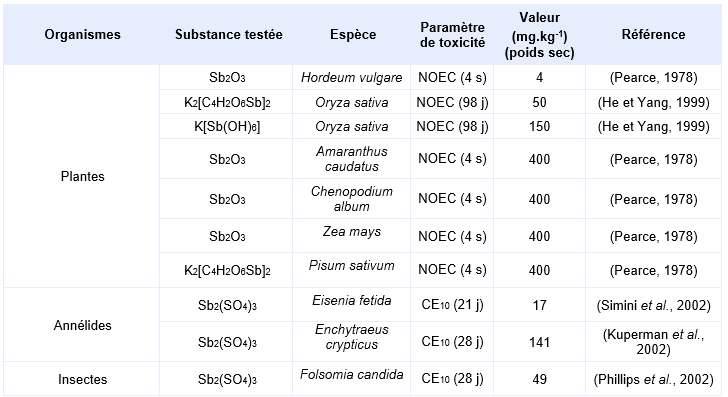
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
NORMES DE QUALITE POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations du guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon le guide technique pour la détermination de normes de qualité environnementales (E.C., 2011), pour les métaux, les données de toxicité en eau douce et eau de mer doivent être séparées a priori. Ceci est dû à la différence de toxicité attendue sur les espèces d'eau douce ou d'eau de mer en raison de la différence dans la spéciation des métaux et leur biodisponibilité ainsi que des capacités d'(osmo)régulation des espèces. Les données ne devraient être combinées que s'il n'y a pas de différence significative démontrable entre la sensibilité de ces deux types d'espèces.
Dans le cas de l'antimoine, une seule donnée d'écotoxicité obtenue sur organisme marin est disponible (un essai en exposition aigüe réalisé sur un poisson) et il n'est donc pas possible de démontrer statistiquement une différence ou une absence de différence de sensibilité entre les espèces marines et d'eau douce. En conséquence, l'AA-QSmarine_eco sera calculée en combinant les données d'eau douce et d'eau de mer. Néanmoins, le facteur d'extrapolation appliqué pour déterminer la AA-QSmarine_eco doit prendre en compte les incertitudes additionnelles telles que la sous-représentation des taxons spécifiques du milieu marin et une diversité d'espèces plus complexe en milieu marin.
![]()
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour l'antimoine, des données aigües et chroniques sont disponibles pour 3 niveaux trophiques. La donnée court terme la plus basse est obtenue sur l'hydre Chlorohydra viridissima, avec une CL50 de 1,77 mg.L-1. Cet organisme est un consommateur secondaire, ce qui le place au même niveau que les vertébrés sur la chaîne trophique (E.C., 2008b). La donnée chronique la plus basse a également été obtenue lors d'un essai sur un consommateur secondaire : le poisson Pimephales promelas (NOEC 28 j à 1,13 mg.L-1). Le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) propose de calculer la AA-QSwater_eco en appliquant un facteur de 10 sur cette valeur. L'INERIS propose donc la valeur suivante :
![]()
![]()
En ce qui concerne les organismes marins, une seule donnée est disponible (un essai en exposition aigüe réalisé sur un poisson) et il n'est pas possible de montrer une différence de sensibilité entre les espèces marines et d'eau douce. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), étant donné que la donnée la plus basse en chronique est obtenue sur un poisson d'eau douce (NOEC (28j) à 1,13 mg.L-1 obtenue pour Pimephales promelas) et que les résultats en exposition aigüe indiquent également un consommateur secondaire (l'hydre Chlorohydra viridissima, avec une CL50 de 1,77 mg.L-1) comme l'espèce la plus sensible, un facteur d'extrapolation de 100 est appliqué pour calculer la AA-QSmarine_eco. L'INERIS propose donc la valeur suivante :
![]()
Concentration Maximum Acceptable (MAC et MACmarine)
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011). Le jeu de données disponibles ne permet pas de mettre en évidence une différence de sensibilité entre les espèces marines et d'eau douce, les données peuvent donc être considérées ensembles.
Pour l'antimoine, le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) recommande d'utiliser un facteur d'extrapolation de 10 pour un jeu de donnée homogène comportant des données pour trois niveaux trophiques différents.
La donnée disponible la plus basse est une CL50 (96h) de 1,77 mg/L obtenue pour Chlorohydra viridissima. L'Ineris propose donc la valeur suivante:
![]()
![]()
En ce qui concerne les organismes marins, une seule donnée est disponible (poisson), il n'est donc pas possible de démontrer statistiquement une différence de sensibilité entre les espèces marines et d'eau douce. Le guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011) prévoit un facteur d'extrapolation de 100 pour un jeu de donnée homogène comportant des données pour trois niveaux trophiques différents :
![]()
![]()

VALEUR GUIDE DE QUALITE POUR LES ORGANISMES BENTHIQUES (QSSED ET QSSED-MARIN)
Une concentration annuelle moyenne est déterminée pour protéger les organismes benthiques dulçaquicoles d'une possible exposition prolongée.
Pour l'antimoine, des données d'écotoxicité aigües sont disponibles pour des espèces benthiques mais les essais ont tous été réalisés dans des milieux aqueux uniquement, ces résultats ne sont donc pas utilisés pour déterminer de QSsed avec la méthode des facteurs d'extrapolation. On dispose en revanche de données chroniques pour 3 espèces benthiques obtenues lors d'essais réalisés dans des milieux eau/sédiment. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 10 s'applique sur la plus faible NOEC valide disponible (NOEC (28j) de 112 mg/kg obtenue pour Chironomus riparius et Lumbriculus variegatus ; soit 78 mg/kg de sédiment humide). L'INERIS propose donc la valeur guide de qualité pour le sédiment :
QSsed dry weight = 112 / 10 = 11,2 mg/kg,
QSsed dry weight = 11 200 μg/kg (soit 7 800 μg/kg poids humide)
En ce qui concerne les organismes marins, aucune donnée long terme valide obtenue lors d'essais sur organismes benthiques marins n'est disponible. La QSsed-marin dry weight peut alors être calculée à partir d'études sur des espèces dulçaquicoles. On dispose de données pour trois espèces d'eau douce aux modes de nutritions différents. Conformément au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011), un facteur d'extrapolation de 50 est appliqué sur la plus faible NOEC disponible et valide (NOEC de 112 mg/kg obtenue pour Chironomus riparius et Lumbriculus variegatus ; soit 78 mg/kg de sédiment humide) pour calculer la QSsed-marin dry weight. L'INERIS propose donc la valeur suivante :
QSsed-marin dry weight = 112 / 50 = 2,24 mg/kg,
QSsed-marin dry weight = 2 240 μg/kg (soit 1 560 μg/kg poids humide)

NORME DE QUALITE EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2011). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés (E.C., 2011).
Pour l'antimoine, un facteur de 90 est appliqué car la durée du test retenu (NOAEL à 1686 mg/kg poids corporel / j sur le rat, soit une NOEC de 33 720 mg.kg-1biota) est 90j. On obtient donc :
QSbiota_sec pois = 111,6 [mg/kgbiota] / 90 = 374,6 mg/kgbiota = 1 240 μg/kgbiota
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
Avec :
BCF : facteur de bioconcentration,
BMF1: facteur de biomagnification,
BMF2: facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biote. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biote.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biote et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF, celles-ci peuvent être estimées à partir du BCF selon le tableau 4-6, page 123, du guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biote, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante selon les espèces considérées.
Les données concernant la bioconcentration de l'antimoine chez les organismes aquatiques (eaux douces et marines) sont très variables selon les auteurs et les espèces. Des BCF de 16 000 pour l'huître marine et de 40 chez des poissons marins ont été mesurés. Au vu du BCF obtenu chez les invertébrés, l'accumulation pourrait être un phénomène significatif, pourtant, compte tenu des faibles concentrations mesurées chez les prédateurs, la bioamplification de l'antimoine le long de la chaine trophique semble peu probable.
Pour l'antimoine, en se basant sur le BCF poisson de 40 et un BMF1 = BMF2 de 1 (l'antimoine ne s'accumule pas le long de la chaine trophique), on a :
QSwater sp = 1 240 [μg/kgbiota] / (40 * 1) = 31 μg/L
QSmarin sp = 1 240 [μg/kgbiota] / (40 * 1 * 1) = 31 μg/L
Pour l'antimoine, avec un BCF mollusque de 16 000 et un BMF1 = BMF2 de 1 (l'antimoine ne s'accumule pas le long de la chaine trophique), on a :
QSwater sp = 1 240 [μg/kgbiota] / (16 000 * 1) = 0,077 μg/L
QSmarin sp = 1 240 [μg/kgbiota] / (16 000 * 1 * 1) = 0,077 μg/L
L'écart entre les résultats obtenus en fonction du BCF choisi est important. Mais la bioaccumulation mesurée sur l'organisme filtreur Crassostrea virginica n'est pas représentative des conditions de prédation attendues dans un milieu naturel. En accord avec le guide technique européen (E.C., 2011) qui recommande d'utiliser un BCF obtenu sur poisson si il est disponible, le BCF de 40 sera utilisé pour la détermination de la norme de qualité pour l'empoisonnement secondaire.
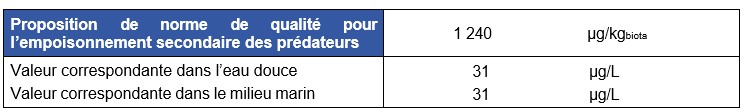
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011) :
![]()
Ce calcul tient compte de :
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 0.4 µg/kgcorporel/j (cf. tableau ci-dessus),
- un poids corporel moyen de 70 kg,
- facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Les composés ne présentent aucune de ces propriétés suite à une exposition orale (le trioxyde d'antimoine est classé catégorie 3 suite à la démonstration d'une augmentation de l'incidence des tumeurs pulmonaires après exposition par inhalation de trioxyde d'antimoine), aucun facteur de sécurité supplémentaire n'est ajouté pour ces effets.
- cons. Journ. Moy : une consommation journalière moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journaliers contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
![]()
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante dans l'eau du milieu peut être estimée en tenant compte de la bioaccumulation de la substance :
- à une concentration dans l'eau douce selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
![]()
En ce qui concerne le choix du BCF, la même démarche que celle employée pour le calcul de la QSwater_sp et la QSmarin_sp est adoptée.
Afin de prendre en compte cet écart important observé sur les BCF, la QSwater_hh food et la QSmarine_hh food seront calculées avec le BCF poisson (40) puis avec le BCF huître (16 000).
Pour les composes d'antimoine, avec un BCFpoisson de 40 et un BMF1 = BMF2 de 1 (l'antimoine ne s'accumule pas le long de la chaine trophique), on obtient donc :
QSwater_hh food = 24,34 / (40 * 1) = 0,6 μg/L
QSmarine_hh food = 24,34 / (40 * 1 * 1) = 0,6 μg/L
Pour les composes d'antimoine, avec un BCFmollusque de 16 000 et un BMF1 = BMF2 de 1 (l'antimoine ne s'accumule pas le long de la chaine trophique), on obtient donc :
QSwater_hh food = 24,34 / (16 000 * 1) = 0,001 μg/L
QSmarine_hh food = 24,34 / (16 000 * 1 * 1) = 0,001 μg/L
L'écart entre les résultats obtenus en fonction du BCF choisi est important. De part la possibilité de l'accumulation de ces composés dans les produits issus de la conchyliculture en mer, et de l'incertitude associée au choix du BCF pour la conversion de la valeur dans le biote en une valeur dans l'eau marine, l'INERIS recommande de mesurer la concentration d'antimoine dans les mollusques marins pour les milieux marins.
Pour les eaux continentales, la substance peut être suivie dans l'eau avec pour référence la QSwater_hh food calculée avec le BCF poisson ou bien être suivie dans le poisson.
Pour les composes d'antimoine :

NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
En principe, lorsque des normes de qualité dans l'eau de boisson existent, soit dans la Directive 98/83/CE (C.E., 1998), soit déterminées par l'OMS, elles peuvent être adoptées. Les valeurs réglementaires de la Directive 98/83/CE doivent être privilégiées par rapport aux valeurs de l'OMS qui ne sont que de simples recommandations.
Il faut signaler que ces normes réglementaires ne sont pas nécessairement établies sur la base de critères (éco)toxicologiques (par exemple les normes pour les pesticides avaient été établies par rapport à la limite de quantification analytique de l'époque pour ce type de substance, soit 0.1 µg.L-1). Pour l'antimoine, la Directive 98/83/CE fixe une valeur de 5 µg.L-1.
A titre de comparaison, la valeur seuil provisoire pour l'eau de boisson est calculée de la façon suivante (E.C., 2010):
![]()
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour ; pour cette substance elle sera considérée égale à 0,4 µg/kgcorporel/j (cf. tableau ci-dessus),
- cons.moy.eau [L.j-1] : une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0,1) afin de tenir compte de ces autres sources de contamination possibles.
- facteur de sécurité supplémentaire pour tenir compte des potentiels effets CMR ou de perturbation endocrine de la substance. Les composés ne présentent aucune de ces propriétés via exposition orale (le trioxyde d'antimoine est classé catégorie 3 suite à la démonstration d'une augmentation de l'incidence des tumeurs pulmonaires après exposition par inhalation de trioxyde d'antimoine), le facteur de sécurité est fixé à 1.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
Ainsi, la norme de qualité correspondante dans l'eau brute se calcule de la manière suivante :
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour les composes d'antimoine , obtient :
![]()
La valeur fixée par la directive 98/83/CE est plus élevée que la valeur calculée ici mais possède une portée réglementaire et s'applique.

Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
SELECTION DE LA VALEUR GUIDE ENVIRONNEMENTALE
Elle est définie à partir de la valeur la plus protectrice parmi tous les compartiments étudiés.
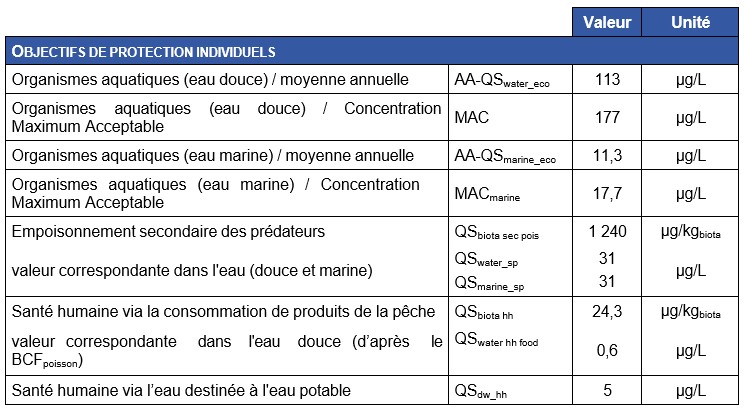
Pour l'antimoine et ses dérivés, la valeur guide proposée pour la santé humaine via la consommation de produits de la pêche est la valeur la plus faible pour l'ensemble des approches considérées. Il est recommandé pour le milieu marin de mesurer la concentration d'antimoine directement dans la chair des mollusques marins.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
L'Antimoine, élément chimique n°51 de symbole (Sb) et de numéro CAS 7440-36-0, est un métalloïde ubiquitaire que l'on trouve généralement sous forme minérale de stibine (Sb2S3) dans la nature en relative faible abondance.
La Chine est le principal fournisseur mondial de minerais d'antimoine, extrait seul ou issu de la coproduction d'autres métaux, avec près de 75% d'un marché représentant environ 143 000 tonnes en 2016.
L'antimoine est rarement utilisé en tant que tel et subit généralement des transformations chimiques avant d'être réutilisé le plus souvent sous forme de trioxyde d'antimoine (Sb2O3) dont la Chine est aussi le principale fournisseur.
L'antimoine est utilisé dans une gamme très variée de produit textiles, plastiques, alliages métalliques. Il est principalement utilisé en tant que retardateur de flamme (≈45-60%) dans l'industrie plastique et textile. On le retrouve aussi en grande partie (≈30%) dans les batteries Plomb-acide bien qu'il s'agisse d'un usage en déclin. Enfin on le retrouve dans de multiples usages mineurs tel que la plasturgie des polymères, les munitions, l'électronique, les peintures et céramiques…
La plupart des rejets dans l'environnement sont majoritairement atmosphériques et d'origine anthropogénique, et sont associés aux exploitations minières, métallurgiques, à la combustion de charbon dans le secteur de l'énergie, l'abrasion des plaquettes de freins, à l'incinérations des déchets municipaux. Les rejets vers les sols et les milieux aquatiques proviennent des stations d'épuration et de l'ensemble du cycle de vie des produits et matériaux contenant de l'antimoine (plastiques, textiles, peintures, alliages métalliques, scories).
L'antimoine présente peu d'alternatives soutenables et sa demande est en constante augmentation alors que seule la filière des batteries Plomb-Antimoine valorise ses déchets à l'heure actuelle. Ainsi, rien ne laisse prévoir une réduction des émissions dans l'environnement à court ou moyen terme.
Abstract
Antimony, a chemical element n°51 and CAS n°7440-36-0, is a ubiquitous metalloid mainly found under its mineral shape named stibnite (Sb2S3) in a relative low abundance.
Either retrieved alone or as a by product during others metals mining process, China is the main supplier of the world antimony ores market, representing a share of ≈75% out of an overall volume estimated around 143 000 tonnes in 2016.
Antimony is rarely consumed in its basic state and is usually undergoing chemical process. Its most common compound is Antimony Trioxide (Sb2O3) which is also mainly produced in China as well.
Antimony is employed in a wide variety of end-uses such as textiles, plastics or alloys. Its main application will be found in flamme-retardant market (≈45-60%) for plastics and textiles. Lead-acide batteries market do also request antimony accounting for ≈30% of global use, even though it is a declining market. Finally, antimony finds application in plenty other minor market such catalyst/heath-stabilizer for polymeres, ammunitions, electronics, painting and coating, ceramics…
Most of its release within the environment arises from anthropogenic sources polluting atmosphere linked to mining activities, metallurgy, coal combustion for energy purpose, brake wear, municipal waste incineration. Waters and Soils contamination occurs from sewage treatment plant and antimony containing products life-cycle as a whole (plastics, textiles, paints, alloys, slags).
Antimony does not exhibit much sustainable alternatives, its demand is not forecast to lower while only lead-antimony batteries sector performs effective recycling (≈90%), thus we do not expect antimony emissions to decline in the upcoming years.
Tableaux de synthèse
Généralités
| CAS | 7440-36-0 |
|---|---|
| SANDRE | 1376 |
| Usages principaux |
FTE 2015 Importer Retardateur de flamme et alliage plomb notamment pour batteries |
| Autres informations d'usage |
FTE 2015 Importer Catalyseur pour la production de PET Composant pour vernis, peinture, pigment Sulfides Antifrictions Médicaments antiparasitaire |
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les paragraphes ci-après présentent les principaux textes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. TEXTES GENERAUXREACHDans le cadre du règlement REACH concernant la mise sur le marché des substances chimiques1 , l'antimoine (Sb) et ses composées ne font pas à l'heure actuelle partie de la liste des substances soumises à restrictions quant à leurs fabrication, mise sur le marché et utilisations (Annexe XVII), ni de la liste des substances soumises à autorisation (Annexe XIV). Cependant, l'antimoniate de plomb (O7Pb2Sb2), aussi appelé « Jaune de Naples » est inscrit sur la liste des SVHC2 de REACH étant donné son caractère reprotoxique. De plus, l'antimoine et certains de ses composés, au vu des diverses sources de dangers reportées et ou suspectées par des entreprises auprès de l'ECHA, font partie du programme CoRAP (Community rolling action plan) et des investigations sont réalisées en 20183 par le BAuA (Institut fédéral de la sécurité et de la santé au travail allemand) en particulier sur l'antimoine (Sb), le trisulfure d'antimoine (SB2S3), le trioxyde de diantimoine (Sb2O3), le trichlorure d'antimoine (Cl3Sb). [1] En application du Règlement (CE) n° 1907/2006 du 18/12/06 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), instituant une agence européenne des produits chimiques [2] « Substances of Very High Concern”, candidates à une inscription sur la liste des substances soumises à autorisation. [3] Les résultats ne sont pas connus à la date de publication de cette fiche, ainsi on ne sait pas si cette évaluation peut déboucher à terme sur une inscription à la liste des SVHC. RÈGLEMENT (CE) 689/2008L'antimoine et ses composés ne figurent pas dans la liste des substances soumises aux notifications d'importations et d'exportations issue du règlement (CE) 689/2008 (Annexe I). DIRECTIVE SUR LES EMISSIONS INDUSTRIELLESLa Directive relative aux émissions industrielles du 24 novembre 2010 (2010/75/UE) prolonge les actions menées par l'Europe en matière de contrôle et de réductions de la pollution émise par ces installations, et établit des valeurs limites par secteur industriel sur des rejets de substances avérées et ou soupçonnées d'être dangereuses pour l'homme et/ou son environnement. L'antimoine et ses composés font l'objet de plages de rejets associés aux Meilleures Techniques Disponibles 4 dans plusieurs secteurs (notamment installations d'incinération ou co-incinération des déchets, grandes installations de combustion, industrie des métaux non-ferreux…) Par exemple, dans le secteur de l'incinération, ces plages de rejets associées aux MTD sont les suivantes :
[4] L'ensemble des conclusions relatives aux Meilleures Techniques Disponibles est consultable sur https://aida.ineris.fr/guides/directive-ied/documents-bref DIRECTIVE CADRE EAU (DCE)L'antimoine (Sb) ainsi que ses composées ne font pas partie de la liste des substances prioritaires. REGLEMENTATION D'USAGESRÉGLEMENTATION DES PRODUITS COSMÉTIQUESLa Réglementation européenne en matière de produit cosmétique s'appuyant sur le texte CE n°1223/2009 visant à assurer un niveau élevé de protection de la santé indique que l'antimoine et ses composés sont interdits dans la conception des produits cosmétiques. REGLEMENTATION CONCERNANT LA MISE SUR LE MARCHE DES JOUETSConformément à la directive 2009/48/EC du 18 juin 2019 encadrant la sécurité relative à la mise en marché des jouets au sein de l'Union Européenne, les acteurs de la filière sont tenus de respecter des limites de migration pour les jouets et leurs composants. Ces limites de migration sont les suivantes pour l'antimoine5 :
Ces valeurs limites ne s'appliquent pas aux jouets ou composants de jouets qui, en raison de leur accessibilité, de leur fonction, de leur volume ou de leur masse, excluent tout danger par succion, léchage, ingestion ou contact prolongé avec la peau. [5] Aucune précision sur les composés d'antimoine. REGLEMENTATION DES MATERIAUX PLASTIQUES EN CONTACT AVEC LES DENREES ALIMENTAIRESLe règlement européen (EU) N°10/2011 du 14 janvier 2011 établit un cadre concernant les matières plastiques, ainsi que les substances chimiques participant à leur composition, et leur entrée en contact avec les aliments. Or le trioxyde d'antimoine (Sb203), est utilisé en raison de ses propriétés ignifugeantes dans la fabrication de polymères et plus précisément de matières plastiques éventuellement destinées à entrer en contact avec des denrées alimentaires. Etant donné le danger du trioxyde d'antimoine6 celui-ci fait l'objet d'une valeur limite7 concernant la composition des matières plastiques entrant en contact avec les denrées alimentaires fixée à 0,04 mg/Kg. [6] Voir la section CLP ainsi que la fiche INRS dont le trioxyde d'antimoine fait l'objet [7] Valeur limite de migration de la substance en mg vers la denrée alimentaire en Kg. REGLEMENTATION DES ADDITIFS ALIMENTAIRESLe règlement européen (EU) No 231/2012 du 9 Mars 2012 établit un cadre légal concernant l'utilisation d'additifs alimentaires. Ainsi, des limites spécifiques visant l'antimoine s'appliquent dans certains additifs :
REGLEMENTATION DU TRANSPORT DES DECHETSLe règlement européen (CE) N°1013/2006 du 14 juin 2006 encadrant le transfert des déchets à risque et notamment en dehors de la communauté européenne s'inscrit dans la lignée de la Convention de Bâle du 22 mars 1989. Dans cet effort de contrôler les flux de déchets dangereux et d'en protéger les pays en développement n'ayant les moyens de les valoriser, des procédures de notifications et de restrictions ont été établies. Ainsi les déchets contenant de l'antimoine et ses composés sont interdits à l'exportation (article 36 et Annexe VIII convention de Bâle) 8 . [8] A l'exception des débris métalliques (y compris alliages), propres, non contaminés, sous forme de produits finis (feuilles, tôles, poutrelles, fil machine, etc.) et sur dérogation suite à l'étude d'un dossier. |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Les paragraphes ci-après présentent les principales valeurs et normes en vigueur à la date de la rédaction de cette rubrique. Cet inventaire n’est pas exhaustif. SEUILS DE REJETS POUR LES INSTALLATIONS CLASSEES ET EXPLOITANTS DE STATION D'EPURATION D'EAUX URBAINESL'antimoine et ses composés sont visés par l'arrêté du 26 décembre 2012 modifiant l'arrêté du 31 janvier 2008 concernant le registre et la déclaration annuelle des émissions polluantes et des déchets en provenance des installations classées pour la protection de l'environnement et exploitants de station d'épuration d'eaux urbaines. L'exploitant d'une installation définie dans l'annexe I doit déclarer ses rejets lorsque ceux-ci dépassent le seuil indiqué dans l'annexe II soit :
Pour les installations d'incinération de déchets non dangereux et les installations d'incinération de déchets dangereux, ce seuil est fixé à 0. L'arrêté du 14 février 2007 fixe une valeur limite s'appliquant aux rejets d'antimoine et ses composés dans les eaux naturelles ou dans un réseau d'assainissement collectif urbain en provenance des installations classées relatives au travail chimique du verre (rubrique n° 2531). Celles-ci doivent respecter une valeur limite de concentration de 0,3 mg.l-110 . L'arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation indique que l'exploitant prend toutes les dispositions nécessaires dans la conception et l'exploitation des installations pour réduire la pollution de l'air à la source. Les seuils suivants s'appliquent :
Les émissions directes ou indirectes d'antimoine et de ses composés sont interdites dans les eaux souterraines, à l'exception de celles dues à la réinjection dans leur nappe d'origine d'eaux à usage géothermique, d'eaux d'exhaure des carrières et des mines ou d'eaux pompées lors de certains travaux de génie civil, conformément aux dispositions de l'arrêté ministériel du 10 juillet 1990 modifié. Cette interdiction ne s'applique pas aux eaux pluviales. [10] Moyenne quotidienne, de plus aucune valeur instantanée ne doit dépasser le double des valeurs limites de concentration. Nomenclature des installations classées L'antimoine est concerné par des textes, notamment pour les rubriques suivantes de la Nomenclature des Installations Classées9 :
[9] Mise à jour par le Ministère de l'Ecologie et du Développement Durable, version consultée en décembre 2018. NORMES ET VALEURS APPLIQUEES EN EAU POTABLELes concentrations limites pour les eaux destinées à la consommation humaine sont issues de l'arrêté du 11/01/07 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine12 . Pour l'antimoine, la limite de qualité des eaux destinées à la consommation humaine est de 5 µg.L-1. [12] Arrêté du 11/01/07 relatif aux limites et références de qualité des eaux brutes et des eauxdestinées à la consommation humaine mentionnées aux articles R. 1321-2, R. 1321-3, R. 1321-7 et R.1321-38 du code de la santé publique VALEURS UTILISEES DANS LE CADRE PROFESSIONNELEn France, l'Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles (INRS) publie des valeurs limites d'exposition professionnelles, celles qui concernent des composés de l'antimoine figurent dans le Tableau 3 : Tableau 3 : Valeurs limites professionnelles d'exposItion 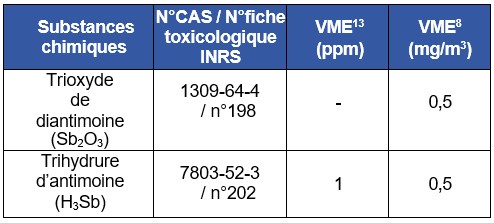 [13] VME = Valeur moyennes d'exposition AUTRES TEXTESMICROPOLLUANTS ET CONTROLE DE LA QUALITE DES EAUXDans le cadre de l'application de la directive européenne cadre sur l'eau (DCE) et des réglementations et efforts européens de contrôle des polluants qui ont suivi, la France planifie au travers du code de l'environnement le contrôle de la qualité des eaux (article L212-2). L'antimoine fait partie de la liste des substances pertinentes à surveiller dans les eaux de surface et souterraines (Arrêté du 7 août 2015 modifiant R. 212-22). De plus, L'antimoine fait partie de la liste initiale des substances pertinentes à surveiller dans le cadre de la circulaire 29/09/10 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées (STEU). Il n'est pas retenu dans la note technique sur les STEU (12/08/16) prise dans le cadre de l'action de recherche RSDE. CONVENTION DE BARCELONEDans le cadre de la convention de Barcelone, la directive n°2013/5/UE du 17 décembre 2012 fixe un cap pour la protection du milieu marin et du littoral de la Méditerranée contre la pollution résultant de l'exploration et de l'exploitation du plateau continental, du fond de la mer et de son sous-sol. A ce titre, l'antimoine est inscrit à la liste des substances et matières nuisibles ou nocives dont le rejet dans la zone du protocole est assujetti à permis spécial. RÈGLEMENTATION AUX ETATS UNISL'antimoine fait partie de la liste des substances prioritaires de l'ATSDR14 (Agency for Toxic Substances and Disease Registry). L'antimoine et ses composés fait également partie de la liste des 188 substances toxiques ou fortement soupçonnées de la section 112 du CAA (Clean Air Act) émise par l'EPA (Agence pour l'Environnement aux Etats-Unis). [14] https://www.atsdr.cdc.gov/spl/resources/1992_atsdr_substance_priority_list.html |
| Informations complémentaires |
L’Antimoine, élément chimique n°51, est un métalloïde de symbole (Sb), du nom latin stibium, faisant référence à sa forme la plus courante dans la nature la stibine (Sb2S3). |
Volume de production
| France |
FTE 2015 Importer 0 t.an-1 (Sb) (2017) ≈7000 t.an-1 (Sb203) (2017) |
|---|---|
| UE |
FTE 2015 Importer 0 t.an-1 (Sb) |
| Monde |
FTE 2015 Importer 143000 t.an-1 (Sb) (2016) |
Consommation
| Volume de consommation en France |
FTE 2015 Importer Pas d'information |
|---|---|
| Part de la consommation dédiée à l’usage principal en France |
65% BRGM (2011) |
Présence dans l'environnement
| Eaux de surface |
FTE 2015 Importer Eaux de surface marines : 184 ± 45 ng.l-1 en moyenne (filella et al, 2002) Eaux douces : quelques ng.l-1 a quelques µg.l-1 (moyenne 0,23 µg.l-1 en eau douce en France en moyenne entre 2015 et 2017) |
|---|---|
| Eaux souterraines |
FTE 2015 Importer Eaux de pluie et eaux souterraines : < 1 µg.L-1 (ATSDR, 2017) |
| Air |
FTE 2015 Importer < 1 ng.m-3 (ATSDR, 2017) |
| Sols |
FTE 2015 Importer Abondance de 0,2 ppm dans la croûte terrestre (BRGM) |
| Informations complémentaires |
L’Antimoine, élément chimique n°51, est un métalloïde de symbole (Sb), du nom latin stibium, faisant référence à sa forme la plus courante dans la nature la stibine (Sb2S3). Elle se présente sous la forme d’un solide cristallin de couleur gris argenté brillant. Il ne ternit pas dans des conditions climatiques courantes et il s’agit d’un mauvais conducteur d’électricité et de chaleur. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
PRODUCTION MINIERE
Figure 2 : La filière de l'antimoine dans le monde
(Source : BRGM)
La plupart des sources d'information sur les minéraux (BRGM, BGS, USGS…) attire notre attention sur le manque d'informations et de transparence concernant la production, les réserves et la consommation d'antimoine. Certains chiffres sont le résultat d'estimations et peuvent être sous-évalués.
PRODUCTION MINIERE CONTEMPORAINE
Les réserves mondiales sont estimées à 1 800 000 t d'équivalent antimoine (Dupont, Arnout, Jones, & Binnemans, 2016), et la Chine en compte à elle seule 950 000 t d'après les chiffres publiés par l'état. Elle est suivie par la Russie, 350 000 t, et la Bolivie 310 000 t.
La production minière est principalement concentrée en Chine à près de 75 % ce qui en fait l'acteur majeur du marché. Les autres producteurs notables sont le Tadjikistan et la Russie. Bien qu'il ait existé des mines produisant de l'antimoine par le passé en Union européenne, il n'y a désormais plus aucun producteur, ce qui place l'UE dans une position de déficit commercial vis-à-vis de cette ressource.
Figure 3 : Production mondiale minière d'antimoine en 2016 (en tonne de métaux)
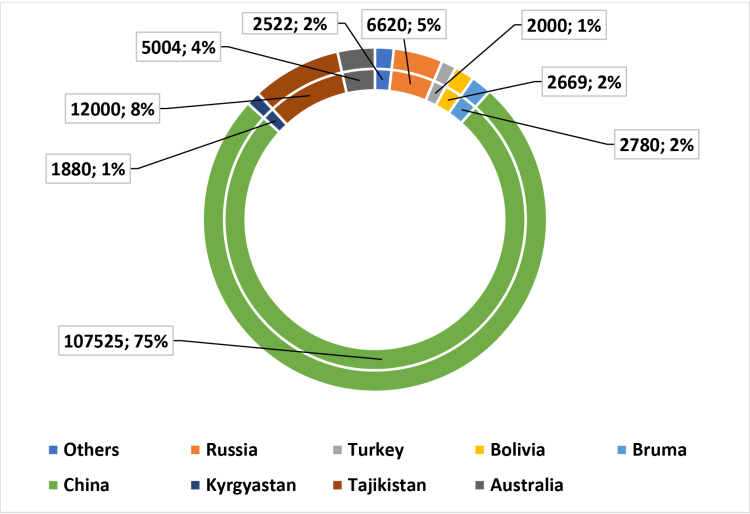
Source : British Geological Survey 2012-2016
Figure 4 : Evolution de la Production Mondiale minière d'Antimoine (en tonne d'antimoine)
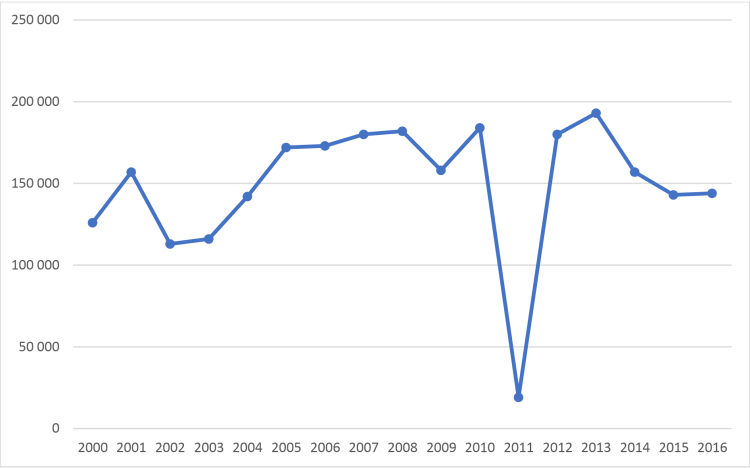
Source : USGS
PRODUCTION MINIERE HISTORIQUE EN FRANCE
Jusqu'en 1991 la France a extrait de ses sols de l'antimoine pour une production totale cumulée de 154 900 t (BRGM, Avril 2015). En effet, la France fut même au premier rang de la production minière mondiale d'antimoine entre 1890 et 1908. Le principal site se situant à la Lucette (53) avec une production historique de 42 000 t. Dans les sites notables on retrouvera aussi les sites de Brioude-Massiac (43/15) et de Rochetréjoux (85). Quelques tentatives d'exploitation perdureront dans les années 80-90 jusqu'à la fermeture du site de Les Brouzils en Vendée.
Figure 5 : Potentiel des gites et gisements français d'antimoine
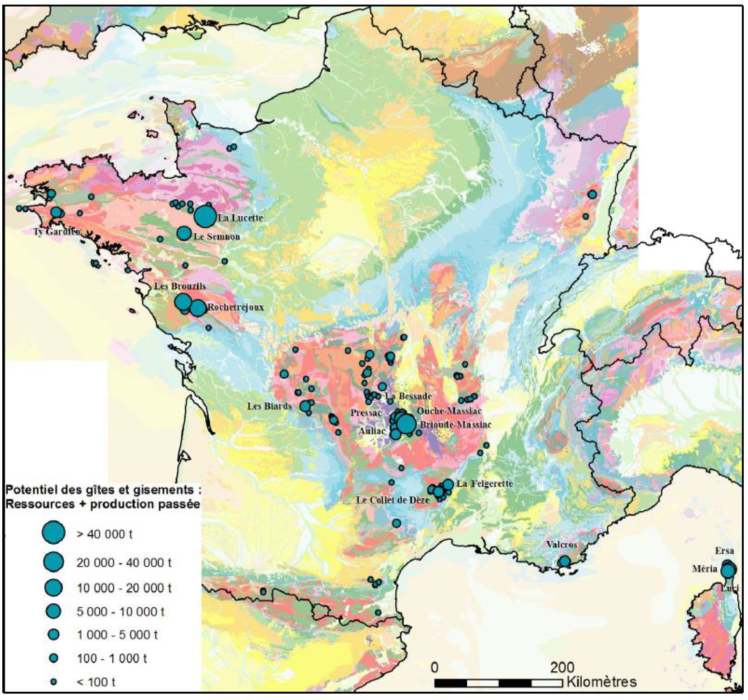
(Source : BRGM , 2011)
PRODUCTION SECONDAIRE D'ANTIMOINE
L'antimoine est utilisé dans des alliages avec d'autres métaux (Plomb, Zinc, Etain, Fer, Nickel…) pour augmenter leur durabilité, notamment dans la confection de batteries plomb-acide et dans une moindre mesure dans les munitions, tôles, tuyaux, câbles, paliers à roulement… Ainsi l'antimoine à l'instar des autres métaux fait l'objet d'un marché secondaire principalement basé sur le recyclage des batteries plomb-acide contenant de l'alliage Pb-Sb qui représente environ 25 % de la consommation d'antimoine (pour un taux de recyclage des batteries se situant autour de 85%). Les batteries sont fondues puis les différents éléments sont récupérés à la suite d'un processus d'affinage.
Celui-ci a été motivé par l'accroissement des prix observé autour de 2010 résultant d'une régulation plus importante des licences d'exploitations et des quotas d'exportations chinois de la production minière d'antimoine.
Figure 6 : Production secondaire d'antimoine aux États-Unis (T/Sb)
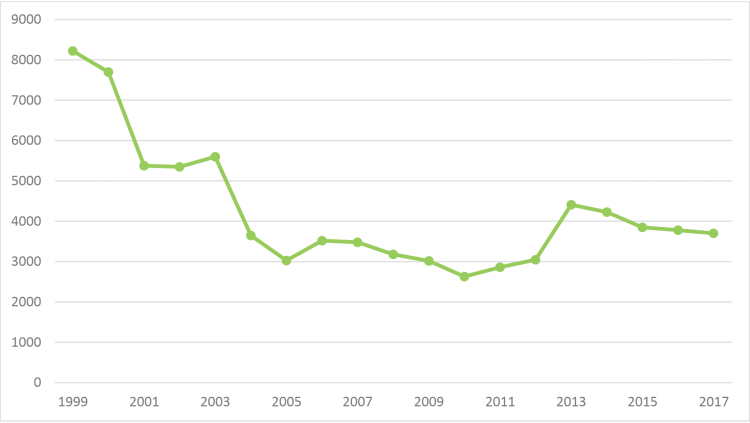
(Source : USGS)
Auparavant un ralentissement de la production secondaire avait été observé au début des années 2000 qui pourrait s'expliquer par la baisse du prix de la source d'antimoine primaire principalement venu de Chine. On observe actuellement, une stabilisation de la production secondaire d'antimoine illustrée par l'exemple des Etats-Unis (Figure 6) qui pourrait s'expliquer par la demande croissante en composés de l'antimoine du secteur des retardateurs de flamme.
L'offre de déchets antimoniés recyclables pourrait se réduire au fur à mesure du remplacement des batteries plombs-antimoine par des batteries plomb-calcium (USGS, 2013). Une tendance d'autant plus marquée par la réduction des doses d'antimoine dans les produits finaux18 (Roskill, 2018). Enfin l'émergence de substituts à la batterie plomb-acide notamment motivée par le marché de l'automobile électrique pourrait entrainer de lourds changements sur la production secondaire d'antimoine.
[18] https://roskill.com/market-report.an-1timony/
PRODUCTION DES COMPOSES D'ANTIMOINE
L'antimoine est couramment vendue aussi sous forme manufacturée de sels, poudres et notamment sous forme oxydée (Sb2O3) qui répond à son usage principal en tant que retardateur de flamme dans les textiles et plastiques. Le trioxyde d'antimoine peut être produit par grillage de trisulfure d'antimoine, par combustion d'antimoine dans l'air ou dans l'oxygène, par hydrolyse alcaline de composés halogènes d'antimoine (trichlorure, tribromure ou triiodure), ou par hydrolyse du trisulfure d'antimoine avec de la vapeur surchauffée19 .
Tout comme l'antimoine, la majorité de la production de ses composés émane de la Chine. En effet, la production de trioxyde d'antimoine est assurée à plus de moitié par la Chine seule (BRGM, 2011). Cependant, contrairement à la production minière, la production de trioxyde d'antimoine, de sulfures ou encore de chlorures d'antimoine est également établie en Europe. Un rapport du BRGM (2011) s'appuyant sur les données de l'USGS estimait la production du trioxyde d'antimoine mondiale à 107 500 t (masse brute) pour l'année 2006 dont 7500 t pour la France. Malheureusement, il n'existe pas de source d'information publique de la production des autres composés
http://www.sica-chauny.com/fr/http://www.pcdlucette.com/ Deux sites situés en France assurent la production de Sb2O3 ainsi que de catalyseurs nécessaires à la plasturgie : la Société Industrielle et Chimique de l'Aisne (SICA) (02) également 1ier producteur européen de trioxyde d'antimoine avec une production annoncée à plus de 10 000 t par an () et la Société des Produits Chimiques de la Lucette (SPDL) (53) (). Ces deux sites sont des filiales de la société belge Sudamin.
[19] Fiches toxicologiques et environnementales des substances chimiques, INERIS 2007
COMMERCE MONDIAL ET BALANCE COMMERCIALE FRANÇAISE
ECHANGES INTERNATIONAUX ET COURS DE L'ANTIMOINE
L'illustration ci-dessous synthétise les échanges commerciaux relatif à l'antimoine, qui à l'image de la production sont centrés sur la Chine.
Figure 7 : Commerce international de l'antimoine
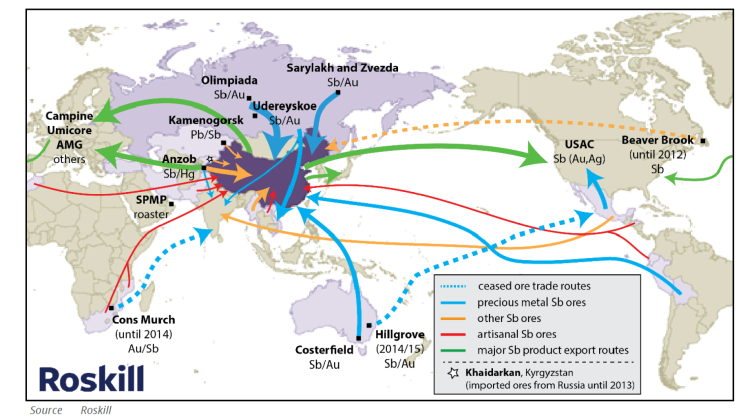
Figure 8 : Cours de l'antimoine basé sur le London Exchange Market index, référence du marché mondiale des métaux non ferreux (US$/t).
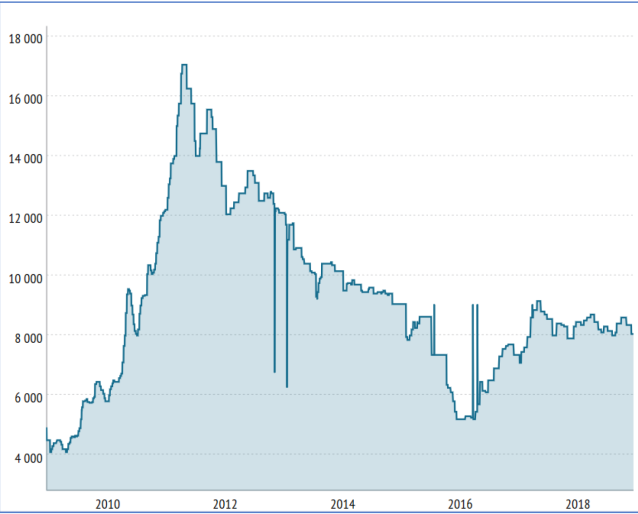
Source : Les Echos investir20 (2018)
L'accroissement des prix autour de 2010 pourrait s'expliquer par la mise en place de quotas sur les exportations chinoises21 . Roskill 22 estime qu'une diminution de la demande est à prévoir dans le secteur des batterie plomb-acide et inversement une augmentation pour la demande dans l'industrie des plastique et textiles (Catalyseurs et Retardateur de flamme)
[20] https://investir.lesechos.fr/cours/matiere-premiere-antimoine-9965pc,wmpcb,ant,ant,opid.html
[21] https://www.globaltradealert.org/state-act/7830
[22] https://roskill.com/market-report.an-1timony/
BALANCE COMMERCIALE FRANÇAISE
D'après le département des statistiques et des études du commerce extérieur23 , en 2017 :
- Les importations de minerais d'antimoine et leurs concentrés représentent 90 milliers d'euros pour une masse totale de 13 tonnes dont 83% depuis la Chine et 14% depuis les Pays-Bas. On ne relève aucune exportation, car il n'y a pas de production.
- Le trioxyde d'antimoine représente une valeur d'exportation de l'ordre de 47 millions d'euros soit 6 596 tonnes avec pour principaux partenaires l'Allemagne (34%), l'Italie (14%), l'Espagne (13%) et le Royaume-Unis (9%). Les importations représenteraient un volume de 979 tonnes pour une valeur de 7 millions € avec pour principal fournisseur la Belgique (80%).
- Le plomb antimonié représenterait un volume d'exportations de l'ordre de 6 752 tonnes pour une valeur de 16 millions € avec pour principaux clients l'Allemagne (67%), la Thaïlande (20%) et la Hongrie (10%). Les importations représentent un volume de 34 807 tonnes pour une valeur de 50 millions € avec pour fournisseurs le Royaume-Uni (77%) et la Belgique (23%).
PERSPECTIVES ECONOMIQUES
Les avis concernant les perspectives économiques font état d'une diminution future de la production minière chinoise qui représente la majeure partie de la production mondiale et est donc au centre des attentions des acteurs du marché (Roskill, 2018)29 . Exceptée la consommation dans le marché des batteries au Plomb, la plupart des usages semble en constante augmentation (European Commission, 2014). De nouveaux usages mineurs soumis à forte concurrence se développent, dans la plasturgie (catalyseur pour les polymères, stabilisateurs de chaleur…), les semi-conducteurs, condensateurs miniaturisés, générateurs thermoélectriques, technologies infrarouges, couches conductrices (ATO) (USGS, 2013) (BRGM, 2011).
Même si de nouveaux sites miniers pourraient voir le jour (Arménie, Australie, Canada, Géorgie, Italie, Laos, Russie, and Turquie) (USGS, 2013) l'UE a ajouté l'antimoine à la liste des matières premières critiques faisant l'objet d'une surveillance accrue dont la recherche d'alternatives est encouragée (European Commission, 2014) en raison de sa rareté, de l'absence de production minière européenne et du quasi-monopole chinois, de l'augmentation constante de notre consommation globale et du manque de substituts soutenables (puisque souvent les alternatives présentent des caractéristiques similaires).
[23] http://lekiosque.finances.gouv.fr/site_fr/NC8/recherche.asp?t=2&iter=2&CS=antimoine
Procédés de production
INFORMATIONS MINERALOGIQUES
L'Antimoine (Sb) est présent en relative faible quantité, avec une abondance moyenne de 0,2 ppm dans la croute terrestre ce qui est comparable au cadmium mais jusqu'à 10 fois inférieur à l'arsenic d'après le BRGM. Cela la positionne donc au 65iéme rang par ordre d'abondance.
Rarement présent sous sa forme native, il existe plus d'une centaine de minerais contenant de l'antimoine. En effet, l'antimoine étant chalcophile il a tendance à s'associer au souffre ainsi qu'aux métaux lourds (Anderson, 2012). La forme la plus courante est le trisulfure d'antimoine (Sb2S3) ou plus communément stibine :
Figure 1 : Photographie de Stibine, Vendée16

L'antimoine peut aussi être retrouvé sous ses formes oxydées (III et V) telles que le trioxyde d'antimoine (Sb2O3).
Aussi, Les gisements d'antimoine contenant de faibles volumes, il est également récupéré en tant que coproduit de l'extraction des métaux auxquels on le retrouve associé tel que l'or, le plomb, zinc, fer…
Tableau 5 : Récapitulatif des principaux minerais antimoniés
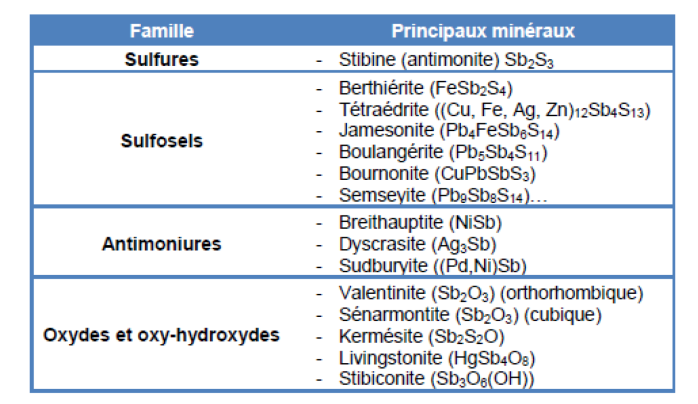
(Source : BRGM)
Du fait de la faiblesse des réserves d'antimoine connues, d'un nombre d'acteurs restreint et fournissant peu d'informations (Chine, Russie…), de son importance économique, du manque d'alternatives identifiées à ses usages, la Commission Européenne l'inclut dans la liste des matières premières en situation critique17 .
[16] Source illustration ( )(https://www.les-mineraux.fr/product/stibine-les-brouzils-vendee-8/)
[17] Report on critical raw materials for the EU, Avril 2014, Commission Européenne Une version plus récente (2017) de la liste existe et dresse un constat similaire tout en ajoutant d'autres matériaux
PROCEDE DE PRODUCTION
L'antimoine, retrouvé en grande majorité sous forme de minerais, doit être séparé des autres métaux post-extraction à l'aide de techniques métallurgiques.
Les minerais sont broyés puis flottés, ce qui génère des concentrés de sulfures et sulfosels.
Ils sont à leur tour grillés afin de produire du trioxyde d'antimoine réduit par la suite en antimoine sous forme de métal.
L'antimoine, en tant que coproduit notamment de la production du plomb, peut être récupéré lors de l'affinage de celui-ci par oxydation afin d'en éliminer les impuretés.
Utilisations
FTE 2015 Importer
L'Europe représentait 19% de la consommation d'antimoine en 2011, devancée par l'Asie (59%) et à égalité avec l'Amérique du Nord (15%) (European Commission, 2014).
L'antimoine sous ses différentes formes est utilisé dans une grande variété de secteurs en vertu de ses propriétés chimiques (résistance à la corrosion, mauvais conducteur d'électricité et de chaleur) :
Figure 9 : Répartition de la consommation d'antimoine en UE (2011)
RETARDATEURS DE FLAMME ET PLASTURGIE
L'antimoine, sous sa forme oxydée (Sb2O3 et Sb2O5), est principalement utilisé dans le secteur des retardateurs de flamme servant dans les plastiques, l'électronique ou encore les vernis (Dupont, Arnout, Jones, & Binnemans, 2016). Il n'est généralement pas utilisé seul mais en tant qu'ignifugeant secondaire ou dans la préparation d'une substance dont la synergie des composants donnera les propriétés ignifugeantes voulues.
Ainsi l'antimoine sera régulièrement associé avec des halogènes (Trifluorure d'antimoine, Tribromure d'antimoine, trichlorure d'antimoine) comme les retardateurs de flamme bromés (RFB) (Gensch, Baron, Blepp, Bunke, & Moch, 2014) entrant dans la composition de nombreux polymères (PVC, PE, Polyester…).
On le trouvera notamment dans la confection des gaines isolantes servant dans la plupart des appareils électroménagers et dans l'industrie automobile (BRGM 2011). On peut le retrouver aussi dans la confection de film plastiques, packaging, bouteilles, vêtements, tapis et rideaux, prises électriques, parechocs, matériaux pour l'aérospatiale, résines, adhésifs par exemple (BRGM 2011) (Gensch, Baron, Blepp, Bunke, & Moch, 2014).
En plus de ces applications en tant que retardateur de flamme dans la plasturgie, on va également retrouver l'antimoine en tant que catalyseur dans les processus d'estérification des fibres et résine de PET (Polytéréphtalate d'éthylène) et comme stabilisateur de chaleur, par exemple dans le processus de fabrication du PVC bien qu'il s'agisse d'un marché un peu plus restreint mais en augmentation constante (BRGM, 2011).
BATTERIE PLOMB-ACIDE ET ALLIAGES METALLIQUES
L'antimoine est aussi utilisé dans la fabrication des batteries plomb-acide, en effet il va permettre de durcir le plomb et d'augmenter sa résistance à la corrosion. On parle ici d'une teneur de 10 à 12%. Il s'agit d'un marché amené à se réduire avec la baisse des teneurs en antimoine dans les batteries pour des raisons d'efficience au profit du calcium, de l'étain, ou encore de l'aluminium (Dupont, Arnout, Jones, & Binnemans, 2016).
L'antimoine entre dans la composition de nombreux autres alliages avec des métaux accroissant leur durabilité comme le zinc, l'étain, le cuivre, le fer pour ne citer qu'eux. En plus des batteries, on va aussi le retrouver dans la confection de tôles, tuyaux, soudures, paliers à roulement, ceinture de convoyage, « métal anglais » (couverts), matériaux antifrictions, munitions, dans le brunissage du fer, les piles thermoélectriques ou encore les semi-conducteurs (électrodes, transistors…) pour l'électronique (allié à l'Indium ou encore l'étain) et autrefois les caractères d'imprimerie (BRGM, 2011).
L'utilisation dans les munitions pourrait donner lieu à des émissions dans l'environnement (munitions de chasse actuelles, ou anciennes zones de conflit).
PEINTURES, CÉRAMIQUES, VERRES ET AUTRES
L'antimoine entre dans la fabrication des pigments (Jaunes de Naples, Jaune Titane…) et de vernis pour la peinture, notamment les peintures à l'eau (INRS, 2005). Il s'agit donc d'un usage pouvant donner particulièrement lieu à des émissions vers les réseaux d'eau usée et les milieux aquatiques.
Dans le secteur militaire, Il entre aussi dans la confection de peintures réfléchissant les infra-rouges (Douay, et al., 2008) (Anderson, 2012).
Dopé à l'oxyde d'étain, l'antimoine entre dans la coloration des composants électroniques (BRGM, 2011). Il entre aussi dans la confection d'émail durcissant et ignifugeant pour la poterie mais aussi d'agent opacifiant pour les porcelaines (BRGM, 2011). Outre les céramiques et les peintures, on peut le retrouver dans la verrerie comme agent opacifiant (INERIS, 2007) ou décolorant pour les verres optiques des appareils photos, photocopieuses, jumelles ou encore les tubes fluorescents (Dupont, Arnout, Jones, & Binnemans, 2016). Enfin il est utilisé en très petite quantité (<1%) dans la confection des tubes cathodiques pour les anciens écrans de télévision, d'ordinateur qui sont supplantés par les écrans à LED (BRGM, 2011).
L'antimoine trouve encore d'autres applications mineures telles que (BRGM, 2011) :
- Médicaments émétiques antiparasitaires contre la leishmaniose (glucantime, pentostam) (BRGM, 2011).
- Sous forme sulfurique (SB2S3) on peut le retrouver dans des applications pyrotechniques comme les feux de Bengale, explosifs, bombes fumigènes, balles traçantes, allumettes et les feux d'artifices (INERIS, 2007).
- Lubrifiants : pour ses propriétés antifriction, du trioxyde d'antimoine est appliqué sur les plaquettes et disques de freins dans l'automobile, ce qui est une source non négligeable de rejets d'antimoine dans l'atmosphère (Tian, et al., 2014).
- Agent de vulcanisation du caoutchouc rouge (Dupont, Arnout, Jones, & Binnemans, 2016).
Rejets dans l’environnement
Sources naturelles
L'antimoine est naturellement présent dans l'environnement sous différentes formes, principalement dans les sols où les particules sont adsorbées. Il s'agit d'un métalloïde très volatil qui a tendance s'évaporer en cas de combustion, ainsi on évaluerait à 41% des émissions totales dans l'air les émissions naturelles provenant des particules déplacées par le vent, des volcans, aérosols marins, feux de forêts, sources biogéniques (Nriagu, 1989).
Figure 10 : Répartition des émissions naturelles dans l'air
Source: (Nriagu, 1989)
Émissions atmosphériques
La forme la plus rejetée dans l'environnement serait le trioxyde d'antimoine (Sb2O3).
Les rejets anthropogéniques d'antimoine dans l'air sont liés aux activités suivantes principalement (Tian, et al., 2014) :
- L'industrie des métaux non ferreux (vapeurs et poussières émises par l'industrie minière et métallurgique lors des opérations d'extraction, de fonte et du raffinage des métaux).
- La combustion d'énergie fossile : du fait de la présence d'antimoine dans les sols et sa chalcophilie, on en retrouve des traces dans le charbon et les combustibles fossiles.
- L'incinération des déchets municipaux, du fait de la présence d'antimoine dans une gamme variée de produits plastiques en tant que retardateurs de flamme (gaines isolantes, tapis, vêtement, emballages…), céramiques, peintures, …
- Les produits lubrifiés avec du trisulfure d'antimoine (Sb2S3) : usure des plaquettes et disques de freins dans le domaine des transports avec des concentrations plus élevées autour des voies de circulation embouteillées (Varrica, Bardelli, Dongarra, & Tamburo, 2013).
- L'industrie de la fonte et de l'acier, avec des traces présentes dans la fonte, et en raison des opérations de brunissage de l'acier (procédé chimique visant à altérer la couleur et pouvant accroitre la résistance à la corrosion, et à l'abrasion).
Figure 11 : Répartition des émissions anthropogéniques atmosphériques en Europe par secteurs majeurs (t/Sb)
Figure 12 : Répartition des émissions anthropogéniques atmosphériques mondiales par secteurs majeurs (t/Sb)
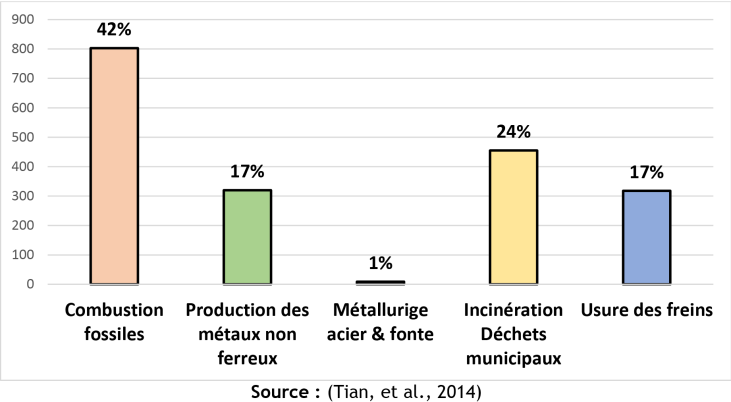
Émissions vers les eaux
Les sources anthropogéniques de rejets d'antimoine dans l'eau seront les mêmes que pour les sols (INERIS, 2007). En effet, on retrouvera les facteurs « primaires « tels que les résidus issus des activités minières, métallurgiques ou encore l'utilisation de peintures, vernis et dans un second temps les rejets des stations de traitement des eaux usées (Choubert, et al., 2011). Ainsi, si la concentration moyenne d'antimoine dans les eaux non-polluées est inférieure à 1µg.l-1, elle peut atteindre des niveaux de concentration 100 fois supérieur aux abords des sites industriels qui sont des sources de pollution (Fillela et al, 2012).
L'antimoine, en tant qu'élément chimique, ne peut se dégrader dans la biosphère. On le retrouve sous différentes formes suivant les conditions auxquelles il est exposé (niveau d'oxygène, présence de métaux comme l'arsenic, le fer ou la manganèse…) et généralement sous ses formes oxydées Sb2O3 et Sb2O5 (INERIS, 2007).
Émissions vers les sols
La concentration d'antimoine dans les sols serait bien plus élevée dans les sites autour des activités industrielles métallurgiques, minières (poussières, scories, boues) et dans une moindre mesure des décharges municipales (ATSDR, 2017). Une étude illustrant ce phénomène sur des sols pollués dans le nord de la France explique des niveaux importants d'antimoine par l'activité de deux fonderies (Metaleurop Nord et Umicore) ainsi que par la combustion passée de charbon à usage domestique (Douay, et al., 2008). En effet, les sols aux alentours de Metaleurop présentent une teneur moyenne d'antimoine de 28,89 mg.Kg-1 de sol sec (médiane à 13,85) et de 20,85 mg.Kg-1 (médiane à 11,30) pour Umicore soit entre 20 et 25 fois la teneur moyenne des sols agricoles régionaux.
Présence environnementale
Atmosphère
La concentration moyenne dans l’air de l’antimoine varie entre 1 et 170 ng/m3 mais peut être jusqu’à 1000 fois supérieure à proximité des sources d’émission (ATSDR, 2017).
Aquatique
Généralement la présence d'antimoine dans l'eau douce n'excède pas 1 µg.l-1 (Filella et al, 2002) y compris dan les eaux sousterraines, avec une concentration estimée à 200 ng.l-1 dans les océans.
La base de données Naïade recense 10 522 prélèvements d'antimoine24 entre 2015 et 2017 en France dans les eaux de surface (eaux, biotes, sédiments, particules). Les données sont résumées dans le Tableau 6.
Tableau 6 : Présence d'antimoine dans l'eau de surface en France
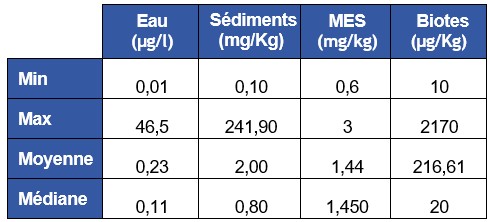
[24] 24008 prélèvements dont 10522 sont supérieurs au seuil de quantification et inférieur au seuil de saturation.
MES : Matière en suspension
Source : NAIADE
Il n'existe pas de Norme de Qualité Environnementale pour l'antimoine, cependant on peut se référer aux valeurs guide environnementales proposées par l'INERIS avec une concentration maximale acceptable dans l'eau de 177µg.l-1 ou encore aux concentrations acceptables proposées aux Pays Bas pour les sédiments de l'ordre de 14 mg/Kg de matière sèche équivalente (RIVM, 2012). Aucun des prélèvements dans l'eau rapportés dans NAIADE entre 2015 et 2017 n'est supérieur à la concentration maximale acceptable proposée par l'INERIS. Environ 8,5% des prélèvements réalisés dans les sédiments sont supérieurs au seuil proposé de 14 mg/kg. Un tiers des prélèvements d'antimoine dans les biotes (12 sur 36) sont supérieurs à la Valeur Guide Environnementale de 24,3 µg/Kg proposée par l'INERIS (Tableau 2).
Terrestre
FTE 2015 Importer
L'antimoine présente une concentration moyenne de l'ordre de 0,2 ppm dans la croûte terrestre (BRGM, 2011).
Les bases de données ADES et CAPEX ne donnent pas d'informations sur la présence d'antimoine dans les eaux souterraines.
Perspectives de réduction
Réduction des rejets
RECYCLAGE
FTE 2015 Importer
La valeur de l'antimoine et une crainte de baisse de la production primaire font que le recyclage de l'antimoine présent dans les matériaux semble recevoir une attention croissante.
L'antimoine contenu dans les batteries au plomb antimonié (Pb-Sb) est souvent récupéré (>90%) et représentait jusqu'à 20% de la production totale d'antimoine en 2010 (Dupont, Arnout, Jones, & Binnemans, 2016). Dans cette filière on peut nommer les acteurs comme ECO BAT TECHNOLOGIES avec 2 sites en France ASPM (60) et STCM (35). Cependant il s'agit d'un usage en déclin au profit des batteries Plomb Calcium notamment (USGS, 2013), ainsi la production secondaire d'antimoine devrait baisser dans le futur.
[28] https://echa.europa.eu/documents/10162/53ff04a3-fc9b-4e53-94e0-a4ec6040ec3e
Pour ce qui est du reste des usages qui sont plus diffus, on ne dispose pas à l'heure actuelle de filière bien établie (European Commission, 2014), l'antimoine non-métallique n'est pas réutilisé. Une exception dans ce domaine est le recyclage de l'antimoine contenu dans le PET : en 2007, environ 25% du PET de bouteilles était recyclé, et autour de 72 % des flocons PET était réutilisé dans les textiles, et 10% dans de nouvelles bouteilles (Henckens, Driessen, & Worrel, 2016).
Cependant, un potentiel de recyclage existe : il est techniquement possible de récupérer l'antimoine des cendres issues de l'incinération de plastiques ou textiles des déchets municipaux ou des eaux de sites industriels. (Dupont, Arnout, Jones, & Binnemans, 2016).
La présence d'antimoine dans l'halophosphate utilisé dans les lampes fluorescentes pourrait donner lieu aussi à la mise en place d'un processus de recyclage via le réseau déjà existant de récupération des lampes classées comme déchets toxiques, mais qui ne valorise pas le contenu en antimoine actuellement. Les perspectives de recyclages concernent aussi les consommations intermédiaires (Catalyseurs) dans la production de polymère et notamment le polyéthylène téréphtalate (PET) utilisé dans les emballages alimentaires et les vêtements, en récupérant l'antimoine dans les résidus d'éthylène glycol issus de la fabrication du polymère (Dupont, Arnout, Jones, & Binnemans, 2016).
Alternatives aux usages
FTE 2015 Importer
Les observations récentes (Roskill, 2018)25 du marché montrent une diminution générale des usages d'antimoine dans les plastiques, textiles et alliages métalliques aux profits de substances comme l'étain, le calcium, le zinc… Un phénomène compensé par une augmentation constante des usages en tant que retardateurs de flamme et catalyseurs dans la plasturgie des polymères.
Plusieurs substituts à l'usage d'antimoine dans les retardateurs de flamme se développent (Posner, 2004). On citera des composés organiques de phosphores chlorés, l'oxyde de zinc et l'oxyde d'aluminium hydraté (BRGM, 2011). En effet, le marché des câbles et gaines retardatrices de flamme qui reste le marché principal de cet usage verrait les parts de marché du trioxyde d'antimoine chuter au profit du trioxyde d'aluminium (Al2O3) qui présente l'avantage d'émettre moins de fumée noire lors de la combustion (Morgan & Wilkie, 2014).
Pour des raisons d'efficacité, l'antimoine est remplacé par d'autre éléments comme le calcium dans les batteries en plomb ou l'étain voire des batteries uniquement en plomb (VRLA), elles-mêmes en concurrences avec les batteries lithium dans certains secteurs26 .
L'utilisation de l'antimoine dans les alliages métalliques afin d'augmenter la durabilité ou pour des d'usage antifrictions pourrait trouver des alternatives parmi d'autres éléments tels que le Baryum (Ba), le Cadmium (Cd), le Calcium (Ca), le Plomb (Pb) ou encore l'Etain (Sn) 27 . Ceci peut expliquer la tendance à la baisse des usages d'antimoine dans les plaquettes de freins notamment (Tian, et al., 2014).
Il est aussi en concurrence avec d'autres métaux (Cd, Cr, Sn, Ti, Zn, Zr) dans la confection de pigments et d'émaux dans les céramiques, peintures et couches de vernis ignifugeants (BRGM, 2011). Il est estimé qu'il est aussi possible de substituer entièrement l'antimoine dans les verres et céramiques dans les années à venir (Henckens, Driessen, & Worrel, 2016).
Concernant les usages en plasturgie en guise de catalyseur pour polymères, l'antimoine rencontrera la même concurrence à laquelle il fait face dans la production de batteries, à savoir les alternatives suivantes : Ba, Cd, Ca, Pb, Sn, Zn (BRGM, 2011). Aussi, la plupart des alternatives commercialisées sont basées sur le Titane (Henckens, Driessen, & Worrel, 2016).
Dans les usages mineurs comme les couches conductrices (ATO) en électronique, allié à l'étain il rencontre la concurrence de produits alternatifs à base d'indium et d'étain (ITO), ou encore de zinc et d'aluminium (AZO) (BRGM, 2011).
A l'inverse des marchés précédant, l'hydrométallurgie du zinc emploie du trioxyde d'arsenic afin d'affiner le processus de purification du zinc. Le trioxyde d'antimoine représenterait une alternative techniquement crédible mais pas assez efficace économiquement et sans assurance de réduire les risques sanitaires et environnementaux28 .
L'antimoine représenterait aussi une alternative au Mercure (Hg) et au Bismuth (Bi) dans la composition des électrodes des points de vue technique et environnemental (Serrano, Diaz-Cruz, Ariño, & Esteban, 2016).
[25] https://roskill.com/market-report.an-1timony/
[26] http://www.seenrgy.com/webservice/document/_getStream.asp?id=8B9CF4C1-F833-438D-82B7-E6652F2A0E4A
[28] https://echa.europa.eu/documents/10162/53ff04a3-fc9b-4e53-94e0-a4ec6040ec3e
Conclusion
FTE 2015 Importer
L'antimoine, moins surveillé que d'autres métaux tels que l'arsenic, le plomb ou le nickel n'en reste pas moins toxique d'où l'existence de réglementation en matière d'usages professionnels et son inscription ainsi que certains de ses composés au Community Action Rolling Plan de l'ECHA en vue d'établir le niveau de dangerosité et les restrictions appropriées.
Bien que des substituts potentiels existent dans la plupart des applications de l'antimoine, la demande reste en constante augmentation à l'exception des batteries qui représente encore le second usage le plus élevé (≈30%). Le quasi-monopole chinois au niveau mondial de la production minière d'antimoine potentiellement soumise à des quotas, et l'incertitude entourant l'offre viennent alimenter les craintes de dépendance en Europe, qui l'a donc inclus dans la liste des matières critiques.
A ce contexte économique incertain vient s'ajouter la pollution issue des rejets d'antimoine. En effet l'accroissement faible mais stable de la consommation d'antimoine donne lieu à des rejets dans la biosphère qui devraient perdurer.
Les rejets dans l'air se font sous forme de trioxyde d'antimoine, et sont associés aux exploitations minières, métallurgiques, à la combustion de charbon dans le secteur de l'énergie, l'abrasion des plaquettes de freins lubrifiées à l'antimoine, l'incinération des déchets municipaux, et pouvant se déplacer sur de grandes distances puis se déposer et s'adsorber sur les sols, ou se déposer directement sur les milieux aquatiques.
A ces rejets dans les sols viennent s'ajouter les boues et les scories contenant de l'antimoine issue des mines, fonderies et autres sites industriels ou encore les dépôts de déchets plastiques, textiles ou alliages métalliques dans les décharges.
Des rejets d'antimoine directs dans les milieux aquatiques pourront provenir de l'usage de matériaux en milieu extérieur, ou de leur contact avec l'eau, ou encore de l'usage de peintures à l'eau en contenant. Une partie de l'antimoine rejeté dans les milieux aquatiques intégrera la matière en suspension, les sédiments ou encore les biotes.
Les perspectives en matière de recyclage de l'antimoine existent mais seule la filière du recyclage des batteries Pb-Sb est opérationnelle à grande échelle (≈90% recyclé). Les sources plus diffuses de la pollution de l'antimoine font l'objet de programmes de recherche impliquant la valorisation de l'antimoine dans les déchets municipaux, le filtrage de l'eau, la récupération de l'antimoine dans les procédés de plasturgie des polymères, dans les lampes halogènes mais rien ne laisse prévoir une réduction des émissions à court ou moyen terme.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :

