Configuration de votre affichage
Vous avez activé le mode de configuration de l'affichage qui permet de sélectionner les informations que vous souhaitez afficher sur la fiche substance. Une fois que vous aurez sélectionné les rubriques à afficher, vous pouvez revenir au mode de consultation de la fiche substance en cliquant à nouveau sur le bouton de filtrage.
Perchlorate d'ammonium (7790-98-9)
Informations générales
Dernière vérification le 29/03/2024
Identification
Numero CAS
7790-98-9
Nom scientifique (FR)
Perchlorate d'ammonium
Nom scientifique (EN)
Autres dénominations scientifiques (Autre langues)
Code EC
232-235-1
Code SANDRE
-
Numéro CIPAC
-
Formule chimique brute
\(\ce{ NH4CIO4 }\)
Code InChlKey
Code SMILES
Cl(=O)(=O)(=O)[O-][NH4+]
Classification CLP
Type de classification
Harmonisée
ATP insertion
CLP00/ATP01
Description de la classification
Classification harmonisée selon réglement 1272/2008 ou CLP
| Mention du danger - Code | H201 |
|---|---|
| Mention du danger - Texte | Explosif : danger d'explosion en masse |
| Classe(s) de dangers | Explosifs |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
| Mention du danger - Code | H271 |
|---|---|
| Mention du danger - Texte | Peut provoquer un incendie ou une explosion ; comburant puissant |
| Classe(s) de dangers | Matières solides et liquides comburants |
| Libellé UE du danger | - |
| Limites de concentration spécifique | - |
| Facteur M | - |
| Estimation de toxicité aigüe | - |
Physico-Chimie
Dernière vérification le 29/03/2024
Généralités
Poids moléculaire
117.49 g/mol
Tableau des paramètres
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Comportement et devenir dans les milieux
Dernière vérification le 29/03/2024
Matrices
Milieu eau douce
Milieu sédiment eau douce
Adsorption :
A partir de la valeur calculée du Koc, on peut penser que l'adsorption du perchlorate d'ammonium est négligeable sur le sédiment et les particules en suspension.
L'ion perchlorate n'est que faiblement adsorbés à la surface des minéraux dans des solutions de force ionique modérée.
(ATSDR, 2008)
Milieu terrestre
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Persistance
Biodégradabilité
Biodégradabilité :
L'ion perchlorate est inerte à la réduction, malgré l'état d'oxydation élevée du chlore (+VII). En solution aqueuse diluée, l'ion perchlorate est très stable et pourrait persister pendant des décennies dans des conditions normales dans les eaux souterraines et les eaux de surface.
Bioaccumulation
Conclusion sur la bioaccumulation
Bioaccumulation/ Biomagnification :
BCF = 0.70 Lepomis Macrochirus BCF(1) = 1.85 Corbicula Fluminea
La substance n'est pas considérée comme bioaccumulable.
Un BCF de 1.85 est utilisé dans la détermination des normes de qualité ce qui correspond à un BMF1 de 1 et un BMF2 de 1 pour les organismes marins. (Dean et al., 2004)
Bibliographie
Toxicologie
Dernière vérification le 29/03/2024
Valeurs accidentelles
Autres seuils accidentels
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs guides
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Valeurs de référence
Introduction
SANTÉ HUMAINE
Ce chapitre traite de la toxicité chronique induite par la substance sur l'homme soit via la consommation d'organismes aquatiques contaminés, soit via l'eau de boisson.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. Compte tenu du mode d'exposition envisagée, seuls les tests sur mammifères exposés par voie orale (dans l'alimentation ou par gavage) ont été recherchés.
Toutes les données présentées ont été validées.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé, et par jour.
TOXICITE
Pour l'évaluation des effets sur la santé humaine, seuls les résultats sur mammifères sont considérés comme pertinents. Contrairement à l'évaluation des effets pour les prédateurs, les effets de type cancérigène ou mutagène sont également pris en compte.
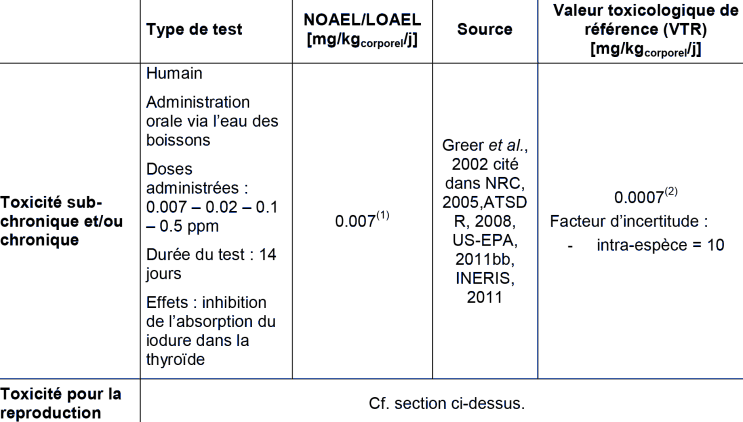
(1) NOEL : No Observed Effect Level; (2) Cette VTR a été déterminé par NRC (2005) et cité dans ATSDR (2008), US-EPA (2011b) et INERIS (2011). Elle est soutenue par des études cliniques, des études épidémiologiques et environnementales, et des études sur l'administration du perchlorate à long terme pour les patients souffrant d'hyperthyroïdie.

Autres valeurs des organismes reconnus
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Ecotoxicologie
Dernière vérification le 29/03/2024
Introduction
Evaluations existantes :
US-EPA, 2002 : •Perchlorate Environmental Contamination: Toxicological Review and Risk Characterization' NRC, 2005 : •Health Implications of Perchlorate Ingestion'
ATSDR, 2008 : •Toxicological profile for perchlorate' OCDE, 2011: •Draft v1 Guidance Document (GD) on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption (No. 150). Case Studies using example chemicals (Perchlorate) •
REACH : Le perchlorate d'ammonium a été enregistré en 2010
Effets endocriniens :
Le perchlorate d'ammonium n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (E.C., 2004) et dans le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage (Petersen et al., 2007).
Cependant, ses effets sur le système endocrinien sont bien connus et la substance fait l'objet d'une des 3 études de cas illustrant le projet de document guide de l'OCDE portant sur les lignes directrice pour l'évaluation de la perturbation endocrinienne (OCDE, 2011).
Critères PBT / POP :
La substance ne remplit pas les critères PBT/vPvB1 (C.E., 2006) ou POP2 (PNUE, 2001).
Norme de qualité existante :
-
Substance(s) associée(s) :
-
[1] Les PBT sont des substances persistantes, bioaccumulables et toxiques et les vPvB sont des substances très persistantes et très bioaccumulables. Les critères utilisés pour la classification des PBT sont ceux fixés par l'Annexe XIII du règlement n°1907/2006 (REACH).
[2] Les Polluants Organiques Persistants (POP) sont des substances persistantes (aux dégradations biotiques et abiotiques), fortement liposolubles (et donc fortement bioaccumulables), et volatiles (et peuvent donc être transportées sur de longues distances et être retrouvée de façon ubiquitaire dans l'environnement). Les critères utilisés pour la classification POP sont ceux fixés par l'Annexe 5 de la Convention de Stockholm placée sous l'égide du PNUE (Programme des Nations Unies pour l'Environnement).
Dangers
Description
ORGANISMES AQUATIQUES
Dans les tableaux ci-dessous, sont reportés pour chaque taxon les résultats des tests d'écotoxicité de la substance. Toutes les données présentées ont été validées dans le cadre des travaux réalisés dans le programme HPVC de l'OCDE.
Ces résultats d'écotoxicité sont principalement exprimés sous forme de NOEC (No Observed Effect Concentration), concentration sans effet observé, d'EC10 concentration produisant 10% d'effets et équivalente à la NOEC, ou de EC50, concentration produisant 50% d'effets. Les NOEC sont principalement rattachées à des tests chroniques, qui mesurent l'apparition d'effets sub-létaux à long terme, alors que les EC50 sont plutôt utilisées pour caractériser les effets à court terme.
Le perchlorate d'ammonium se dissocie très rapidement dans l'eau pour former l'ion ammonium et l'ion perchlorate. Ainsi, l'ion perchlorate agira indépendamment de l'ion ammonium. L'ion ammonium sera dissipé pour être remplacé par un cation différent, tandis que l'ion perchlorate est conservé dans l'environnement.
L'évaluation des dangers de l'ion perchlorate (sous forme anionique : ClO4 -) est menée à partir d'essais réalisés sur différents sels tels que le perchlorate d'ammonium (N°CAS 7790-99-8), le perchlorate de s odium (N°CAS 7601-89-0), le perchlorate de potassium (N°C AS 7778-74-7), et le perchlorate de lithium (N°CAS 7791-03-9) (US-EPA, 1998, US-EPA, 2002) présentés dans le tableau ci-dessous.

Quant à l'ion ammonium, plusieurs études ont montré que sa toxicité pouvait contribuer directement à la létalité des sujets. Le perchlorate réduirait la toxicité de l'ammonium (Sparling et Harvey, 2006, Goleman et Carr, 2006, Goleman et al., 2002a).
On privilégiera donc les données utilisant du perchlorate d'ammonium. Cependant, de nombreuses études utilisent le perchlorate de sodium en raison d'une solubilité dans l'eau plus élevée, et permettant de rendre compte des effets seuls de l'ion perchlorate.
ECOTOXICITE
ECOTOXICITE AQUATIQUE AIGUË
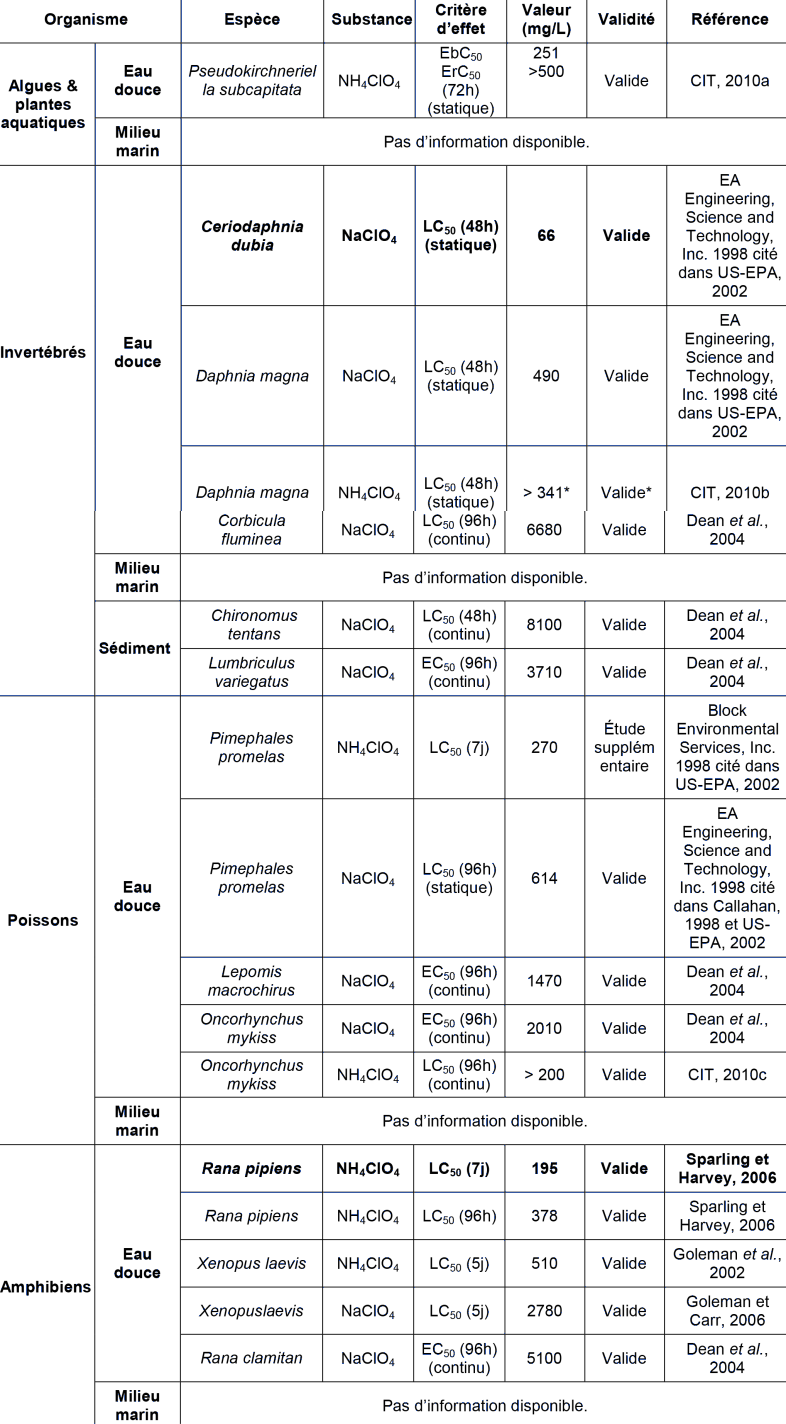
* Les tests préliminaires indiquent une EC50 comprise entre 200 mg.l-1 (inhibition de 15%) et 500 mg.l-1 (inhibition de 60%) mais le test définitif a été réalisé avec des concentrations d'exposition comprises entre 108 et 500 mg.l-1 et l'inhibition observée à 500 mg.l-1 est de seulement 40%.
ECOTOXICITE AQUATIQUE CHRONIQUE
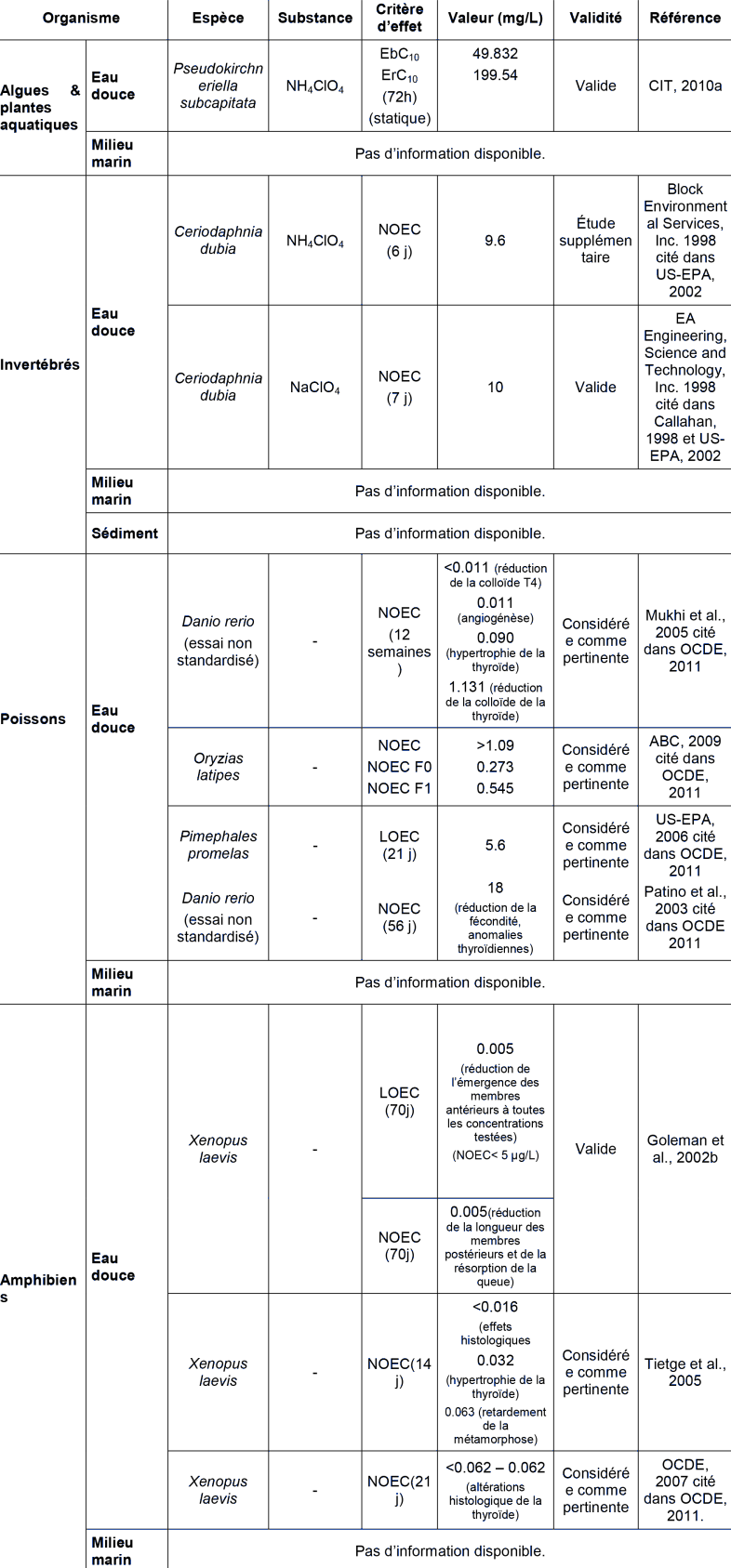
De nombreuses études ont étudié de façon plus spécifique les effets du perchlorate d'ammonium sur le système endocrinien et l'OCDE a récemment fait une revue de la littérature portant sur ces effets (OCDE, 2011). L'étude de l'OCDE rapporte à la fois des études sur mammifères et organismes aquatiques, des essais in vivo et in vitro normalisés ou non, ainsi que des études mécanistiques. Une sélection de ces études, considérées comme pertinentes pour la détermination de la norme de qualité environnementale sont reportées dans le tableau ci-dessus et décrites ci-dessous. On se reportera au rapport de l'OCDE pour une revue plus complète.
Xenopus laevis • Essai non standardisé • Goleman et al., 2002b
Des •ufs et larves (stade 4-10) de xénope (Xenopus laevis) ont été exposés à des concentrations mesurées de perchlorate comprises entre 5 et 425 000 µg.L-1 durant 70 jours. L'émergence des membres antérieurs a été réduite (environ 50% à la LOEC, p < 0,05) à toutes les concentrations testées (NOEC < 5 µg.L-1), tandis que les NOECs pour la réduction de la longueur des membres postérieurs et de la résorption de la queue sont à 5 µg.L-1 (p < 0,01). Cependant dans cette étude un retard de croissance a été observé chez le témoin : 60% des individus ont atteint le stade 58 en 70 jours alors que normalement ce stade doit être atteint en 44 jours. Aussi bien que l'effet sur les pattes antérieures soit significatif à 5 µg.L-1 par rapport au témoin, l'intensité de l'effet est difficilement extrapolable.
Xenopus laevis • Essai non standardisé, similaire OCDE TG 231 • Tietge et al., 2005
Des larves de xénope au stade 51-54 ont été exposées à des concentrations mesurées en perchlorate de 16, 63, 250, 1000 et 4000 µg.L-1 durant 14 jours. Cet essai a été réalisé avec pour objectif d'élaborer un protocole abrégé de la ligne directrice OCDE TG 231 dont l'objectif est d'identifier de potentiels perturbateurs de l'activité thyroïdienne. L'exposition lors de 2 stades distincts de développement (51 et 54) a été testée. La période entre les stades 47 et 52 est considérée comme pré-métamorphose. La prométamorphose commence au stade 53 et les hormones thyroïdiennes sont mesurables au stade 54. On observe que la métamorphose est significativement retardée à partir de 250 µg.L-1 (NOEC = 63 µg.L-1) sans différence entre exposition au stade 51 ou 54, et des effets histologiques ont été observés à la plus faible concentration testée (NOEC < 16 µg.L-1). Une étude complémentaire avec des larves de stade 51 exposées à des concentrations de 8, 16, 63 et 125 µg.L-1 donne une NOEC pour le retardement de la métamorphose à 63 µg.L-1 et une NOEC à 32 µg.L-1 pour l'hypertrophie de la thyroïde.
Xenopus laevis • OCDE TG 231 • OCDE, 2007 cité dans OCDE, 2011.
Des xénopes (Xenopus laevis) ont été exposés à des concentrations nominales de perchlorate de 0, 62.5, 125, 250 et 500 µg.L-1 durant 21 jours (concentration mesurées variant dans la gamme des 20% autour des concentrations nominales). Aux concentrations testées, la longueur du corps, la longueur museau-cloaque, et le poids du corps ont augmenté (de 5 à 20 %) avec des valeurs de NOEC comprises entre 62.5 et 125 µg.L-1. La longueur des membres postérieurs a diminué de 20 à 30 % (NOEC = 125 µg.L-1). Des altérations histologiques de la thyroïde ont été observées à toutes les concentrations testées (NOEC < 62.5-62.5 µg.L-1) incluant une augmentation de la taille des cellules épithéliales de la thyroïde et du volume de la thyroïde.
Les effets observés aux doses les plus basses sont ceux observés dans l'essai non standardisé sur Xenope, de Goleman et al., 2002 dans lequel on observe dès la dose de 5 µg.L-1 une réduction de l'émergence des membres antérieurs et à la dose supérieure une réduction de la taille des membres postérieurs et de la résorption de la queue. Ils sont cohérents avec les effets reportés dans les études de Tietge et al., 2005 et OCDE TG 231 • OCDE 2007. Ces effets sont considérés comme écologiquement pertinents et retenus pour l évaluation. Les autres effets notés par Tietge et al., 2005, en particulier l'hypertrophie de la thyroïde et les modifications histologiques de la thyroïde sont considérés comme les auteurs comme des effets précoces indicateurs d'une perturbations intervenant en deçà des concentrations causant un retard de métamorphose. Ils suggèrent que la compensation thyroïdienne est suffisante pour permettre un développement normal.
Valeurs de danger
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Synthèse
Biote
EMPOISONNEMENT SECONDAIRE
Ce chapitre traite de la toxicité chronique induite par la substance sur les prédateurs via la consommation d'organismes aquatiques contaminés (appelés biote, i.e. poissons ou invertébrés vivant dans la colonne d'eau ou dans les sédiments). Il s'agit donc d'évaluer la toxicité chronique de la substance par la voie d'exposition orale uniquement.
Dans les tableaux ci-dessous, ne sont reportés pour chaque type de test que les résultats permettant d'obtenir les NOEC ou la valeur toxicologique de référence (VTR) les plus protectrices. N'ont été recherchés que des tests sur mammifères ou oiseaux exposés par voie orale (exposition par l'alimentation ou par gavage). Toutes les données présentées ont été jugées valides par l'INERIS.
Les résultats de toxicité sont principalement donnés sous forme de doses journalières : NOAEL (No Observed Adverse Effect Level), ou LOAEL (Lowest Observed Adverse Effect Level). NOAEL et LOAEL sont exprimées en termes de quantité de substance administrée par unité de masse corporelle de l'animal testé et par jour.
Pour calculer la norme de qualité liée à l'empoisonnement secondaire des prédateurs, il est nécessaire de connaître la concentration de substance dans le biote n'induisant pas d'effets observés pour les prédateurs (exprimée sous forme de NOEC). Il est possible de déduire une NOEC à partir d'une NOAEL grâce à des facteurs de conversion empiriques variables selon les espèces testées. Les facteurs utilisés ici sont ceux recommandés par le guide technique européen pour la détermination de normes de qualité (E.C., 2011). Les valeurs de ces facteurs de conversion dépendent de la masse corporelle des animaux et de leur consommation journalière de nourriture. Celles-ci peuvent donc varier d'une façon importante selon le niveau d'activité et le métabolisme de l'animal, la valeur nutritive de sa nourriture, etc. En particulier elles peuvent être très différentes entre un animal élevé en laboratoire et un animal sauvage.
Afin de couvrir ces sources de variabilité, mais aussi pour tenir compte des autres sources de variabilité ou d'incertitude (variabilité inter et intra-espèces, extrapolation du court terme au long terme, etc.) des facteurs d'extrapolation sont nécessaires pour le calcul de la QSbiota sec pois. Les valeurs recommandées pour ces facteurs d'extrapolation sont données dans le guide technique européen (E.C., 2011). Un facteur d'extrapolation supplémentaire (AFdose-réponse) est utilisé dans le cas où la toxicité a été établie à partir d'une LOAEL plutôt que d'une NOAEL.
Les données obtenues sur les mammifères terrestres et les oiseaux, utilisées pour la détermination des valeurs guides pour la protection des prédateurs vis-à-vis de l’empoisonnement secondaire, sont répertoriées dans les tableaux ci-dessous.
ECOTOXICITE POUR LES VERTÉBRÉS TERRESTRES
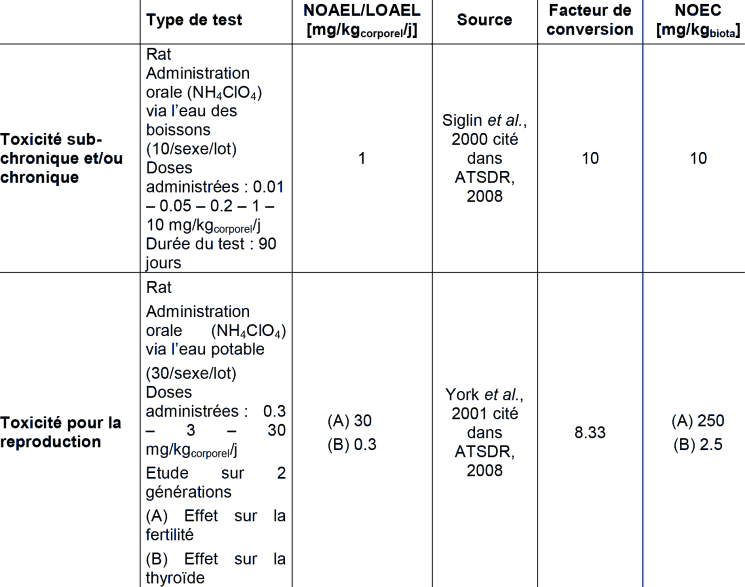
D'après l'ensemble de données examinées, il est très peu probable que le perchlorate ait des effets toxicologiques à des doses inférieures à celles qui affectent la fonction thyroïdienne.
L'évaluation des risques associés à l'exposition au perchlorate est basée sur l'inhibition de l'adsorption de l'iodure par la glande thyroïde.
TOXICITE ORALE POUR LES MAMMIFERES
TOXICITE ORALE POUR LES OISEAUX

Valeurs écotoxicologiques
Introduction
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Dans cette rubrique, sont reportées des valeurs de référence pour la protection des écosystèmes aquatiques et de la santé humaine via l’environnement.
Elles peuvent avoir un statut de « Valeur réglementaire » si elles sont issues
- de réglementations européennes et issues par exemple de dossiers d’évaluation des risques dans le cadre de processus d’autorisation de mise sur le marché des substances chimiques (c’est le cas des Concentrations Prédites Sans Effet pour l’environnement (PNEC) issues des dossiers réglementaires sous REACh ou dans le cas de la réglementation des produits biocides) ou issues de « Normes de Qualité Environnementale » (NQE) de la Directive Cadre européenne sur l’Eau (DCE) ;
- de réglementations françaises telles que les arrêtés de mise en application de la DCE à l’échelle nationale.
Elles peuvent être des « Valeurs guides » lorsque ce sont des propositions scientifiques de l’INERIS qui ne sont pas reportées dans des textes réglementaires. C’est le cas de toutes les valeurs établies par l’INERIS pour guider l’évaluation de la qualité des milieux aquatiques pour les substances qui n’ont pas, ou pas encore, un statut réglementaire dans le contexte de la DCE.
Les « Valeurs Guides Environnementales » (VGE) et les « Normes de Qualité Environnementale » (NQE) sont les outils consacrés pour l’évaluation de la qualité des eaux de surface, dont l’établissement est basé sur une même méthodologie européenne dédiée (E.C., 2018).
Leur construction, d’un point de vue méthodologique, est donc similaire.
Valeurs guides
Description
NORMES DE QUALITÉ POUR LA COLONNE D'EAU
Les normes de qualité pour les organismes de la colonne d'eau sont calculées conformément aux recommandations au guide technique européen pour la détermination des normes de qualité environnementale (E.C., 2011). Elles sont obtenues en divisant la plus faible valeur de NOEC ou d'EC50 valide par un facteur d'extrapolation (AF, Assessment Factor).
La valeur de ce facteur d'extrapolation dépend du nombre et du type de tests pour lesquels des résultats valides sont disponibles. Les règles détaillées pour le choix des facteurs sont données dans le guide technique européen (E.C., 2011).
En ce qui concerne les organismes marins, selon guide technique pour la détermination de normes de qualité environnementale (E.C., 2011), la sensibilité des espèces marines à la toxicité des substances organiques peut être considérée comme équivalente à celle des espèces dulçaquicoles, à moins qu'une différence ne soit montrée.
Néanmoins, le facteur d'extrapolation appliqué pour déterminer la AA-QSmarine_eco doit prendre en compte les incertitudes additionnelles telles que la sous-représentation de taxons clefs et une diversité d'espèces plus complexe en milieu marin.
![]()
Une concentration annuelle moyenne est déterminée pour protéger les organismes de la colonne d'eau d'une possible exposition prolongée.
Pour le perchlorate d'ammonium, on dispose de données valides pour des expositions aiguë et chronique pour les trois niveaux trophiques. A partir de ce jeu de donnée, les effets d'une exposition aiguë sur la mortalité sont observés aux doses les plus faibles chez les crustacés et les effets d'une exposition chronique sur le développement chez les amphibiens. Pour une exposition chronique, on dispose des résultats de trois essais réalisés sur Xenopus laevis visant à évaluer les potentiels effets perturbateurs endocriniens de la substance (OCDE, 2011). Le résultat le plus faible a été obtenu par l'étude réalisée par Goleman et al., 2002b avec une LOEC à 5 µg.L-1 (NOEC< 5 µg.L-1) l'effet pris en compte étant l'émergence des membres antérieurs. Néanmoins du fait d'un retard de développement observé chez le témoin dans cette étude, l'AA-QS est basée sur une autre étude qui porte sur le même effet (retard de métamorphose) chez le même organisme (NOEC = 63 µg.L-1). Compte tenu du nombre de taxons disponibles, l'application du guide technique européen (E.C., 2011) permettrait l'application d'un facteur de sécurité de 10. Cependant, afin de prendre en compte les effets sur les stades précoces de développement et d'une exposition prolongée, il est proposé d'ajouter un facteur supplémentaire de sécurité de 203 pour déterminer la AA-QSwater_eco :
![]()
![]()
En ce qui concerne les organismes marins, aucun essai n'est disponible. Le jeu de données disponible ne permet pas de montrer une différence de sensibilité. La norme de qualité sera donc déterminée conformément au guide technique européen (E.C., 2011), en appliquant un facteur d'extrapolation de 1000 sur la même donnée que précédemment :
![]()
![]()
Concentration Maximale Acceptable (MAC et MACmarine)
La concentration maximale acceptable est calculée afin de protéger les organismes de la colonne d'eau de possibles effets de pics de concentrations de courtes durées (E.C., 2011).
Pour le perchlorate d'ammonium des données aiguës sont disponibles pour les trois niveaux trophiques. On choisit donc d'appliquer un facteur d'extrapolation de 100 sur la donnée la plus faible. Les invertébrés étant les organismes les plus sensibles, le facteur de 100 est appliqué sur la LC50 (48 h) de 66 mg.L-1 observée pour Ceriodaphnia dubia. Du fait de son caractère perturbateur endocrinien, un facteur de sécurité supplémentaire de 10 est appliqué pour calculer la MAC :
![]()
![]()
[3] L'étude mettant en évidence des effets sur la thyroïde a été réalisée avec des organismes au stade 51-54 exposés pendant 14 jours alors que les effets sur l'émergence des membres antérieurs ont été étudiés avec des organismes de stade 4-10 (soit de 8 cellules au gastrula) exposés pendant 70 jours.
En ce qui concerne les organismes marins, aucune donnée aiguë n'est disponible. Pour les mêmes raisons que celles évoquées pour le compartiment eau douce la MACmarine sera déterminée en appliquant un facteur de sécurité de 10000 sur la donnée aiguë la plus faible :
![]()
![]()
VALEUR GUIDE DE QUALITÉ POUR LE SÉDIMENT (QSSED ET QSSED-MARIN)
Un seuil de qualité dans le sédiment est nécessaire (i) pour protéger les espèces benthiques et (ii) protéger les autres organismes d'un risque d'empoisonnement secondaire résultant de la consommation de proies provenant du benthos. Les principaux rôles des normes de qualité pour les sédiments sont de :
- Identifier les sites soumis à un risque de détérioration chimique (la norme sédiment est dépassée)
- Déclencher des études pour l'évaluation qui peuvent conduire à des études plus poussées et potentiellement à des programmes de mesures
- Identifier des tendances à long terme de la qualité environnementale (Art. 4 Directive 2000/60/CE).
Des données de toxicité aiguë sur les organismes benthiques sont disponibles. Cependant, la contamination ayant eu lieu par la voie aqueuse, ces essais ne sont pas donc pas pertinents pour déterminer la valeur guide de qualité pour le sédiment. Ainsi, la QSsed est alors calculée à l'aide de la méthode d'équilibre de partage:
Ce modèle suppose que :
- il existe un équilibre entre la fraction de substances adsorbées sur les particules sédimentaires et la fraction de substances dissoutes dans l'eau interstitielle du sédiment,
- la fraction de substances adsorbées sur les particules sédimentaires n'est pas biodisponible pour les organismes et que seule la fraction de substances dissoutes dans l'eau interstitielle est susceptible d'impacter les organismes,
- la sensibilité intrinsèque des organismes benthiques aux toxiques est équivalente à celle des organismes vivant dans la colonne d'eau. Ainsi, la norme de qualité pour la colonne d'eau peut être utilisée pour définir la concentration à ne pas dépasser dans l'eau interstitielle.
Une valeur guide de qualité pour le sédiment peut être alors calculée selon l'équation suivante (E.C., 2011) :
![]()
Avec :
RHOsed : masse volumique du sédiment en [Kgsed.m-3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par le guide technique européen (E.C., 2011) est utilisée : 1300 kg.m-3 .
Ksed-eau : coefficient de partage sédiment/eau en m3/m3 . En l'absence d'une valeur exacte, les valeurs génériques proposées par le guide technique européen (E.C., 2011) sont utilisées. Le coefficient est alors calculé selon la formule suivante : 0.8 + 0.025 * Koc soit Ksed-eau = 2.95 m3/m3 .
Ainsi, on obtient :
![]()
La concentration correspondante en poids sec peut être estimée en tenant compte du facteur de conversion suivant :
![]()
Avec :
Fsolidesed : fraction volumique en solide dans les sédiments en [m3solide/m3sed]. En l'absence d'une valeur exacte, la valeur générique proposée par le guide technique européen (E.C., 2011) est utilisée : 0.2 m3/m3 .
RHOsolide : masse volumique de la partie sèche en [kgsolide/m3solide]. En l'absence d'une valeur exacte, la valeur générique proposée par le guide technique européen (E.C., 2011) est utilisée : 2500 kg.m-3 .
Pour le perchlorate d'ammonium, la concentration correspondante en poids sec est :
![]()
Selon la même approche que pour le sédiment d'eau douce, une valeur guide de qualité pour le sédiment marin peut être calculée selon la formule suivante :
![]()
QSsed-marin wet weight = 0.07 µg/kg (poidshumide)
La concentration correspondant au poids sec est alors la suivante :
![]()
Le LogKow de la substance étant inférieur à 5, un facteur additionnel de 10 n'est pas jugé nécessaire.
Il faut rappeler que les incertitudes liées à l'application du modèle de l'équilibre de partage sont importantes. Les sédiments naturels peuvent avoir des propriétés très variables en termes de composition (nature et quantité de matières organiques, composition minéralogique), de granulométrie, de conditions physico-chimiques, de conditions dynamiques (taux de déposition/taux de resuspension). Par ailleurs ces propriétés peuvent évoluer dans le temps en fonction notamment des conditions météorologiques et de la morphologie de la masse d'eau. Si bien que le partage entre la fraction de substance adsorbée et la fraction de substances dissoute peut être extrêmement variable d'un sédiment à un autre et l'hypothèse d'un équilibre entre ces deux fractions ne semble pas très réaliste pour des conditions naturelles.
Par ailleurs, certains organismes benthiques peuvent ingérer les particules sédimentaires, et donc être contaminés par la fraction de substance adsorbée sur ces particules, ce qui n'est pas pris en compte par la méthode.
![]()
NORME DE QUALITÉ EMPOISONNEMENT SECONDAIRE (QSBIOTA_SEC POIS)
La norme de qualité pour l'empoisonnement secondaire (QSbiota sec pois) est calculée conformément aux recommandations du guide technique européen (E.C., 2011). Elle est obtenue en divisant la plus faible valeur de NOEC valide par les facteurs d'extrapolation recommandés (E.C., 2011).
Pour le perchlorate d'ammonium, un facteur de 30 est appliqué car le test retenu (NOEC de 2.5 mg.kg-1biota) est une étude de reproduction. On obtient donc :
![]()
Cette valeur de norme de qualité pour l'empoisonnement secondaire peut être ramenée :
- à une concentration dans l'eau selon la formule suivante :
- à une concentration dans l'eau marine selon la formule suivante :
Avec :
BCF : facteur de bioconcentration,
1 BMF: facteur de biomagnification,
2 BMF: facteur de biomagnification additionnel pour les organismes marins.
Ce calcul tient compte du fait que la substance présente dans l'eau du milieu peut se bioaccumuler dans le biota. Il donne la concentration à ne pas dépasser dans l'eau afin de respecter la valeur de la norme de qualité pour l'empoisonnement secondaire déterminée dans le biota.
La bioaccumulation tient compte à la fois du facteur de bioconcentration (BCF, ratio entre la concentration dans le biota et la concentration dans l'eau) et du facteur de biomagnification (BMF, ratio entre la concentration dans l'organisme du prédateur en bout de chaîne alimentaire, et la concentration dans l'organisme de la proie au début de la chaîne alimentaire). En l'absence de valeurs mesurées pour le BMF1 et le BMF2, celles-ci peuvent être estimées à partir du BCF selon le guide technique européen (E.C., 2011).
Ce calcul n'est donné qu'à titre indicatif. Il fait en effet l'hypothèse qu'un équilibre a été atteint entre l'eau et le biota, ce qui n'est pas véritablement réaliste dans les conditions du milieu naturel. Par ailleurs il repose sur un facteur de bioaccumulation qui peut varier de façon importante entre les espèces considérées.
Pour le perchlorate d'ammonium, un BCF de 1.85 (Dean et al, 2003) et un BMF1 = BMF2 de 1 (cf. E.C., 2011) ont été retenus. On a donc :
![]()
![]()
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA LA CONSOMMATION DES PRODUITS DE LA PECHE (QSBIOTA_HH)
La norme de qualité pour la santé humaine est calculée de la façon suivante (E.C., 2011):
![]()
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR), correspondant à une dose totale admissible par jour; pour cette substance elle est considérée égale à 0.0007 mg/kgcorporel/j (cf. tableau ci-dessus) = 0.7 µg/kgcorporel/j,
- Cons. Journ. Moy : une consommation moyenne de produits de la pêche (poissons, mollusques, crustacés) égale à 115 g par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) : la VTR donnée ne tient compte en effet que d'une exposition par voie orale, et pour la consommation de produits de la pêche uniquement. Mais la contamination peut aussi se faire par la consommation d'autres sources de nourriture, par la consommation d'eau, et d'autres voies d'exposition sont possibles (inhalation ou contact cutané). Le facteur correctif de 10% (soit 0.1) permet de rendre l'objectif de qualité plus sévère d'un facteur 10 afin de tenir compte de ces autres sources de contamination possibles.
Ce calcul n'est donné qu'à titre indicatif. Il peut être inadapté pour couvrir les risques pour les individus plus sensibles ou plus vulnérables (masse corporelle plus faible, forte consommation de produits de la pêche, voies d'exposition individuelles particulières). Le facteur correctif de 10% n'est donné que par défaut, car la contribution des différentes voies d'exposition varie selon les propriétés de la substance (et en particulier sa distribution entre les différents compartiments de l'environnement), ainsi que selon les populations considérées (travailleurs exposés, exposition pour les consommateurs/utilisateurs, exposition via l'environnement uniquement). L'hypothèse cependant que la consommation des produits de la pêche ne représente pas plus de 10% des apports journalier contribuant à la dose journalière tolérable apporte une certaine marge de sécurité (E.C., 2011).
Pour le perchlorate d'ammonium, le calcul aboutit à :
![]()
Comme pour l'empoisonnement secondaire, la concentration correspondante :
- dans l'eau douce peut être estimée en tenant compte de la bioaccumulation de la substance :
- dans l'eau marine peut être estimée en tenant compte de la bioaccumulation de la substance :
![]()
Pour le perchlorate d'ammonium, on obtient donc :
![]()
QSmarine_hh food= 42.6 / (1.85* 1 * 1) = 23 µg.L-1
![]()
NORME DE QUALITE POUR LA SANTE HUMAINE VIA L'EAU DE BOISSON (QSdw_hh)
La norme de qualité pour l'eau de boisson est calculée de la façon suivante (E.C., 2011) :
![]()
Ce calcul tient compte de :
- la valeur toxicologique de référence (VTR) ; pour cette substance elle est considérée égale à 0.0007 mg/kgcorporel/j = 0.7 µg/kgcorporel/j,
- une consommation d'eau moyenne de 2 L par jour,
- un poids corporel moyen de 70 kg,
- un facteur correctif de 10% (soit 0.1) afin de tenir compte de ces autres sources de contamination possibles.
L'eau de boisson est obtenue à partir de l'eau brute du milieu après traitement pour la rendre potable. La fraction éliminée lors du traitement dépend de la technologie utilisée ainsi que des propriétés de la substance.
![]()
En l'absence d'information, on considèrera que la fraction éliminée est nulle et le critère pour l'eau de boisson s'appliquera alors à l'eau brute du milieu. Par ailleurs, on rappellera que ce calcul n'est donné qu'à titre indicatif et peut s'avérer inadéquat pour certaines substances et certaines populations.
Pour le perchlorate d'ammonium, on obtient :
![]()
Cependant, il existe deux valeurs guides pour l'eau potable :
- l'OEHHA propose une valeur guide de 6 µg.L-1 pour une exposition chronique au perchlorate dans l'eau de boisson (OEHHA, 2004). Cette valeur est établie à partir de la même étude chez le volontaire sain que la VTR décrite ci-dessus (Greer et al., 2002).
- L'US-EPA propose une valeur projet de 15 µg.L-1 pour une exposition chronique au perchlorate dans l'eau de boisson (US-EPA, 2008). L'US EPA utilise la même formule de calcul que celle de l'OEHHA mais la part relative de l'apport de l'eau de boisson et de la nourriture est différente notamment car l'US EPA préfère prendre une valeur qui tient compte de l'exposition réelle des populations qu'une valeur estimée par défaut. Cette valeur n'est pas adoptée à ce jour car de nombreux commentaires ont été formulés en 2009 notamment en ce qui concerne les valeurs réelle de l'exposition qui sont considérées par certains comme non représentatives de l'exposition réelle.
Après expertise de l'ANSES des deux valeurs guides disponibles, le choix s'est porté sur la valeur déterminée par l'US-EPA, soit 15 µg.L-1. Cette valeur guide devient alors réglementaire et doit être appliquée au niveau national (ANSES, 2011).
![]()
Ce tableau comporte un trop grand nombre d'entrées pour permettre son affichage complet. Pour un affichage complet, utilisez l'une des options ci-dessus.
Bibliographie
Données technico-économiques
Dernière vérification le 29/03/2024
Introduction
FTE 2015 Importer
Le perchlorate d'ammonium est un composé chimique inorganique de formule NH4ClO4 et de numéro CAS 7790-98-9.
Les sources de perchlorate d'ammonium sont à la fois anthropiques et naturelles. La majorité du perchlorate d'origine naturelle provient de dépôts de nitrate que l'on peut trouver dans les déserts chiliens, dépôts qui ont également été utilisés comme fertilisant en agriculture aux Etats-Unis (salpêtre chilien – nitrate de sodium). Du perchlorate peut également être produit naturellement par certains processus atmosphériques.
Le perchlorate d'ammonium d'origine anthropique est notamment utilisé comme oxydant dans les propergols composites (produit de propulsion utilisé dans les moteurs de fusées, missiles…), pour la fabrication de dispositifs pyrotechniques (feux d'artifice, cet usage semble être en diminution à l'échelle française), dans le système de déclenchement des airbags, … La société HERAKLES fabrique et emploie en France le perchlorate d'ammonium pour certaines de ces applications, cette société indique par ailleurs être le seul fabriquant européen de cette substance.
En France, la source principale à ce jour identifiée de perchlorate d'ammonium vers l'environnement est ainsi la source anthropique liée aux activités industrielles (présentes ou passées).
Les émissions françaises anthropiques de perchlorate d'ammonium vers l'environnement (tous milieux) sont très peu renseignées dans la littérature. Néanmoins, les données du site de production de Toulouse de la société HERAKLES illustrent une démarche en cours de réduction des rejets industriels.
Une pollution au perchlorate d'ammonium est recensée dans les bases de données françaises BASOL sur le site de la SME à Saint-Médard-en-Jalles en Gironde (sol et alimentation en eau potable).
Les sels de perchlorates inorganiques sont très solubles dans l'eau et se dissolvent rapidement. Le comportement dans l'environnement du perchlorate d'ammonium est dominé par l'anion perchlorate. Une fois libéré dans l'environnement, le perchlorate est censé être très mobile dans le sol et migrer vers les eaux de surface ou souterraines1 . Cette substance est identifiée comme étant un polluant relativement répandu dans les eaux de surface aux États-Unis depuis 1997.
[1] Cette fiche technico-économique se concentre sur le seul perchlorate d'ammonium, néanmoins il convient de rappeler que de nombreux sels de perchlorate sont actuellement utilisés (perchlorate d'ammonium, de potassium, …) et que tous peuvent potentiellement être à l'origine de la présence d'anions perchlorate dans l'environnement.
Peu d'informations concernant les concentrations en perchlorate d'ammonium dans l'environnement ont été identifiées à l'échelle de la France : des ions perchlorates ont été quantifiés dans l'eau du robinet en Aquitaine, en Midi-Pyrénées et dans le Nord-Pas-de-Calais dans l'eau potable (concernant les deux premières régions, leur origine est attribuée à une activité industrielle à l'amont hydraulique des points de captage).
Concernant le traitement des eaux destinées à la consommation humaine et d'après l'avis de l'Anses daté du 18 juillet 2011, il n'existe pas à l'heure actuelle de procédé de traitement vraiment satisfaisant et efficace permettant l'élimination du perchlorate. Actuellement, la technique de traitement par résines échangeuses d'ions (résines anioniques sélectives des perchlorates2) est la plus utilisée pour traiter les eaux aux Etats-Unis. Les filtrations sur membrane (osmose inverse, nanofiltration) sont des technologies prometteuses qui se développent de plus en plus mais pour lesquelles des recherches sont encore en cours.
Concernant le traitement des eaux souterraines et des sols contaminés au perchlorate, différents types de méthodes sont actuellement employés : bioremédiation in-situ et ex-situ, phytoremédiation et méthodes physico-chimiques.
Enfin, quelques éléments sur les alternatives au perchlorate d'ammonium dans le domaine militaire -propergol (ADN, RDX, CL-20 …) mais également dans le domaine de la pyrotechnie (emploi de nitrocellulose par exemple) ont été identifiés lors de cette étude.
[2] Résine et régerant non agrées par le Ministère chargé de la Santé concernant le traitement des eaux destinées à la consommation humaine (Anses (2011). Avis de l'Anses du 18 juillet 2011 relatif à l'évaluation des risques sanitaires liés à la présence d'ions perchlorate dans les eaux destinées à la consommation humaine, Anses – Saisine n° 2011-SA-0024.).
Tableaux de synthèse
Généralités
| CAS | 7790-98-9 |
|---|---|
| Substance prioritaire dans le domaine de l’eau (DCE) | non |
| Substance soumise à autorisation dans Reach | non |
| Substance soumise à restriction dans Reach | non |
| Substance extrêmement préoccupante (SVHC) | non |
| Réglementations |
FTE 2015 Importer Les principaux textes réglementaires concernant le perchlorate d'ammonium sont présentés ci-après. Cette substance présente aussi bien des applications civiles que militaires (voir paragraphe 2.2) impliquant les mêmes sites de production. Selon la société HERAKLES (2013) ces sites respectent donc la réglementation à portée générale ici présentée. TEXTES GENERAUXD'après le site ESIS de la commission européenne, le perchlorate d'ammonium a été rapporté par les industries de l'Union Européenne comme substance HPV (high production volume6), mais n'a pas été listé dans la liste prioritaire d'évaluation dans le cadre du programme européen des substances existantes (règlement CE N°793/93). Le perchlorate d'ammonium n'est pas cité dans la stratégie communautaire concernant les perturbateurs endocriniens (Communication de la Commission au Conseil et au Parlement européen, du 17 décembre 1999, sur une stratégie communautaire concernant les perturbateurs endocriniens (COM(1999) 706 final). Néanmoins, des études montrent que l'exposition au perchlorate peut avoir des effets sur la santé, principalement en ce qui concerne la fonction thyroïdienne (Santé Canada, 2008 ; Ministère de l'écologie et du développement durable, 2003). En tant que produit explosif, les perchlorates sont soumis à l'arrêté du 04/05/10 relatif aux modalités d'homologation, de marquage, d'étiquetage, d'utilisation et de manipulation des produits explosifs. [6] HPV : High production volume i.e. Grand volume de production. Ces données sont extraites de la base de données IUCLID, où les données ont été rapportées par l'industrie (cf. http://esis.jrc.ec.europa.eu/doc/datavail.pdf site consulté en décembre 2013). Le perchlorate d'ammonium est listé par l'arrêté du 7 mars 2013 portant modification de l'arrêté du 27 juin 2012 relatif à la liste des matériels de guerre et matériels assimilés soumis à une autorisation préalable d'exportation et des produits liés à la défense soumis à une autorisation préalable de transfert (JORF n°0074 du 28 mars 2013 page 5276) : cette substance est identifiée comme matériel de guerre ou matériel assimilé dont l'exportation, sans l'autorisation préalable mentionnée à l'article L. 2335-3 du code de la défense est prohibée. Le perchlorate d'ammonium n'est par contre pas listé dans l'annexe I du règlement européen 689/2008 relatif à l'export et à l'import de substances dangereuses. SEUILS DE REJETS POUR LES INSTALLATIONS INDUSTRIELLESLes ions perchlorate ne sont pas mentionnés dans l'Arrêté du 2 février 1998 relatif aux prélèvements et à la consommation d'eau ainsi qu'aux émissions de toute nature des installations classées pour la protection de l'environnement soumises à autorisation. REGLEMENTATION AYANT TRAIT AUX DECHETSLes perchlorates étaient concernés par la Directive n°91/689/CEE du 12/12/91 relative aux déchets dangereux. Cette directive a été abrogée avec effet au 12 décembre 2010 par l'article 41 de la directive n°2008/98/CE du Parlement européen et du Conseil du 19 novembre 2008. Cette directive établit une hiérarchie d'interventions sur les déchets : prévention, préparation en vue du réemploi, recyclage, autres valorisations, notamment énergétique, élimination. Elle fixe également un objectif général de priorité à la prévention. ACTION DE RECHERCHE RSDELe perchlorate d'ammonium n'appartient pas à la liste des substances pertinentes au titre de l'action nationale de recherche et de réduction des rejets des substances dangereuses dans l'eau RSDE (cf. www.rsde.ineris.fr). Il n'appartient pas non plus à la liste des substances à rechercher dans les rejets des stations de traitement des eaux usées urbaines traitant une charge brute de pollution supérieure ou égale à 600 kg DBO5/j (Circulaire du 29 septembre 2010 relative à la surveillance de la présence de micropolluants dans les eaux rejetées au milieu naturel par les stations de traitement des eaux usées). [11] Le site web de l'Office National de l'Eau et des Milieux Aquatiques est accessible à l'adresse suivante : http://www.onema.fr/ AUTRES TEXTESLe perchlorate d'ammonium est concerné par le règlement REACH. Les informations obtenues suite à l'enregistrement de cette substance en 2010 sont disponibles via le site de l'ECHA (European Chemiclas Agency)12 . Le perchlorate d'ammonium n'est pas mentionné dans la liste des substances prioritaires de la Directive Cadre sur l'Eau (Directive 2000/60 du 23 octobre 2000). Cette substance n'appartient pas non plus à la liste des 15 substances prioritaires supplémentaires proposées par la Commission Européenne pour être ajoutées aux 33 substances de la DCE. Le perchlorate d'ammonium n'appartient pas à la liste des 823 substances du plan micropolluants 2010-201313 . L'ANSES a rendu deux avis (datant du 18 juillet 2011 et du 20 juillet 2012) relatifs à l'évaluation des risques sanitaires liés à la présence d'ions perchlorate dans les eaux destinées à la consommation humaine (Anses, 2011). Ces avis font suite à la saisine de la Direction Générale de la Santé du 31 janvier 2011. Enfin, le perchlorate d'ammonium n'appartient pas ni à la liste des produits chimiques prioritaires ni à la liste des substances potentiellement préoccupantes selon la commission OSPAR14 . [12] http://echa.europa.eu/fr/information-on-chemicals (site consulté en janvier 2014). Ces informations ayant rapport à la classification de cette substance, à sa toxicologie et écotoxicologie, à ses producteurs et distributeurs, à ses usages, à ses propriétés physico-chimiques, … ont été exploités pour la rédaction de ce document. [13] http://www.developpement-durable.gouv.fr/Les-micropolluants-dans-les.html [14] Convention OSPAR : Convention pour la protection du milieu marin de l'Atlantique du nord-est. La liste OSPAR des substances potentiellement préoccupantes a été adoptée en 2002. C'est une liste au fonctionnement dynamique et qui est régulièrement mise à jour lorsque de nouvelles informations sont disponibles. Ceci a conduit à retirer des substances de la liste. Il y a actuellement 315 substances qui pourraient faire l'objet de mesures OSPAR de par leur persistance, leur potentiel du bioaccumulation et leur toxicité ou tout autre considération équivalente. Certaines substances de la liste ont été incluses à la liste OSPAR des produits chimiques devant faire l'objet de mesures prioritaires. Le but est d'identifier les substances qui sont préoccupantes pour l'environnement marin, et pour lesquelles les engagements de la stratégie Substances dangereuses devraient être appliqués, mais qui ne sont pas couvertes de façon adéquate par la législation européenne ou par tout autre forum international (http://www.ospar.org/content/content.asp?menu=30950304450000_000000_000000) . |
| Classification CLP | Voir la classification CLP |
| Valeurs et normes appliquées en France |
FTE 2015 Importer Lors de ce travail, nous n'avons pas identifié de valeur utilisée en milieu professionnel ou pour la population générale pour le perchlorate d'ammonium. En France, l'ion perchlorate n'est pas recherché lors du contrôle sanitaire des eaux destinées à la consommation humaine, défini par l'arrêté du 11 janvier 2007. Néanmoins, l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) a été saisie le 31 janvier 2011 par la Direction Générale de la Santé d'une demande d'avis sur les risques sanitaires liés à la présence d'ions perchlorate dans l'eau potable en Aquitaine et Midi-Pyrénées. Sur la base des avis de l'Anses des 18 juillet 2011 et 20 juillet 2012, la Direction Générale de la Santé a demandé, par principe de précaution, que des restrictions de consommation soient prononcées :
Sur la base des avis de l'Anses, la DGS indique que pour les autres catégories de la population, il n'y a pas lieu de restreindre la consommation d'eau du robinet aux niveaux d'exposition actuellement mis en évidence. Les travaux de l'Anses n'ont pas identifié de d'autres populations vulnérables (par exemple, les personnes immunodéprimées ou ayant des troubles de la thyroïde)7 . Il n'existe pas de norme nationale concernant la concentration en perchlorate dans l'eau potable au sein de l'Union européenne, aux Etats-Unis8 , au Canada9 ou en Australie. A ce jour, il n'y a aucune ligne directrice établie par l'Organisation Mondiale de la Santé (Blake et al., 2009). Néanmoins, le JECFA (Joint FAO/WHO Expert Commitee on Food Additive) a établi une dose provisoire journalière acceptable (PMTDI) de 0,01 mg/kg de poids corporel10 . On notera cependant que divers états des États-Unis ont établi leurs propres valeurs limites (cf. Tableau 2 ci-après). [7] http://www.sante.gouv.fr/perchlorates-dans-l-eau-du-robinet-questions-reponses.html (site consulté en Mai 2013). [8] L'US EPA établit actuellement une norme nationale pour le perchlorate dans l'eau potable (publication de cette norme prévue pour 2013 ; http://water.epa.gov/drink/contaminants/unregulated/perchlorate.cfm). En attente de cette valeur, l'EPA a publié une norme provisoire de 15 µg.L-1. [9] Dans un cas où un approvisionnement d'eau potable aurait été contaminé, Santé Canada recommande une valeur-guide pour l'eau potable de 6 ppb, basée sur un examen des évaluations de risque courantes d'autres organismes (Santé Canada. (2008). "Le perchlorate et la santé humaine." Retrieved mai, 2012, from http://www.hc-sc.gc.ca/ewh-semt/pubs/water-eau/perchlorate-fra.php). [10] http://apps.who.int/food-additives-contaminants-jecfa-database/chemical.aspx?chemID=5885 (site consulté en janvier 2014). Tableau 2. Valeurs limites en perchlorate dans certains états des Etats-Unis (extraits de Blake et al., 2009). 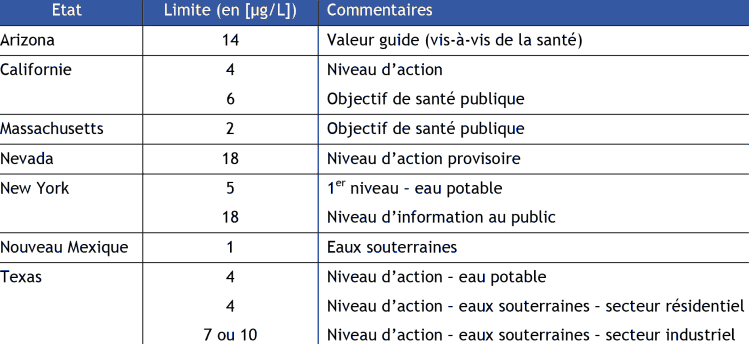 De plus, nous n'avons pas identifié de réglementation spécifique au perchlorate en termes de norme de qualité environnementale. Au moment de la rédaction de cette fiche, l'INERIS travaille, à la demande de l'ONEMA11 , à l'élaboration d'une norme de qualité environnementale pour le perchlorate d'ammonium. |
Production et utilisation
Production et ventes
Données économiques
FTE 2015 Importer
Le perchlorate d'ammonium est l'un des perchlorates les plus produits/utilisés en raison de son important contenu en oxygène (54,5 %) et d'absence de résidu lors de sa décomposition : ces propriétés ainsi qu'une bonne stabilité dans le temps en font un bon propergol pour fusée (Kirk-Othmer, 2004).
Jusqu'en 1940, la production mondiale totale de perchlorates (tous sels confondus) n'a pas dépassé 1 800 tonnes/an. Une croissance brutale de la production a eu lieu au début de la Seconde Guerre mondiale et l'augmentation résultante de la demande pour les propergols de fusées et de missiles. La production annuelle de perchlorate a rapidement augmenté à 18 000 tonnes/an en raison de cette demande et est restée à un niveau élevé par la suite (Kirk-Othmer, 2004).
La production actuelle en perchlorate d'ammonium est difficile à estimer en raison de son statut « stratégique » (ATSDR, 2009 ; Kirk-Othmer, 2004). La production future dépendra essentiellement des programmes spatiaux et militaires (Kirk-Othmer, 2004).
La société HERAKLES est l'unique fabricant européen de perchlorate d'ammonium : il est fabriqué à partir de perchlorate de sodium et est synthétisé et cristallisé sur son site de production de Toulouse. Le broyage en différentes tranches granulométriques (de quelques µm à 400 µm) et l'homogénéisation sont réalisés près de Bordeaux (Site de Saint-Médard en Jalles). La capacité des installations est supérieure à 3 500 tonnes/an (site de Toulouse). Néanmoins, il semblerait que depuis 2008, la production de cette société soit de l'ordre de 3 000 tonnes/an (SNPE Matériaux énergétiques, 2010). Ce chiffre nous a été confirmé pour 2012 par la société HERAKLES (2013) avec la précision que cette production s'effectuait au cours d'une campagne de production d'environ 9 mois.
Aux USA, une société, l'American Pacific Corporation (AMPAC) -Western Electrochemical CO. a été identifié comme producteur de la substance : cette société est représentée en Europe par la société anglaise LSR Associates Ltd (sites web de l'AMPAC 19 et de l'ECHA12).
[19] http://www.apfc.com/pdf/AMMONIUM_PERCHLORATE_%28FRENCH_VERSION%29_MATERIAL_SAFETY_DATA%20SHEET.pdf (site web de l'American Pacific Corporation consulté en janvier 2014).
On notera que selon le site de l'ESIS et à l'échelle européenne, le perchlorate d'ammonium est classé HPVC (High Production Volume Chemical) c'est-à-dire qu'il est produit ou importé par au moins un site industriel dans des quantités supérieures ou égales à 1 000 tonnes (Commission Européenne, 2012). Les deux entreprises productrices/importatrices européennes, toujours selon cette source, sont SME20 (SNPE Matériaux Energétiques) en France et FiatAvio BPD21 (fabricant notamment de moteurs pour l'aérospatiale et aéronautique) en Italie.
Procédés de production
FTE 2015 Importer
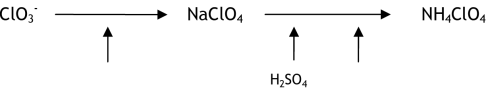
Le perchlorate d'ammonium commercial est produit par réaction de déplacement double22 entre le perchlorate de sodium et le chlorure d'ammonium (Kirk-Othmer, 2004 ; Vogt et al., 2005) :
Les paramètres réactionnels (pH, concentration…) sont détaillés dans les articles des Encyclopédies Kirk-Othmer et Ullmans's (Kirk-Othmer, 2004 ; Vogt et al., 2005).
Le perchlorate d'ammonium ultra-pur peut être produit par réaction directe entre l'ammoniac et une solution pure d'acide perchlorique (Kirk-Othmer, 2004) :
Selon les informations recueillies23 le procédé de production du perchlorate d'ammonium exploité en France peut être représenté de la façon suivante :
[20] Herakles correspond au regroupement des sociétés SME et SNECMA PROPULSION SOLIDE (site internet www.herakles.com/notre-societe/implantations/?lang=fr consulté en Mai 2013).
[21] http://www.aviogroup.com/en.
[22] Echange de cations entre 2 composés ioniques, généralement en solution aqueuse.
Electricité
NH3
Utilisations
SECTEURS D'UTILISATION
FTE 2015 Importer
SECTEURS D'UTILISATION DU PERCHLORATE D'AMMONIUM
Le perchlorate d'ammonium figure dans de nombreuses applications industrielles, en particulier dans les domaines militaires et de l'aérospatiale (ATSDR, 2009).
Cette substance est notamment utilisée (usages détaillés ci-après) (Anses, 2011) :
- •comme oxydant pour les propulseurs de fusées ;
- •pour la fabrication des dispositifs pyrotechniques, des fusées éclairantes et des explosifs pour des applications civiles ou militaires ;
- •en mélange avec l'acide sulfamique afin de produire une épaisse fumée ou un brouillard pour des applications militaires ;
- •dans le système de déclenchement des « airbags » ;
- •pour la fabrication de chandelles à oxygène utilisées en milieux clos (cabines d'avion, sous-marin…) pour des applications civiles ou militaires ;
- •comme composant d'adhésifs temporaires pour les plaques métalliques (le perchlorate d'ammonium est mélangé avec la résine époxy qui, après durcissement, forme la liaison adhésive entre les plaques) ;
- •pour ajuster la force ionique des bains électrolytiques.
Des contaminations liées à l'utilisation de salpêtre chilien (nitrate de sodium) contenant des ions perchlorate et exploité comme fertilisant en agriculture sous forme de granulés, ont été signalées aux USA (Anses, 2011).
Les ions perchlorate ont également été signalés comme impuretés dans des solutions industrielles d'hypochlorites utilisées pour la désinfection des eaux potables (Asami et al., 2009 cités par Anses, 2011).
Selon la société HERAKLES (2013), les trois principaux marchés de la société Herakles sont :
- la propulsion spatiale (propulsion du lanceur Ariane 5) ;
- la propulsion de missiles stratégiques ;
- la fabrication d'air bags destinés à équiper les véhicules.
perchlorate d'ammonium et propergols
Le perchlorate d'ammonium est employé dans les propergols24 composites (composite propellant). Ce type de propergol est principalement constitué par (SNPE Matériaux énergétiques, 2011) :
- •une charge oxydante, le plus souvent du perchlorate d'ammonium qui fournit l'oxygène nécessaire à la combustion ;
- •la poudre combustible métallique ;
- •le liant polymérique qui assure les propriétés mécaniques du bloc de propergol. Le liant lui-même constitué par un polymère de type PBCT25 , PBHT26 … ;
- •le réticulant27 .
On notera que la désignation française des différentes familles de propergol composite est obtenue au moyen d'une nomenclature permettant de distinguer les trois constituants principaux entrant dans la composition du propergol : le liant, la charge énergétique et le combustible métallique.
La désignation française d'un propergol composite est donc constituée (SNPE Matériaux énergétiques, 2011) :
- d'un préfixe qui indique la nature du liant, il existe trois types de liant :
- Le liant contenant un ester nitrique (préfixe NITRA) ;
- Le liant inerte à base de polybutadiène (préfixe BUTA) ;
- Le liant inerte à base de polypropylène glycol (préfixe ISO) ;
- d'une ou plusieurs lettres centrales qui indique(nt) la nature de la charge énergétique, on dénombre trois types de charge :
- La charge énergétique à base de perchlorate d'ammonium (lettre L) ;
- La charge énergétique à base d'hexogène ou d'octogène (lettre M) ;
- La charge énergétique à base de perchlorate de potassium (lettre P) ;
[24] Voir définition au paragraphe 1.1.
[25] PBCT : polybutadiène carboxytéléchélique.
[26] PBHT : polybutadiène hydroxytéléchélique.
[27] Réticuler : former des liaisons chimiques entre des chaînes de polymère pour produire une structure en réseau.
d'un suffixe qui indique la nature du combustible métallique, il existe trois types de combustible métallique :
- Le combustible métallique à base d'aluminium (suffixe ANE) ;
- Le combustible métallique à base de zirconium (suffixe AZE) ;
- Le combustible sans métal (suffixe ITE).
Ainsi, le terme « butalane » désigne un propergol composite constitué d'un liant polybutadiène chargé en perchlorate d'ammonium et en aluminium alors qu'une « butaline » est un propergol composite ayant les mêmes liant et charge énergétique mais sans aluminium.
La page dédiée aux « Lanceurs et orbitographie » du site Educanet28 affiche les proportions suivantes pour les « étages accélérateurs à poudre » du lanceur Ariane 5 :
- 68 % de perchlorate d'ammonium ;
- 18 % d'aluminium ;
- 14 % de polymère (le polybutadiène).
Cette information est confirmée par la société chimique de France qui précise que 237 tonnes de propergol solide sont présents dans les boosters d'Ariane 5 (Société Chimique de France, 2011).
Le magazine Latitude 5 de 200629 indique une fabrication de 15 000 tonnes de propergol sur 14 ans d'activité de la société Regulus30 de 1992 à 2005. Sur la base de ce chiffre ainsi que sur les proportions précédemment affichées, il est possible d'estimer un usage de perchlorate d'ammonium d'environ 730 tonnes par an sur le site de Guyane.
La fabrication d'un chargement de propergol composite comporte les étapes suivantes :
- 1)Malaxage des constituants liquides et pulvérulents pour former une pâte
- 2)Coulage sous vide de la pâte dans la structure du moteur préalablement revêtue d'un matériau de liaison appelé « lieur » ou « liner »
- 3)Polymérisation
- 4)Démoulage du chargement par extraction des outillages de moulage
- 5)Contrôle non-destructif (par rayons X) du chargement
- 6)Assemblage du moteur fusée ou propulseur avec l'intégration de la tuyère et de l'allumeur
[28] http://eduscol.education.fr/orbito/lanc/chimie/chim11.htm. Selon cette même source, la navette spatiale américaine, quant à elle, utilise un combustible répondant aux proportions 70-16-14.
[29] Magazine accessible en ligne depuis le site du CNES : http://www.cnescsg.fr/automne_modules_files/csg_pub/articles/r358_P18-Dossier_L5_N71.pdf -
[30] Regulus est une filiale d'Herakles (http://www.herakles.com/notre-societe/implantations/?lang=fr ; site consulté en mai 2013). Elle exploite l'usine de Propergol de Guyane (UPG).
Le synoptique de la fabrication d'un chargement de propergol composite de la société SME (SNPE Matériaux Energétiques) est disponible sur le site internet SCRIBD http://fr.scribd.com/doc/28712054/A-propos-des-materiaux-energetiques-SNPE (site consulté en mai 2013).
Le propergol solide à base de perchlorate d'ammonium est utilisé notamment dans les boosters31 d'Ariane 5 mais également dans les moteurs des missiles balistiques stratégiques qui équipent les sous-marins (comme par exemple, les missiles M5132).
Au sein de la société Regulus30 (fabriquant le propergol destiné à la fusée Ariane 5), le propergol est préparé au moyen de mélangeurs de grande capacité (11 tonnes) appelés malaxeurs, puis coulé sous vide dans les segments équipés d'un noyau central. Celui-ci est extrait après le durcissement du propergol33 .
Le propergol contient 86 % de charges solides : aluminium et perchlorate d'ammonium dispersés dans une résine polymère. 2 granulométries de perchlorate d'ammonium sont employées : 200 µm brut et 10 µm fin. La production de déchets en perchlorate d'ammonium (nettoyage, fin de lots34…) représente environ 9,8 tonnes de perchlorate d'ammonium pour 8 vols d'Ariane par an (Regulus, 2004). Ces déchets sont traités sur le site de l'usine (voir paragraphe 5.1.2.2).
[31] Booster (moteur d'accélération) : en astronomique ce terme anglais désigne une fusée auxiliaire à très forte poussée pour les engins spatiaux.
[32] http://fr.wikipedia.org/wiki/Missile_M51.
[33] http://www.cnes-csg.fr/web/CNES-CSG-fr/3955-les-industriels.php.
[34] Il est nécessaire que le perchlorate d'ammonium provienne d'un même lot de matière première pour un vol d'Ariane. De plus, pour des raisons de sécurité et de spécifications, une quantité supérieure de perchlorate est produite.
perchlorate d'ammonium et airbags
Il existe différents types de chargements pour générateurs pyrotechniques destinés au marché de la sécurité automobile dont certains employant du perchlorate d'ammonium. Ces chargements sont utilisés notamment pour le déploiement de coussins de protection (dits airbags) (SNPE Matériaux énergétiques, 2009).
Au cours des 30 dernières années, différentes technologies de générateur de gaz à propergol solides ont été explorées pour répondre aux exigences rigoureuses des applications airbag des véhicules. Aux Etats-Unis, dans les années 1990, les systèmes de gonflage à base d'azoture de sodium étaient les plus courants dans les systèmes d'airbag (Struble, 1998 cités par Ulas et al., 2006). Selon ce même auteur, ces systèmes contiennent environ 60 % d'azoture de sodium ou environ 75-100 g de propergol.
Néanmoins, la société HERAKLES (2013), indique que les airbags employés en Europe n'emploient qu'anecdotiquement de l'azoture de sodium. Environ un quart de ces airbags européens contiennent du propergol (en moyenne 50 g de propergol constitué à 40 % de perchlorate d'ammonium par airbag). Néanmoins, cette technologie est annoncée en déclin pour des raisons de coût.
Sur la base de ces données ainsi que de celles affichées par le site internet du ministère en charge du développement durable35 consacré aux statistiques concernant la circulation en France, en 2010, près de 38 millions de véhicules (véhicules particuliers, véhicules utilitaires et véhicules lourds) étaient en circulation. En supposant que chacun de ces véhicules est équipé d'un air bag contenant du propergol (de façon générale, les véhicules actuels possèdent, à minima, 2 airbags et ce chiffre peut monter à plus de 10 selon les modèles), on peut estimer entre 1 900 et 3 300 tonnes de propergol actuellement en « circulation » en France. Soit, en considérant les informations de la société HERAKLES (2013) ou par similitude avec le domaine aéronautique (et une composition du propergol de 68 % de perchlorate d'ammonium), entre 800 et 2 200 tonnes de perchlorate d'ammonium dans le parc automobile national.
[35] http://www.statistiques.developpement-durable.gouv.fr/fileadmin/documents/Produits_editoriaux/ Publications/References/2011/Comptes_transport/C-Bilan%20de%20la%20circulation.pdf
perchlorate d'ammonium et chandelles à oxygène
Les générateurs chimiques d'oxygène (chandelles à oxygène) sont des dispositifs contenant des sels oxydants, par exemple du perchlorate d'ammonium (Anses, 2011), qui sous l'action de la chaleur libèrent de l'oxygène, produit de la réaction chimique. Ces sels sont mélangés (combinés) avec un combustible, généralement de la limaille de fer, pour former une chandelle de chlorate qui produit de l'oxygène par réaction continue. Le combustible sert à la production de chaleur par oxydation. Une fois la réaction entamée, l'oxygène est libéré du sel chauffé par décomposition thermique. Les générateurs chimiques d'oxygène sont utilisés pour produire de l'oxygène permettant de respirer, par exemple dans les aéronefs, les sous-marins, les vaisseaux spatiaux, les abris anti-bombe et les appareils respiratoires36 .
Néanmoins, la société HERAKLES (2013) indique que la grande majorité des chandelles à oxygène ne comporte pas de perchlorate d'ammonium.
perchlorate d'ammonium et feux d'artifice
Le principe de base des feux d'artifice repose sur la combustion pyrotechnique de la poudre noire contenant un composé oxydant (nitrate, chlorate, perchlorate) qui libère de l'oxygène et un composé réducteur (le soufre et le carbone en mélange avec des métaux comme le silicium, le bore, le magnésium et le titane) qui sert de combustible. L'explosion porte à haute température les composés métalliques qui donnent les couleurs. Il existe plusieurs types de pièces pyrotechniques, chacune produisant un effet qui dépend de la composition ou de la structure de l'explosif (Société Chimique de France, 2012).
Le perchlorate est une composante majeure de feux d'artifice : il est utilisé principalement comme agent oxydant. Il se décompose à température modérée à haute en libérant de l'oxygène. Suivant le type de fusée désiré, le perchlorate de potassium ou d'ammonium est utilisé. A titre d'exemple, le contenu en perchlorate et les effets de feux d'artifice sont présentés dans le Tableau 5 ci-après.
36 Nations Unies. (2003). Recommandations relatives au transport des marchandises dangereuses, Treizième édition révisée, Volume1, p.362
Tableau 5. Contenu en perchlorate et feux d'artifice (extrait de Aziz et al., 2006).
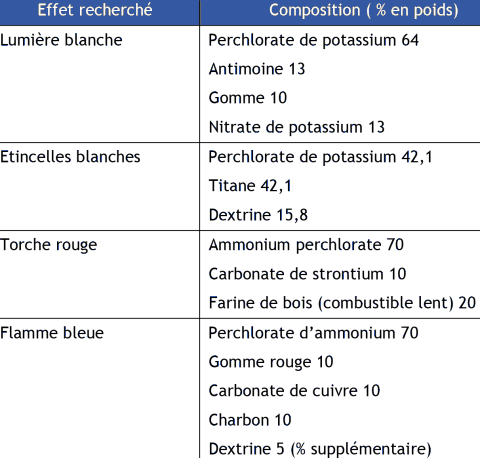
Des professionnels français de ce secteur ont été contactés dans le cadre de la rédaction de cette fiche. Il en ressort que la société Marmajou n'utilise pas de perchlorate d'ammonium mais du perchlorate de potassium (Marmajou, 2012) tandis que deux autres sont susceptibles d'utiliser du perchlorate d'ammonium dans leur formulation (Planète Artifices37 , 2012 ; Groupe Etienne Lacroix, 2012). Il semble, néanmoins, que cet usage soit sur le déclin (Groupe Etienne Lacroix, 2012). Ce constat est confirmé par un expert de l'INERIS.
On notera enfin que Guerard Sécurité (groupe Navimo distribution) qui fournit feux, fusées et engins pyrotechniques pour la sécurité des bateaux de plaisance et navires professionnels n'a pas recensé de perchlorate d'ammonium dans la composition des produits qu'ils distribuent (Groupe Navimo distribution, 2012).
[37] Selon nos informations, ce groupe ne fabrique pas d'artifice, son activité consiste en l'importation de ces produits
perchlorate d'ammonium et explosifs
La société EPC France, premier producteur français d'explosifs civils, a précisé ne pas employer le perchlorate d'ammonium dans son activité mais le perchlorate de sodium sur son site de fabrication de Saint Martin de Crau (EPC France, 2012).
La société Maxam, dans le même domaine d'activité, n'emploie pas non plus de perchlorate d'ammonium aussi bien dans les produits explosifs qu'elle utilise en France et qui sont fabriqués dans leurs différentes usines européennes que dans les produits qui sont fabriqués en France sur le site de Thenezay (Maxam, 2012).
DONNEES ECONOMIQUES
En France, la société HERAKLES38 est présente notamment dans les domaines suivants employant du perchlorate d'ammonium :
- •la propulsion stratégique (participe au développement, à la production et au soutien des moteurs des missiles stratégiques français) et spatiale ainsi que les équipements pyrotechniques ;
- •la sécurité automobile (conception, développement et production des composants énergétiques pour générateurs de gaz utilisés dans le déploiement des airbags (site de Saint-Médard-en-Jalles en Gironde).
A l'échelle de l'Europe, la société FiatAvio BPD39 (Italie) emploie le perchlorate d'ammonium pour produire un propergol solide pour fusées (IUCLID, 2000).
Quelques éléments économiques :
Selon la Société Chimique de France40 , HERAKLES, n°2 mondial, est le seul producteur européen avec une capacité de 4 000 t.an-1 à Toulouse (31). Le n°1 mondial est Western Electrochemical Company (WECCO), société du groupe American Pacific Corporation (AMPAC), seule société productrice aux Etats-Unis, à Iron County dans l'Utah, avec 13 600 t.an-1 de capacité de production.
[38] http://www.herakles.com/IMG/pdf/HERAKLES-12p-fr.pdf.
[39] http://www.aviogroup.com/en.
[40] http://www.societechimiquedefrance.fr/extras/donnees/espace_travail/mine/clat/texclat.htm.
La consommation française est d'environ 3 000 t.an-1 en particulier pour les "boosters" d'Ariane 5, les missiles M45 des sous-marins nucléaires lanceurs d'engins et les systèmes de déclenchement des "airbags".
Le perchlorate d'ammonium (NH4ClO4) entre à 68 % dans les 237 t de propergol solide (poudre), en présence de polybutadiène (14 %) et de poudre d'aluminium (18 %), utilisées dans les "boosters" d'Ariane 5.
HERAKLES couvre environ 20 % du marché mondial de l'airbag.
Le chiffre d'affaires en 2012 de la société HERAKLES était d'environ 700M€ pour un effectif de 3 000 salariés pour l'ensemble de ses activités41 .
Lors de ce travail, nous n'avons pas identifié d'informations concernant le prix du perchlorate d'ammonium.
[41] http ://www.midi-pyrenees.developpementdurable.gouv.fr/IMG/pdf/Presentation_Herakles_reunion_pprt_du_09-07-2012_cle571112.pdf. -
Rejets dans l’environnement
Sources naturelles
FTE 2015 Importer
Les sources de perchlorate (ClO4 -) peuvent être à la fois naturelles et anthropiques (Srinivasan et Sorial, 2009). Le perchlorate d'origine naturelle est principalement associé à des dépôts géologiques d'évaporites18 conservés au sein de zones géographiques où le climat est extrêmement aride : on note ainsi la présence de perchlorate d'ammonium associée aux dépôts de nitrate du désert d'Atacama au Chili (Srinivasan et Sorial, 2009 ; Urbansky et al., 2001).
Sources non-intentionelles
FTE 2015 Importer
Des travaux de recherche ont également montré que le perchlorate pouvait être produit par certains processus atmosphériques liés probablement à l'ozone troposphérique (lui même en grande partie un polluant anthropique). En effet ces travaux ont relevé la présence de perchlorate dans des zones où aucune activité anthropique ayant utilisé cette substance n'avait été recensée). Kang et al. (2008) ont confirmé dans une étude en laboratoire, que le perchlorate pouvait être généré par oxydation à l'ozone de composés chlorés (cf. Figure 1 ci-après).
[17] http://www.ineris.fr/aida/?q=consult_doc/consultation/2.250.190.28.8.5403.
[18] Les évaporites sont des roches sédimentaires constituées de minéraux ayant précipité à la suite d'une augmentation de leurs concentrations dans une saumure.
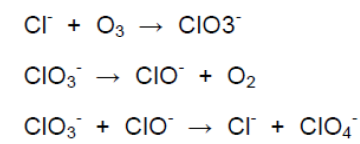
Figure 1. Formation de perchlorate à partir de l'ozone atmosphérique
(Blake et al., 2009 ; Kang et al., 2008).
Émissions anthropiques totales
FTE 2015 Importer
L'utilisation de produits contenant du perchlorate d'ammonium (feux d'artifice, dispositifs pyrotechniques, armement, …) peut être responsable d'une part non négligeable d'émissions anthropiques de la substance dans l'environnement. Néanmoins, même si cette étude n'a pas identifié suffisamment de données pour les quantifier, on doit envisager la possibilité d'observer des émissions anthropiques significatives depuis les sites de production de la
substance. Par exemple, la société HERAKLES (site de Toulouse) producteur de perchlorate d'ammonium déclarait des rejets journaliers de perchlorate d'ammonium vers l'environnement (cf paragraphe 3.4).
Feux d'artifice
Le perchlorate est un composant d'un grand nombre des pièces pyrotechniques, et la fabrication, le stockage, la manutention, l'utilisation et l'élimination de ces produits sont des sources potentielles de perchlorate dans l'environnement. Beaucoup de spectacles pyrotechniques sont tirés sur ou à proximité de plans d'eau augmentant ainsi des émissions potentielles de perchlorate vers les eaux de surface (Aziz et al., 2006). Néanmoins, selon nos informations, le perchlorate de potassium est bien plus utilisé pour ces usages que le perchlorate d'ammonium.
En 2003, environ 100 000 tonnes de feux d'artifice ont été consommées aux États-Unis. Bien que le perchlorate soit largement utilisé comme comburant dans les formulations de feux d'artifice, il existe peu d'informations liées à la quantité de résidus post-combustion et/ou des statistiques sur les taux de « ratés ». Ainsi, il est difficile d'estimer les émissions de perchlorate potentielles via les feux d'artifice vers l'environnement. Des études récentes ont néanmoins détecté du perchlorate dans les sols, les eaux souterraines et / ou dans les eaux de surface à la suite des feux d'artifice (Aziz et al., 2006).
Dasgupta et al. (2005) ont calculé des émissions en perchlorate de l'ordre de 140 tonnes/an aux États-Unis liées aux seules fusées éclairantes (non utilisées en tant que feux d'artifice), soit à 1,4 % de la production américaine de perchlorate total. Ces auteurs n'ont pas pu estimer la quantité en perchlorate libéré lors des feux d'artifice, étant donné que les fusées utilisées varient considérablement dans leur type et la composition.
Usages militaires (missiles…) et aérospatiaux
Le bon fonctionnement des missiles et fusées utilisant le perchlorate d'ammonium dans les propergols n'est pas censé libérer d'importantes quantités de perchlorate dans l'environnement, à l'exception de petites quantités de matière n'ayant pas réagi. Toutefois, les ratés peuvent conduire à la contamination des zones à proximité de points fixes de tir terrestres (Blake et al., 2009).
Le perchlorate d'ammonium dans les propergols de fusées a une durée de vie limitée et doit donc être remplacé périodiquement. Cette action de remplacement et le démantèlement des armes peuvent être responsables d'émissions dans l'environnement (Blake et al., 2009).
En effet, pour retirer le perchlorate usagé, des jets d'eau à haute pression sont utilisés pour laver le propulseur, pouvant ainsi produire de grandes quantités d'eaux usées contaminées (Dasgupta et al., 2006). Si cette eau n'est pas traitée/éliminée de façon appropriée, une
contamination environnementale est susceptible de se produire.
Selon Blake et al. (2009), des rejets peuvent également être attendus lors de l'élimination des munitions, il existe trois méthodes :
- •Brûlage à l'air libre sur une surface bétonnée : la munition est ancrée au sol et brûlée entièrement sur le terrain, une combustion presque complète se produit. Les émissions de perchlorate d'ammonium dans l'environnement sont estimées faibles ;
- •Brûlage à l'air libre dans une « cuve métallique» : les munitions sont empilées et le tout est enflammé (comme ci-dessus). Les émissions de perchlorate d'ammonium dans l'environnement sont également estimées faibles ;
- •Démolition / explosion à l'air libre : chaque munition est détruite par l'utilisation d'explosifs, que ce soit en surface ou dans une fosse. Le propulseur (perchlorate) n'est pas nécessairement détruit intégralement, une partie peut être éjectée de la fosse et une contamination non négligeable peut en résulter.
La société HERAKLES dispose, sur son site de Saint-Médard-en-Jalles, d'une unité de démantèlement destinée à la destruction du propergol des propulseurs en fin de vie et des déchets de production liés aux différents usages du propergol42 .
Airbags et chandelles à oxygène
Lors de ce travail, nous n'avons pas pu identifier d'informations concernant les rejets en perchlorate d'ammonium liés aux airbags ou aux chandelles à oxygène, soit au cours de leur utilisation, soit lors de leur destruction.
Selon le site internet l'Argus43 , il est prévu, lors du recyclage d'un véhicule, de faire exploser les sacs gonflables encore intacts.
Néanmoins, les explosifs d'airbags sont formulés de telle façon que le perchlorate d'ammonium soit le composé limitant de la rédaction d'explosion (HERAKLES, 2013), par conséquent, même si on ne peut pas exclure l'émission de perchlorate d'ammonium dans l'atmosphère lors des phases de destruction des ces airbags, il semble raisonnable d'estimer que celle-ci est de faible importance.
Enfin, la société HERAKLES (2013) indique, qu'à ce jour, il n'existe pas de procédé alternatif à la destruction des airbags en fin de vie par explosion.
[42] http://www.herakles.com/notre-societe/implantations/?lang=fr (consulté en mai 2013)
[43] http://www.largus.fr/actualite-automobile/118226-lairbag-en-cinq-questions_45707.html [Consulté en mai 2013]
Émissions atmosphériques
FTE 2015 Importer
Selon l'ATSDR (2009), les principales sources d'émissions de perchlorate d'ammonium vers l'atmosphère sont liées :
- •aux opérations de production, de traitement et d'utilisation de la substance ;
- •à l'utilisation du perchlorate d'ammonium dans les moteurs des missiles et fusées (tir avorté, décontamination, …) ;
- •aux lancements de feux d'artifice ou de fusées éclairantes..
Émissions vers les eaux
FTE 2015 Importer
Selon l'ATSDR (2009), les principales sources d'émissions de perchlorate d'ammonium vers le milieu aquatique sont liées :
- •à sa production, transformation ou son utilisation ;
- •aux choix des procédés de traitement dans les stations d'épuration (les procédés de précipitation, filtration, oxydation, ou biodégradation aérobie ne semblent pas très efficaces en ce qui concernent les perchlorates) ;
- •à la fabrication ou l'élimination d'explosifs, de propergols, ou des pièces pyrotechniques ;
- •au ruissellement ou à l'érosion du sol (ou sable) contaminé en perchlorate d'ammonium ;
- •aux lancements de feux d'artifice ou à l'usage de fusées éclairantes.
Producteur de perchlorate d'ammonium
Dans le cadre des comités locaux d'information et de concertation, la SME-Safran (site de Toulouse) producteur de perchlorate d'ammonium déclarait des rejets journaliers moyens en perchlorate d'ammonium en sortie de l'atelier de production de 1,06 kg (dans les eaux usées pour 6 mois d'activité) pour environ 10 tonnes de produit manipulés dans l'atelier. Cette valeur moyenne a été calculée entre janvier 2011 et juin 2011 (CLIC, 2011).
Dans le cadre de la Commission de Suivi des Site (CSS) HERAKLES de mai 2013, ces chiffres ont été précisés et actualisés par l'industriel44 :
[44] http://www.midi-pyrenees.developpement-durable.gouv.fr/reunions-2013-a9250.html (site internet consulté en décembre 2013).
- En 2011, l'atelier perchlorate de cette entreprise a fonctionné 9 mois en 5x8 et environ 3 000 tonnes de perchlorate d'ammonium ont été produites
- En 2012, l'atelier perchlorate de cette entreprise a fonctionné 9 mois en 5x8 et environ 2 600 tonnes de perchlorate d'ammonium ont été produites.
Entre 2011 et 2012, l'industriel évalue à 50 % la diminution du rejet d'ions perchlorate aux bornes de l'atelier. Cette diminution est notamment la conséquence de la mise en place en décembre 2012 d'une « station de traitement des effluents gazeux et liquide de l'atelier perchlorate avec recyclage des flux dans le procédé ».
Émissions vers les sols
FTE 2015 Importer
Selon l'ATSDR (2009), les principales sources d'émissions de perchlorate d'ammonium vers le sol sont liées :
- •aux installations fabricant, déclassant ou testant des propergols à base de perchlorate d'ammonium ;
- •à l'utilisation d'explosifs qui contiennent des perchlorates d'ammonium dans les applications souterraines comme l'exploitation minière (rejet de l'oxydant inutilisé au sol) ;
- •aux perchlorates d'ammonium déposés au sols depuis l'atmosphère par des processus de dépôt sec (cf. paragraphe 4.1.3) ;
- •à l'utilisation de feux d'artifice ;
- •à l'utilisation des dépôts évaporitiques chiliens en tant que fertilisant (a concerné les Etats-Unis, ces fertilisants étaient utilisés pour les plants de tabac, mais également pour les agrumes, le coton, et certaines cultures de légumes).
Rejets dans l'environnement
FTE 2015 Importer
Préambule relatif aux parties 3 et 4 sur les « rejets » et « devenir et présence » dans l'environnement du perchlorate d'ammonium :
D'une manière générale, nous n'avons identifié que très peu d'informations dans la littérature concernant les émissions en perchlorate d'ammonium et la quasi-totalité des informations identifiées concernent les Etats-Unis. Il en va de même sur les niveaux de concentrations en perchlorate dans les différents milieux environnementaux.
Comme détaillé dans le paragraphe 4.1, le perchlorate d'ammonium et plus généralement l'ensemble des sels de perchlorate sont très solubles dans l'eau et sont complètement dissociés. En conséquence, pour ces substances et dans le cadre de la problématique environnementale, les différentes études s'intéressent donc principalement au comportement de l'anion perchlorate (il n'est pas toujours possible de déterminer quel sel de perchlorate est à l'origine de la contamination). En conséquence, les données présentées dans cette fiche vont donc concerner principalement le perchlorate et non le perchlorate d'ammonium. Dans la mesure du possible (c'est-à-dire si l'information est disponible), nous nous sommes concentrés sur les émissions liées aux usages de perchlorate d'ammonium et non à tous les perchlorates qui peuvent libérer du perchlorate dans l'environnement.
Deux sources principales de perchlorate d'ammonium dans l'environnement ont été identifiées. Elles se rapportent, selon Blake et al. (2009) :
- •à son utilisation en tant qu'oxydant (y compris dans les propergols) ;
- •à sa présence dans les engrais de nitrate de sodium (salpêtre du Chili importé aux Etats-Unis pendant plus de 100 ans ; l'importation plus récente de cet engrais en France est très improbable).
Pour les Etats-Unis, ces 3 sources ont été estimées respectivement à 10 600, 750 et 130 à 640 tonnes par an, émissions calculées sur les 60 dernières années (Dasgupta et al., 2006).
Pollutions historiques et accidentelles
FTE 2015 Importer
- Base de données BASOL
BASOL est une base de données française sur les sites et sols pollués ou potentiellement pollués appelant une action des pouvoirs publics, à titre préventif ou curatif. Le site internet de cette base de données (BASOL, 2013) permet d'effectuer des recherche par substance.
A la date de rédaction de cette fiche, un site industriel est répertorié dans cette base de données pour une pollution au perchlorate d'ammonium : le site de la SME45 à Saint-Médard-en-Jalles46 (Gironde).
Base de données ARIA
Cet accident a présenté des indices « conséquences environnementales » et « matières dangereuses relâchées » de 1 sur l'échelle européenne des accidents47 .
Parmi les 12 autres accidents (11 industriels appartenant au secteur d'activité de la fabrication de produits explosifs et 1 au secteur de la défense) :
- •2 sont considérés sans conséquences ;
- •7 ont présenté un indice « matières dangereuses relâchées » de 148 ;
- •5 ont présenté un indice « conséquences humaines et sociales » de 1 ;
- •1 a présenté un indice « matières dangereuses relâchées » de 2.
[45] Herakles correspond au regroupement des sociétés SME et SNECMA PROPULSION SOLIDE (site internet www.herakles.com/notre-societe/implantations/?lang=fr consulté en Mai 2013).
[46] http://basol.ecologie.gouv.fr/fiche.php?page=1&index_sp=33.0086. http://basol.environnement.gouv.fr/fiche.php?page=1&index_sp=16.0009
[47] http://www.aria.developpement-durable.gouv.fr/Echelle-europeenne-des-accidents--3309.html.
[48] La gravité de ces événements est classée de façon croissante selon une échelle s'étalant de 1 à 5.
Présence environnementale
Atmosphère
FTE 2015 Importer
Dans l'atmosphère, les sels de perchlorate peuvent exister sous forme d'aérosol solide ou être adsorbés sur les particules en suspension. La solubilité dans l'eau et la vitesse rapide de dissolution des perchlorates indiquent qu'ils peuvent être présents dans les nuages ou le brouillard, même si les phénomènes de dépôt atmosphérique à la surface de la terre sont non négligeables (ATSDR, 2009). Ainsi, l'« élimination » du perchlorate d'ammonium atmosphérique se produit par dépôt sec ou humide.
Aucune donnée n'a été identifiée sur la transformation ou la dégradation des perchlorates dans l'air. Le mécanisme dominant pour la dégradation de composés chimiques de l'atmosphère se fait généralement par leur réaction avec les oxydants en phase gazeuse (Lyman et al., 1990 cités par ATSDR, 2009). Cependant, les espèces oxydantes atmosphériques typiques (ozone, radical oxygène) sont toutes des oxydants plus faibles que le perchlorate. Ainsi, la dégradation atmosphérique par cette voie ne se produit pas.
L'autre processus majeur de dégradation atmosphérique des composés chimiques est la photolyse directe. En général, cette réaction n'est pas significative pour les matériaux en phase solide comme c'est le cas pour les perchlorates. Ainsi, la dégradation des perchlorates par photolyse directe est négligeable (ATSDR, 2009).
Dans la littérature ne sont rapportées que très peu d'informations sur les concentrations atmosphériques en perchlorate.
Shi et al., (2011) ont étudié l'influence des feux d'artifice sur la concentration en perchlorate dans les particules atmosphériques (PM10 et PM10-100). Les mesures ont été réalisées pendant un mois en 2007 (du 1er février au 4 mars) dans la province du Gansu au nord-ouest de la Chine sur deux sites : la ville de Lanzhou et dans le district de Yuzhong (site éloigné des activités industrielles). Les résultats ont montré des niveaux de concentrations allant d'inférieur à la limite de détection à 39,16 ng.m-3 (cf. Figure 5 ci-dessous). Les fréquences de détection du perchlorate dans les aérosols étaient de 91 % (100 %) et 50 % (59 %) pour les PM10 respectivement dans la ville de Lanzhou et le comté de Yuzhong. Les concentrations les plus élevées ont été relevées sur les deux sites lors du nouvel an (fête où des feux d'artifice sont traditionnellement tirés) :
- •39,16 ng.m-3 (PM10-100) et à 9,89 ng.m-3 (PM10) pour la ville de Lanzhou
- •3,43 ng.m-3 (PM10-100) et 4,97 ng.m-3 (PM10) pour le district de Yuzhong.

Figure 5. Concentrations en perchlorate dans les particules atmosphériques (Shi et al., 2011).
Ces concentrations maximales sont environ 6,8 à 26,2 fois supérieures aux concentrations moyennes mesurées au cours de la campagne de mesure, hors feux d'artifice.
Aquatique
FTE 2015 Importer
Les sels de perchlorates inorganiques sont très solubles dans l'eau. Ainsi, ils se dissolvent rapidement et sont complètement dissociés en un anion perchlorate et le cation correspondant (soit NH4 + pour le perchlorate d'ammonium). On notera que l'ammonium est ubiquitaire dans l'environnement. Ainsi, pour les sels de perchlorate, on va principalement s'intéresser au comportement dans l'environnement de l'anion perchlorate (ATSDR, 2009).
On notera que lorsque l'anion perchlorate est détecté dans l'eau, il n'est pas toujours possible de déterminer quel sel de perchlorate est à l'origine de la contamination (perchlorate d'ammonium, de potassium …).
Lorsqu'ils sont libérés dans l'environnement, les perchlorates sont normalement très mobiles dans le sol et migrent vers les eaux de surface ou souterraines. Ils ne sont pas adsorbés de manière significative dans les sédiments ou dans la matière organique en suspension. Aucun processus de dégradation des perchlorates dans l'environnement n'a été clairement mis en évidence. Des expériences en laboratoire suggèrent que les ions perchlorate peuvent être dégradés par des microbes en conditions anaérobies dans le sol et l'eau, bien que la présence de sulfates et de nitrates dans l'environnement atténue ce processus. Des expériences en laboratoire suggèrent également que les perchlorates sont susceptibles d'être absorbés par certaines plantes et peuvent être ensuite réduits en chlorure. Néanmoins, le mécanisme d'absorption par les plantes n'a pas encore été identifié (ATSDR, 2009).
Enfin, depuis le milieu aquatique, les perchlorates ne sont pas susceptibles de se volatiliser vers l'atmosphère (ATSDR, 2009).
- Présence naturelle
Dans le nord du Chili, le perchlorate est naturellement présent dans certains sols (dépôts de nitrate ou salpêtre) tels que dans le désert d'Atacama (Urbansky et al., 2001). Les niveaux de perchlorate dans les dépôts de nitrate du Chili sont de l'ordre de 3,64 % (en masse) et les
concentrations dans les eaux souterraines dans les zones proches peuvent atteindre jusqu'à 10 000 µg.L-1 (INM, 2006 cité par Blake et al., 2009). Les concentrations en perchlorate mesurées dans l'eau potable de trois villes, Taltal, Chañaral et Antofagasta ont été de l'ordre respectivement de 100 à 120, 5 à 7 et < 4 µg.L-1 (limite de détection) (INM, 2006 cité par Blake et al., 2009).
Des concentrations en perchlorate entre < 0,005 µg.L-1 (limite de détection) et 0,105 µg.L-1 (pour une concentration moyenne de 0,015 µg.L-1) ont été rapportées dans les dépôts humides (par exemple, la neige et la pluie) dans le cadre du National Atmospheric Deposition Program49 aux Etats-Unis (Dasgupta et al., 2006).
Plummer et al., (2006) ont détecté des niveaux en perchlorate de 0,12 à 1,8 µg.L-1 dans les eaux souterraines et dans des régions reculées du bassin du Rio Grande dans le centre-nord du Nouveau-Mexique. Les auteurs concluent de ces résultats que le perchlorate a des sources locales non identifiées dont certaines peuvent être d'origine atmosphérique.
Enfin, il semblerait que l'analyse des rapports des isotopes stables de l'oxygène et de chlore dans les échantillons de perchlorate puisse être utilisée pour différencier les sources naturelles et anthropiques (Sturchio et al., 2007 cités par Blake et al., 2009).
Eaux de surface -Rivières
Au Japon, le perchlorate a été détecté à des concentrations maximales de 340 à 2 300 µg.L-1 dans la rivière Tone et la rivière Usui (son affluent) (Kosaka et al., 2007). Les concentrations en perchlorate dans l'eau potable en provenance de la rivière Tone étaient comprises entre 0,06 à 37 µg.L-1. Selon les auteurs, les sources possibles de perchlorate dans ces rivières sont des effluents industriels.
Eaux souterraines
Une enquête sur les niveaux de concentration en perchlorate dans les eaux souterraines aux États-Unis a montré que 45 % des 326 échantillons contenaient moins de 0,040 µg.L-1 de perchlorate ; 13 % avaient des niveaux compris entre 0,04 et 0,12 µg.L-1 et 42 % étaient au-dessus de 0,12 µg.L-1 (Parker et al., 2008 cités par Kannan et al., 2009). Les raisons de la présence en perchlorate ne sont pas connues.
Captages d'eau potable
Le DEFRA (Département des affaires environnementales, alimentaires et rurales du Royaume-Uni) a réalisé, dans le cadre d'un programme sur le perchlorate, une année de suivi (2008-
2009) des concentrations en perchlorate ont été relevées au niveau de 20 sites de captage d'eau potable (à la fois public et privé) à travers l'Angleterre et au Pays de Galles (Blake et al., 2009).
[49] http://nadp.sws.uiuc.edu/.
Le suivi des niveaux de perchlorate montre un bruit de fond général en perchlorate au niveau de l'eau potable brute et traitée en Angleterre et au Pays de Galles (cf. Figure 2 et Figure 3 ci-après). Toutefois, aucun dépassement de la valeur recommandée par l'ANSES et l'US EPA, c'est-à-dire 15 µg.L-1 n'a été enregistré. De plus, aucune source ponctuelle importante de contamination, par exemple via l'utilisation de propulseurs de fusée ou de missiles, n'a été identifiée et aucune variation saisonnière des concentrations en perchlorate n'a été mise en évidence. Il n'est également pas exclu que ces faibles niveaux soient le résultat de processus naturels.
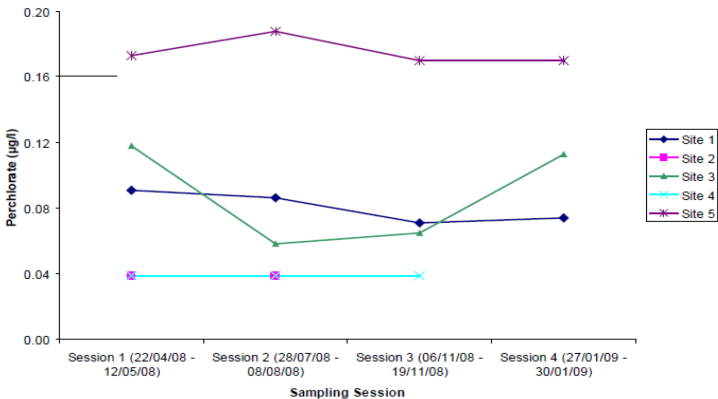
Figure 2. Concentrations en perchlorates en Angleterre et Pays de Galle relevées à proximité de zones géographiques « à faible risque » de contamination par les perchlorates50 (Blake et al., 2009).
[50] Les auteurs de l'étude ont lié la présence potentielle de perchlorate à l'usage de feux d'artifice, de munitions et d'usages mineurs (comme le dynamitage de carrières, …). A partir de cette liste d'activités un certain nombre de sites qui pourraient être considérées comme potentiellement « à risque élevé » a été identifié.
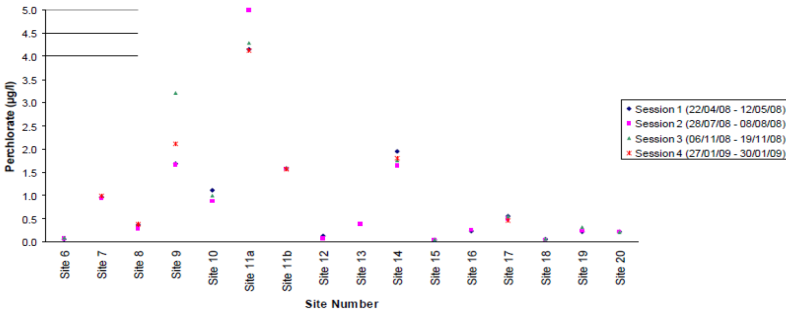
Figure 3. Concentrations en perchlorate en Angleterre et Pays de Galle relevées à proximité de zones géographiques « susceptibles d'être contaminées » par les perchlorates (Blake et al., 2009).
Les sites 6, 11, 12, 13, 14 et 15 ont été sélectionnés car ils étaient situés à proximité d'une installation militaire (utilisation d'explosifs…).
En France, l'ion perchlorate n'est pas recherché lors du contrôle sanitaire des eaux destinées à la consommation humaine, défini par l'arrêté du 11 janvier 2007. Par conséquent, il n'existe aucune donnée dans la base de données (SISE-EAUX51) concernant le perchlorate d'ammonium ou les ions perchlorate (Anses, 2011).
Toujours selon cette source, les données disponibles fournies par les Agences Régionales de Santé (ARS) Midi-Pyrénées et Aquitaine, montrent qu'au robinet du consommateur, entre octobre 2006 et janvier 2011, la concentration maximale en ions perchlorate observée était de 11 µg.L-1.
Dans le cadre de la surveillance du site de la SME (site de Toulouse), l'industriel fait état de concentrations en perchlorate mesurées dans l'eau potable en aout/septembre 2011 variant entre 1 et 2,3 µg.L-1 (réseaux d'eau potable alimentés par le canal latéral à l'aval de Toulouse et influencé par les rejets de SME). Cette période était caractérisée par une faible pluviométrie et des faibles débits de la Garonne et donc une moindre dilution des rejets en
[51] SISE-EAUX Système d'information en Santé-Environnement sur les Eaux (http://www.sante-environnementtravail.fr/minisite.php3?id_rubrique=1008&id_article=4266). -
perchlorate (entre février et août 2011, aucune trace de perchlorate n'avait été relevée dans l'eau potable sur les 2 réseaux influencés par les rejets de SME). Les prélèvements dans l'eau potable (département du Tarn et Garonne) montraient, quant-à-eux une teneur de 2 à 3 µg.L-1 et ceux du Lot-et-Garonne des valeurs comprises entre 1 et 2 µg.L-1 (CLIC, 2011). On notera que ces niveaux de concentration ne dépassent pas les seuils de restriction établis par la DGS. De plus, toujours dans le cadre de la surveillance du site, l'industriel précise que la présence de perchlorate dans la Garonne a été relevée même lors de l'arrêt de l'atelier de production en perchlorate, évoquant ainsi une contamination probable par le biais des sols pollués (CLIC, 2011).
L'ARS Iles-de-France (2012) indique également que l'analyse de l'eau en sortie de l'usine de Saint-Pierre-lès-Nemour (en Seine et Marne), c'est-à-dire au robinet du consommateur, a révélé un taux en ions perchlorates de 13µg.l-152 .
Cette agence a restreint la consommation de cette eau pour la préparation des biberons des nourrissons de moins de six mois pour neuf communes du territoire (Aufferville, Bagneaux sur Loing, Chatenoy, Chevrainvilliers, Darvault, Fay les Nemours, Nemours, Ormesson, Saint-Pierre-lès-Nemours).
On notera enfin que selon actu-environnement53 et la Voix du Nord54 , l'Agence Régionale de Santé (ARS) du Nord-Pas-de-Calais a lancé une étude en octobre 2011 pour déterminer la concentration en ions perchlorates dans l'eau du robinet. En effet, selon l'ARS55 , compte tenu du passé historique de la région, la question se pose de la contamination des eaux par du perchlorate d'ammonium liée aux nombreuses munitions tirées lors de la première guerre mondiale, en particulier, sur la ligne de front qui se trouvait à la limite entre la plaine de Flandres (ex-bassin minier) et le plateau d'Artois.
En octobre 2012, au vu des résultats obtenus, 544 communes des départements du Nord et du Pas-de-Calais étaient concernées par un arrêté de restriction portant sur la consommation d'eau pour les nourrissons de moins de 6 mois et pour les femmes enceintes ou allaitantes.
A la date de rédaction de cette fiche, certaines communes ont vu leur situation évoluer56 .
[52] http://www.ars.iledefrance.sante.fr/Traces-d-ions-perchlorates-dan.141042.0.html.
[53] http://www.actu-environnement.com/ae/news/perchlorates-eau-potable-15570.php4.
[54] http://www.lavoixdunord.fr/region/perchlorates-dans-l-eau-du-robinet-des-seuils-tres-jna29b0n442303.
[55] http://www.ars.nordpasdecalais.sante.fr/fileadmin/NORD-PAS-DE-CALAIS/Actualites/ note_perchlorate_annexe .pdf.
[56] http://www.ars.nordpasdecalais.sante.fr/restriction-consommation-de.145725.0.html.
Boues d'épuration
Dans la plupart des régions chinoises, le perchlorate a été détecté dans des échantillons de boues d'épuration (concentrations comprises entre 0,56 à 379,9 µg/kg pour une concentration moyenne de 21,7 µg/kg) (Shi et al., 2007). La concentration la plus forte mesurée dans les boues (379,9 µg/kg) a été relevée au niveau de la station d'épuration qui recevait environ 58 % d'effluents industriels (industrie électronique) et 42 % d'effluents domestiques. Les trois stations d'épuration qui recevaient environ 90 % d'effluents domestiques avaient des teneurs plus faibles en perchlorate et comprises entre de 16,3 et 37,0 µg/kg.
Niveaux mesurés dans le milieu aquatique après un feu d'artifice
En préalable à ce paragraphe, il convient de rappeler que, selon nos sources, le perchlorate de potassium est bien plus utilisé pour les usages « feu d'artifice » que le perchlorate d'ammonium. Néanmoins, à partir des informations dont nous disposons, il est impossible de savoir si les niveaux de perchlorate mesurés dans le milieu aquatique après un feu d'artifice proviennent de l'usage de perchlorate d'ammonium ou de perchlorate de sodium dans ces artifices.
Wilkin et al. (2007) ont étudié les concentrations en perchlorate dans un lac municipal aux Etats-Unis (Oklahoma) avant et après un feu d'artifice en 2006 tiré sur le lac. La concentration moyenne en perchlorate avant le feu d'artifice était comprise entre 0,005 à 0,081 µg.L-1 (limite de détection de 0,003 µg.L-1).
Après 14 heures, cette dernière avait augmenté à 44,2 µg.L-1 pour revenir à des niveaux de fond dans les 20 à 80 jours suivants. Il a été également rapporté que des feux d'artifice avaient entrainé des niveaux en perchlorate allant jusqu'à 10 µg.L-1 dans les réseaux publics d'approvisionnement en eau potable dans le Massachussetts (Etats-Unis) (SWRCB, 2005).
Kosaka et al. (2007) ont examiné les niveaux de perchlorate dans la rivière Hirose (Japon) juste après un feu d'artifice lancé d'une péniche puis 5 jours plus tard. La concentration immédiatement après le feu d'artifice était de 79 µg.L-1 et avait chuté à 0,39 µg.L-1 après 5 jours.
Blake et al. (2009), dans le cadre d'un programme sur le perchlorate dans les eaux potables au Royaume-Uni ont mesuré les concentrations en cette substance avant et après un feu d'artifice. Les résultats sont présentés sur la Figure 4 ci-dessous et montrent des concentrations en perchlorate variables après un feu d'artifice (comprises entre 1 et 7 µg.L-1).
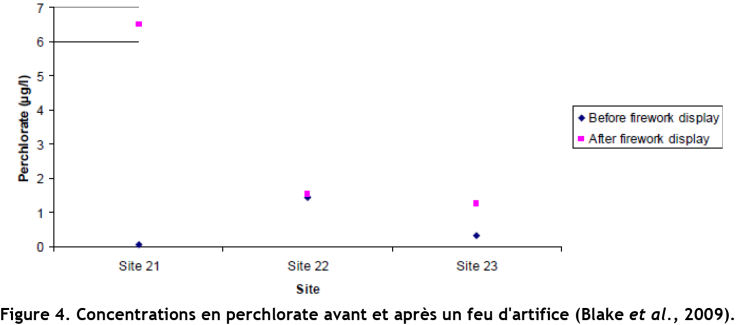
Au vu de ces études, on constate que les feux d'artifice entrainent des niveaux pouvant se révéler relativement ponctuellement importants en perchlorate dans le milieu aquatique juste pour une durée limitée après le lancement pour ensuite diminuer les jours suivants.
Niveaux mesurés dans le milieu aquatique liés aux propergols
Aux Etats-Unis, le perchlorate d'ammonium (par l'intermédiaire de son utilisation dans les propergols solides dans les fusées et missiles) a été signalé comme étant responsable de la contamination d'un grand nombre d'eaux souterraines et d'eaux de surface à des concentrations allant de 8 à 3 700 µg.L-1 (jusqu'à 30 000 µg.L-1 dans les eaux de surface à proximité d'une usine de munitions au Texas) (Crane et al., 2005). Des niveaux en perchlorate d'ammonium 4 à 24 µg.L-1 dans le Nevada et de 4 à 820 µg.L-1 en Californie ont également été mesurés dans les eaux potables (Sturchio et al., 2007 cités par Blake et al., 2009).
Terrestre
FTE 2015 Importer
Les perchlorates sont mobiles dans le sol et sont transportés à travers les sols par infiltration (ATSDR, 2009).
En cas de rejet vers les sols, l'ion perchlorate n'est que faiblement absorbé sur des surfaces minérales. Le perchlorate présentant une haute solubilité dans l'eau, il migre facilement vers les eaux souterraines (HSDB, 2012).
Les perchlorates ne sont pas susceptibles de se volatiliser du sol vers l'atmosphère en raison de leur très faible pression de vapeur (ATSDR, 2009). Toutefois, les perchlorates peuvent être transportés du sol vers l'atmosphère par érosion. Ce processus de convection peut libérer des aérosols ou des particules sur lesquels sont adsorbés des sels de perchlorate secs (ATSDR, 2009).
Dans la littérature ne sont rapportées que très peu d'informations sur les concentrations en perchlorate dans les sols ou sédiments en Europe. Les seules informations identifiées lors de ce travail concernent les Etats-Unis et sont présentées ci-dessous.
Une contamination en perchlorate dans le sol et les sédiments a été mise en évidence dans des installations du département de la défense américaine en 2005 (activités militaires des sites). Les concentrations maximales mesurées en perchlorate dans les sols varient considérablement, allant d'environ 32 à 2 000 000 µg/kg. Les niveaux les plus élevés en perchlorate relevés dans les sédiments étaient compris entre 17 µg/kg et 230 µg/kg (ATSDR, 2009).
Des concentrations en perchlorate variant entre 12 et 704 µg.L-1 ont été mesurées dans 4 des 12 échantillons de l'eau de sédiments d'une usine de munitions de l'Armée au Texas en 1999 (Smith et al., 2001). Il a également été détecté dans 4 des 18 échantillons de sol à proximité d'un bâtiment de cette zone des concentrations de l'ordre de 50 à 322 µg/kg.
La concentration de perchlorate dans des échantillons de sol prélevés sous les fondations d'une installation fabriquant du propergol au Texas variait de 23 à 1 800 000 µg/kg (Cowan, 2000 cités par ATSDR, 2009).
Le perchlorate a été détecté dans 38 % des 113 échantillons de sol et 93 % des 93 échantillons de sédiments prélevés dans la région du lac Mead au Nevada avec une concentration moyenne (maximale) de 58 (1 470) mg/kg et 13 (56) mg/kg, respectivement (Dean et al., 2004).
La concentration de perchlorate dans les échantillons de sol prélevés dans un champ de tabac était de 340 µg/kg en décembre 1999 (Ellington et al., 2001 cités par ATSDR, 2009). Des plants de tabac cultivés dans ce domaine avaient été traités cet été là en utilisant des produits dérivés de salpêtre du Chili (produits qui contenaient des concentrations en perchlorate allant de 35 800 et 1 544 000 µg/kg).
On notera que, bien que le perchlorate, comme nous l'avons vu précédemment, migre facilement vers les eaux souterraines, des concentrations non négligeables de cette substance ont été mesurées dans les sols à proximité de sites en utilisant.
Synthèse
FTE 2015 Importer
Le perchlorate d'ammonium a une utilisation historique bien connue en tant que composant des propulseurs de fusée. D'autres utilisations sont également relativement répandues : emploi dans les feux d'artifice, pour airbags de voiture… Il est également signalé à l'état naturel dans des dépôts évaporitiques de certaines zones du Chili. Des travaux récents ont montré que l'ion perchlorate est un contaminant répandu aux États-Unis mais également dans d'autres pays comme le Japon, la Chine et la Corée (où il a été détecté à la fois dans le milieu aquatique et dans les eaux de boisson) (Blake et al., 2009). En raison principalement des différents usages (utilisation militaire, feux d'artifice, …), le perchlorate d'ammonium ou l'ion perchlorate se révèle être présent, à différentes concentrations, dans tous les compartiments environnementaux (air, eau & sol).
Perspectives de réduction
Réduction des rejets
REDUCTION DES EMISSIONS DE PERCHLORATE
FTE 2015 Importer
Les principales techniques de réduction des émissions de perchlorate peuvent être classées en deux grandes catégories (Ye et al., 2012 ; ITRC, 2008b) :
- •Les techniques physiques ou chimiques :
- Adsorption (charbon actif) ;
- Echanges d'ions ;
- Filtration sur membrane ;
- Autres techniques.
- •Les techniques biologiques :
- Bioremédiation in-situ ;
- Bioremédiation ex-situ ;
- Phytotechnologie ;
- Zones humides artificielles.
LES TECHNIQUES PHYSIQUES OU CHIMIQUES
ADSORPTION (CHARBON ACTIF)
- Filtration physique sur charbon actif en grains
Les charbons actifs présentent une faible affinité pour les ions perchlorate. De plus, le groupe de travail de l'Anses a jugé que la filtration sur charbon actif en grain (CAG) de l'eau avec un flux de 5 m3/m2/h ne pouvait donner des résultats acceptables que pendant une durée de l'ordre de 10 jours (Anses, 2011). Cette courte de durée d'efficacité entraine ainsi des changements de charbon trop fréquents.
Selon ITRC (2008b), le coût de traitement par charbon actif en grains pour les composés organiques est d'environ 1 $ par livre de charbon actif soit entre57 660 $/m3 et 1 320 $/m3 de charbon actif) aux Etats-Unis. Ces coûts sont, toutefois, plus élevés pour le traitement du perchlorate. En effet, ils sont très sensibles à la quantité d'ions concurrents présents. A titre d'exemple, les coûts pour un traitement au charbon actif (installation réalisée sur mesure) et comprenant les médias (charbon actif) et les coûts de régénération ont été estimés à environ 0,05 à 0,01 $/m3 d'eau souterraine à traiter et cela, pour une concentration en perchlorate dans les eaux comprise entre 40 et 70 µg.L-1.
Filtration biologique sur charbon actif en grains
Des tests en laboratoire ont montré que le perchlorate pouvait être complètement détruit par filtration biologique à charbon actif en grains (ou charbon actif dit biologique : lequel possède, adsorbées sur ses parois, des micro-organismes grands consommateurs de matières organiques biodégradables58). Avec un temps de contact eau usée/charbon actif de 9 minutes, la filtration sur charbon actif biologique permet d'obtenir des niveaux en perchlorate inférieurs à 2 µg.L-1 pour des concentrations en entrée de perchlorate comprises entre 10 à 300 µg.L-1, de sulfates entre 0 à 200 mg.L-1, un pH de 6,5 à 9,0 et une température de 5 à 22°C (Brown et al., 2003).
La filtration biologique sur CAG est mise en œuvre sur certaines grandes installations d'eau potable en France, par exemple l'usine du SEDIF de Choisy-le-Roi (94).
Récemment, des chercheurs ont trouvé d'autres matériaux absorbants pour réduire les concentrations en perchlorate dans les eaux, matériaux à base de chitosane59 , d'hydroxyde de fer, d'amine quaternaire …. Cependant, ces nouveaux matériaux absorbants sont actuellement encore en cours d'étude. Divers paramètres comme les influences de la température, le temps d'adsorption, le pH, etc … sont encore à l'étude (Ye et al., 2012).
ECHANGES D'IONS
Les résines échangeuses d'ions constituent une technologie de traitement ex-situ pour les eaux contaminées (milieu aquatique). Les eaux souterraines ou les eaux de surface doivent
[57] Calcul réalisé avec les éléments suivants : 1 livre = 453,59237 grammes et masse volumique apparente des charbons actifs compris entre 300 et 600 kg.m-3 (Techniques de l'ingénieur (2003). Adsporption-Aspects théoriques. J2 730.).
[58] http://www.cnrs.fr/cw/dossiers/doseau/decouv/potable/traitEau.html.
[59] Le chitosane est polymère naturel, de la famille des polysaccharides comme la cellulose ou l'amidon.
être pompées vers la station de traitement. L'échange d'anions est le traitement « physique » le plus couramment utilisé pour les eaux de surface ou souterraines et les lixiviats (ITRC, 2008a).
Selon ITRC (2008a), les avantages de cette méthode sont les suivants :
- •temps de réaction rapide permettant de traiter des débits élevés ;
- •nombreuses études actuelles en recherche et développement qui devront à terme réduire les coûts de cette technique.
Les désavantages de ce procédé sont les suivants :
- •sensibilité à la composition chimique de l'influent ;
- •les matières en suspension peuvent obstruer la résine ;
- •absorption possible d'autres anions (interférences) ;
- •déchets riches en perchlorate nécessitant un traitement ;
- •résines non sélectives nécessitant un remplacement fréquent et un traitement adéquat.
A titre d'exemple, plus de 100 000 volumes de lit60 d'eau souterraine avec des concentrations en perchlorate de l'ordre de 50 µg.L-1 ont pu être traités grâce à cette technologie aux Etats-Unis. La régénération des résines exige de grands volumes de saumure concentrée (12 % de chlorure de sodium).
Selon ITRC (2008b), aux Etats-Unis, la majorité des systèmes de traitement par échanges d'ions utilisent des résines échangeuses d'ions à usage unique (non régénérables). Le fonctionnement de ces systèmes est simple et l'investissement requis est faible comparé à celui de systèmes de traitements régénérables. A l'inverse, les coûts d'exploitation associés au remplacement périodique et l'élimination de la résine peuvent être relativement élevés. En général, les coûts d'exploitation associés aux systèmes non régénérables vont de 0,08 à 0,121 $/m3 d'eau traitée.
Des études ont démontré que les coûts opérationnels pour des résines anioniques faibles régénérables sont inférieurs à ceux des autres résines régénérables ou à usage unique. Les coûts opérationnels pour ces résines anioniques sont estimés à 0,06 à 0,07 $/m3 (ITRC, 2008b).
[60] Volume de lit : volume par heure de liquide qui peut être traité / volume de résine (http://www.lenntech.fr/index.htm).
Dans le cas du traitement d'eau potable, les processus d'élimination physique (en particulier les résines échangeuses d'ions) sont également adaptés dans le cadre des petites installations de traitement. Toutefois, de tels procédés présentent certains inconvénients, tels que le manque de sélectivité ainsi que le résidu des concentrats obtenu qui nécessite un traitement supplémentaire. En conséquence, les processus destructeurs qui réduisent le perchlorate en chlorure sont préférés (Srinivasan et Sorial, 2009).
FILTRATION SUR MEMBRANE
La filtration sur membrane par osmose inverse, nanofiltration et ultrafiltration permet également l'élimination de perchlorate dans l'eau potable (Ye et al., 2012).
Des expériences ont montré qu'environ 80 % de la concentration en perchlorate initiale (100 µg.L-1) dans l'eau pure pouvaient être abattus par nanofiltration, mais cet abattement est plus faible pour des eaux naturelles. L'abattement peut être amélioré par l'ajout d'un agent tensio-actif cationique (Yoon et al., 2003).
Les technologies de filtration sur membrane sont prometteuses pour l'élimination de perchlorate dans l'eau potable, mais celles-ci possèdent un inconvénient important pour les systèmes à grande échelle, à savoir, que les rejets nécessitent un traitement supplémentaire. De plus, le cout de cette technique reste relativement élevé.
En France, l'usine d'eau potable de Mery sur Oise61 dispose, par exemple, d'une unité spécifique de traitement des rejets par nanofiltration.
L'électrodialyse semble être plus efficace que la filtration sur membrane classique pour le perchlorate mais ses coûts d'exploitation restent très élevés (Ye et al., 2012).
Des recherches sont en cours sur l'efficacité des traitements par nanofiltration et osmose inverse (INM, 2006 cité par Blake et al., 2009).
REDUCTION ELECTROCHIMIQUE
Domaine d'application potentiel : des tests aux Etats-Unis ont été réalisés sur des installations d'eau potable ainsi que sur des eaux souterraines contaminées
La réduction électrochimique du perchlorate se produit souvent dans un milieu acide entrainant un inconvénient majeur : l'érosion de l'électrode. Des recherches sont actuellement en cours pour adapter cette méthode de traitement pour les ions perchlorate
[61] http://www.sedif.com/mery.aspx.
(matériau de l'électrode, configuration du réacteur …). Une percée dans ce domaine pourrait permettre d'augmenter l'efficacité de traitement des perchlorates et d'en réduire les coûts. Enfin, l'ensemble de ces recherches ayant été menées dans des laboratoires, il resterait à tester/valider cette méthode sur le terrain (Ye et al., 2012).
UTILISATION DE NANO-PARTICULES
Bien que, selon nos informations, non testée de façon opérationnelle comme traitement des eaux potables contaminées par du perchlorate d'ammonium, l'emploi de nano-particules de fer pourrait s'avérer une voie de traitement innovante (Caliman et al., 2011). Cette technique est notamment étudiée aux Etats-Unis par le « Department of Civil and Environmental Engineering (Lehigh University) », elle souffrirait néanmoins d'une limitation liée à la lenteur de la cinétique de réaction (Jiasheng et al., 2005).
CAS PARTICULIER DES EAUX POTABLES EN FRANCE
Dans son avis du 18 juillet 2011, l'ANSES recense l'efficacité des différents traitements autorisés en France pour les eaux destinées à la consommation humaine vis-à-vis la teneur en ions perchlorate :
- •Les méthodes de rétention :
- Adsorption (faible affinité du charbon actif pour les ions perchlorate) ;
- Echange ionique. Les résines échangeuses d'ions actuellement utilisées et agréées ne sont pas spécifiques des ions perchlorate. Néanmoins, il existe des résines anioniques fortes, sélectives des ions perchlorate. Elles utilisent comme groupe échangeur des ammoniums quaternaires à très longue chaîne. Il existe des résines à deux groupes échangeurs, l'un avec un ammonium quaternaire à longue chaîne, l'autre à chaîne courte. Le meilleur régénérant est l'ion ferrate (FeCl4 -). Ni ces résines, ni le régénérant ne sont agréés par le Ministère chargé de la santé et il se pose le problème de la gestion des régénérats ;
- Rétention membranaire. L'usage de membranes de nanofiltration à bas seuil de coupure (< 100 Da) pourrait être envisagé pour la rétention de ces ions mais se pose le problème du devenir des concentrats.
- •Les méthodes de transformation. Les méthodes de transformation par réduction chimique ou électro-réduction sont inopérantes dans les conditions habituelles de production des eaux à destination de la consommation humaine (EDCH). Les procédés de réduction par voie biologique nécessitent des temps de réaction très longs et peu compatibles avec les contraintes d'une unité de production d'EDCH.
Par conséquent, il semble ne pas exister actuellement de procédé de traitement physique ou chimique vraiment satisfaisant et efficace permettant l'élimination des ions perchlorate des eaux destinées à la consommation humaine (Anses, 2011 ; Srinivasan et Sorial, 2009).
LES TECHNIQUES BIOLOGIQUES
Bien qu'une grande variété de bactéries réductrices du perchlorate soit présente dans le sol et les eaux souterraines, les conditions propices à l'atténuation naturelle n'ont pas encore été pleinement identifiées et sont actuellement à l'étude (ITRC, 2008a).
Les processus biologiques peuvent être utilisés in-situ et ex-situ et aussi bien pour les sols contaminés que pour le milieu aquatique (eau de surface, souterraine). Différentes bactéries sont susceptibles de biodégrader le perchlorate selon le même schéma réactionnel (cf. Figure 6). Dans des conditions à la fois in situ ou ex situ, ces microorganismes peuvent mener efficacement la biotransformation de cette substance.
Figure 6. Traitement biologique du perchlorate (ITRC, 2008a).
La réduction du perchlorate par des processus biologiques dans des conditions anaérobies a été largement étudiée ces dernières années (Kim et Logan, 2001 ; Wallace et al., 1998 ; Gingras et Batista, 2002 ; Okeke et al., 2002). Des enzymes spécifiques dans les cellules de microorganismes font office de catalyseurs lors de la dégradation de perchlorate. En raison de l'efficacité des processus biologiques, l'armée américaine a déjà aménagé des installations de traitement biologique de perchlorate dans plusieurs installations militaires (Wallace et al., 1998).
D'autres études ont démontré une élimination efficace du perchlorate par des processus biologiques par des tests à grande échelle (Kim et Logan, 2001 ; Min et al., 2004 ; Nerenberg et al., 2002). Cependant, aux Etats-Unis, les traitements microbiens n'ont jamais été utilisés directement dans les systèmes de traitement d'eau potable en raison de problèmes d'acceptation du public (problème par rapport à la présence d'agents pathogènes en particulier). Bien que le traitement biologique du perchlorate soit adapté pour traiter les
eaux contenant du perchlorate, son application dans les grandes usines d'eau potable américaine reste, au mieux, envisageable (Srinivasan et Sorial, 2009).
BIOREMEDIATION IN-SITU
La bioremédiation in-situ est généralement appliquée à une zone saturée au niveau de la nappe phréatique, pour restaurer un site contaminé. Les bactéries réductrices de perchlorate peuvent être stimulées par l'ajout d'un substrat de croissance microbienne afin d'obtenir des concentrations en perchlorate inférieures à la limite de détection. Les deux techniques principales utilisées pour les eaux souterraines sont (ITRC, 2008a) :
- •les barrières perméables réactives ;
- •les systèmes d'injection de amendements / réactifs.
Les barrières perméables réactives
Elles sont généralement utilisées pour stopper la migration des contaminants en aval de la source (cf. Figure 7 ci-dessous). Plusieurs barrières peuvent être installées les unes à côté des autres, formant ainsi une grille permettant d'assurer un traitement continu (ITRC, 2008a).
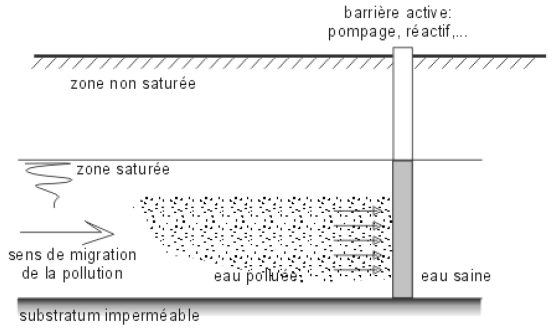
Figure 7. Schéma de principe des barrières perméables réactives (ADEME, 2012).
D'après l'ADEME, l'investissement représente la majeure partie des coûts. Il consiste en la mise en place de l'ouvrage et notamment des barrières de traitement. Les charges récurrentes (entretien, maintenance…) sont également importantes. L'assurance de la pérennité de l'ouvrage nécessite des opérations de maintenance régulière. De plus, la mise en œuvre de barrières perméables réactives implique des coûts de consommables liés à l'utilisation de réactifs. Le suivi analytique et les études visent à vérifier que la pollution est bien confinée puis traitée (potentiellement par des technologies citées ci-avant): ces postes de coût sont cependant plus réduits. Un cout moyen de 5 à 45 euros/m3 a été estimé par l'ADEME et une répartition des couts explicitée sur la Figure 8 ci-dessous (ADEME, 2012).
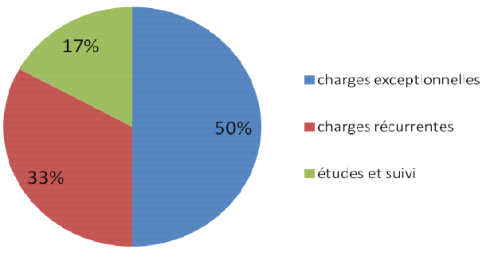
Figure 8. Répartition des coûts pour les barrières perméables réactives (d'après ADEME, 2012).
Systèmes d'injection de réactifs
L'injection de réactifs solubles dans l'eau ou miscibles avec une faible viscosité est généralement une technique à action rapide (ITRC, 2008a). Basées sur un échange d'électrons entre le polluant et l'agent injecté, elle consiste à dégrader le polluant en un composé moins ou non toxique (voir Figure 9 ci-dessous). Les différentes techniques de mises en œuvre de l'oxydation et de la réduction se distinguent par leurs réactifs (ADEME, 2012).
Néanmoins, ces réactifs ne restent que peu de temps dans le réseau aquifère. Les différents réactifs utilisés sont le lactate, le lactate polymérisé, la mélasse, l'éthanol ou l'acétate (ITRC, 2008a).
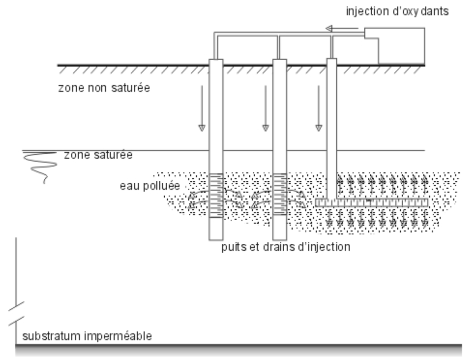
Figure 9. Schéma de principe du procédé pour les eaux souterraines (ADEME, 2012).
D'après l'ADEME et du point de vue économique, pour les eaux souterraines, l'investissement initial est assez limité et correspond à l'installation de l'unité et du réseau de puits d'injection. Le coût de mise en œuvre est lui très important. Les charges liées aux consommations de réactifs sont variables, d'autant plus que le coût unitaire de l'oxydant est fortement soumis au contexte de monopole de fournisseurs américains. D'autre part, la réalisation d'injections ciblées peut réduire les coûts de mise en œuvre. L'oxydation ne nécessite pas de maintenance spécifique. Mais un suivi analytique important est nécessaire pour garantir un résultat durable et prévenir toute réapparition de la pollution. Un cout moyen de 20 à 55 euros/m3 d'eau (20 à 50 euros/tonne pour le traitement des sols pollués) a été estimé par l'ADEME et une répartition des couts explicitée sur la Figure 10 ci-dessous (ADEME, 2012).
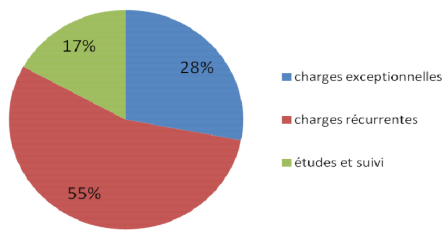
Figure 10. Répartition des coûts pour l'injection de réactifs (d'après ADEME, 2012).
On notera que le département de la défense américaine a testé une technologie innovante de bioremédiation pour les eaux souterraines contaminées en perchlorate : « horizontal flow treatment well » (HFTW). La technologie HFTW se compose de deux puits de traitement, l'un va pomper de l'eau souterraine contaminée d'une région profonde de l'aquifère et injecter cette eau dans une zone moins profonde et l'autre va pomper l'eau souterraine contaminée de la zone moins profonde et injecter dans la partie profonde (cf. Figure 11 ci-après). Les deux puits travaillent en tandem pour établir une zone de recirculation des eaux souterraines dans le sous-sol. Un « donneur d'électrons » est ajouté et mélangé avec l'eau souterraine contaminée dans chaque puits, créant ainsi une zone anaérobie et bioactive (Hatzinger et Diebold, 2009). L'acide citrique a été testé avec succès comme donneur d'électrons permettant ainsi de traiter en même temps des co-contaminants (nitrates et trichloréthylène). 3 modes de fonctionnement ont été testés durant lesquels différents types d'injections d'acide citrique et réglages de pompage des eaux ont été testés :
- •phase I : injection quotidienne et pompage en continu ;
- •phase II : injection 1 à 2 fois par semaine avec une concentration en acide citrique plus importante et pompage en continu ;
- •phase III : mode de fonctionnement « actif-passif », cycle de 15 jours avec 3 jours de pompage et injection d'acide citrique et 12 jours sans pompage).
Les conclusions de ces tests sont que le fonctionnement « actif-passif » (phase III) semble être la meilleure stratégie pour le système HFTW tant en termes de traitement des contaminants qu'en termes de coûts opérationnels et de maintenance. Les détails de ces tests, les résultats et les coûts sont présentés sur le site internet62 et dans le rapport d'étude associé.
[62] http://www.serdp.org/Program-Areas/Environmental-Restoration/Contaminated-Groundwater/Emerging-Issues /ER-200224.
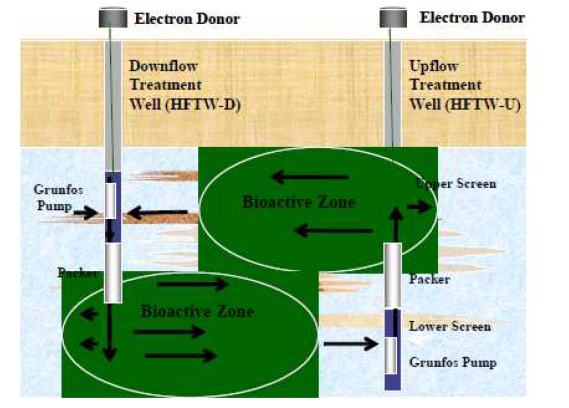
Figure 11. Principe de horizontal flow treatment well (HFTW) (Hatzinger et Diebold, 2009).
En conclusion et d'après le rapport d'ITRC (2008b), les barrières perméables et les systèmes d'injection de réactifs, sont des techniques testées et disponibles pour réduire le perchlorate dans les eaux souterraines ou les sols aux Etats-Unis. Un bon abattement a été constaté sur différents sites américains. Une technologie innovante pour les eaux souterraines contaminées en perchlorate est également en cours de tests par le Département de la Défense américaine : horizontal flow treatment well (HFTW) dont les premiers résultats semblent prometteurs.
BIOREMEDIATION EX-SITU
Les différentes techniques de bioremédiation ex-situ sont les bioréacteurs à flux continu (infiniment mélangé) et les bioréacteurs à gradient spatial de concentration (lit fluidisé ou lit fixe) (ITRC, 2008a).
Les bioréacteurs à flux continu (CSTR Continuous-Flow Stirring-Tank Reactor) sont généralement utilisés pour les eaux industrielles. Cette technique nécessite des faibles débits (ITRC, 2008a).
Les bioréacteurs à lit fluidisé (FBR – Fluidized Bed reactor) permettent de traiter une large gamme de concentration en perchlorate (de 10 ppb à > 500 ppb). Cette technique permet d'éliminer également certains autres contaminants tels que les nitrates (ITRC, 2008a).
Les bioréacteurs à lit fixe (PBR – Fixed-film or packed bed reactor) sont souvent utilisés pour le traitement des eaux usées. Dans le cas particulier du perchlorate, les études avec un pilote ont été réalisées (pas de test « grandeur nature »).
Un réacteur biologique à lit fluidisé a également été testé dans une usine de munitions de l'Armée de Longhorn Karnak, au Texas. Ce procédé a permis de réduire les niveaux de perchlorate dans les eaux souterraines pompées sur site à des niveaux inférieurs à la limite de détection (< 4 ppb) (ATSDR, 2009). Un autre essai avec cette technologie a permis d'abattre les concentrations en perchlorate dans les eaux souterraines avec un rendement de 99,99 % (ATSDR, 2009).
L'usine Regulus63 , exploitante de l'Usine de Propergol de Guyane, possède une installation de traitement du perchlorate d'ammonium (depuis 2005). Ce traitement biologique s'effectue par étapes successives pour transformer le perchlorate en solution (l'Arrêté d'autorisation de l'usine prévoit la destruction du perchlorate d'ammonium par dilution). La capacité de traitement est de 1 560 m3 par an pour un débit de 4,3 m3 d'eau/jour (Regulus, 2004).
Les différentes étapes de traitement sont les suivantes (Regulus, 2004) :
- •le stockage : récupération des eaux de lavage et du mélange de perchlorate d'ammonium, homogénéisation de la solution (concentration maximale en perchlorate de 8 g.L-1) et régulation du débit qui va alimenter les bactéries (débit à 180 L/h) ;
- •la nitrification : traitement par boues activées (bactéries) des ions ammoniums. Le temps de séjour est de 30 jours minimum ;
- •la dénitrification : transformation des ions perchlorates en chlorures par anoxie des boues activées (bactéries). Le temps de séjour est également de 30 jours minimum ;
- •l'aération – décantation : aération permet la réduction de la DCO (demande chimique en oxygène), la décantation permet la séparation et la récupération des boues.
[63] Voir paragraphe 2.2.1.
En sortie, on obtient une solution d'eau salée (5 g.L-1) et une eau de décantation (72 m3 par an) faiblement chargée (pour 1 560 m3 traités par an).
On peut noter qu'en 2009 la société HERAKLES a mis en service sur son site de Saint-Médard-en-Jalles une station de traitement bactériologique des eaux résiduaires perchloratées. En outre, cette station permet depuis janvier 2012 de traiter l'ensemble des effluents de la plateforme pyrotechnique (HERAKLES, 2013). La société HERAKLES (2013) indique un rendement de 99,98 % quant à la destruction du perchlorate d'ammonium par cette station.
En 2008 et 2012 la société HERAKLES a breveté un procédé de purification biologique des solutions aqueuses contenant du perchlorate d'ammonium (HERAKLES, 2013). Ce procédé comporte des étapes de nitrification, dénitrification et réduction des ions perchlorates64 .
PHYTOTECHNOLOGIE
Phytoremédiation
La phytoremédiation est un autre procédé de traitement à l'étude pour les sols, les sédiments et l'eau souterraine contaminés au perchlorate (Nzengung et al., 1999 ; Nzengung et al., 2004 ; Tan et al., 2004 ; Urbansky, 2002 ; van Aken et Schnoor, 2002). Les plantations de laitue et de saules ont montré de bons résultats concernant la réduction des concentrations de perchlorate dans les sols contaminés (US EPA, 2004 ; (Nzengung et al., 1999 ; Nzengung et al., 2004 ; Yu et al., 2004).
Au cours des dix dernières années, les chercheurs ont étudié la transformation de perchlorate en chlorure (minéralisation du perchlorate des sols), dans laquelle les plantes et les microorganismes servent de médias. Le perchlorate peut être partiellement décomposé dans les feuilles de la plante (phytodégradation65) ou dans la rhizosphère (rhizodégradation66) (Schneider, 2009). La phytodégradation s'accompagne de phytoaccumulation (stockage du
[64] http://www.google.com/patents/EP2285745A1?cl=fr.
[65] La phytodégradation, également appelée phytotransformation, correspond à l'élimination des contaminants pris dans les processus métaboliques des plantes, ou à l'élimination des contaminants externes à la plante grâce aux effets de composants produits par la plante (les enzymes par exemple) (Grossi, C. (2006). La Phytoremédiation des composés organiques. Institut Français d'Urbanisme -Université Paris VIII.).
[66] La rhizodégradation correspond à l'élimination des contaminants organiques dans le sol à travers l'activité microbactérienne présente dans la rhizosphère (Ibid.).
perchlorate dans les tissus des végétaux) (Schneider, 2009).
La rhizodégradation, quant à elle, est un processus beaucoup plus rapide impliquant des bactéries dans des conditions anaérobies. Ces dernières vont convertir le perchlorate en chlorate (ClO3 -), chlorite (ClO2 -) et chlorure (Cl-) par réaction avec de nombreux composés organiques (par exemple, l'acétate). De nombreuses plantes terrestres et aquatiques sont capables de traiter le perchlorate dans des conditions données (par exemple, la matière organique assurant le bon développement des plantes…) (Schneider, 2009).
Les avantages de la phytoremédiation sont les suivants (ITRC, 2008b) :
- •le faible coût en comparaison des technologies de traitement décrites ci-dessus. Des rapports mettent en évidence une différence pouvant aller au-delà de 50 % entre le coût d'une décontamination par des traitements physico-chimiques et celui de l'emploi de techniques liées à la phytoremédiation (Grossi, 2006) ;
- •une meilleure acceptation du public ;
- •la possibilité d'améliorer l'aspect esthétique d'un site ;
- •la possibilité de traiter d'autres contaminants, tels que les solvants chlorés….
Les inconvénients de ces techniques sont (ITRC, 2008b) :
- •les restrictions climatiques et l'impossibilité de traiter des pollutions profondes ;
- •le potentiel de transfert des contaminants du sol et des eaux souterraines dans la chaîne alimentaire. En effet, le perchlorate « stocké » dans les tissus de la plante reste un risque écologique jusqu'à sa complète phytodégradation ;
- •la relative lenteur du processus. La dépollution des sols par les plantes demande beaucoup plus de temps que les techniques traditionnelles, par l'obligation de respecter le cycle naturel des plantes, d'où une préférence pour ces dernières malgré leur surcoût (Grossi, 2006) ;
- •la dépendance à des variations saisonnières ;
- •la prédominance du mécanisme de phytodégradation par rapport à celui de rizhodégradation, entrainant ainsi un transfert des contaminants dans les tissus foliaires et nécessitant potentiellement une opération d'élimination de la biomasse végétale ;
En outre, la sélection d'espèces végétales adaptées à la réalisation des objectifs de traitement est importante car le perchlorate est susceptible d'exercer un effet toxique sur certaines espèces.
Zones humides artificielles
Sur la base des essais de bioremédiation et de phytoremédiation dans le cadre du traitement du perchlorate dans les eaux souterraines et les sols, les zones humides artificielles semblent également être une technique envisageable pour la réduction en perchlorate des eaux souterraines et de surface (ITRC, 2008b). En effet, les conditions réductrices des zones humides sols/sédiments, leur forte activité biologique en termes de densité et diversité microbienne, les sources de carbone, la capacité d'absorption des plantes et l'omniprésence des bactéries qui dégradent le perchlorate font potentiellement des zones humides une méthode de réduction des concentrations en perchlorate dans les sols et sédiments. Ces méthodes biologiques permettent également de réduire la concentration d'autres polluants (ITRC, 2008b).
TRAITEMENT DES DECHETS ET MATERIAUX CONTENANT DES PERCHLORATES
TECHNIQUES DE TRAITEMENT DES DECHETS ET MATERIAUX CONTENANT DES PERCHLORATES
Pour détruire les déchets explosifs, il existe différentes méthodes en France. Ces opérations de destruction sont réalisées par des entreprises habilitées (Conseil régional de Picardie, 2012) :
- •le brûlage consiste à incinérer des déchets pyrotechniques sur une aire de destruction matérialisée et isolée des zones d'effets graves d'installations environnantes. Il peut avoir lieu à l'air libre ou en milieu fermé (incinérateur) ;
- •le pétardement ou « pétardage » (mise en détonation) consiste à détruire un objet explosif à l'aide d'une charge placée à son contact direct ;
- •la destruction chimique relève de réactions contrôlées entre la matière pyrotechnique et un ou plusieurs réactifs chimiques additionnels.
- •la dissolution consiste à immerger des compositions contenant des composés solubles (nitrates, chlorates, perchlorates…) dans l'eau pour les détruire, le résidu liquide de telles opérations peut être brûlé si le risque pyrotechnique persiste ou traité biologiquement dans une station d'épuration dédiée. La dilution relève d'un principe comparable en diminuant la concentration du composé explosible dans un autre diluant.
En 2012, la société ROXEL67 (producteur européen de systèmes de propulsion solide destinés aux roquettes, missiles tactique et missiles de croisière) a breveté un procédé de démantèlement de moteurs à propergol solide68 .
Ce traitement de type « dissolution » comporte une étape de destruction du moteur et une étape de purification des eaux contaminées en perchlorate d'ammonium.
La destruction nécessite 4 étapes :
- 1)démantèlement du moteur ;
- 2)montage sur un banc d'essai statique ;
- 3)immersion du banc dans un bain rempli d'eau ;
- 4)déclenchement du propulseur de façon à ce que le propulseur se consume sous l'eau.
La partie soluble des produits de combustion (gaz ou condensats) reste ainsi piégée dans l'eau du bassin tandis que les produits solides non-solubles tombent dans le fond du bassin. Le corps du propulseur ainsi vidé de son combustible et rendu pyrotechniquement inactif est ensuite démonté et désassemblé.
Il faut ensuite purifier l'eau contenant du perchlorate d'ammonium et éventuellement des nitrates (cf. biorémédiation ex-situ)
Quant à elle, la société HERAKLES emploie une technique de démantèlement en trois étapes (HERAKLES70 ; HERAKLES, 2013) :
- 1)vidange des corps propulseurs chargés ;
- 2)broyage des déchets de propergol et extraction des sels de perchlorate et de nitrate permettant la séparation des éléments inertes d'une saumure perchloratée ;
- 3)traitement biologique des sels de perchlorate et de nitrate et rejet de l'eau après traitement.
[67] http://www.roxelgroup.com/ (consulté en janvier 2014).
[68] http://www.google.com/patents/WO2012171718A1?cl=fr (site consulté en décembre 2013).
En outre, cette société, dispose d'ores et déjà d'une installation pilote pour traiter ses eaux résiduaires chargées en perchlorate d'ammonium, à hauteur de 30 tonnes par an. Afin d'étendre ce procédé à d'autres déchets de matériaux énergétiques compatibles (propulseurs, objets et déchets de fabrication pyrotechniques) et ce dans le but de réduire ses activités de brûlage, cette société a déposée un projet d'installation classée pour la protection de l'environnement69 consistant à exploiter des installations de traitement biologique sur le site de Saint-Médard-en-Jalles70 . Les quantités maximales de produits susceptibles d'être annuellement traitées sont de 380 t de propergol (contenant environ 70 % de perchlorate d'ammonium) et de 400 t de perchlorate d'ammonium (incluant le perchlorate d'ammonium contenu dans le propergol). Le démarrage de cette installation était prévu pour fin 2013. Au jour de la rédaction de ce document, nous n'avons pas d'information confirmant cette mise en route.
Une fois cette installation en fonctionnement, la société HERAKLES estime réduire d'environ 80 % les brûlages actuellement réalisés sur le site de Saint-Médard-en-Jalles. De plus cette société projette, grâce à ces installations de traitement biologique, de générer dans la Jalles63 une teneur en perchlorate inférieure à 1,1 µg.L-1 en moyenne et 3,9 µg.L-1 en étiage70 , l'objectif étant en 3 ans d'atteindre un taux d'abattement de perchlorate supérieur à 99.98 % (un tel taux ayant été atteint en 2012 sur la station-pilote).
ELEMENTS DE COUTS LIE AU TRAITEMENT DES DECHETS ET MATERIAUX CONTENANT DES PERCHLORATES
Le Tableau 6 ci-après, synthétise les coûts indiqués par la société HERAKLES pour la mise en place de mesure de réduction des émissions de perchlorate d'ammonium à l'environnement70 .
[69] Avis 2013-052 en date du 13/05/2013 de la Direction régionale de l'Environnement, de l'Aménagement et du Logement d'Aquitaine portant sur la demande d'autorisation d'exploiter des installations de traitement biologique de matériaux énergétiques sur le site de Saint-Médard-en-Jalles (33) de la société HERAKLES.
[70] Résumé non technique des études d'impact et de dangers HERKALES ST-MEDARD du 04/06/2013 (http://www.gironde.gouv.fr/Publications/Publications-legales/Enquetes-publiques-et-mises-a-disposition-du-public-relatives-aux-icpe/Enquetes-publiques-de-l-annee-2013-relatives-aux-icpe/Enquete-publique-du-17-juin-au-17-juillet-2013-Societe-Herakles-Groupe-Safran, site internet consulté en janvier 2014 ).
Tableau 6. Coûts engendrés pour la mise en place de mesure de réduction des émissions de perchlorate d'ammonium à l'environnement sur le site de Saint Médard en Jalles (source HERAKLES70).
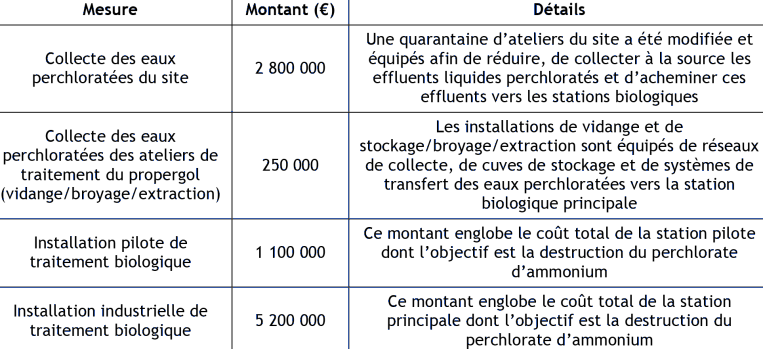
Lors des enquêtes menées auprès des professionnels susceptibles d'utiliser du perchlorate d'ammonium, deux professionnels ont indiqué que les déchets des produits à base de perchlorate employés par ces derniers (perchlorate de sodium et d'ammonium) étaient brulés /incinérés sur leur site (EPC France, 2012 ; Planète Artifices, 2012). Dans le cas d'une incinération, les cendres sont analysées puis envoyées vers un centre de déchets ultimes pour vitrification.
Alternatives aux usages
ALTERNATIVES AUX USAGES DE PERCHLORATE D'AMMONIUM
FTE 2015 Importer
Lors de ce travail, nous n'avons identifié que très peu d'informations concernant les alternatives au perchlorate d'ammonium. Les informations disponibles sont présentées ci-dessous.
PERCHLORATE D'AMMONIUM ET PROPERGOL
Selon un article publié dans l'Usine nouvelle en 2007, le remplacement du perchlorate d'ammonium était à l'étude. Il pourrait être remplacé par un oxydant comme l'ADN71 ou par du RDX72 ou du HMX73 . La SME (SNPE Matériaux Energétiques) travaillait à l'époque sur un liant constitué d'un polymère (inerte ou énergétique) et d'un plastifiant énergétique (Usine Nouvelle, 2007).
Selon l'Usine Nouvelle (2008), la coopération entre la SME (SNPE Matériaux Energétiques) et l'ONERA74 s'est renforcée dans le domaine de la propulsion des lanceurs spatiaux et des missiles (projet Orphee-Operative Research on Hybrid Engine in Europe). Les chercheurs (Laboratoires du Bouchet) travaillent à la mise au point des futurs matériaux énergétiques. A la différence de ce qu'il se passe dans les matériaux actuellement en service, l'énergie est apportée par les différents constituants utilisés et non plus uniquement par les charges solides énergétiques telles que le perchlorate d'ammonium (Usine Nouvelle, 2008).
Les laboratoires du Bouchet travaillent, entre autre, sur les charges énergétiques. Les efforts se portent sur le CL 2075 (la molécule la plus énergétique à ce jour avec une enthalpie de formation de 350 kJ/mole et une densité supérieure à 2) ou encore sur l'ADN (oxydant sans chlore remplaçant potentiel du perchlorate d'ammonium) (Usine Nouvelle, 2008).
Le département de la défense américaine a également mis en œuvre des études sur les alternatives au perchlorate d'ammonium dans les applications de propulsion de missile (Dewey, 2007).
Différents oxydants ont été comparés lors de cette étude :
- •ammonium di(nitramido) amine (ADNA) ;
- •1,3,5,5-tetranitrohexahydropyrimidine (DNNC) ;
- •1,3,3,5,7,7-hexanitro-1,5-diazacyclooctane (HCO) ;
- •diammonium di(nitramido) dinitroethylene (ADNDNE).
[71] ADN : Ammonium Di-Nitramide.
[72] RDX : 1,3,5-trinitroperhydro-1,3,5-triazine ou cyclotriméthylènetrinitramine.
[73] HMX : octahydro-1,3,5,7-tétranitro-1,3,5,7-tetrazocine ou octogène.
[74] Office national d'études et de recherches aérospatiales.
[75] CL 20 ou HNIW (HexaNitrohexaazaIsoWurtzitane).
Les synthèses de ces oxydants ont été difficiles et des recherches sur les procédés de synthèse à grande échelle doivent encore être conduites. La société AMEC Earth & Environmental Inc a mené une première évaluation sur le comportement, le transport, et la toxicité de ces quatre alternatives potentielles au perchlorate. Cette évaluation a donc porté sur l'ADNA et son homologue76 l'ADN, le DNNC et son homologue le RDX, le HCO et son homologue le HMX et l'ADNDNE et son homologue le 1,1-diamino-2,2-dinitroethene (FOX-7).
Par rapport au perchlorate d'ammonium, les composés semblent se comporter de manière similaire dans l'environnement. Néanmoins, chacun des composés est, soit moins soluble dans l'eau que le perchlorate d'ammonium, soit susceptible de s'adsorber sur l'argile et dans les sols ou plus photodégradables. Selon les auteurs, il semble raisonnable de penser que chacun de ces quatre composés serait une amélioration par rapport au perchlorate d'ammonium vis-à-vis de son comportement et son devenir dans l'environnement77 . Les composés sont classés actuellement de la manière suivante DNNC, ADNA, HCO, ADNDNE (classement du plus favorable au moins favorable). Le CL-20, matériau de densité énergétique élevée et disponible dans le commerce, a également été testé en raison des retards dans la synthèse des nouveaux oxydants et a montré de bons résultats (Dewey, 2007).
Selon l'Usine nouvelle (2008), de nouveaux concepts dans le domaine de la propulsion sont également explorés, comme celui de la propulsion hybride, qui associe un oxydant liquide à un réducteur solide, avec l'avantage d'une plus grande sécurité. Le matériau énergétique est alors constitué de polymères avec des charges solides à base de composés hydrocarbonés et d'un liquide tel que l'eau oxygénée.
Néanmoins, au sujet de la propulsion spatiale, il convient préciser que les éventuelles modifications dans la composition du mélange propulseur ne s'imaginent que lors de la rénovation complète du programme (c'est-à-dire à l'occasion de l'utilisation d'une nouvelle génération de lanceurs), révision qui ne s'envisage qu'à moyen terme.
[76] Composé homologue : composé possédant la même fonction chimique.
[77] Une évaluation de la toxicité a également été menée : leur toxicité pour les organismes aquatiques serait très faible et ces composés auraient tendance à moins se concentrer dans les organismes aquatiques.
PERCHLORATE D'AMMONIUM ET PYROTECHNIE
Lorsqu'un feu d'artifice est tiré, du perchlorate est susceptible d'être émis, en faible quantité, vers différents compartiments environnementaux. Au-delà des émissions de perchlorate et du point de vue environnemental, la fumée dégagée ainsi que les métaux utilisés comme colorants par les fusées posent également des problèmes. Des études ont donc été menées sur des composés à forte teneur en azote (moins de carbone et moins de perchlorate signifient aussi moins de fumée. De même qu'une fumée moins dense obscurcit moins la couleur et donc permet de réduire la quantité de colorant) (Halford, 2008).
Selon Halford (2008), des chercheurs ont travaillé sur le remplacement du perchlorate dans des fusées de signalisation de couleur et de feux d'artifice. Jusqu'ici, ils ont eu le plus de succès avec des fusées rouges qui utilisent des oxydants à base de strontium.
Toujours selon cette source, la nitrocellulose (cf. Figure 12 ci-dessous) est probablement l'un des meilleurs ingrédients pour réduire la quantité de fumée. De plus, les sous-produits de combustion (CO2, eau et azote) ainsi que les retombées sont moins problématiques pour l'environnement. Enfin, l'utilisation de nitrocellulose évite d'utiliser des oxydants tels que le perchlorate en raison de son fort contenu en oxygène (Halford, 2008).
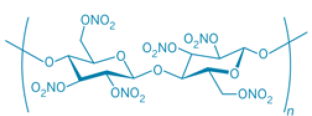
Figure 12. Schéma de la nitrocellulose (Halford, 2008).
Ces fusées sont actuellement environ deux fois plus chères que les fusées traditionnelles (Halford, 2008).
On notera que d'après un expert de l'INERIS et un professionnel du secteur, le perchlorate d'ammonium est de moins en moins employé dans les feux d'artifice en France, notamment au profit du nitrate d'ammonium.
PERCHLORATE D'AMMONIUM ET AIRBAGS
Selon l'ADEME (2007), les fabricants d'airbags ont développé différents types de propergols :
- à base d'aminotetrazole (CHN5) ;
- de nitrate de guanidine (CN3H5) ;
- de perchlorate d'ammonium (NH4ClO4).
Sans pouvoir préciser la réalité de ces usages, il apparait donc qu'il existe des alternatives à l'utilisation du perchlorate d'ammonium pour les airbags.
Conclusion
FTE 2015 Importer
Le perchlorate d'ammonium est un composé chimique inorganique de formule chimique NH4ClO4. Cette substance est un puissant oxydant et elle est principalement employée comme oxydant dans les propergols composites (pour moteurs de fusées, missiles…), pour la fabrication des dispositifs pyrotechniques (feux d'artifice (en faible quantité), airbags, application militaire…).
Les sources de perchlorate d'ammonium sont à la fois anthropiques (et liées aux usages énoncés ci-dessus) et naturelles. La majorité du perchlorate d'origine naturelle provient de dépôts évaporitiques de nitrate que l'on peut trouver dans les déserts chiliens, dépôts qui ont également été utilisés comme fertilisant en agriculture aux USA (salpêtre chilien – nitrate de sodium). Des travaux de recherche ont également montré que le perchlorate pouvait également être produit par certains processus de chimie atmosphérique.
Les sels de perchlorates inorganiques sont très solubles dans l'eau. Ainsi, ils se dissolvent rapidement et sont complètement dissociés en un anion perchlorate et le cation ammonium. Le comportement dans l'environnement du perchlorate d'ammonium est dominé par l'anion perchlorate. Bien que la production de sels de perchlorate ait débuté en milieu des années 1940 aux Etats-Unis, ce n'est qu'à partir de 1997 que cette substance a été identifiée comme étant un polluant relativement répandu dans les eaux de surface aux États-Unis.
Lors cette étude, très peu d'informations concernant les émissions et les concentrations en perchlorate d'ammonium dans l'environnement à l'échelle de la France ont pu être compilées. Des ions perchlorates ont été trouvés dans l'eau potable en Aquitaine, en Midi-Pyrénées et dans le Nord-Pas-de-Calais.
Concernant le traitement des eaux destinées à la consommation humaine et d'après l'avis de l'Anses daté du 18 juillet 2011, il n'existe pas à l'heure actuelle de procédé de traitement vraiment satisfaisant et efficace permettant l'élimination du perchlorate. Actuellement, la technique la plus utilisée pour traiter les eaux concerne les résines échangeuses d'ions (résines anioniques sélectives des perchlorates). Les filtrations sur membrane (osmose inverse, nanofiltration) sont des technologies prometteuses qui se développent de plus en plus mais pour lesquelles des recherches sont encore en cours.
Concernant le traitement des eaux souterraines et des sols contaminés au perchlorate, différentes méthodes ont été identifiées (bioremediation in-situ et ex-situ, phytoremédiation et méthodes physico-chimiques).
Enfin, quelques éléments sur les alternatives au perchlorate d'ammonium dans le domaine militaire -propergol (ADN, RDX, CL-20 …) mais également dans le domaine de la pyrotechnie (emploi de nitrocellulose par exemple) ont été identifiés.
Bibliographie
Archives
Dernière vérification le 29/03/2024
Documents
Exporter la substance
Choisissez le format de l'export :










